Пероральные композиции, содержащие сложный эфир 17-гидроксипрогестерона, и соответствующие способы - RU2640912C2
Код документа: RU2640912C2
Чертежи


Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к композициям, содержащим сложный эфир 17-гидроксипрогестерона, их пероральным лекарственным формам и соответствующим способам. Соответственно, настоящее изобретение относится к области химии, фармацевтических дисциплин, медицины и других медико-санитарных дисциплин.
УРОВЕНЬ ТЕХНИКИ
17-альфа-гидроксипрогестерон (в дальнейшем иначе называемый 17-гидроксипрогестероном или «17ГП») представляет собой С-21 эндогенный стероидный гормон, вырабатываемый в процессе синтеза глюкокортикоидов и половых стероидов. Подобно прогестерону, 17ГП представляет собой природный прогестаген. Он был выделен как из надпочечников, так и из желтых тел. Сложные эфиры 17ГП, как сообщается, обладают прогестогенным действием и, следовательно, могут быть применены при показаниях, связанных с поддержанием беременности, а также с поддержкой для женщин в период пре- или постменопаузы. Сообщается, что 17ГП, не будучи этерефицированным, не проявляет прогестогенную активность. Тем не менее, было показано, что синтетические сложные эфиры 17ГП, такие как 17-гидроксипрогестерона ацетат или 17-альфа-гидроксипрогестерона капроат (в дальнейшем называемый 17-гидроксипрогестерона капроатом или 17ГПК), в экспериментах на животных проявляют выраженную прогестогенную активность при внутримышечном введении. 17-Гидроксипрогестерона капроат является широко используемым прогестином, доступным для внутримышечной инъекции для профилактики преждевременных родов (в качестве альтернативы в дальнейшем именуемых «ПВР»). Как сообщается, этот синтетический эфир капроновой кислоты, неактивен при введении через рот, но действует как прогестин длительного действия при внутримышечном введении. Метаболизмы 17ГП и 17-гидроксипрогестерона капроата у женщин еще не полностью установлены. Данные, полученные для людей и животных, показывают, что внутримышечно введенный 17-гидроксипрогестерона капроат обладает сильным прогестогенным воздействием на эндометрий и более длительным действием по сравнению с прогестероном (в качестве альтернативы в дальнейшем называемым «П»). Это, возможно, связано с более активным связыванием 17-гидроксипрогестерона капроата с рецепторами прогестерона (в качестве альтернативы в дальнейшем называемыми «РП») и плацентарными глюкокортикоидными рецепторами (в качестве альтернативы в дальнейшем называемыми «ГР»), которые могут предотвращать повышение уровня плацентарного гормона высвобождения кортикотропина, который связан с началом родов. Сообщается, что 17-гидроксипрогестерона капроат эффективен в обеспечении лютеиновой поддержки пациентов, проходящих циклы переноса эмбриона при экстракорпоральном оплодотворении (ЭКО).
ПВР с медицинской точки зрения определяются как роды в период с 20 до 36 неделю беременности. В соответствии с отчетом Центра контроля заболеваний 2009 года, ПВР встречаются примерно в 12,3% родов в одних только США, что составляет до примерно полумиллиона ПВР ежегодно. Спонтанные ПВР составляют примерно 70-80% ПВР. Из всех случаев беременности в США, один из восьми новорожденных рождается преждевременно, что соответствует увеличению >18% по сравнению с 1990 годом. Позднедосрочные роды между 35-36 неделями беременности составляют более половины всех ПВР. ПВР является основной причиной заболеваемости и смертности новорожденных. Риск смертности в три раза выше в 35-36 недель, и заболевания, такие как респираторный дистресс, требующий кислорода, нестабильность температуры, гипогликемия, желтуха, синдром дефицита внимания, детский церебральный паралич, задержка развития и т.д., являются довольно распространенным явлением. Связанные с ПВР время и затраты на интенсивной уход являются одной из основных медицинских, социальных и экономических проблем, вследствие которых стоимость родов при ПВР увеличивается до 10 раз от стоимости нормальных родов.
Основными факторами риска, связанными к ПВР, являются следующие: предыдущие спонтанные ПВР в анамнезе (прошлый акушерский анамнез), длина шейки матки (<2,5 см в середине беременности), наличие фибронектина плода в выделениях из влагалища; многоплодная беременность, низкий индекс массы тела (ИМТ) матери, раса матери; возраст матери (<17 и >35 лет) и курение. По меньшей мере одни ПВР в анамнезе являются положительным индикатором будущего возникновения потенциала с 17-50% рецидивов и 28-70% рецидивов при двух предыдущих ПВР. Преимущества продления беременности до полного срока посредством терапевтического вмешательства включают улучшение выживаемости детей в зависимости от гестационного возраста и сокращение пребывания новорожденного в больнице.
Внутримышечные инъекции 17-гидроксипрогестерона капроата доступны для снижения риска ПВР у женщин с одноплодной беременностью и одними спонтанными ПВР в анамнезе. Применение инъекционного препарата, продаваемого под названием Макена (Makena®) (250 мг 17-гидроксипрогестерона капроата в 1 мл), обязывает регулярно посещать врача, поскольку типичный цикл лечения состоит из 16-20 недель инъекций повторяющихся каждую неделю. Этот режим лечения может привести к увеличению дистресса пациента и/или беспокойству в дополнение к увеличению рисков для пациента и плода, связанных с неоднократными путешествиями. Помехи в инъекционной терапии в связи с личными и семейными мероприятиями и нарушение в профессиональной жизни также являются основным недостатком.
Кроме того, как сообщается, побочные эффекты от инъекции 17-гидроксипрогестерона капроата (например, Макены) один раз в неделю (каждые 7 дней), включая реакции в местах инъекции (-45%), такие как крапивница, зуд, отек, образование узелков и боль в месте инъекции, являются значительными.
Сложные эфиры гидроксипрогестерона, такие как ацетат, капроат, ундеканоат более липофильны, чем гидроксипрогестерон. Активное вещество (17-гидроксипрогестерона капроат) в препарате Макена, как известно, нерастворимо в воде (<20 нг/мл) и очень липофильно с ClogP примерно 5,7. Кроме того, 17-гидроксипрогестерона капроат может метаболизироваться в присутствии гепатоцитов плода и взрослого и является субстратом для инактивации цитохрома, такого как CYP3A4 который чрезмерно экспрессирован у беременных женщин (повышающая регуляция ~40%). Ввиду его чрезвычайно низкой растворимости в воде и возможности быть воспринятым при первом прохождении, инактивация в печени перорально доставляемых сложных эфиров 17ГП с длинной цепью осталась проблемой. Сообщается, что 17-гидроксипрогестерона капроат, сложный эфир 17ГП, не обладает пероральной активностью (Saxton DJ et al. Reproductive Biology and Endocrinology 2004, 2:80; Green MF, NJEM 348:2453-2455). Это объясняется, вероятно, очень низкой биодоступностью или отсутствием биодоступности 17ГПК при пероральном введении. Несмотря на большое желание, на сегодняшний день разработка перорально активной композиции длинноцепочечного сложного эфира гидроксипрогестерона остается в значительной степени неудовлетворенной потребностью. Кроме того, чаще всего желательна разработка лекарственных форм, которые обеспечивают введение меньшего числа лекарственных единиц на дозу и/или сниженную частоту приема в день.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения неожиданно обнаружили, что сложные эфиры 17ГП могут быть эффективно перорально доставлены млекопитающим. Фармацевтические пероральные композиции и лекарственные формы согласно настоящему изобретению могут обеспечить эффективную биодоступность сложного эфира 17ГП. Кроме того, композиции и/или лекарственные формы, предложенные в настоящем изобретении, обеспечивают эффективное усиление высвобождения сложных эфиров 17ГП. Также авторы настоящего изобретения неожиданно обнаружили, что сложный эфир 17ГП может быть приготовлен в виде пероральных композиций и их пероральных лекарственных форм с высоким процентом (масс./масс.) загрузки сложного эфира. Например, авторы настоящего изобретения обнаружили, что когда один или более солюбилизирующих агентов, таких как, например, бензиловый спирт, бензилбензоат и т.д., включены в композицию, значительное количество (т.е. больше чем 12% масс./масс.) сложного эфира 17ГП в композиции или лекарственной форме может быть растворено. Повышенное содержание лекарственного вещества в композициях и дозированных формах согласно настоящему изобретению, может обеспечить значительные преимущества, включая, но не ограничиваясь уменьшенным размером или объемом единичной дозы (т.е. таблетка, капсула, сироп, эликсир, напиток и т.д.), уменьшенное количество лекарственных единиц для принятия при однократном введении, улучшенное соблюдение пациентом режима лечения и т.д., потому что пациенты, как правило, могут принимать меньшее количество лекарственных единиц в день, чтобы получить достаточную дозу с обеспечением желаемой эффективности. В отдельном аспекте также было неожиданно обнаружено, что эффективная биодоступность сложного эфира 17ГП может быть обеспечена посредством композиций согласно настоящему изобретению, которые при диспергировании в водной среде, обеспечивают прозрачные или коллоидные до мутного или непрозрачные дисперсии, содержащие частично или полностью солюбилизированное лекарственное средство в указанных дисперсиях.
Было также обнаружено, что композиции согласно настоящему изобретению обеспечивают получение твердых лекарственных форм, таких как таблетки, капсулы, гранулы, шарики, твердые частицы и т.п., которые позволяют преодолеть недостатки, присущие сложному эфиру 17ГП, входящему в состав лекарственной единицы в форме жидкого раствора. Это исключает ряд нежелательных неудобств, таких как специализированный производственный процесс и/или оборудование, низкая химическая и/или физическая стабильность сложного эфира, типичная для жидких растворов ввиду природы сложного эфира или используемых растворителей, и т.п.
Все пероральные лекарственные формы согласно настоящему изобретению содержат лекарственное средство в форме раствора, суспензии, твердых частиц и т.д. и могут быть получены с помощью обычных способов обработки и получения, известных в данной области техники.
Согласно настоящему изобретению предложены композиции и пероральные лекарственные формы, содержащие сложные эфиры 17ГП, а также предложены соответствующие способы. Композиции и пероральные лекарственные формы могут быть приготовлены с включением терапевтически эффективного количества сложного эфира 17ГП и фармацевтически приемлемого носителя. В одном из вариантов реализации настоящего изобретения предложена фармацевтически приемлемая пероральная лекарственная форма для поддержания беременности и поддержки при отсутствии беременности. Указанная фармацевтически приемлемая пероральная лекарственная форма может содержать терапевтически эффективное количество сложного эфира 17ГП и фармацевтически приемлемый носитель. Из указанной пероральной лекарственной формы, при определении с использованием аппарата для растворения 2го типа согласно Фармакопее США (USP) в 900 мл деионизированной воды с 0,5% (масс./об.) лаурилсульфата натрия при 50 об/мин при 37°C, через 60 минут может высвобождаться по меньшей мере 20 масс. % от дозы сложного эфира 17ГП.
В другом варианте реализации предложена фармацевтически приемлемая пероральная лекарственная форма для поддержания беременности и поддержки при отсутствии беременности. Указанная фармацевтически приемлемая пероральная лекарственная форма может содержать терапевтически эффективное количество сложного эфира 17ГП и фармацевтически приемлемый носитель. Из указанной пероральной лекарственной формы, при определении с использованием аппарата для растворения 2го типа согласно USP в 900 мл деионизированной воды с 0,5% (масс./об.) лаурилсульфата натрия при 50 об/мин при 37°C, через 60 минут может высвобождаться по меньшей мере на 20 масс. % больше сложного эфира 17ГП, чем из эквивалентно вводимой пероральной лекарственной формы без носителя.
В некоторых аспектах пероральные лекарственные формы согласно настоящему изобретению могут быть применены для лечения беременных женщин, для которых есть риск преждевременных родов. Такие способы лечения могут включать стадию перорального введения женщине указанной пероральной фармацевтической композиции. В некоторых аспектах, указанное дозируемое количество представляет собой количество, достаточное для обеспечения предполагаемого терапевтического эффекта. В другом варианте реализации пероральные лекарственные формы можно вводить субъектам, нуждающимся в этом. Введение пероральной лекарственной формы обеспечивает лечение по меньшей мере одного состояния, выбранного из преждевременных схваток в родах, преждевременных родов, бесплодия и невынашивания беременности. Состояния и относительное лечение может быть основано на первичных и вторичных измерениях их исхода, связанных с введением сложного эфира 17ГП.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 представляет собой график профиля высвобождения in vitro 17-гидроксипрогестерона капроата, содержащий данные для пероральной лекарственной формы в соответствии с определенным вариантом реализации настоящего изобретения по сравнению с 17-гидроксипрогестерона капроатом без носителя.
Фиг. 2 представляет собой график профиля высвобождения in vitro 17-гидроксипрогестерона, содержащий данные для пероральных лекарственных форм в соответствии с определенным вариантом реализации настоящего изобретения.
Фиг. 3 представляет собой график профиля высвобождения in vitro 17-гидроксипрогестерона, содержащий данные для пероральных лекарственных форм в соответствии с определенным вариантом реализации настоящего изобретения.
Далее будет обращено внимание на отдельные проиллюстрированные варианты реализации, и для их описания будет использоваться конкретная терминология. Тем не менее, следует понимать, что тем самым не подразумевается никакого ограничения объема изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Перед раскрытием и описанием настоящих пероральных лекарственных форм, способов доставки и применения сложных эфиров 17-гидроксипрогестерона, следует отметить необходимость понимания того, что данное изобретение не ограничивается конкретными стадиями способа и материалами, предложенными в настоящем документа, а распространяется на их эквиваленты, что очевидно среднему специалисту в соответствующих областях. Следует также понимать, что терминология в настоящем документе используется только с целью описания конкретных вариантов реализации и не предназначена для ограничения.
Следует отметить, что формы единственного числа, уточненные или не уточненные термином «указанный», включают формы множественное число, если контекстом явно не определено иное. Таким образом, например, ссылка на "вспомогательное вещество" включает ссылку на одно или более таких вспомогательных веществ, а ссылка на "носитель" включает ссылку на один или более таких носителей.
Определения
В настоящем документе термины «лекарственное средство», «активный агент», «биологически активный агент», «фармацевтически активный агент», «терапевтически активный агент» и «фармацевтический продукт» могут быть использованы взаимозаменяемо для обозначения агента или вещества, обладающего измеримой специфичной или выбранной физиологической активностью при введении субъекту в значительном или эффективном количестве. Следует понимать, что термин «лекарственное средство» явным образом охвачен настоящим определением, поскольку многие лекарственные средства и пролекарства, как известно, имеют определенную физиологическую активность. Данные термины хорошо известны в фармацевтической и медицинской областях. Кроме того, когда эти термины используются, или когда конкретный активный агент конкретно указан по названию или категории, следует понимать, что такое указание предназначено для включения непосредственно активного агента, а также его фармацевтически приемлемых солей, сложных эфиров или соединений, находящихся в значительном родстве с указанными, включая, без ограничений, пролекарства, активные метаболиты, изомеры и тому подобное.
В настоящем документе термин «повторный» используется для обозначения повторения или повторного возникновения по меньшей мере одного случая, такого как «выкидыш», «преждевременные роды» или «преждевременные схватки» или «многоплодной беременности» или любой подобной медицинской ситуации в отношении или безотносительно одного и того же партнера, с учетом или без учета предыдущего деторождения.
В настоящем документе термин «лечение» при использовании в сочетании с введением сложного эфира 17-гидроксипрогестерона, относится к введению сложного эфира 17-гидроксипрогестерона субъектам, которые имеют или не имеют симптомов. Другими словами, «лечение» может обозначать акт сокращения или устранения состояния (то есть проявляемых симптомов), или данный термин может обозначать профилактическое лечение (то есть введение пациенту, у которого симптомы не проявляются, для предотвращения их возникновения). Такое профилактическое лечение может также обозначать предотвращение состояния, превентивное действие, превентивные меры и т.д.
В настоящем документе термин «сложный эфир» означает соединения, полученные путем реакции между кислотами и спиртами с удалением воды. Как описано в настоящем документе, термин «сложный эфир» также может представлять класс органических соединений, соответствующих неорганическим солям, образованным из органической кислоты и спирта. В одном из аспектов «сложный эфир 17-гидроксипрогестерона» может представлять собой капроатный сложный эфир, но также может представлять собой сложные эфиры жирных кислот с более длинной цепью, таких как ундекановая кислота и выше, которые, как правило, всасываются в лимфатическую систему и позволяют избежать метаболизма в печени при первом прохождении для целей улучшения эффективности или безопасности.
В настоящем документе термины «состав» и «композиция» используются взаимозаменяемо и относятся к смеси двух или более соединений, элементов или молекул. В некоторых аспектах термины «состав» и «композиция» могут быть использованы для обозначения смеси одного или более активных агентов с носителем или другими вспомогательными веществами. Кроме того, термин «лекарственная форма» может включать один или более состав(ов) или композицию(ий), приготовленные в форме для введения субъекту. Когда любой из вышеуказанных терминов модифицирован термином «пероральный» такие термины относятся к композициям, составам или лекарственным формам, приготовленным и предназначенным для перорального введения субъектам.
Термины «фармацевтически приемлемый носитель» или «носитель» используются взаимозаменяемо и относятся к фармацевтически приемлемому веществу, которое позволяет получить фармацевтическую композицию и/или лекарственную форму сложного эфира 17-гидроксипрогестерона. Кроме того, в некоторых аспектах носитель представляет собой элемент или ингредиент, который может изменяться для изменения скорости высвобождения и/или величины активного агента, например, сложного эфира 17-гидроксипрогестерона, от состава и/или лекарственной формы. В одном из аспектов настоящего изобретения фармацевтически приемлемый носитель представляет собой соединение или смесь соединений, который определяет, кретролирует или способствует, по меньшей мере частично, высвобождение сложного эфира 17-гидроксипрогестерона из фармацевтической пероральной композиции и/или лекарственной формы при определении с использованием аппарата 2 го типа согласно USP примерно в 900 мл искусственного кишечного сока (согласно USP, искусственный кишечный сок (ИКС) без фермента) с 0,5% (масс./масс.) лаурилсульфата натрия при примерно 37°C и 50 об/мин.
В другом варианте реализации композиция или лекарственная форма обеспечивает высвобождение сложного эфира 17-гидроксипрогестерона таким образом, что при определении с использованием аппарата 2 го типа согласно USP примерно в 900 мл искусственного кишечного сока с 0,5% (масс./масс.) лаурилсульфата натрия при примерно 37°C и 50 об/мин после первых 60 минут по меньшей мере на 20% больше чем из пероральной лекарственной формы с эквивалентной дозой сложного эфира 17-гидроксипрогестерона без фармацевтически приемлемого носителя. В другом конкретном варианте реализации из композиции или лекарственной формы высобождается по меньшей мере на 40% больше сложного эфира 17-гидроксипрогестерона после первых 60 минут с пероральной лекарственной формой с эквивалентной дозой сложного эфира 17-гидроксипрогестерона без фармацевтически приемлемого носителя.
Следует отметить, что высвобождение сложного эфира 17-гидроксипрогестерона из композиции или лекарственной формы может быть определено в подходящей солюбилизирующей среде или несолюбилизирующей водной среде примерно при 37°C, в аппарате 2 го типа согласно USP II при 50 об/мин. Например, водная среда может представлять собой воду, искусственный желудочный сок (ИЖС) с ферментом или без фермента, искусственный кишечный сок (ИКС) с ферментом или без фермента, водноспиртовой раствор, раствор поверхностно-активного вещества и т.п. Водную среду можно использовать для целей определения скорости высвобождения и/или величины сложного эфира 17-гидроксипрогестерона из композиций или лекарственных форм. Водная среда может представлять собой несолюбилизирующую водную среду (например, содержащую малое количество поверхностно-активного вещества или не содержащее поверхностно-активного вещества в среде) для полного количества сложного эфира, присутствующего в композиции или лекарственной форме. В одном из вариантов реализации несолюбилизирующая водная среда может солюбилизировать примерно 90% или менее от общего количества сложного эфира, присутствующего в композиции или лекарственной форме. В другом варианте реализации несолюбилизирующая водная среда может солюбилизировать примерно 80% или менее, примерно 70% или менее, примерно 60% или менее, примерно 50% или менее, примерно 30% или менее или примерно 20% или менее от общего количества сложного эфира, присутствующего в композиции или лекарственной форме.
С другой стороны, в другом варианте реализации водная среда способна солюбилизировать по существу весь сложный эфир 17-гидроксипрогестерона, присутствующий в композиции или лекарственной форме. В одном из вариантов реализации водная среда может солюбилизировать по меньшей мере примерно 90% количество сложного эфира 17-гидроксипрогестерона, присутствующего в композиции или лекарственной форме. В конкретном варианте реализации водная среда может солюбилизировать примерно в 1,5-кратное или более, примерно 3-кратное или более, в 5-кратное или более количество эфира 17-гидроксипрогестерона, присутствующего в композиции или лекарственной форме.
В настоящем документе «субъект» относится к млекопитающему, на которое может оказать положительное действие введение композиции лекарственного средства или способ согласно настоящему изобретению. Примеры субъектов включают людей, а также могут включать других животных, таких как лошади, свиньи, крупный рогатый скот, собаки, кошки, кролики и водные млекопитающие. В одном конкретном аспекте субъект представляет собой человека. В другом аспекте субъект представляет собой женщину. В еще одном аспекте указанная пероральная лекарственная форма согласно настоящему изобретению предназначена для женщины, для которой требуется поддержание беременности.
Термин «пероральное введение» означает любой способ введения, в котором активный агент может быть введен путем глотания, жевания, сосания или выпивания пероральной лекарственной формы. Такие твердые или жидкие пероральные лекарственные формы традиционно предназначены для существенного высвобождения или доставки активного агента в желудочно-кишечный тракт за пределы полости рта и/или щечной полости. Примеры твердых лекарственных форм включают обычные таблетки, многослойные таблетки, капсулы, каплеты и т.д., из которых лекарство по существу не высвобождается в рот или в полости рта.
В настоящем документе термины «высвобождение» и «скорость высвобождения» используются взаимозаменяемо для обозначения выделения или высвобождения вещества, включая, без ограничений, лекарственное средство, из лекарственной формы в окружающую среду, такую как водная среда, либо среда in vitro или in vivo.
В настоящем документе термин «липофильный» при использовании в комбинации с обоими твердой и жидкой липофильными добавками (в качестве альтернативы в дальнейшем обозначаемыми «ЛД») относится к добавкам, которые «любят» масло и в общем имеют низкую растворимость в воде или не растворяются в воде. Термин «липофильные поверхностно-активные вещества» (в качестве альтернативы в дальнейшем обозначаемые «ЛПА») относится к липофильным добавкам, которые имеют значения гидрофильно-липофильного баланса (ГЛБ), составляющие 10 или менее, предпочтительно от 2 до 10. С другой стороны, термин «гидрофильный» при использовании в комбинации с обоими твердой и жидкой гидрофильными добавками (в качестве альтернативы в дальнейшем обозначаемыми «ГД») относится к добавкам, которые «любят» воду и в общем имеют среднюю или хорошую растворимость в воде. «Гидрофильные поверхностно-активные вещества» (в качестве альтернативы в дальнейшем обозначаемые «ГПА») представляют собой гидрофильные добавки, обладающие значительными поверхностно-активными свойствами и имеют значения ГЛБ более 10.
В настоящем документе термин «липид» или «липидное вещество», используемый в связи с различными соединениями, относится к жирной кислоте (если не указано иное, имеющей длину цепи больше чем С6) или сложным эфирам жирных кислот или глицеридам сложных эфиров жирных кислот, их смесям и производным, не включая, тем не менее, их соли.
В некоторых аспектах настоящего изобретения высвобождение лекарственного средства может представлять собой контролируемое высвобождение. В настоящем документе термин «контролируемое высвобождение» означает высвобождение лекарственного средства из лекарственной формы в соответствии с заданным профилем. В некоторых аспектам выбранное контролируемое высвобождение может быть промежуточным, отсроченным, пролонгированным, замедленным, пульсирующим, высвобождением в желудок, тонкий кишечник или в ободочную и толстую кишку. В другом аспекте комбинации вышеуказанных профилей высвобождения могут быть использованы для того, чтобы достичь конкретных результатов доставки, таких как немедленного высвобождения с последующим отсроченным и/или замедленным высвобождением активного агента.
В настоящем документе композиция или лекарственная форма обеспечивает «немедленное высвобождение», когда более чем примерно 90% лекарственного средства высвобождается после первых 30 минут в искусственный желудочный сок (ИЖС) согласно USP с ферментом или без фермента.
В настоящем документе термин «поддержание беременности» при использовании для описания функциональности пероральных композиций или лекарственных форм согласно настоящему изобретению может относиться к обеспечению экзогенной прогестагенной поддержки от зачатия до родов, включая, но не ограничиваясь только ими, преждевременные роды, преждевременные схватки и выкидыш. Поддержание беременности может обеспечить улучшенное качество беременности для беременной женщины, плода или обоих. Кроме того, поддержание беременности может также включать повышение фертильности для женщины, пытающейся забеременеть.
В настоящем документе термин «поддержка при отсутствии беременности» при использовании для описания функциональности пероральных композиций или лекарственных форм согласно настоящему изобретению может относиться к состояниям, которые требуют экзогенной добавки прогестогенного агента небеременному субъекту, например, небеременной женщине, включая, но не ограничиваясь только ими, случаи задержки или предотвращения возникновения нежелательной беременности, предотвращения или лечения состояний, обусловленных дефицитом прогестерона, таких как аменорея, фиброиды, контрацепция, подавление послеродовой лактации, лечения дисфункциональных маточных кровотечений, эндометриоза, гиперплазии эндометрия, гиперплазии шейки матки, заместительной гормональной терапии, лечения гиповентиляции, профилактики и лечения остеопороза, наблюдения за состоянием груди, гипотиреоза, мигреневых головных болей, синдрома дисфункции височно-нижнечелюстного сустава, менструальной эпилепсии, карцином эндометрия и/или почечных карцином. В одном из вариантов реализации термин поддержка «при отсутствии беременности» при использовании для описания функциональности пероральных композиций или лекарственных форм согласно настоящему изобретению может относиться к состояниям, которые требуют экзогенной добавки прогестогенного агента согласно изобретению мужчине, например, для осуществления контрацепции, для противостояния эстрогенной активности и т.д. Следует отметить, что настоящие композиции и лекарственные формы сложного эфира 17-гидроксипрогестерона можно вводить отдельно или в комбинации с другой терапией. В другом варианте реализации настоящего изобретения композиции и лекарственные формы сложного эфира 17-гидроксипрогестерона можно применять для дополнения, увеличения, уменьшения, лечения, излечения или предотвращения или для обеспечения профилактики у субъекта, нуждающегося в этом.
В настоящем документе термин «эффективное количество» или «терапевтически эффективное количество» лекарственного средства относится к нетоксичному, но достаточному количеству лекарственного средства для достижения терапевтических результатов в лечении состояния, для которого известно, что данное лекарственное средство является эффективным. Понятно, что различные биологические факторы могут повлиять на способность вещества к реализации намеченной для него задачи. Таким образом, «эффективное количество» или «терапевтически эффективное количество» может зависеть в некоторых случаях от таких биологических факторов. Кроме того, несмотря на то, что достижение терапевтического эффекта может быть измерено врачом или другим квалифицированным медицинским персоналом с использованием методов оценки известных в данной области, следует понимать, что индивидуальные различия и ответ на лечение могут сделать достижение терапевтического эффекта несколько субъективным решением. Определение эффективного количества находится в пределах компетенции среднего специалиста в области фармацевтических наук и медицины. См., например, публикацию Meiner and Tonascia, "Clinical Trials: Design, Conduct, and Analysis", Monographs in Epidemiology and Biostatistics, Vol. 8 (1986), включенную в настоящий документ посредством ссылки.
В настоящем документе термин «примерно» используется для обеспечения гибкости числового диапазона конечной точке при условии, что данное значение может быть «немного выше» или «немного ниже» конечной точки. В настоящем документе множество элементов, структурных элементов, композиционных элементов и/или материалов могут быть представлены в общем списке для удобства. Тем не менее, эти списки должны быть истолкованы таким образом, как если бы каждый элемент списка индивидуально был определен в качестве отдельного и уникального элемента. Таким образом, ни один элемент такого списка не должен быть истолкован как де-факто эквивалент любого другого элемента того же списка исключительно на основе на их присутствия в общей группе без указаний на противоположное.
Концентрации, количества, уровни и другие числовые данные могут быть выражены или представлены в настоящем документе в формате диапазона. Следует понимать, что такой формат диапазона используется только для удобства и краткости и, таким образом, его следует интерпретировать гибко как включающий не только числовые значения, в явном виде перечисленные в качестве пределов диапазона, но также включающий все отдельные числовые значения или поддиапазоны, входящие в этот диапазон как если бы каждое числовое значение и поддиапазон были бы явно указаны. В качестве иллюстрации, числовой диапазон «от примерно 1 до примерно 5» следует толковать как включающий не только явно перечисленные значения от примерно 1 до примерно 5, но также включающий отдельные значения и поддиапазоны в пределах указанного диапазона. Таким образом, в данный числовой диапазон включены отдельные значения, такие как 2, 3 и 4, и поддиапазоны, такие как от 1 до 3, от 2 до 4 и от 3 до 5, и т.д., а также отдельно 1, 2, 3, 4 и 5. Этот же принцип применим и к диапазонам, в которых указано только одно числовое значение в качестве минимума или максимума. Кроме того, такая интерпретация должна применяться независимо от широты диапазона или описываемых характеристик.
Изобретение
Далее будут подробно описаны предпочтительные варианты реализации изобретения.
Несмотря на то, что настоящее изобретение будет описано в связи с предпочтительными вариантами реализации, следует понимать, что не предполагается ограничения настоящего изобретения данными предпочтительными вариантами реализации. Напротив, предполагается, что настоящее изобретение охватывает альтернативы, варианты, модификации и эквиваленты, которые могут быть включены в рамки сущности и объема изобретения, определенные в прилагаемой формуле изобретения.
Во время беременности, как было показано, уровни сывороточного прогестагена, в том числе прогестерона и 17-гидроксипрогестерона у беременных женщин снижаются в случаях внутриутробной гибели, преждевременных схваток, угрозы преждевременных схваток, преждевременного разрыва плодных оболочек, амнионита и отслойки плаценты. Как обсуждалось выше, было обнаружено, что сложные эфиры 17-гидроксипрогестерона имеют потенциал для применения во время беременности для лечения и/или предотвращения следующих состояний и случаев: самопроизвольный аборт у женщин, которые имели предыдущие самопроизвольные аборты, неоднократные самопроизвольные аборты в анамнезе, предыдущее мертворождение, предыдущие преждевременные роды (<37 недель), предыдущий преждевременный (<37 недель) разрыв плодных оболочек, или ПРПО (PROM), гипертензию или токсемию, связанную с предыдущей беременностью, предыдущую отслойку плаценты, угрозу преждевременных родов или серкляж, многоплодную беременность, первичное или вторичное бесплодие, врожденные аномалии матки или любое другое состояние, при котором уровни эндогенного прогестагена (например, прогестерона) ниже, чем при нормальной беременности.
Первичные и вторичные критерии оценки могут быть использованы для определения необходимости и/или эффективности дополнительной терапии сложным эфиром 17-гидроксипрогестерона для поддержания конкретного субъекта, связанной с беременностью, и ее прямого или косвенного воздействия на новорожденных. Типичные первичные и вторичные критерии оценки преждевременных родов и преждевременных схваток включают, без ограничения:
Первичные критерии оценки (по матери):
1. Перинатальная смертность
2. Преждевременные роды (менее чем на 32 неделе беременности)
3. Преждевременные роды (менее чем на 34 неделе беременности)
4. Преждевременные роды (менее чем на 37 неделе беременности)
5. Дополнительная информация о значительных нейро-психических трудностях
Вторичные критерии оценки (по матери):
1. Угроза преждевременных схваток
2. Предсхваточный спонтанный разрыв околоплодных оболочек
3. Неблагоприятные реакции на лекарственные средства
4. Продление беременности (интервал между рандомизацией и родами)
5. Тип родов
6. Количество случаев дородовой госпитализации
7. Удовлетворенность терапией
8. Применение токолиза
Вторичные критерии оценки (младенец):
1. Роды до 37 полных недель
2. Роды до 34 полных недель
3. Роды до 32 полных недель
4. Роды до 28 полных недель
5. Вес при рождении менее трети от веса для гестационного возраста
6. Вес при рождении менее 2500 г
7. Балл по шкале Апгара менее семи на пять минут
8. Синдром дыхательных расстройств
9. Применение механической вентиляции
10. Продолжительность искусственной вентиляции
11. Внутрижелудочковое кровоизлияние - степени IIII или IV
12. Перивентрикулярная лейкомаляция
13. Ретинопатия недоношенных
14. Ретинопатия недоношенных - степени III или IV
15. Хроническое заболевание легких
16. Некротический энтероколит
17. Сепсис новорожденных
18. Гибель плода
19. Неонатальная смертность
20. Госпитализация в отделение интенсивной терапии новорожденных
21. Продолжительность пребывания новорожденного в стационаре
22. Тератогенные эффекты (в том числе маскуланизация младенцев женского пола)
Вторичные критерии оценки (ребенок):
1. Значительные нейросенсорные нарушения (определяется как любое нарушение, выбранное из слепоты, нейросенсорной глухоты, требующей слухового аппарата, среднего или тяжелого церебрального паралича или развития задержки или интеллектуального нарушения)
2. Задержка развития
3. Интеллектуальная недостаточность
4. Двигательная недостаточность
5. Нарушение зрения
6. Слепота
7. Глухота
8. Нарушение слуха
9. Церебральный паралич
10. Поведение ребенка
11. Темперамент ребенка
12. Трудности обучения
13. Дополнительная информация о характеристиках роста в детстве (вес, окружность головы, рост, толщина кожной складки)
Экстракорпоральное оплодотворение
1. Первичные критерии оценки:
1.1. Скорость наступления беременности
1.2. Рождение живого ребенка
1.3. Текущая скорость наступления беременности
1.4. Клиническая беременность, определяемая по ультразвуковым доказательствам сердечной деятельности плода на 6-8 неделе беременности
1.5. Жизнеспособность плода, измеряемая по сердцебиению
1.6. Скорость полного аборта 24-48 часов после получения медицинского лечения при ранней патологии беременности.
2. Вторичные критерии оценки:
2.1. Клиническая беременность
2.2. Скорость цикла отмены
2.3. Количество образовавшихся ооцитов
2.4. Количество образовавшихся эмбрионов
2.5. Оценка гормонов сыворотки
2.6. Оценка фолликулярной жидкости
2.7. Пиковый уровень эстрадиола
2.8. Ампулы гонадотропинов, необходимые во время стимуляции яичников
2.9. Количество дней стимуляции яичников
2.10. Количество возвращенных ооцитов
2.11. Количество перенесенных эмбрионов
2.12. Количество замороженных эмбрионов
2.13. Класс эмбриона
2.14. Скорость имплантации
2.15. Скорость выкидыша
2.16. Исход беременности
2.17. Скорость полного аборта за одну неделю, время удаления продуктов зачатия, корреляция скоростей абортов с уровнями 17-гидроксипрогестерона в сыворотке и тип патологии беременности, количество дней кровотечения и удовлетворенность пациента
2.18. Реакция яичников [оценивается по завершении контролируемой стимуляции яичников и процедуры сбора яиц]
Выкидыш
1. Первичные результаты
1.1. Выкидыш
1.2. Ранний выкидыш на сроке до 12 недель
1.3. Выкидыш позже 12 недель и меньше 23 недель
1.4. Отношение цитокинов ИФН/ИЛ-10
1.5. Клиническая скорость наступления беременности через 8 недель и 12 недель беременности
2. Первичные результаты
2.1. Мать
a. Облегчение боли (угроза выкидыша)
b. Тяжесть «утренней тошноты» - усиленная головная боль
c. тошнота, болезненность молочных желез
d. сообщения о тромбоэмболических явлениях
e. Тромболитические явления
f. депрессия
g. госпитализация в отделение интенсивной терапии
h. последующая фертильность
i. уровень прогестерон-индуцируемого блокирующего фактора (ПИБФ)
j. частота сокращений матки
2.2. Ребенок
a. преждевременные роды;
b. мертворождение;
c. смерть новорожденного;
d. низкий вес при рождении, менее 2500 г
e. генитальные аномалии плода;
f. тератогенные эффекты (нарушающие нормальное развитие плода);
g. госпитализация в отделение интенсивной терапии.
2.3. Общие
a. Внутриутробная смерть плода
b. Мертворождение
c. Относящиеся к плоду
d. Исследовательский анализ исхода беременности путем мониторинга биохимических и клинических показателей беременности, еженедельная оценка сывороточного прогестерона
e. брутто-коэффициент рождаемости, скорость отмены цикла, частота самопроизвольных абортов, скорость наступления биохимической беременности, частота внематочной беременности.
Для прогнозирования преждевременных родов (ПВР) используют несколько биомаркеров. Известно, что среди женщин, имеющих симптомы, отношение правдоподобия (LR+), позволяющее прогнозировать ПВР, составляет больше чем 10 для интерлейкина-6 (ИЛ-6) амниотической жидкости (АЖ), Ureaplasma urealyticum АЖ, а также мультимаркера, состоящего из цервикального ИЛ-6, цервикального ИЛ-8 и длины шейки матки (ДШМ). Также известно, что LR+ составляет от 5 до 10 для С-реактивного белка (СРБ) сыворотки. Для кортикотропин-рилизинг-гормона (КРГ) сыворотки, цервикального ИЛ-6, релаксина сыворотки было зарегистрировано LR+, составляющее от 2,5 до 5.
У женщин при отсутствии симптомов допущенные к применению маркеры Urealyticum и мультимаркер, состоящий из пяти отдельных маркеров [фФН, ДШМ, альфа-фетопротеина (АФП) сыворотки, щелочной фосфатазы сыворотки и гранулоцитарного колониестимулирующего фактора (Г-КСФ) сыворотки], позволяют предсказывать ПВР с LR+ больше чем 10. LR+ составляло от 5 до 10 для релаксина сыворотки и ДШМ. Все значения LR+, зарегистрированные для щелочной фосфатазы сыворотки, эстриола слюны, КРГ сыворотки, Г-КСФ сыворотки, цервикального ИЛ-6, ИЛ-6 АЖ, цервикального фФН, АФП и хламидии, находились в диапазоне между 2,5 и 5. Наконец, LR+ ниже 2,5 было установлено для ферритина сыворотки, СРБ сыворотки, бактериального вагиноза (БВ) и цервикального ферритина.
Выкидыши и возможные выкидыши можно классифицировать несколькими способами: А) угрожающий или возможный выкидыш - состояние, при котором до 20 недель возникает какое-либо маточное кровотечение, но шейка матки закрыта и плод жив; В) неизбежный аборт или выкидыш ("неизбежный" означает, что он не может быть остановлен, в частности, если до 20 недель возникает маточное кровотечение и шейка матки открывается, но ни плод, ни плацента не выходят из организма женщины) - околоплодные оболочки могут иметь или не иметь разрывов (нарушений); C) неполный аборт или выкидыш - состояние, при котором часть плода или плаценты выходит из матки до 20 недель беременности, в то время как часть плаценты или плода остается в матке; D) полный выкидыш - полное изгнание всех околоплодных оболочек и плаценты и закрытие шейки матки до 20 недель; E) несостоявшийся аборт или замершая беременность - гибель плода до 20 недель беременности, при которой ни плод, ни плацента не выталкиваются из матки; F) повторный выкидыш - считают, что у женщины повторный выкидыш, после того как у нее уже было два или более выкидыша подряд; G) погибшее плодное яйцо или анэмбриональная беременность - случается, если после семи недель внутри матки образуется плодное яйцо, но плод отсутствует.
Угроза выкидыша, о которой свидетельствует низкий уровень эндогенного прогестерона или 17-гидроксипрогестерона или вагинальное кровотечение, сопровождаемое или не сопровождаемое коликами в животе в течение 26 недель после зачатия, является частым осложнением беременности. Она возникает примерно в 20% случаев установленной беременности. Риск выкидыша увеличивается у более старших женщин и женщин с выкидышем в анамнезе.
Было показано, что низкие уровни прогестагена сыворотки (прогестерона или 17ГП) или хорионического гонадотропина человека (ХГЧ) являются факторами риска выкидыша. Угроза выкидыша вызывает значительный стресс и тревогу у беременной женщины. Поскольку сложные эфиры 17-гидроксипрогестерона взаимодействуют с рецептором прогестерона, полагают, что лечение сложными эфирами 17-гидроксипрогестерона может быть разработано на основе уровней прогестерона. Одним диагностическим критерием является низкий уровень прогестерона сыворотки, но уровни сильно варьируют на ранних сроках беременности, а любое более позднее снижение может быть объяснено дисфункцией плаценты. Тем не менее, поддержание лютеиновой фазы широко применяют для устранения угрозы выкидыша. В первом триместре беременности риск выкидыша обнаруживается при снижении уровней прогестерона сыворотки. Уровни <5 нг/мл были соотнесены с самопроизвольным выкидышем в 86% случаев по сравнению с всего лишь 8% при уровнях 20-25 нг/мл. Пороговое значение, равное 14 нг/мл, как сообщают, позволяет дифференцировать жизнеспособные и несохраняющиеся беременности. Другие биомаркеры сыворотки матери, такие как опухолевый маркер СА-125, ингибин А, анандамид и прогестерон-индуцируемый блокирующий фактор (ПИБФ), также являются хорошими индикаторами риска выкидыша.
В одном из вариантов реализации композиции согласно настоящему изобретению предназначены для обеспечения увеличения базового уровня эндогенного прогестерона и/или 17-гидроксипрогестерона. В конкретном варианте реализации увеличение базового уровня эндогенного прогестерона может быть больше чем 10%. Прогестагены также оказывают непосредственный фармакологический эффект за счет снижения синтеза простагландинов, приводящий к расслаблению гладкой мускулатуры матки и предотвращению нежелательных сокращений, в результате которых может произойти выкидыш.
Несмотря на то, что пероральные лекарственные формы и способы согласно настоящему изобретению могут быть применены для большинства испытуемых женщин, наиболее подходящими пациентами для перорального приема сложного эфира 17-гидроксипрогестерона согласно настоящему изобретению являются те, которые имеют один или более из следующих состояний, симптомов и/или потребностей: 1) потребность в противовоспалительных средствах; 2) дефицит прогестерона при базовом уровне прогестерона, характеризующемся Сср<14 нг/мл, в начале (первом триместре) беременности или базовых уровнях прогестерона, характеризующихся Сср менее 50 нг/мл, в конце (втором и третьем триместре) беременности; 3) наличие генетической вариации гена SERPINH1, которая вызывает выработку сниженного количества белка, коллагена, что может привести к ослаблению околоплодных оболочек; 4) наличие генетического варианта гена пролилкарбоксипептидазы, ассоциированного с преэклампсией; 5) наличие некоторых бактериальных инфекций (бактериального вагиноза), включая Ureaplasma urealyticum, Mycoplasma Hominis, Gardnerella vaginalis и Peptostreptococcus и виды Bacteroides; 6) наличие аномального метаболома амниотической жидкости (сумма всех метаболических процессов, происходящих в амниотической жидкости), указывающего на риск невынашивания; 7) превышающее средние показатели суммарное воздействие фталатов; 8) аномальный для состояния беременности индекс массы тела; 9) наличие воспалительной микросреды во влагалище на ранних сроках беременности; 10) повышенные уровни урокортина в плазме матери; 11) повышенная активность матки, отмеченная посредством мониторинга активности матки в домашних условиях; 12) положительный анализ на уровни эстриола слюны, служащий основанием для прогноза преждевременных родов; 13) получение настораживающих результатов скрининга на фетальный фибронектин (СфФН); 14) необычное укорочение шейки матки относительно срока беременности, измеренное с помощью УЗИ шейки матки или трансвагинального УЗИ или пальцевого исследования с/без применения прибора для измерения длины шейки матки Cervilenz™; 15) необычные уровни биомаркеров сыворотки матери, таких как опухолевый маркер СА-125, или ингибин А, или анандамид, или прогестерон-индуцируемый блокирующий фактор (ПИБФ); 16) несбалансированное соотношение уровней Th-1-цитокинов и Th-2-цитокинов, таких как ИФН и ИЛ-10.
Кроме поддержания беременности, другие потенциальные применения пероральных лекарственных форм согласно настоящему изобретению, содержащих сложный эфир 17-гидроксипрогестерона, включают, но не ограничиваются перечисленными: a) предотвращение доминирования эстрогена; b) стимулирование образования новой костной ткани и предотвращения/инвертирования течения процесса остеопороза; c) обеспечение предшественников гормонов коры надпочечников (кортикостероидов); d) лечение ряда кожных проблем, таких как акне у взрослых женщин, себорея, розацеа, псориаз и кератоз; e) способствование образованию миелиновой оболочки для защиты нервных волокон и ускорения сигналов нервной системы; f) лечение сопровождающей ПМС депрессии, климакса, послеродовой депрессии и т.д.; g) защита от повреждения головного/спинного мозга, инсульта и/или кровоизлияния.
В одном из вариантов реализации согласно настоящему изобретению предложены пероральные лекарственные формы, содержащие сложные эфиры 17-гидроксипрогестерона, а также соответствующие способы. Пероральные лекарственные формы могут быть приготовлены для поддержания беременности и могут содержать терапевтически эффективное количество сложного эфира 17-гидроксипрогестерона и фармацевтически приемлемый носитель. Из пероральной лекарственной формы через 60 минут может, при измерении с использованием аппарата для растворения 2 го типа согласно USP в 900 мл деионизированной воды с 0,5 (масс./об.) лаурилсульфата натрия при 50 об/мин при 37°C, высвобождаться по меньшей мере 20 масс. % от дозы сложного эфира 17-гидроксипрогестерона. В еще одном дополнительном варианте реализации из указанной пероральной лекарственной формы через 60 минут может, при измерении с использованием аппарата для растворения 2 го типа согласно USP в 900 мл деионизированной воды с 0,5 (масс./об.) лаурилсульфата натрия при 50 об/мин при 37°C, высвобождаться по меньшей мере на 20 масс. % больше сложного эфира 17-гидроксипрогестерона, чем из эквивалентно вводимой пероральной лекарственной формы без носителя.
Ряд сложных эфиров 17-гидроксипрогестерона могут быть использованы в композициях и пероральных лекарственных формах согласно настоящему изобретению. Примеры конкретных приемлемых сложных эфиров 17-гидроксипрогестерона включают, без ограничения, ацетатные эфиры 17-гидроксипрогестерона, капроатные эфиры 17-гидроксипрогестерона, ундеканоатные эфиры 17-гидроксипрогестерона и т.п. и их комбинации. Другие фармакологически активные и приемлемые сложные эфиры 17-гидроксипрогестерона также могут быть получены и использованы в соответствии с вариантами реализации согласно настоящему изобретению, если они обеспечивают требуемую поддержку в состояниях беременности и/или отсутствия беременности.
Сложный эфир 17-гидроксипрогестерона может присутствовать в композициях и пероральных лекарственных формах согласно настоящему изобретению в различных формах. В одном из вариантов реализации сложный эфир 17-гидроксипрогестерона может присутствовать в форме частиц. В одном из вариантов реализации сложный эфир 17-гидроксипрогестерона может присутствовать в форме частиц. Форма частиц может иметь средний диаметр примерно 50 мкм или менее. Форма частиц может иметь средний диаметр примерно 25 мкм или менее. В другом варианте реализации форма частиц может иметь средний диаметр примерно 1 мкм или менее. В другом варианте реализации сложный эфир 17-гидроксипрогестерона может присутствовать в полностью растворенной форме. В другом варианте реализации сложный эфир 17-гидроксипрогестерона может присутствовать в частично растворенной форме. В другом варианте реализации часть сложного эфира 17-гидроксипрогестерона, присутствующая в композиции и/или лекарственной форме, может быть представлена в форме частиц или нерастворенной форме. В некоторых вариантах реализации сложный эфир 17-гидроксипрогестерона может присутствовать как в растворенной форме, так и в форме частиц.
В некоторых вариантах реализации носитель в композициях или пероральных лекарственных формах согласно настоящему изобретению может функционировать с облегчением доставки, высвобождения и/или биодоступности сложного эфира 17-гидроксипрогестерона. В некоторых аспектах, носитель может представлять собой одно соединение или смесь двух или более соединений. Носитель может содержать добавку по меньшей мере одного из липофильных и/или гидрофильных компонентов. Липофильные и гидрофильные добавки, которые могут быть использованы в композициях согласно настоящему изобретению, могут быть выбраны из различных классов фармацевтических вспомогательных веществ, включая, но не ограничиваясь только ими, абсорбенты, кислоты, добавки, антикомкователи, противосклеивающие агенты, пеногасители, антикоагулянты, антимикробные вещества, антиоксиданты, противовоспалительные вещества, вяжущие вещества, антисептики, основания, связующие вещества, буферные вещества, хелатирующие агенты, усилители экскреции, целлюлозы, коагулянты, покрывающие агенты, окрашивающие вещества, красители, пигменты, комплексообразующие агенты, регуляторы роста кристаллов, денатуранты, влагопоглотители, осушители, дегидратирующие агенты, разбавители, разрыхлители, диспергаторы, смягчающие вещества, эмульгаторы, герметики, ферменты, расширители, наполнители, агенты, маскирующие вкус, ароматизаторы, отдушки, гелеобразующие агенты, вещества, способствующие скольжению, отвердители, вещества, увеличивающие жесткость, гигроскопические вещества, смазывающие вещества, увлажнители, агенты, регулирующие pH, пластификаторы, успокаивающие агенты, смягчающие средства, замедлители схватывания, усилители растекания, стабилизаторы, суспендирующие агенты, подсластители, загустители, регуляторы консистенции, поверхностно-активные вещества, замутнители, полимеры, консерванты, антигелеобразователи, вещества для контроля реологии, размягчители, солюбилизаторы; вспомогательные растворители, модуляторы вязкости, поглотители УФ-излучения или их комбинации. В некоторых вариантах реализации могут быть использованы добавки из нескольких классов или типов.
Неограничивающие примеры соединений, которые могут полностью или частично составлять носитель, указаны в следующих списках, упорядоченных по общим категориям. Следует понимать, что категории не предназначены для ограничения конкретных соединений-носителей, но просто присутствуют для облегчения упорядочивания и представления. С учетом этого, типовые соединения-носители могут включать одно или более из следующих:
Триглицериды, такие как масла дерева Aceituno; миндальное масло; арахисовое масло; масло бабассу; масло из семян черной смородины; масло огуречника; каноловое масло (Lipex 108 (Abitec)); касторовое масло; масло какао; кокосовое масло (Pureco 76 (Abitec)); кофейное масло; кукурузное масло; хлопковое масло; масло крамбе; масло трав видов рода Куфея (Cuphea); масло примулы вечерней, масло из виноградных косточек; арахисовое масло; конопляное масло; масло из ореха бассия; масло из семян капок; льняное масло; жир менхадена; масло из семян мадуки длиннолистной; масло из семян горчицы; ойтиковое масло; оливковое масло; пальмовое масло; пальмоядровое масло; арахисовое масло; масло из семян мака; рапсовое масло; масло из рисовых отрубей; сафлоровое масло; жир усача; кунжутное масло; жир печени акулы; масло ореха ши; соевое масло; масло стиллингии; подсолнечное масло; талловое масло; масло из семян чайного дерева; масло из семян табака; тунговое масло (китайское древесное масло): масло вернонии; масло зародышей пшеницы; гидрогенизированное касторовое масло (Castorwax); гидрогенизированное кокосовое масло (Pureco 100 (Abitec)); гидрогенизированное хлопковое масло (Dritex С (Abitec)); гидрогенизированное пальмовое масло (Dritex PST (Abitec); Softisan 154 (Huls)); гидрогенизированное соевое масло (Sterotex НМ NF (Abitec); Dritex S (Abitec)); гидрогенизированное растительное масло (Sterotex NF (Abitec); Hydrokote M (Abitec)); гидрогенизированное хлопковое и касторовое масло (Sterotex K (Abitec)); частично гидрогенизированное соевое масло (Hydrokote АР5 (Abitec)); частично гидрогенизированное соевое и хлопковое масло (Apex B (Abitec)); глицерилтрибутират (Sigma); глицерилтрикапроат (Sigma); глицерилтрикаприлат (Sigma); глицерилтрикапрат (Captex 1000 (Abitec)); глицерилтриундеканоат (Captex 8227 (Abitec)); глицерилтрилаурат (Sigma); глицерилтримиристат (Dynasan 114 (Huls)); глицерилтрипальмитат (Dynasan 116 (Huls)); глицерилтристеарат (Dynasan 118 (Huls)); глицерилтриарцидат (Sigma); глицерилтримиристолеат (Sigma); глицерилтрипальмитолеат (Sigma); глицерилтриолеат (Sigma); глицерилтрилинолеат (Sigma); глицерилтрикаприлат/капрат (Captex 300 (Abitec); Captex 355 (Abitec); Miglyol 810 (Huls); Miglyol 812 (Huls)); глицерилтрикаприлат/капрат/лаурат (Captex 350 (Abitec)); глицерилтрикаприлат/капрат/линолеат (Captex 810 (Abitec); Miglyol 818 (Huls)); глицерилтрикаприлат/капрат/стеарат (Softisan 378 (Huls); (Larodan); глицерилтрикаприлат/лаурат/стеарат (Larodan); глицерил-1,2-каприлат-3-линолеат (Larodan); глицерил-1,2-капрат-3-стеарат (Larodan); глицерил-1,2-лаурат-3-мирирстат (Larodan); глицерил-1,2-миристат-3-лаурат (Larodan); глицерил-1,3-пальмитат-2-бутират (Larodan); глицерил-1,3-стеарат-2-капрат (Larodan); глицерил-1,2-линолеат-3-каприлат (Larodan), их смеси и производные. Фракционированные триглицериды, модифицированные триглицериды, синтетические триглицериды и смеси триглицеридов также находятся в рамках настоящего изобретения.
Поверхностно-активные вещества на основе ПЭГ-моноэфиров жирных кислот (указано название соединения (распространенное коммерческое название продукта (поставщик) (гидрофильно-липофильный баланс, ГЛБ)): ПЭГ 4-100-монолаурат (партия Crodet L (Croda) (>9)); ПЭГ 4-100-моноолеат (партия Crodet O (Croda) (>8)); ПЭГ 4-100-моностеарат (партия Crodet S (Croda), партия Myrj (Atlas/ICI) (>6)); ПЭГ 400-дистеарат (партия Cithrol 4DS (Croda) (>10)); ПЭГ 100, 200, 300-монолаурат (партия Cithrol ML (Croda) (>10)); ПЭГ 100, 200, 300-моноолеат (партия Cithrol МО (Croda) (>10)); ПЭГ 400-диолеат (партия Cithrol 4DO (Croda) (>10)); ПЭГ 400-1000-моностеарат (партия Cithrol MS (Croda) (>10)); ПЭГ-1-стеарат (Nikkol MYS-1EX (Nikko), Coster K1 (Condea) (2)); ПЭГ-2-стеарат (Nikkol MYS-2 (Nikko) (4)); ПЭГ-2-олеат (Nikkol MYO-2 (Nikko) (4,5)); ПЭГ-4-лаурат (Mapeg® 200 ML (PPG), Kessco® PEG 200 ML (Stepan), LIPOPEG 2 L (LIPO Chem.) (9,3)); ПЭГ-4-олеат (Mapeg® 200 MO (PPG), Kessco® PEG 200 MO (Stepan) (8,3)); ПЭГ-4-стеарат (Kessco® PEG 200 MS (Stepan), Hodag 20 S (Calgene), Nikkol MYS-4 (Nikko) (6,5)); ПЭГ-5-стеарат (Nikkol TMGS-5 (Nikko) (9,5)); ПЭГ-5-олеат (Nikkol TMGO-5 (Nikko) (9,5)); ПЭГ-6-олеат (Algon OL 60 (Auschem SpA), Kessco® PEG 300 MO (Stepan), Nikkol MYO-6 (Nikko), Emulgante A6 (Condea) (8,5)); ПЭГ-7-олеат (Algon OL 70 (Auschem SpA) (10,4)); ПЭГ-6-лаурат (Kessco® PEG 300 ML (Stepan) (11,4)); ПЭГ-7-лаурат (Lauridac 7 (Condea) (13)); ПЭГ-6-стеарат (Kessco® PEG300 MS (Stepan) (9,7)); ПЭГ-8-лаурат (Mapeg® 400 ML (PPG), LIPOPEG 4DL (Lipo Chem.) (13)); ПЭГ-8-олеат (Mapeg® 400 MO (PPG), Emulgante A8 (Condea) (12)); ПЭГ-8-стеарат (Mapeg® 400 MS (PPG), Myrj 45 (12)); ПЭГ-9-олеат (Emulgante A9 (Condea) (>10)); ПЭГ-9-стеарат (Cremophor S9 (BASF) (>10)); ПЭГ-10-лаурат (Nikkol MYL-10 (Nikko), Lauridac 10 (Croda) (13)); ПЭГ-10-олеат (Nikkol MYO-10 (Nikko) (11)); ПЭГ-12-стеарат (Nikkol MYS-10 (Nikko), Coster K100 (Condea) (11)); ПЭГ-12-лаурат (Kessco® PEG 600 ML (Stepan) (15)); ПЭГ-12-олеат (Kessco® PEG 600 MO (Stepan) (14)); ПЭГ-12-рицинолеат (CAS # 9004-97-1) (>10)); ПЭГ-12-стеарат (Mapeg® 600 MS (PPG), Kessco® PEG 600 MS (Stepan) (14)); ПЭГ-15-стеарат (Nikkol TMGS-15 (Nikko), Koster K15 (Ccmdea) (14)); ПЭГ-15-олеат (Nikkol TMGO-15 (Nikko) (15)); ПЭГ-20-лаурат (Kessco® PEG 1000 ML (Stepan) (17)); ПЭГ-20-олеат (Kessco® PEG 1000 MO (Stepan) (15)); ПЭГ-20 стеарат (Mapeg® 1000 MS (PPG), Kessco® PEG 1000 MS (Stepan), Myrj 49 (16)); ПЭГ-25-стеарат (Nikkol MYS-25 (Nikko) (15)); ПЭГ-32-лаурат (Kessco® PEG 1540 ML (Stepan) (16)); ПЭГ-32-олеат (Kessco® PEG 1540 MO (Stepan) (17)); ПЭГ-32-стеарат (Kessco® PEG 1540 MS (Stepan) (17)); ПЭГ-30-стеарат (Myrj 51 (>10)); ПЭГ-40-лаурат (Crodet L40 (Croda) (17,9)); ПЭГ-40-олеат (Crodet O40 (Croda) (17,4)); ПЭГ-40-стеарат (Myrj 52, Emerest® 2715 (Henkel), Nikkol MYS-40 (Nikko) (>10)); ПЭГ-45-стеарат (Nikkol MYS-45 (Nikko) (18)); ПЭГ-50-стеарат (Myrj 53 (>10)); ПЭГ-55-стеарат (Nikkol MYS-55 (Nikko) (18)); ПЭГ-100-олеат (Crodet O-100 (Croda) (18,8)); ПЭГ-100-стеарат (Myrj 59, Ariacel 165 (ICI) (19)); ПЭГ-200-олеат (Albunol 200 MO (Taiwan Surf.) (>10)); ПЭГ-400-олеат (LACTOMUL (Henkel), Albunol 400 MO (Taiwan Surf.) (>10)); ПЭГ-600-олеат (Albunol 600 MO (Taiwan Surf.) (>10)) и их комбинации.
ПЭГ-диэфиры жирных кислот (указано название соединения (распространенное коммерческое название продукта (поставщик) (ГЛБ)): ПЭГ-4-дилаурат (Mapeg® 200 DL (PPG), Kessco® PEG 200 DL (Stepan), LIPOPEG 2-DL (Lipo Chem.) (7)); ПЭГ-4-диолеат (Mapeg® 200 DO (PPG), (6)); ПЭГ-4-дистеарат (Kessco® 200 DS (Stepan) (5)); ПЭГ-6-дилаурат (Kessco® PEG 300 DL (Stepan) (9,8)); ПЭГ-6-диолеат (Kessco® PEG 300 DO (Stepan) (7,2)); ПЭГ-6-дистеарат (Kessco® PEG 300 DS (Stepan) (6,5)); ПЭГ-8 дилаурат (Mapeg® 400 DL (PPG), Kessco® PEG 400 DL (Stepan), LIPOPEG 4 DL (Lipo Chem.) (11)); ПЭГ-8 диолеат (Mapeg® 400 DO (PPG), Kessco® PEG 400 DO (Stepan), LIPOPEG 4 DO (Lipo Chem.) (8,8)); ПЭГ-8 дистеарат (Mapeg® 400 DS (PPG), CDS 400 (Nikkol) (11)); ПЭГ-10 дипальмитат (Polyaldo 2PKFG (>10)); ПЭГ-12 дилаурат (Kessco® PEG 600 DL (Stepan) (11,7)); ПЭГ-12 дистеарат (Kessco® PEG 600 DS (Stepan) (10,7)); ПЭГ-12 диолеат (Mapeg® 600 DO (PPG), Kessco® 600 DO (Stepan) (10)); ПЭГ-20 дилаурат (Kessco® PEG 1000 DL (Stepan) (15)); ПЭГ-20 диолеат (Kessco® PEG 1000 DO (Stepan) (13)); ПЭГ-20 дистеарат (Kessco® PEG 1000 DS (Stepan) (12)); ПЭГ-32 дилаурат (Kessco® PEG 1540 DL (Stepan) (16)); ПЭГ-32 диолеат (Kessco® PEG 1540 DO (Stepan) (15)); ПЭГ-32 дистеарат (Kessco® PEG 1540 DS (Stepan) (15)); ПЭГ-400 диолеат (партия Cithrol 4DO (Croda) (>10)); ПЭГ-400 дистеарат (партия Cithrol 4DS (Croda) (>10)) и их комбинации.
Смеси ПЭГ-моно- и диэфиров жирных кислот (указано название соединения (распространенное коммерческое название продукта (поставщик) (ГЛБ)): ПЭГ 4-150-моно-, дилаурат (Kessco® PEG 200-6000 mono, dilaurate (Stepan))); ПЭГ 4-150-моно-, диолеат (Kessco® PEG 200-6000 mono, dioleate (Stepan))); ПЭГ 4-150-моно-, дистеарат (Kessco® 200-6000 mono, distearate (Stepan)) и их комбинации.
Сложные эфиры жирных кислот и полиэтиленгликоля и глицерина (указано название соединения (распространенное коммерческое название продукта (поставщик) (ГЛБ)): ПЭГ-20-глицериллаурат (Tagat® L (Goldschmidt) (16)); ПЭГ-30-глицериллаурат (Tagat® L2 (Goldschmidt) (16)); ПЭГ-15-глицериллаурат (партия Glycerox L (Croda) (15)); ПЭГ-40-глицериллаурат (партия Glycerox L (Croda) (15)); ПЭГ-20-глицерилстеарат (Capmul® EMG (ABITEC), (13)); (Aldo® MS-20 KFG (Lonza))); ПЭГ-20-глицерилолеат (Tagat® О (Goldschmidt) (>10)); ПЭГ-30-глицерилолеат (Tagat® 02 (Goldschmidt) (>10)) и их комбинации.
Продукты переэтерификации масел спиртами: (указано название соединения (распространенное коммерческое название продукта (поставщик) (ГЛБ)): ПЭГ-3-касторовое масло (Nikkol СО-3 (Nikko) (3)); ПЭГ-5-, 9- и 16-касторовое масло (партия ACCONON СА (ABITEC) (6-7)); ПЭГ-20-касторовое масло (Emalex С-20 (Nihon Emulsion), Nikkol СО-20 ТХ (Nikko) (11)); ПЭГ-23-касторовое масло (Emulgante EL23 (>10)); ПЭГ-30-касторовое масло (Emalex С-30 (Nihon Emulsion), Alkamuls® EL 620 (Rhone-Poulenc), Incrocas 30 (Croda) (11)); ПЭГ-35-касторовое масло (Cremophor EL и EL-P (BASF), Emulphor EL, Incrocas-35(Croda), Emulgin RO 35 (Henkel))); ПЭГ-38-касторовое масло (Emulgante EL 65 (Condea))); ПЭГ-40-касторовое масло (Emalex C-40 (Nihon Emulsion), Alkamuls® EL 719 (Rhone-Poulenc) (13)); ПЭГ-50-касторовое масло (Emalex C-50 (Nihon Emulsion) (14)); ПЭГ-56-касторовое масло (Eumulgin® PRT 56 (Pulcra SA) (>10)); ПЭГ-60-касторовое масло (Nikkol CO-60TX (Nikko) (14)); ПЭГ-100-касторовое масло (Thomley (>10)); ПЭГ-200-касторовое масло (Eumulgin® PRT 200 (Pulcra SA) (>10)); ПЭГ-5-гидрогенизированное касторовое масло (Nikkol HCO-5 (Nikko) (6)); ПЭГ-7-гидрогенизированное касторовое масло (Simusol® 989 (Seppic), Cremophor WO7 (BASF) (6)); ПЭГ-10-гидрогенизированное касторовое масло (Nikkol НСО-10 (Nikko) (6,5)); ПЭГ-20-гидрогенизированное касторовое масло (Nikkol НСО-20 (Nikko) (11)); ПЭГ-25-гидрогенизированное касторовое масло (Simulsoi® 1292 (Seppic), Cerex ELS 250 (Auschem SpA) (11)); ПЭГ-30-гидрогенизированное касторовое масло (Nikkol НСО-30 (Nikko) (11)); ПЭГ-40-гидрогенизированное касторовое масло (Cremophor RH 40 (BASF), Croduret (Croda), Emulgin HRE 40 (Henkel) (13)); ПЭГ-45-гидрогенизированное касторовое масло (Cerex ELS 450 (Auschem Spa) (14)); ПЭГ-50-гидрогенизированное касторовое масло (Emalex HC-50 (Nihon Emulsion) (14)); ПЭГ-60-гидрогенизированное касторовое масло (Nikkol HCO-60 (Nikko); Cremophor RH 60 (BASF) (15)); ПЭГ-80-гидрогенизированное касторовое масло (Nikkol HCO-80 (Nikko) (15)); ПЭГ-100-гидрогенизированное касторовое масло (Nikkol НСО-100 (Nikko) (17)); ПЭГ-6-кукурузное масло (Labrafil® М 2125 CS (Gattefosse) (4)); ПЭГ-6-миндальное масло (Labrafil® М 1966 CS (Gattefosse) (4)); ПЭГ-6-масло абрикосовых косточек (Labrafil® М 1944 CS (Gattefosse) (4)); ПЭГ-6-оливковое масло (Labrafil® М 1980 С8 (Gattefosse) (4)); ПЭГ-6-арахисовое масло (Labrafil® М 1969 CS (Gattefosse) (4)); ПЭГ-6-гидрогенизированное пальмоядровое масло (Labrafil® М 2130 BS (Gattefosse) (4)); ПЭГ-6-пальмоядровое масло (Labrafil® М 2130 CS (Gattefosse) (4)); ПЭГ-6-триолеин (Labrafil® М 2735 CS (Gattefosse) (4)); ПЭГ-8-кукурузное масло (Labrafil® WL 2609 BS 5 (Gattefosse) (6-7)); ПЭГ-20-глицериды кукурузного масла (Crovol М40 (Croda) (10)); ПЭГ-20-глицериды миндального масла (Crovol А40 (Croda) (10)); ПЭГ-25-триолеат (TAGAT® TO (Goldschmidt) (11)); ПЭГ-40-пальмоядровое масло (Crovol PK-70 (>10)); ПЭГ-60-глицериды кукурузного масла (Crovol M70 (Croda) (15)); ПЭГ-60-глицериды миндального масла (Crovol A70 (Croda) (15)); ПЭГ-4-каприловые/каприновые триглицериды (Labrafac® Hydro (Gattefosse), (4-5)); ПЭГ-8-каприловые/каприновые глицериды (Labrasol (Gattefosse), Labrafac CM 10 (Gattefosse) (>10)); ПЭГ-6-каприловые/каприновые глицериды (SOFTIGEN® 767 (Huls), Glycerox 767 (Croda) (19)); лауроилмакрогол-32-глицерид (GELUCIRE 44/14 (Gattefosse) (14)); стеароилмакроголглицерид (GELUCIRE 50/13 (Gattefosse) (13)); моно-, ди-, три-, тетраэфиры растительных масел и сорбита (SorbitoGlyceride (Gattefosse) (<10)); пентаэритритилтетраизостеарат (Crodamol PTIS (Croda) (<10)); пентаэритритилдистеарат (Albunol DS (Taiwan Surf.) (<10)); пентаэритритилтетраолеат (Liponate РО-4 (Lipo Chem.) (<10)); пентаэритритилтетрастеарат (Liponate PS-4 (Lipo Chem.) (<10)); пентаэритритилтетракаприлат/тетракапрат (Liponate PE-810 (Lipo Chem.), Crodamol PTC (Croda) (<10)); пентаэритритилтетраоктаноат (Nikkol Pentarate 408 (Nikko))) и их комбинации.
Полигликолизированные жирные кислоты: (указано название соединения (распространенное коммерческое название продукта (поставщик) (ГЛБ)): полиглицерил-2-стеарат (Nikkol DGMS (Nikko) (5-7)); полиглицерил-2-олеат (Nikkol DGMO (Nikko) (5-7)); полиглицерил-2-изостеарат (Nikkol DGMIS (Nikko) (5-7)); полиглицерил-3-олеат (Caprol® 3GO (ABITEC), Drewpol 3-1-О (Stepan) (6,5)); полиглицерил-4-олеат (Nikkol Tetraglyn 1-O (Nikko) (5-7)); полиглицерил-4-стеарат (Nikkol Tetraglyn 1-S (Nikko) (5-6)); полиглицерил-6-олеат (Drewpol 6-1-O (Stepan), Nikkol Hexaglyn 1-O (Nikko) (9)); полиглицерил-10-лаурат (Nikkol Decaglyn 1-L (Nikko) (15)); полиглицерил-10-олеат (Nikkol Decaglyn 1-O (Nikko) (14)); полиглицерил-10-стеарат (Nikkol Decaglyn 1-S (Nikko) (12)); полиглицерил-6-рицинолеат (Nikkol Hexaglyn PR-15 (Nikko) (>8)); полиглицерил-10-линолеат (Nikkol Decaglyn 1-LN (Nikko) (12)); полиглицерил-6-пентаолеат (Nikkol Hexaglyn 5-0 (Nikko) (<10)); полиглицерил-3-диолеат (Cremophor G032 (BASF) (<10)); полиглицерил-3-дистеарат (Cremophor GS32 (BASF) (<10)); полиглицерил-4-пентаолеат (Nikkol Tetraglyn 5-0 (Nikko) (<10)); полиглицерил-6-диолеат (Caprol® 6G20 (ABITEC); Hodag PGO-62 (Calgene), PLUROL OLEIQUE CC 497 (Gattefosse) (8,5)); полиглицерил-2-диолеат (Nikkol DGDO (Nikko) (7)); полиглицерил-10-триолеат (Nikkol Decaglyn 3-0 (Nikko) (7)); полиглицерил-10-пентаолеат (Nikkol Decaglyn 5-0 (Nikko) (3,5)); полиглицерил-10-септаолеат (Nikkol Decaglyn 7-0 (Nikko) (3)); полиглицерил-10-тетраолеат (Caprol® 10G40 (ABITEC); Hodag PGO-62 (CALGENE), Drewpol 10-4-O (Stepan) (6,2)); полиглицерил-10-декаизостеарат (Nikkol Decaglyn 10-IS (Nikko) (<10)); полиглицерил-101-декаолеат (Drewpol 10-10-O (Stepan), Caprol 10G10O (ABITEC), Nikkol Decaglyn 10-O (3,5)); полиглицерил- 10-моно-, диолеат (Caprol® PGE 860 (ABITEC) (11)); полиглицерилполирицинолеат (Polymuls (Henkel) (3-20)) и их комбинации.
Сложные эфиры жирных кислот и пропиленгликоля: (указано название соединения (распространенное коммерческое название продукта (поставщик) (ГЛБ)): пропиленгликольмонокаприлат (Capryol 90 (Gattefosse), Nikkol Sefsol 218 (Nikko) (<10)); пропиленгликольмонолаурат (Lauroglycol 90 (Gattefosse), Lauroglycol FCC (Gattefosse) (<10)); пропиленгликольолеат (Lutrol OP2000 (BASF) (<10)); пропиленгликольмиристат (Mirpyl (<10)); пропиленгликольмоностеарат (ADM PGME-03 (ADM), LIPO PGMS (Lipo Chem.), Aldo® PGHMS (Lonza) (3-4)); пропиленгликольгидроксистеарат (<10)); пропиленгликольрицинолеат (PROPYMULS (Henkel) (<10)); пропиленгликольизостеарат (<10)); пропиленгликольмоноолеат (Myverol P-06 (Eastman) (<10)); пропиленгликольдикаприлат/дикапрат (Captex® 200 (ABITEC), Miglyol® 840 (Huls), Neobee® M-20 (Stepan) (>6)); пропиленгликольдиоктаноат (Captex® 800 (ABITEC) (>6)); пропиленгликолькаприлат/капрат (LABRAFAC PG (Gattefosse) (>6)); пропиленгликольдилаурат (>6)); пропиленгликольдистеарат (Kessco® PGDS (Stepan) (>6)); пропиленгликольдикаприлат (Nikkol Sefsol 228 (Nikko) (>6)); пропиленгликольдикапрат (Nikkol PDD (Nikko) (>6)) и их комбинации.
Смеси сложных эфиров пропиленгликоля и сложных эфиров глицерина: (указано название соединения (распространенное коммерческое название продукта (поставщик) (ГЛБ)): олеиновые эфиры (ATMOS 300, ARLACEL 186 (ICI) (3-4)); стеариновые эфиры (ATMOS 150 (3-4)) и их комбинации.
Моно- и диглицериды: (указано название соединения (распространенное коммерческое название продукта (поставщик) (ГЛБ)): монопальмитолеин (С 16:1) (Larodan) (<10)); моноэлаидин (С 18:1) (Larodan) (<10)); монокапроин (С6) (Larodan) (<10)); монокаприлин (Larodan) (<10)); монокаприн (Larodan) (<10)); монолаурин (Larodan) (<10)); глицерилмономиристат (С14) (Nikkol MGM (Nikko) (3-4)); глицерилмоноолеат (С 18:1) (PECEOL (Gattefosse), Hodag GMO-D, Nikkol MGO (Nikko) (3-4)); глицерилмоноолеат (партия RYLO (Danisco), партия DIMODAN (Danisco), EMULDAN (Danisco), ALDO® MO FG (Lonza), Kessco GMO (Stepan), партия MONOMULS® (Henkel), TEGIN O, DREWMULSE GMO (Stepan), Atlas G-695 (ICI), GMOrphic 80 (Eastman), ADM DMG-40, 70, и 100 (ADM), Myverol (Eastman) (3-4)); глицерина моноолеат/линолеат (OLICINE (Gattefosse) (3-4)); глицерина монолинолеат (Maisine (Gattefosse), MYVEROL 18-92, Myverol 18-06 (Eastman) (3-4)); глицерилрицинолеат (Softigen® 701 (Huls), HODAG GMR-D (Calgene), ALDO® MR (Lonza) (6)); глицерилмонолаурат (ALDO® MLD (Lonza), Hodag GML (Calgene) (6,8)); глицерина монопальмитат (Emalex GMS-P (Nihon) (4)); глицерина моностеарат (Capmul® GMS (ABITEC), Myvaplex (Eastman), IMWITOR® 191 (Huls), CUTINA GMS, Aldo® MS (Lonza), партия Nikkol MGS (Nikko) (5-9)); глицерилмоно-, диолеат (Capmul® GMO-K (ABITEC) (<10)); глицерилпальмитат/стеарат (CUTINA MD-A, ESTAGEL-G18 (<10)); глицерилацетат (Lamegin® EE (Grunau GmbH) (<10)); глицериллаурат (Imwitor® 312 (Huls), Monomuls® 90-45 (Grunau GmbH), Aldo® MLD (Lonza) (4)); глицерилцитрат/лактат/олеат/линолеат (Imwitor® 375 (Huls) (<10)); глицерилкаприлат (Imwitor® 308 (Huls), Capmul® MCMC8 (ABITEC) (5-6)); глицерилкаприлат/капрат (Capmul® MCM (ABITEC) (5-6)); моно-, диглицериды каприловой кислоты (Imwitor® 988 (Huls) (5-6)); каприловые/каприновые глицериды (Imwitor® 742 (Huls) (<10)); моно- и диацетилированные моноглицериды (Myvacet® 9-45, Myvacet® 9-40, Myvacet® 9-08 (Eastman), Lamegin® (Grunau) (3,8-4)); глицерилмоностеарат (Aldo® MS, Arlacel 129 (ICI), LIPO GMS (Lipo Chem.), Imwitor® 191 (Huls), Myvaplex (Eastman) (4,4)); сложные эфиры молочной кислоты и моно-, диглицеридов (LAMEGIN GLP (Henkel) (<10)); дикаппроин (С6) (Larodan) (<10); дикаприн (C10) (Larodan) (<10); диоктаноин (С8) (Larodan) (<10); димиристин (С14) (Larodan) (<10); дипальмитин (С 16) (Larodan) (<10); дистеарин (Larodan) (<10); глицерилдилаурат (С 12) (Capmul® GDL (ABITEC) (3-4)); глицерилдиолеат (Capmul® GDO (ABITEC) (3-4)); сложные эфиры глицерина и жирных кислот (GELUCIRE 39/01 (Gattefosse), GELUCIRE 43/01 (Gattefosse), GELUCIRE 37/06 (Gattefosse) (1,6)); дипальмитолеин (C16:1) (Larodan) (<10); 1,2- и 1,3-диолеин (C18:1) (Larodan) (<10); диэлаидин (С18:1) (Larodan) (<10); дилинолеин (С18:2) (Larodan) (<10) и их комбинации.
Стерины и стериновые производные: (указано название соединения (распространенное коммерческое название продукта (поставщик) (ГЛБ)): холестерин, ситостерин, лагостерин (<10)); ПЭГ-24-эфир холестерина (Solulan С-24 (Amerchol) (>10)); ПЭГ-30-холестанол (Nikkol DHC (Nikko) (>10)); фитостерин (партия GENEROL (Henkel) (<10)); ПЭГ-25-фитостерин (Nikkol BPSH-25 (Nikko) (>10)); ПЭГ-5-соевый стерол (Nikkol BPS-5 (Nikko) (<10)); ПЭГ-10-соевый стерол (Nikkol BPS-10 (Nikko) (<10)); ПЭГ-20-соевый стерол (Nikkol BPS-20 (Nikko) (<10)); ПЭГ-30 соевый стерол (Nikkol BPS-30 (Nikko) (>10)) и их комбинации.
Полиэтиленгликольсорбитановые сложные эфиры жирных кислот: (указано название соединения (распространенное коммерческое название продукта (поставщик) (ГЛБ)): ПЭГ-10-сорбитанлаурат (Liposorb L-10 (Lipo Chem.) (>10)); ПЭГ-20-сорбитанмонолаурат (Tween-20 (Atlas/ICI), Crillet 1 (Croda), DACOL MLS 20 (Condea) (17)); ПЭГ-4-сорбитанмонолаурат (Tween-21 (Atlas/ICI), Crillet 11 (Croda) (13)); ПЭГ-80-сорбитанмонолаурат (Hodag PSML-80 (Calgene); T-Maz 28 (>10)); ПЭГ-6-сорбитанмонолаурат (Nikkol GL-1 (Nikko) (16)); ПЭГ-20-сорбитанмонопальмитат (Tween-40 (Atlas/ICI), Crillet 2 (Croda) (16)); ПЭГ-20-сорбитанмоностеарат (Tween-60 (Atlas/ICI), Crillet 3 (Croda) (15)); ПЭГ-4-сорбитанмоностеарат (Tween-61 (Atlas/ICI), Crillet 31 (Croda) (9,6)); ПЭГ-8-сорбитанмоностеарат (DACOL MSS (Condea) (>10)); ПЭГ-6-сорбитанмоностеарат (Nikkol TS106 (Nikko) (11)); ПЭГ-20-сорбитантристеарат (Tween-65 (Atlas/ICI), Crillet 35 (Croda) (11)); ПЭГ-6-сорбитантетрастеарат (Nikkol GS-6 (Nikko) (3)); ПЭГ-60-сорбитантетрастеарат (Nikkol GS-460 (Nikko) (13)); ПЭГ-5-сорбитанмоноолеат (Tween-81 (Atlas/ICI), Crillet 41 (Croda) (10)); ПЭГ-6-сорбитанмоноолеат (Nikkol TO-106 (Nikko) (10)); ПЭГ-20-сорбитанмоноолеат (Tween-80 (Atlas/ICI), Crillet 4 (Croda) (15)); ПЭГ-40-сорбитанолеат (Emalex ET 8040 (Nihon Emulsion) (18)); ПЭГ-20-сорбитантриолеат (Tween-85 (Atlas/ICI), Crillet 45 (Croda) (11)); ПЭГ-6-сорбитантетраолеат (Nikkol GO-4 (Nikko) (8,5)); ПЭГ-30-сорбитантетраолеат (Nikkol GO-430 (Nikko) (12)); ПЭГ-40-сорбитантетраолеат (Nikkol GO-440 (Nikko) (13)); ПЭГ-20-сорбитанмоноизостеарат (Tween-120 (Atlas/ICI), Crillet 6 (Croda) (>10)); ПЭГ-сорбитолгексаолеат (Atlas G-1086 (ICI) (10)); ПЭГ-6-сорбитолгексастеарат (Nikkol GS-6 (Nikko) (3)) и их комбинации.
Алкиловые простые эфиры полиэтиленгликоля: (указано название соединения (распространенное коммерческое название продукта (поставщик) (ГЛБ)): ПЭГ-2-олеиловый простой эфир, олет-2 (Brij 92/93 (Atlas/ICI) (4,9)); ПЭГ-3-олеиловый простой эфир, олет-3 (Volpo 3 (Croda) (<10)); ПЭГ-5-олеиловый простой эфир, олет-5 (Volpo 5 (Croda) (<10)); ПЭГ-10-олеиловый простой эфир, олет-10 (Volpo 10 (Croda), Brij 96/97 (Atlas/ICI) (12)); ПЭГ-20-олеиловый простой эфир, олет-20 (Volpo 20 (Croda), Brij 98/99 (Atlas/ICI) (15)); ПЭГ-4-лауриловый простой эфир, лаурет-4 (Brij 30 (Atlas/ICI) (9,7)); ПЭГ-9-лауриловый простой эфир (>10)); ПЭГ-23-лауриловый простой эфир, лаурет-23 (Brij 35 (Atlas/ICI) (17)); ПЭГ-2-цетиловый простой эфир (Brij 52 (ICI) (5,3)); ПЭГ-10-цетиловый простой эфир (Brij 56 (ICI) (13)); ПЭГ-20-цетиловый простой эфир (Brij 58 (ICI) (16)); ПЭГ-2-стеариловый простой эфир (Brij 72 (ICI) (4,9)); ПЭГ-10-стеариловый простой эфир (Brij 76 (ICI) (12)); ПЭГ-20-стеариловый простой эфир (Brij 78 (ICI) (15)); ПЭГ-100-стеариловый простой эфир (Brij 700 (ICI) (>10)) и их комбинации.
Сложные эфиры сахаров: (указано название соединения (распространенное коммерческое название продукта (поставщик) (ГЛБ)): дистеарат сахарозы (SUCRO ESTER 7 (Gattefosse), Crodesta F-10 (Croda) (3)); дистеарат/моностеарат сахарозы (SUCRO ESTER 11 (Gattefosse), Crodesta F-110 (Croda) (12)); дипальмитат сахарозы (7,4)); моностеарат сахарозы (Crodesta F-160 (Croda) (15)); монопальмитат сахарозы (SUCRO ESTER 15 (Gattefosse) (>10)); монолаурат сахарозы (Saccharose monolaurate 1695 (Mitsubisbi-Kasei) (15)) и их комбинации.
Полиэтиленгликольалкилфенолы: (указано название соединения (распространенное коммерческое название продукта (поставщик) (ГЛБ)): ПЭГ-10-100-нонилфенол (партия Triton X (Rohm & Haas), партия Igepal СА (GAF, USA), партия Antarox СА (>10)); (GAF, UK); ПЭГ-15-100-октилфеноловый простой эфир (партия Triton N (Rohm & Haas), партия Igepal CO (GAF, USA), партия Antarox CO (GAF, UK) (>10)) и их комбинации.
Блок-сополимеры полиэтилена и полиоксипропилена (также известные как "полоксамеры"): эти полимеры имеют формулу: HO(C<2>H<4>O)(C<3>H<6>O)(C<2>H<4>O)H где "a" и "b" обозначают число полиоксиэтиленовых и полиоксипропиленовых единиц, соответственно. Соединения перечислены согласно международным непатентованным названиям с соответствующими значениями "а" и "b". ПОЭ-ПОП-блок-сополимеры)); (значения a, b для них)); (HO(C<2>H<4>O))); (СОЕДИНЕНИЕ (C<3>H<6>O)(C<2>H<4>O)<а>H (ГЛБ)); (полоксамер 105 (a=11 (b=16 (8)); (полоксамер 108 (a=46 (b=16 (>10)); (полоксамер 122 (a=5 (b=21 (3)); (полоксамер 123 (a=7 (b=21 (7)); (полоксамер 124 (a=11 (b=21 (>7)); (полоксамер 181 (a=3 (b=30)); (полоксамер 182 (a=8 (b=30 (2)); (полоксамер 183 (a=10 (b=30)); (полоксамер 184 (a=13 (b=30)); (полоксамер 185 (a=19 (b=30)); (полоксамер 188 (a=75 (b=30 (29)); (полоксамер 212 (a=8 (b=35)); (полоксамер 215 (a=24 (b=35)); (полоксамер 217 (a=52 (b=35)); (полоксамер 231 (a=16 (b=39)); (полоксамер 234 (a=22 (b=39)); (полоксамер 235 (a=27 (b=39)); (полоксамер 237 (a=62 (b=39 (24)); (полоксамер 238 (a=97 (Ъ=39)); (полоксамер 282 (a=10 (b=47)); (полоксамер 284 (a=21 (b=47)); (полоксамер 288 (a=122 (b=47 (>10)); (полоксамер 331 (a=7 (b=54 (0,5)); (полоксамер 333 (a=20 (b=54)); (полоксамер 334 (a=31 (b=54)); (полоксамер 335 (a=38 (b=54)); (полоксамер 338 (a=128 (b=54)); (полоксамер 401 (a=6 (b=67)); (полоксамер 402 (a=13 (b=67)); (полоксамер 403 (a=21 (b=67)); (полоксамер 407 (a=98 (b=67)) и их комбинации.
Сложные эфиры сорбита и жирных кислот: (указано название соединения (распространенное коммерческое название продукта (поставщик) (ГЛБ)): сорбитанмонолаурат (Span-20 (Atlas/ICI), Crill 1 (Croda), Arlacel 20 (ICI) (8,6)); сорбитанмонопальмитат (Span-40 (Atlas/ICI), Crill 2 (Croda), Nikkol SP-10 (Nikko) (6,7)); сорбитанмоноолеат (Span-80 (Atlas/ICI), Crill 4 (Croda), Crill 50 (Croda) (4,3)); сорбитанмоностеарат (Span-60 (Atlas/ICI), Crill 3 (Croda), Nikkol SS-10 (Nikko) (4,7)); сорбитантриолеат (Span-85 (Atlas/ICI), Crill 45 (Croda), Nikkol SO-30 (Nikko) (4,3)); сорбитансесквиолеат (Arlacel-C (ICI), Crill 43 (Croda), Nikkol SO-15 (Nikko) (3,7)); сорбитантристеарат (Span-65 (Atlas/ICI) Crill 35 (Croda), Nikkol SS-30 (Nikko) (2,1)); сорбитанмоноизостеарат (Crill 6 (Croda), Nikkol SI-10 (Nikko) (4,7)); сорбитансесквистеарат (Nikkol SS-15 (Nikko) (4,2)) и их комбинации.
Сложные эфиры низших спиртов и жирных кислот: (указано название соединения (распространенное коммерческое название продукта (поставщик) (ГЛБ)): этилолеат ((Crodamol ЕО (Croda), Nikkol ЕОО (Nikko) (<10)); изопропилмиристат (Crodamol IPM (Croda) (<10)); изопропилпальмитат (Crodamol IPP (Croda) (<10)); этиллинолеат (Nikkol VF-E (Nikko) (<10)); изопропиллинолеат (Nikkol VF-IP (Nikko) (<10)) и их комбинации.
Ионные поверхностно-активные вещества: (указано название соединения (ГЛБ) соли жирных кислот (>10)); капроат натрия; каприлат натрия; капрат натрия; лаурат натрия; миристат натрия)); миристолеат натрия; пальмитат натрия; пальмитолеат натрия; олеат натрия (18); рицинолеат натрия)); линолеат натрия; линоленат натрия; стеарат натрия; лаурилсульфат натрия (40); тетрадецилсульфат натрия; лаурилсаркозинат натрия; диоктилсульфосукцинат натрия; соли желчных кислот (>10); холат натрия; таурохолат натрия; гликохолат натрия; дезоксихолат натрия; тауродезоксихолат натрия; гликодезоксихолат натрия; урсодезоксихолат натрия; хенодезоксихолат натрия; таурохенодезоксихолат натрия; гликохенодезоксихолат натрия; холилсаркозинат натрия; N-метилтаурохолат натрия и их комбинации.
Фосфолипиды, такие как: яичный/соевый лецитин (Epikuron™; Ovothin™); яичный/соевый лизолецитин; гидроксилированный лецитин; лизофосфатидилхолин; кардиолипин; сфингомиелин; фосфатидилхолин; фосфатидилэтаноламин; фосфатидная кислота; фосфатадилглицерин; фосфатидилсерин и их комбинации.
Сложные эфиры фосфорной кислоты: фосфат полиоксиэтилен-10-олеилового простого эфира диэтаноламмония; продукты этерификации жирных спиртов или этоксилатов жирных спиртов фосфорной кислотой или ангидридом.
Карбоксилаты, такие как: эфиркарбоксилаты (получаемые посредством окисления концевых ОН-групп этоксилатов жирных спиртов); сукцинилированные моноглицериды; стеарилфумарат натрия; стеароилпропиленгликольгидросукцинат; сложные эфиры моно/диацетилированной винной кислоты и моно- и диглицеридов; сложные эфиры лимонной кислоты и моно-, диглицеридов; глицериллактоэфиры жирных кислот и их комбинации.
Ациллактилаты, такие как: лактиловые сложные эфиры жирных кислот; стеароил-2-лактилат кальция/натрия; стеароиллактилат кальция/натрия; альгинатные соли, такие как альгинат натрия, альгинат кальция и другие, и их комбинации.
Гидрофильные полимеры, такие как: карбоксивиниловый полимер, поливинилпирролидон, поливиниловый спирт, сополимеры метакриловой кислоты, макрогол, крахмал, желатин, декстрин, пуллулан, агар, гуммиарабик, поли(этиленгликоль), поли(этиленоксид), поли(виниловый спирт), сополимер этилена и винилового спирта, поли(акриловая кислота), сополимер этилена и акриловой кислоты, поли(этилоксазолин), поли(винилпирролидон), сополимер этилена и винилпирролидона, поли(малеиновая кислота), сополимер этилена и малеиновой кислоты, поли(акриламид) или сополимер поли(этиленоксида) и поли(пропиленоксида); блок-сополимеры, привитые сополимеры молочной кислоты, гликолевой кислоты, эпсилон-капролактона, соолигомеры молочной и гликолевой кислот, триметиленкарбонат, ангидриды и акрилаты аминокислот, бензохиноны, нафтохиноны и т.п.; сополимер N-винилпирролидона и винилового спирта, сополимер этилена и винилового спирта; сополимеры акриловой или метакриловой кислоты; карбомеры, хитозан, метакрилаты (Эудрагиты) и их комбинации.
Кислоты, такие как: уксусная кислота, соляная кислота, бромоводородная кислота, иодоводородная кислота, фосфорная кислота, серная кислота, азотная кислота, акриловая кислота, адипиновая кислота, альгиновая кислота, алкансульфоновая кислота, аминокислота, аскорбиновая кислота, бензойная кислота, борная кислота, масляная кислота, угольная кислота, лимонная кислота, жирная кислота, муравьиная кислота, фумаровая кислота, глюконовая кислота, гидрохинонсульфоновая кислота, изоаскорбиновая кислота, молочная кислота, малеиновая кислота, метансульфоновая кислота, щавелевая кислота, пара-бромфенолсульфокислота, пропионовая кислота, п-толуолсульфокислота, салициловая кислота, стеариновая кислота, янтарная кислота, дубильная кислота, винная кислота, тиогликолевая кислота, толуолсульфокислота, мочевая кислота, их соли и смеси.
Основания, такие как: аминокислоты, сложные эфиры аминокислот, гидроксид аммония, гидроксид калия, гидроксид натрия, гидрокарбонат натрия, гидроксид алюминия, карбонат кальция, гидроксид магния, алюмосиликат магния, синтетический алюмосиликат, синтетический гидротальцит, гидроксиды алюминия и магния, диизопропилэтиламин, этаноламин, этилендиамин, триэтаноламин, триэтиламин, триизопропаноламин и их смеси и комбинации.
Хелатирующие агенты, такие как: натриевая соль ЭДТУ, динатриевая соль ЭДТУ (диэдитат натрия) и их смеси или комбинации. Комплексообразующие агенты, такие как: гидроксипропилциклодекстрин, гидроксипропил-бета-циклодекстрин, сульфобутиловый простой эфир циклодекстрина и их смеси и комбинации. Соли, такие как: соли кислот, оснований, соли жирных кислот, глицеридов жирных кислот, соли желчных кислот и их смеси и комбинации.
Амиды, такие как: например, 2-пирролидон, 2-пиперидон, эпсилон-капролактам, N-алкилпирролидон, N-гидроксиалкилпирролидон, N-алкилпиперидон, N-алкилкапролактам, диметилацетамид, поливинилпирролидон и т.п.
Спирты, такие как: этанол, изопропиловый спирт, бутанол, бензиловый спирт, этиленгликоль, пропиленгликоль, глицерин, сорбит, маннит, диметилизосорбид, полиэтиленгликоль, спирт жирной кислоты, виниловый спирт, полипропиленгликоль, поливиниловый спирт, токоферолы, целлюлозные циклодекстрины, другие производные, формы, их смеси и т.п.
Глицерины и пропилен гликоли, такие как: глицерин, пропиленгликоль, полипропиленгликоль, полипропиленоксиды и их смеси. Полиэтиленгликоли (ПЭГ), такие как: ПЭГ 300, ПЭГ 400, ПЭГ 4000, ПЭГ 6000, ПЭГ 8000, ПЭГ 20000 и их комбинации.
Сложные эфиры, такие как: этилпропионат, трибутилцитрат, ацетилтриэтилцитрат, ацетилтрибутилцитрат, триэтилцитрат, этилолеат, этилкаприлат, этилбутират, триацетин, моноацетат пропиленгликоля, диацетат пропиленгликоля, эпсилон-капролактон и его изомеры, дельта-валеролактон и его изомеры, бета-бутиролактон и его изомеры; диметилацетамид, диметилизосорбид, N-метилпирролидоны, монооктаноин, моноэтиловый эфир диэтиленгликоля и т.п.
Желчные кислоты, такие как: холат, таурохолат, гликохолат, дезоксихолат, тауродезоксихолат, хенодезоксихолат, гликодезоксихолат, гликохенодезоксихолат, таурохенодезоксихолат, урсодезоксихолат, литохолат, тауроурсодезоксихолат, гликоурсодезоксихолат, холилсаркозин.
Целлюлозы, такие как: микрокристаллическая целлюлоза, этилцеллюлоза (ЭЦ), метилэтилцеллюлоза (МЭЦ), карбоксиметилцеллюлоза (КМЦ), карбоксиметилэтилцеллюлоза (КМЭЦ), гидроксиэтилцеллюлоза (ГЭЦ), гидроксипропилцеллюлоза (ГПЦ), ацетат целлюлозы (АЦ), пропионат целлюлозы (ПЦ), бутират целлюлозы (БЦ), ацетат-бутират целлюлозы (АБЦ), ацетат-фталат целлюлозы (АФЦ), ацетат-тримеллитат целлюлозы (АТЦ), гидроксипропилметилцеллюлоза (ГПМЦ), фталат гидроксипропилметилцеллюлозы (ФГПМЦ), ацетат-сукцинат гидроксипропилметилцеллюлозы (АСГПМЦ), ацетат-тримеллитат гидроксипропилметилцеллюлозы (АТГПМЦ) и этилгидроксиэтилцеллюлоза (ЭГЭЦ), различные марки ГПМЦ низкой вязкости (MB меньше чем или равен 50000 дальтон) и высокой вязкости (MB больше чем 50000 дальтон) и их комбинации.
Сложные эфиры целлюлозы, такие как: ацетат целлюлозы, ацетат-бутират целлюлозы, ацетат-фталат целлюлозы, фталат гидроксипропилметилцеллюлозы и их комбинации.
Мукоадгезивные полимеры, такие как, например, токоферолы, такие как, например, токоферол, токоферола ацетат, токоферола сукцинат и их комбинации.
Аминокислоты и модифицированные аминокислоты, такие как: производные аминобороновых кислот, N-ацетилцистеин и их смеси.
Сахара, такие как: мальтоза, сахароза, декстроза, лактоза, фруктоза, маннит, сукралоза, фрукталоза, трегалоза, декстроза, мальтодекстроза и их комбинации.
Сахарные спирты, такие как: маннит, ксилит, сорбит, их комбинации и т.п.
Осмотические агенты, такие как: гидрофильные виниловые и акриловые полимеры, полисахариды, такие как альгинат кальция, полиэтиленоксид (ПЭО), полиэтиленгликоль (ПЭГ), полипропиленгликоль (ППГ), поли(2-гидроксиэтилметакрилат), поли(акриловая) кислота, поли(метакриловая) кислота, поливинилпирролидон (ПВП) и перекрестно сшитый ПВП, поливиниловый спирт (ПВС), сополимеры ПВС/ПВП и сополимеры ПВС/ПВП с гидрофобными мономерами, такими как метилметакрилат, винилацетат и т.п., гидрофильные полиуретаны, содержащие большие блоки ПЭО, кроскармеллоза натрия, каррагинан, гидроксиэтилцеллюлоза (ГЭЦ), гидроксипропилцеллюлоза (ГПЦ), гидроксипропилметилцеллюлоза (ГПМЦ), карбоксиметилцеллюлоза (КМЦ) и карбоксицеллюлоза (КЦ), альгинат натрия, поликарбофил, желатин, ксантановая камедь и натрия крахмалгликолят и т.п.
Другие носители, такие как: двухосновный фосфат кальция, кроскармеллоза натрия, натрия крахмалгликолят, альгинат натрия, фосфолипиды, лецитины, белки (например, коллаген, желатин, зейн, глютен, белок мидии, липопротеин); углеводы (например, альгинаты, каррагинан, производные целлюлозы, пектин, крахмал); камеди (например, ксантановая камедь, гуммиарабик, трагакантовая камедь, аравийская камедь); спермацеты; природные или синтетические воски; карнаубский воск; жирные кислоты (например, стеариновая кислота, гидроксистеариновая кислота); стеарат магния, стеарат кальция, диоксид титана, полиакриловая кислота, силикаты, алюмосиликаты магния, силоксаны, миметики, парафины, жирные спирты; дибутилфталат; дибутилсебацинат; диэтилфталат; диметилфталат; триэтилцитрат; бутиловые и гликолевые сложные эфиры жирных кислот; минеральное масло; цетиловый спирт; стеариловый спирт; камфорное масло; триэтилцитрат, шеллаки, бензалкония хлорид, метилпарабен, пропилпарабен, бензоат натрия и т.п.
В одном из вариантов реализации фармацевтическая композиция или пероральная лекарственная форма могут быть приготовлены с применением по меньшей мере одного из следующих предпочтительных носителей: лимонной кислоты, малеиновой кислоты, винной кислоты, аскорбиновой кислоты, молочной кислоты и их солей, гидроксида калия, гидроксида натрия, гидрокарбоната натрия, карбоната кальция, диоксида кремния, алюмосиликата магния, триэтиламина, глицеридов жирных кислот, пирролидона, поливинилпирролидона, этилового спирта, бензилового спирта, глицерина, пропиленгликоля, полиэтиленгликоля, триэтилцитрата, триацетина, бензилбензоата, желчных кислот, солей желчных кислот, этилцеллюлозы, гидроксипропилэтилцеллюлозы, сложных эфиров целлюлозы, карбомера, метакрилатов, поливинилового спирта, желатина, дистеарина, токоферола монопальмитолеина, токоферола сукцината, кукурузного масла, оливкового масла, арахисового масла, сафлорового масла, кунжутного масла, соевого масла, гидрогенизированного касторового масла, глицерилтрикапрата, глицерилтрилинолеата, глицерилтрикаприлата/капрата, глицерилтрикаприлата/капрата/линолеата, насыщенных полигликозилированных глицеридов, линолевых глицеридов, каприловых/каприновых глицеридов, каприновой кислоты, каприловой кислоты, пальмитиновой кислоты, лауриновой кислоты, стеариновой кислоты, линолевой кислоты, олеиновой кислоты, арахидоновой кислоты, эйкозапентаеновой кислоты, докозагексаеновой кислоты, глицерилмоноолеата, глицерилмонолинолеата, глицерилмонолаурата, глицерина моностеарата, глицерилдистеарата, глицерилпальмитостеарата, глицериллаурата, глицерилкаприлата, ПЭГ-6-кукурузного масла, ПЭГ-6-масла абрикосовых косточек, стеароилмакроголглицерида, ПЭГ-20-сорбитанмоностеарата, ПЭГ-40-гидрогенизированного касторового масла, ПЭГ-35-касторового масла, олеата натрия, лаурилсульфата натрия, лаурилсаркозината натрия, диоктилсульфосукцината натрия, полиглицерил-3-олеата, полиглицерил-10-олеата, полиглицерил-6-диолеата, полиглицерил-10-моно-, диолеата, полоксамера 188, полоксамера 108, полоксамера 182, пропиленгликольмонокаприлата, пропиленгликольмонолаурата, пропиленгликольдикаприлата/дикапрата, пропиленгликолькаприлата/капрата, сорбитанмонолаурата, сорбитанмонопальмитата, сорбитанмоноолеата, сорбитанмоностеарата, сорбитансесквиолеата, сорбитансесквистеарата, мальтозы, сахарозы, фруктозы, маннита, ксилита и их комбинаций.
В одном из вариантов реализации фармацевтические композиции или пероральные лекарственные формы согласно настоящему изобретению могут быть приготовлены с применением гидрофильной добавки. В другом варианте реализации гидрофильная добавка может представлять собой гидрофильное поверхностно-активное вещество. В одном из вариантов реализации, при условии что гидрофильная добавка содержит гидрофильное поверхностно-активное вещество, указанное гидрофильное поверхностно-активное вещество заметно не солюбилизирует сложный эфир 17-гидроксипрогестерона. Неограничивающие примеры гидрофильных добавок включают соли лимонной кислоты, малеиновой кислоты, винной кислоты, уксусной кислоты, аскорбиновой кислоты, бензойной кислоты и молочной кислоты, гидроксид калия, гидроксид натрия, гидрокарбонат натрия, карбонат кальция, диоксид кремния, алюмосиликат магния, гидроксипропилциклодекстрин, глицериды жирных кислот, соли желчных кислот, пирролидон, поливинилпирролидон, этиловый спирт, бензиловый спирт, глицерин, пропиленгликоль, полиэтиленгликольметилцеллюлозу, гидроксипропилметилцеллюлозу, сложные эфиры целлюлозы, карбомер, хитозан, метакрилаты, поливиниловый спирт, желатин, ПЭГ-8-каприловые/каприновые глицериды, лауроилмакрогол-3 2-глицерид, стеароилмакроголглицерид, ПЭГ-40-гидрогенизированное касторовое масло, ПЭГ-35-касторовое масло, олеат натрия, лаурилсульфат натрия, лаурилсаркозинат натрия, диоктилсульфосукцинат натрия, ПЭГ-10-лаурат, ПЭГ-20-олеат, ПЭГ-30-стеарат, ПЭГ-40-лаурат, ПЭГ-20-глицериллаурат, ПЭГ-20-глицерилстеарат, ПЭГ-40-глицериллаурат, ПЭГ-20-глицерилолеат, ПЭГ-10-сорбитанлаурат, ПЭГ-20-сорбитанмонолаурат, ПЭГ-20-сорбитанмоноолеат, полиглицерил- 10-олеат, полиглицерил-10-моно-, диолеат, полоксамер 188, полоксамер 108, мальтозу, сахарозу, фруктозу, маннит, ксилит и их комбинации.
В другом конкретном варианте реализации носитель может представлять собой гидрофильное поверхностно-активное вещество и может представлять собой ионное или неионное поверхностно-активное вещество. Неограничивающие примеры гидрофильных поверхностно-активных веществ включают белки, желатин, соли желчных кислот, ПЭГ-8-каприловые/каприновые глицериды, лауроилмакрогол-32-глицерид, стеароилмакроголглицерид, ПЭГ-40-гидрогенизированное касторовое масло, ПЭГ-35-касторовое масло, олеат натрия, лаурилсульфат натрия, лаурилсаркозинат натрия, диоктилсульфосукцинат натрия, ПЭГ-10-лаурат, ПЭГ-20-олеат, ПЭГ-30-стеарат, ПЭГ-40-лаурат, ПЭГ-20-глицериллаурат, ПЭГ-20-глицерилстеарат, ПЭГ-40-глицериллаурат, ПЭГ-20-глицерил олеат, ПЭГ-10-сорбитанлаурат, ПЭГ-20-сорбитанмонолаурат, ПЭГ-20-сорбитанмоноолеат, полиглицерил-10-олеат, полиглицерил-10-моно-, диолеат, полоксамер 188, полоксамер 108 и их комбинации.
В одном из вариантов реализации гидрофильная добавка может не содержать гидрофильных поверхностно-активных веществ и может представлять собой лимонную кислоту, малеиновую кислоту, винную кислоту, уксусную кислоту, аскорбиновую кислоту, бензойную кислоту, молочную кислоту, гидроксид калия, гидроксид натрия, гидрокарбонат натрия, карбонат кальция, диоксид кремния, алюмосиликат магния, гидроксипропилциклодекстрин, пирролидон, поливинилпирролидон, этиловый спирт, бензиловый спирт, глицерин, пропиленгликоль, полиэтиленгликоль, метилцеллюлозу, гидроксипропилметилцеллюлозу, сложные эфиры целлюлозы, карбомер, хитозан, метакрилаты, поливиниловый спирт, желатин, мальтозу, сахарозу, фруктозу, маннит, ксилит и их комбинации.
В другом варианте реализации носитель для фармацевтических композиций или пероральных лекарственных форм может содержать липофильную добавку. Неограничивающие примеры липофильных добавок включают трибутилцитрат, триэтилцитрат, триацетин, этилцеллюлозу, сложные эфиры целлюлозы, ацетат целлюлозы, ацетат-бутират целлюлозы, ацетат-фталат целлюлозы, фталат гидроксипропилметилцеллюлозы, токоферол, токоферола ацетат, токоферола сукцинат, кукурузное масло, оливковое масло, арахисовое масло, сафлоровое масло, кунжутное масло, соевое масло, гидрогенизированное касторовое масло, глицерилтрикапрат, глицерилтрилаурат, глицерилтриолеат, глицерилтрилинолеат, глицерилтрикаприлат/капрат, глицерилтрикаприлат/капрат/лаурат, глицерилтрикаприлат/капрат/линолеат, глицерилтрикаприлат/капрат/стеарат, насыщенные полигликолизированные глицериды, линолевые глицериды, каприловые/каприновые глицериды, каприновую кислоту, каприловую кислоту, пальмитиновую кислоту, лауриновую кислоту, стеариновую кислоту, линолевую кислоту, олеиновую кислоту, арахидоновую кислоту, эйкозапентаеновую кислоту, докозагексаеновую кислоту, глицерилмоноолеат, глицерилмонолинолеат, глицерилмонолаурат, глицерина моностеарат, глицерилдистеарат, глицерилпальмитостеарат, глицериллаурат, глицерилкаприлат, дистеарин, монопальмитолеин, монолаурин, этилолеат, ПЭГ-6-кукурузное масло, ПЭГ-6-масло абрикосовых косточек, ПЭГ-4-каприловый/каприновый триглицерид, ПЭГ-20-сорбитанмоностеарат, ПЭГ-4-лаурат, ПЭГ-6-дилаурат, полиглицерил-3-олеат, полиглицерил-6-диолеат, полоксамер 182, пропиленгликольмонокаприлат, пропиленгликольмонолаурат, пропиленгликольдикаприлат/дикапрат, пропиленгликолькаприлат/капрат, сорбитанмонолаурат, сорбитанмонопальмитат, сорбитанмоноолеат, сорбитанмоностеарат, сорбитансесквиолеат, сорбитансесквистеарат и их комбинации. В одном из вариантов реализации носитель согласно настоящему изобретению может содержать по меньшей мере 50 масс. % липофильной добавки.
В конкретном варианте реализации липофильная добавка представляет собой по меньшей мере один агент, выбранный из трибутилцитрата, триэтилцитрата, триацетина, этилцеллюлозы, сложных эфиров целлюлозы, ацетата целлюлозы, ацетат-бутирата целлюлозы, ацетат-фталата целлюлозы, фталата гидроксипропилметилцеллюлозы, токоферола, токоферола ацетата, токоферола сукцината, триглицеридов, кукурузного масла, оливкового масла, арахисового масла, сафлорового масла, кунжутного масла, соевого масла, гидрогенизированного касторового масла, глицерилтрикапрата, глицерилтрилаурата, глицерилтриолеата, глицерилтрилинолеата, глицерилтрикаприлата/капрата, глицерилтрикаприлата/капрата/лаурата, глицерилтрикаприлата/капрата/линолеата, глицерилтрикаприлата/капрата/стеарата, насыщенных полигликолизированных глицеридов, линолевых глицеридов, каприловых/каприновых глицеридов, каприновой кислоты, каприловой кислоты, пальмитиновой кислоты, лауриновой кислоты, стеариновой кислоты, линолевой кислоты, олеиновой кислоты, арахидоновой кислоты, эйкозапентаеновой кислоты, докозагексаеновой кислоты, глицерилдистеарата, глицерилпальмитостеарата, дистеарина, тристеарина, парафинового масла, пчелиного воска, животного жира, фитостерина, холестерина, шеллака и их комбинаций.
В конкретном варианте реализации липофильная добавка представляет собой триглицерид. Неограничивающие примеры триглицеридов, подходящих для настоящего изобретения, включают кукурузное масло, оливковое масло, арахисовое масло, пальмовое масло, кокосовое масло, масло земляного ореха, сафлоровое масло, кунжутное масло, соевое масло, касторовое масло, масло примулы, хлопковое масло, растительное масло, масло огуречника, льняное масло, масло из льняных семян, масла, содержащие омега-ненасыщенные жирные кислоты, частично или полностью гидрогенизированное касторовое масло, рыбий жир, жир печени акулы, китовый жир, тюлений жир, глицерилтрикапрат, глицерилтрилаурат, глицерилтриолеат, глицерилтрилинолеат, глицерилтрикаприлат/капрат, глицерилтрикаприлат/капрат/лаурат, глицерилтрикаприлат/капрат/линолеат, глицерилтрикаприлат/капрат/стеарат, насыщенные полигликолизированные глицериды, линолевые глицериды, каприловые/каприновые глицериды, тристеарин и т.п. и их комбинации.
В одном из вариантов реализации липофильная добавка может не содержать липофильных поверхностно-активных веществ. В одном конкретном варианте реализации носитель представляет собой липофильное поверхностно-активное вещество. Неограничивающие примеры липофильных поверхностно-активных веществ, подходящих для настоящего изобретения, включают трибутилцитрат, триэтилцитрат, триацетин, этилцеллюлозу, сложные эфиры целлюлозы, ацетат целлюлозы, ацетат-бутират целлюлозы, бензилбензоат, ацетат-фталат целлюлозы, фталат гидроксипропилметилцеллюлозы, токоферол, токоферола ацетат, токоферола сукцинат, кукурузное масло, оливковое масло, арахисовое масло, сафлоровое масло, кунжутное масло, соевое масло, гидрогенизированное касторовое масло, глицерилтрикапрат, глицерилтрилаурат, глицерилтриолеат, глицерилтрилинолеат, глицерилтрикаприлат/капрат, глицерилтрикаприлат/капрат/лаурат, глицерилтрикаприлат/капрат/линолеат, глицерилтрикаприлат/капрат/стеарат, насыщенные полигликолизированные глицериды, линолевые глицериды, каприловые/каприновые глицериды, каприновую кислоту, каприновую кислоту, пальмитиновую кислоту, лауриновую кислоту, стеариновую кислоту, линолевую кислоту, олеиновую кислоту, арахидоновую кислоту, эйкозапентаеновую кислоту, докозагексаеновую кислоту, глицерилмоноолеат, глицерилмонолинолеат, глицерилмонолаурат, глицерина моностеарат, глицерилдистеарат, глицерилпальмитостеарат, глицериллаурат, глицерилкаприлат, дистеарин, монопальмитолеин, монолаурин, этилолеат, ПЭГ-6-кукурузное масло, ПЭГ-6-масло абрикосовых косточек, ПЭГ-4-каприловый/каприновый триглицерид, ПЭГ-20-сорбитанмоностеарат, ПЭГ-4-лаурат, ПЭГ-6-дилаурат, полиглицерил-3-олеат, полиглицерил-6-диолеат, полоксамер 182, пропиленгликольмонокаприлат, пропиленгликольмонолаурат, пропиленгликольдикаприлат/дикапрат, пропиленгликолькаприлат/капрат, сорбитанмонолаурат, сорбитанмонопальмитат, сорбитанмоноолеат, сорбитанмоностеарат, сорбитансесквиолеат, сорбитансесквистеарат и их комбинации.
В другом конкретном варианте реализации композиции или лекарственные формы согласно настоящему изобретению могут не содержать триглицеридов или по существу не содержать триглицеридов. Таким образом, в одном из вариантов реализации настоящее изобретение не подразумевает включение липофильных или гидрофильных добавок, которые содержат триглицериды в качестве целевого или добавляемого компонента. Тем не менее, следует понимать, что настоящее изобретение не исключает применения липофильных или гидрофильных добавок, содержащих малые количества триглицеридов в качестве примесей или не вступивших в реакцию исходных веществ. Предполагается, что, когда такие липофильные или гидрофильные добавки используют в композициях согласно настоящему изобретению, общее содержание триглицеридов не превышает 5% от массы композиции или лекарственной формы. Таким образом, следует понимать, что "по существу не содержащие триглицеридов" означает не содержащие добавленных триглицеридов, а примеси триглицеридов из липофильных или гидрофильных добавок составляют примерно 5%, или меньше чем 5%, меньше чем 2%, или предпочтительно 0% (отсутствие триглицеридов) от массы композиции. Кроме того, настоящее изобретение не исключает применения липофильных или гидрофильных добавок, которые представляют собой производные триглицеридов, такие как, например, полиэтиленгликолевые или пропилен-гликолевые производные триглицеридов; в то время как эти дериватизированные триглицериды могут обладать свойствами поверхностно-активных веществ, триглицериды сами по себе не являются поверхностно-активными веществами.
Неограничивающие примеры таких липофильных добавок включают трибутилцитрат, триэтилцитрат, триацетин, этилцеллюлозы, сложные эфиры целлюлозы, ацетат целлюлозы, ацетат-бутират целлюлозы, ацетат-фталат целлюлозы, фталат гидроксипропилметилцеллюлозы, токоферол, токоферола ацетат, токоферола сукцинат, насыщенные полигликолизированные глицериды, линолевые глицериды, каприловые/каприновые глицериды, каприновую кислоту, каприловую кислоту, пальмитиновую кислоту, лауриновую кислоту, стеариновую кислоту, линолевую кислоту, олеиновую кислоту, арахидоновую кислоту, эйкозапентаеновую кислоту, бензилбензоат, докозагексаеновую кислоту, глицерилмоноолеат, глицерилмонолинолеат, глицерилмонолаурат, глицерина моностеарат, глицерилдистеарат, глицерилпальмитостеарат, глицериллаурат, глицерилкаприлат, дистеарин, монопальмитолеин, монолаурин, этилолеат, ПЭГ-6-кукурузное масло, ПЭГ-6-масло абрикосовых косточек, ПЭГ-4-каприловый/каприновый триглицерид, ПЭГ-20-сорбитанмоностеарат, ПЭГ-4-лаурат, ПЭГ-6-дилаурат, по лиглицерил-3-олеат, полиглицерил-6-диолеат, полоксамер 182, пропиленгликольмонокаприлат, пропиленгликольмонолаурат, пропиленгликольдикаприлат/дикапрат, пропиленгликолькаприлат/капрат, сорбитанмонолаурат, сорбитанмонопальмитат, сорбитанмоноолеат, сорбитанмоностеарат, сорбитансесквиолеат, сорбитансесквистеарат и их комбинации.
В некоторых вариантах реализации носитель согласно настоящему изобретению может представлять собой агент для контроля высвобождения. В конкретном варианте реализации агент для контроля высвобождения выбран из группы, состоящей из указанных гидрофильных добавок или липофильных добавок или их смеси. В другом конкретном варианте реализации композиции или лекарственные формы согласно настоящему изобретению могут не содержать липофильного поверхностно-активного вещества. В другом конкретном варианте реализации композиции или лекарственные формы согласно настоящему изобретению могут не содержать липофильной добавки.
Как описано выше, в некоторых вариантах реализации фармацевтические композиции и пероральные лекарственные формы согласно настоящему изобретению могут содержать по меньшей мере одну гидрофильную добавку и по меньшей мере одну липофильную добавку. В одном из вариантов реализации, когда присутствуют как гидрофильная добавка, так и липофильная добавка, они могут присутствовать при отношении количества липофильной добавки к количеству гидрофильной добавки, составляющем от примерно 99:1 до примерно 1:99. В одном из вариантов реализации отношение количества липофильной добавки к количеству гидрофильной добавки может составлять от примерно 95:5 до примерно 5:95. В другом варианте реализации отношение количества липофильной добавки к количеству гидрофильной добавки может составлять от примерно 90:10 до примерно 10:90. В одном из вариантов реализации отношение количества липофильной добавки к количеству гидрофильной добавки может составлять от примерно 90:10 до примерно 1:99. В другом конкретном варианте реализации отношение количества липофильной добавки к количеству гидрофильной добавки может составлять от примерно 80:20 до примерно 20:80. В другом конкретном варианте реализации отношение количества липофильной добавки к количеству гидрофильной добавки может составлять от примерно 70:30 до примерно 30:70. В другом конкретном варианте реализации отношение количества липофильной добавки к количеству гидрофильной добавки может составлять от примерно 60:40 до примерно 40:60. В другом конкретном варианте реализации отношение количества липофильной добавки к количеству гидрофильной добавки может составлять примерно 50:50.
В отдельном варианте реализации, при условии что присутствуют как гидрофильное поверхностно-активное вещество, так и липофильная добавка, они могут присутствовать в таких количествах, что, при смешивании 1 массовой части смеси гидрофильного поверхностно-активного вещества и липофильной добавки с 99 частями водного разбавителя, полученная таким образом дисперсия может быть коллоидной, мутной или непрозрачной. Например, водный разбавитель, применяемый для получения дисперсии, представляет собой либо воду, либо 0,5% масс./об. лаурилсульфат натрия в воде. В конкретном варианте реализации дисперсия может демонстрировать поглощение больше чем 0,1 при определении с применением спектрофотометра при 400 нм. В другом конкретном варианте реализации поглощение больше чем 0,3 при 400 нм. В другом варианте реализации средний размер частиц дисперсии составляет примерно 60 нм или более. В другом конкретном варианте реализации средний размер частиц дисперсии составляет примерно 100 нм или более. В другом конкретном варианте реализации средний размер частиц дисперсии составляет примерно 150 нм или более. В еще одном конкретном варианте реализации средний размер частиц дисперсии составляет примерно 200 нм или более. В еще одном конкретном варианте реализации средний размер частиц дисперсии составляет примерно 250 нм или более. Например, водный растворитель, применяемый для диспергирования, представляет собой либо воду, либо 0,5% масс./об. лаурилсульфат натрия в воде. Для целей настоящего изобретения дисперсию считают прозрачной, если она выглядит прозрачной для невооруженного глаза. В одном из вариантов реализации дисперсия может быть прозрачной.
Носитель может присутствовать в количестве, достаточном для солюбилизации сложного эфира 17-гидроксипрогестерона. В некоторых аспектах носитель согласно настоящему изобретению способствует солюбилизации значительного количества сложного эфира 17-гидроксипрогестерона в композиции. В одном из вариантов реализации носитель может солюбилизировать 20 масс. % или большее количество сложного эфира 17-гидроксипрогестерона. В другом варианте реализации носитель может способствовать внесению больше чем примерно 10% масс./масс. сложного эфира в композицию и/или лекарственную форму. В другом варианте реализации содержание лекарственного средства, достигаемое благодаря применению носителя, может быть больше чем 12% масс./масс, от массы композиции и/или лекарственной формы. В другом варианте реализации содержание лекарственного средства, достигаемое благодаря применению носителя, может быть больше чем примерно 15% масс./масс, от массы композиции и/или лекарственной формы. В другом варианте реализации содержание лекарственного средства, достигаемое благодаря включению носителя, может быть больше чем примерно 18% масс./масс. от массы композиции и/или лекарственной формы. В дополнительных вариантах реализации содержание лекарственного средства, достигаемое благодаря включению носителя, может быть больше чем примерно 20%; больше чем примерно 25%, больше чем примерно 30%, больше чем примерно 35%, больше чем примерно 40%, больше чем примерно 50%, больше чем примерно 60%, больше чем примерно 75% или больше чем примерно 90%, где каждое процентное содержание выражено в виде % масс./масс. от массы композиции и/или лекарственной формы.
В одном из вариантов реализации носитель может содержать бензиловый спирт, бензилбензоат, их смеси. В другом варианте реализации носитель может содержать бензиловый спирт, бензилбензоат или их смеси, и количество сложного эфира 17-гидроксипрогестерона может составлять от примерно 5 до примерно 80% масс./масс. от общей массы композиции. В одном из вариантов реализации, когда носитель содержит бензиловый спирт, бензилбензоат или их смеси, количество сложного эфира 17-гидроксипрогестерона может составлять от примерно 5 до примерно 80% масс./масс. от общей массы композиции. В одном из вариантов реализации количество сложного эфира 17-гидроксипрогестерона может составлять от 5% до примерно 60% масс./масс. от общей массы композиции. В другом конкретном варианте реализации, когда носитель содержит бензиловый спирт, бензилбензоат или их смеси, количество сложного эфира 17-гидроксипрогестерона может составлять от примерно 5 до примерно 40% масс./масс. от общей массы композиции. В другом конкретном варианте реализации, когда носитель содержит бензиловый спирт, бензилбензоат или их смеси, количество сложного эфира 17-гидроксипрогестерона может составлять от примерно 5 до примерно 30% масс./масс. от общей массы композиции. В другом конкретном варианте реализации, когда носитель содержит бензиловый спирт, бензилбензоат или их смеси, количество сложного эфира 17-гидроксипрогестерона может составлять от примерно 5 до примерно 25% масс./масс. От общей массы композиции. В одном конкретном варианте реализации, когда носитель содержит бензиловый спирт, бензилбензоат или их смеси, сложный эфир 17-гидроксипрогестерона может быть полностью растворен в композиции и/или лекарственной форме. В другом конкретном варианте реализации сложный эфир 17-гидроксипрогестерона может быть частично растворен в лекарственной форме. В другом конкретном варианте реализации сложный эфир 17-гидроксипрогестерона может представлять собой 17-гидроксипрогестерона капроат.
В одном варианте реализации отношение количества сложного эфира 17-гидроксипрогестерона к суммарному количеству бензилового спирта и бензилбензоата, присутствующих в композиции или пероральной лекарственной форме, может составлять от примерно 1:0,01 (масс./масс.) до примерно 1:5 (масс./масс). В другом варианте реализации указанное отношение может составлять от примерно 1:0,01 (масс./масс.) до примерно 1:3,5 (масс./масс). В другом варианте реализации отношение количества сложного эфира 17-гидроксипрогестерона к суммарному количеству бензилового спирта и бензилбензоата, присутствующих в композиции или пероральной лекарственной форме, может составлять от примерно 1:0,01 (масс./масс.) до примерно 1:2,5 (масс./масс). В другом варианте реализации отношение количества сложного эфира 17-гидроксипрогестерона к суммарному количеству бензилового спирта и бензилбензоата, присутствующих в композиции или пероральной лекарственной форме, может составлять от примерно 1:0,01 до примерно 1:2 (масс./масс).
Фармацевтические композиции и пероральные лекарственные формы могут быть приготовлены и доставлены в виде различных твердых или жидких лекарственных форм. Неограничивающие примеры таких лекарственных форм включают порошок, гранулят, формы в виде частиц, шариков, пеллет, форму для посыпания (sprinkle), суспензию, раствор, таблетки, капсулы и их комбинации. В одном из вариантов реализации фармацевтическая композиция или пероральная лекарственная форма может быть в форме капсулы. В другом варианте реализации фармацевтическая композиция или пероральная лекарственная форма может быть в форме таблетки. В одном из вариантов реализации лекарственная форма представляет собой жесткую или мягкую капсулу. Указанная капсула может быть получена с применением обычных материалов для оболочки капсул, известных в данной области техники; такие материалы могут включать, но не ограничиваются только ими, желатины, целлюлозы, крахмалы, метакрилаты, каррагинаны, поливиниловые спирты и т.п. В другом варианте реализации капсула представляет собой лекарственную форму с немедленным высвобождением. В еще одном варианте реализации капсула представляет собой лекарственную форму с контролируемым высвобождением. В другом варианте реализации таблетка представляет собой лекарственную форму с немедленным высвобождением. В другом варианте реализации таблетка представляет собой лекарственную форму с контролируемым высвобождением.
В одном варианте реализации объем капсулы может составлять примерно 1,5 мл или менее. В другом варианте реализации объем капсулы может составлять примерно 1,2 мл или менее. В одном конкретном варианте реализации объем капсулы может составлять примерно 0,8 мл или менее. В другом варианте реализации отношение массы инкапсулированного заполняющего материала внутри капсулы к объему капсулы может составлять от примерно 0,3 г/мл до примерно 3,5 г/мл. В конкретном варианте реализации указанное отношение может составлять от 0,6 г/мл до примерно 2,5 г/мл. В другом конкретном варианте реализации указанное отношение может составлять от 0,6 г/мл до примерно 1,2 г/мл.
В другом варианте реализации фармацевтическая капсульная пероральная лекарственная форма согласно настоящему изобретению может характеризоваться отношением количества сложного эфира 17-гидроксипрогестерона в композиции к номинальному объему капсулы, составляющим от примерно 0,02 г/мл до примерно 0,8 г/мл. В другом варианте реализации указанное отношение может составлять от примерно 0,02 г/мл до примерно 0,7 г/мл. В конкретном варианте реализации указанное отношение может составлять от примерно 0,02 г/мл до примерно 0,5 г/мл. В другом конкретном варианте реализации указанное отношение может составлять от примерно 0,05 г/мл до примерно 0,5 г/мл. В другом конкретном варианте реализации указанное отношение может составлять от примерно 0,05 г/мл до примерно 0,35 г/мл. В другом конкретном варианте реализации указанное отношение может составлять от примерно 0,05 г/мл до примерно 0,3 г/мл. В другом конкретном варианте реализации указанное отношение может составлять от примерно 0,1 г/мл до примерно 0,25 г/мл.
Пероральные лекарственные формы согласно настоящему изобретению могут быть приготовлены с суммарным содержанием сложного эфира 17-гидроксипрогестерона, эквивалентным от примерно 10 мг до примерно 800 мг 17-гидроксипрогестерона. В одном из вариантов реализации указанная пероральная лекарственная форма может быть приготовлена с суммарным содержанием сложного эфира 17-гидроксипрогестерона, эквивалентным от 20 мг до примерно 400 мг 17-гидроксипрогестерона. Фармацевтическая композиция и пероральные лекарственные формы согласно настоящему изобретению могут быть приготовлены таким образом, чтобы при введении субъекту они могли обеспечить суточную дозу сложного эфира 17-гидроксипрогестерона, эквивалентную от примерно 40 мг до примерно 3200 мг 17-гидроксипрогестерона. В одном из вариантов реализации пероральная лекарственная форма может представлять собой капсулу, и указанная капсула содержит от примерно 10 мг до примерно 300 мг 17-гидроксипрогестерона капроата. В другом варианте реализации пероральная лекарственная форма может представлять собой таблетку, и указанная таблетка содержит от примерно 20 мг до примерно 800 мг 17-гидроксипрогестерона капроата.
С целью обеспечения необходимой суточной дозы фармацевтические композиции и пероральные лекарственные формы могут быть приготовлены для введения с различными интервалами дозирования. В одном из вариантов реализации композиции или пероральные лекарственные формы могут быть приготовлены для введения примерно один раз в 8 часов. В другом варианте реализации композиции или пероральные лекарственные формы могут быть приготовлены для введения субъекту, такому как человек, один раз в 6 часов. В другом варианте реализации композиции или пероральные лекарственные формы могут быть приготовлены для введения примерно один раз в 12 часов. В еще одном дополнительном варианте реализации композиции или пероральные лекарственные формы могут быть приготовлены для введения примерно один раз в 24 часа.
В одном аспекте пероральные лекарственные формы согласно настоящему изобретению можно применять для лечения беременных женщин, которые подвержены риску преждевременных родов. Способы лечения включают стадию перорального введения женщине пероральной фармацевтической композиции. В другом варианте реализации пероральные лекарственные формы могут быть введены субъектам, нуждающимся в этом. Введение пероральной лекарственной формы может обеспечить лечение по меньшей мере одного состояния, выбранного из преждевременных родов, ранних родов, бесплодия и выкидыша. В одном из вариантов реализации субъект, получающий фармацевтическую композицию или пероральную лекарственную форму, может претерпевать или быть подверженным риску по меньшей мере двух из следующих состояний: одноплодной беременности, преждевременных родов и/или ранних родов в анамнезе, преждевременных родов в анамнезе, укорочения шейки матки и стирания шейки матки, более одного, по меньшей мере одного выкидыша в анамнезе и многоплодной беременности в анамнезе. Условия и соответствующее лечение могут быть основаны на первичных и вторичных критериях их оценки, связанных с введением сложного эфира 17-гидроксипрогестерона.
В одном из вариантов реализации при однократном введении человеку фармацевтические композиции или пероральные лекарственные формы согласно настоящему изобретению, содержащие сложный эфир 17-гидроксипрогестерона, могут обеспечить эквивалентную концентрацию Сср-24 ч 17-гидроксипрогестерона больше чем примерно 0,7 нг/мл. В другом варианте реализации указанная пероральная лекарственная форма или композиция может обеспечить Сср-24 ч эквивалентов 17-гидроксипрогестерона больше чем примерно 10 нг/мл. В другом варианте реализации указанная пероральная лекарственная форма или композиция может обеспечить Сср-24 ч эквивалентов 17-гидроксипрогестерона больше чем примерно 30 нг/мл. В другом варианте реализации указанная пероральная лекарственная форма или композиция может обеспечить Сср-24 ч эквивалентов 17-гидроксипрогестерона больше чем примерно 50 нг/мл. В еще одном дополнительном варианте реализации указанная пероральная лекарственная форма или композиция может обеспечить Сср-24 ч эквивалентов 17-гидроксипрогестерона больше чем примерно 100 нг/мл. В одном из вариантов реализации указанную концентрацию Сср-24 ч эквивалентов 17-гидроксипрогестерона определяют посредством анализа образцов плазмы, сыворотки или крови, собираемых после перорального введения, с применением метода ВЭЖХ-МС/МС.
В одном из вариантов реализации при однократном введении человеку фармацевтические композиции или пероральные лекарственные формы согласно настоящему изобретению, содержащие 17-гидроксипрогестерона капроат, могут обеспечить концентрацию Сср-24 ч 17-гидроксипрогестерона капроата, равную примерно 1,0 нг/мл или больше. В другом варианте реализации указанная пероральная лекарственная форма или композиция может обеспечить Сср-24 ч 17-гидроксипрогестерона капроата, равную примерно 20 нг/мл или больше. В другом варианте реализации указанная пероральная лекарственная форма или композиция может обеспечить Сср-24 ч 17-гидроксипрогестерона капроата, равную примерно 50 нг/мл или больше. В другом варианте реализации указанная пероральная лекарственная форма или композиция может обеспечить Сср-24 ч 17-гидроксипрогестерона капроата, равную примерно 100 нг/мл или больше. В одном из вариантов реализации указанную концентрацию Сср-24 ч 17-гидроксипрогестерона капроата определяют посредством анализа образцов плазмы, сыворотки или крови, собираемых после перорального введения, с применением метода ВЭЖХ-МС/МС.
Неожиданно было обнаружено, что композиции и/или лекарственные формы согласно настоящему изобретению обеспечивали значительно улучшенную биодоступность 17-гидроксипрогестерона капроата в зависимости от пероральной дозы 17-гидроксипрогестерона капроата, вводимой субъекту. Соответственно, композиции или лекарственные формы согласно настоящему изобретению обеспечивают, при пероральном введении однократной дозы, отношение AUC(0-24 ч) к дозе примерно 10 или меньше, при этом указанная доза представляет собой количество введенного 17-гидроксипрогестерона капроата в мг. В одном из вариантов реализации отношение 17-гидроксипрогестерона капроата AUC(0-24 ч) к введенной дозе 17-гидроксипрогестерона капроата может составлять от примерно 0,2 нг*ч⋅мл-1⋅мг-1 до примерно 10 нг*ч⋅мл-1⋅мг-1. В другом варианте реализации отношение 17-гидроксипрогестерона капроата AUC(0-24 ч) к введенной дозе 17-гидроксипрогестерона капроата может составлять от примерно 0,3 нг*ч⋅мл-1⋅мг-1 до примерно 7 нг*ч⋅мл-1⋅мг-1. В конкретном варианте реализации указанное отношение AUC(0-24 ч) к дозе составляет от примерно 0,5 до примерно 6 нг*ч⋅мл-1⋅мг-1.
В конкретном варианте реализации при однократном введении фармацевтических композиций или пероральных лекарственных форм согласно настоящему изобретению, содержащих 17-гидроксипрогестерона капроат, человеку после приема пищи, указанная пероральная лекарственная форма или фармацевтическая композиция может обеспечить Сср-24 ч 17-гидроксипрогестерона капроата больше чем примерно 1,0 нг/мл. В другом конкретном варианте реализации фармацевтические композиции или пероральные лекарственные формы согласно настоящему изобретению, содержащие 17-гидроксипрогестерон, могут обеспечить равновесную концентрацию Сср-24 ч 17-гидроксипрогестерона капроата больше чем примерно 1,0 нг/мл при введении человеку в сытом состоянии. В одном из вариантов реализации указанную Сср-24 ч определяют посредством анализа образцов плазмы, сыворотки или крови, собираемых после введения, с применением метода ВЭЖХ-МС/МС. В другом варианте реализации композиции и пероральные лекарственные формы, предложенные в настоящей заявке, могут быть введены перорально с пищевыми продуктами или без них в зависимости от вида или состава пищевых продуктов. В конкретном варианте реализации композиции и пероральные лекарственные формы, содержащие капроатный сложный эфир 17-гидроксипрогестерона, как описано в настоящей заявке, могут быть введены перорально с пищевыми продуктами или без них или в зависимости от вида или состава пищевых продуктов.
В одном из вариантов реализации пероральная лекарственная форма может быть введена перорально с пищевыми продуктами или после приема пищи. В другом варианте реализации композиция или пероральная лекарственная форма может быть введена с обычной или стандартной пищей. В конкретном варианте реализации композиция или пероральная лекарственная форма может быть введена с пищевыми продуктами или пищей, которая обеспечивает энергетическую ценность от примерно 200 калорий до примерно 1000 калорий. В другом конкретном варианте реализации композиция или пероральная лекарственная форма может быть введена с пищей, которая обеспечивает примерно 50% калорий из жира. В другом варианте реализации композиция или пероральная лекарственная форма может быть введена с высококалорийной пищей с высоким содержанием жира. В другом варианте реализации композиция или пероральная лекарственная форма может быть введена с обычной пищей, которая обеспечивает энергетическую ценность от примерно 500 калорий до примерно 1000 калорий. Состав принимаемой пищи может варьировать в зависимости от вкусов и диетических потребностей субъекта. Однако в некоторых ситуациях может быть благоприятно введение композиций и пероральных лекарственных форм пищей, которая обеспечивает отсутствие жира или наличие жира в количестве до примерно 50 г.В одном из вариантов реализации пища может обеспечить от примерно 3 г до примерно 50 г жира. В еще одном дополнительном варианте реализации пища может обеспечить от 10 г до примерно 50 г жира. В другом варианте реализации пища может обеспечить от примерно 15 г до примерно 35 г жира. В одном из вариантов реализации, когда указанную пероральную лекарственную форму вводят женщине, введение может быть произведено безотносительно наличия или питательного состава пищи. В другом варианте реализации при введении указанной пероральной лекарственной формы общая суточная доза сложного эфира 17ГП, вводимая женщине с пищевыми продуктами или после приема пищи, составляет от примерно 20% до примерно 80% от общей суточной дозы, вводимой без пищи, для обеспечения аналогичного благоприятного терапевтического эффекта. В конкретном варианте реализации суточная доза при введении после приема пищи составляет от примерно 20% до примерно 60% от общей суточной дозы, вводимой без пищи, для обеспечения аналогичного благоприятного терапевтического эффекта. В другом варианте реализации композиция или пероральная лекарственная форма может быть введена без пищи или натощак.
Биодоступность при пероральном введении сложного эфира 17-гидроксипрогестерона может быть повышена путем применения указанного сложного эфира в форме мелких частиц, например, измельченных, микронизированных или наноразмерных и т.д., в композиции и/или лекарственной форме согласно настоящему изобретению. Кроме того, биодоступность при пероральном введении может быть повышена путем применения сложного эфира вместе с носителем, который способствует высвобождению по меньшей мере на 20% большего количества сложного эфира из композиции или лекарственной формы при воздействии водной среды по сравнению с эквивалентной дозой сложного эфира без носителя согласно настоящему изобретению. В конкретном варианте реализации биодоступность при пероральном введении капроатного сложного эфира 17-гидроксипрогестерона может быть повышена путем применения указанного сложного эфира в форме мелких частиц, например, измельченных, микронизированных или наноразмерных, или их комбинаций в композиции и/или лекарственной форме согласно настоящему изобретению.
Соответственно, в одном из вариантов реализации биодоступность при пероральном введении сложного эфира 17-гидроксипрогестерона по меньшей мере на 10% больше для композиций или лекарственных форм согласно настоящему изобретению, которые высвобождают по меньшей мере 20% сложного эфира в водной среде по сравнению с эквивалентной дозой сложного эфира, представленного в форме "необработанных" частиц, такой как, например, форма неизмельченных или немикронизированных частиц. В другом варианте реализации биодоступность при пероральном введении сложного эфира 17-гидроксипрогестерона по меньшей мере на 10% больше для композиций или лекарственных форм согласно настоящему изобретению, которые высвобождают по меньшей мере на 20% большее количество сложного эфира из композиции или лекарственной формы при попадании в водную среду по сравнению с не содержащей носителя эквивалентной дозой сложного эфира согласно настоящему изобретению. В конкретном варианте реализации указанный сложный эфир представляет собой 17-гидроксипрогестерона капроат.
Сложный эфир 17-гидроксипрогестерона может являться субстратом для P-гликопротеинов (P-gp), входящих в системы эффлюксных транспортеров. Таким образом, в одном из вариантов реализации биодоступность при пероральном введении может быть повышена по меньшей мере на 10% путем совместного введения сложного эфира 17-гидроксипрогестерона согласно настоящему изобретению с эффективным количеством агентов, ингибирующих P-gp и/или CYP3A4, например, плода карамболы (старфрута), сока грейпфрута, бергамоттина, кафестола (как в нефильтрованном кофе), кетоконазола, эритромицина, мибефрадила, лоперамида и т.д.
В дополнительном аспекте пероральные фармацевтические композиции или пероральные лекарственные формы сложного эфира 17-гидроксипрогестерона в соответствии с настоящим изобретением могут быть применены для обеспечения лютеиновой поддержки субъекта, нуждающегося в этом. В одном из вариантов реализации пероральная композиция или пероральная лекарственная форма может быть приготовлена так, чтобы создать возможность модулирования или титрования дозы и/или режима дозирования сложного эфира 17-гидроксипрогестерона для обеспечения эффективной лютеиновой поддержки субъекта, нуждающегося в этом. В одном конкретном варианте реализации дозу сложного эфира 17-гидроксипрогестерона в форме пероральных композиций или лекарственных форм согласно настоящему изобретению можно модулировать или титровать для обеспечения по мере необходимости эффективной лютеиновой поддержки на ранних сроках беременности. В другом конкретном варианте реализации дозу сложного эфира 17-гидроксипрогестерона в форме пероральных композиций или лекарственных форм согласно настоящему изобретению можно модулировать или титровать для обеспечения по мере необходимости эффективной лютеиновой поддержки на основании индекса массы тела (ИМТ) субъекта. В другом конкретном варианте реализации дозу сложного эфира 17-гидроксипрогестерона в форме пероральных композиций или лекарственных форм согласно настоящему изобретению можно модулировать или титровать для обеспечения по мере необходимости эффективной лютеиновой поддержки на основании расовой или этнической принадлежности субъекта.
Пример модулирования или титрования дозы может быть основан на общей суточной дозе и может включать введение более высокой начальной насыщающей дозы или болюсной дозы с последующим введением более низкой эффективной стандартной дозы. Аналогичным образом, модулирование или титрование дозы может быть основано на общей недельной дозе и может включать введение более высокой начальной насыщающей дозы или болюсной дозы в первые дни недели с последующим введением более низкой эффективной стандартной дозы в последующие дни недели. Режим дозирования может включать наращивание (т.е. с монотонно увеличивающимся приростом) суточной дозы в соответствии с развитием беременности. В конкретном варианте реализации сложный эфир представляет собой 17-гидроксипрогестерона капроат (17-гидроксипрогестерона капроат).
В другом варианте реализации суточная пероральная доза 17-гидроксипрогестерона капроата, вводимая с пищевыми продуктами, составляет от примерно 40 мг до примерно 5000 мг. В другом варианте реализации суточная пероральная доза составляет от примерно 40 мг до примерно 4000 мг. В другом варианте реализации суточная пероральная доза составляет от примерно 80 мг до примерно 4000 мг. В другом варианте реализации суточная пероральная доза составляет от примерно 150 мг до примерно 4000 мг. В другом варианте реализации суточная пероральная доза составляет от примерно 250 мг до примерно 4000 мг. В другом варианте реализации суточная пероральная доза составляет от примерно 500 мг до примерно 4000 мг. В другом варианте реализации суточная пероральная доза составляет от примерно 750 мг до примерно 4000 мг. В другом варианте реализации суточная пероральная доза составляет от примерно 1000 мг до примерно 4000 мг. В другом варианте реализации суточная пероральная доза составляет от примерно 1200 мг до примерно 4000 мг. В другом варианте реализации суточная пероральная доза составляет от примерно 1500 мг до примерно 4000 мг. В другом варианте суточная пероральная доза составляет от примерно 1500 мг до примерно 3000 мг. В другом варианте реализации суточная пероральная доза составляет от примерно 1000 мг до примерно 2000 мг. В другом варианте реализации суточная пероральная доза составляет от примерно 200 мг до примерно 2000 мг. В другом варианте реализации суточная пероральная доза составляет от примерно 400 мг до примерно 2000 мг. В другом варианте реализации суточная пероральная доза составляет от примерно 800 мг до примерно 2000 мг.
В одном конкретном варианте реализации пероральная лекарственная форма согласно настоящему изобретению содержит терапевтически эффективное количество сложного эфира 17-гидроксипрогестерона, при этом из указанной пероральной лекарственной формы через 60 минут, при измерении с использованием аппарата для растворения 2 го типа согласно USP в 900 мл деионизированной воды с 0,5% (масс./об.) лаурилсульфата натрия при 50 об/мин при 37°C, высвобождается по меньшей мере 20 масс. % от дозы сложного эфира 17-гидроксипрогестерона. В другом конкретном варианте реализации из указанной лекарственной формы через 60 минут высвобождается по меньшей мере примерно 40 масс. % от дозы сложного эфира 17-гидроксипрогестерона. В другом конкретном варианте реализации из указанной лекарственной формы через 60 минут высвобождается по меньшей мере примерно 50 масс. % от дозы сложного эфира 17-гидроксипрогестерона. В другом конкретном варианте реализации из указанной лекарственной формы через 60 минут высвобождается по меньшей мере примерно 70 масс. % от дозы сложного эфира 17-гидроксипрогестерона. В конкретном варианте реализации сложный эфир представляет собой 17-гидроксипрогестерона капроат. В другом варианте реализации лекарственную форму вводят с пищевыми продуктами.
После перорального введения сложного эфира 17-гидроксипрогестерона (например, 17-гидроксипрогестерона капроата) в форме композиции или лекарственной формы согласно настоящему изобретению его концентрация в сыворотке, плазме или крови субъекта может быть определена посредством аналитических методов, основанных на радиоиммуноанализе (РИА), высокоэффективной жидкостной хроматографии-масс-спектрометрии (ВЭЖХ-МС/МС) и т.п. Соответственно, уровни сложного эфира в плазме или крови могут быть различными. Следует понимать, что любые относительные сравнения уровней какого-либо соединения в плазме крови следует проводить с применением той же самой методики анализа или должны быть сделаны поправки для корректировки несоответствий, возникающих вследствие особенностей анализа.
Соответственно, в одном из вариантов реализации композиции или лекарственные формы 17-гидроксипрогестерона капроата согласно настоящему изобретению могут обеспечить среднюю равновесную концентрацию ср. Cmax 17-гидроксипрогестерона капроата, составляющую от примерно 10 нг/мл до примерно 800 нг/мл, при этом уровень 17-гидроксипрогестерона капроата в плазме определяют посредством метода ВЭЖХ-МС/МС. В конкретном варианте реализации композиции или лекарственные формы обеспечивают среднюю равновесную концентрацию ср. Cmax 17-гидроксипрогестерона капроата, составляющую от примерно 10 нг/мл до примерно 400 нг/мл.
В дополнительном варианте реализации композиции или пероральные лекарственные формы 17-гидроксипрогестерона капроата согласно настоящему изобретению могут обеспечить среднюю равновесную концентрацию Cmin 17-гидроксипрогестерона капроата, составляющую примерно 1 нг/мл или больше. Концентрации 17-гидроксипрогестерона капроата в плазме можно определять посредством метода ВЭЖХ-МС/МС. В одном из вариантов реализации композиции или пероральные лекарственные формы могут обеспечить среднюю равновесную концентрацию Cmin 17-гидроксипрогестерона капроата, составляющую больше чем примерно 10 нг/мл. В другом варианте реализации композиции или пероральные лекарственные формы могут обеспечить среднюю равновесную концентрацию Cmin 17-гидроксипрогестерона капроата, составляющую больше чем примерно 20 нг/мл, или больше чем примерно 40 нг/мл, больше чем примерно 60 нг/мл, или больше чем примерно 80 нг/мл. В одном конкретном варианте реализации композиция или пероральная лекарственная форма может обеспечить среднюю равновесную концентрацию Cmin, составляющую от примерно 1 до примерно 60 нг/мл. В другом конкретном варианте реализации композиция или лекарственная форма может обеспечить среднюю равновесную концентрацию Cmin, составляющую от примерно 1 нг/мл до примерно 20 нг/мл.
Соответственно, пероральная лекарственная форма 17-гидроксипрогестерона капроата согласно настоящему изобретению может представлять собой лекарственную форму с немедленным высвобождением. В отдельном варианте реализации пероральная лекарственная форма 17-гидроксипрогестерона капроата согласно настоящему изобретению может представлять собой лекарственную форму с контролируемым высвобождением. В другом конкретном варианте реализации лекарственная форма может содержать 17-гидроксипрогестерона капроат в форме фракций как для немедленного высвобождения, так и для контролируемого высвобождения, предпочтительно для замедленного или отсроченного высвобождения.
Следовательно, композиции или лекарственные формы с контролируемым высвобождением 17-гидроксипрогестерона капроата согласно настоящему изобретению могут обеспечить флуктуацию уровней 17-гидроксипрогестерона капроата меньше чем примерно 795 нг/мл, где флуктуация определяется разностью средней равновесной концентрации Cmax и средней равновесной концентрации Cmin 17-гидроксипрогестерона капроата в плазме или сыворотке или крови при пероральном введении.
В другом конкретном аспекте пероральные фармацевтические композиции и/или лекарственные формы 17-гидроксипрогестерона капроата согласно настоящему изобретению могут быть использованы для лечения одного или более состояний, выбранных из группы, состоящей из привычного выкидыша, повторного выкидыша, угрозы выкидыша, болезненных послеродовых схваток, рака эндометрия, лечения первичной и вторичной аменореи, бесплодия вследствие недостаточности желтого тела, дефицита прогестагена, истмико-цервикальной недостаточности, функциональной цервикальной недостаточности и аномальных маточных кровотечений. В дополнительном варианте реализации пероральные фармацевтические композиции и/или лекарственные формы 17-гидроксипрогестерона капроата согласно настоящему изобретению могут быть применены для проверки выработки эндогенного эстрогена и для стимулирования образования секреторного эндометрия и десквамации эндометрия.
В другом варианте реализации пероральные фармацевтические композиции и/или лекарственные формы 17-гидроксипрогестерона капроата согласно настоящему изобретению могут быть применены совместно с добавками омега-3 жирных кислот для лечения пациентов с симптомами преждевременных родов. В конкретном варианте реализации композиции и/или лекарственные формы согласно настоящему изобретению могут содержать по меньшей мере одну омега-жирную кислоту. В другом конкретном варианте реализации композиции и/или лекарственные формы согласно настоящему изобретению могут содержать омега-3, омега-6 или омега-9 жирные кислоты или их смеси.
ПРИМЕРЫ
Следующие примеры предложены для обеспечения более ясного понимания некоторых вариантов реализации настоящего изобретения и никоим образом не ограничивают последнее. Если не указано или не упомянуто иное, составы всех композиций, предложенных в примерах, выражены в % масс./масс. из расчета на конечную композицию. Следует отметить, что за исключением композиций, перечисленных в Примерах 1, 7, 10, 17 и 36, 17-гидроксипрогестерона капроат во всех перечисленных в других примерах композициях может находиться либо в обработанной (измельченной, микронизированной или наноразмерной), либо в необработанной форме. 17-Гидроксипрогестерона капроат в композициях согласно Примерам 1, 7, 10, 17 и 36 не обрабатывали с целью уменьшения размера (т.е. он был неизмельченным, немикронизированным или ненаноразмерным), и средний размер частиц превышал 50 микрометров. Лекарственные формы, представленные в соответствующих Примерах, исследовали на способность высвобождения 17-гидроксипрогестерона капроата с использованием аппарата 2 го типа согласно USP в 900 мл искусственного кишечного сока, содержащего 0,5% масс./масс. лаурилсульфата натрия, при 50 об/мин при 37°C. Процент высвобожденного из каждой композиции 17-гидроксипрогестерона капроата анализировали посредством ВЭЖХ.
ПРИМЕРЫ 1-6 - Композиции на основе 17-гидроксипрогестерона капроата
Композиции на основе 17-гидроксипрогестерона капроата согласно Примерам 1-6 получали с использованием соответствующих компонентов, показанных в Таблице I. Пример 1 иллюстрирует применение 17-гидроксипрогестерона капроата в необработанной кристаллической форме, заключенной в твердые желатиновые капсулы. Пример 2 иллюстрирует микронизированный 17-гидроксипрогестерона капроат без носителя, заключенный в твердые желатиновые капсулы. Композиции согласно Примерам 3-6 получали следующим образом: необходимые количества каждого из компонентов соответствующей композиции, за исключением 17-гидроксипрогестерона капроата, помещали в чистую емкость из нержавеющей стали и перемешивали при примерно 50-70°C с помощью мешалки. Получали жидкую прозрачную или мутную смесь. Добавляли необходимое количество 17-гидроксипрогестерона капроата в прозрачную или мутную смесь и перемешивали с образованием гомогенной жидкой смеси. Заранее определенную навеску полученной жидкой смеси помещали в капсулы подходящего размера в соответствии с требуемой дозой 17-гидроксипрогестерона капроата. Капсулы оставляли затвердевать при комнатной температуре и затем собирали и упаковывали в бутылки из полиэтилена высокой плотности и герметично закрывали крышкой.
Данные по высвобождению 17-гидроксипрогестерона капроата из каждой композиции с применением вышеупомянутых параметров исследования растворения приведены в Таблице I. Следует отметить, что Примеры 1 и 2 (17-гидроксипрогестерона капроат без носителя) и Примеры 3-6 (17-гидроксипрогестерона капроат, смешанный с по меньшей мере одним носителем) могут быть использованы с целью сравнения для облегчения демонстрации преимуществ композиций и лекарственных форм согласно настоящему изобретению.
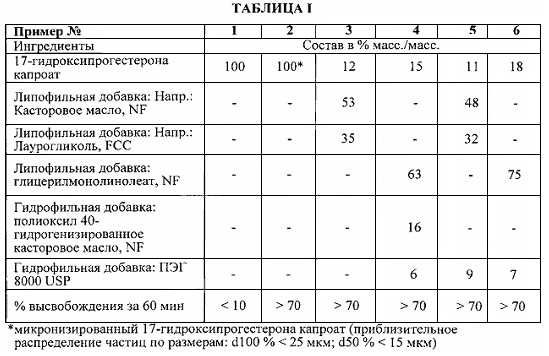
Водная дисперсия смеси, содержащей липофильную добавку и гидрофильное поверхностно-активное вещество, если таковые присутствуют, согласно Примерам 3-6 Таблицы I может быть от мутной до непрозрачной для невооруженного глаза. Ее поглощение при 400 нм может быть больше чем 0,1, или больше чем 0,3, и/или размер частиц дисперсии может превышать 100 нм. В некоторых аспектах средний размер частиц дисперсии может превышать 250 нм. Каждую из водных дисперсий получали путем смешивания 1 части смеси добавок согласно соответствующему примеру и 99 частей водного разбавителя. Композиции согласно Примерам 3-6 могут быть получены путем смешивания добавок 17-гидроксипрогестерона капроата с образованием гомогенного раствора или суспензии. При необходимости смесь можно нагревать (например, до примерно 40-80°C) для получения раствора или достижения состояния гомогенной суспензии. Смесь может быть заключена в капсулу. Лекарственная форма согласно Примерам 1 и 2 содержит 17-гидроксипрогестерона капроат в твердой немикронизированной форме и в форме микронизированных частиц, соответственно. 17-Гидроксипрогестерона капроат может быть полностью растворенным (как в случае Примера 3) или частично растворенным (как в случае Примеров 5 и 6). Составы в соответствии с Таблицей I, если они являются жидкостями, могут также быть приготовлены в виде твердой лекарственной формы путем заключения в капсулы либо как есть, либо в смеси с отвердителем. Альтернативно, они могут быть приготовлены в виде таблеток с применением подходящих вспомогательных веществ для таблетирования.
ПРИМЕРЫ 7-10 - Композиции на основе 17-гидроксипрогестерона капроата
Композиции на основе 17-гидроксипрогестерона капроата согласно Примерам 7-10 могут быть получены с применением показанных в Таблице II ингредиентов, и они обеспечивали указанную эффективность высвобождения.

Следует отметить, что композиции согласно Примерам 7-10 могут быть приготовлены с обеспечением гранул для прессования в таблетку или заключения в капсулу, саше и т.д. с включением подходящих фармацевтических вспомогательных веществ, таких как разбавители, связующие вещества, дезинтегранты, смазывающие вещества, ароматизаторы и т.д.
В отличие Примеров 1 и 7, профили высвобождения 17-гидроксипрогестерона капроата согласно Примерам 8, 9 и 10, представленным в Таблице II, иллюстрируют преимущества меньшего размера частиц 17-гидроксипрогестерона капроата. Эти Примеры также иллюстрируют преимущества различных способов получения, таких как гранулирование, которые обеспечивают твердые композиции с подходящими профилями высвобождения 17-гидроксипрогестерона капроата. В некоторых вариантах реализации капроновокислый сложный эфир в композициях согласно приведенным в Таблице II примерам может быть замещен на другие сложные эфиры 17-гидроксипрогестерона, такие как ацетат или ундеканоат.
ПРИМЕР 11 - Таблетки с покрытием, содержащие 17-гидроксипрогестерона капроат
Таблетки согласно Примерам 7-10, содержащие 17-гидроксипрогестерона капроат, могут быть дополнительно снабжены покрытием с помощью раствора для нанесения покрытия, имеющего типичный состав, указанный в Таблице III, с применением обычных способов нанесения покрытия на таблетки, известных в данной области техники, до увеличения массы на примерно 3-6%.
Входящий в состав покрытия полимер может быть выбран на основании потребности в определенной функциональной возможности, которой лекарственная форма должна быть наделена. Например, можно использовать пленочное покрытие, маскирующее вкус покрытие, кишечнорастворимое покрытие, защитное покрытие, покрытие, обеспечивающее замедленное высвобождение, и т.д. Неограничивающие примеры полимеров для применения в таких покрытиях включают гипромеллозу, полиэтиленгликоль, повидон, сахара, этилцеллюлозы, метакрилаты, фталаты целлюлозы и т.д. Многие обычные вспомогательные вещества для нанесения покрытия, такие как тальк, крахмал, пластификаторы, замутнители, красители, ароматизаторы и т.д. могут также быть применены наряду с входящими в состав покрытий полимерами или сахарами. Растворители для нанесения покрытия можно варьировать соответствующим образом в зависимости от вида используемого полимера или сахара, входящего в состав покрытия.
ПРИМЕРЫ 12-17 - Композиции на основе 17-гидроксипрогестерона капроата
В Таблице IV представлены композиции на основе 17-гидроксипрогестерона капроата согласно Примерам 12-17, которые могут быть получены с применением указанных в Таблице компонентов и способа, аналогичного описанному для Примеров 3-6. Данные по высвобождению 17-гидроксипрогестерона капроата из лекарственной формы также показаны в Таблице IV.

Водная дисперсия смеси липофильной добавки и гидрофильного поверхностно-активного вещества, если таковые присутствуют, согласно показанным в Таблице IV примерам может быть от мутной до непрозрачной для невооруженного глаза. Ее поглощение при 400 нм может быть больше чем 0,1, или больше чем 0,3, и/или размер частиц дисперсии может превышать 100 нм. В некоторых аспектах средний размер частиц дисперсии может превышать 250 нм. Каждую из водных дисперсий получали путем смешивания 1 части смеси добавок согласно соответствующему примеру и 99 частей водного разбавителя.
Композиции в соответствии с Таблицей IV, если они являются жидкостями, могут быть приготовлены в виде твердых лекарственных форм путем заключения в капсулу либо как есть, либо в смеси с отвердителем, таким как полиэтиленгликоль, глицерилдистеарат, воск и т.п. Следует отметить, что эти композиции также могут быть приготовлены с обеспечением гранул для прессования в таблетку или заключения в капсулу, саше и т.д. с включением подходящих фармацевтических вспомогательных веществ, таких как разбавители, связующие вещества, дезинтегранты, смазывающие вещества, ароматизаторы и т.д.
17-Гидроксипрогестерона капроат в композициях согласно приведенным в Таблице IV примерам в некоторых вариантах реализации может быть замещен на другие сложные эфиры 17-гидроксипрогестерона, такие как 17-гидроксипрогестерона ацетат или 17-гидроксипрогестерона ундеканоат.
ПРИМЕРЫ 18-23 - Композиции на основе 17-гидроксипрогестерона капроата
В Таблице V показаны различные композиции на основе 17-гидроксипрогестерона капроата согласно Примерам 18-23, которые могут быть получены с применением указанных в Таблице компонентов.

В Таблице VI представлены различные конкретные варианты реализации разных лекарственных форм (ЛФ-1-ЛФ-9), содержащих 17-гидроксипрогестерона капроат, которые могут быть получены посредством различных комбинаций композиций, показанных в Таблице V.

- Дополнительные способы таблетирования, известные в данной области техники, могут быть применены к приведеным выше в качестве примеров композициям.
- Показанные вспомогательные вещества представляют собой типовые классы вспомогательных веществ, которые можно использовать.
- Форма лекарственного средства может являться взаимозаменяемой с другими формами, такими как микронизированная, просеянная, измельченная, аморфная, наноразмерная и т.д.
Вышеупомянутые лекарственные формы ЛФ-1-ЛФ-9 могут находиться в виде единичных или множественных дисперсных частиц, заключенных в капсулу, или в виде единичных или множественных дисперсных частиц, спрессованных в простую таблетку или многослойные таблетки.
ПРИМЕРЫ 24-28 - Композиции на основе 17-гидроксипрогестерона капроата
В Таблице VII представлены композиции на основе 17-гидроксипрогестерона капроата согласно Примерам 24-28, которые могут быть получены с применением указанных в Таблице компонентов, и соответствующая эффективность высвобождения.

- Дополнительные способы таблетирования, известные в данной области техники, могут быть применены к приведеным выше в качестве примеров композициям.
- Показанные вспомогательные вещества представляют собой типовые классы вспомогательных веществ, которые можно использовать; могут быть применены такие вспомогательные вещества как связующие вещества, дезинтегранты, разбавители, вещества, способствующие скольжению, смазывающие вещества и вспомогательные вещества для нанесения покрытия, хорошо известные в данной области техники.
- Форма лекарственного средства может являться взаимозаменяемой с другими формами, такими как микронизированная, просеянная, измельченная, аморфная, наноразмерная и т.д.
- Вышеупомянутые лекарственные формы могут находиться в виде единичных или множественных дисперсных частиц, заключенных в капсулу, или в виде единичных или множественных дисперсных частиц, спрессованных в монолитную/матричную таблетку или многослойные таблетки.
Согласно Примеру 28, лекарственную форму сначала подвергали воздействию примерно 250 мл искусственного желудочного сока (ИЖС), не содержащего ферментов, в течение первых 30 минут с последующим воздействием 900 мл 0,5 масс. % раствора ЛСН в воде при pH примерно 6,8.
ПРИМЕРЫ 29-35 - Композиции на основе 17-гидроксипрогестерона капроата
В Таблице VIII представлены композиции на основе 17-гидроксипрогестерона капроата и данные по высвобождению для Примеров 29-35, которые могут быть получены с применением указанных в Таблице компонентов и способа, аналогичного описанному для Примеров 12-17.

Вышеприведенные композиции могут быть приготовлены таким образом, чтобы демонстрировать профили немедленного или контролируемого высвобождения. Водная дисперсия смеси липофильной добавки и гидрофильного поверхностно-активного вещества, если таковые присутствуют, согласно примерам Таблицы VIII может быть от мутной до непрозрачной для невооруженного глаза. Ее поглощение при 400 нм может быть больше чем 0,1, в некоторых случаях больше чем 0,3, и/или в некоторых аспектах средний размер частиц дисперсии может превышать 100 нм. В других аспектах средний размер частиц дисперсии может превышать 250 нм. Каждую из водных дисперсий получали путем смешивания 1 части смеси добавок и поверхностно-активных веществ согласно соответствующему примеру и 99 частей водного разбавителя.
Как видно из вышеприведенных Примеров 29, 30 и 35, за счет использования бензилбензоата и/или бензилового спирта может быть достигнуто более высокое содержание действующего вещества (например, ≥20% масс./масс. 17-гидроксипрогестерона капроата) с требуемыми характеристиками высвобождения. 17-Гидроксипрогестерона капроат в составе композиций может оставаться полностью растворенным (Примеры 29, 30, 31 и 33) или может быть частично растворенным (Примеры 32, 34 и 35). Кроме того, для невооруженного глаза водная дисперсия смесей, содержащих липофильную добавку и гидрофильное поверхностно-активное вещество, если таковые присутствуют, согласно Примерам 29-31 и 33-35 может быть от мутной до непрозрачной. В некоторых случаях, ее поглощение при 400 нм больше чем 0,1, или даже больше чем 0,3. Также, средний размер частиц дисперсии может превышать 100 нм или даже превышать 250 нм. Каждую из указанных водных дисперсий получали путем смешивания 1 части смеси добавок и поверхностно-активных веществ согласно соответствующему примеру и 99 частей водного разбавителя.
17-Гидроксипрогестерона капроат в композициях согласно приведенным в Таблице VIII примерам в некоторых аспектах может быть замещен на другие сложные эфиры 17-гидроксипрогестерона, такие как 17-гидроксипрогестерона ацетат или 17-гидроксипрогестерона ундеканоат.
Композиции согласно Примерам 3, 31, 32, 33 и 34 в некоторых аспектах также могут быть введены в виде пероральной жидкости. Эти композиции также можно вводить перорально после подходящего смешивания/разбавления с разбавителем, таким как вода, молоко, фруктовые соки, напитки и т.п., непосредственно перед введением.
В некоторых вариантах реализации содержимое вышеуказанных композиций может быть адсорбировано на некоторых разбавителях и дополнительных вспомогательных веществах и может быть спрессовано в таблетки.
ПРИМЕР 36 - Таблетки, содержащие 17-гидроксипрогестерона капроат
Гранулы для таблетирования, содержащие 17-гидроксипрогестерона капроат, имеющие в своем составе компоненты, указанные в Таблице IX, могут быть получены посредством методов влажного гранулирования. Соответственно, 17-гидроксипрогестерона капроат, микрокристаллическую целлюлозу и кроскармеллозу натрия просеивали через сито с размером ячеек 40 меш согласно стандарту ASTM (Американского общества по испытанию материалов) и смешивали в грануляторе с низкой скоростью сдвига с образованием однородной смеси. Раствор связующего вещества крахмала 1500 в деионизированной воде можно применять для гранулирования сухой порошкообразной смеси до обычного конечного результата гранулирования. Влажный гранулят, высушенный с использованием полочной сушилки или сушилки с псевдоожиженным слоем, можно сортировать по размерам/просеивать, смазывать средством Аэросил 200 (Aerosil 200) и стеаратом магния и прессовать в таблетки.
Таблетки согласно Примеру 36 демонстрировали менее чем 20% высвобождение 17-гидроксипрогестерона капроата за первые 60 минут при исследовании с использованием аппарата 2 го типа согласно USP в 900 мл искусственного кишечного сока, содержащего 0,5% масс./масс. лаурилсульфата натрия, при 50 об/мин при 37°C. Тогда как, в случае применения в вышеприведенном составе микронизированного 17-гидроксипрогестерона капроата (с размером частиц d 100% примерно 50 мкм или менее) с поверхностно-активным веществом или без него можно наблюдать по меньшей мере 40% высвобождение 17-гидроксипрогестерона капроата после временной точки 60 минут.
ПРИМЕРЫ 37-42 - Композиции на основе 17-гидроксипрогестерона капроата
Композиции согласно Примерам 37-39 Таблицы X содержат гидрофильные добавки в качестве носителей. В этом случае, композиции согласно указанным Примерам получали посредством влажного гранулирования с органическим растворителем, таким как этанол, или со смесью этанол-вода в качестве гранулирующей жидкости. Части или целые количества некоторых из применяемых гидрофильных добавок (например, повидоны, плюроники, поверхностно-активные вещества и т.д.) можно растворять в гранулирующей жидкости. По выбору сложный эфир 17-гидроксипрогестерона (например, 17-гидроксипрогестерона капроат) может быть растворен или суспендирован в гранулирующей жидкости. Этой гранулирующей жидкостью далее можно заливать адсорбирующие гидрофильные носители (например, целлюлозы, лактозу и т.д.) при перемешивании с низкой скоростью сдвига. Гранулы могут быть высушены в слабом токе воздуха при комнатной температуре. Высушенные гранулы просеивали через сито с размером ячеек 40 меш согласно стандарту ASTM и заключали в капсулы подходящего размера или прессовали в таблетки в соответствии с требуемой дозировкой 17-гидроксипрогестерона капроата на единицу лекарственной формы.
Композиции на основе 17-гидроксипрогестерона капроата согласно Примерам 40-42 могут быть получены с применением компонентов, указанных в Таблице X, в соответствии со следующим способом: необходимые количества соответствующих неактивных компонентов и 17-гидроксипрогестерона капроата помещали в чистую емкость из нержавеющей стали и осторожно перемешивали при примерно 50-70°C с помощью мешалки с образованием гомогенной смеси. Заранее определенную навеску полученной смеси помещали в твердые желатиновые капсулы и оставляли затвердевать при комнатной температуре.
Лекарственные формы согласно каждому из Примеров 37-42 исследовали на способность высвобождения 17-гидроксипрогестерона капроата с использованием аппарата 2 го типа согласно USP в 900 мл искусственного кишечного сока, содержащего 0,5% масс./масс. лаурилсульфата натрия, при 50 об/мин при 37°C. Процент высвобожденного из каждой композиции 17-гидроксипрогестерона капроата анализировали посредством ВЭЖХ. Результаты исследования высвобождения также представлены в Таблице X.
Следует отметить, что композиции согласно Примерам 37-42 могут быть приготовлены с получением лекарственных форм в виде таблеток с применением по мере необходимости подходящих обычных вспомогательных веществ для таблетирования, таких как разбавители, связующие вещества, дезинтегранты, смазывающие вещества и т.д.

Эффективность высвобождения in vitro 17-гидроксипрогестерона капроата согласно Примерам 37-42, как можно видеть, превосходит эффективность высвобождения согласно Примеру 36. Следует отметить, что в вышеописанные композиции по мере необходимости могут быть включены подходящие количества типовых фармацевтических вспомогательных веществ, таких как вещества, способствующие скольжению, смазывающие вещества, антиадгезивы, дезинтегранты и т.п. Кроме того, подходящие количества гидрофильных модификаторов высвобождения (например, гипромеллозы, Эудрагитов и т.д.) также могут быть включены по мере необходимости в композиции согласно Примерам 37-42. Кроме того, в некоторых частных случаях, когда лекарственная форма в соответствии с Примерами 37-42 представляет собой таблетку, по мере необходимости могут быть применены подходящие функциональные покрытия. Следует также отметить, что в некоторых аспектах композиции, приведенные в качестве примеров в Таблице X, могут быть замещены на другие сложные эфиры 17-гидроксипрогестерона (например, 17-гидроксипрогестерона ацетат, 17-гидроксипрогестерона ундеканоат и т.д.).
ПРИМЕРЫ 43 и 44 - Композиции на основе 17-гидроксипрогестерона капроата
Композиции на основе 17-гидроксипрогестерона капроата согласно Примерам 43 и 44 получали с применением компонентов, указанных в Таблице XI. Каждую композицию получали путем введения 17-гидроксипрогестерона капроата в жидкую смесь соответствующих неактивных компонентов, помещенных в емкость из нержавеющей стали, при примерно 35-70°C и осторожном перемешивании с образованием текучей жидкой смеси. Заранее определенную навеску полученной жидкой смеси помещали в капсулы с твердой или мягкой желатиновой оболочкой и оставляли затвердевать при комнатной температуре. Следует отметить, что жидкую смесь можно также оставить затвердевать при комнатной температуре с образованием твердых агрегатов, которые можно сортировать по размерам с помощью сита с размером ячеек 30 меш согласно стандарту ASTM для получения гранулированных частиц, которые затем можно заключать в твердые желатиновые капсулы или прессовать в таблетки.
Каждую из композиций исследовали на способность высвобождения 17-гидроксипрогестерона капроата с использованием аппарата 2 го типа согласно USP в 900 мл искусственного кишечного сока, содержащего 0,5% масс./масс. лаурилсульфата натрия, при 50 об/мин при 37°C.Процент высвобожденного из каждой композиции 17-гидроксипрогестерона капроата анализировали посредством ВЭЖХ. Результаты исследования высвобождения также представлены в Таблице XI.
ПРИМЕР 45 - Высушенные распылением обособленные частицы, содержащие 17-гидроксипрогестерона капроат
Множество обособленных частиц, содержащих 17-гидроксипрогестерона капроат, может быть получено следующим образом: 15 г смеси (95:5 масс./масс.) измельченных или микронизированных 17-гидроксипрогестерона капроата и лактозы просеивали через сито с размером ячеек 60 меш согласно стандарту ASTM и добавляли при перемешивании к примерно 250 мл раствора 8% масс./об. Повидона K17 в воде. Полученная суспензия может быть высушена распылением с использованием обычного оборудования для распылительной сушки с параметрами, например, температуры нагрева на входе примерно 60-75°C и температуры на выходе примерно 30-38°C, установкой аспиратора на 90-100%, установкой насоса на примерно 8-12 мл/мин и установкой скорости потока на примерно 500-600 л/ч. Конечная твердая композиция на основе 17-гидроксипрогестерона капроата в виде множества обособленных частиц может иметь компонентный состав, включающий примерно 53 масс. % 17-гидроксипрогестерона капроата, примерно 2,8 масс. % лактозы и примерно 44,2 масс. % повидона K17.
ПРИМЕРЫ 46-50 - Композиции на основе 17-гидроксипрогестерона капроата
Смесь 17-гидроксипрогестерона капроата и соответствующих компонентов может быть расплавлена с получением отверждаемого нагреванием материала для заключения в капсулы. Альтернативно, смесь можно вводить в аппарат для экструдирования из расплава, например, одношнековый экструдер (Killion, модель KLB 100), оснащенный шнеком диаметром примерно 1 дюйм и фильерой с гибкими губками длиной примерно 6 дюймов, и с открытием фильеры, отрегулированным на примерно 0,005 дюйма и скоростью вращения шнека, установленной на примерно 50 об/мин. Время пребывания веществ внутри экструдера может быть установлено на примерно 2-8 минут. Экструдированные нити можно охлаждать до комнатной температуры путем пропускания через охлажденный рулон. Нити затем могут быть рассортированы по размерам с помощью сита с размером ячеек 40 меш согласно стандарту ASTM, и порошок можно помещать в капсулы. Типовые композиции для экструдирования из расплава указаны в Таблице XII. Эти лекарственные формы способны высвобождать 40% или более 17-гидроксипрогестерона капроата примерно за первые 60 минут. Следует отметить, что представленные в Таблице XII композиции на основе 17-гидроксипрогестерона капроата могут также быть приготовлены с включением одного или более других веществ, таких как лактоза, крахмалы, гидроксипропилметилцеллюлоза, метакрилат и т.д., при различных концентрациях от примерно 12% до примерно 88% по массе из расчета на общую массу композиции либо до экструдирования из расплава, либо после сортировки по размерам экструдированной из расплава композиции с целью получения множества твердых обособленных частиц для таблеток.

ПРИМЕР 51 - Композиции на основе J 7-гидроксипрогестерона капроата, полученные путем совместного размола
Композиция, содержащая 17-гидроксипрогестерона капроат, может быть получена посредством совместного размола (или совместного измельчения) 80 г 17-гидроксипрогестерона капроата с 15 г ПВП К17 (поливинилпирролидона К17) и 5 г лаурилсульфата натрия в течение периода от примерно 12 часов до примерно 24 часов с использованием керамической шаровой мельницы при примерно 20±5°C. Полученная путем совместного размола композиция может обеспечить лучший профиль высвобождения лекарственного средства in vitro, который может быть по меньшей мере на 20% больше по сравнению с профилем высвобождения in vitro в соответствии с Примером 1 при исследовании с использованием аппарата 2 го типа согласно USP в 900 мл искусственного кишечного сока, содержащего 0,5% масс./масс. лаурилсульфата натрия, при 50 об/мин при 37°C.
ПРИМЕР 52 - Пеллеты, содержащие 17-гидроксипрогестерона капроат
Пеллеты с покрытием, содержащие 17-гидроксипрогестерона капроат, получали с применением ингредиентов, указанных в Таблице XIII. Раствор для распыления материалов покрытия может быть получен путем растворения 25 г 17-гидроксипрогестерона капроата, 6 г плюроника Р68 и 5 г ПВП K30 в примерно 250 мл абсолютного спирта. Раствор для распыления можно периодически распылять на вращающийся слой из 64 г коммерчески доступных шариков микрокристаллической целлюлозы (например, имеющих средний размер частиц в диапазоне от примерно 250 мкм до примерно 600 мкм), помещенный в обычный дражировочный барабан. После нанесения всего раствора для распыления на шарики он может быть высушен в слабом токе воздуха в течение по меньшей мере 1 часа для удаления растворителя. Таким образом, путем регулирования скорости вращения барабана, скорости распыления и потока воздуха на входе и температуры могут быть получены пеллеты или шарики, содержащие 17-гидроксипрогестерона капроат, которые могут быть помещены в капсулу. В процессе распыления можно подсыпать фармацевтические вспомогательные вещества, такие как тальк, крахмал и т.д., во избежание агрегации пеллетов.
Следует отметить, что подходящее аналогичное или эквивалентное оборудование, известное в данной области техники, может быть использовано для достижения этой цели. Кроме того, путем изменения количества раствора для распыления, распыляемого на шариках, или путем изменения концентрации 17-гидроксипрогестерона капроата в растворе для распыления могут быть получены пеллеты с разным содержанием лекарственного средства.
ПРИМЕР 53 - Композиции в виде суспензии, содержащие 17-гидроксипрогестерона капроат
Гомогенная суспензия 17-гидроксипрогестерона капроата, приготовленная в жидкой переносящей среде, содержащая по меньшей мере один осадитель, может быть получена посредством обычных способов, известных в данной области техники. Суспензию можно вводить перорально в виде обычной жидкости, или известный объем суспензии может быть заключен в капсулы. Фармацевтические вспомогательные вещества, известные в данной области техники, такие как суспендирующие агенты, загустители или модификаторы вязкости, увлажняющие агенты и т.д., могут быть использованы для получения гомогенной суспензии лекарственного средства в жидкой переносящей среде.
ПРИМЕР 54 - Оценка in vivo действия композиции на основе 17-гидроксипрогестерона капроата
Предварительную оценку фармакокинетических свойств при пероральном введении 17-гидроксипрогестерона капроата согласно настоящему изобретению проводили на собаках-самцах. Применяли однократные пероральные дозы 17-гидроксипрогестерона капроата, приготовленного в соответствии с приведенными в качестве примеров составами согласно настоящему изобретению, которые составляли 30 мг/кг и 5 мг/кг, для исследования относительной биодоступности при введении с кормом по сравнению с внутримышечной дозой, равной 6,4 мг/кг (композиция, аналогичная коммерчески доступному препарату для внутримышечной инъекции Макена (Makena®)), в качестве положительного контроля.
Уровни 17-гидроксипрогестерона капроата в крови после введения дозы наблюдали в течение 24 часов после перорального введения и в течение 192 часов после введения посредством внутримышечной инъекции. Примерно 2 мл крови отбирали из яремной, головной или подкожной вен непосредственно перед введением дозы и в заранее определенные интервалы времени после введения. В каждой временной точке образцы крови отбирали в вакуумные пробирки и центрифугировали при примерно 3200 об/мин в течение приблизительно 10 минут при примерно 5°C. Проводили анализ уровня 17-гидроксипрогестерона капроата в полученных сыворотках посредством ВЭЖХ-МС/МС. Результаты по концентрации 17-гидроксипрогестерона капроата в образцах представлены в Таблице XIV ниже:

Вопреки сообщениям в литературе, авторы настоящего изобретения неожиданно обнаружили, что пероральные композиции согласно настоящему изобретению обеспечивали значительные уровни 17-гидроксипрогестерона капроата в крови (Cavg) при пероральном введении.
Многочисленные модификации и альтернативные схемы могут быть разработаны специалистами в данной области техники без выхода за рамки настоящего изобретения, и прилагаемая формула изобретения предусматривает такие модификации и схемы. Таким образом, в то время как настоящее изобретение было описано выше с подробностями и детализацией в связи с тем, какие варианты реализации изобретения в настоящее время считают наиболее практичными и предпочтительными, для специалистов в данной области техники будет очевидно, что изменения, включающие, но без ограничения, изменения размеров, материалов, формы, вида, функции и способа обработки, компоновки и применения, могут быть сделаны без отступления от принципов и идей изобретения, предложенных в настоящем описании.
Реферат
Группа изобретений относится к области медицины. Предложены биодоступные пероральные лекарственные формы, содержащие 17-гидроксипрогестерона капроат в форме частиц со средним диаметром 50 мкм или менее, а также соответствующие способы. Указанные пероральные лекарственные формы могут быть приготовлены для поддержания беременности и могут содержать терапевтически эффективное количество 17-гидроксипрогестерона капроата и фармацевтически приемлемый носитель. Из указанной пероральной лекарственной формы при определении с использованием аппарата для растворения 2-го типа согласно USP в 900 мл деионизированной воды с 0,5% (масс./об.) лаурилсульфата натрия при 50 об/мин при 37°C через 60 минут высвобождается по меньшей мере 20 масс. % дозы сложного эфира 17-гидроксипрогестерона. Группа изобретений обеспечивает возможность создания и использования композиций 17-гидроксипрогестерона капроата в пероральной форме с высокой биодоступностью. 4 н. и 50 з.п. ф-лы, 3 ил., 54 пр., 14 табл.
Формула
Документы, цитированные в отчёте о поиске
Композиция с контролируемым высвобождением
Способ получения субмикронных частиц паклитаксела
Композиции пролонгированного действия с контролируемым высвобождением

Комментарии