Композиции пролонгированного действия с контролируемым высвобождением - RU2355385C2
Код документа: RU2355385C2
Чертежи















Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к гелевым композициям пролонгированного действия (гелевым депо-композициям), которые могут быть инъецированы в желаемую область и которые могут обеспечить контролируемое высвобождение лечебного средства в течение определенного/желаемого периода времени. Данное изобретение также относится к способам получения и введения упомянутых композиций.
УРОВЕНЬ ТЕХНИКИ
Биоразрушаемые (биодеградируемые) полимеры используются в медицинских приложениях в течение многих лет. Устройства, иллюстрирующие применение биоразрушаемых полимеров и созданные на их основе, включают в себя шовный материал, хирургические скобы, скрепки, имплантаты и системы доставки лекарственных средств. Большинство данных биоразрушаемых полимеров было основано на гликолиде, лактиде, капролактоне и сополимерах перечисленных соединений.
Биоразрушаемые полимеры могут представлять собой термопластичные материалы, это значит, что они могут быть нагреты и им может быть придана форма различных изделий, таких как волокна, скобы, скрепки, штифты, пленки и т.п. С другой стороны, они могут являться термоотверждающимися материалами, образуемыми реакциями сшивания, которые приводят к получению материалов с высокой молекулярной массой, не плавящимся и не образующим текучих жидкостей при высоких температурах. Хотя термопластические и термоотверждаемые биоразрушаемые полимеры находят много полезных медико-биологических применений, имеется несколько важных ограничений для их использования в организмах различных животных, включая людей, зверей, птиц, рыб и пресмыкающихся.
Системы доставки лекарственных средств на основе твердых имплантатов, содержащих лекарство, включенное в термопластические или термоотверждаемые биоразрушаемые полимеры, использовались широко и успешно. Такие имплантаты должны быть помещены в организм через разрез, который иногда оказывается больше, чем желательно с точки зрения медицинского работника и, порой, ведет к нежеланию пациента давать согласие на применение такого имплантата или системы доставки лекарственного средства. Следующие патенты Соединенных Штатов №№ 5456679, 5336057, 5308348, 5279608, 5234693, 5234692, 5209746, 5151093, 5137727, 5112614, 5085866, 5059423, 5057318, 4865845, 4008719, 3987790 и 3797492, как полагают, являются репрезентативными в отношении подобных систем доставки лекарств и включены в настоящее изобретение при помощи ссылок. Данные патенты описывают резервуарные устройства, устройства осмотической доставки, пульсирующие устройства для доставки лечебного средства.
Введение системы доставки лекарственного средства в виде маленьких частиц, микросфер или микрокапсул позволяет избежать разреза, необходимого для имплантации систем доставки лекарственного средства. Однако данные препараты не всегда удовлетворяют требованиям для биоразрушаемого имплантата. Данные препараты, по своей природе состоящие из мелких частичек, не образуют сплошную пленку или твердый имплантат со структурной целостностью, необходимой для постоянного протеза, причем частицы склонны к агрегации и, следовательно, их поведение трудно предсказать. При помещении в отдельные полости тела, в которых существуют значительные потоки жидкости, такие как рот, периодонтальный карман, глаз или влагалище, данные небольшие частицы, микросферы и микрокапсулы плохо удерживаются из-за их небольших размеров и дискретной природы. Далее, в случае возникновения осложнений, удаление из тела микрокапсул или систем с маленькими частицами без значительного хирургического вмешательства является значительно более трудным, чем в случае целостных имплантатов. Дополнительные проблемы представляют производство, хранение, а также пригодность для введения, в случае микросфер или микрокапсул, изготовленных из данных полимеров и содержащих лекарственные средства для высвобождения в организм.
В качестве ответа на вышеупомянутые проблемы в технике были разработаны различные системы доставки лекарственных средств. Следующие патенты Соединенных Штатов №№ 6432438, 5990194, 5780044, 5733950, 5620700, 5599552, 5556905, 5278201, 5242910 и 4938763, а также публикации PCT WO98/27962, WO 02/00137 и WO 02/058670, как полагают, являются репрезентативными и включены в данный патент при помощи ссылок. См. также Jain, R. et al., "Controlled drug delivery by biodegradable poly(ester) devices: different preparative approaches", Drug Dev. Ind. Pharm., 24(8): 703-727, 1998; Eliaz, R.E. and Kost, J., "Characterization of a polymenric PLGA-injectable implant deliver system for the controlled release of proteins", J. Biomed. Master Res., 50(3): 388-396, 2000; и Jain, R. A., "The manufacturing techniques of various drug loaded biodegradable poly(lactide-co-glycolide) (PLGA) devices", Biomaterials, 21(23): 2475-90, 2000. Данные патенты и публикации описывают полимерные композиции, пригодные для введения имплантатов, использующие растворители и/или пластификаторы.
В описанных ранее полимерных составах инъецируемых имплантатов использовались растворители/пластификаторы, которые хорошо или относительно хорошо растворимы в жидкостях организма, содержащих воду, для того чтобы ускорить быстрое затвердевание полимера в месте нахождения имплантата и ускорить диффузию лекарственного средства из имплантата. Быстрое проникновение воды в подобные полимерные имплантаты, использующие водорастворимые растворители полимеров, представляет собой серьезную проблему, когда имплантат попадает в организм и подвергается действию водосодержащих жидкостей организма. Быстрое поглощение воды часто приводит к тому, что имплантаты приобретают пористую структуру, которая является неоднородной в отношении размера и формы. Как правило, поверхностные поры принимают пальцевидную структуру, распространяющуюся от поверхности внутрь имплантата на одну треть миллиметра или более, причем эти пальцевидные поры открыты с поверхности имплантата в окружающую среду, в которой он используется. Внутренние поры имеют тенденцию быть меньше и менее доступными для жидкостей, представленных в окружающей среде. Свойство быстро поглощать воду часто приводит к неконтролируемому высвобождению лечебного средства, которое проявляется в форме быстрого первоначального высвобождения лечебного средства из полимерного состава, соответствующего взрывному высвобождению лечебного средства, выделившегося из имплантата. Такое взрывное высвобождение часто, если не всегда, приводит к тому, что значительная часть лечебного средства выделяется в течение очень короткого времени, например нескольких часов или 1-2 дней. Подобный результат может быть неприемлем, особенно в тех обстоятельствах, когда желательна контролируемая доставка, т.е. поступление лечебного средства контролируемым образом в течение периода, большего или равного одному месяцу или вплоть до одного года, или если существует узкое терапевтическое окно, причем высвобождение избытка лечебного средства может приводить к вредным последствиям для пациента, подвергаемого лечению, или, если необходимо имитировать естественный дневной график поступления лечебного средства в организм пациента, подвергающегося лечению, в случае таких веществ, как гормоны и т.п.
Соответственно, в случае имплантации подобных устройств пальцевидные поры позволяют очень быстро поглотить внутренние жидкости организма внутрь имплантата с последующим немедленным и быстрым растворением значительных количеств лечебного средства и беспрепятственной диффузией лечебного средства в окружающую среду, что производит эффект взрывного высвобождения, который обсуждался выше.
Более того, быстрое поглощение воды может приводить к преждевременному осаждению полимера, такому, что образуется затвердевший имплантат или имплантат с затвердевшим наружным слоем. Внутренние поры и большая часть внутреннего объема полимера, содержащие лекарственное средство, выводятся из контакта с внутренними жидкостями организма, и это может привести к значительному понижению высвобождения лечебного средства в течение существенного периода времени («время задержки»). Данное время задержки является нежелательным с точки зрения наличия контролируемого пролонгированного высвобождения лечебного средства в организм пациента, подвергаемого лечению. Таким образом, наблюдается взрывное высвобождение лечебного средства, выделенного в короткий промежуток времени немедленно после имплантации, время задержки, в течение которого лечебное средство отсутствует или выделяется в очень маленьких количествах и, затем, продолжительное поступление лекарственного средства (если предположить, что лекарственное средство осталось после взрывного высвобождения) до тех пор, пока его запасы не будут исчерпаны.
Были описаны разнообразные подходы для того, чтобы управлять взрывным высвобождением, а также регулировать и стабилизировать доставку лечебного средства. Следующие патенты Соединенных Штатов №№ 6130200, 5990194, 5780044, 5733950, 5656297, 5654010, 4985404 и 4853218, а также публикация PCT WO 98/27962, как полагают, являются репрезентативными и включены в данный патент при помощи ссылок. Несмотря на некоторые достижения, данные способы не являлись полностью удовлетворительными для большого числа лечебных средств, которые могут быть эффективно доставлены при помощи имплантатов.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение представляет собой способ и композицию (состав) инъецируемого геля пролонгированного действия для системной и локальной доставки лечебного средства в организм пациента в течение продолжительного периода времени. В частности, изобретение обеспечивает контролируемое высвобождение лечебного средства в организм пациента, подвергающегося лечению, причем высвобождение остается контролируемым в течение периода от, приблизительно, равного двум неделям или больше или до одного года после введения, т.е., приблизительно, от двух недель до, приблизительно, двенадцати месяцев после введения, предпочтительно, в течение периода, равного или большего, чем один месяц после введения, или, предпочтительно, в течение периода от, приблизительно, одного месяца до, приблизительно, двенадцати месяцев после введения; предпочтительно, в течение периода, равного или большего, чем 2 месяца после введения, предпочтительно в течение периода, равного или большего, чем 3 месяца после введения, предпочтительно в течение периода от, приблизительно, 3 месяцев до, приблизительно, 9 месяцев после введения, предпочтительно, в течение периода от, приблизительно, 3 месяцев до, приблизительно, 6 месяцев после введения, предпочтительно, в течение периода вплоть до, приблизительно, 3 месяцев, вплоть до, приблизительно, 4 месяцев, вплоть до, приблизительно, 5 месяцев и вплоть до, приблизительно, 6 месяцев после введения. Одноразовое введение инъецируемой гелевой композиции пролонгированного действия обеспечивает более длительное и устойчивое высвобождение активного средства в течение более продолжительного периода времени, снижая, таким образом, частоту введения и повышая готовность пациента проходить лечение. Дополнительно данное изобретение представляет собой способ получения инъецируемой гелевой композиции пролонгированного действия.
В одном аспекте данное изобретение относится к инъецируемой композиции пролонгированного действия для длительной доставки лечебного средства пациенту контролируемым образом в течение предварительно определенного (заданного) периода времени после введения, содержащей:
(a) состав вязкого геля, включающий:
(1) биоразрушаемый, биосовместимый полимер, причем полимер представляет собой полимер на основе молочной кислоты; и
(2) растворитель, обладающий растворимостью в воде, меньшей или равной 7 мас.% при 25°C, в количестве, достаточном для того, чтобы пластифицировать полимер и, вследствие этого, образовать гель; и
(b) лечебное средство, растворенное или диспергированное в геле; причем вышеупомянутое лечебное средство доставляется в течение периода, равного или большего, чем один месяц. Полимер, предпочтительно, представляет собой сополимер молочной и гликолевой кислот, имеющий соотношение сомономеров (соотношение L/G) от, приблизительно, 50:50 до, приблизительно, 100:0 и молекулярную массу, находящуюся в диапазоне от, приблизительно, 3000 до, приблизительно, 120000.
В другом аспекте данное изобретение относится к инъецируемой композиции пролонгированного действия для длительной доставки лечебного средства пациенту контролируемым образом в течение предварительно определенного периода времени после введения, содержащей:
(a) состав вязкого геля, включающий:
(1) биоразрушаемый, биосовместимый полимер, причем полимер представляет собой полимер на основе молочной кислоты; и
(2) растворитель, обладающий растворимостью в воде, меньшей или равной 7 мас.% при 25°C, в количестве, достаточном для того, чтобы пластифицировать полимер и, вследствие этого, образовать гель; и
(b) лечебное средство, растворенное или диспергированное в геле; причем вышеупомянутое лечебное средство доставляется в течение периода, равного или большего, чем один месяц. Полимер, предпочтительно, представляет собой сополимер молочной кислоты и полимера на основе капролактона, включающего капролактон (CL), имеющего соотношение сомономеров (соотношение L/CL) от, приблизительно 25:75 до, приблизительно, 75:25 и молекулярную массу в диапазоне от, приблизительно, 3000 до, приблизительно, 120000.
В другом аспекте данное изобретение относится к инъецируемой композиции пролонгированного действия для длительной доставки лечебного средства пациенту контролируемым образом в течение периода, равного или большего, чем один месяц после введения, содержащей: (a) состав вязкого геля, включающий: (1) биоразрушаемый, биосовместимый полимер, причем полимер представляет собой полимер на основе молочной кислоты; и (2) растворитель, обладающий растворимостью в воде, меньшей или равной 7 мас.% при 25°C, в количестве, достаточном для того, чтобы пластифицировать полимер и, вследствие этого, образовать гель; и (b) лечебное средство, растворенное или диспергированное в геле.
В дополнительном аспекте изобретение относится к инъецируемой композиции пролонгированного действия для длительной доставки лечебного средства пациенту контролируемым образом в течение предварительно определенного периода времени после введения, содержащей: (a) вязкую гелевую композицию, включающую: (1) биоразрушаемый, биосовместимый полимер, причем полимер представляет собой полимер на основе молочной кислоты; и (2) растворитель, обладающий растворимостью в воде, меньшей или равной 7 мас.% при 25°C, в количестве, достаточном для того, чтобы пластифицировать полимер и, вследствие этого, образовать гель; и (b) лечебное средство, растворенное или диспергированное в геле; причем вышеупомянутое лечебное средство доставляется системно контролируемым образом в течение периода, равного или большего, чем один месяц после введения.
В другом аспекте изобретение относится к инъецируемой композиции пролонгированного действия для длительной локальной доставки лечебного средства пациенту контролируемым образом в течение периода времени, равного или большего, чем один месяц после введения, содержащей: (a) состав вязкого геля, включающий: (1) биоразрушаемый, биосовместимый полимер, причем полимер представляет собой полимер на основе молочной кислоты; и (2) растворитель, обладающий растворимостью в воде, меньшей или равной 7 мас.% при 25°C, в количестве, достаточном для того, чтобы пластифицировать полимер и, вследствие этого, образовать гель; и (b) лечебное средство, растворенное или диспергированное в геле.
В дополнительном аспекте изобретение относится к инъецируемой композиции пролонгированного действия для длительной доставки лечебного средства пациенту контролируемым образом в течение предварительно определенного периода времени после введения, содержащей: (a) состав вязкого геля, включающий: (1) биоразрушаемый, биосовместимый полимер, причем полимер представляет собой полимер на основе молочной кислоты; и (2) растворитель, обладающий растворимостью в воде, меньшей или равной 7 мас.% при 25°C, в количестве, достаточном для того, чтобы пластифицировать полимер и, вследствие этого, образовать гель; и (b) лечебное средство, растворенное или диспергированное в геле; причем вышеупомянутое лечебное средство доставляется локально контролируемым образом в течение периода, равного или большего, чем один месяц после введения.
В другом аспекте данное изобретение относится к инъецируемой композиции пролонгированного действия, как описано выше, дополнительно включающей, как минимум, один из следующих компонентов: порообразующее вещество (средство для формирования пор), регулятор растворимости лечебного средства и осмотическое средство.
В другом аспекте данное изобретение относится к инъецируемой композиции пролонгированного действия, как описано выше, в которой вязкий гель дополнительно включает полимер, такой как биоразрушаемый полимер, выбранный из группы, состоящей из полилактидов, полигликолидов, полимеров на основе капролактона, поли(капролактона), полиангидридов, полиаминов, полиэфирамидов, полиортоэфиров, полидиоксанонов, полиацеталей, поликеталей, поликарбонатов, эфиров полифосфорных кислот, полиэфиров, полибутилентерефталата, полиортокарбонатов, полифосфазенов, сукцинатов, поли(яблочной кислоты), поли(аминокислот), поливинилпирролидона, полиэтиленгликоля, полигидроксицеллюлозы, полисахаридов, хитина, хитозана, гиалуроновой кислоты, а также сополимеров, трехкомпонентных сополимеров и смесей перечисленных соединений.
В другом аспекте изобретение относится к инъецируемой композиции пролонгированного действия, как описано выше, в которой растворитель выбран из числа ароматических спиртов, имеющих структурную формулу (I)
Ar-(L)n-OH (I),
в которой Ar представляет собой замещенную или незамещенную арильную или гетероарильную группу, n является нулем или 1 и L представляет собой связующий фрагмент; а также растворитель выбран из группы, состоящей из сложных эфиров ароматических кислот, ароматических кетонов и смесей этих соединений.
В предпочтительных воплощениях растворитель выбран из ароматического спирта, низших алкиловых и аралкиловых эфиров арилсодержащих кислот; кетонов, содержащих арил, аралкил и низший алкил; а также низших алкиловых эфиров лимонной кислоты. Предпочтительно, растворитель выбран из бензилового спирта, бензилбензоата и этилбензоата. В предпочтительных воплощениях состав не содержит растворителей, обладающих растворимостью в воде, большей, чем 7 мас.% при 25°C. Предпочтительно, растворитель имеет растворимость в воде менее 7 мас.%, более предпочтительно менее 5 мас.%, и, более предпочтительно, менее 3 мас.%.
В дополнительных аспектах изобретение относится к способам введения пациенту лечебного средства контролируемым образом в течение периода, равного или большего, чем один месяц после введения, включая введение инъецируемой композиции пролонгированного действия, как описано выше. В определенных воплощениях лечебное средство доставляется системно, контролируемым образом в течение периода, равного или большего, чем один месяц после введения. В дополнительных воплощениях лечебное средство поступает локально контролируемым образом в течение периода, равного или большего, чем один месяц после введения.
В дополнительных аспектах изобретение относится к набору для введения или для длительного поступления лечебного средства в организм пациента контролируемым образом в течение предварительно определенного периода времени после введения; комплекту, включающему:
(a) биоразрушаемый, биосовместимый полимер, причем полимер представляет собой полимер на основе молочной кислоты;
(b) растворитель, обладающий растворимостью в воде, меньшей или равной 7 мас.% при 25°C, в количестве, достаточном для того, чтобы пластифицировать полимер и, вследствие этого, образовать гель;
(c) лечебное средство, растворенное или диспергированное в геле; и, необязательно, один или несколько следующих компонентов:
(d) эмульгирующее средство;
(e) порообразующее средство;
(f) регулятор растворимости лечебного средства, необязательно связанный с лечебным средством; и
(g) осмотическое средство;
причем, по крайней мере, лечебное средство, необязательно связанное с регулятором растворимости, содержится отдельно от растворителя до момента введения лечебного средства пациенту. В дополнительных воплощениях набор включает мерное устройство, такое как шприц, катетер, насос, шприцевой насос, автоинъектор и т.п.
Эти и другие воплощения настоящего изобретения легко осуществимы средним специалистом в данной области техники, учитывая раскрытие изобретения в настоящем описании.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Задачи, изложенные выше, а также другие задачи, признаки и преимущества настоящего изобретения станут более понятными при чтении следующего подробного описания в сочетании с чертежами, как описано в дальнейшем в этом документе.
Фиг.1 представляет собой график, иллюстрирующий реологические свойства композиций пролонгированного действия (депо-композиций) по настоящему изобретению (композиции 42-45).
Фиг.2 представляет собой график, иллюстрирующий реологические свойства композиций пролонгированного действия по настоящему изобретению (композиции 46-48).
Фиг.3 представляет собой график, иллюстрирующий реологические свойства композиций пролонгированного действия по настоящему изобретению (композиции 51 и 52).
Фиг.4 представляет собой график, показывающий усилия при инъецировании композиций пролонгированного действия по настоящему изобретению (композиции 42-45).
Фиг.5 представляет собой график, показывающий усилия при инъецировании композиций пролонгированного действия по настоящему изобретению (композиции 48-50).
Фиг.6А представляет собой график, показывающий профиль высвобождения in vivo человеческого гормона роста (hGH), поступающего из композиций пролонгированного действия по настоящему изобретению (композиции 21 и 22).
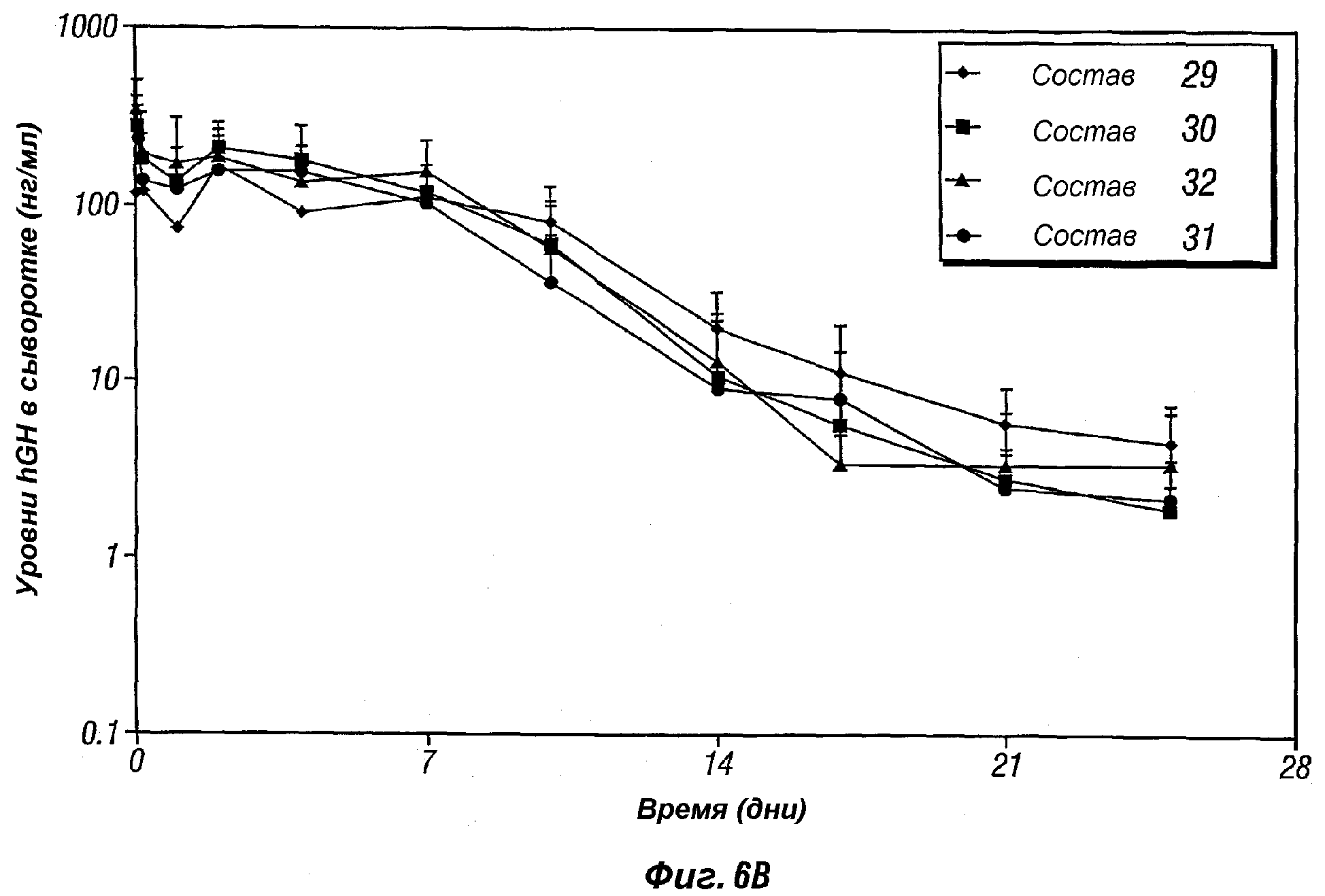
Фиг.6B представляет собой график, показывающий профиль высвобождения in vivo человеческого гормона роста, поступающего из различных композиций пролонгированного действия, включая композиции по настоящему изобретению (композиции 29-31).
Фиг.6C представляет собой график, показывающий профиль высвобождения in vivo человеческого гормона роста, поступающего из различных композиций пролонгированного действия, включая композиции по настоящему изобретению (композиции 33,35,36,39 и 40).
Фиг.6D представляет собой график, показывающий профиль высвобождения in vivo человеческого гормона роста, поступающего из различных композиций пролонгированного действия, включая композиции по настоящему изобретению (композиции 34,35,37,38 и 40).
Фиг.7 представляет собой график, показывающий профиль высвобождения in vivo бупивакаина гидрохлорида, поступающего из композиций пролонгированного действия по настоящему изобретению (композиции 17-18).
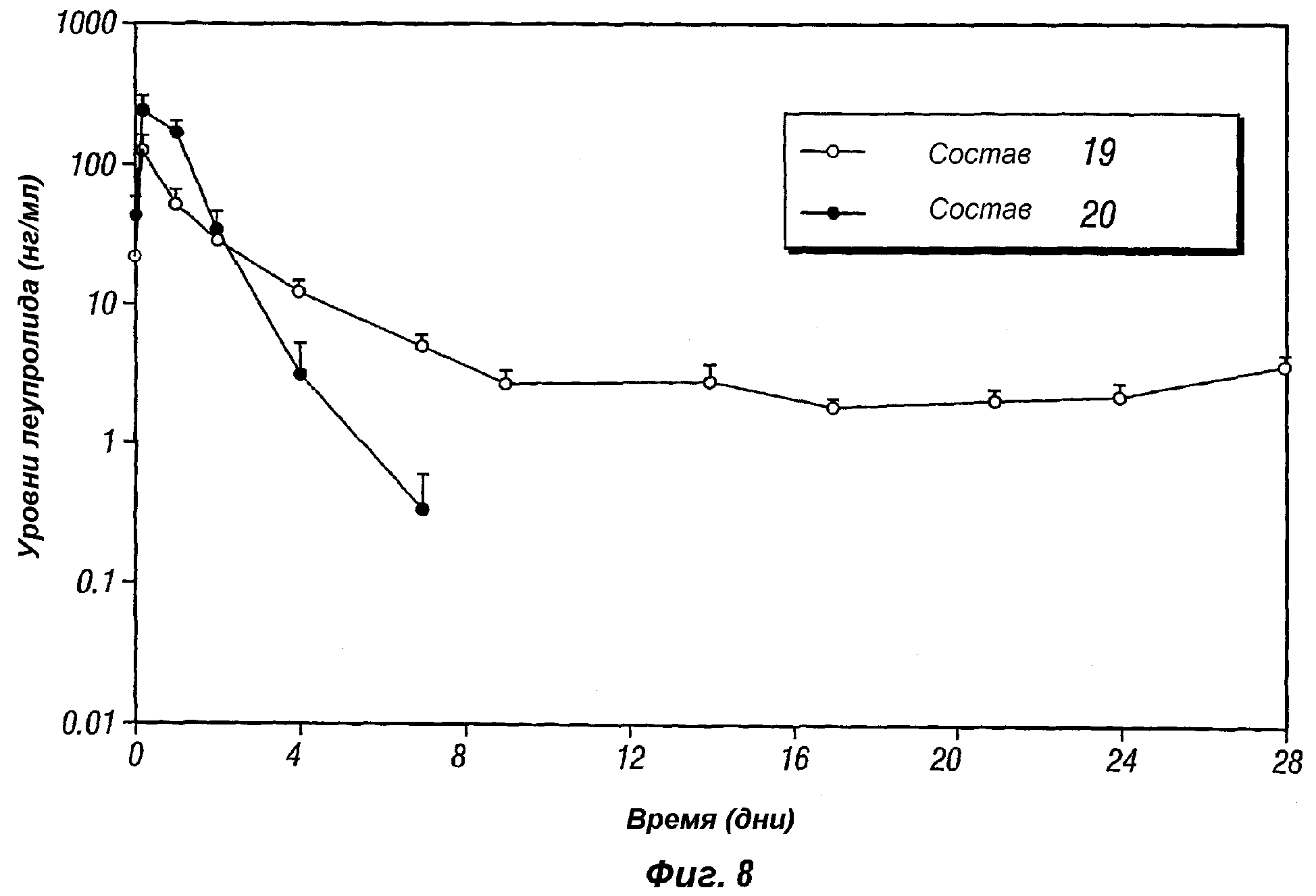
Фиг.8 представляет собой график, показывающий профиль высвобождения in vivo бупивакаина основания, поступающего из композиций пролонгированного действия по настоящему изобретению (композиции 19-20).
Фиг.9 представляет собой график, показывающий профиль высвобождения in vivo бупивакаина основания, поступающего из композиций пролонгированного действия по настоящему изобретению (композиция 20).
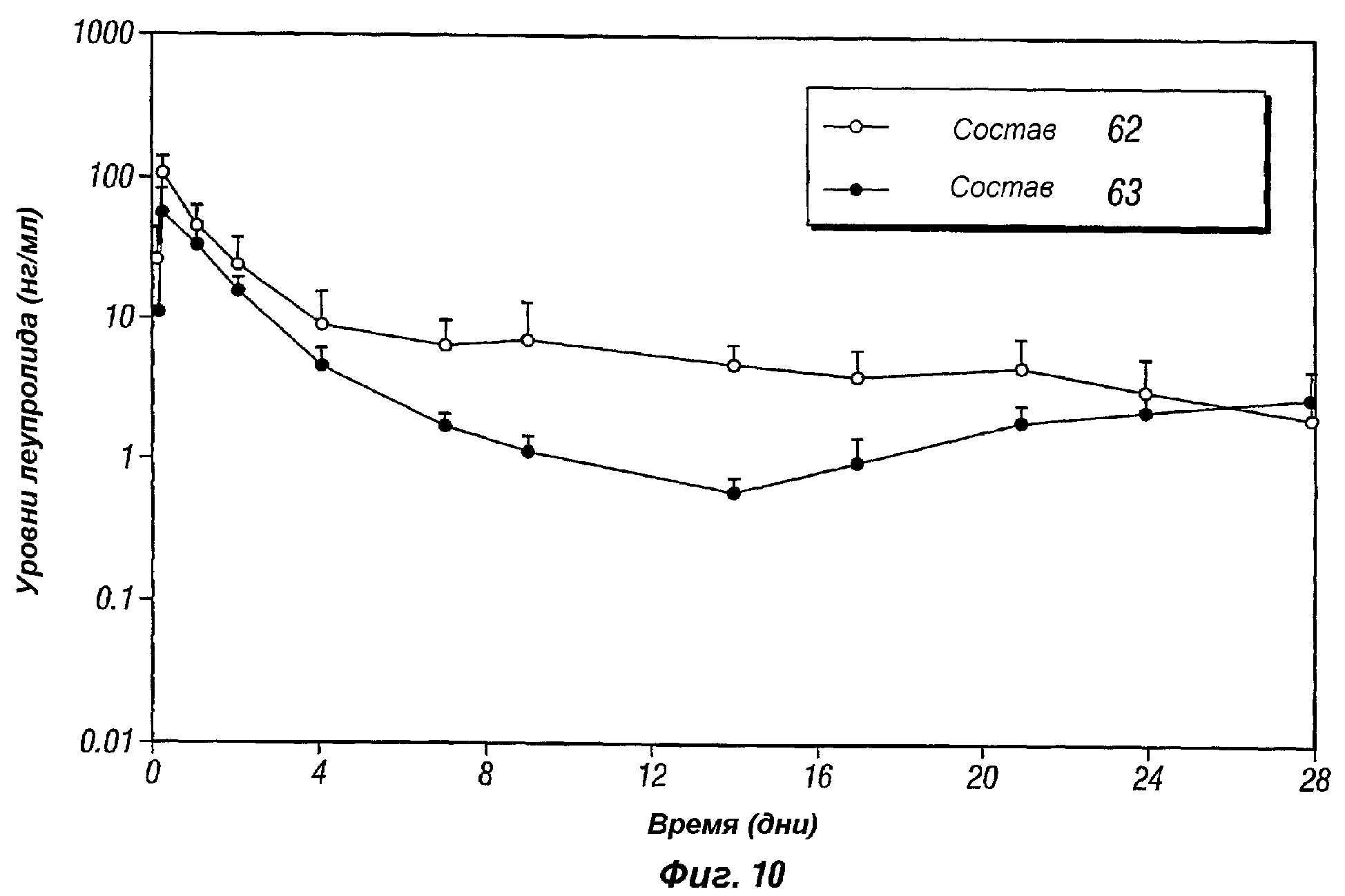
Фиг.10 представляет собой график, показывающий профиль высвобождения in vivo бупивакаина гидрохлорида, поступающего из композиций пролонгированного действия по настоящему изобретению (композиции 62 и 63).
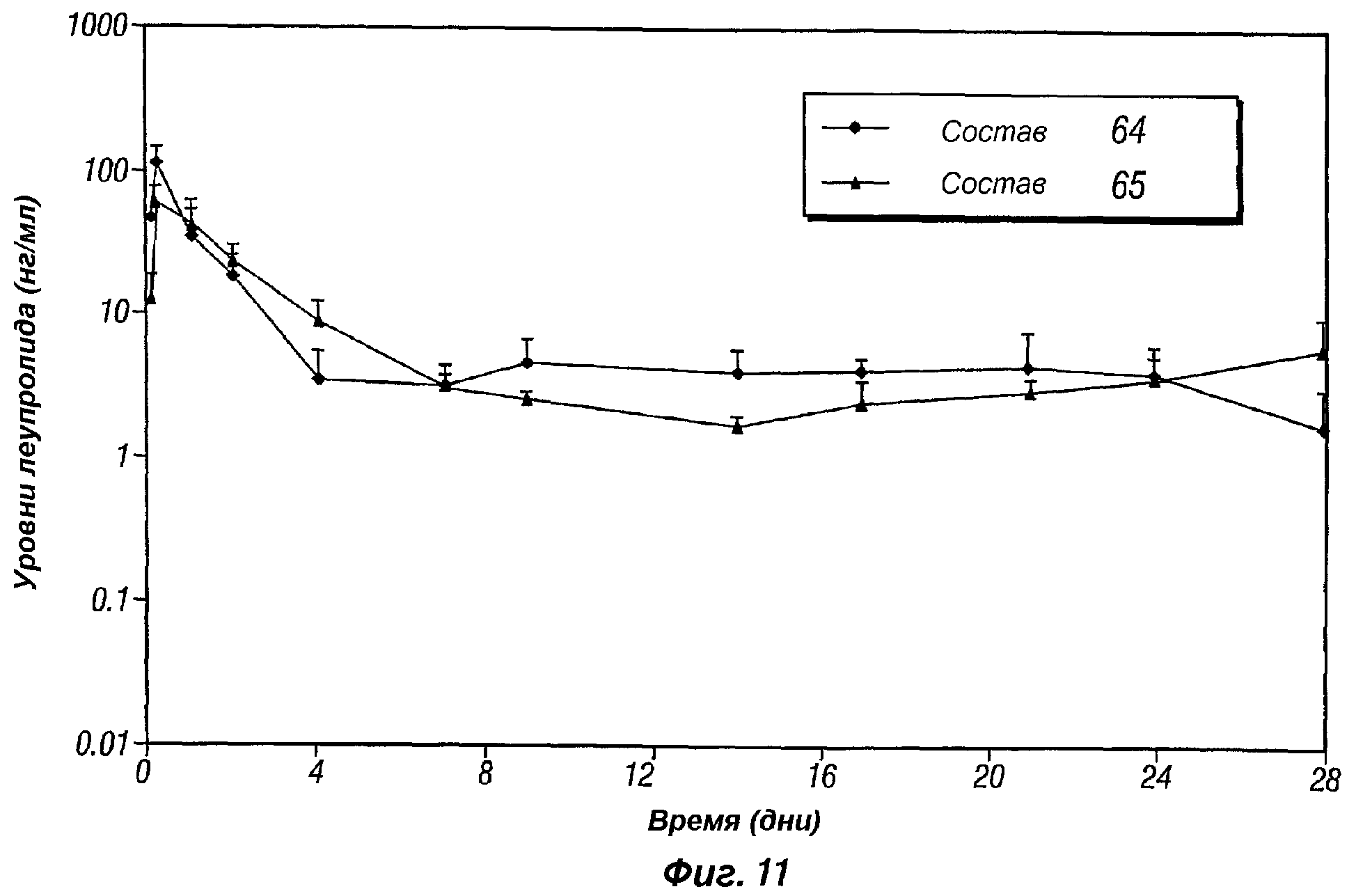
Фиг.11 представляет собой график, показывающий профиль высвобождения in vivo бупивакаина гидрохлорида, поступающего из составов пролонгированного действия по настоящему изобретению (композиции 64 и 65).
Фиг.12 представляет собой график, показывающий профиль высвобождения in vivo бупивакаина гидрохлорида, поступающего из составов пролонгированного действия по настоящему изобретению (композиции 11 и 12).
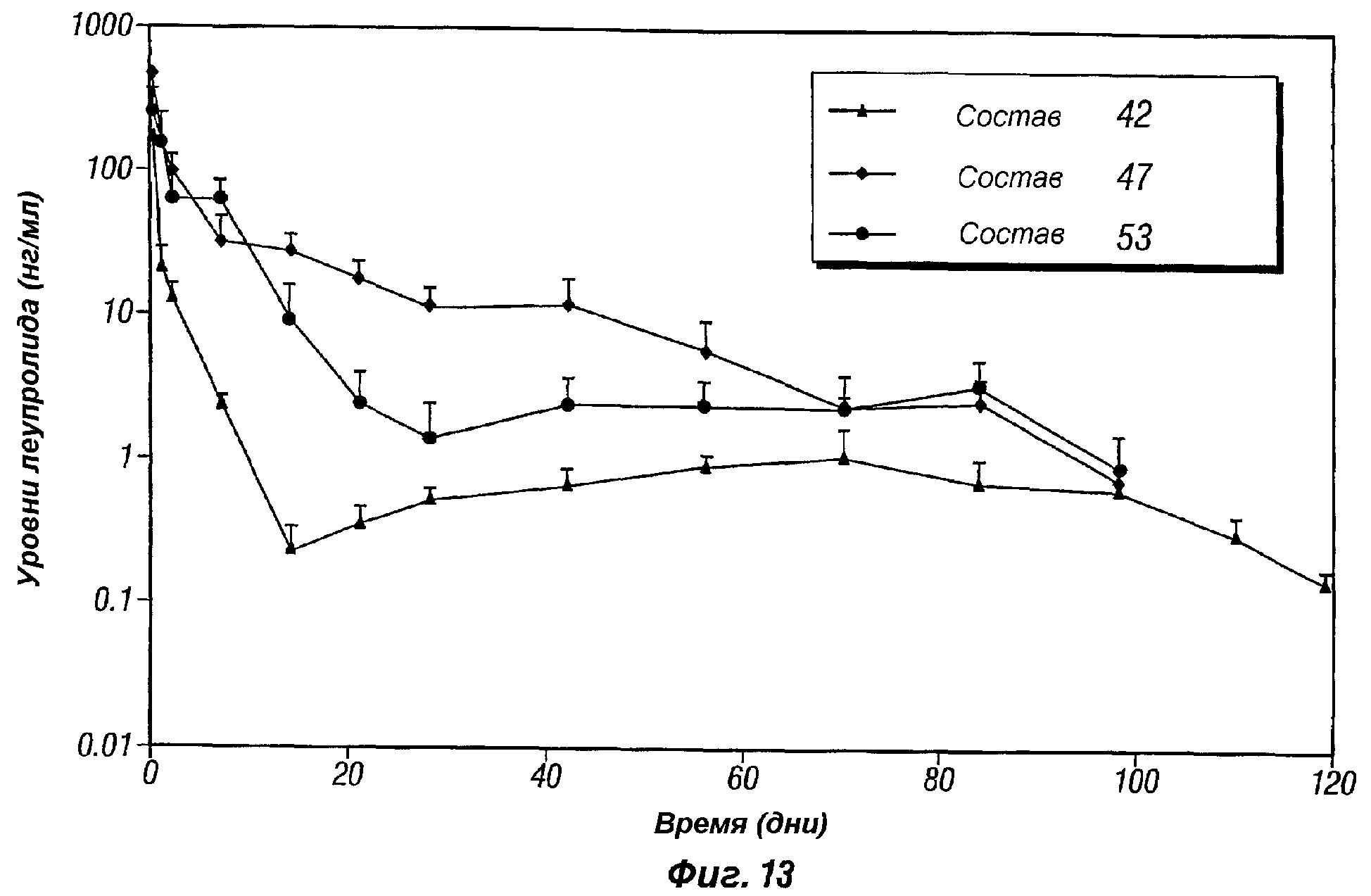
Фиг.13 представляет собой график, показывающий профиль высвобождения in vivo леупролида ацетата, поступающего из композиций пролонгированного действия по настоящему изобретению (композиции 42 и 47), в виде сравнения с 3-месячной Lupron depot® (композиция 53).
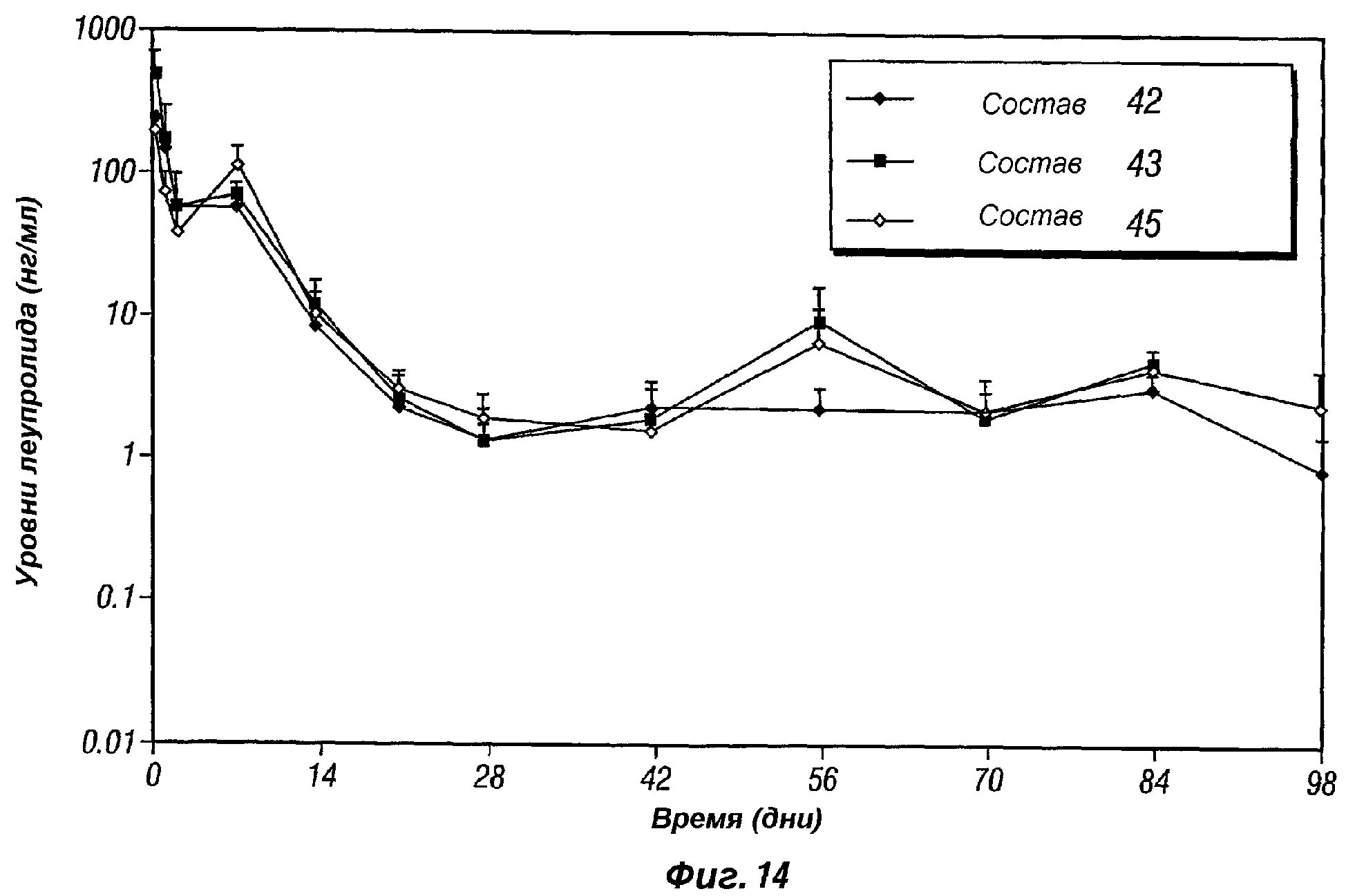
Фиг.14 представляет собой график, показывающий профиль высвобождения in vivo леупролида ацетата, поступающего из композиций пролонгированного действия по настоящему изобретению (композиции 42,43 и 45).
Фиг.15 представляет собой график, показывающий профиль высвобождения in vivo леупролида ацетата, поступающего из композиций пролонгированного действия по настоящему изобретению (композиции 42 и 49).
Фиг.16 представляет собой график, показывающий профиль высвобождения in vivo леупролида ацетата, поступающего из композиции пролонгированного действия по настоящему изобретению (композиция 46), в виде сравнения с 3-месячной Lupron depot® (композиция 53).
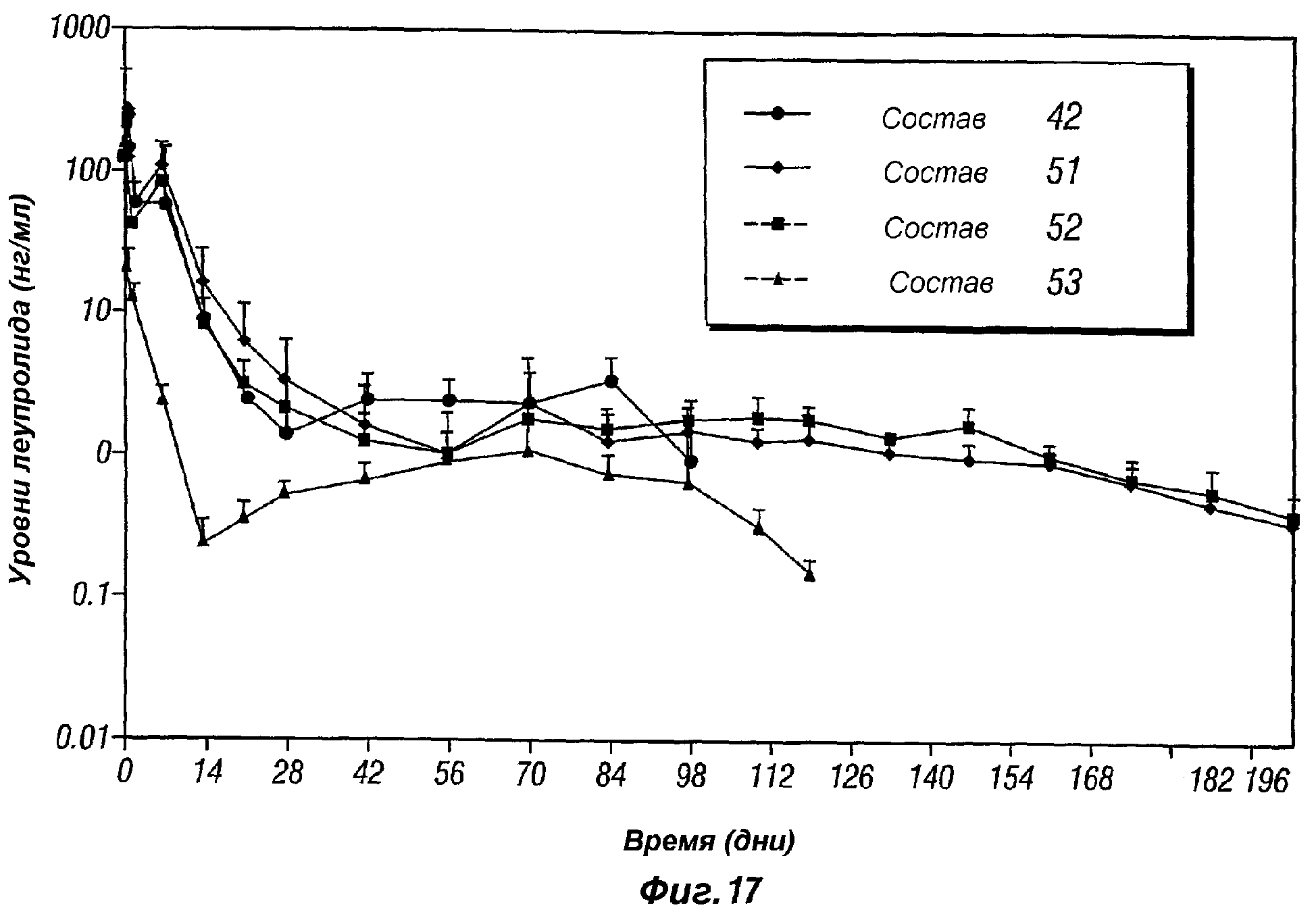
Фиг.17 представляет собой график, показывающий профиль высвобождения in vivo леупролида ацетата, поступающего из композиции пролонгированного действия по настоящему изобретению (композиции 42, 51 и 52), в виде сравнения с 3-месячной Lupron depot® (композиция 53).
Фиг.18 представляет собой график, показывающий профиль высвобождения in vivo леупролида ацетата, поступающего из 3-месячной композиции пролонгированного действия по настоящему изобретению (композиции 54 и 55).
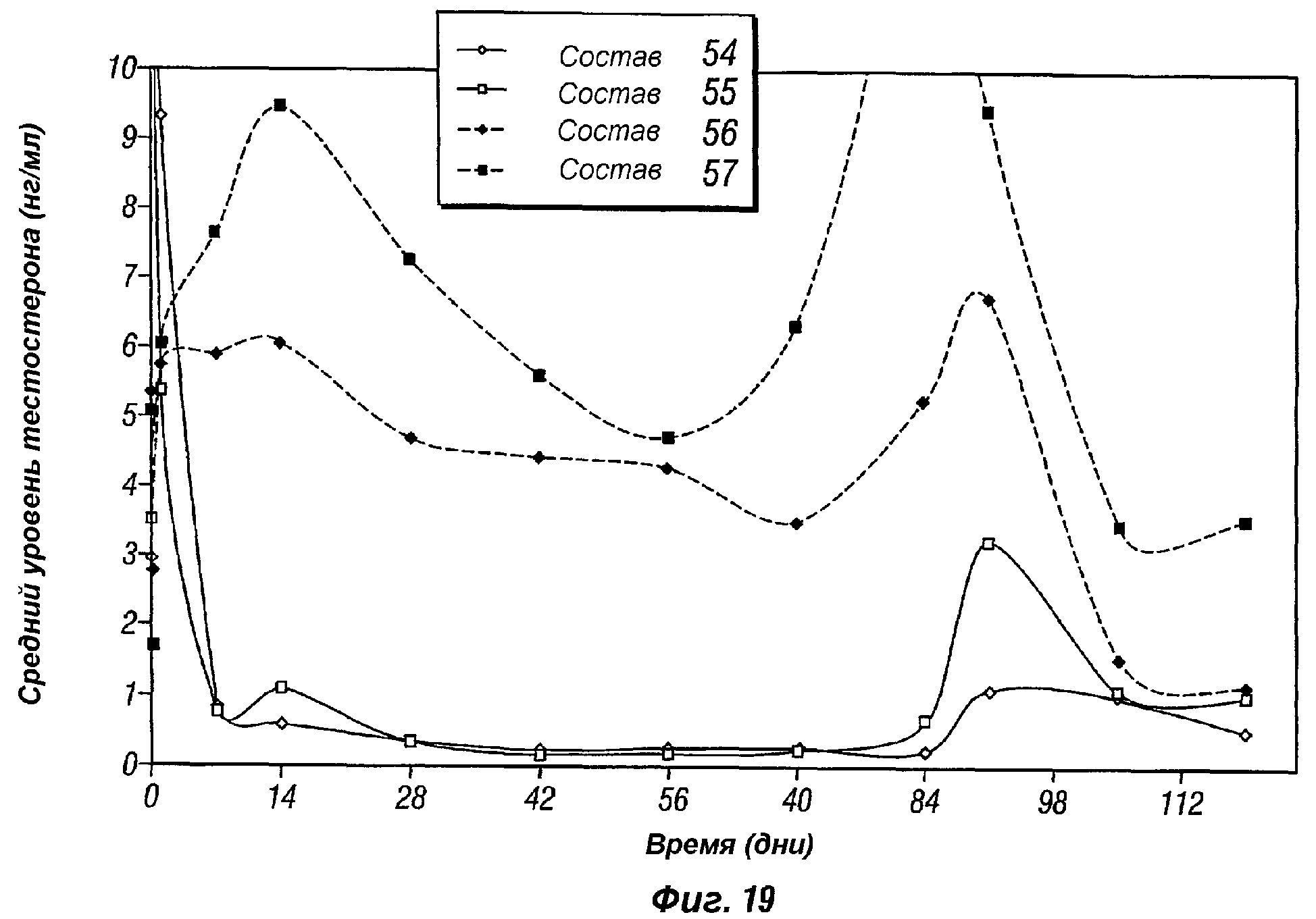
Фиг.19 представляет собой график, показывающий супрессию in vivo крысиного тестостерона под действием 3-месячных композиций пролонгированного действия леупролида ацетата по настоящему изобретению (композиции 54 и 55), в виде сравнения с композициями плацебо без леупролида ацетата (композиции 56 и 57).
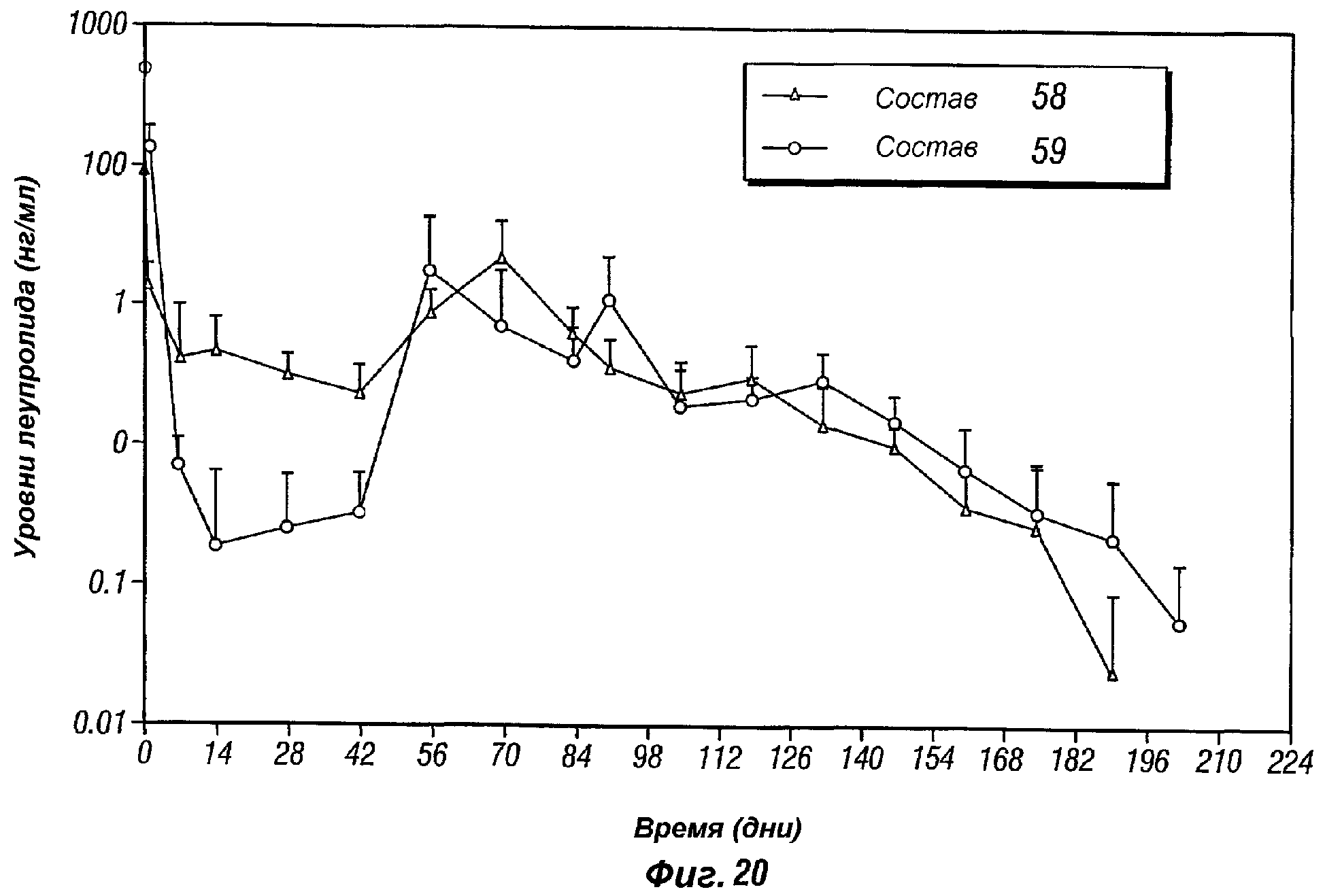
Фиг.20 представляет собой график, показывающий профиль высвобождения in vivo леупролида ацетата, поступающего из 6-месячной композиции пролонгированного действия по настоящему изобретению (композиции 58 и 59).
Фиг.21 представляет собой график, показывающий супрессию in vivo крысиного тестостерона под действием 6-месячных композиций пролонгированного действия леупролида ацетата по настоящему изобретению (композиции 58 и 59), в виде сравнения с композициями плацебо без леупролида ацетата (композиции 60 и 61).
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
ОБЩИЙ ОБЗОР И ОПРЕДЕЛЕНИЯ
Настоящее изобретение направлено на инъецируемые композиции пролонгированного действия для доставки лечебного средства пациенту в течение продолжительного периода времени, во множество участков, если это требуется, и для многократных или повторных инъекций, т.е., например, когда терапевтическое действие лечебного средства снижается или истекает период времени, в течение которого лечебное средство обладает терапевтическим действием, или, например, когда пациенту требуется дальнейшее введение лечебного средства по любой причине, причем инъецируемая композиция пролонгированного действия после введения в тело пациента служит в качестве имплантированной системы доставки и длительного высвобождения лечебного средства. В частности, изобретение обеспечивает контролируемое высвобождение лечебного средства в организм пациента, подвергаемого лечению, причем высвобождение является контролируемым в течение периода, приблизительно равного или превышающего две недели и вплоть до одного года после введения, т.е. периода от, приблизительно, двух недель до, приблизительно, 12 месяцев после введения, предпочтительно, на протяжении периода, равного или большего, чем один месяц после введения; предпочтительно, на протяжении периода, равного или большего, чем 2 месяца после введения, предпочтительно, на протяжении периода, равного или большего, чем 3 месяца после введения, предпочтительно, на протяжении периода от, приблизительно, 3 месяцев до, приблизительно, 9 месяцев после введения, предпочтительно, на протяжении периода от, приблизительно, 3 месяцев до, приблизительно, 6 месяцев после введения, предпочтительно, на протяжении периода вплоть до, приблизительно, 3 месяцев, вплоть до, приблизительно, 4 месяцев, вплоть до, приблизительно, 5 месяцев и вплоть до, приблизительно, 6 месяцев после введения. Настоящее изобретение также относится к способу применения инъецируемой композиции пролонгированного действия, для того чтобы ввести в организм пациента лечебное средство.
Инъецируемая композиция пролонгированного действия представляет собой гель, образованный из полимерной матрицы и содержащий биоразрушаемый, биосовместимый полимер; растворитель, имеющий растворимость в воде, равную или меньшую 7 мас.% при 25°C, в количестве, достаточном для того, чтобы пластифицировать полимер и, вследствие этого, образовать гель; и лечебное средство, растворенное или диспергированное в геле. Настоящее изобретение также направлено на способ системного или местного введения и доставки лечебного средства пациенту, включающий имплантированние инъецируемой композиции пролонгированного действия, как описано выше. Способ системной или локальной доставки по настоящему изобретению представляет собой способ доставки в множество участков, если это необходимо, кроме этого он направлен на многократное или повторное инъецирование, т.е., например, когда терапевтическое действие лечебного средства снижается или истекает период времени, в течение которого лечебное средство обладает терапевтическим действием, или, например, когда пациенту требуется дальнейшее введение лечебного средства по любой причине.
Путем подходящего выбора растворителя ограничивают миграцию воды из водной среды, окружающей имплантат, и лечебное средство высвобождается в организм пациента в течение определенного периода времени, обеспечивая, таким образом, доставку лечебного средства с контролируемым взрывным высвобождением и последующим устойчивым высвобождением лечебного средства.
Неожиданно было обнаружено, что скорость высвобождения лечебного средства из инъецируемых гелевых композиций пролонгированного действия по настоящему изобретению может изменяться при изменении свойств полимера, таких как тип полимера, молекулярная масса полимера (включая модальное распределение полимера) и соотношение сомономеров, из числа мономеров, образующих полимер, концевая группа полимеров; тип растворителя; и, путем изменения соотношений полимер/растворитель, чтобы обеспечить контролируемое устойчивое высвобождение лечебного средства на протяжении длительного периода времени, равного или большего, чем две недели и вплоть до одного года после введения, т.е. от, приблизительно, двух недель до, приблизительно, 12 месяцев после введения, или, предпочтительно, на протяжении периода от, приблизительно, одного месяца после введения до, приблизительно, двенадцати месяцев после введения, предпочтительно, на протяжении периода, равного или большего, чем один месяц после введения; предпочтительно, на протяжении периода, равного или большего, чем 2 месяца после введения, предпочтительно, на протяжении периода, равного или большего, чем 3 месяца после введения, предпочтительно, на протяжении периода от, приблизительно, 3 месяцев до, приблизительно, 9 месяцев после введения, предпочтительно, на протяжении периода от, приблизительно, 3 месяцев до, приблизительно, 6 месяцев после введения, предпочтительно, на протяжении периода вплоть до, приблизительно, 3 месяцев, вплоть до, приблизительно, 4 месяцев, вплоть до, приблизительно, 5 месяцев; и вплоть до, приблизительно, 6 месяцев после введения. График скорости высвобождения и его продолжительность могут регулироваться подходящим выбором полимера (включая соотношение мономеров, например соотношения L/G и CL/L), молекулярной массы полимера (LMW, MMW, HMW), концевой группы полимера (кислотная, сложноэфирная); нерастворимым в воде растворителем, соотношением полимер/растворитель, эмульгирующим средством, средством для образования пор, регулятором растворимости лечебного средства, осмотическим средством и т.п.
Дополнительно настоящее изобретение представляет собой способ контролирования высвобождения лечебного средства из инъецируемой композиции пролонгированного действия. Длительность и скорость высвобождения лечебного средства регулируются при помощи подходящего выбора биоразрушаемого полимера, молекулярной массы полимера, соотношения сомономеров из числа различных мономеров, образующих полимер (например, соотношения L/G и CL/L для данного полимера), соотношений полимер/растворитель и сочетаний данных факторов, как это описано ниже более детально (см. также таблицы A, B, C и D ниже).
В отдельных воплощениях к имплантированным системам могут быть добавлены порообразующие средства и регуляторы растворимости лечебного средства для обеспечения желаемых профилей высвобождения из имплантированных систем, а также могут быть добавлены обычные фармацевтические наполнители и другие добавки, которые не изменяют полезных аспектов настоящего изобретения.
Композиция обеспечивает контролируемое длительное высвобождение лечебного средства путем ограничения миграции воды из водной среды, окружающей имплантированную систему, доставляя, таким образом, лечебное средство на протяжении увеличенного периода, как описано ранее. Одноразовое введение инъецируемой гелевой композиции пролонгированного действия обеспечивает более устойчивое длительное высвобождение действующих средств на протяжении увеличенного периода времени, снижая, таким образом, частоту введения и повышая готовность пациента проходить лечение. Поскольку полимер, входящий в данную композицию, является биоразрушаемым, имплантированная система не должна удаляться хирургически после того, как лечебное средство в имплантате будет исчерпано. Более того, т.к. полимер, входящий в композицию по настоящему изобретению, является биоразрушаемым, композиция может вводиться как системно, так и локально, чтобы охватить доставку в множество участков, если это необходимо, а также композиция применима для многократных или повторных введений, в частности, например, когда терапевтическое действие лечебного средства снижается или истекает период времени, в течение которого лечебное средство обладает терапевтическим действием, или, например, когда пациенту требуется дальнейшее введение лечебного средства по любой причине.
В целом, композиция по настоящему изобретению является гелеобразной и образует, в основном, гомогенные не пористые структуры по всему объему имплантата при имплантации и в ходе высвобождения лекарственного средства, даже в случае затвердевания. Более того, пока полимерный гелевый имплантат будет медленно затвердевать, будучи подвергнут действию водной окружающей среды, твердеющий имплантат может сохранять эластичную (не жесткую) структуру, с температурой перехода в стеклообразное состояние Tg, лежащей ниже 37°C.
Предпочтительные композиции по настоящему изобретению дают возможность лечебному средству заполнить внутреннее пространство полимера с уровнем содержания, превосходящим уровень, требуемый для насыщения воды лечебным средством, облегчая, посредством этого, высвобождение лечебного средства нулевого порядка. Дополнительно предпочтительные композиции могут образовывать вязкие гели, которые имеют температуру перехода в стеклообразное состояние, меньшую, чем 37°C, так что такой гель остается не твердым в течение 24 часового периода времени после имплантации или более.
Было обнаружено, что в случае, когда в системе присутствует растворитель, имеющий растворимость в воде ниже 7 мас.%, достигается подходящее управление взрывным высвобождением и устойчивое высвобождение лечебного средства, независимо от того, присутствует ли в системе регулятор растворимости лечебного средства. Как правило, имплантированная система, применяемая в данном изобретении, будет выделять в первые два дня после имплантации 60% или менее от общего количества лечебного средства, которое должно поступить в организм пациента из имплантированной системы, предпочтительно, 50% или менее, более предпочтительно 40% или менее и, еще более предпочтительно, 30% или менее.
В случае, если состав предназначен для имплантации при помощи инъекции, вязкость, необязательно, может быть изменена добавлением эмульсификаторов или тиксотропных средств, чтобы получить гелевую композицию, имеющую достаточно низкую вязкость, позволяющую данному составу проходить через иглу. Также в имплантированную систему могут быть добавлены порообразующие средства и регуляторы растворимости лечебного средства для того, чтобы обеспечить желаемые графики высвобождения из имплантированной системы, а также могут быть добавлены обычные фармацевтические наполнители и другие добавки, которые не изменяют полезных аспектов настоящего изобретения. Добавка регулятора растворимости к имплантированной системе может позволить применение в данной системе растворителя, имеющего растворимость 7 мас.% или более, с минимальным эффектом взрывного высвобождения и устойчивой доставкой в особых обстоятельствах. Однако в данном изобретении предпочтительно, чтобы в имплантированной системе использовался, по крайней мере, один растворитель, имеющий растворимость в воде менее 7 мас.%, независимо от того, является ли данный растворитель единственным или присутствует в качестве компонента смеси растворителей. Помимо этого было обнаружено, что если используется смесь растворителей, которая содержит растворитель, имеющий растворимость в воде 7 мас.% или менее, смешанный с одним или несколькими растворителями, необязательно имеющими большую растворимость, образуется имплантированная система, демонстрирующая ограниченное поглощение воды, а также минимальный эффект взрывного высвобождения и устойчивые характеристики высвобождения.
ОПРЕДЕЛЕНИЯ
При описании и при изложении формулы настоящего изобретения будет использована следующая терминология, в соответствии с определениями, изложенными ниже.
Формы единственного числа «a», «an» и «the» охватывают множественные объекты ссылок, если контекст явно не указывает на противоположное. Таким образом, например, ссылка на «растворитель» включает одиночный растворитель, равно как и смесь двух или более различных растворителей, ссылка на «лечебное средство» включает одиночное лечебное средство, а также два или более различных лечебных средства в сочетании и т.п.
Термин «лечебное средство» подразумевает средство, которое оказывает лечебное, часто фармакологическое, воздействие при введении человеку или животному, как самостоятельно, так и в сочетании с другими фармацевтическими наполнителями или инертными ингредиентами.
Термин «AUC» означает площадь области под профилем, полученной из анализа in vivo в организме пациента путем нанесения данных по концентрации лечебного средства в плазме крови пациента в зависимости от времени, в виде измерений от времени имплантации композиции до времени «t» после имплантации. Время t будет соответствовать периоду поступления лечебного средства в организм пациента.
Термин «индекс взрывного высвобождения», применительно к отдельным композициям, предназначенным для системной доставки лечебного средства, означает частное, полученное делением (i) AUC, рассчитанной для первого периода времени после имплантации композиции пациенту, разделенной на число часов, входящих в первый период времени (t1), на (ii) AUC, рассчитанную для периода времени поступления лечебного средства, разделенную на число часов, входящих в общую продолжительность периода поступления лечебного средства (t2). Например, 24-часовой индекс взрывного высвобождения представляет собой частное, образованное делением (i) AUC, рассчитанной для первых двадцати четырех часов после имплантации композиции пациенту, разделенной на число 24, на (ii) AUC, рассчитанную для периода времени поступления лечебного средства, разделенную на число часов, входящих в общую продолжительность периода поступления лечебного средства.
Фраза «растворенный или диспергированный» призвана охватить все способы, которыми можно обеспечить наличие лечебного средства в гелевой композиции, включая растворение, диспергирование, суспендирование и т.п.
Термин «системный» применительно к поступлению или введению лечебного средства в организм пациента обозначает, что лечебное средство обнаруживается на биологически значимом уровне в плазме крови пациента.
Термин «локальный» применительно к поступлению или введению лечебного средства в организм пациента обозначает, что лечебное средство поступает в локализованный участок организма, но не обнаруживается на биологически значимом уровне в плазме крови пациента.
Термин «продолжительный период» или «продолжительная длительность» являются взаимозаменяемыми и обозначают период времени, на протяжении которого наблюдается высвобождение лечебного средства из гелевой композиции пролонгированного действия по настоящему изобретению, которое, в общем, имеет место в течение периода, равного или большего, чем две недели, или вплоть до одного года после введения, предпочтительно, на протяжении периода, равного или большего, чем один месяц после введения; предпочтительно, на протяжении периода, равного или большего, чем 2 месяца после введения, предпочтительно, на протяжении периода, равного или большего, чем 3 месяца после введения, предпочтительно, на протяжении периода от, приблизительно, 3 месяцев до, приблизительно, 9 месяцев после введения, предпочтительно, на протяжении периода от, приблизительно, 3 месяцев до, приблизительно, 6 месяцев после введения, предпочтительно, на протяжении периода вплоть до, приблизительно, 3 месяцев, вплоть до, приблизительно, 4 месяцев, вплоть до, приблизительно, 5 месяцев и вплоть до, приблизительно, 6 месяцев после введения.
Термин «гелевый носитель» обозначает композицию, образованную смесью полимера и растворителя в отсутствие лечебного средства.
Термин «начальное взрывное высвобождение» применительно к отдельным композициям по настоящему изобретению обозначает частное, полученное делением (i) количества лечебного средства по массе, выделившегося из композиции за предварительно определённый начальный период времени после имплантации, на (ii) общее количество лечебного средства, которое должно было поступить из имплантированной композиции. Подразумевается, что начальное взрывное высвобождение может изменяться в зависимости от формы и площади поверхности имплантата. Соответственно описанные здесь процентные соотношения и индексы взрывных высвобождений, связанных с начальным взрывным высвобождением, предназначены для применения к композициям, испытанным в форме, полученной в результате дозирования композиции из стандартного шприца.
Термин «регулятор растворимости» применительно к лечебному средству обозначает вещество, которое будет изменять растворимость лечебного средства в растворителе полимера или в воде по отношению к растворимости лечебного средства в отсутствие регулятора. Регулятор может увеличивать или уменьшать растворимость лечебного средства в растворителе или в воде. Однако в случае, когда лечебные средства являются хорошо растворимыми в воде, регулятор растворимости, в общем, будет являться веществом, которое понижает растворимость лечебного средства в воде. Действие регулятора растворимости может обуславливаться взаимодействием регулятора растворимости с растворителем или с лечебным средством как таковым, например, путем образования комплексов, а также взаимодействием как с лечебным средством, так и с растворителем. Все подобные взаимодействия и образования, которые могут появиться, когда регулятор растворимости «ассоциируется» с лечебным средством, предназначены для целей настоящего изобретения. Регуляторы растворимости могут быть смешаны с лечебным средством перед объединением с вязким гелем или могут быть добавлены в вязкий гель перед добавлением лечебного средства, смотря по тому, что более целесообразно.
Термины «субъект» и «пациент», применительно к введению композиции по настоящему изобретению, означают особь животного или человеческое существо.
Термин «тиксотропный» использован в его обычном смысле для обозначения гелевой композиции, который может перейти в жидкое состояние или, по крайней мере, продемонстрировать снижение наблюдаемой вязкости при воздействии механической силы, такой как сдвигающее усилие. Степень снижения является частью функции скорости сдвига геля, который подвергается сдвигающему усилию. Когда сдвигающее усилие прекращается, вязкость тиксотропного геля возвращается к значениям вязкости, равным или близким к тем, которые гель показывал до того, как он был подвергнут сдвигающему усилию. Соответственно при инъецировании из шприца тиксотропный гель может быть подвергнут сдвигающему усилию, которое временно снизит его вязкость в процессе инъекции. Когда процесс инъекции завершен, сдвигающее усилие исчезает, и гель возвращается к состоянию, которое весьма близко к его предыдущему состоянию.
Для целей настоящего изобретения «тиксотропное средство» представляет собой вещество, которое увеличивает тиксотропность композиции, в которую оно входит, способствуя его разжижению и делая возможным понижение усилия при инъекции.
Термин «биоразрушаемый» относится к материалу, который постепенно разлагается, растворяется, гидролизуется и/или разрушается в месте своего нахождения. В общем, биоразрушаемые полимеры в настоящем изобретении представляют собой полимеры, способные к гидролизу, и они разрушаются в месте своего пребывания, главным образом, благодаря гидролизу.
Термин «полимер низкой молекулярной массы (LMW)» относится к биоразрушаемым полимерам, обладающим средневзвешенной молекулярной массой, находящейся в пределах от, приблизительно, 3000 до, приблизительно, 10000; предпочтительно, от, приблизительно, 3000 до, приблизительно, 9000; более предпочтительно от, приблизительно, 4000 до, приблизительно, 8000; и, более предпочтительно, полимер низкой молекулярной массы имеет молекулярную массу, которая определена с помощью гельпроникающей хроматографии (GPS), около 7000, около 6000, около 5000, около 4000 и около 3000.
Термин «полимер средней молекулярной массы (MMW)» относится к биосовместимым, биоразрушаемым полимерам, обладающим средневзвешенной молекулярной массой, находящейся в пределах между, приблизительно, 10000 и, приблизительно, 30000; предпочтительно, от, приблизительно, 12000 до, приблизительно, 20000; более предпочтительно от, приблизительно, 14000 до, приблизительно, 18000; и, более предпочтительно, полимер низкой молекулярной массы имеет молекулярную массу, которая определена с помощью гельпроникающей хроматографии (GPS), около 14000, около 15000, около 16000, около 17000 и около 18000. В предпочтительных воплощениях полимер MMW выбран из PLGA RG502, PLGA RG752 и PLA R202.
Термин «полимер высокой молекулярной массы (HMW)» относится к биосовместимым, биоразрушаемым полимерам, обладающим средневзвешенной молекулярной массой, которая определена с помощью гельпроникающей хроматографии (GPS), превышающей 30000; предпочтительно, от, приблизительно, 30000 до, приблизительно, 250000; более предпочтительно от, приблизительно, 30000 до, приблизительно, 120000. В предпочтительных воплощениях полимер HMW выбран из RG503, PLGA RG755, PLA R206, PCL/PLA 75:25 и PCL/PLA 25:75.
Поскольку все растворители, по крайней мере, на молекулярном уровне до определенной, весьма ограниченной, степени растворимы в воде (т.е. смешиваются с водой), термин «нерастворимый» в контексте настоящего изобретения обозначает, что 7 мас.% или менее, предпочтительно 5 мас.% или менее растворителя может быть растворено в воде или смешано с водой. Для целей настоящего изобретения рассматриваются величины растворимостей растворителя в воде, определенные при 25°C. Поскольку в целом ясно, что опубликованные величины растворимостей могут быть не всегда измерены в тех же самых условиях, пределы растворимости, указанные здесь в виде процентов смешиваемости с водой или растворимости в воде по массе в качестве части или верхнего предела диапазона, могут не являться абсолютными. Например, если верхний предел растворимости растворителя в воде указан здесь как «7 мас.%», и не предусмотрены дальнейшие ограничения на растворитель, считается, что растворитель «триацетин», который имеет опубликованную растворимость в воде 7,17 г в 100 мл воды, включен в 7% предел. Предел растворимости в воде менее 7 мас.% в контексте настоящего изобретения не включает растворитель триацетин или растворители, имеющие растворимость в воде, равную или большую по сравнению с триацетином.
Следующие определения применяются к описанным здесь молекулярным структурам. В контексте настоящего изобретения фраза «имеющий формулу» или «имеющий структуру» не призвана быть ограничивающей и используется в том же смысле, в котором обычно используется термин «состоящий из».
Термин «алкил» в рамках настоящего изобретения имеет отношение к насыщенной углеводородной группе, обычно, хотя не обязательно, содержащей от 1 до приблизительно 30 углеродных атомов, такой как метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, октил, децил и т.п., а также к циклоалкильным группам, таким как циклопентил, циклогексил и т.п. В общем, хотя вновь необязательно, алкильные группы в данном изобретении содержат от 1 до 12 углеродных атомов. Термин «низший алкил» подразумевает алкильную группу с числом атомов углерода от 1 до 6, предпочтительно от 1 до 4 атомов углерода. «Замещенный алкил» относится к алкилу, замещенному одной или несколькими замещающими группами, и термины «алкил, содержащий гетероатом» или «гетероалкил» относятся к алкилу, в котором, по крайней мере, один атом углерода замещен гетероатомом. Если не указано иначе, термины «алкил» и «низший алкил» включают линейный, разветвленный, циклический, незамещенный, замещенный и/или содержащий гетероатом алкил или низший алкил.
Термин «арил» в рамках данного изобретения и если не определено иначе относится к ароматическому заместителю, содержащему одиночное ароматическое кольцо или несколько ароматических колец, которые могут являться конденсированными, быть ковалентно связанными или быть присоединенными к общему фрагменту, такому как метиленовая или этиленовая группа. Предпочтительные арильные группы содержат одно ароматическое кольцо или два конденсированных, или соединенных, ароматических кольца, например фенил, нафтил, бифенил, дифенилэфирная группа, дифениламиногруппа, бензофенон и т.п., причем наиболее предпочтительными арильными группами являются моноциклические группы. «Замещенный арил» имеет отношение к арильному фрагменту, замещенному одной или несколькими замещающими группами, и термины «арил, содержащий гетероатом» и «гетероарил» относятся к арилу, в котором, по крайней мере, один атом углерода замещен гетероатомом. Если не указано иначе, термин «арил» включает такие группы, как гетероарил, замещенный арил и замещенный гетероарил.
Термин «аралкил» относится к алкильной группе, замещенной арильной группой, причем алкил и арил были определены выше. Термин «гетероаралкил» относится к алкильной группе, замещенной гетероарильной группой. Если не указано иначе, термин «аралкил» включает в себя гетероаралкильные и замещенные аралкильные группы, а также незамещенные аралкильные группы. В общем, в контексте данного изобретения термин «аралкил» имеет отношение к арилзамещенной низшей алкильной группе, предпочтительно фенилзамещенной низшей алкильной группе, такой как бензил, фенэтил, 1-фенилпропил, 2-фенилпропил и т.п.
Термин «содержащая гетероатом» и «содержащая гетероатом гидрокарбильная группа» имеют отношение к молекуле или молекулярному фрагменту, в котором один или несколько атомов углерода замещены атомами, отличными от углерода, например азотом, кислородом, серой, фосфором или кремнием. Подобным же образом «гетероциклический» относится к циклическому заместителю, который является заместителем, содержащим гетероатом, термин «гетероарил» относится к арильному заместителю, который содержит гетероатом, и т.п.
С помощью понятия «замещенный», которое входит в термины «замещенный алкил», «замещенный арил» и подобные термины, на которые осуществлялись ссылки в некоторых из приведенных выше определений, обозначается, что в алкильном или арильном фрагменте соответственно, по крайней мере, один атом водорода, связанный с углеродом, замещен одним или несколькими, не мешающими заместителями, такими как гидроксил, алкокси, тио, амино, галоген и т.п.
1. ИНЪЕЦИРУЕМЫЕ КОМПОЗИЦИИ ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ (ДЕПО-КОМПОЗИЦИИ)
Как было описано ранее, инъецируемая композиция пролонгированного действия для доставки лечебного средства на протяжении продолжительного периода времени может быть создана в виде вязкого геля перед инъекцией композиции пациенту. Вязкий гель поддерживает лечебное средство в диспергированном состоянии, чтобы обеспечить надлежащие профили его высвобождения, которые включают профили, имеющие низкий уровень начального взрывного высвобождения лечебного средства, так что лечебное средство выделяется из композиции пролонгированного действия на протяжении определенного периода времени.
Полимер, растворитель и другие вещества по настоящему изобретению должны быть биосовместимыми; это значит, что они не должны вызывать раздражение или некроз в окружающей среде, в которой они применяются. Окружающая среда применения представляет собой жидкую окружающую среду, и она может включать подкожные, внутримышечные, внутрисосудистые (высокий/низкий поток), интрамиокардиальные, адвентициальные, внутриопухолевые, интрацеребральные участки, места ранений, пространства жестких швов или полости тела человека или животного. В определенных воплощениях лечебное средство может вводиться локально, чтобы избежать системных побочных действий или минимизировать их. Гели, содержащие лечебное средство, по настоящему изобретению могут быть инъецированы/имплантированы непосредственно внутрь или применены в виде покрывающего слоя на желаемое место, например на такие места локализации, как подкожное, внутримышечное, внутрисосудистые, интрамиокардиальные, адвентициальные, внутриопухолевые, интрацеребральные участки, места ранений, пространства жестких швов или полости тела человека или животного.
Обычно вязкий гель инъецируют из стандартного шприца для подкожных инъекций через иглу, катетер или троакар, причем шприц предварительно заполняют составом, состоящим из лечебного средства и вязкого геля, чтобы создать средство пролонгированного действия. Часто предпочтительно, чтобы инъекции производились с использованием иглы наименьшего размера (т.е. наименьшего диаметра), чтобы снизить дискомфорт для пациента, когда производятся такие инъекции, как подкожные, внутримышечные, внутрисосудистые (высокий/низкий поток), интрамиокардиальные, адвентициальные, внутриопухолевые, интрацеребральные, в места ранений, пространства жестких швов или полости тела человека или животного. Желательно, чтобы имелась возможность инъецировать гели через иглу или катетер, находящийся в диапазоне от 16 калибра и выше, предпочтительно, 20 калибра и выше, более предпочтительно, 22 калибра и выше, еще более предпочтительно 24 калибра и выше. С гелями высокой вязкости, т.е. гелями, обладающими вязкостью около 200 пуаз или выше, усилия при инъекции, для того чтобы выдавить гель из шприца, имеющего иглу 20-30 калибра, могут быть столь значительными, что сделают инъекцию трудной или практически невозможной, если осуществлять ее вручную. В то же время высокая вязкость геля является желательной, чтобы сохранить целостность композиции после инъекции и в период высвобождения лекарственного средства, а также достичь желаемых характеристик суспендирования лечебного средства в геле.
A. БИОРАЗРУШАЕМЫЙ, БИОСОВМЕСТИМЫЙ ПОЛИМЕР
Полимеры, которые применяются в сочетании с методиками и композициями по настоящему изобретению, являются биоразрушаемыми, т.е. они постепенно разрушаются, например, под действием ферментов или гидролиза, растворяются, разрушаются физически или распадаются другим способом под действием водосодержащих жидкостей в теле пациента. В основном полимеры биоразрушаются в результате гидролиза или физического разрушения, хотя первичным процессом биоразрушения обычно является гидролиз или распад под действием ферментов.
Такие полимеры включают, но не ограничиваются перечисленными, полилактиды, полигликолиды, полимеры на основе капролактона, поликапролактоны, полиангидриды, полиамины, полиэфирамиды, полиортоэфиры, полидиоксаноны, полиацетали, поликетали, поликарбонаты, полифосфазены, сукцинаты, поли(яблочную кислоту), поли(аминокислоты) поливинилпирролидон, полиэтиленгликоль, полигидроксицеллюлозу, полифосфорные эфиры гидроксиметилцеллюлозы, полиэфиры, полибутилентерефталат, полисахариды, хитин, хитозан, гиалуроновую кислоту, а также сополимеры, тройные сополимеры и смеси перечисленных соединений.
Неожиданно было обнаружено, что скорость высвобождения лечебного средства из инъецируемых гелевых композиций пролонгированного действия по настоящему изобретению может изменяться при изменении свойств полимера, таких как тип полимера, молекулярная масса полимера (включая модальное распределение полимера) и соотношение сомономеров, из числа мономеров, образующих полимер; концевая группа полимеров; тип растворителя; а также путем изменения соотношений полимер/растворитель, чтобы обеспечить контролируемое устойчивое высвобождение лечебного средства на протяжении продолжительного периода времени, равного или большего, чем две недели, и вплоть до одного года после введения, предпочтительно на протяжении периода, равного или большего, чем один месяц после введения; предпочтительно, на протяжении периода, равного или большего, чем 2 месяца после введения, предпочтительно, на протяжении периода, равного или большего, чем 3 месяца после введения, предпочтительно, на протяжении периода от, приблизительно, 3 месяцев до, приблизительно, 9 месяцев после введения, предпочтительно, на протяжении периода от, приблизительно, 3 месяцев до, приблизительно, 6 месяцев после введения, предпочтительно, на протяжении периода вплоть до, приблизительно, 3 месяцев, вплоть до, приблизительно, 4 месяцев, вплоть до, приблизительно, 5 месяцев; и вплоть до, приблизительно, 6 месяцев после введения. График скорости высвобождения и его продолжительность могут регулироваться подходящим выбором полимера (включая соотношение мономеров, например, соотношения L/G и CL/L), молекулярной массы полимера (LMW, MMW, HMW), концевой группы полимера (кислотная, сложноэфирная); нерастворимым в воде растворителем, соотношением полимер/растворитель, эмульгирующим средством, средством для образования пор, регулятором растворимости лечебного средства, осмотическим агентом и т.п.
В другом аспекте настоящее изобретение предоставляет способ регулирования высвобождения лечебного средства из инъецируемой композиции пролонгированного действия. Длительность и скорость высвобождения лечебного средства (например, индекс взрывного высвобождения и профиль скорости высвобождения) регулируются надлежащим выбором биоразрушаемого полимера, молекулярной массы полимера, соотношением сомономеров из числа различных мономеров, образующих полимер (например, соотношением L/G и CL/L для полимеров на основе молочной кислоты), и соотношениями полимер/растворитель, как показано ниже в таблицах A, B, C и D. Описанные ранее инъецируемые композиции пролонгированного действия на основе полимолочной кислоты (т.е. соотношение L/G составляет 100:0) демонстрируют профиль высвобождения лечебного средства на протяжении периода приблизительно 3 месяца (который является более коротким, чем тот же период для композиции пролонгированного действия по данному изобретению, см., например, примеры 20 и 21, а также фиг. 13, 16 и 17, которые далее описаны более подробно). Как показывают примеры, следующие далее, было обнаружено, что гелевые композиции пролонгированного действия PLGA по настоящему изобретению, имеющие соотношение L/G приблизительно 75:25, выделяют лечебное средство устойчивым образом на протяжении периода, приблизительно, 3-4 месяца. В дополнительных воплощениях, гелевые композиции пролонгированного действия PLGA по настоящему изобретению, имеющие соотношение L/G приблизительно 100:0 (т.е. полимолочная кислота(PLA)) и соотношение P/S от, приблизительно, 55:45 до, приблизительно, 65:35, выделяют лечебное средство стабильным образом на протяжении периода, приблизительно 6-8 месяцев. В дополнительных воплощениях, гелевые композиции пролонгированного действия PLGA по настоящему изобретению, имеющие молекулярную массу от приблизительно 14000 до, приблизительно, 22000, соотношение L/G от, приблизительно, 75:25 до, приблизительно 100:0 и соотношение P/S от, приблизительно 50:50 до, приблизительно, 65:35, выделяют лечебное средство устойчивым образом на протяжении периода, приблизительно, 3-8 месяцев.
В одном аспекте продолжительность и скорость высвобождения (например, профиль скорости высвобождения и индекс взрывного высвобождения) лечебного средства контролируется подходящим выбором биоразрушаемого полимера.
(A) Молекулярная масса полимера: имеется возможность изменять молекулярную массу полимера для регулирования профиля скорости высвобождения и/или продолжительности поступления лечебного средства. В общем, если молекулярная масса полимера повышается, будет наблюдаться один или несколько из следующих эффектов: индекс взрывного высвобождения понижается, профиль скорости высвобождения становится более плоским и/или продолжительность поступления лечебного средства увеличивается.
(B) Полимеры с различными концевыми группами: гелевая композиция пролонгированного действия, содержащая смесь полимеров с различными концевыми группами, обеспечивает получение композиции пролонгированного действия, обладающей более низким индексом взрывного высвобождения и управляемой продолжительностью доставки, по сравнению с полимерами, которые не являются смесями. Например, смешивание PLGA RG502H (кислотные концевые группы) с PLGA RG502 (эфирные концевые группы) снижает индекс взрывного высвобождения для гелевой композиции пролонгированного действия, имеющей продолжительность высвобождения один месяц; смешивание PLGA RG752H с PLGA RG752 снижает индекс взрывного высвобождения для гелевой композиции пролонгированного действия, имеющей продолжительность высвобождения от, приблизительно, 3 месяцев до, приблизительно, 4 месяцев; смешивание PLA R202H с PLA R202 снижает индекс взрывного высвобождения для гелевой композиции пролонгированного действия, имеющей продолжительность высвобождения, равную 6 месяцам или более; смешивание PLGA RG502H и PLGA RG752 с PLA R202 снижает индекс взрывного высвобождения для гелевой композиции пролонгированного действия, имеющей продолжительность высвобождения, равную 6 месяцам или более. В соответствии с настоящим изобретением гелевая композиция пролонгированного действия содержит смесь полимеров, т.е. смесь полимерных компонентов и, предпочтительно, смесь полимеров, включающих, по крайней мере, один полимер на основе молочной кислоты в качестве одного из полимерных компонентов гелевой композиции пролонгированного действия.
(C) Соотношение сомономеров в полимере: изменение соотношения различных сомономеров, образующих полимер (например, соотношение L/G или CL/L для данного полимера), будет приводить к гелевым композициям пролонгированного действия, обладающим сниженным индексом взрывного высвобождения и управляемой продолжительностью высвобождения лечебного средства. Например, гелевая композиция пролонгированного действия, включающая полимер с соотношением L/G, равным 50:50, имеет короткую продолжительность доставки лечебного средства, изменяющуюся в пределах от 2 дней до приблизительно одного месяца; гелевая композиция пролонгированного действия, содержащая полимер с соотношением L/G, равным 65:35, имеет продолжительность доставки около 2 месяцев; гелевая композиция пролонгированного действия, содержащая полимер с соотношением L/G, равным 75:25, или соотношением L/CL, равным 75:25, имеет продолжительность доставки лечебного средства от, приблизительно, 3 месяцев до, приблизительно, 4 месяцев; гелевая композиция пролонгированного действия, содержащая полимер с соотношением L/G, равным 85:15, имеет продолжительность доставки лечебного средства около 5 месяцев; и гелевая композиция пролонгированного действия, содержащая полимер с соотношением PLA или L/CL, равным 25:75 имеет продолжительность доставки большую или равную 6 месяцам;
(D) Полимеры с различными характеристиками разрушения: гелевая композиция пролонгированного действия, содержащая смесь полимеров, разрушающихся быстрее, и полимеров, разрушающихся медленнее, будет приводить к композициям пролонгированного действия, имеющим более низкий индекс взрывного высвобождения и большую длительность доставки лечебного средства. Например, смешивание PLGA RG 502 с PLGA RG752 приведет к гелевой композиции пролонгированного действия, имеющей пониженный индекс взрывного высвобождения (по сравнению с гелевой композицией, включающей только PLGA RG752) и продолжительность доставки приблизительно от 3 до 4 месяцев после введения. Смешивание PLGA RG 502 и PLGA RG752 с PLA R202 приведет к образованию гелевой композиции пролонгированного действия, имеющей пониженный индекс взрывного высвобождения (по сравнению с гелевой композицией, включающей только PLA R202) и продолжительность доставки, большую или равную 6 месяцам после введения.
(E) Полимеры с различными молекулярными массами, концевыми группами и соотношениями сомономеров: гелевая композиция пролонгированного действия, содержащая смесь полимеров, имеющих различные молекулярные массы, концевые группы и соотношения сомономеров, приводит к композиции пролонгированного действия, имеющей более низкий индекс взрывного высвобождения и контролируемую продолжительность доставки лечебного средства. Например, смешивание LMW PLGA (L/G: 50/50) и PLGA RG502H (кислотные концевые группы) с PLGA RG502 (эфирные концевые группы) приведет к гелевой композиции пролонгированного действия, имеющей более низкий индекс взрывного высвобождения (по сравнению с гелевой композицией, включающей только PLGA RG502) и продолжительность доставки приблизительно один месяц. Смешивание LMW PLGA (L/G: 50/50) и PLGA RG503H (кислотные концевые группы) с PLGA RG752 (эфирные концевые группы) приведет к гелевой композиции пролонгированного действия, имеющей более низкий индекс взрывного высвобождения (по сравнению с гелевой композицией, включающей только PLGA RG752) и продолжительность доставки приблизительно от 3 до 4 месяцев после введения. Смешивание LMW PLGA (L/G: 50/50) и PLGA RG755H (кислотные концевые группы) с PLA R202 (эфирные концевые группы) приведет к гелевой композиции пролонгированного действия, имеющей более низкий индекс взрывного высвобождения (по сравнению с гелевой композицией, включающей только PLA R202) и продолжительность доставки, большую или равную 6 месяцам после введения. Смешивание PLGA RG502H (кислотные концевые группы) и PLGA RG752 (эфирные концевые группы) с PLA R206 (эфирные концевые группы) приведет к гелевой композиции пролонгированного действия, имеющей более низкий индекс взрывного высвобождения (по сравнению с гелевой композицией, включающей только PLA R202) и продолжительность доставки, большую или равную 6 месяцам после введения.
В другом аспекте продолжительность и скорость высвобождения лечебного средства контролируется изменением соотношения полимер/растворитель (P/S). Соотношение полимер/растворитель данной гелевой композиции пролонгированного действия можно изменять, для того чтобы регулировать профиль скорости высвобождения и/или продолжительность поступления лечебного средства. В общем, чем выше соотношение P/S, тем ниже индекс взрывного высвобождения и тем более плоским является профиль скорости высвобождения.
Биоразрушаемые полимеры выбраны из группы, состоящей из полимеров низкой молекулярной массы (LMW), полимеров средней молекулярной массы (MMW), и полимеров высокой молекулярной массы (HMW). Биоразрушаемые полимеры низкой молекулярной массы (LMW) имеют средневзвешенную молекулярную массу, находящуюся в диапазоне от, приблизительно, 3000 до, приблизительно, 10000; предпочтительно, от, приблизительно, 3000 до, приблизительно, 9000; более предпочтительно от, приблизительно, 4000 до, приблизительно, 8000; и, более предпочтительно, полимеры низкой молекулярной массы имеют молекулярную массу, определенную с помощью гельпроникающей хроматографии (GPC), около 7000, около 6000, около 5000, около 4000 и около 3000.
Биоразрушаемые полимеры средней молекулярной массы (MMW) имеют средневзвешенную молекулярную массу, находящуюся в диапазоне между, приблизительно, 10000 и, приблизительно, 30000; предпочтительно, от, приблизительно, 12000 до, приблизительно, 20000; более предпочтительно от, приблизительно, 14000 до, приблизительно, 18000; и, более предпочтительно, полимеры средней молекулярной массы имеют молекулярную массу, определенную с помощью гельпроникающей хроматографии (GPC), около 14000, около 15000, около 16000, около 17000 и около 18000. В предпочтительных воплощениях полимеры MMW выбраны из PLGA RG502, PLGA RG752 и PLA R202.
Биоразрушаемые полимеры высокой молекулярной массы (HMW) имеют средневзвешенную молекулярную массу, определенную с помощью гельпроникающей хроматографии (GPC), большую, чем 30000; предпочтительно, от, приблизительно, 30000 до, приблизительно, 250000; более предпочтительно от, приблизительно, 30000 до, приблизительно, 120000. В предпочтительных воплощениях полимеры HMW выбраны из RG503, PLGA RG755, PLA R206, PCL/PLA 75:25 и PCL/PLA 25:75.
Предпочтительно, полимерная матрица содержит, приблизительно, от 0 мас.% до 95 мас.% полимера низкой молекулярной массы (LMW), предпочтительно от, приблизительно 20 мас.% до, приблизительно, 90 мас.% полимера низкой молекулярной массы (LMW), более предпочтительно от, приблизительно 30 мас.% до, приблизительно, 80 мас.% полимера низкой молекулярной массы (LMW), и, более предпочтительно, от, приблизительно 40 мас.% до, приблизительно, 75 мас.% полимера низкой молекулярной массы (LMW); приблизительно от 0 мас.% до 50 мас.% полимера высокой молекулярной массы (HMW), предпочтительно от, приблизительно, 5 мас.% до, приблизительно 40 мас.% полимера высокой молекулярной массы (HMW), более предпочтительно от, приблизительно, 10 мас.% до, приблизительно 30 мас.% полимера высокой молекулярной массы (HMW), и более предпочтительно от, приблизительно, 15 мас.% до, приблизительно 25 мас.% полимера высокой молекулярной массы (HMW); а также приблизительно, от 0 мас.% до 95 мас.% полимера средней молекулярной массы (MMW), предпочтительно от, приблизительно 20 мас.% до, приблизительно, 90 мас.% полимера средней молекулярной массы (MMW), более предпочтительно от, приблизительно 30 мас.% до, приблизительно, 80 мас.% полимера средней молекулярной массы (MMW), и, более предпочтительно, от, приблизительно 40 мас.% до, приблизительно, 65 мас.% полимера средней молекулярной массы (MMW).
Полимерами, предпочтительными для представленного изобретения, являются полилактиды, т.е. полимеры на основе молочной кислоты, которые могут быть как производными только молочной кислоты, так и сополимерами на основе молочной кислоты, гликолевой кислоты и/или полимерами на основе капролактона, включающими капролактон, которые могут содержать небольшие количества других сомономеров, которые не оказывают существенного влияния на эффективные результаты, которые могут быть достигнуты в соответствии с настоящим изобретением. В контексте настоящего изобретения термин «молочная кислота» включает изомеры L-молочную кислоту, D-молочную кислоту, DL-молочную кислоту и лактиды, в то время как термин «гликолевая кислота» включает гликолиды. Наиболее предпочтительными являются полимеры, выбранные из группы, состоящей из полилактидных полимеров, обычно называемых PLA, поли(лактид-со-гликолидных)сополимеров, называемых обычно PLGA, и сополимеров(капролактон-со-молочная кислота)(PCL-co-LA). Полимер может обладать соотношением мономеров молочная кислота/гликолевая кислота (L/G) от, приблизительно, 50:50 до, приблизительно, 100:0, предпочтительно от, приблизительно, 60:40 до, приблизительно, 85:15, предпочтительно, от, приблизительно 65:35 до, приблизительно 75:25. В определенных воплощениях, когда желаемая продолжительность высвобождения лечебного средства составляет около одного месяца, предпочтительно, чтобы соотношение полимеров L/G составляло 50:50. В других воплощениях, когда желаемая продолжительность высвобождения лечебного средства составляет около 2 месяцев, предпочтительно, чтобы соотношение полимеров L/G составляло 65:35; если желаемая продолжительность высвобождения лечебного средства составляет около 3 месяцев, предпочтительно, чтобы соотношение полимеров L/G составляло 75:25; и если желаемая продолжительность высвобождения лечебного средства составляет около 6 месяцев, предпочтительно, чтобы соотношение полимеров L/G находилось в пределах от 85:15 до 100:0.
Сополимер (капролактон-со-молочная кислота) (PCL-co-LA) имеет соотношение сомономеров капролактон/молочная кислота (CL/L) от, приблизительно, 10:90 до, приблизительно, 90:10, от, приблизительно, 50:50; предпочтительно от, приблизительно, 35:65 до, приблизительно, 65:35; и более предпочтительно от, приблизительно, 25:75 до, приблизительно, 75:25. В определенных воплощениях полимер на основе молочной кислоты включает смесь, приблизительно 0-90% капролатона, приблизительно 0-100% молочной кислоты и, приблизительно, 0-60% гликолевой кислоты.
Как показано в упоминавшемся выше патенте Соединенных Штатов № 5242910, полимер может быть получен в соответствии с идеей патента Соединенных Штатов № 4443340. С другой стороны, полимер на основе молочной кислоты может быть получен непосредственно из молочной кислоты или смеси молочной и гликолевой кислот (в присутствии дополнительных сомономеров или без них) в соответствии с методиками, разработанными в патенте Соединенных Штатов № 5310865. Содержание всех указанных патентов включено посредством ссылок. Подходящие полимеры на основе молочной кислоты являются коммерчески доступными. Полимеры на основе молочной кислоты могут быть полимерами низкой молекулярной массы (LMW); средней молекулярной массы (MMW) или высокой молекулярной массы (HMW), а также смесью перечисленных типов полимеров.
Примеры полимеров включают, но не ограничиваются этим, Поли(D,L-лактид-со-гликолид) 50:50 Resomer® RG502, Поли(D,L-лактид-со-гликолид) 50:50 Resomer® RG502H, Поли-D,L лактид (Resomer® R202, Resomer® R203); Поли-диоксанон (Resomer® X210) (Boehringer Ingelheim Chemicals, Inc., Petersburg, VA). Дополнительные примеры включают, но не ограничиваются этим DL-лактид/гликолид 100:0 (MEDISORB® Polymer 100DL High, MEDISORB® Polymer 100DL Low); DL-лактид/гликолид 85/15 (MEDISORB® Polymer 8515DL High, MEDISORB® Polymer 8515DL Low); DL-лактид/гликолид 75/25 (MEDISORB® Polymer 7525DL High, MEDISORB® Polymer 7525DL Low); DL-лактид/гликолид 65/35 (MEDISORB® Polymer 6535DL High, MEDISORB® Polymer 6535DL Low); DL-лактид/гликолид 54/46 (MEDISORB® Polymer 5050DL High, MEDISORB® Polymer 5050DL Low); и DL-лактид/гликолид 54/46 (MEDISORB® Polymer 5050DL 2A(3), MEDISORB® Polymer 5050DL 3A(3), MEDISORB® Polymer 5050DL 4A(3)) (Medisorb Technologies International L.P., Cincinnati, OH); и Поли-D,L-лактид-со-гликолид 50:50; Поли-D,L-лактид-со-гликолид 65:35; Поли-D,L-лактид-со-гликолид 75:25; Поли-D,L-лактид-со-гликолид 85:15; Поли-DL-лактид; Поли-L-лактид; Поли-гликолид; Поли-ε-капролактон; Поли-DL-лактид-со-капролактон 25:75; и Поли-DL-лактид-со-капролактон 75:25 (Birmingham Polymers, Inc., Birmingham, AL).
Биосовместимый полимер представлен в гелевой композиции в количестве, находящемся в диапазоне приблизительно от, 5 мас.% до 90 мас.%, предпочтительно от, приблизительно, 20 мас.% до, приблизительно, 80 мас.%, предпочтительно от, приблизительно, 30 мас.% до, приблизительно, 75 мас.%, часто от, приблизительно, 35 мас.% до, приблизительно, 70% относительно массы вязкого геля и от, приблизительно, 40 мас.% до, приблизительно, 65% относительно массы вязкого геля, в который входят биосовместимый полимер и растворитель. Биоразрушаемый биосовместимый полимер на основе молочной кислоты присутствует в количестве, составляющем приблизительно от 5 мас.% до, приблизительно, 90 мас.%, и, предпочтительно, от, приблизительно, 25 мас.% до, приблизительно, 80 мас.%, и, более предпочтительно, от, приблизительно, 35 мас.% до, приблизительно, 75 мас.%. Для приготовления инъецируемой гелевой композиции пролонгированного действия, к полимеру добавляют растворитель в количествах, указанных ниже.
B. РАСТВОРИТЕЛИ
Инъецируемые композиции пролонгированного действия по настоящему изобретению в дополнение к биоразрушаемому полимеру и лечебному средству содержат растворитель, нерастворимый в воде. В предпочтительных воплощениях описанные в настоящем изобретении композиции также не содержат растворителей, имеющих растворимость в воде более чем 7% при 25°C.
Растворитель должен быть биосовместимым, должен образовывать вязкий гель с полимером и ограничивать поступление воды внутрь имплантата. Растворитель может являться как отдельным растворителем, так и смесью растворителей, проявляющих упомянутые выше свойства. Термин «растворитель», если особо не указано иначе, обозначает отдельный растворитель или смесь растворителей. Подходящие растворители существенно ограничивают поглощение воды имплантатом и могут быть охарактеризованы, как нерастворимые в воде, т.е. имеющие растворимость в воде менее чем 7 мас.%. Предпочтительно, растворители растворимы в воде в количестве пять процентов по массе или менее; более предпочтительно три процента по массе или менее, и, еще более предпочтительно растворимы в воде в количестве один процент по массе или менее. Наиболее предпочтительно, чтобы растворимость растворителя в воде была равна 0,5 мас.% или менее.
Растворимость в воде может быть определена экспериментально следующим образом: воду (1-5 г) помещают в чистую взвешенную емкость при контролируемой температуре около 20°C, взвешивают и добавляют по каплям испытуемый растворитель. Раствору придают вращательное движение, чтобы наблюдать разделение фаз. Когда точка насыщения оказывается достигнутой, что определяют путем наблюдения разделения фаз, раствор оставляют стоять в течение ночи и вновь проверяют на следующий день. Если раствор все еще остается насыщенным, что определяют путем наблюдения разделения фаз, то определяют массовый процент добавленного растворителя. В противном случае добавляют большее количество растворителя и процесс повторяют. Растворимость или смешиваемость определяют путем деления общей массы добавленного растворителя на окончательную массу смеси растворитель/вода. Если используют смеси растворителей, например 20% триацетина и 80% бензилбензоата, то растворители смешивают предварительно, перед прибавлением к воде.
Растворители, применяемые в настоящем изобретении, в общем, имеют растворимость в воде менее 7 мас.%, как описано выше. Растворители, имеющие подобную величину растворимости, могут быть выбраны из ароматических спиртов, низших алкиловых или аралкиловых эфиров арилсодержащих кислот, таких как бензойная кислота, фталевая кислота, салициловая кислота, низших алкиловых эфиров лимонной кислоты, таких как триэтилцитрат и трибутилцитрат и т.п., а также кетонов, содержащих арил, аралкил и низший алкил. Среди предпочтительных растворителей находятся растворители, имеющие растворимости, находящиеся в указанном выше диапазоне, выбранные из числа соединений, обладающих структурными формулами (I), (II) и (III).
Ароматический спирт имеет структурную формулу (I)
Ar-(L)n-OH (I),
в которой Ar представляет собой замещенную или незамещенную арильную или гетероарильную группу, n является нулем или 1 и L представляет собой связывающий фрагмент. Предпочтительно Ar представляет собой моноциклическую арильную или гетероарильную группу, необязательно замещенную одним или несколькими не мешающими заместителями, такими как гидрокси, алкокси, тио, амино, галоген и т.п. Более предпочтительно Ar представляет собой незамещенную 5- или 6-членную арильную или гетероарильную группу, такую как фенил, циклопентадиенил, пиридинил, пиримидинил, пиразинил, пирролил, пиразолил, имидазолил, фуранил, тиофенил, тиазолил, изотиазолил или т.п. Коэффициент n, равный нулю или 1, обозначает, что связывающий фрагмент L может как присутствовать, так и отсутствовать. Предпочтительно, n представляет собой 1, и L, как правило, является низшим алкиленовым фрагментом, таким как метилен или этилен, также связывающий фрагмент может включать гетероатомы, такие как O, N или S. Наиболее предпочтительно, Ar представляет собой фенил, n представляет собой 1, и L представляет собой метилен, так что ароматический спирт представляет собой бензиловый спирт.
Эфир ароматической кислоты или кетон может быть выбран из эфиров ароматической кислоты, включающих низший алкил и аралкил, а также арил- и аралкилсодержащих кетонов. В основном, хотя и необязательно, эфиры ароматических кислот и кетоны соответственно имеют структурные формулы (II) или (III)

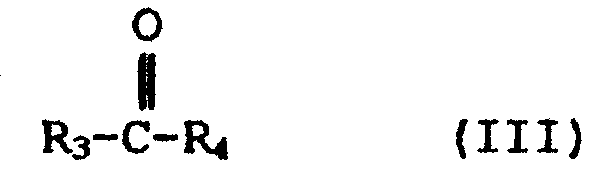
В эфире формулы (II) R1 представляет собой замещенный или незамещенный арил, аралкил, гетероарил или гетероаралкил, предпочтительно, замещенный или незамещенный арил или гетероарил, более предпочтительно, моноциклический или бициклический арил или гетероарил, необязательно замещенный одним или несколькими не мешающими заместителями, такими как гидроксил, карбоксил, алкокси, тио, амино, галоген и т.п., еще более предпочтительно, 5- или 6-членный арил или гетероарил, такой как фенил, циклопентадиенил, пиридинил, пиримидинил, пиразинил, пирролил, пиразолил, имидазолил, фуранил, тиофенил, тиазолил или изотиазолил, и, наиболее предпочтительно, 5- или 6- членный арил. R2 представляет собой гидрокарбил или гидрокарбил, замещенный гетероатомом, как правило, низший алкил или замещенный или незамещенный арил, аралкил, гетероарил или гетероаралкил, предпочтительно, низший алкил или замещенный или незамещенный аралкил или гетероаралкил, более предпочтительно низший алкил или моноциклический или бициклический аралкил или гетероаралкил, необязательно замещенный одним или несколькими не мешающими заместителями, такими как гидроксил, карбоксил, алкокси, тио, амино, галоген и т.п., еще более предпочтительно, низший алкил или 5- или 6-членный аралкил или гетероаралкил, и, наиболее предпочтительно, низший алкил или 5- или 6-членный арил, необязательно замещенный одним или несколькими дополнительными эфирными группами, имеющими структуру -O-(CO)-R1. Наиболее предпочтительными эфирами являются производные бензойной и фталевой кислот.
В кетоне формулы (III) R3 и R4 могут быть выбраны из любых групп R1 и R2, описанных выше.
Известные в технике производные бензойной кислоты, из числа которых могут быть выбраны растворители, имеющие необходимую растворимость, включают без ограничений: 1,4-циклогександиметанолдибензоат, диэтиленгликольдибензоат, дипропиленгликольдибензоат, полипропиленгликольдибензоат, пропиленгликольдибензоат, диэтиленгликольбензоат и смесь дипропиленгликольбензоатов, полиэтиленгликоль(200)дибензоат, изодецилбензоат, неопентилгликольдибензоат, глицерилтрибензоат, пентаэрилтритолтетрабензоат, кумилфенилбензоат, триметилпентандиолдибензоат.
Известные в технике производные фталевой кислоты, из числа которых могут быть выбраны растворители, имеющие необходимую растворимость, включают: алкилбензилфталат, бис-кумилфенилизофталат, дибутоксиэтилфталат, диметилфталат, диэтилфталат, дибутилфталат, диизобутилфталат, бутилоктилфталат, диизогептилфталат, диизононилфталат, нонилундецилфталат, диоктилфталат, диизооктилфталат, дикаприлфталат, фталаты смесей спиртов, ди-(2-этилгексил)фталат, линейный гептилнонилфталат, линейный гептилнонилундецилфталат, линейный нонилфталат, линейный нонилундецилфталат, линейный динонилдидецилфталат (диизодецилфталат), диундецилфталат, дитридецилфталат, ундецилдодецилфталат, децилтридецилфталат, смесь (50/50) диоктил и дидецилфталатов, бутилбензилфталат и дициклогекислфталат.
Многие растворители, использованные в настоящем изобретении, являются коммерчески доступными (Aldrich Chemicals, Sigma Chemicals), или же они могут быть получены стандартной этерификацией соответствующих арилалкановых кислот при использовании кислот, галогенангидридов и, необязательно, катализаторов этерификации, таких как описанные в патенте Соединенных Штатов № 5556905, который включен в настоящее изобретение посредством ссылки, и, в случае кетонов, окислением соответствующих вторичных спиртов, предшествующих им.
Предпочтительные растворители включают ароматические спирты, низшие алкиловые и аралкиловые эфиры арилсодержащих кислот, описанные выше. Представителями кислот являются бензойная кислота и фталевые кислоты, такие как фталевая кислота, изофталевая кислота и терефталевая кислота. Наиболее предпочтительными растворителями являются бензиловый спирт и производные бензойной кислоты, и в их число входят, но не ограничиваются перечисленным, метилбензоат, этилбензоат, н-пропилбензоат, изопропилбензоат, бутилбензоат, изобутилбензоат, вторбутилбензоат, третбутилбензоат, изоамилбензоат и бензилбензоат, причем бензилбензоат является особенно предпочтительным.
Состав также может включать, в дополнение к водонерастворимому растворителю(ям), один или большее число дополнительных растворимых растворителей («компонентных растворителей»), при условии, что любой из этих дополнительных растворителей не является низшим спиртом. Компонентные растворители, совместимые и растворимые в первичном растворителе(ях), могут иметь более высокую растворимость в воде, и итоговые смеси могут все еще значительное ограничивать проникновение воды в имплантат. Подобные смеси будут называться «компонентные смеси растворителей». Применяемые компоненты смесей растворителей могут демонстрировать растворимость в воде большую, чем первичные растворители сами по себе, как правило, между 0,1 мас.% и вплоть до, и включая, 50 мас.%, предпочтительно, вплоть до, и включая, 30 мас.%, и, наиболее предпочтительно, вплоть до, и включая, 10 мас.%, без пагубного влияния на ограничение поглощения воды, демонстрируемого имплантатами по настоящему изобретению.
Компонентные растворители, применяемые в компонентных смесях растворителей, являются такими растворителями, которые смешиваются с первичным растворителем или смесью растворителей и включают, но не ограничиваются перечисленным, триацетин, диацетин, трибутирин, триэтилцитрат, трибутилцитрат, ацетилтриэтилцитрат, ацетилтрибутилцитрат, триэтилглицериды, триэтилфосфат, диэтилфталат, диэтилтартрат, минеральное масло, полибутен, силиконовую жидкость, глицерин, этиленгликоль, полиэтиленгликоль, октанол, этиллактат, пропиленгликоль, пропиленкарбонат, этиленкарбонат, бутиролактон, оксид этилена, оксид пропилена, N-метил-2-пирролидон, 2-пирролидон, глицеролформаль, гликофурол, метилацетат, этилацетат, метилэтилкетон, диметилформамид, диметилсульфоксид, тетрагидрофуран, капролактам, децилметилсульфоксид, олеиновую кислоту и 1-додецилазацикло-гептан-2-он, а также смеси перечисленных соединений.
Предпочтительными смесями растворителей являются те смеси, в которых бензилбензоат представляет собой первичный растворитель, причем смеси образованы из бензилбензоата и либо триацетина, трибутилцитрата, триэтилцитрата, либо N-метил-2-пирролидона или гликофурола. Предпочтительными смесями являются те, в которых бензилбензоат присутствует в количестве 50 мас.% или более, более предпочтительно, 60% или более, и, наиболее предпочтительно, 80% или более от общего количества имеющегося растворителя. Особенно предпочтительны смеси, являющиеся смесями 80:20 по массе бензилбензоат/триацетин и бензилбензоат/N-метил-2-пирролидон. В дополнительных воплощениях предпочтительный растворитель представляет собой бензиловый спирт, причем смеси образованы из бензилового спирта и либо бензилбензоата, либо этилбензоата. Предпочтительными смесями бензиловый спирт/бензилбензоат и бензиловый спирт/этилбензоат являются смесь 1/99 по массе; смесь 20/80 по массе; смесь 30/70 по массе; смесь 50/50 по массе; смесь 70/30 по массе; смесь 80/20 по массе; смесь 99/1 по массе. Особенно предпочтительными смесями бензиловый спирт/бензилбензоат и бензиловый спирт/этилбензоат являются смесь 25/75 по массе и смесь 75/25 по массе.
Растворитель или смесь растворителей обычно присутствуют в количестве приблизительно от 95% до 10 мас.%, предпочтительно, от, приблизительно, 80 до, приблизительно, 20 мас.%, предпочтительно около 70-25 мас.%, предпочтительно около 65-30 мас.% и, часто, 60-40 мас.% от вязкого геля, т.е. от общей массы полимера и растворителя. Массовое отношение полимера к растворителю меняется в пределах от, приблизительно, 20:80 до, приблизительно, 90:10 по массе; предпочтительно от, приблизительно, 30:70 до, приблизительно, 80:20 по массе; предпочтительно от, приблизительно 40:60 до, приблизительно, 75:25 по массе, и, более предпочтительно, от, приблизительно 45:55 до, приблизительно, 65:35 по массе.
В особенно предпочтительном воплощении первичный растворитель выбран из ароматического спирта и низших алкиловых и аралкиловых эфиров бензойной кислоты, и полимер представляет собой полимер на основе молочной кислоты, наиболее предпочтительно выбранный из полилактидных полимеров (PLA), сополимеров поли(лактид-со-гликолид)(PLGA) и сополимеров поли(капролактон-со-молочная кислота) (PCL-co-LA), имеющих соотношение сомономеров L/G от, приблизительно, 50:50 до, приблизительно, 100:0 и соотношение L/CL от, приблизительно, 25:75 до, приблизительно, 75:25; и соотношение полимер растворитель от, приблизительно 40:60 до, приблизительно 65:35. Полимер, предпочтительно, имеет средневзвешенную молекулярную массу, находящуюся в пределах от, приблизительно, 3000 до, приблизительно, 120000, предпочтительно от, приблизительно, 7000, до, приблизительно, 100000, более предпочтительно от, приблизительно, 10000 до, приблизительно, 80000 и, более предпочтительно, полимер имеет молекулярную массу около 14000, около 16000, около 20000, около 30000 и около 60000. В этом случае наиболее предпочтительными растворителями являются бензиловый спирт, бензилбензоат и низшие алкильные эфиры бензойной кислоты, например этилбензоат. Первичные растворители, например ароматический спирт и эфиры бензойной кислоты, могут быть использованы по отдельности или в виде смеси с другими растворимыми растворителями, например триацетином или тиксотропными средствами, например этанолом, как описано в настоящем изобретении.
Растворитель или смесь растворителей способна к растворению полимера с образованием вязкого геля, который может сохранять частицы лечебного средства растворенными или диспергированными, а также изолированными от действия окружающей среды вплоть до высвобождения. Композиции по настоящему изобретению обеспечивают имплантаты, пригодные как для системного, так и для локального введения лечебного средства, причем имплантаты, обладающие низким индексом взрывного высвобождения. Поглощение воды контролируется применением растворителя или компонентной смеси растворителей, которые солюбилизируют или пластифицируют полимер, но существенно ограничивают поглощение воды внутрь имплантата. Дополнительно предпочтительные композиции могут обеспечивать вязкие гели, которые имеют температуру перехода в стеклообразное состояние меньшую, чем 37°C, так что гель остается не жестким на протяжении периода 24 часа и более после имплантации.
Важность ограничения поглощения воды, а также соответствующий выбор полимера и нерастворимого в воде растворителя для контролируемого устойчивого поступления на протяжении короткого периода времени могут быть оценены при обращении к фиг.6-21, которые показывают профили скорости высвобождения in vivo в виде функции времени для различных составов.
В дополнение к регулированию поглощения воды и связанной с этим первоначальным взрывным высвобождением путем подбора растворителя, можно также использовать средства, которые регулируют растворимость лечебного средства в воде, для того чтобы в сочетании с предпочтительными растворителями регулировать взрывного высвобождения лечебного средства из имплантата. Индексы взрывного высвобождения и процент лечебного средства, выделившегося в первые двадцать четыре часа после имплантации, могут быть снижены на величину от одной трети до двух третей или более за счет использования регуляторов растворимости, ассоциированных с лечебным средством. Такие регуляторы, как правило, представляют собой защитные оболочки, вещества, образующие комплексы или иначе ассоциированные с лечебным средством или стабилизирующие его, такие как ионы металлов, другие стабилизирующие средства, воски, липиды, масла, неполярные эмульсии и т.п. Применение подобных регуляторов растворимости может позволить использовать растворители или смеси, лучше растворимые в воде, и добиться снижения индекса взрывного высвобождения в 8 и более раз для системных применений или по отношению к локальным применениям. Как правило, имплантированные системы, применяемые в настоящем изобретении, высвобождают в первые два дня после имплантации 60% или менее от общего количества лечебного средства, которое должно выделиться из имплантированной системы в организм пациента, предпочтительно 50% или менее, более предпочтительно, 40% или менее и, еще более предпочтительно, 30% или менее.
Ограниченное поглощение воды составом по настоящему изобретению часто может обеспечить возможность создать композиции без регуляторов растворимости, в то время как в других композициях такие регуляторы будут необходимы.
В случаях, когда выбор растворителя и полимера приводит к композициям, которые сами по себе существенно ограничивают поглощение воды, может быть желательно добавлять осмотические средства или другие средства и водопритягивающие средства, которые облегчат поглощение воды до желаемого уровня. Такими средствами могут быть, например, сахара и т.п., и они очень хорошо известны в технике.
Ограниченное поглощение воды композициями растворитель-полимер по настоящему изобретению приводит к имплантированным компзициям, созданным с использованием процессов, известных в предыдущей технике, но не содержащим пальцевидных пор на поверхности имплантатов. Обычно состав по настоящему изобретению принимает форму в основном гомогенного губчатого геля, причем поры во внутреннем объеме имплантата являются в основном такими же, как поры на поверхности имплантата. Композиции по настоящему изобретению сохраняют свою гелеобразную консистенцию и вводят лечебное средство контролируемым образом, с неизменной скоростью, на протяжении короткого периода времени, по сравнению с тем, что делали устройства в предыдущей технике. Это становится возможным при подходящем выборе полимеров и водонерастворимых растворителей и, дополнительно, поскольку инъецируемые гелевые композиции пролонгированного действия по настоящему изобретению имеют температуру перехода в стеклообразное состояние Tg, меньшую, чем температура тела пациента, т.е. 37°C для людей. Благодаря нерастворимости в воде растворителей, которые применяются в настоящем изобретении, поглощение воды имплантатом ограничено, причем поры, которые действительно формируются, имеют тенденцию быть похожими на закрытые ячеистые структуры, без значительного количества пор большего размера или пор, распространяющихся от поверхности во внутреннюю область имплантата и являющихся открытыми на поверхности имплантата. Более того, поверхностные поры предоставляют лишь ограниченную возможность воде, содержащейся в жидких средах организма, проникать в имплантат немедленно после имплантации, регулируя, таким образом, эффект взрывного высвобождения. Поскольку композиции перед имплантацией часто являются высоко вязкими, в случае, когда состав предназначен для имплантации путем инъекции, вязкость, необязательно, может быть изменена при помощи использования понижающих вязкость растворимых растворителей, или путем применения эмульгаторов, или путем нагревания, чтобы получить гелевую композицию, имеющую достаточно низкие вязкость или сопротивление сдвигу, для того чтобы сделать возможным прохождение гелевой композиции через иглу.
Ограничение количества лечебного средства, выделяемого в первые 24 часа, что является либо желательным, либо требуемым, зависит от обстоятельств, таких как общая продолжительность периода поступления, терапевтическое окно для лечебного средства, потенциально вредные последствия из-за передозировки, стоимость лечебного средства и тип желаемого воздействия, т.е. системный или локальный. Предпочтительно, 60% или менее лечебного средства будет выделено в первые два дня после имплантации, предпочтительно, 50% или менее, более предпочтительно 40% или менее, и еще более предпочтительно 30% или менее, причем процентные соотношения рассчитаны на основании общего количества лечебного средства, которое должно выделиться на протяжении периода поступления.
В зависимости от конкретного выбранного растворителя или смеси растворителей, полимера, лечебного средства и, необязательно, регуляторов растворимости лечебного средства композиции по настоящему изобретению, предназначенные для системной доставки, могут обеспечивать гелевую композицию, имеющую индекс взрывного высвобождения 8 или менее, предпочтительно, 6 или менее, более предпочтительно, 4 или менее и, наиболее предпочтительно, 2 или менее. Особенно эффективными являются композиции на основе PLGA со средневзвешенной молекулярной массой в пределах от, приблизительно, 3000 до, приблизительно, 120000; предпочтительно от, приблизительно, 7000 до, приблизительно, 100000; более предпочтительно от, приблизительно, 10000 до, приблизительно, 80000; и, более предпочтительно, полимер имеет молекулярную массу от, приблизительно, 14000 до, приблизительно, 60000, в сочетании с растворителями, имеющими растворимость в воде менее чем 7 мас.%, необязательно объединенными с другими растворителями, обеспечивающие имплантаты, предназначенные для системной инъекции лечебного средства, имеющие индекс взрывного высвобождения 10 или менее, предпочтительно, 7 или менее, более предпочтительно, 5 или менее и, наиболее предпочтительно, 3 или менее. Использование смесей растворителей, как описано в настоящем патенте, может быть особенно эффективным в качестве средства для обеспечения достаточной пластификации полимера, чтобы получить вязкую гелевую систему и, в то же время, обеспечить для составов по настоящему изобретению желаемые индексы взрывного высвобождения и ориентиры процентного высвобождения.
Композиции, предназначенные для локальной доставки лечебного средства, созданы тем же самым способом, что и композиции, предназначенные для системного применения. Однако, поскольку локальная доставка лечебного средства пациенту не приводит к появлению обнаружимых уровней лечебного средства в плазме, такие системы должны, скорее, отличаться процентным соотношением лечебного средства, выделяемого в предварительно определенный начальный период, чем индексом взрывного высвобождения, как определено в настоящем изобретении. Как правило, данный период составляет 24 часа после имплантации, и процентное соотношение эквивалентно лечебному средству по массе, высвобождаемому за период (т.е. 24 часа), деленному на количество лечебного средства по массе, которое поступит на протяжении всего периода доставки, и далее результат деления должен быть умножен на число 100. Композиции по настоящему изобретению имеют начальные взрывного высвобождения, составляющие 40% или менее, предпочтительно, 30% или менее, наиболее предпочтительно, 20% или менее, для большинства применений.
Во многих примерах может быть желательным понизить начальное взрывное высвобождение лечебного средства в процессе локального введения, чтобы предотвратить неблагоприятные результаты. Например, имплантаты по настоящему изобретению, содержащие химиотерапевтические средства, подходят для непосредственных инъекций в опухоли. Однако многие химиотерапевтические средства могут демонстрировать побочные токсические действия при системном введении. Следовательно, локальное введение в опухоль может стать выбранным способом лечения. Однако необходимо избегать введения химиотерапевтического средства, которое сопровождается значительной вспышкой, если есть возможность, что подобное средство будет введено в сосудистую или лимфатическую системы, где оно может вызвать побочные действия. Соответственно, в таких примерах эффективными являются имплантированные системы по настоящему изобретению, имеющие, как описано здесь, ограниченную вспышку.
Гель, образованный при помощи смешивания полимера и растворителя, обычно показывает вязкость от, приблизительно, 100 до, приблизительно, 50000 пуаз, предпочтительно, от, приблизительно, 500 до, приблизительно, 30000 пуаз, более предпочтительно, от, приблизительно, 500 до, приблизительно, 10000 пуаз, причем вязкость измеряют при скорости сдвига 1,0 с и 25°C, с использованием реометра Haake через, приблизительно, через 1-2 дня, после того, как смешивание завершено. Смешивание полимера с растворителем может быть выполнено с помощью обычного оборудования с низким усилием сдвига, таком как двойной планетарный миксер Ross, за время от, приблизительно, 10 минут, до, приблизительно, 1 часа, хотя специалист в данной области может выбрать более короткий или более длинный период, в зависимости от специфических физических характеристик получаемой композиции. Поскольку гелевая композиция пролонгированного действия по настоящему изобретению вводится в виде инъецируемой смеси, компенсационный фактор при образовании гелевых составов пролонгированного действия, которые являются вязкими гелями, заключается в том, что смесь полимер/растворитель/лечебное средство имеет весьма низкую вязкость, для того чтобы быть продавленным через иглу небольшого диаметра, например 18-20 калибра. Если это необходимо, регулирование вязкости геля для инъекции может сопровождаться использованием эмульгирующих средств, как описано здесь. Кроме того, подобные композиции должны иметь достаточную стабильность в пространственном отношении, чтобы оставаться локализованными и чтобы при необходимости имелась возможность удалить их. Отдельные гели или гелеобразные композиции по настоящему изобретению удовлетворяют таким требованиям.
Если полимерная композиция должна быть введена в виде инъецируемого геля, необходимо, чтобы степень растворения полимера была сбалансирована с итоговой вязкостью геля, чтобы одновременно обеспечить и разумное усилие при дозировании вязкого геля из иглы или катетера, и потенциальный эффект взрывного высвобождения. Гели высокой вязкости делают возможным доставку лечебного средства без проявления значительного эффекта взрывного высвобождения, но затрудняют дозирование геля через иглу или катетер. В этих случаях к составу, необязательно, может быть добавлено эмульгирующее средство. Кроме этого, поскольку вязкость, в общем, может понижаться при росте температуры смеси, в определенных приложениях может оказаться эффективным понижение вязкости геля с помощью нагревания, чтобы обеспечить более легко инъецируемую смесь. Характеристики снижения сдвигающего усилия гелевых составов пролонгированного действия по настоящему изобретению позволяют им быть легко инъецируемыми в животных, включая людей, при использовании игл или катетеров стандартных калибров, без необходимости применения чрезмерного давления при дозировании.
Когда эмульгирующее средство смешивают с вязким гелем, образованным из полимера и растворителя, используя обычные статические или механические смешивающие устройства, такие как диафрагменный смеситель, эмульгирующее средство образует отдельную фазу, состоящую из диспергированных капелек микроскопического размера, которые обычно имеют средний диаметр менее чем, приблизительно, 100 микрон. Непрерывная фаза образована из полимера и растворителя. Частицы лечебного средства могут быть растворены или диспергированы либо в непрерывной фазе, либо в капельной фазе. В итоговом тиксотропном составе капельки эмульгирующего средства вытягиваются в направлении сдвига и существенно уменьшают вязкость вязкого геля, образованного из полимера и растворителя. Например, в случае вязкого геля, имеющего вязкость от, приблизительно, 5000 до, приблизительно, 50000 пуаз, измеренную при 1,0 с-1 и 25°C, можно получить снижение вязкости до менее чем 100 пуаз, при эмульгировании раствором 10% этанол/вода при 25°C, как было определено с помощью реометра Haake.
В случае применения эмульгирующего средства оно обычно присутствует в количестве, заключенном в диапазоне от, приблизительно, 5 мас.% до, приблизительно 80 мас.%, предпочтительно, от, приблизительно 20 мас.%, до, приблизительно, 60 мас.% и часто от 30 до 50 мас.%, относительно количества инъецируемой гелевой композиции пролонгированного действия, т.е. совокупного количества полимера, растворителя, эмульгирующего средства и лечебного средства. Эмульгирующие средства включают, например, растворители, которые не полностью растворимы в растворителях или смесях растворителей полимера. Показательными эмульгирующими средствами являются вода, спирты, полиспирты, сложные эфиры, карбоновые кислоты, кетоны, альдегиды и смеси перечисленных соединений. Предпочтительными эмульгирующими средствами являются спирты, пропиленгликоль, этиленгликоль, глицерин, вода, а также их растворы и смеси. Особенно предпочтительными являются вода, этанол, изопропиловый спирт, а также их растворы и смеси. Тип эмульгирующего средства влияет на размер диспергированных капелек. Например, этанол образует капельки, имеющие средние диаметры, которые могут быть примерно в десять раз больше, чем капельки, полученные с изотоническим солевым раствором, содержащим 0,9 мас.% хлорида натрия при 21°C.
Следует понимать, что эмульгирующие средства не представляют собой только разбавители, которые снижают вязкость простым понижением концентрации компонентов смеси. Применение обычных разбавителей может снизить вязкость, но оно также может вызвать упоминавшийся ранее эффект взрывного высвобождения при инъекции разбавленной композиции. Напротив, инъецируемая гелевая композиция пролонгированного действия по настоящему изобретению может быть составлена так, чтобы избежать эффекта взрывного высвобождения, путем выбора подходящего полимера, растворителя и эмульгирующего средства, так чтобы после однократного введения на место эмульгирующее средство оказывало небольшое влияние на свойства высвобождения исходной системы.
Хотя инъецируемая гелевая композиция пролонгированного действия по настоящему изобретению предпочтительно создается в виде вязкого геля, средства введения имплантатов не ограничены инъекцией, хотя данный способ доставки часто может быть предпочтительным. Когда инъецируемую гелевую композицию пролонгированного действия вводят в качестве оставляемого в организме препарата, ей может быть придана форма, соответствующая полости тела после завершения хирургического вмешательства, или же композиция может быть применена в виде текучего геля путем нанесения геля кистью или шпателем на сохранившиеся ткани или кости. Такие применения могут позволить внесение лечебного средства в гель с концентрациями, превышающими те, которые обычно имеют место в инъецируемых композициях.
C. ЛЕЧЕБНЫЕ СРЕДСТВА
Лечебное средство может являться любым физиологически или фармакологически активным веществом или веществами, необязательно в сочетании с фармацевтически приемлемыми носителями и дополнительными ингредиентами, такими как антиоксиданты, стабилизаторы, средства для усиления проникновения и другими, которые не оказывают существенного вредного влияния на эффективные результаты, которые могут быть достигнуты с помощью настоящего изобретения. Лечебное средство может быть любым из средств, про которые известно, что они вводятся в тело человека или животного и которые, предпочтительно, растворимы в воде, а не в растворителе, растворяющем полимер. Данные средства включают лекарственные средства, медикаменты, витамины, питательные вещества или т.п. Среди прочих типов средств данному описанию удовлетворяют соединения низкой молекулярной массы, белки, пептиды, генетический материал, питательные вещества, витамины, пищевые добавки, противозачаточные средства, ингибиторы рождаемости и стимуляторы рождаемости.
Лекарственные средства, которые могут вводиться по настоящему изобретению, включают лекарства, которые действуют на периферическую нервную систему, адренергические рецепторы, холенергические рецепторы, скелетные мышцы, сердечно-сосудистую систему, гладкие мышцы, систему кровообращения, синоптические участки, участки узлов нервных окончаний, эндокринную и гормональную системы, иммунную систему, репродуктивную систему, костную систему, системы секреции, пищеварительную и выделительную системы, гистаминовую систему и центральную нервную систему. Подходящие средства могут быть выбраны, например, из числа белков, ферментов, гормонов, полинуклеотидов, нуклеопротеинов, полисахаридов, гликопротеинов, липопротеинов, полипептидов, стероидов, аналгетиков, средств местной анестезии, антибиотиков, антивоспалительных кортикостероидов, глазных лекарственных средств и синтетических аналогов перечисленных препаратов.
Примеры лекарственных средств, которые могут быть доставлены с помощью композиций по настоящему изобретению, включают, но не ограничиваются перечисленным, бупивакаин, бупренорфин, прохлорперазин эдисилат, сульфат железа, аминокапроновую кислоту, мекамиламин гидрохлорид, прокаинамид гидрохлорид, амфетамин сульфат, метамфетамин гидрохлорид, бензамфетамин гидрохлорид, изопротеренол сульфат, фенметразин гидрохлорид, бетанехол хлорид, метахолин хлорид, пилокарпин гидрохлорид, атропин сульфат, скополамин бромид, изопропамид иодид, тридигексетил хлорид, фенформин гидрохлорид, метилфенидат гидрохлорид, теофиллин холинат, цефалексин гидрохлорид, дифенидол, меклизин гидрохлорид, прохлорперазин малеат, феноксибензамин, тиэтилперзин малеат, анисиндон, дифенадион эритритил тетранитрат, дигоксин, изофлуорофат, ацетазоламид, метазоламид, бендрофлуметиазид, хлоропромаид, толазамид, хлормадинон ацетат, фенагликодол, аллопуринол, алюминий аспирин, метотрексат, ацетил сульфизоксазол, эритромицин, гидрокортизон, гидрокортикостерон ацетат, кортизон ацетат, дексаметазон и его производные, такие как бетаметазон, триамцинолон, метилтестостерон, тестостерон, 17-S-эстрадиол, этинилэстрадиол, этинилэстрадиол-3-метиловый эфир, преднизолон, 17α-гидроксипрогестерон ацетат, 19-нор-прогестерон, норгестрел, норэтиндрон, норэтистерон, норэтиэдерон, прогестерон, норгестерон, норэтинодрел, аспирин, индометацин, напроксен, фенопрофен, сулиндак, индопрофен, нитроглицерин, изосорбид динитрат, пропанолол, тимолол, атенолол, алпренолол, циметидин, клонидин, имипрамин, леводопу, хлорпромазин, метилдопу, дигидроксифенилаланин, теофиллин, глюконат кальция, кетопрофен, ибупрофен, цефалексин, эритромицин, галоперидол, зомепирак, лактат железа, винкамин, диазепам, феноксибензамин, дилтиазем, милринон, мандол, кванбенц, гидрохлортиазид, ранитидин, флурбипрофен, фенуфен, флупрофен, толметин, алклофенак, мефенамик, флуфенамик, дифуинал, нимодипин, нитрендипин, нисолдипин, никардипин, фелодипин, лидофлазин, тиапамил, галлопамил, амлодипин, миофлазин, лизинолприл, эналаприл, эналаприлат, каптоприл, рамиприл, фамотидин, низатидин, сукралфат, энинтидин, тетратолол, миноксидил, хлордиазепоксид, диазепам, амитриптилин, имипрамин, палиперидон, рисперидон, октреотид, алендронат, α-4,β-7 рецептор антагонист лейкозита и инфликсимаб (Ремикад).
Дополнительными примерами являются белки и пептиды, которые включают, но не ограничиваются перечисленным, костные морфогенетические протеины, инсулин, колхицин, глюкагон, тироидстимулирующий гормон, паратироидные и гипофизарные гормоны, кальцитонин, ренин, пролактин, кортикотропин, тиреотропный гормон, фолликулостимулирующий гормон, хорионический гонадотропин, рилизинг-гормон гонадотропина, бычий соматотропин, свиной соматотропин, окситоцин, вазопрессин, GRF, соматостатин, липрессин, панкреозимин, лютеинизирующий гормон, LHRH, агонисты и антагонисты LHRH, леупролид, интерфероны, такие как интерферон альфа-2a, интерферон альфа-2b и консенсусный интерферон, интерлейкины, гормоны роста, такие как человеческий гормон роста и его производные, такие как метион-человеческий гормон роста и дез-фенилаланин человеческий гормон роста, паратироидный гормон, бычий гормон роста и свиной гормон роста, ингибиторы фертильности, такие как простагландины, стимуляторы фертильности, факторы роста, такие как эпидермальные факторы роста (EGF), факторы роста, выделенные из тромбоцитов (PDGF), факторы роста фибробластов (FGF), трансформирующие факторы роста-α (TGF-α), трансформирующие факторы роста-β (TGF-β), эритропоэтин (EPO), инсулиноподобный фактор роста-I (IGF-I), инсулиноподобный фактор роста-II (IGF-II), интерлейкин-1, интерлейкин-2, интерлейкин-6, интерлейкин-8, фактор некроза опухолей-α (TNF-α), фактор некроза опухолей-β (TNF-β), интерферон-α (INF-α), интерферон-β (INF-β), интерферон-γ (INF-γ), интерферон-ω (INF-ω), фактор, стимулирующий колониеобразование (CGF), фактор роста сосудистых клеток (VEGF), тромбопоэтин (TPO), факторы роста производные стромальных клеток (SDF), плацентарные факторы роста (PIGF), фактор роста клеток печени (HGF), колониестимулирующий фактор гранулоцитов и макрофагов (GM-CSF), глиальный нейротропиновый фактор (GDNF), колониестимулирующий фактор гранулоцитов (G-CSF), ресничный нейротропный фактор (CNTF), костный фактор роста, трансформирующий фактор роста, костные морфогенные протеины (BMP), факторы коагуляции, человеческий рилизинг-фактор гормона поджелудочной железы, аналоги и производные данных соединений, фармацевтически приемлемые соли данных соединений, либо их аналоги или производные.
По настоящему изобретению также осуществляется локальное применение химиотерапевтических средств, чтобы избежать системных побочных действий или минимизировать их. Гели, содержащие химиотерапевтические средства по настоящему изобретению, могут быть инъецированы непосредственно в опухолевую ткань для стабильного поступления химиотерапевтического средства на протяжении определенного времени. В некоторых случаях, особенно после удаления опухоли, гель может быть имплантирован непосредственно в образовавшуюся полость или может быть применен путем нанесения на оставшуюся опухоль в виде покрытия. В тех случаях, когда гель имплантируют после хирургического вмешательства, имеется возможность использовать гели, имеющие более высокие вязкости, поскольку они не должны проходить через иглу малого диаметра. Репрезентативные химиотерапевтические средства, которые могут доставляться в соответствии с практикой настоящего изобретения, включают, например, карбоплатин, цисплатин, паклитаксел, 5-флуороурацил, BCNU, винкристин, камптотецин, этопсид, цитокины, рибозимы, интерфероны, олигонуклеотиды и олигонуклеотидные последовательности, которые ингибируют трансляцию или транскрибирование генов опухоли, функциональные производные перечисленного, а также общеизвестные химиотерапевтические средства, такие как перечисленные в патенте Соединенных Штатов 5651986. Данное приложение является особенно полезным в случае стабильного поступления водорастворимых химиотерапевтических средств, таких как, например, цисплатин и карбоплатин, а также водорастворимых производных паклитаксела. Отличительные черты данного изобретения, которые позволяют минимизировать эффект взрывного высвобождения, являются особенно эффективными при введении водорастворимых лечебных средств всех видов, но, в особенности, тех соединений, которые являются клинически полезными и эффективными, но могут иметь вредные побочные воздействия.
В пределах, которые не были упомянуты выше, могут быть также использованы лечебные средства, описанные в упоминавшемся патенте Соединенных Штатов № 5242910. Одно особенное преимущество настоящего изобретения заключается в том, что вещества, такие как белки, в качестве примера которых можно привести ферментный лизоцим, а также кДНК и ДНК, объединяются в векторы, как вирусные, так и невирусные, которые с трудом поддаются микроинкапсуляции или превращению в микросферы, могут быть включены в состав по настоящему изобретению, без определенного уровня разложения, вызванного воздействием высоких температур и денатурирующих растворителей, часто присутствующих в других методиках обработки.
Лечебное средство предпочтительно включено в вязкий гель, образованный из полимера и растворителя, в виде частиц, обычно имеющих средний размер от, приблизительно, 0,1 до, приблизительно, 250 микрон, предпочтительно, от, приблизительно, 1 до, приблизительно, 125 микрон и часто от 10 до 90 микрон. Например, частицы, средний размер которых составляет, приблизительно, 5 микрон, были получены распылительной сушкой или сушкой вымораживанием водной смеси, содержащей 50% сахарозы и 50% куриного лизоцима (в отношении сухого веса) и смесей 10-20% hGH и 15-30 ммоль ацетата цинка. Подобные частицы были использованы в отдельных примерах, иллюстрированных чертежами. Обычные процессы лиофилизации также могут быть применены для того, чтобы сформировать частицы лечебного средства различных размеров при использовании подходящих циклов замораживания и высушивания с последующим подходящим измельчением и просеиванием.
Для образования суспензии или для диспергирования частиц лечебного средства в вязком геле, образованном из полимера и растворителя, может быть использовано любое стандартное устройство с низким усилием сдвига, такое как двойной планетарный миксер Ross, при условиях окружающей среды. Таким способом может быть достигнуто эффективное распределение лечебного средства, в основном, без его разрушения.
Лечебное средство, как правило, растворено или диспергировано в смеси в количестве от, приблизительно, 0,1 мас.% до, приблизительно, 70 мас.%, предпочтительно в количестве от, приблизительно, 0,5 мас.% до, приблизительно, 50% и часто от 1 мас.% до 30 мас.% от совокупного количества полимера, растворителя и лечебного средства. В зависимости от количества лечебного средства, присутствующего в составе, можно получить различные профили высвобождения и индексы взрывного высвобождения. Более конкретно, для данного полимера и растворителя, регулируя количество этих компонентов и количество лечебного средства, можно получить профиль высвобождения, который в большей степени зависит от распада полимера, чем от диффузии лечебного средства из композиции, или наоборот. В общем, на ранних стадиях профиль скорости высвобождения главным образом управляется скоростью диффузии и скоростью растворения лечебного средства из композиции; в то же время на более поздних стадиях распад полимера представляет собой основной фактор, определяющий профили скорости распада. В этой связи при более низком уровне содержания лечебного средства профиль высвобождения зависит, в первую очередь, от скорости распада полимера и во вторую очередь от диффузии лечебного средства из композиции, причем в основном скорость высвобождения возрастает или не изменяется со временем (например, плоский профиль).
При более высоких уровнях содержания лечебного средства скорость высвобождения зависит от растворимости лечебного средства в гелевой композиции пролонгированного действия или окружающей среде. Например, если лечебное средство имеет высокую растворимость в составе или окружающей среде, профиль высвобождения зависит, в первую очередь, от скорости диффузии лечебного средства из композиции и, во вторую очередь, от скорости распада полимера, причем в целом скорость высвобождения снижается со временем. Если лечебное средство имеет очень низкую растворимость в составе или окружающей среде, профиль высвобождения зависит, в первую очередь, от скорости диффузии и скорости растворения лечебного средства из композиции и, во вторую очередь, от скорости распада полимера, причем, в общем, скорость высвобождения со временем остается постоянной.
При промежуточных уровнях содержания лечебного средства скорость высвобождения зависит от совместного влияния диффузии лечебного средства из композиции и скорости распада полимера, причем данное совместное влияние можно настраивать, чтобы добиться в основном постоянной скорости высвобождения. Для того чтобы минимизировать вспышку, предпочтительно обеспечить содержание лечебного средства около 30% или менее по массе, по отношению к общей массе гелевой композиции, т.е. общей массе полимера, растворителя и лечебного средства, причем содержание 20% или менее является более предпочтительным.
Скорости высвобождения и содержание лечебного средства можно регулировать, чтобы добиться терапевтически эффективной доставки лечебного средства на протяжении намеченного продолжительного периода доставки. Предпочтительно лечебное средство присутствует в полимерном геле в концентрациях, которые выше, чем концентрация насыщения лечебного средства в воде, для того чтобы обеспечить источник, из которого дозируется лечебное средство. При том, что скорость высвобождения лечебного средства зависит от специфических обстоятельств, таких как лечебное средство, которое предполагается вводить, могут быть получены скорости высвобождения порядка от, приблизительно, 0,1 до, приблизительно, 10000 мкг/день, предпочтительно от, приблизительно, 1 до, приблизительно, 5000 мкг в день в течение периода от, приблизительно, 2 недель до, приблизительно, одного года. Большие количества могут поступать, если доставка должна происходить в течение более коротких периодов. В общем, более высокое высвобождение становится возможным, если может быть допустим более значительный эффект взрывного высвобождения. В случаях, когда гелевая композиция имплантированна хирургически или использована в качестве «оставленного» запаса при хирургическом вмешательстве, чтобы лечить болезненное состояние, или в других условиях, которые возникают в аналогичных обстоятельствах, есть возможность обеспечить более высокие дозы, чем при нормальном введении, когда имплантат инъецируют. Далее, дозу лечебного средства можно регулировать путем регулирования объема имплантированного геля, или объема введенного инъецируемого геля.
Фиг.6 A-D и 7-21 показывают репрезентативные профили высвобождения различных лечебных средств из предпочтительных композиций по настоящему изобретению, полученные на примере крыс. Как показано на чертежах, инъецируемые композиции пролонгированного действия по настоящему изобретению, включающие полимеры, обеспечивают контролируемое устойчивое высвобождение лечебного средства на протяжении определенного/желательного периода времени. Период и профили скорости высвобождения могут быть отрегулированы в зависимости от природы полимера и свойств полимера (например, молекулярная масса, соотношения сомономеров, концевые группы); природы растворителя и соотношения полимер/растворитель.
D. НЕОБЯЗАТЕЛЬНЫЕ ДОПОЛНИТЕЛЬНЫЕ КОМПОНЕНТЫ
В инъецируемом гелевой композиции пролонгированного действия могут присутствовать другие компоненты, в том случае, если они желательны или придают составу полезные свойства, причем в число этих компонентов могут входить полиэтиленгликоль, гигроскопические средства, стабилизирующие средства, средства для формирования пор, тиксотропные средства и другие. Если состав включает пептид или белок, который растворим в водной среде или нестабилен в ней, может быть весьма желательным включить регулятор растворимости, который может, например, являться стабилизирующим средством в смеси. Различные регулирующие средства описаны в патентах Соединенных Штатов №№ 5654010 и 5656297, которые включены в настоящее изобретение при помощи ссылок. В случае hGH, например, предпочтительно включить некоторое количество соли двухвалентного металла, предпочтительно цинка. Примеры подобных регуляторов и стабилизирующих средств, которые могут образовывать комплексы или связываться с лечебным средством, чтобы обеспечить стабилизирующий эффект или эффект регулирования высвобождения, включают катионы металлов, предпочтительно двухвалентных, представленных в смеси в виде карбоната магния, карбоната цинка, карбоната кальция, ацетата магния, сульфата магния, ацетата цинка, сульфата цинка, хлорида цинка, хлорида магния, оксида магния, гидроксида магния, других антацидов и т.п. Количества использованных средств подобного типа зависят от природы образуемых комплексов, если они образуются, и от природы ассоциирования между лечебным средством и рассматриваемым средством. Молярные соотношения регулятора растворимости или стабилизирующего средства и лечебного средства, которые обычно могут быть применены, составляют от, примерно, 100:1 до 1:1, предпочтительно от 10:1 до 1:1.
Тиксотропное средство, т.е. средство, которое придает полимерному гелю тиксотропные свойства, выбрано из числа низших алкиловых спиртов. В число низших алкиловых спиртов входят спирты, которые содержат 2-6 атомов углерода в виде линейной или разветвленной цепи. Примерами таких спиртов являются этанол, изопропанол и т.п. Важно, что такое тиксотропное средство не является растворителем полимера. (См., например, Development of an in situ forming biodegradable poly-lactide-co-glycolide system for controlled release of proteins, Lambert, W.J., and Peck, K.D., Journal of Controlled Release, 33 (1995)189-195).
Порообразующее средство включает биосовместимые материалы, которые при контакте с внутренними жидкостями организма растворяются, диспергируются или распадаются с образованием пор или каналов в полимерной матрице. Как правило, в качестве средства для образования пор могут быть использованы органические и неорганические вещества, которые являются водорастворимыми, такие как сахара (например, сахароза, декстроза), водорастворимые соли (например, хлорид натрия, фосфат натрия, хлорид калия и карбонат натрия), водорастворимые растворители, такие как N-метил-2-пирролидон и полиэтиленгликоль, а также водорастворимые полимеры (например, карбоксиметилцеллюлоза и т.п.). Такие вещества могут содержаться в количествах, колеблющихся от, примерно, 0,1% до, примерно, 100% от массы полимера, но обычно присутствуют в количестве менее 50% и, еще чаще, в количестве менее 10-20% от массы полимера.
II. ПОЛЕЗНОСТЬ И ПРИМЕНЕНИЕ
Средства введения гелевых композиций пролонгированного действия не ограничены инъекцией, хотя эта форма введения часто может быть предпочтительной. Если гелевая композиция пролонгированного действия вводится в виде оставленного в организме продукта, ему может быть придана форма, соответствующая полости тела, существующей после завершения хирургического вмешательства, или композиция может быть применена как жидкий гель путем нанесения геля кистью или шпателем на оставшуюся ткань или кость.
Композиции по настоящему изобретению без лечебного средства применимы для заживления ран, восстановления костей и других целей структурной поддержки.
Для дополнительного понимания различных аспектов настоящего изобретения в соответствии со следующими примерами были получены результаты, представленные в описанных ранее чертежах.
ПРИМЕР 1
ПОЛУЧЕНИЕ ГЕЛЕВОГО НОСИТЕЛЯ
Гелевый носитель для использования в инъецируемой композиции пролонгированного действия получают следующим образом. Стеклянный сосуд взвешивают на аналитических весах Mettler AE 163 или на аналитических весах с верхним загрузчиком Mettler PJ3000. Поли(D,L-лактид-co-гликолид) (PLGA), (соотношение L/G 50/50) с характеристической вязкостью 0,15 (PLGA-BPI, Birmingham Polymers, Ink., Birmingham, AL); Resomer® PLGA RG502 (соотношение L/G 50/50); Resomer® PLGA RG503 (соотношение L/G 50/50); 50:50 Resomer®RG504(PLGARG 504); или Поли(D,L-лактид-co-гликолид) (PLGA), (соотношение L/G 75/25) Resomer® RG752 (Boehringer Ingeheim Chemicals Inc., Petersburg, VA), перемалывают и просеивают через сито 425 микрон. Полимер взвешивают в стеклянном сосуде. Стеклянный сосуд, содержащий полимер, взвешивают и добавляют соответствующий растворитель. Количества компонентов, выраженные в виде процентных соотношений для различных сочетаний полимер/растворитель, показаны ниже в таблице 1. Смесь полимер/растворитель перемешивают при 250±50 об/мин (электрическая мешалка IKA, IKH-Werke GmbH and Co., Stanfen, Germany) в течение, приблизительно, 5-10 минут, получая клейкое пастообразное вещество, содержащее частицы полимера. Сосуд, содержащий смесь полимер/растворитель, герметично закрывают и помещают в инкубатор с контролируемой температурой, которая установлена на уровне 37°C, на срок от 1 до 4 дней, с периодическим перемешиванием в зависимости от типа и/или количества растворителя и полимера. Смесь полимер/растворитель вынимают из инкубатора, когда она принимает вид прозрачного, янтарного, гомогенного раствора. После этого смесь помещают в печь (65°C, 30 мин), пока полимер не растворится в смеси.
Дополнительные гелевые носители для композиций пролонгированного действия приготовляют из следующих растворителей или смесей растворителей: бензилбензоат («BB»), бензиловый спирт («BA»), этилбензоат («EB»), этанол и пропиленгликоль («PG») а также их смесей, и из следующих полимеров: Поли(D,L-лактид-со-гликолид) 75:25 (Resomer® RG752), Поли(D,L-лактид-со-гликолид) 75:25 (Resomer® RG755), Поли(D,L-лактид-со-гликолид) 75:25 (Resomer® RG756), Поли(D,L-лактид-со-гликолид) 85:15 (Resomer® RG858), Поли(D,L-лактид) (Resomer® R104), Поли(D,L-лактид) (Resomer® R202), Поли(D,L-лактид) (Resomer® R202H), Поли(D,L-лактид) (Resomer® R203), Поли(D,L-лактид) (Resomer® R206), Поли(D,L-лактид) (Resomer® R207), Поли(D,L-лактид) (Resomer® R208), Поли-L-лактид-со-D,L-лактид 90:10 (Resomer® LR209), Поли(D,L-лактид-со-гликолид) 50:50 Resomer® RG502; Поли(D,L-лактид-со-гликолид) 50:50 Resomer® RG502H, PLGA-502H; Поли(D,L-лактид-со-гликолид) 50:50 Resomer® RG503, PLGA-503; Поли(D,L-лактид-со-гликолид) 50:50 Resomer® RG755, PLGA-755; Поли(L-лактид) (Resomer® L104), Поли(L-лактид) (Resomer® L206), Поли(L-лактид) (Resomer® L207), Поли(L-лактид) (Resomer® L209), Поли(L-лактид) (Resomer® L210), Поли(L-лактид) (Resomer® L214), Поли D,L-лактид-со-гликолид 75:25 (Resomer® RG752, Resomer® RG756 ); Поли-D,L-лактид-со-гликолид 85:15 (Resomer® RG858); Поли-L-лактид-со-триметилен карбонат 70:30 (Resomer® LT706); Полидиоксанон (Resomer® X 210) (Boehringer Ingeuheim Chemicals Inc., Petersburg,VA); Поли(L-лактид-со-D,L-лактид 70:30(Resomer® LR708), Поли(L-лактид-со-D,L-лактид 90:10 (Resomer® LR209), Поли(D,L-лактид) (MEDISORB® Polymer 100DL High, MEDISORB® Polymer 100DL Low); Поли(D,L-лактид-со-гликолид) 85:15 (MEDISORB® Polymer 8515 DL High, MEDISORB® Polymer 8515 DL Low); Поли(D,L-лактид-со-гликолид) 75:25 (MEDISORB® Polymer 7525 DL High, MEDISORB® Polymer 7525 DL Low); Поли(D,L-лактид-со-гликолид) 65:35(MEDISORB® Polymer 6535 DL High, MEDISORB® Polymer 6535 DL Low); D,L-лактид/гликолид 54/46 (MEDISORB® Polymer 5050 DL High, MEDISORB® Polymer 5050 DL Low) и D,L-лактид/гликолид 54/46(MEDISORB® Polymer 5050 DL 2A(3), MEDISORB® Polymer 5050 DL 3A(3), MEDISORB® Polymer 5050 DL 4A(3)) (Medisorb Technologies International L.P., Cincinnati, OH) и Поли-D,L-лактид-со-гликолид 50:50; Поли-D,L-лактид-со-гликолид 65:35; Поли(D,L-лактид-со-гликолид) 65:35 (Birmingham Polymers, Ink., Birmingham, AL); Поли(D,L-лактид-со-гликолид) 75:25 (Birmingham Polymers, Ink., Birmingham, AL); Поли(D,L-лактид-со-гликолид) 85:15 (Birmingham Polymers, Ink., Birmingham, AL); Поли D,L-лактид (Birmingham Polymers, Ink., Birmingham, AL); Поли L-лактид (Birmingham Polymers, Ink., Birmingham, AL); Полигликолид; Поли-ε-капролактон; Поли(D,L-лактид-со-капролактон) 25:75 (Birmingham Polymers, Ink., Birmingham, AL); и Поли(D,L-лактид-со-капролактон) 75:25 (Birmingham Polymers, Ink., Birmingham, AL). Репрезентативные гелевые носители описаны в таблицах 1-3 ниже.
ПРИМЕР 2
ПОЛУЧЕНИЕ ЧАСТИЦ hGH
Частицы человеческого гормон роста (hGH) (необязательно содержащие ацетат цинка) получают следующим образом: раствор hGH (5 мг/мл) в воде (BresaGen Corporation, Adelaide, Australia) концентрируют до 10 мг/мл, используя прибор для концентрирования/диализа диалитического фильтрования. Отфильтрованный диалитически раствор hGH промывают 5-кратным объемом трис- или фосфатного буферного раствора (pH 7,6). Затем формируют частицы hGH путем распылительной сушки или лиофилизации, используя обычные методики. Фосфатный буферный раствор (5 или 50 ммоль), содержащий hGH (5 мг/мл) (и, необязательно, различные количества ацетата цинка (от 0 до 30 ммоль) в том случае, если приготовляются частицы комплекса с Zn), подвергают распылительной сушке, используя прибор для распылительной сушки Yamato Mini Spray, установленный в соответствии со следующими параметрами:
Лиофилизованные частицы получают из трис буферного раствора (5 или 50 ммоль: pH 7,6) содержащего hGH (5 мг/мл) используя лиофилизатор Durastop μP Lyophilizer в соответствии со следующими циклами замораживания и высушивания:
ПРИМЕР 3
ПОЛУЧЕНИЕ ЧАСТИЦ hGH-СТЕАРИНОВАЯ КИСЛОТА
Частицы человеческого гормона роста (hGH) получают в соответствии со следующим: Лиофилизованный hGH (3,22 г Pharmacia-Upjohn, Stockholm, Sweden) и стеариновую кислоту (3,22 г, 95% чистоты, Sigma-Aldrich Corporation, St.Louis, MO) смешивают и измельчают. Измельченное вещество прессуют в 13 мм круглой форме с усилием 10000 фунтов в течение 5 минут. Прессованные таблетки измельчают и просеивают через сито с сеткой 70 меш с последующим просеиванием через сито с решеткой 400 меш, чтобы получить частицы, имеющие размер частиц в диапазоне 38-212 мкм.
ПРИМЕР 4
ПОЛУЧЕНИЕ БУПИВАКАИНА ОСНОВАНИЯ
Бупивакаин гидрохлорид (Sigma-Aldrich Corporation, St.Louis, MO) растворяют в деионизированной (DI) воде с концентрацией 40 мг/мл (насыщение). К раствору добавляют рассчитанное количество гидроксида натрия (в виде 1 н. раствора) и pH образовавшейся смеси доводят до 10, чтобы осадить бупивакаин основание. Осажденный продукт фильтруют и затем промывают DI водой, по крайней мере, три раза. Осажденный продукт высушивают при 40°C в вакууме в течение 24 часов.
ПРИМЕР 5
ПОЛУЧЕНИЕ ЧАСТИЦ БУПИВАКАИНА
Частицы бупивакаина (как в форме основания, так и в форме гидрохлорида) получают следующим образом. Бупивакаин гидрохлорид (Sigma-Aldrich Corporation, St.Louis, MO) или бупивакаин основание, полученный в соответствии с примером 4, измельчают и затем просеивают до получения установленных фракций, используя 3” сита из нержавеющей стали. Стандартные фракции включают от 25 мкм до 38 мкм, от 38 мкм до 63 мкм и от 63 мкм до 125 мкм.
ПРИМЕР 6
ПОЛУЧЕНИЕ ЧАСТИЦ БУПИВАКАИН-СТЕАРИНОВАЯ КИСЛОТА
Частицы бупивакаина получают следующим образом. Гидрохлорид бупивакаина (100 г, Sigma-Aldrich Corporation, St.Louis, MO) измельчают и просеивают через 63-125 мкм сита. Частицы бупивакаина и стеариновой кислоты (100 г, 95% чистота, Sigma-Aldrich Corporation, St.Louis, MO) смешивают и измельчают. Измельченное вещество прессуют в 13 мм круглой форме с усилием 5000 фунтов в течение 5 минут. Прессованные таблетки измельчают и просеивают через сито с решеткой 120 меш с последующим просеиванием через сито с решеткой 230 меш для получения частиц, имеющих диапазон размеров между 63-125 микрон.
ПРИМЕР 7
ПОЛУЧЕНИЕ ЧАСТИЦ АЦЕТАТА ЛЕУПРОЛИДА
Ацетат леупролида (Mallinckrodt Inc., St.Louis, MI) измельчают и просеивают через сито между 63 и 125 мкм (для получения частиц со стандартным размером 90 мкм). Для ускорения просеивания можно применить просеиватель со встряхиванием GILSON digital Sieve Shaker (Gilson Company Inc., Worthington, OH).
ПРИМЕР 8
ПОЛУЧЕНИЕ ЧАСТИЦ АЦЕТАТ ЛЕУПРОЛИДА-СТЕАРИНОВАЯ КИСЛОТА
Стеариновую кислоту (95% чистота, Sigma-Aldrich Corporation, St.Louis, MO) пропускают через сито 120 меш (125 мкм). Эквивалентные количества измельченного ацетата леупролида (<63 мкм, полученного, как описано в примере 7 выше) и просеянной стеариновой кислоты помещают в смешиватель Waring и смешивают в течение 30 секунд. Смешанные вещества прессуют в 13-мм круглой форме, используя усилие сжатия 5000 фунтов и время выдержки 5 мин. Прессованные пластинки затем измельчают и просеивают через сито 120-меш (125 мкм) и прошедшее - через сито 230 меш (63 мкм).
ПРИМЕР 9
ПОЛУЧЕНИЕ ЧАСТИЦ БУПРЕНОРФИНА
Гидрохлорид бупренофина (100 г, Sigma-Aldrich Corporation, St.Louis, MO) измельчают и просеивают через предварительно выбранные сита, такие как 25, 38, 62 или 125 мкм сита, в зависимости от желаемого размера, который хотят получить у соответствующих частиц Бупренорфина.
ПРИМЕР 10
ПОЛУЧЕНИЕ ЧАСТИЦ БУПРЕНОРФИН-СТЕАРИНОВАЯ КИСЛОТА
Смешивают и измельчают равные количества частиц Бупренорфина (полученных, как описано в примере 9) и стеариновой кислоты (полученных, как описано в примере 3). Измельченные вещества прессуют в 13-мм круглой форме с усилием 5000 фунтов в течение 5 минут. Прессованные таблетки измельчают и просеивают через сито с решеткой 120 меш, с последующим просеиванием через сито 230 меш, чтобы получить частицы, имеющие диапазон размеров 63-125 мкм.
ПРИМЕР 11
ВНЕСЕНИЕ ЛЕКАРСТВЕННОГО СРЕДСТВА
Прессованные частицы, включающие лечебное средство со стеариновой кислотой или без нее, полученные, как описано выше, добавляют к гелевому носителю в количестве 5-30 мас.% и перемешивают вручную, пока сухой порошок полностью не увлажнится. Затем молочную светло-желтую смесь частиц с гелем тщательно перемешивают стандартным образом, используя механическую мешалку Caframo, с присоединенным квадратным металлическим шпателем на конце. Полученные композиции приведены ниже в таблицах 4-12. Готовые гомогенные гелевые композиции переносят в 3, 10 или 30-мл одноразовые шприцы для хранения или дозирования.
ПРИМЕР 12
РЕОЛОГИЧЕСКИЕ СВОЙСТВА КОМПОЗИЦИЙ ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ
В основном вязкость композиций наполнителя пролонгированного действия изучают, используя реометр Bohlin CVO 120 (Bohlin Instruments, Cranbury, NJ). Все измерения выполняют при 24°C, используя 20-мм параллельные пластины. Вязкость различных гелевых композиций или композиций леупролида ацетата по настоящему изобретению, приведенных в таблицах 6-12, определяют, как описано выше. Как показано на Фиг.1, 2 и 3, композиции пролонгированного действия (Композиции №№ 42-48, 51 и 52) имеют отличающиеся реологические свойства. Таким образом, композиции с широким диапазоном вязкостей могут быть получены с помощью сочетания различных полимеров (тип PLGA, молекулярная масса и т.д.), растворителей или со-растворителей, различных соотношений полимер/растворитель в соответствии с настоящим изобретением.
ПРИМЕР 13
УСИЛИЕ ИНЪЕЦИРОВАНИЯ КОМПОЗИЦИЙ ЛЕУПРОЛИДА АЦЕТАТА
Усилие при инъецировании гелевых носителей пролонгированных композиций измеряют с помощью прибора для измерения силы натяжения Instron tensile testing (Instron, Canton, MA), причем определяют максимальное усилие, требуемое для передвижения поршня шприца при скорости 1 мл/мин. Перед измерениями на приборе Instron предварительно наполняют шприцы Hamilton гелевыми носителями композиций. Все измерения выполняют при комнатной температуре, используя иглу 24 калибра длиной 0,5 дюйма.
Усилие при инъецировании различных гелевых композиций или композиций леупролида ацетата по настоящему изобретению, показанных в таблицах 6-12, измерялось, как описано выше. Как показано на Фиг.4 и 5, композиции пролонгированного действия (композиции 42-45 и 48-50) имеют отличающиеся усилия при инъецировании. Таким образом, композиции пролонгированного действия с отличающимися усилиями при инъецировании могут быть изготовлены с применением сочетания различных полимеров (тип PLGA, молекулярная масса и т.д.), растворителей или со-растворителей, различных соотношений полимер/растворитель в соответствии с настоящим изобретением.
ПРИМЕР 14
ПРОФИЛИ СКОРОСТИ ВЫСВОБОЖДЕНИЯ IN VITRO ИЗ ГЕЛЕВЫХ КОМПОЗИЦИЙ ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ
В соответствии с описанными выше методиками получают и исследуют in vitro (в пробирке) репрезентативное количество имплантируемых гелей, чтобы выявить высвобождение лечебного средства как функцию времени. В основном, высвобождение in vitro биологически активного средства из композиции по настоящему изобретению определяют следующим образом. Композицию пролонгированного действия (80-120 мг) загружают в пакетик для чая, помещают в 20-мл сцинтилляционный флакон и добавляют во флакон среду для высвобождения (5 мл фосфатного буферного солевого раствора (PBS) + 0,1% Tween 20, pH 7,4). Флакон инкубируют на водяной бане при 37°C со слабым перемешиванием. Среду заменяют ежедневно в течение первых 5 дней, затем дважды в неделю вплоть до конца периода высвобождения. Количество биологически активного средства, выделенного из композиции, измеряют различными способами в зависимости от природы биологически активного средства. Для белков, в основном, используют гель-хроматографию жидкостную хроматографию высокого давления (SEC HPLC), в то время как для соединений с небольшими молекулами, в основном, используют хроматографию высокого давления с обращенными фазами (rpHPLC) или ультрафиолетовые (UV) методики.
ПРИМЕР 15
ПРОФИЛИ СКОРОСТИ ВЫСВОБОЖДЕНИЯ IN VIVO ИЗ ГЕЛЕВЫХ КОМПОЗИЦИЙ ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ
В соответствии с описанными выше методиками получают репрезентативное количество имплантируемых гелей и исследуют in vivo (в организме) в крысах, чтобы определить высвобождение лечебного средства, которое определяется по концентрациям в сыворотке крови или в плазме, как функцию времени.
В основном, исследования in vivo в крысах выполняют, следуя открытой схеме, чтобы определить уровни содержания лечебного средства (например, hGH, бупивакаина, леупролида, бупренорфина) в плазме при системном введении лечебного средства через имплантированную систему по настоящему изобретению. Гелевую композицию пролонгированного действия, содержащую лечебное средство (приготовленную, как описано выше, в примерах), помещают в одноразовые шприцы 0,25 см3 или 0,5 см3 (например, шприцы Hamilton Gastight) или катетеры. К шприцам присоединяют одноразовые иглы (16 или 18 калибра) и затем нагревают до 37°C, используя циркуляционную баню. Гелевые композиции пролонгированного действия (которые представлены в таблицах 1-12) инъецируют крысам и отбирают кровь через определенные промежутки времени. Все образцы плазмы перед анализом хранят при температуре 4°C. Образцы анализируют на лечебное средство, используя один из следующих способов: радиоиммунный анализ (RIA) или согласованный способ LC/MS/MS (Ricerca, LLC, Painesville, Ohio).
ПРИМЕР 16
ИССЛЕДОВАНИЯ hGH IN VIVO
Репрезентативное количество имплантируемых гелей, которые показаны в таблицах 4-6, исследуют в крысах, чтобы определить профили скорости высвобождения в организме, как описано выше в примере 15. В частности, пролонгированные гелевые композиции hGH инъецируют в крыс из специализированных 0,5 см3 одноразовых шприцев с иглами 16 калибра и отбирают кровь через определенные интервалы времени. Профиль скорости высвобождения hGH из различных гелевых композиций пролонгированного действия определяют с помощью измерений концентрации hGH в сыворотке крови или в плазме в виде функции от времени, как это показано на фиг.6A-D (композиции 21, 22, 29-31 и 33-40). Образцы анализируют на содержание сохранившегося hGH, используя радиоиммунный анализ (RIA).
ПРИМЕР 17
ИССЛЕДОВАНИЯ БУПИВАКАИНА IN VIVO
Репрезентативное количество имплантируемых гелей, которые показаны в таблице 4, исследуют в крысах, чтобы определить профили скорости высвобождения в организме, как описано выше в примере 15. В частности, пролонгированные гелевые композиции бупивакаина инъецируют в крыс из специализированных 0,5 см3 одноразовых шприцев с одноразовыми иглами 18 калибра, отбирают кровь через определенные интервалы времени (1 час, 4 часа и далее в днях 1,2,5,7,9 и 14,21 и 28) и анализируют на бупивакаин, используя LC/MS. Фиг.7,8 и 9 показывают репрезентативные профили высвобождения in vivo бупивакаина гидрохлорида (композиции 17 и 18) и бупивакаина основания (композиции 19 и 20), полученные в крысах из различных пролонгированных композиций, включая композиции по настоящему изобретению. Профиль высвобождения in vivo из пролонгированных композиций, содержащих PLGA низкой молекулярной массы (композиции 18 и 20 на фиг.7,8 и 9), показывает, что время высвобождения уменьшается приблизительно на 7 дней по сравнению с контрольными композициями (с PLGA высокой молекулярной массы, композиции 17 и 19).
ПРИМЕР 18
ИССЛЕДОВАНИЯ БУПИВАКАИНА IN VIVO
Репрезентативное число имплантируемых гелей, которые приведены в таблице 13, тестируют в крысах, чтобы определить профили скоростей высвобождения в организме, как описано выше в примере 17. Фиг.10 и 11 показывают полученные в крысах репрезентативные профили высвобождения in vivo бупивакаина из различных композиций пролонгированного действия, включая композиции по настоящему изобретению. Как показывают графики, в случае, если вводятся одинаковые количества бупивакаина, продолжительность стабильного высвобождения in vivo бупивакаина прямо пропорциональна проценту содержания бупивакаина в пролонгированном гелевой композиции. В частности, при 10% содержании бупивакаин HCl количество выделяемого бупивакаина понижается со временем после исходного спада в течение первых двух недель. Если не ограничиваться специальными теориями, результаты показывают, что на ранних стадиях механизм диффузии может являться первичным механизмом, вносящим вклад в высвобождение лечебного средства, при этом на более поздних стадиях распад полимера может играть значительную роль в процессе высвобождения.
ПРИМЕР 19
ИССЛЕДОВАНИЯ ПРОЛОНГИРОВАННЫХ КОМПОЗИЦИЙ БУПИВАКАИНА IN VIVO С РАЗЛИЧНЫМ РАСПРЕДЕЛЕНИЕМ МОЛЕКУЛЯРНОЙ МАССЫ PLGA
Исследуют репрезентативное количество имплантируемых гелей, которые приведены в таблице 2, чтобы определить в крысах профили высвобождения в организме, как описано выше в примере 15. В частности, пролонгированные гелевые композиции, содержащие бупивакаин, инъецируют в крысу из специального одноразового шприца 0,5 см3, имеющего одноразовую иглу 18 калибра, отбирают кровь через определенные промежутки времени (1 час, 4 часа и в днях 1, 2, 5, 7, 9 и 14, 21 и 28) и анализируют на содержание бупивакаина, используя LC/MS. Фиг.12 показывает репрезентативные профили высвобождения in vivo бупивакаина из композиций 11 и 12, полученные в крысах (бупивакаиновые композиции составляют с применением PLGA с двумя различными распределениями по молекулярной массе в бензилбензоате: одномодальный, содержащий MMW PLGA RG502 и бимодальная смесь HMW PLGA RG503 с LMW PLGA, таблица 2, композиции 11 и 12).
ПРИМЕР 20
ПРОФИЛИ СКОРОСТИ ВЫСВОБОЖДЕНИЯ IN VIVO ИЗ РАЗЛИЧНЫХ ПРОЛОНГИРОВАННЫХ КОМПОЗИЦИЙ ЛЕУПРОЛИДА АЦЕТАТА
Репрезентативное количество имплантируемых гелей, показанных в таблицах 7-9, испытывают в крысах, чтобы определить профили высвобождения в организмах, как описано выше в примере 15. В частности, профили скорости высвобождения леупролида определяют, измеряя концентрации леупролида в сыворотке крови или плазме в качестве функции времени, как показано на фиг.13-16.
В частности, фиг.13 показывает репрезентативные профили высвобождения леупролида ацетата in vivo, полученные в крысах из композиций пролонгированного действия по настоящему изобретению, содержащих PLGA (L/G: 75/25) либо в бензилбензоате (BB) (композиция 42), либо в безиловом спирте (BA) (композиция 47), в сравнении с коммерчески доступной 3-месячной пролонгированной композицийой леупролида ацетата Lupron depot® (композиция 53). Фиг.14 показывает репрезентативные профили высвобождения леупролида ацетата in vivo, полученные в крысах из композиций пролонгированного действия по настоящему изобретению, содержащих PLGA (L/G: 75/25) в бензилбензоате, смеси бензилбензоата и бензилового спирта или бензилбензоата и этанола в качестве тиксотропного агента (композиции 42, 43 и 45 соответственно). Фиг.15 показывает репрезентативные профили высвобождения леупролида ацетата in vivo, полученные в крысах из композиций пролонгированного действия по настоящему изобретению, содержащих PLGA (L/G: 75/25) в бензилбензоате, с частицами лекарственного средства, сформированными либо со стеариновой кислотой, либо без нее (композиции 42 и 49). Фиг.16 показывает репрезентативные профили высвобождения леупролида ацетата in vivo, полученные в крысах из композиций пролонгированного действия по настоящему изобретению, содержащих поли(капролактон-со-молочная кислоту) (PCL-co-LA)(CL/L: 25/75) в бензилбензоате (композиция 46), по сравнению с коммерчески доступной 3-месячной пролонгированной композицийой леупролида ацетата Lupron depot® (композиция 53 - из TAP (передняя камера Lupron depot®3-month 11,25 мг предварительно заполненный двухкамерный шприц, содержащий леупролид ацетат (11,25 мг), полимолочную кислоту (99,3 мг) и D-маннит (19,45 мг). Вторая камера разбавителей содержит натриевую соль карбоксиметилцеллюлозы (7,5 мг), D-маннит (75,0 мг), полисорбат 80 (1,5 мг), воду для инъекции, USP и ледяную уксусную кислоту, USP, чтобы контролировать pH)).
Как показано на фиг.13-16, стабильное высвобождение леупролида ацетата из пролонгированных композиций по настоящему изобретению может быть достигнуто на протяжении от, приблизительно, 3 месяцев до, приблизительно 6 месяцев после введения. Профили высвобождения действующего вещества из пролонгированных композиций могут изменяться с помощью изменения типа полимера и растворителя, а также с помощью изменения соотношений полимер/растворитель.
ПРИМЕР 21
ПРОФИЛИ СКОРОСТИ ВЫСВОБОЖДЕНИЯ IN VIVO ИЗ РАЗЛИЧНЫХ ПРОЛОНГИРОВАННЫХ КОМПОЗИЦИЙ ЛЕУПРОЛИДА АЦЕТАТА
Репрезентативное количество имплантируемых гелей, которые приведены в таблице 10, испытывают в крысах, чтобы определить профили высвобождения в организмах, как описано выше в примере 15. В частности, профили скорости высвобождения леупролида определяют путем измерения концентрации леупролида в сыворотке крови или плазме в качестве функции времени, как показано на фиг.17.
В частности, фиг.17 показывает репрезентативные профили высвобождения леупролида ацетата in vivo, полученные в крысах из композиций пролонгированного действия по настоящему изобретению, содержащих P(DL)LA в бензилбензоате (BB) с различными соотношениями полимер/растворитель (композиции 51 и 52), в сравнении пролонгированной композицией 3-месячной длительности (композиция 42) и с коммерчески доступной 3-месячной пролонгированной композицией леупролида ацетата Lupron depot® (композиция 53).
Как показано на фиг.17, стабильное высвобождение леупролида ацетата из пролонгированных композиций по настоящему изобретению может быть достигнуто на протяжении периода, равного или большего 6 месяцев, путем использования биоразрушаемого полимера с более длинным периодом распада. Профили высвобождения действующего вещества из пролонгированных композиций могут изменяться с помощью изменения типа полимера и растворителя, а также с помощью изменения соотношений полимер/растворитель.
ПРИМЕР 22
ПРОФИЛИ СКОРОСТИ ВЫСВОБОЖДЕНИЯ IN VIVO ИЗ РАЗЛИЧНЫХ ПРОЛОНГИРОВАННЫХ КОМПОЗИЦИЙ БУПРЕНОРФИНА
Репрезентативное количество имплантируемых пролонгированных гелевых композиций бупренорфина по настоящему изобретению испытывают в крысах, чтобы определить профили высвобождения в организмах, как описано выше в примере 15. В частности, профили скорости высвобождения бупренорфина определяют путем измерения концентрации бупренорфина в сыворотке крови или плазме в качестве функции времени. Профили высвобождения действующего вещества из пролонгированных композиций могут изменяться путем изменения типа полимера и растворителя, а также путем изменения соотношений полимер/растворитель.
ПРИМЕР 23
СУПРЕССИЯ ТЕСТОСТЕРОНА IN VIVO ПОД ВОЗДЕЙСТВИЕМ ПРОЛОНГИРОВАННЫХ ГЕЛЕВЫХ КОМПОЗИЦИЙ ЛЕУПРОЛИДА
В основном, исследования в крысах in vivo выполняют, следуя открытой схеме, чтобы определить уровни содержания леупролида в плазме при системном введении леупролида через имплантированную систему по настоящему изобретению. Гелевую композицию леупролида пролонгированного действия (приготовленную, как описано выше в примерах) помещают в одноразовые шприцы 0,25 см3 Hamilton Gastight. К шприцам присоединяют одноразовые иглы 18 калибра и затем нагревают до 37°C, используя циркуляционную баню. Гелевые композиции леупролида ацетата пролонгированного действия инъецируют крысам и отбирают кровь через определенные промежутки времени. Все образцы плазмы перед анализом хранят при температуре 4°C. Образцы анализируют на леупролид, как описано в примере 15, и на тестостерон, используя коммерчески доступный RIA kit (DSL-4000) (Ricerca, LLC, Painesville, Ohio).
ПРИМЕР 24
ПРОФИЛИ СКОРОСТИ ВЫСВОБОЖДЕНИЯ IN VIVO И ЭФФЕКТИВНОСТЬ РАЗЛИЧНЫХ ПРОЛОНГИРОВАННЫХ ГЕЛЕВЫХ КОМПОЗИЦИЙ ЛЕУПРОЛИДА АЦЕТАТА
Репрезентативное количество имплантируемых гелей, которые приведены в таблице 11, испытывают в крысах, чтобы определить профили высвобождения в организмах, а также эффективность, которую измеряют супрессией тестостерона, как описано выше в примере 23. В частности, профили скорости высвобождения леупролида и эффективность, т.е. супрессию тестостерона, определяют путем измерения концентрации леупролида и тестостерона в сыворотке крови или плазме в качестве функции времени, как показано на фиг.19.
В частности, фиг.18 показывает репрезентативные профили стабильного высвобождения леупролида ацетата in vivo, полученные в крысах из композиций пролонгированного действия по настоящему изобретению, содержащих PLGA(L/G:75/25) как в бензилбензоате (BB), так и в безиловом спирте(BA) на протяжении 3 месяцев (композиции 54 и 55). Фиг.19 показывает профили высвобождения тестостерона под действием пролонгированных композиций леупролида ацетата (композиции 54 и 55) по сравнению с пролонгированной композицией плацебо без леупролида ацетата (композиции 56 и 57). Пролонгированные композиции, содержащие леупролид ацетат, демонстрируют устойчивые профили скорости высвобождения в течение продолжительного периода времени, на протяжении 3 или более месяцев, причем они эффективны в отношении супрессии уровня тестостерона в крысах до уровня их кастрации (<0,5 нг/мл) после 10-14 дней по сравнению с композициями плацебо (4-5 нг/мл).
ПРИМЕР 25
ПРОФИЛИ СКОРОСТИ ВЫСВОБОЖДЕНИЯ IN VIVO И ЭФФЕКТИВНОСТЬ РАЗЛИЧНЫХ ПРОЛОНГИРОВАННЫХ ГЕЛЕВЫХ КОМПОЗИЦИЙ ЛЕУПРОЛИДА АЦЕТАТА
Репрезентативное количество имплантируемых гелей, которые приведены в таблице 12, испытывают в крысах, чтобы определить профили высвобождения в организмах, а также эффективность, которую измеряют супрессией тестостерона, как описано выше в примере 23. В частности, профили скорости высвобождения леупролида и эффективность, т.е. супрессию тестостерона определяют, путем измерения концентрации леупролида и тестостерона в сыворотке крови или плазме в качестве функции времени, как показано на фиг.20.
В частности, фиг.20 показывает репрезентативные профили устойчивого высвобождения леупролида ацетата in vivo, полученные в крысах из композиций пролонгированного действия по настоящему изобретению, содержащих P(DL)LA или в бензилбензоате (BB), или в бензиловом спирте (BA), на протяжении 6 месяцев (композиции 58 и 59). Фиг.21 показывает профили высвобождения тестостерона под действием пролонгированных композиций леупролида ацетата (композиции 58 и 59) в сравнении с пролонгированной композицией плацебо без леупролида ацетата (композиции 60 и 61). Пролонгированные композиции, содержащие леупролид ацетат, демонстрируют устойчивые профили скорости высвобождения в течение продолжительного периода времени, на протяжении 6 или более месяцев, причем они эффективны в отношении супрессии уровня тестостерона в крысах до уровня их кастрации (<0,5 нг/мл) после 10-14 дней по сравнению с композициями плацебо (4-5 нг/мл).
Описанные выше отдельные воплощения скорее предназначены быть иллюстративными, чем ограничивающими в отношении настоящего изобретения. Следовательно, настоящее изобретение допускает многочисленные изменения в деталях реализации, которые могут быть выведены из содержащегося здесь описания специалистами в данной области техники. Все эти изменения и модификации рассматриваются как находящиеся в рамках настоящего изобретения и соответствующие его смыслу.
Реферат
Описаны способы и композиции для системного или локального введения лечебного средства пациенту, причем они включают, например, гелевые композиции пролонгированного действия, которые могут быть инъецированы в желаемое местоположение и которые могут обеспечить контролируемое высвобождение лечебного средства на протяжении продолжительного периода времени. Композиции включают биосовместимый полимер, биосовместимый растворитель, имеющий низкую растворимость в воде, который образует вязкий гель с полимером и ограничивает поглощение воды имплантатом, а также лечебное средство. 6 н. и 36 з.п. ф-лы, 17 табл., 21 ил.
Формула
(а) композицию вязкого геля, включающую:
(1) биоразрушаемый, биосовместимый полимер, который представляет собой смесь полимеров, содержащую от приблизительно 20 до приблизительно 90 мас.% полимера со средней молекулярной массой от приблизительно 3000 до приблизительно 10000, определенной при помощи гельпроникающей хроматографии; от приблизительно 5 до приблизительно 40 мас.% полимера со средней молекулярной массой от приблизительно 30000 до приблизительно 250000, определенной при помощи гельпроникающей хроматографии; от приблизительно 20 до приблизительно 90 мас.% полимера со средней молекулярной массой от приблизительно 10000 до приблизительно 30000, определенной при помощи гельпроникающей хроматографии; и
(2) растворитель, имеющий растворимость в воде, меньшую или равную 7 мас.% при 25°С, в количестве, достаточном для того, чтобы пластифицировать полимер и вследствие этого образовать гель, где растворитель выбран из ароматического спирта; С1-С6 алкиловых и аралкиловых эфиров арилсодержащих кислот; кетонов, содержащих арил, аралкил и С1-С6 алкил; а также С1-С6 алкиловых эфиров лимонной кислоты; и
(b) лечебное средство, растворенное или диспергированное в геле; где, вышеупомянутый период времени составляет от приблизительно двух недель до приблизительно двенадцати месяцев после введения.
(a) композицию вязкого геля, включающую:
(1) биоразрушаемый, биосовместимый полимер, который представляет собой смесь полимеров, содержащую от приблизительно 20 до приблизительно 90 мас.% полимера со средней молекулярной массой от приблизительно 3000 до приблизительно 10000, определенной при помощи гельпроникающей хроматографии; от приблизительно 5 до приблизительно 40 мас.% полимера со средней молекулярной массой от приблизительно 30000 до приблизительно 250000, определенной при помощи гельпроникающей хроматографии; от приблизительно 20 до приблизительно 90 мас.% полимера со средней молекулярной массой от приблизительно 10000 до приблизительно 30000, определенной при помощи гельпроникающей хроматографии; и
(2) растворитель, имеющий растворимость в воде меньшую или равную 7 мас.% при 25°С, в количестве, достаточном для того, чтобы пластифицировать полимер и вследствие этого образовать гель, где растворитель выбран из ароматического спирта; С1-С6 алкиловых и аралкиловых эфиров арилсодержащих кислот; кетонов, содержащих арил, аралкил и С1-С6 алкил; а также С1-С6 алкиловых эфиров лимонной кислоты; и
(b) лечебное средство, растворенное или диспергированное в геле; где лечебное средство доставляется системно, контролируемым образом в течение определенного периода времени, который составляет от приблизительно двух недель до приблизительно двенадцати месяцев после введения.
(a) композицию вязкого геля, включающую:
(1) биоразрушаемый, биосовместимый полимер, который представляет собой смесь полимеров, содержащую приблизительно 20 до приблизительно 90 мас.% полимера со средней молекулярной массой от приблизительно 3000 до приблизительно 10000, определенной при помощи гельпроникающей хроматографии; от приблизительно 5 до приблизительно 40 мас.% полимера со средней молекулярной массой от приблизительно 30000 до приблизительно 250000, определенной при помощи гельпроникающей хроматографии; от приблизительно 20 до приблизительно 90 мас.% полимера со средней молекулярной массой от приблизительно 10000 до приблизительно 30000, определенной при помощи гельпроникающей хроматографии; и
(2) растворитель, имеющий растворимость в воде меньшую или равную 7 мас.% при 25°С, в количестве, достаточном для того, чтобы пластифицировать полимер и вследствие этого образовать гель, где растворитель выбран из ароматического спирта; С1-С6 алкиловых и аралкиловых эфиров арилсодержащих кислот; кетонов, содержащих арил, аралкил и С1-С6 алкил; а также С1-С6 алкиловых эфиров лимонной кислоты; и
(b) лечебное средство, растворенное или диспергированное в геле; где лечебное средство доставляется локально, контролируемым образом в течение определенного периода времени, который составляет от приблизительно двух недель до приблизительно двенадцати месяцев после введения.
(i) введение пациенту:
(a) композиции вязкого геля, включающей:
(1) биоразрушаемый, биосовместимый полимер, который представляет собой смесь полимеров, содержащую приблизительно 20 до приблизительно 90 мас.% полимера со средней молекулярной массой от приблизительно 3000 до приблизительно 10000, определенной при помощи гельпроникающей хроматографии; от приблизительно 5 до приблизительно 40 мас.% полимера со средней молекулярной массой от приблизительно 30000 до приблизительно 250000, определенной при помощи гельпроникающей хроматографии; от приблизительно 20 до приблизительно 90 мас.% полимера со средней молекулярной массой от приблизительно 10000 до приблизительно 30000, определенной при помощи гельпроникающей хроматографии; и
(2) растворитель, имеющий растворимость в воде меньшую или равную 7 мас.% при 25°С, в количестве, достаточном для того, чтобы пластифицировать полимер и вследствие этого образовать гель, где растворитель выбран из ароматического спирта; С1-С6 алкиловых и аралкиловых эфиров арилсодержащих кислот; кетонов, содержащих арил, аралкил и С1-С6 алкил; а также С1-С6 алкиловых эфиров лимонной кислоты; и
(b) лечебного средства, растворенного или диспергированного в геле; и
(ii) доставку лечебного средства в организм пациента в течение определенного периода времени от приблизительно двух недель до приблизительно двенадцати месяцев после введения.
(a) биоразрушаемый, биосовместимый полимер, который представляет собой смесь полимеров, содержащую приблизительно 20 до приблизительно 90 мас.% полимера со средней молекулярной массой от приблизительно 3000 до приблизительно 10000, определенной при помощи гельпроникающей хроматографии; от приблизительно 5 до приблизительно 40 мас.% полимера со средней молекулярной массой от приблизительно 30000 до приблизительно 250000, определенной при помощи гельпроникающей хроматографии; от приблизительно 20 до приблизительно 90 мас.% полимера со средней молекулярной массой от приблизительно 10000 до приблизительно 30000, определенной при помощи гельпроникающей хроматографии;
(b) растворитель, имеющий растворимость в воде меньшую или равную 7 мас.% при 25°С, в количестве, достаточном для того, чтобы пластифицировать полимер и вследствие этого образовать гель, где растворитель выбран из ароматического спирта; С1-С6 алкиловых и аралкиловых эфиров арилсодержащих кислот; кетонов, содержащих арил, аралкил и С1-С6 алкил; а также С1-С6 алкиловых эфиров лимонной кислоты;
(c) лечебное средство, растворенное или диспергированное в геле; и необязательно одно или более средств из числа следующих:
(d) эмульгирующее средство;
(e) порообразующее средство;
(f) регулятор растворимости лечебного средства, необязательно связанный с лечебным средством; и
(g) осмотическое средство;
где, по крайней мере, лечебное средство, необязательно связанное с регулятором растворимости, сохраняется отдельно от растворителя вплоть до времени введения лечебного средства пациенту.
(i) введение пациенту:
(а) композиции вязкого геля, включающей:
(1) смесь биоразрушаемых, биосовместимых полимеров, которая представляет собой смесь полимеров, содержащую приблизительно 20 до приблизительно 90 мас.% полимера со средней молекулярной массой от приблизительно 3000 до приблизительно 10000, определенной при помощи гельпроникающей хроматографии; от приблизительно 5 до приблизительно 40 мас.% полимера со средней молекулярной массой от приблизительно 30000 до приблизительно 250000, определенной при помощи гельпроникающей хроматографии; от приблизительно 20 до приблизительно 90 мас.% полимера со средней молекулярной массой от приблизительно 10000 до приблизительно 30000, определенной при помощи гельпроникающей хроматографии; и
(2) растворитель, имеющий растворимость в воде меньшую или равную 7 мас.% при 25°С, в количестве, достаточном для того, чтобы пластифицировать полимер и вследствие этого образовать гель, где растворитель выбран из ароматического спирта; С1-С6 алкиловых и аралкиловых эфиров арилсодержащих кислот; кетонов, содержащих арил, аралкил и С1-С6 алкил; а также С1-С6 алкиловых эфиров лимонной кислоты; и
(b) лечебного средства, растворенного или диспергированного в геле; и
(ii) доставку лечебного средства в организм пациента в течение определенного периода времени от приблизительно двух недель до приблизительно двенадцати месяцев после введения.

Комментарии