Композиция с контролируемым высвобождением - RU2336865C2
Код документа: RU2336865C2
Чертежи




Описание
Изобретение относится к применению полиметакрилатных материалов, особенно тех из них, у которых растворение зависит от рН, и других покрывающих материалов, растворение которых зависит от рН, для контроля высвобождения активного соединения в кишечнике. Настоящее изобретение относится также к применению преднизолона метасульфобензоата (11,17-дигидрокси-21-[(3-сульфобензоил)окси]прегна-1,4-диен-3-20-диона) и фармакологически приемлемых солей, особенно натриевой соли, при лечении воспалительного заболевания кишечника и, особенно, болезни Крона.
В частности, изобретение раскрывает твердую фармацевтическую композицию, имеющую два или более множеств содержащих активное соединение частиц, покрытых полиметакрилатным материалом желаемой толщины, или другим покрывающим материалом, растворение которого зависит от рН, для контроля профиля высвобождения активного соединения, такого как преднизолона метасульфобензоат. Оно раскрывает также применение покрытия определенной толщины из полиметакрилатного материала или другого покрывающего материала, растворение которого зависит от рН, для контроля профиля высвобождения активного соединения в кишечном тракте.
Если из контекста не ясно, что используется свободный сложный эфир, то термин «преднизолона метасульфобензоат» используется в настоящем описании для обозначения фармакологически приемлемых солей преднизолона метасульфобензоата, а также свободного сложного эфира.
Возможность контроля высвобождения активного соединения в желудочно-кишечном тракте является желательной. Некоторые состояния требуют локального лечения кишечника, и, если лекарственные средства, использующиеся для указанной цели, всасываются системно, могут наблюдаться проблематичные побочные эффекты. В других ситуациях кислотные условия в желудке могут разрушать некоторые активные соединения, особенно пептиды и белки, и было бы выгодным обеспечение носителя для их доставки в участки кишечника, из которых они могут всасываться системно или в которых они могут обеспечить свое терапевтическое воздействие. Также может быть выгодным в случае некоторых активных соединений, особенно пептидов и белков, введение в конкретные участки кишечника для системного всасывания, которое может осуществляться в две или более различных областей. Примерами являются соединения, системное всасывание которых зависит от расположения М-клеток или пейеровых бляшек.
В других ситуациях желательным является лишь введение активного соединения пациенту непрерывно в течение определенного периода времени с целью поддержания желаемой концентрации активного соединения в плазме крови, и композиция с контролируемым высвобождением для перорального введения обеспечивает удобный и эффективный способ достижения указанной цели.
Некоторые способы контролирования высвобождения активного соединения известны. Например, обеспечение энтеросолюбильного покрытия на таблетке или капсуле с целью обеспечения ее прохождения через желудок до разрушения в тонком кишечнике хорошо известно. Также известно введение пациенту активного соединения в матриксе с замедленным высвобождением. Другой известный способ заключается в изготовлении производного активного соединения, например, производного глюкуроновой кислоты, которое не будет расщепляться до тех пор, пока не вступит в контакт с соответствующим кишечным ферментом, например, глюкуронидазой, высвобождая таким образом активное соединение.
Особо предусматривается обеспечение композиции с контролируемым высвобождением активных соединений при заболеваниях кишечника, особенно тех из них, для которых будет благоприятным локальное воздействие, и подходящим примером является воспалительное заболевание кишечника (IBD).
Воспалительное заболевание кишечника включает хронические неспецифические воспалительные состояния желудочно-кишечного тракта, двумя главными формами которых являются болезнь Крона и неспецифический язвенный колит.
Болезнь Крона может поражать любую часть желудочно-кишечного тракта, хотя часто она поражает тонкий кишечник, особенно, подвздошную кишку, и может также поражать тощую кишку и любую часть ободочной кишки, включая прямую кишку и, особенно, слепую кишку. Она характеризуется утолщенными участками стенок желудочно-кишечного тракта, с воспалением, распространяющимся на все слои, глубоким изъязвлением и трещинами слизистой оболочки. Пораженные области часто чередуются с участками относительно нормальной ткани.
Для лечения случаев болезни Крона, поражающей ободочную кишку, используется сульфасалазин, поскольку содержит 5-аминосалициловую кислоту в энтеросолюбильной оболочке или в форме с замедленным высвобождением. Стероиды широко используются для лечения тяжелых случаев воспаления толстой кишки, особенно неспецифического язвенного колита и болезни Крона. Обычно их вводят перорально или парентерально для получения системного эффекта, или ректально с помощью клизмы, для получения местного эффекта. Относительно высокие дозы стероидов требуются для лечения тяжелых случаев воспалительного заболевания кишечника. Однако системное всасывание вызывает серьезные побочные эффекты, и хотя системное всасывание меньше при ректальном введении, клизмы лечат только нижние отделы толстой кишки и прямую кишку, а их применение создает неудобства.
Стероидом, наиболее часто применяющимся при пероральном лечении воспалительного заболевания кишечника, является преднизолон (17,21-дигидроксипрегна-1,4-диен-3,11,20-трион) в форме свободного спирта или его сложного эфира, обычно ацетата. Суточные дозы от 15 до 60 мг (рассчитанные как свободный спирт) требуются для лечения тяжелых случаев воспалительного заболевания кишечника, но всасывание в указанных дозах является вредным. Соответственно, существующее лечение преднизолоном ограничено как по дозе, так и по продолжительности терапии.
Было предложено несколько способов и композиций для нацеливания или контроля за высвобождением активного соединения в кишечнике, часто для лечения воспалительного заболевания кишечника и болезни Крона.
US-A-4496553 относится к пероральной фармацевтической композиции, включающей 5-аминосалициловую кислоту (5-ASA), для лечения язвенного колита или болезни Крона. Патент описывает таблетку с замедленным высвобождением, состоящую из гранул 5-ASA, покрытых этилцеллюлозой и спрессованных с гранулами микрокристаллической целлюлозы, тальком и стеаратом натрия. Испытания на пациентах с илеостомией показали, что 50% активного ингредиента из таблеток высвобождается в тонком кишечнике. В патенте утверждается (колонка 6, строки 15-22), что высвобождение можно контролировать варьированием одного или более размеров частиц гранулированного активного ингредиента, толщиной и проницаемостью покрытия, самого активного ингредиента и условий рН внутри частицы с покрытием.
ЕР-В-0097651 описывает композицию для селективного введения 5-аминосалициловой кислоты в толстый кишечник, включающую твердую дозированную форму для перорального введения, содержащую активное соединение, с покрытием в виде слоя толщиной от 60 до 150 микрометров из анионного полимера, который является нерастворимым в желудочном соке и в кишечном соке при рН ниже 7, но растворяется в содержимом толстого кишечника, таким образом, что дозированная форма остается интактной, пока не достигнет толстой кишки.
ЕР-В-0572486 описывает фармацевтическую дозированную форму для перорального введения, которая включает множество гранул лекарственного средства, такого как 5-аминосалициловая кислота, покрытых материалом, который растворяется в кишечнике и содержится в капсуле, которая также покрыта материалом, который растворяется в кишечнике. Композиция предназначена для селективного введения лекарственного средства в кишечник. Утверждается, что гранулы предпочтительно содержатся в капсуле с энтеросолюбильным покрытием, которая высвобождает гранулы в тонком кишечнике, и что гранулы имеют такое покрытие, которое остается по существу интактным до тех пор, пока они не достигнут по крайней мере подвздошной кишки, и, предпочтительно, после чего обеспечивают замедленное высвобождение лекарственного средства в толстой кишке.
ЕР-А-0772443 описывает недезинтегрируемую твердую энтеросолюбильную фармацевтическую композицию, включающую преднизолона метасульфобензоат, относительно быстро растворяющийся при рН 6,5 из матрикса-эксципиента, и дозированные формы, содержащие гранулы данной композиции. Быстрое растворение повышается при наличии реологического модифицирующего супердезинтегранта в количестве по крайней мере 5 мас.%, но недостаточного для того, чтобы вызвать дезинтеграцию композиции. Утверждается, что композиция может включать множество таких гранул, которые могут иметь энтеросолюбильное покрытие, такое как ацетофталат целлюлозы, или, предпочтительно, частично метилэтерифицированные полимеры метакриловой кислоты, имеющие соотношение свободных кислотных групп и сложноэфирных групп приблизительно 1:2, содержащихся в капсуле с энтеросолюбильным покрытием из подходящего покрывающего материала. Покрывающий материал на гранулах предпочтительно представляет собой такой материал, который не растворяется в желудочных соках и кишечном соке при рН ниже 7, но растворяется в кишечном соке более дистальных отделов кишечника. Энтеросолюбильный покрывающий материал капсулы выбран таким образом, чтобы защищать капсулу во время прохождения через желудок. Композиция предназначена для лечения болезни Крона.
ЕР-В-0502032 описывает композицию для высвобождения активного соединения в конкретной области - в толстой кишке, для лечения заболеваний толстой кишки, таких как неспецифический язвенный колит и болезнь Крона. Среди прочих, активным ингредиентом может являться, например, преднизолон или 5-аминосалициловая кислота. Композиция включает активное соединение и аморфную амилозу, с наружным покрытием из целлюлозы или акрилового полимерного материала. Активное соединение предпочтительно покрыто стекловидной амилозой, которая имеет тенденцию не деградироваться до тех пор, пока не достигнет толстого кишечника, где ее атакуют расщепляющие амилозу ферменты, обеспечиваемые микробной флорой, имеющейся в норме в толстом кишечнике. Композиция дополнительно покрыта целлюлозой или акриловым полимерным материалом, который усиливает свойство отсроченного высвобождения композиции, покрытой амилозой. Скорость высвобождения активного соединения из композиции после достижения ею толстой кишки можно контролировать варьированием толщины внутреннего покрытия из амилозы. Утверждается, что возможным также является варьировать высвобождение в толстой кишке нанесением покрытия из амилозы разной толщины на разные частицы активного соединения. Характеристики высвобождения можно варьировать дополнительно сушкой, которая влияет на размер пор и проницаемость, или добавлением жирного или воскоподобного вещества для замедления проникновения воды. Предпочтительно, чтобы наружный покрывающий материал из целлюлозы или акрилового полимера проявлял рН независимую деградацию.
WO-A-9921536 относится к композиции с контролируемым высвобождением, подходящей для доставки активного ингредиента в толстый кишечник. Описывается композиция, которая включает шарики 5-аминосалициловой кислоты, содержащие также микрокристаллическую целлюлозу и имеющие диаметры в пределах от 1,00 до 1,40 мм; указанные шарики покрывают композицией амилозы/этилцеллюлозы в смешанном растворителе (вода и смешиваемый с водой органический растворитель), хотя вместо этилцеллюлозы может быть акриловый полимер. Профили высвобождения изучали для ряда соотношений амилоза/этилцеллюлоза и толщины покрытия. Было установлено, что покрытия с высокой долей этилцеллюлозы обеспечивали очень незначительное высвобождение лекарственного средства, благодаря отсутствию сквозных каналов в амилозе через поверхность покрытия к ядру гранулы, в то время как покрытие с высокой долей амилозы создавало пленки, структура которых была сбалансирована. Соответственно, когда в покрытиях имелись более высокие концентрации амилозы, применяли более толстое покрытие, и результаты показали, что в указанных обстоятельствах высвобождение активного соединения не должно иметь место ранее достижения толстой кишки.
ЕР-А-0264989 описывает фармацевтические композиции производных реина с замедленным высвобождением. В частности, описываются композиции, предназначенные для обеспечения уровней лекарственного средства в крови в течение периода времени до 24 часов от момента введения. Как можно видеть из примера 2 указанной ссылки, описана общая концепция покрытия частиц материалом различной толщины (в примере - ацетофталатом целлюлозы) с целью высвобождения лекарственного соединения с различными скоростями, таким образом, чтобы обеспечить замедленное высвобождение в течение заранее определенного периода времени.
US-A-5529790 описывает фармацевтические композиции, которые обеспечивают отсроченное и замедленное высвобождение лекарственного средства из композиции посредством гидратируемого диффузионного барьерного покрытия. Задержка является следствием скорости гидратации и толщины покрытия, а замедленное высвобождение зависит от проницаемости и толщины покрытия. Диффузионный барьер предпочтительно состоит из пленкообразующего материала, который не растворяется в условиях кишечника, и по крайней мере одной дополнительной добавки, которая контролирует скорость гидратации и проницаемость диффузионного барьера. Предпочтительными пленкообразующими полимерами являются водные дисперсии полностью этерифицированных акриловых смол (например, Eudragit NE30D), полностью этерифицированных акриловых смол, содержащих боковые цепи из четвертичных аминов (например, Eudragit RS30D), или водные дисперсии этилцеллюлозы. Предпочтительной добавкой для контроля скорости гидратации и проницаемости является стеарат магния. Лекарственное средство (например, дилтиазема гидрохлорид) может быть изготовлено в форме сферических микрочастиц, имеющих диаметр в пределах 500-1500 мкм, и предпочтительно изготавливается в виде двух групп частиц, группы с длинной задержкой высвобождения, имеющей низкую скорость гидратации и низкую проницаемость, и группы с короткой задержкой высвобождения, имеющей относительно высокую скорость гидратации и высокую проницаемость, таким образом, что на замедленное высвобождение лекарственного средства можно влиять в течение длительного периода времени. Были выполнены исследования растворения на частицах, имеющих различную толщину покрытия.
US-A-4728512 описывает фармацевтическую композицию, включающую три группы высвобождающих лекарственное средство гранул, помещенных, например, в капсулу, из которых каждая группа гранул высвобождает лекарственное средство в разное время в пищеварительной системе пациента. В частности, описывается композиция, в которой одна группа гранул не имеет покрытия и высвобождает лекарственное средство немедленно после высвобождения гранул из капсулы, вторая группа гранул, которая имеет рН-зависимое покрытие (например, 20-30 мас.% Eudragit S), и третья группа гранул, которая имеет рН-независимое покрытие, такое как система двойного покрытия, в котором зависимый от времени нижний слой (например, гидроксипропилметилцеллюлоза) дополнительно покрыт гидратируемым диффузионным барьерным покрытием (например, Eudragit E30D и стеарат металла). Композиция, таким образом, состоит из трех высвобождающих лекарственное средство систем, которые обеспечивают максимумы высвобождения лекарственного средства в течение периодов времени 0-2 часа после введения, 2-6 часов после введения и 4-10 часов после введения, соответственно. Композиция обеспечивает три дозы лекарственного средства в течение периода времени, например, 12 часов, путем высвобождения лекарственного средства в три приема в количестве, соответствующем относительному количеству каждой группы частиц. Группы частиц покрыты покрывающими материалами различной толщины, и, таким образом, документ описывает общую концепцию применения различных групп частиц с различными свойствами высвобождения для высвобождения активного соединения в различных участках кишечного тракта (посредством различной задержки в высвобождении лекарственного средства из второй и третьей группы гранул).
До сих пор не существует эффективного способа или композиции для контролируемого высвобождения активных соединений в кишечнике, которое преодолевает или отвечает на изменения рН и скорости прохождения, которые наблюдаются на протяжении кишечного тракта.
Желательным был бы улучшенный способ и композиция для контролируемого высвобождения активного соединения, такого как преднизолона метасульфобензоат, в кишечнике.
Авторы в настоящее время установили, что нанесение полиметакрилатного материала различной толщины, растворение которого зависит от величины рН, на частицы преднизолона метасульфобензоата, неожиданно привело к высвобождению преднизолона метасульфобензоата с различными скоростями при одной и той же величине рН и контролируемым образом в рамках диапазона величины рН. Толщину применяемого полиметакрилатного покрытия можно выбирать в зависимости от рН и желаемой скорости и места высвобождения, для обеспечения профиля контролируемого высвобождения преднизолона метасульфобензоата. Покрывающие материалы, растворение которых зависит от величины рН, такие как полиметакрилаты, обычно применяют для обеспечения высвобождения активного соединения в одном месте кишечного тракта. Насколько известно авторам, использование различной толщины покрытия покрывающих материалов, растворение которых зависит от величины рН, не практикуется для обеспечения непрерывного или замедленного высвобождения.
Соответственно, в первом аспекте настоящее изобретение относится к фармацевтической композиции для перорального введения, включающей два или более множеств частиц; указанные частицы включают преднизолона метасульфобензоат, где частицы каждого указанного множества покрыты полиметакрилатным материалом разной толщины по сравнению с частицами данного множества или каждого другого множества, посредством чего преднизолона метасульфобензоат высвобождается в различных участках кишечного тракта.
Авторы также установили, что применение данной технологии можно распространить на композиции, включающие другие активные соединения.
Соответственно, также в первом аспекте настоящее изобретение относится к фармацевтической композиции для перорального введения, включающей два или более множеств частиц; указанные частицы включают активное соединение, в которой частицы каждого указанного множества покрыты полиметакрилатным материалом разной толщины по сравнению с частицами данного множества или каждого другого множества, растворение которого зависит от величины рН, посредством чего активное соединение высвобождается в различных участках кишечного тракта.
Не желая ограничиваться какой бы то ни было конкретной теорией, авторы полагают, что вид высвобождения активного соединения из композиций может происходить благодаря скорее измененной проницаемости покрытия, чем разрушению покрытия различной толщины. Наблюдения показывают, что активное соединение, как представляется, выделяется из композиции до того, как происходит деградация композиции.
Следующие признаки могут быть применены к варианту осуществления в первом аспекте настоящего изобретения, в котором используется преднизолона метасульфобензоат, или к более общему варианту осуществления настоящего изобретения.
Покрывающий материал может представлять собой любой материал, который используется или является подходящим в покрытии пероральных фармацевтических дозированных форм для доставки активного соединения в кишечник, и, предпочтительно, представляет собой производное целлюлозы, растворение которого зависит от величины рН, такое как ацетофталат целлюлозы и ацетофталат гидроксипропилметилцеллюлозы, или полиметакрилатный материал, растворение которого, предпочтительно, зависит от величины рН.
Производное целлюлозы предпочтительно выбирают из ацетофталата целлюлозы, гидроксипропилметилцеллюлозы, фталата гидроксипропилметилцеллюлозы, ацетофталата гидроксипропилметилцеллюлозы и других моно- или полисложноэфирных и/или эфирных производных целлюлозы, растворение которых зависит от величины рН.
Под покрывающим материалом, растворение которого зависит от величины рН, подразумеваются такие материалы, которые, согласно имеющемуся уровню техники, являются нерастворимыми в желудочных средах до тех пор, пока не достигается определенная величина рН, и такие материалы, которые обеспечивают зависимое от величины рН высвобождение лекарственного средства, когда их используют в качестве покрывающего материала для фармацевтических дозированных форм для перорального введения.
Полиметакрилаты, которые являются особенно подходящими для целей настоящего изобретения, представляют собой анионные полимеры диметиламиноэтилметакрилатов, метакриловой кислоты и сложных эфиров метакриловой кислоты в различных соотношениях.
Полиметакрилаты могут представлять собой сополимеры акриловых кислот (таких как метакриловая кислота) и сложных эфиров акриловой кислоты (такие как метилэтакрилат или этилэтакрилат). Предпочтительно, полиметакрилаты, используемые для целей настоящего изобретения, представляют собой сополимеры метакриловой кислоты, которые основаны на метакриловой кислоте и различных сложных эфирах акриловой кислоты (таких как этилакрилат или метилметакрилат), или их смеси. Более предпочтительно, используется один или более сополимеров метакриловой кислоты и метилметакрилата, предпочтительно, имеющих соотношение свободных карбоксильных групп и сложноэфирных групп, например, около 1:2 (продается под зарегистрированным товарным знаком EUDRAGIT S компанией Röhm Pharma GmbH, Darmstadt, Германия), и имеющих молекулярную массу 135000, или около 1:1 (продается компанией Röhm Pharma GmbH под зарегистрированным товарным знаком EUDRAGIT L) или их смеси.
Предпочтительно, в настоящем изобретении используют такие полиметакрилаты, растворение которых зависит от величины рН. Под полиметакрилатами, растворение которых зависит от величины рН, подразумеваются такие полиметакрилаты, которые, согласно имеющемуся уровню техники, являются нерастворимыми в желудочных средах до тех пор, пока не достигается определенная величина рН, и такие полиметакрилаты, которые обеспечивают зависимое от величины рН высвобождение лекарственного средства, когда их используют в качестве покрывающего материала, например, см. The Handbook of Pharmaceutical Excipients, 3-е изд., издано Arthur H. Kibbe (American Pharmaceutical Society and Pharmaceutical Press, 2000). Предпочтительно, полиметакрилатный материал включает полиметакрилат, который является нерастворимым в желудочной среде до тех пор, пока не достигается определенная величина рН, и/или обеспечивает зависимое от величины рН высвобождение лекарственного средства, когда его используют в качестве покрывающего материала, согласно The Handbook of Pharmaceutical Excipients, содержание которой на страницах 401-406 включено в настоящее описание в качестве ссылки.
Указанные полиметакрилаты включают сополимеры метакриловой кислоты и метилметакрилата, имеющие соотношение свободных карбоксильных групп и сложноэфирных групп около 1:2 (продается как EUDRAGIT S компанией Röhm Pharma GmbH), или около 1:1 (продается как EUDRAGIT L компанией Röhm Pharma GmbH), и сополимер метакриловой кислоты и этилакрилата, имеющий соотношение свободных карбоксильных групп и сложноэфирных групп около 1:1 (продается под зарегистрированным товарным знаком EUDRAGIT L 30 D-55 или EUDRAGIT L 100-55 компанией Röhm Pharma GmbH). Более предпочтительно, полиметакрилат представляет собой полиметакрилат, который является растворимым при рН выше 5,5 и, еще более предпочтительно, выше 6.
Предпочтительно, материал, покрывающий частицы каждого множества частиц, является тем же, что покрывает частицы данного множества или каждого другого множества частиц.
В одном варианте осуществления настоящего изобретения частицы каждого из множеств можно покрывать покрывающим материалом, приращение толщины которого выбрано так, чтобы обеспечить однородный профиль высвобождения активного соединения на протяжении по крайней мере одной выбранной части кишечного тракта или на протяжении всего кишечного тракта. Выбранная часть может располагаться вокруг, но предпочтительно, до и после илеоцекального клапана.
Предпочтительно, толщину покрывающего материала и величину ее приращения выбирают таким образом, чтобы обеспечить высвобождение активного соединения во многих участках, так что высвобождение является однородным на протяжении всего кишечника. Может быть желательным, например, при введении активного соединения для лечения болезни Крона, обеспечить однородное высвобождение активного соединения на протяжении подвздошной кишки и толстой кишки и, более конкретно, восходящей ободочной кишки.
В данном варианте осуществления настоящее изобретение может обеспечивать однородное высвобождение активного соединения, что имеет преимущества по сравнению с обычными препаратами с замедленным высвобождением в том, что величины приращения толщины покрывающего материала, особенно, полиметакрилатного материала, можно выбирать таким образом, чтобы преодолеть изменения рН и различающиеся скорости прохождения или транзита капсулы или таблетки через кишечник.
В случае обычных препаратов с замедленным высвобождением изменения скорости прохождения через кишечный тракт может приводить к доставке активного соединения в определенные части кишечника в более низкой концентрации, чем в других частях. Подобно этому, изменения рН в различных частях кишечника имеет тенденцию приводить к различным скоростям высвобождения из обычных препаратов с замедленным высвобождением. Это может приводить к потере эффекта.
У пациентов с воспалительным заболеванием кишечника, особенно, с активным воспалением, скорость прохождения через кишечник и рН внутри кишечника зачастую не соответствуют норме. Обычные композиции с замедленным высвобождением, которые обеспечивают высвобождение активного агента в зависимости от времени или рН, могут не обеспечивать предсказуемой или эффективной доставки активного агента к целевым участкам кишечника. Такие композиции могут приводить к доставке недостаточной дозы в некоторых участках или к доставке чрезмерной дозы, «демпинг дозы», в других участках.
В настоящем варианте осуществления настоящего изобретения указанные изменения можно учитывать, например, покрывая частицы каждого множества частиц покрывающим материалом выбранной толщины, чтобы обеспечить высвобождение во многих участках по всему кишечнику; причем величины приращения толщины покрытия для каждого множества могут варьироваться. Например, для того, чтобы получить однородное высвобождение в тех частях кишечника, в которых скорость прохождения выше, и в тех частях, в которых скорость прохождения ниже, величины приращения толщины покрытия множеств частиц, доставляемых в часть кишечника с более высокой скоростью прохождения, будут меньше, чем у частиц, доставляемых в часть кишечника с более низкой скоростью прохождения, и/или количество частиц в множестве частиц, доставляемых в часть кишечника с более высокой скоростью прохождения, будет больше. Подобно этому, для того, чтобы обеспечить однородное высвобождение в частях кишечника с более высокой величиной рН и с более низкой величиной рН, более толстое покрытие следует наносить на частицы, которые предназначены для высвобождения активного соединения в части кишечника, в которой величина рН более высокая, хотя это будет зависеть от места ее расположения в кишечнике. Таким способом скорость высвобождения активного соединения можно контролировать относительно изменений рН или скорости прохождения через кишечник, независимо только от конкретной достигнутой величины рН или конкретного времени, которое прошло до высвобождения активного соединения.
Альтернативно, толщину покрытия для каждого из множеств можно выбирать таким образом, чтобы влиять на высвобождение активного соединения в конкретных участках кишечника. Например, каждое из множеств частиц можно покрывать покрывающим материалом разной толщины, благодаря чему активное соединение высвобождается, например, в местах вокруг, но предпочтительно, до и после, илеоцекального клапана.
Предпочтительно, имеется два множества частиц; одно множество, в котором частицы покрыты покрывающим материалом такой толщины, чтобы высвобождать активное соединение в дистальной части подвздошной кишки до илеоцекального клапана, и другое множество, в котором частицы покрыты покрывающим материалом другой толщины, чтобы высвобождать активное соединение в проксимальной части слепой кишки, после илеоцекального клапана. Предпочтительно, покрывающим материалом является полиметакрилатный материал, более предпочтительно, сополимер метакриловой кислоты, и, еще более предпочтительно, сополимер метакриловой кислоты и метилметакрилата, предпочтительно, имеющий соотношение свободных карбоксильных групп и сложноэфирных групп приблизительно 1:2.
Покрытие на частицах может иметь толщину, соответствующую теоретической прибавке массы на покрытие 15% для одного из множеств, и 20% прибавки массы - для другого, и, предпочтительно, количество частиц в каждом множестве имеет соотношение покрытых частиц с 15% прибавкой массы и покрытых частиц с 20% прибавкой массы 1:3.
Для того чтобы дополнительно контролировать профиль высвобождения активного соединения на протяжении кишечника, частицы из одного множества частиц можно покрывать другим покрывающим материалом относительно частиц другого множества частиц. Частицы одного множества могут также иметь размер, который отличается от размера для другого множества.
Настоящее изобретение можно использовать, например, для введения активных соединений, которые оказывают местное терапевтическое воздействие в кишечнике, для введения активных соединений с высокой молекулярной массой для местного или системного воздействия и для введения любого активного соединения, для которого имеет преимущества контролируемое высвобождение на протяжении кишечного тракта, например, активных соединений, у которых системное всасывание зависит от места и скорости высвобождения в кишечнике.
Особенно оно пригодно для доставки активных соединений для местного воздействия на один или более участков кишечного тракта. Например, при лечении воспалительного заболевания кишечника и, в частности, болезни Крона, когда пораженные области могут иметь различное месторасположение в кишечном тракте, и контролируемая доставка активного соединения в указанные области без введения в непораженные области сводит к минимуму системное всасывание активного соединения и, следовательно, любой побочный эффект, который может происходить вследствие системного всасывания.
В случае введения высокомолекулярных соединений, например, белков или пептидов, настоящее изобретение можно использовать для защиты активного соединения от деградации в кислых условиях желудка, и оно может, например, обеспечивать доставку соединения в такие области кишечника, из которых оно может всасываться, или в которых располагаются нужные М-клетки или пейеровы бляшки.
Настоящее изобретение особенно пригодно для доставки высокомолекулярных соединений, для которых целостность третичной структуры является критической для эффективности и безопасности соединения. Особенным преимуществом настоящего изобретения является то, что фармацевтическую композицию для перорального введения можно изготавливать в щадящих условиях по сравнению с большинством фармацевтических процессов, в то же время обеспечивая желаемый профиль высвобождения соединения в кишечном тракте.
Примером высокомолекулярного соединения, которое будет приносить пользу при применении в композиции по настоящему изобретению, является эритропоэтин, гликозилированный белковый гормон и гематопоэтический фактор роста, который считается пригодным при лечении анемии при хронической почечной недостаточности среди других состояний, и изучен при лечении анемии при воспалительном заболевании кишечника, а также других нормоцитарных/нормохромных анемий. Эритропоэтин обычно вводят подкожно или внутривенно, хотя описана таблетированная форма эритропоэтина (RU-A-2152206).
Другие классы высокомолекулярных соединений, которые могут приносить пользу при использовании настоящего изобретения, включают интерфероны, антагонисты TNF и специфические белковые и полипептидные агонисты и антагонисты иммунной системы, гормоны, такие как человеческий гормон роста, и цитокины и антагонисты цитокинов.
Другие соединения и классы соединений, введение которых может приносить пользу при использовании настоящего изобретения, включают анальгетики и жаропонижающие; антибактериальные и антипротозойные агенты, такие как метронидазол и другие нитроимидазольные антибиотики, и антибиотики, активные против анаэробных бактерий; кларитромицин и другие макролидные антибиотики; гентамицин, ципрофлоксацин, рифабутин и другие подобные антибиотики, активные против патогенных микроорганизмов, обычно связанных с или вызывающих заболевания кишечника; противовоспалительные агенты, такие как салицилаты, например, 5-аминосалициловая кислота, 4-аминосалициловая кислота и производные, такие как балсалазид, стероиды, особенно преднизолона метасульфобензоат; пробиотики и пребиотики, которые, как было показано, влияют на симптомы воспалительного заболевания кишечника и синдрома раздраженной толстой кишки и на выздоровление от связанной с антибиотиками диареи, и фармакологически активные лекарственные вещества, о которых известно, что они влияют на симптомы синдрома раздраженной толстой кишки, например, те из них, которые воздействуют на серотонинергическую систему, и те из них, которые являются активными в области опиатных рецепторов. α-амилазу и парацетамол также можно вводить с помощью композиции по настоящему изобретению.
Другие соединения, которые могут приносить пользу при использовании настоящего изобретения, включают определенные соединения, обладающие токсическим действием, которое ограничивает их клиническое применение, особенно, вызывающие локальную токсичность в конкретных областях желудочно-кишечного тракта. Указанные соединения включают, среди прочих, примеры антибиотиков, бисфосфонатов и противовоспалительных лекарственных средств. Конкретным примером является метформин, который многие пациенты не переносят из-за неблагоприятного действия на желудочно-кишечный тракт. Настоящее изобретение можно использовать для минимизации концентрации соединения на конкретных участках токсичности и, таким образом, позволить ввести эффективную терапевтическую дозу при уменьшении неблагоприятного действия.
Предпочтительными соединениями для использования в настоящем изобретении являются преднизолона метасульфобензоат, 5-аминосалициловая кислота, метронидазол, кларитромицин, метформин и эритропоэтин.
В предпочтительном варианте осуществления настоящего изобретения композиция дополнительно включает капсулу, предпочтительно, капсулу с энтеросолюбильным покрытием, в которой содержатся множества частиц. Капсула обычно будет представлять собой мягкую или, предпочтительно, твердую желатиновую капсулу, хотя можно использовать другие капсулы, которые будут растворяться в тонком кишечнике. Энтеросолюбильное покрытие будет защищать капсулу во время ее прохождения через желудок. Можно использовать любой подходящий материал для энтеросолюбильного покрытия, который растворяется в тонком кишечнике. Например, можно использовать ацетофталат целлюлозы, ацетофталат гидроксипропилметилцеллюлозы или сначала этилцеллюлозу, а затем полифинилацетофталат, но предпочтительно использовать анионный полимер, имеющий подходящий профиль растворения. В настоящее время предпочтительными полимерами являются анионные карбоксильные полимеры, т.е. полимеры, в которых анионные группы представляют собой по крайней мере преимущественно свободные карбоксильные и/или этерифицированные карбоксильные группы. Особенно предпочтительно, чтобы полимеры представляли собой акриловые полимеры, и предпочтительными в настоящее время полимерами являются сополимеры метакриловой кислоты и метилметакрилата, в которых соотношение свободных кислотных групп и сложноэфирных групп составляет около 1:1 (т.е. Eudragit L).
Альтернативно, частицы можно прессовать в таблетку, на которую можно наносить энтеросолюбильное покрытие.
Покрытие капсулы (или другой дозированной формы) может и, обычно, будет содержать пластификатор и, возможно, другие добавки для покрытия, такие как красящие агенты, агенты, придающие глянец, тальк и/или стеарат магния, которые хорошо известны специалистам в данной области. В частности, анионные карбоксильные акриловые полимерные покрытия обычно содержат от 10 до 25 мас.% пластификатора, особенно диэтилфталата.
Во втором аспекте настоящее изобретение относится к применению покрытия определенной толщины из покрывающего материала, растворение которого зависит от величины рН, на частицах, содержащих активное соединение, для контроля профиля высвобождения активного соединения в кишечном тракте. Под покрывающим материалом, растворение которого зависит от величины рН, подразумеваются покрывающие материалы, растворение которых зависит от величины рН. Например, полиметакрилатный материал, который является нерастворимым при рН 2, но по существу растворимым при рН выше 5,5, представляет собой полиметакрилатный материал, растворение которого зависит от величины рН.
В третьем аспекте настоящее изобретение относится к применению покрывающего материала, выбранного из
А. полиметакрилатного материала и
В. покрывающего материала, растворение которого зависит от величины рН,
для изготовления лекарственного средства, описанного выше, для лечения заболеваний кишечного тракта. В типичном случае, лекарственное средство будет применяться при лечении болезни Крона.
В четвертом аспекте настоящее изобретение относится к способу лечения заболевания кишечного тракта у пациента; указанный способ включает введение пациенту эффективного количества активного соединения для лечения указанного заболевания в составе по крайней мере двух множеств частиц, покрытых, каждое, покрывающим материалом различной толщины, выбранным из
А. полиметакрилатного материала и
В. покрывающего материала, растворение которого зависит от величины рН,
для высвобождения активного соединения в тех местах кишечного тракта, в которых проявляются симптомы заболевания, и/или в которых располагается рецепторный субстрат для активного соединения.
Заболевание может представлять собой любое заболевание кишечного тракта, и активное соединение может представлять собой любое соединение, эффективное при лечении указанного заболевания, но, предпочтительно, заболевание представляет собой любое заболевание, упомянутое выше, и, предпочтительно также, активное соединение представляет собой любое из активных соединений, упомянутых выше для лечения соответствующего заболевания. Наиболее предпочтительно, заболевание представляет собой воспалительное заболевание кишечника, особенно болезнь Крона или анемию, связанную с заболеванием раздраженной кишки, и, еще более предпочтительно, активное соединение представляет собой преднизолона метасульфобензоат, 5-аминосалициловую кислоту, метронидазол, кларитромицин, метформин или эритропоэтин.
Антибиотики, эффективные при лечении воспалительного заболевания кишечника или инфекционных заболеваний кишечника, часто являются токсичными, когда всасываются, и настоящее изобретение можно использовать для их введения в место их действия в кишечнике, достигая достаточных локальных концентраций при минимизации системного всасывания. Особенно настоящее изобретение применимо к токсичным антибиотикам, таким как гентамицин, особенно у пациентов, предрасположенных к токсическим эффектам указанных лекарственных средств, таких как пациенты с нарушением функции почек. Пациенты с хроническими заболеваниями кишечника, например, болезнью Крона и воспалением карманов, которые требуют непрерывного введения определенных антибиотиков, например, метронидазола, в течение длительных периодов времени, по всей вероятности, особенно выиграют от использования настоящего изобретения.
Другие возможные активные агенты включают цитотоксические агенты, такие как циклофосфамид, цисплатин и другие лекарственные средства на основе платины, и винкристин и другие алкалоиды барвинка; иммуномодуляторы, такие как метотрексат, азатиаприн и циклоспорин; и антипаразитарные агенты, такие как албеназол.
Частицы, используемые в настоящем изобретении, обычно представляют собой шарики или гранулы.
Частицы по настоящему изобретению могут представлять собой гранулы, имеющие диаметр в пределах от 500 до 2500 мкм, предпочтительно, от 800 до 1700 мкм, более предпочтительно, от 800 до 1500 мкм, и, еще более предпочтительно, 1000-1500 мкм. Однако, следует понимать, что частицы могут иметь диаметр в упомянутых выше пределах или вне этих пределов, и что единичная дозированная форма по настоящему изобретению может содержать частицы одного или более диаметров или пределов диаметров.
Следует понимать, что истинная толщина покрытия для любой конкретной прибавки массы на покрытие зависит от размера и массы частиц.
Предпочтительно, толщина покрытия по настоящему изобретению находится в пределах от 5% до 30%, более предпочтительно, от 10% до 25%, и, наиболее предпочтительно, приблизительно 15% и приблизительно 20%.
Дозированные формы в соответствии с настоящим изобретением могут содержать частицы, которые содержат различные активные соединения. Например, одно множество частиц может содержать первое активное соединение, а другое множество частиц может содержать второе, отличное от первого, активное соединение. На частицы могут быть нанесены покрытия для обеспечения различных профилей высвобождения для каждого из активных соединений, содержащихся в дозированной форме. Покрытие для каждого из множеств частиц обычно будет представлять собой полиметакрилатные материалы такого состава и толщины, которые обеспечивают желаемый профиль высвобождения для каждого из активных соединений. Альтернативно, одно множество частиц может быть покрыто покрывающим материалом, отличным от покрывающего материала другого множества, для того, чтобы использовать преимущества отличающейся характеристики высвобождения покрывающего материала, не являющегося полиметакрилатом.
Множества частиц в любой подобной дозированной форме обычно будут вводиться в капсуле с энтеросолюбильным покрытием.
Настоящее изобретение далее иллюстрируется следующими неограничивающими примерами со ссылкой на прилагающиеся фигуры.
Фиг. 1 представляет собой график зависимости процента высвобождения (% высвобождения) преднизолона метасульфобензоата из гранул, покрытых сополимером метакриловой кислоты и метилметакрилата, имеющим соотношение свободных карбоксильных групп и сложноэфирных групп 1:2, до теоретической прибавки массы 5%, 15% и 25%, от времени;
Фиг. 2 представляет собой график зависимости процента высвобождения (% высвобождения) преднизолона метасульфобензоата из гранул, покрытых сополимером метакриловой кислоты и метилметакрилата, имеющим соотношение свободных карбоксильных групп и сложноэфирных групп 1:2, до теоретической прибавки массы 15%, от времени, при рН 6,0, 6,2, 6,6 и 7,2;
Фиг. 3 представляет собой график зависимости процента высвобождения (% высвобождения) преднизолона метасульфобензоата из гранул, покрытых сополимером метакриловой кислоты и метилметакрилата, имеющим соотношение свободных карбоксильных групп и сложноэфирных групп 1:2, до теоретической прибавки массы 15% и размера частиц до 1500 мкм и до 2000 мкм, и из гранул, покрытых смешанным полиметакрилатным покрытием из 5% сополимера метакриловой кислоты и этилакрилата с соотношением свободных карбоксильных групп и сложноэфирных групп 1:1 и 95% сополимера метакриловой кислоты и метилметакрилата, имеющего соотношение свободных карбоксильных групп и сложноэфирных групп 1:2, до теоретической прибавки массы 15%, от времени;
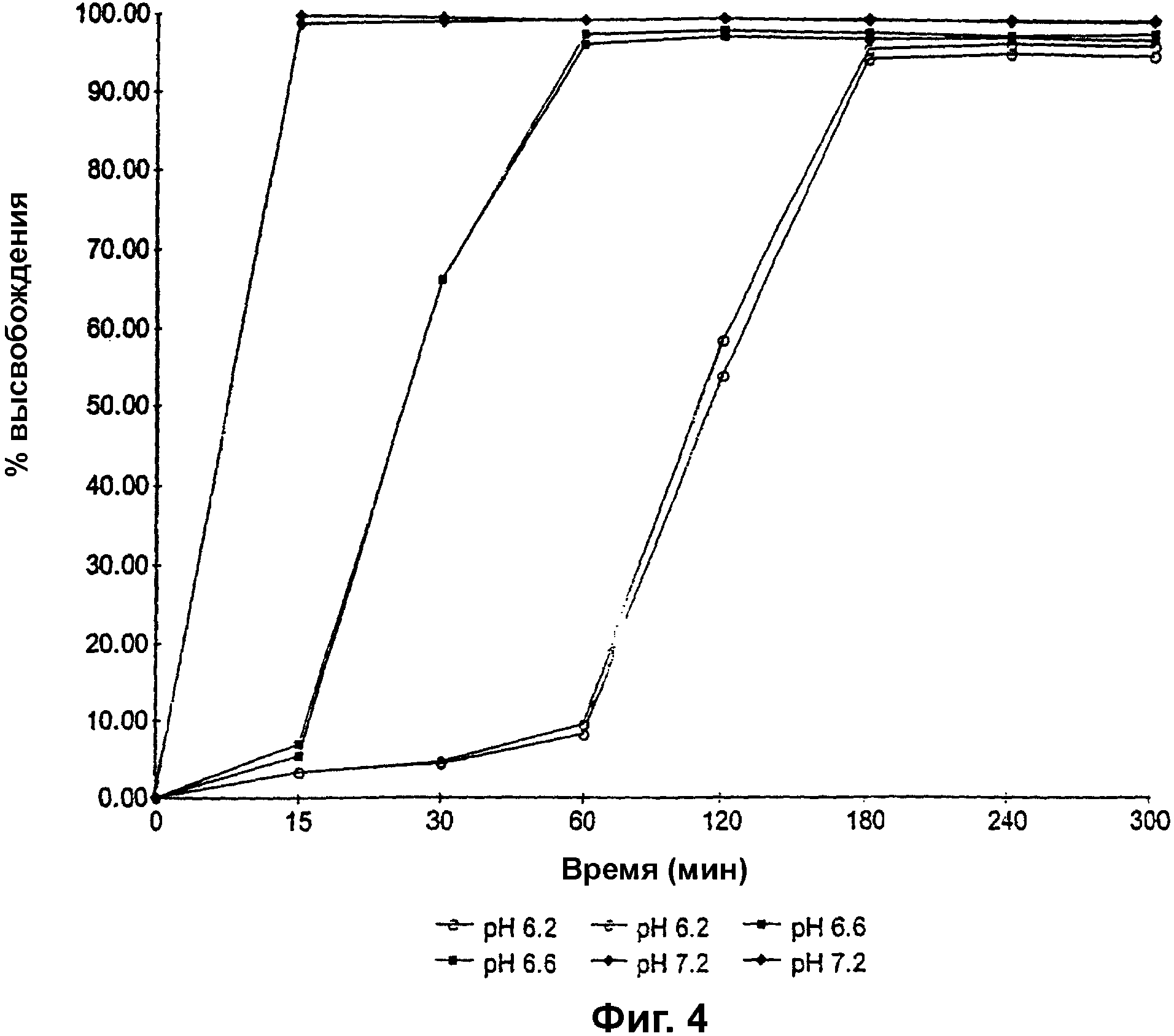
Фиг. 4 представляет собой график зависимости процента высвобождения (% высвобождения) парацетамола из гранул, покрытых сополимером метакриловой кислоты и метилметакрилата, имеющим соотношение свободных карбоксильных групп и сложноэфирных групп 1:2, до теоретической прибавки массы 20%, от времени, при рН 6,2, 6,6 и 7,2;
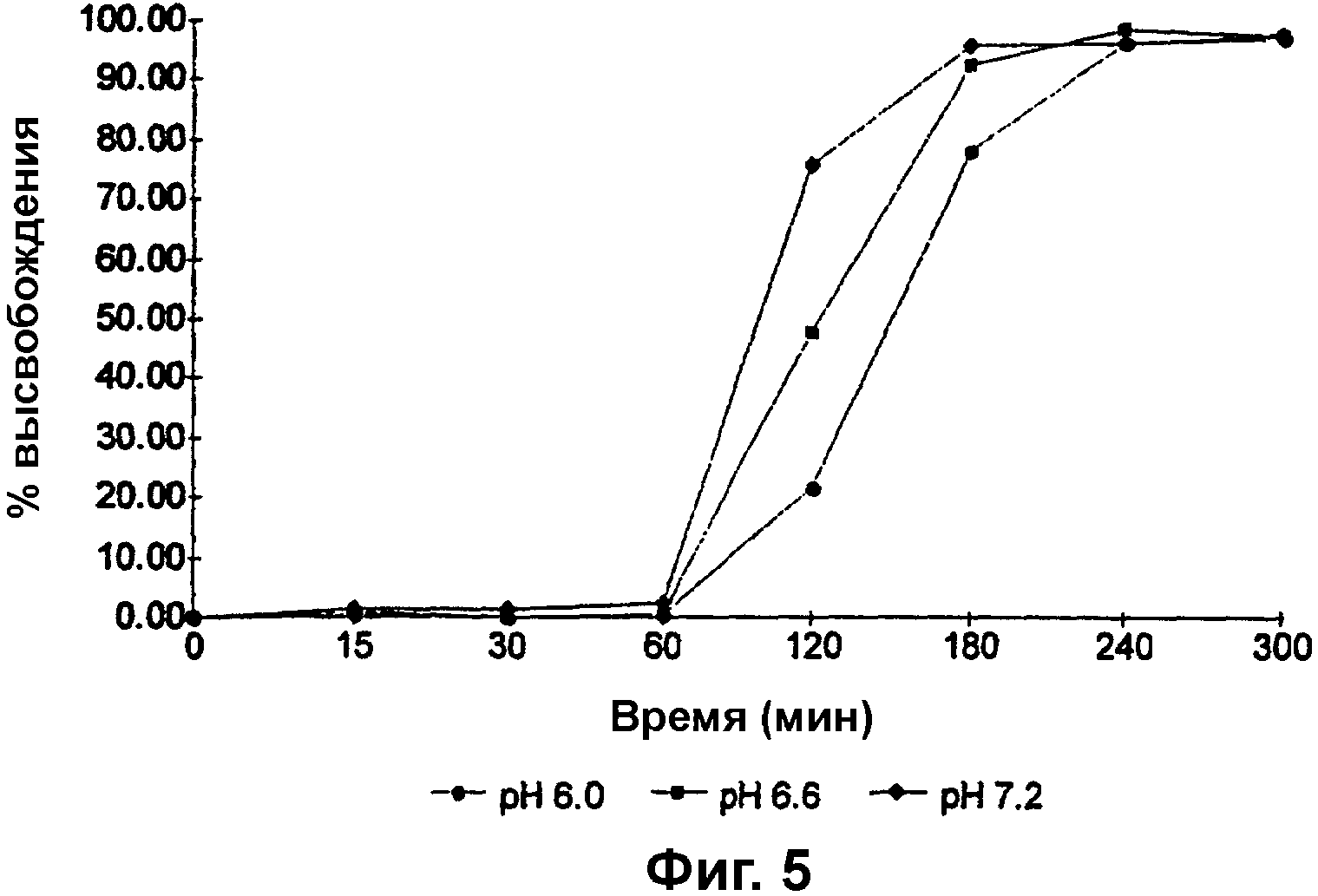
Фиг. 5 представляет собой график зависимости процента высвобождения (% высвобождения) метронидазола из гранул, покрытых сополимером метакриловой кислоты и метилметакрилата, имеющим соотношение свободных карбоксильных групп и сложноэфирных групп 1:2, до теоретической прибавки массы 20%, от времени, при рН 6,0, 6,6 и 7,2;
Фиг. 6 представляет собой график зависимости процента высвобождения (% высвобождения) метронидазола из гранул, покрытых сополимером метакриловой кислоты и метилметакрилата, имеющим соотношение свободных карбоксильных групп и сложноэфирных групп 1:2, до теоретической прибавки массы 15%, 20% и 25%, от времени, при рН 6,6; и
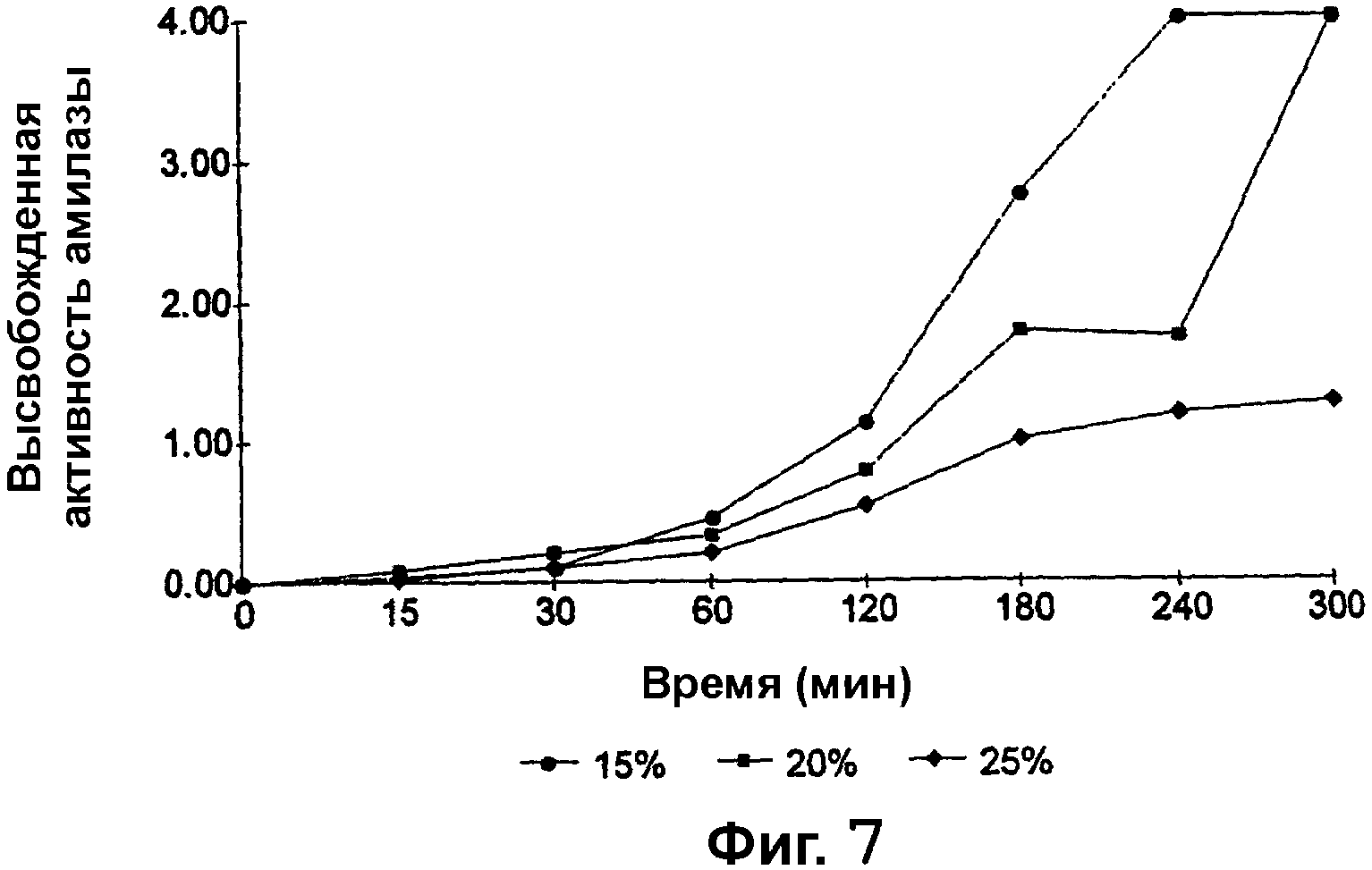
Фиг. 7 представляет собой график, изображающий, каким образом активность амилазы, высвобожденной из гранул α-амилазы, покрытых сополимером метакриловой кислоты и метилметакрилата, имеющим соотношение свободных карбоксильных групп и сложноэфирных групп 1:2, до теоретической прибавки массы 15%, 20% и 25%, изменяется в зависимости от времени при рН 6,0.
Пример 1
Гранулы преднизолона метасульфобензоата изготавливали путем получения сухой смеси 5 мас.% преднизолона натрий-метасульфобензоата, 40 мас.% микрокристаллической целлюлозы (AvicelTM PH 101), 35 мас.% моногидрата лактозы (D80 200 Mesh) и 30 мас.% натрий-кроскармеллозы (Ac-Di-SolTM). Добавляли очищенную воду (185 мас.%) и полученную смесь перемешивали в течение 10 минут для формирования пригодной для экструзии пасты, которую затем экструдировали из резервуара диаметром 25 мм через трубку диаметром 1 мм и длиной приблизительно 5 мм, со скоростью приблизительно 100 мм/мин, с помощью экструдера Niro Fielder Type E140, и сферонизировали (придавали форму сферы) на Nica Systems Spheroniser S700 на 20 см пластине, вращающийся со скоростью приблизительно 33 об/мин. Гранулы затем сушили в грануляторе с псевдоожиженным слоем и просеивали, чтобы гарантировать размер частиц в пределах от 800 до 1500 мкм.
На гранулы затем наносили покрытие распылением сополимера метакриловой кислоты и метилметакрилата, имеющего соотношение свободных карбоксильных групп и сложноэфирных групп 1:2, с получением трех партий, имеющих теоретическую прибавку массы на покрытие (прибавку массы) 5%, 15% и 25%.
Изучали скорость высвобождения преднизолона метасульфобензоата из гранул, имеющих покрытие различной толщины, при различных величинах рН.
Пример 2
Влияние на скорость высвобождения преднизолона метасульфобензоата из гранул, имеющих покрытие до 5%, 15% и 25% прибавки массы, изготовленных, как описано в примере 1, изучали на аппарате для растворения путем перемешивания гранул в среде трехосновного фосфата натрия при рН 6 и отбора образцов с интервалами 15 минут для измерения посредством ВЭЖХ количества преднизолона метасульфобензоата в растворе. Результаты представлены на фиг. 1.
Как можно видеть из фиг. 1, увеличение толщины покрытия значимо уменьшает скорость высвобождения лекарственного средства. Гранулы с покрытием до 5% прибавки массы обеспечивают полное (100%) высвобождение лекарственного средства в течение 15 минут. Однако, гранулы с покрытием до 15% прибавки массы обеспечивали 50% высвобождение лекарственного средства через приблизительно 45 минут и 100% высвобождение лекарственного средства - через приблизительно 100 минут, а гранулы с покрытием до 25% прибавки массы обеспечивали 50% высвобождение лекарственного средства через 120 минут и 100% высвобождение лекарственного средства - через приблизительно 300 минут.
Особенно удивительно то, что частицы, покрытые одним и тем же покрывающим материалом, растворение которого зависит от величины рН, но с разной толщиной, обеспечивают высвобождение лекарственного средства с по существу различными скоростями при одной и той же величине рН.
Пример 3
Изучали влияние рН на скорость высвобождения лекарственного средства из покрытых гранул, имеющих покрытие до 15% прибавки массы, изготовленных, как описано в примере 1. Гранулы изучали на предмет высвобождения лекарственного средства, как описано в примере 2, только с использованием рН 6,0, 6,2, 6,6 и 7,2. Фиг. 2 показывает рН-зависимый характер высвобождения лекарственного средства из покрытых гранул, имеющих покрытие до 15% прибавки массы.
Как можно видеть из фиг. 2, при рН 6 полное высвобождение лекарственного средства наблюдается через приблизительно 120 минут, а 50% высвобождение лекарственного средства - через приблизительно 45 минут. При более высоких значениях рН скорость высвобождения лекарственного средства возрастает до рН 7,2, полное высвобождение лекарственного средства наблюдается через приблизительно 30 минут.
Пример 4
Для того чтобы изучить влияние точного состава покрытия на высвобождение лекарственного средства, две партии гранул преднизолона метасульфобензоата, имеющих 15% прибавки массы за счет одного из двух выбранных полиметакрилатных покрывающих материалов, изготавливали способом, описанным в примере 1. На гранулы первой партии наносили смешанное полиметакрилатное покрытие, состоящее из 5% сополимера метакриловой кислоты и этилакрилата с соотношением свободных карбоксильных групп и сложноэфирных групп 1:1 и 95% сополимера метакриловой кислоты и метилметакрилата, имеющего соотношение свободных карбоксильных групп и сложноэфирных групп 1:2, до прибавки массы 15%. Гранулы второй партии покрывали сополимером метакриловой кислоты и метилметакрилата, имеющим соотношение свободных карбоксильных групп и сложноэфирных групп 1:2, до прибавки массы 15%.
Изучали влияние состава покрытия на высвобождение лекарственного средства из двух партий гранул, как описано в примере 2. Результаты проиллюстрированы на фиг. 3.
Как можно видеть из фиг. 3, партия 1, гранулы в которой были покрыты смесью полиметакрилатов - одного, который растворяется при рН 6,0, и другого, который растворяется при рН 5,5, - высвобождали лекарственное средство с более высокой скоростью, чем партия 2, гранулы которой были покрыты полиметакрилатом, который растворяется при рН от 6,0 до 7,0.
Пример 5
Для того чтобы изучить влияние размера гранул на высвобождение лекарственного средства, гранулы преднизолона метасульфобензоата изготавливали в двух партиях, с использованием способа примера 1; первая партия имела диаметр гранул до 2000 мкм, а вторая - до 1500 мкм, и обе имели покрытие из сополимера метакриловой кислоты и метилметакрилата, имеющего соотношение свободных карбоксильных групп и сложноэфирных групп 1:2, до прибавки массы 15%. Гранулы изучали на предмет высвобождения лекарственного средства, как описано в примере 4. Результаты также показаны на фиг. 3.
Как показывает фиг. 3, увеличение размеров гранул приводило к уменьшению скорости высвобождения лекарственного средства. Возможно, что это происходит потому, что гранула большего размера, имеющая конкретный процент прибавки массы за счет покрытия, имеет более толстое покрытие, чем гранула меньшего размера с тем же процентом прибавки массы за счет покрытия, поскольку соотношение площади поверхности и массы ниже у гранулы большего размера.
Пример 6
Гранулы, содержащие парацетамол вместо преднизолона метасульфобензоата, изготавливали способом, описанным в примере 1, и наносили на них покрытие из сополимера метакриловой кислоты и метилметакрилата, имеющего соотношение свободных карбоксильных групп и сложноэфирных групп 1:2, до прибавки массы 20%, и изучали на предмет высвобождения лекарственного средства, как описано в примере 3, только при рН 6,2, 6,6 и 7,2. Результаты показаны на фиг. 4.
Как можно видеть из фиг. 4, скорость высвобождения лекарственного средства оказалась рН-зависимой; при рН 6,2 50% лекарственного средства высвобождается через 120 минут, а полное высвобождение лекарственного средства наблюдается через приблизительно 300 минут, в то время как при рН 7,2 полное высвобождение лекарственного средства наблюдается через 15 минут.
Соответственно, способность контролировать задержку и скорость высвобождения лекарственного средства не ограничивается преднизолона метасульфобензоатом, но, как очевидно, может использоваться более широко.
Пример 7
Гранулы метронидазола изготавливали, как описано в примере 1, с тем исключением, что 20 мас.% метронидазола использовали вместо 5 мас.% преднизолона метасульфобензоата. Пропорции остальных компонентов доводили до 40 мас.% микрокристаллической целлюлозы (AvicelTM PH 101), 20 мас.% моногидрата лактозы и 20 мас.% натрий-кроскармеллозы (Ac-Di-SolTM).
Гранулы метронидазола затем покрывали распылением сополимера метакриловой кислоты и метилметакрилата, имеющего соотношение свободных карбоксильных групп и сложноэфирных групп 1:2, с получением покрытых гранул, имеющих теоретическую прибавку массы за счет покрытия (прибавку массы) 20%.
Изучали влияние рН на скорость высвобождения метронидазола из гранул метронидазола на аппарате для растворения путем перемешивания гранул в среде трехосновного фосфата натрия при рН 6,0, рН 6,6, а затем при рН 7,2 и отбора образцов с интервалами 15 минут для измерения посредством ВЭЖХ количества метронидазола в растворе. Результаты представлены на фиг. 5.
Как можно видеть из фиг. 5, при рН 6,0 полное высвобождение лекарственного средства наблюдается через приблизительно 240 минут, а 50% высвобождение лекарственного средства наблюдается через приблизительно 145 минут. При более высоком значении рН скорость высвобождения лекарственного средства возрастает до тех пор, пока при рН 7,2 не происходит полное высвобождение лекарственного средства через приблизительно 180 минут.
Пример 8
Гранулы метронидазола изготавливали, как описано в примере 7. Гранулы затем покрывали распылением сополимера метакриловой кислоты и метилметакрилата, имеющего соотношение свободных карбоксильных групп и сложноэфирных групп 1:2, с получением трех партий, имеющих теоретическую прибавку массы за счет покрытия (прибавку массы) 15%, 20% и 25%.
Изучали влияние толщины покрытия на скорость высвобождения метронидазола из покрытых гранул метронидазола на аппарате для растворения путем перемешивания гранул в среде трехосновного фосфата натрия при рН 6,6 и отбора образцов с интервалами 15 минут для измерения посредством ВЭЖХ количества метронидазола в растворе. Результаты представлены на фиг. 6.
Как можно видеть из фиг. 6, увеличение толщины покрытия значимо уменьшает скорость высвобождения лекарственного средства. Гранулы с покрытием до 15% прибавки массы обеспечивают полное (100%) высвобождение лекарственного средства через приблизительно 120 минут. Однако гранулы с покрытием до 20% прибавки массы обеспечивали 50% высвобождение лекарственного средства через приблизительно 120 минут и 100% высвобождение лекарственного средства - через приблизительно 240 минут, а гранулы с покрытием до 25% прибавки массы обеспечивали 50% высвобождение лекарственного средства через приблизительно 200 минут и 100% высвобождение лекарственного средства - через приблизительно 300 минут.
Пример 9
Гранулы α-амилазы изготавливали, как описано в примере 1, с тем исключением, что α-амилазу растворяли в жидкости для гранулирования (воде). Пропорции остальных компонентов составляли 40 мас.% микрокристаллической целлюлозы (AvicelTM PH 101), 20 мас.% моногидрата лактозы и 40 мас.% натрий-кроскармеллозы (Ac-Di-SolTM).
Гранулы затем покрывали распылением сополимера метакриловой кислоты и метилметакрилата, имеющего соотношение свободных карбоксильных групп и сложноэфирных групп 1:2, с получением трех партий, имеющих теоретическую прибавку массы за счет покрытия (прибавку массы) 15%, 20% и 25%.
Изучали влияние толщины покрытия на скорость высвобождения α-амилазы из покрытых гранул α-амилазы при рН 6,0 посредством колориметрии, с использованием анализа на α-амилазу Sigma Enzymatic Assay (EC 3.2.1.1) (Sigma-Aldrich Company Ltd., The Old Brickyard, New Road, Gillingham, Dorset, SP8 4XT, UK), и результаты представлены на фиг. 7.
Как можно видеть из фиг. 7, как и в случае гранул преднизолона метасульфобензоата и гранул метронидазола, увеличение толщины покрытия значимо уменьшает скорость высвобождения лекарственного средства. Количество высвобожденной α-амилазы прямо пропорционально наблюдающейся активности. Гранулы с покрытием до 15% прибавки массы обеспечивали максимальную активность α-амилазы через приблизительно 240 минут. Однако гранулы с покрытием до 20% прибавки массы обеспечивали около 50% общей активности α-амилазы через приблизительно 180 минут и 100% общую активность - через приблизительно 300 минут. Гранулы с покрытием до 25% прибавки массы обеспечивали 25% общей активности через приблизительно 180 минут, но через 300 минут наблюдалось менее 50% общей активности.
Результаты примеров 6-9 показывают, что настоящее изобретение применимо для активных соединений, не являющихся преднизолона метасульфобензоатом. Объем применения настоящего изобретения, таким образом, является удивительно широким.
Следует понимать, что настоящее изобретение не ограничивается деталями, описанными выше со ссылкой на предпочтительные варианты его осуществления, и что многочисленные модификации и вариации могут быть сделаны без отступления от идеи или объема настоящего изобретения, как определено следующей формулой изобретения.
Реферат
Настоящее изобретение относится к медицине и раскрывает улучшенную композицию для контроля профиля высвобождения активного соединения на протяжении кишечного тракта, включающую частицы, особенно гранулы, содержащие активное соединение, которые покрыты покрывающим материалом, растворение которого зависит от величины рН, или полиметакрилатным материалом, растворение которого, предпочтительно, зависит от величины рН, определенной толщины, в зависимости от желательных места и скорости высвобождения активного соединения. В предпочтительных композициях, два или более множества частиц, в которых частицы каждого множества покрыты покрывающим материалом, растворение которого зависит от величины рН, или полиметакрилатным материалом, различной толщины по сравнению с частицами каждого другого множества, содержатся в капсуле с энтеросолюбильным покрытием и обеспечивают высвобождение активного соединения в различных желательных участках кишечного тракта. 2 н. и 26 з.п. ф-лы, 7 ил.

Комментарии