Композиции, способы и наборы для стимулирования мукозальной иммунной системы - RU2748839C2
Код документа: RU2748839C2
Чертежи






























Описание
Область техники
[0001] Настоящее изобретение относится к пробиотическим микроорганизмам, пищевым продуктам, приготовленным с пробиотическими микроорганизмами, и фармацевтическим композициям, включающим пробиотические микроорганизмы. Эти композиции полезны для стимулирования мукозальной иммунной системы и для лечения нарушений, связанных с недостаточным развитием мукозальной иммунной системы.
Предпосылки для создания изобретения
[0002] Интестинальный эпителий непрерывно подвергается воздействию инородных материалов, которые могут быть или вредны, или полезны для организма-хозяина. В результате, интестинальная иммунная система должна поддерживать точный баланс между: 1) защитными иммунными реакций, которые индуцируются интестинальными патогенами или токсинами, и 2) избежанием иммунных реакций как на пищевые антигены, так и на 1014 симбиотических благоприятных микроорганизмов, которые обычно находятся в кишечнике. Нарушение защитных реакций или реакций толерантности может привести к широкой гамме нарушений, включающих, например, инфекции, воспаление, пищевые аллергии, гиперчувствительность к пище, воспалительное заболевание кишечника, болезнь Крона, глютеновую болезнь, заболевание периодонта, ревматоидный артрит, атеросклероз рак толстой кишки.
[0003] Иммунорегуляторная сеть, включающая интестинальную иммунную систему, изменяется с возрастом. Эта сеть плохо развита у младенцев и постепенно создается в течение первых нескольких лет жизни. Недостаточное развитие иммунной системы играет некоторую роль в распространенности инфекций и связанных с пищей нарушений у детей и подростков. И наоборот, способность интестинальной иммунной системы реагировать на новые вызовы снижается в пожилом возрасте.
[0004] Желудочно-кишечные нарушения, например, инфекции, воспалительные заболевания и связанные с пищей нарушения, такие как пищевые аллергии, пищевая непереносимость или пищевая гиперчувствительность, оказывают значительное влияние на здоровье и качество жизни как детей, так и взрослых. Инфекционный гастроэнтерит является наиболее распространенным педиатрическим желудочно-кишечным расстройством. Приблизительно 1 миллиард эпизодов происходят в мире ежегодно, наиболее часто в развивающихся странах среди детей меньше 5 лет. Показатели смертности от инфекционного гастроэнтерита в мире составляют, в среднем, от 3 до 6 миллионов детей в год. В США ежегодно происходят от 25 до 35 миллионов новых случаев, приводящих к 300-400 смертям. Помимо этого, инфекционный гастроэнтерит в США вызывает приблизительно 200 тысяч госпитализаций и 1,5 миллиона посещений врачей на дому, по стоимости превышая 1 миллиард долларов. Связанные с пищей нарушения, такие как аллергии, также оказывают значительное влияние на здоровье детей и взрослых. Симптомы пищевых аллергий могут меняться в зависимости от тяжести аллергии и могут быть в пределах от слабого покалывающего ощущения во рту и на губах до угрожающей жизни анафилаксии. По оценкам, пищевые аллергии влияют на 1-10% населения США. Центр по контролю за заболеваниями установил, что в 2007 года приблизительно 3 миллиона детей младше 18 лет (3,9%) по сообщениям имели пищевую или пищеварительную аллергию в предыдущие 12 месяцев. У некоторых детей пищевые аллергии становятся менее тяжелыми с взрослением, у других они остаются проблемой всей жизни. У детей, которые страдают от аллергии в раннем возрасте, может развиваться "аллергический марш". Например, многие пациенты, которые имеют тяжелые аллергические реакции на коровье молоко в младенчестве, имеют риск развития астмы позже в детстве. Есть показания, что распространенность пищевых аллергий в мире растет.
[0005] Независимо от этиологии, желудочно-кишечные нарушения не только неблагоприятно влияют на здоровье ребенка, но и оказывают серьезное влияние на благосостояние семьи, социальные контакты и посещение школы и посещение работы родителями. Существует постоянная необходимость в терапевтических стратегиях, которые способствуют здоровью желудочно-кишечного тракта, в частности улиц, которые имеют риск желудочно-кишечных нарушений или страдают от них.
Раскрытие изобретения
[0006] Настоящее изобретение предлагает композиции, включающие ферментированный пищевой продукт, причем такой пищевой продукт ферментирован пробиотическими бактериями Lactobacillus paracasei CBA L74, номер международного депонирования LMG Р-24778. Пищевой продукт может быть молочным продуктом или зерновым продуктом. Также предложены композиции, включающие пробиотические бактерии Lactobacillus paracasei CBA L74, номер международного депонирования LMG Р-24778, и физиологически приемлемый носитель. Физиологически приемлемым носителем может быть пищевой продукт или фармацевтический носитель. Также предложены способ изготовления питательной композиции, причем способ включает: предоставление пищевого продукта, объединение пищевого продукта с эффективным количеством пробиотических бактерий, Lactobacillus paracasei CBA L74, номер международного депонирования LMG Р-24778, и, по выбору, совместный инокулят, чтобы образовать смесь, и инкубацию смеси при температуре и в течение времени, достаточных для ферментации. Питательная композиция может быть высушена. Питательная композиция может быть объединена с одним или несколькими дополнительными пищевыми продуктами. Для любой из описанных здесь композиций и способов клетки Lactobacillus paracasei CBA L74 могут быть подвергнуты обработке, которая делает их не реплицирующимися. Концентрация Lactobacillus paracasei CBA L74 в композициях может меняться в зависимости от намеченного использования, например, в качестве питательной композиции или фармацевтической композиции. Подходящие диапазоны включают эквивалент приблизительно от 1×102 колониеобразующих единиц на грамм ("KOE/г") до 1×1012 колониеобразующих единиц на грамм ("KOE/г") сухой массы.
[0007] Также предложены способы лечения пациента, имеющего риск развития желудочно-кишечного нарушения, причем способ включает: идентификацию пациента с риском желудочно-кишечного нарушения, введение эффективного количества композиции, включающей пищевой продукт, причем пищевой продукт ферментирован пробиотическими бактериями Lactobacillus paracasei CBA L74, номер международного депонирования LMG Р-24778. Желудочно-кишечным нарушением может быть дефицит мукозальной иммунной системы, например, недостаточно развитая иммунная система, пищевая аллергия, нарушение, связанное с диареей, бактериальная или вирусная инфекция, синдром раздраженного кишечника, воспалительное заболевание кишечника, болезнь Крона, некротический энтероколит или старение, в частности старение желудочно-кишечной системы.
[0008] Также предложены способы лечения пациента, имеющего желудочно-кишечное нарушение. Эти способы включают: идентификацию пациента, имеющего желудочно-кишечное нарушение, введение эффективного количества композиции, включающей пищевой продукт, причем пищевой продукт ферментирован пробиотическими бактериями Lactobacillus paracasei CBA L74, номер международного депонирования LMG Р-24778. В некоторых вариантах осуществления способы включают: идентификацию пациента, имеющего желудочно-кишечное нарушение, введение эффективного количества фармацевтической композиции, включающей пробиотические бактерии Lactobacillus paracasei CBA L74, номер международного депонирования LMG Р-24778. Желудочно-кишечное нарушение может быть дефицитом мукозальной иммунной системы, например, недостаточно развитая иммунная система, пищевая аллергия, нарушение, связанное с диареей, бактериальная или вирусная инфекция, синдром раздраженного кишечника, воспалительное заболевание кишечника, болезнь Крона или некротический энтероколит.
[0009] Также предложены способы модуляции иммунной системы пациента. Способы включают: идентификацию пациента, нуждающегося в модуляции иммунной системы, и введение эффективного количества композиции, включающей пищевой продукт, причем пищевой продукт ферментирован пробиотическими бактериями Lactobacillus paracasei CBA L74, номер международного депонирования LMG Р-24778.
[0010] Также предложены изделия производства. Они могут включать наборы, включающие измеренное количество питательной композиции, включающей ферментированный пищевой продукт, причем пищевой продукт ферментирован пробиотическими бактериями Lactobacillus paracasei CBA L74, номер международного депонирования LMG Р-24778, и один или несколько предметов, выбираемых из группы, состоящей из упаковочного материала, вкладыша в упаковку, включающего инструкции по использованию, стерильной жидкости и стерильного контейнера. В некоторых вариантах осуществления набор может включать измеренное количество фармацевтической композиции, включающей Lactobacillus paracasei CBA L74, номер международного депонирования LMG Р-24778, и один или несколько предметов, выбираемых из группы, состоящей из упаковочного материала, вкладыша в упаковку, включающего инструкции по использованию, стерильной жидкости и стерильного контейнера.
[0011] Подробности одного или нескольких вариантов осуществления изобретения показаны на прилагаемых чертежах и приведены в описании ниже. Другие признаки, цели и преимущества изобретения станут очевидными из описания, чертежей и формулы изобретения.
Краткое описание чертежей
[0012] Эти и другие признаки и преимущества настоящего изобретения будут более полно раскрыты или сделаны очевидными в последующем подробном описании предпочтительного варианта осуществления изобретения, которое должно рассматриваться вместе с прилагаемыми чертежами, на которых одинаковые номера относятся к одинаковым деталям, и на которых:
[0013] ФИГ. 1 - таблица, показывающая анализ действия L. paracasei CBA L74 на фенотип дендритных клеток.
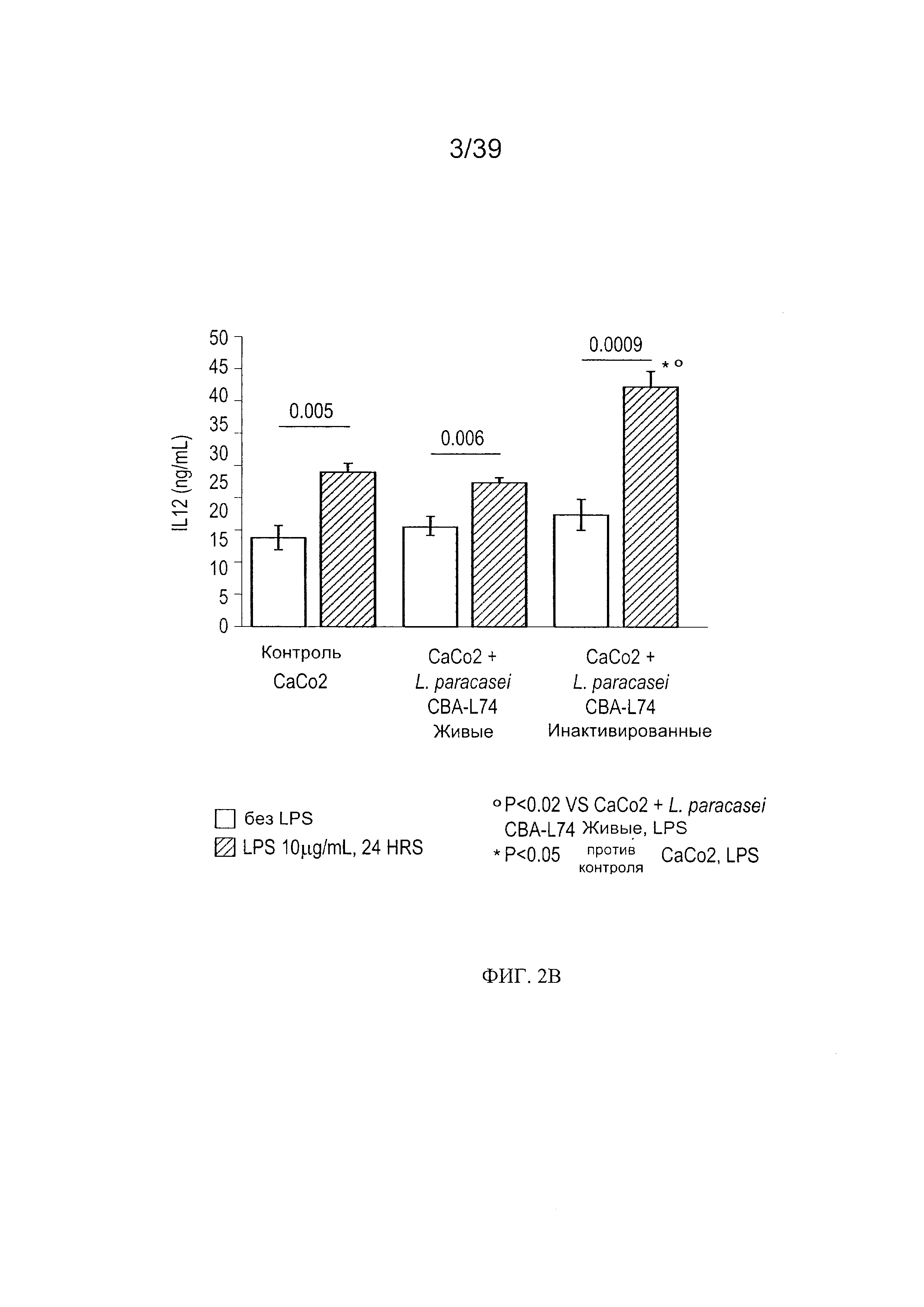
[0014] ФИГ. 2а - график, показывающий продукцию IL-10 в дендритных клетках, культивированных вместе с Сасо2, доступных для L. paracasei CBA L74. ФИГ. 2b - график, показывающий продукцию IL-12 в дендритных клетках, культивированных совместно с Сасо2, доступных для L. paracasei CBA L74.
[0015] ФИГ. 3 - график, показывающий пролиферацию Т-клеток, доступных для дендритных клеток, культивированных вместе с клетками СаСо2.
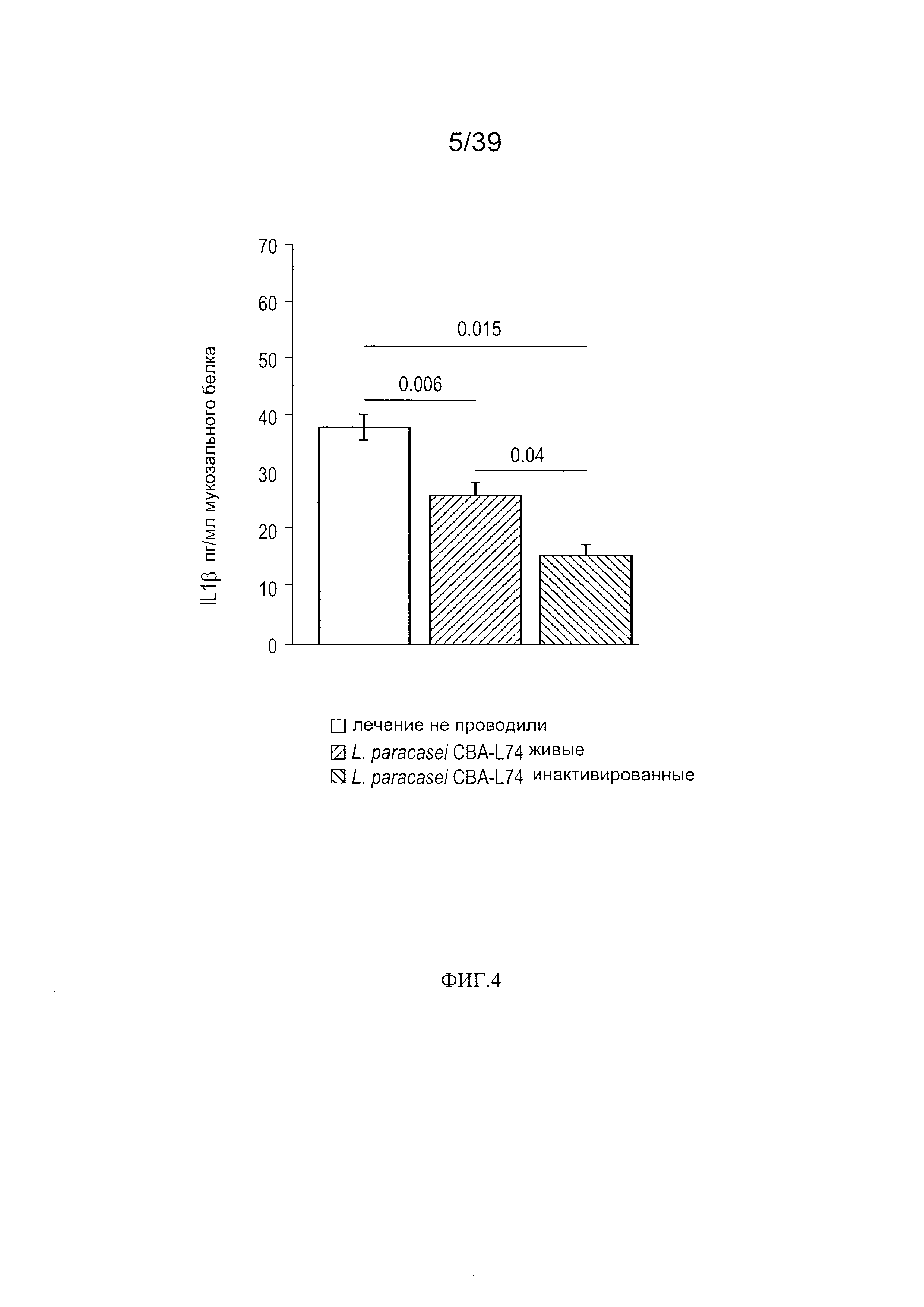
[0016] ФИГ. 4 - график, показывающий продукцию IL-1β в кишечной мукозе мышей, дополненной L. paracasei CBA L74.
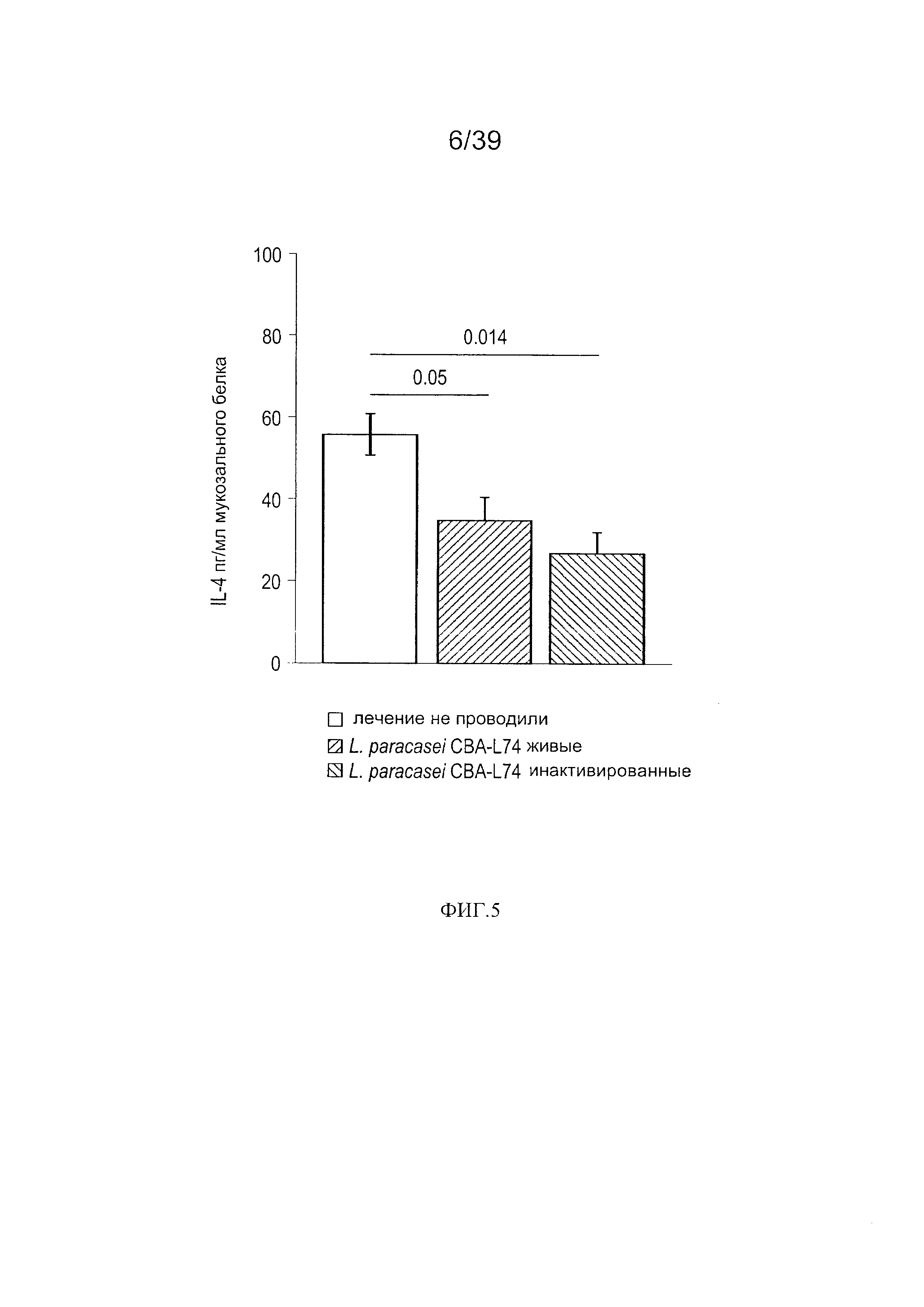
[0017] ФИГ. 5 - график, показывающий продукцию IL-4 в кишечной мукозе мышей, дополненной L. paracasei CBA L74.
[0018] ФИГ. 6 - график, показывающий продукцию IgA в кишечной мукозе мышей, дополненной L. paracasei CBA L74.
[0019] ФИГ. 7 - показывает анализ уровней TLR2, TLR4 и TLR9 в кишечной мукозе мышей, дополненной L. paracasei CBA L74.
[0020] ФИГ. 8 - показывает анализ уровней PPARγ в кишечной мукозе мышей, дополненной L. paracasei CBA L74.
[0021] ФИГ. 9а - график, показывающий уровни сывороточного IL-1β у мышей, дополненного L. paracasei CBA L74. ФИГ. 9b - график, показывающий уровни сывороточного IL-4 у мышей, дополненного L. paracasei CBA L74.
[0022] ФИГ. 10 - таблица, показывающая анализ воздействия L. paracasei СВА L74 на фенотип дендритных клеток у мышей, дополненных L. paracasei CBA L74.
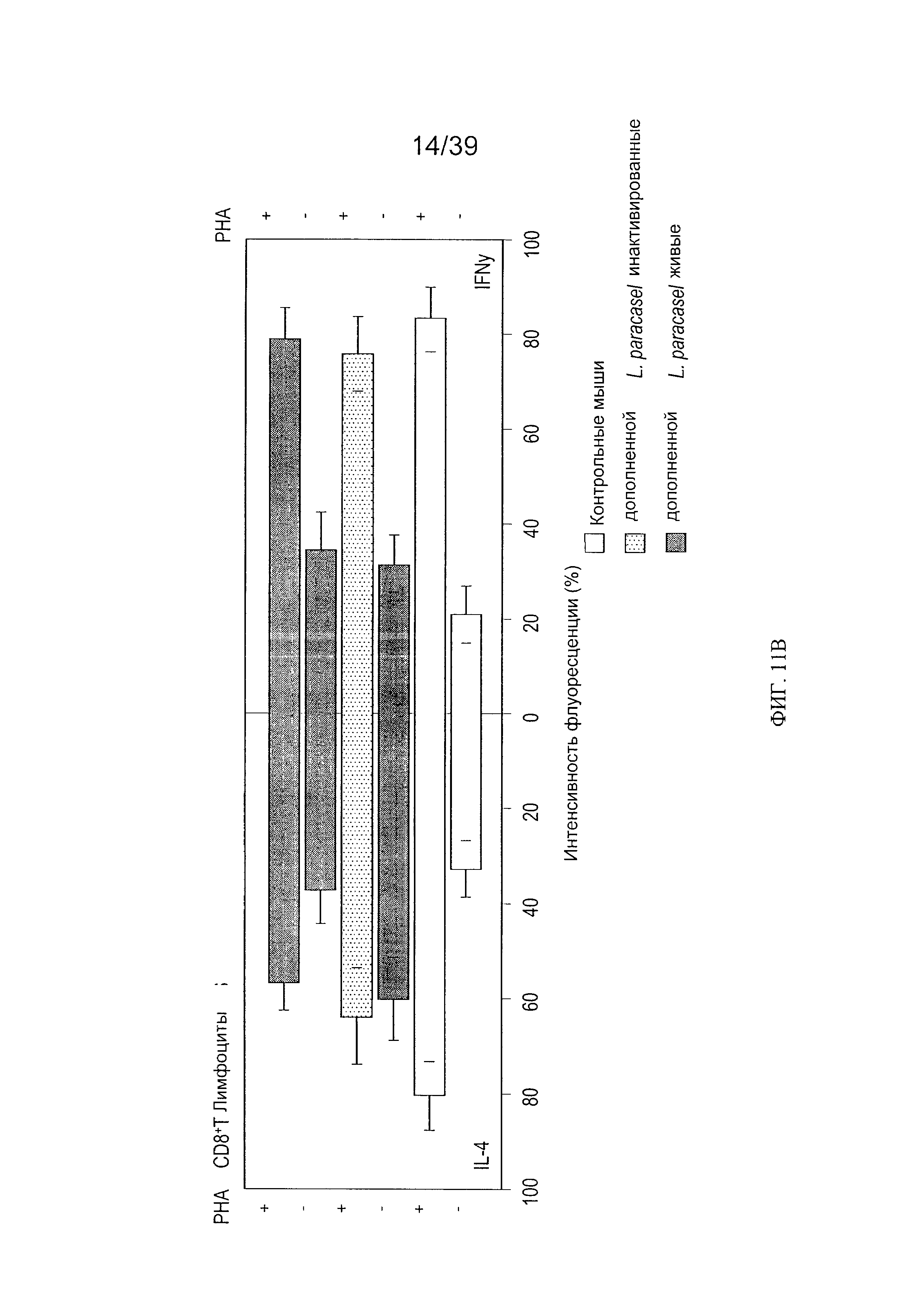
[0023] ФИГ. 11а - график, показывающий фенотипы кишечных лимфоцитов CD4+ у мышей, дополненных L. paracasei СВА L74. ФИГ. 11b - график, показывающий фенотипы кишечных лимфоцитов CD8+ у мышей, дополненных L. paracasei СВА L74
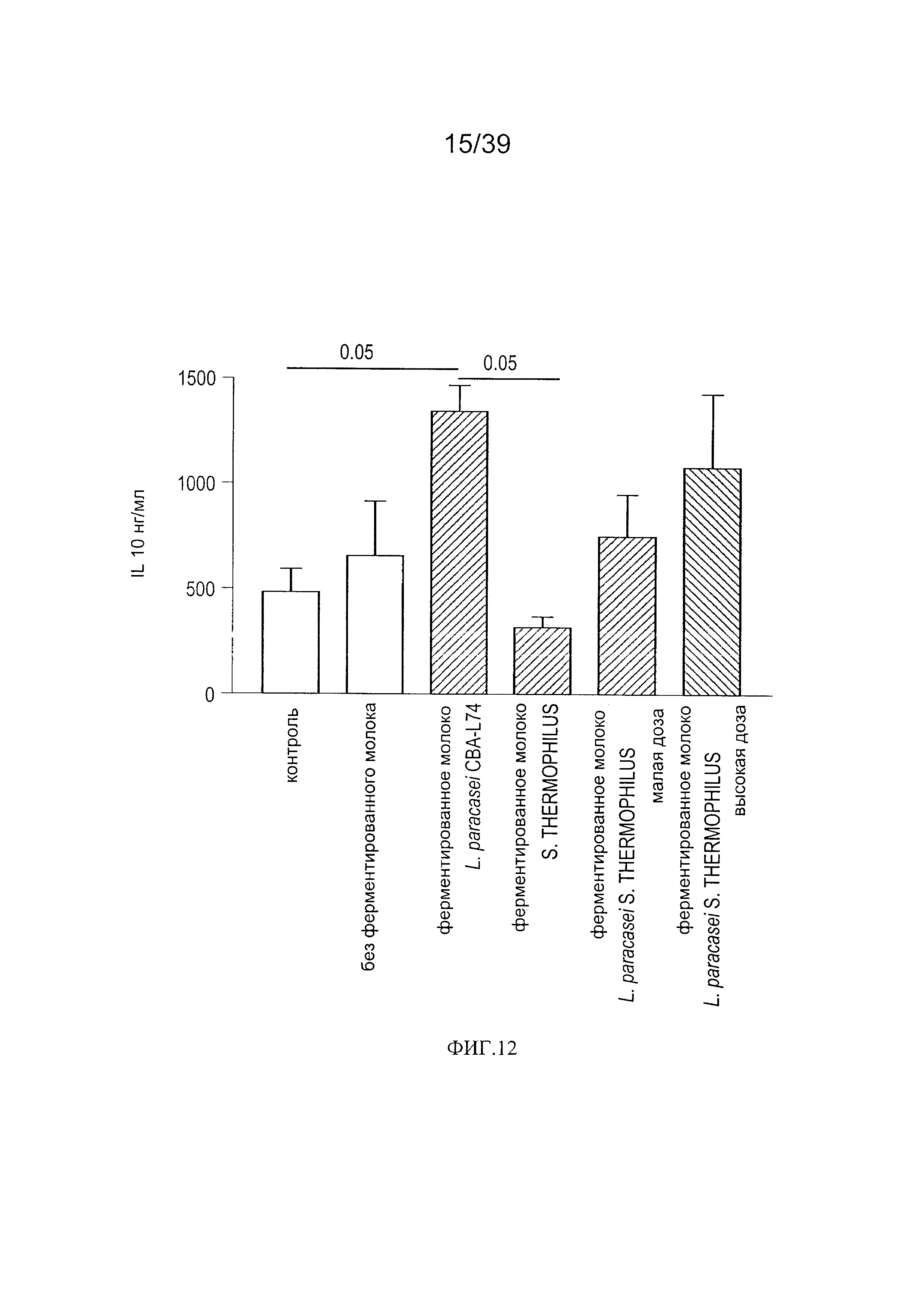
[0024] ФИГ. 12 - график, показывающий продукцию IL-10 в кишечной мукозе мышей, дополненной молоком, ферментированным L. paracasei СВА L74
[0025] ФИГ. 13 - график, показывающий продукцию IL-1β в кишечной мукозе мышей, дополненной молоком, ферментированным L. paracasei СВА L74
[0026] ФИГ. 14 - график, показывающий продукцию IgA в кишечной мукозе мышей, дополненной молоком, ферментированным L. paracasei СВА L74
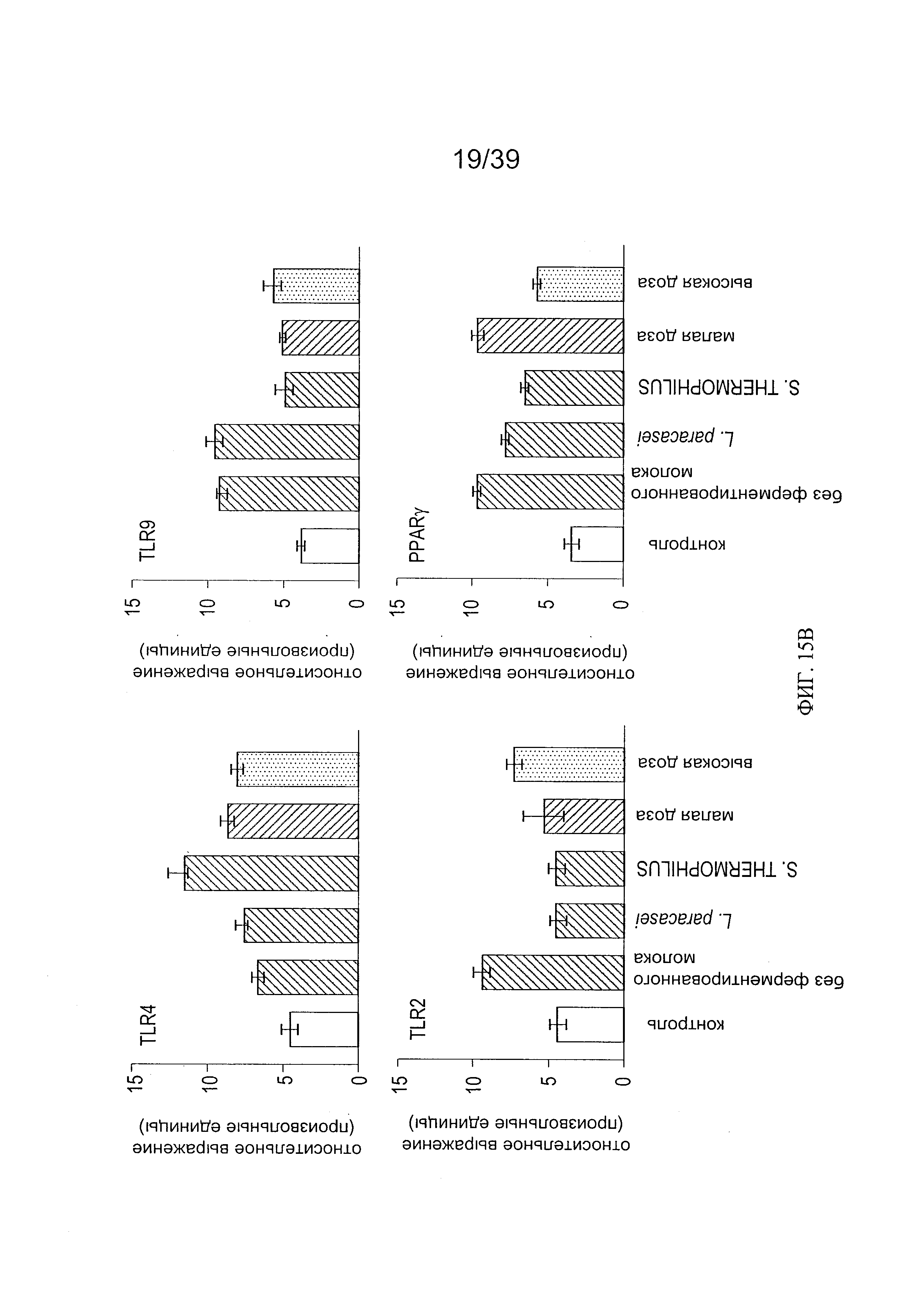
[0027] ФИГ. 15 - показывает анализ уровней TLR2, TLR4, TLR9 и PPARγ в кишечной мукозе мышей, дополненной молоком, ферментированным L. paracasei СВА L74.
[0028] ФИГ. 16 - показывает анализ уровней pNF-kB и IKBα в кишечной мукозе мышей, дополненной молоком, ферментированным L. paracasei СВА.
[0029] ФИГ. 17 - показывает анализ воздействия L. paracasei СВА L74 на фенотип дендритных клеток у мышей, дополненных молоком, ферментированным L. paracasei СВА.
[0030] ФИГ. 18 - показывает анализ воздействия L. paracasei СВА L74 на фенотип дендритных клеток после доступа к LPS или CpG у мышей, дополненных молоком, ферментированным L. paracasei СВА.
[0031] ФИГ. 19 - график, показывающий фенотипы кишечных лимфоцитов CD4+ у мышей, дополненных молоком, ферментированным L. paracasei СВА L74.
[0032] ФИГ. 20 - график, показывающий фенотипы интестинальных лимфоцитов CD8+ у мышей, дополненных молоком, ферментированным L. paracasei СВА L74.
[0033] ФИГ. 21 - гистологическая оценка подвздошной мукозы у мышей, дополненной молоком, ферментированным L. paracasei СВА L74.
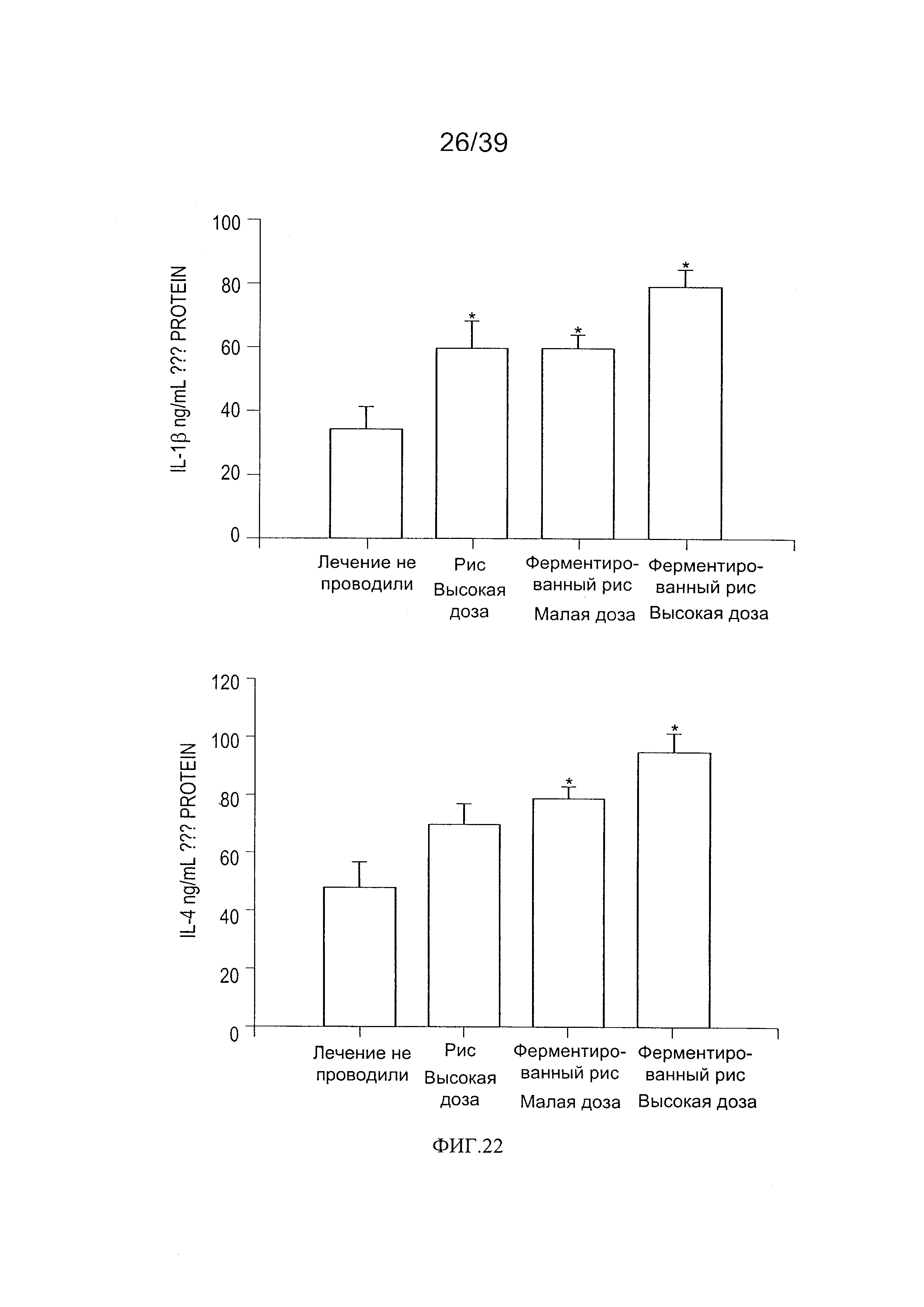
[0034] ФИГ. 22 - график, показывающий продукцию IL-1β и IL-4 в кишечной мукозе мышей, дополненной рисом, ферментированным L. paracasei СВА L74.
[0035] ФИГ. 23 - график, показывающий продукцию IL-10 в кишечной мукозе мышей, дополненной рисом, ферментированным L. paracasei CBA L74.
[0036] ФИГ. 24 - показывает анализ уровней TLR2 и TLR4 в кишечной мукозе мышей, дополненной рисом, ферментированным L. paracasei CBA L74.
[0037] ФИГ. 25а - показывает анализ уровней PPARγ в кишечной мукозе мышей, дополненной рисом, ферментированным L. paracasei СВА L74. ФИГ. 25b - анализ уровней pNF-kB и IKBα в кишечной мукозе мышей, дополненной рисом, ферментированным L. paracasei СВА L74.
[0038] ФИГ. 26 - таблица, показывающая анализ воздействия L. paracasei СВА L74 на фенотип дендритных клеток у мышей, дополненных рисом, ферментированным L. paracasei СВА L74.
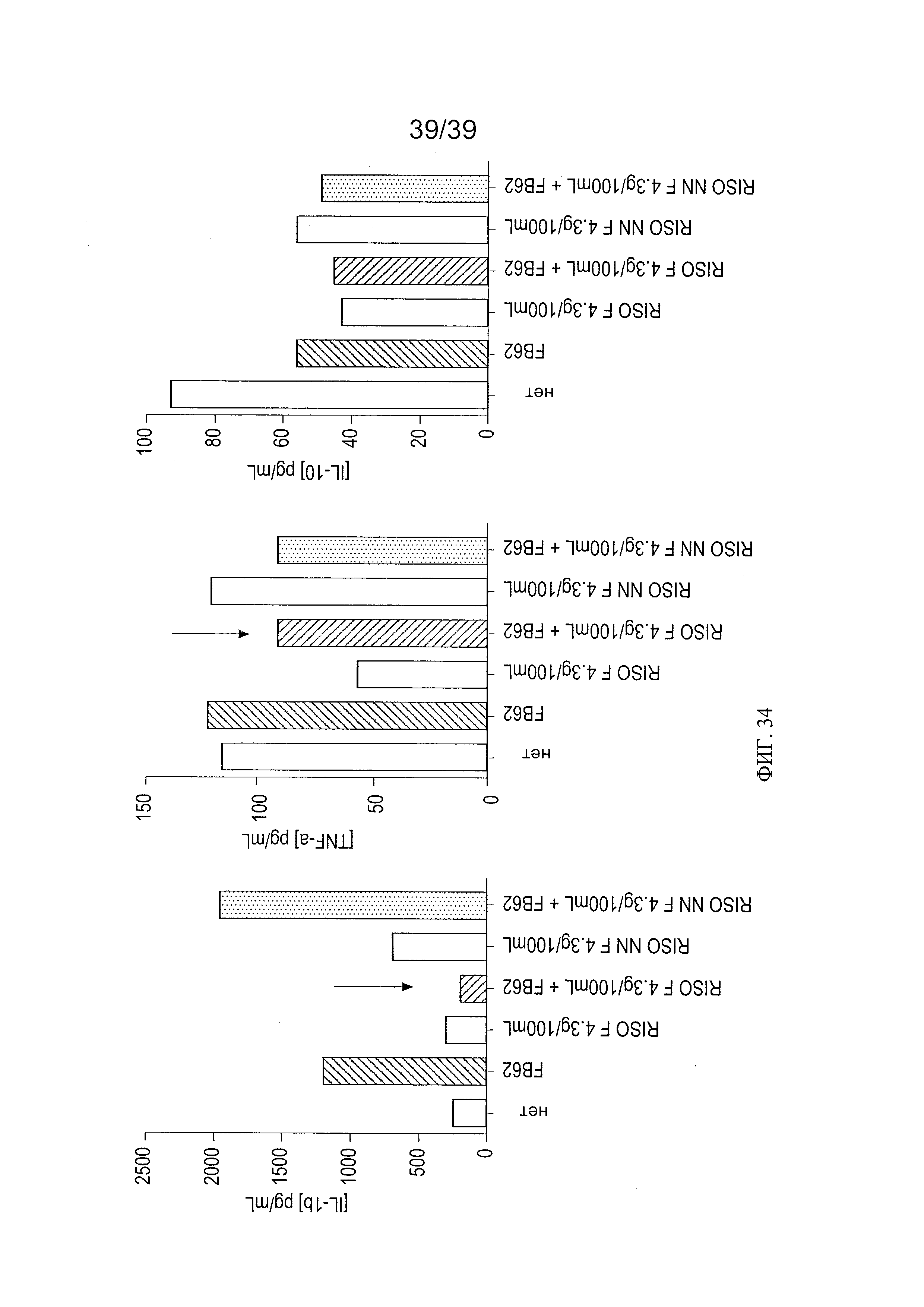
[0039] ФИГ. 27 - таблица, показывающая анализ воздействия L. paracasei СВА L74 на фенотип дендритных клеток после доступа LPS или CpG у мышей, дополненных рисом, ферментированным L. paracasei СВА L74.
[0040] ФИГ. 28 - график, показывающий фенотипы интестинальных лимфоцитов CD4+ у мышей, дополненных рисом, ферментированным L. paracasei СВА L74.
[0041] ФИГ. 29 - график, показывающий фенотипы интестинальных лимфоцитов CD8+ у мышей, дополненных рисом, ферментированным L. paracasei CBA L74
[0042] ФИГ 30 - график, показывающий анализ воздействия клеток L. paracasei CBA L74 и клеточного супернатанта на продукцию IL-10 в человеческих MoDC в присутствии Salmonella typhimurium.
[0043] ФИГ 31 - график, показывающий анализ воздействия клеток L. paracasei CBA L74 и клеточного супернатанта на продукцию IL-12p70 в человеческих MoDC в присутствии Salmonella typhimurium.
[0044] ФИГ 32 - график, показывающий анализ воздействия молока, ферментированного L. paracasei CBA L74, на продукцию IL-10 в человеческих MoDC в присутствии Salmonella typhimurium и воздействие инактивации L. paracasei CBA L74 на продукцию IL-10 в человеческих MoDC в присутствии Salmonella typhimurium.
[0045] ФИГ 33 - график, показывающий анализ воздействия молока, ферментированного L. paracasei CBA L74, на продукцию IL-12p70 в человеческих MoDC в присутствии Salmonella typhimurium и воздействие инактивации L. paracasei CBA L74 на продукцию IL-12p70 в человеческих MoDC в присутствии Salmonella typhimurium.
[0046] ФИГ 34 - график, показывающий анализ воздействия риса, ферментированного L. paracasei CBA L74, на IL-1β, TNF-α и IL-10 в модели эксплантата кишечной ткани в присутствии Salmonella typhimurium.
Подробное описание
[0047] Настоящее изобретение основано, в его части, на открытии автором о том, что пищевые продукты, ферментированные пробиотическим микроорганизмом Lactobacillus paracasei, штамм CBA L74, могут иметь иммуномодулирующие свойства. Этот штамм был выделен авторами изобретения и депонирован согласно Будапештскому договору о международном признании депонирования микроорганизмов для целей патентной процедуры 9 сентября 2008 года в Бельгийских координированных коллекциях микроорганизмов (ВССМ) Лаборатории микробиологии (LMG), Гент, Бельгия. Международный депозитарный орган присвоил ему номер депонирования LMG P-24778. Для облегчения ознакомления с описанием мы не будем в каждом случае повторять фразу "номер депонирования LMG P-24778". Следует понимать, что там, где мы ссылаемся на L. paracasei, штамм CBA L74, мы ссылаемся на депонированный штамм с номером депонирования LMG P-24778.
[0048] Композиции изобретения включают пробиотический микроорганизм L. paracasei CBA L74. Всемирная организация здравоохранения определила пробиотики как: "Живые микроорганизмы, которые при введении в адекватных количествах придают здоровье организму-хозяину". В некоторых вариантах осуществления L. paracasei CBA L74 может быть подвергнут обработкам, которые делают его нереплицирующимся, например, тепловая обработка, обезвоживание, гамма-облучение или УФ-облучение. Нереплицирующийся L. paracasei CBA L74 может быть мертвой клеткой или живой клеткой, которую сделали неспособной к делению. Нереплицирующийся L. paracasei CBA L74 может быть интактной клеткой или клеткой, которая прошла частичный или полный лизис. В некоторых вариантах осуществления нереплицирующиеся клетки могут включать смесь интактных и лизированных клеток.
[0049] Хотя, как мы полагаем, мы понимаем определенные события, которые происходят после введения композиций, изготовленных путем ферментации L. paracasei CBA L74 или включающих последний, композиции настоящего изобретения не ограничены теми, которые проявляют себя воздействием на любой конкретный клеточный механизм. Наша рабочая гипотеза заключается в том, что пробиотические микроорганизмы или композиции, ферментированные пробиотическими микроорганизмами, могут создавать повышенный барьер для транслокации бактерий и бактериальных продуктов в мукозе, конкурентно исключают потенциальные патогены, модифицируют реакцию организма-хозяина на микробные продукты и повышают энтеральное питание такими способами, которые ингибируют рост патогенов. Благоприятные эффекты композиций, включающих нереплицирующиеся пробиотические микроорганизмы, могут развиваться, например, из метаболитов, продуцированных во время ферментации, например, органических кислот, таких как молочная кислоты, масляная кислота или уксусная кислота. Альтернативно или дополнительно, микробная ДНК, например, неметилированные динуклеотиды CpG, фрагменты стенок бактериальных клеток и другие субклеточные компоненты бактерий, такие как белки, углеводы и липиды, могут оказывать иммуномодулирующие действия на мукозальную иммунную систему.
[0050] Авторы изобретения установили, что выделенный штамм L. paracasei СВА L74 модулирует уровни как про-, так и противовоспалительных маркеров при анализе in vitro и in vivo. Более того, иммуномодулирующие эффекты также наблюдались после приема пищевых продуктов, которые были ферментированы L. paracasei СВА L74. Такие иммуномодулирующие эффекты отмечались даже при обработанных ферментированных продуктов, например, теплом, чтобы сделать L. paracasei СВА L74 нереплицирующимся. Соответственно, изобретение предлагает композиции и способы, которые можно использовать для стимуляции интестинальной иммунной системы. Композиции могут включать пищевые продукты, которые ферментированы L. paracasei СВА L74. Пищевые продукты могут быть любыми из широкого круга, которые могут быть ферментированы L. paracasei СВА L74. В некоторых вариантах осуществления композиции могут включать выделенный L. paracasei СВА L74 и физиологический носитель. Носителем может быть пищевой продукт, но изобретение этим не ограничено, и в некоторых вариантах осуществления носителем может быть фармакологический носитель. Также предложены способы изготовления и использования композиций. Способы изобретения включают способы приготовления композиций, включающих L. paracasei СВА L74, способы ферментации пищевых продуктов L. paracasei СВА L74 и способы введения композиций, чтобы вызвать иммуномодулирующую реакцию у пациента. Композиции могут быть введены пациенту, имеющему недостаточно развитую иммунную систему, риск развития желудочно-кишечного нарушения или имеющему желудочно-кишечное нарушение. Способы могут быть использованы на пациентах-людях, таких как дети и подростки, или в ветеринарии. Независимо от пациента (человек или не человек), любые из таких способов могут включать этап идентификации пациента. Например, способы могут включать этап определения, нуждается ли пациент в лечении.
Композиции
Ферментированные пищевые продукты
[0051] Композиции изобретения включают питательные композиции, т.е., пищевые продукты, ферментированные пробиотическим микроорганизмом L. paracasei CBA L74. Может быть использован любой пищевой продукт, поддающийся ферментации L. paracasei CBA L74. Пищевой продукт может быть молочным продуктом, например, молоком или продуктом на основе молока. Примеры источников молока включают, но без ограничения, коров, овец, коз, яков, водяных буйволов, лошадей, ослов, оленей и верблюдов. Независимо от источника, молоко или молочные продукты могут быть в любой форме, подходящей для ферментации L. paracasei CBA L74. Например, молоко может быть цельным молоком или молоком, которое было обработано для удаления некоторой части или всего молочного жира, например, 2% молоко, 1% молоко или обезжиренное молоко. Альтернативно или дополнительно, молоко может быть ранее пастеризовано и/или гомогенизировано, высушено и восстановлено, сгущено или испарено. Также могут быть использованы фракции молочных продуктов, включая казеин, сывороточный белок или лактозу. В некоторых вариантах осуществления молочный продукт может включать приблизительно от 1% до 30% снятого молока, восстановленного из порошка, например, приблизительно 2%, приблизительно 5%, приблизительно 7%, приблизительно 9%, приблизительно 10%, приблизительно 12%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%. Перед ферментацией молочный продукт может быть объединен с одним или больше из следующего: а) углевод (например, дисахарид, такой как декстроза или крахмал; b) липид; с) витамин и d) минерал. Например, порошок из снятого молока может быть объединен с декстрозой в количестве приблизительно 2%, например, приблизительно 0,25%, приблизительно 0,50%, приблизительно 0,75%, приблизительно 1,0%, приблизительно 1,5% или приблизительно 2,0%.
[0052] Пищевой продукт может быть зерновым, например, рисом, пшеницей, овсом, ячменем, кукурузой, рожью, сорго, просом или тритикале. Зерновой продукт может быть цельнозерновым или размолотым в муку. Пищевой продукт может представлять один вид злака или смесь двух или больше видов зерна, например, овсяная мука плюс мука из солодового ячменя. Зерновые продукты могут быть сорта и типа, подходящих для потребления человеком, или могут быть продуктами, подходящими для потребления домашними животными. Обычно зерновой продукт гидратируют перед ферментацией. Концентрация злака может меняться, но подходящие диапазоны включают приблизительно от 5% до приблизительно 50% по массе/объему, например, приблизительно 8% по массе/объему, приблизительно 10% по массе/объему, приблизительно 12% по массе/объему, приблизительно 15% по массе/объему, приблизительно 18% по массе/объему, приблизительно 20% по массе/объему, приблизительно 22% по массе/объему, приблизительно 25% по массе/объему, приблизительно 30% по массе/объему, приблизительно 35% по массе/объему, приблизительно 40% по массе/объему, приблизительно 45% по массе/объему или приблизительно 50% по массе/объему. Примеры концентраций включают 15% по массе/объему риса или смесь из 18,5% по массе/объему овсяной муки плюс 5% по массе/объему муки из солодового ячменя. Значение pH гидратированного зерна можно регулировать, используя любую кислоту, подходящую для потребления. Кислота может быть, например, органической. Подходящие органические кислоты включают уксусную кислоту, лимонную кислоту, молочную кислоту, адипиновую кислоту, яблочную кислоту и винную кислоту. Можно использовать любое сочетание из двух или больше кислот. В некоторых вариантах осуществления pH можно регулировать приблизительно до 4,0, используя лимонную кислоту.
[0053] Пищевой продукт также может быть овощным или фруктовым продуктом, например, соком, пюре, концентратом, пастой, соусом, маринадом или кетчупом. Примеры овощей и фруктов включают, но без ограничения, тыквенные, например, цуккини, кабачок, патиссон, тыква; картофель, спаржа, брокколи, брюссельская капуста, бобы, например, горох, желтая фасоль, лимская фасоль, конские бобы, соевые бобы, капусту, морковь, цветная капуста, огурцы, кольраби, лук-порей, лук-шалот, лук, сахарный горох, английский горох, перец, турнепс, брюкву, помидоры, яблоки, груши, персики, сливы, клубнику, малину, ежевику, чернику, бруснику, бойзенову ягоду, крыжовник, виноград, смородину, апельсины, лимоны, грейпфруты, бананы, манго, киви и карамболу.
[0054] Пищевой продукт также может быть "молоком", изготовленным из зерна (ячменное, овсяное или полбяное "молоко"), орехов ("молоко" из миндаля, кэшью, кокоса, фундука или каштана), бобовых ("молоко" из сои, арахиса, гороха или люпина) или семян ("молоко" из квиноа, кунжута или подсолнечника).
[0055] Также рассматриваются пищевые продукты, включающие животные белки, например, мясо, например, колбасы, сушеное мясо, рыба и сушеная рыба.
[0056] Независимо от типа используемого пищевого продукта, его объединяют с L. paracasei CBA L74 и инкубируют при температуре, достаточной для выполнения ферментации. Можно использовать любой стандартный способ ферментации, известный в данной области. Специфические условия ферментации могут меняться в зависимости от многих факторов, включая, например, тип пищевого продукта, концентрация пищевого продукта, используемое оборудование, объем пробы, исходная концентрация инокулята L. paracasei CBA L74, присутствие, если таковое будет, совместного инокулята, органолептические свойства ферментированного пищевого продукта и намеченное использование ферментированного пищевого продукта.
[0057] Оборудование и субстрат (т.е., ферментируемый пищевой продукт) стерилизуют перед инокуляцией L. paracasei CBA L74, чтобы снизить уровень или устранить живые бактерии, и/или грибы, и/или инфекционные вирусы. Оборудование можно стерилизовать, используя стандартные способы, или согласно инструкциям изготовителя. Выбор конкретного способа стерилизации субстрата будет зависеть, отчасти, от устойчивости субстрата к способу стерилизации. Например, субстрат можно стерилизовать паром и давлением, например, автоклавированием, неоднократными циклами нагрева и охлаждения (например, тиндализацией), воздействием высокого давления (например, паскализацией), ультрафильтрацией или облучением (например, воздействием гамма-излучения, рентгеновского излучения, электронно-лучевым излучением и/или ультрафиолетовым излучением (при длине волны от 10 нм до 320 нм, например, от 50 нм до 320 нм, от 100 нм до 320 нм, от 150 нм до 320 нм, от 180 нм до 320 нм или от 200 нм до 300 нм). Аликвоты субстрата можно удалить после обработки и поместить на планшеты с подходящей средой, чтобы подтвердить отсутствие бактериальных и/или грибковых загрязнений. Если субстрат стерилизован путем воздействия высоких температур, его следует охладить по меньшей мере до 37°C перед инокуляцией L. paracasei CBA L74.
[0058] Субстрат можно инокулировать L. paracasei CBA L74 согласно стандартным способам, например, из свежей жидкой культуры или сублимированной культуры, которая была повторно суспендирована в водной среде в течение короткого времени перед инокуляцией. Обычно L. paracasei CBA L74 добавляют в концентрации приблизительно от 0,5×106 до приблизительно 1×106 KOE/мл субстрата, например, приблизительно 1×106 KOE/мл, приблизительно 2×106 KOE/мл, приблизительно 5×106 KOE/мл, 7×106 KOE/мл 8×106 KOE/мл. Культуру следует перемешивать так, чтобы получить относительно равномерное распределение бактерий и субстрата, но не чрезмерно, поскольку L. paracasei CBA L74 является анаэробными бактериями. Например, культуру объемом 5 л можно перемешивать приблизительно с частотой 150 об/мин. Температура ферментации обычно составляет 37°С. Во время ферментации можно контролировать разные параметры, например, pH, парциальное давление O2, частоту вращения мешалки, температуру, смешивание газа, уровень пены и концентрацию субстрата, и регулировать соответственно. Рост L. paracasei CBA L74 можно контролировать стандартными микробиологическими способами. Ферментацию осуществляют до тех пор, пока концентрация L. paracasei CBA L74 не составит, приблизительно, от 108/мл до 109/мл. В зависимости от субстрата и других условий эта концентрация может быть достигнута приблизительно через 10-30 часов после инокуляции, например, приблизительно через 12 часов, приблизительно 15 часов, приблизительно 18 часов, приблизительно 24 часа, приблизительно 30 часов.
[0059] Пробы субстрата можно проанализировать до, во время и после ферментации, чтобы обеспечить качество, с использованием стандартных микробиологических способов. Примеры способов включают, но без ограничения, рост на агаре Рогоза для L. paracasei CBA L74, рост на агаре для подсчета колоний аэробных микроорганизмов на чашках (РСА), рост на агаре Макконки для колиподобных бактерий, рост на улучшенном клостридиальном агаре (RCM) для Clostridia. В дополнение к подсчету колоний, можно наблюдать морфологию колоний и сравнивать с эталонными пробами.
[0060] В некоторых вариантах осуществления вместе с L. paracasei CBA L74 может быть добавлен совместный инокулятдля содействия инициации ферментации. Подходящие совместные инокуляты для ферментации молочных продуктов включают, например, но без ограничения, Streptococcus thermophilus, Lactobacillus paracasei, Lactobacillus salivarious, Lactobacillus rhamnosus, Lactobacillus casei, Lactobacillus lactis, Lactobacillus delbrueckii, subsp.Bulgaricus, Lactobacillus acidophilus, Lactobacillus brevis или Leuconostoc mesenteroides. Обычно концентрация совместного инокулята будет ниже концентрации L. paracasei CBA L74, например, приблизительно 1×104/мл×105/мл. Конечная концентрация S. thermophilus может составлять приблизительно от 0,5×108/мл до 2,5×108/мл.
Пищевые продукты
[0061] После достижения подходящих концентраций L. paracasei CBA L74 ферментированные пищевые продукты могут быть далее обработаны для использования. В некоторых вариантах осуществления pH ферментированного пищевого продукта можно регулировать, например, от приблизительно 3,0 до близкого к нейтральному, например, 6,5, путем добавления NaOH или KOH. В некоторых вариантах осуществления ферментированный пищевой продукт может быть высушен. Ферментированный пищевой продукт может быть высушен любым способом, известным в данной области, который приведет к сохранению иммуномодулирующих свойств ферментированного пищевого продукта. Примеры способов сушки включают сушку распылением, сушку замораживанием, например, лиофилизацией или барабанную сушку. Конченое содержание воды в ферментированном пищевом продукту может быть разным, но может составлять приблизительно от 1% до 10% или больше. В некоторых вариантах осуществления сушка может делать бактерии L. paracasei CBA L74 нереплицирующимися.
[0062] Сушеные ферментированные пищевые продукты могут быть гидратированы перед использованием. В зависимости от объема жидкости, используемой для гидратации, ферментированные пищевые продукты могут содержать эквивалент приблизительно 102 и 1012 KOE/мл L. paracasei CBA L74. Сушеные бактерии L. paracasei CBA L74 не образуют колоний, так что понимается, что это количество вычисляется на основании численности живых бактерий, которые присутствовали в ферментированных пищевых продуктах перед сушкой. В некоторых вариантах осуществления ферментированные пищевые продукты могут включать эквивалент приблизительно 107-1012 KOE/г, например, приблизительно 5×107 KOE/г, приблизительно 1×108 KOE/г, приблизительно 5×108 KOE/г, приблизительно 1×109 KOE/г, приблизительно 5×109 KOE/г, приблизительно 1×1010 KOE/г, приблизительно 5×1010 KOE/г, приблизительно 1×1011 KOE/г, приблизительно 5×1011 KOE/г сухой массы.
[0063] Два или больше ферментированных пищевых продуктов, приготовленных согласно способам изобретения, могут быть объединены перед введением. Например, ферментированные молочные продукты могут быть объединены с ферментированными зерновыми продуктами. Альтернативно, ферментированный пищевой продукт может быть объединен с другими пищевыми продуктами, например, не ферментированными пищевыми продуктами или пищевыми продуктами, ферментированными с использованием других штаммов бактерий. Можно использовать любое сочетание при условии, что иммуномодулирующие свойства ферментированного пищевого продукта сохраняются. Примеры пищевых продуктов включают, но без ограничения, молочные продукты, например, молоко, йогурт, творог, сыр и продукты на основе сыра, ферментированное молоко, ферментированные продукты на основе молока, порошки на основе молока, детские смеси, детское питание на основе молока, мороженое, мягкое мороженое, пудинги, супы, соусы, пюре или заливки, питательные смеси для пожилых людей; зерновые продукты, например, хлопья, зерновые детские смеси, толокно, картофельную муку, манную крупу, поленту, макаронные изделия, бисквиты, крекеры, энергетические батончики; овощные продукты, например, пюре, детское питание на основе овощей, овощи в маринаде, включая огурцы, капусту, морковь, бобы, перец или приправы; фруктовые продукты, например, детское питание на основе фруктов, продукты из томатов, пюре, соусы, пасты, кетчупы, фруктовые пюре; или продукты на основе белков, например, бобовые, колбасы, ланчи, хот-доги или пища в форме пюре. В некоторых вариантах осуществления ферментированный пищевой продукт может быть объединен с кормом для животных.
[0064] В некоторых вариантах осуществления композиции могут включать ферментаты L. paracasei CBA L74, из которых удалены все или по существу все клетки L. paracasei CBA L74. Способы отделения клеток от питательных сред хорошо известны в данной области и могут быть основаны на физических способах, например, на центрифугировании, чтобы получить гранулу клеток и супернатант культуры, фильтрации, ультрафильтрации, фильтрации в тангенциальном потоке, обычной фильтрации в потоке или обратном осмосе. Альтернативно или дополнительно, способ разделения может быть основан на лиганде и включать, например, антитело, которое специфически связывается с L. paracasei CBA L74. Антитело может быть соединено с твердым носителем, таким как магнитный шарик.
Выделенные L. paracasei CBA L74
[0065] В некоторых вариантах осуществления композиции изобретения включают L. paracasei CBA L74, которые частично или по существу выделены из сред, на которых их выращивали. Клетки L. paracasei CBA L74 могут быть живыми или нереплицирующимися, например, инактивированными, например, путем тепловой обработки. Клетки могут быть лиофилизированы или высушены замораживанием в условиях, которые сохраняют жизнеспособность клеток. Способы лиофилизации хорошо известны в данной области.
Физиологические носители
[0066] В некоторых вариантах осуществления композиции изобретения могут включать выделенные клетки L. paracasei CBA L74 в сочетании с физиологически приемлемым носителем. Клетки L. paracasei CBA L74 могут быть живыми или нереплицирующимися, например, инактивированными, например, путем тепловой обработки. Доза может быть разной, но может составлять приблизительно от 102 до 1012 KOE/г, например, 1×102 KOE/г, 5×102 KOE/г, 1×103 KOE/г, 5×103 KOE/г, 1×104 KOE/г, 5×104 KOE/г, 1×105 KOE/г, 5×105 KOE/г, 1×106 KOE/г, 5×106 KOE/г, 1×107 KOE/г, 5×107 KOE/г, 1×108 KOE/г, 5×108 KOE/г, 1×109 KOE/г, 5×109 KOE/г, 1×1010 KOE/г, 5×1010 KOE/г, 1×1011 KOE/г, 5×1011 KOE/г, 1×1012 KOE/г сухой массы.
[0067] Физиологически приемлемый носитель может быть пищевым продуктом. Выделенные клетки L. paracasei CBA L74 могут быть добавлены к пищевому продукту перед упаковкой или обработкой. Альтернативно или дополнительно, выделенные клетки L. paracasei CBA L74 могут быть добавлены к пищевому продукту перед употреблением. Например, выделенные клетки L. paracasei CBA L74 могут быть объединены с любыми пищевыми продуктами, указанными выше. Пищевой продукт может быть ферментированным или неферментированным. Например, выделенные клетки L. paracasei CBA L74 могут быть добавлены к неферментированному молочному или зерновому продукту. В некоторых вариантах осуществления клетки L. paracasei CBA L74 могут быть добавлены к пищевому продукту в количестве, эквивалентном приблизительно от 107 до 1012 KOE/г, например, приблизительно 5×107 KOE/г, приблизительно 1×108 KOE/г, приблизительно 5×108 KOE/г, приблизительно 1×109 KOE/г, приблизительно 5×109 KOE/г, приблизительно 1×1010 KOE/г, приблизительно 5×1010 KOE/г, приблизительно 1×1011 KOE/г, приблизительно 5×1011 KOE/г сухой массы.
Фармацевтические носители
[0068] Композиции также включают фармацевтически приемлемый носитель. Мы используем термины "фармацевтически приемлемый" (или "фармакологически приемлемый") по отношению к молекулярным телам и композициям, которые не вызывают неблагоприятной, аллергической или другой нежелательной реакции при введении животному или человеку, в зависимости от случая. Термин "фармацевтически приемлемый носитель", как он здесь используется, включает любые и все растворители, дисперсионные среды, покрытия, антибактериальные, изотонные и задерживающие абсорбцию агенты, буферные растворы, наполнители, связующие, смазки, гели, поверхностно-активные вещества и т.д., которые можно использовать как среды для фармацевтически приемлемого вещества.
[0069] Настоящее изобретение также включает фармацевтические композиции, которые содержат, в качестве активного ингредиента, описанные здесь клетки L. paracasei CBA L74 в сочетании с одним или несколькими фармацевтически приемлемыми носителями. В некоторых вариантах осуществления L. paracasei CBA L74 можно стерилизовать, используя известные способы стерилизации, до или после объединения с фармацевтически приемлемым носителем. При изготовлении композиций изобретения L. paracasei CBA L74 обычно смешивают с наполнителем, разбавляют наполнителем или заключают в носитель в форме, например, капсулы, таблетки, пакеты-саше, бумаги или другого контейнера. Если наполнитель служит в качестве разбавителя, он может быть твердым, полутвердым или жидким материалом (например, обычным физраствором), который действует как наполнитель, носитель или среда для активного ингредиента. Таким образом, композиции могут быть в форме таблеток, пилюль, порошков, лепешек, саше, облаток, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей (как твердое вещество или в жидкой среде), мазей, мягких и твердых желатиновых капсул, свечей, стерильных растворов для инъекций и стерильных упакованных порошков. Как известно в данной области, тип разбавителя может быть разным в зависимости от намеченного пути введения. Полученные композиции могут включать дополнительные агенты, такие как консерванты. Наполнитель или носитель выбирают на основе режима и пути введения. Подходящие фармацевтические носители, а также фармацевтические требования по использованию в фармацевтических составах описаны в публикации "Remington's Pharmaceutical Sciences" (Фармацевтика Ремингтона) (Е. W. Martin), хорошо известной в данной области, и в публикации USP/NF (United States Pharmacopeia и the National Formulary) (Фармакопея и национальный фармацевтический справочник США). Некоторые примеры подходящих наполнителей включают лактозу, декстрозу, сахарозу, сорбитол, маннитол, крахмалы, акациевую камедь, фосфат кальция, альгинаты, трагакант, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, воду, сироп и метилцеллюлозу. Составы могут дополнительно включать: смазывающие вещества, такие как тальк, стеарат магния и минеральное масло; смачивающие агенты; эмульгирующие и суспендирующие агенты; консерванты, такие как метил- и пропилгидроксибензоаты; подсластители и вкусовые добавки. Фармацевтические композиции могут быть составлены так, чтобы обеспечивать быстрое, продолженное или отложенное высвобождение активного ингредиента после введения пациенту, путем применения процедур, известных в данной области.
[0070] Фармацевтически приемлемые композиции для использования в способах изобретения, включая те, в которых L. paracasei CBA L74 заключены в коллоиде для перорального приема, могут быть приготовлены согласно стандартным способам. L. paracasei CBA L74 могут быть высушены и уплотнены путем размола или распыления и введены в капсулу для перорального введения. В некоторых вариантах осуществления L. paracasei CBA L74 могут быть объединены с одним или несколькими наполнителями, например, веществом, вызывающим дезинтеграцию, наполнителем, веществом, повышающим скольжение или консервантом. Подходящие капсулы включают капсулы в твердой оболочке и капсулы в мягкой оболочке. Для изготовления капсулы можно использовать любой коллоид на основе липида или полимера. Примеры полимеров, подходящих для изготовления коллоида, включают желатин, растительные полисахариды или их производные, такие как каррагенаны, и модифицированные формы крахмала и целлюлозы, например, гипромеллозу. По выбору, к раствору желирующего агента могут быть добавлены другие ингредиенты, например, пластификаторы, такие как глицерин и/или сорбитол, чтобы уменьшить жесткость капсулы, красители, консерванты, вещества, вызывающие дезинтеграцию, смазки и вещества для обработки поверхности. В некоторых вариантах осуществления капсула не включает желатин. В других вариантах осуществления капсула не включает растительные полисахариды или их производные.
[0071] Независимо от оригинального источника или способа их получения, клетки L. paracasei CBA L74 изобретения могут быть введены в состав в соответствии с их использованием. Эти композиции могут быть изготовлены способом, хорошо известным в фармацевтике, и могут быть введены разными путями, в зависимости от того, желательно ли локальное или системное лечение, и от области лечения. Введение может быть пероральным или топикальным (включая офтальмологическую доставку и доставку к слизистым мембранам, включая интраназальную, вагинальную и ректальную доставку). В некоторых вариантах осуществления введение может быть пульмонарным (например, путем ингаляции или инсуффляции порошков или аэрозолей, включая использование распылителя), внутритрахеальным, интраназальным, эпидермальным и трансдермальным или окулярным. Способы окулярной доставки могут включать топикальное введение (глазные капли), субконъюнктивальную, периокулярную или интравитреальную инъекцию или введение с помощью катетера-баллона или глазных вставок, хирургически помещаемых в свод конъюнктивы. Парентеральное введение включает внутривенную, внутриартериальную, подкожную, интраперитонеальную или внутримышечную инъекцию или инфузию или интракраниальное, например, интратекальное или интравентрикулярное введение. Парентеральное введение может быть в форме одиночной болюсной дозы или может быть, например, выполнено непрерывным перфузионным насосом. Фармацевтические композиции и составы для топикального введения могут включать трансдермальные пластыри, мази, лосьоны, кремы, гели, капли, свечи, спреи, жидкости, порошки и т.д. Могут быть необходимы или желательны известные фармацевтические носители, водные, порошковые или масляные основы, загустители и т.д.
[0072] Композиции могут быть изготовлены в форме стандартных доз, где каждая доза содержит, например, приблизительно от 0,005 мг до 2000 мг L. paracasei CBA L74 в суточной дозе. Термин "стандартная доза" относится к физически дискретным единицам, подходящим в качестве стандартной дозы для пациентов-людей и других млекопитающих, причем каждая доза содержит определенное количество активного материала, вычисленное как дающее желательный терапевтический эффект, вместе с подходящим фармацевтическим наполнителем. Для изготовления твердых композиций, таких как таблетки, основной активный ингредиент смешивают с фармацевтическим наполнителем, чтобы получить твердую композицию определенного состава, содержащую гомогенную смесь соединения настоящего изобретения. Если эти композиции определенного состава названы гомогенными, активный ингредиент обычно равномерно диспергирован в композиции, так что композиция может быть легко разделена на в равной мере эффективные стандартные дозы, такие как таблетки, пилюли и капсулы. Этот твердый состав тогда разделяют на стандартные дозы типа, описанного выше, содержащие, например, от 0,005 мг до приблизительно 1000 мг L. paracasei CBA L74 настоящего изобретения.
[0073] Композиции могут быть изготовлены в форме стандартных доз, где каждая доза содержит, например, приблизительно от 0,1 мг до приблизительно 50 мг, от приблизительно 0,1 мг до приблизительно 40 мг, от приблизительно 0,1 мг до приблизительно 20 мг, от приблизительно 0,1 мг до приблизительно 10 мг, от приблизительно 0,2 мг до приблизительно 20 мг, от приблизительно 0,3 мг до приблизительно 15 мг, от приблизительно 0,4 мг до приблизительно 10 мг, от приблизительно 0,5 мг до приблизительно 1 мг, от приблизительно 0,5 мг до приблизительно 100 мг, от приблизительно 0,5 мг до приблизительно 50 мг, от приблизительно 0,5 мг до приблизительно 30 мг, от приблизительно 0,5 мг до приблизительно 20 мг, от приблизительно 0,5 мг до приблизительно 10 мг, от приблизительно 0,5 мг до приблизительно 5 мг, от приблизительно 1 мг до приблизительно 50 мг, от приблизительно 1 мг до приблизительно 30 мг, от приблизительно 1 мг до приблизительно 20 мг, от приблизительно 1 мг до приблизительно 10 мг, от приблизительно 1 мг до приблизительно 5 мг, от приблизительно 5 мг до приблизительно 50 мг, от приблизительно 5 мг до приблизительно 20 мг, от приблизительно 5 мг до приблизительно 10 мг, от приблизительно 10 мг до приблизительно 100 мг, от приблизительно 20 мг до приблизительно 200 мг, от приблизительно 30 мг до приблизительно 150 мг, от приблизительно 40 мг до приблизительно 100 мг, от приблизительно 50 мг до приблизительно 100 мг активного ингредиента.
[0074] В некоторых вариантах осуществления таблетки или пилюли настоящего изобретения могут быть покрыты или иным образом сформированы, чтобы получить форму дозы, дающую преимущество пролонгированного действия. Например, таблетка или пилюля может включать внутреннюю дозу и наружный компонент дозы, причем последний имеет форму оболочки, в которой заключена первая. Эти два компонента могут быть разделены энтеросолюбильным слоем, который служит для сопротивления дезинтеграции в желудке и позволяет внутреннему компоненту проходить нетронутым в двенадцатиперстную кишку или задерживаться в высвобождении. Для таких энтеросолюбильных слоев или покрытий могут быть использованы разные материалы, причем такие материалы включают ряд полимерных кислот и смесей полимерных кислот с такими материалами как шеллак, цетиловый спирт и ацетат целлюлозы.
[0075] Жидкие формы, в которые могут быть включены композиции настоящего изобретения для перорального введения или инъекции, включают водные растворы, сиропы подходящего вкуса, водные или масляные суспензии и эмульсии определенного вкуса со съедобными маслами, такими как хлопковое, кунжутное, кокосовое или арахисовое масло, а также эликсиры и подобные фармацевтические средства.
[0076] Пропорция или концентрация композиций изобретения в фармацевтической композиции может меняться в зависимости от ряда факторов, включая дозировку, химические характеристики (например, гидрофобность) и путь введения. Например, L. paracasei CBA L74 изобретения могут быть представлены в капсуле, содержащей приблизительно от 0,005 мг до приблизительно 1000 мг для перорального введения. Альтернативно или дополнительно, дозировка может быть выражена как KOE/г сухой массы. Дозировка может быть разной, но может быть в пределах эквивалента приблизительно от 102 до приблизительно 1012 KOE/г, например. 1×102 KOE/г, 5×102 KOE/г, 1×103 KOE/г, 5×103 KOE/г, 1×104 KOE/г, 5×104 KOE/г, 1×105 KOE/г, 5×105 KOE/г, 1×106 KOE/г, 5×106 KOE/г, 1×107 KOE/г, 5×107 KOE/г, 1×108 KOE/г, 5×108 KOE/г, 1×109 KOE/г, 5×109 KOE/г, 1×1010 KOE/г, 5×1010 KOE/г, 1×1011 KOE/г, 5×1011 KOE/г, 1×1012 KOE/г сухой массы.
Способы использования
[0077] Раскрытые здесь композиции в общем и с изменениями пригодны для стимуляции иммуномодулирующей реакции в мукозальной иммунной системе. Пациента, для которых такая стимуляция полезна, включают имеющих дефицит мукозальной иммунной системы, например, имеющих недостаточно развитую иммунную систему, таких как младенцы или дети, имеющих угнетенную иммунную систему, таких как пожилые люди, пациенты, принимающие иммунодепрессанты, проходящие радиационную или химиотерапию, имеющие гиперактивированную иммунную систему из-за аллергии или аутоиммунных нарушений и страдающие от желудочно-кишечных нарушений. Желудочно-кишечные нарушения могут включать инфекции, вызываемые вирусами, например, ротавирусами, патогенными бактериями, например, Salmonella, Yersinia, Shigella, Listeria, Clostridium, E.coli, Е. sakazaki, H. pylori, или патогенными простейшими, например, Entamoeba histolytica, Cryptosporidium spp, Campylobacter spp. Желудочно-кишечные нарушения могут также включать, например, пищевые аллергии, гиперчувствительность к пище, синдром раздраженного кишечника, воспалительное заболевание кишечника, паучит, болезнь Крона, язвенный колит, глютеновую болезнь, некротический энтероколит и старение, в частности старение желудочно-кишечной системы.
[0078] Пациент получает эффективное лечение, когда появляется клинически благоприятный результат. Это может означать, например, полное разрешение симптомов, связанных с дефицитом мукозальной иммунной системы, уменьшение тяжести симптомов, связанных с дефицитом мукозальной иммунной системы или замедление прогресса симптомов, связанных с дефицитом мукозальной иммунной системы. Эти способы могут кроме того включать этапы а) идентификации пациента (например, более конкретно, пациента-человека), который имеет дефицит мукозальной иммунной системы; и b) предоставление пациенту композиции, содержащей L paracasei CBA L74 изобретения, такой как любой ферментированный пищевой продукт, или композиции, включающей L. paracasei CBA L74 в физиологически приемлемом носителе. Количество такой композиции, предоставляемой пациенту, которое приводит к полному разрешению симптомов, связанных с дефицитом мукозальной иммунной системы, уменьшению тяжести симптомов, связанных с дефицитом мукозальной иммунной системы, или замедление прогресса симптомов, связанных с дефицитом мукозальной иммунной системы, считается терапевтически эффективным количеством. Способы изобретения также могут включать этап мониторинга, чтобы помочь оптимизировать дозировку и график, а также прогнозировать результат.
[0079] Способы, раскрытые в настоящем документе, могут быть применены к широкому кругу видов, например, к людям, приматам кроме людей (например, обезьянам), лошадям, свиньям, коровам или другому крупному рогатому скоту, собакам, кошкам или другим млекопитающим, как домашние животные, крысы, мыши или другие лабораторные животные. Описанные здесь композиции подходят для терапевтических композиций и режимов или для производства медикамента для использования при лечении описанных здесь состояний (например, дефицита мукозальной иммунной системы из-за незрелости, старения, инфекции, пищевых аллергий, воспалительного или аутоиммунного заболевания).
[0080] Описанные здесь питательные композиции могут быть введены перорально как часть обычного повседневного рациона пациента. Пищевые композиции могут быть введены как питательная поддержка как детям, так и взрослым. При изготовлении как фармацевтические средства композиции могут быть введены в любую часть тела пациента для последующей доставки к клетке-мишени. Композиция может быть доставлена, но без ограничения, к мозгу, спинномозговой жидкости, суставам, слизистой носа, крови, легким, кишечнику, мышечным тканям, коже или брюшной полости млекопитающего. В смысле путей доставки композиция может быть введена путем внутривенной, интракраниальной, интраперитонеальной, внутримышечной, подкожной, интраректальной, интравагинальной, интратекальной, интратрахеальной, интрадермальной или трансдермальной инъекции, путем перорального или назального введения или путем постепенной перфузии в течение некоторого времени. В еще одном примере аэрозольный препарат композиции может быть введен пациенту путем ингаляции.
[0081] Независимо от того, приготовлены ли композиции как пищевые продукты или фармацевтические средства, требуемая дозировка будет зависеть от пути введения, характера состава, состояния пациента, например, незрелости иммунной системы или желудочно-кишечного нарушения, размера, массы тела, возраста и пола пациента, назначения других лекарств и мнения лечащих врачей. Подходящие дозировки составляют от 0,01 до 1000 мг/кг. Некоторые типичные дозы составляют приблизительно от 1 мкг/кг до приблизительно 1 г/кг массы тела в сутки. В некоторых вариантах осуществления интервал дозы составляет приблизительно от 0,01 мг/кг до приблизительно 100 мг/кг массы тела в сутки. В некоторых вариантах осуществления доза может составлять, например, 1 мг/кг, 2 мг/кг, 5 мг/кг, 10 мг/кг, 20 мг/кг, 50 мг/кг или 100 мг/кг. Дозировка вероятно будет зависеть от таких переменных как тип и степень прогресса заболевания или нарушения, общего состояния здоровья конкретного пациента, относительной биологической эффективности выбранного соединения, состава наполнителя и пути введения.
[0082] Эффективные дозы могут быть экстраполированы из кривых реакции на дозу, полученных с помощью тестовых систем моделей животных или in vitro. Например, анализ in vitro продукции цитокинов мононуклеарными клетками периферической крови (РВМС) может быть полезен для оценки про- и противовоспалительных реакций, например, секреции IL-1β, IL-12, IL-4, TNF-α или IL-10, соответственно. Композиции также могут быть проанализированы на эффекты на моделях животных, например, на продукцию IgA, продукцию цитокинов эксплантами пейеровых бляшек и реакции дендритных клеток и Т-клеток.
[0083] Следует ожидать широких изменений в необходимой дозировке ввиду разных клеток-мишеней и разной эффективности разных путей введения. Изменения в уровнях дозировки можно регулировать, используя стандартные эмпирические процедуры для оптимизации, которые хорошо известны в данной области. Введение может быть однократным или многократным (например, 2- или 3-, 4-, 6-, 8-, 10-, 20-, 50-, 100-, 150-кратным или больше). Инкапсулирование соединений в подходящем средстве доставки (например, полимерных микрочастицах или имплантируемых устройствах) может повысить эффективность доставки.
[0084] Длительность лечения любой представленной здесь композицией может быть любым - от одних суток до всей жизни пациента (например, в течение многих лет). Например, композиция может быть введена один раз в неделю (в течение, например, от 4 недель до многих месяцев или лет), один раз в месяц (например, от трех до 12 месяцев или в течение многих лет) или один раз в год в течение 5 лет, 10 лет или больше. Также следует сказать, что частота лечения может быть изменена. Например, данные композиции можно вводить один раз (или два раза, три раза и т.д.) ежесуточно, еженедельно, ежемесячно или ежегодно. Если композиции имеют, например, форму пищевого продукта, их можно вводить ежедневно с каждым приемом пищи.
[0085] Для определения того, индуцирована ли конкретная реакция, можно использовать любой способ, известный специалистам в данной области. Для определения, индуцирована ли реакция, можно использовать клинические способы, которые оценивают степень состояния конкретной болезни. Например, пациента можно контролировать на уменьшение симптомов, например, уменьшение колик, диареи, запора, тошноты, рвоты, боли в животе, защемления, изжоги, вздутия живота, метеоризма или недержания. Альтернативно или дополнительно можно использовать сывороточные маркеры, технологии получения изображений, например, ультразвуковые, рентгеновские и эндоскопические способы.
[0086] Композиции можно также вводить вместе с другими терапевтическими способами воздействия. Другие терапевтические способы воздействия могут быть разными, исходя из конкретного заболевания, но могут включать, например, средства против диареи, противорвотные средства, антихолинергические средства, противовоспалительные средства, антибиотики, антигистамины и другие пищевые средства лечения, например, гипоаллергенные детские смеси. Совместное введение двух и более терапевтических средств не требует, чтобы их вводили одновременно или тем же путем, если существует перекрывание по времени, в течение которого эти средства оказывают их терапевтическое действие. Предусматривается одновременное или последовательное введение, как введение в разные дни или недели.
Производственные изделия
[0087] Описанные здесь композиции также могут быть собраны в наборы вместе с инструкциями по применению. Соответственно, упакованные продукты {например, контейнеры, содержащие одну или несколько описанных здесь композиций с L. paracasei CBA L74 и упакованные для хранения, отгрузки или продажи в концентрированной или готовой к использованию форме) и наборы, включающие по меньшей мере одно соединение изобретения и инструкции по применению, также входят в объем изобретения. В любом из упакованных продуктов или наборов композиции с L. paracasei CBA L74 могут включать L. paracasei CBA L74, которые были сделаны нереплицирующимися. Например, наборы могут включать измеренные количества питательной композиции, включающей один или несколько пищевых продуктов, ферментированных L. paracasei CBA L74. Инструкции по применению могут быть предоставлены на любой подходящей среде. Например, они могут быть напечатаны на бумажном вкладыше на одном или нескольких языках или предоставлены в аудио или видео формате (например, на компакт-диске). Упаковочные материалы могут включать такие как, например, флаконы, пакеты, контейнеры. В некоторых вариантах осуществления наборы могут включать измеренные количества композиции, включающей L. paracasei CBA L74 в физиологически приемлемом носителе, вместе с упаковочными материала и инструкциями по применению в любом из вышеуказанных форматов. В некоторых вариантах осуществления наборы могут включать контейнеры, содержащие одну или несколько композиций с L. paracasei CBA L74, например, L. paracasei CBA L74 и фармацевтический носитель, и один или более из подходящего стабилизатора, молекулы носителя, вкусовой добавки и т.д., как подходит для намеченного использования. Продукт может включать контейнер (например, флакон, банка, бутыль, мешок и т.д.), содержащий одну или несколько композиций с L. paracasei CBA L74. Помимо этого, производственное изделие также может включать, например, упаковочные материалы, инструкции по применению, шприцы, буферные растворы или другие контрольные реагенты для лечения или контроля состояния, профилактика или лечение которого требуется. Продукт также может включать легенду (например, напечатанную этикетку или вкладыш или другую среду, описывающую порядок применения продукта (например, аудио или видеоленту). Легенды может быть соединена с контейнером (например, прикреплена к контейнеру) и может описывать порядок, в котором следует принимать содержащееся в нем соединение (например, частоту и путь введения), показания для применения и другие аспекты. Компоненты набора могут подходить для немедленного использования. Соединения могут быть готовыми для введения (например, быть в соответствующих дозе единицах) и могут включать фармацевтически приемлемый адъювант, носитель или другой разбавитель и/или дополнительный терапевтический агент. Изобретение охватывает наборы, однако, которые включают концентрированные составы и/или материалы, которые требуют разбавления перед использованием. Альтернативно, соединения могут быть представлены в концентрированной форме с разбавителем и инструкциями по разбавлению. Компоненты набора могут подходить для немедленного использования. Изобретение охватывает наборы, однако, которые включают концентрированные составы и/или материалы, которые требуют разбавления перед использованием.
Примеры
Пример 1: Выделение и определение характеристик L. paracasei CBA-174
[0088] Мы проанализировали разные штаммы Lactobacilli на их способность ферментировать водные суспензии, содержащие разные концентрации рисовой муки или пшеничной муки. Штамм L. paracasei CBA L74 был выбран для дальнейшего анализа на основании низких значений pH и высоких чисел KOE. Этот штамм был депонирован согласно Будапештскому договору о международном признании депонирования микроорганизмов для целей патентной процедуры 9 сентября 2008 года в Бельгийских координированных коллекциях микроорганизмов (ВССМ) Лаборатории по микробиологии (LMG), Гент, Бельгия. Международный депозитарный орган присвоил ему номер депонирования LMG P-24778.
Пример 2: Приготовление молока, ферментированного L. paracasei CBA L74
[0089] Условия:
• субстрат: 9% восстановленного порошкового молока, добавлена декстроза 0,25%
• тепловая обработка субстрата: ультрапастеризация при 135°C в течение 3 с или эквивалентный F0
• совместный инокулят: 5×106 для Lactobacillus paracasei CBA-L74 5×104 для Streptococcus thermophilus (в качестве закваски для ферментации)
• температура ферментации: 37°C
• время ферментации: 15 часов
• pH во время ферментации: не регулировали
• в конце ферментации pH регулировали до 6,5 с помощью раствора NaOH
• сушка распылением при температуре на входе 190°C и температуре на выходе 90°C
• анализ: подсчет клеток на ферментате для определения Streptococcus thermophilus и Lactobacillus paracasei CBA-L74.
[0090] Посев на чашки: Агар, селективный к Lactobacilli (LBS), использовали для детекции Lactobacillus paracasei CBA-L74. Агар L-M17 использовали для подсчета Streptococcus thermophilus. Оба штамма инкубировали при 37°C в анаэробных условиях. Агар для подсчета колоний на чашках (РСА) использовали для детекции загрязнений и инкубировали при 30°C в аэробных условиях.
[0091] Ферментация: совместный инокулят L. paracasei CBA L74 и S. thermophilus 1773 добавили как свежие культуры. Ферментацию проводили в течение 15 часов до концентрации 108 KOE/мл L. paracasei CBA-L74. Исходный pH составлял 6,6. В конце ферментации pH составил 5,1. pH регулировали до 6,5 путем добавления 2,5Н NaOH. Исходная концентрация L. paracesei CB-74 составляла 5×106 KOE/мл; конечная концентрация составила больше чем 108 KOE/мл. Исходная концентрация Streptococcus thermophilus составляла 5×104 KOE/мл; конечная концентрация составила 1×108 KOE/мл. Исходное совокупное число бактерий при подсчете способом РСА составляло 0 в молоке перед инокуляцией и при Т0, и значение "слишком мало колоний для подсчета" (TFTC) после 15 часов ферментации составило 5×104 KOE/мл; конечная концентрация составила 1×108 KOE/мл.
[0092] Сушка: Ферментат сушили при температуре на входе 190°C и температуре на выходе 90°С. Содержание влаги в порошке после сушки распылением составило 4,87%.
Пример 3: Приготовление овсяной и ячменной муки, ферментированной L. paracasei CBA L74
[0093] Мы приготовили 1 л раствора с содержанием 18,5% (масса/объем) овсяной муки + 5% (масса/масса) муки из солодового ячменя, использовав 185 г овсяной муки и 9,25 г муки из солодового ячменя. Значение pH смеси муки и воды регулировали до 4,00 с помощью 0,5М лимонной кислоты. Ферментер стерилизовали путем автоклавирования. Затем в ферментер поместили смесь из муки, воды и лимонной кислоты.
[0094] Смесь подвергли тепловой обработке при 80°C в течение 30 мин, затем охладили до 37°С. Были проверены три разных набора условий ферментации. Все ферментации были прекращены спустя 16 часов, время, которое совпадало с концом логарифмической фазы роста,
[0095] ИСПЫТАНИЕ №1: L. paracasei CBA L74 добавили к прошедшему тепловую обработку раствору зерновых до конечной концентрации 2,3×106 KOE/мл и инкубировали с перемешиванием при 37°С. Спустя 16 часов подсчет на чашках в MRS составил 7,6×108 KOE/мл (бактерии молочной кислоты); загрязнения, измеренные в РСА, МС и SB были ниже 1000 KOE/мл. Конечный pH составил 3,8. Спустя 20 часов подсчет на чашках в MRS составил 1,2×108 KOE/мл (бактерии молочной кислоты); загрязнения отсутствовали. Спустя 24 часа подсчет на чашках в MRS составил 5×108 KOE/мл (бактерии молочной кислоты); загрязнения отсутствовали. Из-за остановки логарифмической фазы через 16 часов, было предпочтительным прекратить ферментации спустя 16 часов.
[0096] ИСПЫТАНИЕ №2 (стабилизированный pH) Эту ферментацию выполнили с поддержанием pH на 4, используя 2Н NaOH. L. paracasei CBA L74 добавили к прошедшему тепловую обработку раствору зерновых до конечной концентрации 2,1×106 KOE/мл и инкубировали с перемешиванием при 37°С. Спустя 16 часов подсчет на чашках в MRS составил 7,5×108 KOE/мл (бактерии молочной кислоты); загрязнения, измеренные в РСА, МС и SB, были ниже 1000 KOE/мл.
[0097] ИСПЫТАНИЕ #3 (стабилизированный pH) Эту ферментацию выполнили путем поддержания pH на 4, используя 2Н NaOH. L. paracasei CBA L74 добавили к прошедшему тепловую обработку раствору зерновых до конечной концентрации 5,1×106 KOE/мл и инкубировали с перемешиванием при 37°С. Спустя 16 часов подсчет на чашках в MRS составил 2,1×109 KOE/мл (бактерии молочной кислоты); загрязнения, измеренные в РСА, МС и SB, были ниже 1000 KOE/мл.
Пример 4: Приготовление рисовой и пшеничной муки, ферментированной L. paracasei CBA L74
[0098] Мы приготовили 1 л раствора с 15% по массе/объему риса, соединив 150 г риса и 900 мл воды. Смесь приготовили при комнатной температуре и перемешали путем встряхивания в течение нескольких минут при 1000-1300 об/мин. Рисовую смесь обработали путем тиндализации, путем нагрева смеси в приборе до 70°C, выдержки при 70°C в течение 20-30 мин, охлаждения до 30-37°C, выдержки при 30-37°C в течение 20-30 мин, нагрева до 70°C, выдержки при 70°C в течение 20-30 мин, охлаждения до температуры ферментации (37°С) при встряхивании с частотой 150-600 об/мин.
[0099] L. paracasei CBA L74 добавили из высушенной замораживанием пробы до конечной концентрации 1×106 KOE/мл. Высушенная замораживанием проба была ресуспендирована в воде и инкубирована в течение короткого времени при 37°C, чтобы активировать бактерии. После инокуляции смесь гомогенизировали путем встряхивания в течение короткого времени при 300-600 об/мин; во время ферментации раствор встряхивали при 150 об/мин. Ферментацию выполнили при 37°C в течение 24 часов при pO2 <15%. Аликвоты взяли во время инокуляции (ТО), через 16 часов (Т16), 18 часов (Т18), 21 час (Т21) и 24 часа (Т24). После ферментации зерновые нагрели до 50°C при постоянном перемешивании. Нагретые зерновые затем сушили распылением при температуре входящего воздуха Т airin 80°С и температуре выходящего воздуха Т airout 210°С. Конечное содержание влаги составило 6%.
[00100] Пробы проанализировали на агаре Рогозы (+ ванкомицин 12 мкг/мл) (48 часов при 37°С) для количественного определения L. paracasei CBA-174, на РСА на совокупное число аэробов (24 часа при 37°С), на агаре Макконки на колиподобные бактерии и на агаре RCM на клостридии.
[00101] Результаты этой ферментации были следующими:
инокулят (L. paracasei CBA-174): 1×106 (+/-

концентрация L. paracasei CBA L74 после 24 часов ферментации: 1×108 (+/-

загрязнения на РСА перед инокуляцией: <104 KOE/мл
загрязнения на агаре Макконки перед инокуляцией: <104 KOE/мл
загрязнения на RCM перед инокуляцией: <10 KOE/мл
загрязнения на РСА после инокуляции: <104 KOE/мл
загрязнения на РСА после 24 часов ферментации: <104 KOE/мл
pH перед добавлением инокулята: 6 (+/- 0.20)
pH через 16 -18 часов: 3,70 (+/- 0.20)
pH через 24 часа: 3,60 (+/- 0.20).
Пример 5: Действие L. paracasei CBA L74 на дендритные клетки в системе совместного культивирования клеток Сасо2
[00102] Мы проанализировали влияние живых и нереплицирующихся клеток L. paracasei CBA L74 в совместной культуре эпителиальных клеток кишечника (клетки Сасо2) и человеческих дендритных клеток (DC). Клетки Сасо2 были посеяны на мембрану Transwell и спустя приблизительно 3 недели, когда трансэпителиальная устойчивость была адекватной, были дополнены клетками L. paracasei CBA L74 на 96 часов. Человеческие дендритные клетки были отделены от моноцитов периферической крови и посеяны в базальный отсек камеры совместной культуры. Трансэпителиальная устойчивость сохранялась постоянной в ходе всего эксперимента.
[00103] Для того, чтобы охарактеризовать фенотип дендритных клеток, мы контролировали экспрессию совместно стимулирующих молекул (CD80 и CD86), MHC-II и молекул адгезии (CD40) на поверхности дендритных клеток. Для определения профиля цитокинов, продуцируемых дендритными клетками, совместно культивируемыми с эпителиальными клетками кишечника, доступными для L. paracasei CBA L74, мы собрали культурную среду и количественно определили IL-10 и IL-12p70 путем ИФА. Для подтверждения способности клеток Сасо2, доступных для L. paracasei CBA L74, кондиционировать дендритные клетки для содействия пролиферации Т-клеток, мы выполнили анализ путем проточной цитометрии (FACS) и смешали культуры лимфоцитов.
[00104] Как показано в таблице на Фиг. 1, инкубация клеток Сасо2 в течение 24 часов вместе с живыми или инактивированными (тепловая инактивация) L. paracasei CBA L74 модифицировала фенотип совместно культивированных дендритных клеток. Кроме того, присутствие L. paracasei CBA L74 модулировало LPS-опосредованные изменения в фенотипе дендритных клеток.
[00105] Затем мы количественно определили цитокины, высвободившиеся из дендритных клеток, культивированных вместе с клетками Сасо2, кондиционированными L. paracasei (живыми или инактивированными). Как показано на Фиг. 2а, дендритные клетки, культивированные совместно с Сасо2, доступными для живых или инактивированных L. paracasei CBA L74, показали статистически значимое увеличение продукции IL-10. Мы не наблюдали значительного увеличения продукции IL-12 в отсутствие эндотоксина LPS (Фиг. 2b). Однако дендритные клетки сохранили способность реагировать на влияние LPS путем усиленной продукции IL-12, что предполагает, что воздействие L. paracasei CBA L74 не влияло на общую способность дендритных клеток реагировать на патогены.
[00106] Затем мы провели функциональный анализ для проверки способности дендритных клеток, доступных для клеток СаСо2, культивированных в присутствии среды или среды, дополненной L. paracasei, модулировать способность Т-клеток к пролиферации после реакции смешанных лимфоцитов. Как показано на Фиг. 3, мы не наблюдали значительных различий в способности дендритных клеток, культивированных вместе с клетками СаСо2, модифицировать пролиферацию Т-клеток.
[00107] Взятые вместе, эти in vitro данные показывают, что L. paracasei CBA L74, живые или инактивированные теплом, могут влиять на окружающую среду, созданную эпителиальными клетками кишечника, что, в свою очередь, модулирует активность других иммунных клеток, таких как дендритные клетки. Общая картина показывает, что дендритные клетки, доступные для среды, кондиционированной Сасо2, снижают экспрессию активационных маркеров, продуцируют противовоспалительные цитокины, такие как IL-10, при этом сохраняя способность реагировать на LPS путем увеличения продукции IL-12.
Пример 6: Влияние L. paracasei CBA L74 на морфологию, экспрессию цитокинов и врожденный иммунитет во всей интестинальной мукозе
[00108] Мы изучили влияние in vivo путем введения L. paracasei CBA L74 (живых и инактивированных теплом) как пищевой добавки для мышей. После двух недель приема добавки животные были умерщвлены, и вся интестинальная мукоза была проанализирована.
[00109] Морфология мукозы: Мы выполнили окрашивание гематоксилином и эозином введенных в парафин срезов подвздошной области. Ни одна из добавок не оказала значительного влияние на архитектуру кишечника и не привела к инфильтрату воспалительных клеток.
[00110] Экспрессия цитокинов и IgA: Затем мы определили, повлияло ли введение L. paracasei СВA L74 (живых или инактивированных) на уровень противо- и провоспалительных цитокинов в интестинальной мукозе. Как показано на Фиг. 4, введение L. paracasei CBA L74 (живых или инактивированных) значительно снизило уровень IL-1J3, мощного провоспалительного медиатора, в интестинальной мукозе мышей. Как показано на Фиг. 5, мы также наблюдали снижение базового уровня IL-4 в мукозе после введения L. paracasei CBA L74 (живых или инактивированных). В конечном итоге мы определили влияние разных режимов добавок на уровень IgA в мукозе. После двух недель дополнения рациона клетками L. paracasei CBA L74 животные были умерщвлены, и интестинальная мукоза была собрана и гомогенизирована. Совокупный IgA затем был измерен способом ИФА, и значения были нормализованы до совокупных белков мукозы. Как показано на Фиг. 6, инактивированные теплом L. paracasei CBA L74 значительно повысили мукозальный IgA.
Врожденный иммунитет: Мы проанализировали влияние добавок к рациону на уровни толл-подобных рецепторов 2, 4 и 9. Эти рецепторы участвуют в распознании консервативных бактериальных структур и, таким образом, играют основную роль в модуляции реактивности иммунных и неиммунных клеток в отношении микробных консервативных структур. Как показано на Фиг. 7, дополнение рациона L. paracasei CBA L74, живыми или инактивированными теплом, повысило уровни экспрессии TLR2 и TLR4. Мы также оценили влияние дополнения рациона на уровни PPARγ в мукозе. Как показано на Фиг. 8, живые L. paracasei CBA L74 значительно повысили уровень PPARγ.
Пример 7: Влияние L. paracasei СВА L74 на уровни циркулирующих цитокинов
[00111] Для оценки того, могут ли пищевые добавки модифицировать уровень циркулирующих цитокинов, мы измерили влияние введения в пищу штамма (живого или инактивированного) на уровень противо- и провоспалительных цитокинов в сыворотке. Как показано на Фиг. 9а и 9b, живые L. paracasei СВА L74 индуцировали статистически значащее снижение уровня IL-1β и умеренное повышение уровня циркулирующего IL-4, соответственно.
Пример 8: Влияние L. paracasei СВА L74 на активность дендритных клеток и Т-лимфоцитов
[00112] Далее мы сосредоточились на влиянии добавления в пищу L. paracasei CBA L74 на иммунные клетки, соответствующие активности связанной с мукозой иммунной системы, а именно дендритных клеток и лимфоцитов. Мы оценили фенотип дендритных клеток в пейеровых бляшках (ПБ), поскольку эти клетки эффективно создают судьбу антигена и способствуют окружающей среде, которая определяет характер адаптивной иммунной реакции.
[00113] Как показано в таблице на Фиг. 10, добавление L. paracasei СВА L74 (живых или инактивированных) снижало экспрессию костимулирующей молекулы CD80 и молекулы адгезии CD40, тогда как экспрессия MHCII была повышена. Эти данные предполагают, что дендритные клетки из добавленных животным L. paracasei СВА L74, как кажется, меньше готовы взаимодействовать с Т-клетками и создавать иммунную реакцию, но их способность обрабатывать и представлять антигены была сохранена.
[00114] Затем мы определили способность пищевой добавки с L. paracasei СВА L74 модифицировать реактивность дендритных клеток к провоспалительным стимулам (таким как бактериальные LPS и CpG). Доступ дендритных клеток от контрольных мышей к LPS или CpG индуцировал сильное повышение активности CD80 в контрольных дендритных клетках. Добавка с инактивированными теплом дендритными клетками L. paracasei СВА L74 не модифицировала реактивность к воспалительным стимулам. Добавка с живыми бактериями значительно снизила активность CD80, индуцированную LPS и CpG.
[00115] В конечном итоге мы исследовали, влияет ли пищевая добавка с L. paracasei СВА L74 (живыми или инактивированными) на поляризацию интестинальных Т-лимфоцитов (каждого из CD4+ и CD8+) в направлении фенотипа Th1 или Th2. Для этих исследований пейеровы бляшки были подвергнуты действию PHA, сильного, неспецифического стимула, и затем поляризацию лимфоцитов оценили путем окрашивания интракином на IL-4 и IFN-γ. Как показано на Фиг. 11а, в отсутствие РНА ("базальное состояние") в лимфоцитах CD4+, IL-4 и IFN были практически в равновесии. Приблизительно 10-12% клеток были положительными для этих цитокинов. Как показано на Фиг. 11b, для CD8+ лимфоцитов в базальном состоянии существовало небольшое преобладание IL-4 над клетками, экспрессирующими IFN. Воздействие лимфоцитов CD4+ или CD8+ на РНА вызвало сильное увеличение во внутриклеточном окрашивании для IL-4 и IFN-γ со смещением к продукции IFN-γ.
[00116] В клетках CD4+ пищевая добавка с живыми L. paracasei СВА L74 повысило уровни IFN-γ в базальном состоянии. После воздействия РНА не было значительных различий в реакции среди групп с добавками (Фиг. 11а). В лимфоцитах CD8+ пероральная добавка с инактивированными L. paracasei СВА L74 благоприятствовала профилю Th2 со стимуляцией продукции IL-4 по сравнению с продукцией IFN-γ (Фиг. 11b). Противовоспалительный профиль далее поддерживался притупленной реакцией на РНА. Подобная тенденция была также очевидна в лимфоцитах CD8+, выделенных из мышей, получавших добавку с живыми L. paracasei CBA-L74, хотя она была и менее выражена.
Пример 9: Влияние молока, ферментированного L. paracasei CBA L74, на маркеры иммунной системы в интестинальной мукозе
[00117] В течение двух недель мышам давали дважды в день одно из следующего: 1) контроль (фосфатный буфер); 2) снятое молоко (не ферментированное); 3) снятое молоко, ферментированное L. paracasei СВА L74 (1×108 KOE/мл); 4) снятое молоко, ферментированное S. thermophilus (6,7×106 KOE/мл); 5) снятое молоко, ферментированное L. paracasei СВА L74 (1×108 KOE/мл) и S. thermophilus (1,18×107 KOE/мл); 6) снятое молоко, ферментированное L. paracasei СВА L74 (1,9×109 KOE/мл) и S. thermophilus (2,2×108 KOE/мл). В конце лечения животных умертвили, и интестинальную мукозу и пейеровы бляшки взяли и обработали для анализа, который описан ниже.
[00118] Уровни цитокинов в интестинальной мукозе. Как показано на Фиг. 12, добавка со снятым молоком, ферментированным L. paracasei СВА L74, вызвала значительное повышение уровней IL-10 в интестинальной мукозе. Введение снятого молока, ферментированного S. thermophilus, индуцировало небольшое снижение по сравнению с контрольными. Введение молока, ферментированного обоими штаммами в повышенных дозах индуцировано повышение в 2,1 раза уровня мукозального IL-10. Ни одно из лечений не оказало значащего влияния на мукозальный IL-1β, хотя добавка со снятым молоком, ферментированным L. paracasei СВА L74, вызвала небольшое повышение мукозальных уровней этого цитокина.
[00119] Активность миелопероксидазы в интестинальной мукозе. Активность миелопероксидазы (МРО) анализировали в гомогенатах интестинальной мукозы. Введение неферментированного молока или молока, ферментированного разными бактериями, не индуцировало статистически значащих различий в активности миелопероксидазы, хотя существовало небольшое повышение активности МРО, наблюдавшееся в мукозе животных, получавших неферментированное молоко.
[00120] Уровни IqA в интестинальной мукозе. Как показано на Фиг. 14, добавка с неферментированным снятым молоком вызвала значительно увеличение содержания IgA в интестинальной мукозе. Это увеличение не наблюдалось у животных, получавших снятое молоко, ферментированное только L. paracasei CBA L74 или только S. thermophilus. Введение молока, ферментированного обоими штаммами в повышенной дозе, индуцировало повышение мукозального IgA.
[00121] Уровни TLR2, TLR4, TLR9 и PPARγ в интестинальной мукозе. Далее мы определили путем вестерн-блоттинга мукозальные уровни основных рецепторов врожденной иммунной системы. Как показано на Фиг. 15, не один из видов лечение не оказал значащего влияния на экспрессию рецептора TLR4. Неферментированное молоко вызвало умеренное повышение уровня TLR2. Введение снятого молока, ферментированного только L. paracasei CBA L74 или S. thermophilus или ими в сочетании в пониженной дозе предотвращало этот эффект. Умеренное повышение, сравнимое с введением только молока, в уровне TLR2 было также очевидно у мышей, получавших молоко, ферментированное обоими штаммами в повышенной дозе. Введение только снятого молока оказало большое влияние на уровни TLR9, тогда как введение молока, ферментированного обоими штаммами, восстановило мукозальные уровни, сравнимые с контрольными. Как показано на Фиг. 15, введение неферментированного молока как такового вызвало сильное повышение в мукозальном PPARγ. Подобный эффект был очевиден у мышей, получавших снятое молоко, ферментированное L. paracasei CBA L74, и пониженную дозу молока, ферментированного обоими штаммами.
[00122] Уровни pNF-kB и IKB в интестинальной мукозе. Мы определили состояние активации NF-κВ, основного фактора транскрипции, вовлеченного как в воспаление кишечника, так и в выживание эпителиальных клеток. Как показано на Фиг. 16, активированный NF-κВ (pNF-κВ) мог быть определен в контрольной нормальной мукозе. После разных видов лечения мы наблюдали только небольшое увеличение уровней pNF-kB в мукозе мышей, получавших снятое молоко, ферментированное только L. paracasei CBA L74 или S. thermophilus, тогда как у мышей, получавших снятое молоко, ферментированное обоими штаммами, pNF-κВ был совместим с контролем. Это повышение уровня pNF-κВ было параллельно исчезновению ингибирующего субзвена NF-κВ, IKB, которое не было обнаружено в мукозе мышей, получавших снятое молоко, ферментированное только L. paracasei CBA L74 или S. thermophilus. Мыши, получавшие снятое молоко, ферментированное обоими штаммами, показали уровни IkB, сравнимые с контрольными.
Пример 10: Влияние молока, ферментированного L. paracasei CBA L74, на фенотип дендритных клеток в интестинальной мукозе
[00123] Фенотип дендритных клеток, экстрагированных из пейеровых бляшек. Мы исследовали влияние пищевой добавки на фенотип интестинальных дендритных клеток. Результаты этого анализа показаны на Фиг. 17. Введение молока, ферментированного только L. paracasei, а также L. paracasei и S. thermophilus в пониженной и повышенной дозе, дало статистически значащее снижение экспрессии CD80 и CD86 по сравнению с контрольными мышами (* означает p<0,05 против контроля), тогда как уровни HLAII и CD40 в общем остались стабильными. Данные на Фиг. 17 выражены как средние ± С.О. из трех разных экспериментов.
[00124] Реакции дендритных клеток, доступных для LPS/CpG. Мы определили способность пищевой добавки модифицировать способность дендритных клеток реагировать на провоспалительные стимулы (такие как бактериальные LPS и CpG). Как показано на Фиг. 18, воздействие LPS и CpG на дендритные клетки, выделенные из контрольных животных, вызвало значительно увеличение экспрессии CD80 (* означает p<0,05 против нестимулированных дендритных клеток контрольных мышей). Подобный эффект наблюдался для очищенных дендритных клеток мышей, получавших неферментированное молоко (° означает p<0,05 против нестимулированных дендритных клеток мышей, получавших неферментированное молоко). Введение только снятого молока, ферментированного только L. paracasei СВА L74, полностью предотвращало LPS-опосредованные эффекты у мышей, получавших неферментированное молоко, хотя оно было менее эффективно при повышении активности CD80, индуцированным CpG. Снятое молоко, ферментированное только S. thermophilus, предотвращало эффекты LPS и CpG и уменьшало экспрессию CD80. В конечном итоге, введение снятого молока, ферментированного обоими штаммами, предотвращало повышение активности CD80, индуцируемое LPS и CpG, и поддерживало экспрессию CD80 на базальных уровнях. Данные на Фиг. 18 выражены как среднее ± С.О. из трех разных экспериментов.
Пример 11: Влияние молока, ферментированного L. paracasei СВА L74, на фенотип Т-лимфоцитов в интестинальной мукозе
[00125] Реакции интестинальных лимфоцитов CD4+ и CD8+, доступных для РИА. Мы задали вопрос, повлияет ли пищевая добавка с молоком (ферментированным или неферментированным) на поляризацию интестинальных Т-лимфоцитов (CD4+ и CD8+) к фенотипу Th1 или Th2. Лимфоциты, полученные из пейеровых бляшек, были подвергнуты действию PHA, и затем поляризацию лимфоцитов оценили путем окрашивания на внутриклеточные IL-4 и IFN-γ.
[00126] Как показано на Фиг. 19, действие РНА значительно повысило продукцию IL4 и IFNγ в лимфоцитах CD4+ по сравнению с контрольными мышами (* означает p<0,05 против нестимулированных лимфоцитов от контрольных мышей). Эта индукция не наблюдалась у мышей, получавших неферментированное или ферментированное молоко. После введения неферментированного молока лимфоциты CD4+ показали повышенные базальные уровни IL4 и IFN-γ по сравнению с контрольными животными (° означает р<0,05 против нестимулированных лимфоцитов от контрольных мышей). Эти данные предполагают, что введение ферментированного молока предотвратило неспецифическую активацию и поддерживало продукцию IL4 и IFN-γ на базальных уровнях.
[00127] Как показано на Фиг. 20, действие PHA на интестинальные лимфоциты CD8+ по сравнению с контрольными мышами повысило продукцию IL4 и IFNγ (* означает p<0,05 против нестимулированных лимфоцитов от контрольных мышей). Эта индукция не наблюдалась у мышей, получавших неферментированное или ферментированное молоко. Введение молока, ферментированного L. paracasei и S. thermophilus в повышенной дозе, снизило базальную продукцию IL4, тогда как после стимуляции с помощью PHA уровни IL4 и IFNγ снизились по сравнению со стимулированными лимфоцитами от контрольных мышей (§ означает p<0,05).
Пример 12: Влияние молока, ферментированного L. paracasei CBA L74 на гистологию интестинальной мукозы
[00128] Для определения распределения пролиферирующих клеток в интестинальной мукозе мы выполнили иммуногистохимический анализ экспрессии Ki67, антигена, экспрессируемого делящимися клетками. У контрольных мышей была четкая иммунореактивность в интестинальных криптах, тогда как окрашивания на ворсинках не было. В ткани мышей, получавших неферментированное молоко была более сильная экспрессия в криптах, хотя эктопической экспрессии антигена не было. У мышей, получавших другой вид ферментированного молока, мы наблюдали сравнимые формы окрашивания. Мы выполнили гистологическую оценку идеальной мукозы в разных экспериментальных группах. Результаты этого исследования показаны на Фиг. 21. Введение неферментированного молока уменьшило число и длину интестинальных ворсинок, тогда как интестинальная морфология сохранилась у животных, получавших разные формы ферментированного молока.
Пример 13: Влияние риса, ферментированного L. paracasei CBA L74, на маркеры иммунной системы в интестинальной мукозе
[00129] Эти эксперименты были выполнены для оценки иммуномодулирующих свойств зерновых, ферментированных L. paracasei CBA-L74. Исследования включали ежесуточное внутрижелудочное введение в течение двух недель: 1) неферментированного риса; 2) ферментированного риса (L. paracasei CBA L74) 100 мг/сутки (соответствует 2×108 КОЕ/л L. paracasei CBA-L74) и 3) ферментированного риса (с L. paracasei CBA L74) 500 мг/сутки (соответствует 109 КОЕ/л L. paracasei CBA-L74). Мыши в период экспериментов не показали каких-либо признаков болезней или диареи. В конце экспериментов мышей умертвили, и пейеровы бляшки (ПБ) были взяты асептическим образом. Эпителиальные клетки были отделены от ПБ путем инкубации в HBSS без Са2+ плюс EDTA, и затем ткани были подвергнуты ферментному расщеплению. Клеточную суспензию промыли, повторно суспендировали в холодной RMPI и использовали для последующих испытаний.
[00130] Вначале мы исследовали влияние разных пищевых добавок на всю интестинальную мукозу. Во-первых, мы выполнили окрашивание гематоксилином и эозином введенные в парафин срезы подвздошной кишки. Ни одна из пищевых добавок не оказала значительного влияния на интестинальную архитектуру и не вызвала инфильтрата воспалительных клеток.
[00131] Затем мы определили, повлияло ли введение риса, ферментированного L. paracasei CBA L74, на уровень противо- и провоспалительных цитокинов в интестинальной мукозе. Как показано на Фиг. 22, введение риса или ферментированного риса повысило уровни мукозальных IL-1β и IL-4. Введение ферментированного риса в наивысшей дозе вызвало снижение уровня IL-10, как показано на Фиг. 23.
[00132] Затем мы определили влияние разных пищевых добавок на уровень мукозального IgA. После двух недель получения добавки животные были умерщвлены, интестинальную мукозу собрали и гомогенизировали. Совокупный уровень IgA был измерен с помощью ИФА, и значения были нормализованы до совокупных мукозальных белков. Ни одна из добавок не оказала значительного влияния на мукозальный IgA.
[00133] Мы проанализировали влияние риса или риса, ферментированного L. paracasei CBA L74, на врожденный иммунитет интестинальной мукозы. Как показано на Фиг. 24, пищевые добавки с рисом и ферментированным рисом (малая доза) оказали только умеренное влияние на мукозальные TLR. Как показано на Фиг. 25а, пищевая добавка с неферментированным рисом резко повысила уровни мукозальных рецепторов PPARγ. Высокие дозы ферментированного риса также повышали уровни мукозальных PPARγ. Как показано на Фиг. 25b, введение пищевой добавки с неферментированным рисом в течение двух недель уменьшило активацию NF-κВ и повысило IKB в мукозе. Добавка с ферментированным рисом в малых дозах не оказала влияния по сравнению с контролем, тогда как повышенная доза оказывала влияние, сравнимое с влиянием, наблюдавшимся с неферментированным рисом.
[00134] Мы также измерили влияние введения пищевых добавок на уровни противо- и провоспалительных цитокинов в сыворотке. Пищевые добавки с рисом или ферментированным рисом (малая доза) не оказали влияния на уровни IL-1β и IL-4 в сыворотке.
Пример 14: Влияние риса, ферментированного L. paracasei CBA L74, на фенотип дендритных клеток в интестинальной мукозе
[00135] Далее мы сосредоточились на воздействии пищевых добавок с неферментированным рисом или рисом, ферментированным L. paracasei CBA L74, на иммунные клетки, относящиеся к активности иммунной системы, связанной с мукозой, а именно дендритные клетки и лимфоциты. Сначала мы пометили суспензию одиночных клеток веществом против CD1 (чтобы идентифицировать дендритные клетки) и против каждого из CD-80 и CD-86, MHC-II и CD-40, чтобы определить уровень активности и зрелости интестинальных дендритных клеток в этих лимфоидных органах. Как показано в таблице на Фиг. 26, мы наблюдали значительное влияние ферментированного риса в высокой дозе на фенотип дендритных клеток. Добавки с неферментированным рисом (в этих экспериментах мы использовали две разные дозы) не оказали влияния, тогда как влияние ферментированного риса на уровни CD80, CD40 и МНС-II было очевидно при дозе 100 мг/сутки и было более выраженным при 500 мг/сутки.
[00136] Далее мы определили способность пищевых добавок с рисом или с рисом, ферментированным L. paracasei CBA L74, модифицировать реактивность дендритных клеток на провоспалительные стимулы (такие как бактериальные LPS и CpG). Как показано в таблице на Фиг. 27, воздействие LPS или CpG на дендритные клетки от контрольных мышей индуцировало повышение активности CD80 в контрольных дендритных клетках. Добавки с неферментированным рисом не модифицировало реактивность на воспалительные стимулы. Добавки с испытанной дозой ферментированного риса снижало повышение активности CD80, индуцируемое LPS и CpG.
Пример 15: Влияние риса, ферментированного L. paracasei CBA L74, на фенотип Т-лимфоцитов в интестинальной мукозе
[00137] Мы исследовали, способны ли пищевые добавки с рисом или рисом, ферментированным L. paracasei CBA L74, влиять на поляризацию интестинальных Т-лимфоцитов (CD4+ и CD8+) к фенотипу Th1 или Th2. Лимфоциты, полученные из пейеровых бляшек, были подвергнуты действию РНА, и затем поляризацию лимфоцитов оценили путем окрашивания интракином на IL-4 и IFN-γ.
[00138] Результаты этого эксперимента с лимфоцитами CD4+ и CD8+ показаны на Фиг. 28 и 29, соответственно. Как показано на Фиг. 28, в базальном состоянии в лимфоцитах CD4+ IL-4 и IFNγ были почти в равновесии, поскольку приблизительно 10-12% клеток положительные на эти цитокины. Как показано на Фиг. 29, в CD8+ в базальном состоянии было небольшое преобладание клеток, экспрессирующих IL-4 по сравнению с IFNγ. Действие PHA на лимфоциты CD4+ и CD8+ вызвало сильное увеличение во внутриклеточном окрашивании для IL-4 и IFNγ при доминировании продукции IFNγ.
[00139] У мышей, получавших неферментированный рис, мы наблюдали преобладание продукции IL-4 (фенотип Th2) как в базальном состоянии, так и после РНА-стимуляции для лимфоцитов CD4+ и CD8+. Однако продукция IL-4 была связана с персистенцией продукции IFNγ в базальном состоянии, и после РНА-стимуляции мы наблюдали повышенную экспрессию этого цитокина, хотя реакция была не такой явной как у контрольных клеток. У мышей, получавших ферментированный рис в базальном состоянии, мы наблюдали преобладание IFNγ-положительных клеток по сравнению с IL-4, хотя в базальном состоянии процентное отношение было сравнимым (для CD4+) или немного меньшим (для CD8+) по сравнению с контролем. После РНА-стимуляции в обеих клеточных популяциях реакция цитокинов была не такой явной как у контрольных мышей, хотя и направленной на фенотип Th1 (преобладание IFNγ-положительных клеток).
Пример 16: Влияние L. paracasei CBA L74 на продукцию IL-10 в полученных из моноцитов дендритных клетках (MoDC) в присутствии Salmonella typhimurium
[00140] Мы проверили способность клеток L. paracasei СВА L74 и супернатантов клеток L. paracasei CBA L74 индуцировать продукции, противовоспалительного цитокина IL-10 в человеческих MoDC в присутствии бактериального патогена Salmonella typhimurium. Человеческие MoDC были получены по меньшей мере от четырех и в некоторых случаях от семи доноров. Как показано на Фиг. 30, все клетки Salmonella typhimurium ("FB62"), контрольный штамм Lactobacillus, L. paracasei 21060 ("В21060") и L. paracasei CBA L74 ("CBAL74") индуцировали продукцию IL-10. Напротив, хотя супернатант Salmonella typhimurium ("sn fb62") индуцировал продукцию IL-10, супернатанты Lactobacilli, штамм Lactobacillus, L. paracasei 21060 ("sn b21060") и L. paracasei СВА L74 ("sn cbal74") не индуцировали. Совместная инкубация супернатанта L. paracasei CBA L74 с Salmonella typhimurium ("sn cbal74 + FB62") индуцировала IL-10 до уровней выше тех, которые наблюдались только с Salmonella typhimurium ("sn fb62 + FB62"). Представляет интерес, что подобный эффект наблюдали, даже если MoDC были предварительно кондиционированы супернатантом L. paracasei CBA L74 только в течение одного часа и затем промыты, чтобы удалить супернатант ("1h sn cbal74 + FB62").
Пример 17: Влияние L. paracasei CBA L74 на продукцию IL-12p70 в полученных из моноцитов дендритных клетках (MoDC) в присутствии Salmonella typhimurium
[00141] Мы проверили способность клеток L. paracasei CBA L74 и супернатантов клеток L. paracasei CBA L74 индуцировать продукцию провоспалительного цитокина IL-12p70 в человеческих MoDC в присутствии бактериального патогена Salmonella typhimurium. Человеческие MoDC были получены по меньшей мере от четырех и в некоторых случаях от семи доноров. Результаты этого эксперимента показаны на Фиг. 31. В противоположность результатам, полученным в Примере 16 для противовоспалительного цитокина, мы обнаружили, что Salmonella typhimurium ("FB62") индуцировал высокие уровни IL-12p70, тогда как контрольный штамм Lactobacillus, L. paracasei 21060 ("В21060") и клетки L. paracasei CBA L74 ("CBAL74") индуцировали только низкие уровни IL-12p70. Здесь также супернатант Salmonella typhimurium ("sn fb62") индуцировал продукцию IL-12p70, но супернатанты обоих штаммов Lactobacillus, L. paracasei 21060 ("sn b21060") и L. paracasei CBA L74 ("sn cbal74") не индуцировали. Совместная инкубация супернатанта L. paracasei CBA L74 с Salmonella typhimurium ("sn cbal74 + FB62") вызвала сильное уменьшение продукции IL-12p70. Этот эффект наблюдался, даже если MoDC были предварительно кондиционированы супернатантом L. paracasei CBA L74 в течение только одного часа и затем промыты, чтобы удалить супернатант ("1h sn cbal74 + FB62"). Это уменьшение превзошло наблюдавшееся для контрольных клеток Lactobacillus, L. paracasei 21060 ("1h sn b21060 + FB62"). Эти данные предполагают, что и L. paracasei CBA L74, и супернатант культуры L. paracasei CBA L74 имеют противовоспалительные свойства, которые могут снижать воспаление, индуцированное бактериальным патогеном Salmonella typhimurium.
Пример 18: Влияние молока, ферментированного L. paracasei CBA L74, на продукцию IL-10 в полученных из моноцитов дендритных клетках (MoDC) в присутствии Salmonella typhimurium
[00142] Мы проверили способность молока, ферментированного L. paracasei CBA L74, индуцировать продукцию противовоспалительного цитокина IL-10 в человеческих MoDC в присутствии бактериального патогена Salmonella typhimurium. Результаты этого эксперимента показаны на Фиг. 32. Хотя инактивированные MoDC обычно не продуцируют IL-10, мы обнаружили, что инкубация MoDC с молоком, ферментированным L. paracasei CBA L74, индуцировала зависимую от дозы продукцию IL-10 (смотрите "matrice CBAL74 1.41gr/100ml" и "matrice CBAL74 0.14gr/100ml"). Эта способность сохранялась даже в присутствии Salmonella typhimurium (смотрите "matrice CBAL74 1.41gr/100ml + FB62" и "matrice CBAL74 0.14gr/100ml + FB62").
[00143] На Фиг. 32 также показано, что L. paracasei CBA L74, которые были активированы теплом ("6.3*106 CFU CBA74 boiled"), обработкой параформальдегидом ("6.3*106 CFU CBA74 PFA") или замораживанием - оттаиванием ("6.3*106 CFU CBA74 F&T"), сохранили способность индуцировать IL-10.
[00144] Как мы наблюдали для питательных сред L. paracasei CBA L74, молоко, ферментированное L. paracasei CBA L74, вызывало значительное, зависящее от дозы уменьшение продукции IL-12p70, индуцируемой Salmonella typhimurium (Фиг. 33). Молоко, ферментированное S. thermophilus, вызывало увеличение продукции IL-12p70 в присутствии Salmonella typhimurium. Однако молоко, ферментированное L. paracasei CBA L74, не стимулировало продукцию IL-12p70, соответствуя противовоспалительным свойствам L. paracasei CBA L74. Эти данные предполагают, что L. paracasei CBA L74 сохранили свои противовоспалительные свойства даже в присутствии более провоспалительных видов.
Пример 19: Влияние супернатантов клеток L. paracasei CBA L74 на продукцию IL-10 и IL12p70 в полученных из моноцитов дендритных клетках (MoDC) в присутствии Enterobacter sakazaki
[00145] Мы проверили способность супернатантов клеток L. paracasei CBA L74 индуцировать продукцию противовоспалительного цитокина IL-10 и провоспалительного цитокина IL-12p70 в человеческих MoDC в присутствии бактериального патогена Enterobacter sakazaki. Мы проверили два штамма Е. sakazaki, N9 и N13. Е. sakazaki индуцировали продукцию IL-10 и IL-12p70 в человеческих MoDC. Добавление супернатантов клеток L. paracasei CBA L74 привело к увеличению в IL-10 и значительному уменьшению в IL-12p70.
Пример 20: Влияние риса, ферментированного L. paracasei CBA L74, на продукцию цитокинов в модели эксплантата ткани в присутствии Salmonella typhimurium
[00146] Эпителий кишечника мыши использовали для создания трехмерной системы совместного культивирования, которая описана в Abud (Exp. Cell Res. 303: 252-262 (2005)). Эксплантаты ткани культивировали в течение 24 часов в присутствии 100% O2 с давлением 1 атмосфера. Нижняя камера содержала 1 мл hEC DMEM плюс ITS-X и EGF. Верхняя камера содержала 200 мл среды плюс или S. typhimurium, рис, ферментированный L. paracasei CBA L74, или рис, ферментированный сочетанием S. typhimurium и L. paracasei CBA L74. Супернатанты собрали, и уровни IL-1β, TNF-α и IL-10 проанализировали путем ИФА. Как показано на Фиг. 33, добавление ферментированного риса значительно уменьшило продукцию провоспалительных цитокинов IL-1β и TNF-α в присутствии S. typhimurium при только умеренном воздействии на уровни противовоспалительного цитокина IL-10.
[00147] Следует понимать, что настоящее изобретение никоим образом не ограничено только раскрытыми выше и показанными на чертежах конкретными конструкциями, но также включает любые модификации или эквиваленты в пределах объема формулы изобретения.
Реферат
Группа изобретений относится к фармацевтической промышленности, а именно к композиции и способу для модуляции мукозальной иммунной системы. Представлены: - композиция для стимулирования мукозальной иммунной системы кишечника, отличающаяся тем, что композиция включает эффективное количество супернатанта культуры пробиотических бактерий Lactobacillus paracasei СБА L74, имеющих номер международного депонирования LMG Р-24778, и физиологически приемлемый носитель; - cпособ модулирования мукозальной иммунной системы кишечника у субъекта, отличающийся тем, что указанный способ включает: идентификацию субъекта, нуждающегося в модуляции иммунной системы; и введение эффективного количества супернатанта культуры пробиотических бактерий Lactobacillus paracasei СБА L74, имеющих номер международного депонирования LMG Р-24778; - питательный набор для стимулирования мукозальной иммунной системы кишечника, включающий эффективное количество супернатанта культуры пробиотических бактерий Lactobacillus paracasei СБА L74, имеющих номер международного депонирования LMG Р-24778, и упаковочный материал и/или вкладыш в упаковку, содержащий инструкции по применению. Вышеописанные композиция, способ и набор эффективны для модуляции мукозальной иммунной системы. 3 н. и 8 з.п. ф-лы, 20 пр., 39 ил.
Формула
Документы, цитированные в отчёте о поиске
Пробиотические композиции и способы

Комментарии