Комплексы антител с несколькими цитокинами - RU2263118C2
Код документа: RU2263118C2
Чертежи













































Описание
Данная заявка основана на приоритете заявки на патент США №60/147924, поданной 9 августа 1999 г., содержание которой включено сюда ссылкой на нее.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способам конструирования и экспрессии белковых комплексов с несколькими цитокинами и композициям с их участием. Более конкретно, изобретение относится к слитым белкам, составленным из нескольких цитокинов и адресующего компонента, и способам использования таковых в лечении заболеваний, таких как рак и вирусная инфекция.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Регуляторные цепи, контролирующие иммунную систему, основываются на секретируемых молекулах сигнальных белков, которые называются цитокинами, предназначенных для включения и выключения функций иммунных клеток и для регуляции их пролиферации. В этих реакциях в общем случае участвуют несколько цитокинов, которые для достижения необходимого биологического эффекта действуют согласованно. Некоторые цитокины, такие как интерлейкин-2 (IL-2), могут самостоятельно индуцировать пролиферацию иммунных клеток и могут активировать другие функции, в том числе секрецию вторичных цитокинов. Другой цитокин, интерлейкин-12 (IL-12) (см. Обзор: Trinchieri // Stood. 1994. Т. 84. С.4008-4027) может индуцировать пролиферацию определенных иммунных клеток и индуцировать другой иммуномодулятор - интерферон-γ (ИФН-γ). Эта индукция ИФН-γ является главной функцией IL-12, хотя IL-12 имеет и другие важные функции, не связанные с ИФН-γ. Поскольку сам IL-12 в случае инфекционного заболевания индуцируется на его ранней стадии, полагают, что он связывает врожденную и приобретенную иммунные системы.
Многочисленные исследования in vitro и на мышиных, и на человеческих иммунных клетках продемонстрировали важность комбинаций цитокинов в развитии оптимальных иммунных реакций. Например, большинство Т-клеток не экспрессируют рецепторы IL-12 (IL-12R) до тех пор, пока их не индуцируют митогенами или не культивируют в присутствии высоких концентраций IL-2 (Desai и др. // J. Immunol. 1992. Т. 148. С.3125-3132). Как только рецепторы экспрессированы, клетки становятся более восприимчивыми к IL-12. Кроме того, IL-12 индуцирует транскрипцию ИФН-γ, но мРНК ИФН-γ после этого быстро разрушается. В присутствии IL-2 мРНК стабилизируется, что приводит к резкому повышению продуцирования ИФН-γ (Спал и др. // J. Immunol. 1992. Т. 148. С.92-98). В других исследованиях было обнаружено, что комбинации цитокинов: IL-3 плюс IL-11 или IL-3 плюс фактор Стила обладают синергидным с IL-12 действием на пролиферацию ранних клеток-предшественников системы кроветворения (Trinchieri, 1994; цитировано выше). Комбинация интерлейкина-4 и гранулоцитного фактора стимуляции образования колоний макрофагами (granulocyte macrophage colony stimulating factor - GM-CSF) особенно полезна для стимуляции дендритных клеток (Palucka и др. // J. Immunology. 1998. Т. 160. С.4587-4595). Для стимуляции опосредованной клетками иммунной реакции полезно также комбинировать IL-12 с IL-18 - недавно открытым запускающим путь Тп1 лимфокином с некоторыми функциями, комплементарными к функциям IL-12 (Hashimoto и др. // J. Immunol. 1999. Т. 163. С.583-589; Barbulescu и др. // J. Immunol. 1998. Т. 160. С.3642-3647). Кроме того, IL-2 и ИФН-γ в некоторых ситуациях обладают синергидным действием (Palladino М.А. // Патент США №5082658).
Во многих таких исследованиях синергизма было обнаружено, что очень важно относительное содержание каждого цитокина. При том, что добавление IL-12 в присутствии субоптимальных количеств IL-2 синергидно действовало на индукцию пролиферации, цитолитическую активность и индукцию ИФН-γ, было показано, что комбинации IL-2 с IL-12 при высокой дозе одного из цитокинов давали антагонистический эффект (Perussia и др. // J. Immunol. 1992. Т. 149. С.3495-3502; Mehrotra и др. // J. Immunol. 1993. Т. 151. С.2444-2452). Подобная же ситуация обнаруживалась при комбинациях IL-12 и IL-7.
Исследования синергизма действия IL-12 и других цитокинов в порождении антиопухолевых реакций у мышей также дали неоднозначные результаты. В некоторых моделях при субоптимальных дозах каждого цитокина обнаруживался синергизм, а более высокие дозы давали повышенную токсичность. На других моделях комбинации IL-12 и IL-2 обладали очень слабым или вообще не обладали синергидным действием (см., например, Nastala и др. // J. Immunol. 1994. Т. 153. С.1697-1706). Эти результаты могут быть следствием того, что in vivo трудно объединить два потенциально синергидных агента, особенно если необходимо поддерживать фиксированное соотношение активностей двух агентов с различными фармакокинетическими свойствами, такими как время полужизни в кровотоке и распределение в организме.
В опытах в культурах клеток in vitro достаточно просто контролировать уровни содержания цитокинов, но in vivo на относительное распределение в организме и локализацию цитокинов может действовать много факторов, что влияет на их иммуностимулирующую способность. Наиболее важным из этих факторов является время полужизни. Время полужизни IL-2 в кровотоке после инъекции болюса составляет около 10 мин. В противоположность этому, было отмечено, что время полужизни IL-12 в кровотоке составляет более 3 ч у мышей (Wysocka и др. // Eur. J. Immunol. 1995. Т.25. С.672) и от 5 до 10 ч у людей (Lotze и др. // Ann NY Acad Sci. 1996. Т.795. С.440-454).
Полагают, что это различие связано с относительно малыми размерами IL-2 и GM-CSF (15-25 кДа против 75 кДа у IL-12), вследствие чего IL-2 и GM-CSF выводятся фильтрацией через почки. Обычно фильтрацией через почки выводятся белки с молекулярным весом менее 50 кДа. Почти все цитокины имеют молекулярный вес менее 50 кДа и подвергаются подобному быстрому выведению фильтрацией через почки. Если необходимо лечение такими двумя небольшими, быстро выводящимися цитокинами, достаточно просто вводить цитокины вместе. Однако для цитокинов с существенно различными временами полужизни совместное введение не является оптимальным.
Системное введение цитокинов затруднено из-за их вредных побочных эффектов. Например, значительное побочное действие наблюдается при введении больших количеств интерферона-альфа, в том числе токсичность для кожи, нервной, иммунной и эндокринной систем. Ожидается, что слияние нескольких цитокинов может дать особенно серьезные побочные эффекты.
Одна из стратегий для уменьшения побочного действия системного введения цитокинов состоит в слиянии цитокина со второй молекулой со способностью к целенаправленному адресованию. Слитые белки, в которых область Fc иммуноглобулина помещена на N-конце другого белка (называемые «иммунофузинами» или слияниями «Fc-X», где Х обозначает лиганд, такой как интерферон-альфа), обладают многими отчетливо выраженными полезными биологическими свойствами (Lo и др. // Патенты США №№5726044 и 5541087; Lo и др. // Protein Engineering. T. 11. С.495). В частности, такие слитые белки могут связываться с подходящими рецепторами для Fc на поверхности клеток. Однако при связывании лиганда со своим рецептором на клеточной поверхности ориентация области Fc меняется, и оказывается, что это препятствует действию последовательностей, которые определяют зависящую от антител опосредованную клетками цитотоксичность (ADCC) и связывание комплемента. В результате область Fc в молекуле Fc-X перестает эффективно направлять ADCC и связывание комплемента. Цитотоксический эффект вследствие слияния N-концевого цитокина и С-концевой области Fc хорошо известен. Например, слияние IL-2 с N-концом области Fc дает молекулу, способную в результате связываться с клетками, имеющими рецептор для IL-2, связывать комплемент и лизировать клетки (Landolfi N.F. // Патент США №5349053, 1993 г.). Наоборот, слитые белки Fc-IL-2 не обладают таким свойством. Таким образом, ожидается, что слияния Fc-X будут иметь полезные качества - увеличенное время полужизни в сыворотке и преимущественное концентрирование в печени без нежелательных эффектов в виде ADCC и связывания комплемента.
Было продемонстрировано, что с областью Fc в конфигурации Fc-X могут быть слиты многие разнообразные белки с коротким временем полужизни в сыворотке, и полученные слияния имеют значительно большее время полужизни в сыворотке. Однако времена полужизни в сыворотке двух различных слияний с Fc в общем случае не будут одинаковыми. Поэтому, если необходима доставка двух различных составляющих X, совместное введение двух различных слитых белков Fc-X в большинстве случаев не будет оптимальным.
При некоторых ситуациях наилучший способ адресованно направить действие цитокина на антиген клеточной поверхности состоит в слиянии его с антителом (или полученным из него фрагментом), имеющим специфичность и сродство (аффинность) к этому антигену (Gillies // Патент США №5650150; Gillies и др. // Ргос. Natl. Acad. Sci. USA. T. 89. С.1428), или в соединении пептидной связью белкового антигена и стимулирующего цитокина в форме слитого белка (Hazama и др. // Vaccine. Т.11. С.629). Хотя антитела сами по себе могут увеличить время полужизни слитого с ними цитокина, между слияниями различных цитокинов с одним и тем же антителом могут еще существовать различия (см., например, Gillies и др. // Bioconjugate Chem. 1993. Т.4. С.230-235; Gillies и др. // J. Immunol. T.160. С.6195-6203), которые затрудняют их совместную локализацию на участке-мишени. Как обсуждалось выше, это может привести к дисбалансу в активностях цитокинов и к уменьшению желаемого синергидного действия. Кроме того, при использовании двух различных слитых белков необходимо испытать безопасность и параметры эффективности каждого слияния порознь, а затем провести испытания их смесей.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает комплексы или слияния двух или более различных цитокинов, полезные как для общей, так и адресованной иммунной терапии. Эти комплексы или слияния факультативно включают другие белковые составляющие. Одной из особенностей таких комплексов или слияний является то, что они обеспечивают заданное соотношение активностей цитокиновых компонентов.
В общем виде настоящее изобретение относится к белковым комплексам, содержащим по меньшей мере два различных цитокина. Цитокины могут находиться в одной и той же полипептидной цепи или же быть связанными ковалентной связью, такой как дисульфидная связь или связь, образованная путем химической сшивки. В качестве альтернативы, цитокины могут находиться в состоянии стабильной нековалентной ассоциации. В некоторых предпочтительных осуществлениях белковый комплекс содержит адресующую составляющую, такую как антитело или фрагмент антитела, которая адресованно направляет комплекс в определенное место (локус) млекопитающего.
В предпочтительном примере осуществления настоящее изобретение предусматривает белковый комплекс, объединяющий биологическую активность двухцепочечного цитокина, такого как IL-12, с биологической активностью второго цитокина. Цитокины могут быть ковалентно связаны (например, слиты) друг с другом. Цитокины могут быть также соединены при посредстве других составляющих. Например, полипептидная цепь, содержащая второй цитокин, может иметь связывающуюся составляющую, которая специфически связывается с IL-12, такую как антитело к IL-12 или рецептор для IL-12. В качестве альтернативы, связывающаяся составляющая может взаимодействовать со второй составляющей, которая ассоциирована с IL-12. Например, если полипептидная цепь, содержащая субъединицу IL-12, содержит также авидин, то полипептид, содержащий второй цитокин, может содержать также биотин как адресующую составляющую. В одном из предпочтительных примеров осуществления второй цитокин - это IL-2.
Настоящее изобретение предусматривает способы получения слитых белков, содержащих IL-12, которые имеют как активность IL-12, так и активность второго цитокина, и при этом обеспечивают более длительное, единое фармакокинетическое поведение, подобное поведению самого IL-12, в итоге увеличивая продолжительность активности второго цитокина и сохраняя баланс активностей двух цитокинов после инъекции животному.
В другом примере осуществления изобретения слитые белки содержат гетеродимерную форму IL-12, в которой субъединицы IL-12 р35 и р40 соединены дисульфидной связью и ковалентно присоединены ко втором цитокину либо на амино-конце, либо на карбоксильном конце субъединицы р35 или р40 IL-12, со следующей общей формулой слитого белка: IL-12-X или X-IL-12, где Х - второй цитокин.
В ином примере осуществления изобретения слитые белки содержат второй цитокин, присоединенный ковалентно либо к амино-концу, либо к карбоксильному концу одноцепочечной (single-chain - sc) формы IL-12, содержащей две полипептидные субъединицы, соединенные гибким пептидным мостиком, со следующей общей формулой слитого белка: sclL-12-X или X-sclL-12.
Еще в одном примере осуществления два цитокина дополнительно слиты с белком, способным образовывать димерную или мультимерную структуру, либо на амино-конце, либо на карбоксильном конце указанной белковой цепи. В предпочтительном варианте этого примера осуществления одна из форм слитого белка IL-12 со вторым цитокином далее слита с частью цепи иммуноглобулина (Ig), такой как область Fc, которая способна к димеризации. Другие примеры осуществления охватывают слияние по меньшей мере одной полипептидной цепи IL-12 на любом конце составляющей Ig и второго цитокина, присоединенного на другом конце.
В следующем примере осуществления два или более цитокина слиты с белком, имеющим адресующую способность в силу связывания со специфическим рецептором. Например, область Fc может связываться с рецепторами для Fc, которые в изобилии находятся в печени. Слияния области Fc с несколькими цитокинами иллюстрирует преимущества совмещения димеризации и адресования, однако в некоторых случаях полезно конструировать слияния с несколькими цитокинами, которые могут только мультимеризоваться или только быть адресантами, но не совмещают обе способности.
В еще одном примере осуществления слитый белок, содержащий несколько цитокинов, дополнительно слит с амино- или карбоксильным концом представителя класса молекул с разнообразной адресующей способностью, такого как антитело или пептидный аптамер с наличием или без каркаса (Colas и др. // Proc NatI Acad Sci USA. 1998. Т.95. С.14272-14277). Конкретный пример осуществления - это слияние нескольких цитокинов по меньшей мере с частью антитела, которое способно связывать антиген, такого как интактное антитело, одноцепочечное антитело или одноцепочечная область Fv. Дополнительные примеры осуществления включают слияния по меньшей мере одной полипептидной цепи IL-12 с любым концом по меньшей мере части цепи антитела, способной связывать антиген, и со вторым цитокином, присоединенным на другом конце.
В соответствии с вышеприведенными описаниями, вообще предпочтительно конструировать слитые белки из нескольких цитокинов и слитые белки из нескольких цитокинов с антителом методом генетической инженерии, так что белковые компоненты соединены ковалентными связями, такими как амидные связи или дисульфидные связи. Однако можно для конструирования таких белковых комплексов использовать также химические сшивающие агенты. Такие методы хорошо известны в области химии белков. В качестве альтернативы, иногда достаточно создать белковые комплексы слиянием различных цитокинов с белками-партнерами, образующими стабильные нековалентные комплексы. Например, используют нековалентно связанный гетеродимерный белок-носитель: первый цитокин слит с одной из субъединиц гетеродимера, второй цитокин слит со второй субъединицей гетеродимера, и оба слитых белка смешаны при подходящих условиях. Например, в одной и той же клетке экспрессируют нуклеиновые кислоты, кодирующие слитые белки с двухсубъединичным цитокином. Таким путем может быть сконструирован белковый комплекс с несколькими цитокинами, в котором цитокиновые компоненты могут быть связаны нековалентно, либо прямо, либо опосредованно. Чтобы соответствовать целям настоящего изобретения, такой комплекс должен быть достаточно стабилен, чтобы сохраниться при введении животному и обеспечить биологический эффект.
Настоящее изобретение предусматривает также нуклеиновые кислоты, кодирующие слитые белки, содержащие два или более цитокинов, где один из цитокинов - предпочтительно IL-12, а кодируемый нуклеиновой кислотой слитый белок факультативно содержит другие белковые составляющие. Предпочтительные примеры осуществления включают нуклеиновые кислоты, кодирующие слияния двух или более цитокинов с димеризующимся белком, таким как область Fc цепи антитела. Другой набор предпочтительных примеров осуществления составляют нуклеиновые кислоты, кодирующие слияния двух или более цитокинов с белком, имеющим адресующую способность, таким как антитело.
Настоящее изобретение предусматривает также способы конструирования слияний с двумя или более цитокинами, а также способы экспрессии таких слитых белков.
Изобретение предусматривает также способы лечения заболеваний и других болезненных состояний, в которых лечение включает подходящую комбинацию активностей двух или более белков. В одном из примеров осуществления по меньшей мере один из белков имеет короткое (например, менее 20 минут) или только умеренно длительное (например, менее 40 минут) время полужизни в сыворотке. Белки слиты методами генетической инженерии или другими методами и вводятся человеку или животному. Таким образом, активности двух белков наличествуют в заданном соотношении, и не требуется вводить два белка порознь с различными режимами дозировок. Кроме того, время полужизни в сыворотке слитого белка вообще более близко к времени полужизни белкового компонента с более длительным временем полужизни в сыворотке, что приводит к удлинению эффективного времени полужизни белка или белков с более коротким временем полужизни в сыворотке.
Конкретнее, изобретение предусматривает способы иммунотерапевтического лечения заболеваний, таких как рак или инфекционные заболевания, или иные заболевания, которые подвергаются лечению двухцепочечным цитокином, таким как IL-12, в комбинации со вторым цитокином. В предпочтительном примере осуществления IL-12 сливают с IL-2 или GM-CSF и вводят животному или человеку. В других предпочтительных примерах осуществления GM-CSF сливают с IL-4 и вводят животному или человеку. В ином примере осуществления IL-12 сливают с IL-18 и вводят животному или человеку. Такие приемы лечения могут быть использованы совместно с другими приемами лечения заболеваний. Кроме того, настоящее изобретение предлагает способы вакцинации против различных антигенов, которые могут быть использованы для профилактики или лечения различных заболеваний.
В иных примерах осуществления этих способов два различных цитокина сливают с димерной белковой составляющей, такой как область Fc антитела, и вводят животному или человеку. В предпочтительной форме этих способов цитокин IL-12 сливают с областью Fc вместе со вторым цитокином, который предпочтительнее представляет собой IL-2 или GM-CSF.
В некоторых других примерах осуществления этих способов два различных цитокина слиты с интактным антителом и водятся животному или человеку. В предпочтительной форме этих способов цитокин IL-12 сливают с антителом вместе со вторым цитокином, который предпочтительнее представляет собой IL-2 или GM-CSF. Настоящее изобретение предлагает также смеси слитых белков антитело-цитокин, пригодные для лечения заболеваний. В одном из примеров осуществления для лечения заболевания используют смесь слитого белка антитело-IL-2 и слитого белка антитело-IL-12. Например, лечат рак, вирусную инфекцию или бактериальную инфекцию.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Все вышеизложенное и другие задачи настоящего изобретения и его различные отличительные особенности могут быть более понятны из последующего описания, сопровождаемого прилагаемыми чертежами. На всех чертежах одинаковые номера обозначают одинаковые структуры.
Фиг.1А дает схематическую иллюстрацию слияния двух цитокинов в простейшем виде: один цитокин слит со вторым цитокином, факультативно через мостик. Фигуры с 1В по 1I показывают различные способы, которыми второй цитокин (обозначенный «cyt») может быть прикреплен к гетеродимерному цитокину IL-12. Конкретно, второй цитокин может быть слит с С-концом р40 (фиг.1В), N-концом р40 (фиг.1С), С-концом р35 (фиг.1D) или N-концом р35 (фиг.1Е). Кроме того, на фиг.1 показано, как второй цитокин может быть слит с одноцепочечным вариантом IL-12. Конкретно, одноцепочечные молекулы IL-12 могут иметь субъединицу р35, прикрепленную к N-концу субъединицы р40, со вторым цитокином на С-конце (фиг.1F) или на N-конце (фиг.1G). В качестве альтернативы, одноцепочечные молекулы IL-12 могут иметь р40 на N-конце р35, со вторым цитокином на С-конце (фиг.1Н) или на N-конце (фиг.1I).
На фигурах 2А-2С схематически показано, как слияния с несколькими цитокинами (заключенные в рамку), представленные на фиг.1, могут быть дополнительно слиты с областью Fc антитела, показанной здесь как шарнир (Н), домен СН2 и домен СН3 (овалы). Конкретно, каждая из восьми молекул фигуры 1 может быть слита либо с С-концом (фиг.2А), либо с N-концом (фиг.2В) области Fc. Кроме того, нет необходимости первый цитокин и второй цитокин (каждый заключен в рамку) соединять непосредственно друг с другом. Они могут быть соединены через область Fc (фиг.2С).
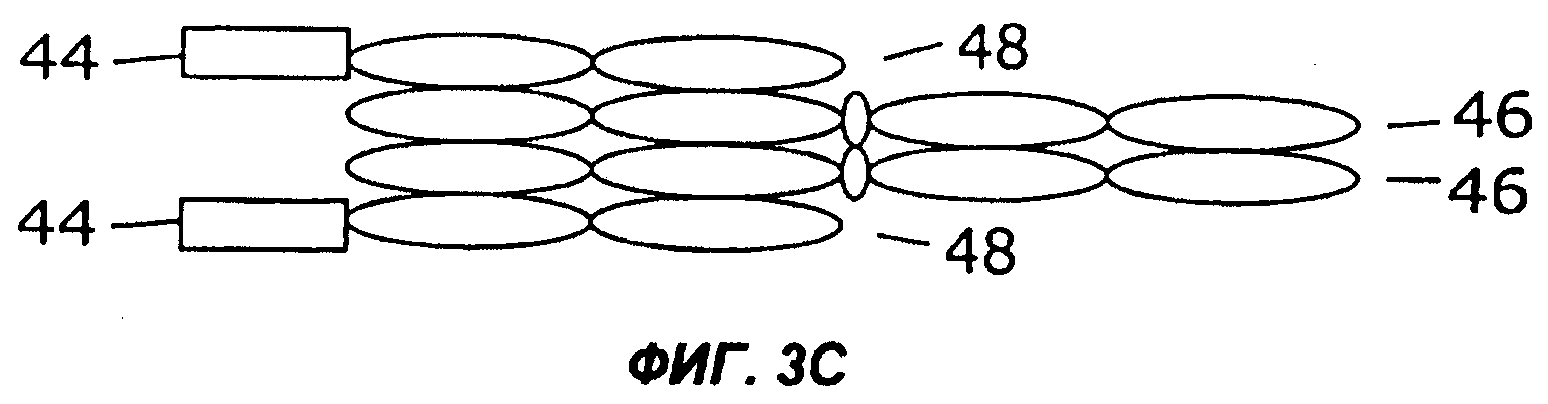
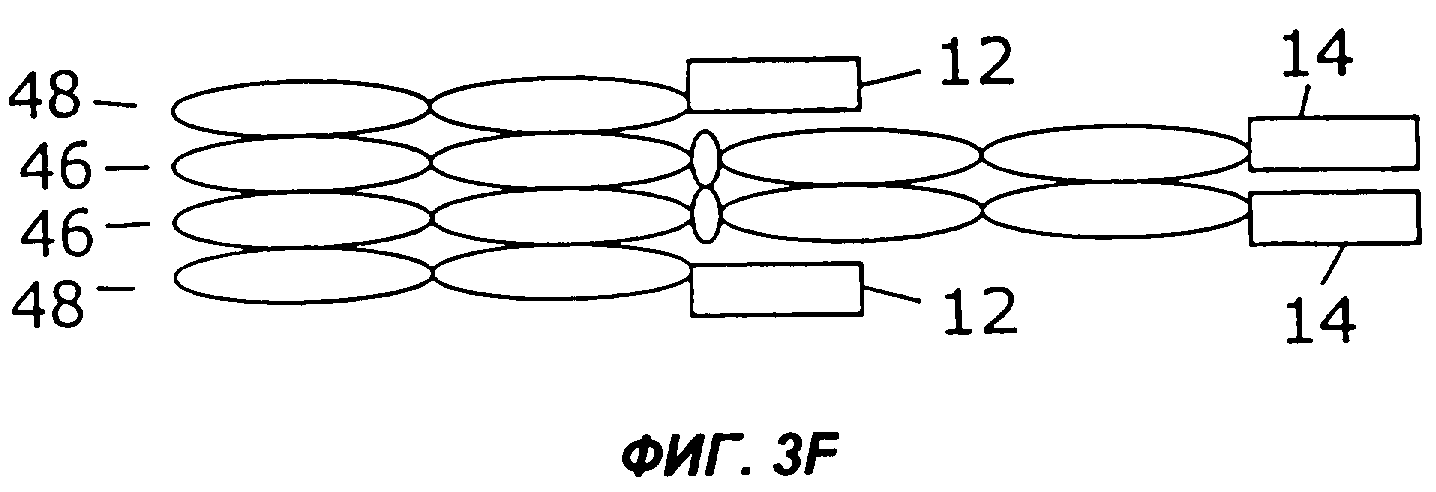
На фигурах 3А - 3G схематически показан набор путей, которыми слитый белок с несколькими цитокинами может быть дополнительно слит с интактным иммуноглобулином, таким как IgG. Область тяжелой цепи V представлена в виде овала, обозначенного Vн, область легкой цепи V представлена в виде овала, обозначенного VL, а константные области представлены пустыми овалами. Слияние с несколькими цитокинами, показанное на фиг.1, может быть помещено на С-конце тяжелой цепи (фиг.2А), на N-конце тяжелой цепи (фиг.2В), на N-конце легкой цепи (фиг.2С), или на С-конце легкой цепи (фиг.2D). Кроме того, существует много способов, которыми первый и второй цитокины могут быть порознь прикреплены к N- и С-концам тяжелой и легкой цепей, три из них показаны на фигурах 3Е - 3G.
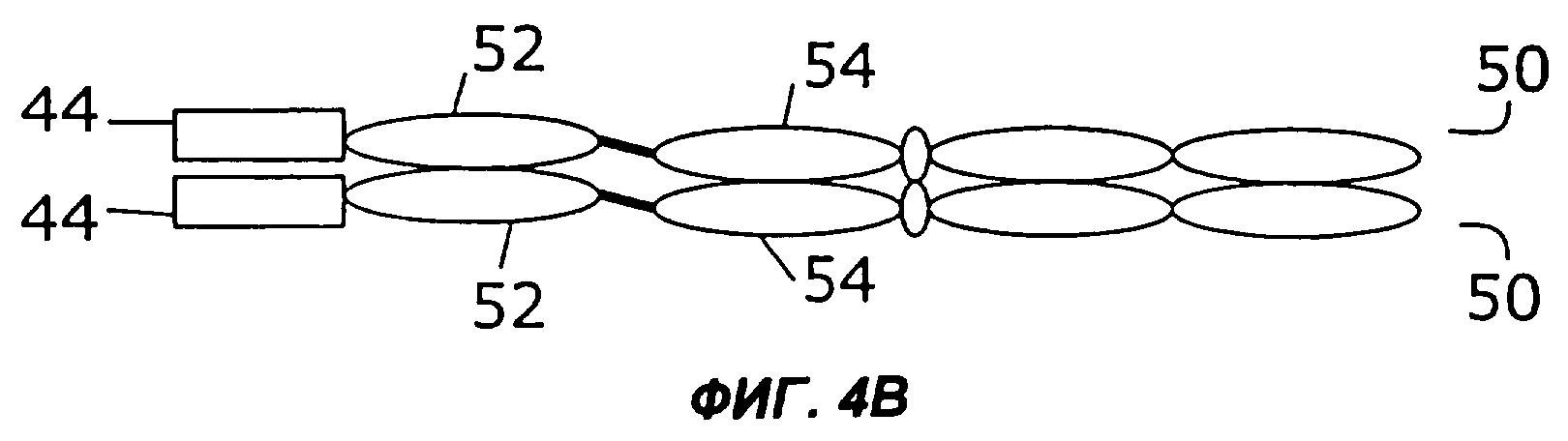
На фигурах 4А - 4С схематически показано, как первый и второй цитокины могут быть слиты с «одноцепочечным» антителом, у которого слиты вариабельная легкая и вариабельная тяжелая цепи, и белок экспрессируется в виде одиночного полипептида, который затем гомодимеризуется. Конкретно, слияние с несколькими цитокинами может быть помещено на С-конце (фиг.4А) или на N-конце (фиг.4В). Кроме того, нет необходимости первый цитокин и второй цитокин соединять непосредственно друг с другом. Они могут быть соединены через одноцепочечное антитело (фиг.4С).
На фигурах 5А - 5С схематически показано, как первый и второй цитокины могут быть слиты с одноцепочечной областью Fv, состоящей из слитых вариабельных областей тяжелой цепи и легкой цепи. Конкретно, слияние первого цитокина со вторым цитокином может быть помещено на С-конце (фиг.5А) или на N-конце (фиг.5В). Кроме того, нет необходимости первый цитокин и второй цитокин соединять непосредственно друг с другом. Они могут быть соединены через одноцепочечную область Fv (фиг.5С).
Фигуры 6А и 6В показывают синергизм действия IL-12 и IL-2 в индукции ИФН-γ в одноядерных клетках периферической крови человека (peripheral blood mononuclear cells - PBMC) в ответ на добавление отдельных цитокинов или слитых белков. На фиг.6А, клетки обрабатывали человеческим IL-12 до (квадраты) или после (крестики) активации фитогемагглютинином, или же слитым белком IL-12-IL-2 до (ромбы) или после (треугольники) активации фитогемагглютинином. На фиг.6В представлен опыт, в котором клетки обрабатывали смесью IL-12 и IL-2, добавляемой при их молярном соотношении 1:1 (зачерненные ромбы), слитым белком (Fc человека)-IL-12-IL-2 (заштрихованные квадраты) и слитым белком (антитело человека)-IL-12-IL-2 (слегка заштрихованные треугольники). По оси Х указана концентрация IL-12 в пг/мл, присутствует ли он как интактный белок или в составе слитого белка. По оси Y указана концентрация ИФН-γ (в нг/мл), определенная методом ELISA.
На фиг.7 представлен типичный биологический анализ IL-12, который позволяет отдельно измерить активность слитого белка и сравнить ее с активностью неслитой молекулы IL-12. Изображена стимуляция включенияЗH-тимидина человеческими PBMC в ответ на введение мышиного IL-12 (пустые кружки), смеси мышиных IL-12 и IL-2, добавленных в молярном соотношении 1:1 (зачерненные квадраты), мышиного IL-2 (пустые треугольники) и слитого белка, содержащего антитело, мышиный IL-12 и мышиный IL-2 (зачерненные ромбы). По оси Х указана концентрация (пМ) мономерного цитокина (цитокинов) в виде интактного белка или в составе слитого белка, по оси Y указано включение меченого тритием тимидина в количестве импульсов в минуту (имп/мин).
На фиг.8 представлен стандартный анализ биологической активности IL-2. График показывает стимуляцию пролиферации мышиных клеток CTLL в ответ на мышиный IL-2 (кружки), на слитый белок антитело-mu.IL-12-mu.IL-2 (ромбы) и мышиный IL-12 (квадраты). По оси Х указана концентрация (пМ) мономерного цитокина (цитокинов) в виде интактного белка или в составе слитого белка. Клетки инкубировали в среде, содержащей в течение 48 ч различные количества цитокина или слитого белка, после чего определяли количество жизнеспособных клеток с помощью теста MTT/MTS. По оси Y указано поглощение при 490 нм в единицах оптической плотности (ОП).
Фиг.9 показывает стимуляцию включения3H-тимидина человеческими РВМС в ответ на мышиный IL-12 (пустые кружки), смесь мышиных IL-12 и IL-2, добавленных в молярном соотношении 1:1 (черные кружки), слитый белок (Fc мыши)-(одноцепочечный IL-12)-IL-2 (черные треугольники) и мышиный одноцепочечный IL-12, слитый с мышиным IL-2 (черные ромбы). По оси Х указана концентрация (пМ) мономерного цитокина (цитокинов) в виде интактного белка или в составе слитого белка, по оси Y указано включение меченого тритием тимидина в количестве импульсов в минуту (имп/мин).
Фиг.10 показывает стимуляцию включения3H-тимидина человеческими РВМС в ответ на мышиный IL-12 (пустые кружки), смесь мышиного IL-12 с GM-CSF, добавленную при их молярном соотношении 1:1 (черные кружки), мышиный GM-CSF (черные треугольники) и слитый белок mu.Fc-mu.IL-12-GM-CSF (крестики). По оси Х указана концентрация (пМ) мономерного цитокина (цитокинов) в виде интактного белка или в составе слитого белка, по оси Y указано включение меченого тритием тимидина (имп/мин).
Фиг.11 демонстрирует эффект введения слитого белка антитело-цитокин-цитокин мышам Balb/C, имеющим подкожные опухоли, полученные из клеток СТ26 карциномы прямой кишки, которые вследствие геноинженерных манипуляций экспрессируют человеческий ЕрСАМ - антиген для KS-1/4. Черными ромбами показан средний объем опухолей у контрольных мышей, которым вводили PBS в дни: 0-й, 1-й, 2-й, 3-й и 4-й. Треугольниками показан средний объем опухолей у мышей, которым вводили 6 мкг KS-IL-12-IL-2. Квадратами обозначен средний объем опухолей у мышей, которым вводили 3,4 мкг KS-IL-2 и 5,3 мкг of KS-IL-12. Инъекции проводили внутрь опухолей. По оси Х указано время (дни), прошедшее после первой инъекции; по оси Y указан средний объем опухолей в кубических мм.
Фиг.12 демонстрирует эффект введения слитого белка антитело-цитокин-цитокин мышам SCID, имеющим подкожные опухоли, полученные из клеток СТ26 карциномы прямой кишки, которые вследствие геноинженерных манипуляций экспрессируют человеческий ЕрСАМ. Ромбами показан средний объем опухолей у контрольных мышей, которым вводили PBS в дни: 0-й, 1-й, 2-й, 3-й и 4-й. Треугольниками показан средний объем опухолей у мышей, которым вводили 6 мкг KS-IL-12-IL-2. Квадратами обозначен средний объем опухолей у мышей, которым вводили 3,4 мкг KS-IL-2 и 5,3 мкг of KS-IL-12. Инъекции проводили внутрь опухолей. По оси Х указано время (дни), прошедшее после первой инъекции; по оси Y указан средний объем опухолей в мм3.
Фиг.13 показывает результаты сравнения действия введения слитого белка антитело-цитокин и антитело-цитокин-цитокин мышам, имеющим подкожные опухоли из клеток карциномы легких Льюиса (LLC), которые вследствие геноинженерных манипуляций экспрессируют человеческий ЕрСАМ. Ромбами показан средний объем опухолей у контрольных мышей, которым внутрь опухолей вводили PBS в дни: 0-й, 1-й, 2-й, 3-й и 4-й. Квадраты показывают средний объем опухолей у мышей, которым внутрь опухолей в дни: 0-й, 1-й, 2-й, 3-й и 4-й вводили 20 мкг KS-IL-2. Треугольниками показан средний объем опухолей у мышей, которым внутрь опухолей в дни: 0-й, 1-й, 2-й, 3-й и 4-й вводили 20 мкг KS-IL-12. Крестиками указан средний объем опухолей у мышей, которым внутрь опухолей в дни: 0-й, 1-й, 2-й, 3-й и 4-й вводили 20 мкг KS-IL-12-IL-2. По оси X указано время (дни), прошедшее после первой инъекции; по оси Y указан средний объем опухолей в мм3.
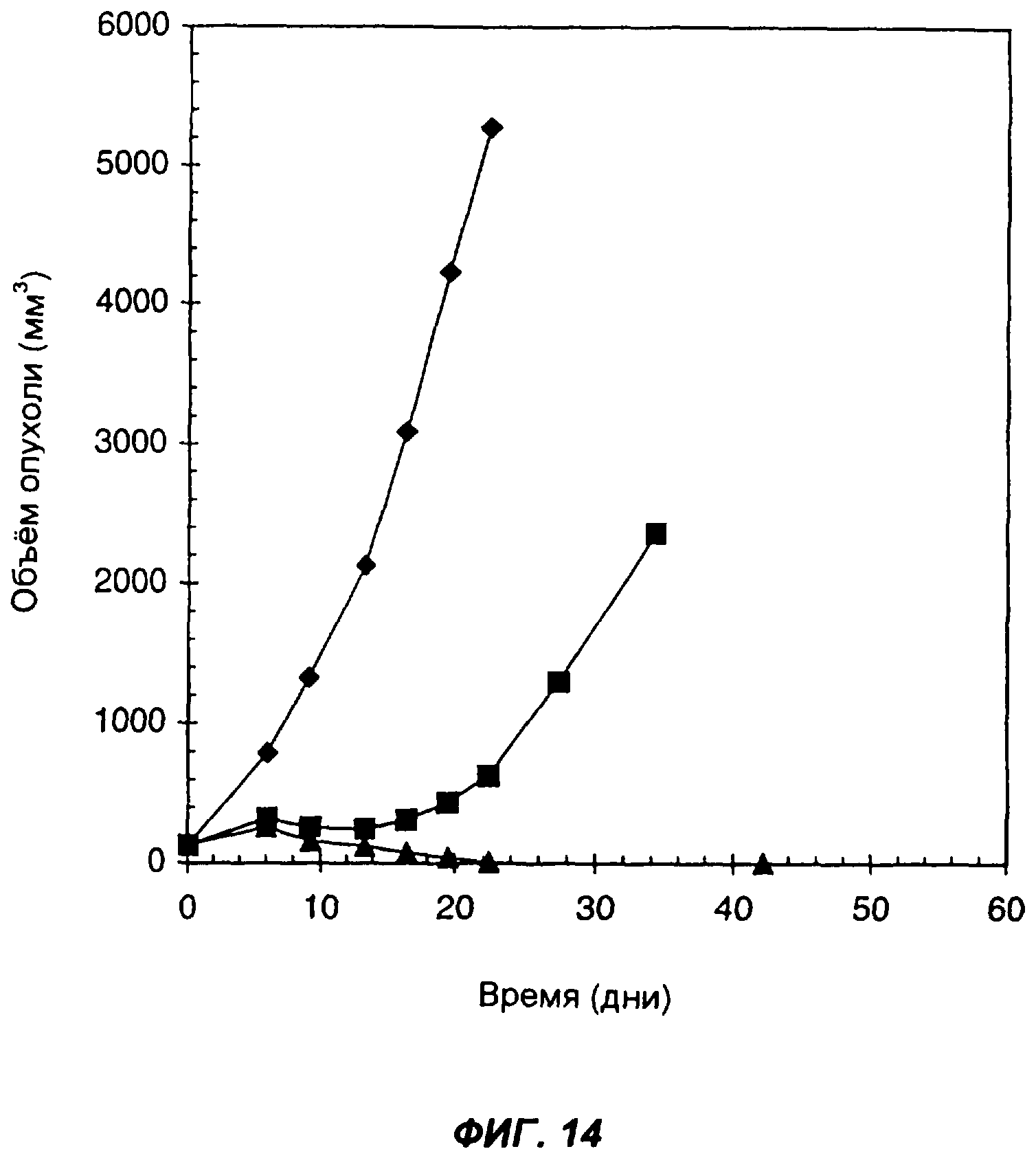
На фиг.14 показан эффект введения слитого белка антитело-цитокин-цитокин мышам, имеющим подкожные опухоли, происходящие из клеток карциномы легких Льюиса, которые вследствие геноинженерных манипуляций экспрессируют человеческий ЕрСАМ. Ромбами показан средний объем опухолей у контрольных мышей, которым внутрь опухолей вводили PBS в дни: 0-й, 1-й, 2-й, 3-й и 4-й. Треугольниками показан средний объем опухолей у мышей, которым вводили 20 мкг KS-IL-12-IL-2. Квадратами показан средний объем опухолей у мышей, которым вводили 11,5 мкг KS-IL-2 и 18 мкг KS-IL-12. Инъекции проводили внутрь опухолей. По оси Х указано время (дни), прошедшее после первой инъекции; по оси Y указан средний объем опухолей в мм3.
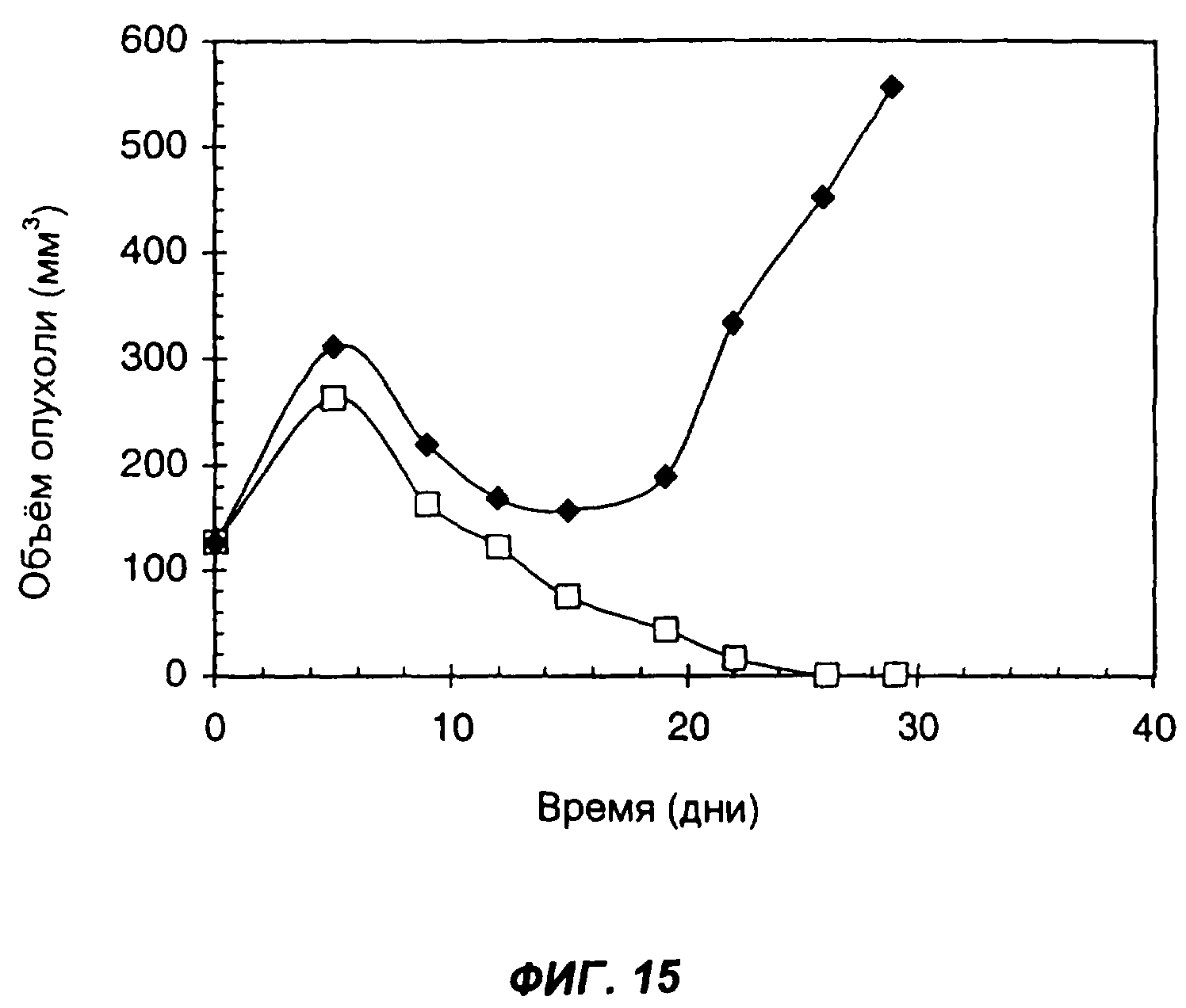
На фиг.15 показан эффект введения слитого белка антитело-цитокин-цитокин мышам, имеющим подкожные опухоли, происходящие из клеток карциномы легких Льюиса, которые экспрессируют или не экспрессируют человеческий ЕрСАМ. Черными квадратами показан средний объем опухолей у мышей, у которых опухоли были получены из клеток LLC/KSA. Черными ромбами показан средний объем опухолей у мышей, у которых опухоли были получены из клеток LLC. Мышам вводили 20 мкг KS-IL-12-IL-2 в дни: 0-й, 1-й, 2-й, 3-й и 4-й. Инъекции проводили внутрь опухолей. По оси Х указано время (дни), прошедшее после первой инъекции; по оси Y указан средний объем опухолей в мм3.
На фиг.16 показан эффект введения слитого белка антитело-цитокин-цитокин мышам, имеющим подкожные опухоли, происходящие из клеток карциномы легких Льюиса. В 0-й день вводили инъекцией подкожно приблизительно 106 клеток. Ромбами показан средний объем опухолей у нативных мышей. Квадратами показан средний объем опухолей у мышей, которые до этого имели подкожные опухоли из клеток карциномы легких Льюиса (LLC), экспрессирующих вследствие геноинженерных манипуляций человеческий ЕрСАМ, и которые были избавлены от этих опухолей введением KS-IL-12-IL-2. По оси Х указано время (дни), прошедшее после инъекции; по оси Y указан средний объем опухолей в мм3.
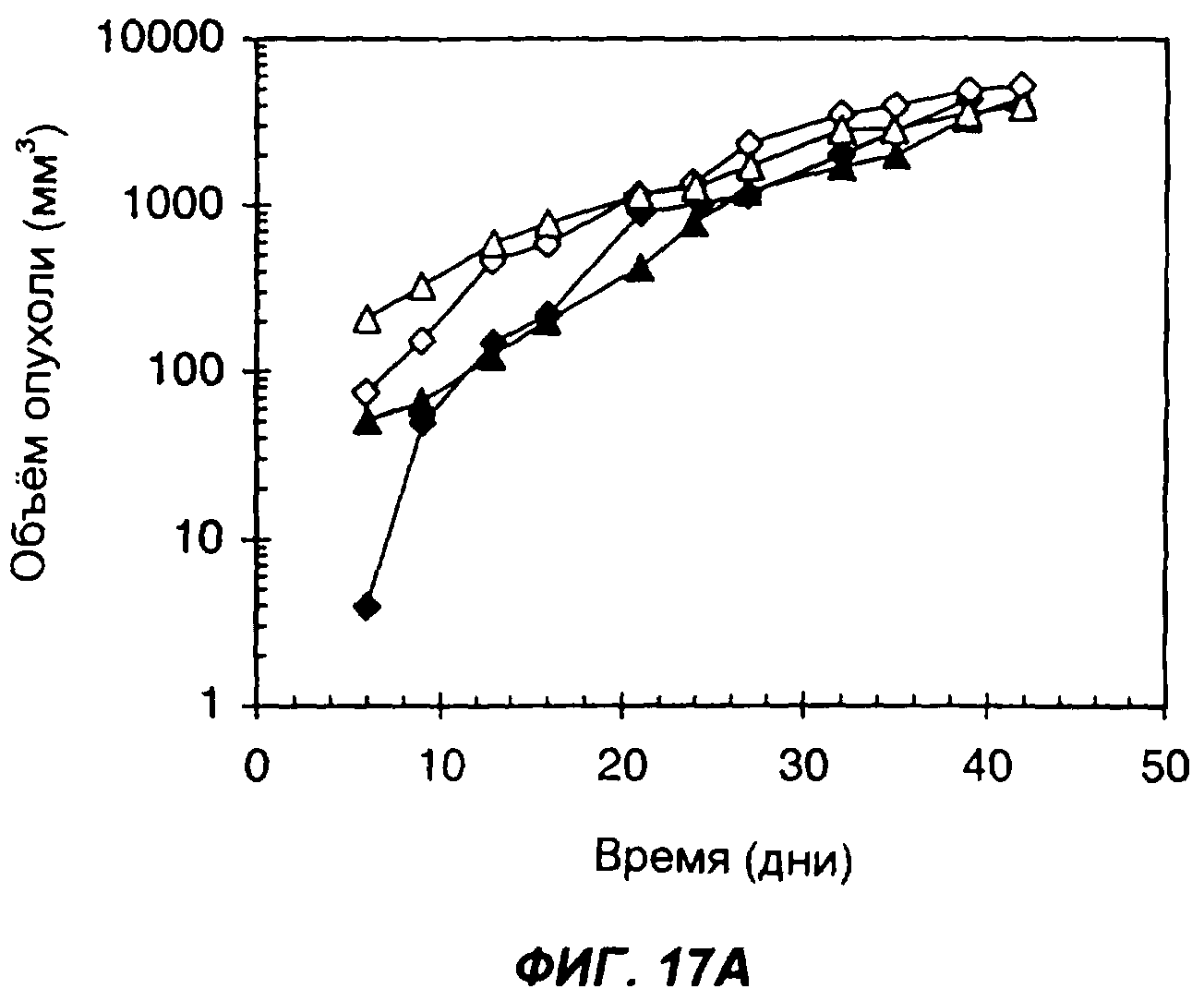
На фигурах 17А и 17В показано влияние секреции опухолевыми клетками белка с одним цитокином или с несколькими цитокинами на способность клеток образовывать опухоли у животных с нормальной иммунной системой. На фиг.17А дано сравнение 4 групп мышей: мыши C57BL/6, которым подкожно вводили 1×106 клеток опухоли LLC (черные ромбы); мыши C57BL/6, которым подкожно вводили 5×106 клеток опухоли LLC (пустые ромбы); мыши C57BL/6, которым подкожно вводили 1×106 опухолевых клеток LLC, экспрессирующих sclL-12 (черные треугольники); и мыши C57BL/6, которым подкожно вводили 5х106опухолевых клеток LLC, экспрессирующих sclL-12 (пустые треугольники). На фиг.17В дано сравнение мышей C57BL/6, которым подкожно вводили 1×106 клеток опухоли LLC (черные ромбы); мышей C57BL/6, которым подкожно вводили 5х106клеток опухоли LLC (пустые ромбы); мышей C57BL/6, которым подкожно вводили 1×106 клеток опухоли LLC, экспрессирующих sclL-12-IL-2 (крестики), и мышей C57BL/6, которым подкожно вводили 5×106 клеток опухоли LLC, экспрессирующих sclL-12 (пустые кружки). По оси Х указано время (дни), прошедшее после инъекции опухолевых клеток. По оси Y указан средний объем опухолей в мм3.
На фиг.18 показано влияние секреции опухолевыми клетками белка с одним цитокином или с несколькими цитокинами на способность клеток образовывать опухоли у иммунодефицитного животного. Эта фигура показывает сравнение мышей SCID, которым подкожно вводили 1×106 клеток опухоли LLC (черные ромбы); мышей SCID, которым подкожно вводили 1×106 клеток опухоли LLC, экспрессирующих sclL-12 (черные треугольники), и мышей SCID, которым подкожно вводили 1×106 клеток опухоли LLC, экспрессирующих sclL-12-IL-2 (пустые кружки). По оси Х указано время (дни), прошедшее после инъекции опухолевых клеток. По оси Y указан средний объем опухолей в мм3.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает белковые молекулы, в которых два или более различных цитокина слиты или образуют комплекс. Белковые комплексы или слитые белки могут факультативно включать дополнительные белковые составляющие, в том числе составляющие, способные к мультимеризации и адресованию, такие как области Fc и участки антител, содержащие сайты соединения с антигеном. Изобретение предлагает также нуклеиновые кислоты, кодирующие слитые белки с несколькими цитокинами. Изобретение также предусматривает способы конструирования нуклеиновых кислот, кодирующих слитые белки с несколькими цитокинами, способы продуцирования слитых белков с несколькими цитокинами и способы применения слитых белков с несколькими цитокинами для лечения заболеваний и болезненных состояний.
В том смысле, как он использован здесь, термин «цитокин» относится к секретируемому белку или его активному фрагменту или мутантной форме, который модулирует активность клеток иммунной системы. Примеры цитокинов включают интерлейкины, интерфероны, хемокины, факторы некроза опухолей, стимулирующие образование колоний факторы для предшественников иммунных клеток и т.д.
В том смысле, как он использован здесь, термин «гетеродимерный цитокин» относится к цитокину, состоящему из двух различных белковых субъединиц. IL-12 является единственным известным до настоящего времени природным гетеродимерным цитокином. Однако могут быть сконструированы искусственные гетеродимерные цитокины. Например, можно объединить IL-6 и растворимый фрагмент IL-6R, получая гетеродимерный цитокин. То же самое можно сделать с CNTF и CNTF-Rα (Trinchieri // Blood. 1994. Т.84. С.4008).
В том смысле, как он использован здесь, термин «интерлейкин-12» (IL-12) обозначает двухсубъединичный цитокин, состоящий из субъединиц р35 и р40, или активное одноцепочечное слияние р35 и р40, или его разновидность, фрагмент или производное.
В том смысле, как он использован здесь, термин «интерлейкин-2» (IL-2) обозначает IL-2 любого млекопитающего, такой как человеческий IL-2, мышиный IL-2, или его активный видовой или аллельный вариант, фрагмент или производное.
В том смысле, как он использован здесь, термин «GM-CSF» обозначает цитокиновый белок млекопитающих - фактор стимуляции образования колоний гранулоцитов/моноцитов (Granulocyte/Monocyte-Colony Stimulating Factor), такой как человеческий GM-CSF, мышиный GM-CSF, или его активный видовой или аллельный вариант, фрагмент или производное.
В том смысле, как он использован здесь, термин «область Fc иммуноглобулина» означает карбоксильно-концевой участок константной области тяжелой цепи иммуноглобулина или его аналог или долю. Например, область Fc иммуноглобулина IgG может содержать по меньшей мере часть шарнирной области, домен СН2 и домен СН3. В предпочтительном примере осуществления область Fc включает по меньшей мере часть шарнирной области и домен СН3. В другом предпочтительном примере осуществления область Fc включает по меньшей мере домен СН2 и более предпочтительно включает также по меньшей мере часть шарнирной области.
В том смысле, как он использован здесь, термин «пептидный мостик» означает один или несколько пептидов, использованных для соединения вместе двух белков (например, белка и области Fc). Пептидный мостик часто представляет собой последовательность аминокислот, таких как, например, с преобладанием глицина и/или серина. Предпочтительно пептидный мостик представляет собой смешанную последовательность с преобладанием остатков глицина и серина длиной приблизительно 10-15 аминокислот.
В том смысле, как он использован здесь, термин «мультимерный» относится к стабильному соединению двух или более белковых субъединиц путем ковалентного или нековалентного взаимодействия, например путем соединения дисульфидными связями.
В том смысле, как он использован здесь, термин «димерный» относится к специфической мультимерной молекуле, в которой две белковые субъединицы стабильно соединены с участием ковалентных или нековалентных взаимодействий. Стабильный комплекс - это комплекс с такой скоростью диссоциации, или скоростью распада, что он разрушается в течение не менее нескольких минут (то есть комплекс должен быть стабилен достаточно долго при использовании in vivo, чтобы достигнуть ткани, куда он адресован, и обеспечить биологический эффект). Сам фрагмент Fc обычно создает димер фрагментов тяжелой цепи, содержащих часть шарнирной области, домен СН2 и/или домен СН3. Однако известно, что многие белковые лиганды связываются со своими рецепторами в виде димеров. Если цитокин Х димеризуется естественным образом, составляющая Х в молекуле Fc-X будет димеризоваться в гораздо большей степени, поскольку процесс димеризации зависит от концентрации. Физическая сближенность двух составляющих X, соединенных Fc, превращает димеризацию во внутримолекулярный процесс, сильно сдвигая равновесие в сторону образования димера и усиливая его связывание с рецептором.
В том смысле, как он использован здесь, термин «вектор» означает любую нуклеиновую кислоту, представляющую собой нуклеотидную последовательность, которая способна быть введенной в клетку-хозяина, рекомбинировать с геномом клетки-хозяина и интегрироваться в геном клетки-хозяина или автономно реплицироваться в виде эписомы. Такие векторы включают линейные нуклеиновые кислоты, плазмиды, фагемиды, космиды, РНК-векторы, вирусные векторы и т.п. Неограничивающие примеры вирусного вектора включают ретровирус, аденовирус и адено-ассоциированный вирус.
В том смысле, как он использован здесь, термин «экспрессия гена» или «экспрессия белка» понимается как означающий транскрипцию последовательности ДНК, трансляцию транскрипта - мРНК и либо секрецию белкового продукта, либо получение белкового продукта в форме, доступной для выделения.
В том смысле, как он использован здесь, термин «иммуноцитокин» означает слитый белок, содержащий антитело и цитокин, как раскрыто в патенте США №5650150.
В том смысле, как он использован здесь, термин «лидерная последовательность» означает белковую последовательность, которая присоединена, обычно на N-конце, ко второй белковой последовательности и таким образом заставляет вторую белковую последовательность экскретироваться из клетки. Обычно лидерная последовательность отщепляется и удаляется из второй белковой последовательности, которая становится зрелым белком. Термин «лидерная последовательность» обычно является синонимом термина «сигнальная последовательность».
В том смысле, как он использован здесь, термин «ЕрСАМ» означает молекулу со свойством адгезии на клетках эпителия (Cirulli и др. 1998. Т.140. С.1519-1534) и является синонимом обозначения «KSA», обозначающего антиген, связываемый моноклональным антителом KS-1/4. ЕрСАМ - это белок клеточной поверхности, который избыточно экспрессируется на раковых клетках, происходящих из клеток эпителия.
В том смысле, как он использован здесь, термин «KS-1/4» относится к конкретным моноклональным антителам, связывающимся с ЕрСАМ.
В том смысле, как они использованы здесь, термины «KS-IL-2», «KS-IL-12» и «KS-IL-12-IL-2» (и подобные им) относятся к слитым белкам антитело-цитокин, состоящим соответственно из KS-1/4 с интерлейкином-2, KS-1/4 с интерлейкином-12 и KS-1/4 вместе и с интерлейкином-12, и с интерлейкином-2. Здесь используются также другие конструкции слитых белков с аналогичными наименованиями. Поскольку можно осуществлять слияние цитокинов с молекулой антитела в различных положениях, такое обозначение, как «KS-IL-12-IL-2», относится (если это не обозначено как-то иначе) к классу белков, содержащих KS-1/4 вместе с интерлейкином-12 и интерлейкином-2, слитыми в любом возможном положении.
В том смысле, как он использован здесь, термин «14.18» относится к определенному моноклональному антителу, которое связывается с опухолеспецифичным антигеном GD2.
Некоторые типовые примеры осуществления белковых конструкций, воплощающие настоящее изобретение, проиллюстрированы на фигурах 1-5. Части молекул, изображенных на фигурах 2-5, обозначены как 1А-1I; это относит их к слитым белкам, показанным на фигурах 1А-1I, и иллюстрирует то, что любой из слитых белков из фиг.1 может быть дополнительно слит, как указано, с другими белками. Цитокины обозначены прямоугольниками, константные области антител обозначены овалами, а вариабельная область тяжелой цепи и вариабельная область легкой цепи обозначены помеченными овалами.
Настоящее изобретение описывает белковые комплексы, содержащие два различных цитокина и факультативно включающие другие белковые составляющие. Гомодимерный цитокин (например, интерферон-альфа, интерферон-бета, интерферон-гамма, IL-5, IL-8 и т.п.), хотя и содержит несколько субъединиц, тем не менее является одним цитокином. Подобным же образом гетеродимерный цитокин, такой как IL-12, хотя и содержит различные субъединицы, является одним цитокином. Более того, гетеродимерная форма гомодимерных в норме цитокинов, как, например, гетеродимер МСР-1/МСР-2, или форма из двух аллелей гомодимерного в норме цитокина (например, Zhang // J. Biol. Chem.1994. Т.269. С.15918-15924) представляют собой одиночный цитокин. Комплексы по настоящему изобретению содержат два различных цитокина, каждый из которых (например, IL-2 и IL-12; IL-4 и GM-CSF; МСР-1 и эотаксин; и т.д.) способен модулировать активность клеток иммунной системы.
На фиг.1А показан предпочтительный пример осуществления изобретения: в слитом белке (10) С-конец первого цитокина (12) слит с N-концом второго цитокина (14), факультативно через область мостика (не показана). В некоторых осуществлениях настоящего изобретения белковый комплекс по изобретению содержит по меньшей мере два цитокина с существенно различным временем полужизни в сыворотке. Например, использование маленького и большого белков часто дает слитый белок с временем полужизни в кровотоке, характерным для большего белка. Таким образом, в случаях, когда необходимо объединить действие IL-12 и второго цитокина, удобно экспрессировать оба цитокина как слитый белок общей формулы IL-12-X или X-IL-12, где Х - второй цитокин. Здесь видны два заслуживающих особого внимания преимущества. Во-первых, увеличивается время полужизни в сыворотке более быстро выводящегося белка. Во-вторых, времена полужизни в сыворотке обоих цитокинов становятся очень близки.
Двухцепочечный цитокин, такой как IL-12, можно слить со вторым цитокином на N- или С-конце каждой из цепей двухцепочечного цитокина. В одном из примеров осуществления второй цитокин слит либо с N-концом, либо с С-концом субъединицы IL-12 - или р35, или р40 (фиг.1В-1Е). В слитом белке 16 на фиг.1В N-конец первого цитокина (12) слит с С-концом субъединицы IL-12 р40 (18). Субъединица р40 (18) соединена с субъединицей IL-12 р35 (20) ковалентной связью (22). В слитом белке 24 на фиг.1С N-конец субъединицы р40 (18) слит с С-концом первого цитокина (12) и соединен с субъединицей р35 (20) ковалентной связью (22). На фиг.1D показан слитый белок (26), в котором N-конец первого цитокина (12) слит с С-концом субъединицы р35 (20), которая соединена ковалентной связью (22) с субъединицей р40 (18). На фиг.1Е слитый белок 28 включает субъединицу р35 (20), слитую ее N-концом с С-концом первого цитокина (12) и соединенную ковалентной связью 22 с субъединицей р40 (18).
Во втором примере осуществления субъединицы IL-12 могут быть слиты с образованием одноцепочечного белка sclL-12, имеющего на N-конце либо субъединицу р35, либо субъединицу р40, а второй цитокин может быть прикреплен к N- или С-концу полученного sclL-12 (фигуры 1F-1I). Так, в предпочтительном примере осуществления, показанном на фиг.1F, слитый белок 30 содержит одноцепочечный IL-12, в котором N-конец субъединицы р40 (18) слит с С-концом субъединицы р35 (20), факультативно через пептидный мостик. В этом примере осуществления N-конец цитокина (12) слит с С-концом субъединицы р40 (18). В показанном на фиг.1G примере осуществления N-конец субъединицы р35 (20) слит с С-концом цитокина (12), факультативно через пептидный мостик. На фигурах 1Н и 1I показаны слитые белки 34 и 36, содержащие другую одноцепочечную версию IL-12, в которой N-конец субъединицы р35 слит с С-концом субъединицы р40, факультативно через пептидный мостик. В показанном на фиг.1Н слитом белке 34 N-конец цитокина 12 слит с С-концом субъединицы р35 (20). В показанном на фиг.1l слитом белке 36 N-конец субъединицы р40 (18) слит с С-концом цитокина 12. В наиболее предпочтительном примере осуществления IL-12 слит с IL-2.
Продуцирование таких молекул проиллюстрировано далее примерами.
Часто удобно экспрессировать гетеромультимерные молекулы, такие как IL-12 или антитело, как одноцепочечные молекулы, в которых неидентичные субъединицы соединены короткими аминокислотными мостиками (Huston и др. // Ргос. Nat. Acad. Sci. 1988. Т. 85. С. 5879; Lieschke и др. // Nat. Biotechnol. 1997. Т. 15. С. 35; Lieschke G.J. и Mulligan R.C. // Патент США №5891680). Конструируют генное слияние, и затем нужный белок может быть экспрессирован в клетках, содержащих одиночную конструкцию рекомбинантной ДНК. Такие одноцепочечные версии гетеромультимерного цитокина могут быть дополнительно слиты со вторым цитокином, который позволяет осуществить экспрессию слитого белка с нужным набором активностей по единичной конструкции рекомбинантной ДНК. Экспрессия таких молекул иллюстрирована далее примерами.
Настоящее изобретение описывает также слитый белок, содержащий IL-4 и GM-CSF. Такая комбинация особенно полезна для функциональной стимуляции предъявления («презентации») антигена дендритными клетками. Другие полезные слияния содержат IL-12 и IL-18. Оба этих цитокина включают иммунную реакцию Th1, но имеют несколько различающиеся, дополняющие друг друга активности.
Настоящее изобретение описывает также слитые белки, в которых несколько различных, слитых цитокинов дополнительно слиты с белком, способным образовывать мультимеры, такие как гомодимеры или гетеродимеры. Преимущество такой молекулы состоит в том, что активность одного или нескольких цитокинов может быть усилена димеризацией. В некоторых случаях усиление активности димеризацией может происходить вследствие того, что цитокин связывается со своим рецептором в виде димера. В одном из примеров осуществления несколько цитокинов слиты с частью молекулы антитела, такой как область Fc (фиг.2). В другом примере осуществления IL-12 и второй цитокин слиты с белковой составляющей, способной к образованию гомодимеров. В предпочтительном примере осуществления второй цитокин - это IL-2 или GM-CSF. Слитые белки можно создать различными способами, используя все возможные чередования нескольких различных белковых составляющих от N-конца к С-концу в слитом белке. Например, если интерлейкин-12 и второй цитокин слиты с областью Fc, оба цитокина могут быть слиты в любом порядке с N- или С-концом области Fc, или же один цитокин может быть слит с N-концом, а второй - с С-концом.
Некоторые из таких циклических перестановок (пермутаций) показаны на фиг.2. Например, в показанном на фиг.2А примере осуществления слитый белок 44 по настоящему изобретению слит с С-концом области Fc, содержащей шарнирную область (38), участок СН2 (40) и участок СН3 (42). Слитый белок 44 может иметь несколько различных структур, в том числе, например, структуру слитых белков 10, 16, 24, 26, 28, 30, 32, 34 или 36, представленных на фигурах 1А-1I. Если слитый белок 44 имеет более одного N-конца и С-конца, как в слитых белках 16, 24, 26 и 28, область Fc можно слить с любым N-концом слитого белка 44. Как показано на фиг.2В, слитый белок 44 может быть слит с N-концом области Fc. В показанном на фиг.2С примере осуществления первый цитокин 12 может быть слит с N-концом области Fc, а второй цитокин 14 может быть слит с С-концом области Fc.
Структурные соображения
Важно отметить, что цитокины, как класс белков, по своим размерам и основным параметрам сворачивания подобны друг другу. Поэтому приведенные здесь конкретные примеры показывают, как можно сконструировать слитые белки с несколькими цитокинами для семейства цитокиновых белков. Например, многие цитокины входят в класс сворачиваемых белков, называемый «четырехспиральным пучком». Белки типа четырехспирального пучка включают: фактор стимуляции колоний гранулоцитов (G-CSF), интерлейкин-6 (IL-6), фактор ингибирования лейкемии (LIF), гормон роста, фактор нейротрофии ресничек (CNTF), лептин, эритропоэтин, фактор стимуляции колоний гранулоцитов-макрофагов (GM-CSF), интерлейкин-5 (IL-5), фактор стимуляции колоний макрофагов (M-CSF), IL-2, IL-4, интерлейкин-3 (IL-3), IL-10, интерферон-бета, интерфероны-альфа и близко родственный им интерферон тау, а также интерферон-гамма (ИФН-γ ).
Кроме IL-5 и ИФН-γ, все эти белки сворачиваются как мономеры с четырьмя приблизительно параллельными альфа-спиралями и двумя пересечениями. Во всех случаях, кроме IL-5 и ИФН-γ, N-конец и С-конец находятся на одной и той же поверхности белка. Поскольку белки типа четырехспирального пучка, кроме IL-5 и ИФН-γ, сворачиваются одинаковым образом, описанные здесь способы для IL-2, IL-4 и GM-CSF применимы и для других белков типа четырехспирального пучка и для других малых цитокиновых белков, которые сворачиваются как мономеры.
Хемокины - это специфический класс цитокинов, которые, как полагают, имеют внеклеточное градиентное распределение и служат посредниками в хемотаксисе специфических классов иммунных клеток. Например, МСР-1 является хемоаттрактантом для моноцитов, макрофагов и активированных Т-клеток; эотаксин - это хемоаттрактант для эозинофилов, а интерлейкин-8 - хемоаттрактант для нейтрофилов. Помимо их функции как хемоаттрактантов, хемокины, как и другие цитокины, способны индуцировать экспрессию определенных генов в определенных клетках-мишенях. Например, полагают, что МСР-1 индуцирует экспрессию тканевого фактора в клетках гладких мышц сосудов (Schecter и др. // J Biol Chem.1997. Т.272. С.28568-28573).
Настоящее изобретение раскрывает слияния цитокин-цитокин и слияния антитело-цитокин-цитокин, в которых один или несколько цитокинов - это хемокин(ы). Изобретение раскрывает также белковые конструкции с тремя или более цитокинами, в которых один или несколько цитокинов - это хемокин(ы). Например, хемокины IP-10, RANTES, MIP-1α, MIP-1β, хемоаттрактантные белки макрофагов, эотаксин, лимфотактин, BLC могут быть слиты со вторым цитокином, соединенным или не соединенным с другими составляющими, такими как антитело.
Геном человека, например, кодирует не менее 50 цитокинов. Известные цитокины вообще имеют сходную трехмерную структуру мономеров и похожий тип белкового сворачивания. Поэтому раскрытые в настоящем изобретении основные типы белковых конструкций и стратегий конструирования могут быть применены к различным известным или не открытым до сего времени цитокинам.
Хемокины имеют особый тип сворачивания с тремя бета-нитями и одной альфа-спиралью. Хемокины сворачиваются как мономеры и в некоторых (но не во всех) случаях затем димеризуются после сворачивания. У всех хемокинов способ сворачивания мономерной субъединицы идентичен и общая структура чрезвычайно подобна. Например, методами рентгеновской кристаллографии и/или ЯМР были определены трехмерные структуры интерлейкина-8, фактора тромбоцитов 4, фактора стимуляции роста меланомы (MGSA), макрофагального воспалительного белка (MIP), RANTES (регулируемого при активации, экспрессируемого и секретируемого Т-клетками в норме), моноцитного хемоаттрактантного белка-1 (МСР-1, MCAF), эотаксина, моноцитного хемоаттрактантного белка-3 (МСР-3), хемокинного домена фракталкина, активирующего нейтрофилы пептида-2 (NAP-2), фактора-1 из клеток стромы (SDF-1), макрофагального воспалительного белка-2, хемокина hcc-2 (макрофагальный воспалительный белок-5), Gro-бета, индуцируемого цитокинами хемоаттрактанта нейтрофилов и CINC/Gro. У все этих структур одинаковая укладка, и они в основном подобны. Благодаря тому, что способ сворачивания хемокинов одинаков, описанные здесь способы для лимфотактина применимы также и к другим хемокиновым белкам.
Часто для осуществления функции хемокина важен его свободный N-конец. Поэтому в некоторых примерах осуществления выгодно конструировать такие слияния, в которых второй цитокин, антитело или иная белковая составляющая может быть слита с С-концом хемокина. Чтобы сконструировать белковый комплекс, содержащий два активных хемокина, полезно, например, слить два различных хемокина с N-концами тяжелой и легкой цепей антитела. Некоторые хемокины, такие как IL-8, при физиологических условиях являются димерами. Для некоторых применений полезно совместно экспрессировать слияние нескольких цитокинов с антителом, такое как слияние IL-8-антитело-цитокин, вместе с неслитой составляющей IL-8 или составляющей IL-8 с другим партнером по слиянию, который не взаимодействует с белковой составляющей - антителом. В этом случае различные составляющие IL-8 слитого белка могут гомодимеризоваться без пространственных препятствий или полимеризации, которая может происходить, если все составляющие IL-8 были слиты с цепью антитела. Нужный слитый белок с несколькими цитокинами можно затем выделить фракционированием по размеру или связыванием со связывающимся с антителом белком, таким как белок А стафилококков.
В предпочтительном примере выполнения слитых белков с несколькими цитокинами, содержащих хемокин, слитый белок включает также составляющую, имеющую функцию адресования, такую как антитело, связывающееся с антигеном. Не вдаваясь в теорию, обычно считают, что распространенность хемокина по всему организму не подействует или не приведет к общему снижению чувствительности клеток к этому хемокину. Кроме того, полагают, что хемоаттрактантная функция хемокина может проявляться только тогда, когда имеется градиент концентрации хемокина.
Предпочтительным примером осуществления является слитый белок лимфокин-антитело-интерлейкин-2. Другой предпочтительный пример осуществления - это такой, в котором и хемокин, и второй цитокин включают иммунный ответ Тh1. Например, весьма предпочтительным примером является слитый белок, содержащий IP-10 и IL-12.
Продление времени полужизни нескольких цитокинов с короткими временами полу жизни
Настоящее изобретение описывает также слитые белки, содержащие два цитокина, оба из которых имеют малое время полужизни в сыворотке, слитые с третьей составляющей, имеющей большое время полужизни в сыворотке. Например, если требуется стимуляция дендритных клеток, полезно объединить активности IL-4 и GM-CSF (Thurner // J Immunol. Methods. 1999. Т.223. С.1-15; Palucka и др. // J. Immunol. 1998. Т.160. С.4587-4595). Поскольку IL-4 и GM-CSF - это небольшие молекулы с короткими временами полужизни в сыворотке, полезно сконструировать слитый белок, содержащий область Fc, IL-4 и GM-CSF. Полученная молекула является мощным стимулятором пролиферации и активности дендритных клеток. Подобным же образом, для доставки цитокинов с объединенными активностями к клеткам, экспрессирующим предварительно определенный антиген, IL-4 и GM-CSF можно слить с адресующим компонентом, таким как антитело.
Область Fc, одна или как часть интактного антитела, может придавать слияниям с несколькими цитокинами некоторые свойства, которые могут быть полезными или неблагоприятными в зависимости от конкретного применения. Эти свойства включают димеризацию, продление времени полужизни в сыворотке, способность связывать комплемент, способность участвовать в зависящей от антител опосредованной клетками цитотоксичности (ADCC) и связывание с рецепторами для Fc. Если наиболее желательной характеристикой является продление времени полужизни в сыворотке, а иммунологические свойства области Fc не важны или нежелательны, предпочтительно использовать область Fc, которая является природным вариантом или мутантом, утратившим одно или несколько иммунологических свойств. Например, если требуется уравнять и продлить времена полужизни в сыворотке двух или нескольких цитокинов с короткими временами полужизни в сыворотке, предпочтительно сконструировать слитый белок с несколькими цитокинами, содержащий область Fc из lgG2 или lgG4, которая имеет относительно сниженное сродство или вообще не имеет сродства к рецепторам для Fc, или же использовать область Fc, содержащую мутацию в сайте связывания с рецепторами для Fc. Фактически уже было показано, что слияние некоторых цитокинов с антителами повышает сродство слитого белка к рецепторам для Fc и что это приводит к повышению скорости их выведения у животных. Было установлено, что использование областей Fc с пониженным сродством к рецепторам для Fc значительно увеличивает время полужизни в сыворотке этих молекул (Gillies и др. // Cancer Res. 1999. Т. 59. С. 2159-2166). В некоторых случаях и в зависимости от использованных цитокинов область Fc, связывающаяся с рецептором для Fc, приводит к интернализации слитого белка с несколькими цитокинами и к разрушению одной или нескольких цитокиновых составляющих.
Адресование
Настоящее изобретение описывает также слитые белки, в которых два или более цитокинов присоединены к белку, способному локализовать цитокины на конкретной молекуле-мишени, клетке или телесном отделе. Предпочтительной молекулой с локализующей способностью является антитело или часть молекулы, содержащая связывающиеся с антигеном вариабельные области антитела. Однако могут быть использованы другие локализующие молекулы или их домены, такие как специфические лиганды или рецепторы, существующие в природе связывающиеся белки, связывающиеся с конкретными субстратами ферменты, искусственно созданные пептиды, которые были отобраны по признаку способности к связыванию или локализации, пептиды с особыми физико-химическими свойствами, имеющими результатом адресующую способность, белки, проявляющие способность к адресованию, благодаря связыванию с адресуемой молекулой, или иные типы белков. В случае слияния с адресуемой молекулой двух цитокинов предпочтительным первым цитокином служит IL-12. Если используется IL-12, то предпочтительный второй цитокин - это IL-2 или GM-CSF.
В случае слияния с антителом существует много способов, которыми могут быть слиты два или более цитокинов, поскольку для присоединения имеется несколько возможных мест. Например, антитело IgG состоит из двух тяжелых и двух легких цепей. Два цитокина можно слить друг с другом и затем присоединить к N- или С-концу либо тяжелой, либо легкой цепи. В качестве альтернативы, каждый цитокин может быть слит по отдельности с одним из N- или С-концов молекулы антитела.
Фиг.3 иллюстрирует набор путей, которыми два цитокина могут быть слиты с молекулой антитела. Например, согласно фиг.ЗА, слитый белок 44 по настоящему изобретению может быть слит с С-концом тяжелой цепи иммуноглобулина (46), которая соединена с легкой цепью иммуноглобулина (48). Как и на фиг.2, слитый белок 44 может иметь различную структуру, в том числе, например, структуру слитых белков 10, 16, 24, 26, 28, 30, 32, 34 или 36, показанных на фигурах 1А-1I. Как показано на фиг.3В, слитый белок 44 может быть слит с N-концом тяжелой цепи иммуноглобулина (46), соединенной с легкой цепью иммуноглобулина (48). В показанных на фигурах 3С и 3D примерах осуществления слитый белок 44 слит с N-концом (фиг.3С) или с С-концом (фиг.3D) легкой цепи иммуноглобулина (48), соединенной с тяжелой цепью иммуноглобулина (46). Как показано на фигурах 3Е и 3F, первый цитокин (12) может быть слит с легкой цепью иммуноглобулина (48), соединенной с тяжелой цепью иммуноглобулина (46), слитой со вторым цитокином (14). Цитокины 12 и 14 могут быть слиты с N-концами (фиг.ЗЕ) или с С-концами (фиг.3F) цепей иммуноглобулина. В качестве альтернативы, как показано на фиг.3G, первый цитокин (12) может быть слит с N-концом легкой цепи иммуноглобулина (48), тогда как второй цитокин (14) слит с С-концом тяжелой цепи иммуноглобулина (46).
Слияния с одноцепочечными антителами
Иногда удобно экспрессировать антитела в форме одноцепочечных молекул. Настоящее изобретение предлагает также слитые белки, в которых два или больше цитокинов слиты с одноцепочечным антителом. Это имеет то преимущество, что сокращается число конструкций ДНК, используемых при экспрессировании нужного слитого белка, что может быть особенно полезно при генотерапии. В частности, если цитокины являются одноцепочечными молекулами, тогда слияние цитокинов с одноцепочечным антителом позволит экспрессировать слитый белок как одну белковую цепь.
Как показано на фигурах 4А-4С, в некоторых примерах осуществления цитокины могут быть слиты с одноцепочечным антителом на его N-конце, его С-конце или на обоих концах. Например, как показано на фиг.4А, слитый белок 44 может быть слит с С-концом одноцепочечного антитела (50), содержащего вариабельную область легкой цепи (52) и вариабельную область тяжелой цепи (54). Как показано на фиг.4В, слитый белок 44 может быть также слит с N-концом одноцепочечного антитела (50). В примере осуществления, показанном на фиг.4С, первый цитокин (12) слит с N-концом одноцепочечного антитела (50), а второй цитокин (14) слит с С-концом одноцепочечного антитела (50).
Предпочтительный пример осуществления представляет собой слияние IL-12 и второго цитокина с одноцепочечным антителом. Более предпочтительный пример осуществления включает в качестве второго цитокина IL-2 или GM-CSF.
Константные области антител обладают свойством участвовать во многих эффекторных функциях. Например, lgG1 участвует в связывании комплемента, ADCC и в связывании с рецептором для Fc. Позиция, в которой цитокин слит, может изменять эффекторную функцию константной области антитела, что полезно, если модуляция таких эффекторных функций необходима.
В некоторых случаях может быть необходимым сконструировать слияние двух или больше цитокинов с составляющей, имеющей адресующую область антитела, но лишенную константных областей. Такой слитый белок меньше по размеру, чем слияние полного антитела с двумя или более цитокинами, что для некоторых целей представляет собой преимущество. Кроме того, такой слитый белок будет лишен одной или нескольких эффекторных функций интактного антитела.
Поэтому настоящее изобретение отводит важное место слитым белкам, в которых два или более цитокина слиты с одноцепочечной областью Fv. Как показано в примерах осуществления, представленных на фигурах 5А-5С, два цитокина могут быть слиты с N-концом или С-концом области Fv, или же цитокины могут быть слиты по одному с каждым из концов. Например, как показано на фиг.5А, слитый белок 44 по настоящему изобретению может быть слит с С-концом одноцепочечной области Fv, содержащей вариабельную область легкой цепи иммуноглобулина (52) и вариабельную область тяжелой цепи иммуноглобулина (54). Слитый белок 44 может быть также слит с N-концом области Fv, как показано на фиг.5В. Как показано на фиг.5С, первый цитокин (12) может быть слит с N-концом области Fv, а второй цитокин (14) может быть слит с С-концом области Fv.
Антитела как гетеродимерные носители для нескольких цитокинов
При некоторых обстоятельствах может потребоваться сконструировать слияние двух или более цитокинов, в котором у обоих цитокинов для активности необходим один и тот же конец. Например, может оказаться так, что для активности каждого цитокина необходим естественно существующий N-конец. Тогда невозможно сконструировать слитый белок в виде одной полипептидной цепи, в котором обе цитокиновые составляющие будут активны.
Антитела - это гетеродимерные белки, состоящие из тяжелых и легких цепей, ковалентно связанных дисульфидными связями. Если необходимо сконструировать слитый белок с несколькими цитокинами, в котором для обеих цитокиновых составляющих необходим интактный, неслитый N-конец, тогда предпочтительно слить два цитокина с N-концами тяжелой и легкой цепей антитела (фиг.3Е). Подобным же образом, если необходимо сконструировать слитый белок с несколькими цитокинами, в котором для обеих цитокиновых составляющих необходим интактный, неслитый С-конец, тогда предпочтительно слить два цитокина с С-концами тяжелой и легкой цепей антитела (фиг.3F). Если антитело используется только как носитель для соединения таким способом двух цитокинов, тогда может быть полезным мутационно изменить или делегировать те части антитела, которые привносят дополнительные свойства, относящиеся к иммунной функции. Например, может быть предпочтительным использование в качестве носителя области Fab, поскольку область Fab сохраняет способность антитела к гомодимеризации, но утрачивает функции, характерные для области Fc. Может также быть полезным использовать антитело или фрагмент антитела, в котором нефункционален сайт связывания с антигеном.
Слияния нескольких цитокинов с антителами объединяют многие из новых отличительных особенностей настоящего изобретения. В слияниях нескольких цитокинов с антителом уравнивается и продлевается время полужизни цитокинов в сыворотке; активность обоих цитокинов локализуется в области-мишени и особенно важно, что исключаются токсические эффекты вследствие системного введения нескольких, синергидно действующих цитокинов, нет необходимости непосредственно сливать цитокины друг с другом, но они могут быть слиты с различными местами тяжелой и легкой цепей молекулы антитела.
При разработке слитого белка, содержащего несколько цитокинов и антитело, существует много возможностей выбора структур и конфигураций, которые можно различить с помощью обычных экспериментов. Полезны также рассмотрения с позиций структурной биологии. Например, многие цитокины попадают в класс, называемый 4-спиральными пучками. Эти структуры состоят из четырех альфа-спиралей, а их N-конец и С-конец близко соседствуют друг с другом. Вообще, поверхность цитокина вокруг N- и С-конца не используется в связывании с цитокиновым рецептором, поэтому оба конца могут быть использованы для слияния с антителом или со вторым цитокином. Однако из-за пространственных (стерических) ограничений иногда трудно прямо слить и N-, и С-конец цитокина типа 4-спирального пучка с различными частями молекул. Поэтому если необходимо слить два различных цитокина типа 4-спирального пучка с антителом, полезно слить цитокины с различными сайтами антитела. В качестве альтернативы, если необходимо сконструировать полипептидную цепь в форме (цепь lg)-цитокин-цитокин, для преодоления стерических проблем можно использовать один или несколько гибких мостиков.
Для присоединения нескольких цитокинов можно вместо антитела использовать также другие секретируемые гетеродимерные молекулы. Например, можно использовать комплекс, содержащий простато-специфический антиген и ингибитор протеаз, с которым он образует комплекс, тяжелую цепь lgA и цепь J, члены семейства TGF-бета и их партнеры по связыванию типа астацина, или IL-12.
Нуклеиновые кислоты
Настоящее изобретение отводит также важное место нуклеиновым кислотам, способным экспрессировать каждый из описанных выше типов белков. Они включают нуклеиновые кислоты, кодирующие слитые белки, содержащие два или более цитокина; слияния с участием двух или более цитокинов и домена димеризации, такого как область Fc; слияния, содержащие два или более цитокина, слитых с антителом, и два или более цитокина, слитых с областью Fv. Предпочтительными формами нуклеиновых кислот являются ДНК-векторы, по которым могут быть в бактериальных клетках или клетках млекопитающих экспрессированы слитые белки. Для слитых белков, содержащих несколько полипептидных цепей, можно использовать несколько нуклеиновых кислот. В качестве альтернативы, может оказаться полезным поместить две или более последовательностей, кодирующих слитый белок, на одну молекулу нуклеиновой кислоты. Примерами иллюстрированы конкретные формы привлекающих внимание нуклеиновых кислот, кодирующих объединения нескольких цитокинов.
Нуклеиновые кислоты по настоящему изобретению особенно полезны для экспрессии слитых белков с несколькими цитокинами либо для продуцирования этих белков, либо для целей генотерапии.
Способы синтеза полезных примеров осуществления настоящего изобретения, а также методы анализа, пригодные для испытания их фармакологической активности, описаны в примерах.
Настоящее изобретение предусматривает также фармацевтические композиции и способы их применения для лечения и предотвращения широкого спектра заболеваний, в том числе (но не ограничиваясь этим) для лечения различных инфекционных заболеваний и рака, а также вакцинации против различных заболеваний.
Слитые белки с несколькими цитокинами могут быть применены для лечения заболеваний, вызванных бактериями, паразитами, грибами или вирусами, или раковых заболеваний. Например, известно, что IL-12 обладает защитным действием при многих типах инфекций, включая (но не ограничиваясь ими) инфекции бактериями Listeria monocytogenes; паразитами Toxoplasma gondii, Leishmania major и Schistosoma mansoni; грибком Candida albicans, и вирусами: вирусом хориоменингита и цитомегаловирусом. Некоторые цитокины вообще действуют в комбинации, это часто полезно для применения слитых белков, содержащих два или более цитокинов, про которые известно, что они действуют синергидно. Например, поскольку известно, что IL-2 усиливает действие IL-12, полезно комбинировать эти цитокины при лечении заболеваний, вызванных бактериями, паразитами, грибами и вирусами.
Предпочтительный способ лечения инфекционного заболевания состоит в использовании слитых белков с несколькими цитокинами, которые дополнительно слиты с адресующим агентом, который помещает несколько цитокинов в место инфекции. Различные стратегии адресования описаны ниже.
Фармацевтические композиции по настоящему изобретению могут быть использованы в форме твердого вещества, разжиженного твердого вещества или в жидких формах дозировки. Такие формы включают, например, пилюли, капсулы, порошки, жидкости, суспензии и т.п., предпочтительно в формах разовой дозировки, пригодных для введения точных доз. Композиции включают подходящий фармацевтический носитель или наполнитель и, кроме того, могут включать другие лекарственные агенты, фармацевтические агенты, носители, адъюванты и т.д. Такие наполнители могут включать другие белки, такие как, например, человеческий сывороточный альбумин или белки плазмы. Фактические способы приготовления таких форм дозировки известны или будут очевидны специалистам в данной области. Композиции или составы для введения в любом случае будут содержать такое количество активного компонента (компонентов), которое эффективно для достижения необходимого эффекта у подлежащего лечению субъекта.
Введение указанных здесь композиций может быть произведено любым из принятых для агентов, обладающих такой активностью, способов введения. Эти способы включают оральное, парентеральное или местное введение и иные способы введения в организм. Предпочтительным способом введения является инъекция.
Количество вводимого активного компонента будет, конечно, зависеть от подлежащего лечению субъекта, тяжести недуга, способа введения и заключения врача, прописывающего лекарство.
Как описано выше, цитокины, такие как IL-2, IL-12, GM-CSF, IL-4 и другие, были изучены в лечении рака. При некоторых обстоятельствах в лечении рака обладает преимуществом использование слитого белка с несколькими цитокинами, ввиду большей простоты введения, повышенного времени полужизни в сыворотке одного из цитокиновых компонентов и/или улучшающей модуляции относительных активностей двух цитокинов.
Предпочтительный способ лечения рака состоит в том, чтобы адресованно направить цитокины в конкретные орган или ткань, так что действие цитокинов может быть сконцентрировано, а побочное действие их распространения в организме может быть исключено. Например, ожидается, что слияния нескольких цитокинов с областью Fc концентрируются в печени, что может быть полезным при лечении рака, локализованного в печени. Более предпочтительный способ состоит в использовании слитого белка с несколькими цитокинами, который дополнительно слит с адресующим агентом, таким как антитело. В частности, антитела KS-1/4 и 14.18 направлены против опухолеспецифичных антигенов (Varki N.M. и др. // Cancer Res 1984. Т.44. С.681-687; Gillies и др. // Journal of Immunological Methods. 1989. Т.125. С.191; патенты США №№4975369 и 5650150). При применении слияния антитела с несколькими цитокинами часто полезно исследовать тип опухоли и выбрать антитело к тому антигену, который вероятнее присутствует в данном типе опухоли. Например, может оказаться полезным охарактеризовать опухоль методом анализа FACS, провести вестерн-блотирование, исследовать ДНК клеток опухоли или просто идентифицировать тип клеток опухоли. Такие методы исследования характеристик опухолей хорошо известны специалистам в области исследования опухолей, таким как онкологи и специалисты по биологии опухолей. Можно также адресованно направлять слитые белки с несколькими цитокинами различными другими способами, такими как слияние с составляющими, представляющими специфические лиганды или рецепторы, слияние с пептидными аптамерами с предварительно выбранной способностью к связыванию, химическая конъюгация с небольшими молекулами с локализующей способностью и т.д. Эти способы адресования могут быть также использованы и при лечении других заболеваний, таких как инфекционные заболевания.
Лечение генотерапией рака и других клеточных нарушений
Нуклеиновые кислоты по настоящему изобретению могут быть использованы как средства генотерапии для лечения рака и других заболеваний, где необходимо нацелить иммунную систему на специфический тип клеток. Например, раковые клетки извлекают из человека или животного, в раковые клетки вводят одну или несколько нуклеиновых кислот, кодирующих слитый белок с несколькими цитокинами, и затем раковые клетки вводят обратно человеку или животному. В качестве альтернативы, можно ввести ДНК в раковую клетку in situ. После этого у человека или животного формируется иммунная реакция на раковые клетки, что может привести к излечению или снижению тяжести ракового заболевания. Генные слияния для нескольких цитокинов, соединенные с подходящими регуляторными элементами для обеспечения экспрессии в клетках млекопитающих, могут быть трансфицированы в раковые клетки любым из многих методов, в том числе с помощью соосаждения с фосфатом кальция, «генной пушки», аденовирусных векторов, катионных липосом, ретровирусных векторов, или с помощью любого другого эффективного метода трансфекции. Нуклеиновые кислоты могут кодировать слитый белок из нескольких цитокинов, дополнительно слитый с другими составляющими.
Противораковая гемотерапия с помощью нуклеиновой кислоты, экспрессирующей слияние нескольких цитокинов, можно комбинировать с другими способами лечения рака, такими как способы, усиливающие иммуностимулирующие свойства слитого цитокинового белка. Например, нуклеиновая кислота по настоящему изобретению может также экспрессировать другие белковые составляющие, которые могут способствовать развитию иммунной реакции на антигены, экспрессируемые раковыми клетками, или может быть трансфицирована совместно с другими нуклеиновыми кислотами, экспрессирующими такие белковые составляющие. Конкретно, в раковые клетки можно совместно трансфицировать нуклеиновые кислоты, экспрессирующие совместно стимулирующий поверхностный белок В7 (Robinson и др. // Патент США №5738852). Трансфекция раковых клеток нуклеиновой кислотой, экспрессирующей слияние нескольких цитокинов, может также сопровождаться введением антитела или иммуноцитокина, нацеленных на раковые клетки (Lode и др. // Proc. Nat. Acad. Sci.1998. Т.95. С.2475). Трансфекция раковых клеток нуклеиновой кислотой, экспрессирующей слияние нескольких цитокинов, может также сопровождаться введением блокатора ангиогенеза (Lode и др. // Proc. Nat. Acad. Sci.1999. Т.9. С.1591).
Способы терапии с использованием дополнительных иммуностимуляторов и/или блокаторов ангиогенеза можно также комбинировать с системным введением слитых белков из нескольких цитокинов. Преимущество совместного введения с дополнительными иммуностимуляторами или блокаторами ангиогенеза состоит в том, что такие воздействия, в отличие от разрушающих ДНК агентов и блокаторов клеточного цикла, не убивают иммунные клетки, которые могут делиться вследствие стимуляции слитым белком с несколькими цитокинами.
Предпочтительный пример осуществления такого способа генотерапии состоит во введении в раковые клетки одной или нескольких нуклеиновых кислот, кодирующей (кодирующих) IL-12 и второй цитокин, и затем в обратном введении раковых клеток человеку или животному. Предпочтительно второй цитокин представляет собой IL-2 или GM-CSF.
Настоящее изобретение предусматривает новые вакцинные композиции и способы усиления действия вакцин, предназначенные для обеспечения у вакцинированных млекопитающих-хозяев защитной опосредованной клетками иммунной реакции на определенные патогены, с использованием в качестве адъюванта двух или более цитокинов, которые были слиты. Например, если требуется иммунная реакция Тh1, можно слить несколько содействующих реакции Тh1 цитокинов и ввести животному полученный слитый белок в комбинации с антигеном.
В частности, можно слить и ввести вместе с антигеном IL-12 и IL-2. В качестве альтернативы, IL-12 и IL-2 можно дополнительно слить с самим антигенным белком и использовать это для стимуляции иммунной реакции. В этом случае изобретение направлено на вакцины, действие которых реализуется через опосредованный клетками иммунитет хозяина, то есть появление цитотоксических Т-лимфоцитов и активированных фагоцитов для обеспечения защиты от инфекции конкретным патогеном. Особенно полезно проводить вакцинации слитыми белками, содержащими IL-12, IL-2 и антиген, поскольку такая комбинация управляет реакцией Тh1 на антиген. Используемые у людей обычные адъюванты, такие как квасцы, имеют тенденцию индуцировать реакцию Тh2.
Если требуется иммунная реакция Тh2, можно использовать слитые комбинации цитокинов, управляющих реакцией Th2. Например, может оказаться полезным слить IL-4 и IL-10, чтобы получить одну молекулу, где полученный слитый белок используется как адъювант. В частности, если необходимо мобилизовать у животного дендритные клетки, можно слитые комбинации IL-4 и GM-CSF либо дополнительно слить с областью Fc для обеспечения связывания с антиген-предъявляющими клетками, либо дополнительно слить с антителом, способным направить слитые цитокины в ткань-мишень, такую как опухоль.
Настоящее изобретение предлагает также новые терапевтические композиции и способы адъювантного усиления действия, направленные на обеспечение синергического действия вместе с определенными терапевтическими композициями, в том числе с так называемыми «раковыми вакцинами», которые могут содержать выбранный антиген, существующий на раковой клетке. Например, белок, содержащий два или несколько слитых цитокинов, можно прямо вводить подходящим способом вместе с нужным образом обработанными раковыми клетками.
ПРИМЕРЫ
Пример 1. Конструирование генных слияний, способных экспрессировать слитые белки цитокин-цитокин
Для создания многофункциональных белков, содержащих несколько цитокинов, были синтезированы генные слияния субъединицы р40 интерлейкина IL-12 с интерлейкином IL-2 и субъединицы р40 интерлейкина IL-12 с GM-CSF. Дополнительно к этому, кодирующую последовательность для зрелого мышиного р35 (SEQ ID NO:1) сливали с промотором и лидерной последовательностью, что обеспечивает высокие уровни экспрессии и эффективную секрецию. Кодирующие последовательности для слияний мышиных компонентов p40-IL-2 и p40-GM-CSF показаны соответственно как SEQ ID NO:2 и SEQ ID NO:3. Было также сконструировано слияние (человеческий p40)-IL-2 (SEQ ID NO: 4). Были сконструированы слияния области Fc мышиного lgG2a с мышиной субъединицей р35 (SEQ ID NO:5) и человеческой субъединицы р35 с областью Fc человеческого lgG1 (SEQ ID NO:6), с использованием ранее раскрытых плазмид (Lo и др. // Protein Engineering. 1998. Т.11. С.495-500; Lo и др. // Патент США №5726087).
Слияние зрелой субъединицы р35 мыши и человека с С-концом тяжелой цепи антитела KS-1/4 описано Gillies и др. (J. Immunology. 1998. Т.160. С.6195-6203). Слияния зрелой субъединицы р35 мыши и человека с С-концом тяжелой цепи антитела 14.18 были сконструированы аналогичным образом (публикация международной заявки WO99/29732).
Обсуждаемый здесь тип стратегии слияния р40 с IL-2 и с GM-CSF вообще применим для слияния двух или более цитокинов. Характерно, что кодирующая последовательность для большинства N-концевых частей содержит сигнальную последовательность секреции, тогда как для С-концевых частей сигнальная последовательность не требуется. При некоторых обстоятельствах может быть полезным поместить кодирующую последовательность для короткого петидного мостика, предпочтительно длиной 10-15 аминокислот и богатого глицином и аланином, между кодирующими последовательностями для двух цитокинов. Манипуляции с ДНК, применяемые для создания всех таких типов слияний, соответствуют уровню подготовки специалистов в данной области.
Например, детали конструирования слияния субъединицы р40 мышиного IL-12 с мышиным IL-2 состояли в следующем. Полномерную кДНК субъединицы р40 мышиного IL-12 клонировали с помощью полимеразной цепной реакции (ПЦР) из клеток селезенки мыши, активированных конканавалином А (концентрация в культуральной среде 5 мкг/мл, в течение 3 дней). Прямой праймер имел последовательность АА GCT AGC ACC ATG TGT CCT CAG AAG СТА ACC (SEQ ID NO:7), в которой сайт Nhel GCL4GC (нуклеотиды 3-8 последовательности SEQ ID NO:7) был помещен в восходящую сторону от кодона инициации трансляции ATG, а обратный праймер имел последовательность СТС GAG СТА GGA TCG GAC CCT GCA GGG (SEQ ID NO: 8), в которой сайт Xhol CTCGAG (нуклеотиды 1-6 последовательности SEQ ID NO:8) был помещен в нисходящую сторону сразу за стоп-кодоном трансляции TAG (антикодон СТА). После проверки нуклеотидной последовательности фрагмент Nhel-Xhol, содержащий кДНК mu-p40 со своим природным лидером, вшивали лигазой в расщепленный рестриктазами Xbal-Xhol вектор pdCs (Lo и др. // Protein Engineering. 1998. Т. 11. С. 495-500). Сайты рестрикции Nhel и Xbal имели совместимые липкие концы, и сайт Nhel был использован для клонирования mu.p40, так как mu.p40 имел внутренний сайт Xbal.
Для конструирования ДНК, кодирующей слияние mu.p40-mu.lL-2, использовали олигонуклеотидный мостик для соединения ДНК mu-p40 ее сайтом PstI (С TGC AG) с фрагментом Smal-Xhol, содержащим кДНК зрелого мышиного IL-2. Последовательность ДНК в месте соединения слитого белка была С TGC AGG GTC CGA ТСС CCG GGT ААА GCA CCC (SEQ ID NO: 9), где С TGC AG (нуклеотиды 1-6 последовательности SEQ ID NO: 9) - это сайт PstI, С CCG GG (нуклеотиды 15-20 последовательности SEQ ID NO: 9) - это сайт Smal, ТСС - остаток С-концевой аминокислотной последовательности мышиной субъединицы р40, а GCA кодирует N-концевой остаток зрелого мышиного IL-2.
ДНК, кодирующая одноцепочечное слияние mu.lL-12-mu.GM-CSF, была получена из ДНК-конструкции, кодирующей указанное выше одноцепочечное слияние mu.lL-12-mu.lL-2 заменой кДНК mu.lL-2 на кДНК mu.GM-CSF в сайте Smal. Последовательность ДНК в месте соединения одноцепочечного mu.lL-12 с mu.GM-CSF была С TGC AGG GTC CGA ТСС CCG GGA ААА GCA (SEQ ID NO:10), где С TGC AG (нуклеотиды 1- последовательности SEQ ID NO:10) - это сайт PstI, С CCG GG (нуклеотиды 17-22 последовательности SEQ ID NO:10) - сайт Smal, ТСС кодирует С-концевой аминокислотный остаток мышиной субъединицы р40, а GCA кодирует N-концевой остаток зрелого мышиного GM-CSF.
Пример 2. Экспрессия слитых белков с IL-12
Слитые белки IL-12-IL-2 экспрессировали следующим образом. Различные сочетания индивидуальных векторов, кодирующих слияния с участием р40, и векторов, кодирующих содержащие р35 белки, вводили совместной трансфекцией в клетки 293 карциномы эпидермиса человека для временной экспрессии слитых белков. ДНК очищали с помощью препаративных наборов (фирма Wizard, Promega Inc.), осаждали этанолом для стерилизации и ресуспендировали в стерильной воде.
Для экспрессии биологически активных гетеродимеров слитого белка с IL-12 различные сочетания индивидуальных векторов, кодирующих слитые и неслитые формы субъединиц, временно экспрессировали при совместной трансфекции клеток 293 карциномы эпидермиса человека. ДНК очищали с помощью препаративных наборов (фирма Wizard, Promega Inc.), осаждали этанолом для стерилизации и ресуспендировали в стерильной воде. Осадки с фосфатом кальция получали стандартными методами, используя 10 мкг ДНК в мл (5 мкг каждой, если проводили совместную трансфекцию двумя плазмидами), и добавляли в количестве 0,5 мл на чашку к культурам клеток 293, выращенным на чашках диаметром 60 мм до приблизительно 70% слияния (Molecular Cloning: A Laboratory Manual, 2nd Ed., Sambrook, Fritsch and Maniatis, eds., Cold Spring Harbor Laboratory Press, 1989). Через 16 ч среду, содержащую осадок, удаляли и заменяли свежей средой. Через 3 дня культуральную жидкость отбирали и анализировали наличие продукта экспрессии трансфицированных генов методом ELISA, биологическим определением активности IL-12 или иммунопреципитацией и анализом меченых радиоактивностью белков электрофорезом в гелях в присутствии SDS. Для введения метки при замене питательной среды на второй день культивирования использовали среду без метионина и добавляли35S-метионин (100 мкКюри/мл). После инкубации еще в течение 16 ч среду отбирали, очищали центрифугированием (5 мин при 13000 об/мин на настольной микроцентрифуге) и инкубировали с гранулами сорбента (белок А)-сефароза (10 мкл гранул на 1 мл надосадочной культуральной жидкости). Через 1 ч инкубации при комнатной температуре гранулы промывали повторным центрифугированием и ресуспендированием в буфере PBS, содержавшем 1% нонидет-Р40 (NP-40). Окончательный осадок ресуспендировали в гелевом буфере с SDS и кипятили 2 мин. После удаления гранул центрифугированием надосадочную жидкость разделяли на две аликвоты. К одной из проб добавляли восстанавливающий агент (5% 2-меркаптоэтанол), и обе пробы кипятили 5 мин, после чего наносили на полиакриламидный гель с SDS. После окончания электрофореза гель экспонировали с рентгеновской фотопленкой (авторадиография).
Трансфекцию осуществляли следующими экспрессирующими плазмидами: mu.p35 плюс mu.p40-IL-2, KS-1/4-mu.p35 плюс mu.p40, KS-1/4-mu.p35 плюс mu.p40-IL-2, 14.18-mu.p35 плюс mu.p40-IL-2, hu.Fc-hu.p35 плюс hu.p40-IL-2, KS-1/4-hu.p35 плюс hu.p40-IL-2, и 14.18-hu.p35 плюс hu.p40-IL-2, где «mu» относится к мышиным белкам, a «hu» - к человеческим.
Когда клетки метили в процессе метаболизма35S-метионином и исследовали секретируемые белки гель-электрофорезом в восстанавливающих условиях в присутствии SDS и авторадиографией, в каждом случае наблюдали высокий уровень экспрессии. Значения молекулярного веса восстановленных слитых белков были предсказаны на основе значений молекулярного веса белков-компонентов, то есть: 35 кДа для субъединицы р35 of IL-12; 40 кДа для субъединицы р40 IL-12; 16 кДа для IL-2; 32 кДа для Fc; 55 кДа для тяжелой цепи иммуноглобулина; и 28 кДа для легкой цепи иммуноглобулина. При анализе наблюдали белки, мигрирующие соответственно значениям молекулярного веса, близким к предсказанным.
Были также выделены стабильно трансфицированные линии клеток, экспрессирующие слитые белки с несколькими цитокинами. Для гетеродимерных конструкций IL-12 p40-IL-2 или IL-12 p40-GM-CSF экспрессирующие векторы, кодирующие слитый белок, были сконструированы так же, как описано ранее для одной субъединицы р40 IL-12 (Gillies и др. // J. Immunol. 1998. Т. 160: С. 6195-6203). Линии трансфицированных клеток, экспрессирующие слитые белки с р40, вторично трансфицировали экспрессирующими векторами, кодирующими субъединицу р35 IL-12, или слитый белок Fc-p35, или слитый белок антитело-р35, описанными в работе Gillies и др. // J. Immunol. 1998. Т.160: С.6195-6203).
Собирали надосадочные жидкости у стабильно трансфицированных клеток, экспрессирующих hu.Fc-IL-12-IL-2 (то есть экспрессирующих KS-p35 и p40-IL-2). Очистку продуктов проводили на сорбенте (белок А)-сефароза связыванием и элюированием в соответствии с предписаниями поставщика (Repligen, Needham, MA, USA). Содержание IL-12 и IL-2 в очищенных белках определяли методом ELISA. Результаты показали, что содержание индивидуальных цитокинов различалось по массе приблизительно в 4 раза, что соответствует 4-кратному различию молекулярных весов IL-12 и IL-2. Подобным же образом, анализ методом ELISA уровней содержания IL-12 и IL-2 в продуктах из трансфицированных клеток, экспрессирующих hu.KS-IL-12-IL-2, дал для IL-12 и IL-2 такие же значения. Таким образом, в пределах точности определений методом ELISA, измеренные величины показывают, что IL-12 и IL-2 продуцируются в молярном соотношении вблизи 1:1. Такие же результаты были получены для слитых белков IL-12-GM-CSF, слитых либо с Fc, либо с целым антителом.
Пример 3. Синергидное действие слитых белков при анализе индукции ИФН-γ
Измеряли биологическую активность слитых белков IL-12-IL-2 в тесте на индукцию ИФН-γ с использованием либо покоящихся, либо активированных митогеном одноядерных клеток периферической крови человека (РВМС), полученных от добровольцев (фиг.6). Продуцирование ИФН-γ измеряли методом ELISA.
Одноядерные клетки периферической крови человека получали от здоровых добровольцев и очищали центрифугированием при 1700 об/мин в течение 20 мин в градиенте Ficoll-Hypaque (Pharmacia). Содержащий РВМС «кожистый» слой разбавляли культуральной средой без сыворотки (SF-RPMI) до 50 мл, клетки собирали центрифугированием при 1500 об/мин в течение 5 мин. После центрифугирования в градиенте клетки ресуспендировали в среде для культур клеток, содержащей 10% сыворотки плода коровы (RPMI-10) с добавкой или без добавки фитогемагглютинина (ФГА, 10 мкг/мл) до плотности клеток 5 х 106 кл/мл и культивировали 3 дня при 37°С в CO2-термостате с увлажнением. Клетки собирали центрифугированием, трижды промывали равным объемом SF-RPMI и ресуспендировали в свежей среде RPM-10 (1 х 106 кл/мл). Аликвоты (100 мкл) распределяли в ячейки планшетов с 96 ячейками, получая конечное число клеток 105 клеток на ячейку. Пробы из культуральной среды последовательно разбавляли и вносили в ячейки планшета с 96 ячейками. В контрольные ячейки вносили IL-12 (фиг.6А) или эквимолярную смесь коммерческих препаратов IL-2 и IL-12 (фиг.6В). Цитокины получали от фирмы R & D Systems. Планшеты инкубировали в течение 48 ч при 37°С в CO2-термостате. В отбираемых для анализа аликвотах (20 мкл) методом ELISA определяли концентрацию ИФН-γ согласно инструкциям поставщика (Endogen, Inc., Woburn, MA, USA).
На фиг.6А представлено сравнение активностей слитого белка IL-12-IL-2 и одного IL-12. Результаты показывают, что один IL-12 индуцирует умеренные уровни ИФН-γ, тогда как слитый белок IL-12-IL-2 в высокой степени индуцирует синтез ИФН-γ. Поскольку известно также, что IL-2 неэффективен в синтезе ИФН-γ, эти результаты показывают, что в слитом белке обе составляющие - IL-12 и IL-2 функциональны и действуют синергидно.
Далее, активности слитого белка Fc-IL-12-IL-2, слитого белка KS-IL-12-IL-2 и смеси эквимолярных количеств IL-12 и IL-2 сравнивали по их способности индуцировать ИФН-γ. Представленные на фиг.6В результаты показывают, что слитый белок Fc-IL-12-IL-2 и слитый белок KS-IL-12-IL-2 имеют приблизительно такую же активность, как и эквимолярная смесь IL-12 и IL-2. Такие же результаты были получены, когда для конструирования слитых белков были использованы мышиные формы IL-2 и IL-12, и конструирование было произведено таким же способом, как описанный в примере 1 для человеческих форм.
Пример 4. Биологическая активность IL-2 и IL-12 в слитых белках IL-12-IL-2
Активности IL-2 и IL-12 в слитых белках сравнивали с активностью свободных цитокинов в тестах на пролиферацию. Активность молекулы (мышиное антитело 14.18)-IL-12-IL-2 испытывали в типовом анализе IL-12 в тесте пролиферации. Человеческие PBMCs получали от добровольцев и культивировали в течение 3 дней в присутствии 5 мкг/мл фитогемагглютинина-Р, промывали средой HBSS Хэнка и высевали в планшеты для микротитрования при плотности 105 клеток на ячейку, согласно стандартной процедуре (Gately М.К., Chizzonite R. и Presky D.H. // Current Protocols in Immunology. 1995. С.6.16.1-6.16.15). Клетки инкубировали в присутствии различных испытуемых белков в течение 48 ч, за 10 ч до определения уровня включения радиоактивности добавляли 0,3 мкКюри3H-тимидина. IL-12 и эквимолярная смесь IL-12 и IL-2 стимулировали включение в клетки3H-тимидина с дозовой зависимостью, а слитый белок 4.18-IL-12-IL-2 был приблизительно столь же эффективен в стимуляции включения3H-тимидина. IL-2 стимулировал включение3H-тимидина только при более высокой молярной концентрации, что указывает на то, что наблюдавшееся включение3H-тимидина, стимулированное слитым белком 14.18-IL-12-IL-2, вызвано в основном активностью его IL-12. Результаты представлены на фиг.7.
Дополнительно испытывали биологическую активность составляющей IL-2 в другом тесте на пролиферацию клеток согласно стандартной процедуре (Davis L.S., Lipsky Р.Е. и Bottomly К. // Current Protocols in Molecular Immunology. 1995. С.6.3.1-6.3.7). Для пролиферации линии клеток мыши CTLL-2 необходим IL-2. Линия клеток CTLL-2 пролиферирует также в ответ на действие IL-4, но она не чувствительна к действию IL-12. Клетки CTLL-2 в активной логарифмической фазе роста промывали дважды средой без IL-2 и высевали в планшеты для микротитрования при плотности 1×104 клеток на ячейку в присутствии различных количеств коммерческого мышиного IL-2, слитого белка mu.14.18-IL-12-IL-2 или коммерческого мышиного IL-12 и продолжали выращивание в течение 48 ч. В конце периода роста методом MTT/MTS определяли количество жизнеспособных клеток. На фиг.8 представлен опыт, в котором варьировали уровни IL-2, IL-12 или слитого белка 14.18-IL-12-IL-2. Результаты показывают, что мышиный IL-2 и слитый белок mu.14.18-IL-12-IL-2 приблизительно одинаково активны в стимуляции пролиферации, тогда как увеличение количества мышиного IL-12 не вызывало заметной стимуляции пролиферации клеток. Этот результат показывает, что стимуляция пролиферации клеток CTLL-2 слитым белком 14.18-IL-12-IL-2 вызвана составляющей IL-2, а не составляющей IL-12.
Пример 5. Конструирование и экспрессия одноцепочечного и многоцепочечного слитых белков IL-12-IL-2 с антителом и без антитела
Одноцепочечный слитый белок с мышиными цитокинами IL-12-IL-2 конструировали следующим образом. Слияние кодирующих последовательностей для p40-IL-2 конструировали с использованием методов, аналогичных использованным в конструировании слияния человеческих белков p40-IL-2 в примере 1. Чтобы соединить ДНК, кодирующие субъединицы р35 и р40 IL-12 и создать единую кодирующую последовательность, синтезировали ДНК, кодирующую мостик, с сайтом Xhol на 5'-конце и сайтом BamHI на 3'-конце. 5'-Конец последовательности, кодирующей слияние мышиной субъединицы р40 с IL-2, был модифицирован введением сайта рестрикции и затем лигирован с 3'-концом мостика. 3'-Конец последовательности, кодирующей мышиную субъединицу р35, был модифицирован созданием сайта рестрикции и лигирован в сайт Xhol мостика. кДНК, кодирующие одноцепочечные mu.lL-12 и mu.p40-mu.lL-2, описанные в примере 1, объединяли с помощью удобного сайта рестрикции в последовательности для р40, чтобы получить третью ДНК-конструкцию, кодирующую одноцепочечное слияние mu.lL-12-mu.lL-2. Эти этапы проводили с использованием различных необходимых векторов и выделенных фрагментов ДНК. Последовательность SEQ ID NO: 11 представляет собой область нуклеотидной последовательности, кодирующей слияние мышиных компонентов р35-мостик-р40-IL-2.
В то же время, с помощью соответствующих методов была сконструирована последовательность, кодирующая соответствующий одноцепочечный мышиный IL-12. Кодирующая последовательность представлена последовательностью SEQ ID NO: 12.
Кроме того, была дополнительно сконструирована последовательность ДНК, кодирующая область Fc мышиного lgG2a, слитого с N-концом слияния р35-linker-p40-IL-2. Кодирующая последовательность представлена как SEQ ID NO: 13.
Культивированные клетки 293 трансфицировали экспрессирующими плазмидами, кодирующими одноцепочечные белки с мышиными партнерами: Fc-IL-12-IL-2 и Fc-IL-12. Экспрессию слитых белков анализировали, как описано в примере 2. Очистку слитых с Fc белков проводили путем их связывания с сорбентом (белок А)-сефароза. Наблюдали высокий уровень экспрессии Fc-IL-12-IL-2 и Fc-IL-12. На основании значений кажущегося молекулярного веса, полученных по миграции в SDS-гелях, был сделан вывод, что белки синтезировались интактными. Эти значения составляли 123 кДа для Fc-IL-12-IL-2 и 107 кДа для Fc-IL-12.
Слитый белок KS-sclL-12-IL-2, описанный в примере 1, представляет собой тетрамер с двумя различными полипептидными цепями: легкой цепью KS-1/4 и тяжелой цепью KS-1/4 с присоединенной на С-конце составляющей sclL-12-IL-2. Чтобы определить, какие сайты на молекуле антитела необходимы для присоединения цитокиновых составляющих, был сконструирован второй слитый белок, в котором составляющие: антитело KS-1/4, IL-12 и IL-2 находились в конфигурации, отличной от конфигурации слияния KS-IL-12-IL-2 в примере 1. Этот второй белок был тетрамерным и состоял из двух различных полипептидов. Один полипептид состоял из легкой цепи антитела KS-1/4. Другой полипептид состоял из одноцепочечного mu. IL-12, слитого со зрелым М-концом тяжелой цепи антитела KS1/4, за которым на карбоксильном конце тяжелой цепи располагался мышиный IL-2.
кДНК, кодирующую субъединицу р35 мышиного IL-12, клонировали с помощью ПЦР из клеток селезенки мыши, активированных конканавалином А (5 мкг/мл культуральной среды в течение 3 дней). Прямой праймер имел последовательность AGCTT GCTAGCAGC ATG TGT САА ТСА CGC ТАС (SEQ ID NO: 14), где сайт Hindlll AAGCTT (нуклеотиды 1-6 последовательности SEQ ID NO: 14) помещен в восходящую сторону от кодона инициации трансляции ATG, a обратный праймер имел последовательность CTCGAG СТТ ТСА GGC GGA GCT CAG АТА GCC (SEQ ID NO: 15), где сайт Xhol CTCGAG (нуклеотиды 1-6 последовательности SEQ ID NO: 15) помещен в нисходящем положении по отношению к стоп-кодону трансляции TGA (антикодон ТСА).
ДНК, кодирующая одноцепочечный IL-12, представляет собой ДНК mu.p35, соединенную с олигонуклеотидом, кодирующим богатый остатками глицина и серина мостик, за которой следует ДНК mu.p40. Полученная конструкция имеет в месте присоединения олигонуклеотида следующую последовательность:

где G AGC TC (нуклеотиды 1-6 последовательности SEQ ID NO: 16) - это сайт рестрикции Sacl, расположенный непосредственно в восходящую сторону от стоп-кодона трансляции мышиной субъединицы р35, GCG кодирует С-концевой аминокислотный остаток мышиной субъединицы р35, GGA TCC (нуклеотиды 50-55 последовательности SEQ ID NO: 16) - сайт рестрикции BamHI, введенный для лигирования, а ATG кодирует N-концевой аминокислотный остаток зрелого mu.p40.
ДНК, кодирующая одноцепочечное слияние mu.IL-12-(тяжелая цепь KS)-mu.GM-CSF, имела в месте соединения mu.p40 и зрелого N-конца тяжелой цепи KS следующую последовательность:

где С TGC AG (нуклеотиды 1-6 последовательности SEQ ID NO: 18) - это сайт рестрикции PstI, расположенный непосредственно в восходящую сторону от стоп-кодона трансляции р40, TCC кодирует С-концевой аминокислотный остаток мышиной субъединицы р40, а CAG кодирует N-концевой аминокислотный остаток тяжелой цепи зрелого KS. Полученная ДНК, кодирующая одноцепочечное слияние mu.IL-12-(тяжелая цепь KS)-mu.lL-2, затем совместно экспрессировали с легкой цепью KS.
Для дальнейшего исследования того, какие концы молекулы антитела пригодны для формирования соединений при слиянии, и того, сколько полипептидов могут быть соединены в слитом белке с несколькими цитокинами, был экспрессирован и испытан на активность третий белок, содержащий KS-1/4, IL-12 и IL-2, а именно IL-12-KS(легкая цепь) + KS(тяжелая цепь)-IL2. Этот слитый белок - гексамер и содержит три различных полипептида. Один полипептид состоит из мышиной субъединицы р35, слитой с легкой цепью антитела KS1/4. Второй полипептид состоит из тяжелой цепи антитела KS1/4, слитой с человеческим IL-2 (Gillies и др. // Proc. Natl. Acad. Sci. USA. 1992. Т.89. С.1428), а третий полипептид - это мышиная субъединица р40. При экспрессии две легкие цепи и две тяжелые цепи соединяются с образованием тетрамерной структуры антитело-цитокины. Вдобавок к этому, р35 на N-конце легкой цепи также связывается дисульфидными связями с р40.
ДНК, кодирующая слияние mu.р35-К8(легкая цепь) имеет в месте соединения следующую последовательность:

где G AGC TC (нуклеотиды 1-6 последовательности SEQ ID NO: 20) - сайт рестрикции Sacl, расположенный непосредственно в восходящую сторону от стоп-кодона трансляции р35, GCG кодирует С-концевой аминокислотный остаток р35, GGA TCC (нуклеотиды 50-55 последовательности SEQ ID NO: 20) - это сайт рестрикции BamHI, введенный, чтобы обеспечить лигирование, a GAG кодирует N-концевой аминокислотный остаток легкой цепи.
Для экспрессирования этого гексамерного слитого белка была создана путем трансфекции экспрессирующим вектором, содержащим ген устойчивости к неомицину, и селекции по G418 клеточная линия, экспрессирующая mu.p40. Экспрессирующую mu.p40 клеточную линию затем трансфицировали экспрессирующим вектором, содержащим единицы транскрипции и легкой цепи, и тяжелой цепи и селективный маркер дигидрофолат-редуктазы, позволяющий вести селекцию на фоне метотрексата (Gillies и др. // J. Immunol. 1998. Т. 160. С. 6195).
Пример 6. Активность слитых белков (мышиный одноцепочечный IL-12)-IL-2
Те же методы, которые были использованы в примере 4, были применены для испытания активности мышиного одноцепочечного слитого белка IL-12-IL-2, продуцированного при кратковременной экспрессии. Количество каждого цитокина в надосадочной жидкости культуры клеток сначала определяли методом ELISA, затем использовали его для установления дозовой зависимости. Значения активности были очень близки к установленным и описанным выше для слитых белков IL-12-IL-2 с Fc и антителом.
Конкретно, активность IL-12 молекул слитых белков с мышиными партнерами: mu.sclL-12-IL-2 и mu.Fc-sclL-12-IL-2 испытывали в тесте на пролиферацию клеток РВМС человека, описанном в примере 4. IL-12 и эквимолярная смесь IL-12 и IL-2 стимулировали включение3H-тимидина в клетки с дозовой зависимостью. В расчете на моль оба слитых белка - и sclL-12-IL-2, и Fc-sclL-12-IL-2 были в стимуляции включения3H-тимидина приблизительно так же эффективны, как и IL-12 (фиг.9). Как описано в примере 4, IL-2 стимулирует включение3H-тимидина только при намного более высоких молярных концентрациях, что свидетельствует о том, что наблюдаемое включение3H-тимидина, стимулированное слитыми белками sclL-12-IL-2, определяется главным образом активностью содержащихся в них IL-12.
В дополнение к этому, в тестах на основе клеток оценивали биологическую активность составляющей IL-2 в слитых белках sclL-12-IL-2, и было обнаружено, что она в пределах точности определения в расчете на моль приблизительно такая же, как и активность коммерческого IL-2. Биологическую активность составляющей IL-2 определяли по пролиферации клеток CTLL-2, как описано в примере 4. Результаты показывают, что мышиный IL-2, слияние мышиных белков sclL-12-IL-2 и слияние мышиных белков Fc-IL-12-IL-2 были приблизительно активны в стимуляции пролиферации. Мышиный IL-12 не приводил к заметной стимуляции пролиферации клеток CTLL-2. Эти результаты показывают, что стимуляция пролиферации клеток CTLL-2 слитыми белками sclL-12-IL-2 осуществляется составляющей IL-2, но не составляющей IL-12.
Активности IL-12 и IL-2 в белках Fc-IL-12-IL-2, IL-12-KS-IL-2 и IL-12-KS(легкая цепь) + KS(тяжелая цепь)-IL-2, описанных в примере 5, также определяли тестом на клеточной основе. С помощью анализа по пролиферации клеток РВМС и по включению меченого тритием тимидина было показано, что белки Fc-IL-12-IL-2, IL-12-KS-IL-2 и IL-12-KS(легкая цепь) + KS(тяжелая цепь)-IL-2 все имеют высокую активность IL-12. Подобным же образом с помощью теста на пролиферацию клеток CTLL-2 было показано, что белки Fc-IL-12-IL-2, IL-12-KS-IL-2 и IL-12-KS(тяжелая цепь) + KS(легкая цепь)-IL-2 все имеют высокую активность IL-2. Кроме того, в анализе ELISA оба белка - и IL-12-KS-IL-2 и IL-12-KS(легкая цепь) + KS(тяжелая цепь)-IL-2 прочно связывались с антигеном ЕрСАМ, даже несмотря на то, что V-области соответственно тяжелой и легкой цепей слиты своими N-концами с другими белками.
Пример 7. Активность слитых белков с мышиными компонентами IL-12-GM-CSF
Активность IL-12 мышиной молекулы Fc-IL-12-GM-CSF определяли в тесте на пролиферацию клеток (фиг.10). Человеческие РВМС получали от трех добровольцев, культивировали с 5 мкг/мл фитогемагглютинина-Р в течение 3 дней, промывали средой HBSS Хэнка и высевали в планшеты для микротитрования при плотности 105 клеток на ячейку, согласно стандартной процедуре (Gately M.K., Chizzonite R. и Presky D.H. // Current Protocols in Immunology. 1995 С.6.16.1-6.16.15). Клетки инкубировали в присутствии различных испытуемых белков в течение 48 ч и за 10 ч до определения уровней включения радиоактивности добавляли 0,3 мкКюри3H-тимидина. IL-12 и эквимолярная смесь IL-12 и GM-CSF стимулировали включение в клетки3H тимидина с дозовой зависимостью, и слитый белок 14.18-IL-12-GM-CSF был приблизительно столь же активен в стимуляции включения3H-т имидина. GM-CSF не стимулировал включение3H-тимидина при испытанных концентрациях, что указывает на то, что наблюдаемое включение3H-тимидина, стимулированное слитым белком 14.18-IL-12-GM-CSF, обусловлено главным образом содержащимся в нем IL-12.
Кроме того, в клеточных тестах была испытана биологическая активность составляющей GM-CSF различных слитых белков IL-12-GM-CSF. Было обнаружено, что составляющая слитого белка GM-CSF активна, причем активность в расчете на моль находится в тех же пределах, что и активность коммерческого GM-CSF. Например, биологическую активность составляющей GM-CSF испытывали в другом тесте на пролиферацию клеток, следуя известной специалистам в области молекулярной иммунологии процедуре (Cooper S.C. и Broxmeyer Н.Е. // Current Protocols in Molecular Immunology. 1996. С.6.4.1-6.4.20). Линия клеток мыши 32D(GM) для пролиферации нуждается в GM-CSF. Эта линия получена из исходной линии клеток 32D, описанной Cooper and Broxmeyer, и является частично чувствительной к GM-CSF (Faas и др. // Eur. J. Immunol. 1993. Т.23. С.1201-1214). Линия клеток 32D(GM) не чувствительна к IL-12. Клетки 32D(GM) в активной логарифмической фазе роста дважды промывали средой без GM-CSF, высевали в ячейки планшета для микротитрования при плотности приблизительно 5×103 клеток на ячейку в присутствии различных количеств коммерческого мышиного GM-CSF или слитого белка с мышиными партнерами IL-12-GM-CSF и выращивали в течение 48 ч. За 16 ч до определения уровня включения радиоактивности добавляли 0,3 мкКюри3H-тимидина. При увеличении количества слитого белка IL-12-GM-CSF была получена зависимость включения3H-тимидина от дозы этого белка. Это указывает на то, что активностью обладает составляющая GM-CSF слитого белка IL-12-GM-CSF. Более того, биологическая активность GM-CSF в слитом белке, рассчитанная на моль, сопоставима с активностью коммерческого мышиного GM-CSF.
Пример 8. Воздействие на карциному прямой кишки иммунопрофицитных мышей слитым белком с несколькими цитокинами
Для проверки того, может ли слитый белок из нескольких цитокинов с антителом быть использован для лечения карциномы прямой кишки у млекопитающих с интактной иммунной системой, были проведены следующие опыты. СТ26 - это полученная из мышей Balb/C линия клеток карциномы прямой кишки. С помощью стандартной техники генетической инженерии этой линии было придано свойство экспрессировать адгезионную молекулу клеток эпителия человека (ЕрСАМ), которая является антигеном, распознаваемым антителом KS-1/4; эти клетки получили обозначение CT26/KSA.
Мышам линии Balb/C инокулировали подкожно 2×106 клеток CT26/KSA. Когда опухоли достигали объема приблизительно 100-200 кубических миллиметров, мышей для дальнейшего исследования разделяли случайным образом на три группы. Начиная с дня 0, группам мышей с опухолями вводили PBS, примерно 3,4 мгк KS-IL-2, смешанного примерно с 5,3 мкг KS-IL-12, или примерно 6 мкг KS-IL-2-IL-12. Эти дозы взяты из расчета введения каждой группе мышей равного количества молекул IL-12 и IL-2. Инъекции проводили внутрь опухоли, один раз в день в течение 5 дней. Размер опухолей измеряли штангенциркулем.
Результаты одного такого опыта приведены на фиг.11. В этом опыте слитый белок KS-IL-2-IL-12 полностью подавлял рост опухолей. Смесь KS-IL-12 и KS-IL-2 также давала значительное подавление роста опухолей, но не такое полное, как KS-IL-2-IL-12. В группе мышей, получавших KS-IL-2-IL-12, 6 мышей из 9 были практически вылечены от опухолей: эти 6 мышей выжили вплоть до 93-го дня, когда опыт был прекращен, и опухоли у этих мышей сократились и исчезли, так что между днями 39-м и 93-м подкожные опухоли нельзя было обнаружить. У остальных 3 мышей рост опухолей был задержан, так что объем опухолей превысил 4000 мм3 только после 87-го дня.
Из мышей, получавших смесь KS-IL-12 и KS-IL-2 две мыши были явно излечены от подкожных опухолей и выжили до конца опыта. Опухоли у остальных 7 мышей не исчезли и со временем увеличивались, достигнув объема 1000 мм3 у одной мыши и более 4000 мм3 у 6 мышей.
Тот факт, что KS-IL-2-IL-12 более эффективен, чем эквимолярная смесь KS-IL-12 и KS-IL-2, был неожиданным. Примененные в этом опыте дозы вводили около 15 пикомолей слитого белка на дозу, что соответствует примерно 9×1012молекул. В начале лечения объем каждой опухоли составлял примерно 160 мм3, что соответствует приблизительно 160 миллионам клеток. Каждая клетка экспрессирует около 106 молекул ЕрСАМ, так что имеется около 1,6×1014 молекул антигена ЕрСАМ, с которыми могут связаться антитела KS. Поэтому маловероятно, что при смешивании KS-IL-12 и KS-IL-2 и инъекции их мышам с такими опухолями эти два иммуноцитокиновых слитых белка конкурируют друг с другом за места связывания с антигеном. Таким образом, эффективная доза IL-12 и IL-2 должна быть по меньшей мере одинаково высока как для смеси KS-IL-12 и KS-IL-2, так и для KS-IL-12-IL-2.
Пример 9. Воздействие слитым белком с несколькими цитокинами на карциному прямой кишки у иммунодефицитных млекопитающих
Многие формы противораковой терапии убивают делящиеся клетки, в том числе клетки иммунной системы. В результате у раковых пациентов иммунитет часто подавляется. Чтобы проверить, можно ли использовать слитые белки с несколькими цитокинами для лечения млекопитающих с подавленной иммунной системой, мышам линии SCID, имеющим опухоли CT26/KSA, вводили KS-IL-12-IL-2, смесь KS-IL-12 и KS-IL-2 или PBS. Мыши SCID имеют дефицит и В, и Т-клеток, и для того чтобы бороться с инфекциями, им необходимы ветви врожденной иммунной системы, такие как естественные клетки-киллеры (NK).
Мышей с подкожными опухолями CT26/KSA получали, как описано в примере 8. Трем группам по 8 мышей в каждой с опухолями приблизительно 100-200 мм3 вводили инъекцией внутрь опухоли препараты в той же дозировке и том же режиме, как в примере 8. Результаты представлены на фиг.12. В этом случае слитый белок KS-IL-12-IL-2 и смесь KS-IL-12 и KS-IL-2 были приблизительно одинаково эффективны: в каждой группе к 25-му дню 5 из 8 мышей были излечены. Однако у 5 из 6 неизлеченных животных опухоли начали расти со скоростью, характерной для опухолей у контрольных животных, с эффективной задержкой примерно от 14 дней до 21 дня. Это не похоже на поведение опухолей у иммунопрофицитных мышей в примере 8: даже если опухоли не были полностью уничтожены обработкой слитым белком KS-IL12-IL2, опухоли не начинали энергично расти вплоть до 60-го дня после начала опыта.
Эти опыты показывают, что слитый белок из нескольких цитокинов с антителом может быть применен для лечения рака у иммуносупрессивного животного.
Пример 10. Лечение карциномы легкого внутриопухолевой инъекцией слитого белка с несколькими цитокинами: сравнение с лечением индивидуальными иммуноцитокинами
Для оценки эффективности при раке легких клеточного происхождения слитых белков с несколькими цитокинами и иммуноцитокинов, несущих одиночную цитокиновую составляющую, был проведен следующий опыт.
Карцинома легкого Льюиса (LLC) - это агрессивная опухоль, полученная из мышей C57BL/6. Линию клеток LLC, экспрессирующих человеческий белок ЕрСАМ, конструировали стандартными методами генетической инженерии, эти клетки получили название LLC/KSA.
Мышей C57BL/6 с подкожными опухолями LLC/KSA получали, как описано в примере 8 (число клеток проверяли методом KML). Пяти группам по 5 мышей в каждой с опухолями размером приблизительно от 100 до 200 мм3, вводили препараты инъекцией в опухоль в течение 5 дней. Мышам вводили PBS, примерно 20 мкг KS-IL-12, примерно 20 мкг KS-IL-2 или примерно 20 мкг KS-IL-12-IL-2.
Результаты приведены на фиг.13. В этом случае слитый белок KS-IL-12-IL-2 был намного более эффективен, чем либо KS-IL-12, либо KS-IL-2. У всех мышей, получавших слитый белок KS-IL-12-IL-2, опухоли к 27-му дню исчезли. На 74-й день у этих мышей был проведен тест на легочные метастазы, как описано в примере 14; исходные подкожные опухоли не появлялись ни в период воздействия, ни в ходе второго опыта. В противоположность этому, введение либо KS-IL-2, либо KS-IL-12 приводило к некоторому заметному съеживанию опухолей и существенной задержке в росте опухолей, но опухоли со временем продолжали расти. Сравнение результатов этого примера с предыдущими примерами показывает, что при некоторых типах болезни и способах введения лечение смесью иммуноцитокинов, несущих различные цитокиновые составляющие, более эффективно, чем лечение индивидуальным типом иммуноцитокина.
Пример 12. Лечение карциномы легкого внутриопухолевой инъекцией слитого белка с несколькими цитокинами: сравнение с лечением смесью иммуноцитокинов
Для оценки эффективности слитых белков с несколькими цитокинами и смесей иммуноцитокинов, несущих различные цитокиновые составляющие, при полученном из клеток раке легкого был проведен следующий опыт.
Мышей C57BL/6 с подкожными опухолями LLC/KSA получали, как описано в примере 11. Трем группам по 7 мышей в каждой с опухолями размером примерно 100-200 мм3 вводили препараты инъекцией в опухоль в течение 5 дней. Мышам вводили PBS, смесь приблизительно 18 мкг KS-IL-12 и приблизительно 11,5 мкг KS-IL-2 или около 20 мкг KS-IL-12-IL-2.
Результаты приведены на фиг.14. В этом случае слитый белок KS-IL-12-IL-2 был намного более эффективен, чем смесь KS-IL-12 и KS-IL-2. У всех мышей, получавших слитый белок KS-IL-12-IL-2, опухоли исчезали к 27-му дню. В противоположность этому, введение смеси KS-IL-12 and KS-IL-2 приводило к некоторому сморщиванию опухолей и существенной задержке их роста, однако рост всех опухолей со временем возобновлялся.
Пример 13. Зависимость противоопухолевой активности слитого белка из нескольких цитокинов с антителом от антигена
Для оценки того, зависит ли эффективность слитого белка из нескольких цитокинов с антителом в лечении опухоли от опухоле-специфичной экспрессии антигена, распознаваемого антителом, был проведен следующий опыт.
Были созданы, как описано в примере 11, группа из 7 мышей с подкожными опухолями LLC/KSA и вторая группа из 9 мышей с опухолями, развивающимися из исходной линии клеток LLC. Этим двум группам мышей с опухолями размером примерно 100-200 мм3 вводили препараты инъекцией в опухоль в течение 5 дней. Мыши получали приблизительно 20 мкг KS-IL-12-IL-2.
Результаты приведены на фиг.15. В этом случае мыши, имевшие опухоли LLC/KSA, были все полностью излечены от опухолей. В противоположность этому, только две мыши с опухолями LLC были излечены, а у всех остальных мышей с опухолями LLC наблюдалось временное уменьшение объема опухолей, но со временем их опухоли разрастались до большого объема.
Эти результаты показывают, что распознавание поверхностного антигена ЕрСАМ способствует прикреплению KS-IL-12-IL-2 к поверхности клеток опухоли LLC/KSA, в результате чего иммунная реакция усиливается. Некоторый противоопухолевый эффект наблюдался также и по отношению к опухолям, происходящим из клеток LLC. Не связывая себя теоретическими соображениями, можно считать, что в этом случае противоопухолевое действие KS-IL-12-IL-2 обусловлено тем фактом, что инъекция слитого белка производилась прямо в опухоль и он поэтому временно локализовался в опухоли.
Пример 14. Формирование иммунной памяти против определенного типа клеток опухоли
При лечении рака главной проблемой является развитие метастазов. Чтобы проверить, может ли лечение слитым белком из нескольких цитокинов с антителом привести к формированию долговременной иммунной памяти о типе клеток опухоли и предотвратить развитие метастазов, был проведен следующий опыт.
Пяти мышам C57BL/6 из примера 11 вводили KS-IL-12-IL-2, и они явно были излечены от подкожных опухолей. На 74-й день от начала лечения, описанного в примере 14, этим пяти мышам вводили внутривенной инъекцией 106клеток LLC/KSA. В качестве контроля 8 мышам C57BL/6 также внутривенно вводили 106 клеток LLC/KSA.
На 28-й день мышей забивали и их легкие исследовали на наличие метастазов. Легкие восьми контрольных мышей были на 70-100% покрыты метастазами, средняя величина покрытия поверхности легких составляла 85%. Средний вес легких у этих мышей был равен 0,86 г. Наоборот, на поверхности легких пяти предварительно подвергнутых лечению мышей не было обнаружено никаких метастазов, а средний вес легких составлял 0,28 г, что соответствует весу нормальных мышиных легких. Эти результаты показывают, что лечебное воздействие на исходные клетки опухоли приводит к развитию долговременной иммунной памяти на опухолевые клетки; эта память препятствует образованию метастазов этим типом опухолевых клеток.
Средний вес легких в контрольной группе без опухолей был 0,2 г. Степень метастазирования оценивали по проценту покрытия поверхности легких слившимися метастатическими узелками, где 0 обозначает отсутствие метастазов, 1 - покрытие 1-25%; 2 - покрытие 25-50%; 3 - покрытие 50-75%; 4 - покрытие 75-100%.
Во втором опыте по исследованию формирования иммунной памяти были использованы 6 из 7 мышей из примера 12, которым были введены опухолевые клетки LLC/KSA, у которых развились подкожные опухоли и затем эти опухоли исчезли. Через 62 дня после начала лечения в примере 12 шести пролеченным мышам и 10 свежим, не получавшим лечения, подкожной инъекцией ввели 106 клеток LLC. Эти клетки не экспрессируют ЕрСАМ - антиген KS человека.
В свежих мышах инъецированные клетки LLC образовывали опухоли, которые росли у всех мышей с большой скоростью. Напротив, опухоли у пролеченных предварительно мышей росли намного медленнее, а у одной из мышей подкожная опухоль не была обнаружена. Результаты представлены на фиг.16.
Поскольку человеческий антиген KS, ЕрСАМ, не экспрессируется на клетках LLC, иммунная реакция на LLC основана на других антигенах, экспрессируемых этими клетками.
Пример 15. Слитые белки с несколькими цитокинами как вакцины
Слитые белки с несколькими цитокинами можно использовать как вакцины, если они слиты с белком-антигеном. Конкретный порядок следования составляющих от N-конца к С-концу, представляет ли слитый белок собой одну полипептидную цепь или является олигомером, может меняться, в зависимости от удобства для конструирования экспрессирующих плазмид. Белок может быть введен разнообразными способами, такими как внутривенный, подкожный, внутрибрюшинный и т.д. Точно так же доза и частота введения вообще нуждаются в эмпирическом подборе, что является стандартной практикой в вакцинации людей и хорошо известно специалистам в области разработки вакцин.
Например, мышам вводят слитый белок в форме антиген-IL-12-цитокин, причем цитокин в слитом белке - это второй цитокин, отличный от IL-12. Контрольным мышам вводят антиген-цитокин, антиген-IL-2 или один антиген. В различные моменты времени в течение и/или после введения антигенного слитого белка отбирают пробы крови из вены и получают и анализируют плазму на содержание антител к данному антигену. Показано, что образуются антитела к антигену. Более того, природа иммунной реакции на антиген соответствует реакции Тh1. Выработка антител сильнее и тип продуцируемых антител иной, чем при определенных контрольных иммунизациях.
Конкретнее, мышам линии Balb/c вводят внутривенно (5 мкг/день, 5 дней) в буфере PBS слитый белок состава (антитело человека)-(мышиный IL-12)-(мышиный IL-2). Контрольным мышам вводят то же антитело, но не присоединенное к слиянию IL-12-IL-2. Ни один из вводимых инъекцией растворов не содержит никакого другого типа адъюванта. На 10-й день из вены отбирают пробы крови в пластиковые микроцентрифужные пробирки с цитратом натрия и получают плазму центрифугированием при максимальной скорости в настольной микроцентрифуге Eppendorf. Ячейки планшета для метода ELISA (96 ячеек) покрывают антителами человека, содержащими константную область человеческого иммуноглобулина. Эти планшеты используют для вылавливания любых мышиных антител, продуцируемых в ответ на иммунизацию. После отмывки несвязанного материала обнаружение связанных мышиных антител производили с помощью козьих антител к мышиной области Fc (Jackson ImmunoResearch), конъюгированных с пероксидазой хрена. Все связанные антитела могут быть специфичными либо к константным областям, либо к вариабельной области человеческого иммуноглобулина, обе эти области представлены в человеческом антителе и слитых белках.
На человеческое антитело без слияния с IL-12-IL-2 реакции почти нет или совсем нет. Напротив, слитый белок индуцирует сильную иммунную реакцию с образованием антител в отсутствие экзогенных адъювантов и несмотря на то, что внутривенный путь введения крайне неблагоприятен по сравнению с подкожным или внутрибрюшинным введением для индукции таких реакций. В группе мышей, которым вводили слитый белок антитело- IL-12-IL-2, наблюдается появление антител изотипа lgG2a, которые типичны для реакций со стимуляцией IL-12. В группе мышей, иммунизированных только человеческим антителом, такие антитела не наблюдаются.
Иммуногенность слитых белков с несколькими цитокинами, содержащих слияние антиген-IL-2 и введенных различными путями, проверяют при инъекции раствора слитого белка (такого как описан выше) в PBS или другом биосовместимом буфере, или в известном адъюванте, таком как неполный или полный адъювант Фрейнда. Например, каждые две недели можно производить одну или несколько подкожных, внутрикожных или внутрибрюшинных инъекций. В качестве альтернативы слитый белок можно вводить сначала подкожной инъекцией, а затем внутрибрюшинной инъекцией. Адъювант Фрейнда нельзя использовать у людей из-за раздражения в месте инъекции. Разрешены для применения у людей и могут быть использованы в настоящем изобретении альтернативные адъюванты, такие как осадки в гидроокиси алюминия (квасцы, «Алюм»). Для внутрикожных инъекций могут быть также использованы новые органические химические адъюванты на основе скваленов и липидов.
Пример 16. Генотерапия слитыми белками с несколькими цитокинами
Была также продемонстрирована обеспеченная методами генотерапии противораковая активность слитых белков с несколькими цитокинами при лечении рака легких. Клетки карциномы легких Льюиса были стабильно трансфицированы с помощью описанной выше системы вирусных векторов (ДНК pLNCX-sclL-12-IL-2 или pLNCX-sclL-12, трансфицированная в упаковочную клеточную линию РА317). Эти конструкции кодируют одноцепочечную версию IL-12, в которой субъединицы р35 и р40 соединены мостиком. Селекцию клонов проводили in vitro в среде с G418, и клоны, стабильно экспрессирующие около 50-60 нг/мл IL-12, идентифицировали методом ELISA (R & D Systems).
Приблизительно 1х106 и приблизительно 5×106 клеток LLC, экспрессирующих sclL-12 или sclL-12-IL-2, вводили подкожной инъекцией мышам линии C57BL/6 и мышам линии SCID. В качестве контроля мышам линии C57BL/6 и мышам линии SCID вводили 2×106 клеток LLC. Клетки LLC, экспрессирующие IL-12, образуют опухоли, которые растут примерно с такой же скоростью, как и опухоли, полученные из клеток LLC, которым не была придана способность экспрессировать цитокины. Однако и у мышей C57BL/6, и у мышей SCID клетки LLC, экспрессирующие sclL-12-IL-2, либо вообще не образуют опухоли, либо образуют опухоли, которые вскоре уменьшаются и исчезают (фигуры 17 и 18).
Пример 17. Конструирование слитых белков с несколькими цитокинами, содержащих IL-4 и GM-CSF
Цитокины IL-4 и GM-CSF при их сочетанном применении являются мощными активаторами дендритных клеток. Слитый белок с несколькими цитокинами, обладающий активностью IL-4 и GM-CSF, может быть сконструирован следующим образом. Кодирующую последовательность для GM-CSF сливали с сохранением рамки считывания с 3'-концом кодирующей последовательности для тяжелой цепи антитела KS-1/4, перед которой помещали лидерную последовательность. В дополнение к этому, кодирующую последовательность для IL-4, включая лидерную последовательность, сливали с сохранением рамки считывания с 5'-концом кодирующей последовательности для легкой цепи зрелого антитела KS-1/4.
Конкретно, чтобы сконструировать ДНК, кодирующую слитый белок из мышиного IL-4 и легкой цепи антитела KS-1/4, кДНК мышиного IL-4 адаптировали с помощью ПЦР, используя прямой праймер TCTAGACC ATG GGT СТС ААС ССС CAG С (SEQ ID NO: 22), в котором сайт Xbal TCTAGA (нуклеотиды 1-6 последовательности SEQ ID NO: 22) был помещен с восходящей стороны от кодона инициации трансляции ATG, и обратный праймер С GGA TCC CGA GTA АТС CAT TTG CAT GAT GCT CTT TAG GCT TTC CAG G (SEQ ID NO: 23), который содержит сайт BamHI GGA TCC (нуклеотиды 2-7 последовательности SEQ ID NO: 23) сразу с 3'-стороны от кодона TCG (антикодон CGA), кодирующего С-концевой аминокислотный остаток мышиного IL-4. После клонирования фрагмента ПЦР и проверки нуклеотидной последовательности фрагмент Xbal-BamHI, содержащий кДНК мышиного IL-4, лигировали с олигонуклеотидным дуплексом BamHI-Aflll, кодирующим богатый остатками глицина и серина гибкий пептидный мостик. Конец Aflll был в свою очередь присоединен к искусственно внедренному сайту Aflll, предшествующему N-концу легкой цепи зрелого антитела KS-1/4. Последовательности ДНК и белка в месте соединения, полученного путем двух лигирований, приведены ниже.

В этой последовательности ДНК участки GGATCC (нуклеотиды 4-9 последовательности SEQ ID NO: 24) и CTTAAG (нуклеотиды 48-53 последовательности SEQ ID NO: 24) являются двумя сайтами рестрикции соответственно BamHI и Aflll, использованными для реконструкции; TCG кодирует С-концевой остаток серина в мышином IL-4; GAG кодирует зрелый N-конец легкой цепи KS-1/4, а аминокислотная последовательность богатого GlySer пептидного мостика показана под последовательностью ДНК. Вокруг сегментов ДНК, кодирующих оба слитых полипептида, подходящим образом были помещены вспомогательные последовательности для высокоэффективной экспрессии, в том числе сильные промоторы; это было сделано с использованием описанных в предыдущих примерах приемов и других стандартных методик молекулярной биологии.
Последовательности ДНК, кодирующие слитые белки IL-4-KS(легкая цепь) и KS(тяжелая цепь)-GM-CSF, были трансфицированы в клетки NS/0, и был достигнут высокий уровень экспрессии соответствующих полипептидов. SDS-PAGE в восстанавливающих условиях показал размытую (диффузную) зону с молекулярным весом около 80 кДа, соответствующую полипептиду (тяжелая цепь)-GM-CSF, и несколько зон вблизи 50 кДа, соответствующих слиянию IL-4-(легкая цепь). Наличие диффузной зоны и упомянутых нескольких зон отражает различную степень гликозилирования соответственно IL-4 и GM-CSF.
Субъединицы объединяются в связанный дисульфидными связями тетрамерный белок со структурой, соответствующей общей структуре на фиг.3G. Этот белок имеет антиген-связывающую активность KS-1/4, способность связываться своими областями Fc с белком А стафилококков и цитокиновую активность IL-4 и GM-CSF. Активность IL-4 измеряли по зависимой от IL-4 стимуляции включения меченого тритием тимидина в клетки CTLL-2. Активность GM-CSF измеряли по зависимой от GM-CSF стимуляции включения меченого тритием тимидина в клетки 32(D)GM. В расчете на моль активность IL-4 и активность GM-CSF в слитом белке KS-IL-4-GM-CSF была близка к активности очищенных IL-4 и GM-CSF.
Слияние цитокинов IL-4 и GM-CSF без присоединенных последовательностей антитела было сконструировано следующим образом. Мышиный IL-4 клонировали с помощью ПЦР из РНК клеток селезенки мыши. Прямой праймер имел последовательность TCTAGACC ATG GGT СТС ААС ССС CAG С (SEQ ID NO: 26), в которой сайт Xbal TCTAGA (нуклеотиды 1-6 последовательности SEQ ID NO: 26) был помещен с восходящей стороны от кодона инициации трансляции ATG, а обратный праймер имел последовательность CGA ТАТ ССС GGA CGA GTA ATC CAT TTG CAT GAT GCT CTT TAG GCT TTC CAG G (SEQ ID NO: 27), в которой сайт EcoRV GAT ATC (нуклеотиды 2-7 последовательности SEQ ID NO: 27) помещен непосредственно в 3'-сторону от кодона TCG (антикодон CGA), кодирующего С-концевой аминокислотный остаток мышиного IL-4. После проверки нуклеотидной последовательности фрагмент Xbal-EcoRV, содержащий кДНК mu.lL-4 с его нативным лидером, был лигирован во фрагмент Smal-Xhol, содержащий кДНК mu. GM-CSF, чтобы получить нижеследующую последовательность в месте соединения слияния между mu.lL-4 и mu.GM-CSF: ATG GAT TAC TCG TCC GGG ATG GGA ААА GCA ССС GCC CGC (SEQ ID NO:28), где С-концевая последовательность mu.lL-4 и N-концевая последовательность mu.GM-CSF выделены жирным шрифтом, a G ATG GG (нуклеотиды 17-22 SEQ ID NO: 28) - это последовательность, являющаяся следствием пришивки лигазой конца с ровным обрезом EcoRV к концу с ровным обрезом Smal. Полученную в результате ДНК, кодирующую слияние mu.lL-4-mu.GM-CSF, затем клонировали в экспрессирующий вектор. Экспрессированный белок анализировали с помощью SDS-PAGE. Было обнаружено, что он мигрирует в виде диффузной зоны с кажущимся молекулярным весом от 45 до 50 кДа. В расчете на моль активность IL-4 и GM-CSF в слиянии IL-4-GM-CSF была близка к активности очищенных IL-4 and GM-CSF.
Пример 18. Конструирование ДНК, кодирующей слитый белок лимфотактин-KS-IL-2 и экспрессия белка лимфотактин-KS-IL-2
Хемокины - это особый класс цитокинов, которые, как полагают, образуют градиенты и являются посредниками в хемотаксисе иммунных клеток. Кроме того, подобно другим цитокинам, хемокины могут индуцировать экспрессию специфических генов в клетках-мишенях. Одна из характерных особенностей хемокинов состоит в том, что для их активности нужен свободный N-конец, что может ограничивать выбор путей, которыми можно конструировать слитые белки.
Был сконструирован слитый белок цитокин-антитело-цитокин, состоящий из цитокина лимфотактина, являющегося хемокином, антитела KS-1/4 и цитокина IL-2. Этот слитый белок был тетрамером и содержал два различных полипептида. Один полипептид состоял из мышиного лимфотактина, слитого с N-концом тяжелой цепи антитела KS-1/4, за которым на С-конце располагался IL-2. Слияние тяжелой цепи KS-1/4 на С-конце с IL-2, т.е. «KS(тяжелая цепь)-IL2» было описано ранее (Gillies и др. // Proc. Natl. Acad. Sci. USA. 1992. Т. 89. С. 1428). Другой полипептид состоял из легкой цепи антитела KS1/4.
Полная кодирующая последовательность мышиного лимфотактина была опубликована в работе Kelner и ZIotnik // Science. 1998. Т. 266. С. 1395. Чтобы сконструировать ДНК, кодирующую слитый белок из мышиного лимфотактина и слияния (тяжелая цепь KS)-IL-2, кДНК мышиного лимфотактина адаптировали с помощью ПЦР, используя прямой праймер TCTAGAGCCACC ATG AGA СТТ СТС СТС CTG AC (SEQ ID NO: 29), в котором сайт Xbal TCTAGA (нуклеотиды 1-6 последовательности SEQ ID NO: 29) был помещен с восходящей стороны от кодона инициации трансляции ATG, и обратный праймер GGA TCC CCC AGT CAG GGT ТАС TGC TG (SEQ ID NO: 30), который вводил сайт BamHI GGA TCC (нуклеотиды 1-6 последовательности SEQ ID NO: 30) непосредственно с 3'-стороны кодона GGG (антикодон CCC), кодирующего С-концевой аминокислотный остаток мышиного лимфотактина. После клонирования ПЦР фрагмента и проверки нуклеотидной последовательности фрагмент Xbal-BamHI, содержавший кДНК мышиного лимфотактина, был лигирован с олигонуклеотидным дуплексом BamHI-Aflll, кодирующим богатый остатками глицина и серина гибкий пептидный мостик. Конец Aflll был в свою очередь соединен с искусственным сайтом Aflll, расположенным перед зрелым N-концом слияния KS(тяжелая цепь)-IL-2. Последовательность ДНК в соединяющем участке, полученном в результате двух лигирований, приведена ниже:
где GGATCC (нуклеотиды 4-9 последовательности SEQ ID NO: 31) и CTTAAG (нуклеотиды 48-53 последовательности SEQ ID NO: 31) - это два сайта рестрикции, соответственно BamHI и Aflll, использованные для реконструкции; ССС кодирует С-концевой аминокислотный остаток мышиного лимфотактина; CAG кодирует зрелый N-конец тяжелой цепи KS-IL-2; аминокислотная последовательность богатого GlySer пептидного мостика показана над последовательностью ДНК. Затем ДНК, кодирующую слияние (мышиный лимфотактин)-(тяжелая цепь KS)-IL-2, клонировали в экспрессирующий вектор, после чего экспрессировали совместно с легкой цепью KS1/4.
Лимфотактинную активность экспрессированного слитого белка лимфотактин-KS-IL-2 испытывали в миграционном тесте в камере Boyden на Т-клетках (Leonard и др. // Current Protocols in Immunology. 1999. С. 6.12.3). В качестве альтернативы, использовали клетки NK (естественные киллеры). В качестве альтернативы, активность лимфотактина определяли в стандартном клеточном тесте на кальциевый поток в ответ на активацию сцепленного с G-белком рецептора (Maghazachi и др. // FASEB J. 1997. Т. 11. С. 765-774). Кроме того, испытывали слитый белок лимфотактин-KS-IL-2 и обнаружили, что он активен в анализе на способность связываться с ЕрСАМ, и он был также активен в тестах на активность IL-2, таких как тест на пролиферацию клеток CTLL-2.
Включение ссылкой
Все упомянутые выше публикации полностью включены в эту заявку ссылкой на них.
Эквиваленты
Изобретение может быть осуществлено в других конкретных формах, не выходя за границы его идеи и существенных характеристик. Поэтому предыдущие осуществления должны рассматриваться во всех отношениях как иллюстрирующие, но не ограничивающие описанное здесь изобретение. Таким образом, сфера изобретения обозначена не столько предшествующим описанием, сколько прилагаемой формулой, и поэтому подразумевается, что здесь содержатся все изменения, укладывающиеся в смысл и область эквивалентности формулы.
Реферат
Изобретение относится к слитым белкам, а именно к многофункциональному слитому белку цитокин-антитело, который включает область иммуноглобулина и слитый белок цитокина формулы IL-12-X или X-IL-12, где интерлейкин-12 (IL-12) представляет собой первый цитокин, а X представляет собой второй цитокин, выбранный из группы, включающей IL-2, IL-4 и GM-CSF, ковалентно присоединенный либо на амино-конце, либо на карбоксильном конце к субъединице p35 или p40 интерлейкина-12 (IL-12) в его гетеродимерной или одноцепочечной форме, причем указанный слитый белок цитокина слит либо своим амино-концом, либо карбоксильным концом с указанной областью иммуноглобулина. Многофункциональный слитой белок цитокин-антитело обладает противораковой активностью. 4 н. и 9 з.п.ф-лы, 18 ил., 1 табл.

Формула
Документы, цитированные в отчёте о поиске
Способ получения димерного одноцепочечного слитого белка (варианты)
Синтетические мембранные везикулы, содержащие функционально активные слитые пептиды как системы для введения лекарственных средств, способ из получения, применение для изготовления лекарственных средств против спида

Комментарии