Способ получения димерного одноцепочечного слитого белка (варианты) - RU2128709C1
Код документа: RU2128709C1
Чертежи




Описание
Настоящее изобретение описывает новый класс связывающих антиген молекул, которые содержат Fv-фрагмент антитела, но не используют константные области антитела. Они также могут быть димеризованы с другими молекулами фрагментов антитела или с фрагментами молекул не-антитела с образованием би- или мультифункциональных антител-фрагментов слитых белков и так называемых миниантител соответственно. Новые слитые белки могут быть использованы в широкой области диагностической и терапевтической медицины.
В последние несколько лет проявляется большой интерес к биотехнологической области модификации антител природного происхождения, чтобы получить более специфические и более индивидуальные виды антител. Поэтому были сделаны попытки получить (модифицированные) фрагменты антител.
Все антитела природного происхождения любого класса имеют по крайней мере два сайта связывания. Это дает им возможность связываться с поверхностью с большим функциональным сродством (также называемой авидностью), чем одновалентные фрагменты, такие как Fab фрагменты. В последние несколько лет были описаны способы (Skerra and Pluckthun, 1988, Science 240, 1038 - 1040; Belter et al, 1988, Science 240, 1041 - 1043), с помощью которых могут быть получены функциональные фрагменты антител в Escherichia coli. Они включают Fv фрагмент (гетеродимер, состоящий из VH и VL) и Fab фрагмент (состоящий из полной легкой цепи с доменами VL и CL, а также первых двух доменов тяжелых цепей VH и CH1).
Однако Fv фрагмент имеет тенденцию диссоциировать на VH и VL и, следовательно, выгодно связывать два домена ковалентно. Одним конкретным путем их связывания является конструирование пептидного линкера между ними или в ориентации VH -линкер- VL или VL -линкер- VH (Bird et al, 1988, Science, 242, 423; Huston et al, 1988, Proc. Nate, Acad. Sci. USA 85, 5879). Полученные в результате фрагменты называют одноцепными Fv фрагментами.
Однако все эти фрагменты являются одновалентными. В этом изобретении мы описываем способ получения малых демиризационных доменов на основе пептидов, образующих амфипатические спирали. Эти пептиды будут упоминаться как "интеркалирующие", но этот термин означает только экспрессию способности нацеленной ассоциации, а не ограничение, относящееся к конкретной структуре поверхности раздела димеризации.
Хотя описанная здесь методология в принципе применима к любым Fab, Fv или scFv фрагментам, только для последних она является наиболее выгодной. В этом случае могут быть сконструированы двухвалентные фрагменты cf очень маленького размера и еще может быть предотвращена диссоциация в VL и VH, а также неправильное спаривание фрагментов цепей, например VL-VL . Фрагменты антител маленького размера являются особенно удобными для многих применений. При диагностических применениях (например, ЭЛАЙЗА, РИА и т.д.) меньшая поверхность молекул снижает проблемы неспецифического взаимодействия, которые, как известно, часто включают константные области. Это же справедливо для использования фрагментов антител в качестве лигандов в аффинной хроматографии. При диагностике или лечении опухолей важно, чтобы значительное количество инъецированного антитела проникало в ткани и локализовалось в опухоли, и это зависит от размеров молекул (Colcher et al, 1990, J. Natl. Cancer Inst., 82, 1191 - 1197). Выход экспрессии и эффективность секреции рекомбинантных белков также являются функцией размера цепи (Skerra and Pluckthun, 1991, Protein Eng, 4, 971), по этой причине предпочтительными являются маленькие белки. Следовательно, молекулы маленького размера являются выгодными по нескольким причинам.
Прежде всего уменьшение молекулярных размеров
антитела означает получение протеолитических фрагментов. Самые маленькие двухвалентные фрагменты, (Fab)'2 фрагменты, являются примерно в два раза большими, чем фрагменты настоящего
изобретения. Следовательно, эти новые фрагменты сочетают три признака: (а) маленький размер, (б) двухвалентность или бифункциональность и (в) способность к функциональной экспрессии в E. coli
Имеется большой интерес к бифункциональным антителам в широком круге областей. Бифункциональные антитела могут быть определены как имеющие две различные специфичности или для двух различных антигенов
или для двух эпитопов одного и того же антигена.
В настоящее время имеется несколько способов получения бифункциональных антител. Однако ни один из существующих способов не позволяет получать исключительно бифункциональные антитела in vivo, а всегда получают смесь молекулярных разновидностей, требующую сложных и дорогостоящих процедур разделения.
Могут быть выделены четыре основных способа. В первом используют химическую сшивку, в которой можно удобно использовать гетеробифункциональные сшивающие агенты. По этому способу химически сшивают после очистки целые антитела (Staerz et al, 1985, Nature 314, 628; Perez et al. 1985, Nature 316, 354 - 356), Fab фрагменты (Carter et al., 1992, Biotechnology 10, 63) и scFv фрагменты (Cumber et al 1992, J. Immunol. 149, 120).
Второй известный способ включает слияние двух гибридов, чтобы получить так называемую гетерогибридому или "квадрому". В этом способе любая легкая цепь может быть спарена с любой тяжелой цепью, а две тяжелые цепи могут дать гомодимеры или гетеродимеры, приводя в результате к очень сложным смесям продуктов (Milstein and Cuello, 1983, Nature 305, 537).
Третий способ относится ко второму и состоит из переноса двух экспрессирующих плазмид в клетку гибридомы, кодирующую тяжелую и легкую цепь второго антитела (Zenz and Weidle 1990, Gene 87, 213) или ретровирусный вектор (De Monte et al, 1990, Acad. Sci 87, 2941 - 2945). Однако при введении смесь продуктов является идентичной смеси второй процедуры.
Наконец, антитела восстанавливают, смешивают и повторно окисляют (Staerz and Bevan, 1986, Immunology Today 7). Опять-таки получают очень сложные смеси продуктов, требующие тонких методов разделения и процедур контроля за качеством.
Следовательно, все еще существует потребность в способе, позволяющем выделять исключительно гетеродимерные антитела непосредственно без сложного приготовления, требующегося для химической сшивки. В настоящем изобретении эта проблема решается за счет: (i) ковалентного связывания соответствующих VH и VL областей в scFv фрагменте и (ii) использования областей димеризации, обеспечивающих только образование гетеродимеров, таких как определенные лейциновые зипперы (Zipper - "застежка-молния") и производные.
Другим важным обстоятельством настоящего изобретения является желание получить по возможности меньшую молекулярную массу биспецифического антитела по изложенным выше детально причинам. Это достигается при использовании scFv фрагментов.
Ряд применений биспецифических антител уже был описан, а большинство из них будет извлекать пользу из этой новой технологии. Например, биспецифические антитела представляют большой интерес в терапии опухолей. Одно плечо антитела может связываться с опухолевым маркером, а другое плечо - с эпитопом Т-клетки, токсином или пептидом или белком, связывающим радионуклид, чтобы довести убивающую функцию до опухолевой клетки. В диагностике одно плечо может быть связано с интересующим анализируемым объектом, а другое - с объектом, который может быть легко оценен количественно, например ферментом. Наконец, в клеточных применениях может быть выгодно получать более высокую селективность при связывании, если два различных эпитопа или тот же самый белковый комплекс могут быть узнаны или если два различных белка могут быть узнаны на той же самой клеточной поверхности.
Итак, целью настоящего изобретения является создание новых индивидуальных и стабильных слитых белков фрагментов антитела с би- или мультифункциональными сайтами связывания.
Было обнаружено, что слитые белки фрагментов антитела, содержащие Fv-фрагменты, могут быть получены методами генетической инженерии, которые проявляют специфические и улучшенные свойства.
Следовательно, объектом изобретения является слитый белок фрагмента мономерного антитела, по существу состоящий из Fv-фрагмента антитела и пептида, который способен к димеризации с другим пептидом путем нековалентного взаимодействия.
Термин "нековалентное взаимодействие" означает любое существующее в нормальных условиях стабильное связывание, которое не является ковалентным связыванием, например связывание за счет вандерваальсовых сил, (стерическое) взаимопроникновение амфифильных пептидов, особенно спиральных пептидов, или пептидов, несущих противоположные заряды аминокислотных остатков. Соответствующие эффективные пептиды называют ранее и далее взаимодействующими или интеркалирующими пептидами.
Амфифильные пептиды содержат вплоть до 50 аминокислот. Предпочтительно они состоят из 10 - 30 аминокислот. В предпочтительном варианте изобретения взаимодействующий пептид является пептидным спиральным пуском (состоящим из спирали, изгиба и другой спирали, смотри выше). В другом варианте взаимодействующий пептид является лейциновым зиппером (Zipper - "застежка-молния"), состоящим из пептида, имеющего несколько повторяющихся аминокислот, в котором каждой седьмой аминокислотой является лейциновый остаток. В других случаях согласно изобретению пептид несет положительно или отрицательно заряженные остатки, например, лизина (положительно заряженный) или глютаминовой кислоты (отрицательно заряженный) таким образом, что этот пептид может связываться с другим пептидом (или второй мономерной единицей), несущей противоположный заряд.
Fv-фрагмент и интеркалирующий пептид связываются друг с другом или непосредственно или с помощью пептидного линкера, предпочтительно с помощью пептидного линкера. В предпочтительном варианте пептидный линкер представляет собой последовательность области петли антитела.
Как определено, Fv-фрагмент состоит из VL и VH области антитела. Fv-фрагмент согласно изобретению предпочтительно является одноцепочечным фрагментом. Одноцепочечные фрагменты могут быть получены по стандартным методикам с использованием стандартных линкерных молекул.
Кроме того, объектом изобретения является димерный слитый белок, по существу состоящий из двух мономерных слитых белков, причем связывание мономерных единиц основано на нековалентном взаимодействии идентичных или различных пептидов, отличающийся тем, что по крайней мере одна мономерная единица является слитым белком Fv-фрагмента антитела, как определено выше.
Если димер содержит два Fv-фрагмента, Fv-фрагменты могут быть одинаковыми (идентичные сайты связывания антигена) или могут быть различными (различные сайты связывания антигена). В этих случаях могут быть получены моно- и биспецифические (Fv)-миниантитела. Согласно изобретению предпочтительными являются биспецифические мини-антитела.
Взаимодействующие пептиды могут быть одинаковыми или различными, предпочтительно они являются идентичными. Интеркалирующие пептиды могут быть ассоциированы параллельно или антипараллельно.
Следовательно, объектом изобретения являются, прежде всего, слитый димерный белок, состоящий из двух Fv-фрагментов с различной специфичностью (сайтами связывания антигена) или идентичных интерксилирующих спиральных пептидов, фрагменты антитела и пептиды связаны вместе с помощью последовательности области петли.
Кроме того, объектом изобретения является димер, состоящий из мономерной единицы, содержащей Fv-фрагмент, и другой мономерной единицы, в которой Fv-фрагмент заменен пептидом не-антитела. Пептид не-антитела может быть токсином, подобным рицину, хелатором или связывающим металл пептидом, или ферментом (например, маркерным ферментом), или пептидом, несущим детектируемую метку (например, радиоизотоп).
Пептид не-антитела также может нести соответствующий сайт связывания указанных групп, включая сайты, направленные к Т-клеткам или фрагментам Т-клеток.
Кроме того, изобретение относится к мономерам или димерам, как определено выше, где взаимодействующий(е) пептид(ы) является(ются) дополнительно слитым с С-конца с белками-мишенями/пептидами, как упоминалось выше, включая соответствующие сайты связывания. Следовательно, полученные в результате слитые белки и мини-антитела соответственно являются мультифункциональными.
Кроме того, изобретение относится к способу получения слитого белка мономерного антитела, как определено выше, отличающемуся тем, что гены, кодирующие Fv-фрагмент, взаимодействующий пептид и, при желании, связующий пептид, клонируют в плазмиду экспрессии, клетку хозяина трансформируют указанной плазмидой экспрессии и культивируют в питательном растворе и слитый мономерный белок экспрессируется в клетке или секретируется в среду.
Наконец, объектом изобретения является способ получения димерного слитого белка, как определено выше, отличающийся тем, что гены, кодирующие полные мономерные слитые белки или их части, клонируют по крайней мере в одну плазмиду экспрессии, клетку хозяина трансформируют указанной(ными) плазмидой(ами) экспрессии и культивируют в питательном растворе, и/или полный димерный слитый белок экспрессируется в клетке или в среду, или мономерные слитые белки экспрессируются отдельно и осуществляют нековалентное связывание между двумя мономерными единицами в среде или in vitro, а в случае, когда клонированы только части слитых белков, осуществляют дополнительно стадии построения белка в соответствии со стандартными методиками.
Димерные Fv-фрагменты, содержащие слитые белки согласно изобретению, показывают высокую активность против соответствующих антигенов и удовлетворительную стабильность. Эти новые двухвалентные или бифункциональные молекулы могут быть получены как складчатые и сборные молекулы в E coli. Эти мини-антитела совместимы с функциональной экспрессией путем секреции.
Детальное описание изобретения.
Выбирают домены для олигомеризации, имеющие очень маленькую молекулярную массу и совместимые с транспортировкой слитого белка через мембрану. Они основаны на двух различных типах амфифильных спиралей.
Амфифильные спирали известны преимущественно, но не исключительно ассоциированными в двух различных молекулярных структурах: четырехспиральные узлы и скрученные спирали. Композиция и образование спиральных узлов были изучены ранее (Eisenberg et al, 1986, Proteins 1, 16 - 22; Ho and de Grado, 1987; J. Am. Chem. Soc. 109, 6751 - 6758: Regan and de Grando, 1988, Science 241, 976 - 978; Hill et al 1990, Science, 294, 543 - 546). Такая молекулярная ассоциация также известна для природных белков (Richardson, 1981, Adv. Prot. Chem. 34, 167).
Четырехспиральный узел может быть образован или четырьмя отдельными молекулами (каждая вносит одну спираль), двумя молекулами, содержащими две спирали каждая (соединенными как спираль-поворот-спираль) или одной молекулой, содержащей спираль-поворот-спираль-поворот-спираль-поворот-спираль повторяющийся структурный элемент. Для димеризации или мультимеризации пригодны только первые две.
Были испытаны три вариации этой последней темы. Во-первых, была использована одна спираль последовательности, приведенной у Eisenberg et al (1986. Proteins I, 16 - 22). Во-вторых, эту последовательность удлинили маленьким гидрофильным пептидом, заканчивающимся цистеином. Поскольку спирали являются ассоциированными, гидрофильные пептиды помогают достаточно тесному контакту, при котором они могут сталкиваться и в окислительных условиях может образоваться дисульфидная связь, как в периплазме E. coli. В третьей вариации используют две спирали в тандеме, разделенные коротким витком кодирующего пептида.
Во второй схеме используют пептиды, которые могут образовать так называемые структуры скрученной спирали. Такие пептиды встречаются в факторах транскрипции, таких как, например GCH4 у дрожжей, и имеют так называемые лейциновые зипперы (Landschulz et al, 1988, Science, 240, 1759 - 1764). Недавно была решена кристаллическая структура этого (O'Shea et al, 1991, Science, 254, 539 - 544) и была показана параллельная компановка спиралей.
Ковалентное присоединение спиралей возможно путем маленького удлинения пептида, снова содержащего цистеин. Поскольку спирали теперь являются параллельными, удлинение пептида может быть намного короче, так как расстояние намного меньше.
Различные устройства димеризации (интеркалирующие спирали), однако, не сливаются непосредственно в домен антитела. Удобно вводить гибкий пептид между концом scFv фрагмента и началом спирали. В виде примера используют область верхней петли IgG3 мыши. Однако могут быть использованы различные петли. Это не требуется для самой димеризации, но обеспечивает пространство для двух scFv доменов, подобное сайтам связывания антигена целого антитела. Таким образом, два сайта связывания охватывают большее расстояние в пространстве и, следовательно, могут доходить до антигенов на твердой поверхности.
Встречающиеся в природе петли антител являются предпочтительными вариантами петель в двухвалентных миниантителах. В случае бифункциональных миниантител петли могут быть короче, поскольку часто молекулы от различных поверхностей являются сшитыми по возможности близко и гибкость димера не является необходимой. Выбор петли определяется последовательностью желаемого остатка, длиной (Argos, 1990, J. Mol. Biol. 211, 943 - 958), совместимостью со складчатостью и стабильностью амфифильных спиралей (Richardson and Richardson 1988, Science 240, 1648 - 1652), секрецией и устойчивостью к протеазам.
Настоящее изобретение рассматривает пептиды как устройства для димеризации, которые должны быть по возможности
маленькими. Одним предпочтительным вариантом является применение пептидов, которые могут образовать амфипатические спирали. Такие спирали закрывают гидрофобную поверхность путем димеризации или даже
мультимеризации. Спирали этого типа характеризуются наличием гидрофобных участков на одной поверхности спирали и содержанием достаточного количества спиралеобразующих остатков. Принципы для таких
пептидов обсуждаются у Eisenberg et al, 1986, O'Shea et al, 1991 (Science 254, 539 - 544), 1992 (Cell 68, 699 - 708)
Было обнаружено, что природные пептиды этого типа, так называемые
лейциновые зипперы, характеризуются периодическим появлением лейцина (каждый седьмой остаток) и других гидрофильных остатков (например, валина) также каждый седьмой остаток. Поскольку эти принципы
теперь являются понятными (O'Shea et al. 1991, 1992, цитированные ссылки), последовательность может быть изменена введением остатка, который делает ассоциацию гомодимеров неблагоприятный, но
благоприятствует ассоциации гетеродимеров. Такое изменение последовательности может, например, включать вставку заряженных мостиков, так что в гомодимерах подобные заряды отталкивают друг друга, а в
гетеродимере противоположные заряды притягивают друг друга (смотри ниже).
Настоящее изобретение также может удлинять бифункциональные миниантитела. В этом случае должны быть использованы устройства димеризации (интеркалирующие пептиды), которые смогут позволить только образование гетеродимеров, а не гомодимеров. Предпочтительными вариантами этой части изобретения являются две различные скрученные спирали, такие как встречающиеся в природе лейциновые зипперы, например, из белков транскрипционного фактора jun и fos (O'Shea et al., 1989, Science 245, 646 - 648).
В другом варианте изобретения константная scFv-петля-спираль может быть удлинена с C-конца с получением в результате слитого белка. Например, слияние с ферментом может быть выполнено для использования таких двухвалентных конструкций в диагностике. Такими ферментами являются, например, щелочная фосфатаза, люциферазы или пероксидаза хрена. Преимущество такого слитого белка антитело-фермент будет в том, что двухвалентность антитела будет приводить к усилению связывания с поверхностно связанным антигеном. Преимущество по сравнению со слитым белком, приготовленным по традиционной технологии (а именно химическим сочетанием антитела с выбранным ферментом) будет в большей согласованности от партии к партии, гомогенности продукта и намного большей простоте способа получения, а именно из E. coli в одну стадию.
Таким же образом миниантитела могут быть удлинены с C-конца включением токсина. Такие иммунотоксины должны быть двухвалентными или даже биспецифическими и, следовательно, сочетают преимущества таких фрагментов антител, связанных выше, с преимуществами, известными из опухолевой терапии для иммунотоксинов. Подобным образом связывающий металл пептид или белок может быть связан генетически для применения в радиоиммунотерапии или при создании изображений опухоли. Такие же преимущества для любого генетически кодируемого гибридного белка будут справедливы, как приведено выше для слияний антитело-фермент.
В другом варианте изобретения может быть получена конструкция типа scFv-петля-спираль для димеризации с другим слитым белком в область димеризации, полностью аналогично тому, что написано выше для образования биспецифических миниантител. Таким образом scFv-фрагмент, например, должен быть точно соответствующим спирали fos белка. Такой чужеродный белок, который может быть сделан для образования гетеродимеров с scFv фрагментом, включает ферменты, полезные в диагностике, токсины, связывающие металл пептиды или белки, полезные в радиоиммунотерапии или при создании радиоизображений.
Используя принципы настоящего изобретения, представленные здесь, области димеризации также могут служить для целей очистки. Рекомбинантный белок любого вида может быть слит в область димеризации, например в петлю-fos-зиппер. После соэкспрессии с scFv-петля-jun гетеродимер может быть очищен в одну стадию на аффинной колонке для scFv-специфичности. В альтернативной попытке "противоположный" зиппер, связанный с носителем колонки, "захватывает" белок-петлю-зиппер при проходе через колонку в виде сырого клеточного экстракта. Элюирование чистого слитого белка из колонки возможно при использовании температуры развертывания зиппера. Последующее выделение из области димеризации достигается путем введения протеолитического сайта, например фактора свертывания крови Xa, в петлю (Nagai and Thogerson, 1987, Meth. Enyzmol. 152, 461-481).
Конкретным преимуществом миниантител, описанных в настоящем изобретении, является возможность сборки в Escherichia coli. В случае гомодвухвалентных конструкций используют принцип димеризации, который разрешает образование гомодимеров. Описанные выше примеры включают скрученные спирали (лейциновый зиппер) GCH4 белка дрожжей или спирали из антипараллельного узла 4-х спиралей. В этом случае scFv-фрагмент экспрессируется в присутствии бактериальной сигнальной последовательности и несет на конце гена scFv фрагмента кодоны для петли и димеризационную спираль или спираль-поворот-спираль. Спирали совместимы с секрецией в периплазматическое пространство в E. coli, где белок складывается, образуется дисульфид и происходит сборка. В таких условиях гомодимерные белки образуются сами и могут быть непосредственно выделены в димерной форме.
Если желательны гетеродвухвалентные конструкции, для объединения необходимо два различных фрагмента scFv или один scFv-фрагмент, ассоциированный с другим белком. В предпочтительном варианте настоящего изобретения оба объединяемых белка экспрессируются в одной и той же клетке, предпочтительно одной и той же плазмидой, предпочтительно в виде дицистронного оперона. Конструкция искусственного дицистронного оперона объяснена, например, у Skerra et al. (1991, Protein Eng. 4, 971). Так как объединение должно происходить в периплазме, потому что scFv-фрагмент может складываться только в окисляющей среде, оба белка должны транспортироваться и оба должны соответствовать сигнальной последовательности. Пептиды димеризации должны выбираться таким образом, чтобы они промотировали объединение двух различных белков, но предотвращали объединение соответствующих гомодимеров. Примерами таких белков являются лейциновые зипперные пептиды белков fos и jun (смотри выше).
Когда не экспрессируются в той же клетке, различные scFv-петля-зиппер конструкции должны быть смешаны вместе в виде сырого клеточного экстракта или очищенного белка и обработаны при повышенной температуре. При отсутствии "противоположного" зиппера, например, scFv-петлю-jun-зиппер конструкция способна образовать гомодимеры. После кратковременного нагревания до температуры плавления около 40oC зипперы нежелательного гомодимера раскрываются и образуют намного более стабильный гетеродимер (O'Shea et al. 1992, Cell 68, 699-708). Без повышения температуры образование гетеродимеров in vitro невозможно, как показали эксперименты.
Краткое описание чертежей и последовательностей.
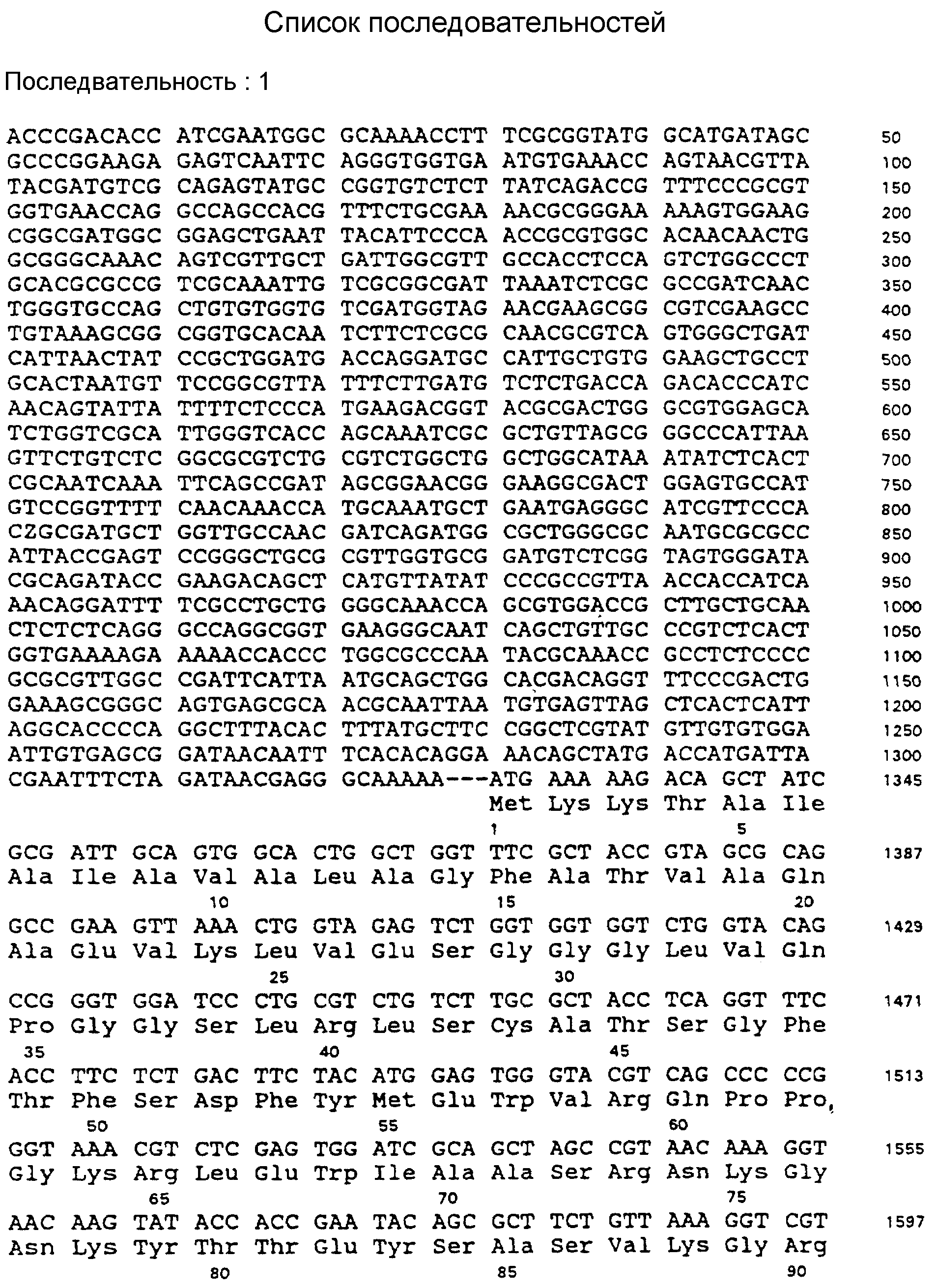
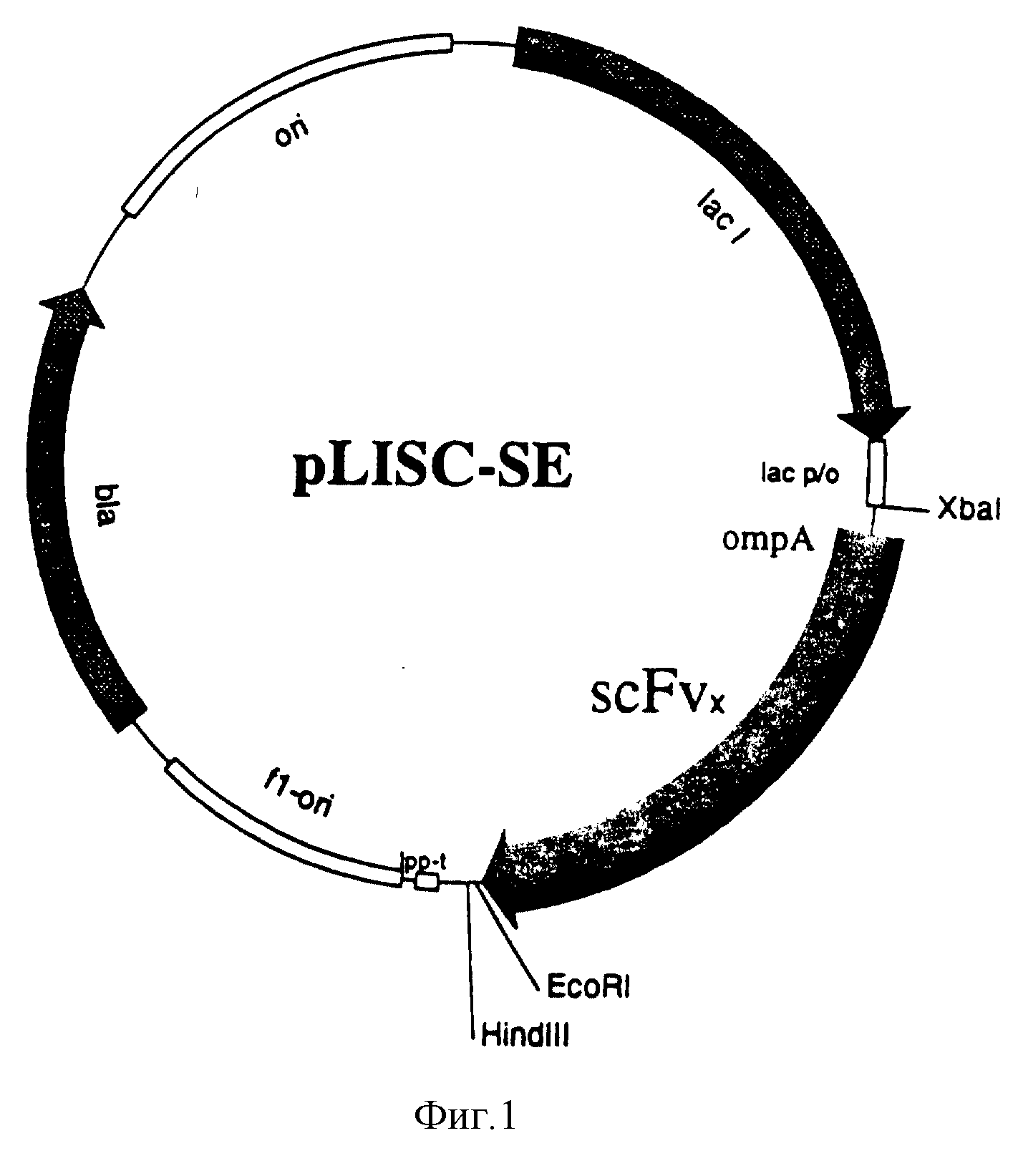
На фиг. 1 представлен scFv-вектор экспрессии pLISC-SE, содержащий scFv-фрагмент.
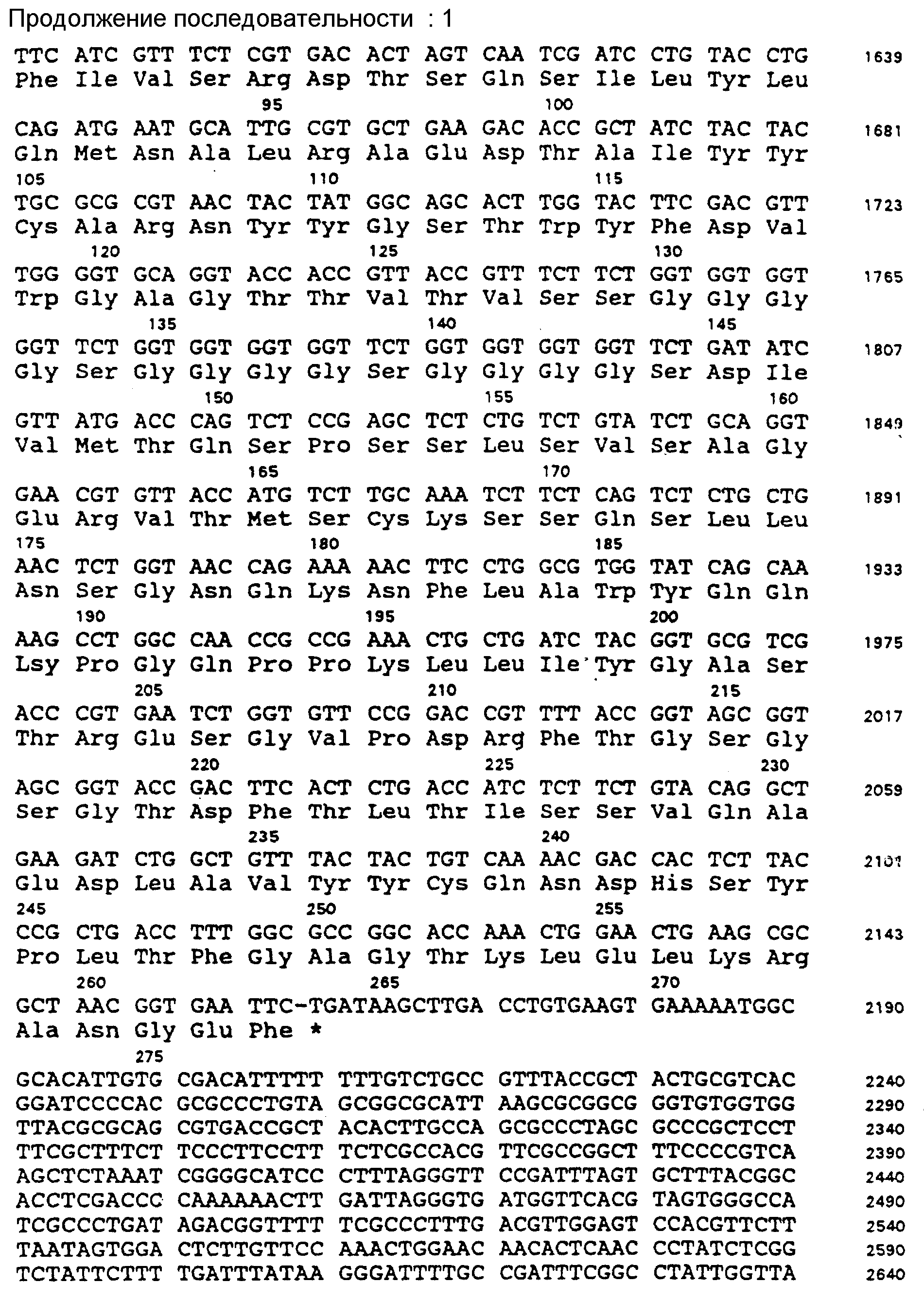
На фиг. 2 представлен дицистронный scFv-петля-зиппер вектор экспрессии pACK • FyJ.
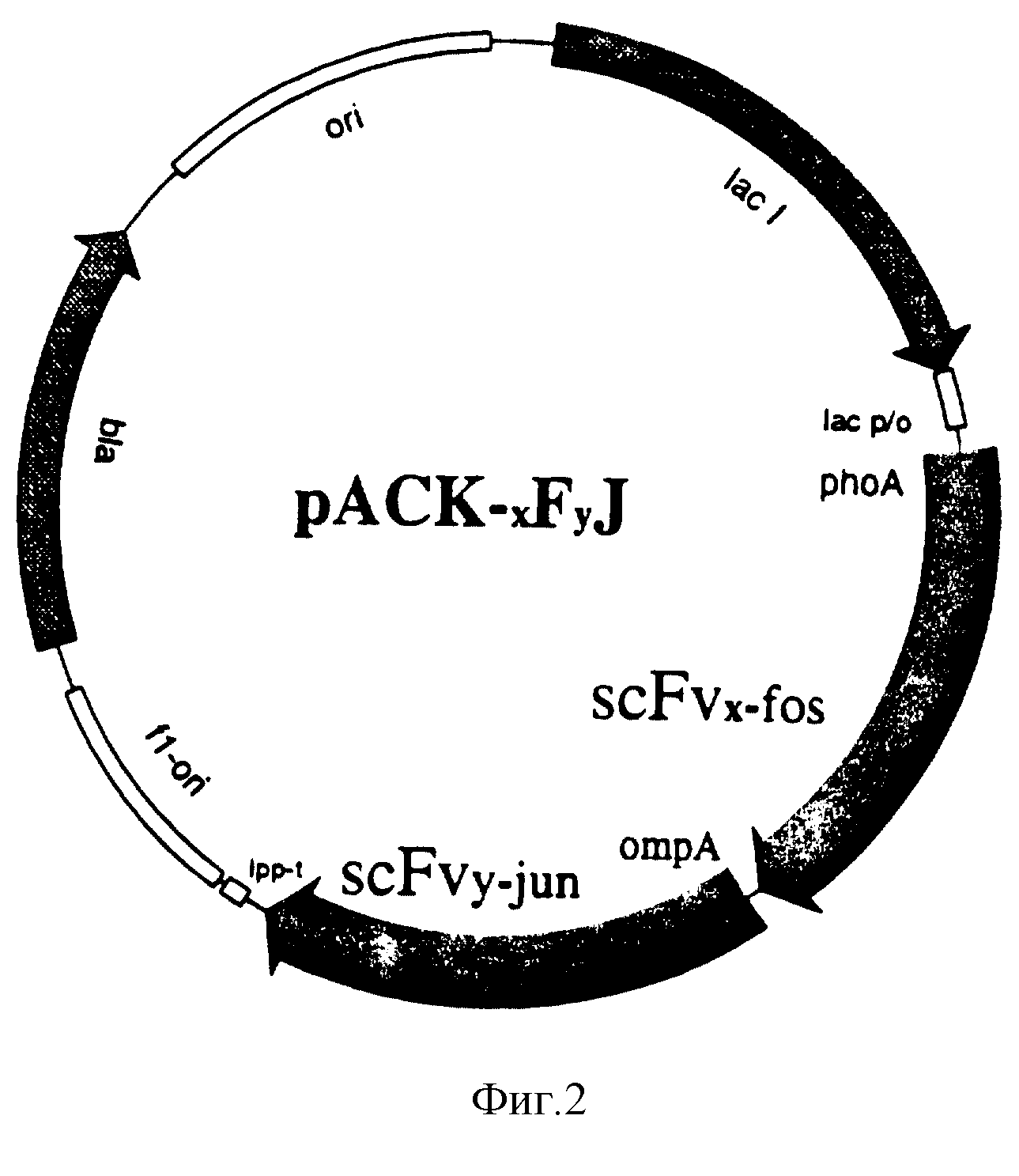
Фиг. 3 - функциональный ЭЛАЙЗА;
концентрации аффинно очищенных белков, измеренные по ОД280 (вертикальная ось) по отношению к молярному числу сайтов связывания на ячейку (горизонтальная ось). Пластины ЭЛАЙЗА покрыты
фосфохолин-БСА и очищенные фосфохолин-специфические миниантитела-белки связываются и детектируются МсРС603 антисывороткой;
(a) сравнение различных миниантител;
(b) сравнение
миниантитела scHLXc с ScFv и цельным IgA.
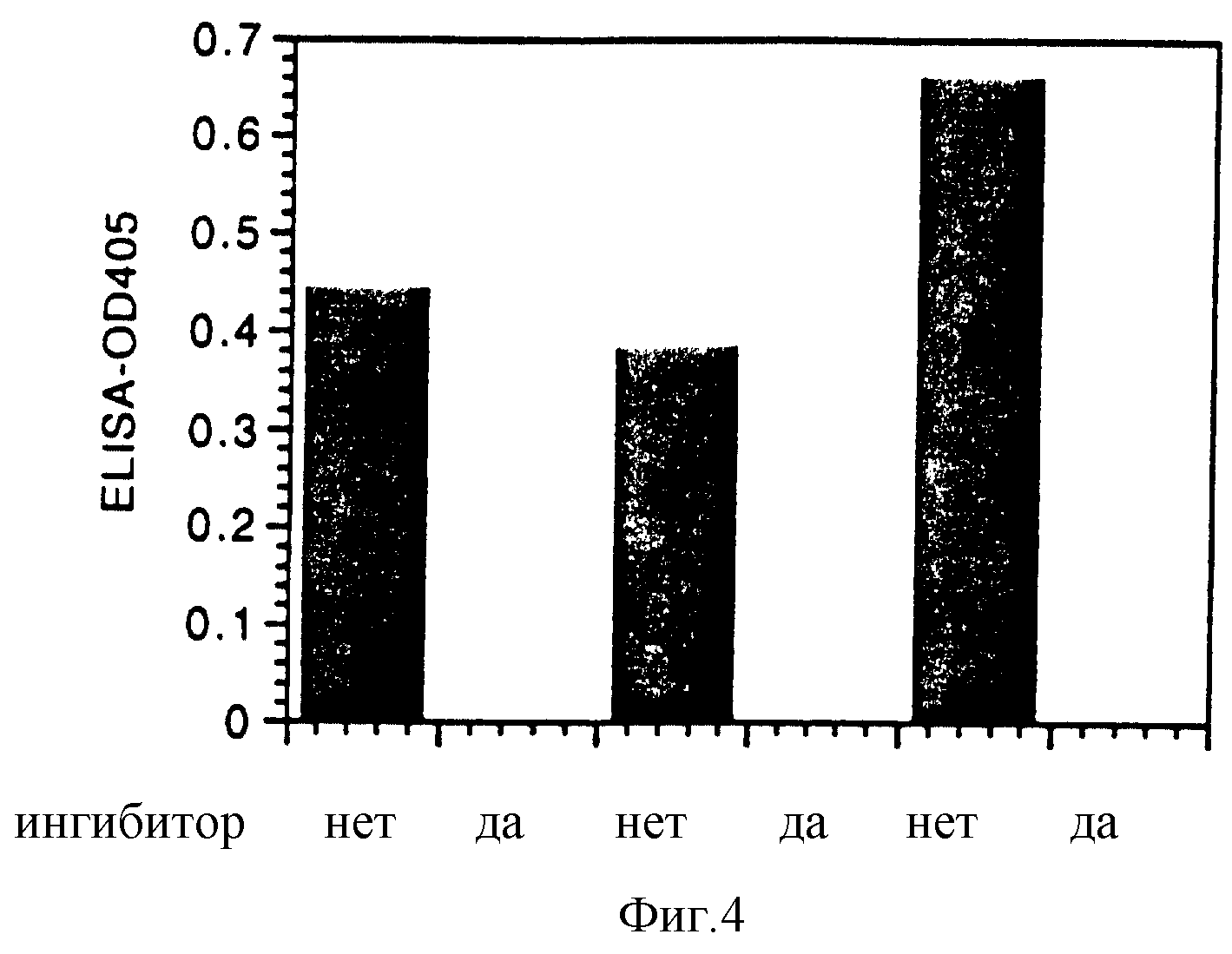
Фиг. 4 - функциональный Анти-лизоцим ЭЛАЙЗА;
PC афоринно очищенные образцы соэкспрессированного анти-PC-анти-лизоцим биспецифического
миниантитела. + и - на горизонтальной оси означает: плюс ингибитор (+) и без ингибитора (-).
Приведенный в конце описания перечень последовательностей относится к номерам идентичности
последовательностей (S.I.N):
S. I. N. 1: Целая нуклеотидная и аминокислотная последовательность pLICS-SE вектора.
S. I. N. 2: Генная кассета, кодирующая интеркалирующую антипараллельную спираль-поворот-спираль (нуклеотидная и амионкислотная последовательность).
S. I. N. 3: Генная кассета, кодирующая интеркалирующую спираль-поворот-спираль (нуклеотидная и аминокислотная последовательность).
S. I. N. 4: Генная кассета, кодирующая интеркалирующую jun-зиппер- и IgG3-петля область.
S. I. N. 5: Генная кассета, кодирующая интеркалирующую fos-зиппер- и IgG3-петля область.
S. I. N. 6: Генная кассета, кодирующая интеркалирующую jun-зиппер и сконструированный линкер.
S. I. N. 7: Генная кассета, кодирующая интеркалирующую fos-зиппер и сконструированный линкер.
Пример 1: Конструкция векторов для секретированных одноцепных фрагментов, содержащих сайт рестрикции для вставки генов для интеркалирующих пептидов.
Методики рекомбинантной ДНК основаны на Sambrook et al. (1989, Molecular Cleoning: A laboratory manual. Second edition. Cold. Spring Harbor Laboratory, New York). Функциональную экспрессию одноцепных Fv фрагментов и миниантител в E. coli J.M 83 осуществляют на векторах, подобных pASK-lis c (Skerra et al. 1991, Protein Eng 4, 971). Сайт-направленный мутагенез проводят непосредственно в этих векторах согласно Kunkel et al. (1987, Meth. Enzymol. 154, 367-382), и Geisselsoder et al. (1987, Biotechiques 5, 786-791), используя хелперный фаг М13К07 (Vieira and Messing, 1987, Meth. Enzymol, 153, 3-11). Проводят SDS-PAGE, как описано Fling and Gregerson (1986, Anal. Biochem. 155, 83-88). Измеряют концентрацию аффинно-очищенных белков по ОД280, используя расчетные коэффициенты экстинкции (Gill and Von Hippel), 1989, Anal. Biochem. 182, 319-326). Используют вектор, такой как pA SK40 (Skerra et al. , 1991, Protein Eng. 4, 971), который содержит сайт инициации репликации, регуляторный промотор, бактериальную сигнальную последовательность после сайта множественного клонирования, терминатор транскрипции и ориджин для однониточных фагов. Ген для одноцепного Fv-фрагмента сконструирован следующим образом: нуклеотидная последовательность VH области непосредственно следует за линкерной последовательностью, кодирующей предпочтительно около 15 остатков, предпочтительно последовательностью (Gby4 Ser)3, непосредственно следующей за последовательностью VL области. Альтернативно последовательность VL области может непосредственно следовать за последовательностью линкера после последовательности VH области.
Если антитело является известной последовательностью, полный ген scFv-фрагмента может быть объединен из синтетических олигонуколетидов. Детальная экспериментальная процедура синтеза такого гена антитела дана, например, у Pluckthun et al, 1987, Cold Spring Harbor Symp. Quant. Biol. 52, 105-112).
Если гены VH и VL областей имеются в других векторах, ген scFv-фрагмента может быть объединен из рестрикционных фрагментов. Например, рестрикционный фрагмент, кодирующий большую часть VH области, может быть вырезан из другой плазмиды, а фрагмент, кодирующий большую часть VL области, может быть вырезан из плазмиды. Оставшиеся участки VL и VH и линкер для scFv фрагмента могут быть обеспечены синтетическими нуклеотидами, которые должны быть лигированы стандартными методами (Sambrook et al. 1989, выше). Смесь фрагментов лигируют в вектор pA SK40 или подобную плазмиду, содержащую пару подходящих сайтов рестрикции.
Если гены антитела не были клонированы ранее, они могут быть получены непосредственно из гибридомной клетки, продуцирующей антитело по реакции полимеразной цепи (PCR; PCR методология описана у Mc Pherson et al, 1991, PCR-A Practical Approach Oxford University Press, New York). Праймеры, пригодные для амплификации VH и VL областей, были даны Orlandi et al, 1989, Proc. Natl. Acad. Sci; USA 86, 3833-3837; Huse et al, 1989, Science 246, 1275-1281; Larrick et al, 1989, Bio-techonology 7, 934-938. Методология получения мРНК из гибридомы также описана в этих ссылках. Отдельные VH и VL гены могут быть клонированы в отдельные векторы и scFv ген объединен в соответствии с принципами, объясненными выше.
Если лигированные фрагменты не приводят в результате к правильной рамке считывания scFv фрагмента, точное слияние с кодонами сигнальной последовательности, находящимися на плазмиде, может быть генерировано сайт-направленным мутагенезом. Конструирование олигонуклеотидов и выполнение возможно любым специалистом в данной области.
Полученная таким образом scFv плазмида экспрессии содержит кодоны бактериальной сигнальной последовательности, непосредственно после первой вариабельной области (VH или VL), линкер и вторую вариабельную область (VL или VH) под контролем регуляторного промотора.
На 3' конце этого гена, соответствующем C-концу scFv белка, введен единичный сайт рестрикции в плазмиду экспрессии для обеспечения вставки кассеты, кодирующей интеркалирующий пептид. Сайт рестрикции вводится сайт-направленным мутагенезом с использованием метода Кункеля (1987, Meth. Enzynol 154, 367 - 382).
Пример полной последовательности плазмиды экспрессии pLISC-SE подходящего одноцепного Fv для получения взаимопроникающего пептида показан на фиг. 1 и последовательности Идентичности N (S.I.N) 1 (смотри список последовательностей).
Пример 2. Схема и конструкция генной кассеты, кодирующей интеркалирующие пептиды с лейциновым зиппером.
Генная кассета, снабженная сайтами рестрикции, совместимыми с сайтом рестрикции на 3'-конце гена scFv фрагмента, должна кодировать последовательность петли (соединение scFv фрагмента с интеркалирующим пептидом) и сам интеркалирующий пептид. Однако область петли также может быть опущена.
В качестве примера последовательность области верхней петли IgG3 мыши (Danl et al. , 1988, EMBO J. 7,1989 - 1994), за которой следует последовательность лейцин-зипперной последовательности белка GCH4 дрожжей (Oas et al. , 1990, Biochemistry T29, 2891 - 2894), подвергается обратной трансляции (back-translated) в часто используемые кодоны E.coli (S.I.N.:2). Синтезируют олигонуклеотиды и лигируют в вектор pLISC-SE, предварительно переваренный EcoRI и Hinol III.
Пример 3. Схема и конструкция генной кассеты, кодирующей интеркалирующие пептиды четырехспирального узла.
Аналогично примеру 2, последовательность области верхней петли IgG3 мыши, за которой следует последовательность спираль-поворот-спираль узла четырех спиралей (Eisenberg et al. 1986, выше) подвергается обратной трансляции в часто используемые кодоны E.coli. Олигонуклеотиды синтезируют и лигируют в вектор pLISC-SE, ранее переваренный EcoRI и Hinol III.
Пример 4. Схема и конструкция двух генных кассет, кодирующих интеркалирующие пептиды лейцин-зиппера и их коэкспрессия.
Аналогично примеру 2, последовательность области верхней петли IgG3 мыши, за которой следует последовательность зипперной последовательности jun белка (O'Shea et al, 1992, выше), подвергается обратной трансляции часто в используемые кодоны E. coli (S.I.N.:4). Синтезируют олигомеры и лигируют в вектор p LISC-SE, предварительно переваренный EcoRI и Hinol III.
В параллельной реакции последовательность области верхней петли машинного IgG3, за которой следует последовательность зипперной последовательности fos белка (O'Shea et al., 1992, Cell 68, 699 - 708) подвергают обратной трансляции в часто используемые кодоны E. coli (S.I.N.:5). Синтезируют олигонуклеотиды и лигируют в вектор p LISC-SE, предварительно переваренный EcoRI и Hinol III. Итак, каждый из двух векторов кодирует различный scFv фрагмент антитела, следующий за пептидной петлей и различным лейцин-зипперным пептидом. Для коэкспрессии обоих scFv фрагментов целый scFv -петля-зиппер ген fos-содержащего продукта вырезают из вектора как Xba I - Hinol III фрагмент и лигируют в вектор, p LISC-SE - scFv - jun, содержащий уже scFv ген другого антитела.
Вновь полученный вектор затем экспрессирует scFv1 - линкер1 -fos - зиппер и scFv2 -линкер2 - jun - зиппер из одного промотора как дицистронный оперон.
Улучшенная последовательность для области петли в контексте fos и jun зипперов дана в S.I.N.:6 и 7. Эта петля короче и, следовательно, не восприимчива к протеолизу. В случаях, когда расстояние между двумя сайтами связывания является менее важным, такие укороченные петли могут быть выгодными. В этом случае "хвост" scFv фрагмента уже укорочен и EcoRI сайт, который получает гены для взаимопроникающих пептидов, уже сдвинулся на четыре остатка выше.
Пример 5: Очистка двухвалентного миниантитела из E coli.
Выращивают E. coli J. M 83, несущий плазмиду, сконструированную, как в примерах 2 и 3, до ОД 550 из 0,5 и индуцируют IPTG при конечной концентрации 1 мМ. Клетки центрифугируют, ресуспендируют в BBS-буфере (200 мМ Na-борат, 160 мМ NaCl pH 8,0) и суспензию пропускают через френч-пресс. В этих примерах используют фосфорилхолин-связывающее мини-антитело. Миниантитело очищают пропусканием через фосфорилхолин-афинный хроматограф, как описано (Chesebro and Metzger, 1972, Biochemistry 11, 766 - 771).
Пример 6: Очистка биспецифического мини-антитела из E.coli.
Выращивают E. coli J. M83, несущий плазмиду, сконструированную как в примерах 2I и 3 и содержащую дицистронный структуральный ген для двух различных scFv (фиг. 2), до ОД 550 при 0,5 и индуцируют IPTG при конечной концентрации 1 мМ. Клетки центрифугируют, ресуспендируют в BBS-буфере (200 мМ Na-борат, 160 мМ NaCl), pH 8,0) и пропускают суспензию через френч-пресс.
В этом примере используют биспецифическое миниантитело, содержащее специфичность как к фосфорилхолину, так и к бензоилампициллину. Миниантитело очищают пропусканием через фосфорилаффинный хроматограф, как описано (Chesebro and Metzger, 1972, выше).
Пример 7: Поверхностное связывание двухвалентных миниантител.
Покрывают пластины ЭЛАЙЗА (Nunc), Macrosorb) (400 г/мл фосфохолин-BSA в PBS-фубере/20 мМ фосфата, pH 7,2, 115 мМ NaCl). Готовят гаптеновый реагент из нитрофенилфосфохолина (Sigma), который восстанавливают и диазотируют, по существу как описано (Chesebro and Metzger, 1972, выше) и проводят реакцию азосочетания с BSA (Sigma) в боратно-солевом буфере (52,5 мМ бората натрия, pH 120 мМ NaCl) при 4oC в течение 48 часов с последующим диализом против PBS. После блокирования непокрытой поверхности пластины 5% снятым молоком (Nestle) в PBS буфере в течение по крайней мере 2 часов периплазматический экстракт или очищенный белок инкубируют в BBS буфере на пластине в течение 90 минут при комнатной температуре. После тщательной промывки (3 раза) оставшиеся фрагменты функционального антитела детектируют в соответствии со стандартными процедурами (Harlow and Lane, 1988, "Antibodies, A Laboratory Manual", Cold Harbor Labor. 555 - 592) с кроличьей анти-McPC603 сывороткой и анти-кроличьим иммуноглобулином, связанным с пероксидазой (Sigma) согласно Gallati (1979, Clin Chem, Clin. Biochem 17, 1-4).
Для всех конструкций миниантител наблюдается огромный прирост при связывании и, следовательно, чувствительности по сравнению с мономерным scFv фрагментом. Это согласуется с одновременным связыванием двух или даже больше сайтов связывания на одной и той же поверхности. Такая авидность слитого белка scHLXc сравнима с природным антителом McPC603, которое не может быть детектировано ЭЛАЙЗА с антигенным покрытием, тогда как мономерный scFv фрагмент может быть детектирован только при концентрациях, в 100 раз больших (фиг. 3a, b). Любое связывание почти полностью ингибируется растворимым гаптеном, за исключением мономерного фрагмента. Термодинамическое сродство природного антитела к растворимому фосфохолину составляет примерно 1,6 S 105 M-1 и, следовательно, является относительно слабым (Metzger et al, 1971, Proceeding of the Ist Congress of Immunology, Academic Press, New Iork, стр 253 - 267) и очевидно является недостаточным для комплекса мономерный фрагмент-гаптен, чтобы выдержать повторные стадии промывки функциональной ЭЛАЙЗА (Kemeny and Challa Combe, 1988, "ELISA and other solid phase immunoasays", Wiley and Sons, New Iork).
Пример 8: Поверхностное связывание бифункциональных миниантител.
Коэкспрессированные бифункциональные миниантитела, распознающие фосфорилхолин одним плечом и лизоцим другим плечом, очищают фосфохолин (РС) афинной хроматографией и испытывают на специфичность к лизоциму. ЭЛАЙЗА-пластины покрывают лизоцимом и проводят анализ ЭЛАЙЗА, как описано в примере 7. Три различных препарата показывают связывание с антиген-поверхностью, которое полностью ингибируется растворимым лизоцимом (фиг. 4).
Реферат
Изобретение относится к биотехнологии и может быть использовано для создания слитых белков фрагментов антитела с би- или мультифункциональными сайтами связывания. ДНК последовательности первой и второй мономерных единиц, кодирующие одноцепочечный Fv фрагмент антитела и амфифильный спиральный пептид, клонируют в одном или двух экспрессирующих векторах. Хозяйские клетки трансформируют вектором (ами) экспрессии и культивируют с последующим выделением целевого продукта, экспрессированного в клетке или среде. Способ позволяет получить димерные слитые белки с высокой активностью против соответствующих антигенов. 2 с. и 1 з.п.ф-лы, 4 ил.

Комментарии