Макроциклические амиды в качестве ингибиторов протеазы - RU2625796C2
Код документа: RU2625796C2
Описание
Настоящее изобретение относится к органическим соединениям, полезным для лечения и/или профилактики у млекопитающих, и в частности, к соединениям, которые являются селективными ингибиторами цистеиновой протеазы катепсина, в частности цистеиновой протеазы катепсина L.
Настоящее изобретение относится, в частности, к соединению формулы (I)
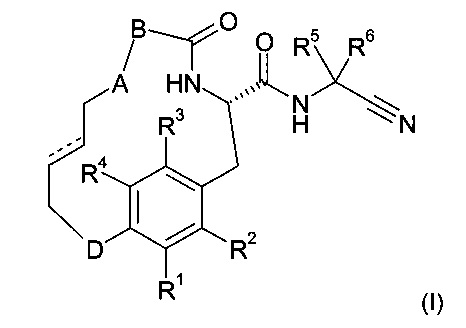
где
А представляет собой-О-, -S-, -СН2-, -NH- или -SO2-;
В представляет собой пяти - двенадцатичленное карбоциклическое кольцо или пяти - двенадцатичленное гетероциклическое кольцо, где кольцо возможно замещено одним или двумя заместителями, независимо выбранными из галогена, алкила, алкокси, галоалкила, галоалкокси, циклоалкила, циклоалкилалкокси, сульфонила, сульфанила, циклоалкилсульфонила, циклоалкилсульфанила, алкоксикарбонилазетидинила, циано, азетидинила или алкилсульфанила;
D представляет собой -O-, -S-, -СН2-, -NH- или -SO2-;
один из R1, R2, R3 и R4 представляет собой водород и другие независимо выбраны из водорода, галогена, алкила, алкокси, галоалкокси, циклоалкила и фенила;
R5 и R6 независимо выбраны из и водорода, алкила, галоалкила, циклоалкила, фенила и фенилалкила;
или R5 и R6 вместе с атомом углерода, к которому они присоединены, образуют циклоалкил, пирролидинил или пиперидинил; и
или его фармацевтически приемлемой соли или эфиру.
Соединения по настоящему изобретению являются селективными ингибиторами цистеиновой протеазы катепсина (Cat), в частности катепсина L и, следовательно, полезны для лечения метаболических заболеваний, таких как диабет, и его осложнений, например, диабетической ретинопатии и диабетической нефропатии, и сосудистых заболеваний, таких как атеросклероз, аневризма брюшной аорты, заболевания периферических артерий, снижение сердечно-сосудистых осложнений при хроническом заболевании почек и диабетической нефропатии и, кроме того, рака, панкреатита и воспалительных заболеваний.
Катепсины млекопитающих представляют собой протеазы цистеинового типа, участвующие в ключевых стадиях биологических и патологических событий. Катепсины считаются легко управляемыми лекарственными целями, насколько это возможно для ингибирования их ферментативной активности с помощью малых молекул и, поэтому представляют интерес для фармацевтической промышленности. Катепсины в основном расположены в кислых компартментах клеток, таких как лизосомы и эндосомы. Кроме того, катепсины секретируются и работают во внеклеточном пространстве, а также в цитоплазме клеток и в ядре. В частности, катепсин L имеет значительное присутствие во всех этих компартментах. При использовании альтернативных сайтов трансляции ниже чем первый AUG, образуются альтернативные формы Cat L, лишенные лидерной последовательности. Укороченные белки Cat L направляются в цитоплазму и ядро. На основании клеточной локализации, Cat L обеспечивает различные клеточные биологические активности.
Данные мышей, дефицитных по LDLrec (рецепторы липопротеинов низкой плотности) и Cat L, подчеркивают роль катепсина L в атеросклерозе, поскольку такие мыши обладают сниженным атеросклеротическим фенотипом (Kitamoto et al., Circulation 2007, 115:2065-75). Кроме того, Cat L дефицитные мыши обладают менее серьезными повреждениями в индуцированной эластазой модели аневризмы брюшной аорты (Sun et al., Arterioscler Thromb Vase Biol. 2011, 31:2500-8). Cat L способствует образованию сосудистых поражений путем содействия накоплению воспалительных клеток, ангиогенезу, и экспрессии протеазы. Он участвует в деградации матрицы, например эластина и коллагена, в качестве секретируемой протеазы, в аутофагической гибели клеток в качестве цитоплазматической протеазы (Mahmood et al., J. Biol. Chem. 2011, 286:28858-66) или посредством процессинга транскрипционных факторов, таких как CUX-1 в качестве ядерной протеазы Goulet et al., Mol. Cell. 2004, 14:207-19; Goulet et al., Biol. Chem. 2006, 387:1285-93)… Образцы сосудистых заболеваний человека от пациентов с атеросклеротической сосудистой системой или AAA (аневризм брюшной аорты) показывают сильную сверхрегуляцию Cat L при тканях, подверженых заболеваниям (Liu et al., Atherosclerosis 2006, 184:302-11).
Цитоплазма варианты Cat L, по-видимому, играют ключевую роль в протеинурических заболеваниях. Подоциты являются ключевым типом клеток, поддерживающих барьерную функцию клубочков в почках. Провоспалительные сигналы, такие как ЛПС (липополисахариды) индуцируют экспрессию Cat L. Цитоплазматический Cat L расщепляет белки, которые регулируют пластичность цитоскелета: динамин и синаптоподин. Cat L дефицитные мыши обладают сниженной протеинурией на моделях острой протеинурии (Reiser et al., J. Clin. Invest. 2010, 120:3421-31; Yaddanapudi et al., J. Clin. Invest. 2011, 121:3965-80).
Cat L дефицитные мыши проявляют сниженный метаболический фенотип, в отношении различных диабетических состояний. Частью механизма является расщепление рецептора инсулина на клетках скелетных мышц (Yang et al., Nat. Cell. Biol. 2007, 9:970-7), однако деградация матрицы, а также расщепление CUX-1 и его роль в лептиновом сигналилинге также вносят вклад в метаболические функции Cat L (Stratigopoulos et al., J. Biol. Chem. 2011, 286:2155-70).
Также было показано, что Cat L сверхактивируется при различных формах рака, от рака молочной железы, легкого, желудка, толстой кишки до меланом и глиом. Клеточные функции Cat L в опосредовании апоптоза, рециклинга лизосом и инвазии клеток, делают ингибирование Cat L при раке привлекательной мишенью. Снижение межклеточной адгезии с помощью Cat L отчасти можно объяснить расщеплением Е-кадгерина (Gocheva et al., Genes Dev. 2006, 20:543-56). Расщепление внеклеточного матрикса может также освободить факторы роста из матрикса, с целью взаимодействия с рецепторами клеточной поверхности.
В настоящем описании термин ʹʹалкилʹʹ, отдельно или в комбинации, означает прямоцепочечную или разветвленную алкильную группу с 1-8 атомами углерода, в частности, прямоцепочечную или разветвленную алкильную группу с 1-6 атомами углерода, и более конкретно прямоцепочечную или разветвленную алкильную группу с 1-4 атомами углерода. Примерами неразветвленной и разветвленной алкильной группы являются метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, изомерные пентилы, изомерные гексилы, изомерные гептилы и изомерные октилы, в частности, метил, этил, пропил, изопропил, изобутил и трет-бутил, более конкретно метил.
Термин ʹʹциклоалкилʹʹ, один или в комбинации, означает циклоалкильное кольцо из 3-8 атомов углерода и, в частности, циклоалкильное кольцо из 3-6 атомов углерода. Примерами С3-С8 циклоалкила являются циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Конкретными циклоалкилами являются циклопропил, циклобутил, циклопентил и циклогексил. Циклопропил является предпочтительным циклоалкилом.
Термин ʹʹалкоксиʹʹ, самостоятельно или в комбинации, означает группу формулы алкил-Ο-, в которой термин ʹʹалкилʹʹ определен ранее, такую как метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси и трет-бутокси, в частности, метокси, этокси, пропокси и изопропокси, более конкретно метокси.
Термин ʹʹциклоалкилоксиʹʹ, самостоятельно или в комбинации, означает группу формулы циклоалкил-Ο-, в которой термин ʹʹциклоалкилʹʹ определен ранее, такую как циклобутилокси, циклопентилокси или циклогексилокси.
Термин ʹʹоксиʹʹ, самостоятельно или в комбинации, обозначает группу -О-.
Термины ʹʹгалогенʹʹ или ʹʹгалоʹʹ, самостоятельно или в комбинации, означают фтор, хлор, бром или йод.
Термины ʹʹгалоалкилʹʹ, ʹʹгалоциклоалкилʹʹ и ʹʹгалоалкоксиʹʹ, самостоятельно или в комбинации, обозначают алкильную группу, циклоалкильную группу и алкоксигруппу соответственно, замещенные по меньшей мере одним галогеном, в частности, замещенные от одного до пяти атомами галогена, в частности одним-тремя галогенами. Фторалкил представляет собой алкильную группу, замещенную по меньшей мере одним атомом фтора, в частности замещенную от одного до пяти атомами фтора, в частности от одного до трех галогенов. Конкретным ʹʹгалоалкиломʹʹ являются трифторметил.
Термин ʹʹсульфонилʹʹ, один или в комбинации, означает группу -SO2-.
Термин ʹʹсульфанилʹʹ, один или в комбинации, означает группу -SO-.
Термин ʹʹпяти - двенадцатичленное карбоциклическое кольцоʹʹ, один или в комбинации, означает карбоциклическое кольцо, содержащее от пяти до двенадцати кольцевых атомов углерода, которые могут быть насыщенными или ненасыщенными, и которое связано с остальной частью соединения формулы (I) через два кольцевых атома. Примерами пяти - двенадцатичленного карбоциклического кольца являются фенил, нафталенил, 1,2,3,4-тетрагидронафталенил, бицикло[4.2.0]окта-1(6), 2,4-триенил, инданил и 6,7,8, 9-тетрагидро-5Н-бензоциклогептенил, в частности, фенил и 1,2,3,4-тетрагидронафталенил, и, в частности фенил.
Термин ʹʹпяти - двенадцатичленное гетероциклическое кольцоʹʹ, один или в комбинации, означает карбоциклическое кольцо, содержащее от пяти до двенадцати кольцевых атомов углерода, которые могут быть насыщенными или ненасыщенными, которое содержит от одного до трех гетероатомов, выбранных из N, О или S, и которое связано с остальной частью соединения формулы (I) через два кольцевых атома. Примерами пяти - двенадцатичленного гетероциклического кольца являются пирролидинил, пиридинил, пиримидинил, пиридазинил, пиразинил, пиразолил, имидазолил, 1,2,3-триазолил, 1,2,4-триазолил, тетразолил, индолил, бензимидазолил, бензтриазолил, пирролопиридинил, пиразолопиридинил, триазолопиридинил и имидазолопиридинил, в частности, пирролидинил, пиридинил и пиримидинил.
Термин ʹʹфармацевтически приемлемые солиʹʹ относится к солям, которые сохраняют биологическую эффективность и свойства свободных оснований или свободных кислот, которые не являются биологически или иным образом нежелательными. Соли образуются с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота, в частности соляная кислота, и органических кислот, таких как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота, N- ацетилцистеин. Кроме того, эти соли могут быть получены посредством добавления неорганического основания или органического основания к свободной кислоте. Соли, полученные из неорганических оснований включают, без ограничения, соли натрия, калия, лития, аммония, кальция, магния. Соли, полученные из органических оснований, включают, без ограничения, соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклические амины и основные ионообменные смолы, такие как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, лизин, аргинин, N- этилпиперидин, пиперидин, полиаминовые смолы. Соединение формулы (I) может также присутствовать в виде цвиттерионов. Особенно предпочтительными фармацевтически приемлемыми солями соединений формулы (I) являются соли соляной кислоты, бромистоводородной кислоты, серной кислоты, фосфорной кислоты и метансульфоновой кислоты.
ʹʹФармацевтически приемлемые эфирыʹʹ означает, что соединения общей формулы (I) могут быть дериватизированы по функциональным группам с получением производных, которые способны превратиться обратно в исходные соединения в условиях in vivo. Примеры таких соединений включают физиологически приемлемые и метаболически лабильные эфирные производные, такие как метоксиметиловые эфиры, метилтиометиловые эфиры и пивалоилоксиметиловые эфиры. Дополнительно, любые физиологически приемлемые эквиваленты соединений общей формулы (I), аналогичные метаболически лабильным эфирам, которые способны превращаться в исходные соединения общей формулы (I) in vivo, включены в объем настоящего изобретения.
Если один из исходных материалов или соединений формулы (I) содержат одну или более функциональных групп, которые не являются стабильными или являются реактивными в условиях реакции одной или нескольких реакционных стадий, соответствующие защитные группы (как описано, например, в ʹʹProtective Groups in Organic Chemistryʹʹ by T.W. Greene and P.G.M. Wutts, 3rd Ed., 1999, Wiley, New York) могут быть введены перед критической стадией, используя способы, хорошо известные в данной области. Такие защитные группы могут быть удалены на более поздней стадии синтеза с использованием стандартных способов, описанных в литературе. Примерами защитных групп являются трет-бутоксикарбонил (Boc), 9-флуоренилметил карбамат (Fmoc), 2-триметилсилилэтил карбамат (Теос), карбобензилокси (Cbz) и п-метоксибензилоксикарбонил (Moz).
Соединение формулы (I) может содержать несколько асимметричных центров и может присутствовать в форме оптически чистых энантиомеров, смесей энантиомеров, таких как, например, рацематы, смесей диастереоизомеров, диастереоизомерных рацематов или смесей диастереоизомерных рацематов.
Термин ʹʹасимметричный атом углеродаʹʹ означает атом углерода с четырьмя различными заместителями. Согласно правилам Кана - Ингольда - Прелога асимметричный атом углерода может быть ʹʹRʹʹ или ʹʹSʹʹ конфигурации.
Настоящее изобретение относится, в частности, к соединению формулы (I), где:
А представляет собой -О-, -S-, -СН2-, -NH- или -SO2-;
В представляет собой пяти-двенадцатичленное карбоциклическое кольцо или пяти-двенадцатичленное гетероциклическое кольцо, где кольцо возможно замещено одним или двумя заместителями, независимо выбранными из галогена, алкила, алкокси, галоалкила, галоалкокси, циклоалкила, циклоалкилалкокси, сульфонила, сульфанила, циклоалкилсульфонила и циклоалкилсульфанила;
D представляет собой -О-, -S-, -СН2-, -NH- или -SO2-;
один из R1, R2, R3 и R4 представляет собой водород, а другие независимо выбраны из водорода, галогена, алкила, алкокси, галоалкокси, циклоалкила и фенила;
R5 и R6 независимо выбраны из и водорода, алкила, галоалкила, циклоалкила, фенила и фенилалкила;
или R5 и R6 вместе с атомом углерода, к которому они присоединены, образуют циклоалкил, пирролидинил или пиперидинил; и
представляет собой одинарную связь углерод-углерод или двойную связь углерод-углерод;
или его фармацевтически приемлемой соли или эфиру.
Настоящее изобретение относится, в частности, к следующему: Соединение формулы (I), где А представляет собой -O-, -S-, -СН2- или -NH; Соединение формулы (I), где В представляет собой фенил, замещенный фенил, пирролидинил, замещенный пирролидинил, пиридинил, замещенный пиридинил, пиримидинил, замещенный пиримидинил, 1,2,3,4-тетрагидронафталенил, бицикло[4.2.0]окта-1 (6), 2,4-триенил, инданил или 6,7,8,9-тетрагидро-5Н-бензоциклогептенил, где замещенный фенил представляет собой фенил, замещенный одним или двумя заместителями, выбранными из галогена, алкила, циклоалкила, алкокси, галоалкила, азетидинила, алкилсульфанила и циано, где замещенный пирролидинил представляет собой пирролидинил, замещенный одним или двумя заместителями, независимо выбранными из галогена, алкила, алкокси, галоалкокси, циклоалкила, алкилсульфанила, алкилсульфонила, циклоалкилсульфанила и циклоалкилсульфонила, где замещенный пиридинил представляет собой пиридинил, замещенный галогеном, алкилом, циклоалкилом, алкокси или галогеналкокси, и где замещенный пиримидинил представляет собой пиримидинил, замещенный галогеном, алкилом, циклоалкилом, алкокси или галогеналкокси;
Соединение формулы (I), где В представляет собой фенил, галофенил, пирролидинил, галопирролидинил, алкилпирролидинил, алкоксифенил, алкилпиридинил, галоалкилфенил, тетрагидронафтил, азетидинилфенил, цианофенил или алкилсульфанилфенил;
Соединение формулы (I), где В представляет собой фенил, бромфенил, хлорфенил, дифторфенил, метоксифенил или метилпиридин, трифторметилфенил, азетидинилфенил, цианофенил или метилсульфанилфенил;
Соединение формулы (I), где В представляет собой фенил, замещенный фенил, пирролидинил, замещенный пирролидинил, пиридинил, замещенный пиридинил, пиримидинил, замещенный пиримидинил, 1,2,3,4-тетрагидронафталенил, бицикло[4.2.0]окта-1(6), 2,4-триенил, инданил или 6,7,8,9-тетрагидро-5Н-бензоциклогептенил, где замещенный фенил представляет собой фенил, замещенный одним или двумя заместителями, выбранными из галогена, алкила, циклоалкила, алкокси и галоалкокси, где замещенный пирролидинил представляет собой пирролидинил, замещенный одним или двумя заместителями, независимо выбранными из галогена, алкила, алкокси, галоалкокси, циклоалкила, алкилсульфанила, алкилсульфонила, циклоалкилсульфанила и циклоалкилсульфонила, где замещенный пиридинил представляет собой пиридинил, замещенный галогеном, алкилом, циклоалкилом, алкокси или галоалкокси, и где замещенный пиримидинил представляет собой пиримидинил, замещенный галогеном, алкилом, циклоалкилом, алкокси или галоалкокси;
Соединение формулы (I), где В представляет собой фенил, галофенил, пирролидинил, галопирролидинил, алкилпирролидинил, алкоксифенил, алкилпиридинил, галоалкилфенил или тетрагидронафтил;
Соединение формулы (I), где В представляет собой фенил, бромфенил, хлорфенил, метоксифенил или метилпиридинил;
Соединение формулы (I), где D представляет собой -О-;
Соединение формулы (I), где один из R1 и R4 представляет собой водород, а другой представляет собой галоген;
Соединение формулы (I), где один из R1 и R4 представляет собой водород и другой представляет собой бромо, хлоро или йодо;
Соединение формулы (I), где R2 и R3 одновременно представляют собой водород;
Соединение формулы (I), где R5 и R6 вместе с атомом углерода, к которому они присоединены, образуют циклоалкил; и
Соединение формулы (I), где R5 и R6 вместе с атомом углерода, к которому они присоединены, образуют циклопропил.
Настоящее изобретение также относится к соединению формулы (I), выбранному из:
(Е)-(S)-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6(11),7,9,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(E)-(S)-5-оксо-11,16-диокса-4-аза-трицикло[15.2.2.1*6,10*]докоза-1(20),6,8,10(22),13,17(21),18-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(Е)-(S)-5-оксо-17-окса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(Е)-(S)-19-хлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6(11),7,9,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(E)-(S)-19-хлор-5-оксо-17-окса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(E)-(S)-18-хлор-5-оксо-11,16-диокса-4-аза-трицикло[15.2.2.1*6,10*]докоза-1(20),6,8,10(22),13,17(21),18-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(S)-19-хлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(E)-(S)-8-бромо-19-хлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(S)-8-бромо-19-хлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(E)-(S)-8,19-дихлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(S)-8,19-дихлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(E)-(S)-18-хлор-5-оксо-16-окса-4,10-диаза-трицикло[15.2.2.0*6,10*]геникоза-1(20),13,17(21),18-тетраен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(E)-(3S,8S)-18-хлор-8-фтор-5-оксо-16-окса-4,10-диаза-трицикло[15.2.2.0*6,10*]геникоза-1(20),13,17(21),18-тетраен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(E)-(S)-18-хлор-8,8-дифтор-5-оксо-16-окса-4,10-диаза-трицикло[15.2.2.0*6,10*]геникоза-1(20),13,17(21),18-тетраен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(Е)-(5)-18-хлор-8,8-диметил-5-оксо-16-окса-4,10-диаза-трицикло[15.2.2.0*6,10*]геникоза-1(20),13,17(21),18-тетраен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(Е)-(S)-19-хлор-8-метокси-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(S)-19-хлор-8-метокси-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(E)-(S)-19-хлор-9-метокси-5-оксо-17-окса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(E)-(S)-19-хлор-9-метил-5-оксо-17-окса-12-тиа-4,10-диаза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(E)-(S)-19-хлор-5-оксо-9-трифторметил-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(E)-(S)-19-хлор-5-оксо-17-окса-4,12-диаза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(S)-19-хлор-9-метокси-5-оксо-17-окса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(S)-19-хлор-5-оксо-9-трифторметил-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(E)-(S)-19-йодо-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.*6,11*]докоза-1(21),6,8,10,14,18(22), 19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(E)-(S)-19-йодо-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида, стереоось R;
(E)-(S)-19-йодо-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида, стереоось S;
(3Е,12S)-22-хлор-N-(1-цианоциклопропил)-14-оксо-2,5,11,12,13,14,16,17,18,19-декагидро-7,10-этенонафто[2,3-b][1,12,5]диоксазациклогексадецин-12-карбоксамида;
(E)-(S)-8-хлор-19-йод-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(12S)-22-хлор-N-(1-цианоциклопропил)-14-оксо-2,3,4,5,11,12,13,14,16,17,18,19-додекагидро-7,10-этенонафто[2,3-b][1,12,5]диоксазациклогексадецин-12-карбоксамида;
(S)-19-йодо-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6(11),7,9,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(S)-8-хлор-19-йод-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6(11),7,9,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(E)-(S)-19-хлор-8-фтор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(E)-(S)-9,19-дихлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(E)-(S)-19-хлор-5-оксо-8-трифторметил-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(S)-19-хлор-8-фтор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(S)-9,19-дихлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(S)-19-хлор-5-оксо-8-трифторметил-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амида; и
(E)-(S)-8-бромо-19-хлор-5-оксо-17-окса-4,12-диаза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида.
Настоящее изобретение также относится к соединению формулы (I), выбранному из:
3-[(E)-(S)-19-хлор-3-(1-циано-циклопропилкарбамоил)-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-heptaen-8-ил]-азетидин-1-карбоновой кислоты трет-бутилового эфира;
(E)-(S)-19-хлор-8-циано-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(Е)-(S)-8-азетидин-3-ил-19-хлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
3-[(S)-19-хлор-3-(1-циано-циклопропилкарбамоил)-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-hехаеn-8-ил]-азетидин-1-карбоновой кислоты трет-бутилового эфира;
(S)-8-азетидин-3-ил-19-хлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(Е-Z)-(8)-19-хлор-8,10-дифтор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(Е)-(S)-19-хлор-7,8-дифтор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(Z)-(S)-19-хлор-7,8-дифтор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(E)-(S)-19-хлор-8-метилсульфанил-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(E)-(S)-10,19-дихлор-8-фтор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(S)-19-хлор-8-циано-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(S)-19-хлор-7,8-дифтор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амида; и
(S)-19-хлор-8-метилсульфанил-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амида.
Настоящее изобретение также относится к соединению формулы (I), выбранному из:
(E)-(S)-19-хлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6(11),7,9,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(E)-(S)-19-хлор-5-оксо-17-окса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(E)-(S)-18-хлор-5-оксо-11,16-диокса-4-аза-трицикло[15.2.2.1*6,10*]докоза-1(20),6,8,10(22),13,17(21),18-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(E)-(S)-8-бромо-19-хлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(S)-8-бромо-19-хлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(E)-(S)-8,19-дихлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(S)-8,19-дихлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(Е)-(S)-19-хлор-8-метокси-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(S)-19-хлор-8-метокси-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(E)-(S)-19-хлор-9-метил-5-оксо-17-окса-12-тиа-4,10-диаза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(E)-(S)-19-хлор-5-оксо-8-трифторметил-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида; и
(S)-19-хлор-5-оксо-8-трифторметил-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амида.
Настоящее изобретение также относится, в частности, к соединению формулы (I), выбранному из:
(E)-(S)-19-хлор-5-оксо-8-трифторметил-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(S)-19-хлор-5-оксо-8-трифторметил-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(Е)-(S)-8-азетидин-3-ил-19-хлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(S)-8-азетидин-3-ил-19-хлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(E-Z)-(S)-19-хлор-8,10-дифтор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(E)-(S)-19-хлор-7,8-дифтор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(Е)-(S)-19-хлор-8-метилсульфанил-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(S)-19-хлор-8-циано-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амида;
(S)-19-хлор-7,8-дифтор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амида; и
(S)-19-хлор-8-метилсульфанил-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амида.
Соединения формулы (I) могут быть получены в соответствии со способами, известными в уровне техники квалифицированным специалистам, и, в частности, в соответствии с реакциями, описанными ниже.


R1-4 и D являются такими, как определено выше; X представляет собой уходящую группу, такую как Cl, Br, I, ОН, мезилат, тозилат, нозилат, брозилат или трифлат.
Защищенное производное аминокислоты, такое как 1 или 3 взаимодействует с производным аминоацетонитрила в присутствии одного из различных амидсвязывающих реагентов, таких как BOP-Cl, TBTU, ВОР, РуВор, HATU, EDCl/HOBT, DIC/HOBT, DCC/HOBT, и т.д. с получением соответствующих амидов 2 или 4. Амид 4 переносят на амид 2 посредством взаимодействия Х-СН2-СН=СН2 с 4 в присутствии основания или посредством реакции Мицунобу в присутствии фосфинового производного, такого как PPh3 и т.д. Амин 5 получили посредством взаимодействия амида 2 с подходящей кислотой, такой как ТФУ, муравьиная кислота, HCl в диоксане, и т.д. и последующей щелочной экстракцией.

А и В являются такими, как определено выше; X представляет собой уходящую группу, такую как Cl, Br, I, ОН, мезилат, тозилат, нозилат, брозилат или трифлат.
Соединение b получили посредством взаимодействия карбоновой кислоты a с Х-СН2-СН=СН2 в присутствии основания или посредством реакции Мицунобу в присутствии фосфинового производного, такого как PPh3 и т.д. Эфир b затем сапонифицировали обработкой b с помощью основания, такого как NaOH, КОН, LiOH, и т.д. с получением конечных строительных блоков с.
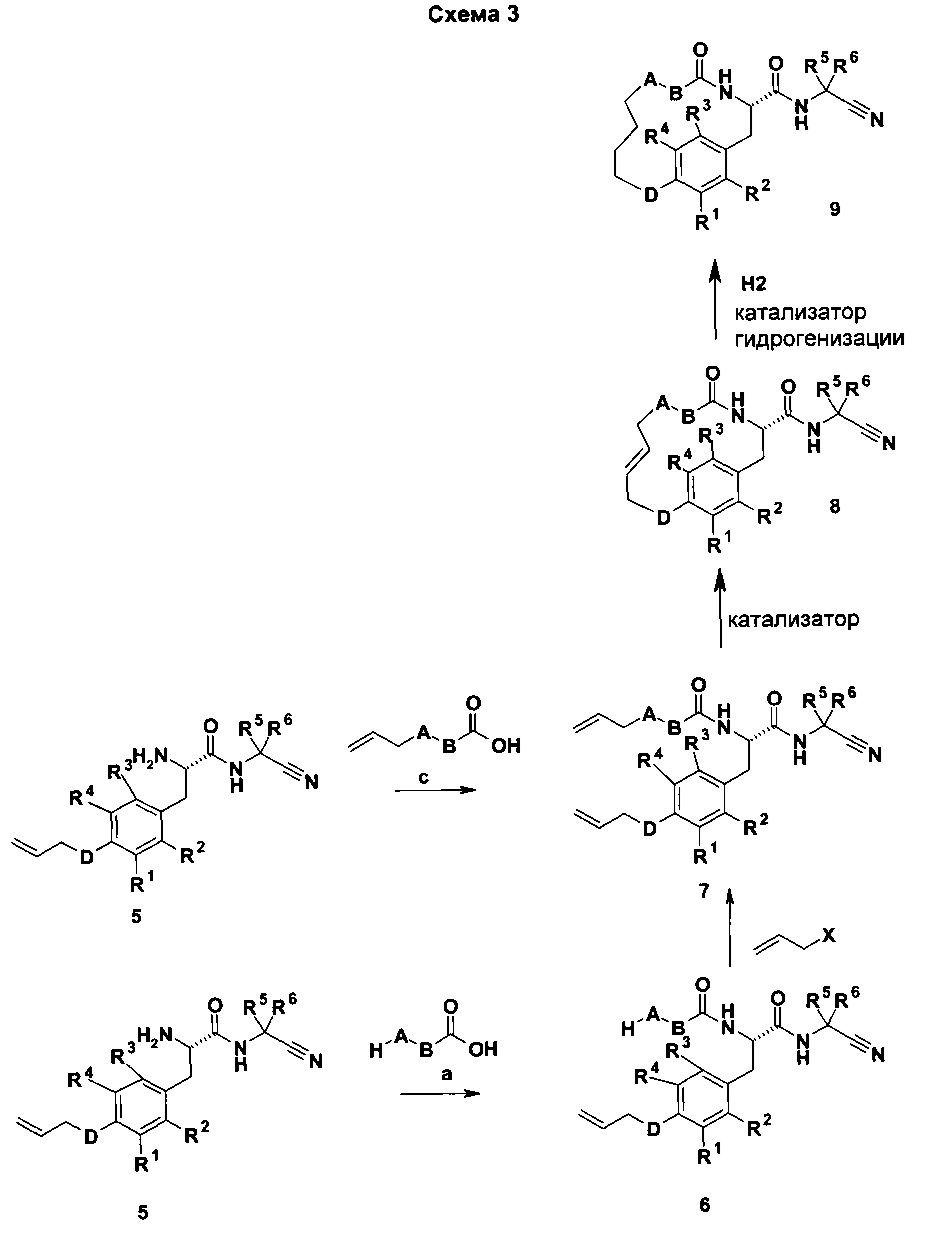
А, В, R1-4 и D являются такими, как определено выше; X представляет собой уходящую группу, такую как Cl, Br, I, ОН, мезилат, тозилат, нозилат, брозилат или трифлат; или X представляет собой A-Y, где Υ представляет собой уходящую группу, как определено выше. В последнем случае А не представлена в карбоновой кислоте a, используемой для реакции от 5 до 6.
Амин 5 взаимодействует с производными карбоновой кислоты a или c с получением амидов 6 или 7 в присутствии одного из различных амидсвязывающих реагентов, таких как BOP-Cl, TBTU, ВОР, РуВор, HATU, EDCl/HOBT, DIC/HOBT; DCC/HOBT, и т.д. Амид 6 переносят на амид 7 посредством взаимодействия Х-СН2-СН=СН2 с 6 в присутствии основания или посредством реакции Мицунобу в присутствии фосфинового производного, такого как PPh3 и т.д. Макроцикл 8 получили посредством обмена с замыканием кольца соединения 7 с использованием одного из катализаторов, известных в уровне техники (например, Grubbs I, Grubbs II, Катализатор Граббса-Ховейда I или II, и т.д.) с или без кислотного (Льюис) катализа. Макроцикл 9 получили с помощью каталитической гидрогенизации соединения 8, с использованием водорода при атмосферном или более высоком давлении и одного из различных катализаторов гидрогенизации, известных из уровня техники (например, Pd/C; никель Ренея, PtO2. и т.д.)

R1-2 и D являются такими, как определено выше; X представляет собой уходящую группу, такую как Cl, Br, I, ОН, мезилат, тозилат, нозилат, брозилат или трифлат; Ε представляет собой метил, этил, пропил, бензил или изопропил.
Ортогонально защищенное аминокислотное производное 10 обработали Х-СН2-СН=СН2 в присутствии основания или посредством реакции Мицунобу в присутствии фосфинового производного, такого как PPh3 и т.д. с получением соединения 11. Отщепление аминозащитной группы с помощью подходящей кислоты, такой как ТФУ, муравьиная кислота, HCl в диоксане, и т.д. и последующая щелочная экстракция дали свободный амин 12.
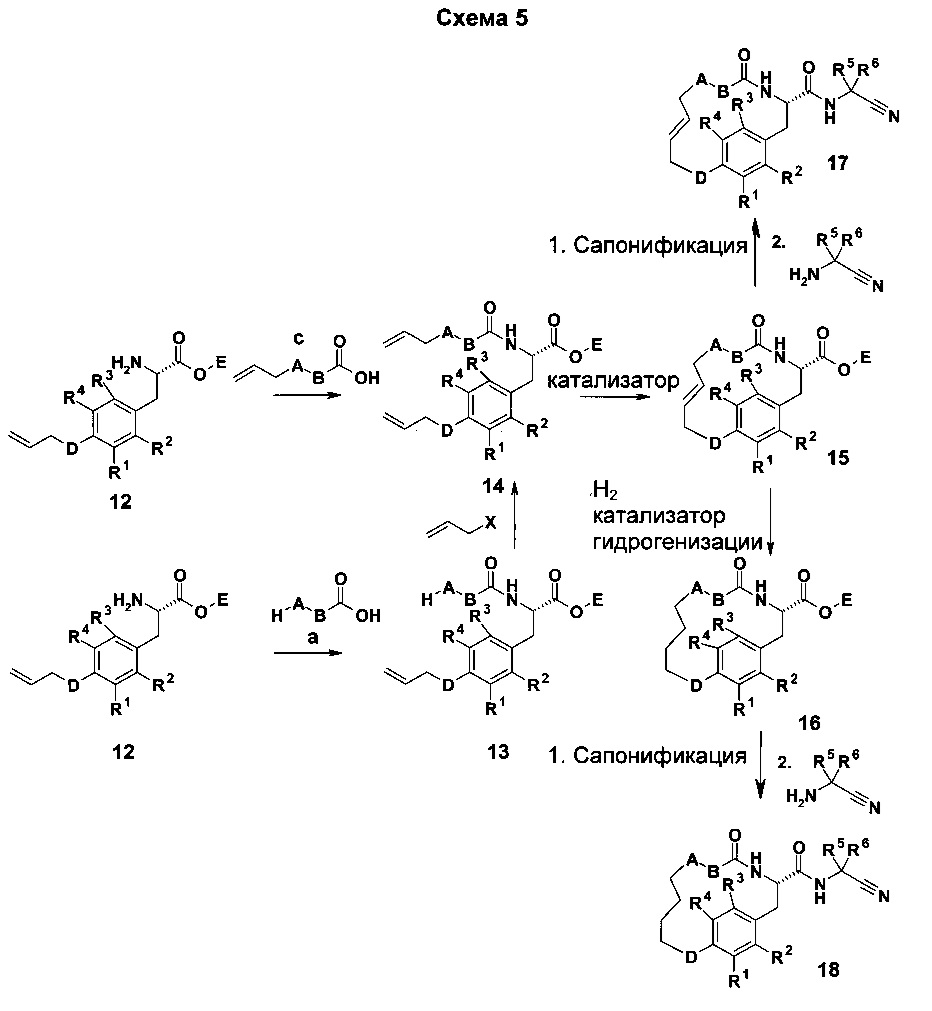
А, В, R1-4 и D являются такими, как определено выше; X представляет собой уходящую группу, такую как Cl, Br, I, ОН, мезилат, тозилат, нозилат, брозилат или трифлат; или X представляет собой A-Y, где Υ представляет собой уходящую группу, как определено выше. В последнем случае А не представлена в карбоновой кислоте а используемой для реакции от 12 до 13. Ε представляет собой метил, этил, пропил, бензил или изопропил.
Амин 12 взаимодействует с производными карбоновой кислоты а или с до амидов 13 или 14 в присутствии одного из различных амидсвязывающих реагентов, таких как BOP-Cl, TBTU, ВОР, РуВор, HATU, EDCl/HOBT, DIC/НОВТ, DCC/HOBT, и т.д. Амид 13 переносят на амид 14 посредством взаимодействия Х-СН2-СН=СН2 с 13 в присутствии основания или посредством реакции Мицунобу в присутствии фосфинового производного, такого как PPh3 и т.д. Макроцикл 15 получили посредством обмена с замыканием кольца соединения 14 с использованием одного из катализаторов, известных в уровне техники (например, катализатор Граббса I поколения, катализатор Граббса II поколения, катализатор Граббса-Ховейда I или II, и т.д.) с или без кислотного (Льюис) катализа. Макроцикл 16 получили с помощью каталитической гидрогенизации соединения 15 с использованием водорода при атмосферном или более высоком давлении и одного из различных катализаторов гидрогенизации, известных из уровня техники (например, Pd/C; никель Ренея, PtO2, и т.д.). Оба макроцикла 15 или 16 затем сапонифицировали с использованием основания, такого как LiOH, NaOH, КОН, и т.д. до соответствующих карбоновых кислот, которые затем взаимодействовали с производными аминоацетонитрила в присутствии одного из различных амидсвязывающих реагентов, таких как BOP-Cl, TBTU, ВОР, РуВор, HATU, EDCl/HOBT, DIC/HOBT, DCC/HOBT, и т.д. до конечных макроциклических амидов 17 и 18.

А, В, R1-4 и D являются такими, как определено выше; Ε представляет собой метил, этил, пропил, бензил или изопропил.
Соединение 14 (см. схему 5) сапонифицируют с использованием основания, такого как LiOH, NaOH, КОН, и т.д. до соответствующей карбоновой кислоты, которая затем взаимодействует с производными аминоацетонитрила в присутствии одного из различных амидсвязывающих реагентов, таких как BOP-Cl, TBTU, ВОР, РуВор, HATU, EDCl/HOBT, DIC/HOBT; DCC/HOBT, и т.д. с получением амида 19. Макроцикл 20 получили посредством обмена с замыканием кольца с использованием одного из катализаторов, известных в уровне техники (например, катализатор Граббса I поколения, катализатор Граббса II поколения, Катализатор Граббса-Ховейда I или II, и т.д.) с или без кислотного (Льюис) катализа. Макроцикл 21 получили с помощью каталитической гидрогенизации соединения 20 с использованием водорода при атмосферном или более высоком давлении и одного из различных катализаторов гидрогенизации, известных из уровня техники (например, Pd/C; никель Ренея, PtO2, и т.д.)
Настоящее изобретение также относится к способу получения соединения формулы (I), включающему следующие стадии:
(a) взаимодействие соединения формулы (А)

в присутствии водорода и катализатора гидрогенизации;
(b) взаимодействие соединения формулы (В)

в присутствии H2N-CR5R6-CN; или
(c) взаимодействие соединения формулы (С)

в присутствии катализатора обмена с замыканием кольца; где R1-R6, А, В, D и

На стадии (с), примерами катализаторов метатезиса с замыканием кольца являются катализатор Граббса I поколения (бензилиденбис(трициклогексилфосфин)дихлорорутений), катализатор Граббса II поколения (бензилиден[1,3-бис(2,4,6-триметилфенил)-2-имидазолидинилиден]дихлоро-(трициклогексилфосфин)рутений), катализатор Граббса-Ховейда I поколения (дихлоро(о-изопропоксифенилметилен)(трициклогексил-фосфин)рутений(II)) и катализатор Граббса-Ховейда II поколения (1,3-бис-(2,4,6-триметилфенил)-2-имидазолидинилиден)-дихлоро(о-изопропоксифенилметилен)рутений).
Настоящее изобретение также относится к соединению формулы (I), полученному в соответствии со способом по настоящему изобретению.
Настоящее изобретение, кроме того, относится к:
Соединение формулы (I) для применения в качестве терапевтически активного вещества;
Фармацевтическая композиция, содержащая соединение формулы (I) и терапевтически инертный носитель;
Применение соединения формулы (I) для лечения или профилактики диабета, диабетической ретинопатии, диабетической нейропатии, атеросклероза, аневризмы брюшной аорты, болезни периферических артерий, хронической болезни почек, диабетической нейропатии, опухолей и панкреатита;
Применение соединения формулы (I) при получении лекарственного средства для лечения или профилактики диабета, диабетической ретинопатии, диабетической нейропатии, атеросклероза, аневризмы брюшной аорты, болезни периферических артерий, хронической болезни почек, диабетической нейропатии, опухолей и панкреатита;
Соединение формулы (I) для лечения или профилактики диабета, диабетической ретинопатии, диабетической нейропатии, атеросклероза, аневризмы брюшной аорты, болезни периферических артерий, хронической болезни почек, диабетической нейропатии, опухолей и панкреатита; и
Способ лечения или профилактики диабета, диабетической ретинопатии, диабетической нейропатии, атеросклероза, аневризмы брюшной аорты, болезни периферических артерий, хронической болезни почек, диабетической нейропатии, опухолей и панкреатита, который включает введение эффективного количества соединения формулы (I) нуждающемуся в этом пациенту.
Другое воплощение настоящего изобретения относится к фармацевтическим композициям или лекарственным средствам, содержащим соединения по изобретению и терапевтически инертный носитель, разбавитель или эксципиент, а также способы применения соединений по изобретению для получения таких композиций и лекарственных средств. В одном примере соединения формулы (I) могут быть приготовлены путем смешивания при комнатной температуре, соответствующем рН и при желаемой степени чистоты, с физиологически приемлемыми носителями, например, носителями, которые нетоксичны для реципиентов в используемых дозах и концентрациях, в галенову форму введения. РН композиции зависит в основном от конкретного применения и концентрации соединения, но предпочтительно может варьироваться от примерно 3 до примерно 8. В одном примере соединение формулы (I) готовится в ацетатном буфере при рН 5. В другом воплощении соединения формулы (I) являются стерильными. Соединение может храниться, например, в виде твердой или аморфной композиции, в виде лиофилизированного препарата или в виде водного раствора.
Композиции изготавливаются, дозируются и вводятся в соответствии с надлежащей медицинской практикой. Факторы, рассматривающиеся в данном контексте включают конкретное расстройство, подлежащее лечению, конкретное млекопитающее, подлежащее лечению, клиническое состояние конкретного пациента, причину расстройства, место доставки агента, способ введения, схему введения и другие факторы, известные практикующим врачам.
Соединения по изобретению можно вводить любыми подходящими путями, в том числе перорально, местно (в том числе трансбуккально и подъязычно), ректально, вагинально, трансдермально, парентерально, подкожно, внутрибрюшинно, внутрилегочно, внутрикожно, интратекально и эпидурально и интраназально, и, при желании для местного лечения, введение в очаг поражения. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение.
Соединения по настоящему изобретению можно вводить в любой удобной форме для введения, например, таблетки, порошки, капсулы, растворы, дисперсии, суспензии, сиропы, спреи, суппозитории, гели, эмульсии, пластыри и т.п. Такие композиции могут содержать обычные для фармацевтических препаратов компоненты, например, разбавители, носители, модификаторы рН, подсластители, наполнители и другие активные агенты.
Типичный препарат готовят путем смешивания соединения по настоящему изобретению и носителя или эксципиента. Подходящие носители и эксципиенты хорошо известны специалистам в данной области техники и подробно описаны, например, в Ansel, Howard С, et al., Anselʹs Pharmaceutical Dosage Forms and Drug Delivery Systems. Philadelphia: Lippincott, Williams & Wilkins, 2004; Gennaro, Alfonso R., et al. Remington: The Science and Practice of Pharmacy. Philadelphia: Lippincott, Williams & Wilkins, 2000; and Rowe, Raymond C. Handbook of Pharmaceutical Excipients. Chicago, Pharmaceutical Press, 2005. Композиции могут также включать один или более буферов, стабилизирующих агентов, поверхностно-активные вещества, смачивающие агенты, смазывающие агенты, эмульгаторы, суспендирующие агенты, консерванты, антиоксиданты, кроющие агенты, глиданты, технологические добавки, красители, подсластители, отдушки, ароматизаторы, разбавители и другие известные добавки для обеспечения элегантной презентации препарата (например, соединения по настоящему изобретению или его фармацевтической композиции) или помощи в изготовлении фармацевтического продукта (например, лекарственного средства).
Далее изобретение проиллюстрировано следующим примерами, которые не ограничивают его.
Примеры
Сокращения:
AcOEt: Этилацетат;
ACN: Ацетонитрил;
ВОР: Бензотриазолил-N-окси-трис(диметиламино)-фосфония гексафторфосфат;
BOP-Cl: Бис-(2-оксо-3-оксаолидинил)-фосфиновой кислоты хлорид;
CDI: 1,1ʹ-Карбонилдиимидазол;
DCM: Дихлорметан
DIEA: Диизопропилэтиламин;
DMF: Ν,Ν-Диметилформамид;
EDCl: N-(3-Диметиламинопропил)-Nʹ-этил-карбодиимида гидрохлорид;
Катализатор Граббса I поколения:
Бензилиденбис(трициклогексилфосфин)дихлорорутений;
Катализатор Граббса II поколения: Бензилиден[1,3-бис(2,4,6-триметилфенил)-2-имидазолидинилиден]дихлоро-(трициклогексилфосфин)рутений;
Катализатор Граббса-Ховейда I поколения: Дихлоро(о-изопропоксифенилметилен)(трициклогексил-фосфин)рутений(II);
Катализатор Граббса-Ховейда II поколения: 1,3-бис-(2,4,6-триметилфенил)-2-имидазолидинилиден)-дихлоро(о-изопропоксифенилметилен)рутений;
HATU: O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат;
НОВТ: 1-гидроксибензотриазол;
Основание Хунига: этил-диизопропиламин;
МеОН: Метанол;
Mes-Cl: Мезилхлорид;
Na2SO4: Судьфат натрия;
Nos-Cl: 3-Нитробензолсульфонилхлорид;
РуВОР: Бензотриазол-1-ил-окситрипирролидинфосфония гексафторфосфат;
TBTU: O-(бензотриазол-1-ил)-N,Ν,Nʹ,Nʹ-тетраметилурония тетрафторборат;
ТГФ: Тетрагидрофуран;
ТФУ: Трифторуксусная кислота; и
Tos-Cl: ТОлуол-4-сульфонилхлорид.
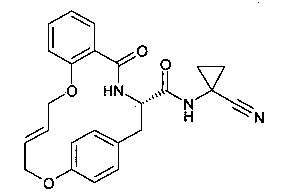
Пример 1
(Е)-(S)-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6(11),7,9,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид
A) [(S)-2-(4-Аллилокси-фенил)-1-(1-циано-циклопропилкарбамоил)-этил]-карбаминовой кислоты трет-бутиловый эфир
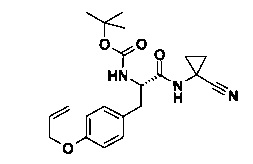
(S)-3-(4-(аллилокси)фенил)-2-(трет-бутоксикарбониламино)пропановую кислоту (5 г, 15.6 ммоль, Экв: 1.00) растворили в ДМФ (30 мл). Добавили HATU (11.8 г, 31.1 ммоль, Экв: 2.00), Основание Хунига (4.02 г, 5.43 мл, 31.1 ммоль, Экв: 2.00) и 1-амино-1-циклопропанкарбонитрила гидрохлорид (2.21 г, 18.7 ммоль, Экв: 1.20) к вышеуказанной суспензии и перемешивали при 25°C в течение 24 ч. Реакционную смесь влили в 0.1 Μ HCl (250 мл) и экстрагировали AcOEt (3×75 мл). Органические слои высушили над Na2SO4 и сконцентрировали под вакуумом. Неочищенное вещество растворили в CH2Cl2 (10 мл), 2 минуты спустя оно начало преципитироваться. Суспензию отфильтровали. Отфильтрованный раствор очистили с помощью флеш-хроматографии (силикагель, 80 г, 0% до 90% AcOEt в гептане) с получением светло-желтого осадка (3.0 g; 50%). m/z=286.1 [М+Н-Вос]+.
B) (S)-3-(4-Аллилокси-фенил)-2-амино-N-(1-циано-циклопропил)-пропионамид

Пример 1А) (3 г, 7.78 ммоль, Экв: 1.00) растворили в муравьиной кислоте (48.0 г, 40 мл, 1.04 моль, Экв: 134) и перемешивали при 25°C в течение 4 ч. Реакционную смесь осторожно довели с помощью ледяного водного 10% раствора Na2CO3 до рН=8 и экстрагировали CH2Cl2. Водный слой промыли всего 3 раза CH2Cl2, объединенные органические слои высушили над Na2SO4, отфильтровали и эвапорировали досуха с получением желтого масла (2.0 г; 90%). m/z=286.1 [М+Н]+.
C) 2-Аллилокси-N-[(S)-2-(4-аллилокси-фенил)-1-(1-циано-циклопропилкарбамоил)-этил]-бензамид

Пример 1В) (150 мг, 526 мкмоль, Экв: 1.00) растворили в ДМФ (4 мл). Добавили HATU (400 мг, 1.05 ммоль, Экв: 2.00), основание Хунига (136 мг, 184 мкл, 1.05 ммоль, Экв: 2.00) и 2-(аллилокси)бензойную кислоту (112 мг, 631 мкмоль, Экв: 1.20) к этой суспензии и перемешивали при 25°C в течение 3 ч. Неочищенное вещество очистили с помощью препаративной ВЭЖХ с получением серо-белого осадка (175 мг; 75%). m/z=446.3 [М+Н]+.
D) (E)-(S)-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.06,11]докоза-1(21),6(11),7,9,14,18(22), 19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

В 500 мл двухгорлышковой колбе, катализатор Граббса II поколения (88.0 мг, 104 мкмоль, Экв: 0.3) объединили с дихлорметаном (80 мл) с получением светло-коричневого раствора. Раствор нагрели до 50°C (с обратным холодильником) в атмосфере азота. Пример 1С) (154 мг, 346 мкмоль, Экв: 1.00), растворенный в безводном дихлорметане (40 мл) по каплям перенесли при кипении с обратным холодильником в колбу с помощью шприца. После завершения добавления, цвет поменялся со светло- коричневого до темно-коричневого. Раствор нагревали при температуре кипения с обратным холодильником при перемешивании в течение 4 ч. Реакционную смесь охладили до комнатной температуры, отфильтровали через силикагелевый фильтр, эвапорировали досуха. Неочищенное вещество очистили с помощью препаративной ВЭЖХ с получением коричневого осадка (29 мг; 20%). m/z=416.0 [М-Н]-.
Пример 2
(E)-(S)-5-оксо-11,16-диокса-4-аза-трицикло[15.2.2.1*6,10*]докоза-1(20),6,8,10(22),13,17(21),18-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Соединение, указанное в заголовке, получили по аналогии с примером 1 с получением коричневого осадка (6 мг; 7%). m/z=418.1759 [М+Н]+.
Пример 3
(Е)-(S)-5-оксо-17-окса-4-аза-трицикло[16.2.2.0%6,11&]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Соединение, указанное в заголовке, получили по аналогии с примером 1 с продолжительностью реакции 24 ч вместо 4 ч на последней стадии с получением серо-белого осадка (3 мг; 2%). m/z=416.1973 [М+Н]+.
Пример 4
(Е)-(S)-19-хлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6(11),7,9,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

A) [(S)-2-(3-хлор-4-гидрокси-фенил)-1-(1-циано-циклопропилкарбамоил)-этил]-карбаминовой кислоты трет-бутиловый эфир

(S)-2-(трет-бутоксикарбониламино)-3-(3-хлор-4-гидроксифенил)пропановую кислоту (3.86 г, 12.2 ммоль, Экв: 1.00) растворили в ДМФ (50 мл). Добавили HATU (9.3 г, 24.4 ммоль, Экв: 2.00), 1-амино-1-циклопропанкарбонитрила гидрохлорид (1.74 г, 14.7 ммоль, Экв: 1.20) и основание Хунига (3.16 г, 4.27 мл, 24.4 ммоль, Экв: 2.00) к полученной суспензии. Реакционную смесь перемешивали при 25°C в течение 24 ч. Реакционную смесь влили в водный раствор 0.1 Μ HCl (300 мл), экстрагировали дихлорметаном (3×125 мл), высушили над Na2SO4, отфильтровали и эвапорировали. Неочищенное вещество очистили с помощью флеш-хроматографии (силикагель, 80 г, 0% до 65% AcOEt в n-гептане) с получением белого осадка (3.13 г; 67%). m/z=378.1 [ΜΗ]-.
B) [(S)-2-(4-Аллилокси-3-хлор-фенил)-1-(1-циано-циклопропилкарбамоил)-этил]-карбаминовой кислоты трет-бутиловый эфир
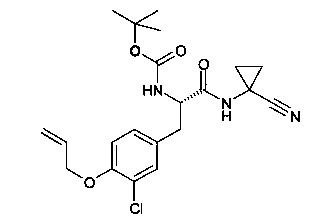
Пример 4А) (3.13 г, 8.24 ммоль, Экв: 1.00) растворили в дихлорметане (25 мл) и добавили основание Хунига (2.66 г, 3.6 мл, 20.6 ммоль, Экв: 2.50) и аллил бромид (1.2 г, 856 мкл, 9.89 ммоль, Экв: 1.2). Реакционную смесь перемешивали 4 ч при 25°C. После этого, добавили дополнительное количество аллил бромида (598 мг, 428 мкл, 4.94 ммоль, Экв: 0.6) и реакционную смесь перемешивали в течение ночи при 25°C. Снова добавили аллил бромид (598 мг, 428 мкл, 4.94 ммоль, Экв: 0.6) и реакционную смесь перемешивали в течение ночи при 40°C. После этого добавили дополнительное количество аллил бромида (598 мг, 428 мкл, 4.94 ммоль, Экв: 0.6) и реакционную смесь перемешивали в течение 3 дней при 40°C. Реакционную смесь охладили до комнатной температуры и экстрагировали водным раствором 0.5 н HCl/CH2Cl2. Органические слои высушили над Na2SO4, отфильтровали и сконцентрировали под вакуумом. Неочищенное вещество очистили с помощью флеш-хроматографии (силикагель, 70 г, 0% до 60% AcOEt в гептане) с получением белого осадка (1.9 г; 54%). m/z=420.2 [М+Н]+; 364.0 [M+H-tBu]+; 320.0 [М+Н-Вос]+.
С) (E)-(S)-19-хлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6(11),7,9,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Используя в качестве исходного вещества Пример 4В), соединение, указанное в заголовке, получили по аналогии с примером 1 с получением серо-белого осадка (3 мг; 2%). m/z=416.1973 [М+Н]+.
Пример 5
(Е)-(S)-19-хлор-5-оксо-17-окса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Используя в качестве исходного вещества Пример 4В), соединение, указанное в заголовке, получили по аналогии с примером 1 с получением серо-белого осадка (5 мг; 3%). m/z=450.1 [М+Н]+.
Пример 6
(E)-(S)-18-хлор-5-оксо-11,16-диокса-4-аза-трицикло[15.2.2.1*6,10*]докоза-1(20),6,8,10(22),13,17(21),18-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Используя в качестве исходного вещества Пример 4 В), соединение, указанное в заголовке, получили по аналогии с примером 1 с получением светло-желтого осадка (75 мг; 35%). m/z=450.1 [М+Н]+.
Пример 7
(S)-19-хлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-amide
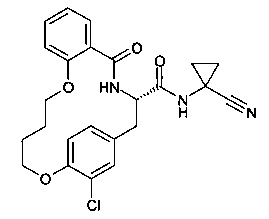
А) (S)-2-трет-Бутоксикарбониламино-3-(3-хлор-4-гидрокси-фенил)-пропионовой кислоты метиловый эфир
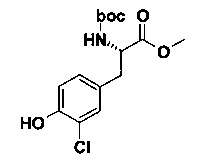
В 10 мл круглодонной колбе, (S)-2-(трет-бутоксикарбониламино)-3-(3-хлор-4-гидроксифенил)пропаноата дициклогексиламмониевую соль (300 мг, 604 мкмоль, Экв: 1.00) объединили с безводным ТГФ (2 мл) с получением белой суспензии. Добавили LiOH гидрат (38.4 мг, 905 мкмоль, Экв: 1.50) и смесь перемешивали в течение 30 мин при 25°C. Затем добавили Me2SO4 (80.1 мг, 60.7 мкл, 604 мкмоль, Экв: 1.00). Реакционную смесь нагрели до 80°C и перемешивали в течение 2 ч. После этого смесь перемешивали в течение 18 ч при 50°C. Неочищенную реакционную смесь сконцентрировали под вакуумом. Реакционную смесь влили в насыщенный водный раствор NaHCO3 и экстрагировали AcOEt (2х). Органические слои объединили и промыли солевым раствором (1х). Органические слои высушили над Na2SO4 и сконцентрировали под вакуумом. Неочищенное вещество очистили с помощью флеш-хроматографии (силикагель, 20 г, n-гептан/AcOEt 4/1, 3/1) с получением бесцветного масла (132 мг; 66%). m/z=330.2 [М+Н]+; 274.1[M+H-tBu]+; 230.2 [М+Н-Вос]+.
B) (S)-3-(4-Аллилокси-3-хлор-фенил)-2-трет-бутоксикарбониламино-пропионовой кислоты метиловый эфир

В 10 мл круглодонной колбе, (S)-метил 2-(трет-бутоксикарбониламино)-3-(3-хлор-4-гидроксифенил)пропаноат (120 мг, 364 мкмоль, Экв: 1.00) объединили с помощью ДХМ (4 мл) с получением бесцветного раствора. Основание Хунига (118 мг, 159 мкл, 910 мкмоль, Экв: 2.50) и 3-бромпроп-1-ен (54.5 мг, 39.0 мкл, 437 мкмоль, Экв: 1.20) добавили. Реакционную смесь нагрели до 40°C и перемешивали в течение 2 ч. После этого смесь нагревали в течение 20 ч при 40°C. Дополнительное количество аллил бромида (1.8 экв) добавили и смесь перемешивали в течение дополнительных 3 дней при 40°C. Реакционную смесь влили в водный 0.1 Μ HCl и экстрагировали с помощью ДХМ (2х). Органические слои объединили, промыли насыщенным водным раствором NaHCO3 (1х) и солевым раствором (1х). Органические слои высушили над Na2SO4 и сконцентрировали под вакуумом. Неочищенное вещество очистили с помощью флеш-хроматографии (силикагель, 20 г, n-гептан/AcOEt 4/1) с получением бесцветного масла (100 мг, 74%). m/z=370.2 [М+Н]+; 270.3 [М+Н-Вос]+.
C) (S)-3-(4-Аллилокси-3-хлор-фенил)-2-амино-пропионовой кислоты метиловый эфир

В 10 мл круглодонной колбе, (S)-метил 3-(4-(аллилокси)-3-хлорфенил)-2-(трет-бутоксикарбониламино)пропаноат (90 мг, 243 мкмоль, Экв: 1.00) объединили с муравьиной кислотой (1.12 г, 933 мкл, 24.3 ммоль, Экв: 100) и перемешивали при КТ в течение 3 ч. Неочищенную реакционную смесь сконцентрировали под вакуумом. Реакционную смесь нейтрализовали 5% водным Na2CO3 и экстрагировали с помощью ДХМ (3x). Органические слои объединили и высушили над Na2SO4 и сконцентрировали под вакуумом с получением бесцветного масла (68 мг; 100%). m/z=270.3 [М+Н]+; 292.1 [M+Na]+.
D) (S)-2-(2-Аллилокси-бензоиламино)-3-(4-аллилокси-3-хлор-фенил)-пропионовой кислоты метиловый эфир
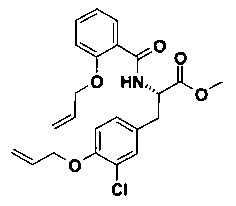
В 10 мл круглодонной колбе, (S)-метил 3-(4-(аллилокси)-3-хлорфенил)-2-аминопропаноат (65 мг, 241 мкмоль, Экв: 1.00) объединили с ДМФ (2 мл) с получением бесцветного раствора. Добавили 2-(аллилокси)бензойную кислоту (54.2 мг, 289 мкмоль, Экв: 1.20), HATU (183 мг, 482 мкмоль, Экв: 2.00) и основание Хунига (62.3 мг, 84.2 мкл, 482 мкмоль, Экв: 2.00). Реакционную смесь перемешивали при 22°C в течение 16 ч. Реакционную смесь влили в насыщенный водный раствор NaHCO3 и экстрагировали с помощью ДХМ (2х). Органические слои объединили, промыли 0.1 Μ водным HCl (1х), водой (3x), и солевым раствором (1х). Органические слои высушили над Na2SO4 и сконцентрировали под вакуумом. Неочищенное вещество очистили с помощью флеш-хроматографии (силикагель, 10 г, n-гептан/AcOEt 4/1) с получением светло-желтого масла (96 мг; 93%). m/z=430.2 [М+Н]+.
E) (Е)-(S)-19-хлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты метиловый эфир
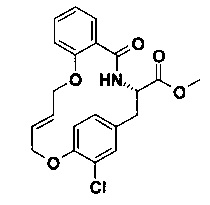
В 250 мл трехгорлышковой колбе катализатор Граббса II поколения (56.3 мг, 66.3 мкмоль, Экв: 0.30) объединили с безводным DCM (50 мл) с получением коричневого раствора. Реакционную смесь нагрели до 50°C (с обратным холодильником) в атмосфере аргона. По каплям добавили (S)-метил 3-(4-(аллилокси)-3-хлорфенил)-2-(2-(аллилокси)бензамидо)пропаноат (95 мг, 221 мкмоль, Экв: 1.00), растворенный в безводном ДХМ (30 мл). Реакционную смесь перемешивали при 50°C в течение 2 ч в атмосфере аргона. Реакционную смесь перемешивали в течение 1 ч при 50°C для ускорения завершения реакции. Неочищенную реакционную смесь сконцентрировали под вакуумом и очистили с помощью флеш-хроматографии (силикагель, 10 г, n-гептан/AcOEt 4/1, 3/1) с получением коричневого масла (42 мг; 47%). m/z=402.2 [М+Н]+.
F) (S)-19-хлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты метиловый эфир
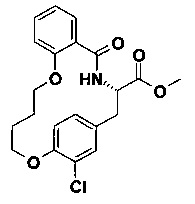
В 10 мл круглодонной колбе, Пример 7Е) (42 мг, 105 мкмоль, Экв: 1.00) объединили с AcOEt (2 мл) с получением коричневого раствора. Добавили Pd/C 10% (11.1 мг, 10.5 мкмоль, Экв: 0.10). Реакционную смесь перемешивали интенсивно при 22 °C в течение 2 ч в атмосфере водорода. Реакционную смесь отфильтровали через бумажный фильтр. Его промыли несколько раз AcOEt и растворитель эвапорировали досуха с получением черного масла (38 мг; 90%). m/z=404.3 [М+Н]+.
G) (S)-19-хлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновая кислота

В 10 мл круглодонной колбе, Пример 7F) (38 мг, 94.1 мкмоль, Экв: 1.00) объединили с ТГФ (1.5 мл) и водой (1 мл) с получением серого раствора. Гидрат гидроксида лития (4.79 мг, 113 мкмоль, Экв: 1.20) добавили. Реакционную смесь перемешивали при 22°C в течение 3 ч в атмосфере аргона. Неочищенную реакционную смесь сконцентрировали под вакуумом. Реакционную смесь влили в водную 1 Μ HCl до достижения рН=1-2 и затем экстрагировали с помощью ДХМ (4х). Органические слои высушили над Na2SO4 и сконцентрировали под вакуумом с получением коричневой смолы (35 мг; 95%). m/z=388.1 [М-Н]-.
Η) (S)-19-хлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

В 10 мл круглодонной колбе, Пример 7G) (35 мг, 89.8 мкмоль, Экв: 1.00) объединили с ДМФ (1 мл) с получением светло-коричневого раствора. Добавили HATU (68.3 мг, 180 мкмоль, Экв: 2.00), 1-аминоцикло-пропанкарбонитрила гидрохлорид (13.0 мг, 108 мкмоль, Экв: 1.20) и основание Хунига (40.6 мг, 54.9 мкл, 314 мкмоль, Экв: 3.50). Реакционную смесь перемешивали при 22°C в течение 20 ч. Реакционную смесь влили в насыщенный водный раствор NaHCO3 и экстрагировали с помощью ДХМ (2х). Органические слои объединили, промыли водой (3х) и солевым раствором (1х). Органические слои высушили над Na2SO4 и сконцентрировали под вакуумом. Неочищенное вещество очистили с помощью флеш-хроматографии (силикагель, 10 г, n-гептан/AcOEt 1/1) и препаративной ВЭЖХ с получением светло-коричневого порошка (11 мг; 27%). m/z=454.2 [М+Н]+.
Пример 8
(Е)-(S)-8-бромо-19-хлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

А) (S)-2-(2-Аллилокси-5-бромо-бензоиламино)-3-(4-аллилокси-3-хлор-фенил)-пропионовой кислоты метиловый эфир

Соединение получили по аналогии с примером 7D) с получением желтого масла (72%). m/z=510.0502 [М+Н]+.
B) (S)-2-(2-Аллилокси-5-бромо-бензоиламино)-3-(4-аллилокси-3-хлор-фенил)-пропионовая кислота

В 10 мл круглодонной колбе, Пример 8А) (140 мг, 275 мкмоль, Экв: 1.00) объединили с ТГФ (1.5 мл) и водой (1.5 мл) с получением бесцветного раствора. Гидрат гидроксида лития (14.0 мг, 330 мкмоль, Экв: 1.20) добавили. Реакционную смесь перемешивали при 22°C в течение 24 ч в атмосфере аргона. Неочищенную реакционную смесь сконцентрировали под вакуумом. После этого, смесь нейтрализовали с помощью водной HCl (1N) до достижения рН=1-2. После этого смесь экстрагировали четыре раза с помощью ДХМ. Органические слои высушили над Na2SO4 и сконцентрировали под вакуумом с получением желтого масла (148 мг; 100%). m/z=496.0 [М+Н]+.
C) 2-Аллилокси-N-[(S)-2-(4-аллилокси-3-хлор-фенил)-1-(1-циано-циклопропилкарбамоил)-этил]-5-бромо-бензамид

В 10 мл круглодонной колбе, Пример 8В) (140 мг, 283 мкмоль, Экв: 1.00) объединили с ДМФ (2 мл) с получением светло-желтого раствора. Добавили HATU (215 мг, 566 мкмоль, Экв: 2.00), 1-аминоциклопропанкарбонитрила гидрохлорид (40.3 мг, 340 мкмоль, Экв: 1.20) и основание Хунига (128 мг, 173 мкл, 990 мкмоль, Экв: 3.50). Реакционную смесь перемешивали при 22°C в течение 16 ч. Реакционную смесь влили в водный насыщенный раствор NaHCO3 и экстрагировали с помощью ДХМ (дважды). Органические слои объединили, промыли водой (3х) и солевым раствором (1х). Органические слои высушили над Na2SO4 и сконцентрировали под вакуумом. Неочищенное вещество очистили с помощью флеш-хроматографии (силикагель, 20 г, n-гептан/AcOEt 9/1, 4/1, 2/1) с получением желтого осадка (40 мг; 25%). m/z=560.0758 [М+Н]+.
D) (Е)-(S)-8-бромо-19-хлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

В 100 мл трехгорлышковой колбе, катализатор Граббса II поколения (16.4 мг, 19.3 мкмоль, Экв: 0.30) объединили с безводным ДХМ (15 мл) с получением коричневого раствора. Реакционную смесь нагрели до 50°C и по каплям добавили Пример 8С) (36 мг, 64.4 мкмоль, Экв: 1.00), растворенный в ДХМ (15 мл), очень медленно (25 мин). Реакционную смесь нагрели до 50°C и перемешивали в течение 2 ч. Неочищенную реакционную смесь сконцентрировали под вакуумом. Неочищенное вещество очистили с помощью флеш-хроматографии (силикагель, 10 г, n-гептан/AcOEt 2/1, 1/1) с получением коричневого осадка (18 мг, 53%). m/z=532.0 [М+Н]+.
Пример 9
(S)-8-бромо-19-хлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0%6,11&]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

В 10 мл круглодонной колбе, Пример 8D) (15 мг, 28.3 мкмоль, Экв: 1.00) объединили с этилацетатом (1 мл) с получением светло-коричневого раствора. Добавили Pd/C 10% (3.01 мг, 2.83 мкмоль, Экв: 0.10). Реакционную смесь перемешивали при 22°C в течение 4 ч в атмосфере Н2. Реакционную смесь отфильтровали через бумажный фильтр и промыли несколько раз AcOEt. Фильтрат сконцентрировали под вакуумом. Неочищенное вещество очистили с помощью флеш-хроматографии (силикагель, 5 г, n-гептан/AcOEt 2/1, 1/1, 1/2) с получением светло-коричневого осадка (8 мг; 53%). m/z=534.0 [М+Н]+.
Пример 10
(E)-(S)-8,19-дихлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Соединение, указанное в заголовке, получили по аналогии с примером 8 с получением коричневого осадка (22 мг; 45%). m/z=486.2 [М+Н]+.
Пример 11
(S)-8,19-дихлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Соединение, указанное в заголовке, получили по аналогии с примером 9 с получением коричневого осадка (9 мг; 56%). m/z=488.2 [М+Н]+.
Пример 12
(Е)-(S)-18-хлор-5-оксо-16-окса-4,10-диаза-трицикло[15.2.2.0*6,10*]геникоза-1(20),13,17(21),18-тетраен-3-карбоновой кислоты (1-циано-циклопропил)-амид

А) (S)-2-[(S)-2-(4-Аллипокси-3-хлор-фенил)-1-метоксикарбонил-этилкарбамоил]-пирролидин-1-карбоновой кислоты трет-бутиловый эфир

В 25 мл круглодонной колбе, (S)-1-(трет-бутоксикарбонил)пирролидин-2-карбоновую кислоту (279 мг, 1.3 ммоль, Экв: 1.00) и (5)-метил 3-(4-(аллилокси)-3-хлорфенил)-2-аминопропаноат (350 мг, 1.3 ммоль, Экв: 1.00) объединили с ДМФ (6 мл) с получением бесцветного раствора. Добавили HATU (986 мг, 2.59 ммоль, Экв: 2.00) и основание Хунига (335 мг, 453 мкл, 2.59 ммоль, Экв: 2.00). Реакционную смесь перемешивали при 25°C в течение 20 ч. Реакционную смесь влили в насыщенный водный раствор NaHCO3 и экстрагировали с помощью ДХМ (2х). Органические слои объединили, промыли водой (3х) и солевым раствором (1х). Органические слои высушили над Na2SO4 и сконцентрировали под вакуумом. Неочищенное вещество очистили с помощью флеш-хроматографии (силикагель, 20g, n-гептан/AcOEt 3/1, 2/1) с получением желтого масла (570 мг; 94%). m/z=467.2 [М+Н]+; 367.1 [М+Н-Вос]+.
B) (S)-3-(4-Аллилокси-3-хлор-фенил)-2-[((S)-пирролидин-2-карбонил)-амино]-пропионовой кислоты метиловый эфир

В 10 мл круглодонной колбе, Пример 12А) (570 мг, 1.22 ммоль, Экв: 1.00) объединили с муравьиной кислотой (5.62 г, 4.68 мл, 122 ммоль, Экв: 100). Реакционную смесь перемешивали при 25°C в течение 24 ч. Неочищенную реакционную смесь сконцентрировали под вакуумом. Реакционную смесь подщелачили с помощью водного раствора 5% Na2CO3 и экстрагировали с помощью ДХМ (4х). Органические слои высушили над Na2SO4 и сконцентрировали под вакуумом с получением желтого масла (328 мг; 73%). m/z=367.1 [М+Н]+.
C) (S)-3-(4-Аллилокси-3-хлор-фенил)-2-[((S)-1-бут-3-енил-пирролидин-2-карбонил)-амино]-пропионовой кислоты метиловый эфир
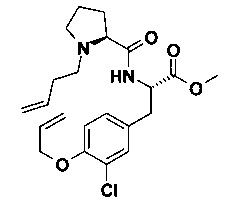
В 10 мл круглодонной колбе, Пример 12В) (312 мг, 851 мкмоль, Экв: 1.00) объединили с ацетонитрилом (6.00 мл) с получением светло-коричневого раствора. Добавили основание Хунига (132 мг, 178 мкл, 1.02 ммоль, Экв: 1.20) и 4-бромбут-1-ен (141 мг, 106 мкл, 1.02 ммоль, Экв: 1.20). Реакционную смесь перемешивали при 75°C в течение 24 ч. Неочищенную реакционную смесь сконцентрировали под вакуумом. Реакционную смесь влили в 5% водный раствор Na2CO3 и экстрагировали с помощью ДХМ (2х). Органические слои объединили, промыли водой (1х) и солевым раствором (1х). Органические слои высушили над Na2SO4 и сконцентрировали под вакуумом. Неочищенное вещество очистили с помощью флеш-хроматографии (силикагель, 20 г, n-гептан/AcOEt 3/1, 2/1, 1/1) с получением желтого масла (210 мг; 59%). m/z=421.1 [М+Н]+.
D) (E)-(S)-18-хлор-5-оксо-16-окса-4,10-диаза-трицикло[15.2.2.0*6,10*]геникоза-1(20),13,17(21),18-тетраен-3-карбоновой кислоты метиловый эфир

Пример 12С) (100 мг, 238 мкмоль, Экв: 1.00)) развели в безводном дегазированном ДХМ (10 мл) в атмосфере азота и добавили паратолуолсульфоновую кислоту (12% в уксусной кислоте) (682 мг, 637 мкл, 475 мкмоль, Экв: 2.00). Реакционную смесь перемешивали при 45°C в течение 30 мин. После этого, бесцветный раствор добавили по каплям с помощью шприца (15 мин) к коричневому раствору катализатора Граббса II поколения (60.5 мг, 71.3 мкмоль, Экв: 0.30), растворенному в безводном дегазированном ДХМ (80 мл) при кипении с обратным холодильником в атмосфере азота. Реакционную смесь перемешивали при 50°C в течение 2 ч. Реакционную смесь влили в водный раствор 5% Na2CO3 и экстрагировали с помощью ДХМ (3х). Органические слои высушили над Na2SO4 и сконцентрировали под вакуумом. Неочищенное вещество очистили с помощью флеш-хроматографии (силикагель, 20 г, ДХМ, ДХМ/МеОН 99/1, 98/2) с получением коричневой смолы (81 мг; 87%) в виде смеси эпимеров. m/z=393.1575 [М+Н]+ (смесь эпимеров).
E) (Е)-(S)-18-хлор-5-оксо-16-окса-4,10-диаза-трицикло[15.2.2.0*6,10*]геникоза-1(20),13,17(21),18-тетраен-3-карбоновая кислота с хлоридом лития
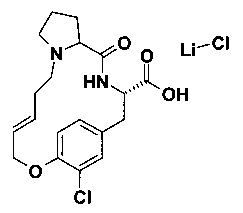
В 10 мл круглодонной колбе, Пример 12D) (80 мг, 204 мкмоль, Экв: 1.00) объединили с ТГФ (2 мл) и водой (2 мл) с получением коричневого раствора. Гидрат гидроксида лития (12.9 мг, 305 мкмоль, Экв: 1.50) добавили к этому раствору. Реакционную смесь перемешивали при 25°C в течение 4 ч. Неочищенную реакционную смесь сконцентрировали под вакуумом. Оставшуюся водную фазу нейтрализовали до рН=1-2 водной 1н HCl. Смесь эвапорировали досуха с получением коричневого осадка (91 мг; 100%). m/z=379.2 [М+Н]+.
F) (E)-(S)-18-хлор-5-оксо-16-оксо-4,10-диаза-трицикло[15.2.2.0*6,10*]геникоза-1(20),13,17(21),18-тетраен-3-карбоновой кислоты (1-циано-циклопропил)-амид

В 10 мл круглодонной колбе, Пример 12Е (90 мг) объединили с ДМФ (3 мл) с получением коричневого раствора. Добавили HATU (162 мг, 427 мкмоль, Экв: 2.00), 1-аминоциклопропанкарбонитрила гидрохлорид (31.0 мг, 256 мкмоль, Экв: 1.20) и основание Хунига (138 мг, 187 мкл, 1.07 ммоль, Экв: 5.00). Реакционную смесь перемешивали при 25°С в течение 16 ч. Реакционную смесь влили в насыщенный водный раствор NaHCO3 и экстрагировали с помощью ДХМ (2х). Органические слои объединили, промыли водой (3х) и солевым раствором (1х). Органические слои высушили над Na2SO4 и сконцентрировали под вакуумом. Неочищенное вещество очистили с помощью флеш-хроматографии (силикагель, 10 г, ДХМ/МеОН 99/1, 98/2) и препаративной ВЭЖХ с получением желтого осадка (7 мг; 8%). m/z=443.4 [М+Н]+.
Пример 13
(Е)-(3S,8S)-18-хлор-8-фтор-5-оксо-16-окса-4,10-диаза-трицикло[15.2.2.0*6,10*]геникоза-1(20),13,17(21),18-тетраен-3-карбоновой кислоты (1-циано-циклопропил)-амид

А) (2S,4S)-1-But-3-енил-4-фтор-пирролидин-2-карбоновой кислоты метиловый эфир

В 25 мл круглодонной колбе, (2S,4S)-метил 4-фторпирролидин-2-карбоксилата гидрохлорид (160 мг, 871 мкмоль, Экв: 1.00) объединили с ацетонитрилом (3 мл) с получением белой суспензии. Основание Хунига (282 мг, 380 мкл, 2.18 ммоль, Экв: 2.50) и 4-бромбут-1-ен (144 мг, 108 мкл, 1.05 ммоль, Экв: 1.20) добавили последовательно. Реакционную смесь перемешивали при 70°C в течение 2 дней. Неочищенную реакционную смесь сконцентрировали под вакуумом. Реакционную смесь влили в водный раствор 5% Na2CO3 и экстрагировали с помощью ДХМ (2х). Органические слои объединили, промыли солевым раствором (1х), органические слои высушили над Na2SO4 и сконцентрировали под вакуумом с получением желтой жидкости (160 мг; 91%). m/z=202.2 [М+Н]+.
B) (2S,4S)-1-бут-3-енил-4-фтор-пирролидин-2-кар6оновая кислота; соединение с хлоридом лития
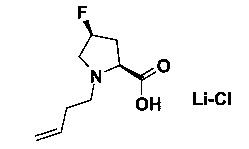
В 10 мл круглодонной колбе, Пример 13А) (150 мг, 745 мкмоль, Экв: 1.00) объединили с ТГФ (1.5 мл) и водой (1.5 мл). Добавили гидрат гидроксида лития (37.9 мг, 894 мкмоль, Экв: 1.20). Реакционную смесь перемешивали при 25°C в течение 16 ч. Неочищенную реакционную смесь сконцентрировали под вакуумом и подкислили водной 1 н HCl до достижения рН=1.5. Неочищенный продукт эвапорировали досуха с получением светло-коричневого масла (237 мг; 97%). m/z=188.2 [М+Н]+.
C) (S)-3-(4-Аллилокси-3-хлор-фенил)-2-трет-бутоксикарбониламино-пропионовая кислота

В 25 мл круглодонной колбе, Пример 7В) (308 мг, 833 мкмоль, Экв: 1.00) объединили с ТГФ (3 мл) и водой (5.00 мл) с получением бесцветного раствора. Гидрат гидроксида лития (42.4 мг, 0.999 ммоль, Экв: 1.20) добавили. Реакционную смесь перемешивали в течение 2 ч при 25°C. Неочищенную реакционную смесь сконцентрировали под вакуумом. Затем реакционную смесь подкислили до рН=1 с помощью водного раствора 1 н HCl. Смесь экстрагировали с помощью ДХМ (4х).Органические слои высушили над Na2SO4 и сконцентрировали под вакуумом с получением белой смолы (286 мг; 97%). m/z=354.3 [М+Н]+.
D) [(S)-2-(4-Аллилокси-3-хлор-фенил)-1-(1-циано-циклопропилкарбамоил)-этил]-карбаминовой кислоты трет-бутиловый эфир

В 25 мл круглодонной колбе, Пример 13С) (285 мг, 801 мкмоль, Экв: 1.00) объединили с ДМФ (6 мл) с получением бесцветного раствора. Добавили HATU (609 мг, 1.6 ммоль, Экв: 2.00), 1-амино-циклопропанкарбонитрила гидрохлорид (115 мг, 961 мкмоль, Экв: 1.20) и основание Хунига (362 мг, 490 мкл, 2.8 ммоль, Экв: 3.50). Реакционную смесь перемешивали при 25°C в течение 16 ч. Реакционную смесь влили в водный насыщенный раствор NaHCO3 и экстрагировали с помощью ДХМ (2х). Органические слои объединили, промыли водой (3х) и солевым раствором (1х). Органические слои высушили над Na2SO4 и сконцентрировали под вакуумом. Неочищенное вещество очистили с помощью флеш-хроматографии (силикагель, 20 г, n-гептан/AcOEt 3/1, 2/1) с получением серо-белого осадка (318 мг; 95%). m/z=420.2 [М+Н]+.
E) (S)-3-(4-Аллилокси-3-хлор-фенил)-2-амино-N-(1-циано-циклопропил)-пропионамид
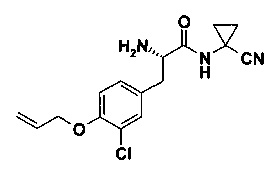
В 10 мл круглодонной колбе, Пример 13D) (300 мг, 714 мкмоль, Экв: 1.00) объединили с муравьиной кислотой (3.29 г, 2.74 мл, 71.4 ммоль, Экв: 100). Реакционную смесь перемешивали при 25°C в течение 16 ч. Неочищенную реакционную смесь сконцентрировали под вакуумом. Реакционную смесь влили в водный раствор 5% Na2CO3 и экстрагировали с помощью ДХМ (4х). Органические слои высушили над Na2SO4 и сконцентрировали под вакуумом с получением желтой смолы (220 мг; 96%). m/z=320.1 [М+Н]+.
F) (S)-1-бут-3-енил-4-фтор-пирролидин-2-кар6оновой кислоты [(S)-2-(4-аллилокси-3-хлор-фенил)-1-(1-циано-циклопропилкарбамоил)-этил]-амид
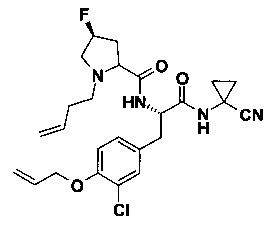
В 10 мл круглодонной колбе, Пример 13В) (164 мг, 497 мкмоль, Экв: 1.50) объединили с ДМФ (3 мл). Добавили HATU (252 мг, 663 мкмоль, Экв: 2.00), Пример 13Е) (106 мг, 331 мкмоль, Экв: 1.00) и основание Хунига (150 мг, 203 мкл, 1.16 ммоль, Экв: 3.50). Реакционную смесь перемешивали при 25°C в течение 16 ч. Реакционную смесь влили в насыщенный водный раствор NaHCO3 и экстрагировали с помощью ДХМ (2х). Органические слои объединили, промыли водой (3х) и насыщенным NaCl (1х). Органические слои высушили над Na2SO4 и сконцентрировали под вакуумом. Неочищенное вещество очистили с помощью флеш-хроматографии (силикагель, 20 г, ДХМ/МеОН 98/2) с получением желтого масла (119 мг; 73%) в виде смеси эпимеров. m/z=489.2 [М+Н]+.
G) (Е)-(3S,8S)-18-хлор-8-фтор-5-оксо-16-окса-4,10-диаза-трицикло[15.2.2.0*6,10*]геникоза-1(20),13,17(21),18-тетраен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Соединение, указанное в заголовке, получили по аналогии с примером 12D) с получением желтой смолы (3.5 мг; 4%) в виде смеси эпимеров. m/z=461.3 [М+Н]+.
Пример 14
(E)-(S)-18-хлор-8,8-дифтор-5-оксо-16-окса-4,10-диаза-трицикло[15.2.2.0*6,10*]геникоза-1(20),13,17(21),18-тетраен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Соединение, указанное в заголовке, получили по аналогии с примером 13 с получением желтого масла (7 мг; 13%) в виде смеси эпимеров. m/z=479.1647 [М+Н]+.
Пример 15
(Е)-(S)-18-хлор-8,8-диметил-5-оксо-16-окса-4,10-диаза-трицикло[15.2.2.0*6,10*]геникоза-1(20),13,17(21),18-тетраен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Соединение, указанное в заголовке, получили по аналогии с примером 13 с получением желтого масла (7 мг; 13%) в виде смеси эпимеров. m/z=471.2156 [М+Н]+.
Пример 16
(Е)-(S)-19-хлор-8-метокси-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Соединение, указанное в заголовке, получили по аналогии с примером 8 с получением коричневого осадка (49 мг; 52%). m/z=482.3 [М+Н]+.
Пример 17
(S)-19-хлор-8-метокси-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Соединение, указанное в заголовке, получили по аналогии с примером 9 с получением серо-белого осадка (23 мг; 64%). m/z=484.4 [М+Н]+.
Пример 18
(E)-(S)-19-хлор-9-метокси-5-оксо-17-окса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид
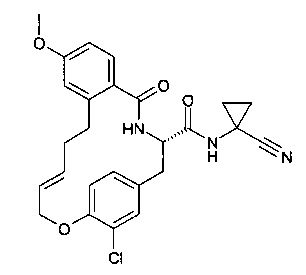
Соединение, указанное в заголовке, получили по аналогии с примером 8 с использованием в качестве исходного вещества 2-(бут-3-енил)-4-метоксибензойной кислоты с получением коричневого осадка (43 мг; 48%). m/z=480.2 [М+Н]+.
Пример 19
(E)-(S)-19-хлор-9-метил-5-оксо-17-окса-12-тиа-4,10-диаза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Соединение, указанное в заголовке, получили по аналогии с примером 8 с использованием в качестве исходного вещества 2-(аллилтио)-6-метилникотиновой кислоты, за исключением макроциклизации: В 10 мл круглодонной колбе, (S)-N-(3-(4-(аллилокси)-3-хлорфенил)-1-(1-цианоциклопропиламино)-1-оксопропан-2-ил)-2-(аллилтио)-6-метилникотинамид (50 мг, 97.8 мкмоль, Экв: 1.00) объединили с безводным дегазированным ДХМ (50 мл) в атмосфере аргона и добавили изопропоксид титана (IV) (16.7 мг, 17.2 мкл, 58.7 мкмоль, Экв: 0.60). Этот раствор добавили по каплям (20 мин) в раствор катализатора Граббса II поколения (24.9 мг, 29.4 мкмоль, Экв: 0.30), растворенного в безводном дегазированном ДХМ (35 мл) в атмосфере аргона при 50°C (с обратным холодильником). После добавления реакционную смесь нагрели до 50°C и перемешивали в течение 3 дней в атмосфере аргона. Неочищенное вещество очистили с помощью флеш-хроматографии (силикагель, 20 г, n-гептан/AcOEt 2/1, 1/1) с получением коричневого осадка (4 мг; 6%). m/z=483.0 [М+Н]+.
Пример 20
(Е)-(S)-19-хлор-5-оксо-9-трифторметил-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

A) 2-(Аллилокси)-4-(трифторметил)бензойная кислота

В 25 мл круглодонной колбе, 2-гидрокси-4-(трифторметил)бензойную кислоту (300 мг, 1.46 ммоль, Экв: 1.00) объединили с ацетонитрилом (3.00 мл). K2CO3 (503 мг, 3.64 ммоль, Экв: 2.50) и добавили 3-бромпроп-1-ен (454 мг, 325 мкл, 3.64 ммоль, Экв: 2.50). Реакционную смесь нагрели до 80°C и перемешивали в течение 3 ч. Растворитель эвапорировали. Неочищенную реакционную смесь влили в воду и экстрагировали с помощью ДХМ (2х). Органические слои высушили над Na2SO4 и сконцентрировали под вакуумом. 2-аллилокси-4-трифторметил-бензойной кислоты аллиловый эфир (433 мг) был получен. Неочищенный бисалкилированный продукт объединили с этанолом (2.5 мл) и водой (0.5 мл) и добавили гидроксид натрия (116 мг, 2.91 ммоль, Экв: 2.00). Реакционную смесь нагрели до 80°C и перемешивали в течение 16 ч. Неочищенную реакционную смесь сконцентрировали под вакуумом. Реакционную смесь обработали водным раствором 1 Μ HCl до достижения рН=1-2. После этого, смесь экстрагировали с помощью ДХМ (3х). Органические слои высушили над Na2SO4 и сконцентрировали под вакуумом с получением светло-желтого осадка (296 мг; 83% две стадии), m/z=245.2 [М-Н]-.
B) Е)-(S)-19-хлор-5-оксо-9-трифторметил-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Соединение, указанное в заголовке, получили по аналогии с примером 8, используя в качестве исходного вещества Пример 20А), с получением коричневого осадка (112 мг; 49%). m/z=520.2 [М+Н]+.
Пример 21
(E)-(S)-19-хлор-5-оксо-17-окса-4,12-диаза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Соединение, указанное в заголовке, получили по аналогии с примером 19 с использованием в качестве исходного вещества 2-аллиламино-бензойной кислоты с получением светло-серого осадка (5 мг; 9%). m/z=451.0 [М+Н]+.
Пример 22
(S)-19-хлор-9-метокси-5-оксо-17-окса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Соединение, указанное в заголовке, получили по аналогии с примером 9, используя в качестве исходного вещества Пример 18, с получением серо-белого осадка (10 мг; 33%). m/z=482.3 [М+Н]+.
Пример 23
(S)-19-хлор-5-оксо-9-трифторметил-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Соединение, указанное в заголовке, получили по аналогии с примером 9, используя в качестве исходного вещества Пример 20, с получением серого осадка (20 мг; 22%). m/z=522.3 [М+Н]+.
Пример 24
(E)-(S)-19-йодо-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид
Соединение, указанное в заголовке, получили по аналогии с примером 4 с получением коричневого осадка (130 мг; 41%) в виде смеси атропизомеров. m/z=544.1 [М+Н]+.
Пример 25
(Е)-(S)-19-йодо-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид, стереоось R
Соединение, указанное в заголовке, получили после хиральной хроматографии с получением серо-белого осадка (2 мг; 17%). m/z=544.1 [М+Н]+.
Пример 26
(E)-(S)-19-йодо-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид, стереоось S

Соединение, указанное в заголовке, получили после хиральной хроматографии с получением серо-белого осадка (2 мг; 17%). m/z=544.1 [М+Н]+.
Пример 27
(3Е,12S)-22-хлор-N-(1-цианоциклопропил)-14-оксо-2,5,11,12,13,14,16,17,18,19-декагидро-7,10-этенонафто[2,3-b][1,12,5]диоксазациклогексадецин-12-карбоксамид

Соединение, указанное в заголовке, получили по аналогии с примером 20 с использованием в качестве исходного вещества 3-гидрокси-5,6,7,8-тетрагидро-нафтален-2-карбоновой кислоты с получением коричневого осадка (58 мг; 33%). m/z=506.2 [М+Н]+.
Пример 28
(Е)-(S)-8-хлор-19-йод-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Соединение, указанное в заголовке, получили по аналогии с примером 20 с использованием в качестве исходного вещества 2-аллилокси-4-хлор-бензойной кислоты с получением коричневого осадка (62 мг; 55%). m/z=578.2 [М+Н]+.
Пример 29
(12S)-22-хлор-N-(1-цианоциклопропил)-14-оксо-2,3,4,5,11,12,13,14,16,17,18,19-додекагидро-7,10-этенонафто[2,3-b][1,12,5]диоксазациклогексадецин-12-карбоксамид

Соединение, указанное в заголовке, получили по аналогии с примером 9, используя в качестве исходного вещества Пример 27, с получением светло-коричневого осадка (20 мг; 50%). m/z=508.3 [М+Н]+.
Пример 30
(S)-19-йодо-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6(11),7,9,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Пример 24 (20 мг, 36.8 мкмоль, Экв: 1.00) и никель Ренея (9.99 мг, 79.1 мкмоль, Экв: 2.15) объединили с этилацетатом (2 мл) и перемешивали в атмосфере водорода при 50°C и давлении 10 бар в течение 20 ч. Неочищенную реакционную смесь отфильтровали и эвапорировали досуха с получением светло-коричневого осадка (17 мг; 68%) в виде смеси атропизомеров. m/z=544.0741 [М+Н]+.
Пример 31
(S)-8-хлор-19-йод-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6(11),7,9,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Соединение, указанное в заголовке, получили по аналогии с примером 30, используя в качестве исходного вещества Пример 24 с получением светло-коричневого осадка (17 мг; 68%) в виде смеси атропизомеров. m/z=578.0352 [М+Н]+.
Пример 32
(E)-(S)-19-хлор-8-фтор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Соединение, указанное в заголовке, получили по аналогии с примером 20 с использованием в качестве исходного вещества 5-фтор-2-гидрокси-бензойной кислоты с получением коричневого осадка (98 мг; 57%). m/z=470.4 [М+Н]+.
Пример 33
(E)-(S)-9,19-дихлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид
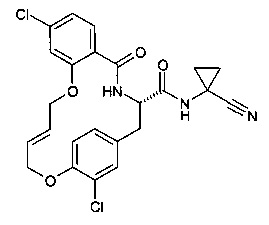
Соединение, указанное в заголовке, получили по аналогии с примером 20 с использованием в качестве исходного вещества 2-аллилокси-4-хлор-бензойной кислоты с получением коричневого осадка (92 мг; 41%). m/z=486.3 [М+Н]+.
Пример 34
(E)-(S)-19-хлор-5-оксо-8-трифторметил-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Соединение, указанное в заголовке, получили по аналогии с примером 20 с использованием в качестве исходного вещества 2-аллилокси-5-трифторметил-бензойной кислоты с получением коричневого осадка (92 мг; 36%). m/z=520.3 [М+Н]+.
Пример 35
(S)-19-хлор-8-фтор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амид
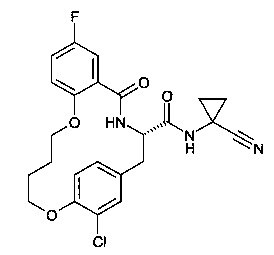
Соединение, указанное в заголовке, получили по аналогии с примером 9, используя в качестве исходного вещества Пример 32, с получением светло-коричневого осадка (20 мг; 62%). m/z=472.3 [М+Н]+.
Пример 36
(S)-9,19-дихлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Соединение, указанное в заголовке, получили по аналогии с примером 9, используя в качестве исходного вещества Пример 33, с получением светло-коричневого осадка (29 мг; 72%). m/z=488.2 [М+Н]+.
Пример 37
(S)-19-хлор-5-оксо-8-трифторметил-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Соединение, указанное в заголовке, получили по аналогии с примером 9, используя в качестве исходного вещества Пример 34, с получением светло-коричневого осадка (39 мг; 86%). m/z=522.4 [М+Н]+.
Пример 38
(E)-(S)-8-бромо-19-хлор-5-оксо-17-окса-4,12-диаза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид
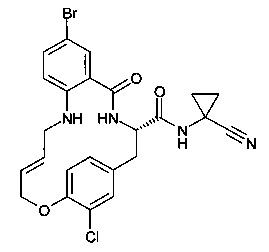
Соединение, указанное в заголовке, получили по аналогии с примером 19 с использованием в качестве исходного вещества 2-аллиламино-5-бромо-бензойной кислоты с получением светло-коричневого осадка (8 мг; 4%). m/z=531.0610 [М+Н]+.
Пример 39
3-[(E)-(S)-19-хлор-3-(1-циано-циклопропилкарбамоил)-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-heptaen-8-ил]-азетидин-1-карбоновой кислоты трет-бутиловый эфир

A) 3-(4-Аллилокси-3-карбокси-фенил)-азетидин-1-карбоновой кислоты трет-бутиловый эфир
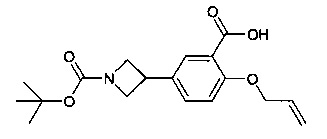
Пример 39А) получили по аналогии с примером 20А) с использованием в качестве исходного вещества коммерчески доступного 3-(3-карбокси-4-гидрокси-фенил)-азетидин-1-карбоновой кислоты трет-бутилового эфира с получением соединения, указанного в заголовке, в виде светло-желтого масла (18 мг; 100%). m/z=332.3 [М-Н]-.
B) 3-[(Е)-(S)-19-хлор-3-(1-циано-циклопропилкарбамоил)-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-8-ил]-азетидин-1-карбоновой кислоты трет-бутиловый эфир

Пример 39В получили по аналогии со способами, описанными в примерах 8C-D), используя в качестве исходных веществ Пример 13Е) и Пример 39А) с получением соединения, указанного в заголовке, в виде коричневого осадка (104 мг; 50%). m/z=607.2 [М+Н]+.
Пример 40
(Е)-(S)-19-хлор-8-циано-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Пример 40 получили по аналогии со способами, описанными в примерах 8C-D), используя в качестве исходного вещества Пример 13Е) и 2-аллилокси-5-циано-бензойную кислоту (полученную по аналогии с примером 20А)) с получением соединения, указанного в заголовке, в виде коричневого осадка (104 мг; 50%). m/z=607.2 [М+Н]+.
Пример 41
(Е)-(S)-8-азетидин-3-ил-19-хлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

В 5 мл кругло-донной колбе Пример 39В) (20 мг, 32.9 мкмоль, Экв: 1.00) объединили с муравьиной кислотой (227 мг, 190 мкл, 4.94 ммоль, Экв: 150). Реакционную смесь перемешивали при 22°C в течение 2 ч. Реакционную смесь погасили водным раствором 5% Na2CO3 до достижения рН=10-12 и экстрагировали с помощью ДХМ (4×50 мл). Органические слои высушили над Na2SO4 и сконцентрировали под вакуумом.
Неочищенное вещество очистили с помощью флеш-хроматографии (силикагель, 5 г, ДХМ/МеОН 98/2, 9/1, ДХМ/MeOH/NH4OH 90/9/1) с получением соединения, указанного в заголовке, в виде светло-коричневого осадка (10 мг; 60%). m/z=507.3 [М+Н]+.
Пример 42
3-[(S)-19-хлор-3-(1-циано-циклопропилкарбамоил)-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-8-ил]-азетидин-1-карбоновой кислоты трет-бутиловый эфир

Пример 42 получили по аналогии с примером 9 с получением соединения, указанного в заголовке, в виде коричневого осадка в виде смеси атропизомеров (68 мг; 94%). m/z=609.2 [М+Н]+.
Пример 43
(S)-8-азетидин-3-ил-19-хлор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Пример 43 получили по аналогии с примером 41, используя в качестве исходного вещества Пример 42 с получением соединения, указанного в заголовке, в виде белого осадка в виде смеси атропизомеров (22 мг; 53%). m/z=509.4 [М+Н]+.
Пример 44
(E-Z)-(S)-19-хлор-8,10-дифтор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Пример 44 получили по аналогии со способами, описанными в примерах 8C-D), используя в качестве исходного вещества Пример 13Е) и 2-аллилокси-3,5-дифтор-бензойную кислоты (полученную по аналогии с примером 20А)) с получением соединения, указанного в заголовке, в виде коричневого осадка (13 мг; 8%). m/z=488.1 [М+Н]+.
Пример 45
(Е)-(S)-19-хлор-7,8-дифтор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Пример 45 получили по аналогии со способами, описанными в примерах 8C-D), используя в качестве исходного вещества Пример 13Е) и 6-аллилокси-2,3-дифтор-бензойную кислоту (полученную по аналогии с примером 20А)) с получением соединения, указанного в заголовке, в виде коричневого осадка (41 мг; 25%). m/z=488.2 [М+Н]+.
Пример 46
(Z)-(S)-19-хлор-7,8-дифтор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Пример 46 получили в виде побочного продукта реакции во время синтеза Примера 45 с получением соединения, указанного в заголовке, в виде коричневого осадка (24 мг; 15%). m/z=488.2 [М+Н]+.
Пример 47
(E)-(S)-19-хлор-8-метилсульфанил-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Пример 47 получили по аналогии со способами, описанными в примерах 8C-D), используя в качестве исходного вещества Пример 13Е) и 2-аллилокси-5-метилсульфанил-бензойную кислоту (полученную по аналогии с примером 20А)) с получением соединения, указанного в заголовке, в виде коричневого осадка (58 мг; 54%). m/z=498.2 [М+Н]+.
Пример 48
(E)-(S)-10,19-дихлор-8-фтор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,14,18(22),19-гептаен-3-карбоновой кислоты (1-циано-циклопропил)-амид
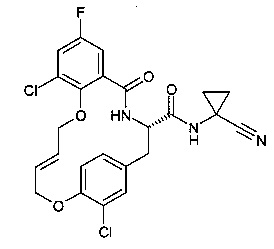
Пример 48 получили по аналогии со способами, описанными в примерах 8C-D), используя в качестве исходного вещества Пример 13Е) и 2-аллилокси-3-хлор-5-фтор-бензойную кислоту (полученную по аналогии с примером 20А)) с получением соединения, указанного в заголовке, в виде смеси атропизомеров и в виде коричневого осадка (5 мг; 3%). m/z=504.1 [М+Н]+.
Пример 49
(S)-19-хлор-8-циано-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Пример 49 получили по аналогии с примером 9, используя в качестве исходного вещества Пример 40, с получением соединения, указанного в заголовке, в виде коричневого осадка (6 мг; 45%). m/z=477.1343 [М-Н]-.
Пример 50
(S)-19-хлор-7,8-дифтор-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Пример 50 получили по аналогии с примером 9, используя в качестве исходного вещества Пример 45, с получением соединения, указанного в заголовке, в виде коричневого осадка в виде смеси атропизомеров (18 мг; 45%). m/z=490.1339 [М+Н]+.
Пример 51
(S)-19-хлор-8-метилсульфанил-5-оксо-12,17-диокса-4-аза-трицикло[16.2.2.0*6,11*]докоза-1(21),6,8,10,18(22),19-гексаен-3-карбоновой кислоты (1-циано-циклопропил)-амид

Пример 51 получили по аналогии с примером 9, используя в качестве исходного вещества Пример 47, с получением соединения, указанного в заголовке, в виде коричневого осадка в виде смеси атропизомеров (3.3 мг; 9%). m/z=500.1404 [М+Н]+.
Пример 52
Ферментативный анализ ингибирования катепсина
Ферментативная активность измерялась наблюдением увеличения интенсивности флуоресценции, вызванной расщеплением пептидного субстрата, содержащего флуорофор, излучение которого гасилось интактным пептидом.
Буфер для анализа: 100 мМ фосфат калия рН 6.5, ЭДТА-Na 5 мМ, Triton X-1000.001%, DDT 5 мМ.
Ферменты (все 1 нМ): Катепсин S человека и мыши, Cat К, Cat В, Cat L
Субстрат (20 мкМ): Z-Val-Val-Arg-AMC, за исключением Cat К, для которого использовали Z-Leu-Arg-AMC (оба от компании Bachem).
Ζ = Безилоксикарбонил.
АМС = 7-амино-4-метил-кумарин.
Конечный объем: 100 мкл.
Возбуждение 360 нм, Излучение 465 нм.
Фермент добавили к разведениям соединений в 96-луночном микротитровальном планшете и реакция с субстратом началась. Излучение флуоресценции измеряли через 20 минут, в течение этого времени наблюдалось линейное увеличение при отсутствии ингибитора. Значения IC50 подсчитывались стандартными способами. Результаты выражены в мкМ в данной ниже таблице.
В вышеуказанном анализе, соединения по настоящему изобретению обладали значениями IC50 для Катепсина L между 0.00001 и 200 мкМ. Значения IC50 для некоторых конкретных соединений находятся между 0.00001 и 100 мкМ, более конкретно между 0.00001 и 80 мкМ.
Кроме того, некоторые соединения по изобретению обладают селективностью для ингибирования Катепсина L относительно других катепсинов, и, в частности, относительно Катепсина S, более чем в 10 раз.
Полученные для некоторых соединений результаты формулы (I) в вышеприведенном анализе Катепсина L показаны в следующей таблице.



Активный ингредиент просеивают и смешивают с микрокристаллической целлюлозой и смесь гранулируют с раствором поливинилпирролидона в воде. Гранулят затем смешивают с карбоксиметилкрахмалом натрия и стеаратом магния и прессуют с получением ядер 120 или 350 мг соответственно. Ядра покрывают водным раствором/суспензией вышеупомянутого пленочного покрытия.

Компоненты просеяли, смешали и заполнили ими капсулы размера 2.

Активный ингредиент растворяют в смеси полиэтиленгликоля 400 и воды для инъекций (часть). РН доводят до 5,0 добавлением уксусной кислоты. Объем доводят до 1,0 мл добавлением оставшегося количества воды. Раствор фильтруют, разливают в ампулы с использованием соответствующего оборудования и стерилизуют.
Реферат
Изобретение относится к соединению формулы (I), а также к фармацевтическим композициям на его основе и к применению для лечения или профилактики диабета, диабетической ретинопатии, диабетической нейропатии, атеросклероза, аневризмы брюшной аорты, хронической болезни почек и опухолей. Технический результат: соединение формулы (I) может быть применено в качестве лекарственного средства. 4 н. и 13 з.п. ф-лы, 1 табл., 52 пр.
Формула


Документы, цитированные в отчёте о поиске
1-цианоциклопропильные производные в качестве ингибиторов катепсина к
Макроциклические соединения для применения в качестве ингибиторов васе

Комментарии