Бициклическое соединение - RU2640416C2
Код документа: RU2640416C2
Описание
Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к бициклическому соединению, характеризующемуся гемнезависимой активирующей функцией в отношении растворимой гуанилатциклазы, и к фармацевтическому средству, содержащему такое соединение.
Предпосылки создания настоящего изобретения
Растворимая гуанилатциклаза (sGC) представляет собой фермент, который продуцирует циклический гуанозинмонофосфат (cGMP) из гуанозинтрифосфата (GTP), и который включает в себя димер α-субъединицы и β-субъединицы. β-субъединица связывает гем и для получения инактивированной структуры координированное с гемом железо обычно взаимодействует с остатком гистидина, являющимся 105-м остатком аминокислоты. Известно, что монооксид азота (NO) представляет собой основной стимулирующий sGC фактор in vivo, и согласно взаимодействию с гемовым железом, которое находится в β-субъединице sGC, и разобщению взаимодействия между гемовым железом и остатком гистидина в β-субъединице, он способствует преобразованию в активированную форму. Затем, cGMP, продуцированный активированной sGC, активирует, например, протеинкиназу или ионный канал, играющие различные роли, включая расслабление гладкой мускулатуры сосудов, супрессирование активации тромбоцитов, супрессирование пролиферации клеток и передачу нейронами обонятельных сигналов. При патологическом состоянии активность sGC снижена, и происходит декомпозиция sGC, супрессирующая cGMP систему и приводящая тем самым, например, к сокращению гладкой мускулатуры сосудов, активации тромбоцитарной или пролиферации клеток. В конечном итоге, это может вызвать, например, артериальную гипертензию, легочную гипертензию, сердечную недостаточность, нарушение эндотелиальной функции, атеросклероз, заболевание периферических сосудов, стенокардию, тромбоз, инфаркт миокарда, эректильную дисфункцию или нарушение почечной функции (непатентные документы 1 и 2).
Для активации sGC в клинической практике широко используют нитраты, такие как нитроглицерин. Они индуцируют активацию sGC путем обеспечения экзогенного NO и проявляют тем самым фармацевтический эффект. Однако известно, что в дополнение к побочным эффектам к нитратным средствам имеется толерантность, что является значимой проблемой для фармацевтического средства. Было предположено, что толерантность к нитратным средствам основана на механизме снижения активности митохондриальной альдегиддегидрогеназы, участвующей в высвобождении NO, отличном от sGC (непатентный документ 3). Поэтому, к соединению, напрямую активирующему sGC и не связанному с высвобождением NO, может не иметься толерантности. Кроме того, было продемонстрировано, что в условиях болезненного состояния, такого как старение, гипертензия, сахарный диабет или гиперлипидемия, окисление гемового железа или декомпозиция гема усиливается оксидативным стрессом, что предупреждает взаимодействие между NO и гемом, а потому нельзя ожидать значительной активации sGC (непатентный документ 4). В качестве отличного от NO стимулирующего sGC средства известен гемзависимый прямой стимулятор sGC, представленный риоцигуатом (патентный документ 1). Такие соединения могут активировать sGC независимо от NO, однако описано, что они не могут полностью проявить активирующее sGC свойство в условиях окисления гемового железа (непатентный документ 5). Таким образом, считается, что в противоположность NO или риоцигуату, соединение, характеризующееся способностью напрямую активировать sGC независимо от состояния окисления гема, будет эффективно для лечения или профилактики различных нарушений, таких как гипертензия, легочная гипертензия, сердечная недостаточность, нарушение эндотелиальной функции, атеросклероз, заболевание периферических сосудов, стенокардия, тромбоз, инфаркт миокарда, эректильная дисфункция и нарушение функции почек.
В качестве соединения, характеризующегося способностью напрямую активировать sGC независимо от состояния окисления гема, в патентном документе 2 раскрыты цинацигуат и его производные, в патентном документе 3 раскрыты производные пиразола, триазола, в патентном документе 4 раскрыты 2,6-дизамещенные пиридиновые производные, и в патентном документе 5 раскрыты гетероциклические производные.
Перечень цитированных документов
Патентные документы
Патентный документ 1: WO 2003/095451 A.
Патентный документ 2: WO 2001/019780 A.
Патентный документ 3: WO 2009/032249 A.
Патентный документ 4: WO 2009/071504 A.
Патентный документ 5: WO 2009/123316 A.
Непатентные документы
Непатентный документ 1: Handbook of Experimental Pharmacology, Germany, Springer-Verlag, 2009, Vol.191, p.309-339.
Непатентный документ 2: Handbook of Experimental Pharmacology, Germany, Springer-Verlag, 2009, Vol.191, p.277-308.
Непатентный документ 3: The Journal of Clinical Investigation, USA, American Society for Clinical Investigation, 2004, Vol. 113, p. 352-354.
Непатентный документ 4: The Journal of Clinical Investigation, USA, American Society for Clinical Investigation, 2006, Vol. 116, p. 2552-2561.
Непатентный документ 5: European Respiratory Journal, Switzerland, European Respiratory Society, 2008, Vol. 32, p. 881-891.
КРАТКОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Задачи, подлежащие решению настоящим изобретением
Целью настоящего изобретения является предоставление нового соединения, которое характеризуется гемнезависимой активирующую функцию в отношении растворимой гуанилатциклазы и которое применимо в качестве фармацевтического продукта.
Способы решения задачи
В сложившихся обстоятельствах, авторы настоящего изобретения синтезировали различные соединения и оценивали их, используя в качестве индикатора функцию активации растворимой гуанилатциклазы. В результате было обнаружено, что соединение со структурой, в которой бициклическое соединение связано с атомом азота, характеризуется высокой гем-независимостью, превосходной способностью активировать растворимую гуанилатциклазу и применимо в качестве фармацевтического средства для профилактики или лечения различных нарушений, которые связаны с растворимой гуанилатциклазой, и, соответственно, авторы оформили настоящее изобретение.
Конкретно, настоящее изобретение относится к соединению, представленному общей формулой (1), его фармацевтически приемлемой соли или его сольвату:

где A представляет собой неразветвленную C1-C3алкиленовую группу, где метиленовая группа необязательно замещена O или S;
n представляет собой целое число от 3 до 5;
каждый из X1 и X2 независимо представляет собой CH или N;
каждый из W1 и W2 независимо представляет собой карбоксильную группу или тетразолильную группу;
V представляет собой неразветвленную или разветвленную C1-C8алкиленовую группу, в которой метиленовая группа необязательно замещена O или S;
R представляет собой группу, выбранную из следующих:

в которых R1, R2, R3, R4 и R5 представляет собой атом водорода, атом галогена, C1-C6алкильную группу, которая может содержать группу-заместитель, C1-C6алкоксигруппу, C3-C6циклоалкильную группу, C3-C6циклоалкоксигруппу, галогенC1-C4алкильную группу, галогенC1-C4алкоксигруппу, винильную группу, которая может содержать группу-заместитель, этинильную группу, которая может содержать группу-заместитель, арильную группу, которая может содержать группу-заместитель на ароматическом кольце, арилоксигруппу, которая может содержать группу-заместитель на ароматическом кольце, бензильную группу, которая может содержать группу-заместитель на бензольном кольце, фенэтильную группу, которая может содержать группу-заместитель на бензольном кольце, бензилоксигруппу, которая может содержать группу-заместитель на бензольном кольце, бензилсульфанильную группу, которая может содержать группу-заместитель на бензольном кольце, бензиламиногруппу, которая может содержать группу-заместитель на бензольном кольце, фенилоксиметильную группу, которая может содержать группу-заместитель на бензольном кольце, фенилсульфанилметильную группу, которая может содержать группу-заместитель на бензольном кольце, или фениламинометильную группу, которая может содержать группу-заместитель на бензольном кольце,
m представляет собой целое число 1 или 2, и
каждый из Y1 и Y2 независимо представляет собой метилен, O или S, при условии, что они оба одновременно не представляют собой S.
Настоящее изобретение дополнительно относится к фармацевтическому средству, содержащему соединение, представленное рассмотренной выше общей формулой (1), его фармацевтически приемлемую соль или его сольват.
Настоящее изобретение дополнительно относится к фармацевтической композиции, содержащей соединение, представленное рассмотренной выше общей формулой (1), его фармацевтически приемлемую соль или его сольват, и фармацевтически приемлемый носитель.
Настоящее изобретение дополнительно относится к соединению, представленному рассмотренной выше общей формулой (1), его фармацевтически приемлемой соли или его сольвату для профилактики или лечения нарушений, связанных с растворимой гуанилатциклазой, таких как сердечная недостаточность, гипертензия, легочная гипертензия или ишемическая болезнь сердца.
Настоящее изобретение дополнительно относится к применению соединения, представленного рассмотренной выше общей формулой (1), его фармацевтически приемлемой соли или его сольвата для получения фармацевтического средства для профилактики или лечения нарушений, связанных с растворимой гуанилатциклазой, таких как сердечная недостаточность, гипертензия, легочная гипертензия или ишемическая болезнь сердца.
Настоящее изобретение кроме того относится к способу профилактики или лечения нарушений, связанных с растворимой гуанилатциклазой, таких как сердечная недостаточность, гипертензия, легочная гипертензия или ишемическая болезнь сердца, характеризующемуся введением эффективного количества соединения, представленного рассмотренной выше общей формулой (1), его фармацевтически приемлемой соли или его сольвата.
ПОЛЕЗНЫЕ ЭФФЕКТЫ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Соединение согласно настоящему изобретению, характеризуется высокой гем-независимостью, превосходной способностью активировать растворимую гуанилатциклазу и применимо в качестве фармацевтического средства для профилактики или лечения различных нарушений, связанных с растворимой гуанилатциклазой. Примеры нарушений, которые могут предупреждаться или лечиться путем активации растворимой гуанилатциклазы, включают в себя сердечную недостаточность, гипертензию, легочную гипертензию или ишемическую болезнь сердца.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Описанная в настоящем документе «неразветвленная алкиленовая группа» означает неразветвленную алкиленовую группу, содержащую установленное число атомов углерода. Конкретные примеры включают в себя метиленовую группу, (CH2)2, (CH2)3, (CH2)4, (CH2)5- и (CH2)6.
Описанная в настоящем документе «разветвленная алкиленовая группа» означает разветвленную алкиленовую группу, содержащую установленное число атомов углерода. Конкретные примеры включают в себя CH(CH3), CH(C2H5), CH(C3H7), CH(C4H9), CH(C5H11), CH2CH(CH3)- и CH2CH2CH(CH3).
Выражение «метиленовая группа необязательно замещена O или S», описанное в настоящем документе применительно к «неразветвленной или разветвленной алкиленовой группе», означает, что любая метиленовая группа в неразветвленной или разветвленной алкиленовой группе замещена O или S. Примеры случая, когда «неразветвленная алкиленовая группа» представляет собой метиленовую группу с одним атомом углерода, также включают в себя O- и S. Конкретные примеры включают в себя CH2O, CH2S, (CH2)2S, (CH2)3O, (CH2)3S, (CH3)O, CH(CH3)O, CH(CH3)S, CH2CH(CH3)O- и CH2CH(CH3)S.
Описанный в настоящем документе «атом галогена» включает в себя атом фтора, атом хлора, атом брома и атом йода.
Описанная в настоящем документе «C1-C6алкильная группа» означает неразветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, или разветвленную алкильную группу, содержащую от 3 до 6 атомов углерода. Примеры C1-C6алкильной группы включают в себя метильную группу, этильную группу, н-пропильную группу, н-бутильную группу, изопропильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, н-пентильную группу и н-гексильную группу.
Описанная в настоящем документе «C1-C6алкоксигруппа» означает «C1-C6алкильную группу», в которой один атом водорода замещен атомом кислорода. Конкретно, это неразветвленная алкоксигруппа, содержащая от 1 до 6 атомов углерода, или разветвленная алкоксигруппа, содержащая от 3 до 6 атомов углерода, и примеры C1-C6алкоксигруппы включают в себя метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропоксигруппу, н-бутоксигруппу, изобутоксигруппу, трет-бутоксигруппу, н-пентилоксигруппу и н-гексилоксигруппу.
Описанная в настоящем документе «C3-C6циклоалкильная группа» означает циклическую алкильную группу, содержащую от 3 до 6 атомов углерода. Конкретные примеры включают в себя циклопропильную группу, циклобутильную группу, циклопентильную группу и циклогексильную группу.
Описанная в настоящем документе «C3-C6циклоалкоксигруппа» означает «C3-C6циклоалкильную группу», в которой один атом водорода замещен атомом кислорода. Конкретные примеры включают в себя циклопропоксигруппу, циклобутоксигруппу, циклопентилоксигруппу и циклогексилоксигруппу.
Описанная в настоящем документе «галогенC1-C4алкильная группа» означает C1-C4алкильную группу, которая представляет собой неразветвленную алкильную группу, содержащую от 1 до 4 атомов углерода, или разветвленную алкильную группу, содержащую 3 или 4 атома углерода, в которой один или несколько атомов водорода замещены атомом галогена. Примеры галогенC1-C4алкильной группы включают в себя хлорметильную группу, дихлорметильную группу, трихлорметильную группу, фторметильную группу, дифторметильную группу, трифторметильную группу, бромметильную группу, дибромметильную группу, трибромметильную группу, 2-хлорэтильную группу, 2,2-дихлорэтильную группу, 2,2,2-трихлорэтильную группу, 2-фторэтильную группу, 2,2-дифторэтильную группу, 2,2,2-трифторэтильную группу, 1,1,2,2-тетрафторэтильную группу, пентафторэтильную группу, 2-бромэтильную группу, 2,2,2-трибромэтильную группу, 3,3,3-трихлорпропильную группу, 3,3,3-трифторпропильную группу, 3,3,3-трибромпропильную группу, 4,4,4-трихлорбутильную группу и 4,4,4-трифторбутильную группу.
Описанная в настоящем документе «галогенC1-C4алкоксигруппа» означает «галогенC1-C4алкильную группу», в которой один атом водорода замещен атомом кислорода. Примеры галогенC1-C4алкоксигруппы включают в себя хлорметоксигруппу, дихлорметоксигруппу, трихлорметоксигруппу, фторметоксигруппу, дифторметоксигруппу, трифторметоксигруппу, 2-хлорэтоксигруппу, 2,2-дихлорэтоксигруппу, 2,2,2-трихлорэтоксигруппу, 2-фторэтоксигруппу, 2,2-дифторэтоксигруппу, 2,2,2-трифторэтоксигруппу, 1,1,2,2-тетрафторэтоксигруппу, пентафторэтоксигруппу, 3,3,3-трихлорпропоксигруппу, 3,3,3-трифторпропоксигруппу, 4,4,4-трихлорбутоксигруппу и 4,4,4-трифторбутоксигруппу.
Описанная в настоящем документе «арильная группа» означает моноциклическую или полициклическую ароматическую углеводородную группу, содержащую от 6 до 10 атомов углерода. Примеры арильной группы включают в себя фенильную группу и нафтильную группу. Более конкретные примеры включают в себя фенильную группу, 1-нафтильную группу и 2-нафтильную группу.
Описанная в настоящем документе «арилоксигруппа» означает «арильную группу», в которой один атом водорода замещен атомом кислорода. Примеры арилоксигруппы включают в себя феноксигруппу и нафтоксигруппу. Более конкретные примеры включают в себя феноксигруппу, 1-нафтоксигруппу и 2-нафтоксигруппу.
Описанное в настоящем документе выражение «которая может содержать группу-заместитель» означает отсутствие замещения или содержание в некотором подходящем для замещения положении одной или нескольких замещающих групп, которые являются одинаковыми или отличаются друг от друга, предпочтительно, 1 2, и более предпочтительно одну группу-заместитель. Примеры группы-заместителя включают в себя атом галогена, C1-C6алкильную группу, C1-C6алкоксигруппу, C3-C6циклоалкильную группу, C3-C6циклоалкоксигруппу, галогенC1-C4алкильную группу и арильную группу. Определение каждой группы-заместителя представлено выше, и она может дополнительно содержать группу-заместитель.
В том, что касается атома галогена, представленного R1, R2, R3, R4 и R5, то он предпочтительно представляет собой атом фтора или атом хлора, и более предпочтительно атом хлора.
Если C1-C6алкильная группа, которая может содержать группу-заместитель, которая представлена R1, R2, R3, R4 и R5, содержит ее, то примеры группы-заместителя включают в себя C1-C6алкоксигруппу, C3-C6циклоалкильную группу и C3-C6циклоалкоксигруппу. Среди них предпочтительной является C3-C6циклоалкильная группа, и особенно предпочтительной является циклогексильная группа. В том, что касается C1-C6алкильной группы, которая может содержать группу-заместитель, то она предпочтительно представляет собой метильную группу, этильную группу, изопропильную группу, трет-бутильную группу, 2-метоксиэтильную группу, 2-циклопропилэтильную группу или 2-циклогексилэтильную группу, и более предпочтительно изопропильную группу, трет-бутильную группу или 2-циклогексилэтильную группу.
В том, что касается C1-C6алкоксигруппы, представленной R1, R2, R3, R4 и R5, то она предпочтительно представляет собой метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропоксигруппу или трет-бутоксигруппу, и более предпочтительно метоксигруппу или трет-бутоксигруппу.
В том, что касается C3-C6циклоалкильной группы, представленной R1, R2, R3, R4 и R5, то она предпочтительно представляет собой циклопропильную группу или циклогексильную группу, и более предпочтительно циклопропильную группу.
В том, что касается C3-C6циклоалкоксигруппы, представленной R1, R2, R3, R4 и R5, то примеры включают в себя циклопропилоксигруппу, циклопентилоксигруппу и циклогексилоксигруппу. Предпочтительно она представляет собой циклогексилоксигруппу.
В том, что касается галогенC1-C4алкильной группы, представленной R1, R2, R3, R4 и R5, то она предпочтительно представляет собой C1-C4алкильную группу, замещенную одним или несколькими атомами фтора. Более предпочтительно, она представляет собой C1-C4алкильную группу, замещенную 1 5 атомами фтора. Конкретные примеры включают в себя трифторметильную группу, 2,2,2-трифторэтильную группу, 1,1,2,2-тетрафторэтильную группу и пентафторэтильную группу. Более предпочтительно, она представляет собой трифторметильную группу.
В том, что касается галогенC1-C4алкоксигруппы, представленной R1, R2, R3, R4 и R5, то она предпочтительно представляет собой C1-C4алкоксигруппу, которая замещена одним или несколькими атомами фтора. Более предпочтительно, она представляет собой C1-C4алкоксигруппу, замещенную 1 5 атомами фтора. Конкретные примеры включают в себя трифторметоксигруппу, 2,2,2-трифторэтоксигруппу, 1,1,2,2-тетрафторэтоксигруппу и пентафторэтоксигруппу. Более предпочтительно, она представляет собой трифторметоксигруппу.
Если винильная группа, которая может содержать группу-заместитель, или этинильная группа, которая может содержать группу-заместитель, представленную R1, R2, R3, R4 и R5, содержит группу-заместитель, то группа-заместитель предпочтительно представляет собой C1-C6алкильную группу, C3-C6циклоалкильную группу или арильную группу, и арильная группа предпочтительно представляет собой фенильную группу. Арильная группа может дополнительно содержать группу-заместитель, такую как атом галогена, C1-C6алкильная группа или галогенC1-C4алкильная группа. Предпочтительно, если винильная группа не будет замещена или будет содержать 1 2 группы-заместителя. В частности, предпочтительно, если винильная группа содержит одну группу-заместитель. Предпочтительно, если этинильная группа не содержит группы-заместителя или содержит одну группу-заместитель. Примеры винильной группы, которая может содержать группу-заместитель, или этинильной группы, которая может содержать группу-заместитель, включают в себя винильную группу, циклогексилвинильную группу, стирильную группу, этинильную группу, 3-метил-1-бутин-1-ильную группу, циклопропилэтинильную группу, циклогексилэтинильную группу и фенилэтинильную группу. Предпочтительной является циклогексилвинильная группа, стирильная группа или циклогексилэтинильная группа.
В том, что касается арильной группы, которая может содержать группу-заместитель на ароматическом кольце, или арилоксигруппы, которая может содержать группу-заместитель на ароматическом кольце, представленную R1, R2, R3, R4 и R5, то ароматическое кольцо предпочтительно представляет собой бензольное кольцо. Если ароматическое кольцо содержит группу-заместитель, то она предпочтительно представляет собой атом галогена, C1-C6алкильную группу, C1-C6алкоксигруппу или галогенC1-C4алкильную группу. Предпочтительно, если арильная группа или арилоксигруппа, которая может содержать группу-заместитель, не содержит группы-заместителя или содержит 1 2 группы-заместителя. Более предпочтительно, если она содержит одну группу-заместитель в пара-положении. Конкретные примеры арильной группы или арилоксигруппы, которая может содержать группу-заместитель, включают в себя фенильную группу, 4-трифторметилфенильную группу, 4-хлорфенильную группу, 4-трет-бутилфенильную группу, 4-метоксифенильную группу, феноксигруппу, 4-трифторметилфеноксигруппу, 4-хлорфеноксигруппу, 4-трет-бутилфеноксигруппу и 4-метоксифеноксигруппу. Более предпочтительной является фенильная группа, 4-трифторметилфенильная группа, 4-трет-бутилфенильная группа, феноксигруппа, 4-трифторметилфеноксигруппа или 4-трет-бутилфеноксигруппа.
В том, что касается бензильной группы, которая может содержать группу-заместитель на бензольном кольце, фенэтильной группы, которая может содержать группу-заместитель на бензольном кольце, бензилоксигруппы, которая может содержать группу-заместитель на бензольном кольце, бензилсульфанильной группы, которая может содержать группу-заместитель на бензольном кольце, бензиламиногруппы, которая может содержать группу-заместитель на бензольном кольце, фенилоксиметильной группы, которая может содержать группу-заместитель на бензольном кольце, фенилсульфанилметильной группы, которая может содержать группу-заместитель на бензольном кольце, или фениламинометильной группы, которая может содержать группу-заместитель на бензольном кольце, представленную R1, R2, R3, R4 и R5 (здесь и далее в настоящем документе, группы с бензильной по фениламинометильную совместно называют типом бензильной группы), то предпочтительно, чтобы она не была замещена или содержала 1 2 группы-заместителя на бензольном кольце. Особенно предпочтительно, если она содержит одну группу-заместитель в пара-положении. В том, что касается группы-заместителя, то предпочтительно она представляет собой атом галогена, C1-C6алкильную группу или галогенC1-C4алкильную группу, более предпочтительно галогенC1-C4алкильную группу, и наиболее предпочтительно трифторметильную группу. В том, что касается типа бензильной группы, то предпочтительно она представляет собой фенэтильную группу, бензилоксигруппу или бензилсульфанильную группу, и особенно предпочтительно фенэтильную группу. Конкретные примеры типа бензильной группы, которая может содержать группу-заместитель на бензольном кольце, включают в себя бензильную группу, фенэтильную группу, бензилоксигруппу, бензилсульфанильную группу, бензиламиногруппу, фенилоксиметильную группу, фенилсульфанилметильную группу, фениламинометильную группу, (4-фтор)фенэтильную группу, (4-фтор)бензилоксигруппу, (4-фтор)бензилсульфанильную группу, (4-трифторметил)фенэтильную группу, (4-трифторметил)бензилоксигруппу, (4-трифторметил)бензилсульфанильную группу, (4-трет-бутил)фенэтильную группу, (4-трет-бутил)бензилоксигруппу и (4-трет-бутил)бензилсульфанильную группу. Предпочтительной является фенэтильная группа, бензилоксигруппа, бензилсульфанильная группа, фенилоксиметильная группа, фенилсульфанилметильная группа или фениламинометильная группа, и более предпочтительной фенэтильная группа, бензилоксигруппа или бензилсульфанильная группа.
Конкретные примеры неразветвленной C1-C3алкиленовой группы, представленной A, включают в себя метиленовую группу, O, S, CH2CH2, CH2O, CH2S, OCH2, SCH2, (CH2)3, OCH2CH2, SCH2CH2, CH2OCH2, CH2SCH2, CH2CH2O- и CH2CH2S. Среди них метиленовая группа, O, CH2CH2, CH2O, OCH2, CH2CH2CH2, CH2OCH2, CH2SCH2- и CH2CH2O- являются предпочтительными, и CH2CH2- и CH2O- являются особенно предпочтительными.
n наиболее предпочтительно равно 4.
X2 наиболее предпочтительно представляет собой CH.
W1 и W2 предпочтительно представляют собой карбоксильную группу.
Конкретные примеры неразветвленной или разветвленной C1-C8алкиленовой группы, представленной V, включают в себя метиленовую группу, O, S, CH2CH2, CH(CH3)O, CH2CH(CH3), CH2CH(CH3)O, CH2CH(CH3)S, CH2O, CH2S, OCH2- и SCH2. Среди них предпочтительными являются CH2CH2, CH(CH3)O- и CH2O, и особенно предпочтительной является CH2O.
Если группа, представленная R, соответствует следующей формуле

где m представляет собой целое число 1 или 2, и
каждый из Y1 и Y2 независимо представляет собой метиленовую группу, O или S, при условии, что они одновременно не представляют собой S,
то конкретные примеры включают в себя группу, представленную следующей формулой:

Среди них предпочтительной является группа, выбранная из следующей формулы:
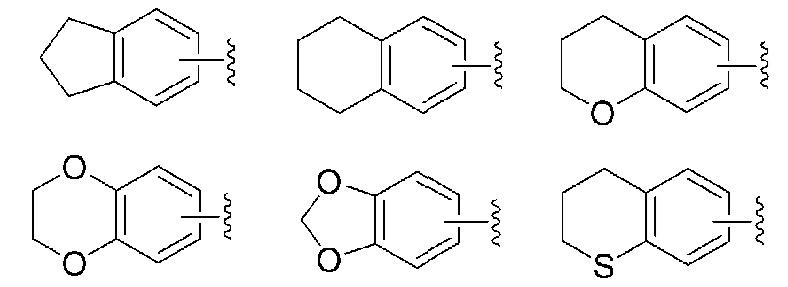
В том, что касается группы, представленной R, то предпочтительной является группа, выбранная из следующей формулы:

и особенно предпочтительными среди групп, представленных выше, являются группы

В том, что касается R1, то предпочтительным является C1-C6алкильная группа, которая может содержать группу-заместитель, C3-C6циклоалкильная группа, C1-C6алкоксигруппа, галогенC1-C4алкильная группа, винильная группа, которая может содержать группу-заместитель, этинильная группа, которая может содержать группу-заместитель, арильная группа, которая может содержать группу-заместитель на ароматическом кольце, арилоксигруппа, которая может содержать группу-заместитель на ароматическом кольце, бензильная группа, которая может содержать группу-заместитель на бензольном кольце, фенэтильная группа, которая может содержать группу-заместитель на бензольном кольце, бензилоксигруппа, которая может содержать группу-заместитель на бензольном кольце, бензилсульфанильная группа, которая может содержать группу-заместитель на бензольном кольце, бензиламиногруппа, которая может содержать группу-заместитель на бензольном кольце, фенилоксиметильная группа, которая может содержать группу-заместитель на бензольном кольце, фенилсульфанилметильная группа, которая может содержать группу-заместитель на бензольном кольце, или фениламинометильная группа, которая может содержать группу-заместитель на бензольном кольце. Более предпочтительно, он представляет собой C1-C6алкильную группу, C3-C6циклоалкильную группу, винильную группу, которая может содержать группу-заместитель, этинильную группу, которая может содержать группу-заместитель, фенэтильную группу, которая может содержать группу-заместитель на бензольном кольце, бензилоксигруппу, которая может содержать группу-заместитель на бензольном кольце, или бензилсульфанильную группу, которая может содержать группу-заместитель на бензольном кольце. Предпочтительным положением для R1 замещения является мета-положение или пара-положение. В настоящем документе, группа-заместитель на C1-C6алкильной группе предпочтительно представляет собой C1-C6алкоксигруппу, C3-C6циклоалкильную группу или C3-C6циклоалкоксигруппу. Группа-заместитель на винильной группе или этинильной группе предпочтительно представляет собой C1-C6алкильную группу, C3-C6циклоалкильную группу, фенильную группу, галогенфенильную группу, C1-C6алкилфенильную группу или галогенC1-C4алкилфенильную группу. В том, что касается арильной группы, предпочтительной является фенильная группа. В том, что касается арилоксигруппы, предпочтительной является феноксигруппа. Группа-заместитель на арильной или арилоксигруппе предпочтительно представляет собой атом галогена, C1-C6алкильную группу, C1-C6алкоксигруппу или галогенC1-C4алкильную группу. Группа-заместитель на бензольном кольце предпочтительно представляет собой атом галогена, C1-C6алкильную группу или галогенC1-C4алкильную группу.
В том, что касается R2, то предпочтительным является винильная группа, которая может содержать группу-заместитель, этинильная группа, которая может содержать группу-заместитель, бензильная группа, которая может содержать группу-заместитель на бензольном кольце, фенэтильная группа, которая может содержать группу-заместитель на бензольном кольце, бензилоксигруппа, которая может содержать группу-заместитель на бензольном кольце, бензилсульфанильная группа, которая может содержать группу-заместитель на бензольном кольце, бензиламиногруппа, которая может содержать группу-заместитель на бензольном кольце, фенилоксиметильная группа, которая может содержать группу-заместитель на бензольном кольце, фенилсульфанилметильная группа, которая может содержать группу-заместитель на бензольном кольце, или фениламинометильная группа, которая может содержать группу-заместитель на бензольном кольце. Более предпочтительно, он представляет собой винильную группу, которая может содержать группу-заместитель, фенэтильную группу, которая может содержать группу-заместитель на бензольном кольце, бензилоксигруппу, которая может содержать группу-заместитель на бензольном кольце, или бензилсульфанильную группу, которая может содержать группу-заместитель на бензольном кольце. Наиболее предпочтительно, он представляет собой фенэтильную группу, которая может содержать группу-заместитель на бензольном кольце. В настоящем документе, группа-заместитель на винильной группе или этинильной группе предпочтительно представляет собой C1-C6алкильную группу, C3-C6циклоалкильную группу, фенильную группу, галогенфенильную группу, C1-C6алкилфенильную группу или галогенC1-C4алкилфенильную группу. Группа-заместитель на бензольном кольце предпочтительно представляет собой атом галогена, C1-C6алкильную группу или галогенC1-C4алкильную группу.
В том, что касается R3, то предпочтительным является атом водорода, C1-C6алкильная группа, которая может содержать группу-заместитель, C1-C6алкоксигруппа или галогенC1-C4алкильная группа. Наиболее предпочтительно, он представляет собой атом водорода. Наиболее предпочтительным положением для R3 замещения является пара-положение. В настоящем документе, группа-заместитель на C1-C6алкильной группе предпочтительно представляет собой C1-C6алкоксигруппу, C3-C6циклоалкильную группу или C3-C6циклоалкоксигруппу.
В том, что касается R4, то предпочтительным является атом водорода, C1-C6алкильная группа, которая может содержать группу-заместитель, C1-C6алкоксигруппа или галогенC1-C4алкильная группа, арильная группа, которая может содержать группу-заместитель на ароматическом кольце, или арилоксигруппа, которая может содержать группу-заместитель на ароматическом кольце. Наиболее предпочтительно, он представляет собой атом водорода. Предпочтительным положением для R4 замещения является 6 положение. В настоящем документе, группа-заместитель на C1-C6алкильной группе предпочтительно представляет собой C1-C6алкоксигруппу, C3-C6циклоалкильную группу или C3-C6циклоалкоксигруппу. В том, что касается арильной группы, то предпочтительной является фенильная группа. В том, что касается арилоксигруппы, то предпочтительной является феноксигруппа. Группа-заместитель на арильной или арилоксигруппе предпочтительно представляет собой атом галогена, C1-C6алкильную группу, C1-C6алкоксигруппу или галогенC1-C4алкильную группу.
В том, что касается R5, то предпочтительным является атом водорода, бензильная группа, которая может содержать группу-заместитель на бензольном кольце, фенэтильная группа, которая может содержать группу-заместитель на бензольном кольце, бензилоксигруппа, которая может содержать группу-заместитель на бензольном кольце, бензилсульфанильная группа, которая может содержать группу-заместитель на бензольном кольце, бензиламиногруппа, которая может содержать группу-заместитель на бензольном кольце, фенилоксиметильная группа, которая может содержать группу-заместитель на бензольном кольце, фенилсульфанилметильная группа, которая может содержать группу-заместитель на бензольном кольце, или фениламинометильная группа, которая может содержать группу-заместитель на бензольном кольце. Более предпочтительно, он представляет собой атом водорода или фенэтильную группу. Предпочтительным положением для R5 замещения является 6 положение. В настоящем документе, группа-заместитель на бензольном кольце предпочтительно представляет собой атом галогена, C1-C6алкильную группу или галогенC1-C4алкильную группу.
В общей формуле (1) предпочтительно, если A представляет собой метиленовую группу, O, CH2CH2, CH2O, OCH2, CH2CH2CH2, CH2OCH2, CH2SCH2- или CH2CH2O-;
n представляет собой целое число от 3 до 5;
W1 и W2 представляют собой карбоксильную группу;
V представляет собой CH2CH2, CH(CH3)O- или CH2O-; и
R представляет собой следующее:

В указанной формуле, значения R1, R2, Y1, Y2 и m определены выше.
В общей формуле (1) более предпочтительно, если A представляет собой метиленовую группу, O, CH2CH2, CH2O, OCH2, CH2CH2CH2, CH2OCH2, CH2SCH2- или CH2CH2O;
n представляет собой целое число 4;
W1 и W2 представляют собой карбоксильную группу;
V представляет собой CH2CH2, CH(CH3)O- или CH2O-; и
R представляет собой следующее:

В указанной формуле, значения R1, R2, Y1, Y2 и m определены выше.
Согласно предпочтительному варианту осуществления, R1 предпочтительно представляет собой C1-C6алкильную группу, которая может содержать группу-заместитель, C3-C6циклоалкильную группу, C1-C6алкоксигруппу, галогенC1-C4алкильную группу, винильную группу, которая может содержать группу-заместитель, этинильную группу, которая может содержать группу-заместитель, арильную группу, которая может содержать группу-заместитель на ароматическом кольце, арилоксигруппу, которая может содержать группу-заместитель на ароматическом кольце, бензильную группу, которая может содержать группу-заместитель на бензольном кольце, фенэтильную группу, которая может содержать группу-заместитель на бензольном кольце, бензилоксигруппу, которая может содержать группу-заместитель на бензольном кольце, бензилсульфанильную группу, которая может содержать группу-заместитель на бензольном кольце, бензиламиногруппу, которая может содержать группу-заместитель на бензольном кольце, фенилоксиметильную группу, которая может содержать группу-заместитель на бензольном кольце, фенилсульфанилметильную группу, которая может содержать группу-заместитель на бензольном кольце, или фениламинометильную группу, которая может содержать группу-заместитель на бензольном кольце. Более предпочтительно, он представляет собой C1-C6алкильную группу, C3-C6циклоалкильную группу, винильную группу, которая может содержать группу-заместитель, этинильную группу, которая может содержать группу-заместитель, фенэтильную группу, которая может содержать группу-заместитель на бензольном кольце, бензилоксигруппу, которая может содержать группу-заместитель на бензольном кольце, или бензилсульфанильную группу, которая может содержать группу-заместитель на бензольном кольце. В настоящем документе, группа-заместитель на алкильной группе, винильной группе, этинильной группе, арильной группе, арилоксигруппе и бензольном кольце предпочтительно является такой же, как описано выше.
В том, что касается R2, то предпочтительным является винильная группа, которая может содержать группу-заместитель, этинильная группа, которая может содержать группу-заместитель, бензильная группа, которая может содержать группу-заместитель на бензольном кольце, фенэтильная группа, которая может содержать группу-заместитель на бензольном кольце, бензилоксигруппа, которая может содержать группу-заместитель на бензольном кольце, бензилсульфанильная группа, которая может содержать группу-заместитель на бензольном кольце, бензиламиногруппа, которая может содержать группу-заместитель на бензольном кольце, фенилоксиметильная группа, которая может содержать группу-заместитель на бензольном кольце, фенилсульфанилметильная группа, которая может содержать группу-заместитель на бензольном кольце, или фениламинометильная группа, которая может содержать группу-заместитель на бензольном кольце. Более предпочтительно, он представляет собой винильную группу, которая может содержать группу-заместитель, фенэтильную группу, которая может содержать группу-заместитель на бензольном кольце, бензилоксигруппу, которая может содержать группу-заместитель на бензольном кольце, или бензилсульфанильную группу, которая может содержать группу-заместитель на бензольном кольце. Наиболее предпочтительно, он представляет собой фенэтильную группу, которая может содержать группу-заместитель на бензольном кольце. В настоящем документе, группа-заместитель на винильной группе, этинильной группе и бензольном кольце предпочтительно является такой же, что и описанная выше.
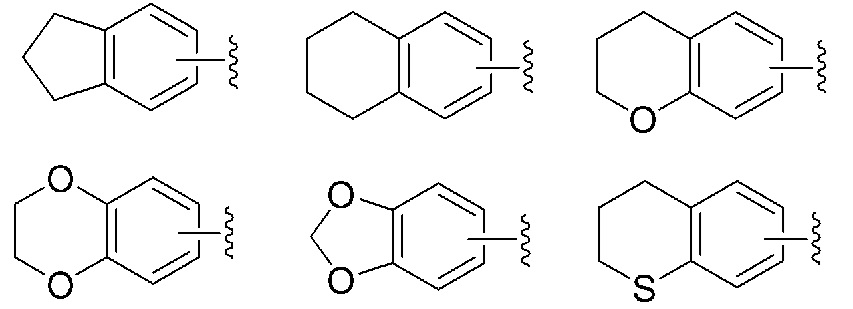
Согласно предпочтительному варианту осуществления, если значение R представлено

то предпочтительно он представляет собой группу, выбранную из следующих
Конкретные примеры особенно предпочтительных соединений из числа соединений общей формулы (1) согласно настоящему изобретению включают в себя следующие:
1-{N-(4-карбоксибутил)-N-[2-[2-[4-(2-фенилэтил)бензилокси]фенил]этил]амино}индан-5-карбоновую кислоту (пример 1);
5-{N-(4-карбоксибутил)-N-[2-[2-[4-(2-фенилэтил)бензилокси]фенил]этил]амино}-5,6,7,8-тетрагидронафталин-2-карбоновую кислоту (пример 2);
5-{N-(4-карбоксибутил)-N-[2-[2-[4-(2-фенилэтил)бензилокси]фенил]этил]амино}-6,7,8,9-тетрагидро-5H-бензоциклогептен-2-карбоновую кислоту (пример 3);
4-{N-(4-карбоксибутил)-N-[2-[2-[4-(2-фенилэтил)бензилокси]фенил]этил]амино}хроман-7-карбоновую кислоту (пример 4);
4-{N-(4-карбоксибутил)-N-[2-[2-[4-(2-фенилэтил)бензилокси]фенил]этил]амино}тиохроман-7-карбоновую кислоту (пример 5);
5-{N-(4-карбоксибутил)-N-[2-[2-[4-(2-фенилэтил)бензилокси]фенил]этил]амино}-5,6,7,8-тетрагидрохинолин-2-карбоновую кислоту (пример 6);
3-{N-(4-карбоксибутил)-N-[2-[2-[4-(2-фенилэтил)бензилокси]фенил]этил]амино}-2,3-дигидробензофуран-6-карбоновую кислоту (пример 7);
4-{N-(4-карбоксибутил)-N-[2-[2-[4-(2-фенилэтил)бензилокси]фенил]этил]амино}изохроман-7-карбоновую кислоту (пример 8);
5-{N-(4-карбоксибутил)-N-[2-[2-(2-хлорбензилокси)фенил]этил]амино}-5,6,7,8-тетрагидронафталин-2-карбоновую кислоту (пример 13);
5-{N-[2-[2-(4-бензилоксибензилокси)фенил]этил]-N-(4-карбоксибутил)амино}-5,6,7,8-тетрагидронафталин-2-карбоновую кислоту (пример 14);
5-{N-[2-[2-(4-бензилсульфанилбензилокси)фенил]этил]-N-(4-карбоксибутил)амино}-5,6,7,8-тетрагидронафталин-2-карбоновую кислоту (пример 15);
5-{N-(4-карбоксибутил)-N-[2-[2-(4-феноксиметилбензилокси)фенил]этил]амино}-5,6,7,8-тетрагидронафталин-2-карбоновую кислоту (пример 16);
5-{N-(4-карбоксибутил)-N-[2-[2-(4-фенилсульфанилметилбензилокси)фенил]этил]амино}-5,6,7,8-тетрагидронафталин-2-карбоновую кислоту (пример 17);
5-{N-(4-карбоксибутил)-N-[2-[2-(4-этинилбензилокси)фенил]этил]амино}-5,6,7,8-тетрагидронафталин-2-карбоновую кислоту (пример 19);
5-{N-(4-карбоксибутил)-N-[2-[2-(4-циклогексилэтинилбензилокси)фенил]этил]амино}-5,6,7,8-тетрагидронафталин-2-карбоновую кислоту (пример 22);
5-{N-(4-карбоксибутил)-N-[2-[2-[4-((E)-2-циклогексилэтенил)бензилокси]фенил]этил]амино}-5,6,7,8-тетрагидронафталин-2-карбоновую кислоту (пример 23);
5-{N-(4-карбоксибутил)-N-[2-[2-[4-(2-циклогексилэтил)бензилокси]фенил]этил]амино}-5,6,7,8-тетрагидронафталин-2-карбоновую кислоту (пример 24);
5-{N-(4-карбоксибутил)-N-[2-[2-[транс-4-(2-фенилэтил)циклогексилметокси]фенил]этил]амино}-5,6,7,8-тетрагидронафталин-2-карбоновую кислоту (пример 26);
5-{N-(4-карбоксибутил)-N-[2-[2-[цис-4-(2-фенилэтил)циклогексилметокси]фенил]этил]амино}-5,6,7,8-тетрагидронафталин-2-карбоновую кислоту (пример 27);
5-{N-(4-карбоксибутил)-N-[2-[2-(5,6,7,8-тетрагидронафталин-1-илметокси)фенил]этил]амино}-5,6,7,8-тетрагидронафталин-2-карбоновую кислоту (пример 29);
5-{N-[2-[2-(3-трет-бутилбензилокси)фенил]этил]-N-(4-карбоксибутил)амино}-5,6,7,8-тетрагидронафталин-2-карбоновую кислоту (пример 41);
5-{N-(4-карбоксибутил)-N-[2-[2-(4-циклопропилбензилокси)фенил]этил]амино}-5,6,7,8-тетрагидронафталин-2-карбоновую кислоту (пример 42);
5-{N-(4-карбоксибутил)-N-[2-[2-(4-изопропилбензилокси)фенил]этил]амино}-5,6,7,8-тетрагидронафталин-2-карбоновую кислоту (пример 43);
5-{N-[2-[2-[(1R)-1-(4-трет-бутилфенил)этокси]фенил]этил]-N-(4-карбоксибутил)амино}-5,6,7,8-тетрагидронафталин-2-карбоновую кислоту (пример 45);
5-{N-(4-карбоксибутил)-N-[2-[2-(индан-5-илметокси)фенил]этил]амино}-5,6,7,8-тетрагидронафталин-2-карбоновую кислоту (пример 46).
Описанное в настоящем документе соединение общей формулы (1) может образовывать изомер, такой как геометрический изомер, оптический изомер, стереоизомер или таутомер. Соединения общей формулы (1) согласно настоящему изобретению включают в себя любой из указанных изомеров или их смеси.
Кроме того, соединение общей формулы (1) согласно настоящему изобретению включает в себя соединения, полученные мечением, например, изотопом (например,2H,3H,14C,35S или125I).
Кроме того, настоящее изобретение включает в себя фармацевтически приемлемые соли соединения общей формулы (1). Конкретные примеры включают в себя кислотно-аддитивные соли с неорганическими кислотами, такие как гидрохлорид, гидробромид, гидройодид, сульфат, нитрат и фосфат, кислотно-аддитивные соли с органическими кислотами, такие как формиат, ацетат, трихлорацетат, трифторацетат, пропионат, оксалат, малонат, сукцинат, фумарат, малеат, лактат, малат, тартрат, цитрат, метансульфонат, этансульфонат, бензолсульфонат, пара-толуолсульфонат (4-метилбензолсульфонат), аспарагинат и глутамат; соли с неорганическими основаниями, такие как соли натрия, соли калия, соли магния, соли кальция, соли аммония и соли алюминия; и соли с органическими основаниями, такими как метиламин, этиламин, этаноламин, лизин и орнитин.
Кроме того, согласно настоящему изобретению могут существовать гидраты, различные сольваты и кристаллические полиморфы соединения (1) согласно настоящему изобретению и их фармацевтически приемлемые соли. Однако, аналогичным образом, не существует ограничений, и настоящее изобретение может включать в себя любую отдельную кристаллическую форму и смесь кристаллических форм и может включать в себя любую из них.
Кроме того, соединение (1) согласно настоящему изобретению может быть получено в виде пролекарства посредством включения в состав фармацевтически приемлемой группы. Примеры образующей пролекарство фармацевтически приемлемой группы включают в себя группы, описанные в Prog. Med., 5, 2157-2161 (1985), или в «Development of Pharmaceutical Products» (Hirokawa Shoten Ltd., 1990) Vol. 7, Molecular Design, 163-198.
Соединение общей формулы (1) согласно настоящему изобретению, его фармацевтически приемлемая соль или его сольват (здесь и далее в настоящем документе совместно именуемые соединением согласно настоящему изобретению) могут быть получены с использованием характерных особенностей, основанных на типе основного скелета или его группы-заместителя, и с использованием различных способов синтеза, которые известны per se применительно к введению групп-заместителей или преобразованию функциональных групп.
Примеры способа получения соединения согласно настоящему изобретению представлены ниже, однако предполагается, что способ получения соединения согласно настоящему изобретению не ограничивается указанными способами.
Соединение общей формулы (1) может быть получено, например, в соответствии со следующей схемой:
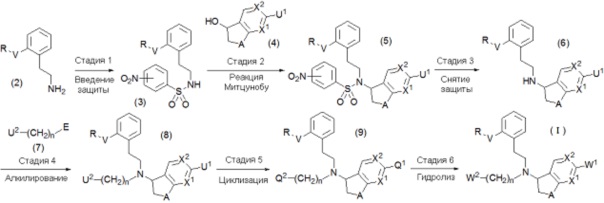
где значения A, n, X1, X2, W1, W2, R и V определены выше. Каждый из U1 и U2 соответствует W1 и W2, и если W1 и/или W2 представляет собой тетразолильную группу, то U1 и/или U2 представляет собой цианогруппу, и если W1 и/или W2 представляет собой карбоксильную группу, то U1 и/или U2 представляет собой CO2R6. Каждый из Q1 и Q2 соответствует W1 и W2, и если W1 и/или W2 представляет собой тетразолильную группу, то Q1 и/или Q2 также представляет собой тетразолильную группу, и если W1 и/или W2 представляет собой карбоксильную группу, то Q1 и/или Q2 представляет собой CO2R6. В настоящем документе, R6 представляет собой C1-C6алкильную группу. E представляет собой уходящую группу или гидроксильную группу.
Описанная в настоящем документе «уходящая группа» представляет собой группу, которая замещена в присутствии основания, или группу, содержащую активированный атом кислорода. Конкретные примеры включают в себя атом галогена; тригалогенметилоксигруппу, такую как трихлорметилокси; сульфонилоксигруппу низшего алкана, такую как метансульфонилоксигруппа или этансульфонилоксигруппа; сульфонилоксигруппу низшего галогеналкана, такую как трифторметансульфонилоксигруппа или пентафторэтансульфонилоксигруппа; и арилсульфонилоксильную группу, такую как бензолсульфонилоксигруппа, пара-толуолсульфонилоксигруппа или пара-нитробензолсульфонилоксигруппа.
Стадия 1: Введение нозильных защитных групп
Соединение (3) может быть получено путем осуществления взаимодействия соединения (2) с агентом для введения нитробензолсульфонильной группы в присутствии или в отсутствие основания, в отсутствие растворителя или в инертном растворителе. Примеры агента для введения нитробензолсульфонильной группы, который может быть использован, включают в себя 2-нитробензолсульфонилхлорид и 4-нитробензолсульфонилхлорид. Используемое количество агента для введения нитробензолсульфонильной группы относительно соединения (2) обычно составляет от 1 до 5 эквивалентов, и предпочтительно от 1 до 2 эквивалентов. Примеры основания, которое может быть использовано, включают в себя карбонатную соль щелочного металла, гидрокарбонатную соль щелочного металла, гидроксид щелочного металла и третичные органические амины, такие как триэтиламин или диизопропилэтиламин. Примеры растворителя, который может быть использован, включают в себя ароматические углеводороды, такие как бензол или толуол, нитрилы, такие как ацетонитрил, пропионитрил или бутиронитрил, галогенированные углеводороды, такие как хлороформ или дихлорметан, эфиры, такие как диэтиловый эфир или тетрагидрофуран (здесь и далее в настоящем документе именуемый THF), воду или их смесь. Температура реакции обычно составляет от -30°C до 40°C, и предпочтительно от 0°C до комнатной температуры. Время реакции обычно составляет от 0,5 до 24 часов, и предпочтительно от 0,5 до 3 часов.
При этом, соединение (2) либо является коммерчески доступным, либо может быть получено известным способом.
Стадия 2: Реакция Митцунобу
Соединение (5) может быть получено путем осуществления взаимодействия соединения (3) с соединением (4) в присутствии агента дегидратации и конденсации, в отсутствие растворителя или в инертном растворителе.
Используемое количество соединения (4) относительно соединения (3) обычно составляет от 1 до 3 эквивалентов, и предпочтительно от 1 до 1,5 эквивалентов. Примеры агента дегидратации и конденсации, который может быть использован, включают в себя сочетание соединения азодикарбоновой кислоты, такого как диэтилазодикарбоксилат или 1,1'-азобис(N,N-диметилформамид), и фосфинов, таких как трифенилфосфин или три-н-бутилфосфин. Используемое количество агента дегидратации и конденсации относительно соединения (3) обычно составляет от 1 до 3 эквивалентов, и предпочтительно от 1 до 1,5 эквивалентов, для каждого. Примеры растворителя, который может быть использован, включают в себя ароматические углеводороды, такие как бензол или толуол, галогенированные углеводороды, такие как хлороформ или дихлорметан, эфиры, такие как диэтиловый эфир или THF, и амиды, такие как N,N-диметилформамид (здесь и далее в настоящем документе именуемый DMF) или диметилацетамид. Температура реакции обычно составляет от -30°C до 40°C, и предпочтительно от 0°C до комнатной температуры. Время реакции обычно составляет от 1 до 48 часов, и предпочтительно от 1 до 24 часов.
При этом, соединение (4) либо является коммерчески доступным, либо может быть получено известным способом.
Стадия 3: Снятие нозильных защитных групп
Соединение (6) может быть получено путем осуществления взаимодействия соединения (5) в присутствии основания и агента для снятия защитных групп, в отсутствие растворителя или в инертном растворителе.
Используемый агент для снятия защитных групп представляет собой, например, первичные или вторичные органические амины, такие как н-пропиламин или пирролидин; и тиолы, такие как 1-додекантиол, тиофенол или тиогликолевая кислота. Используемое количество агента для снятия защитных групп относительно соединения (5) обычно составляет от 1 до 5 эквивалентов, и предпочтительно от 1 до 2 эквивалентов. Примеры основания, которое может быть использовано, включают в себя карбонатную соль щелочного металла, гидрокарбонатную соль щелочного металла, гидрид щелочного металла, алкоксид щелочного металла и третичные органические амины. Примеры растворителя, который может быть использован, включают в себя нитрилы, такие как ацетонитрил, пропионитрил или бутиронитрил, галогенированные углеводороды, такие как хлороформ или дихлорметан, амиды, такие как DMF или диметилацетамид, или их смесь. Температура реакции обычно составляет от -30°C до 40°C, и предпочтительно от 0°C до комнатной температуры. Время реакции обычно составляет от 1 до 48 часов, и предпочтительно от 1 до 24 часов.
Стадия 4: Алкилирование
Соединение (8) может быть получено путем осуществления взаимодействия соединения (6) с соединением (7) в присутствии основания, и при необходимости с добавкой, в отсутствие растворителя или в инертном растворителе. Используемое количество соединения (7) относительно соединения (6) обычно составляет от 1 до 5 эквивалентов, и предпочтительно от 1 до 3 эквивалентов. Примеры основания, которое может быть использовано, включают в себя карбонатную соль щелочного металла, гидрокарбонатную соль щелочного металла, гидрид щелочного металла, алкоксид щелочного металла и органические амины, такие как триэтиламин, диизопропилэтиламин или пиридин. Примеры добавки, которая может быть использована, включают в себя катализатор межфазного переноса, такой как йодид щелочного металла, соль тетрабутиламмония или краун-эфир. Примеры растворителя, который может быть использован, включают в себя ароматические углеводороды, такие как бензол или толуол, нитрилы, такие как ацетонитрил, пропионитрил или бутиронитрил, галогенированные углеводороды, такие как хлороформ или дихлорметан, кетоны, эфиры, такие как диэтиловый эфир или THF, спирты, такие как метанол, этанол или 2-пропанол, амиды, такие как DMF или диметилацетамид, или их смесь. Температура реакции обычно составляет от комнатной температуры до 150°C, и предпочтительно от комнатной температуры до 100°C. Время реакции обычно составляет от 5 до 72 часов, и предпочтительно от 8 до 48 часов.
Стадия 5: Циклизация тетразола
Если, по меньшей мере, один из U1 и U2 соединения (8) представляет собой цианогруппу, то соединение (9) может быть получено известным способом преобразования цианогруппы в тетразолильную группу, например, способом, предусматривающим взаимодействие в инертном растворителе в присутствии азидного соединения.
Примеры азидного соединения, которое может быть использовано, включают в себя азидную соль металла, триалкилазид олова, азид аммония и триметилсилилазид. На этой стадии, при необходимости, может быть надлежащим образом использована добавка. Примеры добавки, которая может быть использована, включают в себя хлорид алюминия, четвертичную соль аммония, соль магния, оксид диалкилолова и хлорид цинка. Примеры растворителя, который может быть использован, включают в себя ароматические углеводороды, такие как бензол или толуол, галогенированные углеводороды, такие как хлороформ или дихлорметан, эфиры, такие как диэтиловый эфир или THF, амиды, такие как DMF или диметилацетамид, или их смесь. Температура реакции обычно составляет от комнатной температуры до 180°C, и предпочтительно от 50°C до 120°C. Время реакции обычно составляет от 5 до 72 часов, и предпочтительно от 8 до 48 часов.
Стадия 6: Гидролиз
Если, по меньшей мере, один из Q1 и Q2соединения (9) представляет собой CO2R6, то соединение (1) общей формулы (1) может быть получено посредством деэстерификации соединения (9).
Реакция деэстерификации обычно может быть выполнена способом, хорошо известным из области синтетической органической химии, в зависимости от типа сложноэфирной группы (CO2R6). Например, соединение общей формулы (1) может быть получено путем проведения реакции гидролиза в присутствии основания.
Примеры основания, которое может быть использовано, включают в себя карбонатную соль щелочного металла, гидроксид щелочного металла, гидроксид щелочноземельного металла и алкоксид щелочного металла. Примеры растворителя, который может быть использован, включают в себя эфиры, такие как диэтиловый эфир или THF, спирты, такие как метанол, этанол или 2-пропанол, воду или их смесь. При этом для настоящей реакции гидролиза вода является необходимой. Температура реакции обычно составляет от 0°C до 150°C, и предпочтительно от комнатной температуры до 80°C. Время реакции обычно составляет от 1 до 48 часов, и предпочтительно от 3 до 24 часов.
При этом, если в общей формуле (1) W1 и W2 оба представляют собой карбоксильную группу, то стадия 5 может быть пропущена. Кроме того, если W1 и W2 оба представляют собой тетразолильную группу, то стадия 6 может быть пропущена. Кроме того, оптически активное соединение общей формулы (1) может быть получено путем проведения реакции деэстерификации оптически активных соединений (8) и (9). Кроме того, применительно к соединению общей формулы (1), оптически активное соединение общей формулы (1) может быть также получено посредством HPLC фракционирования с использованием хиральной колонки.
Если V представляет собой O, CH(CH3)O- или CH2O, то соединение общей формулы (1) может быть получено посредством получения соединения (8) способом, представленным ниже на схеме, из соединения (11), которое получают из соединения следующей формулы (10) согласно тому же способу, что и представленный выше на стадии 1-4

где R7 представляет собой защитную группу для гидроксильной группы.

где значения A, n, X1, X2, R, U1, U2, E и R7 определены выше, V представляет собой O, CH(CH3)O- или CH2O, и G представляет собой простую связь или метиленовую группу. При этом, соединение (10) либо является коммерчески доступным, либо может быть получено известным способом.
Стадия 7: Снятие защитных групп
Соединение (12) может быть получено посредством снятия защитных групп с соединения (11).
Снятие защитных групп обычно может быть выполнено способом, хорошо известным в области синтетической органической химии (например, способом, раскрытым T. W. Greene, P. G. Wuts, Greene's Protective Groups in Organic Synthesis. Fourth Edition, 2006, John Wiley & Sons, Inc.).
Стадия 8: Алкилирование и реакция Митцунобу
Если E в соединении (13) представляет собой уходящую группу, то соединение (8) может быть получено из соединения (12) и соединения (13) согласно тому же способу, что и представленный выше на стадии 4.
Кроме того, если E в соединении (13) представляет собой гидроксильную группу, то соединение (8) может быть получено из соединения (12) и соединения (13) согласно тому же способу, что и представленный выше на стадии 2.
Более того, соединение общей формулы (1) может быть также получено посредством получения соединения (6) способом согласно следующей схеме

где значения A, X1, X2, R, V и U1 определены выше.
Стадия 9: Окисление
Соединение (15) может быть получено путем осуществления взаимодействия соединения (14) и окислителя в инертном растворителе.
Примеры окислителя, который может быть использован, включают в себя гипервалентные соединения йода, такие как 1,1,1-триацетокси-1,1-дигидро-1,2-бензйодоксол-3(1H)-он (DMP) или 1-гидрокси-1,2-бензйодоксол-3(1H)-он-1-оксид (IBX); сочетание алкоксида алюминия и акцептора водорода, такого как бензохинон, бензофенон, ацетон или бензальдегид; сочетание перрутената тетрапропиламмония (TPAP) или 2,2,6,6-тетраметил-1-пиперидинилокси-радикала (TEMPO) и со-окислителя, такого как гипохлорит, гипобромид или N-хлорсукцинимид; и сочетание диметилсульфоксида (здесь и далее в настоящем документе именуемого DMSO) и электрофильного активирующего реагента, такого как дициклогексилкарбодиимид, пентоксид фосфора, уксусный ангидрид или оксалилхлорид. Используемое количество окислителя относительно соединения (14) обычно составляет от 1 до 10 эквивалентов, и предпочтительно от 1 до 3 эквивалентов. На этой стадии, при необходимости, может быть добавлено основание, такое как пиридин или гидрокарбонат натрия. Примеры растворителя, который может быть использован, включают в себя ароматические углеводороды, такие как бензол или толуол, нитрилы, такие как ацетонитрил, пропионитрил или бутиронитрил, галогенированные углеводороды, такие как хлороформ или дихлорметан, эфиры, такие как диэтиловый эфир или THF, сложные эфиры, такие как этилацетат, пропилацетат или бутилацетат, амиды, такие как DMF или диметилацетамид, сульфоксиды, такие как DMSO или сульфолан, или их смесь. Температура реакции обычно составляет от -30°C до 100°C, и предпочтительно от 0°C до комнатной температуры. Время реакции обычно составляет от 0,5 до 24 часов, и предпочтительно от 1 до 8 часов.
Стадия 10: Восстановительное аминирование
Соединение (6) может быть получено путем осуществления взаимодействия соединения (15) с соединением (16) в присутствии или в отсутствие кислоты, в отсутствие растворителя или в инертном растворителе, с получением сначала основания Шиффа с его последующим взаимодействием в присутствии восстановителя.
Используемое количество соединения (16) относительно соединения (15) обычно составляет от 1 до 3 эквивалентов, и предпочтительно от 1 до 1,5 эквивалентов. Примеры кислоты, которая может быть использована, включают в себя неорганическую кислоту, такую как соляная кислота, бромистоводородная кислота, фосфорная кислота или серная кислота, и органическую кислоту, такую как муравьиная кислота, уксусная кислота, пропионовая кислота, метансульфоновая кислота или пара-толуолсульфоновая кислота. Примеры восстановителя, который может быть использован, включают в себя боргидридное соединение, такое как комплекс боран-тетрагидрофуран, боргидрид натрия, цианоборгидрид натрия, триацетоксиборгидрид натрия; алюмогидридное соединение, такое как алюмогидрид лития; и водород. Используемое количество восстановителя относительно соединения (15) обычно составляет от 1 до 10 эквивалентов, и предпочтительно от 1 до 5 эквивалентов. Примеры растворителя, который может быть использован, включают в себя ароматические углеводороды, такие как бензол или толуол, галогенированные углеводороды, такие как хлороформ или дихлорметан, эфиры, такие как диэтиловый эфир или THF, сложные эфиры, такие как этилацетат, пропилацетат или бутилацетат, спирты, такие как метанол, этанол или 2-пропанол, или смесь этого. Температура реакции обычно составляет от -78°C до 150°C, и предпочтительно от 0°C до 60°C. Время реакции обычно составляет от 5 минут до 24 часов, и предпочтительно от 30 минут до 4 часов.
При этом соединение (16) либо является коммерчески доступным, либо может быть получено известным способом.
Соединение согласно настоящему изобретению, которое получают, как описано выше, характеризуется способностью активировать sGC и превосходной гем-независимостью, что продемонстрировано в последующих тестовых примерах. Поэтому соединение согласно настоящему изобретению применимо в качестве фармацевтического средства для профилактики и лечения связанных с sGC нарушений у животных, включая людей, в частности, различных нарушений, для которых способность активировать sGC является эффективной. Примеры таких нарушений включают в себя сердечную недостаточность, гипертензию, легочную гипертензию или ишемическую болезнь сердца.
Если соединение согласно настоящему изобретению используют в качестве фармацевтического средства, то введение может осуществляться как посредством перорального введения, так и парентерального введения. Дозу соединения согласно настоящему изобретению подходящим образом определяют в соответствии с конкретными случаями с учетом, например, подлежащего лечению заболевания или симптома, возраста, массы тела или пола субъекта, которому выполняют введение. Обычно, в случае перорального введения доза соединения согласно настоящему изобретению для взрослого человека (масса тела приблизительно 60 кг) составляет в сутки соответственно от 1 мг до 1000 мг, предпочтительно от 3 мг до 300 мг, и более предпочтительно от 10 мг до 200 мг, и ее вводят однократно или 2 4 раздельными дозами. Кроме того, в случае внутривенного введения доза для взрослого человека в сутки составляет соответственно от 0,01 мг до 100 мг, предпочтительно от 0,01 мг до 50 мг, и более предпочтительно от 0,01 мг до 20 мг на килограмм веса, и ее вводят в течение суток однократно или в виде множества раздельных доз.
Фармацевтическая композиция согласно настоящему изобретению может быть приготовлена общим способом с использованием, по меньшей мере, одного типа соединения согласно настоящему изобретению и фармацевтически приемлемой добавки.
Примеры фармацевтической композиции согласно настоящему изобретению для перорального введения включают в себя таблетку, пилюлю, капсулу, гранулу, порошок, эмульсию, раствор, суспензию, сироп и эликсир. Они, как правило, могут быть приготовлены в виде фармацевтической композиции, в которой смешаны, по меньшей мере, один тип соединения согласно настоящему изобретению и добавка, такая как фармацевтически приемлемый разбавитель, наполнитель или носитель. Также возможно содержание добавки, такой как связующее вещество, разрыхлитель, смазка, вызывающее набухание средство, способствующее набуханию средство, глазировочное средство, пластификатор, стабилизатор, антисептическое средство, антиоксидант, краситель, способствующее растворению средство, способствующее суспендированию средство, эмульгатор, подсластитель, консервант, буферное вещество или увлажнитель.
Примеры фармацевтической композиции согласно настоящему изобретению для парентерального введения включают в себя инъекционный раствор, суппозиторий, глазные капли, ингаляционное средство, мазь, гель, крем и пластырь. Они, как правило, могут быть приготовлены в виде фармацевтической композиции, в которой смешаны, по меньшей мере, один тип соединения согласно настоящему изобретению и добавка, такая как фармацевтически приемлемый разбавитель, вспомогательное средство или носитель. Также возможно содержание добавки, такой как стабилизатор, антисептическое средство, способствующее растворению средство, увлажняющее средство, консервант, антиоксидант, вкусоароматизатор, гелеобразующее средство, нейтрализующее средство, буферное вещество, изотоническое средство, поверхностно-активное вещество, краситель, забуферивающее средство, загуститель, увлажнитель, наполнитель, усилитель всасывания, способствующее суспендированию средство или связующее вещество.
Кроме того, поскольку это не противоречит цели настоящего изобретения, фармацевтическая композиция, содержащая соединение согласно настоящему изобретению может подходящим образом содержать другой тип фармацевтически эффективного компонента, подобного диуретикам.
Здесь и далее в настоящем документе, настоящее изобретение конкретно описывается посредством примеров, однако настоящее изобретение ими не ограничивается.
Справочный пример 1: простой метоксиметил-2-(2-нитровинил)фениловый эфир
2-Метоксиметоксибензальдегид (16,4 г) суспендировали в нитрометане (54 мл), добавляли ацетат аммония (5,95 г), и перемешивали в течение 30 минут при 80°C. После охлаждения до комнатной температуры растворитель выпаривали в условиях пониженного давления, остаток суспендировали в воде, а затем экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором в указанном порядке и сушили над безводным сульфатом натрия. Затем, растворитель выпаривали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на диол-силикагеле (5% этилацетат в гексане) с получением указанного в заголовке соединения (11,6 г) в виде желтого масла.
1H-ЯМР (CDCl3) δ: 8,22 (1H, д, J=13,6 Гц), 7,83 (1H, д, J=13,6 Гц), 7,50-7,41 (2H, м), 7,23 (1H, дд, J=8,4, 0,9 Гц), 7,07 (1H, ддд, J=8,4, 7,5, 1,1 Гц), 5,33 (2H, с), 3,52 (3H, с).
Справочный пример 2: 2-(2-метоксиметоксифенил)этиламин
Алюмогидрид лития (6,30 г) суспендировали в тетрагидрофуране (здесь и далее в настоящем документе, именуемом THF) (400 мл), при охлаждении на льду по каплям добавляли раствор соединения справочного примера 1 (11,6 г) в THF (100 мл), и нагревали с обратным холодильником в течение 30 минут. При охлаждении на льду, малыми порциями добавляли декагидрат сульфата натрия (21,4 г), перемешивали в течение 15 минут при комнатной температуре, и фильтровали через целит. Растворитель выпаривали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (20% метанол в хлороформе) с получением указанного в заголовке соединения (6,73 г) в виде желтого масла.
1H-ЯМР (CDCl3) δ: 7,21-7,15 (2H, м), 7,09-7,06 (1H, м), 6,97-6,92 (1H, м), 5,21 (2H, с), 3,48 (3H, с), 2,95 (2H, т, J=6,9 Гц), 2,79 (2H, т, J=6,9 Гц).
Справочный пример 3: метил-3-меркаптобензоат
3-Меркаптобензойную кислоту (10,0 г) суспендировали в метаноле (310 мл), добавляли серную кислоту (0,3 мл), и перемешивали в течение 24 часов при нагревании с обратным холодильником. После охлаждения до комнатной температуры растворитель выпаривали в условиях пониженного давления, и добавляли к остаткам воду. После корректировки значения pH смеси до 8 с использованием насыщенного водного раствора гидрокарбоната натрия смесь экстрагировали этилацетатом и сушили над безводным сульфатом натрия. После отгонки растворителя в условиях пониженного давления остаток очищали методом колоночной хроматографии на силикагеле (10% этилацетат в гексане) с получением указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 7,95 (1H, дд, J=2,0, 1,5 Гц), 7,82 (1H, ддд, J=7,7, 1,5, 1,3 Гц), 7,45 (1H, ддд, J=7,9, 2,0, 1,3 Гц), 7,31 (1H, дд, J=7,9, 7,7 Гц), 3,91 (3H, с), 3,54 (1H, с).
Справочный пример 4: 3-(3-метоксикарбонилфенилсульфанил)пропионовая кислота
Соединение справочного примера 3 (10,3 г) растворяли в ацетоне (150 мл), в условиях охлаждения на льду добавляли карбонат калия (17,0 г) и 3-бромпропионовую кислоту (10,3 г), и перемешивали в течение 2,5 часов при комнатной температуре. Растворитель выпаривали в условиях пониженного давления, и суспендировали остаток в воде. После корректировки значения pH смеси до 1 с использованием 6 М соляной кислоты смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором в указанном порядке и сушили над безводным сульфатом натрия. Затем, растворитель выпаривали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (50% этилацетат в гексане) с получением указанного в заголовке соединения (14,5 г) в виде белого порошка.
1H-ЯМР (CDCl3) δ: 8,03 (1H, дд, J=1,8, 1,7 Гц), 7,88 (1H, ддд, J=7,9, 1,7, 1,1 Гц), 7,55 (1H, ддд, J=7,7, 1,8, 1,1 Гц), 7,38 (1H, дд, J=7,9, 7,7 Гц), 3,92 (3H, с), 3,22 (2H, т, J=7,3 Гц), 2,70 (2H, т, J=7,3 Гц).
Справочный пример 5: метил-4-оксотиохроман-7-карбоксилат
Соединение справочного примера 4 (2,40 г) суспендировали в полифосфорной кислоте (13 мл) и перемешивали в течение 15 минут при 70°C. После охлаждения до комнатной температуры к смеси добавляли лед и воду. После экстрагирования этилацетатом органический слой промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором в указанном порядке и сушили над безводным сульфатом натрия. Затем, растворитель выпаривали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (5% этилацетат в гексане) с получением указанного в заголовке соединения (0,36 г) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 8,16 (1H, д, J=8,2 Гц), 7,96 (1H, д, J=1,6 Гц), 7,78 (1H, дд, J=8,2, 1,6 Гц), 3,94 (3H, с), 3,30-3,25 (2H, м), 3,04-3,00 (2H, м).
Справочный пример 6: 5,6,7,8-тетрагидрохинолин-5-он-N-оксид
5,6,7,8-Тетрагидрохинолин-5-он (7,12 г) растворяли в дихлорметане (138 мл), в условиях охлаждения на льду добавляли 3-хлорпероксибензойную кислоту (14,5 г), и перемешивали в течение 4 часов при той же температуре. После добавления насыщенного водного раствора гидрокарбоната натрия и разбавления хлороформом нерастворимые вещества удаляли путем фильтрования через целит. После добавления 1 М водного раствора гидроксида натрия смесь экстрагировали хлороформом и сушили над безводным сульфатом натрия. Затем, растворитель выпаривали в условиях пониженного давления. Остаток суспендировали в диэтиловом эфире и собирали путем фильтрования с получением указанного в заголовке соединения (6,61 г) в виде порошка желтого цвета.
1H-ЯМР (CDCl3) δ: 8,44 (1H, дд, J=6,4, 0,9 Гц), 7,87 (1H, дд, J=8,0, 0,9 Гц), 7,32-7,25 (1H, м), 3,24 (2H, т, J=6,2 Гц), 2,74-2,65 (2H, м), 2,28-2,17 (2H, м).
Справочный пример 7: 2-циан-5,6,7,8-тетрагидрохинолин-5-он
Соединение справочного примера 6 (6,59 г) растворяли в дихлорметане (81 мл), в условиях охлаждения на льду добавляли триметилсилилцианид (17,9 мл) и N,N-диметилкарбамоилхлорид (8,19 мл), и перемешивали в течение 2,3 часов при комнатной температуре и в течение 4,5 часов при 30°C. После охлаждения до комнатной температуры добавляли 2 М водный раствор гидроксида натрия и энергично перемешивали. После этого, проводили экстрагирование хлороформом. Экстракт сушили над безводным сульфатом натрия, и выпаривали растворитель в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (4-30% этилацетат в гексане) с получением указанного в заголовке соединения (6,07 г) в виде порошка бледно-коричневого цвета.
1H-ЯМР (CDCl3) δ: 8,40 (1H, д, J=8,0 Гц), 7,68 (1H, д, J=8,0 Гц), 3,21 (2H, т, J=6,3 Гц), 2,79-2,72 (2H, м), 2,31-2,18 (2H, м).
Справочный пример 8: 5-оксо-5,6,7,8-тетрагидрохинолин-2-карбоновая кислота
Соединение справочного примера 7 (6,05 г) добавляли к конц. соляной кислоте (70 мл), и перемешивали в течение 14 часов при нагревании с обратным холодильником. После охлаждения до комнатной температуры конц. соляную кислоту упаривали в условиях пониженного давления. Остаток растворяли в 25% растворе метанола в хлороформе, промывали насыщенным солевым раствором, и сушили над безводным сульфатом натрия. Растворитель выпаривали в условиях пониженного давления, остаток суспендировали в диизопропиловом эфире и собирали путем фильтрования с получением указанного в заголовке соединения (6,38 г) в виде порошка бледно-коричневого цвета.
1H-ЯМР (CDCl3) δ: 8,53 (1H, д, J=8,0 Гц), 8,19 (1H, д, J=8,0 Гц), 3,23 (2H, т, J=6,3 Гц), 2,81-2,75 (2H, м), 2,32-2,21 (2H, м).
Справочный пример 9: метил-5-оксо-5,6,7,8-тетрагидрохинолин-2-карбоксилат
В соответствии со способом, описанным в справочном примере 3, указанное в заголовке соединение (731 мг) получали из соединения справочного примера 8 (980 мг) в виде бледно-коричневого порошка.
1H-ЯМР (CDCl3) δ: 8,42 (1H, д, J=8,1 Гц), 8,09 (1H, д, J=8,1 Гц), 4,03 (3H, с), 3,27 (2H, т, J=6,0 Гц), 2,78-2,72 (2H, м), 2,30-2,18 (2H, м).
Справочный пример 10: 2,3-дигидро-3-оксобензофуран-6-ила трифторметансульфонат
2,3-Дигидро-6-гидрокси-3-оксобензофуран (2,00 г) растворяли в дихлорметане (22 мл), добавляли пиридин (5,39 мл), и в условиях охлаждения на льду по каплям добавляли трифторметансульфоновый ангидрид (2,69 мл). После перемешивания при той же температуре в течение 2 часов растворитель выпаривали в условиях пониженного давления. Остаток разбавляли этилацетатом, промывали водой и насыщенным солевым раствором в указанном порядке, и сушили над безводным сульфатом натрия. После выпаривания растворителя в условиях пониженного давления остаток очищали методом колоночной хроматографии на силикагеле (5-20% этилацетат в гексане), суспендировали в смеси гексан/диизопропиловый эфир, и собирали путем фильтрования с получением указанного в заголовке соединения (1,84 г) в виде порошка желтого цвета.
1H-ЯМР (CDCl3) δ: 7,77 (1H, д, J=8,4 Гц), 7,10 (1H, д, J=2,0 Гц), 7,02 (1H, дд, J=8,4, 2,0 Гц), 4,73 (2H, с).
Справочный пример 11: 2,3-дигидро-3-гидроксибензофуран-6-ила трифторметансульфонат
Соединение справочного примера 10 (940 мг) растворяли в THF (15 мл), в условиях охлаждения на льду несколькими отдельными порциями добавляли боргидрид натрия (146 мг), и перемешивали при той же температуре в течение 1,5 часов. В условиях охлаждения на льду, добавляли насыщенный водный раствор хлорида аммония, а затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, и выпаривали растворитель в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (6-35% этилацетат в гексане) с получением указанного в заголовке соединения (785 мг) в виде желтого масла.
1H-ЯМР (CDCl3) δ: 7,47 (1H, д, J=8,2 Гц), 6,86 (1H, дд, J=8,2, 2,2 Гц), 6,80 (1H, д, J=2,2 Гц), 5,40 (1H, ддд, J=6,8, 6,8, 2,8 Гц), 4,66 (1H, дд, J=10,9, 6,8 Гц), 4,53 (1H, дд, J=10,9, 2,8 Гц), 2,01 (1H, д, J=6,8 Гц).
Справочный пример 12: метил-2,3-дигидро-3-гидроксибензофуран-6-карбоксилат
Соединение справочного примера 11 (155 мг) растворяли в DMF (3,0 мл), добавляли метанол (0,40 мл), триэтиламин (0,38 мл), 1,3-бис(дифенилфосфино)пропан (11,2 мг) и ацетат палладия (II) (6,10 мг), и перемешивали в атмосфере монооксида углерода в условиях обычного давления в течение 3 часов. После охлаждения до комнатной температуры смесь разбавляли водой и экстрагировали диэтиловым эфиром. Органический слой промывали водой и насыщенным солевым раствором в указанном порядке и сушили над безводным сульфатом натрия. Растворитель выпаривали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (33% этилацетат в гексане) с получением указанного в заголовке соединения (75,0 мг) в виде светло-розового порошка.
1H-ЯМР (CDCl3) δ: 7,66 (1H, дд, J=7,7, 1,5 Гц), 7,52 (1H, д, J=1,5 Гц), 7,47 (1H, д, J=7,7 Гц), 5,41 (1H, ддд, J=6,8, 6,8, 2,9 Гц), 4,62 (1H, дд, J=10,8, 6,8 Гц), 4,50 (1H, дд, J=10,8, 2,9 Гц), 3,91 (3H, с), 2,05 (1H, д, J=6,8 Гц).
Справочный пример 13: 4-оксоизохроман-7-ила трифторметансульфонат
В соответствии со способом, описанным в справочном примере 10, указанное в заголовке соединение (1,70 г) получали из 7-гидроксиизохроман-4-она (1,00 г) в виде белого порошка.
1H-ЯМР (CDCl3) δ: 8,16 (1H, д, J=8,6 Гц), 7,32 (1H, дд, J=8,6, 2,4 Гц), 7,18 (1H, д, J=2,4 Гц), 4,93 (2H, с), 4,40 (2H, с).
Справочный пример 14: метил-4-оксоизохроман-7-карбоксилат
В соответствии со способом, описанным в справочном примере 12, указанное в заголовке соединение (588 мг) получали из соединения справочного примера 13 (1,50 г) в виде белого порошка.
1H-ЯМР (CDCl3) δ: 8,13-8,04 (2H, м), 7,92 (1H, с), 4,94 (2H, с), 4,41 (2H, с), 3,96 (3H, с).
Справочный пример 15: метил-5-гидрокси-6,7,8,9-тетрагидро-5H-бензоциклогептен-2-карбоксилат
В соответствии со способом, описанным в справочном примере 11, указанное в заголовке соединение (526 мг) получали из метил-5-оксо-6,7,8,9-тетрагидро-5H-бензоциклогептен-2-карбоксилата (523 мг) в виде белого порошка.
1H-ЯМР (CDCl3) δ: 7,88 (1H, дд, J=8,1, 1,6 Гц), 7,77 (1H, д, J=1,6 Гц), 7,56 (1H, д, J=8,1 Гц), 5,01-4,96 (1H, м), 3,90 (3H, с), 2,99-2,91 (1H, м), 2,79-2,71 (1H, м), 2,08-1,97 (2H, м), 1,89 (1H, д, J=4,0 Гц), 1,85-1,68 (3H, м), 1,46-1,33 (1H, м).
Соединения справочных примеров 16-18, которые были получены в соответствии со способом, описанным в справочном примере 15, с использованием соединений справочных примеров 5, 9 и 14, представлены в таблице 1.
Справочный пример 19: 4-(фенилсульфанилметил)бензиловый спирт
Метил-4-(фенилсульфанилметил)бензоат (1,07 г) растворяли в THF (14 мл), в условиях охлаждения на льду малыми порциями добавляли алюмогидрид лития (200 мг), и перемешивали в течение 40 минут при той же температуре. В условиях охлаждения на льду малыми порциями добавляли декагидрат сульфата натрия, и фильтровали через целит. Растворитель выпаривали в условиях пониженного давления. Остаток суспендировали в гексане и собирали путем фильтрования с получением указанного в заголовке соединения (910 мг) в виде белого порошка.
1H-ЯМР (DMSO-D6) δ: 7,34-7,12 (9H, м), 5,10 (1H, т, J=5,7 Гц), 4,44 (2H, д, J=5,7 Гц), 4,21 (2H, с).
Справочный пример 20: N-[4-(тетрагидро-2H-пиран-2-илоксиметил)бензил]-N-фенил-2-нитробензолсульфонамид
N-Фенил-2-нитробензолсульфонамид (1,95 г) растворяли в DMF (15 мл), в условиях охлаждения на льду добавляли раствор карбоната калия (1,16 г) и 2-(4-хлорметилбензилокси)тетрагидро-2H-пиран (2,02 г) в DMF (3 мл), и перемешивали в течение 18 часов при 40°C. После охлаждения до комнатной температуры растворитель выпаривали в условиях пониженного давления. Остаток суспендировали в воде и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором в указанном порядке и сушили над безводным сульфатом натрия. Затем, растворитель выпаривали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (33% этилацетат в гексане) с получением указанного в заголовке соединения (3,29 г) в виде масла желтого цвета.
1H-ЯМР (CDCl3) δ: 7,66-7,64 (2H, м), 7,54-7,42 (2H, м), 7,27-7,17 (7H, м), 7,12-7,06 (2H, м), 4,95 (2H, с), 4,73 (1H, д, J=12,1 Гц), 4,68-4,66 (1H, м), 4,45 (1H, д, J=12,1 Гц), 3,92-3,85 (1H, м), 3,54-3,49 (1H, м), 1,89-1,51 (6H, м).
Справочный пример 21: N-(4-гидроксиметилбензил)-N-фенил-2-нитробензолсульфонамид
Соединение справочного примера 20 (3,37 г) растворяли в метаноле (35 мл), добавляли моногидрат пара-толуолсульфоновой кислоты (133 мг), и перемешивали в течение 30 минут при комнатной температуре. Растворитель выпаривали в условиях пониженного давления, и растворяли остаток в этилацетате. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором в указанном порядке и сушили над безводным сульфатом натрия. Затем, растворитель выпаривали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (50% этилацетат в гексане) с получением указанного в заголовке соединения (2,57 г) в виде порошка бледно-коричневого цвета.
1H-ЯМР (CDCl3) δ: 7,66-7,65 (2H, м), 7,54-7,43 (2H, м), 7,26-7,17 (7H, м), 7,10-7,06 (2H, м), 4,95 (2H, с), 4,64 (2H, д, J=5,1 Гц), 1,63 (1H, т, J=5,1 Гц).
Справочный пример 22: 4-(3-метил-1-бутин-1-ил)бензиловый спирт
4-Йодбензиловый спирт (1,00 г) растворяли в DMF (17 мл), добавляли йодид меди (I) (97,7 мг), триэтиламин (0,89 мл) и 3-метил-1-бутин (1,27 мл), и перемешивали в течение 10 минут в атмосфере аргона. Затем, к смеси добавляли хлоридбис(трифенилфосфин)палладия (II) (300 мг), и перемешивали в течение 4,3 часов при комнатной температуре в атмосфере аргона. После фильтрования через целит смесь промывали этилацетатом, и выпаривали растворитель в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (6-40% этилацетат в гексане) с получением указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (CDCl3) δ: 7,38 (2H, д, J=8,3 Гц), 7,27 (2H, д, J=8,3 Гц), 4,67 (2H, д, J=5,5 Гц), 2,85-2,70 (1H, м), 1,66 (1H, т, J=5,5 Гц), 1,26 (6H, д, J=7,0 Гц).
Соединения справочных примеров 23 и 24, которые были получены с использованием соответствующих веществ в соответствии со способом, описанным в справочном примере 22, представлены в таблице 2.
Справочный пример 25: 4-((E)-2-циклогексилвинил)бензиловый спирт
4-Йодбензиловый спирт (2,34 г) растворяли в DMF (40 мл), добавляли винилциклогексан (1,32 г), триэтиламин (1,81 мл) и хлорид бис(трифенилфосфин)палладия (II) (700 мг), и перемешивали в течение 23 часов при 80°C. После охлаждения до комнатной температуры растворитель выпаривали в условиях пониженного давления, и очищали остаток методом колоночной хроматографии на силикагеле (8-30% этилацетат в гексане) с получением указанного в заголовке соединения (672 мг) в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 7,34-7,19 (4H, м), 6,29 (1H, д, J=16,0 Гц), 6,13 (1H, дд, J=16,0, 6,8 Гц), 4,67-4,56 (3H, м), 2,15-2,00 (1H, м), 1,82-1,51 (4H, м), 1,37-1,04 (6H, м).
Справочный пример 26: 4-(2-циклогексилэтил)бензиловый спирт
Соединение справочного примера 25 (283 мг) растворяли в метаноле (7,0 мл), добавляли палладий-фиброин (57,0 мг), и перемешивали в атмосфере водорода в условиях нормального давления при комнатной температуре в течение 45 минут. После фильтрования через целит смесь промывали метанолом, и выпаривали растворитель в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (5-35% этилацетат в гексане) с получением указанного в заголовке соединения (206 мг) в виде желтого порошка.
1H-ЯМР (CDCl3) δ: 7,27 (2H, д, J=8,1 Гц), 7,17 (2H, д, J=8,1 Гц), 4,66 (2H, д, J=5,9 Гц), 2,66-2,57 (2H, м), 1,82-1,60 (5H, м), 1,57-1,44 (3H, м), 1,32-1,10 (4H, м), 1,01-0,85 (2H, м).
Справочный пример 27: метил-транс-4-((E)-2-фенилвинил)циклогексанкарбоксилат
В соответствии со способом, описанным в справочном примере 25, указанное в заголовке соединение (326 мг) получали из метил-транс-4-винилциклогексанкарбоксилата (492 мг) в виде твердого вещества коричневого цвета.
1H-ЯМР (CDCl3) δ: 7,39-7,12 (5H, м), 6,36 (1H, д, J=15,9 Гц), 6,14 (1H, дд, J=15,9, 7,0 Гц), 3,68 (3H, с), 2,35-2,21 (1H, м), 2,19-1,99 (3H, м), 1,97-1,87 (2H, м), 1,60-1,43 (2H, м), 1,30-1,14 (2H, м).
Справочный пример 28: транс-4-((E)-2-фенилвинил)циклогексилметиловый спирт
В соответствии со способом, описанным в справочном примере 19, указанное в заголовке соединение (99,0 мг) получали из соединения справочного примера 27 (120 мг) в виде белого порошка.
1H-ЯМР (CDCl3) δ: 7,38-7,22 (4H, м), 7,21-7,14 (1H, м), 6,36 (1H, д, J=16,0 Гц), 6,16 (1H, дд, J=16,0, 7,0 Гц), 3,48 (2H, д, J=6,2 Гц), 2,17-2,01 (1H, м), 1,95-1,79 (4H, м), 1,64-1,31 (2H, м), 1,30-1,15 (2H, м), 1,12-0,96 (2H, м).
Справочный пример 29: метил-транс-4-(2-фенилэтил)циклогексанкарбоксилат
Соединение справочного примера 27 (200 мг) растворяли в метаноле (5,0 мл), добавляли 5% палладированный уголь (80,0 мг), и перемешивали в атмосфере водорода при давлении 3 атм. при комнатной температуре в течение 7,3 часов. После фильтрования через целит смесь промывали метанолом, и выпаривали растворитель в условиях пониженного давления. Остаток разбавляли этилацетатом, промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель выпаривали в условиях пониженного давления, и очищали остаток методом колоночной хроматографии на силикагеле (5% этилацетат в гексане) с получением указанного в заголовке соединения (192 мг) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 7,31-7,23 (2H, м), 7,21-7,11 (3H, м), 3,66 (3H, с), 2,66-2,58 (2H, м), 2,25 (1H, тт, J=12,3, 3,5 Гц), 2,03-1,93 (2H, м), 1,92-1,83 (2H, м), 1,57-1,20 (5H, м), 0,97 (2H, ддд, J=16,3, 13,4, 3,5 Гц).
Справочный пример 30: транс-4-(2-фенилэтил)циклогексилметиловый спирт
В соответствии со способом, описанным в справочном примере 19, указанное в заголовке соединение (166 мг) получали из соединения справочного примера 29 (190 мг) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 7,31-7,23 (2H, м), 7,21-7,12 (3H, м), 3,45 (2H, д, J=6,4 Гц), 2,66-2,59 (2H, м), 1,91-1,74 (4H, м), 1,60-1,16 (5H, м), 1,06-0,82 (4H, м).
Справочный пример 31: метил-цис-4-((E)-2-фенилвинил)циклогексанкарбоксилат
Бромид бензилтрифенилфосфония (2,94 г) растворяли в THF (23,0 мл), при -20°C малыми порциями добавляли трет-бутоксид калия (1,07 г), и перемешивали в течение 1 часа при той же температуре. Затем, по каплям в течение 35 минут добавляли раствор метил-цис-4-формилциклогексанкарбоксилата (1,00 г) в THF (6,0 мл), и перемешивали в течение 1,6 часов при той же температуре. После повышения температуры до комнатной смесь перемешивали после добавления воды и экстрагировали толуолом. Органический слой промывали водой и насыщенным солевым раствором в указанном порядке. После сушки над безводным сульфатом натрия растворитель выпаривали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (9% этилацетат в гексане) с получением указанного в заголовке соединения (268 мг) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 7,37-7,15 (5H, м), 6,37 (1H, д, J=16,6 Гц), 6,22 (1H, дд, J=16,6, 6,6 Гц), 3,69 (3H, с), 2,62-2,50 (1H, м), 2,38-2,24 (1H, м), 2,10-2,00 (3H, м), 1,76-1,42 (5H, м).
Справочный пример 32: метил-цис-4-(2-фенилэтил)циклогексанкарбоксилат
В соответствии со способом, описанным в справочном примере 29, указанное в заголовке соединение (248 мг) получали из соединения справочного примера 31 (268 мг) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 7,31-7,23 (2H, м), 7,20-7,13 (3H, м), 3,68 (3H, с), 2,64-2,48 (3H, м), 2,05-1,92 (2H, м), 1,67-1,23 (9H, м).
Справочный пример 33: цис-4-(2-фенилэтил)циклогексилметиловый спирт
В соответствии со способом, описанным в справочном примере 19, указанное в заголовке соединение (208 мг) получали из соединения справочного примера 32 (248 мг) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 7,31-7,24 (2H, м), 7,21-7,14 (3H, м), 3,54 (2H, т, J=5,3 Гц), 2,64-2,56 (2H, м), 1,72-1,32 (12H, м), 1,25-1,18 (1H, м).
Справочный пример 34: 6-тиохроманкарбальдегид
6-Бромтиохроман (1,00 г) растворяли в THF (15,0 мл), при -78°C по каплям добавляли 2,69 М раствор н-бутиллития в гексане (3,24 мл), и перемешивали в течение 1 часа при той же температуре. После добавления DMF (0,71 мл) при той же температуре смесь перемешивали в течение 16 часов, повышая температуру до комнатной. Добавляли насыщенный водный раствор хлорида аммония, и после экстрагирования этилацетатом промывали органический слой насыщенным солевым раствором. После сушки над безводным сульфатом натрия растворитель выпаривали в условиях пониженного давления, и очищали остаток методом колоночной хроматографии на силикагеле (2-15% этилацетат в гексане) с получением указанного в заголовке соединения (342 мг) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 9,85 (1H, с), 7,57-7,48 (2H, м), 7,21 (1H, д, J=8,1 Гц), 3,12-3,05 (2H, м), 2,89 (2H, т, J=6,1 Гц), 2,20-2,10 (2H, м).
Справочный пример 35: 6-тиохроманметиловый спирт
Соединение справочного примера 34 (340 мг) растворяли в метаноле (10 мл), в условиях охлаждения на льду несколькими отдельными порциями добавляли боргидрид натрия (91,2 мг), и перемешивали при той же температуре в течение 1 часа. В условиях охлаждения на льду добавляли насыщенный водный раствор хлорида аммония, а затем перемешивали. Растворитель выпаривали в условиях пониженного давления. После разбавления этилацетатом смесь промывали водой и насыщенным солевым раствором в указанном порядке. После сушки над безводным сульфатом натрия растворитель выпаривали в условиях пониженного давления, и очищали остаток методом колоночной хроматографии на силикагеле (6-50% этилацетат в гексане) с получением указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 7,11-7,01 (3H, м), 4,58 (2H, д, J=5,1 Гц), 3,06-2,98 (2H, м), 2,81 (2H, т, J=6,1 Гц), 2,17-2,05 (2H, м).
Справочный пример 36: 1-оксо-6-фенилэтинил-1,2,3,4-тетрагидронафталин
В соответствии со способом, описанным в справочном примере 22, указанное в заголовке соединение (1,10 г) получали из 5-оксо-5,6,7,8-тетрагидронафталин-2-илтрифторметансульфоната (1,47 г) в виде желтого порошка.
1H-ЯМР (CDCl3) δ: 8,01 (1H, д, J=7,9 Гц), 7,56-7,51 (2H, м), 7,46-7,34 (5H, м), 2,96 (2H, т, J=6,0 Гц), 2,67 (2H, т, J=6,6 Гц), 2,15 (2H, тт, J=6,6, 6,0 Гц).
Справочный пример 37: 1-гидрокси-6-фенилэтинил-1,2,3,4-тетрагидронафталин
В соответствии со способом, описанным в справочном примере 11, указанное в заголовке соединение (485 мг) получали из соединения справочного примера 36 (493 мг) в виде белого порошка.
1H-ЯМР (CDCl3) δ: 7,58-7,48 (2H, м), 7,43-7,29 (6H, м), 4,79-4,75 (1H, м), 2,87-2,66 (2H, м), 2,08-1,73 (4H, м), 1,59 (1H, ушир.с).
Справочный пример 38: 1-гидрокси-6-(2-фенилэтил)-1,2,3,4-тетрагидронафталин
В соответствии со способом, описанным в справочном примере 26, указанное в заголовке соединение (423 мг) получали из соединения справочного примера 37 (482 мг) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 7,37-7,17 (6H, м), 7,05 (1H, дд, J=7,7, 1,6 Гц), 6,95 (1H, д, J=1,6 Гц), 4,80-4,75 (1H, м), 2,95-2,64 (6H, м), 2,01-1,72 (4H, м), 1,63 (1H, д, J=6,2 Гц).
Справочный пример 39: 4-(фенилсульфанилметил)бензилхлорид
Соединение справочного примера 19 (77,0 мг) растворяли в дихлорметане (2,0 мл), добавляли тионилхлорид (30 мкл), и перемешивали в течение 1,8 часов. Растворитель и реагенты упаривали в условиях пониженного давления с получением неочищенного указанного в заголовке соединения в виде белого аморфного вещества.
1H-ЯМР (CDCl3) δ: 7,34-7,14 (9H, м), 4,56 (2H, с), 4,10 (2H, с).
Соединения справочных примеров 40-46, которые были получены с использованием соответствующих веществ в соответствии со способом, описанным в справочном примере 39, представлены в таблице 3.
Справочный пример 47: 2-{2-[(E)-2-[4-((E)-2-фенилвинил)фенил]винил]фенил}этанол
В соответствии со способом, описанным в справочном примере 25, указанное в заголовке соединение (4,80 г) получали из 2-(2-бромфенил)этилового спирта (3,42 г) и 4-винил-транс-стильбена (4,21 г) в виде твердого вещества желтого цвета.
1H-ЯМР (DMSO-D6) δ: 7,69-7,60 (7H, м), 7,50 (1H, д, J=16,2 Гц), 7,41-7,35 (2H, м), 7,29-7,20 (6H, м), 7,12 (1H, д, J=16,2 Гц), 4,73 (1H, т, J=5,7 Гц), 3,57 (2H, тд, J=7,0, 5,7 Гц), 2,93 (2H, т, J=7,0 Гц).
Справочный пример 48: 2-{2-[2-[4-(2-фенилэтил)фенил]этил]фенил}этанол
В соответствии со способом, описанным в справочном примере 29, указанное в заголовке соединение (4,56 г) получали из соединения справочного примера 47 (4,80 г) в виде бесцветного масла.
1H-ЯМР (DMSO-D6) δ: 7,36-7,22 (4H, м), 7,20-7,08 (9H, м), 4,69 (1H, т, J=5,5 Гц), 3,55 (2H, тд, J=7,1, 5,5 Гц), 2,86-2,80 (4H, м), 2,84 (2H, т, J=7,1 Гц), 2,79-2,74 (2H, м), 2,75 (2H, т, J=6,3 Гц).
Справочный пример 49: 2-{2-[2-[4-(2-фенилэтил)фенил]этил]фенил}ацетальдегид
Соединение справочного примера 48 (496 мг) растворяли в DMSO (10 мл), добавляли IBX (840 мг), и перемешивали в течение 1,5 часов при комнатной температуре. К смеси добавляли этилацетат и воду в указанном порядке, и перемешивали в течение 1 часа при комнатной температуре. Осадок фильтровали и промывали этилацетатом. После разделения жидкости органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. После этого, растворитель выпаривали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (10-30% этилацетат в гексане) с получением указанного в заголовке соединения (422 мг) в виде бесцветного масла.
1H-ЯМР (DMSO-d6) δ: 9,62 (1H, т, J=1,7 Гц), 7,27-7,22 (5H, м), 7,20-7,15 (4H, м), 7,13-7,07 (4H, м), 3,77 (2H, д, J=1,7 Гц), 2,83 (4H, с), 2,74-2,72 (4H, м).
Справочный пример 50: метил-5-[2-(2-{2-[4-(2-фенилэтил)фенил]этил}фенил)этиламино]-5,6,7,8-тетрагидронафталин-2-карбоксилат
В атмосфере аргона метил-5-амино-5,6,7,8-тетрагидронафталин-2-карбоксилатгидрохлорид (311 мг) растворяли в дихлорметане (26 мл), добавляли триэтиламин (0,18 мл), и перемешивали в течение 5 минут при комнатной температуре. Соединение справочного примера 49 (422 мг) и уксусную кислоту (0,11 мл) добавляли в указанном порядке, и перемешивали в течение 10 минут при той же температуре. Затем, в условиях охлаждения на льду добавляли триацетоксиборгидрид натрия (681 мг), а затем перемешивали в течение 2 часов при комнатной температуре. Добавляли насыщенный водный раствор гидрокарбоната натрия, экстрагировали этилацетатом, и сушили над безводным сульфатом натрия. Растворитель выпаривали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (30-70% этилацетат в гексане) с получением указанного в заголовке соединения (607 мг) в виде бесцветного масла.
1H-ЯМР (DMSO-d6) δ: 7,68-7,63 (2H, м), 7,50 (1H, д, J=8,4 Гц), 7,29-7,08 (13H, м), 3,80 (3H, с), 3,73 (1H, ушир. с), 2,85-2,79 (7H, м), 2,76-2,75 (8H, м), 1,93-1,56 (4H, м).
Справочный пример 51: N-[2-(2-метоксиметоксифенил)этил]-2-нитробензолсульфонамид
Соединение справочного примера 2 (6,72 г) растворяли в дихлорметане (186 мл), в условиях охлаждения на льду добавляли триэтиламин (5,67 мл) и 2-нитробензолсульфонилхлорид (10,1 г), и перемешивали в течение 1 часа при той же температуре. Растворитель выпаривали в условиях пониженного давления. Остаток суспендировали в этилацетате, промывали водой и насыщенным солевым раствором в указанном порядке, и сушили над безводным сульфатом натрия. Растворитель выпаривали в условиях пониженного давления, и очищали остаток методом колоночной хроматографии на силикагеле (20% этилацетат в гексане) с получением указанного в заголовке соединения (11,0 г) в виде желтого масла.
1H-ЯМР (CDCl3) δ: 8,10-8,05 (1H, м), 7,83-7,79 (1H, м), 7,72-7,66 (2H, м), 7,18-7,12 (1H, м), 7,04-7,01 (2H, м), 6,86 (1H, ддд, J=8,6, 7,5, 1,3 Гц), 5,51 (1H, т, J=5,5 Гц), 5,19 (2H, с), 3,46 (3H, с), 3,39 (2H, тд, J=6,9, 5,5 Гц), 2,87 (2H, т, J=6,9 Гц).
Справочный пример 52: N-{2-[2-[4-(2-фенилэтил)бензилокси]фенил]этил}-2-нитробензолсульфонамид
В соответствии со способом, описанным в справочном примере 51, указанное в заголовке соединение (2,47 г) получали из 2-{2-[4-(2-фенилэтил)бензилокси]фенил}этиламина (1,83 г) в виде желтого масла.
1H-ЯМР (CDCl3) δ: 7,97 (1H, дд, J=7,6, 1,7 Гц), 7,76 (1H, дд, J=7,3, 1,8 Гц), 7,66-7,55 (2H, м), 7,37-7,12 (10H, м), 7,01 (1H, дд, J=7,3, 1,6 Гц), 6,86-6,78 (2H, м), 5,43 (1H, т, J=5,7 Гц), 5,00 (2H, с), 3,40 (2H, тд, J=6,8, 5,7 Гц), 2,94 (4H, с), 2,86 (2H, т, J=6,8 Гц).
Справочный пример 53: метил-1-{N-[2-(2-метоксиметоксифенил)этил]-(2-нитробензолсульфонамид)}индан-5-карбоксилат
Соединение справочного примера 51 (733 мг) растворяли в толуоле (10 мл), в условиях охлаждения на льду добавляли метил-1-гидроксииндан-5-карбоксилат (577 мг), три-н-бутилфосфин (0,75 мл) и 1,1'-азобис(N,N-диметилформамид) (517 мг), и перемешивали в течение 14,5 часов при комнатной температуре. Растворитель выпаривали в условиях пониженного давления. Остаток снова растворяли в этилацетате. Смесь промывали водой и насыщенным солевым раствором в указанном порядке, и сушили над безводным сульфатом натрия. Растворитель выпаривали в условиях пониженного давления, и очищали остаток методом колоночной хроматографии на силикагеле (20% этилацетат в гексане) с получением указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (CDCl3) δ: 8,19-8,16 (1H, м), 7,92 (1H, с), 7,86-7,83 (1H, м), 7,74-7,66 (3H, м), 7,29-7,25 (1H, м), 7,14-7,08 (1H, м), 6,97-6,93 (2H, м), 6,85 (1H, ддд, J=8,4, 7,4, 1,1 Гц), 5,66-5,61 (1H, м), 5,00 (1H, д, J=6,8 Гц), 4,95 (1H, д, J=6,8 Гц), 3,90 (3H, с), 3,38-3,19 (2H, м), 3,27 (3H, с), 3,13-2,78 (3H, м), 2,67-2,49 (2H, м), 2,23-2,11 (1H, м).
Соединения справочных примеров 54-61, которые были получены с использованием соответствующего соединения (4) и соединения справочного примера 51 или 52 в соответствии со способом, описанным в справочном примере 53, представлены в таблице 4 и таблице 5.
Справочный пример 62: метил-1-[2-(2-метоксиметоксифенил)этиламино]индан-5-карбоксилат
Соединение справочного примера 53 (1,08 г) растворяли в DMF (10 мл), в условиях охлаждения на льду добавляли тиофенол (0,41 мл) и карбонат калия (553 мг), и перемешивали в течение 18 часов при комнатной температуре. После разбавления водой экстрагировали диэтиловым эфиром. Органический слой промывали водой и насыщенным солевым раствором в указанном порядке, и сушили над безводным сульфатом натрия. Растворитель выпаривали в условиях пониженного давления, и очищали остаток методом колоночной хроматографии на амин-силикагеле (67% этилацетат в гексане) с получением указанного в заголовке соединения (638 мг) в виде желтого масла.
1H-ЯМР (CDCl3) δ: 7,88-7,85 (2H, м), 7,32 (1H, д, J=7,7 Гц), 7,20-7,15 (2H, м), 7,08 (1H, дд, J=8,6, 1,1 Гц), 6,95 (1H, ддд, J=8,4, 7,5, 1,1 Гц), 5,20 (2H, с), 4,30 (1H, т, J=7,0 Гц), 3,90 (3H, с), 3,45 (3H, с), 3,05-2,77 (6H, м), 2,49-2,38 (1H, м), 1,91-1,79 (1H, м).
Соединения справочных примеров 63-70, которые были получены с использованием соединений справочных примеров 54-61 в соответствии со способом, описанным в справочном примере 62, представлены в таблице 6. При этом соединения справочных примеров 66, 67, 68 и 70 выделяли в виде гидрохлорида.
Справочный пример 71: метил-1-{N-(4-метоксикарбонилбутил)-N-[2-(2-метоксиметоксифенил)этил]амино}индан-5-карбоксилат
Соединение справочного примера 62 (636 мг) растворяли в DMF (9,0 мл), добавляли карбонат калия (495 мг) и метил-5-бромвалерат (0,51 мл), и нагревали в течение 18,5 часов при 95°C. После охлаждения до комнатной температуры растворитель выпаривали в условиях пониженного давления. Остаток суспендировали в воде и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором в указанном порядке, и сушили над безводным сульфатом натрия. Растворитель выпаривали в условиях пониженного давления, и очищали остаток методом колоночной хроматографии на силикагеле (17% этилацетат в гексане) с получением указанного в заголовке соединения (568 мг) в виде желтого масла.
1H-ЯМР (CDCl3) δ: 7,84-7,82 (2H, м), 7,27-7,24 (1H, м), 7,17-7,07 (2H, м), 7,01 (1H, дд, J=8,2, 1,0 Гц), 6,90 (1H, ддд, J=8,4, 7,3, 1,1 Гц), 5,07 (2H, с), 4,57 (1H, т, J=8,0 Гц), 3,90 (3H, с), 3,66 (3H, с), 3,35 (3H, с), 2,97-2,56 (6H, м), 2,52 (2H, т, J=6,9 Гц), 2,29 (2H, т, J=7,2 Гц), 2,23-2,13 (1H, м), 2,02-1,89 (1H, м), 1,74-1,48 (4H, м).
Соединения справочных примеров 72-81, которые были получены с использованием соединения справочного примера 50 и соединений справочных примеров 63-70 в соответствии со способом, описанным в справочном примере 71, представлены в таблице 7 и таблице 8.
Справочный пример 82: метил-1-{N-(4-метоксикарбонилбутил)-N-[2-(2-гидроксифенил)этил]амино}индан-5-карбоксилат
Соединение справочного примера 71 (564 мг) растворяли в THF (5,5 мл) и метаноле (0,5 мл), добавляли конц. соляную кислоту (0,6 мл), и перемешивали в течение 22 часов при комнатной температуре. Растворитель выпаривали в условиях пониженного давления, остаток разбавляли водой, корректировали значение pH до 8 с использованием насыщенного водного раствора гидрокарбоната натрия в условиях охлаждения на льду. После экстрагирования этилацетатом органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель выпаривали в условиях пониженного давления, и очищали остаток методом колоночной хроматографии на силикагеле (20% этилацетат в гексане) с получением указанного в заголовке соединения (304 мг) в виде желтого масла.
1H-ЯМР (CDCl3) δ: 12,19 (1H, с), 7,86-7,81 (2H, м), 7,53 (1H, д, J=8,1 Гц), 7,14 (1H, ддд, J=9,7, 8,1, 1,9 Гц), 6,96-6,91 (2H, м), 6,74 (1H, ддд, J=8,4, 7,2, 1,3 Гц), 4,76 (1H, т, J=7,4 Гц), 3,89 (3H, с), 3,62 (3H, с), 3,04-2,54 (7H, м), 2,43-2,22 (4H, м), 2,10-1,98 (1H, м), 1,61-1,51 (4H, м).
Соединения справочных примеров 83 и 84, которые были получены с использованием соединений справочных примеров 72 и 74 в соответствии со способом, описанным в справочном примере 82, представлены в таблице 9.
Справочный пример 85: метил-1-{N-(4-метоксикарбонилбутил)-N-[2-[2-[4-(2-фенилэтил)бензилокси]фенил]этил]амино}индан-5-карбоксилат
Соединение справочного примера 82 (298 мг) растворяли в ацетонитриле (2,8 мл), добавляли 4-(2-фенилэтил)бензилхлорид (194 мг) и карбонат калия (145 мг), и перемешивали в течение 18 часов при нагревании с обратным холодильником. После охлаждения до комнатной температуры растворитель выпаривали в условиях пониженного давления, остаток суспендировали в воде, а затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель выпаривали в условиях пониженного давления, и очищали остаток методом колоночной хроматографии на силикагеле (17% этилацетат в гексане) с получением указанного в заголовке соединения (393 мг) в виде желтого масла.
1H-ЯМР (CDCl3) δ: 7,81-7,78 (2H, м), 7,31-7,09 (12H, м), 6,90-6,85 (2H, м), 4,97 (1H, д, J=13,2 Гц), 4,93 (1H, д, J=13,2 Гц), 4,51 (1H, т, J=8,1 Гц), 3,88 (3H, с), 3,64 (3H, с), 2,94-2,82 (6H, м), 2,76-2,59 (4H, м), 2,42 (2H, т, J=6,9 Гц), 2,21 (2H, т, J=7,3 Гц), 2,14-2,06 (1H, м), 1,97-1,84 (1H, м), 1,65-1,39 (4H, м).
Соединения справочных примеров 86-108, которые были получены с использованием соответствующего соединения (13) и соединения справочного примера 83 84 в соответствии со способом, описанным в справочном примере 85, представлены в таблицах 10-13.
Справочный пример 109: метил-5-{N-(4-метоксикарбонилбутил)-N-[2-[2-[транс-4-((E)-2-фенилвинил)циклогексилметокси]фенил]этил]амино}-5,6,7,8-тетрагидронафталин-2-карбоксилат
В соответствии со способом, описанным в справочном примере 53, указанное в заголовке соединение (132 мг) получали из соединения справочного примера 83 (175 мг) и соединения справочного примера 28 (95,0 мг) в виде желтого масла.
1H-ЯМР (CDCl3) δ: 7,76-7,63 (3H, м), 7,39-7,23 (4H, м), 7,23-7,10 (2H, м), 7,07 (1H, дд, J=7,3, 1,6 Гц), 6,84 (1H, ддд, J=8,4, 7,3, 1,1 Гц), 6,77 (1H, дд, J=8,3, 1,1 Гц), 6,37 (1H, д, J=16,1 Гц), 6,17 (1H, дд, J=16,1, 7,0 Гц), 4,05-3,95 (1H, м), 3,89 (3H, с), 3,73-3,65 (2H, м), 3,64 (3H, с), 2,94-2,59 (6H, м), 2,51 (2H, т, J=7,0 Гц), 2,27 (2H, т, J=7,5 Гц), 2,15-1,95 (3H, м), 1,95-1,83 (3H, м), 1,76-1,38 (8H, м), 1,33-1,03 (4H, м).
Соединения справочных примеров 110-115, которые были получены с использованием соответствующего соединения (13) и соединения справочного примера 83 в соответствии со способом, описанным в справочном примере 109, представлены в таблице 14.
Справочный пример 116: метил-5-{N-(4-метоксикарбонилбутил)-N-[2-[2-[4-(2-фениламинометил)бензилокси]фенил]этил]амино}-5,6,7,8-тетрагидронафталин-2-карбоксилат
В соответствии со способом, описанным в справочном примере 62, указанное в заголовке соединение получали из соединения справочного примера 96 (172 мг) в виде желтого масла.
1H-ЯМР (CDCl3) δ: 7,69-7,60 (3H, м), 7,35-7,08 (8H, м), 6,89-6,84 (2H, м), 6,74-6,64 (3H, м), 4,94 (2H, с), 4,33 (2H, с), 3,97-3,91 (1H, м), 3,87 (3H, с), 3,64 (3H, с), 2,90-2,60 (6H, м), 2,44 (2H, т, J=7,0 Гц), 2,19 (2H, т, J=7,3 Гц), 2,00-1,91 (2H, м), 1,63-1,38 (7H, м).
Справочный пример 117: метил-5-{N-[4-(1H-тетразол-5-ил)бутил]-N-[2-[2-[4-(2-фенилэтил)бензилокси]фенил]этил]амино}-5,6,7,8-тетрагидронафталин-2-карбоксилат
Соединение справочного примера 81 (102 мг) суспендировали в толуоле (5,0 мл), добавляли азид триметилолова (175 мг), и перемешивали в течение 44 часов при нагревании с обратным холодильником. После охлаждения до комнатной температуры растворитель выпаривали в условиях пониженного давления. Остаток растворяли в метаноле (2 мл) и перемешивали в течение 15 минут при комнатной температуре. Затем, растворитель выпаривали в условиях пониженного давления, и очищали остаток методом колоночной хроматографии на силикагеле (2% метанол в хлороформе) с получением указанного в заголовке соединения (84 мг) в виде желтого аморфного вещества.
1H-ЯМР (CDCl3) δ: 7,70-7,69 (3H, м), 7,30-7,06 (11H, м), 6,91-6,83 (2H, м), 4,92 (2H, с), 4,26 (1H, дд, J=8,8, 5,9 Гц), 4,11 (1H, с), 3,87 (3H, с), 2,98-2,69 (12H, м), 2,54 (2H, т, J=6,1 Гц), 2,02-1,84 (2H, м), 1,75-1,48 (6H, м).
Справочный пример 118: 8-оксо-5,6,7,8-тетрагидроизохинолин-3-илтрифторметансульфонат
В соответствии со способом, описанным в справочном примере 10, указанное в заголовке соединение (1,53 г) получали из 5,6,7,8-тетрагидроизохинолин-3,8-диона (970 мг) в виде желтого масла.
1H-ЯМР (CDCl3) δ: 8,96 (1H, с), 7,07 (1H, с), 3,05 (2H, т, J=6,1 Гц), 2,76-2,70 (2H, м), 2,26-2,16 (2H, м).
Справочный пример 119: 3-циан-8-оксо-5,6,7,8-тетрагидроизохинолин
Соединение справочного примера 118 (1,53 г) растворяли в DMF (12 мл), в атмосфере аргона добавляли цианид цинка (487 мг) и тетракис(трифенилфосфин)палладий (0) (299 мг), и перемешивали в течение 3 часов при 80°C. После фильтрования через целит смесь разбавляли этилацетатом и промывали насыщенным солевым раствором. После сушки над безводным сульфатом натрия растворитель выпаривали в условиях пониженного давления, и очищали остаток методом колоночной хроматографии на силикагеле (8 16% этилацетат в гексане), суспендировали в смеси гексана/диизопропилового эфира, и собирали путем фильтрования с получением указанного в заголовке соединения (680 мг) в виде белого порошка.
1H-ЯМР (CDCl3) δ: 9,20 (1H, с), 7,64-7,62 (1H, м), 3,03 (2H, т, J=6,0 Гц), 2,79-2,72 (2H, м), 2,28-2,18 (2H, м).
Справочный пример 120: 8-оксо-5,6,7,8-тетрагидроизохинолин-3-карбоновая кислота
В соответствии со способом, описанным в справочном примере 8, указанное в заголовке соединение (685 мг) получали из соединения справочного примера 119 (672 мг) в виде белого порошка.
1H-ЯМР (CDCl3) δ: 9,14 (1H, с), 8,15 (1H, с), 3,10 (2H, т, J=6,0 Гц), 2,81-2,73 (2H, м), 2,29-2,19 (2H, м).
Справочный пример 121: метил-8-оксо-5,6,7,8-тетрагидроизохинолин-3-карбоксилат
Соединение справочного примера 120 (540 мг) растворяли в хлороформе (14 мл), и в условиях охлаждения на льду добавляли раствор диазометана в диэтиловом эфире до завершения реакции. Добавляли уксусную кислоту до того момента, как реакционный раствор становился бесцветным, и выпаривали растворитель в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (8-80% этилацетат в гексане) с получением указанного в заголовке соединения (360 мг) в виде белого порошка.
1H-ЯМР (CDCl3) δ: 9,24 (1H, с), 8,06-8,04 (1H, м), 4,03 (3H, с), 3,05 (2H, т, J=6,1 Гц), 2,78-2,70 (2H, м), 2,27-2,16 (2H, м).
Справочный пример 122: метил-8-гидрокси-5,6,7,8-тетрагидроизохинолин-3-карбоксилат
В соответствии со способом, описанным в справочном примере 11, указанное в заголовке соединение (448 мг) количественно получали из соединения справочного примера 121 (432 мг).
1H-ЯМР (CDCl3) δ: 8,78(1H, с), 7,88(1H, с), 4,96-4,86(1H, м), 4,00(3H, с), 2,96-2,70(2H, м), 2,15-1,76(5H, м).
Соединения справочных примеров 123 и 124, которые были получены с использованием соответствующего соединения (4) и соединения справочного примера 51 в соответствии со способом, описанным в справочном примере 53, представлены в таблице 15.
Соединения справочных примеров 125 и 126, которые были получены с использованием соединений справочных примеров 123 и 124 в соответствии со способом, описанным в справочном примере 62, представлены в таблице 16.
Соединения справочных примеров 127 и 128, которые были получены с использованием соединений справочных примеров 125 и 126 в соответствии со способом, описанным в справочном примере 71, представлены в таблице 17.
Соединения справочных примеров 129 и 130, которые были получены с использованием соединений справочных примеров 127 и 128 в соответствии со способом, описанным в справочном примере 82, представлены в таблице 18.
Соединения справочных примеров 131-139, которые были получены с использованием соответствующего соединения (13) и соединения справочного примера 82, соединения справочного примера 83, соединений справочных примеров 129 или 130 в соответствии со способом, описанным в справочном примере 85, представлены в таблице 19 и таблице 20.
Соединения справочных примеров 140 и 141, которые были получены с использованием соответствующего соединения (13) и соединения справочного примера 83 в соответствии со способом, описанным в справочном примере 109, представлены в таблице 21.
Пример 1: 1-{N-(4-карбоксибутил)-N-[2-[2-[4-(2-фенилэтил)бензилокси]фенил]этил]амино}индан-5-карбоновая кислота
Соединение справочного примера 85 (391 мг) растворяли в ТГФ (1,0 мл) и метаноле (2,1 мл), добавляли 2,5 М водный раствор гидроксида натрия (1,0 мл), и перемешивали в течение 1,5 часов при 50°C. После охлаждения до комнатной температуры растворитель выпаривали в условиях пониженного давления. Остаток снова растворяли в воде. Значение pH корректировали до 4 добавлением 2 М соляной кислоты, смесь экстрагировали хлороформом и сушили над безводным сульфатом натрия. Растворитель выпаривали в условиях пониженного давления, и очищали остаток методом колоночной хроматографии на силикагеле (10-20% метанол в хлороформе) с получением указанного в заголовке соединения в виде бесцветного аморфного вещества.
1H-ЯМР (CD3OD) δ: 7,92-7,87 (2H, м), 7,50 (1H, д, J=7,9 Гц), 7,30-7,09 (11H, м), 7,03 (1H, д, J=7,5 Гц), 6,90 (1H, ддд, J=8,2, 7,3, 0,7 Гц), 5,11 (1H, дд, J=8,2, 4,9 Гц), 4,99 (2H, с), 3,19-2,82 (12H, м), 2,41-2,14 (4H, м), 1,78-1,46 (4H, м).
ESI-MS обнаружено: m/z 592 (M+H)+.
Соединения примеров 2-49, которые были получены с использованием соответствующего соединения справочного примера в соответствии со способом, описанным в примере 1, представлены в таблицах 22-32.
Соединения примеров 50-69, которые были получены с использованием соответствующего оптически активного соединения справочного примера в соответствии со способом, описанным в примере 1, представлены в таблицах 33-37.
В последующих тестовых примерах соединение согласно настоящему изобретению было протестировано на способность активировать sGC.
Тестовый пример 1
Максимальный эффект активирования sGC
Для этого анализа использовали клетки яичника китайского хомяка (клетки CHO-K1), в которых стабильно экспрессируются α-субъединица и β-субъединица sGC человека и селективный циклонуклеотидзависимый канал мыши (CNGA2).
Клетки CHO-K1, в которых стабильно экспрессируются sGC человека и CNGA2 мыши, культивировали при температуре 37°C в среде F-12, содержащей 10% (об./об.) фетальной бычьей сыворотки (FBS), пенициллин (100 ед./мл), стрептомицин (100 ед/мл), G418 (250 мкг/мл) и зеоцин (250 мкг/мл). Клетки суспендировали в культуральной среде, высевали на 96-луночный планшет, а затем культивировали при температуре 37°C в течение 24 часов. После промывания аналитическим буфером 1 (140 ммоль/л хлорида натрия, 5 ммоль/л хлорида калия, 0,5 ммоль/л хлорида магния, 0,01 ммоль/л хлорида кальция, 10 ммоль/л глюкозы, 0,4 ммоль/л сульфата магния, 10 ммоль/л 4-(2-гидроксиэтил)пиперазин-1-илэтансульфоновый кислоты и 125 мкмоль/л сульфинпиразона, pH 7,4), добавляли индикаторный раствор, в котором используемый в качестве флуоресцентного индикатора Ca2+ FURA2-AM был растворен в аналитическом буфере 1 в концентрации 5 мкмоль/л, а затем культивировали в течение 60 минут при температуре 37°C. Индикаторный раствор удаляли. После промывания аналитическим буфером 1 добавляли раствор тестируемого соединения, и инкубировали в течение 10 минут при комнатной температуре. Планшет помещали во флуориметр (Flex Station II, Molecular Devices, LLC), а затем измеряли внутриклеточную концентрацию кальция как относительную интенсивность флуоресценции, полученную при каждой длине волны возбуждения (длина волны возбуждения 340 нм и 380 нм и длина волны испускания 510 нм).
Раствор тестируемого соединения приготавливали путем растворения каждого из тестируемых соединений в DMSO до концентрации 10 ммоль/л, с последующим добавлением аналитического буфера 2 (140 ммоль/л хлорида натрия, 5 ммоль/л хлорида калия, 0,5 ммоль/л хлорида магния, 1 ммоль/л хлорида кальция, 10 ммоль/л глюкозы, 0,4 ммоль/л сульфата магния, 10 ммоль/л 4-(2-гидроксиэтил)пиперазин-1-илэтансульфоновой кислоты, 125 мкмоль/л сульфинпиразона, 100 мкмоль/л изобутилметилксантина, 10 мкмоль/л 1H-[1,2,4]-оксадиазол[4,3-a]хиноксалин-1-она (здесь и далее в настоящем документе, ODQ), pH 7,4) для разбавления с получением тестируемой концентрации 10 мкмоль/л.
Активность тестируемого соединения соответствует коэффициенту увеличения (%)активности sGC во время добавления раствора тестируемого соединения относительно активности sGC во время добавления контрольного раствора, и ее рассчитывали путем деления относительной интенсивности флуоресценции во время добавления тестируемого соединения на относительную интенсивность флуоресценции контрольного раствора и вычитания активности sGC (100%) во время добавления контрольного раствора.
Результаты анализа представлены в таблицах 38 и 39.
В этом методе анализа при активации sGC увеличивается внутриклеточная концентрация cGMP, и вследствие открытия CNGA2, следующего за увеличением cGMP, увеличивается концентрация внутриклеточного Ca2+. Поэтому активация sGC может быть измерена по изменению концентрации внутриклеточного Ca2+. Поскольку ODQ представляет собой окислитель, который специфичен в отношении гемсвязывающего атома железа, и гемовый атом железа окисляется в присутствии ODQ, гемзависимой активации sGC не происходит. Таким образом, в отсутствие ODQ может быть оценена максимальная активация sGC, включая гемзависимую активацию, тогда как гемнезависимая активация sGC может быть оценена в присутствии ODQ. При этом, как в присутствии, так и в отсутствие ODQ, активность sGC имеет постоянное значение после проявления максимального значения при концентрации 10 мкмоль/л или более для любого тестируемого соединения, включая цинацигуат в качестве сравнительного примера, а потому значение активности при 10 мкмоль/л использовали в качестве максимального эффекта каждого тестируемого соединения на активность sGC (Emax).
Как представлено в таблице 38 и таблице 39, все соединения согласно настоящему изобретению существенно увеличивали активность sGC в присутствии ODQ, ясно указывая на то, что они представляют собой гемнезависимое средство, напрямую активирующее sGC. Кроме того, по сравнению с цинацигуатом, соединения согласно настоящему изобретению демонстрировали более высокие значения Emax и в случае присутствия и в отсутствие ODQ, ясно указывая на то, что они характеризуются лучшей активирующей sGC способностью, чем цинацигуат.
Тестовый пример 2
Гемнезависимая активирующая способность sGC
Активность исследуемых соединений измеряли тем же способом, что и представленный в тестовом примере 1, при тестируемых концентрациях 0,0001, 0,001, 0,003, 0,01, 0,03, 0,1, 1 и 10 мкмоль/л.
Долю гемнезависимой активности каждого тестируемого соединения применительно к активации sGC получали путем деления EC50 в отсутствие ODQ на EC50 в присутствии ODQ (EC50 получали из концентрационной зависимости активности, которую строили на основании вышеуказанных данных). Более конкретно, чем меньше соотношение EC50, тем меньшее изменение активности sGC обусловлено присутствием или отсутствием ODQ, а потому изменение считается более гемнезависимым.
Значение EC50 получали путем измерения активности каждого соединения, подлежащего тестированию в концентрациях 0,0001, 0,001, 0,003, 0,01, 0,03, 0,1, 1 и 10 мкмоль/л, и вычисления с использованием четырех-параметрической логистической модели, с использованием Assay Explorer (Accelrys).
Результаты теста представлены в таблице 40.
Как представлено в таблице 40, было обнаружено, что все соединения согласно настоящему изобретению характеризуются более низким соотношением EC50, чем цинацигуат, и являются более гемнезависимыми по сравнению с цинацигуатом.
Тестовый пример 3
Оценка функции расслабления кровеносного сосуда
Типичные соединения согласно настоящему изобретению оценивали по способности к расслаблению кровеносного сосуда в соответствии со следующим тестовым примером. В этом методе анализа под анестезией с фенобарбиталом (30 мг/кг) индуцировали кровотечение из верхней части сердца крысы (самец SD), а затем выделяли брюшную аорту. Соединительную ткань, окружающую кровеносный сосуд, удаляли с брюшной аорты в ледяном растворе Кребса-Хенселейта (раствор KH) (118 ммоль/л хлорида натрия, 4,7 ммоль/л хлорида калия, 1,2 ммоль/л сульфата магния, 1,2 ммоль/л дигидрофосфата калия, 25 ммоль/л гидрокарбоната натрия, 2,5 ммоль/л хлорида кальция и 10 ммоль/л глюкозы, pH 7,4). После этого, кольцевой образец длиной 2 мм приготавливали и фиксировали в 5 мл инкубаторе органов, заполненном раствором KH. Раствор KH хранили при температуре 37°C и аэрировали смесью газов из 95% O2 и 5% CO2. Образец стабилизировали в течение 1 часа при статическом натяжении в 1 г. Раствор KH меняли дважды в течение этого периода. Натяжение образца регистрировали мультиканальным регистратором при помощи датчика и усилителя. После стабилизации образца вызывали сокращение посредством применения 1 мкмоль/л фенилэфрина (Phe), и осуществляли кумулятивное введение каждого соединения (0,001, 0,01, 0,03, 0,1, 0,3, 1, 3, 10, 30, 100, 1000, 10000 нмоль/л). Для оценки случая с использованием 1H-1,2,4-оксадиазол-(4,3a)-хиноксалин-1-она (ODQ) за 10 минут до добавления Phe добавляли 10 мкмоль/л ODQ, и проводили ту же оценку, что и упомянутая выше.
Значение EC50 вычисляли с использованием четырехпараметрической логистической модели с использованием Assay Explorer (Accelrys). Раствор тестируемого соединения растворяли в DMSO так, что концентрация каждого тестируемого соединения составляла 1000-кратную относительно конечной концентрации.
Результаты теста представлены в таблице 41.
Как представлено в таблице 41, было обнаружено, что все соединения согласно настоящему изобретению характеризуются более низким соотношением EC50, чем цинацигуат, и являются более гемнезависимыми, чем цинацигуат.
Промышленная применимость
Бициклическое соединение согласно настоящему изобретению, его фармацевтически приемлемая соль или его сольват характеризуется способностью активировать растворимую sGC с отличной гем-независимостью, а потому применимо в качестве фармацевтического средства для профилактики или лечения различных нарушений, связанных с растворимой гуанилатциклазой, например, сердечной недостаточности, гипертензии, легочной гипертензии или ишемической болезни сердца.
Реферат
Изобретение относится к новому соединению общей формулы (1) и его фармацевтически приемлемой соли, которые обладают гемнезависимой активирующей функцией в отношении растворимой гуанилатциклазы. Соединения могут найти применение для профилактики или лечения нарушений, связанных с растворимой гуанилатциклазой, таких как гипертензия, легочная гипертензия, сердечная недостаточность, нарушение эндотелиальной функции, атеросклероз, заболевание периферических сосудов, стенокардия, тромбоз, инфаркт миокарда, эректильная дисфункция или нарушение почечной функции. В общей формуле (1)(1),А представляет собой неразветвленную C-Салкиленовую группу, где одна метиленовая группа необязательно замещена О или S; n представляет собой целое число от 3 до 5; каждый из Xи Xнезависимо представляет собой СН или N; каждый из Wи Wнезависимо представляет собой карбоксильную группу или Wпредставляет карбоксильную группу и Wпредставляет собой тетразолильную группу; V представляет собой неразветвленную или разветвленную C-Салкиленовую группу, в которой одна метиленовая группа необязательно замещена О или S; R представляет собой группу, выбранную из следующих,в которых R, R, R, Rи Rпредставляет собой атом водорода, атом галогена, C-Салкильную группу, которая может содержать группу-заместитель, C-Салкоксигруппу, С-Сциклоалкильную группу, С-Сциклоалкоксигруппу, галогенС-Салкильную группу, галогенС-Салкоксигруппу, винильную группу, которая может содержать группу-заместитель, этинильную группу, которая может содержать группу-заместитель, фенильную группу, которая может содержать группу-заместитель на ароматическом кольце, феноксигруппу, которая может содержать группу-заместитель на ароматическом кольце, бензильную группу, которая может содержать группу-заместитель на бензольном кольце, фенэтильную группу, которая может содержать группу-заместитель на бензольном кольце, бензилоксигруппу, которая может содержать группу-заместитель на бензольном кольце, бензилсульфанильную группу, которая может содержать группу-заместитель на бензольном кольце, бензиламиногруппу, которая может содержать группу-заместитель на бензольном кольце, фенилоксиметильную группу, которая может содержать группу-заместитель на бензольном кольце, фенилсульфанилметильную группу, которая может содержать группу-заместитель на бензольном кольце, или фениламинометильную группу, которая может содержать группу-заместитель на бензольном кольце, где группа-заместитель указана в формуле изобретения, m представляет собой целое число 1 или 2 и каждый из Yи Yнезависимо представляет собой метилен, О или S при условии, что они оба одновременно не представляют собой S. 5 н. и 4 з.п. ф-лы, 41 табл., 213 пр.
Формула





Документы, цитированные в отчёте о поиске
Гидроксамовые кислоты, пригодные для лечения гиперпролиферативных нарушений
Комбинация ингибитора циклооксигеназы-2 и ингибитора гистондезацетилазы










































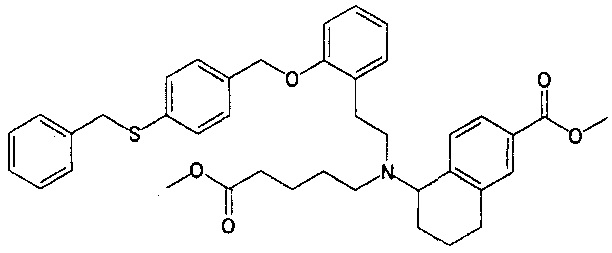







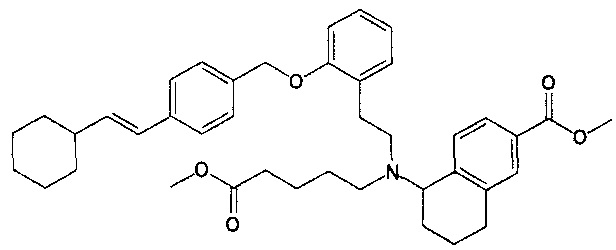













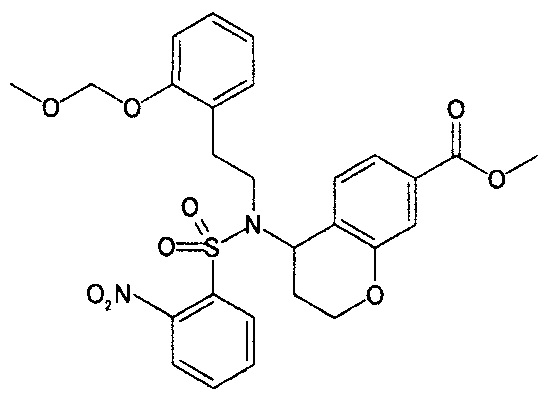
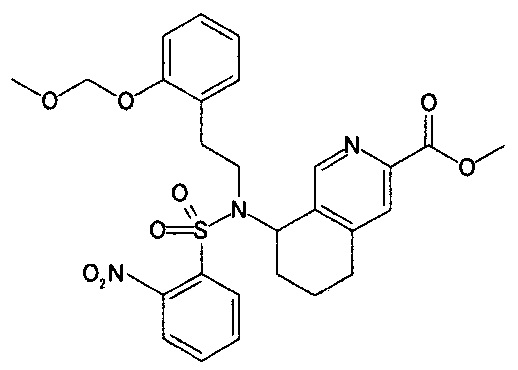














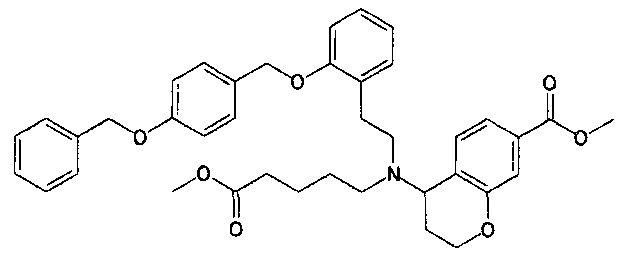

















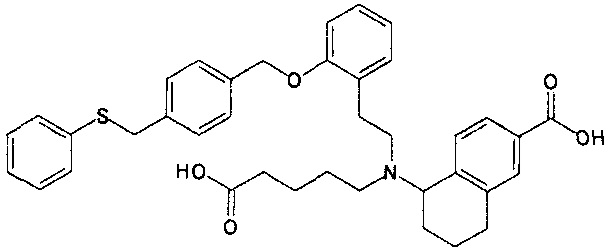










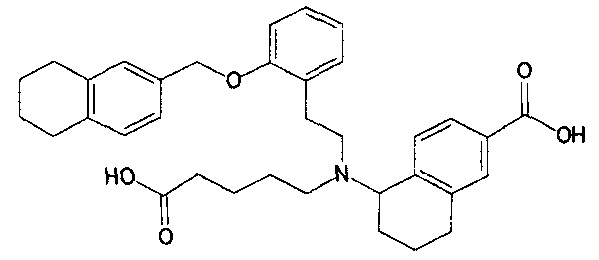







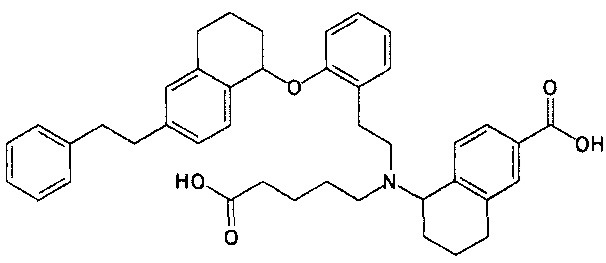



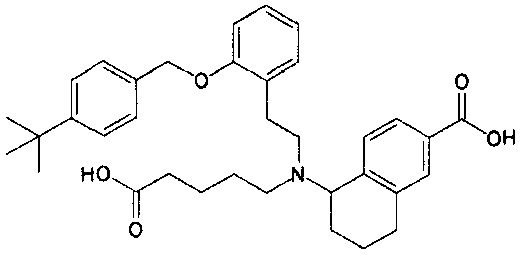
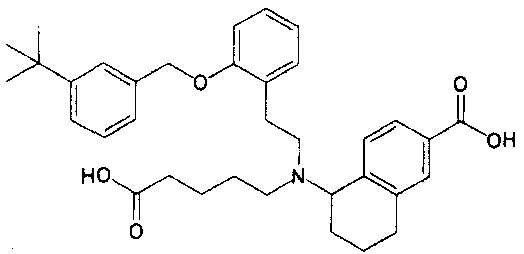





























Комментарии