Пищевой продукт, содержащий специфичную к пролину протеазу, способ его производства и его применение для расщепления токсичных или аллергенных пептидов глютена - RU2446210C2
Код документа: RU2446210C2
Чертежи



Описание
Область техники, к которой относится изобретение
Изобретение относится к пищевому продукту, содержащему специфичную к пролину протеазу, к способу его производства и к его применению для расщепления токсичных или аллергенных пептидов глютена (клейковины).
Предшествующий уровень техники
Известно, что потребление глютена, т.е. общего пищевого белка, присутствующего в пшенице, ячмене, ржи, пшеницы спельте и тритикале, вызывает заболевание у некоторых индивидуумов. Глютен представляет собой сложную смесь богатых глутамином и пролином глиадинов и глютенинов, которые, как предполагается, ответственны за развитие ряда заболеваний. Вследствие аминокислотного состава глютенов их специфические части довольно устойчивы к протеолитическому расщеплению в желудочно-кишечном тракте человека. В результате этого могут накапливаться специфические, богатые пролином пептиды, что может привести к нежелательным симптомам, таким как непереносимость различных пептидов, образующихся из глютена. Например, в литературе описаны аминокислотные последовательности пептидов, ответственных за токсичность глютена, наблюдавшуюся у пациентов, страдающих глютеновой болезнью - целиакией (Arentz-Hansen et al., J. Exp.Med. 2000; 6: 337-342; Vader et al., Gastroenterology 2002; 122: 1729-1737).
Целиакия - это широко распространенное аутоиммунное заболевание тонкого кишечника. У больных целиакией наблюдается значительное превалирование различных аутоиммунных расстройств, главным образом, диабета I типа, герпетиформного дерматита, аутоиммунного тиреоидита, коллагенозов, аутоиммунной алопеции (облысения) и аутоиммунного гепатита. Целиакия часто сопровождается также психическими и неврологическими симптомами, которые могут привести к далеко идущим последствиям нарушения метаболизма пептидов, богатых пролином.
В таких случаях только соблюдение безглютеновой диеты на протяжении всей жизни может эффективно предупреждать клинические симптомы у больных целиакией. Но, к несчастью для таких больных, глютен представляет собой дешевый белок с вызывающим интерес потенциалом его использования, поэтому он широко применяется в различных пищевых продуктах, таких как реализуемые в торговой сети супы, соевые соусы, соусы, мороженое, картофельные чипсы и хот-доги. Вот почему больные с непереносимостью глютена нуждаются в подробном перечне пищевых продуктов, которые позволили бы им избежать потребления молекул проблематичного глютена, поскольку потребление глютена даже в таком малом количестве, как 50 мг в сутки, может вызвать у них повторное проявление клинических симптомов.
Сегодня понятно, что проблематичные богатые пролином пептиды, присутствующие в глютене, являются высоко устойчивыми к расщеплению желудочными пептидазами и пептидазами поджелудочной железы, такими как пепсин, трипсин, химотрипсин и др. Только специфические ферменты, которые могут гидролизовать пептидные связи, включающие пролин, способны к экстенсивному гидролизу богатых пролином последовательностей с разрушением при этом эпитопов, релевантных для целиакии. Сообщалось о различных ферментах, находящих полезное применение для инактивирования токсичных богатых пролином пептидов, таких как пролил-олигопептидазы (ЕС 3.4.21.26; Shan et al. Science 297, p.2275-2279) и дипептидил-пептидаза IV (ЕС 3.4.14.5; US-A-2002/0041871). Опубликован также ряд патентных заявок, в которых упоминается возможная роль специфичных к пролину протеаз в снижении антигенности пищевых продуктов, содержащих глютен (например, WO-A-2002/45523), а также применение таких ферментов для предупреждения клинических симптомов целиакии и сопутствующих заболеваний (например, WO 03068170 и WO 2005/027953). Совсем недавно была продемонстрирована пригодность ферментотерапии для лечения больных целиакией с применением дуоденальных экстрактов (Cornell et al., Scandinavian Journal of Gastroenterology, 2005; 40: 1304-1312).
WO-A-2002/45523 раскрывает конкретное применение специфичной к пролину эндопротеазы для протеолиза полипептидов, включая пептиды, богатые пролином. Заявка описывает введение эндопротеазы в белковые пищевые продукты для подавления в них горечи или снижения их аллергенности. В WO-A-2005/027953 подчеркивается, что эта конкретная эндопротеаза идеально подходит в качестве диетической добавки, поддерживающей процесс переваривания пищевого глютена, поскольку она показывает широкий pH-оптимум, что позволяет ферменту быть активным в ротовой полости, пищеводе, желудке и оставаться активным в двенадцатиперстной кишке.
WO 2005/027953 направлена на удаление токсичных богатых пролином пептидов из пищевого продукта перед его потреблением, в результате чего предупреждается или минимизируется воздействие на организм токсичных богатых пролином пептидов. В заявке раскрывается также применение стабилизированных ферментных композиций в качестве средства, способствующего пищеварению. В описанном подходе фермент потребляется вместе с пищевым продуктом с тем, чтобы богатые пролином и/или богатые глутамином белковые последовательности пищевого продукта расщеплялись при прохождении через желудочно-кишечный тракт. Однако согласно WO 2005/027953 ферментная композиция может вводиться только в богатые пролином и/или богатые глутамином пищевые продукты с активностью воды ниже 0,85 с тем, чтобы ферменты оставались достаточно активными. В том случае, если пищевой продукт должен храниться в течение длительных периодов времени, следует избегать его контакта с влагой или влажным воздухом, т.е. в таких случаях предлагается использовать сухие пищевые продукты. Такой подход значительно ограничивает выбор пищевых продуктов, которые можно комбинировать с эндопротеазой.
Применение ферментных композиций во влагосодержащих пищевых продуктах, таких как маргарин или подобные ему спреды, хорошо известно, в основном, из уровня техники. Однако в большинстве случаев ферменты добавляют в качестве технологических добавок, облегчающих обработку, и пролонгированная ферментативная активность, т.е. активность, которая сохраняется после упаковки продукта, в этих случаях не требуется. Например, DE-A-101 04 945 раскрывает низкожирные спреды, содержащие фосфолипиды и ферменты, например, трансглютаминазу, без применения эмульгаторов или стабилизаторов. После кратковременного инкубационного периода на стадии изготовления продукта трансглютаминаза инактивируется тепловой обработкой при 95°С в течение 2-3 минут.
WO-A-95/28092 касается применения стабилизаторов, таких как полиолы, для стабилизации эмульсий вода-в-масле, пригодных для пищевых продуктов, в которых эмульсии содержат термолабильное соединение, такое как фермент. В противоположность двум вышеупомянутым заявкам, WO-A-95/28092 направлена на долгосрочную стабилизацию ферментной активности. С этой целью в водную фазу вводится от 40% до 50% глицерина, как указано в примере. Однако введение таких высоких количеств полиолов в пищевые продукты либо не допускается, либо неприемлемо с органолептической точки зрения.
Описание сущности изобретения
Авторами изобретения установлено, что специфичные к пролину протеазы можно использовать в качестве ингредиента в пищевых продуктах с высокой активностью воды, в которых отсутствуют высокие количества стабилизаторов ферментов. Такие продукты можно даже подвергать пастеризации с целью гарантирования их адекватной стабильности в хранении без значительных потерь характерной ферментной активности. В настоящей заявке продемонстрировано, что в пищевых продуктах, таких как начинки для сэндвичей, верхние начинки, приправы, соусы, различные напитки, и в эмульсиях, таких как низкожирные спреды, специфичные к пролину протеазы остаются достаточно активными для достижения адекватного гидролиза последовательностей богатого пролином глютена в желудке. В большинстве случаев вкус пищевого продукта не страдает или не изменяется от присутствия фермента.
Тот факт, что фермент выдерживает обработку пастеризацией, сам по себе удивителен, поскольку в уровне техники высказывалось предположение, что в условиях высокой активности воды большинство ферментов не способно выдерживать режимы пастеризации. Равным образом предполагалось, что большая часть ферментов теряет свою активность в продуктах с высокой активностью воды спустя одну неделю хранения. Таким образом, удивительным является также то, что согласно изобретению фермент поддерживает свою активность в течение периодов времени до одного года, если пищевой продукт с высокой активностью воды хранится при режимах охлаждения. Под выражением "при режимах охлаждения" подразумеваются температуры ниже 10°С, предпочтительно от 0 до 10°С, более предпочтительно от 2°С до 8°С.
Таким образом, изобретение относится к пастеризованным и стабильным в хранении пищевым продуктам, имеющим активность воды по меньшей мере 0,80, предпочтительно по меньшей мере 0,85, и содержащим специфичную к пролину протеолитическую активность, которая достаточно высока для обеспечения детоксикации богатых пролином белковых последовательностей. Токсичными количествами богатых пролином белковых последовательностей считаются присутствующие в глютене количества порядка выше 1 мг.
Согласно другому аспекту изобретения раскрывается стабильный в хранении пищевой продукт, имеющий активность воды по меньшей мере 0,80, предпочтительно по меньшей мере 0,85, и содержащий специфичную к пролину протеолитическую активность, которая способна обеспечить детоксикацию богатых пролином белковых последовательностей, в котором пищевой продукт содержит менее 1% мас./мас., белка или пептидов и предпочтительно пищевой продукт не содержит глютена.
Настоящее изобретение относится также к стерильной специфичной к пролину протеазе. Под "стерильной" имеется в виду не содержащая микроорганизмов, предпочтительно не содержащая также бактериальных спор. Специфичная к пролину протеаза предпочтительно подвергается фильтрованию для удаления микроорганизмов, предпочтительно и бактериальных спор.
Белки зерновых можно разделить на альбумины, глобулины, проламины и глютелины. Глютен представляет собой нерастворимую в воде белковую фракцию зерновых, таких как пшеница, рожь, пшеница спельта, овес, ячмень, кукуруза и рис, которая остается после промывки с целью удаления крахмала и растворимых в воде компонентов. Его можно подразделить на глиадины и глютенины. Глютенины можно подразделить на высоко- и низкомолекулярные субъединицы. Подробное обсуждение белков глютена см. Wheat Gluten (P.R.Shewry and A.S.Tatham eds., Cambridge: Royal Society of Chemistry, 2000) или обзорную статью Wieser (1996) в Acta Paediatr. Suppl. 412: 3-9.
В соответствии с признанными во всем мире схемами классификации и номенклатуры всех ферментов от IUMB олигопептидазы, дипептидилпептидазы и эндопротеазы - это ферменты, гидролизующие внутренние пептидные связи, которые в свою очередь подразделяются на дополнительные подклассы на основе их каталитического механизма. Предпочтительной специфичной к пролину протеазой, пригодной для цели настоящего изобретения, является кислотоустойчивая и стабильная к пепсину эндопротеаза из A.niger, раскрываемая в WO-A-02/45524 и WO-A-2005/027953, которая способна расщеплять пептиды и нативные белки с карбоксильной стороны пролиновых остатков и которая способна также расщеплять пептиды и нативные белки в условиях очень низкого pH и в присутствии пепсина. Эта эндопротеаза сохраняется в присутствии фермента пепсина в кислотных условиях и, по всей вероятности, продолжает оставаться активной и в двенадцатиперстной кишке. Наиболее предпочтительной эндопротеазой является специфичная к пролину эндопротеаза, выделенная из грибка пищевого качества Aspergillus или специфичная к пролину эндопротеаза, относящаяся к семейству S28 сериновых протеаз.
Активность воды - это относительное наличие воды в веществе. Она определяется в уровне техники как давление водяного пара, деленное на давление чистой воды при той же температуре. Таким образом, чистая дистиллированная вода имеет активность воды, равную точно единице. Активность воды отличается от влагосодержания (% воды) в пищевом продукте. Влагосодержание - это общее количество влаги, т.е. количество связанной плюс количество свободной влаги, присутствующей в образце, в то время как активность воды определяется измерением только свободной влаги и обычно выражается как aw или процентное содержание равновесной относительной влажности (Equilibrium Relative Humidity) (% ERH). Активность воды пищевого продукта - это постоянная относительная влажность воздуха в непосредственной близости от пищевого продукта, когда между пищевым продуктом и окружающим его воздухом устанавливается равновесие. Эта постоянная относительная влажность обозначается как «% ERH», если она выражается в процентах (от 0 до 100%), или как «активность воды», если она выражается числом от 0 до 1,0. Методы определения активности воды детально изложены в официальных методах анализа АОАС International (1995), метод 978.18.
Под "тепловой обработкой" в настоящем описании имеется в виду тепловая обработка при температуре по меньшей мере 65°С, предпочтительно при температуре по меньшей мере 70°С, в течение по меньшей мере 2 секунд, предпочтительно в течение по меньшей мере 20 секунд. Примером такой тепловой обработки может служить пастеризация, применяемая для молока, т.е. тепловая обработка при 72°С в течение 15 секунд. Пастеризация - это понятие, известное квалифицированному специалисту. Получаемый в результате пастеризации пищевой продукт является микробиологически безопасным продуктом, имеющим длительный срок хранения.
Под "пищевым продуктом" имеется в виду продукт или пищевой ингредиент, который предназначен для употребления без предварительных тепловых обработок, таких как выпекание, жарка или варка. Под "пищевым продуктом, имеющим длительный срок хранения", следует понимать продукт, имеющий срок хранения по меньшей мере от одной недели до года или более, в течение которого гарантируется сохранение органолептических свойств, а также микробиологической безопасности продукта. Очевидно, что допускаемый срок хранения в значительной степени зависит от фактических режимов хранения пищевого продукта. Многие скоропортящиеся пищевые продукты должны храниться в охлажденном виде для максимизации их срока хранения.
Если в пищевом продукте изобретения используются стабилизаторы, в частности полиолы, такие как глицерин, сорбит, сахароза, полипропиленгликоль, трегалоза, мальтодекстрины, лактоза и глюкоза, то их количество в большинстве случаев составляет менее 10 мас.%, предпочтительно менее 5 мас.% от пищевого продукта.
Предпочтительно пищевой продукт согласно изобретению содержит менее 1 мас.%/мас., казеина, более предпочтительно пищевой продукт согласно изобретению не содержит казеина.
Прием специфичных к пролину протеаз в форме пилюль или таблеток позволил бы больным, страдающим непереносимостью глютена, безопасно употреблять содержащие глютен пищевые продукты. Однако авторами изобретения теперь установлено, что протеазу можно также удобно вводить в пищевые продукты, которые сами по себе могут вообще не содержать глютена или содержать его в малых количествах, но которые традиционно комбинируются с содержащими глютен пищевыми продуктами. Более предпочтительно пищевые продукты согласно изобретению, содержащие эндопротеазу, представляют собой пищевые ингредиенты, которые в уровне техники рассматриваются как "не содержащие глютена". В соответствии с "Codex Standard for Gluten-Free Foods" (Кодексом стандартов на безглютеновые пищевые продукты) (Codex Stan 118-198) Кодекса Алиментариус (Стандарты ФАО/ВОЗ на продовольственные товары) содержание азота в пищевых ингредиентах, полученных из содержащих глютен зерновых, может не превышать 0,05 г (50 мг) на 100 г продукта в пересчете на сухое вещество в том случае, если указанные ингредиенты используются в не содержащем глютена пищевом продукте.
Согласно настоящему изобретению раскрывается пищевой продукт, который содержит специфичную к пролину протеолитическую активность в количестве более 0,5 PPU из расчета на порцию, т.е. ферментная активность, присутствующая в одной порции, способна гидролизовать 25 мг глютена. Одна порция - это количество пищи, потребляемой за один прием в течение обычно одного часа, предпочтительно в течение 40 минут.
Пищевые продукты, предпочитаемые в качестве носителя специфичных к пролину протеаз, являются такими пищевыми продуктами, которые требуется хранить охлажденными. Особенно предпочтительно, когда содержащий протеазу пищевой продукт является приправой, т.е. пищевым продуктом, который используется для усиления вкуса и аромата других пищевых продуктов, преимущественно содержащих глютен пищевых продуктов. Приправы имеют то преимущество, что они в изобилии имеются в домашнем хозяйстве, ресторанах, столовых и супермаркетах и в типичных случаях имеют длительный срок хранения. Предпочтительными примерами приправ являются томатный соус или томатный кетчуп. Такие продукты обычно имеют pH ниже 4,2, более предпочтительно ниже 4,0, что подразумевает, что они требуют только ограниченной обработки пастеризацией. Примерами других продуктов повышенной кислотности, требующих ограниченной обработки пастеризацией и особенно пригодных в качестве носителей для активной специфичной к пролину протеазы, являются фруктовые соки и фруктовые концентраты. Фактически даже подкисленная или газированная питьевая вода в бутылках может служить отличным носителем указанного фермента. "Шипучки", подобные овощным или фруктовым концентратам, также подпадают под эту категорию. Равным образом, продукты повышенной кислотности, содержащие консервант пищевого качества, такой как бензоат или сорбат, представляют собой отличные носители для фермента. Например, глазурь или начинки для сэндвичей, обычно употребляемые в комбинации с содержащими глютен пищевыми продуктами, такими как хлеб, имеющими показатели активности воды выше 0,85. Отличным носителем могут служить также продукты с очень высокой кислотностью, которые вообще не требуют пастеризации, такие как напитки типа колы, поскольку специфичная к пролину протеаза показывает заметную стабильность при таких условиях. Кроме того, фермент вполне совместим с препаратами, содержащими высокие концентрации жизнеспособных пробиотиков. Обычно такие пробиотические продукты имеют активность воды выше 0,95 и стабилизируются pH ниже 4,0.
Дополнительно изобретение относится к способу производства пищевого продукта, содержащего ферментную композицию изобретения, в котором специфичная к пролину протеаза добавляется в пищевой продукт после того, как этот пищевой продукт был подвергнут обработке пастеризацией. В таком подходе фермент может добавляться стерильным к уже пастеризованному продукту. Примером подходящей технологии для такого подхода является технология асептического дозирования, как, например, технология, продаваемая фирмой Tetra Рак (Terra Aldose TMS; см., например, http://www.tetrapak-processing.de/produkte/pdf/aldose.pdf).
Еще одним вариантом воплощения изобретения является эмульсия вода-в-масле или масло-в-воде, спред, предпочтительно маргарин или низкожирный спред. Широко употребляемые низкожирные спреды, предназначенные для употребления вместе с содержащим глютен пищевым продуктом, исключительно пригодны в качестве носителя для ферментного средства, способствующего пищеварению. Высокое содержание воды в этих продуктах позволяет вводить в них большие количества фермента, и продукты обычно хранятся при режимах охлаждения, традиционно при температурах порядка 7°С или ниже. Поскольку фермент ограничивается водной фазой, такие эмульсии также подпадают под категорию продуктов, имеющих активность воды по меньшей мере 0,85.
Другими важными преимуществами этого варианта воплощения изобретения является то, что хлеб или спред тщательно перемешиваются в ротовой полости, чем инициируется расщепление молекул глютена специфичной к пролину протеазой. Кроме того, известно, что присутствие соединений жирного ряда тормозит опорожнение желудка через орально-сенсорный механизм. Оба механизма приводят к более интенсивному и длительному взаимодействию между ферментом и глютеном, так что фермент и глютен могут максимально взаимодействовать друг с другом, прежде чем химус (пищевая кашица) достигнет двенадцатиперстной кишки. Это очень важно, поскольку известно, что двенадцатиперстная кишка является самой начальной частью желудочно-кишечного тракта, которая может провоцировать патогенные реакции молекул богатого пролином глютена. Было установлено, что специфичная к пролину протеаза, в частности кислотоустойчивая специфичная к пролину эндопротеаза из A.niger, согласно WO-A-2002/45523, имеет широкий pH-оптимум, что позволяет ей быть активной в ротовой полости, пищеводе, желудке и в двенадцатиперстной кишке. Тот факт, что специфичная к пролину эндопротеаза проявляет такую высокую остаточную активность при введении ее в эмульсию, является полностью неожиданным. Имеющаяся литература скорее единодушна в своих выводах относительно того, что контакт с эмульгаторами и последующее введение в эмульсии оказывают значительный стресс на ферменты и легко приводят к их инактивированию (см., например, Gatorae et al. в "Stability and Stabilization of Enzymes", Elsevier Sci. Publish. 1993, p.329, или de Roos and Waistra, "Colloids and Interfaces B"; Biointerfaces 6 (1996) 201-208). Поэтому особенно подходящим для настоящего изобретения является фермент:
- обладающий пролин-специфичной эндопротеазной активностью, и
- имеющий аминокислотную последовательность, идентичную SEQ ID No. 2 (см. WO 2002/45523), или имеющий аминокислотную последовательность, которая имеет по меньшей мере 80%-ную, предпочтительно по меньшей мере 90%-ную, идентичность с аминокислотной последовательностью с аминокислотами от 1 до 526 SEQ ID No. 2 (см. WO 2002/45523). Уровень идентичности между аминокислотными последовательностями определяется методом, упомянутым в WO 2002/45523 на странице 15.
Ферментная композиция согласно изобретению должна вводиться в пищевой продукт в таком количестве, которое соответствует общему количеству перевариваемого белка. Например, низкожирный спред обычно наносится на ломтик хлеба. На ломтик хлеба 18 граммов обычно наносятся пять граммов спреда. Хлеб в типичных случаях содержит 8% белка, из которых 7% составляет глютен, т.е. один ломтик хлеба содержит 1,5 грамма белка. Для достижения адекватного гидролиза в процессе переваривания в желудочно-кишечном тракте всех белков, т.е. включая и глютеновую фракцию, при использовании фермента, описанного в WO 2002/45523, требуется примерно 20 PPU фермента из расчета на 1 грамм присутствующего белка (для определения этого см. раздел Материалы и методы). Таким образом, для переваривания 1,5 грамма белка требуется 1,5 раза по 20 PPU, что соответствует 30 PPU. Эти 30 PPU должны обеспечиваться пятью граммами низкожирного спреда, что подразумевает активность фермента 6000 PPU/кг низкожирного спреда. Введение ферментной композиции согласно изобретению вряд ли способно повлиять на производство и свойства низкожирного спреда. Однако во избежание появления горечи, о которой часто сообщается в молочных продуктах после обработки их ферментами с протеолитической активностью, в спреде согласно изобретению предпочтительно избегается использование гидрофобных белков, таких как казеины. Так, вкусовые качества спреда можно улучшить за счет введения в него ферментированного белка молочной сыворотки с тем, чтобы обеспечить типичные вкус и аромат сливочного масла. Авторами изобретения установлено, что остаточные белки, присутствующие в ферментированной сыворотке, гидролизуются специфичным к пролину ферментом, но это не оказывает отрицательного действия на органолептические показатели. Специфичная к пролину протеаза предпочтительно добавляется в водную фазу перед формированием эмульсии, наиболее предпочтительно специфичная к пролину протеаза добавляется стерильной после пастеризации водной фазы, но перед формированием эмульсии. Существует ряд способов эффективного производства низкожирных спредов. Согласно одному из них масляная фаза, содержащая эмульгаторы, вкусоароматические добавки, витамины и красители, поддерживается в умеренно нагретом и щадящем перемешиваемом режиме во избежание отрицательного воздействия на качество масла. Затем водная фаза и масляная фаза смешиваются вместе и подаются в вотатор (теплообменник-смеситель). Более подробное описание приготовления эмульсий можно найти в литературе, в том числе у Moustafa в "Practical Handbook of Soybean Processing and Utilization"; David R. Erickson editor; совместная публикация AOCS Press и United Soybean Board. В настоящее время спреды с введением полезных для здоровья соединений, таких как фитостерины/станолы или арахидоновые кислоты, пользуются все возрастающей популярностью. Поскольку указанные соединения являются маслорастворимыми, они не влияют на стабильность фермента в водной фазе.
Таким образом, изобретение относится к способу производства пищевого продукта, содержащего ферментную композицию по изобретению, в котором специфичная к пролину протеаза добавляется в пищевой продукт либо перед, либо после подвергания пищевого продукта пастеризации.
В принципе можно использовать также и другие ферменты, обладающие способностью к гидролизу пептидных связей, включающих пролиновые остатки, такие как пролил-олигопептидаза (ЕС 3.4.21.26) или дипептидил-пептидаза IV (DPP IV, ЕС 3.4.14.5), или дипептидил-пептидаза II (DPP II, ЕС 3.4.14.2). Эти протеазы упоминаются в перечне, к примеру, Augustyns et al. (Current Medicinal Chemistry, 2005, 12, 971-998). Однако для того, чтобы специфичная к пролину протеаза стала пригодной в качестве облегчающего пищеварение средства в пищевом продукте, т.е. либо в пищевом продукте, содержащем глютен, либо в пищевом продукте, предназначенном для использования в комбинации с содержащими глютен пищевыми продуктами, специфичная к пролину протеаза должна: i) показывать pH-оптимум, который обеспечивает адекватную активность в кислотной области pH, превалирующей в желудке, предпочтительно при pH ниже 5; ii) выживать в присутствии желудочно-кишечного протеолитического фермента пепсина при указанных кислотных условиях; iii) оставаться активной во влагосодержащем окружении в течение по меньшей мере срока хранения пищевого продукта. Кроме того, допускается введение кофермента для достижения синергизма при гидролизе белков глютена. Очевидно, что кофермент должен удовлетворять таким же требованиям стабильности, что и специфичный к пролину фермент, в пищевом продукте. Изобретение относится также к применению специфичной к пролину протеазы в качестве способствующего пищеварению средства в производстве пастеризованного пищевого продукта, имеющего активность воды по меньшей мере 0,85, как указывалось выше, в целях предупреждения клинических симптомов целиакии или сопутствующих ей расстройств. Предпочтительно пищевой продукт предназначен для употребления в комбинации с содержащим глютен пищевым продуктом.
Причиной целиакии служит непереносимость некоторых пептидов, богатых пролином и глутамином. Неполное расщепление этих пептидов обусловливает развитие и степень тяжести целиакии. Целиакия часто сопровождается психическими и неврологическими симптомами. Уже в 1979 г. Panksepp (Trends in Neuroscience 1979; 2: 174-177) сформулировал теорию избыточных опиоидов, в которой он высказал предположение, что нарушение метаболизма опиоидов является частью патогенеза при аутизме. Таким образом, пищевой продукт, содержащий эндопротеазу по изобретению, может употребляться также больными, страдающими психическими расстройствами, включая аутизм, шизофрению, ADHD, биполярные расстройства настроения и депрессию, все из которых связаны с потреблением пищевых белков, богатых пролином. Другие расстройства, связанные с целиакией, включают аутоиммунные расстройства, главным образом, диабет I типа, герпетиформный дерматит, рак кишечника, кишечные неходжкинские лимфомы, аутоиммунный тиреоидит, коллагенозы, аутоиммунную алопецию и аутоиммунный гепатит. Кроме того, синдром раздраженной толстой кишки (IBS) связывают с трудно перевариваемыми богатыми пролином белковыми последовательностями. Пользу от настоящего изобретения могут получить больные, страдающие любым из вышеупомянутых расстройств. Такие больные могут быть любого возраста и включать взрослых и детей. Дети, в частности, могут выиграть от профилактических мероприятий, когда предупреждение на более ранней стадии воздействия токсичных пептидов глютена может предотвратить начальное развитие болезни. Введение композиции специфичных к пролину эндопротеаз имеет особое преимущество для той категории пациентов, среди которых большой популярностью пользуются приправы, в частности, майонез и кетчуп. Детей, нуждающихся в профилактике, можно идентифицировать по генетическому тесту на предрасположенность к болезни, например, путем классифицирования HLA-системы (антигенной системы лейкоцитов), изучения семейного анамнеза, пробой на Т-клетки или другими медицинскими средствами.
Описание фигур
Фиг.1 - уровни стимулирующих Т-клетки эпитопов, извлеченных из "желудка", без специфичной к пролину эндопротеазы. Условия эксперимента такие, какие описаны в Примере 3. "Альфа" относится к уровню реакционно-способных молекул альфа-глиадина; "гамма" - к уровню реакционно-способных молекул гамма-глиадина; "HMW" - к уровню реакционно-способных HMW (высокомолекулярных)-глютенинов и "LMW" - к уровню реакционно-способных LMB(низкомолекулярных)-глютенинов.
Фиг.2 - уровни стимулирующих Т-клетки эпитопов, извлеченных из "желудка", содержащих специфичную к пролину эндопротеазу. Условия эксперимента такие, какие описаны в Примере 3. См. пояснения к фиг.1, объясняющие значение "альфа", "гамма", "HMW и "LMW".
Фиг.3 - уровни стимулирующих Т-клетки эпитопов в осадках, извлеченных из "желудка", с добавлением и без добавления специфичной к пролину эндопротеазы и подвергнутых вестерн-блоттингу с обработкой антителами, специфичными для альфа-глиадина. Условия эксперимента такие, какие описаны в Примере 3.
Фиг.4 - % остаточной ферментной активности в водной фазе после расплавления низкожирного спреда при 53°С, добавления специфичной к пролину эндопротеазы в водную фазу и встряхивания смеси вода/жир в течение 10, 70 и 100 минут при 53°С. Условия эксперимента такие, какие описаны в Примере 4.
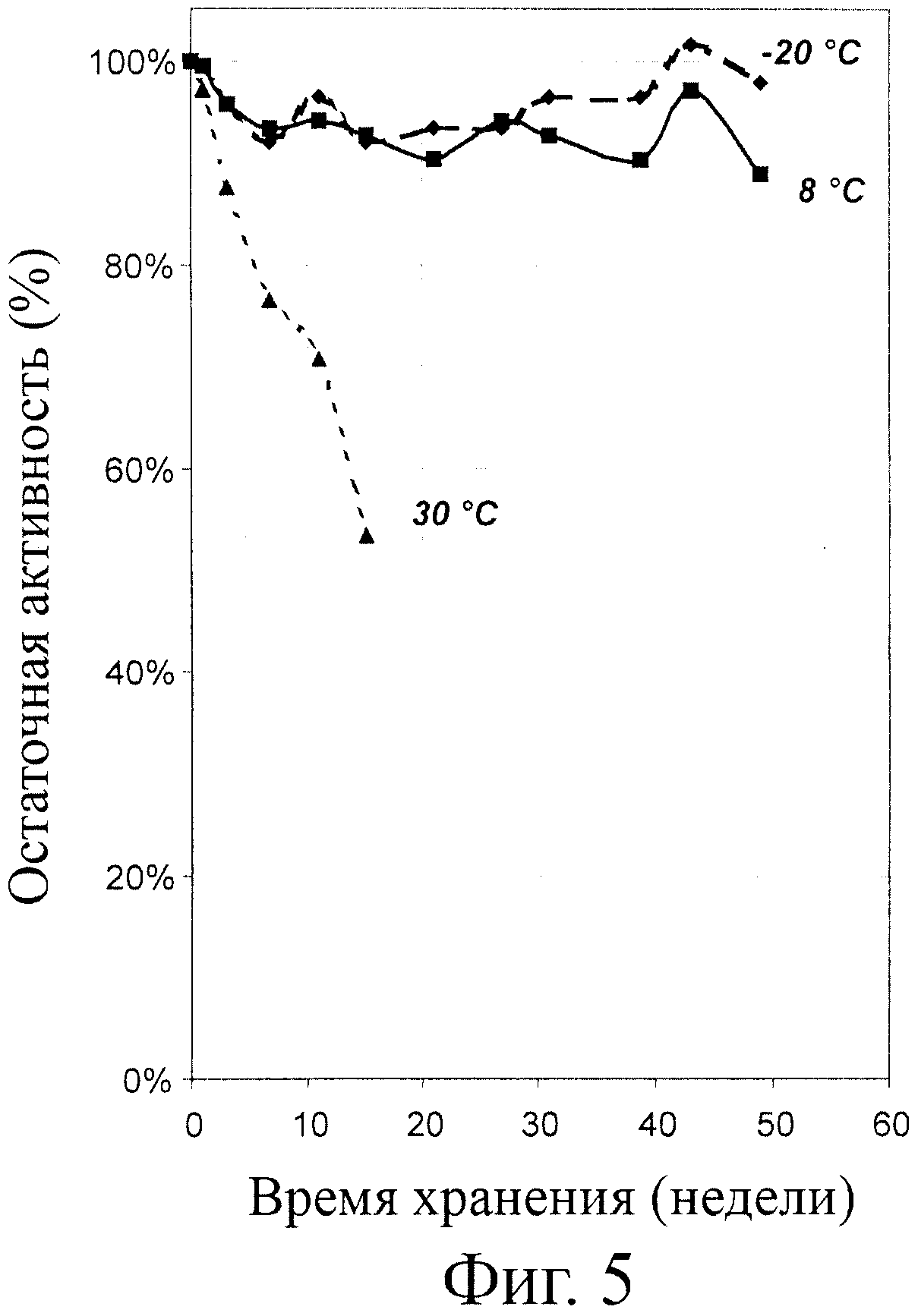
Фиг.5 - стабильность в хранении специфичной к пролину эндопротеазы в водной фазе низкожирного спреда при различных температурах хранения. Условия эксперимента такие, какие описаны в Примере 5.
Материалы и методы
Тесты на активность фермента
Активность пролинспецифичной эндопротеазы, выделенной из A.niger, определялась тестом с использованием CBZ-Gly-Pro-pNA (Bachem, Bubendorf, Швейцария) в качестве субстрата при 37°С в цитратном/динатрий-фосфатном буфере с pH 4,6. Продукты реакции контролировались спектрофотометрически при 405 нм. Увеличение спектральной поглощательной способности при 405 нм во времени является мерой активности фермента. Единица пролин-протеазы (PPU) определяется как количество фермента, которое высвобождает 1 мкмол р-нитроанилида в минуту при заданных условиях и при концентрации субстрата 0,37 мМ Z-Gly-Pro-pNA.
Количественное обнаружение стимулирующих Т-клетки эпитопов
Концентрация стимулирующих Т-клетки эпитопов как глиадина, так и глютенинов в растворимых фракциях динамической желудочно-кишечной in vitro модели определялась с помощью проб на конкурентность с использованием моноклональных антител (mAB). С этой целью образцы разводились буфером, содержащим 50 мМ Na2HPO4/NaH2PO4 (pH 7,0), 150 мМ NaCl, 0,1% Tween-20 и смесь ингибиторов протеазы (Complete, Roche Diagnostics GmbH, Penzberg, Germany). Пробы выполнялись дважды, как описывалось ранее (Spaenij-Dekking et al., (2004) Gut 53, 1267-1273).
Анализ белков с помощью 1D SDS-PAGE и вестерн-блоттинга
Для определения уровня стимулирующих Т-клетки эпитопов, присутствующих в твердых (осажденных) фракциях различных образцов динамической желудочно-кишечной in vitro модели, выполнялись эксперименты по проведению 1D SDS-PAGE (одномерный электрофорез в полиакриламидном геле с использованием додецилсульфата натрия). Твердые фракции солюбилизировались путем растворения образцов белка в 6-кратном объеме буфера (60% глицерина, 300 мМ Трис-а (pH 6,8), 12 мМ ЭДТУ (pH 8,0), 12% SDS, 864 мМ 2-меркаптоэтанола, 0,05% бромфенолового синего) и наносились на 12,5% SDS-PAGE гель. Визуализация белков проводилась либо с помощью их прямого окрашивания красителем для белков Imperial Protein Stain (Pierce, Rockford I.L., USA), либо после вестерн-блоттинга на PVDF мембраны с использованием mAB (моноклональные антитела), специфичных для стимулирующих Т-клетки эпитопов α- и γ-глиадина (Spaenij-Dekking et al., (2004) Gut 53, 1267-1273) и HMW(высокомолекулярных)- и LMW(низкомолекулярных)-глютенинов (Spaenij-Dekking et al., Gastroenterology 2005; 797-806).
Конкурентный анализ с использованием антител
Для проведения конкурентного анализа с использованием антител у мышей Balb С инициировали выработку моноклональных антител против вышеупомянутых стимулирующих Т-клетки альфа-, гамма-глиадина и пептида LMW-глютенина. После объединения селезенок мышей с линией клеток миеломы мышей были получены продуцирующие антитела гибридомы. Последние клонировали ограниченным разведением, а mAB (моноклональные антитела), секретируемые этими клетками, тестировали на пригодность их использования в конкурентном анализе. Для каждой из специфичностей отбирали одно или два подходящих mAB и определяли эпитопы, распознаваемые различными mAB (таблица 1).
С использованием mAB проводили конкурентные анализы, которые позволили количественно обнаружить стимулирующие Т-клетки эпитопы, присутствующие как в нативных (интактных) белках, так и в малых пептидах, размером примерно 11 аминокислот (размер эпитопа Т-клетки) при низких уровнях их содержания.
В конкурентном анализе различные разбавления образцов смешивались с фиксированной концентрацией биотинилированного (т.е. обработанного биотином) пептида-индикатора (который кодирует эпитоп Т-клетки). Для количественной оценки глиадина в указанной пробе была построена стандартная кривая с использованием Европейского стандартного глиадина IRMM-480 в диапазоне концентраций от 10 микрограммов (мкг)/мл до 10 нанограммов (нг)/мл. Количественная оценка LMW-глютенина проводилась с использованием синтетического пептида, кодирующего стимулирующий Т-клетки эпитоп в диапазоне от 1 мкг/мл до 1 нг/мл. В то время как количественная оценка HMW-глютенина проводилась с использованием продукта гидролиза пепсином/трипсином рекомбинантных белков HMW-глютенинов в диапазоне от 1 мкг/мл до 1 нг/мл. Визуальная оценка наличия связанного с антителом биотинилированного пептида проводилась с использованием стрептавидина в качестве метки.
Пример 1
Стерилизация фильтрованием специфичной к пролину эндопротеазы
Фильтрование является предпочтительном вариантом стерилизации ферментов. Подлежащий стерилизации раствор фермента может быть получен очисткой хроматографией, и этот раствор может содержать один или более растворителей либо других добавок для регулирования активности фермента и его последующей стабилизации. Подходящими стабилизаторами являются, например, сорбит и глицерин. Глицериновые растворители могут добавляться в концентрации от 10 до 70 мас.%/мас. раствора фермента, более предпочтительно от 30 до 60 мас.%/мас.
Стерилизация фильтрованием может осуществляться путем прокачки насосом ферментного раствора через стерильный фильтр. Предпочтительно стерилизация фильтрованием проводится путем предварительной фильтрации с последующей вторичной фильтрацией через патронный фильтр 0,22 нм. Стерилизованный таким путем ферментный раствор может добавляться через стерильное дозирующее устройство в емкость для выдержки, содержащую предварительно подвергнутый пастеризации или стерилизации водный пищевой продукт или пищевой ингредиент. Затем содержащий фермент продукт или пищевой ингредиент может сразу фасоваться в упаковку. Если ферментный раствор требуется ввести в жирный или низкожирный спред, то в этом случае стерилизованный ферментный раствор можно смешать с пастеризованной водной фазой, а полученную смесь подвергнуть затем эмульгированию вместе с жиром или маслом при соответствующей повышенной температуре.
Для получения стерилизованного ферментного раствора, предназначенного для использования в лабораторном масштабе, раствор специфичной к пролину эндопротеазы, выделенной из A.niger, стерилизовался фильтрованием по следующей методике. Шприц заполнялся 1 мл ферментного концентрата, и сверху шприца помещался стерильный фильтр Millex GV 0,22 мкм от фирмы Millipore с площадью поверхности 4,91 см. Под действием давления рукой ферментный раствор пропускался через фильтр Millipore 0,22 мкм, в результате чего обеспечивался стерилизованный раствор с активностью фермента, соответствующей активности ферментного раствора до стерилизации фильтрованием.
Пример 2
Переваривание хлеба в динамической желудочно-кишечной in vitro модели в отсутствие и в присутствии специфичной к пролину эндопротеазы
Прохождение пищи через желудочно-кишечный тракт является очень динамичным процессом, который невозможно имитировать в статических in vitro моделях. Динамическая желудочно-кишечная in vitro модель, такая как разработанная TNO (Zeist, Нидерланды), является общепринятой моделью процесса пищеварения, которая в значительной степени имитирует прогрессирующие динамические процессы в желудке и в тонком кишечнике (Minekus et al., ATLA 1995, 23, 197-209; Larsson et al., J. Sci. Food Agic. 1997, 74, 99-106). Результаты, полученные на этих моделях, показали очень большое сходство с результатами, полученными в исследованиях на человеке и животных.
С целью изучения переваривания белого хлеба в отсутствие и в присутствии специфичной к пролину эндопротеазы, выделенной из A.niger, были предприняты эксперименты на указанной динамической желудочно-кишечной модели. Эти эксперименты выполнялись при усредненных физиологических условиях желудочно-кишечного тракта, таких как описанные в литературе для взрослых молодого возраста после приема полутвердой пищи. Хлеб сначала "прожевывался", т.е. тщательно смешивался с ферментами слюны в течение 5 минут и в отсутствие (контроль) или в присутствии специфичной к пролину эндопротеазы из A.niger. В собственно эксперименте 70 граммов белого хлеба (содержащего 5 граммов глютена) гомогенизировались вместе с 11 мл желудочного сока в отсутствие или в присутствии 100 PPU специфичной к пролину эндопротеазы. После гомогенизации 25% смеси добавлялись в систему пищеварения in vitro. В желудочном отделе pH постепенно снижался в результате секреции желудочного сока. "Проглоченные" ферменты слюны (амилаза) присутствовали изначально, в то время как желудочные ферменты (пепсин и желудочная липаза) секретировались постепенно. Пепсин становился активным при pH ниже 5,0. В продолжение 2,5 часов содержимое желудка постепенно поступало в тонкий кишечник через "клапан привратника желудка". В отделе двенадцатиперстной кишки pH регулировался на уровне pH 6,5 за счет секреции бикарбоната. В этот же отдел постепенно секретировались сок поджелудочной железы, содержащий амилазу, липазу и протеолитические ферменты (например, трипсин и химотрипсин), и желчь. Продукты секреции смешивались с пищей, поступающей из желудка, путем перистальтического смешивания и постепенно перемещались в отделы тощей кишки и подвздошной кишки.
Спустя 4-5 часов примерно 80% содержимого тонкого кишечника постепенно переместилось в "толстую кишку" (склянка для образцов) через "подвздошно-слепокишечный клапан". Соединения - продукты пищеварения непрерывно подвергались диализу на выходе из отделов тощей кишки и подвздошной кишки модели через мембранные системы из полупроницаемых полых волокон. Склянки для диализа заменялись каждые 2 часа.
В процессе прохождения белков глютена (и пищи) через отделы динамической системы из отделов желудка, двенадцатиперстной кишки и тощей кишки отбирались небольшого объема образцы (около 2 мл) в следующие моменты времени: t=0, 15, 30, 45, 60, 90, 120, 150, 180 и 240 мин. Сразу после отбора образцы замораживались в сухом льду с целью подавления активности ферментов. В конце каждого эксперимента остатки из разных отделов собирались на сухой лед и хранились в двух пробирках по 10 мл каждая при минус 20°С.
Пример 3
Тестирование переваренного in vitro хлеба на присутствие токсичных эпитопов глютена
Существуют два типа реагентов, которые можно использовать для измерения присутствия пептидов глютена в образцах пищи: клоны Т-клеток, выделенные из тонкого кишечника больных целиакией, и моноклональные антитела, специфичные для различных пептидов глютена. Клоны Т-клеток реагируют на пептиды глютена, когда последние связываются с молекулами HLA-DQ2 или HLA-DQ8, обусловливающими предрасположенность к болезни. Эти ответные реакции Т-клеток зоны воспаления служат, как предполагается, главной причиной целиакии. Клоны Т-клеток, специфичных для пептидов альфа-, гамма-глиадина, LMW-глютенина и HMW-глютенина, вполне доступны (см. Wal van de, Y. et al., Eur. J. Immunol. 29, 3133-3139 (1999) & Vader et al., Gastroenterology, 122: 1729-1737 (2002)). Моноклональные антитела, специфичные для стимулирующих Т-клетки альфа-глиадина, гамма-глиадина, пептидов низкомолекулярного (LMW) и высокомолекулярного (HMW) глютенинов, также доступны и вводились в конкурентный анализ для обнаружения этих пептидов в образцах пищи (Spaenij-Dekking et al., Gut 53: 1267-1273 (2004)).
Фракции желудка и двенадцатиперстной кишки, собранные в моменты времени t=0, 15, 30, 45, 60, 90 и 120 минут, приготовленные с добавлением и без добавления специфичной к пролину эндопротеазы, подвергались предварительной обработке согласно следующей методике, предназначенной для инактивирования специфичной к пролину эндопротеазы. Сначала pH образцов повышался до pH 11-12 с помощью 1 М NaOH, а затем сразу же нейтрализовался с помощью 1 М HCl. После центрифугирования в продолжение 10 минут при 14000 об/мин супернатанты, а также осадки различных образцов собирались и подвергались тепловой обработке при 85°С в течение 10 минут для подавления любой остаточной ферментной активности. Из супернатантов приготавливались разведения 1:40, 1:200, 1:1000 и 1:5000 в 20 мМ фосфатном буфере с pH 7, 150 мМ NaCl, 0,1% Tween-20, смеси 2 ингибиторов протеазы без ЭДТА. Указанные разведения, а также фракции осадков хранились при -20°С до проведения измерения на следующий день.
После размораживания образцов растворимые в воде фракции образцов анализировались в конкурентном анализе с моноклональными антителами, специфичными для альфа- и гамма-глиадина и для LMW- и HMW-глютенинов. С этой целью образцы обрабатывались, как указывается в разделе Материалы и методы, и проводились измерения различных разведений. Результаты, полученные для этих растворимых в воде образцов из желудка, представлены на фиг.1 (полученные в отсутствие специфичной к пролину эндопротеазы) и на фиг.2 (полученные в присутствии специфичной к пролину эндопротеазы). Удалось обнаружить все компоненты глютена за исключением HMW-глютенинов. Полученные данные четко показывают, что добавление специфичной к пролину эндопротеазы из A.niger оказывает сильно выраженное влияние на присутствие этих белков глютена в растворимой фракции: даже при t=0 (т.е. спустя менее 1 минуты после добавления фермента к препарату для перорального употребления) можно было наблюдать резкое снижение наличия белков/пептидов глютена.
В отдельно проводившемся эксперименте нерастворимые в воде фракции (т.е. осадок) образцов из желудка подвергались SDS-PAGE с последующим переносом разделенных белков на PVDF-мембраны. Затем эти мембраны окрашивались специфичным для альфа-глиадина антителом (фиг.3). В то время как антитело обнаружило глиадин во всех фракциях без специфичной к пролину эндопротеазы, добавление специфичной к пролину эндопротеазы приводило к значительному ослаблению сигнала спустя t=45 минут. При t=90 и t=120 минут вряд ли можно было обнаружить глиадин в образцах из желудка, полученных из материала, переваренного в присутствии специфичной к пролину эндопротеазы.
На основании всех этих данных можно сделать вывод, что специфичная к пролину эндопротеаза является высокоэффективной в расщеплении молекул глютена, присутствующих в растворимой в воде фракции. Поскольку использованные в указанной пробе антитела являются специфичными для аминокислотных последовательностей, более коротких, чем требуемые для стимуляции Т-клеток, это указывает на то, что обработка специфичной к пролину эндопротеазой приводит к сильному сокращению потенциально вредных молекул типа глютена в растворимой в воде фракции. Благодаря тому, что эти преимущественно растворимые в воде пептиды эффективно взаимодействуют, что и следовало ожидать, с рецепторными участками, релевантными для целиакии, данные, полученные для растворимой в воде фракции глютена, высоко релевантны для in vivo условий.
Совершенно удивительным образом специфичная к пролину эндопротеаза способна также к гидролизу молекул глютена, присутствующих и в нерастворимой в воде фазе. Спустя 90 минут молекулы глиадина нельзя было обнаружить во фракциях, обработанных ферментом, в то время как в контрольных образцах такие молекулы все еще присутствовали.
Совместные результаты, описанные в настоящем примере, указывают на то, что специфичная к пролину эндопротеаза согласно изобретению способна расщеплять глютен в условиях, имитирующих условия в желудке человека. Более того, фермент способен делать это настолько эффективно, что токсичных эпитопов глютена фактически не остается.
Пример 4
Совместимость специфичной к пролину эндопротеазы с производством низкожирного спреда
Для проверки того, сохраняет или нет специфичная к пролину эндопротеаза свою активность при воздействии эмульгаторов при повышенных температурах и введении в эмульсию вода-в-масле, проводился следующий тест.
В местном супермаркете был куплен низкожирный спред "Halvarine voor op brood" (40% жира) производства фирмы Winner Food BV, Lopik, Нидерланды. Указанные на его этикетке ингредиенты включали моно- и диглицериды жирных кислот (Е 471) в качестве эмульгатора, сорбиновую кислоту (Е200) в качестве консерванта, лимонную кислоту, растительные масла и жиры, воду, вкусоароматические добавки, витамины А и D и соль. Способность к плавлению низкожирного спреда оценивалась в термостатируемом инкубаторе, оборудованном встряхивающим устройством. При 53°С низкожирный спред полностью расплавился, показав медленное разделение на водный слой и жировой слой.
Для обеспечения введения адекватного количества специфичной к пролину эндопротеазы в низкожирный спред 15 мл жидкого ферментного концентрата, содержащего примерно 10 PPU/мл (определение фермента см. раздел Материалы и методы), были подвергнуты сублимационной сушке в пробирке Грейнера на 50 мл. Полученный порошок (около 2,25 грамма) смешивался с 25 граммами низкожирного спреда, после чего смесь расплавлялась при 53°С в термостатируемом инкубаторе, оборудованном встряхивающим устройством, что способствовало растворению полученного сублимационной сушкой порошка фермента. Сразу после расплавления и спонтанного разделения на воду и жир образец (300 мкл) извлекался из водного слоя в пробирке и охлаждался до комнатной температуры. После извлечения этого первого образца пробирка, содержащая разжиженную эмульсию с ферментом, интенсивно встряхивалась в течение 10 секунд и выдерживалась при 53°С. Спустя 10, 70 и 100 минут вновь извлекались из водного слоя образцы по 300 мкл, которые после извлечения интенсивно встряхивались. В заключение все образцы, полученные из водного слоя, разводились в 1000 раз 100 мМ ацетатного буфера с pH 4,2, и остаточная активность фермента измерялась пробой с микротитровальным планшетом (МТР). С этой целью после гидролиза синтетического пептидного субстрата Ala-Ala-Pro-pNA (Pepscan, Lelystad, Нидерланды) с получением трипептида Ala-Ala-Pro и окрашенной молекулы pNa проводились в течение 10 минут кинетические измерения при 405 нм и 40°С с помощью планшет-ридера TECAN Genios МТР Reader (Зальцбург, Австрия). Субстрат Ala-Ala-Pro-pNA (скорее чем Z-Gly-Pro-pNa) использовался по той причине, что Ala-Ala-Pro-pNA позволяет проводить измерение намного меньших количеств фермента. Каждая лунка планшета содержала 250 мкл раствора субстрата (3 мМ AAP-pNa в 100 мМ ацетатного буфера с pH 4,2) и предварительно нагревалась в планшет-ридере Tecan Genios МТР Reader в течение 10 минут при 40°С. Реакция инициировалась добавлением 50 мкл соответствующего разведения фермента (в данном случае в 1000 раз). Высвобождение молекулы pNa происходило за 15 минут. Сбор данных проводился программным обеспечением Magellan (Tecan). Было зафиксировано увеличение оптической плотности при 405 нм; последующая обработка проводилась в Excel с получением картинки, представленной на фиг.4. Активность специфичной к пролину эндопротеазы сразу после расплавления спреда составила по результатам определения 100%. Эти результаты показали, что на активность фермента окружение низкожирного спреда едва ли оказывает влияние при 53°С. Даже встряхивание расплавленного спреда, имитирующее процесс эмульгирования, оказывало лишь незначительное влияние или вообще не оказывало влияния, несмотря на чрезмерное пенообразование.
Пример 5
Стабильность в хранении специфичной к пролину эндопротеазы в водной фазе низкожирного спреда
Для проверки стабильности в хранении специфичной к пролину эндопротеазы в водной фазе низкожирного спреда приготавливалась содержащая молочную кислоту водная фаза с pH 4,5 и активностью воды 0,98. Во избежание бактериального заражения водной фазы добавляемый для доведения концентрации до 600 ppm (частей на миллион частей) концентрированный раствор бензоата натрия был стерильным. Затем добавлялась стерильная (стерилизация фильтрованием) специфичная к пролину эндопротеаза для достижения активности фермента 15 PPU/грамм. Общий раствор распределялся по большому числу небольших стерильных склянок. Некоторые из этих склянок размещались при минус 20°С и служили в качестве контроля, остальные склянки содержались при 8°С и при 30°С. Каждые несколько недель измерялась остаточная активность специфичного к пролину фермента в разных склянках. Активность фермента измерялась согласно методике, подробно изложенной в разделе Материалы и методы.
Результаты, представленные на фиг.5, показывают, что при хранении фермента при температуре 8°С он остается достаточно активным в течение периода времени по меньшей мере 50 недель при указанных высоких значениях aw.
Пример 6
Переваривание in vitro тостов с малиновой начинкой сверху, содержащей фермент
Для демонстрации концепции применения содержащей фермент начинки для облегчения расщепления молекул токсичного глютена в пищевом продукте был проведен следующий эксперимент. Сначала приготовлялись 250 мл стабильной в хранении малиновой начинки. К жидкому ферментному концентрату в количестве 204 г (12 PPU/мл) добавлялись 20,7 грамма сахарозы, 1,0 грамм лимонной кислоты, 0,02% малиной вкусоароматической добавки (Givaudan, 76525-36) и 20,7 грамма 0,5%-ного раствора сахарина в воде. После растворения всех этих ингредиентов добавлялись 3,11 грамма ксантана (Keltrol RD, CP Kelco, Il.), которые растворялись в результате тщательного размешивания. Конечный pH вязкой массы составил 3,7; конечная концентрация фермента - около 9,8 PPU/г начинки; конечная активность воды - примерно 0,99. Концентрация бензоата поддерживалась на уровне примерно 600 ppm. Таким же способом был приготовлен продукт плацебо, содержащий все упомянутые ингредиенты, но без активного специфичного к пролину фермента. В качестве контроля с ранее проводившимися экспериментами (см. Примеры 2 и 3) в тест был введен также невязкий раствор чистого фермента.
Для проверки эффективности всех этих различных препаратов в расщеплении токсичных эпитопов глютена проводился тест на переваривание in vitro, в котором сокращение числа эпитопов происходило во времени. С этой целью на ломтик (около 10 граммов, содержащий 1,4 г белка) закупленного в торговой сети белого пшеничного хлеба, обжаренного в виде тостов (Bolletje, "Engelse toast"), наносился фермент в различной форме. Так, один ломтик покрывался содержащей фермент малиновой начинкой; один ломтик покрывался начинкой-плацебо (т.е. без ферментной активности), а к еще одному ломтику добавлялся чистый жидкий фермент. В случаях начинки, содержащей фермент, и добавления чистого жидкого фермента активность фермента дозировалась таким образом, чтобы она составляла 20 PPU/г присутствующего белка. Спустя пять минут после нанесения различных продуктов на тосты последние измельчали и смешивали с 60 мл (для контроля и жидкого варианта фермента) и с 62,3 мл (для образования геля) раствора с pH 5,0, имитирующего желудочный сок (NaCl (4,8 г/л), KCl (2,2 г/л), CaCl2 (0,22 г/л) и NaHCO3 (1,5 г/л)). 2,3 мл такого же раствора, содержащего свиной пепсин (Sigma, Р-7012) в концентрации 500 KU/л, добавлялись к каждому из тостов.
Первый образец был получен при t=0 минут (т.е. спустя 5 минут после добавления раствора пепсина). Затем pH каждой смеси постепенно снижался с целью имитации медленного подкисления содержимого желудка. pH снижался с pH 5 до pH 4,5, и спустя 15 минут после отбора первого образца отбирался второй образец. В следующие 15 минут pH вновь снижался до pH 4, и при t=30 минут от начала эксперимента отбирался третий образец. Последующие образцы отбирались следующим образом: при t=45 минут (после понижения pH до 3,5); при t=60 минут (после понижения pH до 3,0); при t=90 минут (после понижения pH до 2,5); после этого pH понижался до 2,0 и дополнительные образцы отбирались при t=120 минут и, в заключение при t=150 минут. Все образцы мгновенно замораживались в жидком азоте и хранились при -80°С.
Для измерения остаточных уровней эпитопов глютена в различных препаратах замороженные образцы сначала подвергались процедуре тщательного инактивирования фермента. Еще будучи замороженными, образцы подвергались тепловой обработке при 95°С в течение 30 минут, затем pH образцов повышался до pH 11-12, потом понижался до pH 2 и в заключение нейтрализовался до pH 6. Затем образцы вновь подвергались тепловой обработке при 95°С в течение 15 минут, после чего отбиралось аликвотное количество их (1 мл) и центрифугировалось в продолжение 30 минут в центрифуге Эппендорфа. Полученный супернатант содержал растворимую в воде фракцию, а осадок - нерастворимую в воде фракцию. Количественная оценка остаточного уровня стимулирующих Т-клетки эпитопов в растворимой в воде фракции проводилась пробами на конкурентность с использованием моноклональных антител в соответствии с Spaenij-Dekking et al., (2004) Gut 53, 1267-1273 (см. также раздел Материалы и методы). Результаты этих проб на конкурентность (среднее от двух автономных измерений) представлены в таблице 2. Остаточные уровни стимулирующих Т-клетки эпитопов во фракции осадка воспроизводились визуально вестерн-блоттингом (см. Пример 3). Результаты последнего эксперимента (фотографии не приводятся), равно как и данные, полученные для растворимой в воде фракции, подтверждают эффективное расщепление различных стимулирующих Т-клетки эпитопов обоими препаратами, содержащими фермент.
В итоге полученные данные четко указывают на то, что оба препарата, содержащие фермент, независимо от того, в каком виде он присутствует - в виде чистого свободного фермента или в виде желированного продукта типа джема с высокой активностью воды, эффективно разрушали большинство стимулирующих Т-клетки эпитопов глютена при инкубации в течение примерно 30 минут в условиях, имитирующих условия в желудке человека. Только LMW (низкомолекулярная) фракция оказалась, по-видимому, более устойчивой к расщеплению ферментом в используемой (in vitro) экспериментальной установке.
Реферат
Изобретение относится к пищевым продуктам, содержащим специфичную к пролину протеазу, способам их производства и применению специфичной к пролину протеазы при производстве пищевых продуктов. Пастеризованный пищевой продукт, содержащий специфичную к пролину протеазу, имеет активность воды, по меньшей мере, 0,85. В качестве фермента используют протеазу, выделенную из Aspergillus или относящуюся к семейству S28 сериновых протеаз. Оптимальная активность указанной протеазы при значении pH от 1 до 7, предпочтительно при значении pH от 2 до 6. Также предложен пищевой продукт, содержащий менее 1 мас.% белка или пептидов к массе продукта. Указанные пищевые продукты получают добавлением в них специфичной к пролину протеазы. Употребление таких продуктов обеспечивает расщепление пептидов глютена и рекомендовано больным, страдающим непереносимостью глютена. 5 н. и 12 з.п. ф-лы, 5 ил., 2 табл., 6 пр.

Комментарии