Липидная композиция для лечения желудочно-кишечных нарушений и активации развития и созревания кишечника - RU2469545C2
Код документа: RU2469545C2
Чертежи




Описание
Область техники, к которой относится изобретение
Это изобретение имеет отношение к области желудочно-кишечных заболеваний и нарушений и развитию и созреванию кишечника.
Уровень техники
Адекватное питание новорожденных важно для правильного роста и исключения осложнений, связанных с нехваткой питательных веществ. Требования к питанию новорожденных изменяются в зависимости от метаболических состояний, степени доношенности и заболеваний, которые влияют на желудочно-кишечную систему, дыхательную и сердечную системы.
Младенцы могут страдать от нескольких нарушений пищеварительной системы, которые могут варьировать от легкого дискомфорта до тяжелых, угрожающих жизни заболеваний.
Рост случаев преждевременных родов, в купе с усовершенствованием выхаживания младенцев в результате применения передовых технологий, приводит к увеличению в необходимости развивать инновационные и экономичные методы лечения для недоношенных младенцев в ходе неонатального периода и дальнейшей жизни. Кишечник недоношенных младенцев не достигает той зрелости, которая в норме формируется за третий триместр беременности, и они часто рождаются с незрелым желудочно-кишечным трактом и с желудочно-кишечными заболеваниями и нарушениями.
В US 2003/0072865 описана детская смесь, включающая липидный компонент, в котором остатки пальмитиновой кислоты составляют более чем 10% от общего содержания остатков жирных кислот, присутствующих в триглициридах, что приводит к снижению запоров, дискомфорта в области живота и желудочно-кишечных проблем.
Постнатальные фазы развития, приводящие к созреванию эпителиальных клеток кишечника, проходят в раннем периоде жизни животного: морфогенез и клеточная дифференциация подготавливают эпителий для выполнения функции расщепления и поглощения молозива и компонентов молока; утолщение слизистой происходит благодаря росту ворсинок и крипт.
Структура и функция эпителия желудочно-кишечного тракта у новорожденных резко изменяется перед отлучением от груди для адаптации к изменениям, происходящим в питании при переходе с молока на твердую пищу. Хотя созревание кишечника у новорожденного является предметом интенсивных исследований, факторы, служащие переключателями для основных биохимических и морфологических изменений в процессе созревания, до сих пор плохо изучены. Новорожденные младенцы имеют очень незрелую клеточную выстилку в кишечном тракте. Соединения между энтероцитами не прочные, и щеточная кайма и слои слизистой оболочки развиты не полностью. Из-за менее прочного барьера слизистой оболочки младенец серьезно рискует получить инфекцию, и у него может развиться аллергия. Таким образом, необходимо созревание кишечника и дифференциация барьера кишечника, защищающего от агрессивной внешней среды.
На протяжении всей жизни эпителиальные клетки кишечника должны выполнять различные роли, включая классические функции расщепления и поглощения, поддержание барьера против вредных антигенов и бактерий, секрецию воды и электролитов для поддержания соответствующей вязкости содержимого полости и вымывания вредных компонентов.
Развитие, созревание, адаптация и дифференциация кишечника чрезвычайно важны в течение жизни субъекта.
Раскрытие изобретения
Настоящее изобретение обеспечивает применение липидной композиции, включающей, по меньшей мере, один триглицирид, имеющий следующую формулу I:

в которой R1, R2 и R3 могут быть одинаковыми или разными и каждый из которых независимо выбирают из Н или ацильной группы, которую выбирают из группы, состоящей из остатков насыщенных, мононенасыщенных и полиненасыщенных жирных кислот, причем общее содержание остатков пальмитиновой кислоты в композиции равно примерно 15-55% от общего содержания остатков жирной кислоты в композиции, для получения пищевой или фармацевтической композиции или композиции, содержащей нутрицевтик, или функциональных продуктов питания, для предупреждения и лечения желудочно-кишечных заболеваний и нарушений и для активизации развития, созревания, адаптации и дифференциации кишечника.
Объектом изобретения дополнительно является способ лечения субъекта, имеющего или серьезно рискующего получить желудочно-кишечное заболевание или нарушение, и способ активации развития, созревания, адаптации и дифференциации кишечника, включающий введение субъекту липидной композиции, включающей, по меньшей мере, один триглицирид, имеющий следующую формулу I:

в которой R1, R2 и R3 могут быть одинаковыми или разными и каждый из которых независимо выбирают из Н или ацильной группы, которую выбирают из группы, состоящей из остатков насыщенных, мононенасыщенных и полиненасыщенных жирных кислот, причем общее содержание остатков пальмитиновой кислоты в композиции равно примерно 15-55% от общего содержания остатков жирной кислоты в композиции.
Чертежи к описанию изобретения
С целью понимания изобретения и для того, чтобы увидеть, как оно может быть осуществлено на практике, далее будут описаны воплощения с помощью неограничивающего примера, с отсылкой к прилагаемым чертежам, на которых:
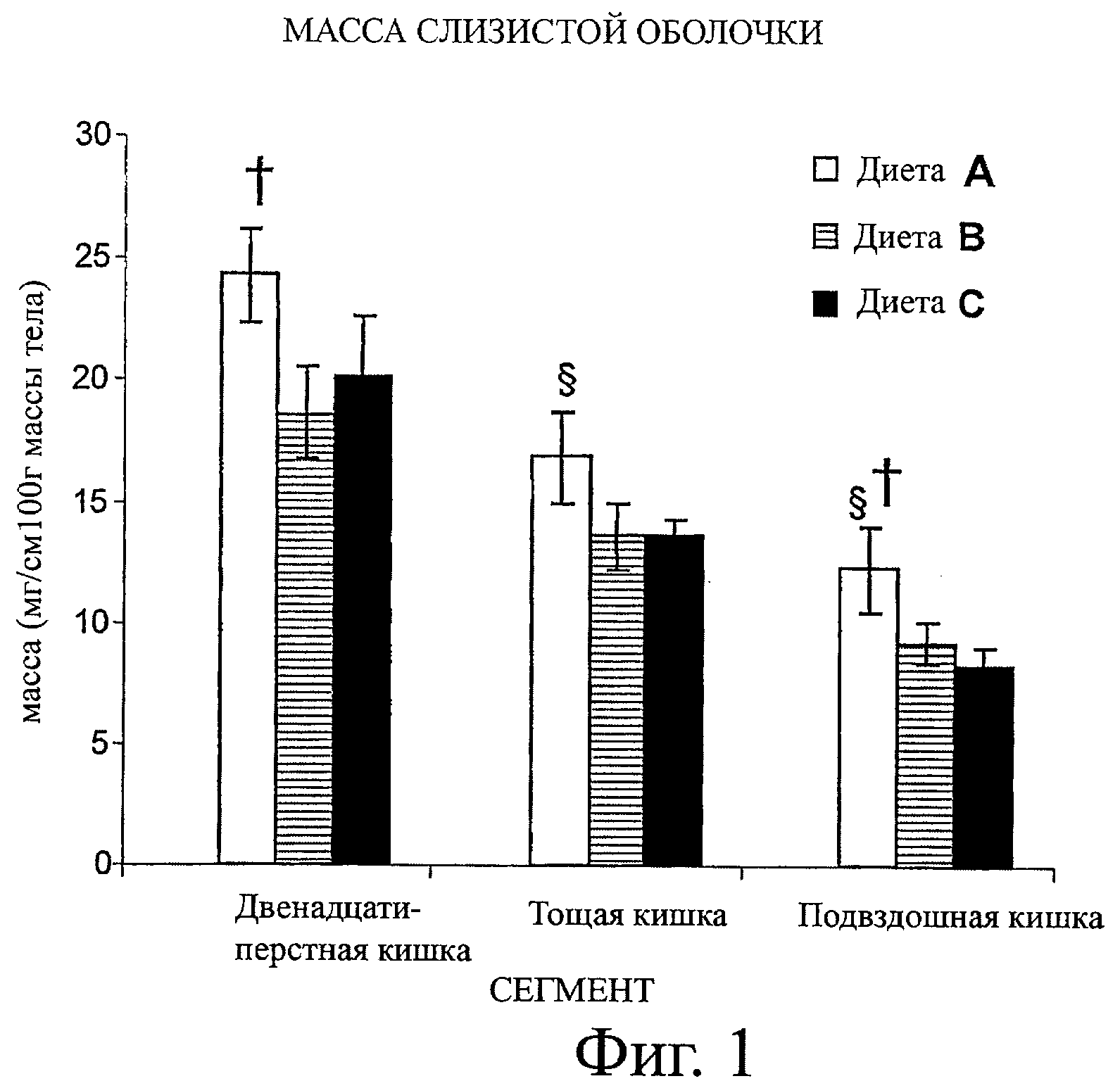
Фигура 1 демонстрирует влияние диетической терапии на массу слизистой оболочки крыс после 2-недельного кормления. Величины представляют собой среднее значение ±SEM. Сравнивают диету А (содержащую масла с высоким содержанием пальмитиновой кислоты в положении sn-2), диету В (содержащую стандартную смесь растительных масел с высоким содержанием пальмитиновой кислоты) и диету С (содержащую масла с низким содержанием пальмитиновой кислоты).
§р<0,05 диета А или диета В по сравнению с диетой С
†p<0,05 диета А по сравнению с диетой В
Фигура 2 демонстрирует влияние диетической терапии на микроскопические характеристики кишечника у крыс после 2-недельного кормления. Величины представляют собой среднее значение ±SEM. Сравнивают диету А (содержащую масла с высоким содержанием пальмитиновой кислоты в положении sn-2), диету В (содержащую стандартную смесь растительных масел высоким содержанием пальмитиновой кислоты) и диету С (содержащую масла с низким содержанием пальмитиновой кислоты).
§р<0,05 диета А или диета В по сравнению с диетой С
†p<0,05 диета А по сравнению с диетой В
Фигура 3 демонстрирует влияние диетической терапии на пролиферацию энтероцитов у крыс после 2-недельного кормления. Включение 5-BrdU в пролиферирующие клетки крипт тощей и подвздошной кишки определяли с помощью козьих антител к BrdU. Число меченых клеток в 10-ти хорошо ориентированных, продольных криптах на секцию от каждой крысы определяют с помощью световой микроскопии. Величины представляют собой среднее значение ±SEM. Сравнивают диету А (содержащую масла с высоким содержанием пальмитиновой кислоты в положении sn-2), диету В (содержащую стандартную смесь растительных масел высоким содержанием пальмитиновой кислоты) и диету С (содержащую масла с низким содержанием пальмитиновой кислоты).
§р<0,05 диета А или диета В по сравнению с диетой С
†р<0,05 диета А по сравнению с диетой В
Фигура 4: Смыкание и дифференциацию монослоя Сасо-2 клеток в результате инкубации с жировой смесью 7 (масло, обогащенное высоким содержанием пальмитиновой кислоты в положении sn-2) по сравнению с LPO (масло с низким содержанием пальмитиновой кислоты) оценивают с помощью измерений трансэпителиального электрического сопротивления (Trans-Epithelial-Electrical-Resistance (TEER)).
(A) Измерение величин TEER клеток, инкубированных в течение 7-ми и 9-ти дней с 10 мкМ различных масел или с контрольным маслом.
(B) Отношения (дельта) величин TEER на 7-й и 9-й день показывает дополнительное увеличение в слиянии и дифференциации клеток Сасо-2.
Осуществление изобретения
Настоящее изобретение обеспечивает применение липидной композиции, включающей, по меньшей мере, один триглицирид, имеющий следующую формулу I:

в которой R1, R2 и R3 могут быть одинаковыми или разными и каждый из которых независимо выбирают из Н или ацильной группы, которую выбирают из группы, состоящей из остатков насыщенных, мононенасыщенных и полиненасыщенных жирных кислот, причем общее содержание остатков пальмитиновой кислоты в композиции равно примерно 15-55% от общего содержания остатков жирной кислоты в композиции, для получения пищевой или фармацевтической композиции или композиции, содержащей нутрицевтик, или функциональных продуктов питания, для предупреждения и лечения желудочно-кишечных заболеваний и нарушений и для активизации развития, созревания, адаптации и дифференциации кишечника.
Липидная композиция, примененная в изобретении, обычно включает смесь указанных триглициридов, имеющих формулу I. Такая смесь включает два или более триглицирида, имеющих формулу I.
Настоящее изобретение дополнительно касается способа лечения субъекта, имеющего желудочно-кишечное заболевание или нарушение или серьезно рискующего приобрести их, и активизации развития, созревания, адаптации и дифференциации кишечника, включающий введение субъекту липидной композиции, включающей, по меньшей мере, один триглицирид, имеющий следующую формулу I:

в которой R1, R2 и R3 могут быть одинаковыми или разными и каждый из которых независимо выбирают из Н или ацильной группы, которую выбирают из группы, состоящей из остатков насыщенных, мононенасыщенных и полиненасыщенных жирных кислот, причем общее содержание остатков пальмитиновой кислоты в композиции равно примерно 15-55% от общего содержания остатков жирной кислоты в композиции.
Настоящее изобретение дополнительно касается способа предупреждения желудочно-кишечного заболевания или нарушения у субъекта, включающий введение субъекту липидной композиции, включающей, по меньшей мере, один триглицирид, имеющий следующую формулу I:

в которой R1, R2 и R3 могут быть одинаковыми или разными и каждый из которых независимо выбирают из Н или ацильной группы, которую выбирают из группы, состоящей из остатков насыщенных, мононенасыщенных и полиненасыщенных жирных кислот, причем общее содержание остатков пальмитиновой кислоты в композиции равно примерно 15-55% от общего содержания остатков жирной кислоты в композиции.
Композиции по изобретению предназначены для лечения или предупреждения желудочно-кишечных заболеваний и нарушений у субъекта и для активации развития, созревания, адаптации и дифференциации кишечника.
Следует понимать, что термин «субъект», применяемый в этой заявке, охватывает любого млекопитающего, включая (без ограничения) людей, домашних животных (например, кошку, собаку) и сельскохозяйственных животных (например, корову, козу, овцу). Указанный субъект может быть на любой стадии развития или зрелости его жизненного цикла. Субъект может быть, но, не ограничиваясь, новорожденным, недоношенным и доношенным младенцем, ребенком ясельного возраста, ребенком младшего возраста, подростком, взрослым или пожилым субъектом.
Термин «младенец», применяемый в этой заявке, может быть любым младенцем, таким (без ограничения) новорожденным, недоношенным и доношенным младенцем, глубоко недоношенным младенцем, у которого имеется склонность к незрелому желудочно-кишечному тракту, младенцем, родившимся с очень малой массой тела (VLBW) или родившимся с экстремально низкой массой тела (ELBW), в особенности тем младенцем, который обладает повышенным риском к возникновению некротизирующего энтероколита, и т.п.
Термин «композиция», применяемый в этой заявке, может быть (без ограничения) питательной композицией (такой как детская смесь), композицией, содержащей нутрицевтик (такой как пищевая добавка), функциональными продуктами питания, лечебным питанием или фармацевтической композицией.
В одном из воплощений липидную композицию, применяемую в изобретении, получают из природного, синтетического или полусинтетического источника. В дополнительном специфическом воплощении указанный природный источник представляет собой любой растительный, животный или микроорганизменный источник. В еще одном дополнительном воплощении получение указанной липидной композиции включает энзиматический катализ.
Термин «питательная композиция», применяемый здесь, может быть любой питательной композицией, включая (без ограничений) заменитель жира человеческого молока, детскую смесь, молочный продукт, мороженое, бисквит, изделие из сои, выпечку, мучные кондитерские изделия и хлеб, соус, суп, готовый пищевой продукт, замороженные пищевые продукты, приправу, кондитерские изделия, масла и жир, маргарин, обмазку, начинку, крупяные изделия, растворимый продукт, питание для младенцев, питание для детей ясельного возраста, батончик, закуску, конфету и изделие из шоколада.
Термин «функциональные продукты питания», применяемый здесь, могут быть любым продуктом здорового питания, включая (без ограничений) молочный продукт, мороженое, бисквит, изделие из сои, выпечку, мучные кондитерские изделия и хлеб, соус, суп, готовый пищевой продукт, замороженные пищевые продукты, приправу, кондитерские изделия, масла и жир, маргарин, обмазку, начинку, крупяные изделия, растворимый продукт, напитки и коктейли, питание для младенцев, батончик, закуску, конфету и изделие из шоколада.
Термин «композиции, содержащие нутрицевтик», применяемый здесь, могут быть композициями, содержащими любой нутрицевтик, который может быть любым веществом, рассматриваемым в качестве питания или части питания, и который приносит пользу с точки зрения медицины или здоровья, включая предупреждение и лечение заболевания. Такие композиции, содержащие нутрицевтик, включают (без ограничений) вносимые в пищу дополнительные вещества, вкусовую добавку, пищевую добавку, пищу, полученную генно-инженерными методами, такую как, например, овощи, изделия из трав, и пищевые продукты, подвергшиеся технологической обработке, такие как пищевые изделия из хлебных злаков, супы и напитки, и стимулирующие продукты функционального питания, продукты лечебного питания и продукты, содержащие лечебные средства.
В отдельном воплощении изобретения фармацевтические композиции или композиции, содержащие нутрицевтик, представляют собой композиции с дозированной формой доставки.
Подходящие способы введения субъекту композиции изобретения представляют собой пероральное, буккальное и подъязычное введение или введение через зонд для искусственного кормления. В специфическом воплощении соединения вводят перорально.
Конкретная доза и режим введения композиции, безусловно, будут зависеть от предполагаемого терапевтического эффекта (например, лечение желудочно-кишечного заболевания) и могут изменяться в зависимости от конкретного состава, способа введения, возраста и состояния индивидуального субъекта, которому предполагается ввести композицию.
Настоящее изобретение, таким образом, также обеспечивает фармацевтическую композицию, применяемую в изобретении в смеси с фармацевтически приемлемыми вспомогательными соединениями, и необязательно другими терапевтическими средствами. Вспомогательные соединения должны быть "приемлемыми" в том смысле, что они должны быть совместимыми с другими ингредиентами композиции и не вредны для тех, кому их вводят.
В одном из воплощений фармацевтическая композиция дополнительно включает, по меньшей мере, одно фармацевтически активное средство.
Композиции могут быть получены с помощью любого способа, хорошо известного в такой области техники как фармацевтика.
Такие способы включают стадию объединения ингредиентов с любым вспомогательным средством. Вспомогательное средство (вспомогательные средства), называемое также вспомогательный ингредиент (вспомогательные ингредиенты), включает общепризнанное в данной области техники вспомогательное средство, такое как основы, наполнители, связующие средства, разбавители, дезинтегрирующие средства, смазывающие средства, красители, ароматизирующие вещества, антиоксиданты и увлажняющее средство.
Фармацевтические композиции, подходящие для перорального введения, могут быть представлены в виде дискретных лекарственных форм, таких как пилюли, таблетки, драже или капсулы, или в виде порошка или гранул, или в виде раствора или суспензий.
Композиции могут быть представлены в виде упаковок, содержащих лекарственное средство для однократного или многократного приема, например запечатанные флаконы и ампулы, и могут храниться в сублимированном (лиофилизированном) состоянии, требующем добавления только стерильной жидкой основы, например воды, перед употреблением.
Изобретение дополнительно обеспечивает коммерческую упаковку для приготовления композиции для применения в изобретении, такую как источник пригодного к употреблению в пищу жира или пищевое изделие в соответствии с изобретением, которая включает (а) источник жира, который при энтеральном введении субъекту предупреждает или лечит нарушения пищеварительной системы и/или активирует развитие, созревание, адаптацию и дифференциацию кишечника; (b) необязательно, по меньшей мере, один из пригодных к употреблению в пищу физиологически приемлемых белков, углеводов, витаминов, минералов, аминокислот, нуклеотидов и активных или неактивных добавок; (с) необязательно, по меньшей мере, одну из пригодных к употреблению в пищу физиологически приемлемых основ или разбавителей для внесения компонента/компонентов, определенных в (а) и (b); (d) средства и емкости для перемешивания компонентов, определенных в (а), (b) и/или (с); и (е) инструкции по применению, такие как, но, не ограничиваясь, инструкции по сроку хранения, инструкции для приготовления источника жира или пищевого изделия для введения, требуемые разведения, дозировки, частота введения и им подобные.
Коммерческая упаковка в соответствии с изобретением может также содержать источник жира в готовой к употреблению форме, вместе с инструкцией по применению. Дозировки обычно определяют в соответствии с возрастом, весом, полом и состоянием субъекта, в соответствии с надлежащей медицинской практикой, известной штатным врачам и другому медицинскому персоналу.
Следует понимать, что термин «желудочно-кишечное заболевание или нарушение», применяемый здесь, охватывает гастроэзофагеальный рефлюкс (GER), гастроэзофагеальное рефлюксное заболевание (GERD), некротизирующий энтероколит (NEC), гипербилирубинемию, воспалительные заболевания кишечника (такие как, но, не ограничиваясь, болезнь Крона и язвенный колит), синдром укороченной тонкой кишки, кишечные разрезы или рассечения, реанастомоз кишечника, язву, хирургическое вмешательство, например, при лечении спаек кишечника и непроходимости кишечника.
Следует понимать, что термин «кишечник», применяемый здесь, охватывает сегмент пищеварительного тракта протяженностью от желудка до заднего прохода. У людей и других млекопитающих, кишечник состоит из двух сегментов, тонкий кишечник (у людей дополнительно подразделен на двенадцатиперстную кишку, тощую кишку и подвздошную кишку) и толстый кишечник (у людей дополнительно подразделен на слепую кишку и ободочную кишку). Другие млекопитающие могут иметь еще более сложный кишечник.
Следует понимать, что термин «активация развития кишечника», применяемый здесь, охватывает активацию процесса или части процесса усиления, увеличения, нарастания, поддержания или продвижения формирования специализированной зрелости эпителия.
Следует понимать, что термин «созревание кишечника», применяемый здесь, охватывает активацию процесса или части процесса усиления, увеличения, нарастания, поддержания или продвижения процессов дифференциации энтероцитов и сегментов кишечника.
Как развитие, так и созревание кишечника (сегмента) может быть измерено с помощью таких показателей слизистой оболочки кишечника, как, но, не ограничиваясь, объем кишечника, масса кишечника и масса слизистой оболочки кишечника, и с помощью таких гистологических изменений, как, но, не ограничиваясь, высота ворсинок и глубина крипт.
Следует понимать, что термин «активация адаптации кишечника», применяемый здесь, охватывает любое физиологическое изменение, с помощью которого всасывающая способность тонкого кишечника усиливается, увеличивается, нарастает, поддерживается или продвигается, включая, но, не ограничиваясь, увеличение или удлинение ворсинок, обнаруживаемых в выстилке, увеличение диаметра тонкого кишечника и замедление перистальтики или движения пищи через тонкий кишечник.
Следует понимать, что термин «активация дифференциации кишечника», применяемый в этой заявке, охватывает процесс, с помощью которого предифференцированная клетка становится специализированной клеткой, например, в случае дифференциации кишечника плюрипотентные стволовые клетки, локализованные около основания крипты, последовательно дифференцируют в один из четырех типов зародышевых клеток: всасывающие энтероциты, бокаловидные клетки, клетки Панета и энтероэндокринные клетки.
GER (гастроэзофагеальный рефлюкс) представляет собой нарушение, при котором жидкое содержимое желудка выбрасывается обратно. Вместо того чтобы продавливаться в кишечник, содержимое выбрасывается вверх в пищевод. У младенцев основной причиной GER является незрелость нижнего пищеводного сфинктера. Если рефлюкс повреждает пищевод, то это называют GERD.
GERD (гастроэзофагеальное рефлюксное заболевание) представляет собой нарушение с хроническими симптомами или повреждением слизистой оболочки, вызываемой нарушенным рефлюксом в пищеводе. Это обычно связано с временными или постоянными изменениями в барьере между пищеводом и желудком. GERD в большей степени проявляется у младенцев, имеющих незрелый или не полностью развившийся желудочно-кишечный тракт.
Гипербилирубинемия представляет собой распространенную и в большинстве случаев неопасную проблему. Цвет обычно возникает в результате аккумуляции в коже несвязанного, неполярного, жирорастворимого пигмента билирубина. Токсический эффект повышения уровня несвязанного билирубина в сыворотке крови усиливается под действием некоторых факторов, таких как свободные жирные кислоты, которые снижают удержание билирубина в кровотоке.
NEC представляет собой желудочно-кишечное заболевание, которому, главным образом, подвержены недоношенные младенцы; оно включает инфекцию и воспаление, которые вызывают разрушение пищеварительного тракта (кишечника) или части пищеварительного тракта. NEC представляет собой наиболее распространенное и серьезное желудочно-кишечное нарушение, встречающееся среди госпитализированных недоношенных младенцев.
Исследования показали, что чем раньше рождается младенец, тем выше риск NEC, и что младенцы, вскармливаемые грудью, рискуют меньше, чем младенцы получавшие детские смеси.
NEC обычно возникает после того, как начинается вскармливание молоком. Недоношенные младенцы имеют незрелый пищеварительный тракт, который чувствителен к изменениям в токе крови и склонен к инфекции.
Точная причина, приводящая к NEC неизвестна, но существует несколько теоретических объяснений. Считается, что ткани кишечника недоношенных младенцев ослаблены из-за слишком низкого снабжения кислородом или из-за слабого кровотока, и когда начинается вскармливание, дополнительный стресс, возникающий из-за движения пищи через кишечник, позволяет бактериям, которые в норме обнаруживаются в кишечнике, проникать и повреждать ткани стенки кишечника.
Младенец теряет способность продолжать питаться и начинает чувствовать себя заболевшим, если бактерии продолжают проникать через стенку кишечника и иногда в кровоток. Поскольку системы организма младенца незрелы, то даже при быстром лечении NEC могут возникнуть серьезные осложнения.
По-видимому, и другие факторы увеличивают риск развития NEC. Некоторые специалисты полагают, что состав детской смеси, скорость доставки детской смеси или незрелость мембран слизистой в кишечнике может вызвать NEC.
Воспалительное заболевание кишечника (IBD) представляет собой группу воспалительных состояний толстого кишечника и тонкого кишечника. Основные типы IBD представляют собой болезнь Крона и язвенный колит. Язвенный колит представляет собой воспалительное заболевание толстого кишечника. При язвенном колите внутренняя выстилка - или слизистая оболочка - кишечника становится воспаленной (это означает, что выстилка стенки кишечника краснеет и набухает) и развиваются язвы, что означает открытые болезненные раны. Воспалительное заболевание кишечника (IBD) может вызывать такие симптомы как, но, не ограничиваясь, кровянистый стул, скрытая кровь в стуле, потеря массы тела, кровавый понос, снижение физической активности, тяжелая анемия, укорочение длины ободочной кишки и перианальное повреждение. Болезнь Крона отличается от язвенного колита областями пищеварительного тракта, охваченными заболеванием, - она чаще всего поражает последнюю часть тонкого кишечника (называемую терминальной подвздошной кишкой) и части толстого кишечника. Однако болезнь Крона не ограничена этими областями и может поражать любые части пищеварительного тракта. Болезнь Крона вызывает воспаление, которое распространяется намного глубже в слои стенки кишечника по сравнению с язвенным колитом. Болезнь Крона обычно имеет тенденцию вовлекать всю стенку пищеварительного тракта целиком, тогда как язвенный колит поражает только выстилку пищеварительного тракта.
Синдром укороченной тонкой кишки (SBS) представляет собой нарушение, связанное с недостаточным всасыванием, которое вызывается удалением в результате хирургического вмешательства тонкого кишечника или редко связано с полным нарушением функции большого сегмента пищеварительного тракта. В большинстве случаев синдром приобретается после рождения, хотя некоторые дети рождаются с врожденным коротким пищеварительным трактом. SBS обычно не развивается до тех пор, пока человек не потеряет более чем двух третей от своего тонкого кишечника.
Термин «хирургическое вмешательство», применяемый в этой заявке, охватывает вмешательство с целью, например, установления диагноза и/или лечения повреждения, порока или заболевания. Такое вмешательство может включать операцию или процедуру на желудочно-кишечном тракте, такую как, но, не ограничиваясь, кишечный разрез или рассечение и реанастамоз кишечника. Кишечный разрез или рассечение может представлять собой разрез или рану, сделанную путем разрезания кишечника с помощью острого инструмента, такого как применяют при хирургических операциях.
Реанастамоз кишечника представляет собой соединение между двумя сосудами в организме. Хирургический анастамоз включает восстановление соединения между двумя сосудами или полыми частями органа, например, если часть кишечника была удалена и оставшиеся свободные концы соединяют и сшивают.
Спайки кишечника представляют собой полоски фиброзной ткани, которые могут соединять петли кишечника друг с другом, или кишечник с другими органами брюшной полости, или кишечник с брюшной стенкой. Эти полоски могут смещать секции кишечника с его места их обычного положения и могут блокировать продвижение пищи. Спайки представляют собой основную причину непроходимости кишечника. Спайки могут присутствовать при рождении (врожденные) или могут сформироваться после хирургического вмешательства на брюшной полости или после воспаления.
Непроходимость кишечника означает частичную или полную механическую или немеханическую блокаду тонкого или толстого кишечника. Младенцы первого года жизни чаще всего имеют непроходимость кишечника, вызванную мекониевой непроходимостью кишечника, заворотом кишок и инвагинацией кишок. Мекониевая непроходимость кишечника, которая представляет собой неспособность к прохождению первой экскреции с фекалиями после рождения (мекония), представляет собой нарушение новорожденных. Она также может иметь место у младенцев с очень низкой массой при рождении (VLBW). При мекониевой непроходимости кишечника аномальный меконий должен быть удален с помощью клизмы или посредством хирургического вмешательства. Заворот кишок представляет собой скручивание как тонкого, так и толстого кишечника, которое может прервать доставку крови к пищеварительному тракту, что приведет к смерти тканей (гангрене). При инвагинации кишок пищеварительный тракт втягивается внутрь самого себя, таким образом как складывается радиоантенна. Это нарушение наиболее распространено у детей в возрасте между тремя и девятью месяцами, хотя оно также случается у детей более старшего возраста. Мальчики страдают от инвагинаций кишок почти в два раза чаще, чем девочки.
Источник жира применяют для получения композиции, например, такой как детская смесь. Такая композиция, например детская смесь, может дополнительно включать другие компоненты, такие как, но, не ограничиваясь, источник белка, источник углевода, минералы, витамины, нуклеотиды, аминокислоты и, необязательно, по меньшей мере, одно из следующего: носитель, разбавитель, добавку или эксипиент, все пригодные к употреблению в пищу.
Жировая смесь для получения композиции по изобретению, такая как детская смесь, может быть, но не ограничивается, любым источником жира, таким как те, что описаны в патентной заявке WO 05/036987, которые включают жировые концентраты (также называемые жировые основы). Жировая смесь, примененная в настоящем изобретении, может быть любым питательным ингредиентом, включающим пригодный к употреблению в пищу источник жира. В особом воплощении жировые смеси представляют собой смеси, которые основаны на синтетических триглициридах (которые могут быть получены как химическим, так и энзиматическим путем), которые имитируют композицию триглициридов жира человеческого грудного молока. В одном из воплощений такая жировая основа (и жировая смесь) характеризуется высоким содержанием пальмитиновой кислоты в положении sn-2 триглициридов, имеющих формулу I, (например, по меньшей мере, 30%) и высоким содержанием ненасыщенных жирных кислот в положении sn-1 и sn-3 триглицирида, имеющего формулу I, (например, по меньшей мере, 50% от общего содержания жирной кислоты в положениях sn-1 и sn-3). Неограничивающий пример представляет собой смесь, которая называется InFat®(Enzymotec Ltd., Migdal HaEmeq, Israel).

Поскольку жировые смеси получают с помощью смешивания жировой основы с другими маслами, композиция жирных кислот жировых смесей возникает как из композиции жирной кислоты, как жировой основы, так и других масел, смешанных с жировой основой.
Детская смесь, полезная для целей изобретения, может быть жировой композицией заменителя человеческого молока, включающей жировую смесь, состоящую, по меньшей мере, из 25% жировой основы с вплоть до, по меньшей мере, 75% одного растительного масла.
Нелимитирующие примеры растительного масла, применяемого при получении смесей по изобретению, представляют собой соевое, пальмовое, каноловое, кокосовое, пальмоядровое, подсолнечное, кукурузное и рапсовое масло, а также другие растительные масла и жиры, и их смеси.
Применяемый здесь термин «липид» имеет отношение к жирам и жироподобным соединениям, которые, по существу, нерастворимы в воде и которые включают, но не ограничиваясь, триглицириды, стеролы, жирные кислоты и т.д.
Применяемый здесь термин «ацильная группа» имеет отношение к органическому радикалу, обозначаемому формулой -C(=O)R, в которой R выбирают из насыщенного, мононенасыщенного и полиненасыщенного С4-С28 алифатического остатка жирной кислоты.
Применяемый здесь термин «жирная кислота» имеет отношение к карбоновой кислоте с длинным неразветвленным хвостом (цепью), который может быть как насыщенным, так и ненасыщенным, имеющим одну ненасыщенную связь (мононенасыщенные жирные кислоты) или две или более ненасыщенных связей (полиненасыщенные жирные кислоты).
Нелимитирующие примеры насыщенных жирных кислот, которые могут быть применены в этом изобретении, включают: масляную кислоту (бутановую кислоту, С4:0), капроновую кислоту (гексановую кислоту, С6:0), каприловую кислоту (октановую кислоту, С8:0), каприновую кислоту (декановую кислоту, С10:0), лауриновую кислоту (додекановую кислоту, С12:0), миристиновую кислоту (тетрадекановую кислоту, С14:0), пальмитиновую кислоту (гексадекановую кислоту, С16:0), стеариновую кислоту (октадекановую кислоту, С18:0), арахиновую (эйкозановую кислоту, С20:0), бегеновую кислоту (докозановую кислоту С22:0).
Нелимитирующие примеры ненасыщенных жирных кислот, которые могут быть применены в этом изобретении, включают: миристоленовую кислоту (ω-5, С14:1), пальмитолеиновую кислоту (ω-7, С16:1), олеиновую кислоту (ω-9, С18:1), линолевую кислоту (ω-6, С18:2), альфа-линоленовую кислоту (ω-3, С18:3), арахидоновую кислоту (ω-6, С20:4), эйкозапентаеновую кислоту (ω-3, С20:5), эруковую кислоту (ω-9, С22:1) и докозагексаеновую кислоту (ω-3, С22:6).
В одном из воплощений изобретения R2 представляет собой остаток насыщенной жирной кислоты. В дополнительном воплощении остаток насыщенной жирной кислоты выбирают из C14-C18 остатков насыщенной жирной кислоты. В еще одном дополнительном воплощении насыщенная жирная кислота представляет собой остаток пальмитиновой кислоты.
В одном из воплощений общее содержание остатков пальмитиновой кислоты равно от примерно 15% до примерно 40% от общего содержания остатков жирной кислоты в композиции. В другом воплощении общее содержание остатков пальмитиновой кислоты равно от примерно 15% до примерно 33% от общего содержания остатков жирной кислоты в композиции.
В другом воплощении изобретения оба R1 и R3 представляют собой Н.
В одном из воплощений, по меньшей мере, 13% от общего содержания жирных кислот в положении sn-2 скелета триглицирида представляют собой остатки пальмитиновой кислоты. В другом воплощении, по меньшей мере, 15% от общего содержания жирных кислот в положении sn-2 скелета триглицирида представляют собой остатки пальмитиновой кислоты. В еще одном воплощении, по меньшей мере, 18% от общего содержания жирных кислот в положении sn-2 скелета триглицирида представляют собой остатки пальмитиновой кислоты. В еще одном воплощении, по меньшей мере, 22% от общего содержания жирных кислот в положении sn-2 скелета триглицирида представляют собой остатки пальмитиновой кислоты.
В одном из воплощений, по меньшей мере, 30% от общего содержания остатков пальмитиновой кислоты в композиции присоединены в положении sn-2 углеродного скелета триглицирида. В другом воплощении, по меньшей мере, 33% от общего содержания остатков пальмитиновой кислоты присоединены в положении sn-2 углеродного скелета триглицирида. В еще одном воплощении, по меньшей мере, 38% от общего содержания остатков пальмитиновой кислоты присоединены в положении sn-2 углеродного скелета триглицирида. В еще одном воплощении, по меньшей мере, 40% от общего содержания остатков пальмитиновой кислоты присоединены в положении sn-2 углеродного скелета триглицирида.
В дополнительном воплощении изобретения R1 и R3 представляют собой остатки ненасыщенной жирной кислоты.
В одном из воплощений, по меньшей мере, 50% от общего содержания остатков жирной кислоты в положениях sn-1 и sn-3 углеродного скелета триглицирида представляют собой остатки ненасыщенных жирных кислот. В дополнительном воплощении, по меньшей мере, 70% от общего содержания остатков жирной кислоты в положениях sn-1 и sn-3 углеродного скелета триглицирида представляют собой остатки ненасыщенных жирных кислот. В одном из воплощений указанный остаток ненасыщенной жирной кислоты выбирают из группы, состоящей из олеиновой кислоты, линолевой кислоты, линоленовой кислоты и гадолиновой кислоты. В одном из специфических воплощений, по меньшей мере, 35% остатков ненасыщенной жирной кислоты в положениях sn-1 и sn-3 представляют собой остатки олеиновой кислоты. В дополнительном специфическом воплощении, по меньшей мере, 40% остатков ненасыщенной жирной кислоты в положениях sn-1 и sn-3 представляют собой остатки олеиновой кислоты.
В одном из специфических воплощений, по меньшей мере, 4% указанных остатков ненасыщенной жирной кислоты в положениях sn-1 и sn-3 представляют собой остатки линолевой кислоты. В дополнительном специфическом воплощении, по меньшей мере, 6% указанных остатков ненасыщенной жирной кислоты в положениях sn-1 и sn-3 представляют собой остатки линолевой кислоты.
В первом воплощении указанная липидная композиция состоит из:
0-10% С8:0 жирных кислот от общего содержания жирных кислот;
0-10% С10:0 жирных кислот от общего содержания жирных кислот;
0-22% С12:0 жирных кислот от общего содержания жирных кислот;
0-15% С14:0 жирных кислот от общего содержания жирных кислот;
15-55% С16:0 жирных кислот от общего содержания жирных кислот, среди которых, по меньшей мере, 30% в положении sn-2;
1-7% С18:0 жирных кислот от общего содержания жирных кислот;
20-75% С18:1 жирных кислот от общего содержания жирных кислот;
2-40% С18:2 жирных кислот от общего содержания жирных кислот;
0-8% С18:3 жирных кислот от общего содержания жирных кислот;
другие жирные кислоты присутствуют в количестве, равном менее чем 8% от общего содержания жирных кислот.
Во втором воплощении указанная липидная композиция состоит из:
5-15% С12:0 жирных кислот от общего содержания жирных кислот;
2-10% С14:0 жирных кислот от общего содержания жирных кислот;
17-25% С16:0 жирных кислот от общего содержания жирных кислот, среди которых, по меньшей мере, 40% в положении sn-2;
2-5% С18:0 жирных кислот от общего содержания жирных кислот;
28-45% С18:1 жирных кислот от общего содержания жирных кислот;
5-20% С18:2 жирных кислот от общего содержания жирных кислот;
1-3% С18:3 жирных кислот от общего содержания жирных кислот;
другие жирные кислоты присутствуют в количестве, равном менее чем 5% от общего содержания жирных кислот.
Все возможные комбинации указанного первого и указанного второго воплощения также предусматриваются, например:
0-22% С12:0 жирных кислот от общего содержания жирных кислот (из первого воплощения) может быть скомбинировано с
2-10% С14:0 жирных кислот от общего содержания жирных кислот;
20-25% С16:0 жирных кислот от общего содержания жирных кислот;
2-5% С18:0 жирных кислот от общего содержания жирных кислот;
28-45% С18:1 жирных кислот от общего содержания жирных кислот;
5-20% С18:2 жирных кислот от общего содержания жирных кислот;
1-3% С18:3 жирных кислот от общего содержания жирных кислот;
другие жирные кислоты присутствуют в количестве, равном менее чем 5% от общего содержания жирных кислот.
Следует понимать, что соединения, обеспечиваемые заявкой, могут содержать хиральные центры. Такие хиральные центры могут иметь как (R)-, так и (S)-конфигурацию, или могут быть любой их смесью. Таким образом, соединения, обеспечиваемые заявкой, могут быть энантиомерно чистыми, или могут быть стереоизомерными или диастереоизомерными смесями, такими как рацемические или нерацемические смеси.
ПРИМЕРЫ
Изобретение дополнительно описано в следующих примерах, которые никоим образом не предназначены для ограничения объема притязаний изобретения, охватываемого формулой изобретения.
Пример 1
Композиции
Таблица 1 описывает состав некоторых жировых основ с высоким содержанием пальмитиновой кислоты в положении sn-2 (далее в этом документе «жировые основы»). Таблица 2 описывает состав некоторых источников жира (далее в этом документе «жировые смеси»), включающий любую из жировых основ 1, 7, 8, 9, 10 или 11 для применения в предмете изобретения.
Жировая основа может составлять примерно 30-83% жировых смесей, подходящих для применения в композиции для применения в изобретении.
Получение этих источников жира проводили точно так, как описано в патентной заявке WO 05/036987.
Все числа представлены в % (масс./масс.), за исключением отношения, которое определено как %. С16:0 представляет собой общее содержание пальмитиновой кислоты. С16:0 в sn-2 представляет собой % пальмитиновой кислоты в sn-2 от общего содержания жирных кислот в положении sn-2. Отношение означает % пальмитиновой кислоты в sn-2 от общего содержания пальмитиновой кислоты {((% пальмитата в sn-2 от общего содержания жирных кислот в положении sn-2)/3)/(% общего содержания пальмитиновой кислоты)}×100.
С16:0 представляет собой общее содержание пальмитиновой кислоты. С16:0 в sn-2 представляет собой % пальмитиновой кислоты в sn-2 от общего содержания жирных кислот в положении sn-2. Отношение означает % sn-2 пальмитиновой кислоты от общего содержания пальмитиновой кислоты {((% sn-2 пальмитата от общего содержания жирных кислот в положении sn-2) / 3)/ (% суммарной пальмитиновой кислоты) }х100. Все числа представлены в % (масс./масс.), за исключением отношения, которое определено как %.
Пример 2
Детская смесь
Детские смеси, включающие жировую основу и дополнительные масла и жиры (т.е. жировые смеси), которые имитируют жировую композицию человеческого грудного молока, получают следующим образом.
Фракцию жиров получают путем смешивания жировой основы с другими маслами. Масло смешивают с другими компонентами детской смеси (белками, углеводами, минералами, витаминами и прочими). Кашицу пропускают через гомогенизатор под давлением и получают стабильную эмульсию. Гомогенизированный продукт затем высушивают в распылительной сушилке и получают конечный продукт. Другие добавки могут быть внесены к сухому порошку для получения конечной композиции.
Фракцию жиров, полученную путем смешивания жировой основы с другими маслами и жирами, такими как описаны выше, дополнительно смешивают с другими питательными веществами, такими как белки, минералы, витамины и углеводы и получают пищевое изделие, обеспечивающее младенца основными питательными веществами, также обнаруживаемыми в человеческом молоке. Питательные вещества и жиры гомогенизируют, применяя гомогенизирование под давлением и распылительную сушилку для получения гомогенного порошка. Порошок дополнительно повторно диспергируют в воде (приблизительно 9 г порошка на 60 мл воды) и получают смесь, готовую для употребления в пищу. Содержание жира готового питания составляет приблизительно 3,5 г на 100 мл, что соответствует содержанию жира в человеческом грудном молоке, которое варьирует в диапазоне 30-40 г/л.
Таблица 3 показывает состав жирных кислот в жировой смеси 11, включающей жировую основу изобретения (30%), которую перемешивают/смешивают с другими маслами и жирами, применяемыми для создания источника жира, применяемого в детской смеси для применения в изобретении. Таблица 4 показывает ингредиенты и свойства детской смеси, включающей источник жира по таблице 3. Поскольку жировые смеси получают путем смешивания жировой основы с другими маслами, композиция жирных кислот смесей получается из композиции жирных кислот как жировой основы, так и других масел, смешанных с жировой основой.
Все числа представлены в % (масс./масс.), за исключением отношения, которое определено как %. С16:0 представляет собой общее содержание пальмитиновой кислоты. С16:0 в sn-2 представляет собой % пальмитиновой кислоты в sn-2 от общего содержания жирных кислот в положении sn-2. Отношение означает % sn-2 пальмитиновой кислоты от общего содержания пальмитиновой кислоты {((% sn-2 пальмитата от общего содержания жирных кислот в положении sn-2)/3)/(% общего содержания пальмитиновой кислоты)}×100.
Содержание жира и точный состав композиции контролируют с целью получения детских смесей, разработанных для имитации различных периодов лактации.
Таблица 5 показывает композицию жирных кислот в жировой смеси 12, включающей жировую основу изобретения, смешанную с другими маслами и жирами, применяемыми для создания источника жира, примененного в детской смеси для применения в изобретении.
Все числа представлены в % (масс./масс.), за исключением отношения, которое определено как %. С16:0 представляет собой общее содержание пальмитиновой кислоты. С16:0 в sn-2 представляет собой % пальмитиновой кислоты в sn-2 от общего содержания жирных кислот в положении sn-2. Отношение означает % sn-2 пальмитиновой кислоты от общего содержания пальмитиновой кислоты {((% sn-2 пальмитата от общего содержания жирных кислот в положении sn-2)/3)/(% общего содержания пальмитиновой кислоты)}×100.
Пример 3
Влияние жировой смеси на желудочно-кишечную (GI) устойчивость и зрелость кишечника
Влияние жировых основ и жировых смесей настоящего изобретения на устойчивость GI и зрелость кишечника определяли с помощью клинического исследования в моделях на животных, на (i) недоношенных крысах (Ito Y et al. Intestinal microcirculatory dysfunction during the development of experimental necrotizing enterocolitis Pediatric Research 2007), и (ii) в модели на новорожденных (Dvorak В, Epidermal growth factor reduces the development of necrotizing enterocolitis in a neonatal rat model. Am J Physiol Gastrointest Liver Physiol. 2002), обе модели представляют собой модели недоношенных младенцев.
Исследование включает три группы животных, которые получали детские смеси, отличавшиеся только по жировым композициям, главным образом, по содержанию пальмитиновой кислоты. Одной группе вводили стандартный заменитель крысиного молока (который имитирует крысиное молоко), второй группе вводили заменитель крысиного молока, содержание пальмитиновой кислоты в жире которого было равно примерно 8% от общего содержания жирной кислоты, из которой примерно 10% находилось в положении sn-2 триглицирида, и третьей группе вводили заменитель крысиного молока, содержавший жировую смесь 1 (смотри таблицу 2), содержание пальмитиновой кислоты в жире которой было равно примерно 20% от жирной кислоты, из которой ~50% находилось в положении sn-2 триглицирида. Детскую смесь вводили всем группам в течение 3 месяцев и устойчивость их GI определяли с помощью хорошо разработанной методики определения GI устойчивости и оценки общего состояния здоровья перед началом исследования и в ходе исследования, приблизительно каждый месяц. Дополнительно, зрелость кишечника исследуемых субъектов определяли с помощью гистологических анализов в конце исследования. Животные в первой и третьей группе демонстрировали лучшую устойчивость GI и зрелость кишечника, чем животные второй группы, согласно данным статистического анализа протоколов и данным, полученным с помощью гистологических тестов. Животные в третьей группе демонстрировали даже более хорошую устойчивость GI и зрелость кишечника, чем животные первой группы, согласно данным статистического анализа протоколов и данным, полученным с помощью гистологических тестов.
Пример 4
Влияние диеты, основанной на жировой смеси 6, на рост, развитие и созревание кишечника у крыс, отлученных от грудного вскармливания
Эффективность влияния жировой смеси (смотри таблицу 2) на усиление роста, развития и созревания кишечника изучали в модельных экспериментах на животных. Животных, которых кормили диетой с высоким содержанием пальмитиновой кислоты в положении sn-2 (смесь жиров 6), сравнивали с животными, находившимися на параллельных диетах, в которых пальмитиновая кислота была или в сходных концентрациях, или в низких концентрациях.
Постановка эксперимента
60 крыс-самцов Sprague-Dawley получали из лаборатории Harlan Laboratories (Rehovot, Israel) в возрасте 21-го дня, непосредственно после отлучения от грудного вскармливания, и с массой тела, равной 40-50 г.
Крысам произвольным образом назначали получение одной из 3-х различных диет (смотри таблицы 6 и 7); предлагаемые диеты различались только по содержанию жира:
1) диета А: диета с маслом, содержащим 21% пальмитиновой кислоты, из которой 48% эстерифицировано в положении sn-2 (содержит жировую смесь 6 (смотри таблицу 2));
2) диета В: диета с маслом, содержащим 22% пальмитиновой кислоты, из которой 13% эстерифицировано в положении sn-2;
3) диета С: диета с маслом, содержащим 8% пальмитиновой кислоты, из которой 11% эстерифицировано в положении sn-2.
Исследование проводили в две фазы
1. В первой фазе диетическое лечение вводят в течение одной недели. Крыс случайным образом распределяют по трем группам, каждая группа содержит по 12 животных.
2. Во второй фазе диетическое лечение вводят в течение двух недель. Крыс случайным образом распределяют в одну из трех групп, каждая группа содержит по 8 животных.
На 8-й или на 15-й день кормления животных анестезируют, забивают, извлекают тонкий кишечник и разделяют на три сегмента: двенадцатиперстную кишку, проксимальную тощую кишку и терминальную подвздошную кишку. Сегменты тонкого кишечника применяют для макроскопического анализа патологий, морфологических и гистологических анализов, которые указывают на зрелость кишечника исследуемых животных.
Диеты
Все диеты были идентичными в отношении содержания питательных веществ и различались только в отношении типа масла (таблицы 6 и 7).
Все числа представлены в % (масс./масс.), за исключением отношения, которое определено как %. С16:0 представляет собой общее содержание пальмитиновой кислоты. С16:0 в sn-2 представляет собой % пальмитиновой кислоты в sn-2 от общего содержания жирных кислот в положении sn-2. Отношение означает % sn-2 пальмитиновой кислоты от общего содержания пальмитиновой кислоты {((% sn-2 пальмитата от общего содержания жирных кислот в положении sn-2)/3)/(% общего содержания пальмитиновой кислоты)}×100. Пальмитиновая кислота в sn-2 от общего содержания насыщенной жирной кислоты в sn-2 представляет собой % пальмитиновой кислоты в sn-2 от общего содержания насыщенной жирной кислот в положении sn-2.
Потребление пищи
Во время периода кормления массу тела и непотребленную пищу взвешивали два раза в неделю. Рассчитывают потребление пищи и выражают его в граммах в день. Потребление энергии и жира рассчитывают в соответствии с количеством потребленной пищи.
Макропатологический и морфологический анализ кишечника
Тонкий кишечник извлекают и разделяют на три сегмента: двенадцатиперстную кишку, проксимальную тощую кишку и терминальную подвздошную кишку. Каждый сегмент взвешивают и рассчитывают массу на 1 см длины пищеварительного тракта. Сегменты открывают; объем кишечника в каждом сегменте измеряют в трех различных участках и рассчитывают средний объем кишечника. Слизистую оболочку соскабливают и взвешивают. Массы пищеварительного тракта и слизистой оболочки выражают в мг/см длины пищеварительного тракта /100 г массы тела.
Анализ гистологических измерений
Гистологические срезы получают из остатков тощей и подвздошной кишок.
Для гистологических исследований кишечник рассекают по противобрыжеечному краю и промывают холодным солевым раствором. Кусочки проксимальной тощей кишки сразу же сдвигают к связке Трейтца, и терминальную подвздошную кишку около подвздошно-цекального сочленения фиксируют в течение 24 часов в 5%-ном формалине, промывают абсолютным спиртом и заливают в парафин. Поперечные 5 мкм срезы получают по стандартной методике и окрашивают гематоксилином и эозином. Высоту ворсинок и глубину крипт измеряют, применяя программу для анализа изображений Image Pro Plus 4 (Media Cybernetics, Baltimore, Maryland, USA) и выражают в мкм.
Пролиферация энтероцитов
Пролиферацию клеток крипт исследовали, применяя биотинилированные систему моноклональных антител против BrdU, обеспечиваемую в виде набора (Zymed Laboratories, Inc, San Francisco, CA). Стандартный реагент для мечения, 5-бромдезоксиуридин (5-BrdU) (Cat. No. 00-0103, Zymed Laboratories, Inc, San Francisco, CA), вводили с помощью инъекции внутрибрюшинно в концентрации, равной 1 мл/100 г массы тела за 2 часа перед забоем. Тканевые срезы (5 мкм) освобождали от парафина и обводняли с помощью ксилола и набора спиртов с понижающейся концентрацией. Срезы нагревали в течение 10-ти минут в цитратном буфере, предварительно обрабатывали денатурирующим раствором в течение 20-ти минут и инкубировали с блокирующим раствором в течение 10-ти минут. Срезы окрашивали биотинилированными моноклональными антителами против BrdU в течение 60-ти минут и затем обрабатывали стрептавидин-пероксидазой в течение 10-ти минут. Развитие BRDU-положительной окраски получали путем инкубирования срезов со смесью DUB в течение 3-5 минут. Показатель пролиферации определяли как отношение числа клеток крипт, позитивно прокрашенных на BrdU, на 10 крипт (Shamir et al., 2005. Digestive Diseases and Sciences, Vol.50, No.7 pp.1239-1244 and Sukhotnik et al., 2008 Dig Dis Sci.; Vol 53(5): 1231-9).
Результаты
Потребление энергии, потребление пищи и жира
Потребление пищи значительно вырастало в течение двухнедельного периода у всех животных, без статистически значимой разницы между экспериментальными группами.
Показатели слизистой оболочки кишечника
Влияние диетической терапии на показатели слизистой оболочки кишечника были различными в проксимальном и дистальном отделах кишечника. Протестированные показатели слизистой оболочки кишечника представляли собой объем кишечника, массу пищеварительного тракта и массу слизистой оболочки. Эти показатели указывают на физиологическое развитие ткани кишечника.
В проксимальном отделе кишечника
В проксимальном отделе кишечника (тощая кишка и двенадцатиперстная кишка), после кормления в течение одной недели крысы группы, получавшей диету А, демонстрировали статистически значимое увеличение пищеварительного тракта и массы слизистой оболочки по сравнению с группой, получавшей диету С (таблица 8). Следует отметить, что удаление пальмитиновой кислоты в диете С приводит к появлению первых признаков гипоплазии слизистой оболочки, которая становится еще более заметной после 2-х недель диетического лечения. После двух недель кормления крысы из группы, получавшей диету А, демонстрировали тенденцию к увеличению массы пищеварительного тракта в отделе тощей кишки, при сравнении с животными, получавшими диету В и диету С. Масса слизистой оболочки животных, получавших диету А, была значительно больше по сравнению этим параметром у животных, получавших диету С (р=0,027) (фигура 1, таблица 8).
В подвздошной кишке
В подвздошной кишке после кормления в течение одной недели не было различий в массах пищеварительного тракта и слизистой оболочки между крысами, получавшими диету А и диету В. Однако крысы, получавшие диету А и диету В, демонстрировали увеличенную массу слизистой оболочки по сравнению с массой слизистой оболочки животных, получавших диету С (таблица 8). После двух недель кормления в группе с диетой А было обнаружено увеличение массы пищеварительного тракта и слизистой оболочки, по сравнению с группой с диетой С. Кроме того, крысы с диетой А, показали увеличение массы слизистой оболочки подвздошной кишки по сравнению с группой, получавшей диету В (р=0,048) (таблица 8).

Фигура 1 показывает, что диета А оказывает общее улучшающее влияние на массу слизистой после двух недель диетической терапии по сравнению с диетами В и С. Массу пищеварительного тракта и слизистой оболочки выражают как мг/см длины пищеварительного тракта /100 г массы тела (BW).
Микроскопические изменения
После одной недели кормления диета С приводит к значительному укорачиванию ворсинок подвздошной кишки по сравнению с другими группами (таблица 9). Эти эффекты усиливаются после двух недель кормления; диета А приводит к значительно более сильным микроскопическим изменениям по сравнению с диетой В и диетой С (фигура 2, таблица 9). Животные, получавшие диету А, демонстрировали более высокие ворсинки в тощей кишке (Р=0,028) и в подвздошной кишке (Р=0,018) по сравнению с животными, получавшими диету В, а также высокие ворсинки в подвздошной кишке по сравнению животными, получавшими диету С (Р=0,033). Животные, получавшие диету А, также демонстрировали значительно более глубокие крипты в тощей кишке по сравнению с животными, получавшими диету В и С (Р=0,015, 0,0016, соответственно), и в подвздошной кишке по сравнению с животными, получавшими диету В и С (Р=0,024, 0,04, соответственно). Дополнительно, существует явная корреляция между полученными гистологическими и микроскопическими параметрами.
Фигура 2 показывает, что диета А оказывает общее улучшающее воздействие на микроскопические параметры пищеварительного тракта после двух недель диетической терапии по сравнению с диетами В и С.
Пролиферация энтероцитов
В тощей кишке
Кормление животных в течение одной недели диетой А приводило к значительному увеличению в клеточной пролиферации при сравнении с животными, получавшими диету В и С, и кормление животных диетой В увеличивало клеточную пролиферацию по сравнению с крысами, получавшими диету С. После двухнедельного кормления только диетой А крысы продемонстрировали существенно более высокий индекс пролиферации в тощей кишке при сравнении с крысами, получавшими диету С (Р=0,036) (фигура 3, таблица 10).
В подвздошной кишке
После кормления в течение одной недели: группа, получавшая диету А, показала сильную стимуляцию пролиферации энтероцитов при сравнении с группой, получавшей диету С (таблица 10).
После кормления в течение двух недель, группа, получавшая диету А, показала сильную стимуляцию пролиферации энтероцитов в подвздошной кишке. Животные, получавшие диету А, показали значительно более высокий индекс пролиферации в подвздошной кишке при сравнении с животными, получавшими диету В и диету С (Р=0,0004, 0,0001, соответственно) (фигура 3, таблица 10). Следует отметить, что воздействие диеты С приводит к самой низкой скорости пролиферации энтероцитов в подвздошной кишке при сравнении с другими группами (таблица 10).
Таким образом, лечение диетой А приводит к усилению развития и созревания кишечника, которое обнаруживается после первой недели диетической терапии и становится более значительным после двух недель лечения. Выраженное увеличение в высоте ворсинок рассматривают в качестве важного показателя увеличения площади всасывающей поверхности в этой группе животных. Увеличение числа клеток с криптами наряду с гипертрофией индивидуальных клеток, которое было продемонстрировано морфометрически, представляет собой характеристику ткани, в которой происходит усиление клеточной пролиферации и/или восстановления.
Удаление пальмитиновой кислоты из диеты С приводит к гипопластическим изменениям в тощей кишке и, в особенности, в подвздошной кишке. Эти изменения появляются после однонедельной диетической терапии и вырастают после 2-недельной диетической терапии, и они подчеркивают пагубное влияние нехватки пальмитиновой кислоты. Кроме того, снижение пролиферации энтероцитов, показанное у крыс, которые получали диету с низким содержанием пальмитата, может рассматриваться как основной механизм, ответственный за снижение клеточной массы кишечника и гипоплазию слизистой оболочки.
Динамический процесс обновляемости клеток кишечника представляет собой функцию скорости пролиферации клеток крипт, миграцию вдоль оси крипта-ворсинки, дифференциацию энтероцитов и клеточную смерть в процессе апоптоза. Значительное увеличение клеточной пролиферации после получения диеты А сопровождается тенденцией к снижению клеточного апоптоза, следовательно, происходит усиление клеточной обновляемости в ходе роста кишечника.
Наконец, высокое содержание пальмитиновой кислоты, высокое количество из которой присоединено в положении sn-2, представляет собой важный фактор в росте кишечника у крыс, отлученных от грудного питания. Диета А приводит к заметному усилению развития, роста и созревания кишечника по сравнению с диетами, содержащими смесь стандартных растительных масел, смешанных с композициями с высоким содержанием пальмитиновой кислоты или с низким содержанием пальмитиновой кислоты. Заметное усиление развития, роста и созревания кишечника проявляется через одну неделю и усиливается после 2-х недель диетической терапии. Диета А дополнительно демонстрирует более сильное стимулирующее влияние на пролиферацию и обновляемость энтероцитов по сравнению с другими диетами.
Снижение образования кальциевого мыла представляет собой общепризнанное и хорошо известное полезное влияние как масла, обогащенного пальмитиновой кислотой, эстерифицированной в положении sn-2, так и масла с низким содержанием пальмитиновой кислоты (Коо et al., 2006, Journal of American college of Nutrition, Vol. 25, No 2 pp. 117-122). Это влияние сходно между этими маслами и известно, что ему приписывают снижение дискомфорта и симптомов, имеющих отношение к перевариванию пищи.
Поскольку диета А (в вышеприведенных примерах) продемонстрировала превосходящие и значительно отличающиеся эффекты на развитие и созревание кишечника, по сравнению с диетой С, очевидно, что эти эффекты по усилению развития и созревания кишечника не имеют отношения или не связаны с влиянием на снижение образования кальциевого мыла.
Пример 5
Влияние жировой смеси на пролиферацию и дифференциацию клеток Сасо-2
Влияние жировой смеси на пролиферацию и дифференциацию в культуре ткани изучали на клетках Сасо-2. Линию клеток Сасо-2 в настоящее время применяют во многих качественных и количественных исследованиях в качестве модели эпителиальных клеток кишечника in vitro. Клетки растут на проницаемых вставках из плотных контактов и достигают многих из морфологических и функциональных характеристик энтероцитов тонкого кишечника (Artursson P., Karlsson J., 1991, Biochem. Biophys. Res. Commun., Vol. 175, 880-885). Эта модельная клеточная система демонстрировала положительное влияние жировых добавок изобретения на созревание кишечника посредством клеточной пролиферации и трансклеточной проницаемости.
Постановка эксперимента
Сасо-2 клетки, происходящие из колоректальной карциномы человека, получали из АТСС (Американская коллекция типовых культур, АТСС® Number HTB-37).
Клетки Сасо-2 растили в среде роста в стерильных условиях. Клетки дважды пересевали перед обработкой. Культуры клеток инкубировали при 37±1°С, 5±0,5% СO2 и 95±5% влажности, в пластиковых флаконах (NUNC). Дифференциацию и созревание Сасо-2 клеток определяли по слиянию клеток и трансклеточному транспорту.
Смыкание клеток и трансклеточный транспорт
Смыкание клеток и трансклеточный транспорт измеряли в Сасо-2 клетках, которые высевали на полиэфирные мембранные вкладыши. Смыкание и дифференциацию клеточного монослоя на мембранных вкладышах измеряли на 7-й и 9-й день после посева путем анализа измерений трансэпителиального электрического сопротивления (TEER). Измерение TEER стал универсальным широко принятым приемом в большинстве удобных, надежных и не вызывающих разрушений способах для оценки и контроля роста культур эпителиальных тканей in vitro. Смыкание клеточного монослоя, которое представляет собой модель созревания кишечника, определяют с помощью увеличения в TEER. TEER измеряют с помощью электрода Millicell-ERS («Millipore») в ходе клеточной инкубации в среде роста, содержавшей 2 мкМ тестируемого вещества:
(i) добавка масла с низким содержанием пальмитиновой кислоты (8% от общего содержания жирных кислот, причем примерно 10% из которых находилось в положении sn-2) (LPO - смотри таблицу 11).
(ii) жировая смесь 7 с высоким содержанием пальмитиновой кислоты (20% от общего содержания жирных кислот, из которых примерно 50% находилось в положении sn-2) (смотри таблицу 2).
Все числа представлены в % (масс./масс.), за исключением отношения, которое определено как %. С16:0 представляет собой общее содержание пальмитиновой кислоты. С16:0 в sn-2 представляет собой % пальмитиновой кислоты в положении sn-2 от общего содержания жирных кислот в положении sn-2. Отношение означает % sn-2 пальмитиновой кислоты от общего содержания пальмитиновой кислоты {((% sn-2 пальмитата от общего содержания жирных кислот в положении sn-2)/3)/(% общего содержания пальмитиновой кислоты)}×100.
Результаты
Параметры смыкания
Через семь дней после посева клеток Сасо-2 величина TEER в присутствии масла LPO была равна 233±59 Ом/см2. После двух дополнительных дней, т.е. через 9 дней после посева клеток Сасо-2, величина TEER увеличилась на 119,4 (фиг.4В) и достигла 352,5±37 Ом/см2 (фиг.4А). В присутствии жировой смеси 7 через семь дней после посева клеток Сасо-2 величина TEER была равна 330±11 Ом/см2, а после двух дополнительных дней - 389±26 Ом/см2 (фиг.4А), т.е. увеличилась на 59,2 Ом/см2 (фиг.4В). Измерения TEER контрольных клеток показали величины, равные 325±12 Ом/см2 и 432±11, через 7 и 9 дней после посева, соответственно (фиг.4А); а суммарное увеличение было равно 107,2 Ом/см2, т.е. больше чем в присутствии жировой смеси 7 (фиг.4В). Поскольку скорость роста слоя насыщала приблизительно полный монослой, то изменения в опытах с маслом LPO, будучи наивысшими, указывают на то, что они были наименее дифференцированными из трех масел.
Заключение: in vitro модель показала, что инкубация с жировой смесью 7 не мешает пролиферации и дифференциации Сасо-2 клеток, обратно эффекту инкубации с маслом с низким содержанием пальмитиновой кислоты. Результаты указывают на то, что жировая смесь 7 активизирует развитие кишечника и ускоряет созревание, тогда как масло с низким содержанием пальмитиновой кислоты мешает развитию кишечника.
Пример 6
Влияние содержания пальмитиновой кислоты в диете на восстановление и лечение синдрома укороченной тонкой кишки в модели на животных
Влияние диет с различным содержанием пальмитиновой кислоты на предупреждение и лечение синдрома укороченной тонкой кишки, а также улучшение созревания и адаптации кишечника изучали в модельных экспериментах на животных.
Постановка эксперимента
Животных как после рассечения пищеварительного тракта с реанастомозом, так и после частичной небольшой резекции пищеварительного тракта случайным образом распределяют в одну из диетических групп, которые отличались только по содержанию пальмитиновой кислоты. По окончании периода кормления животных забивают и исследуют гистологические параметры кишечника и пролиферацию и апоптоз энтероцитов.
Исследование проводили в две фазы:
1. В первой фазе диетическое лечение проводили перед индукцией синдрома укороченной тонкой кишки и после нее и контролировали влияние различных диет на восстановление после симптома.
2. Во второй фазе диетическое лечение проводили после индукции синдрома укороченной тонкой кишки и контролировали влияние различных диет на улучшение адаптации кишечника, восстанавливающегося после симптома.
Диеты
Все диеты были одинаковыми в отношении содержания питательных веществ и различались только по содержанию пальмитиновой кислоты:
1) диета I: диета с маслом, содержащим, по меньшей мере, 15% пальмитиновой кислоты, из которой, по меньшей мере, 33% эстерифицировано в положении sn-2.
2) диета II: диета с маслом, содержащим, по меньшей мере, 15% пальмитиновой кислоты, из которой приблизительно 10% эстерифицировано в положении sn-2.
3) диета III: диета с маслом, содержащим приблизительно 8% пальмитиновой кислоты, из которой приблизительно 10% эстерифицировано в положении sn-2.
Хирургическое вмешательство
Животных анестезируют и оперируют; брюшную полость вскрывают с помощью срединного разреза. У животных, которых подвергали частичному небольшому иссечению пищеварительного тракта, 75% резекции проводили, сохраняя сосудистую аркаду и оставляя 5 см проксимального отдела тощей кишки и 10 см дистального отдела подвздошной кишки. Непрерывность кишечника восстанавливали с помощью однослойного анастомоза конец в конец. У животных, которых подвергали рассечению пищеварительного тракта с реанастомозом, кишечник разделяли и подвергали реанастомозу без резекции. После лапаротомии все животные имели доступ к воде в течение первых 24 часов после хирургического вмешательства (Sukhotnik et al., 2004, Pediatr. Surg. Int. Vol. 20 (4): 235-239).
Потребление пищи
На протяжении периода кормления перед хирургическим вмешательством и после него определяли массы тела и непотребленной пищи. Потребление пищи рассчитывали и выражали в граммах на день. Потребление энергии и жир рассчитывали в соответствии с количеством потребленной пищи.
Исследование показало, что ранее обеспечение животного диетой I приводит к улучшению восстановления после синдрома укороченной тонкой кишки. Дополнительно, обеспечение животных после индукции синдрома укороченной тонкой кишки диетой I приводит к увеличению суммарной массы стенки кишечника и слизистой оболочки и к улучшению скорости восстановления после синдрома укороченной тонкой кишки, как показано путем улучшения адаптации слизистой оболочки, после резекции/индукции пищеварительного тракта. Животные, получавшие диету I, демонстрировали более сильные ответы в виде гиперплазии слизистой оболочки в оставшемся кишечнике и более сильное стимулирующее влияние на восстановление роста кишечника по сравнению с животными, получавшими другие диеты.
Пример 7
Влияние содержания пальмитиновой кислоты в диете на предупреждение и лечение некротизирующего энтероколита (NEC) в модели на животных
Влияние диет с различным содержанием пальмитиновой кислоты на предупреждение и лечение некротизирующего энтероколита (NEC) исследовали на модели недоношенных животных с гипоксией-гипотермией, получавших детскую смесь.
Постановка эксперимента
Животные случайным образом распределяли в одну из групп с диетами, которые отличались только по содержанию в них пальмитиновой кислоты.
Исследование проводили в две фазы:
1. В первой фазе после периода выкармливания животных подвергали индукции NEC путем гипоксии-гипотермии и контролировали влияния различных диет на возникновение и тяжесть протекания NEC и коэффициент выживаемости.
2. Во второй фазе диетическое лечение проводили после индукции NEC и контролировали влияние различных диет на улучшение восстановления кишечника.
Методика индуцирования NEC
Экспериментальный NEC вызывали с помощью следующей методики:
новорожденных детенышей, начиная с 2-часового возраста и затем каждые 12 часов, подвергали гипоксии, давая им дышать 100%-ным газообразным азотом в закрытой чистой пластиковой камере в течение 60 с, затем подвергали гипотермии, оставляя на холоду при 4°С в течение 10 мин.
Диеты
Все диеты были идентичными в отношении содержания питательных веществ и различались только по содержанию пальмитиновой кислоты.
1) диета I: диета с маслом, содержащим, по меньшей мере, 15% пальмитиновой кислоты, из которой, по меньшей мере, 33% эстерифицировано в положении sn-2.
2) диета II: диета с маслом, содержащим, по меньшей мере, 15% пальмитиновой кислоты, из которой приблизительно 10% эстерифицировано в положении sn-2.
3) диета III: диета с маслом, содержащим приблизительно 8% пальмитиновой кислоты, из которой приблизительно 10% эстерифицировано в положении sn-2.
Данные анализов
Для исследования возникновения и тяжести протекания NEC первое кормление тестируемыми диетами начинали в возрасте 24-х часов. Детенышей случайным образом распределяли в одну из групп с диетами, которые различались только по содержанию в них пальмитиновой кислоты. Животных кормили с рождения с помощью орогастрального зонда для искусственного питания. Всех детенышей осматривали ежечасно на наличие клинических признаков NEC, таких как вздутие живота, расстройство дыхания и заторможенность. Через 96 часов после рождения или при признаках заболевания детенышей забивали путем декапитации (Travadi et al., 2006, Pediatr Res. Vol. 60(2): 185-9). После забоя ткани кишечника животного обрабатывали и исследовали на общую массу и гистологическую оценку повреждений (NEC).
Для исследования влияния диет на восстановление кишечника животных кормили различными диетами после индукции NEC. Исследовали миграцию (восстановление) и пролиферацию эпителиальных клеток кишечника, которые представляют собой ключевые элементы при восстановлении после повреждения кишечника.
Для того чтобы исследовать влияние различных диет на пролиферацию и миграцию энтероцитов бромдезоксиуридин вводили внутрибрюшинно за 18 часов до забоя, для подготовки кишечника к бромдезоксиуридиновой иммунногистохимии (Feng J, Besner GE., 2007, J Pediatr Surg. Vol. 42(1): 214-20).
Исследование показало, что если животное рано начинало получать диету I, то это приводило к снижению возникновения и тяжести протекания NEC. Дополнительно, получение животными, у которых развились клинические признаки заболевания NEC, диеты I приводит к предупреждению общего нарушения целостности кишечника или потери слизистой оболочки. Животные, получавшие диету I, демонстрировали менее глубокие патологические изменения NEC по сравнению с животными, получавшими другие диеты.
Способность высокого содержания пальмитиновой кислоты в положении sn-2 защищать кишечник от NEC частично связана с ее способностью сохранять миграцию и пролиферацию энтероцитов.
Пример 8
Влияние содержания пальмитиновой кислоты в диете на предупреждение и лечение воспалительных заболеваний кишечника в модели на животных
Влияние диет с различным содержанием пальмитиновой кислоты на предупреждение и лечение воспалительных заболеваний кишечника, таких как болезнь Крона (CD) и язвенный колит (UC), исследовали в экспериментальной модели на животных.
Постановка эксперимента
Воспалительные заболевания кишечника у животных вызывали путем введения декстрана сульфата натрия (DSS) в их питьевой воде, затем животных случайным образом распределяли в одну из групп с диетами, которые различались только по содержанию в них пальмитиновой кислоты.
Исследование проводили в две фазы:
1. В первой фазе после периода диетического лечения к питьевой воде животных добавляли DSS и контролировали влияние различных диет на предупреждение или снижение возникновения или тяжести протекания воспалительных заболеваний кишечника.
2. Во второй фазе диетическое лечение проводили после введения DSS в питьевую воду животных и исследовали влияние различных диет на улучшение восстановления после воспалительного заболевания кишечника.
Диеты
Все диеты были идентичными в отношении содержания питательных веществ и различались только по содержанию пальмитиновой кислоты.
1) диета I: диета с маслом, содержащим, по меньшей мере, 15% пальмитиновой кислоты, из которой, по меньшей мере, 33% эстерифицировано в положении sn-2.
2) диета II: диета с маслом, содержащим, по меньшей мере, 15% пальмитиновой кислоты, из которой приблизительно 10% эстерифицировано в положении sn-2.
3) диета III: диета с маслом, содержащим приблизительно 8% пальмитиновой кислоты, из которой приблизительно 10% эстерифицировано в положении sn-2.
Индукция воспалительного заболевания кишечника
Введение DSS в питьевую воду грызунов широко применяют в качестве экспериментальной модели UC, поскольку это приводит к острому и хроническому колиту и воспроизводит клинические и гистопатологические характеристики человеческого UC. DSS представляет собой сульфатированный полимер, который индуцирует пятнистое повреждение слизистой оболочки дозозависимым образом. Он также индуцирует воспаление исходно посредством прямого токсического влияния на эпителиальные клетки, таким образом приводя к развитию тяжелого колита (Vicario et al., 2007, J Nutr.; Vol. 137(8): 1931-7).
Потребление пищи
На протяжении периода кормления определяли массы тела и непотребленной пищи. Потребление пищи рассчитывали и выражали в граммах на день. Потребление энергии и жира рассчитывали в соответствии с количеством потребленной пищи.
Данные анализов
В исследовании по изучению предупреждения заболевания животных случайным образом распределяли по группам с различными диетами. После периода выкармливания каждую группу случайным образом разделяли на две экспериментальные группы, одна получала DSS в питьевой воде, и другие получали только водопроводную воду, и контролировали возникновение и тяжесть протекания воспалительного заболевания пищеварительного тракта путем измерения продукции некоторых медиаторов, вовлеченных в развитие воспалительного ответа в кишечнике, таких как лейкотриен В(4) (LTB(4)), фактор некроза опухоли альфа (ТNFальфа) и окись азота (NO) (Camuesco D, 2005, J Nutr. Vol. 135(4): 687-94).
В исследовании по изучению лечения заболевания животных, выживших после воспалительного заболевания пищеварительного тракта, случайным образом распределяли по диетическим группам и кормили разными диетами. После периода лечения животных контролировали на наличие клинических показателей (потеря массы тела, кровавый понос, снижение физической активности, тяжелая анемия, укорочение длины ободочной кишки и перианальное повреждение) (Kishimoto S, 2000, Dig Dis Sci. Vol. 45(8): 1608-16).
Животных забивали и оценивали адаптацию кишечника с помощью гистопатологических анализов (оценка патологических повреждений в баллах) и анализа высоты ворсинок слизистой оболочки (VH), глубины крипт (CD), общего веса слизистой оболочки, включения бромдезоксиуридина (BrdU), показателей клеточной пролиферации и полнослойной DNA и количество белка в качестве показателя адаптивного роста кишечника (Evans ME, 2005, JPEN J. Parenter. Enteral. Nutr.; Vol.29(5):315-20).
Исследование показало, что получение животным диеты I на ранней стадии приводит к снижению возникновения воспалительных заболеваний кишечника. Кроме того, кормление животных после индукции воспалительных заболеваний кишечника диетой I приводит, во-первых, к снижению случаев возникновения заболевания в слизистой оболочке ободочной кишки (нарушение барьера эпителиальной слизистой оболочки и повышение инфильтрации нейтрофилов) и дополнительно к снижению индукции тяжелого колита с диареей и повреждениями слизистой оболочки ободочной кишки. Было получено общее положительное изменение в функции слизистой оболочки и в воспалении после кормления животных диетой I.
Пример 9
Влияние содержания пальмитиновой кислоты на потребление энергии, связанное с синдромом укороченной тонкой кишки в модели на животных
Влияние диет с различным содержанием пальмитиновой кислоты на поглощение энергии, потребляемую калорийность и нарушенную абсорбцию жира, связанные с синдромом укороченной тонкой кишки, исследовали в экспериментальной модели на животных.
Постановка эксперимента
Животных после индукции синдрома укороченной тонкой кишки с помощью частичного небольшого иссечения пищеварительного тракта случайным образом распределяли в одну из групп с диетами, которые различались только по содержанию в них пальмитиновой кислоты. После кормления контролировали влияние различных диет на нарушенную абсорбцию жира и усвоение пищи в кишечнике. Обычно считают, что если улучшаются желудочно-кишечные симптомы, то улучшается и количество энергии, получаемое из диеты.
Хирургические вмешательства
Животных анестезировали и подвергали хирургическому вмешательству; брюшную полость вскрывали с помощью срединного разреза. У животных, которых подвергали частичному небольшому иссечению пищеварительного тракта, проводили 75%-ную резекцию, сохраняя сосудистую аркаду и оставляя 5 см проксимального отдела тощей кишки и 10 см дистального отдела подвздошной кишки. Непрерывность кишечника восстанавливали с помощью однослойного анастомоза конец в конец. У животных, которых подвергали рассечению пищеварительного тракта с реанастомозом, кишечник разделяли и проводили реанастомоз без резекции. После лапаротомии все животные имели доступ к воде в течение первых 24 часов после хирургического вмешательства (Sukhotnik et al., 2004, Pediatr. Surg. Int. Vol. 20 (4): 235-239).
Потребление пищи
На протяжении периода кормления перед хирургическим вмешательством и после него определяли массы тела и непотребленной пищи. Потребление пищи рассчитывали и выражали в граммах на день.
Данные анализов
По анализу кала определяли потери энергии и источники энергии.
После диетического лечения собирали образцы кала как источник данных о пище. Образцы кала анализировали на суммарную энергию, суммарный азот, содержание жира и концентрацию жирной кислоты. Тестировали общую экскрецию калорийности (калорийность экскрементов). Количество энергии на грамм образца кала измеряли с помощью баллистической калориметрической бомбы (Miller PS, Payne PR. 1959, A ballistic bomb calorimeter. Br. J Nutr; Vol. 13: 501-8) в образцах лиофилизированного кала (Murphy et al., 1991, Archives of Disease in Childhood; Vol. 66: 495-500).
Диеты
Все диеты были идентичными в отношении содержания питательных веществ и различались только по содержанию пальмитиновой кислоты.
1) диета I: диета с маслом, содержащим, по меньшей мере, 15% пальмитиновой кислоты, из которой, по меньшей мере, 33% эстерифицировано в положении sn-2.
2) диета II: диета с маслом, содержащим, по меньшей мере, 15% пальмитиновой кислоты, из которой приблизительно 10% эстерифицировано в положении sn-2.
3) диета III: диета с маслом, содержащим приблизительно 8% пальмитиновой кислоты, из которой приблизительно 10% эстерифицировано в положении sn-2.
Исследование показало, что диета I приводит к улучшению продолжительного нарушения всасывания жира и поглощения энергии и к снижению экстракции энергии кала при синдроме укороченной тонкой кишки.
Дополнительно, получение животными после индукции синдрома укороченной тонкой кишки диеты I приводит к улучшению степени излечения от синдрома укороченной тонкой кишки.
Пример 10
Влияние содержания пальмитиновой кислоты в диете на предупреждение изменений в проницаемости кишечника, связанных с воспалительными заболеваниями кишечника в модели на животных
Влияние диет с различным содержанием пальмитиновой кислоты на предупреждение изменений в проницаемости кишечника, связанных с воспалительными заболеваниями кишечника, такими как болезнь Крона (CD) и язвенный колит (UC), исследовали в экспериментальной модели на животных.
Постановка эксперимента
Животных, у которых воспалительные заболевания кишечника вызывали путем введения декстрана сульфата натрия (DSS) в питьевой воде, случайным образом распределяли в одну из групп с диетами, которые различались только по содержанию в них пальмитиновой кислоты. Диетическое лечение проводили после введения DSS и исследовали влияние различных диет на проницаемость кишечника с помощью измерения утечки бактериального липополисахарида (LPS) из кишечника, анализируя уровень LPS в крови после нагрузки кишечника.
Диеты
Все диеты были идентичными в отношении содержания питательных веществ и различались только по содержанию пальмитиновой кислоты.
1) диета I: диета с маслом, содержащим, по меньшей мере, 15% пальмитиновой кислоты, из которой, по меньшей мере, 33% эстерифицировано в положении sn-2.
2) диета II: диета с маслом, содержащим, по меньшей мере, 15% пальмитиновой кислоты, из которой приблизительно 10% эстерифицировано в положении sn-2.
3) диета III: диета с маслом, содержащим приблизительно 8% пальмитиновой кислоты, из которой приблизительно 10% эстерифицировано в положении sn-2.
Индукция воспалительного заболевания кишечника
Введение DSS в питьевую воду грызунов широко применяют в качестве экспериментальной модели UC, поскольку он приводит к острому и хроническому колиту и воспроизводит клинические и гистопатологические характеристики человеческих UC. DSS представляет собой сульфатированный полимер, который индуцирует пятнистое повреждение слизистой оболочки дозозависимым образом. Он также индуцирует воспаление исходно посредством прямого токсического влияния на эпителиальные клетки, таким образом приводя к развитию тяжелого колита (Vicario et al., 2007, J Nutr.; Vol. 137(8): 1931-7).
Потребление пищи
На протяжении периода кормления определяли массу тела и непотребленной пищи. Потребление пищи рассчитывали и выражали в граммах на день. Потребление энергии и жир рассчитывали в соответствии с количеством потребленной пищи.
Данные анализов
Животных, перенесших воспалительное заболевание кишечника, случайным образом распределяли по диетическим группам и кормили различными диетами. После периода лечения животных осматривали на предмет обнаружения клинических признаков (потеря массы тела, кровавый понос, снижение физической активности, тяжелая анемия, укорочение длины ободочной кишки и перианальное повреждение) (Kishimoto S, 2000, Dig Dis Sci. Vol; 45(8): 1608-16) и проводили исследования проницаемости кишечника.
Исследование проницаемости кишечника
Для оценки влияния различных диет на проницаемость кишечника применяли оценку утечки бактериального липополисахарида (LPS) (LPS; Escherichia coli serotype 0111:В4; «Sigma-Aldrich») из кишечника, анализируя уровень LPS в крови после нагрузки кишечника. LPS животным вводили с помощью зонда для искусственного кормления. Тридцать минут после нагрузки LPS животных забивали и отбирали кровь для анализа путем исследования эндотоксина, применяя набор с лизатом амебоцитов Limulus (LAL) («BioWhittaker», Walkersville, MD) (Lambert et al., 2003, J Pharmacol Exp. Ther. Vol. 305(3): 880-6).
Получение животными диеты I после индукции воспалительного заболевания кишечника приводит к предупреждению увеличения проницаемости кишечника. Кормление диетой I вызывает снижение уровня эндотоксина в плазме по сравнению с диетой II и диетой III. Результаты показывают, что кишечник животных, получавших диету I, способен к восстановлению функции снижения в барьере во время восстановления после воспалительного заболевания пищеварительного тракта.
Реферат
Изобретение относится к пищевой и фармацевтической промышленности. Предложено применение липидной композиции для получения пищевой, фармацевтической, нутрицевтической композиции или функциональных продуктов питания, для предупреждения и лечения синдрома короткого кишечника, воспалительных заболеваний кишечника или некротизирующего энтероколита, и для активизации развития, созревания, адаптации и дифференциации кишечника у субъекта. При этом композиция включает, по меньшей мере, один триглицерид, ацильная группа которого состоит из остатков насыщенных, мононенасыщенных и полиненасыщенных жирных кислот, причем общее содержание остатков пальмитиновой кислоты в композиции равно примерно 15-55% от общего содержания остатков жирной кислоты. При этом, по меньшей мере, 13% от общего содержания жирных кислот в положении sn-2 углеродного скелета триглицерида представляют собой остатки пальмитиновой кислоты в композиции. Предложен способ лечения или предупреждения состояния у субъекта, имеющего, или серьезно рискующего получить, синдром короткого кишечника, воспалительные заболевания кишечника или некротизирующий энтероколит, и активации развития, созревания, адаптации и дифференциации кишечника, включающий введение субъекту вышеуказанной липидной композиции. Изобретение позволяет предупредить или предотвратить вышеуказанные нарушения в кишечнике у субъекта. 2 н. и 35 з.п. ф-лы, 4 ил., 11 табл.
Формула

в которой R1, R2 и R3 могут быть одинаковыми или разными и каждый из которых независимо выбирают из Н или ацильной группы, которую выбирают из группы, состоящей из остатков насыщенных, мононенасыщенных и полиненасыщенных жирных кислот, причем общее содержание остатков пальмитиновой кислоты в композиции равно примерно 15-55% от общего содержания остатков жирной кислоты, причем, по меньшей мере, 13% от общего содержания жирных кислот в положении sn-2 углеродного скелета триглицерида представляют собой остатки пальмитиновой кислоты в композиции, для получения пищевой или фармацевтической, или композиции, содержащей нутрицевтик, или для получения функциональных продуктов питания, для предупреждения и лечения синдрома короткого кишечника, воспалительных заболеваний кишечника или некротизирующего энтероколита, и для активизации развития, созревания, адаптации и дифференциации кишечника у субъекта.
0-10% С8:0 жирных кислот от общего содержания жирных кислот;
0-10% С10:0 жирных кислот от общего содержания жирных кислот;
0-22% С12:0 жирных кислот от общего содержания жирных кислот;
0-15% С14:0 жирных кислот от общего содержания жирных кислот;
15-55% С16:0 жирных кислот от общего содержания жирных кислот;
в которой, по меньшей мере, 30% в положении sn-2;
1-7% С18:0 жирных кислот от общего содержания жирных кислот;
20-75% С18:1 жирных кислот от общего содержания жирных кислот;
2-40% С18:2 жирных кислот от общего содержания жирных кислот;
0-8% С18:3 жирных кислот от общего содержания жирных кислот;
другие жирные кислоты присутствуют в количестве менее чем 8% от общего содержания жирных кислот.
5-15% С12:0 жирных кислот от общего содержания жирных кислот;
2-10% С14:0 жирных кислот от общего содержания жирных кислот;
17-25% С16:0 жирных кислот от общего содержания жирных кислот;
в которой, по меньшей мере, 40% в положении sn-2;
2-5% С18:0 жирных кислот от общего содержания жирных кислот;
28-45% С18:1 жирных кислот от общего содержания жирных кислот;
5-20% С18:2 жирных кислот от общего содержания жирных кислот;
1-3% С18:3 жирных кислот от общего содержания жирных кислот;
другие жирные кислоты присутствуют в количестве менее чем 5% от общего содержания жирных кислот.

в которой R1, R2 и R3 могут быть одинаковыми или разными, и каждый из которых независимо выбирают из Н или ацильной группы, которую выбирают из группы, состоящей из остатков насыщенных, мононенасыщенных и полиненасыщенных жирных кислот, причем в композиции общее содержание остатков пальмитиновой кислоты равно примерно 15-55% от общего содержания остатков жирной кислоты в композиции, причем, по меньшей мере, 13% от общего содержания жирных кислот в положении sn-2 углеродного скелета триглицерида представляют собой остатки пальмитиновой кислоты.
Документы, цитированные в отчёте о поиске
Композиция для детского питания (варианты) и способ получения белкового гидролизата
Способ снижения заболеваемости некротическим энтероколитом у детей (варианты)

Комментарии