Способ снижения заболеваемости некротическим энтероколитом у детей (варианты) - RU2199317C2
Код документа: RU2199317C2
Чертежи



Описание
Область техники, к которой относится изобретение
Изобретение касается в основном энтеральных составов, которые содержат полиненасыщенные жирные кислоты с длинной цепью
(ПНЖК), и
способа получения данных энтеральных композиций, а также способов снижения заболеваемости некротическим энтероколитом. В частности, данное изобретение относится к энтеральным композициям,
содержащим
ПНЖК с длинной цепью - арахидоновую кислоту (АК) и докозагексаеновую кислоту (ДГК), которые практически не содержат холестерин, и могут быть получены из липидов яичного желтка. ПНЖК с
длинной цепью,
полученные из яичного желтка, в основном находятся в форме фосфолипидов. Способ получения данной композиции обеспечивает улучшенные органолептические свойства и стабильность.
Энтеральное введение
данных композиций может снижать заболеваемость некротическим энтероколитом.
Уровень техники
ПНЖК с длинной цепью в составах или композициях для
энтерального применения являются
предметом широкого обсуждения в литературе. Например, в патенте США 4670285 ("Кландинин") раскрывают специфическую смесь жиров, пригодную для применения в составах
для детского питания. В частности,
смесь жиров в Кландинине содержит, по меньшей мере, одну С20 или С22 n-6 жирную кислоту и С20 или С22 n-3 жирную
кислоту. Описывают, что данные жирные
кислоты в некоторых определенных количествах позволяют избежать вредных эффектов смеси жиров в детском питании. С20 или С22 n-6 жирные
кислоты присутствуют в продукте в общем
количестве приблизительно от 0,13 до 5,6 мас.% от всех жирных кислот в продукте. С20 или С22 n-3 жирные кислоты (при их наличии)
составляют приблизительно от 0,013 до 3,33 мас.%
от общего количества всех жирных кислот в продукте. Кландинин открывает использование яичных липидов как источника n-6 и n-3 жирных кислот, однако
яичный липид, используемый в Кландинине, содержит
также холестерин на высоких уровнях. Далее в данном документе рекомендуют использование от 75 до 95 частей (по массе) липида яичного желтка при том,
что остальная часть масел представлена кокосовым
маслом или соевым маслом. Номенклатура, использованная в Кландинине для жирных кислот, будет использована в данном контексте.
В публикации WO 93/20717 раскрывают состав детского питания, который содержит не более чем субраздражающие количества свободных жирных кислот с длинной цепью (C16-C22) и триглицеридов. В данной заявке также описано, что получение сложных эфиров низших алкилов, таких как этиловые эфиры данных жирных кислот, в составах для детского питания практически устраняет способность жирных кислот разрушать эпителий кишечника ребенка, но обеспечивает всасывание и процессинг структур жирных кислот.
Патент США 4918063, выданный Lichtenberger, раскрывает композиции, содержащие уникальные смеси фосфолипидов и нейтральных липидов для профилактики и лечения язв и воспалительных заболеваний кишечника. В данном патенте описывают смеси насыщенных или ненасыщенных фосфолипидов с насыщенными или ненасыщенными триглицеридами и/или стеринами, которые обеспечивают эффективную защиту от язвы в экспериментальных моделях на животных. В данном патенте описывают также включение многовалентных катионов или антиоксидантов в липидную смесь для повышения активности.
В Международной Публикации WO 96/10922 Kohn и соавт. описывают смесь жиров состава для детского питания, характеризующуюся тем, что арахидоновая кислота и докозагексаеновая кислота присутствуют в смеси жиров в форме фосфолипидов.
В Европейской патентной заявке 0376628 В1 Tomarelli описывает жировую композицию на основе только растительных масел, в которой используют нестандартизированное пальмовое масло или нестандартизированное пальмовое олеиновое масло в качестве единственного источника пальмитиновой кислоты. Описано также, что все жировые композиции на основе растительных масел являются особенно подходящими для составов для детского питания для недоношенных (или имеющих при рождении низкую массу тела) детей. Жировые композиции для недоношенных детей из заявки Tomarelli включают триглицериды с цепью средней длины (ТСЦ) с нестандартизованным маслом, содержащим пальмитиновую кислоту, маслом, содержащим лауриновую кислоту, маслом, содержащим олеиновую кислоту, и маслом, содержащим линоленовую кислоту.
Несмотря на важный вклад обсуждаемых выше материалов, сохраняется необходимость в составах для детского питания, которые содержат яичные фосфолипиды в качестве источника ПНЖК с длинной цепью в концентрациях, подходящих для питания. Кроме того, существует также необходимость в разработке способов приготовления составов для энтерального применения, содержащих яичные фосфолипиды, чтобы при этом состав имел приемлемые органолептические свойства. Данные композиции, в частности, находят применение в составах для детского питания для рожденных в срок и недоношенных детей, для которых установлена потребность в ПНЖК с длинной цепью для правильного развития нервной системы и развития зрительной активности. Кроме того, они могут обладать защитным действием в отношении кишечника.
Некротический энтероколит (НЭК) представляет собой серьезную проблему для детей, имеющих при рождении массу тела менее приблизительно 1500 г. Несмотря на исследования в течение почти трех десятилетий, точная этиология и патофизиология НЭК остается неясной. НЭК является опасным для жизни заболеванием, характеризующимся ишемическим некрозом участвующих в нем структур пищеварительного тракта и пневматозом кишечника, который часто приводит к перфорации кишки. У недоношенных детей с НЭК отмечают клиническую картину, характеризующуюся нестабильностью температуры, сонливостью, застоем в желудке, рвотой, вздутием живота, большим количеством крови или наличием скрытой крови в стуле и радиографическим подтверждением пневматоза кишечника, воздухом в воротных венах или пневмоперитонеумом. Появляется апноэ, быстро возникают шок и подкожный адипонекроз, и обычно наступает смерть.
Множество авторов провели различные наблюдения и представили факторы, влияющие на данное заболевание. (Nue, Pediatr. Clin. North. Am., апрель, 1996, вып. 43(2), с. 409-32). Примерами являются следующие наблюдения и факторы.
Plageole и соавт. Некротический энтероколит у новорожденных, обзор для клиницистов. Union-Med-Can., 1991, сент. - окт., вып. 120(5), с. 334-8. Авторы предполагают, что патогенез НЭК включает мезентериальную ишемию, недоразвитие желудочно-кишечного тракта, энтеральное кормление и возможно даже инфекцию.
Caplan и соавт. Роль фактора
активации тромбоцитов и фактора некроза опухоли-α в
неонатальном некротическом энтероколите. Journal of Pediatrics, июнь, 1990, с. 960-964. Авторы показывают, что у пациентов с НЭК повышены
уровни фактора активации тромбоцитов и фактора некроза
опухоли-α.
Kliegman и соавт. Клостридии как патогены при неонатальном некротическом энтероколите, The Journal of Pediatrics,
август, 1979, с. 287-289. Авторы описывают выделение
Clostridia perfringens у детей с неонатальным НЭК.
Ostertag и соавт. Раннее энтеральное кормление не влияет на заболеваемость некротическим энтероколитом. Pediatrics, т. 77, No 3, март 1986, с. 275-280. Авторы показывают, что разбавленное раннее энтеральное введение калорийной пищи не оказывает неблагоприятного воздействия в плане заболеваемости НЭК.
Rell и соавт. Неонатальный некротический энтероколит. Annals of Surgery, т. 187, январь 1978, No 1, с. 1-7. Авторы предлагают использование комбинированной антимикробной терапии для лечения детей с НЭК.
Eyal и соавт. Некротический энтероколит у детей с очень низкой массой тела при рождении: сравнение вскармливания грудным молоком с парентеральным кормлением. Archives of Disease in Childhood, 1982, вып. 57, с. 274-276. Авторы показывают, что заболеваемость НЭК у детей с низкой массой тела при рождении снижалась при задержке начала энтерального кормления.
Finer и соавт. Витамин Е и некротический энтероколит. Pediatrics, т. 73, No 3, март, 1984. Авторы полагают, что введение витамина Е для снижения частоты острых осложнений после ретролентальной фиброплазии может быть связано с повышением заболеваемости НЭК.
Brown и соавт. Профилактика некротического энтероколита у новорожденных. JAMA, 24 ноября 1978, т. 240, No 22, с. 2452-2454. Авторы показывают, что НЭК можно избежать при использовании режима кормления с медленным увеличением.
Kosloske. Патогенез и профилактика некротического энтероколита: гипотеза, основанная на личных наблюдениях и обзоре литературы. Pediatrics, т. 74, No 5, декабрь, 1984, с. 1086-1092. Автор выдвигает гипотезу о том, что НЭК возникает при совпадении двух или трех патологических событий: (1) кишечной ишемии, (2) колонизации патогенными бактериями и (3) избытка белкового субстрата в полости кишечника.
Kosloske, supra показывает, что НЭК редко возникает у детей, вскармливаемых только грудным молоком. У человека грудное молоко играет роль в пассивной иммунизации кишечника новорожденных и содержит факторы, способствующие росту Bifidobacterium в кишечной флоре. Показано также, что замораживание, пастеризация или хранение оказывают неблагоприятное воздействие на полезное содержимое молока человека.
Таким образом, существует множество различных мнений относительно этиологии и лечения НЭК и остается необходимость в создании композиций и способов, которые могут лучше лечить и/или снижать частоту данного опасного и часто летального состояния.
Сущность изобретения
Данное изобретение имеет множество аспектов. В первом аспекте изобретение рассматривает способ
снижения заболеваемости некротическим
энтероколитом у детей, восприимчивых к некротическому энтероколиту. Данный способ предусматривает введение эффективного количества, по меньшей мере, одной ПНЖК с
длинной цепью, выбранной из группы
С20 n-6 жирных кислот, С22 n-6 жирных кислот, C20 n-3 жирных кислот и С22 ω-3 жирных кислот. Например, была
показана эффективность введения
арахидоновой кислоты - n-6 жирной кислоты. Введение может быть энтеральным или парентеральным. Более предпочтительной является комбинация n-6 и n-3 жирных кислот,
например совместное использование
арахидоновой кислоты и докозагексаеновой кислоты. Уровень энтерального введения составляет, по меньшей мере, 1,0 мг n-6-жирных кислот на килограмм массы тела ребенка
в день. В более предпочтительном
варианте осуществления используют комбинацию n-6 и n-3-жирных кислот в массовом соотношении приблизительно от 2:1 до приблизительно 4:1 при введении, по меньшей мере,
5,0 мг n-6-жирных кислот с
длинной цепью в день.
Способ может быть осуществлен путем введения с пищей достаточного количества энтеральной композиции, содержащей арахидоновую кислоту и докозагексаеновую кислоту, с целью доставки в организм данного ребенка от приблизительно 1,0 до приблизительно 60 мг на кг в день арахидоновой кислоты и от приблизительно 0,25 до приблизительно 35 мг на кг в день докозагексаеновой кислоты. Более типичные количества составляют от приблизительно 5,0 до приблизительно 40 мг арахидоновой кислоты и от приблизительно 1,5 до приблизительно 20 мг докозагексаеновой кислоты на кг в день. Предпочтительно, когда соотношение масс арахидоновой кислоты и докозагексаеновой кислоты находится в интервале от приблизительно 2 до приблизительно 4. Предпочтительно, когда полиненасыщенные жирные кислоты с длинной цепью находятся в форме фосфолипидов, особенно фосфатидилхолина. Данные фосфолипиды присутствуют в высоких концентрациях в яичном лецитине и яичных фосфатидах.
Таким образом, в следующем аспекте изобретение представляет способ снижения заболеваемости некротическим энтероколитом у детей. Данный способ предусматривает введение данному ребенку с пищей достаточного количества энтеральной пищевой композиции, содержащей белок, углевод и фосфолипиды, для обеспечения, по меньшей мере, 1,0 мг n-6 полиненасыщенных жирных кислот с длинной цепью в день. Предпочтительно, чтобы кормление далее обеспечивало, по меньшей мере, 0,5 мг n-3 полиненасыщенных жирных кислот с длинной цепью в день в виде арахидоновой кислоты и докозагексаеновой кислоты соответственно.
В другом аспекте изобретение представляет способ снижения частоты возникновения некротического энтероколита у детей. Данный способ предусматривает введение ребенку фосфолипидов в количестве, эффективно снижающем заболеваемость некротическим энтероколитом.
Обычно данные фосфолипиды вводят для получения концентрации между приблизительно 60 и приблизительно 2400 мкмол, предпочтительно между приблизительно 200 и приблизительно 1500 мкмол, наиболее предпочтительно между приблизительно 400 и приблизительно 1000 мкмол фосфолипидов на кг в день. Источник фосфолипидов не имеет решающего значения; фосфолипиды, полученные из яичного лецитина, пригодны для данного изобретения. Фосфолипиды также легко получить из мембран животного происхождения, включая мембраны жировых шариков молока. Другие источники, богатые фосфолипидами, включают соевые бобы и другие растительные масла. При использовании фосфолипидов яичного лецитина предпочтительным количеством для энтерального введения является количество, достаточное для получения, по меньшей мере, 1,0 мг n-6 жирных кислот с длинной цепью в день. Предпочтительно, чтобы яичный фосфолипид обеспечивал арахидоновую кислоту в качестве значительной части n-6 жирных кислот, и предпочтительно, чтобы он также обеспечивал докозагексаеновую кислоту и/или другие n-3 жирные кислоты с длинной цепью в вышеуказанных соотношениях. Это может иметь синергетический эффект. Однако замечено, что длина и насыщенность жирных кислот, связанных с глицериновым скелетом, в данном "фосфолипидном" аспекте изобретения не являются решающими, и в данном случае возможно использование жирных кислот, отличных от ПНЖК с длинной цепью.
В еще одном аспекте изобретение представляет способ снижения частоты возникновения некротического энтероколита у детей. Данный способ предусматривает введение ребенку холина в количестве, эффективном для снижения заболеваемости некротическим энтероколитом. Обычно указанный холин вводят для получения концентрации между приблизительно 60 и приблизительно 1800 мкмол, более предпочтительно между приблизительно 150 и приблизительно 1200 мкмол холина на кг в день. Источник холина не имеет решающего значения; фосфатидилхолин может быть предпочтительным, и фосфатидилхолин, полученный из яичного лецитина, пригоден для данного изобретения. Другие источники, богатые холином или фосфатидилхолином, включают соевые бобы и другие растительные масла. При использовании холина из яичного лецитина предпочтительным является его введение в комбинации с n-6 и/или n-3 жирными кислотами для получения, по меньшей мере, 1,0 мг n-6 жирных кислот с длинной цепью в день. Предпочтительно, чтобы яичный лецитин обеспечивал арахидоновую кислоту в качестве значительной части n-6 жирных кислот, и предпочтительно, чтобы он также обеспечивал докозагексаеновую кислоту и/или другие n-3 жирные кислоты с длинной цепью в вышеуказанных соотношениях. Это может иметь синергетический эффект. Однако с точки зрения фосфолипидного аспекта длина и насыщенность жирных кислот, связанных с глицериновым скелетом какого-либо фосфатидилхолина, используемого в изобретении, не являются решающими, и в данном случае возможно использование жирных кислот, отличных от ПНЖК с длинной цепью. Альтернативно может быть использован холин из источников, отличных от фосфолипидов.
Кроме того, поскольку благоприятные эффекты были отмечены у детей, восприимчивых к энтероколиту, возможно, что данные благоприятные эффекты также распространяются на взрослых людей. Таким образом, следующим аспектом изобретения является использование вышеописанных композиций для лечения или профилактики язвенных колитов и близких кишечных состояний у взрослых. При этом дозировка будет определена на основе более высокой массы тела взрослого пациента и других факторов, известных в уровне техники.
Другие аспекты
изобретения, включая энтеральные препараты и способы их приготовления, описаны далее в заявке. Например, в еще одном аспекте изобретения
способ получения энтерального состава, содержащего фосфолипиды
яичного желтка, предусматривает следующие стадии:
(а) получение сухого порошка яичных фосфатидов, практически не содержащих
холестерин;
(б) диспергирование указанной фракции
фосфолипидов в водной фазе с образованием дисперсии фосфолипидов и
(в) смешивание указанной дисперсии фосфолипидов с густой
суспензией других компонентов данного энтерального состава.
В соответствии со способом предпочтительно, чтобы дисперсия в водной фазе содержала от приблизительно 2 до приблизительно 15 мас.% яичного фосфатида, и предпочтительно добавление порошка яичного фосфатида к воде при температуре приблизительно от 20 до 50oС. Данный аспект может быть использован для получения состава для детского питания, содержащего арахидоновую кислоту и докозагексаеновую кислоту в форме фосфолипидов, указанный энтеральный состав получают данным способом.
В еще одном аспекте изобретение представляет препарат для детского питания, содержащий белок, углеводы и липиды, усовершенствование которого характеризуется тем, что смесь липидов содержит триглицериды со средней длиной цепи и яичный фосфолипид, причем уровень яичного фосфолипида составляет от приблизительно 1 мас.% до приблизительно 40 мас.% от смеси липидов и данный яичный фосфолипид практически не содержит холестерин. Обычно уровень яичного фосфолипида составляет от 5 до 30 мас.% от смеси липидов и концентрация арахидоновой кислоты в препарате составляет от приблизительно 10 до приблизительно 31 мг на 100 ккал. Более предпочтительно включение в препарат также докозагексаеновой кислоты в концентрации от приблизительно 3 до приблизительно 16 мг на 100 ккал и присутствие арахидоновой кислоты и докозагексаеновой кислоты в соотношении от приблизительно 4:1 до приблизительно 2: 1.
Сведения, подтверждающие возможность осуществления изобретения
Основная
терминология
Жирные кислоты представляют собой
углеводородные цепи различной длины, содержащие на одном конце карбоновую кислоту, что делает их до определенной степени полярными и
гидрофильными в данном положении, тогда как, с другой стороны, они
остаются в различной степени гидрофобными в зависимости от длины углеводородной цепи. Жирные кислоты делят на классы на основании
длины углеводородной цепи. Например, цепи, содержащие менее 6 атомов
углерода, считают "короткими" цепями; цепи, содержащие приблизительно 6-18 атомов углерода, являются "средними" и цепи из 20 или
более атомов углерода считают "длинными". Жирные кислоты могут также
иметь одну или более двойных связей, которые представляют собой точки "ненасыщенности" в углеводородной цепи. Как используют в
данном контексте, термин "ПНЖК с длинной цепью" означает жирную кислоту
из двадцати или более атомов углерода, имеющую, по меньшей мере, две двойные связи углерод-углерод (полиненасыщенная). Число и
положение двойных связей в жирных кислотах определяют соглашением по
номенклатуре. Например, арахидоновая кислота ("АК" или "АРК") имеет цепь длиной 20 атомов углерода и 4 двойные связи, начинающиеся
на шестом атоме углерода от метильного конца. В результате ее
обозначают, как "С20:4 n-6". Аналогично докозагексаеновая кислота ("ДГК") имеет цепь длиной 22 атома углерода с 6 двойными
связями, начинающимися с третьего атома углерода от метильного
конца, и ее обозначают как "С22:6 n-3". Известны также менее распространенные ПНЖК с длинной цепью, некоторые из которых
приведены в Таблицах 2 и 5 (ниже сплошной разделительной линии).
"Глицериды" представляют собой сложные липиды, имеющие глицериновый скелет, образующий сложные эфиры с жирными кислотами. "Триглицерид" (т.е. "триацилглицерин") содержит три этерифицированные жирные кислоты, по одной на каждый участок гидроксила на глицериновом скелете. Ди- и моноглицериды содержат соответственно две или одну этерифицированную жирную кислоту. Фосфоглицерид (т.е. "фосфолипид" или "фосфатид" - термины употребляют взаимозаменяемо) отличается от триглицеридов тем, что содержит максимум две этерифицированные жирные кислоты, тогда как третье положение глицеринового скелета этерифицировано фосфорной кислотой, образуя "фосфатидную кислоту". В естественных условиях фосфатидная кислота обычно связывается со спиртом, который обусловливает наличие сильно полярного начала молекулы. Два таких спирта, обычно обнаруживаемые в естественных условиях, являются холином и этаноламином. "Лецитин" представляет собой фосфатидную кислоту, связанную с аминоспиртом "холином", и известен также как "фосфатидилхолин". Лецитины варьируют по содержанию компонента жирной кислоты, и их источником могут быть, например, яйца и соя. Цефалин (фосфатидилэтаноламин), фосфатидилсерин и фосфатидилинозит представляют собой другие фосфоглицериды.
Фосфолипиды обычно обнаруживают в мембранах всех живых систем. Традиционными источниками фосфолипидов являются яичный желток и соевое масло. Фосфолипиды могут также быть получены из головного мозга, почек, сердца и легкого млекопитающих или из мембран жировых шариков молока. Кроме того, могут быть использованы источники микробной природы (масла одноклеточных), такие как масла водорослей и грибов, в частности, для компонентов жирных кислот АК и ДГК фосфолипидов.
Куриные яйца являются относительно богатым источником липидов. Приблизительно 33% желтка куриного яйца составляет липид, приблизительно 67% которого представлено триглицеридом, 28% - фосфолипидом и оставшаяся часть в основном представляет собой холестерин (представлены мас.%). Данные цифры являются приблизительными и могут варьировать до некоторой степени в зависимости от корма, породы и условий содержания кур. Из фосфолипидной фракции приблизительно 75% представлено фосфатидилхолином и приблизительно 20% представлено фосфатидилэтаноламином. Структура холина составляет приблизительно от 15 до 30% каждой молекулы фосфолипида в зависимости от присоединенной определенной жирной кислоты. Таким образом, содержание холина в яичном фосфолипиде может варьировать от приблизительно 10 мас.% до приблизительно 25 мас. % или в пересчете на общий яичный липид - от приблизительно 3 мас.% до приблизительно 7 мас.%.
Композиции
Композиции,
используемые в изобретении, содержат n-6 и/или n-3 ПНЖК с длинной цепью. Источник ПНЖК с длинной цепью не является решающим. Известные источники
ПНЖК с длинной цепью включают рыбий жир или масла
морских организмов, липид и фосфолипиды яичного желтка, масла одноклеточных организмов (например, масла водорослей и масла грибов). Из уровня техники
следует, что некоторые источники лучше других с
точки зрения получения больших количеств специфических ПНЖК с длинной цепью. Другие съедобные полуочищенные или очищенные источники ПНЖК с длинной
цепью будут очевидными для специалистов. Новые
источники ПНЖК с длинной цепью могут быть созданы с помощью генетических манипуляций с овощными и масличными растениями, и использование данных
рекомбинантных продуктов также входит в данное
изобретение.
ПНЖК с длинной цепью могут быть введены в композицию в форме сложных эфиров свободных жирных кислот, моно-, ди- и триглицеридов, фосфоглицеридов, включая лецитины, и/или их смесей. Может быть предпочтительным введение ПНЖК с длинной цепью в форме фосфолипидов, в частности фосфатидилхолина. В настоящее время предпочтительным источником, по меньшей мере, при его обработке таким образом, что его органолептические свойства и уровень холестерина являются приемлемыми, вероятно, являются фосфолипиды яичного желтка, возможно, в связи с высоким содержанием фосфолипидов и/или фосфатидилхолина, связанных с ПНЖК, полученными из яиц.
n-6 и/или n-3 ПНЖК с длинной цепью могут применяться в форме раствора для внутривенного (т. е. парентерального) введения, как, например, холин и фосфатидилхолин. Раствор для внутривенного введения предпочтительно будет содержать эффективные количества ПНЖК, фосфолипида и/или холина в приемлемом для ежедневного введения объеме раствора для парентерального введения. Точная концентрация вследствие этого широко варьирует в зависимости от предусмотренного объема введения и является значительно более высокой в болюсе или продукте для парентерального введения маленького объема, чем в гидратированном или питательном продукте для парентерального введения. Парентеральные композиции будут, как правило, включать фармацевтически приемлемые носители и наполнители, такие как буферы, консерванты и т.п.
n-6 и/или n-3 ПНЖК с длинной цепью, а также холин и фосфолипид могут альтернативно вводиться в форме энтеральной композиции. Энтеральные композиции, содержащие ПНЖК с длинной цепью, холин или фосфолипид, могут быть в форме раствора или эмульсии активного ингредиента или в питательной основе, содержащей белок, углеводы, другие жиры, минералы и витамины. Энтеральные композиции, содержащие активные компоненты, могут служить либо дополнительным, либо полным искусственным питанием. Концентрация ПНЖК с длинной цепью в энтеральной композиции может варьировать от почти 100 мас.% (в случае болюсной эмульсии) до 0,5 мас.% (в случае полного питательного состава) композиции в зависимости от способа введения и намеченной цели. В полных питательных составах концентрация может быть даже ниже при введении достаточного количества состава для доставки эффективного количества ПНЖК с длинной цепью.
Особенно предпочтительный вариант осуществления данного изобретения касается усовершенствованного полного питательного состава, пригодного для кормления детей, включая недоношенных детей. Данная предпочтительная композиция содержит белок, углеводы и липиды, в которых от приблизительно 6 до приблизительно 40 мас. % от общего содержания липидов представлено яичным фосфолипидом, который практически не содержит холестерин. Термин "практически не содержит" означает, что содержание холестерина в яичном фосфолипиде не превышает 0,1 мас.% и предпочтительно составляет менее 0,05 мас.% от общего содержания липидов.
Специалисты легко поймут, что означает "состав для детского питания". В разбавленном или восстановленном (если он исходно находится в форме концентрата или порошка) до готового для кормления состояния типичный состав для детского питания содержит приблизительно 10-35 г белка на литр состава, 20-50 г липида на литр состава, 60-110 г углеводов на литр состава и другие различные компоненты, такие как витамины, минералы, клетчатка, эмульгаторы и т.п. С целью разъяснения компонентов состава для детского питания и способов его получения в данный контекст введены в виде ссылки следующие патенты США: 1) патент США 5492899, выданный Masor и соавт.; 2) патент США 5021245, выданный Borschel и соавт.; 3) патент США 5234702, выданный Katz и соавт.; 4) патент США 5602109, выданный Masor и соавт. и 5) патент США 4670268, выданный Mahmoud. В частности, данный вариант осуществления изобретения охватывает состав для детского питания, содержащий приблизительно 40-50 г липида на литр состава, в котором липид содержит смесь триглицеридов со средней цепью и яичный фосфолипид, который практически не содержит холестерин. Обычно липидная смесь содержит приблизительно от 1 до 40 мас.%, более предпочтительно от приблизительно 5 до приблизительно 30 мас.% яичного фосфолипида. Данный вариант осуществления специально разработан для получения ПНЖК с длинной цепью, выбранных из n-3 жирных кислот и n-6 жирных кислот, фосфолипидов и/или холина в количествах, благоприятных для детей.
Способ
получения
Поскольку желтки куриных яиц включают как триглицериды, так и фосфатиды, может быть предпочтительной обработка яичных желтков с
использованием органических
растворителей таким образом, чтобы отделить фосфатиды от триглицеридов, стеринов (например, холестерина) и других компонентов. Для данного отделения пригодны различные
описанные в литературе способы,
по меньшей мере, на лабораторном уровне. Альтернативно данные яичные фосфатиды, практически не содержащие холестерин, являются коммерчески доступными в форме сухого
порошка в Pfanstiehl, Inc.
(Waukegan, IL), каталожный No P-123.
Затем яичный фосфатид вводят в энтеральную композицию, соответствующую данному изобретению. Вследствие содержания липидов ожидалось, что введение яичных фосфатидов в энтеральный состав легче проводить в масляной фазе. Однако было неожиданно обнаружено, что данные дисперсии липид-липид были неприемлемыми и что приготовление водной дисперсии яичного фосфатида приводило к получению улучшенного продукта. Для получения наилучших результатов водные дисперсии приблизительно 2-15 мас.%, предпочтительно приблизительно от 3 до приблизительно 8 мас.% следует готовить в прохладной до комнатной температуры воде (приблизительно 20-25oС). Более теплая вода давала менее приемлемые органолептические свойства.
Густые суспензии углевода, белка и липида, которые содержат источник макропитания, готовят раздельно, как известно из уровня техники, и данные суспензии смешивают при приблизительно от 130 до 140o С. Непосредственно перед гомогенизацией дисперсию фосфатида смешивают с остальными компонентами состава.
В особенно предпочтительном варианте осуществления перед добавлением дисперсии фосфатида к смеси конечного продукта (непосредственно перед гомогенизацией) дисперсию фосфатида деаэрируют под умеренным вакуумом. Деаэрация может быть осуществлена с помощью любого механизма, но распыляющий деаэратор при приблизительно 15 дюймах (375 мм) рт.ст. обеспечивал удовлетворительные результаты. Как было показано, данная дополнительная стадия улучшает органолептические свойства и запах конечного продукта даже более чем фильтрация через активированный уголь или комбинация двух данных способов (см. Пример 3).
Для получения композиций для парентерального введения, используемых в данном изобретении, может быть использована традиционная технология получения стерильных парентеральных препаратов. В данном случае может быть предпочтительным не использовать яичные фосфатиды и применять вместо них триглицеридные масла или сложные эфиры жирных кислот, такие, которые могут быть обнаружены в рекомбинантных или одноклеточных источниках масел.
Промышленное применение
Композиции, соответствующие данному изобретению, используют как искусственное питание для детей
и/или взрослых. Добавление ПНЖК с длинной цепью, в частности, n-6 и n-3
жирных кислот и особенно АК и ДГК, обычно считают благоприятным для развития нервной системы и зрительной активности у детей,
хотя в литературе также были обнаружены противоположные данные.
Композиции, используемые в данном изобретении, включают композиции, содержащие какой-либо или все компоненты из
следующих:
(а) ПНЖК с длинной цепью, выбранную из n-6 и n-3 жирных
кислот, обычно в форме фосфолипида или фосфатидилхолина;
(б) полярные фосфолипиды независимо от природы или длины
присоединенных жирных кислот;
(в) холин, предпочтительно
фосфатидилхолин.
Например, состав, усиленный яичным фосфолипидом, подробно описанный в примерах, обеспечивал повышенные уровни описанных компонентов и, как было неожиданно обнаружено, значительно снижал заболеваемость НЭК в популяциях детей, восприимчивых к НЭК. В более конкретном варианте осуществления способ снижения заболеваемости НЭК осуществляют путем введения арахидоновой кислоты (АК, 20: 4 n-6) или, более предпочтительно, АК в комбинации с докозагексаеновой кислотой (ДГК, 22:6 n-3).
В более широком смысле данный аспект изобретения охватывает способ снижения заболеваемости некротическим энтероколитом у детей, которые восприимчивы к некротическому энтероколиту. Данный способ предусматривает введение эффективного количества, по меньшей мере, одной ПНЖК, выбранной из группы С20 n-6 жирных кислот, С22 n-6 жирных кислот, С20 n-3 жирных кислот и С22 n-3 жирных кислот. Введение осуществляют на уровне, по меньшей мере, 1,0 мг n-3 жирных кислот на килограмм массы тела ребенка в день. В более предпочтительном варианте осуществления используют комбинацию n-6 и n-3 жирных кислот при соотношении масс приблизительно от 2:1 до приблизительно 4:1.
Далее раскрывается способ снижения частоты возникновения некротического энтероколита у детей. Данный способ предусматривает введение ребенку яичных фосфолипидов в количестве, обеспечивающем, по меньшей мере, 1,0 мг n-6 жирных кислот с длинной цепью в день. Предпочтительно яичные фосфолипиды обеспечивают АК в виде значительной доли n-6 жирных кислот и предпочтительно обеспечивают также ДГК и/или другие n-3 жирные кислоты с длинной цепью в вышеупомянутых соотношениях.
Дополнительный аспект данного изобретения касается энтерального введения человеку фосфолипидов, в частности фосфолипидов, содержащих АК и/или ДГК, которые быстро повышают уровни жирных кислот АК и ДГК в сыворотке крови человека относительно композиций, содержащих триглицериды АК и ДГК.
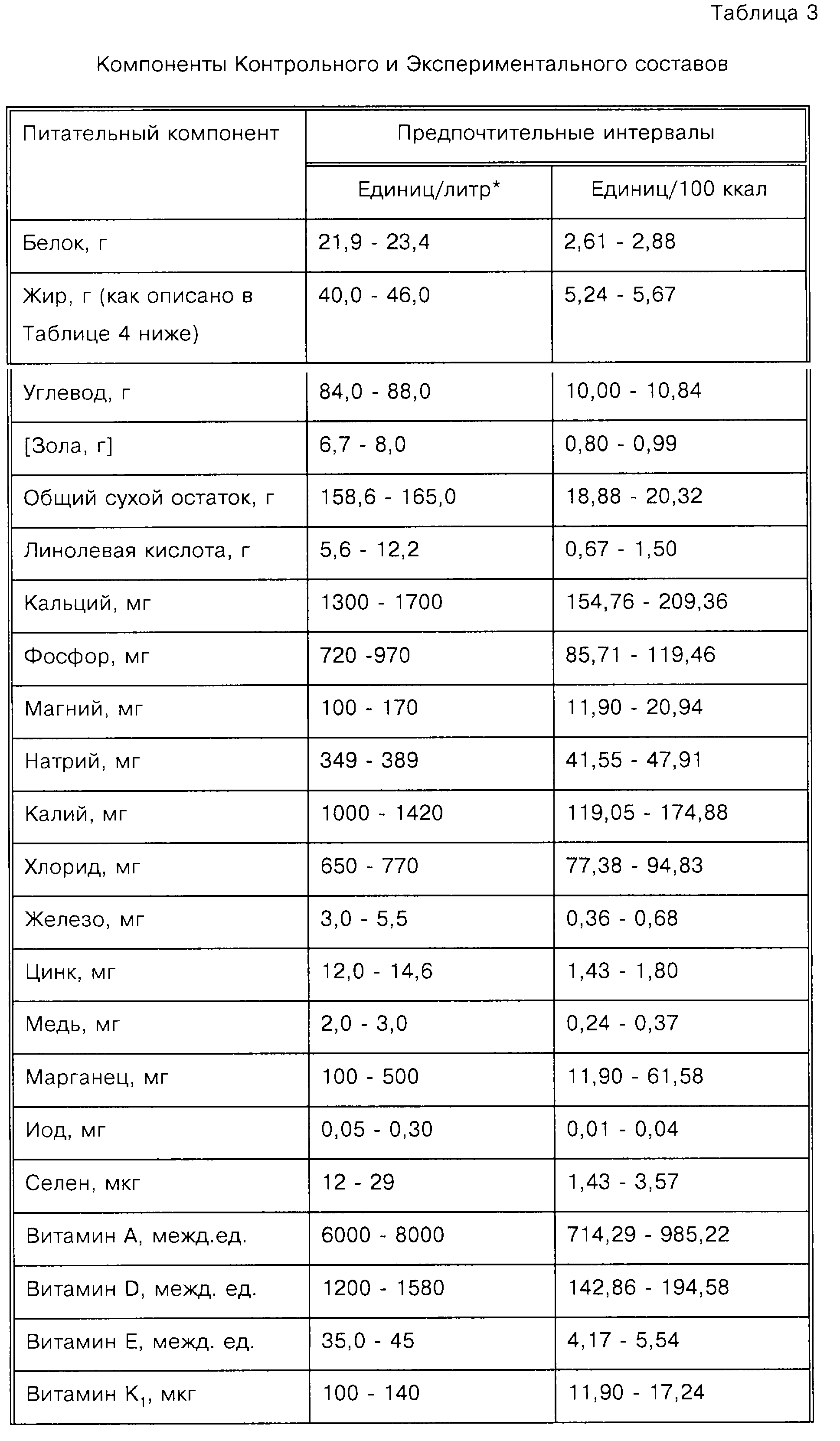
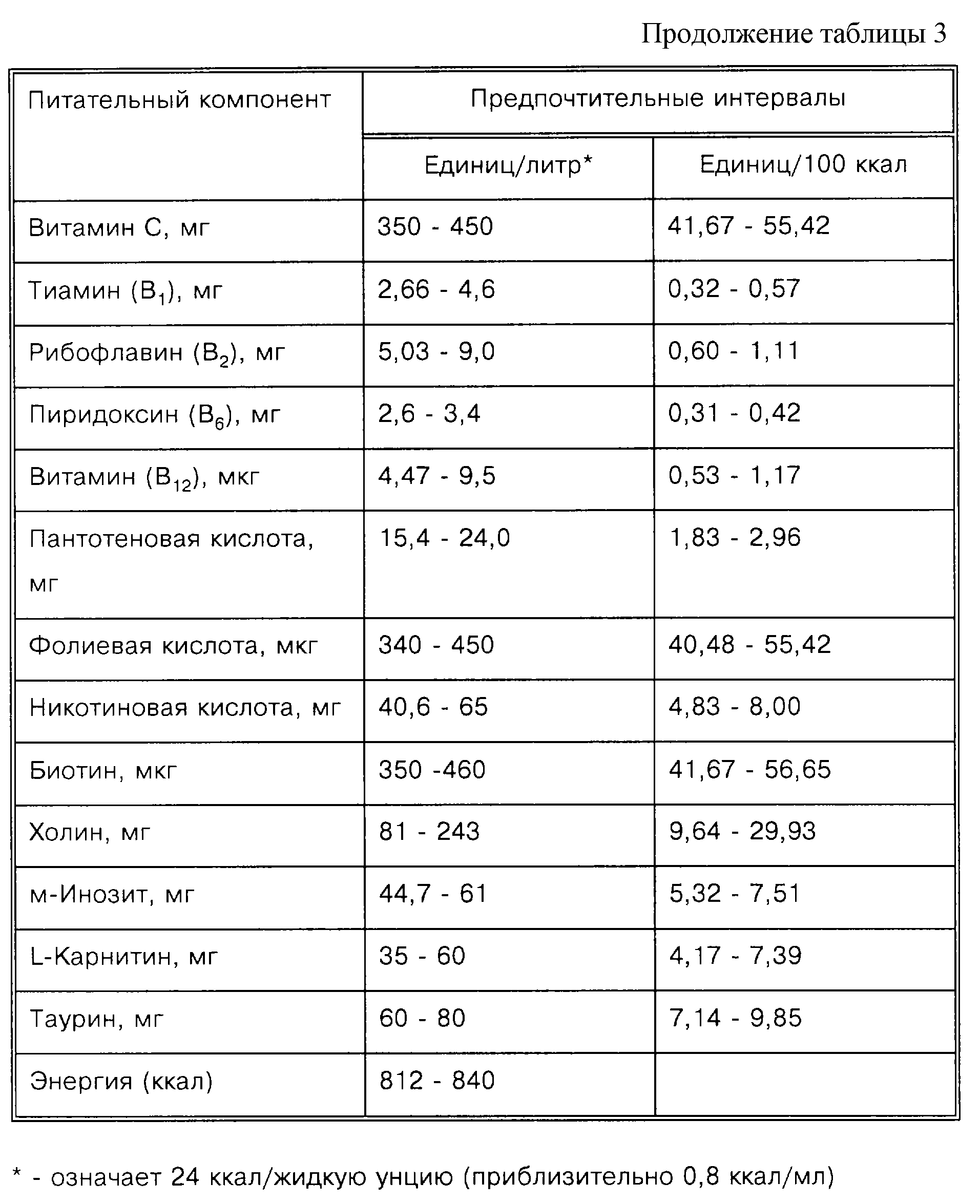
Более подходящей мерой введения композиций, соответствующих изобретению, является ежедневное потребление в мг/кг массы тела ребенка. В Таблице 1 представлены рекомендации относительно минимума, предпочтительного и идеального диапазонов для каждой из композиций, используемых в изобретении.
Широкий размах диапазонов существует во многом вследствие того факта, что не все дети, которым, вероятно, должно принести пользу данное изобретение, будут потреблять равные объемы состава. Те, кто потребляет меньше, получают меньше каждого ингредиента. Диапазон идеального потребления предполагает, что будет потребляться приблизительно 100 ккал. Являются также спорными способы оценки содержания холина.
Как можно видеть из Таблицы 1, наиболее предпочтительным является приблизительно 2-4-кратное превышение содержания АК относительно ДГК. Также показано, что минимальные уровни фосфолипида и холина идентичны. Это достигается получением всего фосфолипида в виде фосфатидилхолина. Поскольку другие азотсодержащие спирты заменяют холин (например, этаноламин, серин или инозит), относительное количество холина в общем фосфолипиде снижается.
АК и/или ДГК могут быть введены индивидуально как отдельные компоненты, или вместе, или в комбинации с другими ингредиентами, такими как белок, липид, углевод, витамины и минералы. Искусственное питание для детей с низкой массой тела при рождении является либо парентеральным (внутривенное кормление), либо энтеральным. Таким образом, соответствующие уровни ПНЖК с длинной цепью могут быть введены в питательный раствор для парентерального введения или добавлены в принятый энтеральный состав для детей с низкой массой тела при рождении. Наиболее предпочтительно способ, соответствующий данному изобретению, осуществляют путем энтерального введения состава для детского питания, разработанного для детей с низкой массой тела при рождении, который содержит АК и ДГК. Данный состав для детского питания далее содержит подходящие уровни углеводорода и белка и подходящую комбинацию минералов и витаминов. Примером состава для детского питания для использования в способах, соответствующих изобретению, является модифицированный Similac Special Care® (Ross Products Division of Abbott Laboratories, Columbus, Ohio), который более детально обсуждается в Примере 2.
Дополнительным аспектом данного изобретения является способ повышения уровней арахидоновой кислоты и докозагексаеновой кислоты в сыворотке крови человека. Данный способ предусматривает стадию введения указанному человеку энтерального состава, содержащего АК и ДГК в форме фосфолипидов.
Недавние исследования данных заявителей показали, что введение ПНЖК с длинной цепью детям, восприимчивым к НЭК, будет снижать заболеваемость НЭК и может снижать также уровень и остроту НЭК. Заявители также обнаружили, что введение фосфолипидов животной или растительной природы также эффективно снижает заболеваемость НЭК в популяциях детей, которые восприимчивы к НЭК.
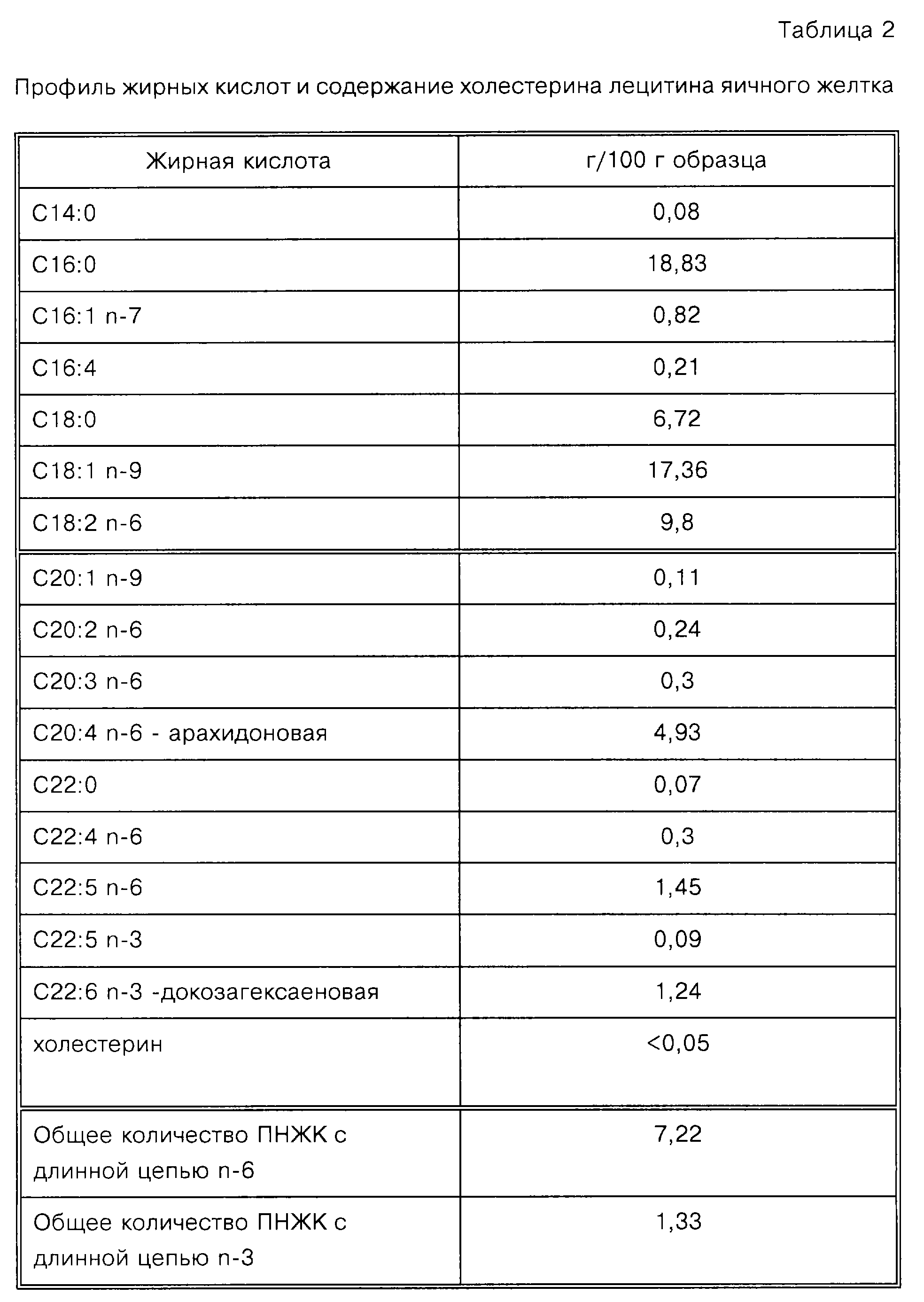
Пример 1
Фосфолипид яичного
желтка получают от Pfanstiehl, Inc. (Waukegan, IL-Каталожный
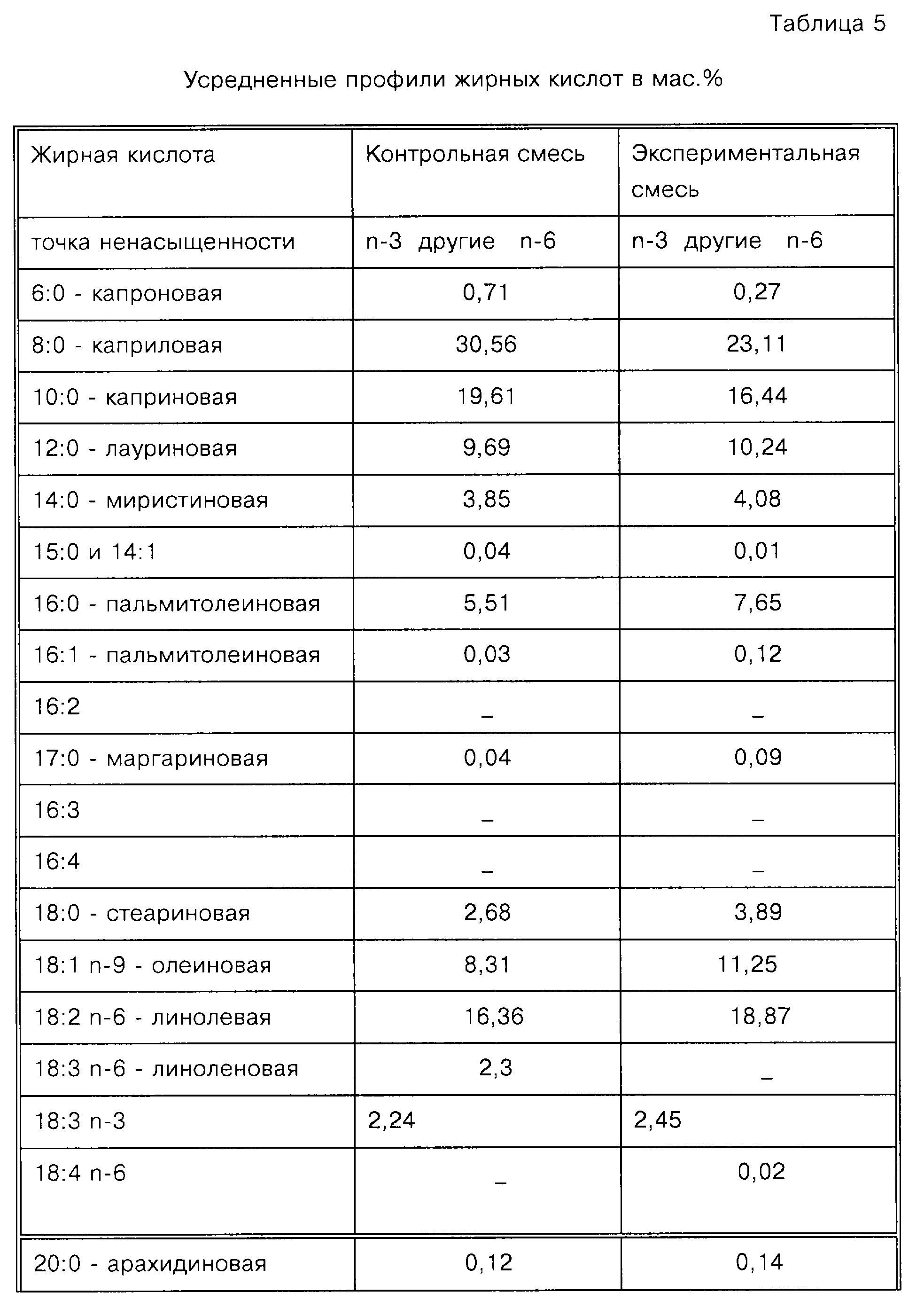
No P-123) и используют в следующих Примерах. Профиль жирных кислот и холестерина данного яичного фосфатида представлен в таблице 2.
Приведена также сумма всех n-3 и всех n-6 ПНЖК с длинной цепью.
Специалисты оценят, что специфические уровни различных жирных кислот, содержащихся в липиде яичного желтка, варьируют в зависимости от породы, корма и возраста кур. Кроме того, способ экстракции, применяемый Pfanstiehl для получения фосфатида, используемого в Примерах, дает материал, который содержит чрезвычайно низкий уровень холестерина, обеспечивая при этом профиль жирных кислот, который широко применяется в области приготовления продуктов питания.
Пример 2
В данном примере
"Экспериментальный" и "Контрольный" составы для детского питания
готовят соответственно с добавлением и без добавления яичного фосфатида из Примера 1. Контрольная композиция представляет собой Similac
Special Care® (Ross Products Division of
Abbot Laboratories, Columbus, Ohio), ее готовят, используя следующий список ингредиентов, который дает состав, имеющий композицию,
представленную в Таблицах 3-5: вода (Kosher), нежирное молоко,
гидролизованный кукурузный крахмал, лактоза, фракционированное кокосовое масло (триглицериды со средней цепью), концентрат белка молочной
сыворотки, соевое масло, кокосовое масло, трехосновный фосфат
кальция, цитрат калия, цитрат натрия, хлорид магния, аскробиновая кислота, моно- и диглицериды, соевый лецитин, карбонат кальция,
каррагинан, хлорид холина, сульфат двухвалентного железа, м-инозит,
таурин, никотинамид, L-карнитин, α-токоферола ацетат, сульфат цинка, пантотенат кальция, хлорид калия, сульфат меди,
рибофлавин и витамина А пальмитат, гидрохлорид тиамина хлорида, гидрохлорид
пиридоксина, биотин, фолиевая кислота, сульфат марганца, филлохинон, витамин D3, селенит натрия и
цианокобаламин.
Обычно густые суспензии белка, углевода, липида, витаминов и минералов готовят отдельно, а затем смешивают перед гомогенизацией, как в основном описывают в ранее включенных Патентах США, относящихся к производству составов для детского питания.
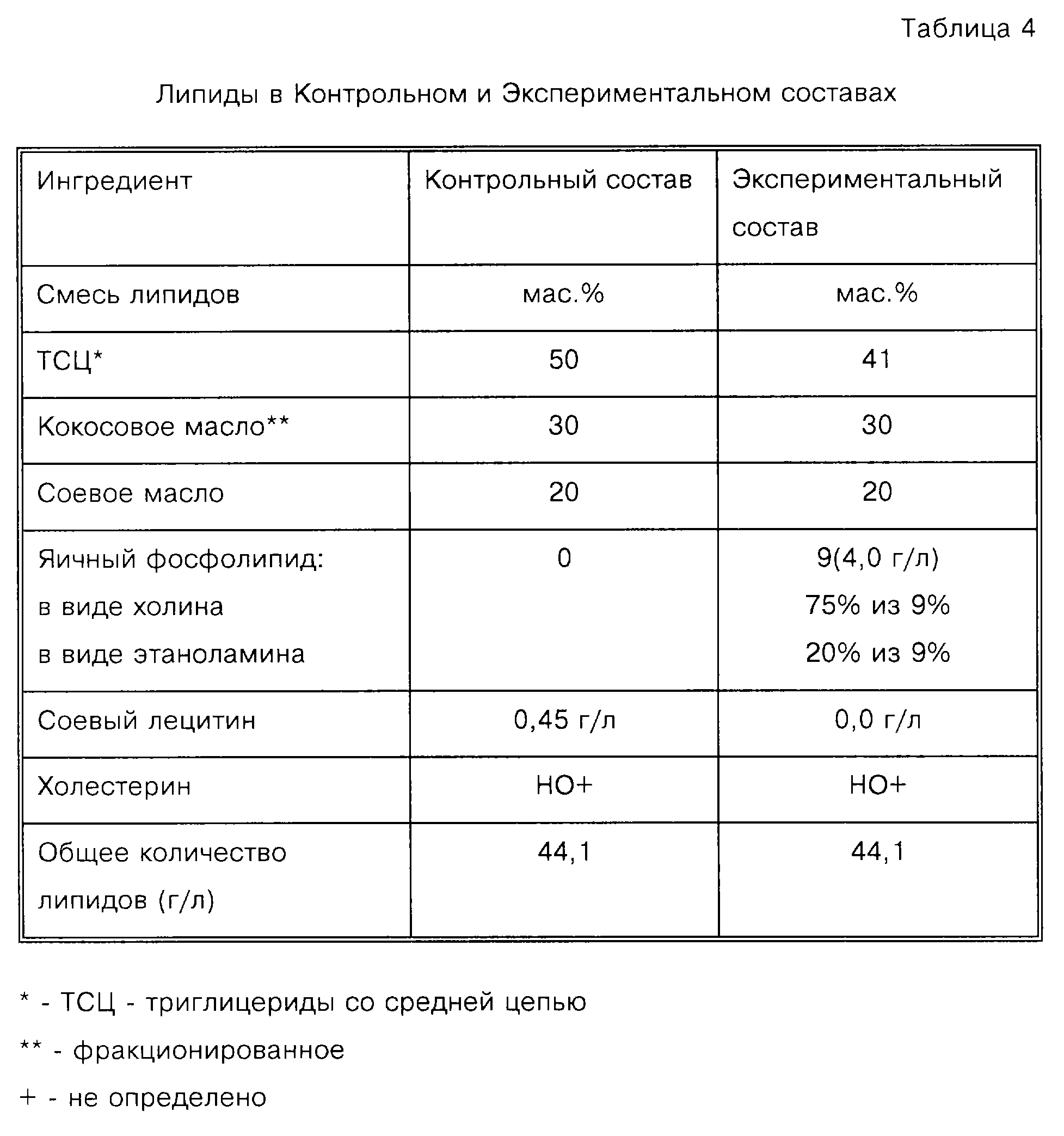
В экспериментальном составе яичный фосфатид, соответствующий Примеру 1, вводят в состав во время приготовления. Сначала яичный фосфатид диспергируют в воде при 25oС для получения 8% дисперсии. Непосредственно перед гомогенизацией дисперсию фосфатида смешивают с густыми суспензиями белка, углевода, витаминов, минералов и других липидов и получают "Экспериментальный" состав, имеющий композицию, представленную в Таблицах 3-5. Количества каждого компонента приводят как "на литр", так и "на ккал", поскольку в уровне техники хорошо известно приготовление составов для детского питания с калорийностью, повышенной или пониженной относительно стандарта 20 ккал на жидкую унцию (приблизительно 0,7 ккал/мл).
В таблице 4 представлено содержание липидов (единственное отличие), используемых в Контрольном и Экспериментальном продуктах. Можно заметить, что два состава имеют одинаковое общее количество липидов, но принципиально отличаются заменой части триглицеридов со средней цепью яичным фосфолипидом. Данная замена обеспечивает значительно более высокие уровни фосфолипидов и холина, а также дополнительные ПНЖК с длинной цепью.
В
таблице 5 приводят профиль содержания жирных кислот для Контрольного и Экспериментального составов. Он
представляет сумму компонентов жирных кислот яичного лецитина и состава Similac Special Care®.
Включение яичного фосфатида приводит к содержанию 0,21 мас.% n-3 жирных кислот
с длинной цепью в общей смеси липидов и 0,48 мас.% n-6 жирных кислот с длинной цепью в общей
смеси липидов. В частности 0,14 мас.% от общей смеси липидов составляет ДГК и 0,41 мас.% от общей смеси
липидов составляет АК. При введении 100 ккал/кг/день на 1 кг массы тела ребенка данная формула
обеспечивает приблизительно 22 мг АК и приблизительно 7 мг ДГК в день. Конечно, это является только одним
из возможных вариантов осуществления соотношений в соответствии с данным изобретением.
Пример 3
В данном эксперименте варианты способа оценивают в плане уменьшения
органолептических недостатков, связанных с использованием яичных фосфолипидов. Выделение яичных
фосфолипидов, используемых в данном изобретении, часто приводит к получению яичного фосфатида, который
имеет какие-либо органолептические свойства, непригодные для использования в составе для
детского питания. Они могут быть улучшены при дальнейшем получении продукта, который не является неприятным ни
для ребенка, ни для ухаживающего за ним. Ниже описывают способ улучшения конечного
продукта.
Готовят ряд питательных составов, подобных составу, соответствующему Примеру 2, за исключением того, что 6 мас.% жировой смеси составляет яичный фосфолипид, который предварительно обрабатывают с использованием различных процедур. Яичный фосфолипид диспергируют в части масляной смеси, описанной в Примере 2, или в части воды. Масляные дисперсии являются неприемлемыми и не могут быть использованы даже после нагревания до приблизительно 95oС. Дисперсию фосфолипида в воде при температуре от комнатной до теплой легко приготовить, и она является предпочтительным средством для получения водной дисперсии.
Исходную порцию дисперсии 3 мас.% яичного фосфолипида готовят путем перемешивания фосфолипида с водой при 90oС в течение приблизительно 1 часа. Часть данной дисперсии проводят через: (1) только деаэратор; (2) только устройство для фильтрования через активированный уголь; (3) комбинацию деаэратора и устройства для фильтрования через активированный уголь и (4) не обрабатывают.
Устройство для фильтрации через активированный уголь содержит 80 г активированного угля, а устройство для деаэрации работает при умеренном вакууме (15 дюймов (375 мм) рт.ст.). Части порции проводят через устройство для фильтрации 3 раза и один раз через деаэратор. При использовании обоих способов часть смеси сначала пропускают через фильтр, в потом через деаэратор. Обработанные части смеси затем добавляют к соответствующим питательным составам непосредственно перед гомогенизацией и упаковкой образцов.
Затем образцы первично оценивают на привкус (органолептические свойства) с помощью экспертов. Результаты оценки представлены в Таблице 6.
Неожиданно образцом с наименьшим привкусом оказывается образец, содержащий дисперсию, которую проводят только через деаэратор. Дисперсия, которую проводят через деаэратор и фильтр с активированным углем, имеет самый плохой результат за исключением контроля (дисперсия фосфолипида без обработки).
Пример 4
Составами,
приготовленными в соответствии с Примерами 2 и 3, кормят детей в
исследовании, проводимом в Отделении ухода за новорожденными Центра Новорожденных Университета Теннесси под руководством др. Susan Е.
Carlson при финансовой поддержке Ross Products Division of Abbot
Laboratories (Исследование АЕ78), гранта NICHD RО1-HD31329 и гранта Национального глазного института RО1-EY08770. Параметры
исследований включают рост, развитие нервной системы и зрительной
активности. Считают, что ПНЖК являются физиологически важными для развития головного мозга и глаз и быстро накапливаются в тканях
плода в последний триместр беременности. Таким образом, недоношенные
дети не накапливают нормальные уровни ПНЖК с длинной цепью по сравнению с доношенными детьми.
Критерии включения: Включение в данное клиническое исследование основывается на "низкой" массе тела при рождении (менее 1500 г (в интервале 750-1375 г)) при отсутствии диагноза сердечных, респираторных, желудочно-кишечных или иных системных заболеваний. Ребенок также не имеет в истории рождения асфиксии или клинических осложнений, касающихся несовместимости группы крови, У матерей включенных в исследование детей в медицинской карте отсутствуют пренатальные инфекции с доказанными неблагоприятными воздействиями на детей. Наркомания у матери является критерием исключения. Всех детей начинают кормить перорально на 7 день жизни.
В течение клинического исследования в него включают всего 120 детей в первые 7 дней жизни. За исключением одного ребенка, которого переводят в другую больницу вскоре после включения в исследование (Контроль), за всеми остальными детьми (n=119) наблюдают в одной и той же больнице. Детей включают (случайным "слепым" образом) в 1 из 3 групп, две из которых получают Контрольный состав во время их пребывания в больнице, а одна группа получает Экспериментальный состав (см. Пример 2). Детей, потерянных (умерших) во время пребывания в больнице, заменяют другими детьми, включаемыми в ту же группу лечения. Согласно плану исследования большее количество детей кормят Контрольным составом. Общее число детей, которых кормят Контрольным составом, более чем в два раза превышает число детей, которых кормят Экспериментальным составом.
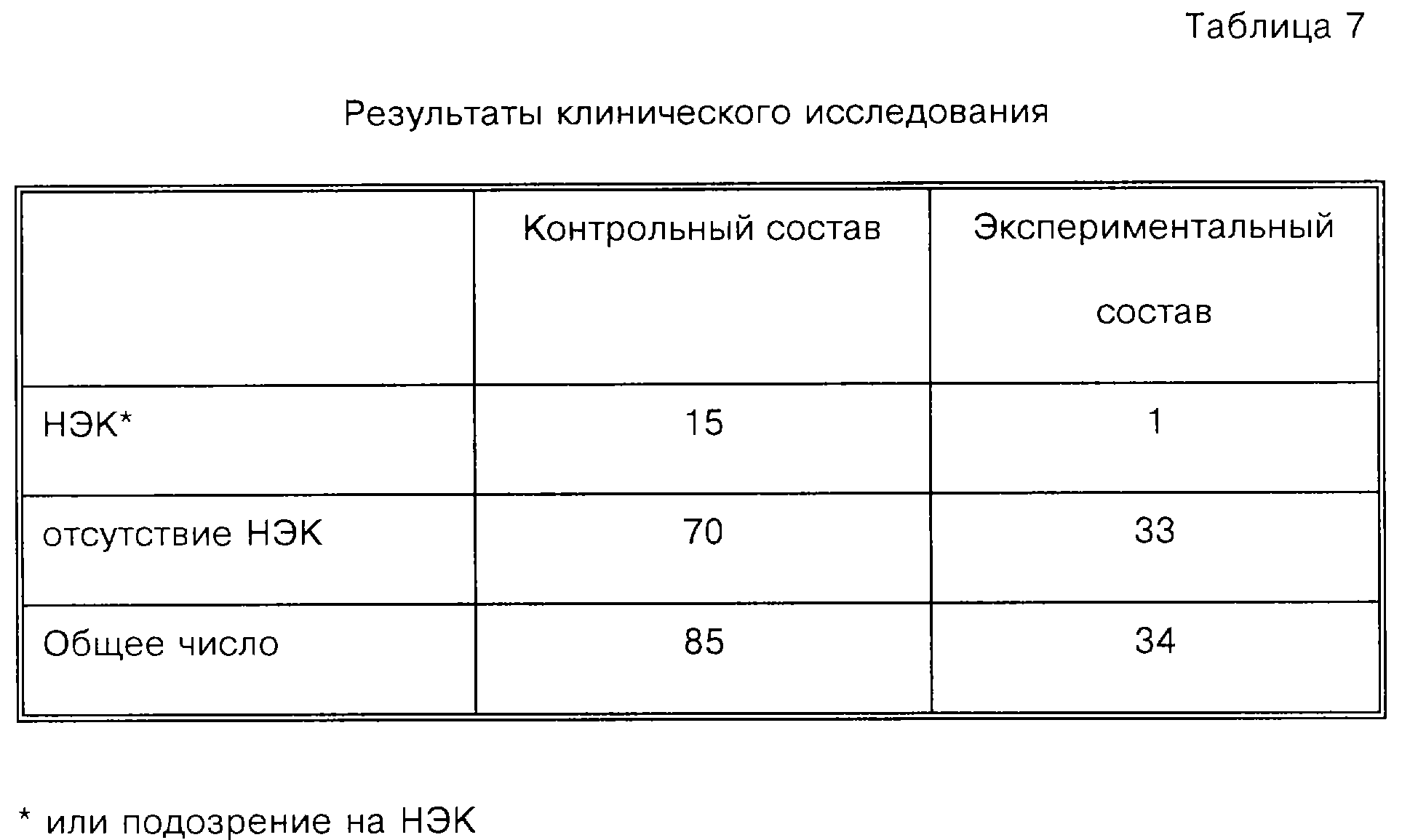
Результаты: Неожиданно обнаруживают, что повышенная заболеваемость некротическим энтероколитом (НЭК) наблюдается в Контрольных группах по сравнению с Экспериментальной группой. В Таблице 7 группируют общее число новорожденных в соответствии с лечением (Контроль по отношению к Эксперименту) и представляют число новорожденных в каждой группе, у которых развивается НЭК. Считают, что НЭК имеется или предполагается, когда клинические признаки и симптомы соответствуют данному заболеванию, например, вздутие живота, остаточные массы в желудке, желчная рвота, кал с кровью, присутствие слизи в кале и присутствие С-реактивного белка на уровне ≥ 0,5 мг/декал (Pourcyrous и соавт. "Значение серийных реакций С-реактивного белка при неонатальных инфекциях и других заболеваниях" Pediatr., 1993, т. 92, с. 431-435). НЭК подтверждают у 15 детей в Контрольной и только у 1 в Экспериментальной группе.
Статистический анализ данных результатов с использованием теста Фишера (двухвостового) показывает, что число детей с подтвержденным НЭК в Контрольной группе(ах) значительно превышает (р=0,039) число детей с НЭК в Экспериментальной группе.
Пример
5
В данном эксперименте оценивают включение АК и ДГК при парентеральном
введении питания (внутривенном питании). Раствор для парентерального введения может содержать различные компоненты,
известные в уровне техники, с добавлением АК и ДГК в форме фосфолипида,
триглицеридов или метиловых эфиров. АК и ДГК могут быть единственными активными ингредиентами, смешанными с принятыми
парентеральными носителями или наполнителями, или, более предпочтительно, АК и ДГК
включают в состав для парентерального введения, предназначенный для дополнения или обеспечения полного
искусственного питания ребенка. Типичные питательные растворы для парентерального введения
содержат уровни липидов, обеспечивающие приблизительно 2г/кг/день. Уровень АК и ДГК в смеси липидов должен
предпочтительно обеспечивать введение от 10 до 30 мг/кг/день АК и 3 до 15 мг/кг/день ДГК.
Пример 6
В данном эксперименте яичный лецитин экспериментального состава,
соответствующего Примеру 2, заменяют соевым лецитином на уровне, приблизительно в 10 раз превышающем его
уровень в контрольном составе. Соевый лецитин подобно другим фосфолипидам, выделенным из
растительных источников, не содержит полиненасыщенные кислоты с длинной цепью, однако полярная природа
фосфолипидов и их способность к быстрой инкорпорации в слизистую оболочку кишечника могут
создать защитный эффект в отношении выстилки кишки, что приводит к результатам, сравнимым с результатами,
полученными для экспериментального состава, соответствующего Примеру 2. Кроме того, соевый
лецитин содержит линолевую кислоту (18:2n-6 - предшественник пищевой основной жирной кислоты АК) и
линоленовую кислоту (18:3n-3 - предшественник пищевой основной жирной кислоты ДГК).
Пример 7
В данном эксперименте использование фосфолипидов, содержащих АК и ДГК в составе
для детского питания, сравнивают с триглицеридами, содержащими АК и ДГК. Состав, соответствующий
Примеру 2, сравнивают с аналогичным составом для детского питания, в котором яичный фосфолипид заменен
смесью триглицеридов одноклеточных микроорганизмов, содержащих сравнимые уровни АК и ДГК.
В клиническую оценку включают здоровых доношенных детей с целью определения уровней АК и ДГК в сыворотке крови после энтерального введения. Ожидают, что у детей, которых кормят составом с фосфолипидами, будут достигаться уровни АК и ДГК в сыворотке крови, более близкие данным уровням у детей, вскармливаемых грудным молоком, по сравнению с контрольным составом, содержащим АК и ДГК в форме триглицеридов. Данный эксперимент должен продемонстрировать, что фосфолипиды, содержащие АК и ДГК, являются предпочтительной формой введения по сравнению с триглицеридами, содержащими АК и ДГК. Таким образом, в данном контексте представляют улучшенные энтеральные составы и способы повышения уровней АК и ДГК в сыворотке крови.
Модификации и альтернативные варианты осуществления композиций и способов, соответствующих данному изобретению, будут очевидны для специалиста в свете предшествующего описания. Соответственно данное описание предназначено только для иллюстрации и служит для целей представления специалистам способа его реализации. Полный объем изобретения, защита которого предусматривается, определен в прилагаемой формуле изобретения.
Реферат
Ребенку, восприимчивому к некротическому энтероколиту, вводят, по меньшей мере, одну n-6 полиненасыщенную жирную кислоту (ПНЖК), например арахидоновую кислоту, в комбинации с, по меньшей мере, одной n-3 ПНЖК, например докозагексаеновой кислотой. Указанные ПНЖК обычно используют в форме фосфолипида или фосфатидилхолина. Указанное введение проводят энтерально или парентерально. Комбинация указанных ПНЖК обеспечивает синергический эффект в лечении некротического энтероколита. Согласно другим вариантам способа снижения заболеваемости некротическим энтероколитом ребенку вводят эффективное количество фосфолипидов, предпочтительно полученных из яичного лецитина, или вводят эффективное количество холина, предпочтительно фосфатидилхолина. Использование указанных препаратов снижает заболеваемость детей некротическим энтероколитом, который является опасным для жизни заболеванием. 3 с. и 25 з.п.ф-лы, 7 табл.
Формула
03.10.1997 - по пп.1, 5, 7, 9-14 и 16-28;
21.02.1997 - по пп.2-4;
28.03.1997 - по пп.6, 8 и 15.

Комментарии