Соединения малононитрила и их применение в качестве пестицидов - RU2274638C2
Код документа: RU2274638C2
Описание
Область техники
Настоящее изобретение относится к соединениям малононитрила и их применению в качестве пестицидных композиций.
Предшествующий уровень техники
До настоящего времени для борьбы с вредителями, такими как насекомые-вредители, клещи-вредители и нематоды, использовались разнообразные пестицидные композиции. Требования к необходимым пестицидным композициям существенно изменились, включая внимание к их действию на окружающую среду и приобретение вредителями устойчивости к средствам борьбы. При таких обстоятельствах появились значительные требования к разработке новых пестицидных композиций.
Описание изобретения
Авторы настоящего изобретения провели интенсивный поиск соединений, обладающих превосходной пестицидной активностью. В результате было установлено, что соединения малононитрила формулы (Y), указанной ниже, обладают превосходной активностью для борьбы с вредителями, такими как насекомые-вредители, клещи-вредители и нематоды, что дало возможность осуществить настоящее изобретение.
Таким образом, настоящее изобретение относится к соединениям малононитрила формулы (Y) (далее упоминаемым как настоящее(ие) соединение(я)):

где R1 и R2 являются одинаковыми или различными и независимо представляют собой C1-C5(галоген)алкил, C1-C5(галоген)алкилокси, C2-C5(галоген)алкенил, C2-C5(галоген)алкинил, водород или циано;
R3 представляет собой C1-C3галогеналкил, C2-C4галогеналкенил или C2-C4галогеналкинил;
m представляет собой целое число от 1 до 3;
R5 представляет собой галоген, циано, нитро, C1-C4 (галоген)алкил, C2-C4(галоген)алкенил, C2-C4(галоген)алкинил, C1-C4(галоген)алкилокси, C1-C4(галоген)алкилтио, C1-C4(галоген)алкилсульфинил, C1-C4(галоген)алкилсульфонил, C1-C4(галоген)алкилкарбонил, C1-C4 (галоген)алкилоксикарбонил, C1-C4(галоген)алкилкарбонилокси, бензилокси, фенилокси или фенилтио, где фенилокси и фенилтио группы необязательно могут быть замещены галогеном или C1-C3алкилом;
n представляет собой целое число от 0 до 4;
R6 представляет собой водород, галоген, циано, нитро, C1-C4(галоген)алкил, C2-C4(галоген)алкенил, C2-C4(галоген)алкинил, C1-C4(галоген)алкилокси, C1-C4 (галоген)алкилтио, C1-C4(галоген)алкилсульфинил, C1-C4(галоген)алкилсульфонил, C1-C4(галоген)алкилкарбонил, C1-C4(галоген)алкилоксикарбонил, C1-C4(галоген)алкилкарбонилокси, бензилокси, фенилокси или фенилтио, где фенилокси и фенилтио группы необязательно могут быть замещены галогеном или C1-C3алкилом;
при условии, что когда n равно 2 или более, то заместители R5 являются одинаковыми или отличаются друг от друга.
Настоящее изобретение также относится к применению настоящих соединений в качестве пестицидов, к пестицидным композициям, включающим настоящие соединения в качестве активных ингредиентов и к способу борьбы с вредителями, включающему нанесение настоящих соединений на вредителей или места обитания вредителей.
Способ осуществления изобретения
При определении заместителей, как использовано в данном описании, каждая группа имеет следующее значение:
(Галоген)алкильная группа относится к алкилу, в котором один или несколько атомов водорода необязательно замещены на галоген.
(Галоген)алкилокси группа относится к алкилокси, в котором один или несколько атомов водорода необязательно замещены на галоген.
(Галоген)алкенильная группа относится к алкенилу, в котором один или несколько атомов водорода необязательно замещены на галоген.
(Галоген)алкинильная группа относится к алкинилу, в котором один или несколько атомов водорода необязательно замещены на галоген.
(Галоген)алкилтио группа относится к алкилтио, в котором один или несколько атомов водорода необязательно замещены на галоген.
(Галоген)алкилсульфинильная группа относится к алкилсульфинилу, в котором один или несколько атомов водорода необязательно замещены на галоген.
(Галоген)алкилсульфонильная группа относится к алкилсульфонилу, в котором один или несколько атомов водорода необязательно замещены на галоген.
(Галоген)алкилкарбонильная группа относится к алкилкарбонилу, в котором один или несколько атомов водорода необязательно замещены на галоген.
(Галоген)алкилоксикарбонильная группа относится к алкилоксикарбонилу, в котором один или несколько атомов водорода необязательно замещены на галоген.
(Галоген)алкилкарбонилокси группа относится к алкилкарбонилокси, в котором один или несколько атомов водорода необязательно замещены на галоген.
Галогеналкильная группа относится к алкилу, в котором по крайней мере один или несколько атомов водорода замещены на галоген.
Галогеналкенильная группа относится к алкенилу, в котором по крайней мере один или несколько атомов водорода замещены на галоген.
Галогеналкинильная группа относится к алкинилу, в котором по крайней мере один или несколько атомов водорода замещены на галоген.
Термин «C1-C10» или им подобные относится к числу атомов углерода, составляющих алкильную, алкенильную или алкинильную группу в каждом из заместителей. Например, C1-C4(галоген)алкилкарбонил означает алкилкарбонил, в котором один или несколько атомов водорода необязательно замещены на галоген, где алкильная часть состоит из C1-C4атомов углерода.
В настоящих соединениях каждая группа включает конкретные группы, как перечислено ниже:
C1-C5(Галоген)алкильная группа, представленная R1 или R2, может включать метил, этил, пропил, 1-метилэтил, 1,1-диметилэтил, 2,2-диметилпропил, хлорметил, фторметил, дифторметил, трифторметил, 2,2,2-трифторэтил и 1,1,2,2-тетрафторэтил.
C1-C5(Галоген)алкилокси группа, представленная R1 или R2, может включать метокси, этокси, 1-метилэтокси, трифторметокси, дифторметокси, 2,2,2-трифторэтокси и 1,1,2,2-тетрафторэтокси.
C2-C5 (Галоген)алкенильная группа, представленная R1 или R2, может включать винил, 1-пропенил, 2-пропенил, 2,2-дифторвинил и 1,2,2-трифторвинил.
C2-C5(Галоген)алкинильная группа, представленная R1 или R2, может включать этинил, 1-пропинил, 2-пропинил и 3,3,3-трифтор-1-пропинил.
C1-C3 (Галоген)алкильная группа, представленная R3, может включать фторметил, хлорметил, дифторметил, дихлорметил, трифторметил, трихлорметил, 1,1-дифторэтил, пентафторэтил, 1,1-дифторпропил, гептафторпропил, 2,2,2-трифторэтил, 3,3,3-трифторпропил и 1,1,2,2-тетрафторэтил.
C2-C4(Галоген)алкенильная группа, представленная R3, может включать 1-хлорвинил, 2-хлорвинил, 1-фторвинил, 2-фторвинил, 2,2-дихлорвинил, 2,2-дибромвинил, 2,2-дифторвинил, 1,2,2-трифторвинил, 1-(трифторметил)винил, 3,3,3-трифтор-1-пропенил, 2,3,3,3-тетрафтор-1-пропенил, 1,2,3,3,3-пентафтор-1-пропенил, 3,3-дифтор-2-пропенил, 2,3,3-трифтор-2-пропенил и 3,4,4-трифтор-3-бутенил.
C2-C4(Галоген)алкинильная группа, представленная R3, может включать 3-хлор-2-пропинил и 3,3,3-трифтор-1-пропинил.
Атом галогена, представленный R5 или R6, может включать фтор, хлор, бром и йод.
C1-C4(Галоген)алкильная группа, представленная R5 или R6, может включать метил, этил, пропил, 1-метилэтил, 1,1-диметилэтил, трифторметил, пентафторэтил, 3,3,3-трифторэтил и 1,1,2,2-тетрафторэтокси.
C2-C4(Галоген)алкенильная группа, представленная R5 или R6, может включать винил, 1-пропенил, 2-пропенил и 2,2-дифторвинил.
С2-C4(Галоген)алкинильная группа, представленная R5 или R6, может включать этинил, 1-пропинил, 2-пропинил и 3,3,3-трифтор-1-пропинил.
C1-C4(Галоген)алкилокси группа, представленная R5 или R6, может включать метокси, этокси, трифторметокси, бромдифторметокси, дифторметокси, хлордифторметокси, пентафторэтокси, 2,2,2-трифторэтокси и 1,1,2,2-тетрафторэтокси.
C1-C4(Галоген)алкилтио группа, представленная R5 или R6, может включать метилтио, трифторметилтио, 2,2,2-трифторэтилтио и 1,1,2,2-тетрафторэтилтио.
C1-C4 (Галоген)алкилсульфинильная группа, представленная R5 или R6, может включать метилсульфинил и трифторметилсульфинил.
C1-C4 (Галоген)алкилсульфонильная группа, представленная R5 или R6, может включать метилсульфонил и трифторметилсульфонил.
C1-C4 (Галоген)алкилкарбонильная группа, представленная R5 или R6, может включать ацетил и трифторацетил.
C1-C4(Галоген)алкилоксикарбонильная группа, представленная R5 или R6, может включать метоксикарбонил и 2,2,2-трифторэтоксикарбонил.
C1-C4(Галоген)алкилкарбонилокси группа, представленная R5 или R6, может включать ацетилокси, пропионилокси и трифторацетилокси.
Фенилокси группа, необязательно замещенная галогеном или C1 -C3алкилом, которая представлена R5 или R6, может включать фенокси, п-метилфенокси, м-метилфенокси и п-хлорфенокси.
Фенилтио группа, необязательно замещенная галогеном или C1-C3 алкилом, которая представлена R5 или R6, может включать фенилтио, п-метилфенилтио, м-метилфенилтио и п-хлорфенилтио.
Варианты осуществления настоящего изобретения могут включать следующие соединения:
Соединения малононитрила формулы (Y), где R1 представляет собой водород и R2 представляет собой C1-C5(галоген)алкил, C2-C5(галоген)алкенил или водород;
Соединения малононитрила формулы (Y), где оба R1 и R2 представляют собой водород;
Соединения малононитрила формулы (Y), где R3 представляет собой С1-С3фторалкил или С2-С4фторалкенил,
Соединения малононитрила формулы (Y), где R5 представляет собой галоген, n представляет собой целое число от 0 до 2;
Соединения малононитрила формулы (Y), где R6 представляет собой галоген, циано, нитро, C1-C4(галоген)алкил, C1-C4(галоген)алкилокси или C1-C4(галоген)алкилтио;
Соединения малононитрила формулы (Y), где R5 представляет собой галоген, n представляет собой целое число от 0 до 2, и R6 представляет собой галоген, циано, нитро, C1-C4 галогеналкил, C1-C4 галогеналкилокси или C1-C4 галогеналкилтио;
Соединения малононитрила формулы (Y), где R3 представляет собой С1-С3 фторалкил или С2-С4 фторалкенил, R5 представляет собой галоген, n представляет собой целое число от 0 до 2 и R6 представляет собой галоген, циано, нитро, C1-C4(галоген)алкил, C1-C4(галоген)алкилокси или C1-C4(галоген)алкилтио;
Соединения малононитрила формулы (Y), где R1 и R2 являются одинаковыми или разными и независимо представляют собой C1-C3(галоген)алкил, C1-C3(галоген)алкилокси, C2-C4(галоген)алкенил, C2-C4(галоген)алкинил, водород или циано, R5 и R6 являются одинаковыми или разными и независимо представляют собой галоген, циано, нитро, C1-C3(галоген)алкил, C1-C3(галоген)алкилокси, C1-C3(галоген)алкилтио, C1-C3(галоген)алкилсульфинил, C1-C3(галоген)алкилсульфонил, C1-C3(галоген)алкилкарбонил или C1-C3(галоген)алкилоксикарбонил;
Соединения малононитрила формулы (Y), где R1 представляет собой водород, R2 представляет собой C1-C5(галоген)алкил, C2-C5(галоген)алкенил или водород, R3 представляет собой С1-С3 фторалкил или С2-С4 фторалкенил, R5 представляет собой галоген, n представляет собой целое число от 0 до 2 и R6 представляет собой галоген, циано, нитро, C1-C4(галоген)алкил, C1-C4(галоген)алкилокси или C1-C4(галоген)алкилтио;
Соединения малононитрила формулы (Y), где R3 представляет собой 1,2, 2-трифторвинил, m равно 2 и R6 представляет собой трифторметил;
Соединения малононитрила формулы (Y), где R3 представляет собой 1,2,2-трифторвинил, m равно 2 и R6 представляет собой дифторметокси;
Соединения малононитрила формулы (Y), где R3 представляет собой 1,2,2-трифторвинил, m равно 2 и R6 представляет собой трифторметокси;
Соединения малононитрила формулы (Y), где R3 представляет собой 1,2,2-трифторвинил, m равно 2 и R6 представляет собой трифторметилтио;
Соединения малононитрила формулы (Y), где R3 представляет собой 1,2,2-трифторвинил, m равно 2 и R6 представляет собой 1,1,2,2-тетрафторэтокси;
Соединения малононитрила формулы (Y), где R3 представляет собой 1,2,2-трифторвинил, m равно 2 и R6 представляет собой хлор;
Соединения малононитрила формулы (Y), где R3 представляет собой 1,2,2-трифторвинил, m равно 2 и R6 представляет собой бром;
Соединения малононитрила формулы (Y), где R3 представляет собой 1,2, 2-трифторвинил, m равно 2 и R6 представляет собой фтор;
Соединения малононитрила формулы (Y), где R3 представляет собой 1,2,2-трифторвинил, m равно 2 и R6 представляет собой циано;
Соединения малононитрила формулы (Y), где R3 представляет собой 1,2,2-трифторвинил, m равно 2 и R6 представляет собой нитро;
Соединения малононитрила формулы (Y), где R3 представляет собой трифторметил, m равно 2 и R6 представляет собой трифторметил;
Соединения малононитрила формулы (Y), где R3 представляет собой трифторметил, m равно 2 и R6 представляет собой дифторметокси;
Соединения малононитрила формулы (Y), где R3 представляет собой трифторметил, m равно 2 и R6 представляет собой трифторметокси;
Соединения малононитрила формулы (Y), где R3 представляет собой трифторметил, m равно 2 и R6 представляет собой трифторметилтио;
Соединения малононитрила формулы (Y), где R3 представляет собой трифторметил, m равно 2 и R6 представляет собой 1,1,2,2-тетрафторэтокси;
Соединения малононитрила формулы (Y), где R3 представляет собой трифторметил, m равно 2 и R6 представляет собой хлор;
Соединения малононитрила формулы (Y), где R3 представляет собой трифторметил, m равно 2 и R6 представляет собой бром;
Соединения малононитрила формулы (Y), где R3 представляет собой трифторметил, m равно 2 и R6 представляет собой фтор;
Соединения малононитрила формулы (Y), где R3 представляет собой трифторметил, m равно 2 и R6 представляет собой циано;
Соединения малононитрила формулы (Y), где R3 представляет собой трифторметил, m равно 2 и R6 представляет собой нитро;
Соединения малононитрила формулы (Y), где R3 представляет собой пентафторэтил, m равно 2 и R6 представляет собой трифторметил;
Соединения малононитрила формулы (Y), где R3 представляет собой пентафторэтил, m равно 2 и R6 представляет собой дифторметокси;
Соединения малононитрила формулы (Y), где R3 представляет собой пентафторэтил, m равно 2 и R6 представляет собой трифторметокси;
Соединения малононитрила формулы (Y), где R3 представляет собой пентафторэтил, m равно 2 и R6 представляет собой трифторметилтио;
Соединения малононитрила формулы (Y), где R3 представляет собой пентафторэтил, m равно 2 и R6 представляет собой 1,1,2,2-тетрафторэтокси;
Соединения малононитрила формулы (Y), где R3 представляет собой пентафторэтил, m равно 2 и R6 представляет собой хлор;
Соединения малононитрила формулы (Y), где R3 представляет собой пентафторэтил, m равно 2 и R6 представляет собой бром;
Соединения малононитрила формулы (Y), где R3 представляет собой пентафторэтил, m равно 2 и R6 представляет собой фтор;
Соединения малононитрила формулы (Y), где R3 представляет собой пентафторэтил, m равно 2 и R6 представляет собой циано;
Соединения малононитрила формулы (Y), где R3 представляет собой пентафторэтил, m равно 2 и R6 представляет собой нитро;
Соединения малононитрила формулы (Y), где R3 представляет собой трифторметил, m равно 1 и R6 представляет собой трифторметил;
Соединения малононитрила формулы (Y), где R3 представляет собой трифторметил, m равно 2 и R6 представляет собой трифторметокси;
Соединения малононитрила формулы (Y), где R3 представляет собой трифторметил, m равно 1 и R6 представляет собой трифторметилтио;
Соединения малононитрила формулы (Y), где R3 представляет собой трифторметил, m равно 1 и R6 представляет собой хлор;
Соединения малононитрила формулы (Y), где R3 представляет собой трифторметил, m равно 1 и R6 представляет собой фтор;
Соединения малононитрила формулы (Y), где R3 представляет собой трифторметил, m равно 1 и R6 представляет собой циано;
Соединения малононитрила формулы (Y), где R3 представляет собой трифторметил, m равно 1 и R6 представляет собой нитро;
Соединения малононитрила формулы (Y), где R3 представляет собой трифторметил, m равно 3 и R6 представляет собой трифторметил;
Соединения малононитрила формулы (Y), где R3 представляет собой трифторметил, m равно 3 и R6 представляет собой трифторметокси;
Соединения малононитрила формулы (Y), где R3 представляет собой трифторметил, m равно 3 и R6 представляет собой трифторметилтио;
Соединения малононитрила формулы (Y), где R3 представляет собой трифторметил, m равно 3 и R6 представляет собой хлор;
Соединения малононитрила формулы (Y), где R3 представляет собой трифторметил, m равно 3 и R6 представляет собой фтор;
Соединения малононитрила формулы (Y), где R3 представляет собой трифторметил, m равно 3 и R6 представляет собой циано;
Соединения малононитрила формулы (Y), где R3 представляет собой трифторметил, m равно 3 и R6 представляет собой нитро;
Соединения малононитрила формулы (Y), где R3 представляет собой 2,2-дихлорвинил, m равно 1 и R6 представляет собой трифторметил;
Соединения малононитрила формулы (Y), где R3 представляет собой 2,2-дихлорвинил, m равно 1 и R6 представляет собой трифторметокси;
Соединения малононитрила формулы (Y), где R3 представляет собой 2,2-дихлорвинил, m равно 1 и R6 представляет собой трифторметилтио;
Соединения малононитрила формулы (Y), где R3 представляет собой 2,2-дихлорвинил, m равно 1 и R6 представляет собой хлор;
Соединения малононитрила формулы (Y), где R3 представляет собой 2,2-дихлорвинил, m равно 1 и R6 представляет собой фтор;
Соединения малононитрила формулы (Y), где R3 представляет собой 2,2-дихлорвинил, m равно 1 и R6 представляет собой циано;
Соединения малононитрила формулы (Y), где R3 представляет собой 2,2-дихлорвинил, m равно 1 и R6 представляет собой нитро;
Соединения малононитрила формулы (Y), где R3 представляет собой 2, 2-дифторвинил, m равно 1 и R6 представляет собой трифторметил;
Соединения малононитрила формулы (Y), где R3 представляет собой 2,2-дифторвинил, m равно 1 и R6 представляет собой трифторметокси;
Соединения малононитрила формулы (Y), где R3 представляет собой 2,2-дифторвинил, m равно 1 и R6 представляет собой трифторметилтио;
Соединения малононитрила формулы (Y), где R3 представляет собой 2,2-дифторвинил, m равно 1 и R6 представляет собой хлор;
Соединения малононитрила формулы (Y), где R3 представляет собой 2,2-дифторвинил, m равно 1 и R6 представляет собой фтор;
Соединения малононитрила формулы (Y), где R3 представляет собой 2,2-дифторвинил, m равно 1 и R6 представляет собой циано;
Соединения малононитрила формулы (Y), где R3 представляет собой 2, 2-дифторвинил, m равно 1 и R6 представляет собой нитро;
Соединения малононитрила формулы (Y), где R3 представляет собой 3,3,3-трифтор-1-пропенил, m равно 1 и R6 представляет собой трифторметил;
Соединения малононитрила формулы (Y), где R3 представляет собой 3,3,3-трифтор-1-пропенил, m равно 1 и R6 представляет собой трифторметокси;
Соединения малононитрила формулы (Y), где R3 представляет собой 3,3,3-трифтор-1-пропенил, m равно 1 и R6 представляет собой трифторметилтио;
Соединения малононитрила формулы (Y), где R3 представляет собой 3,3,3-трифтор-1-пропенил, m равно 1 и R6 представляет собой хлор;
Соединения малононитрила формулы (Y), где R3 представляет собой 3,3,3-трифтор-1-пропенил, m равно 1 и R6 представляет собой фтор;
Соединения малононитрила формулы (Y), где R3 представляет собой 3,3,3-трифтор-1-пропенил, m равно 1 и R6 представляет собой циано;
Соединения малононитрила формулы (Y), где R3 представляет собой 3,3,3-трифтор-1-пропенил, m равно 1 и R6 представляет собой нитро;
Соединения малононитрила формулы (Y), где R3 представляет собой 3,3, 3-трифтор-1-пропинил, m равно 1 и R6 представляет собой трифторметил;
Соединения малононитрила формулы (Y), где R3 представляет собой 3,3,3-трифтор-1-пропинил, m равно 1 и R6 представляет собой трифторметокси;
Соединения малононитрила формулы (Y), где R3 представляет собой 3,3,3-трифтор-1-пропинил, m равно 1 и R6 представляет собой трифторметилтио;
Соединения малононитрила формулы (Y), где R3 представляет собой 3,3,3-трифтор-1-пропинил, m равно 1 и R6 представляет собой хлор;
Соединения малононитрила формулы (Y), где R3 представляет собой 3,3,3-трифтор-1-пропинил, m равно 1 и R6 представляет собой фтор;
Соединения малононитрила формулы (Y), где R3 представляет собой 3,3,3-трифтор-1-пропинил, m равно 1 и R6 представляет собой циано;
Соединения малононитрила формулы (Y), где R3 представляет собой 3,3,3-трифтор-1-пропинил, m равно 1 и R6 представляет собой нитро;
Соединения малононитрила формулы (Y), где R3 представляет собой гептафторпропил, m равно 1 и R6 представляет собой трифторметил;
Соединения малононитрила формулы (Y), где R3 представляет собой гептафторпропил, m равно 1 и R6 представляет собой трифторметокси;
Соединения малононитрила формулы (Y), где R3 представляет собой гептафторпропил, m равно 1 и R6 представляет собой трифторметилтио;
Соединения малононитрила формулы (Y), где R3 представляет собой гептафторпропил, m равно 1 и R6 представляет собой хлор;
Соединения малононитрила формулы (Y), где R3 представляет собой гептафторпропил, m равно 1 и R6 представляет собой фтор;
Соединения малононитрила формулы (Y), где R3 представляет собой гептафторпропил, m равно 1 и R6 представляет собой циано;
Соединения малононитрила формулы (Y), где R3 представляет собой гептафторпропил, m равно 1 и R6 представляет собой нитро;
Соединения малононитрила формулы (Y), где R3 представляет собой пентафторэтил, m равно 1 и R6 представляет собой трифторметил;
Соединения малононитрила формулы (Y), где R3 представляет собой пентафторэтил, m равно 1 и R6 представляет собой трифторметокси;
Соединения малононитрила формулы (Y), где R3 представляет собой пентафторэтил, m равно 1 и R6 представляет собой трифторметилтио;
Соединения малононитрила формулы (Y), где R3 представляет собой пентафторэтил, m равно 1 и R6 представляет собой хлор;
Соединения малононитрила формулы (Y), где R3 представляет собой пентафторэтил, m равно 1 и R6 представляет собой фтор;
Соединения малононитрила формулы (Y), где R3 представляет собой пентафторэтил, m равно 1 и R6 представляет собой циано;
Соединения малононитрила формулы (Y), где R3 представляет собой пентафторэтил, m равно 1 и R6 представляет собой нитро;
Соединения малононитрила формулы (Y), где R3 представляет собой фторметил, m равно 1 и R6 представляет собой трифторметил;
Соединения малононитрила формулы (Y), где R3 представляет собой фторметил, m равно 1 и R6 представляет собой трифторметокси;
Соединения малононитрила формулы (Y), где R3 представляет собой фторметил, m равно 1 и R6 представляет собой трифторметилтио;
Соединения малононитрила формулы (Y), где R3 представляет собой фторметил, m равно 1 и R6 представляет собой хлор;
Соединения малононитрила формулы (Y), где R3 представляет собой фторметил, m равно 1 и R6 представляет собой фтор;
Соединения малононитрила формулы (Y), где R3 представляет собой фторметил, m равно 1 и R6 представляет собой циано;
Соединения малононитрила формулы (Y), где R3 представляет собой фторметил, m равно 1 и R6 представляет собой нитро;
Соединения малононитрила формулы (Y), где R3 представляет собой фторметил, m равно 2 и R6 представляет собой трифторметил;
Соединения малононитрила формулы (Y), где R3 представляет собой фторметил, m равно 2 и R6 представляет собой трифторметокси;
Соединения малононитрила формулы (Y), где R3 представляет собой фторметил, m равно 2 и R6 представляет собой трифторметилтио;
Соединения малононитрила формулы (Y), где R3 представляет собой фторметил, m равно 2 и R6 представляет собой хлор;
Соединения малононитрила формулы (Y), где R3 представляет собой фторметил, m равно 2 и R6 представляет собой фтор;
Соединения малононитрила формулы (Y), где R3 представляет собой фторметил, m равно 2 и R6 представляет собой циано;
Соединения малононитрила формулы (Y), где R3 представляет собой фторметил, m равно 2 и R6 представляет собой нитро;
Соединения малононитрила формулы (Y), где R3 представляет собой хлорметил, m равно 1 и R6 представляет собой трифторметил;
Соединения малононитрила формулы (Y), где R3 представляет собой хлорметил, m равно 1 и R6 представляет собой трифторметокси;
Соединения малононитрила формулы (Y), где R3 представляет собой хлорметил, m равно 1 и R6 представляет собой трифторметилтио;
Соединения малононитрила формулы (Y), где R3 представляет собой хлорметил, m равно 1 и R6 представляет собой хлор;
Соединения малононитрила формулы (Y), где R3 представляет собой хлорметил, m равно 1 и R6 представляет собой фтор;
Соединения малононитрила формулы (Y), где R3 представляет собой хлорметил, m равно 1 и R6 представляет собой циано;
Соединения малононитрила формулы (Y), где R3 представляет собой хлорметил, m равно 1 и R6 представляет собой нитро;
Соединения малононитрила формулы (Y), где R3 представляет собой 1,1-дифторэтил, m равно 2 и R6 представляет собой трифторметил;
Соединения малононитрила формулы (Y), где R3 представляет собой 1,1-дифторэтил, m равно 2 и R6 представляет собой трифторметокси;
Соединения малононитрила формулы (Y), где R3 представляет собой 1,1-дифторэтил, m равно 2 и R6 представляет собой трифторметилтио;
Соединения малононитрила формулы (Y), где R3 представляет собой 1,1-дифторэтил, m равно 2 и R6 представляет собой хлор;
Соединения малононитрила формулы (Y), где R3 представляет собой 1,1-дифторэтил, m равно 2 и R6 представляет собой фтор;
Соединения малононитрила формулы (Y), где R3 представляет собой 1,1-дифторэтил, m равно 2 и R6 представляет собой циано;
Соединения малононитрила формулы (Y), где R3 представляет собой 1,1-дифторэтил, m равно 2 и R6 представляет собой нитро;
Соединения малононитрила формулы (Y), где R3 представляет собой 1-(трифторметил)винил, m равно 1 и R6 представляет собой трифторметил;
Соединения малононитрила формулы (Y), где R3 представляет собой 1-(трифторметил)винил, m равно 1 и R6 представляет собой трифторметокси;
Соединения малононитрила формулы (Y), где R3 представляет собой 1-(трифторметил)винил, m равно 1 и R6 представляет собой трифторметилтио;
Соединения малононитрила формулы (Y), где R3 представляет собой 1-(трифторметил)винил, m равно 1 и R6 представляет собой хлор;
Соединения малононитрила формулы (Y), где R3 представляет собой 1-(трифторметил)винил, m равно 1 и R6 представляет собой фтор;
Соединения малононитрила формулы (Y), где R3 представляет собой 1-(трифторметил)винил, m равно 1 и R6 представляет собой циано;
Соединения малононитрила формулы (Y), где R3 представляет собой 1-(трифторметил)винил, m равно 1 и R6 представляет собой нитро;
Соединения малононитрила формулы (Y), где R3 представляет собой 1-(трифторметил)винил, m равно 2 и R6 представляет собой трифторметил;
Соединения малононитрила формулы (Y), где R3 представляет собой 1-(трифторметил)винил, m равно 2 и R6 представляет собой трифторметокси;
Соединения малононитрила формулы (Y), где R3 представляет собой 1-(трифторметил)винил, m равно 2 и R6 представляет собой трифторметилтио;
Соединения малононитрила формулы (Y), где R3 представляет собой 1-(трифторметил)винил, m равно 2 и R6 представляет собой хлор;
Соединения малононитрила формулы (Y), где R3 представляет собой 1-(трифторметил)винил, m равно 2 и R6 представляет собой фтор;
Соединения малононитрила формулы (Y), где R3 представляет собой 1-(трифторметил)винил, m равно 2 и R6 представляет собой циано;
Соединения малононитрила формулы (Y), где R3 представляет собой 1-(трифторметил)винил, m равно 2 и R6 представляет собой нитро.
Предпочтительными соединениями среди соединений (Y) являются соединения, где R6представляет собой галоген, циано, нитро, C1-C4(галоген)алкил, C1-C4(галоген)алкилокси или C1-C4(галоген)алкилтио; соединения, где n представляет собой число от 1 до 3 и по крайней мере один из R5 представляет собой галоген, циано, нитро, C1-C4(галоген)алкил, C1-C4(галоген)алкилокси или C1-C4 (галоген)алкилтио; или соединения, где R3представляет собой 1,2,2-трифторвинил, трифторметил, пентатфорэтил, 3,3, 3-трифтор-1-пропенил, гептафторпропил, 1,1-дифторэтил или 1-(трифторметил)винил.
Более предпочтительные соединения представляют собой соединения, где R6 представляет собой галоген, циано, нитро, C1-C4 фторалкил, C1-C4 фторалкилокси или C1-C4 фторалкилтио; соединения, где n представляет собой число от 1 до 3 и по крайней мере один из R5 представляет собой галоген, циано, нитро, C1-C4 фторалкил, C1-C4 фторалкилокси или C1-C4 фторалкилтио; или соединения, где m равно 2 и R3 представляет собой трифторметил.
Далее будут описаны способы получения настоящих соединений.
Настоящие соединения могут быть получены, например, с использованием следующих способов получения 1 или 2.
Способ получения 1
Данный способ представляет собой взаимодействие соединения (a) с соединением (b) в присутствии основания.

где R1, R2, R3, R5, R6, m и n являются такими, как определено выше, и Z представляет собой галоген, метансульфонил, трифторметансульфонил или толуолсульфонил.
Взаимодействие обычно проводят в растворителе. Растворитель, который можно использовать в реакции, может включать амиды кислот, такие как диметилформамид; простые эфиры, такие как диэтиловый эфир и тетрагидрофуран; органические соединения серы, такие как диметилсульфоксид и сульфолан; галогенированные углеводороды, такие как 1,2-дихлорэтан и хлорбензол; ароматические углеводороды, такие как толуол и ксилол; воду и их смеси.
Основание, которое можно использовать в реакции, может включать неорганические основания, такие как гидрид натрия, гидроксид натрия, гидроксид калия и карбонат калия; алкоксиды щелочных металлов, такие как метоксид натрия, этоксид натрия и трет-бутоксид калия; амиды щелочных металлов, такие как диизопропиламид лития; и органические основания, такие как 4-диметиламинопиридин, 1,4-диазабицикло[2,2,2]октан и 1,8-диазабицикло[5,4,0]-7-ундецен. Количество основания, используемого в реакции, обычно используется в соотношении от 1 до 10 молей на 1 моль соединения (a).
Температура реакции обычно колеблется в диапазоне от -20°C до 100°C.
Время реакции обычно колеблется от 1 до 24 часов.
Количество соединения (b), используемого в реакции, обычно используется в соотношении от 1 до 10 молей на 1 моль соединения (a).
После проведения взаимодействия реакционную смесь выливают в воду с последующими обычными процедурами обработки после реакции, включая экстракцию органическим растворителем и концентрирование, выделяя таким образом настоящие целевые соединения, которые могут быть очищены такими методами как хроматография или перекристаллизация.
Способ получения 2
Этот способ включает взаимодействие соединения (c) с соединением (d) в присутствии основания.

где R1, R2, R3, R5, R6, m, n и Z являются такими, как определено выше.
Взаимодействие обычно проводят в растворителе. Растворитель, который можно использовать в реакции, может включать амиды кислот, такие как диметилформамид; простые эфиры, такие как диэтиловый эфир и тетрагидрофуран; органические соединения серы, такие как диметилсульфоксид и сульфолан; галогенированные углеводороды, такие как 1,2-дихлорэтан и хлорбензол; ароматические углеводороды, такие как толуол и ксилол; воду и их смеси.
Основание, которое можно использовать в реакции, может включать неорганические основания, такие как гидрид натрия, гидроксид натрия, гидроксид калия и карбонат калия; алкоксиды щелочных металлов, такие как метоксид натрия, этоксид натрия и трет-бутоксид калия; амиды щелочных металлов, такие как диизопропиламид лития; и органические основания, такие как 4-диметиламинопиридин, 1,4-диазабицикло[2,2,2]октан и 1,8-диазабицикло[5,4,0]-7-ундецен. Количество основания, используемого в реакции, обычно используется в соотношении от 1 до 10 молей на 1 моль соединения (a).
Температура реакции обычно колеблется в диапазоне от -20°C до 100°C.
Время реакции обычно колеблется от 1 до 24 часов.
Количество соединения (b), используемого в реакции, обычно используется в соотношении от 1 до 10 молей на 1 моль соединения (a).
После проведения взаимодействия реакционную смесь выливают в воду с последующими обычными процедурами обработки после реакции, включая экстракцию органическим растворителем и концентрирование, выделяя таким образом целевые соединения, которые могут быть очищены такими методами как хроматография или перекристаллизация.
Соединение (а) может быть получено, например, путем показанным на следующей схеме.

где R1, R2, R5, R6 и n являются такими, как определено выше.
Стадия 1
Соединение (f) может быть получено взаимодействием соединения (e) с малононитрилом.
Взаимодействие обычно проводят в растворителе и в присутствии основания. Растворитель, который можно использовать в реакции, может включать амиды кислот, такие как N,N-диметилформамид; простые эфиры, такие как диэтиловый эфир и тетрагидрофуран; галогенированные углеводороды, такие как хлороформ, 1,2-дихлорэтан и хлорбензол; ароматические углеводороды, такие как толуол и ксилол; спирты, такие как метанол, этанол и изопропанол; и их смеси.
Основание, которое можно использовать в реакции, может включать гидроксид тетрабутиламмония. Количество основания, используемого в реакции, обычно используется в соотношении от 0,01 до 0,5 моля на 1 моль соединения (е).
Количество малононитрила, используемое в реакции, обычно используется в соотношении от 1 до 10 молей на 1 моль соединения (е).
Температура реакции обычно колеблется в диапазоне от -20°C до 200°C.
Время реакции обычно колеблется от 1 до 24 часов.
Взаимодействие при необходимости можно проводить при удалении из реакционной системы воды, которая генерируется в реакции.
После реакции реакционную смесь выливают в воду с последующими обычными процедурами обработки, включая экстракцию органическим растворителем и концентрирование, выделяя таким образом целевые настоящие соединения, которые могут быть очищены такими методами как хроматография или перекристаллизация.
Стадия 2
(1) Случай, где R2 представляет собой заместитель, отличающийся от водорода и циано:
Соединение (a) может быть получено взаимодействием соединения (f) с металлоорганическим соединением.
Взаимодействие обычно проводят в растворителе и, при необходимости, в присутствии соли меди.
Растворитель, который можно использовать при реакции, может включать простые эфиры, такие как диэтиловый эфир и тетрагидрофуран; ароматические углеводороды, такие как толуол и ксилол; и их смеси.
Металлоорганическое соединение, которое можно использовать в реакции, может включать органические соединения магния, такие как метилмагний йодид, этилмагний бромид, изопропилмагний бромид, винилмагний бромид, этинилмагний бромид и диметилмагний; органические соединения лития, такие как метиллитий; органические соединения цинка, такие как диэтилцинк; и органические соединения меди, такие как трифторметил медь. Металлоорганические соединение обычно используют в реакции в соотношении от 1 до 10 молей на 1 моль соединения (f).
Соль меди, которую можно использовать в реакции, может включать йодид меди (I) и бромид меди (I). Количество медной соли, используемое в реакции, обычно не превышает 1 моля на 1 моль соединения (f).
Температура реакции обычно колеблется в диапазоне от -20°C до 100°C.
Время реакции обычно составляет от 1 до 24 часов.
После реакции реакционную смесь выливают в воду с последующими обычными процедурами обработки, включая экстракцию органическим растворителем и концентрирование, выделяя таким образом целевые настоящие соединения, которые могут быть очищены такими методами как хроматография или перекристаллизация.
(2) Случай, где R2 представляет собой водород:
Соединение (a) может быть получено восстановлением соединения (f).
Восстановление обычно проводят в растворителе.
Растворитель, который можно использовать при реакции, может включать простые эфиры, такие как диэтиловый эфир и тетрагидрофуран; ароматические углеводороды, такие как толуол и ксилол; спирты, такие как метанол, этанол и пропанол; воду и их смеси.
Восстановитель, который можно использовать в реакции, может включать боргидрид натрия. Количество используемого в реакции восстановителя обычно составляет от 0,25 до 2 молей на 1 моль соединения (f).
Время реакции обычно колеблется от минуты до 24 часов.
Температура реакции обычно колеблется в диапазоне от 0°C до 50°C.
После реакции реакционную смесь выливают в воду с последующими обычными процедурами обработки, включая экстракцию органическим растворителем и концентрирование, выделяя таким образом целевые соединения, которые могут быть очищены такими методами как хроматография или перекристаллизация.
(3) Случай, где R2 представляет собой циано:
Соединение (a) может быть получено взаимодействием соединения (f) с цианидом.
Растворитель, который можно использовать при реакции, может включать простые эфиры, такие как диэтиловый эфир и тетрагидрофуран; ароматические углеводороды, такие как толуол и ксилол; и их смеси.
Цианид, который можно использовать в реакции, может включать цианид тетрабутиламмония. Количество цианида, используемого в реакции, обычно составляет от 1 до 10 молей на 1 моль соединения (f).
Температура реакции обычно колеблется в диапазоне от -20°C до 100°C.
Время реакции обычно составляет от 1 до 24 часов.
После реакции реакционную смесь выливают в воду с последующими обычными процедурами обработки, включая экстракцию органическим растворителем и концентрирование, выделяя таким образом целевые соединения, которые могут быть очищены такими методами как хроматография или перекристаллизация.
Вредители (сельского хозяйства), против которых настоящие соединения проявляют подавляющую активность, могут включать насекомых-вредителей, клещей-вредителей и нематод-вредителей, конкретными примерами которых являются следующие:
Полужесткокрылые (Hemiptera):
Дельфациды (Delphacidae), такие как Laodelphax striatellus, Nilaparvata lugens и Sogatella furcifera;
Дельтоцефалиды (Deltocephalidae), такие как Nephotettix cincticeps и Nephotettix virescens;
Тли (Aphididae), такие как Aphis gossypii и Myzus persicae;
Pentatomidae, такие как Nezara antennata, Riptortus clavetus, Eysarcoris lewisi, Eysarcoris parvus, Plautia stali и Halyomorpha misia;
Алейродиды (белокрылки, Aleyrodidae), такие как Trialeurodes vaporariorum и Bemisia argentifolii;
Щитовки (Coccidae), такие как Aonidiella aurantii, Comstockaspis perniciosa, Unaspis citri, Ceroplastes rubens и Icerya purchasi;
Tingidae;
Psyllidae;
Чешуекрылые (Lepidoptera);
Огневки (Pyralidae), такие как Chilo suppressalis, Cnaphalocrocis medinalis, Notarcha derogata и Plodia interpunctella;
Совки (Noctuidae), такие как Spodoptera litura, Pseudaletia separata, Thoricoplusia spp., Heliothis spp., и Helicoverpa spp.;
Белянки (Pieridae), такие как Pieris rapae;
Листовертки (Tortricidae), такие как Adoxophyes spp., Grapholita molesta и Cydia pomonella;
Carposinidae, такие как Carposina niponensis;
Lyonetiidae, такие как Lyonetia spp.;
Lymantriidae, такие как Lyamantria spp. и Euproctis spp.;
Yponomentidae, такие как Plutella xylostella;
Gelechiidae, такие как Pectinophora gossypiella;
Arctiidae, такие как Hyphantria cunea;
Tineidae, такие как Tinea translucens и Tineola bisselliella;
Двукрылые:
Calicidae, такие как Culex pipiens pallens, Culex tritaeniorhynchus и Culex quinquefasciatus;
Aedes spp., такие как Aedes aegypti и Aedes albopictus;
Anopheles spp., такие как Anopheles sinensis;
Хирономиды (комары-дергунцы, Chironomidae);
Мухи (Muscidae), такие как Musca domestica и Muscina stabulans;
Calliphoridae;
Sarcophagidae;
Fanniidae;
Anthomyiidae, такие как Delia platura и Delia antiqua;
Tephritidae;
Дрозофилы (Drosophilidae);
Psychodidae;
Simuliidae;
Tabanidae;
Stomoxyidae;
Agromyzidae;
Жуки (Coleoptera):
Жуки-блошки (Diabrotica spp.), такие как Diabrotica virgifera и Diabrotica undecimpunctata howardi;
Пластинчатоусые жуки (Scarabaeidae), такие как Anomala cuprea и Anomala rufocuprea;
Curculionidae, такие как Sitophilus zeamais, Lissorhoptrus oryzophilus и Callosobruchuys chienensis;
Tenebrionidae, такие как Tenebrio molitor и Tribolium castaneum;
Chrysomelidae, такие как Oulema oryzae, Aulacophora femoralis, Phyllotreta striolata и Leptinotarsa decemlineata;
Anobiidae;
Epilachna spp., такие как Epilachna vigintioctopunctata;
Lyctidae;
Bostrychidae;
Cerambycidae;
Paederus fuscipes;
Dictyoptera:
Таракан рыжий (Blattella germanica), Periplaneta fuliginosa, таракан американский (Periplaneta americana), Periplaneta brunnea и таракан черный (Blatta orientalis);
Thysanoptera:
Thrips palmi, Thrips tabaci, Frankliniella occidentalis, Frankliniella intonsa;
Перепончатокрылые (Hymenoptera):
Formicidae;
Vespidae;
Bethylidae;
Tenthredinidae, такие как Athalia japonica;
Orthoptera:
Gryllotalpidae;
Acrididae;
Siphonaptera:
Ctenocephalides felis, Ctenocephalides canis, Pulex irritans, Xenopsylla cheopis;
Anoplura:
Pediculus humanus corporis, Phthirus pubis, Haematopinus eurysternus и Dalmalinia ovis;
Isoptera:
Reticulitermes speratus и Coptotermes formosanus,
Клещи (Acarina):
Tetranychidae, такие как Tetranychus urticae, Tetranychus kanzawai, Panonychus citri, Panonychus ulmi и Oligonychus spp.;
Eriophyidae, такие как Aculops pelekassi и Aculus schlechtendali;
Tarsonemidae, такие как Polyphagotarsonemus latus;
Tenuipalpidae;
Tuckerellidae;
Ixodidae, такие как Haemaphysalis longicornis, Haemaphysalis flava, Dermacentor taiwanicus, Ixodes ovatus, Ixodes persulcatus и Boophilus microplus,
Клещи (Acaridae), такие как Tyrophagus putrescentiae,
Epidermoptidae, такие как Dermatophagoides farinae и Dermatophagoides ptrenyssnus,
Cheyletidae, такие как Cheyletus eruditus, Cheyletus malaccensis и Cheyletus moorei,
Dermanyssidae;
Пауки (Arachnida):
Chiracanthium japonicum и Latrodectus hasseltii,
Губоногие (Chilopoda):
Thereuonema hilgendorfi и Scolopendra subspinipes,
Diplopoda:
Oxidus gracilis и Nedyopus tambanus,
Isopoda:
Armadillidium vulgare;
Брюхоногие (Gastropoda):
Limax marginatus и Limax flavus,
Нематоды (Nematoda):
Pratylenchus coffeae, Pratylenchus fallax, Heterodera glycines, Globodera rostochiensis, Meloidogyne hapla и Meloidogyne incognita.
Когда настоящие соединения используют в качестве активных ингредиентов пестицидных композиций, их можно использовать как таковые без добавления каких-либо других ингредиентов. Однако обычно их используют в смеси с твердыми носителями, жидкими носителями и/или газообразными носителями и, при необходимости, с добавлением вспомогательных веществ, таких как поверхностно-активные вещества, с последующим получением композиций в виде различных форм, таких как эмульгируемые концентраты, масляные составы, текучие составы, дусты, смачиваемые порошки, гранулы, составы в виде паст, микрокапсулированные составы, пены, аэрозольные составы, газообразные составы на основе диоксида углерода, таблетки или составы на основе смолы. Такие составы можно использовать путем переработки в ядовитые приманки, шампуни, спирали от комаров, электрические подставки от комаров, дымовые устройства, фумиганты или пластины.
В таких составах настоящие соединения обычно содержатся в количестве от 0,1% до 95% по весу.
Твердый носитель, который можно использовать в композиции, может включать следующие материалы в виде тонкодисперсного порошка или в гранулированном виде: глины (например, каолиновую глину, диатомовую землю, бентонит, глину Фубазами (Fubasami), кислую глину); тальк, керамические и другие неорганические минералы (например, серицит, кварц, серу, активированный уголь, карбонат кальция, гидрированный диоксид кремния); и химические удобрения (например, сульфат аммония, фосфат аммония, нитрат аммония, хлорид аммония, мочевину).
Жидкий носитель может включать ароматические или алифатические углеводороды (например, ксилол, толуол, алкилнафталин, фенилксилилэтан, керосин, светлые масла, гексан, циклогексан); галогенированные углеводороды (например, хлорбензол, дихлорметан, дихлорэтан, трихлорэтан); спирты (например, метанол, этанол, изопропиловый спирт, бутанол, гексанол, этиленгликоль); простые эфиры (например, диэтиловый эфир, диметиловый эфир этиленгликоля, монометиловый эфир диэтиленгликоля, моноэтиловый эфир диэтиленгликоля, монометиловый эфир пропиленгликоля, тетрагидрофуран, диоксан); сложные эфиры (например, этилацетат, бутилацетат); кетоны (например, ацетон, метилэтилкетон, метилизобутилкетон, циклогексанон); нитрилы (ацетонитрил, изобутиронитрил); сульфоксиды (например, диметилсульфоксид); амиды кислот (например, N,N-диметилформамид, N,N-диметилацетамид); растительные масла (например, соевое масло и хлопковое масло); растительные эфирные масла (например, апельсиновое масло, иссоповое масло, лимонное масло) и воду.
Газообразный носитель может включать газообразный бутан, газообразный фреон, ожиженный нефтяной газ (LPG), диметиловый эфир и диоксид углерода.
Поверхностно-активное вещество может включать алкилсульфатные соли; соли алкилсульфоновых кислот, соли алкиларилсульфоновых кислот; алкилариловые простые эфиры и их полиоксиэтиленовые производные; простые эфиры полиэтиленгликоля; сложные эфиры многоатомных спиртов и производные сахарных спиртов.
Другие вспомогательные вещества могут включать связующие агенты, диспергирующие агенты и стабилизаторы, конкретными примерами которых являются казеин, желатин, полисахариды (например, крахмал, аравийская камедь, производные целлюлозы, альгиновая кислота), производные лигнина, бентонит, сахара, синтетические водорастворимые полимеры (например, поливиниловый спирт, поливинилпирролидон, полиакриловая кислота), РАР (фосфат изопропиловой кислоты), BHT (2,6-ди-трет-бутил-4-метилфенол), BHA (смеси 2-трет-бутил-4-метоксифенола и 3-трет-бутил-4-метоксифенола), растительные масла, минеральные масла, жирные кислоты и сложные эфиры жирных кислот.
Материал основы для составов на основе смолы может включать полимеры винилхлорида и полиуретаны. Такие материалы основы могут включать, при необходимости, пластификаторы, такие как эфиры фталевой кислоты (например, диметилфталат, диоктилфталат), эфиры адипиновой кислоты и стеариновую кислоту. Составы на основе смолы могут быть получены смешиванием соединений с материалом основы с помощью обычного пластикатора и последующим формованием литьем под давлением, экструзией или прессованием. Они могут быть переработаны, при необходимости, путем последующего формования и нарезания на составы на основе смолы, имеющие различную форму, например в виде пластин, пленок, ленты, сетей или ниток. Такие составы на основе смолы перерабатывают, например, в виде ошейников для животных, ушных клипс для животных, составов в виде листов, нитей или шестов-приманок для применения в садоводстве.
Материал основы для ядовитых приманок может включать зерновые порошки, растительные масла, сахара и кристаллическую целлюлозу. При необходимости могут быть добавлены дополнительные агенты, включая антиоксиданты, такие как дибутилгидрокситолуол и нордигидрогваяретовая кислота; консерванты, такие как дегидроуксусная кислота, агенты для предотвращения поедания детьми и домашними животными, такие как порошок жгучего перца; и ароматизаторы, привлекающие насекомых, такие как сырный ароматизатор, луковый ароматизатор и арахисовое масло.
Пестицидные композиции по настоящему изобретению могут использоваться, например, путем непосредственного нанесения на вредителей и/или посредством нанесения на места обитания вредителей (например, на стволы деревьев, тела животных, почву).
Когда пестицидные композиции по настоящему изобретению используются для борьбы с вредителями в сельском хозяйстве и лесоводстве, применяемое количество обычно составляет от 1 до 10000 г/га, предпочтительно от 10 до 500 г/га. Составы, такие как эмульгируемые концентраты, смачиваемые порошки, текучие порошки и микрокапсулированные составы, обычно используют после разбавления водой таким образом, чтобы они имели концентрацию активного ингредиента от 1 до 1000 частей на миллион, тогда как такие составы как дусты и гранулы обычно используют как таковые. Данные составы могут быть непосредственно нанесены на растения для защиты от вредителей. Данные составы также могут быть введены в почву для борьбы с вредителями, обитающими в почве, или также могут быть нанесены на грядки перед посадкой или нанесены на ямы для посадки или нижнюю часть растений при посадке. Кроме того, пестицидные композиции по настоящему изобретению в виде листов, которые могут использоваться с помощью таких способов, при которых листовые составы оборачивают вокруг растений, размещают поблизости от растений или размещают на поверхности почвы у нижней части растений.
Когда пестицидные композиции по настоящему изобретению используют для предотвращения эпидемий, их применяемое количество из расчета на количество активного ингредиента обычно составляет от 0,001 до 10 мг/м3 для объемного применения или от 0,001 до 100 мг/м2 для применения на плоскости. Составы, такие как эмульгируемые концентраты, смачиваемые порошки и текучие порошки обычно используют после разбавления водой до концентрации активного ингредиента от 0,01 до 10000 частей на миллион, тогда как такие составы, как масляные составы, аэрозоли, дымящие препараты или ядовитые приманки обычно используют как таковые.
Когда пестицидные композиции по настоящему изобретению используют для борьбы с внешними паразитами на домашних животных, таких как крупный рогатый скот, овцы, козы и домашняя птица, или на небольших животных, таких как собаки, кошки, крысы и мыши, их можно применять в ветеринарии с использованием хорошо известных способов. Так, в качестве конкретных способов применения для системного контроля введение осуществляют, например, с использованием таблеток, добавок к корму, в виде суппозиториев или инъекций (например, внутримышечных, подкожных, внутривенных, внутрибрюшинных) или для несистемного контроля, например, используют распыление, обработку орошением или обработку «нанесением пятен» с использованием масляного состава или водного раствора, купание животного с использованием шампуня или одевание животному ошейника или ушной клипсы, полученной из состава на основе смолы. Количество настоящих соединений при введении в тело животного обычно колеблется в диапазоне от 0,1 до 1000 мг на 1 кг веса каждого животного.
Пестицидные композиции по настоящему изобретению также могут использоваться в смеси или в сочетании с другими инсектицидами, нематоцидами, акарицидами, бактерицидами, фунгицидами, гербицидами, регуляторами роста растений, синергистами, удобрениями, почвенными кондиционерами, кормом для животных и тому подобным.
Примеры инсектицидов и акарицидов включают фосфорорганические соединения, такие как фенитротион [O,О-диметил О-(3-метил-4-нитрофенил)фосфортиоат], фентион [O, О-диметил О-(3-метил-4-(метилтио)фенил)фосфортиоат], диазинон [О,О-диэтил О-2-изопропил-6-метилпиримидин-4-илфосфортиоат], хлорпирифос [O,O-диэтил О-3,5,6-трихлор-2-пиридилфосфортиоат], DDVP [2, 2-дихлорвинилдиметилфосфат], цианофос [О-4-цианофенил O,О-диметилфосфортиоат], диметоат [O,О-диметил S-(N-метилкарбамоилметил)дитиофосфат], фентоат [этил 2-диметоксифосфинотиоилтио(фенил)ацетат], малатион [диэтил(диметоксифосфинотиоилтио)сукцинат] и азинфосметил [S-3,4-дигидро-4-оксо-1,2,3-бензотриазин-3-илметил O,О-диметилфосфордитиоат]; карбаматные соединения, такие как BPMC (2-втор-бутилфенилметилкарбамат), бенфракарб [этил N-[2,3-дигидро-2,2-диметилбензофуран-7-илоксикарбонил(метил)аминотио]-N-изопропил-β-аланинат], пропоксур [2-изопропоксифенил N-метилкарбамат] и карбарил [1-нафтил N-метилкарбамат]; пиретроидные соединения, такие как этофенпрокс [2-(4-этоксифенил)-2-метилпропил-3-феноксибензиловый простой эфир], фенвалерат [(RS)-α -циано-3-феноксибензил (RS)-2-(4-хлорфенил)-3-метилбутират], эсфенвалерат [(S)-α-циано-3-феноксибензил (S)-2-(4-хлорфенил)-3-метилбутират], фенпропатрин [(RS)-α-циано-3-феноксибензил 2,2, 3,3-тетраметилциклопропанкарбоксилат], циперметрин [(RS)-α-циано-3-феноксибензил (1RS)-цис,транс-3-(2,2-дихлорвинил)-2,2-диметилциклопропанкарбоксилат], перметрин [3-феноксибензил (1RS)-цис, транс-3-(2,2-дихлорвинил)-2,2-диметилциклопропанкарбоксилат], цигалотрин [(RS)-α-циано-3-феноксибензил (Z)-(1RS)-цис-3-(2-хлор-3,3,3-трифторпроп-1-енил)-2,2-диметилциклопропанкарбоксилат], делтаметрин [(S)-α-циано-3-феноксибензил (1R)-цис-3-(2,2-дибромвинил)-2,2-диметилциклопропанкарбоксилат], циклопротрин [(RS)-α-циано-3-феноксибензил (RS)-2, 2-дихлор-1-(4-этоксифенил)циклопропанкарбоксилат], флувалинат [α-циано-3-феноксибензил N-(2-хлор-α,α,α-трифтор-п-толил)-D-валинат], бифентрин [2-метилбифенил-3-илметил (Z)-(1RS)-цис-3-(2-хлор-3,3,3-трифторпроп-1-енил)-2,2-диметилциклопропанкарбоксилат], 2-метил-2-(4-бромдифторметоксифенил)пропил 3-феноксибензиловый простой эфир, тралометрин [(S)-α -циано-3-феноксибензил (1R-цис)-3-{(1RS)(1,2,2,2-тетрабромэтил)}-2,2-диметил-циклопропанкарбоксилат], силафлуофен [(4-этоксифенил)-{3-(4-фтор-3-феноксифенил)пропил}диметилсилан], d-фенотрин [3-феноксибензил (1R-цис,транс)хризантемат], цифенотрин [(RS)-α-циано-3-феноксибензил (1R-цис,транс)хризантемат], d-резметрин [5-бензил-3-фурилметил (1R-цис,транс)хризантемат], акринатрин [(S)-α-циано-3-феноксибензил (1R,цис-(Z))-2,2-диметил-3-{3-оксо-3-(1,1,1,3,3,3-гексафторпропилокси)пропенил}циклопропанкарбоксилат], цифлутрин [(RS)-α-циано-4-фтор-3-феноксибензил 3-(2, 2-дихлорвинил)-2,2-диметилциклопропанкарбоксилат], тефлутрин [2,3,5,6-тетрафтор-4-метилбензил (1RS-цис(Z))-3-(2-хлор-3,3,3-трифторпроп-1-енил)-2,2-диметилциклопропанкарбоксилат], трансфлутрин [2,3,5, 6-тетрафторбензил (1R-транс)-3-(2,2-дихлорвинил)-2,2-диметилциклопропанкарбоксилат], тетраметрин [3,4,5,6-тетрагидрофталимидометил (1RS)-цис,транс-хризантемат], аллетрин [(RS)-3-аллил-2-метил-4-оксоциклопент-2-енил (1RS)-цис,транс-хризантемат], праллетрин [(S)-2-метил-4-оксо-3-(2-пропинил)циклопент-2-енил (1R)-цис,транс-хризантемат], эмпентрин [(RS)-1-этинил-2-метил-2-пентенил (1R)-цис,транс-хризантемат], имипротрин [2,5-диоксо-3-(проп-2-инил)имидазолидин-1-илметил (1R)-цис,транс-2,2-диметил-3-(2-метилпроп-1-енил)циклопропанкарбоксилат], d-фураметрин [5-(2-пропинил)фурфурил (1R)-цис,транс-хризантемат] и 5-(2-пропинил)фурфурил 2,2,3,3-тетраметилциклопропанкарбоксилат; неоникотиноидные производные, такие как N-циано-N'-метил-N'-(6-хлор-3-пиридилметил)ацетамидин; нитенпирам [N-(6-хлор-3-пиридилметил)-N-этил-N'-метил-2-нитровинилидендиамин]; тиаклоприд [1-(2-хлор-5-пиридилметил)-2-цианоиминотиазолин]; тиаметоксам [3-((2-хлор-5-тиазолил)метил)-5-метил-4-нитроимино-тетрагидро-1,3,5-оксадиазин], 1-метил-2-нитро-3-((3-тетрагидрофурил)метил)гуанидин и 1-(2-хлор-5-тиазолил)метил-3-метил-2-нитрогуанидин; производные нитроиминогексагидро-1,3,5-триазина; хлорированные углеводороды, такие как эндосульфан [оксид 6,7,8,9,10,10-гексахлор-1,5,5a,6,9,9a-гексагидро-6,9-метано-2,4,3-бензодиоксатиепина], γ -BHC [1,2,3,4,5,6-гексахлорциклогексан] и 1,1-бис(хлорфенил)-2,2,2-трихлорэтанол; соединения бензоилфенилмочевины, такие как хлорфлуазурон [1-(3, 5-дихлор-4-(3-хлор-5-трифторметилпиридин-2-илокси)фенил)-3-(2,6-дифторбензоил)мочевина], тефлубензурон [1-(3,5-дихлор-2,4-дифторфенил)-3-(2,6-дифторбензоил)мочевина] и флуфеноксурон [1-(4-(2-хлор-4-трифторметилфенокси)-2-фторфенил)-3-(2,6-дифторбензоил)мочевина]; ювенильный гормон, такой как соединения, такие как пирипроксифен [4-феноксифенил-2-(2-пиридилокси)пропиловый эфир], метопрен [изопропил (2E,4E)-11-метокси-3,7,11-триметил-2,4-додекадиеноат] и гидропрен [этил (2E,4E)-11-метокси-3,7,11-триметил-2,4-додекадиеноат]; производные тиомочевины, такие как диафентиурон [N-(2, 6-диизопропил-4-феноксифенил)-N'-трет-бутилкарбодиимид]; соединения фенилпиразола; 4-бром-2-(4-хлорфенил)-1-этоксиметил-5-трифторметилпиррол-3-карбонитрил [хлорфенаприл]; метоксадиазон [5-метокси-3-(2-метоксифенил)-1,3,4-оксадиазол-2(3H)-он], бромпропилат [изопропил 4,4'-дибромбензилат], тетрадифон [4-хлорфенил-2,4,5-трихлорфенилсульфон], хинометионат [S,S-6-метилхиноксалин-2, 3-диилдитиокарбонат], пиридабен [2-трет-бутил-5-(4-трет-бутилбензилтио)-4-хлорпиридазин-3(2H)-он], фенпироксимат [трет-бутил (E)-4-[(1,3-диметил-5-феноксипиразол-4-ил)метиленамино-оксиметил]бензоат], тебуфенпирад [N-(4-трет-бутилбензил)-4-хлор-3-этил-1-метил-5-пиразолкарбоксамид], полинактиновые комплексы [тетранактин, динактин и тринактин], пиримидифен [5-хлор-N-[2-{4-(2-этоксиэтил)-2, 3-диметилфенокси}этил]-6-этилпиримидин-4-амин], милбемектин, абамектин, ивермектин и азадирахтин [AZAD]. Примеры синергистов включают бис-(2,3,3,3-тетрахлорпропиловый)эфир (S-421), N-(2-этилгексил)бицикло[2,2,1]гепт-5-ен-2,3-дикарбоксимид (MGK-264) и α-[2-(2-бутоксиэтокси)этокси]-4,5-метилендиокси-2-пропилтолуол (пиперонил бутоксид).
Далее настоящее изобретение будет проиллюстрировано следующими примерами получения, примерами составов и примерами испытаний, однако, настоящее изобретение не ограничено только данными примерами. В примерах композиций, номера настоящих соединений являются такими, как показано ниже в таблице 1.
Далее будут описаны некоторые примеры получения настоящих соединений.
Пример получения 1
Первоначально, 0,50 г (4-хлорбензил)малононитрила растворяли в 10 мл N,N-диметилформамида, к которому добавляли 0,16 г гидрида натрия (60% в масле) при перемешивании при охлаждении льдом. После прекращения выделения газообразного водорода добавляли по каплям при перемешивании при охлаждении льдом 0,48 мл 2,3-дихлорпропена с последующим перемешиванием при комнатной температуре в течение 5 часов. Затем к реакционной смеси добавляли 10%-ную соляную кислоту, после чего смесь экстрагировали диэтиловым эфиром. Органический слой последовательно промывали 10%-ной соляной кислотой, насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, а затем концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле, получая 0,19 г 2-(4-хлорбензил)-2-(2-хлор-2-пропенил)малононитрила (настоящее соединение (1)).
Выход: 27%;
Т.пл.: 85,5°С.
Пример получения 2
С использованием 0,50 г (4-(трифторметилтио)бензил)малононитрила, 5 мл N,N-диметилформамида, 90 мг гидрида натрия (60% в масле) и 0,26 г 2,3-дихлорпропена и в соответствии со способом, описанным в примере получения 1, получали 0,30 г 2-(хлор-2-пропенил)-2-(4-трифторметилтио)бензил)малононитрила (настоящее соединение (2)).
Выход: 47%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 3,05 (2Н, с), 3,32 (2Н, с), 5,58-5,66 (2Н, м), 7,48 (2Н, д), 7,73 (2Н, д).
Пример получения 3
С использованием 0, 1 г бензилмалононитрила, 5 мл N,N-диметилформамида, 0,073 г карбоната цезия и 0,1 г 2,2,2-трифторэтил-трифторметансульфоната и в соответствии со способом, описанным в примере получения 1, получали 0, 057 г 2-бензил-2-(2,2,2-трифторэтил)малононитрила (настоящее соединение (3)).
Выход: 40%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,76 (2Н, кв), 3, 36 (2Н, с), 7,37-7,47 (5Н, м).
Пример получения 4
С использованием 0,1 г бензилмалононитрила, 5 мл N,N-диметилформамида, 0,010 г гидрида натрия (60% в масле) и 0,04 г 4-бром-1,1,2-трифтор-1-бутена и в соответствии со способом, описанным в примере получения 1, получали 0,042 г 2-бензил-2-(3,4,4-трифтор-3-бутенил)малононитрила (настоящее соединение (4)).
Выход: 57%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,17-2,23 (2Н, м), 2,64-2,78 (2Н, м), 3,27 (2Н, с), 7,34-7,45 (5Н, м).
Пример получения 5
С использованием 0,3 г (4-(трифторметокси)бензил)малононитрила, 5 мл N,N-диметилформамида, 0,073 г карбоната цезия и 0,35 г 2,2,3,3,3-пентафторпропил-трифторметансульфоната и в соответствии со способом, описанным в примере получения 1, получали 0,12 г 2-(2,2,3,3,3-пентафторпропил)-2-(4-(трифторметокси)бензил)малононитрила (настоящее соединение (5)).
Выход: 29%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,76 (2Н, т), 3,38 (2Н, с), 7,30 (2Н, д), 7,46 (2Н, д).
Пример получения 6
С использованием 0,3 г (3,3,3-трифторпропил)малононитрила, 3 мл N,N-диметилформамида, 0,08 г гидрида натрия (60% в масле) и 0,4 г 4-ацетилбензилбромиида и в соответствии со способом, описанным в примере получения 1, получали 0,43 г 2-(4-ацетилбензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (6)).
Выход: 78%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,22-2,34 (2Н, м), 2,51-2,61 (2Н, м), 2,67 (3Н, с), 3,42 (2Н, с), 7,50 (2Н, д), 7,97 (2Н, д).
Пример получения 7
С использованием 0,3 г (2, 6-дихлор-4-(трифторметил)бензил)малононитрила, 5 мл N,N-диметилформамида, 0,05 г гидрида натрия (60% в масле) и 0,20 г 1-бром-3,3,3-трифторпропана и в соответствии со способом, описанным в примере получения 1, получали 0,21 г 2-(2,6-дихлор-4-(трифторметил)бензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (7)).
Выход: 53%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,41-2,49 (2Н, м), 2,52-2,63 (2Н, м), 3,79 (2Н, с), 7,68 (2Н, с).
Пример получения 8
С использованием 0,3 г (4-(трифторметил)бензил)малононитрила, 6 мл N,N-диметилформамида, 0,60 г гидрида натрия (60% в масле) и 0,38 г 4-иод-1,1,1,2,2-пентафторбутана и в соответствии со способом, описанным в примере получения 1, получали 0,30 г 2-(3,3,4,4,4-пентафторбутил)-2-(4-(трифторметил)бензил)малононитрила (настоящее соединение (8)).
Выход: 54%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,27-2,62 (4Н, м), 3,86 (2Н, с), 7,53 (2Н, д), 7,71 (2Н, д).
При этом также получали 15 мг 2-(3,4,4, 4-тетрафтор-2-бутенил)-2-(4-(трифторметил)бензил)малононитрила (настоящее соединение (48)) в качестве соединения с низкой полярностью.
Выход: 3%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,96 (2Н, д), 3,30 (2Н, с), 5,78 (1Н, дт), 7,53 (2Н, д), 7,71 (2Н, д).
Пример получения 9
С использованием 3,86 г (4-бромбензил)малононитрила, 25 мл N,N-диметилформамида, 0,72 г гидрида натрия (60% в масле) и 3,20 г 1-бром-3,3,3-трифторпропана и в соответствии со способом, описанным в примере получения 1, получали 4,61 г 2-(4-бромбензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (9)).
Выход: 85%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,18-2,27 (2Н, м), 2,45-2,60 (2Н, м), 3,22 (2Н, с), 7,26 (2Н, д), 7,57 (2Н, д).
Пример получения 10
С использованием 0,3 г (4-(трифторметокси)бензил)малононитрила, 10 мл N,N-диметилформамида, 0,06 г гидрида натрия (60% в масле) и 0,38 г 4-йод-1,1,1,2,2-пентафторбутана и в соответствии со способом, описанным в примере получения 1, получали 0,15 г 2-(3,3,4,4,4-пентафторбутил)-2-(4-(трифторметокси)бензил)малононитрила (настоящее соединение (10)).
Выход: 28%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,21-2,62 (4Н, м), 3,30 (2Н, с), 7,27 (2Н, д), 7,43 (2Н, д).
Пример получения 11
В атмосфере азота 0,40 г 2-(2-формилэтил)-2-(4-(трифторметил)бензил)малононитрила растворяли в 10 мл трихлорфторметана, к которому медленно добавляли по каплям 0,20 мл трифторида диэтиламиносеры и затем перемешивали в течение 30 минут. Затем к реакционной смеси добавляли воду, после чего смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии, получая 0,15 г 2-(3,3-дифторпропил)-2-(4-(трифторметил)бензил)малононитрила (настоящее соединение (11)).
Выход: 34%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,19-2,34 (4Н, м), 3,31 (2Н, с), 6,00 (1Н, тт), 7,53 (2Н, д), 7,71 (2Н, д).
Пример получения 12
С использованием 0,50 г бензилмалононитрила, 10 мл N,N-диметилформамида, 0,14 г гидрида натрия (60% в масле) и 0,63 г 1-бром-3,3,3-трифторпропана и в соответствии со способом, описанным в примере получения 1, получали 0,14 г 2-бензил-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (12)).
Выход: 17%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,20-2,27 (2Н, м), 2,45-2,59 (2Н, м), 3,28 (2Н, с), 7,34-7,48 (5Н, м).
Пример получения 13
С использованием 0,50 г (4-(трифторметилтио)бензил)малононитрила, 10 мл N,N-диметилформамида, 0,09 г гидрида натрия (60% в масле) и 0,38 г 1-бром-3,3,3-трифторпропана и в соответствии со способом, описанным в примере получения 1, получали 0,03 г 2-(4-(трифторметилтио)бензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (13)).
Выход: 11%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,20-2,29 (2Н, м), 2,51-2,62 (2Н, м), 3,29 (2Н, с), 7,45 (2Н, д), 7,73 (2Н, д).
Пример получения 14
С использованием 0,80 г 2-(3-гидроксипропил)-2-(4-(трифторметил)бензил)малононитрила, 8 мл дихлорметана и 0,3 мл трифторида диэтиламиносеры и в соответствии со способом, описанным в примере получения 11, получали 0,05 г 2-(3-фторпропил)-2-(4-(трифторметил)бензил)малононитрила (настоящее соединение (14)).
Выход: 5%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,14-2,20 (4Н, м), 3,30 (2Н, с), 4,59 (2Н, дт), 7,53 (2Н, д), 7,69 (2Н, д).
Пример получения 15
С использованием 1,00 г (4-хлорбензил)малононитрила, 10 мл N,N-диметилформамида, 1, 0 г гидрида натрия (60% в масле) и 0,93 г 1-бром-3,3,3-трифторпропана и в соответствии со способом, описанным в примере получения 1, получали 0,21 г 2-(4-хлорбензил)-2-(3,3, 3-трифторпропил)малононитрила (настоящее соединение (15)).
Выход: 22%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,17-2,26 (2Н, м), 2,48-2,63 (2Н, м), 3,24 (2Н, с), 7,32 (2Н, д), 7,42 (2Н, д).
Пример получения 16
С использованием 1,00 г (4-фторбензил)малононитрила, 15 мл N,N-диметилформамида, 0,23 г гидрида натрия (60% в масле) и 1,02 г 1-бром-3,3,3-трифторпропана и в соответствии со способом, описанным в примере получения 1, получали 0,34 г 2-(4-фторбензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (16)).
Выход: 22%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,20-2,27 (2Н, м), 2,47-2,62 (2Н, м), 3,24 (2Н, с), 7,13 (2Н, дд), 7,37 (2Н, дд).
Пример получения 17
С использованием 0,50 г (2,4,6-трифторбензил)малононитрила, 10 мл N,N-диметилформамида, 0,11 г гидрида натрия (60% в масле) и 0,46 г 1-бром-3,3, 3-трифторпропана и в соответствии со способом, описанным в примере получения 1, получали 0,07 г 2-(2,4,6-трифторбензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (17)).
Выход: 10%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,22-2,29 (2Н, м), 2,50-2,61 (2Н, м), 3,68 (2Н, с), 6,82 (2Н, дд).
Пример получения 18
С использованием 5,00 г (4-нитробензил)малононитрила, 60 мл N,N-диметилформамида, 1,10 г гидрида натрия (60% в масле) и 4,85 г 1-бром-3,3,3-трифторпропана и в соответствии со способом, описанным в примере получения 1, получали 0,80 г 2-(4-нитробензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (18)).
Выход: 11%;
1 H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,28-2,32 (2Н, м), 2,52-2,64 (2Н, м), 3,40 (2Н, с), 7,58 (2Н, д), 8,33 (2Н, д).
Пример получения 19
С использованием 1, 00 г (3,4-дифторбензил)малононитрила, 10 мл N,N-диметилформамида, 0,20 г гидрида натрия (60% в масле) и 1,38 г 1-бром-3,3,3-трифторпропана и в соответствии со способом, описанным в примере получения 1, получали 0,32 г 2-(3,4-дифторбензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (19)).
Выход: 21%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,20-2,29 (2Н, м), 2,50-2,61 (2Н, м), 3,22 (2Н, с), 7,11-7,15 (2Н, м), 7,21-7,31 (2Н, м).
Пример получения 20
С использованием 0,50 г (4-хлорбензил)малононитрила, 5 мл N,N-диметилформамида, 0,12 г гидрида натрия (60% в масле) и 0,30 мл 1,1,3-трихлорпропена и в соответствии со способом, описанным в примере получения 1, получали 0,52 г 2-(4-хлорбензил)-2-(3,3-дихлор-2-пропенил)малононитрила (настоящее соединение (20)).
Выход: 66%;
Т.пл.: 67,5°С.
Пример получения 21
С использованием 2,00 г (3,4-дихлорбензил)малононитрила, 20 мл N,N-диметилформамида, 0,36 г гидрида натрия (60% в масле) и 2,37 г 1-бром-3,3,3-трифторпропана и в соответствии со способом, описанным в примере получения 1, получали 0,42 г 2-(3,4-дихлорбензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (21)).
Выход: 45%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,22-2,29 (2Н, м), 2,50-2,62 (2Н, м), 3,21 (2Н, с), 7,25 (1Н, д), 7,51 (2Н, дд).
Пример получения 22
С использованием 1,00 г (4-цианобензил)малононитрила, 10 мл N,N-диметилформамида, 0,36 г гидрида натрия (60% в масле) и 2,37 г 1-бром-3,3,3-трифторпропана и в соответствии со способом, описанным в примере получения 1, получали 0,42 г 2-(4-цианобензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (22)).
Выход: 22%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,25-2,30 (2Н, м), 2,51-2,62 (2Н, м), 3,31 (2Н, с), 7,53 (2Н, д), 7,76 (2Н, д).
Пример получения 23
С использованием 1,00 г (4-хлорбензил)малононитрила, 10 мл N,N-диметилформамида, 0,21 г гидрида натрия (60% в масле) и 1,44 г 4-йод-1,1,1,2,2-пентафторбутана и в соответствии со способом, описанным в примере получения 1, получали 0,47 г 2-(4-хлорбензил)-2-(3, 3,4,4,4-пентафторбутил)малононитрила (настоящее соединение (23)).
Выход: 28%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,25-2,32 (2Н, м), 2,41-2,53 (2Н, м), 3,25 (2Н, с), 7,33 (2Н, д), 7,43 (2Н, д).
Пример получения 24
С использованием 1,00 г (4-хлорбензил)малононитрила, 10 мл N,N-диметилформамида, 0,21 г гидрида натрия (60% в масле) и 0,67 г 1-бром-2-фторэтана и в соответствии со способом, описанным в примере получения 1, получали 0,30 г 2-(4-хлорбензил)-2-(2-фторэтил)малононитрила (настоящее соединение (24)).
Выход: 22%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,39 (2Н, дт), 3,27 (2Н, с), 4,83 (2Н, дт), 7,34 (2Н, д), 7,41 (2Н, д).
Пример получения 25
С использованием 1,00 г (4-хлорбензил)малононитрила, 15 мл N,N-диметилформамида, 0,073 г карбоната цезия и 1,47 г 2,2,3,3-тетрафторпропил трифторметансульфоната и в соответствии со способом, описанным в примере получения 1, получали 0,12 г 2-(4-хлорбензил)-2-(2,2,3,3-тетрафторпропил)малононитрила (настоящее соединение (25)).
Выход: 7%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,69 (2Н, т), 3,31 (2Н, с), 5,87 (1Н, тт), 7,34 (2Н, д), 7,41 (2Н, д).
Пример получения 26
Первоначально 0,55 г 4-йодбензилбромида растворяли в 10 мл N-диметилформамида, к смеси добавляли по каплям суспензию 0,11 г гидрида натрия (60% в масле) и 0,30 г (3,3,3-трифторпропил)малононитрила в 5 мл N,N-диметилформамида при перемешивании при охлаждении льдом. После перемешивания в течение 4 часов при 0°С к реакционной смеси при комнатной температуре добавляли 10%-ную соляную кислоту и смесь экстрагировали этилацетатом. Органический слой последовательно промывали водой, насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле, получая 0,16 г 2-(4-йодбензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (26)).
Выход: 22%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,17-2,23 (2Н, м), 2,49-2,60 (2Н, м), 3,22 (2Н, с), 7,11 (2Н, д), 7,78 (2Н, д).
Пример получения 27
С использованием 0,15 г (4-винилбензил)хлорида, 3 мл N,N-диметилформамида, 0,05 г гидрида натрия (60% в масле) и 0,17 г 1-бром-(3,3,3-трифторпропил)малононитрила и в соответствии со способом, описанным в примере получения 27, получали 0,18 г 2-(3,3,3-трифторпропил)-2-(4-винилбензил)малононитрила (настоящее соединение (27)).
Выход: 63%;
1 H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,20-2,24 (2Н, м), 2,48-2,63 (2Н, м), 3,26 (2Н, с), 5,32 (2Н, д), 5,80 (2Н, д), 6,72 (2Н, дд), 7,33 (2Н, д), 7,41 (2Н, д).
Пример получения 28
С использованием 0,20 г (4-(трифторметокси)бензил)малононитрила, 5 мл N,N-диметилформамида, 50 мг гидрида натрия (60% в масле) и 0,17 мл 1,1,3-трихлорпропена и в соответствии со способом, описанным в примере получения 1, получали 80 мг 2-(3,3-дихлор-2-пропенил)-2-(4-(трифторметокси)бензил)малононитрила (настоящее соединение (28)).
Выход: 28%;
Т.пл.: 96,5°С.
Пример получения 29
С использованием 0,20 г (4-(трифторметокси)бензил)малононитрила, 5 мл N,N-диметилформамида, 50 мг гидрида натрия (60% в масле) и 0,46 г 1,1,3-трибромпропена и в соответствии со способом, описанным в примере получения 1, получали 0,16 г 2-(3,3-дибром-2-пропенил)-2-(4-(трифторметокси)бензил)малононитрила (настоящее соединение (29)).
Выход: 44%;
Т.пл.: 126,7°С.
Пример получения 30
С использованием 0,23 г 3-нитро-4-метилбензилбромида, 3 мл N,N-диметилформамида, 0,05 г гидрида натрия (60% в масле) и 0,17 г (3,3,3-трифторпропил)малононитрила и в соответствии со способом, описанным в примере получения 26, получали 0,10 г 2-(3-нитро-4-метил-бензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (30)).
Выход: 31%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2, 25-2,30 (2Н, м), 2,49-2,61 (2Н, м), 2,65 (3Н, с), 3,31 (2Н, с), 7,45 (1Н, д), 7,55 (1Н, д), 8,00 (1Н, с).
Пример получения 31
С использованием 0,16 г 4-этилбензилхлорида, 3 мл N,N-диметилформамида, 0,05 г гидрида натрия (60% в масле) и 0,17 г (3,3,3-трифторпропил)малононитрила и в соответствии со способом, описанным в примере получения 26, получали 0,14 г 2-(4-этилбензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (31)).
Выход: 50%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 1,25 (3Н, т), 2,04-2,23 (2Н, м), 2,50-2,58 (2Н, м), 3,23 (2Н, с), 7,24-7,28 (4Н, м).
Пример получения 32
С использованием 0,20 г 3-метоксибензилбромида, 3 мл N, N-диметилформамида, 0,05 г гидрида натрия (60% в масле) и 0,17 г (3,3,3-трифторпропил)малононитрила и в соответствии со способом, описанным в примере получения 26, получали 0,09 г 2-(3-метоксибензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (32)).
Выход: 33%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,19-2,22 (2Н, м), 2,48-2,59 (2Н, м), 3,24 (2Н, с), 3,83 (3Н, с), 6,90-7,00 (3Н, м), 7,31 (1Н, м).
Пример получения 33
С использованием 0,23 г 4-трет-бутилбензилбромида, 3 мл N, N-диметилформамида, 0,05 г гидрида натрия (60% в масле) и 0,17 г (3,3,3-трифторпропил)малононитрила и в соответствии со способом, описанным в примере получения 26, получали 0,14 г 2-(4-трет-бутилбензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (33)).
Выход: 47%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 1,33 (9Н, с), 2,20-2,24 (2Н, м), 2,48-2,59 (2Н, м), 3,24 (2Н, с), 7,29 (2Н, д), 7,43 (2Н, д).
Пример получения 34
С использованием 0,22 г 4-(метилтио)бензилбромида, 3 мл N, N-диметилформамида, 0,05 г гидрида натрия (60% в масле) и 0,17 г (3,3,3-трифторпропил)малононитрила и в соответствии со способом, описанным в примере получения 26, получали 0,15 г 2-(4-(метилтио)бензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (34)).
Выход: 50%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,17-2, 22 (2Н, м), 2,43-2,53 (2Н, м), 2,50 (3Н, с), 3,16 (2Н, с), 7,29 (4Н, с).
Пример получения 35
С использованием 0,21 г 4-изопропилбензилбромида, 3 мл N,N-диметилформамида, 0,05 г гидрида натрия (60% в масле) и 0,17 г (3,3,3-трифторпропил)малононитрила и в соответствии со способом, описанным в примере получения 26, получали 0,24 г 2-(4-изопропилбензил)-2-(3,3, 3-трифторпропил)малононитрила (настоящее соединение (35)).
Выход: 85%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 1,27 (6Н, д), 2,20-2,23 (2Н, м), 2, 51-2,60 (2Н, м), 3,36 (2Н, с), 7,26 (4Н, с).
Пример получения 36
С использованием 0,24 г 3-(трифторметил)бензилбромида, 3 мл N,N-диметилформамида, 0,05 г гидрида натрия (60% в масле) и 0,17 г (3,3,3-трифторпропил)малононитрила и в соответствии со способом, описанным в примере получения 26, получали 0,17 г 2-(3-(трифторметил)бензил)-2-(3,3, 3-трифторпропил)малононитрила (настоящее соединение (36)).
Выход: 53%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,21-2,29 (2Н, м), 2,48-2,62 (2Н, м), 3,33 (2Н, с), 7,52-7,72 (3Н, м).
Пример получения 37
С использованием 0,14 г 3-метилбензилхлорида, 3 мл N,N-диметилформамида, 0,05 г гидрида натрия (60% в масле) и 0,17 г (3,3,3-трифторпропил)малононитрила и в соответствии со способом, описанным в примере получения 26, получали 0,17 г 2-(3-метилбензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (37)).
Выход: 62%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,18-2,23 (2Н, м), 2,36 (3Н, с), 2,47-2,59 (2Н, м), 3,23 (2Н, с), 7,16 (1Н, с), 7,22-7,33 (3Н, м).
Пример получения 38
С использованием 0,21 г 2-хлор-4-нитробензилхлорида, 3 мл N,N-диметилформамида, 0,05 г гидрида натрия (60% в масле) и 0,17 г (3,3, 3-трифторпропил)малононитрила и в соответствии со способом, описанным в примере получения 26, получали 0,15 г 2-(2-хлор-4-нитробензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (38)).
Выход: 46%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,32-2,36 (2Н, м), 2,49-2,60 (2Н, м), 3,60 (2Н, с), 7,60 (1Н, д), 8,23 (1Н, д), 8,39 (1Н, с).
Пример получения 39
С использованием 0,28 г 3-хлор-4-(трифторметил)бензилхлорида, 3 мл N,N-диметилформамида, 0,05 г гидрида натрия (60% в масле) и 0,17 г (3,3, 3-трифторпропил)малононитрила и в соответствии со способом, описанным в примере получения 26, получали 0,25 г 2-(3-хлор-4-(трифторметил)бензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (39)).
Выход: 70%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,26-2,30 (2Н, м), 2,52-2,63 (2Н, м), 3,28 (2Н, с), 7,24 (1Н, д, 7,29 (1Н, д), 7,70 (1Н, дд).
Пример получения 40
С использованием 0,23 г 2,3-диметоксибензилбромида, 3 мл N,N-диметилформамида, 0,05 г гидрида натрия (60% в масле) и 0,17 г (3,3, 3-трифторпропил)малононитрила и в соответствии со способом, описанным в примере получения 26, получали 0,26 г 2-(2,3-диметоксибензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (40)).
Выход: 80%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,18-2,22 (2Н, м), 2,46-2,57 (2Н, м), 3,37 (2Н, с), 3,88 (3Н, с), 3,90 (3Н, с), 6,95-7,11 (2Н, д).
Пример получения 41
С использованием 0,10 г 2-хлор-4-(трифторметил)бензилбромида, 3 мл N,N-диметилформамида, 0,05 г гидрида натрия (60% в масле) и 0,17 г (3, 3,3-трифторпропил)малононитрила и в соответствии со способом, описанным в примере получения 26, получали 0,05 г 2-(2-хлор-4-(трифторметил)бензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (41)).
Выход: 39%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,21-2,35 (2Н, м), 2,49-2,63 (2Н, м), 3,56 (2Н, с), 7,62 (1Н, д), 7,68 (1Н, д), 7,78 (1Н, с).
Пример получения 42
С использованием 2,05 г 2-(1-(4-хлорфенил)этил)малононитрила, 10 мл N,N-диметилформамида, 1,38 г карбоната калия и 1,77 г 1-бром-3,3, 3-трифторпропана и в соответствии со способом, описанным в примере получения 1, получали 0,49 г 2-(1-(4-хлорфенилэтил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (42)).
Выход: 17%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 1,71 (3Н, д), 1,86-2,14 (2Н, м), 2,40-2,60 (2Н, м), 3,22 (1Н, кв), 7,27 (2Н, д), 7,39 (2Н, д).
Пример получения 43
Первоначально 1,00 г 2-(3,3,3-трифторпропил)-2-(4-винилбензил)малононитрила (настоящее соединение (27)) растворяли в 10 мл хлороформа, к раствору медленно добавляли по каплям 0,5 г брома, растворенного в 8 мл хлороформа, при перемешивании при охлаждении льдом с последующим перемешиванием в течение 5 часов. Затем к реакционной смеси добавляли воду, смесь экстрагировали хлороформом. Органический слой последовательно промывали водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле, получая 1,07 г 2-(4-(1,2-дибромэтил)бензил-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (43)).
Выход: 68%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,22-2,26 (2Н, м), 2,49-2,61 (2Н, м), 3,27 (2Н, с), 3,97 (1Н, т), 4,07 (1Н, дд), 5,14 (1Н, дд), 7,39 (2Н, д), 7,48 (2Н, д).
Пример получения 44
С использованием 0,51 г (2-хлор-4-фторбензил)малононитрила, 5 мл N,N-диметилформамида, 0,12 г гидрида натрия (60% в масле) и 0,34 г 1-бром-3,3, 3-трифторпропана и в соответствии со способом, описанным в примере получения 1, получали 0,21 г 2-(2-хлор-4-фторбензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (44)).
Выход: 34%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,27-2,31 (2Н, м), 2,50-2,62 (2Н, м), 3,48 (2Н, с), 7,07 (1Н, м), 7,26 (1Н, м), 7,53 (1Н, м).
Пример получения 45
С использованием 0,49 г 3-метил-4-нитробензилметансульфоната, 5 мл N,N-диметилформамида, 0,10 г гидрида натрия (60% в масле) и 0,3 г (3,3, 3-трифторпропил)малононитрила и в соответствии со способом, описанным в примере получения 26, получали 0,51 г 2-(3-метил-4-нитробензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (45)).
Выход: 82%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,14-2,30 (2Н, м), 2,51-2,65 (2Н, м), 2,66 (3Н, с), 7,37 (1Н, д), 7,39 (1Н, д), 8,03 (1Н, дд).
Пример получения 46
С использованием 0,32 г (4-цианобензил)малононитрила, 7 мл N,N-диметилформамида, 0,12 г гидрида натрия (60% в масле) и 0,25 г 1-бром-2-фторэтана и в соответствии со способом, описанным в примере получения 1, получали 0,10 г 2-(4-цианобензил)-2-(2-фторэтил)малононитрила (настоящее соединение (46)).
Выход: 22%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,45 (2Н, дт), 3,36 (2Н, с), 4,85 (2Н, дт), 7,55 (2Н, д), 7,75 (2Н, д).
Пример получения 47
С использованием 0,40 г (4-нитробензил)малононитрила, 5 мл N,N-диметилформамида, 0,12 г гидрида натрия (60% в масле) и 0,25 г 1-бром-2-фторэтана и в соответствии со способом, описанным в примере получения 1, получали 0,10 г 2-(4-нитробензил)-2-(2-фторэтил)малононитрила (настоящее соединение (47)).
Выход: 22%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,47 (2Н, дт), 3,41 (2Н, с), 4,86 (2Н, дт), 7,61 (2Н, д), 8,30 (2Н, д).
Пример получения 48
С использованием 0,50 г (4-(трифторметокси)бензил)малононитрила, 9 мл N,N-диметилформамида, 96 мг гидрида натрия (60% в масле) и 0,79 г 4-бром-1,1,2-трифтор-1-бутена и в соответствии со способом, описанным в примере получения 1, получали 0,19 г 2-(3,4, 4-трифтор-3-бутенил)-2-(4-(трифторметокси)бензил)малононитрила (настоящее соединение (49)).
Выход: 27%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2, 19-2,26 (2Н, м), 2,66-2,81 (2Н, м), 3,26 (2Н, с), 7,28 (2Н, д), 7,43 (2Н, д).
Пример получения 49
С использованием 0,50 г (4-(трифторметокси)бензил)малононитрила, 8 мл N,N-диметилформамида, 96 мг гидрида натрия (60% в масле) и 0,74 г 1-бром-3,3,3-трифторпропана и в соответствии со способом, описанным в примере получения 1, получали 0,14 г 2-(3,3, 3-трифторпропил)-2-(4-(трифторметокси)бензил)малононитрила (настоящее соединение (50)).
Выход: 21%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,21-2, 28 (2Н, м), 2,46-2,61 (2Н, м), 3,27 (2Н, с), 7,27 (2Н, д), 7,44 (2Н, д).
Пример получения 50
С использованием 0,47 г (4-бромбензил)малононитрила, 5 мл N, N-диметилформамида, 0,12 г гидрида натрия (60% в масле) и 0,25 г 1-бром-2-фторэтана и в соответствии со способом, описанным в примере получения 1, получали 0,27 г 2-(4-бромбензил)-2-(2-фторэтил)малононитрила (настоящее соединение (51)).
Выход: 48%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,39 (2Н, дт), 3,26 (2Н, с), 4,83 (2Н, дт), 7,22 (2Н, д), 7,55 (2Н, д).
Пример получения 51
С использованием 0,37 г (4-метоксибензил)малононитрила, 5 мл N,N-диметилформамида, 0,12 г гидрида натрия (60% в масле) и 0,25 г 1-бром-2-фторэтана и в соответствии со способом, описанным в примере получения 1, получали 0,23 г 2-(2-фторэтил)-2-(4-метоксибензил)малононитрила (настоящее соединение (52)).
Выход: 49%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,35 (2Н, дт), 3,22 (2Н, с), 3,76 (3Н, с), 4,80 (2Н, дт), 6,91 (2Н, д), 7,28 (2Н, д).
Пример получения 52
С использованием 0,41 г 2-(1-(4-хлорфенил)этил)малононитрила, 5 мл N,N-диметилформамида, 0,12 г гидрида натрия (60% в масле) и 0,25 г 1-бром-2-фторэтана и в соответствии со способом, описанным в примере получения 1, получали 0,22 г 2-(1-(4-хлорфенил)этил)-2-(2-фторэтил)малононитрила (настоящее соединение (53)).
Выход: 44%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 1,71 (3Н, д), 2,04-2,33 (2Н, м), 3,30 (1Н, кв), 4,80 (2Н, дт), 7,28 (2Н, д), 7,37 (2Н, д).
Пример получения 53
С использованием 0,50 г (4-(трифторметилтио)бензил)малононитрила, 10 мл N,N-диметилформамида, 86 мг гидрида натрия (60% в масле) и 0,74 г 4-бром-1,1, 2-трифтор-1-бутена и в соответствии со способом, описанным в примере получения 1, получали 0,12 г 2-(3,4,4-трифтор-3-бутенил)-2-(4-(трифторметилтио)бензил)малононитрила (настоящее соединение (54)).
Выход: 17%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,20-2,27 (2Н, м), 2,68-2,82 (2Н, м), 3,28 (2Н, с), 7,45 (2Н, д), 7,72 (2Н, д).
Пример получения 54
С использованием 0,45 г (4-(трифторметил)бензил)малононитрила, 5 мл N,N-диметилформамида, 0,12 г гидрида натрия (60% в масле) и 0,25 г 1,1,3-трихлорпропена и в соответствии со способом, описанным в примере получения 1, получали 0,28 г 2-(3,3-дихлор-2-пропенил)-2-(4-(трифторметил)бензил)малононитрила (настоящее соединение (55)).
Выход: 37%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,96 (2Н, д), 3,28 (2Н, с), 6,09 (1Н, д), 7,53 (2Н, д), 7,70 (2Н, д).
Пример получения 55
С использованием 0,37 г (4-цианобензил)малононитрила, 5 мл N,N-диметилформамида, 0,12 г гидрида натрия (60% в масле) и 0,25 г 1,1,3-трихлорпропена и в соответствии со способом, описанным в примере получения 1, получали 0,17 г 2-(4-цианобензил)малононитрила (настоящее соединение (56)).
Выход: 29%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,97 (2Н, д), 3,24 (2Н, с), 6,08 (1Н, д), 7,53 (2Н, д), 7,64 (2Н, д).
Пример получения 56
С использованием 0,48 г 2-(1-(4-(трифторметил)фенил)этил)малононитрила, 5 мл N, N-диметилформамида, 0,12 г гидрида натрия (60% в масле) и 0,34 г 1-бром-3,3,3-трифторпропана и в соответствии со способом, описанным в примере получения 1, получали 0,26 г 2-(1-(4-(трифторметил)фенил)этил-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (57)).
Выход: 39%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 1,76 (3Н, д), 1,90-2,23 (2Н, м), 2,43-2,96 (2Н, м), 3,32 (1Н, кв), 7,48 (2Н, д), 7,71 (2Н, д).
Пример получения 57
Первоначально 0,2 г (2-(4-(1, 2-дибромэтил)бензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (43)) растворяли в 5 мл N-диметилформамида, к смеси добавляли 0,1 г трет-бутоксида калия при перемешивании при охлаждении льдом. После перемешивания в течение 5 часов при комнатной температуре к реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой последовательно промывали водой, насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле, получая 0,05 г 2-(4-(2-бромвинил)бензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (58)).
Выход: 39%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,20-2,26 (2Н, м), 2,49-2,61 (2Н, м), 3,27 (2Н, с), 3,51 (2Н, с), 5,84 (1Н, д), 6,17 (1Н, д), 7,34 (2Н, д), 7,68 (2Н, д).
Пример получения 58
С использованием 0,37 г (4-фторбензил)малононитрила, 5 мл N,N-диметилформамида, 0,12 г гидрида натрия (60% в масле) и 0,25 г 1-бром-2-фторэтана и в соответствии со способом, описанным в примере получения 1, получали 0, 22 г 2-(4-фторбензил)-2-(2-фторэтил)малононитрила (настоящее соединение (59)).
Выход: 49%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,40 (2Н, дт), 3, 28 (2Н, с), 4,83 (2Н, дт), 7,04-7,14 (2Н, м), 7,36-7,40 (2Н, м).
Пример получения 59
С использованием 0,49 г бензилмалононитрила, 15 мл N,N-диметилформамида, 0,14 г гидрида натрия (60% в масле) и 0,33 г 1,3-дихлорпропена и в соответствии со способом, описанным в примере получения 1, получали 0,25 г 2-бензил-2-((Е)-3-хлор-2-пропенил)малононитрила (настоящее соединение (60)) в качестве высокополярного соединения.
Выход: 36%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,71 (2Н, д), 3,21 (2Н, с), 6,06 (1Н, дт), 6,37 (1Н, д), 7,36-7,45 (5Н, м).
Одновременно получали 0,28 г 2-бензил-2-((Z)-3-хлор-2-пропенил)малононитрила (настоящее соединение (61)) в качестве низкополярного соединения.
Выход: 40%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,98 (2Н, д), 3,26 (2Н, с), 6,00 (1Н, дт), 6,49 (1Н, д), 7,37-7,52 (5Н, м).
Пример получения 60
С использованием 0,30 г (3,4,4-трифтор-3-бутенил)малононитрила, 5 мл N,N-диметилформамида, 75 мг гидрида натрия (60% в масле) и 0,52 г 2-хлор-4-(трифторметил)бензилбромида и в соответствии со способом, описанным в примере получения 1, получали 0,28 г 2-хлор-4-(трифторметил)бензил)-2-(3,4,4-трифтор-3-бутенилмалононитрила (настоящее соединение (62)).
Выход: 45%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,30 (2Н, т), 2,66-2,88 (2Н, м), 3,56 (2Н. с), 7,63 (1Н, д), 7,70 (1Н, д), 7,75 (1Н, с).
Пример получения 61
С использованием 1,01 г (3-хлорбензил)малононитрила, 5 мл N,N-диметилформамида, 1,38 г карбоната калия и 1,44 г 1-бром-2-хлорэтана и в соответствии со способом, описанным в примере получения 1, получали 0,60 г 2-(3-хлорбензил)-2-(2-хлорэтил)малононитрила (настоящее соединение (63)).
Выход: 23%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,44 (2Н, дд), 3,25 (2Н, с), 3,81 (2Н, дд), 7,27-7,43 (4Н, м).
Пример получения 62
С использованием 0,23 г (4-(трифторметил)бензил)малононитрила, 3 мл N,N-диметилформамида, 0,05 г гидрида натрия (60% в масле) и 0,13 г 1-бром-2-фторэтана и в соответствии со способом, описанным в примере получения 1, получали 0,12 г 2-(2-фторэтил)-2-(4-трифторметил)бензил)малононитрила (настоящее соединение (64)).
Выход: 48%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,43 (2Н, дт), 3,58 (2Н, с), 4,85 (2Н, дт), 7,54 (2Н, д), 7,70 (2Н, д).
Пример получения 63
С использованием 0,24 г (3-бромбензил)малононитрила, 3 мл N,N-диметилформамида, 0,10 г гидрида натрия (60% в масле) и 0,13 г 1-бром-2-фторэтана и в соответствии со способом, описанным в примере получения 1, получали 0,11 г 2-(3-бромбензил)-2-(2-фторэтил)малононитрила (настоящее соединение (65)).
Выход: 33%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,38 (2Н, дт), 3,26 (2Н, с), 3,83 (3Н, с), 4,86 (2H, дт), 7,27-7,37 (2Н, м), 7, 54-7,57 (2Н, м).
Пример получения 64
С использованием 0,15 г (3,4,4-трифтор-3-бутенил)малононитрила, 5 мл N,N-диметилформамида, 38 мг гидрида натрия (60% в масле) и 0, 27 г 2,6-дихлор-4-(трифторметил)бензилбромида и в соответствии со способом, описанным в примере получения 1, получали 0,18 г 2-(2,6-дихлор-4-(трифторметил)бензил)-2-(3,4, 4-трифтор-3-бутенил)малононитрила (настоящее соединение (66)).
Выход: 51%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,39-2,45 (2H, м), 2,71-2,83 (2Н, м), 3,80 (2Н, с), 7,70 (2Н, с).
Пример получения 65
С использованием 0,25 г (4-бром-2-фторбензил)малононитрила, 3 мл N,N-диметилформамида, 0,10 г гидрида натрия (60% в масле) и 0,13 г 1-бром-2-фторэтана и в соответствии со способом, описанным в примере получения 1, получали 0,11 г 2-(4-бром-2-фторбензил)-2-(2-фторэтил)малононитрила (настоящее соединение (67)).
Выход: 33%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,41 (2Н, дт), 3,35 (2Н, с), 4,82 (2Н, дт), 7,32-7,42 (3Н, м).
Пример получения 66
С использованием 0,20 г (3,4,4-трифтор-3-бутенил)малононитрила, 5 мл N,N-диметилформамида, 50 мг гидрида натрия (60% в масле) и 0,25 г α-бром-п-толунитрила и в соответствии со способом, описанным в примере получения 1, получали 0,21 г 2-(4-цианобензил)-2-(3,4,4-трифтор-3-бутенил)малононитрила (настоящее соединение (68)).
Выход: 63%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,21-2,32 (2Н, м), 2,68-2,87 (2Н, м), 3,31 (2Н, с), 7,54 (2Н, д), 7,72 (2Н, д).
Пример получения 67
С использованием 0,24 г (2-бромбензил)малононитрила, 3 мл N,N-диметилформамида, 0,10 г гидрида натрия (60% в масле) и 0,13 г 1-бром-2-фторэтана и в соответствии со способом, описанным в примере получения 1, получали 0,12 г 2-(2-бромбензил)-2-(2-фторэтил)малононитрила (настоящее соединение (69)).
Выход: 37%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,47 (2Н, дт), 3,58 (2Н, с), 4,82 (2Н, дт), 7,24 (1Н, дд), 7,28 (1Н, дд), 7,58 (1Н, д), 7,65 (1Н, д).
Пример получения 68
С использованием 0,21 г 2, 4-дифторбензилбромида, 3 мл N,N-диметилформамида, 0,05 г гидрида натрия (60% в масле) и 0,17 г (3,3,3-трифторпропил)малононитрила и в соответствии со способом, описанным в примере получения 26, получали 0,17 г 2-(2,4-дифторбензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (70)).
Выход: 57%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,21-2,26 (2Н, м), 2,47-2,59 (2Н, м), 3,34 (2Н, с), 6,91-7,02 (2Н, м), 7,40-7,47 (2Н, м).
Пример получения 69
С использованием 0,21 г 3,5-дифторбензилбромида, 3 мл N,N-диметилформамида, 0,05 г гидрида натрия (60% в масле) и 0,17 г (3,3,3-трифторпропил)малононитрила и в соответствии со способом, описанным в примере получения 26, получали 0,21 г 2-(3, 5-дифторбензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (71)).
Выход: 73%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,22-2,28 (2Н, м), 2,49-2,61 (2Н, м), 3,23 (2Н, с), 6,87-6,95 (3Н, м).
Пример получения 70
С использованием 1,0 г (4-(трифторметил)бензил)малононитрила, 8 мл N,N-диметилформамида, 0, 73 г карбоната цезия и 1,0 г 2,2,2-трифторэтилтрифторметансульфоната и в соответствии со способом, описанным в примере получения 1, получали 0,58 г 2 (2,2, 2-трифторэтил)-2-(4-(трифторметил)бензилмалононитрила (настоящее соединение (72)).
Выход: 40%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,84 (2Н, кв), 3,40 (2Н, д), 7,55 (2Н, д), 7,72 (2Н, д).
Пример получения 71
С использованием 0,50 г (4-(трифторметил)бензил)малононитрила, 6 мл N,N-диметилформамида, 98 мг гидрида натрия (60% в масле) и 0,46 г 4-бром-1,1,2-трифтор-1-бутена и в соответствии со способом, описанным в примере получения 1, получали 0,16 г 2-(3,4, 4-трифтор-3-бутенил)-2-(4-(трифторметил)бензил)малононитрила (настоящее соединение (73)).
Выход: 21%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,21-2, 27 (2Н, м), 2,70-2,79 (2Н, м), 3,31 (2Н, с), 7,52 (2Н, д), 7,71 (2Н, д).
Пример получения 72
С использованием 0,50 г (4-(трифторметил)бензил)малононитрила, 6 мл N, N-диметилформамида, 98 мг гидрида натрия (60% в масле) и 0,43 г 1-бром-3,3,3-трифторпропана и в соответствии со способом, описанным в примере получения 1, получали 0,30 г 2-(3,3, 3-трифторпропил)-2-(4-(трифторметил)бензил)малононитрила (настоящее соединение (74)).
Выход: 40%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,23-2,30 (2Н, м), 2,47-2,66 (2Н, м), 3,32 (2Н. с), 7,52 (2Н, д), 7,71 (2Н, д).
Пример получения 73
С использованием 0,19 г 2-фторбензилбромида, 3 мл N,N-диметилформамида, 0,05 г гидрида натрия (60% в масле) и 0,17 г (3,3,3-трифторпропил)малононитрила и в соответствии со способом, описанным в примере получения 26, получали 0,17 г 2-(2-фторбензил)-2-(3,3, 3-трифторпропил)малононитрила (настоящее соединение (75)).
Выход: 63%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,20-2,26 (2Н, м), 2,46-2,62 (2Н, м), 3,38 (2Н, с), 7,14-7,45 (4Н, м).
Пример получения 74
С использованием 0,50 г (4-(трифторметил)бензил)малононитрила, 5 мл N,N-диметилформамида, 363 мг карбоната цезия и 0,63 г 2,2,3,3,3-пентафторпропилтрифторметансульфоната и в соответствии со способом, описанным в примере получения 1, получали 0,20 г 2-(2,2,3,3, 3-пентафторпропил)-2-(4-(трифторметил)бензилмалононитрила (настоящее соединение (76)).
Выход: 34%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,78 (2Н, т), 3,43 (2Н, с), 7,56 (2Н, д), 7,75 (2Н, д).
Пример получения 75
С использованием 0,50 г (4-(трифторметил)бензил)малононитрила, 5 мл N,N-диметилформамида, 59 мг гидрида натрия (60% в масле) и 0,77 г 2,2,3,3,4,4,4-гептафторбутилтрифторметансульфоната и в соответствии со способом, описанным в примере получения 1, получали 73 мг 2-(2,2,3,3,4,4, 4-гептафторбутил)-2-(4-(трифторметил)бензилмалононитрила (настоящее соединение (77)).
Выход: 8%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,82 (2Н, т), 3,43 (2Н, с), 7,56 (2Н, д), 7,73 (2Н, д).
Пример получения 76
С использованием 0,50 г (4-(трифторметил)бензил)малононитрила, 5 мл N,N-диметилформамида, 88 мг гидрида натрия (60% в масле) и 0,53 г 1-йод-4,4,4-трифторбутана и в соответствии со способом, описанным в примере получения 1, получали 0,25 г 2-(4,4, 4-трифторбутил)-2-(4-(трифторметил)бензилмалононитрила (настоящее соединение (78)).
Выход: 30%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 1,99-2,39 (4Н, м), 2,18-2,24 (2Н, м), 3,26 (2Н, с), 7,49 (2Н, д), 7,67 (2Н, д).
Пример получения 77
С использованием 0,15 г 3-фторбензилхлорида, 3 мл N,N-диметилформамида, 0,05 г гидрида натрия (60% в масле) и 0,17 г (3,3,3-трифторпропил)малононитрила и в соответствии со способом, описанным в примере получения 26, получали 0,11 г 2-(3-фторбензил)-2-(3,3, 3-трифторпропил)малононитрила (настоящее соединение (79)).
Выход: 41%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,21-2,26 (2Н, м), 2,47-2,57 (2Н, м), 3,26 (2Н, с), 7,08-7,18 (3Н, м), 7,38-7,45 (1Н, м).
Пример получения 78
С использованием 0,26 г 2,3,4,5,6-пентафторбензилбромида, 3 мл N,N-диметилформамида, 0,05 г гидрида натрия (60% в масле) и 0,17 г (3,3,3-трифторпропил)малононитрила и в соответствии со способом, описанным в примере получения 26, получали 0,11 г 2-(2,3,4,5,6-пентафторбензил)-2-(3,3, 3-трифторпропил)малононитрила (настоящее соединение (80)).
Выход: 61%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,28-2,34 (2Н, м), 2,50-2,68 (2Н, м), 3,47 (2Н, с).
Пример получения 79
С использованием 0,21 г 2-хлорбензилбромида, 3 мл N,N-диметилформамида, 0,05 г гидрида натрия (60% в масле) и 0,17 г (3,3, 3-трифторпропил)малононитрила и в соответствии со способом, описанным в примере получения 26, получали 0,22 г 2-(2-хлорбензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (81)).
Выход: 78%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,28-2,34 (2Н, м), 2,50-2,62 (2Н, м), 3,53 (2Н, с), 7,30-7,40 (2Н, м), 7,47-7,55 (2Н, м).
Пример получения 80
С использованием 0,16 г 3-хлорбензилхлорида 3 мл N,N-диметилформамида, 0,05 г гидрида натрия (60% в масле) и 0,17 г (3,3,3-трифторпропил)малононитрила и в соответствии со способом, описанным в примере получения 26, получали 0,12 г 2-(3-хлорбензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (82)).
Выход: 42%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,26-2,31 (2Н, м), 2,47-2,62 (2Н, м), 3,53 (2Н, с), 7,26-7,55 (4Н, м).
Пример получения 81
С использованием 0,20 г 2,4-дихлорбензилхлорида, 3 мл N,N-диметилформамида, 0,05 г гидрида натрия (60% в масле) и 0,17 г (3,3,3-трифторпропил)малононитрила и в соответствии со способом, описанным в примере получения 26, получали 0,23 г 2-(2,4-дихлорбензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (83)).
Выход: 70%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,26-2,31 (2Н, м), 2,48-2,63 (2Н, м), 3,48 (2Н, с), 7,35 (1Н, дд), 7,47 (1Н, д), 7,52 (1Н, д).
Пример получения 82
С использованием 0,19 г 4-метилбензилбромида, 3 мл N,N-диметилформамида, 0,05 г гидрида натрия (60% в масле) и 0,17 г (3,3,3-трифторпропил)малононитрила и в соответствии со способом, описанным в примере получения 26, получали 0,20 г 2-(4-метилбензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (84)).
Выход: 76%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,17-2,27 (2Н, м), 2,38 (3Н, 1Н), 2,48-2,60 (2Н, м), 3,23 (2Н, с), 7,21-7,27 (4Н, м).
Пример получения 83
С использованием 0,22 г (4-(трифторметил)бензил)малононитрила, 3 мл N,N-диметилформамида, 0,05 г гидрида натрия (60% в масле) и 0,31 г 1-бром-3-хлорпропана и в соответствии со способом, описанным в примере получения 1, получали 0,15 г 2-(3-хлорпропил)-2-(4-(трифторметил)бензилмалононитрила (настоящее соединение (85)).
Выход: 26%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,20-2,26 (4Н, м), 3,26 (2Н, д), 3,68 (2Н, дд), 7,51 (2Н, д), 7,69 (2Н, д).
Пример получения 84
С использованием 0,22 г (4-(трифторметил)бензил)малононитрила, 3 мл N,N-диметилформамида, 0,05 г гидрида натрия (60% в масле) и 0,33 г 1-бром-3-хлор-2-метилпропана и в соответствии со способом, описанным в примере получения 1, получали 0,19 г 2-(3-хлор-2-метилпропил)-2-(4-(трифторметил)бензилмалононитрила (настоящее соединение (86)).
Выход: 30%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 1, 45 (3Н, д), 1,94 (1Н, дд), 2,31 (1Н, дд), 2,36-2,43 (1Н, м), 3,29 (2Н, с), 3,52 (1Н, дд), 3,68 (1Н, дд), 7,53 (2Н, д), 7,69 (2Н, д).
Пример получения 85
С использованием 0,22 г (4-(трифторметил)бензил)малононитрила, 3 мл N,N-диметилформамида, 0,05 г гидрида натрия (60% в масле) и 0,34 г 1-бром-4-хлорбутана и в соответствии со способом, описанным в примере получения 1, получали 0,20 г 2-(4-хлорбутил)-2-(4-(трифторметил)бензилмалононитрила (настоящее соединение (87)).
Выход: 32%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 1,92-2,14 (4Н, м), 3,27 (2Н, с), 2,36-2,43 (1Н, м), 3,29 (2Н, с), 3,57 (2Н, дд), 7,52 (2Н, д), 7,69 (2Н, д).
Пример получения 86
С использованием 0,52 г (3-бензилоксибензил)малононитрила, 5 мл N,N-диметилформамида, 0,12 г гидрида натрия (60% в масле) и 0,34 г 1-бром-3,3,3-трифторпропана и в соответствии со способом, описанным в примере получения 1, получали 0,28 г 2-(3-(бензилокси)бензил-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (88)).
Выход: 38%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,05-2,22 (2Н, м), 2,47-2,59 (2Н, м), 3,24 (1Н, кв), 5,09 (2Н, с), 6,95-7,26 (3Н, м), 7,29-7,52 (6Н, м).
Пример получения 87
С использованием 0,39 г 2-(4-метоксибензил)малононитрила, 5 мл N,N-диметилформамида, 0,12 г гидрида натрия (60% в масле) и 0,34 г 1-бром-3,3,3-трифторпропана и в соответствии со способом, описанным в примере получения 1, получали 0,15 г 2-(4-метоксибензил)-2-(3,3,3-трифторпропил)малононитрила (настоящее соединение (89)).
Выход: 27%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,04-2,22 (2Н, м), 2,46-2,63 (2Н, м), 3,79 (1Н, кв), 3,83 (3Н, с), 6,92 (2Н, д), 7,27 (2Н, д).
Далее будут описаны некоторые способы получения промежуточных соединений как ссылочные способы получения.
Ссылочный пример получения 1
Первоначально 1,00 г (4-хлор-α-метилбензилиден)малононитрила формулы:

растворяли в 20 мл диэтилового эфира, добавляли к смеси каталитическое количество йодида меди (I) и при перемешивании при охлаждении льдом добавляли по каплям раствор метилмагний йодида в диэтиловом эфире (получен из 0,30 г магния, 10 мл диэтилового эфира и 0,86 мл йодистого метила) с последующим перемешиванием в течение 30 минут при охлаждении льдом. Затем добавляли к реакционной смеси 10%-ную соляную кислоту, смесь экстрагировали этиловым эфиром. Органический слой последовательно промывали 10%-ной соляной кислотой, насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле, получая 0,74 г (1-(4-хлорфенил)-1-метилэтил)малононитрила (промежуточное соединение (2)).
Выход: 69%.
Ссылочный пример получения 2
Первоначально 1,02 г (4-хлорбензилиден)малононитрила растворяли в 20 мл тетрагидрофурана, добавляли к смеси каталитическое количество йодида меди (I) и при перемешивании при охлаждении льдом добавляли по каплям раствор изопропилмагний бромида в тетрагидрофуране (полученный из 0,34 г магния, 10 мл тетрагидрофурана и 1,46 мл бромистого изопропила) с последующим перемешиванием в течение 30 минут при охлаждении льдом. Затем добавляли к реакционной смеси для подкисления 10%-ную соляную кислоту и экстрагировали этиловым эфиром. Органический слой последовательно промывали 10%-ной соляной кислотой, насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле, получая 0,66 г (1-(4-хлорфенил)-2-метилпропил)малононитрила (промежуточное соединение (3)).
Выход: 52%.
Ссылочный пример получения 3
Первоначально 4,44 г (4-(трифторметил)бензилиден)малононитрила растворяли в 20 мл этанола и при перемешивании при комнатной температуре добавляли по каплям суспензию 0,19 г боргидрида натрия в 5 мл этанола с последующим перемешиванием при комнатной температуре в течение 30 минут. Затем к реакционной смеси для подкисления добавляли 10%-ную соляную кислоту и экстрагировали смесь диэтиловым эфиром. Органический слой последовательно промывали 10%-ной соляной кислотой, насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле, получая 2,30 г (4-(трифторметил)бензил)малононитрила (промежуточное соединение (4)).
Выход: 51%.
Ссылочный пример получения 4
Первоначально 3,00 г (4-хлор-α-метилбензилиден)малононитрила растворяли в 20 мл этанола и при перемешивании при комнатной температуре добавляли по каплям суспензию 0,15 г боргидрида натрия в 5 мл этанола с последующим перемешиванием при комнатной температуре в течение 30 минут. Затем к реакционной смеси добавляли 10%-ную соляную кислоту и экстрагировали смесь диэтиловым эфиром. Органический слой последовательно промывали 10%-ной соляной кислотой, насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле, получая 1,70 г (1-(4-хлорфенил)этил)малононитрила (промежуточное соединение (6)).
Выход: 56%.
Ссылочный пример получения 5
Первоначально 10,0 г 4-(трифторметокси)бензальдегида и 3,50 г малононитрила растворяли в 60 мл 70% (вес./вес.) водном этаноле, к которому добавляли каталитическое количество гидроксида бензилтриметиламмония и смесь перемешивали при комнатной температуре в течение ночи. Затем к реакционной смеси добавляли насыщенный водный раствор хлорида натрия и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток перекристаллизовывали из смеси трет-бутилметилового эфира и гексана, получая 9,24 г (4-(трифторметокси)бензилиден)малононитрила.
Выход: 74%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 7,37 (2H, д), 7,76 (1H, с), 7,98 (2H, д).
Затем 2,61 г (4-(трифторметокси)бензилиден)малононитрила растворяли в 20 мл тетрагидрофурана и при перемешивании при комнатной температуре добавляли по каплям суспензию 0,11 г боргидрида натрия в 5 мл этанола с последующим перемешиванием при комнатной температуре в течение 30 минут. Затем к реакционной смеси добавляли 10%-ную соляную кислоту и экстрагировали смесь диэтиловым эфиром. Органический слой последовательно промывали 10%-ной соляной кислотой, насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле, получая 2,20 г (4-(трифторметокси)бензил)малононитрила (промежуточное соединение (7)).
Выход: 83%.
Ссылочный пример получения 6
С использованием 1,19 г (4-(трифторметокси)бензилиден)малононитрила, 20 мл тетрагидрофурана, каталитического количества йодида меди (I) и раствора изопропилмагний бромида в тетрагидрофуране (полученного из 0,39 г магния, 10 мл тетрагидрофурана и 2,36 г бромистого изопропила) и в соответствии со способом, описанным в ссылочном примере получения 2, получали 0,77 г (1-(4-(трифторметокси)фенил)-2-метилпропил)малононитрила (промежуточное соединение (8)).
Выход: 55%.
Ссылочный пример получения 7
С использованием 1,19 г (4-(трифторметокси)бензилиден)малононитрила, 20 мл тетрагидрофурана, каталитического количества йодида меди (I) и 12,5 мл раствора метилмагний бромида в тетрагидрофуране (примерно 1М, доступен от Tokyo Kasei Kogyo Co., Ltd) и в соответствии со способом, описанным в ссылочном примере получения 2, получали 0,76 г (1-(4-(трифторметокси)фенил)этил)малононитрила (промежуточное соединение (10)).
Выход: 60%.
Ссылочный пример получения 8
Первоначально 4,46 г (3,4-дихлорбензилиден)малононитрила растворяли в 20 мл тетрагидрофурана и при перемешивании при комнатной температуре добавляли по каплям суспензию 0,19 г боргидрида натрия в 5 мл этанола с последующим перемешиванием при комнатной температуре в течение 30 минут. Затем добавляли 10%-ную соляную кислоту и экстрагировали смесь диэтиловым эфиром. Органический слой последовательно промывали 10%-ной соляной кислотой, насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле, получая 3,15 г (3,4-дихлорбензил)малононитрила (промежуточное соединение (12)).
Выход: 70%.
Ссылочный пример получения 9
С использованием 4,46 г (2,4-дихлорбензилиден)малононитрила, 20 мл тетрагидрофурана и суспензии 0,19 г боргидрида натрия в 5 мл этанола и в соответствии со способом, описанным в ссылочном примере получения 8, получали 3,10 г (2,4-дихлорбензил)малононитрила (промежуточное соединение (13)).
Выход: 69%.
Ссылочный пример получения 10
Первоначально 10,0 г 4-(трифторметилтио)бензальдегида и 2,92 г малононитрила растворяли в 50 мл 70% (вес/вес) водном этаноле, к смеси добавляли каталитическое количество гидроксида бензилтриметиламмония и смесь перемешивали при комнатной температуре в течение ночи. Затем к реакционной смеси добавляли насыщенный водный раствор хлорида натрия и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток перекристаллизовывали из системы растворителей, состоящей из трет-бутилметилового эфира и гексана, получая 10,5 г (4-(трифторметилтио)бензилиден)малононитрила.
Выход: 85%;
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 7,78 (1H, с), 7,79 (2H, д), 7,93 (2H, д).
Затем 8,00 г (4-(трифторметилтио)бензилиден)малононитрила и 3,35 г бензальдегида растворяли в 320 мл этанола и при перемешивании при комнатной температуре медленно добавляли 3,41 г фенилендиамина и смесь перемешивали при комнатной температуре в течение 5 часов. Затем реакционную смесь концентрировали, добавляли 300 мл трет-бутилметилового эфира и нерастворимые вещества отфильтровывали. Фильтрат концентрировали и полученный остаток подвергали хроматографии на силикагеле, получая 6,22 г (4-(трифторметилтио)бензил)малононитрила (промежуточное соединение (14)).
Выход: 77%.
Ссылочный пример получения 11
Первоначально смешивали 6,98 г малононитрила, 681 мг бромида тетрабутиламмония и 10,0 г 4-бром-1,1,2-трифтор-1-бутена и при перемешивании при 0°C в атмосфере азота медленно добавляли 5,92 г трет-бутоксида калия. Смесь дополнительно перемешивали при комнатной температуре в течение 12 часов. Затем реакционную смесь выливали в воду с последующей экстракцией трет-бутилметиловым эфиром. Органический слой промывали водой, насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле, получая 1,31 г (3,4,4-трифтор-3-бутенил)малононитрила (промежуточное соединение (17)).
Выход: 26%.
Ссылочный пример получения 12
С использованием 4,0 г (4-(трифторметокси)бензилиден)малононитрила, 30 мл тетрагидрофурана, 175 мг диметилсульфидного комплекса бромида меди (I) и 26 мл раствора (0,98 М) винилмагний бромида в тетрагидрофуране и в соответствии со способом, описанным в ссылочном примере получения 2, получали 1,60 г (1-(4-трифторметоксифенил)-2-пропенилмалононитрила (промежуточное соединение (18)).
Ссылочный пример получения 13
Первоначально 27,6 г малононитрила растворяли в 50 мл N,N-диметилформамида и добавляли при комнатной температуре 27,6 г карбоната калия с последующим перемешиванием в течение 1 часа. Затем медленно добавляли по каплям раствор 17,7 г 1-бром-3,3, 3-трифторпропана, растворенного в 20 мл N,N-диметилформамида, с последующим перемешиванием в течение 1 часа. Затем к реакционной смеси добавляли воду и смесь экстрагировали диэтиловым эфиром. Органический слой последовательно промывали водой, насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле, получая 11,3 г (3,3,3-трифторпропил)малононитрила (промежуточное соединение (16)).
Выход: 68%.
Ссылочный пример получения 14
Первоначально 20 мл тетрагидрофурана медленно добавляли по каплям к смеси 0,50 г дигидротетракис(трифенилфосфин)рутения и 3,00 г (4-(трифторметил)бензил)малононитрила в атмосфере азота с последующим перемешиванием в течение 15 минут. Затем медленно добавляли по каплям 0,82 г акролеина с последующим перемешиванием в течение 1 часа при комнатной температуре и затем растворитель отгоняли. Остаток подвергали колоночной хроматографии на силикагеле, получая 1,58 г 2-(2-формилэтил)-2-(4-трифторметил)бензил)малононитрила (промежуточное соединение (19)).
Выход: 42%.
Ссылочный пример получения 15
Первоначально 0,01 г боргидрида натрия добавляли к раствору 0,30 г 2-(2-формилэтил)-2-(4-трифторметил)бензил)малононитрила (промежуточное соединение (19)) в этаноле при 0°С с последующим перемешиванием в течение 5 часов при комнатной температуре. Затем к реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле, получая 0,19 г 2-(3-гидроксипропил)-2-(4-трифторметил)бензил)малононитрила (промежуточное соединение (20)).
Выход: 61%.
Ссылочный пример получения 16
С использованием 1,42 г (2,4,6-трифторбензилиден)малононитрила, 50 мл этанола и 0,08 г боргидрида натрия и в соответствии со способом, описанным в ссылочном примере получения 3, получали 1,29 г (2,4,6-трифторбензил)малононитрила (промежуточное соединение (21)).
Выход: 90%.
Ссылочный пример получения 17
С использованием 10,0 г (3,4-дифторбензилиден)малононитрила, 200 мл этанола и 0,6 г боргидрида натрия и в соответствии со способом, описанным в ссылочном примере получения 3, получали 8,05 г (3,4-дифторбензил)малононитрила (промежуточное соединение (23)).
Выход: 80%.
Ссылочный пример получения 18
С использованием 10,0 г (2-хлор-4-фторбензилиден)малононитрила, 200 мл этанола и 0,6 г боргидрида натрия и в соответствии со способом, описанным в ссылочном примере получения 3, получали 0,55 г (2-хлор-4-фторбензил)малононитрила (промежуточное соединение (24)).
Выход: 53%.
Ссылочный пример получения 19
Первоначально 0,93 г 3-бромбензальдегида и 0,33 г малононитрила растворяли в 5 мл этанола, к смеси добавляли 1,5 мл воды с последующим перемешиванием при комнатной температуре в течение 4 часов. Затем, после охлаждения до -5°С добавляли по каплям суспензию 57 мг боргидрида натрия в 3 мл этанола с последующим перемешиванием при -5°С в течение 30 минут. К реакционной смеси добавляли 10%-ную соляную кислоту и смесь экстрагировали этилацетатом. Органический слой промывали водой, сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле, получая 0,94 г (3-бромбензил)малононитрила (промежуточное соединение (28)).
Выход: 83%.
Ссылочный пример получения 20
С использованием 1,02 г 2-фтор-4-бромбензальдегида, 0,33 г малононитрила, 8 мл этанола, 1,5 мл воды и 57 мг боргидрида натрия и в соответствии со способом, описанным в ссылочном примере получения 19, получали 1,21 г (2-фтор-4-бромбензил)малононитрила (промежуточное соединение (29)).
Выход: 95%.
Ссылочный пример получения 21
С использованием 1,06 г (3-бензилокси)бензальдегида, 0,33 г малононитрила, 8 мл этанола, 1,5 мл воды и 57 мг боргидрида натрия и в соответствии со способом, описанным в ссылочном примере получения 19, получали 1,20 г (3-бензилокси)бензил)малононитрила (промежуточное соединение (31)).
Выход: 92%.
Ссылочный пример получения 22
С использованием 1,0 г (2, 6-дихлор-4-(трифторметил)бензилиден)малононитрила, 20 мл этанола и 0,03 г боргидрида натрия и в соответствии со способом, описанным в ссылочном примере получения 3, получали 0,97 г (2, 6-дихлор-4-(трифторметил)бензил)малононитрила (промежуточное соединение (32)).
Выход: 90%.
Промежуточные соединения, использованные при получении соединений, показаны ниже с соответствующими номерами соединений и физическими данными.
Промежуточное соединение (1)
(4-Хлорбензил)малононитрил

т.пл.: 96,9°C.
Промежуточное соединение (2)
(1-(4-Хлорфенил-1-метилэтил)малононитрил

nD22,0: 1,5372.
Промежуточное соединение (3)
(1-(4-Хлорфенил)-2-метилпропил)малононитрил

nD21,5: 1,5289
Промежуточное соединение (4)
(4- (Трифторметил)бензил)малононитрил

т.пл.: 79,1°C.
Промежуточное соединение (5)
(4-Цианобензил)малононитрил

т.пл.: 118,7°C.
Промежуточное соединение (6)
(1-(4-Хлорфенил)этил)малононитрил

nD24,5: 1,5349.
Промежуточное соединение (7)
(4-(Трифторметокси)бензил)малононитрил

т.пл.: 88,3°C.
Промежуточное соединение (8)
(1-(4-(Трифторметокси)фенил-2-метилпропил)малононитрил
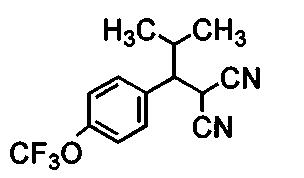
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 0,83 (3H, д), 1,16 (3H, д), 2,29-2,45 (1H, м), 2,87 (1H, дд), 4,18 (1H, д), 7,25-7,30 (2H, м), 7,38-7,42 (2H, м).
Промежуточное соединение (9)
(4-Бромбензил)малононитрил

т.пл.: 97,7°C.
Промежуточное соединение (10)
(1-(4-(Трифторметокси)фенил)этил)малононитрил

1H-ЯМР (CDCl3, TMC, δ (м.д.)): 1,65 (3H, д), 3,49 (1H, дк), 3,85 (1H, д), 7,24-7,29 (2H, м), 7,38-7,42 (2H, м).
Промежуточное соединение (11)
(4-Фторбензил)малононитрил

т.пл.: 117,2° C.
Промежуточное соединение (12)
(3,4-Дихлорбензил)малононитрил

т.пл.: 83,3°C.
Промежуточное соединение (13)
(2,4-Дихлорбензил)малононитрил

т.пл.: 62,5°C.
Промежуточное соединение (14)
(4-(Трифторметилтио)бензилмалононитрил

1H-ЯМР (CDCl3, TMC, δ (м.д.)): 3,15 (2H, д), 3,95 (1H, т), 7,37 (2H, д), 7,70 (2H, д).
Промежуточное соединение (15)
Бензилмалононитрил

т.пл.: 89,1°С.
Промежуточное соединение (16)
(3,3,3-Трифторпропил)малононитрил

1H-ЯМР (CDCl3, ТМС, δ (м.д.)): 2,32-2,42 (2Н, м), 2,43-2,52 (2Н, м), 3, 91 (1Н, т).
Промежуточное соединение (17)
(3,4,4-Трифтор-3-бутенил)малононитрил

1H-ЯМР (CDCl3, ТМС, δ (м.д.)): 1,18-1,28 (1Н, м), 2,27-2,34 (2Н, м), 2,58-2,72 (2Н, м), 3,88 (1Н, т).
Промежуточное соединение (18)
(1-(4-Трифторметоксифенил)-2-пропенил)малононитрил

1H-ЯМР (CDCl3, ТМС, δ (м.д.)): 3,95-4,03 (2Н, м), 5,40-5,53 (2Н, м), 6,08-6,19 (1Н, м), 7,28 (2Н, д), 7,39 (2Н, д).
Промежуточное соединение (19)
2-(2-Формилэтил)-2-(4-(трифторметил)бензил)малононитрил

1H-ЯМР (CDCl3, TMC, δ (м.д.)): 2,35 (2Н, т), 2,94 (2Н, т), 3,30 (2Н, с), 7,53 (2Н, д), 7,69 (2Н, д), 9,82 (1Н, с).
Промежуточное соединение (20)
2-(3-Гидроксипропил)-2-(4-(трифторметил)бензил)малононитрил

1H-ЯМР (CDCl3, TMC, δ (м.д.)): 1,94-2,01 (2Н, м), 2,12-2,17 (3Н, м), 3,28 (2Н, с), 3,74 (2Н, т), 7,53 (2Н, д), 7,67 (2Н, д).
Промежуточное соединение (21)
(2,4,6-Трифторбензил)малононитрил

1 H-ЯМР (CDCl3, TMC, δ (м.д.)): 3,41 (2Н, д), 4,03 (1Н, т), 6,79 (2Н, дд).
Промежуточное соединение (22)
(4-Нитробензил)малононитрил

т.пл.: 155,7°C.
Промежуточное соединение (23)
(3, 4-Дифторбензил)малононитрил

1H-ЯМР (CDCl3, TMC, δ (м.д.)): 3,28 (2Н, д), 3,94 (1Н, т), 7,06-7,24 (3Н, м).
Промежуточное соединение (24)
(2-Хлор-4-фторбензил)малононитрил

1H-ЯМР (CDCl3, TMC, δ (м.д.)): 3,36 (2Н, д), 3,97 (1Н, т), 6,97 (1Н, дд), 7,13 (1Н, дд), 7,29 (1Н, дд).
Промежуточное соединение (25)
(4-Метоксибензил)малононитрил

т.пл.: 89,6°C.
Промежуточное соединение (26)
(1-(4-Трифторметил)фенил)этил)малононитрил

1H-ЯМР (CDCl3, TMC, δ (м.д.)): 1,68 (3Н, д), 3,53 (1Н, дкв), 3,89 (1Н, д), 7,68 (2Н, д), 7,89 (2Н, д).
Промежуточное соединение (27)
(3-Хлорбензил)малононитрил

nD19,5: 1,5403.
Промежуточное соединение (28)
(3-Бромбензил)малононитрил

1H-ЯМР (CDCl3, TMC, δ (м.д.)): 3,26 (2Н, д), 3,93 (1Н, т), 7,26-7,30 (2Н, м), 7,48 (1Н, уш.с), 7, 51-7,55 (1Н, м).
Промежуточное соединение (29)
(2-Фтор-4-бромбензил)малононитрил
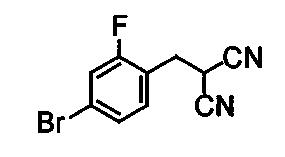
1H-ЯМР (CDCl3, TMC, δ (м.д.)): 3,98 (1Н, т), 7,23 (1Н, д), 7,32-7,38 (2Н, м).
Промежуточное соединение (30)
(2-Бромбензил)малононитрил

1H-ЯМР (CDCl3, TMC, δ (м.д.)): 3,45 (2Н, д), 4,15 (1Н, т), 7,23-7,29 (1Н, м), 7,35-7,42 (2Н, м), 7,62 (1Н, д).
Промежуточное соединение (31)
(3-(бензилокси)бензилмалононитрил

1H-ЯМР (CDCl3, TMC, δ (м.д.)): 3,24 (2Н, д), 3,88 (1Н, т), 5,07 (2Н, с), 6,89-6,99 (3Н, м), 7,28-7,45 (6Н, м).
Промежуточное соединение (32)
(2, 6-Дихлор-4-(трифторметил)бензил)малононитрил

1H-ЯМР (CDCl3, TMC, δ (м.д.)): 3,78 (2Н, д), 4,23 (1Н, т), 7,68 (2Н, с).
Конкретные примеры настоящих соединений приведены в таблице 1 с соответствующими номерами соединений.
Таблица 1
Соединения формулы (Y):

Далее будут описаны некоторые примеры составов, где части представляют собой части по весу. Настоящие соединения обозначены под номерами соединений, показанными в таблице 1.
Пример состава 1
Девять частей каждого из настоящих соединений с (1) по (87) растворяли в 37,5 частях ксилола и 37,5 частях диметилформамида и добавляли 10 частей полиоксиэтиленстиролфенилового эфира, 6 частей додецилбензолсульфоната кальция с последующим тщательным перемешиванием и смешиванием, получая эмульгируемый концентрат каждого из соединений.
Пример состава 2
К 40 частям каждого из настоящих соединений с (1) по (87) добавляли 5 частей Sorpol® 5060 (Toho Chemical Industry Co., Ltd.) с последующим тщательным перемешиванием и добавляли 32 части Carplex® #80 (синтетический гидратированный тонкодисперсный порошок диоксида кремния; закуплен у Shionogi & Co., Ltd.) и 23 части диатомовой земли 300 меш, смесь перемешивали с использованием смесителя, получая смачиваемый порошок для каждого из соединений.
Пример состава 3
К 3 частям каждого из настоящих соединений с (1) по (87) добавляли 5 частей синтетического гидратированного тонкодисперсного порошка диоксида кремния, 5 частей додецилбензолсульфоната натрия, 30 частей бентонита и 57 частей глины с последующим тщательным перемешиванием и смешиванием, к этой смеси добавляли подходящее количество воды с последующим дополнительным перемешиванием, гранулированием с использованием гранулятора и сушкой на воздухе, получая гранулы для каждого из соединений.
Пример состава 4
Первоначально, тщательно перемешивали в ступке 4,5 части каждого из настоящих соединений с (1) по (87), 1 часть гидратированного тонкодисперсного порошка диоксида кремния, 1 часть Doriresu B (Sankyo Co., Ltd.) в качестве коагулянта и 7 частей глины с последующим перемешиванием и смешиванием с помощью смесителя. К полученной смеси добавляли 86,5 частей нарезанной глины с последующим перемешиванием и смешиванием, получая дуст для каждого из соединений.
Пример состава 5
Десять частей каждого из настоящих соединений с (1) по (87), 35 частей копировальной бумаги с белым покрытием, содержащей 50 частей аммониевой соли полиоксиэтиленалкилового эфирного сульфата и 55 частей воды смешивали и измельчали в порошок способом влажного размола, получая состав для каждого из соединений.
Пример состава 6
Первоначально 0,5 части каждого из настоящих соединений с (1) по (87) растворяли в 10 частях дихлорметана, который смешивали с 89,5 частями ISOPAR®М (изопарафин; Exxon Chemical Co.), получая масляный состав для каждого из соединений.
Пример состава 7
Первоначально 0,1 части настоящих соединений с (1) по (87) и 49,9 части NEO-CHIOZOL (Chuo Kasei K. K.) помещали в аэрозольный баллон, к которому присоединяли аэрозольный клапан. Затем баллон заполняли 25 частями диметилового эфира и 25 частями LPG с последующим встряхиванием и присоединеняли рукоятку, получая аэрозоль на масляной основе.
Пример состава 8
Первоначально смешивали с получением раствора 0,6 части каждого из настоящих соединений с (1) по (87), 0,01 части BHT, 5 частей ксилола, 3,39 части дезодорированного керосина и 1 часть эмульгатора (Atmos 300; Atmos Chemical Co.). Затем данный раствор и 50 частей дистиллированной воды помещали в аэрозольный баллон, к которому присоединяли клапан, и под давлением через клапан заполняли баллон 40 частями пропеллента (LPG), получая аэрозоль на водной основе.
Следующий пример испытаний демонстрирует, что настоящие соединения могут использоваться в качестве активных ингредиентов пестицидных композиций. Настоящие соединения обозначены под номерами соединений, показанными в таблице 1.
Пример испытания 1. Пестицидный тест против Nilaparvata lugens
Каждый состав соединений 2, 5, 7, 8, 9, 10, 11, 12, 13, 15, 16, 19, 21, 22, 23, 24, 25, 26, 27, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 43, 44, 46, 49, 50, 53, 55, 57, 58, 59, 61, 64, 66, 68, 72, 73, 74, 76, 78 и 89, полученный в соответствии с примером состава 5, разводили водой таким образом, чтобы концентрация активного ингредиента достигала 500 частей на миллион, для получения тест-жидкости для каждого соединения. И каждый состав соединений 17 и 76, полученный в соответствии с примером состава 5, разводили водой таким образом, чтобы концентрация активного ингредиента достигала 200 частей на миллион, для получения тест-жидкости для каждого соединения.
Пятьдесят граммов формовочного порошка Bonsoru 2 (закуплен у Sumitomo Chemical Co., Ltd.) помещали в полиэтиленовую чашку и высаживали в нее от 10 до 15 семян риса. Затем растения риса проращивали до стадии развития второго листа и затем подрезали растения до одинаковой высоты, составляющей 5 см. Тест-жидкости, которые были получены, как описано выше, распыляли на растения риса из расчета 20 мл/чашку. После того как тест-жидкость, распыленная на растения риса высохла, полиэтиленовую чашку с растениями риса помещали в большую полиэтиленовую чашку и в нее помещали свободно 30 личинок Nilaparvata lugens первой возрастной стадии (коричневая дельфацида). Большую полиэтиленовую чашку затем держали накрытой и оставляли в теплице при 25°C. На 6-й день после высвобождения личинок Nilaparvata lugens исследовали число Nilaparvata lugens, паразитирующих на растениях риса.
В результате при обработке каждым из описанных выше соединений число паразитов-вредителей на 6-й день после обработки не превышало 3.
Пример испытания 2. Пестицидный тест против Nilaparvata lugens.
Каждый состав соединений 5, 8, 9, 10, 11, 12, 13, 15, 16, 18, 19, 21, 22, 23, 27, 31, 33, 34, 36, 37, 39, 40, 41, 44, 49, 50, 57, 68, 72, 73, 74, 77 и 89, полученный в соответствии с примером состава 5, разводили водой таким образом, чтобы концентрация активного ингредиента достигала 45,5 частей на миллион, для получения тест-жидкости для каждого соединения. И каждый состав соединений 17, 26 и 76, полученный в соответствии с примером состава 5, разводили водой таким образом, чтобы концентрация активного ингредиента достигала 18,2 части на миллион, для получения тест-жидкости для каждого соединения.
Пятьдесят граммов формочного порошка Bonsoru 2 (закуплен у Sumitomo Chemical Co., Ltd.) помещали в полиэтиленовую чашку, имеющую пять отверстий диаметром 5 мм, и высаживали в нее от 10 до 15 семян риса. Затем растения риса проращивали до стадии развития второго листа и полиэтиленовую чашку с растениями риса помещали в большую чашку, содержащую 55 мм тест-жидкости, полученной как описано выше. Растения риса оставляли в теплице при 25°C в течение 6 дней и затем подрезали растения на одной высоте, составляющей 5 см. Тридцать личинок Nilaparvata lugens (коричневая дельфацида) первой возрастной стадии помещали в большую чашку, которую затем держали накрытой и оставляли в теплице при 25°C. На 6-й день после высвобождения личинок Nilaparvata lugens исследовали число Nilaparvata lugens, паразитирующих на растениях риса.
В результате при обработке каждым из описанных выше соединений число паразитов-вредителей на 6-й день после обработки не превышало 3.
Пример испытания 3. Пестицидный тест против Aphis gossypii
Каждый состав соединений 8, 9, 10, 11, 13, 15, 16, 18, 19, 21, 22, 23, 24, 34, 39, 41, 46, 47, 50, 51, 52, 53, 57, 59, 64, 67, 69 и 74, полученный в соответствии с примером состава 5, разбавляли водой таким образом, чтобы концентрация активного ингредиента составляла 500 частей на миллион, для получения тест-жидкости каждого из соединений.
Семена огурца высаживали в полиэтиленовую чашку объемом 90 мл, наполненную формовочным порошком Aisai 1 (доступен от Katakura Chikkarin Co., Ltd.) и выращивали до стадии развития третьего листа. Примерно 30 Aphis gossypii (хлопковая тля) помещали для паразитирования на растения огурца, которые затем оставляли на 24 часа. Тест-жидкость распыляли из расчета 20 мл/чашку на растения огурца. После того как распыленная тест-жидкость высыхала, полиэтиленовые чашки с растениями огурца помещали в большую полиэтиленовую чашку, которую держали закрытой и оставляли в теплице при 25°C. На 6-й день после нанесения исследовали число Aphis gossypii.
В результате при обработке каждым из описанных выше соединений число выживших вредителей на 6-й день после обработки не превышало 3.
Пример испытания 4. Пестицидный тест против Eysarcoris lewisi
Каждый состав соединений 8, 9, 10, 11, 14, 21, 22, 23, 39, 50, 74 и 76, полученный в соответствии с примером состава 1, разбавляли водой таким образом, чтобы концентрация активного ингредиента составляла 100 частей на миллион, для получения тест-жидкости каждого из соединений.
Затем 3-5 семян арахиса погружали на 1 минуту в тест-жидкость, которую получали, как описано выше. После того как тест-жидкость, которой обрабатывали семена арахиса, высушивали бумажным полотенцем, фильтровальную бумагу, увлажненную 1 мл воды помещали на дно полиэтиленовой чашки и помещали на нее семена арахиса. От шести до восьми взрослых особей Eysarcoris lewisi свободно оставляли в полиэтиленовой чашке, которую затем держали закрытой в теплице при 25°C. На 7-й день после высвобождения Eysarcoris lewisi подсчитывали число мертвых вредителей и умирающих вредителей.
В результате при обработке каждым из описанных выше соединений степень мертвых и умирающих вредителей составила 100%.
Пример испытания 5. Пестицидный тест против Lepitinotarsa decemlineata
Каждый состав соединений 5, 8, 10, 15, 21, 50, 74, 76 и 78, полученный в соответствии с примером состава 1, разбавляли водой таким образом, чтобы концентрация активного ингредиента составляла 1,6 части на миллион, для получения тест-жидкости каждого из соединений.
Лист баклажана погружали на 1 минуту в тест-жидкость, которую получали, как описано выше. После того как тест-жидкость, которой обрабатывали семена арахиса, высушивали бумажным полотенцем, лист баклажана помещали в полиэтиленовую чашку диаметром 3 см. Одну личинку второй стадии зрелости Lepitinotarsa decemlineata (колорадский картофельный жук) свободно оставляли в полиэтиленовой чашке, которую затем держали закрытой в теплице при 25°C. Этот тест проводили десять раз для одного соединения. На 5-й день после высвобождения Lepitinotarsa decemlineata исследовали число умерших вредителей и умирающих вредителей.
В результате при обработке каждым из описанных выше соединений степень мертвых и умирающих вредителей превышала 80%.
Пример испытания 6. Пестицидный тест против Musca domestica.
Каждый состав соединений 4, 5, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16,18,19, 21, 22, 23, 26, 27, 31 33, 34, 35, 36, 39, 42, 44, 45, 46, 49, 50, 53, 54, 57, 59, 71, 72 73, 74, 77, 78, 79, 88 и 89, полученный в соответствии с примером состава 5, разбавляли водой таким образом, чтобы концентрация активного ингредиента составляла 500 частей на миллион, для получения тест-жидкости каждого из соединений.
На дно полиэтиленовой чашки диаметром 5,5 см помещали фильтровальную бумагу того же размера, на которую добавляли по каплям в количестве 0,7 мл тест-жидкость, полученную, как описано выше, и помещали на нее 30 мг сахарозы в качестве приманки. Десять взрослых самок Musca domestica (домашняя муха) свободно оставляли в полиэтиленовой чашке, которую затем держали закрытой. Через 24 часа определяли выживаемость мух для определения смертности.
В результате при обработке каждым из описанных выше соединений смертность составила 100%.
Пример испытания 7. Пестицидный тест против Blattalla germanica
Каждый состав соединений 4, 5, 6, 7, 8, 9, 10, 11, 13, 15, 16, 17, 19, 21, 22, 23, 26, 31, 34, 36, 39, 42, 44, 49, 50, 54, 57, 62, 70, 72, 73, 74, 77 и 80, полученный в соответствии с примером состава 5, разбавляли водой таким образом, чтобы концентрация активного ингредиента составляла 500 частей на миллион, для получения тест-жидкости каждого из соединений.
На дно полиэтиленовой чашки диаметром 5,5 см помещали фильтровальную бумагу того же размера, на которую добавляли по каплям в количестве 0,7 мл тест-жидкость, полученную как описано выше, и помещали на нее 30 мг сахарозы в качестве приманки. Два взрослых самца Blattella germanica (таракан рыжий) помещали в полиэтиленовую чашку, которую затем держали закрытой. Через 6 дней определяли выживаемость для определения смертности.
В результате при обработке каждым из описанных выше соединений смертность составила 100%.
Пример испытания 8. Пестицидный тест против Cullex pipiens pallens
Каждый состав соединений 1, 2, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 42, 43, 44, 46, 49, 50, 54, 55, 56, 57, 59, 62, 64, 66, 68, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88 и 89, полученный в соответствии с примером состава 5, разбавляли водой таким образом, чтобы концентрация активного ингредиента составляла 500 частей на миллион, для получения тест-жидкости каждого из соединений.
К 100 мл ионообменной воды добавляли по каплям в количестве 0,7 мл тест-жидкость, полученную, как описано выше. Концентрация активного ингредиента составляла 3,5 части на миллион. Двадцать личинок конечной стадии Cullex pipiens pallens (комар обыкновенный) оставляли свободно в этом растворе. Через 1 день определяли выживаемость для определения смертности.
В результате при обработке каждым из описанных выше соединений смертность составила более 90%.
Пример испытания 9. Пестицидный тест против Cenocephalides felis
Каждый состав соединений 8, 15, 19, 21 и 34 растворяли в ацетоне, получая 0,2 мл раствора с концентрацией 0,114% вес./вес., которым равномерно обрабатывали фильтровальную бумагу, имеющую диаметр 3,8 см, и высушивали на воздухе. Количество активного ингредиента составляло 200 мг/м2 . Фильтровальную бумагу помещали в крышку стеклянной бутылки емкостью 200 мл. Двадцать взрослых Cenocephalides felis (блоха кошачья) выпускали в стеклянную бутылку, которую затем закрывали крышкой. Стеклянную бутылку переворачивали, чтобы обеспечить контакт блох с фильтровальной бумагой. Через 24 часа определяли смертность.
В результате при обработке каждым из описанных выше соединений смертность составила 100%.
Промышленная применимость
Настоящее изобретение позволяет эффективно бороться с такими вредителями как насекомые-вредители, клещи-вредители и нематоды-вредители.
Реферат
Настоящее изобретение относится к новым соединениям малононитрила формулы (Y):

где R1 и R2 являются одинаковыми или различными и независимо представляют собой С1-С5(галоген)алкил или водород; R3 представляет собой C1-С3галогеналкил или С2-С4галогеналкенил; m представляет собой целое число от 1 до 3; R5 представляет собой галоген, нитро, С1-С4(галоген)алкил, С1-С4(галоген)алкилокси или бензилокси; n представляет собой целое число от 0 до 4; R6 представляет собой водород, галоген, циано, нитро, C1-С4(галоген)алкил, С2-С4(галоген)алкенил, С1-С4(галоген)алкилокси, C1-С4(галоген)алкилтио, С1-С4(галоген)алкилкарбонил, при условии, что когда n равно 2 или более, заместители R5 являются одинаковыми или отличаются друг от друга. Также изобретение относится к композиции для борьбы с насекомыми-вредителями, включающей соединение молононитрила по п.1 в качестве активного ингредиента и носитель; к способу борьбы с насекомыми-вредителями, включающему нанесение пестицидно эффективного количества соединения малононитрила по п.1 на насекомых-вредителей или места их обитания; к применению соединения малононитрила по п.1 в качестве активного ингредиента композиции для борьбы с насекомыми-вредителями. Кроме того, изобретение относится к новому промежуточному соединению для получения соединения формулы (Y) - (3,3,3-трифторпропил)малононитрила формулы:

5 н. и 5 з.п. ф-лы, 1 табл.
Формула


Документы, цитированные в отчёте о поиске
Способ получения натриевой соли 1-амино-1-цианамидо-2,2-дицианэтилена

Комментарии