Средства улучшения сайленсинга генов или его характеристик - RU2775479C2
Код документа: RU2775479C2
Чертежи


Описание
Настоящее изобретение относится к контролю экспрессии генов с помощью двухнитевой РНК. В частности, настоящее изобретение относится к способу повышения способности двухнитевой РНК, вводимой экзогенно, т.е. извне по отношению к организму-мишени и в относительно суровых условиях окружающей среды, осуществлять сайленсинг экспрессии генов в этом организме. Настоящее изобретение также относится к композициям для применения согласно способу и к применению согласно способу известных средств, которые обеспечивают "гашение" положительного заряда в комплексе, содержащем полинуклеотид, в частности, dsRNA, и катионный полимер.
Хорошо известно явление РНК-интерференции, потенциально способное обеспечивать сайленсинг экспрессии генов.
РНК является относительно нестабильной и может быстро разрушаться, например, с помощью рибонуклеаз, которые повсеместно присутствуют даже вне клеток. Проблема с применением dsRNA либо непосредственно в отношении организмов-мишеней, либо путем экзогенного введения в месторасположение, в котором они находятся, связана с плохой стабильностью РНК.
Под экзогенным применением подразумевают применение в отношении организма-мишени таким образом, что организм может включать ее в себя, или что dsRNA продуцируется первым организмом, который отличается от организма-мишени, и что организм-мишень включает в себя первый организм или его часть, содержащую dsRNA, так что, в любом случае, указанная dsRNA способна осуществлять посттранскрипционный сайленсинг гена, содержащего нуклеотидную последовательность, соответствующую нуклеотидной последовательности, содержащейся в dsRNA.
Экзогенное применение отличается от эндогенного продуцирования, под которым подразумевается продуцирование (как правило, посредством экспрессии соответствующей гетерологичной последовательности) в клетках организма-мишени двухнитевой РНК, способной к посттранскрипционному сайленсингу генов-мишеней.
При этом экзогенно применяемая dsRNA, как правило, способна оказывать соответствующий биологический эффект в течение короткого периода времени, возможно даже на протяжении нескольких дней после применения, этот эффект обычно быстро снижается при применении dsRNA, обычно имеющей период полужизни, составляющий, например, в почве меньше приблизительно 12-24 часов и дополнительно зависящий от определенных условий окружающей среды, в которую ее вводят.
Были предложены различные решения этой проблемы, в том числе стабилизация dsRNA посредством инкапсулирования или обеспечиваемого иным образом связывания ее с полимером, который повышает ее стабильность, за счет чего обеспечивается увеличенная продолжительность действия. Такая стабилизированная dsRNA, тем не менее, не лишена своих собственных недостатков, поскольку комплекс, образованный между ней и катионным полимером, может быть связан или иным образом связывается с заряженными частицами, присутствующими в месторасположении или в его области, что обеспечивает снижение его доступности или препятствует перемещению комплекса через месторасположение и, как правило, к участку, в котором расположен организм-мишень. Этот недостаток усугубляется перемещением организмов-мишеней от участка, по отношению к которому изначально применяли dsRNA.
Таким образом, настоящее изобретение относится к решению проблемы, с одной стороны, стабилизации dsRNA в достаточной степени, чтобы обеспечить оказание ею необходимых биологических эффектов, и, с другой стороны, обеспечения возможности таким образом стабилизированной dsRNA оставаться доступной или перемещаться или быть перемещаемой в пределах месторасположения, в котором или в области которого расположен организм-мишень.
Согласно настоящему изобретению представлен способ подавления или, по существу, уменьшения связывания композиции, содержащей комплекс, образованный между катионным полимером и полинуклеотидом, с отрицательно заряженными молекулами, присутствующие в почве, предусматривающий включение в композицию гасящего средства, способного, по существу, нейтрализовать положительные заряды комплекса.
В особенно предпочтительном варианте осуществления композиции по настоящему изобретению полинуклеотид представляет собой dsRNA, полимер представляет собой полиамин, и гасящее средство представляет собой моноальдегид или моноэпоксид.
В особенно предпочтительном варианте осуществления настоящего изобретения полимер представляет собой линейный или разветвленный полиэтиленимин, полипептид или катионный полисахарид.
В особенно предпочтительном варианте осуществления настоящего изобретения полимер представляет собой линейный или разветвленный полиэтиленимин.
В особенно предпочтительном варианте осуществления настоящего изобретения отрицательно заряженные частицы предусматривают гуминовую кислоту.
Настоящее изобретение также предусматривает способ контроля заражения подземными вредителями растений, включающий обеспечение
a) композиции, содержащей комплекс, образованный между катионным полимером и dsRNA,
b) по существу, нейтрализации положительных зарядов наружной поверхности комплекса из а) с помощью гасящего средства и
c) применения композиции из b) по отношению к почве,
где dsRNA обеспечивает посттранскрипционный сайленсинг гена-мишени в указанном подземном вредителе растений.
Подземные вредители растений включают тех вредителей, которые пребывают в почве на протяжении по меньшей мере части своего жизненного цикла, например, на стадии личинки.
Подземные вредители включают вредителей из группы, состоящей из Diabrotica virgifera virgifera (западный кукурузный жук), Diabrotica barberi (северный кукурузный жук), Diabrotica undecimpunctata howardi (южный кукурузный жук), Diabrotica virgifera zeae (мексиканский кукурузный жук), Diabrotica speciosa (тыквенный жук), нематод, проволочников, и червовидных личинок, и соответствующих почвенных патогенов, таких как бактерии и грибы.
Предпочтительно подземный вредитель относится к виду из рода Diabrotica.
Настоящее изобретение также предусматривает применение гасящего средства для нейтрализации, по существу, остаточных положительно заряженных групп в комплексе, содержащем полинуклеотид и катионный полимер.
Настоящее изобретение также предусматривает композицию, содержащую комплекс, образованный между катионным полимером и полинуклеотидом, и гасящее средство, способное, по существу, нейтрализовать остаточные положительно заряженные группы наружной поверхности комплекса, где полимер выбран из группы, состоящей из разветвленного или линейного полиэтиленимина, имидазолсодержащих полимеров, хитозанов, катионных полисахаридов, полиамидоаминов, полимеров и сополимеров аминокислот, таких как лизин, гистидин и аргинин, которые содержат аминогруппы, и полиаминов.
В особенно предпочтительном варианте осуществления настоящего изобретения катионный полимер, присутствующий в композиции, представляет собой разветвленный или линейный полиэтиленимин.
Под "комплексом" понимают молекулярную структуру, образованную путем свободной ассоциации, предусматривающую две или больше составных молекулярных структур (ионных или незаряженных).
Если катионный полимер и полинуклеотид образуют комплекс, суммарный отрицательный заряд на полинуклеотиде может быть недостаточным для противодействия или "нейтрализации" всех положительно заряженных групп наружной поверхности катионного полимера, в результате чего комплекс содержит остаточные положительно заряженные группы наружной поверхности.
Полинуклеотид по настоящему изобретению может представлять собой РНК. РНК может представлять собой dsRNA, но она также может представлять собой siRNA, miRNA или любую другую молекулу РНК, способную обеспечивать сайленсинг генов с помощью RNAi. Предпочтительно полинуклеотид представляет собой dsRNA.
Предпочтительно dsRNA содержит по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19, по меньшей мере 20, по меньшей мере 21, по меньшей мере 22, по меньшей мере 23, по меньшей мере 24, по меньшей мере 25, по меньшей мере 30, по меньшей мере 35, по меньшей мере 40, по меньшей мере 45, по меньшей мере 50 или больше нуклеотидов, которые идентичны или комплементарны гену-мишени в организме-мишени.
Подходящие гены-мишени представляют собой таковые, в которых посттранскрипционный сайленсинг характеризуется негативным воздействием на организм-мишень. Например, изменение роста, остановка роста, повышенная смертность, снижение репродуктивной способности или снижение плодовитости, снижение проявления или приостановка поведения или перемещения с целью питания или снижение проявления или приостановка развития, представляющего собой стадию метаморфоза.
Катионный полимер можно выбирать из группы, состоящей из разветвленного или линейного полиэтиленимина, имидазолсодержащих полимеров, хитозанов, катионных полисахаридов, полиамидоаминов и полимеров аминокислот, таких как лизин и аргинин, которые содержат третичные аминогруппы. В качестве альтернативы катионный полимер может представлять собой полиамин или разветвленный полиамин, содержащий по меньшей мере 5 аминогрупп. Простые полиамины, такие как спермин, спермидин, путресцин и кадаверин, не являются особенно предпочтительными в случае, если полинуклеотид представляет собой dsRNA, поскольку применение гасящего средства для нейтрализации любого остаточного заряда комплекса, образованного между таким простым полиамином и dsRNA, может вызывать разъединение комплекса.
В предпочтительном варианте осуществления композиции комплекс содержится в клеточном лизате или образуется внутри интактных клеток, и к нему добавляют гасящее средство.
В отношении гасящего средства что угодно, что содержит одну группу, которая способна к осуществлению реакции с амином с гашением положительного заряда на нем, является достаточным, хотя некоторые средства являются предпочтительными, в том числе изоцианаты, моноэпоксиды, сложные моноэфиры, монокарбоновые кислоты, моноангидриды, моноальдегиды и пирокарбонаты.
Однако особенно предпочтительное гасящее средство представляет собой моноальдегид или моноэпоксид. Моноальдегид может быть водорастворимым или нерастворимым в воде. Водорастворимые моноальдегиды, присутствующие в композиции по настоящему изобретению, включают метаналь, этаналь, пропаналь, бутаналь, пентаналь и гексаналь. Предпочтительные водонерастворимые моноальдегиды включают гептаналь, октаналь и деканаль. Предпочтительные моноэпоксиды включают глицидиловый эфир полиэтиленгликоля со степенью полимеризации, варьирующейся от 1 до приблизительно 10.
Гасящее средство должно присутствовать в композиции в количестве, достаточном для гашения, по существу, любых остаточных положительно заряженных групп наружной поверхности в комплексе, так что комплекс практически не связывается с отрицательно заряженными частицами, такими как присутствующие в почве, примером которых является гуминовая кислота. Квалифицированный специалист в области химических составов способен легко определить, какими являются эти количества, но, как правило, они присутствуют в композиции в таком количестве, что количество молей моновалентного гасящего средства равняется от приблизительно 10% до приблизительно 190% от количества молей амина, присутствующего в комплексе (учитывая, что первичные амины являются бивалентными в случае реакций гашения, тогда как вторичные амины являются моновалентными).
В случае если полинуклеотид представляет собой dsRNA, он содержит последовательность, которая, по существу, идентична последовательности mRNA гена в эукариотической клетке. В частности, эукариотным организмом может быть насекомое, выбранное из группы, состоящей из Diabrotica virgifera virgifera (западный кукурузный жук), Diabrotica barberi (северный кукурузный жук), Diabrotica undecimpunctata howardi (южный кукурузный жук), Diabrotica virgifera zeae (мексиканский кукурузный жук), Diabrotica speciosa (тыквенный жук), нематод, проволочников, и червовидных личинок, и соответствующих почвенных патогенов, таких как бактерии и грибы. Нейтрализация остаточного положительного заряда в комплексе, содержащем полинуклеотид и катионный полимер, позволяет комплексу перемещаться более свободно по субстрату, который содержит молекулы с отрицательным зарядом, в отношении которого применяют комплекс, или через него.
Хорошо известно, что контроль кукурузных корневых червей не обязательно является полностью эффективным, если композиция, содержащая инсектицидное средство, применяется в отношении месторасположения, которое предусматривает личинку корневого червя как часть экосистемы почвы. Одной возможной причиной является то, что доступность или перемещение инсектицидной композиции через почву может быть затруднено электростатическими и/или другими связывающими взаимодействиями между активным ингредиентом и/или инсектицидным составом в целом и заряженными компонентами почвы, в отношении которой ее применяют. Под "доступностью" понимают, что активный ингредиент пребывает в водной фазе почвы вместо адсорбирования твердыми компонентами.
Настоящее изобретение будет более очевидным из следующего(-их) неограничивающего(-их) примера(-ов).
Используются следующие сокращения: - % вес/вес=процентная доля в виде функции от общего веса;
ODU=единицы оптической плотности (поглощение при 600 нм);
PBS-буфер=буфер, представляющий собой фосфатно-буферный солевой раствор;
BPEI, 25 кДа=разветвленный полиэтиленимин с молекулярным весом 25 кДа (25000 г/моль).
Пример 1.
Контрольный образец А. 10 мкл IVT-dsRNA при номинальной концентрации 1 мг/мл объединяли с 13 мкл 10% раствора bPEI (разветвленный полиэтиленимин), 60 кДа, в PBS-буфере. Полученное разбавляли до 500 мкл общего объема в PBS, затем объединяли с 10 мг коллоидного диоксида кремния [Aerosil 200, Evonik]. Образец вращали в течение короткого времени в центрифуге при 2000 об./мин. и собирали надосадочную жидкость. Добавляли 1 мкл 1% Na-соли гепарина для разъединения каждого комплекса bPEI-dsRNA. При пропускании через гель для электрофореза не была видна полоса, соответствующая dsRNA, что указывало на то, что все из комплексов связались с коллоидным диоксидом кремния.
Тестовый образец В. Этот образец получали тем же способом, что и контрольный образец А, за исключением того, что перед объединением с коллоидным диоксидом кремния добавляли 25 мкл 10% раствора пентаналя в PBS-буфере для гашения и обеспечивали осуществление реакции при условиях окружающей среды в течение 1 часа. В этом случае была видимой полоса, которая соответствовала свободной dsRNA, и интенсивность полосы указывала на то, что приблизительно 25% общей dsRNA не связалось с коллоидным диоксидом кремния в форме комплекса bPEI-dsRN.
Пример 2.
Покрытые PEI (=полиэтиленимин) клетки могут обеспечивать повышение стабильности dsRNA в почве. Однако покрытие клеток с помощью PEI может привести к сильному адсорбированию клеток почвой в силу взаимодействия аминогрупп с кислотными группами в почве. Это может ухудшать мобильность в почве и доставку dsRNA к CRW. Путем осуществления реакции покрытия PEI с глутаральдегидом или моноальдегидом (пентаналь) свободные аминогруппы на PEI можно гасить, так что их взаимодействие с почвой снижается. Однако гашение с помощью глутаральдегида приводит в некоторой степени к флокуляции, что может ослаблять мобильность в почве. Как показано ниже, обработка моноальдегидом не приводит к флокуляции и, таким образом, может быть предпочтительным способом гашения свободных аминов.
1. Интактные клетки (предварительно обработанные 0,002% вес/вес на ODU глутаральдегидом и затем промытые) ресуспендировали при 12 ODU/мл в PBS-буфере и разделяли на аликвоты по 1 мл.
2. Получали растворы BPEI, 25 кДа, при концентрации 2% вес/вес BPEI (рН ~11) и при концентрации 1,25% вес/вес BPEI (рН~7).
3. Каждую аликвоту интактных клеток обрабатывали, как приведено ниже, растворами BPEI и записывали наблюдения.
Аликвота 1. Добавляли BPEI (рН 11) до конечной концентрации BPEI, составляющей 0,1% вес/вес, затем обрабатывали 0,2% глутаральдегида. Наблюдали мгновенную сильную флокуляцию.
Аликвота 2. Добавляли BPEI (рН 11) до конечной концентрации BPEI, составляющей 0,1% вес/вес, затем обрабатывали 0,2% пентаналя. Флокуляции не наблюдали.
Аликвота 3. Добавляли BPEI (рН 7) до конечной концентрации BPEI, составляющей 0,1% вес/вес, затем обрабатывали 0,2% глутаральдегида. Наблюдали мгновенную флокуляцию, не такую сильную, как в случае с аликвотой 1, размер частиц хлопьев был меньше при визуальной оценке.
Аликвота 4. Добавляли BPEI (рН 7) до конечной концентрации BPEI, составляющей 0,1% вес/вес, затем обрабатывали 0,2% пентаналя. Флокуляции не наблюдали.
Пример 3.
Модификация полиэтиленимина (PEI)
Пегилирование PEI с помощью эпоксифункционализированного PEG
Диглицидиловый эфир PEG (500D) сначала гасили с помощью Трис-HCl (рН 7) для достижения гашения половины эпоксигрупп в дифункционализированном PEG с получением монофункционализированного PEG. Это осуществляли путем смешивания диглицидилового эфира PEG 20% раствора Трис-HCl (рН 7) в соотношении, обеспечивающем достижение реакции с половиной эпоксигрупп на PEG, с последующей инкубацией в течение ночи при повышенной температуре. Монофункционализированный PEG, полученный таким образом, смешивали с раствором разветвленного PEI (значение рН доводили до 7) при соотношениях, обеспечивающих достижение различных уровней пегилирования первичных аминов на PEI (номинальное достижение 30%, 60% и 90% гашения первичных аминов). Фактическую степень гашения первичных аминов на PEI определяли путем выполнения колориметрического анализа с применением TNBSA (2,4,6-тринитробензолсульфоновой кислоты). Фактические полученные уровни пегилирования были следующими (таблица 1) и, как ожидалось, несколько отличались от номинальной цели по нескольким возможным причинам, включая то, что превращение дифункционального PEG в монофункциональный не было специфической реакцией, и вследствие стерического затруднения, блокирующего доступность первичных аминов. Различие между номинальной и фактической степенью гашения не влияет на исход эксперимента, поскольку было запланировано перекрыть диапазон фактической степени гашения.
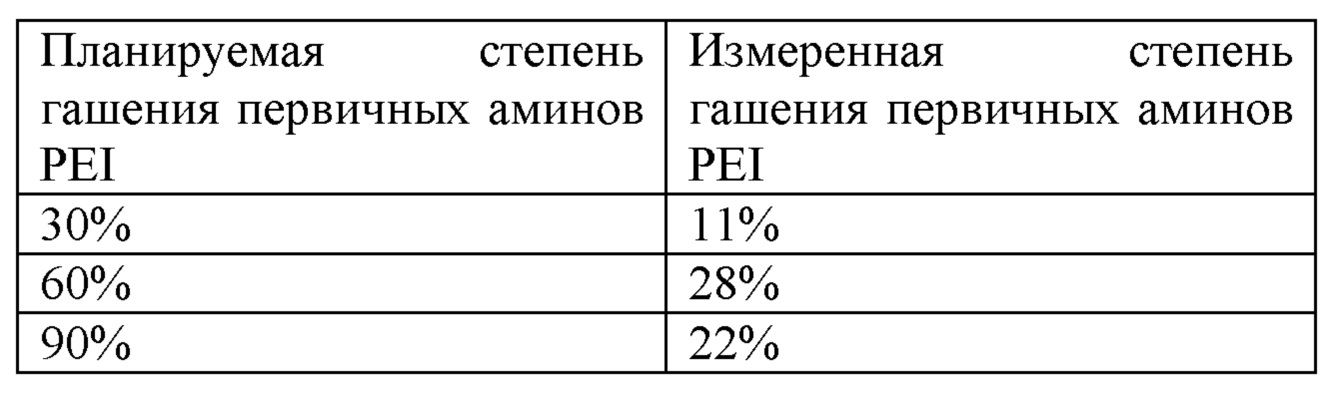
Таблица 1
Модификация PEI с помощью диэтилпирокарбоната
Первичные аминогруппы на PEI гасили с помощью осуществления реакции с диэтилпирокарбонатом (DEPC) путем непосредственного добавления DEPC к растворам PEI, доведенным до значения рН 7, для достижения разных уровней гашения первичных аминов с помощью DEPC (в частности, достижения 25%, 50% и 75% гашения). Фактическую степень гашения первичных аминов на PEI определяли путем выполнения колориметрического анализа с применением TNBSA (2,4,6-тринитробензолсульфоновой кислоты). Фактические уровни модификации с помощью DEPC измеряли следующим образом (таблица 2), и, как отмечалось выше, несоответствие между планируемой и фактической степенью гашения не влияет на исход эксперимента.
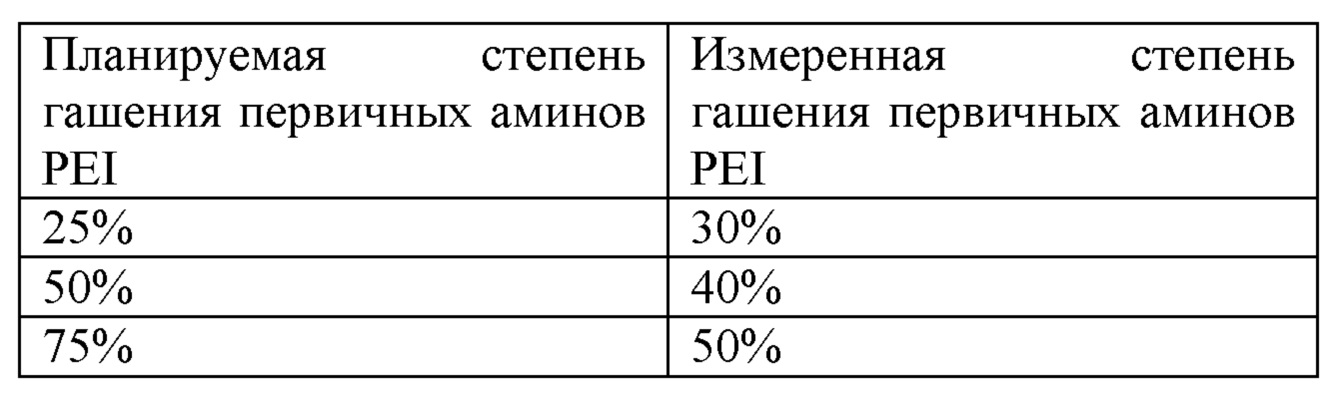
Таблица 2
Пример 4.
Оценка значений аффинности связывания модифицированного по сравнению с немодифицированным PEI в отношении почвы
Растворы немодифицированного PEI и растворы PEI, модифицированного с помощью пегилирования или DEPC, инкубировали с почвой в соотношении вес/вес 2:1 (раствор: почва) в течение 1 часа. Концентрации тестовых растворов варьировали от 0 до 0,08% PEI. После инкубации с почвой почву отделяли от растворов PEI путем центрифугирования. Несвязанный PEI, оставшийся в растворе, оценивали с помощью анализа с применением TNBSA. Профиль связывания PEI с почвой представлен изотермами связывания (фигура 1). Уровень гашения первичных аминогрупп на PEI указан числами в скобках в подписи.
Пример 5.
Аффинность связывания комплексов dsRNA-PEI
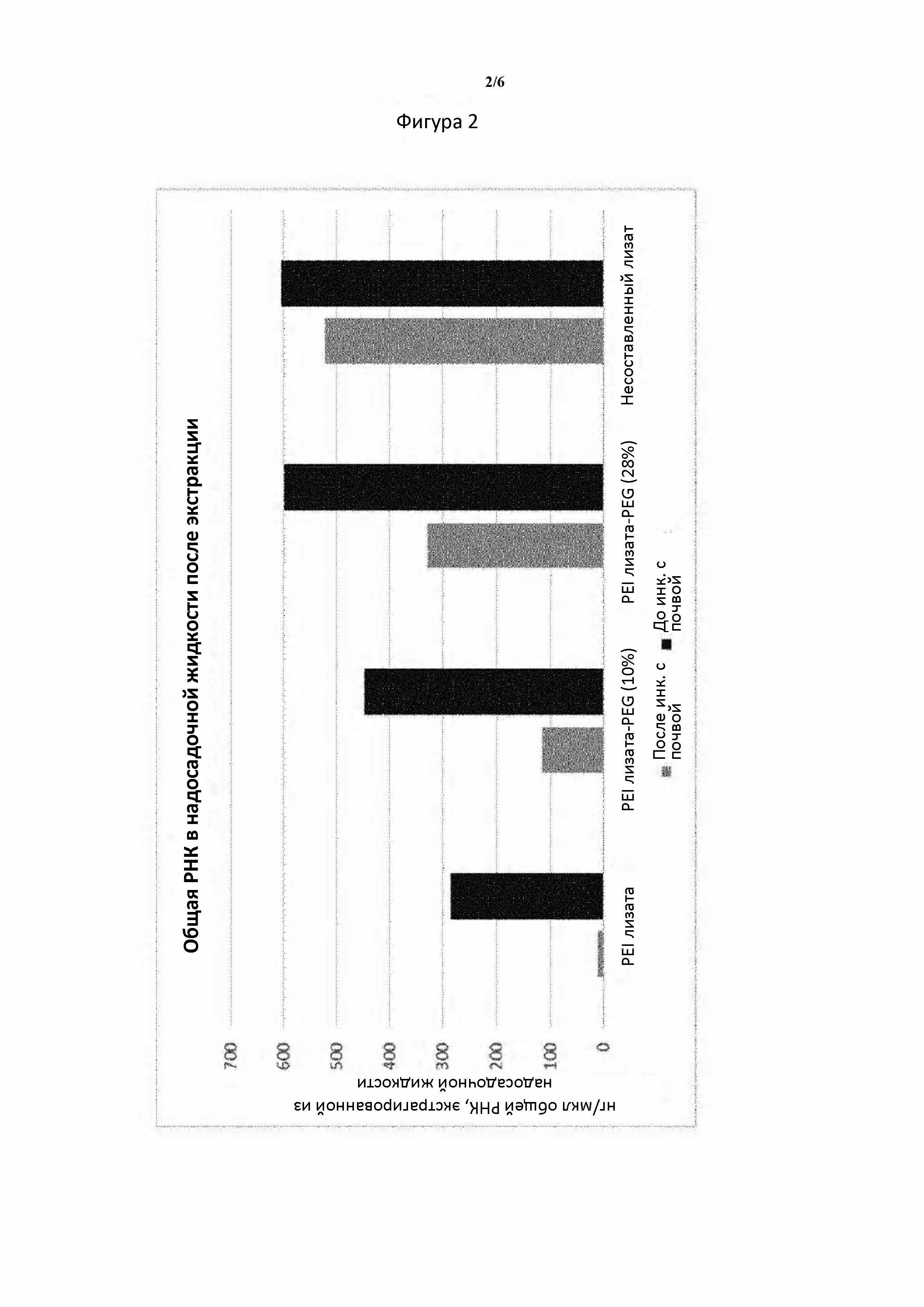
Клеточный лизат Е. coli,, экспрессирующей dsRNA, смешивали с растворами PEI следующим образом: лизаты разбавляли до 25 OD/мл и растворы PEI добавляли в лизаты до конечной концентрации 0,75%. Растворы с комплексом dsRNA-PEI лизата дополнительно разбавляли в 2,5 раза и инкубировали с почвой в соотношении вес/вес 2:1 раствор: почва в течение 1 часа. Несоставленный раствор лизата применяли в качестве контроля. Почву затем осаждали путем центрифугирования и несвязанную общую РНК в надосадочной жидкости экстрагировали из комплексов путем добавления полианиона с отсоединением dsRNA от PEI с последующей экстракцией с помощью RNAZol RT. Концентрацию общей РНК, присутствующей в надосадочной жидкости образцов, количественно определяли с помощью спектроскопии UV-Vis (фигура 2).
Пример 6.
Оценка стабильности dsRNA лизата в комплексах, полученных с помощью модифицированных PEI
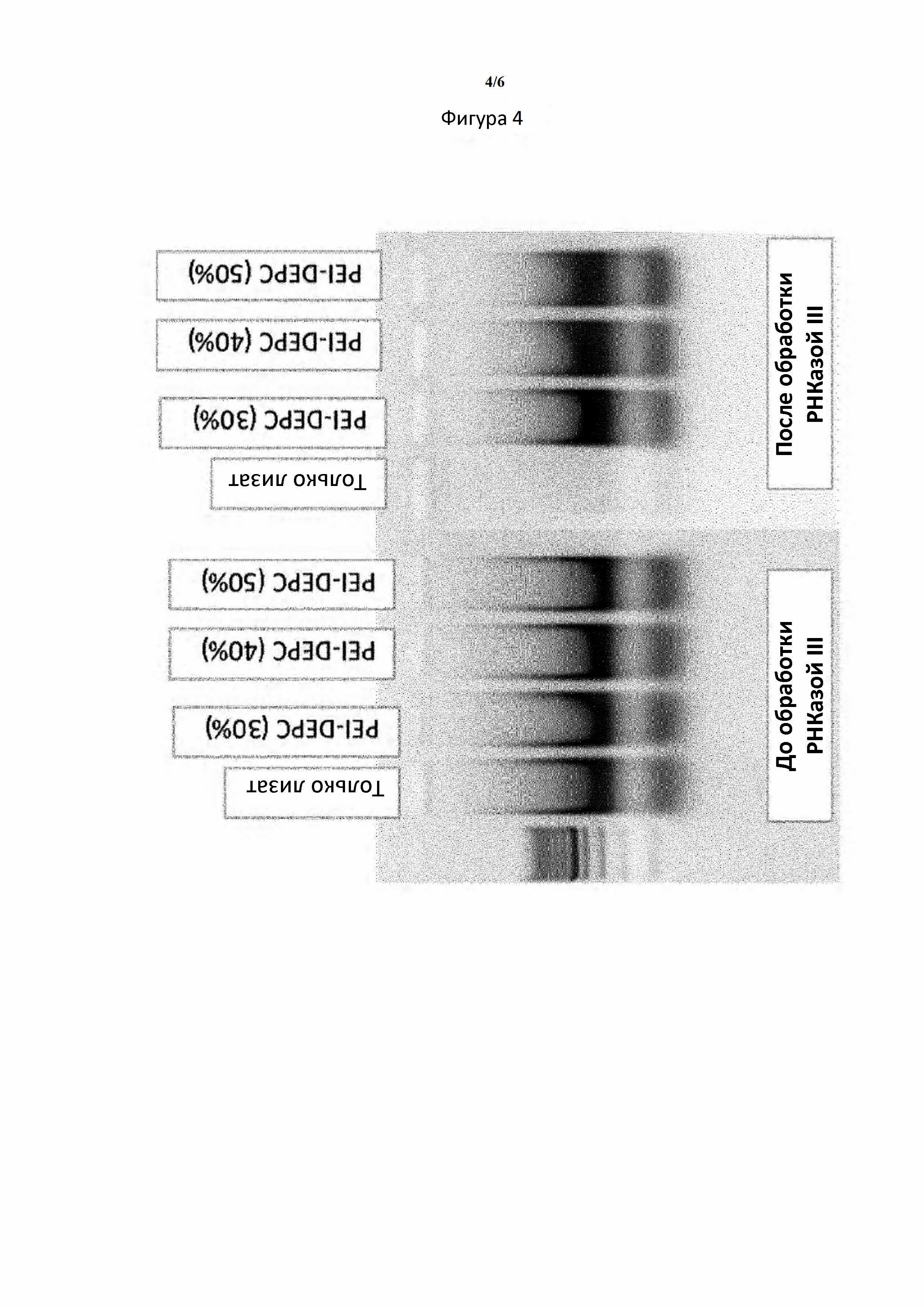
Клеточный лизат Е. coli, экспрессирующей dsRNA, смешивали с растворами PEI следующим образом: лизаты разбавляли до 50 OD/мл и растворы PEI добавляли в лизаты до конечной концентрации 0,5% (1X PEI) или 1,5% (3Х PEI). Растворы с комплексом dsRNA-PEI лизата инкубировали с РНКазой III в течение ночи при 37°С. Общую РНК экстрагировали из комплексов путем добавления полианиона с отсоединением dsRNA от PEI с последующей экстракцией с помощью RNAZol RT. Целостность dsRNA оценивали с применением электрофореза на агарозном геле (фигуры 3 и 4).
Пример 7.
Оценка биодоступности dsRNA в комплексах, полученных с помощью модифицированных PEI
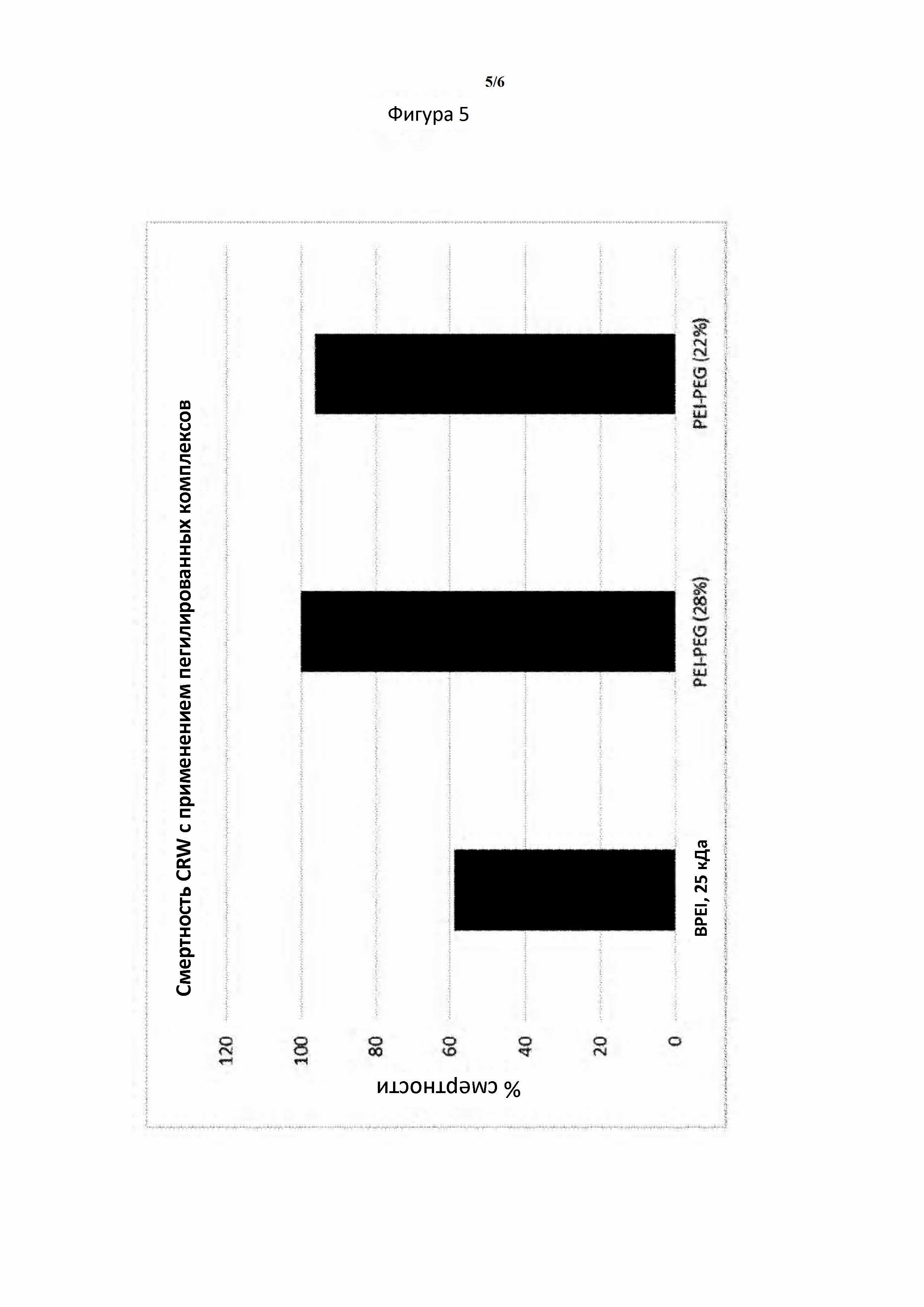
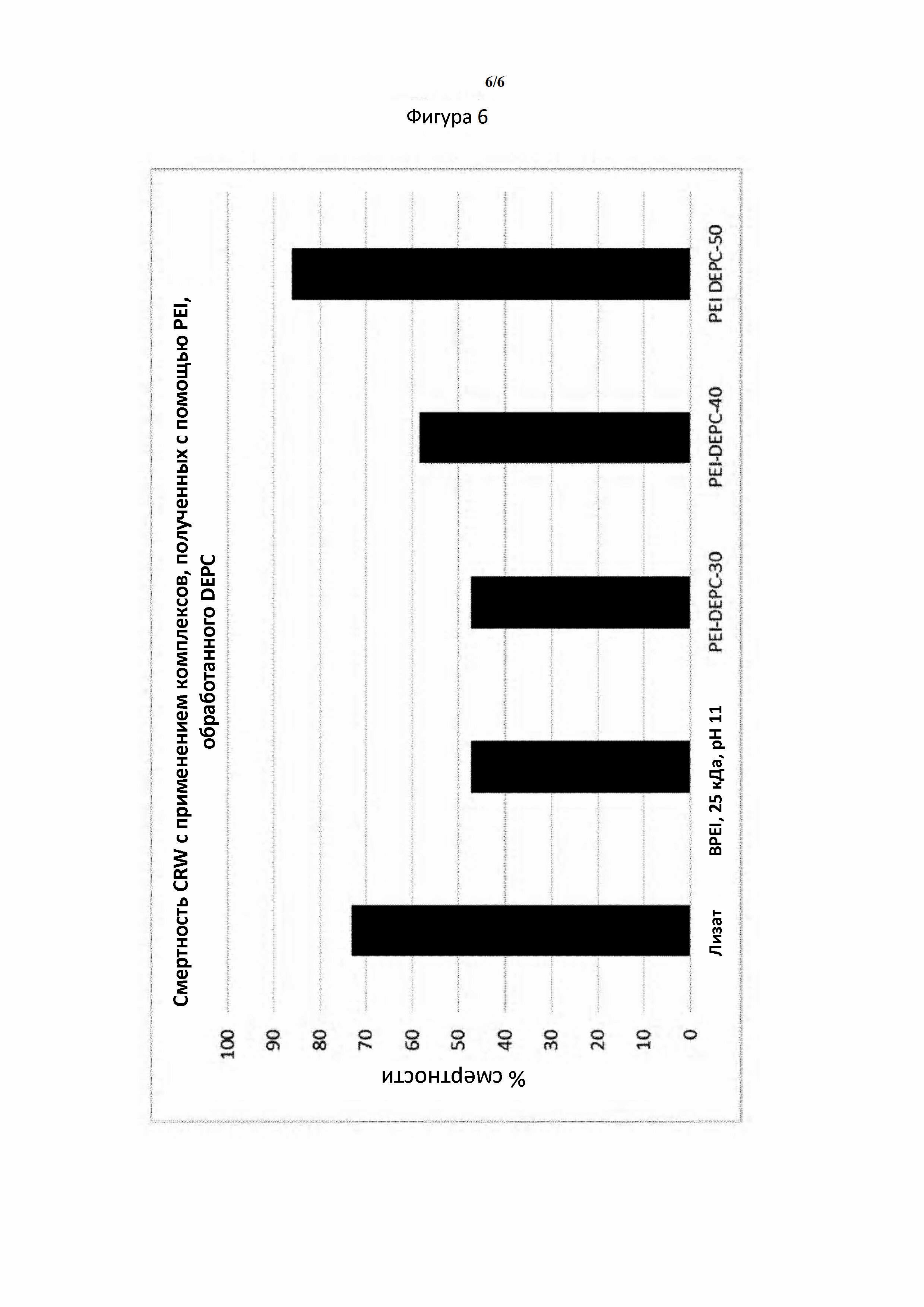
Биологический анализ с включением в искусственный рацион западного кукурузного жука проводили с применением комплексов, полученных с помощью модифицированных PEI и лизата Е. coli, экспрессирующей dsRNA. Составы лизатов разбавляли с применением воды без РНКазы и очень хорошо смешивали с равным количеством рациона (0,5 мл рациона и 0,5 мл разбавленных растворов составов) путем смешивания на вортексе до гомогенного состояния. Три повторности проводили для каждого типа состава и в каждый планшет для повторности добавляли примерно 12 новорожденных личинок. Планшеты инкубировали при комнатной температуре. Смертность документировали через день на протяжении анализа. Конечные коэффициенты смертности представлены на фигурах 5 и 6, и они показали повышенную активность гашенных комплексов. Эти данные также подтверждались с помощью биологического анализа в почве.
Условные обозначения к фигурам
Фигура 1. Как пегилированные, так и PEI, обработанные с помощью DEPC, характеризовались сниженными значениями аффинности связывания по сравнению с немодифицированным PEI.
Фигура 2. Комплексы, полученные с помощью пегилированных PEI, связываются с почвой в меньшей степени, следовательно, остаются в надосадочной жидкости после инкубации с почвой. Чем выше степень пегилирования, тем ниже значение аффинности связывания комплекса с почвой.
Фигура 3. Стабильность dsRNA лизата в комплексах, полученных с помощью модифицированных PEI (пегилированных PEI). dsRNA стабильна в комплексах, полученных с помощью пегилированных PEI.
Фигура 4. Стабильность dsRNA лизата в комплексах, полученных с помощью модифицированных PEI (PEI, обработанных DEPC). dsRNA стабильна в комплексах, полученных с помощью PEI, обработанных DEPC.
Фигура 5. Смертность CRW повышается, когда dsRNA образует комплекс с пегилированным PEI, по сравнению с комплексами, полученными с помощью немодифицированного PEI, что указывает на улучшенную биодоступность dsRNA в модифицированных комплексах.
Фигура 6. Смертность CRW повышается, когда dsRNA образует комплекс с DEPC-PEI, по сравнению с комплексами, полученными с помощью немодифицированного PEI, что дает основание для предположения об улучшенной биодоступности dsRNA в модифицированных комплексах. Более высокие уровни модификации PEI приводят к улучшенной биодоступности.
Реферат
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая способ подавления или, по существу, уменьшения степени связывания композиции, содержащей комплекс, образованный между катионным линейным или разветвленным полиэтилениминовым полимером и полинуклеотидом, с отрицательно заряженными молекулами, присутствующими в почве, способ контроля заражения насекомым рода Diabrotica, применение гасящего средства, которое представляет собой глутаральдегид или моноальдегид для, по существу, нейтрализации остаточных положительно заряженных групп в комплексе, композиция для контроля заражения насекомым рода Diabrotica и способ получения композиции. В одном из вариантов реализации полинуклеотид представляет собой дцРНК и указанная дцРНК обеспечивает посттранскрипционный сайленсинг гена-мишени в насекомое Diabrotica. Изобретение расширяет арсенал средств для контроля заражения насекомым рода Diabrotica. 5 н. и 12 з.п. ф-лы, 6 ил., 2 табл., 7 пр.
Формула
Документы, цитированные в отчёте о поиске
Способы генетического контроля поражения растений насекомыми и применяемые для этого композиции

Комментарии