Противомикробная композиция на основе полифенолов и полисахаридов, способ ее получения и применение - RU2754067C2
Код документа: RU2754067C2
Чертежи
Описание
Область техники
Настоящее изобретение относится к области органической химии и фармацевтики и касается противовирусной и противомикробной композиции, содержащей продукт совместной обработки полифенола и полисахарида, способа получения указанной композиции и противовирусному средству.
Уровень техники
Природные полифенолы являются объектами повышенного интереса со стороны фармацевтической индустрии благодаря широкому спектру фармакологической активности и структурному разнообразию (J. Agric. Food Chem., 58, 10016-10019, (2010)).
В частности, они обладают противоопухолевой (Cancer Res., 49, 3754-3758, (1989)), противовирусной (Contraception, 39, 579-587 (1989)), антипаразитарной (Science 218, 288-289 (1982)) и антиоксидантной активностями (J. Biol. Chem., 156, 633-642 (1944)).
Однако, к недостаткам природных полифенолов, являющимся препятствием для их широкого применения в качестве лекарственных средства, следует отнести высокую токсичность для репродуктивной системы, сердца, печени (Yin Juanjuan, A Dissertation for the Degree of Doctor of Philosophy The Graduate School of Clemson University, (2010)), а также низкую растворимость в воде.
Для преодоления этих недостатков используют различные подходы.
Наиболее распространенным подходом, является структурная модификация полифенолов, как с сохранением заместителей в ароматическом кольце (Chem. Nat. Comp., 33, 545-547, (1998)), так и со структурными изменениями заместителей (J. Pharm. Sci., 64, 6, 1073-1075 (1975)), или ароматического ядра (Chem. Nat. Comp., 30, 1, 42-48, (1994)). Однако получаемые при этом новые низкомолекулярные соединения, несмотря на снижение токсичности, имеют низкую растворимость в воде и в каждом случае требуют разработки методики получения и выделения продукта реакции.
Другим подходом к улучшению растворимости и снижению токсичности полифенолов является получение нековалентных композиций с олигомерными и полимерными носителями: поливинилпирролидоном (Chem. Nat. Comp., 32, 2, 177-179 (1996)), глицирризиновой кислотой (Chem. Nat. Comp., 32, 2, 177-179 (1996)), циклодекстринами (Spectrochimica Acta, Part A, 61, 1025-1028, (2005)), а также их инкапсулирование в полимерные мицеллы (Патент US 8945627). При этом исходные соединения присутствуют в продукте в структурно неизменном виде. Возможности данного подхода ограничиваются структурным разнообразием полифенолов и их производных.
Третьим подходом к преодолению недостатков природных полифенолов является изменение структуры полифенолов за счет ковалентного связывания с полимерным носителем, примером реализации которого является противовирусный препарат Кагоцел®, в котором за счет одновременного снижения числа альдегидных групп в полисахариде и полифеноле достигаются необходимые физико-химические и биологические свойства (Патент RU 22700708). Однако, ограниченное структурное разнообразие функциональных групп полифенола и высокомолекулярного носителя, для которых возможно ковалентное связывание, существенно ограничивает применение этого подхода. Кроме того, в ряде случаев наблюдается ухудшение растворимости полученных соединений.
Учитывая вышесказанное, сохраняет свою актуальность задача по созданию контролируемого метода получения композиций полифенолов и полисахаридов с улучшенными физико-химическими и биологическими свойствами по сравнению с исходными компонентами с целью получения продуктов с заданными характеристиками в зависимости от условий проведения процесса и исходя из небольшого структурного разнообразия исходных соединений. На сегодняшний день прецеденты такого рода в литературе отсутствуют.
Сущность изобретения
Задачей настоящего изобретения является разработка новых композиций на основе полифенолов и полисахаридов и способов их получения.
Настоящее изобретение относится к противомикробной, предпочтительно противовирусной композиции, содержащей, биологически эффективное количество активного компонента, представляющего собой продукт совместной обработки водного и/или водно-органического раствора полифенола ʺDʺ и водного и/или водно-органического раствора полисахарида ʺРʺ, взятых в массовом отношении полифенол ʺDʺ: полисахарид ʺРʺ, составляющим от 1000:1 до 1:1000, при pH от 0,1 до 14, при температуре от температуры замерзания растворителя до температуры кипения растворителя органическими и/или неорганическими кислотами или основаниями, и/или органическими и/или неорганическими солями до содержания карбонильных и/или гидроксильных групп в полисахариде по отношению к исходному содержанию от 99,99 до 0% и степени превращения исходного полифенола в полифенолы с молекулярной массой от 100 до 2000 атомных единиц массы от 0,1 до 100%; необязательно с последующей нейтрализацией реакционной смеси органическими и/или неорганическими кислотами или основаниями до рН=1-13, предпочтительно 7-10, с последующим выделением и очисткой полученного продукта;
где полифенол ʺDʺ представляет собой от 1 до 100 соединений, каждое из которых имеет молекулярную массу от 100 до 2000 атомных единиц массы, количество фенольных групп от 2 до 40 и содержащих от 0 до 20 отличных от фенольной функциональных групп, которые могут быть подвергнуты предварительной обработке в водном и/или водно-органическом растворе с содержанием органических растворителей в количестве от 0 до 100%, при рН в диапазоне от 0,1 до 14, органическими и/или неорганическими кислотами или основаниями, и/или органическими и/или неорганическими солями до степени превращения исходного полифенола в полифенолы с молекулярной массой от 100 до 2000 атомных единиц массы от 0,1до 100%;
предпочтительно полифенол ʺDʺ представляет собой от 1 до 50 соединений, каждое из которых содержит от 2 до 6 фенольных групп, от 1 до 12 отличных от фенольной функциональных групп с молекулярной массой от 120 до 700 атомных единиц массы.
наиболее предпочтительно полифенол ʺDʺ представляет собой от 1 до 40 соединений, каждое из которых содержит от 2 до 6 фенольных групп, от 1 до 8 отличных от фенольной функциональных групп с молекулярной массой от 300 до 550 атомных единиц массы;
где полисахарид ʺPʺ содержит от 1 до 10 полисахаридных цепей, предпочтительно 1 полисахаридную цепь, со средневесовой молекулярной массой от 0,4 до 3000 кДа каждая, предпочтительно от 1 до 500 кДа, наиболее предпочтительно от 1 до 50 кДа, состоящих из ковалентно связанных звеньев следующего состава:
[A][B][C];
где
«А» представляет собой звенья в составе полисахарида следующей общей формулы:
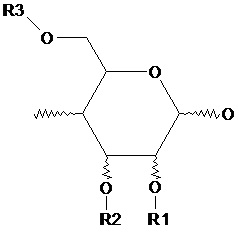
где
R1, R2, R3 независимо представляет собой Н, полисахарид ʺРʺ, (R5СН)nСООR4;
R4 представляет собой Н, Li, Na, K, предпочтительно R4 представляет собой Н, Na;
R5 представляет собой H, линейный или разветвленный С1-С10 алкил, предпочтительно R5 представляет собой H;
n принимает значения от 0 до 10, предпочтительно n принимает значения от 1 до 2;
«B» представляет собой окисленные звенья в составе полисахарида с молекулярной массой от 15 до 500 Да, содержащее от 1 до 6 функциональных групп, способных к реакциям нуклеофильного присоединения;
предпочтительно «B» представляет собой окисленные звенья в составе полисахарида с молекулярной массой от 150 до 300 Да, содержащее от 1 до 3 функциональных групп, способных к реакциям нуклеофильного присоединения;
«C» представляет собой продукт превращения окисленных звеньев в условиях обработки водного и/или водно-органического раствора полисахарида ʺРʺ, при pH от 0,1 до 14, при температуре от температуры замерзания растворителя до температуры кипения растворителя органическими и/или неорганическими кислотами или основаниями, и/или органическими и/или неорганическими солями до содержания карбонильных и/или гидроксильных групп в полисахариде по отношению к исходному содержанию от 99,99 до 0%;
предпочтительно «C» представляет собой продукт превращения окисленных звеньев в условиях обработки водного и/или водно-органического раствора полисахарида ʺРʺ, при pH от 0,1 до 14 при температуре от температуры замерзания растворителя до температуры кипения растворителя органическими и/или неорганическими кислотами или основаниями, и/или органическими и/или неорганическими солями до содержания карбонильных и/или гидроксильных групп в полисахариде по отношению к исходному содержанию от 95 до 20%;
и
где указанный полисахарид может быть подвергнут предварительной обработке в водно-органической среде с содержанием органических растворителей в количестве от 0 до 100%, при рН в диапазоне от 1 до 14, при температуре от температуры замерзания растворителя до температуры кипения растворителя органическими и/или неорганическими кислотами или основаниями, и/или органическими и/или неорганическими солями до содержания карбонильных и/или гидроксильных групп в полисахариде по отношению к исходному содержанию от 99,99 до 0% необязательно с дополнительными стадиями очистки и/или обессоливания и/или фракционирования;
и фармацевтически приемлемые вспомогательные вещества.
В другом аспекте настоящее изобретение относится к противовирусной и противомикробной композиции, содержащей:
биологическиэффективное количество активного компонента, представляющего собой полисахарид «Р», где полисахарид ʺPʺ содержит от 1 до 10 полисахаридных цепей, предпочтительно 1 полисахаридную цепь, со средневесовой молекулярной массой от 0,4 до 3000 кДа каждая, предпочтительно от 1 до 500 кДа, наиболее предпочтительно от 1 до 50 кДа, состоящих из ковалентно связанных звеньев следующего состава:
[A][B][C];
где
«А» представляет собой звенья в составе полисахарида следующей общей формулы:

где
R1, R2, R3 независимо представляет собой Н, полисахарид ʺРʺ, (R5СН)nСООR4;
R4 представляет собой Н, Li, Na, K, предпочтительно R4 представляет собой Н, Na;
R5 представляет собой H, линейный или разветвленный С1-С10 алкил, предпочтительно R5 представляет собой H;
n принимает значения от 0 до10, предпочтительно n принимает значения от 1 до 2;
«B» представляет собой окисленные звенья в составе полисахарида с молекулярной массой от 15 до 500 Да, содержащее от 1 до 6 функциональных групп, способных к реакциям нуклеофильного присоединения;
предпочтительно «B» представляет собой окисленные звенья в составе полисахарида с молекулярной массой от 150 до 300 Да, содержащее от 1 до 3 функциональных групп, способных к реакциям нуклеофильного присоединения;
«C» представляет собой продукт превращения окисленных звеньев в условиях обработки водного и/или водно-органического раствора полисахарида ʺРʺ, при pH от 0,1 до 14, при температуре от температуры замерзания растворителя до температуры кипения растворителя органическими и/или неорганическими кислотами или основаниями, и/или органическими и/или неорганическими солями до содержания карбонильных и/или гидроксильных групп в полисахариде по отношению к исходному содержанию от 99,99 до 0%;
предпочтительно «C» представляет собой продукт превращения окисленных звеньев в условиях обработки водного и/или водно-органического раствора полисахарида ʺРʺ, при pH от 0,1 до 14 при температуре от температуры замерзания растворителя до температуры кипения растворителя органическими и/или неорганическими кислотами или основаниями, и/или органическими и/или неорганическими солями до содержания карбонильных и/или гидроксильных групп в полисахариде по отношению к исходному содержанию от 95 до 20%;
и
где указанный полисахарид может быть подвергнут предварительной обработке в водно-органической среде с содержанием органических растворителей в количестве от 0 до 100%, при рН в диапазоне от 1 до 14, при температуре от температуры замерзания растворителя до температуры кипения растворителя органическими и/или неорганическими кислотами или основаниями, и/или органическими и/или неорганическими солями до содержания карбонильных и/или гидроксильных групп в полисахариде по отношению к исходному содержанию от 99,99 до 0% необязательно с дополнительными стадиями очистки и/или обессоливания и/или фракционирования;
и фармацевтически приемлемые вспомогательные вещества.
Еще одним объектом настоящего изобретения является противомикробная комбинация, содержащая одну из вышеуказанных композиций и по меньшей мере один экстракт растительного сырья, обладающий по меньшей мере одной из следующих активностей: антиоксидантная, антибактериальная, иммуностимулирующая, противомикробная, противоопухолевая, противовоспалительная, где содержание экстракта в составе комбинации составляет от 0,01 до 99,99%, предпочтительно от 1,0 до 50,0%, наиболее предпочтительно от 1,0 до 10,0%.
В предпочтительном варианте растительный экстракт представляет собой водный, спиртовой, масляный или органический экстракт из следующего растительного сырья: корень астрагала, ацерола, лист артишока, ангелика, бузина черная, плоды, листья и цветы боярышника, березовые почки, корневище валерианы с корнями, виноградные косточки, гибискус, девясил, дуб, женьшень, зеленый чай, имбирь, клубничный лист, клюква, кора белой ивы, календула, кора осины, грейпфрут, жеруха лекарственная, лопух, плоды малины, можжевельник, дыня горькая, мята перечная, черника, трава пустырника, расторопша, ромашка аптечная, сабельник, бобы соевые, корень солодки, плоды облепихи, фенхель, хрен, тимьян, чеснок, шалфей, элеутерококк, эхинацея пурпурная или их комбинации.
Еще одним другим объектом настоящего изобретения является противомикробная комбинация, содержащая одну из вышеуказанных композиций и, по меньшей мере, одну противомикробную фармацевтическую субстанцию, где содержание субстанции в составе комбинации составляет от 0,0000001 до 99,9999999%, предпочтительно 0,0000001 до 10,0%, наиболее предпочтительно 0,0001 до 5,0%.
Предпочтительно в качестве фармацевтической субстанции используют: арбидол, осельтамивир, римантадин.
Еще одним объектом изобретения является способ получения вышеуказанных композиций, включающий:
- стадию предварительной обработки полифенола ʺDʺ в водно-органической среде с содержанием органических растворителей в количестве от 0 до 100%, при рН в диапазоне от 0,1 до 14, при температуре от температуры замерзания растворителя до температуры кипения растворителя органическими и/или неорганическими кислотами или основаниями, и/или органическими и/или неорганическими солями до степени превращения исходного полифенола в полифенолы с молекулярной массой от 100 до 2000 атомных единиц массы от 0,01 до 100%;
и/или стадию предварительной обработки полисахарида ʺPʺ в водно-органической среде с содержанием органических растворителей в количестве от 0 до 100%, при рН в диапазоне от 1 до 14, при температуре от температуры замерзания растворителя до температуры кипения растворителя органическими и/или неорганическими кислотами или основаниями, и/или органическими и/или неорганическими солями до содержания карбонильных и/или гидроксильных групп в полисахариде по отношению к исходному содержанию от 99,99 до 0% с необязательно дополнительными очисткой и/или обессоливанием и/или фракционированием;
- стадию обработки водного и/или водно-органического раствора полифенола ʺDʺ и водного и/или водно-органического раствора полисахарида ʺРʺ, взятых в массовом отношении полифенол: полисахарида от 1000:1 до 0:1000, при pH от 0,1 до 14, при температуре от температуры замерзания растворителя до температуры кипения растворителя органическими и/или неорганическими кислотами или основаниями, и/или органическими и/или неорганическими солями до содержания карбонильных и/или гидроксильных групп в полисахариде по отношению к исходному содержанию от 99,99 до 0% и/или степени превращения исходного полифенола в полифенолы с молекулярной массой от 100 до 2000 атомных единиц массы от 0,01 до 100%;
- последующую стадию выделения и очистки полученного продукта; и
- стадию объединения полученного продукта с фармацевтически приемлемыми вспомогательными веществами.
Также способ получения вышеуказанных композиций может включать необязательную стадию нейтрализации реакционной смеси органическими и/или неорганическими кислотами или щелочами до рН=1-13, предпочтительно 7-10;
Предпочтительно полифенол представляет собой от 1 до 10 соединений, каждое из которых содержит от 2 до 6 фенольных групп, от 2 до 12 отличных от фенольной функциональных групп с молекулярной массой от 120 до 700 атомных единиц массы, наиболее предпочтительно апогоссипол, госсиполон, госсиндан, апогоссиполон, 1,1',6,6',7,7'-гексагидрокси-5,5'-диизопропил-3,3'-диметил-2,2'-бинафталин-8-карбальдегид, 6,6',7,7'-тетрагидрокси-5,5'-диизопропил-3,3'-диметил-1,1',4,4'-тетраоксо-1,1',4,4'-тетрагидро-2,2'-бинафталин-8-карбальдегид, этил [(8-формил-1,1',6,6',7'-пентагидрокси-5,5'-диизопропил-3,3'-диметил-2,2'-бинафталин-7-ил)окси]ацетат, госсипол, госсиполуксусную кислоту;
Предпочтительно, на стадии предварительной обработки степень превращения исходного полифенола в полифенолы с молекулярной массой от 100 до 2000 атомных единиц массы от 50 до 100%, наиболее предпочтительно 80-100%.
Предпочтительно полисахарид представляет собой целлюлозу, карбоксиметилцеллюлозу, декстран, карбоксиметилдекстран, диальдегид карбоксиметилцеллюлозы, диальдегид декстрана, диальдегидцеллюлозы, диальдегид карбоксиметилдекстрана, крахмал, диальдегид крахмала, декстрин, диальдегид декстрина и продукты их превращения в водных и/или водно-органических растворах при pH от 0,1 до 14.
Предпочтительно, на стадии предварительной обработки полисахарида содержание карбонильных и/или гидроксильных групп в полисахариде по отношению к исходному содержанию составляет от 95,0 до 20,0%.
Предпочтительно, стадия предварительных обработок проводится при рН от 7 до 14, наиболее предпочтительно от 10 до 14.
Предпочтительно, предварительные обработки проводятся при температуре от 10 до 60°С.
Предпочтительно, на стадии предварительных обработок органический растворитель представляет собой ацетон, этиловый спирт, изопропиловый спирт, 1,4-диоксан, тетрагидрофуран.
Предпочтительно, на стадии обработки степень превращения исходного полифенола в полифенолы с молекулярной массой от 100 до 2000 атомных единиц массы составляет от от 50 до 100%, наиболее предпочтительно 80-100%.
Предпочтительно, на стадии обработки содержание карбонильных и/или гидроксильных групп в полисахариде по отношению к исходному содержанию составляет от 95,0 до 20,0%.
Предпочтительно стадия обработки проводится при рН от 7 до 14, наиболее предпочтительно от 10 до 14.
Предпочтительно стадия обработки проводится при температуре от 10 до 60°С, наиболее предпочтительно от 18 до 55°С.
Предпочтительно на стадии обработки органический растворитель представляет собой ацетон, этиловый спирт, изопропиловый спирт, 1,4-диоксан, тетрагидрофуран.
Предпочтительно стадии предварительной обработки полифенола ʺDʺ и полисахарида «Р» выполняют одновременно в одном реакторе.
Еще одним объектом настоящего изобретения является противомикробное средство, содержащее одну любую из вышеуказанных композиций. Противомикробное средство по настоящему изобретению эффективно в отношении вирусов гриппа, герпеса, гепатита, ВИЧ, респираторных вирусных инфекций и бактериальных инфекций.
Еще одним объектом настоящего изобретения является биологически активная добавка, обладающая одним или несколькими эффектами, предпочтительно антиоксидантным, антибактериальным, иммуностимулирующим, противомикробным, противоопухолевым, противовоспалительным, содержащая комбинацию по настоящему изобретению.
Еще одним объектом настоящего изобретения является противомикробное средство, содержащее комбинацию по настоящему изобретению.
Описание чертежей
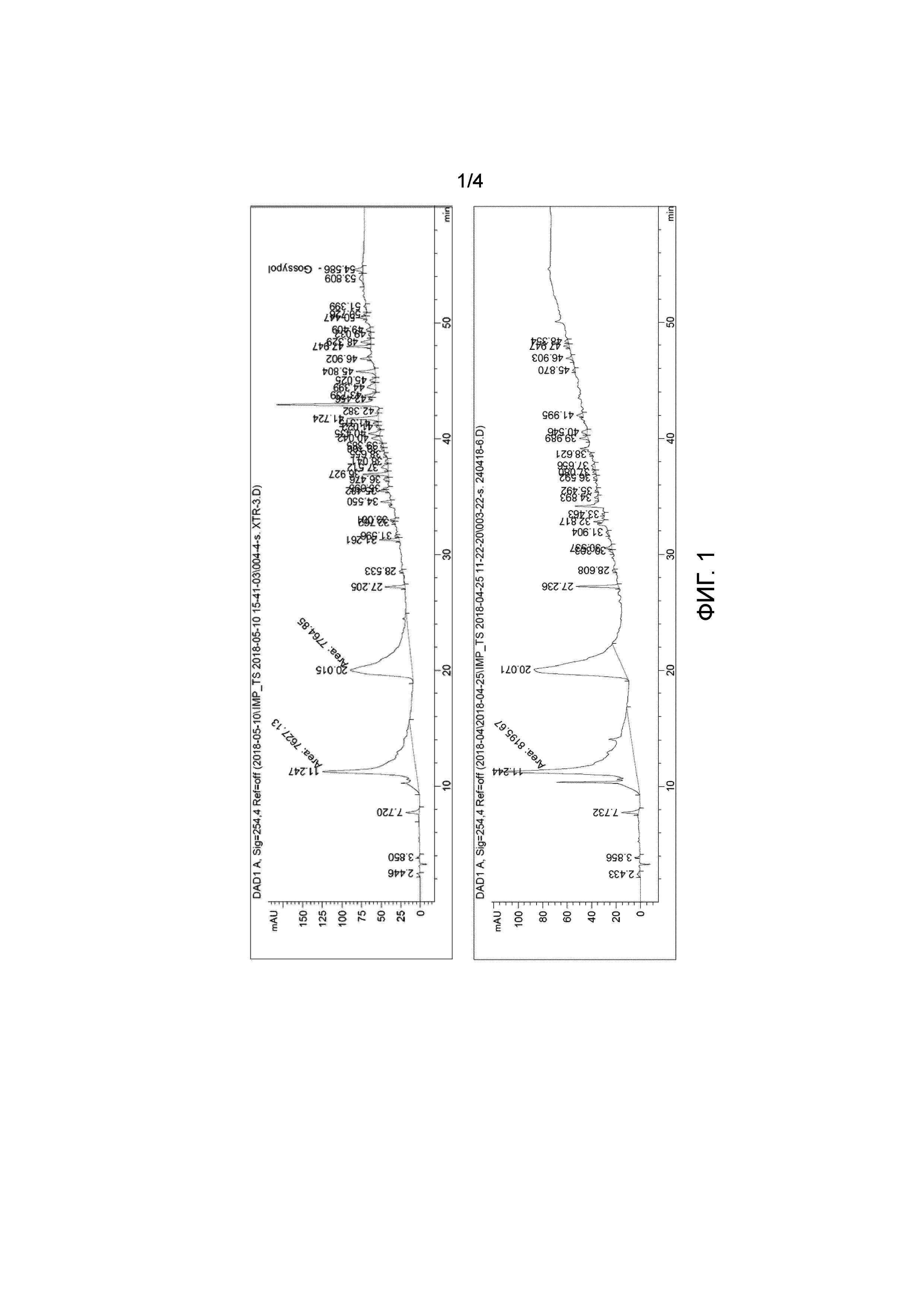
На Фиг.1 приведены хроматограммы композиций, полученные с модификацией введенного полифенола, детектирование при 254 нм.
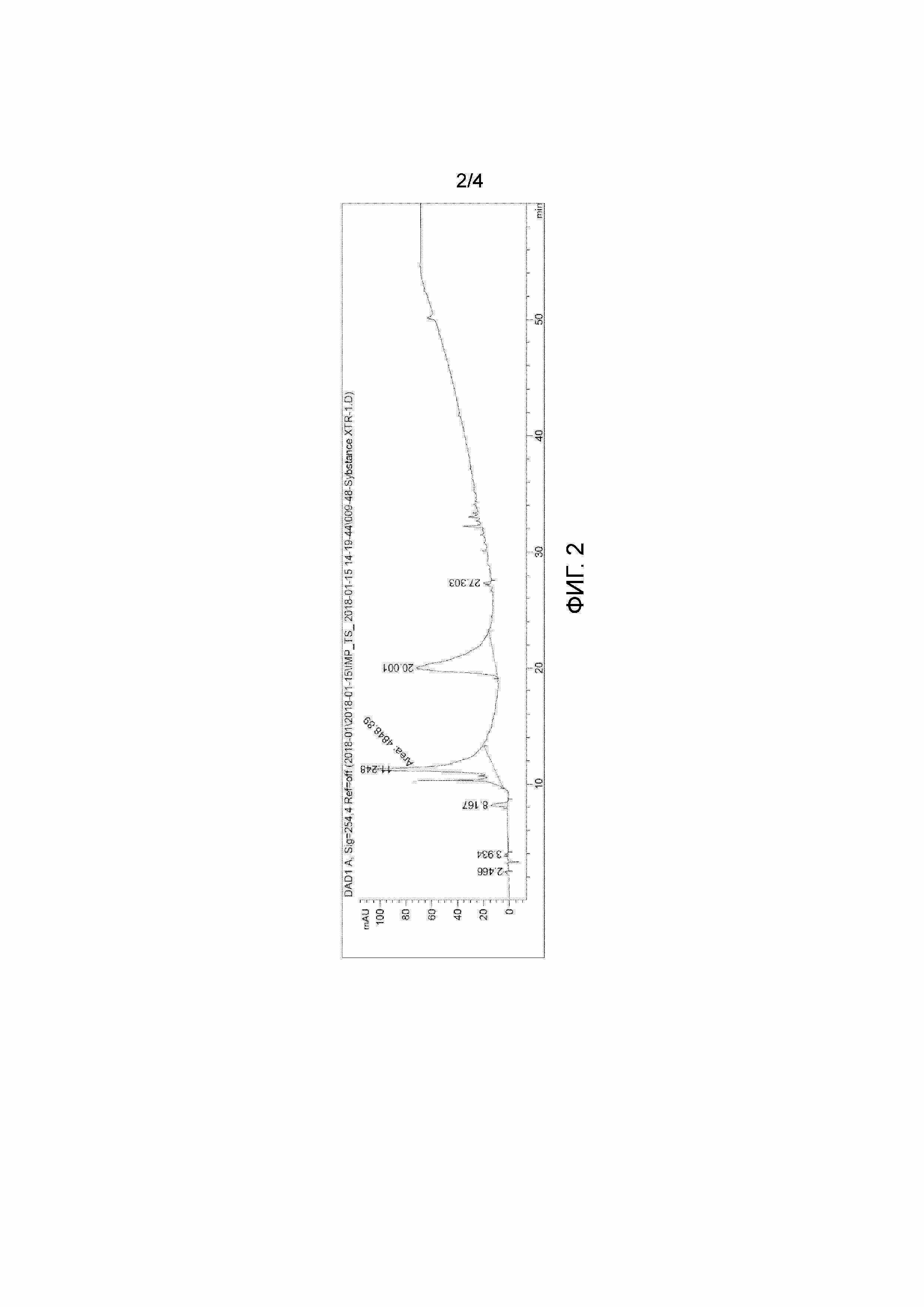
На Фиг.2 приведена хроматограмма композиции, полученной без введения полифенолов, детектирование при 254 нм.
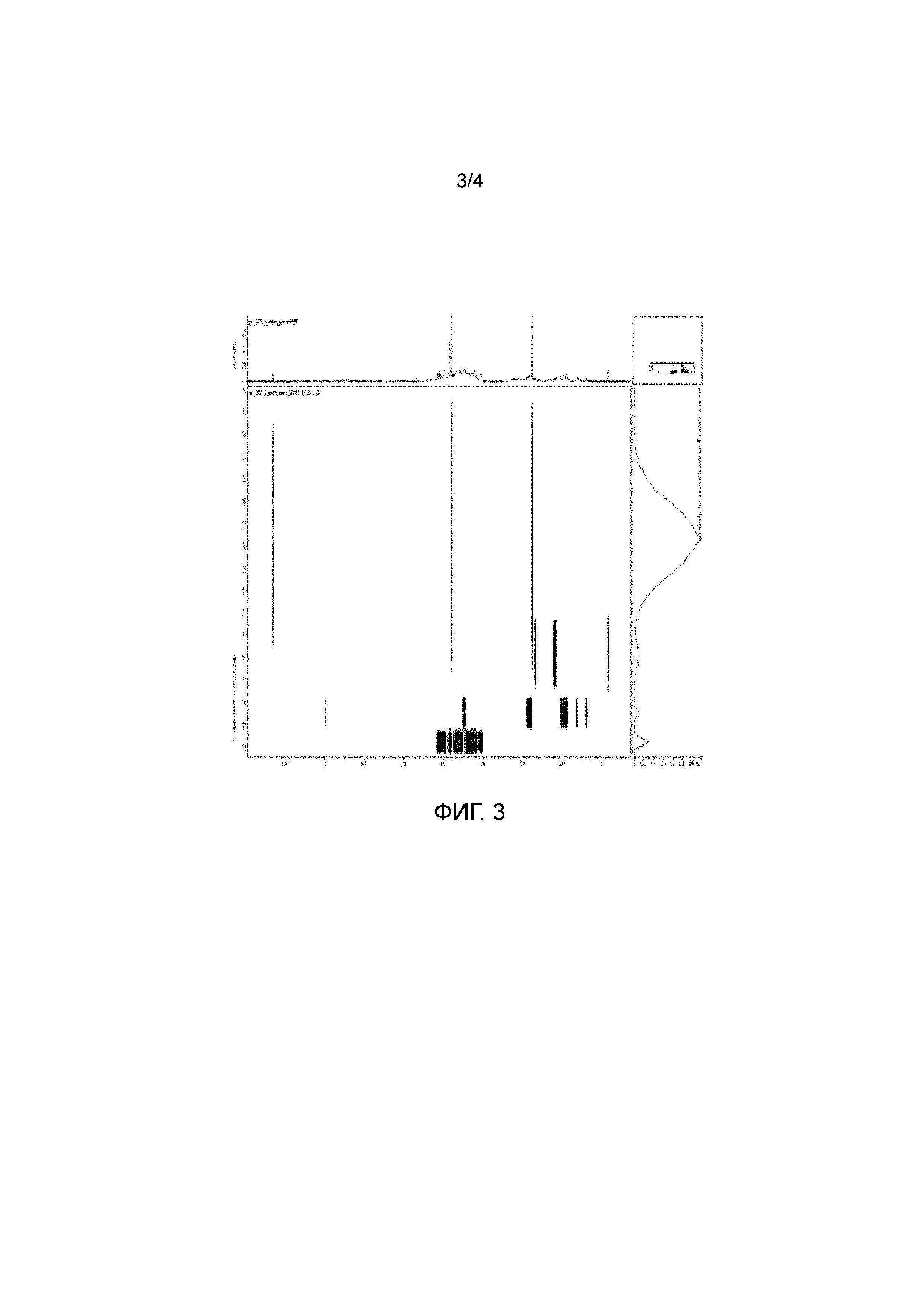
На Фиг.3 представлены спектры DOSY для образцов по примеру 9.
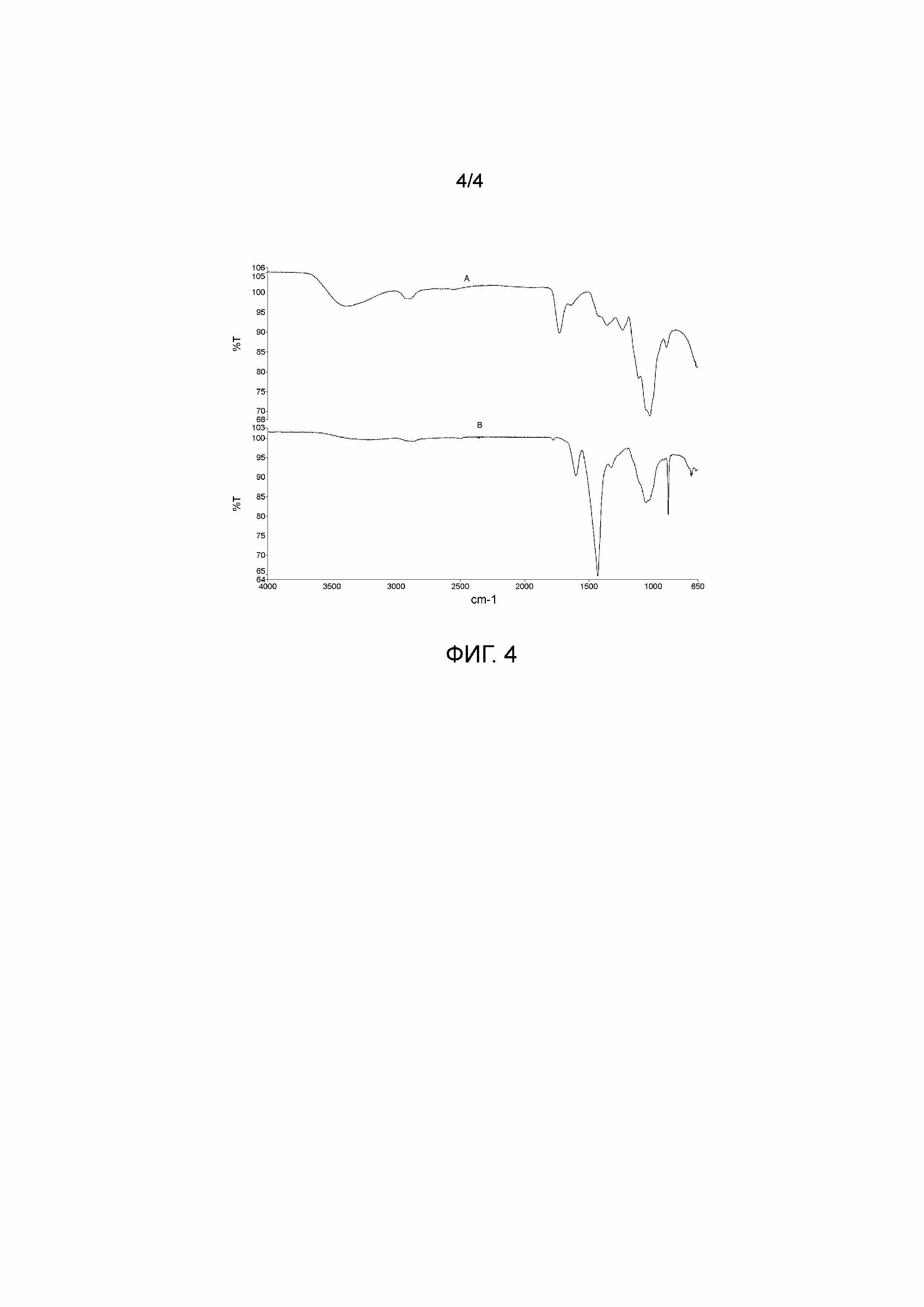
На Фиг.4 приведен ИК-спектр композиции (пример 8) в сравнении с исходным полимером, полученные методом НПВО.
Подробное описание изобретения
В контексте настоящего описания:
термин «совместная обработка» означает одновременное пребывание двух и более исходных соединений в одной реакционной смеси до окончания реакции;
термин «предварительная обработка» означает пребывание одного исходного соединения (полисахарид или полифенол) в указанных физико-химических условиях до достижения целевых изменений структуры до введения второго соединения (полифенол или полисахарид)
термин «полифенол» означает класс химических соединений, характеризующихся присутствием более чем одной фенольной группы, предпочтительно 2-6 фенольные группы, с молекулярной массой от 100 до 2000 атомных единиц массы, предпочтительно от 100 до 700 атомных единиц массы, содержащих от 0 до 20 отличных от фенольной функциональных групп, предпочтительно 0-8 отличных от фенольной функциональных групп, в частности, госсипол, апогоссипол, госсиполон, госсиндан, апогоссиполон, 1,1',6,6',7,7'-гексагидрокси-5,5'-диизопропил-3,3'-диметил-2,2'-бинафталин-8-карбальдегид, 6,6',7,7'-тетрагидрокси-5,5'-диизопропил-3,3'-диметил-1,1',4,4'-тетраоксо-1,1',4,4'-тетрагидро-2,2'-бинафталин-8-карбальдегид, галловая кислота, эпигаллокатехин, галлол;
термин «водный раствор» означает раствор с концентрацией растворенного вещества от 0,00001 до 99,999 массовых %, в котором вода является растворителем;
термин «водно-органический раствор» означает раствор с концентрацией растворенного вещества от 0,00001 до 99,999 массовых %, в котором в качестве растворителя выступает гомогенная смесь воды и органического растворителя в массовом отношении от 100:0 до 0:100, в частности, смеси воды с этанолом, воды с ацетоном, воды с изопропанолом, воды с диоксаном;
термин «органическая кислота» означает органическое соединение, проявляющее кислотные свойства, в частности, муравьиная кислота, уксусная кислота, щавелевая кислота, п-толуолсульфоновая кислота, лимонная кислота, винная кислота;
термин «неорганическая кислота» означает неорганическое соединение, проявляющее кислотные свойства, в частности, соляная кислота, серная кислота, ортофосфорная кислота, хлорная кислота, угольная кислота, азотная кислота;
термин «органическое основание» означает любое органическое соединение, способное принимать положительно заряженные ионы, в частности, триэтиламин, 4-метилморфолин, N-этилдиизопропиламин, трет-бутилат калия, этилат натрия;
термин «неорганическое основание» означает любое неорганическое соединение, способное принимать положительно заряженные ионы, в частности, карбонат натрия, гидроксид калия, ацетат натрия, гидроксид натрия, гидрокарбонат натрия, карбонат цезия, карбонат калия;
термин «органическая соль» означает любое органическое соединение, которое в водных растворах диссоциирует на катионы и анионы органических кислотных остатков, в частности, оксалаты, карбоксилаты, алкоголяты, ацетаты, феноляты, аскорбаты, тартраты, цитраты, пиридиниевые соли;
термин «неорганическая соль» означает любое неорганическое соединение, которое в водных растворах диссоциирует на катионы и анионы кислотных остатков, в частности, хлориды, сульфаты, карбонаты;
термин «органический растворитель» означает любое органическое соединение, способное растворять различные вещества, в частности, алифатические и ароматические углеводороды и их галоген производные, спирты, простые и сложные эфиры, кетоны.
термин «функциональная группа» означает совокупность атомов, определяющая характерные химические свойства данного класса соединений, в частности, гидроксильная, карбонильная, карбоксильная, алкильная, арильная и другие;
термин «фенольная группа» означает гидроксильная группа, связанная с атомом углерода ароматического или гетероароматического кольца;
термин «полисахарид» означает продукт поликонденсации моносахаридов, содержащий звенья моносахаридов, связанных друг с другом через любой атом кислорода, либо продукт синтетической модификации углеводов, в частности, целлюлоза, карбоксиметилцеллюлоза, декстран, карбоксиметилдекстран, диальдегид карбоксиметилцеллюлозы, диальдегид декстрана, диальдегидцеллюлозы, диальдегид карбоксиметилдекстрана, крахмал, диальдегид крахмала, декстрин, диальдегид декстрина и продукты их превращения в водных и/или водно-органических растворах при pH от 0,1 до 14;
термин «ковалентно связанные звенья» означает звенья одной или нескольких цепей полисахарида, связанные между собой ковалентной связью через любой атом одного звена при участии любой функциональной группы другого звена, в частности, гидроксильной, карбонильной, полуацетальной, карбоксильной и др.
термин «полисахаридная цепь» означает продукт поликонденсации моносахаридов, содержащий звенья моносахаридов, связанных друг с другом через любой атом кислорода, либо продукт синтетической модификации углеводов, содержащий структурно родственные полисахаридные фрагменты одного типа с различным количеством звеньев и молекулярно-массовым распределением, в частности, целлюлоза, карбоксиметилцеллюлоза, декстран, карбоксиметилдекстран, диальдегид карбоксиметилцеллюлозы, диальдегид декстрана, диальдегидцеллюлозы, диальдегид карбоксиметилдекстрана, крахмал, диальдегид крахмала, декстрин, диальдегид декстрина и продукты их превращения в водных и/или водно-органических растворах при pH от 0,1 до 14;
термин «окисленное звено» означает один или несколько продуктов превращения звена полисахарида под действием окислителей, сопровождающегося изменением его структуры и появлением новых функциональных групп, находящихся в свободной карбонильной, полуальдальной, полуацетальной, ацетальной формах, в частности,
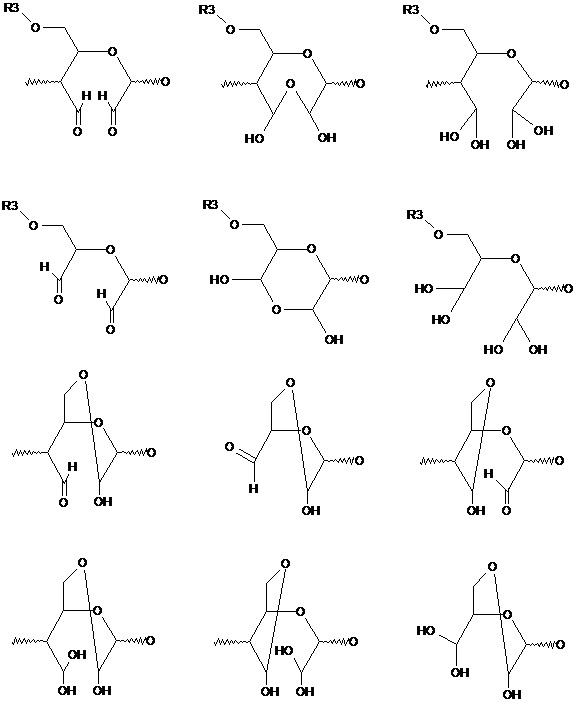
термин «свободная карбонильная форма» означает продукт превращения звена полисахарида под действием окислителей, содержащий более одной карбонильной группы, в частности,
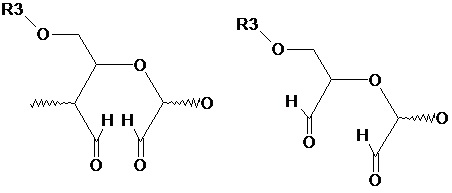
термин «полуальдальная форма» означает продукт превращения звена полисахарида под действием окислителей, в котором альдегидные группы находятся в связанном с одной или несколькими молекулами воды состоянии, в частности,
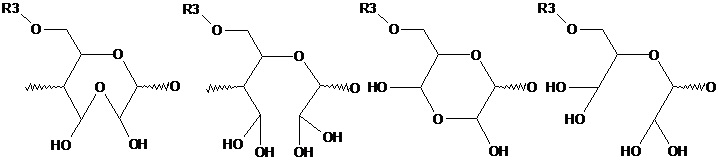
термин «полуацетальная форма» означает продукт превращения звена полисахарида, в котором как минимум одна альдегидная группа находятся в связанном с одним замещенным атомом кислорода звена полисахарида или иных соединений, в частности,
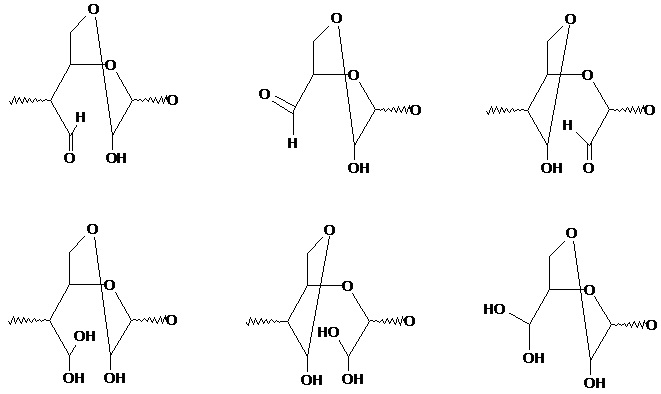
термин «ацетальная форма» означает продукт превращения звена полисахарида под, в котором как минимум одна альдегидная группа находятся в связанном с двумя замещенными атомами кислорода звена полисахарида или иных соединений;
термин «замещенный атом кислорода» означает любую структуру ROH, в которой заместитель R не является водородом или кислородом;
термин «фармацевтически приемлемое вспомогательное вещество» означает вещество, разрешенное для использования в фармацевтической промышленности для создания готовых лекарственных форм и не являющееся действующим веществом, но способное влиять как на биологическую эффективность действующего вещества, так и на физические свойства готовой лекарственной формы.
термин «комбинация» означает гомогенную или практически гомогенную смесь компонентов, биологический эффект от которой отличается от суммарного эффекта ее составляющих.
термин «экстракт растительного сырья» означает вещество, полученное путем извлечения и концентрирования из базового сырья растительного происхождения.
Методы исследования
Спектроскопия ядерного магнитного резонанса (ЯМР)
Метод использовали для установления молекулярного строения веществ.
Для получения спектральных данных, точную навеску образца (15-30 мг) растворяли в 50 мг D2O с рН=10-11 (добавляли Na2CO3 или NaOH), к раствору приливали 50 мкл раствора ТСП в D2O концентрации 1мг/мл (внесенная масса ТСП при этом 50 мкг). Растворы переносили в ампулу ЯМР d=5мм и помещали в ЯМР спектрометр. Настраивали однородность магнитного поля. Регистрировали спектры. Сигналы выставлялись по химическому сдвигу ТСП, равному 0 м.д. или по остаточным протонам сигнала растворителя.
Спектры DOSY регистрировались при следующих условиях: количество точек на спектр 32К; задержка между импульсами 15 с; 90° импульс; количество накоплений спектра - 64, градиент от 3 мТ/м до 0,4 Т/м содержащий 16 точек, diffusion time 0,1 с.
Высокоэффективная жидкостная хроматография с УФ-спектрофотометрическим и масс-спектрометрическим детектированием (ВЭЖХ-УФ-МС)
Метод использовали для установления качественного и количественного состава композиций. Анализ проводили на жидкостном хроматографе Agilent 1260 с последовательным детектированием на диодно-матричном и масс-селективном детекторах. Разделение проводили на хроматографической колонке Zorbax Eclipse Plus C18 производства «Agilent», используя в качестве элюентов 0,1% раствор муравьиной кислоты в воде и ацетонитрил в градиентном режиме элюирования. В используемом одноквадрупольном масс-спектрометрическом детекторе ионизация осуществляется методом электрораспыления, детектирование проводили в режиме регистрации отрицательных ионов. Детектирование на диодно-матричном детекторе выполняли при длине волны 254 нм и регистрировали УФ-спектр в диапазоне от 200 до 400 нм.
Инфракрасная спектроскопия с преобразованием Фурье (ИК)
Метод ИК-спектроскопии использовали с целью подтверждения структуры полученных соединений. Регистрацию спектров проводили на спектрометре Spectrum 65 производства «Perkin Elmer» диске с калия бромидом, в области от 4000 дл 400 см-1 и методом НПВО в области от 4000 до 650 см-1.
Спектрофотомерия в ультрафиолетовой и видимой областях спектра (УФ-ВИД)
Метод спектрофотомерии использовали с целью подтверждения подлинности получаемых соединений. Регистрацию спектров проводили на спектрофотометре Lambda 25 производства «Perkin Elmer» в кварцевых кюветах толщиной 1 см в диапазоне 220-700 см-1.
Потенциометрическое кислотно-основное титрование
Метод потенциометрического кислотно-основного титрования использовали для определения количества карбонильных групп в образцах.
Для определения использовали оксимный метод, который основан на реакции альдегидных групп с солянокислым гидроксиламином в результате которой выделяется соляная кислота, которая оттитровывается растворов гидроксида натрия.
Гель-проникающая хроматография (ГПХ)
Метод гель-проникающей хроматографии использовали для определения молекулярной массы и молекулярно-массовых характеристик полимерных композиций и исходного сырья. Анализ проводили на жидкостном хроматографе Waters с последовательным детектированием на рефрактометрическом и диодно-матричном детекторах. Разделение проводили на соединенных последовательно колонках Ultrahydrogel 1000 и Ultrahydrogel 120 размером 300 × 7.8 мм, заполненных гелем на основе гидроксилат полиметакрилата с размером пор 1000 и 120 Å соответственно (Waters), используя в качестве элюента 0,05 М фосфатный буферный раствор (рН=7,0) при изократическом режиме элюирования.
Для калибровки колонки использовали стандарты декстрана со средневесовыми молекулярными массами (Мw) 9900, 16230, 41100, 60300, 129000, 214800, 456800.
Калибровочные кривые аппроксимировали полиномом 3-го порядка. Расчет молекулярно-массовых характеристик полимера проводили с использованием универсальной калибровки и программного обеспечения «Breeze 2».
Пример 1
В химический стакан емкостью 200 мл наливают 27,6 г воды, добавляют 60 г р-ра NaOH 34,8%. Далее при перемешивании добавляют 60 г Диальдегида карбокcиметилцеллюлозы (далее ДАКМЦ) с содержанием карбонильных групп 0,94 ммоль/г, поддерживая температуру не выше 58°С. Перемешивают реакционную массу 3 часа при комнатной температуре, после чего останавливают перемешивание и выдерживают 18 часов до содержания карбонильных групп 81,4% относительно исходного полимера. На следующий день подкисляют реакционную массу 10 г гидрокарбоната натрия, перемешивают 30 минут и выделяют в ацетон и сушат. Получают композицию с выходом 76,8 г.
Пример 2
В химический стакан емкостью 200 мл наливают 70 г раствора 20% NaOH. Затем при перемешивании добавляют 7 г ДАКМЦ с содержанием карбонильных групп 2,3 ммоль/г и перемешивают реакционную массу при 25°С в течение 60 минут до содержания карбонильных групп в полисахариде 26,5% по отношению к исходному содержанию, после чего добавляют к реакционной массе 23 г гидрокарбоната натрия, перемешивают 30 минут. Далее реакционную массу выделяют в ацетон и сушат в сухожаровом шкафу. Получают композицию с выходом 39,2 г.
Пример 3
В химический стакан емкостью 200 мл наливают 70 г раствора 20% Na2СО3. Затем при перемешивании добавляют 7 г ДАКМЦ с содержанием карбонильных групп 2,3 ммоль/г и перемешивают реакционную массу при 25°С в течение 180 минут до содержания карбонильных групп в полисахариде 62,2% по отношению к исходному содержанию. Далее реакционную массу выделяют в ацетон и сушат в сухожаровом шкафу. Получают композицию с выходом 18,8 г.
Пример 4
В химический стакан емкостью 200 мл наливают 20 г воды, добавляют 1 г р-ра NaOH 10%. Далее при перемешивании добавляют 1 г диальдегида декстрана (далее ДАД) с содержанием карбонильных групп 1,60 ммоль/г, поддерживая температуру не выше 58°С. Перемешивают реакционную массу 3 часа при комнатной температуре, после чего останавливают перемешивание и выдерживают 18 часов до содержания карбонильных групп 46,9% относительно исходного полимера. На следующий день подкисляют реакционную массу 0,12 г гидрокарбоната натрия, перемешивают 30 минут и лиофилизуют. Получают композицию с выходом 1,0 г.
Пример 5
В химический стакан емкостью 200 мл наливают 20 г воды, добавляют 1 г р-ра NaOH 34,8%. Далее при перемешивании добавляют 1 г ДАД с содержанием карбонильных групп 1,60 ммоль/г, поддерживая температуру не выше 58°С. Перемешивают реакционную массу 3 часа при комнатной температуре, после чего останавливают перемешивание и выдерживают 18 часов до содержания карбонильных групп 66,2% относительно исходного полимера. На следующий день подкисляют реакционную массу 0,12 г гидрокарбоната натрия, перемешивают 30 минут и лиофилизуют. Получают композицию с выходом 1,4 г.
Пример 6
В химический стакан емкостью 200 мл наливают 9,2 г воды и 20 г раствора 34,8% NaOH. Затем при перемешивании добавляют 20 г ДАКМЦ с содержанием карбонильных групп 0,94 ммоль/г и перемешивают реакционную массу при 25°С 20 минут до содержания карбонильных групп в полисахариде 81,4% по отношению к исходному содержанию, после чего прибавляют к нему раствор 0,02 г полугоссипола в 2 мл ацетона. Далее перемешивают реакционную массу 20 минут при 25°С до степени превращения исходного полифенола в полифенолы с молекулярной массой от 100 до 2000 атомных единиц массы 100% и содержания карбонильных групп в полисахариде 81,4% по отношению к исходному содержанию. Далее реакционную массу лиофилизуют. Получают композицию с выходом 20,2 г.
Пример 7
В химический стакан емкостью 200 мл наливают 9,2 г воды и 20 г раствора 34,8% NaOH. Затем при перемешивании добавляют 20 г ДАКМЦ с содержанием карбонильных групп 0,94 ммоль/г и перемешивают реакционную массу при 25°С 20 минут до содержания карбонильных групп в полисахариде 81,4% по отношению к исходному содержанию, после чего прибавляют к нему раствор 0,1 г полугоссипола в 5 мл ацетона. Далее перемешивают реакционную массу 20 минут при 25°С до степени превращения исходного полифенола в полифенолы с молекулярной массой от 100 до 2000 атомных единиц массы 86,4%и содержания карбонильных групп в полисахариде 81,4% по отношению к исходному содержанию. Далее реакционную массу лиофилизуют. Получают композицию с выходом 20,5 г.
Пример 8
В химический стакан емкостью 200 мл наливают 10,0 г воды и 24 г раствора 34,8% NaOH. Затем при перемешивании добавляют 24 г ДАКМЦ с содержанием карбонильных групп 0,94 ммоль/г и перемешивают реакционную массу 20 минут, поддерживая температуру не выше 58°С, до содержания карбонильных групп в полисахариде 89,36% по отношению к исходному содержанию. Параллельно готовят раствор госсипола, для чего растворяют 0,4 г госсиполуксуной кислоты в смеси 25 мл ацетона, 2,4 мл раствора 34,8% NaOH и 10,0 мл воды в течение 10 минут при температуре 25°С. После чего раствор полифенола приливают к раствору полимера. Далее перемешивают реакционную массу 10 минут при 37°С и 60 минут при 20°С до степени превращения исходного полифенола в полифенолы с молекулярной массой от 100 до 2000 атомных единиц массы 100% и содержания карбонильных групп в полисахариде 89,36% по отношению к исходному содержанию. Затем добавлением NaHCO3 доводят рН реакционной массы до 11, выделяют продукт в ацетон. Получают композицию с выходом 28,7 г.
Пример 9
В химический стакан емкостью 200 мл наливают 10,0 г воды и 24 г раствора 34,8% NaOH. Затем при перемешивании добавляют 24 г ДАКМЦ с содержанием карбонильных групп 0,94 ммоль/г и перемешивают реакционную массу 20 минут, поддерживая температуру не выше 58°С, до содержания карбонильных групп в полисахариде 93,61% по отношению к исходному содержанию. Параллельно готовят раствор госсипола, для чего растворяют 1,6 г госсиполуксуной кислоты в смеси 25 мл ацетона, 2,4 мл раствора 34,8% NaOH и 10,0 мл воды в течение 10 минут при температуре 25°С. После чего раствор полифенола приливают к раствору полимера. Далее перемешивают реакционную массу 10 минут при 37°С и 60 минут при 20°С до степени превращения исходного полифенола в полифенолы с молекулярной массой от 100 до 2000 атомных единиц массы 100% и содержания карбонильных групп в полисахариде 93,61% по отношению к исходному содержанию. Затем добавлением NaHCO3 доводят рН реакционной массы до 11, выделяют продукт в ацетон. Получают композицию с выходом 28,7 г.
Пример 10
В химический стакан емкостью 500 мл наливают 200 г раствора 20% NaOH. Затем при перемешивании добавляют 20 г ДАКМЦ с содержанием карбонильных групп 0,94 ммоль/г и 0,2 г госсипола. Затем перемешивают реакционную массу при 25°С в течение 72 часов до содержания карбонильных групп в полисахариде 24,5% по отношению к исходному содержанию и степени превращения исходного полифенола в полифенолы с молекулярной массой от 100 до 2000 атомных единиц массы 100%, после чего добавляют к реакционной массе 75 г гидрокарбоната натрия, перемешивают 30 минут. Далее реакционную массу лиофилизуют. Получают композицию с выходом 45,4 г.
Пример 11
В химический стакан емкостью 500 мл наливают 200 г раствора 20% NaOH. Затем при перемешивании добавляют 20 г ДАКМЦ с содержанием карбонильных групп 0,94 ммоль/г и 0,6 г госсипола. Затем перемешивают реакционную массу при 25°С в течение 72 часов до содержания карбонильных групп в полисахариде 34,0% по отношению к исходному содержанию и степени превращения исходного полифенола в полифенолы с молекулярной массой от 100 до 2000 атомных единиц массы 100%, после чего добавляют к реакционной массе 75 г гидрокарбоната натрия, перемешивают 30 минут. Далее реакционную массу лиофилизуют. Получают композицию с выходом 49,5 г.
Пример 12
В химический стакан емкостью 500 мл наливают 200 г раствора 20% NaOH. Затем при перемешивании добавляют 20 г ДАКМЦ с содержанием карбонильных групп 0,94 ммоль/г и 1 г госсипола. Затем перемешивают реакционную массу при 25°С в течение 72 часов до содержания карбонильных групп в полисахариде 34,0% по отношению к исходному содержанию и степени превращения исходного полифенола в полифенолы с молекулярной массой от 100 до 2000 атомных единиц массы 100,0%, после чего добавляют к реакционной массе 75 г гидрокарбоната натрия, перемешивают 30 минут. Далее реакционную массу лиофилизуют. Получают композицию с выходом 39,5 г.
Пример 13
В химический стакан емкостью 200 мл наливают 27,6 г воды, добавляют 60 г р-ра NaOH 34,8%. Далее при перемешивании добавляют 60 г ДАКМЦ с содержанием карбонильных групп 0,94 ммоль/г, поддерживая температуру не выше 58°С. Перемешивают реакционную массу 3 часа при комнатной температуре, после чего останавливают перемешивание и выдерживают 18 часов до содержания карбонильных групп 81,4% относительно исходного полимера. На следующий день подкисляют реакционную массу 10 г гидрокарбоната натрия, перемешивают 30 минут и выделяют в ацетон и сушат. Полученное вещество загружают в установку для ультрафильтрации и проводят ультрафильтрацию на мембране 10 кДА, получая полимерный полупродукт с содержанием карбонильных групп 0,85 ммоль/г.
В химический стакан емкостью 50 мл наливают 20 мл воды. Затем при перемешивании добавляют 0,5 г полимерного полупродукта с содержанием карбонильных групп 0,85 ммоль/г и перемешивают реакционную массу при 25°С в течение 10 минут, после чего прибавляют к нему 1 мл раствора осельтамивира фосфата (10-3г) в воде, выдержанного при 25°С в течение 5 минут. Затем перемешивают реакционную массу 30 минут при 25°С. Далее реакционную массу лиофилизуют. Получают комбинацию с выходом 0,5 г.
Пример 14
В химический стакан емкостью 200 мл наливают 27,6 г воды, добавляют 60 г р-ра NaOH 34,8%. Далее при перемешивании добавляют 60 г ДАКМЦ с содержанием карбонильных групп 0,94 ммоль/г, поддерживая температуру не выше 58°С. Перемешивают реакционную массу 3 часа при комнатной температуре, после чего останавливают перемешивание и выдерживают 18 часов до содержания карбонильных групп 81,4% относительно исходного полимера. На следующий день подкисляют реакционную массу 10 г гидрокарбоната натрия, перемешивают 30 минут и выделяют в ацетон и сушат. Получают полимерный полупродукт с содержанием карбонильных групп 0,79 ммоль/г.
В химический стакан емкостью 100 мл наливают 50 мл ацетона. Затем при перемешивании добавляют 10 г полимерного полупродукта с содержанием карбонильных групп 0,79 ммоль/г и перемешивают реакционную массу при 25°С в течение 5 минут, после чего добавляют к реакционной массе 0,3 г экстракта эхинацеи в 3 мл ацетона. Затем перемешивают реакционную массу 30 минут при 25°С. Далее реакционную массу досуха упаривают на роторном испарителе и сушат в сухожаровом шкафу при 40°С. Получают комбинацию с выходом 10 г.
Пример 15
В химический стакан емкостью 200 мл наливают 27,6 г воды, добавляют 60 г р-ра NaOH 34,8%. Далее при перемешивании добавляют 60 г ДАКМЦ с содержанием карбонильных групп 0,94 ммоль/г, поддерживая температуру не выше 58°С. Перемешивают реакционную массу 3 часа при комнатной температуре, после чего останавливают перемешивание и выдерживают 18 часов до содержания карбонильных групп 81,4% относительно исходного полимера. На следующий день подкисляют реакционную массу 10 г гидрокарбоната натрия, перемешивают 30 минут и выделяют в ацетон и сушат. Получают полимерный полупродукт с содержанием карбонильных групп 0,79 ммоль/г.
В химический стакан емкостью 100 мл наливают 50 мл ацетона. Затем при перемешивании добавляют 10 г полимерного полупродукта с содержанием карбонильных групп 0,79 ммоль/г и перемешивают реакционную массу при 25°С в течение 5 минут, после чего добавляют к реакционной массе 0,3 г экстракта солодки в 3 мл ацетона. Затем перемешивают реакционную массу 30 минут при 25°С. Далее реакционную массу досуха упаривают на роторном испарителе и сушат в сухожаровом шкафу при 40°С. Получают комбинацию с выходом 10 г.
Пример 16
В химический стакан емкостью 200 мл наливают 27,6 г воды, добавляют 60 г р-ра NaOH 34,8%. Далее при перемешивании добавляют 60 г ДАКМЦ с содержанием карбонильных групп 0,94 ммоль/г, поддерживая температуру не выше 58°С. Перемешивают реакционную массу 3 часа при комнатной температуре, после чего останавливают перемешивание и выдерживают 18 часов до содержания карбонильных групп 81,4% относительно исходного полимера. На следующий день подкисляют реакционную массу 10 г гидрокарбоната натрия, перемешивают 30 минут и выделяют в ацетон и сушат. Получают полимерный полупродукт с содержанием карбонильных групп 0,79 ммоль/г.
В химический стакан емкостью 100 мл наливают 50 мл ацетона. Затем при перемешивании добавляют 10 г полимерного полупродукта с содержанием карбонильных групп 0,79 ммоль/г и перемешивают реакционную массу при 25°С в течение 5 минут, после чего добавляют к реакционной массе 0,3 г экстракта имбиря в 3 мл ацетона. Затем перемешивают реакционную массу 30 минут при 25°С. Далее реакционную массу досуха упаривают на роторном испарителе и сушат в сухожаровом шкафу при 40°С. Получают комбинацию с выходом 10 г.
Пример 17
В химический стакан емкостью 200 мл наливают 27,6 г воды, добавляют 60 г р-ра NaOH 34,8%. Далее при перемешивании добавляют 60 г ДАКМЦ с содержанием карбонильных групп 0,94 ммоль/г, поддерживая температуру не выше 58°С. Перемешивают реакционную массу 3 часа при комнатной температуре, после чего останавливают перемешивание и выдерживают 18 часов до содержания карбонильных групп 81,4% относительно исходного полимера. На следующий день подкисляют реакционную массу 10 г гидрокарбоната натрия, перемешивают 30 минут и выделяют в ацетон и сушат. Получают полимерный полупродукт с содержанием карбонильных групп 0,79 ммоль/г.
В химический стакан емкостью 100 мл наливают 50 мл ацетона. Затем при перемешивании добавляют 10 г полимерного полупродукта с содержанием карбонильных групп 0,79 ммоль/г и перемешивают реакционную массу при 25°С в течение 5 минут, после чего добавляют к реакционной массе 0,3 г экстракта девясила в 3 мл ацетона. Затем перемешивают реакционную массу 30 минут при 25°С. Далее реакционную массу досуха упаривают на роторном испарителе и сушат в сухожаровом шкафу при 40°С. Получают комбинацию с выходом 10 г.
Таблица 1
Соотношение компонентов в полученных композициях
Таблица 2
Соотношение компонентов в полученных комбинациях
Пример фармацевтического препарата
Таблетки получали обычным способом, а именно путем смешивания ингредиентов и таблетирования на таблетирующей машине методом прямого прессования. Качественный и количественный состав таблеток приведены в таблице 3.
Таблица 3
* Лудипресс - лактоза прямого прессования, состав: лактоза моногидрат, повидон (Коллидон 30), кросповидон (Коллидон CL).
При проверке растворимости установлено, что при растворении таблетки в 500 мл воды при 100 оборотах мешалки в минуту в раствор за 45 мин переходит 100% активного вещества.
Разработанные методы получения композиций, вследствие введения дополнительных стадий с четко определенными контрольными точками, позволяют получать продукты с улучшенными физико-химическими и биологическими характеристиками по сравнению с исходными полифенолами, а также, делают возможным значительное расширение структурного разнообразия продуктов исходя из ограниченного количества исходных соединений.
В таблице 4 приведены примеры, в которых показано, что при использовании одинаковых исходных компонентов в зависимости от условий могут быть получены композиции с различным качественным и количественным составом образующихся полифенолов (пример 8 и 9) и полимерной составляющей (пример 4 и 5).
В частности, при проведении процесса в сильнощелочных условиях, происходит превращение неустойчивых в щелочных условиях полифенолов с образованием их структурных аналогов. Хроматограммы композиций с модификацией введенного полифенола представлены на Фиг.1.
Таблица 4
Характеристика композиций по содержанию полифенолов
Дополнительным преимуществом разработанных методов является возможность введения в состав композиций вспомогательных веществ (например, карбоната натрия) в ходе синтеза, а не путем последующего добавления к готовой фармацевтической субстанции. Помимо этого, вышеизложенные методы позволяют корректировать биологические свойства путем получения комбинаций как с другими фармацевтическими субстанциями (пример 13), так и с экстрактами лекарственных растений (примеры 14-17).
Строение и количественный состав полученных композиций были изучены методами ВЭЖХ-УФ-МС, ЯМР, ГПХ, ИК-спектрометрии и потенциометрического титрования.
Идентификацию, введенных в полимер, ароматических компонентов проводили по стандарту соответствующих полифенолов или времени удерживания, масс- и уф-спектрам. Содержание неидентифицированных полифенолов в полученных композициях определяли методом ВЭЖХ, проводя расчет по внешнему стандарту-госсиполу ввиду отсутствия стандартов каждого из индивидуальных веществ.
Так как ВЭЖХ хроматограммы продуктов-композиций отличаются от соответствующих хроматограмм бланков (продуктов без введения полифенолов) только наличием пиков индивидуальных полифенолов, можно говорить об отсутствии ковалентной связи между компонентами композиции.
Хроматограмма композиции, полученной без введения полифенолов, детектирование при 254 нм представлена на Фиг.2.
Дополнительным подтверждением отсутствия ковалентной связи между полимером и полифенолами служат данные ЯМР анализа композиции, представленной на Фиг.3. Для образца по примеру 9 был зарегистрированы спектр DOSY, показывающий различие в коэффициентах самодиффузии между полимером (группа сигналов в области 3-5 м.д.) и полифенолами (области ароматических сигналов 6-11 м.д. и алифатических сигналов 2,5 -0,5 м.д.).
Структура полимерной части при получении композиций претерпевает основные изменения лишь в отношении карбонильных групп. В таблице 5 показаны примеры композиций, для которых условия были подобраны таким образом, чтобы полимерная часть модифицировалась в различной степени, что находит отражение в содержании альдегидных групп по сравнению с исходным полимером.
Таблица 5
Характеристика композиций по содержанию альдегидных групп
На Фиг.4 приведен ИК-спектр композиции (пример 8) в сравнении с исходным полимером. Можно заметить, что вид ИК-спектра композиции практически полностью определяется полимерной составляющей. По сравнению с ИК-спектром исходного ДА КМЦ значительных изменений по положению и интенсивности полос поглощения не наблюдается кроме характеристичной полосы при 1727 см-1, соответствующая колебаниям карбонильных групп.
Изменение в содержании альдегидных групп находит отражении и на ИК-спектре, где наблюдается полное исчезновение полосы 1727 см-1, соответствующее колебаниям карбонильных групп.
Средневесовая молекулярная масса полученных композиций находится в диапазоне от 3530 до 39100 Да и определяется типом введенного полимера и условиями проведения процесса (таблица 6).
Таблица 6
Молекулярно-массовые характеристики композиций
Количество, введенной в синтез солевой составляющей, определяли потенциометрическим титрованием. Количество, соли, присутствующее в композициях полностью соотносится с введенным.
Определение цитотоксического действия субстанций в культуре клеток
В экспериментальной работе использовали клеточную линию MDCK ECACC (Sigma, кат. № 85011435), на 67-70 пассажах. Линию культивировали в среде Игла MEM (ПанЭко), содержащей 10% фетальной сыворотки (HyClone), 300 мкг/мл L-глутамина и 0,1 мг/мл нормоцина.
Клетки линии MDCK ECACC вносили в 96-луночные планшеты в среде Игла MEM (ПанЭко), содержащей 10% фетальной сыворотки (HyClone), 300 мкг/мл L-глутамина и 0,1 мг/мл нормоцина из расчета 18000 кл/лунку, культивировали 24 ч и промывали бессывороточной средой 1 раз перед внесением субстанций.
Для разведения тестируемых веществ использовали поддерживающую среду следующего состава: среда Игла МЕМ (ПанЭко), содержащую 2% фетальной сыворотки (HyClone), 300 мкг/мл L-глутамина, 12 мкг/мл химопсин-трипсина и 0,1 мг/мл нормоцина.
Каждую точку тестировали в 4 параллельных лунках. Последнее разведение помещали в первые 2 лунки из 4, в две последние лунки из 4 вносили поддерживающую среду (контроль среды культивирования).
Клетки инкубировали с тестируемыми веществами в течение 48 ч в CO2-инкубаторе при температуре 37°С, после чего удаляли культуральную среду и в каждую лунку добавляли по 100 мкл поддерживающей среды и 20 мкл раствора MTS (Promega, кат.№ G3581). После инкубации в течение 3 ч при 37°С определяли оптическую плотность при длине волны 492 нм и референсной длине волны 620 нм при помощи планшетного спектрофотометра BIO-RAD. Концентрация тестируемого вещества, уменьшающая значение оптической плотности на 50% по сравнению с контролем клеток, принималась за 50% цитотоксическую дозу (СС50).
Изучение действия препаратов на инфекционный титр вируса в культуре клеток MDCK
В исследованиях использовали вирус гриппа A/Пуэрто-Рико/8/34 (H1N1), адаптированный к линии MDCK. Инфекционную и гемагглютинирующую активность вируса определяли согласно методам, рекомендованным ВОЗ.
Исследования вирусспецифического действия тестируемых веществ в отношении штамма A/Пуэрто Рико/8/34 проводили на клетках MDCK ECACC, используя в качестве поддерживающей среду Игла МЕМ (ПанЭко), содержащую 2% фетальной сыворотки (HyClone), 300 мкг/мл L-глутамина, 12 мкг/мл химопсин-трипсина и 0,1 мг/мл нормоцина. Культуру клеток MDСК ECACC подготавливали так же, как и в опытах по определению цитотоксического действия изучаемых веществ. Перед заражением вирусом клетки MDCK 1 раз промывали бессывороточной средой Игла МЕМ, добавляли предварительно подготовленные разведения препаратов в 100 мкл поддерживающей среды (однократной концентрации) и инкубировали 1 ч при 37°С. Затем добавляли по 10 мкл предварительно приготовленных 10-кратных разведений вируса. Контроли вирусов и клеток культивировали в той же среде. Учет результатов проводили через 48 ч по ЦПД и в РГА. В РГА использовали 0,75% взвесь эритроцитов человека (I группа) в физиологическом растворе.
Обработка и анализ данных
Расчет значений 50% цитотоксической концентрации (CC50) и 50% эффективной концентрации (IC50) для каждого из изученных соединений проводили при помощи пакета программ Exсel и GraphPad Prism 6.01. За рабочую модель для анализа CC50 принимали 4-параметрическое уравнение логистической кривой (пункты меню «Нелинейная регрессия» -«Sigmoidal dose-response (variable slope)»). Для анализа IC50 принимали 4-параметрическое уравнение логистической кривой (пункты меню «Нелинейная регрессия» -«log (inhibitor) vs. response (variable slope)»). Результаты представлены в Таблице 7.
Таблица 7
* Вещества с выраженной противовирусной активностью имеют ID50 cр≥1.50.
Все протестированные образцы по сравнению с известными полифенолами (госсипол и апогоссипол) имеют существенно более низкие уровни цитотоксичности при соизмеримых или более высоких уровнях активности.
Результат исследования МИК и МБК
Эксперименты проводили согласно Руководству по проведению доклинических исследований (редакция Миронова, 2012г).
Определяли:
1. МИК=МПК=Минимальную Ингибирующую (Подавляющую, бактериостатическую) концентрацию;
2. МБК=Минимальную Бактерицидную Концентрацию.
1. Staphylococcus aureus (клинический изолят)
Исследование на клиническом штамме стафилококка проводили при инфицирующей дозе стафилококка 105. Препараты по примерам 1, 8, 9 разводили до 100 мг/мл c помощью равных объемов DMSO и воды для инъекций. Препараты пропускали через фильтр. Определение МПК проводили методом серийных разведений в 96 луночном плоскодонном планшете путем совместного культивирования в жидкой питательной среде препарата и тест штамма в двух повторностях. МПК определяли по наименьшей концентрации препарата, который подавляет видимый рост микроорганизма. Для определения МБК, а после инкубации из лунок сеяли на агаризованную среду. Результаты представлены в Таблице 8.
Таблица 8
Для препаратов по примерам 1, 8 при совместном культивировании с стафилококком в концентрации 105 МПК составила 25 мг/мл, а МБК не установили (выше чем концентрация препарат в исходной лунке). Для препарата по примеру 9 МПК составила 25 мг/мл, а МБК - 50 мг/мл.
2. Staphylococcus aureus 6538P (эталонный штамм)
Исследование на тест-штамме стафилококка (Staphylococcus aureus 6538P) проводили при разных инфицирующих дозах стафилококка 103,104,105,106, 107. Препараты по примерам 1 и 9 разводили до 100 мг/мл, препарат по примеру 8 до 200 мг/мл c помощью равных объемов DMSO и воды для инъекций. Размешивали и в течение 2 часов растворяли на водяной бане на 37°С. Препараты пропускали через фильтр. Препараты по примерам 1 и 9 разводили первоначально до 200 мг/мл, но так как не удалось фильтровать, разводили растворы еще 2 раза.
Определение МПК проводили методом серийных разведений в 96-луночном плоскодонном планшете путем совместного культивирования в жидкой питательной среде препарата и тест штамма в двух повторностях. МПК определяли по наименьшей концентрации препарата, который подавляет видимый рост микроорганизма. Для определения МБК, а после инкубации из лунок сеяли на агаризованную среду. Результаты представлены в Таблице 9.
Таблица 9
* Не определяли.
При сравнении действия препарата по примеру 9 до фильтрации и после фильтрации на концентрации стафилококка 106, 107 было обнаружено, что МПК и МБК препарата до и после фильтрации отличаются. При действии на 106 МПК снижена в 4 раза после фильтрации (до фильтрации 6,25 мг/мл, после - 25 мг/мл), а МБК после фильтрации не определилось (>50), а до фильтрации 50 мг/мл. При действии на 107 МПК снижена в 2 раза после фильтрации (до фильтрации 12,5 мг/мл, после - 25 мг/мл), а МБК после фильтрации не определилось (>50), а до фильтрации 50 мг/мл.
Реферат
Группа изобретений относится к области медицины, а именно к противомикробному средству, представляющему собой продукт, полученный путем обработки исходного полисахарида, выбранного из группы, состоящей из диальдегида карбоксиметилцеллюлозы и диальдегида декстрана, в водной или водно-органической среде при рН в диапазоне от 10 до 14 для получения обработанного полисахарида с содержанием карбонильных групп от 95 до 20 мас.% по отношению к исходному полисахариду, также относится к противомикробной комбинации, содержащей противомикробное средство и по меньшей мере одно другое противомикробное средство, содержание которого в составе комбинации составляет от 0,000001 до 50,0 мас.%, также относится к способу получения обработанного полисахарида с содержанием карбонильных групп от 95 до 20 мас.% по отношению к исходному полисахариду, включающему: - стадию предварительной обработки исходного полисахарида, выбранного из группы, состоящей из диальдегида карбоксиметилцеллюлозы и диальдегида декстрана в водной или водно-органической среде при рН в диапазоне от 10 до 14 для получения обработанного полисахарида с содержанием карбонильных групп от 95 до 20 мас.% по отношению к исходному полисахариду, и - последующую стадию выделения полученного продукта, и также относится к противомикробной композиции, содержащей эффективное количество противомикробного средства или противомикробной комбинации и фармацевтически приемлемые добавки. Группа изобретений обеспечивает получение продукта с улучшенными физико-химическими и биологическими характеристиками по сравнению с исходными полифенолами и полисахаридами, обеспечивает получение веществ с противовирусной активностью, которые имеют более низкие уровни цитотоксичности при соизмеримых или более высоких уровнях активности, где между компонентами композиции, состоящей из полифенольной и полисахаридной частей, отсутствуют ковалентные связи. 4 н. и 4 з.п. ф-лы, 4 ил., 9 табл., 17 пр.
Формула
Документы, цитированные в отчёте о поиске
Полимерные производные госсипола, способ их получения и фармацевтическая композиция на их основе
Растворимая ассоциативная карбоксиметилцеллюлоза,содержащие ее композиции, способ ее получения и применения
Полисахарид семени тамаринда для применения в лечении микробных инфекций

Комментарии