Полимерные производные госсипола, способ их получения и фармацевтическая композиция на их основе - RU2577539C2
Код документа: RU2577539C2
Чертежи



Описание
Область техники
Настоящее изобретение относится к области органической химии и фармакологии и касается нового полимерного производного госсипола, а именно госсипола, ковалентно связанного с диальдегидполисахаридами, способа его получения.
Уровень техники
Госсипол-2,2′бис(1,6,7-тригидрокси-5-изопропил-3-метил-8-формилнафталин) (C30H30O8) - это природный полифенол, выделяемый из растения хлопчатника и хлопкового масла следующей формулы:

Молекула госсипола
Молекула госсипола состоит из двух одинаковых фрагментов, соединенных одинарной С-С связью и образующих двугранный угол φ между плоскостями нафталиновых циклов, в среднем близкий к 90°. Вращение вокруг связи С-С затруднено стерически, поэтому госсипол при извлечении из хлопчатника представляет собой рацемическую смесь, состоящую из (-) и (+) энантиомеров, которые можно разделить:

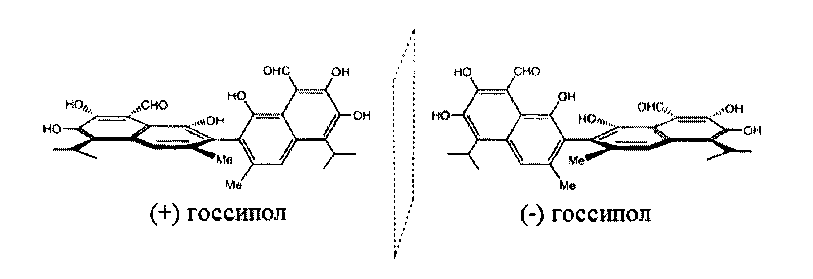
Химическая и энантиомерная (+) и (-) структуры госсипола
Энантиомерная форма госсипол (-) по активности и токсичности превышает энантиомерную форму госсипола (+) и рацемическую смесь.
Для госсипола, помимо энантиомерии, характерна симметричная и асимметричная таутомерия. В зависимости от растворителя он может находиться в трех таутомерных формах: альдегидной, лактольной и кетольной:
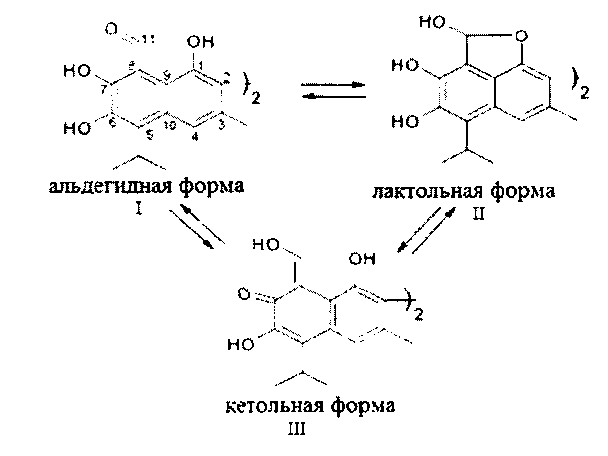
Структура таутомеров и нумерация атомов молекулы госсипола
Альдегидная форма доминирует в нерастворенном твердом состоянии госсипола и неполярных растворителях, таких как хлороформ и дихлорметан. Кетольный таутомер присутствует в водных щелочных растворах и не стабилен в нейтральных и кислотных растворителях, где может переходить в альдегидную форму. В полярных растворителях госсипол находится в равновесии между лактольной и альдегидной формами и смещается в сторону лактольного таутомера в случае повышения нуклеофильности растворителя, например в диметилсульфоксиде. Симметричный кетольный таутомер госсипола образует стабильные комплексы с ионами двух- и трехвалентного железа и цинка. Катионы никеля и меди смещают равновесие в сторону образования лактольной формы [Juanjuan Yin, Chemical modification and biological activity exploration of the natural product-gossipol, PhD Dissertation, Clemson University, 2010].
Госсипол является высокоактивным веществом и обладает целым рядом видов фармакологической активности. Известны исследования по противовирусной, антипролиферативной, антиоксидантной и интерферон-индуцирующей активности. В патентных публикациях предложено использовать госсипол и его производные в качестве противораковых средств, средств лечения аутизма детей, герпеса, лекарств для лечения вирусного иммунодефицита человека ВИЧ, гепатита С, а также генерализованных форм грибковых инфекций. В патентной публикации [RU 2270708] предложено использовать госсипол и его производные в качестве противовирусных препаратов, эффективных для лечения заболеваний вызванных вирусами гриппа, герпеса А и В, а также аденовирусной инфекции.
Обладая уникальным набором фармакологических свойств, госсипол является высокотоксичным соединением, поэтому наряду с высокой противовирусной активностью препараты на его основе обладают целым рядом побочных действий. Он угнетает мужскую фертильность и обладает высокой цитотоксичностью для быстро делящихся клеток. Одним из наиболее эффективных способов снижения токсичности физиологически активных соединений является их присоединение на полимер-носитель, что в ряде случаев позволяет использовать высокоактивные вещества для лечения и при этом избежать побочных эффектов связанных с общетоксическим действием.
В литературе описаны полимерные производные фармакологически активных веществ (ФАВ) прививочного типа, содержащие лекарственное вещество, связанное ковалентной связью с биоразлагаемым полимерным носителем полисахаридного типа [Н.А. Платэ, А.Н. Васильев. Физиологически активные полимеры. Москва, Химия, 1986, 296 c.]. Связывание фармакологически активного вещества (ФАВ) с полимером-носителем тем или иным видом связи позволяет снижать токсичность, улучшать растворимость, а в ряде случаев осуществлять целевой транспорт образующегося полимерного лекарства в орган мишень. Такие полимеры содержат, как правило, лекарства пептидного типа, присоединенные с использованием аминогрупп пептида с образованием азометиновой связи между молекулой физиологически активного вещества и полимером-носителем. Молекула госсипола не имеет аминогрупп, поэтому не может быть присоединена с использованием азометиновой связи.
Также в качестве аналога можно привести описанное в патентной литературе [UZ IAP 04811] полимерное производное госсипола, обладающее противовирусными свойствами, в котором он связан с карбоксиметилцеллюлозой с образованием сополимера натриевой соли карбоксиметилцеллюлозы и госсипола. Сополимер описан как содержащий следующие звенья: натриевая соль 2,3-диэтокси-6-О-карбоксиметил-(1→4)-β-D-оксиглюкозы-диэтоксигоссиполята (C46PH57O17Na); 2-этокси-(1→4)-β-D-оксиглюкозы-диэтоксигоссиполята (С42Н50О12); 2-О-карбоксиметил-(1→4)β-D-глюкозы (C8H11O7Na); 2,6-О-дикарбоксиметил-(1→4)-β-D-глюкозы (C10H12O9Na2). Химическую структуру сополимера в соответствии с указанным аналогом определить невозможно, так как она описана с использованием неноменклатурных наименований соединений. При этом использованы как номенклатурные, так и тривиальные (оксиглюкоза, этоксигоссиполят) формулы в произвольной комбинации с вовлечением в описание товарного знака (ЦелАгрип). Можно предположить, что в соответствии с прототипом молекула госсипола содержит остатки этилового спирта, а кроме того, связана с полисахаридом, полученным из карбоксиметилцеллюлозы. Таким образом в вышеуказанном изобретении к карбоксиметилцеллюлозе присоединен не сам госсипол, а другие химические соединения.
Аналогом предложенного изобретения является обладающий противовирусным действием коньюгат госсипола с натрийкарбоксиметилцеллюлозой с молекулярной массой 780-180000 Да при соотношении госсипол:натрийкарбоксиметилцеллюлоза (1-5):(99-95) масс.%, содержащий до 20% низкомолекулярной фракции 780-1500 Да и до 80% высокомолекулярной фракции 1500-180000 Да [RU 2499002].
Наиболее близким аналогом предложенного изобретения является обладающая противовирусной активностью натриевая соль сополимера госсипола и карбоксиметилцеллюлозы следующей формулы:

где
а:b:с=1:(3-6):(5-7),
молекулярной массы 120000-130000,
эмпирической формулы:
[(С38Н39 NaO15)а(С6Н10О5)b(C8H11NaO7)с]n,
которая раскрыта в [RU 22707087]. В другой публикации [RU 2453559] описан улучшенный способ получения указанного полимерного производного госсипола и его применение в комплексной терапии пациентов с аутическими расстройствами.
Известные способы получения натриевой соли сополимера госсипола и карбоксиметилцеллюлозы, представляющей собой наиболее близкий аналог заявленного изобретения, заключаются во взаимодействии госсипола с окисленной диальдегидкарбоксиметилцеллюлозой в различных условиях. При этом сама окисленная целлюлоза не выделена и не описана. Известно, что окисление целлюлозы в одних и тех же условиях может протекать с образованием различных продуктов: диальдегид карбоксиметилцеллюлозы, соответствующей оксикислоты и дикислоты. Направление реакции зависит от множества факторов, трудно поддающихся контролю. К ним можно отнести интенсивность освещения, которая влияет на радикальный процесс периодатного окисления по Малопраду, скорость удаления молекулярного иода, а также микропримеси в исходной карбоксиметилцеллюлозе. Кроме того, на окисление и присоединения госсипола могут влиять как микропримеси в госсиполе, так и наличие окислителей растворенного в среде кислорода воздуха.
Сущность изобретения
Задачей настоящего изобретения является расширение ассортимента фармакологически активных полимерных производных госсипола, сохраняющих присущую госсиполу фармакологическую активность и обладающих контролируемым уровнем токсичности, который зависит от способа химической модификации альдегидных групп госсипола. Расширение имеющегося набора противовирусных средств является постоянной работой направленной на предотвращение привыкания и развития новых форм инфекций, устойчивых к существующим средствам.
Настоящее изобретение относится к новому полимерному производному госсипола, имеющему следующую общую формулу (I):

где R′′=Sach; R′′=Sach или Н;
Sach - окисленное звено пентозы или гексозы в составе полисахарида одной из указанных ниже формул:

где R=-СН2ОН; -СН(ОН)СН2ОН; -CH2OR′; -СН(ОН)CH2OR′;
R′=-СН2СН2ОН; -CH2CH2NH2; -СН2С(O)ОН; -SO3H, -OSO3H;
-СН2С(O)OR′′;
R′′=Alk.
и молекулярную массу от 1 до 2000 кДа, предпочтительно от 3 до 80 кДа.
Другим объектом настоящего изобретения является способ получения полимерного производного госсипола общей формулы (I), включающий окисление полисахарида йодной кислотой или ее солями с образованием окисленного полисахарида, содержащего замкнутые ацетальной или азометиновой связью окисленные циклы, последующее выделение образовавшегося окисленного полисахарида и его взаимодействие с госсиполом или его производным при рН от 3,5 до 14 и мольном соотношении госсипол:окисленное полисахаридное звено от 10:1 до 1:100.
Еще одним другим объектом изобретения является продукт, обладающий противовирусной активностью, полученный указанным выше способом.
Описание чертежей
На Фиг. 1 представлен ЯМР 13С спектр исходной карбоксиметилцеллюлозы в растворе D2O с отнесением сигналов.
На Фиг. 2 представлены фрагменты ЯМР13С спектров (1)-карбосиметилцеллюлозы; (2)-диальдегидкарбоксиметилцеллюлозы со степенью окисления 65%; и (3)-диальдегидкарбоксиметилцеллюлозы со степенью окисления 80%.
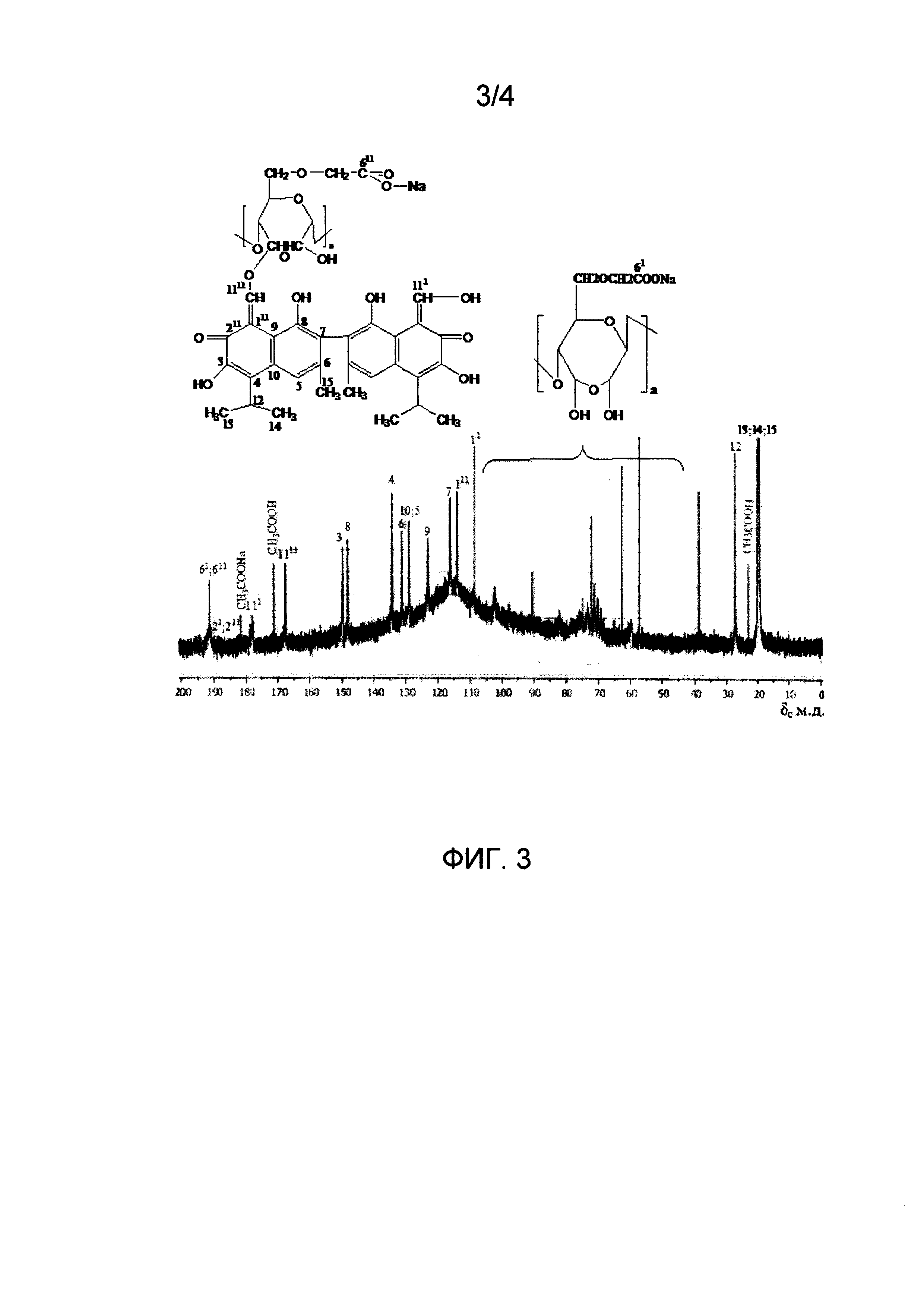
На Фиг. 3 показан спектр ЯМР13С полимерного производного госсипола, ковалентно связанного с ДАКМЦ, полученного в условиях избытка госсипола.
На Фиг. 4 показан спектр ЯМР13С полимерного производного госсипола, ковалентно связанного с диальдегиддекстраном (ДАД), полученного в условиях избытка госсипола.
Подробное описание изобретения
В качестве госсиполсодержащего сырья в изобретении используют как сам госсипол в виде индивидуального соединения, так и любые его производные, предпочтительно клатрат госсипола с уксусной кислотой, далее именуемый госсиполуксусная кислота или ГУК.
В качестве полимеров-носителей в изобретении используют полисахариды. Под полисахаридами подразумевают пентозаны, и гексозаны, и гетерополисахариды, то есть полипиранозы, полифуранозы, смещанные полисахариды и их производные, а именно: глюканы, ксиланы, маннаны, галактаны, фруктозаны, арабинаны, арабиногалактаны, глюкозаминогликаны, глюкуроноксиланы, глюкоманнаны, галактоглюкоманнаны, арабиногалактаны, сульфополисахариды, сульфамино и аминополисахариды, содержащие в углеводном звене вицинальные гидроксильные группы, либо гидроксильную и аминогруппу, способные вступать в реакцию периодатного окисления Маллапрада [А. Берка, Я. Вултерин, Я. Зыка. Новые редокс-методы в аналитической химии, пер. с чеш., Москва, 1968, с. 114-127. В. Я. Захаранс. "Изв. АН Латв. ССР, сер. хим. н.", 1982, №1, с. 3-18] с образованием диальдегидполисахарида, его циклической полуацетали или циклического азометина в соответствии со следующей схемой.
Схема окисления полисахаридов с образованием циклических полуацеталей и азометинов

где R=-СН2ОН; -СН(ОН)СН2ОН; -CH2OR′; -СН(ОН)CH2OR′;
R′=-СН2СН2ОН; -CH2CH2NH2; -СН2С(O)ОН; -SO3H, -OSO3H;
-СН2С(O)OR′′;
R′′=Alk;
n - полимерность соединения.
В изобретении используют как линейные, так и разветвленные, а также полимофные (разнозвенные) полисахариды и их производные, содержащие в одной макромолекуле различные типы моносахаридов, соединенные разными типами гликозидных связей. В качестве примеров можно привести такие полисахариды как карбоксиметилцеллюлоза, оксиэтилцеллюлоза, гемицеллюлоза, декстран и его производные, альгиновая кислота, крахмал и ее производные: оксиэтилкрахмал, карбоксиметилкрахмал, аминоэтилкрахмал, каррагинан, хитозан, фикол и его производные.
До периодатного окисления указанные выше полисахариды малопригодны для ковалентного связывания госсипола и требуют химической модификации для получения реакционно-способных производных. В качестве реакции активирования полимера-носителя в изобретении используют реакцию периодатного окисления с получением диальдегидполисахаридов в циклической форме, а именно диальдегидполисахаридов, в которых окисленные звенья замкнуты полуацетальной либо азометиновой связью в 5-, 6- либо 7-членный цикл, как показано на приведенной выше Схеме окисления полисахаридов с образованием циклических полуацеталей и азометинов.
Для этого в изобретении их окисляют йодной кислотой или ее солью, предпочтительно метапериодатом натрия, или калия в водной или водно-органической среде. Используют два способа: гомофазное окисление метапериодатом натрия в водном растворе, либо гетерофазное окисление при пропускании раствора полисахарида через анионообменную смолу в IO4- форме. Гомофазное окисление предпочтительно для лабораторных и полупрепаративных условий. Оно позволяет легко контролировать степень окисления, изменяя соотношение реагентов. Гетерофазный метод более подходит для заводских условий, поскольку позволяет избежать стадии очистки продукта от солей и остаточных количеств периодата. Оба предложенных способа приводят к образованию аналогичных по химической структуре и свойствам полимеров.
Количество окисленных звеньев зависит от соотношения полисахарид:периодат, времени реакции и от структуры звеньев основной цепи полисахарида. Так, если в структуре звена, как в карбоксиметилцеллюлозе (КМЦ), имеется только одна пара вицинальных гидроксильных групп способных к реакции Маллапрада, то на окисление одного моля звеньев расходуется один моль периодата и количество окисленных звеньев эквивалентно количеству периодата в следующей реакции:
Схема реакции периодатного окисления карбоксиметилцеллюлозы с образованием диальдегидкарбоксиметилцеллюлозы

Если в структуре звена имеется три вицинальных гидроксила, как, например, в декстране, то на ее окисление может быть израсходовано две молекулы периодата и зависимость степени окисления от количества периодата носит более сложный характер (см. Таблицу 1). Степень окисления определяли как количество окисленных звеньев в 100 сахарных звеньях полисахарида независимо от их структуры. В случае КМЦ при расчете степени окисления суммировали как карбоксиметилированные так и остаточные некарбоксиметилированные глюкозные звенья. Для декстрана при расчете суммировали все звенья, образовавшиеся в результате окисления независимо от их химической структуры. В соответствии с изобретением степень окисления диальдегидполисахаридов находится в пределах от 0.1 звена на 100 сахарных звеньев полисахарида (γ=0,1) до 100 звеньев на 100 сахарных звеньев полисахарида (γ=100). Что эквивалентно содержанию от 1 окисленного звена в 1000 сахаридных звеньях полисахарида до полностью окисленного полисахарида.
Молекула декстрана имеет три вицинальных гидроксила в ангидроглюкозном (АГЗ) звене. В зависимости от соотношения декстран:периодат окисление может протекать в две стадии с образованием продуктов трех типов: А, В и С по следующей схеме:
Схема периодатного окисления декстрана с образованием диальдегиддекстрана

На первой стадии расходуется один моль периодата, при этом происходит окисление с разрывом связи С(3)-С(4) или С(2)-С(3) и образованием звеньев А и В соответственно. На второй стадии расходуется второй моль периодата, и происходит окисление образовавшегося диальдегидного звена с разрывом С(2)-С(3) в продукте А или С(3)-С(4) в продукте В соответственно с выделением муравьиной кислоты и образованием звена С. Известно, что скорость реакции второй стадии окисления примерно равна первой, поэтому в полученном полисахариде могут одновременно присутствовать все три типа звеньев. Звенья не существуют в разомкнутом виде и сразу образуют семичленные (А и В) и шестичленные (С) циклические полуацетали соответственно, как показано на Схеме периодатного окисления декстрана с образованием диальдегиддекстрана.
Соотношение звеньев А, В и С после полного завершения реакции зависит от соотношения периодат:АГЗ.

Присоединение госсипола к полимеру-носителю проводят при рН от 3,5 до 14,0, предпочтительно от 7,0 до 11,0, наиболее предпочтительно 8,5. В качестве среды используют водную или водно-органическую среду, в которой госсипол растворим, а активированный полисахарид растворяется или набухает. В качестве примера можно привести щелочные боратные, фосфатные, и другие безамонийные буферные растворы, не содержащие аминов, а также щелочные водно-органические смеси, содержащие спирты (метиловый, этиловый и изопропиловый), кетоны (ацетон, метилэтилкетон), целлозольвы, ацетонитрил, диоксан, тетрагидрофуран, диметилсульфоксид, а также другие растворители, смешивающиеся с водой, или их смеси в разных сочетаниях. Предпочтительно содержание органического растворителя в водно-органической среде находится в пределах от 1 до 85% масс. Реакцию проводят при температуре от 0°С до температуры кипения растворителя, предпочтительно при температуре, близкой к 18°С. Длительность реакции не регламентируется и зависит от температуры реакции. Предпочтительно от 15 минут до 5 суток, наиболее предпочтительно 8 часов.
Химическая структура образующегося полимерного соединения определяется относительным количеством госсипола в реакции, а более конкретно мольным соотношением госсипола и окисленных полисахаридных звеньев, именуемым в дальнейшем госсипол:окисленное звено или ГСП:ОЗ. В примерах конкретного исполнения это соотношение описано как мольное соотношение клатратного соединения госсипола с уксусной кислотой (ГУК), используемого в качестве исходного сырья, и окисленных полисахаридных звеньев конкретного полисахарида в реакции далее именуемое ГУК:ДАКМЦ для реакции госсипола с диальдегидкарбоксиметилцеллюлозой, либо ГУК:ДАД для реакции госсипола с диальдегиддекстраном.
Мольное соотношение госсипол:окисленное звено ГСП:ОЗ в реакции в соответствии с изобретением находится в интервале от 10:1 до 1:100, предпочтительно от 10:1 до 5:1 для полимеров, содержащих госсипол, связанный с вовлечением в реакцию одной альдегидной группы, и предпочтительно от 1:2 до 1:100 для полимеров, содержащих госсипол, связанный с вовлечением в реакцию обеих альдегидных групп.
При применении большого избытка госсипола в реакции и соотношении ГСП:ОЗ 10:1 образуется соединение, в котором госсипол связан с полимером-носителем с использованием только одной из симметричных частей молекулы (в общей формуле (I) R′=Sach; R′′=Н). При этом в реакцию вступает только одна из двух альдегидных групп госсипола. Вторая альдегидная группа остается химически не модифицированной.
При проведении реакции в условиях большого избытка окисленных звеньев полисахарида и соотношении ГСП:ОЗ от 1:10 до 1:100 образуется соединение, в котором госсипол связан с полимером-носителем с использованием обеих симметричных частей молекулы и соответственно с химической модификацией обеих альдегидных групп госсипола (в общей формуле (I) R′=Sach; R′′=Sach).
При всех остальных мольных соотношениях госсипол:окисленное звено ГСП:ОЗ, а также в условиях, близких к равномольным, образуется неразделимая смесь вышеуказанных моно- и дизамещенных производных госсипола в разном соотношении.
Во всех описанных случаях со стороны окисленных звеньев в реакцию вступает любая, но только одна из двух гидроксильных групп циклической полуацетали либо циклического азометина, без нарушения целостности цикла.
Содержание окисленных звеньев в полисахариде в соответствии с изобретением от 1 окисленного звена в 1000 ангидросахаридных звеньях полисахарида до полностью окисленного полисахарида. При этом в полимере-носителе в реакцию могут вступать как все окисленные звенья, в случае низкоокисленных полимеров, так и только часть из них с образованием неразделимой смеси макромолекул, содержащей неокисленные звенья, окисленные, но незамещенные госсиполом и окисленные замещенные госсиполом. В каждой конкретной макромолекуле как все окисленные звенья, так и только часть из них может содержать присоединенную молекулу госсипола.
Контролируемая химическая модификация альдегидных групп госсипола в соответствии с изобретением используется для регулирования токсичности госсипола, ковалентно связанного с полимерами-носителями. Это достигается изменением соотношения содержания моно- и дизамещенных производных госсипола в неразделимой полимерной смеси в которой моно- и дизамещенные молекулы госсипола могут быть связаны с одной и той же или с разными макромолекулами полисахарида. Чем выше содержание монозамещенного производного и доля незамещенных альдегидных групп, тем, соответственно, выше общая токсичность полимера.
Выделение продукта реакции из реакционной смеси в соответствии с изобретением осуществляется любым подходящим способом, предпочтительно одним из вышеперечисленных: осаждением в соответствующий осадитель с последующим переосаждением или без него; диализом; хроматографией через сорбенты либо ионообменные смолы с последующим осаждением либо удалением растворителя упариванием, лиофилизацией либо распылительной сушкой.
Примеры конкретного выполнения
Характеристика используемых веществ
Na-Карбоксиметилцеллюлоза
Фирма-изготовитель Ashland (US). Марка "Blanose" 7МЕ, партия 070411/2. Линейный полимер, производное целлюлозы. Степень карбоксиметилирования - 65%, Mw=712 кДа. Порошок светло-желтого цвета. Использовали без дополнительной очистки.
Госсиполуксусная кислота
Произведена в Узбекистане, «О′ZATANDART» агенство «AXBOROT-МА′LUMOT VARKAZ» UNITAR предприятие. Мелкокристаллический порошок однородной структуры от светло-желтого до темно-желтого цвета с зеленоватым оттенком. Использовали без дополнительной очистки.
Декстран
Клинические кровезаменители «Полиглюкин» и «Реополиглюкин», производства предприятия «Красфарма» обессоливали диализом и лиофилизовали. Ярко белый рыхлый волокнистый порошок.
Методы исследования
Спектроскопия ядерного магнитного резонанса
Спектроскопию ядерного магнитного резонанса на ядрах13С использовали для исследования химического строения синтезированных полимеров.
Образцы готовили в виде растворов в ДМСО-d6, D2O и D2O с добавлением NaOH. Спектры ЯМР13С записывали в режиме подавления расщепления на протонах со стробируемой развязкой, а также с использованием режима DEPT на приборах Bruker СХР-200 с рабочей частотой 50.32 МГц при температуре 297 К.
Также спектры снимали на приборе Bruker Avance-600 с рабочей частотой 150,94 МГц при температуре 297 К в тех же режимах.
Спектры регистрировали в лаборатории ядерного магнитного резонанса ИНЭОС РАН.
Инфракрасная спектроскопия с Фурье преобразованием
Инфракрасную спектроскопию с Фурье-преобразованием использовали для исследования химического строения окисленных звеньев в образцах диальдегидкарбоксиметилцеллюлозы, ГУК, а также коньюгата ГУК-ДАКМЦ и коньюгата ГУК-ДАД. ИК-спектры снимали на приборе Nicolet 380 в области от 400 до 4000 см-1 с разрешением 2 см-1 при комнатной температуре из таблеток с KBr. Для обработки спектров использовали программное обеспечение "OMNIC" компании "Thermo Scientific" и "ACD labs" 10.0. Для увеличения чувствительности использовали метод деконволюции пиков с аппроксимацией гауссовыми и лоренцевыми кривыми.
Ультрафиолетовая спектрофотометрия
Ультрафиолетовую спектроскопию использовали для контроля процесса и изучения кинетики периодатного окисления карбоксиметилцеллюлозы, декстрана и разработки метода количественного определения госсипола в субстанции. Спектры поглощения записывали на спектрофотометре СПЕКС ССП - 715 в ультрафиолетовой области спектра 190-1050 нм. Результаты обрабатывали с использованием программного обеспечения UV-Vis analyst и ACD/SpecManager.
Гель-проникающая хроматография
Гель-проникающую хроматографию использовали для определения молекулярной массы, молекулярно-массового распределения и состава исходной карбоксиметилцеллюлозы, полученных образцов диальдегидкарбоксиметилцеллюлозы, диальдегиддекстрана и продуктов присоединения госсипола к диальдегидкарбоксиметилцеллюлозе и диальдегиддекстрану. Анализы проводили на жидкостных хроматографах Agilent 1200 и Waters, снабженных двумя детекторами, соединенными последовательно: рефрактометрическим детектором и мультиволновым ультрафиолетовым детектором.
Анализ проводили на колонках Ultrahydrogel Linear, 1000, 250, 120 фирмы "Waters", а также на паре колонок Ultrahydrogel 1000 и 120, соединенных последовательно при температуре колонок + 25°С с водяным и воздушным термостатированием. Элюенты: 0,2М ацетатно-аммонийный буфер рН=8,4, 0. 1М боратный буфер рН=8,6 и 0,1М боратный буфер рН 11,0, скорость потока 0,5 мл/мин. В качестве стандартов для калибровки колонки использовали стандартные полиакриламиды, полизтиленоксиды и пулуланы узкого молекулярно-массового распределения. Калибровочные кривые аппроксимировали полиномом 3-й степени.
Расчет молекулярно-массовых характеристик полимера проводили с использованием универсальной калибровки и программного обеспечения «Millenium» и «Breeze 2».
Периодатное окисление полисахарида, содержащего только два вицинальных гидроксила
Таким полисахаридом является карбоксиметилцеллюлоза. При ее периодатном окислении происходит разрыв С-С связи между С (2) и С(3) углеродными атомами с образованием окисленных циклических звеньев только одного типа.
Синтез диальдегидкарбоксиметилцеллюлозы (ДАКМЦ) в водном растворе
К раствору, содержащему 4,00 г натриевой соли карбоксиметилцеллюлозы (КМЦ) в 400,0 мл дистиллированной воды, добавляли раствор, содержащий 4,28 г NaIO4 в 200,0 мл воды. Раствор оставляли при комнатной температуре, в темном месте в колбе с открытым горлом при перемешивании (таблица 2). По окончании реакции смесь диализовали против дистиллированной воды четверо суток с четырехкратной сменой диализной воды до отрицательной реакции диализата на ион IO3- по йодкрахмальной бумаге. Полученный продукт лиофилизировали или осаждали в этиловый спирт, промывали, сушили в вакууме без нагревания.
Синтез диальдегидкарбоксиметилцеллюлозы (ДАКМЦ) в водно-органической среде
К 50,0 мл равнообъемной смеси воды и ацетона прибавляли при интенсивном перемешивании 4.00 г натриевой соли карбоксиметилцеллюлозы (КМЦ), смесь оставляли набухать при перемешивании в течение 24 часов. К набухшей смеси при перемешивании прибавляли раствор, содержащий 4,28 г NaIO4 в 50,0 мл воды. Смесь перемешивали при комнатной температуре в темноте месте в колбе с открытым горлом. Массовые соотношения исходных продуктов реакции и условия окисления представлены в Таблице 2. По окончании реакции к смеси прибавляли раствор 1,5 г KJ в 50,0 мл воды для удаления следов иода и очищали диализом либо четырехкратной дробной промывкой водным ацетоном до отрицательной реакции диализата или промывных вод на ион IO3- по йодкрахмальной бумаге. Полученный продукт лиофилизировали либо осаждали в этиловый спирт, промывали, сушили в вакууме без нагревания.
Определение степени окисления диальдегидкарбоксиметилцеллюлозы (ДАКМЦ) и диальдегиддекстрана (ДАД) методом обратного йодометрического титрования
В четыре плоскодонные колбы, объемом 50,0 мл каждая, помещали 4 навески диальдегидкарбоксиметилцеллюлозы (диальдегиддекстрана) по 20,0 мг, взвешенные с точностью до 0,1 мг. К каждой навеске приливали 10 мл 0,1н NaOH, перемешивали 5 минут; приливали 20,0 мл 0,01 н I2, перемешивали 0,5 часа. Затем к каждой пробе приливали 12.0 мл 0.1н HCl и титровали раствором 0,01н Na2S2O3, используя крахмал в качестве индикатора. Одновременно делали холостой опыт, где вместо диальдегидккарбоксиметилцеллюлозы (диальдегиддекстрана) использовали неокисленную карбоксиметилцеллюлозу (декстран).
Степень окисления рассчитывали по формуле (1):

где

V′(Na2S2O3)контр. - поправочный коэффициент, полученный путем титрования тиосульфата натрия йодом.
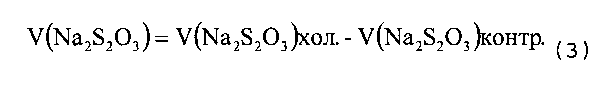
V(Na2S2O3)хол. - объем, пошедший на титрование карбоксиметилцеллюлозы (декстрана) тиосульфатом натрия;
V(Na2S2O3)контр. - объем, пошедший на титрование диальдегидкарбоксиметилцеллюлозы (диальдегиддекстрана) тиосульфатом натрия.
g - навеска полимера, в мг,
М(100 АГЗ)=24700 - для КМЦ марки Blanoza 7 MF,
М(100АГЗ)=16200 - для декстрана.

Структура окисленных звеньев диальдегидкарбоксиметилцеллюлозы (ДАКМЦ)
Анализ ЯМР13С спектров исходной КМЦ (см. Фиг.1), а также образцов диальдегидкарбоксиметилцеллюлозы различных степеней окисления подтвердил вывод о том, что альдегидные группы в окисленных звеньях существуют не в свободном виде, а в виде циклических полуацеталей. В спектрах отсутствуют сигналы альдегидных групп в области 195-200 м.д. Предположение о существовании в водном растворе альдегидных групп в гидратированной форме не подтверждается, такие сигналы в спектрах не обнаружены (см. Фиг. 2). Сигнал 102,77 м.д. соответствует С(1) атому углерода ангидроглюкозного звена КМЦ. Метиленовая группа С(7) при карбоксильной группе имеет химический сдвиг 71,79 м.д. Карбонильные сигналы С(8) проявляются в слабом поле и имеют химические сдвиги: 179,21 м.д. - для свободной кислоты и 178,37 м.д. для карбоксилат аниона. Сигнал высокой интенсивности при 60,55 м.д. согласно литературным данным относят к сигналу С′(6) ангидроглюкозного звена немодифицированного атома целлюлозы, а модифицированный атом С(6) имеет химический сдвиг, равный 70.98 м.д. Химический сдвиг атома углерода С(5) равен 82,56 м.д. Пик при 150,65 м.д. низкой интенсивности соответствует сигналу примеси карбоната натрия, образовавшегося при взаимодействии щелочи с диоксидом углерода.
Анализ спектров ДАКМЦ различных степеней окисления (см. Фиг. 2) показал, что с увеличением степени окисления уменьшается интенсивность сигналов при 74,62 и 73,58 м.д. Это сигналы С(2) и С(3) неокисленного ангидроглюкозного звена ДАКМЦ. Чем выше степень окисления, тем ниже их интенсивность и соответственно ниже содержание неокисленных звеньев в полимере.
Сигнал 75,4 3 м.д. соответствует атому углерода С′(4) при переходе от низкоокисленных полимеров к высокоокисленным его интенсивность практически не изменяется, в окислении он не участвует.
С увеличением степени окисления карбоксиметилцеллюлозы возрастает как количество, так и интенсивность пиков в области 85-100 м.д. Это сигналы полуацетальных атомов углерода С-О-С. Увеличение количества сигналов связано с увеличением числа возможных диастериомерных полуацетальных структур.
В высокоокисленном полимере сигнал 99,89 и 99,62 м.д. соответствуют атому С′′(4), он претерпевает сдвиг в слабое поле вследствие того, что у соседнего атома углерода С′′(3) появляется более электроотрицательный заместитель. Пики 96.25, 95,51, 94,76 м.д. относятся к 4 атому углерода в разветвлениях 1-6 окисленной карбоксиметилцеллюлозы. Сигналы 91,95, 91,20, 90,45 м.д. принадлежат атому С′′(2), а сигналы 89,67, 88,59, 88,30, 87,99 м.д. атому С′′(3).
Синтез полимерного производного госсипола, ковалентно связанного с диальдегидкарбоксиметилцеллюлозой в условиях избытка госсипола (см. Таблицу 3)
В плоскодонную колбу объемом 100 мл помещали 1,000 г ДАКМЦ
с γок=40,44%. В колбу добавляли 20,0 мл боратного буфера (рН=8,5), оставляли перемешиваться на магнитной мешалке до полного растворения.
Госсипол массой 1,543 г помещали в коническую колбу объемом 250,0 мл и растворяли в минимальном количестве 0,1н NaOH объемом 90,0 мл с перемешиванием на магнитной мешалке до полного растворения. Затем в полученный раствор тонкой струйкой, при помощи бюретки при перемешивании добавляли боратный буфер (рН=8,5) объемом 90,0 мл. Проверяли рН при помощи лакмусовой бумаги (рН=8,5).
Раствор ДАКМЦ медленно приливали к раствору госсипола при интенсивном перемешивании на магнитной мешалке. Объединенный раствор перемешивали 195 минут и по окончании реакции раствор помещали в диализный мешок. Продукт диализовали против боратного буфера до обесцвечивания промывных вод, затем четыре раза против дистиллированной воды.
Синтез полимерного производного госсипола, ковалентно связанного с диальдегидкарбоксиметилцеллюлозой в условиях избытка окисленного полисахарида (см. Таблицу 3)
В плоскодонную колбу объемом 100 мл помещали 1.000 г ДАКМЦ
с γок=40.44%. В колбу добавляли 20.0 мл боратного буфера (рН=8,5), оставляли перемешиваться на магнитной мешалке до полного растворения.
Госсипол массой 0,100 г помещали в коническую колбу объемом 50,0 мл и растворяли в минимальном количестве 0,1н NaOH объемом 10,0 мл с перемешиванием на магнитной мешалке до полного растворения. Затем, в полученный раствор тонкой струйкой, при помощи бюретки при перемешивании добавляли боратный буфер (рН=8,5) объемом 10,0 мл. Проверяли рН при помощи лакмусовой бумаги (рН=8,5).
Раствор госсипола медленно приливали к раствору ДАКМЦ при интенсивном перемешивании на магнитной мешалке. Объединенный раствор перемешивали 160 минут и по окончании реакции раствор помещали в диализный мешок. Продукт диализовали против боратного буфера до обесцвечивания промывных вод, затем четыре раза против дистиллированной воды.

Структура полимерного производного госсипола, ковалентно связанного с диальдегидкарбоксиметилцеллюлозой
В спектре ЯМР13С продукта, полученного в условиях небольшого избытка госсипола в реакции (см. Фиг. 3), присутствуют сигналы углеродов ароматических колец госсипола в области 120-170 м.д. и сигналы ДАКМЦ в области 55-110 м.д. и 190 м.д. (углерод карбоксильной группы ДАКМЦ). Сигнал в области 169 м.д. принадлежит углероду альдегидной группы в енольной форме монозамещенной молекулы госсипола. Отсутствие сигналов не связанного госсипола в неенолизованной форме 146 м.д. означает, что его содержание в продукте не превышает 5-7% мольных. На спектре приведено полное отнесение сигналов.
С учетом присутствия в диальдегидкарбоксиметилцеллюлозе окисленных звеньев сформированных из некарбоксилированных целлюлозных циклов, в химической структуре продукта, полученного в условиях избытка полисахарида, присутствуют три типа госсиполсодержащих звеньев:


Синтез полимерного производного госсипола, ковалентно связанного с диальдегиддекстраном (ДАД), полученного в условиях избытка госсипола
В плоскодонную колбу объемом 100 мл помещали 0,2154 г ДАД
(1 ммоль-экв) с γок=71.05% и [η]=0,0858 и 5 мл боратного буфера (рН=8,5), оставляли перемешиваться на магнитной мешалке до полного растворения.
0,518 г ГУК (1 ммоль-экв) растворяли в 5 мл 0,1н NaOH. В полученный раствор прибавляли четырехкратный избыток 0,1 М боратного буфера (рН=8,5). В полученный раствор медленно прибавляли раствор ДАД. Смесь перемешивали сутки при комнатной температуре, очищали диализом с последующей лиофилизацией. Массовые соотношения исходных продуктов реакции и условия реакции представлены в Таблице 4.

В представленном на Фиг. 4 спектре ЯМР13С продукта, полученного в условиях избытка госсипола в реакции (недостатка полисахарида), присутствуют сигналы углеродов ароматических колец госсипола в области 120-160 м.д. и сигналы ангидроглюкозного звена ДАД в области 55-110 м.д. и 190 м.д. (углерод карбоксильной группы ДАД). Сигнал в области 162 м.д. принадлежит атому углерода монозамещенной молекулы госсипола структура. Отсутствие сигналов не связанного госсипола 146 м.д. означает, что его содержание в продукте не превышает 5-7 % мольных.
Определение цитотоксических свойств госсипола, ковалентно связанного с диальдегидкарбоксиметилцеллюлозой.
В 96-луночные плоскодонные тест-планшеты помещают клетки в количестве 10000 клеток на лунку в объеме 100 мкл полной среды, содержащей 10% эмбриональной телячьей сыворотки (ЭТС). Клетки культивируют в течение суток в ламинарном шкафу в темноте. Затем из лунок тест-планшетов удаляют жидкую среду пипеткой, оставляя иммобилизованные живые клетки. Взамен жидкой среды в лунки вносят по 100 мкл разведений тестируемых препаратов, приготовленных на полной среде. Каждое разведение дублируют в 3-4 повторностях. На планшете готовят 4 контрольные лунки, в которые добавляют по 100 мкл свежей полной среды, не содержащей тестируемых препаратов. Планшет помещают в ламинарный шкаф и клетки культивируют в течение 3 сут. Затем из лунок удаляют жидкое содержимое, вносят по 100 мкл полной среды и по 20 мкл ЭТС, перемешивают в насадке пипетки и инкубируют 3,5 часа в ламинарном шкафу в темноте, после чего на спектрофотометре ТЕСАК измеряют относительную оптическую плотность раствора в каждой лунке при 4 92 нм относительно его поглощения при длине волны сравнения 620 нм. Цитотоксичность СС50 рассчитывают по стандартной методике: Terry L. Riss and Richard A. Moravec «Use jf multiple assay endpoints to investigate the effects of incubation time, dose of toxin, and plating density in cellbased cytotoxicity assays». ASSAY and Drug Development Technologies Volume 2, Number 1, 2004 р.51-62.

Исследование in vitro противовирусного действия полимерных производных госсипола на разных штаммах вируса гриппа А.
список сокращений:
ТЦД50 - тканевая цитопатогенная доза, вызывающая гибель 50% клеток монослоя
ЦПД - цитопатическое действие
ТК50 - токсическая доза препарата, вызывающая гибель 50% клеток монослоя
ЭК50 - эффективная доза препарата, при которой выживает 50% клеток монослоя
Методика
К клеткам MDCK, достигшим монослоя на 96-луночных культуральных планшетах, добавляли исследуемые препараты в серийных разведениях. После этого клетки заражали вирусом гриппа в дозе 10ТЦД50/лунку. Для определения ТК50 клетки с теми же концентрациями препаратов заражены не были. Инфицированные клетки инкубировали в течение 72 часов, при этом в контроле ЦПД достигает 100%. После этого клетки окрашивали красителем МТЗ, оптическую плотность считывали на планшетном ридере. Точные значения ТК50 и ЭК50 были определены путем построения нелинейной регрессии данных. Химиотерапевтический индекс рассчитывали по формуле ХТИ=ТК50/ЭК50.

В результате проведенных экспериментов неожиданно было установлено различие в специфической противовирусной активности исследуемых полимерных производных, зависящей от штамма вируса, которая обусловлена соотношением ГСП:ОЗ в полимерном производном. Использование смеси полимерных производных приведет к расширению спектра противовирусной активности. Таким образом, нами установлено, что в зависимости от связывания госсипола с окисленным звеном полисахарида (двумя или одной связью) можно изменять и контролировать противовирусную активность и значительно расширить арсенал противовирусных средств.
Реферат
Изобретение относится к новым производным госсипола, которые могут быть использованы в фармакологии, общей формулы (I):где R=Sach; R=Sach или Н; Sach - остаток окисленного полисахарида, имеющего звенья одной из указанных ниже формул:где n означает полимерность соединения с содержанием от 1 окисленного звена в 1000 сахаридных звеньев полисахарида до полностью окисленного полисахарида, где полисахарид выбран из карбоксиметилцеллюлозы или декстрана, и средневесовую молекулярную массу Mот 1 до 2000 кДа, предпочтительно от 3 до 80 кДа. Предложены новые производные госсипола с противовирусной активностью и эффективный способ их получения, включающий взаимодействие окисленного полисахарида, имеющего звенья формул:с содержанием от 1 окисленного звена в 1000 сахаридных звеньев полисахарида до полностью окисленного полисахарида, с госсиполом при рН от 3,5 до 14 и мольном соотношении госсипол:окисленное полисахаридное звено от 10:1 до 1:100. 3 н. и 7 з.п. ф-лы, 5 табл., 4 ил.
Формула

где RI=Sach; RII=Sach или Н;
Sach - остаток окисленного полисахарида, имеющего звенья одной из указанных ниже формул:


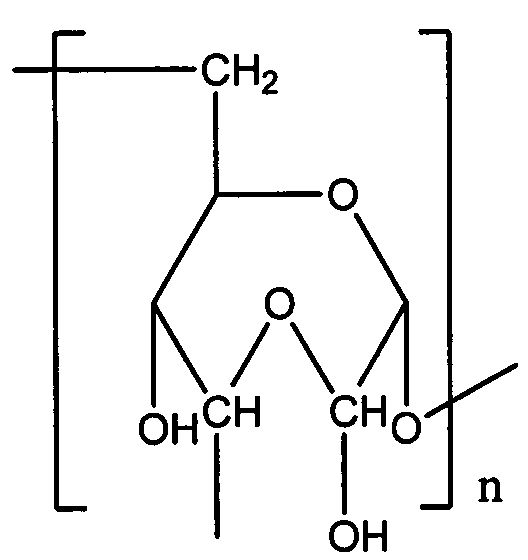


где n означает полимерность соединения с содержанием от 1 окисленного звена в 1000 сахаридных звеньев полисахарида до полностью окисленного полисахарида, где полисахарид выбран из карбоксиметилцеллюлозы или декстрана,
и средневесовую молекулярную массу Mw от 1 до 2000 кДа, предпочтительно от 3 до 80 кДа.

где RI=Sach; RII=Sach или Н;
Sach - остаток окисленного полисахарида, имеющего звенья одной из указанных ниже формул:

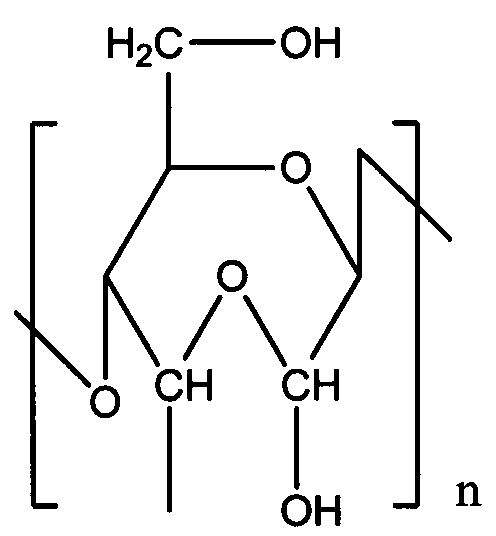
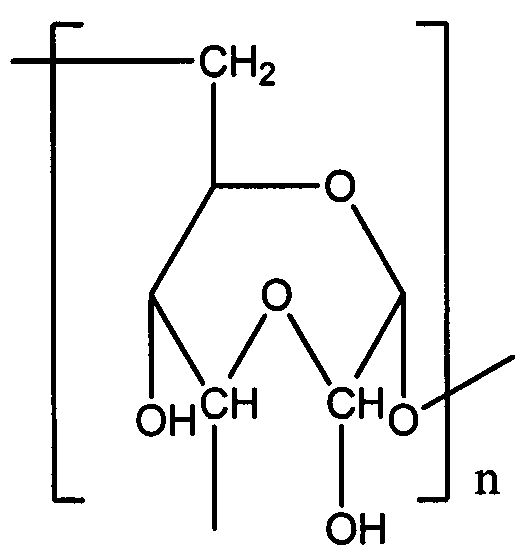


где n означает полимерность соединения с содержанием от 1 окисленного звена в 1000 сахаридных звеньев полисахарида до полностью окисленного полисахарида, где полисахарид выбран из карбоксиметилцеллюлозы или декстрана,
и средневесовую молекулярную массу Mw от 1 до 2000 кДа, предпочтительно от 3 до 80 кДа,
где указанный способ включает взаимодействие окисленного полисахарида, имеющего звенья одной из указанных формул:




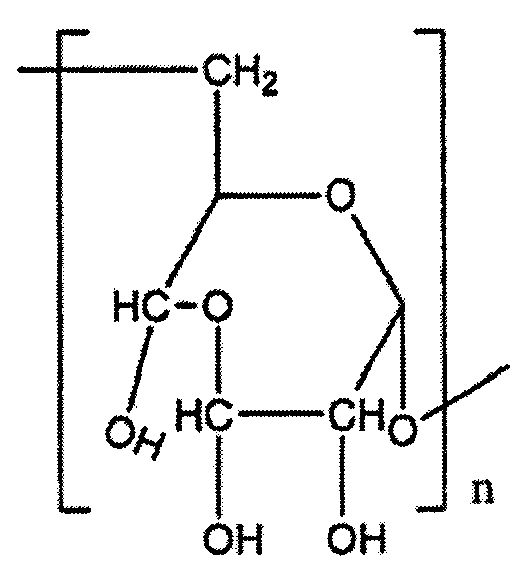
с содержанием от 1 окисленного звена в 1000 сахаридных звеньев полисахарида до полностью окисленного полисахарида,
с госсиполом при рН от 3,5 до 14 и мольном соотношении госсипол : окисленное полисахаридное звено от 10:1 до 1:100.

Комментарии