Животная модель, экспрессирующая люциферазу под контролем промотора основного белка миелина (mbp-luci), и применение модели для визуализации биолюминесценции in vivo - RU2601128C2
Код документа: RU2601128C2
Чертежи





















Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к изготавливаемой модели биовизуализации люциферазы под контролем основного белка миелина (MBP-luci), используемой, например, для визуализации и количественного определения демиелинизации/ремиелинизации на уровне транскрипции в режиме реального времени на живых животных с использованием методик биовизуализации.
ОБЛАСТЬ ТЕХНИКИ
При разработке лекарственных средств степень потерь является высокой с учетом того, что только одно из пяти соединений проходит путь от разработки до разрешения к применению (DiMasi, JA, et al., J Health Econ 22,151-185). Более того, несмотря на значительно увеличившееся финансирование процент введения новых лекарственных средств на рынок остается относительно постоянным на протяжении последних 30 лет, с двумя-тремя веществами в новых классах лекарственных средств в итоге выходящими на рынок в год (Lindsay MA, Nature Rev Drug Discovery, 2, 831-838).
Молекулярная и функциональная визуализация, используемая на начальных стадиях разработки лекарственных средств, может дать информацию о биологической активности и подтвердить мишеневые лекарственные эффекты. Соответственно ожидается, что вложения в технологию молекулярной визуализации улучшат разработку лекарственных соединений (Rudin M, et al., Progress in Drug Res, 2005, vol 62, 185-255). Преимущество методик молекулярной визуализации по сравнению с более общепринятыми способами получения данных состоит в том, что их можно проводить на интактном организме с достаточным пространственным и временным разрешением для изучения биологических процессов in vivo. Кроме того, данные способы молекулярной визуализации позволяют повторное, неинвазивное, унифицированное и относительно автоматизированное исследование одного животного в различные точки времени, таким образом повышая статистическую мощность долгосрочных исследований и снижая требуемое число животных и стоимость исследований. Модель MBP-luci поддерживает как увеличение производительности первичного скрининга потенциальных лекарственных соединений in vivo, так и повышение чувствительности биологических анализов. Исходные прототипные соединения часто неоптимальны в качестве лекарственных продуктов для продажи, однако детекция специфичной и значительной активности in vivo может повлечь оптимизацию химических структур для достижения приемлемого уровня активности и минимизации токсичности in vivo в отношении лечения определенных заболеваний ЦНС.
Молекулярная визуализация
Молекулярная визуализация относится к объединению подходов из различных дисциплин (например, клеточной и молекулярной биологии, химии, медицины, фармакологии, физики, биоинформатики и инженерии) для использования и интеграции способов визуализации при оценке определенных молекулярных процессов на клеточном и субклеточном уровне в живом организме (Massoud T.F., Genes Dev. 17:545-580).
Возникновение генетической инженерии внесло, по-видимому, главные изменения в прикладную науку, включая, например, в направление поиска лекарственных средств. Аналогичным образом, разработка и использование процедур визуализации на животных обеспечивает новое средство в области доклинических исследований (Maggie A, Ciana P. Nat. Rev. Drug Discvy. 4, 249-255). Животные модели традиционно были трудоемкими вследствие сложности количественной оценки физиологических событий в реальном времени. Со временем были разработаны новые способы визуализации для преодоления данных сложностей (например, МРТ, КТ, ПЭТ). В последнее время для неинвазивной детекции активности генов-мишеней используют биолюминесцентную визуализацию на основе in vivo экспрессии люциферазы, светоизлучающего фермента светлячка.
В результате объединения генной инженерии животных со способами молекулярной визуализации стало возможным проводить динамические исследования определенных молекулярных процессов на живых животных. Этот подход мог бы потенциально оказать воздействие на протоколы доклинических исследований, таким образом, значительно меняя все аспекты медицины (Maggie A. Trends Pharmacolo. Sci. 25, 337).
Молекулярная визуализация: биолюминесцентная
Биолюминесцентная визуализация in vivo (BLI) представляет собой чувствительный инструмент, основанный на детекции эмиссии света из клеток или тканей. Использование технологии репортерных генов делает возможным анализ определенных клеточных и биологических процессов в живом организме посредством способов визуализации in vivo. Биолюминесценция, ферментативная выработка видимого света живым организмом, является природным феномером, наблюдаемым для многих видов животных, за исключением млекопитающих (Contag, CH, Mol. Microbiol. 18:593-603). Люциферазы представляют собой ферменты, которые катализируют окисление субстрата, высвобождая фотоны света (Greer LFIII, Luminescence 17:43-74). Наиболее широко используется биолюминесценция североамериканского светлячка. При экспрессии гена люциферазы светлячка (luc) продуцируется фермент люцифераза, который превращает субстрат D-люциферин в нереакционноспособный оксилюциферин, в результате испуская зеленый свет при 562 нм. Вследствие того, что ткани млекопитающих обычно не испускают биолюминесценцию, in vivo BLI является перспективным методом, поскольку изображения можно получать с очень низким фоновым сигналом.
BLI требует генетической инженерии клеток или тканей с использованием экспрессионной кассеты, состоящей из биолюминесцентного репортерного гена под контролем промотора выбранного гена, обеспечивающего экспрессию светового репортера (фиг. 1). Для начала испускания света субстрат (например, люциферин) вводят с помощью интрацеребрально-вентрикулярной, внутрисосудистой, внутрибрюшинной или подкожной инъекции.
Свет, испускаемый люциферазой/люциферином способен проникать сквозь ткань толщиной от нескольких миллиметров до сантиметров; однако интенсивность потока фотонов снижается примерно в 10-раз на каждый сантиметр толщины ткани (Contag CH Mol. Microbio. 18: 593-603). Для детекции биолюминесценции in vivo необходимо использовать чувствительные инструменты светодетекции. Детекторы измеряют число фотонов, испускаемых на единицу площади. Низкий уровень света при длинах волн между 400 и 1000 нм можно детектировать с помощью камер с прибором с зарядовой связью (CCD), который превращает световые фотоны, ударяющие кремниевые пластины, в электроны (Spibey CP et al Electrophoresis 22:829-836). С помощью программного обеспечения можно конвертировать сигналы электронов в двумерное изображение. С помощью программного обеспечения также можно количественно оценить интенсивность испускаемого света (число испускаемых фотонов, попадающих на детекторы) и превратить эти числовые величины в псевдоцветную графику. Фактические данные измеряются числом фотонов, но псевдоцветная графика обеспечивает возможность быстрой визуальной интерпретации. Количественные измерения в пределах области, представляющей интерес, могут быть необходимы для более тонких различий. Использование охлаждаемых CCD-камер снижает температурный шум, а светонепроницаемый корпус позволяет оптимальную визуализацию и количественную оценку продуцируемого люциферазой света (Contag CH, Annu.Rev.Biomed.Eng. 4:235-260).
Полезно иметь изображение люциферазного сигнала, наложенное на другой тип изображения, такой как автограф или радиоавтограф для анатомического положения испускаемого сигнала (фиг. 2). Программное обеспечение осуществляет наложение изображений для визуализации и интерпретации.
Демиелинизирующее заболевание, олигодендроциты и основной белок миелина
Основной белок миелина (МВР) требуется для нормального уплотнения и функционирования миелина. Совместно с гликопротеином миелина олигодендроцитов (MOG) и протеолипидным белком (PLP) эти белки составляют семейство структурных белков миелина и синтезируются клетками, продуцирующими миелин: олигодендроцитами в центральной нервной системе (ЦНС) и Шванновскими клетками в периферической нервной системе (ПНС). В развивающейся ЦНС экспрессия МВР совпадает с временным периодом миелинизации. Соответственно, в данной области МВР принят в качестве маркера созревания олигодендроцитов. Высокий уровень экспрессии МВР (вместе с другими белками) совпадает с выработкой миелина, продолжается на всем протяжении миелиногенеза и снижается при разрушении аксона (Gupta et al. Brain Res. 464:133-141).
Заболевания, которые влияют на целостность миелина приводят к нарушенной проводимости аксональных сигналов в затронутых нейронах и могут привести к нарушению восприятия, движения, познания или других функций в зависимости затронутых нейронов. Термин «демиелинизирующие заболевания» описывает эффект заболевания, а не его причину, и они могут быть вызваны генетическими причинами, инфекционными средствами, аутоиммунными реакциями и неизвестными факторами. Все эти заболевания остаются патологическими состояниями человека с огромной нереализованной необходимостью медицинского вмешательства, часто связанного с необходимостью восстановительных методов лечения.
Демиелинизирующие заболевания центральной нервной системы включают:
- Рассеянный склероз (совместно с аналогичными заболеваниями, называемыми идиопатическими воспалительными демиелинизирующими заболеваниями);
- Поперечный миелит;
- Болезнь Девика;
- Прогрессирующую мультифокальную лейкоэнцефалопатию;
- Оптический неврит;
- Лейкодистрофии;
- Болезнь Пелицеуса-Мерцбахера;
- Дисфункцию/потерю миелина, также связанную с повреждением спинного мозга, болезнью Альцгеймера и Паркинсона и шизофренией.
Демиелинизирующие заболевания периферической нервной системы включают:
- Синдром Гийена-Барре и его хронический аналог, хроническую воспалительную демиелинизирующую полинейропатию;
- Периферические нейропатии (вызываемые токсинами, диабетом анти-MAG, антителами и т.п.);
- Болезнь Шарко-Мари-Тута.
In vivo модели демиелинизации
Общей стадией при разработке доклинических потенциальных соединений для борьбы с демиелинизирующими заболеваниями является оценка действия терапевтических потенциальных соединений на животных моделях, которые повторяют частично или полностью процесс демиелинизации, и которые обладают способностью к эндогенной ремиелинизации. Химически индуцированную демиелинизацию можно получить на животных моделях, и 6-8 недельные молодые самцы мышей восприимчивы к демиелинизации, получаемой в результате 4-6 недельной диеты, включающей 0,2%-ный купризон (бис-циклогексанон-оксалдигидразон) (Ludwin SK, 1978, Lab Invest 39: 597-612). При воздействии купризона демиелинизация возникает по всему мозгу, но наиболее легко детектируется в области высокой концентрации белого вещества - мозолистом теле (Merkler et al., 2005, NMR Biomed 18: 395-403). Демиелинизация становится очевидной в течение 3 недель после начала диеты с купризоном. Замещение диеты нормальной пищей дает возможность практически полной ремиелинизации в течение 4-6 недель (Matsushima et al., 2001, Brain Pathol 11: 107-116). Иммуногистохимическое окрашивание аксональных повреждений с использованием белка-предшественника амилоида или импрегнации в серебро по Бильщовскому не выявляет значительных аксональных повреждений у 8-недельных мышей (Merkler). Однако поперечное сечение аксонов значительно увеличивалось у 6-7 месячных мышей, частично способствуя задержке ремиелинизации, наблюдаемых у старых животных (Irvine KA, et al., 2006, J Neuroimmunol 175: 69-76). Количество клеток-предшественников олигодендроцитов, которые после дифференцировки замещают миелин, а также клеток микроглии и макрофагов, резко возрастает примерно через 4 недели на купризоновой диете и необходимо для эффективной ремиелинизации (Franco RJM, 2002, Nat Rev 3: 705-714).
Для количественной оценки измерений содержания миелина целый мозг или его субобласти можно выделить и провести оценку с помощью дот-блоттинга или Вестерн-блоттига. В альтернативном варианте, краткосрочный подход с высоким разрешением (относительно долгосрочного) для контроля субобластей потери и восстановления миелина включает количественную стереологию. Например, компьютерную стереологическую систему (CAST) можно использовать для оценки измерения миелина, окрашенного люксолом быстрым синим (красителем миелина) в мозолистом теле. Толуидиновый синий и электронная микроскопия являются необходимыми конечными стадиями для гарантии того, что уплотненный миелин образует правильную оболочку ранее оголенных аксонов. В отношении долгосрочной оценки Т2-взвешенная МРТ является средством количественной оценки изменений миелина в мозолистом теле мышей на купризоновой диете (Sanofi-Aventis Neurology, 2008, неопубликованные данные).
Модель биовизуализации MBP-luci, которая отслеживает статус миелинизации in vivo в режиме реального времени
В статье 2003 года Farhadi et al. (The Journal of Neuroscience, November 12, 2003, 23(32):10214-10223) было опубликовано, что промотор МВР содержит регуляторные элементы, четыре далеко отстоящих консервативных модуля, M1, M2, M3 и M4, размер которых находится в диапазоне 0,1-0,4 т.п.о., которые критичны для регуляции времени миелинизации и ремиелинизации (см. фиг. 1, 3 и 4). С использованием Lac Z в качестве репортерного гена они продемонстрировали, что проксимальные модули M1 и M2 обеспечивают относительно низкий уровень экспрессии в олигодендроцитах в ходе развития ЦНС, в то время как расположенная выше (в 5'-направлении от них) М3-область обеспечивает высокий уровень экспрессии в олигодендроцитах в ходе развития ЦНС и в ЦНС взрослых животных. Более того, данная область М3 необходима для экспрессии в ходе ремиелинизации после демиелинизирующего повреждения. М4 также обеспечивает экспрессию МВР в миелинизирующх Шванновских клетках.
Существующие способы с использованием животных моделей для оценки изменений в миелине in vivo являются затратными по времени, обычно занимающими 4-8 недель, и требуют большого числа животных. МВР-промотор ДНК, который включает все 4 специфичные регуляторные области, экспрессирующий ген люциферазы, составляет основу трансгенной модели мыши биовизуализации MBP-luci, которая была разработана для отслеживания изменений в транскрипционной активности основного белка миелина (МВР) в мозге, спинном мозге и/или периферической нервной систем в режиме реального времени. Эту трансгенную модель на грызунах можно использовать для in vitro и in vivo доказательства первичных исследований, направленных на отбор разрабатываемых кандидатов для лечения демиелинизирующих заболеваний человека, и она предлагает множество улучшений относительно существующих моделей:
- Возможность неинвазивного отслеживания изменений в миелинизации нервной системы с помощью биолюминесценции снижает материальные и трудовые ресурсы, связанные с посмертными гистологическими анализами и анализами тканевой экспрессии.
- Долгосрочные исследования значительно увеличивают чувствительность модели к изменениям в миелинизации. В предшествующих методах анализа необходимо было использовать отдельные группы животных для каждой временной точки, и это ограничивало количество данных, которые можно было собрать в ходе исследования. Вводились дополнительные переменные из-за необходимости использования отдельных групп животных.
- Данные биовизуализации обрабатываются быстро, обычно в течение того же дня, таким образом, позволяя регулирование (например, увеличение продолжительности исследования для достижения достоверности или более раннего окончания вследствие отсутствия влияния лекарственного соединения) для оптимизации схемы исследования и снижения ненужных затрат ресурсов.
- Группы животных и соответствующие воздействия можно оценивать в нулевой временной точке, что оптимизирует статистическую достоверность исследования, одновременно снижая число животных, необходимых на каждую группу воздействия. Данные исследований можно нормализовать на исходные значения, значительно снижая природную биологическую вариабельность, в тоже время обеспечивая более убедительные выводы по эффектам конкретных методов лечения.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новой модели in vivo для оценки эффектов терапевтических соединений на степень демиелинизации (например, нейропротекцию, защиту миелина) и ремиелинизации (например, восстановление). Биовизуализация животных и способы скрининга соединений по настоящему изобретению позволяют скрининг и/или подтверждение первичной валидации фармацевтических соединений и других терапевтических агентов посредством получения в режиме реального времени соответствующих данных с высоким разрешением на живых животных. Дополнительно, оценки можно получить относительно потенциальной токсичности, PK/PD и терапевтического окна, тем самым позволяя более точный прогноз в отношении дозировок для приматов и человека.
Настоящее изобретение относится к улучшенным инструментам и способам для изучения событий миелинизации с использованием живого трансгенного модельного организма. Изобретение снижает общее число требуемых индивидов по сравнению с другими моделями, поскольку каждый индивид может служить в качестве своего собственного базового контроля в долгосрочных исследованиях. Таким образом, снижается вариабельность между организмами, повышая достоверность статистических результатов. В различных аспектах изобретения достигаются различные преимущества. Несколько различных способов применения описаны в нижеследующем обсуждении.
Путем корреляции с экспрессией МВР настоящее изобретение обеспечивает способы мониторинга событий демиелинизации и/или ремиелинизации в живом модельном организме. Способ может включать трансгенно-модифицированные клетки-предшественники для получения модельного организма, в котором экспрессируется ген люциферазы под контролем МВР-промотора. Ген люциферазы при экспрессии может функционировать, продуцируя свет (биолюминесценция), в присутствии субстрата, такого как люциферин. Миелинизирующую и демиелинизирующую активность можно оценить путем мониторинга биолюминесценции в организме. Аппарат для визуализации и анализа предусматривает быструю корреляцию биолюминесценции и событий миелинизации относительно определенных участков тела организма.
Для изучения событий в центральной и периферической нервной системе особенно подходящими модельными организмами являются позвоночные организмы, которые используют миелин в своей нервной ткани. Млекопитающие являются организмами, которые используют миелин для усиления нейрональной проводимости как в ЦНС, так и ПНС. Общепринятые модели на млекопитающих, таких как грызуны (например, крысы, мыши), кролики, овцы, приматы, морские свинки и т.п., являются подходящими модельными организмами для использования в практическом применении настоящего изобретения.
Размер организма не является per se лимитирующим фактором. Однако размер аппарата можно оптимизировать к форме или размеру конкретного организма.
Одно событие биовизуализации может обеспечить желаемую информацию. Однако преимущество настоящего изобретения относится к возможности повторять измерения одного животного в множестве временных точек и сравнивать данные множества измерений. Один организм служит, таким образом, в качестве своего собственного контроля или базовой линии.
Соответственно, возможна биовизуализация в течение одного или нескольких временных интервалов демиелинизации или ремиелинизации у одного организма. Более того, нормализация сигнала визуализации на протяжении интервалов демиелинизации или ремиелинизации, для которых визуализация на протяжении повторяющихся интервалов эффективна для детекции уровня транскрипта МВР в организме в течении одного или нескольких событий, обеспечивает более достоверные данные.
Биолюминесцентный сигнал ослабляется тканями тела. Соответственно, нервная ткань, ближайшая к поверхности тела, дает наиболее сильный сигнал. Сигнал на детекторе можно увеличивать, получая более высокий выход сигнала в результате внесения в реакцию большего количества люциферазы, например, используя более высокую концентрацию, или увеличивая активность фермента либо уровень экспрессии. Сбор данных также можно улучшить, используя более чувствительные детекторы. Более чувствительные детекторы часто требуют охлаждающих аппаратов для получения достаточного уровня сигнала и для минимизации шума. Время, в течение которого собирают данные, также служит для увеличения уровня сигнала.
Модельным организмом по настоящему изобретению может быть трансгенное животное, содержащее ген люциферазы, который находится под контролем МВР-промотора. Животным может быть млекопитающее, например, любое млекопитающее, используемое в качестве животной модели. Крысы и мыши являются общепринятыми животными моделями. Ген люциферазы под контролем МВР-промотора экспрессируется в определенных тканях-мишенях модели, когда промотор активируется или запускается
МВР-промотор может содержать М1-М3 или может содержать М1-М4.
Сигнал можно усилить с помощью простых манипуляций, таких как выбор модели, чей волосяной покров меньше ослабляет сигнал. Например, модель, чей волосяной покров меньше ослабляет сигнал по сравнению с мышами С57/В6, будет давать сигнал, превосходящий сигнал, получаемый от мышей С57/В6.
Настоящее изобретение также относится к способу разработки модельного организма для биовизуализации. Разработку можно осуществить, начиная, например, со штамма мышей и получая трансгенных животных, затем отбирая одну или несколько линий, у которых визуализация всей мыши in vivo на пике постнатальной миелинизации показывает, например, ЦНС-специфичную визуализацию; затем отбирая одну или несколько линий, у которых визуализация ex vivo подтверждает экспрессию люциферазного трансгена в желаемой области, например, главным образом - в областях уплотненного белого вещества мозга. Затем можно отобрать одну или несколько линий, в которых интенсивность визуализации люциферазы четко коррелирует с изменениями в демиелинизации и ремиелинизации. Для улучшения данных можно отобрать одну или несколько линий, которые показывают ясную гистологическую демиелинизацию в ходе соответствующих манипуляций.
Купризоновая модель демиелинизации подходит для использования с настоящим изобретением. Время проведения биовизуализации зависит от характеристик развития модельного организма, например, можно выбрать время, принимая во внимание то, что пик постнатальной миелинизации обычно приходится приблизительно на 3-5-ю неделю жизни мышей G1.
Настоящее изобретение полезно для скрининга химических соединений, биологических соединений и других терапевтических элементов, которые могут влиять на миелиновые события в организме. Для влияния на миелиновые события соединение может модулировать экспрессию генов, или внутриклеточные либо межклеточные сигнальные события. Эти примеры являются только некоторыми конкретными примерами и не должны рассматриваться в качестве полного объема изобретения, который описан в формуле.
Хотя МВР-промотор хорошо охарактеризован с использованием репортерного гена lac Z, как описано, например, Farhadi (см. выше), использование моделей MBP-lac Z ограничено вследствие требований к забору тканей и их фиксации для детекции β-галактозидазы (продукта репортерного гена lacZ). Этот процесс требует гистохимических методик, несовместимых с детекцией в живых животных. Для того чтобы обойти эту проблему было предложено использование биолюминесцентных или флуоресцентных систем для создания трансгенной модели биовизуализации, в которой люциферазный или GFP-репортер избирательно контролируется крупными участками МВР-промотора.
Эта новая модель биовизуализации была разработана для визуализации и количественной оценки событий демиелинизации и/или ремиелинизации у живых животных, например, мышей, в режиме реального времени. Такой мониторинг можно использовать совместно с автоматизированными способами биовизуализации. Модель является полезным инструментом, например, для валидации мишени (например, когда модельных мышей для биовизуализации скрещивают с нокаутными и трансгенными мышами, имеющими желаемые признаки), а также для валидации соединений (например, для измерения эффективности соединения в модели, такой как купризоновый или экспериментальный аутоиммунный энцефаломиелит [EAE]) на сравнительной или количественной основе для принятия критических ключевых решений относительно выбора мишени и разработки соединений.
Настоящая модель биовизуализации (MBP-luci TG) была создана и использована для количественной оценки событий демиелинизации/ремиелинизации in vivo. Преимуществом модели биовизуализации является возможность проведения долгосрочных исследований, так что каждый организм может служить в качестве своего собственного контроля. Таким образом, избегают умерщвления животных в определенных точках времени. Можно постоянно отслеживать отдельных мышей на протяжении процесса демиелинизации и ремиелинизации.
Способ биовизуализации требует меньше времени и ресурсов для отслеживания биологического ответа в живых мышах.
Краткое описание фигур
На фигуре 1 показана общая схема МВР-люциферазной трансгенной модели, которую используют для отслеживания изменений в экспрессии миелина в режиме реального времени.
На фигуре 2 показано, что эндогенный МВР-промотор имеет четыре элемента, которые дифференциально регулируют экспрессию МВР в олигодендроцитах в ходе развития животного и во взрослом состоянии. (HF Farhadi: J.Neurosc. 2003, 23 (32), 10214-10223). M1/M2, оба регулируют транскрипты ранних постнатальных стадий. М3 вовлечен в транскрипционную регуляции экспрессии у зрелого животного. М4 участвует в экспрессии транскриптов МВР в Шванновских клетках. Структура трансгена MBP-luci имеет две формы МВР-промотора. Линия 121 содержит элемент М4 и, как полагают, имеет экспрессию люциферазы в мозге, спинном мозге и периферической нервной системе. Линия 171 состоит из более короткого МВР-промотора (например, лишена элемента М4), и люцифераза в ней экспрессируется главным образом в мозге, что подтверждено анализом биовизуализации.
На фигуре 3 показана кассета для экспрессии трансгена MBP-luci, включающая МВР-промотор с 5 т.п.о. 5'-ДНК в векторе для экспрессии люциферазы.
На фигуре 4 показана кассета для экспрессии трансгена MBP-luci, включающая МВР-промотор с 10 т.п.о. 5'-ДНК в векторе для экспрессии люциферазы.
На фигуре 5 показан пример древа скрининга линии с трансгеном MBP-luci.
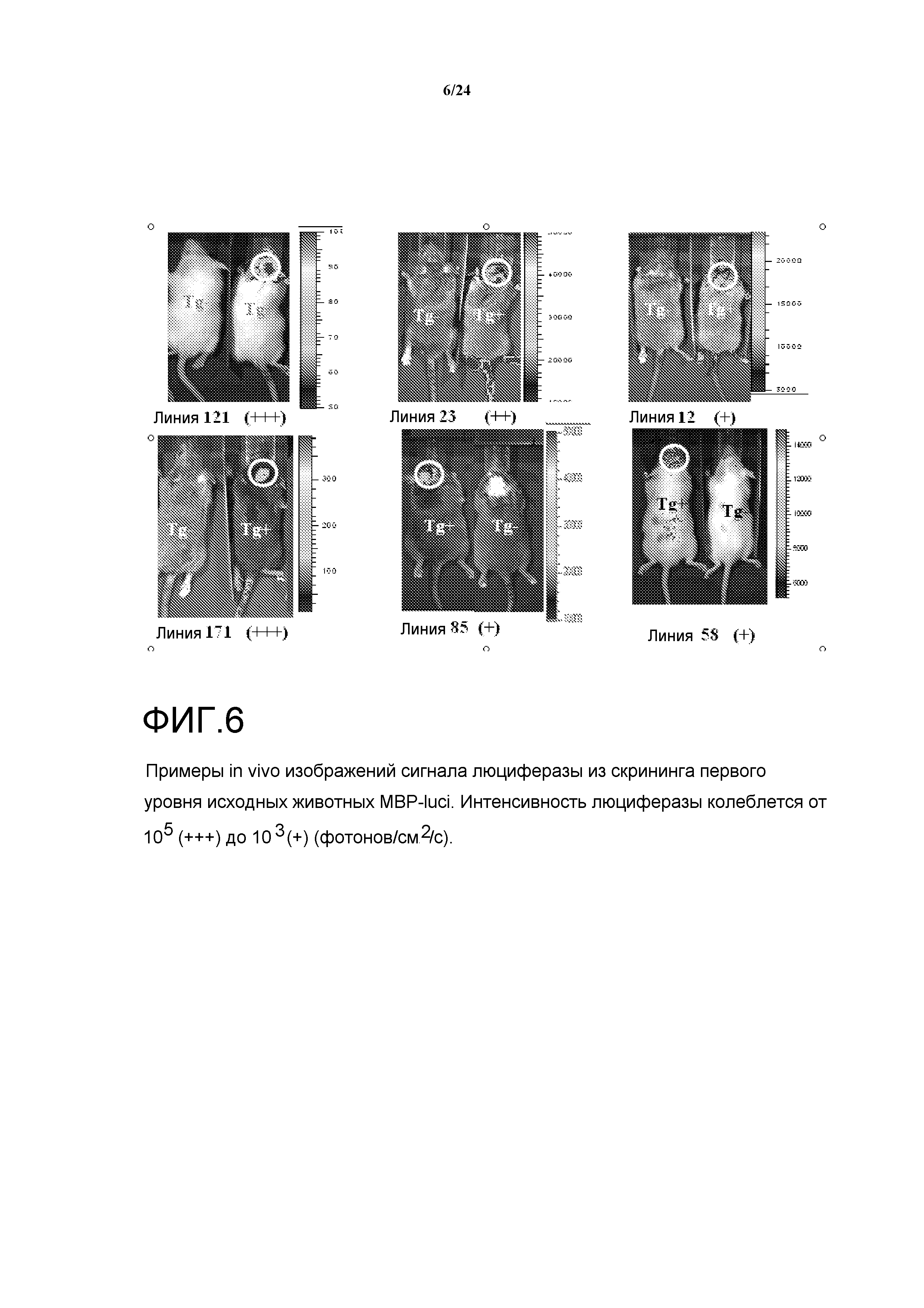
На фигуре 6 показаны изображения сигнала люциферазы in vivo из скрининга первого уровня исходных животных с MBP-luci. Интенсивность люциферазы колеблется от 105 (+++) до 103 (+) (фотонов/см2/с).
На фигуре 7 показан модельный организм, биовизуализацию которого проводили в семь недель (А) и в 10 месяцев (В), который иллюстрирует снижение интенсивности изображения сигнала люциферазы в мозге с возрастом, что коррелирует со снижением миелинизации, наблюдаемой после раннего постнатального развития.
На фигуре 8 показана in vivo биовизуализация мышей MBP-luci. Отрицательный трансген, мышь дикого типа (WT) находится слева с фоновой биолюминесценцией, измеренной в черепе (ROI: целевая область), которая равняется 2,7×103 фотонов/с. Справа представлена гетерозиготная мышь MBP-luci, и биолюминесценция в ROI равняется 1,327×105 фотонов/с. Гомозиготная мышь MBP-luci представлена в центре с величиной биолюминесценции в ROI, составляющей 3,2924×105 фотонов/с, которая приблизительно превышает (как ожидалось) гетерозиготную величину в два раза.
На фигуре 9 показана ЦНС-специфичная экспрессия люциферазы во времени. Черепная биолюминесценция от MBP-luci-трансгенных мышей, как показано, снижается начиная с недели 4 (А и *) до недели 8 (В и **) и совпадает с уровнем транскриптов эндогенного МВР, определенных с помощью анализа Taqman (C).
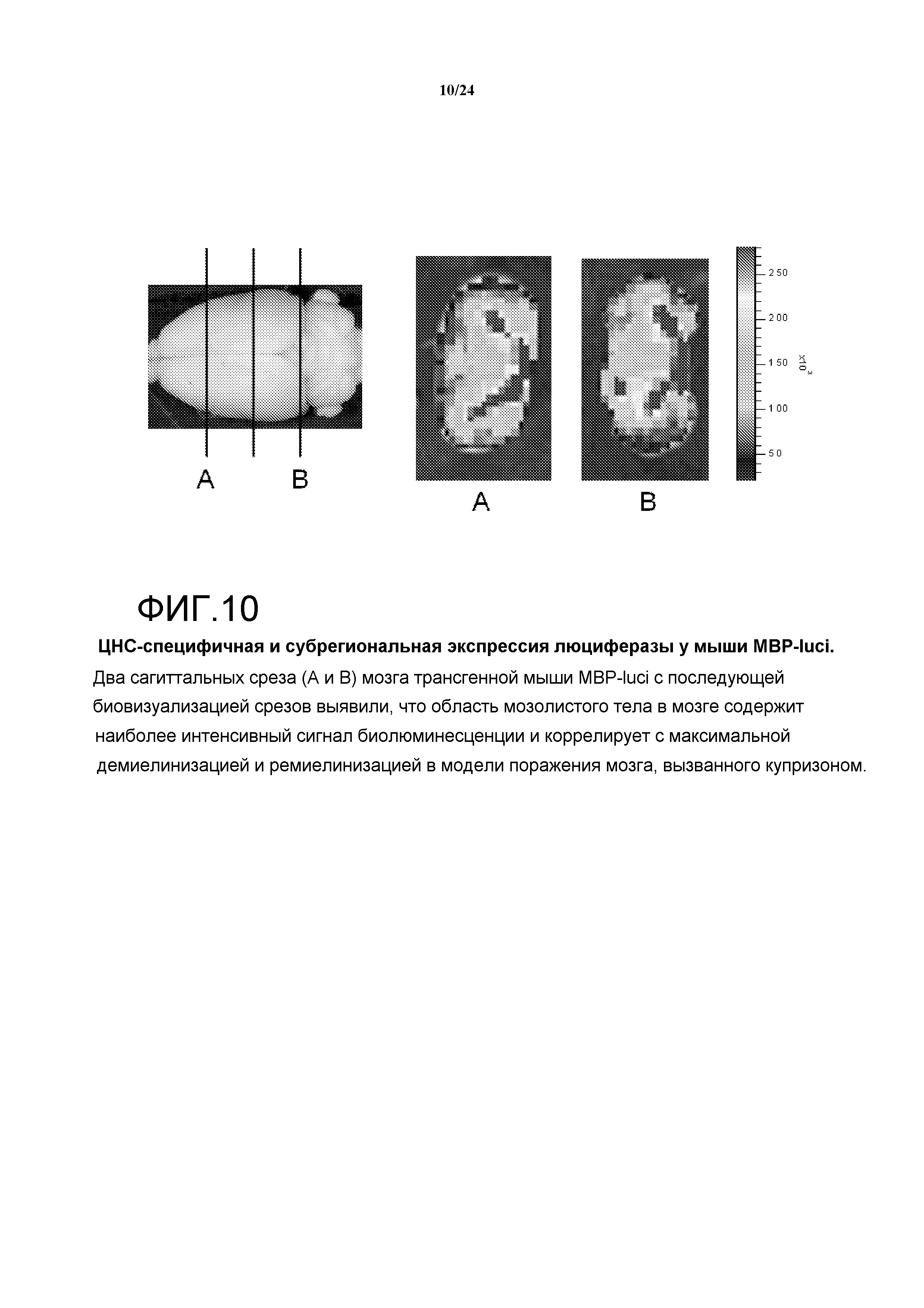
На фигуре 10 показана специфичная и субрегиональная экспрессия люциферазы в мыши MBP-luci. Два сагиттальных среза (А и В) мозга трансгенной мыши MBP-luci с последующей биовизуализацией срезов выявили, что область мозолистого тела в мозге содержит наиболее интенсивный сигнал биолюминесценции и коррелирует с максимальной демиелинизацией и ремиелинизацией в модели поражения мозга, вызванного купризоном.
На фигуре 11 показана биовизуализация в модели MBP-luci и другие биологические ответы, которые, как известно, возникают при купризоновой диете. В данном случае купризоновую диету поддерживали в течение четырех недель, и результаты биовизуализации и клеточных изменений показаны слева на графике. Предполагается, что результаты еженедельной биовизуализации (указана стрелкой) изменяются параллельно уровню экспрессии эндогенного МВР (Matsushima GK and Morell P, Brain Pathology 11, 1-10, 2001).
На фигуре 12 показаны изменения мРНК эндогенного МВР в ответ на непрерывное воздействие купризоновой диеты у мышей C57 BL/6J дикого типа. 8-недельные мыши получали купризон в питании в течение интервала до 12 недель (закрашенные треугольники). Во второй группе (незакрашенные треугольники) купризон из питания был убран через 6 недель, и мышам давали восстановиться в течение интервала до 6 дополнительных недель. Данные по уровню мРНК представляют собой однократное определение с помощью Нозерн-блоттинга и представлены относительно среднего из трех контролей (Jurevics H, et al., Journal of Neurochemistry, 2002, 82, 126-136).
На фигуре 13 показано продемонстрированное влияние купризоновой диеты на модель биовизуализации, MBP-luci. Сигнал визуализации может ясно имитировать профиль экспрессии эндогенного гена МВР. Наблюдается двух-трехкратное снижение сигнала визуализации на протяжении кормления пищей, содержащей купризон (от недели 0 до недели 4), а также трех-четырехкратное увеличение сигнала визуализации после отмены питания с купризоном (от недели 4 до недели 7).
На фигуре 14 показано окрашивание люксолом быстрым синим (LFB) мозолистого тела в модели MBP-luci. Мыши получали либо купризон, либо нормальную пищу, в течение четырех недель, затем обе мыши были возвращены на обычную диету. Через 6 недель явную демиелинизацию в мозолистом теле (В) модели MBP-luci на купризоне можно было детектировать гистохимически с использованием окрашивания LFB по сравнению с группой на нормальной диете (А). Гистохимический анализ структурных изменений в миелинизации коррелировал с измерениями в сигнале биовизуализации у модели MBP-luci, получавшей воздействие.
На фигуре 15 показано, что действующее соединение - агонист рецептора дельта, активированного пролифератором пероксисом (PPARδ) (далее '517) - усиливает сигнал визуализации от люциферазы в линии 171 гетерозиготных мышей в течение периода спонтанной ремиелинизации. Восьминедельных мышей MBP-luci (линия 171 гетерозиготная, штамм B6C3H) помещали на диету, содержащую 0,2% купризона, в течение 4 недель, затем переводили на нормальную твердую диету, позволяя ремиелинизацию. Мышам затем перорально вводили дважды в день либо носитель (0,6%-ную натриевую соль карбоксиметилцеллюллозы и 0,5%-ный Tween 80) или 30 мг/мг действующего соединения агониста PPARδ '517, в течение 8 дней в указанных временных точках. Данные нормализовали по фоновым сигналам в нулевой неделе. Действующее соединение '517 (n=12) вызывало 30-100%-ное относительное повышение сигнала люциферазы по сравнению с группой носителя (n=12), которое объясняли эффектом соединения на стимуляцию дифференцировки клеток-предшественников олигодендроцитов (например, в соответствии с данными in vitro).
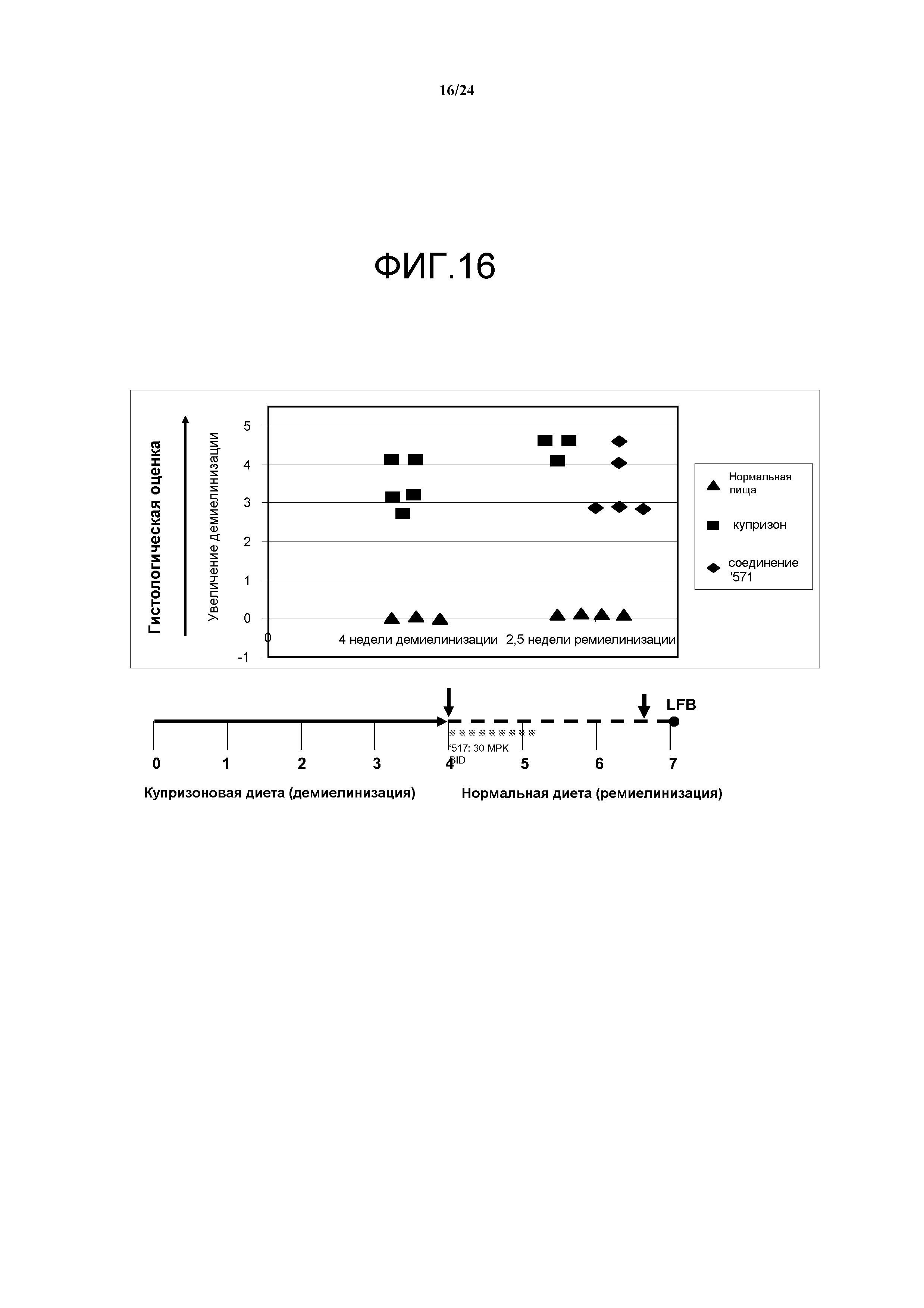
Фигура 16: действующее соединение агонист PPARδ, '517, усиливает окрашивание миелина люксолом быстрым синим (LFB) в течение фазы ремиелинизации (линия 171 гетерозиготная, штамм B6C3H). Парасагиттальные среды ткани фиксированного в формалине и заключенного в парафин мозга окрашивали LFB для качественной оценки миелина в мозолистом теле. Окрашенные среды для каждой временной точки оценивали и выставляли баллы по шкале от 0 (полная миелинизация) до 5 (полная демиелинизация). Система оценки была следующая: 0 = нормальный миелин, демиелинизация отсутствует, 1 = минимальная, локальная демиелинизация, 2 = слабая до средней, локальная демиелинизация, 3 = средняя, местами интенсивная демиелинизация, 4 = тяжелая, местами интенсивная демиелинизация, 5 = тяжелая, диффузная демиелинизация. Гистологическая оценка срезов LFB-окрашенного мозга мышей после 4 недель на купризоне подтвердила средне-тяжелую демиелинизацию мозолистого тела гетерозиготных мышей линии 171 (n=5). Обработка действующим соединением '517 (n=5) по сравнению с контрольной группой, получавшей носитель (n=3), с 4 по 5 неделю в течение фазы ремиелинизации привела к заметному увеличению количества миелина, определенному с помощью окрашивания LFB на 7-й неделе. Несмотря на небольшое число животных в группах гистологические данные подтверждают in vivo данные биовизуализации люциферазы, указывая на увеличение ремиелинизации у мышей, обработанных соединением '517, по сравнению с контрольной группой, получавшей носитель.
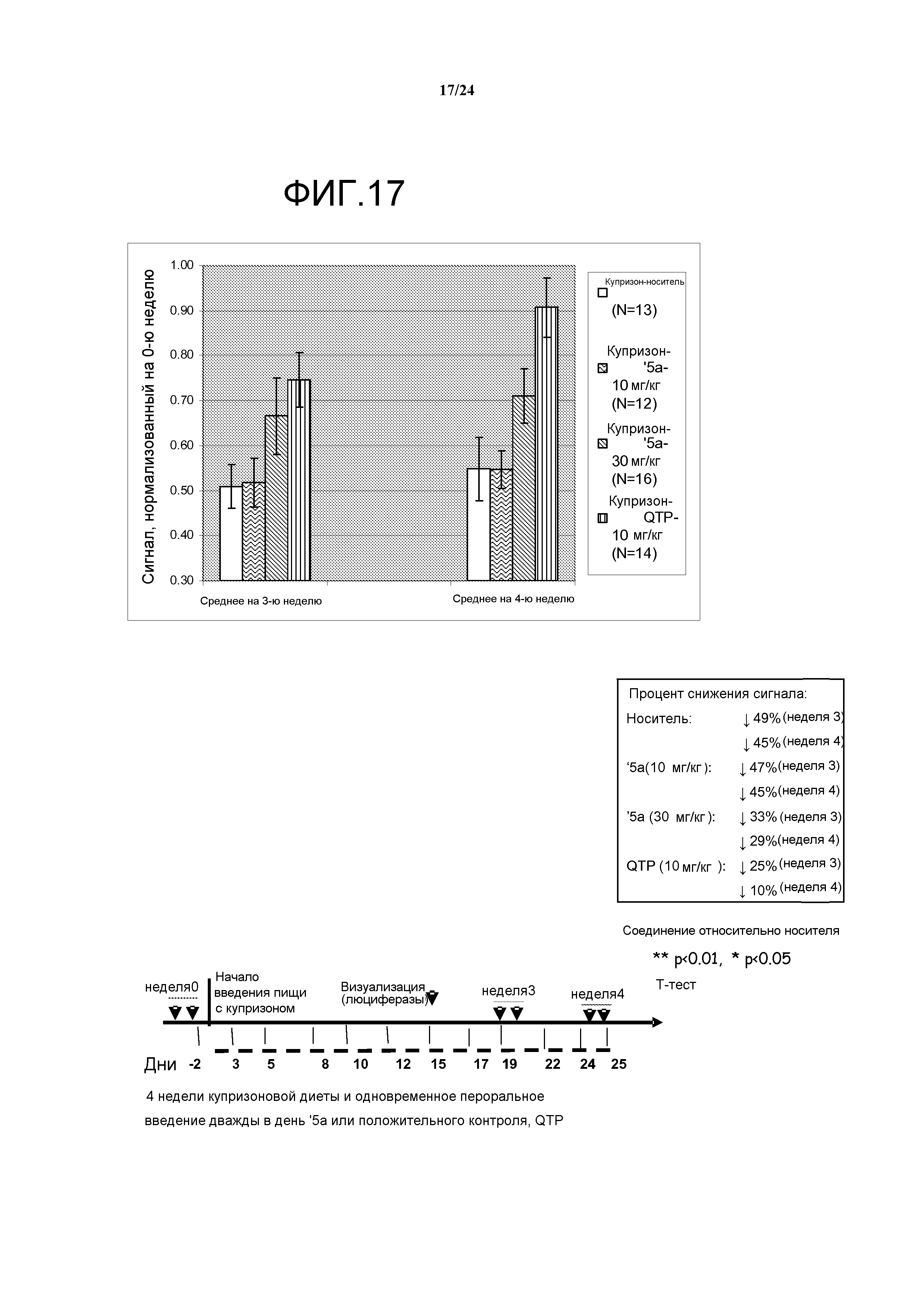
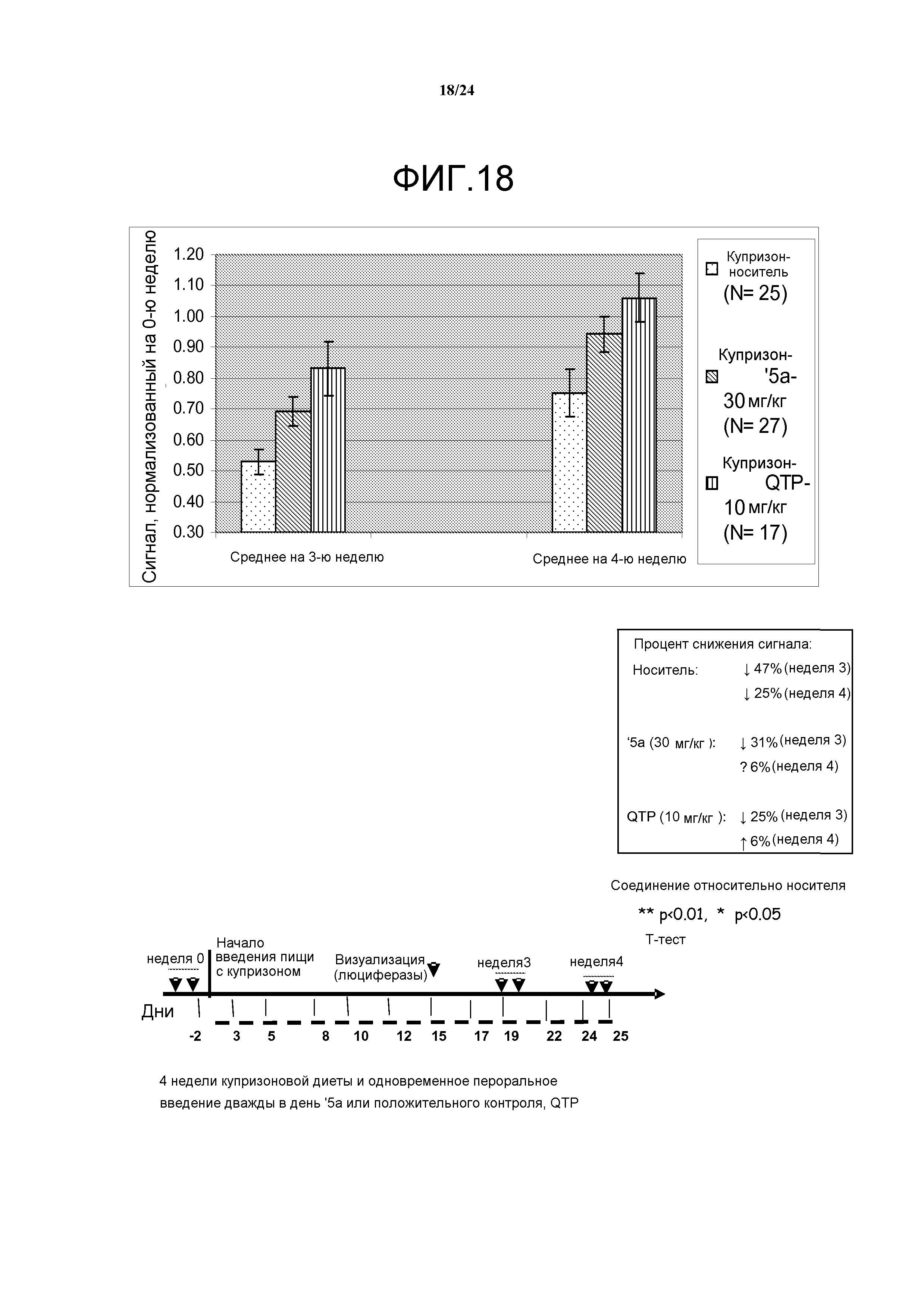
Фигура 17: агонист эстрогенового бета-рецептора (ERβ) (далее '5a) в количестве 30 мг/кг и положительный контроль Кветиапин в количестве 10 мг/кг обладают защитным действием в ходе фазы демиелинизации в купризоновой модели. Гетерозиготные мыши B6C3H линии 171 MBP-luc получали купризоновую диету в течение 4 недель, и им перорально вводили '5a (10 мг/кг или 30 мг/кг) или положительный контроль Кветиапин (QTP). Визуализацию мышей проводили в 0-ю неделю (базовая лини), данные 3-й недели и 4-й недели нормализовали на базовую линию 0-й недели. Группа QTP показывала значительное увеличение сигнала при визуализации относительно контроля носителя для двух временных точек 3-й и 4-й недели в концентрации 10 мг/кг. Результаты для группы, получавшей воздействие QTP, соответствовали данным, опубликованным Yanbo Zhang et al. под названием «Quetiapine alleviates the cuprizone-induced white matter pathology in brain of C57BL/6 mouse» (Schizophrenia Research, 2008, Dec 106, 182-91). Соединение '5a в количестве 30 мг/кг показывало усиленный сигнал по сравнению с носителем на 3-ю (тенденция) и 4-ю (достоверно) недели на купризоновой диете. '5a в количестве 10 мг/кг не давало значительного эффекта ни на 3-й, ни на 4-й неделе. Результаты позволяют предположить, что модель визуализации MBP-luci достаточно чувствительна для детекции дозозависимых изменений в купризоновой модели.
Фигура 18: группы, получавшие '5a (30 мг/кг) и QTP (10 мг/кг), имеют значительно более высокую активность трансгена по сравнению с контрольной группой, получавшей носитель, на 3-й и 4-й неделе. Данные модели визуализации подтверждают, что как QTP, так и '5a, ослабляют индуцированную купризоном демиелинизацию мозга и разрушение миелина.
На фигуре 19 показано сравнение сигнала визуализации купризоновой модели между гомозиготными и гетерозиготными мышами (B6C3H, линия 171). Поколение гетерозиготных мышей N3 скрещивали между собой для получения гомозиготных мышей по аллелю MBP-luci. Гомозиготные мыши показывали более чем двукратное окно сигнала биовизуализации относительно гомозиготных мышей в течение воздействия купризона. Две копии репортерного гена у гомозигот показывали более чем двукратное снижение сигнала в течение фазы демиелинизации (например, после 4 недель на купризоновой диете) и двукратное увеличение сигнала в течение фазы ремиелинизации (например, через 1 неделю после отмены купризоновой диеты и возврата на нормальный твердый корм).
Хотя данные демонстрируют, что гетерозиготная линия 171 (штамм B6C3H) работает в купризоновой модели и может детектировать эффекты соединений, модель можно дополнительно улучшить скрещиванием до гомозиготности для усиления интенсивности сигнала биовизуализации. Это также упрощает получение модели и снижает расходы на генотипирование, поскольку колонии мышей можно содержать как гомозиготные. В общем, большее окно визуализации может расширить детекции эффектов соединений в исследованиях характеристик фармакологических соединений.
Фигура 20: микрофотография мозолистого тела (темная продольная структура в квадратных скобках - 201) в парасагиттальном срезе ткани из фиксированного в формалине и заключенного в парафин мозга мыши, окрашенном LFB, демонстрирует оценку миелинового статуса области белого вещества. Эту область использовали для количественного цифрового визуального анализа окрашивания люксолом быстрым синим (LFB) мозолистого тела.
Фигура 21: сравнение окна визуализации и гистологического окна для трех различных линий MBP-luci (линия 171 B6C3H гетерозиготный штамм, линия 121 C57BL/6 гетерозиготный штамм и линия 171 B6C3H гомозиготный штамм). Мышей помещали на диету, содержащую 0,2% купризона в течение 4 или 5 недель. Данные визуализации нормализовали на измерения базовой линии в 0-й неделе. В конце каждого исследования выделяли мозг мышей и серии парафиновых срезов окрашивали на миелин люксолом быстрым синим (LFB). В таблице приведены средние качественные оценки LFB-окрашивания (0-5). Гомозиготные мыши линии 171 B6C3H демонстрировали максимальное снижение сигнала визуализации и также демонстрировали наиболее выраженную демиелинизацию, оценку которой проводили с помощью качественной гистологии. Гетерозиготные мыши линии 171 B6C3H показывали наименьшее окно визуализации и также наименьшую демиелинизации по гистологии на 4-й неделе.
Фигура 22: Использование гомозиготных мышей линии 171 в купризоновой модели было дополнительно валидировано путем демонстрации ответа на воздействие кветиапина (QTP). Мышей содержали на купризоновой диете в течение 5 недель, и одновременно они получали перорально ежедневно QTP (10 мг/кг). Визуализацию мышей проводили в 0-ю неделю (базовая линия), 3-ю и 5-ю неделю. Данные нормализовали на измерения базовой линии в 0-й неделе. QTP (10 мг/кг) вызывал значительное повышение сигнала визуализации по сравнению с контролем (носителем) как на 3-й, так и на 4-й неделе. Результаты соответствовали полученным на гетерозиготных мышах линии 171 (фигура 17 и 18). Данные указывают на то, что гомозиготных мышей линии 171 можно использовать для оценки эффекта соединений на сохранение экспрессии и целостность миелина в купризоновой модели.
Фигура 23: Ex vivo визуализация спинного мозга на мыши линии 121. Наложение люминесценции иллюстрирует, что экспрессия трансгена сосредоточена в областях белого вещества мозга и спинного мозга. Это дополнительно поддерживает выводы, полученные из экспериментов по биовизуализации всего тела животного.
Фигура 24: качественный анализ цифровых изображений окрашивания люксолом быстрым синим (LFB) мозолистого тела мышей C57Bl/6; дикого типа, гетерозиготной линии 171 и гомозиготной линии 171. Процентное значение площади с положительным LFB-окрашиванием в мозолистом теле вычисляли, используя алгоритм цветовой деконволюции Aperio® на вручную обведенных областях мозолистого тела на сканированных цифровых изображениях окрашенных слайдов. Для каждого животного проводили количественную оценку одного среза. Число животных на группу варьировало от 9 до 10. Процентное содержание площадей, положительно окрашенных LFB, вычисляли для каждого животного и для групп. Статистическую достоверность между группами вычисляли, используя парный t-тест. И гомозиготные мыши линии 171, и мыши дикого типа C57 BL/6, демонстрировали сильную демиелинизацию (% положительного окрашивания составлял 40-60%) после 4 недель питания купризоном. В отличие от этого, гетерозиготные мыши линии 171 демонстрировали только слабую демиелинизацию (% положительного окрашивания составлял 65-80%). Поэтому, гомозиготные мыши линии 171 указаны в качестве предпочтительной линии для использования в модели демиелинизации, индуцированной купризоном.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Следующие пять критериев были успешно применены последовательно для оптимизации отбора модели биовизуализации:
Определенные варианты осуществления можно создать на основе линий мышей, трансгенно-модифицированных либо векторами 5К, либо 10К, в соответствии с нижеследующим способом. Результаты, описанные ниже, являются одним таким способом отбора, который начинался с 35 трансгенных линий. На фигуре 5 графически представлено краткое изложение этого способа.
Из созданных трансгенных линий можно выбрать линии, в которых визуализация in vivo всего животного, например, мыши, на пике постнатальной миелинизации (например, на 3-5 неделе для мышей G1) дает ЦНС-специфичную визуализацию. Шесть из отобранных 35 линий были выбраны для следующей стадии отбора.
Затем были отобраны линии, в которых визуализация ex vivo подтверждает экспрессию люциферазного трансгена главным образом в области белого вещества мозга. Пять из 6 линий из стадии 1 были отобраны для следующей стадии.
Затем были отобраны линии, у которых интенсивность визуализации люциферазы сильно коррелировала с изменениями в демиелинизации и ремиелинизации, индуцированными в этом примере модели демиелинизации с помощью купризона. Три из 5 линий из стадии 2 были отобраны для следующей стадии.
Затем были отобраны линии, которые показывали явную гистологическую демиелинизацию в вышеуказанной купризоновой модели. Две из 3 линий из стадии 3 были отобраны в качестве предпочтительных линий.
В качестве итогового доказательства концепции авторы отобрали одну линию, в которой эффективность A003398711, PPARδ-селективного агониста, оптимально детектировалась в модели биовизуализации.
Типовая линия, названная «линия 171 (штамм B6C3, гетерозиготная)» была отобрана с использованием вышеуказанных пяти критериев и использована в качестве предпочтительной модели.
Более подробное описание этого способа описано в примерах ниже.
Определения
В контексте настоящего изобретения, если не указано иное, термины имеют значения, обычно используемые в научном языке, который может отличаться от общеупотребительного разговорного языка.
Ген следует истолковывать в широком смысле, включая транскрибируемые, а также нетранскрибируемые области.
Соединение следует истолковывать в широком смысле, включая химические соединения, например, органические химические молекулы, биологические соединения, например, антитела и антиген-узнающие фрагменты и конструкции, нуклеиновые кислоты, например, РНКи и т.п.
Были получены трансгенные мыши, в которых экспрессируется люцифераза светлячка. У этих животных репортерный ген, ген люциферазы, соединен с МВР-промотором, таким образом, обеспечивающим экспрессию люциферазы в клетках области белого вещества (миелинизированной), например, ЦНС, при индукции экспрессии МВР. Системная инъекция субстрата люциферина (внутривенная, внутрибрюшинная, подкожная) создает детектируемый и доступный для количественной оценки световой сигнал из головы живой мыши. Применяя купризоновую демиелинизирующую модель для отбора линий MBP-luci и повторно вводя с помощью инъекций этим животным люциферин можно периодически наблюдать и количественно оценивать демиелинизацию и ремиелинизацию посредством неинвазивной визуализации биолюминесценции во времени, например, в течение двухмесячного периода. С помощью этой модели был успешно осуществлен количественный мониторинг индуцированной купризоном демиелинизации и индуцированной соединением PPARδ ремиелинизации.
Успехи в технологии детекторов привели к значительному улучшению чувствительности и качества изображения. Фотоны на сегодняшний день детектируют с помощью специализированных камер с прибором с зарядовой связью (CCD), который превращает световые фотоны, ударяющие кремниевые пластины, в электроны. CCD-камеры пространственно кодируют интенсивность падающих фотонов в профили электрических зарядов, которые затем обрабатываются, создавая изображение. Шум снижают путем интенсивного охлаждения CCD-камеры и установки камеры в светонепроницаемый корпус. Эти камеры обычно управляются компьютером в ходе получения и анализа изображения. Системы камер второго поколения, которые имеют гораздо меньший размер, и, поэтому, могут располагаться на лабораторных столах, сделали технологию реализуемой и практичной для ежедневных экспериментов. Компания Xenogene имеет в продаже технологию биовизуализации.
Наличие средств визуализации обусловило возникновение оптических методик, основанных на биолюминесценции или флуоресценции, как наиболее доступных и легких в обращении. Биолюминесцентная визуализация (BLI) отличается заметной чувствительностью, поскольку фоновая люминесценция (шум) от тканей является чрезвычайно низкой. На сегодняшний день BLI успешно использовали для наблюдений за биологическими процессами, такими как клеточное движение, развитие опухолей, экспрессия генов и вирусная инфекция, на множестве животных моделей.
Люцифераза светлячка требует внутриклеточных кофакторов, таких как АТФ, для активности. Это ограничивает ее использование клетками, которые были генно-инженерно модифицированы для экспрессии фермента. В результате, множество полезных применений визуализации, например, мониторинг распределения циркулирующих факторов, детекция экспрессии внеклеточных антигенов и мечение эндогенных клеток, не подходят для визуализации с использованием люциферазы светлячка. Дополнительным недостатком люциферазы светлячка является отсутствие альтернативных субстратов для детекции ее в фиксированных образцах клеток и тканей. Это создает трудности в корреляции in vivo визуализации и микроскопического анализа.
Чувствительность детекции света, выделяемого из внутренних органов зависит от нескольких факторов, включая уровень экспрессии люциферазы, глубину меченных клеток в организме (расстояние, которое фотоны должны пройти сквозь ткань) и чувствительность системы детекции.
Описан мониторинг экспрессии кассет для экспрессии люциферазного репортера с использованием неинвазиной визуализации всего животного (Contag, C., патент США № 5650135, 22 июля, 1997, включен в настоящее описание в качестве ссылки; Contag, P., et al., Nature Medicine 4(2):245-247, 1998; Contag, C., et al., OSA TOPS on Biomedical Optical Spectroscopy and Diagnostics 3:220-224, 1996; Contag, C. H., Photochemistry and Photobiology 66(4):523-531, 1997; Contag, C. H., et al., Molecular Microbiology 18(4):593-603, 1995). В такой визуализации обычно используют по меньшей мере один элемент фотодетекторного устройства, например, камеру с прибором с зарядовой связью (CCD).
Контрольные элементы МВР-гена
Основные белки миелина (МВР) представляют собой семейство полипептидов, которые в основном экспрессируются в нервной системе, где они исполняют главную роль в миелинизации. Экспрессия МВР, например, в дифференцирующихся олигодендроцитах, в основном регулируется на транскрипционном уровне. В Journal of Neuroscience Farhadi et al. описывали новый регуляторный комбинаторный элемент, который контролирует экспрессию гена МВР во времени.
Farhadi et al. показали, что в глии используются различные комбинации регуляторных последовательностей для контроля экспрессии МВР на различных стадиях в течение и после начала миелинизации.
Основной белок миелина (МВР) требуется для нормального уплотнения миелина и вовлечен как в экспериментальные, так и в возникающие у человека демиелинизирующие заболевания, такие как множественный склероз.
Для дальнейших успехов в понимании биологии миелина и для тестирования соединений, увеличивающих количество миелина, в живых организмах. В настоящем изобретение использовали свойства МВР-промотора и наиболее чувствительную люциферазную репортерную технологию для создания настоящей модели MBP-luci. В данный момент модель позволяет чувствительные in vivo измерения транскрипционных ответов гена миелина в живых животных.
Конструирование репортерных кассет MBP-luci
Проводили скрининг ВАС-библиотеки 129SvEv (Cell & Molecular Technologies) с пробой, расположенной в М3-области МВР-промотора. Проба составляла 507 п.о. и была получена с парой праймеров (5'-actccttaccacacttcttgcagg-3' и 5'-tctattgggtgatgtgtgccatc-3). ВАС-клоны МВР (SEQ ID NO:1 и 2) были подтверждены с этой же пробой с помощью Саузерн-анализа (фрагмент 7,6 т.п.о. после расщепления EcoRI и/или 13,8 т.п.о. после расщепления BamHI).
«Длинный» МВР-промотор, содержащий М1-М4 (10 т.п.о.), амплифицированный с помощью высокоточной ПЦР с набором праймеров (MBP-L-SP2 5-gggggatccacctgggacgtagcttttgctg и MBP-AP1 5-ggggtttaaactccggaagctgctgtggg) (SEQ ID NO:3 и 4), клонировали в вектор xl-topo (Invitrogen), получая промежуточный вектор (вектор Topo MBP10k). Затем промотор MBP 10 т.п.о. (фрагмент BamH1-PmeI) встраивали в вектор pGL3 hygro/neo (по сайтам BglII и PmeI). Итоговый вектор с фрагментом 10 т.п.о. был назван pGL3-hygro-long MBP-luci (см., например, фиг. 4).
«Короткий» МВР-промотор, содержащий М1-М3 (5 т.п.о.), амплифицированный с помощью высокоточной ПЦР с набором праймеров (MBP-S-SP2 5-gggggatccatccctggatgcctcagaagag и MBP-AP1 5-ggggtttaaactccggaagctgctgtggg) (SEQ ID NO:5 и 6) клонировали в вектор p2.1-topo (Invitrogen), получая промежуточный вектор (вектор Topo MBP5k). Затем промотор MBP 5 т.п.о. (фрагмент BamH1-PmeI) встраивали в вектор pGL3 hygro/neo (по сайтам BglII и PmeI). Итоговый вектор с фрагментом 5 т.п.о. был назван pGL3-hygro-short MBP-luci (см., например, фиг. 3).
Последовательности ДНК из обеих плазмид pGL3-hygo-MBP подтверждали наличие последовательностей M1, M2, M3 и M4. Кроме того, транзиентная трансфекция данных плазмид в клетки 293Т давала детектируемую люциферазную активность.
Работа с животными и создание трансгенных мышей
Работу с животными проводили в соответствии с федеральными инструкциями. Использовали три различных штамма мышей (FVB, B6C3 и C57 BL/6). Визуализацию проводили после ингаляционного наркоза изофлураном (Baxter, Deerfield, IL); мышей наблюдали до полного восстановления.
Трансгенные мыши были получены следующим образом: либо плазмиду pGL3-hygro-MBP10k-luci, либо плазмиду pGL3-hygro-MBP5k-luci расщепляли ферментами NotI и BamH1. Фрагмент, содержащий МВР-промотор, люциферазу и сигнал полиаденилирования, затем очищали через гель. Трансгенных мышей получали с помощью стандартных инъекций в проядра эмбрионов мышей FVB, B6C3 или C57BL/6. Кратко, в ходе микроинъекции в проядро ДНК кассеты гена MBP-luci вводили напрямую в яйцеклетку мыши сразу после оплодотворения. Используя тонкую иглу ДНК вводили с помощью инъекции в большое мужское проядро, которые образуется из сперматозоида. ДНК стремится встроиться в виде множества тандемно расположенных копий в случайные положения в геноме, часто после прохождения одного или нескольких клеточных делений. Поэтому, полученная мышь является только частично трансгенной. Если трансгенные клетки участвуют в образовании зародышевой линии, то тогда будет продуцироваться некоторое количество трансгенных яйцеклеток или спермы и следующее поколение мышей будет полностью трансгенным.
Исходные трансгенные животные и их потомство Tg+ G1 идентифицировали с помощью полимеразной цепной реакции (ПЦР) на ДНК из хвостовой биопсии с использованием праймеров, специфичных к гену люциферазы светлячка (ПЦР-праймеры: 5'gaaatgtccgttcggttggcagaagc-3', и 5'ccaaaaccgtgatggaatggaacaaca-3') (SEQ ID NO:7 и 8).
Проводили визуализацию потомства 25 положительных исходных трансгенных животных с использованием In vivo Imaging System (IVIS 100; Xenogen, Alameda, CA), в результате были идентифицированы шесть трансгенных линий, которые показывали сигнал визуализации в мозге (две линии мышей FVB и четыре линии мышей B6C3HF1). Поскольку в данном эксперименте не было получено ни одного положительного сигнала в мозге для трансгенных мышей на основе штамма C57 BL/6, то для одной линии FVB проводили обратное скрещивание с мышами C57BL/6, чтобы получить штамм C57 BL6. Мышей линии 171 B6C3 впоследствии размножали скрещиванием друг с другом для получения гомозиготных трансгенных скрещивающихся пар. Для линии 171 B6C3F 1 также проводили обратное скрещивание с линией альбиносов C57.
Таблица 1.
Для скрининга выбранных линий MBP-luci использовали биолюминесцентную визуализацию in vivo. Мышей G1 анестезировали изофлюраном, и дозу 250 мг/кг люциферина вводили с помощью инъекций через хвостовую вену или подкожно. Через восемь минут после инъекции люциферина проводили визуализацию мышей. Были идентифицированы шесть линий, которые давали сигнал визуализации в мозге (фиг. 5, две линии штамма FVB: 58 и 121 и четыре линии штамма B6C3: 12, 23, 85 и 171). За исключением линии 58 другие пять линий показывали ex vivo сигнал визуализации люциферазы в области белого вещества мозга.
В таблице 1 показаны данные для 35 положительных по трансгенной ДНК исходных мышей, идентифицированных вскоре после рождения посредством ПЦР-генотипирования на биопсии хвоста. Пятнадцать из полученных ДНК-положительных исходных линий несли MBP-10k luci, а двадцать ДНК-положительных исходных линий несли MBP-5k luci. В данной заявке трансген и трансгенных мышей сокращенно обозначали MBP-luci.
На фигурах 7 и 9 показано, что биолюминесценция в модели MBP-luci хорошо коррелировала с областью ЦНС и с возрастной миелинизацией.
Визуализация ex vivo и анализ на люминометре
Визуализацию люциферазы ex vivo выделенных органов проводили сразу после эвтаназии животных с помощью СО2, через 10 мин после подкожной инъекции люциферина (250 мг/кг). Удаленные органы помещали на черную бумагу, покрытую листом пластика, и визуализировали с помощью IVIS; сильный сигнал биолюминесценции оставался детектируемым в пределах 20-30 мин после удаления органов. Анализ изображений и количественную оценку биолюминесценции проводили с использованием программного обеспечения Living Image (Xenogen Corp.).
Образцы ткани помещали в буфер для лизиса с ингибиторами (Passive Lysis Buffer [Promega] и Complete Mini Protease Inhibitor Cocktail [Roche, Indianapolis, IN]). Ткани гомогенизировали с использованием гомогенизатора для тканей. Ткани дополнительно гомогенизировали обработкой ультразвуком в течение короткого времени. Гомогенаты тканей центрифугировали и осветленные лизаты использовали для анализа на люминометре. Для анализа на люминометре субстрат для анализа люциферазы (Luciferase Assay System, Promega) готовили, как указано изготовителем. Гомогенаты тканей (20 мкл) и субстрата (100 мкл) смешивали и измеряли на люминометре. Получали значения фоновой люминесценции и вычитали из данных по интенсивности люминесценции. Определяли концентрацию белка с использованием набора BCA Protein Assay Kit (Pierce, Rockford, IL), следуя протоколу изготовителя. Вычисляли люминесценцию для каждого белкового лизата в виде относительных единиц света на микрограмм белка.
Индуцируемая купризоном демиелинизация и гистологическая валидация
Введение купризона мышам в течение четырех недель приводило к сильной демиелинизации мозолистого тела. Индуцированная купризоном демиелинизация связана со значительным микроглиозом и привлечением макрофагов (Bakker and Ludwin, J Neurol Sci 78: 125-37, 1987; Hiremath et al., J Neuroimmunol 92: 38-49, 1998; McMahon et al., J Neuroimmunol 130: 32-45, 2002), но имела минимальные Т-клеточные ответы (Matsushima and Morell, Brain Pathol 11: 107-16, 2001). Постоянная и прогнозируемая природа места поражения миелина в данной модели обуславливает легкую количественную оценку изменений в миелинизации мозолистого тела. Эти измерения могут быть результатом миелинизации de-novo с помощью клеток-предшественников олигодендроцитов, однако предупреждение терминальной демиелинизации иммуномодуляторными механизмами (Pluchino et al., Nature 436: 266-71, 2005) может быть возможным альтернативным объяснением.
Как указано выше, множество штаммов трансгенных мышей с МВР-люциферазой (MBP-luci Tg) были охарактеризованы с помощью in vivo оценки событий индуцированной купризоном демиелинизации/ремиелинизации. Экспрессия люциферазы (luci) под управлением промотора основного белка миелина (МВР) позволяет количественную оценку in vivo биовизуализации миелина в мозге трансгенных (Tg) млекопитающих, экспрессирующих белок МВР. В модели, например, можно использовать мышей дикого типа C57/BL6, получающих 0,2% купризона в своей диете. Предшествующие модели требовали конечного умерщвления животных во временных точках для оценки миелина после обработки различными соединениями. Вследствие необходимости большого числа животных вариабельность между животными являлась фактором, требующим дополнительных индивидов исследования (большего числа животных (n) в группе) для достижения достоверности.
Мыши линии 171 (B6C3) MBP 5k-luci показывали выраженную и достоверную демиелинизацию в мозолистом теле мозга, которую оценивали гистохимическим окрашиванием люксолом быстрым синим (LFB) после 4 недель на диете с 0,2%-ным содержанием купризона. Данная демиелинизация дополнительно коррелировала с падением сигнала люциферазы при in vivo биовизуализации.
Однако штамм мышей FVB линии 121 MBP 10-Luci не показывал сравнимую демиелинизацию. На мышах FVB были проведены дополнительные исследования в попытках идентифицировать возможную схему варьирования количества купризона в диете и варьирования периодов времени воздействия купризона, которая могла бы привести к значительной демиелинизации. Результаты показали только средний уровень демиелинизации при оценке с помощью окрашивания LFB в мозолистом теле. Соответственно, предпочтение было отдано разработке линии 171.
Влияние различных штаммов на купризоновую модель:
Трансгенных мышей часто создают, используя штамм FVB/NJ (FVB) вследствие его высокой плодовитости. Мышей штамма FVB также интенсивно используют для трансгенной модели биовизуализации благодаря белому цвету их меха, который относительно не поглощает свет. Удаление волосяного покрова, например, с помощью бритья также можно использовать для снижения потери сигнала вследствие поглощения или рассеивания волосяным покровом или мехом в FVB или других штаммах.
Вследствие того что для купризоновой модели наблюдались различия между штаммами, то выбор штамма может повлиять на результаты. Выбор оптимального штамма для конкретной цели рассматривается как рутинная оптимизация, зависящая, например, от выбранного метода анализа и оборудования. Однако создание трансгенного млекопитающего не считается ограничивающим фактором; скорее, восприимчивость конкретного штамма и трансгенной линии, например, к условиям, влияющим на демиелинизацию, используют в качестве критерия отбора для улучшения качества данных. В зависимости от выбранного события миелинизации/демиелинизации выбор штамма или генетической основы может повлиять на результаты. Полагают, что определенные модели демиелинизации могут работать лучше в конкретных штаммах. Такой выбор модели и штамма будет считаться рутинным в качестве части разработки метода анализа. Хотя потребление в пищу купризона является превосходной моделью для исследования демиелинизации и ремиелинизации, в этой модели присутствуют сильные генетические факторы, по-видимому, выражающиеся в разнице между штаммами.
Штамм FVB:
Мыши штамма FVB были выбраны частично благодаря своему белому цвету меха. Мыши FVB представляют собой систему, подходящую для большинства трансгенных экспериментов и последующих генетических анализов. Например, инбредный штамм FVB отличается мощными репродуктивными способностями и постоянными большими пометами. Это снижает стоимость и время при получении больших популяций. Более того, оплодотворенные яйцеклетки мышей FVB содержат крупные и выраженные проядра, что облегчает микроинъекции ДНК. Кроме того, штамм FVB имеет белый цвет меха альбиносов и представляет собой наилучший выбор для биовизуализации. Эти признаки делают штамм FVB предпочтительным для использования в исследованиях с трансгенными моделями биовизуализации. Однако можно использовать другие штаммы, если они проявляют желаемые характеристики.
Мыши штамма FVB очень чувствительны к 0,2%-ному купризону в отношении потери веса. Для того чтобы избежать сильной потери веса и токсичности необходимо использовать двух-трехкратную норму питания/добавки Transgel в неделю. Кроме того, авторы изобретения показали, что у мышей штамма FVB наблюдается минимальная гистологическая демиелинизация при различных схемах кормления купризоном.
Соответственно, для облегчения будущей валидации и применения проводили возвратное скрещивание линии 121 MBP 10k-luci (штамм FVB) с C57 Bl/6.
Штамм В6С3/Тас:
Гибридный штамм В6С3 можно создать скрещиванием самок мышей C57 BL/6Ntac с самцами мышей C3H/HeNTac из коммерческих колоний компании Taconic US. Данный штамм имеет цвет меха черный или агути. В6С3 будет гетерозиготным по локусам, которые отличаются у C57BL/6 и C3H, и гомозиготным по локусам, которые одинаковы для данных штаммов.
У мышей B6C3/Tac наблюдалась явная гистологическая демиелинизация. Более конкретно, демиелинизация у гомозиготных мышей линии 171 MBP 5k-Luci модели биовизуализации была лишь немного менее интенсивной с небольшой вариабельностью по сравнению с мышами C57BL6 дикого типа. Демиелинизация у гетерозиготных мышей линии 171 MBP 5k-Luci была значительно менее выражена, более локализована и более вариабельна по сравнению с мышами C57BL6 и гомозиготными мышами линии 171 MBP 5k-Luci. Эти результаты иллюстрируют, что модель MBP-luci может быть полезна для определения чувствительности индивидуума, штамма или вида к событию, влияющему на миелинизацию. Кроме того, конструкция MBP-luci не теряет своей полезности даже у млекопитающих с черным мехом.
Штамм BALB/cJ:
Также исследовали эффект купризона на кортикальную демиелинизацию в мышах BALB/cJ. У этих мышей кортикальная демиелинизация была только частичной.
Более того, кортикальное накопление микроглии было заметно увеличено у мышей BALB/cJ, в то время как микроглия отсутствовала в коре головного мозга мышей C57BL/6. Эти отличия штаммов могут быть полезны для осуществления различных исследовательских целей.
Штамм C57 BL/6J Jax:
Животные с генетической основой C57BL/6 подходят для многих купризоновых модельных исследований и использовались в нескольких лабораториях в течение последних трех десятилетий. При кормлении 8-недельных мышей C57BL/6 0,2%-ным купризоном в диете специфично наносится ущерб зрелой олигодендроглие (она не может соответствовать метаболическим требованиям обеспечивать большое количество миелина), и она входит в апоптоз. За этим событием сразу следует привлечение микроглии и фагоцитоз миелина. Исследование экспрессии гена миелина, согласованное с морфологическими исследованиями, указывает на то, что даже при постоянном метаболическом стрессе, клетки-предшественники олигодендроглии пролиферируют и проникают в демиелинизированные области. При прекращении воздействия купризона происходит практически полная ремиелинизация в течение нескольких недель. Можно предположить наличие межклеточного взаимодействия между различными типами клеток. Поэтому, способ и модель по изобретению могут быть полезны для исследования событий межклеточных взаимодействий, например, определения участия потенциального фактора в инициации миелинизации, скрининга соединений, которые обеспечивают инициацию и скрининга соединений, ингибирующих инициацию.
Кроме того, воспроизводимость модели MBP-luci указывает на то, что она может позволять тестирование манипуляций (например, доступных методов нокаута или получения трансгенных животных на общей генетической основе, методов интерферирующих РНК или фармакологических воздействий), которые могут ускорить или замедлить процесс демиелинизации и/или ремиелинизации.
Улучшение модели MBP-luci
Хотя было показано, что линия 171 (штамм B6C3H, гетерозиготная) работает в исследованиях миелинизации/демиелинизации, модель можно дополнительно улучшить путем (1) скрещивания до гомозиготности для увеличения интенсивности сигнала биовизуализации и снижения стоимости получения модели и генотипирования; (2) скрещивания со штаммом животных-альбиносов, таким как штамм С57, для уменьшения ослабления сигнала визуализации вследствие белого меха и для снижения реакции кожи после множественных депиляций; (3) скрещивания линии 121 со штаммом C57 BL/6 для соответствия разработанному в компании штамму для купризоновой модели воздействия на ЦНС.
На настоящий момент авторы продемонстрировали, что гомозиготные животные линии 171 показывали более чем 2-кратное окно биовизуализации относительно гетерозиготных животных линии 171 (две копии кассеты репортерного гена на клетку). Другие эксперименты также демонстрировали, что мыши-альбиносы С57 отвечали на купризоновую модель.
Система визуализации и анализ данных
Биолюминесценцию измеряли неинвазивным способом, используя систему визуализации IVIS (Xenogen Corp., Alameda, CA). Изображения получали через 10 мин после внутриперитонеальной инъекции люциферина (250 мг/кг; Xenogene Corp.) с 60-секундным накоплением сигнала, биннинг 10, если в тексте не указано иное. В ходе получения изображений, мышей анестезировали непрерывно посредством ингаляции ~2%-ным изофлураном (Abbott Laboratories Ltd., Kent, United Kingdom).
Описание системы визуализации:
Систему визуализации IVIS® Imaging System 100 (Xenogene) использовали для сбора данных, относящихся к данному изобретению. Чувствительные системы визуализации IVIS® 100-й серии от компании Xenogen предлагают регулируемое прямоугольное поле зрения, например, 10-25 см, позволяя получать изображения для 5 мышей или 2 крупных крыс, а также одного стандартного микротитровочного планшета. Система включает CCD-камеру (с прибором с зарядовой связью), имеющую 25 мм (1,0 дюймовую) квадратную истонченную матрицу с задней засветкой, которая криогенно охлаждается примерно от -90 до -120°C, например, до -105°C посредством системы охлаждения замкнутого цикла (без жидкого азота) для минимизации электронного фона и максимизации чувствительности. CCD-камера создана для высокоэффективной детекции фотонов, в частности, в красной области спектра. Она может детектировать очень маленькое число фотонов, а также работать в качестве традиционной камеры; представление изображений в этом широком диапазоне сигнала является функцией программного обеспечения Living Image® от компании Xenogen. В ней присутствует шестипозиционный диск со светофильтрами для выделения различных полос спектра. Эта спектральная информация может дать больше данных о глубине и распределении клеток-источников излучения. CCD-камера охлаждается, и электронный выход оптимизирован таким образом, чтобы данные, собранные для создания in vivo изображений в режиме реального времени, имели необычайно низкий уровень шума.
Светонепроницаемый корпус для визуализации
В высшей степени светонепроницаемый корпус для визуализации (с низким фоновым сигналом) позволяет использовать приборы 100-й серии системы визуализации IVIS® в стандартных лабораторных условиях освещенности. Полка для образца в камере для визуализации двигается вверх и вниз для регулировки поля зрения. Исследователь может видеть все животное или может сфокусироваться на одном участке для более подробного изучения. Полка подогревается для улучшения состояния анестезированных животных, например, мышей или крыс. Система включает характеристики, важные для работы с животными, такие как полка для образцов с подогревом, соединения для газовой анестезии и опцию полноценной газовой анестезии от Xenogen - систему XGI-8 Gas Anesthesia System, показанную на интернет-странице компании. Более вместительная камера позволяет использование более крупных тестируемых индивидов или большее число тестируемых индивидов.
Приготовление люциферина для биолюминесцентного анализа in vivo:
В примерах использовали следующие материалы:
калиевую соль D-люциферина светлячка 1,0 г на ампулу (например, Xenogen XR-1001 или Biosynth L-8220).
DPBS без Mg2+ и Ca2+.
Фильтр на флакон (0,2 мкм).
Следующую процедуру использовали для визуализации:
Готовили концентрированный раствор люциферина (25 мг/мл в DPBS) и стерилизовали через фильтр 0,2 мкм. Аликвоты по 5 мл хранили при -20°C. Доза инъекции составляла 10 мкл/г веса тела. Количество рассчитывали, чтобы каждая мышь получала по 250 мг люциферина на кг веса тела (например, для 20-граммовой мыши объем инъекции составлял 200 мкл, чтобы мышь получила 2,0 мг люциферина). Люциферин вводили с помощью подкожных, внутрибрюшинных или внутривенных инъекций за несколько минут до проведения визуализации. Кинетические исследования для люциферина необязательно проводили для каждой животной модели, чтобы определить окно пикового сигнала.
3.6 Способ визуализации MBP-luci:
Как описано выше, мышам вводили с помощью инъекций 250 мг/кг D-люциферина подкожно, внутрибрюшинно или внутривенно. Через 5 минут (для внутривенного введения) или через 8 минут (для внутрибрюшинного или подкожного введения) проводили визуализацию мышей, используя IVIS 100 (Xenogen), в течение 16 минут (визуализация в течение 60-секунд и 60-секундный интервал для 8 фотографий с биннингом 8). Для количественной оценки биолюминесценции идентичные круглые области выделяли вокруг головы каждой мыши и количественно оценивали сигнал визуализации в среднюю интенсивность свечения (фотоны/с/см2/стерадиан), используя программное обеспечение LIVINGIMAGE software (version 2.5, Xenogen). Выделенные области сохраняли постоянными по площади и положению во всех экспериментах. Данные нормализовали на биолюминесценцию в начале воздействия для каждого животного.
3.7 Статистический анализ
Для статистического анализа использовали пакеты статистического программного обеспечения EverStat V5 и Sigma Stat. В качестве средних значений брали среднее значение визуализации в группе и вычисляли SE (стандартную ошибку) для всех групп.
При сравнению средних величин для двух групп использовали парный тест Вилкоксона или непарный тест Вилкоксона. Двусторонние значения P<0,05 считали статистически достоверными.
ПРИМЕРЫ
Создание трансгенных мышей
«Длинный» промотор имеет длину примерно 10 т.п.о., содержащих M1, M2, M3, M4, а «короткий» промотор имеет длину примерно 5 т.п.о., содержащих M1, M2 и M3. Эти промоторы были клонированы с помощью высокоточной ПЦР из бактериальной искусственной хромосомы (ВАС) мыши, содержащей ген МВР. Затем каждый фрагмент промотора клонировали в вектор, например, в полилинкерный участок вектора pGL3-hygro (фиг. 1 и фиг. 2).
Плазмиды расщепляли рестриктазами NotI и BamHI для высвобождения кассет для экспрессии трансгена MBP-luci (фиг. 3), которые использовали для создания трансгенных мышей с использованием штаммов FVB/Tac и B6C3/Tac и стандартных методик микроинъекций в проядра.
Общие стратегии получения трансгенных (Tg) животных хорошо известны в данной области, например, описаны в Pinkert, C. A. (ed.) 1994. Transgenic animal technology: A laboratory handbook. Academic Press, Inc., San Diego, Calif.; Monastersky G. M. and Robl, J. M. (ed.) (1995) Strategies in transgenic animal science. ASM Press. Washington D.C.).
Сигнал трансгена MBP-Luci, сопоставленный с событиями демиелинизации/ремиелинизации
Для валидации экспериментов трансгенную линию 121 (штамм FVB) MBP10K-luci с наблюдаемой экспрессией люциферазы в области белого вещества использовали в купризоновой модели. Как показано на фиг. 11, первое исследование на купризоне проводили с повторной визуализацией люциферазы в 1-ю, 2-ю и 4-ю неделю (на диете, содержащей 0,2% купризона) с последующим возвращением к нормальному питанию без купризона с визуализацией на 5-й, 6-й и 7-й неделе (недели 1-3 ремиелинизации). Как показано на фигуре экспрессия люциферазы в этой линии 121 четко коррелировала с динамикой индуцированной купризоном демиелинизации и ремиелинизации. Эти данные согласуются с опубликованными данными по экспрессии мРНК МВР (Jurevics et al., Journal of Neurochemistry, 2002, 82, 126-136). Известно, что мыши штамма FVB чувствительны к 0,2%-ному купризону, что видно по потере веса. Обычно, чтобы избежать сильной потери веса и токсичности для данного штамма необходимо использовать двух-трехкратную норму питания/добавки Transgel в неделю.
Валидация купризоновой модели:
Хорошо известной и широко используемой моделью демиелинизации/ремиелинизации является купризоновая модель на мышах. Эта модель включает потребление с пищей купризона, вещества, хелатирующего медь (обычно в количестве 0,2% по весу; бис-циклогексанон-оксалдигидразон, CAS# 370-81-0, Sigma C9012), вводимого в измельченное питание для лабораторных грызунов в течение, например, четырех-шести последовательных недель (см., например: Matsushima and Morell, 2001). Было показано, что купризон избирательно токсичен для зрелых олигодендроцитов. Последующее переключение с купризонового питания на нормальное создает условия, способствующие восстановлению, так что через четыре-шесть недель после удаления купризона из питания у мышей будет наблюдаться интенсивная ремиелинизация в мозолистом теле. Таким образом, купризоновая модель обеспечивает завершенный in vivo подход для исследования аспектов демиелинизации и ремиелинизации (фиг. 11 и 12).
В качестве дополнительного доказательства была протестирована линия 171 (штамм В6С3) MBP 5k-luci. Этот штамм также показывал коррелирующий ответ визуализации на события индуцированной купризоном демиелинизации и ремиелинизации, как показано на фиг. 13. 7 Tg+ мышей получали воздействие 0,2%-ного купризона в течение 6 недель, а 3 Tg+ мыши получали нормальное питание в течение 6 недель. Все 7 мышей перенесли диету с 0,2%-ным содержанием купризона и имели среднюю потерю веса 15-25%. Наблюдалось значительное падение сигнала визуализации при воздействии купризона (демиелинизации). Например, наблюдалось 43%-ное падение сигнала с 0-й недели до 4-й недели и 74%-ное падение сигнала с 0-й недели до 6-й недели.
Гистологическая валидация купризоновой модели на мышах MBP-luci
Для гистологической валидации задачей было подтверждение в модели биовизуализации того, что ответ репортерного гена в течение воздействия купризона коррелирует с структурно детектируемой демиелинизацией в мозолистом теле мышей, получавших купризон. Это патологическое состояние визуализировали окрашиванием люксолом быстрым синим (LFB) (см. фигуры 20 и 24).
Более конкретно, для линии 121 MBP 10k-luci (штамм FVB) при питании 0,2%-ным купризоном в первоначальных исследованиях только минимальная демиелинизация была детектирована при окрашивании LFB. Для того чтобы получить ясную гистологическую картину демиелинизации на данных мышах штамма FVB следовали различным схемам кормления купризоном в попытках избежать сильной потери веса. Группам с дозировкой купризона 0,2%, 0,175% и 0,15% (6-недельное исследование) требовалось в 3-4 раза больше нормы питания/добавки Transgel в неделю, чтобы избежать сильной потери веса и токсичности. Также дополнительно снижали концентрацию купризона и увеличивали время воздействия. Исследования с концентрациями купризона (0,14%, 0,12% и 0,1%) и временем воздействия (7 недель и 9 недель) тестировали с нормальным питанием/добавкой Transgel до одного раза в неделю. Однако все данные показывали, что мыши штамма FVB (8-недельные, вес 28,5 г ±3 г) имели меньшую гистологическую демиелинизацию при различных схемах питания купризоном. Линия FVB не была выбрана в качестве особенно предпочтительного варианта для предварительной разработки данной исследовательской модели. Хотя штамм FVB хорошо подходит для визуализации, а также по чувствительности к токсичности купризона, потеря веса может вносить искажающие выходные данные переменные, которые легко исключить в данных предварительных исследованиях, выбрав другой штамм.
В другом штамме мыши линии 171 MBP 5k-luci (B6C3) (8-недельные, вес 25 г±3 г) показывали ясную гистологическую демиелинизацию.
Ткани мозга мышей собирали в конце шести недель воздействия 0,2%-ным купризоном. Все семь мышей, получавших купризон, имели явную демиелинизацию в области мозолистого тела, а все три контрольные мыши показывали нормальную миелинизацию в области мозолистого тела. Эти данные, полученные на линии 171 MBP 5K-luci, обеспечивают дополнительные доказательства, что сигнал визуализации отслеживает индуцированную купризоном фазу демиелинизации.
Дополнительный количественный LFB-анализ (фиг. 14) продемонстрировал, что гомозиготные мыши линии 171 MBP-Luci (B6C3) (8-недельные, вес 21 г±3 г) показывали более согласованную и немного более интенсивную демиелинизацию на 4-й неделе по сравнению с гетерозиготными мышами линии 171 (B6C3H) (8-недельные, вес 25,5 г±3 г). Области с большей плотностью в овалах показывают окрашенный миелин.
Кроме того, самцы мышей дикого типа штамма C57Bl/6 (8-недельные, вес 20 г±3 г), получавшие питание с 0,2%-ным содержанием купризона, показывали более интенсивную и более согласованную демиелинизацию. Штамм C57 BL/6 служит в качестве положительной контрольной линии для купризоновой модели и эффекта тестируемого соединения PPARσ, описанного в предварительных исследованиях.
1. Подтверждение на мышах MBP-luci положительного эффекта действующего соединения селективного агониста PPARσ на ремиелинизацию ЦНС:
Мышей с МВР-люциферазой использовали для оценки возможности использования данной модели биовизуализации in vivo для детекции эффекта действующего соединения агониста рецептора дельта, активированного пролифератором пероксисом (PPARδ), ('571), на ремиелинизацию ЦНС.
Рецепторы, активированные пролифератором пероксисом (PPAR), принадлежат к суперсемейству ядерных рецепторов, которые функционируют в качестве транскрипционных факторов, регулирующих экспрессию генов-мишеней. В отличие от других транскрипционных факторов активность ядерных рецепторов можно модулировать связыванием с соответствующими лигандами - небольшими липофильными молекулами, легко проникающими сквозь биологические мембраны. Несмотря на сложность клеточных сигнальных путей для семейства ядерных рецепторов их давно успешно используют в качестве мишеней лекарственных соединений. PPAR необходимы для регуляции клеточной дифференцировки, развития и метаболизма. PPAR имеют три близкородственные изоформы, кодируемые отдельными генами, идентифицированными к настоящему времени - обычно известными как PPARα, PPARγ и PPARδ, также известный как PPARβ; J. Berger and D. E. Miller, Annu. Rev. Med., 2002, 53, 409-435). Каждый подтип рецептора имеет характерный ДНК-связывающий домен (DBD) и лиганд-связывающий домен (LBD), оба необходимые для активированной лигандом экспрессии генов. PPAR связываются в качестве гетеродимеров с рецептором ретиноидов Х (RXR).
PPARδ, по-видимому, в значительной степени экспрессируется в ЦНС; однако большинство его функций все еще остается неизвестными. Однако отдельный интерес представляет открытие, что PPARδ экспрессируется в олигодендроцитах грызунов, главных липид-продуцирующих клетках ЦНС (J. Granneman, et al., J. Neurosci. Res., 1998, 51, 563-573). Однако также было найдено, что селективный агонист PPARδ значительно усиливает экспрессию генов миелина и диаметр миелиновой оболочки в культуре клеток мыши (I. Saluja et al., Glia, 2001, 33, 194-204). Мыши, нокаутные по PPARδ, имели меньший общий размер мозга и меньшую степень миелинизации белого вещества (Mol cell Biology 200 20:5119). Дополнительно, агонисты PPARδ проявляют защитные эффекты в экспериментальной аутоиммунной энцефаломиелитной (ЕАЕ) модели множественного склероза (Polak et al., J Neuroimmunology 2005 168:65-75).
Коллеги авторов ранее продемонстрировали, что селективные агонисты PPARδ играют функциональную роль в нейрональной ткани и стимулируют дифференцировку клеток-предшественников олигодендроцитов. SAR117145, перорально биодоступный, проникающий через гемато-энцефалический барьер селективный агонист PPARδ стимулировал дифференцировку клеток-предшественников олигодендроцитов грызунов и человека in vitro концентрационнозависимым образом; эффект, который мог быть блокирован селективным антагонистом PPARδ.
В олигодендроцитах крыс повышенной экспрессии основного белка миелина предшествовала повышенная экспрессия мРНК расположенной ниже в сигнальном каскаде мишени PPAR, Angptl4, и это повышение блокировалось «нокдауном» PPARδ с помощью лентивирусных кшРНК. В мышиной купризоновой модели острой демиелинизации, в которой мышей кормили диетой с 2% купризона в течение 4 недель, SAR117145 усиливало ремиелинизацию ЦНС, усиливало экспрессию мРНК Angptl4 и улучшало аксональную проводимость по мозолистому телу. Активация Angptl4 в ЦНС сопровождалась повышенной экспрессией в икроножной мышце, позволяя предположить, что это явление может служить потенциальным заместительным маркером. Эти данные демонстрируют, что агонисты PPARδ могут усиливать ремиелинизацию ЦНС и улучшать аксональную функцию, и позволяют предложить их возможное применение в стимуляции эндогенных процессов восстановления для лечения демиелинизирующих заболеваний (патентная заявка США 20070149580, ПРИМЕНЕНИЕ АГОНИСТОВ РЕЦЕПТОРА ДЕЛЬТА, АКТИВИРУЕМОГО ПРОЛИФЕРАТОРОМ ПЕРОКСИСОМ, ДЛЯ ЛЕЧЕНИЯ МС И ДРУГИХ ДЕМИЕЛИНИЗИРУЮЩИХ ЗАБОЛЕВАНИЙ).
Действующее соединение агониста PPARδ ('517; фиг. 15) было протестировано на гетерозиготных мышах линии 171 В6С3Н. 8-недельных мышей помещали на диету, содержащую 0,2% купризона, в течение 4 недель, затем давали нормальное питание для ремиелинизации. Мышам затем перорально вводили дважды в день либо носитель (0,6%-ную натриевую соль карбоксиметилцеллюлозы и 0,5%-ный Tween 80) или 30 мг/мг действующего соединения агониста PPARδ '517, в течение 8 дней и визуализировали во временных точках, указанных на графике. Данные нормализовали на сигналы базовой линии в 0-й неделе. Наблюдалось относительное повышение люциферазного сигнала на 30-100% в группе действующего соединения '517 (n=15) относительно группы носителя (n=13), что, как полагают авторы, является следствием усиления дифференцировки клеток-предшественников олигодендроцитов.
Эффект '517 дополнительно подтверждали гистологически окрашиванием люксолом быстрым синим (LFB) в этом же исследовании (фигура 16). Парасагиттальные тканевые срезы из фиксированного в формалине, заключенного в парафин мозга окрашивали LFB для количественной оценки миелина в мозолистом теле. Окрашенные среды для каждой временной точки оценивали и выставляли баллы по шкале от 0 (полная миелинизация) до 5 (полная демиелинизация). Система оценки была следующая: 0 = нормальный миелин, демиелинизация отсутствует, 1 = минимальная, локальная демиелинизация, 2 = слабая до средней, локальная демиелинизация, 3 = средняя, местами интенсивная демиелинизация, 4 = тяжелая, местами интенсивная демиелинизация, 5 = тяжелая, диффузная демиелинизация. Гистологическая оценка срезов LFB-окрашенного мозга мышей после 4 недель на купризоне подтвердила средне-тяжелую демиелинизацию мозолистого тела гетерозиготных мышей линии 171 (n=5). Обработка действующим соединением '517 (n=5) по сравнению с контрольной группой, получавшей носитель (n=3), с 4-й по 5-ю неделю в течение фазы ремиелинизации привела к заметному увеличению количества миелина, определенному с помощью окрашивания LFB на 7-й неделе. Несмотря на небольшое число животных в группах гистологические данные подтверждают in vivo данные биовизуализации люциферазы, указывая на увеличение ремиелинизации у мышей, получавших соединение '517, по сравнению с контрольной группой, получавшей носитель.
Второе исследование PPARδ 517 с гетерозиготными мышами линии 171 показало аналогичные результаты (данные не показаны, и также воздействие '517 было увеличено на три недели). В согласии с первым исследованием (фигура 15) второе исследование также позволяет предположить, что '517 ускоряло дифференцировку клеток-предшественников олигодендроцитов на ранней стадии восстановления в ходе процесса ремиелинизации (M Lindner and S Heine, et al., Neuropathology and Applied Neurobiology, 34, 105-114, 2008).
2. Детекция с помощью мышей MBP-luci эффектов агониста ERβ, '5a, или соединения положительного контроля, QTP, на экспрессию миелина.
Эстрогеновые рецепторы (ER) принадлежат к семейству стероидных ядерных рецепторов, которые действуют напрямую на ДНК через специфичные респонсивные элементы и модулируют экспрессию генов. Существует два подтипа ER - ERα и ERβ. ERα имеет высокий уровень экспрессии в матке, простате, яичниках, костной ткани, ткани молочных желез и мозге, в то время как ERβ присутствует в ткани толстой кишки, простаты, яичников, костного мозга и головного мозга. Избирательное воздействие на ERβ представляет собой перспективный терапевтический подход, позволяющий избежать побочных эффектов от ERα. На сегодняшний момент идентифицированы соединения, избирательно воздействующие на определенный подтип ER.
Например, показано, что агонисты ERβ (а не ERα) обладают защитным действием в отношении олигодендроцитов и апоптоза клеток нейробластомы in vitro. Кроме того, ERβ или агонист ER ослабляет EAE и обладает нейропротекторным эффектом (сохранение миелина и аксонов). Исходя из применения предшествующего действующего соединения агониста PPARδ, '517, линию MBP-luci использовали для определения профиля действа агониста ERβ, '5a, в купризоновой модели. Кроме того, авторы включили лекарство против шизофрении от компании AstraZeneca, Кветиапин (в количестве 10 мг/кг, перорально, ежедневно), в качестве положительного контроля, исходя из его защитного эффекта на индуцированную купризоном демиелинизацию (Schizophrenia Research, 2008 Dec 106, 182-91). Было проведено два независимых исследования на гетерозиготных мышах линии 171 B6CH.
Первое исследование (фигура 17) показало, что агонист ERβ, '5a, и положительный контроль, Кветиапин (QTP) обладали защитным действием на протяжении периода демиелинизации в купризоновой модели. Гетерозиготных мышей B6C3H линии 171 MBP-luc кормили диетой, содержащей купризон, в течение 4 недель, и им перорально вводили '5a (10 мг/кг, N=12, или 30 мг/кг, N=16) или QTP (10 мг/кг, N=14). Визуализацию мышей проводили в 0-ю неделю (базовая линия), данные 3-й и 4-й недели нормализовали на базовую линию в 0-й неделе. Аналогично предшествующему исследованию (фигура 15) группа носителя давала 49%-ное (3-я неделя) и 45%-ное (4-я неделя) снижение сигнала биовизуализации. Группа QTP показывала значительное увеличение сигнала относительно группы контроля-носителя как на 3-й неделе, так и на 4-й неделе в количестве 10 мг/кг. Результаты для воздействия QTP соответствовали данным, опубликованным Zhang et al. (Schizophrenia Research, 2008, 106:182-91). Соединение '5a в количестве 30 мг/кг показывало значительное увеличение сигнала относительно носителя на 4-й неделе, однако не показывало достоверной разницы относительно сигнала в количестве 10 мг/кг на 3-й или 4-й неделе. Эти результаты позволяют предположить, что модель визуализации MBP-luci можно использовать для исследования дозозависимых защитных эффектов на купризоновой модели.
Дополнительное исследование (фигура 18) было спланировано для подтверждения результата первого исследования (фигура 17), но с большей когортой для групп носителя и соединения '5a в количестве 30 мг/кг. В согласии с результатами первого исследования воздействие на мышей QTP в количестве 10 мг/кг (N=17) давало статистически значимое ингибирование индуцированного купризоном снижения сигнала по сравнению с контрольной группой носителя (N=25) на 3-й неделе (25%-ное относительно 47%-ного снижения, p=0,028) и на 4-й неделе (6%-ное повышение относительно 25%-ного снижения). Кроме того, '5a в количестве 30 мг/кг (N=27) приводил к значительно большей активности трансгена по сравнению с контрольной группой носителя на 3-й неделе (31%-ное относительно 47%-ного снижения, p=0,0079) и 4-й неделе (6%-ное снижение относительно 25%-ного снижения, p=0,0015).
Эти два исследования продемонстрировали, что соединение '5a в количестве 30 мг/кг предупреждало в значительной степени индуцированное купризоновой диетой снижение сигнала биовизуализации в ЦНС хотя и не до такой же степени как положительный контроль, QTP, в количестве 10 мг/кг (в условиях, используемых в данных экспериментах). Поскольку в предшествующих исследованиях показано прямое взаимодействие между выраженностью миелинизации ЦНС и сигналом биовизуализации от MBP-luci, данные результаты позволяют предположить, что оба соединения, '5a и QTP, предупреждают демиелинизацию в ЦНС на протяжении введения купризоновой диеты. Данные модели визуализации позволяют предположить, что и QTP, и '5a, ослабляют индуцированную купризоном демиелинизацию мозга и разрушение миелина.
3. Сравнение линий MBP-luci в купризоновой модели.
Для определенных вариантов применения биовизуализации было создано шесть трансгенных линий на основе различных штаммов.
Проводили сравнение сигнала визуализации от гомозиготных и гетерозиготных мышей линии 171 В6С3Н в купризоновой модели (фиг.19). Две копии репортерного гена у гомозиготных животных показывали более чем двукратное снижение сигнала на протяжении фазы демиелинизации и более чем двукратное увеличение сигнала в течение фазы ремиелинизации. Хотя продемонстрировано, что гетерозиготная линия 171 (штамм B6C3H) работает в купризоновой модели и может детектировать эффекты соединений, ожидается, что модель можно дополнительно улучшить скрещиванием до гомозиготности для повышения интенсивности сигнала биовизуализации. Это упростило бы получение моделей и снизило бы расходы на генотипирование, поскольку колонии мышей можно содержать как гомозиготные. Более того, чем больше окно визуализации, тем более чувствительна модель в отношении детекции индуцированных соединениями изменений.
На фигуре 20 показано сравнение гистологических данных окрашивания LFB для трех различных линий в купризоновой модели. Количественные данные окрашивания LFB подтвердили результаты биовизуализации, полученные с линией 171 B6C3H, что гомозиготные мыши имеют более ярко выраженную демиелинизации, индуцированную купризоном; аналогичную тяжести, наблюдаемой для обычно используемого штамма мышей C57 BL/6 дикого типа. Гетерозиготные мыши линии 171 показывали менее тяжелую демиелинизацию, в то время как эти гетерозиготные мыши линии 171 показывали наименьшую степень индуцированной купризоном демиелинизации.
На фигуре 21 продемонстрировано, что линия MBP-luci с наибольшим снижением сигнала биовизуализации также имела наибольшую демиелинизацию, оцениваемую гистологически. Три различных линии MBP-luci (гетерозиготный штамм B6C3H линии 171, гетерозиготный штамм C57BL/6 линии 121 и гомозиготный штамм B6C3H линии 171) сравнивали с помощью биовизуализации и гистологического окрашивания люксолом быстрым синим (LFB; окрашивание миелина). Мышей помещали на диету, содержащую 0,2% купризона в течение 4 или 5 недель. Данные визуализации нормализовали на измерения базовой линии в 0-й неделе. В конце каждого исследования собирали мозг мышей и окрашивали серии парафиновых срезов на миелин с помощью LFB. Средняя качественная LFB-оценка (0-5) показана в таблице на фигуре 21. Гомозиготные мыши линии 171 B6C3H показывали наибольшее снижение сигнала визуализации и также демонстрировали наиболее интенсивную демиелинизацию, определенную с помощью качественной гистологической оценки. Гетерозиготные мыши линии 171 B6C3H показывали наименьшее окно визуализации, а также наименьшую гистологическую демиелинизацию на 4-й неделе. Гомозиготные мыши линии 171 B6C3H имели наибольшее снижение сигнала биовизуализации на протяжении кормления животных пищей с купризоном относительно своей базовой линии до начала кормления купризоном. Например, через три недели на купризоновой диете гомозиготные мыши 171 B6C3H имели 72%-ное снижение сигнала (отношение сигнала на 3-й неделе к сигналу в 0-й неделе, p<0,05), в то время как гетерозиготные мыши линии 171 B6C3H имели 45%-ное снижение сигнала биовизуализации (относительно 0-й недели, p<0,05). Гетерозиготные мыши линии 121 C57 BL/6 имели наименьшее снижение люциферазного сигнала (33%-ное снижение на 3-й неделе относительно 0-й недели, p<0,05).
Чувствительность и ответную реакцию модели MBP-luci дополнительно подтверждали воздействием QTP (10 мг/кг) на гомозиготных мышей 171 B6C3H, которое показано на фигуре 22. В согласии с результатами, полученными с использованием гетерозиготных мышей 171 B6C3H (фигуры 17 и 18), показано, что QTP (10 мг/кг) значительно предупреждает снижение сигнала биовизуализации. Исходя из этих результатов гомозиготные мыши линии 171 B6C3H были идентифицированы в качестве оптимальной линии для модели биовизуализации индуцированной купризоном демиелинизации.
4. Дополнительное применение модели MBP-luci
Мыши MBP-luci экспрессируют люциферазу как в головном, так и в спинном мозге. Как показано на фигуре 23, люминесцентный сигнал в основном наблюдался в области белого вещества головного и спинного мозга. Кроме того, что визуализация люциферазы в головном мозге была успешно продемонстрирована для применения в купризоновой модели, сигнал визуализации люциферазы в спинном мозге можно использовать в экспериментальной аллергической энцефалитной (ЕАЕ) модели рассеянного склероза или применять в качестве модели спинного мозга.
Реферат
Изобретение относится к неинвазивной модели визуализации на основе люциферазы под контролем промотора основного белка миелина для визуализации и количественного определения событий демиелинизации и ремиелинизации в ЦНС на транскрипционном уровне. Экспрессирующие люциферазу трансгенные животные были созданы с промотором основного белка миелина (МВР), присоединенным к репортеру - люциферазе светлячка. Модель биовизуализации, MBP-luci, обеспечивает средство мониторинга статуса миелинизации и эффективности тестируемых соединений, модулирующих ремиелинизацию. Преимуществом биовизуализации является то, что индивид в долгосрочном исследовании может служить в качестве своего собственного контроля. Одного индивида можно отслеживать на протяжении процесса демиелинизации и ремиелинизации непрерывно в течение по меньшей мере 10-недельного периода. Эта модель обеспечивает возможность нормализации ответа визуализации индивидуальных животных и обеспечивает качественные данные со значительно сниженной вариабельностью. В дополнение, возможно снижение числа животных, необходимых для исследования эффективности соединений, благодаря отсутствию необходимости умерщвления когорт животных в различных временных точках. 3 н. и 8 з.п. ф-лы, 24 ил., 1 табл.
Формула
трансгенную модификацию указанного млекопитающего, не являющегося человеком, для экспрессии гена люциферазы под контролем промотора основного белка миелина (МВР), где указанный МВР-промотор содержит регуляторные модули М1-М4 или содержит модули М1-М3;
мониторинг биолюминесценции указанного млекопитающего; и
корреляцию указанного светового выхода с определенными участками тела указанного млекопитающего, не являющегося человеком;
повторение указанного мониторинга в том же млекопитающем, не являющемся человеком, в отличное от времени указанного исходного мониторинга; и
сравнение выхода событий указанного мониторинга для наблюдения изменения миелинизации в организме того же млекопитающего, не являющегося человеком.
нормализацию сигнала визуализации на протяжении интервалов демиелинизации или ремиелинизации, причем указанная визуализация на протяжении интервалов эффективно определяет изменения в уровне транскрипта МВР в указанном млекопитающем, не являющемся человеком, на протяжении указанных интервалов.
трансгенную модификацию указанного млекопитающего для экспрессии гена люциферазы под контролем промотора основного белка миелина (МВР);
мониторинг биолюминесценции указанного млекопитающего, не являющегося человеком;
корреляцию указанного светового выхода с определенными участками тела указанного млекопитающего, не являющегося человеком;
введение соединения или агента, эффект на демиелинизацию и ремиелинизацию которого определяется в живом млекопитающем, не являющемся человеком;
повторение указанного мониторинга в том же млекопитающем, не являющемся человеком, после введения соединения или агента;
сравнение выхода событий указанного мониторинга; и
определение эффекта соединения или агента на миелинизацию на основании сравнения событий указанного мониторинга, где уменьшение сигнала визуализации соответствует увеличению демиелинизации, а увеличение сигнала визуализации соответствует увеличению ремиелинизации.
Документы, цитированные в отчёте о поиске
Способ получения трансгенной овцы

Комментарии