Новые связывающие молекулы с противоопухолевой активностью - RU2627185C1
Код документа: RU2627185C1
Чертежи
































































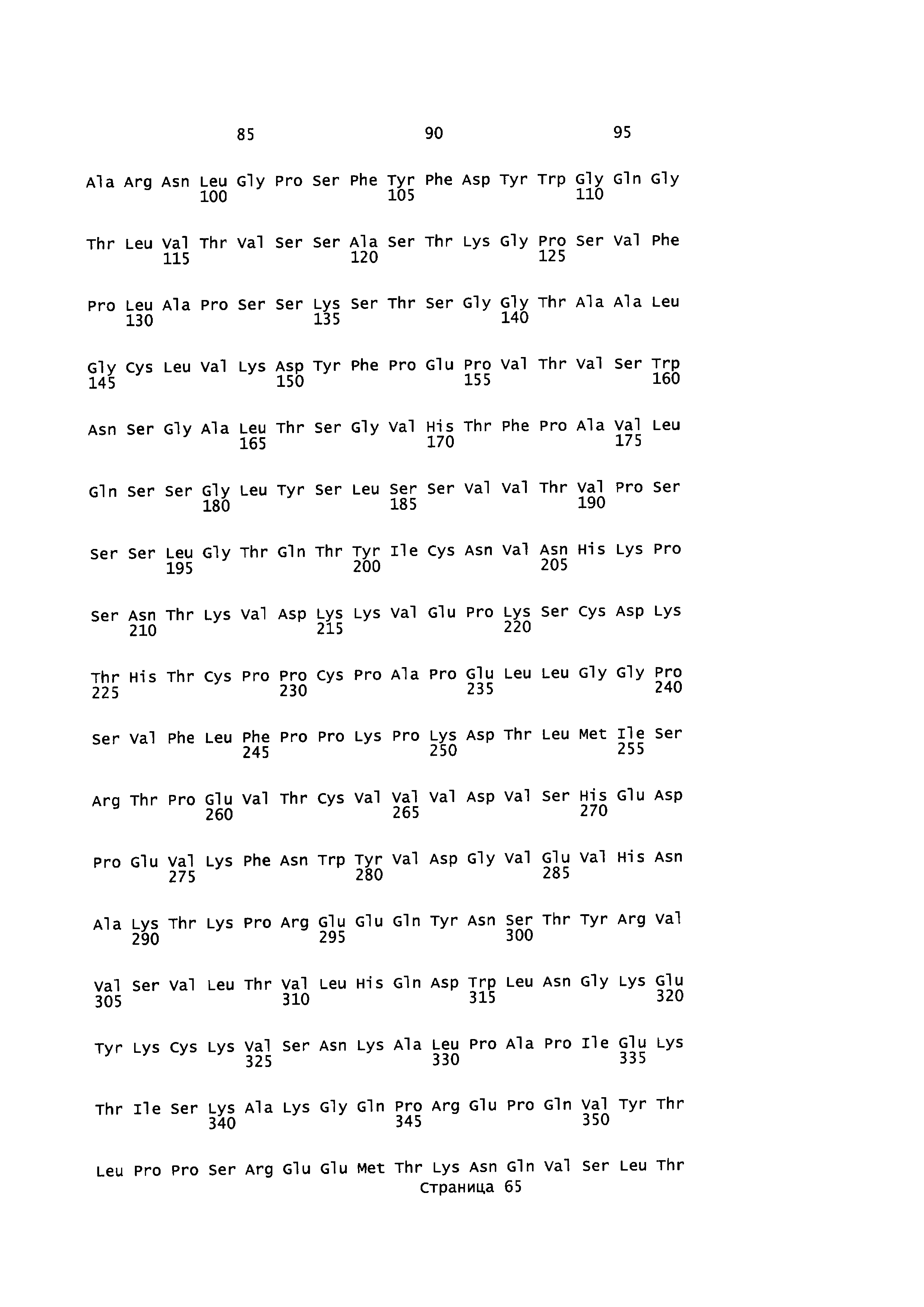





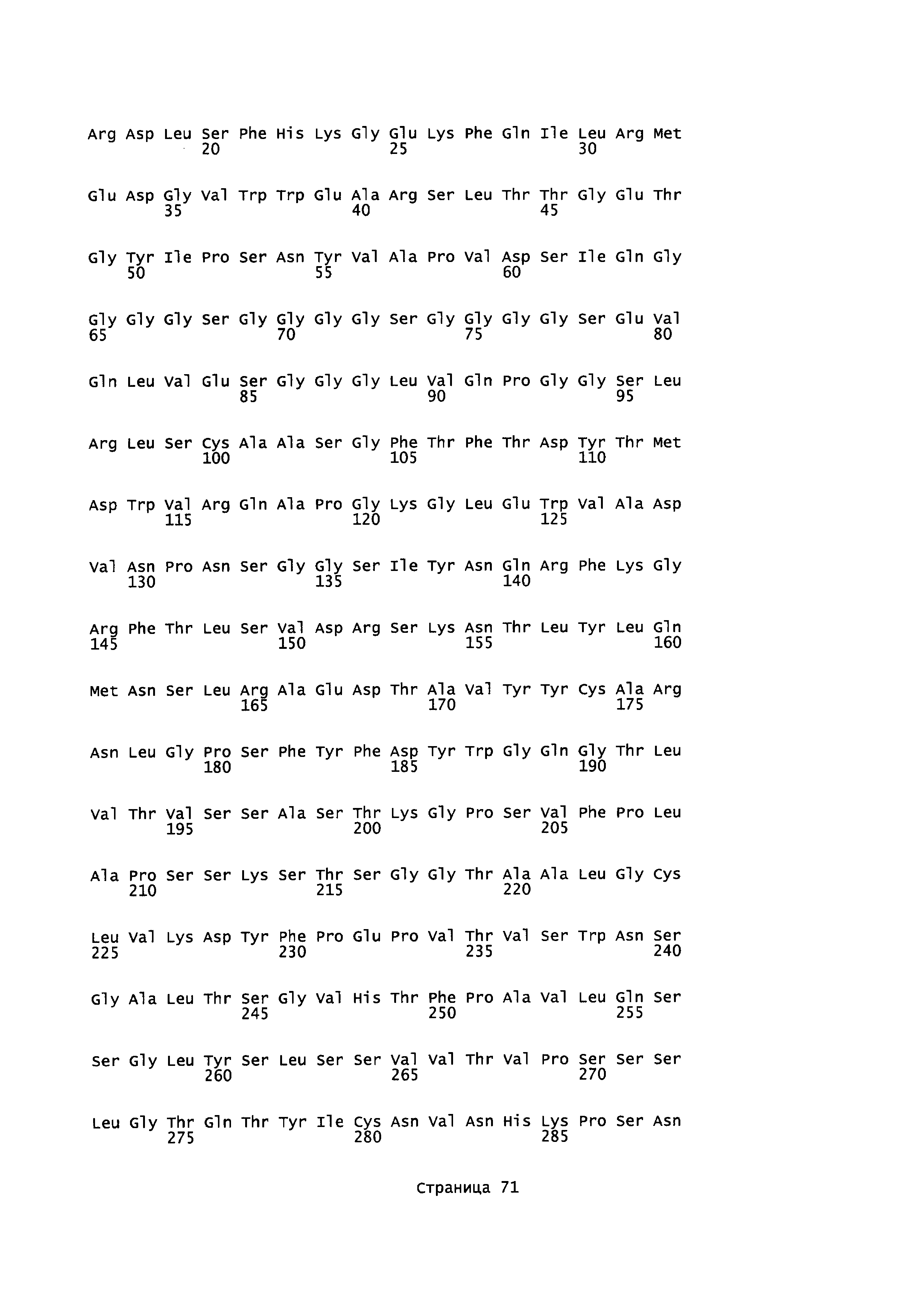















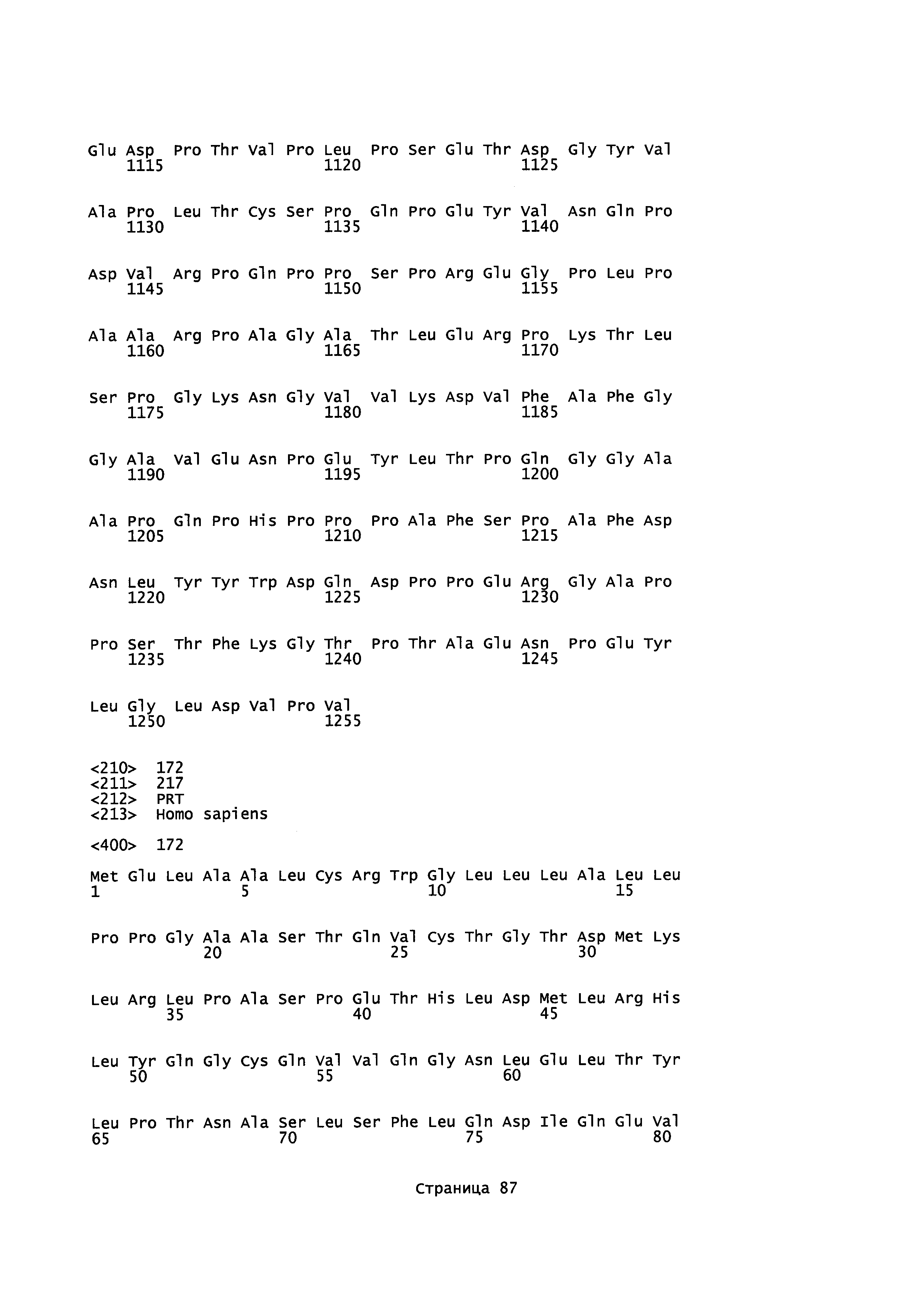






Описание
Настоящее изобретение относится к связывающей молекуле, которая специфически связывается с двумя различными эпитопами антигена, экспрессированного на опухолевых клетках, при этом связывающая молекула включает (а) первый связывающий (поли)пептид, который специфически связывается с первым эпитопом указанного антигена, экспрессированного на опухолевых клетках, при этом указанный первый связывающий (поли)пептид представляет собой полипептид, образованный из Fyn SH3; и (b) второй связывающий (поли)пептид, который специфически связывается со вторым эпитопом указанного антигена, экспрессированного на опухолевых клетках. Настоящее изобретение также относится к молекуле нуклеиновой кислоты, кодирующей связывающую молекулу по изобретению, вектору, включающему указанную молекулу нуклеиновой кислоты, а также клетке-хозяину или хозяину, не являющемуся человеком, трансформированному указанным вектором. Изобретение также относится к способу получения связывающей молекулы по изобретению, а также к фармацевтической и диагностической композиции. Кроме того, настоящее изобретение также относится к связывающей молекуле, молекуле нуклеиновой кислоты, вектору или клетке-хозяину по изобретению для применения при лечении опухолей.
В данном описании цитируется ряд документов, в том числе, заявки на патент и руководства изготовителей. Указанные документы, хотя и не рассматриваются как относящиеся к патентоспособности данного изобретения, включены в данное описание в качестве ссылок. Конкретнее, все цитированные документы включены в качестве ссылок в такой же степени, как если бы каждый отдельный документ специфически и отдельно включался в качестве ссылки.
Связывающие реагенты, происходящие не от иммуноглобулинов (все вместе называемые «каркасами»; см., например, Skerra (2000), J. Mol. Recognit, 13, 167-187), предполагаются для применения в качестве диагностических и терапевтических средств. Свыше 50 различных белковых каркасов предложено за последние 10-15 лет, причем наиболее продвинутыми подходами в этой области (как суммировано в работе Gebauer and Skerra (2009), Curr. Opinion in Chemical Biology, 13: 245-255) являются аффитела (на основе Z-домена стафилококкового белка А), домены типа Kunitz, аднектины (на основе 10-го домена фибронектина человека), антикалины (образованные из липокалинов), DARPins (образованные из белков анкиринового повтора), авимеры (основанные на полимеризованном LDLR-A) и финомеры, которые образованы от человеческого домена Fyn SH3.
Вообще, домен SH3 присутствует в самых разных белках, участвующих в клеточной передаче сигналов (Musacchio et al. (1994), Prog. Biophys. Mol. Biol., 61, 283-297). Такие домены не занимают фиксированное положение в белках и могут быть экспрессированы и очищены независимо. В настоящее время известно более 1000 появлений домена, в том числе, примерно 300 доменов SH3 человека (Musacchio (2003), Advances in Protein Chemistry, 61, 211-268). Хотя существует большое разнообразие последовательностей доменов SH3, их всех объединяет консервативная складка: компактный бета-бочонок, образованный двумя антипараллельными бета-листами (Musacchio (2003), Advances in Protein Chemistry, 61, 211-268). Типично домены SH3 связываются с богатыми пролином пептидами, содержащими связывающий лейтмотив РХХР (Ren et al. (1993), Science, 259, 1157-1161), но также описаны примеры необычных сайтов связывания SH3 (Karkkainen et al. (2006), EMBO Rep., 7, 186-191). Большинство доменов SH3, секвенированных до сих пор, имеют общую длину приблизительно в 60-65 аминокислот, но некоторые из них могут, в отличие, иметь 85 аминокислот из-за вставок в петли, соединяющие основные консервативные элементы вторичной структуры (Коуата et al. (1993), Cell 72(6), 945-952). Выравнивание различных доменов SH3 выявляет консервативные аминокислотные остатки, ответственные за правильное формирование структуры, а также за узнавание канонического богатого пролином мотива (Larson et al. (2000), Protein Science, 9, 2170-2180).
Лечение опухолей обычными химиотерапевтическими средствами опирается на ожидание того, что лекарственные средства будут преимущественно убивать быстро делящиеся опухолевые клетки, а не здоровые клетки. Однако отсутствие селективности в отношении опухолевых клеток ведет к токсичности для здоровых тканей с увеличенными скоростями пролиферации, таких как костный мозг, желудочно-кишечный тракт и волосяные фолликулы. Химиотерапевтические средства показывают плохое накопление в массе опухоли вследствие плохой перфузии крови, неравномерной сосудистой сети и высокого интерстициального давления в окружающей среде опухоли (Bosslet et al. (1998), Cancer Res., 58: 1195-1201). Более того, белки с множественной лекарственной устойчивостью могут снижать усвоение лекарственного средства (Ramachandran et al. (1999), Mol. Diagn., 4: 81-94). Как следствие, разработка терапевтических средств, нацеленных преимущественно на опухолевые клетки, представляет собой основное средоточие современных противораковых исследований. В таком контексте направленная доставка терапевтических средств в место нахождения опухоли путем связывания с опухольассоциированными антигенами является развивающейся областью в современных противораковых исследованиях, которая сулит концентрацию биоактивных молекул в неопластических повреждениях, сберегая в то же время здоровые ткани (Pfaffen et al. (2010), Exp. Cell Res., 316(5), 836-847). Например, при раке молочной железы и яичников наблюдается положительная регуляция белка HER2, что коррелирует с неблагоприятным прогнозом (Slamon et al. (1987), Science, 235: 177-182; Slamon et al. (1989), Science, 244: 707-712). При ряде других типов опухолей, включая карциномы мочевого пузыря, слюнных желез, эндометрия, поджелудочной железы, щитовидной железы, почек, легких, верхнего отдела желудочно-кишечного тракта и толстой кишки, также наблюдают сверхэкспрессию HER2 (часто, но не постоянно, из-за амплификации гена) (Scholl et al. (2001), Ann. Oncol., 12 Suppl. 1: S81-87; Ross J.S. (2011), Biomark Med., 3: 307-318; Fukushige et al. (1986), Mol. Cell Biol., 3: 955-958; Cohen et al. (1989), Oncogene, 1: 81-88; Weiner et al. (1990), Cancer Res., 50: 421-425; Park et al. (1989), Cancer Res., 23: 6605-6609; Zhau et al. (1990), Mol. Carcinog., 5: 254-257; Aasland et al. (1988), Br. J. Cancer, 4: 358-363; Seliger et al. (2000), Int. J. Cancer, 87(3): 349-359). Кроме того, обнаружено, что HER2 сверхэкспрессируется при раке предстательной железы, хотя на меньших уровнях по сравнению с тканями молочной железы (Minner et al. (2010), Clin. Cancer Res., 16(5): 1553-1560).
Ранее описаны некоторые HER2-связываюшие белки, такие как аффитела и DARPins (Wikman et al. (2004), Protein Eng. Des. Sel., 17(5): 455-462; Zahnd et al. (2007), 369(4): 1015-1028). Кроме того, Hudziak с сотр. описывают создание панели мышиных анти-HER2 антител (включающей антитела 4D5 и 2С4), которые охарактеризованы с использованием клеточной опухолевой линии рака молочной железы человека (Hudziak et al. (1989), Mol. Cell Biol., 9(3): 1165-1172; см. также патент США №5677171). Определялась относительная клеточная пролиферация клеток после воздействия антител. Авторы показывают, что антитела 4D5 ингибируют клеточную пролиферацию наиболее эффективно. Рекомбинантная гуманизированная версия мышиных анти-HER2 антител 4D5 (huMAb4D5-8, трастузумаб, герцептин, см. также патент США №5821337) одобрена Управлением по пищевым продуктам и лекарственным средствам США в 1998 для лечения HER2-положительного метастазирующего рака молочной железы (МВС) в комбинации с химиотерапией. В настоящее время трастузумаб рекомендуется как первоочередное лечение для пациентов с метастазирующими HER2-положительными опухолями или как единственное средство (ограниченная группа пациентов) или в комбинации с эндокринной терапией или химиотерапией, а также во вспомогательном фоне (Awada et al. (2012), Cancer Treat. Rev., 106(1): 6-13). Однако во время лечения трастузумабом часто встречается первичная (присущая) или вторичная (приобретенная во время лечения) устойчивость (Tsang et al. (2012), Br. J. Cancer, 106: 6-13). Например, наблюдали, что степень первичной устойчивости к единственному средству трастузумабу в случае сверхэкспрессирующего HER2 метастазирующего рака молочной железы составляет 66-89%. Кроме того, у большинства пациентов, у которых достигалась начальная реакция на схемы лечения на основе трастузумаба, устойчивость развивается в пределах 1 года (Nahta et al. (2006), Nat. Clin. Pract. Oncol., 3(5): 269-280). В литературе описано несколько стратегий для преодоления устойчивости к лечению трастузумабом (см. обзоры Tsang et al. (2012), Br. J. Cancer, 106: 6-13; Awada et al. (2012), Cancer Treat. Rev., 106(1): 6-13).
Одно привлекательное направление для преодоления устойчивости представляет собой использование комбинаций HER2-связывающих средств. В таком контексте несколько групп показывают, что комбинация двух анти-HER2 антител подавляет рост клеточных опухолевых линий человека in vitro и/или in vivo лучше, чем лечение только одним антителом (Yamashita-Kashima et al. (2011), Clin. Cancer Res., 17(15): 5060-5070; Scheuer et al. (2009), Cancer Res., 69(24): 9330-9336; Lee-Hoeflich et al. (2008), Cancer Res., 68(14): 5878-5887; Kasprzyk et al. (1992), Cancer Res., 52: 2771-2776; Ben-Kasus et al. (2009), Proc. Natl. Acad. Sci. USA, 106(9): 3294-3299). Примечательно, что повышенную эффективность наблюдают при предклинических исследованиях, когда трастузумаб объединяют с пертузумабом (пертузумаб представляет собой гуманизированную форму мышиного антитела 2С4, описанную Hudziak et al. (Hudziak et al. (1989), Mol. Cell Biol., 9(3): 1165-1172; патент США №5677171); Adams C.W. et al. (2006), Cancer Immunol. Immunother., 55: 717-727; WO 2001/00245)), и клинические испытания фазы 2 показывают, что совместное введение трастузумаба и пертузумаба вызывает противоопухолевые реакции у пациентов, которые имели предварительно установленное развитие заболевания, пока получали терапию на основе трастузумаба (Baselga et al. (2010), J. Clin. Oncol., 28: 1138-1144). Пертузумаб связывается с доменом II внеклеточной части HER2, в то время как трастузумаб связывается с сайтом в домене IV HER2, который является ближайшим к мембране. Показано, что пертузумаб из-за его специфичности связывания предотвращает образование активных гетеродимеров HER2 с другими рецепторами HER (такими как HER1, HER3 и HER4) (Agus et al. (2002), Cancer Cell, 2: 127-137; Fendly et al. (1990), Cancer Res., 50(5): 1550-1558).
Недавно в клиническом исследовании фазе III показано, что комбинация пертузумаб плюс трастузумаб плюс доцетаксел по сравнению с плацебо плюс трастузумаб плюс доцетаксел существенно пролонгирует выживание без развития, когда используется как первоочередное лечение для пациентов с HER2-положительным метастазирующим раком молочной железы (Baselga et al. (2012), N. Engl. J. Med., 366(2): 109-119). Однако среднее независимо оцененное выживание без развития пролонгируется только на 6,1 месяцев (из 12,4 месяцев в контрольной группе до 18,5 месяцев в группе пертузумаба). Кроме того, комбинация двух или большего числа биологических соединений делает необходимой дозировку двух молекул, что обычно делает регулирование и клинические процедуры более трудными. Кроме того, различия в фармакокинетике и концентрации в тканях могут снизить эффективность двух антител.
На основании улучшенной терапевтической эффективности комбинаций антител, имеющих целью различные эпитопы на HER2 или EGFR (HER1) (Perera et al. (2005), Clin. Cancer Res., 11: 6390-6399), были предприняты усилия для конструирования полиспецифических белков, имеющих целью EGFR и HER2, которые связываются с различными эпитопами или EGFR (WO 2011/020033) или HER2 (устная презентация Woisetschlager М., Bispeciflc Antibody Summit 2011, September 27, 2011, Boston, USA; слайды №№5 и 15).
В WO 2011/020033 EGFR-связьшаюшие белки на основе домена фибронектина выделили и слили с С- или N-концом или тяжелой и/или легкой цепи моноклонального анти-EGFR антитела 225 (также известного как цетуксимаб (эрбитукс®)). Показано, что EGFR-связывающие домены фибронектина узнают эпитопы иные, чем антитело 225. Обнаружено, что некоторые из полученных гибридов фибронектин-антитело индуцируют образование кластеров EGFR, и отрицательная регуляция более эффективна, чем самого антитела 225.
В презентации Woisetschlager М. (устная презентация Woisetschlager М., Bispecific Antibody Summit 2011, September 27, 2011, Boston, USA; слайды №№5 и 15) описывается биспецифическое антитело на основе трастузумаба, имеющее целью HER2, трастузумаб-HER2-1, связывающееся с двумя различными эпитопами на HER2. Однако усиленной активности биспецифического антитела на основе трастузумаба по сравнению с немодифицированным трастузумабом не наблюдают.
Таким образом, несмотря на тот факт, что много усилий вложено в улучшение противопухолевых терапий, все еще требуется идентификация новых терапевтических соединений для улучшенного лечения рака, которые преодолевают вышеописанные недостатки.
К такой потребности обращены положения воплощений, охарактеризованные в формуле изобретения.
Соответственно, настоящее изобретение относится к связывающей молекуле, которая специфически связывается с двумя различными эпитопами антигена, экспрессированного на опухолевых клетках, при этом связывающая молекула включает (а) первый связывающий (поли)пептид, который специфически связывается с первым эпитопом указанного антигена, экспрессированного на опухолевых клетках, при этом указанный первый связывающий (поли)пептид представляет собой полипептид, образованный из Fyn SH3; и (b) второй связывающий (поли)пептид, который специфически связывается со вторым эпитопом указанного антигена, экспрессированного на опухолевых клетках.
Термин «связывающая молекула, которая специфически связывается с двумя различными эпитопами на антигене» относится к связывающей молекуле с двумя специфичностями связывания для одного антигена, экспрессированного на опухолевых клетках. Иными словами, связывающая молекула по настоящему изобретению способна специфически связываться с двумя различными сайтами связывания (т.е., эпитопами) в указанном одном антигене. Более того, биспецифическая связывающая молекула по настоящему изобретению способна связываться с указанными двумя различными эпитопами в одно и то же время.
Согласно настоящему изобретению считается, что молекула связывается специфически (что также в данном случае называется «взаимодействует специфически»), когда соответствующая молекула, по существу, не реагирует перекрестно с эпитопом подобной структуры. Перекрестную реактивность панели молекул при исследовании можно проверить, например, путем оценки связывания указанной панели молекул в обычных условиях с эпитопом, представляющим интерес, а также с рядом более или менее (структурно и/или функционально) близких родственных эпитопов. Только те молекулы, которые связываются с эпитопом, представляющим интерес, в его релевантном контексте (например, специфический мотив в структуре белка), но по существу не связываются с каким-либо другим эпитопом, считаются специфическими для эпитопа, представляющего интерес.Соответствующие способы описаны, например, в Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, 1988; или в Harlow and Lane, Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, 1999). Термин «молекула, которая по существу не реагирует перекрестно с эпитопом подобной структуры», используемый в данном описании, относится к молекуле, которая связывается с антигеном-мишенью с аффиностью, по меньшей мере, в 5 раз большей, чем с эпитопом подобной структуры, предпочтительнее, с аффиностью, по меньшей мере, в 10 раз большей, такой как, например, в 50 раз более высокая аффинность, предпочтительнее, с аффиностью, по меньшей мере, в 100 раз большей, такой как, например, в 500 раз более высокая аффинность. Даже предпочтительнее, она связывается с антигеном-мишенью с аффиностью, по меньшей мере, в 1000 раз большей, чем с эпитопом подобной структуры, такой как, например, по меньшей мере, в 10000 раз более высокая аффинность, и наиболее предпочтительно, по меньшей мере, в 100000 раз более высокая аффинность
Термин «антиген, эксперссированный на опухолевых клетках» относится к антигену, который или не экспрессируется на неопухолевых клетках, или экспрессируется на опухолевых клетках в большем количестве, чем на неопухолевых клетках. Предпочтительно антиген экспрессируется на опухолевых клетках в количестве, по меньшей мере, в два раза большем, чем на неопухолевых клетках, предпочтительнее, по меньшей мере, в пять раз большем количестве, таком как, например, по меньшей мере, в 10 раз большее количество, даже предпочтительнее, по меньшей мере, в 100 раз большее количество, такое как, например, по меньшей мере, в 1000 раз большее количество, и наиболее предпочтительно, по меньшей мере, в 10000 раз большее количество. Подходящие антигены-мишени включают любой такой антиген, который экспрессируется более интенсивно на опухолевых клетках, предпочтительно, антиген является одним из антигенов, определенных в данном описании ниже.
Термин «(поли)пептид», используемый в связи с настоящим изобретением, описывает линейные молекулярные цепи аминокислот, включая одноцепочечные белки или их фрагменты. Термин относится к группе молекул, которые включают группу пептидов, состоящую из аминокислот числом до 30, а также группу полипептидов (также называемых в данном описании белками), состоящих из более чем 30 аминокислот.
Кроме того, настоящим изобретением также охватываются пептидомиметики такого (поли)пептида, при этом аминокислотная(ые) и/или (поли)пептидная(ые) связь(и) заменена(ы) функциональными аналогами. Такие функциональные аналоги включают все известные аминокислоты иные, чем аминокислоты, кодируемые геном 20, такие как селеноцистеин. Термин «(поли)пептид» также относится к природным модифицированным (поли)пептидам, где модификация осуществлена, например, путем гликозилирования, ацетилирования, фосфорилирования, и подобные модификации, которые хорошо известны в технике.
Согласно настоящему изобретению, связывающая молекулы включает два связывающих (поли)пептида, определенных в (а) и (b).
Первый связывающий (поли)пептид специфически связывается с первым эпитопом на указанном антигене, экспрессированном на опухолевых клетках, и представляет собой полипептид, образованный из Fyn SH3. Следует иметь в виду, что в связывающей молекуле по изобретению могут присутствовать одна или несколько копий указанного первого связывающего (поли)пептида, например, две, три или четыре копии первого связывающего (поли)пептида.
Эпитоп может представлять собой конформационный или линейный эпитоп.В полипептидных антигенах конформационный (или прерывистый) эпитоп характеризуется присутствием двух или больше дискретных аминокислотных остатков, которые разделены в первичной последовательности, но располагаются близко друг к другу на поверхности молекулы, когда полипептид складывается в нативную трехмерную структуру, составляющую эпитоп (Sela (1969), Science, 166, 1365; и Laver (1990), Cell, 61, 553-6). Два или больше дискретных аминокислотных остатков, вносящих вклад в эпитоп, присутствуют в отдельных участках или даже в одной или нескольких (поли)пептидных цепях антигена. Напротив, линейный или непрерывный эпитоп состоит из двух или больше дискретных аминокислотных остатков, которые располагаются вблизи друг друга в одном линейном сегменте (поли)пептидной цепи.
Термин «полипептид, образованный из Fyn SH3», в данном случае используемый взаимозаменяемо с термином «финомер», относится к связывающему (поли)пептиду, образованному не от иммуноглобулина (например, так называемому каркасу, как описано выше), образованному из домена Fyn SH3 человека. Образованные из Fyn SH3 полипептиды хорошо известны в технике и описаны, например, в Grabulovski et al. (2007), JBC, 282, p. 3196-3204, или в WO 2008/022759, Bertschinger et al. (2007), Protein Eng. Des. Sel., 20(2): 57-68, Gebauer and Skerra (2009), Curr. Opinion in Chemical Biology, 13: 245-255).
Домен SH3 киназы Fyn (Fyn SH3) включает 63 остатка, а именно, аминокислоты 83-145 последовательности, описанной в Semba et al. (1986) (Proc. NatI. Acad. Sci. USA, 83(15): 5459-63), и Kawakami et al. (1986) (Mol. Cell Biol., 6(12): 4195-201), с последовательностью
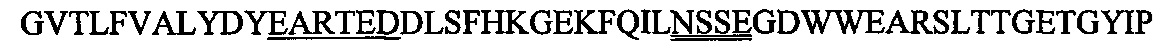

Как показано в технике (WO 2008/022759; Grabulovski et al. (2007), JBC, 282, p. 3196-3204), домен Fyn SH3 является особенно привлекательным каркасом для получения связывающих белков, т.н., финомеров. Это разумно, поскольку финомеры (i) могут быть экспрессированы в бактериях в растворимой форме в больших количествах, (ii) не образуют агрегатов при хранении в растворе, (iii) являются весьма устойчивыми (Тпл 70,5°С), (iv) не имеют цистеиновых остатков и (v) первоначально происходят от человека, отличаясь полностью консервативной аминокислотной последовательностью от мыши до человека, причем за счет этого снижаются нежелательные иммуногенные реакции.
В технике описано получение производных Fyn SH3 полипептида, подходящих для определенного антигена-мишени. Например, можно создать бибилиотеку различных Fyn SH3, в которых изменена последовательность, показанная выше в SEQ ID NO: 164. Предпочтительно изменение осуществляют (i) в последовательности, представляющей RT-петлю, или, необязательно, в позиции в пределах двух аминокислот, граничащих с указанной последовательностью (т.е., последовательностью DYEARTEDDL, показанной выше в SEQ ID NO: 164), или (ii) Scr-петле или, необязательно, в позиции в пределах двух аминокислот, граничащих с указанной последовательностью (т.е., последовательностью LNSSEG, показанной выше в SEQ ID NO: 164), или (iii) в обеих последовательностях одновременно. Предпочтительно изменение представляет собой замену, делецию или присоединение, описанные в технике (см., например, WO 2008/022759; Grabulovski et al. (2007), JBC, 282, p. 3196-3204). Средства и способы изменения аминокислотной последовательности хорошо известны в технике и описаны в технике, например, в Grabulovski et al. (2007), JBC, 282, p. 3196-3204. Затем такую библиотеку Fyn SH3 можно клонировать в фагмидный вектор, такой как, например, pHEN1 (Hoogenboom et al. "Multi-subunit proteins on the surface of filamentous phage: methodologies for displaying antibody (Fab) heavy and light chains", Nucleic Acids Res., 19(15): 4133-7, 1991), и затем библиотеку презентируют на фагах (фаговый дисплей) и подвергают пэннингу, предпочтительно, повторяющимся циклам пэннинга, например, по меньшей мере, двум, предпочтительнее, по меньшей мере, трем циклам пэннинга против соответствующего антигена. Затем можно выполнить скрининг на связывание (поли)пептидов установленными методами, такими как, например, моноклональный фаговый ELISA. Затем можно использовать секвенирование идентифицированных таким образом клонов для обнаружения обогащенных последовательностей. Идентифицированный таким образом связывающий (поли)пептид затем можно подвергнуть дополнительным стадиям созревания, например, путем генерации дополнительных библиотек на основе изменений идентифицированных последовательностей и повторенных стадий фагового дисплея и пэннинга. Наконец, можно проанализировать перекрестную реактивность и иммуногенность полученного образованного из Fyn SH3 полипептида, и можно выбрать образованный из Fyn SH3 полипептид, специфический для антигена-мишени.
Такие способы скринига фагового дисплея и оптимизации связывающих (поли)пептидов вообще известны в технике.
Второй связывающий (поли)пептид, определенный в (b), специфически связывается со вторым эпитопом указанного антигена, экспрессированного на опухолевых клетках. Соответственно, и как описано в данном описании выше, это означает, что тот же антиген связывается таким вторым связывающим (поли)пептидом, однако связывается другой эпитоп на указанном антигене. Термин «другой» эпитоп относится к эпитопу, который не перекрывается эпитопом, с которым специфически связывается первый связывающий (поли)пептид. Соответственно связывание одного связывающего (поли)пептида согласно изобретению не блокирует связывание второго связывающего (поли)пептида, причем таким образом создается возможность одновременного связывания обоих связывающих (поли)пептидов. Второй связывающий (поли)пептид может представлять собой любой (поли)пептид, способный специфически связываться с эпитопом-мишенью, такой как, например, антитело или любой из описанных выше связывающих реагентов неиммуноглобулинового происхождения или каркасы, предпочтительно, каркас, выбранный из группы, состоящей из аффител (на основе Z-домена стафилококкового белка А), доменов типа Kunitz, аднектинов (на основе 10-го домена фибронектина человека), антикалинов (образованных из липокалинов), DARPins (образованных из белков анкиринового повтора), авимеров (образованные из полимерного LDLR-A). Все такие каркасы хорошо известны в технике и описаны в ссылках, цитированных в данном описании выше.
Связывающие (поли)пептиды, заключенные в связывающей молекуле по изобретению, могут образовывать одну полипептидную цепь или могут присутствовать в связывающей молекуле по изобретению в виде нескольких полипептидных цепей, которые могут ковалентно или нековалентно связываться друг с другом. Когда связывающие (поли)пептиды образуют одну полипептидную цепь, они могут располагаться в любом порядке в пределах каждой молекулы, например, (а)-(b) или (b)-(а). Предпочтительнее связывающие (поли)пептиды (а) и (b) располагаются в изложенном порядке, например, в порядке (а)-(b) в направлении от N-конца к С-концу. Когда связывающие (поли)пептиды не образуют одну полипептидную цепь, они еще могут образовывать линейную цепь, в которой они связываются друг с другом. В таком случае они также могут располагаться в любом порядке в указанной линейной цепи, таком как, например, (а)-(b) или (b)-(а). Предпочтительнее связывающие (поли)пептиды (а) и (b) располагаются в изложенном порядке, например, в порядке (а)-(b). Связывающие (поли)пептиды могут располагаться к каждому другому в порядке голова-к-хвосту, т.е., один связывающий (поли)пептид (ковалентно или нековалентно) связывается своим N-концом с С-концом другого связывающего (поли)пептида, или может располагаться в порядке голова-к-голове или хвост-к-хвосту, т.е., один связывающий (поли)пептид связывается (ковалентно или нековалентно) своим N-концом с N-концом другого связывающего (поли)пептида, или своим С-концом с С-концом другого связывающего (поли)пептида. Следует иметь в виду, что связывающие (поли)пептиды также могут образовывать нелинейную компановку. Также следует иметь в виду, что существует требование ко всем связывающим молекулам, описанным в данном описании, что связывающая активность двух связывающих (поли)пептидов с их соответствующими эпитопами сохраняется или, по существу, сохраняется, как определено в данном описании ниже, после образования связывающих молекул, т.е., ковалентной или нековалентной ассоциации двух связывающих(поли)пептидов. Когда связывающая молекула образуется из нескольких (поли)пептидных цепей, предпочтительно, когда такие цепи ковалентно связываются друг с другом.
Связывающую молекулу по изобретению можно получить любым из способов получения (поли)пептидов, известных в технике. Например, как подробнее описано в данном описании ниже, одна или несколько молекул нуклеиновой кислоты, кодирующих связывающую молекулу по настоящему изобретению, могут быть экспрессированы в подходящем хозяине, и затем полученную таким образом связывающую молекулу можно выделить. Альтернативным способом получения связывающей молекулы по изобретению является трансляция мРНК in vitro. Подходящие бесклеточные экспрессирующие системы для применения согласно настоящему изобретению включают лизат кроличьих ретикулоцитов, экстракт зерна пшеницы, микросомные мембраны поджелудочной железы собаки, экстракт S30 Е. coli и спаренные системы транскрипция/трасляция, такие как TNT-система (Promega). Такие системы создают возможность эксперссии рекомбинантных (поли)пептидов после добавления клонирующих векторов, фрагментов ДНК или последовательностей РНК, содержащих кодирующие участки и соответствующие промоторные элементы.
Кроме получения рекомбинанта, связывающую молекулу по изобретению можно получить синтетически, например, прямым пептидным синтезом с использованием твердофазных методов (сравни Stewart et al. (1969), Solid Phase Peptide Synthesis; Freeman Co, San Francisco; Merrifield, J. Am. Chem. Soc, 85 (1963), 2149-2154). Синтез синтетических белков можно выполнить с использованием ручных методов или автоматически. Автоматизированный синтез можно осуществить, например, с использованием пептидного синтезатора Applied Biosystems 431A (Perkin Elmer, Foster City CA) согласно инструкциям, предоставленным изготовителем. Различные фрагменты можно химически синтезировать по отдельности и объединить с использованием химических способов получения полноразмерных молекул. Как указано выше, можно использовать химический синтез, такой как твердофазная процедура, описанная в Houghton, Proc. Natl. Acad. Sci. USA (82), (1985), 5131-5135. Кроме того, связывающую молекулу по изобретению можно получить полусинтетически, например, путем комбинирования получения рекомбинантным и синтетическим методом.
Согласно настоящему изобретению, неожиданно обнаружилось, что связывающая молекула, включающая полипептид, образованный из Fyn SH3, и второй связывающий (поли)пептид со специфичностью связывания с тем же антигеном, но другим эпитопом указанного антигена, показывает в результате щревосходную антипролиферативную активность в отношении опухолевых клеток. Такая активность выше, чем активность моноспецифического полипептида, образованного из Fyn SH3 (в двухвалентном формате как гибрид Fc), или одного второго связывающего (поли)пептида, и самое неожиданное, также значительно выше, чем антипролиферативное действие обоих соединений, взятых в комбинации. Соответственно, получение связывающей молекулы по настоящему изобретению приводит к улучшенному действию по сравнению с двумя отдельными связывающими (поли)пептидами.
Соответственно, настоящее изобретение относится к связывающей молекуле, при этом связывание указанной связывающей молекулы с опухолевыми клетками, экспрессирующими соответствующий антиген-мишень на своей поверхности, приводит к улучшенному ингибированию опухолевой активности, которое выше, чем ингибирование опухолевой активности, полученное путем комбинированного связывания двух моноспецифических связывающих белков, при этом первый моноспецифический связывающий белок включает или состоит из полипептида, образованного из Fyn SH3 (а), и второй моноспецифический связывающий белок включает или состоит из связывающего (поли)пептида (b). Предпочтительно улучшенное ингибирование опухолевой активности является синергическим, т.е., больше, чем аддитивный эффект по сравнению с ингибированием опухолевой активности, полученным путем комбинированного связывания двух моноспецифических связывающих белков.
В предпочтительном воплощении связывающей молекулы по изобретению антиген, экспрессированный на опухолевых клетках, выбирают из группы, состоящей из HER2, других членов семейства EGFR, включая HER1, HER3 и HER4, других семейств тирозинкиназных рецепторов, включая ALK, AXL, DDR, ЕРН, FGFR, ЕРН, FGFR, INSR, MET, MUSK, PDGFR, РТК7, RET, ROR, ROS, RYK, TIE, TRK, VEGFR, семейства AATYK, EpCAM, CD20, CD33, CD52 и CD30.
HER2 определяется согласно области техники, к которой относится данное изобретение, и относится к рецептору типа 2 эпидермального фактора роста человека (также называемому HER2/neu или ErbB-2, см. выше), рецептору в 185 кД, впервые описанному в 1984 (Schlechter et al. (1984), Nature, 312: 513-516). Человеческий HER2 (SEQ ID NO: 171) представлен ссылкой NCBI NP_004439 (дата публикации 26 февр. 2012) и описан в технике, например, в Robinson et al. (2000), Oncogene, 19: 5548-5557, а также в ссылках, цитированных в данном описании выше. Другие мишени семейств тирозинкиназных рецепторов (EGFR, ALK, AXL, DDR, ЕРН, FGFR, ЕРН, FGFR, INSR, MET, MUSK, PDGFR, PTK7, RET, ROR, ROS, RYK, TIE, TRK, VEGFR, AATYK) хорошо известны в технике и описаны, в том числе, в ссылках в Robinson et al. (2000), Oncogene, 19: 5548-5557.
EpCAM определяется согласно области техники, к которой относится данное изобретение, и относится к фактору адгезии эпителиальных клеток, который представляет собой панэпителиальный дифференцировочньш антиген, который экспрессируется почти на всех карциномах. Человеческий ЕрСАМ представлен UniProtKB/Swiss-Prot, инвентарный номер Р16422.2 (дата публикации 22 февр. 2012) и описан в технике, например, в Strnad et al. (1989), Cancer Res., 49(2): 314-317.
CD20 определяется согласно области техники, к которой относится данное изобретение, и относится к антигену В-лимфоцитов CD20. Человеческий CD20 представлен ссылочной последовательностью NCBI NP_690605.1 (дата публикации 8 янв. 2012) и описан в технике, например, в Dawidowicz et al. (2011), Clin. Exp. Rheumatol., 29(5): 839-842.
CD33 определяется согласно области техники, к которой относится данное изобретение, и относится к антигену CD33. Человеческий CD33 представлен ссылочной последовательностью NCBI NP_001763.3 (дата публикации 18 дек. 2011) и описан в технике, например, в Raponi et al. (2011), Leuk. Lymphoma, 52(6): 1098-1107.
CD52 определяется согласно области техники, к которой относится данное изобретение, и относится к антигену CD52 (антиген САМРАТН-1). Человеческий CD52 представлен GenBank, инвентарный номер ЕАХ07822.1 (дата публикации 4 февр. 2010) и описан в технике, например, в Venter et al. (2001), Science, 291(5507): 1304-1351.
CD30 определяется согласно области техники, к которой относится данное изобретение, и относится к антигену CD30. Человеческий CD30 представлен GenBank, инвентарный номер ААА51947.1 (дата публикации 1 ноя. 1994) и описан в технике, например, в Durkop, Н et al. (1992), Cell, 68(3): 421-427.
В предпочтительном воплощении биспецифической связывающей молекулы по изобретению антигеном является HER2.
В другом предпочтительном воплощении биспецифической связывающей молекулы по изобретению второй связывающий (поли)пептид представляет собой антитело.
Антитело может представлять собой моноклональное или поликлональное антитело любого класса антител. Термин «антитело» также включает фрагменты антитела или его производные, которые еще сохраняют специфичность связывания полноразмерного или немодифицированного антитела. Антитело по изобретению также включает такие воплощения, как синтетические, химерные, одноцепочечные и гуманизированные антитела.
Термин «фрагмент антитела» относится к фрагментам, таким как (i) Fab-фрагмент, (ii) F(ab')2-фрагмент, (iii) Fd-фрагмент (состоящий из доменов VHC и CH1), (iv) Fv-фрагмент и (v) изолированный участок, определяющий комплементарность (CDR), имеющий достаточный каркас для специфического связывания, например, антигенсвязывющую часть вариабельного участка. Термин «производное антитела» в контексте изобретения определяет химически модифицированные антитела и фрагменты антител. Определение включает svFv-фрагменты, одно доменные антитела и т.д.. Соответственно, производные антител обычно представляют собой (поли)пептиды, образованные из молекул антител, и/или (поли)пептиды, которые модифицированы химическими/биохимическими методами или методами молекулярной биологии. Минимальным требованием для специфического взаимодействия фрагмента антитела со специфическим эпитопом является присутствие одного или нескольких CDR из вариабельной тяжелой цепи (VH) и/или вариабельной легкой цепи (VL) исходного антитела в контексте, который допускает подбор фрагмента и эпитопа. Такой контекст может быть обеспечен использованием подходящего каркаса антитела. Как известно в технике, термин «каркас» применительно к антителу или фрагменту антитела определяет аминокислотную последовательность, которая функционирует как спейсер между CDR, а также наращивает их N-концы и С-концы и обеспечивает структуру, которая допускает образование CDR антигенсвязывающего сайта. Модификация каркаса или последовательностей CDR, например, для улучшения аффинности связывания, методами молекулярной биологии может включать модификацию (поли)пептидов с использованием обычных методов, известных в технике, например, с использованием аминокислотной(ых) делеции(й), вставки(вставок), замены(замен), добавления(й), и/или рекомбинации(й) и/или другой(их) модификации(й) (например, посттрансляционных и химических модификаций, таких как гликозилирование или фосфорилирование), известных в технике, одних или в комбинации. Способы введения таких модификаций в последовательность ДНК, лежащую в основе аминокислотной последовательности цепи иммуноглобулина, хорошо известны специалистам в данной области техники, см., например, Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, 2nd edition 1989 and 3rd edition 2001; Gerhardt et al., Methods for General and Molecular Bacteriology, ASM Press, 1994; Lefkovits, Immunology Methods Manual: The Comprehensive Sourcebook of Techniques, Academic Press, 1997; или Golemis, Protein-Protein Interactions: A Molecular Cloning Manual, Cold Spring Harbor Laboratory Press, 2002.
Антитело, согласно изобретению, способно специфически связываться/взаимодействовать с эпитопом. Эпитоп может представлять собой полипетидную структуру, а также соединения, которые не включают аминокислоты, такие как, например, полисахариды. Термин «специфически связываться/взаимодействовать с» определен в данном описании выше.
Предпочтительно антитело представляет собой моноклональное антитело. Даже предпочтительнее, (моноклональное) антитело представляет собой антитело класса IgG, IgA, IgE, IgD или IgM (а также их подтипов (например, IgG1, IgG2, IgG3 и IgG4)).
Следует иметь в виду, что образованный из Fyn SH3 полипептид, представляющий собой первый связывающий (поли)пептид, может быть соединен с антителом в любой возможной позиции до тех пор, пока связывающие способности двух связывающих (поли)пептидов сохраняются или по существу сохраняются, как определено в данном описании ниже. Например, образованный из Fyn SH3 полипептид, представляющий собой первый связывающий (поли)пептид, может быть соединен с антителом по N- или С-концу или тяжелой цепи или легкой цепи, когда используется полное антитело. Предпочтительно образованный из Fyn SH3 полипептид соединяется с N-концом легкой цепи антитела.
В другом предпочтительном воплощении связывающей молекулы по настоящему изобретению первый и второй связывающие (поли)пептиды соединяются линкером
Термин «линкер», используемый согласно настоящему изобретению, относится к последовательным аминокислотам (т.е., пептидным линкерам), а также к непептидным линкерам, которые разделяют связывающие (поли)пептиды связывающей молекулы по изобретению. Также будет очевидно, что когда связывающая молекула по настоящему изобретению представляет собой одну полипептидную цепь, линкер представляет собой пептидный линкер.
Характер, т.е. длина и/или строение (как, например, аминокислотная последовательность) линкера могут модифицировать или улучшить устойчивость и/или растворимость молекулы, могут улучшить гибкость полученной связывающей молекулы и/или могут улучшить связывание с антигеном-мишенью за счет уменьшения пространственных затруднений. Длина и строение линкера зависят от строения соответствующих связывающих (поли)пептидов связывающей молекулы по изобретению. Специалисту хорошо известны способы испытания на пригодность различных линкеров. Например, можно легко проверить свойства связывающей молекулы, анализируя ее на аффинность связывания с использованием различных типов линкеров. Кроме того, можно выполнить соответствующие измерения для каждого одного связывающего (поли)пептида и сравнить с аффинностью связывания связывающей молекулы. Устойчивость полученной молекулы можно измерить методами, известными в технике, такими как, например, использование метода ELISA для определения остаточной связывающей способности молекулы после инкубации в человеческой сыворотке при 37°С в течение некоторых периодов времени.
Пептидные линкеры, предусмотренные настоящим изобретением, представляют собой (поли)пептидные линкеры, состоящие из аминокислот.Предпочтительно линкер имеет от 1 до 100 аминокислот в длину. Предпочтительнее линкер имеет от 5 до 50 аминокислот в длину, и даже предпочтительнее, линкер имеет от 10 до 20 аминокислот в длину. Наиболее предпочтительно, линкер имеет 15 аминокислот в длину. В предпочтительном воплощении линкер представляет собой гибкий линкер с, например, аминокислотами аланином и серином или глицином и серином. Предпочтительно линкерные последовательности представляют собой (Gly4Ser)1, (Gly4Ser)2 или (Gly4Ser)3. Наиболее предпочтительно, линкер представляет собой (Gly4Ser)3.
Термин «непептидный линкер», используемый в соответствии с настоящим изобретением, относится к группам-связкам с двумя или больше реакционноспособными группами, но исключая пептидные линкеры, определенные выше. Например, непептидный линкер может представлять собой полимер, такой как, например, полиэтиленгликоль, имеющий реакционноспособные группы на обоих концах, которые по отдельности связываются с реакционноспособными группами связывающих частей молекулы по изобретению, например, аминоконцом, лизиновым остатком, гистидиновым остатком или цистеиновым остатком. Реакционноспособные группы полимера включают гидроксильную группу, альдегидную группу, пропиональдегидную группу, бутилальдегидную группу, малеимидную группу, кетоновую группу, винилсульфоновую группу, тиольную группу, гидразидную группу, карбонилдиимидазольную (CDI) группу, нитрофенилкарбонатную (NPC) группу, тризилатную группу, изоцианатную группу и сукцинимидные производные. Примеры сукцинимидных производных включают сукцштамидилпропионат (SPA), сукцинимидилбутановую кислоту (SBA), сукцинимидилкарбоксиметилат (SCM), сукцинимидилсукцинамид (SSA), сукцинимидилсукцинат (SS), сукцинимидилкарбонат и N-гидроксисукцинимид (NHS). Реакционноспособные группы на обоих концах непептидного полимера могут быть одинаковыми или различными. Например, непептидньгй полимер может содержать малеимидную группу на одном конце и альдегидную группу на другом конце. Предпочтительно полимер представляет собой полиэтиленгликоль.
Наиболее предпочтительно линкер представляет собой пептидный линкер.
В другом предпочтительном воплощении связывающая молекула по изобретению также включает, по меньшей мере, один дополнительный (поли)пептид.
Неограничительными примерами таких дополнительных (поли)пептидов являются фармацевтически и/или диагностически активные компоненты, в том числе метки или функциональные (поли)пептиды, подходящие для улучшения характеристик связывающей молекулы по изобретению.
Фармацевтически и/или диагностически активные компоненты можно, например, выбрать из цитокинов, токсичных соединений, хемокинов, ферментов, флуоресцентных красителей и фотосенсибилизаторов, фактора предшественника коагулянта, предпочтительно, тканевого фактора, радионуклеидов или компонентов, которые модулируют время полужизни в сыворотке связывающей молекулы по изобретению.
Неограничительные примеры цитокинов включают, например, IL-2, IL-12, TNF-альфа, IFN-альфа, IFN-бета, IFN-гамма, IL-10, IL-15, IL-24, GM-CSF, IL-3, IL-4, IL-5, IL-6, IL-7, IL-9, IL-11, IL-13, LIF, CD80, В70, TNF-бета, LT-бета, лиганд CD-40, лиганд Fas, TGF-бета, IL-альфа и IL-1-бета.
Примеры токсичных соединений включают, без ограничения, калихеамицин, мейтансиноид, неокарзиностатин, эсперамицин, динемицин, кедарцидин, мадуропептин, дезоксорубицин, даунорубицин, ауристатин, цепь рицин-А, модекцин, усеченный экзотоксин A Pseudomonas, дифтерийный токсин и рекомбинантный гелонин.
Неограничительные примеры хемокинов включают IL-8, GRO альфа, GRO бета, GRO гамма, ENA-78, LDGF-PBP, GCP-2, PF4, Mig, IP-10, SDF-1 альфа/бета, BUNZO/STRC33, I-TAC, BLC/BCA-1, MIP-1 альфа, MIP-1 бета, MDC, ТЕСК, TARC, RANTES, НСС-1, НСС-4, DC-CK1, MIP-3 альфа, MIP-3 бета, МСР-1-5, эотаксин, эотаксин-2,1-309, MPIF-1,6Ckine, СТАСК, МЕС, лимфотактин и фракталкин.
Флуоресцентные красители включают, например, красители Alexa Fluor или Cy, и фотосенсибилизаторы включают, например, фототоксичный красный белок флуоресценции KillerRed или гематопорфирин.
Неограничительные примеры ферментов включают ферменты для активации пролекарств, предпочтительно, ферменты, выбранные из группы, состоящей из карбоксипептидаз, глюкуронидаз и глюкозидаз.
Радионуклеиды можно выбрать, например, из группы гамма-испускающих изотопов, предпочтительно18F,64Cu,68Ga,86Y,124I; из группы бета-излучателей, предпочтительно,131I,90Y,177Lu,67Cu; или из группы альфа-излучателей, предпочтительно,213Bi,211At.
Примеры компонентов, которые модулируют время полужизни в сыворотке, включают, без ограничения, полиэтиленгликоль (ПЭГ), Fc-домены антител, альбуминсвязывающие белки и конформационно расстроенные полипептидные последовательности.
Неограничительные примеры меток включают Strep-метки, His-метки, Myc-метки, ТАР-метки или Flag-метки. Дополнительные функциональные (поли)пептиды представляют собой, например, пептиды секреции, такие как лидер секреции каппа, или пептиды, обеспечивающие сайты N-гликозилирования.
Как отмечалось выше, некоторые из дополнительных (поли)пептидов могут иметь дополнительную фармацевтическую или диагностическую активность или могут усиливать устойчивость связывающей молекулы по изобретению, улучшая посредством этого ее активность ингибирования роста опухоли, в то время как другие дополнительные (поли)пептиды могут взамен облегчить получение и/или очистку связывающей молекулы.
Способы добавления определенных выше дополнительных (поли)пептидов к связывающей молекуле по изобретению хорошо известны специалистам в данной области техники и описаны, например, в Sambrook, 2001, цит. выше. Следует иметь в виду, что дополнительные (поли)пептиды могут быть связаны нековалентно со связывающей молекулой по изобретению или могут быть связаны ковалентно, например, они могут образовывать слитый белок со связывающей молекулой, например, они могут образовывать одну полипептидную цепь. Такой слитый белок может быть, например, кодирован одной молекулой нуклеиновой кислоты.
Настоящим изобретением также охватываются мультимеры, такие как, например, димеры, тримеры, тетрамеры и т.д., образованные связывающей молекулой по изобретению, необязательно включающей дополнительные (поли)пептиды, определенные выше. Такие мультимеры могут образовываться путем ковалентной или нековалентной ассоциации, предпочтительно, путем ковалентной ассоциации. Предпочтительно мультимеры образуются через линкеры, определенные в данном описании выше, предпочтительно, определенные выше пептидные линкеры. Предпочтительнее линкер представляет собой (Gly4Ser)1, (Gly4Ser)2 или (Gly4Ser)3. Наиболее предпочтительно, линкер представляет собой (Gly4Ser)3.
В другом предпочтительном воплощении связывающей молекулы по изобретению первый связывающий (поли)пептид включает или состоит из (i) аминокислотной последовательности, выбранной из SEQ ID NO: 1-152, или (ii) аминокислотной последовательности, имеющей, по меньшей мере, 65% идентичность с аминокислотной последовательностью SEQ ID NO: 1.
В тех воплощениях, где связывающий (поли)пептид включает (а не состоит из) указанные аминокислотные последовательности, дополнительные аминокислоты надстраивают специфическую последовательность или по N-концу или по С-концу или по обоим концам. Предпочтительно по N-концу присутствуют не более 50 дополнительных аминокислот, и не более 50 дополнительных аминокислот присутствуют по С-концу. Предпочтительнее не более 40, например, не более 30, предпочтительнее, не более 20, например, не более 10, не более 9, не более 8, не более 7, не более 6, не более 5, не более 4, не более 3, не более 2 и, даже предпочтительнее, не более 1 дополнительной аминокислоты независимо присутствует по любому одному N- или С-концу или по обоим концам. Следует иметь в виду, что существует предварительное требование, что связывающая способность связывающей молекулы в отношении двух различных эпитопов антигена-мишени в присутствии таких дополнительных аминокислот сохраняется или по существу сохраняется, как определено в данном описании ниже. Дополнительные последовательности могут включать, например, последовательности, введенные, например, для очистки. Предпочтительно первый связывающий (поли)пептид состоит из аминокислотной последовательности, упомянутой в (i) или (ii). Предпочтительнее первый связывающий (поли)пептид состоит из аминокислотной последовательности SEQ ID NO: 1.
Согласно настоящему изобретению термин «% идентичности последовательностей» описывает число совпадений («попаданий») аминокислот/нуклеотидов в двух или большем количестве выровненных аминокислотных или нуклеотидных последовательностей по сравнению с числом аминокислотных остатков или нуклеотидов, составляющих общую длину аминокислотных последовательностей или нуклеиновой кислоты (или части по сравнению с целым). Иными словами, с использованием выравнивания двух или больше последовательностей или субпоследовательностей можно определить процент аминокислотных остатков или нуклеотидов, которые являются одинаковыми (например, 65% или 80% идентичность), когда (суб)последовательности сравнивают и выравнивают для максимального соответствия в окне сравнения или в определенном участке при измерении с использованием алгоритма сравнения последовательностей, известного в технике, или когда выравнивают вручную и проверяют визуально. Предпочтительными (поли)пептидами согласно изобретению являются (поли)пептиды, в которых описанная идентичность существует в участке, который составляет, по меньшей мере, примерно 15-25 аминокислот в длину, предпочтительнее, в участке, который составляет, по меньшей мере, примерно 30-50 аминокислот в длину. Более предпочтительными (поли)пептидами согласно настоящему изобретению являются (поли)пептиды, в которых описанная идентичность существует по всей длине (поли)пептидов, конкретно упомянутых в данном описании. Специалистам в данной области техники будет известно, как определить процент идентичности между/среди последовательностей с использованием, например, алгоритмов, таких как основанные на алгоритме NCBI BLAST (Stephen F. Altschul, Thomas L. Madden, Alejandro A. Schäffer, Jinghui Zhang, Zheng Zhang, Webb Miller, и David J. Lipman (1997), "Gapped BLAST and PSI-BLAST: a new generation of protein database search programs", Nucleic Acids Res. 25: 3389-3402), компьютерной программе CLUSTALW (Thompson, Nucl. Acids Res., 2 (1994), 4673-4680) или FASTA (Pearson and Lipman, Proc. Natl. Acad. Sci, 1988, 85; 2444).
Согласно данному изобретению предпочтительно используют алгоритм NCBI BLAST. Для аминокислотных последовательностей программа BLASTP использует длину слова по умолчанию (W) 3 и ожидание (Е) 10. Программа BLASTN для нуклеотидных последовательностей использует длину слова по умолчанию (W) 11, ожидание (Е) 10, М=5, N=4, и сравнение обеих цепей. Оценочная матрица BLOSUM62 (Henikoff, Proc. Natl. Acad. Sci., 1989, 89: 10915) использует выравнивания (В) 50, ожидание (Е) 10, М=5, N=4, и сравнение обеих цепей. Соответственно все (поли)пептиды, имеющие идентичность последовательностей, по меньшей мере, 80% при определении с помощью программы NCBI BLAST попадают в объем изобретения.
Согласно такому воплощению настоящего изобретения также охватываются последовательности с, по меньшей мере, 65% идентичностью, такой как, по меньшей мере, 70%, по меньшей мере, 80%, по меньшей мере, 85% и, по меньшей мере, 90% идентичность последовательностей. Даже предпочтительнее идентичность составляет, по меньшей мере, 95%, например, по меньшей мере, 98%, по меньшей мере, 99% и, наиболее предпочтительно, по меньшей мере, 99,5%.
Аминокислотная последовательность с, по меньшей мере, 65% идентичностью последовательностей с аминокислотной последовательностью SEQ ID NO: 1, предпочтительно имеет следующую формулу I:
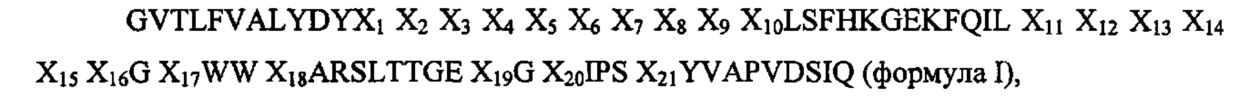
при этом X1 - Х7 и Х11 - Х13 и Х17 - Х21 выбирают, каждый независимо, из G, V, Т, L, F, A, Y, D, S, Н, K, Е, Q, I, W, R, М, Р, N и С; предпочтительнее, из G, V, Т, L, F, A, Y, D, S, Н, K, Е, Q, I, W, R, М, Р и N; и
при этом X8 - Х10 и Х11 - X16 выбирают, каждый независимо, из G, V, Т, L, F, A, Y, D, S, Н, K, Е, Q, I, W, R, М, Р, N и С; предпочтительнее, из G, V, Т, L, F, A, Y, D, S, Н, K, E, Q, I, W, R, M, P и N;
или при этом один или больше из X8 - Х10 и Х11 - X16 отсутствуют.
Предпочтительнее
X1 выбирают из Т, Е, D, Q, Y, V, W, N, S, F или K;
Х2 выбирают из S, A, R или Т;
Х3 выбирают из Y, R, Н, Т, N, V, W или S;
Х4 выбирают из N, D, М, Y, R, Р, Е, L, Н, Т, G или F;
Х5 выбирают из Т, S, Р, Q, R, K, G, Q, A, D, М, N, L, F, Y или Е;
Х6 выбирают из R, М, K, D, F, Т, G, Н, S, Р, N, Q, Y, L, А или Р;
Х7 выбирают из D, G, V, L, Н, N, R, F, S или А;
X8 выбирают из G, S, Е, D, Р, Y или отсутствует;
Х9 выбирают из Q, D, S, Н или отсутствует;
Х10 выбирают из D, V или отсутствует;
Х11 выбирают из R, K, Q, N, S, G, W, М, Н, L, F, Е, Т, Р, A, D или V;
Х12 выбирают из М, R, Е, G, N, D, S, A, Q, F, Р, K, Y, Т, Н, V, L или W;
Х13 выбирают из Е, W, Р, R, K, S, V, N, D, Н, G, Т, Q, A, Y, L или М;
Х14 выбирают из D, R, Q, S, A, N, Р, I, Н, Т, Y, Е, L, K, М, V, I, W или отсутствует;
Х15 выбирают из G, S, I, L, А, V, Т, Е, D, Q, R, Р, K, М, Н, Y или отсутствует;
X16 выбирают из K, G, R, А, Т, V, S, I, Е, Q, Р, D, N, Н или отсутствует;
Х17 выбирают из V, D, Т, I или Y;
X18 выбирают из Е, A, R, Т или Q;
Х19 выбирают из Т, I или V;
Х20 выбирают из Y, L или F;
Х21 выбирают из N or S.
В предпочтительном воплощении остатки X в формуле I выбирают независимо из X1 - Х10, представляющих собой TSYNTRD (т.е., при этом X8 - Х10 отсутствуют); Х11 - X16, представляющих собой RMED (т.е., при этом Х14 - X16 отсутствуют); Х17, представляющего собой V; X18, представляющего собой Е; Х19, представляющего собой Т; Х20, представляющего собой Y, и/или Х21, представляющего собой N.
Предпочтительно связывающий (поли)пептид, включающий или состоящий из аминокислотной последовательности имеющей, по меньшей мере, 65% идентичность последовательностей с аминокислотной последовательностью SEQ ID NO: 1, сохраняет или по существу сохраняет связывающую способность связывающего (поли)пептида, состоящего из SEQ ID NO: 1, т.е., прочность связывания в отношении соответствующего эпитопа-мишени сохраняется или по существу сохраняется.
Образованный из Fyn SH3 полипептид С12 (SEQ ID NO: 1) имеет константу диссоциации для своего специфического эпитопа на HER2 7×10-8 М при определении методом поверхностного плазмонного резонанса (SPR). Для этого образованный из Fyn SH3 полипептид захватывается, например, специфическими антителами с меткой His, которые иммобилизованы на сенсорном чипе BIAcore. После введения антигена, содержащего специфический эпитоп, контролируют образование комплекса, и получают константы кинетической ассоциации (kon) и кинетической диссоциации (koff) или константы диссоциации (KD) путем построения кривых с использованием оценочной программы BIAcore. Соответственно, связывающая способность связывающего (поли)пептида, включающего или состоящего из аминокислотной последовательности имеющей, по меньшей мере, 65% идентичность последовательностей с аминокислотной последовательностью SEQ ID NO: 1, по существу сохраняется, если, предпочтительно, в одних и тех же условиях, сохраняется константа диссоциации для связывания HER2, по меньшей мере, 1×10-4 М, такая как, например, по меньшей мере, 1×10-5 М, предпочтительнее, по меньшей мере, 1×10-6 М, и наиболее предпочтительно, по меньшей мере, 1×10-7 М. Также изобретению соответствуют связывающие (поли)пептиды, имеющие константу диссоциации, по меньшей мере, 1×10-8 М, такую как, например, по меньшей мере, 1×10-9 М, предпочтительнее, по меньшей мере, 1×10-10 М, такую как, например, по меньшей мере, 1×10-11 М, даже предпочтительнее, по меньшей мере, 1×10-12 М, и наиболее предпочтительно, по меньшей мере, 1×10-13 М. Способы оценки связывающей способности хорошо известны в технике и включают, без ограничения, методы поверхностного плазмонного резонанса (SPR) или ELISA.
Как показано в прилагаемых примерах, связывающие молекулы, включающие образованный из Fyn SH3 полипептид С12 (SEQ ID NO: 1), и вторую специфичность связывания, специфически связываются с опухолевым антигеном HER2 и дают улучшенное ингибирующее действие со вторым связывающим (поли)пептидом. Соответственно, предпочтительно, что связывающая молекула по изобретению включает образованный из Fyn SH3 полипептид, включающий или состоящий из SEQ ID NO: 1.
Как это следует из примера 14, приведенного в данном описании ниже, образованный из Fyn SH3 полипептид С12 (SEQ ID NO: 1) связывается с эпитопом HER2, который располагается в пределах домена IHER2 (SEQ ID NO: 172). Вовлеченные остатки бежа HER2 определяют с использованием сканирования аланином, и находят, что аминокислотные позиции Т166, R188, Р197, S202 и R203 домена I HER2 вовлечены в связывание между образованным из Fyn SH3 полипептидом С12 и HER2.
В результате в другом предпочтительном воплощении связывающей молекулы по изобретению первый связывающий (поли)пептид включает или состоит из аминокислотной последовательности, которая связывается с эпитопом в пределах домена I HER2 (SEQ ID NO: 172), включающего его аминокислотные позиции Т166, R188, Р197, S202 и R203.
В другом предпочтительном воплощении связывающей молекулы по изобретению второй связывающий (поли)пептид представляет собой антитело, при этом (i) тяжелая цепь антитела включает или состоит из аминокислотной последовательности SEQ ID NO: 154, и легкая цепь антитела включает или состоит из аминокислотной последовательности SEQ ID NO: 155; (ii) тяжелая цепь антитела включает или состоит из аминокислотной последовательности SEQ ID NO: 160, и легкая цепь антитела включает или состоит из аминокислотной последовательности SEQ ID NO: 163; (iii) тяжелая цепь антитела включает или состоит из аминокислотной последовательности, имеющей, по меньшей мере, 65% идентичность последовательности с аминокислотной последовательностью SEQ ID NO: 154, и легкая цепь антитела включает или состоит из аминокислотной последовательности, имеющей, по меньшей мере, 65% идентичность последовательности с аминокислотной последовательностью SEQ ID NO: 155; или (iv) тяжелая цепь антитела включает или состоит из аминокислотной последовательности, имеющей, по меньшей мере, 65% идентичность последовательности с аминокислотной последовательностью SEQ ID NO: 160, и легкая цепь антитела включает или состоит из аминокислотной последовательности, имеющей, по меньшей мере, 65% идентичность последовательности с аминокислотной последовательностью SEQ ID NO: 163.
Примеры молекул нуклеиновой кислоты, кодирующих тяжелые и легкие цепи SEQ ID NO: 154, 155, 160 и 163, показаны в SEQ ID NO: 165, 166, 168 и 169, соответственно.
Согласно такому воплощению настоящего изобретения, в (iii) и (iv) также охватываются последовательности, имеющие, по меньшей мере, 65% идентичность последовательности, такую как, по меньшей мере, 70%, по меньшей мере, 80%, по меньшей мере, 85% и, по меньшей мере, 90% идентичность последовательности с упомянутыми аминокислотными последовательностями. Даже предпочтительнее, идентичность составляет, по меньшей мере, 95%, как, например, по меньшей мере, 98%, по меньшей мере, 90% и, наиболее предпочтительно, по меньшей мере, 99,5% с упомянутыми аминокислотными последовательностями.
Предпочтительнее антитело, определенное в (iii) или (iv), представляет собой антитело, в котором изменение в идентичности последовательностей происходит только в вариабельном домене антител, так что константный участок вариантных антител идентичен константному участку антитела, определенного в (i) и (ii), соответственно. Вариабельные домены анти-HER2 антитела 1, используемые в данном случае, располагаются в аминокислотах 1-119 SEQ ID NO: 154 и в аминокислотах 1-107 SEQ ID NO: 155, в то время как вариабельные домены анти-HER2 антитела 2, используемые в данном случае, располагаются в аминокислотах 1-120 SEQ ID NO: 160 и в аминокислотах 1-107 SEQ ID NO: 163. Даже предпочтительнее, изменение в идентичности последовательностей происходит только в доменах CDR антител, так что остальные (не-CDR) участки вариантных антител идентичны остальным (не-CDR) участкам антитела, определенного в (i) и (ii), соответственно. Домены CDR анти-HER2 антитела 1, используемые в данном случае, располагаются в аминокислотах 31-35 (CDR1), 50-66 (CDR2) и 99-108 (CDR3) SEQ ID NO: 154 и аминокислотах 24-34 (CDR1), 50-56 (CDR2) и 89-107 (CDR3) SEQ ID NO: 155, в то время как домены CDR анти-HER2 антитела 2, используемые в данном случае, располагаются в аминокислотах 31-35 (CDR1), 50-66 (CDR2) и 99-108 (CDR3) SEQ ID NO: 160 и аминокислотах 24-34 (CDR1), 50-56 (CDR2) и 89-107 (CDR3) SEQ ID NO: 163.
Все определения, приведенные выше в отношении первого связывающего (поли)пептида, например, в отношении термина «включающий», и предпочтительные величины идентичности последовательностей и способы их определения, применяют mutatis mutandis также к указанному второму связывающему (поли)пептиду связывающей молекулы по изобретению.
Кроме того, второй связывающий (поли)пептид, определенный в (ii), предпочтительно сохраняет или по существу сохраняет связывающую способность связывающего (поли)пептида, определенного в (i), и второй связывающий (поли)пептид, определенный в (iv), предпочтительно сохраняет или по существу сохраняет связывающую способность связывающего (поли)пептида, определенного в (ii). Как определено в данном описании выше, связывающая способность связывающего (поли)пептида (iii) или (iv) по существу сохраняется, если сохраняется, по меньшей мере, 60% его связывающей способности. Предпочтительно сохраняется, по меньшей мере, 75% или больше, или предпочтительнее, по меньшей мере, 80% его связывающей способности. Более предпочтительно, когда сохраняется, по меньшей мере, 90%, например, по меньшей мере, 95%, даже предпочтительнее, по меньшей мере, 98%, например, по меньшей мере, 99% связывающей способности связывающего (поли)пептида, определенного в (i) или (ii), соответственно. Наиболее предпочтительно, когда связывающая способность сохраняется полностью, т.е., до 100%. Также соответствуют изобретению связывающие (поли)пептиды с повышенной связывающей способностью по сравнению со связывающими (поли)пептидами, определенными в (i) или (ii), соответственно, т.е., с активностью более 100%. Предпочтительно связывающая способность относится к способности связывающего (поли)пептида связывать HER2. Способы оценки связывающей способности описаны в данном описании выше.
Антитела по данному изобретению, определенные в (i) или (ii), имеют константу диссоциации для своего специфического эпитопа на HER2 от 2×10-9 М до 2×10-10 М при определении методом поверхностного плазмоннного резонанса (SPR). Для этого антитела захватываются специфическими к человеческому IgG антителами, которые иммобилизованы на сенсорном чипе BIAcore. После введения антигена, содержащего специфический эпитоп, контролируют образование комплекса, и получают константы кинетической ассоциации (kon) и кинетической диссоциации (koff) или константы диссоциации (KD) путем подбора кривых с использованием оценочной программы BIAcore. Соответственно, связывающая способность антитела, имеющего, по меньшей мере, 65% идентичность последовательностей с антителом (i) или (ii), по существу сохраняется, если константа диссоциации для связывания HER2, измеренная, предпочтительно, в одних и тех же условиях, по меньшей мере, 1×10-5 М, такая как, например, по меньшей мере, 1×10-6 М, предпочтительнее, по меньшей мере, 1×10-7 М, даже предпочтительнее, по меньшей мере, 1×10-8 М, и наиболее предпочтительно, по меньшей мере, 1×10-9 М, сохраняется. Также изобретению соответствуют антитела, имеющие повышенную связывающую способность по сравнению со связывающими (поли)пептидами, определенными в (i) или (ii), т.е., с активностью более 100%. Например, в данном случае предусмотрены антитела, имеющие константу диссоциации, по меньшей мере, 1×10-10 М, такую как, например, по меньшей мере, 1×10-11 М, предпочтительнее, по меньшей мере, 1×10-12 М, и наиболее предпочтительно, по меньшей мере, 1×10-13 М.
Предпочтительно второй связывающий (поли)пептид представляет собой антитело, при этом тяжелая цепь антитела состоит из аминокислотной последовательности SEQ ID NO: 154, и легкая цепь антитела состоит из аминокислотной последовательности SEQ ID NO: 155.
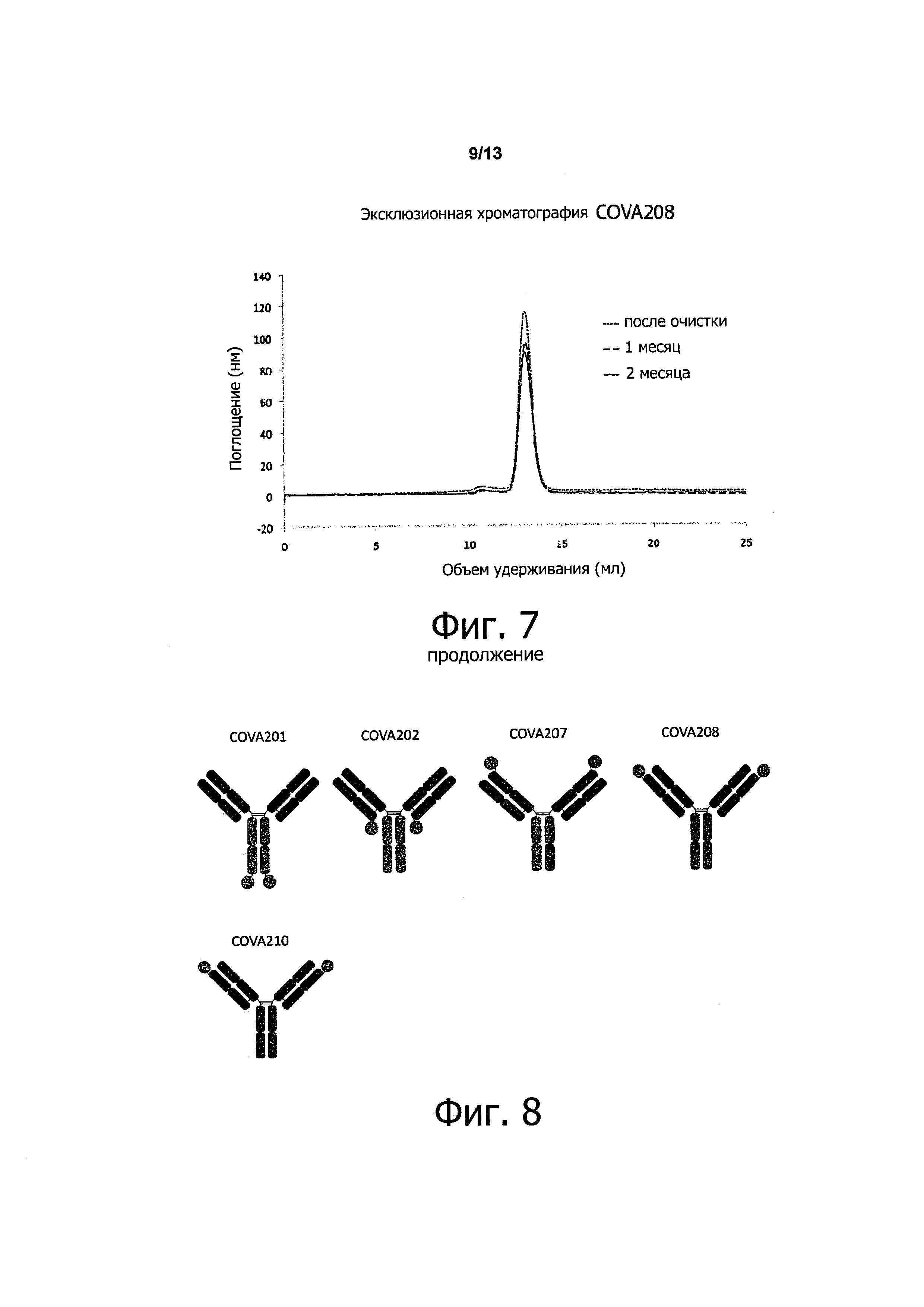
Предпочтительно первый связывающий (поли)пептид состоит из аминокислотной последовательности SEQ ID NO: 1, и второй связывающий (поли)пептид представляет собой антитело, при этом тяжелая цепь антитела состоит из аминокислотной последовательности SEQ ID NO: 154, и легкая цепь антитела состоит из аминокислотной последовательности SEQ ID NO: 155. Предпочтительнее, С-конец SEQ ID NO: 1 соединен с N-концом легкой цепи указанного антитела, т.е., SEQ ID NO: 155. В даже более предпочтительном воплощении связывающей молекулы по изобретению первый связывающий (поли)пептид состоит из аминокислотной последовательности SEQ ID NO: 1, соединенной через линкер (Gly4Ser)3 со вторым связывающим (поли)пептидом, который представляет собой антитело, при этом тяжелая цепь антитела состоит из аминокислотной последовательности SEQ ID NO: 154, и легкая цепь антитела состоит из аминокислотной последовательности SEQ ID NO: 155, и при этом линкер соединяет С-конец SEQ ID NO: 1 с N-концом легкой цепи антитела, т.е., SEQ ID NO: 155. Аминокислотная последовательность такого слитого белка из SEQ ID NO: 1, линкера (Gly4Ser)3 и легкой цепи, представленной SEQ ID NO: 155, показана в SEQ ID NO: 159 (пример молекулы нуклеиновой кислоты, кодирующей такую аминокислотную последовательность, показан в SEQ ID NO: 167). Следует иметь в виду, что когда в качестве второго связывающего (поли)пептида используют антитело, включающее, например, две легких цепи и две тяжелых цепи, и при этом первый связывающий (поли)пептид слит или с легкой или с тяжелой цепью указанного антитела, полученная связывающая молекула в соответствии с настоящим изобретением может включать указанное одно антитело и два первых связывающих (поли)пептида, слитых с каждой одной из двух цепей антитела (или легкой или тяжелой). Примеры таких связывающих молекул по изобретению описаны в прилагаемых примерах и показаны ниже, например, на фигуре 8.
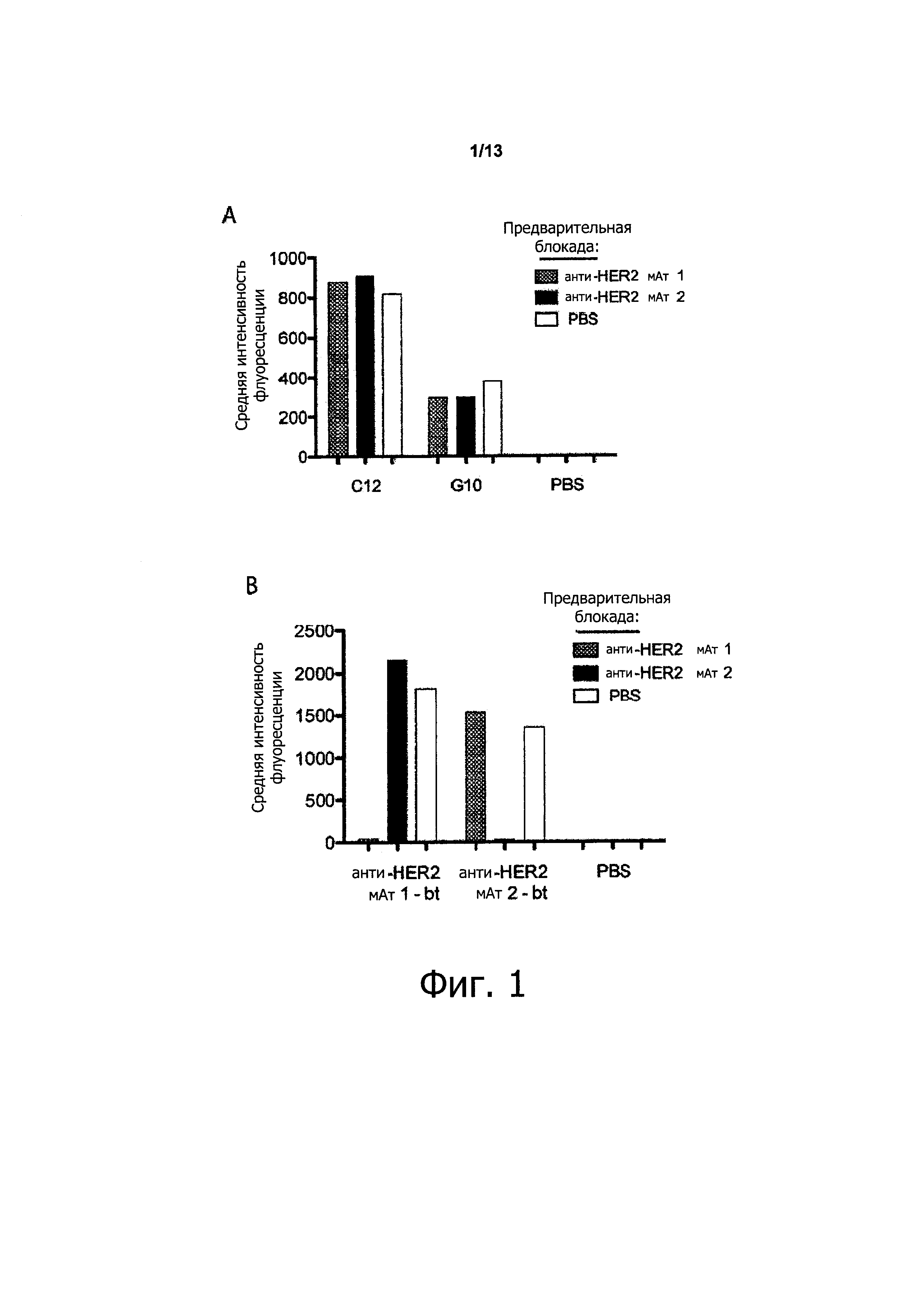
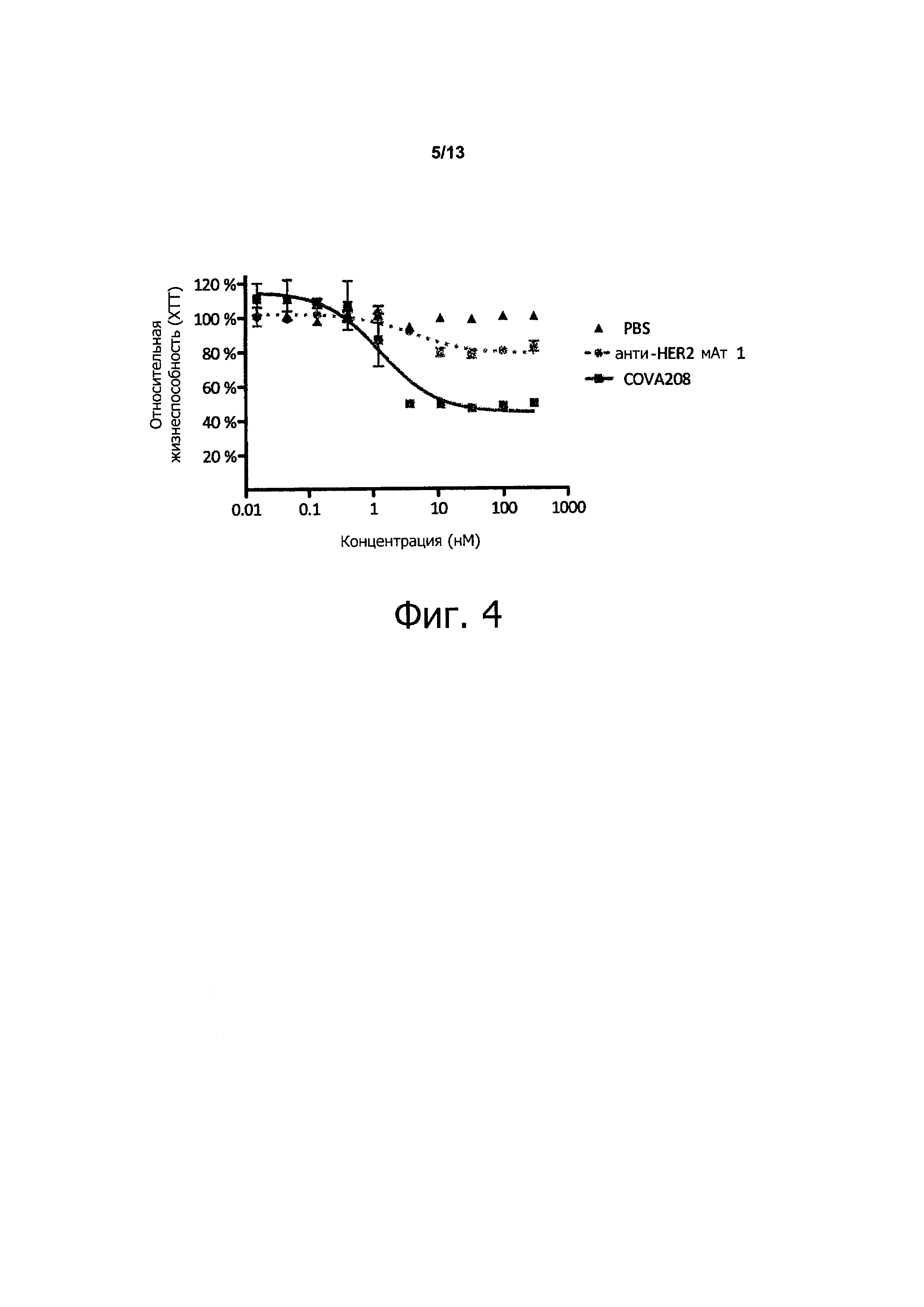
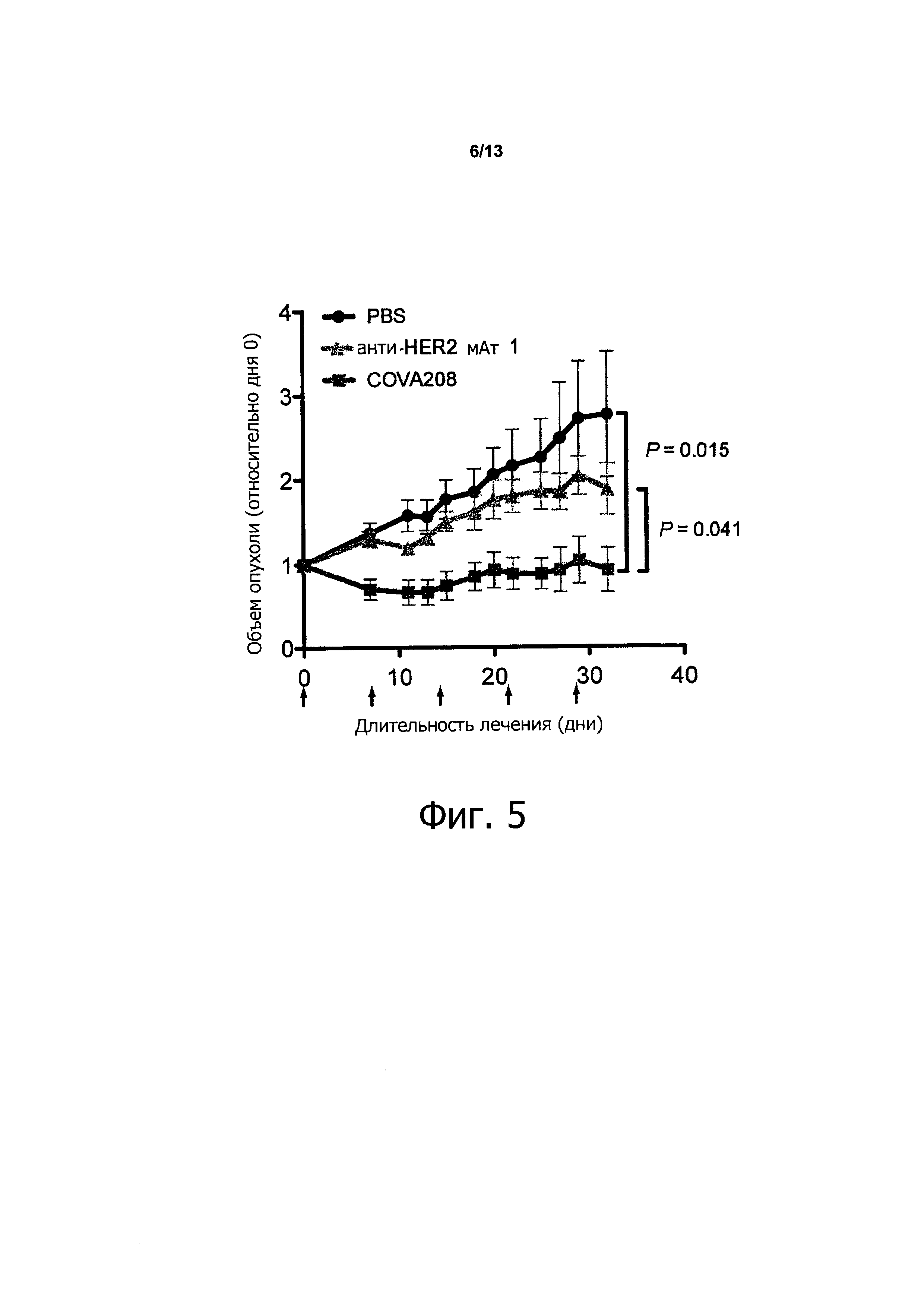
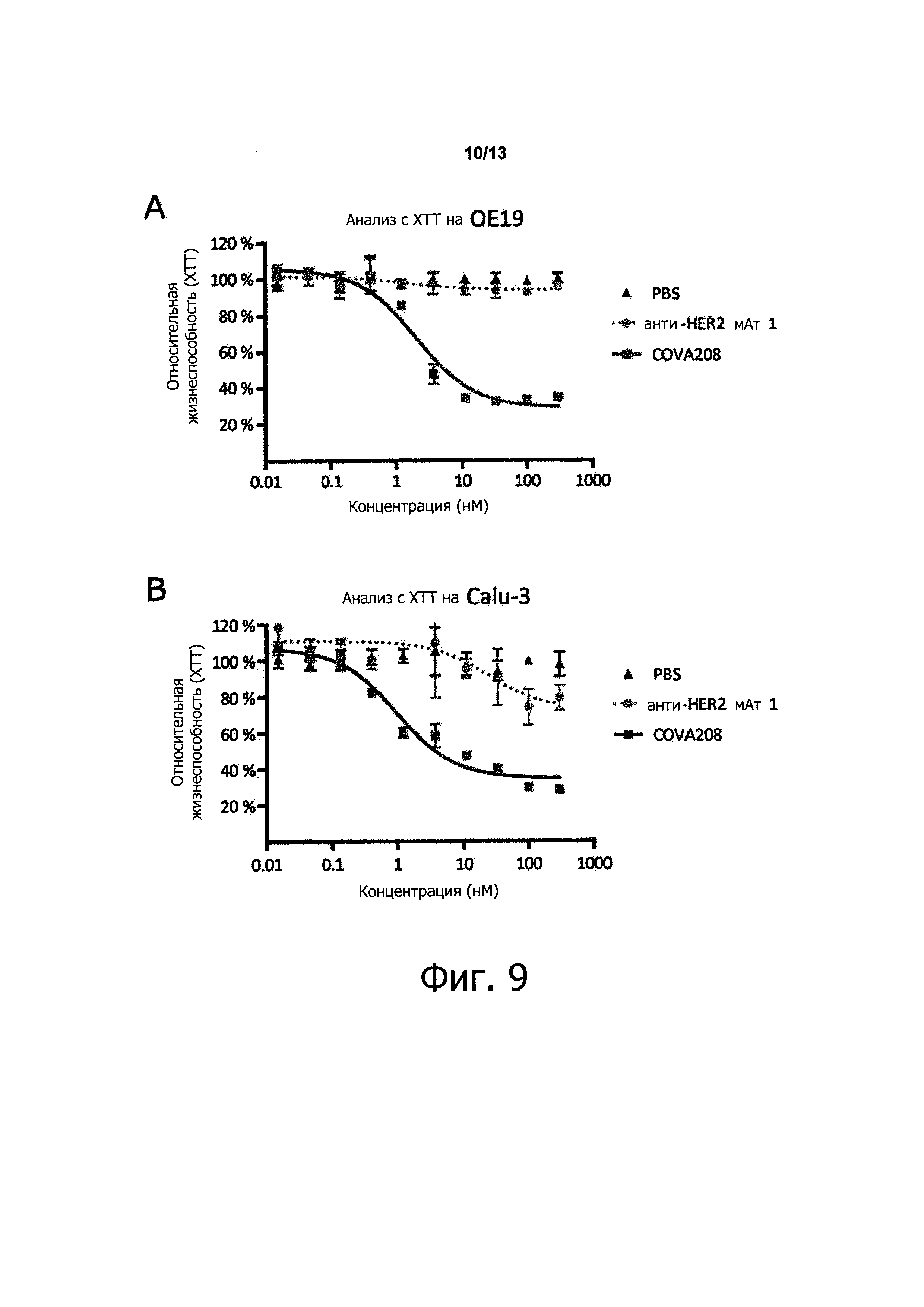
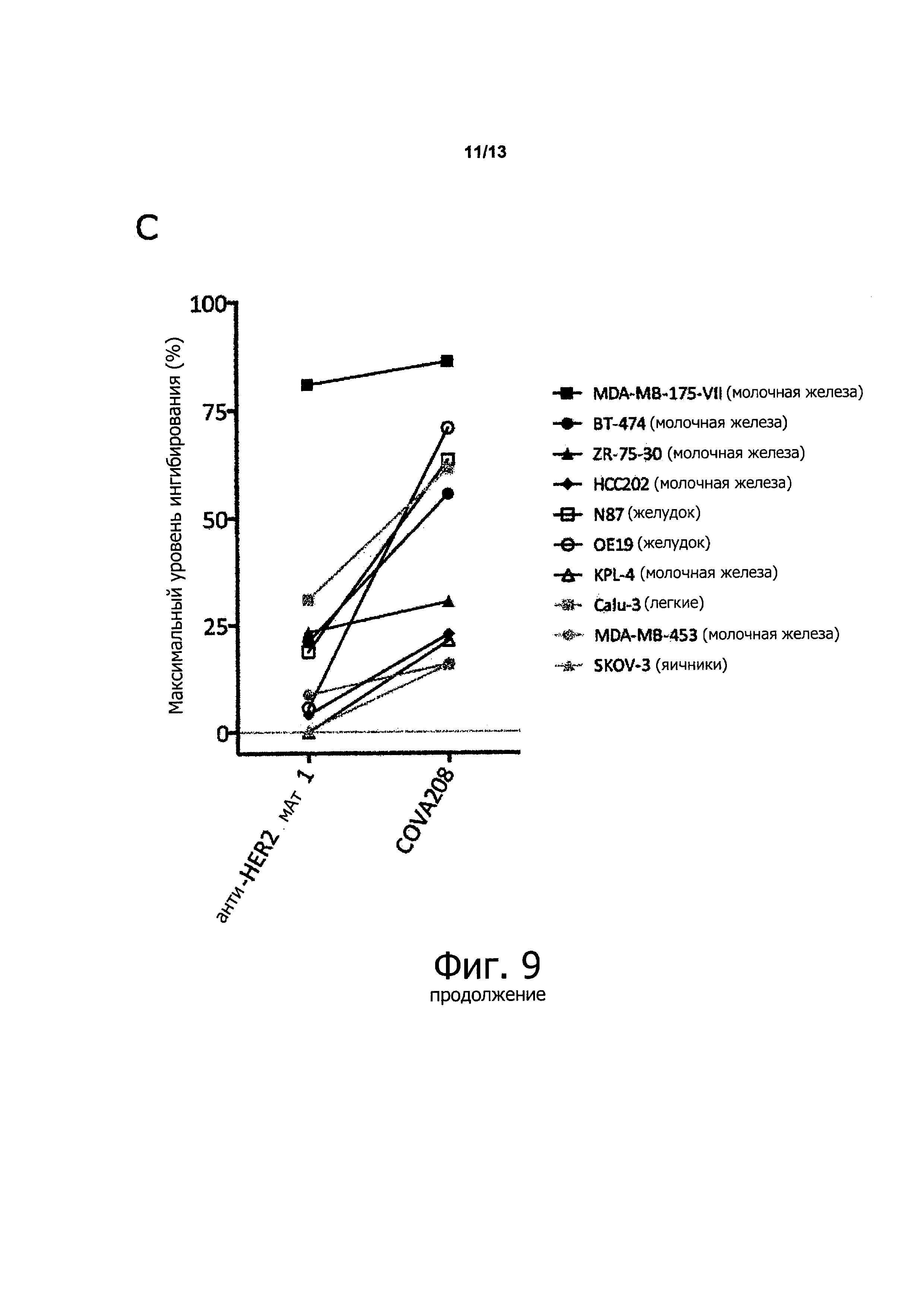
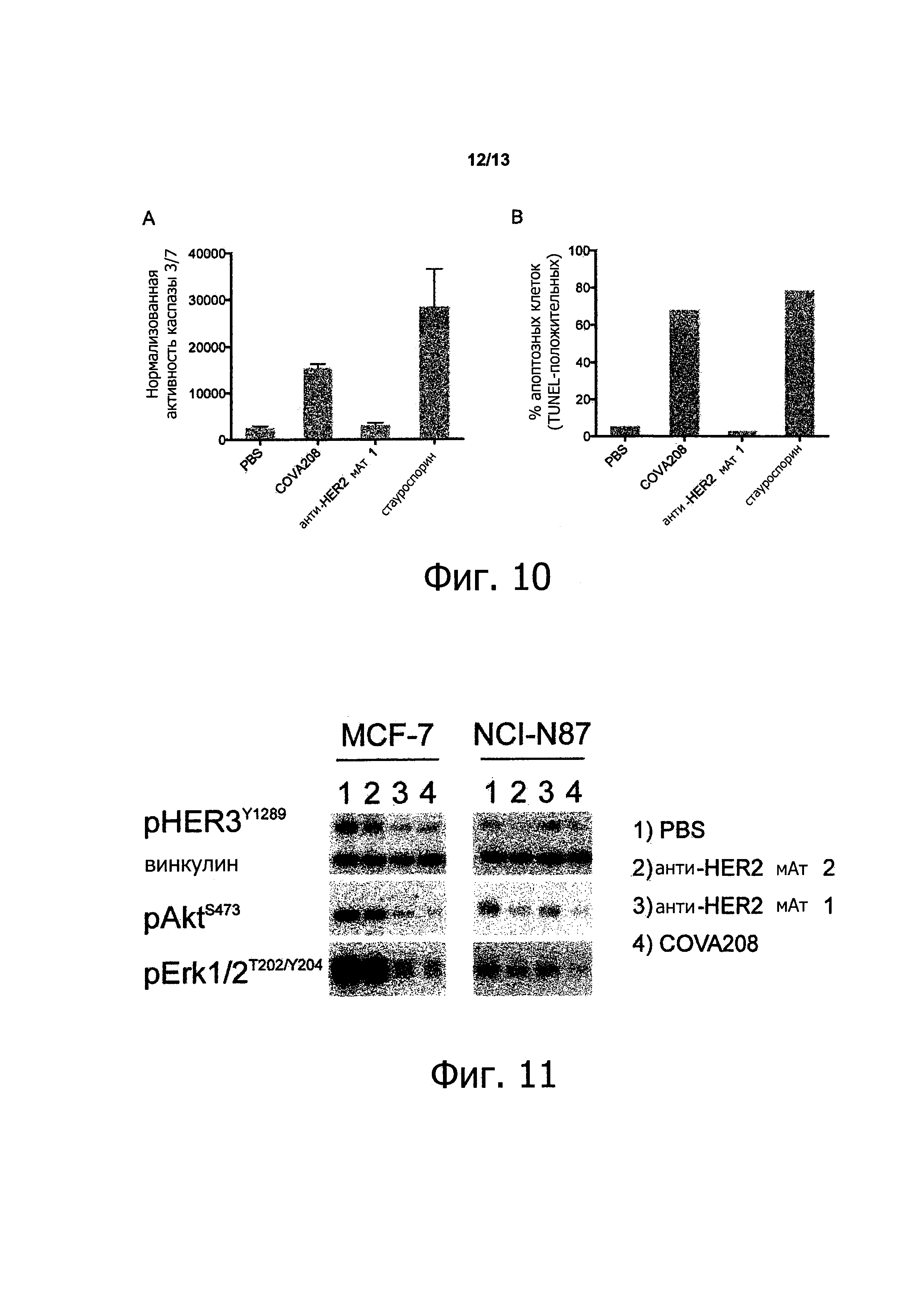
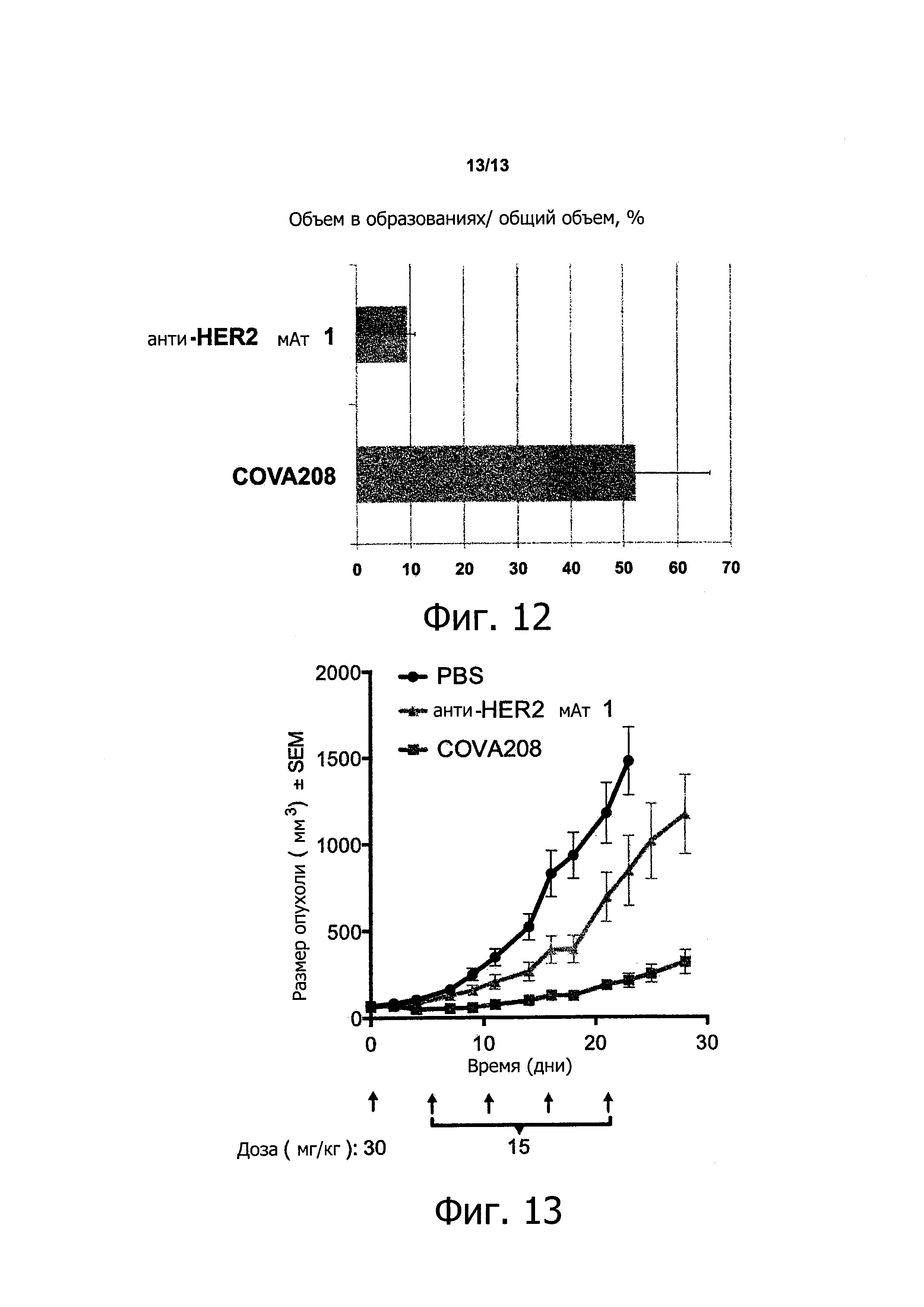
Как показано в прилагаемых примерах, связывающая молекула, определенная выше (также называемая в данном описании COVA208), проявляет превосходную противоопухолевую активность в отношении опухолей, экспрессирующих HER2. Противоопухолевая активность, наблюдаемая с использованием связывающей молекулы по изобретению, существенно выше, чем ингибирование активности опухоли, полученное путем комбинированного связывания двух моноспецифических белков, при этом первый моноспецифический связывающий белок представляет собой бивалентный образованный из Fyn SH3 полипептид, имеющий SEQ ID NO: 153 (т.е., Fc-гибрид С12 (SEQ ID NO: 1)), и второй моноспецифический связывающий белок представляет собой анти-НЕ112 антитело 1, при этом тяжелая цепь антитела состоит из аминокислотной последовательности SEQ ID NO: 154, и легкая цепь антитела состоит из аминокислотной последовательности SEQ ID NO: 155.
Настоящее изобретение также относится к молекуле нуклеиновой кислоты, кодирующей связывающую молекулу по изобретению.
В соответствии с настоящим изобретением, термин «молекула нуклеиновой кислоты», в данном описании также называемая «полинуклеотидом» или «нуклеотидной последовательностью», определяет линейную молекулярную цепь, состоящую из более 30 нуклеотидов. «Молекулы нуклеиновой кислоты», в соответствии с настоящим изобретением, включают ДНК, такую как, например, геномная ДНК, и РНК, например, мРНК. Также включены молекулы, имитирующие нуклеиновую кислоту, известные в технике, такие как, например, синтетические или полусинтетические производные ДНК или РНК, и смешанные полимеры. Такие имитирующие нуклеиновую кислоту молекулы или производные нуклеиновой кислоты согласно изобретению включают фосфоротиоатнуклеиновую кислоту, фосфороамидатнуклеиновую кислоту, 2'-O-метоксиэтилрибонуклеиновую кислоту, морфолинонуклеиновую кислоту, гекситолнуклеиновую кислоту (HNA) и замкнутую нуклеиновую кислоту (LNA) (см. Braasch and Corey, Chem. Biol., 2001, 8: 1). LNA представляет собой производное РНК, в котором образован рибозный цикл за счет метиленовой связи между 2'-кислородом и 4'-углеродом. Они могут содержать дополнительные основания неприродных или деривативных нуклеотидов, что будет очевидно для специалистов в данной области техники.
Следует иметь в виду, что связывающая молекула по настоящему изобретению может быть кодирована одной молекулой нуклеиновой кислоты или несколькими молекулами нуклеиновой кислоты, кодирующими части связывающей молекулы, такие как, например, отдельные связывающие (поли)пептиды или различные цепи антитела. После экспрессии таких молекул нуклеиновой кислоты они образуют связывающую молекулу по изобретению через нековалентные связи, такие как, например, водородные связи, ионные связи, ван дер-ваальсовы силы или гидрофобные взаимодействия, или через ковалентные связи, такие как, например, дисульфидные связи.
Например, когда связывающая молекула представляет собой образованный из Fyn SH3 полипептид, связанный с фрагментом антитела, включающим, например, только scFv-фрагмент, или dAb, тогда связывающая молекула может быть кодирована одной молекулой нуклеиновой кислоты. Когда связывающая молекула включает образованный из Fyn SH3 полипептид, связанный с полноразмерным антителом, как показано в прилагаемых примерах, первая молекула нуклеиновой кислоты может кодировать образованный из Fyn SH3 полипептид и цепь антитела, с которой связан образованный из Fyn SH3 полипептид, и вторая молекула нуклеиновой кислоты может кодировать остальную цепь антитела. С другой стороны, одна молекула нуклеиновой кислоты также может кодировать такие отдельные полипептидные цепи, например, когда кодирующие нуклеотидные последовательности включены в вектор, включающий соответствующие регуляторные элементы для каждой кодирующей последовательности. Следует иметь в виду, что когда для кодирования связывающей молекулы по изобретению используют несколько нуклеотидных последовательностей (или векторов, как описано ниже), может потребоваться приведение полученных экспрессированных полипептидов в контакт для того, чтобы образовать связывающую молекулу по изобретению.
В соответствии с настоящим изобретением термин «молекула нуклеиновой кислоты по изобретению» охватывает как одну молекулу нуклеиновой кислоты, так и несколько молекул нуклеиновой кислоты, до тех пор, пока все компоненты связывающей молекулы по изобретению кодируются таким образом.
Настоящее изобретение также относится к вектору, включающему молекулу нуклеиновой кислоты по изобретению.
Предпочтительно вектор представляет собой плазмиду, космиду, вирус, бактериофаг или другой вектор, обычно используемый, например, в генной инженерии.
Молекула нуклеиновой кислоты по настоящему изобретению может быть встроена в некоторые коммерчески доступные векторы. Неограничительные примеры включают прокариотические плазмидные векторы, такие как pQE-12, ряда pUC, pBluescript (Stratagene), ряд экспрессирующих векторов рЕТ (Novagen) или pCRTOPO (Invitrogen), лямбда gt11, pJOE, ряда pBBR1-MCS, pJB861, pBSMuL, pBC2, pUCPKS, pTACT1 и векторы, совместимые с экспрессией в клетках млекопитающих, подобные векторной системе Е-027 pCAG Kosak-Cherry (L45a), pREP (Invitrogen), pCEP4 (Invitrogen), pMClneo (Stratagene), pXT1 (Stratagene), pSG5 (Stratagene), EBO-pSV2neo, pBPV-1, pdBPVMMTneo, pRSVgpt, pRSVneo, pSV2-dhfr, pIZD35, вектор pcDV1, экспрессирующий кДНК Okayama-Berg (Pharmacia), pRc/CMV, pcDNA1, pcDNA3 (Invitrogen), pcDNA3.1, pSPORT1 (GIBCO BRL), pGEMHE (Promega), pLXIN, pSIR (Clontech), pIRES-EGFP (Clontech), pEAK-10 (Edge Biosystems) pTriEx-Hygro (Novagen) и pCINeo (Promega). Примеры плазмидных векторов, подходящих для Pichia pastoris, включают, например, плазмиды рА0815, pPIC9K и pPIC3.5K (все Invitrogen). Другим вектором, подходящим для экспрессии белков в эмбрионах Xenopus, эмбрионах полосатого данио, а также клетках самых разных млекопитающих и птиц, является многоцелевой экспрессирующий вектор pCS2+.
Молекула нуклеиновой кислоты по настоящему изобретению, упомянутая выше, также может быть встроена в векторы так, что образуется слитый продукт трансляции с другой молекулой нуклеиновой кислоты. Другие молекулы нуклеиновой кислоты могут, например, кодировать белок, который улучшает растворимость и/или облегчает очистку связывающей молекулы, кодированной молекулой нуклеиновой кислоты по изобретению, или бежа, представляющего интерес, что должно наблюдаться с помощью флуоресцентного изображения. Неограничительные примеры таких векторов включают рЕТ32, рЕТ41, рЕТ43. Векторы также могут содержать дополнительный экспрессируемый полинуклеотид, кодирующий один или несколько шаперонов, для облегчения правильной укладки бежа. Подходящие бактеиальные экспрессирующие хозяева включают, например, штаммы, полученные из TGI, BL21 (такие как BL21(DE3), BL21(DE3)PlysS, BL21(DE3)RIL, BL21 (DE3)PRARE) или Rosettaa.
В отношении методов модификации векторов см. Sambrook and Russel, 2001. Как правило, векторы могут содержать один или несколько ориджинов репликации (ori) и систем наследования для клонирования или экспрессии, один или несколько маркеров селекции у хозяина, например, устойчивость к антибиотикам, и одну или несколько экспрессирующих кассет. Подходящие ориджины репликации включают, например, ориджины репликации Col E1, вируса SV40 и М 13.
Кодирующие последовательности, встроенные в вектор, можно, например, синтезировать стандартными методами или выделить из природных источников. Цитирование кодирующих последовательностей к транскрипционным регуляторньгм элементам и/или другим аминокислотным кодирующим последовательностям можно выполнить с использованием установленных методов. Такие регуляторные последовательности хорошо известны специалистам в данной области техники и включают, без ограничения, регуляторные последовательности, обеспечивающие инициацию транскрипции, внутренние рибосомные сайты проникновения (IRES) (Owens, Proc. Natl. Acad. Sci. USA, 98 (2001), 1471-1476) и, необязательно, регуляторные элементы, обеспечивающие терминацию транскрипции и стабилизацию транскрипта. Неограничительные примеры регуляторных элементов, обеспечивающих инициацию транскрипции, включают кодон инициации трансляции, энхансеры, такие как, например, SV40-энхансер, инсуляторы и/или промоторы, такие как, например, промотор цитомегаловируса (CMV), промотор SV40, промотор RSV (вируса саркомы Рауса), промотор lacZ, промотор куриного бета-актина, промотор CAG (комбинация промотора куриного бета-актина и немедленнораннего энхансера цитомегаловируса), промотор gai10, промотор фактора элонгации 1α человека, промотор АОХ1, промотор GAL1, промотор СаМ-киназы, промотор lac, trp или tac, промотор lacUV5, многогранный промотор многоядерного вируса гипергидроза autographa californica (AcMNPV) или интрон глобина в клетках млекопитающих и других животных. Промотор lac является типичным индуцируемым промотором, применимым для прокариотических клеток, который можно индуцировать с использованием аналога лактозы изопропилтиол-b-D-галактозида («IPTG»). Неограничительные примеры регуляторных элементов, обеспечивающих терминацию транскрипции, включают сайт V40-поли-А, сайт tk-поли-А или SV40, lacZ или сигналы многогранного полиаденилирования AcMNPV, которые должны быть включены после нуклеотидной последовательности по изобретению. Дополнительные регуляторные элементы могут включать энахансеры трансляции, последовательности Козак и вставочные последовательности, фланкированные донорскими и акцепторными участками сплайсинга РНК, нуклеотидные последовательности, кодирующие сигналы секреции, или, в зависимости от используемой экспрессирующей системы, сигнальные последовательности, способные направлять экспрессированный полипептид в клеточный компартмент.Например, может быть включена N-концевая фланкирующая последовательность или «лидерная последовательность», которую в технике также называют «сигнальным пептидом». Специалист может выбрать лидерные последовательности без особых затруднений. Лидерную последовательность предпочтительно используют для экспрессии любой цепи антитела (включая легкую цепь, тяжелую цепь) или домена, но далее она не требуется в экспрессированной зрелой конструкции. Более того, также могут быть включены элементы, такие как ориджин репликации, ген устойчивости к лекарственным средствам, регуляторы (как часть индуцируемого промотора).
Экспрессирующий вектор по изобретению способен управлять репликацией и экспрессией молекулы нуклеиновой кислоты по изобретению и кодируемой ею связывающей молекулы.
Котрансфекция с селектируемым маркером, таким как dhfr, gpt, неомицин, гигромицин, дает возможность идентификации и изоляции трансфицированных клеток. Трансфицированную нуклеиновую кислоту можно также амплифицировать для экспрессии больших количеств кодированной связывающей молекулы. Маркер DHFR (дигидрофолатредуктаза) применим для разработки клеточных линий, которые несут несколько сотен или даже несколько тысяч копий гена, представляющего интерес.Другим применимым маркером селекции является фермент глутаминсинтаза (GS) (Murphy et al., 1991; Bebbington et al., 1992). С использованием таких маркеров клетки выращивают в избирательной среде, и отбирают клетки с самой высокой устойчивостью. Экспрессирующие векторы будут предпочтительно включать, по меньшей мере, один селектируемый маркер. Такие маркеры включают дигидрофолатредуктазу, G418 или устойчивость к неомицину для эукариотических клеточных культур и гены устойчивости к тетрациклину, канамицину или ампициллину для культивирования в Е. coli или других бактериях.
Молекулы нуклеиновой кислоты по изобретению могут быть созданы таким образом, что возможно прямое введение их в клетки или их создают такими, чтобы из можно было вводить в клетки посредством электропорацию (с использованием, например, Multiporator (Eppendorf) или Genepulser (BioRad)), PEI (Polysciences Inc. Warrington, Eppelheim), Са2+-опосредуемой трансфекции или с использованием липосом (например, "липофектамин" (Invitrogen)), нелипосомных соединений (например, "Fugene" (Roche)), липосом, фаговых векторов или вирусных векторов (например, аденовирусных, ретровирусных, лентивирусных). Кроме того, также можно использовать бакуловирусы или системы на основе вируса коровьей оспы или вируса леса Семлики в качестве вектора в эукариотической экспрессирующей системе для молекул нуклеиновой кислоты по изобретению. Экспрессирующие векторы, полученные из таких вирусов, как ретровирусы, вирус осповакцины, аденоассоциированный вирус, вирусы герпеса или вирус папилломы крупного рогатого скота, можно использовать для доставки молекул нуклеиновой кислоты или вектора в популяцию клеток-мишеней. Способы, которые хорошо известны специалистам в этой области техники, можно использовать для конструирования рекомбинантных вирусных векторов; см., например, методы, описанные в Sambrook, 2001, и Ausubel, 2001.
Следует иметь в виду, что связывающая молекула по изобретению кодирована несколькими молекулами нуклеиновой кислоты, и указанные несколько молекул нуклеиновой кислоты могут быть заключены в один или в несколько векторов. Термин «вектор по изобретению» охватывает как один вектор, так и несколько векторов до тех пор, пока все компоненты связывающей молекулы по изобретению кодированы таким образом.
Настоящее изобретение также относится к клетке-хозяину или хозяину, не являющемуся человеком, трансформированному вектором по изобретению.
Указанный хозяин или клетка-хозяин могут быть получены путем введения вектора по изобретению в хозяина или клетку-хозяина, которые после их наличия опосредуют экспрессию связывающей молекулы, кодированной вектором.
В соответствии с настоящим изобретением хозяин может представлять собой трансгенное не являющееся человеком животное, трансфицированное с помощью и/или экспрессирующее вектор по настоящему изобретению. В предпочтительном воплощении трансгенное животное представляет собой млекопитающее, например хомяка, корову, кошку, свинью, собаку или лошадь.
В предпочтительном воплощении хозяин представляет собой клетку, такую как изолированная клетка, которая может являться частью клеточной культуры.
Подходящие прокариотические клетки-хозяева включают, например, бактерии родов Escherichia, Bacillus, Streptomyces и Salmonella typhimurium. Подходящие эукариотические клетки-хозяева включают, например, клетки грибов, среди прочих, дрожжей, таких как Saccharomyces cerevisiae или Pichia pastoris, или клетки насекомых, таких как дрозофила S2 и Spodoptera Sf9, и клетки растений, а также клетки млекопитающих. Подходящие среды и условия для культивирования для вышеописанных клеток-хозяев известны в данной области техники.
Клетки-хозяева млекопитающих включают, без ограничения, клетки человека Hela, HEK293, Н9 и клетки Юрката, мышиные клетки NIH3T3 и С127, Cosl, Cos7 и CV1, перепелиные клетки QC1, мышиные N-клетки, клетки яичника китайского хомячка (СНО) и клетки меланомы Боуэса. С другой стороны, связывающая молекула по изобретению может быть экспрессирована в устойчивой клеточной линии, которая содержит генную конструкцию, охватывающую молекулу нуклеиновой кислоты по изобретению или вектор по изобретению, интегрированные в хромосому.
В другом предпочтительном воплощении указанная клетка представляет собой первичную клетку или первичную клеточную линию. Первичные клетки представляют собой клетки, которые получены непосредственно из организма. Подходящими первичными клетками являются, например, фибробласты эмбриона мыши, первичные гепатоциты, кардиомиоциты и нейроны мыши, а также мышечные стволовые клетки (клетки-спутники) мыши и полученные из них устойчивые клеточные линии.
Настоящее изобретение также относится к способу получения связывающей молекулы по изобретению, включающему культивирование клетки-хозяина по изобретению в подходящих условиях и выделение связывающей молекулы, продуцированной указанной клеткой-хозяином.
Подходящие условия для культивирования прокариотических или эукариотических хозяев хорошо известны специалистам в данной области техники. Например, подходящими условиями для культивирования бактерий является выращивание их при снабжении кислородом в среде Луриа-Бертани (LB). Для того, чтобы повысить выход и растворимость продукта экспрессии, среду можно забуферить или снабдить подходящими добавками, известными для усиления или облегчения того и другого. Е. coli можно культивировать при температуре от 4 до примерно 37°С, точная температура или последовательность температур зависит от молекулы, которую сверхэкспрессируют. Вообще специалист также понимает, что такие условия можно адаптировать к потребностям хозяина и требованиям для экспрессируемой связывающей молекулы. В случае, когда молекулы нуклеиновой кислоты изобретения находятся под контролем индуцируемого промотора в векторе, присутствующем в клетке-хозяине, экспрессия связывающей молекулы может быть индуцирована добавлением соответствующего индуцирующего агента. Подходящие протоколы и стратегии экспрессии известны специалистам.
В зависимости от типа клетки и ее специфических требований культуры клеток млекопитающих можно получить, например, на среде RPMI или DMEM, содержащей 10% (об./об.) FCS, 2 мМ L-глутамина и 100 Е/мл пенициллина/стрептомицина. Клетки можно выдерживать при 37°С в атмосфере с 5% СО2, насыщенной водой.
Подходящими средами для культуры клеток насекомых являются, например, среда TNM + 10% FCS, или среда SF900. Клетки насекомых обычно выращивают при 27°С в виде адгезионной культуры или суспензионной кулльтуры.
Подходящие протоколы экспрессии для эукариотических клеток известны специалистам, и их можно найти, например, в Sambrook, 2001, loc cit.
Способы выделения полученной связывающей молекулы хорошо известны в технике и включают, без ограничения, стадии способа, такие как ионобменная хроматография, гель-хроматография (эксклюзионная хроматография), аффинная хроматография, высокоэффективная жидкостная хроматография (ВЭЖХ), ВЭЖХ с обращенной фазой, диск-гель-электрофорез или иммунопреципитация, см., например, Sambrook, 2001, loc cit.
Настоящее изобретение также относится к композиции, включающей, по меньшей мере, один компонент из (i) связывающей молекулы по изобретению, (ii) молекулы нуклеиновой кислоты по изобретению, (iii) вектора по изобретению или (v) клетки-хозяина по изобретению.
Термин «композиция», используемый в соответствии с настоящим изобретением, относится к композиции, которая включает, по меньшей мере, один из указанных компонентов. Она также необязательно может включать молекулы, способные изменять характеристики соединений по изобретению посредством, например, стабилизации, модуляции и/или усиления их функции. Композиция может находиться в твердой или жидкой форме и может находиться, среди прочего, в форме (а) порошка(ов), (а) таблетки(таблеток) или (а) раствора(ов).
В предпочтительном воплощении композиция представляет собой фармацевтическую композицию, также включающую, необязательно, фармацевтически приемлемый носитель.
В соответствии с настоящим изобретением термин «фармацевтическая композиция» относится к композиции для введения пациенту, предпочтительно, пациенту человеку. Фармацевтическая композиция по изобретению включает соединения, указанные выше. Фармацевтическая композиция по настоящему изобретению может включать, необязательно и дополнительно, фармацевтически приемлемый носитель. «Фармацевтически приемлемым носителем» обозначается нетоксичный твердый, полутвердый или жидкий наполнитель, разбавитель, инкапсулирующий материал или вспомогательное средство любого типа. Примеры подходящих фармацевтических носителей хорошо известны в технике и включают растворы хлорида натрия, забуференные фосфатом растворы хлорида натрия, воду, эмульсии, такие как эмульсии масло/вода, различные типы смачивающих веществ, стерильные растворы, органические растворители и т.д.. Предпочтительно носитель представляет собой парентеральный носитель, предпочтительнее, раствор, который изотоничен с кровью реципиента. Термин «парентеральный», используемый в данном описании, относится к способам введения, которые включают внутривенную, внутримышечную, интраперитонеальную, интрастернальную, подкожную и внутрисуставную инъекцию и инфузию. Носитель соответственно содержит небольшие количества добавок, таких как вещества, которые усиливают изотоничность и химическую устойчивость. Такие материалы являются нетоксичными для реципиентов в используемых дозировках и концентрациях и включают буферирующие вещества, такие как фосфаты, цитраты, сукцинаты, уксусную кислоту и другие органические кислоты или их соли; антиоксид анты, такие как аскорбиновая кислота; низкомолекулярные (менее примерно десяти остатков) (поли)пептиды, например, полиаргинин или трипептиды; белки, такие как сывороточный альбумин, желатин или также иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутаминовая кислота, аспарагиновая кислота или аргинин; моносахариды, дисахариды и другие углеводы, в том числе целлюлозу или ее производные, глюкозу, маннозу или декстрины; хелатообразователи, такие как ЭДТК; спирты-сахара, такие как маннит или сорбит; противоионы, такие как натрий; и/или неионогенные поверхностно-активные вещества, такие как полисорбаты, полоксамеры или ПЭГ.
Композиции, включающие такие носители, могут быть получены известными традиционными способами. Как правило, композиции получают, осуществляя равномерный и тщательный контакт компонентов фармацевтической композиции с жидкими носителями или тонкоизмельченными твердыми носителями или теми и другими. Затем, при необходимости, продукту придают форму нужного препарата.
Такие фармацевтические композиции можно вводить субъекту в соответствующей дозе. Схема приема будет определяться лечащим врачом и клиническими факторами. Как хорошо известно в медицине, дозировки для любого одного пациента зависят от многих факторов, в том числе, размера пациента, площади поверхности тела, возраста, определенного вводимого соединения, пола, времени и способа введения, общего состояния здоровья и других лекарственных средств, вводимых параллельно. Терапевтически эффективное количество для данной ситуации будет легко определяться простым экспериментом, что входит в компетенцию рядового клинициста или врача. Фармацевтическая композиция может вводиться однократно или регулярно в течение продолжительного периода времени. Как правило, введение фармацевтической композиции должно находиться в интервале, например, от 10 мкг/кг массы тела до 2 г/кг массы тела в однократной дозе. Однако более предпочтительная дозировка может находиться в интервале от 100 мкг/кг до 1,5 г/кг массы тела, даже предпочтительнее, от 1 мг/кг до 1 г/кг массы тела, и даже еще предпочтительнее, от 5 мг/кг до 500 мг/кг массы тела в однократной дозе.
Введение фармацевтических композиций по изобретению можно осуществлять различными путями, например, путем внутривенного, интраперитонеального, подкожного, внутримышечного, интрадермального, интраназального или интрабронхиального введения.
Соединения фармацевтической композиции, используемой для терапевтического введения, должны быть стерильными. Стерильность легко достигается фильтрацией через мембраны для стерильной фильтрации (например, мембраны 0,2 мкм).
Компоненты фармацевтической композиции обычно будут храниться в одно- или многодозовых контейнерах, например, запаянных ампулах или флаконах, в виде водного раствора или в виде лиофилизованного препарата для восстановления. Как пример лиофилизованного препарата, 10-мл флаконы заполняют 5 мл стерильно фильтрованного 1% (мас./об.) водного раствора, и полученную смесь лиофилизуют.Раствор для инфузии получают восстановлением лиофилизованного(ых) соединения(й) с использованием бактериостатической воды для инъекции. Также могут присутствовать консерванты и другие добавки, такие как, например, антимикробные средства, антиоксиданты, хелатообразователи и инертные газы и т.п.. Фармацевтическая композиция может включать дополнительные средства, в зависимости от предполагаемого применения фармацевтической композиции.
Фармацевтическая композиция может применяться, в частности, для лечения опухолей, как раскрывается ниже.
В другом предпочтительном воплощении композиция по изобретению представляет собой диагностическую композицию.
В соответствии с настоящим изобретением термин «диагностическая композиция» относится к композициям для диагностирования отдельных пациентов на их возможную реакцию на фармацевтические композиции по изобретению или излечимость фармацевтическими композициями по изобретению. Диагностическая композиция по изобретению включает соединения, указанные выше. Диагностическая композиция также может включать соответствующее(ие) буферное(ые) вещество(а) и т.д.. Диагностическая композиция может быть упакована в контейнер или несколько контейнеров.
Настоящее изобретение также относится к связывающей молекуле по изобретению, молекуле нуклеиновой кислоты по изобретению или вектору по изобретению для применения при лечении опухолей.
Термин «опухоль» в соответствии с настоящим изобретением относится к классу заболеваний или расстройств, характеризующихся неконтролируемым делением клеток, и охватывает все типы опухолей, такие как, например, раковые опухоли и доброкачественные опухоли, а также солидные опухоли и несолидные опухоли. Раковые опухоли дополнительно характеризуются способностью таких опухолей к распространению или путем непосредственного прорастания в соседние ткани через инвазию или путем имплантации в отдаленные места путем метастазирования, когда опухолевые клетки переносятся кровотоком или лимфатической системой.
Предпочтительно опухоль представляет собой раковую опухоль, выбранную из группы, включающей рак молочной железы, рак яичников, рак мочевого пузыря, рак слюнных желез, рак эндометрия, рак поджелудочной железы, рак щитовидной железы, рак почек, рак легких, рак, задевающий верхний отдел желудочно-кишечного тракта, рак толстой кишки, колоректальный рак, рак предстательной железы, плоскоклеточный рак, карциному головы и шеи, рак шейки матки, глиобластому, злокачественный асцит, лимфомы и лейкозы.
Все типы онкозаболеваний, описанные в данном описании, хорошо известны специалистам и определяются согласно соответствующей области техники и уровню знаний специалистов.
Описание чертежей
Фигура 1. Эксперименты с FACS по связыванию с использованием клеток В-474, сверхэкспрессирующих HER2.
(A) Связывание образованных из Fyn SH3 полипептидов С12 (SEQ ID NO: 1) и G10 (SEQ ID NO: 2) на HER2 с предварительной блокировкой или без нее эпитопа анти-HER2 антитела 1 (анти-HER2 mAb 1; при этом тяжелая цепь имеет аминокислотную последовательность SEQ ID NO: 154, и легкая цепь имеет аминокислотную последовательность SEQ ID NO: 155; примеры молекул нуклеиновой кислоты, кодирующей тяжелую и легкую цепь, показаны в SEQ ID NO: 156 и 166) и анти-HER2 антитела 2 (анти-HER2 mAb 2; при этом тяжелая цепь имеет аминокислотную последовательность SEQ ID NO: 160, и легкая цепь имеет аминокислотную последовательность SEQ ID NO: 163; примеры молекул нуклеиновой кислоты, кодирующей тяжелую и легкую цепь, показаны в SEQ ID NO: 168 и 169). PBS - забуференный фосфатом физиологический раствор представляет собой отрицательный контроль.
(B) Связывание биотинилированного анти-HER2 антитела 1 и биотинилированного анти-НЕК2 антитела 2 (биотинилированные антитела указываются аббревиатурой «bt») с предварительной блокировкой или без нее эпитопа анти-HER2 антитела 1 и анти-HER2 антитела 2. PBS - забуференный фосфатом физиологический раствор представляет собой отрицательный контроль.
Фигура 2. Анализы in vitro пролиферации со сверхэкспрессирующей HER2 клеточной линией рака желудка NCI-N87.
Образованный из Fyn SH3 полипептид С12 (SEQ ID NO: 1) сливают с Fc-частью человеческого IgG для создания моноспецифического бивалентного белка, названного Fc-С12 (SEQ ID NO: 153). Смесь комбинации финомера C12-Fc с анти-HER2 антителом 1 (анти-HER2 mAb 1) (показана на фиг. 2А) и с анти-HER2 антителом 2 (анти-HER2 mAb 2) (показана на фиг. 2С) не снижает скорость пролиферации клеток NCI-N87 более эффективно, чем соответствующие отдельные анти-HER2 антитела. Однако антипролиферативная активность связывающих молекул COVA208 (SEQ ID NO: 154 и 159) (показаны на фиг. 2В) и COVA210 (SEQ ID NO: 160 и 161; пример молекулы нуклеиновой кислоты, кодирующей SEQ ID NO: 161, показан в SEQ ID NO: 170) (фиг. 2D) выше, чем активность соответствующего немодифицированного антитела. COVA208 состоит из слияния С12 (SEQ ID NO: 1) по N-концу с легкой цепью антитела 1 (SEQ ID NO: 154 и 155), и COVA210 состоит из слияния С12 (SEQ ID NO: 1) по N-концу с легкой цепью антитела 2 (SEQ ID NO: 160 и 163), см. также фигуру 8.
Фигура 3. Антипролиферативная активность гибридов финомер-антитело изменяется в зависимости от относительной ориентации финомера и сайта связывания антитела. Антипролиферативная активность различных слитых белков финомер-антитело в клеточном анализе на пролиферацию с клетками рака желудка NCI-N87 показывает изменения (А) и (В), и COVA208 показывает наилучшее антипролиферативное действие на такой клеточной линии (фиг. 3В). Максимальное действие показано в таблицах и дается в проценте жизнеспособности. COVA201 (SEQ ID NO: 156 и 155), COVA202 (SEQ ID NO: 154 и 157), COVA207 (SEQ ID NO: 158 и 155) и COVA208 (SEQ ID NO: 154 и 159) все представляют собой слитые белки образованного из Fyn SH3 полипептида С12 (SEQ ID NO: 1) и анти-HER2 антитела 1 (анти-HER2 mAb 1) (SEQ ID NO: 154 и 155). COVA201 состоит из слияния по С-концу с тяжелой цепью, COV202 представляет собой слияние по С-концу с легкой цепью, COVA207 состоит из слияния по N-концу с тяжелой цепью, и COVA208 представляет собой слияние по N-концу с легкой цепью, см. также фигуру 8.
Фигура 4. Антипролиферативную активность COVA208 (SEQ ID NO: 154 и 159) (слияние финомера С12 по N-концу с легкой цепью анти-HER2 антитела 1 (анти-HER2 mAb 1, SEQ ID NO: 154 и 155) определяют в клеточном анализе с клеточной линией рака молочной железы ВТ-474, сверхэкспрессирующей HER2. COVA208 показывает превосходную антипролиферативную активность по сравнению с немодифицированными антителами.
Фигура 5 отображает исследование на животных на мышиной модели с ксенотрансплататом рака желудка NCI-N87. Клетки рака желудка NCI-N87 инокулируют подкожно голым мышам CD1 (n=6 на группу обработки). Когда опухоль достигает размера примерно 140 мм3, животных обрабатывают ударной дозой 30 мг/кг COVA208 (SEQ ID NO: 154 и 159), анти-HER2 антитела 1 (анти-HER2 mAb 1 (SEQ ID NO: 154 и 155)) или плацебо (PBS). Обработку продолжают в течение четырех недель инъекциями i.p. (15 мг/кг) (показано стрелками), и измеряют размер опухолей штангенциркулем. Находят, что COVA208 подавляет рост опухоли лучше, чем моноспецифическое анти-HER2 антитело 1 или плацебо (PBS). Приводится средний объем опухоли у 6 мышей (относительно дня 0, когда обработка начиналась) ± среднеквадратическая ошибка (SEM).
Фигура 6. Концентрации в сыворотке COVA208 (SEQ ID NO: 154 и 159) и анти-HER2 антитела 1 (анти-HER2 mAb 1 (SEQ ID NO: 154 и 155)) в различные моменты времени после однократной i.v. инъекции мышам С57 В1/6. Шесть последних точек используют для вычисления конечного времени полужизни 247 час (COVA208) и 187 час (анти-HER2 антитело 1). Строят график зависимости средней концентрации в сыворотке от времени, величины ошибки представляют стандартные отклонения (SD).
Фигура 7. SDS PAGE COVA208 (SEQ ID NO: 154 и 159) и анти-HER2 антитела 1 (анти-HER2 mAb 1 (SEQ ID NO: 154 и 155)) (вверху) и эксклюзионные хроматограммы COVA208 после очистки и после хранения в течение 1 и 2 месяцев при 4°С (внизу). Очевидно, что COVA208 не образует никаких агрегатов.
Фигура 8. Схематическое отображение различных форматов связывающих молекул, которые связываются с двумя различными эпитопами антигена. COVA201 (SEQ ID NO: 156 и 155), COVA202 (SEQ ID NO: 154 и 157), COVA207 (SEQ ID NO: 158 и 155) и COVA208 (SEQ ID NO: 154 и 159) все представляют собой слитые белки образованного из Fyn SH3 полипептида С12 (SEQ ID NO: 1) и анти-HER2 антитела 1 (анти-HER2 mAb 1) (SEQ ID NO: 154 и 155). COVA201 состоит из слияния по С-концу с тяжелой цепью, COV202 представляет собой слияние по С-концу с легкой цепью, COVA207 состоит из слияния по N-концу с тяжелой цепью, и COVA208 представляет собой слияние по N-концу с легкой цепью. COVA210 (SEQ ID NO: 160 и 161) состоит из слияния С12 (SEQ ID NO: 1) по N-концу с легкой цепью антитела 2 (SEQ ID NO: 160 и 163).
Фигура 9. Анализы in vitro пролиферации с клеточными линиями, сверхэкспрессирующими HER2. COVA208 (SEQ ID NO: 154 и 159) подавляет рост клеток OE19 (фиг. 9А) и Calu-3 (фиг. 9В) более эффективно, чем анти-HER2 антитело 1 (анти-HER2 mAb 1 (SEQ ID NO: 154 и 155)). Фигура 9С суммирует результаты in vitro анализов пролиферации, выполненных на 10 различных клеточных линиях, для каждой на график нанесен максимальный уровень ингибирования. Соответствующие точки для COVA208 и анти-HER2 антитела 1 соединены для облегчения сравнения между двумя соединениями.
COVA208 показывает улучшенное подавление роста клеток по сравнению с анти-HER2 антителом 1 на всех 10 клеточных линиях.
Фигура 10. COVA208 (SEQ ID NO: 154 и 159) способен индуцировать апоптоз, что определяют по активности каспазы-3/7 (фиг. 10А) и по окрашиванию TUNEL (фиг. 10В). Анти-HER2 антитело 1 (анти-HER2 mAb 1 (SEQ ID NO: 154 и 155)) не увеличивает ни активность каспазы-3/7, ни фракцию TUNEL-положительных клеток, что указывает, что способность индуцировать апоптоз уникальна для COVA208. В качестве положительного контроля используют стауроспорин. Величина ошибки на фиг. 10А показывает стандартное отклонение при трехкратном повторе.
Фигура 11. COVA208 (SEQ ID NO: 154 и 159) ингибирует лигандзависимую активацию передачи сигнала HER2 на клетках MCF-7 (левая часть), а также лиганднезависимую активацию передачи сигнала HER2 на клетках NCI-N87 (правая часть). Анти-HER2 антитело 1 (анти-HER2 mAb 1 (SEQ ID NO: 154 и 155)) ингибирует передачу сигнала только на клетках MCF-7, в то время как анти-HER2 антитело 2 (анти-HER2 mAb 2 (SEQ ID NO: 160 и 163)) активно только на клетках NCI-N87. В качестве нагрузочного контроля служит винкулин.
Фигура 12. COVA208 интернализуется клетками NCI-N87. После окрашивания поверхности и последующих 5 час инкубации 52% COVA208 (SEQ ID NO: 154 и 159) обнаруживают в сферических образованиях в цитозоле, что определяют из изображений конфокального лазерного сканирования, анализированных с помощью программы Imaris. Окрашивание анти-HER2 антитела 1 (анти-HER2 mAb 1 (SEQ ID NO: 154 и 155)) остается преимущественно мембранассоциированным, и только 9% окрашивания локализовано в цитозольных сферических образованиях.
Фигура 13 отображает исследование на животных на мышиной модели с ксенотрансплантатом рака молочной железы KPL-4. Клетки рака молочной железы KPL-4 инокулируют подкожно мышам SCID с врожденным отсутствием естественных клеток-киллеров (n=8 на группу обработки). Когда опухоли достигают размера примерно 70 мм3, животных обрабатывают ударной дозой 30 мг/кг COVA208 (SEQ ID NO: 154 и 159), анти-HER2 антитела 1 (анти-HER2 mAb 1 (SEQ ID NO: 154 и 155)) или плацебо (PBS). Обработку продолжают в течение четырех недель инъекциями i.p. (15 мг/кг) (показано стрелками), и измеряют размер опухолей штангенциркулем. Находят, что COVA208 подавляет рост опухоли значительно лучше, чем моноспецифическое анти-HER2 антитело 1 или плацебо (PBS). Приводится средний объем опухоли у 8 мышей ± среднеквадратическая ошибка (SEM).
Изобретение иллюстрируют примеры.
Пример 1. Образованные из Fyn SH3 полипептиды связываются с HER2
Методы
1) Фаговый ELISA на рекомбинантном белке HER2
ДНК, кодирующую аминокислоты, показанные в SEQ ID NO: 9-121, клонируют в фагмидный вектор pHEN1, как описано для библиотеки Fyn SH3 в Grabulovski et al. (Grabulovski et al. (2007), JBC, 282, p. 3196-3204). Получение фагов выполняют согласно стандартным протоколам (Viti F. et al. (2000), Methods Enzymol., 326, 480-505). Моноклональные бактериальные супернатанты, содержащие фаги, используют для ELISA: биотинилированный внеклеточный домен HER2, содержащий аминокислоты 23-652 полноразмерного бежа (закупают у Bender Medsystems или R&D как гибрид с человеческим Fcγ1; биотнилирование выполняют сульфо-NHS-LC-биотином (Peirce) согласно инструкциям изготовителя), иммобилизуют в лунках, покрытых стрептавидином (StreptaWells, High Bind, Roche), и после блокировки 2% молоком (Rapilait, Migros, Швейцария) в PBS добавляют 20 мкл 10% молока в PBS и 80 мкл фаговых супернатантов. После инкубации в течение 1 часа несвязанные фаги отмывают, и связанные фаги детектируют конъюгатом анти-М13-HPR-антитело (GE Healthcare). Детекцию пероксидазной активности осуществляют, добавляя субстрат ВМ синий POD (Roche), и реакцию останавливают, добавляя 1 М H2SO4. Положительные на фаговый ELISA клоны проверяют фаговым ELISA на отсутствие перекрестной реактивности со стрептавидином (StreptaWells, High Bind, Roche) и человеческим IgG (Sigma).
Последовательность ДНК специфических связывающих факторов проверяют секвенированием ДНК.
2) Эксперимент FACS на клетках SKOV-3, сверхэкспрессирующих HER2
ДНК, кодирующую полипептиды, показанные в SEQ ID NO: 1-8 и SEQ ID NO: 122-152, субклонируют в бактериальный экспрессирующий вектор pQE12 так, что полученные конструкции содержат С-концевую myc-гексагистидиновую метку (SEQ ID NO: 162), как описано в Grabulovski et al. (Grabulovski et al. (2007), JBC, 282, p. 3196-3204). Полипептиды экспрессируют в цитозоле бактерий Е. coli, и получают 1,8 мл осветленного лизата на мл исходной культуры. Смешивают 100 мкл осветленного лизата, содержащего полипептиды, со 100 мкл клеточной суспензии, содержащей 1,25×105 клеток SKOV-3 в смеси PBS/1% FCS/0,2% азида натрия. После 60-мин инкубации на льду клетки промывают, и детектируют связанные последовательности с помощью 10 мкг/мл анти-тус мышиных антител 9Е10 (Roche), и затем с помощью конъюгата антимышиный IgG-Alexa 488 (Invitrogen). Затем окрашенные клетки анализируют в анализаторе FACS. Последовательность ДНК специфических связывающих полипептидов проверяют секвенированием ДНК.
Результаты
Аминокислотные последовательности образованных из Fyn SH3 связывающих полипептидов представлены в SEQ ID NO: 1-152 в виде приложения в списке последовательностей.
Пример 2. Образованные из Fyn SH3 полипептиды связываются с другими эпитопами HER2, сравнение с анти-HER2 антителами
Методы
Последовательности ДНК, кодирующие образованные из Fyn SH3 клоны С12 (SEQ ID NO: 1) и G10 (SEQ ID NO: 2), субклонируют в бактериальный экспрессирующий вектор pQE12 так, что полученные конструкции содержат С-концевую myc-гексагистидиновую метку (SEQ ID NO: 162), и две конструкции экспрессируют и очищают с помощью гексагистидиновой метки, как описано в Grabulovski et al. (Grabulovski et al. (2007), JBC, 282, p. 3196-3204).
Тяжелые и легкие цепи (SEQ ID NO: 154 и SEQ ID NO: 155) airra-HER2 антитела 1 и анти-HER2 антитела 2 (SEQ ID NO: 160 и SEQ ID NO: 163) временно коэкспрессируют в клетках СНО. Антитела очищают от культурального супернатанта аффинной хроматографией на колонке MabSelect SuRe (GE healthcare).
Предварительно инкубируют 105 клеток ВТ-474 (АТСС) с избытком 1 мкМ анти-HER2 антитела 1, анти-HER2 антитела 2 или PBS в течение 60 мин на льду. Затем к клеткам добавляют 300 нМ С12 или G10 плюс 20 нМ анти-myc мышиных антител 9Е10 (Roche) без промывки от блокирующих антител. После 45-мин инкубации клетки промывают, и детектируют связанные комплексы С12/9Е10 и G10/9E10 с помощью конъюгата антимышиный IgG-Аlеха488. Клетки анализируют FACS. Связывание С12 и G10 с поверхностями клеток, блокированных анти-HER2 антителом 1 или анти-HER2 антителом 2, сравнивают со связыванием с неблокированными клетками. Для того, чтобы проанализировать эффективность блокады эпитопов анти-HER2 антителом 1 и 2, к предварительно блокированным клеткам добавляют 25 нМ биотинилированных антител (биотнилирование выполняют сульфо-NHS-LC-биотином (Peirce) согласно инструкциям изготовителя), и затем осуществляют детекцию с помощью конъюгата стрептавидин-аллофикоцианин.
Результаты
Результаты эксперментов показаны на фигуре 1. Предварительная блокировка любыми антителами радикально уменьшает связывание соответствующих биотинилированных антител, что показывает, что на стадии предварительной блокировки эффективно и специфически блокируются эпитопы двух различных антител (фигура 1В).
Связывание С12 и G10 не затрагивается предварительной блокировкой ни анти-HER2 антителом 1, ни анти-HER2 антителом 2, что показывает, что оба клона связываются с различными эпитопами для анти-HER2 антитела 1 и анти-HER2 антитела 2 (фигура 1А).
Пример 3. Связывающие молекулы по изобретению имеют более сильное антипролиферативное действие, чем комбинация отдельных связывающих белков
Имеющие целью HER2 связывающие молекулы с двумя различными спцифичностями связывания создают путем слияния С12 через глицинсериновй линкер (Gly4Ser)3 с N-концом легкой цепи анти-HER2 антитела 1 (что приводит к белку, называемому COVA208) или анти-HER2 антитела 2 (что приводит к белку, называемому COVA210).
Методы
Анти-HER2 антитело 1 (SEQ ID NO: 154 и SEQ ID NO: 155), анти-НЕR2 антитело 2 (SEQ ID NO: 160 и SEQ ID NO: 163), COVA208 (SEQ Ю NO: 154 и SEQ ID NO: 159) и COVA210 (SEQ ID NO: 160, SEQ ID NO: 161) временно коэксперссируют в клетках СНО и очищают от культурального супернатанта аффинной хроматографией на колонке MabSelect SuRe (GE healthcare). Двухвалентный моносфпецифический формат клона С12 создают путем слияния через (Gly4Ser)3 с N-концом человеческого Fcγ1, что приводит к Fc-C12 (SEQ ID NO: 153). Белок экспрессируют и очищают так, как описано для анти-HER2 антитела 1, анти-HER2 антитела 2, COVA208 и COVA210.
Ингибирующее действие на рост конструкций, имеющих целью HER2, исследуют in vitro на линии опухолевых клеток NCI-N87 (закупают у АТСС). Такую линию клеток рака желудка человека, сверхэкспрессирующую HER2, выращивают в RPMI1640 (Gibco) с добавлением 10% FBS (Gibco; инактивирована при 56°С в течение 45 мин). В 96-луночный планшет высевают 7000 клеток в 100 мкл среды для роста на лунку. После инкубации при 37°С/5% СО2 в течение 24 час добавляют 20 мкл анти-HER2 конструкций Fc-C12, COVA208, COVA210, анти-HER2 антитело 1 или анти-HER2 антитело 2 или комбинации средств. Каждое условие выполняют при трехкратном повторе, и средства добавляют в трехкратных разведениях в концентрациях от 300 нМ до 0,015 нМ. В случае комбинаций каждое средство используют в указанной концентрации (например, 300 нМ Fc-C12 + 300 нМ анти-HER2 антитела 1). Через 5 суток жизнеспособность обработанных культур анализируют ХТТ (Roche). Реагент ХТТ превращается метаболически активными клетками в окрашенный продукт формазан, который поглощает свет с длиной волны 450 нм. Поглощение непосредственно коррелирует с числом живых клеток. Вычисляют жизнеспособность, %, относительно клеток, обработанных PBS, согласно формуле
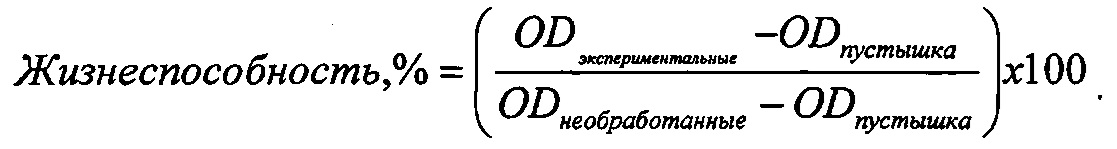
Строят график средней жизнеспособности, %, против log 10 (концентрации), и полученные кривые зависимости от дозы анализируют нелинейной регрессией с помощью программы Prism с использованием трехпараметрического уравнения
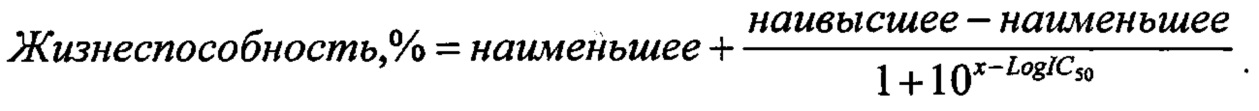
Результаты
Гибрид образованного из Fyn SH3 связывающего полипептида С12 с Fcγ1 человека по С-концу не оказывает какого-либо действия на жизнеспособность клеток (фигуры 2А и 2С). При добавлении в комбинации с анти-HER2 антителом 1 или анти-HER2 антителом 2 Fc-C12 существенно не повышает и не понижает активность указанных двух антител (фигуры 2А и 2С). Однако, когда клон С12 сливают по N-концу легкой цепи с анти-HER2 антителом 1 (COVA208) или анти-HER2 антителом 2 (COVA210) с образованием молекул с двумя различными специфичностями связывания для антигена, это усиливает антипролиферативное действие немодифицированных соответствующих антител (фигуры 2В и 2D).
В итоге, такие результаты показывают, что молекулы COVA208 и COVA210 превосходят комбинацию отдельных моноспецифических связывающих белков.
Пример 4. Антипролиферативная активность гибдридов анти-HER2 финомер-антитело различается в зависимости от относительной ориентации финомера и сайта связывания антитела
Несколько различных гибридов С12-антитело испытывают на их способность подавлять рост опухолевых клеток NCI-N87 для того, чтобы исследовать влияние места слияния, в котором образованная из Fyn SH3 последовательность присоединена к антителу.
Методы
COVA201 (SEQ ID NO: 156; SEQ ID NO: 155), COVA202 (SEQ ID NO: 154; SEQ ID NO: 157), COVA207 (SEQ ID NO: 158; SEQ ID NO: 155) и COVA208 (SEQ ID NO: 154; SEQ ID NO: 159) все представляют собой гибриды C12-анти-HER2 антитело 1, в которых клон С12 слит по С-концу тяжелой цепи (COVA201), С-концу легкой цепи (COVA202), N-концу тяжелой цепи (COVA207) и N-концу легкой цепи (COVA208). Экспрессию и очистку выполняют так, как описано для COVA208 в примере 3. Анализ на подавление роста клеток выполняют на клетках NCI-N87 как описано в примере 3.
Результаты
Обнаружено, что различные форматы С12-анти-HER2 антитело 1 проявляют различную активность (фигуры 3А и 3В). COVA208 является наиболее эффективным при подавлении роста опухолевых клеток и снижает относительную жизнеспособность до 37%. COVA207 и COVA201 показывают промежуточную активность (жизнеспособность 52% и 61% соответственно), в то время как COVA202 менее активен и снижает жизнеспособность до 67%, но все еще лучше, чем анти-HER2 антитело 1 (жизнеспособность 81-82%). Такие результаты показывают, что гибриды одной пары образованной из Fyn SH3 последовательности и антитела имеют различную активность в зависимости от места слияния, и что слияние по N-концу легкой цепи С12 с анти-HER2 антителом 1 (=COVA208) показывает самую сильную антипролиферативную активность.
Пример 5. COVA208 подавляет рост клеток ВТ-474 с более высокой эффективностью, чем анти-HER2 антитело 1
Методы
Подавление роста клеток COVA208 (SEQ ID NO: 154 и 159) сравнивают с анти-HER2 антителом 1 (SEQ ID NO: 154 и 155) на клеточной линии рака молочной железы человека ВТ-474 (закупают у АТСС). Клеточная линия, сверхэкспрессирующая HER2, является одной из самых охарактеризованных моделей для исследования активности средств, имеющих целью HER2. Клетки ВТ-474 выращивают в среде DMEM/F12 (Gibco) с добавлением 10% инактивированной нагреванием FBS (Gibco) и 10 мкг/мл человеческого рекомбинантного инсулина. Анализ выполняют так, как описано в примере 3 для клеток NCI-N87.
Результаты
COVA208 показывает более хорошую антипролиферативную активность, чем анти-HER2 антитело 1 (фигура 4).
Пример 6. COVA208 подавляет рост NCI-N87 опухоли in vivo более эффективно, чем анти-HER2 антитело 1
COVA208 исследуют in vivo на подавление роста опухоли и сравнивают с анти-HER2 антителом 1.
Методы
Имплантируют 5×106 клеток опухоли желудка (АТСС; CRL-5822) s.c. атимическим голым мышам CD-I (Charles River). Размеры опухоли и массу тела регистрируют три раза в неделю. Объем опухоли вычисляют по формуле объем = (ширина)2 × длина × π/6. Когда средний размер опухоли достигает примерно 140 мм3, что бывает через 42 дня после инокуляции опухоли, мышей произвольно распределяют на три группы обработки, включающие по шесть мышей каждая, и начинают обработку. COVA208 (SEQ ID NO: 154 и 159) и анти-HER2 антитело 1 (SEQ ID NO: 154 и 155) вводят i.p. один раз в неделю в течение четырех недель (в целом пять инъекций). Первая (ударная) доза составляет 30 мг/кг, и каждая последующая (поддерживающая) доза составляет 15 мг/кг. Мышам в контрольной группе вводят PBS.
Результаты
Обработка анти-HER2 антителом 1 приводит только с слабому подавлению роста опухоли (фигура 5). COVA208 показывает улучшенное регулирование роста опухоли на протяжении обработки по сравнению с анти-HER2 антителом 1. В день 32 опухоли у мышей, обработанных COVA208, уменьшились в объеме на 8% по сравнению с начальным размером опухоли в начале обработке (d=0), в то время как мыши, обработанные анти-HER2 антителом 1, показывают увеличение объема на 88%.
Такой результат показывает, что COVA208 показывает значительную превосходную эффективность in vivo по сравнению с анти-HER2 антителом 1.
Пример 7. COVA208 показывает in vivo РК профиль, подобный антителу
Методы
Фармакокинетический профиль COVA208 исследуют на мышах C57BL/6 (Charles River) и сравнивают с анти-HER2 антителом 1. Трем мышам C57BL инъецируют i.v. 200 мкг COVA208 (SEQ ID NO: 154 и 159) или анти-HER2 антитела 1 (SEQ ID NO: 154 и 155). Через 10 мин, 6, 24, 48, 96, 120, 144 и 168 часов отбирают кровь в покрытые ЭДТК микровете (Sarstedt), центрифугируют в течение 10 мин при 9300 g, и определяют ELISA сывороточные уровни COVA208 или анти-HER2 антитела 1. Темные титрационные микропланшеты maxisorp (Nunc) сенсибилизируют 50 нМ ECD (Bender MedSystems). После блокировки 4% молоком (Rapilait, Migros, Швейцария) в PBS добавляют 40 мкл PBS и 10 мкл сыворотки соответствующего разведения. После инкубации в течение 1 часа лунки промывают PBS, и детектируют связанные COVA208 или анти-ШЖ2 антитело 1 с помощью конъюгата белок A-HRP (Sigma). Разрабатывают анализ с флуорегенным субстратом QuantaRed (Pierce), и измеряют интенсивность флуоресценции через 5-10 мин при 544 нм (возбуждение) и 590 нм (испускание). Сывороточные уровни COVA208 и анти-HER2 антитела 1 определяют с использованием стандартной кривой COVA208 и анти-HER2 антитела 1 (каждого разведенного до 333-0,5 нг/мл). Из концентраций COVA208 и анти-HER2 антитела 1, определенных в сыворотке в различные моменты времени, и полученного наклона к фазы элиминации (на графике в полулогарифмической шкале) вычисляют время полужизни с использованием формулы t1/2=ln2/-k.
Результаты
Как видно на фигуре 6, времена полужизни COVA208 и анти-HER2 антитела 1 при определении из фазы элиминации (бета-фаза, моменты времени 24 часа - 168 час) являются весьма схожими (247 и 187 час, соответственно). Такие данные показывают, что COVA208 имеет in vivo РК свойства, схожие с лекарственными средствами.
Пример 8. COVA208 устойчив и не образует агрегатов
Целостность и устойчивость COVA208 оценивают SDS-PAGE и эксклюзионной хроматографией.
Методы
Очищенные COVA208 (SEQ ID NO: 154 и 159) и anra-HER2 антитело 1 (SEQ ID NO: 154 и 155) анализируют SDS-PAGE. В 4-12% гель Bis/Tris Novex в рабочем буфере 1х MOPS (Invitrogen) загружают 4 мкг белка или с уменьшенным или с неуменыпенным числом дисульфидных связей вместе с маркером молекулярной массы (RPN800e; GE healthcare). Полосы белка визуализируют окрашиванием кумасси.
Профиль эксклюзионной хроматографии (SEC) COVA208 определяют сразу же после очистки, а также после хранения белка в PBS при 4°С в течение одного или двух месяцев. Загружают 100 мкл COVA208 в концентрации 1,75 мг/мл в колонку с супердексом 200 10/300 GL в PBS (GE healthcare) при скорости потока 0,5 мл/мин, и контролируют элюирование из колонки, считывая OD280.
Результаты
Результаты SDS-PAGE и профили SEC COVA208 приводятся на фигуре 7. COVA208 при SDS-PAGE просматривается в ясно определяемых полосах с ожидаемой молекулярной массой (верхняя часть). Особый интерес представляет тот результат, что не имеется нативной легкой цепи, детектируемой в COVA208 (MW вблизи 30 кД), что указывает, что не происходит отщепление образованного из Fyn SH3 клона С12 от легкой цепи антитела.
COVA208, элюированный в одном главном пике, образует «колонку» SEC с объемом удерживания 13,1 мл (наименьший). Анти-HER2 антитело 1 элюируется при 13,2 мл. Что наиболее важно, в препарате белка COVA208 не обнаруживается никаких агрегатов, которые могли бы элюироваться при примерно 8 мл. Профиль SEC COVA208 не изменяется после двух месяцев хранения при 4°С. Пик элюции остается узким, симметричным и появляется при том же объеме удерживания. Препарат белка остается свободным от агрегатов после 1 и 2 месяцев хранения. Это показывает, что COVA208 остается устойчивым в течение продолжительных периодов хранения при 4°С. В итоге, такие результаты подтверждают, что COVA208 представляет собой устойчивую монодисперсную молекулу с оптимальными биофизическими свойствами.
Пример 9. COVA208 имеет превосходную ингибирующую активность по сравнению с анти-HER2 антителом 1 на панели из десяти линий опухолевых клеток, сверхэкспрессирующих HER2
Антиролиферативную активность COVA208 (SEQ ID NO: 154 и 159) сравнивают с анти-HER2 антителом 1 (SEQ ID NO: 154 и 155) на различных HER2-положительных клеточных линиях. Анализы с ХТТ выполняют по существу так, как описано в примере 3. Клеточные линии, используемы в данном эксперименте, и экспериментальные условия приводятся в таблице 1. Кривые дозовой зависимости подбирают к трехпараметрическому уравнению, как описано в примере 3, и максимальное подавление роста вычисляют по формуле
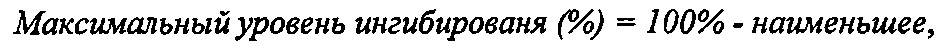
при этом переменную наименьшее определяют из нелинейной регрессии кривых дозовой зависимости с использованием формулы
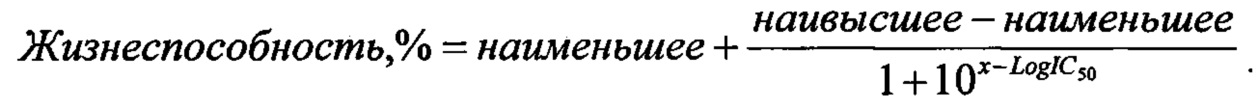
Результаты таких анализов показаны на фигуре 9. Фигуры 9А и 9В показывают кривые дозовой зависимости, полученные на клеточных линиях ОЕ19 и Calu-3, соответственно. Фигура 9С представляет максимальное подавление роста, полученное на каждой клеточной линии с COVA208 и анти-HER2 антителом 1, включая результаты на клеточных линиях NCI-N87 и ВТ-474, показанные на фигурах 2 и 4. COVA208 показывает улучшенную антипролиферативную активность по сравнению с анти-HER2 антителом 1 на 10 клеточных линиях.
Пример 10. COVA208 индуцирует апоптоз в клетках рака желудка NCI-N87
Способность COVA208 индуцировать апоптоз исследуют на клетках NCI-N87, анализируя ферментативную активность каспазы 3/7 и детектируя фрагментацию ДНК окрашиванием TUNEL.
Методы
Анализ каспазы 3/7. 45000 клеток NCI-N87 высевают в лунки 96-луночного титрационного микропланшета. На следующий день к клеткам добавляют 100 нМ анти-HER2 антитела 1 (SEQ ID NO: 154 и 155), COVA208 (SEQ ID NO: 154 и 159) или PBS при трехкратном повторе. В качестве положительного контроля добавляют 1 мкМ стауроспорина. После двухсуточной инкубации определяют активность каспазы-3 и каспазы-7 с использованием набора fluorescence Apo-ONE® homogenous caspase-3/7 (Pierce).
Жизнеспособность обработанных культур анализируют ХТТ параллельно на планшетах для перепечатывания колоний микроорганизмов, и жизнеспособность, %, относительно образцов, обработанных PBS, вычисляют так, как описано в примере 3. Активность каспазы 3/7 делят на жизнеспособность, %, и получают нормализованную активность каспазы 3/7.
Анализ с TUNEL. В 6-луночных планшетах распределяют 0,8×106 клеток NCI-N87. На следующий день к клеткам добавляют 300 нМ анти-HER2 антитела 1 (SEQ ID NO: 154 и 155), COVA208 (SEQ ID NO: 154 и 159) или PBS. В качестве положительного контроля добавляют 1 мкМ стауроспорина. После трехсуточной инкубации клетки отделяют, фиксируют в формалине, пропитывают 70% холодным этанолом, и 3'-гидроксильные концы ДНК метят комплексом флуоресцеин-дезоксиуридинтрифосфат (FITC-dUTP) с использованием набора APO-DIRECT (Phoenix flow systems). Меченые клетки анализируют FACS, и определяют % TUNEL-положительных клеток с помощью воротного механизма в отношении популяции FITC-dUTP-положительных клеток.
Результаты
Результаты анализа каспазы 3/7 показаны на фигуре 10А. COVA208 приводит к повышенной активности каспазы 3/7, что показывает, что COVA208 индуцирует апоптоз клеток NCI-N87. Анти-HER2 антитело 1 не участвует в индуцированной активности каспазы 3/7.
Результаты анализа с TUNEL приводятся на фигуре 10В. COVA208 индуцирует фрагментацию ДНК в большинстве клеток, что также подтверждает, что COVA208 способен индуцировать апоптоз, в то время как анти-НЕR2 антитело 1 неспособно.
Пример 11. COVA208 ингибирует лигандзависимую и лиганднезависимую передачу сигнала, опосредуемую HER2
Активация HER2 передачи сигнала вперед ведет к фосфорилированию НЕR3, что приводит к активации метаболического пути PI3K-Akt-mTOR или к активации пути MARK/Erk. В линиях опухолевых клеток, которые отображают достаточно высокую плотность HER2 на поверхности, такие нижележащие пути (downstream) также могут быть активированы лигандами HER3, которые промотируют образование гетеродимера HER2-HER3 (лигандзависимая передача сигнала).
Для того чтобы исследовать действие COVA208 на передачу сигнала вперед HER2, сверхэеспрессирующие HER2 клетки NCI-N87 обрабатывают COVA208 (SEQ ID NO: 154 и 159), анти-HER2 антителом 1 (SEQ ID NO: 154 и 155), анти-HER2 антителом 2 (SEQ ID NO: 160 и 163) и PBS, и анализируют клеточные лизаты на фосфорбелки иммуноблоттингом.
Анализ также выполняют на клетках MCF-7, слабоэкспрессирующих HER2, в которых фосфорилирование вперед запускается только после добавления лиганда HER3 герегулина-1β.
Методы
Клетки NCI-N87 (АТСС; CRL-5822) распределяют в 6-луночных культуральных планшетах в полной среде по 1×106 клеток в 3 мл на лунку. После инкубации в течение ночи при 37°С/5% СО2 добавляют 40 мкг/мл анти-HER2 средств, и клетки инкубируют при 37°С/5% СО2 в течение 72 час. Затем клетки лизируют на льду в буфере для лизиса клеток, содержащем 1% тритона-Х, и смеси ингибитора протеазы и ингибитора фосфатазы (Roche Applied Sciences).
Клетки MCF-7 (АТСС; НТВ-22) культивируют в MEM (Gibco) + 10% FBS (Gibco). Клетки распределяют в 6-луночных культур альных планшетах по 0,5×106 клеток в 3 мл на лунку. После инкубации в течение ночи при 37°С/5% СО2 клетки выдерживают в среде без сыворотки в течение 3 час, затем добавляют 40 мкг/мл анти-HER2 средств в течение 1 часа, в течение которого клетки выдерживают при 37°С/5% СО2. Через 45 мин в течение 15 мин добавляют 2 нМ человеческий рекомбинантный герегулин-1β (R&D systwems). Затем клетки лизируют на льду в буфере для лизиса клеток, содержащем 1% тритона-Х, и смеси ингибитора протеазы и ингибитора фосфатазы (Roche Applied Sciences).
Полные клеточные лизаты осветляют центрифугированием при 16000×g в течение 10 мин при 4°С, и в осветленных лизатах определяют концентрацию белка Брэдфорд-анализом (Bio-RAD). Отделяют 10 мкг белка на 4-12% бис-трис-гелях Novex® (Invitrogen), и переносят на PVDF мембрану.
Фосфобелки детектируют на PVDF мембране с помощью антител против pHER3Y1289 (Millipore), pAktS473 (CST) или pErk1/2T202/Y204 (CST), затем вторичных конъюгированных с HRP антител (Jackson Immuno Research). Винкулин детектируют с помощью винкулинспецифических антител (Millipore), и он служит в качестве нагружающего контроля. Иммуноблотты проявляют хемилюминесцентным субстратом HRP с затравкой ECD (GE healthcare) и выставляют на рентгеновском снимке.
Результаты
Результаты данного эксперимента показаны на фигуре 11. В клетках MCF-7, в которых активация HER2 передачи сигнала вперед требует лиганды HER3, COVA208 и анти-HER2 антитело 1 - оба блокируют фосфорилирование HER3, Akt и Erk1/2 в равной степени хорошо, что показывает, что COVA208 сохраняет активность своего родительского антитела. Напротив, анти-HER2 антитело 2 не блокирует лигандзависимое фосфорилирование HER3, Akt или Erk1/2.
В клетках NCI-N87, где фосфорилирование белков передачи сигнала вперед HER2 происходит независимо от лигандов HER3, COVA208 эффективно блокирует фосфорилирование НЕR3, Akt или Erk1/2, в то время как анти-HER3 антитело 1 не блокирует фосфорилирование. Анти-HER2 антитело 2 также способно эффективно блокировать передачу сигнала HER2 в таких условиях. Такие результаты показывают, что COVA208 блокирует лигандзависимые, а также лиганднезависимые события передачи сигнала вперед HER2, в отличие от анти-HER2 антител 1 и 2, которые блокируют одно событие, но не блокируют другое.
Пример 12. COVA208 интернализуется клетками NCI-N87
Для того, чтобы исследовать промотирует ли COVA208 интернализацию рецептора HER2 in vitro, клетки NCI-N87 культивируют в присутствии COVA208 (SEQ ID NO: 154 и 159) или анти-HER2 антитела 1 (SEQ ID NO: 154 и 155) с последующей фиксацией и пропитыванием клеток и последующей детекцией анти-HER2 средств при помощи вторичного антитела флуоресценции. Микроскопические изображения используют для оценки субклеточного распределения сигнала флуоресценции.
Методы
Клетки NCI-N87, выращенные в боковых лунках камеры Lab-Tek II СС2, метят по поверхности на льду в течение 1 часа 100 нМ COVA208 или анти-НЕR2 антителом 1. Затем несвязанное анти-HER2 средство отмывают. В качестве положительного контроля в некоторые лунки добавляют 1 мкМ гелданамицин (ингибитор Hsp90), который вызывает быструю интернализацию HER2. Клетки переносят в условия 37°С/5% СО2 на 0 час или 5 час для возможности интернализации, затем фиксируют формалином и пропитывают сапонином. Меченное Alexa488 антитело против человеческого IgG (Invitrogen) используют для детекции анти-HER2 средств на пропитанных клетках, и окрашивают ядра красителем Hoechst 33342. Окрашенные клетки анализируют на лазерном сканирующем конфокальном микроскопе Leica TCS SP2-AOBS. Оптические срезы (z-стеки, d=0,2 мкм) собирают и анализируют три участка. Количество анти-HER2 средств, которые локализуются в отдельных точечных образованиях, определяют с помощью программы Imaris 7.4.0 (Bitplane) с использованием наружного инструмента для детектируемых сфероидных образований и выражают в процентах анти-HER2 средств, присутствующих в точках:
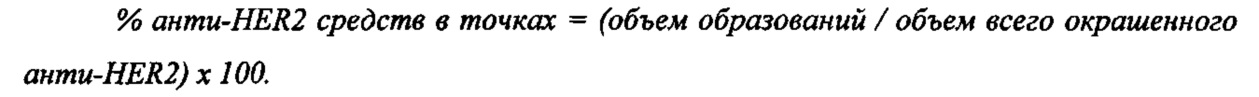
Результаты
После поверхностного мечения и перед инкубацией при 37°С COVA208 и анти-HER2 антитело 1 локализуются на клеточной мембране. После 5-часовой инкубации при 37°С COVA208 присутствует в отдельных точках в цитозоле, хотя клеточная мембрана только слабо окрашена. Напротив, анти-HER2 антитело 1 после 5-часовой инкубации при 37°С заключено в клеточной мембране, и в цитозоле обнаруживается только совсем мало точек. При совместной инкубации с гелданамицином анти-HER2 антитело 1 также обнаруживается в точках, и клеточная мембрана отрицательна для антитела. Такие результаты показывают, что, в отличие от анти-HER2 антитела 1, COVA208 быстро интернализуется в клетки NCI-N87.
Количественное определение % окрашиваний, появляющихся в точках, показано на фигуре 12. Большая часть COVA208 локализуется в точках, в то время как только небольшая часть анти-HER2 антитела 1 обнаруживается в точках.
Пример 13. COVA208 подавляет рост опухоли молочной железы KPL-4 in vivo более эффективно, чем анти-HER2 антитело 1
COVA208 исследуют in vivo на опухолях молочной железы KPL-4 на подавление роста и сравнивают с анти-HER2 антителом 1.
Методы
Клетки опухоли молочной железы человека KPL-4 (3×106, Kurebayashi et al. (1999), Br. J. Cancer., 79; 707-717) имплантируют в жировой слой молочной железы самкам мышей с врожденным отсутствием клеток-киллеров SCID (Charles River). Размеры опухоли и массу регистрируют три раза в неделю. Объем опухоли вычисляют согласно формуле объем = (масса)2 × длина × π/6. Когда средний размер опухоли достигает 70 мм3, мышей произвольно распределяют в три группы обработки, включающие по восемь мышей каждая, и начинают обработку. COVA208 (SEQ ID NO: 154 и 159), анти-HER2 антитело 1 (SEQ ID NO: 154 и 155) или PBS вводят i.p. один раз в неделю в течение четырех недель (всего пять инъекций). Первая (ударная) доза составляет 30 мг/кг, и каждая последующая (поддерживающая) доза составляет 15 мг/кг.
Результаты
Обработка анти-HER2 антителом 1 приводит только к совсем небольшому подавлению роста опухоли (фигура 13). COVA208 показывает существенно лучшее регулирование роста опухоли. Такой результат также подтверждает, что COVA208 показывает существенно лучшую эффективность in vivo по сравнению с анти-HER2 антителом 1.
Пример 14. Определение эпитопа HER2, связанного образованным из Fyn SH3 полипептидом С12
Эпитоп, связанный образованным из Fyn SH3 полипептидом С12 (SEQ ID NO: 1) на HER2, идентифицируют подходом с аланинсканирующей мутацией, и выполняют это в Integral Molecular Inc. (Филадельфия, США). Библиотеку мутаций созданных с помощью shotgun мутагенеза создают так, как описано в Paes et al. (2009), J. Am. Chem. Soc, 131(20): 6952-6954. Коротко, конструируют эукариотическую экспрессирующую плазмиду, кодирующую полноразмерный человеческий HER2, с С-концевой меткой эпитопа V5His. С использованием в качестве матрицы конструкции исходной кДНК, во внеклеточный домен HER2 вводят мутации аминокислот на аланин для сканирования (аминоксилоты 23-652 SEQ ID NO: 171) с использованием мутагенеза на основе ПЦР. Остатки, которые уже представляют собой аланин в исходной конструкции, мутируют в метионин. Мутированные конструкции и исходную контрольную конструкцию HER2 экспрессируют в клетках НЕК-293Т. Через двадцать четыре часа после трансфекции клетки промывают PBS и фиксируют в 4% параформальдегиде. Клетки инкубируют с контрольным моноклональным анти-HER2 антителом (МАВ1129, R&D Systems) или с образованным из Fyn SH3 клоном С12 (экспрессированным как N-концевой гибрид с Fc) в PBS с Ca2+/Mg2+ (PBS++) и 10% нормальной козьей сывороткой (NGS) в течение 1 часа. После двух промывок в PBS клетки инкубируют с козьими античеловеческими конъюгированными с Alexa Fluor 488 вторичными антителами (Jackson, West Grove, РА) в PBS++ и NGS в течение 1 часа с последующими 2 промывками в PBS. Проводят измерения в микропланшетах поточной цитометрией с использованием системы скрининга Intellicyt HTFC и осуществляют количественную оценку с использованием программы Forecyt (Intellicyt Corporation, Albuquerque, NM).
Обнаружено, что образованный из Fyn SH3 полипептид С12 (SEQ ID NO: 1) связывается с эпитопом HER2, который располагается в домене IHER2 (SEQ ID NO: 172). Подробнее, идентифицируют пять мутаций на аланин, которые приводят к заметно уменьшенному связыванию связывающих молекул, включающих образованный из Fyn SH3 полипептид С12 (SEQ ID NO: 1), в то время как связывание контрольных антител МАВ1129 сохраняется. Такие мутации включают Т166А, R188A, Р197А, S202A and R203A при сравнении с последовательностью SEQ ID NO: 172. Иными словами, по меньшей мере, аминокислотные позиции Т166, R188, Р197, S202 and R203 домена I HER2 вовлекаются в связывание между образованным из Fyn SH3 полипептидом С12 и HER2.
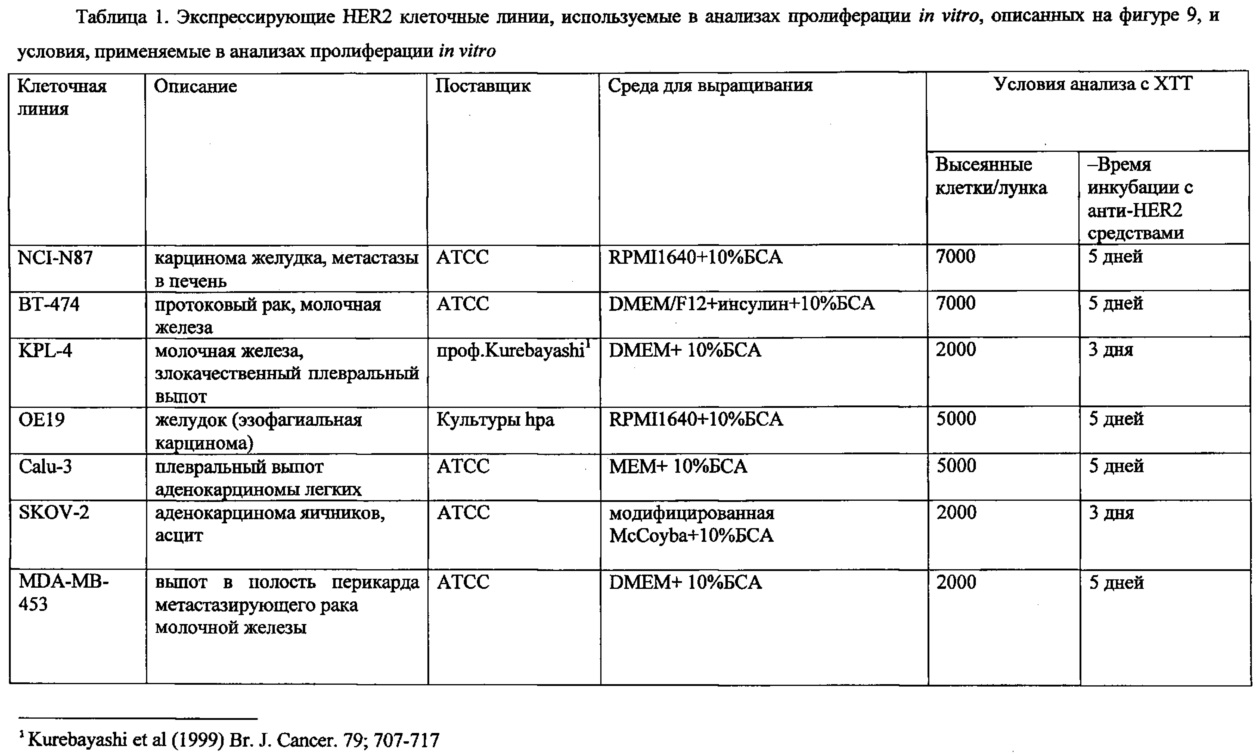

Реферат
Настоящая группа изобретений относится к биотехнологии и медицине. Предложены связывающая молекула, специфически связывающаяся с двумя различными эпитопами на HER2, и способ ее получения, а также кодирующая ее молекула нуклеиновой кислоты, экспрессирующий вектор, включающий эту молекулу нуклеиновой кислоты, клетка-хозяин для экспрессии связывающей молекулы, трансформированная экспрессирующим вектором, и фармацевтическая композиция для лечения рака, включающая связывающую молекулу, или молекулу нуклеиновой кислоты ее кодирующую, или экспрессирующий вектор. Предложенная связывающая молекула включает первый полипептид, содержащий аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO:1, и второй полипептид, являющийся антителом, с тяжелой и легкой цепями, содержащими аминокислотные последовательности, по меньшей мере на 95% идентичные SEQ ID NO:154 и SEQ ID NO:155 соответственно. Связывающая молекула эффективно подавляет рост опухолевых клеток и показывает высокую антипрофилиративную активность. Предложенная группа изобретений может быть использована в медицине в противоопухолевой терапии. 6 н. и 11 з.п. ф-лы, 13 ил., 1 табл., 14 пр.
Формула
Документы, цитированные в отчёте о поиске
Композиция антител к her2

Комментарии