Композиция антител к her2 - RU2361880C2
Код документа: RU2361880C2
Чертежи



























Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к композиции, включающей основной вид антитела к HER2, которое связывается с доменом II в HER2, или к варианту его аминокислотной последовательности, включающему лидерное удлинение на амино-конце. Изобретение также относится к фармацевтическим композициям, включающим указанную композицию, и к вариантам терапевтического использования такой композиции.
Предпосылки создания изобретения
Антитела к Her2
Семейство рецепторов HER2 тирозинкиназ представляет собой важные модуляторы роста, дифференциации и выживания клеток. Указанное семейство рецепторов включает четыре разных представителя, включая рецепторы эпидермального фактора роста (EGFR, ErbB1 или HER1), HER2 (ErbB2 или p185neu), HER3 (ErbB3) и HER4 (ErbB4 или tyro2).
EGFR, кодируемый геном erbB1, вовлекается в процесс злокачественного роста у человека. В частности, повышенная экспрессия EGFR наблюдается при раке молочной железы, мочевого пузыря, легкого, головы, шеи и желудка, а также в случае глиобластомы. Повышенная экспрессия рецептора EGFR часто ассоциирована с повышенной продукцией лиганда EGFR, трансформирующего фактора роста альфа (TGF-α), одними и теми же опухолевыми клетками, приводя к активации рецептора через путь аутокринной стимуляции (Baselga and Mendelsohn Pharmac Ther. 64: 127-154 (1994)). Моноклональные антитела против EGFR или его лигандов, TGA-α и EGF, рассматриваются как терапевтические средства при лечении таких видов злокачественных новообразований (см., например, Baselga and Mendelsohn, выше; Masui et al., Cancer Research, 44: 1002-1007 (1984) и Wu et al., J. Clin. Invest., 95: 1897-1905 (1995)).
Второй представитель семейства HER, p185neu, вначале был идентифицирован как продукт трансформирующего гена из нейробластом крыс, которым вводили химический препарат. Активированная форма протоонкогена neu возникает в результате точечной мутации (замена валина на глютаминовую кислоту) в трансмембранном участке кодируемого белка. Амплификация человеческого гомолога neu наблюдается при раке молочной железы и яичника и коррелирует с плохим прогнозом (Slamon et al., Science, 235: 177-182 (1987); Slamon et al., Science, 244: 707-712 (1989); патент США № 4968603). К настоящему времени в опухолях человека не выявлены точечные мутации, аналогичные neu протоонкогену. Суперэкспрессия HER2 (зачастую, но не полностью в соответствии с генной амплификацией) также наблюдается при других карциномах, включая карциномы желудка, эндометрия, слюнной железы, легкого, почки, толстой кишки, щитовидной железы, поджелудочной железы и мочевого пузыря (см., в числе других, King et al., Science, 229: 974 (1985); Yokota et al., Lamcet 1: 765-767 (1986); Fukushige et al., Mol. Cell. Biol., 6: 955-958 (1986); Guerin et al., Oncogene Res., 3: 21-31 (1988); Cohen et al., Oncogene, 4: 81-88 (1989); Yonemura et al., Cancer Res., 51: 1034 (1991); Borst et al., Gynecol. Oncol., 38: 364 (1990); Wеiner et al., Cancer Res., 50: 421-425 (1990); Kern et al., Cancer Res., 50: 5184 (1990); Park et al., Cancer Res., 49: 6605 (1989); Zhau et al., Mol. Carcinog., 3: 254-257 (1990); Aasland et al., Br. J. Cancer., 57: 358-363 (1988); Williams et al., Pathobiology 59: 46-52 (1991); и McCann et al., Cancer, 65: 88-92 (1990)). HER2 может суперэкспрессироваться при раке предстательной железы (Gu et al., Cancer Lett., 99: 185-9 (1996); Ross et al., Hum Pathol., 28: 827-33 (1997); Ross et al., Cancer 79: 2162-70 (1997) и Sadasivan et al., J. Urol., 150: 126-31 (1993)).
Антитела против крысиного p185neu и белковых продуктов человеческого HER2, описанные Дребином с соавторами (Drebin et al.), вызывают образование антител против генного продукта neu крыс, p185neu (см., например, Drebin et al., Cell., 41: 695-706 (1985); Myers et al., Meth. Enzym., 198: 277-290 (1991); и WO 94/22578). Дребин с соавторами (Drebin et al., Oncogene, 2: 273-277 (1988)) показали, что смеси антител, активных в отношении двух разных участков на p185neu, приводят к синергическим противоопухолевым эффектам на neu-трансформированных клетках NIH-3T3, имплантированных мышам nude (см., также патент США № 5824311, выданный 20 октября 1998 года).
Худзиак с соавт. (Hudziak et al., Mol. Cell. Biol., 9(3): 1165-1172 (1989)) описывают получение панелей антител к HER2, которые были охарактеризованы с использованием клеточной линии опухоли молочной железы человека SK-BR-3. Относительную пролиферацию клеток SK-BR-3 после экспозиции с антителами определяют по окрашиванию монослоев кристаллическим фиолетовым через 72 часа. В рамках данного теста определяют максимальное ингибирование антителом, названным 4D5, которое ингибирует клеточную пролиферацию на 56%. Другие антитела в рассматриваемой панели снижают клеточную пролиферацию в меньшей степени по данным данного теста. Было также показано, что антитело 4D5 сенсибилизирует клеточную линию опухоли человека, осуществляющую суперэкспрессию HER2, к цитотоксическим эффектам TNF-α (см. также патент США № 5677171, выданный 14 октября 1997 года). Описанные Худзиаком с соавт. (Husziak et al.) антитела к HER2 были также охарактеризованы другими авторами (Fendly et al., Cancer Research, 50: 1550-1558 (1990); Kotts et al., In Vitro 26(3): 59A (1990); Sarup et al., Growth Regulation, 1: 72-82 (1991); Shepard et al., J. Clin Immunol., 11(3): 117-127 (1991); Kumar et al., Mol. Cell. Biol., 11(2): 979-986 (1991); Lewis et al., Cancer Immunol. Immunother., 37: 255-263 (1993); Pietras et al., Oncogene, 9: 1829-1838 (1994); Vitеtta et al., Cancer Research, 54: 5301-5309 (1994); Sliwkowski et al., J. Biol. Chem., 269(20): 14661-14665 (1994); Scott et al., J. Biol. Chem., 266: 14300-5 (1991); D'souza et al., Proc. Natl. Acad. Sci., 91: 7202-7206 (1994); Lewis et al., Cancer Research, 56: 1457-1465 (1996) и Schaefer et al., Oncogene, 15: 1385-1394 (1997)).
Рекомбинантная гуманизированная версия мышиного антитела HER2 4D5 (huMab4D5-8, rhuMab HER2, Трастузумаб (Trastuzumab) или HERCEPTIN®; патент США № 5821337) клинически активна у пациентов с метастазирующими раковыми опухолями молочной железы, осуществляющими суперэкспрессию HER2, которым проводилась предшествующая обширная противораковая терапия (Basegla et. al., J. Clin. Oncol., 14: 737-744 (1996)). Трастузумаб (Trastuzumаb) был одобрен Агентством по контролю за лекарственными и пищевыми продуктами США (Food and Drug Аdministration) 25 сентября 1998 года для лечения пациентов с метастазирующими раковыми опухолями молочной железы, в случае если опухоли осуществляют суперэкспрессию HER2 белка.
В литературе также описаны другие антитела к HER2 с различными свойствами (Tagliabue et. al., Int J. Cancer., 47: 933-937 (1991); McKenzie et. al., Oncogene, 4: 543-548 (1989); Maier et. al., Cancer Res., 51: 5361-5369 (1991); Bacus et. al., Molеcular Carcinogenesis, 3: 350-362 (1990); Stancovski et. al., PNAS (USA) 88: 8691-8695 (1991); Bacus et. al., Cancer Research, 52: 2580-2589 (1992); Xu et. al., Int. J. Cancer 53: 401-408 (1993); WO 94/00136; Kasprzyk et. al., Cancer Research, 52: 2771-2776 (1992); Hancock et. al., Cancer Res., 51: 4575-4580 (1991); Shawver et. al., Cancer Res., 54: 1367-1373 (1994); Arteaga et. al., Cancer Res., 54: 3758-3765 (1994); Harwerth et. al., J. Bol. Chem., 267: 15160-15167 (1992); патент США № 5783186 и Klapper et. al., Oncogene 14: 2099-2109 (1997)).
Скрининг с целью выявления гомологов привел к идентификации двух других представителей семейства рецепторов HER: HER3 (патенты США №№ 5183884 и 5480968, а также Kraus et. al., PNAS (USA) 86: 9193-9197 (1989)) и HER4 (заявка на патент EР № 599274; Plowman et. al., Proc. Natl. Acad. Sci. USA, 90: 1746-1750 (1993) и Plowman et. al., Nature, 366: 473-475 (1993)). Оба указанных рецептора проявляют повышенную экспрессию по меньшей мере в некоторых клеточных линиях рака молочной железы.
Рецепторы HER в основном найдены в различных сочетаниях в клетках и считается, что гетеродимеризация повышает разнообразие клеточных ответов на множество лигандов HER (Earp et. al., Breast Cancer Research and Treatment 35: 115-132 (1995)). EGFR связывается с шестью разными лигандами: эпидермальный фактор роста (EGF), трансформирующий фактор роста альфа (TGF-α), афирегулин, гепаринсвязывающий эпидермальный фактор роста (HB-EGF), бетацеллюлин и эпирегулин (Groenen et. al., Growth Factors, 11: 235-257 (1994)). Семейство белков герегулинов, получаемых при альтернативном сплайсинге одного гена, дает лиганды для HER3 и HER4. Семейство герегулинов включает герегулины альфа, бета и гамма (Holmes et. al., Science, 256: 1205-1210 (1992); патент США № 5641869; и Schaefer et. al., Oncogene, 15:1385-1394 (1997)), факторы дифференциации neu (NDF), глиальные факторы роста (GGF), фактор, индуцирующий активность ацетилхолинового рецептора (ARIA), и фактор, образуемый из сенсорных и двигательных нейронов (SMDF). В литературе имеются соответствующие обзоры (см. Groenen et. al., Growth Factors, 11: 235-257 (1994); Lemke et al., G. Molec & Cell. Neurosci., 7: 247-262 (1996) и Lee et. al., Pharm. Rev., 47: 51-85 (1995)). Недавно были идентифицированы три дополнительных лиганда HER: нейрегулин-2 (NRG-2), который, как сообщается, связывается с HER3 или HER4 (Chang et. al., Nature 387: 509-512 (1997); и Carraway et. al., Nature, 387: 512-516 (1997)), нейрегулин-3, который связывается с HER4 (Zhang et. al., PNAS (USA), 94(18): 9562-7 (1997)), и нейрегулин-4, который связывается с HER4 (Harari et. al., Oncogene, 18: 2681-89 (1999)), HB-EGF, бетацеллюлин и эпирегулин также связываются с HER4.
Поскольку EGF и TGF-α не связываются с HER2, EGF стимулирует EGFR и HER2 к образованию гетеродимера, который активирует EGFR, что проводит к фосфорилированию HER2 в гетеродимере. Димеризация и/или трансфосфорилирование, по всей видимости, активируют тирозинкиназу HER2 (см., Earp et. al., выше). Аналогично, в том случае когда HER3 совместно экспрессируется с HER2, образуется активный сигнальный комплекс и антитела, направленные против HER2, способны разрушать данный комплекс (Sliwkowski et. al., J. Biol. Chem., 269(20): 14661-14665 (1994)). Дополнительно, аффинность HER3 в отношении гетерорегулина (HRG) повышается до более высокого уровня аффинности в случае совместной экспрессии с HER2 (см. также Levi et. al., Journal of Neuroscience 15: 1329-1340 (1995); Morrissey et. al., Proc. Natl. Acad. Sci. USA 92: 1431-1435 (1995); и Lewis et. al., Cancer Res., 56: 1457-1465 (1996) в том, что касается белкового комплекса HER2-HER3. HER4, как и HER3, образует активный сигнальный комплекс с HER2 (Carraway and Cantley, Cell, 78: 5-8 (1994)).
Для воздействия на сигнальную систему HER был разработано антитело rhuMAb 2C4 (Pertuzumab, OMNITARGTM) как гуманизированное антитело, которое ингибирует димеризацию HER2 с другими HER рецепторами, что приводит к ингибированию осуществляемых под действием лиганда фосфорилирования и активации, а также пути активации RAS и АКТ в направлении считывания информации. На фазе I испытаний Пертузумаба (Pertuzumab) в качестве единственного средства для лечения солидных опухолей 3 субъектов с развитым раком яичников подвергали лечению Пертузумабом. У одного пациента отмечался стойкий частичный ответ, а у другого пациента отмечалось стабилизация заболевания в течение 15 недель (Agus et. al., Proc. Am. Soc. Clin. Oncol., 22:192, Abstract 771 (2003)).
Композиции, включающие вариант антитела
В патенте США № 6339142 описывается композиция с антителом к HER2, включающая смесь антитела против HER2 и одного или нескольких его вариантов, где количество активного(ых) варианта(ов) составляет менее, чем примерно 25%. Трастузумаб (Trastuzumab) представляет собой пример антитела к HER2.
Райд с соавт. (Reid et. al.) в постерной презентации на фармацевтической конференции (Well Characterized Biotech Phаrmaceutical Conference) (январь 2003 года) в докладе, посвященном эффектам изменений клеточной культуры на характеристике гуманизированного антитела («Effects of Cell Culture Process Changes on Humanized Antibody Characteristics»), описывает композицию с неназванным гуманизированным IgG1 антителом, содержащим N-концевую гетерогенную структуру, созданную комбинацией VHS сигнального пептида, N-концевого глютамина и пироглютаминовой кислоты в его тяжелой цепи.
Рид с соавт. (Reed et. al) в постерной презентации на конференции, посвященной получению антител (IBC Antibody Production Conference) (февраль 2002 года) в докладе, посвященном роли хроматографического метода в оценке антител («The Ideal Chromatographic Antibody Characterization Method»), описывает способ удлинения VHS- тяжелой цепи E25, представляющего собой гуманизированное IgG1 антитело.
Раус с соавт. (Rouse et. al.) в постерной презентации на конференции WCBP (6-9 января 2004 года) в докладе, посвященном методам оценки гликопротеина («Top Down' Glycoprotein Characterization by High Resolution Mass Spectometry and Its application to Biopharmaceutical Development»), описывают композицию на основе моноклонального антитела, включающего N-концевую гетерогенную структуру, полученную из остатков сигнального-3AHS или-2HS пептида, на их легкой цепи.
В презентации на IBC конгрессе (IBC Meeting) (сентябрь 2000 года) Джилл Портер (Jill Porter) представил стратегический подход, связанный с использованием сравнительных исследований и тестов для характеристики биологических препаратов («Strategic Use of Comparability Studies and Assay for Well Characterized Biologicals»), в котором обсуждается получаемая на поздних этапах элюции форма ZENАPAXTM, включающая три дополнительных аминокислотных остатка на тяжелой цепи.
Краткое описание сущности изобретения
Настоящее изобретение относится к композиции, включающей основной вид антитела к HER2, которое связывается с доменом II в HER2, и варианту по аминокислотной последовательности, включающему лидерное удлинение на аминоконце.
Дополнительно, настоящее изобретение относится к композиции, включающей смесь основного вида антитела к HER2, содержащего последовательности вариабельных участков легкой и тяжелой цепей SEQ ID NO: 3 и 4 соответственно и вариант аминокислотной последовательности основного вида антитела, включающий VHS-лидерное удлинение на аминоконце, присоединенной к одному или двум вариабельным доменам легкой цепи, где от примерно 1% до примерно 20% молекул антитела в композиции включают VHS-лидерное удлинение на аминоконце.
Настоящее изобретение также относится к полипептиду, включающему аминокислотную последовательность SEQ ID NO: 23 или ее дезамидированный и/или окисленный вариант, а также к антителу, включающему (а) легкую цепь, содержащую данный полипептид, и (b) тяжелую цепь, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 16, SEQ ID NO: 24 и дезамидированного и/или окисленного варианта SEQ ID NO: 16 или SEQ ID NO: 24.
Настоящее изобретение также относится к фармацевтическому препарату, включающему композицию в фармацевтически приемлемом носителе, и к способу лечения HER2-экспрессирующего рака у пациента, включающему введение пациенту указанного фармацевтического препарата в количестве, эффективном для лечения рака.
Краткое описание фигур
На фиг.1 представлена схема белковой структуры HER2 и аминокислотных последовательностей домена I-IV (SEQ ID NO: 19-22 соответственно) его внеклеточного домена.
На фиг.2А и 2В показаны результаты сопоставления аминокислотных последовательностей вариабельного легкого (VL) (фиг.2А) и вариабельного тяжелого (VH) (фиг.2В) доменов мышиного моноклонального антитела 2С4 (SEQ ID NO: 1 и 2 соответственно); VL и VH доменов гуманизированного антитела 2С4 версии 574 (SEQ ID NO: 3 и 4 соответственно) и консенсусных последовательностей каркасных участков VL и VH (hum κ1, легкая каппа, подгруппа I, humIII, тяжелая, подгруппа III) (SEQ ID NO: 5 и 6 соответственно). Стрелки указывают на различия между гуманизированным вариантом 2С4 574 и мышиным моноклональным антителом 2С4 или между гуманизированным антителом 2С4 574 и мышиным моноклональным антителом 2С4 и каркасным участком человеческой молекулы. В скобках показаны гипервариабельные участки (CDR).
На фиг.3А и 3В показаны аминокислотные последовательности легкой цепи (SEQ ID NO: 15) и тяжелой цепи (SEQ ID NO: 16) Пертузумаба (Pertuzumab). CDR выделены жирным шрифтом. Углеводный фрагмент присоединен к Asn 299 в тяжелой цепи.
На фиг.4А и 4В показаны аминокислотные последовательности легкой цепи (SEQ ID NO: 17) и тяжелой цепи Пертузумаба, каждая из которых включает интактную последовательность сигнального пептида на аминоконце (SEQ ID NO: 18).
На фиг.5 схематически показано связывание 2С4 в сайте связывания гетеродимера в HER2, что препятствует гетеродимеризации с активированным EGFR или HER3.
На фиг.6 показано спряжение HER2/HER3 с путями MAРK и Akt.
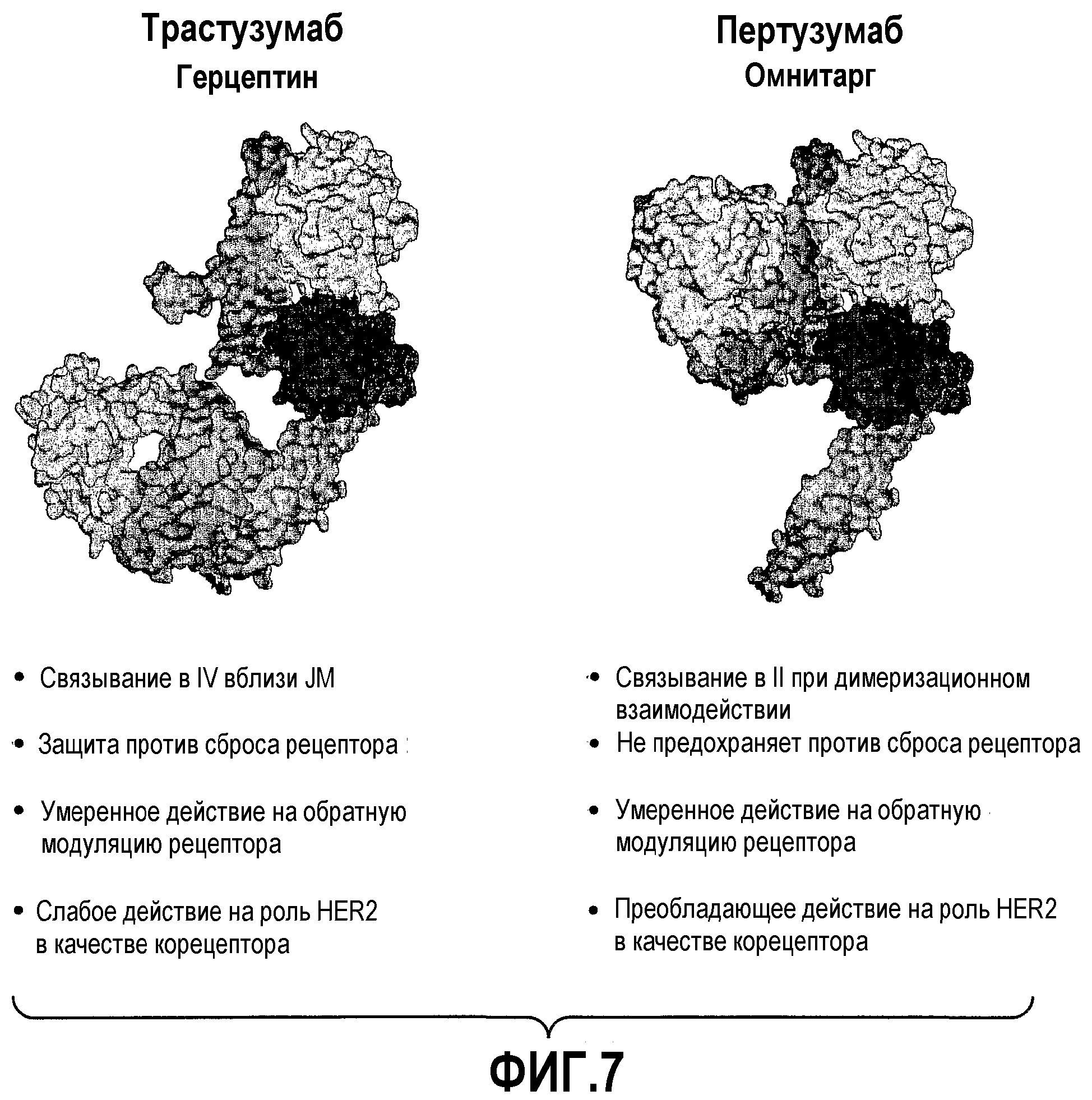
На фиг.7 проиллюстрированы результаты сравнительного изучения активности Трастузумаба и Пертузумаба (Trastuzumab and Pertuzumab).
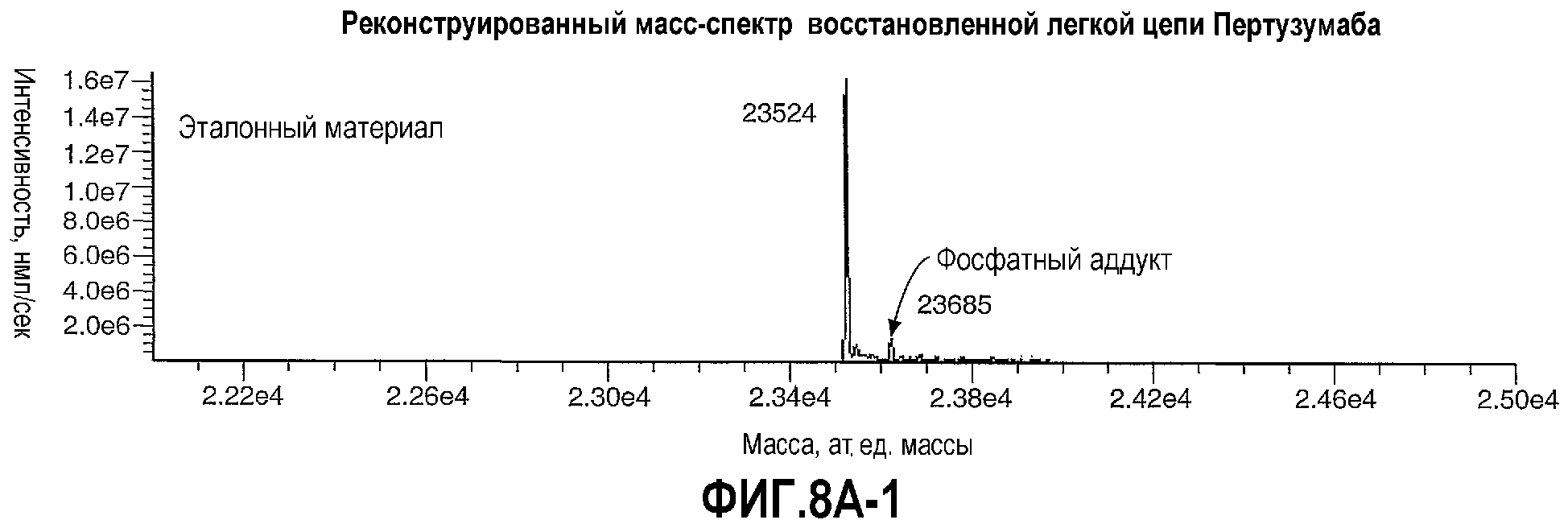
На фиг.8А и 8В показаны реконструированные масс-спектры восстановленной легкой цепи (фиг.8А) и тяжелой цепи (фиг.8В) Пертузумаба.
На фиг.9А и 9В приведены результаты анализа нативного Пертузумаба (фиг.9А) и CPB-расщепленного Пертузумаба (фиг.9В) методом катионообменной хроматографии.
На фиг.10 показан результат анализа Пертузумаба методом гель-хроматографии.
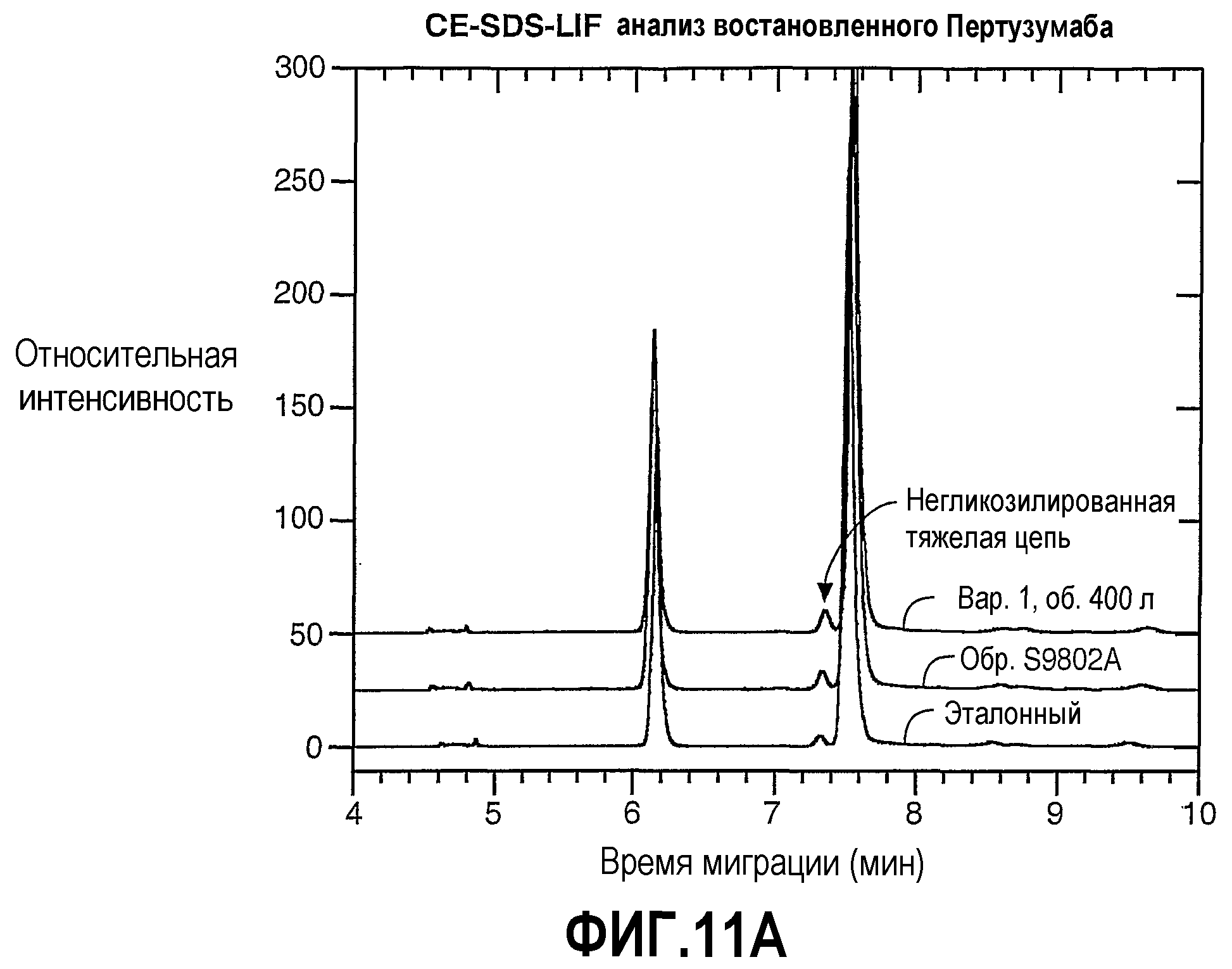
На фиг.11А и 11В показан результат CE-SDS-LIF анализа восстановленного Пертузумаба (фиг.11А) и интактного Пертузумаба (фиг.11В).
На фиг.12А и 12В показаны пептидные карты после расщепления Пертузумаба трипсином (фиг.12А) и LYS-C пептидные карты Пертузумаба (фиг.12B).
На фиг.13 приведены результаты СЕ-анализа N-связанных олигосахаридов, высвобожденных из Пертузумаба.
На фиг.14 показаны олигосахаридные структуры, обычно наблюдаемые в IgG антителах.
На фиг.15 показан позитивный вариант масс-спектрального анализа MALDI-TOF нейтральных олигосахаридов, высвобожденных из Пертузумаба.
На фиг.16А и 16В приведены аминокислотные последовательности легкой цепи (SEQ ID NO: 13) и тяжелой цепи (SEQ ID NO: 14) Трастузумаба (Trastuzumab).
На фиг.17А и 17В показана последовательность легкой цепи Пертузумаба (SEQ ID NO: 23) и вариант последовательности тяжелой цепи Пертузумаба (SEQ ID NO: 24).
Подробное описание предпочтительных вариантов осуществления изобретения
I. Определения
Термин «основной вид антитела» в контексте настоящего описания относится к структуре аминокислотной последовательности в композиции, которая в количественном отношении представляет собой преобладающую антительную молекулу в композиции. Предпочтительно основной вид антитела представляет собой антитело к HER2, такое как антитело, которое связывается с доменом II HER2, антитело, которое ингибирует димеризацию HER более эффективно, чем Трастузумаб (Trastuzumab), и/или антитело, которое связывается с сайтом гетеродимерного связывания HER2. Предпочтительный вариант указанного основного вида антитела в контексте настоящего описания представляет собой такой вариант, который включает вариабельную легкую и вариабельную тяжелую аминокислотные последовательности SEQ ID NO: 3 и 4 и, наиболее предпочтительно, включает аминокислотные последовательности легкой цепи и тяжелой цепи, SEQ ID NO: 15 и 16 (Пертузумаб).
Термин «вариант аминокислотной последовательности» антитела в контексте настоящего описания представляет собой антитело с аминокислотной последовательностью, которая отличается от последовательности, имеющейся в основном виде антитела. Обычно варианты аминокислотной последовательности обладают по меньшей мере примерно 70% гомологией с основным видом антитела и, предпочтительно, они характеризуются по меньшей мере примерно 80% и, более предпочтительно, по меньшей мере 90% гомологией с основным видом антитела. Варианты аминокислотной последовательности содержат замещения, делеции и/или вставки в определенных положениях внутри данной аминокислотной последовательности или в непосредственной близости от аминокислотной последовательности основного вида антитела. Примеры вариантов аминокислотных последовательностей в контексте настоящего описания включают кислый вариант (например, дезамидированный вариант антитела), основный вариант, антитело с лидерным удлинением на аминоконце (например, VHS-) на его одной или двух легких цепях, антитело с С-концевым лизиновым остатком на его одной или двух тяжелых цепях, антитело с одним или несколькими окисленными остатками метионина и т.п., а также включает сочетания различных аминокислотных последовательностей тяжелой и/или легкой цепей. Варианты антител, особенно интересные в контексте настоящего описания, представляют собой антитело, включающее лидерное удлинение на аминоконце в одной или двух цепях антитела, необязательно также включающее другие различия по аминокислотной последовательности и/или по гликозилированию относительно основного вида антитела.
Термин «вариант по гликозилированию» антитела в контексте настоящего описания относится к антителу с одним или несколькими углеводными фрагментами, присоединенными к молекуле, которая отличается от одного или нескольких углеводных фрагментов, присоединенных к антителу основного вида. Примеры вариантов по гликозилированию включают антитело с G1 или G2 олигосахаридной структурой вместо G0 олигосахаридной структуры, присоединенной к Fc участку, антитело с одним или двум углеводными фрагментами, присоединенными к его одной или двум легким цепям, антитело без углеводного фрагмента, присоединенного к его одной или двум тяжелым цепям антитела и т.п., а также сочетание таких изменений в гликозилировании.
В том случае когда антитело содержит Fc участок, олигосахаридная структура, такая как структура, показанная на фиг.14, может быть присоединена к одной или двум тяжелым цепям антитела, например, по остатку 299. В случае Пертузумаба G0 представляет собой доминирующую олигосахаридную структуру с другими возможными олигосахаридными структурами, такими как G0-F, G-1, Man5, Man6, G1-1, G1(1-6), G1(1-3) и G2, которые встречаются в меньших количествах в композиции Пертузумаба.
Если особо не указано иное, термин «G1 олигосахаридная структура» в контексте настоящего описания включает G1(1-6) и G1(1-3) структуры.
Термин «лидерное удлинение на аминоконце» в контексте настоящего описания относится к одному или нескольким аминокислотным остаткам аминоконцевой лидерной последовательности, которые присутствуют на аминоконце одной или нескольких тяжелых или легких цепей антитела. Пример аминоконцевого лидерного удлинения включает три аминокислотных остатка или состоит из трех аминокислотных остатков VHS, присутствующих на одной или обеих легких цепях варианта антитела.
Термин «дезамидированное» антитело представляет собой антитело, в котором один или несколько аспарагиновых остатков были дериватизированы с образованием, например, аспарагиновой кислоты, сукцинимида или изо-аспарагиновой кислоты.
Термин «гомология» определяется как процент остатков в аминокислотной последовательности варианта, которые оцениваются как идентичные, по результатам сопоставления последовательностей и введения, при необходимости, гэпов для достижения максимального процента гомологии. Способы и компьютерные программы, применяемые для такого сопоставления, известны в данной области. Одна из соответствующих компьютерных программ представляет собой «Align 2», разработанную компанией Genentech Inc., которая была зарегистрирована с документацией для пользователей в Бюро США по защите авторских прав (United States Copyright Office, Washington, DC 20559) 10 декабря 1991 года.
В контексте настоящего описания термин «катионообменный анализ» относится к способу, с помощью которого композицию, включающую два или более соединений, разделяют на основе разницы их зарядов с использованием катионообменника. Катионообменник обычно включает ковалентно связанные отрицательно заряженные группы. Предпочтительно рассматриваемый катионообменник представляет собой слабый катионообменник и/или включает карбоксилатную функциональную группу, такую как в катионообменной колонке PROPAC WCX-10TM, поставляемой компанией Dionex.
Термин «рецептор HER» представляет собой рецептор белка тирозинкиназы, который принадлежит к семейству рецепторов HER и включает рецепторы EGFR, HER2, HER3 и HER4, а также других представителей данного семейства, которые могут быть идентифицированы в будущем. Рецептор HER обычно содержит внеклеточный домен, который может связывать лиганд HER, липофильный трансмембранный домен, консервативный внутриклеточный тирозинкиназный домен и сигнальный домен на карбоксиконце, содержащий несколько тирозиновых остатков, которые могут быть фосфорилированы. Предпочтительный рецептор HER представляет собой нативную последовательность человеческого рецептора HER.
Внеклеточный домен HER2 включает четыре домена: домен I (аминокислотные остатки примерно на участке 1-195), домен II (аминокислотные остатки примерно на участке 196-319), домен III (аминокислотные остатки примерно на участке 320-488) и домен IV (аминокислотные остатки примерно на участке 489-630) (остатки пронумерованы без сигнального пептида) (см. Garrett et al., Mol. Cell., 11: 495-505 (2003); Cho et al., Nature., 421: 756-760 (2003); Franklin et al., Cancer Cell., 5: 317-328 (2004); или Plowman et al., Proc. Natl. Acad. Sci., 90: 1746-1750 (1993). См., также чертеж на фиг.1, прилагаемый к настоящему описанию.
Термины «ErbB1», «HER1», «рецептор эпидермального фактора роста» и «EGFR» в контексте настоящего описания используются взаимозаменяемо и относятся к EGFR, описанному, например, в работе Карпентера с соавт. (Carpenter et al., Ann. Rev. Biochem., 56: 881-914 (1987), включая его естественные мутантные формы (например, делеционный мутант EGFR, описанный, например, в работе Хамфри с соавт. (Humphrey et al., PNAS (USA), 87: 4207-4211 (1990)). Термин erbB1 относится к гену, кодирующему белковый продукт EGFR.
Термины «ErbB2» и «HER2» используются взаимозаменяемо и относятся к человеческому белку HER2, описанному в литературе (см., например, Semba et al., PNAS (USA)., 82: 6497-6501 (1985) и Yamomoto et al., Nature, 319: 230-234 (1986) (номер доступа в Genеbank X03363). Термин «erbB2» относится к гену, кодирующему человеческий ErbB2, и «neu» относится к гену, кодирующему крысиный p185neu. Предпочтительный HER2 представляет собой нативную последовательность человеческого HER2.
Термины «ErbB3» и «HER3» относятся к полипептидному рецептору, описанному, например, в патентах США №№ 5183884 и 5480968, а также в работе Крауса с соавт. (Kraus et al., PNAS (USA), 86: 9193-9197 (1989)).
Термины «ErbB4» и «HER4» в контексте настоящего описания относятся к полипептидному рецептору, описанному, например в заявке на патент EР № 599274; а также в работах Плаумана с соавт. (Plowman et al., Proc. Natl. Acad. Sci. USA, 90: 1746-1750 (1993); и Plowman et al., Nature, 366: 473-475 (1993)), включая его изоформы, описанные, например, в WO 99/19488, опубликованной 22 апреля 1999 года.
Термин «лиганд HER» обозначает полипептид, который связывается с рецептором HER и/или активирует его. Лиганд HER, представляющий особый интерес в контексте настоящего описания, относится к нативной последовательности человеческого лиганда HER, такого как эпидермальный фактор роста (EGF) (Savage et al., J. Biоl. Chem., 247: 7612-7621 (1972)); трансформирующий фактор роста альфа (TGF-α) (Marquardt et al., Science 223: 1079-1082 (1984)); амфирегулин, также известный как аутокринный фактор роста невриномы или кератиноцитов (Shoyab et al., Science, 243: 1074-1076 (1989)); Kimura et al., Nature, 348: 257-260 (1990); и Cook et al., Mol. Cell. Biol., 11: 2547-2557 (1991); бетацеллюлин (Ching etal., Science 259: 1604-1607 (1993)) и Sasada et al., Biochem. Biophys. Res. Commun., 190: 1173 (1993)); гепаринсвязывающий эпидермальный фактор роста (HB-EGF) (Higashiyama et al., Science, 251: 936-939 (1991)); эпирегулин (Toyoda et al., J. Biol. Chem., 270: 7495-7500 (1995)); и Komurasaki et al., Oncogenе, 15: 2841-2848 (1997)); герегулин (см. ниже); нейрегулин-2 (NRG-2) (Carraway et. al., Nature, 387: 512-516 (1997)); нейрегулин-3 (NRG-3) (Zhang et. al., Proc. Natl. Acad. Sci., 94: 9562-9567 (1997)); нейрегулин-4 (NRG-4) (Harari et. al., Oncogene, 18: 2681-89 (1999)) или крипто (CR-1) (Kannan et al., J. Biol. Chem., 272(6): 3330-3335 (1997)). Лиганды HER, которые связывают EGFR, включают EGF, TGF-α, амфирегулин, бетацеллюлин, HB-EGF и эпирегулин. Лиганды HER, которые связывают HER3, включают герегулины. Лиганды HER, способные связывать HER4, включают бетацелюллин, эпирегулин, HB-EGF, NRG-2, NRG-3, NRG-4 и герегулины.
Термин «герегулин» (HRG) в контексте настоящего описания относится к полипептиду, кодируемому генным продуктом герегулина, описанному в патенте США № 5641869 или в работе Марчионни с соавт. (Marchionni et al., Nature, 362: 312-318 (1993)). Примеры герегулина включают герегулин-α, герегулин-β1, герегулин-β2, герегулин-βЕ3 (Holmes et al., Science 256: 1205-1210 (1992); и патент США № 5641869); фактор дифференциации neu (NDF) (Peles et al., Cell 69: 205-216 (1992)); фактор, индуцирующий активность ацетилхолинового рецептора (ARIA) (Falls et al., Cell 72: 801-815 (1993); фактор роста глиальных клеток (GGF) (Marchionni et al., Nature, 362: 312-318 (1993)); фактор, образуемый из сенсорных и двигательных нейронов (SMDF) (Ho et al., J. Biol. Chem., 270: 14523-14532 (1995)); γ-герегулин (Schaefer et. al., Oncogenе 15: 1385-1394 (1997)). Термин включает также биологически активные фрагменты и/или варианты по аминокислотной последовательности нативной последовательности полипептида HRG, такие как EGF-подобный фрагмент его домена (например,
HRGЕ1177-244).
Термин «димер HER» в контексте настоящего описания представляет собой нековалентно ассоциированный димер, включающий по меньшей мере два различных рецептора HER. Такие комплексы могут образовываться, когда клетка, экспрессирующая два или несколько рецепторов HER, подвергается воздействию лиганда HER, и могут быть выделены иммунопреципитацией и далее проанализированы методом ДСН-ПААГ, как описано, например, в работе Silwkowski et al., J. Biol. Chem., 269(20): 14661-14665 (1994). Примеры таких димеров HER включают гетеродимеры EGFR-HER2, HER2-HER3 и HER3-HER4. Кроме того, димер HER может включать два или более рецептора HER2, объединенных с другим рецептором HER, таким как HER3, HER4 или EGFR. С димером могут быть ассоциированы другие белки, такие как субъединица цитокинового рецептора (например, gp130).
Термин «сайт гетеродимерного связывания» на HER2 относится к участку во внеклеточном домене HER2, который контактирует или вступает во взаимодействие с участком во внеклеточном домене EGFR, HER3 или HER4 при образовании из них димера. Такой участок обнаружен в домене II в HER2 (Franklin et al., Cancer Cell, 5: 317-328 (2004)).
Термины «активация HER» или «активация HER2» относятся к активации или фосфорилированию одного или нескольких рецепторов HER или рецепторов HER2. В основном, активация HER приводит к сигнальной трансдукции (которая, например, вызывается внутриклеточным доменом киназы, фосфорилирующей тирозиновые остатки в рецепторе HER или в полипептидном субстрате). HER активация может быть опосредована связыванием лиганда HER с димером HER, включающим интересующий рецептор HER. Связывание лиганда HER с димером HER может активировать домен киназы одного или нескольких рецепторов HER в димере и, таким образом, приводить к фосфорилированию тирозиновых остатков в одном или нескольких рецепторах HER и/или к фосфорилированию тирозиновых остатков в дополнительном(ых) полипептиде(ах) субстрата, таком как внутриклеточные Akt или MAPK киназы.
Термин «антитело» в контексте настоящего описания используется в самом широком смысле и конкретно охватывает интактные моноклональные антитела, поликлональные антитела, полиспецифические антитела (например, биспецифические антитела), образованные по меньшей мере из двух интактных антител и антительных фрагментов, которые демонстрируют желательную биологическую активность.
Термин «моноклональное антитело» в контексте настоящего описания относится к антителу, полученному из популяции по существу гомогенных антител, например, индивидуальных антител, включающих популяцию, представители которой идентичны или связываются с одним и тем же эпитопом, за исключением возможных вариантов, которые могут возникать в процессе продукции моноклонального антитела, такие как варианты, приведенные в настоящем описании. В отличие от препаратов поликлональных антител, которые в типичном случае включают различные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Кроме своей специфичности моноклональные антитела имеют достоинства в том, что они не загрязнены другими иммуноглобулинами. Определение «моноклональный» указывает на характер антитела, которое получают по существу из гомогенной популяции антител, и его не следует трактовать в плане ограничения способа получения антител определенным методом. Например, моноклональные антитела, используемые в соответствии с настоящим изобретением, могут быть получены по методу гидридом, впервые описанному Kohler et al., Nature, 256: 495 (1975), или могут быть получены с использованием рекомбинантой ДНК (см., например, патент США № 4816567). «Моноклональные антитела» могут быть выделены из библиотеки фаговых антител с использованием методик, описанных в литературе (см., например, Clackson et al., Nature, 352: 624-628 (1991) и Marks et al., J. Mol. Biol., 222: 581-597 (1991)).
Приведенные в настоящем описании моноклональные антитела включают, в частности, «химерные» антитела, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных из конкретного вида или принадлежащих конкретному классу или подклассу антител, тогда как оставшаяся часть цепи(ей) идентична или гомологична соответствующим последовательностям в антителах, полученных из другого вида или принадлежащих к другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они демонстрируют желательную биологическую активность (патент США № 4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA, 81: 6851-6855 (1984)). Интересные в контексте настоящего описания химерные антитела включают «приматизированные» антитела, включающие антигенсвязывающие последовательности вариабельного домена, полученные от приматов, отличных от человека (например, Old World Monkey, Ape и т.п.), и последовательности константного участка человеческой молекулы.
Термин «фрагменты антител» включает часть интактного антитела, предпочтительно включающую его антигенсвязывающий или вариабельный участок. Примеры антительных фрагментов включают фрагменты Fab, Fab', F(ab')2 и Fv, диантитела, линейные антитела, одноцепочечные молекулы антител и полиспецифические антитела, образованные из антительного(ых) фрагмента(ов).
«Интактное антитело» представляет собой такое антитело, которое включает антигенсвязывающий вариабельный участок, а также константный домен легкой цепи (CL) и константные домены тяжелой цепи CH1, CH2 и CH3. Константные домены могут представлять собой константные домены нативной последовательности (например, константные домены нативной последовательности человека) или их варианты по аминокислотной последовательности. Предпочтительно интактное антитело обладает одной или несколькими эффекторными функциями и включает олигосахаридную структуру, присоединенную к одной или двум тяжелым цепям.
Термин «эффекторные функции» антитела относится к биологической активности, определяемой Fc участком (нативная последовательность Fc участка или вариант Fc участка по аминокислотной последовательности) антитела. Примеры эффекторных функций антитела включают связывание C1q, комплементзависимая цитотоксичность, связывание Fc рецептора, антитело-обусловленная клеточнозависимая цитотоксичность (ADCC), фагоцитоз, отрицательная регуляция рецепторов клеточной поверхности (например, рецептора B клеток; BCR) и т.п.
В зависимости от аминокислотной последовательности константного участка своих тяжелых цепей интактные антитела могут быть распределены по разным «классам». Идентифицировано пять основных классов интактных антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть подразделены на «подклассы» (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA и IgA2. Тяжелую цепь константных доменов, которая соответствует разным классам антител, называют α, δ, ∈, γ и μ соответственно. Субъединичные структуры и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны.
Термины «антитело-обусловленная клеточнозависимая цитотоксичность» и «ADCC» относятся к клеточной реакции, в которой специфичные цитотоксичные клетки, экспрессирующие Fc рецепторы (FcR) (например, естественные клетки-киллеры (NK), нейтрофилы и макрофаги), распознают связанное антитело на целевой клетке и далее вызывают лизис целевой клетки. Первичные клетки для реакции ADCC, клетки NK экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FсγRII и FcγRIII. Экспрессия FcR на гематопоэтических клетках показана в таблице 3 на странице 464 в работе Раветча и Кинета (Ravetch and Kinet, Annu. Rev. Immunol, 9:457-92 (1991)). Для оценки ADCC активности интересующей молекулы проводят тест ADCC in vitro, описанный в патенте США № 5500362 или 5821337. Применяемые в таких тестах эффекторные клетки включают мононуклеарные клетки периферической крови (МНПК (PBMC)) и естественные клетки-киллеры (NK). Альтернативно или дополнительно ADCC активность интересующей молекулы может быть оценена in vitro, например, на модели животных, такой как описана в работе Клайнеса с соавт. (Clynes et al., PNAS (USA), 95: 652-656 (1998)).
Термин «эффекторные клетки человека» относится к лейкоцитам, которые экспрессируют один или несколько FcR и выполняют эффекторную функцию. Предпочтительно клетка экспрессирует по меньшей мере FcγRIII и выполняет ADCC эффекторную функцию. Примеры человеческих лейкоцитов, которые вовлекаются в ADCC, включают мононуклеарные клетки периферической крови (МНПК), естественные клетки-киллеры (NK), моноциты, цитотоксические T клетки нейтрофилы, при этом МНПК и NK клетки являются предпочтительными. Эффекторные клетки могут быть выделены из своего нативного источника, например из крови или МНПК, как показано в настоящем описании.
Термины «Fc рецептор» или «FcR» в контексте настоящего описания используется для описания рецептора, который связывается с Fc участком антитела. Предпочтительно FcR представляет собой нативную последовательность человеческого FcR. Кроме того, предпочтительный FcR представляет собой такой рецептор, который связывается с IgG антителом (гамма рецептор) и включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, в том числе аллельные варианты и формы указанных рецепторов, полученные при альтернативном сплайсинге. Рецепторы FcγRII включают FcγRIIА («активирующий» рецептор) и FcγRIIВ («ингибирующий» рецептор), которые имеют сходные аминокислотные последовательности и отличаются, прежде всего, по своим цитоплазматическим доменам. Активирующий рецептор FcγRIIА включает тирозинсодержащий активирующий мотив иммунорецептора (ITAM) в своем цитоплазматическом домене. Ингибирующий рецептор FcγRIIВ включает тирозинсодержащий ингибирующий мотив иммунорецептора (ITIM) в своем цитоплазматическом домене (см. обзор M. in Daëron, Annu. Rev. Immunоl., 15: 203-234 (1997)). FcR описаны в ряде работ (Ravetch and Kinet, Annu. Rev. Immunol., 9: 457-92 (1991); Capel et al., Immunomethods, 4: 25-34 (1994); и de Haas et al., J. Lab. Clin. Med., 126: 330-41 (1995)). Другие FcR, включая такие формы, которые могут быть идентифицированы в будущем, охватываются термином «FcR», используемым в настоящем описании. Данный термин также включает неонатальный рецептор FcRn, который отвечает за перенос материнских IgG в плод (Guyer et al., J. Immunol., 117-587 (1976) и Kim et al., J. Immunol., 24: 249 (1994)).
Термин «комплементзависимая цитотоксичность» или «CDC» относится к способности молекулы лизировать свою мишень в присутствии комплемента. Путь активации комплемента инициируется в результате связывания первого компонента системы комплемента (C1q) с молекулой (например, антителом) в комплексе с соответствующим антигеном. Для оценки активации комплемента проводят CDC тест, описанный, например, в работе Gazzano-Santoro et al., J. Immunol. Methods 202: 163 (1996).
Термин «нативные антитела» обычно обозначает гетеродимерные гликопротеины с массой примерно 150000 дальтон, состоящие из двух идентичных легких (L) цепей и двух тяжелых (Н) идентичных цепей. Каждая легкая цепь присоединена к тяжелой цепи одной ковалентной дисульфидной связью, при этом количество дисульфидных связей в тяжелых цепях различных иммуноглобулиновых изотипов варьирует. Каждая тяжелая и легкая цепи также содержат определенным образом расположенные межцепьевые дисульфидные мостики. Каждая тяжелая цепь содержит один концевой вариабельный домен (VH), за которым следует множество константных доменов. Каждая легкая цепь имеет вариабельный домен на одном конце (VL) и константный домен на другом конце. Константный домен легкой цепи определенным образом расположен относительного первого константного домена тяжелой цепи, и вариабельный домен легкой цепи определенным образом расположен относительно вариабельного домена тяжелой цепи. Считается, что некоторые аминокислотные остатки образуют интерфейс между вариабельными доменами легкой цепи и тяжелой цепи.
Термин «вариабельный» определяет тот факт, что некоторые части вариабельных доменов существенно различаются по последовательности между антителами и выполняют определенную роль при связывании и определении специфичности каждого конкретного антитела к конкретному антигену. Однако вариабельность неравномерно распределена по вариабельным доменам антител. Она сконцентрирована в трех сегментах, называемых гипервариабельными участками, в вариабельных доменах как легкой цепи, так и тяжелой цепи. Более высококонсервативные части вариабельных доменов называют каркасными участками (FR). Вариабельные домены нативных тяжелой и легкой цепей включают, каждый, FR, которые в основном имеют 3-складчатую конфигурацию, соединенный тремя гипервариабельными участками, которые образуют петли, объединяющие и в некоторых случаях образующие часть 3-складчатой структуры. Гипервариабельные участки в каждой цепи поддерживаются вместе в непосредственной близости от FR и вместе с гипервариабельными участками другой цепи участвуют в образовании антигенсвязывающего сайта антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Константные домены не вовлекаются непосредственно в связывание антитела с антигеном, но демонстрируют различные эффекторные функции, такие как участие антитела в антителообусловленной клеточнозависимой цитотоксичности (ADCC).
Термин «гипервариабельный участок» в контексте настоящего описания относится к аминокислотным остаткам антитела, которые отвечают за связывание антигена. Гипервариабельный участок, в основном, включает аминокислотные остатки из «участка, определяющего комплементарность» или «CDR» (например, остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и 31-35 (H1), 50-56 (H2) и 95-102 (H3) в вариабельном домене тяжелой цепи (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)) и/или остатки из «гипервариабельной петли» (например, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (H1), 53-55 (H2) и 96-101 (H3) в вариабельном домене тяжелой цепи (Chothia and Lesk J. Mol. Biol., 196: 901-917 (1987)). Остатки в «каркасном участке» или «FR» включают такие остатки вариабельного домена, которые отличаются от остатков, входящих в гипервариабельный домен, приведенный выше.
Расщепление антител папаином дает два идентичных антигенсвязывающих фрагмента, называемых «Fab» фрагментами, каждый из которых содержит один антигенсвязывающий сайт и остаточный «Fc» фрагмент, наименование которого отражает его способность быстро кристаллизоваться. Пепсиновая обработка приводит к получению фрагмента F(ab')2, который содержит два антигенсвязывающих сайта и все еще способен к объединению с антигеном.
«Fv» представляет собой минимальный антительный фрагмент, который содержит полный сайт распознавания антигена и связывания антигена. Данный участок состоит из димера, включающего один вариабельный домен тяжелой цепи и один вариабельный домен легкой цепи, в жесткой, нековалентной ассоциации. Эта такая конфигурация, в рамках которой три гипервариабельных участка каждого вариабельного домена взаимодействуют, определяя сайт связывания антигена на поверхности VH-VL димера. В совокупности, шесть гипервариабельных участков определяют антигенсвязывающую специфичность антитела. Однако даже один вариабельный участок (или половина Fv, включающая только три гипервариабельных участка, специфичных для антигена) обладает способностью распознавать антиген и связываться с ним, хотя и с меньшей аффинностью, чем полный сайт связывания.
Fab фрагмент также содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Fab' фрагменты отличаются от Fab фрагментов добавлением нескольких остатков на карбоксиконце СН1 домена тяжелой цепи, включающего один или несколько цистеинов из шарнирной области антитела. Fab'-SH представляет собой обозначение Fab', в котором цистеиновый(ые) остаток(ки) константных доменов содержат по меньшей мере одну свободную тиоловую группу. F(ab')2 фрагменты антител обычно получают в виде пары Fab' фрагментов, которые содержат между собой шарнирные цистеины. Известны также другие химические структуры фрагментов антител.
Термин «легкие цепи» антител из любого вида позвоночных может относиться к одному из двух четко различающихся типов, называемых каппа (κ) и ламбда (λ), что определяется аминокислотными последовательностями их константных доменов.
«Одноцепоченые Fv» или «scFv» фрагменты антител включают домены VH и VL антитела, где указанные домены присутствуют в одноцепочечном полипептиде. Предпочтительно Fv полипептид также включает полипептидный линкер между доменами VH и VL, что позволяет «scFv» формировать желательную структуру для связывания антигена. В литературе имеется обзор scFv (Plückthun, in Thе Pharmacology of Monoclonal Antibodies, vol. 113, Rosenberg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994)). scFv фрагменты антител к HER2 описаны в WO 93/16185, в патенте США № 5571894 и патенте США № 5587458.
Термин «диантитела» относится к малым фрагментам антител с двумя антигенсвязывающими сайтами, фрагменты которых включают вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) в одной и той же полипептидной цепи (VH-VL). При использовании линкера, длина которого слишком мала для того, чтобы осуществлялось спаривание между двумя доменами одной цепи, создаются условия для того, чтобы домены спаривались с комплементарными доменами другой цепи с образованием двух антигенсвязывающих сайтов. Диантитела более полно описаны, например, в EP 404097, WO 93/11161 и Hollinger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993).
«Гуманизированные» формы антител из организмов, отличных от человека (например, из грызунов), представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из иммуноглобулина, отличного от человеческого. Чаще всего гуманизированные антитела представляют собой человеческие иммуноглобулины (реципиентное антитело), в которых остатки из гипервариабельного участка реципиента замещены остатками из гипервариабельного участка от вида, отличного от человека (донорное антитело), такого как мышь, крыса, кролик или примат, отличный от человека, обладающие желательной специфичностью, аффинностью и функциональными свойствами. В некоторых случаях остатки каркасной области (FR) человеческого иммуноглобулина замещают соответствующими остатками из источника, отличного от человека. Кроме того, гуманизированные антитела могут включать остатки, которые не встречаются в реципиентном антителе или в донорном антителе. Такие модификации создают для того, чтобы дополнительно повысить функциональные возможности антитела. В целом, гуманизированное антитело включает по существу все или по меньшей мере один или, в типичном случае, два вариабельных домена, в которых все или по существу все гипервариабельные петли соответствуют таковым в иммуноглобулине, отличном от человека, или все или по существу все FR представляют такие FR, которые имеют последовательность иммуноглобулина человека. Гуманизированное антитело необязательно также будет включать по меньшей мере часть константного участка иммуноглобулина (Fc), в типичном случае человеческого иммуноглобулина. Дополнительные детали описаны в литературе (Jones et al., Nature 321: 522-525 (1986); Riechmann et al., Nature 332: 323-329 (1988) и Presta Curr. Op. Struct. Biol., 2: 593-596 (1992)).
Гуманизированные антитела к HER2 включают huMAb4D5-1, huMAb4D5-2, huMAb4D5-3, huMAb4D5-4, huMAb4D5-5, huMAb4D5-6, huMAb4D5-7 и huMAb4D5-8 или Trastuzumab (HERCEPTIN®), как показано в таблице 3 в патенте США № 5821337, который включен в настоящее описание в качестве ссылки; гуманизированные антитела 520C9 (W0 93/21319) и гуманизированные антитела 2C4 приведены в настоящем описании.
В контексте настоящего описания термины Tрастузумаб (HERCEPTIN®) и huMAb4D5-8 относятся к антителу, включающему аминокислотные последовательности легкой и тяжелой цепей SEQ ID NO: 13 и 14 соответственно.
В контексте настоящего описания термины Пертузумаб (OMNITARG®) и rhuMAb2С4 относятся к антителу, включающему аминокислотные последовательности вариабельной легкой и вариабельной тяжелой цепей SEQ ID NO: 3 и 4 соответственно. В том случае когда Пертузумаб представляет собой интактное антитело, он предпочтительно включает аминокислотные последовательности легкой и тяжелой цепей SEQ ID NO: 15 и 16 соответственно.
«Оголенное антитело» представляет собой такое антитело (в контексте настоящего описания), которое не конъюгировано с гетерологичной молекулой, такой как цитотоксичный фрагмент или радиоактивная метка.
«Выделенное» антитело представляет собой такое антитело, которое было идентифицировано и/или восстановлено из компонента его природного окружения. Контаминирующие компоненты природного окружения включают материалы, которые могут препятствовать диагностическому или терапевтическому использованию антитела и могут включать ферменты, гормоны и другие протеиновые и непротеиновые растворенные вещества. В предпочтительных вариантах антитело очищают (1) до содержания более, чем 95 мас.% антитела, по данным метода Лоури, и наиболее предпочтительно до содержания более, чем 99 мас.% (2) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности при проведении центрифужного варианта секвенирования или (3) до гомогенности, по результатам анализа в ДСН-ПААГ, в восстановительных или в не восстановительных условиях, с использованием кумасси-блю или, предпочтительно, с использованием серебряного красителя. Выделенное антитело включает антитело in situ в рекомбинантных клетках, где не присутствует по меньшей мере один компонент из природного окружения антитела. Однако обычно антитело выделяют с использованием по меньшей мере одной стадии очистки.
Антитело к HER2, которое «ингибирует димеризацию HER более эффективно, чем Tрастузумаб», представляет собой такое антитело, которое снижает или устраняет образование димера HER2 более эффективно (например, по меньшей мере в два раза более эффективно), чем Tрастузумаб. Предпочтительно такое антитело ингибирует димеризацию HER2 по меньшей мере также эффективно, как антитело, выбранное из группы, состоящей из интактного моноклонального антитела мыши 2С4, Fab фрагмента мышиного моноклонального антитела 2С4, интактного Пертузумаба и Fab фрагмента Пертузумаба. Можно оценить ингибирование димеризации HER при непосредственном исследовании димеров HER, или по результатам оценки активации HER, или по прохождению сигнала в направлении считывания информации, которые приводят к димеризации HER, и/или на основе анализа сайта связывания антитела-HER2 и т.п. Тесты для скрининга антител на их способность ингибировать димеризацию HER более эффективных, чем Трастузумаб, описаны в литературе (Agus et al., Cancer Cell 2: 127-137 (2002) и WO 01/00245 (Adams et al.)). Только в качестве примера следует отметить, что можно тестировать ингибирование димеризации HER при оценке, например, ингибирования образования димера HER (см., например, фиг.1A-B в работе Agus et al., Cancer Cell, 2: 127-137 (2002) и WO 01/00245), по снижению активации лиганда HER в клетках, которые экспрессируют димеры HER (см., например, WO 01/00245 и фиг.2А-В в работе Agus et al., Cancer Cell, 2: 127-137 (2002)); по блокированию связывания лиганда HER с клетками, которые экспрессируют димеры HER (см., например, WO 01/00245 и фиг.2Е в работе Agus et al., Cancer Cell, 2: 127-137 (2002)); по ингибированию роста раковых клеток (например, клеток MCF7, MDA-MD-134, ZR-75-1, MD-MB-175, T-47D), которые экспрессируют димеры HER в присутствии (или в отсутствие) лиганда HER (см., например, WO 01/00245 и фиг.3A-D в работе Agus et al., Cancer Cell, 2: 127-137 (2002)); по ингибированию прохождения сигнала в направлении считывания информации (например, по ингибированию HRG-зависимого фосфорилирования AKT или по ингибированию HRG- или ТGF-α-зависимого фосфорилирования MAPK) (см., например, WO01/00245 и фиг.2C-D в работе Agus et al., Cancer Cell, 2: 127-137 (2002)). Можно оценить, ингибирует ли антитело димеризацию HER путем изучения сайта связывания антитело-HER2, например, при оценке структуры или модели, такой как кристаллическая структура антитела, связанного с HER2 (см., например, Franklin et al., Cancer Cell, 5: 317-328 (2004)).
Антитело к HER2 может «ингибировать HRG-зависимое фосфорилирование AKT» и/или «ингибировать HRG- или ТGFα-зависимое фосфорилирование MAPK» более эффективно (например, по меньшей мере более эффективно в два раза), чем Tрастузумаб (см., например, в качестве примера Agus et al., Cancer Cell, 2: 127-137 (2002) и WO 01/00245).
Антитело к HER2 может представлять собой такое антитело, которое «не ингибирует расщепление эктодомена HER2» (Molina et al., Cancer Res., 61: 4744-4749 (2001)).
Антитело к HER2, которое «связывается с гетеродимерным сайтом связывания» HER2, связывается с остатками в домене II (и необязательно также связывается с остатками других доменов внеклеточного домена HER2, таких как домены I и III) и может пространственно мешать, по крайней мере в некоторой степени, образованию гетеродимера HER2-EGFR, HER2-HER3, HER2-HER4. Франклин с соавт. (Franklin et al., Cancer Cell, 5: 317-328 (2004)) охарактеризовали кристаллическую структуру гетеродимера HER2-Пертузумаб, депонированного в банке данных белков (RCSB Protein Data Bank (ID Code IS78)), приведя пример антитела, которое связывается с гетеродимерным сайтом связывания HER2.
Антитело, которое «связывается с доменом II» в HER2, связывается с остатками в домене II и необязательно с остатками в другом(их) домене(ах) HER2, таких как домены I и III. Предпочтительно антитело, которое связывается с доменом II, связывается с местом соединения между доменами I, II и III в HER2.
Термин «агент, ингибирующий рост» в контексте настоящего описания относится к соединению или композиции, которые ингибируют рост клетки, особенно HER-экспрессирующей раковой клетки in vitro или in vivo. Таким образом, агент, ингибирующий рост, может быть таким агентом, который существенно снижает процент HER-экспрессирующих клеток в S фазе. Примеры ростингибирующих агентов включают агенты, которые блокируют прогрессию клеточного цикла (в месте, отличном от S фазы), такие как агенты, которые индуцируют остановку на G1 фазе и остановку на M фазе. Классические блокаторы M фазы включают алкалоиды барвинка (винкристин и винбластин), таксаны и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Действие агентов, которые индуцируют остановку на G1 фазе, также распространяется на S фазу, останавливая ее, и включают, например, ДНК-алкилирующие агенты, такие как тамоксифен, преднизон, дакарбазин, меклоретамин, цисплатин, метотрексат, 5-фторурацил и ара-С. Дополнительная информация может быть найдена в соответствующем руководстве (The Molecular Basis of Cancer, Mendelsohn and Israel, eds., Chapter 1, под названием «Cell cycle regulation, oncogenes, and antineoplastic drugs» by Murakami et al. (WB Saunders: Philadelphia, 1995), в особенности с.13).
Примеры антител, «ингибирующих рост», включают такие антитела, которые связываются с HER2 и ингибируют рост раковых клеток, суперэкспрессирующих HER2. Предпочтительные ростингибирующие антитела к HER2 ингибируют рост опухолевых клеток молочной железы SK-BR-3 в клеточной культуре более чем на 20%, и предпочтительно более чем на 50% (в частности, от примерно 50% до примерно 100%), в концентрации антитела, равной примерно 0,5-30 г/мл, где ингибирование роста определяют через шесть дней после экспозиции клеток SK-BR-3 с антителами (см. патент США № 5677171, выданный 14 октября 1997 года). Тест на ингибирование роста клеток SK-BR-3 описан более детально в указанном патенте и также приводится ниже в настоящем описании. Предпочтительное ростингибирующее антитело представляет собой гуманизированный вариант мышиного моноклонального антитела 4D5, например, Tрастузумаб.
Антитело, которое «индуцирует апоптоз», представляет собой такое антитело, которое индуцирует программированную гибель клеток, определяемую по связыванию аннексина V, по фрагментации ДНК, по сморщиванию клетки, разбавлению эндоплазматического ретикулюма, фрагментации клеток и/или по образованию мембранных везикул (называемых апоптозными телами). Указанная клетка обычно представляет такую клетку, которая осуществляет суперэкспрессию рецептора HER2. Предпочтительно такая клетка представляет собой опухолевую клетку, например клетку молочной железы, яичника, желудка, эндометрия, слюнной железы, легкого, почки, толстой кишки, щитовидной железы, поджелудочной железы или мочевого пузыря. In vitro такая клетка может представлять собой клетку линий SK-BR-3, BT474, Calu 3, MDA-MB-453, MDA-MB-361 и SKOV3. Доступны различные методы для оценки клеточных явлений, ассоциированных с апоптозом, например транслокация фосфатидилсерина (ФС) может быть измерена по связыванию аннексина. Фрагментация ДНК может быть оценена по образованию «ступенчатости» ДНК и по ядерной/хроматиновой конденсации, где фрагментация ДНК может быть оценена по увеличению числа гиподиплоидных клеток. Предпочтительно антитело, которое индуцирует апоптоз, представляет собой такое антитело, которое приводит к примерно 2-50-кратной, предпочтительно, примерно 5-50-кратной и, наиболее предпочтительно, примерно к 10-50-кратной индукции связывания аннексина, относительно необработанных клеток, в тесте на связывание аннексина с использованием клеток BT474 (см. ниже). Примеры антител к HER2, которые индуцируют апопотоз, включают 7C2 и 7F3.
«Эпитоп 2С4» представляет собой участок во внеклеточном домене HER2, с которым связывается антитело 2С4. Для проведения скрининга с целью выявления антител, которые связываются с эпитопом 2С4, может быть проведен обычный тест по перекрестному блокированию, такой как тест, описанный в соответствующем руководстве (Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, ED Harlow and David Lane (1988)). Альтернативно может быть проведено картирование эпитопа для оценки, связывается ли антитело с эпитопом 2С4 в HER2, с использованием для этого известных методик и/или можно исследовать структуру антитело-HER2 (Franklin et al., Cancer Cell, 5: 317-328 (2004)) для определения, какой(ие) домен(ы) HER2 связывается(ются) с антителом. Эпитоп 2С4 включает остатки домена II во внеклеточном домене HER2. 2С4 и Пертузумаб связываются с внеклеточным доменом HER2 в месте соединения доменов I, II и III (Franklin et al., Cancer Cell 5: 317-328 (2004)).
«Эпитоп 4D5» представляет собой участок во внеклеточном домене HER2, с которым связываются антитело 4D5 (ATCC CRL 10463) и Tрастузумаб. Данный эпитоп расположен близко к трансмембранному домену HER2, локализуясь внутри домена IV в HER2. С целью скрининга антител, которые связываются с эпитопом 4D5, проводят традиционный тест по перекрестному блокированию, описанный, например, в известном руководстве (Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, ED Harlow and David Lane (1988)). Альтернативно может быть проведено картирование эпитопа для оценки, связывается ли антитело с 4D5 эпитопом в HER2 (например, с одним или несколькими остатками на участке, включающем остатки от примерно 529 до примерно 625 включительно, фиг.1).
«Эпитоп 7С2/7F3» представляет собой участок на N-конце внутри домена I внеклеточного домена HER2, с которым связываются антитела 7C2 и/или 7F3 (каждое из которых депонировано в ATCC, см. ниже). С целью скрининга антител, которые связываются с эпитопом 7С2/7F3, может быть проведен традиционный тест по перекрестному блокированию, такой как тест, описанный в соответствующем руководстве (Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, ED Harlow and David Lane (1988)). Альтернативно может быть проведено картирование эпитопа для оценки, связывается ли антитело с эпитопом 7С2/7F3 в HER2 (то есть с любыми одним или несколькими остатками на участке от примерно 22 до примерно 52 остатка в HER2, фиг.1).
Термин «лечение» в контексте настоящего описания относится и к терапевтическому варианту лечения, и к профилактическим, или превентивным мерам. Нуждающиеся в лечении пациенты включают как тех, кто уже имеет заболевание, так и тех пациентов, в отношении которых необходимо провести профилактику. В этой связи подлежащий лечению пациент может быть диагностирован, как имеющий заболевание, или предрасположенный, или чувствительный к заболеванию.
Термины «рак» и «раковый» относятся или описывают физиологическое состояние у млекопитающих, которое в типичном случае характеризуется нерегулируемым ростом клеток. Примеры рака включают, без ограничения, карциному, лимфому, бластому (включая медуллобластому и ретинобластому), саркому (включая липосаркому и саркому синовиальных клеток), нейроэндокринные опухоли (включая карциноидные опухоли, гастриному и рак островковых клеток), мезотелиому, нейриному (включая акустическую нейрому), менингиому, аденокарциному, меланому и лейкоз или лимфоидный злокачественный рост. Более конкретные примеры таких видов рака включают плоскоклеточный рак (например, плоскоклеточный рак эпителиальных клеток), рак легкого, включая мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого и плоскоклеточную карциному легкого, рак брюшины, гепатоцеллюлярный рак, рак желудка, включая рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак молочной железы, рак мочевого пузыря, гепатому, рак толстой кишки, рак прямой кишки, колоректальный рак, рак эндометрия или матки, карциному слюнной железы, рак почки, или ренальный рак, рак предстательной железы, рак вульвы, рак щитовидной железы, гетапокарциному, анальную карциному, карциному полового члена, тестикулярный рак, рак пищевода, опухоли желчных путей, а также рак головы и шеи.
Термин «эффективное количество» относится к количеству лекарственного средства, которое является эффективным для лечения заболевания у пациента. В том случае когда указанное заболевание представляет собой рак, эффективное количество лекарственного средства может снижать число раковых клеток, снижать размер опухоли, ингибировать (то есть замедлять до некоторой степени и предпочтительно останавливать) инфильтрацию раковых клеток в периферические органы, ингибировать (то есть снижать до некоторой степени или предпочтительно останавливать) метастазирование опухоли, ингибировать, до некоторой степени, рост опухоли и/или ослаблять, до некоторой степени, один или несколько симптомов, ассоциированных с раком. В зависимости от той степени, в какой лекарственное средство может предупреждать рост и/или уничтожать существующие раковые клетки, средство может быть цитостатическим и/или цитотоксическим. Эффективное количество может увеличивать период свободного выживания без прогрессирования, приводя к объективной реакции (включая частичную реакцию, PR, или полную, CR), повышать общее время выживания и/или ослаблять один или несколько симптомов рака.
Термин «HER2-экспрессирующий рак» представляет собой такой вид рака, который включает клетки, содержащие на поверхности белок HER2.
Рак, который осуществляет «суперэкспрессию» HER представляет собой такой вид рака, который обладает существенно повышенным уровнем рецептора HER, такого как HER2, на клеточной поверхности, в сравнении с нераковой клеткой того же типа ткани. Такая суперэкспрессия может быть вызвана генной амплификацией или повышенным уровнем транскрипции или трансляции. Суперэкспрессия рецептора HER может быть определена в диагностическом или прогностическом тесте путем оценки повышенных уровней белка HER, имеющего на поверхности клетки (например, в рамках иммуногистохимического теста, IHC). Альтернативно или дополнительно можно измерять уровни в клетке HER-кодирующей нуклеиновой кислоты, например, с помощью флуоресцентной гибридизации in situ (FISH, см. WO 98/45479, опубликованной в октябре 1998 года), с помощью саузерн-блоттинга или с использованием методики полимеразно-цепной реакции (ПЦР), такой как количественная ПЦР в масштабе реального времени (ОТ-ПЦР). Можно также исследовать степень суперэкспрессии рецептора HER посредством определения скрытого антигена (например, во внеклеточном домене HER) в биологической жидкости, такой как сыворотка (см., например, патент США № 4933294, выданный 12 июня 1990 года; WO 91/05264, опубликованной 18 апреля 1991 года; патент США № 5401638, выданный 28 марта 1995 года; и Sias et al., J. Immunol. Methods 132: 73-80 (1990)). Кроме указанных выше тестов, специалистам-практикам известно и доступно множество других тестов in vivо. Например, клетки в организме пациента подвергают воздействию антитела, которое может быть необязательно помечено выявляемой меткой, например радиоактивным изотопом, после чего оценивают уровень связывания антитела с клетками в организма пациента, например, проводя внешнее сканирование радиоактивности или при отборе для анализа биопсийного образца, взятого из пациента, который ранее подвергался воздействию антитела.
И наоборот, рак, который «не экспрессирует рецептор HER2», представляет собой такой вид рака, который не экспрессирует рецептор HER2 в большей мере, чем нормальные клетки, в сравнении с нераковыми клетками того же типа ткани.
Рак, который «осуществляет суперэкспрессию» лиганда HER, представляет собой такой вид рака, который продуцирует существенно более высокие уровни лигандов в сравнении с не раковой клеткой того же типа ткани. Такая суперэкспрессия может быть вызвана генной амплификацией или в результате повышенной транскрипции, или трансляции. Суперэкспрессия HER может быть определена диагностически посредством оценки уровня лиганда (или кодирующей его нуклеиновой кислоты) у пациента, например, в биопсийном образце опухоли или при использовании различных диагностических тестов, таких как IHC, FISH, саузерн-блоттинг, ПЦР, а также в рамках тестов in vivo, описанных выше.
Термин «цитотоксический агент» в контексте настоящего описания относится к веществу, которое ингибирует функцию клеток или препятствует осуществлению такой функции и/или вызывает деструкцию клеток. Указанный термин включает радиоактивные изотопы (At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32 и радиоактивные изотопы Lu), химиотерапевтические агенты и токсины, такие как малые молекулы токсинов или энзиматически активные токсины бактерий, грибов, растений или токсины животного происхождения, включая их фрагменты и/или варианты.
«Химиотерапевтический агент» представляет собой химическое соединение, используемое при лечении рака. Примеры химиотерапевтических агентов включают алкилирующие агенты, такие как тиотепа и циклофосфамид (CYTOXAN®); алкилсульфонаты, такие как бисульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламин; ацетогенины (в особенности буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, MARINOL®); бета-лапахон; лапахол; колхицины; бетулиновую кислоту; камптотецин (включая синтетический аналог топотекан (HYCAMTIN®), CPT-11 (иринотекан, CAMPTOSAR®), ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; СС-1065 (включая его адозелезиновые, карзелезиновые и бизелезиновые синтетические аналоги); подофиллотоксин; подофиллиновая кислота; тенипозид; криптофицины (в особенности криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги KW-2189 и CB-TM1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотистые средства, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, меклоретамин, гидрохлорид оксида меклоретамина, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урациловая мазь; нитромечевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, в особенности, калихеамицин гамма II и калехеамицин омега II (см., например, Agnew, Chem. Intl. Ed. Engl., 33: 183-186 (1994)); динемицин, включая динемицин А; эсперамицин; а также неокарциностатиновый хромофор и родственные хромопротеиновые энедииновые хромофоры-антибиотики), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (включая ADRIAMYCIN®, морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин, липосомальную форму для инъекций доксорубицина-HCl (DOXIL®), липосомальный доксорубицин TCL D-99 (MYOCET®), пеглилированый липосомальный доксорубицин (CAELYX®) и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин С, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат, гемцитабин (GEMZAR®), тегафур (UFTORAL®), капецитабин (XELODA®), эпотилон и 5-фторурацил (5-ФУ); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; пуриновые аналоги, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; пиримидиновые аналоги, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; анти-адреналовые соединения, такие как аминоглютетимид, митотан, трилостан; средства, восполняющие фолиевую кислоту, такие как фролиновая кислота; ацеглатон; альдофосфамидный гликозид; аминолевулиновая кислота; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демекольцин; диазиквон; элфорнитин; эллиптиния ацетат; этоглюцид; нитрат галлия; гидроксимочевина; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2"-трихлортриэтиламин; трихотецены (в особенности Т-2 токсин, верракурин А, роридин А и ангуидин); уретан; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ara-C»); тиотепа; таксоид, например, паклитаксел (TAXOL®), композиция паклитаксела на основе наночастиц, полученная генноинженерными методами из альбумина (ABRAXANETM), и доцетаксел (TAXOTЕRE®); хлоранбуцил; 6-тиогуанин; меркаптопурин; метотрексат; платиновые агенты, такие как цисплатин, оксалиплатин и карбоплатин; препараты барвинка, которые препятствуют полимеризации тубулина из образующихся микротрубочек, включающие винбластин (VELBAN®), винкристин (ONCOVIN®), виндезин (ELDISIN®, FILDESIN®) и винорелбин (NAVELBINE®); этопозид (VP-16); ифосфамид; митоксантрон; лейкововин; новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота, включая бексаротен (TARGRETIN®); бисфосфонаты, такие как клодронат (например, BONEFOS® или OSTAС®), этидронат (DIDRОCАL®), NE-58095, золедроновая кислота/золедронат (ZOMETA®), алендронат (FOSAMAX®), памидронат (AREDIA®), тилудронат (SKELID®), или резидронат (ACTONEL®); троксацитабин (1,3-диоксолановый нуклеозидный аналог цитозина); антисмысловые олигонуклеотиды, в особенности те, которые ингибируют экспрессию генов на сигнальных путях, вовлекаемых в аберрантную пролиферацию клеток, такие как, например, PKC-альфа, Raf, H-Ras и рецептор фактора роста эпидермальных клеток (EGF-R); вакцины, такие как вакцина THERATОРE® и вакцины для генной терапии, например, вакцина ALLOVECTIN®, вакцина LEUVECTIN® и вакцина VAXID®; ингибитор топоизомеразы 1 (например, LURTOTECAN®); rmRH (например, ABARELIX®); BAY439006 (сорафениб; Bayer); SU-11248 (Pfizer); перифозин, ингибитор COX-2 (например, целекоксиб или эторикоксиб); протеосомный ингибитор (например, PS341); бортезомиб (VELCADE®); CCI-779; типифарниб (R11577); орафениб, ABT510; ингибитор Bcl-2, такой как облимерсен-натрий (GENASENSE®); пиксантрон; ингибиторы EGFR (см. приведенное ниже определение); ингибиторы тирозинкиназы (см. приведенное ниже определение); и фармацевтически приемлемые соли, кислоты или производные указанных выше соединений, а также сочетания двух или более указанных выше соединений, таких как CHOP, сокращенное название комбинированной терапии с использованием циклофосфамида, доксорубицина, винкристина и преднизолона, и FOLFOX, сокращенное название лечения, включающего оксиплатин (FLOXATINTM), объединенную с 5-ФУ и лейкововином.
В данное определение также включаются антигормональные агенты, которые действуют в плане регуляции или ингибирования гормонального воздействия на опухоли, такие как антиэстрогены со смешанным агонистским/антагонистским профилем, включающие тамоксифен (NOLVADEX®), 4-гидрокситамоксифен, торемифен (FARESTON®), идоксифен, дролоксифен, ралоксифен (EVISTA®), триоксифен, кеоксифен и селективные модуляторы рецептора эстрогена (SERM), такие как SERM3; чистые антиэстрогены без агонистстких свойств, такие как фулвестрант (FASLODEX®) и EM800 (такие агенты могут блокировать димеризацию рецептора эстрогена (ER), ингибировать связывание ДНК, повышать метаболизм ER и/или подавлять уровни ER), ингибиторы ароматазы, включающие стероидные ингибиторы ароматазы, такие как форместан и экземестан (AROMASIN®), и нестероидные ингибиторы ароматазы, такие как анастразол (ARIMIDEX®), летрозол (FEMARA®) и аминоглютетимид и другие ингибиторы ароматазы, включающие ворозол (RIVISOR®), ацетат мегестрола (MEGASE®), фадрозол, имидазол; агонисты гормонрилизинга лютеинизирующего гормона, включающие леупролид (LUPRON® и ELIGARD®), гозерелин, бузерелин и триптерелин; половые гормоны, включающие прогестины, такие как ацетат мегестрола и ацетат медроксипрогестерона, эстрогены, такие как диэтилстилбестрол и премарин, и андрогены/ретиноиды, такие как флуоксиместерон, все трансретиноевые кислоты и фенретинид; онапристон; антипрогестероны; отрицательные регуляторы рецептора эстрогена (ERD), антиандрогены, такие как флутамид, нилутамид и бикалутамид; тестолактон; и фармацевтически приемлемые соли, кислоты или производные любого из указанных выше соединений, а также сочетания двух или более указанных соединений.
В контексте настоящего описания термин «EGFR-направленное лекарственное средство» относится к терапевтическому агенту, который связывается с EGFR и необязательно ингибирует активацию EGFR. Примеры таких агентов включают антитела и малые молекулы, которые связываются с EGFR. Примеры антител, которые связываются с EGFR, включают MAb579 (ATCC CRL HB 8506), MAb 455 (ATCC CRL HB 8507), MAb 225 (ATCC CRL HB 8508), MAb 528 (ATCC CRL 8509) (см. патент США № 4943533, Mendelsohn et al.) и их варианты, такие как химеризованное антитело 225 (C225 или Cetuximab; ERBUTIX®) и человеческое антитело 225 с измененной формой (Н225) (см. WO 96/40210, Imclone Systems Inc.); IMC-11F8, полностью человеческон EGFR-направленное антитело (Imclone); антитела, которые связывают мутантный EGFR типа II (патент США № 5212290); гуманизированные и химерные антитела, которые связываются с EGFR, описанные в патенте США № 5891996; и человеческие антитела, которые связываются с EGFR, такие как ABX-EGF или Панитумумаб (Раnitumumab) (см. WO 98/50433, Abgenix/Amgen); EMD 55900 (Stragliotto et. al., Eur. J. Cancer, 32A: 636-640 (1996)); EMD7200 (матузумаб (matuzumab)) и гуманизированное EGFR антитело, направленное против EGFR, которое конкурирует с EGF и TGF-альфа за связывание с EGFR (EMD/Merck); человеческое EGFR антитело, HuMax-EGFR (GenMab); полностью гуманизированные антитела, известные как E1.1, E2.4, E2.5, E6.2, E6.4, E2.11, E6.3 и E7.6.3, которые были описаны в патенте США № 6235883; MDX-447 (Madarex Inc.); и мAb 806 или гуманизированное мAb 806 (Johns et. al., J. Biol. Chem., 279(29): 30375-30384 (2004)). Анти-EGFR антитело может быть конъюгировано с цитотоксическим агентом с образованием иммуноконъюгата (см., например, EP659439A2, Merck Patent GmbH). Антагонисты EGFR включают малые молекулы, такие как соединения, описанные в патентах США №№ 5626582, 5457105, 5475001, 5654307, 5679683, 6084095, 6265410, 6455534, 6521620, 6596726, 6713484, 5770599, 6140332, 5866572, 6399602, 6344459, 6602863, 6391874, 6344455, 5760041, 6002008 и 5747498, а также в указанных ниже РСТ публикациях: WO 98/14451, WO 98/50038, WO 99/09016 и WO 99/24037. Конкретные малые молекулы антагонистов EGFR включают OSI-774 (CP-358774, эрлотиниб, TARCEVA® Genentech/OSI Pharmaceutical); PD 183805 (CI 1033, 2-пропенамид, N-[4-[(3-хлор-4-фторфенил)амино]-7-[3-(4-морфолинил)пропокси]-6-хиназолинил]-, дигидрохлорид; Pfizer Inc.), ZD1839, гефитиниб (IRESSAТМ) 4-(3'-хлор-4'-фторанилино)-7-метокси-6-(3-морфолинопропокси)хиназолин, AstraZeneca), ZM 105180 (6-амино-4-(3-метилфениламино)хиназолин, Zeneca); BIBX-1382 (N8-(3-хлор-4-фторфенил)-N2-(1-метилпиперидин-4-ил)пиримидо[5,4-d]пиримидин-2,8-диамин, Boehringer Ingelheim); PKI-166 ((R)-4-[4-[(1-фенилэтил)амино]-1Н-пирроло[2,3-d]пиримидин-6-ил]фенол); (R)-6-(4-гидроксифенил)-4-[(1-фенилэтил)амино]-7Н-пирроло[2,3-d]пиримидин); CL-387785 (N-[4-[(3-бромфенил)амино]-6-хиназолинил]-2-бутинамид); EKB-569 (N-[4-[(3-хлор-4-фторфенил)амино]-3-циано-7-этокси-6-хинолинил]-4-(диметиламино)-2-бутенамид) (Wyeth); AG1478 (Sugen); AG1571 (SU 5271; Sugen); двойные ингибиторы EGFR/HER2 тирозинкиназы, такие как лапатиниб (GW572016 или (N-[3-хлор-4-[(3-фторфенил)метокси]фенил]-6-[5-[[[2-метилсульфонил)этил]амино]метил]-2-фуранил]-4-хиназолинамин; Glaxo-SmithKline) или цианогуанидинхиназолиновые и цианоамидинхиназоламиновые производные.
«Ингибитор тирозинкиназы» представляет собой молекулу, которая ингибирует тирозинкиназную активность тирозинкиназы, такой как рецептор HER. Примеры таких ингибиторов включают EGFR-направленные лекарственные средства, указанные в предшествующем абзаце, малые молекулы ингибитора тирозинкиназы HER2, такие как TAK 165, доступный от Takeda; CP-724714, пероральный селективный ингибитор рецептора тирозинкиназы ErbB2 (Pfizer and OSI); двойные HER ингибиторы, в частности EKB-569 (доступный от Wyeth), которые предпочтительно связываются с EGFR, но ингибирует и HER2, и EGFR-суперэкспрессирующие клетки; лапатиниб (GW572016; доступный от Glaxo-SmithKline), пероральный тирозинкиназный ингибитор HER2 и EGFR; PKI-166 (доступный от Novartis); ингибиторы pan-HER, в частности канертиниб (CI-1033; Pharmacia); ингибиторы Raf-1, в частности антисмысловой агент ISIS-5132, доступный от ISIS Pharmaceutical, который ингибирует сигнальный путь от Raf-1; TК ингибиторы, не направленные на HER, такие как иматиниба мезилат (GLEEVACТМ), доступный от Glaxo; ингибитор внеклеточно регулируемой МАРК тирозинкиназы I CI-1040 (доступный от Pharmacia); хиназолины, такие как PD 153035, 4-(3-хлоранилино)хиназолин; пиридопиримидины; пиримидопиримидины; пирролопиримидины, такие как СGP 59326, CGP 60261 и CGP 62706, пиразолопиримидины, 4-(фениламино)-7Н-пирроло[2,3-d]пиримидины; куркумин (диферилоилметан, 4,5-бис(4-фторанилино)фталимид); нитротиофеновые фрагменты, содержащие тирфостины; PD-0183805 (Warner-Lamber); антисмысловые молекулы (например, такие, которые связываются с нуклеиновой кислотой, кодирующей HER); хиноксалины (патент США № 5804396); трифостины (патент США № 5804396); ZD6474 (Astra Zeneca); PTK-787 (Novartis/Schering AG); игибиторы pan-HER, такие как CI-1033 (Pfizer); аффинитак (ISIS 3521; Isis/Lilly); иматиниба мезилат (Gleevac; Novartis); PKI-166 (Novartis); GW2016 (Glaxo SmithKline); CI-1033 (Pfizer); EKB-569 (Wyeth); семаксиниб (Sugen); ZD6474 (Astra Zenеca); PTK-787 (Novartis/Schering AG); INC-1C11 (Imclone); цианогуанидинхиназолиновые и цианоамидинхиназоламиновые производные; или агенты, описанные в других работах: патент США № 5804396; WO 99/09016 (American Cyanamid); WО 98/43960 (American Cyanamid); WO 97/38983 (Warner Lambert); WO 99/06378 (Warner Lambert); WO 99/06396 (Warner Lambert); WO 96/30347 (Pfizer, Inc.); WO 96/33978 (Zeneca); WO 96/3397 (Zeneca); WO 96/33980 (Zeneca) и US 2005/0101617.
Термин «антиангиогенный агент» относится к соединению, которое блокирует или препятствует, в некоторой мере, развитию кровеносных сосудов. Антиангиогенный фактор может быть представлен, например, малой молекулой или антителом, которые связываются с фактором роста или рецептором фактора роста, вовлекаемым в прогрессирование ангиогенеза. Предпочтительный антиангиогенный фактор в контексте настоящего описания представляет собой антитело, которое связывается фактором роста эндотелия сосудов (VEGF), такой как бевацизумаб (Bevacizumab) (AVASTIN®).
Термин «цитокин» представляет собой родовой термин для обозначения белков, высвобождаемых одной клеточной популяцией, которые действуют на другие клетки в качестве межклеточного медиатора. Примеры таких цитокинов включают лимфокины, монокины и традиционные полипептидные гормоны. В число цитокинов включается также ростовой гормон, такой как гормон роста человека, N-метионильный гормон роста человека и гормон роста быка, паратиреоидный гормон, тироксин, инсулин, проинсулин, релаксин, прорелаксин, гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (ФСГ), тиреоидстимулирующий гормон (TСГ) и лютеинизирующий гормон (ЛГ), фактор роста клеток печени, фактор роста фибробластов, пролактин, плацентарный лактоген, фактор некроза опухоли α и β; муллериан-ингибирующее вещество; мышиный пептид, ассоциированный с ганадотропином; инхибин; активин; фактор роста эндотелия сосудов; интегрин; тромбопоэтин (ТПО); фактор роста нервных клеток, такой как NGF-β; фактор роста тромбоцитов; трансформирующие факторы роста (TGF), такие как TGF-α и TGF-β; инсулиноподобный фактор роста - I и II; эритропоэтин (EPO); остеоиндуктивные факторы; интерфероны, такие как интерферон-α, -β и -γ; колониестимулирующие факторы (КСФ (CSF)), такой как макрофагальный КСФ (М-КСФ (M-СSF)); гранулоцитарно-макрофагальный КСФ (ГМ-КСФ (GM-CSF)); гранулоцитарный КСФ (Г-КСФ (G-CSF)); интерлейкины (IL), такие как IL-1, IL-1α, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12; фактор некроза опухолевых клеток, такой как TGF-α и TGF-β; и другие полипептидные факторы, включающие LIF и набор с лигандом (KL). В контексте настоящего описания термин цитокины включает белки из природных источников или из рекомбинантной клеточной культуры биологически активных эквивалентов нативной последовательности цитокинов.
II. Композиция с вариантом антитела к HER2
Настоящее изобретение относится, по меньшей мере частично, к некоторым композициям с антителом к HER2. Предпочтительно антитело к HER2 (основное антитело к HER2 или его вариант, по отдельности или оба) представляет такое антитело, которое связывается с доменом II в HER2, ингибирует димеризацию HER2 более эффективно, чем Трастузумаб (Trastuzumab) и/или связывается с сайтом гетеродимерного связывания в HER2. Предпочтительный вариант основного вида антитела в контексте настоящего описания представляет собой такой вид антитела, которое включает аминокислотные последовательности вариабельной легкой и вариабельной тяжелой цепей SEQ ID NO: 3 и 4 и, наиболее предпочтительно, включает аминокислотные последовательности легкой и тяжелой цепей SEQ ID NO: 15 и 16 Пертузумаб.
Приведенные в настоящем описании композиции включают смесь основного вида HER2 и его вариант по аминокислотной последовательности, включающий лидерное удлинение на аминоконце. Предпочтительно лидерное удлинение на аминоконце находится на легкой цепи антительного варианта (например, на одной или двух легких цепях варианта антитела). Основной вид антитела к HER2 или варианта антитела может представлять собой интактное антитело или фрагмент антитела (например, Fab, F(ab')2 фрагменты), но предпочтительно оба представляют собой интактные антитела.
В контексте настоящего описания вариант антитела включает лидерное удлинение на аминоконце на его одной или нескольких тяжелых или легких цепях. Предпочтительно лидерное удлинение на аминоконце находится на одной или двух легких цепях антитела. Лидерное удлинение на аминоконце предпочтительно включает VHS- или состоит из него.
Наличие лидерного удлинения на аминоконце в композиции может быть выявлено различными методами анализа, включая, без ограничения, анализ N-концевой последовательности, тест, основанный на гетерогенности по заряду (например, катионообменная хроматография или капиллярный зонный электрофорез), масс-спектрометрия и т. п. Количество варианта антитела в композиции в основном варьирует от того количества, которое составляет нижний предел выявления любого теста (предпочтительно при анализе по методу катионообменной хроматографии), используемого для выявления варианта антитела, до количества менее, чем количество присутствующего основного вида антитела. В основном, примерно 20% или менее (в частности, от примерно 1% до примерно 15%, например, от 5% до примерно 15%, предпочтительно, от примерно 8% до примерно 12%) молекул антитела в композиции включают лидерное удлинение на аминоконце. Такие процентные доли предпочтительно определяют с использованием катионообменной хроматографии.
Кроме варианта с лидерным удлинением на аминоконце в настоящем описании рассматриваются также другие изменения аминокислотной последовательности основного антитела и/или его варианта, включающие, без ограничения, антитело, содержащее С-концевой лизиновый остаток на его одной или обеих тяжелых цепях (такой вариант антитела может присутствовать в количестве от примерно 1% до примерно 20%), дезамидированный вариант антитела (в котором, например, Asn-386 и/или Asn-391 в одной или двух тяжелых цепях Пертузумаба дезамидированы), антитело с одним или несколькими окисленными метиониновыми остатками (например, Пертузумаб, включающий окисленный мет-254) и т.п.
Кроме того, основной вид антитела или его вариант может включать вариации, определяемые наличием гликозилирования, не ограничивающие примеры которых включают антитело, имеющее олигосахаридную структуру G1 или G2, присоединенную к его Fc участку, антитело, включающее углеводный фрагмент, присоединенный к его легкой цепи (например, один или несколько углеводных фрагментов, таких как глюкоза или галактоза, присоединенные к одной или двум легким цепям антитела, например, присоединенные к одному или нескольким лизиновым остаткам), антитело, включающее одну или две негликозилированных тяжелых цепи, или антитело, включающее сиалилированный олигосахарид, присоединенный к его одной или двум тяжелым цепям и т.п.
Настоящее изобретение также относится к полипептиду, включающему аминокислотную последовательность SEQ ID NO: 23 или ее дезамидированный и/или окисленный вариант. Кроме того, настоящее изобретение относится к антителу, включающему одну или две легких цепи, где одна или несколько указанных легких цепей, включают аминокислотную последовательность SEQ ID NO: 23. Антитело также включает одну или две тяжелых цепи, где одна или обе тяжелых цепи включают аминокислотные последовательности SEQ ID NO: 16 или SEQ ID NO: 24 (или их дезамидированные и/или окисленные варианты).
Композиция может быть с использованием клеточной линии, созданной генноинженерными методами, например, из клеточной линии клеток яичника китайского хомяка, экспрессирующих антитело к HER2, или может быть получена методами пептидного синтеза.
III. Получение антител к HER2
Ниже приводится описание репрезентативных методик, используемых для получения антител согласно настоящему изобретению. Антиген к HER2, используемый для получения антител, может представлять собой растворимую форму внеклеточного домена HER2 или его части, которая содержит желательный эпитоп. Альтернативно клетки, экспрессирующие HER2 на поверхности своих клеток (например, клетки NIH-3T3, трансформированные для суперэкспрессии HER2), или клеточная линия карциномы, такая как линия клеток SK-BR-3 (см. Stancovski et al., PNAS (USA), 88: 8691-8695 (1991)), могут быть использованы для получения антител. Специалистам в данной области известны также другие формы HER2, пригодные для получения антител.
(i) Поликлональные антитела
Поликлональные антитела предпочтительно создают у животных путем множественных подкожных (п/к) или внутрибрюшинных (в/б) инъекций релевантного антигена и адъюванта. Может быть полезно провести конъюгацию релевантного антигена с белком, который является иммуногенным для вида, подлежащего иммунизации, например с гемоцианином из моллюска Megathura crenulata, сывороточным альбумином, бычьим тиреоглобином и ингибитором соевого трипсина, с использованием бифункуционального или дериватизирующего агента, например малеинимидобензоилсульфосукцинимидного эфира (конъюгация происходит через цистеиновые остатки), N-гидроксисукцинимида (через лизиновые остатки), глютаральдегида, янтарного альдегида, SOCl2 или R1N=C=NR, где R и R1 представляют собой разные алкильные группы.
Животных иммунизируют антигеном, иммуногенными конъюгатами или их производными путем объединения, например, от 100 г или 5 г белка или конъюгата (для кролика или мыши соответственно) с 3 объемами полного адъюванта Фрейнда с последующей инъекцией раствора внутрикожно во множественные области. Через месяц животным проводят повторную обработку в 1/5-1/10 количестве от исходного количества пептида или конъюгата в полном адъюванте Фрейнда путем подкожной инъекции во множественные области. Через 7-14 дней у животных отбирают кровь и определяют в сыворотке титр антител. Повторную обработку проводят до достижения стадии плато на графике титров. Предпочтительно проводят повторную обработку животных конъюгатом на основе одного и того же антигена, но конъюгируют с другим белком и/или с помощью другого сшивающего реагента. Конъюгаты могут быть также получены в рекомбинантной клеточной культуре в виде белков слияния. Кроме того, могут использоваться агрегирующие агенты, такие как глинозем, для усиления иммунного ответа.
(ii) Моноклональные антитела
Моноклональные антитела получают из популяции по существу гомогенных антител, то есть индивидуальных антител, включающих популяцию, представители которой идентичны и/или связываются с одним и тем же эпитопом, за исключением возможных вариантов, которые могут возникать при получении моноклональных антител, таких как варианты, описанные в настоящем изобретении. Так, определение «моноклональный» указывает на характер антитела, которое не представляет собой смесь отдельных антител.
Например, моноклональные антитела могут быть получены с использованием метода гибридом, впервые описанным Колером с соавт. (Kohler et al., Nature, 256: 495 (1975)), или могут быть созданы с использованием методик рекомбинантной ДНК (патент США № 4816567).
В рамках методики гибридомы мышь или другое подходящее животное в качестве хозяйского организма, такое как хомяк, иммунизируют в соответствии с приведенным выше описанием для проявления действия лимфоцитов, которые продуцируют или способны продуцировать антитела, которые могут специфически связываться с белком, используемым для иммунизации. Альтернативно лимфоциты могут быть иммунизированы in vitro. Лимфоциты далее сливают с миеломными клетками с использованием подходящего объединяющего агента, такого как полиэтиленгликоль, с образованием гибридомных клеток (Goding, Monoclonal Antibodies: Principles and Practice, pp. 59-103 (Academic Press, 1986)).
Полученные таким образом гибридомные клетки высевают и растят в подходящей культуральной среде, которая предпочтительно содержит одно или несколько веществ, ингибирующих рост или выживание неслитых исходных миеломных клеток. Например, если исходные миеломные клетки не содержат фермент гипоксантингуанинфосфорибозилтрансферазу (HGPRT или HPRT), то культуральная среда для гибридом в типичном случае будет включать гипоксантин, аминоптерин и тимидин (среда НAT), которая в существенной мере препятствует росту HGPRT-дефицитных клеток.
Предпочтительные миеломные клетки представляют собой такие клетки, которые эффективно сливаются, поддерживают стабильный высокий уровень продукции антител выбранными антитело-продуцирующими клетками и чувствительны к среде, такой как среда НАТ. Среди них предпочтительными миеломными клеточными линиями являются мышиные миеломные линии, такие как линии, полученные из мышиных опухолей MOPC-21 и MPC-11, доступные от Salk Institute Cell Distribution Center, San Diego, California USA, и SP-2 или клетки X63-Ag8-653, доступные от Американской Коллекции типовых культур (American Type Culture Collection, Rockville, Maryland USA). Описаны также человеческие миеломные и гетеромиеломные клеточные линии мыши-человека для продукции человеческих моноклональных антител (Kozbor, J. Immunol., 133: 3001 (1984); и Brodeur et al., Monoclonal Antibodies Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)).
Культуральную среду, в которой выращивают гибридомные клетки, анализируют для определения продукции моноклональных антител против антигена. Предпочтительно специфичность по связыванию моноклональных антител, продуцируемых гибридомными клетками, определяют иммуноосаждением или тестом на связывание in vitro, таким как радиоиммуноанализ (РИA) или твердофазный иммуноферментный анализ (ELISA).
Афинность по связыванию моноклонального антитела может быть определена, например, по методике Скетчарда (Scatchard) (Munson et al., Anal. Biochem., 107: 220 (1980)).
После идентификации гибридомных клеток в качестве клеток, продуцирующих антитела с желательной специфичностью, афинностью и/или активностью, такие клоны могут быть подвергнуты субклонированию по процедурам предельного разбавления с последующим выращиванием по стандартным методикам (Goding, Monoclonal Antibodies: Principles and Practice, pp. 59-103 (Academic Press, 1986)). Подходящие культуральные среды для данной цели включают, например, среду D-MEM и среду RPMI-1640. Кроме того, гибридомные клетки могут выращиваться in vivo в виде асцитных опухолей у животных.
Моноклональные антитела, секретируемые субклонами, могут быть соответствующим образом отделены от культуральной среды, асцитной жидкости или сыворотки с использованием обычных процедур очистки антител, таких как, например, очистка на колонке с белком А-сефарозой, хроматография на гидроксилапатите, гель-электрофорез, диализ или аффинная хроматография.
ДНК, кодирующая моноклональные антитела, может быть легко выделена и секвенирована с использованием традиционных процедур (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелую и легкую цепи мышиных антител). Гибридомные клетки служат в качестве предпочтительного источника такой ДНК. После выделения ДНК может быть введена в вектор экспрессии, который затем трансфицируют в хозяйские клетки, такие как Е. coli, COS клетки, клетки яичника китайского хомяка (CHO) или миеломные клетки, которые в ином случае не продуцируют антительный белок, с достижением синтеза моноклональных антител в рекомбинантных хозяйских клетках. Рекомбинантная экспрессия ДНК, кодирующей антитела, в бактериях описана в ряде обзоров (Skerra et al., Curr. Opinion in Immunol., 5: 256-262 (1993) и Plückthun, Immunol. Revs., 130: 151-188 (1992)).
В другом варианте моноклональные антитела или фрагменты антител могут быть выделены из библиотеки фаговых антител, получаемых с использованием методик, описанных в литературе (McCafferty et al., Nature., 348: 552-554 (1990)). Клаксон и Маркс (Clackson et al., Nature., 352: 624-628 (1991) и Marks et al., J. Mol. Biol., 222: 581-597 (1991)) описывают выделение мышиных и человеческих антител, соответственно, с использованием фаговых библиотек. Последующие очистки приводят к продукции высокоаффинных (в нM диапазоне) человеческих антител, получаемых за счет перегруппировки цепей (Marks et al., Bio/Technology, 10: 779-783 (1992)), а также при проведении комбинаторной инфекции и рекомбинации in vivo в качестве стратегии создания очень больших фаговых библиотек (Waterhouse et al., Nuc. Acids, Res., 21: 2265-2266 (1993)). Таким образом, данные методики представляют собой жизнеспособные альтернативы традиционным гибридомным методикам моноклональных антител для выделения моноклональных антител.
ДНК может быть также модифицирована, например, путем замещения кодирующей последовательности константных доменов тяжелой цепи и легкой цепи человеческой молекулы гомологичных мышиных последовательностей (патент США № 4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA., 81: 6851 (1984)) или путем ковалентного присоединения ко всей кодирующей последовательности иммуноглобулина или к части кодирующей последовательности для не иммуноглобулинового полипептида.
В типичном случае такие не иммуноглобулиновые пептиды замещают константными доменами антитела или они могут быть замещены вариабельными доменами одного антигенобъединенного сайта антитела с образованием химерного бивалентного антитела, включающего антигенобъединенный сайт со специфичностью к одному антигену и другой антигенобъединенный сайт со специфичностью к другому антигену.
III. Гуманизированные антитела
Методы гуманизации антител из источников, отличных от человека, описаны в литературе. Предпочтительно гуманизированное антитело содержит один или несколько аминокислотных остатков, введенных в него из другого источника, который отличен от человека. Указанные аминокислотные остатки, отличные от человеческих, обычно называют «импортные» остатки, которые в типичном случае берут из «импортного» вариабельного домена. Гуманизация может быть по существу проведена по методике Винтера с сотр. (Winter and co-workes) (Jones et al., Nature, 321: 522-525 (1986); Riechman et al., Nature., 332: 323-327 (1988); Verhoeyen et al., Science, 239: 1534-1536 (1988)) путем замещения последовательностей гипервариабельных участков на соответствующие последовательности человеческого антитела. Соответственно, такие «гуманизированные» антитела представляют собой химерные антитела (патент США № 4816567), в которых значительно меньше, чем в интактном вариабельном домене человеческого антитела, замещено соответствующей последовательностью из вида, отличного от человека. Практически, гуманизированные антитела представляют собой в типичном случае человеческие антитела, в которых некоторые остатки гипервариабельного участка и, возможно, некоторые остатки FR замещены остатками из аналогичных сайтов в антителах грызунов.
Выбор человеческих вариабельных доменов как легкой, так и тяжелой цепей, используемых для получения гуманизированных антител, очень важен для достижения антигенности. В соответствии с так называемым методом «бест-фит» («best-fit»), или наилучшей подгонки, последовательность вариабельного домена в антителе грызуна подвергают скринингу с использованием полной библиотеки известных последовательностей вариабельных доменов антител человека. Человеческая последовательность, которая отличается наибольшей близостью к последовательности грызуна, отбирается в качестве каркасного участка человеческой молекулы (FR) для гуманизированного антитела (Sims et al., J. Immunol., 151: 2296 (1993)); Chothia et al., J. Mol. Biol., 196: 901 (1987)). В другой методике используется конкретный каркасный участок, получаемый из консенсусной последовательности всех человеческих антител определенной подгруппы легких или тяжелых цепей. Такого рода подход может быть использован для получения ряда различных гуманизированных антител (Carter et al., Proc. Natl. Acad. Sci. USA, 89: 4285 (1992)); Prestа et al., J. Immunol., 151: 2623 (1993)).
Кроме того, важно, чтобы при гуманизации антител сохранялась высокая аффинность к антигену и другие полезные биологические свойства. Для достижения данной цели, в соответствии с предпочтительным методом, гуманизированные антитела получают при проведении анализа исходных последовательностей и различных концептуальных гуманизированных продуктов с использованием трехмерных моделей исходных и гуманизированных последовательностей. Трехмерные иммуноглобулиновые модели доступны и известны специалистам в данной области. Доступны также компьютерные программы, которые позволяют увидеть вероятные трехмерные конформационные структуры выбранных предполагаемых иммуноглобулиновых последовательностей. При осмотре таких картин можно проанализировать вероятную роли остатков в функционировании предполагаемой иммуноглобулиновой последовательности, то есть провести анализ остатков, которые влияют на способность данного иммуноглобулина связывать свой антиген. В этом случае остатки FR могут быть отобраны и объединены с реципиентными и импортными последовательностями, так чтобы достигались желательные характеристики антитела, такие как повышенная аффинность для целевого(ых) антигена(ов). В основном, остатки гипервариабельного участка непосредственно и наиболее значительно вовлечены в процесс связывания с антигеном, оказывая на него влияние.
В документе WO 01/00245 описывается получение репрезентативных гуманизированных антител к HER2, которые связывают HER2 и блокируют активацию лиганда рецептора HER. Особенно интересное в данном контексте гуманизированное антитело блокирует EGF, TGF-α и/или HRG-опосредованную активацию MAPK по существу столь же эффективно, как и интактное мышиное моноклональное антитело 2C4 (или его Fab фрагмент) и/или связывает HER2 по существу столь же эффективно, как и интактное мышиное моноклональное антитело 2C4 (или его Fab фрагмент). Описанное в настоящем изобретении гуманизированное антитело может, например, включать остатки гипервариабельного участка из источника, отличного от человека, включенного в вариабельный домен тяжелой цепи молекулы человека, и может также включать замещение в каркасном участке (FR) в положении, выбранном из группы, состоящей из 69H, 71H и 73H, где используется система нумерации вариабельного домена в соответствии с определенной системой (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991)). В одном варианте гуманизированное антитело включает замещение в FR по двум или всем положениям: 69H, 71H и 73H.
Представляющее интерес в настоящем контексте репрезентативное гуманизированное антитело включает в гипервариабельном участке тяжелой цепи остатки GFTFТDYTMX, где X предпочтительно обозначает D или S (SEQ ID NO: 7), DVNPNSGGSIYNQRFKG (SEQ ID NO: 8) и/или NLGPSFYFDY (SEQ ID NO: 9), необязательно включая модификации аминокислот таких CDR остатков, то есть такие модификации, которые по существу сохраняют или повышают аффинность антител. Например, вариант антитела, интересного в контексте настоящего описания, может иметь от примерно одного до примерно семи или примерно пять аминокислотных замещений в указанных выше CDR последовательностях вариабельного участка тяжелой цепи. Такие варианты антител могут быть получены путем аффинного насыщения, например, как будет описано ниже. Наиболее предпочтительное гуманизированное антитело включает в вариабельном участке тяжелой цепи аминокислотную последовательность SEQ ID NO: 4.
Гуманизированное антитело может включать остатки гипервариабельного участка вариабельного домена легкой цепи KASQDVSIGVA (SEQ ID NO: 10); SASYX1X2X3, где X1 обозначает предпочтительно R или L, X2 обозначает предпочтительно Y или E, X3 обозначает предпочтительно T или S (SEQ ID NO: 11); и/или QQYYIYPYT (SEQ ID NO: 12), например, дополнительно к CDR остаткам вариабельного домена тяжелой цепи, указанных в предшествующем абзаце. Такие гуманизированные антитела необязательно включают модификации аминокислот в указанных выше CDR остатках, например, модификации, которые по существу сохраняют или повышают аффинность антитела. Например, вариант антитела, интересного в контексте настоящего описания, может иметь от примерно одного до примерно семи или примерно пять аминокислотных замещений в указанных выше CDR последовательностях вариабельного домена легкой цепи. Такие варианты антител могут быть получены путем аффинного насыщения, например, по описанной ниже методике. Наиболее предпочтительное гуманизированное антитело включает аминокислотную последовательность вариабельного участка легкой цепи SEQ ID NO: 3.
Настоящее изобретение также относится к «созревшим» в плане аффинности антителам, которые связываются с HER2 и блокируют активацию лиганда рецептора HER. Исходное антитело может представлять собой человеческое антитело или гуманизированное антитело, например антитело, включающее вариабельные последовательности легкой и/или вариабельные последовательности тяжелой цепи SEQ ID NO: 3 и 4 соответственно (например, вариант 574). «Созревшее» в плане аффинности антитело предпочтительно связывается с рецептором HER2 с аффинностью, превосходящей аффинность интактного мышиного 2С4 или интактного варианта 5С4 (например, от примерно двух или примерно четырех раз до примерно 10 раз или примерно 1000 раз повышенной аффинностью, по данным оценки с использованием HER2-внеклеточного домена (ECD) по методу ELISA). Репрезентативные CDR остатки вариабельной тяжелой цепи, подходящие для замещения, включают H28, H30, H34, H35, H64, H96, H99 или сочетания двух или более остатков (например, двух, трех, четырех, пяти, шести или семи таких остатков). Примеры CDR остатков вариабельного домена легкой цепи, подходящие для изменения, включают L28, L50, L53, L56, L91, L92, L93, L94, L96, L97 или сочетания двух или более остатков (например, двух, трех, четырех, пяти или примерно до десяти таких остатков).
В настоящем описании рассматриваются различные формы гуманизированного антитела или «созревшего» в плане аффинности антитела. Например, гуманизированное антитело или «созревшее» в плане аффинности антитело может представлять собой антительный фрагмент, такой как Fab, который необязательно может быть конъюгирован с одним или несколькими цитотоксическими агентами с получением иммуноконъюгата. Альтернативно гуманизированное антитело или «созревшее» в плане аффинности антитело может представлять собой интактное антитело, такое как интактное IgG1 антитело.
(iv) Человеческие антитела
В качестве альтернативы процессов гуманизации можно получать человеческие антитела. Например, в настоящее время возможно создавать трансгенных животных (например, мышей), которые способны при иммунизации продуцировать полный репертуар человеческих антител в отсутствие продукции эндогенного иммуноглобулина. Например, описано, что гомозиготные делеции в гене соединяющего участка тяжелой цепи антитела (JH) в химерных и мутантных мышах зародышевой линии приводят к полному ингибирования продукции эндогенного антитела. Перенос генной совокупности человеческого зародышевого иммуноглобулина в зародышевую линию таких мутантных мышей приводит к продукции человеческих антител при антигенной провокации (см., например, Jakobovits et al., Proc. Natl. Acad. Sci. USA., 90: 2551 (1993); Jakabovits et al., Nature, 362: 255-258 (1993); Bruggermann et al., Year in Immuno., 7: 33 (1993); и патенты США №№ 5591669, 5589369 и 5545807).
Альтернативно методика проявления активности фагов (McCafferty et al., Nature, 348: 552-553 (1990)) может использоваться для продукции человеческих антител и антительных фрагментов in vitro из генного репертуара вариабельного домена иммуноглобулина (V) от иммунизированных доноров. В соответствии с данной методикой гены для V домена антитела клонируют в рамке считывания в основном или минорном гене белковой оболочки или нитевидного бактериофага, такого как M13 или fd, и проявляют в качестве функциональных антительные фрагменты на поверхности фаговой частицы. Поскольку нитевидная частица содержат копию одноцепочечной ДНК фагового генома, селекция на основе функциональных свойств антител также приводит к селекции гена, кодирующего антитело, демонстрирующее указанные свойства. Таким образом, фаг имитирует некоторые свойства B-клеток. Способ фагового дисплея может проводиться в разных форматах, как это описано в обзоре (см., например, Jоhnson, Kevin S. and Chiswell, David J., Current Opinion in Structural Biology, 3: 564-571 (1993)). Может использоваться несколько источников сегментов V-гена для фагового дисплея. Клаксон с соавт. (Clackson et al., Nature, 352: 624-628 (1991)) выделили различные совокупности антиоксазолоновых антител из небольшой случайной комбинаторной библиотеки V генов, полученных из селезенки иммунизированных мышей. Может быть создан репертуар V генов от иммунизированных доноров-людей, и антитела к совокупности разных антигенов (включая собственные антигены) могут быть выделены, в соответствии, по существу, с описанной в литературе методикой (Marks et al., J. Mol. Biol., 222: 581-597 (1991) или Griffith et al., EMBO J, 12: 725-734 (1993)). См. также патенты США №№ 5565332 и 5573905.
Человеческие антитела могут быть также получены in vitro с использованием активированных В-клеток (см. патенты США №№ 5567610 и 5229275).
Человеческие антитела к HER2 описаны в патенте США № 5772997, выданном 30 июля 1998 года, и в WO 97/00271, опубликованной 3 января 1997 года.
(v) Фрагменты антител
Были разработаны различные методики для получения фрагментов антител. Традиционно указанные фрагменты получают путем протеолитического расщепления интактных антител (см., например, Morimoto et al., Journal of Biochemical and Biophysical Methods, 24: 107-117 (1992); и Brennan et al., Science, 229: 81 (1985)). Однако такие фрагменты могут быть получены непосредственно с помощью рекомбинантных хозяйских клеток. Например, антительные фрагменты могут быть выделены из описанных выше библиотек фаговых антител. Альтернативно фрагменты Fab'-SH могут быть непосредственно восстановлены из E. coli и химически связаны с образованием фрагмента F(ab')2 (Carter et al., Bio/Technology 10; 163-167 (1992)). В соответствии с другим подходом фрагменты F(ab')2 могут быть выделены непосредственно из культуры рекомбинантных хозяйских клеток. Специалистам в данной области известны другие методики получения антительных фрагментов. В других вариантах выбираемое антитело представляет собой одноцепочечный фрагмент Fv (scFv). См. WO 93/16185; патент США № 5571894; и патент США № 5587458. Антительный фрагмент может также представлять собой «линейное антитело», например, описанное в патенте США № 5641870. Такие фрагменты линейного антитела могут быть моноспецифичными или биспецифичными.
(vi) Биспецифичные антитела
Биспецифичные антитела представляют собой антитела, которые обладают связывающей специфичностью по меньшей мере к двум разным эпитопам. Репрезентативные биспецифичные антитела могут связываться с двумя разными эпитопами на белке HER2. Другие такие антитела могут объединять сайт связывания HER2 с сайтом(ами) связывания EGFR, HER3 и/или HER4. Альтернативно плечо HER2 может быть объединено с плечом, которое связывается с триггерной молекулой на лейкоците, такой как молекула Т-клеточного рецептора (например, СD2 или СD3), или Fc рецепторы для IgG (FcγR), такие как FcγRI(CD64), FcγRII(CD32) или FcγRIII(CD16), так что достигается фокусирование клеточных защитных механизмов на HER2-экспрессирующей клетке. Биспецифичные антитела могут также использоваться для локализации цитотоксических агентов в клетках, которые экспрессируют HER2. Указанные антитела обладают HER2-связывающим плечом и плечом, которое связывает цитотоксический агент (например, сапорин, антиинтерферон α, алкалоид барвинка, цепь рицина А, метотрексат или радиоактивный изотоп гаптена). Биспецифичные антитела могут быть получены в виде антител полной длины или фрагментов антител (например, фрагментов F(ab')2 биспецифичных антител).
В документе WO 96/16673 описано биспецифичное антитело HER2/FсγRIII и в патенте США № 5837234 описывает биспецифичное антитело HER2/FсγRI IDM1 (Osidem). Биспецифичное антитело HER2/Fс-α показано в WO 98/02463. В патенте США № 5821337 описывается биспецифичное антитело HER2/CD3. MDX-210 представляет собой биспецифичное HER2-FсγRIII антитело.
Способы получения биспецифичных антител известны в данной области. Традиционный способ получения биспецифичных антител полной длины основан на совместной экспрессии двух пар тяжелой цепи-легкой цепи иммуноглобулина, где обе цепи имеют разную специфичность (Millstein et al., Nature, 305: 537-539 (1983)). В результате случайного перераспределения тяжелой и легкой цепей иммуноглобулина получаемые гибридомы (квадромы) создают потенциальную смесь из 10 разных антительных молекул, среди которых только одна имеет правильную биспецифичную структуру. Очистка такой корректной молекулы, которая обычно проводится методом аффинной хроматографии, весьма сложна, и выход продукта низкий. Аналогичные процедуры описаны в WO 93/08892 и в литературе (Traunecker et al., EMBO J., 10: 3655-3659 (1991)).
В соответствии с другим подходом вариабельные домены антител с желательными специфичностями по связыванию (объединенные сайты антитело-антиген) сливают с последовательностями константных доменов иммуноглобулина. Слияние осуществляют предпочтительно с константным доменом тяжелой цепи иммуноглобулина, включающим по меньшей мере часть шарнира, CH2 и CH3 участки. Предпочтительно иметь первый константный участок в тяжелой цепи (CH1), который содержит сайт, необходимый для связывания легкой цепи, присутствующей по меньшей мере в одной из гибридных молекул. ДНК, кодирующую тяжелую цепь слитых молекул иммуноглобулина и, при желании, легкую цепь иммуноглобулина, встраивают в отдельные векторы экспрессии и подвергают совместной трансфекции в подходящий хозяйский организм. В результате достигают большей стабильности в корректировке взаимных пропорций трех полипептидных фрагментов, в случае если используют неравные части трех полипептидных цепей в конструкции для достижения оптимальных выходов. Однако возможно встраивать кодирующие последовательности для двух или трех полипептидных цепей в один вектор экспрессии в том случае, когда экспрессия по меньшей мере двух полипептидных цепей, имеющихся в равных частях, приводит к высоким выходам или когда такие соотношения не имеют особого значения.
В предпочтительном варианте осуществления данного подхода биспецифичные антитела состоят из гибридной тяжелой цепи иммуноглобулина с первой связывающей специфичностью в одном плече и гибридной пары тяжелой цепи-легкой цепи иммуноглобулина (с обеспечением второй связывающей специфичности) в другом плече. Было обнаружено, что такая ассиметричная структура облегчает отделение желательного биспецифичного соединения от нежелательных комбинаций иммуноглобулиновых цепей, поскольку наличие легкой цепи иммуноглобулина в одной половине биспецифичной молекулы облегчает процесс разделения. Указанный подход описан в WO 94/04690. Дополнительные детали получения биспецифичных молекул описаны в работе Суреша с соавт. (Suresh et al., Methods in Enzymology, 121: 210 (1986)).
В соответствии с другим подходом, описанным в патенте США № 5731168, интерфейс между парой антительных молекул может быть сконструирован таким образом, чтобы максимизировать процент гетеродимеров, которые получают из культуры рекомбинантных клеток. Предпочтительный интерфейс включает по меньшей мере часть домена СН3 константного домена антитела. В соответствии с данным методом одна или несколько боковых цепей малых аминокислот из интерфейса в первой антительной молекуле замещают более длинными боковыми цепями (например, тирозином или триптофаном). Компенсаторные «полости» идентичного или близкого размера относительно крупной(ых) боковой(ых) цепи(ей) создают на интерфейсе второй антительной молекулы путем замещения крупных боковых цепей аминокислот более мелкими (например, аланином или треонином). Это создает механизм повышения выхода гетеродимеров относительно других нежелательных промежуточных продуктов, таких как гомодимеры.
Биспецифичные антитела включают сшивку «гетероконъюгатных» антител. Например, одно из антител в гетероконъюгате может быть объединено с авидином, другое - с биотином. Было высказано предположение, что такие антитела, например, позволяют клеткам иммунной системы достигать нежелательных клеток для воздействия на них (патент США № 4676980) и могут использоваться для лечения ВИЧ-инфекции (HIV) (WО 91/00360, WO 92/200373 и EP 03089). Гетероконъюгатные молекулы могут быть получены с использованием методов сшивки. Подходящие сшивающие агенты известны в данной области и, в частности, описаны в патенте США № 4676980, где приведено множество методик сшивки.
Методики получения биспецифичных молекул из антительных фрагментов описаны в литературе. Например, биспецифичные антитела могут быть получены с использованием химической сшивки. Бренан с соавт. (Brennan et al., Science, 229: 81 (1985)) описывает процедуру, в рамках которой интактные антитела подвергают протеолитическому расщеплению с образованием F(ab')2 фрагментов. Указанные фрагменты восстанавливают в присутствии арсенида натрия в качестве дитиол-комплексообразующего агента для стабилизации ближайших дитиолов и предупреждения образования внутримолекулярных дисульфидных связей. Образованные фрагменты Fab' затем преобразуют в тионитробензоатные производные (TНБ). Один из Fab'-TНБ производных далее превращают в Fab'-тиол путем восстановления меркаптоэтиламином и смешивают с эквимолярным количеством другого Fab'-TНБ производного с образованием специфичного антитела. Получаемые биспецифичные антитела могут быть использованы в качестве агентов для селективной иммобилизации ферментов.
В последнее время удалось упростить метод непосредственного выделения фрагментов Fab'-SH из E. coli, которые могут быть химически связаны с образованием биспецифичных антител. Шалаби с соавт. (Shalaby et al., J. Exp. Med., 175: 217-225 (1992)) описывает получение молекул полностью гуманизированного биспецифичного антитела F(ab')2. Каждый фрагмент Fab' отдельно секретируется из E. Coli, после чего его подвергают непосредственно химическому связыванию in vitro с образованием биспецифичного антитела. Полученное таким образом биспецифичное антитело способно связываться с клетками, осуществляющими суперэкспрессию рецептора HER2, и нормальными человеческими Т-клетками, а также запускать литическую активность цитотоксических лимфоцитов человека против опухолевых мишеней молочной железы человека.
Описано большое число методик получения и выделения фрагментов биспецифичных антител непосредственно из культуры рекомбинантных клеток. Например, биспецифичные антитела получают с использованием лейциновых зипперов (Kostelny et al., J. Immunol., 148(5): 1547-1553 (1992)). Пептиды с лейциновым зиппером из белков Fos и Jun связывают с Fab' частями двух разных антител путем генного слияния. Антительные гомодимеры восстанавливают в шарнирной области с образованием мономеров и затем подвергают повторному окислению с образованием антительных гетеродимеров. Данный метод может также использоваться для получения антительных гомодимеров. Методика образования «диантител», описанная в работе Холлингера с соавт. (Hollinger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993)), обеспечивает альтернативный механизм получения фрагментов биспецифичных антител. Фрагменты включают вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) с помощью линкера, который слишком короткий для того, чтобы позволить спаривание между доменами на одной и той же цепи. Соответственно, домены VH и VL одного фрагмента заставляют спариваться с комплементарными доменами VL и VH другого фрагмента, что приводит к образованию двух антигенсвязывающих сайтов. Была также предложена другая стратегия получения фрагментов биспецифичных антител за счет использования димеров одноцепочечных Fv (sFv) (см. Gruber et al., J. Immunol., 152: 5368 (1994)).
Рассматриваются также антитела более чем с двумя валентностями. Например, могут быть получены триспецифичные антитела (Tutt et al., J. Immunol., 147: 60 (1991)).
(vii) Другие модификации аминокислотных последовательностей
Описываются также модификации аминокислотных последовательностей антител к HER2. Например, может быть желательно улучшить аффинность по связыванию и/или другие биологические свойства антитела. Варианты аминокислотной последовательности антитела к HER2 получают путем введения соответствующих нуклеотидных изменений в нуклеиновую кислоту для антитела к HER2 или путем пептидного синтеза. Такие модификации включают, например, делеции и/или вставки, и/или замещения остатков в аминокислотных последовательностях антитела к HER2. Используют любое сочетание делеций, вставок и замещений для создания окончательной конструкции при условии, что окончательная конструкции обладает желательными характеристиками. Изменения аминокислотной цепи также могут изменять посттрансляционные процессы антитела к HER2, такие как изменение числа или положения сайтов гликозилирования.
Полезный способ идентификации некоторых остатков или участков антитела к HER2, которые имеют предпочтительную локализацию для мутагенеза, носят название «мутагенез по методу сканирования аланина», описанный в литературе (Cunningham and Wells Science, 244: 1081-1085 (1989)). В соответствии с данной методикой идентифицируют остаток или группу целевых остатков (например, заряженные остатки, такие как arg, asp, his, lys и glu) и замещают нейтральными или отрицательно заряженными аминокислотами (наиболее предпочтительно аланином или полиаланином) с тем, чтобы оказать эффект на взаимодействие аминокислот с антигеном HER2. Такие аминокислотные положения, которые демонстрируют функциональную чувствительность к замещениям, далее корректируют путем введения дополнительных или других вариантов на основе сайтов замещения. Таким образом, тогда как сайт введения для достижения вариаций в аминокислотной последовательности предопределен, природа мутации per se заранее не предопределена. Например, для анализа функционирования мутации в данном сайте проводят ala сканирование или случайный мутагенез в целевом кодоне или на участке, и экспрессированные варианты антитела к HER2 подвергают скринингу на наличие желательной активности.
Вставки аминокислотной последовательности включают амино- и/или карбоксиконцевые слияния, варьирующие по длине от одного остатка до полипептидов, содержащих сотни или более остатков, а также вставки между последовательностями одного или большого числа аминокислотных остатков. Примеры концевых вставок включают антитело к HER2 с N-концевым метионильным остатком или антитело, слитое с цитотоксическим полипептидом. Другие варианты молекулярной вставки антитела к HER2 включают вариант слияния на N- или С-конце антитела к HER2 с ферментом (например, ADEPT) или полипептидом, который повышает период полувыведения антитела из сыворотки.
Другой тип варианта представляет собой вариант по замещению аминокислот. Указанные варианты содержат по меньшей мере один аминокислотный остаток в молекуле антитела к HER2, который замещен другим остатком. Сайты, представляющие наибольший интерес для мутагенеза по типу замещения, включают гипервариабельные участки, или CDR, но для этой цели могут также рассматриваться изменения в участке FR или Fc. Консервативные замещения проиллюстрированы в таблице 1 в колонке «предпочтительное замещение». Если такие замещения приводят к изменению биологической активности, то могут быть введены более существенные изменения, обозначенные как «примерные замещения» в таблице 1, или которые дополнительно описаны ниже в примечании по классам аминокислот и далее может быть проведен скрининг продуктов.
Существенные модификации в биологических свойствах антитела отслеживают при проведении селекции таких вариантов по замещению, которые значительно отличаются по своему эффекту на сохранение (а) структуры полипептидного скелета в зоне замещения, например, на пластинчатую или спиральную конформацию, (b) заряд или гидрофобность молекулы в сайте-мишени или (с) объем боковой цепи. Аминокислоты могут быть сгруппированы по сходству в свойствах боковых цепей (A. L. Lehninger, in Biochemistry, second ed., pp. 73-75, Wоrth Publishers, New York (1975)):
(1) неполярные: Ala (A), Val (V), Leu (L), Ile (I), Pro (P), Phe (F), Trp (W), Met (M);
(2) незаряженные полярные: Gly (G), Ser (S), Thr (T), Cys (C), Tyr (Y), Asn (N), Gln (Q);
(3) кислые: Asp (D), Glu (E);
(4) основные: Lys (K), Arg (R), His (H).
Альтернативно природные остатки могут быть подразделены на группы на основании общности свойств их боковых цепей:
(1) гидрофобные: Норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислые: Asp, Glu;
(4) основные: Нis, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Не консервативные замещения будут приводить к обмену представителей из одного или нескольких классов на представителей другого класса.
Любой цистеиновый остаток, не вовлекаемый в поддержание соответствующей конформации антитела к HER2, также может быть замещен в основном серином с улучшением стабильности молекулы к окислению и с предотвращением аберрантной сшивки. И наоборот, могут быть добавлены цистеиновая(ые) связь(и) к антителу для повышения его стабильности (в особенности, когда антитело представляет собой антительный фрагмент, такой как фрагмент Fv).
Особенно предпочтительный вариант по замещению включает замещение одного или нескольких остатков в гипервариабельном участке исходного антитела (например, гуманизированного или человеческого антитела). В основном, окончательный(ые) вариант(ы), выбираемый(ые) для дальнейшей работы, будет(ут) обладать улучшенными биологическими свойствами относительно исходного антитела, из которого он(и) был(и) получен(ы). Удобный способ создания таких вариантов по замещению включает методику достижения созревания по аффинности с использованием фагового дисплея. Вкратце, такая методика заключается в том, что несколько сайтов гипервариабельного участка (например, 6-7 сайтов) подвергают мутированию с образованием всех возможных аминокислотных замещений в каждом сайте. Получаемые таким образом варианты антител просматривают в моновалентном режиме с использованием частиц нитевидных фагов в виде слияния с продуктом гена III от М13, упакованного внутри каждой частицы. Варианты с фаговым дисплеем далее подвергают скринингу на наличие биологической активности (например, аффинности по связыванию) в соответствии с описанной методикой. Для идентификации сайтов гипервариабельного участка, подходящих для модификации кандидатов, проводят мутагенез по сканированию аланина для идентификации остатков гипервариабельного участка, существенно влияющих на связывание с антигеном. Альтернативно или дополнительно может быть полезно проанализировать кристаллическую структуру комплекса антиген-антитело для идентификации контактных точек между антителом и человеческим HER2. Такие контактные остатки и близлежащие остатки могут рассматриваться как кандидаты для замещения по разработанной методике. При получении таких вариантов панель вариантов подвергают скринингу в соответствии с приведенным описанием, и антитела с улучшенными свойствами, определяемыми по одному или нескольким релевантным тестам, отбирают для дальнейшей работы.
Другой тип аминокислотного варианта антитела основан на изменении исходной картины гликозилирования антитела. Под изменением в данном случае понимается делеция одного или нескольких углеводных фрагментов, имеющихся в антителе, и/или добавление одного или нескольких сайтов гликозилирования, которые не присутствуют в антителе.
Гликозилирование антител происходит в типичном случае по механизму N-связывания или О-связывания. N-связывание относится к присоединению углеводного фрагмента к боковой цепи аспарагинового остатка. Трипептидные последовательности аспарагин-Х-серин и аспарагин-Х-треонин, где Х может быть любой аминокислотой, за исключением пролина, представляют собой распознаваемые последовательности для ферментативного присоединения углеродного фрагмента к боковой цепи аспарагина. Таким образом, наличие одной из указанных трипептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. О-связанное гликозилирование относится к присоединению одного из сахаров: N-ацетилгалактозамина, галактозы или ксилозы, к гидроксиаминокислоте, чаще всего такой, как серин или треонин, хотя может также использоваться 5-гидроксипролин или 5-гидроксилизин.
Добавление сайтов гликозилирования к антителу обычно осуществляется путем изменения аминокислотной последовательности так, чтобы она содержала одну или несколько указанных выше трипептидных последовательностей (в случае сайтов N-связанного гликозилирования). Изменение может быть также осуществлено путем добавления или замещения одного или нескольких сериновых или треониновых остатков к последовательности исходного антитела (в случае сайтов О-связанного гликозилирования).
В том случае когда антитело включает участок Fc, может быть изменена любая олигосахаридная структура, присоединяемая к нему. Например, антитела со зрелой углеводной структурой, которая не содержит фукозы, присоединенной к участку Fc антитела, описаны в заявке на патент США 2003/0157108 А1 (Presta, L). См. также патент США 2004/0093621 А1 (Kyowa Hakko Kogyo Co., Ltd.). Антитела, содержащие в углеводной структуре разделяющий ее на две части N-ацетилглюкозамин (GlcNAc), которая присоединена к участку Fc антитела, рассматриваются в WO 03/011878 (Jean-Mairet et al.) и в патенте США № 6602684 (Umana et al.). Антитела, содержащие по меньшей мере один галактозный остаток в олигосахаридной структуре, присоединенной к участку Fc антитела, описаны в WO 97/30087 (Patel et al.). См. также WO 98/58964 (Raju, S) и WO 99/22764 (Raju, S), которые относятся к антителам с измененным углеводом, присоединенным к Fc участку. В настоящем описании также рассматриваются антительные композиции, включающие основной вид антитела с такими углеводными структурами, присоединенными к одной или двум тяжелым цепям Fс участка.
Молекулы нуклеиновых кислот, кодирующие варианты антитела к HER2 по аминокислотной последовательности, получают с использованием множества методик, известных в данной области. Указанные методики включают, без ограничения, выделение из природного источника (в случае наличия природных вариантов аминокислотной последовательности) или подход на основе олигонуклеотидного (или сайт-направленного) мутагенеза, ПЦР-мутагенеза и кассетного мутагенеза ранее полученного варианта или не вариантной версии антитела к HER2.
(viii) Скриниг антител с желательными свойствами
Выше были описаны методики получения антител. Можно также проводить отбор антител с определенными биологическими свойствами, при желании.
Для идентификации антитела, которое блокирует активацию лиганда рецептора HER, определяют способность антитела блокировать связывание лиганда HER с клетками, экспрессирующими рецептор HER (например, в конъюгации с другим рецептором HER, с которым интересующий рецептор HER образует гетероолигомер HER). Например, клетки, экспрессирующие в естественном состоянии рецептор HER или гетеродимер HER или трансфицированные для целей экспрессии рецептора HER или гетеродимера HER, могут инкубироваться с антителом, после чего их подвергают воздействию меченого лиганда HER. Далее определяют способность антитела к HER2 блокировать связывание лиганда с рецептором HER в гетероолигомере HER.
Например, ингибирование связывания HRG с линией клеток опухоли молочной железы MCF7 антителами к HER2 может быть достигнуто при использовании монослойных культур клеток MCF7 в формате 24-ячеечных планшетов на льду по существу, как описано в WO 01/00245. К каждой ячейке добавляют моноклональные антитела к HER2 и проводят инкубацию в течение 30 минут. Затем добавляют125I-меченый rHRGβ1177-224 (25 пм) и продолжают инкубацию еще в течение 4-16 часов. Строят кривые зависимости ответа от дозы и вычисляют показатель ИК50 для интересующего антитела. В одном варианте антитело, которое блокирует активацию лиганда рецептора HER, имеет показатель ИК50 по ингибированию связывания HRG с клетками MCF7 в данном тесте, равный примерно 50 нМ или менее, более предпочтительно, 10 нМ или менее. В том случае когда антитело представляет собой антительный фрагмент, такой как фрагмент Fab, показатель ИК50 для ингибирования связывания HRG с клетками MCF7 в данном тесте составляет, например, около 100 нМ или менее, более предпочтительно, 50 нМ или менее.
Альтернативно или дополнительно может быть определена способность антитела к HER2 блокировать стимулированное лигандом HER фосфорилирование тирозина в рецепторе HER, присутствующем в гетеродимере HER. Например, клетки, эндогенно экспрессирующие рецепторы HER или трансфицированные для целей его экспрессии, инкубируют с антителом, после чего проводят тест на определение активности по фосфорилированию тирозина, зависимому от лиганда HER, с использованием анти-фосфотирозинмоноклонального антитела (которое необязательно может быть конъюгировано с выявляемой меткой). Для определения активации рецептора HER и блокирования данной активности антителом может также использоваться тест на активацию киназного рецептора, описанный в патенте США № 5766863.
В одном варианте может быть проведен скрининг на наличие антитела, которое ингибирует HRG-стимуляцию фосфорилирования p180 тирозина в клетках MCF7 по существу в соответствии с методикой, описанной в WO 01/00245. Например, клетки MCF7 вносят в ячейки 24-ячеечных планшетов и добавляют к каждой ячейке моноклональное антитело к HER2, после чего проводят инкубацию в течение 30 минут при комнатной температуре, затем добавляют к каждой ячейке rHRGβ1177-244 до конечной концентрации 0,2 нМ, и инкубация еще может быть продолжена еще в течение 8 минут. Далее среды отсасывают из каждой ячейки и останавливают реакцию добавлением 100 мкл ДСН-содержащего буфера для образцов (5% ДСН, 25 мМ DTT и 25 мМ Трис-HCl, pH 6,8). Каждый образец (25 мкл) подвергают электрофорезу в градиенте 4-12% геля (Novex) и затем электрофоретически переносят на поливинилидендифторидную мембрану. Получают антифосфотирозиновые (1 мкг/мл) иммуноблоты, и интенсивность преобладающей реактивной полосы, соответствующей Mr~180000, определяют количественно денситометрией в проходящем свете. Выбранное антитело предпочтительно существенно ингибирует HRG-стимулируемое фосфорилирование р180 тирозина примерно на 0-35% от контрольного значения в данном тесте. По данным денсинометрии в проходящем свете строят кривую зависимости доза-ответ для ингибирования HRG-стимуляции фосфорилирования р180 тирозина и вычисляют показатель ИК50 для интересующего антитела. В одном варианте антитело, которое блокирует активацию лиганда рецептора HER, имеет показатель ИК50 для ингибирования HRG-стимуляции фосфорилирования р180 тирозина в данном тесте, равный примерно 50 мМ или менее, более предпочтительно, 10 мМ или менее. В том случае когда антитело представляет собой антительный фрагмент, такой как фрагмент Fab, показатель ИК50 для ингибирования HRG-стимуляции фосфорилирования р180 тирозина в данном тесте может составлять, например, около 100 нМ или менее, более предпочтительно, 50 нМ или менее.
Можно также оценить ростингибирующие эффекты антитела на MDA-MB-175 клетки, например, по существу в соответствии с описанной в литературе методикой (Schaefer et al., Oncogene 15: 1385-1394 (1997)). В соответствии с данным тестом MDA-MB-175 клетки обрабатывают моноклональным антителом к HER2 (10 мкг/мл) в течение 4 дней и окрашивают кристаллическим фиолетовым. Инкубация с антителом к HER2 может демонстрировать ростингибирующий эффект на данную клеточную линию аналогично тому, что происходит под действием моноклонального антитела 2С4. В другом варианте экзогенный HRG несущественно реверсирует такое ингибирование. Предпочтительно антитело способно ингибировать пролиферацию MDA-MB-175 клеток в большей степени, чем моноклональное антитело 4D5 (и необязательно, в большей степени, чем моноклональное антитело 7F3) как в присутствии, так и в отсутствие экзогенного HRG.
В одном варианте интересующее антитело к HER2 может блокировать герегулинзависимую ассоциацию HER2 с HER3 в клетках MCF7 и SK-BR-3, как показывают данные эксперимента по совместной иммунопреципитации, описанного в WO 01/00245, значительно более эффективно, чем моноклональное антитело 4D5, и предпочтительно, значительно более эффективно, чем моноклональное антитело 7F3.
Для идентификации ростингибирующей способности у антител к HER2 можно провести скрининг антител, которые ингибируют рост раковых клеток, осуществляющих суперэкспрессию HER2. В одном варианте выбранное ростингибирующее антитело способно ингибировать рост SK-BR-3 клетки в клеточной культуре примерно на 20-100% и, предпочтительно, примерно на 50-100% в концентрации антитела примерно 0,5-30 мкг/мл. Для идентификации таких антител может быть проведен тест с использованием SK-BR-3 клеток, как описано в патенте США № 5677171. В соответствии с данным тестом клетки SK-BR-3 растят в смеси 1:1 F12 и DMEM среды с добавкой 10% фетальной сыворотки теленка, глютамина и пенициллина/стрептомицина. Клетки SK-BR-3 высевают в количестве 20000 клеток в чашки для культуры клеток диаметром 35 мм (2 мл/35 мм чашку). К каждой чашке добавляют 0,5-30 мкг/мл антитела к HER2. Через шесть дней подсчитывают количество клеток и сравнивают с их количеством в необработанном варианте с использованием электронного счетчика клеток COULTERTM. Те антитела, которые ингибируют рост клеток SK-BR-3 примерно на 20-100% или примерно на 50-100%, отбирают как ростингибирующие антитела. В патенте США № 5677171 описаны тесты для скрининга ростингибирующих антител, таких как 4D5 и 3E8.
Для выбора антител, которые индуцируют апопотоз, может быть проведен тест на связывание аннексина с использованием клеток BT474. Клетки BT474 высевают в чашки Петри для культивирования, как было описано в предшествующем абзаце. Далее среду удаляют и заменяют свежей средой без добавок или средой, содержащей 10 мкг/мл моноклонального антитела. После трехдневной инкубации монослои промывают ФБР и отделяют при обработке трипсином. Далее клетки центрифугируют, суспендируют в Са2+-связывающем буфере и вносят аликвоты в пробирки, как указывалось выше в тесте на определение уровня гибели клеток. Далее пробирки метят аннексином (например, аннексин V-FTIC) (1 мкг/мл). Образцы анализируют с использованием проточного цитометра FACSCANTM и программного обеспечения FACSCONVERTTMCellQuest (Becton Dickinson). Те антитела, которые индуцируют статистически значимые уровни связывания аннексина относительно контроля, отбирают в качестве апоптоз-индуцирующих антител. Кроме теста на связывание аннексина может быть проведен тест на окрашивание ДНК с использованием клеток BT474. Для проведения такого теста клетки BT474, которые были обработаны рассматриваемым антителом, как было описано в предшествующих двух параграфах, инкубируют с 9 мкг/мл HOECHST 33342TM в течение 2 часов при температуре 37°С и затем анализируют в проточном цитрометре EPICS ELITETM (Coulter Corporation) с использованием программного обеспечения
MODFIT LTTM (Verity Software House). Антитела, индуцирующие изменения в проценте апоптозных клеток, которые превышают в 2 или более раза (и предпочтительно в 3 или более раза) соответствующий уровень в необработанных клетках (вплоть до 100% апоптозных клеток), отбирают как проапоптозные антитела по результатам данного теста. См. WO 98/17797, в котором описаны тесты для скрининга антител, индуцирующих апоптоз, таких как 7С2 и 7F3.
Для скрининга антител, которые связываются с эпитопом на HER2, связывающимся с интересующим антителом, проводят традиционный тест по перекрестному блокированию, такой как описан в соответсвующем руководстве (Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988)) для оценки, блокирует ли антитело в перекрестном режиме связывание антитела, такого как 2С или Пертузумаб, с HER2. Альтернативно или дополнительно может быть проведено картирование эпитопа по методикам, известным в данной области, или может быть проведено исследование структуры антитело-HER2 (Franklin et al., Cancer Cell 5: 317-328 (2004)) для выявления, какой(ие) домен(ы) HER2 связывается(ются) с антителом.
(ix) Иммуноконъюгаты
Настоящее изобретение также относится к иммуноконъюгатам, включающим антитело, конъюгированное с цитотоксическим агентом, таким как химиотерапевтический агент, токсин (например, малая молекула токсина или энзиматически активный токсин бактериального, грибного, растительного или животного происхождения, включая их фрагменты и/или варианты) или радиоактивный изотоп (то есть радиоактивный конъюгат).
Выше были описаны химиотерапевтические агенты, используемые при создании таких иммуноконъюгатов. Конъюгаты антитела и одной или нескольких малых молекул токсина, таких как калхеамицин, майтанзин (патент США № 5208020), трихотен и СС1065, также включены в настоящее описание.
В одном предпочтительном варианте осуществления настоящего изобретения антитело подвергают конъюгированию с одной или несколькими молекулами майтанзина (в частности, от примерно 1 до примерно 10 молекул майтанзина на молекулу антитела). Майтанзин может быть, например, превращен в May-SS-Me, который может быть восстановлен до May-SH3 и дальше подвергнут реакции с модифицированным антителом (Chari et al., Cancer Research 52: 127-131 (1992)) с образованием иммуноконъюгата майтанзиноид-антитело.
Другой интересующий иммуноконъюгат включает антитело к HER2, конъюгированное с одной или несколькими молекулами калихеамицина. Семейство калихеамициновых антибиотиков способно создавать разрывы в двуцепочечной ДНК, при использовании в субпикомолярных концентрациях. Структурные аналоги калихеамицина, которые могут при этом использоваться, включают, без ограничения
γ1I, α2I, α3I, N-ацетил-γ1I, PSAG и θI1 (Hunman et al., Cancer Research 53: 3336-3342 (1993) и Lode et al., Cancer Research 58: 2925-2928 (1998)). См. также патенты США №№ 5714586; 5712374; 5264584 и 5773001, приведенные в настоящем описании в качестве ссылки.
Энзиматически активные токсины и их фрагменты, которые могут при этом использоваться, включают А цепь дифтерийного токсина, не связывающиеся активные фрагменты дифтерийного токсина, цепь А экзотоксина (из Pseudomonas aeruginosa), цепь А рицина, цепь А абрина, цепь А модеццина, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, PAPII and PAP-S), ингибитор momordica charantia, курцин, кротин, ингибитор sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трихотецены. См., например, WO 93/21232, опубликованную 28 октября 1993 года.
Настоящее изобретение также относится к иммуноконъюгату, образованному между антителом и соединением с нуклеолитической активностью (например, с рибонуклеазой или ДНК-эндонуклеазой, такой как дезоксирибонуклеаза; ДНКаза).
Доступно множество радиоактивных изотопов для получения радиоконъюгированных антител к HER2. Примеры включают At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32 и радиоактивные изотопы Lu.
Конъюгаты антител и цитотоксического агента могут быть получены с использованием множества бифункциональных белковых связывающих агентов, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат, иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат-HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глютаральдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), бис-диазониевые производные (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные фтористые соединения (такие как 1,5-дифтор-2,4-динитробензол). Например, рициновый иммунотоксин может быть получен по описанной в литературе методике (Vitetta et al., Science 238: 1098 (1987)). 1-Изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота, меченая углеродом-14 (MX-DTPA), представляет собой пример хелатирующего агента, применяемого для конъюгации радионуклеотида с антителом. См. WO 94/11026. Линкер может представлять собой «расщепляемый линкер», облегчающий высвобождение цитотоксического агента в клетку. Например, может использоваться кислотолабильный линкер, линкер чувствительный к пептидазе, диметиловый линкер или линкер, содержащий дисульфидную связь (Chari et al., Cancer Research 52: 127-131 (1992)).
Альтернативно белок слияния, включающий антитело к HER2 и цитотоксический агент, может быть получен, например, с использованием рекомбинантных методик или методов пептидного синтеза.
В еще одном варианте осуществления настоящего изобретения антитело может быть конъюгировано с «рецептором» (таким как стрептавидин) для использования в нацеливании на опухолевые клетки, где конъюгат антитело-рецептор вводят пациенту, после чего из кровотока удаляют несвязанный конъюгат с использованием хелатирующего агента и далее вводят «лиганд» (например, авидин), который конъюгирован с цитотоксическим агентом (например, с радионуклеотидом).
(х) Другие модификации антител
Другие модификации антител также приводятся в настоящем описании. Например, антитело может быть связано с одним из множества небелковых полимеров, например с полиэтиленгликолем, полипропиленгликолем, полиоксиалкиленами или сополимерами полиэтиленгликоля и полипропиленгликоля. Антитело может быть также захвачено в микрокапсулы, получаемые, например, по методике коацервации и в процессе межслойной полимеризации (например, гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли-(метилметациталатные) мирокапсулы соответственно) в коллоидных системах доставки лекарственных средств (например, в липосомах, альбуминовых микросферах, микроэмульсиях, наночастицах и нанокапсулах) или в макроэмульсиях. Такие методики описаны в руководстве Ремингтона (Remington's Pharmаceutical Sciences, 16th edition, Oslo, A., Ed., (1980)).
Может быть желательно модифицировать антитело согласно настоящему изобретению с точки зрения изменения его эффекторных функций таким образом, чтобы усилить антитело-обусловленную клеточнозависимую цитотоксичность (ADCC) и/или комплементзависимую цитотоксичность антитела (CDC). Такой результат может быть достигнут при введении одного или нескольких аминокислотных замещений в Fc участок антитела. Альтернативно или дополнительно в участок Fc могут быть введены один или несколько цистеиновых остатков, что способствует образованию в данном участке межцепьевых дисульфидных связей. Получаемое таким образом гомодимерное антитело может обладать повышенной способностью к интернализации и/или повышенной комплементзависимой способностью к уничтожению клеток и антитело-обусловленной клеточнозависимой цитотоксичностью (ADCC). См. Caron et al., J. Exp. Med., 176: 1191-1195 (1992) и Shopes, B. J. Immunol., 148: 2918-2922 (1992). Гомодимерные антитела с повышенной противоопухолевой активностью могут быть также получены с использованием гетеробифункциональных сшивающих линкеров, как описано в литературе (cм. Wolff et al., Cancer Research, 53: 2560-2565 (1993)). Альтернативно может быть сконструировано антитело, которое обладает двойными Fc участками и, в этой связи, может обладать повышенной способностью к комплементзависимому лизису и ADCC (см. Stevenson et al., Anti-Cancer Drug Design 3: 219-230 (1989)).
В документе WO 00/42072 описываются антитела с повышенной функцией ADCC в присутствии человеческих эффекторных клеток, где антитела включают замещения аминокислот в своих участках Fc. Предпочтительно антитело с повышенной ADCC способностью включает замещения в положениях 298, 333 и/или 334 в Fc участке. Предпочтительно измененный участок Fc представляет собой участок Fc человеческого IgG1, включающий или состоящий из замещений по одному, двум или трем положениям.
Антитела с измененным C1q связыванием и/или комплементзависимой цитотоксичностью (CDC) описаны в WO 99/51642, в патенте США № 6194551В1, в патенте США № 6242195В1, в патенте США № 6528624 В1 и в патенте США № 6538124 (Idusogie et al.). Антитела включают аминокислотные замещения по одному или нескольким положениям аминокислот 270, 322, 326, 327, 329, 313, 333 и/или 334 в своем участке Fc.
Для повышения периода полувыведения антитела из сыворотки можно включать эпитоп связывания сальважного рецептора антитела (в особенности фрагмента антитела), как описано, например, в патенте США № 5739277. В контексте настоящего описания термин «эпитоп связывания сальважного рецептора» относится к эпитопу участка Fc молекулы IgG (такой как IgG1, IgG2, IgG3 или IgG4), который ответственен за повышение периода полувыведения из сыворотки in vivo молекулы IgG. Антитела с замещениями в участке Fc и с повышенными периодами полувыведения из сыворотки также описаны в WO 00/42072 (Presta, L.).
Описаны также сконструированные антитела с тремя или более (предпочтительно четырьмя) сайтами связывания функционального антитела (заявка на патент США № US2002/0004587 A1, Miller et al.).
Приведенные в настоящем описании антитела к HER2 также могут быть изготовлены в виде иммунолипосом. Липосомы, содержащие антитела, получают по известным в данной области методикам, таким как описаны в литературе (Epstein et al., Proc. Natl. Acad. Sci. USA, 82: 3688 (1985); Hwang et al., Proc. Natl. Acad. Sci. USA, 77: 4030 (1980); патенты США №№ 4485045 и 4544545; и WO 97/38731, опубликованная 23 октября 1997 года). Липосомы с повышенным периодом циркуляции в кровотоке описаны в патенте США № 5013556.
Особенно полезные липосомы могут быть созданы по методике выпаривания с обращением фазы на основе липидной композиции, содержащей фосфатидилхолин, холестерин и ПЭГ-дериватизированный фосфатидилэтаноламин (ПЭГ-ФЭ). Липосомы подвергают экструзии через фильтры с заданным размером пор с получением липосом желательного диаметра. Fab' фрагменты антитела по настоящему изобретению могут быть конъюгированы с липосомами, описанными в работе Мартина с соавт. (Martin et al., J. Biol. Chem., 257: 286-288 (1982)) посредством реакции обмена дисульфидными связями. В состав липосом может быть также необязательно включен химиотерапевтический агент (см. Gabizon et al., J. National Cancer Inst., 81(19) 1484 (1989)).
IV. Фармацевтические композиции
Терапевтические композиции согласно настоящему изобретению получают при смешивании композиции с необязательными фармацевтически приемлемыми носителями, эксципиентами или стабилизаторами (Remington's Pharmаceutical Sciences, 16th edition, Oslo, A., Ed., (1980)) в виде лиофилизированных композиций или водных растворов, пригодных для хранения. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов в используемых дозировках и включают буферы, такие как буферы на основе фосфата, цитрата и других органических кислот; антиоксиданты, включающие аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмония хлорид, гексаметония хлорид, бензалкония хлорид, бензетония хлорид, фенол, бутиловый или бензиловый спирт, алкилпарабены, такие как метил- или пропилпарабен, катехол, резорцинол, циклогексанол, 3-пентанол, и м-крезол); низкомолекулярные (содержащие менее чем примерно 10 остатков) полипептиды, белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глютамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включающие глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА; сахара, такие как сахароза, манит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как TWEENTM, PLURONICSTM или полиэтиленгликоль (ПЭГ). Композиции лиофилизированных антител к HER2 описаны в WO 97/04801.
Композиция по настоящему изобретению может также содержать более одного активного соединения, при необходимости, для использования по показаниям в плане проводимого лечения, предпочтительно соединения, обладающие комплементарной активностью, которые не оказывают неблагоприятного эффекта друг на друга. Например, может быть желательно также обеспечить наличие антител, которые связываются с EGFR, HER2 (например, антитела, которое связывается с другим эпитопом на HER2), HER3, HER4 или факторы роста эндотелиальных клеток сосудов (VEGF) в составе одной композиции. Альтернативно или дополнительно композиция может также включать химиотерапевтический агент, цитотоксический агент, цитокин, ростингибирующий агент, антигормональный агент, EGFR-направленное лекарственное средство, антиангиогенный агент, ингибитор тирозинкиназы, и/или кардиопротектор. Такие молекулы могут присутствовать в подходящем сочетании в количествах, которые эффективны для целей предполагаемого лечения.
Активные ингредиенты могут быть также захвачены в получаемые микрокапсулы, например, при использовании метода коацервации или межслойной полимеризации, например, в состав гидроксиметилцеллюлозных или желатиновых микрокапсул и поли-(метилметацилатных) микрокапсул соответственно, в состав коллоидных системах доставки лекарственных средств (например, в липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или макроэмульсии. Такие методики описаны в руководстве Ремингтона (Remington's Pharmаceutical Sciences, 16th edition, Oslo, A., Ed., (1980)).
Могут быть получены препараты с пролонгированным высвобождением. Подходящие примеры препаратов с пролонгированным высвобождением включают полупроницаемые матрицы на основе твердых гидрофобных полимеров, содержащие антитело, где указанные матрицы имеют вполне определенную форму, например, пленок или микрокапсул. Примеры матриц в препаратах с пролонгированным высвобождением включают полиэфиры, гидрогели (например, поли-(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды (патент США № 3773919), сополимеры L-глютаминовой кислоты и этил-L-глютамат, не разлагаемый этиленвинилацетат, разлагаемые сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON DEPOTTM (инъецируемые микросферы, состоящие из сополимера молочной кислоты-гликолевой кислоты и ацетата лейпролида) и поли-D-(-)-3-гидроксимасляная кислота.
Используемые для введения in vivo композиции должны быть стерильными. Стерильность легко достигается путем фильтрования через стерильные мембраны для фильтрования.
V. Скрининг пациентов, подходящих для терапии
В соответствии с предпочтительным вариантом осуществления настоящего изобретения пациент, выбираемый для проведения данной терапии, имеет опухоль или другую клетку или ткань, демонстрирующие активацию HER (и предпочтительно HER2). В одном варианте уровень активации HER (или HER2) в раковых клетках и других тестируемых клетках существенно превосходит уровень активации данного рецептора в нераковых или нормальных клетках того же типа ткани. Такая избыточная активация может быть результатом суперэкспрессии рецептора HER и/или наличие выше нормального уровня лиганда HER, доступного для активации рецептора HER в раковых клетках. Такая избыточная активация может вызывать и/или может быть вызвана злокачественным статусом раковой клетки. В некоторых вариантах рак может быть подвергнут диагностическому или прогностическому тестированию для определения, имеет ли место амплификация и/или суперэкспрессия рецептора HER, которая приводит к такой избыточной активации рецептора HER. Альтернативно или дополнительно рак может быть подвергнут диагностическому или прогностическому тестированию для определения, имеет ли место амплификация и/или суперэкспрессия лиганда HER в раковой ткани, которая способствует избыточной активации рецептора. В подмножестве таких видов рака избыточная активация рецептора может быть результатом функционирования аутокринного стимулирующего пути. Различные репрезентативные тесты, используемые для выявления активации HER, описаны ниже более подробно.
(i) Димеры HER
Образцы могут быть оценены на наличие димеров HER как индикаторов активации HER или HER2. Любой известный в настоящей области метод может использоваться для выявления димеров HER, таких как EGFR-HER2, HER2-HER3. Ниже описаны некоторые предпочтительные методики. Указанные методики позволяют выявить нековалентные белок-белковые взаимодействия или иным образом указывают на близость, существующую между интересующими белками.
Для выявления димеров HER могут быть использованы иммуноафинные методы, такие как иммунопреципитация или ELISA. В одном варианте осуществления настоящего изобретения используют антитела к HER2 для иммунопреципитации комплексов, включающих HER2 из опухолевых клеток, и полученный иммунопреципитат затем зондируют на наличие EGFR или HER3 путем иммуноблоттинга. В другом варианте антитела к EGFR или HER3 могут быть использованы для имммунопреципитации, и далее иммунопреципитат зондируют с использованием антител к HER2. В еще одном варианте используют лиганды HER, специфичные к комплексам EGFR, HER3, EGFR-HER2 или комплексам HER2-HER3, для получения преципитатных комплексов, которые далее зондируют на наличие HER2. Например, лиганды могут быть конъюгированы с авидином, и полученный комплекс очищают на колонке с биотином.
В других вариантах, таких как ELISA или антительный анализ по типу «сэндвича», антитела к HER2 иммубилизуют на твердой подложке, приводят в контакт с опухолевыми клетками или лизатом опухолевых клеток, промывают и подвергают воздействию антител против EGFR или HER3. Связывание указанных антител, которое может быть выявлено непосредственно или по вторичному антителу, конъюгированному с выявляемой меткой, указывает на наличие гетеродимеров. В некоторых вариантах иммобилизуют антитело к EGFR или HER3, и антитело к HER2 используют на стадии выявления. В других вариантах лиганды HER могут использоваться вместо антител к HER или в сочетании с ними.
Химическое или УФ-опосредованное связывание также может использоваться для ковалентного присоединения димеров на поверхность живых клеток (Hunter et al., Biochem. J., 320: 847-53). Примеры химических сшивающих агентов включают дитиобис(сукцинимидил)пропионат (DSP) и 3,3'-дитиобис(сульфосукцинимидил)пропионат (DTSSP). В другом варианте клеточный экстракт из химически сшитых опухолевых клеток анализируют электрофорезом в ДСН-ПААГ и проводят иммуноблоттинг с антителами против EGFR и/или HER3. Суперсдвиг полосы соответствующего молекулярного веса, вероятнее всего, отражает наличие димеров EGFR-HER2 или HER2-HR3, поскольку HER2 представляет собой предпочтительный партнер в димерном комплексе с EGFR и HER3. Такой результат может быть подтвержден последующим иммуноблоттингом с антителами к HER2.
Метод флуоресцентного резонансного переноса энергии (FRET) также может использоваться для выявления димеров EGFR-HER2 или димеров HER2-HER3. FRET выявляет изменения белковых конформаций и наличие белок-белковых взаимодействий in vivo и in vitro, на основании выявления переноса энергии от донорного флуорофора к акцепторному флуорофору (Selvin, Nat. Struct. Biol., 7: 730-34 (2000)). Перенос энергии имеет место только в том случае, если донорный флуорофор находится в достаточной близости к акцепторному флуорофору. В типичном эксперименте, проводимом по методу FRET, два белка или два сайта на одном белке метят разными флуоресцентными зондами. Один из зондов, донорный зонд, возбуждают до высокоэнергетического состояния отраженным светом с заданной длиной волны. Донорный зонд затем переносит свою энергию на второй зонд, акцепторный зонд, приводя к снижению интенсивности флуоресценции донора и повышению эмиссии флуоресценции у акцептора. Для измерения уровня переноса энергии донорную интенсивность в образце, меченном донорным и акцепторным зондами, сравнивают с соответствующей интенсивностью в образце, меченном только донорным зондом. Необязательно интенсивность акцептора сравнивают только в образцах донора-акцептора и акцептора. Соответствующие зонды, известные в данной области, включают, например, мембранопроникающие красители, такие как флуоресцин и родамин, органические красители, такие как цианиновые красители, и лантанидные атомы (Selvin, выше). Методы и приборы, используемые для выявления и измерения переноса энергии, также известны в данной области (Selvin, выше).
Методики, основанные на FRET подходе, приемлемые для выявления и измерения белок-белкового взаимодействия в индивидуальных клетках, также известны в данной области. Например, микроскопия для выявления переноса флуоресцентной резонансной энергии донора по фотоосветлению (pbFRET) и микроскопия для идентификации периода действия флуоресценции (FLIM) могут использоваться для выявления димеризации рецепторов на клеточной поверхности (Selvin, выше; Gadella & Jovin, J. Cell Biol., 129: 1543-58 (1995)). В одном варианте используют pbFRET на клетках, либо "в суспензии", либо «in situ», для выявления и измерения уровня образования димеров EGFR-HER2 или HER2-HER3, как описано в работе Наги с соавт. (Nagy et al., Cytometry, 32: 120-131 (1998)). Приведенные методики позволяют измерить снижение периода действия флуоресценции у донора из-за переноса энергии. В конкретном варианте для исследования димеризации EGFR-HER2 или HER2-HER3 может быть использована технология проточной цитометрии (Foerster-type FRET метод (FCET)), описанная в литературе (см., например, Nagy et al., выше, и Brockhoff et al., Cytometry, 44: 338-48 (2001)).
FRET предпочтительно используют в сочетании со стандартными методиками иммуногистохимического мечения (Kenwоrthy, Methods, 24: 289-96 (2001)). Например, антитела, конъюгированные с соответствующими флуоресцентными красителями, могут использоваться в качестве зондов для мечения двух разных белков. Если белки находятся в достаточной близости друг к другу, то флуоресцентные красители действуют как доноры и акцепторы для FRET. Перенос энергии выявляют стандартными методами. Перенос энергии может быть выявлен с помощью проточной цитометрии или при использовании систем дигитальной микроскопии, таких как системы, включающие конфокальную микроскопию или флуоресцентную микроскопию с широким полем, объединенные с камерой со связанными зарядами (CCD).
В одном варианте осуществления настоящего изобретения антитела к HER2 и, либо антитела к EGFR, либо к HER3 непосредственно метят двумя разными флуорофорами, например, как описано в работе Наги с соавт. (Nagy et al., выше). Опухолевые клетки или лизат опухолевых клеток подвергают контакту с дифференциально мечеными антителами, которые действуют как доноры и акцепторы для FRET в присутствии димеров EGFR-HER2 или HER2-HER3. Альтернативно немеченые антитела против HER2 и, либо против EGFR, либо против HER3, используют вместе с дифференциально мечеными вторичными антителами, которые действуют как доноры и акцепторы. См., например, работу Брокхоффа с соавт. (Brockhoff et al., выше). Выявляют перенос энергии, выявляют и определяют наличие димеров, если метки находятся в тесной близости.
В других вариантах лиганды рецептора HER, которые специфичны для HER2 и, либо для EGFR, либо для HER3, метят флуоресцентной меткой и используют для FRET исследований.
В еще других вариантах осуществления настоящего изобретения наличие димеров на поверхности опухолевых клеток подтверждают совместной локализицией HER2 либо с EGFR, либо с HER3 с использованием стандартных прямых или опосредованных иммунофлуоресцентных методик и конфокальной микроскопии лазерного сканирования. Альтернативно используют лазерное сканирование (LSI) для выявления связывания антител и совместной локализации HER2 либо с EGFR, либо с HER3 в масштабе высокопроизводительного анализа с использованием микроячеечных планшетов, как описано в литературе (Zuck et al., Proc. Natl. Acad. Sci. USA, 96: 11122-27 (1999)).
В других вариантах присутствие димеров EGFR-HER2 и/или HER2-HER3 идентифицируют за счет выявления энзиматической активности, которая зависит от близости димерных компонентов. Антитело к HER2 конъюгирует с одним ферментом, а антитело к EGFR или HER3 конъюгирует со вторым ферментом. Добавляют первый субстрат для первого фермента и в результате реакции получают второй субстрат для второго фермента. Это запускает реакцию с другой молекулой с образованием выявляемого соединения, такого как краситель. Наличие другого химического компонента разрушает второй субстрат, предупреждая реакцию со вторым ферментом, если первый и второй ферменты, и, значит, оба антитела не находятся в тесной близости. В конкретном варианте опухолевые клетки или лизаты клеток подвергают контакту с антителом к HER2, который конъюгируют с глюкозооксидазой, и антителом к HER3 или HER1, которое конъюгируют с пероксидазой хрена. К реакционной смеси добавляют глюкозу вместе с предшественником красителя, таким как ДАБ, и каталазу. Наличие димеров выявляют по развитию окрашивания на ДАБ.
Димеры могут быть также выявлены с использованием методов, основанных на системе eTagTM теста (Aclara Bio Sciences, Mountan View, CA), как описано, например, в заявке на патент США 2001/0049195, опубликованной 6 декабря 2001 года, которая включена в настоящее описания полностью в качестве ссылки. Метка eTagTM, или «электрофоретическая метка», включает выявляемый репортерный фрагмент, такой как флуоресцентная группа. Указанная метка также может включать «модификатор мобильности», который состоит по существу из фрагмента, обладающего уникальной электрофоретической подвижностью. Указанные фрагменты позволяют осуществлять отделение и выявление eTagTM из сложной смеси в определенных условиях электрофоретического разделения, например, при проведении капиллярного электрофореза (КЭ). Часть метки eTagTM, содержащей репортерный фрагмент и необязательно модификатор мобильности, связывают с первым целевым связывающим фрагментом с помощью расщепляемой сшивающей группы с образованием первого связанного соединения. Первый целевой связывающий фрагмент специфически распознает определенную первую мишень, такую как нуклеиновая кислота или белок. Первый целевой связывающий фрагмент не ограничивается каким-либо образом и может представлять собой, например, полинуклеотид или полипептид. Предпочтительно первый целевой связывающий фрагмент представляет собой антитело или фрагмент антитела. Альтернативно первый целевой связывающий фрагмент может представлять собой лиганд рецептора HER или его фрагмент, компетентный по связыванию.
Связывающая группа предпочтительно включает расщепляемый фрагмент, такой как энзиматический субстрат, или любую химическую связь, которая может быть расщеплена в определенных условиях. В том случае когда первый целевой связывающий фрагмент соединяется со своей мишенью, вводят и/или активируют расщепляющий фрагмент, при этом связывающая группа расщепляется, высвобождая часть eTagTM, содержащую репортерный фрагмент и модификатор мобильности. Таким образом, наличие «свободного» eTagTM указывает на связывание целевого связывающего фрагмента со своей мишенью.
Предпочтительно второе связываемое соединение включает расщепляющий агент и второй целевой связываемый фрагмент, который специфически распознает вторую мишень. Второй целевой связываемый фрагмент также не ограничивается каким-либо образом и может представлять собой, например, антитело, или фрагмент антитела, или лиганд рецептора HER, или фрагмент лиганда, компетентный по связыванию. Расщепляющий агент представляет собой такой агент, который будет расщеплять лишь связывающую группу в первом связываемом соединении, если первое связываемое соединение и второе связываемое соединение находятся в тесной близости.
В одном варианте осуществления настоящего изобретения первое связывающее соединение включает eTagTM, в котором антитело к HER2 служит в качестве первого целевого связывающего фрагмента. Второе связывающее соединение включает антитело к EGFR или HER3, присоединенное к расщепляющему фрагменту, способному расщеплять связующую группу eTagTM. Предпочтительно связывающий фрагмент должен быть активирован для того, чтобы он смог расщеплять связывающую группу. Опухолевые клетки или лизаты опухолевых клеток подвергают контакту с eTagTM, который связывается с HER2 и с модифицированным антителом к EGFR или HER3, которые связываются с EGFR или HER3 на поверхности клеток. Несвязанное связывающее соединение предпочтительно удаляют и, при необходимости, активируют расщепляющий агент. Если присутствуют димеры EGFR-HER2 или HER2-HER3, расщепляющий агент будет расщеплять связывающую группу и высвобождать eTagTM за счет близости расщепляющего агента к связывающей группе. Свободный eTagTM может быть затем обнаружен с использованием любого известного метода, такого как капиллярный электрофорез.
В одном варианте расщепляющий агент представляет собой такой активируемый химический компонент, который действует на связывающую группу. Например, связывающий агент может быть активирован посредством воздействия света на образец.
В другом варианте конструируют eTagTM с использованием антител к EGFR или HER3 в качестве первого целевого связывающего фрагмента, а второе связывающее соединение конструируют на основе антитела к HER2.
В еще одном варианте димер HER выявляют с использованием антитела или другого реагента, который специфически или предпочтительно связывается с димером, в сравнении с вариантом его связывания с рецептором HER димера.
(ii) Фосфорилирование HER2
После иммунопрециптации с антителами к EGFR, HER2 или HER3, как было описано в предыдущем абзаце, может быть необязательно проведен функциональный тест на димеры в качестве альтернативы или дополнения к иммуноблоттингу. В одном варианте после иммунопреципитации с антителом к HER3 проводят тест на определение активности тирозинкиназы рецептора в иммунопреципитате. Поскольку HER3 не содержит тирозинкиназной активности, наличие тирозинканазной активности в иммунопреципитате будет указывать на то, что, по всей вероятности, HER3 вовлекается в ассоциацию с HER2 (Graus-Porta et l., EMBO J., 16: 1647-55 (1997); Klapper et. al., Proc. Natl. Acad. Sci. USA, 96: 4995-5000 (1999)). Этот результат может быть подтвержден иммуноблоттингом с антителами к HER2. В другом варианте после иммунопреципитации с антителом к HER2 проводят тест для определения тирозинканазной активности рецептора EGFR. В рамках данного теста иммунопреципитат подвергают контакту с радиоактивной АТФ и пептидным субстратом, который имитирует сайт трансфосфорилирования HER2 под действием EGFR in vivo. Фосфорилирование пептида указывает на наличие совместной иимунопреципитации и, таким образом, димеризации EGFR с HER2. Тесты на тирозинкиназную активность рецептора известны в данной области и включают тесты, которые выявляют фосфорилирование целевых субстратов, например в случае фосфотирозинового антитела, и активацию соответствующих сигнальных путей трансдукции, таких как MAPK путь.
Фосфорилирование рецептора HER может быть оценено посредством иммунопреципитации одного или нескольких рецепторов HER, таких как рецептор HER2 (HER2), и вестерн-блотт-анализа. Например, положительный результат выявляется по наличию полосы фосфо-HER2 в геле с использованием фосфотирозинового антитела, выявляющего фосфорилированный(ые) тирозиновый(ые) остаток(ки) в иммунопреципитированном(ых) рецепторе(ах) HER. Антифосфотирозиновые антитела коммерчески доступны от PanVera (Madison, WI), дочерней компании Invitrogen, Chemicon International Inc. (Temecula, CA) или от Upstatе Biotechnology (Lake Placid, NY). Отрицательный результат соответствует отсутствию такой полосы.
В другом варианте фосфорилирование рецептора HER2(HER2) оценивают по результатам иммуногистохимического анализа с использованием фосфо-специфического антитела к HER2 (клон PN2A; Thor et al., J. Clin. Oncol., 18(18): 3230-3239 (2000)).
Другие методики выявления фосфорилирования рецептора(ов) HER включают, без ограничения, KIRA ELISA (патенты США №№ 5766863, 5891650, 5914237, 6025145 и 6287784), масс-спектрометрию (включая сравнение размеров фосфорилированного и нефосфорилированного HER2) и тест на близость e-tag с использованием и антитела к HER (например, HER2), и фосфо-специфического или фосфотирозин-специфического антитела (например, с использованием набора для тестирования eTagTM, доступного от компании Aclara BioSciences, Mountan View, CA). Ниже описано более подробно проведение теста на eTagTM.
Можно также использовать фосфо-специфические антитела в клеточном варианте для выявлении статуса фосфорилирования в клеточном образце с наличием белка, вовлекаемого в сигнальную трансдукцию (US 2003/0190689).
(iii) Лиганды HER2
Уровни лиганда HER, такого как TGF-α, в опухоли или в ассоциации с опухолью могут быть выявлены по известным процедурам. Такие тесты позволяют идентифицировать белок и/или нуклеиновую кислоту, кодирующую его в исследуемом образце. В одном варианте уровни лиганда HER в опухоли могут быть определены с использованием имунногистохимического метода (IHC) (см., например, Scher et al., Clin. Cancer Research, 1: 545-550 (1995)). Альтернативно или дополнительно можно оценить уровни лиганда HER - кодирующей нуклиновой кислоте в тестируемом образце, например, с помощью FISH, саузерн-блоттинга или ПЦР методик.
(iv) Виды рака с суперэкспрессией, отличной от HER2
Хотя рак может быть охарактеризован по суперэкспрессии рецептора HER2, настоящее изобретение также относится к способу лечения рака, который не относится к HER2-экспрессирующему виду рака.
Для определении экспрессии HER2 при раке доступно множество диагностических/прогностических тестов. В одном варианте суперэкспрессию HER2 анализируют по методике IHC, например, с использованием HERCEPTEST® (Dako). Погруженные в парафин тканевые срезы из биопсийного образца опухоли подвергают IHC тесту и проводят окрашивание для определения интенсивности окраски на белок HER2 с использованием следующих критериев:
Балл 0: не наблюдается окрашивание или окрашивание мембраны наблюдается менее чем в 10% опухолевых клеток.
Балл 1+: слабое/незначительно выявляемое окрашивание мембраны более чем в 10% опухолевых клеток. Клетки окрашиваются лишь в части мембраны.
Балл 2+: от слабого до умеренно полного окрашивания мембраны более чем в 10% опухолевых клеток.
Бал 3+: от умеренного до сильного полного окрашивания мембраны более чем в 10% опухолевых клеток.
Указанные виды опухоли с баллами от 0 до 1+ в плане оценки суперэкспрессии HER2 рассматриваются как не суперэкспрессирующие HER2, тогда как опухоли с баллами от 2+ или 3+ характеризуются как суперэкспрессирующие HER2.
Опухоли, осуществляющие суперэкспрессию HER2, могут быть ранжированы на основании результов иммуногистохимического анализа по числу копий молекул HER2, экспрессируемых в клетке, которые могут быть определены биохимически:
0 = 0-10000 копий/клетку,
1+ = по меньшей мере примерно 200000 копий/клетку,
2+ = по меньшей мере примерно 500000 копий/клетку,
3+ = по меньшей мере примерно 2000000 копий/клетку.
Суперэкспрессия HER2 на уровне 3+, которая ведет к лигандзависимой активации тирозинкиназы (Hudziak et al., Proc. Natl. Acad. Sci. USA, 84: 7159-7163 (1987)), осуществляется примерно в 30% случаев при раке молочной железы, и у этих пациентов снижается уровень выживания, свободный от рецидивов, а также показатель общего выживания (Slamon et al., Science, 244: 707-712 (1989); Slamon et al., Science. 235: 177-182 (1987)). Альтернативно или дополнительно могут быть проведены FISH тесты, такие как INFORMTM (поставляемый от компании Ventana, Arizona) или PATHVISIONTM (Vysis, Illinois) на фиксированном в формалине, погруженном в парафин образце опухолевой ткани для выявления уровня (при его наличии) суперэкспрессии HER2 в опухоли.
В одном варианте рак может представлять собой такой вид, который экспрессирует (и может осуществлять суперэкспрессию) EGFR, и такая экспрессия может быть оценена по методам оценки экспрессии HER2, описанным выше.
Суперэкспрессия рецептора HER или лиганда HER или их амплификация могут быть оценены с использованием диагностического теста in vivo, например, путем введения молекулы (такой как антитело), которая связывается с обнаруживаемой молекулой и содержит присоединенную выявляемую метку (например, радиоактивный изотоп), после чего проводят внешнее сканирование пациента для определения локализации метки.
VI. Лечение композицией с антителом к HER2
Считается, в соответствии с настоящим изобретением, что антитело к HER2 может использоваться для лечения рака. Такой рак в основном включает HER2-экспрессирующие клетки, такие как описанное антитело к HER2, которые способны связываться с раковыми клетками. Выше в разделе «Определения» перечислены различные виды рака, которые могут подвергаться лечению данной композицией.
Также считается, что антитело к HER2 может использоваться для лечения различных не злокачественных заболеваний или расстройств, таких как аутоиммунные заболевания (например, псориаз; эндометриоз, склеродерма, рестеноз, полипы, такие как полипы кишечника, полипы носа или полипы желудочно-кишечного тракта; фиброаденома; респираторные заболевания; холецистит; нейрофиброматоз; поликистоз почки; воспалительные заболевания; кожные расстройства, включая псориаз и дерматит; сосудистые заболевания; состояния, включающие аномальную пролиферацию эпителиальных клеток сосудов; язвы желудочно-кишечного тракта; болезнь Менетрие, секретирующие аденомы или синдром потери белка; почечные расстройства; ангиогенные расстройства; заболевания глаз, такие как возрастная дегенерация желтого пятна, синдром гистоплазмоза глаза; неоваскуляризация сетчатки, связанная с пролиферативной диабетической ретинопатией; васкуляризация сетчатки, диабетическая ретинопатия или возрастная дегенерация желтого пятна; костные патологии, ассоциированные с такими состояниями как остеоартрит, рахит и остеопороз; повреждение, возникающее после церебральной ишемии; фиброзные или отечные заболевания, такие как цирроз печени, фиброз легкого, саркоидоз, тиреоидит, синдром системной гипервязкости, болезнь Ослера-Ведера-Рендю, хроническая окклюзивная болезнь легких, или отек, возникающий после ожога, травмы, облучения, инсульта, гипоксии или ишемии; реакция гиперчувствительности кожи; диабетическая ретинопатия и диабетическая нефропатия; синдром Гийена-Барра; болезнь «трансплантат против хозяина» или отторжение трансплантата; болезнь Педжета; воспаление кости или суставов; фотостарение (то есть старение, вызванное УФ-облучением кожи человека); доброкачественная гипертрофия предстательной железы; некоторые микробные инфекции, включающие микробные патогены, выбранные из аденовирусов, гантавирусов, Borellia burgdorferi, Yеrsinia spp. и Bordеtеlla pertussis; тромбы, вызванные агрегацией тромбоцитов; состояния репродуктивной системы, такие как эндометриоз; синдром гиперстимуляции яичников; преклампсия; дисфункциональное кровотечие из матки или менометроррагия; синовит; атерома; острые и хронические нефропатии (включая пролиферативный гломерулонефрит и болезнь почек, вызванную диабетом); экзема; гипертрофное образование рубцов; эндотоксический шок и грибковая инфекция; семейный аденоматозный полипоз; нейродегенеративные заболевания (например, болезнь Альцгеймера, деменция, ассоциированная со СПИДом, болезнь Паркинсона, боковой амиотрофный склероз, retinitis pigmentosa, атрофия спинальных мышц и мозжечковая дегенерация); миелодиспластические синдромы; апластическая анемия; ишемическое повреждение; фиброз легкого, почки или печени; Т-клеточная гиперчувствительность; инфантильный гипертрофный пилорический стеноз; деструктивный синдром мочевого тракта; псориатический артрит; и тиреоидит Хашимото. Предпочтительные не злокачественные показания для терапии согласно настоящему изобретению включают псориаз, эндометриоз, склеродерму, сосудистое заболевание (например, рестеноз, атеросклероз, ишемическую болезнь сердца или гипертензию), полипы толстой кишки, фиброаденому или респираторное заболевание (например, астму, хронический бронхит, бронхеоэктаз или фиброзно-кистозную дегенерацию).
Лечение с использованием антитела к HER2 приводит к ослаблению признаков или симптомов заболевания. Например, в том случае когда подлежащее лечению заболевание представляет рак, такая терапия может привести к улучшению показателей выживания (общего выживания и/или выживания, свободного от прогрессирования) и/или может привести к объективному клиническому ответу (к частичному или полному).
Предпочтительно антитело к HER2 в композиции вводится в виде «оголенного» антитела. Однако вводимое антитело к HER2 может быть конъюгировано с цитотоксическим агентом. Предпочтительно иммуноконъюгат и/или белок HER2, с которым он связан, интернализуется в клетке, что приводит к повышению терапевтической эффективности иммуноконъюгата по уничтожению раковых клеток, с которыми он связывается. В предпочтительном варианте цитотоксический агент воздействует на нуклеиновую кислоту или препятствует функционированию нуклеиновой кислоты в раковых клетках. Примеры таких цитотоксических агентов включают майтанзиноиды, калихеамицины, рибонуклеазы и ДНК-эндонуклеазы.
Антитело к HER2 вводят пациенту-человеку с использованием известных методов, таких как внутривенное введение, например, в виде болюса или путем непрерывной инфузии в течение определенного периода времени, например, посредством внутримышечного, внутрибрюшинного, интрацереброспинального, подкожного, внутрисуставного, внутрисиновиального, интратекального, перорального, местного или ингаляционного введения. Предпочтительным является внутривенное введение антительной композиции.
Используемая для целей профилактики или лечения заболевания соответствующая дозировка антитела к HER2 зависит от типа заболевания, подлежащего лечению, как это было определено выше, от тяжести течения заболевания, с какой, профилактической и терапевтической целью вводят антитело к HER2, от наличия предшествующей терапии, от истории болезни пациента и его отзывчивости на антитело к HER2, и определяется выбором лечащего врача. Антитело к HER2 в соответствующем варианте вводится пациенту один раз или в виде серии лечебных процедур. В зависимости от типа и тяжести заболевания количество от 1 мкг/кг до 50 мг/кг (например, 0,1-20 мг/кг) антитела к HER2 может рассматриваться как подходящая исходная дозировка для введения пациенту в виде одного или нескольких отдельных введений или путем непрерывной инфузии. В одном варианте время непрерывной инфузии антитела к HER2 может быть больше, чем последующее время курсов инфузии и, например, составляет около 90 минут для начальной инфузии и около 30 минут для последующих инфузий (если первоначальная инфузия хорошо переносилась). Предпочтительная дозировка антитела к HER2 находится в диапазоне от примерно 0,05 мг/кг до примерно 10 мг/кг. Таким образом, пациенту может вводиться одна или несколько доз, составляющие примерно 0,5 мг/кг, 2,0 мг/кг, 4,0 мг/кг, 10 мг/кг (в любом сочетании). Такие дозы могут вводиться в перемежающемся режиме, например, каждую неделю или каждые три недели (например, так, чтобы пациент получал от примерно двух до примерно двадцати, в частности, примерно шесть доз антитела к HER2). Может вводиться более высокая нагрузочная доза, после чего вводят одну или несколько сниженных доз. В одном варианте антитело к HER2 вводят в нагрузочной дозе, составляющей примерно 840 мг, после чего вводят примерно 420 мг приблизительно каждые 3 недели. В другом варианте антитело к HER2 вводят в виде дозы, составляющей примерно 1050 мг, приблизительно каждые 3 недели.
Другие терапевтические агенты могут быть объединены с антителом к HER2. Такие формы объединенного введения включают совместное введение или конкурентное введение, в рамках которых могут использоваться отдельные композиции или одна фармацевтическая композиция, а также может проводиться последовательное введение в любом порядке, при этом предпочтительно должен быть период времени, когда оба (или все) активные агенты одновременно проявляют свою биологическую активность. Таким образом, другой терапевтический агент может вводиться до или после антитела к HER2. В данном варианте время между по меньшей мере одним введением другого терапевтического агента и по меньшей мере одним введением антитела к HER2, предпочтительно, составляет приблизительно 1 месяц или менее, и, наиболее предпочтительно, составляет приблизительно 2 недели или менее. Альтернативно другой терапевтический агент и антитело к HER2 вводят конкурентно пациенту в виде одной композиции или отдельных композиций.
Примеры других терапевтических агентов, которые могут быть объединены с антителом к HER2, включают любой один или несколько химиотерапевтических агентов, таких как антиметаболит, например гемцитабин; второе, другое антитело к HER2 (например, ростингибирующее антитело к HER2, такое как Трастузумаб, или антитело к HER2, которое индуцирует апоптоз HER2-суперэкспрессирующих клеток, такое как 7С2, 7F3 или их гуманизированные варианты); второе антитело против другого антигена, ассоциированного с опухолью, такое как EGFR, HER3, HER4; антигормональное соединение, например, антиэстрогенное соединение, такое как тамоксифен или ингибитор ароматазы; кардиопротекстор (для предотвращения или снижения дисфункции миокарда, ассоциированной с терапией); цитокин; лекарственное средство, направленное на EGFR (такое как TARCEVA®, IRESSA® или Cetuximab); антиангиогенный агент (в особенности Бевацизумаб, предлагаемый компанией Genentech под торговой маркой AVASTINTM); ингибитор тирозинкиназы; ингибитор COX (например, ингибитор COX-1 или COX-2); нестероидное противовоспалительное средство, Celecoxib (CELEBREX®); ингибитор фарнезилтрасферазы (например, Tипифарниб/ZARNESTRA® R115777, доступный от компании Johnson and Johnson, или Лонафарниб SCH66336, доступный от компании Schering-Plough); антитело, которое связывается с онкофетальным белком CА 125, такое как Ореговомаб (MoAb B43.13); вакцина, содержащая HER2 (такая как вакцина AutoVac с HER2, доступная от компании Pharmеxia, или белковая вакцина APC8024, доступная от Dendreon, или вакцина, содержащая пептид HER2, доступная от GSK/Corixa); другая HER-направленная терапия (включающая, например, трастузумаб, цетуксимаб, гефитиниб, эрлотиниб, CI1033, GW2016 и т.п.); ингибитор Raf и/или ras (см., например, WO 2003/86467); доксил; топетекан; таксан; GW572016; TLK286; EDM-7200; лекарственное средство, которое применяется для лечения тошноты, такое как антагонист серотонина, стероид или бензодиазепин; лекарственное средство, которое используется для профилактики или лечения кожной сыпи или в стандартной терапии акне, включающая местные или пероральные антибиотики; жаропонижающее средство, такое как ацетаминофен, дифенгидрамин или меперидин; гематопоэтический фактор роста и т.п.
Подходящие дозировки любого из указанных совместно вводимых агентов включают такие дозы, которые обычно используются и которые могут быть снижены благодаря комбинированному действию (синергии) агента и антитела к HER2. Лечение с использованием сочетания композиции с антителом к HER2 и другого терапевтического агента может приводить к синергическому эффекту, или к терапевтическому эффекту, более высокому, чем аддитивный, у пациента.
Если вводят химиотерапевтический агент, его обычно вводят в известных дозировках или необязательно снижают дозировку за счет объединенного действия лекарственных средств, а также в связи с отрицательными побочными эффектами, вызываемыми введением химиотерапевтического агента. Подготовку и выбор режима дозирования таких химиотерапевтических агентов проводят в соответствии с инструкциями производителя или они могут быть определены эмпирически практикующим специалистом. Подготовка и режим дозирования таких химиотерапевтических агентов также описаны в соответствующем руководстве (Chemotherapy Service Ed., M.C. Perry, Williams & Wilkins, Baltimore, MD (1992)).
В дополнение к указанным выше терапевтическим режимам пациент может подвергаться хирургии для удаления раковых клеток и/или лучевой терапии.
VII. Депонирование материалов
Указанные ниже гибридомные клеточные линии депонированы в Американской Коллекции типовых культур (American Type Culture Collection, 10801 University Boulevard, Manassas, VA 20110-2209, USA (ATCC):
Дополнительные детали изобретения поясняются в прилагаемом ниже неограничивающем примере. Содержание всех цитированных документов приведено в качестве ссылок.
ПРИМЕР
ХАРАКТЕРИСТИКА КОМПОЗИЦИЙ, СОДЕРЖАЩИХ ПЕРТУЗУМАБ
Пертузумаб представляет собой рекомбинантное гуманизированное моноклональное антитело, полученное на основе каркаса человеческого IgG1 (). Указанное антитело включает две тяжелых цепи (448 остатков) и две легких цепи (214 остатков). Две тяжелых цепи соединены двумя межцепьевыми дисульфидными связями, и каждая легкая цепь присоединена к тяжелой цепи через одну межцепьевую дисульфидную связь. Имеется один сайт N-связывающего гликозилирования в Fc области Пертузумаба в положении Asn-299 двух тяжелых цепей. Пертузумаб отличается от HERCEPTIN® (Трастузумаб) участками связывания эпитопа в легкой цепи (различие в 12 аминокислотах) и тяжелой цепи (различие в 30 аминокислотах). В результате указанных различий Пертузумаб связывается с совершенно другим эпитопом на рецепторе HER2. Связывание Пертузумаба с рецептором HER2 на человеческих эпителиальных клетках препятствует образованию комплексов с другими представителями семейства рецепторов HER (Agus et al., Cancer Cell, 2: 127-137 (2002)). За счет блокирования образования комплекса Пертузумаб препятствует ростстимулирующим эффектам лигандов для данных комплексов (например, EGF и герегулин). Эксперименты in vitro показывают, что Пертузумаб и Пертузумаб-Fab ингибируют связывание герегулина (HRG) с клетками MCF7 и что HRG-стимулированное фосфорилирование комплекса HER2-HER3 может ингибироваться под действием и Пертузумаба, и Пертузумаба-Fab (Agus et al., Cancer Cell, 2: 127-137 (2002)). Кроме того, ингибирование опухолевого роста in vivo Пертузумабом и полиэтиленгликолевым производным Fab Пертузумаба характеризуется сравнимыми результатами на модели мышей с ксенотрансплантатом рака предстательной железы (Agus et al., Cancer Cell, 2: 127-137 (2002)). Эти данные позволяют полагать, что Fc участок антитела не является обязательным для ингибирования роста опухоли, и, кроме того, бивалентность и Fc-опосредованные эффекторные функции не требуются для биологической активности in vivo или in vitro.
Были проанализированы указанные ниже образцы, полученные в результате экспрессии в рекомбинантных клетках яичника китайского хомяка (CHO):
АНАЛИЗ N-КОНЦЕВОЙ ПОСЛЕДОВАТЕЛЬНОСТИ
Анализ N-концевой последовательности проводят с использованием стандартных методик деградации Эдмана, и полученные результаты представлены в таблице 2А, таблице 2В и таблице 2С для эталонного материала, образца S9802А и варианта 1 объемом 400 л из отдела разработки материалов соответственно. Ожидаемые N-концевые последовательности (фиг.3А и фиг.3В) легкой и тяжелой цепей были получены для всех образцов. Дополнительная минорная последовательность, соответствующая легкой цепи с тремя дополнительными аминокислотами Val-His-Ser (VHS), предшествующая ожидаемой N-концевой последовательности, также была обнаружена во всех пяти образцах. VHS последовательность представляет собой часть сигнального пептида, который удаляется из белка при его секретировании. Альтернативно расщепление сигнального пептида приводит к удлинению VHS на N-конце Пертузумаба. В материалах, ранее полученных на стадии I/II клинических испытаний, примерно 2%-4% молекул Пертузумаба имеют одну из двух легких цепей, которые содержат N-концевую VHS последовательность. Однако уровень легких цепей с N-концевой VHS последовательностью в данных материалах (1-2% каждой легкой цепи) был слишком низким для выявления по методу N-концевого анализа последовательности. В пяти образцах из отдела разработки процесса уровень данного вида легкой цепи несколько выше выявляемого предела, свойственного N-концевому анализу, примерно 4-5%. Данные N-концевого секвенирования пяти образцов из отдела разработки процессов соответствуют результатам разделения методом катионообменной хроматографии, которые показывают, что пять образцов из отдела разработки процесса содержат примерно 9% молекул Пертузумаба с одной легкой цепью, содержащей удлинение VHS (см. показанные ниже результаты катионообменной хроматографии (CEC)).
Не было выявлено других последовательностей (предел обнаружения составляет 3%), что указывает на отсутствие внутренних сайтов расщепления.
МАСС-СПЕКТРОМЕТРИЧЕСКИЙ АНАЛИЗ
Образцы Пертузумаба восстанавливают дитиотреитолом и анализируют масс-спектрометрией по методу электрораспыления - ионизации (ESI-MS) с использованием масс-спектрометра PE SCIEX API 3000TM для подтверждения соответствия масс легкой и тяжелой цепи ожидаемым для них последовательностям. Восстановленные масс-спектры для стандартного материала, образца S9802A и варианта 1 объемом 400 л из отдела разработки процесса показаны в сравнительном аспекте на фиг.8А и фиг.8В. Наблюдаемая масса легкой цепи (23524 Да) соответствует ожидаемому значению, рассчитанному на основе ее последовательности для всех трех материалов. Были выявлены два дополнительных минорных пика со значениями 23685 Да и 23847 Да (на 161 и 323 Да выше, чем масса легкой цепи соответственно). Первый пик (23685 Да), по всей видимости, возникает в результате гликозилирования легкой цепи. Второй пик (23847 Да) наблюдается более четко в материалах из отдела разработки процесса в объеме 400 л. Данный пик соответствует преимущественно легкой цепи с удлинением Val-His-Ser (см. приведенные выше результаты анализа N-концевой последовательности и результаты анализа по методу катионообменной хроматографии) или соответствует легкой цепи с двумя сайтами гликозилирования.
Наблюдаются значения некоторых масс, которые соответствуют разным формам тяжелой цепи. Преобладающим видом тяжелой цепи является цепь с массой 50532 Да, которая возникает из тяжелой цепи, состоящей из остатков 1-448 с олигосахаридной структурой G0. Другие выявленные формы включают тяжелую цепь, содержащую остатки 1-448 с олигосахаридной структурой G1 или G2 (фиг.8В).
ЗАРЯДНАЯ ГЕТЕРОГЕННОСТЬ, ВЫЯВЛЯЕМАЯ КАТИОНООБМЕННОЙ ХРОМАТОГРАФИЕЙ И КАПИЛЛЯРНЫМ ЗОННЫМ ЭЛЕКТРОФОРЕЗОМ
Катионообменную хроматографию (СЕС) используют для оценки зарядной гетерогенности Пертузумаба. Образцы до и после лечения карбоксипептидазой B (CPB) анализируют с использованием катионообменной колонки DIONEXTM (PROPAC WCX-10TM, 4 мм × 250 мм) с использованием буфера 20 мМ MES, pH 6,0, через которую пропускают градиент NaCl. Сравнение хроматограмм проиллюстрировано на фиг.9А (до лечения CPB) и на фиг.9В (после лечения CPB). Во всех трех лотах наблюдаются множественные пики. Для целей характеристики хроматограммы делят на шесть участков (помеченных как А-F, на фиг.9А и 9В). Относительные площади пиков для шести участков приведены в таблице 3А и таблице 3В. Количество кислого варианта (на участке А) выше в образце S9802A и в материалах объемом 400 л из отдела разработки процесса, чем в эталонном материале. Уровень основных вариантов на участке C и D, которые, как было показано, содержат Пертузумаб с С-концевым лизиновым остатком на одной (участок С) или обеих (участок D) тяжелых цепях, снижен в образце S9802A и в материалах объемом 400 л из отдела разработки процесса в сравнении с эталонным материалом. После лечения СPB молекулы Пертузумаба с одним или двумя С-концевыми лизинами на тяжелой цепи превращают в основной вид по участку В, и больше не выявляется их наличие на участках C и D. Лишь маленький пик, который не был еще идентифицирован, остается на участке С после CPB лечения. Основной вариант на участке Е, который, как было показано, возникает из молекул Пертузумаба с одной легкой цепью, содержащей удлинение VHS, выше в материалах объемом 400 л из отдела разработки процесса (9-10%), чем в эталонном материале и в образце S9802A (4%). Было показано, что основной вариант на участке F представляет собой Пертузумаб, содержащий N-концевое VHS удлинение на одной легкой цепи и С-концевой лизин на одной тяжелой цепи. Как результат содержания более высокого уровня кислотных и основных вариантов, главный вид на участке С представлен в меньшем количестве в материалах объемом 400 л из отдела разработки процесса, чем в эталонном материале и в образце S9802A.
Кроме катионообменной хроматографии используют капиллярный зонный электрофорез (CZE) для выявления зарядной гетерогенности Пертузумаба. Идентифицируют пики, полученные при ZCE, и определяют их корреляцию с пиками, наблюдавшимися по данным CEC анализа, проводя индивидуальный анализ объединенных CEC и CZE фракций. Относительные количества вариантов по заряду, выявляемых методами CZE и CEC, оказались сравнимыми для всех анализируемых материалов.
Биологическая активность вариантов по заряду Пертузумаба в разных фракциях СЕС, по всей видимости, одинакова, как следует из данных клеточного теста на антипролиферацию. Таким образом, не ожидается, что зарядная гетерогенность Пертузумаба будет так влиять на его эффективность. Биологическая активность материалов объемом 400 л из отдела разработки процесса сравнима с таковой для эталонного материала и образца S9802A (см. биологическую активность и таблицу 4).
ГЕЛЬ-ХРОМАТОГРАФИЯ
Используют гель-хроматографию (SEC) для выявления уровня агрегации Пертузумаба. Образцы анализируют с использованием колонки TOSOHAAS TSK G3000SWXLTM (7,8 мм × 300 мм). Используют изократическую элюцию (100 мМ фосфата калия, pH 6,8, 0,5 мл/мин), проводя мониторинг поглощения в УФ области при 280 нм. Данные SEC анализа эталонного материала, образца S9802A и варианта 1 объемом 400 л из отдела разработки процесса показаны на фиг.10. Уровень мономера неизменно составляет более 99,6% по площади пика, а количество агрегата ниже 0,3% во всех анализируемых материалах.
АНАЛИЗ ПО МЕТОДУ СЕ-SDS-LIF
Анализ по методу капиллярного электрофореза с додецилсульфатом натрия и вызванной лазером флуоресценцией (СE-SDS-LIF) также используют для оценки чистоты образцов Пертузумаба. Наблюдают аналогичную электрофореграмму в случае эталонного материала, образца S9802A и варианта 1 объемом 400 л из отдела разработки процесса при проведении или без проведения восстановления (фиг.11А и фиг.11В). Уровни негликозилированной тяжелой цепи, выявляемые при анализе электрофореграмм восстановленных материалов, соответствуют от 2,6 до 4,3% (относительно общего количества тяжелой цепи). Количества агрегатов в данных образцах (не восстановленных), выявляемые в соответствии с анализом по методу СE-SDS-LIF, соответствуют результатам, полученным по методу СЕС. Нет признаков наличия значительных количеств фрагментов продукта или других примесей, по данным анализа указанных образцов методом СE-SDS-LIF. Результаты анализа по методу СE-SDS-LIF позволяют полагать, что профиль примесей в материалах объемом 400 л из отдела по разработке процесса аналогичен уровню примесей, наблюдаемому для эталонного материала и образца S9802A.
АНАЛИЗ МЕТОДОМ ДСН-ПААГ
Анализ методом электрофореза в ДСН-полиакриламидном геле (ДСН-ПААГ) (4-20% Т гель (Daiichi Pure Chemical Co., Tokyo, Japan) при окрашивании SYPRORUBYTM) проводят для сравнения восстановленного и интактного образцов эталонного материала, образца S9802A и материалов объемом 400 л из отдела разработки процесса. Не отмечается новых полос в материалах объемом 400 л из отдела по разработке процесса, что снова указывает на то, что общий профиль примесей в материалах объемом 400 л из отдела разработки процесса аналогичен данному уровню для эталонного материала и образца S9802A.
АНАЛИЗЫ ПО МЕТОДУ ТРИПСИНОВОЙ ОБРАБОТКИ И ПЕПТИДНОГО КАРТИРОВАНИЯ С ИСПОЛЬЗОВАНИЕМ LYS-C
Анализы методом трипсиновой обработки и Lys-C пептидного картирования проводят для изучения в сравнительном аспекте первичной структуры Пертузумаба в эталонном материале, образце S9802A и материалах объемом 400 л из отдела разработки процесса. Аликвоты восстановленного и S-карбоксиметилированного Пертузумаба подвергают расщеплению трипсином, и аликвоты восстановленного и сульфитолизированного Пертузумаба подвергают расщеплению эндопротеиназой Lys-C. Продукты расщепления трипсином выделяют хроматографией с обращением фазы с использованием колонки VYDAC C-18TM (4,6 мм × 250 мм) в градиенте 0-60% ацетонитрила. Поглощение отслеживают при длине волны 214 нм и определяют пептидные массы по методу ESI-MS с использованием THERMO FINNIGAN LCQTM. Продукты расщепления Lys-C разделяют хроматографией с обращением фазы с использованием колонки ZORBAX C-8TM (4,6 мм × 250 мм) в градиенте 0-100% изопропилового спирта (IPA). Поглощение отслеживают при длине волны 214 нм и определяют пептидные массы по методу ESI-MS с использованием THERMO FINNIGAN LCQTM.
Карты трипсиновой обработки и Lys-C пептидные карты для эталонного материала, образца S9802A и материала варианта 1 объемом 400 л из отдела разработки процесса показаны в сравнительном аспекте на фиг.12А и фиг.12 В соответственно. Как карты трипсиновой обработки, так и карты Lys-C обработки для всех трех материалов по существу идентичны. Большая часть пептидов была идентифицирована методом LС-MS, и полученные результаты были сопоставлены с ожидаемой массой пептидов. В пептидах после трипсиновой обработки были идентифицированы 97,1% (436/449) остатков тяжелой цепи и 95,8% (205/214) остатков легкой цепи. Данная последовательность охватывает 98,4% (442/449) и 70,6% (151/214) тяжелой и легкой цепей соответственно по данным Lys-C картирования. Было показано, что N-концевой пептид, содержащий удлинение VHS, элюируется совместно с N-концевым пептидом без удлинения VHS по результатам анализа продуктов трипсинового картирования пептидов методом LC-MS. Не выявляется значительных количеств дезамидированных или окисленных продуктов в полученных пептидных картах.
БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
Биологическую активность Пертузумаба определяют путем измерения его способности ингибировать пролиферацию клеточной линии рака молочной железы человека MDA-MB-175-VII. Процент специфической активности, полученный для пяти образцов объемом 400 л из отдела разработки процесса (таблица 4) составляет от 90 до 96%, что близко к активности эталонного материала (100%, по определению) и образца S9802A (98%, по данным сертификата анализа). Как и ожидалось, зарядная гетерогенность не влияет на эффективность Пертузумаба. Все материалы характеризуются сравнимой антипролиферативной активностью.
АНАЛИЗ N-СВЯЗАННЫХ ОЛИГОСАХАРИДОВ
Часть гетерогенности по массе в тяжелой цепи возникает из-за гликозилирования по Asn-299. Для оценки гетерогенности олигосахаридов образцы Пертузумаба расщепляют в течение ночи с использованием PNGase F для высвобождения N-связанных гликанов. Высвобожденные олигосахариды далее подвергают дериватизации с использованием флуорофора 9-амино-1,4,6-трисульфоната (APTS). Индивидуальные гликановые формы разделяют методом капиллярного электрофореза (CE) (Beckman P/ACE 5500 CE с покрытым оболочкой капилляром Beckman) и определяют количество путем выявления флуоресценции.
Электрофореграммы, полученные в результате СЕ анализа высвобожденных нейтральных олигосахаридов из эталонного материала, образца S9802A и варианта 1 объемом 400 л материала из отдела разработки процесса, приведены на фиг.13. В качестве стандарта на фиг.14 показаны олигосахаридные структуры, обычно выявляемые в человеческих IgG антителах, а также дано краткое описание использованной номенклатуры. Относительные количества олигосахаридов во всех материалах показаны в таблице 5.
Олигосахариды со структурами G0 и G1 представляют собой преимущественные гликаны. Пики, возникающие на основе других олигосахаридных структур, также выявляются на электрофореграммах. Такие структуры включают G2, G0-F, G-1, Man5 и G1-1 (или Man6) гликоформы. Дополнительно изоформы подвергают разрешению. Распределение наблюдаемых гликанов было аналогично во всех материалах (таблица 5). Однако в сравнении с эталонными материалами и материалами объемом 400 л из отдела разработки процесса материал фазы II (образец S9802A) содержит меньшее количество гликанов с G0 структурой и больше гликанов с G1 структурой. Несмотря на различие в распределении гликанов, все материалы характеризуются сходной биологической активностью. Дополнительно, показано, что изменения в гетерогенности гликанов не оказывают существенного воздействия на связывающую эффективность Пертузумаба для рецептора FcRn (таблица 6) или рецептора Fc-гамма (таблица 7) (см. тесты на связывание рецептора FcRn и рецептора Fc-гамма).
Высвобожденные нейтральные олигосахариды также подвергают анализу масс-спектрометрией MALDI-TOF (MALDI-TOF/MS). MALDI-TOF спектры для высвобожденных нейтральных олигосахаридов из эталонного материала, образца S9802A и варианта 1 объемом 400 л материала из отдела разработки процесса приведены в сравнительном аспекте на фиг.15. Структура и распределение гликанов, выявляемые по данным MALDI-TOF/MS анализа, соответствуют результатам, полученным при анализе по методу CE.
АНАЛИЗ ПО МЕТОДУ КАПИЛЛЯРНОГО ИЗОЭЛЕКТРОФОКУСИРОВАНИЯ
Анализ по методу капиллярного изоэлектрофокусирования (cIEF) используют для выявления pI Пертузумаба в эталонном материале, образце S9802A и варианте 1 объемом 400 л материала из отдела разработки процесса. Хотя относительные количества разных заряженных видов в исследуемых материалах несколько различаются по данным CEC анализа, показатель pI для основного вида составляет 8,7 во всех образцах.
АНАЛИЗ СВОБОДНЫХ СУЛЬФГИДРИЛЬНЫХ ГРУПП
Проводят тестирование эталонного материала, образца S9802A и варианта 1 объемом 400 л материала из отдела разработки процесса на наличие свободных тиоловых групп (неспаренных цистеиновых остатков) с использованием анализа по методу Эллмана. Уровень свободных тиоловых групп был ниже предела выявления (примерно 0,05 моль свободных тиоловых групп на моль белка) во всех исследованных материалах.
АНАЛИЗ СВЯЗЫВАНИЯ РЕЦЕПТОРА FcRn
Афинности по связыванию рецептора FcRn для Пертузумаба из эталонного материала, образца S9802A и варианта 1 объемом 400 л материалов из отдела разработки процесса сравнивают в рамках ELISA теста по методике, аналогичной методике, описанной в литературе (Shields et al., J. Biol. Chem., 276: 6591-6604 (2001)). Эталонный материал используют в качестве стандарта.
В начале в ячейки 96-ячеечных планшетов MAXISORPTM (Nunc, Roskilde, Denmark) наслаивают NEUTRAVADINTM (Pierce, Rockford, IL) и оставляют при температуре 4°С в течение ночи. Затем к ячейкам добавляют биотинилированный человеческий FcRn по 2 мкг/мл и проводят инкубацию в течение одного часа. К ячейкам планшета добавляют одиннадцать двукратных серийных разведений образцов Пертузумаба (3,1-3200 нг/мл) и инкубируют в течение двух часов. Связанный Пертузумаб выявляют при добавлении меченого козьего F(ab')2 против человеческого IgG F(ab')2 (Jackson ImmunoResearch, West Grove, PA) и используют 3,3',5,5'-тетраметилбензидин (TMБ) (Kirkegaard & Perry Laboratories, Gaithersburg, MD) в качестве субстрата. Поглощение измеряют при длине волны 450 нм на приборе TITERTEK MULTISKANTM (MCC/340) (ICN, Costa Mesа, CA). FcRn-связывающую аффинность Пертузумаба также оценивают во втором формате ELISA, где в ячейки планшета вносят HER2-EСD. К ячейкам планшета добавляют серийные разведения образцов Пертузумаба и инкубируют в течение двух часов. Планшеты промывают и добавляют 2 мг/мл биотинилированного человеческого FcRn. Связанный FcRn выявляют с использованием Стрептавидин-HRP с TMБ в качестве субстрата.
Определяют поглощение в средней точке на кривой титрования (mid-OD) для стандарта (например, эталонного материала) и соответствующих концентраций стандарта и образцов в данной точке mid-OD. Относительную связывающую аффинность вычисляют при делении концентрации в точке mid-OD для стандарта на соответствующий показатель для образца.
Относительные связывающие аффинности, полученные в обоих форматах ELISA, приведены в таблице 6. Данные из двух разных форматов ELISA сравнимы. Хотя распределение гликанов в разных материалах Пертузумаба не идентично, FcRn-связывающие аффинности исследуемых материалов сравнимы, что указывает на то, что имеющаяся в Пертузумабе гетерогенность по гликанам не оказывает явного эффекта на FcRn-связывающую аффинность.
ТЕСТ НА СВЯЗЫВАНИЕ Fc-ГАММА РЕЦЕПТОРА
Связывание Пертузумаба с человеческими Fc-гамма рецепторами (FcγR) оценивают в тесте ELISA в соостветствии с методикой, описанной в литературе (Shields et al., J. Biol. Chem., 276: 6591-6604 (2001)).
Мономерный IgG может связывать с высокой аффинностью FcγRIa (CD64), однако низкоаффинные рецепторы (FcγRIIa (CD32A), FcγRIIb (CD32B) и FcγRIIIa (CD16)) требуют мультимерных IgG для достижения существенного связывания. Исходя из этого, для тестирования низкоаффинных рецепторов перед тестированием формируют мультимеры Пертузумаба путем смешивания каждого образца (200 нг/мл) с козьей каппа-цепью против человеческой молекулы (400 мг/мл; ICN Biomedical, Irvine, CA). Человеческий FcγR экспрессируют в виде рекомбинантных белков слияния на основе внеклеточного домена рецептора альфа-цепей с Gly/His6/GST (глицин/6 гистидинов/глютатион-S-трансферазой). Используют планшеты с наслоенным анти-GST в тесте по блокированию бычьего сывороточного альбумина (БСА) для захвата FcγR. К ячейкам планшета добавляют рецепторы (10 мл в концентрации 0,25 мг/мл) и инкубируют в течение 1 часа. Добавляют серийные разведения образцов Пертузумаба (100 мл) в виде мономеров для FcγRIa и в виде мультимеров для низкоаффинного FcγR, и планшеты инкубируют в течение двух часов. Связанный Пертузумаб выявляют при добавлении конъюгированного с пероксидазой хрена козьего F(ab')2 против человеческой молекулы (Jackson ImmunoResearch, Laboratories, West Grove, PA) и ТМБ в качестве субстрата. Значения ЭК50 для связывания Пертузумаба с FcγR определяют анализом по методу нелинейной регрессии с использованием модели с четырьмя параметрами (KaleidaGraph, Synergy Software, Reading, PA). В качестве контрольного антитела используют RITUXAN® (образец С2B81298-2).
Значения ЭК50 для связывания Пертузумаба с FcγR показаны в таблице 7. Из приведенных данных видно, что эталонный материал, образец S9802A и материалы объемом 400 л из отдела разработки процесса имеют сравнимые связывающие аффинности для FcγR. Полученные результаты указывают на то, что имеющаяся в Пертузумабе гетерогенность по гликанам не оказывает существенного эффекта на его FcγR-связывающие аффинности.








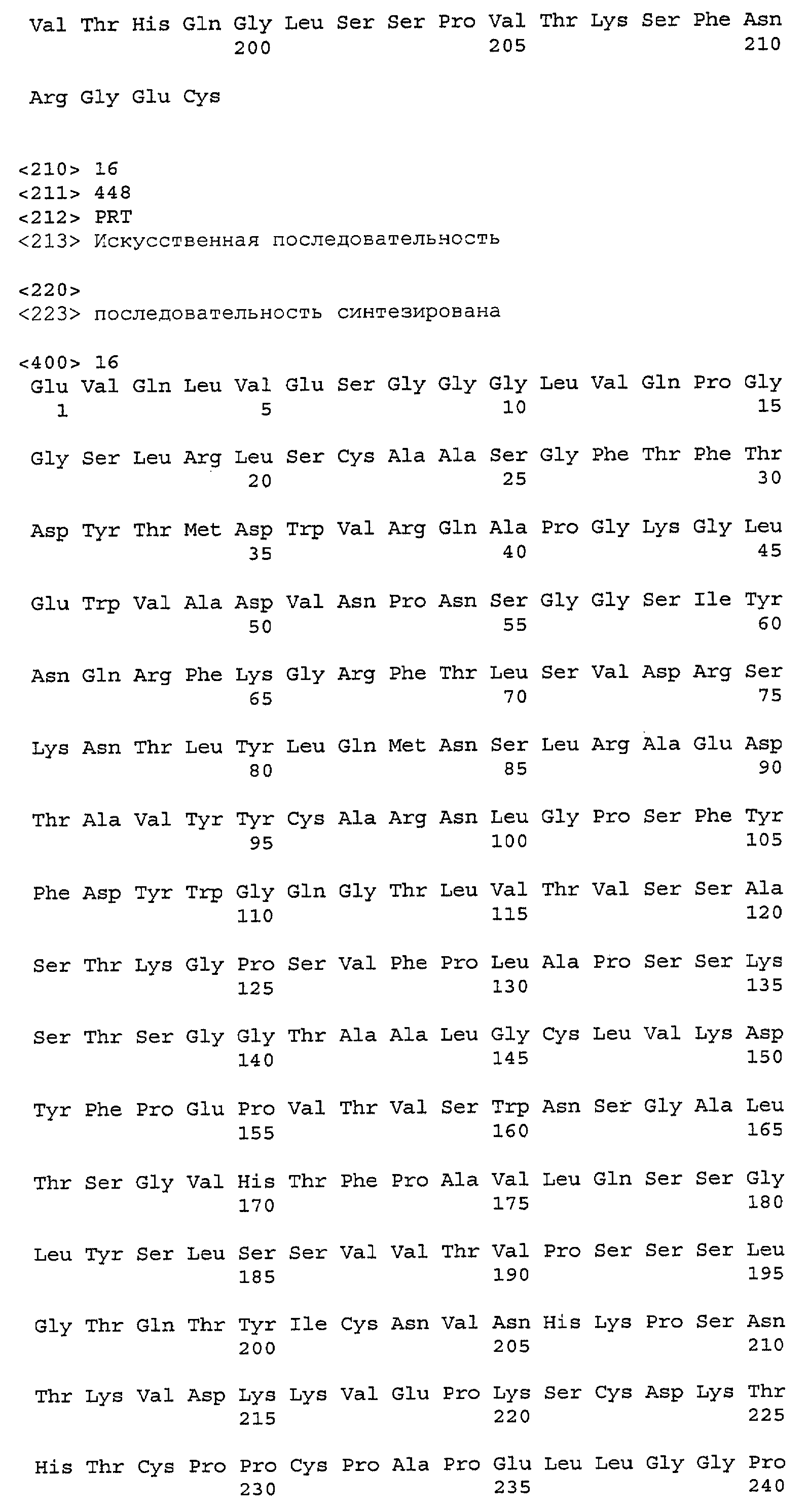
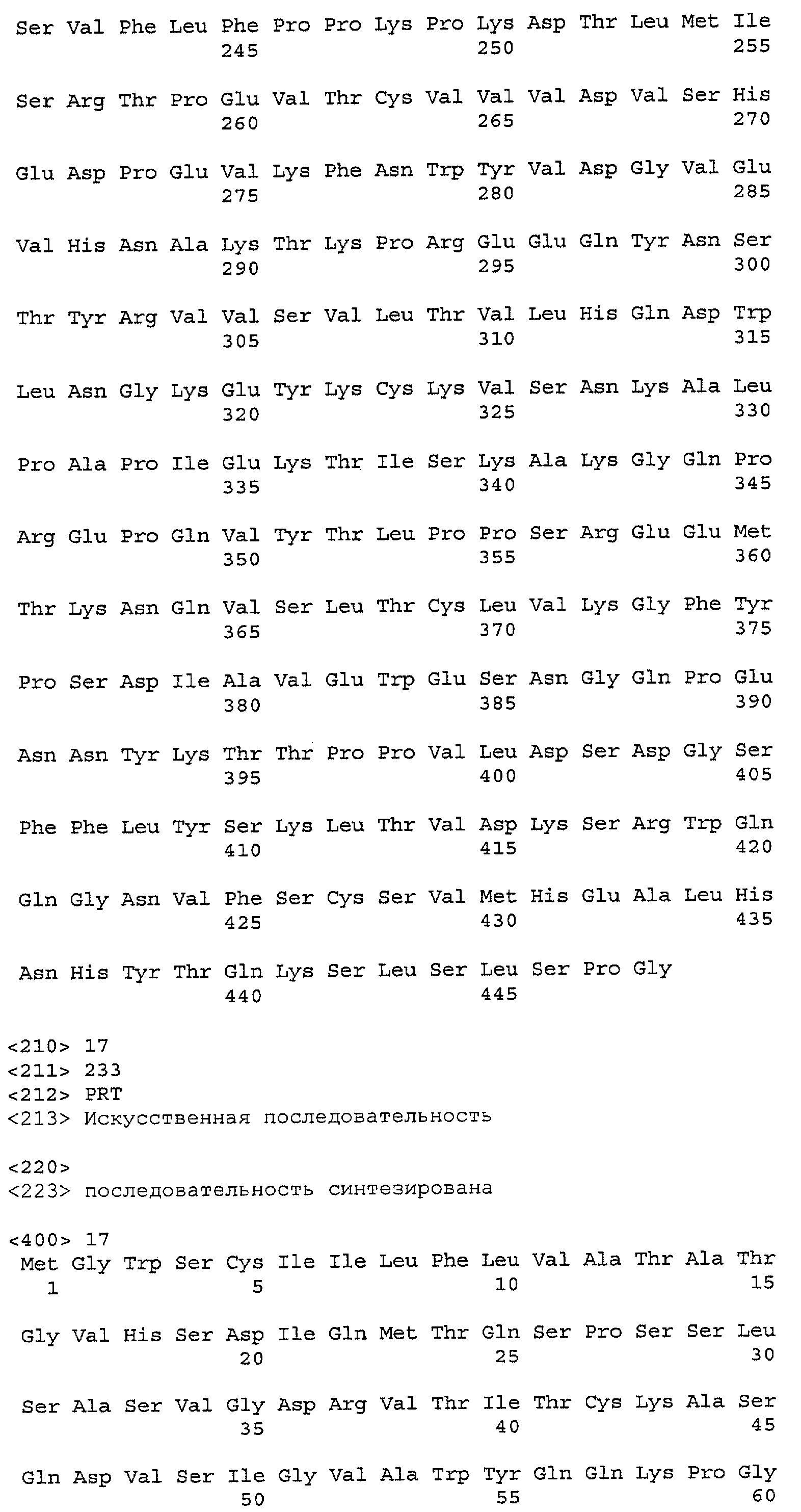








Реферат
Изобретение относится к биотехнологии. Описывается композиция для лечения рака, включающая основной вид антитела к HER2, который связывается с доменом II в HER2, и его вариант по аминокислотной последовательности, включающий лидерное удлинение на аминоконце. Изобретение позволяет расширить арсенал средств, используемых для лечения рака. 5 з.п. ф-лы, 31 ил., 7 табл.



Комментарии