Апоптотические антитела против ige - RU2500686C2
Код документа: RU2500686C2
Чертежи





















































































































































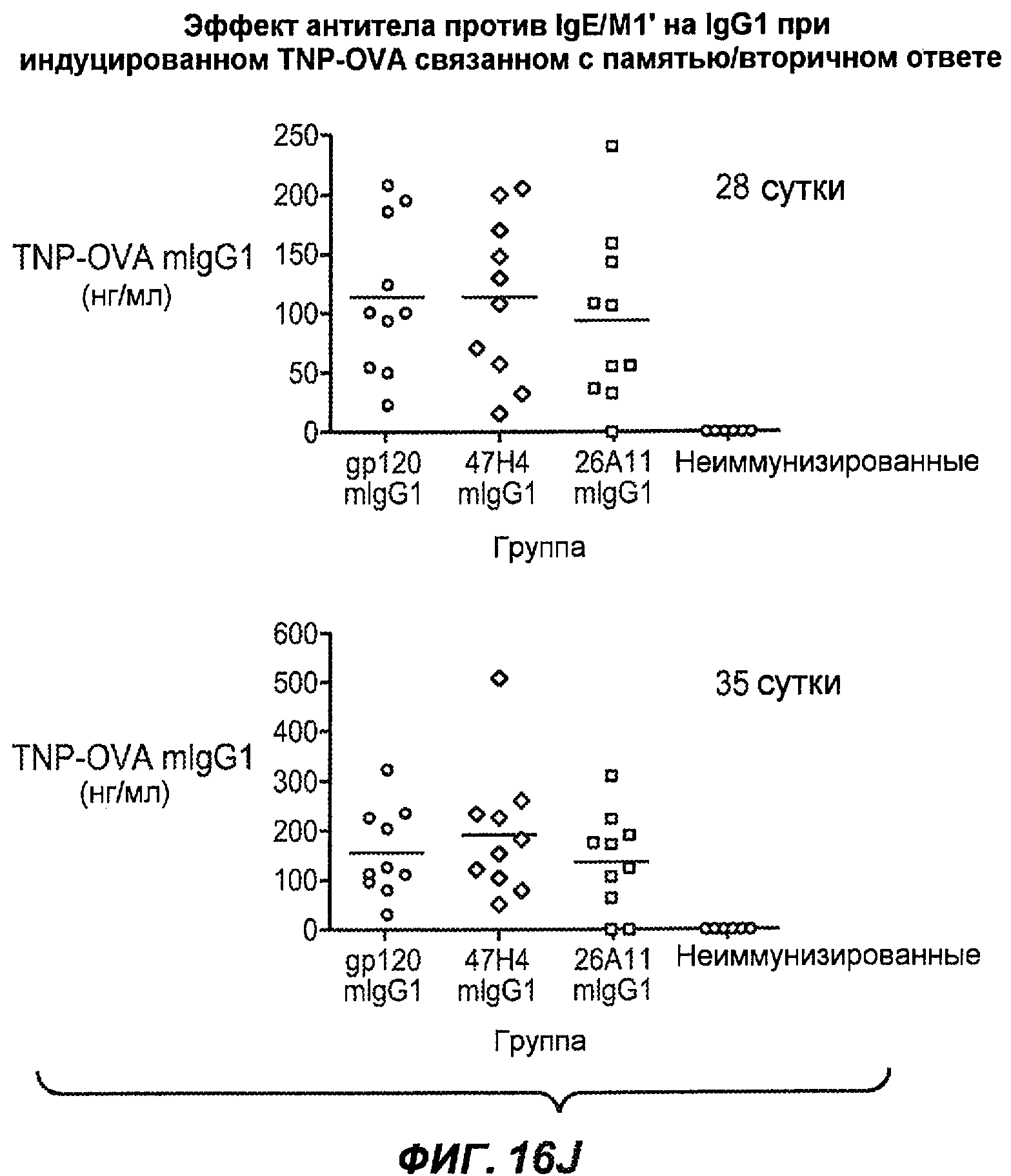

















Описание
Обратное действие
По данному изобретению испрашивается приоритет согласно 35 U.S.C. § 119 (e) по U.S.S.N. 60/896339, поданной 22 марта 2007 года.
Уровень техники, к которому относится изобретение
Область изобретения
Настоящее изобретение относится к апоптотическим антителам против IgE, кодирующим их нуклеиновым кислотам, их терапевтическим композициям и к их применению для лечения опосредуемых IgE нарушений.
Описание связанной области
Аллергия относится к определенным заболеваниям, при которых иммунные ответы на антигены окружающей среды вызывают воспаление ткани и дисфункцию органа. Клинические проявления каждого аллергического заболевания отражают иммунологически индуцированный воспалительный ответ в вовлеченном органе или ткани. Эти проявления, как правило, не зависят от химических или физических свойств антигена. Разнообразие аллергических ответов возникает вследствие вовлечения различных иммунологических эффекторных каскадов, каждый из которых создает уникальную картину воспаления.
Аллергия распространена по всему миру. Однако склонность к конкретным заболеваниям варьирует среди различных возрастных групп, полов и рас. Преобладание восприимчивости к конкретным аллергенам определяется как генетической предрасположенностью, так и географическими и культурными факторами, которые ответственны за воздействие аллергена. Клиническое состояние аллергии поражает только некоторых индивидов, которые встречаются с каждым аллергеном. Возникновение аллергического заболевания при воздействии аллергена требует не только предшествующей "сенсибилизации", но также других факторов, которые определяют локализацию реакции в конкретном органе.
Биологический процесс, который предшествует аллергическому заболеванию при воздействии аллергена, состоит в том, что аллерген индуцирует иммунный ответ, известный как "сенсибилизация" или фаза сенсибилизации. После сенсибилизации у индивида отсутствуют симптомы до тех пор, пока не произойдет последующее воздействие аллергена. Эффект сенсибилизации также известен как иммунная память.
Одним из первичных каскадов, индуцирующих воспаление, является каскад через иммуноглобулин E (IgE). IgE играет центральную роль в аллергии вследствие его роли в качестве рецептора аллергенов на поверхности тучных клеток и базофилов. Антитела IgE Fc-участком молекулы фиксируются к высокоаффинному рецептору клеточной поверхности, называемому FcεRI, на поверхности тучных клеток и базофилов. Аллергическая реакция начинается, когда поливалентная молекула аллергена связывается с антителами, которые оккупируют эти рецепторы. Результатом является связывание FcεRI, который, в свою очередь, дает внутриклеточный сигнал, вызывая высвобождение и активацию медиаторов воспаления: гистамина, лейкотриенов, хемотактических факторов, активирующего тромбоциты фактора и протеаз. Эти активированные медиаторы действуют локально и вызывают повышенную проницаемость сосудов, расширение сосудов, сокращение гладких мышц и секрецию слизистых желез. Такие события клинически называют немедленной или ранней фазой, и они происходят в пределах первых 15-30 минут после воздействия аллергена. В течение последующих 12 часов происходит прогрессирующая инфильтрация в ткани воспалительных клеток, протекающая от нейтрофилов к эозинофилам и к мононуклеарным клеткам в ответ на другие химические медиаторы, до конца не изученные. Этот период времени, составляющий 6-12 часов после воздействия аллергена, называют поздней фазой, и он характеризуется клиническими проявлениями клеточного воспаления. С учетом того, что эти реакции поздней фазы, особенно в легком, возникают в отсутствии реакций ранней фазы, все еще не понятно полностью, является ли реакция поздней фазы обязательно опосредуемой IgE.
IgE существует в мембраносвязанной форме и в секретируемой форме. Эти различные формы, по-видимому, являются вариантами сплайсинга. Предшествующие подходы для достижения терапевтического эффекта посредством подавления IgE направлены, главным образом, на секретируемую форму (например, XOLAIR®, омализумаб), чтобы предотвратить или нейтрализовать дальнейшее "вооружение" иммунной системы. Секретируемая форма IgE представляет собой более короткую форму, главным образом концы Fc-участка на CH4-домене (фиг.1), в то время как более длинная форма включает дополнительные C-концевые остатки, включающие пептиды, кодируемые экзонами, известными как М1/М1' и M2. В то время как было описано две различные формы мембраносвязанных IgE, как с сегментом из 52 аминокислот, известным как М1', так и без него [Batista et al., J. Exp. Med. 184: 2197-2205 (1996)], авторы не смогли подтвердить, что в мембраносвязанной форме отсутствует этот сегмент М1'. Общепринятая терапия антителами против IgE, которые связываются с секретируемой формой IgE, приводит к снижению свободных сывороточных, но не тотальных сывороточных IgE. Casale et al., J. Allergy Clin. Immunol. 100 (1): 110-121 (1997).
Кроме того, было отмечено, что в отсутствие сигнала от антигена B-клетки, рецепторы (т.е. иммуноглобулины) которых являются перекрестно связанными, подвержены апоптозу. Неожиданно авторы выявили, что нацеливание на М1'-сегмент IgE посредством антител против IgE может привести к индукции апоптоза B-клеток. Поскольку потомки активированных B-клеток могут привести к плазматическим клеткам, которые образуют и секретируют секретируемую форму IgE, устранение продуцирующих IgE B-клеток через апоптоз обеспечивает новый терапевтический подход для лечения аллергии.
Сущность изобретения
Настоящее изобретение относится к апоптотическим антителам против IgE, или их функциональным фрагментам, и к их применению для лечения опосредуемых IgE нарушений. Кроме того, изобретение относится к композициям и способам ингибирования продукции IgE и их секреции из B-клеток. Кроме того, изобретение относится к композициям и способам специфичного устранения продуцирующих IgE B-клеток и снижения тотального сывороточного IgE.
В одном варианте осуществления изобретение относится к антителу против IgE/М1', которое специфично связывает М1'-сегмент IgE и которое индуцирует апоптоз в экспрессирующих IgE B-клетках. В конкретном аспекте антитело специфично устраняет продуцирующие IgE B-клетки. В другом конкретном аспекте антитело снижает тотальный сывороточный IgE. В другом конкретном аспекте, антитело снижает как тотальный, так и свободный сывороточный IgE. В следующем конкретном аспекте сывороточный IgE является аллергенспецифичным. В следующем конкретном аспекте антитело связывается с IgE, источником которого является человек, макак-резус и яванский макак. В следующем конкретном аспекте антитело является химерным. В следующем конкретном аспекте антитело является гуманизированным. В следующем аспекте антитело представляет собой антитело человека.
В другом варианте осуществления изобретение относится к антителу против IgE/М1', которое специфично связывается с любым из эпитопов М1', соответствующих пептидам, представленным на фиг.5. В конкретном аспекте антитело специфично связывается с тем же эпитопом, что и эпитоп, связываемый антителом, выбранным из группы, состоящей из 47H4, 7A6, 26A11, 47H4v5, 7A6v1 и 26A11v6. В другом конкретном аспекте антитело связывается с эпитопом, соответствующим пептиду, выбранному из группы, состоящей из пептида 4 (SEQ ID NO:8), пептида 5 (SEQ ID NO:9), пептида 7 (SEQ ID NO:11) или пептида 8 (SEQ ID NO:12). В другом конкретном аспекте антитело связывается с пептидом 4 (SEQ ID NO:8).
В другом варианте осуществления изобретение относится к эпитопу М1' IgE, выбранному из группы, состоящей из пептида 4 (SEQ ID NO:8), пептида 5 (SEQ ID NO:9), пептида 7 (SEQ ID NO:11) или пептида 8 (SEQ ID NO:12). В конкретном аспекте пептид М1' представляет собой пептид 4 (SEQ ID NO:8).
В следующем варианте осуществления изобретение относится к антителу против IgE, которое специфично связывается с М1'-сегментом IgE с аффинностью связывания Скэтчарда в отношении IgE человека, эквивалентной аффинности связывания Скэтчарда для антитела мыши 47H4 против IgE/М1' или его гуманизированного варианта. В конкретном аспекте аффинность эквивалентна аффинности связывания 47H5. В другом конкретном аспекте аффинность составляет от 0,30 до 0,83 нм. В другом конкретном аспекте аффинность эквивалентна аффинности связывания 47H4v5. В следующем конкретном аспекте аффинность составляет приблизительно 1,5 нм.
В следующем варианте осуществления изобретение относится к антителу против IgE/М1', содержащему области HVR тяжелой цепи и легкой цепи антитела, представленного на любой из фиг.6A-F и фиг.20-25. В конкретном аспекте антитело дополнительно содержит вариабельные области тяжелой и легкой цепей последовательностей антител, представленных на любой из фиг.6A-F и фиг.20-25. В другом конкретном аспекте антитело содержит полноразмерные тяжелые и легкие цепи антител, представленных на любой из фиг.6A-F. В другом конкретном аспекте тяжелые и легкие цепи последовательностей антитела представлены на фиг.6A-F. В следующем конкретном аспекте антитело выбрано из группы, состоящей из 26A11, 26A11v1-16, 7A6, 7A6v1, 47H4, 47H4v1-6. В следующем конкретном аспекте антитело представляет собой 47H4v5. В следующем конкретном аспекте антитело является афукозилированным.
В следующем варианте осуществления изобретение относится к композиции, содержащей антитело против IgE/М1', содержащее области HVR тяжелой и легкой цепи антитела, представленного на любой из фиг.6A-F, в сочетании с по меньшей мере одним фармацевтически приемлемым носителем. В конкретном аспекте антитело выбрано из группы, состоящей из 26A11, 26A11v1-16, 7A6, 7A6v1, 47H4, 47H4v1-6. В другом конкретном аспекте антитело представляет собой 47H4v5. В другом конкретном аспекте антитело является афукозилированным.
В следующем варианте осуществления изобретение относится к композиции, содержащей антитело против IgE/М1', содержащее области HVR тяжелой и легкой цепи антитела, представленного на любой из фиг.8-13, в сочетании с одним или несколькими лекарственными средствами, выбранными из группы, состоящей из антитела против IgE, антигистамина, бронходилятатора, глюкокортикоида, NSAID, антагониста TNF, антагониста интегрина, иммунодепрессивного средства, антагониста IL-4, антагониста IL-13, двойного антагониста IL-4/IL-13, DMARD, антитела, которое связывается с B-клеточным поверхностным маркером, и антагониста BAFF. В конкретном аспекте композиция дополнительно содержит по меньшей мере один фармацевтически приемлемый носитель.
В следующем варианте осуществления изобретение относится к выделенной нуклеиновой кислоте, кодирующей области HVR тяжелой цепи антитела против IgE/М1', представленного на любой из фиг.6A-F. В конкретном аспекте выделенная нуклеиновая кислота дополнительно содержит нуклеиновую кислоту, кодирующую области HVR легкой цепи антитела, представленного на любой из фиг.6A-F. В другом конкретном аспекте антитело является химерным. В другом конкретном аспекте антитело является гуманизированным. В следующем аспекте антитело представляет собой антитело человека. В следующем конкретном аспекте антитело выбрано из группы, состоящей из 26A11, 26A11v1-16, 7A6, 7A6v1, 47H4, 47H4v1-6. В следующем конкретном аспекте антитело представляет собой 47H4v5. В следующем конкретном аспекте антитело является афукозилированным. В следующем аспекте нуклеиновая кислота дополнительно содержит вектор, пригодный для экспрессии нуклеиновой кислоты. В следующем конкретном аспекте вектор дополнительно содержит клетку-хозяина, пригодную для экспрессии нуклеиновой кислоты. В следующем конкретном аспекте клетка-хозяин представляет собой эукариотическую клетку или прокариотическую клетку. В следующем конкретном аспекте эукариотическая клетка представляет собой клетку млекопитающих, такую как клетка яичника китайского хомячка (CHO).
В следующем варианте осуществления изобретение относится к способу получения антитела против IgE/М1', которое специфично связывается с М1'-сегментом IgE, или его функционального фрагмента, включающему культивирование клетки-хозяина, содержащего нуклеиновую кислоту, кодирующую такое антитело или фрагмент в форме, пригодной для экспрессии, в условиях, пригодных для продукции такого антитела или фрагмента, и выделение антитела или фрагмента.
В следующем варианте осуществления изобретение относится к изделию, содержащему контейнер, в котором находится композиция, описанная в настоящем документе, и вкладыш в упаковку с указанием на применение для лечения опосредуемого IgE нарушения. В конкретном аспекте изделие представляет собой флакон. В другом конкретном аспекте изделие представляет собой предварительно заполненный шприц. В другом конкретном аспекте предварительно заполненный шприц, кроме того, находится в инъекционном устройстве. В следующем конкретном аспекте инъекционное устройство представляет собой автоматический впрыскиватель.
В следующем варианте осуществления изобретение относится к способу специфичного устранения продуцирующих IgE B-клеток, включающему введение терапевтически эффективного количества антитела против IgE/М1', которое специфично связывается с М1'-сегментом IgE и индуцирует апоптоз в экспрессирующих IgE B-клетках. В конкретном аспекте антитело содержит области HVR тяжелой и легкой цепи антитела, представленного на любой из фиг.6A-F. В другом конкретном аспекте способ снижает тотальный сывороточный IgE. В другом конкретном аспекте способ снижает как свободный сывороточный, так и тотальный сывороточный IgE. В следующем конкретном аспекте сывороточный IgE является аллергенспецифичным. В следующем конкретном аспекте антитело выбирают из группы, состоящей из 26A11, 26A11v1-16, 7A6, 7A6v1, 47H4, 47H4v1-6. В следующем конкретном аспекте антитело представляет собой 47H4v5. В следующем конкретном аспекте антитело обладает активностью ADCC.
В следующем варианте осуществления изобретение относится к способу лечения опосредуемого IgE нарушения, включающему введение терапевтически эффективного количества антитела против IgE/М1', которое специфично связывается с М1'-сегментом IgE и индуцирует апоптоз в экспрессирующих IgE B-клетках. В конкретном аспекте антитело специфично устраняет продуцирующие IgE B-клетки. В другом конкретном аспекте антитело снижает тотальный сывороточный IgE. В другом конкретном аспекте антитело снижает как тотальный, так и сывороточный IgE. В следующем конкретном аспекте сывороточные IgE являются аллергенспецифичными. В следующем конкретном аспекте антитело содержит области HVR тяжелой и легкой цепи антитела, представленного на любой из фиг.6A-F. В следующем конкретном аспекте антитело выбрано из группы, состоящей из 26A11, 26A11v1-16, 7A6, 7A6v1, 47H4, 47H4v1-6. В следующем конкретном аспекте антитело представляет собой 47H4v5. В следующем конкретном аспекте антитело обладает активностью ADCC. В следующем конкретном аспекте опосредуемое IgE нарушение выбрано из группы, состоящей из аллергического ринита, астмы (например, аллергической астмы и неаллергической астмы), атопического дерматита, аллергической гастроэнтеропатии, гиперчувствительности (например, анафилаксии, крапивницы, пищевой аллергии и т.д.), аллергического бронхолегочного аспергиллеза, паразитарных заболеваний, интерстициального цистита, гипер-IgE-синдрома, атаксии-телеангиэктазии, синдрома Вискотта-Олдрича, бестимусной лимфоплазии, IgE-миеломы и реакции "трансплантат против хозяина". В следующем конкретном аспекте опосредуемое IgE нарушение представляет собой пищевую аллергию, анафилаксию, контактный дерматит и аллергическую пурпуру.
В следующем варианте осуществления изобретение относится к способу лечения опосредуемого IgE нарушения, включающему введение композиции, содержащей терапевтически эффективное количество антитела против IgE/М1', которое специфично связывается с М1'-сегментом IgE и индуцирует апоптоз в экспрессирующих IgE B-клетках, в сочетании с терапевтически эффективным количеством по меньшей мере одного лекарственного средства, выбранного из группы, состоящей из антитела против IgE, антигистамина, бронходилятатора, глюкокортикоида, NSAID, противоотечного средства, средства от кашля, аналгетика, антагониста TNF, антагониста интегрина, иммунодепрессивного средства, антагониста IL-4, антагониста IL-13, двойного антагониста IL-4/IL-13, DMARD, антитела, которое связывается с B-клеточным поверхностным маркером, и антагониста BAFF. В конкретном аспекте антитело специфично устраняет продуцирующие IgE B-клетки. В другом конкретном аспекте антитело снижает тотальный сывороточный IgE. В другом конкретном аспекте антитело снижает как тотальный, так и свободный IgE. В следующем конкретном аспекте сывороточный IgE является аллергенспецифичным. В следующем конкретном аспекте антитело содержит области HVR тяжелой и легкой цепи антитела, представленного на любой из фиг.6A-F. В следующем конкретном аспекте антитело выбрано из группы, состоящей из 26A11, 26A11v1-16, 7A6, 7A6v1, 47H4, 47H4v1-6. В следующем конкретном аспекте антитело представляет собой 47H4v5. В следующем конкретном аспекте антитело обладает активностью ADCC.
В следующем варианте осуществления изобретение относится к способу лечения опосредуемого IgE нарушения, включающему комбинированную схему лечения, состоящую из введения терапевтически эффективного количества антитела против IgE/М1', которое специфично связывается с М1'-сегментом IgE и индуцирует апоптоз в экспрессирующих IgE B-клетках, до, одновременно или после проведения известного способа лечения аллергических нарушений. В конкретном аспекте сочетание включает введение антитела против IgE, антигистамина, бронходилятатора, глюкокортикоида, нестероидного противовоспалительного лекарственного средства, иммунодепрессанта, антагониста IL-4, антагониста IL-13, двойного антагониста IL-4/IL-13, противоотечного средства, средства от кашля или аналгетика. В другом конкретном аспекте антитело против IgE/М1' вводят в сочетании со схемой лечения, направленной на снижение чувствительности к аллергену. В конкретном аспекте антитело специфично устраняет продуцирующие IgE B-клетки. В другом конкретном аспекте антитело снижает тотальный сывороточный IgE. В другом конкретном аспекте антитело снижает как тотальный, так и свободный IgE. В следующем конкретном аспекте сывороточный IgE является аллергенспецифичным. В следующем конкретном аспекте антитело содержит области HVR тяжелой и легкой цепи антитела, представленного на любой из фиг.6A-F. В следующем конкретном аспекте антитело выбрано из группы, состоящей из 26A11, 26A11v1-16, 7A6, 7A6v1, 47H4, 47H4v1-6. В следующем конкретном аспекте антитело представляет собой 47H4v5. В следующем конкретном аспекте антитело обладает активностью ADCC.
В следующем варианте осуществления изобретение относится к способу предупреждения индуцированной аллергеном продукции IgE, включающему введение терапевтически эффективного количества антитела против IgE/М1', которое специфично связывается с М1'-сегментом IgE и индуцирует апоптоз в экспрессирующих IgE B-клетках. В конкретном аспекте антитело содержит области HVR тяжелой и легкой цепи антитела, представленного на любой из фиг.6A-F. В другом конкретном аспекте способ специфично устраняет продуцирующие IgE B-клетки. В другом конкретном аспекте способ снижает тотальный сывороточный IgE. В следующем конкретном аспекте способ снижает как свободный сывороточный, так и тотальный сывороточный IgE. В следующем конкретном аспекте сывороточный IgE является аллергенспецифичным. В следующем конкретном аспекте антитело выбрано из группы, состоящей из 26A11, 26A11v1-16, 7A6, 7A6v1, 47H4, 47H4v1-6. В следующем конкретном аспекте антитело представляет собой 47H4v5. В следующем конкретном аспекте антитело обладает активностью ADCC.
В следующем варианте осуществления изобретение относится к способу снижения индуцируемой аллергеном продукции IgE, включающему введение терапевтически эффективного количества антитела против IgE/М1', которое специфично связывается с М1'-сегментом IgE и индуцирует апоптоз в экспрессирующих IgE B-клетках. В конкретном аспекте антитело содержит области HVR тяжелой и легкой цепи антитела, представленного на любой из фиг.6A-F. В другом конкретном аспекте способ специфично устраняет продуцирующие IgE B-клетки. В другом конкретном аспекте способ снижает тотальный сывороточный IgE. В следующем конкретном аспекте способ снижает как свободный сывороточный, так и тотальный сывороточный IgE. В следующем конкретном аспекте сывороточный IgE является аллергенспецифичным. В следующем конкретном аспекте антитело выбрано из группы, состоящей из 26A11, 26A11v1-16, 7A6, 7A6v1, 47H4, 47H4v1-6. В следующем конкретном аспекте антитело представляет собой 47H4v5. В следующем конкретном аспекте антитело обладает активностью ADCC.
В следующем варианте осуществления изобретение относится к композиции, пригодной для любого из ранее описанных способов.
В следующем варианте осуществления изобретение относится к применению композиции для любого из описанных ранее способов.
В следующем варианте осуществления изобретение относится к гибридоме мыши, депонированной в ATCC 21 марта 2007 года, с обозначением, выбранным из группы, состоящей из 7A6.18, 1C11.10.20, 47G4.6.2, 47H4.12.10, 42H4.6.9, 42A5.20.11, 26A11.6.5, 51D2.22.15, 45C1.6.14, 26B11.3.12, 28E9.12.9. В конкретном аспекте изобретение относится к антителу, секретируемому депонированной гибридомой.
В следующем варианте осуществления изобретение относится к трансгенному животному, у которого экспрессируется М1'-сегмент человека в IgE.
Краткое описание рисунков
На фиг.1A-B представлено выравнивание выбранных участков константной цепи IgE человека (SEQ ID NO:1), макака-резус (SEQ ID NO:2) и яванского макака (SEQ ID NO:3). Представлено приблизительное расположение трансмембранных и внутриклеточных доменов CH2, CH3, CH4, М1'.
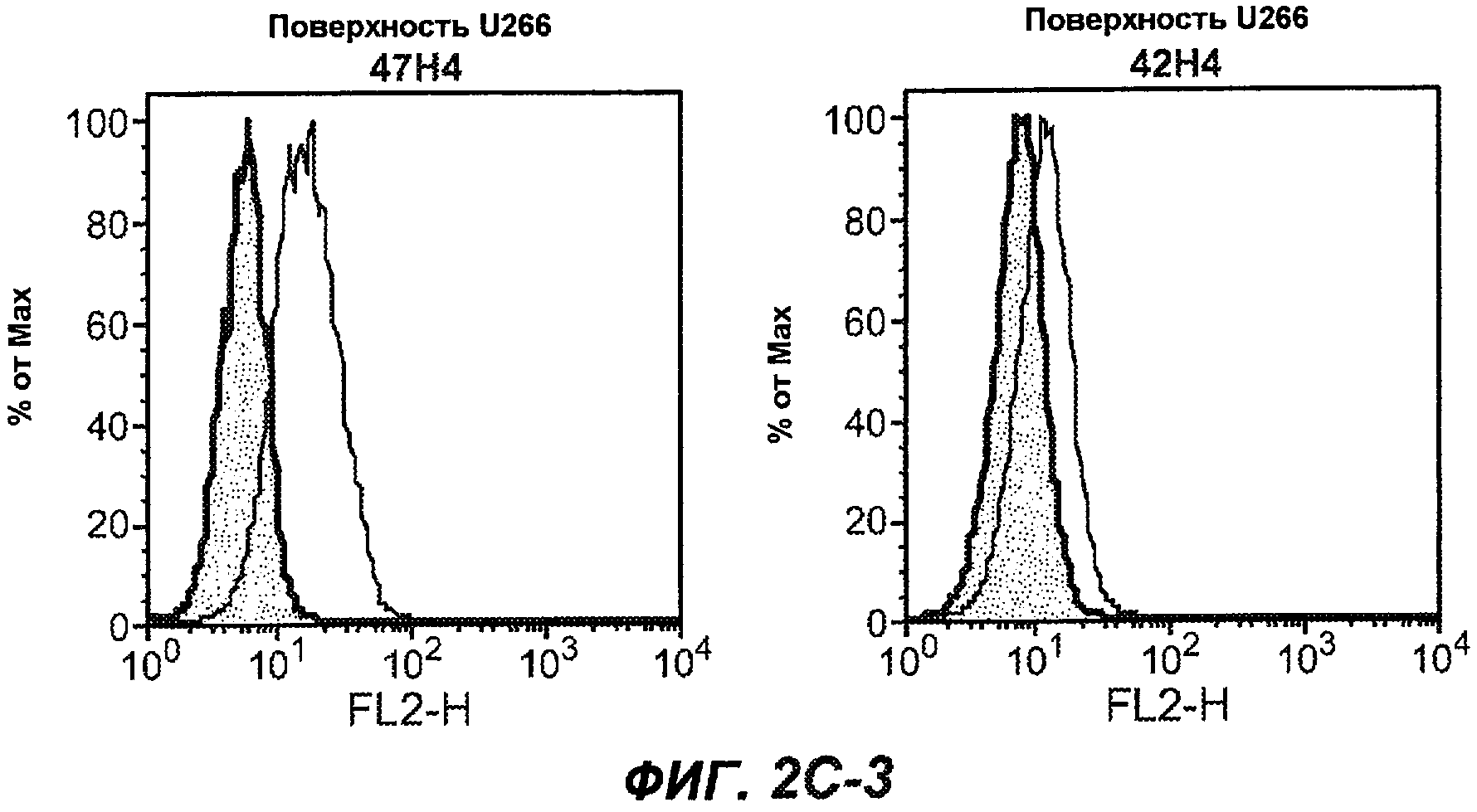
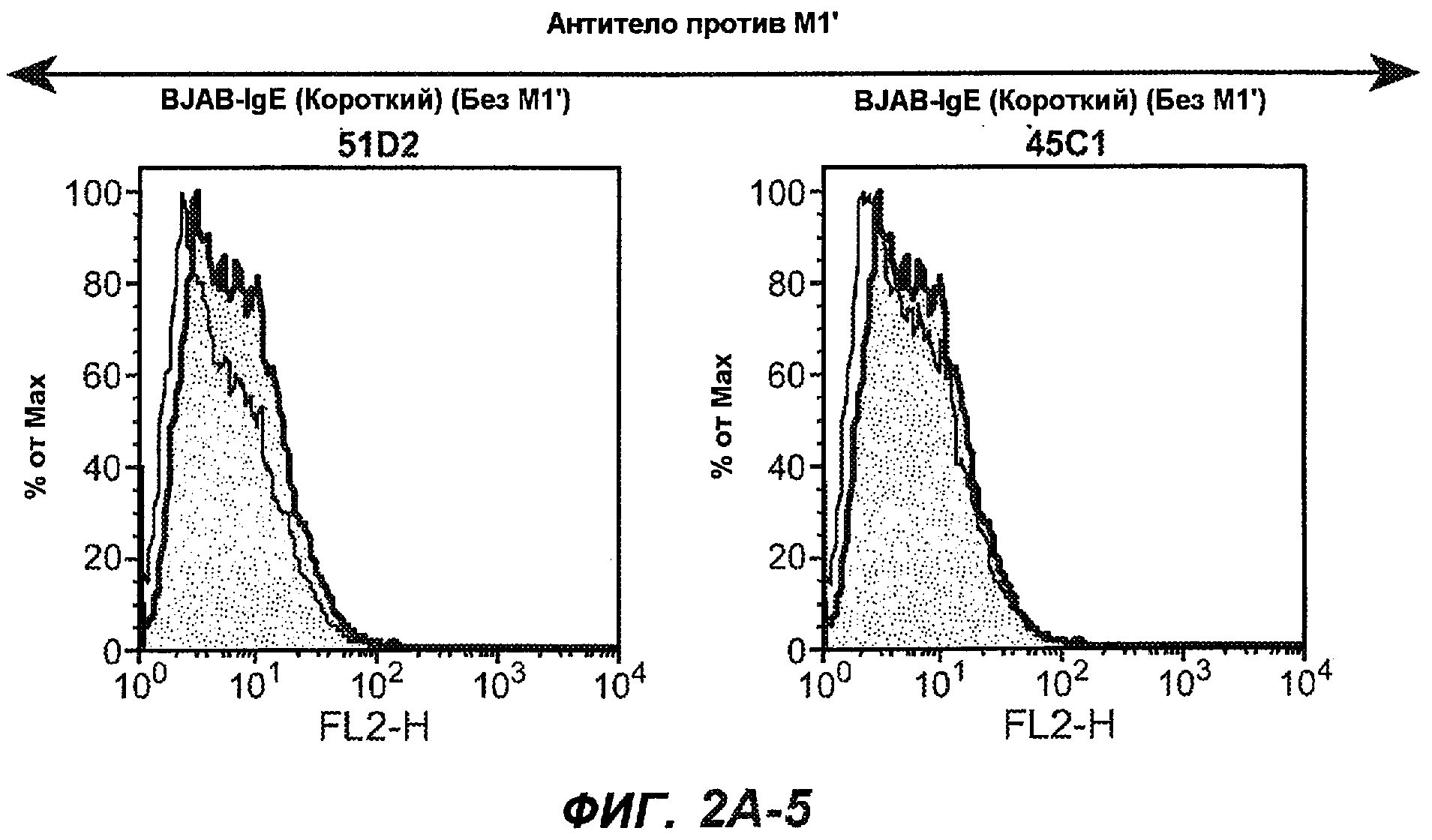
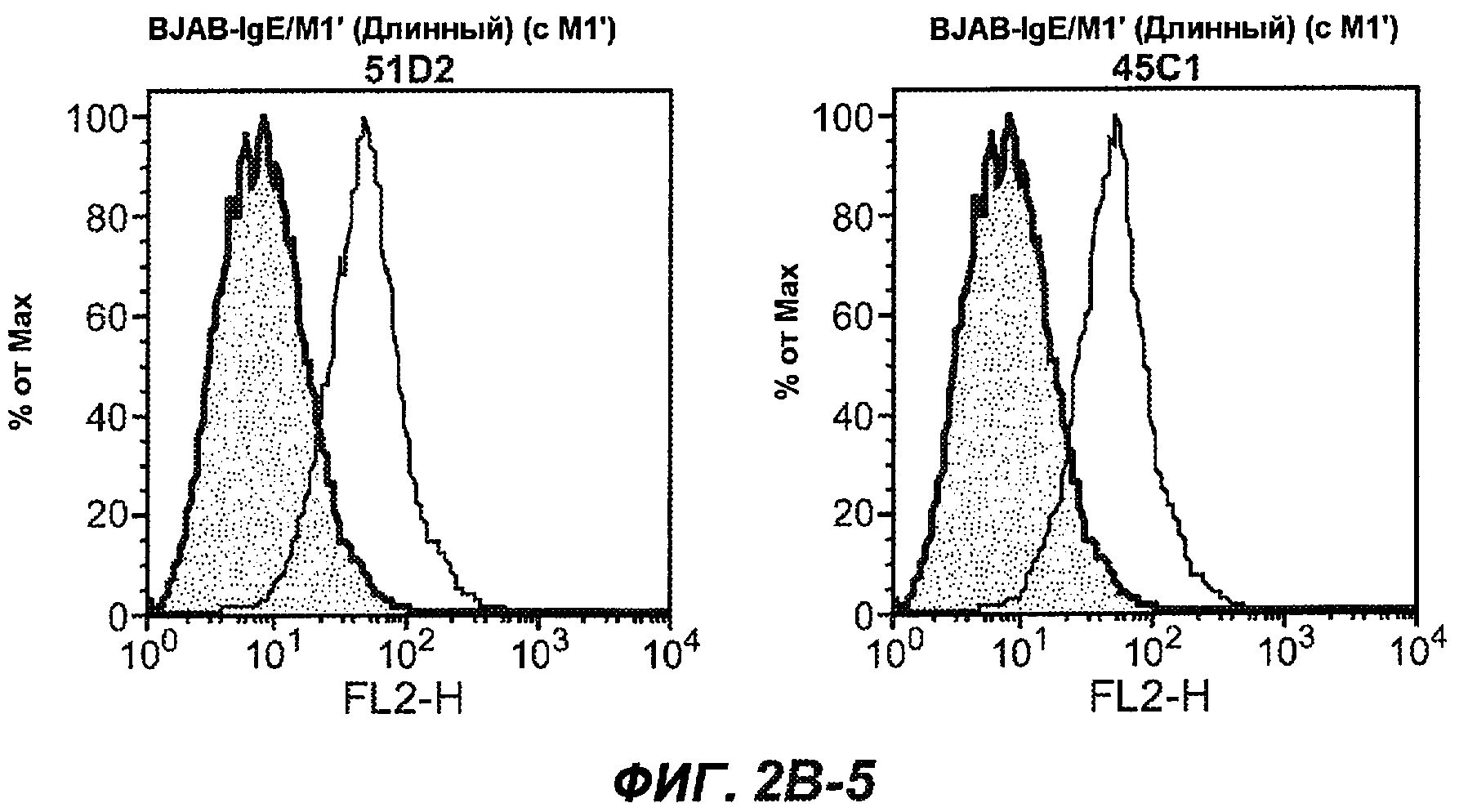
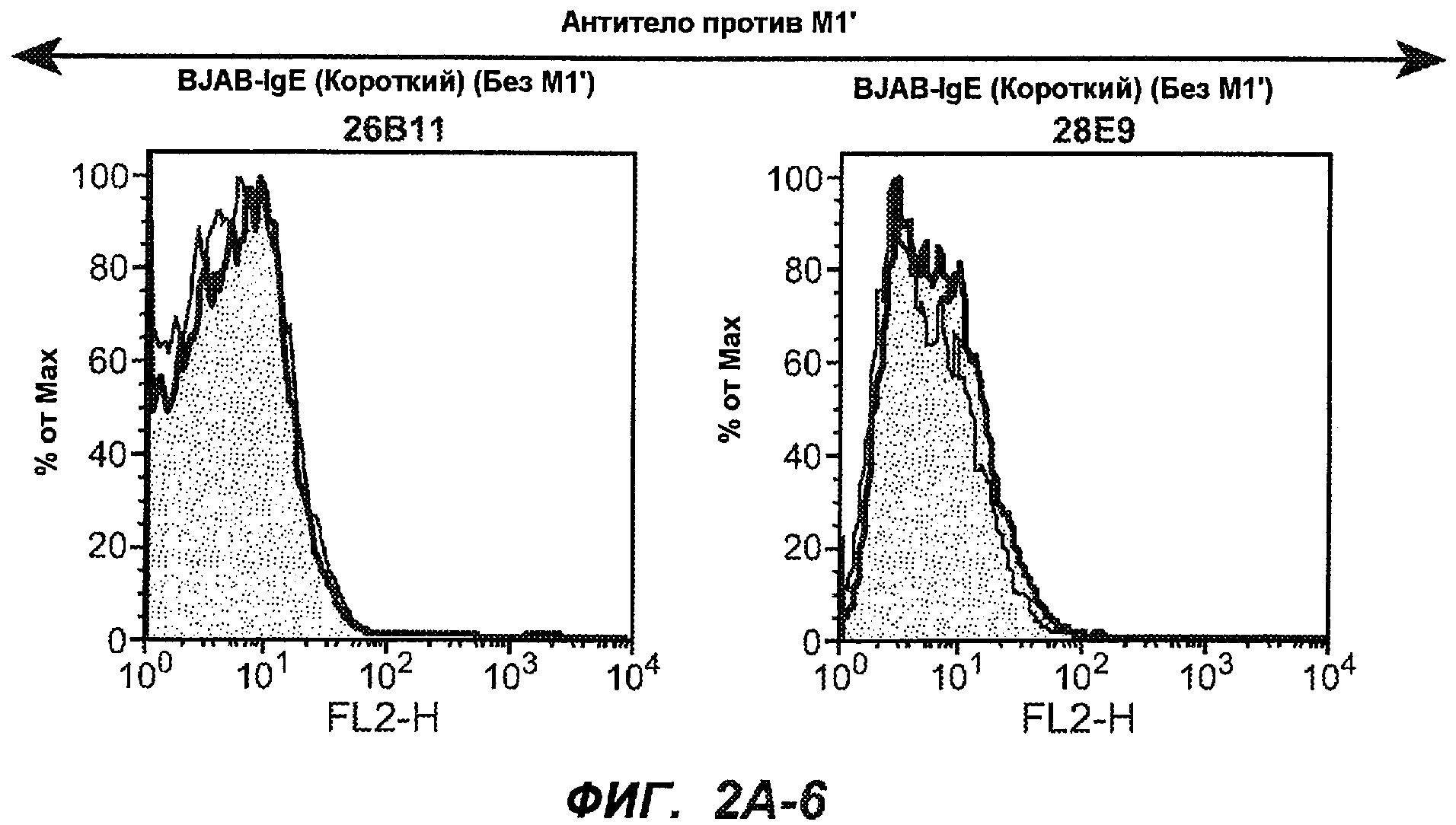
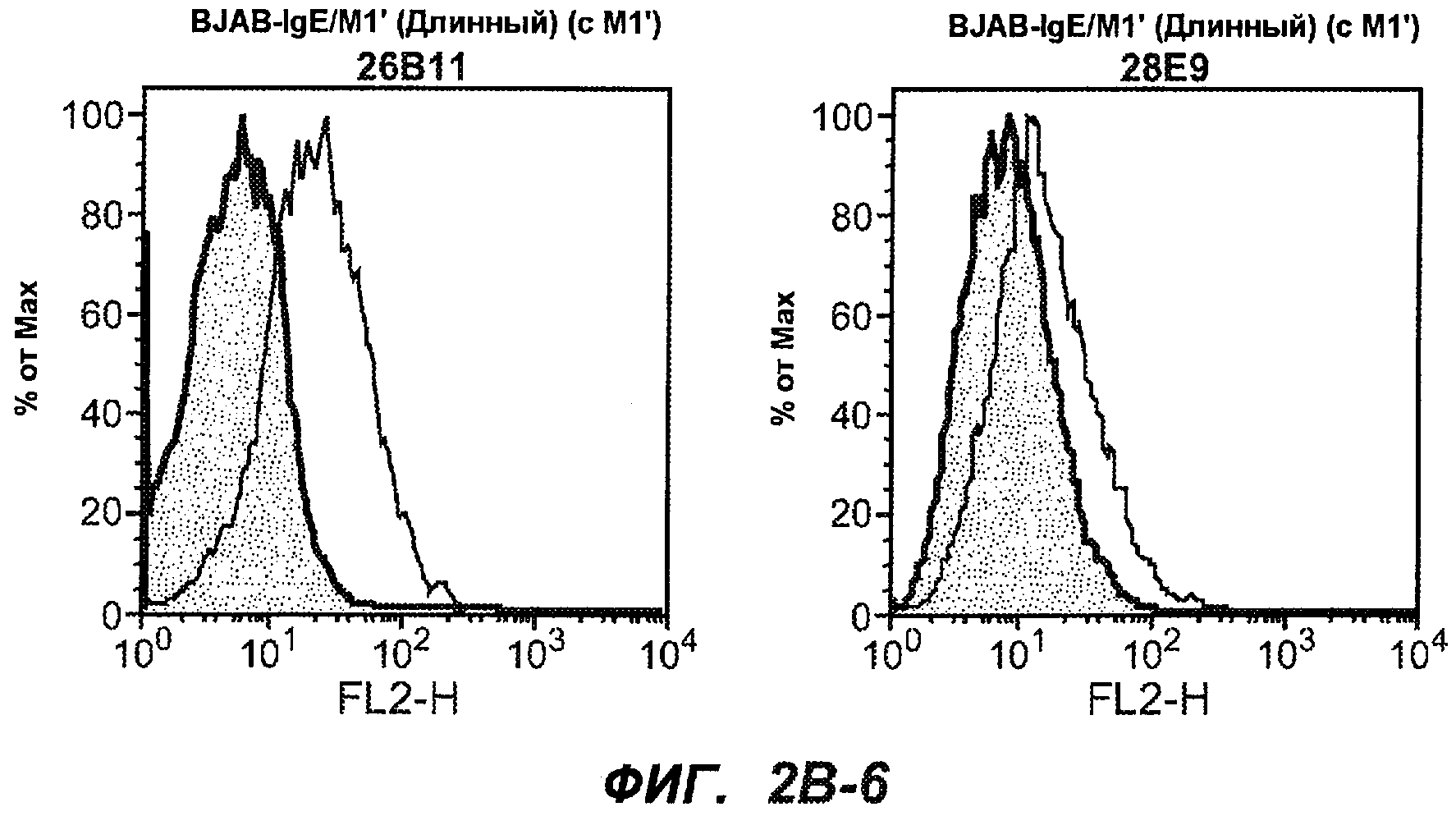
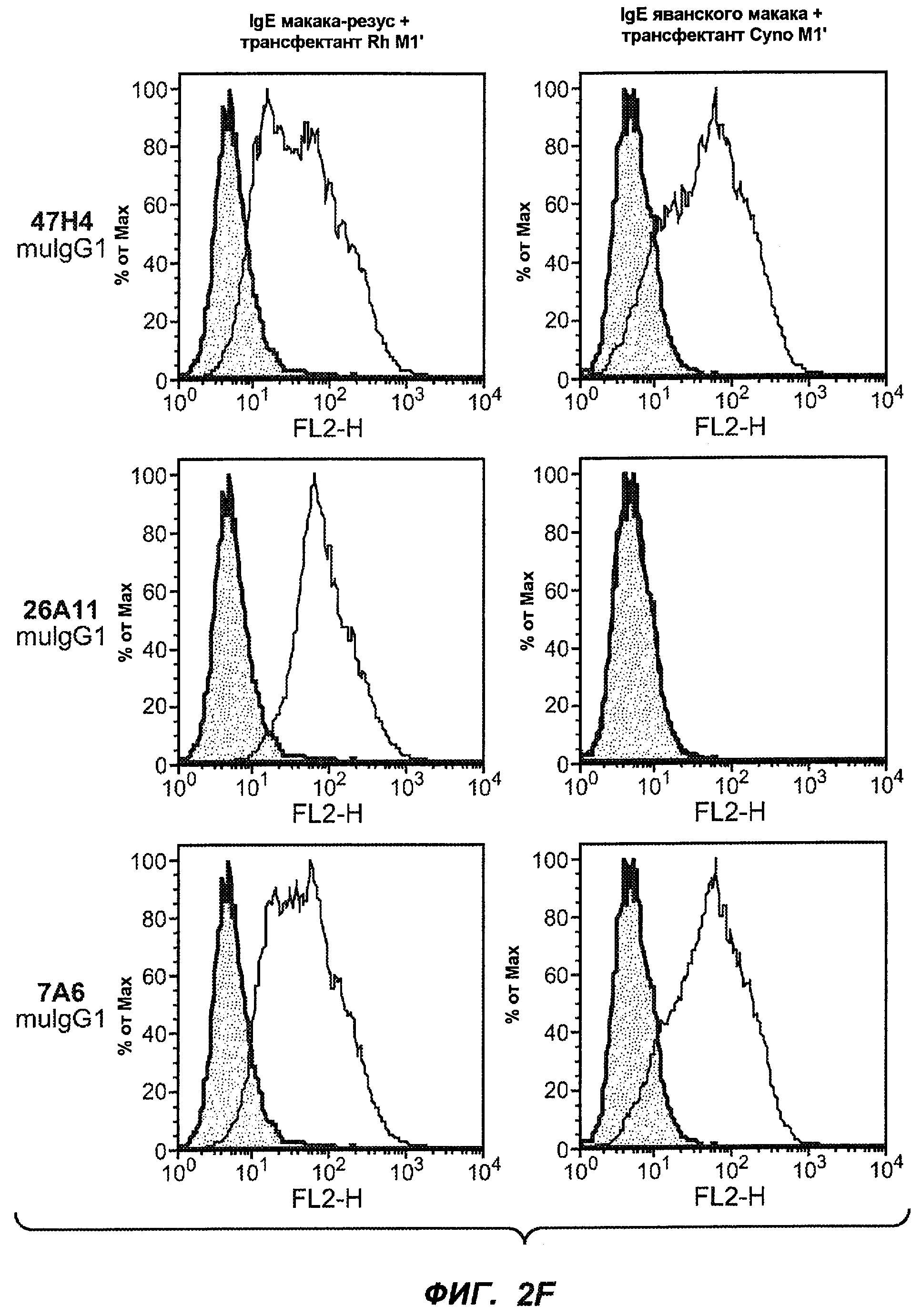
На фиг.2A-C представлены графики Скэтчарда для FACS, на которых показана специфичность различных антител против M1'. На фиг.2A-1-2A-6 представлено связывание с короткой формой IgE (без М1'), а на фиг.2B-1-2B-6 представлено связывание с длинной формой (с М1'). На фиг.2C-1-2C-6 представлено связывание с IgE, экспрессируемым клеточной линией U266. Затемненными кривыми показана интенсивность флуоресценции относительно контрольного Ab, а незатемненными кривыми показана относительная флуоресценция тестируемого антитела. На фиг.2D-F представлена специфичность связывания антител мыши 47H4, 26A11 и 7A6 против IgE/М1'. На фиг.2D показано, что 47H4 связывается с IgE/М1' человека, макака-резус и яванского макака, но не с IgE, лишенным М1'. На фиг.2E показано, что 47H4 связывается с U266, а 26A11 и 7A6 не связываются с ним. На фиг.2F показано, что 47H4 и 7A6 связываются с М1' как макака-резус, так и яванского макака, в то время как 26A11 связывается только с М1' макака-резус. На фиг.2G-I показана специфичность связывания гуманизированных антител 47H5v.5, 26A11v6 и 7A6v1 против IgE/М1'. На фиг.2G показано, что все три гуманизированных варианта 47H4v5, 26A11v6 и 7A6v1 являются специфичными к IgE-М1', но не к IgE, лишенному М1'. На фиг.2H показано, что варианты 47H4v5 и 26A11v6 (но не 7A6v1) связывают U266. На фиг.2I показано, что 47H4v5 и 7A6v1 связывает М1' макака-резус и яванского макака, а 26A11v6 связывает только М1' макака-резус.
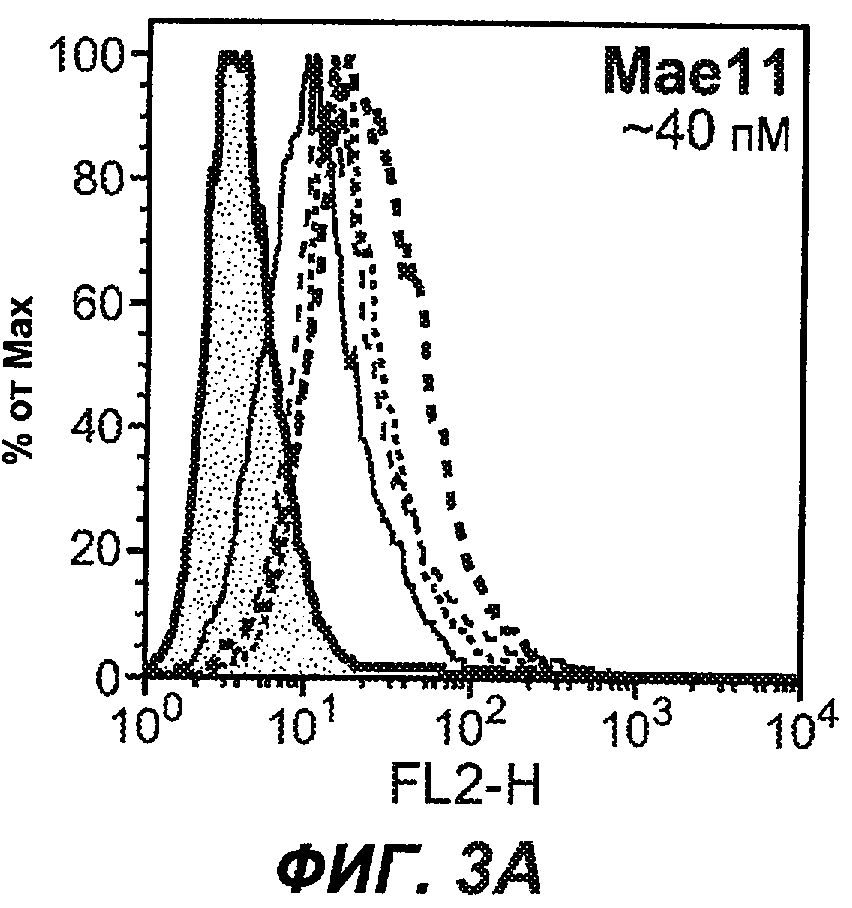
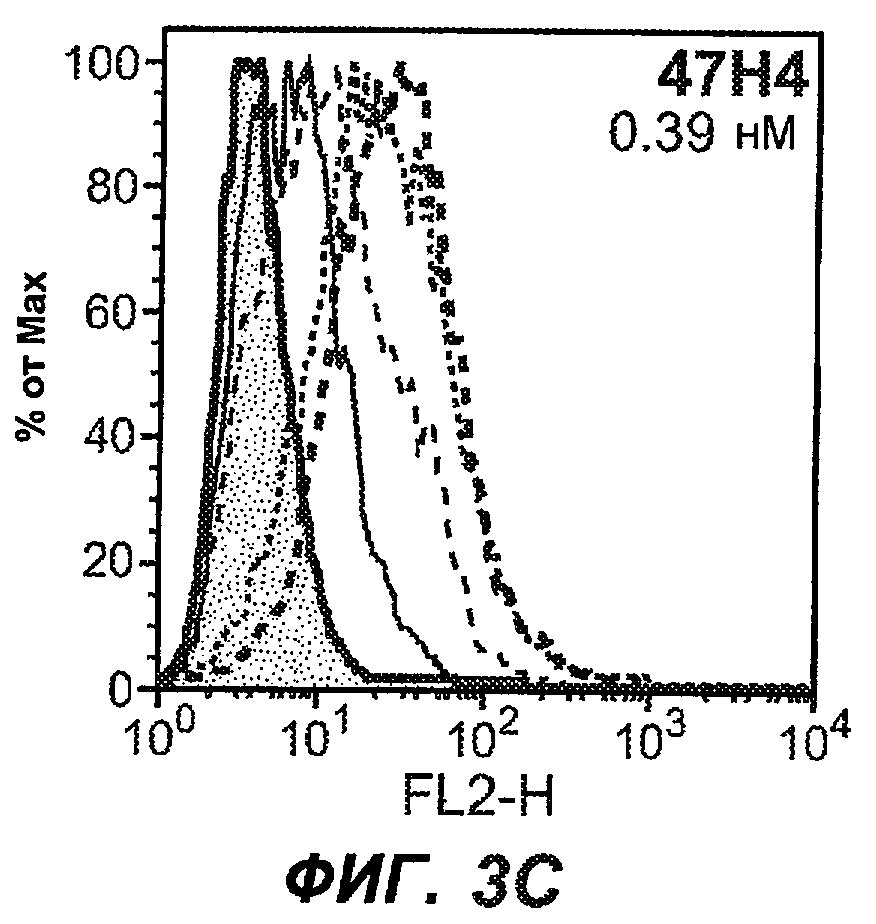
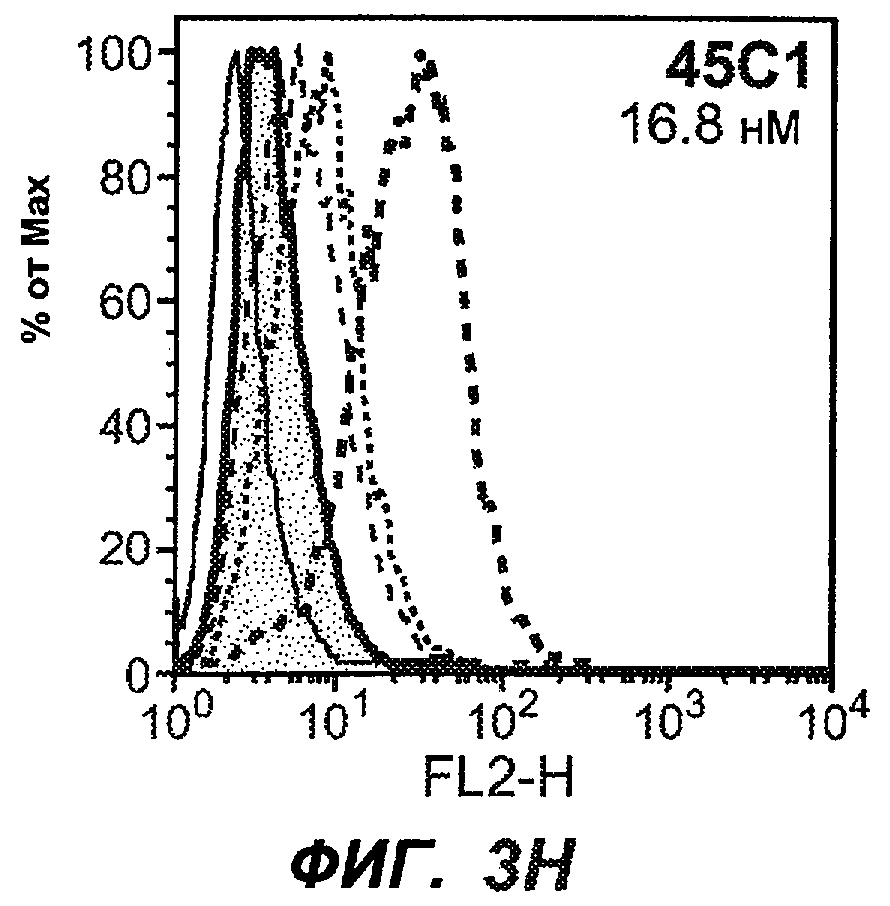
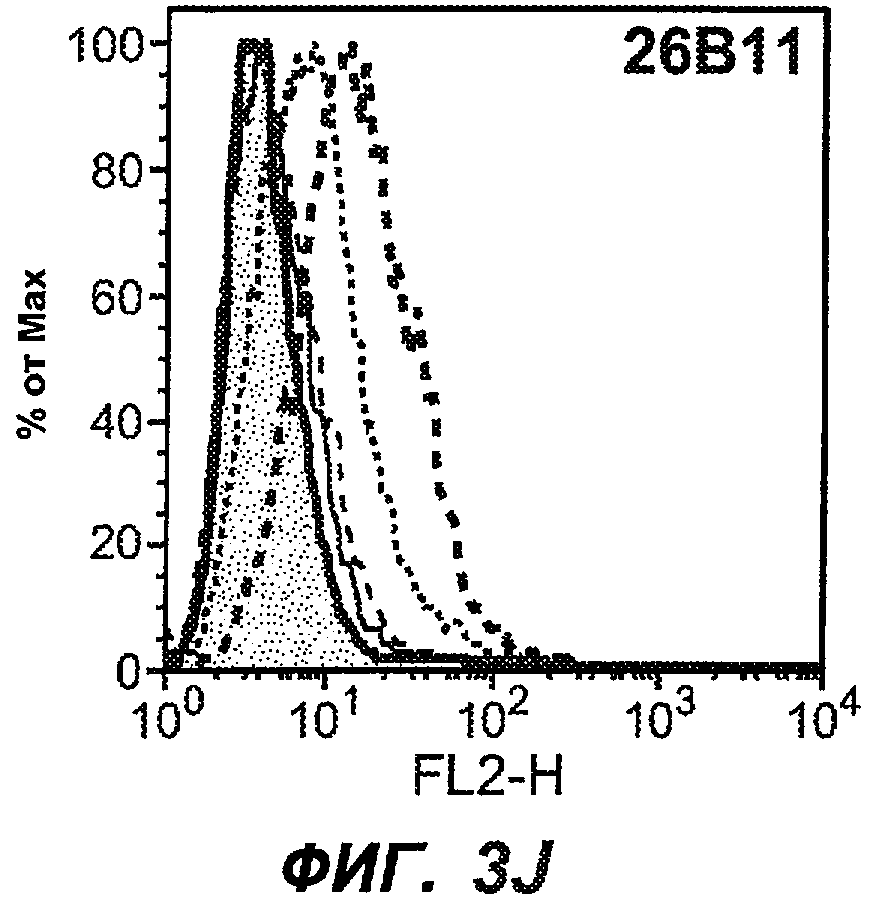
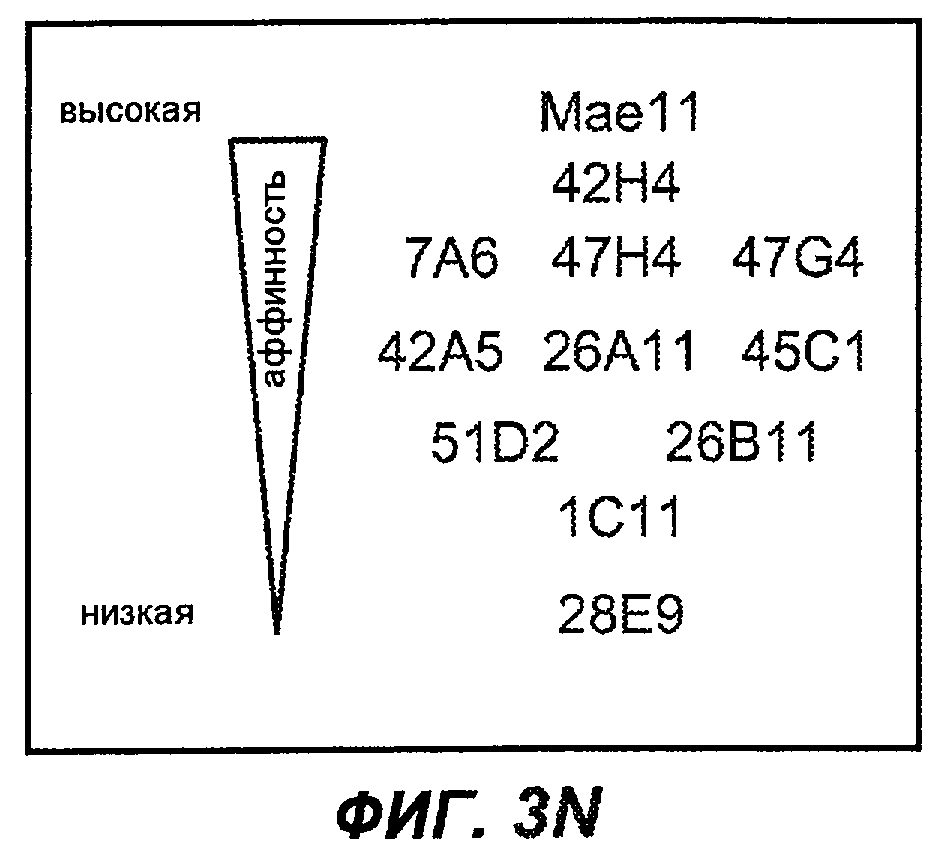
На фиг.3A-L представлены графики FACS, на которых показана относительная аффинность связывания различных антител против M1' с использованием серийных разведений, показанных на фиг.3M. На фиг.3N представлена относительная аффинность для каждого антитела. На фиг.3O обобщенно представлена аффинность антител мыши 47H4, 26A11 и 7A6, при определении анализом Скэтчарда, против М1' человека, макака-резус и яванского макака. Если нет иных указаний, представленные числа представляют собой средние значения. На фиг.3P обобщенно представлена аффинность указанных гуманизированных вариантов антител 47H4 и 26A11, при измерении посредством анализа Скэтчарда, против М1' человека, макака-резус и яванского макака.
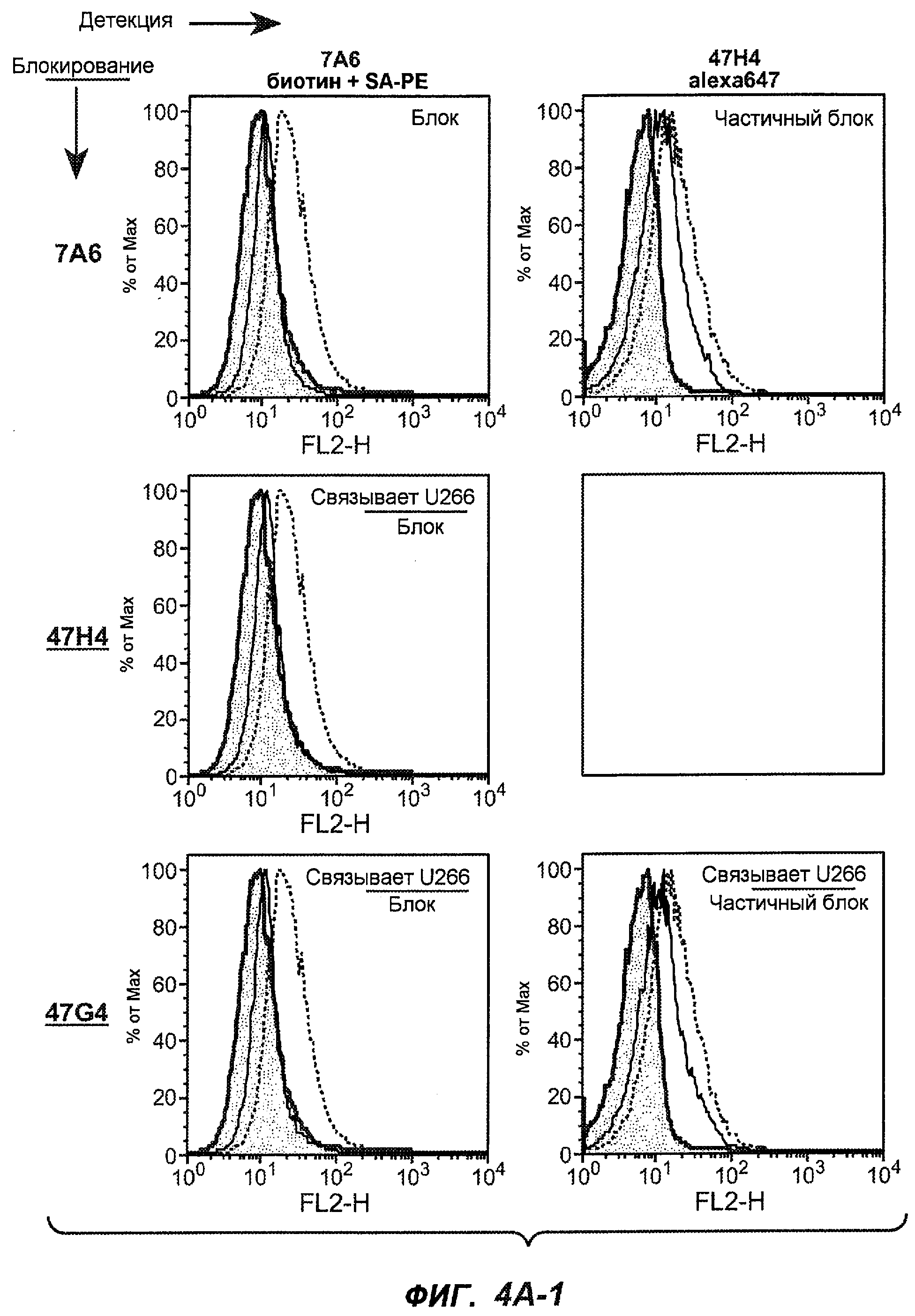
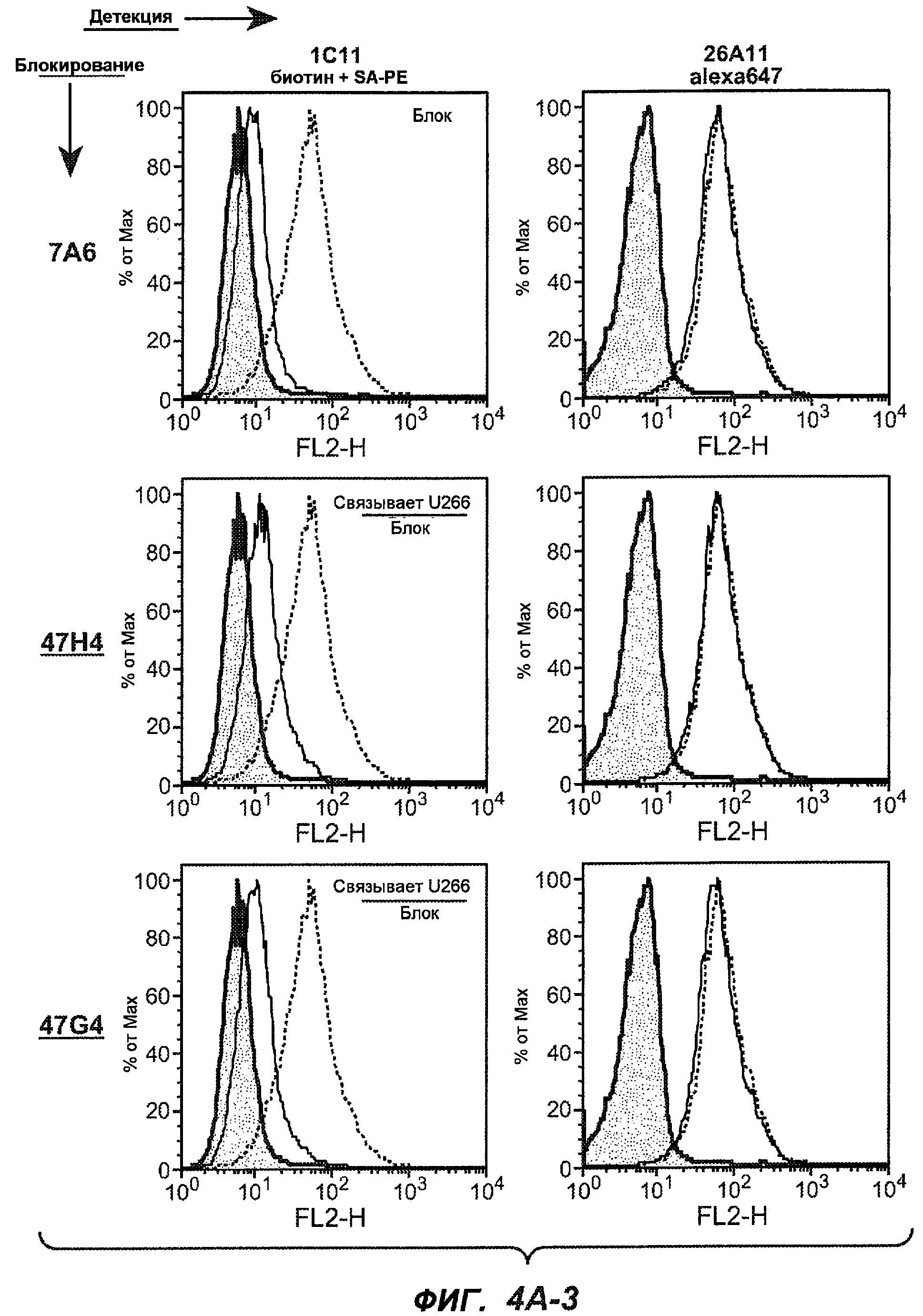
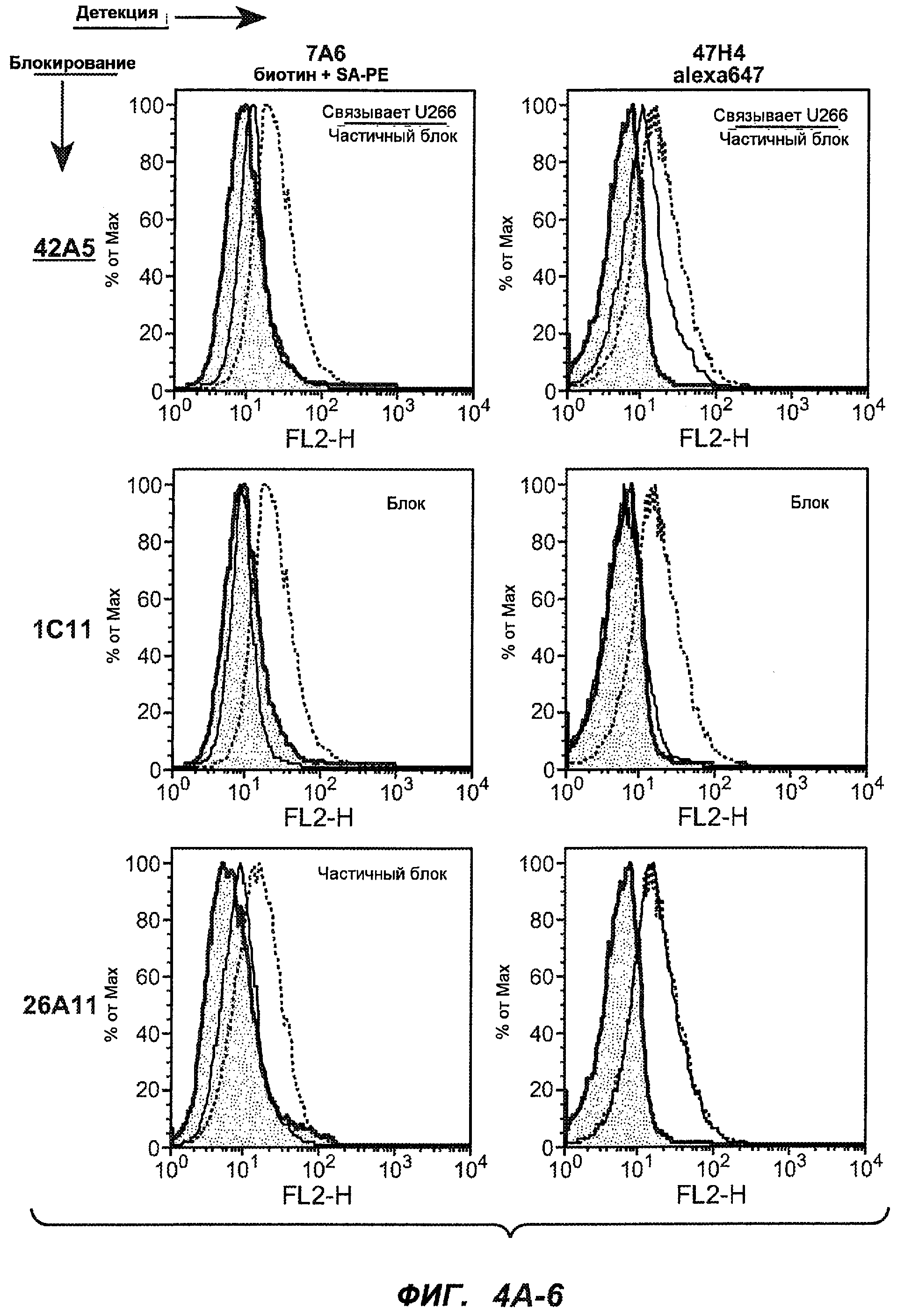
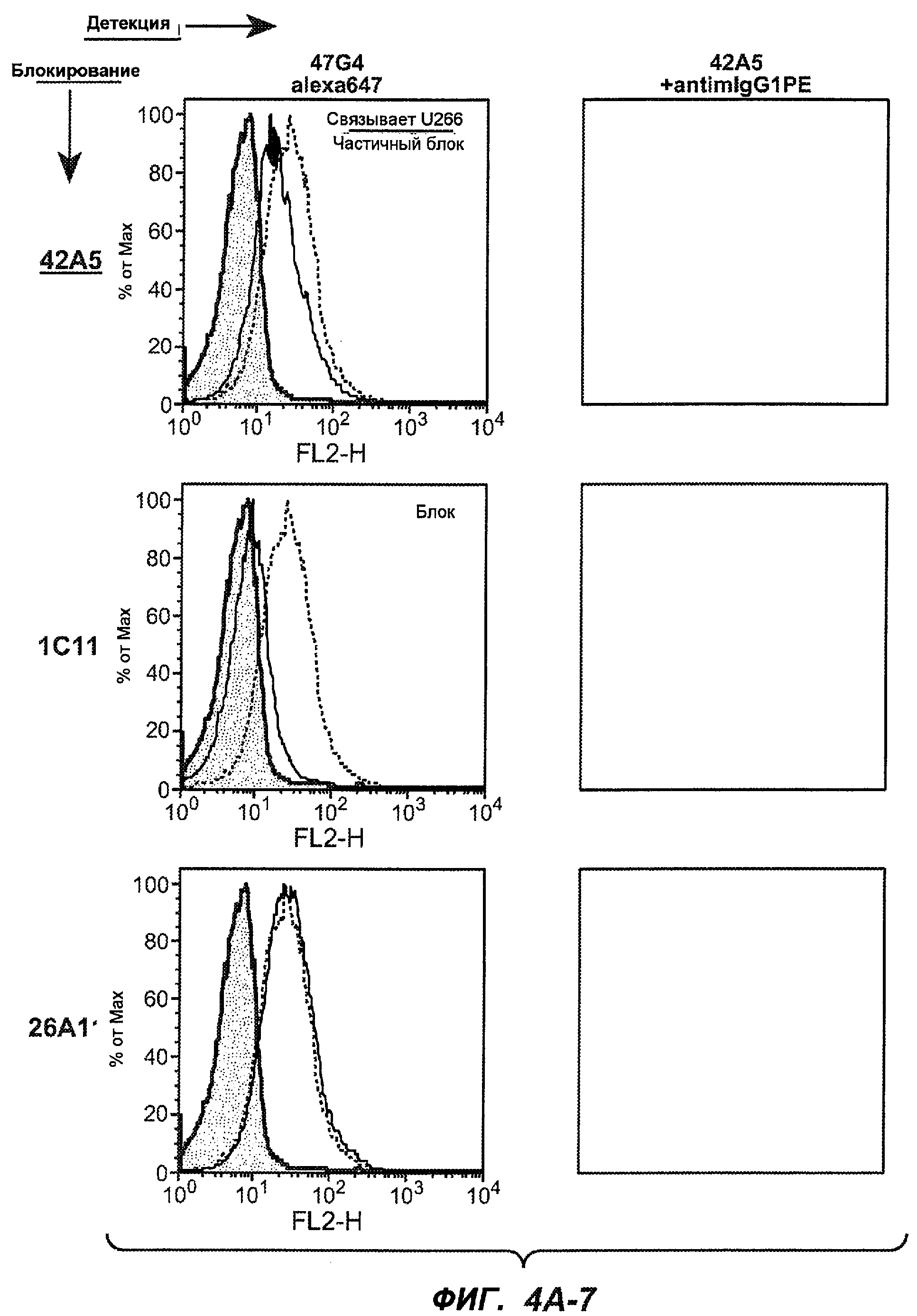
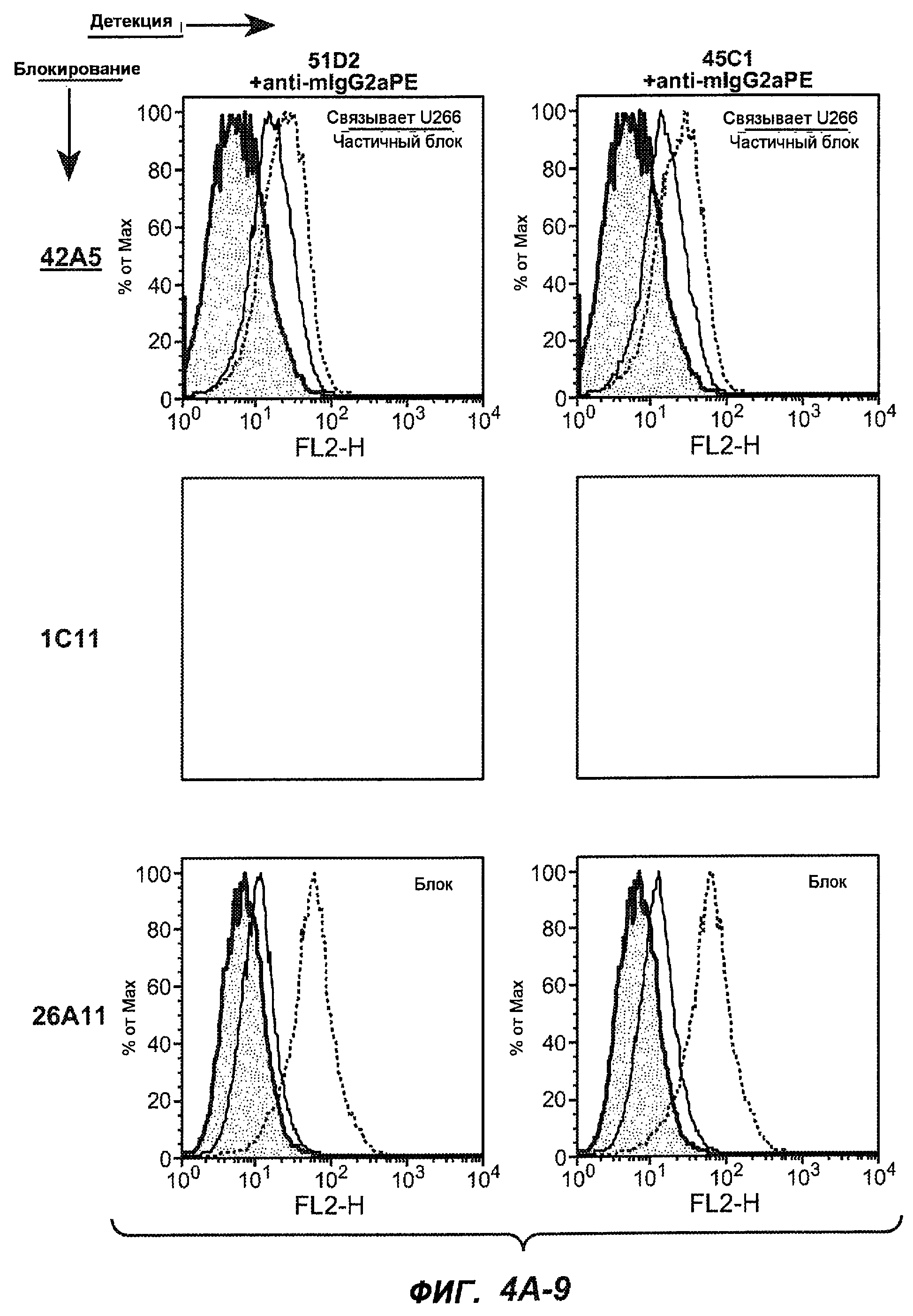
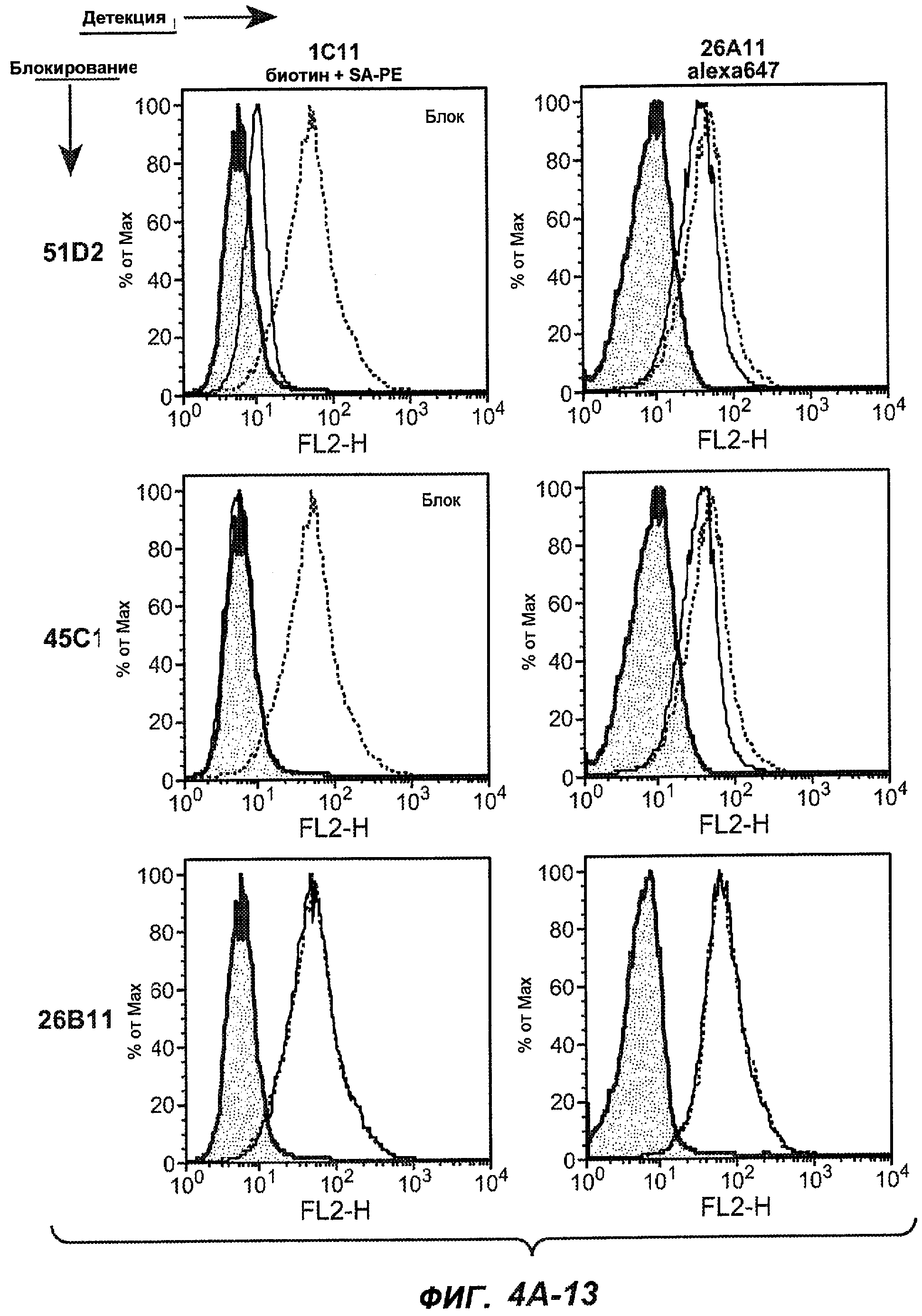
На фиг.4A-D представлено исследование относительного связывания/блокирования антител против M1'. На фиг.4A-1-4A-20 представлены графики FACS, на которых показаны антитела, которые блокировали или частично блокировали связывание. На фиг.4B представлен двумерный график, на котором показана относительная способность блокировать связывание других антител (частично или полностью с использованием молярного отношения 1:1). На фиг.4C представлен двумерный график, который в большей степени сфокусирован на конкретно указанных антителах и в котором исследование блокирования повторяли с молярным отношением 10:1. На фиг.4D представлена схема, на которой представлено распределение по группам в результате исследований связывания/блокирования эпитопа.
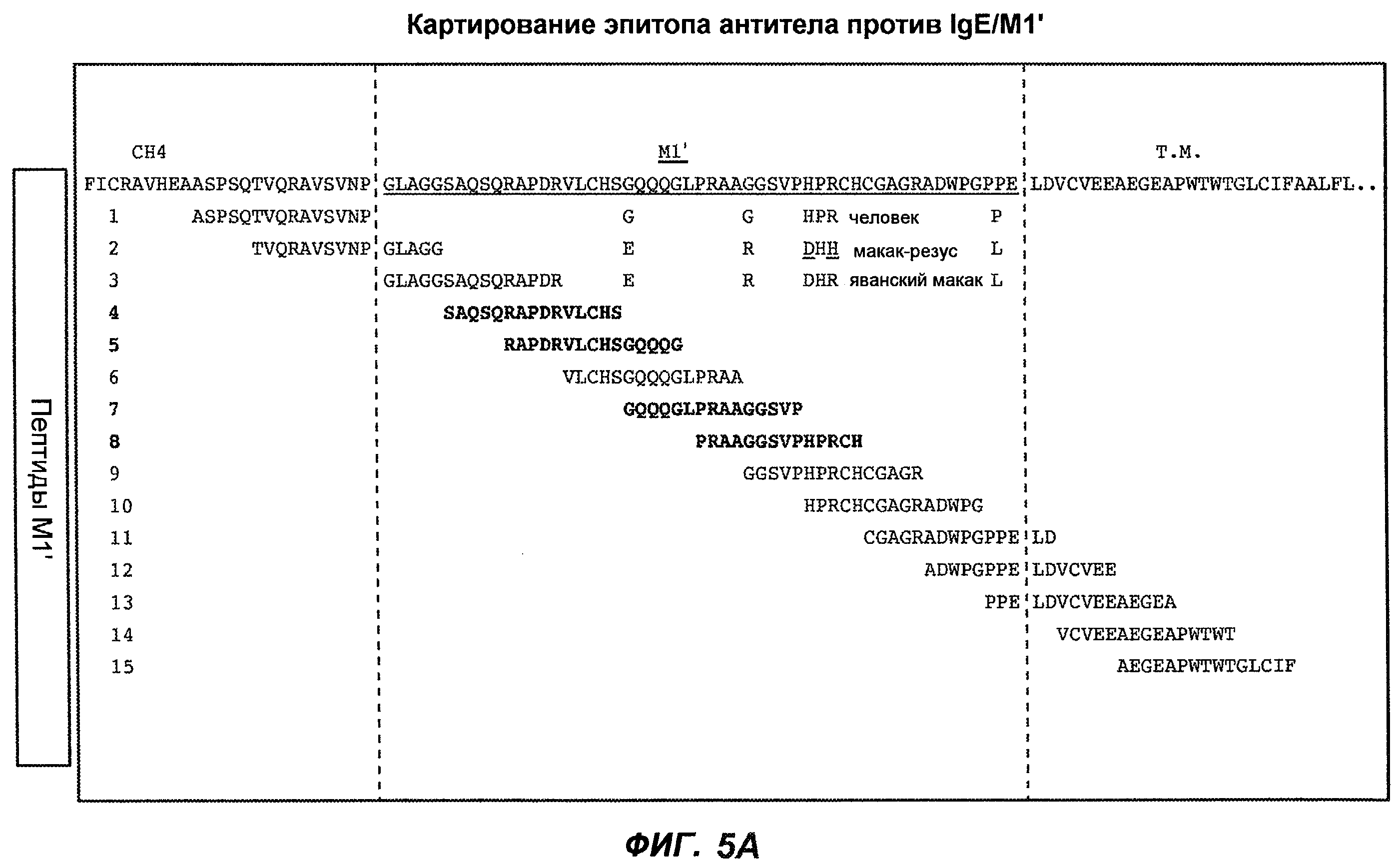
На фиг.5A-C показаны исследования связывания эпитопов, проводимые с использованием 47H4, 7A6 и 26A11. На фиг.5A показан М1'-сегмент, включающий соседние N- и C-концевые остатки (SEQ ID NO:3) и пептиды 1-5 М1' (SEQ ID NO:5-19), соответственно, используемые для определения связывания эпитопа. На фиг.5B и 5D показано, что исходные антитела мыши 47H4 связывают пептид 4, 7A6 связывает пептиды 4 и 5, и 26A11 связывает пептиды 7 и 8. На фиг.5C и 5E показано, что гуманизированные варианты 47H4v5 связывают пептид 4, а 7A67v1 связывает пептиды 4 и 5, и 26A11v6 связывает пептиды 7 и 8, сохраняя, таким образом, специфичность к эпитопу исходных антител мыши.
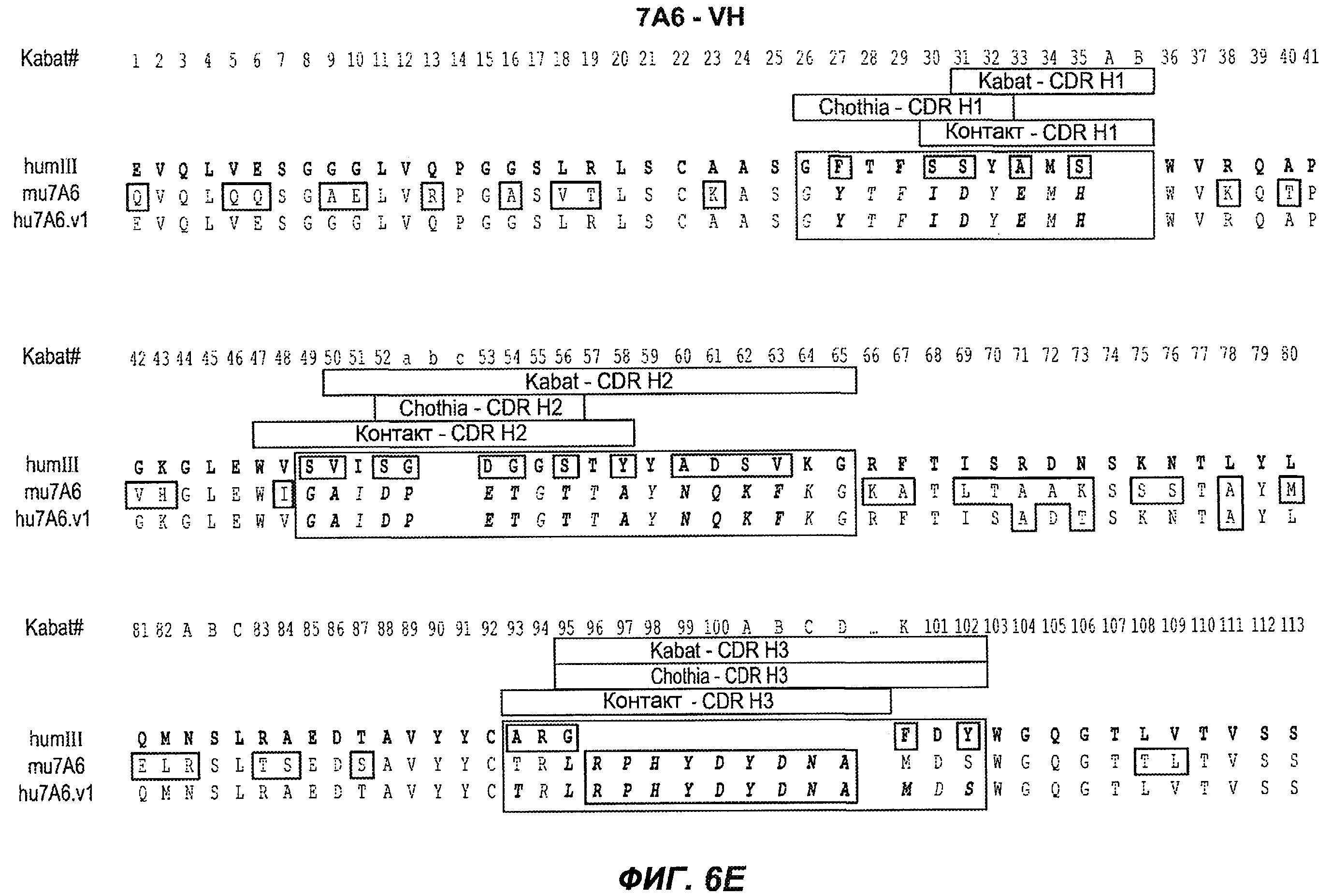
На фиг.6A-F показаны последовательности вариабельных областей легкой и тяжелой цепей антител мыши 26A11, 7A6 и 47H4 и их различных гуманизированных вариантов. Положения пронумерованы согласно Kabat, и гипервариабельные области, которые пересажены в вариабельную консенсусную рамку (каппа I для легкой цепи, подгруппы III для тяжелой цепи), заключены в прямоугольник. На фиг.6A показаны, относительно легкой цепи каппа I человека (SEQ ID NO:20), вариабельная область легкой цепи 26A11 (SEQ ID NO:21) и гуманизированные варианты 1, 4 (SEQ ID NO:22), варианты 2, 5 (SEQ ID NO:23), варианты 3, 6 (SEQ ID NO:24), варианты 13, 15 (SEQ ID NO:25) и варианты 14, 16 (SEQ ID NO:26). На фиг.6B показаны, относительно легкой цепи каппа I человека (SEQ ID NO:20), вариабельная область легкой цепи 7A6 (SEQ ID NO:27) и гуманизированный вариант 1 (SEQ ID NO:28). На фиг.6C показаны, относительно легкой цепи каппа I человека (SEQ ID NO:20), вариабельная область легкой цепи 47H4 (SEQ ID NO:29) и гуманизированные варианты 1, 3 (SEQ ID NO:30) и варианты 2, 4-6 (SEQ ID NO:31). На фиг.6D показаны, относительно тяжелой цепи III человека (SEQ ID NO:32), вариабельная область тяжелой цепи 26A11 (SEQ ID NO:33) и гуманизированные варианты 1-3, 13, 14 (SEQ ID NO:34) и варианты 4-6, 15, 16 (SEQ ID NO:35). На фиг.6E показаны, относительно тяжелой цепи человека (SEQ ID NO:34), вариабельная область тяжелой цепи 7A6 (SEQ ID NO:36) и гуманизированный вариант 1 (SEQ ID NO:37). На фиг.6F показаны, относительно тяжелой цепи III человека (SEQ ID NO:32), вариабельная область тяжелой цепи 47H4 (SEQ ID NO:38) и гуманизированные варианты 1, 2 (SEQ ID NO:39), варианты 3-4 (SEQ ID NO:40), вариант 5 (SEQ ID NO:41) и вариант 6 (SEQ ID NO:42).
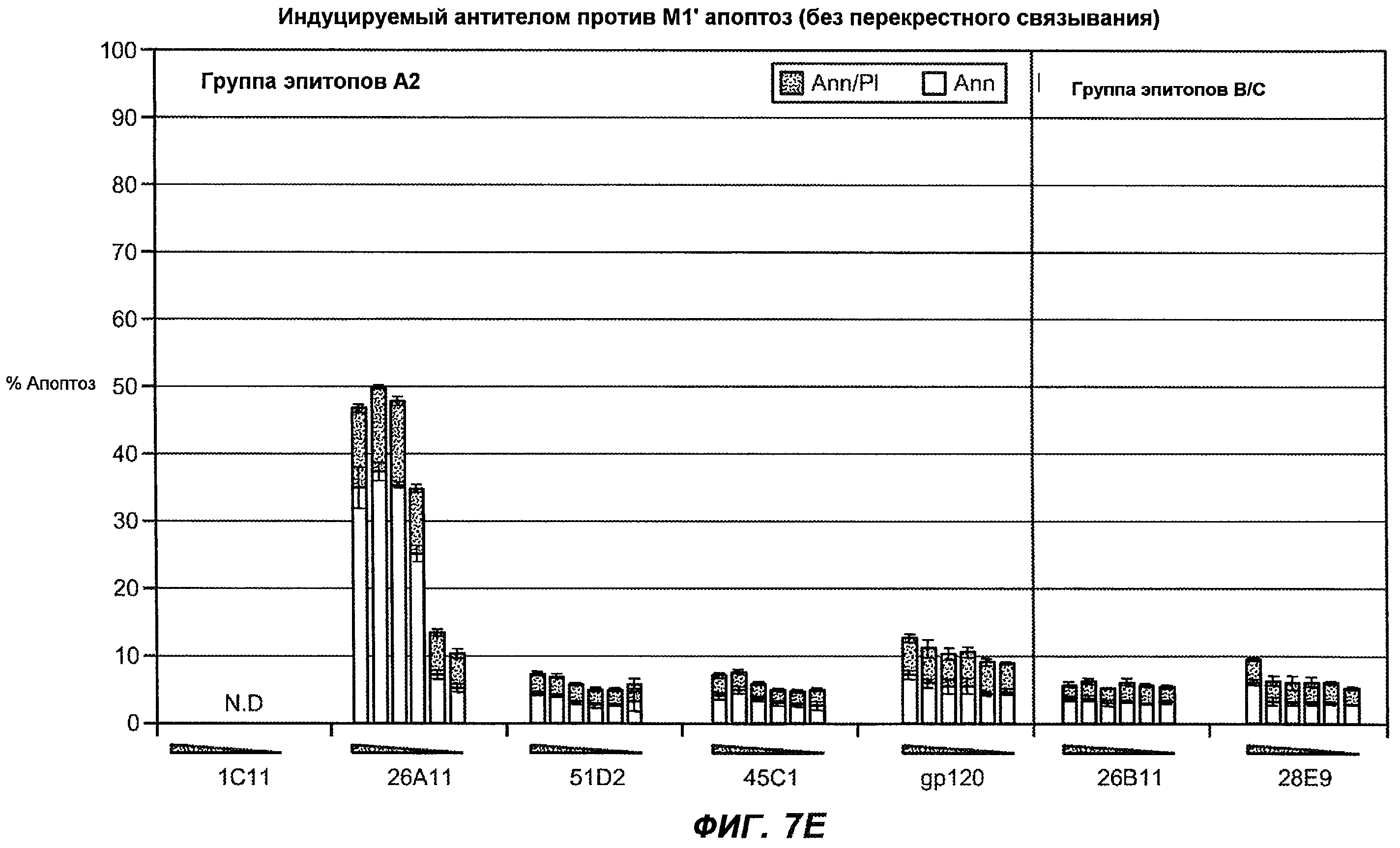
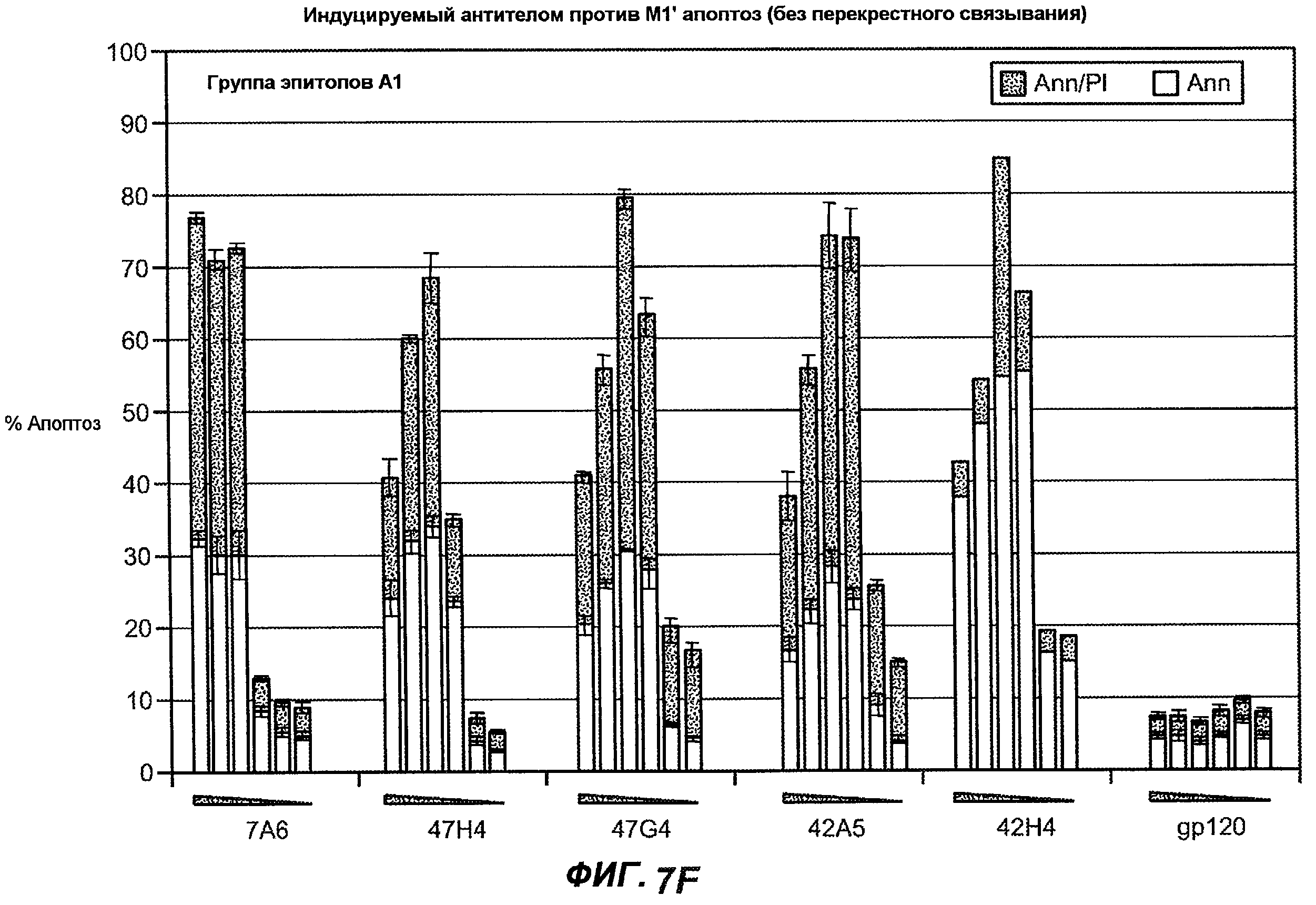
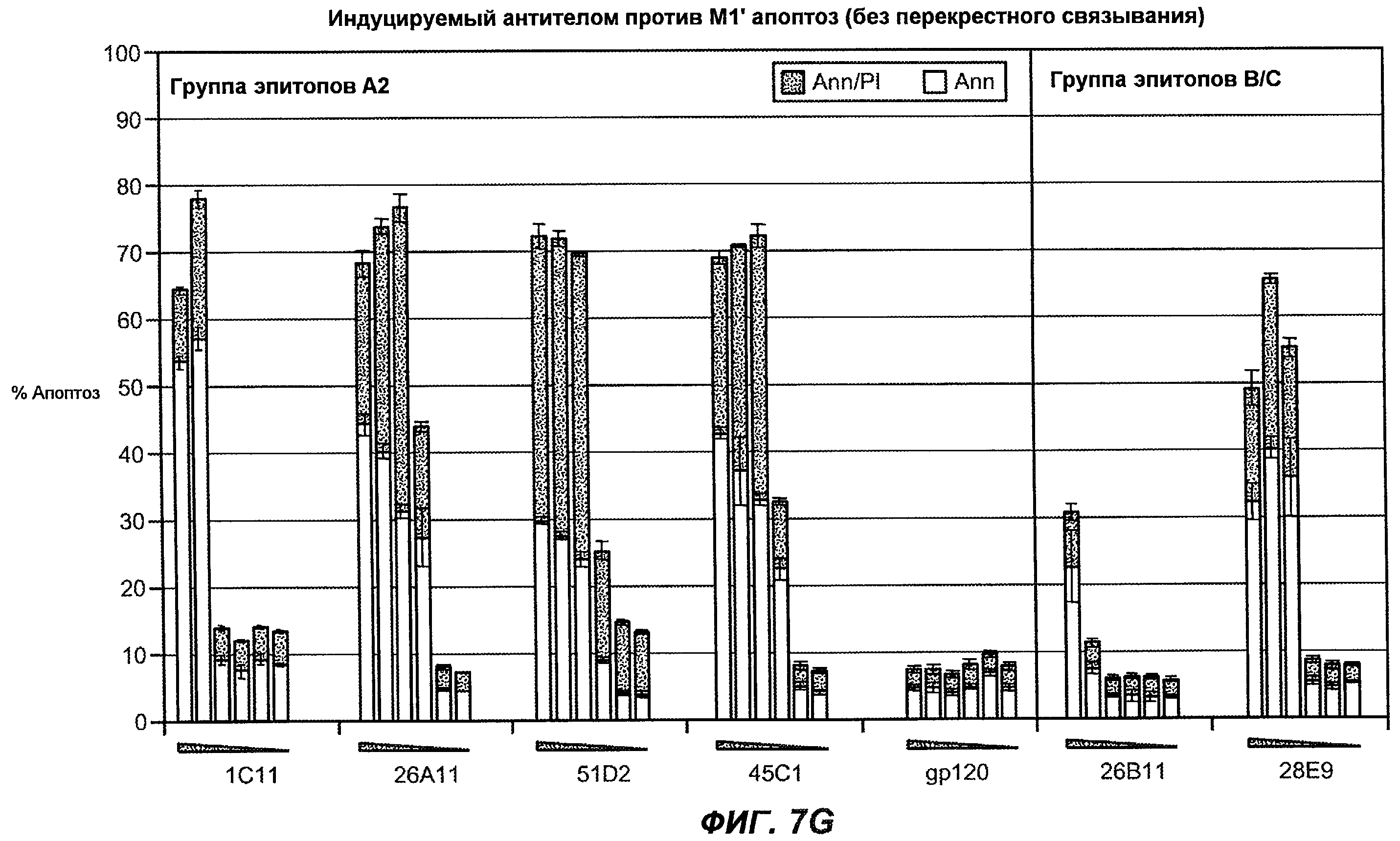
На фиг.7A-G показана апоптотическая активность исходных антител против M1' в трансфицированных IgE-М1' клетках Daudi. На фиг.7A представлен график FACS, на котором, по существу, показано, что IgM экспрессируется на более высоком уровне, чем IgE. На фиг.7B показан эффект перекрестного связывания антител [F(ab')2] против IgM и применения камптотецина в отношении индукции апоптоза, соответственно. Клетки, положительно окрашенные аннексином, но отрицательно PI, являются погибающими, а клетки, положительно окрашенные как аннексином, так и PI, являются погибшими. На фиг.7C представлено графическое изображение общего наблюдаемого апоптоза, на котором светлым столбцом показаны клетки аннексин-(+) и PI-(-), а темным столбцом показаны аннексин-(+) и PI-(+). На фиг.7D-7G представлено графическое изображение индуцируемого антителами против M1' апоптоза при концентрациях 25, 10, 1, 0,1, 0,01 и 0,001 мкг/мл. На фиг.7D представлены результаты применения антител М1' группы эпитопа A1, включающих 7A6, 47H4, 47G4, 42A5, 42H4 (вместе с контролями MAE-11 и GP120), без перекрестного связывания. На фиг.7E представлены результаты применения антител М1' группы эпитопа A2, включающих 1C11, 26A11, 51D2, 45Cl) и группы эпитопов B/C, включающих 26B11 и 28E9, без перекрестного связывания. На фиг.7F показана группа эпитопа A1 с перекрестным связыванием, а на фиг.7G показаны группы эпитопов A2 и B/C с перекрестным связыванием.
На фиг.8A-B показана апоптотическая активность гуманизированных вариантов против M1' в клетках Daudi, трансфицированных IgE-М1', обработанных различными гуманизированными вариантами антитела против M1' в концентрациях 25, 10, 1, 0,1, 0,01 и 0,001 мкг/мл. На фиг.8A показано, что гуманизированные варианты 47H4v5, 26A11v6 и 7A6v1 индуцируют апоптоз в диапазоне 30-40% при концентрации на более высоких уровнях (т.е. 10-25 мкг/мл вариантов 47H4 и 26A11, 1, 10 и 25 мкг варианта 7A6). На фиг.8B показана апоптотическая активность того же антитела в отношении трансфицированных IgE-М1' клеток Daudi, которые обработаны в присутствии перекрестно связывающегося антитела козы против F(ab')2 IgG человека. Все антитела индуцировали максимальные уровни апоптоза 70-90%, с некоторым снижением апоптотической активности при высоких концентрациях (например, 47H4-v1, -v2, 26A11-v1, -v14). На фиг.8C показано, что 47H4v5 дикого типа и афукозилированное 47H4v5 были способны индуцировать апоптоз на сходных уровнях.
На фиг.9A-B1-2 показана способность антител мыши против M1' индуцировать поток кальция в клетки Daudi-IgE/М1'. Фиг.9A является контролем, демонстрирующим эффект антитела против IgM и MAE11, а на фиг.9B1-B2 показан эффект применения указанных антител мыши против M1'.
На фиг.10 показана способность гуманизированного антитела47H4v5 против IgE/М1' дикого типа (wt) и афукозилированного варианта индуцировать ADCC. В то время как варианты wt и афукозилированные варианты индуцируют сходную максимальную цитотоксичность, афукозилированный вариант ("AF") был более эффективным, чем форма дикого типа (EC50 AF ~0,83 нМ, EC50 wt ~6,6 нМ).
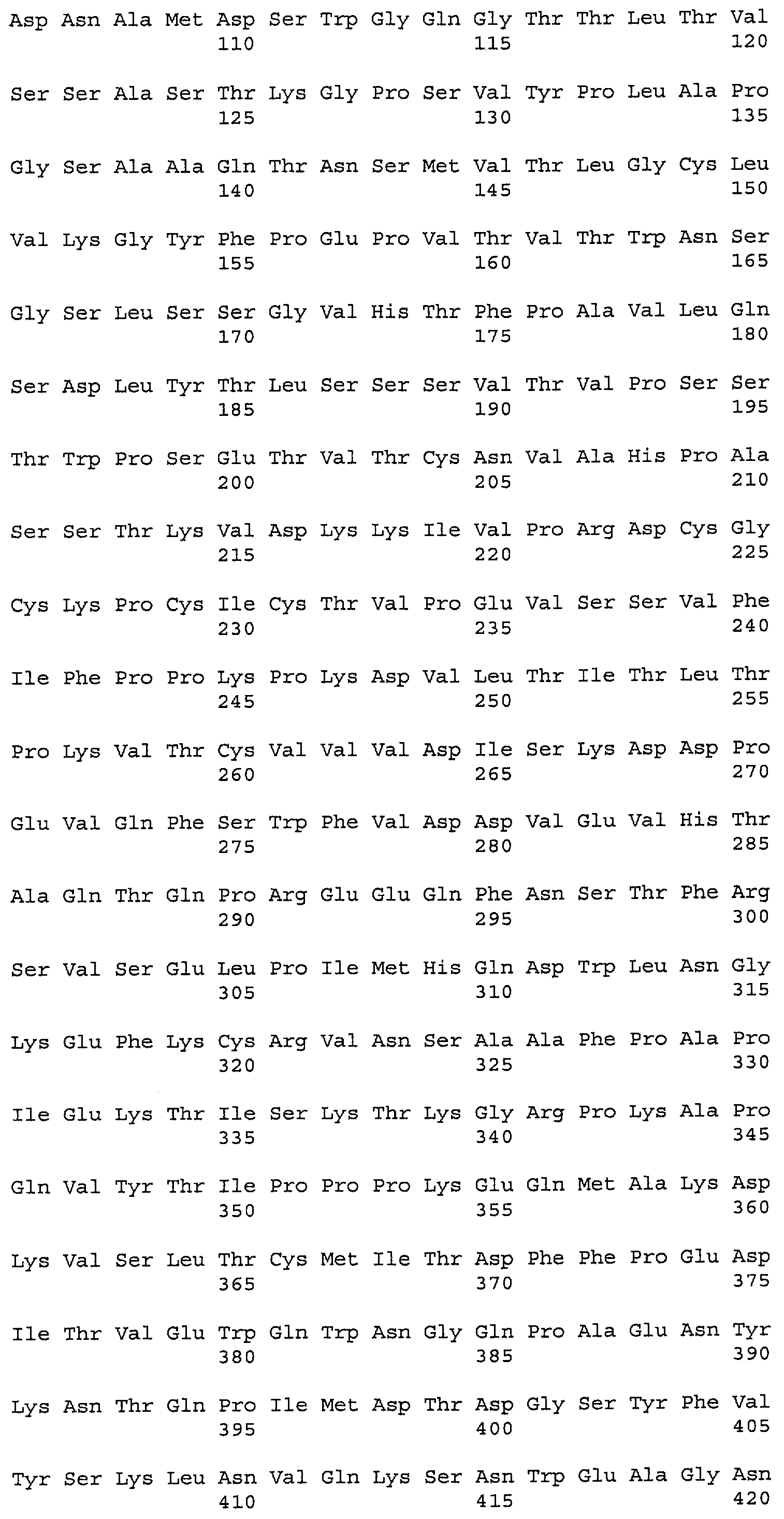
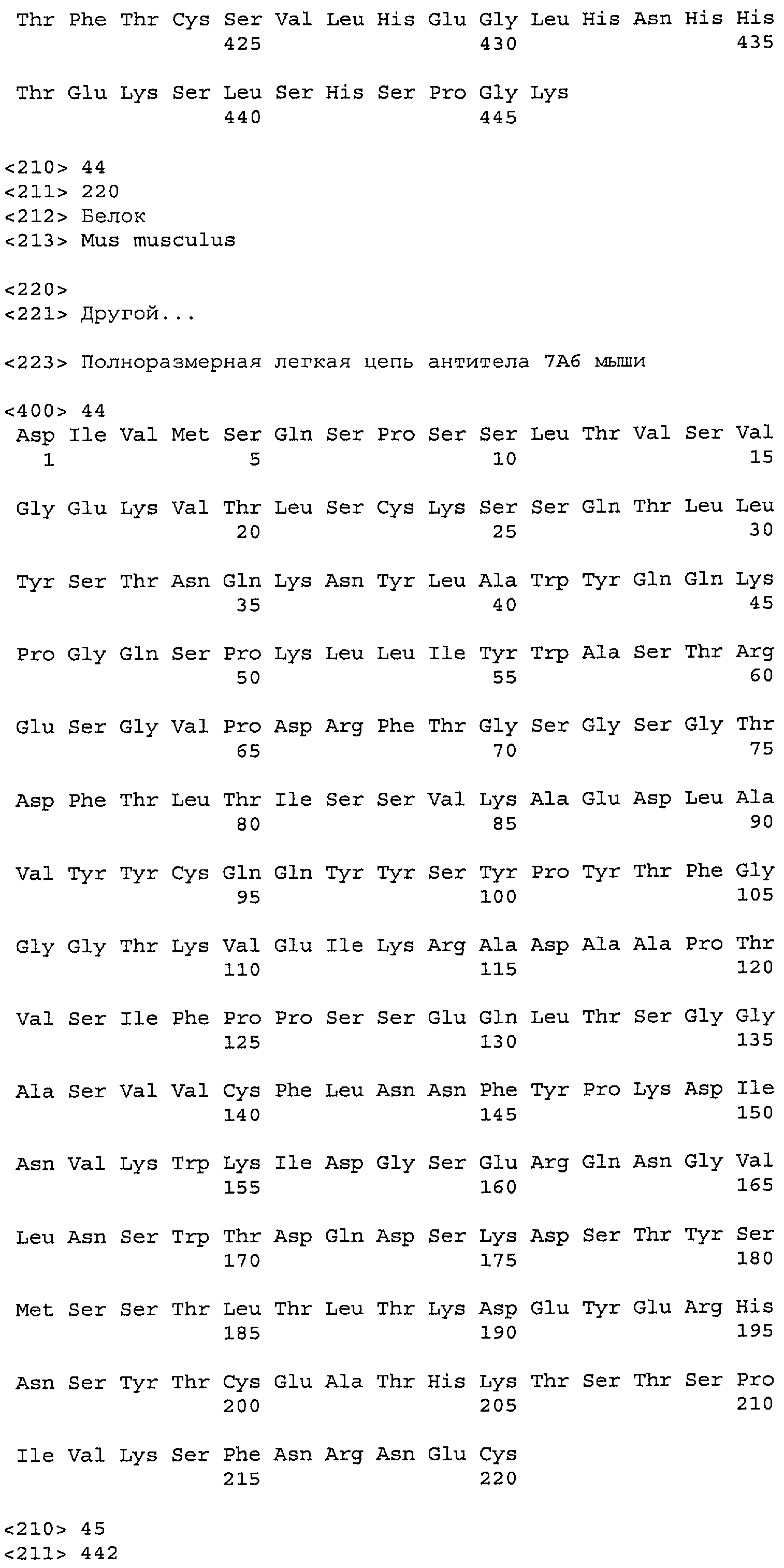
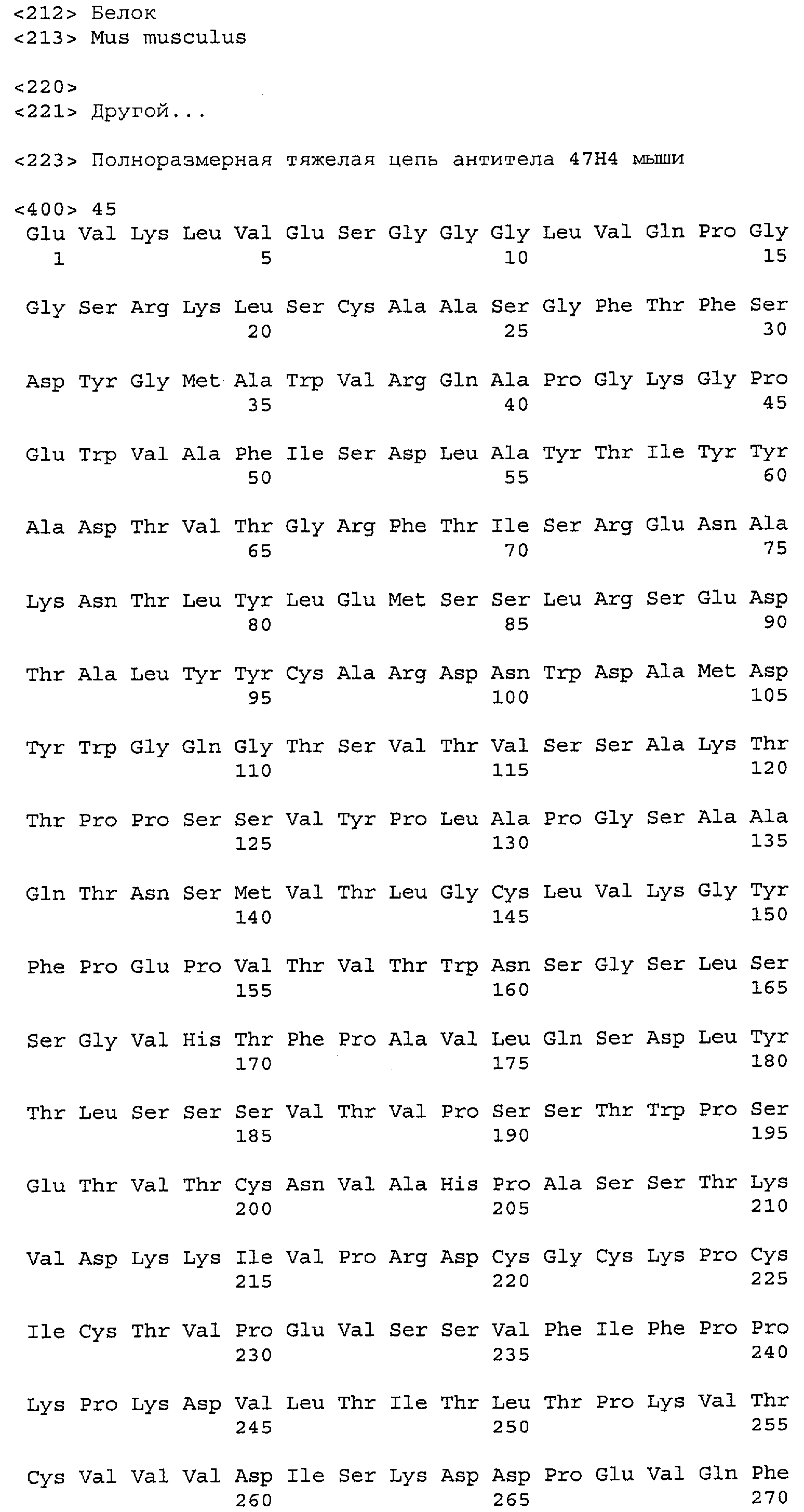
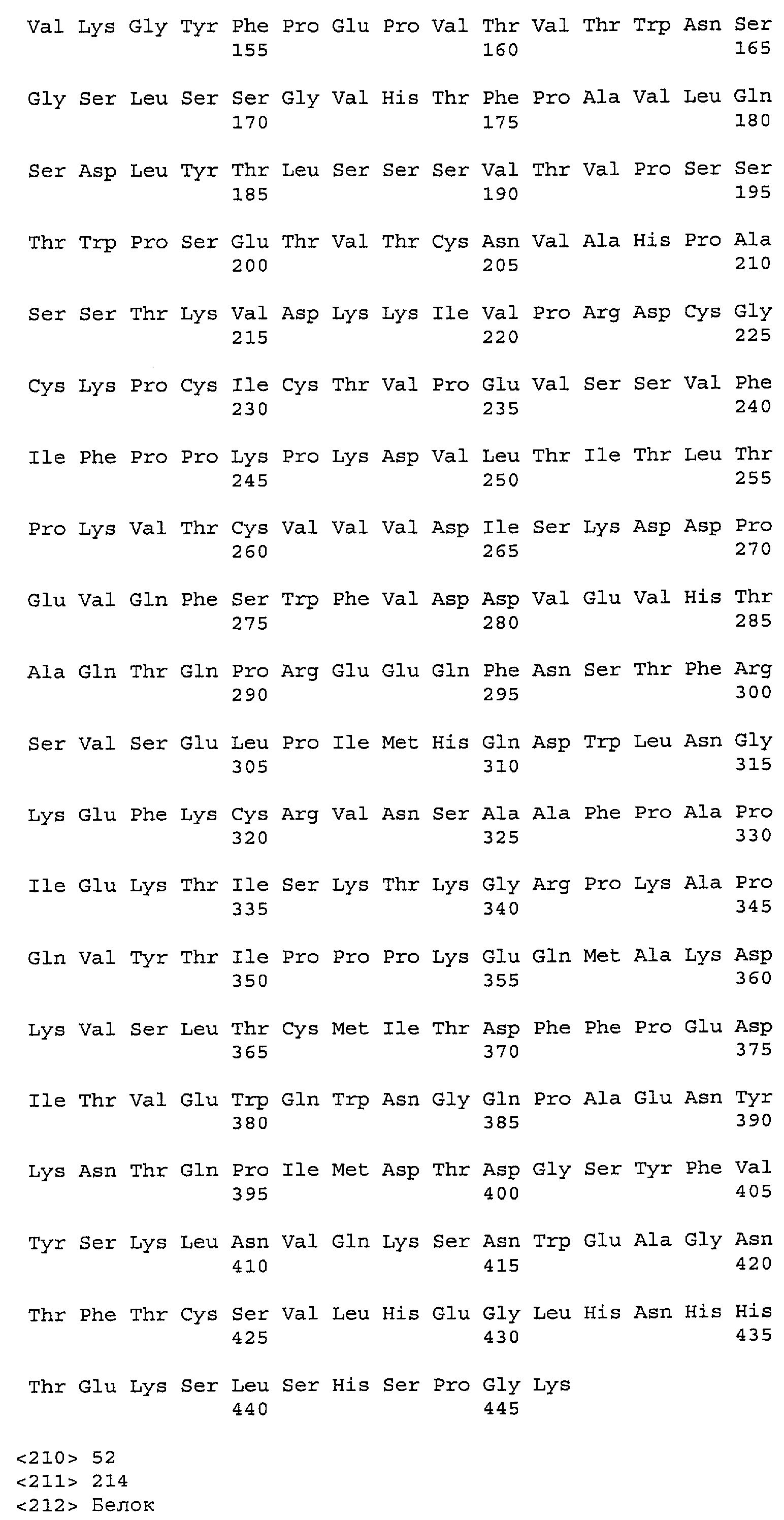
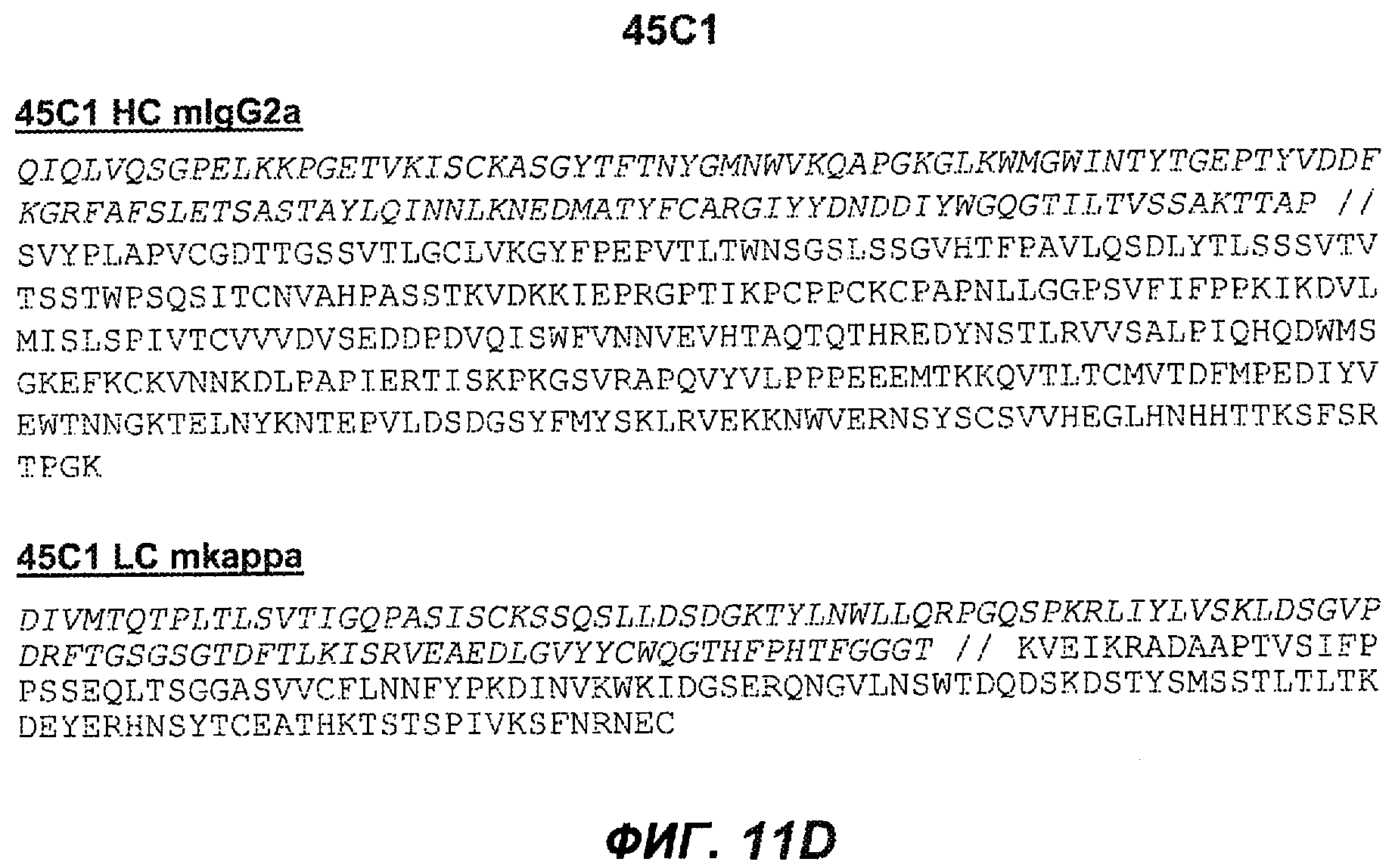
На фиг.11A-F представлены полноразмерные последовательности тяжелых и легких цепей антител мыши против IgE/М1'. Вариабельные области показаны курсивом, а HVR (гипервариабельные области) подчеркнуты. На фиг.11A показаны тяжелая и легкая цепи антитела 7A6 мыши (SEQ ID NO:43 и 44) соответственно. На фиг.11B показаны тяжелая и легкая цепи антитела 47H4 мыши (SEQ ID NO:45 и 46) соответственно. На фиг.11C показаны тяжелая и легкая цепи антитела 26A11 мыши (SEQ ID NO:47 и 48), соответственно. На фиг.11D показаны тяжелая и легкая цепи антитела 45C1 мыши (SEQ ID NO:49 и 50) соответственно. На фиг.11E показаны тяжелая и легкая цепи антитела 28E9 мыши (SEQ ID NO:51 и 52) соответственно. На фиг.11F показаны тяжелая и легкая цепи антитела 1C11 мыши (SEQ ID NOS: 53 и 54) соответственно.
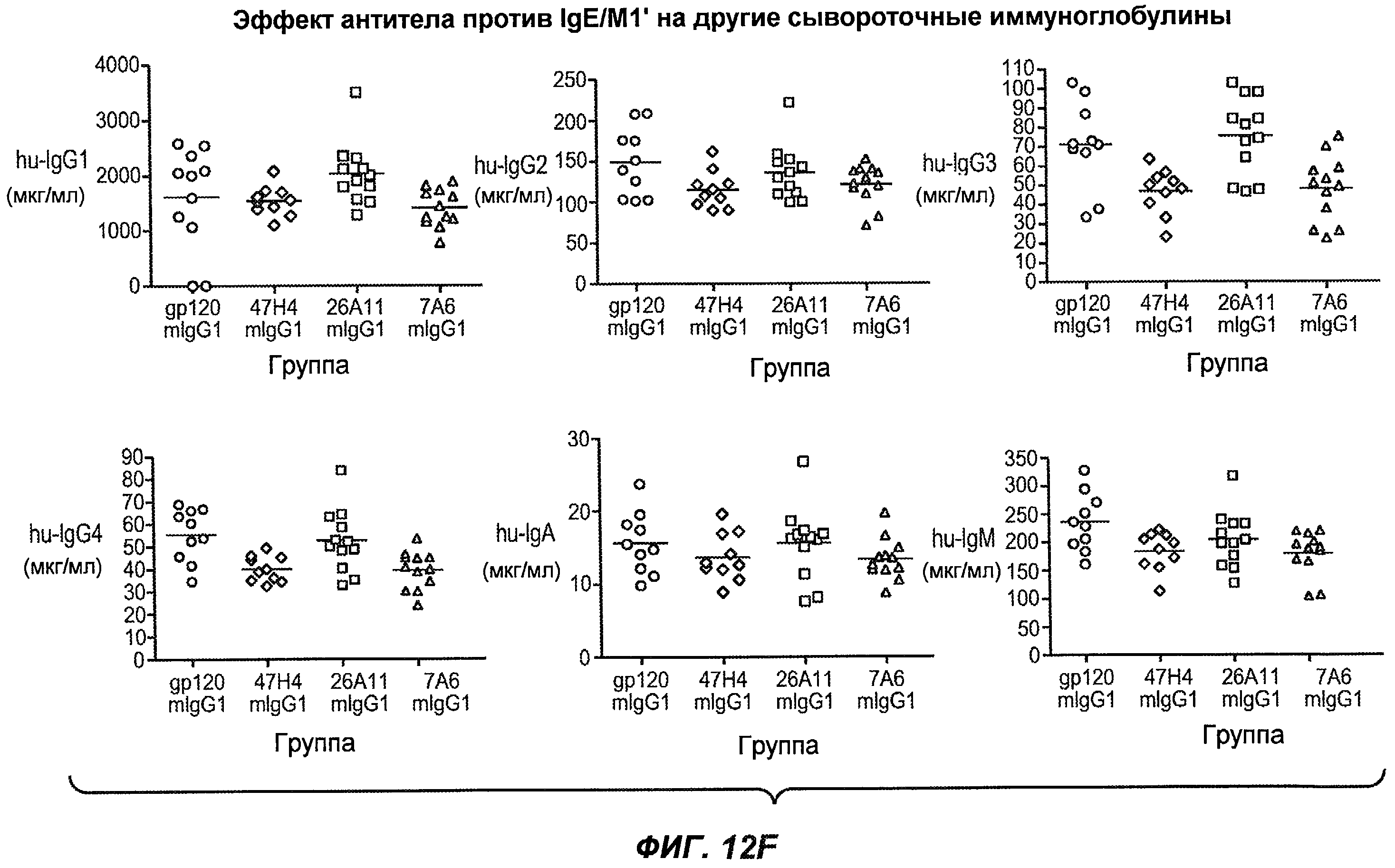
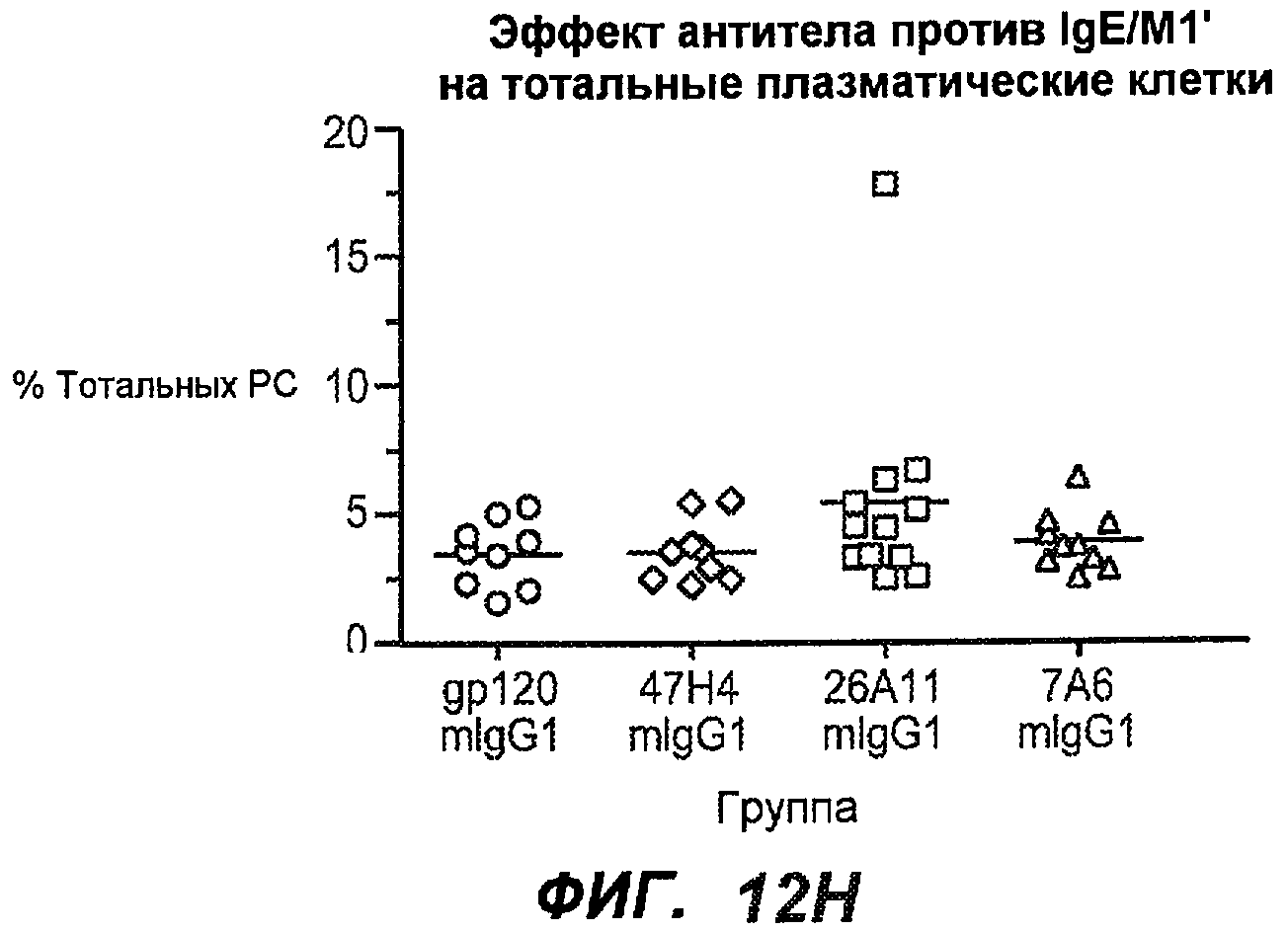
На фиг.12A-I показана способность антител мыши против IgE/М1' ингибировать продукцию сывороточного IgE и продуцирующих IgE плазматических клеток в модели атопии hu-SCID. На фиг.12A представлено графическое изображение схемы эксперимента. На фиг.12B-C показано, что введение антител мыши против IgE/М1' снижало уровни IgE на 65-84%. На фиг.12D-E показано, что снижение продуцирующих IgE клеток in vivo составило 19-69%. На фиг.12F-G показано, что уровни других иммуноглобулинов (например, IgG1-4, IgA, IgM) были относительно неизмененными. На фиг.12H-I показано, что не наблюдалось снижения общего количества плазматических клеток в селезенке.
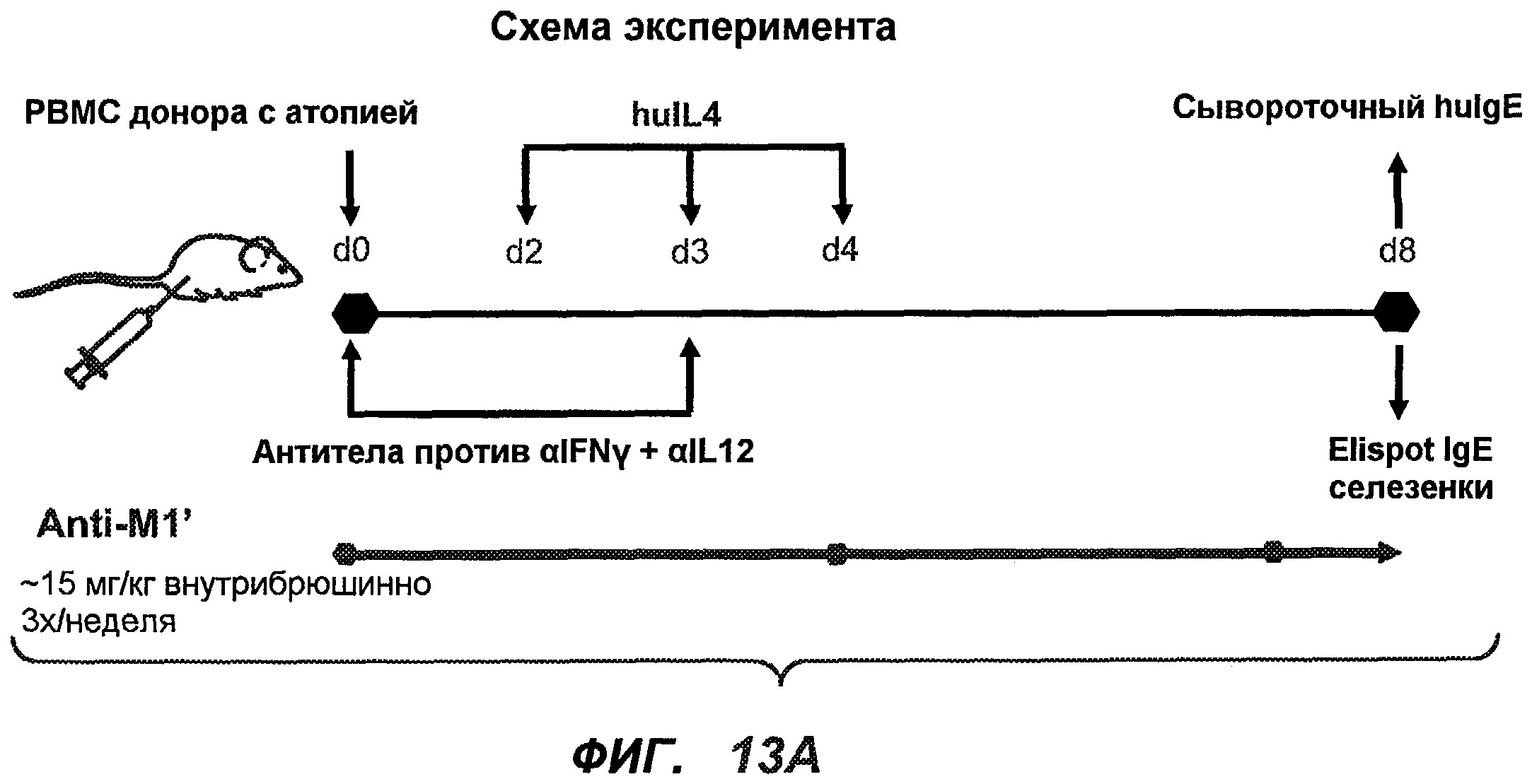
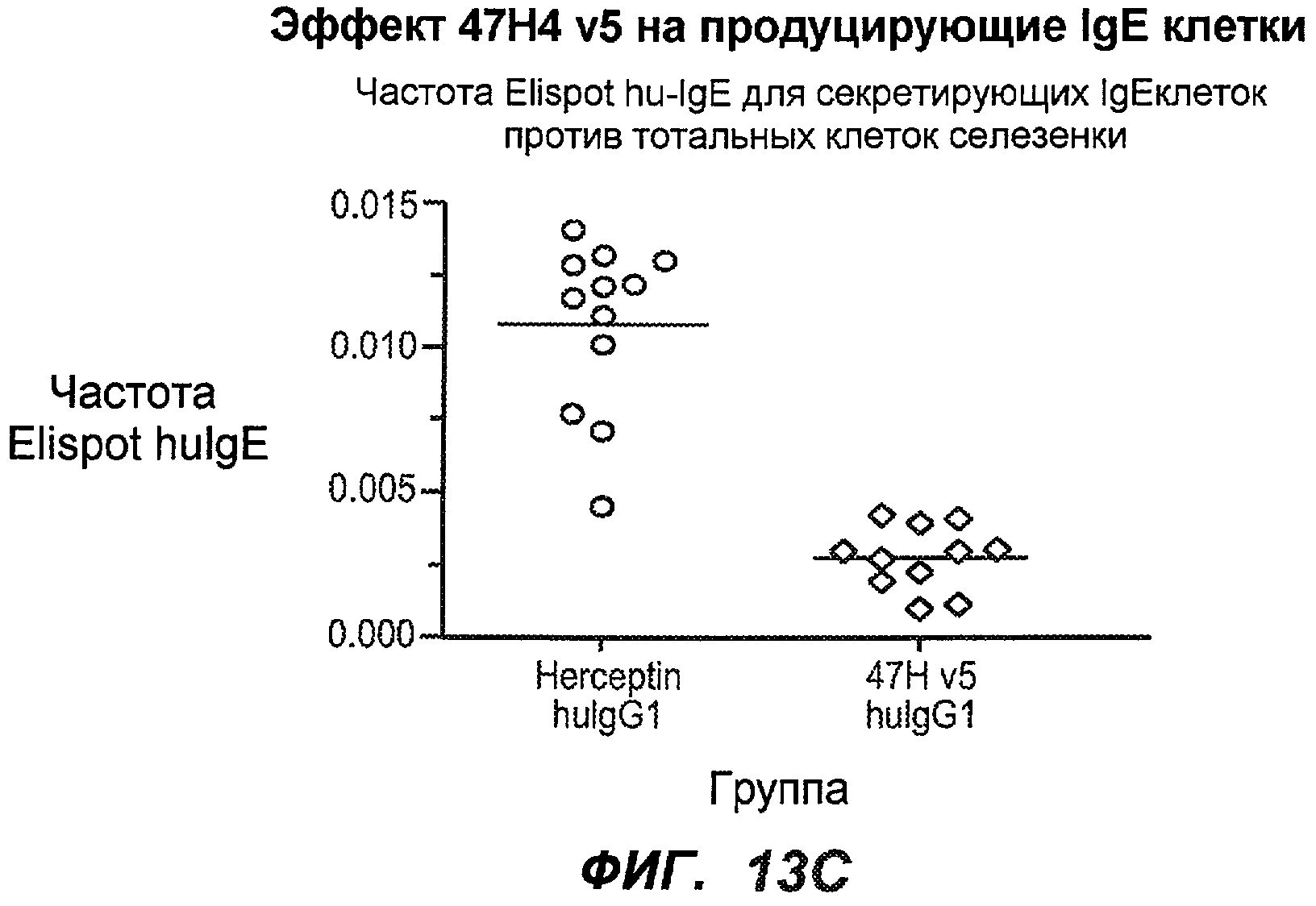
На фиг.13A-H показан эффект гуманизированного варианта 47H4v5 на уровни иммуноглобулинов в модели атопии hu-SCID. На фиг.13A представлено графическое изображение схемы эксперимента. На фиг.13B-D показано, что сывороточный IgE был снижен на 79% и что продуцирующие IgE плазматические клетки были снижены на 75%. На фиг.13E-F показано отсутствие снижения уровней других сывороточных иммуноглобулинов. На фиг.13G-H показано отсутствие снижения уровней тотальных плазматических клеток, таким образом, демонстрируя, что 47H4 специфично снижает продуцирующие IgE плазматические клетки, которые являются очень небольшой долей тотальных плазматических клеток.
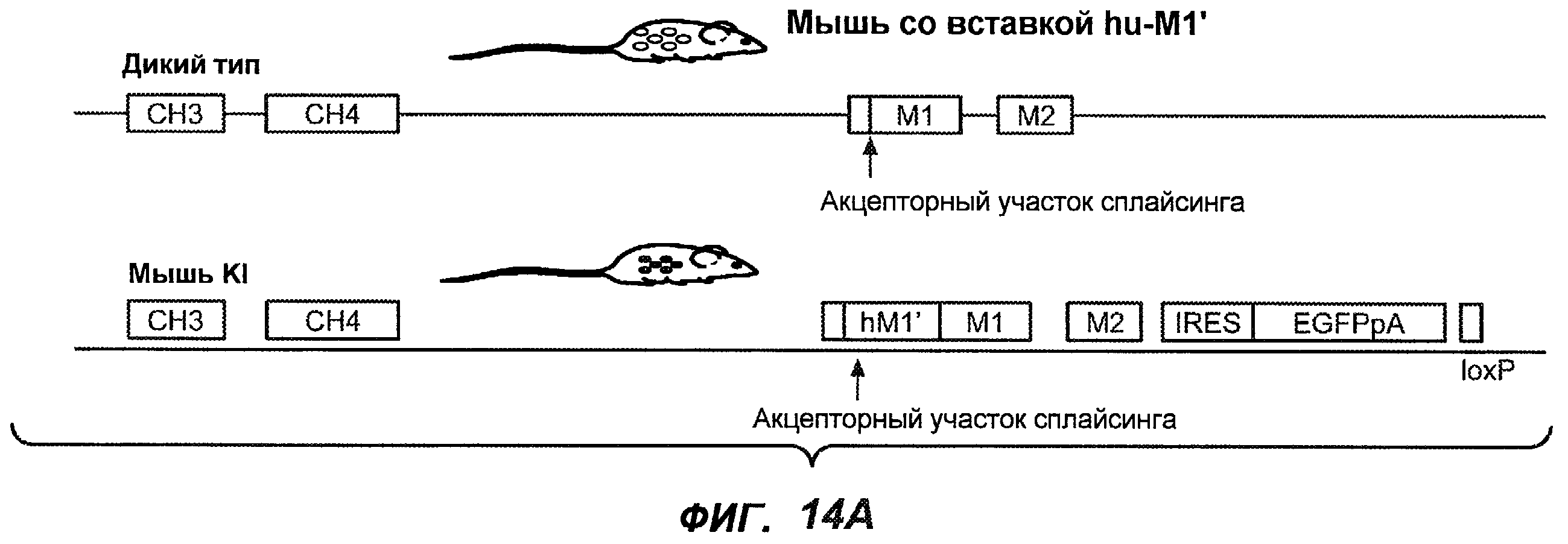
На фиг.14A-D проиллюстрировано получение мышей с включением гена huM1'. На фиг.14A представлено расположение экзона М1' на локусе IgE мыши. На фиг.14B представлена схема рекомбинации в локусе IgE мыши, приводящей к созданию заданного аллеля. На фиг.14C показано генотипирование посредством ПЦР с полосой размером 668 п.н. у мышей wt и с полосой 457 п.н. у мышей с включением М1'. На фиг.14D показан Саузерн-блот, в котором фрагмент HindIII размером 7,4 т.п.н. у мышей wt превращается во фрагмент размером 3 т.п.н. у мышей с включением hu-М1', а фрагмент BamHI размером 14,1 т.п.н. превращается во фрагмент размером 18,1 т.п.н. во включенном аллеле hu-М1'. Показаны мыши как дикого типа, так и гетерозиготные мыши.
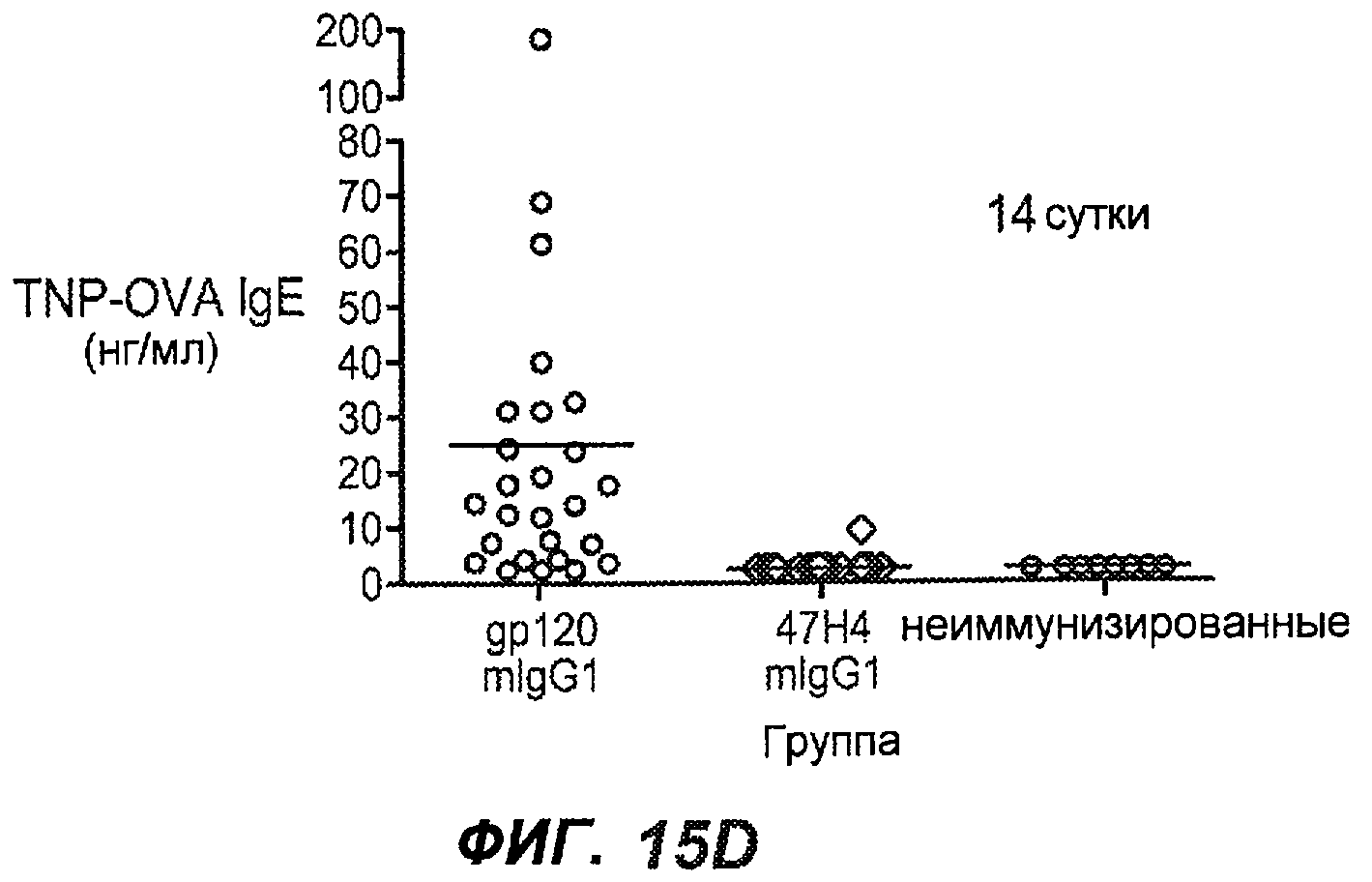
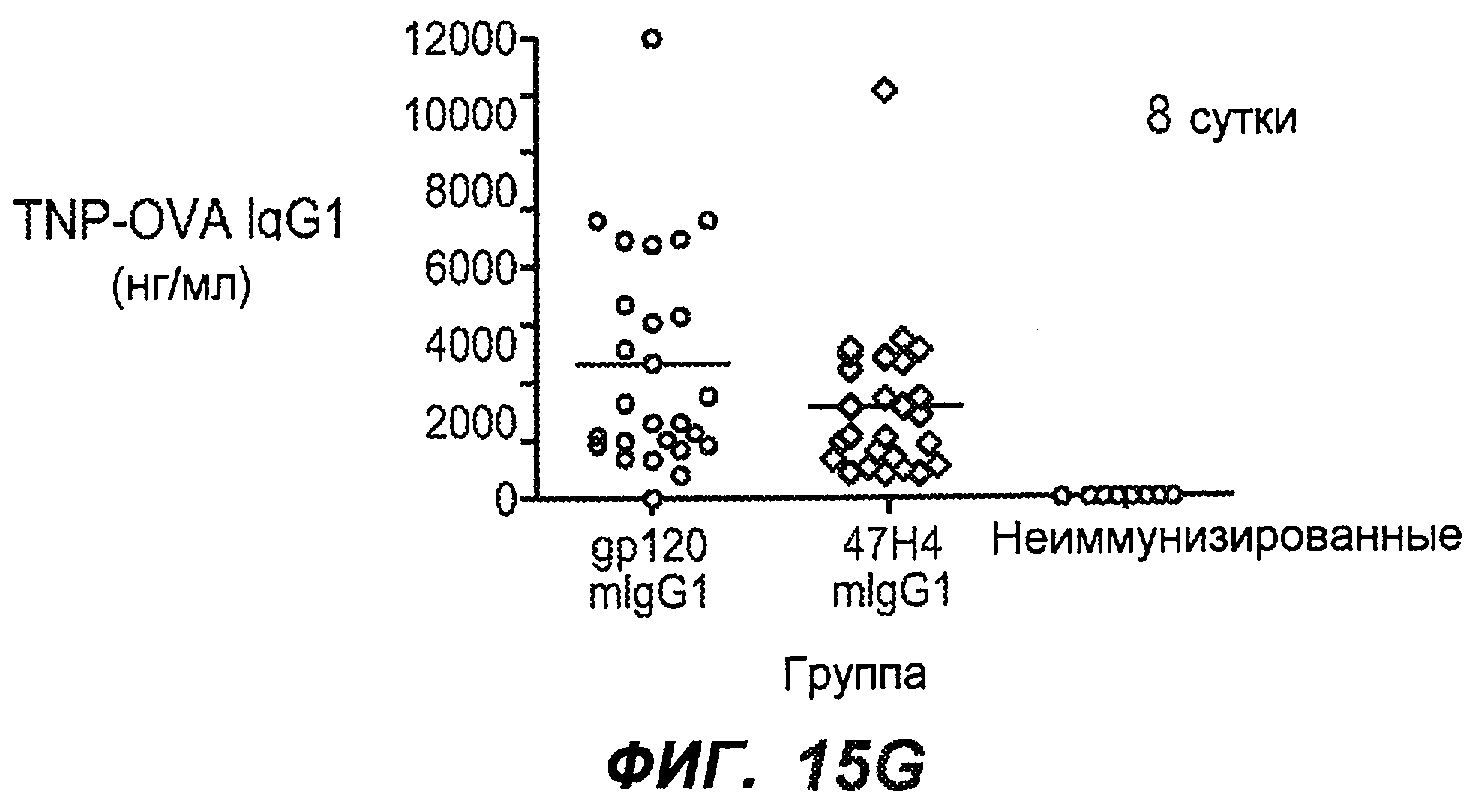
На фиг.15A-I показана способность антител против IgE/М1' предотвращать образование IgE при первичном иммунном ответе. На фиг.15A представлена схема, на которой показан временной график схемы эксперимента, включая введение TNP/OVA и антител против IgE/М1'. На фиг.15B представлен график уровней антигенспецифичного IgE с течением времени и показано, что хотя уровни антигенспецифичного IgE у контрольных животных (т.е. gpl20) достигали максимальных уровней от 8 до 14 суток, антитело против IgE/М1' предотвращало какое-либо повышение, и определенные уровни антигенспецифичного IgE не отличались значимо от неиммунизированных мышей. На фиг.15C-D показано, что введение антитела против IgE/М1' предотвращало повышение уровней антигенспецифичного сывороточного IgE на 8 и 14 сутки, соответственно, и они статистически не отличались от уровней у неиммунизированных мышей (фиг.15E). На фиг.15F-I показано, что на уровни антигенспецифичного IgG1 не оказывало значимого воздействия антитело против IgE/М1' на протяжении 28 суток эксперимента (за исключением умеренного различия на 14 сутки).
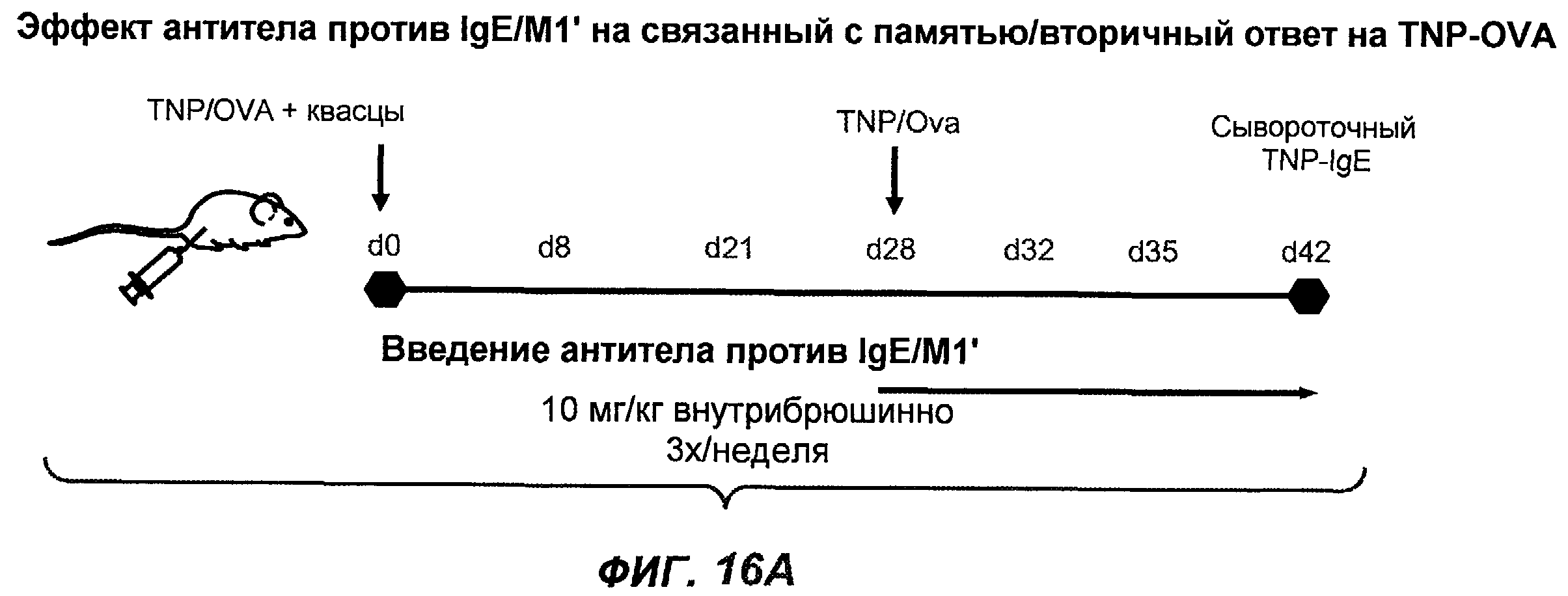
На фиг.16A-K показана способность антител против IgE/М1' предотвращать образование антигенспецифичного IgE при иммунном ответе памяти или вторичном иммунном ответе. На фиг.16A представлена схема, на которой показан временной график вторичной инъекции TNP-OVA и введения антител против IgE/М1', которое впервые вводили на 28 сутки. На фиг.16B представлен график уровней антигенспецифичного IgE с течением времени и показано, что вторичный IgE-ответ на вспомогательную инъекцию TNP-OVA на 28 сутки является более быстрым, достигая пика через 4 суток, а не через 8-9 суток, как при первичном ответе. На фиг.16C-D показано, что уровни антигенспецифичных IgE у мышей, которым вводили антитело против IgE/М1', были значимо снижены по сравнению с изотипическим контролем на 59-65% к 32 суткам и на 90-93% к 35 суткам. На фиг.16E показано, что к 42 суткам (12 сутки начального введения антитела против IgE), уровни антигенспецифичного IgE снижались до уровня, статистически не отличающегося от контрольных наивных мышей. На фиг.16F-H показано, что от 28 до 49 суток введение антитела против IgE/М1' снижало уровни IgE в сыворотке на 74-84%, и средний суточный уровень антигенспецифичного IgE также снижался на 74-83%. На фиг.16I-K показано, что на уровни антигенспецифичного IgG1 не влияло значимо антитело против IgE/М1'.
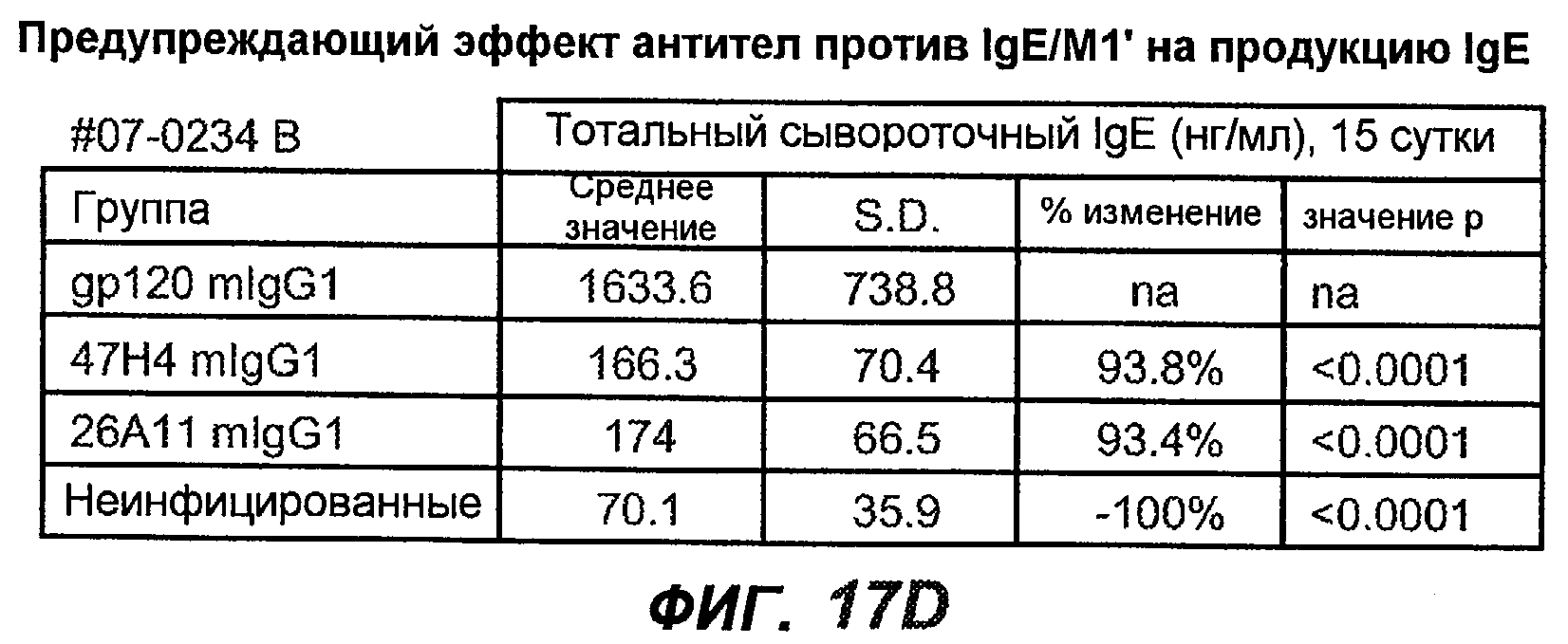
На фиг.17A-D проиллюстрирована способность антител против IgE/М1' профилактически снижать продукцию IgE в ответ на инфекцию Nippostrongylus brasiliensis ("NB"). На фиг.17A представлена схема, на которой показана схема эксперимента. Животным проводили введение три раза в неделю, начиная с 0 суток по 21 сутки. На фиг.17B показаны уровни IgE с течением времени в ответ на инфекцию NB с антителом против IgE/М1' и контрольным антителом. На фиг.17C-D показано, что на 15 сутки животные, которым вводили антитело против IgE/М1', имели сниженные уровни IgE в сыворотке, не отличающиеся на статистически значимом уровне от неинфицированных мышей.
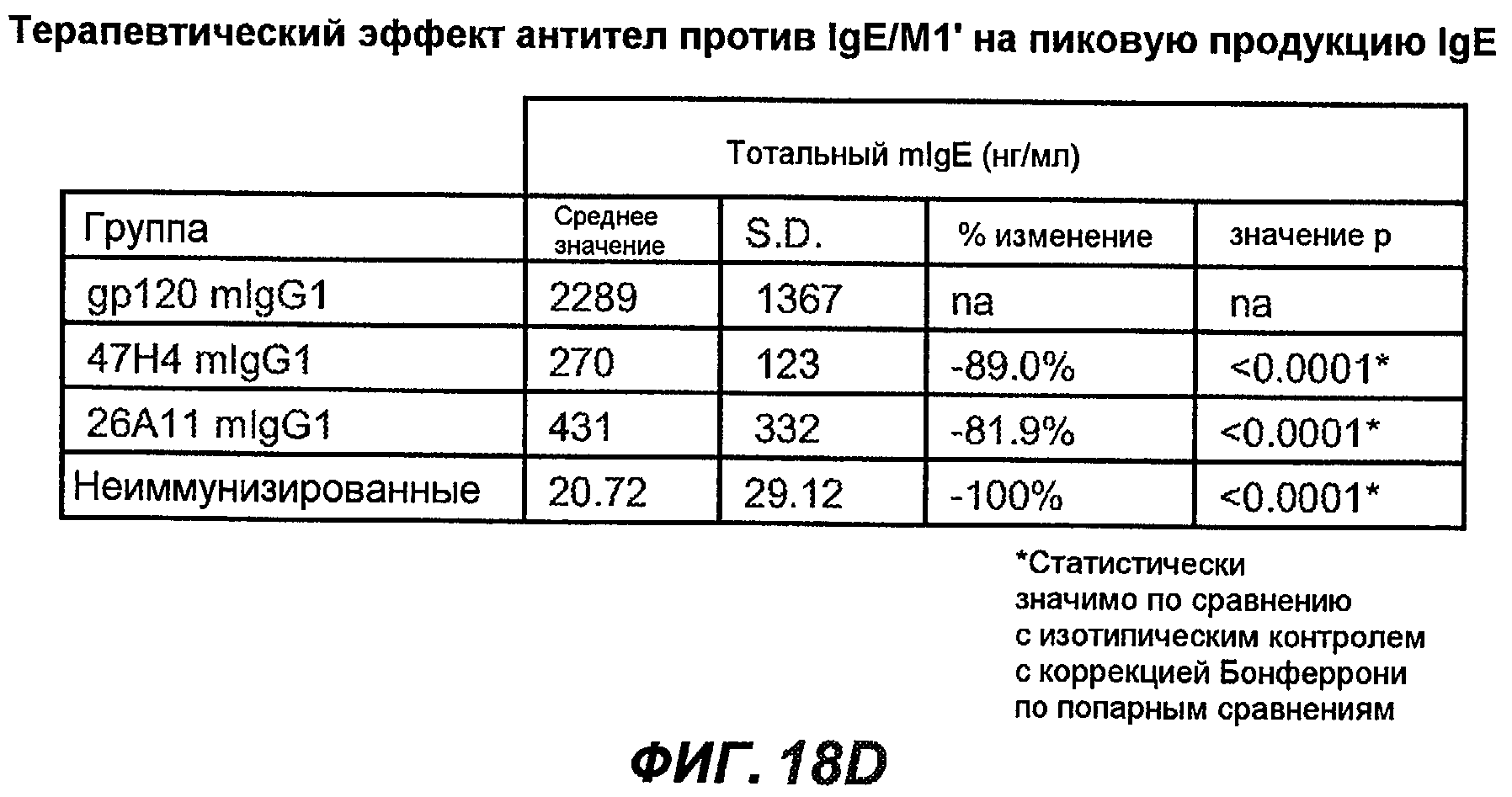
На фиг.18A-I проиллюстрирована способность антител против IgE/М1' к терапевтическому лечению максимального ответа IgE на инфекцию Nippostrongylus brasiliensis ("NB"). На фиг.18A представлена схема, на которой показана схема эксперимента. Животным проводили введение три раза в неделю с 11 до 21 сутки. На фиг.18B показаны уровни IgE с течением времени в ответ на инфекцию NB с антителом против IgE/М1' и контрольным антителом. На фиг.18C-D показано, что антитело против IgE/М1' снижало уровни IgE в сыворотке на 82-89% в течение четырех суток введения. На фиг.18E показано, что к 21 суткам уровни IgE у мышей, которым вводили антитело против IgE/М1', снижались у животных на 97-98%, и они достигали уровней, не отличающихся на статистически значимом уровне от неинфицированной контрольной группы. На фиг.18F-G показано, что продуцирующие IgE плазматические клетки (количественно определенные посредством Elispot) в лимфатических узлах и селезенке снижались на 88-94% и 57-66% соответственно. На фиг.18H-I показано, что уровень тотальных плазматических клеток (CD138+) как в лимфатических узлах, так и в селезенке повышался во всех обработанных группах по сравнению с неинфицированными мышами и что введение антитела против IgE/М1' не изменяет значимо общее количество плазматических клеток в каком-либо из органов. Эти результаты демонстрируют способность антител против IgE/М1' снижать уровни IgE в сыворотке посредством устранения продуцирующих IgE клеток in vivo.
На фиг.19A-G проиллюстрирована способность антител против IgE/М1' к терапевтическому лечению ответа IgE, происходящего в поздний период цикла инфекции, на инфекцию Nippostrongylus brasiliensis ("NB"). На фиг.19A представлена схема, на которой показана схема эксперимента, в котором животным проводили введение три раза в неделю, начиная с 40 суток. На фиг.19B показано, что максимальная продукция IgE происходила на 15 сутки, и что все антитела против IgE/М1' снижали сывороточный IgE. На фиг.19C-D показано, что антитело против IgE/М1' демонстрирует значимое снижение как абсолютных, так и нормализованных уровней IgE, соответственно, относительно начала введения. На фиг.19E-G показано, что введение антитела против IgE/М1' значимо снижало уровни IgE в сыворотке по сравнению с изотипическим контролем в виде mIgG1 против gp120 от 48 до 55 суток.
Подробное описание предпочтительного варианта осуществления
Все ссылки, упомянутые в настоящем документе, конкретно включены в настоящий документ в качестве ссылок.
Основные способы
При применении на практике настоящего изобретения будут использоваться, если нет иных указаний, общепринятые способы молекулярной биологии (включая рекомбинантные способы), микробиологии, клеточной биологии, биохимии и иммунологии, которые находятся в пределах квалификации в данной области. Такие способы полностью разъяснены в литературе, такой как Molecular Cloning: A Laboratory Manual, second edition (Sambrook et al., 1989); Oligonucleotide Synthesis (MJ. Gait, ed., 1984); Animal Cell Culture (R.I. Freshney, ed., 1987); Methods in Enzymology (Academic Press, Inc.); Current Protocols in Molecular Biology (F.M. Ausubel et al., eds 1987, и периодические дополнения); PCR: The Polymerase Chain Reaction (Mullis et al., ed., 1994); A Practical Guide to Molecular Cloning (Perbal Bernard V., 1988); Phage Display: A Laboratory Manual (Barbas et al., 2001).
Развитие и активация лимфоцитов
Два основных типа лимфоцитов у человека представляют собой T (образованные в тимусе) и B (образованные в костном мозге). Эти клетки образуются из гемопоэтических стволовых клеток в костном мозге и печени плода, которые коммитированы на лимфоидный путь развития. Потомки этих стволовых клеток идут различными путями, созревая либо в B-, либо в T-лимфоциты. Развитие B-лимфоцитов человека происходит полностью в костном мозге. С другой стороны, T-клетки развиваются из незрелых предшественников, которые покидают костный мозг и достигают через кровоток тимуса, где они пролиферируют и дифференцируются в зрелые T-лимфоциты.
Зрелые лимфоциты, источником которых является тимус или костный мозг, находятся в неактивном, или "покоящемся" состоянии, т.е. они являются митотически неактивными. Когда они рассредоточиваются в кровотоке, эти "наивные" или "некоммитированные" лимфоциты путешествуют в различные вторичные или периферические лимфоидные органы, такие как селезенка, лимфатические узлы или миндалины. Большинство некоммитированных лимфоцитов обладают присущей им короткой продолжительностью жизни и погибают в пределах нескольких суток после того, как они покидают костный мозг или тимус. Однако если такая клетка получает сигналы, которые указывают на присутствие антигена, она может активироваться и претерпевать последовательные раунды клеточного деления. Затем некоторые из полученных клеток-потомков возвращаются в покоящееся состояние и становятся лимфоцитами памяти - B- и T-клетками, которые, по существу, подготовлены к следующей встрече со стимулирующим аллергеном. Другие потомки активированных некоммитированных лимфоцитов представляют собой эффекторные клетки, которые выживают в течение только нескольких суток, однако обладают определенными защитными видами активности.
Активация лимфоцитов относится к упорядоченной серии событий, через которые проходит покоящийся лимфоцит после стимуляции для деления и образования потомков, некоторые из которых становятся эффекторными клетками. Полный ответ включает как индукцию пролиферации клеток (митогенез), так и проявление иммунологических функций. Лимфоциты становятся активированными, когда определенные лиганды связываются с рецепторами на их поверхностях. Лиганды отличаются для T-клеток и B-клеток, однако конечные внутриклеточные физиологические механизмы сходны.
В то же время чужеродные антигены самостоятельно могут индуцировать активацию лимфоцитов, особенно крупные полимерные антигены, которые перекрестно связывают поверхностные иммуноглобулины на B-клетках, или другие гликопротеины на T-клетках. Однако большинство антигенов не являются полимерными, и даже связывание прямо с B-клеткой в больших количествах не приводит к активации. B-клетки активируются этими более распространенными антигенами, когда они стимулируются одновременно с активированными вблизи хелперными T-лимфоцитами. Такая стимуляция может происходить от лимфокинов, секретируемых T-клеткой, однако наиболее эффективно она передается посредством прямого контакта B-клетки с поверхностными белками T-клеток, которые взаимодействуют с определенными поверхностными рецепторами B-клеток, создавая вторичный сигнал.
B-клетки
Отличительным признаком B-клеток является способность синтезировать иммуноглобулины. Иммуноглобулины (Ig) представляют собой крайне разнообразное семейство белков, состоящих из сходных типов полипептидов, называемых тяжелыми цепями и легкими цепями. Каждый Ig специфично связывается с высокой аффинностью со своим собственным специфическим антигеном. Зрелые B-клетки могут экспрессировать иммуноглобулин в двух различных формах, каждая из которых выполняет уникальные функции. В покоящихся B-лимфоцитах (некоммитированных или B-лимфоцитах памяти) иммуноглобулины экспрессируются только на клеточной поверхности, где они действуют в основном в качестве мембраносвязанного рецептора для конкретных антигенов. В противоположность этому, B-клеточные эффекторные клетки (плазматические клетки) секретируют иммуноглобулин в окружающую среду. Такой секретируемый иммуноглобулин сохраняет способность распознавать и связывать ("лицом к лицу") мембраносвязанную форму покоящихся B-клеток), и обычно его называют антителом.
Когда активированный B-лимфоцит делится, некоторые из его потомков становятся B-клетками памяти, а остальные дифференцируются в плазматические клетки. Поскольку плазматические клетки имеют относительно короткий срок жизни, если не образуются новые плазматические клетки, популяция вымирает, и иммуноглобулины более не секретируются. В результате, активация B-клеток, как правило, приводит к временной волне пролиферации, с последующим всплеском секреции антитела, которая возрастает, а затем стихает в течение нескольких дней или нескольких недель. B-клетки являются основным типом клеток, вовлеченных в гуморальный иммунитет или в защитный эффект, опосредуемый тканевыми жидкостями. Поскольку антитела против IgE/М1' по изобретению, по существу, устраняют B-клетки, включая B-клетки памяти, их можно использовать для "сброса" памяти. Таким образом, эффект этого может состоять в том, что B-клеточный компонент, который запускает аллергический ответ у индивидов, может снизиться или даже устраниться.
T-клетки
T-лимфоциты не экспрессируют иммуноглобулины, однако, вместо этого они выявляют наличие чужеродных веществ с помощью поверхностных белков, называемых T-клеточными рецепторами. Эти рецепторы распознают антигены либо посредством прямого контакта, либо через влияние на активность других иммунных клеток. Вместе с макрофагами T-клетки являются основным типом клеток, вовлеченных в клеточно-опосредуемый иммунитет.
В отличие от B-клеток T-клетки могут выявлять чужеродные вещества только в конкретных условиях. В частности, T-лимфоциты будут распознавать чужеродный белок, только если он сначала расщепляется на пептиды небольших размеров, которые затем экспонируются на поверхности второй клетки-хозяина, называемой антигенпрезентирующей клеткой (APC). Множество типов клеток-хозяев могут представлять антигены в некоторых условиях, однако определенные типы более специфично адаптированы для этой цели, и они особенно важны для контроля активности T-клеток, и включают макрофаги и другие B-клетки. Презентирование антигена зависит, частично, от определенных белков, называемых белками основного комплекса гистосовместимости (MHC), на поверхности презентирующих клеток. Таким образом, для стимуляции клеточно-опосредуемого иммунитета чужеродные пептиды должны быть представлены T-клеткам в сочетании с пептидами MHC, и это сочетание должно быть распознано T-клеточным рецептором.
Существует два существенных подтипа T-клеток: цитотоксические T-лимфоциты (Tc-клетки или CTL) и хелперные T-клетки (TH), которые можно ориентировочно идентифицировать, исходя из экспрессии на клеточной поверхности маркера CD8 и CD4. Tc-клетки важны для защиты от вирусов, и они могут уничтожать вирусы прямо посредством распознавания определенных экспрессируемых на клеточной поверхности вирусных пептидов. TH-клетки обеспечивают пролиферацию, созревание и иммунологическую функцию других типов клеток, например секрецию лимфокинов для контроля активности B-клеток, макрофагов и цитотоксических T-клеток. Как некоммитированные T-лимфоциты, так и T-лимфоциты памяти обычно остаются в покоящемся состоянии, и в этом состоянии они не проявляют существенной хелперной или цитотоксической активности. Когда они активированы, эти клетки претерпевают несколько раундов митотического деления с образованием дочерних клеток. Некоторые из этих дочерних клеток возвращаются в покоящееся состояние в качестве клеток памяти, однако другие из них становятся эффекторными клетками, которые активно проявляют хелперную цитотоксическую активность. Эти дочерние клетки сходны с их родительскими клетками: CD4+ клетки могут образовывать только потомство CD4+, а клетки CD8+ образуют только потомство CD8+. Эффекторные T-клетки экспрессируют поверхностные маркеры, которые не экспрессируются на покоящихся T-клетках, таких как CD25, CD28, CD29, CD40L, рецепторы трансферрина и белки MHC II класса. Когда активирующие стимулы устраняются, цитотоксическая или хелперная активность постепенно стихает в течение нескольких суток, поскольку эффекторные клетки либо погибают, либо возвращаются в покоящееся состояние.
Аналогично активации B-клеток T-лимфоцит отвечает на большинство антигенов и также требует двух типов одновременных стимулов. Первым является антиген, который, если он надлежащим образом экспонирован белками MHC на антигенпрезентирующей клетке, может быть распознан и связан T-клеточными рецепторами. Так как этот комплекс антиген-MHC не посылает сигнал внутрь клетки, он обычно является недостаточным для возникновения активации T-клеток. Полная активация, такая как происходит с помощью хелперных T-клеток, требует костимуляции с другими специфичными лигандами, называемыми костимуляторами, которые экспрессируются на поверхности антигенпрезентирующей клетки. Активация цитотоксической T-клетки, с другой стороны, как правило, требует IL-2, цитокина, секретируемого активированными хелперными T-клетками.
Иммунный ответ
Три основных функциональных свойства иммунной системы млекопитающих, отличающей ее от других систем защиты организма, включают: (1) специфичность - способность распознавать и отвечать или не отвечать индивидуально среди широкого множества молекул-мишеней, (2) избирательность - способность отличить "свое" от "не своего", так чтобы спокойно сосуществовать со всеми бесчисленными белками и другим органическим материалом, но, тем не менее, энергично отвечать на чужеродный материал, который проникает в организм, и (3) память - способность формироваться на основании опыта, так что последующая встреча с конкретным чужеродным патогеном спровоцирует более быстрый и энергичный ответ, чем ответ, который происходит при первоначальной встрече. Поскольку антагонисты IgE по изобретению индуцируют апоптоз в обладающих IgE B-клетках, ожидается, что они ослабят или даже устранят иммунную память на конкретные антигены. Ожидается, что это будет обладать особенным преимуществом, когда энергичный иммунный ответ на обычные аллергены является патологическим, как, например, в случае атопических нарушений.
Некоммитированные лимфоциты постоянно высвобождаются из первичных лимфоидных органов на периферию, каждый из которых обладает поверхностными рецепторами, которые обеспечивают связывание антигена. Связывание антигена в B-клетках опосредуется через связанные с поверхностью иммуноглобулины, в то время как в T-клетках оно опосредуется T-клеточными рецепторами. Когда некоммитированные лимфоциты не активируются, они погибают в пределах нескольких суток после выхода на периферию. Лимфоциты, которые активируются, выживают и пролиферируют с образованием дочерних клеток, которые затем могут претерпевать дальнейшие циклы активации и пролиферации. Скорость и интенсивность ответа на данный антиген определяется, главным образом, клональной селекцией: чем больше популяция дочерних клеток или клонов, специфичных к конкретному антигену, тем больше количество клеток, которые могут осуществлять распознавание и участвовать в иммунном ответе. Каждый иммунный ответ представляет собой комплексную и сложно регулируемую последовательность событий, вовлекающую несколько типов клеток. Он запускается, когда иммуноген проникает в организм и встречает специализированный класс клеток, называемый антигенпрезентирующими клетками (APC). Эти APC захватывают малое количество иммуногена и экспонируют его в форме, которую могут распознавать антигенспецифичные хелперные T-лимфоциты. Затем хелперные T-клетки активируются и, в свою очередь, обеспечивают активацию других классов лимфоцитов, таких как B-клетки или цитотоксические T-клетки. Затем активированные лимфоциты пролиферируют и осуществляют специфичные для них эффекторные функции. На каждой стадии этого процесса лимфоциты и APC взаимодействуют друг с другом через прямой контакт или посредством секреции регуляторных цитокинов.
Экзогенные антигены, которые захватываются APC, претерпевают серию изменений, называемых процессингом антигена. Такой процессинг, особенно белковых иммуногенов, вовлекает денатурацию и частичное протеолитическое расщепление, так что иммуноген расщепляется на короткие пептиды. Затем ограниченное количество полученных пептидов нековалентно связывается с белками MHC II класса и транспортируется к поверхности APC, этот процесс известен как презентирование антигена. CD4+ хелперный T-лимфоцит, который прямо контактирует с APC, может активироваться, однако это произойдет, только если он экспрессирует T-клеточный рецепторный белок, который может распознавать и связывать конкретный комплекс пептид-MHC, представленный APC.
Хелперные T-клетки (TH) являются основными организаторами иммунного ответа, поскольку они необходимы для активации двух других лимфатических эффекторных клеток: цитотоксических T-клеток (TС) и секретирующих антитело плазматических клеток. Активация TH происходит на ранней стадии иммунного ответа и требует по меньшей мере двух сигналов. Один сигнал обеспечивается посредством связывания T-клеточного рецептора для антигенов с комплексом антигенный пептид-MHC на поверхности APC, и он передается через белковый комплекс CD3, а второй костимуляторный сигнал через APC, как полагают, является следствием связывания отдельного передающего сигнал белка на поверхности T-клеток со специфичным лигандом на APC. Одно такое взаимодействие происходит между T-клеточным белком CD28 и семейством поверхностных белков APC, известных как B7. Другие пары поверхностных белков также могут опосредовать костимуляцию.
Вместе эти два сигнала индуцируют начало секреции хелперными T-клетками цитокина, известного как интерлейкин-2 (IL-2), а также они начинают экспрессировать специфичные высокоаффинные рецепторы для IL-2 на их поверхности. IL-2 представляет собой высокоэффективный митогенный фактор для T-лимфоцитов, и он необходим для пролиферативного ответа активированных T-клеток. Эффект IL-2 на клетку, из которой он секретируется, представляет собой феномен, известный как аутокринный эффект. Кроме того, было показано, что даже если T-клетка получает оба сигнала, она не пролиферирует, если ее собственные поверхностные рецепторы для IL-2 блокированы. Также IL-2 может действовать на клетки в непосредственной близости, посредством так называемого паракринного эффекта. Этот эффект является особенно важным для активации TC-клеток, которые, как правило, не продуцируют достаточное количество IL-2 для стимуляции их собственной пролиферации. В дополнение к IL-2 активированные TH-клетки секретируют другие цитокины и обеспечивают рост, дифференцировку и функционирование B-клеток, макрофагов и других типов клеток.
Контакт между APC и антигенспецифичной TH-клеткой также оказывает эффекты на APC - один из наиболее важных из которых представляет собой высвобождение IL-1. Полагают, что этот цитокин действует аутокринно, повышая поверхностную экспрессию белков MHC II класса и различных молекул адгезии, таким образом, делая связывание TH-клетки более прочным и усиливая презентирование антигена. В то же время IL-1 функционирует паракринно в отношении TH-клеток, обеспечивая секрецию IL-2 и экспрессию рецептора для IL-2.
В ходе активации TH-клеток ранее описанным образом, некоторые B-клетки также могут связывать иммуноген через их рецепторы для антигенов, которые представляют собой мембраносвязанные формы антител, которые будут позднее секретироваться. В отличие от T-клеток B-клетки распознают иммуноген в его свободной непроцессированной форме. Специфичное связывание антигена обеспечивает один тип сигнала, который может привести к активации B-клеток. Второй тип обеспечивается активированными TH-клетками, которые экспрессируют белки, которые способствуют активации B-клеток посредством связывания с неиммуноглобулиновыми рецепторами на их поверхности. Эти сигналы TH, которые действуют на любую B-клетку независимо от антигенной специфичности, известны как хелперные факторы. Эти хелперные факторы включают IL-2, IL-4 и IL-6. Однако помощь более эффективно достигается через межклеточный контакт, который позволяет белкам на поверхности T-клеток прямо контактировать с белками на B-клетке. Наиболее эффективная форма опосредуемой контактом помощи происходит, когда белок, называемый лигандом CD40 (CD40L), который экспрессируется на клетках TH только после того, как они активируются, связывается с белком, называемым CD40, на B-клетках. В процессе, известном как неспецифическая активация, даже контакт с активированной B-клеткой может быть достаточным для активации покоящихся B-клеток, даже если их поверхностные иммуноглобулины не связали антиген.
TC-лимфоциты функционируют, устраняя клетки, которые экспрессируют чужеродные антигены на их поверхностях, такие как инфицированные вирусом клетки хозяина. Большинство TC-клеток экспрессируют CD8, а не CD4, и, таким образом, они распознают антигены, связанные с белками MHC класса I, а не класса II. Когда соматическая клетка инфицирована вирусом, некоторые иммуногенные вирусные белки могут претерпевать процессинг в клетке, а затем полученные пептиды могут появляться в качестве поверхностных комплексов с молекулами MHC класса I. Затем эти комплексы пептид-MHC могут быть распознаны T-клеточным рецептором антигенспецифичного клона, предоставляя один из двух сигналов, необходимых для активации TС-клеток. Этот первый сигнал индуцирует высокоаффинные рецепторы для IL-2 на TC-клетке. Второй сигнал обеспечивается IL-2, секретируемым ближайшим активированным TH-лимфоцитом. При получении обоих сигналов активированная TC-клетка приобретает цитотоксическую активность, что позволяет ей уничтожать клетку, с которой она связана, а также любые другие клетки, обладающие теми же комплексами пептид-MHC класса I. В некоторых случаях уничтожение происходит, поскольку TC высвобождает определенные токсины на клетку-мишень; в других случаях TC индуцирует совершение клеткой-мишенью самоубийства посредством апоптоза. Активированная TC-клетка также пролиферирует, давая начало дополнительным TC-клеткам с той же антигенной специфичностью.
Каскад IgE/тучная клетка/медиаторы.
Антитела IgE Fc-участком молекулы фиксируются к высокоаффинному рецептору клеточной поверхности, называемому FcεRI на поверхности тучных клеток и базофилов. Аллергическая реакция начинается, когда поливалентная молекула аллергена связывается с антителами, которые оккупируют эти рецепторы. Результатом является связывание FcεRI, который, в свою очередь, дает внутриклеточный сигнал, вызывая высвобождение и активацию медиаторов воспаления: гистамина, лейкотриенов, хемотактических факторов, активирующего тромбоциты фактора и протеаз. Эти активированные медиаторы действуют локально и вызывают повышенную проницаемость сосудов, расширение сосудов, сокращение гладких мышц и секрецию слизистых желез. Такие события клинически называют немедленной или ранней фазой, и они происходят в пределах первых 15-30 минут после воздействия аллергена. В течение последующих 12 часов происходит прогрессирующая инфильтрация в ткани воспалительных клеток, протекающая от нейтрофилов к эозинофилам и к мононуклеарным клеткам в ответ на другие химические медиаторы, до конца не изученные. Это период времени, составляющий 6-12 часов после воздействия аллергена, называют поздней фазой и он характеризуется клиническими проявлениями клеточного воспаления. С учетом того, что эти реакции поздней фазы, особенно в легком, возникают при отсутствии реакций ранней фазы, все еще не понятно полностью, является ли реакция поздней фазы обязательно опосредуемой IgE.
Этот механизм, главным образом, ответственен за анафилаксию, крапивницу и атопические заболевания, такие как аллергический ринит, аллергическая астма, атопический дерматит и аллергическая гастроэнтеропатия.
Каскад эффекторный T-лимфоцит/лимфокин
Определенные аллергические заболевания опосредуются реакцией аллергена с эффекторным T-лимфоцитом, сенсибилизированным к конкретному аллергену при предыдущем воздействии. Когда встречается аллерген, CD4+ T-клетки активируются, образуя лимфокины, что приводит в течение нескольких суток к накоплению инфильтрата мононуклеарных клеток.
I. Определения
"Аллерген" или "иммуноген" представляет собой молекулу, которая запускает иммунный ответ. Как используют в настоящем документе, термин охватывает либо саму антигенную молекулу, либо ее источник, такой как зерно пыльцы, перхоть животных, яд насекомых или продукт питания. Он контрастирует с термином "антиген", который относится к молекуле, которая может специфично распознаваться иммуноглобулином или T-клеточным рецептором. Любое чужеродное вещество, способное индуцировать иммунный ответ, является потенциальным аллергеном. Известно, что аллергенными являются множество различных химических веществ как природного, так и синтетического происхождения. Сложные природные органические химические вещества, особенно белки, обладают возможностью вызвать опосредуемую антителом аллергию, в то время как простые органические соединения, неорганические химические вещества и металлы с большим предпочтением вызывают опосредуемую T-клетками аллергию. В некоторых случаях один аллерген может быть ответственным более чем за один тип аллергии. Воздействие аллергена может происходить посредством ингаляции, инъекции или контакта с кожей.
Термин "антитело" включает моноклональные антитела (в том числе полноразмерные антитела, которые обладают Fc-областью иммуноглобулина), композиции антител с полиэпитопной специфичностью, полиспецифичные антитела (например, биспецифичные антитела, антитела-димеры (diabody) и одноцепочечные молекулы, а также фрагменты антител (например, Fab, F(ab')2 и Fv). Термин "иммуноглобулин" (Ig) используют в настоящем документе взаимозаменяемо с термином "антитело".
Основной элемент антитела из 4 цепей представляет собой гетеротетрамерный гликопротеин, состоящий из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Антитело IgM состоит из 5 основных гетеротетрамерных элементов вместе с дополнительным полипептидом, называемым J-цепью, и, таким образом, оно содержит 10 антигенсвязывающих участков, в то время как секретируемые антитела IgA могут полимеризоваться с образованием поливалентных систем, содержащих 2-5 основных элементов из 4 цепей вместе с J-цепью. В случае IgG элемент из 4 цепей, как правило, имеет массу 150000 дальтон. Каждая L-цепь связана с H-цепью одной ковалентной дисульфидной связью, в то время как две H-цепи связаны друг с другом одной или несколькими дисульфидными связями в зависимости от изотипа H-цепи. Каждая H- и L-цепь имеет расположенные с равными интервалами межцепочечные дисульфидные мостики. Каждая H-цепь имеет на N-конце вариабельный домен (VH), за которым следуют три константных домена (CH) для каждой из α- и γ-цепей и четыре CH-домена для изотипов μ и ε. Каждая L-цепь имеет на N-конце вариабельный домен (VL), за которым следует константный домен (CL) на ее другом конце. VL выравнивается с VH, и CL выравнивается с первым константным доменом тяжелой цепи (CH1). Полагают, что конкретные аминокислотные остатки образуют поверхность контакта между вариабельными доменами легкой цепи и тяжелой цепи. Образование пары VH и VL формирует один антигенсвязывающий участок. Для структуры и свойств различных классов антител см., например, Basic and Clinical Immunology, 8th edition, Daniel P. Sties, Abba I. Terr and Tristram G. Parslow (eds.), Appleton & Lange, Norwalk, CT, 1994, страница 71 и глава 6.
L-цепь любых видов позвоночных может быть отнесена к одному из двух четко отличающихся типов, называемых каппа и лямбда, на основе аминокислотных последовательностей их константных доменов. В зависимости от аминокислотной последовательности константного домена их тяжелых цепей (CH), иммуноглобулины можно отнести к различным классам или изотипам. Существует пять классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, имеющих тяжелые цепи, обозначаемые как α, δ, ε, γ и μ соответственно. Классы γ и α далее подразделяются на подклассы на основе относительно небольших различий в последовательности CH и функции, например у человека экспрессируются следующие подклассы: IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2.
"Выделенное" антитело представляет собой антитело, которое идентифицировано, отделено и/или извлечено из компонента среды, где оно продуцируется (например, природным образом или рекомбинантно). Предпочтительно выделенный полипептид не ассоциирован с любыми другими компонентами среды, в которой он индуцируется. Загрязняющие компоненты среды, где он продуцируется, такие как компоненты, полученные из рекомбинантных трансфицированных клеток, представляют собой вещества, которые препятствуют применению антитела для исследования, диагностики или лечения, и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В предпочтительных вариантах осуществления антитело очищают (1) до более чем 95% по массе антитела, как определяют способом Лоури, и наиболее предпочтительно до более чем 99% по массе; (2) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности с использованием секвенатора с вращающимся стаканом; или (3) до гомогенности при SDS-PAGE в восстанавливающих или невосстанавливающих условиях с использованием кумасси синего или, предпочтительно, окрашивания серебром. Выделенное антитело включает антитело в рекомбинантных клетках in situ, поскольку в этом случае отсутствует по меньшей мере один компонент условий естественного окружения антитела. Однако, как правило, выделенные пептид или антитело будут получены посредством по меньшей мере одной стадии очистки.
"Вариабельная область" или "вариабельный домен" антитела относится к N-концевым доменам тяжелой или легкой цепи антитела. Вариабельные домены тяжелой цепи и легкой цепи могут быть обозначены как "VH" и "VL" соответственно. Эти домены, как правило, являются наиболее вариабельными частями антитела (относительно других антител того же класса) и содержат антигенсвязывающие участки.
Термин "вариабельный" относится к тому факту, что последовательности определенных сегментов вариабельных доменов значительно отличаются среди антител. V-домен опосредует связывание антигена и определяет специфичность конкретного антитела к его конкретному антигену. Однако вариабельность не является равномерной на протяжении всего участка вариабельных доменов. Вместо этого, она сконцентрирована в трех сегментах, называемых гипервариабельными областями (HVR) в вариабельных доменах как легкой цепи, так и тяжелой цепи. Более высококонсервативные участки вариабельных доменов называют каркасными областями (FR). Вариабельные домены нативных тяжелых и легких цепей содержат четыре FR, главным образом, приминающих конфигурацию бета-слоев, соединенных тремя HVR, которые формируют петли, объединяющие структуру бета-слоев и в некоторых случаях формирующие ее часть. HVR в каждой цепи расположены вместе в непосредственной близости от FR-областей и, совместно с HVR другой цепи, участвуют в формировании антигенсвязывающего сайта антител (см. Kabat et al., Sequences of Protein of Immunological Interest, 5th Ed. National Institutes of Health, Bethesda, MD. (1991)). Константные домены не вовлечены непосредственно в связывание антитела с антигеном, но они проявляют различные эффекторные функции, такие как участие антитела в антителозависимой клеточной цитотоксичности.
Как используют в настоящем документе, термин "моноклональное антитело" относится к антителу из совокупности, по существу, гомогенных антител, т.е. отдельные антитела, составляющие совокупность, являются идентичными, за исключением возможных встречающихся в природе мутаций и/или посттрансляционных модификаций (например, изомеризаций, амидаций), которые могут быть представлены в небольших количествах. Моноклональные антитела являются высокоспецифичными, и они направлены против одного антигенного участка. В противоположность препаратам поликлональных антител, которые, как правило, включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело в препарате моноклонального антитела направлено против одной детерминанты на антигене. В дополнение к их специфичности, моноклональные антитела являются преимущественными в том, что они синтезированы из своей гибридомной культуры, не содержащей других иммуноглобулинов. Определение "моноклональный" указывает на тот признак антитела, что его получают из, по существу, гомогенной совокупности антител, и не подразумевает того, что антитело должно быть получено каким-либо конкретным способом. Например, моноклональные антитела, предназначенные для применения в соответствии с настоящим изобретением, можно получать множеством способов, включая, например, способ гибридом (например, Kohler and Milstein, Nature, 256:495 (1975); Hongo et al., Hybridoma, 14 (3):253-260 (1995), Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling et al., Monoclonal Antibodies and T-Cell Hybrodimas 563-681 (Elsevier, N.Y., 1981)), способы рекомбинантных ДНК (см., например, патент США № 4816567), технологии фагового дисплея (см., например, Clackson et al., Nature, 352:624-628 (1991); Marks et al., J. Mol. Biol., 222:581-597 (1991); Sidhu et al., J. Mol. Biol. 338(2):299-310 (2004); Lee et al., J. Mol. Biol. 340(5):1073-1093 (2004); Fellouse, Proc. Nat. Acad. Sci. USA 101(34):12467-12472 (2004); и Lee et al. J. Immunol. Methods 284(1-2):119-132 (2004)) и технологии продуцирования антитела человека или антител, подобных антителам человека, у животных, которые имеют части локусов или генов иммуноглобулинов человека, кодирующие последовательности иммуноглобулинов, или все эти локусы или гены (см., например, WO 1998/24893; WO 1996/34096; WO 1996/33735; WO 1991/10741; Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggemann et al., Year in Immunol., 7:33 (1993); патенты США №№ 5545807, 5545806, 5569825, 5625126, 5633425 и 5661016; Marks et al., Bio/Technology, 10:779-783 (1992); Lonberg et al., Nature, 368:856-859 (1994); Morrison, Nature, 368:812-813 (1994); Fishwild et al., Nature Biotechnology, 14:845-851 (1996); Neuberger, Nature Biotechnology, 14:826 (1996); и Lonberg and Huszar, Intern. Rev. Immunol., 13:65-93 (1995)).
Термин "голое антитело" относится к антителу, которое не конъюгировано с цитотоксической группой или радиоактивной меткой.
Термины "полноразмерное антитело", "интактное антитело" или "целое антитело" используют взаимозаменяемо, и они относятся к антителу в его, по существу, интактной форме в противоположность фрагменту антитела. Конкретно, целые антитела включают антитела с тяжелыми и легкими цепями, включающими Fc-область. Константные домены могут представлять собой константные домены с нативной последовательностью (например, константные домены с нативной последовательностью человека) или их варианты по аминокислотной последовательности. В некоторых случаях интактное антитело может иметь одну или несколько эффекторных функций.
"Фрагмент антитела" содержит часть интактного антитела, предпочтительно антигенсвязывающую или вариабельную область интактного антитела. Примеры фрагментов антител включают Fab, Fab', F(ab')2 и Fv-фрагменты, антитела-димеры, линейные антитела (см., например, патент США № 5641870, пример 2, Zapata et al., Protein Eng., 8(10):1057-1062 [1995]), одноцепочечные молекулы антител и полиспецифичные антитела, образованные фрагментами антител.
Расщепление антител папаином приводит к образованию двух идентичных антигенсвязывающих фрагментов, называемых "Fab"-фрагментами, и остаточного "Fc"-фрагмента, название которого отражает его способность легко кристаллизоваться. Fab-фрагмент состоит из целой L-цепи вместе с доменом вариабельной области H-цепи (VH) и первым константным доменом одной тяжелой цепи (CH1). Каждый Fab-фрагмент является одновалентным в отношении связывания антигена, т.е. он обладает одним антигенсвязывающим участком. Обработка антитела пепсином приводит к одному крупному F(ab')2-фрагменту, который приблизительно соответствует двум связанным дисульфидом Fab-фрагментам, имеющим различную антигенсвязывающую активность, и, кроме того, способен к перекрестному связыванию антигена. Fab'-фрагменты отличаются от Fab-фрагментов наличием дополнительных нескольких остатков на C-конце домена CH1, включая один или несколько цистеинов из шарнирной области антитела. Fab'-SH представляет собой обозначение для Fab', в котором остаток(ки) цистеина константных доменов обладает свободной тиольной группой. F(ab')2-фрагменты антитела исходно были получены в качестве пар Fab'-фрагментов, которые обладают шарнирными цистеинами между ними. Также известно другое химическое связывание фрагментов антител.
Fc-фрагмент содержит C-концевые части обеих H-цепей, удерживаемые вместе дисульфидами. Эффекторные функции антител определяются последовательностями Fc-участка, который также является частью, распознаваемой Fc-рецепторами (FcR), встречающимися на определенных типах клеток.
"Fv" представляет собой минимальный фрагмент антитела, который содержит полный антигенраспознающий и антигенсвязывающий сайт. Этот фрагмент состоит из димера доменов, состоящих из одной вариабельной области тяжелой цепи и одной вариабельной области легкой цепи, связанных прочной нековалентной связью. Сворачивание этих двух доменов образует шесть гипервариабельных петель (3 петли в каждой из H- и L-цепи), которые предоставляют аминокислотные остатки для связывания антигена и обеспечивают специфичность связывания антигена антителом. Однако даже один вариабельный домен (или половина Fv, содержащая только три области HVR, специфичных к антигену) обладает способностью распознавать и связывать антиген, хотя и с более низкой аффинностью, чем целый участок связывания.
"Одноцепочечные Fv", также сокращаемые как "sFv" или "scFv", представляют собой фрагменты антител, которые содержат VH и VL-домены антитела, соединенные в единую полипептидную цепь. Предпочтительно полипептид sFv также необязательно содержат полипептидный линкер между VH- и VL-доменами, который обеспечивают возможность формирования в sFv структуры, требуемой для связывания антигена. Для обзора sFv см. Pluckthun in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds. Springer-Verlag, New York, pp. 269-315 (1994).
"Функциональные фрагменты" антител по изобретению содержат часть интактного антитела, как правило, включающую антигенсвязывающую или вариабельную область интактного антитела или F-область антитела, которая сохраняет способность связывания FcR или обладает модифицированной способностью связывания FcR. Примеры фрагментов антитела включают линейное антитело, одноцепочечное антитело молекул и полиспецифичные антитела, образованные из фрагментов антитела.
Термин "антитела-димеры" (diabody) относится к небольшим фрагментам антител, полученных конструированием sFv-фрагментов (см. предыдущий абзац) с короткими линкерами (приблизительно 5-10 остатков) между VH- и VL-доменами, так что достигается образование пар V-доменов между цепями, а не внутри цепей, с образованием, таким образом, двухвалентного фрагмента, т.е. фрагмента, имеющего два антигенсвязывающих сайта. Биспецифичные антитела-димеры представляют собой гетеродимеры двух "пересекающихся" sFv-фрагментов, в которых VH- и VL-домены двух антител присутствуют на различных полипептидных цепях. Антитела-димеры более подробно описаны, например, в EP 404097; WO 93/11161; Hollinger et al., Proc. Natl Acad. Sci. USA 90:6444-6448 (1993).
В настоящем документе моноклональные антитела конкретно включают "химерные" антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи является идентичной или гомологичной соответствующим последовательностям в антителах, полученных из конкретного вида или принадлежащих к конкретному классу или подклассу антител, в то время как оставшаяся часть цепи(ей) является идентичной или гомологичной соответствующим последовательностям в антителах, полученных из другого вида или принадлежащих другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они проявляют требуемую биологическую активность (патент США № 4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)). Представляющие интерес в настоящем документе химерные антитела включают антитела PRIMITIZED®, где антигенсвязывающая область антитела образована антителом, полученным, например, иммунизацией макак представляющим интерес антигеном. Как используют в настоящем документе, "гуманизированное антитело" применяют в качестве подтипа "химерных антител".
"Гуманизированные" формы антител, отличных от человеческих (например, мышиных), представляют собой химерные антитела, которые содержат минимальную последовательность, образованную иммуноглобулином не человека. В одном варианте осуществления гуманизированное антитело представляет собой иммуноглобулин человека (реципиентное антитело), в котором остатки из HVR реципиента заменены остатками HVR не относящегося к человеку вида (донорное антитело), такого как мышь, крыса, кролик или не относящийся к человеку примат, имеющими требуемую специфичность, аффинность и емкость. В некоторых случаях остатки каркасной области FR иммуноглобулина человека заменяют соответствующими остатками не человека. Более того, гуманизированные антитела могут содержать остатки, которые не встречаются ни в реципиентном антителе, ни в донорном антителе. Эти модификации могут быть проведены для дополнительного улучшения характеристик антитела, таких как аффинность связывания. Как правило, гуманизированное антитело будет содержать по существу все по меньшей мере из одного и, как правило, двух вариабельных доменов, в которых все или по существу все из гипервариабельных петель соответствуют гипервариабельным петлям последовательности иммуноглобулина не человека, и все или по существу все из областей FR представляют собой области FR консенсусной последовательности иммуноглобулина человека, хотя FR-области могут включать замену одного или нескольких отдельных остатков, которые улучшают характеристики антитела, такие как аффинность связывания, изомеризация, иммуногенность и т.д. Количество этих аминокислотных замен в FR, как правило, составляет не более 6 в H-цепи, и не более 3 в L-цепи. Гуманизированное антитело также необязательно будет содержать по меньшей мере часть константной области (Fc) иммуноглобулина, как правило, константной области иммуноглобулина человека. Для более подробного описания см. Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992). Также см., например, Vaswani and Hamilton, Ann. Allergy, Asthma & Immunol. 1:105-115 (1998); Harris, Biochem. Soc. Transactions 23:1035-1038 (1995); Hurle and Gross, Curr. Op. Biotech. 5:428-433 (1994); и патенты США №№ 6982321 и 7087409.
"Антитело человека" представляет собой антитело, которое обладает аминокислотной последовательностью, соответствующей последовательности антитела, продуцируемого у человека и/или полученного с использованием любого из способов получения антител человека, как описано в настоящем документе. Это определение антитела человека конкретно исключает гуманизированное антитело, содержащее антигенсвязывающие остатки не человека. Антитела человека можно получать с использованием различных способов, известных в данной области, включая библиотеки фагового дисплея. Hoogenboom and Winter, J. Mol. Biol., 227:381 (1991); Marks et al., J. Mol. Biol, 222:581 (1991). Также для получения моноклональных антител человека доступны способы, описанные в Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985); Boerner et al., J. Immunol, 147(l):86-95 (1991). Также см. van Dijk and van de Winkel, Curr. Opin. Pharmacol. 5:368-74 (2001). Антитела человека можно получать введением антигена трансгенному животному, которое модифицировано для продукции таких антител в ответ на иммунизацию антигеном, и эндогенные локусы которых заблокированы, например, иммунизированных xenomice (см., например, патенты США №№ 6075181 и 6150584, касающиеся технологии XENOMOUSETM). Также см., например, Li et al., Proc. Natl. Acad. Sci. USA, 103:3557-3562 (2006) в отношении антител человека, полученных технологией B-клеточных гибридом человека.
Как используют в настоящем документе, термин "гипервариабельная область", "HVR" или "HV" относится к областям вариабельного домена антитела, которые обладают гипервариабельными последовательностями и/или образуют структурно определенные петли. Как правило, антитела содержат шесть областей HVR: три в VH (H1, H2, H3) и три в VL (L1, L2, L3). В нативных антителах H3 и L3 проявляют наибольшее многообразие из шести HVR, и, в частности, полагают, что H3 играет уникальную роль в обеспечении специфичности антител. См., например, Xu et al. Immunity 13:37-45 (2000); Johnson and Wu in Methods in Molecular Biology 248:1-25 (Lo, ed., Human Press, Totowa, NJ, 2003)). Действительно, природные антитела верблюдовых, состоящие только из тяжелой цепи, являются функциональными и стабильными в отсутствии легкой цепи. См., например, Hamers-Casterman et al., Nature 363:446-448 (1993) и Sheriff et al., Nature Struct. Biol. 3:733-736 (1996).
В настоящем документе используется и охватывается ряд определений HVR. Области HVR, которые представляют собой определяющие комплементарность области по Kabat (CDR), основаны на вариабельности последовательности и используются наиболее широко (Kabat et al., выше). Chothia, вместо этого, ссылается на расположение структурных петель (Chothia and Lesk J. Mol. Biol. 196:901-917 (1987)). Области HVR AbM представляет собой компромисс между CDR Kabat и структурными петлями Chothia, и они используются программным обеспечением для модулирования антител Oxford Molecular's AbM. "Контактные" HVR основаны на анализе доступных комплексных кристаллических структур. Остатки из каждой из этих HVR указаны ниже.
Области HVR могут содержать "удлиненные HVR" следующим образом: 24-36 или 24-34 (L1), 46-56 или 50-56 (L2) и 89-97 или 89-96 (L3) в VL, и 26-35 (H1), 50-65 или 47-65 (предпочтительный вариант осуществления) (H2) и 93-102 (H3) в VH. Остатки вариабельных доменов пронумерованы согласно Kabat et al., выше, для каждого из этих определений удлиненных HVR.
Остатки "каркасной области" или "FR" представляют собой остатки вариабельного домена, отличные от остатков HVR, как определено в настоящем документе.
Выражение "нумерация остатков вариабельных доменов по Kabat" или "нумерация аминокислотных положений по Kabat", и их варианты, относится к системе нумерации, используемой для вариабельных доменов тяжелой цепи или вариабельных доменов легкой цепи из собрания антител в Kabat et al., выше. С использованием этой системы нумерации действительная линейная аминокислотная последовательность может содержать меньшее количество аминокислот или дополнительные аминокислоты, соответствующие укорочению FR или HVR вариабельного домена, или вставке в них. Например, вариабельный домен тяжелой цепи может включать вставку одной аминокислоты (остаток 52a согласно Kabat) после остатка 52 H2 и встроенные остатки (например, остатки 82a, 82b и 82c, и т.д. согласно Kabat) после остатка 82 FR тяжелой цепи. Нумерацию остатков по Kabat можно определять для данного антитела посредством выравнивания в областях гомологии последовательности антитела со "стандартной" пронумерованной по Kabat последовательностью.
"Акцепторная каркасная область человека" для целей, представленных в настоящем документе, представляет собой каркасную область, содержащую аминокислотную последовательность каркасной области VL или VH, образованную каркасной областью иммуноглобулина человека или консенсусной каркасной областью человека. Акцепторная каркасная область человека, "образованная" каркасной областью иммуноглобулина человека или консенсусной каркасной областью человека, может содержать такую же его аминокислотную последовательность, или она может содержать ранее существующие изменения аминокислотной последовательности. В некоторых вариантах осуществления количество ранее существующих аминокислотных изменений составляет 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее или 2 или менее.
"Консенсусная каркасная область человека" представляет собой каркасную область, которая представляет собой наиболее часто встречающиеся аминокислотные остатки при выборе последовательностей каркасной области VL или VH иммуноглобулина человека. Как правило, выбор последовательностей VL или VH иммуноглобулина человека проводят из подгруппы последовательностей вариабельных доменов. Как правило, подгруппа последовательностей представляет собой подгруппу согласно Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991). В одном варианте осуществления, для VL, подгруппа представляет собой подгруппу каппа I согласно Kabat et al., выше. В одном варианте осуществления, для VH, подгруппа представляет собой подгруппу III согласно Kabat et al., выше.
"Консенсусная каркасная область подгруппы III VH" содержит консенсусную последовательность, полученную из аминокислотных последовательностей подгруппы III вариабельного домена тяжелой цепи согласно Kabat et al., выше. В одном варианте осуществления аминокислотная последовательность консенсусной каркасной области подгруппы III VH содержит по меньшей мере часть из следующих последовательностей или все из них: EVQLVESGGGLVQPGGSLRLSCAAS (H1) (SEQ ID NO:55), WVRQAPGKGLEWVA (SEQ ID NO:56) (H2), RFTISRDDSKNTLYLQMNSLRAEDTAVYYCAR (SEQ ID NO:57) (H3), WGQGTLVTVSS (SEQ ID NO:58) (H4).
"Консенсусная каркасная область подгруппы I VL" содержит консенсусную последовательность, полученную из аминокислотных последовательностей в подгруппе I вариабельного домена легкой цепи каппа Kabat et al., выше. В одном варианте осуществления аминокислотная последовательность консенсусной каркасной области подгруппы I VH содержит по меньшей мере часть из следующих последовательностей, или все из них: DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO:59) (L1), WYQQKPGKAPKLLIY (SEQ ID NO:60) (L2), GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO:61) (L3), FGQGTKVEIKR (SEQ ID NO:62) (L4).
"Модификация аминокислот" в указанном положении, например Fc-области, относится к замене или делеции указанного остатка, или вставке по меньшей мере одного аминокислотного остатка рядом с указанным остатком. Вставка "рядом" с указанным остатком означает вставку в пределах одного или двух остатков от него. Вставка может быть N-концевой или C-концевой относительно указанного остатка. Предпочтительной модификацией аминокислот в настоящем документе является замена.
Антитело "с созреванием аффинности" представляет собой антитело с одним или несколькими изменениями в одной или нескольких его HVR, которые приводят к повышению аффинности антитела к антигену по сравнению с исходным антителом, которое не обладает этим изменением(ями). В одном варианте осуществления антитело с созреванием аффинности обладает наномолярной или даже пикомолярной аффинностью к антигену-мишени. Антитела с созреванием аффинности получают способами, известными в данной области. Например, Marks et al., Bio/Technology 10:779-783 (1992) описывают созревание аффинности "перетасовкой" VH- и VL-доменов. Случайный мутагенез остатков HVR и/или каркасной области описан, например: Barbas et al. Proc Nat. Acad. Sci. USA 91:3809-3813 (1994); Schier et al. Gene 169:147-155 (1995); Yelton et al. J. Immunol. 155:1994-2004 (1995); Jackson et al., J. Immunol. 154(7):3310-9 (1995); и Hawkins et al., J. Mol. Biol. 226:889-896 (1992).
Антитело, которое "специфично связывается с" или является "специфичным к" конкретному полипептиду или эпитопу на конкретном полипептиде, представляет собой антитело, которое связывается с конкретным полипептидом или эпитопом на конкретном полипептиде без существенного связывания с любым другим полипептидом или эпитопом полипептида. Например, специфичные к М1' антитела по настоящему изобретению являются специфичными к внеклеточному сегменту М1' IgE, находящемуся на IgE, связанном на B-клетках, но отсутствующему на секретируемых IgE.
"Блокирующее" антитело или "антитело-антагонист" представляет собой антитело, которое ингибирует или снижает биологическую активность антигена, который оно связывает. В некоторых вариантах осуществления блокирующие антитела или антитела-антагонисты значительно или полностью ингибируют биологическую активность антигена. Апоптотические антитела против IgE по изобретению блокируют активность IgE в отношении опосредования иммунного ответа таким образом, чтобы снизились как свободный сывороточный, так и тотальный сывороточный IgE.
Антитела, которые "индуцируют апоптоз" или являются "апоптотическими", представляют собой антитела, которые индуцируют запрограммированную клеточную гибель, как определяют стандартными способами анализа апоптоза, такими как связывание аннексина V, фрагментация ДНК, сморщивание клеток, набухание эндоплазматической сети, фрагментация клетки и/или образование мембранных везикул (называемых апоптотическими тельцами). Например, апоптотическую активность антител против IgE по настоящему изобретению можно показать окрашиванием клеток со связанным на поверхности IgE аннексином V.
Термин "тотальный сывороточный IgE" относится к тотальному количеству IgE, присутствующему в образце, включая как свободный или несвязанный, так и IgE, который находится в комплексе с партнером по связыванию (например, антителом против IgE, обладающей IgE B-клеткой). "Свободный сывороточный IgE" относится к IgE, который не связан с партнером по связыванию.
Термин "аллергенспецифичный IgE" относится к IgE, который является специфичным к конкретному антигену, вследствие первоначального воздействия антигена в процессе, известном как аллергическая сенсибилизация, который связывает поверхность тучных клеток и базофилов и который может вызывать активацию тучных клеток и базофилов при последующем воздействии того же аллергена. Некоторые митогенные факторы в вирусах (например, цитомегаловирус - CMV), бактериях (например, Staphylococcus), гельминтах (например, Ascaris, Schistosoma) и адъювантные факторы в загрязненном воздухе (например, сигаретный дым и дизельный выхлоп) стимулируют продукцию молекул IgE без инициации какой-либо специфичной к аллергену IgE-сенсибилизации. Таким образом, поскольку уровни IgE могут повышаться таким образом, который не обязательно предрасполагает хозяина к тому, чтобы он стал более чувствительным к опосредуемому IgE нарушению, иногда уровни аллергенспецифичного IgE используют при клинической оценке.
Термин "специфично устраняет продуцирующие IgE B-клетки" означает способность специфично снижать популяцию или эффективность B-клеток, которые специфично секретируют IgE (т.е. плазматических клеток), но не оказывают существенного влияния на популяцию или эффективность B-клеток, которые секретируют другие иммуноглобулины, такие как IgG1, IgG2, IgG3, IgG4, IgA и IgM.
Термин "твердая фаза" означает неводную матрицу, к которой антитело по настоящему изобретению может прикрепляться. Примеры твердых фаз, охватываемые в настоящем документе, включают твердые фазы, образованные частично или полностью из стекла (например, стекла с контролируемым размером пор), полисахаридов (например, агарозы), полиакриламидов, полистирола, поливинилового спирта и силиконов. В определенных вариантах осуществления, в зависимости от контекста, твердая фаза может включать лунку планшета для анализа; в других вариантах осуществления она представляет собой колонку для очистки (например, колонку для аффинной хроматографии). Также этот термин включает дисперсную твердую фазу из дискретных частиц, такую как твердая фаза, описанная в патенте США № 4275149.
"Эффекторные функции" антитела относятся к видам биологической активности, свойственным Fc-области (Fc-области с нативной последовательностью или Fc-области варианта по аминокислотной последовательности) антитела, и они могут варьировать в зависимости от изотипа антитела. Примеры эффекторных функций антитела включают: связывание C1q и комплементзависимую цитотоксичность; связывание Fc-рецептора; антителозависимую клеточно-опосредуемую цитотоксичность (ADCC); фагоцитоз; подавление рецепторов клеточной поверхности (например, рецепторов B-клеток) и активацию B-клеток.
"Антителозависимая клеточно-опосредуемая цитотоксичность" или ADCC относится к форме цитотоксичности, при которой секретируемый Ig, связанный с Fc-рецепторами (FcR), присутствующими на определенных цитотоксических клетках (например, естественных киллерных (NK) клетках, нейтрофилах и макрофагах), позволяет этим цитотоксическим эффекторным клеткам связываться специфично с обладающей антигеном клеткой-мишенью и впоследствии уничтожать клетку-мишень посредством цитотоксинов. Антитела "вооружают" цитотоксические клетки, и они необходимы для уничтожения клетки-мишени посредством этого механизма. Основные клетки для осуществления ADCC, NK-клетки, экспрессируют только FcγRIII, в то время как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на кроветворных клетках представлена в таблице 3 на странице 464 Ravetch and Kinet, Annu. Rev. Immunol. 9:457-92 (1991). Для оценки активности представляющей интерес молекулы в отношении ADCC можно проводить анализ ADCC in vitro, такой как анализ, описанный в патенте США №№ 5500362 или 5821337. Пригодные для таких анализов эффекторные клетки включают мононуклеарные клетки периферической крови (PBMC) и естественные киллерные (NK) клетки. Альтернативно, или дополнительно, активность представляющей интерес молекулы в отношении ADCC можно оценивать in vivo, например, в модели на животных, такой как описана в Clynes et al. PNAS (USA) 95:652-656 (1998).
Если в настоящем документе нет иных указаний, нумерация остатков в тяжелой цепи иммуноглобулина представляет собой нумерацию согласно индексу EU по Kabat et al., выше. "Индекс EU по Kabat" относится к нумерации остатков антитела EU IgG1 человека.
Термин "Fc-область" в настоящем документе используют для определения C-концевого участка тяжелой цепи иммуноглобулина, включая Fc-области с нативной последовательностью и варианты Fc-областей. Хотя границы Fc-области тяжелой цепи иммуноглобулина могут варьировать, Fc-область тяжелой цепи IgG человека определяется как участок от аминокислотного остатка в положении Cys226, или от Pro230, до его C-конца. C-концевой лизин (остаток 447 согласно системе нумерации EU) Fc-области можно быть удален, например, в ходе продукции или очистки антитела, или посредством рекомбинантной инженерии нуклеиновой кислоты, кодирующей тяжелую цепь антитела. Таким образом, композиция интактных антител может содержать совокупности антител, где все остатки K447 удалены, совокупности антител, где остатки K447 не удалены, и совокупности антител, имеющие смесь антител с остатком K447 и без него. Пригодные Fc-области с нативной последовательностью для применения в антителах по изобретению включают IgG1, IgG2, IgG3 и IgG4 человека.
"Fc-рецептор" или "FcR" относится к рецептору, который связывается с Fc-областью антитела. Предпочтительным FcR является FcR человека с нативной последовательностью. Более того, предпочтительным FcR является FcR, который связывает антитело IgG (гамма-рецептор) и включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, в том числе аллельные варианты и альтернативно сплайсированные формы этих рецепторов, рецепторы FcγRII включают FcγRIIA ("активирующий рецептор") и FcγRIIB ("ингибирующий рецептор"), которые обладают сходными аминокислотными последовательностями, отличающимися, главным образом, своими цитоплазматическими доменами. Активирующий рецептор FcγRIIA в своем цитоплазматическом домене содержит иммунорецепторный тирозинсвязывающий активирующий мотив (ITAM). Ингибирующий рецептор FcγRIIB в своем цитоплазматическом домене содержит иммунорецепторный тирозинсвязывающий ингибирующий мотив (ITIM) (см. M. Daeron, Annu. Rev. Immunol. 15:203-234 (1997)). FcR рассмотрены в Ravetch and Kinet, Annu. Rev. Immunol. 9:457-92 (1991); Capel et al., Immunomethods 4:25-34 (1994); и de Haas et al., J. Lab. Clin. Med. 126:330-41 (1995). К термину "FcR" в настоящей заявке относятся другие FcR, том числе FcR, которые будут выявлены в будущем.
Термин "Fc-рецептор" или "FcR" также включает неонатальный рецептор, FcRn, который отвечает за перенос материнских IgG плоду. Guyer et al., J. Immunol. 117:587 (1976) и Kim et al., J. Immunol. 24:249 (1994). Способы определения связывания с FcRn известны (см., например, Ghetie and Ward, Immunol. Today 18:(12):592-8 (1997); Ghetie et al., Nature Biotechnology 15(7):637-40 (1997); Hinton et al., J. Biol. Chem. 279(8):6213-6 (2004); WO 2004/92219 (Hinton et al.).
Связывание с FcRn in vivo и время полужизни в сыворотке высокоаффинных связывающих полипептидов FcRn человека можно анализировать, например, у трансгенных мышей или в трансфицированных клеточных линиях человека, экспрессирующих FcRn человека, или у приматов, которым вводят полипептиды, имеющие вариант Fc-области. В WO 2004/42072 (Presta) описаны варианты антитела, которые повышают или снижают связывание с FcR. Также см., например, Shields et al., J. Biol. Chem. 9(2):6591-6604 (2001).
"Эффекторные клетки человека" представляют собой лейкоциты, которые экспрессируют один или несколько FcR и выполняют эффекторные функции. Предпочтительно клетки экспрессируют по меньшей мере FcγRIII и выполняют эффекторную функцию ADCC. Примеры лейкоцитов человека, которые опосредуют ADCC, включают мононуклеарные клетки периферической крови (PBMC), естественные киллерные (NK) клетки, моноциты, цитотоксические T-клетки и нейтрофилы, причем клетки PBMC и MNK являются предпочтительными. Эффекторные клетки можно выделять из природного источника, например крови.
"Комплементзависимая цитотоксичность" или "CDC" относится к лизису клетки-мишени в присутствии комплемента. Активация классического каскада комплемента запускается связыванием первого компонента системы комплемента (C1q) с антителами (соответствующего подкласса), которые связываются с узнаваемым ими антигеном. Для анализа активации комплемента можно проводить анализ CDC, например, как описано в Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996).
Полипептидные варианты с измененными аминокислотными последовательностями Fc-области и повышенной или сниженной способностью связывать C1q описаны в патенте США № 6194551B1 и WO99/51642. Содержание этих патентных публикаций конкретно включено в настоящий документ в качестве ссылки. Также см., Idusogie et al. J. Immunol. 164:4178-4184 (2000).
Участок N-гликозилирования в IgG находится в области Asn297 CH2-домена. Также настоящее изобретение относится к композициям связывающего CD20 гуманизированного антитела, имеющего Fc-область, где приблизительно 80-100% (и предпочтительно приблизительно 90-99%) антитела в композиции содержит зрелую коровую углеводную структуру, которая лишена фукозы, связанную с Fc-областью гликопротеина. В настоящем документе показано, что такие композиции проявляют неожиданное повышение связывания с FcγRIIIA(F158), которое не настолько эффективно, как связывание с FcγRIIIA (V158), в отношении взаимодействия с IgG человека. Таким образом, ожидается, что композиции, представленные в настоящем документе, превзойдут ранее описанные композиции антител против CD20, особенно для лечения пациентов-людей, у которых экспрессируется FcγRIIIA (F158). FcγRIIIA (F158) является более распространенным, чем FcγRIIIA (V158) у нормальных здоровых афроамериканцев и европейцев. См. Lehrnbecher et al. Blood 94:4220 (1999). Кроме того, в настоящей заявке показано синергичное повышение связывания FcγRIII и/или функции ADCC, которое является следствием комбинирования вариантов по гликозилированию, представленных в настоящем документе, с модификацией(ями) аминокислотной последовательности в Fc-области гликопротеина.
"Аффинность связывания", главным образом, относится к силе всех суммарных нековалентных взаимодействий между одним участком связывания молекулы (например, антитела) и его партнера по связыванию (например, антигена). Если нет иных указаний, как используют в настоящем документе, "аффинность связывания" относится к свойственной аффинности связывания, которая отражает взаимодействие 1:1 между членами связывающейся пары (например, антитела и антигена). Аффинность молекулы X к ее партнеру Y может быть представлена, главным образом, с помощью константы диссоциации (Kd). Аффинность можно определять обычными способами, известными в данной области, включая способы, описанные в настоящем документе. Низкоаффинные антитела, как правило, связывают антиген медленно и имеют тенденцию легко диссоциировать, а высокоаффинные антитела, как правило, связывают антиген быстрее и имеют тенденцию оставаться в связанном состоянии дольше. В данной области известно множество способов определения аффинности связывания, любые из которых можно использовать для целей настоящего изобретения. Конкретные иллюстративные и типовые варианты осуществления для определения аффинности связывания описаны ниже.
В одном варианте осуществления "Kd" или "значение Kd" по этому изобретению определяют с помощью анализа связывания меченного радиоактивной меткой антигена (RIA), проводимого с Fab-вариантом представляющего интерес антитела и его антигеном, как описано для представленного ниже анализа. Связывающую аффинность в растворе Fab к антигену определяют посредством уравновешивания Fab минимальной концентрацией (125I)-меченного антигена в присутствии титрованных серий немеченого антигена, а затем захвата связанного антигена с помощью покрытого антителом против Fab планшета (см., например, Chen et al., J. Mol. Biol. 293:865-881 (1999)). Для определения условий анализа на микропланшеты для титрования (DYNEX Technologies, Inc.) наносят в течение ночи 5 мкг/мл улавливающего антитела против Fab (Cappel Labs) в 50 мМ карбонате натрия (pH 9,6), а затем блокируют 2% (масс./об.) бычьим сывороточным альбумином в PBS в течение от двух до пяти часов при комнатной температуре (приблизительно 23°C). В планшете без адсорбента (Nunc #269620), 100 пМ или 26 пМ [125I]-антигена смешивают с серийными разведениями представляющего интерес Fab (например, в соответствии с оценкой антитела против VEGF, Fab-12, в Presta et al., Cancer Res. 57:4593-4599 (1997)). Затем представляющий интерес Fab инкубируют в течение ночи; однако инкубацию можно продолжать в течение более длительного периода (например, приблизительно 65 часов), чтобы обеспечить достижение равновесия. После этого смеси переносят в улавливающий планшет для инкубации при комнатной температуре (например, в течение одного часа). Затем раствор удаляют, и планшет промывают восемь раз 0,1% раствором поверхностно-активного вещества TWEEN-20TM в PBS. После высыхания планшетов добавляют 150 мкл/лунка сцинтилляционной жидкости (MICROSCINT-20TM; Packard), и планшеты подвергают подсчету на гамма-счетчике TOPCOUNTTM (Packard) в течение десяти минут. Концентрации каждого Fab, которые дают меньше или равно 20% максимального связывания, выбирают для применения в конкурентных анализах связывания.
Согласно другому варианту осуществления Kd определяют с использованием анализов поверхностного плазмонного резонанса с использованием инструмента BIACORE®-2000 или BIACORE®-3000 (BIAcore, Inc., Piscataway, NJ) при 25°C с чипами с иммобилизованным антигеном CM5 при ~10 единиц ответа (RU). В кратком изложении, биосенсорные чипы из карбоксиметилированного декстрана (CM5, BIAcore Inc.) активируют гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) согласно инструкциям поставщика. Антиген разбавляют 10 мМ ацетатом натрия, pH 4,8, до 5 мкг/мл (~0,2 мкМ) перед инъекцией со скоростью потока 5 мкл/минута для достижения приблизительно 10 единиц ответа (RU) связанного белка. После инъекции антигена инъецируют 1M этаноламин для блокирования не вступивших в реакцию групп. Для определения кинетики двукратные серийные разведения Fab (от 0,78 нМ до 500 нМ) инъецируют в PBS с 0,05% раствором поверхностно-активного вещества TWEEN 20TM (PBST) при 25°C при скорости потока приблизительно 25 мкл/мин. Константы ассоциации (kon) и константы диссоциации (koff) вычисляют с использованием простой модели связывания Ленгмюра "один к одному" (BIAcore® Evaluation Software version 3.2) посредством одновременной подгонки сенсограмм ассоциации и диссоциации. Равновесную константу диссоциации (Kd) вычисляют как отношение koff/kon. См., например, Chen et al., J. Mol. Biol. 293:865-881 (1999). Если константа ассоциации превышает 106 M-1 с-1 посредством анализа поверхностного плазмонного резонанса, выше, то константу ассоциации можно определить с использованием способа флуоресцентного тушения, посредством которого определяют повышение или снижение интенсивности испускания флуоресценции (возбуждение = 295 нм; испускание = 340 нм, полоса пропускания 16 нм) при 25°C для 20 нМ антитела против антигена (форма Fab) в PBS, pH 7,2, в присутствии возрастающих концентраций антигена, как определяют в спектрофотометре, таком как оборудованный останавливаемой струей спектрофотометр (Aviv Instruments) или спектрофотометр серии 8000 SLM-AMINCOTM (ThermoSpectronic) со встряхиваемой кюветой.
"Константа ассоциации", "скорость ассоциации", "коэффициент ассоциации" или "kon" согласно этому изобретению также можно определить, как описано выше, с использованием системы BIACORE®-2000 или BIACORE®-3000 (BIAcore, Inc., Piscataway, NJ).
Выражение "по существу сниженный" или "по существу отличающийся", как используют в настоящем документе, означает достаточно высокую степень отличия между двумя числовыми значениями (как правило, одно из них ассоциировано с молекулой, а другое ассоциировано с эталонной/сравниваемой молекулой), так что специалист в данной области может считать отличие между двумя значениями статистическими значимыми в контексте биологической характеристики, определяемой указными значениями (например, значениями Kd). Отличие между указанными двумя значениями, например, превышает приблизительно 10%, превышает приблизительно 20%, превышает приблизительно 30%, превышает приблизительно 40% и/или превышает приблизительно 50% относительно значения эталонной/сравниваемой молекулы.
Термин "по существу сходный" или "по существу одинаковый", как используют в настоящем документе, обозначает достаточно высокую степень сходства между двумя числовыми значениями (например, одно из них ассоциировано с антителом по изобретению, а другое ассоциировано с эталонным/сравниваемым антителом), так что специалист в данной области может считать отличие между двумя значениями небольшими или не имеющими биологической и/или статистической значимости в контексте биологической характеристики, определяемой указанными значениями (например, значениями Kd). Отличие между указанными двумя значениями составляет, например, менее чем приблизительно 50%, менее чем приблизительно 40%, менее чем приблизительно 30%, менее чем приблизительно 20% и/или менее чем приблизительно 10% относительно эталонного/сравниваемого значения.
"Процентную (%) идентичность аминокислотной последовательности" или "гомологию" в отношении последовательности пептида, полипептида или антитела определяют как процентное количество аминокислотных остатков в последовательности-кандидате, которые идентичны с аминокислотными остатками в конкретной пептидной или полипептидной последовательности после выравнивания последовательностей и внесения пропусков, если необходимо, для достижения максимальной процентной идентичности последовательностей, и не считая какие-либо консервативные замены частью идентичности последовательностей. Выравнивание для целей определения процентной идентичности аминокислотных последовательностей можно проводить различными способами, которые находятся в пределах специальных знаний, например, с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN или MEGALIGN™ (DNASTAR). Специалисты в данной области могут определить соответствующие параметры для проведения выравнивания, включая любые алгоритмы, требуемые для достижения максимального выравнивания на протяжении всей длины сравниваемых последовательностей. Однако для целей, представленных в настоящем документе, значения % идентичности аминокислотных последовательностей получают с использованием компьютерной программы для сравнения последовательностей ALIGN-2, созданной Genentech, Inc. Исходный текст был представлен с пользовательской документацией в U.S. Copyright Office, Washington D.C., 20559, где он зарегистрирован под U.S. Copyright Registration No. TXU510087. Программа ALIGN-2 является общедоступной через Genentech, Inc., South San Francisco, California. Программа ALIGN-2 должна быть составлена для применения на операционной системе UNIX, предпочтительно цифровой UNIX V4.0D. Все параметры сравнения последовательностей установлены программой ALIGN-2 и не изменяются.
В случаях когда ALIGN-2 используют для сравнений аминокислотных последовательностей, % идентичность аминокислотных последовательностей данной аминокислотной последовательности A к, с или против данной аминокислотной последовательности B (которую альтернативно можно назвать данной аминокислотной последовательностью A, которая содержит определенную % идентичность аминокислотной последовательности к, с или против данной аминокислотной последовательности B) можно вычислять следующим образом:
100 умножить на частное X/Y,
где X представляет собой число аминокислотных остатков, оцененных как идентичные совпадения программой выравнивания или алгоритмом выравнивания последовательностей A и B, и где Y представляет собой общее количество аминокислотных остатков в B. Понятно, что когда длина аминокислотной последовательности A не равна длине аминокислотной последовательности B, % идентичность аминокислотной последовательности A к B не будет равна % идентичности аминокислотной последовательности B к A.
Если конкретно не указано иное, все значения % идентичности аминокислотных последовательностей, используемые в настоящем документе, получают, как описано в предыдущем абзаце с использованием компьютерной программы ALIGN-2.
“Выделенная” молекула нуклеиновой кислоты, кодирующая антитела, представленные в настоящем документе, представляет собой молекулу нуклеиновой кислоты, которая идентифицирована и отделена по меньшей мере от одной загрязняющей молекулы нуклеиновой кислоты, с которой она обычно ассоциирована в окружении, в котором она продуцирована. Предпочтительно выделенная нуклеиновая кислота не ассоциирована с компонентами, ассоциированными с окружением, где она продуцируется. Выделенные молекулы нуклеиновых кислот, кодирующие полипептиды и антитела, представленные в настоящем документе, находятся в форме, отличной от формы или условий, в которых она встречается в природе. Таким образом, выделенные молекулы нуклеиновых кислот отличаются от молекулы нуклеиновой кислоты, кодирующей полипептиды и антитела, представленные в настоящем документе, которые существуют в клетках в природе.
Термин “последовательности контроля” относится к последовательностям ДНК, необходимым для экспрессии функционально связанной кодирующей последовательности в конкретном организме-хозяине. Контрольные последовательности, которые пригодны для прокариот, включают, например, промотор, необязательно последовательность оператора и участок связывания рибосом. Известно, что эукариотические клетки используют промоторы, сигналы полиаденилирования и энхансеры.
Нуклеиновая кислота является "функционально связанной", если она находится в функциональной связи с другой последовательностью нуклеиновой кислоты. Например, ДНК для препоследовательности или секреторной лидерной последовательности функционально связана с ДНК полипептида, если она экспрессируется в качестве пребелка, который участвует в секреции полипептида; промотор или энхансер является функционально связанным с кодирующей последовательностью, если он влияет на транскрипцию последовательности; или участок связывания рибосом является функционально связанным с кодирующей последовательностью, если он расположен таким образом, чтобы облегчить трансляцию. Как правило, "функционально связанный" означает, что связанные последовательности ДНК являются соседними, и, в случае секреторной лидерной последовательности, являются соседними и находятся в рамке считывания. Однако энхансеры на должны быть смежными. Связывание осуществляют посредством лигирования в соответствующих участках рестрикции. Если таких участков нет, используют синтетические олигонуклеотидные соединительные элементы или линкеры в соответствии с общепринятой практикой.
Термин "меченный эпитопом", при применении в настоящем документе, относится к химерному полипептиду, содержащему полипептид или антитело, описанные в настоящем документе, которые являются слитыми с "полипептидом-меткой". Полипептид-метка имеет достаточное количество остатков для обеспечения эпитопа, против которого можно получать антитело, но в то же время является достаточно коротким, чтобы не препятствовать активности полипептида, с которым он слит. Также полипептид-метка предпочтительно является совершенно уникальным, так что антитело, по существу, не вступает в перекрестные реакции с другими эпитопами. Пригодные полипептиды-метки, как правило, имеют по меньшей мере шесть аминокислотных остатков, как правило, между приблизительно 8 и 50 аминокислотных остатков (предпочтительно между приблизительно 10 и 20 аминокислотных остатков).
Как используют в настоящем документе, термин "иммуноадгезин" означает подобные антителу молекулы, которые сочетают специфичность связывания гетерологичного белка ("адгезин") с эффекторными функциями константных доменов иммуноглобулинов. Структурно иммуноадгезины содержат аминокислотную последовательность с требуемой специфичностью связывания, отличающуюся от участка распознавания антигена и участка связывания антитела (т.е. являющуюся "гетерологичной"), слитую с последовательностью константного домена иммуноглобулина. Часть адгезина в молекуле иммуноадгезина, как правило, представляет собой непрерывную аминокислотную последовательность, содержащую по меньшей мере участок связывания рецептора или лиганда. Последовательность константного домена иммуноглобулина в иммуноадгезине может быть получена из любого иммуноглобулина, такого как изотипы IgG-1, IgG-2, IgG-3 или IgG-4, IgA (включая IgA-1 и IgA-2), IgE, IgD или IgM. Слитые молекулы Ig предпочтительно включают замену доменом полипептида или антитела, описанного в настоящем документе, по меньшей мере одного вариабельного участка в молекуле Ig. В особенно предпочтительном варианте осуществления слитая молекула иммуноглобулина включает шарнирную область, CH2 и CH3, или шарнирную область, CH1-, CH2- и CH3-участки молекулы IgG1. Для получения слитых молекул иммуноглобулинов также см. патент США № 5428130, выданный 27 июня 1995 года. Например, пригодные иммуноадгезины в качестве вторых лекарственных средств, пригодных для комбинированной терапии, представленной в настоящем документе, включают полипептиды, которые содержат связывающие BLyS участки рецептора BLyS без слияния трансмембранного BR3, TACI или BCMA с константным доменом последовательности иммуноглобулина.
"Слитый белок" и "слитый полипептид" относятся к полипептиду, имеющему два участка, ковалентно связанных друг с другом, где каждый из участков представляет собой полипептид, имеющий отличающееся свойство. Свойство может представлять собой биологическое свойство, такое как активность in vitro или in vivo. Также свойство может представлять собой простое химическое или физическое свойство, такое как связывание с молекулой-мишенью, катализ реакции и т.д. Два участка могут быть связаны прямо простой пептидной связью или через пептидный линкер, и они будут находиться в рамке считывания друг с другом.
"Стабильный" состав представляет собой состав, в котором белок, по существу, сохраняет свою физическую и химическую стабильность и целостность при хранении. В данной области доступны различные аналитические способы определения стабильности белка, и они рассмотрены в Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, New York, Pubs. (1991) и Jones, A. Adv. Drug Delivery Rev. 10:29-90 (1993). Стабильность можно определять при выбранной температуре в течение выбранного периода времени. Для быстрого скрининга состав можно держать при 40°C в течение от 2 недель до 1 месяца, в течение которых измеряют стабильность. Когда состав надлежит хранить при 2-8°C, как правило, состав должен быть стабильным при 30°C или 40°C в течение по меньшей мере 1 месяца, и/или он должен быть стабильным при 2-8°C в течение по меньшей мере 2 лет. Когда состав подлежит хранению при 30°C, как правило, состав должен быть стабильным в течение по меньшей мере 2 лет при 30°C и/или стабильным при 40°C в течение по меньшей мере 6 месяцев. Например, в качестве индикатора стабильности белка в ходе хранения можно использовать степень агрегации. Таким образом, "стабильный" состав может представлять собой состав, где менее чем приблизительно 10% и предпочтительно менее чем приблизительно 5% белка присутствует в качестве агрегата в составе. В других вариантах осуществления можно определять любое повышение образования агрегатов в ходе хранения состава.
"Восстановленный" состав представляет собой состав, который получен разбавлением лиофилизированного состава белка или антитела в разбавителе, так что этот белок диспергирован в нем. Разбавленный состав пригоден для введения (например, парентерального введения) пациенту, подлежащему лечению представляющим интерес белком, и в определенных вариантах осуществления изобретения он может представлять собой состав, который пригоден для подкожного введения.
"Изотонический" состав представляет собой состав, который обладает, по существу, таким же осмотическим давлением, что и кровь человека. Изотонические составы, как правило, будут иметь осмотическое давление от приблизительно 250 до 350 мосм. Термином "гипотонический" описывают состав с осмотическим давлением ниже осмотического давления крови человека. Соответственно, термин "гипертонический" используют для описания состава с осмотическим давлением выше осмотического давления крови человека. Изотоничность можно определять с использованием, например, парофазного осмометра или замораживающего осмометра. Составы по настоящему изобретению являются гипертоничными в результате добавления соли и/или буфера.
Как используют в настоящем документе, "носители" включают фармацевтически приемлемые носители, эксципиенты или стабилизаторы, которые являются нетоксичными для клетки или млекопитающего, подвергаемых их воздействию, в используемых дозировках и концентрациях. Часто физиологически приемлемый носитель представляет собой водный pH-буферный раствор. Примеры физиологически приемлемых носителей включают буферы, такие как фосфат, цитрат, и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту; низкомолекулярные (менее чем приблизительно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как EDTA; спирты сахаров, такие как маннит или сорбит; солеобразующие противоионы, такие как натрий; и/или неионные поверхностно-активные вещества, такие как TWEEN™, полиэтиленгликоль (PEG) и PLURONICS™.
"Вкладыш в упаковку" относится к инструкциям, обычно включаемым в коммерческие упаковки лекарственных средств, которые содержат информацию о показаниях, обычно включаемую в коммерческие упаковки лекарственных средств, которые содержат информацию о показаниях, применении, дозировке, введении, противопоказаниях, других лекарственных средствах, подлежащих комбинированию с упакованным продуктом, и/или предупреждения, касающиеся применения таких лекарственных средств и т.д.
"Фармацевтически приемлемая кислота" включает неорганические и органические кислоты, которые являются нетоксичными в концентрации и форме, в которых они включены в состав. Например, пригодные неорганические кислоты включают хлороводородную, перхлорную, бромоводородную, йодоводородную, азотную, серную, сульфоновую, сульфиновую, сульфаниловую, фосфорную, угольную и т.д. Пригодные органические кислоты включают прямые и разветвленные алкильные, ароматические, циклические, циклоалифатические, арилалифатические, гетероциклические, насыщенные, ненасыщенные, моно-, ди- и трикарбоновые кислоты, включая, например, муравьиную, уксусную, 2-гидроксиуксусную, трифторуксусную, фенилуксусную, триметилуксусную, трет-бутилуксусную, антраниловую, пропановую, 2-гидроксипропановую, 2-оксопропионовую, пропандиовую, циклопентанпропионовую, циклопентанпропионовую, 3-фенилпропионовую, бутановую, бутандиовую, бензойную, 3-(4-гидроксибензоил)бензойную, 2-ацетоксибензойную, аскорбиновую, коричную, лаурилсерную, стеариновую, муконовую, миндальную, янтарную, эмбоновую, фумаровую, яблочную, малеиновую, гидроксималеиновую, малоновую, молочную, лимонную, виннокаменную, гликолевую, гликоновую, глюконовую, пировиноградную, глиоксаловую, щавелевую, мезиловую, янтарную, салициловую, фталовую, пальмовую, пальмеиновую, тиоциановую, метансульфоновую, этансульфоновую, 1,2-этандисульфоновую, 2-гидроксиэтансульфоновую, бензолсульфоновую, 4-хлорбензолсульфоновую, нафталин-2-сульфоновую, п-толуолсульфоновую, камфорсульфоновую, 4-метилбицикло[2.2.2]-окт-2-ен-1-карбоновую, глюкогептоновую, 4,4'-метиленбис-3-(гидрокси-2-ен-1-карбоновую), гидроксинафтоевую кислоты.
"Фармацевтически приемлемые основания" включают неорганические и органические основания, которые являются нетоксичными в концентрации и форме, в которых они включены в состав. Например, пригодные основания включают основания, образованные образующими неорганическое основание металлами, такими как литий, натрий, калий, магний, кальций, аммоний, железо, цинк, медь, марганец, алюминий, N-метилглюкамин, морфолин, пиперидин, и органические нетоксические основания, включая первичные, вторичные и третичные амины, замещенные амины, циклические амины и основные ионообменные смолы, [например, N(R')4+ (где R' независимо представляет собой H или C1-4алкил, например, аммоний, Tris)], например, изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, 2-диэтиламиноэтанол, триметамин, дициклогексиламин, лизин, аргинин, гистидин, кофеин, прокаин, гидрабамин, холин, бетаин, этилендиамин, глюкозамин, метилглюкамин, теобромин, пурины, пиперазин, пиперидин, N-этилпиперидин, полиаминовые смолы и т.п. Особенно предпочтительными органическими нетоксическими основаниями являются изопропиламин, диэтиламин, этаноламин, триметамин, дициклогексиламин, холин и кофеин.
Дополнительные фармацевтически приемлемые кислоты и основания, применимые с настоящим изобретением, включают кислоты и основания, которые образованы из аминокислот, например гистидина, глицина, фенилаланина, аспарагиновой кислоты, глутаминовой кислоты, лизина и аспарагина.
"Фармацевтически приемлемые" буферы и соли включают буферы и соли, образованные как из кислотно-аддитивных солей, так и из основно-аддитивных солей указанных выше кислот и оснований. Конкретные буферы и/или соли включают гистидин, сукцинат и ацетат.
"Фармацевтически приемлемый сахар" представляет собой молекулу, которая, при комбинировании с представляющим интерес белком, значительно препятствует или снижает химическую и/или физическую нестабильность белка при хранении. Когда состав предназначен для лиофилизации и последующего восстановления, "фармацевтически приемлемые сахара" также могут быть известны в качестве "лиопротектора". Иллюстративные сахара и их соответствующие спирты сахаров включают: аминокислоту, такую как моноглутамат натрия или гистидин; метиламин, такой как бетаин; лиотропную соль, такую как сульфат магния; полиол, такой как трехатомные спирты сахаров или спирты сахаров с большей молекулярной массой, например глицерин, декстран, эритрит, глицерин, арабит, ксилит, сорбит и маннит; пропиленгликоль; полиэтиленгликоль; PLURONICS®; и их сочетания. Дополнительные иллюстративные лиопротекторы включают глицерин и желатин, и сахара мелибиозу, мелизитозу, рафинозу, маннотриозу и стахиозу. Примеры редуцирующих сахаров включают глюкозу, мальтозу, лактозу, мальтулозу, изомальтулозу и лактулозу. Примеры нередуцирующих сахаров включают нередуцирующие гликозиды полигидроксисоединений, выбранные из спиртов сахаров и других неразветвленных полиспиртов. Предпочтительными спиртами сахаров являются моногликозиды, особенно соединения, полученные восстановлением дисахаридов, таких как лактоза, мальтоза, лактулоза и мальтулоза. Гликозидная боковая группа может быть либо глюкозидной, либо галактозидной. Дополнительными примерами спиртов сахаров являются глюцит, мальтит, лактит и изомальтулоза. Предпочтительными фармацевтически приемлемыми сахарами являются нередуцирующие сахара трегалоза или сахароза. Фармацевтически приемлемые сахара добавляют в состав в "обеспечивающем защиту количестве" (например, перед лиофилизацией), которое означает, что белок, по существу, сохраняет его физическую и химическую стабильность и целостность при хранении (например, после восстановления и хранения).
Представляющий интерес в настоящем документе "разбавитель" представляет собой разбавитель, который является фармацевтически приемлемым (безопасным и нетоксичным для введения человеку), и он пригоден для получения жидкого состава, такого как состав, разбавленный после лиофилизации. Иллюстративные разбавители включают стерильную воду, бактериостатическую воду для инъекций (BWFI), pH-буферный раствор (например, фосфатно-солевой буфер), стерильный физиологический раствор, раствор Рингера или раствор декстрозы. В альтернативном варианте осуществления разбавители могут включать водные растворы солей и/или буферов.
"Консервант" представляет собой соединение, которое можно добавлять в состав, представленный в настоящем документе, для снижения бактериальной активности. Добавление консерванта может, например, облегчать получение состава для многократного применения (с многократной дозой). Примеры потенциальных консервантов включают хлорид октадецилдиметилбензиламмония, хлорид гексаметония, хлорид бензалкония (смесь хлоридов алкилбензилдиметиламмония, в которых алкильные группы представляют собой соединения с длинной цепью) и хлорид бензэтония. Другие типы консервантов включают ароматические спирты, такие как фенол, бутиловый и бензиловый спирт, алкилпарабены, такие как метил- или пропилпарабен, катехол, резорцинол, циклогексанол, 3-пентанол и м-крезол. Наиболее предпочтительным консервантом, представленным в настоящем документе, является бензиловый спирт.
"Лечение" относится к клиническому вмешательству, предназначенному для изменения естественного течения у индивида или в клетке, подвергаемых лечению, и его можно проводить либо для профилактики, либо в процессе клинической патологии. Желательные эффекты лечения включают профилактику возникновения или повторного возникновения заболевания, профилактику метастазов, снижение скорости прогрессирования заболевания, смягчение или облегчение болезненного состояния и ремиссию или улучшенный прогноз. В некоторых вариантах осуществления антитела по изобретению применяют для замедления развития заболевания или нарушения. Субъекта успешно "лечат", например, с использованием апоптотических антител против IgE по изобретению, если смягчается один или несколько симптомов, ассоциированных с опосредуемым IgE нарушением.
"Эффективное количество" относится по меньшей мере к количеству, эффективному в дозировках и в течение периодов времени, необходимых для достижения требуемого или указанного эффекта, включая терапевтический или профилактический результат.
"Терапевтически эффективное количество" представляет собой по меньшей мере минимальную концентрацию, требуемую для достижения поддающегося измерению улучшения или профилактики конкретного нарушения. Терапевтически эффективное количество, представленное в настоящем документе, может варьировать в соответствии с такими факторами, как болезненное состояние, возраст, пол и масса тела пациента, и способность антитела вызывать требуемый ответ у индивида. Терапевтически эффективное количество также представляет собой количество, в котором любые токсические или вредные эффекты антитела перевешиваются терапевтически полезными эффектами. "Профилактически эффективное количество" относится к количеству, эффективному в дозировках в течение периодов времени, необходимых для достижения требуемого профилактического результата. Как правило, но не обязательно, поскольку профилактическую дозу применяют у субъектов перед заболеванием или на ранней стадии заболевания, профилактически эффективное количество может быть меньшим, чем терапевтически эффективное количество.
"Длительное" введение относится к введению лекарственного средства (средств) в постоянном режиме, в противоположность экстренному, так чтобы достигнуть исходного терапевтического эффекта (активности) в течение более длительного периода времени. "Прерывающееся" введение представляет собой лечение, которое не проводят последовательно без прерывания, а вместо этого оно является циклическим.
"Млекопитающее" для целей лечения относится к любому животному, классифицируемому как млекопитающее, включая человека, домашних и сельскохозяйственных животных, и животных зоопарков, спортивных животных, или комнатных животных, таких как собаки, лошади, кролики, крупный рогатый скот, свиньи, хомяки, песчанки, мыши, хорьки, крысы, кошки и т.д. Предпочтительно млекопитающее представляет собой человека.
Термин "фармацевтический состав" относится к препарату, который находится в такой форме, чтобы обеспечить эффективность биологической активности активного ингредиента, и который не содержит дополнительных компонентов, которые являются неприемлемо токсичными для субъекта, которому состав намереваются вводить. Такие составы являются стерильными.
"Стерильный" состав является асептическим или не содержащим каких-либо живых микроорганизмов и их спор.
Термин "приблизительно", как используют в настоящем документе, относится к обычному диапазону ошибок для соответствующего значения, хорошо известному специалисту на этом уровне техники.
Как используют в настоящем документе, "антигистамин" представляет собой средство, которое является антагонистом физиологического эффекта гистамина. Связывание гистамина с его рецепторами, H1 и H2, приводит к характерным симптомам и эффектам аллергии или зуду, красноте, опуханию и т.д. Многие антигистамины действуют, блокируя связывание гистамина с его рецепторами, H1, H2; однако другие, как полагают, действуют, ингибируя высвобождение гистамина. Примерами антигистаминов являются хлорфенирамин, дифенгидрамин, прометазин, кромолин натрия, астемизол, азатидина малеат, брофенирамина малеат, карбиноксамина малеат, цетиразина гидрохлорид, клемастина фумарат, ципрогептадина гидрохлорид, дексбромфенирамина малеат, дексхлорфенирамина малеат, дименгидринат, дифенгидрамина гидрохлорид, доксиламина сукцинат, фексофендадина гидрохлорид, терфенадина гидрохлорид, гидроксизина гидрохлорид, лоратидин, меклизина гидрохлорид, трипеланнамина цитрат, трипеленнамина гидрохлорид, трипролидина гидрохлорид.
Как используют в настоящем документе, "бронходилятатор" относится к средствам, которые являются антагонистами или вызывают реверсию сужения бронхов, физиологического события, которое происходит, как правило, в ранней фазе астматических реакций, приводящего к снижению жизненной емкости легких и нехватке дыхания. Примеры бронходилятаторов включают адреналин, альфа- и бета-адренергетики широкого спектра действия, и бета-адренергетики, альбутерол, пирбутерол, метапротеренол, сальметерол и изоэтарин. Также бронходилятации можно достигать посредством введения ксантинов, включая аминофиллин и теофиллин.
Как используют в настоящем документе, "глюкокортикоид" относится к стероидным средствам, обладающим противовоспалительной активностью. Глюкокортикоиды широко используют для смягчения астматической реакции поздней фазы. Примеры глюкокортикоидов включают преднизон, беклометазон дипропионат, триамцинолон ацетонид, флунизолид, бетаметазон, будезонид, дексаметазон, дексаметазон трамцинолон, флудроацетат кортизона, флунизолид, флутиказон пропионат, гидрокортизон, преднизолон [включая метилпреднизолон {например, SOLU-MEDROL® метилпреднизолона натрия сукцинат)] и триамцинолон.
Как используют в настоящем документе, "нестероидное противовоспалительное средство" или "NSAID" относится к средствам, обладающим противовоспалительной активностью, которые являются нестероидными. Примеры NSAID включают ацематацин, ацетаминофен, аспирин, азапропазон, бенорилат, бромфенак натрия, ингибиторы циклооксигеназы (COX)-2, такие как GR 253035, MK966, целекоксиб (CELEBREX®; 4-(5-(4-метилфенил)-3-(трифторметил)-1H-пиразол-1-ил)бензолсульфонамид) и вальдекоксиб (BEXTRA®), диклофенак, диклофенак ретард, диклофенак натрий, дифлунизал, этодолак, фенбуфен, фенопрофен кальций, флурбипрофен, ибупрофен, ибупрофен ретард, индометацин, кетопрофен, меклофенамат натрий, мефенаминовую кислоту, мелоксикам (MOBIC®), набуметон, напроксен, напроксен натрий, оксифенбутазон, фенилбутазон, пироксикам, сулиндак, теноксикам, тиапрофеновую кислоту, толметин, толметин натрий, включая его соли и производные, и т.д.
Термин "опосредуемые IgE нарушения" включает атопические нарушения, которые характеризуются общей врожденной склонностью иммунологически отвечать на многие распространенные встречающиеся в природе ингалируемые или поступающие с пищей антигены и постоянной продукцией антител IgE. Конкретные атопические нарушения включают аллергическую астму, аллергический ринит (конъюнктивит), атопический дерматит, пищевую аллергию, анафилаксию, контактный дерматит, аллергическую гастроэнтеропатию, аллергический бронхолегочный аспергиллез и аллергическую пурпуру (Геноха-Шенлейна). Пациенты с атопией часто имеют множественную аллергию, что означает, что они имеют антитела IgE ко многим аллергенам окружающей среды, и симптомы от многих аллергенов окружающей среды, включая сезонные, постоянные и профессиональные аллергены. Примеры сезонных аллергенов включают пыльцу (например, трава, дерево, рожь, тимофеевка, амброзия), а примеры постоянных аллергенов включают грибы (например, плесень, споры плесени), перья, животных (например, перхоть домашних или других животных) и дебрис насекомых (например, пылевой клещ). Примеры профессиональных аллергенов также включают животных (например, мышей) и растительные антигены, а также лекарственные средства, детергенты, металлы и иммуноусилители, такие как изоцианаты. Неантигенные специфичные стимулы, которые могут приводить к опосредуемой IgE реакции, включают инфекцию, раздражающие агенты, такие как дым от сигарет, дым от горения, частицы дизельного выхлопа и диоксид серы, физическая нагрузка, простуда и эмоциональный стресс. Специфические реакции гиперчувствительности у индивидов с атопией и без нее с определенным генетическим фоном могут быть следствием воздействия белков пищи (например, бобовых растений, орехов), яда (например, насекомых, змей), вакцин, гормонов, антисыворотки, ферментов, латекса, антибиотиков, мышечных релаксантов, витаминов, цитотоксинов, опиатов и полисахаридов, таких как декстрин, декстран железа и полигелин.
Другие нарушения, ассоциированные с повышенными уровнями IgE, которые, по-видимому, являются опосредуемыми IgE и поддаются лечению составами по настоящему изобретению, включают атаксию-телеангиэктазию, синдром Черджа-Стросс, экзему, энтерит, гастроэнтеропатию, реакцию "трансплантат против хозяина", гипер-IgE (Джоба) синдром, гиперчувствительность (например, анафилактическую гиперчувствительность, кандидоз, васкулит), IgE-миелому, воспалительное заболевание кишечника (например, болезнь Крона, язвенный колит, колит неясного генеза и инфекционный колит), мукозит (например, мукозит полости рта, желудочно-кишечный мукозит, назальный мукозит и проктит), некротизирующий энтероколит и эзофагит, паразитарные заболевания (например, трипаносомиаз), связанный с гиперчувствительностью васкулит, крапивницу и синдром Вискотта-Олдрича.
Кроме того, нарушения, которые могут поддаваться лечению снижением уровней IgE, независимо от того, ассоциированы ли сами нарушения с повышенным IgE, и которые, таким образом, следует рассматривать в пределах объема "опосредуемого IgE нарушения", включают болезнь Аддисона (хроническая недостаточность коры надпочечников), алопецию, наследственный ангионевротический отек, отек Квинке (болезнь Баннистера, ангионевротический отек), анкилозирующий спондилит, апластическую анемию, артериит, амилоидоз, иммунные нарушения, такие как аутоиммунная гемолитическая анемия, аутоиммунный оофорит, аутоиммунный орхит, аутоиммунная полиэндокринная недостаточность, аутоиммунная гемолитическая анемия, аутоиммуноцитопения, аутоиммунный гломерулонефрит, болезнь Бехчета, бронхит, болезнь Бюргера, буллезный пемфигоид, синдром Каплана (ревматоидный пневмокониоз), кардит, брюшные афты, синдром Чедиака-Хигаси, хроническую обструктивную болезнь легких (COPD), синдром Когана-Риза (радужно-роговичный эндотелиальный синдром), CREST-синдром, герпетиформный дерматит (болезнь Дюринга), сахарный диабет, эозинофильный фасциит, эозинофильный нефрит, эписклерит, наружный аллергический альвеолит, семейный пароксизмальный полисерозит, синдром Фелти, фиброзирующий альвеолит, гломерулонефрит, синдром Гудпасчера, гранулоцитопению, гранулему, гранулематоз, гранулематозный миозит, болезнь Грэйвса, синдром Гийена-Барре (полиневрит), тиреоидит Хашимото (хронический лимфоматозный тиреоидит), гемохроматоз, гистоцитоз, гиперэозинофильный синдром, синдром раздраженной кишки, ювенильный артрит, кератит, лепру, красную волчанку, болезнь Лайелла, болезнь Лайма, смешанное заболевание соединительной ткани, мононеврит, множественный мононеврит, синдром Макла-Уэлса, кожно-слизистый лимфоидный синдром (болезнь Кавасаки), многоцентровой ретикулогистиоцитоз, рассеянный склероз, миастению gravis, фунгоидный микоз, панникулит, пемфигоид, пемфигус, перикардит, полиневрит, узловой полиартериит, псориаз, псориатический артрит, легочный артрит, аденоматоз легких, фиброз легких, рецидивирующий полихондрит, ревматическую атаку, ревматоидный артрит, риносинусит (синусит), саркоидоз, склерит, склерозирующий холангит, сывороточную болезнь, синдром Сезари, синдром Шегрена, синдром Стивенса-Джонсона, системный мастоцитоз, отторжение трансплантата, тромбоцитопеническую пурпуру, тимическую алимфоплазию, увеит, витилиго, гранулематоз Вегенера.
"Аутоиммунное нарушение" в настоящем документе представляет собой заболевание или нарушение, возникающее в собственных тканях индивидуума и направленное против них, или отдельный его признак или его проявление, или состояние, возникающее как его вследствие. Для многих из этих аутоиммунных и воспалительных нарушений может существовать множество клинических и лабораторных маркеров, включая, но не ограничиваясь ими, гипергаммаглобулинемию, высокие уровни аутоантител, отложение комплексов антиген-антитело в тканях, польза от кортикостероидного или иммунодепрессивного лечения и агрегаты лимфоидных клеток в пораженных тканях. Без ограничения какой-либо теорией, касающейся опосредуемых B-клетками аутоиммунных нарушений, полагают, что B-клетки демонстрируют патогенный эффект при аутоиммунных заболеваниях человека через множество механических каскадов, включая продукцию аутоантител, образование иммунных комплексов, активацию дендритных клеток и T-клеток, синтез цитокинов, прямое высвобождение хемокинов и предоставление очага для эктопического неолимфогенеза. Каждый из этих каскадов может участвовать в различной степени в патологии аутоиммунных заболеваний.
"Аутоиммунное заболевание" может представлять собой орган-специфическое заболевание (т.е. иммунный ответ направлен специфично против системы органов, такой как эндокринная система, гемопоэтическая система, кожа, сердечно-легочная система, желудочно-кишечная и печеночная системы, почечная система, щитовидная железа, уши, нервно-мышечная система, центральная нервная система, и т.д.) или системное заболевание, которое может поражать множество систем органов (например, системная красная волчанка (SLE), ревматоидный артрит (RA), полимиозит и т.д.). Предпочтительные такие заболевания включают аутоиммунные ревматологические нарушения (например, такие как RA, синдром Шегрена, склеродермия, волчанка, такая как SLE и волчаночный нефрит, полимиозит-дерматомиозит, криоглобулинемия, синдром антифосфолипидных антител и псориатический артрит), аутоиммунные желудочно-кишечные и печеночные нарушения (например, такие как воспалительные заболевания кишечника (например, язвенный колит и болезнь Крона), аутоиммунный гастрит и пернициозная анемия, аутоиммунный гепатит, первичный биллиарный цирроз, первичный склерозирующий холангит и глютеновая энтеропатия), васкулит (например, такой как ANCA-отрицательный васкулит и ANCA-ассоциированный васкулит, включая васкулит Чарга-Стросса, гранулематоз Вегенера и микроскопический полиангиит), аутоиммунные неврологические нарушения (например, такие как рассеянный склероз, опсоклонус-миоклонус-синдром, миастения gravis, оптический нейромиелит, болезнь Паркинсона, болезнь Альцгеймера и аутоиммунные полиневропатии), почечные нарушения (например, такие как гломерулонефрит, синдром Гудпасчера и болезнь Бергера), аутоиммунные дерматологические нарушения (например, такие как псориаз, крапивница, уртикария, пемфигус обыкновенный, буллезный пемфигоид и кожная красная волчанка), гематологические нарушения (например, такие как тромбоцитопеническая пурпура, тромботическая тромбоцитопеническая пурпура, посттрансфузионная пурпура и аутоиммунная гемолитическая анемия), атеросклероз, увеит, аутоиммунные заболевания слуха (например, такие как болезнь внутреннего уха и потеря слуха), болезнь Бехчета, синдром Рейно, трансплантация органа и аутоиммунные эндокринные нарушения (например, такие как связанные с диабетом аутоиммунные заболевания, такие как инсулин-зависимый сахарный диабет (IDDM), болезнь Аддисона и аутоиммунное заболевание щитовидной железы (например, болезнь Грэйвса и тиреоидит). Более предпочтительные такие заболевания включают, например, RA, язвенный колит, ANCA-ассоциированный васкулит, волчанку, рассеянный склероз, синдром Шегрена, болезнь Грэйвса, IDDM, пернициозную анемию, тиреоидит и гломерулонефрит.
Термин "цитотоксическое средство", как используют в настоящем документе, относится к веществу, которое ингибирует функционирование клеток, или препятствует ему, и/или вызывает разрушение клеток. Подразумевают, что термин включает радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32 и радиоактивные изотопы Lu) и токсины, такие как низкомолекулярные токсины или ферментативно активные токсины из бактерий, грибов, растений или животных, включая их фрагменты.
"Химиотерапевтическое средство" представляет собой химическое соединение, пригодное для лечения злокачественной опухоли. Примеры химиотерапевтических средств включают алкилирующие средства, такие как тиотепа и циклофосфамид (CYTOXAN®); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламин; ацетогинины (особенно буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, MARINOL®); бета-лапахон; лапахол; колхицины; бетулиновую кислоту; камптотецин (включая синтетический аналог топотекан (HYCAMTIN®), CPT-11 (иринотекан, CAMPTOSAR®), ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; пеметрексед; каллистатин; CC-1065 (включая его синтетические аналоги на основе адозелезина, карзелезина и бизелезина); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги, KW-2189 и CB1-TM1); элеутеробин; панкратистатин; TLK-286; CDP323, пероральный ингибитор альфа-4-интегрина; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид оксида мехлорэтамина, мелфалан, новэмбихин, фенестерин, преднимустин, трофосфамид, иприт урацила; нитрозомочевинаы, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин и ранимустин; антибиотики, такие как эндииновые антибиотики (например, калихеамицин, особенно калихеамицин гамма1I и калихеамицин омега1I (см., например, Nicolaou et al., Agnew, Chem Intl. Ed. Engl., 33:183-186 (1994)); динемицин, включая динемицин A; эсперамицин; а также хромофор на основе неокарциностатина и сходные хромопротеиновые хромофоры на основе эндииновых антибиотиков), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, сактиномицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (включая ADRIAMYCIN®, морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин, инъекцию липосом доксорубицин HCl (DOXIL®) и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марселломицин, митомицины, такие как митомицин C, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат, гемцитабин (GEMZAR®), тегафур (UFTORAL®), капецитабин (XELODA®), эпотилон и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пуринов, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидинов, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин и иматиниб (производное 2-фениламинопиримидина), а также другие ингибиторы c-Kit; антиадренальные средства, такие как аминоглутетимид, митотан, трилостан; средства для восполнения фолиевой кислоты, такие как фролиновая кислота; ацеглатон; альдофосфамид гликозид; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демекольцин; диазиквон; эльфорнитин; ацетат эллиптиния; этоглуцид; нитрат галлия; гидроксимочевину; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2"-трихлортриэтиламин; трихотецены (особенно токсин T-2, верракурин A, роридин A и ангвидин); уретан; виндезин (ELDISINE®, FILDESIN®); дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-C"); тиотепу; таксоиды, например, паклитаксел (TAXOL®), сконструированный с альбумином состав паклитаксела в виде частиц (ABRAXANETM) и доксетаксел (TAXOTERE®); хлорамбуцил; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин (VELBAN®); платина; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ONCOVIN®); оксалиплатин; лейковорин; винорелбин (NAVELBINE®); новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; фармацевтически приемлемые соли, кислоты или производные любого из указанных выше; а также сочетания двух или нескольких из указанных выше, такие как CHOP, сокращенное название для комбинированной терапии циклофосфамидом, доксорубицином, винкристином и преднизолоном, и FOLFOX, сокращенное название для схемы лечения оксалиплатином (ELOXATINTM) в сочетании с 5-FU и лейковорином.
Также к этому определению относятся антигормональные средства, которые действуют, регулируя, снижая, блокируя или ингибируя эффекты гормонов, которые могут обеспечивать рост злокачественной опухоли, и их часто предоставляют в форме системного лечения, или лечения всего организма. Они сами могут представлять собой гормоны. Их примеры включают антиэстрогены и селективные модуляторы рецепторов эстрогена (SERM), включая, например, тамоксифен (в том числе тамоксифен NOLVADEX®), ралоксифен (EVISTA®), дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (FARESTON®); антипрогестероны; средства, подавляющие рецепторы эстрогена (ERD); антагонисты рецептора эстрогена, такие как фулвестран (FASLODEX®); средства, которые функционируют, подавляя или прекращая работу яичников, например, агонисты рилизинг-фактора лютеинизирующего гормона (LHRH), такие как леупролида ацетат (LUPRON® и ELIGARD®), гозерелина ацетат, бузерелина ацетат и триптерелин; антиандрогены, такие как флутамид, нилутамид и бикалутамид; и ингибиторы ароматазы, которые ингибируют фермент ароматазу, которая регулирует продукцию эстрогена в надпочечниках, например, такие как 4(5)-имидазолы, аминоглутетимид, ацетат мегестрола (MEGASE®), экземестан (AROMASIN®), форместан, фадрозол, ворозол (RIVISOR®), летрозол (FEMARA®) и анастрозол (ARIMIDEX®). Кроме того, такое определение химиотерапевтических средств включает бисфосфонаты, такие как клодронат (например, BONEFOS® или OSTAC®), этидронат (DIDROCAL®), NE-58095, золедроновая кислота/золедронат (ZOMETA®), алендронат (FOSAMAX®), памидронат (AREDIA®), тилудронат (SKELID®) или ризедронат (ACTONEL®); а также троксацитабин (нуклеозидный аналог цитозина 1,3-диоксолан); антисмысловые олигонуклеотиды, в частности, олигонуклеотиды, которые ингибируют экспрессию генов в каскадах передачи сигнала, вовлеченных в нарушенную пролиферацию клеток, например, такие как PKC-alpha, Raf, H-Ras и рецептор эпидермального фактора роста (EGF-R); вакцины, такие как вакцина THERATOPE® и вакцины для генной терапии, например, вакцина ALLOVECTIN®, вакцина LEUVECTIN® и вакцина VAXID®; ингибитор топоизомеразы 1 (LURTOTECAN®); антиэстроген, такой как фулвестрант; ингибитор Kit, такой как иматиниб или EXEL-0862 (ингибитор тирозинкиназы); ингибитор EGFR, такой как эрлотиниб или цетуксимаб; ингибитор против VEGF, такой как бевацизумаб; аринотекан; rmRH (например, ABARELIX®); лапатиниб и лапатиниб дитозилат (двойной низкомолекулярный ингибитор тирозинкиназ ErbB-2 и EGFR, также известный как GW572016); 17AAG (производное гелданамицина, которое представляет собой яд на основе белка теплового шока (Hsp) 90), и фармацевтически приемлемые соли, кислоты или производные любого из указанных выше.
"Ингибирующее рост средство" относится к соединению или композиции, которые ингибируют рост клетки, рост которой зависит от активации рецептора либо in vitro, либо in vivo. Таким образом, ингибирующее рост средство включает средство, которое значительно снижает процентное количество клеток в S-фазе. Примеры ингибирующих рост средств включают средства, которые блокируют прогрессирование клеточного цикла (в месте, отличном от S-фазы), такие как средства, которые индуцируют остановку в G1-фазе и остановку M-фазе. Классические блокаторы M-фазы включают алкалоиды барвинка (винкристин и винбластин), таксаны и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Те средства, которые вызывают остановку в G1-фазе, также вовлекают остановку в S-фазе, например, алкилирующие ДНК средства, такие как тамоксифен, преднизон, дакарбазин, мехлорэтамин, цисплатин, метотрексат, 5-фторурацил и ara-C. Дополнительную информацию можно найти в The Molecular Basis of Cancer, Mendelsohn and Israel, eds., глава 1 под названием "Cell cycle regulation, oncogenes, and antineoplastic drugs" by Murakami et al. (WB Saunders: Philadelphia, 1995), особенно стр. 13. Таксаны (паклитаксел и доцетаксел) представляют собой лекарственные средства против злокачественной опухоли, полученные из тисового дерева. Доцетаксел (TAXOTERE®, Rhone-Poulenc Rorer), полученный из тиса европейского, представляет собой полусинтетический аналог паклитаксела (TAXOL®, Bristol-Myers Squibb).
Термин "цитокин" является общим термином для белков, высвобождаемых одной популяцией клеток, которые воздействуют на другую клетку в качестве межклеточных медиаторов. Примерами таких цитокинов являются лимфокины, монокины, интерлейкины (IL), такие как IL-1, IL-1α, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-11, IL-12, IL-13, IL-15, включая PROLEUKIN® rIL-2; фактор некроза опухоли, такой как TNF-α или TNF-β; и другие полипептидные факторы, включая LIF и kit-лиганд (KL). Как используют в настоящем документе, термин "цитокин" включает белки из природных источников или из рекомбинантных клеточных культур и биологически активные эквиваленты цитокинов с нативной последовательностью, включая полученные синтетическими способами низкомолекулярные соединения и их фармацевтически приемлемые производные и соли.
Термин "гормон" относится к полипептидным гормонам, которые, как правило, секретируются железистыми органами с протоками. К гормонам относятся, например, гормон роста, такой как гормон роста человека, N-метионильный гормон роста человека и бычий гормон роста; паратиреоидный гормон; тироксин; инсулин; проинсулин; релаксин; эстрадиол; гормон-замещающая терапия; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан или тестолактон; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (FSH), тиреостимулирующий гормон (TSH) и лютеинизирующий гормон (LH); пролактин, плацентарный лактоген, гонадотропин-ассоциированный пептид мыши, гонадотропин-рилизинг фактор; ингибин; активин; мюллерово ингибирующее вещество и тромбопоэтин. Как используют в настоящем документе, термин "гормон" включает белки из природных источников или из рекомбинантной клеточной культуры и биологически активные эквиваленты гормона с нативной последовательностью, включая синтетически продуцируемые низкомолекулярные соединения и их фармацевтически приемлемые производные и соли.
Термин "фактор роста" относится к белкам, которые обеспечивают рост и включают, например, печеночный фактор роста; фибробластный фактор роста; сосудисто-эндотелиальный фактор роста; факторы роста нервов, такие как NGF-β; тромбоцитарный фактор роста; трансформирующие факторы роста (TGF), такие как TGF-α и TGF-β; инсулиноподобный фактор роста-I и -II; эритропоэтин (EPO); остеоиндуктивные факторы; интерфероны, такие как интерферон-α, -β и -γ; и колониестимулирующие факторы (CSF), такие как макрофагальный CSF (M-CSF); гранулоцитарно-макрофагальный CSF (GM-CSF) и гранулоцитарный CSF (G-CSF). Как используют в настоящем документе, термин "фактор роста" включает белки из природных источников или из культуры рекомбинантных клеток и биологически активные эквиваленты фактора роста с нативной последовательностью, включая синтетически продуцируемые низкомолекулярные соединения и их фармацевтически приемлемые производные и соли.
Термин "интегрин" относится к рецепторному белку, который позволяет клеткам как связываться с внеклеточным матриксом, так и отвечать на него, и который вовлечен в различные клеточные функции, такие как заживление ран, дифференцировка клеток, хоминг опухолевых клеток и апоптоз. Они являются частью крупного семейства рецепторов клеточной адгезии, которые вовлечены во взаимодействия клетка-внеклеточный матрикс и клетка-клетка. Функциональные интегрины состоят из двух трансмембранных гликопротеиновых субъединиц, называемых альфа и бета, которые являются нековалентно связанными. Альфа-субъединицы обладают гомологией между собой, также как и бета-субъединицы. Рецепторы всегда содержат одну альфа-цепь и одну бета-цепь. Примеры включают Альфа-6-бета-1, Альфа-3-бета-1, Альфа-7-бета1, LFA-1 и т.д. Как используют в настоящем документе, термин "интегрин" включает белки из природных источников или из культуры рекомбинантных клеток и биологически активные эквиваленты интегрина с нативной последовательностью, включая синтетически продуцируемые низкомолекулярные соединения и их фармацевтически приемлемые производные и соли.
"Антагонист TNF" определяют в настоящем документе как молекулу, которая снижает, блокирует, ингибирует, устраняет активность TNFα или препятствует ей in vitro, in situ и/или предпочтительно in vivo. Пригодный антагонист TNF также может снижать, блокировать, устранять, препятствовать, предотвращать и/или ингибировать синтез РНК, ДНК или белка TNF, высвобождение TNFα, передачу сигнала рецептора TNFα, расщепление мембранного TNFα, активность TNFα, продукцию и/или синтез TNFα. Такие антагонисты TNF включают, но не ограничиваются ими, антитела против TNFα, их антигенсвязывающие фрагменты, их конкретные мутанты или домены, которые специфично связываются с TNFα, которые при связывании с TNFα разрушают или устраняют клетки, экспрессирующие TNFα у млекопитающего, и/или препятствуют одной или нескольким функциям этих клеток, растворимый рецептор TNF (например, p55, p70 или p85) или его фрагмент, слитые полипептиды, низкомолекулярный антагонист TNF, например связывающий TNF белок I или II (TBP-I или TBP-II), нерелимонмаб, CDP-571, инфликсимаб, энтерацепт (ENBRELTM), адалимулаб (HUMIRATM), CDP-571, CDP-870, афелимомаб, ленерцепт и т.п.), их антигенсвязывающие фрагменты, и рецепторные молекулы, которые специфично связываются с TNFα; соединения, которые препятствуют и/или ингибируют синтез TNFα, высвобождение TNFα или его действие на клетки-мишени, такие как талидомид, тенидап, ингибиторы фосфодиэстеразы (например, пентоксифиллин и ролипрам), агонисты рецептора аденозина A2b и усилители рецептора аденозина A2b; соединения, которые препятствуют и/или ингибируют передачу сигнала TNFα, такие как ингибиторы киназы митоген-активируемого белка (MAP); соединения, которые блокируют и/или ингибируют расщепление мембранного TNFα, такие как ингибиторы металлопротеиназ; соединения, которые блокируют и/или ингибируют активность TNFα, такие как ингибиторы ангиотензинпревращающего фермента (ACE) (например, каптоприл); и соединения, которые блокируют и/или ингибируют продукцию и/или синтез TNFα, такие как ингибиторы MAP-киназы. Предпочтительный антагонист включает антитело.
"Фактор некроза опухоли-альфа", "TNF-альфа" или "TNFα" относится к молекуле TNFα человека, содержащей аминокислотную последовательность по Pennica et al., Nature, 312:721 (1984) или Aggarwal et al., JBC, 260:2345 (1985). "Ингибитор TNFα" в настоящем документе представляет собой средство, которое ингибирует, до некоторой степени, биологическую функцию TNFα, главным образом, через связывание с TNFα и нейтрализацию его активности. Примеры ингибиторов TNFα в настоящем документе включают этанерцепт (ENBREL®), инфликсимаб (REMICADE®) и адалимумаб (HUMIRATM).
Примеры "антагонистов интегринов или антител против интегринов" в настоящем документе включают антитело против LFA-1, такое как эфализумаб (RAPTIVA®), коммерчески доступное от Genentech, или антитело против альфа-4-интегрина, такое как натализумаб (ANTEGREN®), доступное от Biogen, или диазациклические производные фенилаланина (WO 2003/89410), производные фенилаланина (WO 2003/70709, WO 2002/28830, WO 2002/16329 и WO 2003/53926), производные фенилпропионовой кислоты (WO 2003/10135), производные энамина (WO 2001/79173), производные пропановой кислоты (WO 2000/37444), производные алкановой кислоты (WO 2000/32575), замещенные фенильные производные (патенты США №№ 6677339 и 6348463), производные ароматических аминов (патент США № 6369229), полипептиды дизинтегринового домена ADAM (US2002/0042368), антитела к интегрину альфа-v-бета-3 (EP 633945), аза-связанные бициклические производные аминокислот (WO 2002/02556) и т.д.
Термин "иммунодепрессивное средство" относится к веществу, которое действует, подавляя или маскируя иммунную систему субъекта, подвергаемого лечению в рамках настоящего документа. Оно может включать вещества, которые подавляют продукцию цитокинов, снижают или подавляют экспрессию собственных антигенов, или маскируют антигены MHC. Примеры таких средств включают 2-амино-6-арил-5-замещенные пиримидины (см. U.S. 4665077); нестероидные противовоспалительные лекарственные средства (NSAID); ганцикловир, такролимус, глюкокортикоиды, такие как кортизол или альдостерон, противовоспалительные средства, такие как ингибитор циклооксигеназы, ингибитор 5-липоксигеназы, или антагонист рецептора лейкотриена; антагонисты пуринов, такие как азатиоприн или микофенолата мофетил (MMF); трокад (Ro32-355); антагонист периферического сигма-рецептора, такой как ISR-31747; алкилирующие средства, такие как циклофосфамид; бромкриптин; даназол; дапзон; глутаральдегид (который маскирует антигены MHC, как описано в U.S. 4120649); антиидиотипические антитела для антигенов MHC и фрагментов MHC; циклоспорин A; стероиды, такие как кортикостероиды или глюкокортикостероиды или аналоги глюкокортикоидов, например преднизон, метилпреднизолон, включая метилпреднизолона натрия сукцинат SOLU-MEDROL®, римексолон и дексаметазон; ингибиторы дигидрофолатредуктазы, такие как метотрексат (пероральный или подкожный); средства против малярии, такие как хлороквин и гидроксихлороквин; сульфасалазин; лефлуномид; ингибиторы высвобождения цитокинов, такие как моноклональные антитела SB-210396 и SB-217969 и антагонист MHC II, такой как ZD2315; антагонист рецептора PG1, такой как ZD4953; блокатор адгезии VLA4, такой как ZD7349; антитела против цитокинов или против рецепторов цитокинов, включая антитела против интерферона-альфа, -бета или -гамма, антитела против TNF-α (инфликсимаб (REMICADE®) или адалимумаб), иммуноадгезин против TNF-α (этанерцепт), антитела против TNF-бета, блокаторы интерлейкина-1 (IL-1), такие как рекомбинантный ингибитор HuIL-1Ra и IL-1B, антитела против интерлейкина-2 (IL-2) и антитела против рецептора IL-2; слитый токсин IL-2; антитела против L3T4; лефлуномид; гетерологичный антилимфоцитарный глобулин; OPC-14597; NISV (модификатор иммунного ответа); незаменимую жирную кислоту, такую как гаммалиноленовая кислота или эйкозапентаеновая кислота; блокаторы CD-4, общие антитела против T-клеток, предпочтительно антитела против CD3 или против CD4/CD4a; костимуляторный модификатор (например, слитая молекула CTLA4-Fc, также известная как ABATACEPTTM; антитела против рецептора интерлейкина-6 (IL-6) и его антагонисты; антитела против LFA-1, включая антитела против CD11a и против CD18; растворимый пептид, содержащий связывающий домен LFA-3 (WO 1990/08187); стрептокиназу; IL-10; антагонисты IL-4, антагонисты IL-13 и биспецифичные антитела-антагонисты IL-4/IL-13, трансформирующий фактор роста-бета (TGF-бета); стрептодорназу; РНК или ДНК из хозяина; FK506; RS-61443; энлимомаб; CDP-855; ингибитор PNP; CH-3298; GW353430; 4162W94, хлорамбуцил; дезоксиспергуалин; рапамицин; T-клеточный рецептор (US 5114721); фрагменты T-клеточного рецептора (Offner et al., Science, 251:430-2 (1991); WO 1990/11294; Janeway, Nature, 341:482-483 (1989) и WO 1991/01133); антагонисты BAFF, такие как антитела против BAFF и антитела против BR3; антагонисты zTNF4 (Mackay and Mackay, Trends Immunol., 23:113-5 (2002)); биологические агенты, которые препятствуют хелперным сигналам T-клеток, такие как антитело против рецептора CD40 или антитело против лиганда CD40 (CD 154), включая блокирующие антитела против CD40-лиганд CD40 (например, Durie et al., Science, 261:1328-30 (1993); Mohan et al., J. Immunol., 154:1470-80 (1995)) и CTLA4-Ig (Finck et al., Science, 265:1225-7 (1994)); и антитела против рецептора T-клеток (EP 340109), такие как T10B9. Некоторые предпочтительные иммунодепрессивные средства в настоящем документе включают циклофосфамид, хлорамбуцил, азатиоприн, лефлуномид, MMF или метотрексат (MTX).
"Модифицирующие заболевание противоревматические лекарственные средства" или "DMARD" включают, например, хлороквин, гидроксихлороквин, миокризин, ауранофин, сульфасалазин, метотрексат, лефлуномид, этанерцепт, инфликсимаб (и пероральный и подкожный MTX), азатиоприн, D-пенициламин, соли золота (пероральные), соли золота (внутримышечные), миноциклин, циклоспорин, например циклоспорин A и местный циклоспорин, стафилококковый белок A (Goodyear and Silverman, J. Exp. Med., 197:1125-39 (2003)), включая его соли и производные, и т.д.
"B-клетка" представляет собой лимфоцит, который созревает в костном мозге и включает наивную B-клетку, B-клетку памяти или эффекторную B-клетку (плазматические клетки). B-клетка в настоящем документе может быть нормальной или незлокачественной.
"Поверхностный маркер B-клеток" или "поверхностный антиген B-клеток" в настоящем документе представляет собой антиген, экспрессируемый на поверхности B-клетки, на который может быть нацелен антагонист, который с ним связывается. Иллюстративные поверхностные маркеры B-клеток включают поверхностные маркеры лейкоцитов CD10, CD19, CD20, CD21, CD22, CD23, CD24, CD37, CD40, CD53, CD72, CD73, CD74, CDw75, CDw76, CD77, CDw78, CD79a, CD79b, CD80, CD81, CD82, CD83, CDw84, CD85 и CD86 (для описаний, см. The Leukocyte Antigen Facts Book, 2nd Edition. 1997, ed. Barclay et al. Academic Press, Harcourt Brace & Co., New York). Другие поверхностные маркеры B-клеток включают RP105, FcRH2, B-cell CR2, CCR6, P2X5, HLA-DOB, CXCR5, FCER2, BR3, Btig, NAG14, SLGC16270, FcRH1, IRTA2, ATWD578, FcRH3, IRTA1, FcRH6, BCMA и 239287. Предпочтительный поверхностный маркер B-клеток предпочтительно экспрессируется на B-клетках по сравнению с другими не B-клеточными тканями млекопитающего, и он может экспрессироваться как на предшественниках B-клеток, так и на зрелых B-клетках. Наиболее предпочтительными такими маркерами являются CD20 и CD22.
Антиген "CD20", или "CD20", представляет собой негликозилированный фосфопротеин массой около 35 кДа, встречающийся на поверхности более чем 90% B-клеток из периферической крови или лимфоидных органов. CD20 присутствует как на нормальных B-клетках, так и на злокачественных B-клетках, однако он не экспрессируется на стволовых клетках. Другие названия для CD20 в литературе включают "ограниченный B-лимфоцитами антиген" и "Bp35". Антиген CD20 описан в Clark et al., Proc. Natl. Acad. Sci. (USA) 82:1766 (1985), например.
Антиген "CD22", или "CD22", также известный как BL-CAM или Lyb8, представляет собой интегральный мембранный гликопротеин 1 типа с молекулярной массой приблизительно от 130 (сокращенный) до 140 кДа (несокращенный). Он экспрессируется как в цитоплазме, так и на клеточных мембранах B-лимфоцитов. Антиген CD22 появляется рано при дифференцировке B-клеточных лимфоцитов приблизительно на той же стадии, что и антиген CD19. В отличие от других B-клеточных маркеров экспрессия CD22 на мембране ограничена поздними стадиями дифференцировки, находящимися между зрелыми B-клетками (CD22+) и плазматическими клетками (CD22-). Антиген CD22 описан, например, в Wilson et al., J. Exp. Med. 173:137 (1991) и Wilson et al., J. Immunol. 150:5013 (1993).
"Антитело, которое связывается с B-клеточным поверхностным маркером" представляет собой молекулу, которая, при связывании с B-клеточным поверхностным маркером, разрушает или устраняет B-клетки у млекопитающего и/или препятствует одной или нескольким функциям B-клеток, например, посредством снижения или предотвращения гуморального ответа, вызываемого B-клеткой. Антитело предпочтительно способно устранять B-клетки (т.е. снижать уровни циркулирующих B-клеток) у млекопитающего, которого ими лечат. Такое устранение может быть достигнуто посредством различных механизмов, таких как антителозависимая клеточно-опосредуемая цитотоксичность (ADCC) и/или комплементзависимая цитотоксичность (CDC), ингибирование пролиферации B-клеток и/или индукция гибели B-клеток (например, посредством апоптоза).
Примеры антител против CD20 включают: "C2B8", которое в настоящее время называют "ритуксимабом" ("RITUXAN®") (патент США № 5736137); меченное итрием-[90] антитело 2B8 мыши, которое обозначают как "Y2B8" или "ибритутомаб тиуксетан" (ZEVALIN®), коммерчески доступный от IDEC Pharmaceuticals, Inc. (патент США № 5736137; 2B8 депонировано в ATCC с регистрационным номером № HB11388 22 июня 1993 года); IgG2a мыши "B1", также называемое "тозитумомабом", необязательно меченное131I с образованием антитела "131I-B1" или "йодный I131 тозитумомаб" (BEXXARTM), коммерчески доступный от Corixa (см. также патент США № 5595721); моноклональное антитело мыши "1F5" (Press et al. Blood 69(2):584-591 (1987) и его варианты, включающие 1F5 "с состоящим из фрагментов каркасом" или гуманизированное 1F5 (WO 03/002607, Leung, S.; номер ATCC HB-96450); антитело 2H7 мыши и химерное антитело 2H7 (патент США № 5677180); гуманизированное 2H7 (WO 2004/056312 (Lowman et al.) и как указано ниже); полностью человеческое высокоаффинное антитело HUMAX-CD2TM, нацеленное на молекулу CD20 на клеточной мембране B-клеток (Genmab, Denmark; см., например, Glennie and van de Winkel, Drug Discovery Today 8:503-510 (2003) и Cragg et al., Blood 101:1045-1052 (2003)); моноклональные антитела человека, указанные в WO 2004/035607 (Teeling et al.); антитела AME-133TM(Applied Molecular Evolution); антитело A20 или его варианты, такие как химерное или гуманизированное антитело A20 (cA20, hA20 соответственно (US 2003/0219433, Immunomedics)); и моноклональные антитела L27, G28-2, 93-1B3, B-C1 или NU-B2, доступные от International Leukocyte Typing Workshop (Valentine et al., In: Leukocyte Typing III (McMichael, Ed., p. 440, Oxford University Press (1987)). Предпочтительные в настоящем описании антитела против CD20 представляют собой химерные, гуманизированные антитела против CD20 или антитела против CD20 человека, более предпочтительно ритуксимаб, гуманизированное антитело 2H7, химерное или гуманизированное антитело A20 (Immunomedics) и антитело против CD20 человека HUMAX-CD20TM (Genmab).
Термины "ритуксимаб" или "RITUXAN®" в настоящем документе относятся к полученному способами генетической инженерии химерному моноклональному антителу мыши/человека, направленному против антигена CD20 и обозначаемому "C2B8" в патенте США № 5736137, включая его фрагменты, которые сохраняют способность связывать CD20.
Исключительно для целей настоящего документа и если нет иных указаний, "гуманизированное 2H7" относится к гуманизированному антителу против CD20, или его антигенсвязывающему фрагменту, где антитело является эффективным для устранения B-клеток приматов in vivo. Антитело включает антитела, указанные в US 2006/0062787 и на его фигурах, и включая вариант 114, последовательности которого представлены в US 2006/0188495. Также см. US 2006/0034835 и US 2006/0024300. Обобщая различные предпочтительные варианты осуществления изобретения, V-область вариантов на основе варианта 16 2H7, как описано в US 2006/0062787, будет иметь аминокислотные последовательности v16, за исключением положений аминокислотных замен, которые указаны в таблице ниже. Если нет иных указаний, варианты 2H7 будут иметь ту же L-цепь, что и v16.
Одним предпочтительным гуманизированным 2H7 является интактное антитело или антитело фрагмент, имеющий последовательность варианта 16. Другое предпочтительное гуманизированное 2H7 обладает последовательностями варианта 114.
"Антагонисты BAFF" представляют собой любые молекулы, которые блокируют активность BAFF или BR3. Они включают иммуноадгезины, содержащие участок BR3, TACI или BCMA, который связывает BAFF, или их варианты, которые связывают BAFF. В других аспектах антагонист BAFF представляет собой антитело BAFF. "Антитело против BAFF" представляет собой антитело, которое связывает BAFF, и предпочтительно связывает BAFF в области BAFF человека, содержащей остатки 162-275 BAFF человека. В другом аспекте антагонист BAFF представляет собой антитело против BR3. "Антитело против BR3" представляет собой антитело, которое связывает BR3, и предпочтительно связывает BR3 в области BR3 человека, содержащей остатки 23-38 BR3 человека. Последовательности BAFF человека и BR3 человека могут быть найдены, например, в US 2006/0062787. Другие примеры связывающих BAFF полипептидов или антител против BAFF могут быть найдены, например, в WO 2002/092620, WO 2003/014294, Gordon et al., Biochemistry 42(20):5977-83 (2003), Kelley et al., J. Biol. Chem. 279:16727-35 (2004), WO 1998/18921, WO 2001/12812, WO 2000/68378 и WO 2000/40716.
"Антитело против IgE" включает любое антитело, которое специфично связывается с IgE таким образом, чтобы не индуцировать перекрестное связывание, когда IgE связан с высокоаффинным рецептором на тучных клетках и базофилах. Иллюстративные антитела включают антитела по изобретению, а также rhuMabE25 (E25, XOLAIR®), E26, E27, а также CGP-5101 (Hu-901) и антитело HA. Аминокислотные последовательности вариабельных доменов тяжелой и легкой цепи гуманизированных антител E25, E26 и E27 против IgE описаны, например, в U.S.P. 6172213 и WO 99/01556. Антитело CGP-5101 (Hu-901) описано в Come et al. (1997), J. Clin. Invest. 99(5):879-887, WO 92/17207 и ATCC депозит № BRL-10706, BRL-11130, BRL-11131, BRL-11132 и BRL-11133. Антитело HA описано в USSN 60/444229, WO 2004/070011 и WO 2004/070010.
II. Способы осуществления изобретения
A. Рекомбинантное получение
Также изобретение относится к выделенной нуклеиновой кислоте, кодирующей апоптотические антитела против IgE, векторам и клеткам-хозяевам, содержащим такую нуклеиновую кислоту, и к рекомбинантным способам получения антитела.
Для рекомбинантной продукции антитела нуклеиновую кислоту, кодирующую его, выделяют и встраивают в реплицируемый вектор для последующего клонирования (амплификации ДНК) или для экспрессии. ДНК, кодирующую моноклональное антитело, легко выделяют и секвенируют с использованием общепринятых способов (например, с использованием олигонуклеотидных зондов, которые способны специфично связываться с генами, кодирующими тяжелую и легкую цепи антитела). Доступно множество векторов. Компоненты векторов, как правило, включают, но не ограничиваются ими, один или несколько из следующих компонентов: сигнальная последовательность, ориджин репликации, один или несколько генов селектируемых маркеров, энхансерный элемент, промотор и последовательность терминации транскрипции.
(1) Компонент - сигнальная последовательность
Антитело против IgE по этому изобретению можно получать рекомбинантными способами не только прямо, но также в качестве полипептида, слитого с гетерологичным полипептидом, который предпочтительно представляет собой сигнальную последовательность или другой полипептид, обладающий участком для специфичного расщепления на N-конце зрелого белка или полипептида. Выбранная гетерологичная сигнальная последовательность предпочтительно представляет собой последовательность, которая распознается и преобразуется (т.е. расщепляется сигнальной пептидазой) в клетке-хозяине. В случае прокариотических клеток-хозяев, которые не распознают и не преобразуют нативную сигнальную последовательность антитела, сигнальную последовательность можно заменять прокариотической сигнальной последовательностью, выбранной, например, из группы из лидерных последовательнотсей щелочной фосфатазы, пенициллиназы, lpp или термостабильного энтеротоксина II. В случае секреции в дрожжах нативную сигнальную последовательность можно заменять, например, лидерной последовательностью инвертазы дрожжей, лидерной последовательностью α-фактора (включая лидерные последовательности α-фактора Saccharomyces и Kluyveromyces) или лидерной последовательностью кислой фосфатазы, лидерной последовательностью глюкоамилазы C. albicans или сигнальной последовательностью, описанной в WO 90/13646. Для экспрессии в клетках млекопитающих доступны сигнальные последовательности млекопитающих, а также вирусные секреторные лидерные последовательности, например сигнальная последовательность gD вируса простого герпеса.
ДНК такого участка-предшественника лигируют в рамке считывания с ДНК, кодирующей связывающее IgE антитело.
(2) Ориджин репликации
Векторы, как для экспрессии, так и для клонирования, содержат последовательность нуклеиновой кислоты, которая обеспечивает репликацию вектора в одной или нескольких выбранных клетках-хозяевах. Как правило, в векторах для клонирования эта последовательность представляет собой последовательность, которая обеспечивает репликацию вируса независимо от хромосомной ДНК хозяина, и включает ориджины репликации или автономно реплицирующиеся последовательности. Такие последовательности хорошо известны для множества бактерий, дрожжей и вирусов. Ориджин репликации из плазмиды pBR322 является пригодным для большинства грамотрицательных бактерий, плазмидный ориджин 2µ пригоден для дрожжей, и различные вирусные ориджины (SV40, вируса полиомы, аденовируса, VSV или BPV) пригодны для клонирования векторов в клетках млекопитающих. Как правило, для экспрессирующих векторов млекопитающих компонент, представляющий собой ориджин репликации, не требуется (ориджин SV40, главным образом, можно использовать только потому, что он содержит ранний промотор).
(3) Компонент селекции гена
Экспрессирующие и клонирующие векторы могут содержать ген для селекции, также называемый селектируемым маркером. Типичные гены для селекции кодируют белки, которые (a) придают устойчивость к антибиотикам или другим токсинам, например ампициллину, неомицину, метотрексату или тетрациклину, (b) комплементируют дефекты ауксотрофов или (c) обеспечивают основные питательные вещества, которые не доступны из комплексных сред, например ген, кодирующий D-аланинрацемазу для Bacilli.
В одном примере схемы селекции используют лекарственное средство для остановки роста клетки-хозяина. Клетки, которые успешно трансформированы гетерологичным геном, продуцируют белок, придающий устойчивость к лекарственному средству, и, таким образом, выживают после режима селекции. Примерами такого доминантного вида селекции является применение лекарственных средств неомицина, микофеноловой кислоты и гигромицина.
Другим примером пригодных селектируемых маркеров для клеток млекопитающих являются маркеры, которые позволяют идентификацию клеток, способных захватывать нуклеиновую кислоту, кодирующую связывающее IgE антитело, такие как гены DHFR, тимидинкинизы, металлотионеина-I и -II, предпочтительно гены металлотионеина приматов, аденозиндезаминазы, орнитиндекарбоксилазы и т.д.
Например, клетки, трансформированные геном для селекции DHFR, сначала идентифицируют культивированием всех трансформантов в культуральной среде, которая содержит метотрексат (Mtx), конкурентный антагонист DHFR. При использовании DHFR дикого типа пригодные клетки-хозяева представляют собой клеточную линию яичника китайского хомячка (CHO), дефицитную по активности DHFR (например, ATCC CRL-9096).
Альтернативно клетки-хозяева (в частности, хозяева дикого типа, которые содержат эндогенный DHFR), трансформированные или совместно трансформированные с последовательностями ДНК, кодирующими связывающее IgE антитело по изобретению, белок DHFR дикого типа и другой селектируемый маркер, такой как аминогликозид-3'-фосфотрансфераза (APH), можно отбирать выращиванием клеток на среде, содержащей вещество для селекции по селектируемому маркеру, такое как аминогликозидный антибиотик, например канамицин, неомицин или G418. См. патент США № 4965199.
Пригодным геном для селекции для применения в дрожжах является ген trp1, находящийся в дрожжевой плазмиде YRp7 (Stinchcomb et al., Nature, 282:39 (1979)). Ген trp1 представляет собой селектируемый маркер для мутантного штамма дрожжей, у которого отсутствует способность расти в отсутствие триптофана, например ATCC № 44076 или PEP4-1. Jones, Genetics, 85:12 (1977). Затем наличие повреждения trp1 в геноме дрожжевой клетки-хозяина обеспечивает эффективные условия для определения трансформации по росту в отсутствие триптофана. Аналогично дефицитные по Leu2 штаммы дрожжей (ATCC 20622 или 38626) комплементируют известными плазмидами, обладающими геном Leu2.
Кроме того, векторы, полученные из кольцевой плазмиды pKD1 1,6 мкм, можно использовать для трансформации дрожжей Kluyveromyces. Альтернативно описаны экспрессирующие системы для крупномасштабной продукции рекомбинантного химозина телят для K. lactis. Van den Berg, Bio/Technology, 8:135 (1990). Также описаны стабильные мультикопийные экспрессирующие векторы для секреции зрелого рекомбинантного сывороточного альбумина человека посредством промышленных штаммов Kluyveromyces. Fleer et al., Bio/Technology, 9:968-975 (1991).
(4) Компонент - промотор
Экспрессирующие и клонирующие векторы, как правило, содержат промотор, который распознается организмом-хозяином и функционально связан с нуклеиновой кислотой, кодирующей связывающее IgG антитело. Промоторы, пригодные для применения в прокариотических хозяевах, включают промотор phoA, промоторные системы β-лактамазы и лактозы, промотор щелочной фосфатазы, промоторную систему триптофана (trp) и гибридные промоторы, такие как промотор tac. Однако пригодными являются другие бактериальные промоторы. Промоторы для применения в бактериальных системах также содержат последовательность Шайна-Дальгарно (S.D.), функционально связанную с ДНК, кодирующей связывающее IgG антитело.
Известны промоторные последовательности для эукариот. Практически все эукариотические гены обладают AT-богатой областью, расположенной приблизительно от 25 до 30 оснований выше участка инициации транскрипции. Другая последовательность, находящаяся от 70 до 80 оснований выше точки начала транскрипции множества генов, представляет собой участок CNCAAT, где N может представлять собой любой нуклеотид. На 3'-конце большинства эукариотических генов находится последовательность AATAAA, которая может представлять собой сигнал для добавления поли-A хвоста к 3'-концу кодирующей последовательности. Все из этих последовательностей можно встраивать в эукариотические экспрессирующие векторы.
Примеры пригодных промоторных последовательностей для применения в дрожжевых хозяевах включают промоторы 3-фосфоглицераткиназы или других гликолитических ферментов, таких как енолаза, глицеральдегид-3-фосфатдегидрогеназа, гексокиназа, пируватдекарбоксилаза, фосфофруктокиназа, глюкоза-6-фосфатизомераза, 3-фосфоглицеромутаза, пируваткиназа, триозофосфатизомераза, фосфоглюкоизомераза и глюкокиназа.
Другие дрожжевые промоторы, которые представляют собой индуцибельные промоторы, обладающие дополнительным преимуществом контролируемой условиями выращивания транскрипции, представляют собой промоторные участки алкогольдегидрогеназы 2, изоцитохрома C, кислой фосфатазы, ферментов деградации, связанных с метаболизмом азота, металлотионеина, глицеральдегид-3-фосфат дегидрогеназы и ферментов, ответственных за употребление мальтозы и галактозы. Кроме того, пригодные векторы и промоторы для применения для экспрессии в дрожжах описаны в EP 73657. Также предпочтительно с дрожжевыми промоторами используют дрожжевые энхансеры.
Транскрипция связывающего IgG антитела с векторов в клетках-хозяевах млекопитающих контролируется, например, промоторами, получаемыми из геномов вирусов, таких как вирус полиомы, вирус оспы птиц, аденовирус (такой как аденовирус 2), вирус папилломы крупного рогатого скота, вирус саркомы птиц, цитомегаловирус, ретровирус, вирус гепатита-B и наиболее предпочтительно вирус обезьяны 40 (SV40), гетерологичными промоторами млекопитающих, например, промотором актина или промотором иммуноглобулина, промоторами теплового шока, при условии, что такие промоторы являются совместимыми с системами клеток-хозяев.
Ранние и поздние промоторы вируса SV40 обычно получают в качестве рестрикционного фрагмента SV40, который также содержит ориджин репликации вируса SV40. Предранний промотор цитомегаловируса человека обычно получают в качестве рестрикционного фрагмента HindIIIE. Система для экспрессии ДНК в хозяевах, относящихся к млекопитающим, с использованием вируса папилломы крупного рогатого скота в качестве вектора описана в патенте США № 4419446. Модификация этой системы описана в патенте США № 4601978. См. также Reyes et al., Nature 297:598-601 (1982) в отношении экспрессии кДНК интерферона человека в клетках мышей под контролем промотора тимидинкиназы из вируса простого герпеса. Альтернативно в качестве промотора можно использовать длинный концевой повтор вируса саркомы Рауса.
(5) Компонент - энхансерный элемент
Транскрипцию ДНК, кодирующей связывающее IgG антитело по данному изобретению, у высших эукариот часто усиливают посредством встраивания в вектор энхансерной последовательности. Известно много энхансерных последовательностей из генов млекопитающих (глобина, эластазы, альбумина, α-фетопротеина и инсулина). Однако, как правило, используют энхансер из вируса эукариотической клетки. Примеры включают энхансер SV40 на поздней стороне ориджина репликации (п.о. 100-270), энхансер раннего промотора цитомегаловируса, энхансер полиомы на поздней стороне ориджина репликации и энхансеры аденовируса. См. также Yaniv, Nature 297:17-18 (1982) в отношении энхансеров для активации эукариотических промоторов. Энхансер может быть присоединен в векторе к кодирующей связывающее IgE антитело последовательности в положении 5' или 3', однако предпочтительно он расположен в участке, расположенном в 5'-направлении от промотора.
(6) Компонент для терминации транскрипции
Экспрессирующие векторы, используемые в эукариотических клетках-хозяевах (в клетках дрожжей, грибов, насекомых, растений, животных, человека или содержащих ядро клетках из других многоклеточных организмов), также содержат последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности обычно находятся на 5'- и иногда на 3'-нетранслируемых участках эукариотических или вирусных ДНК или кДНК. Эти участки содержат нуклеотидные фрагменты, транскрибируемые в качестве полиадинилированных фрагментов в нетранслируемом участке мРНК, кодирующей связывающее IgG антитело. Одним пригодным компонентом для терминации транскрипции является участок полиаденилирования бычьего гормона роста. См. WO 94/11026 и описанный в ней экспрессирующий вектор.
(7) Выбор и трансформация клеток-хозяев.
Пригодные клетки-хозяева для клонирования или экспрессии ДНК в векторах, представленных в настоящем документе, представляют собой клетки прокариот, дрожжей или высших эукариот, описанных выше. Пригодные для этой цели прокариоты включают эубактерии, такие как грамотрицательные или грамположительные организмы, например Enterobacteriaceae, такие как Escherichia, например E. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например Salmonella typhimurium, Serratia, например Serratia marcescans, и Shigella, а также Bacilli, такие как B. subtilis и B. licheniformis (например, B. licheniformis 41P, описанные в DD 266710, опубликованной 12 апреля 1989 года), Pseudomonas, такие как P. aeruginosa и Streptomyces. Одним предпочтительным хозяином E. coli для клонирования является E. coli 294 (ATCC 31446), хотя также пригодными являются другие штаммы, такие как E. coli B, E. coli X1776 (ATCC 31537) и E. coli W3110 (ATCC 27325). Эти примеры являются иллюстративными, но не ограничивающими.
Полноразмерное антитело, фрагменты антитела и слитые белки антитела можно получать в бактериях, в частности, когда гликозилирование и Fc-эффекторная функция не требуются, например, когда терапевтическое антитело конъюгировано с цитотоксическим средством (например, токсином) и иммуноконъюгат самостоятельно демонстрирует эффективность в отношении разрушения клеток опухоли. Полноразмерные антитела обладают более высоким временем полужизни в кровотоке. Продукция в E. coli является более быстрой и более экономичной. Для экспрессии фрагментов антитела и полипептидов в бактериях см., например, U.S. 5648237 (Carter et al.), U.S. 5789199 (Joly et al.) и U.S. 5840523 (Simmons et al.), в которых описаны участок инициации трансляции (TIR) и сигнальные последовательности для оптимизации экспрессии и секреции. После экспрессии антитело выделяют из клеточной массы E. coli в растворимой фракции, и их можно очищать, например, с помощью колонки с белком A или G, в зависимости от изотипа. Конечную очистку можно проводить аналогично процессу очистки антитела, экспрессируемого, например, в клетках CHO.
В дополнение к прокариотам пригодными хозяевами для клонирования или экспрессии кодирующих связывающего IgG антитела векторов являются эукариотические микроорганизмы, такие как нитевидные грибы или дрожжи. Saccharomyces cerevisiae, или обычные пекарские дрожжи, наиболее распространены среди низших эукариотических микроорганизмов-хозяев. Однако широко доступным и пригодным здесь является ряд других родов, видов и штаммов, таких как Schizosaccharomyces pombe; хозяева Kluyveromyces, такие как, например, K. lactis, K.fragilis (ATCC 12424), K. bulgaricus (ATCC 16045), K. wickeramii (ATCC 24178), K. waltii (ATCC 56500), K. drosophilarum (ATCC 36906), K. thermotolerans и K. marxianus; yarrowia (EP 402226); Pichia pastoris (EP 183070); Candida; Trichoderma reesia (EP 244234); Neurospora crassa; Schwanniomyces, такие как Schwanniomyces occidentalis; и нитевидные грибы, такие как, например, хозяева Neurospora, Penicillium, Tolypocladium и Aspergillus, такие как A. nidulans и A. niger.
Пригодные клетки-хозяева для экспрессии гликозилированного связывающего IgG антитела получают из многоклеточных организмов. Примеры клеток беспозвоночных включают клетки растений и насекомых. Выявлен ряд штаммов и вариантов бакуловирусов и соответствующих пермиссивных клеток-хозяев среди хозяев, таких как Spodoptera frugiperda (гусеница), Aedes aegypti (москит), Aedes albopictus (москит), Drosophila melanogaster (плодовая мушка) и Bombyx mori. Множество штаммов вирусов для трансфекции являются широко доступными, например, вариант L-1 Autographa californica NPV и штамм Bm-5 Bombyx mori NPV, и такие вирусы можно использовать здесь в качестве вирусов в соответствии с настоящим изобретением, в частности, для трансфекции клеток Spodoptera frugiperda.
Также в качестве хозяев можно использовать растительные клеточные культуры хлопка, кукурузы, картофеля, сои, петунии, томата и табака, ряски и другие клетки растений.
Однако наибольший интерес представляют клетки позвоночных, и размножение клеток позвоночных в культуре (культуре тканей) стало общепринятым способом. Примерами пригодных хозяев, представляющих собой клеточные линии млекопитающих, являются линия почки обезьяны CV1, трансформированные SV40 (COS-7, ATCC CRL 1651); эмбриональная линия почки человека (клетки 293 или 293, субклонированные для выращивания в суспензионной культуре, Graham et al., J. Gen Virol. 36:59 (1977)); клетки почки молодого хомячка (BHK, ATCC CCL 10); клетки яичника китайского хомячка/-DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci USA 77:4216 (1980)); клетки Сертоли мыши (TM4, Mather, Biol. Reprod. 23:243-251 (1980)); клетки почки обезьяны (CV1 ATCC CCL 70); клетки почки африканской зеленой мартышки (VERO-76, ATCC CRL-1587); клетки цервикальной карциномы человека (HELA, ATCC CCL 2); клетки почки собаки (MDCK, ATCC CCL 34); клетки печени крысы буффало (BRL 3A, ATCC CRL1442); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); клетки опухоли молочной железы мыши (MMT 060562, ATCC CCL51); клетки TRI (Mather et al., Annals N.Y. Acad. Sci 383:44-68 (1982)); клетки MRC 5; клетки FS4; и линия гепатомы человека (Hep G2).
Для продукции связывающего IgG антитела клетки-хозяева трансформируют описанными выше экспрессирующими и клонирующими векторами и культивируют их в общепринятой среде, модифицированной соответствующим образом, для индукции промоторов, селекции трансформантов или амплификации генов, кодирующих требуемые последовательности.
(8) Культивирование клеток-хозяев
Клетки-хозяева, используемые для продукции связывающего IgG антитела по данному изобретению, можно культивировать в различных средах. Для культивирования клеток-хозяев пригодными являются коммерчески доступные среды, такие как среда Хэма F10 (Sigma), минимальная поддерживающая среда ((MEM), (Sigma)), RPMI-1640 (Sigma) и среда Игла, модифицированная способом Дульбекко, ((DMEM), Sigma). Кроме того, для клеток-хозяев в качестве культуральной среды можно использовать любую из сред, описанных в Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal. Biochem. 102:255 (1980), патентах США №№4767704; 4657866; 4927762, 4560655 или 5122469, WO 90/03430, WO 87/00195 или патенте США Re. 30985. Любые их этих сред можно дополнить при необходимости гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлорид натрия, кальция, магния и фосфат), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как лекарственное средство GENTAMYCINTM), микроэлементами (определяемыми как неорганические соединения, обычно представленные в конечных концентрациях микромолярного диапазона) и глюкозой или эквивалентными источниками энергии. Также можно добавлять любые другие необходимые дополнительные вещества в соответствующих концентрациях, которые известны специалистам в данной области. Условия культивирования, такие как температура, pH и т.п., представляют собой условия, которые ранее использовали для выбранных для экспрессии клеток-хозяев, и они будут понятны специалисту в данной области.
(9) Очистка антитела
При использовании рекомбинантных способов антитело может продуцироваться внутриклеточно, в периплазматическом пространстве, или оно может непосредственно секретироваться в среду. При внутриклеточной продукции антитела, в качестве первого этапа удаляют частицы дебриса, либо клетки-хозяева, либо лизированные фрагменты, например, посредством центрифугирования или ультрафильтрации. В Carter et al., Bio/Technology 10:163-167 (1992) описан способ выделения антител, которые секретируются в периплазматическое пространство E. coli. В кратком изложении, клеточную массу размораживают в присутствии ацетата натрия (pH 3,5), EDTA и фенилметилсульфонилфторида (PMSF) в течение приблизительно 30 мин. Клеточный дебрис можно удалять центрифугированием. Когда антитело секретируется в среду, супернатанты из таких экспрессирующих систем, как правило, сначала концентрируют с использованием коммерчески доступного фильтра для концентрирования белка, например, элемента для ультрафильтрации Amicon или Millipore Pellicon. На любой из предшествующих стадий можно включать ингибитор протеаз, такой как PMSF, для ингибирования протеолиза, и для предотвращения роста ненужных контаминирующих организмов можно добавлять антибиотики.
Композицию антитела, полученную из клеток, можно очищать с использованием, например, хроматографии с гидроксилапатитом, гель-электрофореза, диализа и аффинной хроматографии, причем аффинная хроматография является предпочтительным способом очистки. Пригодность белка A в качестве аффинного лиганда зависит от вида и изотипа любого Fc-домена иммуноглобулина, который находится в антителе. Белок A можно использовать для очистки антител, в основе которых лежат тяжелые цепи 1, 2 или 4 человека (Lindmark et al., J. Immunol. Meth. 62:1-13 (1983)). Белок G рекомендован для всех изотипов мыши и для цепи 3 человека (Guss et al., EMBO J. 5:1567-1575 (1986)). Матрица, к которой присоединен аффинный лиганд, наиболее часто представляет собой агарозу, однако доступными являются и другие матрицы. Механически стабильные матрицы, такие как стекло с контролируемым размером пор или поли(стиролдивинил)бензол, обеспечивают более высокие скорости потока и более короткое время обработки, чем те, которых достигают с помощью агарозы. В случае когда антитело содержит домен CH3, для очистки пригодна смола ABXTM (J. T. Baker, Phillipsburg, NJ). Также в зависимости от антитела, подлежащего выделению, пригодны другие способы очистки белка, такие как фракционирование на ионообменной колонке, осаждение этанолом, обращенно-фазовая ВЭЖХ, хроматография на диоксиде кремния, хроматография на SEPHAROSE™ с гепарином, хроматография на анионной или катионной обменной смоле (такая как колонка с полиаспарагиновой кислотой), хроматофокусирование, SDS-PAGE и осаждение сульфатом аммония.
После предварительной стадии(ий) очистки смесь, содержащую представляющее интерес антитело и примеси, можно подвергать хроматографии гидрофобного взаимодействия с низким значением pH с использованием буфера для элюирования при pH приблизительно 2,5-4,5, предпочтительно проводимой при низких концентрациях соли (например, приблизительно 0-0,25 M соли).
В. Получение антитела
1) Поликлональные антитела
Поликлональные антитела предпочтительно индуцируют у животных многократными подкожными (sc) или внутрибрюшинными (ip) инъекциями соответствующего антигена и адъюванта. Может быть пригодной конъюгация соответствующего антигена (особенно когда используют синтетические пептиды) с белком, который является иммуногенным у видов, подлежащих иммунизации. Например, антиген можно конъюгировать с гемоцианином лимфы улитки (KLH), сывороточным альбумином, бычьим тиреоглобулином, или ингибитором трипсина сои, с использованием бифункционального или образующего производное средства, например сложного эфира малеимидобензоилсульфосукцинимида (конъюгация через остатки цистеина), N-гидроксисукцинимида (через остатки лизина), глутаральдегида, янтарного ангидрида, SOCl2 или R1N=C=NR, где R и R1 являются независимыми низшими алкильными группами. Примеры адъювантов, которые можно использовать, включают полный адъювант Фрейнда и адъювант MPL-TDM (монофосфориллипид A, синтетический дикориномиколат трегалозы). Протокол иммунизации может быть выбран специалистом в данной области без излишнего экспериментирования.
Животных иммунизируют против антигена, иммуногенных конъюгатов или производных комбинированием, например, 100 мкг или 5 мкг белка или конъюгата (для кроликов или мышей, соответственно) с 3 объемами полного адъюванта Фрейнда и инъекцией раствора внутрикожно в несколько участков. Через один месяц животным проводят повторную иммунизацию от 1/5 до 1/10 от исходного количества пептида или конъюгата в полном адъюванте Фрейнда посредством подкожной инъекции в несколько участков. Через семь-четырнадцать суток у животных отбирают кровь, и сыворотку анализируют в отношении титра антител. Животным проводят повторные иммунизации до достижения титрами плато. Конъюгаты также можно получать в рекомбинантной клеточной культуре в качестве белковых слитых молекул. Также для усиления иммунного ответа пригодным образом используют вызывающие агрегацию средства, такие как квасцы.
2) Моноклональные антитела
Моноклональные антитела получают из совокупности, по существу, гомогенных антител, т.е. отдельные антитела, составляющие совокупность, являются идентичными, за исключением возможных встречающихся в природе мутаций и/или посттрансляционных модификаций (например, изомеризаций, амидаций), которые могут быть представлены в небольших количествах. Таким образом, определение "моноклональный" указывает на тот признак антитела, что оно не является смесью отдельных антител.
Например, моноклональные антитела можно получать с использованием способа гибридом, впервые описанного Kohler et al., Nature, 256:495 (1975), или их можно получать способами рекомбинантных ДНК (патент США № 4816567).
В способе гибридом мышь или другого пригодного животного-хозяина, такого как хомяк, иммунизируют, как описано выше, для получения лимфоцитов, которые продуцируют или способны продуцировать антитела, которые специфично связываются с белком, используемым для иммунизации. Альтернативно лимфоциты можно иммунизировать in vitro. После иммунизации лимфоциты выделяют, а затем подвергают слиянию с миеломной клеточной линией с использованием пригодного средства, вызывающего слияние клеток, такого как полиэтиленгликоль, с получением гибридомных клеток (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)).
Иммунизирующее средство, как правило, включает антигенный белок или его слитый вариант. Как правило, используют либо лимфоциты периферической крови человека ("PBL"), если желательными являются клетки человека, либо клетки селезенки или клетки лимфатических узлов, если желательными являются клетки не человека. Затем лимфоциты подвергают слиянию с иммортализованной клеточной линией с использованием пригодного вещества для слияния, такого как полиэтиленгликоль, с получением гибридомной клетки. Goding, Monoclonal Antibodies: Principles and Practice, Academic Press (1986), pp. 59-103.
Иммортализованные клеточные линии, как правило, представляют собой трансформированные клетки млекопитающих, в частности миеломные клетки грызунов, бычьих и человека. Как правило, используют миеломные клеточные линии крысы или мыши. Полученные таким образом гибридомные клетки высевают и выращивают в пригодной культуральной среде, которая предпочтительно содержит одно или несколько веществ, которые ингибируют рост или выживание неслитых исходных клеток миеломы. Например, если исходные клетки миеломы лишены фермента гипоксантин-гуанин-фосфорибозил-трансферазы (HGPRT или HPRT), селективная культуральная среда для гибридом, как правило, включает вещества гипоксантин, аминоптерин и тимидин (среда HAT), которые препятствуют росту клеток, дефицитных по HGPRT.
Предпочтительные иммортализованные миеломные клетки представляют собой клетки, которые эффективно подвергаются слиянию, которые поддерживают стабильно высокий уровень продукции антител отобранными антителопродуцирующими клетками и являются чувствительными к среде, такой как среда HAT. Среди них, предпочтительными являются линии миеломы мышей, такие как линии, полученные из опухолей мышей MOPC-21 и MPC-11, доступные от Salk Institute Cell Distribution Center, San Diego, California USA, и клетки SP-2 (и их производные, например, X63-Ag8-653), доступные от American Type Culture Collection, Manassas, Virginia USA. Также для продукции моноклональных антител человека описаны миеломные клеточные линии человека и линии гетеромиеломы мыши - человека (Kozbor, J. Immunol, 133:3001 (1984); и Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)).
Культуральную среду, в которой выращивают гибридомные клетки, оценивают в отношении продукции моноклональных антител, направленных против антигена. Предпочтительно специфичность связывания моноклональных антител, продуцируемых гибридомными клетками, определяют посредством иммунопреципитации или анализа связывания in vitro, такого как радиоиммунный анализ (RIA) или твердофазный иммуноферментный анализ (ELISA).
Культуральную среду, в которой гибридомные клетки культивируют, можно оценивать в отношении наличия моноклональных антител, направленных против требуемого антигена. Предпочтительно аффинность и специфичность связывания моноклонального антитела можно определять с помощью иммунопреципитации или анализа связывания in vitro, такого как радиоиммунный анализ (RIA) или твердофазный иммуноферментный анализ (ELISA). Такие способы и анализы известны в данной области. Например, аффинность связывания моноклонального антитела можно определять, например, посредством анализа Скэтчарда, описанного в Munson et al., Anal. Biochem., 107:220 (1980).
После идентификации гибридомных клеток, которые продуцируют антитела с требуемой специфичностью, аффинностью и/или активностью, клоны можно субклонировать способами лимитирующих разведений и выращивать стандартными способами (Goding, выше). Пригодные для этой цели культуральные среды включают, например, среду D-MEM или RPMI-1640. Кроме того, гибридомные клетки можно выращивать in vivo у млекопитающих в качестве опухолей.
Моноклональные антитела, секретируемые субклонами, пригодным способом выделяют из культуральной среды, асцитной жидкости или сыворотки общепринятыми способами очистки антител, например, таких как хроматография с A-Sepharose, хроматография с гидроксилапатитом, гель-электрофорез, диализ или аффинная хроматография.
Моноклональные антитела также можно получать способами рекомбинантных ДНК, такими как способы, описанные в патенте США № 4816567, и как описано выше. ДНК, кодирующую моноклональные антитела, легко выделяют и секвенируют с использованием общепринятых способов (например, с использованием олигонуклеотидных зондов, которые способны специфично связываться с генами, кодирующими тяжелые и легкие цепи антител мыши). Гибридомные клетки служат в качестве предпочтительного источника такой ДНК. Для обеспечения синтеза моноклональных антител в таких рекомбинантных клетках-хозяевах, после выделения ДНК можно встраивать в экспрессирующие векторы, которые затем трансфицируют в клетки-хозяева, такие как клетки E. coli, клетки COS обезьяны, клетки яичника китайского хомячка (CHO) или клетки миеломы, которые в ином случае не продуцируют белок антитела. Обзорные статьи по рекомбинантной экспрессии в бактериях ДНК, кодирующей антитело, включают Skerra et al., Curr. Opinion in Immunol. 5:256-262 (1993) и Pluckthun, Immunol. Revs., 130:151-188 (1992).
В следующем варианте осуществления антитела можно выделять из фаговых библиотек антител, созданных с использованием способов, описанных в McCafferty et al., Nature, 348:552-554 (1990). В Clackson et al., Nature, 352:624-628 (1991) и Marks et al., J. Mol. Biol., 222:581-597 (1991) описано выделение антител мыши и человека, соответственно, с использованием фаговых библиотек. В более поздних публикациях описана продукция высокоаффинных (нМ-порядок) антител человека посредством перестановки цепей (Marks et al., Bio/Technology, 10:779-783 (1992)), а также комбинаторной инфекции и рекомбинации in vivo в качестве стратегии для конструирования очень крупных фаговых библиотек (Waterhouse et al., Nucl. Acids. Res., 21:2265-2266 (1993)). Таким образом, эти способы представляют собой приемлемые альтернативы традиционным способам гибридомных моноклональных антител для выделения моноклональных антител.
Также ДНК можно модифицировать, например, посредством замены последовательностями константного домена тяжелой и легкой цепи человека гомологичных последовательностей мыши (патент США № 4816567; и Morrison, et al., Proc. Natl. Acad. Sci. USA, 81:6851 (1984)), или ковалентного связывания кодирующей иммуноглобулин последовательности со всей кодирующей последовательностью для полипептида, не являющегося иммуноглобулином, или ее частью. Как правило, такими полипептидами, не являющимися иммуноглобулинами, заменяют константные домены антитела, или ими заменяют вариабельные домены одного антигенсвязывающего сайта антитела с получением химерного двухвалентного антитела, содержащего один антигенсвязывающий сайт со специфичностью к одному антигену и другой антигенсвязывающий сайт со специфичностью к другому антигену.
Моноклональные антитела, описанные в настоящем документе, могут быть одновалентными, и способы их получения хорошо известны в данной области. Например, один способ вовлекает рекомбинантную экспрессию легкой цепи иммуноглобулина и модифицированной тяжелой цепи. Тяжелую цепь укорачивают, как правило, в любой точке Fc-участка, чтобы предотвратить поперечное связывание тяжелой цепи. Альтернативно соответствующие остатки цистеина можно заменять другим аминокислотным остатком или удалять для предотвращения поперечного связывания. Также для получения одновалентных антител пригодны способы in vitro. Расщепление антител с получением их фрагментов, в частности Fab-фрагментов, можно проводить с использованием общепринятых способов, известных в данной области.
Химерные или гибридные антитела также можно получать in vitro с использованием известных способов химии синтетических белков, включая способы, вовлекающие поперечно-сшивающие агенты. Например, иммунотоксины можно конструировать с использованием реакции дисульфидного обмена или посредством образования тиоэфирной связи. Примеры пригодных для этой цели реагентов включают иминотиолат и метил-4-меркаптобутиримидат.
3) Гуманизированные антитела.
Антитела по изобретению, кроме того, могут включать гуманизированные антитела или антитела человека. Гуманизированные формы антител не человека (например, мыши) представляют собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие подпоследовательности антител), которые содержат минимальную последовательность, образованную иммуноглобулином не человека. Гуманизированные антитела представляют собой иммуноглобулины человека (реципиентное антитело), в которых остатки из определяющей комплементарность области (CDR) реципиента заменены остатками CDR не относящегося к человеку вида (донорное антитело), такого как мышь, крыса или кролик, имеющими требуемую специфичность, аффинность и емкость. В некоторых случаях остатки каркасной области Fv иммуноглобулина человека заменяют соответствующими остатками не человека. Гуманизированные антитела также могут содержать остатки, которые не встречаются ни в реципиентном антителе, ни в импортных последовательностях CDR или каркасной области. Как правило, гуманизированное антитело будет содержать, по существу, все по меньшей мере из одного и, как правило, двух вариабельных доменов, в которых все или по существу все из областей CDR соответствуют CDR иммуноглобулина не человека, и все или по существу все из областей FR представляют собой области FR консенсусной последовательности иммуноглобулина человека. Гуманизированное антитело также в оптимальном случае будет содержать по меньшей мере часть константного участка (Fc) иммуноглобулина, как правило, константного участка иммуноглобулина человека. Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992).
Способы гуманизации антител, не являющихся человеческими, описаны в данной области. Как правило, гуманизированное антитело обладает одним или несколькими встроенными в него аминокислотными остатками из источника, который не является человеческим. Такие не являющиеся человеческими аминокислотные остатки часто называют "импортными" остатками, которые, как правило, взяты из "импортной" вариабельного домена. Гуманизацию, главным образом, можно проводить в соответствии со способом Winter и коллег, Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988), посредством замены CDR или последовательностями CDR крысы соответствующих последовательностей антитела человека. Таким образом, такие "гуманизированные" антитела представляют собой химерные антитела (патент США № 4816567), где, по существу, менее целого вариабельного домена человека замещено соответствующей последовательностью вида, не относящегося к человеку. На практике, гуманизированные антитела, как правило, представляют собой антитела человека, в которых некоторые остатки CDR и, возможно, некоторые остатки FR заменены остатками из аналогичных сайтов антител грызунов.
Выбор вариабельных доменов человека, как легких, так и тяжелых цепей, для использования при получении гуманизированных антител является очень важным для снижения антигенности. В соответствии с так называемым способом "наилучшего соответствия", последовательность вариабельного домена антитела грызуна анализируют относительно целой библиотеки известных последовательностей вариабельных доменов человека. Последовательность человека, которая является наиболее сходной с последовательностью грызуна, и каркасную область (FR) человека в ней принимают для гуманизированного антитела (Sims et al., J. Immunol, 151:2296 (1993); Chothia et al., J. Mol. Biol, 196:901 (1987)). В другом способе используют конкретную каркасную область, полученную из консенсусной последовательности всех антител человека из конкретной подгруппы легких или тяжелых цепей. Один и тот же каркас можно использовать для нескольких различных гуманизированных антител (Carter et al., Proc. Natl. Acad. Sci USA, 89:4285 (1992); Presta et al., J. Immunol, 151:2623 (1993)).
Кроме того, важно, чтобы антитела были гуманизированы с сохранением высокой аффинности к антигену и других положительных биологических свойств. Для достижения этой цели, в соответствии с предпочтительным способом, гуманизированные антитела получают с помощью процесса анализа исходных последовательностей и различных предполагаемых гуманизированных продуктов с использованием трехмерных моделей исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов являются широко доступными и известны специалистам в данной области. Доступными являются компьютерные программы, которые иллюстрируют и выводят на экран возможные трехмерные конформационные структуры выбранных последовательностей иммуноглобулинов-кандидатов. Исследование этих выведенных на экран данных позволяет проводить анализ возможной роли остатков в функционировании предполагаемых последовательностей иммуноглобулинов, т.е. анализ остатков, которые влияют на способность иммуноглобулина-кандидата связывать свой антиген. Таким образом, можно отобрать остатки FR и комбинировать их из реципиентной и импортной последовательностей таким образом, чтобы были достигнуты требуемые свойства антител, такие как повышенная аффинность к антигену(ам)-мишени. Как правило, непосредственное и наиболее существенное влияние на связывание антигена оказывают остатки CDR.
Предусмотрены различные формы гуманизированного антитела. Например, гуманизированное антитело может представлять собой фрагмент антитела, такой как Fab, который необязательно конъюгирован с одним или несколькими цитотоксическим средством(ами) для получения иммуноконъюгата. Альтернативно гуманизированное антитело может представлять собой интактное антитело, такое как интактное антитело IgG1.
4) Антитела человека
В качестве альтернативы гуманизации можно получать антитела человека. Например, в настоящее время возможным является получение трансгенных животных (например, мышей), которые способны, при иммунизации, продуцировать полный набор антител человека в отсутствии продукции эндогенных иммуноглобулинов. Например, было описано, что гомозиготная делеция гена области соединения тяжелых цепей антител (JH) у химерных мышей и мутантных мышей зародышевой линии приводит к полному ингибированию продукции эндогенных антител. Перенос системы генов иммуноглобулинов зародышевой линии человека в таких мутантных мышей зародышевой линии приводит к продукции антител человека при антигенной стимуляции. См., например, Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggermann et al., Year in Immuno., 7:33 (1993); и патент США № 5591669 и WO 97/17852.
Альтернативно для получения антител человека и фрагментов антител in vitro можно использовать технологию фагового дисплея из наборов генов вариабельных (V) доменов иммуноглобулинов неиммунизированных доноров. McCafferty et al., Nature 348:552-553 (1990); Hoogenboom and Winter, J. Mol. Biol. 227:381 (1991). В соответствии с этим способом гены V домена антител клонируют в рамке считывания либо главного, либо второстепенного гена оболочки нитевидного бактериофага, такого как M13 или fd, и они экспонируются в качестве функциональных фрагментов антител на поверхности частицы фага. Вследствие того, что нитевидная частица содержит одноцепочечную копию ДНК генома фага, селекция на основе функциональных свойств антитела также приведет к селекции гена, кодирующего антитело, проявляющее такие свойства. Таким образом, фаг имитирует некоторые из свойств B-клетки. Фаговый дисплей можно проводить в различных формах, рассмотренных, например, в Johnson, Kevin S. and Chiswell, David J., Current Opinion in Structural Biology 3:564-571 (1993). Для фагового дисплея можно использовать несколько источников сегментов V-генов. Clackson et al., Nature, 352:624-628 (1991), выделили набор разнообразных антител против оксазолона из небольшой случайной комбинаторной библиотеки V-генов, полученной из селезенок иммунизированных мышей. Можно сконструировать набор V-генов из неиммунизированных доноров-людей и можно выделять антитела против широкого набора антигенов (в том числе против собственных антигенов), главным образом, в соответствии со способами, описанными Marks et al., J. Mol Biol. 222:581-597 (1991), или Griffith et al., EMBO J. 12:725-734 (1993). См., также, патенты США №№ 5565332 и 5573905.
Также для получения моноклональных антител человека доступны способы Cole et al., и Boerner et al. (Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985) и Boerner et al., J. Immunol. 147(1):86-95 (1991). Аналогично антитела человека можно получать введением локусов иммуноглобулинов человека трансгенным животным, например, мышам, у которых эндогенные гены иммуноглобулинов частично или полностью инактивированы. При иммунизации наблюдают продукцию антитела человека, которое в высокой степени сходно с антителом, наблюдаемым у человека во всех отношениях, включая реаранжировку генов, сборку и набор антител. Этот подход описан, например, в патентах США №№ 5545807, 5545806, 5569825, 5625126, 5633425, 5661016 и в следующих научных публикациях: Marks et al., Bio/Technology 10:779-783 (1992); Lonberg et al., Nature 368: 856-859 (1994); Morrison, Nature 368:812-13 (1994), Fishwild et al., Nature Biotechnology 14:845-51 (1996), Neuberger, Nature Biotechnology 14: 826 (1996) и Lonberg и Huszar, Intern. Rev. Immunol. 13:65-93 (1995).
Как рассмотрено выше, антитела человека также можно получать посредством активированных B-клеток in vitro (см. патенты США 5567610 и 5229275).
5) Фрагменты антител
В некоторых случаях преимущественным является использование фрагментов антител, вместо целых антител. Меньший размер фрагментов позволяет быстрое выведение и может обеспечить улучшенный доступ к солидным опухолям.
Для получения фрагментов антител были разработаны различные способы. Традиционно эти фрагменты получали посредством протеолитического расщепления полноразмерных антител (см., например, Morimoto et al., Journal of Biochemical and Biophysical Methods 24:107-117 (1992); и Brennan et al., Science, 229:81 (1985)). Однако эти фрагменты в настоящее время можно получать непосредственно с помощью рекомбинантных клеток-хозяев. Fab-, Fv- и scFv-фрагменты антител могут быть экспрессированы и секретированы в E. coli, таким образом, позволяя простой способ получения больших количеств этих фрагментов. Фрагменты антител можно выделять из фаговых библиотек антител, описанных выше. Альтернативно фрагменты Fab'-SH можно выделять непосредственно из E. coli и химически связывать с получением фрагментов F(ab')2 (Carter et al., Bio/Technology 10:163-167 (1992)). В соответствии с другим подходом фрагменты F(ab')2 можно выделять непосредственно из рекомбинантной культуры клеток-хозяев. Fab- и F(ab')2-фрагмент с повышенным временем полужизни in vivo описаны в патенте США № 5869046. В других вариантах осуществления предпочтительное для выбора антитело представляет собой одноцепочечный Fv-фрагмент (scFv). См. WO 93/16185, патент США № 5571894 и патент США № 5587458. Фрагмент антитела также может представлять собой "линейное антитело", например, как описано в патенте США 5641870. Такие линейные фрагменты антител могут быть моноспецифичными или биспецифичными.
6) Антителозависимая опосредуемая ферментом пролекарственная терапия (ADEPT)
Антитела по настоящему изобретению также можно использовать в ADEPT посредством конъюгации антитела с активирующим пролекарство ферментом, который превращает пролекарство (например, пептидильное химиотерапевтическое средство, см. WO 81/01145) в активное лекарственное средство против злокачественной опухоли. См., например, WO 88/07378 и патент США № 4975278.
Ферментный компонент иммуноконъюгата, пригодного для ADEPT, включает любой фермент, способный действовать на пролекарство таким образом, чтобы превращать его в более активную цитотоксическую форму.
Ферменты, которые пригодны в способе по этому изобретению, включают, но не ограничиваются ими, гликозидазу, глюкозооксидазу, лизоцим человека, глюкуронидазу человека, щелочную фосфатазу, пригодную для превращения фосфатсодержащих пролекарств в свободные лекарственные средства; арилсульфатазу, пригодную для превращения сульфатсодержащих пролекарств в свободные лекарственные средства; цитозиндезаминазу, пригодную для превращения нетоксичного 5-фторцитозина в лекарственное средство против злокачественной опухоли 5-фторурацил; протеазы, такие как протеаза serratia, термолизин, субтилизин, карбоксипептидазы (например, карбоксипептидазу G2 и карбоксипептидазу A) и катепсины (такие как катепсины B и L), которые пригодны для превращения пептидсодержащих пролекарств в свободные лекарственные средства; D-аланилкарбоксипептидазы, пригодные для превращения пролекарств, которые содержат D-аминокислотные заместители; отщепляющие углевод ферменты, такие как β-галактозидаза и нейраминидаза, пригодные для превращения гликозилированных пролекарств в свободные лекарственные средства; β-лактамазу, пригодную для превращения лекарственных средств, превращенных в производные с β-лактамами, в свободные лекарственные средства; и пенициллинамидазы, такие как амидаза пенициллина V или амидаза пенициллина G, пригодные для превращения лекарственных средств, преобразованных по их азотам аминов посредством феноксиацетильной или фенилацетильной групп, соответственно, в свободные лекарственные средства. Альтернативно антитела с ферментативной активностью, также известные в данной области как "абзимы", можно использовать для превращения пролекарств по изобретению в свободные активные лекарственные средства (см., например, Massey, Nature 328:457-458 (1987)). Конъюгаты антитело-абзим можно получать, как описано в настоящем документе, для доставки абзима в популяцию опухолевых клеток.
Указанные выше ферменты можно ковалентно связывать с полипептидами или антителами, описанными в настоящем документе, способами, хорошо известными в данной области, такими как применение гетеробифункциональных поперечно-сшивающих средств, рассмотренных выше. Альтернативно слитые белки, содержащие по меньшей мере антигенсвязывающую область антитела по изобретению, связанную по меньшей мере с функционально активной частью фермента по изобретению, можно конструировать с использованием способов рекомбинантных ДНК, хорошо известных в данной области (см., например, Neuberger et al., Nature 312:604-608 (1984)).
7) Биспецифичные и полиспецифичные антитела
Биспецифичные антитела (BsAb) представляют собой антитела, которые обладают специфичностью связывания по меньшей мере двух различных эпитопов, включая эпитопы на одном или на разных белках. Альтернативно одно плечо может быть нацелено на связывание с антигеном-мишенью, а другое плечо может быть комбинировано с плечом, которое связывается с триггерной молекулой на лейкоците, такой как молекула T-клеточного рецептора (например, CD3), или Fc-рецепторы для IgG (FcγR), такие как FcγR1 (CD64), FcγRII (CD32) и FcγRIII (CD16), так чтобы сосредоточить и локализовать механизмы клеточной защиты на экспрессирующей антиген-мишень клетке. Такие антитела можно получать из полноразмерных антител или фрагментов антител (например, биспецифичные антитела F(ab')2).
Также биспецифичные антитела можно использовать для локализации цитотоксических средств в клетках, которые экспрессируют антиген-мишень. Такие антитела обладают одним плечом, которое связывается с требуемым антигеном, и другим плечом, которое связывает цитотоксическое средство (например, сапорин, антитело против интерферона-a, алкалоид барвинка, A-цепь рицина, метотрексат или гаптен с радиоактивным изотопом). Примеры известных биспецифичных антител включают антитело против ErbB2/антитело против FcgRIII (WO 96/16673), антитело против ErbB2/антитело против FcgRI (U.S.P. 5837234), антитело против ErbB2/антитело против CD3 (U.S.P. 5821337).
Способы получения биспецифичных антител известны в данной области. Общепринятый способ получения полноразмерных биспецифичных антител основан на совместной экспрессии двух пар тяжелая цепь/легкая цепь иммуноглобулинов, где две цепи обладают различной специфичностью. Millstein et al., Nature, 305:537-539 (1983). Вследствие случайной сборки тяжелых и легких цепей иммуноглобулинов, такие гибридомы (квадромы) потенциально продуцируют смесь из 10 различных молекул антител, из которых только одна обладает правильной биспецифичной структурой. Очистка правильных молекул, которую обычно проводят посредством стадий аффинной хроматографии, является довольно трудоемкой и выход продукта является низким. Аналогичные способы описаны в WO 93/08829 и в Traunecker et al., EMBO J., 10:3655-3659 (1991).
В соответствии с другим подходом проводят слияние вариабельных доменов антитела с требуемой специфичностью связывания (сайтами связывания антитело-антиген) с последовательностями константных доменов иммуноглобулинов. Предпочтительно проводят слияние с константным доменом тяжелой цепи иммуноглобулина, содержащим по меньшей мере часть шарнирной области, CH2 и CH3. Предпочтительно, чтобы по меньшей мере один из компонентов, предназначенных для слияния, обладал первым константным доменом тяжелой цепи (CH1), содержащим участок, необходимый для связывания легкой цепи. ДНК, кодирующую предназначенные для слияния компоненты тяжелых цепей иммуноглобулинов и, если желательно, легкой цепи иммуноглобулина, встраивают в отдельные экспрессирующие векторы и котрансфицируют в пригодный организм-хозяин. Это обеспечивает значительную гибкость при регулировании соотношений трех полипептидных фрагментов друг с другом в вариантах осуществления, где неравные соотношения трех полипептидных цепей в конструкции обеспечивает оптимальный выход требуемого биспецифичного антитела. Однако возможным является встраивание двух или всех трех полипептидных цепей в один экспрессирующий вектор, если экспрессия по меньшей мере двух полипептидных цепей в равных соотношениях приводит к высокому выходу продукта или если соотношения не имеют существенного влияния на требуемое сочетание цепей.
В предпочтительном варианте осуществления этого подхода биспецифичные антитела состоят из тяжелой цепи гибридного иммуноглобулина с одной специфичностью связывания на одном плече, и пары тяжелая цепь-легкая цепь гибридного иммуноглобулина (обладающей другой специфичностью связывания) на другом плече. Было обнаружено, что такая асимметричная структура облегчает разделение требуемого биспецифичного соединения и нежелательных сочетаний цепей иммуноглобулинов, поскольку наличие легкой цепи иммуноглобулина только в одной половине биспецифичной молекулы обеспечивает легкий способ разделения. Этот подход описан в WO 94/04690. Для более подробного описания получения биспецифичных антител см., например, Suresh et al., Methods in Enzymology, 121:210 (1986).
В соответствии с другим подходом, описанным в WO 96/27011 или в патенте США № 5731168, для максимального увеличения процентного количества гетеродимеров, которые выделяют из рекомбинантных клеточных культур можно сконструировать область контакта между парой молекул антител. Предпочтительная область контакта содержит по меньшей мере часть CH3-области константного домена антитела. В этом способе одну или несколько небольших боковых цепей аминокислот из области контакта первой молекулы антитела заменяют на более крупные боковые цепи (например, тирозин или триптофан). В области контакта второй молекулы антитела создают компенсирующие "полости" идентичного или сходного с крупной боковой цепью(ями) размера посредством замены крупных боковых цепей аминокислот на цепи меньших размеров (например, аланин или треонин). Это обеспечивает механизм для повышения выхода гетеродимера по сравнению с другими нежелательными конечными продуктами, такими как гомодимеры.
Способы получения биспецифичных антител из фрагментов антител также описаны в литературе. Например, биспецифичные антитела можно получать с использованием образования химических связей. В Brennan et al., Science, 229:81 (1985) описан способ, где интактные антитела протеолитически расщепляют с получением F(ab')2-фрагментов. Эти фрагменты восстанавливают в присутствии вещества, образующего комплексы с дитиолами, арсенита натрия, для стабилизации соседних дитиолов и предотвращения образования межмолекулярного дисульфида. Затем полученные Fab'-фрагменты превращают в производные с тионитробензоатом (TNB). Одно из производных Fab'-TNB затем повторно превращают в производное Fab'-TNB с получением биспецифичного антитела. Полученные биспецифичные антитела можно использовать в качестве средств для селективной иммобилизации ферментов.
Fab'-фрагменты можно прямо выделять из E. coli и химически связывать с образованием биспецифичных антител. В Shalaby et al., J. Exp. Med., 175:217-225 (1992) описано получение полностью гуманизированных молекул биспецифичного антитела F(ab')2. Осуществляли секрецию из E. coli каждого Fab'-фрагмента по отдельности и их подвергали прямому химическому соединению in vitro с образованием биспецифичного антитела. Биспецифичное антитело, полученное таким образом, обладало способностью связываться с клетками, сверхэкспрессирующими рецептор ErbB2, и нормальными T-клетками человека, а также запускать литическую активность цитотоксических лимфоцитов человека против мишеней, представляющих собой рак молочной железы человека.
Также были описаны различные способы получения и выделения фрагментов двухвалентных антител непосредственно из рекомбинантной клеточной культуры. Например, были получены двухвалентные гетеродимеры с использованием лейциновых молний. Kositelny et al., J. Immunol., 148(5):1547-1553 (1992). Пептиды лейциновой молнии белков Fos и Jun связывали с Fab'-участками двух различных антител посредством слияния генов. Гомодимеры антител восстанавливали в шарнирной области с получением мономеров, а затем повторно окисляли с получением гетеродимеров антител. Способ "димеров антител", описанный Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993) обеспечивает альтернативный механизм получения биспецифичных/двухвалентных фрагментов антител. Фрагменты содержат вариабельный домен тяжелой цепи VH, связанный с вариабельным доменом легкой цепи (VL) посредством линкера, который является слишком коротким для возможности образования пары между двумя доменами на одной и той же цепи. Таким образом, домены VH и VL одного фрагмента вынуждены образовывать пару с комплементарными доменами VL и VH другого фрагмента, таким образом, формируя два антигенсвязывающих сайта. Также описана другая стратегия для получения фрагментов биспецифичных/двухвалентных антител с использованием димеров одноцепочечных Fv (sFv). См. Gruber et al., J. Immunol, 152:5368 (1994).
Также предусмотрены антитела более чем c двумя валентностями. Например, можно получать триспецифичные антитела. Tutt et al. J. Immunol. 147:60 (1991).
Иллюстративные биспецифичные антитела могут связываться с двумя различными эпитопами на данной молекуле. Альтернативно плечо, направленное против белка, можно комбинировать с плечом, которое связывается с триггерной молекулой на лейкоците, такой как молекула T-клеточного рецептора (например, CD2, CD3, CD28 или B7), или Fc-рецепторы для IgG (FcγR), такие как FcγRI (CD64), FcγRII (CD32) и FcγRIII (CD 16), так чтобы сосредоточить механизмы клеточной защиты на клетках, экспрессирующих конкретный белок. Также биспецифичные антитела можно использовать для локализации цитотоксических средств в клетках, которые экспрессируют конкретный белок. Такие антитела обладают связывающим белок плечом и плечом, которое связывает цитотоксическое средство или хелатор радионуклидов, такой как EOTUBE, DPTA, DOTA или TETA. Другое представляющее интерес биспецифическое антитело связывает представляющий интерес белок и, кроме того, связывает тканевой фактор (TF).
8) Поливалентные антитела
Поливалентное антитело может интернализовываться (и/или катаболизироваться) быстрее, чем двухвалентное антитело, клеткой, экспрессирующей антиген, с которым антитела связываются. Антитела по настоящему изобретению могут представлять собой поливалентные антитела (которые могут относиться к классу, отличному от класса IgM) с тремя или более антигенсвязывающими сайтами (например, четырехвалентные антитела), которые можно легко получать посредством рекомбинантной экспрессии нуклеиновой кислоты, кодирующей полипептидные цепи антитела. Поливалентное антитело может содержать домен димеризации и три или более антигенсвязывающих сайтов. Предпочтительный домен димеризации содержит (или состоит из них) Fc-участок или шарнирную область. В этом случае, антитело будет содержать Fc-область и три или более антигенсвязывающих сайтов со стороны N-конца Fc-участка. Предпочтительное поливалентное антитело, представленное в настоящем документе, содержит (или состоит из них) от трех до приблизительно восьми, однако предпочтительно четыре антигенсвязывающих сайта. Поливалентное антитело содержит по меньшей мере одну полипептидную цепь (и предпочтительно две полипептидные цепи), где полипептидная цепь(и) содержит два или более вариабельных домена. Например, полипептидная цепь(и) может содержать VD1-(X1)n-VD2-(X2)n-Fc, где VD1 представляет собой первый вариабельный домен, VD2 представляет собой второй вариабельный домен, Fc представляет собой одну полипептидуную цепь Fc-участка, X1 и X2 представляют собой аминокислоту или полипептид, и n равно 0 или 1. Например, полипептидная цепь(и) может содержать цепь VH-CH1-подвижный линкер-VH-CH1-Fc-участок; или цепь VH-CH1-VH-CH1-Fc-участок. Поливалентное антитело, представленное в настоящем документе, предпочтительно дополнительно содержит по меньшей мере два (и предпочтительно четыре) полипептида вариабельного домена легкой цепи. Поливалентное антитело, представленное в настоящем документе, например, может содержать от приблизительно двух до приблизительно восьми полипептидов вариабельного домена легкой цепи. Полипептиды вариабельного домена легкой цепи, рассматриваемые в настоящем документе, содержат вариабельный домен легкой цепи и, необязательно, дополнительно содержат CL-домен.
9) Гетероконъюгаты антител
Гетероконъюгаты антител также находятся в объеме настоящего изобретения. Гетероконъюгаты антител состоят из двух ковалентно связанных антител. Например, одно из антител в гетероконъюгате может быть связано с авидином, а другое с биотином. Такие антитела, например, были предложены для нацеливания клеток иммунной системы против нежелательных клеток, U.S.P. № 4676980, и для лечения ВИЧ-инфекции. WO 91/00360, WO 92/200373 и EP 0308936. Предусмотрено, что антитела можно получать in vitro с использованием известных способов химии синтетических белков, включая способы, вовлекающие поперечно-сшивающие средства. Например, иммунотоксины можно конструировать с использованием реакции дисульфидного обмена или посредством образования тиоэфирной связи. Примеры пригодных реагентов для этой цели включают иминотиолат и метил-4-меркаптобутиримидат и реагенты, описанные, например, в патенте США № 4676980. Гетероконъюгаты антител можно получать с использованием любого пригодного способа поперечного сшивания. Пригодные средства для поперечного сшивания хорошо известны в данной области и описаны в патенте США № 4676980, совместно с рядом способов поперечного сшивания.
10) Инженерия эффекторных функций
Может быть желательной модификация антитела по изобретению в отношении эффекторной функции, например, чтобы усилить антигензависимую клеточно-опосредуемую цитотоксичность (ADCC) и/или комплементзависимую цитотоксичность (CDC) антитела. Этого можно достигать внесением одной или нескольких аминокислотных замен в Fc-участок антитела. Альтернативно, или дополнительно, в Fc-участок можно вносить остаток(и) цистеина, обеспечивая, таким образом, формирование дисульфидной связи между цепями в этом участке. Полученное таким образом гомодимерное антитело может обладать улучшенной способностью к интернализации и/или усиленным комплементзависимым уничтожением клеток и повышенной антителозависимой клеточной цитотоксичностью (ADCC). См. Caron et al., J. Exp. Med. 176:1191-1195 (1992) и Shopes, B. J. Immunol. 148:2918-2922 (1992). Гомодимерные антитела с повышенной противоопухолевой активностью также можно получать с использованием гетеробифункциональных поперечных линкеров, как описано в Wolff et al., Cancer Research 53:2560-2565 (1993). Альтернативно можно сконструировать антитело, которое обладает дублированными Fc-участками и, таким образом, может обладать повышенной способностью в отношении лизиса комплементом и ADCC. См. Stevenson et al., Anti-Cancer Drug Design 3:219-230 (1989).
Для увеличения времени полужизни антитела в сыворотке можно встраивать в антитело (особенно во фрагмент антитела) связывающий рецептор спасения эпитоп, как описано, например, в патенте США 5739277. Как используют в рамках настоящей заявки, термин "связывающий рецептор спасения эпитоп" относится к эпитопу Fc-участка молекулы IgG (например, IgG1, IgG2, IgG3 или IgG4), который отвечает за повышение периода полураспада в сыворотке молекулы IgG in vivo.
11) Иммуноконъюгаты
Настоящее изобретение также относится к иммуноконъюгатам или конъюгатам антитело-лекарственное средство (ADC), содержащим антитело, конъюгированное с цитотоксическим средством, таким как химиотерапевтическое средство, токсин (например, ферментативно активный токсин бактерий, грибов, растений или животных, в том числе его фрагменты и/или варианты), или с радиоактивным изотопом (т.е. радиоконъюгатом). Такие ADC должны демонстрировать приемлемый профиль безопасности.
Применение ADC для местной доставки цитотоксических или цитостатических средств, например лекарственных средств для уничтожения или ингибирования опухолевых клеток при лечении злокачественной опухоли [Syrigos and Epenetos, Anticancer Research 19:605-14 (1999); Niculeascu-Duvaz and Springer, Adv. Drug Del. Rev. 26:151-72 (1997); US 4975278], теоретически позволяет направленную доставку группы лекарственного средства в опухоли и внутриклеточное накопление в ней, где системное введение таких неконъюгированных лекарственных средств может привести к неприемлемым уровням токсичности для нормальных клеток, кроме опухолевых клеток, которые стремятся устранить (Baldwin et al., Lancet, 603-05 (1986); Thorpe, (1985) Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review, in Monoclonal Antibody '84: Biological And Clinical Applications, A. Pinchera et al. (eds), pp. 475-506). Таким образом, желательной является максимальная эффективность при минимальной токсичности. Было описано, что для этих стратегий пригодны как поликлональные антитела, так и моноклональные антитела (Rowland et al., Cancer Immunol. Immunother. 21:183-87 (1986)). Лекарственные средства, используемые в этих способах, включают дауномицин, доксорубицин, метотрексат и виндезин. Токсины, используемые в конъюгатах антитело-токсин, включают бактериальные токсины, такие как дифтерийный токсин, токсины растений, такие как рицин, низкомолекулярные токсины, такие как гелданамицин (Mandler et al., J. Nat. Cancer Inst. 92(19):1573-81 (2000); Mandler et al., Bioorganic & Med. Chem. Letters 10:1025-28 (2000); Mandler et al., Bioconjugate Chem. 13:786-91 (2002)), майтанзиноиды (EP 1391213; Liu et al., Proc. Natl. Acad. Sci. USA 93:8618-23 (1996)) и калихеамицин (Lode et al., Cancer Res. 58:2928 (1998); и Hinman et al., Cancer Res. 51:3336-42 (1993)). Токсины могут оказывать их цитотоксические и цитостатические эффекты посредством механизмов, включающих связывание тубулина, связывание ДНК или ингибирование топоизомеразы. Некоторые цитотоксические лекарственные средства имеют тенденцию к тому, чтобы быть неактивными или менее активными, когда они конъюгированы с крупными антителами или белковыми лигандами рецепторов.
Химиотерапевтические средства, пригодные для получения таких иммуноконъюгатов, описаны выше, и они включают BCNU, стрептозоицин, винкристин, винбластин, адриамицин и 5-фторурацил.
Ферментативно активные токсины и их фрагменты, которые можно использовать, включают A-цепь дифтерийного токсина, несвязывающие активные фрагменты дифтерийного токсина, A-цепь экзотоксина (из Pseudomonas aeruginosa), A-цепь рицина, A-цепь абрина, A-цепь модецина, альфа-сарцин, белки Aleurites fordii, белки-диантаны, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор momordica charantia, курцин, кротин, ингибитор sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трихотецены. Для получения радиоконъюгированных антител доступны различные радионуклиды. Их примеры включают212Bi,131I,131In,90Y и186Re. Конъюгаты антитела и цитотоксического средства получают с использованием множества бифункциональных связывающих белки веществ, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как 2,6-диизоцианат толуола) и вторичные активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин на основе рицина можно получать, как описано в Vitetta et al., Science 238:1098 (1987). Меченная углеродом 14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) представляет собой иллюстративный хелатирующий агент для конъюгации радионуклеотида с антителом. См. например, WO 94/11026.
Конъюгаты антитела и цитотоксического средства получают с использованием множества бифункциональных связывающих белки веществ, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как 2,6-диизоцианат толуола) и вторичные активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин на основе рицина можно получать, как описано в Vitetta et al. Science 238:1098 (1987). Меченная углеродом 14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) представляет собой иллюстративный хелатирующий агент для конъюгации радионуклеотида с антителом. См. WO94/11026. Линкер может представлять собой "расщепляющий линкер", облегчающий высвобождение цитотоксического лекарственного средства в клетке. Например, можно использовать неустойчивый к действию кислот линкер, чувствительный к пептидазе линкер, диметиловый линкер или содержащий дисульфид линкер (Chari et al., Cancer Res. 52:127-131 (1992)).
Кроме того, также в качестве конъюгируемых токсинов для применения в составе по изобретению предусмотрены низкомолекулярные токсины, такие как калихеамицин, майтанзин (U.S.P. 5208020), трихотен и CC1065. В одном варианте осуществления полноразмерное антитело или его антигенсвязывающие фрагменты можно конъюгировать с одной или несколькими молекулами майтанзиноидов (например, от приблизительно 1 до приблизительно 10 молекул майтанзиноидов на молекулу антитела). Майтанзиноиды представляют собой ингибиторы митоза, которые действуют, ингибируя полимеризацию тубулина. Майтанзиноиды, выделенные из природных источников или полученные синтетически, включая майтанзин, майтанзинал и их производные и аналоги, были описаны, см., например, патент США № 5208020 и ссылки, цитированные в нем (см. со столбца 2, строка 53, по столбец 3, строка 10), и патенты США 3896111 и 4151042. Способы получения конъюгатов антитело-майтанзиноид также описаны в патенте США № 5208020. В предпочтительном варианте осуществления майтанзиноид связан с антителом посредством дисульфидной или другой содержащей серу линкерной группы. Майтанзин, например, можно превращать в May-SS-Me, который можно восстанавливать до May-SH3 и подвергать реакции с модифицированным антителом с получением иммуноконъюгата майтанзиноид-антитело. Chari et al., Cancer Res. 52:127-131 (1992). Антитело можно модифицировать известными способами, а затем антитело, содержащее свободные или защищенные тиольные группы, подвергать реакции с содержащим дисульфид майтанзиноидом с получением конъюгата. Можно определять цитотоксичность конъюгата антитело-майтанзиноид in vitro или in vivo известными способами и измерять IC50.
Калихеамицин представляет собой другой представляющий интерес иммуноконъюгат. Антибиотики семейства калихеамицинов способны образовывать двухцепочечные разрывы ДНК в субпикомолярных концентрациях. Структурные аналоги калихеамицина, которые можно использовать, включают, но не ограничиваются ими, γ11, α21,

Также предусмотрены иммуноконъюгаты, образованные между антителом и соединением с нуклеолитической активностью (например, с рибонуклеазой или ДНК-эндонуклеазой, такой как дезоксирибонуклеаза, ДНКаза).
В ADC по изобретению антитело (Ab) конъюгировано с одной или несколькими группами лекарственных средств (D), например, от приблизительно 1 до приблизительно 20 групп лекарственных средств на антитело, через линкер (L). ADC формулы I можно получать несколькими способами, с использованием реакций, условий и реагентов органической химии, известных специалистам в данной области, включая: (1) реакцию нуклеофильной группы антитела с двухвалентным линкерным реагентом, с образованием Ab-L, через ковалентную связь, с последующей реакцией с группой лекарственного средства D; и (2) реакцию нуклеофильной группы в группе лекарственного средства с двухвалентным линкерным реагентом, с образованием D-L, через ковалентную связь, с последующей реакцией с нуклеофильной группой антитела.
Ab-(L-D)p (Формула I)
Нуклеофильные группы на антителах включают, но не ограничиваются ими: (i) N-концевые аминогруппы, (ii) аминогруппы боковых цепей, например лизина, (iii) тиольные группы боковых цепей, например цистеин, и (iv) гидроксил сахара или аминогруппы, где антитело является гликозилированным. Аминогруппы, тиольные и гидроксильные группы являются нуклеофильными и способны вступать в реакцию с образованием ковалентных связей с электрофильными группами на линкерных группах и линкерных реагентах, включая: (i) активные сложные эфиры, такие как сложные эфиры NHS, сложные эфиры HOBt, галоформиаты и галоидангидриды; (ii) алкил- и бензилгалогениды, такие как галоацетамиды; и (iii) альдегиды, кетоны, карбоксильные и малеинимидные группы. Определенные антитела обладают поддающимися восстановлению межцепочечными дисульфидами, т.е. цистеиновыми мостиками. Антитела могут быть получены реакционноспособными для конъюгации с линкерными реагентами посредством обработки восстановителем, таким как DTT (дитиотреитол). Каждый цистеиновый мостик, таким образом, будет образовывать, теоретически, два реакционноспособных тиольных нуклеофила. Дополнительные нуклеофильные группы можно вносить в антитела посредством реакции лизинов с 2-иминотиоланом (реагентом Трота) с превращением в результате амина в тиол.
ADC по изобретению также можно получать посредством модификации антитела внесением электрофильных групп, которые могут реагировать с нуклеофильными заместителями на линкерном реагенте или лекарственном средстве. Сахара гликозилированных антител могут быть окисленными, например, периодатными окислительными реагентами, с образованием групп альдегида или кетона, которые могут реагировать с аминогруппой линкерных реагентов или групп лекарственного средства. Полученные иминогруппы Шифова основания могут образовывать стабильную связь, или их можно восстанавливать, например, боргидридными реагентами с образованием стабильных связей аминов. В одном варианте осуществления реакция углеводной части гликозилированного антитела либо с галактозооксидазой, либо с периодатом натрия может приводить к карбонильным (альдегидным и кетоновым) группам в белке, которые могут вступать в реакции с соответствующими группами на лекарственном средстве (Domen et al., J. Chromatog., 510:293-302 (1990)). В другом варианте осуществления белки, содержащие N-концевые остатки серина или треонина, могут вступать в реакцию с мета-периодатом натрия, с образованием в результате альдегида вместо первой аминокислоты (Geoghegan and Stroh, Bioconjugate Chem. 3:138-46 (1992); US 5362852). Такой альдегид можно подвергать реакции с группой лекарственного средства или с нуклеофилом линкера.
Аналогично нуклеофильные группы на группе лекарственного средства включают, но не ограничиваются ими, аминогруппы, тиольные, гидроксильные, гидразидные, оксимные, гидразиновые, тиосемикарбазоновые, гидразинкарбоксилатные и арилгидразидные группы, способные вступать в реакции с образованием ковалентных связей с электрофильными группами на линкерных группах и линкерных реагентах, включая: (i) активные сложные эфиры, такие как сложные эфиры NHS, сложные эфиры HOBt, галоформиаты и галогенангидриды; (ii) алкил- и бензилгалогениды, такие как галоацетамиды; и (iii) альдегиды, кетоны, карбоксильные и малеимидные группы.
Альтернативно слитый белок, содержащий антитело и цитотоксическое средство, можно получать, например, рекомбинантными способами или пептидным синтезом. Отрезок ДНК может включать соответствующие участки, кодирующие два участка конъюгата, либо соседних друг с другом, либо разделенных участком, кодирующим линкерный пептид, который не препятствует требуемым свойствам конъюгата.
В другом варианте осуществления антитело можно конъюгировать с "рецептором" (таким как стрептавидин) для применения в предварительном нацеливании на опухоль, где конъюгат антитело-рецептор вводят пациенту, а затем удаляют несвязанный конъюгат из кровотока с использованием средства для выведения, а затем вводят "лиганд" (например, авидин), который конъюгирован с цитотоксическим средством (например, радионуклеотидом).
ADC, представленные в настоящем документе, необязательно получают с помощью поперечно-сшивающих реагентов: BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоат), которые являются коммерчески доступными (например, Pierce Biotechnology, Inc., Rockford, IL).
Также антитело можно конъюгировать с высокорадиоактивным атомом. Для получения радиоконъюгированных антител доступно множество радионуклидов. Их примеры включают At211, Bi212, I131, In131, Y90, Re186, Re188, Sm153, P32 и Pb212 и радиоактивные изотопы Lu. Когда конъюгат используют для диагностики, он может содержать радиоактивный атом для сцинтиграфических исследований, например, Tc99 или I123, или спиновую метку для визуализации посредством ядерного магнитного резонанса (ЯМР) (также известной как магнитно-резонансная томография, mri), такую как йод-123, йод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Радиоактивные или другие метки можно включать в конъюгат известными способами. Например, пептид может биологически синтезироваться или его можно синтезировать химическим синтезом аминокислот с использованием пригодных предшественников аминокислот, включающих, например, фтор-19 вместо водорода. Метки, такие как Tc99 или I123, Re186, Re188 и In111, можно связывать через остаток цистеина в пептиде. Иттрий-90 можно присоединять через остаток лизина. Способ IODOGEN® можно использовать для включения йода-123, Fraker et al., Biohem. Biophys. Res. Commun. 80:49-57 (1978). Другие способы конъюгации радионуклидов описаны в "Monoclonal Antibodies in Immunoscintigraphy", (Chatal, CRC Press 1989).
Альтернативно слитый белок, содержащий антитело и цитотоксическое средство, можно получать рекомбинантными способами или пептидным синтезом. Отрезок ДНК может содержать соответствующие области, кодирующие две части конъюгата, соседние друг с другом или разделенные областью, кодирующей линкерный пептид, который не препятствует требуемым свойствам конъюгата.
В другом варианте осуществления антитело можно конъюгировать с "рецептором" (таким как стрептавидин) для применения в предварительном нацеливании на опухоль, где конъюгат антитело-рецептор вводят пациенту, а затем удаляют несвязанный конъюгат из кровотока с использованием средства для выведения, а затем вводят "лиганд" (например, авидин), который конъюгирован с цитотоксическим средством (например, радионуклеотидом).
12) Другие модификации аминокислотной последовательности
Предусмотрена модификация(ии) аминокислотной последовательности антител, описанных в настоящем документе. Например, может быть желательным повышение аффинности связывания и/или других биологических свойств антитела. Варианты аминокислотной последовательности антитела получают внесением соответствующих нуклеотидных замен в нуклеиновую кислоту антитела или посредством пептидного синтеза. Такие модификации включают, например, делеции и/или вставки, и/или замены остатков в аминокислотных последовательностях антитела. Для получения конечной конструкции проводят любое сочетание из делеции, вставки и замены, при условии, что конечная конструкция обладает требуемыми характеристиками. Аминокислотные замены также могут изменять посттрансляционные процессы антитела, например они могут изменять количество или положение участков гликозилирования.
Пригодный способ идентификации определенных остатков или участков антитела, которые являются предпочтительными участками для мутагенеза, называют "сканирующим аланином мутагенезом", как описано Cunningham and Wells, Science, 244:1081-1085 (1989). В данном случае выявляют остаток или группу остатков-мишеней (например, заряженные остатки, такие как arg, asp, his, lys и glu) и заменяют на нейтральную или отрицательно заряженную аминокислоту (наиболее предпочтительно аланин или полиаланин) для нарушения взаимодействия аминокислот с антигеном. Те положения аминокислот, которые демонстрируют функциональную чувствительность к замещению, затем подтверждают посредством внесения дополнительных или других вариантов в участки замещения, или вместо них. Таким образом, поскольку участок для внесения изменения в аминокислотную последовательность является предопределенным, нет необходимости в непосредственной предопределенности характера мутации. Например, для анализа действия мутации в данной области, в кодоне-мишени или участке-мишени проводят сканирующий ala или случайный мутагенез и экспрессированные варианты антитела подвергают скринингу в отношении наличия требуемой активности.
Вставки в аминокислотную последовательность включают N- и/или C-концевые слитые последовательности, обладающие длиной в диапазоне от одного остатка до полипептидов, содержащих сто или более остатков, а также вставки одного или нескольких аминокислотных остатков внутрь последовательности. Примеры концевых вставок включают антитело с N-концевым метионильным остатком или антитело, слитое с цитотоксическим полипептидом. Другие варианты вставок в молекулу антитела против сфинголипида включают слияние N- или C-конца антитела с ферментом (например, ADEPT) или полипептидом, который повышает время полужизни антитела в сыворотке.
Другим типом варианта является вариант с аминокислотной заменой. Эти варианты имеют по меньшей мере один остаток аминокислоты в молекуле антитела, замененный другим остатком. Участки, представляющие наибольший интерес для проведения мутагенеза с замещением, включают гипервариабельные области, но также предусматриваются изменения FR. Консервативные замены представлены в таблице A, ниже, под заголовком "Предпочтительные замены". Если результатом таких замен является изменение биологической активности, тогда можно вносить более значительные изменения, обозначенные "Иллюстративные замены" в таблице A, приведенные ниже, или как описано далее в отношении классов аминокислот, и продукты подвергать скринингу.
Существенные модификации биологических свойств антитела проводят, выбирая замены, которые значительно отличаются по их эффекту на поддержание (a) структуры полипептидного остова в области замены, например, такой как конформация в виде слоя или спирали, (b) заряда или гидрофобности молекулы в участке-мишени, или (c) объема боковой цепи. Встречающиеся в природе остатки можно разделить на основе общих свойств их боковых цепей:
(1) гидрофобные: норлейцин, met, ala, val, leu, ile;
(2) нейтральные гидрофильные: cys, ser, thr;
(3) кислые: asp, glu;
(4) основные: asn, gln, his, lys, arg;
(5) остатки, влияют на ориентацию цепи: gly, pro; и
(6) ароматические: trp, tyr, phe.
Неконсервативные замены вовлекают замену члена одного из этих классов членом другого класса.
Любой остаток цистеина, не вовлеченный в поддержание надлежащей конформации гуманизированного антитела, также можно заменять для повышения устойчивости молекулы к окислению и предотвращения ошибочного поперечного сшивания. Напротив, к антителу можно добавлять цистеиновую связь(и) для повышения его стабильности (в частности, когда антитело представляет собой фрагмент антитела, такой как Fv-фрагмент).
Особенно предпочтительный тип варианта с заменой включает замену одного или нескольких остатков гипервариабельной области исходного антитела (например, гуманизированного антитела или антитела человека). Как правило, полученный вариант(ы), отобранный для дальнейшей разработки, обладает улучшенными свойствами относительно исходного антитела, из которого он получен. Удобным способом получения таких вариантов с заменами является созревание аффинности с использованием фагового дисплея. В кратком изложении, в несколько участков гипервариабельной области (например, в 6-7 участков) вносят мутации для получения всех возможных замен аминокислот в каждом участке. Варианты антитела, полученные таким образом, экспонируют в одновалентной форме в частицах нитевидных фагов в качестве антител, слитых с продуктом гена III M13, упакованных в каждой частице. Затем проводят скрининг вариантов, экспонированных посредством фагов, в отношении их биологической активности (например, аффинности связывания), как описано в настоящем документе. В целях выявления участков гипервариабельной области, являющихся кандидатами для модификации, можно проводить сканирующий аланином мутагенез для выявления остатков гипервариабельной области, в значительной степени участвующих в связывании антигена. Альтернативно, или дополнительно, может быть целесообразным проведение анализа кристаллической структуры комплекса антиген-антитело для определения участков контакта между антителом и IgE. Такие образующие контакт остатки и соседние остатки являются кандидатами для замены в соответствии с представленными в настоящем документе способами. После получения таких вариантов панель вариантов подвергают скринингу, как описано в настоящей заявке, и для дальнейшей разработки могут отбирать антитела с наилучшими свойствами в одном или нескольких подходящих анализах.
В другом типе аминокислотного варианта антитела изменен исходный характер гликозилирования антитела. Под изменением подразумевают удаление одной или нескольких углеводных групп, находящихся на антителе, и/или добавление одного или нескольких участков гликозилирования, которые не присутствуют в антителе.
Гликозилирование антител, как правило, является либо N-связанным или O-связанным. N-связанное относится к присоединению углеводной группы к боковой цепи остатка аспарагина. Трипептидные последовательности аспарагин-X-серин и аспарагин-X-треонин, где X представляет собой любую аминокислоту, за исключением пролина, представляют собой последовательности, распознаваемые для ферментативного присоединения углеводной группы к боковой цепи аспарагина. Таким образом, наличие любой из этих трипептидных последовательностей в полипептиде создает потенциальный участок гликозилирования. O-связанное гликозилирование относится к присоединению одного из сахаров, представляющих собой N-ацетилгалактозамин, галактозу или ксилозу, к гидроксиаминокислоте, обычно к серину или треонину, хотя также могут быть использованы 5-гидроксипролин или 5-гидроксилизин.
Добавление участков гликозилирования в антитело удобно проводить посредством изменения аминокислотной последовательности таким образом, чтобы она содержала одну или несколько из описанных выше трипептидных последовательностей (в случае участков N-связанного гликозилирования). Также изменение можно осуществлять добавлением одного или нескольких остатков серина или треонина в последовательность исходного антитела, или заменой одним или несколькими остатками серина или треонина в последовательности исходного антитела (в случае участков O-связанного гликозилирования).
Молекулы нуклеиновых кислот, кодирующие варианты аминокислотных последовательностей антитела против IgE, получают множеством способов, известных в данной области. Эти способы включают, но не ограничиваются ими, выделение из природного источника (в случае природных вариантов аминокислотных последовательностей) или получение посредством олигонуклеотид-направленного (или сайт-направленного) мутагенеза, мутагенеза посредством ПЦР и кассетного мутагенеза ранее полученного измененного или не измененного варианта антитела против IgE.
13) Другие модификации антител
Антитела по настоящему изобретению можно дополнительно модифицировать, чтобы они содержали дополнительные небелковые группы, которые известны в данной области и легкодоступны. Предпочтительно группы, пригодные для получения производных антитела, представляют собой растворимые в воде полимеры. Неограничивающие примеры растворимых в воде полимеров включают, но не ограничиваются ими, полиэтиленгликоль (PEG), сополимеры этиленгликоль/пропиленгликоль, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилен/малеиновый ангидрид, полиаминокислоты (либо гомополимеры, либо случайные сополимеры) и декстран или поли(н-винилпирролидон)полиэтиленгликоль, гомополимеры полипропиленгликоля, сополимеры оксид полипропилена/оксид этилена, полиэтоксилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. Пропиональдегид полиэтиленгликоля может иметь преимущества при производстве вследствие его стабильности в воде. Полимер может иметь любую молекулярную массу, и он может быть разветвленным или неразветвленным. Количество полимеров, связанных с антителом, может варьировать, и если присоединено более одного полимера, они могут представлять собой одинаковые или различные молекулы. Как правило, количество и/или тип полимеров, используемых для получения производных, можно определять, исходя из факторов, включающих, но не ограничивающихся ими, конкретные свойства или функции антитела, подлежащего улучшению, того, будет ли использовано производное антитела для терапии в определенных условиях, и т.д. Такие способы и другие пригодные составы описаны в Remington: The Science and Practice of Pharmacy, 20th Ed., Alfonso Gennaro, Ed., Philadelphia College of Pharmacy and Science (2000).
C. Фармацевтические составы
Терапевтические составы получают для хранения смешиванием активного ингредиента, имеющего требуемую степень чистоты, с необязательными фармацевтически приемлемыми носителями, эксципиентами или стабилизаторами (Remington: The Science и Practice of Pharmacy, 20th Ed., Lippincott Williams & Wiklins, Pub., Gennaro Ed., Philadelphia, PA 2000). Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов в используемых дозировках и концентрациях и включают буферы, антиоксиданты, включая аскорбиновую кислоту, метионин, витамин E, метабисульфит натрия; консерванты, обеспечивающие изотоничность средства, стабилизаторы, комплексы металлов (например, комплексы Zn-белок); хелатирующие агенты, такие как EDTA и/или неионные поверхностно-активные вещества.
Когда лекарственное средство представляет собой фрагмент антитела, предпочтительным является наименьший ингибиторный фрагмент, который специфично связывается со связывающим доменом белка-мишени. Например, исходя из последовательностей вариабельной области антитела, можно сконструировать фрагменты антитела или даже пептидные молекулы, которые сохраняют способность связывать последовательность белка-мишени. Такие пептиды можно синтезировать химически и/или получать посредством технологии рекомбинантных ДНК (см., например, Marasco et al., Proc. Natl. Acad. Sci. USA 90:7889-7893 [1993]).
Буферы используют для контроля pH в диапазоне, который оптимизирует терапевтическую эффективность, особенно если стабильность является зависимой от pH. Буферы предпочтительно присутствуют в концентрациях, варьирующих от приблизительно 50 мМ до приблизительно 250 мМ. Пригодные буферные средства для применения с настоящим изобретением включают как органические, так и неорганические кислоты и их соли, например цитрат, фосфат, сукцинат, тартрат, фумарат, глюконат, оксалат, лактат, ацетат. Кроме того, буферы могут содержать соли гистидина и триметиламина, такие как Tris.
Консерванты добавляют для замедления роста микроорганизмов, и они, как правило, присутствуют в диапазоне 0,2%-1,0% (масс./об.). Пригодные консерванты для применения с настоящим изобретением включают хлорид октадецилдиметилбензиламмония; хлорид гексаметэтония; галогениды бензалкония (например, хлорид, бромид, йодид), хлорид бензэтония; тимеросал, фенол, бутил или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол, 3-пентанол и м-крезол.
Обеспечивающие тоничность средства, иногда известные как "стабилизаторы", присутствуют для коррекции или поддержания тоничности жидкости в композиции. При применении с крупными заряженными биомолекулами, такими как белки и антитела, их часто называют "стабилизаторами", поскольку они могут взаимодействовать с заряженными группами боковых цепей аминокислот, таким образом, снижая потенциал для межмолекулярных и внутримолекулярных взаимодействий. Обеспечивающие тоничность средства могут присутствовать в любом количестве от 0,1% до 25% по массе, предпочтительно от 1 до 5%, учитывая относительные количества других ингредиентов. Предпочтительные обеспечивающие тоничность средства включают многоосновные спирты сахаров, предпочтительно трехосновные спирты сахаров или более, такие как глицерин, эритрит, арабит, ксилит, сорбит и маннит.
Дополнительные эксципиенты включают средства, которые могут служить в качестве одного или нескольких из следующих: (1) наполнители, (2) усилители растворимости, (3) стабилизаторы и (4) и средства, препятствующие денатурации или прикреплению к стенке контейнера. Такие эксципиенты включают многоатомные спирты сахаров (перечисленные выше); аминокислоты, такие как аланин, глицин, глутамин, аспарагин, гистидин, аргинин, лизин, орнитин, лейцин, 2-фенилаланин, глутаминовая кислота, треонин и т.д.; органические сахара или спирты сахаров, такие как сахароза, лактоза, лактит, трегалоза, стахиоза, манноза, сорбоза, ксилоза, рибоза, рибит, миоинозитоза, миоинозит, галактоза, галактит, глицерин, циклитолы (например, инозитол), полиэтиленгликоль; содержащие серу восстановители, такие как мочевина, глутатион, тиоктовая кислота, тиогликолят натрия, тиоглицерин, α-монотиоглицерин и тиосульфат натрия; низкомолекулярные белки, такие как сывороточный альбумин человека, бычий сывороточный альбумин, желатин или другие иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; моносахариды (например, ксилоза, манноза, фруктоза, глюкоза); дисахариды (например, лактоза, мальтоза, сахароза); трисахариды, такие как раффиноза; и полисахариды, такие как декстрин или декстран.
Неионные поверхностно-активные вещества или детергенты (также известные как "смачивающие вещества") присутствуют для облегчения растворения лекарственного средства, а также для защиты терапевтического белка от индуцируемой встряхиванием агрегации, и также они допускают воздействие на состав напряжения сдвига на поверхности без денатурации активного терапевтического белка или антитела. Неионные поверхностно-активные вещества присутствуют в диапазоне от приблизительно 0,05 мг/мл до приблизительно 1,0 мг/мл, предпочтительно от приблизительно 0,07 мг/мл до приблизительно 0,2 мг/мл.
Пригодные неионные поверхностно-активные вещества включают полисорбаты (20, 40, 60, 65, 80 и т.д.), полиоксамеры (184, 188 и т.д.), полиолы PLURONIC®, TRITON®, моноэфиры сорбитана полиоксиэтилена (TWEEN®-20, TWEEN®-80 и т.д.), лауромакрогол 400, стеарат полиоксила 40, полиоксиэтилен гидрогенизированное касторовое масло 10, 50 и 60, моностеарат глицерина, сложный эфир жирной кислоты и сахарозы, метилцеллюлозу и карбоксиметилцеллюлозу. Анионные детергенты, которые можно использовать, включают лаурилсульфат натрия, сульфосукцинат диоктилнатрия и сульфонат диоктилнатрия. Катионные детергенты включают хлорид бензалкония или хлорид бензэтония.
В случае составов, подлежащих введению in vivo, они должны быть стерильными. Стерильность состава можно обеспечить фильтрацией через стерильные фильтрационные мембраны. Терапевтические композиции, представленные в настоящем документе, как правило, помещают в контейнер, имеющий отверстие для стерильного доступа, например, пакет с внутривенным раствором или флакон, имеющий пробку, проницаемую иглой для подкожной инъекции.
Способ введения соответствует известным и общепринятым способам, например, посредством однократного или многократного болюсного введения или инфузии в течение длительного периода времени пригодным образом, например инъекцией или инфузией подкожным, внутривенным, внутрибрюшинным, внутримышечным, внутриартериальным, внутрираневым или внутрисуставным способами, местным введением, ингаляцией или способами замедленного высвобождения или продленного высвобождения.
Состав, представленный в настоящем документе, также может содержать более одного активного соединения при необходимости в случае конкретного показания, подвергаемого лечению, предпочтительно соединения с дополняющими видами активности, которые не оказывают отрицательного эффекта друг на друга. Альтернативно, или дополнительно, композиция может содержать цитотоксическое средство, цитокин или ингибирующее рост средство. Такие молекулы пригодным образом присутствуют в сочетании в количествах, которые эффективны для предполагаемой цели.
Активные ингредиенты также можно заключать в микрокапсулы, полученные, например, способами коацервации или межфазной полимеризации (например, микрокапсулы на основе гидроксиметилцеллюлозы или желатина и микрокапсулы на основе полиметилметакрилата, соответственно), в коллоидные системы для доставки лекарственного средства (например, липосомы, микросферы на основе альбумина, микроэмульсии, наночастицы и нанокапсулы), или в микроэмульсии. Такие способы описаны в Remington's Pharmaceutical Science 18th edition, выше.
Стабильность белков и антител, описанных в настоящем документе, можно повышать с использованием нетоксичных "растворимых в воде солей поливалентных металлов". Их примеры включают Ca2+, Mg2+, Zn2+, Fe2+, Fe3+, Cu2+, Sn2+, Sn4+, Al2+ и Al3+. Примеры анионов, которые могут образовывать растворимые в воде соли с указанными выше катионами поливалентных металлов, включают анионы, образованные из неорганических кислот и/или органических кислот. Такие растворимые в воде соли обладают растворимостью в воде (при 20°C) по меньшей мере приблизительно 20 мг/мл, альтернативно по меньшей мере приблизительно 100 мг/мл, альтернативно по меньшей мере приблизительно 200 мг/мл.
Пригодные неорганические кислоты, которые можно использовать для образования "растворимых в воде солей поливалентных металлов" включают хлороводородную, уксусную, серную, азотную, тиоциановую и фосфорную кислоту. Пригодные органические кислоты, которые можно использовать, включают алифатические карбоновые кислоты и ароматические кислоты. Алифатические кислоты, находящиеся в пределах этого определения, можно определить как насыщенные или ненасыщенные C2-9карбоновые кислоты (например, алифатические моно-, ди- и трикарбоновые кислоты). Например, иллюстративные монокарбоновые кислоты, находящиеся в пределах этого определения, включают насыщенные C2-9 монокарбоновые кислоты: уксусную, пропионовую, масляную, валериановую, капроновую, энантовую, каприловую, пеларгоновую и каприоновую кислоты, и ненасыщенные C2-9монокарбоновые кислоты: акриловую, пропиоловую, метакриловую, кротоновую и изокротоновую кислоты. Иллюстративные дикарбоновые кислоты включают насыщенные C2-9 дикарбоновые кислоты: малоновую, янтарную, глутаровую, адипиновую и пимелиновую, а ненасыщенные C2-9дикарбоновые кислоты включают малеиновую, фумаровую, цитраконовую и мезаконовую кислоты. Иллюстративные трикарбоновые кислоты включают насыщенные C2-9 трикарбоновые кислоты: трикарбаллильную и 1,2,3-бутантрикарбоновую кислоту. Кроме того, карбоновые кислоты по этому определению также могут содержать одну или две гидроксильные группы с образованием гидроксикарбоновых кислот. Иллюстративные гидроксикарбоновые кислоты включают гликолевую, молочную, глицериновую, тартроновую, яблочную, виннокаменную и лимонную кислоту. Ароматические кислоты в пределах этого определения включают бензойную и салициловую кислоту.
Обычно используемые растворимые в воде соли поливалентных металлов, которые можно использовать для облегчения стабилизации инкапсулированных полипептидов по этому изобретению, включают, например: (1) соли металлов и неорганических кислот, представляющие собой галогениды (например, хлорид цинк, хлорид кальция), сульфаты, нитраты, фосфаты и тиоцианаты; (2) соли алифатических карбоновых кислот и металлов (например, ацетат кальция, ацетат цинка, пропионат кальция, гликолят цинка, лактат кальция, лактат цинка и тартрат цинка); и (3) соли ароматических карбоновых кислот и металлов, представляющие собой бензоаты (например, бензоат цинка) и салицилаты.
D. Способы лечения
Для профилактики или лечения заболевания соответствующая дозировка активного вещества будет зависеть от типа заболевания, подлежащего лечению, как определено выше, тяжести и течения заболевания, от профилактических или терапевтических целей введения молекулы, предшествующего лечения, клинического анамнеза пациента и ответа на антитело и от решения лечащего врача. Средство пригодным образом вводят пациенту за один раз или на протяжении серии введений.
Предпочтительным способом лечения является лечение опосредуемых IgE нарушений. Опосредуемые IgE нарушения включают атопические нарушения, которые характеризуются врожденной склонностью иммунологически отвечать на распространенные встречающиеся в природе ингалируемые и проглатываемые антигены и постоянной продукцией антител IgE. Конкретные атопические нарушения включают аллергическую астму, аллергический ринит, атопический дерматит и аллергическую гастроэнтеропатию. Пациенты с атопией часто имеют множественную аллергию, что означает, что они обладают антителами IgE ко множеству аллергенов окружающей среды, и симптомами от множества аллергенов окружающей среды, включая пыльцу, грибы (например, плесень), дебрис животных и насекомых и некоторые продукты питания.
Однако нарушения, связанные с повышенными уровнями IgE, не ограничиваются нарушениями с врожденной (атопической) этиологией. Другие нарушения, связанные с повышенными уровнями IgE, которые, по-видимому, являются опосредуемыми IgE и поддаются лечению составами по настоящему изобретению, включают гиперчувствительность (например, анафилактическую гиперчувствительность), экзему, крапивницу, аллергический бронхолегочный аспергиллез, паразитарные заболевания, гипер-IgE-синдром, атаксию-телеангиэктазию, синдром Вискотта-Олдрича, тимическую алимфоплазию, IgE-миелому и реакцию "трансплантат против хозяина".
Аллергический ринит, также известный как риноконъюнктивит или сенная лихорадка, является наиболее распространенным проявлением атопической реакции на ингалируемые аллергены, тяжесть и длительность которого часто коррелирует с интенсивностью и длительностью воздействия аллергена. Он представляет собой хроническое заболевание, которое впервые может возникнуть в любом возрасте, однако его начало, как правило, происходит в детском или подростковом возрасте. Типичный приступ состоит из обильной водянистой ринореи, пароксизмального чихания, обструкции носовых ходов и зуда носа и неба. Носоглоточный отток слизи также вызывает боль в горле, очистку горла и кашель. Также могут быть симптомы аллергического блефароконъюнктивита, с интенсивным зудом конъюнктивы и век, покраснением, слезоотделением и светобоязнью. Тяжелые приступы часто сопровождаются системным недомоганием, слабостью, усталостью и иногда болезненностью мышц после интенсивных периодов чихания.
Астма, также известная как обратимое обструктивное заболевание воздушных путей, характеризуется повышенной отвечаемостью трахеобронхиального дерева на респираторные раздражители и сужающие просвет бронхов химические вещества, вызывающие приступы свистящего дыхания, диспноэ, ощущения стесненности в груди и кашель, которые обратимы спонтанно или при лечении. Она представляет собой хроническое заболевание, вовлекающее воздушные пути целиком, однако его тяжесть варьирует от случайных мягких переходных эпизодов до тяжелой, хронической, опасной для жизни обструкции бронхов. Астма и атопия могут сосуществовать, однако половина астматиков также обладают атопией, и еще меньшее процентное количество пациентов с атопией также имеют астму. Однако атопия и астма не полностью независимы, поскольку астма более часто происходит у индивидов с атопией, чем у индивидов без атопии, особенно в детском возрасте. Кроме того, астма исторически была разделена на две подгруппы: экзогенная астма и наследственная астма.
Экзогенная астма, также известная как аллергическая, атопическая или иммунологическая астма, характерна для пациентов, у которых астма развивается, главным образом, на раннем периоде жизни, как правило, в младенческом или детском возрасте. Другие проявления атопии, включая экзему или аллергический ринит, часто сосуществуют. Астматические приступы могут происходить в сезоны пыльцы, в присутствии животных или при воздействии домашней пыли, перьевых подушек, или других аллергенов. Кожные тесты показывают положительные реакции в виде волдырей и покраснения на вызывающие заболевание аллергены. Интересно, что тотальные концентрации IgE в сыворотке часто повышены, однако иногда они являются нормальными.
Наследственная астма, также известная как неаллергическая или идиопатическая астма, как правило, впервые возникает во взрослом возрасте, после выраженной респираторной инфекции. Симптомы включают хроническую или рецидивирующую обструкцию бронхов, несвязанную с сезонами пыльцы или воздействием других аллергенов. Кожные тесты являются отрицательными на обычные атопические аллергены, концентрация IgE в сыворотке является нормальной. Дополнительные симптомы включают мокроту с кровью и эозинофилию. Другие схемы классификации астмы на подгруппы, такие как аспирин-чувствительная, индуцируемая физической нагрузкой, инфекционная и психологическая, определяют только внешние пусковые факторы, которые оказывают влияние на некоторых пациентов в большей степени, чем другие.
В заключение, важно отметить, что хотя некоторые классификации исторически ассоциируют аллергическую астму только с зависимостью от IgE, в настоящее время существуют убедительные статистически значимые данные, демонстрирующие корреляцию между IgE и астмой (как аллергической, так и неаллергической). Глава 27, "The Atopic Diseases", A.I. Terr in Medical Immunology, 9th Ed., Simon and Schuster, Stites et al., Ed. (1997). В результате, термин "опосредуемые IgE нарушения" для целей этой патентной заявки включает как аллергическую, так и неаллергическую астму.
Физические признаки астматического приступа включают тахипноэ, слышимое свистящие дыхание и применение вспомогательных мышц при дыхании. Также обычно имеются учащенный пульс и повышенное кровяное давление, а также повышенные уровни эозинофилов в периферической крови и носовых секретах. Легочные функции демонстрируют снижение скоростей потока воздуха и объем форсированного выдоха в течение 1 секунды (FEV1). Общая емкость легких и функциональная остаточная емкость, как правило, являются нормальными или немного повышенными, однако они могут снижаться при чрезмерном бронхоспазме.
Патология астмы может отличаться реакциями ранней фазы и поздней фазы. Ранняя фаза характеризуется сокращением гладких мышц, отеком и гиперсекрецией, а реакции поздней фазы характеризуются клеточным воспалением. Астму могут индуцировать различные неспецифические пусковые механизмы, включая инфекции (например, респираторные вирусные инфекции), физиологические факторы (например, физическая нагрузка, гипервентиляция, глубокое дыхание, психологические факторы), атмосферные факторы (например, диоксид серы, аммиак, холодный воздух, озон, пар дистиллированной воды), пищевые факторы (например, пропранолол, аспирин, нестероидные противовоспалительные лекарственные средства), экспериментальные ингалируемые средства (например, гипертонические растворы, лимонная кислота, гистамин, метахолин, простагландин F2α) и профессиональные ингалируемые вещества (например, изоцианаты). Различные профессиональные аллергены или аллергены окружающей среды, которые вызывают аллергическую астму, могут включать животные продукты, пыль насекомых, морских животных, растительные продукты, плоды, семена, листья и пыльцу, органические красители и чернила, микробные агенты, ферменты, лекарственные средства, стерилизующие агенты и неорганические и органические химические вещества.
Атопический дерматит, также известный как экзема, нейродерматит, атопическая экзема или пруриго Беснера, представляет собой распространенное хроническое кожное нарушение, характерное для подгруппы пациентов с семейными и иммунологическими признаками атопии. Основным признаком является зудящий воспалительный ответ кожи, который вызывает характерную симметрично распределенную кожную сыпь с предпочтением к определенным областям. Также часто имеется сверхпродукция IgE B-лимфоцитами. Хотя атопический дерматит классифицируют как кожную форму атопии, поскольку он ассоциирован с аллергическим ринитом и астмой и высокими уровнями IgE, тяжесть дерматита, однако, не всегда коррелирует с воздействием аллергенов при кожных тестах, и десенсибилизация (в отличие от других аллергических заболеваний) не является эффективным лечением. Хотя высокие сывороточные IgE подтверждают диагноз аллергической астмы, нормальные уровни не исключают его. Возникновение заболевания может происходить в любом возрасте, и очаги возникают остро, начинаясь с эритематозной отечной папулы или бляшки с шелушением. Зуд приводит к вытеканию содержимого и образованию корки, а затем к хронической лихенизации. На клеточном уровне острый очаг является отечным, и кожа инфильтрирована мононуклеарными клетками, CD4-лимфоцитами. Нейтрофилы, эозинофилы, плазматические клетки и базофилы являются редкими, однако имеются дегранулированные тучные клетки. Характерными для хронических очагов являются гиперплазия эпидермиса, гиперкератоз и паракератоз, и кожа инфильтрирована мононуклеарными клетками, клетками Лангерганса и тучными клетками. Также могут присутствовать очаговые области фиброза, включая вовлечение периневрия небольших нервов.
Аллергическая гастроэнтеропатия, также известная как эозинофильная гастроэнтеропатия, представляет собой необычное проявление атопии, при котором множество связанных с IgE видов пищевой чувствительности ассоциировано с локальной реакцией слизистой оболочки желудочно-кишечного тракта. Она является редкой у взрослых, но более частой, однако временной, у младенцев. Состояние возникает, когда употребленные пищевые аллергены реагируют с локальными антителами IgE в слизистой оболочке тощей кишки и происходит высвобождение медиаторов тучных клеток, что приводит к желудочно-кишечным симптомам вскоре после приема пищи. Продолжающееся воздействие приводит к хроническому воспалению, что приводит к потере белка желудочно-кишечным трактом и гипопротеинемическому отеку. Потеря крови через воспаленную слизистую оболочку кишечника может быть достаточно значительной, чтобы вызвать железодефицитную анемию. После воздействия аллергена аллергическая реакция происходит локально в слизистой оболочке верхнего отдела желудочно-кишечного тракта, однако она устраняется при устранении аллергена.
Анафилаксия и крапивница несомненно являются опосредуемыми IgE, однако они лишены генетических детерминант, и у индивидов с атопией отсутствует предрасположенность к ним. Анафилаксия представляет собой острую генерализованную аллергическую реакцию с одновременным вовлечением нескольких систем органов, как правило, сердечно-сосудистой, дыхательной, кожной и желудочно-кишечной. Реакция является иммунологически опосредуемой, и она происходит при воздействии аллергена, к которому субъект ранее был сенсибилизирован. Крапивница и ангионевротический отек относятся к физическому набуханию, эритеме и зуду, вследствие стимуляции гистамином рецепторов в поверхностных кожных кровеносных сосудах, и они являются признаком системной анафилаксии. Системная анафилаксия представляет собой возникновение опосредуемой IgE реакции одновременно во множестве органов, вследствие лекарственного средства, яда насекомых или пищи. Она возникает внезапно посредством индуцированных аллергеном тучных клеток, нагруженных IgE, что приводит к выраженному и опасному для жизни изменению функционирования различных жизненно важных органов. Сосудистый коллапс, острая обструкция дыхательных путей, расширение и отек сосудов кожи, и спазм мышц желудочно-кишечного тракта и мочеполовых путей происходят практически одновременно, хотя и не всегда в одинаковой степени.
Патология анафилаксии включает ангионевротический отек и чрезмерное растяжение легких, с закупоркой слизью дыхательных путей и очаговым ателектазом. На клеточном уровне легкие выглядят сходно с острым астматическим приступом, с гиперсекрецией подслизистых желез бронхов, отеком слизистой и подслизистой оболочек, приливом крови к перибронхиальным сосудам и эозинофилией в стенках бронхов. Могут присутствовать отек легких и кровоизлияние в легкие. Может происходить спазм мышц бронхов, перерастяжение и даже разрыв альвеол. Важные признаки анафилаксии у человека включают отек, переполнение сосудов и эозинофилию в собственной пластинке гортани, трахее, надгортанника и гортанной части глотки.
Воздействие аллергена может происходить через прием с пищей, инъекцию, ингаляцию или контакт с кожей или слизистой оболочкой. Реакция начинается в пределах нескольких секунд или минут после воздействия аллергена. Может присутствовать предварительный испуг или ощущение скорой смерти, с последующими вскоре симптомами в одной или нескольких системах органов-мишеней: сердечно-сосудистой, дыхательной, кожной или желудочно-кишечной.
Аллергены, ответственные за анафилаксию, отличаются от обычно ассоциированных с атопией. Обычными их источниками являются продукты питания, лекарственные средства, яд насекомых или латекс. Пищевые аллергены включают аллергены, имеющиеся у ракообразных, моллюсков (например, омара, креветок, крабов), рыб, в бобовых (например, орехах, горохе, бобах, лакрице), семенах (например, кунжуте, хлопковом семени, тмине, горчице, льняном семени, семени подсолнуха), орехах, ягодах, яичных желтках, гречке и молоке. Лекарственные аллергены включают аллергены, имеющиеся в гетерологичных белках и полипептидах, полисахаридах и гаптенных лекарственных средствах. Аллергены насекомых включают насекомых Hymenoptera, включая пчелу медоносную, складчатокрылую осу, шершня, осу и огненного муравья.
Хотя адреналин является типичным средством лечения анафилаксии, как правило, при менее тяжелой реакции в виде крапивницы или ангиневротического отека назначают антигистамины или другие блокаторы гистамина.
E. Комбинированная терапия
Способ по изобретению можно комбинировать с известными способами лечения опосредуемого IgE нарушения, либо в качестве комбинированных или дополнительных стадий лечения, либо в качестве дополнительных компонентов терапевтического состава.
Например, антигистамины, особенно антигистамины без седативного действия, можно вводить заранее, перед или одновременно с антителами против IgE по изобретению. Пригодные антигистамины включают антигистамины, представляющие собой алкиламин (например, хлорфенирамин), этаноламин (например, дифенгидрамин) и фенотиазин (например, прометазин). Хотя многие антигистамины являются антагонистами фармакологических эффектов гистамина посредством блокирования участков его рецепторов на эффекторных клетках, другие распространенные антигистаминовые лекарственные средства действуют посредством блокирования высвобождения гистамина из тучных клеток, которые сенсибилизированы и "вооружены" аллергенспецифичными IgE (например, кромолин натрий). Примеры антигистаминов включают астемизол, азатидина малеат, брофенирамина малеат, карбиноксамина малеат, цетиразина гидрохлорид, клемастина фумарат, ципрогептадина гидрохлорид, дексбромфенирамина малеат, дексхлорфенирамина малеат, дименгидринат, дифенгидрамина гидрохлорид, доксиламина сукцинат, фексофендадина гидрохлорид, терфенадина гидрохлорид, гидроксизина гидрохлорид, лоратидин, меклизина гидрохлорид, трипеланнамина цитрат, трипеленнамина гидрохлорид, трипролидина гидрохлорид.
Конкретные симптомы опосредуемых IgE нарушений (например, реакции ранней фазы) можно смягчать симпатомиметиками или лекарственными средствами, обладающими бронхорасширяющим эффектом. Адреналин представляет собой альфа и бета-адренергетик широкого спектра действия, часто вводимый подкожно в дозе 0,2-0,5 мл в виде водного раствора 1:100. Когда желательным является более длительный эффект, часто используют форму адреналина более длительного действия (т.е. тербуталин) в суспензии 1:200. Пригодные дополнительные бета-адренэргетики включают альбутерол, пиребутерол, метапротеренол, сальметерол, изоэтарин и форметерол для назального введения (например, посредством карманного устройства для распыления, импульсного устройства для вдыхания при положительном давлении или дозируемых ингаляторов под давлением) или перорально.
Расширения бронхов также достигают посредством введения ксантинов, особенно когда их вводят в сочетании с указанными выше симпатомиметическими лекарственными средствами. Примеры ксантинов включают аминофиллин (внутривенно 250-500 мг) и теофиллин (перорально, концентрация в сыворотке 10-20 мкг/мл).
Другие симптомы различных опосредуемых IgE нарушений (например, реакций поздней фазы) можно смягчать посредством введения глюкокортикоидов или других лекарственных средств, обладающих противовоспалительными эффектами. Преднизон (30-60 мг в сутки) вводят системно в случае тяжелых приступов, а беклометазона дипропионат, триамцинолона ацетонид и флунизолид вводят в форме аэрозоля в качестве длительной поддерживающей терапии. Дополнительные кортикостероиды, которые обладают противовоспалительными эффектами, включают бетаметазон, будезонид, дексаметазон, флудроацетат кортизона, флунизолид, флуказона пропионат, гидрокортизон, метилпреднизолон, преднизолон, преднизон, триамцинолон.
Нестероидные противовоспалительные лекарственные средства, которые также можно применять в сочетании со способами лечения по изобретению, включают ацетаминофен, аспирин, бромфенак натрий, диклофенак натрий, дифлунизал, этодолак, фенопрофен кальций, флурбипрофен, ибупрофен, индометацин, кетопрофен, меклофенамат натрий, мефенаминовая кислота, набуметон, напроксен, напроксен натрий, оксифенбутазон, фенилбутазон, пироксикам, сулиндак, толметин натрий.
Кроме того, максимальный терапевтический эффект также может быть достигнут при введении противоотечных средств (например, фенилэфрина, фенилпропаноламина, псевдоэфедрина), средств от кашля (например, декстрометорфана, кодеина или гидрокодона) или аналгетика (например, ацетаминофена, аспирина).
Десенсибилизация аллергеном представляет собой форму лечения, при которой аллергены инъецируют пациенту для снижения или устранения аллергического ответа. Также в качестве иммунотерапии аллергеном известны гипосенсибилизация или инъекционная терапия аллергии. Ее часто используют в сочетании с другими способами лечения аллергии, но не часто в качестве основного лечения. Ее успешно использовали, когда возможно устранение аллергена. Типичное лечение десенсибилизацией аллергеном включает подкожную инъекцию стерильного аллергена в возрастающих дозах один или два раза в неделю до достижения дозы, которая вызывает временную небольшую локальную область воспаления в области инъекции. Затем дозу вводят по поддерживающей схеме один раз каждые 2-4 недели. Аллергическую десенсибилизацию наиболее часто применяют при лечении аллергической астмы и аллергического ринита, хотя она имела успех и при лечении анафилаксии. Также десенсибилизацию эффективно использовали применением адъювантов, таких как неполный адъювант Фрейнда, который представляет собой эмульсию водного раствора антигена в минеральном масле. Физиологический эффект создает нерастворимое липидное депо, из которого постепенно высвобождаются капли аллергена. Другой формой десенсибилизации аллергеном является полимеризация мономерных аллергенов глутаральдегидом с получением молекулы с относительно низкой аллергенностью (т.е. она вызывает аллергический ответ), при сохранении эффективной степени иммуногенности.
F. Фармацевтические дозировки
Дозировки и требуемая концентрация лекарственного средства в фармацевтических композициях по настоящему изобретению могут варьировать, в зависимости от конкретного предусмотренного применения. Определение соответствующей дозировки или способа введения находятся в пределах квалификации специалиста в данной области. Эксперименты на животных обеспечивают надежное руководство для определения эффективных доз для терапии у человека. Межвидовое масштабирование эффективных доз можно проводить в соответствии с принципами, установленными Mordenti, J. and Chappell, W. "The Use of Interspecies Scaling in Toxicokinetics", In Toxicokinetics and New Drug Development, Yacobi et al., Eds, Pergamon Press, New York 1989, pp.42-46.
Когда используют введение in vivo полипептидов или антител, описанных в настоящем документе, нормальные величины дозировок могут варьировать от приблизительно 10 нг/кг до приблизительно 100 мг/кг массы тела млекопитающего или более в сутки, предпочтительно от приблизительно 1 мг/кг/сутки до 10 мг/кг/сутки, в зависимости от способа введения. Руководство по конкретным дозировкам и способам доставки предоставлено в литературе; см., например, патенты США №№ 4657760, 5206344 или 5225212. К объему изобретения относится, что различные составы будут эффективными для различных способов лечения и при различных нарушениях и что введение, предназначенное для лечения конкретного органа или ткани, может требовать доставки способом, отличным от способа для другого органа или ткани. Более того, дозировки можно вводить посредством одного или нескольких отдельных введений или посредством непрерывной инфузии. Для многократного введения в течение нескольких суток или более, в зависимости от состояния, лечение продолжают до тех пор, пока не произойдет желательное подавление симптомов заболевания. Однако могут быть пригодными другие схемы дозирования. Мониторинг хода этой терапии легко проводить общепринятыми способами и анализами.
G. Введение состава
Составы настоящему изобретению, включая, но не ограничиваясь ими, восстанавливаемые составы, вводят млекопитающему, нуждающемуся в лечении белком, предпочтительно человеку, согласно известным способам, таким как внутривенное введение, например, в качестве болюсной инъекции или посредством непрерывной инфузии в течение периода времени, посредством внутримышечного, внутрибрюшинного, интрацереброспинального, подкожного, внутрисуставного введения, введения внутрь синовиальной оболочки, интратекального, перорального, местного или ингаляционного способов.
В предпочтительных вариантах осуществления составы вводят млекопитающему посредством подкожного (т.е. под кожу) введения. Для таких целей состав можно инъецировать с использованием шприца. Однако доступны другие устройства для введения состава, такие как устройства для инъекции (например, устройства INJECT-EASETM и GENJECT™), шприцы-ручки (такие как GENPENTM), автоматические инъекционные устройства, безыгольные устройства (например, MEDIJECTORTM и BIOJECTORTM) и системы для доставки в виде подкожных пластырей.
В конкретном варианте осуществления настоящее изобретение относится к наборам для введения однократной дозы. Такие наборы содержат контейнер с водным составом терапевтического белка или антитела, включая как однокамерные, так и многокамерные предварительно заполненные шприцы. Иллюстративные предварительно заполненные шприцы доступны от Vetter GmbH, Ravensburg, Germany.
Соответствующая дозировка ("терапевтически эффективное количество") белка будет зависеть, например, от типа состояния, подлежащего лечению, тяжести и течения состояния, от профилактических или терапевтических целей введения белка, предшествующего лечения, клинического анамнеза пациента и ответа на белок, от типа применяемого белка и от решения лечащего врача. Белок пригодным образом вводят пациенту за один раз или на протяжении серии введений, и его можно вводить пациенту в любое время после постановки диагноза. Белок можно вводить в качестве единственной терапии или вместе с другими лекарственными средствами или способами терапии, пригодными для лечения представляющего интерес состояния.
Когда выбранный белок представляет собой антитело, от приблизительно 0,1-20 мг/кг является исходной предполагаемой дозировкой для введения пациенту, например, посредством либо одного, либо большего количества отдельных введений. Однако могут быть пригодны другие схемы дозирования. Мониторинг хода этого лечения легко проводить общепринятыми способами.
Применение состава против IgE (например, rhuMAbE-25, rhMAbE-26, Hu-901) включает лечение или профилактику опосредуемых IgE аллергических заболеваний, паразитарных инфекций, интерстициального цистита и астмы, например. В зависимости от заболевания или нарушения, подлежащего лечению, пациенту вводят терапевтически эффективное количество (например, приблизительно 1-15 мг/кг) антитела против IgE.
H. Изделия
В другом варианте осуществления изобретения предусмотрено изделие, которое содержит состав и в котором предпочтительно предоставлены инструкции по его применению. Изделие содержит контейнер. Пригодные контейнеры включают, например, бутыли, флаконы (например, двухкамерные флаконы), шприцы (такие как однокамерные и двухкамерные шприцы) и пробирки для анализа. Контейнеры могут быть изготовлены из множества материалов, таких как стекло или пластмасса. Контейнер содержит состав. На этикетке на контейнере, или прилагаемой к нему, представлено руководство по восстановлению и/или применению. Кроме того, на ярлыке может быть указано, что состав пригоден или предназначен для подкожного введения. Контейнер, содержащий состав, может представлять собой флакон для многократного применения, который позволяет повторные введения (например, 2-6 введений) восстановленного состава. Кроме того, изделие может содержать второй контейнер, содержащий пригодный разбавитель (например, BWFI). При смешении разбавителя и лиофилизированного состава конечная концентрация белка в восстановленном составе будет, как правило, составлять по меньшей мере 50 мг/мл. Кроме того, изделие может включать другие материалы, желательные с коммерческой и пользовательской точки зрения, включая другие буферы, разбавители, фильтры, иглы, шприцы и вкладыши в упаковку с инструкциями по применению.
Изобретение будет более понятным с помощью представленных ниже примеров. Однако их не следует истолковывать, как ограничивающие объем изобретения. Все цитаты на протяжении описания включены в настоящий документ в качестве ссылок в полном объеме.
В другом варианте осуществления изобретение относится к изделию, содержащему составы, описанные для введения в автоматическом впрыскивателе. Автоматический впрыскиватель можно описать как устройство для инъекции, которое при активации будет доставлять его содержимое без дополнительного необходимого действия пациента или вводящего лица. Они, в частности, пригодны для самостоятельного введения терапевтических составов, когда скорость доставки должна быть постоянной и время доставки превышает несколько моментов времени.
ПРИМЕР 1
Выделение IgE приматов
IgE человека клонировали из миеломной клеточной линии с IgE человека U266 (ATCC, Manassas, VA, TIB #196). Последовательности IgE макака-резус и яванского макака определяли клонированием и секвенированием IgE из кДНК, полученной из мононуклеарных клеток периферической крови макака-резус и яванского макака, которые были стимулированы с получением клеток (PBMC) с переключенными IgE. Прямые и обратные праймеры (представленные ниже) конструировали на основе последовательностей IgE человека. Вышерасположенный прямой праймер конструировали непосредственно выше CH2-домена. Обратный праймер конструировали на конце трансмембранного домена. PBMC макака-резус и яванского макака получали из California National Primate Research Center (Davis, CA). 5×106 PBMC культивировали с IL-4 (100 нг/мл) и CD40L (3 мкг/мл) (R&D Systems, Minneapolis, MN, #204-IL и #617-CL. соответственно) в течение 4 суток. Затем клетки собирали, получали РНК (RNeasy Mini Kit, #74106, Qiagen, Valencia, CA) и получали кДНК с использованием набора BD Sprint Powerscript oligo dT priming kit (BD Biosciences, San Jose, CA, #639558). Затем проводили ОТ-ПЦР [94°C в течение 2 минут; 94°C в течение 15 секунд; 60°C в течение 30 секунд; 68°C в течение 2 минут; 30 циклов; 68°C в течение 10 минут]. После указанных циклов добавляли Taq-полимеразу (10 минут при 72°С) для добавления выступающих концов A для клонирования TA (Invitrogen, Carlsbad, CA, #45-0641). Продукты ПЦР клонировали посредством TOPO-TA cloning, а затем подтверждали последовательности клонов (Genentech, Inc.). Последовательности человека, макака-резус и яванского макака выравнивали с использованием программ для анализа собственной разработки (Genentech, Inc.). Представленные ниже гомологии приведены для последовательностей между CH2-доменами и трансмембранными доменами. Между последовательностями макака-резус (432 аминокислоты) и яванского макака (431 аминокислота) было 6 отличий, и они были приблизительно на 98,6% гомологичными. Между последовательностями человека и макака-резус было 53 отличия, соответствующих 87,7% гомологии. Между последовательностями человека и яванского макака было 56 отличий, соответствующих 87% гомологии (см. фиг.1).
Праймеры, используемые для клонирования:
Прямые праймеры выше последовательности CH2:
5'-ccgcccaccgtgaagatcttacagtc (SEQ ID NO:63)
Обратный праймер на конце трансмембранного домена:
5'-cggctcgagactaggcgtggggctggaggacgttg (SEQ ID NO:64)
ПРИМЕР 2
Выделение Ab против IgE/М1'
Получение слитого белка CH3-CH4-M1/Fc
Слитый белок CH3-CH4-M1' IgE/Fc человека получали амплификацией посредством ПЦР доменов CH3-CH4-M1' IgE человека плюс дополнительные 15 аминокислот непосредственно ниже М1'-домена из кДНК, полученной из клеток U266 (ATTC Manassas, VA, TIB#196). Получали РНК из клеток U266 (RNeasy Mini Kit, #74106, Qiagen, Valencia, CA), и кДНК получали с использованием BD Sprint Powerscript oligo dT priming (BD Biosciences, San Jose, CA, #639558). Проводили ОТ-ПЦР, и продукт ПЦР клонировали посредством TOPO-TA cloning (Invitrogen, Carlsbad, CA, #45-0641). Для экспрессии в клетках млекопитающих добавляли N-концевую сигнальную последовательность с помощью мутагенеза посредством ПЦР, и сигнальную последовательность+CH3+CH4+М1'+15 аминокислот клонировали в экспрессирующий вектор (pRK huIgG1 Fc; Genentech) с получением конструкции, слитой на C-конце с Fc-областью IgG1 человека. Последовательность конечного белка, включая сигнальную последовательность и Fc IgG1 человека, является следующей:

Белок получали временной трансфекцией клеток CHO (Genentech), и белок очищали из клеточного культурального супернатанта с использованием стандартных способов колоночной хроматографии на белке A-сефарозе.
Иммунизация и получение гибридом
Панель панспецифичных антител, которые селективно связывают М1'-часть IgE-М1' человека, получали с использованием белка CH3-CH4-M1'/Fc. В каждую подушечку задней лапы мыши BALB/c инъецировали 1 мкг CH3-CH4-M1'/Fc, ресуспендированного в адъюванте из монофосфорил-липида A и дикориномиколата трегалозы (MPLTM+TDM) (Corixa, Hamilton, MT), с интервалами от 3 до 4 суток. Сыворотку отбирали после 8 вспомогательных инъекций и титровали посредством твердофазного иммуноферментного анализа (ELISA) и активированной флуоресценцией сортировки клеток и проточной цитометрии (скрининг FACS, см. следующий раздел) для того, чтобы убедиться, что мышь имеет высокий иммунный ответ на CH3-CH4-М1'/Fc. Через трое суток после последней вспомогательной инъекции клетки подколенного узла подвергали слиянию с клеточной линией миеломы мыши P3X63Ag.U.1 (см., например, Chuntharapai et al., 1997, Methods Enzymol. 288:15-27). Селекцию слитых гибридомных клеток относительно неслитых клеток подколенного узла или миеломных клеток проводили с использованием селекции посредством гипоксантина-аминоптерина-тимидина (HAT) в Medium D из набора для селекции гибридом ClonaCell® (StemCell Technologies, Inc., Vancouver, BC, Canada), с получением в совокупности 4224 клонов.
Скрининг панспецифичных антител против М1' человека
Клоны гибридомы, полученные, как описано ранее, подвергали скринингу в отношении продукции моноклональных антител, связывающихся с М1'-участком белка CH3-CH4-M1'/Fc, М1'-участком IgE-М1' человека, экспрессированным на поверхности клеточной линии B-клеточной лимфомы мыши A20 (IgE-M1'/A20), и М1'-участком IgE-М1' человека, стабильно экспрессированным на поверхности клеточной линии B-клеточной лимфомы человека BJAB (IgE-M1'/BJAB). Отрицательные контроли включали CD-4/Fc человека, IgE человека, стабильно экспрессированный на поверхности клеточной линии B-клеточной лимфомы мыши A20 (IgE/A20), клеточную линию B-клеточной лимфомы мыши A20 (A20), IgE человека, стабильно экспрессированный на поверхности клеточной линии B-клеточной лимфомы человека BJAB (IgE/BJAB), и клеточную линию B-клеточной лимфомы человека (BJAB).
Скрининг ELISA
Для скрининга 4224 клонов проводили твердофазный иммуноферментный анализ (ELISA), главным образом, как описано в Baker et al., 2002, Trends Biotechnol, 20:149-156. Анализы проводили как в 384-, так и в 96-луночных планшетах. В кратком изложении, на 384-(или 96-)луночные планшеты наносили 50 мкл антител козы против Fc IgG человека (MP Biomedicals, Irvine, CA) в концентрации 2 мкг/мл в буфере для нанесения (0,05M карбонатный буфер, pH 9,6), накрывали и хранили в течение ночи при 4°C. После удаления раствора для нанесения, в каждую лунку добавляли 80 мкл (или 200 мкл для 96-луночного планшета) раствора для анализа/блокирующего раствора, содержащего 0,5% бычий сывороточный альбумин и 0,05% Tween®-20 в PBS (pH 7,4) (разбавитель ELISA), и планшеты инкубировали при комнатной температуре в течение одного часа при встряхивании. Затем лунки промывали три раза 100 мкл (или 300 мкл для 96-луночного планшета) 0,05% Tween®-20 в PBS (буфер для промывания).
После стадии промывания в каждую лунку добавляли 50 мкл (или 100 мкл для 96-луночного планшета) раствора антигена, содержащего 0,4 мкг/мл CH3-CH4-M1'/Fc или CD-4/Fc человека в разбавителе ELISA, и планшеты инкубировали при комнатной температуре в течение одного часа при встряхивании. Лунки промывали три раза буфером для промывания, как указано выше. Добавляли супернатант от отдельных гибридомных клонов, так чтобы в одной лунке с CH3-CH4-M1'/Fc и одной лунке с CD-4/Fc человека находилось 50 мкл (или 100 мкл для 96-луночного планшета) супернатанта от единичного клона гибридомы. Планшеты инкубировали при комнатной температуре в течение одного часа при встряхивании, и лунки промывали три раза буфером для промывания, как указано выше.
После промывания в каждую лунку добавляли 50 мкл (или 100 мкл для 96-луночного планшета) разведения 1:1000 антител овцы против IgG мыши, связанных с пероксидазой хрена (без перекрестной реактивности с IgG человека (MP Biomedicals)), в разбавителе для ELISA. Планшеты инкубировали при комнатной температуре в течение одного часа при встряхивании, промывали три раза буфером для промывания, как указано выше, и сушили с помощью ударов. Лунки проявляли добавлением 50 мкл (или 100 мкл для 96-луночного планшета) субстрата пероксидазы для микролунок - тетраметилбензидина (TMB) (BioFX Laboratories, Owing Mills, MD, каталожный #TMBW-0100-01) в каждую лунку и инкубацией при комнатной температуре в течение 5-10 минут или до тех пор, пока не наблюдалось существенное изменение цвета. Проявление останавливали добавлением в каждую лунку 50 мкл (или 100 мкл для 96-луночного планшета) TMB Stop Solution (BioFX Laboratories каталожный #BSTP-0100-01). Планшеты анализировали с помощью устройства для считывания планшетов Sunrise (Tecan US, Inc., Research Triangle Park, NC) при 650 нм.
В качестве контролей использовали предварительную сыворотку и полисыворотку. Образцы предварительной крови содержали сыворотку мыши перед иммунизацией, и образцы полисыворотки содержали антисыворотку мыши, полученную после 10 иммунизаций.
Скрининг FACS
Для скрининга 3221 клонов, полученных в примере 1, проводили активированную флуоресценцией сортировку клеток (FACS) с использованием клеточных линий IgE-M1'/A20 и IgE-M1'/BJAB. Клеточные линии IgE/A20, IgE/BJAB, A20 и BJAB служили в качестве отрицательных контролей. Клетки ресуспендировали и центрифугировали при 500g в течение 5 минут при 4°C. Среду аспирировали, и клетки ресуспендировали в буфере FACSFlow (BD Biosciences, San Jose, CA) при 4°C с 1% эмбриональной телячьей сывороткой (буфер для окрашивания клеток). Клетки центрифугировали, как указано выше, среду аспирировали, и клетки ресуспендировали в количестве 2×106 клеток/мл буфера для окрашивания клеток при 4°C. Клетки добавляли в 96-луночные планшеты с круглым дном в количестве 50 мкл/лунка (1x105 клеток/лунка), и в каждую лунку добавляли 100 мкл супернатанта от отдельных гибридомных клонов, так чтобы супернатант каждой гибридомы инкубировали в одной лунке, содержащей каждую клеточную линию. Планшет инкубировали на льду в течение 30 минут. Планшет центрифугировали при 500g в течение 5 минут при 4°C, и супернатанты аспирировали. Каждую лунку ресуспендировали в 200 мкл буфера для окрашивания клеток при 4°C, и планшеты центрифугировали, как указано выше. Буфер для окрашивания клеток аспирировали.
После стадии промывания клетки в каждой лунке ресуспендировали в 100 мкл антител козы против Fc IgG мыши, связанных с R-фикоэритрином (Jackson Immunoresearch, West Grove, PA), в разведении 1:1000 в буфере для окрашивания клеток при 4°C, и планшеты инкубировали в темноте на льду в течение 30 минут. Планшет центрифугировали при 500g в течение 5 минут при 4°C, и супернатанты аспирировали. Каждую лунку ресуспендировали в 200 мкл буфера для окрашивания клеток при 4°C, и планшеты центрифугировали, как указано выше. Буфер для окрашивания клеток аспирировали. Клетки в каждой лунке ресуспендировали в 200 мкл буфера для окрашивания клеток при 4°C и переносили в 1,2-мл микропробирки для титрования (Quality Scientific Plastics, Petaluma, CA). FACS проводили на FACScan или FACSCalibur (BD Biosciences).
N-концевое секвенирование/выделение РНК/секвенирование и клонирование
Антитела очищали от супернатанта гибридом с антителами против IgE/М1' и анализировали N-концевым секвенированием для определения клональности в фосфатно-солевом буфере. Каждое антитело выделяли на Precast 4-20% Tris HCl SDS-PAGE (Invitrogen, Carlsbad, CA) в восстанавливающих условиях. Каждую из разделенных тяжелой цепи (HC) и легкой цепи (LC) подвергали N-концевому секвенированию с использованием N-концевого секвенатора Procise 494 (Applied Biosystems, Foster City, CA) с использованием 20-мин цикла, как описано в Henzel et al. Analytical Biochemistry 267, 148-160 (1999). Первые 25 остатков секвенировали для установления моноклональности. Когда цепи HC или LC Ab блокировали пироглутамильной группой, которая делает N-концевую аминокислоту недоступной для секвенирования способом Эдмана, перед секвенированием проводили удаление блокирующей группы. Пироглутамильную группу удаляли ферментом пироглутаматаминопептидазой (PGAP, Sigma, St Louis, MO) с использованием протокола, описанного Pham et al. Elctrophoresis 2005, 26 4243-4251.
Определили, что последовательности М1' тяжелой цепи (HC) и легкой цепи (LC) антител 7A6, 1C11, 47H4, 26A11, 45Cl и 28E9 являлись следующими:

Для определения полноразмерных последовательностей конструировали 5'-вырожденные праймеры из N-концевых аминокислотных последовательностей и известных сегментов генов Ig, и проводили ПЦР с вырожденными нижележащими консервативными последовательностями тяжелой и легкой цепи.
Прямые праймеры


Обратные праймеры
Праймер для тяжелой цепи (HCR) 5'-ctggacagggatccagagttccaggtcactgtcactggctcaggg (SEQ ID NO:90)
Праймер для легкой цепи (LCR) 5'-ctgtaggtgctgtctttgctgtcctgatcagtccaactg (SEQ ID NO:91)
РНК собирали из гибридом с антителами против IgE/М1' (RNeasy Mini Kit, #74106, Qiagen, Valencia, CA) и получали кДНК с использованием набора BD Sprint Powerscript oligo dT priming kit (BD Biosciences, San Jose, CA, #639558). Проводили ПЦР с использованием указанных выше праймеров, и продукты ПЦР клонировали с использованием набора TOPO-TA (Invitrogen, Carlsbad, CA, #45-0641). ПЦР проводили с использованием Platinum Pfx High Fidelity Polymerase (Invitrogen, Carlsbad, CA, #11708-039) с условиями для ПЦР [94°C в течение 2 минут; 94°C в течение 15 секунд; 60°C в течение 30 секунд; 68°C в течение 2 минут; 30 циклов; 68°С в течение 10 минут]. Клоны подвергали скринингу в отношении вставок, и множество клонов секвенировали (Genentech, Inc.) для подтверждения исходной последовательности гена тяжелой цепи и легкой цепи антитела против IgE/М1'.
Вариабельные домены антитела против M1' субклонировали в экспрессирующие векторы с различными Fc-участками с получением химерных антител с Fc различных видов и/или изотипов. Конструировали праймеры для клонирования вариабельного домена (CDR + каркасная область) в Fc-участки IgG2a мыши, IgG2a-DANA мыши, и IgG1 человека.
Конструировали праймеры для включения участков рестрикции в последовательность тяжелой и легкой цепи. Тяжелые цепи клонировали с использованием BsiWI и ApaI. Легкие цепи клонировали с использованием EcoRV и KpnI. Затем новые продукты ПЦР расщепляли и лигировали в экспрессирующие векторы mIgG2a (LPG10), mIgG2a-DANA (pErk-E27DANA) или huIgG1 для тяжелой цепи, или mKappa (LPG2) или huKappa (Genentech, Inc.). Подтверждали последовательность конечных клонов (Genentech, Inc.).
3'-праймеры и сочетания прямых и обратных праймеров для клонирования вариабельных последовательностей CDR являются следующими:
Обратные праймеры


Сочетания праймеров:

Легкая цепь 47H4 имела внутренний участок KpnI, который исключал прямое клонирование в экспрессирующие векторы mKappa и huKappa. Во внутренний участок KpnI вносили мутацию с использованием набора Quick Change XL Site Directed Mutagenesis Kit (Stratagene, Cedar Creek, Texas, #200517-5) [95°C в течение 1 минуты; 95°C в течение 50 секунд; 60°C в течение 50 секунд; 68°C в течение 4,5 минут; 68°C в течение 7 минут]. Праймеры конструировали в соответствии с требованиями набора для мутации одного нуклеотида в участке KpnI, которая не изменяла аминокислотную последовательность. TAC подвергали мутации в TAT, который сохранял тирозин (Y) в этом положении. Последовательности конечных клонов подтверждали (Genentech, Inc.).
Праймеры, используемые для мутагенеза, представляли собой:

ПРИМЕР 2A
Гуманизация антител против IgE/М1'
В этом примере описана гуманизация мышиных антител 26A11, 7A6 и 47H4 против IgE/М1'.
Материалы и способы
Домен М1' ассоциированного с мембраной IgE человека экспрессировали в качестве слитой с Fc конструкции в клетках CHO и очищали общепринятыми способами. Гибридомы, экспрессирующие антитела 26A11, 7A6 и 47H4, получали посредством иммунизации мышей рекомбинантным слитым белком М1'-Fc и идентифицировали посредством ELISA с использованием планшетов, покрытых М1'-Fc. Функциональные антитела идентифицировали по их способности связываться с экспрессирующими М1' клетками и запускать апоптоз.
Клонирование вариабельных доменов 26A11, 7A6 и 47H4 мыши
Тотальную РНК экстрагировали из гибридомных клеток, продуцирующих 26A11, 7A6 или 47H4, с использованием стандартных способов. Вариабельные домены легкой цепи (VL) и тяжелой цепи (VH) амплифицировали с использованием ОТ-ПЦР с вырожденными праймерами для тяжелой и легкой цепей. Прямые праймеры были специфичны к N-концевой аминокислотной последовательности VL- и VH-участков. Соответственно, обратные праймеры для LC и HC конструировали, чтобы они гибридизовывались с участком в константном домене легкой цепи (CL) и константном домене 1 тяжелой цепи (CH1), которые являются высококонсервативными между видами. Полинуклеотидную последовательность вставок определяли с использованием общепринятых способов секвенирования. Аминокислотные последовательности VL и VH 26A11, 7A6 и 47H4 представлены на фиг.6A и 6D, 6B и 6E, и 6C и 6F, соответственно.
Прямое пересаживание гипервариабельных областей в акцепторную консенсусную каркасную область человека
Фагмида, используемая для этой работы, представляет собой одновалентный вектор Fab-g3 для дисплея и состоит из 2 открытых рамок считывания под контролем одного промотора phoA. Первая открытая рамка считывания состоит из сигнальной последовательности stII, слитой с доменами VL и CH1 акцепторной легкой цепи, а вторая состоит из сигнальной последовательности stII, слитой с доменами VH и CH1 акцепторной тяжелой цепи, с последующим вспомогательным белком оболочки фага P3.
VL- и VH-домены из антител 26A11, 7A6 или 47H4 мыши (mu26A11, mu7A6 или mu47H4) выравнивали с консенсусными последовательностями VL каппа I человека (huKI) и VH подгруппы III человека (huIII). Для получения пересаженных CDR, гипервариабельные области из mu26A11, mu7A6 или mu47H4 пересаживали в консенсусные акцепторные каркасные области huKI и huIII с получением прямого пересаженного CDR (26A11.v1, 7A6.v1 или 47H4.v1) (Фиг.6A-6F). В VL-домене пересадке подвергали следующие участки в консенсусный акцептор человека: положения 24-34 (L1), 50-56 (L2) и 89-97 (L3). В VH-домене пересадке подвергали положения 26-35 (H1), 49-65 (H2) и 94-102 (H3). MacCallum et al. [MacCallum et al. J. Mol. Biol. 262:732-745 (1996)] анализировали кристаллические структуры комплексов антитела и антигена и выявили, что положение 49 и 94 тяжелой цепи является частью области контакта, таким образом, по-видимому, является обоснованным включение этих положений в определение CDR-H2 и CDR-H3 при гуманизации антител.
Гуманизированные антитела 26A11.v1, 7A6.v1 и 47H4.v1 против IgE/М1' получали в качестве антител IgG посредством мутагенеза Kunkel экспрессирующих векторов LC и HC с использованием отдельных олигонуклеотидов для каждой гипервариабельной области. Также с использованием мутагенеза Kunkel проводили аминокислотные замены для повышения стабильности. Kunkel et al., J. Biol. Chem. 263(29):14784-14789 (1988). Правильные клоны идентифицировали секвенированием ДНК.
Продукция IgG
Для целей скрининга исходно получали варианты IgG в клетках 293. Векторы, кодирующие VL и VH (25 мкг), трансфицировали в клетки 293 с использованием системы FuGene. 500 мкл FuGene смешивали с 4,5 мл среды DMEM, не содержащей FBS, и инкубировали при комнатной температуре в течение 5 мин. К этой смеси добавляли каждую цепь (25 мкг) и инкубировали при комнатной температуре в течение 20 мин, а затем переносили в пять флаконов T-150 для трансфекции в течение при 37°C в 5% CO2. На следующие сутки среду, содержащую смесь для трансфекции, удаляли и заменяли 23 мл среды PS04 с 0,1 мл/л микроэлементов (A0934) и 10 мг/л инсулина (A0940). Клетки инкубировали в течение дополнительных 5 суток, после чего среду собирали при 1000 об/мин в течение 5 мин и подвергали стерильной фильтрации с использованием 0,22-мкм фильтра с низким связыванием белка. Образцы можно хранить при 4°C после добавления 2,5 мл 0,1% PMSF на каждые 125 мл среды.
Определение аффинности
Определение аффинности проводили с помощью анализа Скэтчарда, ELISA со связыванием клеток и поверхностного плазмонного резонанса с использованием BIAcoreTM-2000 или A100.
Анализ Скэтчарда - клетки Daudi человека, клетки IgE/М1' макака-резус и яванского макака получали для связывания в холодном буфере для связывания, состоящем из основной среды с 10 мМ HEPES pH 7,4, и 2% FBS, а также 40 мкг/мл IgG человека. Клетки разбавляли до концентрации 1,7×106 клеток/мл и держали на льду до их включения в анализ. Белки/антитела йодировали способом с йодогеном. Получали различные концентрации холодного белка в трех экземплярах с использованием разведения 1:2, начиная с насыщающей концентрации и заканчивая концентрацией, равной нулю, всего с 14 концентрациями. Ко всем разведениям добавляли горячий белок в одной концентрации для конкуренции с холодным белком. В конце к смеси горячего и холодного белков добавляли клетки, использовали 250000 клеток на образец. Анализируемую смесь держали при 4°C в течение 4 часов, при встряхивании. Затем каждый образец собирали и фильтрули на мембране, промывали по меньшей мере 3 раза буфером для связывания, позволяли высохнуть, а затем подсчитывали в течение 1 минуты с использованием автоматического гамма-счетчика Perkin Elmer Wizard 1470 Auto Gamma Counter.
Конкурентный электрохемилюминесцентный анализ связывания клеток
Относительную аффинность связывания гуманизированных вариантов определяли с использованием конкурентного электрохемилюминесцентного анализа связывания клеток. Трансфицированные клетки BJAB, экспрессирующие IgE-М1' (BJAB-IgE/М1')(длинный), или контрольные трансфицированные клетки, не экспрессирующие М1' (BJAB-IgE) (короткий), промывали фосфатно-солевым буфером (PBS) и высевали в количестве 25000 клеток/лунка в 25 мкл PBS на 96-луночные планшеты MULTI-ARRAY High Bind (Meso Scale Discovery). Клетки инкубировали на планшетах в течение одного часа при комнатной температуре для обеспечения прикрепления клеток к лункам. Для блокирования неспецифичного связывания в каждую лунку добавляли 25 мкл 30% FBS в PBS. Затем планшеты инкубировали при комнатной температуре в течение 30 минут при мягком встряхивании. Блокирующий раствор удаляли и добавляли серийные разведения гуманизированных вариантов (0,022-1333 нМ), дополненных фиксированным количеством биотинилированного антитела против М1' IgE (33,3 нМ 26A11 или 47H4) в 25 мкл PBS, содержащего 2% FBS (буфер для анализа). После инкубации в течение одного часа при комнатной температуре при мягком встряхивании планшеты промывали три раза PBS (300 мкл/лунка) с использованием устройства для промывания микропланшетов (ELx405 Select, Bio-Tek Instruments, Inc., Winooski, VT). Также детекцию связанных антител проводили добавлением 25 мкл меченного рутением стрептавидина в буфере для анализа в концентрации 0,25 мкг/мл. После инкубации в течение одного часа при комнатной температуре планшеты промывали и добавляли буфер Tris-based Read Buffer T (1x, без поверхностно-активного вещества) (Meso Scale Discovery) (150 мкл/лунка). Электрохемилюминесцентные сигналы регистрировали с использованием устройства для считывания Sector Imager 6000 (Meso Scale Discovery).
Biacore 2000 - Использовали две ориентации; иммобилизовывали либо М1'-Fc, либо конкретный вариант антитела (приблизительно 100 RU, в 10 мМ ацетате натрия pH 4,8 на сенсорном чипе CM5), и соответствующий лиганд (вариант антитела или M1'Fc, соответственно) служил в качестве анализируемого вещества (инъецируемый со скоростью потока 30 мкл/мин, с использованием 2-кратного серийного разведения от 0,5 до 1000 нМ в PBST). Каждый образец анализировали с ассоциацией в течение 3 минут и диссоциацией в течение 10 минут. После каждой инъекции чип регенерировали с использованием 10 мМ глицина pH 1,7.
Biacore A-100 - М1' иммобилизовывали (приблизительно 100 RU, в 10 мМ ацетате натрия pH 4,8 на сенсорном чипе CM-5), и вариант антитела служил в качестве анализируемого вещества (инъецируемый со скоростью потока 30 мкл/мин, с использованием 2-кратного серийного разведения от 0,5 до 1000 нМ в PBST). Каждый образец анализировали с ассоциацией в течение 5 минут и диссоциацией в течение 5 минут. После каждой инъекции чип регенерировали с использованием 10 мМ глицина pH 1,7.
Связывающий ответ корректировали вычитанием потока ячеек контрольного потока из ячеек потока варианта IgG 18F7. Для анализа кинетики использовали модель Ленгмюра 1:1 для одновременного приведения в соответствие kon и koff.
Результаты и обсуждение
Пересаженные CDR 26A11, 7A6 и 47H4 - Акцепторная каркасная область человека, используемая для гуманизации, основана на консенсусном VL-домене каппа I человека и консенсусном VH-домене подгруппы III человека. VL- и VH-домены mu26A11, mu7A6 и mu47H4 выравнивали с доменами каппа I и подгруппы III человека; каждую определяющую комплементарность область (CDR) идентифицировали и пересаживали в акцепторную каркасную область человека с получением пересаженной CDR, которая не могла экспрессироваться в качестве IgG (фиг.6A-6F).
Оценка аффинности - 26A11.v1, 7A6.v1 и 47H4.v1 оценивали с использованием ELISA со связыванием клеток и посредством поверхностного плазмонного резонанса (таблица 1). Эти анализы показали, что пересаженные CDR обладали аффинностью, в значительной степени сходной с соответствующими им гибридомными антителами.
Устранение потенциальных участков дезамидации и образования изоаспарагиновой кислоты в CDR-L1 26A11 и 47H4 - Для избежания возможных проблем при изготовлении потенциальные участки образования изоаспарагиновой кислоты Asn28-Gly29 в CDR-L1 47H4.v1 и Asn31-Ser32 в CDR-L1 26A11.v1 устраняли посредством исследования остатков, находящихся в этих положениях в других антителах (фиг.6A, 6C, таблица I). Было выявлено, что замены Gly29 на Ala29 в CDR-L1 47H4.v1 (47H4.v2 и 47H4.v5) и Ser32 на Tyr32 в CDR-L1 26A11 (26A11.v3 и 26A11.v6) или Ala32 (26A11.v2 или 26A11.v5) являются пригодными заменами. Кроме того, замена Asn31 либо на Ser31 (26A11.v13 или 26A11.v15) или Gln31 (26A11.v14 или 26A11.v16) также служила для устранения потенциальной дезамидации и образования изоаспарагиновой кислоты и привела к кандидатам с аффинностью, сходной с соответствующими им гибридомными антителами.
Потенциального окисления Met34 в CDR-H1 либо 26A11.v1, либо 47H4.v1 избегали заменой этого остатка на Ile34 в обоих антителах без влияния на связывание М1'.
ПРИМЕР 3
Специфичность Ab против M1'
Специфичность клонов антител против IgE/М1' тестировали на линии B-клеток человека BJAB (ATCC Manassas, VA, #HB-136), трансфицированной IgE с последовательностью М1' ("длинная форма") или IgE, лишенным последовательности М1' ("короткая форма"). Клеточные линии BJAB с IgE получали посредством ретровирусной трансдукции клеток BJAB с использованием экспрессирующего вектора pMSCV (Washington University, St. Louis, MO). кДНК полноразмерных тяжелой и легкой цепей B-клеточного рецептора человека для IgE получали из миеломной клеточной линии с IgE U266 человека (ATCC, Manassas, VA, TIB#196) и субклонировали в ретровирусный вектор в сочетании с IRES (Internal Ribosomal Entry Sequence) для обеспечения бицистронной котрансфекции и коэкспрессии тяжелой и легкой цепей антитела. Дополнительное описание способа ретровирусной трансдукции предоставлено ниже.
Упаковочные клетки PG13 (ATCC CRL-10686) высевали на 10-см планшет для культивирования тканей в количестве 2×106 клеток на планшет (DMEM с высоким содержанием глюкозы, 10% FBS, пенициллин, стрептомицин, 2 мМ L-глутамин) в течение 24 часов. Клетки трансфицировали ДНК-конструкциями pMSCV с использованием FuGENE6 и культивировали в течение 2 суток при 37°C, 5% CO2. Супернатант клеточной культуры, содержащий ретровирусные частицы, собирали и фильтровали через фильтр с размером пор 0,4 микрон. Добавляли стерильный сульфат протамина до конечной концентрации 10 мкг/мл, и 4 мл супернатанта использовали для инфицирования приблизительно 1×106 клеток BJAB посредством проведения инфицирования при вращении при 32°C в течение 90 минут, с последующим продолжающимся культивированием в ретровирусном супернатанте в течение 3-4 часов при 37°C в 5% CO2. Инфицированные клетки BJAB выделяли, переносили в клеточную культуральную среду RPMI (RPMI, 10% FBS (Hyclone, Logun, UT, #SH30071.03), пенициллин, стрептомицин, 2 мМ L-глутамин) и подвергали размножению для сортировки. Положительно трансфицированные клетки идентифицировали проточной цитометрией с использованием антитела против IgE человека MAE11 (Genentech) для детекции поверхностных IgE.
Антитела против IgE/М1' являются специфичными к длинной форме, но не к короткой форме мембранных IgE, как определяют по окрашиванию при проточной цитометрии клеточных линий BJAB с короткой и длинной формами IgE. В качестве положительного контроля использовали антитело против IgE человека (Mae11) (Genentech, Inc.) вследствие его способности связываться как с длинной, так и с короткой формой IgE. В качестве изотипических контролей использовали антитела mIgG1 к gp120 или антитела mIgG2a к белкам пыльцы (Genentech, Inc).
Клетки BJAB выращивали в RPMI 10% FBS (Hyclone, Logun, UT, #SH30071.03), пенициллин/стрептомицин, 2 мМ L-глутамин (Genentech, Inc.). Клетки 0,5×106 BJAB-Long или BJAB-short блокировали сывороткой мыши (10 мкл) (VWR, #RLD 108-0100) и человека (10 мкл) (Sigma, St. Louis, MO, #S-2257) в течение 15 минут на льду в 100 мкл буфера для промывания FACs (2% FBS в 1X PBS (Genentech, Inc.)). Затем клетки окрашивали 1 мкг/мл каждого антитела против M1' в течение дополнительных 20 минут на льду, а затем промывали 1 мл буфера для промывания FACs и центрифугировали при 1200 об/мин в течение 5 минут. Клетки ресуспендировали в 100 мкл буфера для промывания FACs, а затем окрашивали антителами козы против IgG-PE мыши (5 мкл) (Caltag/Invitrogen, Carlsbad, CA, #M30004-4) на льду в течение 20 минут. Клетки промывали, как указано выше, и ресуспендировали в 1 мл буфера для промывания FACs для анализа на устройстве FACs Calibur (BD, Inc, Franklin Lakes, NJ). Все протестированные антитела были специфичны к длинной форме IgE и не связывали клетки BJAB-IgE/короткая форма на уровне, превышающем изотипический контроль. Наблюдали широкий диапазон относительной аффинности на основе интенсивности окрашивания.
Также авторы настоящего изобретения оценивали связывание антитела против M1' с клеточной линией U266 (ATCC, Manassas, VA, #TIB196), которая естественным образом экспрессирует низкий уровень IgE человека, содержащих М1', на клеточной поверхности. Клетки U266 поддерживали при высокой плотности (1-2×106/мл) в среде для гибридомы [RPMI 1640, 15% эмбриональная телячья сыворотка, 2 мм L-глутамин, 10 мМ HEPES, 4,5 г/л глюкоза, 1,5 г/л бикарбонат]. Клетки U266 окрашивали антителами против M1' в концентрации 1 мкг/мл. 47H4, 47G4 и 42A5 окрашивали U266 на уровнях, сходных с Mae11. Антитела 42H4, 45C1 и 28E9 окрашивали U266 на очень низких уровнях. 7A6, 1C11, 26A11, 51D2 и 26B11 не окрашивали U266 (фиг.2C).
ПРИМЕР 3A
Специфичность связывания антител против IgE/М1' мыши
На фиг.2D-F представлено связывание мышиных антител 47H4, 26A11 и 7A6 против IgE/М1' с коллекцией клеточных линий, которые экспрессируют IgE/М1' человека, макака-резус и яванского макака.
Специфичность клонов антител против IgE/М1' тестировали на линии B-клеток человека BJAB (ATCC Manassas, VA, #HB-136) и Daudi (ATCC #CCL-213), инфицированных ретровирусом для экспрессии длинной формы IgE с последовательностью М1' или короткой формы IgE, лишенной последовательности М1'. Клетки BJAB выращивают в RPMI 10% FBS (Hyclone, Logun, UT, #SH30071.03), пенициллин/стрептомицин, 2 мМ L-глутамин (Genentech, Inc.). 0,5×106 клеток BJAB-Long или BJAB-short блокировали сывороткой мыши (10 мкл) (VWR, #RLD 108-0100) и человека (10 мкл) (Sigma, St. Louis, MO, #S-2257) в течение 15 минут на льду в 100 мкл буфера для промывания FACs (2% FBS в IX PBS (Genentech, Inc.)). Затем клетки окрашивали 1 мкг/мл каждого антитела против M1' в течение дополнительных 20 минут на льду, а затем промывали 1 мл буфера для промывания FACs и центрифугировали при 1200 об/мин в течение 5 минут. Клетки ресуспендировали в 100 мкл буфера для промывания FACs, а затем окрашивали антителами козы против IgG-PE мыши (5 мкл) (Caltag/Invitrogen, Carlsbad, CA, #M30004-4) на льду в течение 20 минут. Клетки промывали, как указано выше, и ресуспендировали в 1 мл буфера для промывания FACs для анализа на устройстве FACs Calibur (BD, Inc, Franklin Lakes, NJ). Все протестированные антитела были специфичны к длинной форме IgE и не связывали клетки BJAB-IgE/короткая форма на уровне, превышающем изотипический контроль. Наблюдали широкий диапазон относительной аффинности на основе интенсивности окрашивания.
Специфичность клонов антител против IgE/М1' тестировали на линии B-клеток человека Daudi, инфицированной ретровирусом для экспрессии мембранных IgE с последовательностью М1' (длинная форма) или мембранных IgE, лишенных последовательности М1' (короткая форма). Антитела против IgE/М1' (47H4, 26A11, 7A6) являются специфичными к длинной форме, но не к короткой форме (фиг.2D). Антитело mIgG1 против gp120 использовали в качестве изотипического контроля (Genentech, Inc).
Линию B-клеток человека Daudi трансдуцировали ретровирусом, содержащим кассету IgE человека/М1' приматов IgE/М1' либо макака-резус, либо яванского макака, либо человека. После трансдукции клетки, экспрессирующие IgE/М1' человека, макака-резус и яванского макака, сортировали сортером FACs до >98% чистоты посредством 3-4 сортировок.
На фиг.2F представлена способность антител против IgE/М1' связывать М1' макака-резус и яванского макака. 47H4 и 7A6 связывают М1' как макака-резус, так и яванского макака, а 26A11 связывает только М1' макака-резус.
В дополнение к трансфектантным клеточным линиям Daudi, авторы настоящего изобретения оценивали связывание антитела против IgE/М1' с U266, миеломной клеточной линии с IgE человека (ATCC, Manassas, VA, #TIB196). Клетки U266 поддерживали при высокой плотности (1-2×106/мл) в среде для гибридомы [RPMI 1640, 15% эмбриональная телячья сыворотка, 2 мМ L-глутамин, 10 мМ HEPES, 4,5 г/л глюкоза, 1,5 г/л бикарбонат]. Клетки U266 окрашивали антителами против M1' в концентрации 1 мкг/мл. Антитело против IgE/М1' 47H4 связывало U266, а 26A11 и 7A6 не связывали их (фиг.2E).
ПРИМЕР 3B
Специфичность связывания гуманизированных антител против IgE/М1'
В примере 3B показано связывание гуманизированных антител против IgE/М1' с коллекцией клеточных линий, которые экспрессируют IgE/М1' человека, макака-резус и яванского макака.
С использованием указанных линий B-клеток человека Daudi или BJAB, сверхэкспрссирующих М1' человека, макака-резус и яванского макака, рассмотренных в примере 3A, тестировали специфичность клонов гуманизированных антител против IgE/М1' на линии B-клеток Daudi, инфицированной ретровирусом для экспрессии длинной формы IgE с последовательностью М1' или короткой формы IgE, лишенной последовательности М1'. Гуманизированные антитела против IgE/М1' (47H4v5, 26A11v6, 7A6v1) являются специфичными к длинной форме, но не к короткой форме (без М1') [Фиг.2G]. В качестве изотипического контроля использовали MAb huIgG1 против Her2 HERCEPTIN® (Genentech, Inc.). Кроме того, гуманизированные антитела против IgE/М1' (47H4v5 и 26A11v6) связываются с клеточными линиями U266 (фиг.2H).
На фиг.2I показана способность гуманизированных антител против IgE/М1' связывать М1' как макака-резус, так и яванского макака. Оба антитела 47H4v5 и 7A6v1 связывают М1' как макака-резус, так и яванского макака, а 26A11v6 связывает только М1' макака-резус.
ПРИМЕР 4
Относительная аффинность связывания антител против M1'
Авторы настоящего изобретения наблюдали широкий диапазон интенсивностей связывания антитела против IgE/М1' в концентрации 1 мкг/мл. Для оценки относительной аффинности этих антител к рецептору длинной формы IgE, авторы настоящего изобретения окрашивали клетки BJAB-Long серией разведений антитела против M1' (1, 0,1, 0,01, 0,001 мкг/мл). Клетки BJAB-Long блокировали сывороткой мыши и человека (10 мкл) в течение 20 минут на льду. Клетки окрашивали соответствующим количеством антитела против М1' или изотипическими контролями в виде mIgG1 против gpl20 или mIgG2a против белков пыльцы в течение последующих 20 минут. Затем клетки промывали буфером для промывания FACs (1 мл), центрифугировали (1200 об/мин в течение 5 минут), а затем ресуспендировали в 100 мкл буфера для промывания FACs с антителом козы против IgG-PE мыши (5 мкл) (CALTAG/Invitrogen, Carlsbad, CA #M30004-4) для детекции. Клетки снова промывали, как указано выше, а затем анализировали на устройстве FACs Calibur (BD, Inc, Franklin Lakes, NJ). Установка напряжения была основана на 0,001 мкг/мл изотипического контроля. Из этих результатов антитела-кандидаты против IgE/М1' располагали в соответствии с относительной аффинностью связывания: 42H4>7A6, 47H4, 47G4>42A5, 26A11, 45C1>51D2, 26B11>1C11>28E9.
В дополнение к определению относительной аффинности титрованием антитела и детекцией посредством FACs, авторы настоящего изобретения также определяли аффинность выбранных антител против M1' к клеточным линиям BJAB, экспрессирующим длинную форму IgE с использованием анализа Скэтчарда. Клетки BJAB-Long получали для связывания в холодном буфере для связывания, состоящем из основной среды с 10 мМ HEPES pH 7,4, и 2% FBS, а также с 40 мкг/мл IgG человека. Клетки разбавляли до концентрации 1,7×106 клеток/мл и держали на льду до добавления в анализируемую смесь. Антитела йодировали способом с йодогеном. Получали различные концентрации немеченого антитела в трех экземплярах с использованием разведения 1:2, начиная с насыщающей концентрации и заканчивая концентрацией, равной нулю, всего с 14 концентрациями. Ко всем разведениям конкурентного немеченого антитела добавляли йодированное антитело в одной концентрации. Наконец, к каждой смеси йодированного и немеченого антитела добавляли 250000 клеток BJAB-Long. Образцы инкубировали при 4ºC в течение 4 часов при встряхивании. Затем каждый образец собирали и фильтровали на мембране, промывали по меньшей мере 3 раза буфером для промывания, позволяли высохнуть, а затем подвергали измерению в течение 1 минуты с использованием автоматического гамма-счетчика Perkin Elmer Wizard 1470 Auto Gamma Counter.
ПРИМЕР 4A
Аффинность Скэтчарда антител против IgE/М1' мыши
Получали клетки BJAB или Daudi, экспрессирующие различные формы IgE с М1' (человека, макака-резус, яванского макака) или без него для связывания в холодном буфере для связывания, состоящем из основной среды с 10 мМ HEPES pH 7,4, и 2% FBS, а также 40 мкг/мл IgG человека. Клетки разбавляли до концентрации 1,7×106 клеток/мл и держали на льду до добавления их в анализируемую смесь. Белки/антитела йодировали способом с йодогеном. Получали различные концентрации холодного белка в трех экземплярах с использованием разведения 1:2, начиная с насыщающей концентрации и заканчивая концентрацией, равной нулю, всего с 14 концентрациями. Ко всем разведениям добавляли горячий белок в одной концентрации для конкуренции с холодным белком. В конце к смеси горячего и холодного белков добавляли клетки, использовали 250000 клеток на образец. Анализируемую смесь держали при 4°C в течение 4 часов при встряхивании. Затем каждый образец собирали и фильтровали на мембране, промывали по меньшей мере 3 раза буфером для связывания, позволяли высохнуть, а затем подсчитывали в течение 1 минуты с использованием автоматического гамма-счетчика Perkin Elmer Wizard 1470 Auto Gamma Counter.
На фиг.3O обобщенно представлены аффинности антител против M1' мыши, измеренные анализом Скэтчарда. Антитело мыши mIgG1 47H4 связывало М1' человека, макака-резус, яванского макака с аффинностью 0,79, 0,77 и 0,97 нМ, соответственно. Антитела мыши mIgG1 26A11 и mIgG1 7A6 связывали М1' человека с аффинностью 2,3 и 0,64 нМ соответственно.
На фиг.3P обобщенно представлены аффинности связывания гуманизированных антител против IgE/М1' к М1' человека, макака-резус и яванского макака. Гуманизированное антитело huIgG1 47H4v5 связывало М1' человека, макака-резус и яванского макака с аффинностью 1,5, 1,3 и 2,5 нм соответственно. Гуманизированные антитела 47H4v2, 47H4v1, 26A11v6, 26A11v14 и 26A11v1 связывали М1' человека с аффинностью 0,54, 0,37, 1,85, 1,5 и 1,06 соответственно.
ПРИМЕР 5
Исследования связывания/блокирования эпитопа антителом против IgE/М1'
Исследования блокирования проводили для антител-кандидатов против IgE/М1' в целях определения перекрывающихся или отличающихся эпитопов для связывания. Когда блокирующие и осуществляющие детекцию антитела имели различный изотип (т.е. IgG1 относительно IgG2a), эти отличия в изотипах исследовали для определения степени блокирования посредством детекции с помощью изотип-специфичного вторичного антитела (CALTAG/Invitrogen, Carlsbad, CA, антитело козы против IgG1-PE мыши #32004, или антитело козы против IgG2a мыши #M32204). Когда блокирующие и связывающие антитела имели один изотип, антитела конъюгировали с биотином (Pierce, Rockford, IL, EZ-link-sulfo-NHS-LC-Biotin #CAS 127062-220) и подвергали детекции с помощью стрептавидин-PE (BD #554061), или конъюгировали с Alexa-647 (Molecular Probes/Invitrogen, Carlsbad, CA, #A20173). Исходно блокирующие и осуществляющие детекцию антитела использовали в соотношении 1:1 (10 мкг/мл) (фиг.4A-4B). Сочетания антител, которые исходно не осуществляли блокирование или осуществляли только частичное блокирование, далее тестировали с использованием блокирования 10:1 для детекции соотношения антител. Клетки BJAB-Long блокировали сывороткой мыши и человека (как описано выше), а затем окрашивали блокирующим антителом (10 мкг/мл) в буфере для промывания FACs (2% FBS/1X PBS) в течение 20 минут на льду. Клетки промывали в буфере для промывания FACs, а затем окрашивали антителом для детекции в соотношении 1:1 (10 мкг/мл) или 10:1 (1 мкг/мл) в течение 20 минут на льду. Клетки снова промывали, как указано выше, а затем анализировали на устройстве FACS Calibur (BD, Inc, Franklin Lakes, NJ). Окрашенные клетки сравнивали с изотипическим контрольным антителом, представляющим собой либо mIgG1 против gpl20 (Genentech, Inc.), либо mIgG2a против белков пыльцы (Genentech, Inc.) (фиг.4C). Для сравнения, полное блокирование определяли посредством окрашивания тем же неконъюгированным антителом, когда это было возможно.
Исследования блокирования выявили три основные связывающие группы: A, B и C. Группу A далее подразделяли на две группы: A1 (47H4, 47G4, 42H4, 42A5) и A2 (45C1, 51D2, 26A11), исходя из частично перекрывающихся эпитопов (фиг.4D). Группа C (26B11) имела очень небольшое перекрывание с другими антителами-кандидатами. Три кандидата перекрывались более широко, чем другие. Оказалось, что 1C11 имеет перекрывающееся связывание с группой A1 и A2, и оно только частично блокировалось группой B (28E9). 7A6, главным образом, относится к группе A1, однако, оно частично взаимодействовало с кандидатами из группы A2. 28E9 относится к группе, состоящей только из него. 28E9 только частично взаимодействовало с кандидатами из группы A2.
ПРИМЕР 5A
Картирование эпитопа
На фиг.5A-E показаны исследования связывания эпитопов, проводимые с использованием антител против IgE/М1'. Антитела мыши 47H4, 7A6 и 26A11 представлены на фиг.5B и 5D, а гуманизированные варианты 47H4v5, 7A6v1 и 26A11v6 представлены на фиг.5C и 5E.
Исследования картирования эпитопа: кандидаты мыши
Получали 15 пептидов, охватывающих последовательность, окружающую и включающую М1' человека (Clifford Quan) (фиг.5A). Пептиды ресуспендировали либо в dH20, либо в 50% DMSO. Пептиды наносили на 96-луночные планшеты (планшеты для ELISA с высокой способностью связывать белок NUNC Maxisorp #44-2404) в количестве 1 мкг/мл в буфере для нанесения (0,05 M карбонат/бикарбонат (pH 9,6) (100 мкл на лунку). В качестве положительного контроля связывания использовали слитый белок М1'-Fc. Отрицательные контроли включали лунки, на которые было нанесено IgE человека (U266), и непокрытые лунки. Пептидам давали покрыть лунки в течение ночи при 4°C. На следующее утро планшеты промывали 3 раза буфером для промывания (PBS/0,05% Tween-20 (pH 7,4)). Затем планшеты блокировали в блокирующем буфере (PBS, 0,5% BSA (pH 7,4)) в течение 1 часа при осторожном встряхивании. Получали разведения антител (40 нг/мл и 1 нг/мл), подлежащих тестированию (mIgG1 47H4, huIgG1 47H4v5, mIgG1 26A11, huIgG1 26A11v6, mIgG1 7A6, huIgG1 7A6v1) в буфере Magic Buffer [PBS (pH 7,4), 0,5% BSA, 0,05% Tween-20, 10 м.д. Proclin., 0,2% BgG, 0,25% Chaps, 5 мМ EDTA, 0,35M NaCl]. Антитела mIgG1 против gp120 и HERCEPTIN® huIgG1 использовали в качестве контролей для антител против IgE/М1' мыши и человека соответственно. После достаточного блокирования планшетов (0,5% BSA/1X PBS) планшеты промывали 3 раза, а затем в планшет добавляли антитела в трех экземплярах (100 мкл на лунку). Затем планшеты инкубировали в течение 2 часов при комнатной температуре. Планшеты с антителом мыши промывали 3 раза, а затем добавляли антитело против IgG1 мыши-биотина (BD Biosciences (A85-1) #553441) (1:10000, 100 мкл на лунку) и инкубировали в течение 1 часа при комнатной температуре (RT). После 3 промываний добавляли SA-HRP (BD Biosciences #554066) (1:20000, 100 мкл на лунку) и инкубировали в течение 1 часа. Планшеты с антителом IgG1 человека промывали, как указано выше, и добавляли антитело против huIgG.Fc-HRP (Jackson ImmunoResearch (#109-036-098)) (1:10000, 100 мкл на лунку), и инкубировали в течение 1 часа при RT. После завершения вторичных инкубаций планшеты промывали 6 раз и добавляли субстрат TMB (BD OptEIA #555214) (100 мкл на лунку). Реакцию субстрат-HRP останавливали 1M H3PO4 через ~4 минут. Затем проводили считывание планшетов при 450/650. Данные представляли в качестве относительной OD (OD450/CD650).
На фиг.5B и 5D представлено связывание мышиных антител-кандидатов 26A11, 7A6 и 47H4 против IgE/М1' с пептидами М1'. Связывание этих кандидатов коррелирует с группами эпитопов, определенных в исследованиях блокирования антитела. mIgG1 47H4 связывало пептид 4 (SAQSQRAPDRVLCHS) (SEQ ID NO:8). mIgG1 7A6 связывало пептиды 4 (SAQSQRAPDRVLCHS) (SEQ ID NO:8) и 5 (RAPDRVLCHSGQQQG) (SEQ ID NO:9). mIgG1 26A11 связывало пептиды 7 (GQQQGLPRAAGGSVP) (SEQ ID NO:11) и 8 (PRAAGGSVPHPRCH) (SEQ ID NO:12).
На фиг.5C и 5E представлено связывание гуманизированных антител против IgE/М1' с пептидами М1'. Картирование эпитопа проводили, как описано выше, для соответствующих антител мыши, за исключением того, что использовали отличающееся вторичное антитело. Планшеты с антителом IgG1 человека промывали, как указано ранее, и добавляли вторичное антитело IgG.Fc-HRP (Jackson ImmunoResearch (#109-036-098) (1:10000, 100 мкл на лунку), и инкубировали в течение 1 часа при RT. Связывание эпитопов соответствовало связыванию, наблюдаемому для исходных антител мыши. 47H4v5 связывало пептид 4 (SAQSQRAPDRVLCHS) (SEQ ID NO:8). 7A6v1 связывало пептиды 4 (SAQSQRAPDRVLCHS) (SEQ ID NO:8) и 5 (RAPDRVLCHSGQQQG) (SEQ ID NO:9). mIgG1 26A11 связывало пептиды 7 (GQQQGLPRAAGGSVP) (SEQ ID NO:11) и 8 (PRAAGGSVPHPRCH) (SEQ ID NO:12).
ПРИМЕР 6
Индукция апоптоза антителом против IgE/М1' мыши в клетках Daudi-IgE/Long
Клетки Daudi-Long (IgE/М1') использовали для тестирования эффекта перекрестного сшивания поверхностных IgE на индукцию апоптоза. Клетки Daudi (ATCC, Manassas, VA, #CCL-213) представляют собой клеточную линию лимфомы Беркитта, известную тем, что она чувствительна к апоптозу в ответ на перекрестное сшивание BCR. Клетки Daudi, экспрессирующие длинную форму IgE, получали посредством ретровирусной трансдукции тяжелой и легкой цепей U266 IgE с М1', как описано выше для получения клеток BJAB с длинным IgE. Анализ проточной цитометрией клеток Daudi-IgE/Long с использованием антител против эндогенного IgM и трансфицированного B-клеточного рецептора IgE показал более высокую экспрессию IgM, чем IgE. Апоптоз клеток Daudi-IgE/Long исследовали в клетках, культивированных до плотности 0,2×106/1,5 мл в культуральной среде [RPMI, 10% FBS (Hyclone, Logun, UT, #SH30071.03), пенициллин/стрептомицин (Gibco/Invitrogen, Carlsbad, CA #15140-122), 2 мМ глутамин (Genentech, Inc.), 10 мМ HEPES (7,2) (Genentech, Inc.), 1 мМ пируват Na (Gibco/Invitrogen, Carlsbad, CA #11360), 1,59 г/л раствор бикарбоната натрия (Gibco/Invitrogen, Carlsbad, CA #25080-094)]. Перед началом анализа апоптоза, погибшие клетки удаляли посредством градиента фиколла (GE Healthcare #17-1440-03) для снижения фоновых уровней погибших клеток в анализе. 0,2×106 клеток культивировали в трех экземплярах с антителами против M1' или контрольными антителами в растворе в течение 72 часов. Затем клетки собирали и анализировали в отношении уровней апоптоза с использованием набора Annexin V-FITC Apoptosis Detection Kit I (BD Biosciences, San Jose, CA #556547). Клетки промывали два раза холодным PBS (Genentech, Inc.), а затем ресуспендировали в 100 мкл 1X буфера для связывания (0,1M Hepes/NaOH (pH 7,4), 1,4M NaCl, 25 мМ CaCl2) (BD Biosciences, San Jose, CA, #51-66121E). Затем клетки окрашивали 2,5 мкл антителом к аннексину V-FITC (BD Biosciences, San Jose, CA #51-65874X) и 5 мкл йодида пропидия (PI) (BD Biosciences, San Jose, CA #51-6621 IE) в темноте. Через 15 минут в каждую пробирку добавляли 400 мкл 1X буфера для связывания, и клетки анализировали на устройстве для проточной цитометрии FACs Calibur (BD, Inc. Franklin Lakes, NJ). Для каждого образца получали приблизительно 10-20000 результатов. Погибающие клетки определяли как положительные по аннексину V и отрицательные по PI. Погибшие клетки являются положительными как по аннексину V, так и по PI. Процентное количество каждой популяции (погибших и погибающих) вычисляли с использованием программного обеспечения для анализа FlowJo FACs (Tree Star, Inc., Ashland, Oregon). Данные для трех экземпляров усредняли и вычисляли стандартные отклонения. Процентный апоптоз вычисляли как суммы погибших и погибающих клеток и наносили на график с использованием Excel (Microsoft, Inc.).
В качестве положительных контролей для индукции апоптоза в клеточной линии Daudi-IgE/Long использовали камптотецин (Sigma- Aldrich, St. Louis, MO, #C9911 - 100 мг) и антитело против IgM (JacksonImmuno Research, West Grove, PA, #109-006-120). В качестве отрицательных контролей для этого анализа использовали антитела mIgG1 против gp120 или mIgG1 против белков пыльцы (Genentech, Inc.). Клетки Daudi-IgE/Long культивировали с диапазоном концентраций антител против IgE/М1' или изотипических контрольных антител (25, 10, 1, 0,1, 0,01, 0,001 мкг/мл). Тестируемые антитела против IgE/М1' представляли собой 7A6, 47H4, 47G4, 42A5, 42H4, 1C11, 26A11, 51D2, 45C1, 26B11 и 28E9 (Genentech, Inc.). Также для сравнения использовали антитело против IgE человека (Mae11-mIgG1).
Изотипические контрольные антитела против gp120 и против белков пыльцы не индуцировали апоптоз на уровне, превышающем необработанные клетки. Фоновые уровни апоптоза находились в диапазоне 10-15% для каждого эксперимента. Антитела против IgE/М1' 7A6 (>10 мкг/мл), 47H4 (>10 мкг/мл) и 47G4 (25 мкг/мл) индуцировали апоптоз клеток Daudi с длинным IgE. 26A11 индуцировало апоптоз со сходными показателями (~30-50%), однако при значительно более низких концентрациях (>0,1 мкг/мл). 42A5, 51D2, 45C1, 26B11 и 28E9 не индуцировали апоптоз выше фоновых уровней. Mae11 также не индуцировало апоптоз выше фоновых уровней.
Также авторы настоящего изобретения проводили анализ апоптоза в присутствии вторичного антитела козы против F(ab')2 IgG мыши (Jackson ImmunoResearch, West Grove, PA #115-006-062) для сверхперекрестного связывания B-клеточного рецептора для IgE на клеточной линии Daudi. Эксперименты по перекрестному связыванию проводили в присутствии антитела козы против F(ab')2 IgG мыши (30 мкг) (JacksonImmuno Research, West Grove, PA, #115-006-062). За исключением 26B11 (30%) все антитела индуцировали максимальные уровни апоптоза 70-80%, однако, в различных концентрациях. Эти антитела можно подразделить на две группы. 7A6, 1C11, 26A11, 51D2, 45Cl и 28E9 индуцировали максимальный апоптоз при наиболее высоких концентрациях. Другая группа 47H4, 47G4, 42A5 и 42H4, и MAE11 проявляла сниженный апоптоз при более высоких концентрациях.
ПРИМЕР 6A
Индукция апоптоза гуманизированными антителами против IgE/М1' в клетках Daudi/длинный IgE
Клетки Daudi-Long (IgE/М1') использовали для тестирования эффекта перекрестного связывания поверхностного IgE на индукцию апоптоза в этой клеточной линии. Клетки Daudi (ATCC, Manassas, VA, #CCL-213) представляют собой клеточную линию лимфомы Беркитта человека, известную тем, что она чувствительна к апоптозу в ответ на перекрестное связывание BCR. Клетки Daudi-IgE/Long культивировали с плотностью 0,2x106/1,5 мл в культуральной среде [RPMI, 10% FBS (Hyclone, Logun, UT, #SH30071.03), пенициллин/стрептомицин (Gibco/Invitrogen, Carlsbad, CA #15140-122), 2 мМ глутамин (Genentech, Inc.), 10 мМ HEPES (7,2) (Genentech, Inc.), 1 мМ пируват Na (Gibco/Invitrogen, Carlsbad, CA #11360), 1,59 г/л раствор натрия бикарбонат (Gibco/Invitrogen, Carlsbad, CA #25080-094)] в течение предшествующей ночи, а затем погибшие клетки удаляли с помощью градиента фиколла (GE Healthcare #17-1440-03) на следующие сутки. Это снижало фоновые уровни гибели клеток в анализе. 0,2×l06 клеток культивировали в трех экземплярах с антителами против M1' и без них или с контрольными антителами в растворе в течение 72 часов. Затем клетки собирали и анализировали в отношении уровней апоптоза с использованием Annexin V-FITC Apoptosis Detection Kit I (BD Biosciences, San Jose, CA #556547). Клетки промывали два раза в холодном PBS (Genentech, Inc.), а затем ресуспендировали в 100 мкл 1X буфера для связывания (0,1M Hepes/NaOH (pH 7,4), 1,4M NaCl, 25 мМ CaCl2) (BD Biosciences, San Jose, CA, #51-66121E). Затем клетки окрашивали 2,5 мкл антитела к аннексину V-FITC (BD Biosciences, San Jose, CA #51-65874X) и 5 мкл йодида пропидия (PI) (BD Biosciences, San Jose, CA #51-66211E) в темноте. Через 15 минут в каждую пробирку добавляли 400 мкл 1X буфера для связывания, и клетки анализировали на устройстве для проточной цитометрии FACs Calibur (BD, Inc. Franklin Lakes, NJ). Для каждого образца получали приблизительно 10-20000 результатов. Погибающие клетки определяли как положительные по аннексину V и отрицательные по PI. Погибшие клетки являются положительными как по аннексину-V, так и по PI. Процентное количество каждой популяции (погибших и погибающих) вычисляли с использованием программного обеспечения FlowJo FACs (Tree Star, Inc., Ashland, Oregon). Данные от трех экземпляров усредняли и вычисляли стандартные отклонения. Процентный апоптоз вычисляли как суммы погибших и погибающих клеток и наносили на график с использованием Excel (Microsoft, Inc.).
Антитело против IgM (JacksonImmuno Research, West Grove, PA, #109-006-120) использовали в качестве положительного контроля для индукции апоптоза в клеточной линии Daudi-IgE/Long. В качестве отрицательного контроля для этого анализа использовали huIgG1 HERCEPTIN® (Genentech, Inc.). Клетки Daudi-IgE/Long культивировали с диапазоном концентраций антител против IgE/М1' или изотипических контрольных антител (25, 10, 1, 0,1, 0,01, 0,001 мкг/мл). Эксперименты по вторичному поперечному связыванию проводили в присутствии антитела козы против F(ab')2 IgG человека (50 мкг) (Biosource #AHI1301). Тестируемые антитела против IgE/М1' представляли собой 47H4v5, 26A11v6, huIgG1 7A6v1.
Изотипический контрольный huIgG1 HERCEPTIN® не индуцировал апоптоз на уровне, превышающем уровень необработанных клеток. Фоновые уровни апоптоза находились в диапазоне 10-15% для каждого эксперимента. Антитела против IgE/М1' 47H4v5, 26A11v6 и 7A6v1 индуцировали апоптоз в диапазоне 30-40% (фиг.8A).
Авторы настоящего изобретения повторили указанные анализы в присутствии вторичного антитела козы против F(ab')2 IgG человека (Biosource #AHI1301) для перекрестного связывания рецептора IgE на клеточной линии Daudi. Все антитела индуцировали максимальные уровни апоптоза 70-90%, с некоторым снижением апоптотической активности при высоких концентрациях первичного антитела против IgE/М1' (фиг.8B).
47H4v5 дикого типа против афукозилированного 47H4v5 при индукции апоптоза без вторичного перекрестного связывания.
Афукозилированный вариант (AF) 47H4v5 получали с использованием клеточных линий BIOWA (Genentech, Inc.). Как вариант WT (дикий тип), так и вариант AF 47H4v5 были способны индуцировать апоптоз на сходных уровнях (фиг.8C).
Таблица 1
Аффинности связывания гуманизированного антитела против IgE/М1'

ПРИМЕР 7
Индуцированный поток кальция
Авторы настоящего изобретения исследовали способность антител против M1' индуцировать поток кальция в клетках Daudi-IgE/Long в качестве доказательства того, что эти антитела могут индуцировать клеточную передачу сигнала ниже B-клеточного рецептора для IgE. Клетки Daudi (ATCC, Manassas, VA, #CCL-213), которые сверхэкспрессируют длинную форму IgE/М1', культивировали в течение ночи при небольшой плотности 0,2×106/мл. На следующее утро погибшие клетки удаляли посредством градиента фиколла (GE Healthcare #17-1440-03). Клетки нагружали большой партией Indo-1 для обеспечения равномерной нагрузки для всех стимулов. Клетки ресуспендировали в количестве 5×106/мл в культуральной среде (RPMI-10% FBS (Hyclone), пенициллин/стрептомицин, 2 мМ L-глутамин) и комбинировали с красителем для детекции кальция Indo-1 (5 мкМ) (Molecular probes/Invitrogen, Carlsbad, CA, #11223). Затем клетки промывали в культуральной среде и ресуспендировали в количестве 106/мл. Использовали 106 клеток на стимул. Образцы нагревали на водяной бане при 37°C в течение 5 минут перед анализом на устройстве FACs Vantage machine (BD, Inc, Franklin Lakes, NJ). Образцы исходно анализировали в течение 1 минуты для получения исходного уровня, а затем стимулировали 20 мкг каждого антитела, за исключением антитела против IgM (10 мкг). Данные получали в течение 8-10 минут. Кинетический анализ проводили на программном обеспечении FlowJo FACs (Tree Star, Inc., Ashland, Oregon). Данные представлены в качестве отношения Indo-1 405 связанный/Indo-1 1530 свободный. Все антитела против M1' сравнивали с изотипическим контрольным mIgG1 против gp120 (20 мкг). В качестве положительных контролей использовали антитело против IgM (Jackson Immuno-Research, West Grove, PA, #109-005-129) и антитело против IgE (Mae11, Genentech, Inc.). 7A6, 47H4, 47G4, 26A11 и 1C11 индуцировали поток кальция в клетках Daudi с длинным IgE. 28E9 и 42A5 индуцировали низкие уровни потока кальция. 45C1, 26B11 и 51D2 не индуцировали поток кальция.
ПРИМЕР 8
Индукция ADCC антителом против IgE/М1' 47H4v5 wt и афукозилированным антителом
Антителозависимая клеточноопосредуемая токсичность обеспечивает связывание цитотоксических клеток (через антитело) с антигенсвязывающей клеткой-мишенью, а затем уничтожает клетку-мишень цитотоксинами. Антитела против IgE/М1', обладающие активностью ADCC или усиленной активностью ADCC, могут иметь повышенную терапевтическую ценность в отношении лечения опосредуемых IgE нарушений.
Было открыто, что антитела, продуцируемые в клетках млекопитающих, которые являются афукозилированными, обладают усиленной активностью ADCC. В представленном ниже эксперименте описана продукция афукозилированного антитела против IgE/М1'.
Клетки NK выделяли из 100 мл цельной крови (RosetteSep #15065, Stem Cell Technologies). Чистоту клеток NK определяли окрашиванием антителом против CD56 человека. В каждом анализе использовали на >70% чистые CD56+ NK-клетки. Антитела против IgE/М1' и изотипический контроль в виде huIgG1 MAb против Her2 HERCEPTIN® подвергали серийному титрованию. Эти антитела (50 мкл) инкубировали с клетками BJAB, сверхэкспрессирующими IgE/М1' человека на клеточной поверхности в течение 30 минут при комнатной температуре в RPMI-1640 (без фенолового красного) (BioWhitaker #12-918F) с 1% FBS (клеточную линию получали, как описано выше). Затем к клеточной линии добавляли NK-клетки (50 мкл) в соотношении 15:1 (150000 NK-клеток к 10000 мишеней (BJAB-Long)). Анализы осуществляли в трех повторах. Затем BJAB-huLong, антитела и NK-клетки инкубировали в течение 4 часов при 37°C. После культивирования 96-луночные планшеты с U-образным дном центрифугировали и супернатанты собирали (100 мкл). Затем супернатанты тестировали в отношении высвобождения LDH с использованием LDH reaction Assay (Roche #1644793). Мишень отдельно и лизированную мишень использовали для вычисления процентной цитотоксичности. Супернатанты инкубировали в равном объеме с реакционной смесью LDH, как описано изготовителем, в течение 30-60 минут. Затем проводили считывание планшетов при 490 нм. % Цитотоксичность вычисляли следующим образом: = (экспериментальное значение - мишень отдельно)/лизированная мишень - мишень отдельно). Данные наносили на график с использованием Kaleidagraph, и для получения значений ED50 использовали кривые наилучшего соответствия.
На фиг.10 показано, что изотипическое контрольное антитело huIgG1 HEREPTIN® индуцировало цитотоксичность на низком уровне. Антитела против IgE/М1' индуцировали специфичную цитотоксичность. Форма дикого типа и афукозилированная форма антитела против IgE/М1' 47H4v5 индуцировали сходную максимальную % цитотоксичность (~70-80%). Афукозилированное 47H4v5 было более эффективным, чем форма дикого типа (EC50 афукозилированного 47H4v5 составляла ~0,83 нМ; EC50 47H4v5 дикого типа составляла ~6,6 нМ).
ПРИМЕР 9
Эффект антител против IgE/М1' у мышей hu-SCID с атопией
На фиг.12A и 13A продемонстрирована способность антител против IgE/М1' (как антител мыши, так и гуманизированных, соответственно) ингибировать продукцию IgE в сыворотке и продуцирующих IgE плазматических клеток в модели атопии hu-SCID. В эксперименте 1 (#07-0377) тестировали антитела-кандидаты против IgE/М1', а в эксперименте 2 (#07-1232) тестировали антитело-кандидат против IgE/М1'.
Доноров подвергали скринингу в отношении сывороточных уровней IgE из собственной программы доноров крови авторов изобретения Leukopack. Отбирали двух доноров для предоставления клеток для модели hu-SCID атопии, которые идентифицировали себя как имеющие аллергию и имели уровни IgE в сыворотке 1696 и 1152 нг/мл. Нормальные доноры, как правило, имеют IgE в диапазоне от <100 до 300 нг/мл.
Эксперименты с hu-SCID представлены на фиг.12A и 13A. PBMC выделяли посредством лейкофореза и градиента в плотности фиколла (GE Healthcare #17-1440-03) и количественно определяли. 108 клеток PBMC (108 на 100 мкл) инъецировали внутрибрюшинно облученным мышам SCID-beige на нулевые сутки. Для направления ответа в сторону продукции IgE мышам вводили антитело против IFNγ (BD Biosciences, San Jose, CA, #554698) и антитело против IL12 (100 мкг/доза) (BD Biosciences, San Jose, CA, #554659) на 0 и 3 сутки; и rhIL-4 (100 нг/доза) (R&D Systems, Minneapolis, MN, #204-IL-010) на 2, 3, 4 сутки. Мышам вводили экспериментальные антитела (т.е. антитело против IgE/М1') три раза в неделю (приблизительно каждые трое суток), начиная с 0 суток до конца исследования. Клеткам человека позволяли размножаться между 7 и 14 сутками, после чего мышей подвергали эвтаназии. Образцы крови получали на 7 сутки и в конце исследования. На последние сутки эксперимента мышей подвергали эвтаназии и выделяли клетки селезенки. Для анализа IgE посредством Elispot и FACs использовали суспензии отдельных клеток для определения степени восстановления клеток человека и устранения плазматических клеток с IgE.
Данные представлены в качестве среднего значения ± стандартное отклонение. Значения P вычисляли с использованием статистического программного обеспечения JMP. Тест Даннетта сравнивает средние значения групп, где все тестируемые группы тестируют против группы сравнения. Каждый парный t-критерий Стьюдента сравнивает каждую пару групп с использованием t-критерия Стьюдента. Затем применяют поправку Бонферрони для коррекции значений p для каждого парного t-критерия Стьюдента для ограничения попарных сравнений. Порог для всех значений p составляет 0,05. Процентное изменение данных, представленное на фиг.12 A-I и 13 A-H, вычисляли между группой введения и контрольной группой без нормализации к исходным уровням.
Уровни свободных IgE определяли с использованием способа ELISA для человека, в котором на 384-луночные планшеты для ELISA Maxisorp (Nalge Nunc International, Rochester, NY) наносили 1 мкг/мл моноклонального антитела MAE11 в 50 мМ карбонатном буфере, pH 9,6, при 4°C в течение ночи и блокировали 0,5% бычьим сывороточным альбумином в PBS при комнатной температуре в течение 1 часа. Стандарты (0,098-12,5 нг/мл) и трехкратные серийные разведения образцов (минимальное разведение 1:10 для избежания какого-либо эффекта сыворотки) в PBS, содержащем 0,5% бычий сывороточный альбумин, 0,05% полисорбат 20, 10 миллионных долей Proclin 300 (Supelco, Bellefonte, PA), 0,25% CHAPS (Sigma, St. Louis, MO), 0,2% бычий глобулин g (Biocell, Rancho Dominguez, CA) и 5 мМ EDTA, инкубировали на планшетах при комнатной температуре в течение 1 часа. Детекцию связанных IgE проводили посредством инкубации меченного пероксидазой антитела козы против IgE человека (Kirkegaard & Perry Laboratories, Gaithersburg, MD) в лунках в течение 1 часа. Добавляли субстрат 3,3',5,5'-тетраметилбензидин (Kirkegaard & Perry Laboratories, Gaithersburg, MD) и реакцию останавливали добавлением 1M фосфорной кислоты. Между стадиями планшеты промывали. Поглощение считывали при 450 нм на устройстве для считывания Titertek stacker reader (ICN, Costa Mesa, CA). Стандартную кривую приводили в соответствие с использованием четерехпараметрической нелинейной регрессионной программы для подгонки кривых (разработанной в Genentech). Данные, которые попадали в линейный диапазон стандартной кривой, использовали для вычисления концентрации IgE в образцах.
Панель изотипов иммуноглобулинов человека получали получением моноклонального антитела мыши (mAb) к IgG1 человека (клон 2C11, Abeam Inc., Cambridge, MA), которое разбавляли до 4 мкг/мл в 0,05M натрий-карбонатном буфере, pH 9,6, и наносили на планшеты для ELISA (384-луночные планшеты с высоким связыванием, Greiner Bio One, Monroe, NC), инкубируя в течение ночи при 4°C. После промывания 3 раза буфером для промывания (PBS/0,05% Tween-20) планшеты блокировали смесью PBS/0,5% бычий сывороточный альбумин (BSA) в течение от 1 до 2 часов. Эту и все другие инкубации проводили при комнатной температуре на орбитальном устройстве для встряхивания. Образцы сыворотки мыши разбавляли 1:100 с последующими серийными разведениями 1:3 с использованием буфера для анализа (PBS/0,5% BSA/0,05% Tween 20/0,25% CHAPS/5 мМ EDTA/15PPM Proclin). С использованием того же буфера получали серийные разведения IgG1 для стандартной кривой (12,20-1560 нг/мл). Размораживали предварительно разбавленные замороженные контроли в высокой, средней и нижней областях стандартной кривой. После стадии блокирования планшеты промывали, и образцы, стандарты и контроли добавляли в 384-луночные планшеты и инкубировали в течение 2 часов. Планшеты промывали, и биотинилированное mAb мыши к IgG1 человека (Zymed Laboratories, South San Francisco, CA) разбавляли в буфере для анализа 1:500 и добавляли в промытые планшеты для инкубации в течение 1 ч. После промывания стрептавидин-пероксидазу хрена (SA-HRP) (GE Healthcare, Piscataway, NJ) разбавляли в 1:40000 в буфере для анализа и добавляли в планшеты. После инкубации в течение 30 мин и конечной стадии промывания добавляли тетраметилбензидин (TMB) (Kirkegaard & Perry Laboratories, Gaithersburg, MD), и цвет проявляли в течение от 10 до 15 минут. Реакцию останавливали добавлением 1M фосфорной кислоты. Оптическую плотность получали с использованием устройства для считывания микропланшетов (длина волны для сравнения 450 нм, 650 нм), и концентрации образцов вычисляли, исходя из 4-параметрической подгонки к стандартным кривым. Минимальная поддающаяся количественному определению концентрация IgG1 человека в образцах сыворотки мыши составила 1,22 мкг/мл.
Этот общий способ ELISA, описанный выше, также использовали для анализа других изотипов Ig.
IgG2
MAb мыши против IgG2 человека (специфичные к цепи γ2) (Southern Biotech, Birmingham, AL) наносили на планшеты для ELISA в количестве 4 мкг/мл. Диапазон стандартной кривой для IgG2 человека составил 12,20-1560 нг/мл. Биотинилированное mAb мыши против IgG2 человека (специфичное к цепи γ2) (Southern Biotech) разбавляли до 0,5 мкг/мл и использовали в качестве антитела для детекции. SA-HRP добавляли в 384-луночные планшеты в разведении 1:10000. Минимальная поддающаяся количественному определению концентрация IgG2 человека в образцах сыворотки мыши составила 1,22 мкг/мл.
IgG3
MAb мыши против IgG3 человека (Zymed Laboratories) разбавляли до 1 мкг/мл и наносили на планшеты для ELISA. Диапазон стандартной кривой для IgG3 человека составлял 0,78-100 нг/мл. Биотинилированное mAb мыши против IgG3 человека (специфичное к цепи γ3) (Southern Biotech) разбавляли до 0,1 мкг/мл и использовали в качестве антитела для детекции. SA-HRP добавляли в 384-луночные планшеты в разведении 1:20000. Минимальная поддающаяся количественному определению концентрация IgG3 человека в образцах сыворотки мыши составила 78,1 нг/мл.
IgG4
Очищенное mAb мыши против IgG4 человека (BD Pharmingen, San Jose, CA) разбавляли до 0,25 мкг/мл и наносили на планшеты ELISA. Диапазон стандартной кривой для IgG4 человека составлял 0,20-25 нг/мл. Конъюгированное с биотином mAb мыши против IgG4 человека (BD Pharmingen) разбавляли до 0,25 мкг/мл и использовали в качестве антитела для детекции. SA-HRP добавляли в 384-луночные планшеты в разведении 1:20000. Минимальная поддающаяся количественному определению концентрация IgG4 человека в образцах сыворотки мыши составила 39,1 нг/мл.
IgA
Очищенное mAb мыши против IgA1/A2 человека (BD Pharmingen) разбавляли до 2 мкг/мл и наносили на планшеты для ELISA. Диапазон стандартной кривой для IgA человека составлял 0,20-25 нг/мл. Конъюгированное с биотином mAb мыши против IgA1/A2 человека (BD Pharmingen) разбавляли до 1 мкг/мл и использовали в качестве антитела для детекции. SA-HRP добавляли в 384-луночные планшеты добавляли в разведении 1:80000. Минимальная поддающаяся количественному определению концентрация IgA человека в образцах сыворотки мыши составила 39,1 нг/мл.
IgM
Очищенное mAb мыши против IgM человека (BD Pharmingen) разбавляли до 0,5 мкг/мл и наносили на планшеты для ELISA. Диапазон стандартной кривой для IgM человека составлял 0,78-100 нг/мл. Конъюгированное с биотином mAb против IgM мыши (BD Pharmingen) разбавляли до 0,5 мкг/мл и использовали в качестве антитела для детекции. SA-HRP добавляли в 384-луночные планшеты в разведении 1:40000. Минимальная поддающаяся количественному определению концентрация IgM человека в образцах сыворотки мыши составила 156 нг/мл.
Спленоциты Hu-SCID, спленоциты мыши или клетки лимфатических узлов подсчитывали с использованием микросфер Fluoresbrite YG (Polysciences, Inc. #18862) на проточном цитометре FACs Calibur (BD (San Jose, CA)).
Для определения частоты продуцирующих IgE плазматических клеток у мышей hu-SCID после введения rhuIL-4, антител против IFNγ и против IL-12 в течение 15 суток использовали анализы Elispot. На планшеты для Elispot (Millipore, Billerica, MA, #MSIPS4510, прозрачные) наносили разведение 1:500 первичного неконъюгированного антитела против IgE человека (AXXORA, San Diego, CA, #BET-A80-108A) в буфере для нанесения [Genentech, Inc. (A3323)] в количестве 100 мкл/лунка в течение ночи при 4°C. Затем раствор первичного антитела удаляли, и планшеты промывали два раза буфером для промывания (1X PBS, 0,05% Tween-20). Мембраны блокировали 200 мкл/лунка 0,5% BSA в 1X PBS в течение 0,5-1 часа при 37°C. Блокирующий раствор удаляли, и в планшет добавляли клетки положительного контроля или спленоциты hu-SCID. В качестве положительного контроля для анализа использовали продуцирующую IgE миеломную клеточную линию человека U266 (ATCC, Manassas, VA, #TIB196). Клетки U266 добавляли в планшет, начиная с концентрации 3000 клеток/0,1 мл (=0,032×106/мл) среды для гибридомы [RPMI 1640, 15% эмбриональная телячья сыворотка, 2 мМ L-глутамин, 10 мМ HEPES, 4,5 г/л глюкоза, 1,5 г/л бикарбонат], а затем проводили семь серийных разведений (1:2). Суспензии отдельных клеток целой селезенки ресуспендировали в 1 мл среды. В первую лунку добавляли 100 мкл. Затем проводили семь серийных разведений 1:2. Клетки гибридомы U266 и клетки селезенки инкубировали в течение ночи при 37°C. На следующие сутки планшеты промывали три раза буфером для промывания (1XPBS, 0,05% Tween-20), а затем в каждую лунку добавляли 100 мкл/лунка вторичного антитела, конъюгированного антитела против IgE-щелочная фосфатаза (Sigma, St. Louis, MO, A-3525) в количестве 1:2000 в 0,5% BSA/1X PBS и инкубировали при 37°C в течение 2 часов. Планшеты промывали три раза, а затем ополаскивали один раз ddH2О (Genentech, Inc.). В каждую лунку добавляли 100 мкл/лунка раствора BCIP/NBT (R&D Systems, Minneapolis, MN, Elispot Blue Color Module, #SEL002) и инкубировали в темноте в течение 30 минут. Затем планшеты промывали один раз ddH2О, и планшету позволяли высохнуть при комнатной температуре. Планшеты отправляли в BD Biosciences для подсчета (BD, Inc., Franklin Lakes, NJ). Количество плазматических клеток вычисляли с использованием числа выявленных пятен, кратности разведения (входные данные о клетках) и общего подсчета для клеток селезенки.
Плазматические клетки человека получали извлечением селезенок на 15 сутки из мышей hu-SCID, которым вводили антитело. Получали суспензии отдельных клеток и фильтровали. 5×106 клеток блокировали сывороткой человека (Sigma, St. Louis, MO, #S-2257) и мыши (VWR, #RLD108-0100), а затем окрашивали антителом против CD38 человека-PE (BD Biosciences, San Jose, CA, #555460) и антителом против PC человека-FITC (Dakocytomation, Glostrup, Denmark, #K2311) в буфере для промывания FACs (2% FBS, 1X PBS) на льду в течение 20 минут. Затем клетки промывали и анализировали на устройстве FACs Calibur (BD, Inc., Franklin Lakes, NJ). В качестве положительного контроля успешного переноса PBMC использовали экспрессию CD38 человека. Плазматические клетки определяли как клетки с высоким CD38, PC+.
В эксперименте #07-0377 (фиг.12A) три антитела против IgE/М1' (47H4, 26A11 и 7A6) тестировали против изотипического контрольного muIgG1 против gp120. У мышей, которым вводили изотипический контроль, образовывались IgE человека на высоком уровне к 9 суткам. Введение антител-кандидатов против IgE/М1' снижало уровни IgE на 65-84% (фиг.12B-C). Введение антитела против IgE/М1' также снижало продуцирующие IgE клетки in vivo на 19-69% (фиг.12D-E). На другие сывороточные Ig относительно не влияло введение антитела против IgE/М1' (снижение на ~30% наблюдали в случае некоторых антител против M1' для huIg1, IgG3 и IgG4 (фиг.12F-G). Снижение процентного содержания тотальных плазматических клеток селезенки наблюдали при ведении антитела против IgE/М1' (фиг.12H-I).
В эксперименте #07-1232 (фиг.13A) гуманизированное антитело против IgE/М1' (47H4v5) тестировали против изотипического контрольного антитела HERCEPTIN®-huIgG1. У мышей, которым вводили изотипический контроль, образовывались высокие уровни сывороточного IgE к 8 суткам. Введение huIgG1 против IgE/М1' снижало уровни IgE на 79% (фиг.13B-D) и продуцирующие клетки на 75% (фиг.13C-D). Не наблюдали снижения других сывороточных Ig (IgG1, IgG2, IgG3, IgG4, IgM, IgA) (фиг.13E-F) или процентного количества тотальных плазматических клеток в селезенке (фиг.13G-H). Эти исследования демонстрируют, что антитела против IgE/М1' специфично снижают сывороточные IgE и продуцирующие IgE клетки, но не иммуноглобулины других изотипов.
ПРИМЕР 10
Трансгенные мыши с М1' человека
Получение трансгенных мышей со вставкой гена huM1'
Поскольку у мышей в норме не экспрессируется домен М1', сходный с доменом человека, авторы получили мышей с доменом М1' "встроенным в" локус IgE мыши (фиг.14A). В последовательности М1' человека использовали акцепторный участок сплайсинга М1 мыши выше нее, а затем ее подвергали слиянию с последовательностью М1 мыши ниже нее (фиг.14B). Также встраивали кассету IRES-EGFPpA-Neo с 3'-стороны последовательности M2 мыши. Эта вставка позволяет экспрессию IgE мыши с доменом М1' человека на поверхности IgE+ B-клеток. Последовательность М1' не экспрессируется на секретируемых IgE.
Скрининг линий со вставкой М1' (ПЦР)
Мышей со вставкой М1' человека генотипировали посредством ПЦР с использованием праймеров, специфичных к последовательности локуса IgE мыши и М1' человека. Используемые праймеры были следующими:

Очищенную геномную ДНК анализировали с помощью указанных выше праймеров с использованием 32 циклов следующей программы [94°C 4 мин; 94°C 1 мин; 60°C 30 с; 72°C 1 мин (30 циклов); 72°C 10 мин]. Затем продукты ПЦР разделяли на 2% агарозном геле с 0,5X TBE. Генотип дикого типа после ПЦР давал продукт размером 668 п.н., а продукт со вставкой hu-М1' имел размер 457 п.н. (фиг.14C).
Скрининг линий со вставкой М1' (Саузерн)
Клетки ES со вставкой huM1' и конечные линии мыши подвергали скринингу и подтверждали с помощью саузерн-блота. 10 мкг очищенной геномной ДНК клеток ES или Tail расщепляли посредством HindIII для левого плеча или BamHI для правого плеча в течение ночи. Затем расщепленную ДНК разделяли на 0,8% агарозном геле с 1X TAE. Затем ДНК переносили на нейлоновую мембрану (Roche #1417240) с использованием буфера для денатурации (1,5M NaCl; 0,5M NaOH) в течение ночи. Мембрану промывали, подвергали поперечному сшиванию посредством УФ, а затем погружали в раствор DIG Easy Hyb solution (Roche #1585762) на 4 часа при вращении при 46°C. Зонды получали посредством ПЦР с использованием набора PCR DIG probe Synthesis Kit, в соответствии с руководством изготовителя (Roche # 11636090910).
Праймеры для левого плеча представляли собой:
FOR 5'-TGTCTGGTGGTGGACCTGGAAAGCG (SEQ ID NO:109)
Rev 5'-TCCTCGCTCTCCTCCTCTGGTGGTG (SEQ ID NO:110)
Праймеры для правого плеча представляли собой:
FOR 5'-CCATGCAACCTAGTATCCTATTCTC (SEQ ID NO:111)
Rev 5 '-CTTTATACAGGAGAACCTAGCCCAG (SEQ ID NO:112)
Зонды тестировали против немеченого продукта ПЦР для того, чтобы убедиться в увеличенном размере и хорошем мечении DIG. Затем блоты гибридизовали в течение ночи с денатурированным зондом в течение ночи при 46°C при вращении. На следующие сутки блоты промывали и проявляли с помощью антитела против DIG согласно инструкциям изготовителя. Блоты экспонировали на пленку в течение 15-20 минут. На фиг.14D проиллюстрированы результаты саузерн-блоттинга. Мыши дикого типа давали фрагмент HindIII левого плеча размером 7,4 т.п.н., который становился фрагментом размером 3 т.п.н. в аллеле со вставкой hu-М1'. Мыши дикого типа давали фрагмент BamHI правого плеча размером 14,1 т.п.н., который становился фрагментом размером 18,1 т.п.н. у мышей со вставкой аллеля hu-М1'. Мыши дикого типа и гетерозиготные мыши представлены (фиг.14D).
ПРИМЕР 11
Трансгенная модель с Hu-М1': иммунизация TNP-OVA
В этом примере проиллюстрирована способность антител-кандидатов против IgE/М1' препятствовать образованию IgE вследствие стимуляции посредством TNP-OVA как при первичном иммунном ответе (Exp. #07-0234F; фиг.15A-I), так и при связанном с памятью иммунном ответе (Exp. #07-0234B; фиг.16A-K) на TNP-OVA. TNP-OVA или тринитрофенил-овальбумин представляет собой сильнодействующий иммуноген, часто используемый для получения сильных антительных иммунных ответов.
Данные выражают в качестве среднего значения ± стандартное отклонение. Значения P вычисляли с использованием статистического программного обеспечения JMP. Тест Даннетта сравнивает средние значения групп, где все тестируемые группы тестируют против группы сравнения. Каждый парный t-критерий Стьюдента сравнивает каждую пару групп с использованием t-критерия Стьюдента. Затем применяют поправку Бонферрони для коррекции значений p каждого парного t-критерия Стьюдента для ограничения попарных сравнений. Процентное изменение данных, полученных для первичного ответа (фиг.15A-I) и связанного с памятью иммунного ответа (фиг.A-K), вычисляли вычитанием среднего значения для неинфицированной и неиммунизированной групп из каждого значения для мыши, средние значения для групп вычисляли заново, а затем вычисляли процентное изменение против контрольной группы для каждого момента времени.
Иммунизация посредством TNP-OVA у мышей со вставкой IgE/М1' человека (C57BL/6) индуцирует сбалансированный ответ Th1/Th2 in vivo. Уровни антигенспецифичных IgE после первичной иммунизации и нагрузки достигает уровней ~10-200 нг/мл. В эксперименте #07-0234F мышей со вставкой huM1' (C57B1/6) иммунизировали посредством TNP-OVA (Biosearch Technologies, Novato, CA) (100 мкг в 2 мг квасцов на мышь внутрибрюшинно) на 0 сутки (фиг.15A). Затем мышам вводили 0,1 мг/кг антител три раза в неделю между 0 и 28 сутками (фиг.15A). В эксперименте #07-0234B мышей со вставкой huM1' (C57B1/6) иммунизировали посредством TNP-OVA/квасцы на 0 сутки (как указано выше), а затем нагружали TNP-OVA (100 мкг на мышь внутрибрюшинно) на 28 сутки (фиг.16A). Мышам вводили 10 мг/кг антител между 28 и 49 сутками (фиг.16A). У мышей проводили забор крови в ходе иммунного ответа для мониторинга антигенспецифических уровней сывороточных IgE и IgG1.
Специфичные к TNP-OVA IgE и IgG1 измеряли с использованием планшетов для ELISA (384-луночные с поверхностью MaxiSorpTM, Nunc, Neptune, NJ), на которые наносили в течение 12-18 ч при 2-8°C 25 мкл/лунка TNP-OVA (отношение TNP:OVA составляло 13:1) (Biosearch Technologies, Novato, CA), разбавленного до 0,5 мкг/мл в 50 мМ смеси карбонат натрия/бикарбонат, pH 9,6. Затем из планшетов сливали жидкость и подвергали блоттингу в сухом виде. В планшеты добавляли блокирующий буфер (PBS, 0,5% BSA, pH 7,2, 50 мкл/лунка) на 1-2 ч. Эту и все последующие инкубации проводили при комнатной температуре при осторожном встряхивании. Образцы разбавляли 1/50 в разбавителе для анализа (PBS, 0,5% BSA, 0,05% Tween-20, 0,01% Proclin 300) с последующими серийными разведениями 1/3 на одиннадцать точек. Стандарты подвергали двукратному серийному разведению в разбавителе для анализа на семь точек, начиная с 1 нг/мл для IgG1 против TNP-OVA и 3 нг/мл для IgE против TNP-OVA. Планшеты промывали три раза буфером для промывания (PBS, 0,05% Tween-20, pH 7,2) и добавляли стандарты, образцы и контроли (25 мкл/лунка) в дублированные планшеты для отдельной детекции изотипов IgG1 и IgE. После инкубации в течение 1,5-2 ч планшеты промывали шесть раз буфером для промывания. Биотинилированное mAb крысы против IgG1 и IgE мыши (BD Biosciences, San Diego, CA) разбавляли до 0,5 мкг/мл для IgG1 или 1,0 мкг/мл для IgE в разбавителе для анализа и добавляли в соответствующие планшеты (25 мкл/лунка). Планшеты инкубировали в течение 1-1,5 ч и промывали шесть раз буфером для промывания. Конъюгат стрептавидин-пероксидаза хрена (AMDEX, GE Healthcare, Piscataway, NJ) разбавляли 1/80000 для IgG1 или 1/5000 для IgE и добавляли в планшеты (25 мкл/лунка) на 30 мин. После промывания шесть раз буфером для промывания планшеты проявляли добавлением 25 мкл/лунка тетраметилбензидина (Kirkegaard & Perry Laboratories, Gaithersburg, MD) и инкубацией в течение 15 мин для IgG1 или 25 мин для IgE. Реакцию останавливали добавлением 25 мкл/лунка 1M H3PO4, и поглощение считывали при 450 нм со сравнением при 620 нм. Результаты неизвестных образцов интерполировали из 4-параметрической подгонки к стандартным кривым.
Плазматические клетки из селезенки или лимфатических узлов мыши сначала идентифицировали отделением CD138+ клеток. Эти продуцирующие IgE плазматические клетки количественно определяли способом Elispot. Для тотальных продуцирующих IgE клеток антитело против IgE (из набора BD OptEIA mIgE #555248) наносили на планшеты MultiScreen HTS (Millpore #MSIPS4W10) в разведении 1:2 с использованием буфера для нанесения ELISA в количестве 50 мкл на лунку. Нанесение проводили при 4°C в течение ночи. На следующее утро планшеты промывали 5 раз 200 мкл стерильного PBS-tween 20 (0,05%) с использованием многоканальной пипетки в вытяжном шкафу для культивирования тканей. Затем планшеты блокировали в 300 мкл PBS/5% BSA или среде для культивирования клеток (RPMI-1640, 10% FBS) в течение двух часов при комнатной температуре. Получали суспензии отдельных клеток из селезенки или лимфатического узла, и клетки количественно определяли посредством FACS (как указано выше). Клетки получали для высевания, начиная с 107 клеток с последующими 3-4-кратными разведениями для моделей иммунизации посредством TNP-OVA, или с 4×106 клеток с последующими 2-кратными разведениями для моделей инфекции Nippostrongylus. B-клеточную линию мыши A20 использовали в качестве отрицательного контроля, а клеточную линию TIB-141 использовали в качестве положительного контроля. Клеточные разведения проводили в среде для культивирования клеток (RPMI-1640 + 10% FBS). После стадии блокирования планшеты промывали один раз средой для культивирования клеток и аспирировали. Клетки высевали в объеме 100 мкл на лунку. Затем планшеты инкубировали в течение ночи при 37°C, 5% CO2. На следующие сутки планшеты промывали 6 раз с использованием SkanWasher 300 (Molecular Devices (Sunnyvale, CA)) посредством PBS-tween 20 (0,05%). Затем использовали биотинилированное вторичное антитело из набора BD OptEIA mIgE (#555248) в концентрации, указанной изготовителем, как правило, между 1:250 и 1:500 в 100 мкл/лунка. Вторичное антитело получали в PBS/1% BSA. Затем планшеты инкубировали в течение 1 часа при комнатной температуре, а затем промывали 6 раз с использованием SkanWasher300 посредством PBS-tween 20 (0,05%). Затем добавляли стрептавидин AP (R&D #SEL002) в разведении 1:60 в 100 мкл на лунку, снова получали в PBS/1% BSA и инкубировали в течение 1 часа при комнатной температуре. Затем планшеты промывали, как указано выше, 3 раза, а затем два раза ополаскивали DI-водой. Любую оставшуюся жидкость промокали бумажным полотенцем. Затем добавляли реагент для проявления, BCIP/NBT (100 мкл/лунка), и планшеты инкубировали в течение 30 минут при комнатной температуре в темноте. Затем субстрат удаляли, и планшет промывали два раза DI-водой. Планшеты переворачивали для удаления какого-либо избытка воды и позволяли высохнуть. Пятна количественно определяли с использованием препаровальной лупы.
В эксперименте #07-0234F тестировали способность антитела против IgE/М1' предотвращать ответ IgE на первичную иммунизацию посредством TNP-OVA. У мышей, которым вводили изотипическое контрольное антитело против gp120, образовывался сывороточный IgE, достигая максимальных уровней между 8 и 14 сутками (~25 нг/мл) (фиг.15B). Введение антитела против IgE/М1' препятствовало повышению сывороточного IgE к 8 (98%) и 14 (99%) суткам (фиг.15C-D). Это снижение значимо отличалось от животных, которым вводили изотипический контроль, и не значимо отличалось от неиммунизированых мышей (фиг.15C-E). На уровни антигенспецифичного IgG1 антитело против IgE/М1' только умеренно влияло на протяжении 28 суток эксперимента (фиг.15F-I).
В эксперименте #07-0234B тестировали способность антитела против IgE/М1' препятствовать вторичному ответу/связанному с памятью ответу IgE на TNP-OVA. Вторичный ответ IgE на вспомогательную инъекцию TNP-OVA на 28 сутки является более быстрым, достигая пика через 4 суток, а не на 8-9 сутки, как при первичном ответе (фиг.16B). Введение антител-кандидатов против IgE/М1', начиная с вспомогательной инъекции, на 28 сутки снижало возрастание IgE между 28 и 35 сутками (фиг.16B). Уровни IgE при введении антитела против IgE/М1' были значимо снижены по сравнению с изотипическим контролем, на 59-75% к 32 суткам и на 90-93% к 35 суткам (фиг.16C-D). К 35-42 суткам уровни IgE не отличались значимо от неиммунизированных мышей (фиг.16E). Анализ площади под кривой для этих групп по введению между 28 и 49 сутками, кроме того, демонстрирует, что антитело против IgE/М1' снижало уровни сывороточных IgE на 74-84%, и средний суточный уровень антигенспецифичного IgE также снижался на 74-83% (фиг.16F-H). После введения антитела против IgE/М1' не наблюдали значимого снижения антигенспецифичного IgG1 (фиг.16I-K).
ПРИМЕР 12
Трансгенная модель Hu-М1': модель инфекции Nippostronsylus brasiliensis
В этом примере проиллюстрирована способность антител против IgE/М1' препятствовать продукции IgE (фиг.17A-D), а также терапевтически снижать продукцию IgE при ранее индуцированной инфекции Nippostrongylus brasiliensis. Снижение продукции IgE оценивали посредством введения антител против IgE/М1' как на пике уровней IgE иммунного ответа (фиг.18A-I), так и при применении позднее при иммунном ответе (фиг.19A-G).
Nippostrongylus brasiliensis представляет собой желудочно-кишечного круглого червя, который инфицирует крыс и мышей. Его яйца выводятся в экскрементах и созревают до стадии L3 инфекционной личинки. Личинка L3 проникает в хозяина через кожу и мигрирует в кровеносные сосуды, а затем через одни или двое суток она проникает в легкое. После развития в личинку стадии L4 в легком она продвигается вдоль трахеи и пищевода хозяина и достигает тощей кишки на 2-3 сутки. Личинка созревает во взрослого червя и спаривается, и продуцирует яйца приблизительно на 5 сутки. Яйца N. brasiliensis экскретируется из хозяина вместе с экскрементами.
Мыши, инфицированные N. brasiliensis, демонстрируют исходный врожденный иммунный ответ, с последующим сильным иммунитетом 2 типа для выведения инфекции. Отложение комплемента и фибронектина выявляют на более ранней стадии инфекции для облегчения привлечения и прикрепления лейкоцитов. Эффекторные клетки, такие как эозинофилы, базофилы и клетки CD4+ Th2, привлекаются в легкое для борьбы против инфекции. Th2-цитокины, IL-4 и IL-13, играют основную роль в поддержании иммунного ответа в легком, и они требуются для выведения червя из кишечника. Ответы 2 типа характеризуются высокими уровнями продукции антител, включая IgE.
У мышей со вставкой IgE/М1' (C57BL/6) возникает сильный IgE-ответ на инфекцию N. brasiliensis, достигающий пика на 15-20 сутки (фиг.17B, 18B, 19B). Затем уровни сывороточного IgE падают до более низкого, однако, поддерживаемого повышенным, уровня. Мышей инфицировали Nippostrongylus brasiliensis на 0 сутки. Во всех трех экспериментах с инфекцией N. brasiliensis мышам вводили 10 мг/кг антител mIgG1 против IgE/М1' или изотипического контроля mIgG1 против gp120. В исследовании профилактики (фиг.17A), мышам со вставкой huM1' проводили введение три раза в неделю, начиная на 0 суток по 21 сутки. В исследовании максимальной продукции (фиг.18A), мышам со вставкой huM1' проводили введение три раза в неделю на 11 и 21 сутки. На стадии позднего вмешательства (фиг.19A), мышам со вставкой huM1' проводили введение три раза в неделю между 41 и 62 сутками.
Данные представлены в качестве среднего значения ± стандартное отклонение. Значения р вычисляли с использованием статистического программного обеспечения JMP. Тест Даннетта сравнивает средние значения групп, где все тестируемые группы тестируют против группы сравнения. Каждый парный t-критерий Стьюдента сравнивает каждую пару групп с использованием t-критерия Стьюдента. Затем применяют поправку Бонферрони для коррекции значений p каждого парного t-критерия Стьюдента для ограничения попарных сравнений. Процентное изменение данных, представленных для исследования профилактики и максимальной продукции, вычисляли вычитанием среднего значения для неинфицированной и неиммунизированной групп из каждого значения для мыши, средние значения для групп вычисляли заново, а затем вычисляли процентное изменение против контрольной группы для каждого момента времени. На стадии позднего вмешательства процентное изменение вычисляли в каждой группе по введению посредством сравнения суток 48 и 55 с сутками 41. Продуцирующие IgE плазматические клетки определяли и оценивали посредством Elispot, как описано ранее в примере 12.
В исследовании профилактики тестировали способность антитела против IgE/М1' предотвращать повышение IgE в ответ на первичную инфекцию Nippostrongylus. Контрольные мыши (которым вводили изотип) достигали высоких уровней продукции IgE к 15 суткам после инфекции (~3000 нг/мл). Мыши, которым вводили антитело против IgE/М1', обладали сниженной продукцией IgE после инфекции (снижение на 93-94% по сравнению с mIgG1 против gp120), которая не отличалась значимо от неинфицированных мышей (фиг.17B-D).
В исследовании максимальной продукции тестировали способность антитела против IgE/М1' терапевтически снижать уровни IgE на пике ответа IgE на инфекцию N. brasiliensis. Все группы по введению достигали высоких уровней IgE (~2000 нг/мл) к 11 суткам после инфекции Nippostrongylus (фиг.18B). Введение антитела против IgE/М1' начинали на 11 сутки на пике этого ответа. Кандидаты mIgG1 против IgE/М1' снижали уровни сывороточного IgE на 82-89% в пределах четырех суток после введения (фиг.18C-D). К 21 суткам уровни IgE у мышей, которым вводили антитело против IgE/М1', были снижены на 97-98%, достигая уровней, которые статистически не отличались от группы неинфицированных контролей (фиг.18E). Продуцирующие IgE плазматические клетки количественно определяли посредством Elispot против IgE. Инфекция N. brasiliensis индуцировала значительные количества продуцирующих IgE клеток как в брызжеечном лимфатическом узле (~30 клеток на 4×106; фиг.18F), так и в селезенке (~10 клеток на 4×106; фиг.18G). К 21 суткам введение антитела против IgE/М1' снижало продуцирующие IgE клетки в брызжеечном лимфатическом узле на 88-94% и в селезенке на 57-66%. Частота тотальных плазматических клеток (клеток CD138+) в брызжеечном лимфатическом узле и селезенке была повышена во всех группах по введению по сравнению с неинфицированными мышами, и не было значимого изменения частоты тотальных плазматических клеток в любом органе вследствие введения антитела против IgE/М1' (фиг.18H-I). Эти результаты демонстрируют способность антител против IgE/М1' снижать сывороточный IgE до номинальных уровней посредством устранения продуцирующих IgE клеток in vivo, даже при применении на пиковом уровне продукции IgE.
В исследовании позднего вмешательства тестировали способность антитела против IgE/М1' снижать поддерживающийся низкий уровень IgE, который достигается поздно в инфекционном цикле. Все группы по введению достигали пика продукции IgE приблизительно на 15 сутки. При начале введения антитела против IgE/М1' на 41 сутки существовали некоторые отличия в уровнях сывороточного IgE среди групп по введению (фиг.19B-C), которые нормализовали, принимая уровни 41 суток за 100% (фиг.19D). Введение антитела против IgE/М1' значимо снижало уровни сывороточного IgE по сравнению с изотипическим контрольным mIgG1 против gp120 между 48 и 55 сутками (фиг.19E-G). К 48 и 55 суткам уровни IgE были снижены на 64-75% и 75-84% соответственно по сравнению с изотипическим контролем (mIgG1 против gp120), которые снижали на 20% и 37% соответственно (фиг.19F-G). Отличие в средних уровнях IgE между группами по введению не отличалось значимо от группы изотипического контроля (gp120) перед началом лечения антителом против IgE/М1' (фиг.19E). Однако введение антител против IgE/М1' показало более резкое и значительное снижение уровней сывороточного IgE, чем снижение, наблюдаемое в контрольной группе к 48 суткам (фиг.19F) и 55 суткам (фиг.19G). Процентное изменение и значение p (d41) вычисляли посредством сравнения каждой группы по введению на 48 или 55 сутки с исходным значением той же группы на 41 сутки перед введением.
ПРИМЕР 13
Экспрессия антитела против IgE/М1' в клетках млекопитающих
В этом примере проиллюстрировано получение потенциально гликозилированных форм требуемого белка или антитела посредством рекомбинантной экспрессии в клетках млекопитающих.
В качестве экспрессирующего вектора используют вектор, pRK5 (см. EP 307247, опубликованный 15 марта 1989 года). Необязательно, ДНК, кодирующую легкую и/или тяжелую цепь антитела против IgE/М1', лигируют в pRK5 с выбранными ферментами рестрикции для обеспечения встраивания такой ДНК с использованием способов лигирования, таких как описаны в Sambrook et al., выше.
В одном варианте осуществления выбранные клетки-хозяева могут представлять собой клетки 293. Клетки 293 человека (ATCC CCL 1573) выращивают до смыкания монослоя в планшетах для культивирования тканей в среде, такой как DMEM, дополненной эмбриональной телячьей сывороткой и, необязательно, питательными компонентами и/или антибиотиками. Приблизительно 10 мкг, если ДНК, кодирующая антитело против IgE/М1', лигирована в pRK5, смешивают приблизительно с 1 мкг ДНК, кодирующей РНК гена VA [Thimmappaya et al., Cell, 31:543 (1982)], и растворяют в 500 мкл 1 мМ Tris-HCl, 0,1 мМ EDTA, 0,227 M CaCl2. К этой смеси капельно добавляют 500 мкл 50 мМ HEPES (pH 7,35), 280 мМ NaCl, 1,5 мМ NaPO4, и позволяют образовываться осадку в течение 10 минут при 25°C. Осадок суспендируют и добавляют к клеткам 293 и позволяют оседать в течение приблизительно четырех часов при 37°C. Культуральную среду аспирируют и добавляют 2 мл 20% глицерина в PBS в течение 30 секунд. Затем клетки 293 промывают бессывороточной средой, добавляют свежую среду, и клетки инкубируют в течение приблизительно 5 суток.
Приблизительно через 24 часа после трансфекций культуральную среду удаляют и заменяют культуральной средой (отдельно) или культуральной средой, содержащей 200 мкКи/мл35S-цистеина и 200 мкКи/мл35S-метионина. После инкубации в течение 12 часов кондиционированную среду собирают, концентрируют на центробежном фильтре и наносят на гель с 15% SDS. Обработанный гель можно высушивать и проявлять на пленку в течение выбранного периода времени для выявления наличия антитела против IgE/М1'. Культуры, содержащие трансфицированные клетки, можно подвергать дальнейшей инкубации (в бессывороточной среде), и среду тестировать в выбранных биологических анализах.
В альтернативном способе антитело против IgE/М1' можно вводить в клетки 293 временно с использованием способа с сульфатом декстрана, описанным Somparyrac et al., Proc. Natl. Acad. Sci., 12:7575 (1981). Клетки 293 выращивают до максимальной плотности во вращающемся флаконе и добавляют 700 мкг ДНК, кодирующей антитело против IgE/М1', лигированной в pRK5. Сначала клетки концентрируют из вращающейся колбы посредством центрифугирования и промывают посредством PBS. Осадок в виде ДНК-декстрана инкубируют на клеточном осадке в течение четырех часов. Клетки обрабатывают 20% глицерином в течение 90 секунд, промывают средой для культивирования тканей и повторно помещают во вращающуюся колбу, содержащую среду, 5 мкг/мл бычьего инсулина и 0,1 мкг/мл бычьего трансферрина. Приблизительно через четверо суток кондиционированную среду центрифугируют и фильтруют для удаления клеток и дебриса. Затем образец, содержащий экспрессированное антитело против IgE/М1', можно концентрировать и очищать выбранным способом, таким как диализ и/или колоночная хроматография.
В другом варианте осуществления антитело против IgE/М1' можно экспрессировать в клетках CHO. ДНК, кодирующую антитело против IgE/М1', лигированную в pRK5, можно трансфицировать в клетки CHO с использованием известных реагентов, таких как CaPO4 или DEAE-декстран. Как описано выше, культуры клеток можно инкубировать, и среду заменять культуральной средой (отдельно) или средой, содержащей радиоактивную метку, такую как35S-метионин. После определения наличия антитела против IgE/М1' культуральную среду можно заменять бессывороточной средой. Предпочтительно, культуры инкубируют в течение приблизительно 6 суток, а затем собирают кондиционированную среду. Затем среду, содержащую экспрессированное антитело против IgE/М1', можно концентрировать и очищать любым выбранным способом.
Меченные эпитопом варианты антитела против IgE/М1' также можно экспрессировать в клетках-хозяевах CHO. ДНК, кодирующую антитело против IgE/М1', лигированную в pRK5, можно субклонировать из вектора pRK5. Вставку субклона можно подвергать ПЦР для слияния в рамке считывания с выбранной эпитопной меткой, такой как метка поли-his в экспрессирующем векторе Baculovirus. Затем меченную поли-his ДНК, кодирующую вставку антитела против IgE/М1', можно субклонировать в запускаемый SV40 вектор, содержащий селектируемый маркер, такой как DHFR, для селекции стабильных клонов. В конце, клетки CHO можно трансфицировать (как описано выше) запускаемым SV40 вектором. Для подтверждения экспрессии можно проводить мечение, как описано выше. Затем культуральную среду, содержащую экспрессированное меченное поли-His антитело против IgE/М1', можно концентрировать и очищать любым выбранным способом, например Ni2+-хелатной аффинной хроматографией.
Антитело против IgE/М1' также можно экспрессировать в клетках CHO и/или COS способом временной экспрессии или в клетках CHO любым способом стабильной экспрессии.
Стабильную экспрессию в клетках CHO проводят с использованием следующего способа. Белки экспрессируют в качестве конструкции IgG (иммуноадгезин), в которой кодирующие последовательности для растворимых форм (например, внеклеточных доменов) соответствующих белков подвергают слиянию с последовательностью константной области IgG1, содержащей шарнирную область, CH2- и CH2-домены и/или которая представляет собой меченную поли-His форму.
После амплификации посредством ПЦР соответствующие ДНК субклонируют в экспрессирующий вектор CHO с использованием стандартных способов, как описано в Ausubel et al., Current Protocols of Molecular Biology, Unit 3,16, John Wiley and Sons (1997). Векторы, экспрессирующие СНО, конструируют, чтобы они имели совместимые участки рестрикции с 5'- и 3'-стороны от представляющей интерес ДНК для обеспечения удобного переноса кДНК'. Вектор, используемый для экспрессии в клетках CHO, является таким, как описано в Lucas et al., Nucl. Acids Res. 24:9 (1774-1779 (1996), и в нем используется ранний промотор/энхансер SV40 для запуска экспрессии представляющей интерес кДНК и дигидрофолатредуктазы (DHFR). Экспрессия DHFR позволяет селекцию для стабильного поддержания плазмиды после трансфекции.
Двенадцать микрограмм требуемой плазмидной ДНК вводят приблизительно в 10 миллионов клеток CHO с использованием коммерчески доступных реагентов для трансфекции SUPERFECT® (Quiagen), DOSPER® или FUGENE® (Boehringer Mannheim). Клетки выращивают, как описано в Lucas et al. выше. Приблизительно 3×10-7 клеток замораживают в ампуле для последующего выращивания и продукции, как описано ниже.
Ампулы, содержащие плазмидную ДНК, размораживают помещением на водяную баню и смешивают встряхиванием. Содержимое пипетируют в центрифужной пробирке, содержащей 10 мл среды, и центрифугируют при 1000 об/мин в течение 5 минут. Супернатант аспирируют, и клетки ресуспендируют в 10 мл селективной среды (0,2 мкм фильтрованного PS20 с 5% 0,2 мкм диафильтрованной эмбриональной телячьей сывороткой). Затем клетки разделяют на аликвоты в 100 мл во вращающейся колбе, содержащей 90 мл селективной среды. Через 1-2 суток клетки переносят в 250 мл вращающуюся колбу со 150 мл селективной среды для роста и инкубируют при 37°C. Еще через 2-3 суток в 250-мл, 500-мл и 2000-мл вращающиеся колбы высевают 3×105 клеток/мл. Клеточные среды заменяют свежей средой посредством центрифугирования и ресуспендирования в среде для продукции. Хотя можно использовать любую пригодную для CHO среду, в действительности можно использовать среду для продукции, описанную в патенте США № 5122469, выданном 16 июня 1992 года. В 3-литровую вращающуюся колбу для продукции высевают 1,2×106 клеток/мл. На 0 сутки определяют число клеток и pH. На 1 сутки проводят забор образцов из вращающейся колбы и начинают барботирование фильтрованным воздухом. На 2 сутки проводят забор образцов из вращающейся колбы, температуру изменяют до 33°C и добавляют 30 мл 500 г/л глюкозы и 0,6 мл 10% пеногасителя (например, 35% эмульсии полидиметилсилоксана, Dow Corning 365 Medical Grade Emulsion). На протяжении продукции, pH при необходимости корректируют для поддержания его на уровне приблизительно 7,2. Через 10 суток, или когда жизнеспособность падает до уровня менее 70%, клеточную культуру собирают центрифугированием и фильтруют через 0,22-мкм фильтр. Фильтрат либо хранят при 4°C, либо сразу помещают на колонки для очистки.
Для меченных поли-His конструкций белки очищают с использованием колонки Ni-NTA (Qiagen). Перед очисткой в кондиционированную среду добавляют имидазол до концентрации 5 мМ. Кондиционированную среду нагнетают в 6-мл колонку Ni-NTA, уравновешенную при 4°C, в 20 мМ буфере Hepes, pH 7,4, содержащем 0,3M NaCl и 5 мМ имидазол со скоростью потока 4-5 мл/мин. После нагрузки колонку промывают дополнительным буфером для уравновешивания, и белок элюируют буфером для уравновешивания, содержащим 0,25 M имидазол. Затем высокоочищенный белок обессоливают в буфере для хранения, содержащем 10 мМ Hepes, 0,14 M NaCl и 4% маннит, pH 6,8, c помощью 25-мл колонки G25 Superfine (Pharmacia) и хранят при -80°C.
Конструкции иммуноадгезина (Fc-содержащие) очищают из кондиционированной среды следующим образом. Кондиционированную среду нагнетают в 5-мл колонку с белком A (Pharmacia), уравновешенную в 20 мМ Na-фосфатном буфере, pH 6,8. После нагрузки колонку интенсивно промывают буфером для уравновешивания, а затем элюируют 100 мМ лимонной кислотой, pH 3,5. Элюированный белок сразу нейтрализуют сбором 1-мл фракций в пробирки, содержащие 275 мкл 1M буфера Tris, pH 9. Высокоочищенный белок впоследствии обессоливают в буфере для хранения, как описано выше для меченных поли-His белков. Гомогенность оценивают посредством SDS-полиакриламидных гелей и посредством N-концевого секвенирования аминокислот способом деградации Эдмана.
Депонирование материала
Следующие материалы были депонированы в American Type Culture Collection, 10801 University Blvd., Manassas, VA 20110-2209, USA (ATCC):
Депонирование этих материалов было сделано согласно условиям Будапештского договора о международном признании депонирования микроорганизмов для целей патентной процедуры и правил в нем (Будапештский договор). Это гарантирует поддержание жизнеспособной культуры депонированных материалов в течение тридцати (30) лет от даты депонирования, и по меньшей мере в течение пяти (5) лет после самого последнего запроса образца. Депонированные материалы станут доступными в ATCC по условиям Будапештского договора, и они являются объектом соглашения между Genentech, Inc. и ATCC, которая гарантирует постоянную и неограниченную доступность потомства культуры депонированного материала обществу при выдаче соответствующего патента США или при открытии доступа обществу патентной заявки США или другой страны, в зависимости от того, что наступит ранее, и гарантирует доступность потомства лицу, определенному комиссаром по патентам и торговым маркам США, уполномоченному для этого согласно 35 USC В§ 122 и правилам для комиссаров в соответствии с ним (включая 37 CFR В§ 1.14 с конкретной ссылкой на 886 OG 638).
Правопреемник настоящей заявки согласен, что, если депонированная культура материалов погибнет или будет утрачена или разрушена при культивировании в пригодных условиях, материалы будут быстро заменены при уведомлении другими такими же материалами.
Доступность депонированного материала не следует истолковывать как разрешение применять на практике изобретение в нарушение прав, предоставляемых по распоряжению какого-либо правительства согласно его патентным законам.
Представленное выше письменное описание считают достаточным для того, чтобы специалист мог применять изобретение на практике. Настоящее изобретение не ограничено объемом примеров, представленных в настоящем документе. Действительно, различные модификации изобретения в дополнение к модификациям, представленным и описанным в настоящем документе, станут очевидными специалистам в данной области, исходя из представленного выше описания, и они попадают в объем прилагаемой формулы изобретения.
Реферат
Настоящее изобретение относится к области иммунологии. Предложено антитело, специфично связывающее сегмент M1' IgE и которое индуцирует апоптоз в экспрессирующих IgE В-клетках, и его антигенсвязывающий фрагмент. Также рассмотрены композиции и способы лечения опосредуемого IgE нарушения, изделие, способ специфического устранения продуцирующих IgE В-клеток, способы профилактики и снижения индуцируемой аллергеном продукции IgE, а также выделенная нуклеиновая кислота, вектор экспрессии, клетка-хозяин и способ получения антитела по изобретению с их использованием. Настоящее изобретение может найти дальнейшее применение в терапии заболеваний, ассоциированных с IgE. 17 н. и 29 з.п. ф-лы, 19 ил., 5 табл., 13 пр.
Формула
a. HVR-L1 -
i) остатки 24-34 SEQ ID NOS: 21, 22, 23, 24, 25 или 26,
ii) остатки 24-40 SEQ ID NOS: 27 или 28,
iii) остатки 24-39 SEQ ID NOS: 29, 30 или 31;
b. HVR-L2 -
i) остатки 50-56 SEQ ID NOS: 21, 22, 23, 24, 25 или 26,
ii) остатки 56-62 SEQ ID NOS: 27 или 28,
iii) остатки 55-61 SEQ ID NOS: 29, 30 или 31;
c. HVR-L3 -
i) остатки 89-97 SEQ ID NOS: 21, 22, 23, 24, 25 или 26,
ii) остатки 55-61 SEQ ID NOS: 27 или 28,
iii) остатки 94-102 SEQ ID NOS: 29, 30 или 31;
d. HVR-H1 -
i) остатки 26-35 SEQ ID NOS: 33, 34 или 35,
ii) остатки 26-35 SEQ ID NOS: 36 или 37,
iii) остатки 26-35 SEQ ID NOS: 38, 39, 41 или 42;
e. HVR-H2 -
i) остатки 49-66 SEQ ID NOS: 33, 34 или 35,
ii) остатки 49-66 SEQ ID NOS: 36 или 37,
iii) остатки 49-66 SEQ ID NOS: 38, 39, 41 или 42;
f. HVR-H3 -
i) остатки 97-102 SEQ ID NOS: 33, 34 или 35,
ii) остатки 97-111 SEQ ID NOS: 36 или 37,
iii) остатки 97-106 SEQ ID NOS: 38, 39, 41 или 42.
a. HVR-L1 -
i) остатки 24-34 SEQ ID NOS: 21, 22, 23, 24, 25 или 26,
ii) остатки 24-40 SEQ ID NOS: 27 или 28,
iii) остатки 24-39 SEQ ID NOS: 29, 30 или 31;
b. HVR-L2 -
i) остатки 50-56 SEQ ID NOS: 21, 22, 23, 24, 25 или 26,
ii) остатки 56-62 SEQ ID NOS: 27 или 28,
iii) остатки 55-61 SEQ ID NOS: 29, 30 или 31;
c. HVR-L3 -
i) остатки 89-97 SEQ ID NOS: 21, 22, 23, 24, 25 или 26,
ii) остатки 55-61 SEQ ID NOS: 27 или 28,
iii) остатки 94-102 SEQ ID NOS: 29, 30 или 31;
d. HVR-H1 -
i) остатки 26-35 SEQ ID NOS: 33, 34 или 35,
ii) остатки 26-35 SEQ ID NOS: 36 или 37,
iii) остатки 26-35 SEQ ID NOS: 38, 39, 41 или 42;
e. HVR-H2 -
i) остатки 49-66 SEQ ID NOS: 33, 34 или 35,
ii) остатки 49-66 SEQ ID NOS: 36 или 37,
iii) остатки 49-66 SEQ ID NOS: 38, 39, 41 или 42;
f. HVR-H3 -
i) остатки 97-102 SEQ ID NOS: 33, 34 или 35,
ii) остатки 97-111 SEQ ID NOS: 36 или 37,
iii) остатки 97-106 SEQ ID NOS: 38, 39, 41 или 42.
a. HVR-L1 содержит остатки 24-39 SEQ ID NO: 31;
b. HVR-L2 содержит остатки 55-61 SEQ ID NO: 31;
c. HVR-L3 содержит остатки 94-102 SEQ ID NO: 31;
d. HVR-H1 содержит остатки 26-35 SEQ ID NO: 41;
e. HVR-H2 содержит остатки 49-66 SEQ ID NO: 41;
f. HVR-H3 содержит остатки 97-106 SEQ ID NO: 41.
Документы, цитированные в отчёте о поиске
Улучшенное анти-ige антитело (варианты) и способ улучшения полипептидов

Комментарии