Улучшенное анти-ige антитело (варианты) и способ улучшения полипептидов - RU2242515C2
Код документа: RU2242515C2
Чертежи














Описание
Предпосылки изобретения
Данное изобретение относится к иммуноглобулину Е (IgЕ), IgЕ антагонистам, анти-IgЕ антителам, способным к связыванию с IgЕ человека, и к способу улучшения полипептидов, включая анти-IgЕ антитела.
IgЕ является членом семейства иммуноглобулина, который переносит аллергические реакции, такие как астму, пищевые аллергии, гиперчувствительность и широко распространенное обычное синус воспаление. IgЕ секретируется В-клетками и В-лимфоцитами и экспрессируется на их поверхности. IgЕ связывается с В-клетками (а также с моноцитами, эозинофилами и тромбоцитами) через его Fc область с IgЕ рецептором низкой аффинности, известного как FcεRII. Подвергая млекопитающего воздействию аллергена, В-клетки, создающие поверхностно-связанное IgЕ антитело, специфичное для антигена, “активируются” и обнаруживаются в IgE-секретируемых плазматических клетках (плазмоцитах). Полученный аллерген-специфический IgЕ далее циркулирует по кровяному руслу и связывается с поверхностью тучных клеток в тканях и базофилами в крови посредством рецептора высокого сродства (аффинности), также известного как FcεRI. Таким образом, тучные клетки и базофилы становятся чувствительными к аллергену. Последующее воздействие на аллерген вызывает перекрестное связывание базофильных и тучных клеточных FcεRI, которое приводит к выделению гистамина, лейкотриенов и факторов активации тромбоцитов, эозинофильных и нейтрофильных хемотоксических факторов и цитокинов IL-3, IL-4, IL-5 и GM- CSF, которые ответственны за клиническую гиперчувствительность и анафилаксию.
Патологическое состояние гиперчувствительности характеризуется чрезмерной иммунной реакцией к аллергену(ам), приводящей к изменениям тучных тканей, если аллерген присутствует в относительно больших количествах или если гуморальное и клеточное иммунное состояние находится на повышенном уровне.
Физиологические изменения при анафилактической гиперчувствительности могут включать интенсивное сокращение (сужение) бронхиол и бронхов легких, сокращение гладкой мышцы и дилатацию (расширение) капилляров. Предрасположенность к данному состоянию, по-видимому, происходит в результате взаимодействия между генетическими факторами и факторами, относящимися к окружающей среде. Обычные аллергены, относящиеся к окружающей среде, которые индуцируют анафилактическую гиперчувствительность, встречаются в пыльце, пище, клещах бытовой пыли, перхоти животных, грибковых спорах и ядах насекомых. Атопическая аллергия связана с анафилактической гиперчувствительностью и включает расстройства, например астму, аллергические риниты и конъюнктивиты (сенную лихорадку), экзему, крапивницу и пищевую аллергию. Однако анафилактический шок, опасное для жизни состояние анафилаксии, обычно провоцируется укусами насекомых или источником лекарственной терапии.
Недавно была продолжена стратегия лечения гиперчувствительности 1 типа или анафилактической гиперчувствительности, которая пытается блокировать IgЕ от связывания с рецептором (FcεRI) высокого сродства (аффинности), находящегося на базофилах и тучных клетках, и тем самым препятствуют выделению гистамина и других анафилактических факторов, приводящих к патологическим состояниям.
WO 93/04173, опубликованная 4 марта 1993 года, описывает IgE/lgGI химеры, относящиеся к человеку, где IgGI остатки замещены на аналогичные IgE остатки. Заявители родственной заявки USSN 08/405617 описывают облагороженные анти-IgE антитела, где антитело, относящееся к мышам или крысам, направленное против IgE (МаЕII) человека, применяли для обеспечения CDR, областей, которые замещали на IgGI структуру иммуноглобулина (rhuMaE25). Методика облагораживания описана в работах Reichman, L. et al., Nature 332:323 (1988) и Jones. P.T. et al., Nature 321:522 (1986).
Установлено, что хотя при облагораживании антител мышей или крыс получают анти-IgE молекулы, которые предусматривают подобную аффинность к IgE, как МаЕII мышей или крыс, без иммуногенной реакции, выявленной последними (Shields et al., Int. Arch. Allergy Immunol. 107: 308-213 (1995)), это до сих пор не привело к созданию анти-IgE с аффинностью для IgE, которая несомненно лучше, чем МаЕII или анти-IgE мышей или крыс.
Рекомбинантные моноклональные антитела подвергают реакциям деградации, которые затрагивают все полипептиды или протеины, как, например, изомеризация аспарагиновой кислоты или остатков аспарагина. Как показано ниже, остатки аспартата (I) в -Asp-Gly-последовательностях могут изомеризоваться в изоаспартат (III) через циклическое имидное производное (II) (Geiger and Clarke. J. Вiоl, Chem. 262:785-794 (1987)). Боковая цепь карбоновой кислоты (аспарагиновой кислоты (I)) реагирует с амидным азотом соседнего глицина с образованием циклического производного аспарагиновой кислоты (II), которое далее образует - изоаспарагиновая кислота - глициновый остаток (III). Равновесие, скорость и рН-зависимость данной реакции изучали на модельных пептидах, выделенных с помощью жидкостной хроматографии высокого разрешения с обращенной фазой (Oliyai and Borchardt, Pharm. Res. 10:95-102 (1993)). Считают, что тенденция претерпевать изомеризацию также зависит от локальной жесткости части молекулы, содержащей -Asp-Gly-последовательность (Geiger and Clarke, supra).

Примером известного антитела, которое претерпевает изомеризацию аспарагиновой кислоты, является сильное анти-IgE антитело, известное как rhuMabE-25 (E-25). Данное превращение может происходить спонтанно, но может индуцироваться для прохождения, если E-25 инкубируют при 37°С в течение 21 дня. Конечным результатом является введение дополнительной метильной группы в полипептидный скелет антитела, которая может привести к конформационным изменениям - уменьшению связывающей аффинности. Исследование E-25 с помощью -c-Asp-Gly- и изо-Asp-Gly вариантов в положении VL 32-33 показывало, что хотя изомеризационное превращение можно свести к минимуму замещением аланина или глутаминовой кислоты на остаток VL32, само превращение приводит к трехкратному уменьшению связывания Cacia et al., supra.
Таким образом, существует острая необходимость в создании улучшенных полипептидов, включая антитела, которые не только не проявляют “дезактивирования” при изомеризации аспартила, но также демонстрируют сродство к молекуле-мишени (например, антигену), равное или большее, чем сродство неулучшенного полипептида.
Сущность изобретения
Данное изобретение относится к способу улучшения полипептида, обладающего сродством (аффинностью) к молекуле-мишени, путем комбинирования стадий, включающих: (1) определение остатков аспаратила, которые склонны к изомеризации; (2) замещение альтернативных остатков и проверка полученных мутантов, что касается сродства (аффинности) к молекуле-мишени. В предпочтительном варианте способ замещения остатков представляет собой “созревание аффинности” с фаговым отображением (AMPD). В другом предпочтительном варианте полипептид представляет собой антитело и молекула-мишень является антигеном. В другом предпочтительном варианте антитело является анти-IgE и молекула-мишень - IgE.
В более предпочтительном варианте изобретение относится к способу улучшения аффинности анти-IgE антитела Е-25 путем замещения остатка 32 Asp VL CDR-L1 на Glu, наряду с модификацией остатков 27 Gln, 28 Ser и 31 Туr VL CDR-L1 на Lys, Pro и Gly соответственно. Еще в другом более предпочтительном варианте Е-25 анти-IgE антитело имеет дополнительные модификации в остатках VH CDR2: 53 Thr на Lys, 55Asp на Ser, 57 Ser на Glu и 59 Asn на Lys.
В другом варианте изобретение относится к анти-IgE антителу, обладающему улучшенной аффинностью к IgE.
В предпочтительном варианте анти-IgE антитело включает остатки тяжелой и легкой цепи, содержащей фрагменты последовательности, обозначенные “е27” и “е26” на фиг.2. Наоборот, анти-IgE антитело включает полной длины последовательности тяжелой и легкой цепи, обозначенные “Е27” и “Е26” на фиг.12.
Данное изобретение также относится к композициям анти-IgE улучшенной аффинности или его функциональным фрагментам, имеющим фармацевтическое применение. Данное изобретение относится также к производственному изделию, содержащему анти-IgE антитело улучшенной аффинности.
Еще в другом варианте данное изобретение относится к способу уменьшения или ингибирования IgE-опосредованного продуцирования гистамина.
Еще в другом варианте данное изобретение относится к способу лечения и IgE-опосредованных нарушений путем введения антител, описанных в изобретении, или их функциональных фрагментов.
Другие аспекты изобретения будут ясны из следующего детального описания и представленной формулы изобретения.
Краткое описание чертежей
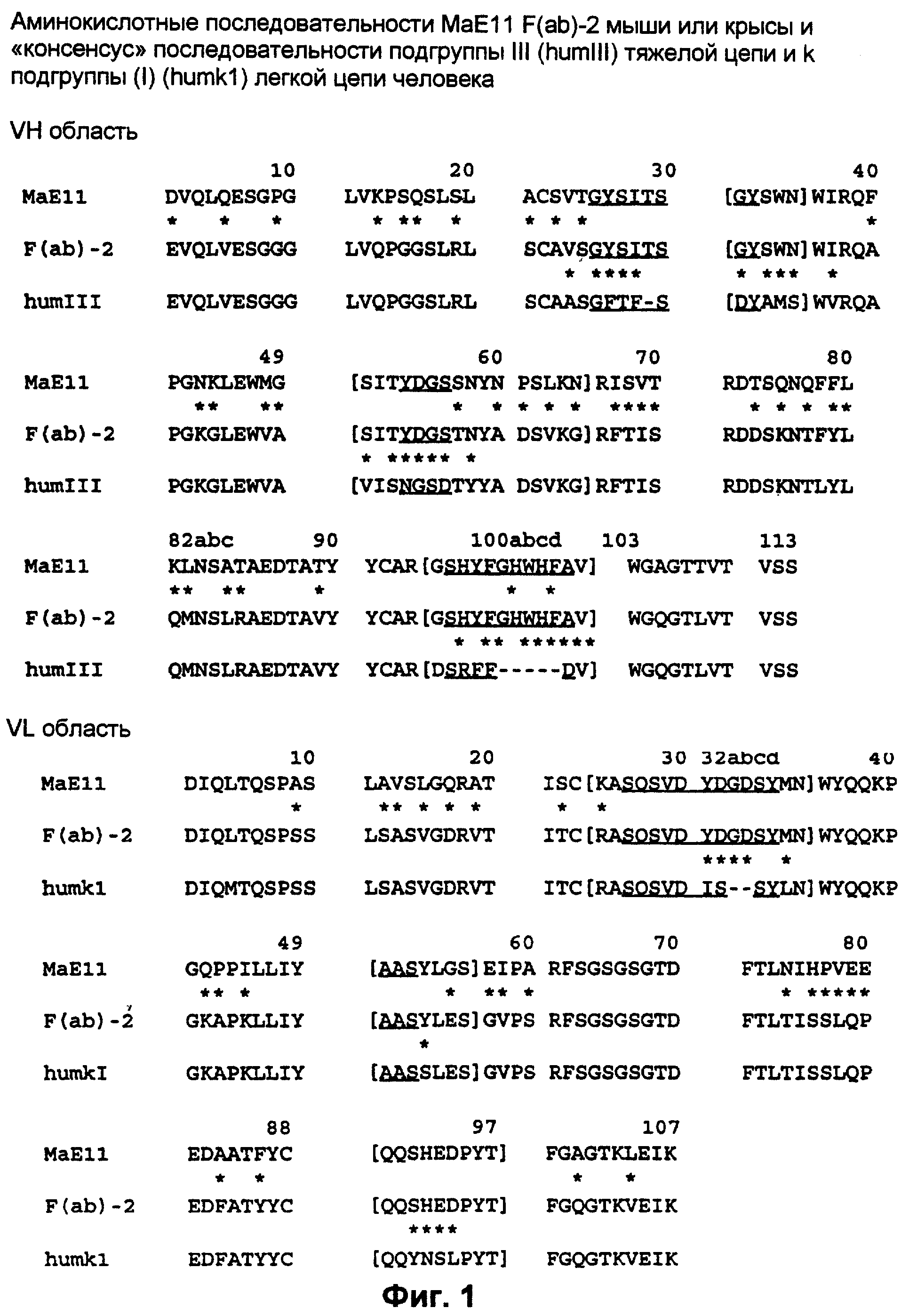
На фиг.1 сравнивают VH и VL области MAEII антитела мыши или крысы, “консенсус”-последовательностей подгруппы III (hum III) тяжелой цепи и подгруппы I (humk1) легкой цепи и фрагмента F(ab)-2, принадлежащего человеческому роду; модифицированный фрагмент антитела человека с CDR остатками и определенные остатки остовной области (остова), модифицированные на мышиные или крысиные.
На фиг.2 сравнивают отличия последовательностей CDR областей легкой цепи и тяжелой цепи для rhuMabe 25, е426 и последовательности е26 и е27. Нумерация остатка - последовательная, в противоположность Кэботу с сотр. Также заметьте, что данные последовательности представляют собой только фрагменты и не являются фактическими остатками полной длины тяжелой и легкой цепи.
Фиг.3 представляет собой график FACS-анализа, показывающего способность исследуемого антитела ингибировать ПТС-конъюгированное IgЕ связывание с а-цепью высокоаффинного FcεRI рецептора, экспрессируемого на СНО 3D10 клетках. Показан процент ингибирования mAb MaEII мышей или крыс (а), отрицательный контроль облагороженного mAb4D5 (


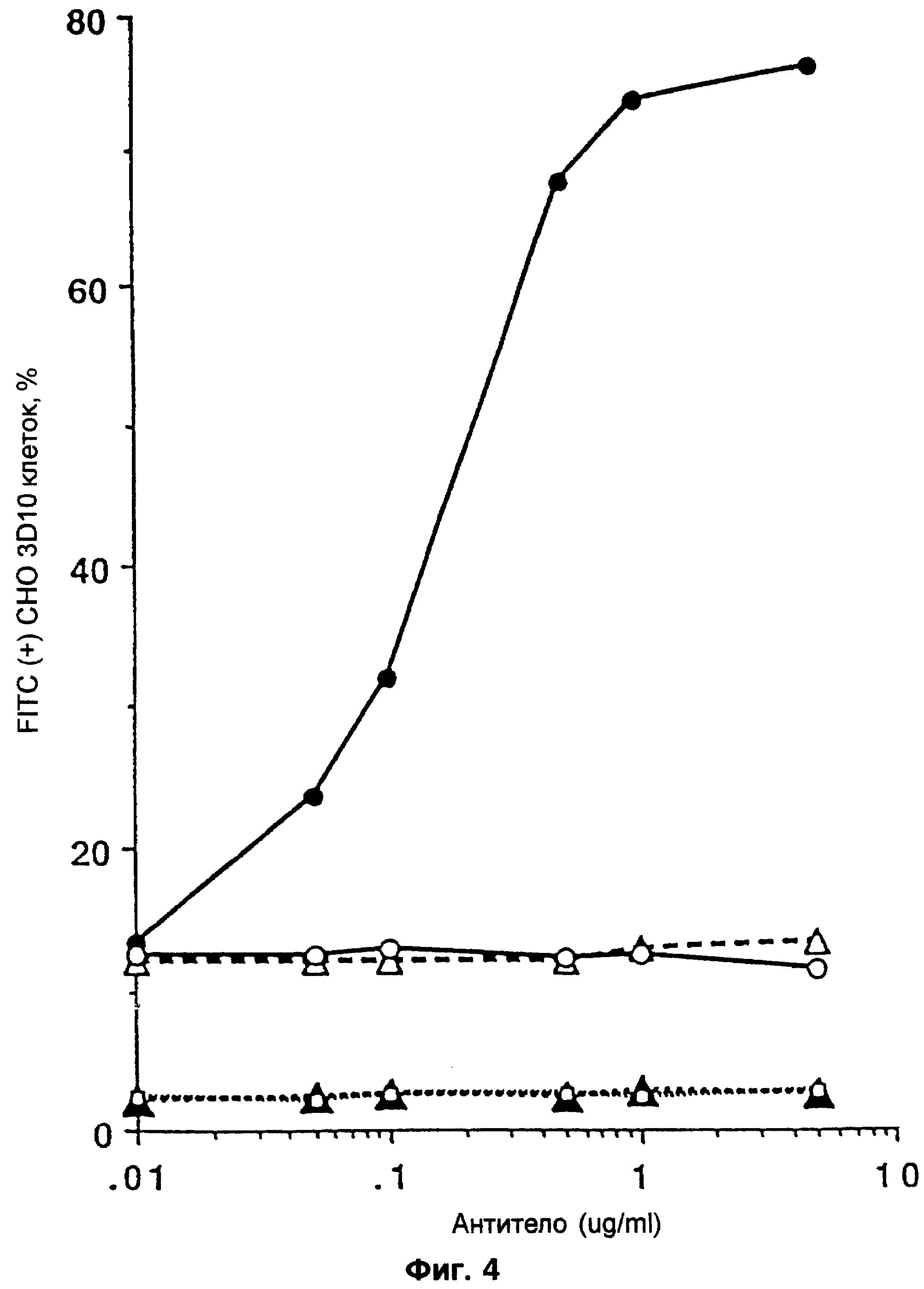
Фиг.4 представляет собой график FACS-анализа, определяющего связывание исследуемого антитела с IgE-нагруженного α-субъединицей высокоаффинного FcεRI рецептора, экспрессируемого на СНО 3D10 клетках. Связывание в процентах с mAb MaEII мыши или крысы (о), облагороженного варианта 12 (


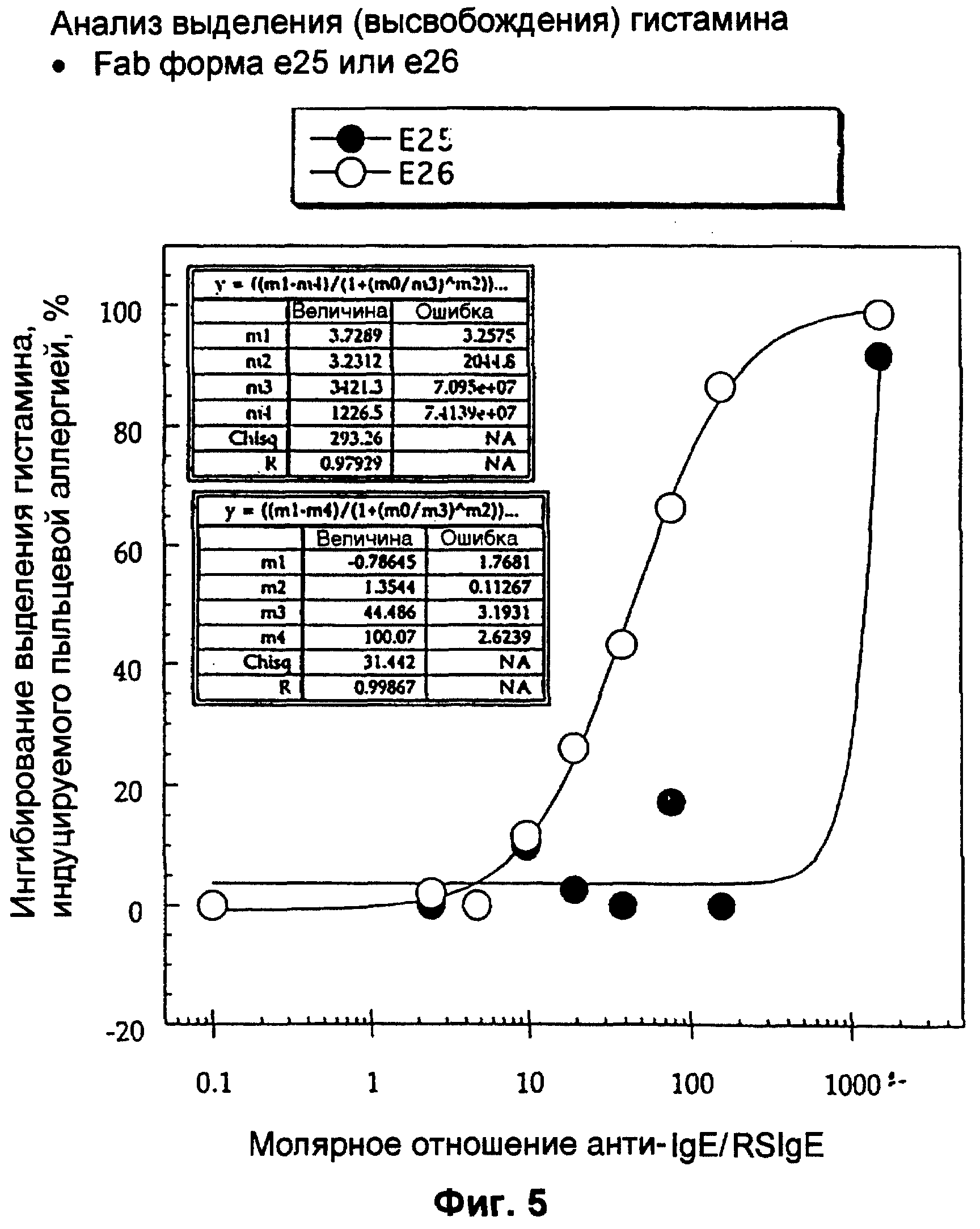
Фиг.5 представляет собой кривые зависимости молярного отношения анти-IgE от ингибирования выделения гистамина, индуцируемого пыльцевой аллергией (в процентах). Приведены Е-25 (•) и Е-26 (о). Результаты указывают на то, что F(ab) форма е26 обладает лучшим ингибированием пыльцевой аллергии при дозозависимом методе с половиной максимального ингибирования при молярном соотношении 44:1 (анти-IgE: RsIgEI).
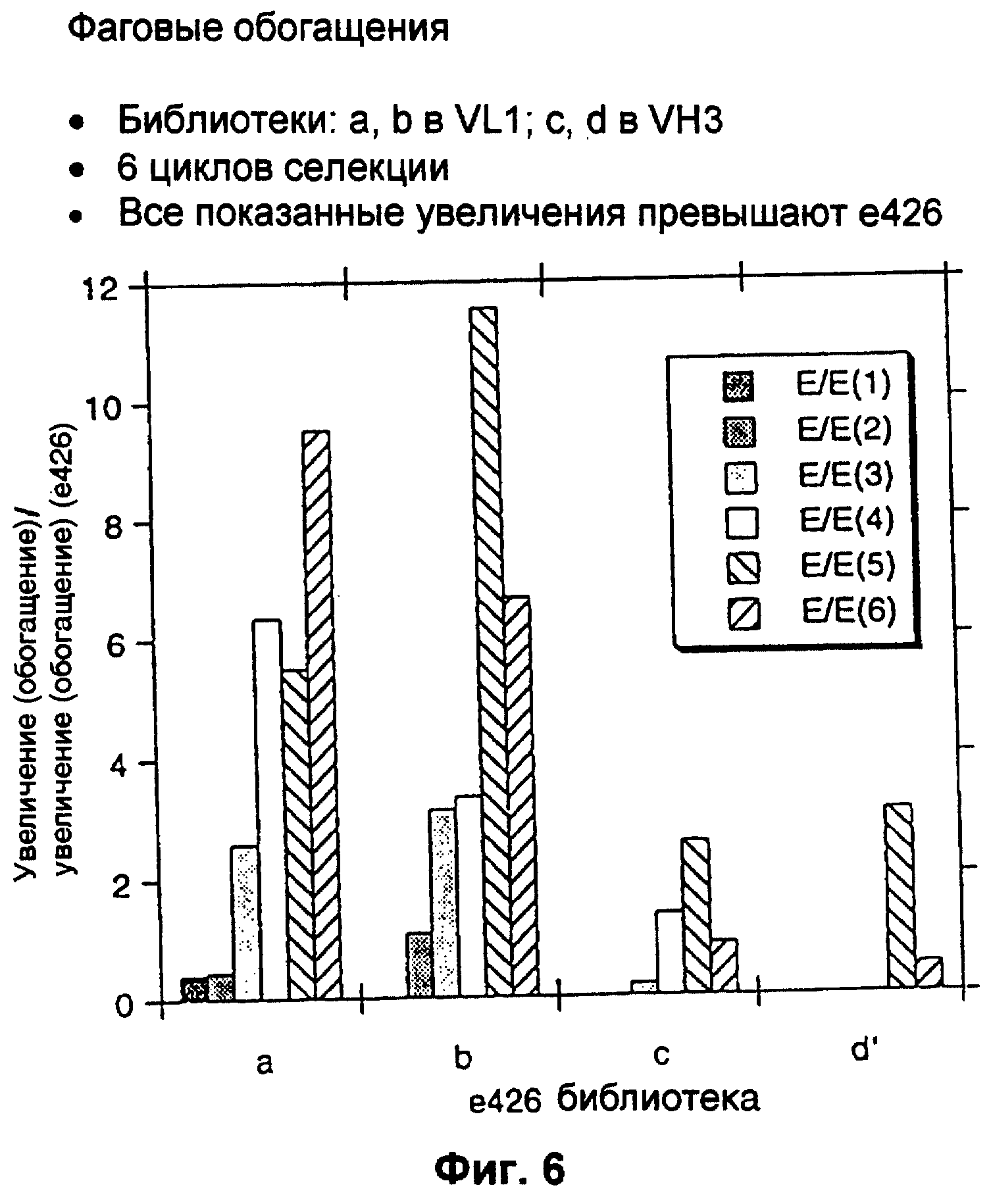
Фиг.6 представляет собой графическое изображение увеличения аффинности после различных циклов селекции по аффинности, описанной в разделе II примера 4. Показано отношение связывающего обогащения (увеличения) для каждого пула к таковому для дикого типа (Emut/Ewt). Результаты указывают, что VL библиотеки (обозначенные “а” и “в”), показывающие последовательно улучшенные относительные обогащения, вплоть до ~10-кратного улучшения по сравнению с диким типом после 5-6 циклов обогащения. Кроме того, VH библиотеки (“с” и “d”), показывающие ~3-кратное улучшение после -3 циклов. Следует иметь в виду, что “а” относится к Fab-фаговой библиотеке, подвергаемой мутации в остатках 27, 28, 30 и 31 CDR-1 VL, в то время как “b” относится к мутациям в 30, 31, 32 и 34, а “с” и “d” являются независимыми F(ab) библиотеками с мутациями в остатках 101, 102, 103, 105 и 107.
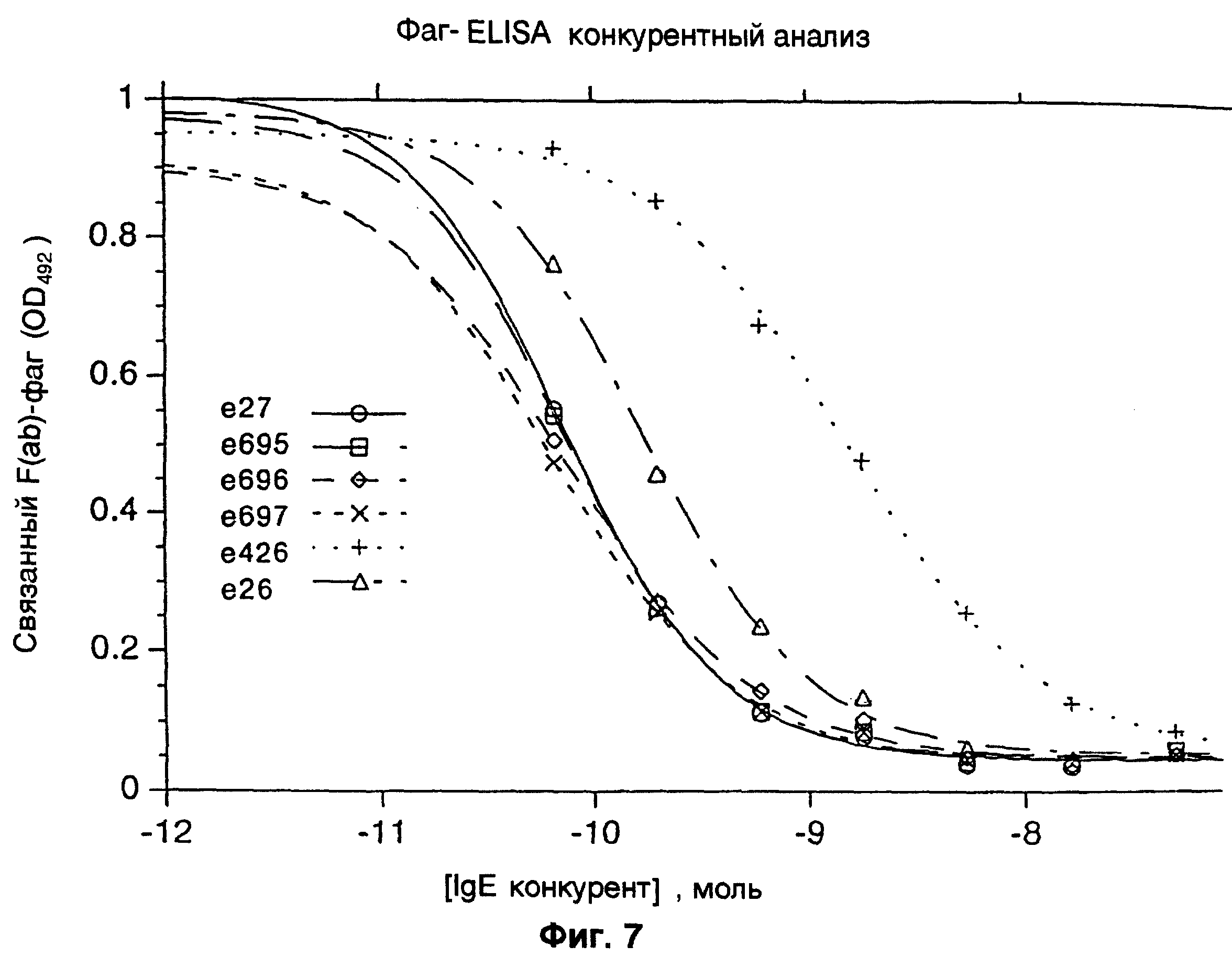
Фиг.7 представляет собой зависимость наблюдаемой оптической плотности от концентрации IgE конкурентного антитела при фаг ELISA конкурентном изучении конечных вариантов от комбинаций VL CDR1 мутаций в е26 с VH с CDR2 мутациями в клонах 235-5,1; 235-5,2; 235-5,3 и 235-5,4, соответственно переименованные в е27, е695, е696 и е697 и описанные в разделе V примера 4.
Фиг.8 представляет собой зависимость абсорбции при 490 нм от различных концентраций е25, е26 и е27 анти-IgE антитела в методе анализа биотина на бактериологических чашках, описанного в разделе VI примера 4.
Фиг.9 демонстрирует F(ab) кажущуюся связывающую аффинность (сродство) е25, е26 и е27, измеренную с помощью BIAcore TM-2000 резонансной системы поверхностного плазмона. 1,5-Серийные разбавления F(ab) фрагментов антитела вводили через IgE чип в PBS/Tween буфере (0,05% Tween-20 в фосфатном забуференном физиологическом растворе) при 25°С, используя скорость потока 20 мкл/мин. Приведенные равновесные константы диссоциации (Kd) вычислены из отношения наблюдаемых kon/koff для каждого Fab варианта.
Фиг.10 демонстрирует последовательность плазмиды р426, которую использовали в качестве темплаты (матрицы) для создания библиотеки специфических “стоп” темплат в примере 4.
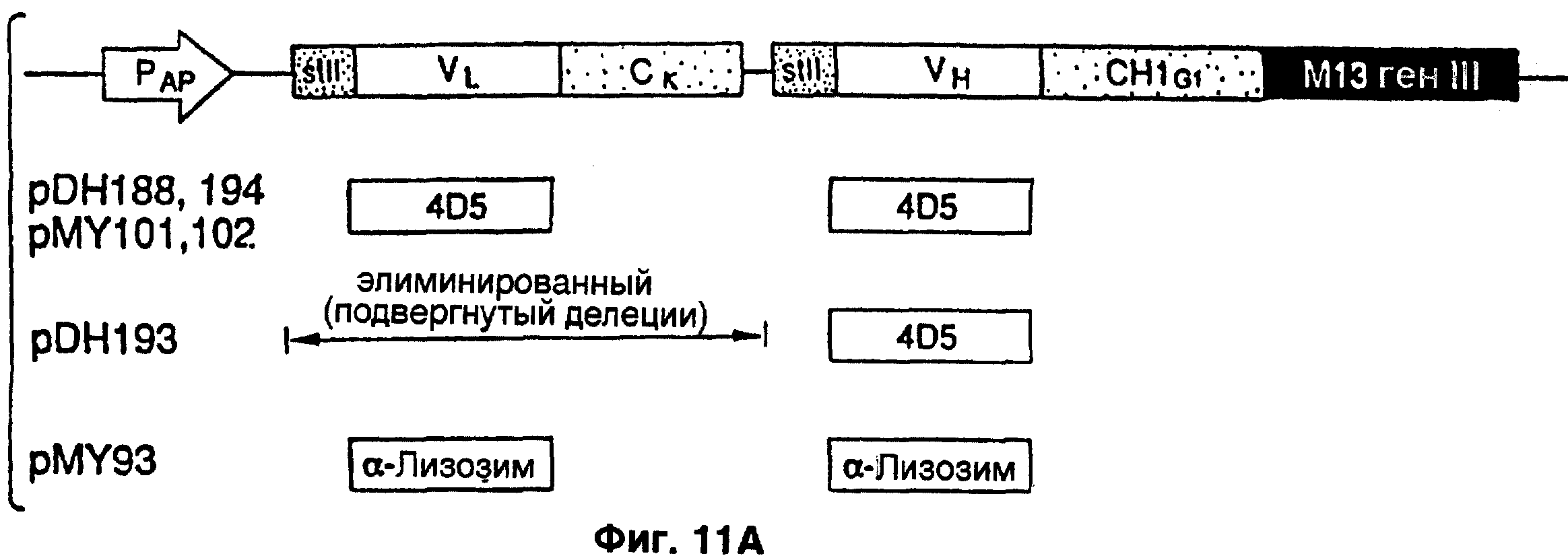
Фиг.11А. Диаграмы вставки плазмиды pDH188, содержащей ДНК, которая кодирует легкую и тяжелую цепь (вариабельной и константной области
1) Fab облагороженного антитела, направленного к HER-2 рецептору. VL и VH являются вариабельными областями легкой и тяжелой цепей соответственно. Ck-константная область “каппа” (κ) легкой цепи человека, CH1G1-первая константная область “гамма” (γ) цепи I человека. Обе кодирующие области начинаются с бактериальной stII сигнальной последовательности.
В. Схематическая диаграмма целой плазмиды pDH188, содержащей вставку, описанную в 11А. После трансформации плазмиды в Е. coli SR101 клетках и прибавления фаг-помощника, плазмида упаковывается в фаговые корпускулы. Некоторые из этих частиц (корпускул) обнаруживают Fab-p III слияние (где pIII представляет собой протеин, кодируемый М13 геном III ДНК).
Фиг.12 изображает полную длину остатков тяжелой и легкой цепи анти-IgE антител Е25, Е26 и Е27.
Фиг.13 представляет F(ab) фрагменты анти-IgE антител е26 и е27.
Фиг.14 представляет sFV фрагменты анти-IgE антител е26 и е27.
Фиг.15 представляет F(ab)'2 фрагменты анти-IgE антител е26 и е27.
SEQ ID No.1 представляет последовательность экспрессирующей плазмиды е426, используемой в изобретении, также приведенной на фиг.10.
SEQ ID No.2 представляет последовательность вариабельной области тяжелой цепи МаЕII, приведенной на фиг.1.
SEQ ID No.3 представляет последовательность вариабельной области тяжелой цепи F(ab)-2, приведенной на фиг.1.
SEQ ID No.4 представляет последовательность вариабельной области тяжелой цепи hum11, приведенной на фиг.1.
SEQ ID No.5 представляет последовательность вариабельной области легкой цепи МаЕII, приведенной на фиг.1.
SEQ ID No.6 представляет последовательность вариабельной области легкой цепи F(ab)-2, приведенной на фиг.1.
SEQ ID No.7 представляет последовательность вариабельной области легкой цепи hum11, приведенной на фиг.1.
SEQ ID No.8 представляет последовательность вариабельной области легкой цепи е26 и е27, приведенной на фиг.2.
SEQ ID No.9 представляет последовательность вариабельной области легкой цепи е426, приведенной на фиг.2.
SEQ ID No.10 представляет последовательность вариабельной легкой цепи е25, приведенной на фиг.2.
SEQ ID No.11 представляет последовательность вариабельной области тяжелой цепи е27, приведенной на фиг.2.
SEQ ID No.12 представляет последовательности вариабельной области тяжелой цепи е25, е26 и е426, приведенные на фиг.2.
SEQ ID No.13 представляет последовательность полной длины вариабельной области легкой цепи е25, как показано на фиг.12.
SEQ ID No.14 представляет последовательность полной длины вариабельной области тяжелой цепи е25, как показано на фиг.12.
SEQ ID No.15 представляет последовательность полной длины вариабельной области легкой цепи е26, как показано на фиг.12.
SEQ ID No.16 представляет последовательность полной длины вариабельной области тяжелой цепи е26, как показано на фиг.12.
SEQ ID No.17 представляет последовательность полной длины вариабельной области легкой цепи е27, как показано на фиг.12.
SEQ ID No.18 представляет последовательность полной длины вариабельной области тяжелой цепи е27, как показано на фиг.12.
SEQ ID No.19 представляет вариабельную область легкой цепи Fab фрагмента е26 и е27, как показано на фиг.13.
SEQ ID No.20 представляет вариабельную область Fab фрагмента тяжелой цепи е26, как показано на фиг.13.
SEQ ID No.21 представляет вариабельную область Fab фрагмента тяжелой цепи е27, как показано на фиг.13.
SEQ ID No.22 представляет sFv фрагмент е26, как показано на фиг.14.
SEQ ID No.23 представляет sFv фрагмент е27, как показано на фиг.14.
SEQ ID No.24 представляет вариабельную область легкой цепи F(ab)'2 фрагмента для е26 и е27, как показано на фиг.15.
SEQ ID No.25 представляет вариабельную область тяжелой цепи F(ab)'2 фрагмента для е26, как показано на фиг.15.
SEQ ID No.26 представляет вариабельную область тяжелой цепи F(ab)'2 фрагмента для е27, как показано на фиг.15.
Подробное описание предпочтительных вариантов
Упомянутые в изобретении отдельные ссылки, патентные заявки и патенты следует рассматривать как литературные ссылки, приведенные в тексте описания.
Определения
Термины, используемые в данной заявке, следует толковать в обычном и типичном смысле, обычно используемом в данной области. Однако заявители желают, чтобы следующим терминам были даны определения, которые приводятся ниже.
Термины “протеин” или “полипептид” предполагается использовать взаимозаменяемо. Они относятся к цепи двух (2) или более аминокислот, которые связаны вместе пептидной или амидной связями, независимо от посттрансляционной модификации (например, гликозилирования или фосфорилирования). Предполагается, в частности, чтобы антитела охватывались данным определением.
Полипептиды данного изобретения могут включать более одной субъединицы, где каждая субъединица кодируется отдельной ДНК последовательностью.
Фразу “практически идентичный”, что касается полипептидной последовательности антитела, следует толковать как антитело, проявляющее по крайней мере, 70%-ную, предпочтительно 80%-ную, более предпочтительно 90%-ную и наиболее предпочтительно 95%-ную идентичность последовательности относительно полипептидной последовательности. Термин в отношении последовательности нуклеиновой кислоты следует толковать как последовательность нуклеотидов, проявляющих, по крайней мере, 85%-ную, предпочтительно 90%-ную, более предпочтительно 95%-ную и наиболее предпочтительно 97%-ную идентичность последовательности относительно последовательности нуклеиновой кислоты. Для полипептидов длина последовательностей сравнения обычно составляет, по крайней мере, 25 аминокислот. Для нуклеиновых кислот длина должна обычно составить по крайней мере 75 нуклеотидов.
Понятие “идентичность” или “гомологичность” следует толковать как означающее процентное содержание остатков аминокислот в кандидатной последовательности, которые идентичны остаткам соответствующей последовательности, с которой ее сравнивают, после сравнения последовательностей и введения “брешей”, если необходимо достичь максимального процента идентичности для полной последовательности и не учитывая любые консервативные замещения как часть идентичности последовательности. Ни N- или С-концевой удлиняющей, ни инсерционные сегменты не следует толковать как уменьшающие идентичность или гомологичность. Методы и компьютерные программы для сравнения хорошо известны. Идентичность последовательности можно определить, используя программное обеспечение для анализа последовательности (например, Sequence Analysis Software Package, Genetics Computer Group, University of Wisconsin Biotechnology Center, 1710 University Ave., Madison, WI 53705). Данное программное обеспечение подходит для подобных последовательностей путем определения степени гомологичности для разнообразных замещений, делеций (элиминирований) и других модификаций.
Термин “антитело” используется в самом широком смысле и, в частности, охватывает моноклональные антитела (включая моноклональные тела полной длины), поликлональные, мультиспецифические (например, биспецифические антитела) и фрагменты антител (например, Fab, F(ab')2 и Fv), до тех пор пока они проявляют требуемую биологическую активность. Антитела (Abs) и иммуноглобулины (Igs) являются гликопротеинами, имеющими одинаковые структурные характеристики. В то время как антитела проявляют связывающую специфичность к специфическому антигену, иммуноглобулины включают и антитела и другие подобные антителам молекулы, которые не обладают антигенной специфичностью. Полипептиды последнего типа, например, продуцируются с низкой концентрацией лимфатической системой и с увеличенной концентрацией миеломами.
Нативные антитела и иммуноглобулины обычно представляют собой гетеротетрамерные гликопротеины с молекулярным весом около 150000 дальтон, состоящие из двух идентичных легких (L) и двух идентичных тяжелых (Н) цепей. Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, в то время как количество дисульфидных связей изменяется между тяжелыми цепями различных изотипов иммуноглобулина. Каждая тяжелая и легкая цепь также имеет регулярно расположенные дисульфидные мостики внутри цепи. Каждая тяжелая цепь имеет на одном конце вариабельную область (VH), за которой следует ряд константных областей. Каждая легкая цепь имеет вариабельную область на одном конце (VL) и константную область на ее другом конце. Константную область легкой цепи сравнивают с первой константной областью тяжелой цепи, и вариабельную область легкой цепи сравнивают с вариабельной областью тяжелой цепи. Полагают, что определенные остатки аминокислот образуют поверхность раздела между вариабельными областями легкой и тяжелой цепей (Clothia et al., J. Mol. Вiоl. 186, 651-660 (1985); Novothny, Haber, Proc. Natl. Acad. Sci. USA 82, 4592-4596 (1985)).
“Изолированное” антитело является антителом, которое было идентифицировано и отделено и/или выделено из компонента окружающей среды, в которой его продуцировали. Контаминантные (примесные) компоненты при его продуцировании являются вещества, которые будут мешать диагностическим или терапевтическим применениям антитела и могут включать ферменты, гормоны и другие напоминающие протеин и протеин не напоминающие подобные растворенные вещества. В предпочтительных вариантах антитело будут очищать, измеряя чистоту с помощью, по крайней мере, трех разных методов: 1) до более чем 95 мас.% антитела, как определено по методу Лоури, и наиболее предпочтительно более 99 мас.%;
2) до степени, достаточной для получения, по крайней мере, 15 остатков N-концевой или внутренней аминокислотной последовательности с использованием быстровращающегося чашечного секвенатора; или 3) до однородности с помощью SDS-PAGE в восстанавливающих или невосстанавливающих условиях, применяя Кумасси синий или предпочтительно краситель из серебра. Изолированное антитело включает антитело in situ внутри рекомбинантных клеток, до тех пор пока будет присутствовать, по крайней мере, один компонент природного окружения антитела. Однако обычно изолированное антитело должно получаться с помощью, по крайней мере, одной стадии очистки.
“Видозависимое антитело”, например, антитело млекопитающего против IgE человека представляет собой антитело, которое обладает более сильным связывающим сродством к антигену из первого вида млекопитающего, чем оно имеет для гомологии данного антигена из второго вида млекопитающего. Обычно видозависимое антитело “связывается специфично” с антигеном, человека (т.е. имеет величину связывающего сродства (аффинности) (Kd) не более чем ~1×10-7 М, предпочтительно не более чем 1×10-8 М и наиболее предпочтительно не более чем ~1×10-9М), но имеет связывающее сродство к гомологии антигена из второго вида млекопитающего, но не человека, которое составляет, по крайней мере, в 50 раз, или, по крайней мере, в 500 раз, или, по крайней мере, в 1000 раз слабее, чем связывающее сродство к антигену человека. Видозависимое антитело может быть любым из разных типов антител, как указано выше, но предпочтительно является облагороженным антителом или антителом человека.
Термин “мутант антитела” относится к аминокислотной последовательности варианта антитела, в котором модифицированы один или несколько аминокислотных остатков. Такие мутанты имеют идентичность последовательности менее 100% или сходство с аминокислотной последовательностью, составляющей, по крайней мере, 75% идентичности аминокислотной последовательности или сходство с аминокислотной последовательностью или вариабельной области тяжелой или легкой цепи антитела, более предпочтительно, по крайней мере, 80%, более предпочтительно, по крайней мере, 85%, более предпочтительно, по крайней мере, 90% и наиболее предпочтительно, по крайней мере, 95%. Так как способ изобретения равно применим к полипептидам, антителам и их фрагментам, данные термины иногда применяются взаимозаменяемо.
Термин “вариабельная” в контексте вариабельная область антитела относится к факту, что некоторые (определенные) части вариабельных областей широко отличаются среди антител по последовательности и применяются в связывании и специфичности каждого отдельного антитела к ее отдельному антигену. Однако разнообразие не распределяется равномерно по вариабельным областям антител. Оно концентрируется в трех сегментах, называемых гипервариабельными участками (complementarity determining regions, CDRs) известные так же, как гипервариабельные участки в легкой и тяжелой цепи вариабельных областей. Имеются, по крайней мере, две методики для определения CDRs:
(1) подход, основанный на разнообразии последовательности перекрестных видов (т.е. Kabat et al. Sequences of Proteins of Immunological Interest (National Institute of Health, Bethesda, MD 1987); и
(2) подход, основанный на кристаллографических исследованиях комплексов антиген-антитело (Chothia, С. et al., Nature 342:877 (1989)). Что касается антитела заявителя -анти-IgE, некоторые CDRs определяли комбинированием подходов Kabat et al., и Chothia et al. Более высоко сохраненные части вариабельных областей называются остовной областью (framework, FR). Вариабельные области нативных тяжелой и легкой цепей, включают четыре FR области, в значительной степени принимающих β-складчатую конфигурацию, связанную с тремя CDRs, которые образуют петли, и в некоторых случаях, образуя часть β-складчатой конфигурации. CDRs в каждой цепи держатся вместе в непосредственной близости от FR областей и с CDRs от другой цепи способствуют образованию антигенсвязывающего центра антител (см. Kabat et al.). Константные области непосредственно не вовлекаются в связывание антитела с антигеном, но проявляют различную эффекторную функцию, например участие антитела в антителозависимой клеточной токсичности.
Термин “фрагмент антитела” относится к части антитела полной длины, обычно к антигенсвязывающей или вариабельной области. Примеры фрагментов антитела включают Fab, Fab', F(ab')2 и Fv-фрагменты. Папаиновый гидролизат антитела продуцирует два идентичных антигенсвязывающих фрагмента, называемые Fab-фрагментом, каждый с единственным антигенсвязывающим центром и остаточный (осадочный) “Fc” фрагмент, называемый так за его способность легко кристаллизоваться. Обработка пепсином дает F(ab')2 фрагмент, который имеет два антигенсвязывающих фрагмента, которые способны перекрестно связывать антиген и другой остаточный фрагмент (который называется pFc'). Дополнительные фрагменты могут включать диатела, линейные антитела, молекулы антител с одной цепью и мультиспецифические антитела, образованные из фрагментов антитела. “Функциональный фрагмент”, что касается антител, относится к Fv, F(ab) и F(ab')2 фрагментам.
“Fv” фрагмент является минимальным фрагментом антитела, который содержит полный (законченный) сайт узнавания антигена и связывающий сайт. Данная область содержит димер одной тяжелой и одной легкой цепи вариабельной области в устойчивой нековалентной ассоциации (VH-VL димер). Она находится в такой конфигурации, что три CDRs каждой вариабельной области взаимодействуют для определения антигенсвязывающего центра на поверхности VH-VL димера. Совместно шесть CDRs придают антигенсвязывающую специфичность антителу. Однако даже отдельная вариабельная область (или половина Fv, включающая только три CDRs, специфичных к антигену) обладает способностью узнавать и связывать антиген, хотя и с низшей аффинностью, чем полный связывающий сайт.
Fab фрагмент [также обозначенный как F(ab)] также содержит константную область легкой цепи и первичную константную область (СH1) тяжелой цепи. Fab' фрагменты отличаются от Fab фрагментов добавлением нескольких остатков на карбоксильном конце тяжелой цепи СН1 области, включая один или несколько цистеинов из шарнирной области антитела. Fab'-SH является обозначением в данном изобретении Fаb'-фрагмента, в котором остаток(ки) цистеина константных областей имеет свободную тиольную группу. F(аb')-фрагмент продуцируют расщеплением дисульфидной связи у цистеинов шарнирной области F(ab')2 продукта пепсинового гидролизата. Специалистам известны дополнительные химические соединения фрагментов антитела.
Легкие цепи антител (иммуноглобулина) из любого вида позвоночных можно приписать одному из двух несомненно различных типов, называемых каппа (κ) и лямда (λ) в зависимости от аминокислотных последовательностей их константной области.
В зависимости от аминокислотных последовательностей константной области их тяжелых цепей “иммуноглобулины” можно отнести к различным классам. Существуют, по крайней мере, пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM и несколько из них можно дополнительно разделить на подклассы (изотипы), например IgG-1, lgG-2, IgG-3 и IgG-4; IgA-1 и IgA-2. Константные области тяжелых цепей, которые относятся к различным классам иммуноглобулинов, называются α, δ, ε, γ и μ соответственно. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны. Предпочтительным иммуноглобулином для применения в данном изобретении является иммуноглобулин Е.
Термин “моноклональное антитело”, как он используется в данном изобретении, относится к антителу, полученному из популяции, по-существу, гомогенных антител, т.е. индивидуальные антитела, содержащие популяцию, являются идентичными, за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела высокоспецифичны, причем направлены к отдельной области детерминанты. Кроме того, в противоположность препаратам обычных (поликлональных) антител, которые обычно включают различные антитела, направленные к разным детерминантам (эпитопам), каждое моноклональное антитело направлено к отдельной детерминанте на антигене. В дополнение к их специфичности, моноклональные антитела выгодны тем, что они синтезируются гибридомной культурой, незагрязненной другими иммуноглобулинами. Определение “моноклональный” указывает на характер антитела, поскольку было получено из практически гомогенной популяции антител, и не следует истолковывать как требующие продуцирования антитела определенным способом. Например, моноклональные антитела, используемые в данном изобретении, можно получать гибридомным методом, впервые описанным Kohler и Milstein, Nature 256:495 (1975) или можно получать рекомбинантными методами, например, как описано в U.S. Pat. No. 4816567. Моноклональные антитела, используемые в данном изобретении, можно также отделять от фаговых библиотек антител, применяя методику, описанную Clackson et al., Nature 352: 624-628 (1991), а также Marks et al., J. Mol. Biol. 222: 581-597 (1991).
Моноклональные антитела, конкретно, включают “химерные” антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных из отдельного вида или принадлежащих отдельному классу или подклассу антитела, в то время как остаток цепи(ей) идентичен или гомологичен соответствующим последовательностям в антителах, полученных из другого вида, или принадлежащих другому классу или подклассу антитела, а также фрагментам этих антител, до тех пор пока они проявляют требуемую биологическую активность (U.S. Pat. No. 4816567); Morrison et al., Proc. Natl. Acad. Sci. 81:6851-6855 (1984).
“Облагороженные” формы антител, не принадлежащих к человеческому роду (например, относящиеся к мышам или крысам), представляют собой гибридные иммуноглобулины, цепи иммуноглобулина или его фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие последовательности антител), которые содержат минимальную последовательность, полученную из не принадлежащего человеческому роду иммуноглобулина. Большей частью облагороженные антитела являются иммуноглобулинами человека (реципиентное антитело), в которых остатки из гипервариабельного участка (CDR) реципиента замещены остатками из CDR, не принадлежащего человеческому роду (донорское антитело), например мыши, крысы или кролика, имеющих требуемую специфичность, сродство и емкость. В некоторых примерах остатки Fv остовной области иммуноглобулина человека замещены соответствующими не принадлежащими человеческому роду остатками. Кроме того, облагороженное антитело может включать остатки, которых нет ни в реципиентном антителе, ни в импортируемой CDR последовательности или последовательности остовной области. Данные модификации предприняты для дополнительной очистки и оптимизации характеристики антитела. Обычно облагороженное антитело должно содержать практически все, по крайней мере, одну или обычно две вариабельные области, в которых все или практически все CDR области соответствуют таковым для иммуноглобулина, не принадлежащего к человеческому роду, и все или практически все FR области являются “консенсус” (обобщающей типичной) последовательностью иммуноглобулина человека. Оптимально, если облагороженное антитело также будет включать, по крайней мере, часть константной области иммуноглобулина (Fc), обычно область иммуноглобулина человека. Более подробно см.: Jones et al., Nature 321: 522-525 (1986); Reichmann et al., Nature 332: 323-329 (1988); Presta, Curr. Op. Struct. Biol. 2: 593-596 (1992).
Фрагменты “отдельной цепи Fv” или “sFv” антитела включают VH и VL области антитела, где данные области присутствуют в одной полипептидной цепи. Обычно Fv полипептид дополнительно включает полипептидный линкер между VH и VL-областями, который дает возможность sFv образовать нужную структуру для связывания антигена. Обзор по sFv см. Pluckthun in The Pharmacology of Monoclonal Antibodies, Vol. 113, Rosenburg and Moore eds. Springer-Verlag, New York, pp.269-315 (1994).
Термин “диатело” относится к малым фрагментам антитела с двумя антигенсвязывающими центрами, фрагменты которых включают вариабельную область тяжелой цепи (VH), связанную с вариабельной областью легкой цепи (VL) в той же полипептидной цепи (VH-VL). При использовании линкера, который слишком короткий для того, чтобы произошло спаривание между двумя областями на одной и той же цепи, области заставляют спариваться с комплементарными областями другой цепи и создавать два антигенсвязывающих центра. Диатела более подробно описаны, например, в ЕР 404097; WO 93/11161 и Hollinger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993).
Фраза “функциональный фрагмент или аналог” антитела представляет собой соединение, обладающее качественной биологической активностью, такой же как и антитело полной длины. Например, функциональный фрагмент или аналог анти-lgE антитела является антителом, которое может связываться с IgE иммуноглобулином таким образом, чтобы предотвратить или существенно уменьшить способность такой молекулы связываться с высокоаффинным рецептором FcεRI.
Понятия “аминокислота” и “аминокислоты” относятся ко всем встречающимся в природе L-α-аминокислотам. Идентифицируют аминокислоты, как описано в разделе А. Получение антитела: (IV) Генерирование мутантных антител. Термин “вариант аминокислоты” относится к молекулам, имеющим некоторые отличия в их аминокислотных последовательностях по сравнению с нативной аминокислотной последовательностью.
“Замененные” варианты являются вариантами, из которых, по крайней мере, один аминокислотный остаток в нативной последовательности удален и на это место в том же самом положении введена другая аминокислота. Замещения могут быть одиночными, когда замещается только одна аминокислота в молекуле или они могут быть множественными, когда в одной и той же молекуле замещаются две или несколько аминокислот. “Вставленные” варианты являются вариантами с вставленными одной или несколькими аминокислотами, непосредственно примыкающими к аминокислоте в определенном положении в нативной последовательности. Непосредственно примыкающей к аминокислоте означает связанный или с α-карбоксильной или α-аминогруппой аминокислоты. “Элиминированные” (делетиционные) варианты являются вариантами с удаленной одной или несколькими аминокислотами в нативной аминокислотной последовательности. Обычно элиминированные варианты должны иметь одну или две аминокислоты, удаленные в определенной части молекулы.
Термины “клетка”, “линия клеток” и “культура клеток” используются равнозаменяемо, и все эти обозначения включают потомство. Также очевидно, что все потомства не должны быть в точности идентичными по ДНК вследствие преднамеренных или ненамеренных мутаций. Включены мутантные потомства, которые имеют одинаковую функцию или биологическое свойство, как проверено для обычной трансформированной клетки.
“Клетки-хозяева”, используемые в данном изобретении, обычно являются прокариотическими или эукариотическими хозяевами. Примеры соответствующих клеток-хозяев описаны в разделе В. Векторы, клетки-хозяева и рекомбинантные методы: (VII) Селекция и трансформирование клеток-хозяев.
“Трансформация” означает введение ДНК в организм с тем, чтобы ДНК реплицировалась или как экстрахромосомный элемент или с помощью хромосомной интеграции.
“Трансфекция” относится к поглощению экспрессирующего вектора клеткой-хозяином независимо от того, экспрессируются ли в действительности любые кодирующие последовательности.
Термин “трансфектированная клетка-хозяин” и “трансформированная” относятся к введению ДНК в клетку. Клетка называется “клетка-хозяин” и может быть прокариотической или эукариотической. Типичные прокариотические клетки-хозяева включают различные штаммы e.coli.
Типичными эукариотическими клетками-хозяевами являются млекопитающие, как, например, яичник китайского хомячка или клетки человеческого происхождения. Введенная последовательность ДНК может быть из аналогичного клетке-хозяину вида или из отличного от клетки-хозяина вида, или это может быть последовательность гибридной ДНК, содержащей некоторые чужеродные и некоторые гомологичные ДНК.
Термин “способный к репликации экспрессирующий вектор” и “экспрессирующий вектор” относятся к части ДНК, обычно двухцепочечной, которую можно ввести в часть чужеродной ДНК. Чужеродную ДНК определяют как гетерологичную ДНК, не встречающуюся в природе в клетке-хозяине. Вектор используют для транспортировки чужеродной или гетерологичной ДНК в соответствующую клетку-хозяина. Если в клетке-хозяине вектор может реплицировать независимо от хромосомной ДНК хозяина, то могут генерироваться несколько копий вектора и введенной (чужеродной) ДНК.
Термин “вектор” означает конструкцию ДНК, содержащую последовательность ДНК, которая непосредственно связана с соответствующей контрольной последовательностью, способной осуществлять экспрессию ДНК в соответствующем хозяине. Такие контрольные последовательности включают промотор для осуществления транскрипции и произвольную операторную последовательность для контроля транскрипции; последовательность, кодирующую соответствующие рибосом-связывающие участки мРНК, и последовательности, которые контролируют окончание (терминацию) транскрипции и трансляции. Вектор может быть плазмидой, фаговой корпускулой или просто потенциальной геномной вставкой. Однажды трансформированный в соответствующий хозяин вектор может реплицировать и функционировать независимо от генома хозяина или может в некоторых случаях интегрироваться в геном. В данном определении “плазмида” и “вектор” иногда используются как взаимозаменяемые понятия, поскольку плазмида в настоящее время является наиболее часто используемой формой вектора. Однако изобретение предполагает включить другую форму вектора, которая выполняет эквивалентную функцию, тем, которые уже известны или станут известными в данной области. Типичные экспрессирующие векторы для экспрессии клеточной культуры млекопитающих базируются, например, на pRK5 (ЕР 307247), pSV16B (WO 91/08291) и pVL1392 (Pharmingen).
“Липосома” представляет собой маленький пузырек, состоящий из липидов различных видов, фосфолипидов и/или поверхностно-активного вещества, который пригоден для доставки лекарственного средства млекопитающим (например, мутанты антитела, описанные в данном изобретении, и, возможно, химиотерапевтический агент). Компоненты липосомы обычно располагаются в двойном слое подобно липидному устройству биологических мембран.
Выражение “контрольные последовательности” относится к последовательностям ДНК, необходимым для экспрессии операбельно связанной кодирующей последовательности в отдельном организме хозяина. Контрольные последовательности, которые пригодны для прокариотов, включают, например, промотор, возможно операторную последовательность и рибосомсвязывающий сайт. Известно, что эукариотические клетки используют промоторы, сигналы полиаденилирования и энхансеры.
Молекула “изолированной” нуклеиновой кислоты является молекула нуклеиновой кислоты, которую определяют и отделяют от, по крайней мере, одной контаминантной молекулы нуклеиновой кислоты, с которой она обычно связана в природном источнике нуклеиновой кислоты антитела. Изолированная молекула нуклеиновой кислоты отличается от формы или окружения, в котором она находится в природе. Поэтому молекулы изолированной нуклеиновой кислоты отличны от молекулы нуклеиновой кислоты, которая существует в природных клетках. Однако изолированная молекула нуклеиновой кислоты включает молекулу нуклеиновой кислоты, содержащейся в клетках, которые обычно экспрессируют антитело, где, например, молекула нуклеиновой кислоты находится в хромосомном расположении, отличном от расположения в природных клетках.
Нуклеиновая кислота “непосредственно (операбельно) связана”, когда ее помещают в функциональную зависимость с последовательностью другой нуклеиновой кислоты. Это может быть ген и регуляторная последовательность(и), которые связаны таким образом, чтобы допускать экспрессию гена, когда соответствующие молекулы (например, протеины активатора транскрипции) связываются с регуляторной последовательностью(ями). Например, ДНК предпоследовательности или секреторного лидера непосредственно связывается с ДНК полипептида, если он экспрессирует как предпротеин, который участвует в секреции полипептида; промотор или энхансер непосредственно связывается с кодирующей последовательностью, если она влияет на транскрипцию последовательности; или рибосомсвязывающий сайт непосредственно связывается с кодирующей последовательностью, если она влияет на транскрипцию последовательности; или рибосомсвязывающий сайт непосредственно связывается с кодирующей последовательностью, если она располагается так, чтобы облегчить трансляцию. Обычно “непосредственно (операбельно) связанный” означает, что последовательности ДНК, будучи связанными, являются смежными (соприкасающимися) и в случае секреторного лидера - смежными (соприкасающимися) в фазе считывания. Однако энхансеры не должны быть смежными (соприкасающимися). Соединение достигается лигированием (сшиванием) в удобных сайтах рестрикции. Если таких сайтов не существует, используются синтетические олигонуклеотидные адаптеры или ликеры в соответствии с принятой практикой.
“Лечение” относится как к терапевтическому лечению, так и профилактическим и предохраняющим мероприятиям. Те, которым необходимо лечение, включают тех, у которых уже имеются расстройства, а также тех, у которых расстройства необходимо предотвратить.
“Расстройство” представляет какое-либо состояние, которое улучшается при лечении полипептидом. Оно включает хронические и острые расстройства или болезни, включающие такие патологические состояния, к которым предрасположены млекопитающие, о которых идет речь.
Термин “иммуносупрессивный агент”, как он используется в данном изобретении для прикладной терапии, относится к веществам, которые действуют для подавления или маскирования иммунной системы хозяина, в которой трансплантат трансплантируется. Он должен включать вещества, которые подавляют продуцирование цитокина, регулируют по типу отрицательной связи или подавляют экспрессию аутоантигена или маскируют МНС антигены. Примеры таких агентов включают 2-амино-5-арил-5-замещенные пиримидины (см. U.S. Pat. No. 4665077); азатиоприн (или циклофосфамид в случае побочной реакции на азатиоприн); бромкриптин; глутаровый альдегид (который маскирует МНС антигены, как описано в U.S. Pat. No. 4120649); антиидиотипические антитела для МНС антигенов и NHC фрагментов; циклоспорин А; стероиды, такие как гликокортикостероиды, например преднизон, метилпреднизон и дексаметазон; цитокин или антагонисты рецептора цитокина, включающие анти-интерферон-γ, -β, или α-антитела; антитела противоопухолевого некрозного фактора-α ; антитела противоопухолевого некрозного фактора-β; антитела анти-интерлейкина-2 и антитела анти-IL-2 рецептора; анти-L3Т4 антитела; гетерологичный анти-лимфоцитарный глобулин; пан-Т антитела, предпочтительно анти-СD3 или анти-СD4/СD4а антитела; растворимый пептид, содержащий LFA-3 связывающую область (WO 90/08187 опубликованная 26 июля 1990 года); стрептокиназу; TGF-β; стрептодорназу; РНК или ДНК от хозяина; FK506; RS-61443; дезоксиспергуалин; рапамицин; Т-клеточный рецептор (U.S. Pat. No. 5114721); фрагменты Т-клеточного рецептора (Offner et al., Science 251: 430-432 (1991); WO 90/11294 и WO 91/01133); и антитела Т-клеточного рецептора (ЕР 340109), например Т10В9. Данные агенты вводят в одно и то же время или в раздельные времена с СD11а антителом и применяют в тех же или меньших дозах, чем ранее было известно. Предпочтительный дополнительный иммуносупрессивный агент должен зависеть от многих факторов, включая тип лечимого расстройства, включая тип осуществляемой трансплантации, а также историю болезни больного, но общее предпочтение отдается агенту, который выбирают из циклоспорина А, глюкокортикостероида (наиболее предпочтителен преднизон или метилпреднизолон), ОКТ-3 моноклонального антитела, азатиоприна, бромкриптина, гетерологического анти-лимфоцитарного глобулина или их смеси.
Термины “рак” и “раковый” относятся к физиологическому состоянию или описывают его у млекопитающих, которое обычно характеризуется неконтролируемым клеточным ростом. Примеры рака включают, но не ограничиваются карциномой, лимфомой, бластомой, саркомой и лейкемией. Более частные примеры рака включают сквамозный клеточный рак, мелкоклеточный рак легкого, немелкоклеточный рак легкого, желудочно-кишечный рак, панкреатический рак, глиобластому, цервикальный рак, овариальный рак, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, рак прямой кишки, внутриматочную карциному, карциному слюнной железы, рак почек, почечный рак, рак предстательной железы, рак наружных женских органов, рак щитовидной железы, печеночную карциному и разные типы рака головы и шеи.
“Млекопитающий” с позиции лечения относится к любому животному, классифицируемому как млекопитающее, включая людей, домашних и сельскохозяйственных животных, приматов и животных зоопарка, спортивных или комнатных животных, например собак, лошадей, кошек, коров и т.д.
Термин “эпитоп меченый” при использовании в данном изобретении означает полипептид, слитый с “эпитопной меткой”. Полипептид эпитопной метки имеет достаточно остатков для обеспечения эпитопа, относительно которого можно получить антитело, еще он является достаточно коротким, так что он не влияет на активность полипептида. Предпочтительно то, что эпитопная метка также достаточно уникальна с тем, чтобы антитело практически не давало перекрестную реакцию с другими эпитопами. Соответствующий меченый полипептид обычно имеет, по крайней мере, 6 аминокислотных остатков, обычно 8-50 аминокислотных остатков (предпочтительно 9-30 остатков). Примеры включают flu НА меченый полипептид и его антитело 12СА5 (Field et al., Mol. Cell. Biol. 8: 2159-2165 (1988)); c-myc меченый и 8F9, ЗС7, 6Е10, G4, В7 и 9Е10 антитела (Evan et al., Mol. Cell. Biol. 5 (12): 3610-3616 (1985)); и гликопротеин D (g.D) меченого вируса простого герпеса и его антитело (Paborsky et al., Protein Engineering 3(6): 547-553 (1990)). В некоторых вариантах эпитопная метка является “спасенным рецепторсвязанным эпитопом”.
Используемый в данном изобретении термин “спасенный рецепторсвязанный эпитоп” относится к эпитопу Fc области IgG молекулы (например, IgG1, IgG2, IgG3 или IgG4), который ответственен за увеличение in vivo периода полужизни в кровяном русле IgG молекулы.
Термин "цитотоксичный агент" относится к веществу, которое ингибирует или предупреждает функцию клеток и/или вызывает их разрушение. Термин предназначен для включения радиоактивных изотопов (например, I131, I125, Y90 и Re186), химиотерапевтических агентов и токсинов, например ферментативно активных токсинов бактериального, грибкового, растительного или животного происхождения или их фрагменты.
“Химиотерапевтический агент” представляет химическое соединение, пригодное для лечения рака. Примеры химиотерапевтических агентов включают Адримицин, Доксорубицин, 5-Фторурацил, Арабинозид цитозина ("Ага-С"), Циклофосфамид, Тиотера, Таксотер (Доцетаксел), Булсулфан, Цитоксин, Таксол, Метотрексат, Цисплатин, Мелфалан, Бинбластин, Блеомицин, Этопозид, Ифосфамид, Митомицин С, Митоксантрон, Винкристин, Винорелбин, Карбоплатин, Тенипозид, Дауномицин, Карминомицин, Аминоптерин, Дактиномицин, Митомицин, Эсперамицин (см. U.S. Pat. No. 4675187), Мелфалан и другие родственные азотсодержащие препараты из горчицы.
Понятие “предшественник лекарственного средства” относится к предшественнику или производной форме фармацевтически активного вещества, которое менее токсично к опухолевым клеткам по сравнению с исходным лекарством и способно ферментативно активироваться или превращаться в более активную исходную форму. См., например, Wilman "Prodrugs in Cancer Chemotherapy", Biochemical Society Transactions, 14, pp. 375-382, 615 Meeting, Belfast (1986) и Stella et al., (ed.), "Prodrugs: A Chemical Approach to Targeted Drug Delivery" Directed Drug Delivery, Borchardt et al., (ed.) pp.247-267, Human Press (1985). Предшественники лекарственных средств, описанные в данном изобретении, включают, но не ограничиваются только фосфатсодержащими, тиофосфатсодержащими, сульфатсодержащими, пептидсодержащими, модифицированными D-аминокислотой; гликозилированными, β-лактамсодержащими, возможно замещеннными феноксиацетамидсодержащими или возможно замещенными фенилацетамидсодержащими предшественниками лекарств, 5-фторцитозином или другим 5-фторуридиновым предшественником лекарственных средств, которые могут превращаться в более активные цитотоксические препараты. Примеры цитотоксических препаратов, которые могут дериватизироваться в форму предшественника лекарственного средства, включают, но не ограничиваются химиотерапевтическими средствами, описанными выше.
Слово “метка” относится к детектируемому соединению или составу, который конъюгирует непосредственно или косвенно с антителом. Метка может детектироваться сама (например, радиоизотопные метки или флуоресцентные метки) или, в случае ферментативой метки, могут катализировать химическое изменение субстратного вещества или состава, которое детектируют.
В данном изобретении “твердая фаза” означает безводную матрицу, к которой может прилипать антитело. Пример твердых фаз включает фазы, частично или полностью полученные из стекла (например, стекло с контролируемым размером пор), полисахаридов (например, агароза), полиакриламидов, полистирола, поливинилового спирта и силиконов. В некоторых вариантах, в зависимости от контекста, твердая фаза может включать как раз аналитический планшет; в других - это колонка для очистки (например, колонка аффинной хроматографии). Данный термин включает также прерывистую твердую фазу дискретных частиц, например, описанную в U.S.Pat. No. 4275 149.
Анти-IgE антитело человека означает антитело, которое соединяется с IgE человека таким образом, что оно ингибирует или существенно уменьшает связывание IgE с высокоаффинным рецептором, FcεRI. Предпочтительно данное анти-IgE антитело является Е-25.
Термин “расстройство, связанное с IgE” означает состояние или болезнь, которая характеризуется сверхпродуцированием и/или гиперчувствительностью к иммуноглобулину IgE. Особенно следует включить состояния, связанные с анафилактической гиперчувствительностью и атопическими аллергиями, включая, например, астму, аллергические риниты и конъюнктивиты (сенную лихорадку), экзему, крапивницу и пищевую аллергию. Однако серьезное физиологическое состояние анафилактического шока, обычно вызываемое пчелиным или змеиным укусами или источником лекарственной терапии, также включается в рамки данного термина.
“Созревание аффинности, использующей фаговое отображение” (AMPD) относится к процессу, описанному в работе Lowman et al., Biochemistry 30(45): 10832-10838 (1991), см. также Hawkins et al, J. Mol. Biol. 254: 889-896 (1992). Данный процесс, хотя строго не ограничивается следующим описанием, можно кратко описать так: некоторые сайты гипервариабельной области (например, 6-7 сайтов) мутируют, чтобы генерировать все возможные аминокислотные замещения в каждом сайте. Таким образом генерированные мутанты антитела воспроизводятся в одновалентной форме из волокнистых фаговых корпускул как слияния с продуктом М13 гена III, упакованного внутри каждой корпускулы. Фаг, экспрессирующий разные мутанты, может совершать циклы по кругам связанного отбора, за которым следует изолирование и секвенирование данных мутантов, которые обнаруживают высокую аффинность. Способ также описан в WO 92/09690, опубликованной 11 июня 1992 года. Модифицированная методика, включающая объединенную индикацию аффинности, описана в Cunningham B.C. еt аl., ЕМВО J. 13(11): 2508-2515 (1994).
Способ предлагает метод отбора новых связывающих полипептидов, включающий: а) создание реплицирующего вектора экспрессии, включающего первый ген, кодирующий полипептид, второй ген, кодирующий, по крайней мере, часть природного или дикого типа протеина с фаговой оболочки, где первый и второй гены являются гетеролитическими, и регуляторный элемент транскрипции непосредственно связан с первым и вторым генами, тем самым, образуя слияние гена, кодирующего слитый белок; б) мутация вектора в одном или нескольких выбранных положениях в пределах первого гена, тем самым, формулируя (образуя) семейство родственных плазмид; в) трансформирование соответствующих клеток-хозяев с плазмидами; г) заражение трансформированных клеток-хозяев фаг-помощником, имеющим ген, кодирующий протеин фаговой оболочки; д) культивирование трансформированных зараженных клеток-хозяев в условиях, подходящих для образования рекомбинантных фагемидных корпускул, содержащих, по крайней мере, часть плазмиды и способных трансформировать хозяин; условия регулируются так, чтобы не более чем незначительное количество фагемидных корпускул воспроизводило более одной копии слитого протеина на поверхности корпускулы; ж) контактирование фагемидных корпускул с молекулой-мишенью так, чтобы, по крайней мере, часть фагемидных корпускул связывалась с молекулой-мишенью; и з) отделение фагемидных корпускул, которые связываются, от тех, которые не связываются. Предпочтительно, если метод дополнительно включает трансформирование соответствующих клеток-хозяев с рекомбинантными фагемидными корпускулами (частицами), которые связываются с молекулой-мишенью, и повторение стадий с г) по з) один или несколько раз.
Наоборот, способ включает полипептиды, которые составлены более чем из одной субъединицы, где реплицирующий вектор экспрессии, включающий регуляторный элемент транскрипции, непосредственно связанный с ДНК, кодирующей представляющую интерес субъединицу, соединяют с протеином с фаговой облочки.
Применяемый в данном изобретении термин “фаговая библиотека антитела” относится к фаговой библиотеке, используемой в процессе созревания аффинности, как описано выше в Hawkins et. al., J. Mol. Biol. 254: 889-896 (1992) и в Lowman et al., Biochemistry 30(45): 10832-10838 (1991).
Каждая библиотека содержит гипервариабельную область (например, 6-7 сайтов), для которой генерируются все возможные аминокислотные замещения. Таким образом генерированные мутанты антитела воспроизводятся в одновалентной форме из волокнистых фаговых корпускул как слияния с М13 продуктом гена III, упакованного в каждой корпускуле и экпрессируемого на наружную сторону фага.
Используемая в данном изобретении “комнатная” или “температура окружающей среды” составит 23-25°С.
“Связывающий полипептид” означает любой полипептид, который связывается с молекулой-мишенью выбранной аффинности. Предпочтительно, когда полипептид представит собой протеин, который наиболее предпочтительно содержит более чем ~100 аминокислотных остатков. Обычно полипептид будет представлять гормон, антитело или его фрагмент.
“Высокая аффинность” означает величину аффинной константы Kd<10-5 М и предпочтительно Kd<10-7 M при физиологических условиях.
“Молекула-мишень” означает молекулу, не обязательно протеин, из которой желательно продуцировать антитело или лиганд. Однако предпочтительно, если мишень будет протеином, и наиболее предпочтительно, если антигеном. Однако особенно следует включить в рамки данного термина рецепторы, например рецепторы гормонов.
Вся нумерация аминокислотных остатков иммуноглобулина, включая аминокислотную нумерацию пептидов, соответствующих определенным частям IgE, мутантных IgЕ молекул и химерных (гибридных) IgE молекул, которая упоминается в данном изобретении, осуществлена в соответствии с номенклатурой Кэбота для аминокислотных остатков иммуноглобулина (Kabat et al., Sequences of Proteins of Immunological Interest (National Institute of Health, Bethesda, MD 1987)).
Способы осуществления изобретения
I. Способ улучшения аффинности молекулы-мишени А. Идентификация способных к изомеризации остатков аспартила
Идентификация способных к изомеризации остатков аспартила может осуществляться любым техническим приемом, известным специалистам. Например, Cacia et al., Biochemistry 35:1897-1903 (1996), описывают способ, где анти-IgE антитело Е-25 (которое содержит -Asp-Gly-остатки) инкубировали при 37°C в течение 21 дня. Идентификацию изомеризованных -Asp-Gly- осуществляли хроматографическим и масс-спектрометрическим анализом необработанных и обработанных протеазой фрагментов. Так как сообщалось, что изомеризация происходит с остатками аспарагинила (Т. Geiger, S. Clarke. J. Вiоl. Chem. 262(2): 785-794 (1987)), данное изобретение предпочтительно также может применяться для систематической оценки и улучшения качества полипептидов, содержащих остатки аспарагинила.
В. Выбор альтернативных остатков, которые улучшают аффинность молекулы-мишени
Специалистам доступно много способов, которые позволяют оптимизировать аффинность рецептора. Обычно все эти способы включают замещение различных аминокислотных остатков в представляющем интерес сайте, за которым следует скрининг (тестирование) рецепторной аффинности мутантного полипептида. Метод, который предпочтителен для применения в данном изобретении, является “созревание аффинности” с использованием фагового отображения (Hawkins et al., J. Mol. Biоl. 254: 889-896 (1992); Lowman et al., Biochemisry 30(45): 10832-10838 (1991)). Вкратце несколько сайтов гепервариабельной области (например, 6-7 сайтов) мутируются для генерирования всех возможных аминокислотных замещений в каждом сайте. Таким образом генерированные мутанты антитела воспроизводятся в одновалентной форме из волокнистых фаговых корпускул, как слияния М13 продукта гена III, упакованного в каждой корпускуле. Фаг, экспрессирующий различные мутанты, может совершать циклы по кругам отбора связывания, за которыми следует изолирование и секвенирование этих мутантов, которые показывают высокую аффинность.
Способ отбора новых связывающих полипептидов предпочтительно использует библиотеку структурно родственных полипептидов. Библиотеку структурно родственных полипептидов, слитых с протеином фаговой оболочки, продуцируют с помощью мутагенеза, и предпочтительно единственная копия каждого родственного полипептида отображается на поверхности фагемидной корпускулы, содержащей ДНК, кодирующую данный полипептид. Эти фагемидные корпускулы далее контактируют с молекулой-мишенью, и те корпускулы, обладающие наибольшей аффинностью для мишени, отделяются от корпускул с меньшей аффинностью. Высокоаффинные биндеры далее амплифицируют путем заражения бактериальным хозяином и стадию конкурентного связывания повторяют. Процесс повторяют до тех пор, пока не получают полипептиды нужной аффинности.
Наоборот, многовалентный фаг (McCafferty et al., Nature 348: 552-554 (1990); Clackson et al., Nature 352: 624-628) (1991)) также можно использовать для экспрессии случайных точковых мутаций (генерируемых применением склонной к ошибочному действию ДНК-полимеразы) для генерирования библиотеки фаговых фрагментов антитела, которые далее можно тестировать по аффинности к антигену (Hawkins et al., J. Mol Biol. 254: 889-896 (1992).
Предпочтительно, когда во время процесса “созревания аффинности” реплицирующий вектор экспрессии находится под устойчивым контролем регуляторного элемента транскрипции и условия культивирования регулируются так, чтобы количество или число фагемидных корпускул, воспроизводящих более одной копии слитого протеина на поверхности корпускулы, составляло менее ~1%. Также предпочтительно, когда количество фагемидных корпускул, воспроизводящих более одной копии слитого протеина, составляет менее 10% от количества фагемидных корпускул, воспроизводящих единственную копию слитого протеина. Наиболее предпочтительно, когда это количество составляет менее 20%.
Обычно в способе, описанном в данном изобретении, экспрессирующий вектор должен дополнительно содержать секреторные сигнальные последовательности, слитые с ДНК, кодирующей каждую субъединицу полипептида, и регуляторный элемент транскрипции должен быть промоторной системой. Предпочтительные промоторные системы выбирают из LacZ, λPL,ТС, Т7 полимеразы, триптофана и промоторов щелочной фосфатазы и их смесей.
Также обычно первичный ген должен кодировать протеин млекопитающего, предпочтительно протеин должен быть анти-IgE антителом. Дополнительные антитела приводятся в разделе II.А. Получение антитела, (VI) мультиспецифические антитела (хотим заметить, однако, что антитела не должны быть мультиспецифическими). Дополнительные полипептиды включают гормон роста человека (human growth hormone, hGH), N-метионил-гормон роста человека, бычий гормон роста, паратиреоидный гормон, тироксин, А-цепь инсулина, В-цепь инсулина, проинсулин, А-цепь релаксина, В-цепь релаксина, прорелаксин, гликопротеиновые гормоны, например фолликулостимулирующий гормон (follicle stimulating hormone, FSH), тиреостимулирующий гормон (thyroid stimulating hormone, THS) и лютеинизирующий гормон (leutinizing hormone, LH), рецепторы гликопротеинового гормона, калцитонин, глюкагон, фактор VIII, сурфактант легкого, урокиназа, стрептокиназа, тканевый активатор плазминогена человека (human tissue-type plasminogen activator t-PA), бомбезин, фактор IX, тромбингемопоэтический фактор роста, α-фактор и β-фактор, вызывающие некроз опухолевых клеток, энкефалиназа, сывороточный альбумин человека, Мюллерова ингибирующая субстанция, гонадотропин-связывающий пептид мыши, микробный протеин, например β-лактамаза, протеин тканевого фактора, ингибин, активин, васкулярный эндотермальный фактор роста, рецепторы гормонов и факторов роста, интегрин, тромбопоэтин, протеин А или D, ревматоидные факторы, нервные факторы роста, например NGF-β, тромбоцитарный фактор роста, трансформирующие факторы роста (transforming growth factors, TGF), такие как TGF-α и TGF-β, инсулиноподобный фактор роста -I и -II, связывающие протеины инсулиноподобного фактора роста, CD-4, ДНКаза, латентно ассоциированный пептид, эритропоэтин, остеоиндуктивные факторы, интерфероны, такие как α-, β- и γ-интерферон, колониестимулирующие факторы (colony stimulating factors, CSFs), такие как М-CSF, GM-CSF и G-CSF, интерлейкины (IIs), например IL-1, IL-2, IL-3, IL-4; супероксиддисмутаза, комплементзависимый стимулятор гемолиза, вирусный антиген, протеины HIV-оболочки, такие как GP120, GP140, предсердные натриуретические пептиды А, В или С; иммуноглобулины и фрагменты любого из вышеперечисленных протеинов.
Предпочтительно, если первый ген будет кодировать полипептид одной или нескольких субъединиц, содержащих более 100 аминокислотных остатков и будет изгибаться (складываться), образуя множество жестких вторичных структур, воспроизводящих множество аминокислот, способных к взаимодействию с мишенью. Предпочтительно, если первый ген будет мутировать на кодонах, относящихся только к аминокислотам, способным к взаимодействию с мишенью с тем, чтобы была сохранена целостность жестких вторичных структур.
Обычно способ, описанный в данном изобретении, должен применять фаг-помощник, который выбирают из М13К07, M13R408, M13-VCS и Phi X 174. Предпочтительным фаг-помощником является М13К07 и предпочтительным протеином оболочки является М13 фаг гена II протеина оболочки. Предпочтительным хозяином является E.coli и протеаза дефицитные штаммы E.coli. Были обнаружены новые hGH варианты, выбранные с помощью способа, предложенного в данном изобретении. Созданы фагемидные экспрессирующие векторы, которые содержат супрессивный терминирующий кодон, функционально расположенный между нуклеиновыми кислотами, кодирующими полипептид и протеин фаговой оболочки.
1. Выбор полипептидов для воспроизведения (отображения) на поверхности фага
Повторные циклы селекции “полипептида” используют для отбора большей и большей связывающей аффинности с помощью фагемидной селекции множественных аминокислотных изменений, которые выбирают с помощью множественного отбора циклов. После первого круга фагемидной селекции, включающей первичную область селекции аминокислот в полипептиде лиганда или антитела, проводят дополнительные круги фагемидной селекции в других областях или аминокислотах лиганда. Циклы фагемидной селекции повторяют до тех пор, пока достигаются необходимые аффинные свойства. Для иллюстрации данного процесса в примере 4 фаговое отображение проводили циклами. Группировали аффинность, комбинацию мутаций от различных CDRs и т.д.
Из вышеприведенного ясно, что аминокислотные остатки, которые образуют связывающую область полипептида, не будут последовательно связываться и могут находиться на разных субъединицах полипептида, что означает связывающую область треков с определенной вторичной структурой в связывающем сайте, а не первичную структуру. Таким образом, обычно мутации должны вводиться в кодоны, кодирующие аминокислоты в определенной вторичной структуре в сайтах, направленных от внутренней стороны полипептида, с тем чтобы они имели возможность взаимодействовать с мишенью.
Однако не существует необходимого условия, чтобы полипептид, выбранный в качестве лиганда или антитела для молекулы-мишени, нормально связывался с данной мишенью. Таким образом, гликопротеиновый гормон, например TSH, может быть выбран в качестве лиганда для FSH рецептора и библиотеку мутантных TSH молекул применяют в методе, описанном в данном изобретении, для продуцирования новых вариантов лекарственных средств.
Таким образом, в данном изобретении рассматривается любой полипептид, который связывается с молекулой-мишенью, особенно с антителами. Предпочтительными полипептидами являются полипептиды, которые имеют фармацевтическое применение. Примеры антител перечислены в разделе II.А. Получение антитела, (IV) мультиспецифические антитела (заметим, что антитела не должны быть мультиспецифическими). Более предпочтительные полипептиды включают гормон роста, включая гормон роста человека; дез-N-метионил-гормон роста человека и бычий гормон роста; паратиреоидный гормон; тиреостимулирующий гормон; тироксин, А-цепь инсулина, В-цепь инсулина; прорелаксин, гонадотропин-связывающий пептид мыши; микробный протеин, например β -лактамаза, протеин тканевого роста; ингибин; активин; васкулярный эндотелиальный фактор роста; рецепторы гормонов и факторов роста; интегрин; тромбопоэтин; протеин А или D; ревматоидные факторы; нервный фактор роста, например NGF-β; тромбоцитарный фактор роста; фибробластовый фактор роста, например aFGF и bFGF; эпидермальный фактор роста; трансформирующий фактор роста, например TGF-α и TGF-β; инсулиноподобный фактор роста -I и -II; связывающие протеины инсулиноподобного фактора роста; CD-4; ДНК-аза, латентно ассоциированный пептид; эритропоэтин; остеоиндуктивные факторы, такие как часть HIV-оболочки; иммуноглобулины и фрагменты любого из вышеперечисленных полипептидов. Кроме того, один или несколько предопределенных аминокислотных остатков на полипептиде могут замещаться, вставляться или элиминироваться, например, для продуцирования продуктов с улучшенными биологическими свойствами. К тому же, включают фрагменты этих полипептидов, особенно биологически активные фрагменты. Еще более предпочтительными полипептидами являются фактор роста человека и предсердные натриуретические пептиды А, В и С, эндотоксин, субтилизин, трипсин и другие сериновые протеазы.
Также предпочтительно, когда полипептидные гормоны, которые могут определяться в виде любой аминокислотной последовательности, продуцировали в первичной клетке, которая специфично связывается с рецептором на том же клеточном типе (аутокринные гормоны) или на вторичном клеточном типе (неаутокринном) и вызывали физиологическую реакцию, характерную для клетки, секретирующей гормон. Такие полипептидные гормоны включают цитокины, лимфокины, нейротрофические гормоны и аденогипофизные полипептидные гормоны, например гормон роста, пролактин, плацентарный лактоген, лютеинизирующий гормон, фолликулостимулирующий гормон, β-липотропин, γ-липотропин и эндорфины; гипоталамусный рилизин-ингибирующий гормон, например кортикотропин-рилизинг гормоны, гормон роста рилизин-ингибирующий гормон, гормон роста-рилизинг фактор; и другие полипептидные гормоны, например предсердные натриуретические пептиды А, В или С.
2. Получение первого гена (гена I), кодирующего нужный полипептид
Ген, кодирующий нужный полипептид (например, антитело), можно получать с помощью известных способов (см. Sambrook et al., Molecular Biology: A Laboratory Manual, Cold Spring Harbor Press, Cold Spring Harbor, New York, (1989)). Если известна последовательность гена, то ДНК, кодирующую ген, можно синтезировать химически (Merrifield. J. Am. Chem. Soc. 85:2149 (1963)). Если последовательность гена не известна, или если ген ранее не был выделен, то его можно клонировать из кДНК библиотеки (сделанной из РНК, полученной из соответствующей ткани, в которой нужный ген экспрессируется) или из соответствующей библиотеки геномной ДНК. Далее ген выделяют, используя соответствующий зонд. Для библиотек кДНК соответствующие зонды включают моноклональные или поликлональные антитела (при условии, что библиотека кДНК является библиотекой экспрессируемых последовательностей), олигонуклеотиды и комплементарные или гомологичные кДНК-ты или их фрагменты. Зонды, которые можно использовать для изолирования представляющего интерес гена от библиотеки геномной ДНК, включают кДНК-ты или их фрагменты, которые кодируют вышеупомянутый или подобный ген, гомологичные геномные ДНК-ты или ферменты ДНК и олигонуклеотиды. Тестирование (скрининг) кДНК или геномной библиотеки выбранным зондом проводят, используя стандартные методики, описанные в главах 10-12 монографии Sambrook et al., supra.
Альтернативным приемом для изолирования гена, кодирующего нужный полипептид (например, антитело), является применение методологии полимеразной реакции синтеза цепи (polymerase chain reaction, PCR), как описано в разделе 14 монографии Sambrook et al., supra. Данный метод требует использования олигинуклеотидов, которые должны гибридизироваться с нужным геном, поэтому, по крайней мере, некоторая часть последовательности ДНК данного гена должна быть известна для того, чтобы генерировать олигонуклеотиды.
После изолирования гена для амплификации его можно вводить в соответствующий вектор (предпочтительно плазмиду), как в общих чертах описано в Sambrook et al., supra.
3. Создание (конструирование) реплицирующих векторов экспрессии
В то время как доступны и могут применяться на практике несколько типов векторов, предпочтительны плазмидные векторы, поскольку они могут создаваться сравнительно легко и могут легко амплифицировать. Плазмидные векторы обычно содержат целый ряд компонентов, включающих промотор, сигнальные последовательности, гены фенотипической селекции, источник сайтов репликации, и другие необходимые компоненты, известные для специалистов.
Промоторы, наиболее часто используемые в прокариотических векторах, включают систему lac Z промотора, pho А промотор щелочной фосфатазы, APL промотор бактериофага (чувствительный к температуре промотор), tac промотор (гибридный trp-lac промотор, который регулируется lac репрессором), промотор триптофана и Т7 промотор бактериофага. Относительно общих описаний промоторов см. раздел 17 монографии Sambrook et al., supra. Хотя существуют наиболее часто используемые промоторы, также можно использовать другие подходящие микробные промоторы.
Предпочтительными промоторами являются промоторы, которые могут устойчиво регулироваться, так что может контролироваться экспрессия слитого гена. Если экспрессия неконтролируемая, приводящая к множеству копий слитого протеина на поверхности плазмиды, может происходить многоточечная фиксация плазмиды с мишенью. Полагают, что эта многоточечная фиксация, также называемая “авидностью” или “хелатным эффектом”, приводит к селекции (отбору) ошибочных полипептидов “высокой аффинности”, вызванных множеством копий слитого протеина, воспроизводимых на фагемидной корпускуле в непосредственной близости друг от друга, чтобы “хелатировать” мишень (комплектовать с мишенью). Если происходит многоточечная фиксация, эффективная или кажущаяся Kd может быть такой же высокой, как индивидуальные Kds продукта для каждой копии воспроизведенного слитого белка.
С помощью устойчивой регуляции экспрессии слитого белка, так что только незначительное количество, т.е. меньше 1% фагемидных корпускул содержат многочисленные копии слитого протеина, преодолевается “хелатный эффект”, позволяющий осуществлять соответствующий отбор полипептидов высокой аффинности. Таким образом, в зависимости от промотора, условий культивирования хозяина регулируют до максимума количество фагемидных корпускул, содержащих единственную копию слитого протеина и сводят до минимума количество фагемидных корпускул, содержащих многочисленные копии слитого протеина.
Предпочтительными промоторами, используемыми в данном изобретении, являются lac Z промотор и pho А промотор. lac Z промотор регулируется lac репрессором протеина lac i, и таким образом, транскрипция слитого гена может контролироваться манипулированием уровня lac репрессорного протеина. С целью иллюстрации фагемид, содержащий lac Z промотор, выращивают в клеточном штамме, который содержит копию lac i репрессорного гена, репрессора для lac Z промотора. Типичные клеточные штаммы, содержащие lac i ген, включают JM 101 и XL-1 Blue (синий). В другом случае, клетка-хозяин может котрансфектировать с плазмидой, содержащей как репрессор lас i, так и lac Z промотор. Иногда обе вышеупомянутые методики используются одновременно, т.е. фагемидные корпускулы, содержащие lac Z промотор, выращивают в клеточных штаммах, содержащих lac i ген, и клеточные штаммы котрансфектируют с плазмидой, содержащей и lac Z, и lac i гены. Обычно, когда один желает экспрессировать ген, к трансфектированному вышеуказанному хозяину следует прибавить индуктор, например изопропилтиогалактозид (isopropylthiogalactoside, IPTG). Однако в данном изобретении эта стадия опущена, чтобы (а) свести к минимуму экспрессию слияний гена III на количество фагемид и (б) предотвратить плохую или неправильную упаковку фагемиды, вызванную индукторами, например IPTG, даже при низких его концентрациях. Обычно, если индуктор не прибавляют, количество слитых протеинов на фагемидную корпускулу составляет свыше 0,1 (количеств слитых протеинов в объеме на количество фагемидных корпускул). Наиболее предпочтительным промотором является pho А. Полагают, что данный промотор следует регулировать уровнем неорганического фосфата в клетке, где фосфат действует для регуляции по типу отрицательной связи активности промотора. Таким образом, при истощении в клетках фосфата активность промотора может увеличиться. Желаемый результат достигается выращиванием клеток в обогащенной фосфатом среде, например 2YT или LB, тем самым контролируя экспрессию слияния гена III.
Другим пригодным компонентом векторов, используемым в данном изобретении, является сигнальная последовательность. Данная последовательность обычно располагается непосредственно в 5'-концевой области к гену, кодирующему слитый протеин, и, таким образом, должна считывать у аминоконца слитого протеина. Однако в некоторых случаях было продемонстрировано, что сигнальная последовательность располагается в положении, отличном от 5' к гену, кодирующему секретируемый протеин. Данная последовательность является мишенью протеину, к которому она присоединена через внутреннюю мембрану бактериальной клетки. ДНК, кодирующую сигнальную последовательность, можно получить в качестве фрагмента рестрикционной эндонуклеазы из любого гена, кодирующего протеин, который имеет сигнальную последовательность. Соответствующие прокариотические сигнальные последовательности можно получить из генов, кодирующих, например, LamB или OmpF (Wong et al., Gene 68:193 (1983)), MalE, Pho А и других генов. Предпочтительными прокариотическими сигнальными последовательностями, используемыми в данном изобретении, является сигнальная последовательность E.coli термостабильного энтеротоксина II(STII), как описано в работе Chang et al., Gene 55:189 (1987).
Другим пригодным компонентом векторов являются гены фенотипической селекции. Типичными генами фенотипической селекции являются гены, кодирующие протеины, которые придают устойчивость к антибиотикам клеток-хозяев. В качестве иллюстрации для этой цели широко применяют устойчивый к ампициллину (amp) и тетрациклину (tet) ген.
Конструкцию соответствующих векторов, включающую вышеупомянутые компоненты, а также ген, кодирующий описанный полипептид (ген I), получают с применением стандартных методик рекомбинантной ДНК, как описано у Sambrook et al., supra. Изолированные фрагменты ДНК, которые необходимо соединить для образования вектора, расщепляют, сшивают и лигируют вместе в определенном порядке и ориентации для генерирования нужного вектора.
ДНК расщепляют, используя соответствующий рестрикционный фермент или ферменты в подходящем буфере. Обычно используют около 0,2-1 мкг плазмиды или фрагментов ДНК с ~1-2 рестрикционного фермента в ~20 мкл буферного раствора. Соответствующие буферные растворы, концентрации ДНК времена и температуры инкубации определяются производителями рестрикционных ферментов. Обычно времена инкубации около одного или двух часов при 37°С являются приемлемыми, хотя некоторые ферменты требуют более высоких температур. После инкубации ферменты и другие контаминанты удаляют экстрагированием гидролизованного раствора смесью фенола и хлороформа и ДНК выделяют из водной фракции осаждением этанолом.
Чтобы лигировать фрагменты ДНК вместе для образования функционального вектора, концы фрагментов ДНК должны быть совместимы один с другим. В некоторых случаях концы должны быть совместимы непосредственно после гидролиза эндонуклеазой. Однако может быть необходимо сначала превратить прилипающие концы, обычно продцируемые эндонуклеазным гидролизом, в дефосфорилированные концы, чтобы сделать их совместимыми для лигирования. Для дефосфорилирования концов ДНК обрабатывают в соответствующем буфере в течение, по крайней мере, 15 минут при 15°С 10 единицами фрагмента Кленова ДНК полимеразы I (Klenow) в присутствии четырех трифосфатов-дезоксинуклеотида. Далее ДНК очищают с помощью фенол-хлороформной экстракции и осаждением этанолом.
Гидролизованные фрагменты ДНК можно разделить по размерам и отобрать с применением ДНК гель-электрофореза. ДНК можно подвергать электрофорезу с помощью матрицы из агарозы или полиакриламида. Выбор матрицы будет зависеть от размера разделяемых фрагментов ДНК. После электрофореза ДНК экстрагируют из матрицы электроэлюцией или, если в качестве матрицы используют низкоплавящуюся агарозу, расплавлением агарозы и экстракцией из нее ДНК, как описано в разделах 6.30-6.33 в монографии Sambrook et al., supra.
Фрагменты ДНК, которые необходимо лигировать вместе (предварительно гидролизованные соответствующими ферментами рестрикции, так что концы каждого лигируемого фрагмента совместимы), помещают в раствор в примерно эквимолярных количествах. Раствор также должен содержать АТР, буфер и лигазу, например Т4 ДНК-лигазу при ~10 единицах на 0,5 мкг ДНК. Если фрагмент ДНК необходимо лигировать в вектор, вектор сначала линеаризуют с помощью отрезания (урезания) соответствующей эндонуклеазой(ами) рестрикции. Далее линеаризованный вектор обрабатывают щелочной фосфатазой или кишечной фосфатазой теленка. Обработка фосфатазой предотвращает самолигирование вектора во время стадии лигирования.
После лигирования вектор с только что введенным чужеродным геном трансформируют в соответствующую клетку-хозяина. Предпочтительными клетками-хозяевами являются прокариоты. Соответствующие прокариотические клетки-хозяева включают E.coli штамм М101, E.coli K12 штамм 294 (АТСС номер 31446), E.coli штамм W3110 (АТСС номер 27325), E.coli X1776 (АТСС номер 31537), E.coli XL-1 Blue (стратаген) и E.coli В; однако также можно использовать много других штаммов E.coli, например НВ101, NM522, NM538, NM539 и много других видов и сортов прокариотов. В дополнении к E.coli штаммам, перечисленным выше, бациллы, например Bacillus subtilis, другие энтеробактерии, например Salmonella typhimurium или Serratia marcesans и разные виды Pseudomonas; все они могут применяться в виде хозяев.
Трансформация прокариотических клеток легко совершается при использовании кальцийхлоридного способа, как описано в разделе 1.82 монографии Sambrook et al., supra. Наоборот, для трансформирования данных клеток можно использовать электропорацию (Neumann et al., EMBO J. 1: 841 (1982)). Трансформированные клетки отбирают по росту на антибиотиках, обычно тетрациклине (tet) или ампициллине (amp), к которым они оказывают устойчивость вследствие присутствия tet и /или аmр устойчивых генов на векторе.
После отбора трансформированных клеток эти клетки культивируют в культуре и далее изолируют плазмидную ДНК (или другой вектор с введенным чужим геном). Плазмидную ДНК можно изолировать известными методами. Два подходящих метода представляют собой получение ДНК в малом количестве и получение ДНК в крупном масштабе, как описано в разделах 1.25-1.33 монографии Sambrook et al., supra. Изолированную ДНК можно очищать известными методами, например, которые описаны в разделе 1.40 у Sambrook et al., supra. Далее очищенную плазмидную ДНК анализируют с помощью рестрикционного картирования и/или секвенирования ДНК. Секвенирование ДНК обычно осуществляют или по методу Messing et al. Nucleic Acids Res. 9:309 (1981) или по методу Maxam etal., Meth. Enzymol 65:499 (1980).
4. Слияние гена
Стадия фаговой аффинности предполагает слияние гена, включающего нужный полипептид (ген 1), со вторым геном (ген 2), так что слитый ген генерируется во время транскрипции. Ген 2 обычно является геном протеина оболочки фага, и предпочтительно это фаг М13 гена III протеина оболочки или его фрагмент. Слияние генов 1 и 2 может осуществляться путем вставки гена 2 в определенный сайт на плазмиде, которая содержит ген 1 или путем вставки гена 1 в определенный сайт на плазмиде, которая содержит ген 2.
Вставка гена в плазмиду требует, чтобы плазмида была сокращена в определенном месте, чтобы ген можно было бы вставить. Таким образом, должен быть сайт рестрикционной эндонуклеазы в данном месте (предпочтительно уникальный сайт, так что плазмида будет урезана только в единственном месте во время гидролиза рестрикционной эндонуклеазой). Плазмиду гидролизуют, фосфорилируют и очищают, как описано выше. Ген далее вставляется в данную линеаризованную плазмиду при лигировании двух ДНК вместе. Лигирование можно выполнять, если концы плазмиды совместимы с концами гена, который вставляют. Если для урезания и плазмиды и изолирования вставленного гена используют те же рестрикционные ферменты, то ДНК-ты можно лигировать непосредственно вместе, используя лигазу, например бактериофаговую Т4 ДНК лигазу и инкубируя смесь при 16° С в течение 1-4 часов в присутствии АТР и лигазного буфера, как описано в разделе 1.68 монографии Samrook et al., supra. Если концы несовместимы, их можно сначала дефосфорилировать с помощью фрагмента Кленова ДНК-полимеразы I или бактериофаговой Т4 ДНК-полимеразы, обе из которых требуют четырех трифосфатов дезоксирибонуклеотида для заполнения выступающих (“липких”) одноцепочечных концов гидролизованной ДНК. Наоборот, концы могут дефосфорилироваться с применением нуклеазы, например нуклеазы S1 или фасолевой нуклеазы, обе из которых действуют путем обрезания выступающих (“липких”) одноцепочечных ДНК. Далее ДНК классифицируют с применением лигазы, как описано выше. В некоторых случаях может быть невозможным дефосфорилирование концов вставляемого гена, поскольку изменяется рамка считывания кодирующей области. Чтобы преодолеть данную проблему, можно использовать олигонуклеотидные линкеры. Линкеры служат в качестве мостика для соединения плазмиды с вставляемым геном. Эти линкеры можно получать синтетически в виде двуцепочечной или одноцепочечной ДНК при использовании стандартных способов. У линкеров имеется один конец, который совместим с концами вставленного гена; линкеры вначале лигируют с данным геном, используя описанные выше способы лигирования. Предполагают, что другой конец линкеров совместим с плазмидой для лигирования. При конструировании линкеров следует принимать меры, чтобы не разрушить рамку считывания вставляемого гена или рамку считывания гена, содержащегося на плазмиде. В некоторых случаях может стать необходимым создание линкеров с тем, чтобы они кодировали часть аминокислоты или чтобы они кодировали одну или несколько аминокислот.
Между геном 1 и геном 2 может вставляться ДНК, кодирующая кодон терминации, такими кодонами терминации являются UAG(amber), UAA(ocher) и UGA (opel), Microbiology, Davis et al., Harper and Row, New York, 1980, pp.237, 245-47 и 274). Кодон терминации, экспрессируемый в клетке-хозяине дикого типа, приводит к синтезу гена 1 продукта протеина без присоединения протеина гена 2. Однако рост в супрессорной клетке-хозяине приводит к синтезу заметных количеств слитого протеина. Такие супрессорные клетки-хозяева содержат тРНК, модифицированную для вставки аминокислоты в положение кодона терминации мРНК, тем самым приводя к продуцированию заметных количеств слитого протеина. Такие супрессорные клетки-хозяева хорошо известны и описаны, например e.coli супрессорный штамм (Bullock et al., BioTechnologies 5: 376-379 (1987). Могут использоваться любые приемлемые методы для помещения такого терминирующего кодона в мРНК, кодирующую слитый полипептид.
Способный к супрессии кодон можно вставлять между первым геном, кодирующим полипептид, и вторым геном, кодирующим, по крайней мере, часть протеина фаговой оболочки. Наоборот, способный к супрессии кодон терминации можно вставлять по-соседству с сайтом слияния при замещении триплета последней аминокислоты в лолипептиде или первой аминокислоты в протеине фаговой оболочки. Если фагемиду, содержащую способный к супрессии кодон, выращивают в супрессорной клетке-хозяине, то это приводит к заметному продуцированию полипептида слияния, содержащего полипептид и протеин оболочки. Если фагемиду выращивают в несупрессорной клетке-хозяине, полипептид синтезируют без слияния с протеином фаговой оболочки вследствие терминации на вставленном супрессорном триплете, кодирующем UAG, UAA или UGA. В несупрессорной клетке полипептид синтезируют и секретируют из клетки-хозяина вследствие отсутствия слитого протеина фаговой оболочки, который в противном случае держит на якоре ее в клетке-хозяине.
5. Изменение (мутация) гена 1 в выбранных положениях
Ген 1, кодирующий нужный полипептид, может изменяться в одном или нескольких выбранных кодонах. Однако кодон, соответствующий способному к изомеризации остатку аспартила, должен заменяться. Изменение определяют как замещение, элиминирование (делецию) или введение одного или нескольких кодонов в ген, кодирующий полипептид, который приводит к изменению в аминокислотной последовательности полипептида по сравнению с неизмененной или нативной последовательностью того же самого полипептида. Предпочтительно, когда изменения будут при замещении, по крайней мере, одной аминокислоты любой другой аминокислотой в одной или нескольких областях молекулы. Изменения можно продуцировать с помощью целого ряда известных способов. Данные способы включают, но не ограничиваются, сайтнаправленным мутагенезом с использованием олигонуклеотидов и кассетным мутагенезом.
а. Сайтнаправленный мутагенез с использованием олигонуклеотидов
Сайтнаправленный мутагенез с использованием олигонуклеотидов является предпочтительным способом получения замещенных, элиминированных и вставленных вариантов гена 1. Данный технический прием хорошо известен, поскольку описан Zoller et al., Nucleic Acids Res. 10: 6487-6504 (1987). Вкратце, ген 1 изменяют гибридизацией олигонуклеотида, кодирующего нужную мутацию, с ДНК-темплатом, где темплат представляет собой одноцепочечную форму плазмиды, содержащей неизмененную или нативную ДНК-последовательность гена 1. После гибридизации ДНК-полимеразу используют для синтеза полной вторичной комплементарной цепи темплата, который, таким образом, будет включать олигонуклеотидный праймер и кодировать выбранное изменение гена 1.
Обычно используют олигонуклеотиды, содержащие, по крайней мере, 25 нуклеотидов. Оптимальный олигонуклеотид будет содержать от 12 до 15 нуклеотидов, которые полностью комплементарны с темплатом на любой стороне нуклеотида(ов), кодирующего мутации. Это обеспечивает то, что олигонуклеотид будет гибридизироваться надлежащим образом с одноцепочечной ДНК-темплатной молекулой. Олигонуклеотиды легко синтезируются с применением известных способов, описанных, например, Сrеа et al., Proc. Natl. Acad. Sci. USA 75: 5765 (1978).
ДНК-темплат может только генерироваться векторами, которые получены или из бактериофаговых М13 векторов (обычно пригодны М13mр18 и М13mр19 вектора), или векторами, которые содержат одноцепочечный фаговый ориджин или репликацию, как описано Viera et al., Meth. Enzymol. 153:3 (1987). Таким образом, ДНК, которую необходимо мутировать, должна вставляться в один из этих векторов для того, чтобы генерировать одноцепочечные темплаты. Продуцирование одноцепочечного темплата описано в разделах 4.21-4.41 монографии Sambrook et al., supra.
Чтобы изменить последовательность нативной ДНК, олигонуклеотид гибридизируют с одноцепочечной темплатой в соответствующих условиях гибридизации. ДНК-полимеризующий фермент, обычно фрагмент Кленова ДНК-полимеразы I, далее прибавляют для синтеза комплементарной цепи темплата, используя олигонуклеотид в качестве праймера для синтеза. Таким образом получают гетеродуплексную молекулу, так что одна цепь ДНК кодирует мутированную форму гена 1 и другая цепь (первоначальный темплат) кодирует нативную, неизменную последовательность гена 1. Данная гетеродуплексная молекула далее трансформируется в соответствующую клетку-хозяина, обычно прокариотическую, например E.coli JM-101. После выращивания клеток их помещают на агаровые пластинки и осуществляют скрининг, используя олигонуклеотидный праймер, меченный32фосфатом, для идентификации бактериальных колоний, которые содержат мутированную ДНК.
Способ, описанный только что выше, можно модифицировать с тем, чтобы создать гомодуплексную молекулу, где обе цепи плазмиды содержат мутацию(и). Модификация заключается в следующем: одноцепочечный олигонуклеотид отжигают в одноцепочечный темплат, как описано выше. Смесь трех дезоксирибонуклеотидов; дезоксирибоаденозина (dATP), дезоксирибогуанозина (dGTP) и дезоксириботимидина (sTTP) соединяют с модифицированным тио-дезоксирибоцитозином, называемым dCTP-(aS) (Amersham). Данную смесь прибавляют к темплат-олигонуклеотидному комплексу. При прибавлении ДНК-полимеразы к данной смеси генерируют цепь ДНК, идентичную темплату, за исключением мутантных оснований. Кроме того, данная новая цепь ДНК будет содержать dCTP-(aS) вместо dCTP, которая служит для защиты ее от гидролиза рестрикционной эндонуклеазой. После того как темплатная цепь двуцепочечного гетеродуплекса разрезается соответствующим ферментом рестрикции, темплатную цепь можно гидролизовать ExoIII нуклеазой или другой пригодной нуклеазой помимо области, которая содержит подвергаемый мутагенезу сайт(ы). Далее реакцию останавливают для отделения молекулы, которая только частично является одноцепочечной. Далее образуется законченный двуцепочечный ДНК-гомодуплекс с применением ДНК-полимеразы в присутствии всех четырех дезоксирибонуклеотидных трифосфатов, АТР и ДНК-лигазы. Данная гомодуплексная молекула далее может трансформироваться в соответствующую клетку-хозяина, как, например, E.coli JM101, как описано выше.
Мутанты с более чем одной замещаемой аминокислотой могут генерироваться одним из следующих способов. Если аминокислоты расположены близко в полипептидной цепи, они могут мутироваться одновременно, используя один олигонуклеотид, который кодирует все требуемые замещения аминокислот. Если, однако, аминокислоты расположены на некотором расстоянии друг от друга (разделены более чем 10 аминокислотами), их труднее генерировать отдельным олигонуклеотидом, который кодирует все нужные изменения. Вместо этого можно использовать один или два альтернативных метода.
В первом методе отдельный олигонуклеотид генерируют для каждой замещаемой аминокислоты. Далее олигонуклеотиды отжигают в одноцепочечную темплатную ДНК одновременно, и вторая цепь ДНК, которую синтезируют из темплата, будет кодировать все нужные замещения аминокислот. Альтернативный способ включает два или несколько кругов мутагенеза для продуцирования нужного мутанта. Первый круг, как описано для отдельных мутантов, заключается в том, что ДНК дикого типа используют для темплата и олигонуклеотид, кодирующий первое необходимое замещение(я) аминокислоты, отжигают в темплату и далее генерируют гетеродуплексную ДНК-молекулу. Второй круг мутагенеза использует мутированную ДНК, продуцируемую в первом круге мутагенеза в виде темплата. Таким образом, данный темплат уже содержит одну или несколько мутаций. Олигонуклеотид, кодирующий дополнительное замещение(я) нужной аминокислоты, далее отжигают до данного темплата, и полученная цепь ДНК теперь кодирует мутации как от первого, так и второго кругов мутагенеза. Полученную ДНК можно применять в виде темплата в третьем круге мутагенеза и т.д.
б. Кассетный мутагенез
Данный метод является также предпочтительным для получения замещенных, элиминированных и вставленных вариантов гена. Метод основан на описаном Wells et al., Gene 34: 315 (1985) методе. Исходным материалом является плазмида (или другой вектор), включающая ген 1, ген, который необходимо мутировать. Идентифицируют кодон(ы) в мутируемом гене 1. Должен существовать уникальный сайт рестрикции эндонуклеазы на каждой стороне идентифицированного участка(ов) мутации. Если такие сайты рестрикции не существуют, их можно генерировать с применением вышеописанного метода сайтнаправленного мутагенеза с использованием олигонуклеотидов для введения их в соответствующие расположения в гене 1. После того как сайты рестрикции введены в плазмиду, плазмиду урезают в этих сайтах для ее линеаризации. Двуцепочечный олигонуклеотид, кодирующий последовательность ДНК между сайтами рестрикции, но содержащий нужную мутацию(и), синтезируется с использованием стандартных методик. Две цепи синтезируются отдельно и затем гибридизируются вместе с использованием стандартных способов. Данный двуцепочечный олигонуклеотид называется кассетой. Кассета конструируется так, чтобы имелись 3' и 5' концы, которые совместимы с концами линеаризованной плазмиды, с тем чтобы кассета непосредственно лигировалась с плазмидой. Данная плазмида теперь содержит последовательность мутированной ДНК гена 1.
6. Получение ДНК, кодирующей нужный протеин
В альтернативном варианте данное изобретение предлагает продуцирование вариантов нужного протеина, содержащего одну или несколько субъединиц. Каждая субъединица обычно кодируется отдельными генами. Каждый ген, кодирующий каждую субъединицу, можно получить с помощью известных методов (см., например, раздел II). В некоторых случаях необходимо получить ген, кодирующий различные субъединицы, используя отдельные методы, выбранные из любых способов, описанных в разделе II.
Если конструируют (создают) реплицирующий вектор экспрессии, где нужный протеин содержит более одной субъединицы, все субъединицы могут регулироваться одним и тем же промотором, обычно расположенным в 5' к ДНК, кодирующей субъединицу, или каждая может регулироваться одним и тем же промотором, обычно расположенным в 5' к ДНК, кодирующей субъединицы, или каждая может регулироваться отдельным промотором, соответствующим образом ориентированным в векторе с тем, чтобы каждый промотор операбельно связывался с ДНК, предназначенной для регулирования. Отбор промоторов проводят, как описано выше в разделе III.
При конструировании реплицирующего вектора экспрессии, содержащего ДНК, кодирующую нужный протеин с множеством субъединиц, читателя отсылают к фиг.11, где с целью иллюстрации вектор изображается схематически, показывая ДНК, кодирующую каждую субъединицу фрагмента антитела. Данная фиг.11 показывает, что обычно одна из субъединиц нужного протеина будет сливаться с протеином фаговой оболочки, например, М13 ген III. Данный слитый ген обычно будет содержать его собственную сигнальную последовательность. Отдельный ген кодирует другую субъединицу или субъединицы и, очевидно, что каждая субъединица обычно имеет свою собственную сигнальную последовательность. Фиг.11 также показывает, что один промотор может регулировать экспрессию обоих субъединиц. Наоборот, каждая субъединица может независимо регулироваться другим промотором. Слитую конструкцию “субъединица нужного протеина - протеин фаговой оболочки” можно получить, как описано выше в разделе IV.
Если создается семейство вариантов нужного мультисубъединичного протеина, ДНК, кодирующая каждую субъединицу в векторе, может мутироваться в одном или нескольких положениях в каждой субъединице. Если создают варианты мультисубъединичного антитела, предпочтительные сайты мутагенеза относятся к кодонам, кодирующим аминокислотные остатки, расположенные в гипервариабельных участках (CDRs) легкой цепи, тяжелой цепи или обеих цепей. CDRs обычно называются гипервариабельными участками. Способы мутагенеза ДНК, кодирующей каждую субъединицу нужного протеина, в основном описаны выше в разделе V.
7. Получение молекул-мишеней и связывание с фагемидой
Протеины мишени, например рецепторы, можно отделить от природных источников или получить с помощью известных рекомбинантных способов. С целью иллюстрации глюкопротеиновые гормональные рецепторы можно получить с помощью способа, описанного в работе McFarland et al., Science 245: 494-499 (1989), негликозилированные формы, экспрессируемые в Е. соli, описаны в статье Fuh et al., J Вiоl. Chem. 265: 3111-3115 (1990). Другие рецепторы можно получить с помощью стандартных методов.
Очищенный протеин мишени может присоединяться к соответствующей матрице, например агарозным гранулам, акриламидным гранулам, стеклянным гранулам, целлюлозе, различным акрильным сополимерам, гидроксиалкил-метакрилатным гелям, полиакрильным и полиметакрильным сополимерам, нейлону, нейтральным и ионным носителям и т.д. Присоединение протеина-мишени к матрице можно осуществлять с помощью методов, описанных в Methods in Enzymol. 44 (1976), или другими известными способами.
После присоединения протеина-мишени к матрице иммобилизованная мишень связывается с библиотекой фагемидных частиц в условиях, пригодных для связывания, по крайней мере, части фагемидных частиц с иммобилизованной мишенью. Обычно условия, включая рН, ионную силу, температуру и т.д., должны быть близкими к физиологическим условиям.
Связанные фагемидные частицы (биндеры, binders), обладающие высокой аффинностью к иммобилизованной мишени, отделяют от частиц (корпускул) с низкой аффинностью (и, таким образом, не связываются мишенью) с помощью промывания. Биндеры можно отделить от иммобилизованной матрицы с помощью целого ряда способов. Данные способы включают конкурентное отделение от иммобилизованной мишени с помощью ряда способов. Эти способы включают конкурентное отделение с применением лиганда дикого типа, изменением рН и/или ионной силы и другими известными методами.
Соответствующие клетки-хозяева заражают биндерами и фагом-помощником и клетки-хозяева культивируют в условиях, подходящих для амплификации фагемидных частиц. Далее фагемидные частицы собирают и процесс отбора повторяют один или несколько раз до тех пор, пока не будут выбраны биндеры нужной аффинности для молекулы-мишени.
Возможно, что библиотека фагемидных частиц может последовательно контактировать более чем с одной иммобилизованной мишенью для улучшения селективности отдельной мишени. Например, дело в том, что лиганд, такой как hGH содержит более одного природного рецептора. В случае hGH и рецептор гормона роста, и пролактиновый рецептор связывают hGH лиганд. Желательно улучшить селективность hGH для рецептора гормона роста по сравнению с пролактиновым рецептором. Это можно достигнуть путем первоначального связывания библиотеки фагемидных частиц с иммобилизованным пролактиновым рецептором, элюируя частицы низкой аффинности (т.е. более низкой, чем hGH дикого типа) пролактинового рецептора и далее связывая пролактиновые “биндеры” или “не биндеры” низкой аффинности или с иммобилизованным рецептором гормона роста и отбирая биндеры высокой аффинности рецептора гормона роста. В данном случае hGH мутант, обладающий более низкой аффинностью пролактинового рецептора, должен иметь терапевтическое применение, даже если аффинность рецептора гормона роста несколько ниже, чем аффинность дикого типа hGH. Эта же стратегия может применяться для улучшения селективности определенного гормона или протеина для рецептора первичной функции по сравнению с "клиренс"-рецептором.
В другом варианте данного изобретения можно получить улучшенную субстратную аминокислотную последовательность. Это может быть полезным для получения лучших “урезанных” сайтов для ликеров протеина или для лучших субстратов/ингибиторов протеазы. В данном варианте иммобилизованную молекулу, например hGH рецептор, биотин-авидиновый рецептор или рецептор, способный ковалентно связываться с матрицей), подвергают слиянию с геном III через линкер. Линкер предпочтительно составит от 3 до 10 аминокислот и будет действовать в качестве субстрата для протеазы. Фагемида будет создана, как описано выше, где ДНК, кодирующая линкерную область, произвольно мутируется для получения рандомизированной библиотеки фагемидных частиц с различными аминокислотными последовательностями в сайте связывания. Библиотеку фагемидных частиц далее иммобилизуют на матрице и подвергают действию нужной протеазы. Фагемидные частицы, обладающие предпочтительными или лучшими субстратными аминокислотными последовательностями в линейной области нужной протеазы, будут элюироваться, первоначально продуцируя обогащенную фракцию фагемидных частиц, кодирующих предпочтительные линкеры. Данные фагемидные частицы далее совершают циклы несколько раз для продуцирования обогащенной фракции частиц, кодирующих “консенсус” последовательность(и).
II. Генерирование антител
Исходное антитело можно получить, используя известные способы или генерируя антитела. Типичные способы генерирования антител описаны более подробно в следующих разделах.
Антитело направлено против нужного антигена. Предпочтительно, когда антиген является биологически важным полипептидом и введение антитела млекопитающим, страдающим от болезни или расстройства, может привести к терапевтическому эффекту для данного млекопитающего. Однако также рассматриваются антитела, направленные против неполипептидных антигенов (например, опухолеспецифические гликолипидные антигены; см. U.S. Pat. No. 5091178).
Если антиген представляет собой полипептид, он может быть трансмембранной молекулой (например, рецептором) или лигандом, например фактором роста. Типичные антигены включают молекулы, например ренин; гормон роста, включая гормон роста человека и бычий гормон роста; фактор секреции гормона роста; паратиреоидный гормон, гликагон; факторы, препятствующие свертыванию крови, такие как протеин С; предсердный натриуретический фактор; сурфактант легкого; активатор плазминогена, например урокиназный, или мочевой, или тканевый активатор плазминогена (tPA), бомбезин; тромбин; гемопоэтический фактор роста; α- и β-фактор, вызывающие некроз опухолевых клеток; энкефалиназа; RANTES (regulated activation normally T-cell expressed and secreted), регулирующий активацию экспрессии и секреции нормальных Т-клеток); человеческий фагоцитарный воспалительный белок (MIP-1-α); сывороточный альбумин, например сывороточный альбумин человека; Мюллерова ингибирующая субстанция; А-цепь релаксина; В-цепь релаксина; прорелаксин; мышиный гонадотропин-связывающий пептид; микробный протеин, например β-лактамаза; ДНК-аза; IgE; цитотоксический Т-лимфоцитсвязанный антиген (cytotoxic T-lymphocyte associated antigen, CTLA), например CTLA-4; ингибин; активин; васкулярный эндотелиальный фактор роста (vascular endothelial growth factors, VEGF); рецепторы гормонов или факторов роста; протеин А и D; ревматоидные факторы; нейротрофический фактор, например нейротрофический фактор костного происхождения (bone-derived neurotrophic factor, BDNF), нейротрофин- 3; -4; -5 или -6 (NT-3, NT-4, NT-5 или NT-6) или нервный фактор роста NGF-B; тромбоцитарный фактор роста (platelet-derived growth factor, PDGF), факторы роста фибробластов (fibroblast growth factor, FGF), например aFGF и bFGF; эпидермальный фактор роста (epidermal growth factor, EGF); трансформирующий фактор роста (transforming growth factor, TGF), например TGF-α и TGF-β, включая TGF-β1, TGF-β2, TGF-β3, TGF-β4 или TGF-β5; инсулиноподобный фактор роста, -I и -II (insulin-like growth factor binding protein); СD-протеины, например CD-3, CD-4, CD-8 CD1-9 и CD-20; эритропоэтин; остеоиндуктивные факторы; иммунотоксины; протеин, участвующий в остеогенезе (bone morphogenetic protein, BMP); интерферон, например α-, β- и γ-интерферон; колониестимулирующие факторы (соlоnу stimulating factors, CSFs), например M-CSF, GM-CSF и G-CSF; интерлейкины (IIs), например от IL-1 до IL-10; супероксиддисмутаза; Т-клеточные рецепторы; поверхностно-мембранные протеины; “хоминг” рецепторы, адрессин; регуляторные протеины; интегрины; например CD11a, CD11b, CD11c, CD18 и ICAM, VLA-4 и VCAM; опухолеспецифический антиген, например HER2, HER3 или HER4 рецептор; и фрагменты любых вышеперечисленных пептидов.
Предпочтительные молекулярные мишени для антител, охватываемые данным изобретением, включают CD протеины, например CD3, CD4, CD8, CD 19, CD20 и CD34; члены ЕrbВ рецепторного семейства, например EGF рецептор, HER2, HER3 или HER4 рецептор; молекулы клеточной адгезии, например LFA-1, Mac 12, р150,95, VLA-4, ICAM-1, VCAM и αv/β3 интегрин, включающий или α- и β-субъединицы (например, анти-CDIIa, awH-CD18 или анти-CDIIb антитела); факторы роста, например VEGF; IgE; антигены группы крови; flk2/flk3 рецептор; рецептор ожирения (obesity receptor, OB); mpl рецептор; CTLA-4; протеин С и др. Особенно предпочтительной мишенью является IgЕ.
Антитело выращивают против антигена, полученного из первого вида млекопитающего. Первым видом млекопитающего предпочтительно является человек. Однако рассматривают другие виды млекопитающего, например сельскохозяйственные, комнатные животные или животные зоопарка, например, если антитело предполагают использовать для лечения таких млекопитающих. Антиген из вида первого млекопитающего можно выделять из его природного источника для целей генерирования антитела против него. Однако, как указано ниже, клетки, включающие антиген, можно использовать в качестве иммуногенов для создания антител. В других вариантах антиген продуцируют рекомбинантно или его создают с применением других синтетических способов. Отобранное антитело обычно должно обладать достаточно сильным связывающим сродством к антигену. Например, антитело может связывать антиген из первого вида млекопитающего с величиной связывающей аффинности (Кd) не более чем ~1×10-7 М, предпочтительно не более 1×10-8 М и наиболее предпочтительно не более 1×10-9 М. Аффинности антител можно, например, определить с помощью насыщенного связывания; твердофазного иммуноферментного анализа (ELISA) и конкурентного анализа (например, RIAs).
Также антитело может подвергаться другим проверкам биологической активности, например, чтобы оценить его эффективность в качестве терапевтического средства. Такая проверка известна и зависит от антигена мишени и предполагает использование антитела. Примеры включают проверку адгезинового монослоя кератиноцита и анализ смешанной реакции лимфоцитов для CDIIa (каждая описана ниже в примере); проверку ингибирования опухолевого роста (как описано, например, в WO 89/06692); анализы антителозависимой клеточно-опосредованной цитотоксичности (antibody dependent cellular cytotoxicity, ADCC) и комплемент-зависимой цитотоксичности (complement-mediated cytotoxicity, CDS) (U.S. Pat. No. 5500362) и анализы агонистической активности или гематопоэза (см. WO 95/27062).
Для отбора антител, которые связываются с отдельным эпитопом на представляющем интерес антигене, например, те, которые блокируют связывание МНМ24 антитела, можно провести рутинный анализ смешанного блокирования, например, который описан в Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, Ed. Harbow and David Lane (1988). Наоборот, картирование эпитопа, например, как описано у Champe et al., J. Biol. Chem. 270: 1388-1394 (1995), можно выполнять для определения того, связывает ли антитело нужный эпитоп.
Далее определяют взаимозависимость антитела. Связывающую аффинность антитела для гомологии антигена, используемого для генерирования антитела (где гомология состоит из “второго” вида млекопитающего), определяют с использованием описанных выше способов. В предпочтительном варианте второй вид млекопитающего представляет собой млекопитающее, не относящееся к человеческому роду, которому антитело вводят в предклинических исследованиях. Таким образом, вид второго млекопитающего может быть -примат, не относящийся к человеческому роду, например резус, павлин, бабуин, шимпанзе и макака. В других вариантах вторым видом млекопитающего могут быть, например, грызуны, кошка или собака. Видозависимое антитело обычно должно обладать связывающей аффинностью к антигену из второго вида млекопитающего, не относящегося к человеческому роду, которая, по крайней мере, в 50 раз, или по крайней мере, в 500 раз, или по крайней мере, в 1000 раз более слабая, чем связывающая аффинность к антигену из первого вида млекопитающего. Данная связывающая аффинность обычно должна быть такой, чтобы видозависимое антитело нельзя было бы эффективно использовать для предклинических исследований во втором виде млекопитающего.
В то время как предпочтительный способ для определения видозависимости (и для оценки мутантов антитела с улучшенными свойствами; см. ниже) заключается в количественном определении связывающей аффинности антитела, в других вариантах изобретения оценивают одно или несколько биологических свойств видозависимого антитела и мутанта антитела в дополнение или вместо определений связывающей аффинности. Такие типичные биологические проверки описаны выше. Такие проверки особенно полезны, если даются показания в отношении терапевтической эффективности антитела. Обычно, хотя необязательно, антитела, которые показывают улучшенные свойства в таких проверках, также будут обладать улучшенной аффинностью. Таким образом, в одном варианте изобретения, где анализ выбора состоит в проверке биологической активности, а не в проверке связывающей аффинности, видозависимое антитело обычно должно иметь “биологическую активность”, используя “материал” (например, антиген, клетка, ткань, орган или все животное) из второго вида млекопитающего, которая, по крайней мере, в 50 раз, или по крайней мере, в 500 раз, или, по крайне мере, в 1000 раз менее эффективна, чем биологическая активность в соответствующей проверке, применяя реагенты из первого вида млекопитающего.
Видозависимое антитело далее изменяют с тем, чтобы генерировать мутант антитела, который обладает более сильной связывающей аффинностью к антигену из второго вида млекопитающего, чем видозависимое антитело. Мутант антитела предпочтительно обладает связывающей аффинностью к антигену из млекопитающего, не принадлежащего человеческому роду, которая, по крайней мере, в 10 раз сильнее, предпочтительно, по крайней мере, в 20 раз сильнее, более предпочтительно, по крайней мере, в 500 раз сильнее и иногда, по крайней мере, в 1000 или 2000 раз сильнее, чем связывающая аффинность видозависимого антитела к антигену. Увеличение нужной или требуемой связывающей аффинности будет зависеть от первоначальной связывающей аффинности видозависимого антитела. Однако используемая проверка является проверкой биологической активности; мутант антитела предпочтительно обладает биологической активностью в проверке выбора, которая, по крайней мере, имеет в 10 раз лучшую, предпочтительно, по крайней мере, имеет в 20 раз лучшую, более предпочтительно, по крайней мере, в 50 раз лучшую и иногда, по крайней мере, в 100 или 200 раз лучшую, чем биологическая активность видозависимого антитела в данной проверке.
Для генерирования мутанта антитела одно или несколько аминокислотных изменений (например, замещения вводят в одно или несколько изменений (например, замещений) остатков остовной области) могут вводиться в видозависимое антитело, если результатом является улучшение связывающей аффинности мутанта антитела к антигену из второго вида млекопитающего. Примеры модифицируемых остатков остовной области включают остатки, которые нековалентно связывают антиген непосредственно (Amit et al., Science 233: 747-753 (1986)); взаимодействуют с / воздействуют на конформацию CDR (Chothia et al., J. Mol. Biol. 196: 901-917 (1987)); и/или участвуют в VL-VH поверхности раздела (ЕР 239400В1). В некоторых вариантах модификация одного или нескольких остатков остовной области приводит к увеличению связывающей аффинности антитела к антигену из второго вида млекопитающего. Например, от примерно одного до пяти остатков остовной области могут изменяться в данном варианте изобретения. Иногда может быть достаточным получение мутанта антитела, пригодного для использования в предклиническиих исследованиях, даже если не изменялись остатки гипервариабельной области. Однако обычно мутант антитела должен включать дополнительные изменения вариабельной области.
Остатки вариабельной области, которые изменяют, могут меняться произвольно, особенно, если первоначальная связывающая аффинность видозависимого антитела к антигену из второго вида млекопитающего, является таковой, что такие произвольно продуцируемые мутанты антител могут легко подвергаться скринингу (отбору, проверке).
Способы продуцирования антител, которые могут быть взаимозависимыми и поэтому требовать модификации согласно способам, разработанным в данном изобретении, являются следующими:
А. Получение антитела
(I) Получение антигена
Растворимые антигены или их фрагменты, возможно конъюгированные с другими молекулами, могут использоваться в качестве иммуногенов для генерирования антител. Для трансмембранных молекул, например, рецепторы и их фрагменты (например, внеклеточная область рецептора) могут использоваться в качестве иммуногена. Наоборот, клетки, экспрессирующие трансмембранную молекулу, могут применяться в качестве иммуногена. Такие клетки можно получить из природного источника (например, линий раковых клеток) или могут быть клетками, которые трансформируются рекомбинантными способами для экспрессии трансмембранной молекулы. Ясно, что другие антигены и их формы пригодны для получения антител.
(II) Поликлональные антитела
Поликлональные антитела обычно возникают у млекопитающих, не относящихся к человеческому роду, при многочисленных подкожных (sc) или внутрибрюшинных (ip) инъекциях соответствующего антигена и адъюванта. Это может быть полезно для конъюгирования соответствующего антигена с протеином, который является иммуногенным в иммунизируемых видах, например гемоцианин лимфы улитки, сывороточный альбумин, бычий тиреоглобулин или соевый ингибитор трипсина, используя бифункциональный или дериватизирующий агент, например эфир малеимидобензоил-сульфосукцинимида (конъюгация через остатки цистеина), N-гидроксисукцинимид (через остатки лизина), глутаровый альдегид, ангидрид янтарной кислоты, тионилхлорид или R'N=C=CR, где R и R' представляют собой разные алкильные группы.
Животных иммунизируют антигеном, иммуногенными конъюгатами или производными при смешивании, например, 100 мкг или 5 мкг протеина или конъюгата (для кроликов или мышей соответственно) с тремя объемами полного адъюванта Фрейнда и введении раствора через кожу в многочисленные места. Месяцем позже животных ревакцинировали от 1/5 до 1/10 части от первоначального количества пептида или конъюгата в полном адъюванте Фрейнда путем подкожной инъекции в многочисленные места. Через 7-14 дней у животных брали кровь и сыворотку анализировали на титр антитела. Животных ревакцинировали до тех пор, пока титр не переставал изменяться. Предпочтительно животных ревакцинировали конъюгатом того же антигена, но конъюгированного с другим протеином и/или посредством другого перекрестно-сшивающего реагента. Конъюгаты также можно приготовить в рекомбинантной клеточной культуре путем слияния белка. Также агенты, вызывающие агрегацию, как, например, квасцы, успешно применяют для усиления иммунного ответа (реакции).
Выбранное антитело млекопитающего обычно должно обладать достаточно сильной связывающей аффинностью к антигену. Например, антитело может связывать анти-IgE антиген человека с величиной связывающей аффинности (Kd) не более 1×10-7 М, предпочтительно не более 1×10-8 М и наиболее предпочтительно не более 1×10-9 М. Аффинности антител можно определить с помощью насыщающего связывания; твердофазного иммуноферментного анализа (ELISA) и конкурентного анализа (например, радиоиммуноанализа).
Для отбора анти-IgE антител человека можно провести рутинный анализ перекрестного связывания, который описан в Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed. Harlow and David Lane (1988). Наоборот, картирование эпитопа, например, как описано у Champe et al., J. Вiоl. Chem. 270: 1388-1394 (1995), можно выполнить для определения связывания.
В то время как предпочтительный способ определения эффективности полипептида или антитела заключается в количественном определении связывающей аффиности антитела; другие варианты дают оценку одному или нескольким биологическим свойствам антитела в дополнение или вместо определений связывающей аффинности. Такие проверки особенно полезны, если они обеспечивают показание, что касается терапевтической эффективности антитела. Обычно, хотя и необязательно, антитела, которые показывают улучшенные свойства в таких проверках, также должны обладать улучшенной связывающей аффинностью.
(III) Моноклональные антитела
Моноклональные антитела являются антителами, которые распознают отдельную область детерминанты. Их неизменная специфичность делает моноклональные антитела более пригодными, чем поликлональные антитела, которые обычно содержат антитела, которые распознают целый ряд разных областей детерминанты.
Моноклональные антитела можно получать, используя метод гибридом, впервые описанный Kohler et al., Nature 256: 495 (1975), или можно получать методами рекомбинактной ДНК (U.S. Pat. No. 4816567).
В методе гибридом мышь или другое подходящее животное-хозяин, например хомяка или макаку, иммунизируют, как описано выше, для выявления лимфоцитов, которые продуцируют или способны продуцировать антитела, которые будут специфически связываться с протеином, используемым для иммунизации. Наоборот, лимфоциты могут подвергаться иммунизации in vitro. Лимфоциты затем сливаются с миеломными клетками с применением соответствующего фактора, вызывающего слияния клеток, как, например, полиэтиленгликоля, с образованием клетки гибридомы (Coding, Monoclonal Antibodies: Principles and Practice, pp. 59-103 (Academic Press, (1986)).
Таким образом, полученные клетки гибридом засевают и выращивают в подходящей культурной среде, которая предпочтительно содержит одно или несколько веществ, которые ингибируют рост или естественный отбор неслившихся родительских миеломных клеток. Например, если родительские миеломные клетки испытывают недостаток в ферменте -гипоксантингуанинфосфорибозилтрансферазе (HGPRT или HPRT), тогда культурная среда для гибридом обычно должна содержать гипоксантин, аминоптерин и тимидин (ГАТ-среда), вещества, которые предотвращают рост HGPRT-дефицитных клеток.
Предпочтительными миеломными клетками являются те, которые легко сливаются, поддерживают стабильно высокий уровень продуцирования антитела отобранными антитело-продуцирующими клетками и являются восприимчивыми к среде, как, например, к ГАТ-среде. Среди них предпочтительными миеломными клеточными линиями являются относящиеся к мышам или крысам миеломные линии, как, например, полученные из МОРС-21 и МРС-11 опухолей мышей, доступные из центра - Salk Institute Cell Distribution Center, San Diego, California USA, и SP-2 или X63-Ag8-653 клетки, доступные из американской коллекции культур (American Type Culture Collection, Rockville, Maryland USA). Также для продуцирования моноклональных антител человека были описаны миеломные клеточные линии человека и гетеромиеломные клеточные линии мыши-человека (Kozbar, J. Immunol., 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker. Inc., New York, (1987)).
Культурную среду, в которой культивируются клетки гибридом, проверяли на продуцирование моноклональных антител, направленных против антигена. Предпочтительно связывающую специфичность моноклональных антител, продуцируемых клетками гибридом, определяют с помощью иммунопреципитации или реакцией связывания in vitro, такой как радиоиммуноанализ (radioimmunoassay, RIA) или твердофазный иммуноферментный анализ (enzyme-linked immunoabsorbent assay, ELISA).
После того как клетки гибридомы, которые продуцируют антитела требуемой специфичности, аффинности и/или активности идентифицируют, клоны можно субклонировать с применением техники ограниченного разбавления и культивировать стандартными способами (Goding, Monoclonal Antibodies: Principals and Practice, pp. 59-103, Academic Press, 1986). Подходящей культурной средой для этой цели является, например, D-MEM или RPMI-1640 среда. Кроме того, клетки гибридом можно культивировать стандартными in vivo в виде асцитных опухолей у животных.
Моноклональные антитела, выделяемые (секретируемые) субклонами, легко отделяются от культурной среды, асцитической жидкости или сыворотки обычными способами очистки иммуноглобулинов, такими как протеин А-сефороза, гидроксилапатитная хроматография, гель-электрофорез, диализ или аффинная хроматография.
ДНК, кодирующая моноклональные антитела, легко выделяется и секвенируется с использованием обычных методик (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелую и легкую цепи моноклональных антител). Клетки гибридом служат предпочтительным источником таких ДНК. Однажды выделенная ДНК может помещаться в экспрессирующие векторы, которые затем трансфектируются в клетках-хозяевах, например, клетки Е. соli., клетки COS обезьяны, клетки яичника китайского хомячка (Chinese hamster ovary, CHO) или миеломные клетки, которые иным способом не продуцируют белок иммуноглобулина, применяя синтез моноклональных антител в рекомбинантных клетках-хозяевах. Рекомбинантное продуцирование антител более детально будет описано ниже.
В другом варианте антитела или фрагменты антител можно выделять из фаговых библиотек антител, генерируемых с использованием методики, описанной в McCafferty et at., Nature, 348: 552-554 (1990). В работах Clackson et al. Nature 352: 624-628 (1991) и Marks et al., J. Mol. Biol., 222: 581-597 (1991) описано выделение антител, относящихся к мышам или крысам и к человеку, соответственно, с использованием фаговых библиотек. Последующие публикации описывают продуцирование антител человека высокой аффинности (в пределах nМ) путем перестановки (перемещения) цепи (Marks et al., Bio/Technology, 10: 779-783 (1992)), а также комбинаторной инфекцией и рекомбинацией in vivo как стратегии создания очень больших фаговых библиотек (Water-house et al., Nuc. Acids. Res., 21: 2265-2266 (1993)). Таким образом, эти методы являются жизнеспособными вариантами по отношению к традиционным методам гибридом моноклональных антител для отделения моноклональных антител.
ДНК также можно модифицировать, например, замещением кодирующей последовательности на константные области тяжелой и легкой цепи человека вместо гомологических последовательностей, относящихся к мышам или крысам (U.S. Patent No. 4816567; Morrison, et al., Proc. Natl. Acad. Sci., USA, 81: 6851 (1984)), или ковалентным присоединением к иммуноглобулиновому полипептиду.
Обычно такие неиммуноглобулиновые полипепиды замещаются на константные области антитела, или они замещаются на вариабельные области одного антигенсвязывающего центра антитела для создания химерного двухвалентного антитела, включающего один антигенсвязывающий центр антитела, обладающий специфичностью к антигену, и другой антигенсвязывающий центр антитела, обладающий специфичностью к другому антигену.
(IV) Генерирование мутантных антител
Если видозависимое антитело идентифицировано и выделено, то часто полезно генерировать вариант антитела или мутант, в котором изменяют один или несколько аминокислотных остатков в одной или нескольких гипервариабельных областях антитела млекопитающего. Наоборот или к тому же, одно или несколько изменений (например, замещений) остатков остовной области могут вводить в антитело млекопитающего, где это приводит к улучшению связывающей аффинности мутанта антитела для IgE человека. Примеры остатков остовной области для модификации включают остатки, которые непосредственно нековалентно связывают антиген (Amit et al., Science 233: 747-753 (1986)); взаимодействуют с / воздействуют на конформацию CDR (Chothia et al., J. Mol Biol. 196: 901-917 (1987)); и/или участвуют в VH-VL поверхности раздела (ЕР 239400 В1). В некоторых вариантах модификация одного или нескольких остатков остовной области приводит к увеличению связывающей аффинности антитела для антигена человека. Например, от примерно одного до пяти остатков остовной области могут изменяться в данном варианте изобретения. Иногда может быть достаточным получение мутанта антитела, пригодного для использования в предклинических исследованиях, даже если не изменялись остатки гипервариабельной области. Однако обычно мутант антитела должен включать дополнительные изменения вариабельной области.
Изменяемые остатки гиперварибельной области могут заменяться произвольно, особенно, если первоначальная связывающая аффинность видозависимого антитела является такой, что произвольно продуцированные мутанты антитела могут легко подвергаться отбору (проверке).
Одна пригодная для генерирования мутантов антитела методика известна как “аланин сканирующий мутагенез” (Cunningham B.C., Wells J.A. Science 244: 1081-1085 (1989); Cunningham B.C., Wells J.A. Proc. Natl. Acad. Sci. USA 84, 6434-6437 (1991)). В данном случае для оказания влияния на взаимодействие аминокислот с антигеном из вида второго млекопитающего один или несколько остатков гипервариабельной области заменяют на остаток(ки) аланина или полиаланина. Эти остатки гипервариабельной области, демонстрирующие функциональную чувствительность к замещениям, далее очищают введением дополнительных или других мутаций в сайтах замещения и для сайтов замещения. Таким образом, хотя сайт для введения изменения аминокислотной последовательности определяют заранее, природа мутации, по-существу, не должна быть заранее определена. Ala-мутанты, продуцированные таким образом, подвергают отбору по их биологической активности, описанной в данном изобретении. Подобные замещения могут предприниматься с другими аминокислотами, в зависимости от нужного свойства, создаваемого сканирующими остатками.
Изобретение также относится к синтетическому способу идентификации аминокислотных остатков, которые модифицируют. Согласно данному способу, идентифицируют остатки гипервариабельной области в видозависимом антителе, которые вовлечены в связывание первого вида млекопитающего, и остатки гипервариабельной области, вовлеченные в связывание гомологии данного антигена из второго вида млекопитающего. Для достижения этого можно осуществить аланированное сканирование остатков гипервариабельной области видозависимого антитела, причем каждый ala-мутант проверяют на связывание с первым и вторым видом млекопитающего. Тем самым идентифицируют остатки гипервариабельной области, вовлеченные в связывание антигена из первого вида млекопитающего (например, человека), и остатки, вовлеченные в связывание гомологии антигена из второго вида млекопитающего (например, не относящегося к человеческому роду). Предпочтительно, чтобы остаток(ки), в значительной степени вовлеченный(ые) в связывание антигена из второго вида млекопитающего (например, млекопитающего, не относящегося к человеческому роду), а не антиген из первого вида млекопитающего (например, человека) выбирали в качестве кандидатов для модификации. В другом варианте для модифицирования отбирают эти остатки, в значительной степени вовлеченные в связывание антигена из первого и второго вида млекопитающего. Еще в другом, но менее предпочтительном варианте эти остатки, которые вовлекают в связывание антигена из IgЕ человека, но не гомологичный IgЕ млекопитающего (не относящегося к человеческому роду), отбирают для модификации. Такая модификация может включать делецию (элиминирование) остатка или вставку одного или нескольких остатков по соседству с представляющим интерес остатком. Однако обычно модификация включает замещение остатка на другую аминокислоту.
Обычно можно начать с консервативного замещения, например, показанного в таблице А, ниже в графе “предпочтительные замещения”. Если такие замещения приводят к изменению биологической активности (например, связывающей аффинности), тогда вводят более существенные изменения, названные “типичные замещения” в табл.А, или, как в дальнейшем описано в отношении классов аминокислот, и продукты подвергают проверке.
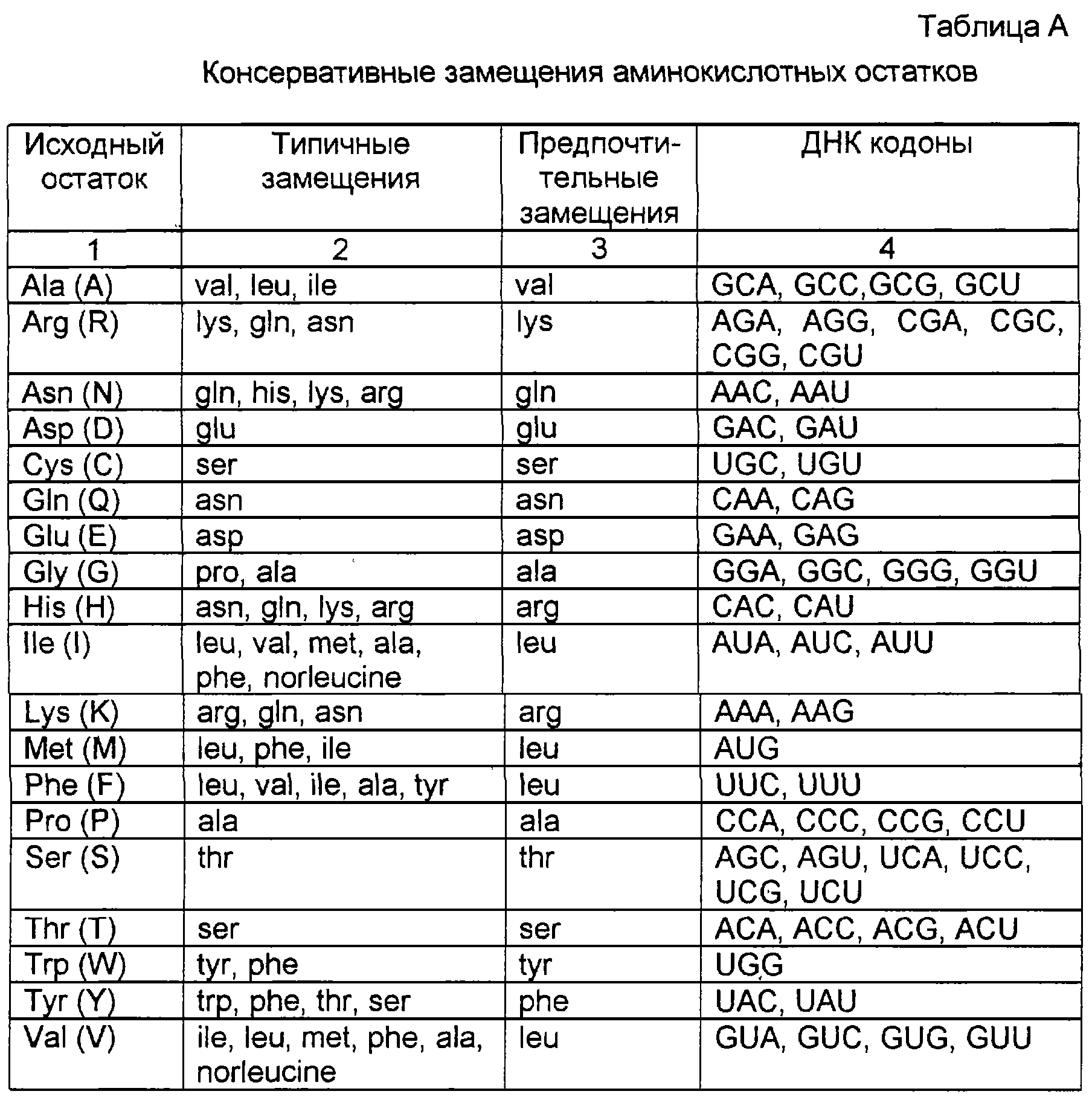
Даже более существенные модификации в биологических свойствах антител совершают выбором замещений, которые отличаются в значительной степени по их влиянию на сохранение: (а) структуры полипептидного остова в области замещения, например, складчатой или спиральной конформации; (б) заряда или гидрофобности молекулы в сайте-мишени или (в) объема боковой цепи. Встречающиеся в природе остатки разделяют на группы, в зависимости от общих свойств боковой цепи:
(1) гидрофобные: norleucine (норлейцин), met, ala, val, leu, ile;
(2) нейтральные или гидрофильные: cys, ser, thr, asp, gln;
(3) кислые; asp, glu;
(4) основные (щелочные): his, lys, arg;
(5) остатки, которые влияют на ориентацию цепи: gly, pro; и
(6) ароматические: trp, tyr, phe.
Неконсервативные замещения вызовут обмен представителя одного их этих классов на другой класс.
Молекулы нуклеиновой кислоты, кодирующей аминокислотную последовательность мутантов, получают с помощью целого ряда известных способов. Данные способы включают, но не ограничиваются только сайтнаправленным мутагенезом с использованием олигонуклеотидов, PCR мутагенезом и кассетным мутагенезом ранее полученного мутанта или немутантной версии видозависимого антитела. Предпочтительным способом получения мутантов является сайтнаправленный мутагенез (см. Kunkel, Proc. Natl. Acad. Sci. USA 82: 488 (1985)).
В некоторых вариантах мутант антитела будет иметь лишь единственный замещенный остаток гипервариабельной области, например, из 2 до 15 возможных замещений гипервариабельной области.
Обычно мутант антитела с улучшенными биологическими свойствами должен иметь аминокислотную последовательность, которая, по крайней мере, на 75% идентична или подобна аминокислотной последовательности вариабельной области тяжелой или легкой цепи IgE антитела человека против млекопитающего, более предпочтительно, по крайней мере, 80%, более предпочтительно, по крайней мере, 85%, еще более предпочтительно, по крайней мере, 90% и наиболее предпочтительно, по крайней мере, 95%. Идентичность или подобие в отношении последовательности определяют как процент аминокислотных остатков в последовательности кандидата, которая идентична (т.е. одинаковый остаток) или подобна (т.е. аминокислотный остаток из одной и той же группы, основанной на общих свойствах боковой цепи, supra) остаткам видозависимого антитела, после проведения сравнительного анализа последовательностей и введения двух нитевых разрывов, если необходимо, для достижения максимального процента идентичности последовательности.
Наоборот, мутанты антитела можно генерировать с помощью систематической мутации CDR областей тяжелой и легкой цепей анти-IgE антитела. Предпочтительная методика для генерирования таких мутантов антитела включает применение “созревания аффинности”, используя фаговое изображение (Hawkins et al., J. Mol. Biol. 254: 889-896 (1992) и Lowman et al., Biochemistry 30(54): 10832-10838 (1991)). Известно, что слияния бактериофаговой оболочки с протеином (Smith, Science 228: 1315 (1985); Scott, Smith, Science 249: 386 (1990); Cwirla et al., Proc. Natl. Acad. Sci. USA 8: 309 (1990); Devlin et al., Science 249: 404 (1990); в приведенном обзоре Wells, Lowman, Curr. Opin. Struct. Biol. 2: 597 (1992); U.S. No. Pat. 5223409) пригодны для связывания фенотипа отображенных протеинов или пептидов с генотипом бактериофаговых частиц, которые их кодируют. F(ab) области антител также были отображены на фаге (McCafferty et al., Nature 348: 552 (1990); Barbas et al., Proc. Natl. Acad. Sci. USA 88: 7978 (1991); Garrard et al., Biotechnol. 9: 1373 (1991)).
Одновалентное фаговое отображение содержит отображение набора вариантов протеина в виде слияний с протеином бактериофаговой оболочки таким образом, чтобы ограничить воспроизведение вариантов до только одной копии на несколько фаговых корпускул (Bass et al., Proteins 8: 309 (1990)). “Созревание аффинности” или улучшение равновесных связывающих аффинностей различных протеинов ранее было достигнуто посредством последовательного применения мутагенеза, одновалентного фагового отображения функционального анализа и прибавления благоприятных мутаций, как это является примером в случае гормона роста человека (Lowman, Wells, J. Mol. Biol. 234: 564-578 (1993); U.S. Pat. No. 5534617), а также F(ab) области антител (Barbas et al., Proc. Natl. Acad. Sci. USA 91: 3809 (1994); Yang et al., J. Mol. Biol. 254: 392 (1995)).
Библиотеки многих (106) вариантов протеина, отличающиеся в определенных положениях их последовательностью, можно создать из бактериофаговых частиц, каждая из которых содержит ДНК, кодирующую отдельный вариант протеина. После циклов аффинной очистки с использованием иммобилизованного антигена индивидуальные клоны бактериофагов изолируют и аминокислотную последовательность их воспроизведенного протеина выводят из их ДНК.
(а) Облагороженные антитела и антитела человека
Облагораживание является способом получения химерного антитела, где существенно меньшая часть неповрежденной вариабельной области, относящейся к человеческому роду, была замещена соответствующей последовательностью из видов, не относящихся к человеческому роду. Облагороженное антитело имеет один или несколько аминокислотных остатков, введенных в нее из источника, который не принадлежит к человеческому роду. Данные аминокислотные остатки, не принадлежащие к человеческому роду, часто называют “чужеродными” остатками, которые обычно берут из “чужеродной” вариабельной области. Облагораживание можно осуществить, в основном, следуя способу Уинтера с сотр. (Winter) (Jones et al., Nature 321: 522-525 (1986); Riechman et al., Nature 332: 323-327 (1988); Verhoeyen et al., Science 239: 1534-1536 (1988)), путем замещения гипервариабельных участков CDRs или CDR последовательностей грызунов на соответствующие последовательности антитела человека. Соответственно, такие “облагороженные” антитела являются химерными антителами (U.S. Pat. No. 4816567), в которых значительно меньшая часть неповрежденной вариабельной области человека замещена на соответствующую последовательность из вида, не принадлежащего к человеческому роду. На практике облагороженные IgЕ антитела имеют некоторые CDR остатки и возможно некоторые FR остатки, замещенные остатками аналогичных центров в антителах, относящихся к мышам или крысам.
Выбор вариабельных областей человека, как легкой, так и тяжелой, используемых для получения облагороженных антител, очень важен для уменьшения антигенности. Согласно так называемому методу “наилучшего соответствия”, проводят скрининг последовательности вариабельной области антитела грызуна относительно полной (всей) библиотеки известных последовательностей вариабельных областей человека. Последовательность, принадлежащая человеческому роду, которая ближе всего к последовательности грызуна, далее принимается в качестве остовной области (FR) человека для облагороженного антитела (Sims et al., J. Immunol., 151: 2296 (1993), Chothia et al., J. Mol. Biol., 196: 901 (1987)). Другой способ использует определенную остовную область, полученную из “консенснусной” последовательности всех антител человека определенной подгруппы легкой или тяжелой цепей. Эту же остовную область можно использовать для некоторых других облагороженных антител (Carter et al., Proc. Natl. Acad. Sci., USA, 89: 4285 (1992); Presta et al., J. Immunol. 151: 2623 (1993)).
Кроме того, важно, что антитела облагораживаются с сохранением высокой аффинности к антигену и других важных биологических свойств. В соответствии с предпочтительным вариантом для достижения этой цели облагороженные антитела получают методом анализа исходных (родительских) последовательностей и различных концептуальных облагороженных продуктов, используя трехмерные модели родительских и облагороженных последовательностей. Модели отдельных областей антитела, например VH и VL областей, создают отдельно от “консенсусных” последовательностей, основываясь на F(ab) структурах, которые имеют аналогичные последовательности. Трехмерные модели иммуноглобулина обычно доступны и известны специалистам. Имеются компьютерные программы, которые иллюстрируют и отображают вероятные трехмерные конформационные структуры выбранных кандидатных последовательностей иммуноглобулина. Анализ этих отображений позволяет сделать вывод о возможной роли остатков в функционировании кандидатной последовательности иммуноглобулина, т.е. сделать вывод об остатках, которые влияют на способность кандидата иммуноглобулина связывать антиген. Например, при моделировании фрагмента F(ab)-12 в примере 2 использовали МАЕ11 мышей или крыс в качестве темплата для стимулирования остатков CDR и остовной области для модифицирования (видоизменения) вместе с молекулярным моделированием для получения мутантной последовательности.
В качестве другого примера можно упомянуть контрольное антитело Mab4d5. Модель создавали, основываясь на нескольких Fab структурах из банка данных протеина Брукхавена (Brookhaven) (входы 1FB4, 2RHE, 2МСР, 3FAB, 1 FBg, 2HFL и 1 REI). F(ab) фрагмент KOL (Marquart M. et al., J. Mol. Biol. 141: 369-391 (1980)) как первый выбранный в качестве темплата для VL и VH областей и дополнительные структуры далее накладывались на данную структуру, используя координаты их главной цепи атомов (программа INSIGHT, Biosym Technologies). Подобные программы и приемы используют для моделирования нужного антитела.
Типичный анализ, использующий молекулярное моделирование, можно проводить следующим образом. Расстояние от темплаты Сα до аналогичного Са в каждой из накладываемых структур вычисляют для положения каждого данного остатка. Обычно, если все (или почти все) Сα-Сα расстояния для данного остатка ≤1

Таким образом, остатки остовной области можно выбрать и отделить от реципиента и чужеродных последовательностей с тем, чтобы достичь нужных характеристик антитела, например увеличенную аффинность для антигена(ов)-мишени. Обычно CDR остатки непосредственно и в основном включают для оказания влияния на связывание антигена. Данный способ использовали при создании F(ab)-12 в примере 2, где применяли комбинацию CDR остатков крыс или мышей вместе с молекулярным моделированием для создания фрагмента облагороженного анти-IgE антитела мышей или крыс.
Наоборот, в настоящее время возможно продуцировать трансгенных животных (например, мышей), которые при иммунизации способны продуцировать полный спектр антител человека в отсутствии продуцирования эндогенного иммуноглобулина. Например, было описано, что гомозиготная делеция тяжелой цепи области соединения (JH) гена антитела в химерных и линии-эмбриона мутантных мышей приводит к полному ингибированию продуцирования эндогенного антитела. Перенос ранжированного ряда гена иммуноглобулина линии-эмбриона человека в такую линию-эмбриона мутантных мышей приведет к продуцированию антител человека при антигенном стимуле (см., например, Jakobovits et al., Proc. Natl. Acad. Sci. USA 90: 2551 (1993)); Jacobovits et al., Nature 362: 255-258 (1993); Bruggermann et al., Year in Immunol. 7: 33 (1993); и Duchosal et al., Nature 355: 258 (1992)). Антитела человека можно также получить из библиотек фагов-отображений (Hoogenboom et al., J. Mol. Biol. 227: 381 (1991); Marks et al, J. Mol. Biol., 222: 581-597 (1991); Vaughan et al., Nature Biotech. 14: 309 (1996)).
(б) Дополнительные модификации
После продуцирования мутанта антитела определяют биологическую активность данной молекулы относительно видозависимого антитела. Как отмечалось выше, это может включать определение связывающей аффинности и/или других биологических активностей антитела. В предпочтительном варианте изобретения получают патель мутантов антитела и проверяют связывающую активность к антигену из второго вида млекопитающего. Один или несколько мутантов антитела, выбранных с помощью этого первоначального скрининга, подвергают одной или нескольким дальнейшим проверкам биологической активности, чтобы подтвердить, что мутант(ы) антитела с увеличенной связывающей аффинностью действительно пригоден, например, для предклинических исследований. В предпочтительных вариантах мутант антитела сохраняет способность связывать антиген из первого вида млекопитающего со связывающей аффинностью, подобной видозависимому антителу. Это можно достигнуть путем отмены изменения остатков гипервариабельной области, включенных в связывание антигена из антитела против человека. В других вариантах, мутант антитела может иметь значительно измененную связывающую аффинность от первого вида млекопитающего (например, связывающая аффинность к антигену лучше, но может быть хуже, чем видозависимое антитело).
Мутант(ы) антитела, таким образом выбранный, можно подвергнуть дальнейшим модификациям, в зависимости от предполагаемого применения антитела. Такие модификации могут вовлекать дальнейшее изменение аминокислотной последовательности, слияние с гетерологическим(ими) полипептидом(ами) и/или ковалентные модификации, такие как разработанные выше. Что касается изменений аминокислотной последовательности, типичные модификации тщательно разработаны ниже. Например, любые остатки цистеинов, не вовлеченные в сохранение соответствующей конформации мутанта антитела, также могут замещаться обычно серином для улучшения окислительной стабильности молекулы и предотвращения отклоняющегося от нормы перекрестного сшивания. Наоборот, (а) цистеиновую связь(и) можно добавлять к антителу для улучшения его стабильности (особенно, если антитело представляет собой фрагмент антигена, например Fv фрагмент). Другой тип аминокислотного мутанта имеет измененную структуру гликозилирования. Этого можно достигнуть путем делеции (элиминирования) одного или нескольких углеводных остатков, имеющихся в антителе, и/или добавлением одного или нескольких сайтов (центров) гликозилирования, которые не.присутствуют в антителе. Гликозилирование антител обычно является N-связанным или O-связанным. N-связанное относится к присоединению углеводного остатка к боковой цепи остатка аспарагина. Последовательности трипептида аспарагин-Х-серин и аспаргин-Х-треонин, где Х - любая аминокислота, исключая пролин, являются последовательностями распознавания ферментативного присоединения углеводного остатка к боковой цепи аспарагина. Таким образом, присутствие любой из этих трипептидных последовательностей в полипептиде создает потенциальный сайт (центр) гликозилирования. O-связанное гликозилирование относится к присоединению сахара через эфирный кислород; например, N-ацетилгалактозамин, галактоза, фукоза или ксилоза, связанная с гидроксиаминокислотой, чаще серином или треонином, хотя также можно использовать 5-гидроксипролин или 5-гидроксилизин. Добавление сайтов гликозилирования к антителу удобно совершать путем изменения аминокислотной последовательности с тем, чтобы она содержала одну или несколько вышеописанных трипептидных последовательностей (для N-связанных сайтов гликозилирования). Изменение также можно совершить при добавлении или замещении одного или нескольких остатков серина или треонина в последовательности исходного антитела (для O-связанных сайтов гликозилирования).
(V) Фрагменты антитела
Разработаны разнообразные способы продуцирования фрагментов антитела. По традиции данные фрагменты получают через протеолитический гидролиз неповрежденных антител (см., например, Morimoto et al., J. Biochem. Biophys. Meth. 24: 107-117 (1992) и Brennan et al., Science 229: 81 (1985)). Однако эти фрагменты можно в настоящее время продуцировать непосредственно рекомбинантными клетками-хозяина. Например, фрагменты антитела можно изолировать от фаговых библиотек антитела, рассмотренных выше. Наоборот, F(ab')2-SH фрагменты можно непосредственно выделить из E.coli и химически соединить для образования F(ab')2 фрагментов (Carter et al., Bio/Technology 10: 163-167 (1992)). Согласно другому подходу, F(ab') фрагменты можно изолировать непосредственно из рекомбинантной культуры клетки-хозяина. Другие способы продуцирования фрагментов антитела очевидны для специалистов. В других вариантах выбранное антитело является Fv фрагментом отдельной цепи (scFv) (PCT Patent Application WO 93/16185).
(VI) Мультиспецифические антитела
Мультиспецифические антитела обладают связывающими специфичностями, по крайней мере, к двум различным антигенам. В то время как такие молекулы обычно должны связывать только два антигена (т.е. биспецифические антитела, BsAbs), антитела с дополнительными специфичностями, например триспецифические антитела, включены в данное изобретение под таким названием. Примеры BsAbs включают биспецифические антитела с одним плечом, направленным против антигена опухолевой клетки, и другим плечом, направленным против цитотоксичной стимулированной молекулы, например анти-FсyRI/анти-СD15, анти-p185HER2/FcyRIII (CD16), анти-СD3/противораковых В-клеток (1D10), анти-СD3/анти-р185HER2, анти-СD3/анти-р97, анти-СD3/анти-почечно-клеточная карцинома, анти-СD3/анти-ОVСАR-3, анти-СD3/L-D1 (анти-толстокишечная карцинома), анти-СD3/анти-аналог меланоцитного стимулирующего гормона, анти-EGF рецептор/анти-СD3, анти-СD3/анти-САМА1, анти-СD3/анти-СD19, анти-СD3/МоV18, анти-нервно-клеточная адгезионная молекула (neural cell adhesion molecule, NСАМ)/анти-СD3, анти-фолат-связывающий протеин (folate binding protein, РВР)/анти-СD3, анти-“пэн” карциному связывающий антиген (АМОС-31)/анти-СD3; BsAbs с одним плечом, которое специфически связывается с опухолевым антигеном и другим плечом, которое связывается с токсином, например анти-сапонин/анти-Id-1, анти-СD22/анти-сапорин, анти-СD7/анти-сапорин, анти-СD38/анти-сапорин, анти-СЕА/анти-А цепь рицина, анти-СD22/анти-сапорин, анти-СD7/анти-сапорин, анти-СD38/анти-сапорин, анти-СЕА/анти-А цепь рицина, анти-α-интерферон (IFN-α)/анти-идиотип гибридомы, анти-СЕА/анти алкалоид винка; BsAbs для превращения фермент-активированных предшественников лекарственных средств, например анти-СD30/анти-щелочная фосфатаза (которая катализирует превращение предшественника лекарственного препарата фосфата митомицина в митомициновый спирт); BsAbs, которое можно использовать в качестве фибринолитических агентов, например анти-фибрин/анти-тканевый активатор плазминогена (tissue, plasminogen activator, tPA), анти-фибрин/анти-урокиназоподобный активатор плазминогена (urokinase-type plasminogen activator, uPA), BsAbs для конъюгирования иммунных комплексов с клеточно-поверхностными рецепторами, например антилипопротеин низкой плотности (low density lipoprotein, LDL)/aнти-Fc рецептор (например, FcγRI, FcγRII или FcγRIII); BsAbs для применения в лечении инфекционных заболеваний, например анти-СВ3-анти-вирус простого герпеса (herpes simplex virus, HSV), анти-Т-клеточный рецептор. CD3 комплекс/анти-грипп, анти-РсγR/анти-HIV, BsAbs для детектирования опухоли, in vitro или in vivo, например анти-СЕА/анти-EOTUBE, анти-СЕА/анти-DPTA, анти-р185HER2/анти-гаптен; BsAbs в качестве адъювантов вируса; и BsAbs в качестве диагностических средств, например анти-IgG кролика/анти-ферритин, анти-пироксидаза из хрена (horseradish peroxidase, НRР)/анти-гормон, анти-соматостатин/анти-вещество Р, анти-НRР/анти-FIТС, анти-СЕА/анти-β-галактозидаза. Примеры триспецифических антител включают анти-СD3/анти-СD4/анти-СD37, анти-СD3/анти-СD5/анти-СD37 и анти-СD3/анти-СD8/анти-СD37. Биспецифические антитела можно получить в виде антител полной длины или фрагментов антител (например, F(ab')2 биспецифических антител).
Способы получения биспецифических антител известны. Традиционное продуцирование биспецифических антител полной длины основано на коэкспрессии двух пар тяжелой цепи - легкой цепи иммуноглобулина, где две цепи обладают различными специфичностями (Millstein et al., Nature 305: 537-539 (1983)). Вследствие произвольного набора тяжелой и легкой цепей иммуноглобулина данные гибридомы (квадромы) продуцируют возможную смесь десяти различных молекул антитела, из которых только одна обладает правильной биспецифической структурой. Очистка “правильной” молекулы, которую обычно выполняют с помощью аффинной хроматографии, является довольно обременительной процедурой, и выход продукта - низким. Подобные методики описаны впервые в WO 93/08829 и в Traunecker et at., EMBO J. 10: 3655-3659 (1991).
Согласно различным подходам, вариабельные области антитела с нужными связывающими специфичностями (антитело-антиген связывающие сайты) подвергают слиянию с последовательностями константной области иммуноглобулина. Слияние преимущественно происходит с константной областью тяжелой цепи иммуноглобулина, включающей, по крайней мере, часть шарнирной, СН2 и СН3 областей. Предпочтительно, чтобы первая константная область тяжелой цепи (СН1), содержащая центр (сайт), необходимый для связывания легкой цепи, присутствовала, по крайней мере, при одном слиянии. ДНК-ты, кодирующие слияния тяжелой цепи иммуноглобулина и, если требуется, легкой цепи иммуноглобулина, вставляются в определенные экспрессирующие векторы и котрансфектируются в подходящий организм хозяина. Это обеспечивает высокую жесткость в регулировании взаимных соотношений трех фрагментов полипептида в случае, когда неравные соотношения трех цепей полипептида, используемых в конструкции, дают оптимальные выходы. Однако возможно вставить кодирующие последовательности двух или всех трех цепей полипептида в один экспрессирующий вектор, когда экспрессия, по крайней мере, двух полипептидных цепей, взятых в равных соотношениях, приводит к высоким выходам или когда соотношения не имеют особого значения.
В предпочтительном варианте одно плечо биспецифического антитела составлено из тяжелой цепи гибрида иммуноглобулина с первичной связывающей специфичностью и второе плечо - из пары тяжелой-легкой цепи гибрида иммуноглобулина (обеспечивая вторичную связывающую специфичность). Найдено, что эта асимметрическая структура облегчает отделение соответствующего биспецифического соединения от ненужных комбинаций цепей иммуноглобулина, поскольку присутствие легкой цепи имммуноглобулина только в одной части биспецифической молекулы обеспечивает удобный способ отделения. Этот подход предложен в WO 94/04690. Для более детального описания получения биспецифических антител см., например, Suresh et al., Methods in Enzymology, 121: 210 (1986).
Согласно другому подходу, описанному в WO 96/27011, поверхность раздела между парами молекул антитела можно создать, доведя до максимума процентное содержание гетеродимеров, которые выделяют из рекомбинантной клеточной культуры. Предпочтительная поверхность раздела включает, по крайней мере, часть области константной области антитела. В данном способе одну или несколько малых аминокислотных боковых цепей из поверхности раздела первой молекулы антитела замещают (заменяют) большими боковыми цепями (например, тирозином или триптофаном). Уравновешивающие “полости” идентичного или подобного размеру большой боковой цепи(ей) создают на поверхности раздела второй молекулы антитела путем замены больших аминокислотных боковых цепей меньшими (например, аланином или треонином). Это обеспечивает механизм для увеличения выхода гетеродимера по сравнению с другими ненужными конечными продуктами, например гомодимерами.
Биспецифические антитела включают перекрестносшитые или “гетероконъюгированные” антитела. Например, одно из антител в гетероконъюгате может соединяться с авидином, другое - с биотином. Такие антитела, например, были предложены для клеток-мишеней иммунной системы для ненужных (лишних) клеток (US Patent No. 4676980) и для лечения ВИЧ инфекции (WO 91/00360, WO 92/200373 и ЕР 03089). Гетероконъюгированные антитела можно получить с применением любых удобных перекрестносшивающих методов. Подходящие перекрестносшивающие агенты наряду с некоторыми перекрестносшивающими методиками хорошо известны и описаны в US Patent No. 4676980.
Способы получения биспецифических антител из фрагментов антител также были описаны в литературе. Например, биспецифические антитела можно получить, применяя химическое сшивание. Brennan et al., Science 229: 81 (1985) описывает методику, в которой неповрежденные антитела протеолитически расщепляются с образованием F(ab')2 фрагментов. Эти фрагменты восстанавливают в присутствии дитиолкомплексующего агента натрия арсенита, стабилизируя винцинальные дитиолы и препятствуя образованию внутримолекулярных дисульфидных связей. Генерированные F(ab)' фрагменты далее превращают в тионитробензоатные (TNB) производные. Затем одно из Fab'-TNB-производных превращают в Fаb'-тиол восстановлением с помощью меркаптоэтиламином и смешивают с эквимолярным количеством другого Fab'-TNB производного с образованием биспецифического антитела. Продуцированные биспецифические антитела можно использовать в качестве агентов для селективной иммобилизации ферментов.
Недавний прогресс способствовал прямому выделению Fab'-SH фрагментов из Е.соli, которые можно химически связывать с образованием биспецифических антител. Shalaby et al., J. Exp. Med 175; 217-225 (1992) описывают продуцирование молекулы полностью “облагороженного” биспецифического антитела F(ab')2. Каждый Fab' фрагмент отдельно секретировали из E.coli и подвергали прямому химическому сшиванию in vitro с образованием биспецифического антитела. Таким образом полученное биспецифическое антитело было способно связываться с клетками, сверхпродуцирующими ЕrbВ2 рецептор, и нормальными Т-клетками человека, а также стимулировать литическую активность цитотоксических лимфоцитов человека против мишеней опухоли молочной железы человека.
Были также описаны различные способы получения и выделения фрагментов биспецифических антител непосредственно из рекомбинантной клеточной культуры. Например, биспецифические антитела были получены с использованием связывания лейцином (Kostelny et al., J. Immunol. 148(5); 1547-1553 (1992). Лейцинсвязанные пептиды из Fos и Jun протеинов присоединяли к Fab' частям двух различных антител при слиянии гена. Гомодимеры антитела восстанавливали в шарнирной области с образованием мономеров и затем заново окисляли с образованием гетеродимеров антитела. Данный способ можно также использовать для продуцирования гомодимеров антитела. Технология “диатела”, описанная в работе Hollinger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993), обеспечивала альтернативный механизм получения фрагментов биспецифического антитела. Фрагменты включают вариабельную область тяжелой цепи (VH), связанную с вариабельной областью легкой цепи (VL), с помощью линкера, который слишком мал, чтобы допустить соединение двух областей на одной и той же цепи. Таким образом, VH и VL области одного фрагмента принудительно соединяют с комплементарными (гипервариабельными) VL и VH областями другого фрагмента, тем самым образуя два антигенсвязывающих центра. Также сообщалось о другой стратегии получения фрагментов биспецифического антитела с использованим димеров одной цепи Fv(sFv) (см. Gruger et al., J. Immunol., 152: 5368 (1994)).
Рассматривают более чем двухвалентные антитела. Например, можно получить триспецифические антитела (Tutt et al., J. Immunol. 147: 60 (1991)).
(VII) Инженерия эффекторной функции
Желательно модифицировать антитело, что касается его эффекторной функции с тем, чтобы увеличить эффективность антитела в связывании, например, с IgE. Например, остаток(и) цистеина может вводиться в Fc-область, тем самым способствуя образованию дисульфидной связи между цепями в данной области. Таким образом, полученное гомодимерное антитело может иметь улучшенную способность интернализации и/или увеличенный комплемент-опосредованный лизис и увеличенную антитело-зависимую клеточную цитотоксичность (antibody-dependent cellular cytotoxicity, ADCC), см. Caron et al., J. Exp. Med. 176: 1191-1195 (1992) и Shopes В., J. Immunol. 148: 2918-2922 (1993). Наоборот, может быть создано антитело, которое имеет двойную Fc область и тем самым может иметь увеличенный комплементный лизис и ADCC способности. См. Stevenson et al., Anti-Cancer Drug Design 3: 219-230 (1989).
(VIII) Иммуноконъюгаты
Изобретение также относится к иммуноконъюгатам, содержащим антитело, конъюгированное с цитотоксическим агентом, как, например, хемотерапевтическим агентом, токсином (например, ферментативно активный токсин бактериального, грибкового, растительного и животного происхождения или их фрагменты) или радиоактивным изотопом (т.е. радиоконъюгат).
Хемотерапевтические агенты, пригодные для образования таких иммуноконъюгатов, описаны выше. Ферментативно активные токсины и их фрагменты, которые можно использовать, включают А-цепь дифтерии, несвязывающие активные ферменты токсина дифтерии, А-цепь экзотоксина (из Pseudomonas aeruginosa), А-цепь рицина, А-цепь абрина, А-цепь модецина, α-сарцин, протеины Aleurites fordii, протеины диантина, протеины Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор momordica charantia, курин, кротин, ингибитор sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены. Целый ряд радионуклидов доступны для продуцирования радиоконъюгированных антител. Примеры включают212Bi,131I,131In,90Y и186Re.
Конъюгаты антитела и цитотоксического агента получают, используя ряд бифункциональных протеин-связывающих агентов, например N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), иминотиолан (IT), бифункциональные произодные имидоэфиров (например, диметиладипимидат HCL), активные эфиры (например, дисукцинимидилсуберат), альдегиды (например, диметиладипимидат HCL), активные эфиры (например, дисукцинимидилсуберат), альдегиды (например, глутаровый альдегид), бисазидосоединения (например, бис-n-(азидобензоил)гександиамин), бис-диазониевые производные (например, бис-n-(диазонийбензоил)этилендиамин), диизоцианаты (например, толуол-2,6-диизоцианат) и бис-активные фторсодержащие соединения (например, 1,5-дифтор-2,4-динитробензол). Например, рициновый иммунотоксин можно получить, как описано в статье Vitetta et al., Science 238: 1098 (1987). С14-меченая 1-изотиоцианатобензил-3-метилдиэтилен)триаминпентауксусная кислота (MX-DTPA) является типичным комплексующим агентом для конъюгирования радионуклеотида с антителом. См. WO 94/11026.
В другом варианте антитело может конъюгировать с “рецептором” (например, стрептавидином) для применения в предконъюгировании опухоли, в которую антитело-рецепторный конъюгат вводят пациенту, за которым следует удаление несвязанного конъюгата из циркуляции, используя очищающий агент, и далее вводят “лиганд” (например, авидин), который конъюгирует с цитотоксическим агентом (например, радионуклеотидом).
(IX) Иммунолипосомы
Описанные в данном изобретении мутанты антител можно также рассматривать как иммунолипосомы. Липосомы, содержащие антитело, получают известными способами, например, описанными в работах Epstein et al., Proc. Natl. Acad. Sci. USA 82: 3688 (1985); Hwang et al., Proc. Natl. Acad. Sci. USA 77: 4030 (1980) и U.S. Pat. Nos. 4485045 и 4544545. Липосомы с увеличенным временем обращения впервые описаны в U.S. Pat. No. 5013556.
Особенно полезные липосомы можно генерировать с помощью способа обращенно-фазового выпаривания с жидкой композицией, содержащей фосфатидилхолин, холестерин и PEG-дериватизированный фосфатидилэтаноламин (PEG-PE). Липосомы выдавливают через фильтры с определенным размером пор с образованием липосом нужного даметра. Fab' фрагменты антитела могут конъюгировать с липосомами, как описано в статье Martin et al., J. Biol. Chem. 257: 286-288 (1982), через дисульфидную реакцию обмена. Хемотерапевтический агент (например, доксорубицин) возможно содержится в липосоме (См. Gabizon et al., J. National Cancer Inst. 81 (19): 1484 (1989)).
(X) Антителозависимая ферментотерапия предшественником лекарственного средства (ADEPT)
Антитело, описанное в данном изобретении, можно также применять в ADEPT при конъюгировании антитела с ферментом, активирующим предшественника лекарственного средства, который превращает предшественника (например, пептидил-хемотерапевтический агент см. WO 81/01145) в активное противоопухолевое средство (См., например, WО88/07378 и U.S. Pat. No. 4975278).
Ферментный компонент иммуноконъюгата, пригодный для ADEPT, включает любой фермент, способный воздействовать на предшественника лекарственного препарата таким образом, чтобы превратить его в более активную цитотоксическую форму.
Ферменты, которые пригодны для описанного в данном изобретении способа, включают, но не ограничиваются, щелочной фосфатазой, пригодной для превращения фосфатсодержащих предшественников лекарственных средств в свободные лекарственные препараты; арилсульфатазой, пригодной для превращения сульфатсодержащих предшественников лекарственных средств в свободные лекарственные препараты; цитозиндеаминазой, пригодной для превращения нетоксичного 5-фторцитозина в противоопухолевый препарат 5-фторурацил; протеазами, например протеазой, термолизином, субтилизином, карбоксипептидазами и катепсинами (например, катепсины В и L), которые пригодны для превращения пептидсодержащих предшественников, лекарственных средств в свободные лекарственные препараты; D-аланинкарбоксилпептидазами, пригодными для превращения предшественников лекарственных средств, которые содержат D-аминокислотные заместители; углеводрасщепляющими ферментами, например β-галактозидазой; и нейраминидазой, пригодными для превращения гликозилированных предшественников лекарственных средств в свободные лекарственные препараты; β-лактамазой, пригодной для превращения лекарственных средств, дериватизированных β-лактамами в свободные лекарственные препараты; и пенициллинамидазой, например пенициллин-V амидазой или пенициллин-G амидазой, пригодными для превращения предшественников лекарственных средств, дериватизированных по их аминным азотам феноксилацетильными или фенилацетильными группами, соответственно, в свободные лекарственные препараты. Наоборот, антитела с ферментативной активностью, также известные как “абзимы”, можно применять для превращения предшественников лекарственных средств в свободные активные лекарственные препараты (Massey, Nature 328: 457-458 (1987)). Антитело-абзимные конъюгаты можно приготовить для доставки абзима к популяции опухолевых клеток.
Ферменты могут ковалентно связываться с мутантом антитела с помощью хорошо известных способов, например применением гетеробифункциональных перекрестносшивающих реагентов, о которых сообщалось выше. Наоборот, слитые протеины, включающие, по крайней мере, антигенсвязывающую область антитела, связанную, по крайней мере, с функционально активной порцией (частью) фермента, можно создать с применением хорошо известных способов рекомбинантных ДНК (Neuberger et al., Nature 312: 604-608 (1984)).
(XI) Слияния антитело-спасенного рецепторсвязывающего эпитопа
В некоторых вариантах возможно применять фрагмент антитела, а не все антитело для увеличения, например, пенетрации опухоли. В данном случае возможно модифицировать фрагмент антитела для того, чтобы увеличить время полужизни сыворотки. Это можно достигнуть, например, включением спасенного рецепторсвязывающего эпитопа во фрагменте антитела (например, мутацией соответствующей области во фрагменты антитела или включением эпитопа в пептидной метке, который далее сливают с фрагментом антитела на конце или в середине, например, с помощью ДНК- или пептидного синтеза).
Спасенный рецепторсвязывающий эпитоп предпочтительно представляет область, в которой один или несколько аминокислотных остатков из одной или двух петель Fc области переносят в аналогичное положение фрагмента антитела. Более предпочтительно, когда переносятся три или более остатков из одной или двух петель Fc области. Еще более предпочтительно, когда эпитоп берут из СН2 домена Fc области (например, IgЕ) и переносят в СН1, СН3 или VH область или более чем в одну такую область антитела. Наоборот, эпитоп берут из СН2 домена Fc области и переносят в CL область, или VL область, или в обе области фрагмента антитела.
(XII) Другие ковалентные модифицикации антитела
Ковалентные модификации антитела включены в объем изобретения. Их можно получить, если необходимо, химическим синтезом или ферментативным или химическим гидролизом антитела. Другие типы ковалентных модификаций антитела вводят в молекулу путем взаимодействия аминокислотных остатков антитела с органическим дериватизирующим агентом, который способен реагировать с выбранными N- или С-концевыми остатками боковых цепей.
Цистеиновые остатки чаще всего реагируют с α-галогенацетатами (и соответствующими аминами), например хлоруксусной кислотой или хлорацетамидом, с получением карбоксиметил- или карбоксиамидометил-производных. Цистеинил-остатки также дериватизируют по реакции с бромтрифторацетоном, α-бром-β-(5-имидазоил)пропионовой кислотой, хлорацетилфосфатом, N-алкилмалеимидами, 3-нитро-2-пиридилдисульфидом, метил-2-пиридилдисульфидом, n-хлормеркурибензоатом, 2-хлормеркура-4-нитрофенолом или хлор-2-нитробензо-2-окса-2,3-диазолом.
Гистидиновые остатки дериватизируют по реакции с диэтилпирокарбонатом при рН 5,5-7,0, так как данный агент относительно специфичен для гистидина боковой цепи. n-Бромфенацилбромид также пригоден; реакцию предпочтительно проводят в 0,1 М растворе какодилата натрия при рН 6,0.
Лизиновые и аминоконцевые остатки реагируют с ангидридами янтарной или других карбоновых кислот. Дериватизация данными агентами оказывает влияние на изменение заряда лизиновых остатков. Другие подходящие реагенты для дериватизации α-аминосодержащих остатков включают имидоэфиры, например метилпиколинимидат, пиридоксальфосфат, пиридоксаль, хлорборгидрид, тринитробензолсульфокислоту, O-метилизомочевину, 2,4-пентандион и трансаминазой катализируемую реакцию с глиоксилатом.
Аргининовые остатки модифицируют реакцией с одним или несколькими стандартными реагентами, среди которых фенилглиоксаль, 2,3-бутандион, 1,2-циклогександион и нингидрин. Дериватизация остатков аргинина требует, чтобы реакцию проводили в щелочных условиях вследствие высокого значения рКагуанидиновой функциональной группы. Кроме того, реагенты могут реагировать с группами лизина, а также с ε-аминогруппой аргинина.
Специфическую модификацию тирозиновых остатков можно осуществить особенно при введении спектральных меток в тирозиновые остатки по реакции с ароматическими диазониевыми соединениями или тетранитрометаном. Чаще используют N-ацетилимидизол и тетранитрометан для образования O-ацетилтирозил-производных и 3-нитропроизводных соответсвенно. Тирозиновые остатки йодируют125I или131I для получения меченых протеинов для применения в радиоиммуноанализе.
Карбоксилсодержащие группы (аспартил или глутамил) селективно модифицируют с помощью карбодиимидов (R-N=C=C-R'), где R и R' представляют разные алкилгруппы, например 1-циклогексил-3-(2-морфолинил-4-этил)карбодиимид или 1-этил-3-(4-азония-4,4-диметилпентил)карбодиимид.
Кроме того, аспартил и глутамилсодержащие остатки превращают в аспарагинил- и глутаминилсодержащие остатки при взаимодействии с ионами аммония.
Глутаминил- и аспарагинилсодержащие остатки часто деамидируют в соответствующие глутамил- и аспартилсодержащие остатки соответственно. Эти остатки в нейтральных или щелочных условиях. Деамидированная форма этих остатков выпадает из объема данного изобретения.
Другие модификации включают гидроксилирование пролина и лизина, фосфорилирование гидроксильных групп серил- или треонилсодержащих остатков, метилирование α-аминогрупп боковых цепей лизина, аргинина и гистидина (Т.Е.Creighton, Proteins: Structure and Molecular Properties, W.H. Freeman and Co., San Francisco, pp. 79-86 (1983)), ацетилирование N-концевых аминогрупп и амидирование любой С-концевой карбоксильной группы.
Другой тип ковалентной модификации включает химически или ферментативно связанные гликозиды с антителом. Данные методики выгодны тем, что они не требуют продуцирования антитела в клетке-хозяине, которая обладает гликозилирующими способностями для N- или O-связанного гликозилирования. В зависимости от используемого способа связывания, сахар(а) может присоединяться к: а) аргинину и гистидину; (б) свободным карбоксильным группам; (в) свободным сульфгидрильным группам, например цистеину; (г) свободным гидроксильным группам, например серину, треонину или гидроксипролину; (д) ароматическим остаткам, например фенилаланину, тирозину или триптофану; или (е) амидной группе глутамина. Данные способы описаны в WO 87/0530, опубликованной 11 сентября 1987 года и в Aplin, Wriston CRC Crit. Rev. Biochem. pp. 259-306 (1981).
Удаление любых остатков углеводов, присутствующих на антителе, может выполняться химически или ферментативно. Химическое дегликозилирование требует воздействия на антитело соединения - трифторметансульфокислоты или равноценного соединения. Эта обработка приводит к гидролизу большинства или всех сахаров, за исключением связывающего углевода (N-ацетилгликозамина или N-ацетилгалактозамина), оставляя антитело неповрежденным. Химическое гликозилирование описано Hakimuddin et al., Arch. Biochem. Biophys. 259: 52 (1987) и Egde et al., Anal. Biochem. 118: 131 (1981). Ферментативный гидролиз углеводных остатков на антителах можно достигнуть применением целого ряда эндо- и экзогликозидаз, как описано в Thotakura etal., Meth. Enzymol. 138: 350 (1987).
Другой тип ковалентной модификации антитела включает связывание антитела с одним из целого ряда не напоминающих протеинополимеров, например полиэтиленгликолем, полипропиленгликолем или полиоксилалкиленами, методом, изложенным в U.S. Pat. No. 4640835; 4496689; 4301144; 4670417; 4791192 или 4179337.
В. Векторы, клетки-хозяева и рекомбинантные способы
Изобретение также относится к изолированной нуклеиновой кислоте, кодирующей мутант антитела, как описано в данном изобретении, векторам и клеткам-хозяевам, содержащим нуклеиновую кислоту, и рекомбинантным способам продуцирования мутанта антитела.
Для рекомбинантного продуцирования мутанта антитела нуклеиновую кислоту, кодирующую его, изолируют и вставляют в реплицирующий вектор для дальнейшего клонирования (амплификция ДНК) или для экспрессии. ДНК, кодирующую мутант моноклонального антитела, легко изолируют и секвенируют с применением обычных способов (например, применяя олигонуклеотидные зонды, которые способны специфично связываться с генами, кодирующими тяжелую и легкую цепи мутанта антитела). Имеются в наличии много векторов. Компоненты векторов обычно включают, но не ограничиваются, одной или несколькими сигнальными последовательностями, источником репликации, одним или несколькими маркерными генами, энхансерным элементом, промотором и транскрипционной концевой последовательностью.
(I) Компонент сигнальной последовательности
Мутант антитела можно продуцировать рекомбинантно не только непосредственно, но также в виде слитого полипептида с гетерологическим полипептидом, который предпочтительно является сигнальной последовательностью или другим полипептидом, имеющим специфический сайт гидролиза на N-конце созревшего протеина или полипептида. Выбранная гетерологическая олсигнальная последовательность является предпочтительно последовательностью, которую распознают и процессируют (т.е. гидролизуют сигнальной пептидазой) клеткой-хозяином. Для прокариотических клеток-хозяев, которые не распознают и процессируют сигнальную последовательность нативного антитела, сигнальную последовательность замещают прокариотической сигнальной последовательностью, выбранной, например, из группы щелочной фосфатазы, пенициллиназы, Iрр или лидерной последовательности термостабильного энтеротоксина II. При секреции дрожжей нативная сигнальная последовательность может замещаться, например, лидерной последовательностью дрожжевой инвертазы, лидерной последовательностью α -фактора (включая лидерную последовательность α-факторов Saccharomyces и Kluyveromyces) или лидерной последовательностью кислой фосфатазы, лидерной последовательностью C.Albicans глюкоамилазы или сигнальной последовательностью, описанной в WO 90/13646. В экспрессии клеток млекопитающих доступны сигнальные последовательности млекопитающих, а также вирусные секреторные лидерные последовательности, например gD сигнальная последовательность простого герпеса.
ДНК для такой прекурсорной области лигируют в рамке считывания с ДНК, кодирующей мутант антитела.
(II) Источник компонента репликации
И экспрессирующий и клонирующий векторы содержат последовательность нуклеиновой кислоты, которая дает возможность вектору реплицироваться в одной или нескольких выбранных клетках-хозяевах. Обычно в клонирующих векторах эта последовательность является последовательностью, которая дает возможность вектору реплицироваться независимо от хозяина хромосомной ДНК и включает источники репликации или автономно реплицирующие последовательности. Такие последовательности известны для целого ряда бактерий, дрожжей и вирусов. Источник репликации из плазмиды pBR322 пригоден для большей части грамотрицательных бактерий, источник 2μ плазмиды пригоден для дрожжей и различные вирусные источники (SV40, полиома, аденовирус, VSV или BPV) пригодны для клонирования векторов в клетках млекопитающих. Обычно источник компонента репликации не требуется для экспрессирующих векторов млекопитающих (SV40 источник обычно может применяться только потому, что он содержит ранний промотор).
(III) Компонент гена селекции
Экспрессирующие и клонирующие векторы могут содержать ген селекции, также называемый селектируемый маркер. Типичные гены селекции кодируют протеины, которые (а) обладают резистентностью к антибиотикам или другим токсинам, например ампициллину, неомицину, метотрексату или тетрациклину; (б) дополняют ауксотрофические недостаточности (дефициты) или (в) поставляют дефицитные питательные вещества, недоступные из сложной среды, например ген, кодирующий D-аланинрацемазу для Bacilli.
Один пример селекционной схемы использует лекарственное средство для задержки роста клетки-хозяина. Данные клетки, которые успешно трансформируются гетерологическим геном, продуцируют протеин, обладающий лекарственной резистентностью, и, таким образом, выдерживают (сохраняют) режим селекции. Примеры такой доминантной селекции используют лекарственные препараты - неомицин, микофенольную кислоту и гигромицин.
Другим примером соответствующих селектируемых маркеров для клеток млекопитающих являются маркеры, которые облегчают идентификацию компонента клеток для принятия нуклеиновой кислоты антитела, например DHFR, тимидинкиназа, металлотионеин-I и -II, предпочтительно металлотионеиновые гены примата, аденозиндеаминаза, орнитин-декарбоксилаза и т.д.
Например, клетки, трансформированные DHFR селектируемым геном, первоначально идентифицируют при культивировании всех трансформантов в культурной среде, которая содержит метотрексат (Mtx), конкурентный антагонист DHFR. Соответствующая клетка-хозяин, когда применяют DHFR дикого типа, представляет собой линию клеток яичника китайского хомячка (СНО), лишенную DHFR-активности.
Наоборот, клетки-хозяева (предпочтительно хозяева дикого типа, которые содержат эндогенную DHFR), трансформированные или котрансформированные с ДНК последовательностями, кодирующими антитело, DHFR протеин дикого типа и другие селектируемые маркеры, например аминогликозид-3'-фосфотрансферазу (АРН) можно отобрать с помощью роста клеток в среде, содержащей агент (фактор) селекции для селектируемого маркера, например аминогликозидный антибиотик - канамицин, неомицин или G418 (U.S. Pat. No. 4965199).
Подходящим геном селекции для использования в дрожжах, является trp1 ген, присутствующий в дрожжевой плазмиде Yrp7 (Stinchcomb et al., Nature 282: 39 (1979)). Ген trp1 представляет селектируемый маркер для мутантных штаммов дрожжей, испытывающих недостаток в способности для роста в триптофане, например АТСС No. 44076 или РЕР4-1. Jones, Genetics 85: 12 (1977). Наличие trp1 повреждения в дрожжевом геноме клетки-хозяина далее обеспечивает эффективную окружающую среду для обнаружения трансформации с помощью роста в отсутствии триптофана. Аналогично, Leu2-дефицитные дрожжевые штаммы (АТСС 20622 или 38626) дополняются известными плазмидами, производящими Leu2 ген.
Кроме того, векторы, полученные из 1,6 μm круглой плазмиды (pKD1), можно использовать для трансформации Kluyveromyces дрожжей. Наоборот, экспрессирующая система для крупномасштабного продуцирования рекомбинантного химозина теленка сообщалась для K.lactis. Van den Berg, Bio/Technology 8: 135 (1990). Также описаны многокопийные стабильные экспресирующие векторы для селекции зрелого рекомбнантного сывороточного альбумина человека промышленными штаммами Kluyveromyces. Fleer et al., Bio/Technology 9: 968-975(1991).
(IV) Компонент промотор
Экспрессирующие и клонирующие векторы обычно содержат промотор, который распознается клеткой-хозяином и непосредственно (операбельно) связывается с нуклеиновой кислотой антитела. Промоторы, пригодные для применения с прокариотическими хозяевами, включают phoA промотор, β-лакгамазную и лактозную промоторные системы, щелочную фосфотазу, триптофановую (trp) промоторную систему и гибридные промоторы, например tac промотор. Однако пригодны другие известные бактериальные промоторы. Промоторы, применяемые в бактериальных системах, также должны содержать Shine-Dalgarno (S.D.) последовательность, непосредственно связанную с ДНК, кодирующей антитело.
Промоторные последовательности известны для эукариотов. Фактически все эукариотические гены имеют АТ-богатую область, расположенную приблизительно на 25 до 30 оснований в 3'-5' направлении от сайта (центра), где инициируется транскрипция. Другая последовательность, найденная из 70-80 оснований в 3'-5'-направлении от начала транскрипции многих генов является CNCAAT областью, где N может быть любым нуклеотидом. У 3' конца большинства эукариотических генов имеется ААТААА последовательность, которая может быть сигналом для присоединения poly А хвоста к 3'-концу кодирующей последовательности. Все эти последовательности соответствующим образом вставляются в эукариотические экспрессирующие векторы.
Примеры соответствующих промоторных последовательностей, применяемых с дрожжевыми хозяевами, включают промоторы для 3-фосфоглицераткиназы или других гликолитических ферментов, например энолазы глицеральдегид-3-фосфатдегидрогеназы, гексокиназы, пируват-декарбоксилазы, фосфофруктокиназы, глюкозо-6-фосфатизомеразы, 3-фосфоглицератмутазы, пируваткиназы, триозафосфатизомеразы, фосфо-глюкозоизомеразы и глюкокиназы.
Другие дрожжевые промоторы, которые являются индуцируемыми промоторами, обладающими дополнительным преимуществом транскрипции, контролируемой условиями роста, представляют собой промоторные области алкогольдегидрогеназы 2; изоцитохрома С; кислой фосфатазы; вызывающих распад ферментов; связанных с метаболизмом азота; металлотионеины, глицеральдегид-3-фосфат-дегидрогеназы; и ферменты, ответственные за утилизацию мальтозы и галактозы. Соответствующие векторы и промоторы, применяемые в экспрессии дрожжей, дополнительно описаны в ЕР 73657. Дрожжевые энхансеры также полезно использовать с дрожжевыми промоторами.
Транскрипция антитела из векторов в клетки-хозяева млекопитающего контролируется, например, промоторами, полученными из геномов вирусов, таких как вирус полиомы, вирус оспы птиц, аденовирус (например, аденовирус 2), бычий папилломный вирус, вирус птичьей саркомы, цитомегаловирус, ретровирус, вирус гепатита В и наиболее предпочтительно вакуолизирующий обезьяний вирус 40 (SV40); из гетерологичных промоторов млекопитающих, например актиновый промотор или иммуноглобулиновый промотор, из “хитшоковых” промоторов, при условии, что такие промоторы совместимы с системой клетки-хозяина.
Ранние и поздние промоторы SV40 вируса обычно получают в виде SV40 рестрикционного фрагмента, который также содержит SV40 вирусный источник репликации. Ближайший ранний промотор цитомегаловируса человека обычно получают в виде HindIIIE рестрикционного фрагмента. Система для экспрессии ДНК в хозяевах млекопитающих, использующая бычий папилломный вирус в качестве вектора, описана в U.S. Pat. No. 4419446. Модификация данной системы описана в U.S. Pat. No. 4601978. Наоборот, кДНК β-интерферона человека была экспрессирована в клетках мыши под контролем тимидинкиназного промотора из вируса простого герпеса. Наоборот, вирус “rous” длинного терминального повтора можно использовать в качестве промотора.
(V) Компонент энхансерного элемента
Транскрипция ДНК, кодирующей антитело высшими эукариотами, часто увеличивается при вставке энхансерной последовательности в вектор. В настоящее время известно много энхансерных последовательностей из генов млекопитающих (глобин, эластаза, альбумин, α -фетопротеин и инсулин). Обычно можно использовать энхансер из вируса эукариотической клетки.
Примеры включают SV40 энхансер на последнем участке ориджина репликации (bр 100-270), цитомегаловирус раннего промоторного энхансера, полиомный энхансер на последнем участке ориджина репликации, аденовирусные энхансеры. См. также Yaniv, Nature 297: 17-18 (1982) по усиливающим элементам для активации эукариотических промоторов. Энхансер может вращиваться в вектор в положении 5' или 3' к антителокодирующей последовательности, но предпочтительно располагается в положении 5' от промотора.
(VI) Компонент окончания транскрипции
Экспрессирующие векторы, используемые в эукариотических клетках-хозяевах (дрожжи, грибы, насекомые, растения, животные, человек или ядросодержащая клетка из других млекопитающих организмов), также должны содержать последовательности, необходимые для окончания транскрипции и для стабилизации мРНК. Такие последовательности обычно доступны из 5' и иногда 3' нетранслируемых областей эукариотических или вирусных ДНК-т или кДНК-т. Эти области содержат нуклеотидные сегменты, считываемые как полиаденилированные фрагменты в нетранслируемой части мРНК, кодирующей антитело. Одним пригодным компонентом окончания транскрипции является бычий гормон роста полиаденилированной области. См. WO 94/11026 и описанный экспрессирующий вектор.
(VII) Отбор и трансформация клеток-хозяев
Подходящими клетками-хозяевами для клонирования или экспрессии ДНК в векторы являются прокариотические, дрожжевые или высшие эукариотические клетки, описанные выше. Соответствующие прокариоты для этой цели включают эубактерии, например грамотрицательные или грамположительные организмы, например Enterobacteria, такие как Esherichia, например E.coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например Salmonella typhimurium, Serratia, например Serratia marcescans и Shigella; а также Bacilli, такие как В. Subtilis и В. Licheniformis (например, B. Licheniformis 41 Р, описанные в DD 266710, опубликованный 12 апреля 1981 года); Pseudomonas, такие как Р. aeruginosa и Streptomyces. Предпочтительными E.coli, клонирующими хозяина, являются E.coli 294 (АТСС 31446), хотя пригодны и другие штаммы, например E.coli В, E.coli Х1776 (АТСС 31537) и E.coli W3110 (АТСС 27325). Данные примеры являются иллюстративными, а не ограничивающими.
Кроме того, прокариоты, эукариотические микробы, например гифомицеты или дрожжи, являются подходящими клонирующими или экспрессирующими хозяевами для антителокодирующих векторов. Среди низших эукариотических микроорганизмов хозяина наиболее часто используют Saccharomyces cerevisiae или обычные пекарские дрожжи. Обычно доступен и пригоден ряд других видов, разновидностей и штаммов, например Schizosaccharomyces pombe'; Kluyveromyces хозяева, например K.lactis, K.fragilis (АТСС 12424), K.bulgaricus (АТСС 16045), К. wickeramii (АТСС 24178), К. waltii (АТСС 56500), K.drosophilarum (АТСС 36906), K.thermotolerans и K.marxianus; yarrowia (EP 402226); Pichia pastoris (EP 183070); Candida; Trichoderma reesia (EP 244234); Neurospora crassa; Schwanniomyces, такие как Schwanniomyces occidentalis; и гифомицеты, например Neurospora, Penicillium, Tolypocladium и Aspergillus хозяева, такие как A.Nidulans и A.niger.
Подходящие клетки-хозяева для экспрессии гликозилированных антител получены из многоклеточных организмов. По-существу, любая высшая эукариотическая клеточная культура является реальной или из позвоночной или беспозвоночной культуры. Примеры беспозвоночных клеток включают клетки растений и насекомых, Luckow et al., Bio/Technology 6, 47-55 (1988); Miller et al., Genetic Engineering, Setlow et al. eds. Vol. 8, pp.277-279 (Plenam publishing 1986); Mseda et al., Nature 315: 592-594 (1985). Идентифицированы многочисленные бакуловирусные штаммы и варианты и соответствующие рекомендуемые клетки-хозяева насекомых из хозяев, таких как Spodoptera frugiperda (гусеница), Aedas aegypti (москит), Aedes albopictus (москит), Drosophila melanogaster (бабочка) и Bombyx mori. Особая линия клеток, представляющая интерес, является sf9 линия клеток насекомых. Публично доступен целый ряд вирусных штаммов для трансфекции, например L-1 вариант Autographs californica NPV и Bm-5 штамм Bombyx mori NPV, и такие вирусы могут использоваться в данном изобретении, особенно для трансфекции клеток Spodoptera frugiperda. Кроме того, в качестве хозяина могут использоваться растительные клеточные культуры хлопка, кукурузы, картофеля, сои, петунии, томата и табака.
Однако самый большой интерес представляют клетки позвоночных, и выращивание клеток позвоночных в культуре (тканевой культуре) стало рутинной процедурой, см. Tissue Culture, Academic Press, Kruse and Patterson, eds. (1973). Примерами пригодных линий клеток-хозяев млекопитающих являются CVI линия почки обезьяны, трансформированная SV40 (COS-7, ATCC CRL 1651); линия эмбриональной почки человека (293 или 293 клетки, субклонированные для роста в суспендированной культуре, Graham et al., J. Gen. Virol, 36: 59 (1977)); клетки почки детеныша хомячка (ВНК, АТСС CCL10); клетки DHFR яичника китайского хомячка (СНО, Urlaub et al., Proc. Natl. Acad. Sci. USA, 77,: 4216 (1980)); клетки Сертоли мыши (ТМ4, Mather, Вiоl. Reprod. 23: 243-251 (1980); клетки почки обезьяны (CVI, АТСС CCL70); клетки почки африканской зеленой обезьяны (VERO-76, АТСС CRL-1587); клетки цервикальной карциномы человека (HELA, АТСС CCL 2); клетки почки собаки (MDCK, АТСС CCL 34); клетки печени буйвольной крысы (BRL 3А, АТСС CRL 1442); клетки легкого человека (W138, АТСС CCL 75); клетки печени человека (Нер G2, НВ 8065); опухоль молочной железы мыши (ММТ 060562, АТСС CCL51); TRI клетки (Mather et al., Annals N.J. Acad. Sci. 383: 44-68 (1982)); MRC 5 клетки; FS4 клетки; и линия гепатомы человека (Нер G2).
Клетки-хозяева трансформируют вышеуказанными экспрессирующими или клонирующими векторами для продуцирования антител и культивируют в обычной (стандартной) питательной среде, модифицированной соответствующим образом для индуцирования промоторов, отбора трансформантов или амплификации генов, кодирующих нужные последовательности.
(VIII) Культивирование клеток-хозяев
Клетки-хозяева, используемые для продуцирования мутанта антитела, могут культивироваться в целом ряде сред. Для культивирования клеток-хозяев пригодны коммерчески доступные среды, такие как Ham's F10 (Sigma), минимальная поддерживающая среда (Minimal Essential Medium MEM, Sigma), RPMI-1640 (Sigma) и модифицированная по способу Дульбекко среда Игла (Dulbecco's Modified Eagle's Medium, DMEM, Sigma). Кроме того, любая среда, описанная в обзорах, работах, патентах и заявках (Ham et al., Meth. Enzymol. 58: 44 (1979); Barnes et al., Anal. Biochem. 102: 255 (1980); U.S. Pat No. 4767704; 4657866; 4927762; 4560655 или 5122469; WO 87/00195 или U.S. Pat. No. Re. 30985, может использоваться в качеств культурной среды для клеток-хозяев. Любые их этих сред могут дополняться при необходимости гормонами и/или другими факторами роста (например, инсулином, трансферрином или эпидермальным фактором роста), солями (например, Х-хлоридами, где X - натрий, кальций, магний; и фосфатами), буферами (например, HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (например, препаратом GENTAMYCIN™), микроэлементами (определенными как неорганические соединения, обычно присутствующие в конечных концентрациях на микромолярном уровне) и глюкозой или эквивалентным источником энергии. Любые другие необходимые конглютинины также могут включаться в соответствующих концентрациях, которые известны специалистам. Условия культивирования, например температура, рН и другие, являются условиями, ранее используемыми для клетки-хозяна, выбранной для экспрессии, и будут известны специалистам.
(IX) Очистка антитела
При использовании рекомбинантных способов мутант антитела может продуцироваться внутриклеточно, в периплазматическом пространстве или секретировать непосредственно в среду. Если мутант антитела продуцируется внутриклеточно, в первой стадии частицы дебриса, или клетки-хозяева, или лизированные (разрушенные) фрагменты удаляют, например, центрифугированием или ультрафильтрацией. Картер (Carter et al., Bio/Technology 10: 163-167 (1992)) описал методику изолирования антител, которые секретируют в периплазматическое пространство E.coli. Вкратце, клеточную пасту оттаивают (размягчают) в присутствии ацетата натрия (рН 3,5), EDTA и фенилметилсульфонилфторида (phenylmethylsulfonylfluoride, PMSF) в течение ~30 минут. Клеточный дебрис можно удалить центрифугированием. Если мутант антитела секретирует в среду, супернатанты от таких экспрессирующих систем обычно вначале концентрируют, используя промышленно доступный фильтр концентрирования протеина, например Amicon или Millipore Pellicon ультрафильтрационное устройство. Ингибитор протеазы, как, например, PMSF, может вовлекаться в любую из предыдущих стадий для ингибирования протеолиза и могут включаться антибиотики для предотвращения роста случайных контаминации.
Композицию антитела, полученную из клеток, можно очистить, например, хроматографией на гидроксилапатите, гель электрофорезом, диализом и аффинной хроматографией, причем аффинная хроматография в качестве способа очистки предпочтительна. Пригодность протеина А в качестве аффинного лиганда зависит от типа и изотипа любой Fc области иммуноглобулина, которая присутствует в мутанте антитела. Протеин А можно использовать для очистки антител, которые базируются на тяжелых цепях γ1, γ2 или γ4, принадлежащих человеческому роду (Lindmark et al., J. Immunol. Meth. 62: 1-13 (1983)). Протеин G рекомендуется для всех изотипов мышей и для γ3 человека (Guss et al., EMBO J. 5: 1567-1575 (1986)). Матрица, к которой присоединен аффинный лиганд, чаще всего является агарозой, но пригодны и другие матрицы. Механически прочные матрицы, например стекло с определенным размером пор или поли(стиролдивинил)бензол, предусматривают большую скорость потока и более короткие времена обработки, чем это можно достигнуть с помощью агарозы. Если мутант антитела содержит СН3 область, для очистки пригоден полимер Bakerbond АВХТМ (J.Т.Baker, Phillipsburg, NJ). В зависимости от выделяемого мутанта антитела также пригодны другие способы очистки протеинов, например фракционирование (разделение) на ионообменной колонке, осаждение этанолом, HPLC с обращенной фазой, хроматография на силикагеле, хроматография на гепарин-SEPHAROSE™, хроматография на анионообменном или катионообменном полимере (например, на колонке с полиаспарагиновой кислотой), хроматофокусирование, SDS-PAGE и осаждение сульфатом аммония.
После любой предварительной стадии(й) очисток смесь, содержащая нужный мутант антитела и контаминанты, может подвергаться хроматографии гидрофобного взаимодействия с низким рН, применяя буфер для элюирования с рН 2,5-4,5, предпочтительно осуществляемой при низкой концентрации соли (например, 0-0,25 М соли).
В. Фармацевтические композиции
Терапевтические композиции полипептида или антитела получают в виде лиофилизированных композиций или водных растворов при смешивании полипептида требуемой степени чистоты с возможными "фармацевтически приемлемыми" носителями, наполнителями и стабилизаторами, обычно применяемыми в данной области (все из которых называются "наполнителями"). Например, буферные агенты, стабилизирующие агенты, консерванты, агенты, создающие изотоничность, неионные детергенты, антиоксиданты и другие смешанные добавки (см. Remington's Pharmaceutical Sciences, 16th edition, A.Osol, Ed. (1980)). Эти добавки должны быть нетоксичными к реципиентам при применяемых дозах и концентрациях.
Буферные агенты служат для поддержания рН в пределах, которые почти соответствуют физиологическим условиям. Они предпочтительно присутствуют при концентрациях в пределах от 2 mM до 50 mМ. Пригодные для применения буферные агенты включают и органические и неорганические кислоты и их соли, например цитратные буферы (например, смесь однозамещенный цитрат натрия -двузамещенный цитрат натрия, смесь лимонная кислота - тризамещенный цитрат натрия, смесь лимонная кислота - монозамещенный цитрат натрия, и т.д.), сукцинатные буферы (например, смесь янтарная кислота - однозамещенный сукцинат натрия, смесь янтарная кислота - гидроокись натрия, смесь янтарная кислота - двузамещенный сукцинат натрия), тартратные буферы (например, смесь винная кислота - тартрат натрия, смесь винная кислота - тартрат калия, смесь винная кислота - гидроокись натрия и т.д.), фумаратные буферы (например, смесь фумаровая кислота - монозамещенный фумарат натрия, смесь фумаровая кислота - двузамещенный фумарат натрия, смесь монозамещенный фумарат натрия - двузамещенный фумарат натрия и т.д.), глюконатные буферы (например, смесь глюконовая кислота - глюконат натрия, смесь глюконовая кислота - гидроокись натрия, смесь глюконовая кислота - глюконат калия и т.д.), оксалатный буфер (например, смесь щавелевая кислота - оксалат натрия, смесь щавелевая кислота - гидроокись натрия, смесь щавелевая кислота - оксалат калия и т.д.), лактатные буферы (например, смесь молочная кислота - лактат натрия, смесь молочная кислота - гидроокись натрия, смесь молочная кислота - лактат калия и т.д.) и ацетатные буферы (например, смесь уксусная кислота - ацетат натрия смесь уксусная кислота - гидроокись натрия и т.д.). Кроме того, следует упомянуть фосфатные буферы, гистидиновые буферы и соли триметиламина, например, трис (Tris) буферы.
Консерванты прибавляют для замедления роста микробов в количествах от 0,2% до 1% (вес./об.). Пригодные для использования консерванты включают фенол, бензиловый спирт, м-крезол, метилпарабен, пропилпарабен, октадецилдиметилбензиламмоний хлорид, бензалконий галоиды (например, хлорид, бромид, йодид), гексаметоний хлорид, алкилпарабены, например метил- или пропилпарабен, катехин, резорцин, циклогексанол и 3-пентанол.
Изотонициферы, иногда называемые “стабилизаторами”, присутствуют для обеспечения изотоничности жидких композиций и включают многоатомные спирты углеводов, предпочтительно трехатомные или высшие спирты углеводов, например глицерин, эритрит, арабит, ксилит, сорбит и маннит. Полиатомные спирты могут присутствовать в количестве от 0,1% до 25% (весовых), предпочтительно от 1% до 5%, с учетом соответствующих количеств других ингредиентов.
Стабилизаторы относятся к широкой категории наполнителей, которые могут изменяться по назначению от наполнителей до добавки, которая солюбилизирует терапевтический агент или помогает предотвратить денатурацию или адгезию к стенке флакона. Типичными стабилизаторами могут быть полиатомные спирты углеводов (перечисленные выше); аминокислоты, например аргинин, лизин, глицин, глутамин, аспарагин, гистидин, аланин, орнитин, L-лейцин, 2-фенилаланин, глутаминовая кислота, треонин и т.д., органические сахара или сахарные спирты, например лактоза, трегалоза стахиоза, маннит, сорбит, ксилит, рибит, миоинозит галактин, глицерин и тому подобные, включая циклиты, например инозит, полиэтиленгликоль; полимеры аминокислот; серосодержащие восстановители, например мочевина, глутатион, тиоктовая кислота, тиоглюконат, тиоглицерин, α-монотиоглицерин и тиосульфат натрия; низкомолекулярные полипептиды (т.е. менее 10 остатков); протеины, например сывороточный альбумин человека, бычий сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, например поливинилпирролидон, моносахариды, например ксилоза, манноза, фруктоза, глюкоза; дисахариды, такие как лактоза, мальтоза, сахароза и трисахариды, например рафиноза; полисахариды, например, декстран. Стабилизаторы присутствуют в количестве от 0,1 до 10000 весовых частей на весовую часть активного протеина.
Неионные поверхностно-активные вещества или детергенты (также известные как “увлажняющие агенты”) присутствуют для оказания помощи в растворении терапевтического агента, а также для защиты терапевтического протеина от агрегации, вызванной перемешиванием (встряхиванием), которая также позволяет композиции подвергаться действию поверхностного сдвигающего напряжения без денатурации протеина. Соответствующие неионные поверхностно-активные вещества включают полисорбаты (20, 80 и т.д.), полиоксамеры (184, 188 и т.д.), плуроник (Pluronic®), полиоли, связанные с полиоксиэтиленом, моноэфиры сорбитана (Tween®-20, (Tween®-80 и т.д.). Неионные поверхностно-активные вещества присутствуют в количестве от ~0,05 мг/мл до ~1 мг/мл, предпочтительно от ~0,07 мг/мл до ~0,2 мг/мл.
Дополнительные разнообразные наполнители включают такие наполнители, как, например, крахмал, комплексообразующие агенты (например, EDTA), антиоксиданты (например, аскорбиновая кислота, метионин, витамин Е) и сорастворители.
Композиция может также содержать более одного активного соединения, когда необходимо для лечения отдельного показания, предпочтительно активные соединения с взаимодополняющими активностями, которые не оказывают отрицательного воздействия друг на друга. Например, в дальнейшем может стать желательным ввести иммуносупрессорный агент. Такие молекулы присутствуют соответственно вместе в количестве, которое эффективно для предназначенной цели.
Активные ингредиенты могут также включаться в микрокапсулу, полученную, например, способами коацервации или полимеризация на поверхности раздела фаз, например, гидроксиметилцеллюлозной или желатиновой микрокапсулы и поли(метилметакрилатной) микрокапсул, соответственно, в коллоидных системах доставки лекарств (например, липосомы, альбумин микросферы, микроэмульсии, микрочастицы и микрокапсулы) или в макроэмульсиях. Эти способы рассмотрены в Remington's Pharmaceutical Sciences, 16th edition A. Osal. Ed. (1980).
Композиции, применяемые для введения in vivo, должны быть стерильными. Это легко достигается, например, фильтрацией через стерильные фильтрационные мембраны.
Можно получить композиции пролонгированного действия (непрерывного высвобождения). Соответствующие примеры пролонгированных композиций включают полупроницаемые матрицы твердых гидрофобных полимеров, содержащих мутант антитела, матрицы которых находятся в форме, например, пленок или микрокапсул. Примеры пролонгированных матриц включают полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый) спирт, полиактиды (U.S. Pat. No. 3773919), сополимеры L-глутаминовой кислоты и этил-L-глутамата, не подвергающийся деградации этиленвинилацетат, подвергающиеся деградации сополимеры молочной кислоты -гликолевой кислоты, например LUPRON DEPOT™ (вводимые с помощью инъекции микросферы, состоящие из сополимера молочная кислота - гликолевая кислота и лейпролидацетат) и поли-D-(-)-3-гидроксимасляная кислота. Хотя полимеры, например этиленвинилацетат и молочная кислота - гликолевая кислота, позволяют выделять молекулы в течение 100 дней, некоторые гидрогели высвобождают протеины в течение более коротких периодов времени. Если инкапсулированные антитела остаются в теле в течение длительного времени, они могут денатурировать или агрегировать в результате действия влаги при 37°С, приводящего к потере биологической активности и возможным изменениям в иммуногенности. Можно предложить рациональные стратегии стабилизации в зависимости от рассматриваемого механизма. Например, если обнаружено, что механизм агрегации представляет собой межмолекулярное образование S-S связи через тиодисульфидный обмен, стабилизацию можно достигнуть модифицированием сульфгидрильных остатков, лиофилизированием из кислых растворов, контролированием содержания влаги, применением соответствующих добавок и разработкой специфических композиций полимерных матриц.
Количество терапевтического полипептида, антитела или его фрагмента, которое будет эффективным при лечении отдельного расстройства или состояния, будет зависеть от природы расстройства или состояния и может определяться стандартными клиническими способами. Если возможно, желательно определить кривую дозовой зависимости и до проверки фармацевтической композиции на людях вначале проверить in vitro и затем на модельных системах животных. Однако, основываясь на общих понятиях, фармацевтическая композиция, эффективная в стимуляции выживания сенсорных нейронов, может обеспечить локальную концентрацию терапевтического агента, равную от 5 до 20 нг/мл, предпочтительно между 10 и 20 нг/мл. В дополнительном специфическом варианте фармацевтическая композиция, эффективная в стимуляции роста и выживания ретинальных нейронов, может обеспечить локальную концентрацию терапевтического агента от 10 нг/мл до 100 нг/мл.
В предпочтительном варианте водный раствор терапевтического полипептида, антитела или его фрагмента вводят с помощью подкожной инъекции. Каждая доза может изменяться от ~0,5 мкг до ~50 мкг на один килограмм веса тела или более предпочтительно от ~3 мкг до ~30 мкг на один килограмм веса тела.
Дозовая схема для подкожного введения может изменяться от одного раза в неделю до ежедневного введения в зависимости от целого ряда клинических факторов, включая вид болезни, тяжести заболевания и чувствительности субъекта к терапевтическому агенту.
Г. Нетерапевтические применения мутанта антитела
Мутанты антитела могут применяться в качестве агентов для очистки аффинной хроматографией. В данном способе антитела иммобилизуют на твердой фазе, например смоле (полимере) сефадекс (Sephadex) или на фильтровальной бумаге, используя известные методы. Иммобилизованный мутант антитела контактируют с образцом, содержащим очищаемый антиген, и затем носитель промывают соответствующим растворителем, который должен удалить по существу все вещества в образце, за исключением очищаемого антигена, который связывается с иммобилизованным мутантом антитела. Наконец, носитель промывают другим подходящим растворителем, например глициновым буфером с рН 5, который отделит антиген от мутанта антитела.
Мутантные антитела могут также быть полезными в диагностических анализах, например, для обнаружения экспрессии нужного антигена в специфических клетках, тканях или сыворотке.
Для диагностических применений мутант антитела обычно должен быть меченым детектируемым фрагментом. Доступны многочисленные метки, которые можно сгруппировать по следующим категориям:
(а) Радиоизотопы, например,36S,14C,125I,3H и131I. Мутант антитела можно метить радиоизотопом с применением способов, описанных, например, в Current Protocols in Immunology, Vol. 1-2, Coligen et al., Ed., Wiley. Interscience, New York, Pubs. (1991), и радиоактивность можно измерять с применением счетчиков сцинтилляции.
(б) Доступны флуоресцентные метки, например хелатные соединения редкоземельных металлов (хелаты еврония) или флуоресцин и его производные, родамин и его производные, дансил, лизамин (Lissamine), фикоэритрин и Texas Red. Флуоресцентные метки могут конъюгировать с мутантом антитела при применении, например, способов, описанных в Currrent Protocols in Immunology, supra. Флуоресценцию можно оценить количественно с применением флуориметра.
(в) Доступны различные фермент-субстратные метки, и U.S. Pat. No. 4275149 приводит обзор некоторых из них. Фермент обычно катализирует химическое изменение хромогенного субстрата, которое может измеряться различными способами. Например, фермент может катализировать изменение цвета субстрата, которое можно измерить спектрофотометрически. Наоборот, фермент может изменять флуоресценцию или хемилюминесценцию субстрата. Способы количественной оценки флуоресценции описаны выше. Хемилюминесцентный субстрат с помощью химической реакции становится электронно возбужденным и затем может испускать свет, который можно измерить (например, хемилюминометром), или передать энергию флуоресцентому акцептору. Примеры ферментативных меток включают люциферазы (например, люциферазу из светляков и бактериальную люциферазу; U.S. Pat. No. 4737456); люцифирин, 2,3-дигидрофталазиндионы, малатдегидрогеназу, уреазу, пероксидазу, например пероксидазу из хрена (horseradish peroxidase, HRPO), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизозим, сахаридоксидазу (например, глюкозоксидазу, галактозооксидазу и глюкозо-6-фосфатдегидрогеназу), гетероциклические оксидазы (например, уриказу и ксантиноксидазу), лактопероксидазу, микропероксидазу и тому подобные ферменты. Способы конъюгирования ферментов с антителами описаны в O'Sullivan et al., Methods for the Preparation of Enzyme-Antibody Conjugates for use in Enzyme Immunoassay, in Methods in Enzym. (Ed. J. Langone, H. Van Vunaksi), Academic press, New York, 73: 147-166 (1981).
Примеры фермент-субстратных комбинаций, например, включают:
(I) пероксидазу из хрена (HRPO) с перекисью водорода в качестве субстрата, где перекись водорода окисляет предшественник красящего вещества (например, о-фенилендиамин, (orthophenylene diamine, OPD) или 3,3',5,5'-тетраметилбензидин гидрохлорида (ТМВ);
(II) щелочную фосфататазу (alkaline phosphatase, АР) с n-нитро-фенилфосфатом в качестве хромогенного субстрата; и
(III) β-D-галактозидазу (β-D-Gal) с хромогенным субстратом (например, n-нитрофенил-β-D-галактозидом или флуорогенным субстратом 4-метиллумбеллиферил-β-D-галактозидом.
Специалистам доступны и многочисленные другие фермент-субстратные комбинации. Например, их обзор см. в U.S. Pat. No. 4275149, 4318980.
Иногда метка косвенно конъюгирует с мутантом антитела. Специалистам известны разнообразные способы для достижения этого. Например, мутант антитела может конъюгировать с биотином и любая из трех основных категорий, упомянутых выше меток, может конъюгировать с авидином или vice versa. Биотин селективно связывается с авидином, и, таким образом, метка может конъюгировать с мутантом антитела косвенным путем. Наоборот, чтобы достигнуть, косвенного конъюгирования метки с мутантом антитела, мутант антитела конъюгирует с малым гаптеном (например, диглоксином) и одним из видов упомянутых выше меток конъюгирует с мутантом антигаптенового антитела (например, антидиглоксиновое антитело). Таким образом, можно достичь косвенное конъюгирование метки с мутантом антитела.
В другом варианте не требующий введения метки мутант антитела и его присутствие можно детектировать с применением меченого антитела, которое связывается с мутантом антитела.
Антитела могут применяться в любом известном методе анализа, например анализах конкурентного связывания, прямых и косвенных сэндвич-анализах и иммуно-преципитационных анализах. Zola, Monoclonal antibodies: A Manual of Technologies, pp. 147-158 (CRS Press, Inc., 1987).
Проверки конкурентного связывания основаны на способности меченого стандарта конкурировать с исследуемым образцом за связывание с ограниченным количеством мутанта антитела. Количество антигена в исследуемом образце обратно пропорционально количеству стандарта, который связывается с антителами. Чтобы облегчить определение количества стандарта, которое связывается, антитела обычно переводят в нерастворимую форму до или после конкуренции. В результате стандарт и исследуемый образец, которые связаны с антителами, можно обычным образом отделить от стандарта и исследуемого образца, который остается несвязанным.
“Сэндвичевые” анализы включают применение двух антител, каждое способное к связыванию с разной иммуногенной областью или эпитопом, или протеином, который обнаруживают. В сэндвичевом анализе анализируемый исследуемый образец связывается с первичным антителом, которое иммобилизовано на твердом носителе и затем вторичное антитело связывается с исследуемым образцом, образуя, таким образом, нерастворимый комплекс из трех частей. См., например, U.S. Pat. No. 4376110. Вторичное антитело само может метиться детектируемым фрагментом (прямые сэндвичевые анализы) или может определяться с использованием антииммуноглобулинового антитела, которое мечено детектируемым фрагментом (косвенный сэндвичевый анализ). Например, одним видом сэндвичевого анализа является ELISA анализ, в случае которого детектируемым остатком является фермент.
Для иммуногистохимии опухолевый образец, например, может быть свежим или замороженным или может быть включенным в парафин и связанным с консервантом, таким как формалин.
Антитела можно также использовать в диагностических анализах in vivo. Обычно мутант антитела метят радиоизотопом (например,111In,99Тc,14С,131I,3H,32P,35S), с тем чтобы опухоль можно было локализовать, применяя иммуносцинтиграфию.
Д. Диагностические наборы (комплекты)
Для удобства полипептид или антитело, описанные в данном изобретении, могут входить в набор, т.е. в упакованный комплект реагентов в заранее определенных количествах с инструкциями для выполнения диагностической проверки (анализа). Если мутант антитела мечен ферментом, то набор должен включать субстраты и кофакторы, необходимые для фермента (например, предшественник субстрата, который обеспечивает детектируемый хромофор или флуорофор). Кроме того, могут входить другие добавки, например стабилизаторы, буферы (например, блокирующий буфер или лизисный буфер) и другие. Относительные количества различных реагентов могут изменяться в широком пределе, чтобы обеспечить концентрации реагентов в растворе, которые существенно оптимизируют чувствительность анализа. В частности, реагенты могут быть в виде порошков, обычно лиофилизированных, включая наполнители, которые при растворении обеспечат раствор реагента соответствующей концентрации.
Е. Применения полипептида или антитела in vivo
Предполагается, что полипептид или антитела могут применяться для лечения млекопитающих. В одном варианте антитело вводят, например, млекопитающим, не принадлежащим человеческому роду, для целей получения предклинических данных. Типичные млекопитающие, не принадлежащие человеческому роду, которых лечат, включают приматов, собак, кошек, грызунов и других млекопитающих, для которых проводят предклинические исследования. С помощью таких млекопитающих можно создать модели животных для болезни, которую лечат антителом, или могут использовать для исследования токсичности нужного антитела. В каждом их этих вариантов исследования по увеличению дозы можно проводить на млекопитающих.
Антитело или полипептид вводят любыми подходящими способами, включая парентеральное, подкожное, внутрибрюшинное, внутрилегочное и интраназальное введение, если необходимо для локального иммуносупрессивного лечения, введением внутрь патологического изменения. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Кроме того, мутант антитела соответствующим образом вводят с помощью инфузии импульсом, особенно с уменьшающимися дозами мутанта антитела. Предпочтительно, когда дозирование происходит в виде инъекций, наиболее предпочтительно в виде внутривенных или подкожных инъекций, частично, в зависимости от того, является ли введение недолгим или постоянным.
Для профилактики или лечения болезни соответствующая дозировка антитела или полипептида должна зависеть от вида болезни, которую лечат, тяжести и течения заболевания, вводится ли мутант антитела для профилактических или терапевтических целей, зависеть от предшествующей терапии, клинической истории пациента и реакции на мутант антитела, и благоразумия посещаемых врачей. Антитело против IgЕ человека соответствующим образом вводят пациенту один раз или в течение циклов лечения.
В зависимости от типа и тяжести заболевания от ~1 мкг/кг до 150 мг/кг (например, 0,1-20 мг/кг антитела или полипептида) является первоначальной кандидатной дозой для введения пациенту, или, например, при одном или нескольких отдельных введениях или с помощью непрерывной инфузии. Обычная ежедневная доза может варьироваться от ~1 мкг/кг до 100 мг/кг или более в зависимости от упомянутых выше факторов. При повторных введениях через несколько дней или более длительного срока, в зависимости от состояния, лечение продолжают до тех пор, пока не произойдет нужного подавления симптомов болезни. Однако можно применять другие величины доз. Прогресс данной терапии легко контролируется обычными способами и анализами. Типичное дозирование анти-LFA-1 или анти-ICАМ-1 антитела описано в WO 94/04188.
Композиция мутанта антитела должна создаваться, дозироваться и вводиться способом, совместимым с современной медицинской практикой. Факторы для рассмотрения в данном контексте включают определенные нарушения, которые лечат, определенных млекопитающих, которых лечат, клиническое состояние индивидуального пациента, причину нарушения, место доставки агента, способ введения, график введения и другие факторы, известные медикам. Назначаемое “терапевтически эффективное количество” мутанта антитела будет зависеть от таких соображений и является минимальным количеством, необходимым для профилактики, замедления или лечения заболевания или расстройства. Мутант антитела не обязательно, но возможно входит в состав композиции с одним или несколькими агентами, используемыми в данный момент для профилактики или лечения рассматриваемого заболевания. Эффективное количество других агентов зависит от количества присутствующего антитела против IgЕ человека в композиции, вида заболевания или лечения и других рассмотренных выше факторов. Они обычно применяются в тех же дозах и способах введения, как описано выше, или от 1 до 99% от до этого применяемых доз.
Ж. Промышленные изделия
В другом варианте изобретения предлагают промышленное изделие, содержащее материалы, пригодные для лечения описанных выше расстройств. Промышленное изделие включает контейнер и этикетку. Подходящие контейнеры включают, например, флакон, пузырек, шприцы и пробирки. Контейнеры можно изготовить из различных материалов, таких как стекло или пластмасса. Контейнер содержит композицию, которая эффективна для лечения и может иметь стерильное входное отверстие (например, контейнером может быть баллон для внутривенного раствора или флакон с пробкой, способной протыкаться иглой для подкожных инъекций). Активным агентом композиции является мутант антитела. Этикетка на контейнере или связанная с ним указывает, что композиция используется для лечения выбранного состояния. Промышленное изделие может дополнительно включать второй контейнер, содержащий фармацевтически приемлемый буфер, например фосфатом забуференный физиологический раствор, раствор Рингера и раствор декстрозы. Он может дополнительно включать другие материалы, необходимые с коммерческой точки зрения и точки зрения пользователя, включая другие буферные растворы, растворители, фильтры, иголки, шприцы и упаковочные вкладные листы с инструкциями применения.
Следующие примеры предлагаются для иллюстрации, а не для ограничения.
Пример 1
Получение моноклональных тел для IgE
Получали восемь моноклональных антител (МАЕ10-МАЕ17), способных блокировать связывание IgE с FcεRI. Моноклональные антитела для IgE получали из супернатантов U266B1 клеток (АТСС TIB 196) с применением аффинной хроматографии на изолированном анти-IgE антителе (Genentech МАЕ1). Для МАЕ12 пять BALB/c самок мышей шестинедельного возраста иммунизировали в их лапы 10 мкг очищенного IgE в адъюванте Риби. Последующие инъекции проводили аналогичным образом одну и три недели после первоначальной иммунизации. Через три дня после последней инъекции паховое и подколенное лимфатическое утолщение удаляли и собирали, суспензию отдельных клеток готовили при пропускании ткани через стальную сетку. Клетки сливали при соотношении 4:1 с миеломой мыши Р3Х63 -Аg8,653 (АТСС CRL 1580) в высококонцентрированной глюкозе (DMEM), содержащей 50% вес./об. полиэтиленгликоля 4000. Для МАЕ14, МАЕ15 и МАЕ13 иммунизацию проводили аналогичным образом за исключением МАЕ13, для которого применяли 30 мкг IgE на инъекцию, и IgЕ фрагмент 315-347 (Кэбот) анализировали в виде предварительно слитого бустера. Для МАЕ10 и МАЕ11 инъекции проводили подкожно в две дозы по 100 мкг и заключительную бустер-инъекцию – 50 мкг и для слияния использовали клетки селезенки.
Слитые клетки далее помещали на пластинку при плотности 2×105 на лунку в планшете тканевой культуры с 96 лунками. После 24 часов добавляли HAT селективную среду (гипоксантин/аминоптерин/тимидин, Sigma, #H0262). Из 1440 помещенных лунок 365 содержали клетки роста после HAT селекции.
Через 15 дней после слияния супернатанты проверяли на присутствие антител, специфических для IgE человека с помощью твердофазного иммуноферментного анализа (enzyme-linked immunosorbent assay, ELISA). ELISA проводили следующим образом (со всеми инкубациями, выполненными при комнатной температуре). Исследуемые пластинки (Nunc Immunoplate) покрывали в течение 2 часов антителом крысы против IgG мыши (Boehringer Mannheim, #605-500) при 1 мкг/мл в 50 mM натрий-карбонатном буфере, рН 9,6, далее связывали с 0,5% бычьего сывороточного альбумина в фосфатном забуференном физиологическом растворе (PBS) в течение 30 минут, затем промывали четыре раза PBS, содержащим 0,05% твина (Tween 20, PBST). Прибавляли исследуемые супернатанты и инкубировали 2 часа при встряхивании и далее промывали четыре раза с помощью PBST. IgE человека (очищенный из U266 клеток, как описано выше) прибавляли при 0,5 мкг/мл и инкубировали в течение одного часа при встряхивании, затем промывали четыре раза с помощью PBST. Пероксидазу из хрена, конъюгированную с антителом козла против IgЕ человека (Kirkegard & Perry Labs, #14-10-04, 0,5 мг/мл), прибавляли при 1:2500 разбавлении и инкубировали в течение одного часа, далее промывали 4 раза с помощью PBST. Пластинки обрабатывали прибавлением 100 мкл/лунку раствора, содержащего 10 мг о-фенилендиамин дигидрохлорида (Sigma, #Р8287) и 10 мкл 30% раствора перекиси водорода в 25 мл фосфат-цитратном буфере, рН 5,0 и инкубированием в течение 15 минут. Реакцию останавливали прибавлением 100 мкл/лунку 2,5 М серной кислоты. Данные получали считыванием пластинок в автоматизированном ELISA спектрофотометре для прочтения планшетов при абсорбции на 490 нм. Для МАЕ12, исследовали 365 супернатантов и 100 были специфичны к IgE человека. Аналогичные частоты IgE специфичности получали, когда проводили скрининг для других антител. Все моноклональные антитела, описанные в данном изобретении, были IgG1 изотипом; за исключением МАЕ17, который был IgG2b и за исключением МАЕ14, который был IgG2a.
Каждое из IgE специфических антител дополнительно исследовали в основанном на клетках и пластинках анализе для отбора антител, которые связывали, с IgE таким образом, чтобы ингибировать IgE связывание с FcεRI, и которые не способны к связыванию с FCEH-связанным IgE. Результаты данных анализов приведены ниже в табл.1 и 2.
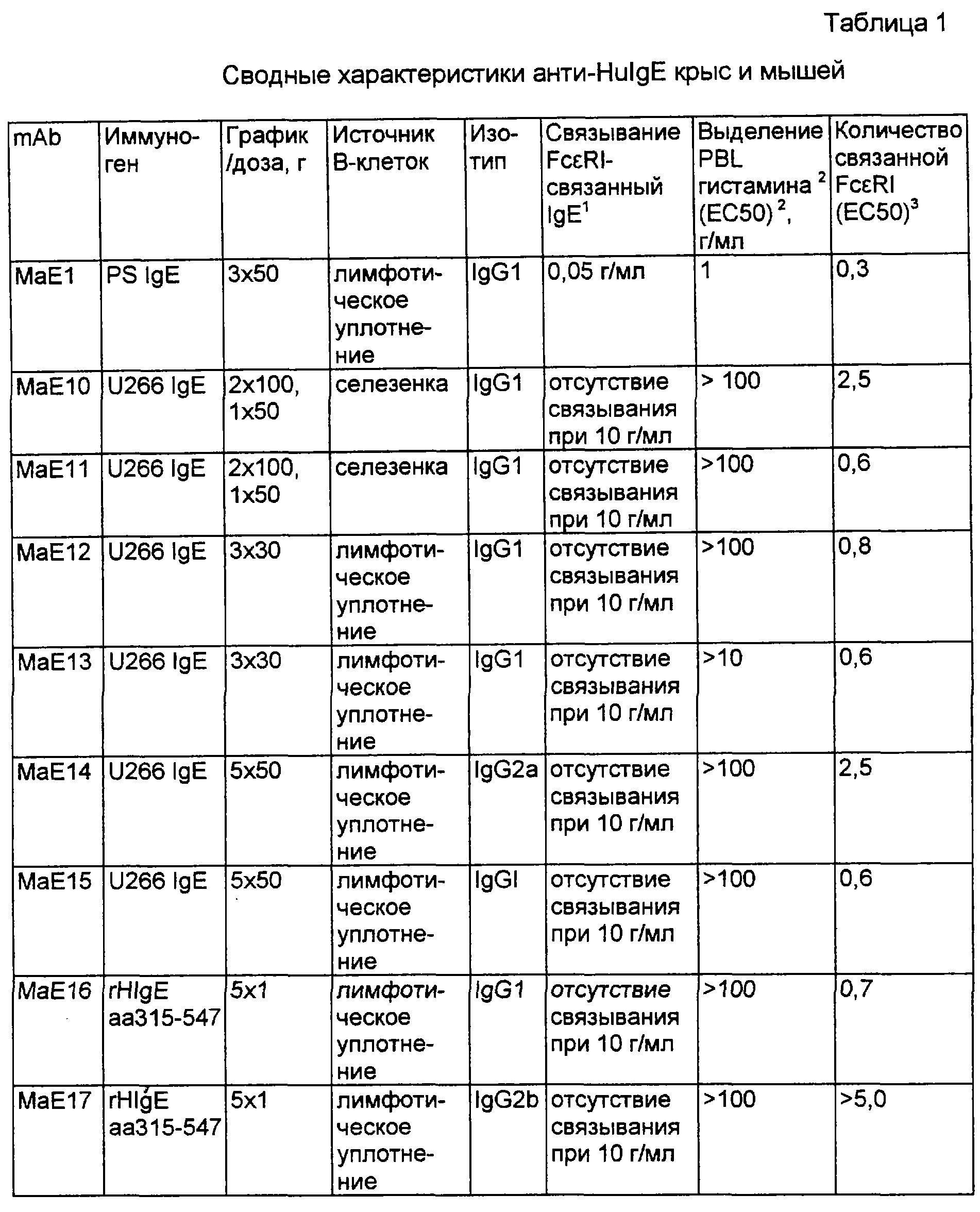

1. Основанная на методе FACS проверка для анализа моноклональных антител мышей и крыс против IgE человека
Скрининг моноклональных антител крыс или мышей против IgE человека мышей или крыс, связанных с IgE на СНО 3D10 (FcεRI a+).
а) СНО 3D10 клетки (FcεRI стабильный трансфектант по α-цепи, Hakimi et al., J. Biol. Chem. 25: 22079) при 5х105 клеток в образце инкубируют с U266 IgE стандартом (серия N13068-46) при 10 мкг/мл в 100 мкл FACS буфера (0,1% BSA, 10 mM азида натрия в PBS, рН 7,4) в течение 30 минут при 4°С, за которым следует одно промывание FACS буфером. Количество связанного IgE определяют при инкубировании аликвота IgE нагруженных клеток с поликлональным FITC конъюгированным антителом кролика против IgG человека (Accurate Chem. Co., AXL-475F, серия No. 16) при 50 мкл/мл в течение 30 минут при 4°С, за которым следовало три промывания FACS буфером.
б) IgE нагруженные клетки инкубируют с 100 мкл супернатанта гибридомы мыши или крысы против IgE человека (концентрация IgG крысы или мыши варьировалась в пределах от 1 до 20 мкг/мл) в течение 30 минут при 4°С, за которым следовало одно промывание FACS буфером. Genentech-моноклональное антитело против IgE человека (МаЕ1) при 10 мкг/мл используют в качестве положительного контроля связывания. Genentech моноклональное антитело MAD6P, которое не распознает IgE, используют при 10 мкл/мл в качестве отрицательного контроля.
в) Связывание моноклонального антитела с IgE человека на СНО клетках детектировали путем инкубирования клеток с 20 мкг/мл FITC-конъюгированного, очищенного с помощью аффинной хроматографии F(ab')2 антитела козла против IgG мыши (Organon Teknica, #10711-0081) в течение 30 минут при 4°С, за которым следовали три промывания FACS буфером. Клетки прибавляют к 400 мкл буфера, содержащего 2 мкл/мл йодида пропидия (Sigma, #P4170) для окрашивания переживающих клеток.
г) Клетки анализируют на Becton Dickinson FACSCAN проточном цитометре. Устанавливают затворы прямого рассеяния света и 90° бокового рассеяния для анализа гомогенной популяции клеток. Переживающие клетки, которые окрашивают пропидий йодидом, исключают из анализа. Супернатанты гибридом, которые не связывают IgE на СНО 3D10 клетках, рассматривали кандидатами для дополнительного скрининга.
2. Выделение гистамина из базофилов периферической крови
Гепаринизированную кровь получали из нормальных доноров и разбавляли 1:4 в модифицированном Tyrodes буфере (25 mM трис, 150 mM NaCl, 10 mM CaCl2, MgCl2, 0,3 мг/мл HSA, pH 7,35), далее инкубировали с 1 нМ IgE человека (ND) при 4°С в течение 60 минут. Далее клетки прибавляли к Tyrodes буферу, содержащему или моноклональные анти-IgE Abs мышей или крыс (10 мг/м), или поликлональные антитела против человеческой антисыворотки в качестве положительного контроля и инкубировали при 37°С в течение 30 минут. Клетки осаждали центрифугированием, гистамин в супернатантах ацетилировали и содержание гистамина определяли, используя RIA набор (АМАС, Inc. Wesbrook, Main). Общее количество гистамина определяли из клеток, подверженных нескольким раундам замораживания-размораживания.
3. Блокирование Fits конъюгированного IgE связывания с FcεRI цепью
Влияние антител на IgE связывание исследовали путем предварительной инкубации Fits меченого IgE с различными МаЕ антителами при 37°С в течение 30 минут в PBS, содержащем 0,1% BSA и 10 mM азида натрия с pH 7,4, далее инкубируя комплекс с 5× 105 3D10 клеток при 4°С в течение 30 минут. Клетки затем промывали три раза и измеряли среднюю проточную флуоресценцию при 475 нм. В качестве контроля использовали mAb (Мае1) крысы или мыши против IgE человека, которое не блокирует IgE связывание с FcεRI α-цепью.
4. Анализ связывания антитела крысы или мыши против человеческого IgЕ человека с положительными В клетками U266 IgЕ мембраны
а) U266 В1 клетки (мембрана IgЕ+) культивировали в щелочной среде, дпополненной 15% сывороткой эмбрионального теленка, инактивированной нагреванием (Hyclone, #A-1111-L), пенициллином, стрептомицином (100 ед/мл) и L-глутамином (2 mM).
б) Клетки (5×105/аликвот) инкубируют в 100 мкл FACS буфера, содержащего моноклональные антитела крысы или мыши против IgE человека при 10; 5; 1; 0,5 и 0,1 мкг/мл в течение 30 минут на льду в 96-луночном титрационном микропланшете с круглым дном, за которым следовало два промывания FACS буфером. В качестве положительного контроля используют Genentech моноклональное МАЕ1.
в) Клетки инкубируют в 100 мкл FACS буфера, содержащего 50 мкг/мл (1:20 биомассы) FITC конъюгированного F(ab')2 антитела козла, очищенного аффинной хроматографией, против IgE мыши (Organon Teknika, #1711-0084) в течение 30 минут на льду, за которым следует три промывания FACS буфером. Клетки прибавляют к 400 мкл FACS буфера, содержащего пропидий йодид при 2 мкг/мл для окрашивания переживающих клеток.
5. Основанные на FACS анализы связывания с FCεRI (CD23)+B клетка IМ9
а) IМ9 В-клетки миеломы человека (АТСС CCL 159, Ann. N.Y. Acad. Sci. 190: 221-234 (1972)) поддерживали в GIF щелочной среде с 10% бычьей эмбриональной сыворотки, инактивированной нагреванием, пенициллином, стрептомицином (100 ед/мл) и L-глутамином (2 mM).
б) Клетки (5×105/аликвот) инкубировали в 100 мкл FACS буфера, содержащего U266 IgE стандарт при 2 мкл/мл в течение 30 минут при 4°С в 96-луночном титрационном микропланшете, за которым следовало два промывания FACS буфером. В качестве контроля клетки инкубировали в одном буфере или буфере, содержащем 2 мкг/мл IgG1 человека (Behring Diagnostics, Cat, No. 400112, lot No. 801024).
в) Далее клетки инкубировали с моноклональными антителами крысы или мыши против IgE человека при 0,1 до 10 мкг/мл в течение 30 минут на льду. В качестве положительного контроля применяли Genentech моноклональное МАЕ1.
г) Далее клетки инкубировали в 100 мкл FACS буфера, содержащего FITC конъюгированное F(ab')2 козла против IgG мыши при 50 мкг/мл (Organon Teknika, # 1711-0084) в течение 30 минут при 4°С, за которым следовало 3 промывания FACS буфером.
д) Затем клетки прибавляли к 400 мкл буфера, содержащего пропидий йодид при 2 мкг/мл для окрашивания переживающих клеток.
е) Клетки анализировали на Becton Dickenson FACSCAN проточном цитометре. Устанавливали затворы прямого рассеяния света и 90° бокового рассеяния для анализа гомогенной популяции клеток и переживающие клетки, которые окрашивали пропидий йодидом, исключали из анализа. FITC положительные клетки (IgE связывание) анализировали относительно клеток, окрашенных одним FITC антителом кролика против IgE человека.
ж) В качестве положительного контроля для определения уровня CD23 на поверхности IM9 клеток в каждом эксперименте аликвоты клеток окрашивали Becton Dickinson моноклональным антителом Leu 20 крысы или мыши (анти-CD23) при 10 мкг/мл в течение 30 минут при 4°С, за которым следовало два промывания. Далее клетки инкубировали с FITC конъюгированным F(ab')2 козла против IgG крысы или мыши, очищенного аффинной хроматографией.
6. Блокирование антитела FITC конъюгированным IgE, связанным с IgE рецептором низкой аффинности
Связывание 40 нМ FITC меченого IgE с IgE рецептором низкой аффинности (CD33 или FcεRI), экспрессируемом на В лимфобластомных клетках IM-9, анализировали проточной цитометрией на FACSCAN проточном цитометре. Влияние антител на FITS IgE связывание изучали с помощью предварительной инкубации FITS IgE с антителами крысы или мыши против IgE человека при 0,1-10 мкг/мл химеры при 37°С в течение 30 минут в PBS, содержащем 0,1% BSA и 10 mM азида натрия с рН 7,4, далее инкубируя комплекс с 5×105 клеток при 4°С в течение 30 минут. Клетки далее промывали три раза и измеряли среднюю проточную флуоресценцию при 475 нм.
7. Процедура (схема) анализа IgE in vitro
а) Мононуклеарные клетки периферической крови отделяли от нормальных доноров.
б) Клетки промывали с PBS для удаления по возможности большего количества тромбоцитов.
в) Мононуклеарные клетки подсчитывали и ресуспендировали в среде с 1×106 клеток/мл. Средой являлась смесь DMEM с пенициллином и стрептомицином, 15% сывороткой лошади, IL-2 (25 ед/мл) и IL-4 (20 нг/мл).
г) Антитела прибавляли в соответствующих концентрациях в день 0, 5 и 8.
д) Культуры инкубировали в 24-луночном Falcon культуральном планшете ткани в течение 14 дней.
е) На 14 день супернатанты удаляли и анализировали концентрации IgE с помощью процедуры IgE специфического ELISA.
8. Константу аффинности (Kd) mAb мыши или крысы по отношению к IgE человека определяли анализом равновесного связывания (Scatchard)
а) IgE (ND и PS аллотипы йодировали с хлорамином Т и отделяли от свободного125I с помощью колонки с РD10 сефадексом G25 (Pharmacia, #17-0851-01) в RIA буфере: PBS, 0,05% бычьего сывороточного альбумина (Sigma, #А-7888), 0,5% Твина (Tween 20, Sigma, #P-1379), 0,01% тимерозола (Sigma, #T-5125), рН 7,4. Приблизительно 78-95% послеколоночных подсчетов (каунтов) осаждали 50% трихлоруксусной кислотой и удельная активность йодированных IgE препаратов варьировалась от 1,6 до 13 μCi/мкг, допуская 70% эффективность счета.
б) Определенную концентрацию125I (приблизительно 5×104 число импульсов/мин) прибавляли для варьирования концентраций немеченого IgE (1 до 200 нМ) в конечном объеме 0,1 мл RIA буфера в 12×75 мм пропиленовых пробирках. mAB's мыши или крысы против IgE человека (20 mM конечная концентрация) в 0,1 мл RIA буфера далее прибавляли к конечному анализируемому объему - 0,2 мл.
в) Образцы инкубировали 16-18 часов при 25°С при непрерывном перемешивании.
г) Связанные и свободные125I IgE разделяли прибавлением 0,3 мл смеси очищенного аффинной хроматографией антитела козла против IgG мыши (Boehringer Mannheim #605-208), связанного с CNBr-активированной сефарозой 4В (Sepharose 4В, Pharmacia, #17-0430-10) и носителем протеина А сефарозы (Repligen, #IPA 300) в RIA буфере и инкубировали от 1 до 2 часов при 25°С при непрерывном перемешивании. Далее прибавляли RIA буфер (1 мл) и пробирки центрифугировали 5 минут при 400хg. Образцы затем считывали для определения общего числа импульсов. Супернатанты удаляли с помощью мелко откалиброванной пастеровской пипетки, образцы заново считывали и вычисляли связанные импульсы (каунты) в сравнении со свободными.
д) Scatchard анализ проводили с применением Fortran программы (Scanplot), основанной на программе Ligand, написанной P.Munson в NIH. Scanplot использует уравнение действующих масс соответствующего предела как функцию полного использования Rodbard типа регрессионного анализа.
Пример 2
Получение облагороженного МаЕН
Введение
Следующий пример описывает различные способы получения облагороженного МаЕ11, в котором остатки модифицированы путем сайтнаправленного мутагенеза для достижения 12 анти-IgE МаЕ11 вариантов [F(ab)1-12]. Остатки F(ab)12 применяли в качестве темплаты для создания rhuMaE25 или Е25, высокопотентного анти-IgE антитела, описанного в заявке PCT/US92/06860, поданной 14 августа 1992.
Способы
mAb MaE11 крысы или мыши против IgE человека, показанное на фиг.1, модифицировали с помощью сайтнаправленного мутагенеза (Kunkel T.A. Ргос.Natl. Acad. Sci. USA 82: 488 (1985)) из дезоксиуридинсодержащего темплата, включающего легкую цепь κ-подгруппы I, принадлежащей человеческому роду, и тяжелую цепь (VH-CH1) подгруппы III, принадлежащей человеческому роду, в плазмиде на основе pUC119, pAK2 (Carter et al., Ргос.Natl. Acad. Sci. USA 89: 4285 (1992)) для получения варианта F(ab)-1. F(ab)-2 создали из F(ab)-1 темплаты и все другие облагороженные F(ab) варианты создали из темплаты F(ab)-2. Плазмиды трансформировали в E.coli штаммы JM101 для получения двухцепочечной или одноцепочечной ДНК (Messing J. Recomb. DNA Tech. Bull. 2:43 (1979); Ausuble et al., Current Protocols in Molecular Biology, Unit 1 (1997)). Остатки легкой и тяжелой цепи полностью секвенировали с применением дидезоксинуклеотидного способа. ДНК, кодирующую легкую и тяжелую цепи, далее субклонировали в производное E.coli F(ab) экспрессирующую плазмиду рАК19 (Carter et al., Biotechology 10: 163 (1992)). Производное испытывало недостаток цистеинов в шарнирной области, которые образуют дисульфидные связи между тяжелыми цепями в F(ab)'2 фрагментах. F(ab) фрагменты в противоположность IgG антителам полной длины облегчали анализ умеренно большого количества вариантов, так как можно использовать E.coli экспрессию, а не методы культивирования клеток млекопитающих. Эти отдельные (частные) варианты описаны в заявке WO 93/04173, опубликованной 4 марта 1993 г. Если определяли лучший вариант, его впоследствии субклонировали в плазмиду, кодирующую IgG1 человека полной длины (см. ниже).
Экспрессирующие плазмиды трансформировали в E.coli штамм ММ294 (Meselon M., R. Yuan, Nature 217: 1110 (1968)) и моноспецифическую колонию культивировали в 5 мл 2YT среды-карбенициллине (100 мкг/мл) в течение 5-8 часов при 37°С. Далее культуру (5 мл) прибавляли к 100 мл АР5 среды - карбенициллину (100 мкг/мл) и давали возможность для культивирования в течение 16 часов в 500 мл встряхивателе при 37°С. Культуру центрифугировали при 4000хg и удаляли супернатант. После замораживания в течение 1 часа осадок после центрифугирования ресуспендировали в 5 мл холодного 10 mM трис-буфера, 1 mМ EDTA и 50 мкл 0,1 М бензамидина (Sigma, St. Louis), последний из которых прибавляли для ингибирования протеолиза. После осторожного встряхивания на льду в течение 1 часа образец центрифугировали при 10000xg в течение 15 минут. Супернатант применяли для колонки протеин А-сефароза CL-4B (Pharmacia) (0,5 мл чистого объема вещества), далее промывали 10 мл раствора 3М хлорида калия / 100 мл трис-буфера, рН 8,0, за которым следовало элюирование 100 mM уксусной кислотой (2,5 мл), рН 2,8 в 1 М трис-буфере, рН 8,0 (0,5 мл).
F(ab) буфер затем заменяли на PBS, используя Centricon-30 (Amicon), и концентрировали до конечного объема, равного 0,5 мл. SDS-PAGE гелей каждых F(ab) фрагментов проводили для того, чтобы оценить чистоту. F(ab) концентрации определяли, используя для 0,1% ε280, равное 1,0. Коэффициент эстинкции определяли, используя концентрацию протеина из аминокислотного анализа очищенного F(ab)-2 и A280 для того же образца.
Отобранные F(ab) фрагменты непосредственно анализировали жидкостной хроматомасс-спектрометрией для подтверждения молекулярного веса. Образцы вводили в жидкостную хроматографическую систему с заполненной капиллярной колонкой (Henzel W.J. et al., Anal. Biochem. 187: 228 (1990)) и непосредственно анализировали с помощью Sciex API 3 масс-спектрометра. Для калибровки использовали высшие заряженные состояния человеческого гормона роста (м.в. 22256,2), применяя те же инструментальные параметры, как и параметры, используемые для образцов.
Для генерирования версий облагороженного МаЕ11 IgG1 человека полной длины, тяжелые и легкие цепи субклонировали раздельно в ранее описанные pRK плазмиды (German et al., DNA Protein Eng. Tech. 2:3 (1990)). Соответствующую тяжелую и легкую цепь плазмиды (в зависимости от нужного изменения(ий) последовательности) котрансфектировали в аденовирус-трансформированную линию клеток эмбриональной почки человека, известную как 293 (Graham et al., J. Gen. Virol 36: 59 (1977)), используя высокоэффективную методику (Graham et al., supra and Gorman, Science 221:551). Среду заменяли на несодержащую сыворотку среду и собирали ежедневно в течение 5 дней. Антитела очищали от собранных супернатантов с применением протеина А-сефарозы CL-4B (Pharmacia). Заменяли буфер в элюированном антителе на PBS с помощью G25 гель-фильтрации, концентрировали ультрафильтрацией, используя Centriprep-30 или Centricon-100 (Millipore) и хранили при 4°С. Концентрацию антитела определяли общим IgG-связанным ELISA. Результаты описаны в табл.4.
Гомогенный иммуноанализ рецептора
Аналитический планшет с 96 лунками (Nunc) покрывали 0,05 мл FcεRI α-цепи IgG химерного рецептора в буфере для сенсибилизации поверхностей (50 mM карбонат, бикарбонат, рН 9,0) в течение 12 часов при 4-8°С. Лунки удаляли и прибавляли 250 мкл блокирующего буфера (PBS, 1% BSA, рН 7,2) и инкубировали в течение одного часа при 4°С. В отдельном аналитическом планшете образцы и контрольные МаЕ11 крысы или мыши титровали от 200 до 0,001 мкг/мл при 1:4 разбавлениях анализируемым буфером (0,5% BSA и 0,05% твина 20, PBS, рН 7,2) и прибавляли равный объем 10 нг/мл биотинилированного IgE (О. Shannessy D.J. et al., Immunol. Let. 8: 273 (1984)), за которым следовала инкубация планшета в течение 2-3 часов при 25°С. Покрытые FcεRI лунки промывали три раза PBS и 0,05% твином 20 (Sigma) и 50 мкл образца из лунок переносили и инкубировали при встряхивании в течение 30 минут при 25°С. Раствор Стрептавидина-HRP (500 мкг/мл, Sigma), разбавленный до 1:5000 в анализируемом буфере, прибавляли при 50 мкл/лунке, за которым следует инкубация планшета в течение 15 минут при встряхивании и промывании, как описано выше. 50 мкл/лунка Microwell Peroxidase Substrate (пероксидазного субстрата, Kirkgaard and Perry Laboratories) прибавляли, и цвет появлялся в течение 30 минут. Реакцию останавливали прибавлением равного объема 1N HCl и абсорбцию измеряли при 450 нм. Концентрацию при 50% ингибирования вычисляли путем построения кривой зависимости процента ингибирования от концентрации блокирующего антитела с помощью нелинейного четырех параметрового подбора кривой, используя данные анализа Kalelidagraph (Synergy Software). Результаты представлены в табл.3.
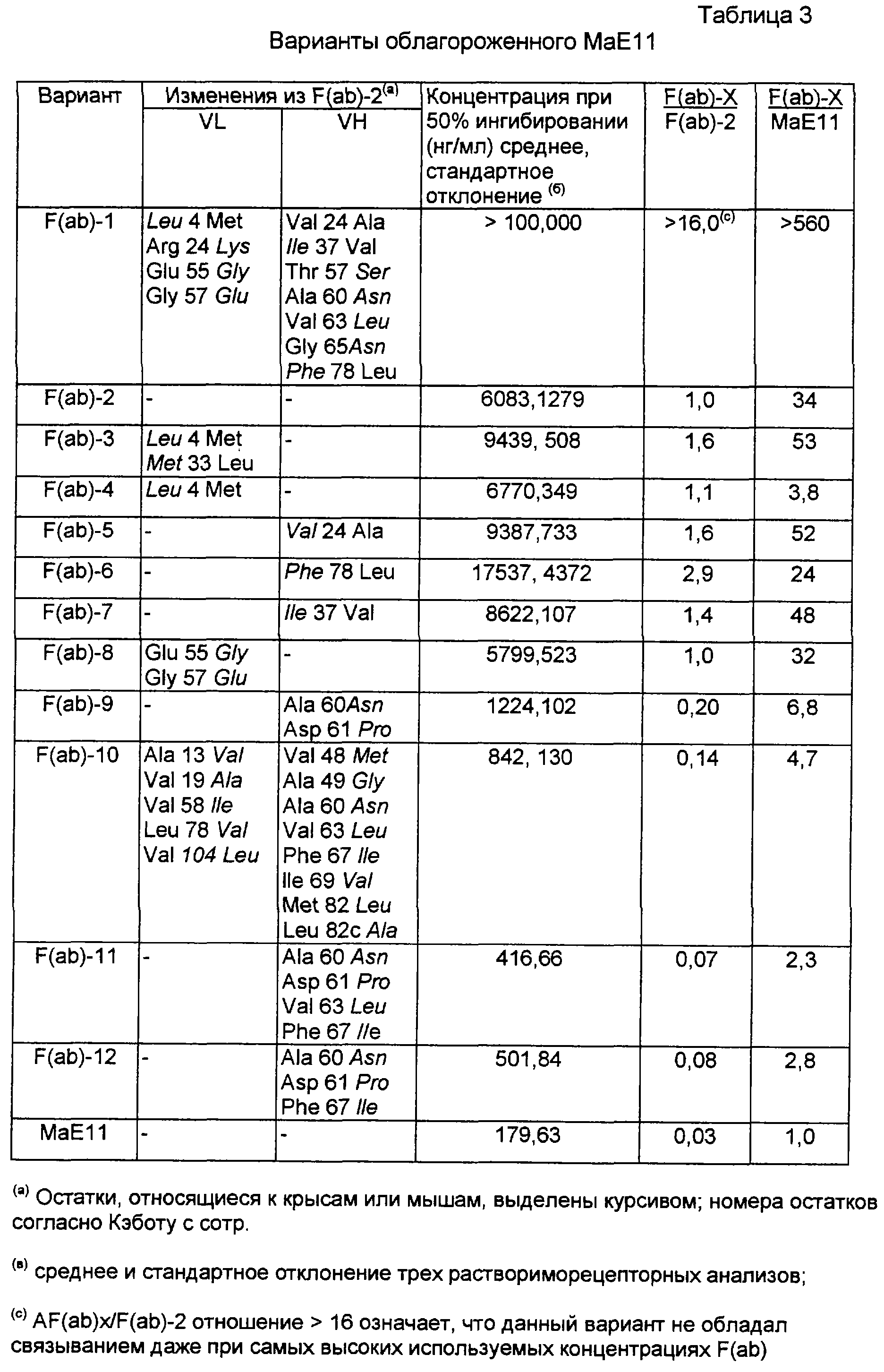
Анализы (проверки) связывания, основанные на FACS
Способность антитела ингибировать FIТС-конъюгированное (Goding J.W. J.lmmunol. Methods, 13: 215 (1976)) IgE связывание с α-цепью высокоаффинного FcεRI рецептора, экспрессированного на СНО 3D10 клетках (Hakimi J. et al., J. Biol. Chem., 265: 22079 (1990)), определяли с помощью проточной цитометрии. FITC-конъюгироаванный IgE (40 нМ) проинкубировали с антителом (0,3-1,0×10-6М) при 37°С в течение 30 минут в FACS буфере (PBS, 0,1% BSA и 10 mM азида натрия, рН 7,4). Комплекс далее инкубировали с 5× 105 СНО СD10 клетками при 4°С в течение 30 минут. Клетки промывали три раза FACS буфером и измеряли среднюю проточную флуоресценцию при 475 нм на FACScan проточном цитометре (Becton Dickinson). MaE1, mAb крысы или мыши против IgE человека, которое не блокирует IgE связывание с FcεRI α-цепью использовали в качестве положительного контроля и МОРС21 (Cappel), моноклональное антитело крысы или мыши, которое не распознают IgE, использовали в качестве отрицательного контроля. Результаты приведены на фиг.3.
Связывание антител с IgE-нагруженным FcεRI
Антитела, связанные с IgE человека, соединенные с α-субъединицей FcεRI, экспрессированной на СНО 3D10 клетках с 10 мкг/мл IgE человека в течение 30 минут при 4°С. Клетки промывали три раза, за которым следовало 30 минутное инкубирование с изменяющимися концентрациями или mAbs MaE1 или МаЕ11 крысы или мыши против IgE человека или облагороженного mAb варианта 12[F(ab)12]. MOPC21 (IgG1 мыши или крысы) применяли в качестве контроля для mAbs крысы или мыши, тогда как облагороженное 4D5 mAb (Carter et al., Proc. Natl. Acad. Sci. USA 89: 4285 (1992)) IgG1 человека использовали в качестве контроля для F(ab)12. Связывание mAbs крысы или мыши детектировали с FIТС-конъюгированным F(ab')2 козла против IgE мыши (10 мкг/мл). Связывание облагороженного mAb детектировали (обнаруживали) с помощью FIТС-конъюгированного F(ab')2 козла против IgG человека (50 мкг/мл), которое очищено с помощью аффинной хроматографии на IgE колонке для минимизации перекрестного взаимодействия с IgE. Результаты представлены на фиг.4.
Компьютерно-графические модели относящихся к крысам или мышам и облагороженных F(ab')s
Последовательности VL и VH областей F(ab) фиг.1 использовали для создания компьютерно-графической модели VL и VH областей МаЕ11, относящегося к крысам или мышам. Данную модель впоследствии применяли для определения, какие остатки остовной области должны включаться в облагороженное антитело, которое приводит к созданию F(ab)-2. Также создавали модели облагороженных вариантов для подтверждения правильности выбора остатков остовной области, относящихся к крысам или мышам. Создание моделей осуществляли, как описано в работах Carter et al., Proc. Natl. Acad. Sci. USA 89: 4285 (1992), Eigenbrot С. et al., J. Mol. Biol. 229: 969 (1993)).
Результаты
Конструкция облагороженных МаЕ11 антител
Данное исследование облагороженных антител использовало “консенсусную” последовательность человека. Это находится в противоречии с другими способами облагораживания, которые используют последовательности, принадлежащие человеку, самые близкие к Ig крысы или мыши. Sherman et al., J. Immunol. 147: 4366 (1991); Kettleborough et al., Protein Eng. 4: 773 (1991); Tempest et al., Biotechnology 9: 266 (1991); Co et al., Proc. Natl. Acad. Sci. USA 88: 2869 (1991); Routledge Eur. J. Immunol. 21: 2717 (1991). Эта консенсусная последовательность человека, состоящая из остовной области, основанной на подгруппе III VH и подгруппе I VLk человека, как определено в монофафии Кэбота (Kabat et al., Sequences of Proteins of Immunological Interest, 5ed., National Institute of Health, Bethesda, MD, (1991)). F(ab)-1 создавали трансплантацией шести CDR's, как определено Кэботом (Kabat, supra) на остовной области IgG1 человека. Все остатки остовной области сохраняли такими, как у человеческого Ig. Данный вариант лучше описать как прямой “CDR обмен”. F(ab)-1 показал незначительное ингибирование IgE связывания с рецептором (табл.3). Ранее сообщалось о невозможности такого “CDR обмена” вариантов для связывания их антигенов. (Carter et al., supra; Tempest et al., supra). Следует заметить, что точная последовательность F(ab)-1 не описана в табл.3, однако данную последовательность можно вывести замещением Кэбота CDR остатков МаЕ11 крысы или мыши (указанные в скобках) на соответствующие остатки из фрагмента антитела человека. Фиг.1 показывает CDRs Кэбота в скобках слева и справа, в то время как CDRs Хотиа (Chothia) - подчеркнуты.
Для того чтобы помочь интерпретации и уменьшить путаницу, остатки, относящиеся к фрагментам антител человека, писали нормальным шрифтом, в то время как остатки, относящиеся к крысам или мышам, представлены курсивом. Если показывают замещения остатков, первый остаток является замещаемым остатком, второй является вставленным остатком, и используют нумерацию Кэбота для обозначения нативной последовательности.
F(ab)-2 вариант основан на молекулярном моделировании. В этой молекуле несколько остатков остовной области крыс или мышей включали в остовную область человека. В F(ab)-2 использовали определения CDR's, предложенные Kabat et al., supra (которые основаны на разнообразии (изменчивости) межвидовой последовательности), за исключением CDR-H1 и CDR-H2.
Определения CDR-H1, основанные на разнообразии (изменчивости) последовательности (Kabat et al., supra), значительно отличаются от определений, основанных на кристаллографических исследованиях комплексов антиген-антитело (Chothia et al., Nature 342: 877 (1989)) (фиг.1). Поэтому CDR-H1 заново определяли для включения обоих определений, т.е. остатков 26-35 человека.
Определение CDR-H2, основанное на разнообразии последовательности (Kabat et аl.), содержит больше остатков, чем определение, основанное на кристаллических структурах антитело-антиген (Chothia et аl.) [см. фиг.1 CDR's Кэбота обозначены скобками, Хотиа - подчеркнуты]. Поскольку не обнаружена кристаллическая структура, которая указывала бы на связи антитело-антиген для остатков 60-65 антитела человека, CDR-H2 модифицировали, чтобы включить гибрид двух определений, т.е. остатки 50-58 антитела человека. В результате в F(ab)-2 использовали более короткий вариант CDR-H2 по сравнению с F(ab)-1.
В результате F(ab)-2 создавали с минимальным количеством изменений остатков антитела человека на остатки антител крыс или мышей, которые полагали, требуются для сохранения связывания. Созданы 10 дополнительных вариантов для того, чтобы исследовать влияния углубленных остатков на CDR конформации, а также оценить предсказываемые влияния молекулярного моделирования значимых остатков остовной области и исследовать другие остатки, представляющие интерес.
Для исследования влияния углубленных остатков на CDR конформацию создавали F(ab)-3 до F(ab)-7, в которых остатки фрагментов антител крыс или мышей обратно меняли на остатки фрагментов антител человека. Как показано в табл.4 (с помощью F(ab)-3 и F(ab)-4), боковые цепи в VL4 и VL33 оказывали минимальное влияние на связывание и, предположительно, на конформацию CDR-L1 в облагороженном антителе.
Моделирование предполагало, что остаток VH24 остовной области может оказывать влияние на CDR-L1 конформацию и VH37 мог влиять на поверхность раздела VL-VH. Однако замещение остатка в антителе человека в VH24 [F(ab)-5] или VH37[F(ab)-7] показывало минимальное уменьшение связывания. Наоборот, замещение остатка Phe в остовной области крыс или мышей в положении VH78 на Leu [F(ab)-6] человека вызывало значительное уменьшение связывания. Модели предполагают, что этот остаток оказывает влияние на конформацию CDR-H1 и/или CDR-H2.
F(ab)-9 -F(ab)-12 исследовали замещение остатков антитела человека на крысиные или мышиные. Все эти четыре варианта проявляли существенное улучшение в связывании по сравнению с F(ab)-2 (см. табл.3, 4 и фиг.3). В F(ab)-9, который проявлял в 5 раз большее связывание по сравнению с F(ab)-2, два остатка в CDR-H2 (как определено Kabat et al., supra) заменяли на остатки антитела крысы или мыши: Ala VH 60 Asn Asp H61 Pro. Замещение Pro должно изменить CDR-H2 конформацию и/или жесткость и предполагают, что Asn H60 углублен в поверхность раздела VL-VH, возможно взаимодействуя с Asp VL1.
F(ab)-10, который демонстрировал впоследствии улучшенное связывание по сравнению с F(ab)-2, являлся вариантом, в котором все углубленные остатки (определенные как остатки с доступной площадью поверхности, составляющей менее 5% от количества остатков свободной аминокислоты) и в VL и VH областях были МаЕ11 крысы или мыши. По-существу, F(ab)-10 можно представить себе как МаЕ11 крысы или мыши, в котором только доступные не относящиеся к CDR остаткам в VL и VH областях заменяли на остатки, принадлежащие человеку.
Чтобы определить, являлось ли улучшенное связывание F(ab)-10 следствием одного или нескольких остатков, создали варианты F(ab)-11 и F(ab)-12. Вместо F(ab)-2, F(ab)-9 применяли в качестве основной темплаты, из которой получают данные варианты, поскольку они проявляли в 5 раз лучшее связывание. Моделирование предполагало, что боковые цепи при VH63 и VH67 могут влиять на конформацию CDR-H2. Полагают, что VH63 часть CHR-H2, как определено Кэботом с сотр. (Kabat et al., supra), а не как определено Chothia et al., supra. Полагают, что VН67-остаток остовной области в обоих определениях. В F(ab)-11, VH63 и VH67 являлись остатками Leu и llе крыс или мышей соответственно. В F(ab)-12 только VH67 заменяли на llе крысы или мыши.
В раствориморецепторном и клеточном анализах (табл.4) и клеточном анализе (табл.4, фиг.3) оба варианта F(ab)-11 и F(ab)-12 проявляли связывание, которое, по крайней мере, такое же, как у F(ab)-10, и лучше, чем у F(ab)-9. Это предполагает, что улучшенное связывание F(ab)-10 не обусловлено переупаковкой (перезаполнением) внутренней VH области остатками, относящимися к крысам или мышам, но было обусловлено влиянием только единственного остатка, т.е. VH 67.
F(ab)-8 создали замещением VL55 остатка Glu человека на Gly крысы или мыши, а также аналогичных замещений в VL57 Gly на Glu. F(ab)-2 использовал остатки, принадлежащие человеку, в то время как F(ab)-8 замещал в этих положениях остатки, относящиеся к крысам или мышам. Как можно легко видеть из табл.3, замещение этих остатков не влияет на рецепторное связывание.
Найденные F(ab) варианты, обладающие связыванием, близким к МаЕ11 крыс или мышей, а именно F(ab)-2, F(ab)-9, F(ab)-10 и F(ab)-12, использовали для генерирования IgG1 молекул полной длины. Связывание этих молекул по отношению к варианту F(ab)-2 или МаЕ11 являлось сравнимым со связыванием, проявляемым F(ab) фрагментами. Данные результаты представлены в табл.4.

Связывание МаЕ11 с IgЕ-нагруженным FcεRI
МаЕ11 крысы или мыши предотвращает связывание свободного IgE с FcεRI на тучных клетках, но не вызывает выделение гистамина при связывании с IgE-нагруженным FcεRI. Как показано на фиг.4, и МаЕ11 крыс или мышей и облагороженный вариант 12 (IgG1-12), а также отрицательный контроль изотипа антитела МОРС21 и отрицательный контроль изотипа облагороженного 4D5 (Carter et al., supra) не связывали IgE-нагруженное FcεRI на СНО 3D10 клетках. Наоборот, МаЕ1 антитело крысы или мыши, которое связывается с IgE, но не предотвращает IgE связывание с FcεRI, связывался с IgE-нагруженным FcεRI. В отличие от IgG1 контроля человека (облагороженное 4D5) изотип IgG1 крыс или мышей (как представлено МОРС21) проявляет неспецифическое фоновое связывание на этих клетках, составляющее 10%. МаЕ11 не дает окрашивания свыше контроля МОРС21, и облагороженный вариант 12 не дает окрашивания свыше контроля облагороженного 4D5 (фиг.4).
Частичная проверка (сканирование) CDR остатков апанина, важных в IgE связывании
Последовательности МаЕ11 CDR's указывают на преобладание заряженных остатков (фиг.1). CDR-L1 содержат три Asp остатка, тогда как CDR-L3 имеет His, Glu и Asp. CDR-H3 имеет три His остатка. Модели МаЕ11 крыс или мышей и облагороженного МаЕ11 иллюстрировали пространственную близость всех этих заряженных остатков (не показано). Наоборот, одиночный Asp45 в CDR-H2 пространственно отделен от других заряженных остатков. Аланин замещали с помощью сайт-направленного мутагенеза (Kunkel, Proc. Natl. Acad. Sci. USA 82: 488 (1985)) на каждый из этих заряженных остатков для генерирования вариантов. В CDR-L1 изменение одного из трех Asp остатков, Asp VL32b, эффективно устраняет IgE связывание [F(ab)-16; табл.5], тогда как замещение других Asp остатков имело минимальный эффект [F(ab)-14; F(ab)-15]. Одновременное замещение Glu VL93 и Asp VL94 на аланин в CDR-L3 [F(ab)-17; табл.5] также уменьшало связывание, хотя не в такой степени, как при замещении VL32b. Отдельное замещение трех His остатков в CDR-H3 на Ala приводило к небольшому улучшению связывания [F(ab)-21] или трехкратному уменьшению связывания [F(ab)-20, F(ab)-22]. Однако одновременное изменение всех трех His остатков устраняло связывание [F(ab)-19]. Хотя не легко определить, включены ли заряженные остатки в прямое связывание с IgE или обеспечивают некоторую конформационную стабильность к их соответствующим CDR's, варианты F(ab)-13 до F(ab)-22 показывают, что CDR-L1 и CDR-H3 являются важными детерминантами в IgE связывании.

Краткое изложение и заключение
Создание функционального, облагороженного анти-IgE антитела крысы или мыши включает замещение нескольких остатков остовной области, относящейся к крысам или мышам, на остовную область, принадлежащую человеку. Кроме того, картирование заряженных CDR остатков указывало, что некоторые из них важны в антитело-IgE взаимодействии.
Согласно предыдущим исследованиям (Carter et al., supra; Shearman et al., J. Immunol. 147: 4366 (1991); Kettleborough et al., Protein Eng. 4: 773 (1991); Tempest Biotechnology 9: 266 (1991)), варианты от F(ab)-1 до F(ab)-12 указывают, что остатки остовной области могут оказывать значительное влияние на функцию антитела. Этому особенно придается значение, когда рассматривают F(ab)-1, который является прямым CDR обменом, в котором только шесть CDR's, относящихся к крысам или мышам, трансплантировали (пересаживали) в остатки остовной области, относящейся к человеку. Потенциальное объяснение этого включает CDR-H2. Углубленные гидрофобные остатки в положении VH63 и VH67 могут влиять на конформацию CDR-H2. Создавали варианты, содержащие четыре комбинации в положениях VH63 и Н67, т.е. Leu и llе, относящиеся к крысам или мышам соответственно [МаЕ11 и F(ab)-11], VaI и Phe [F(ab)-2] Leu и Phe [F(ab)-1] и VaI и lle [F(ab)-12]. Четкий вывод из данных связывания этих четырех вариантов указывает, что важным остатком является VH67, который должен быть llе крысы или мыши для того, чтобы обеспечить аффинность, сопоставляемую с МаЕ11 крысы или мыши. В F(ab)-1 этот остаток представлял собой Phe человека.
Из 12 остатков в F(ab)-1, удерживаемых как принадлежащих человеку [по сравнению с F(ab)-2], 8 отдельно заменяли на относящиеся к крысам или мышам в других вариантах. Три изменения не оказывали влияние на связывание: VL4 [F(ab)-4]; VL55 и VL57 [F(ab)-8]. Замещения двух остатков: VH60 и VH61 [F(ab)-9], улучшало связывание, тогда как три уменьшали связывание: VH24 [F(ab)-5]; VH37 [F(ab)-7] и VH78 [F(ab)-6].
Вариант F(ab)-10 создавали с помощью гипотезы, предложенной Пэдланом (Padlan E.A. Mol. Immunol. 28: 489 (1991)), который предполагал, что иммуногенность антитела крысы или мыши можно уменьшить при замене только доступных остатков остовной области. В данном варианте гидрофобная внутренняя область VL и VH областей, другими словами, вариант представлял собой МаЕ11 крысы или мыши, в котором только доступные остатки остовной области в VL и VH заменяли на последовательность, принадлежащую человеку. Хотя F(ab)-10 проявлял связывание, близкое к связыванию МаЕ11 крысы или мыши, изменения в отдельной аминокислотной области, VH67 человека на крыс или мышей, оказывали такое же воздействие на улучшение связывания [F(ab)-12, IgG1-12].
Облагороженный вариант, обладающий связыванием, сопоставимым с МаЕ11 крысы или мыши, который также требовал наименьших изменений, представлял собой F(ab)-12. Данный вариант замещал только 5 остатков остовной области антитела человека крысиными или мышиными (VL4, VH24, VH37, VH67 и VH78). Четыре из этих остатков определяли молекулярным моделированием. Пятый, VH67, а также CDR-H2 остатки VH60 и VH61 включали, используя молекулярные модели для попытки улучшить связывание исходного варианта F(ab)-2.
Пример 3
Проверка выделения гистамина
Введение
Это представляет собой анализ гистамина тучных клеток крысы (rat mast cell histamine assay, RMCHA), который количественно измеряет биологическую активность рекомбинантного облагороженного моноклонального анти-IgE антитела, основанную на способности антитела блокировать выделение гистамина из аллерген-чувствительных RBL 48 клеток. Кроме того, данное определение проводят в физиологических условиях, в аналогичных человеческому организму условиях. RBL 48 клетки получали из родительской линии тучных клеток крысы RBL 2H3, которые впоследствии трансфектировали α -субъединицей высокоаффинного IgE рецептора человека (FcεRI) (Gilfillan A.M. J. Immunol. 149 (7): 2445-2451 (1992)).
Способы
RBL 48 клетки (Gilfillan et al., supra) культивировали в sIMDM, среде Дульбекко, модифицированной по способу Искова, дополненной 10% сывороткой эмбрионального теленка, 2 mМ глутамина и 500 мкг/мл активного генетицина (geneticin, Gibco, #860-1811) в Т175 матрасе тканевой культуры (Falcon #3028) при 37°С в увлажненном 5% СO2-инкубаторе (Fischer, model #610). Клетки собирали при выдерживании 4 мл раствора PBS/0, 05% трипсина/ 0,53 mM EDTA в течение 2 минут при 37°С, за которым следовало центрифугирование (400хg, 10 мин) и ресуспендирование в свежей sIMDM. Клетки в суспензии подсчитывали с помощью гемоцитометра (Reichert-Jung) и плотность доводили до 0,4×106 клеток/мл. Далее производили посев клеток при 100 мкл/лунке (40000 клеток в лунке) во внутренних 60 лунках 96-луночного, U-образного планшета (Linbro) тканевой культуры и культивировали в течение 24 часов при 37°С в увлажненном 5% СO2 инкубаторе. После однократного промывания 200 мкл/лунка sIMDM (через аспирацию) клетки проинкубировали 30 минут при 90 мкл/лунка раствора разбавителя (sIMDM, 3 ед/мл Na-гепарина) со специфичным к пыльцевой аллергии IgE (RSIgE, 10 нг/мл, 23,48 нг/мл общего IgE, 1,43% специфичной к пыльцевой аллергии плазмы человека, North American Biological, lot #42-365054).
После инкубирования 10 мкл/лунка анти-IgE антитела (разбавленного разбавителем, 0,06-39,4 мкг/мл) или разбавитель (для контроля полного выделения гистамина, фона и пыльцевой аллергии) прибавляли к клеткам и планшет инкубировали в течение 24 часов в 5% СO2 при 37°С в инкубаторе. После инкубации клетки аспирировали (удаляли) и промывали 3 раза 200 мкл/лунку sIMDM. После промывания клетки инкубировали с 100 мкл/лунке или (1) 0,5% раствора тритона (для полного выделения гистамина), (2) буфера для выделения гистамина (HRB, 50% D2O, 0,8% NaCl, 1,3 mM CaCl2 sIMDM или (3) антигена пыльцевой аллергии (NIH #А-601-903А-185, 0,1 мкг/мл в HRB) при 37°С в течение 30 минут и реакцию останавливали при помещении на лед (100% D2O=100%, 0,8% NaCl, 1,3 mM CaCl2).
Планшет центрифугировали 5 минут при 900хg (2460 об/мин) при 4°С, супернатанты собирали и разбавляли 1:80 в PBS (1:1000 в PBS для контроля полного выделения гистамина) для определения гистамина с использованием гистаминового набора иммуноферментного анализа с аффинной хроматографией (Histamine Enzyme Immunoassay Kit, Immunotech #1153). Супернатанты (100 мкг/лунка) переносили в пробирки для ацилирования, содержащие ацилирующий порошок (в наборе), и подвергали реакции с 50 мкл ацилирующего буфера (в наборе) в течение 30 минут при комнатной температуре. Ацилированный гистамин (50 мкг/лунка) далее переносили в планшет для конъюгирования (в наборе) и инкубировали с 200 мкг/лунка гистаминацетилхолинэстеразного конъюгата (в наборе) в течение 18 часов при 4°С.
После инкубирования лунки подвергали блоттингу и промывали для удаления несвязанного конъюгата с помощью 4-кратного промывания 300 мкг/лунке промывного буфера (Immunotech kit, #1153). Прибавляли хроматогенный субстрат (ацетилтиохолин, дитионитробензоат, 200 мкл/лунка, в наборе) и инкубировали в темноте при комнатной температуре в течение 30 минут. Реакцию останавливали прибавлением “стоп” раствора (50 мкл/лунке, в наборе) и определяли абсорбцию при 405 нм с 620 нм сравнением на SLT 340 АТТС спектрофотометре для прочтения планшетов. Интенсивность абсорбции обратно пропорциональна концентрации гистамина (выраженной в виде нМ), которую определяют из стандартной кривой для гистамина (из ферментного иммунодиагностического набора, АМАС). Процент полного выделения гистамина вычисляли из данных концентрации гистамина и процент ингибирования вычисляли с помощью 100%-полного выделения гистамина. Результаты приведены на фиг.5.
Резюме и заключение
График зависимости молярного соотношения анти-IgE от процента ингибирования выделения гистамина, индуцируемого пыльцевой аллергией, указывает, что F(ab) форма е26 антитела обладает лучшими свойствами выделения гистамина, индуцируемого пыльцевой аллергией, по сравнению с F(ab) формой е25 антитела. Е26 ингибирует выделение гистамина, индуцируемого пыльцевой аллергией в зависимости от дозы с молярным отношением, равным 44:1 для полумаксимума ингибирования (анти-IgE: RSIgE). Наоборот, е25 ингибирует только выделение гистамина, от между 200:1 до 1550:1 анти-IgE: RSIgE). Величину молярного соотношения для половины максимального ингибирования для кривой е25 определяли от 400:1 до 500:1. Поэтому, основываясь на данных величины молярного соотношения для половины максимального ингибирования, которая является мерой связывающей аффинности молекулы, е26 молекула связывается с RSIgE примерно в 10 раз лучше, чем е25 молекула.
Пример 4
Пример фагового отображения
Введение
Данный пример описывает анти-IgE антитела с улучшенной специфической аффинностью, генерируемые посредством одновалентного фагового отображения и отбора F(ab) фрагментов, полученных из Е25 облагороженного анти-lgE антитела (Presta et al., J. Immunol. 151: 2623 (1993)).
Способы
I. Создание одновалентных F(аb)-фаговых библиотек
Создавали несколько F(ab) библиотек. В качестве исходного вектора е25 вариант, содержащий замещение D32E VL (чтобы исключить IsoAsp изомеризации), сливали с С-концевой областью бактериофага М13g3р с помощью известных приемов, см., например, Bass et al., Proteins 8: 309 (1990). Данная плазмида, которая известна как р426, показана на фиг.10. Сначала F(аb)-фаг “дикого типа” р426 использовали в качестве темплаты для создания библиотек-специфических “стоп” темплатов. Введением стоп-кодонов (ТАА и TGA) исходная молекула превращается в неактивную, тем самым уменьшая теневые (фоновые) эффекты и темплат-специфическое (гибридизационное) смещение в стадиях мутагенеза при создании библиотеки (Lowman, Wells: Methods: Соmр. Methods Enzymol. 3: 205 (1991)). Данные темплаты создавали, применяя одноцепочечный темплат-направленный мутагенез (Kunkel et al., Methods Enzymol. 204: 125 (1991)) с олигонуклеотидами, представленными в табл.10.
Впоследствии эти стоп-темплаты применяли во втором круге мутагенеза, используя перечисленные в табл.11 олигонуклеотиды для генерирования библиотек в каждой из указанных CDR областей. NNS генерирующие кодоны применяли для получения всех двадцати аминокислот в каждой из указанных CDR областей (Основания нуклеотидов обозначены одиночными буквами согласно номенклатуре IUPAC; N=A, G, С или Т; S=G или С). NNS генерирующие кодоны применяли для получения всех двадцати аминокислот в каждом произвольно выбранном положении, применяя 32 различных возможных кодона. Амбер-стоп кодон (TAG) кодирует Gln в используемой здесь супрессорной системе; т.е. supE супрессорный штамм XL-1 Blue (голубой); Bullock et al., Biotecniques 5: 376 (1987). Наличие амбер-кодона между областью тяжелой цепи антитела и g3р областью на фаге позволяет экспрессию фаг-обнаруженного слитого протеина только в амбер-супрессорных штаммах E.coli, в то время как растворимый F(ab) протеин такой же конструкции можно получить в несупрессорных штаммах E.coli (Lowman, et al., Biochemistry 30:10832 (1991); Lowman and Wells, Methods Comp. Methods Enzymol. 3: 205 (1991); Hoogenboom et al., Nucl. Acids Res. 19: 4133 (1991)). Однако специалистам известны другие стоп-кодоны для использования в других Е. coli фаг-экспрессирующих системах.
Продукты произвольных реакций мутагенеза трансформировали в клетки E.coli (Stratagene, XL-1 Blue) электропорацией и амплифицировали культивированием в течение ночи при 37°С М13К07 фаг-помощником (Vierra and Messing, Methods Enzymol. 153: (1987)).


II. Фаг-связывающие селекции
Для отборов по аффинности фаговых корпускул, обнаруживающих F(ab) варианты, фаги получали с помощью осаждения хлористым натрием/полиэтиленгликолем (NaCl/PEG) супернатантов культуры E.coli. Фаги суспендировали в PBS буфере, затем разбавляли в сыворотке лошади (catalog no. A-3311-D, Hyclone, Logan UT), содержащей 0,05% Tween™-20 (Твина-20), а также необнаруживающие фаги в качестве отрицательного контроля. В качестве положительного контроля е426 F(аb)-фаг “дикого типа” смешивали с необнаруживающим фагом и подвергали ложным селекциям.
Maxisorp 96-луночные планшеты для культивирования (Nunc) покрывали 2 мкг/мл IgE (IgE человека; Genentech lot #9957-36) в 50 mM натрийкарбонатном буфере, рН 9,6 в течение ночи при 4°С. Далее IgE раствор удаляли и планшеты инкубировали с блокирующим раствором сыворотки лошади (без Tween™-20) 2 часа при комнатной температуре.
Блокирующий раствор удаляли и фаговый раствор инкубировали на планшетах в течение одного часа при комнатной температуре. Затем фаговый раствор удаляли и планшеты промывали 10 раз буфером PBS/Tween™-20 (0,05%). Лунки заполняли PBS/Tween и инкубировали в течение 10 минут, после чего планшеты снова промывали 10 раз.
F(ab)-фaг, оставшийся связанным на планшете, элюировали 20 mM HCl, нейтрализовали буфером Трис-HCl, рН 8 и культивировали с фаг-помощником, как описано выше. Аликвоту фага последовательно разбавляли, смешивали со свежими клетками XL-1 Blue, помещали на соответствующие антибиотические планшеты и подсчитывали количество CFUs (colony-forming units, колониеобразующих единиц) F(аb)-обнаруживающего (карбенициллин-резистетного; CFUa) или необнаруживающего (хлорамфеникол-резистентного CFUc) элюируемого фага. Улучшение (обогащение) (Emut) F(ab)-обнаруживающего по сравнению с необнаруживающим фагом в каждом круге определяли как (CFUa/CFUc) для элюируемого пула, разделив на (CFUa/CFUc) исходный пул. Улучшение (обогащение) для контрольного фага (Ewt) дикого типа вычисляли таким же образом.
Последующие раунды селекции по аффинности проводили, как описано выше, за исключение того, что период инкубации после первых 10 промываний увеличивали в каждом раунде. Для того чтобы сравнить эффективность фаговой селекции от раунда к раунду при увеличивающихся стрингерных условиях, фактор обогащения в каждом раунде нормализовали (упорядочивали) по отношению к фактору обогащение контроля дикого типа. Отношение связывающего обогащения для каждого пула к связывающему обогащению дикого типа (Emut/Ewt) показано на фиг.6. Так как при равновесии большая фракция высокоаффинного варианта должна связываться с IgE планшетом по сравнению с низкоаффинным вариантом, более высокоаффинные варианты должны удаляться более эффективно и поэтому обнаруживать большие относительные улучшения (обогащения). Действительно, VL1 библиотеки последовательно показывали улучшенные относительные обогащения, вплоть до примерно в десять раз большие относительные обогащения, чем дикий тип после 5-6 кругов (раундов) селекции. С помощью данного измерения VL1 библиотеки показывали большее улучшение аффинности по сравнению с диким типом, чем это показывали VH3 библиотеки. Несоразмерность в результатах между двумя сериями CDR библиотек можно отразить большим энергетическим вкладом VL1 к связыванию антигена. Наоборот, VH3 CDR е25 могут уже более точно оптимизироваться для IgE связывания, чем VL1 CDR, таким образом, допуская большее относительное улучшение связывающих взаимодействий, вносимыми VL1, посредством замещений боковой цепи.
ДНК секвенирование показало, что большинство F(аb)-фаговых вариантов из первой VL CDR1 библиотеки (произвольно выбранные положения 27, 28, 29 и 31) сохраняло остаток D30 дикого типа и предпочтительно мутированный Y31G (табл.15, в которой клоны от третьего круга (раунда) обозначены как 212-3.х и клоны от шестого круга (раунда) обозначены 212-6.х). Хотя наблюдали целый ряд замещений в положениях Q27 и S28, один клон, содержащий Q27K и S28P, доминировал в фаговом пуле после шести кругов (раундов) селекции. Данный клон также содержал предпочтительные остатки D30 и G31, предполагая, что данная комбинация боковых цепей может быть оптимальной для IgE-связывания.
Во второй VL CDR1 библиотеке (произвольно выбранные положения 30, 31, 32 и 34) большинство селектантов сохраняли остатки дикого типа в D30 и Е32; только D34 дикого типа наблюдали среди секвенированных клонов. В данной библиотеке наблюдали целый ряд разновидностей остатков в Y31. Наблюдали дополнительную ложную мутацию G33S - в двух клонах 213-6.7 и 213-6.8 (табл.15).
Анализ секвенирования клонов от VH CDR3 библиотеки после трех кругов (раундов) селекции показал, что библиотека в основном сводится в отдельный клон, т.е. 214-3.1, имеющий остатки дикого типа в положениях 101-103, с замещениями Н105Т и H107Y (табл.15).

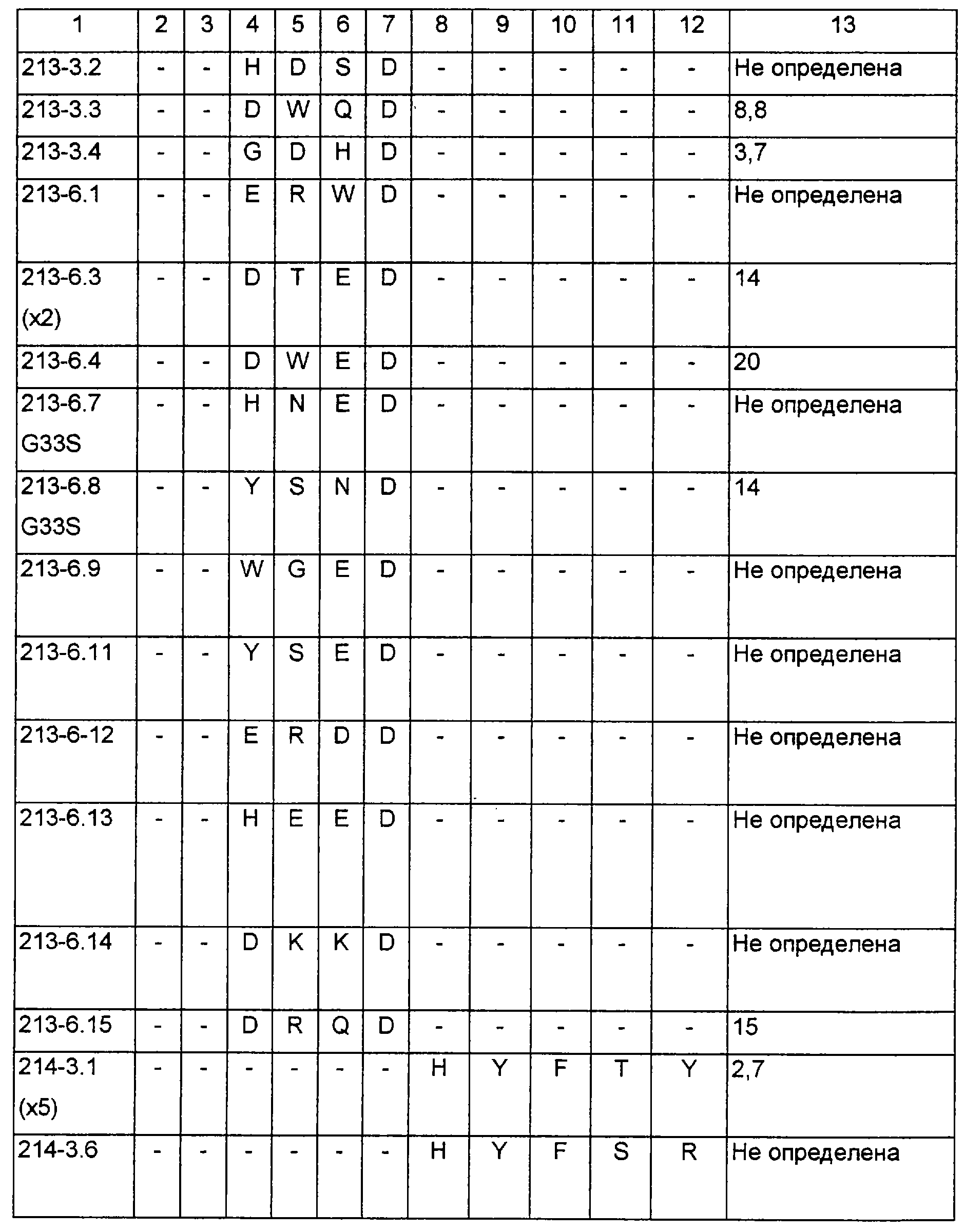
IV Фаг-ELISA анализы выбранных F(ab) клонов
Для оценки результатов фаг-связывающих селекций фаги трансфектировали в E.coli XL-1 Blue клетки и культивировали в суспензионной культуре или помещали на содержащие антибиотик планшеты. Клоны произвольно собирали с этих планшетов для анализа секвенирования и связывания с помощью конкурентного-фаг-ELISA. (Cunningham et al., EMBO J. 13: 2508 (1994); Lowman, Chapter 24, in Methods in Molecular Biology, vol. 87, S. Cabilly (ed.), Humana Press Inc., Totawa, NJ (1997)).
Для оценки относительных IgE связывающих аффинностей фаг титровали на планшете с адсорбированным IgE, как описано выше для нормализации обнаруженных F(ab) концентраций. Фаг предварительно смешивали с серийными растворами IgE, далее прибавляли к IgE-адсорбированному планшету и инкубировали в течение одного часа при комнатной температуре. Затем планшеты промывали 10 раз PBS/Tween и прибавляли раствор антифагового антитела кролика, смешанного с конъюгатом антитела козла или козы против кролика и пероксидазы из хрена. После одночасового инкубирования при комнатной температуре планшеты обрабатывали хромогенным веществом -о-фенилендиамином (Sigma). Реакцию останавливали прибавлением1/2 объема 2,5 М H2SO4. Измеряли оптическую плотность при 490 нм на спектрофотометре для прочтения планшетов. IC50 каждого варианта определяли с помощью подбора 4-параметровой кривой для каждого набора данных (Lowman, Methods in Mol. Biol., supra). Относительную связывающую аффинность каждого клонируемого варианта фага определяли как отношение его IC50 к варианту начального фага, е426 (табл.15-16).
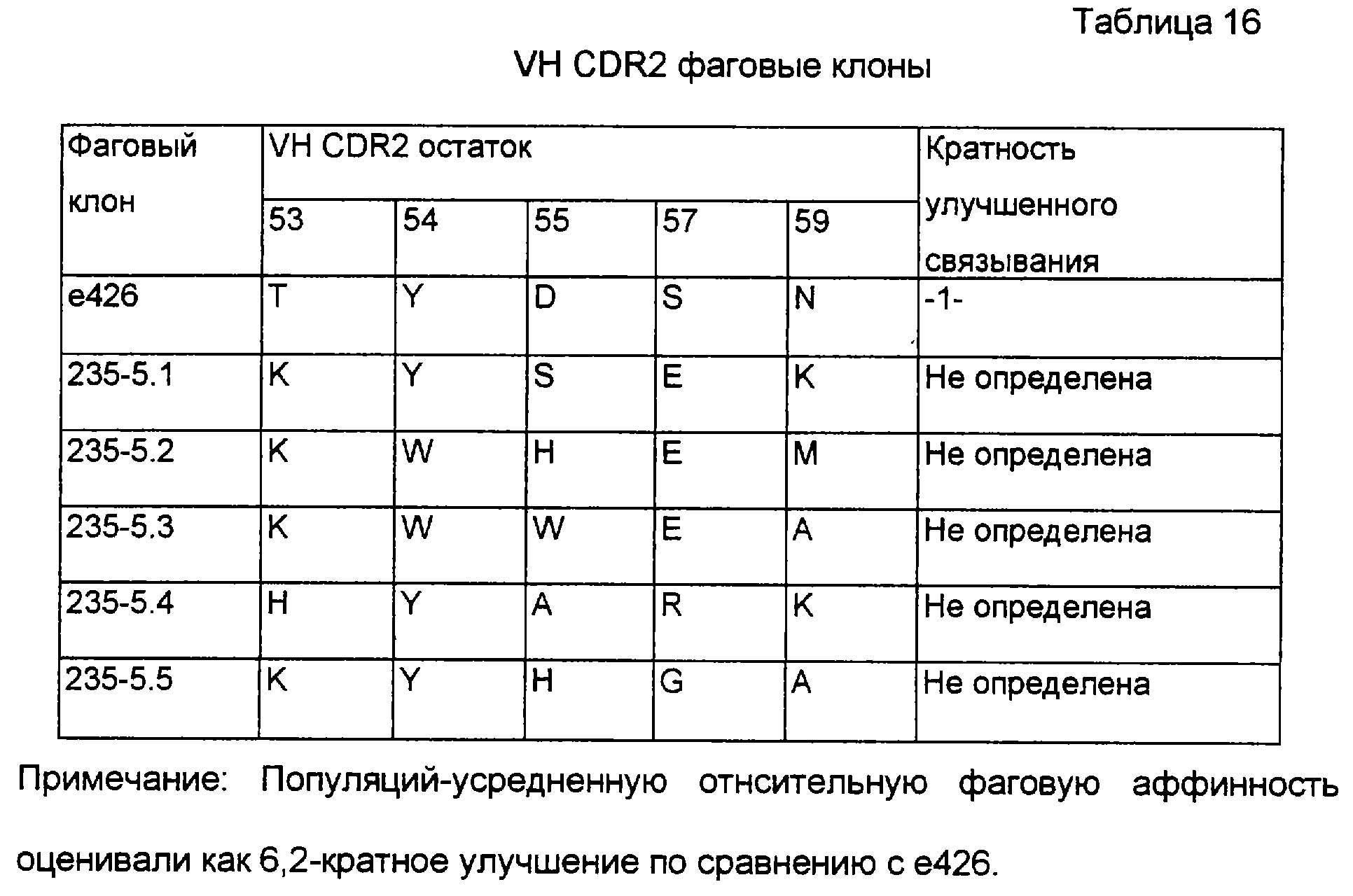
В некоторых случаях фаговые пулы от данного круга (раунда) селекции проверяли en masse для того, чтобы получить оценку средней относительной аффинности популяции [IС50(вес.)/ IС50(мутанта)] для IgE. Например, VL CDRI библиотека, остатки 32, 33, 35 и 37 показывали только 3,6-кратное улучшение аффинности против е426 после 5 кругов (раундов) селекции, хотя родительский вариант данной библиотеки (е26), по-видимому, имел в 25 раз улучшенную аффинность. Поэтому VL-CDR1 библиотеку этих отдельных остатков далее не рассматривали (не продолжали). С другой стороны, VH CDR2 фаговый пул показывал 6,2 кратное улучшение аффинности по сравнению с родительским е426 фагом.
Также создавали фаговые библиотеки CDR областей VL CDR2, остатки 54-57 и VL CDR3, остатки 96-98, 99 и 100. Однако аминокислотным замещениям в этих положениях не удавалось генерировать какое-либо обогащение по сравнению с е426. Фаговую библиотеку генерировали для VH CDR1, остаткам 26-30 также не удавалось генерировать какое-либо улучшение (обогащение) по сравнению с е26, и найдено, что доминировали при контаминации е26-фагом. Это предполагает, что варианты большей аффинности, чем е26 не присутствовали в первоначальных библиотеках.
Фаговые библиотеки CDR областей VL CDR1, остатки 27, 28, 30, 31, 32, 34, а также VH CDR1, остатки 101, 102, 103, 105 и 107 представлены в табл.15, в то время как VH CDR2 представлены в табл.16. В табл.15 и 16 библиотеки клонов, которые не показывали значительно большую аффинность, чем е26, в дальнейшем не рассматривали (не продолжали) и не определяли фактора улучшения связывания.
V. Смешанные (объединенные) мутации из фагового скрининга
Мутации в различных сайтах внутри протеина часто демонстрируют дополнительное влияние на функцию протеина (Wells, Biochemistry 29: 8509 (1990)). Поэтому несколько мутаций из первоначальных фаговых библиотек, описанных выше, объединяли для улучшения связывания с IgE.
Для того чтобы уменьшить вероятность увеличения иммуногенности анти-IgE антитела, необходимо минимизировать степень мутаций от Е-25. В результате, если измеряли независимо, использовали только мутации из фаговых вариантов, которые обнаруживали наибольшее улучшение аффинности. Кроме того, частота, с которой наблюдали данный фаговый клон, может быть связана с уровнем экспрессии и/или протеолитической стабильности (Lowman and Wells, supra (1991)). Выбирали один определенный клон из VL1 библиотеки 212-6.7 - переименованный е26, поскольку проявлял аффинность, в 25 раз улучшенную по сравнению с е426 в фаг-ELISA анализах (табл.17).
VH CDR2 библиотека также показывала улучшение аффинности по сравнению с е426, хотя это улучшение, только в 6,2 раза большее по сравнению с собранным фагом. Аффинность собранного фага демонстрировала улучшенную связывающую аффинность для, по крайней мере, нескольких членов пула, не измеряя аффинности всех отдельных членов. Использование собранного фага также позволяет идентифицировать, какое увеличение аффинности было достигнуто после данного круга (раунда) и должны ли продолжаться отборы по аффинности (т.е. если пул аффинности достиг максимума, последующие круги (раунды) вряд ли дадут дополнительное улучшение (обогащение)). Как таковое использование данных собранной аффинности является очень полезным инструментом скрининга (проверки, тестирования).
Очевидно, что мутации в VH CDR2 области могут действовать аддитивно с мутациями в VL CDR1, поскольку VH CDR2 петлевой фрагмент находится на расстоянии от VH CDR1 петлевого фрагмента и в кристаллической структуре, и в молекулярной модели. Однако, поскольку некоторые комбинации этих мутаций могут, тем не менее, быть несовместимыми, мы исследовали четыре разных смешанных мутанта: е26 смешанный (объединенный) с мутациями, имеющимися в клонах 235-5.1, 235-5.2, 235-5.3 и 235-5.4 (табл.17). Данные конструкции создавали с помощью мутагенеза Кюнкеля (Kunkel et al., Methods Enzymol. 204: 125 (1991)), применяя е26 F(аb)-фаг в качестве темплаты с мутагенными олигонуклеотидами, кодирующими VH2 мутации.
Фаг-ELISA анализы (Lowman, Methods in Molecular Biology, vol. 87, Cabilly (ed), Humana Pres Inc., Totawa, N.J. (1997)) использовали для сравнения конечных вариантов от смешанных VL CDR1 мутаций в е26 с VH CDR2 мутациями в клонах 235-5.1; 235-5.2; 235-5.3 и 235-5.4. Растворимые F(ab) протеины также получали и сравнивали по анализу биотин-IgЕ-планшета, представленного ниже в табл.17 и на фиг.7.

VI. Биотин-планшетный анализ (конкурентный анализ FcεRI-IqG химеры)
Введение: цель данного примера заключается в сравнении, как различные анти-IgE F(ab)s конкурируют с иммобилизованной IgG химерой высокоаффинного IgE рецептора за связывание с биотинилированным IgE человека в жидкой фазе, когда анти-IgE F(ab) и биотин-IgE прибавляли одновременно к планшету с адсорбированной химерой IgE рецептора. Поскольку концентрация анти-IgE F(ab) увеличивается, количество биотинилированного IgE, который может связываться с рецептором на планшете, уменьшается, приводя к более низкой величине оптической плотности, измеренной с помощью спектрофотометра.
Nunc maxisorp планшеты (catalog no. F96) покрывали (адсорбировали) 100 нг/лунке FcεR-l-IgG (Haak-Frendsho et al., J. Immunol. 151: 352 (1993)), (Genentech, lot #2148-74) (6,4 мг/мл) добавлением 100 мкл с концентрацией 1 мкг/мл исходного раствора антител в 50 нМ натрийкарбонатного буфера (рН 9,6) в течение от 12 до 24 часов при 4°С. Планшеты промывали три раза ELISA промывным буфером (0,05% полисорбат 20 (Sigma) в PBS (рН 7,4)) и блокировали инкубацией с 200 мкл буфера для ELISA (трис-забуференный физиологический раствор, рН 4,45 с 0,5% RIA степени чистоты бычьего сывороточного альбумина (Sigma); 0,05% полисорбата 20 и 4 mM EDTA) в течение 60 минут. После трех промываний промывным буфером трижды прибавляли 100 мкл серийных в 2 раза разбавленных анти-IgE F(ab)s в буфере для проведения анализа с начальной концентрацией 200 нМ к ELISA планшету. Разбавления проводили многоканальной пипеткой Titertek®. Биотинилированный IgE в буфере для анализа (100 мкл, 1:500 разбавленный 0,5 мг/мл исходный раствор) прибавляли во все лунки и смесь инкубировали в миниорбитальном шейкере (Bellco) в течение 60 минут при 25°С. IgE очищали с помощью аффинной хроматографии от супернатанта U266B1 миеломной (АТСС TIB 196) культуры и биотинилировали с примененим биоцитингидразида (O'Shannessy et al., Immunol. Lett. 8: 273 (1984); Pierce Chemical). Образцы промывали пять раз с помощью промывного буфера и связанный IgE обнаруживали с помощью 100 мкл пероксидаза-конъюгированного стрептавидина (Zymed) при разбавлении 1:3000 в течение 90 минут. Образец далее снова промывали шесть раз промывным буфером, за которым следовало прибавление 100 мкл субстратного раствора (400 мкл/мл о-фенилендиамина дигидрохлорида и 4 mM H2O2 в PBS) и инкубировали 6 минут.
Далее реакцию останавливали 4,5 М H2SO4 (100 мкл) и измеряли абсорбцию при 490 нм на спектрофотометре для прочтения планшетов Uvmax (Molecular Devices). Абсорбция при различных величинах F(ab) концентраций е25, е26 и е27 F(ab) фрагментов антитела изображена на фиг.8.
Заключение: Кривые на фиг.8 указывают, что Е26 и Е27 имеют большую аффинность, чем Е25 к высокоаффинному рецептору, и что Е27 показывал наибольшую аффинность.
VII. BIAcore анализы растворимых F(ab) протеинов
Рецепторсвязывающие аффинности нескольких F(ab) фрагментов вычисляли (Lofas and Johnson, J. Chem. Soc. Commun. 21: 1526-1528 (1990)) из констант скоростей ассоциации и диссоциации, измеренных с помощью BIAcore ТМ-2000 резонансной системы поверхностного плазмона (BIAcore, Inc.). Биосенсорный чип активировали для ковалентного связывания IgE, используя гидрохлорид N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимид (NHS) согласно инструкциям производителей (BIAcore). IgE разбавляли в 10 нМ буфера ацетата натрия (рН 4,5), который дополнительно разбавляли до примерно 30 мкг/мл и вводили с помощью инъекции через чип для получения сигнала от 800 до 12400 единиц аллергической реакции (RU) иммобилизованного вещества. Так как сигнал в RU пропорционален массе иммобилизованного вещества, это означает, что диапазон плотностей иммобилизованного IgE на матрице примерно от 0,4 до 6,5 пкмоль/см2. Наконец, вводили 1М этаноламина в качестве блокирующего агента. Регенерацию проводили с 4,5 М MgCl2.
Для кинетических измерений 1,5 серийные разведения F(ab) фрагментов антитела вводили через IgE чип в PBS/Tween буфере (0,05% Tween-20 в фосфат забуференном физиологическом растворе) при 25°С, при скорости потока 20 мкл/мин (фиг.9).
Данные диссоциации соответствовали односайтовой модели для получения koff±s.d. (стандартное отклонение измерений). Константу скорости псевдопервого порядка (ks) вычисляли для каждой кривой ассоциации и изображали как функцию концентрации протеина для получения kon±s.d.e. (стандартная ошибка допуска). Равновесные константы диссоциации для F(ab):IgE связывания, kd's вычисляли из SPR измерений в виде koff/kon. В отсутствие экспериментальных артефактов, таких как повторное связывание диссоциированных F(ab), наблюдаемая koff не зависит от концентрации F(ab). Также, поскольку равновесная константа диссоциации kd, обратно пропорциональна koff, оценку улучшения аффинности можно сделать, принимая, что скорость ассоциации (kon) постоянна для всех вариантов. koff наряду с вычисленным временем полураспада приведены в табл.18.
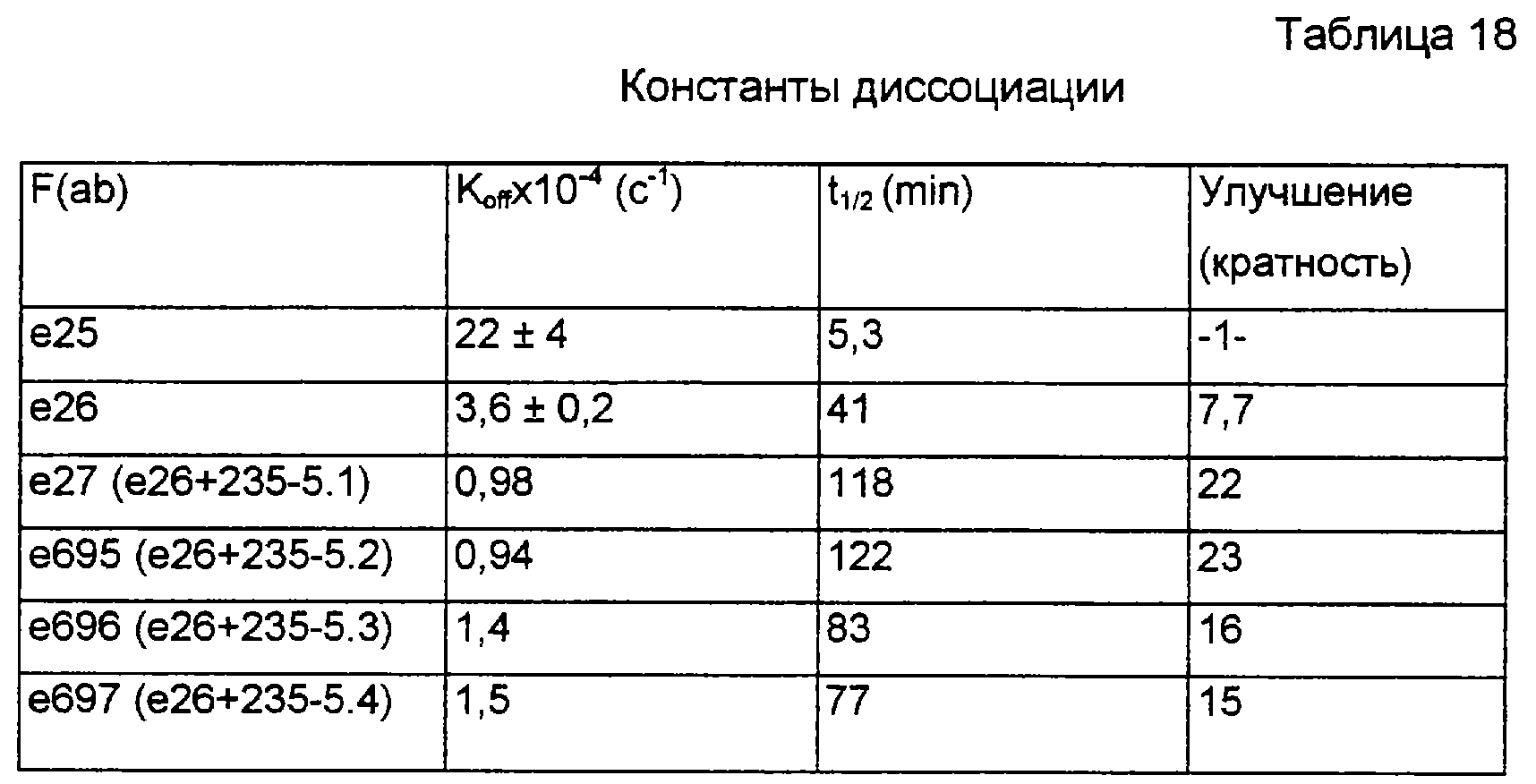
VIII. Экспрессия и очистка F(ab)
Анти-IgE F(ab) E-25 (Presta et al, J. Immunol. 151: 2623-2632 (1993)) и варианты в фагемидах, полученных из р426 (фиг.10), экспрессировали в штамме 34В8 Е. соli, Toothpick культуры (10 мл) в 2YT среде с 50 мкг/мл карбенициллина инкубировали 8 часов при 37°С и далее переносили в 1 литр модифицированной АР-5, содержащей 50 мкг/мл карбенициллина и инкубировали в течение 24 часов при 37°С. Культуры центрифугировали в 500 мл флаконах при 7000 об/мин в течение 15 минут при 4°С. Осадок после центрифугирования замораживали в течение, по крайней мере, 3 часов при 20°С. Каждые 500 мл осадка после центрифугирования суспендировали в 12,5 мл холодного раствора 25% сахарозы в 50 mM трис-буфере рН 8,0, содержащем 1 mM бензамидина (Sigma) при 4°С. Суспензию солюбилизировали при перемешивании при 4°С в течение 3 часов. Суспензию центрифугировали при 18000 об/мин в течение 15 минут при 4°С и F(ab)s, экспрессируемые в супернатанте, очищали с помощью аффинной хроматографии на протеине G (Pharmacia). Колонку промывали раствором 10 mM Tris (рН 7,6) и 1 mM EDTA (рН 8,0) и F(ab)s элюировали 100 mM уксусной кислотой (рН 3,0), объем которой равен 2,5 объемам колонки, и сразу же нейтрализовали до нейтрального значения рН 0,5 объемами 1М трис рН 8,0. Элюаты концентрировали и буфер заменяли на PBS с помощью centricon 30 микроконцентраторов (Amicon). Концентрацию протеина определяли абсорбцией на 280 нМ с помощью спектрофотометра (Beckman DU 64) и чистоту образца оценивали с использованием 4-20% SDS PAGE гелей (Novex) в восстановительной среде с 5% β-меркантоэтанола.
IX. Результаты и заключение
Результаты фаг-ELISA конкурентных опытов показывают, что в то время как е26 F(аb)-фаг примерно в 9 раз улучшает аффинность по сравнению с е426, комбинационные варианты е695, е696 и е697 в 20-40 раз улучшены по сравнению с е426-фагом. Дополнительные комбинации фаг-полученных мутаций могут дать варианты антитела с аналогично улучшенными аффинностями.
Когда F(ab) растворимые протеины исследовали в биотин-IgE планшетном анализе, е26 F(ab) и е27 F(ab) улучшались примерно в 10 раз и 30 раз соответственно по сравнению с е25, что касается ингибирования IgE связывания FCeRI-IgG. Koff определение с помощью BIAcore анализа подтверждает эти относительные аффинности. В частности, е26 и е27 показали в 7,7 раз и 22 раза меньшую Koff, чем е25. Большее время полужизни означает, что IgE “занят” или оказывает помощь вариантам, неспособным к связыванию с высокоаффинным рецептором в течение более длительного периода, таким образом приводя к увеличению терапевтической эффективности анти-IgE.
Таким образом, данные равновесного и кинетического связывания подтверждают заключение о том, что е26 и е27 F(ab)2 связывают IgE примерно в 10-раз и 30 раз сильнее соответственно, чем е25. Предполагают, что антитела полной длины (IgGs), содержащие соответствующие F(ab) мутации, демонстрируют аналогичные относительные аффинности к е25 IgG.


















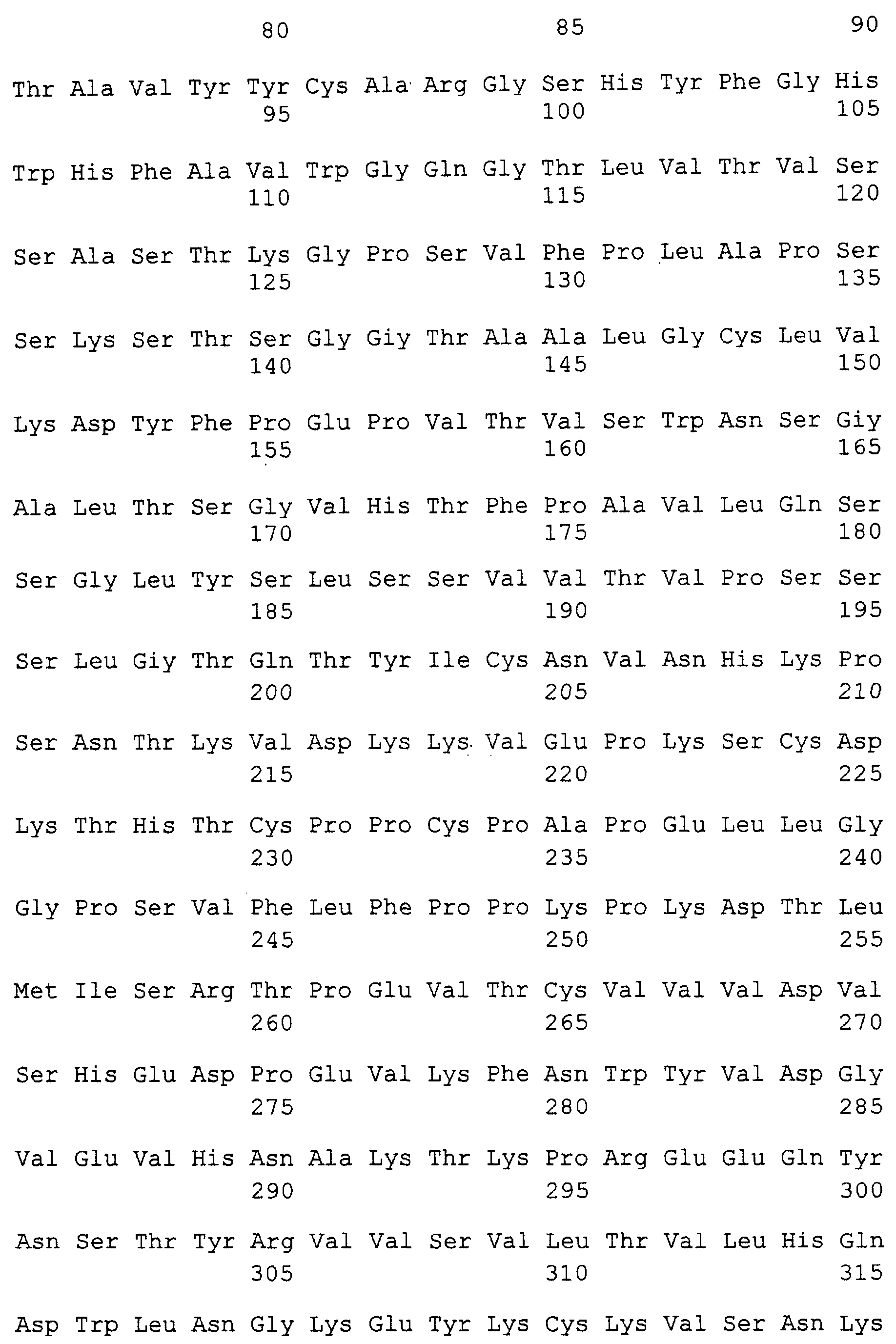












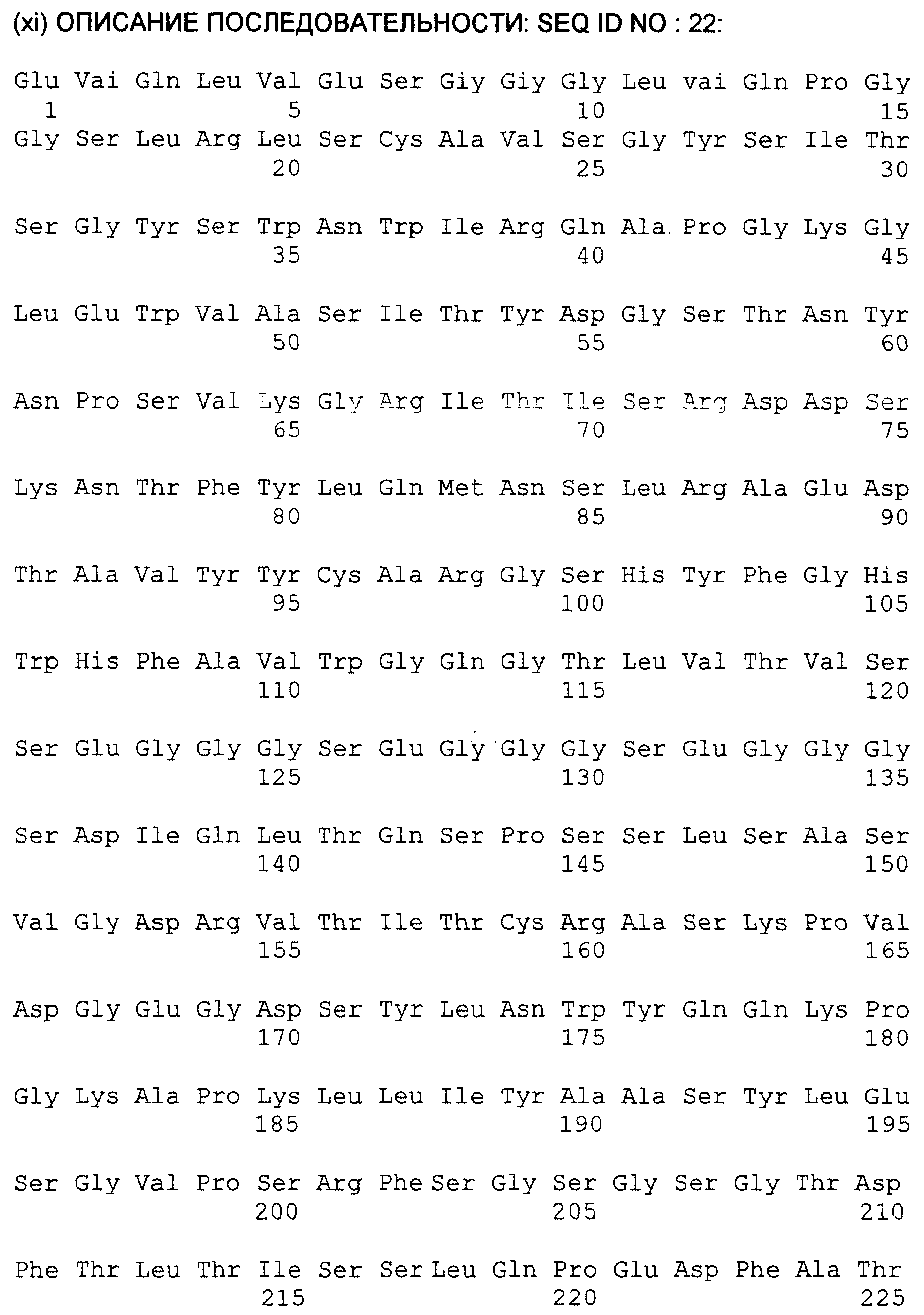





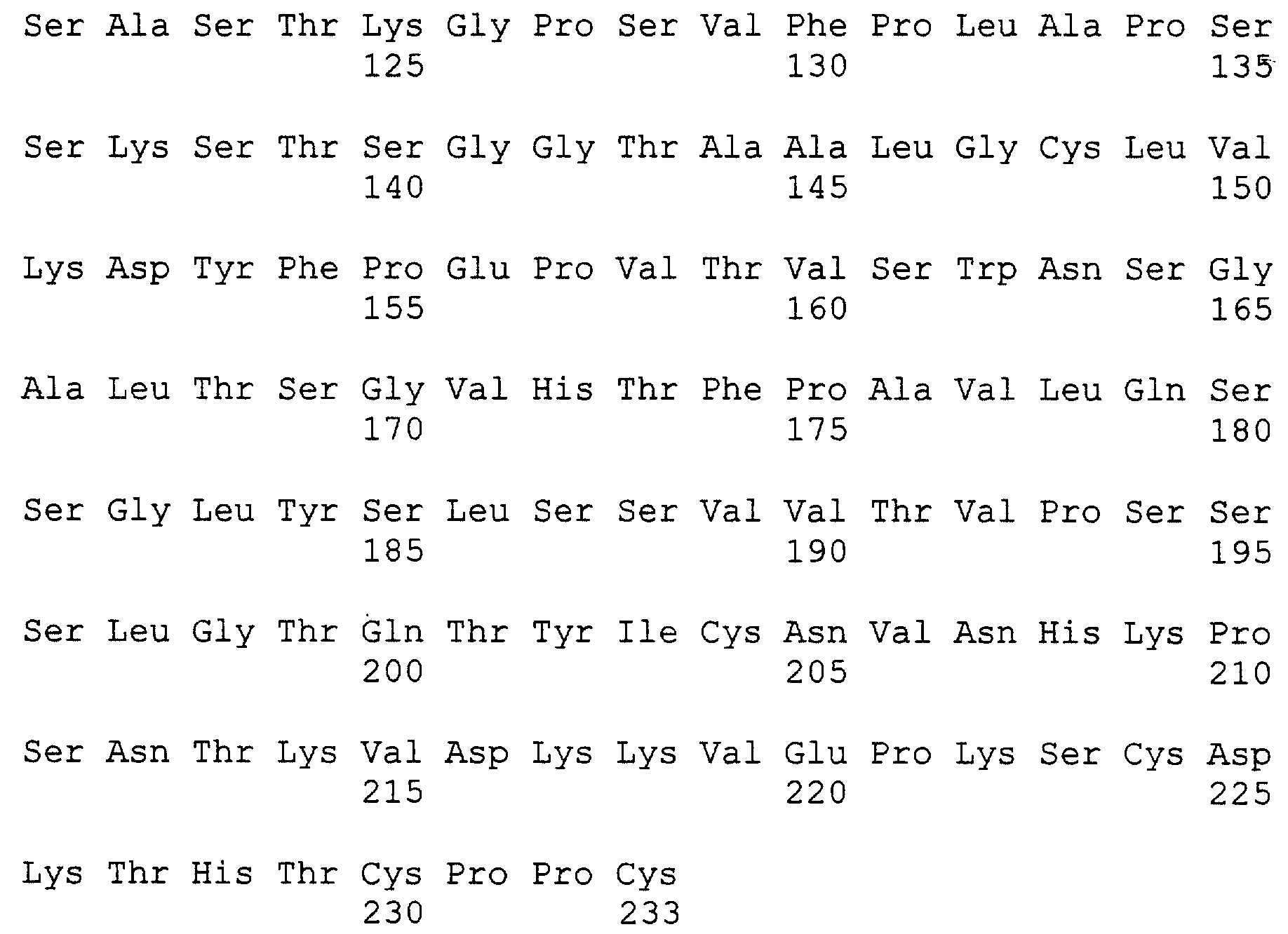
Реферат
Изобретение относится к биотехнологии, в частности к иммуноглобулину Е (IgE), IgE-антагонистам, анти-IgE антителам, способным к связыванию с IgE человека, и к способу улучшения полипептидов, включая анти-IgE антитела. Данное изобретение позволяет получить улучшенные полипептиды, включая антитела, которые не только не проявляют “дезактивирования” при изомеризации аспартила, но также проявляют сродство к молекуле-мишени, например антигену. 11 н. и 5 з.п. ф-лы, 15 ил., 19 табл.

Комментарии