Способ получения трансгенных птиц с использованием эмбриональных стволовых клеток - RU2473688C2
Код документа: RU2473688C2
Чертежи












Описание
Настоящее изобретение относится к биотехнологии птиц и, особенно, к способу получения трансгенных птиц. Изобретение особенно полезно для создания трансгенных птиц, продуцирующих большое количество интересующего рекомбинантного белка в яйце.
Имея более чем 400 биомолекул в стадии клинической разработки и рынка на более чем 30 миллиардов долларов, область терапевтики показала ускоренный рост за прошлые пятнадцать лет. Большинство рекомбинантных белков требует специфичных посттрансляционных модификаций для полноценной биологической активности и, таким образом, они должны производиться в клетках млекопитающего, выращенных в крупномасштабных биореакторах. Стоимость, связанная с такой системой получения, объединенная с важными количественными потребностями, обуславливает увеличение задержек всего процесса разработки нового продукта. В этом контексте трансгенные животные могут представлять собой экономически выгодную альтернативу, особенно если модификация могла бы быть передана к потомству через клетки зародышевой линии.
В то время как кролики, козы и коровы представляют большой интерес, курицу долго рассматривали как самую выгодную биологическую систему получения для быстрого и рентабельного получения рекомбинантных терапевтических белков в куриных яйцах. Возможности кур по откладыванию яиц действительно замечательны, так как курица для продажи откладывает приблизительно 250 яиц в год, при этом каждое яйцо содержит почти 4 грамма яичных белков. Если только 100 мг рекомбинантных белков должны были бы быть получены в яйце, небольшая стая из 1000 куриц, таким образом, была бы способна произвести 25 кг неочищенных рекомбинантных белков в год. Кроме того, коммерческая яичная промышленность уже высоко автоматизирована, и органы надзора спокойны в отношении полученных из яиц продуктов, так как за десятилетия много человеческих вакцин произведены в куриных яйцах.
Аналогично, в производстве домашней птицы также может быть интерес в использовании переноса генов для ускоренной селекции генетических признаков, имеющих коммерческий интерес (то есть "технология мета-клонирования"). Идея состояла бы в том, чтобы обойти классическую схему селекции: [Родословная->пра-прародители->прародители->родители], чтобы получить за более короткое время требуемого птенца. Наиболее вероятное использование трансгенной техники в получении домашней птицы могло бы заключаться в передаче устойчивости к болезни, что является общей практикой для трансгенных растений, или улучшении усвоения пищи. Кроме того, трансгенная техника могла быть стратегией сохранения генетических ресурсов птиц. Пока разделение в различные места племенных животных, самых ценных животных в производстве домашней птицы, является единственным способом предотвратить потерю лет селекционных программ в случае возникновения проблем (например, вирусные инфекции) у размножающихся особей. Такой подход является дорогим и не является гарантией от национальных санитарных решений, предписывающих профилактическое устранение всей местной домашней птицы, чтобы проверить вирусную инфекцию, как в Нидерландах в 2003 году.
Создание модифицированного животного подразумевает сначала стабильное введение трансгена в геном животного. Различные техники для введения ДНК, исследованные за предшествующие 25 лет: (i) микроинъекция ДНК, (ii) вирусная трансдукция, (iii) передача гена через сперму, (iv) ядерный перенос, основанный на клетках перенос с использованием (v) первичных зародышевых клеток, или (vi) зародышевых стволовых клеток. Для птенца только подход микроинъекции ДНК (Love et al, 1994 Biotechnology 12:60-63) и вирусная трансдукция (Bosselman et al, 1990 J. Reprod. FertlL. Suppl. 41: 183-195) были признаны для наследуемой передачи трансгена. Однако эти две техники имеют несколько недостатков; они являются громоздкими и трудными и имеют низкую эффективность, частично из-за случайной интеграции и глушения трансгена. У техники вирусной трансдукции есть дополнительное ограничение по размеру трансгена, который будет включен в вирусный вектор. Эти две техники не позволяли на сегодня достигать уровня экспрессии белка, сходного с коммерческими разработками.
Инъекции в развивающийся эмбрион птенца первичных зародышевых клеток (ПЗК) или зародышевых стволовых клеток (ES), ранее in vitro генетически сконструированных, являются среди многообещающих техник переноса генов у птиц особенными, потому что эти техники позволяют достичь интеграции целевого трансгена в специфичные сайты в пределах генома, что должно позволить достичь высокую экспрессию трансгена. Однако, чтобы использовать этот подход для получения трансгенных птенцов, должна быть выполнена важная предпосылка: клетки должны остаться живыми во время манипуляций in vitro, в то время все еще поддерживая их способность включаться в реципиентный эмбрион, чтобы создать совокупность клеток зародышевой линии и затем передать модификацию потомству.
В прошлом было сделано много попыток, чтобы преодолеть различные технические препятствия на каждой стадии способа и сегодня соматические и наследуемые химеры получены инъекцией недавно изолированных клеток бластодермы, выделенных из неинкубированных эмбрионов, в подзародышевую полость недавно отложенных эмбрионов. Вклад клеток донора и реципиента был оценен в (i) популяции меланоцитов посредством анализа черно-белого пигментирования (полосатые плимутроки или коричневые леггорны имеют рецессивную аллель в локусе I, в то время как белые леггорны имеют доминантную аллель в локусе I); (ii) популяции эритроцитов посредством анализа ДНК-фингерпринтинг; (iii) гонадах посредством исследования потомства с полученным от донора фенотипом (Petitte et al, 1990 Development 108:185-189; Carsience et al, 1993 Development 117:669-675; Thoraval et al, 1994 Poultry Science 73:1897-1905; Pain et al, 1996 Development 122:2339-2348). Химера, имеющая вклад как в соматические ткани, так и в зародышевую линию, наблюдалась, когда клетки бластодермы были введены после от 48 часов (Etches et al, 1996 Mol. Reprod. Dev. 45:291-288) до 7 дней культуры (Pain et al, 1996). Etches и соавторы в 1996 году продемонстрировали, что значительно больше соматических химер наблюдалось после инъекции клеток, совместно культивируемых с фибробластами мыши. Pain и соавторы (1996) засевали птичьи клетки бластодермы на линию клеток фибробласты мыши STO. Статус ES клеток, поддерживаемых в культуре, давал экспрессию ЕСМА-7 и SSEA-1 эпитопов и теломеразную активность (Pain et al, 1996). Пролиферация в отсутствие дифференцировки клеток бластодермы стимулировалась наличием ингибирующего лейкемию фактора (LIF) и других факторов, IL-11, SCF, bFGF, IGF-1 и дифференцировка замедлялась выдерживанием с моноклональным антителом к ретиноевой кислоте (Pain et al, 1996). Было показано, что колонизация эмбриона полученными от донора клетками облегчалась, когда реципиентный эмбрион подвергался действию радиации до инъекции донорских клеток (Carsience et al, 1993).
Однако клетки бластодермы, поддерживаемые в культуре, давали меньшее количество химер, что показывает уменьшенный вклад в соматические ткани, по сравнению с частотой и степенью соматических химер, наблюдаемых после инъекции недавно полученных клеток. Кроме того, даже в этом случае было продемонстрировано, что каждая из составляющих частей стратегии основанного на клетках трансгенеза птиц могла быть достигнута; ни одно трансгенное животное, которое было бы получено с использованием техники ES клеток, не было описано.
Остается потребность в эффективных способах создания трансгенных кур. Это является целью настоящего изобретения.
Для достижения этой цели и в соответствии с назначением изобретения, как реализовано и подробно описано здесь, настоящее изобретение представляет собой способ культивирования зародышевых стволовых клеток (ES) птиц, включающий стадии: а) суспендирования клеток ES, происходящих от диска бластодермы оплодотворенного, предпочтительно неинкубированного, птичьего яйца (яиц), в основной культуральной среде, дополненной:
- инсулиноподобным фактором роста 1 (IGF-1) и/или реснитчатым нейротрофическим фактором (CNTF); и
- возможно, по меньшей мере одним фактором роста, выбранным из группы, включающей интерлейкин 6 (IL-6), рецептор интерлейкина 6 (IL-6R), фактор стволовых клеток (SCF), фактор роста фибробластов (FGF), ингибирующий лейкемию фактор (LIF), интерлейкин 11 (IL-11), онкостатин и кардиотрофин; и
- животной сывороткой;
b) засевания суспензии клеток ES, полученных на стадии а), на слой питающих клеток и дальнейшего культивирования клеток ES в течение по меньшей мере от 2 до 10 пассажей, предпочтительно от 2 до 20 пассажей;
c) возможно удаления по меньшей мере одного фактора роста, выбранного из SCF, FGF, IL-6, IL-6R, LIF, онкостатина, кардиотрофина и IL-11 из культуральной среды;
d) дальнейшего культивирования клеток ES в питательной среде стадии с) на слое питающих клеток.
В предпочтительном варианте изобретения способ культивирования зародышевых стволовых клеток (ES) птиц по изобретению включает стадии:
a) суспендирования клеток ES, происходящих от диска бластодермы оплодотворенного, предпочтительно неинкубированного, птичьего яйца (яиц), в основной культуральной среде, дополненной инсулиноподобным фактором роста 1 (IGF-1), реснитчатым нейротрофическим фактором (CNTF), интерлейкином 6 (IL-6), рецептором интерлейкина 6 (IL-6R), фактором стволовых клеток (SCF), фактором роста фибробластов (FGF) и животной сывороткой;
b) засевания суспензии клеток ES, полученной на стадии а) на слой питающих клеток и дальнейшего культивирования клеток ES в течение по меньшей мере от 2 до 10 пассажей, предпочтительно от 2 до 20 пассажей;
c) возможно удаление по меньшей мере одного фактора роста, выбранного из группы, включающей SCF, FGF, IL-6 и IL-6R из культуральной среды, и, предпочтительно, удаление факторов роста SCF, FGF, IL-6 и IL-6R из культуральной среды;
d) дальнейшего культивирования клеток ES в питательной среде стадии с) на слое питающих клеток.
В другом предпочтительном варианте изобретения способ культивирования зародышевых стволовых клеток (ES) птиц по изобретению включает стадии:
a) суспендирования клеток ES, происходящих от диска бластодермы оплодотворенного, предпочтительно неинкубированного птичьего яйца (яиц), в основной культуральной среде, дополненной инсулиноподобным фактором роста 1 (IGF-1), реснитчатым нейротрофическим фактором (CNTF), интерлейкином 6 (IL-6), рецептором интерлейкина 6 (IL-6R), фактором стволовых клеток (SCF), фактором роста фибробластов (FGF) и животной сывороткой;
b) засевания суспензии клеток ES, полученных на стадии а), на слой питающих клеток и дальнейшего культивирования клеток ES в течение по меньшей мере от 2 до 10 пассажей;
c) возможно удаления по меньшей мере одного фактора роста, выбранного из группы, включающей SCF и FGF, из культуральной среды; и предпочтительно удаления обоих факторов роста SCF и FGF из культуральной среды;
d) дальнейшего культивирования клеток ES в питательной среде стадии с) на слое питающих клеток.
Необязательную стадию с) способа по изобретению выполняют, когда признаки летальности и/или дифференцировки клеток ES наблюдаются в культуре. Примерами признаков дифференцировки являются, например, морфологические изменения клеток к типичному морфологическому типу, такому как, например, тип эпителиальных клеток или тип фибробластов. Другой пример дифференцировки может быть отсутствие или уменьшение экспрессии маркерных генов клеток ES, таких как теломераза, щелочная фосфатаза, антиген SSEA-1, которые являются маркерными генами клеток ES.
В более предпочтительном варианте изобретения способ культивирования зародышевых стволовых клеток (ES) птиц по изобретению включает стадии:
а) суспендирования клеток ES, происходящих от диска бластодермы оплодотворенного, предпочтительно неинкубированного птичьего яйца (яиц), в основной культуральной среде, дополненной по меньшей мере инсулиноподобным фактором роста 1 (IGF-1), реснитчатым нейротрофическим фактором (CNTF), интерлейкином 6 (IL-6), рецептором интерлейкина 6 (IL-6R), фактором стволовых клеток (SCF), фактором роста фибробластов (FGF) и животной сывороткой;
b) засевания суспензии клеток ES, полученных на стадии а), на слое питающих клеток и дальнейшего культивирования клеток ES в питательной среде стадии а).
В другом более предпочтительном варианте изобретения способ культивирования зародышевых стволовых клеток (ES) птиц по изобретению включает стадии:
a) суспендирования клеток ES, происходящих от диска бластодермы оплодотворенного неинкубированного птичьего яйца (яиц), в основной культуральной среде, дополненной по меньшей мере инсулиноподобным фактором роста 1 (IGF-1), реснитчатым нейротрофическим фактором (CNTF), интерлейкином 6 (IL-6), рецептором интерлейкина 6 (IL-6R) и животной сывороткой;
b) засевания суспензии клеток ES, полученных на стадии а), на слой питающих клеток и дальнейшего культивирования клеток ES в питательной среде стадии а).
В другом более предпочтительном варианте изобретения способ культивирования зародышевых стволовых клеток (ES) птиц по изобретению включает стадии:
a) суспендирования клеток ES, происходящих от диска бластодермы оплодотворенного неинкубированного птичьего яйца (яиц), в основной культуральной среде, дополненной по меньшей мере инсулиноподобным фактором роста 1 (IGF-1), реснитчатым нейротрофическим фактором (CNTF) и животной сывороткой;
b) засевания суспензии клеток ES, полученных на стадии а), на слой питающих клеток и дальнейшего культивирования клеток ES в питательной среде стадии а).
Термин "птица", как используется здесь, предназначен для обозначения любых видов, подвидов или пород организмов таксономического класса "птицы", таких как, но не ограничен ими, курица, индейка, утка, гусь, перепела, фазаны, попугаи, зяблики, ястребы, вороны, страус, страус эму и австралийский страус. Термин "птичий", "птица" или "птицы", как используется здесь, имеет то же самое значение и будет использован неотчетливо. В предпочтительном варианте изобретения "птицы" обозначают любое животное таксономического порядка:
- "Anseriformes" (то есть утка, гусь, лебедь и родственные виды). Порядок Anseriformes включает приблизительно 150 видов птиц в трех семействах: Anhimidae (крикуны), Anseranatidae (полулапчатый гусь) и Anatidae, который включает свыше 140 видов водоплавающих птиц, среди которых утки, гуси и лебеди. Все виды в порядке высоко адаптированы для водного существования на водной поверхности. Все из них являются водоплавающими с эффективным плаванием (хотя некоторые впоследствии стали главным образом сухопутными). Термин включает различные породы уток, например пекинская утка и московская утка.
- "Galliformes" (то есть курица, перепела, индейка, фазан и родственные виды). Galliformes - порядок птиц, включающий кур, индюков, перепелов и фазанов. Приблизительно 256 видов найдены по всему миру. Термин включает различные породы Gallus gallus, или кур, например S86N, Valo, белый леггорн, коричневый леггорн, суссекские, нью-хэмпшир, род-айленд, австралорп, минорка, амрокс, Калифорнийская серая, восточный лансинг, итальянская куропатчатая, Маран, полосатый плимутрок, голошейная (Сои Nu Rouge; CNR), GF30, ISA, а также породы индюков, фазанов, перепелов и другой домашней птицы, обычно выращиваемой.
- "Columbiformes" (то есть голубь и родственные виды). Порядок птиц Columbiformes включает очень широко распространенных горлиц и голубей.
В предпочтительном варианте изобретения птичья клетка по настоящему изобретению представляет собой куриную клетку. Курица предпочтительно выбрана из группы пород кур, включающей S86N, Valo, белый леггорн, коричневый леггорн, суссекские, нью-хэмпшир, род-айленд, австралорп, минорка, амрокс, Калифорнийская серая, восточный лансинг, итальянская куропатчатая, Маран, полосатый плимутрок, голошейная (Cou Nu Rouge; CNR), GF30, ISA. В более предпочтительном варианте изобретения куриная клетка ES по настоящему изобретению представляет собой клетку породы полосатый плимутрок. В предпочтительном варианте изобретения птичья клетка по настоящему изобретению является клеткой утки. В более предпочтительном варианте изобретения клетка ES утки по настоящему изобретению представляет собой клетку породы пекинской или московской.
Клетки стадии а) являются птичьими зародышевыми стволовыми клетками. Зародышевые стволовые клетки (клетки ES) являются стволовыми клетками, у которых есть типичная особенность, касающаяся того, что их получают из культивируемых частей или всего очень раннего эмбриона (например, стадия бластулы). Эти клетки ES показывают in vitro все характеристики стволовой клетки, a in vivo - уникальную способность, касающуюся помощи в морфогенезе эмбриона и участия в колонизации зародышевой линии, когда они заново имплантированы каким бы то ни было образом в реципиентный эмбрион. Первичные зародышевые клетки (ПЗК), которые являются клетками-предшественниками спермы или клеток-ооцитов, которые развиваются после половой зрелости, являются мультипотентными клетками ES и составляют подтип клеток ES. Предпочтительно, птичьи зародышевые стволовые клетки по изобретению изолированы из диска бластодермы оплодотворенного птичьего яйца (яиц) на стадии развития, представляющей собой стадию между стадиями VI и XII по классификации Эйял-Гилади и Кохава (Eyal-Giladi & Kochav), и более предпочтительно примерно стадию Х по классификации Эйял-Гилади и Кохава (см. классификацию EYAL-GILADI: EYAL-GILADI and KOCHAV, 1976, "From cleavage to primitive streack formation: a complementary normal table and a new look at the first stages of the development in the chick". "General Morphology" Dev. Biol. 49:321-337). В предпочтительном варианте изобретения клетки стадии а) изолированы из недавно отложенных оплодотворенных яиц, то есть на стадии развития, которую называют откладкой яиц. Согласно Sellier et al. (2006, J. Appl. Poult. Res., 15:219-228) откладка яиц соответствует следующим стадиям развития согласно классификации Эйял-Гилади (Eyal-Giladi):
Московская утка: стадия VII
Цесарка: стадия VII-VIII
Индейка: стадия VII-VIII
Пекинская утка: стадия VIII
Курица: стадия Х
Японский перепел: стадия XI
Гусь: стадия XI.
Предпочтительно, зародышевые стволовые клетки (ES) пекинской утки стадии а) получены разъединением эмбриона(ов) в пределах стадии VIII (откладка яиц) по классификации Эйял-Гилади.
Предпочтительно, зародышевые стволовые клетки (ES) московской утки стадии а) получены разъединением эмбриона(ов) в пределах стадии VII (откладка яиц) по классификации Эйял-Гилади.
Предпочтительно, куриные зародышевые стволовые клетки (ES) стадии а) получены разъединением эмбриона(ов) в пределах стадии Х (откладка яиц) по классификации Эйял-Гилади.
Более предпочтительно, яйца никогда не инкубируют (то есть "неинкубированные"). Клетки, изолированные из диска бластодермы, включают птичьи эмбриональные клетки, более подробно птичьи зародышевые стволовые клетки (ES); эти птичьи эмбриональные клетки являются тотипотентными или мультипотентными клетками. Клетки бластодермы представляют собой сильно связанные клетки, которые растут как колонии; они имеют округлую морфологию, с большим ядром и малой цитоплазмой (см. Фиг.2). Морфология клеток бластодермы развивается во время культивирования (стадии Фиг.2 B и С способа по изобретению) от сильно связанных клеток до более диссоциированных клеток с более свободными связями. Птичьи клетки ES, полученные на стадии с) предпочтительно, имеют более свободные связи.
Согласно другому варианту изобретения клетки стадии а) являются популяцией зародышевых стволовых клеток, обогащенных первичными зародышевыми клетками (ПЗК). Более предпочтительно, птичьи клетки ES стадии а) представляют собой очищенные ПЗК. У птиц первичные зародышевые клетки возникают из центральной области бластодермы (Ginsburg and Eyal-Giladi, 1987 Development 101(2):209-19; Karagenc et al, 1996 Dev Genet 19(4):290-301; Petitte et al, 1997 Poult Sci. 76(8): 1084-92). Затем они перемещаются в передний, внезародышевый участок, пока еще зародышевый полумесяц не имеет сосудистой сети между 2,5 и 5 днями эмбрионального развития, чтобы достигнуть зародышевый гребень. Они колонизируют зародышевый гребень, где они, в конечном счете, дифференцируются в ооциты или сперматоциты (Nieuwkoop and Sutasurya, 1979. The Migration of the primordial germ cells. In: Primordial germ cell in Chordates. London: Cambridge University Press p.113-127). О способах выделения ПЗК из донорских птичьих эмбрионов сообщалось в литературе и они могут быть легко осуществлены специалистом в данной области техники (см., например, JP924997, опубликованный 7 сентября 1993 Pub. №05-227947; Chang et al. 1992. Cell Biol. Int. 19(2): 143-149; Naito et al. 1994 Mol. Reprod. Dev. 39: 153-161; Yasuda et al. 1992. J. Reprod. Fert. 96: 521-528; Chang et al. 1992 Cell Biol. Int. Reporter 16(9): 853-857). Согласно варианту изобретения ПЗК собирают из крови зародыша, собранной из спинной аорты куриного эмбриона на стадии 12-14 по классификации Hamburger и Hamilton (Hamburger & Hamilton 1951 A series of normal stages in the development of chick embryo. J. Morphol. 88: 49-92). В другом предпочтительном варианте изобретения ПЗК собирают из зародышевого полумесяца механическим вскрытием куриного эмбриона или из гонад. Однако, как обсуждалось выше, другие способы выделения ПЗК известны и могут применяться как альтернатива.
"Полная культуральная среда" обозначает основную среду, предпочтительно основную синтетическую среду, с добавлением по меньшей мере одного фактора роста и животной сыворотки. Пример полной культуральной среды описан в WO 03/076601, WO 05/007840, ЕР 787180, US 6114168, US 5340740, US 6656479, US 5830510 и в Pain et al. (1996, Development 122:2339-2348). Согласно изобретению "основная среда" означала питательную среду с классическим составом среды, который позволяет, отдельно, по меньшей мере выживание клеток, и еще лучше, рост клеток. Примерами основных сред являются ВМЕ (основная среда Игла), MEM (минимальная среда Игла), среда 199, DMEM (модифицированная Дульбекко среда Игла), GMEM (модифицированная Глазго среда Игла), DMEM-HamF12, Ham-F12 и Ham-F10, модифицированная по способу Исков среда Дульбекко, среда 5А МакКоя, RPMI 1640. Основная среда включает неорганические соли (в качестве примеров: CaCl2, KCl, NaCl, NaHCO3, NaH2PO4, MgSO4…), аминокислоты, витамины (тиамин, рибофлавин, фолиевая кислота, D-Ca пантотенат...) и другие компоненты, такие как глюкоза, бета-меркаптоэтанол, пируват натрия. Предпочтительно основная среда представляет собой синтетическую среду. Наиболее предпочтительная основная среда по изобретению представляет собой DMEM-HamF12, которая дополнена 2 мМ L-глутамином, 1 мМ пируватом натрия, 1% заменимых аминокислот, 0,16 мМ бетамеркаптоэтанолом.
Альтернативно, полная культуральная среда представляет собой кондиционированную среду, предпочтительно кондиционированную среду BRL. Посредством примера кондиционированные среды BRL получают согласно признанным в данной области техники способам, таким как описаны Smith и Hooper (1987, Dev. Biol. 121: 1-9). Клетки BRL доступны из АТСС под номером доступа CRL-1442. Кондиционированная среда может быть добавлена экзогенными факторами роста как описано ниже.
Термин "фактор роста", как используется здесь, означал экзогенный фактор роста, добавленный в культуральную среду, необходимую для выживания и роста птичьих клеток в культуре. Возможно схематично отличить два семейства факторов роста: цитокины и трофические факторы. Цитокины представляют собой, главным образом, цитокины, действие которых осуществляется через рецептор, который связан с белком gp130. Таким образом, ингибирующий лейкемию фактор (LIF), интерлейкин 11, интерлейкин 6, рецептор интерлейкина 6, реснитчатый нейротрофический фактор (CNTF), онкостатин и кардиотрофин имеют сходный образ действия с усилением на уровне рецептора конкретной цепи и комбинации последнего с белком gp130 в мономерной или иногда гетеродимерной форме. Трофические факторы представляют собой, главным образом, фактор стволовых клеток (SCF), инсулиновый фактор роста 1 (IGF-1) и фактор роста фибробластов (FGF), предпочтительно основной FGF (bFGF) или человеческий FGF (hFGF).
Полная культуральная среда, используемая на стадии а) способа по изобретению, включает основную среду, предпочтительно основную синтетическую среду, и по меньшей мере один цитокин, действие которого осуществляется через рецептор, который связан с белком gp130 и/или по меньшей мере одним трофическим фактором. Предпочтительно, полная культуральная среда согласно изобретению включает основную среду и по меньшей мере один фактор роста, выбранный из группы, состоящей из ингибирующего лейкемию фактора (LIF), онкостатина, кардиотрофина, инсулинового фактор роста 1 (IGF-1), реснитчатого нейротрофического фактор (CNTF), интерлейкина 6 (IL-6), рецептора интерлейкина 6 (IL-6R), фактор стволовых клеток (SCF), фактор роста фибробластов (FGF), интерлейкина 11 (IL-11).
Согласно первому предпочтительному варианту изобретения полная культуральная среда представляет собой основную среду с добавлением животной сыворотки и по меньшей мере IGF-1 и CNTF.
Согласно второму предпочтительному варианту изобретения полная культуральная среда представляет собой основную среду с добавлением животной сыворотки и по меньшей мере IGF-1, CNTF, IL-6 и IL-6R.
Согласно третьему предпочтительному варианту изобретения полная культуральная среда представляет собой основную среду с добавлением животной сыворотки и по меньшей мере IGF-1, CNTF, IL-6, IL-6R, SCF, FGF.
Согласно другому варианту изобретения полная культуральная среда представляет собой кондиционированную культуральную среду, включающую факторы роста (то есть экспрессируемые клетками BRL, например) и возможно с добавлением по меньшей мере одного экзогенного фактора роста, выбранного из группы, включающей ингибирующий лейкемию фактор (LIF), инсулиновый фактор роста 1 (IGF-1), реснитчатый нейротрофический фактор (CNTF), интерлейкин 6 (IL-6), рецептор интерлейкина 6 (IL-6R), фактор стволовых клеток (SCF), фактор роста фибробластов (FGF), интерлейкин 11 (IL-11).
Концентрация факторов роста IGF-1, CNTF, IL-6, IL-6R, SCF, FGF, IL-11 в основной среде или в кондиционированной культуральной среде составляет приблизительно от 0,01 до 10 нг/мл, предпочтительно, от 0,1 до 5 нг/мл, и более предпочтительно приблизительно 1 нг/мл.
Птичьи зародышевые стволовые клетки по изобретению культивируют на слое питающих клеток. Питающие клетки могут или быть клетками или линиями клеток, культивируемыми с целью получения клеток ES. Альтернативно, питающие клетки могут быть заменены внеклеточным матриксом вместе со связанными факторами роста. Соответственно, питающий матрикс будет относиться либо к питающим клеткам, либо к внеклеточному матриксу. Питающий матрикс, как используется здесь, получен в соответствии с методиками, известными в данной области техники. Как отмечено выше, предпочтительно, чтобы питающий матрикс был предварительно кондиционирован. Термин "предварительно кондиционирован" означает, что питающий матрикс культивируют в присутствии среды в течение периода времени до депонирования клеток, происходящих от диска бластодермы оплодотворенных птичьих яиц, в контакте с питающим матриксом, например, времени, достаточного для того, чтобы инициировать и установить выработку, например, факторов роста или других факторов питающим матриксом; обычно питающий матрикс предварительно кондиционирован культивированием питающего матрикса отдельно в течение одного - двух дней до депонирования клеток, происходящих от диска бластодермы оплодотворенных птичьих яиц, в контакте с питающим матриксом. Питающие клетки предпочтительно включают клетки-фибробласты мыши. Фибробласты STO являются предпочтительными, но первичные фибробласты также являются пригодными. Также, в то время как настоящее изобретение было описано относительно использования матриц питающих клеток мыши, при этом рассмотрено, что питающие матрицы, включающие клетки других видов мышей (например, крыс), других видов млекопитающих (например, копытных, быков, свиней) или видов птиц (например, Gallinacea, кур, индейки, утки, гуся, перепела, фазана), могут также использоваться. В другом варианте изобретения питающие клетки по изобретению могут быть трансфицированы вектором(ами) экспрессии, позволяющим, например, добиться конститутивной экспрессии факторов роста, таких как птичий SCF в клетках STO. Таким образом, эта "питающая клетка" производит фактор в форме, которая растворима и/или присоединена к плазматической мембране клеток. Таким образом, процесс культивирования по настоящему изобретению может необязательно включать создание монослоя питающих клеток. Питающие клетки инактивированы митотически с использованием стандартных методик. Например, питающие клетки могут быть подвергнуты действию Х или гамма-излучения (например, 4000 Рад гамма-излучения) или могут быть обработаны митоцином С (например, 10 мкг/мл в течение 2-3 часов). Процедуры для митотической инактивации клеток также детально описаны в информации, обычно присылаемой с клетками из Американской коллекции типовых культур (АТСС), 10801 University Boulevard, Manassas, Va. 20110-2209 (например, питающие клетки STO доступны под номером доступа АТСС 1503). Монослои могут необязательно культивироваться до приблизительно 80%-ного слияния, предпочтительно до приблизительно 90%-ного слияния, и более предпочтительно до приблизительно 100%-ного слияния. В то время как конфигурация питающих клеток в виде монослоя является предпочтительной конфигурацией для культуры, любая подходящая конфигурация подразумевается как находящаяся в рамках настоящего изобретения. Таким образом, например, слои, монослои, кластеры, агрегаты или другие ассоциации или группировки питающих клеток рассматриваются как находящиеся в рамках настоящего изобретения и, в частности, рассматриваются как подпадающие под значение термина "матрикс".
Культуральная среда по изобретению дополнена животной сывороткой. Животная сыворотка, предпочтительно используемая, является эмбриональной животной сывороткой. Эмбриональная бычья сыворотка является предпочтительной. Также, в то время как настоящее изобретение было описано относительно использования эмбриональной бычьей сыворотки, рассматривается, что животная сыворотка, содержащая сыворотку из других видов животных (например, куры, лошади, свиньи, копытных, и т.д.), также может использоваться. Конечная концентрация животной сыворотки в культуральной среде составляет приблизительно 1%-25%, предпочтительно 5%-20%, более предпочтительно 8%-12%. В предпочтительном варианте изобретения конечная концентрация животной сыворотки в культуральной среде составляет приблизительно 10%. Согласно предпочтительному варианту изобретения культуральная среда включает приблизительно 10% эмбриональной сыворотки теленка. Культуральная среда по изобретению может содержать, кроме того, антибиотики, такие как, например, пенициллин и стрептомицин для предотвращения загрязнения бактериями.
Согласно другому варианту изобретения изобретение представляет собой способ генетической модификации птичьих зародышевых стволовых клеток, включающий стадии:
a) трансфекции клеток ES, полученных и культивируемых согласно способу выше, вектором;
b) отбора трансфицированных клеток ES предпочтительно добавлением агента для отбора в питательную среду, такого как, например, антибиотики, аминокислоты, гормоны;
с) поиск и размножение устойчивых генетически модифицированных клонов ES;
d) культивирование указанной генетически модифицированной клетки ES стадии с) на слое питающих клеток в культуральной среде, как ранее описано.
Согласно первому варианту изобретения указанная культуральная среда стадии а) содержит животную сыворотку и по меньшей мере один фактор роста, выбранный из группы, включающей IGF1, CNTF, IL-6, IL-6R, IL-11, LIF, FGF, SCF, онкостатин, кардиотрофин. Согласно предпочтительному варианту изобретения указанная культуральная среда стадии d) содержит животную сыворотку и IGF1 и CNTF. Согласно другому варианту изобретения указанная культуральная среда стадии d) содержит животную сыворотку и IGF1 и CNTF и необязательно по меньшей мере один фактор роста, выбранный из группы, включающей IL-6, IL-6R, IL-11, LIF, FGF, SCF, онкостатин и кардиотрофин. Согласно третьему предпочтительному варианту изобретения указанная культуральная среда стадии d) содержит животную сыворотку IGF1, CNTF, IL-6 и IL-6R. Согласно четвертому предпочтительному варианту изобретения указанная культуральная среда стадии d) содержит животную сыворотку и IGF1, CNTF, IL-6, IL-6R, SCF и FGF.
Клетки ES стадии с) генетически модифицированы. Генетическая модификация осуществляется либо временной, либо стабильной трансфекцией вектором клеток ES. Согласно предпочтительному варианту изобретения ES стабильно трансфицированы вектором согласно способам, известным специалистам в данной области техники. Согласно первому варианту изобретения, вектор случайно вставлен в геном клеток ES. Согласно предпочтительному варианту изобретения вектор вставлен путем гомологичной рекомбинации в геном клеток ES. WO 03/043414 описывает протоколы и векторы экспрессии для генетической модификации клеток ES путем гомологичной рекомбинации.
Клетки ES стадии а) могут поддерживаться и культивироваться в течение длительного периода времени in vitro до их введения в реципиентный эмбрион. Этот длительный период времени позволяет генетически модифицировать указанные клетки. Согласно предпочтительному варианту изобретения клетки культивируют in vitro в течение по меньшей мере 5 дней, по меньшей мере 10 дней, по меньшей мере 14 дней, по меньшей мере 25 дней, по меньшей мере 50 дней, по меньшей мере 75 дней, по меньшей мере 100 дней.
Термины "вектор", как используется здесь, относится к существующей в природе или синтетической одно- или двунитевой плазмиде или вирусной молекуле нуклеиновой кислоты, которая может быть трансфицирована в клетки и реплицируется независимо от, или в пределах, генома клетки-хозяина. Кольцевую двунитевую плазмиду можно линеаризовать обработкой соответствующей рестриктазой, подобранной на основе нуклеотидной последовательности плазмидного вектора. Нуклеиновая кислота может быть вставлена в вектор путем разрезания вектора рестриктазами и лигированием частей. Молекула нуклеиновой кислоты может представлять собой РНК или ДНК. Термин "плазмида", как используется здесь, относится к маленькому кольцевому ДНК-вектору, способному к независимой репликации в пределах бактериальной или дрожжевой клетки-хозяина. Вектор нуклеиновой кислоты дополнительно включает по меньшей мере одну регуляторную последовательность, искусственным путем связанную с нуклеотидной последовательностью, кодирующей "интересующий полипептид". Регуляторные последовательности хорошо известны в данной области техники и могут быть выбраны так, чтобы гарантировать хорошую экспрессию связанной нуклеотидной последовательности без лишних экспериментов специалистами. Как используется здесь, термин "регуляторные последовательности" включает промоторы, энхансеры и другие элементы, которые могут контролировать экспрессию. Стандартные учебники по молекулярной биологии, такие как Sambrook et al. eds., "Molecular Cloning: A Laboratory Manual" 2nd ed. Cold Spring Harbor Press (1989) и Lodish et al. eds., "Molecular Cell Biology," Freeman (2000) могут помочь в создании проекта подходящего вектора экспрессии, промотора и других элементов для контроля экспрессии. Следует признать, однако, что выбор подходящего вектора экспрессии зависит от множества факторов, включая выбор клетки-хозяина, которая будет трансформирована, и/или типа белка, который будет экспрессироваться. Также полезными для различных применений являются тканеселективные (то есть тканеспецифичные) промоторы, то есть промоторы, с которых экспрессия идет предпочтительно в клетках конкретного вида ткани, по сравнению с одним или более другими типами ткани. Иллюстративный тканеспецифичный промотор представляет собой куриный специфичный для яйцевода промотор, который естественно связан с белками птичьих яиц, в том числе с овальбумином, лизозимом, овомукоид, кональбумином и овомуцином и т.п. Пригодные промоторы также включают экзогенно-индуцируемые промоторы. Они представляют собой промоторы, которые могут быть "включены" в ответ на добавленный извне компонент или стимул, который обычно не является эндогенным метаболитом или цитокином. Примеры включают индуцируемый антибиотиками промотор, такой как индуцируемый тетрациклином промотор, индуцируемый теплом промотор, индуцируемый светом промотор, или индуцируемый лазером промотор (например, Halloran et al., 2000, Development 127(9): 1953-1960; Gemer et al., 2000, Int. J. Hyperthermia 16(2): 171-81; Rang and Will, 2000, Nucleic Acids Res. 28(5): 11205; Hagihara et al., 1999, Cell Transplant. 8(4): 4314; Huang et al., 1999, Mol. Med. 5(2): 129-37; Forster, et al., 1999, Nucleic Acids Res. 27(2): 708-10; and Liu et al., 1998, Biotechniques 24(4): 624-8, 630-2 (1998)). Как используется здесь, термин "интересующий полипептид " или "интересующий белок" относится к аминокислотному полимеру трех или больше аминокислот в виде последовательности, связанных посредством пептидных связей. Термин "полипептид" включает белки, фрагменты белка, аналоги белка, олигопептиды, пептиды и т.п. Термин "полипептид" предполагает полипептиды как определено выше, которые кодируются нуклеиновыми кислотами, полученными с помощью рекомбинантной методики, изолированными из соответствующего источника или синтезированными. Неограничивающие примеры полипептидов представляют собой гормоны роста, цитокин, интерлейкин, интерферон, ферменты, иммуноглобулины или их фрагменты. Термины "трансфекция" или "трансфицированный", как используется здесь, относятся к способу вставки нуклеиновой кислоты в клетку-хозяин (то есть птичьих ES). Много методик известны специалистам для облегчения трансфекции нуклеиновыми кислотами прокариотического или эукариотического организма. Эти способы включают множество методик, в том числе, но не ограничены ими, обработка клеток высокими концентрациями соли, такой как, но не только, соль кальция или магния, электрическим полем (то есть электропорация), детергентом, или опосредованная липосомами трансфекция (то есть липофекция и др.), чтобы получить клетку-хозяин, компетентную для поглощения молекул нуклеиновой кислоты.
Изобретение также представляет собой способ получения химерного птенца, включающий стадии:
a) введения птичьих клеток ES, полученных и культивируемых способом по изобретению, в подзародышевую полость реципиентного птичьего эмбриона; и
b) инкубирования эмбриона, полученного на стадии а), чтобы вылупился птенец;
c) отбора указанного химерного птенца, содержащего чужеродные клетки, колонизировавшие указанного птенца.
Термин "птенец", как используется здесь, обозначает молодую птицу и включает молодого птенца. Термин "подзародышевая полость" означает пространство между бластодермой и желтком. Это пространство образуется, когда клетки бластодермы абсорбируют жидкость из белка и выделяют ее между собой и желтком.
Также целью изобретения является создание способа получения генетически модифицированного химерного птенца, включающего стадии:
a) введения генетически модифицированных ES, полученных и культивируемых способом по изобретению, в подзародышевую полость реципиентного птичьего эмбриона; и
b) инкубирования эмбриона, полученного на стадии а), чтобы вылупился птенец;
c) отбора указанного химерного птенца, содержащего генетически модифицированные чужеродные клетки, колонизировавшие указанного птенца.
Отбор указанного химерного птенца может быть выполнен или фенотипическим, или генотипическим исследованием. Согласно предпочтительному варианту изобретения химерный птенец отобран фенотипическим исследованием оперения.
Согласно другому варианту изобретения способ получения химерного птенца по изобретению может включить дополнительную стадию определения пола реципиентного эмбриона, предшествующую введению клеток ES.
Согласно другому варианту изобретения реципиентный эмбрион получен из недавно отложенного неинкубированного яйца и включает от приблизительно 5000 до приблизительно 70000 клеток. Предпочтительно, указанный реципиентный эмбрион находится на стадии, состоящей между стадиями VI и XII по классификации Эйял-Гилади и Кохава, предпочтительно:
- около стадии Х по классификации Эйял-Гилади и Кохава, когда эмбрион - курица;
- около стадии VII по классификации Эйял-Гилади и Кохава, когда эмбрион - московская утка;
- около стадии VIII по классификации Эйял-Гилади и Кохава, когда эмбрион - пекинская утка;
- около стадии XI по классификации Эйял-Гилади и Кохава, когда эмбрион - японский перепел или гусь;
- около стадии VII-VIII по классификации Эйял-Гилади и Кохава, когда эмбрион - цесарка или индейка.
Предпочтительно, по меньшей мере 1000 клеток ES, по меньшей мере 10000 клеток ES, по меньшей мере 15000 клеток ES, по меньшей мере 30000 ES, по меньшей мере 45000 клеток ES, по меньшей мере 65000 клеток ES, по меньшей мере 85000 клеток ES или по меньшей мере 100000 клеток ES вводят в подзародышевую полость реципиентного птичьего эмбриона. Согласно предпочтительному варианту изобретения по меньшей мере 30000 клеток ES вводят в подзародышевую полость реципиентного птичьего эмбриона.
Клетки ES, введенные в подзародышевую полость реципиентного птичьего эмбриона, могут быть смешанной популяцией женских и мужских клеток ES. Согласно другому варианту изобретения реципиентный эмбрион и донорские клетки ES являются предварительно имеющими пол перед введением. Согласно предпочтительному варианту изобретения женские клетки ES введены в подзародышевую полость женского реципиентного птичьего эмбриона. Согласно другому предпочтительному варианту изобретения мужские клетки ES введены в подзародышевую полость мужского реципиентного птичьего эмбриона.
Способ получения химерного птенца по изобретению включает необязательную стадию слабого облучения реципиентного эмбриона Х- или гамма-облучением перед введением клеток ES в подзародышевую полость указанного реципиентного эмбриона. Согласно предпочтительному варианту изобретения куриный реципиентный эмбрион облучают от 3 до 6 Грей Х лучей, предпочтительно приблизительно 4 Грей Х лучей. Согласно предпочтительному варианту изобретения приблизительно 15000 куриных клеток ES вводят в подзародышевую полость реципиентного эмбриона курицы, предварительного облученного 4 Грей X-лучей. Согласно другому предпочтительному варианту изобретения по меньшей мере 30000 куриных клеток ES вводят в подзародышевую полость необлученного реципиентного эмбриона курицы.
Согласно первому варианту изобретения реципиентный эмбрион курицы имеет породу белого леггорна, а донорские куриные клетки ES получены от породы, выбранной из группы, состоящей из породы полосатый плимутрок, породы Маран, породы S86N. Согласно второму варианту изобретения реципиентный эмбрион курицы имеет породу, выбранную из породы полосатый плимутрок, породы Маран, породы S86N, а донорские куриные клетки ES получены от породы белого леггорна.
Отбор химерного птенца по изобретению, содержащего чужеродные клетки, включает стадии:
a) получения образца генетического материала от указанного химерного птенца;
b) анализа на наличие полиморфизма в последовательности вируса птичьего лейкоза, интегрированного в птичий геном, и где полиморфизм является идентифицируемым посредством амплификации с использованием набора праймеров, выбранных из группы, состоящей из набора прямого праймера 5'-GGTGTAAATATCAAAATTATC-3' (SEQ ID №1) и обратного праймера 5'-CGGTTAAAATACGAATAGAGA-3' (SEQ ID №2) и набора прямого праймера 5'-CTATGAGCAGTTACGAGGGTC-3' (SEQ ID №3) и обратного праймера 5'-CGGACCAACAGGCTAGTCTC-3' (SEQ ID №4). Согласно предпочтительному варианту изобретения указанные куриные клетки ES получены от пород полосатый плимутрок, а указанный реципиентный эмбрион имеет породу белого леггорна. Указанную амплификацию выполняют полимеразной цепной реакцией (ПЦР) или ПЦР с обратной транскрипцией, и где указанный анализ включает расщепление амплифицированной ПЦР ДНК рестриктазой Hindi.
Способ идентификации наличия или отсутствия полиморфизма выбирают из группы, состоящей из: анализа полиморфизма длины рестрикционных фрагментов (ПДРФ), анализа гетеродуплексов, одноцепочечного конформационного полиморфизма (SSCP), гель-электрофореза в градиенте при денатурирующих условиях (DGGE), гель-электрофореза в градиенте температур (TGGE), аллель-специфичных олигонуклеотидов (ASO), дидезокси-фингерпринтинга (ddF).
Стадия анализа на наличие указанного полиморфизма включает стадии:
a) расщепления указанного генетического материала рестриктазой Hinсll;
b) разделения фрагментов, полученных указанным расщеплением;
c) обнаружения рестрикционного профиля, образуемого указанными фрагментами; и
d) необязательно, сравнения указанного профиля по меньшей мере с одним рестрикционным профилем, полученным расщеплением генетического материала белого леггорна, Марана, полосатого плимутрока, S86N с использованием рестриктазы Hincll, где различие в рестрикционных профилях, обнаруженных на стадиях с) и d), является показателем химерного птенца, содержащего чужеродные клетки.
Изобретение также включает способ получения потомства химерного птенца, где указанный способ включает следующие стадии:
a) выращивания отобранного химерного птенца, полученного способом по изобретению, во взрослую птицу;
b) скрещивания указанной взрослой птицы, содержащей чужеродные клетки, таким образом производя потомство птицы; и
c) отбора птиц в потомстве, содержащем чужеродные клетки. Отбор указанных птиц может быть выполнен фенотипическим исследованием оперения или, если возможно, генотипическим исследованием путем анализа на наличие полиморфизма Hincll в последовательности вируса птичьего лейкоза, интегрированного в геном птицы.
Способ может включать дополнительный шаг экспрессии чужеродного полипептида, кодируемого вектором, содержащимся в генетически модифицированных чужеродных клетках. Предпочтительно, чужеродный полипептид доставляется в биологические жидкости птицы, такие как кровь, сперма, моча, или белок развивающегося птичьего яйца, отложенного самкой генетически модифицированной птицы.
Настоящее изобретение также относится к культуральной среде для генетически и негенетически модифицированных птичьих зародышевых стволовых клеток (ES), предпочтительно клеток ES курицы и утки, дополненной животной сывороткой и содержащей по меньшей мере один фактора роста, выбранный из группы, состоящей из инсулиноподобного фактора роста 1 (IGF-1), реснитчатого нейротрофического фактора (CNTF), интерлейкина 6 (IL-6), рецептора интерлейкина 6 (IL-6R), интерлейкина 11, фактора стволовых клеток (SCF), фактора роста фибробластов (FGF), ингибирующего лейкемию фактора (LIF), онкостатина и кардиотрофина, где указанная среда достаточна для поддержания указанных куриных зародышевых стволовых клеток в культуре в течение по меньшей мере 10 дней, в течение по меньшей мере 30 дней, предпочтительно в течение по меньшей мере 100 дней и более предпочтительно в течение бесконечного периода.
Согласно предпочтительному варианту изобретения настоящее изобретение также относится к основной культуральной среде для генетически или негенетически модифицированных птичьих зародышевых стволовых клеток (ES), предпочтительно предпочтительно клеток ES курицы и утки, дополненной животной сывороткой и содержащей инсулиноподобный фактор роста 1 (IGF-1) и реснитчатый нейротрофический фактор (CNTF).
Согласно второму предпочтительному варианту изобретения настоящее изобретение относится к основной культуральной среде для генетически и негенетически модифицированных птичьих зародышевых стволовых клеток (ES), предпочтительно клеток ES курицы и утки, дополненной животной сывороткой и содержащей инсулиноподобный фактор роста 1 (IGF-1), реснитчатый нейротрофический фактор (CNTF), интерлейкин 6 (IL-6), рецептор интерлейкина 6 (IL-6R).
Согласно третьему предпочтительному варианту изобретения настоящее изобретение относится к основной культуральной среде для генетически и негенетически модифицированных птичьих зародышевых стволовых клеток (ES), предпочтительно клеток ES курицы и утки, дополненной животной сывороткой и содержащей инсулиноподобный фактор роста 1 (IGF-1), реснитчатый нейротрофический фактор (CNTF), интерлейкин 6 (IL-6), рецептор интерлейкина 6 (IL-6R), фактор стволовых клеток (SCF), фактор роста фибробластов (FGF).
Указанная среда достаточна для поддержания указанных птичьих зародышевых стволовых клеток (ES), предпочтительно клеток ES курицы и утки, в культуре в течение по меньшей мере 7 дней, в течение по меньшей мере 14 дней, в течение по меньшей мере 30 дней, в течение по меньшей мере 50 дней, и предпочтительно в течение по меньшей мере 100 дней. Культуральная среда по изобретению может необязательно дополнительно содержать по меньшей мере одно соединение, выбранное из группы, включающей интерлейкин-11, кардиотрофин, онкостатин и/или LIF. Культуральная среда изобретения может дополнительно содержать слой (то есть подложку) питающих клеток.
Изобретение также представляет собой способ исследования генетического полиморфизма, чтобы различить породу кур белого леггорна от другой породы кур, где указанный способ включает стадии:
a) получения образца генетического материала от указанной породы кур белого леггорна, и образца генетического материала от указанной другой породы кур;
b) анализа на наличие полиморфизма в последовательности вируса птичьего лейкоза, интегрированного в птичий геном, и где полиморфизм является идентифицируемым посредством амплификации с использованием набора праймеров, выбранных из группы, состоящей из набора прямого праймера 5'-GGTGTAAATATCAAAATTATC-3' (SEQ ID №1) и обратного праймера 5'-CGGTTAAAATACGAATAGAGA-3' (SEQ ID №2) и набора прямого праймера 5'-CTATGAGCAGTTACGAGGGTC-3' (SEQ ID №3) и обратного праймера 5'-CGGACCAACAGGCTAGTCTC-3' (SEQ ID №4).
В способе генетического исследования полиморфизма согласно изобретению амплификацию предпочтительно выполняют полимеразной цепной реакцией (ПЦР) или ПЦР с обратной транскрипцией.
Стадия анализа на наличие указанного полиморфизма включает стадии:
a) расщепления указанного генетического материала рестриктазой Hincll;
b) разделения фрагментов, полученных указанным расщеплением;
c) обнаружения рестрикционного профиля, образуемого указанными фрагментами; и
d) сравнение указанного профиля, полученного расщеплением генетического материала белого леггорна с использованием рестриктазы Hincll, и указанного профиля, полученного расщеплением генетического материала указанной другой породы кур, где наличие сайта рестрикции Hincll является показателем породы белого леггорна, а отсутствие сайта рестрикции Hincll является показателем, что это не порода белый леггорн.
Способ идентификации наличия или отсутствия полиморфизма выбирают из группы, состоящей из: анализа полиморфизма длины рестрикционных фрагментов (ПДРФ), анализа гетеродуплексов, одноцепочечного конформационного полиморфизма (SSCP), гель-электрофореза в градиенте при денатурирующих условиях (DGGE), гель-электрофореза в градиенте температур (TGGE), аллель-специфичных олигонуклеотидов (ASO), дидезокси-фингерпринтинга (ddF).
Нижеприведенные примеры поясняют изобретение более подробно. Следующие препараты и примеры даны, чтобы дать возможность специалистам в данной области техники более ясно понять и применять настоящее изобретение. Настоящее изобретение, однако, не ограничено объемом иллюстрированных вариантов изобретения, которые предназначены только как иллюстрация отдельных аспектов изобретения, а способы, которые функционально эквивалентны, находятся в рамках изобретения. Действительно, различные модификации изобретения в дополнение к описанным здесь станут очевидными для специалистов в данной области техники из предшествующего описания и сопутствующих рисунков. Такие модификации входят в объем приложенной формулы изобретения. В качестве оставшегося описания будет сделана ссылка к подписям к фигурам ниже.
ФИГУРЫ
Фиг.1: кинетика клеточной культуры птичьих клеток ES
Куриные клетки ES были выращены на слое питающих клеток мыши в культуральной среде, дополненной 10%-ной эмбриональной сывороткой теленка и IGF1, CNTF, IL-6, IL-6R, SCF, FGF.
Число клеток было определено в каждой диссоциации. Число клеток, полученное для каждой диссоциации, было добавлено для определения кумулятивного коэффициента пролиферации.
Фиг.2: Морфология куриных клеток ES
Морфологии клеток бластодермы:
(A) BR22p2 и (В) BR22p3: клетки округлой формы с большим ядром и малой цитоплазмой.
(С) BR29p12: рассредоточенные с более свободными связями клетки бластодермы.
Фиг.3: Экспрессия специфичного для клетки маркерного гена SSEA-1
Экспрессия специфичных для клеток ES маркерных генов SSEA-1 была проверена на клетках бластодермы, поддерживаемых in vitro в течение различного периода культивирования. Левая панель А: фазовый контраст. Правая панель В: окрашивание антителами.
Фиг.4: Активность щелочной фосфатазы клеток ES
Эндогенная активность щелочной фосфатазы клеток бластодермы. Клетки были окрашены по активности щелочной фосфатазы в течение различного периода культивирования.
Фиг.5: Изменение экспрессии маркерных генов дифференцировки VASA, THY1, BRACHYURY, в то время как клетки поддерживаются в культуре.
Маркерные гены и культура. 1: Костный мозг, 2: Эмбрион (голова); 3: Мужские гонады, 4: эмбрион (стадия X); 5: питающая клетка (STO); 6: питающая клетка (SN); 7: BR 4-5; 8: BR4-6; 9: BR 5-2; 10: BR 8-7; 11: BR 8-8; 12: BR 8-9; 13: BR 8-12; 14: V 9-19; 15: BR 15-0; 16: BR 15-1; 17: BR 15-2; 18: BR 15-3; 19: BR 15-5; 20: BR 15-6; 21: BR 15-7; 22: BR 15-8; 23: BR 15-8; 24: BR 15-9; 25: BR 15-10; 26: BR 15-11; 27: BR 18-2; 28: BR 18-3; 29: BR 18-4; 30: BR 18-5; 31: BR 19-1; 32: BR 19-2; 33: BR 19-3; 34: BR 19-4; 35: BR 20-2; 36: BR 20-3; 37: S1 p20; 38: гДНК полосатого плимутрока; 39: вода; 40: вода.
Экспрессия маркерных генов Vasa, Thy-1 и Brachuyry (Т) во время различного периода культивирования. GAPDH является контрольным маркерным геном. Клетки поддерживались в культуре в течение нескольких недель. Осадок из клеток в каждой диссоциации был заморожен. Экстракция РНК и ПЦР с обратной транскрипцией были выполнены затем для каждого осадка из клеток.
Фиг.6: анализ профиля ПЦР ПДРФ пород кур донора и реципиента и химеры
Профиль ПЦР ПДРФ пород кур донора и реципиента и химеры. 7 недавно отложенных яиц с зародышем от пород кур донора и реципиента инкубировали в течение 5 дней. ДНК была выделена из эмбрионов полностью. Соматическая химера: эмбрион с инъецированными донорскими клетками, инкубировали в течение 18 дней. ДНК была извлечена из крови, сердца, печени, селезенки и гонад.
Фиг.7: Клетки курицы донора были инъецированы в реципиентный эмбрион курицы. Реципиентные эмбрионы инкубировали до вылупления. Химерные птицы были выращены до взрослого состояния.
Фиг.8: потомство F1 и F2
8А: Птица F1 с типичным пигментированием оперения полосатого плимутрока
8В: Птицы F2 от курицы 5664-5665. Курицы были осеменены спермой петухов полосатого плимутрока. Яйца инкубировали до вылупления.
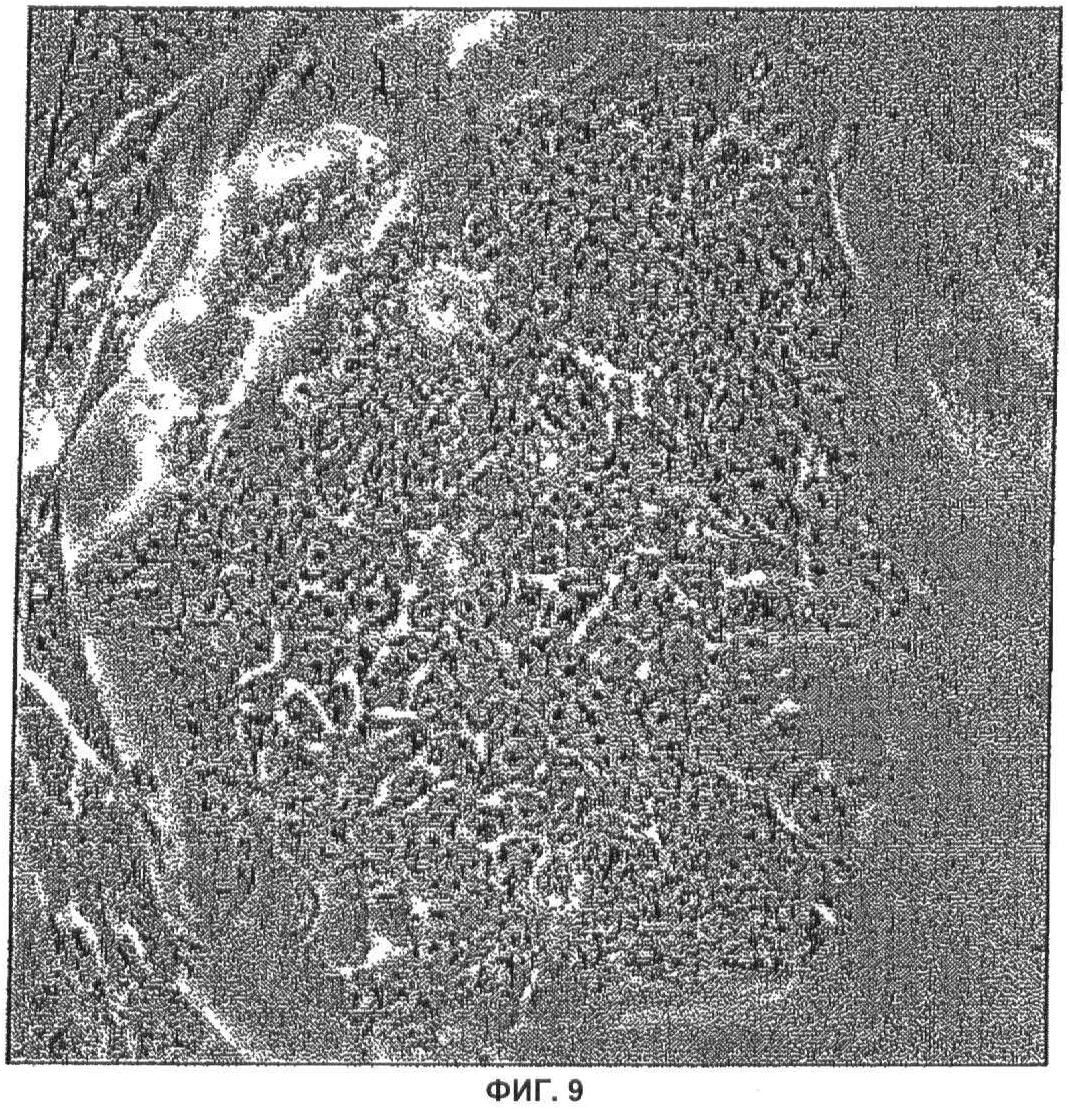
Фиг.9: Морфология клеток ES утки
Клетки ES утки выращивали на слое питающих клеток мыши в культуральной среде DMEM, дополненной 10%-ной эмбриональной сывороткой теленка и IGF1, CNTF, IL-6, IL-6R, SCF, FGF.
ПРИМЕРЫ
ПРИМЕР 1: Материалы и способы
Клетки бластодермы
Эмбрионы собрали из недавно отложенных неинкубированных яиц. Стерильное кольцо фильтровальной бумаги положили на эмбрион с бластодиском в центр вырезанной площади. Мембрана желтка была рассечена по кругу за пределами диска. Диск переворачивали и переносили в чашку Петри с PBS при комнатной температуре. Избыток желтка тщательно отмывали. Всю бластодерму удаляли аккуратным отсасыванием пипеткой Пастера и переносили в PBS. В среднем 200 эмбрионов собирали вместе. Клетки центрифугировали дважды при 300 g. Осадок клеток механически разъединяли в культуральной среде. Клетки в полной культуральной среде засевали на слой инактивированных питающих клеток STO. Клетки бластодермы поддерживали при 39°C в 7,5% CO2. Клетки разъединяли инкубацией при 39°C в растворе проназы (от 5 до 2% мас./об.). Разъединенные клетки засевали на новый слой питающих клеток в полной среде. Между пассажами 3 и 5 клетки засевали в минимальной питательной среде, на слой питающих клеток STO.
Культуральная среда
Полная культуральная среда была составлена на основе DMEM-F12, дополненной 10% эмбриональной сывороткой теленка (JRH), 0,16 мМ бета-меркаптоэтанолом (SIGMA), 1% заменимыми аминокислотами (Biowhittaker), 1 мМ пируватом натрия (Biowhittaker), 2 мМ L-глутамином (Biowhittaker), 1 нг/мл IGF1 (Tebu), 1 нг/мл CNTF (Eurobio), 1 нг/мл IL-6 (Eurobio), 1 нг/мл IL-6R (Tebu), 1 нг/мл SCF (Tebu), 1 нг/мл bFGF (Peprotech), 1% пенистрептомицином (Biowhittaker).
Альтернативно, полная культуральная среда была составлена на основе DMEM-F12, дополненной 10% эмбриональной сывороткой теленка (JRH), 0, 16 мМ бета-меркаптоэтанолом (SIGMA), 1% заменимыми аминокислотами (Biowhittaker), 1 мМ пируватом натрия (Biowhittaker), 2 мМ L-глутамином (Biowhittaker), 1 нг/мл IGF1 (Tebu), 1 нг/мл CNTF (Eurobio), 1 нг/мл IL-6 (Eurobio), 1 нг/мл IL-6R (Tebu), 1% пенистрептомицином (Biowhittaker).
Альтернативно, полная культуральная среда может также быть составлена на основе DMEM-F12, дополненной 10% эмбриональной сывороткой теленка (JRH), 0,16 мМ бета-меркаптоэтанолом (SIGMA), 1% заменимыми аминокислотами (Biowhittaker), 1 мМ пируватом натрия (Biowhittaker), 2 мМ L-глутамином (Biowhittaker), 1 нг/мл IGF1 (Tebu), 1 нг/мл CNTF (Eurobio), 1% пенистрептомицином (Biowhittaker).
Подготовка питающих клеток
Фибробласты мыши клеточной линии STO (АТСС) поддерживали при 37,5°C, 7,5% CO2 в DMEM (Cambrex), дополненной 4% эмбриональной сывороткой теленка (JRH) и 1% глутамином (Biowhittaker). При незначительном слиянии клетки STO разъединяли проназой (Roche) 1X, промывали PBS и облучали 45 Грей гамма-лучей. Питающие клетки засевали в концентрации от 1,5×106 до 2×106 клеток в свежую питательную среду в 100-миллиметровых чашки.
Трансфекция
Линия клеток STO: pGPARa и pMEHCS были предоставлены д-ром Bertrand Pain. pCINeo был куплен у Promega. ДНК-плазмиды была получены с использованием щелочного лизиса и очистки полиэтиленгликолем. Для трансфекции клетки засевали утром в концентрации 0,5×106 клеткок в 100-миллиметровую чашку. Их трансфицировали вечером 3,0 мкг кольцевой pCINeo, 15 мкг pGPARα или pMEHCS с использованием для липофекции FuGENE 6 (Roche). День спустя клетки промывали и питательная среда была заменена. Отбор с использованием неомицина, 0,3 мг/мл, начали в Д1 и продолжали в течение 8 дней. Устойчивые клетки были размножены и заморожены в жидком азоте.
Реакция щелочной фосфатазы:
Клетки были промыты дважды PBS и фиксированы в 1,5% формальдегиде, 0,5% глютаральдегиде, 0,1% Igepal в течение 10-20 минут при 4°C. После промывания клетки инкубировали при 37°C в окрашивающем растворе щелочной фосфатазы, составленном из 100 мМ NaCl, 100 мМ Трис рН 9,5, 50 мМ MgCl2, 1 мг/мл NBT, 0,1 мг/мл BCIP. Реакцию остановливали добавлением PBS 1х или H2O.
Иммунофлюоресцентный анализ:
Антитела SSEA-1 были куплены у Банка гибридом для исследований развития (Developmental Studies Hybridoma Bank) Университета Айовы. Клетки были фиксированы либо 20 минут при 4°C в 1,5% формальдегиде, 0,5% глютаральдегиде, или в 0,2% глютаральдегиде, 0,01% Igepal, либо 10 минут при комнатной температуре в 4% параформальдегиде или метаноле.
Клетки инкубировали в PBS-BSA 0,1% в течение 2-4 часов. В течение ночи добавляли первое разбавленное антитело. После промывания второе FITC-маркированное антитело IgG было добавлено в течение 1 часа при 4°C. Реакция была остановлена удалением антитела и промыванием клеток PBS. Клетки наблюдали в флуоресцентный микроскоп.
ПЦР ПДРФ (полиморфизм длины рестрикционных фрагментов продукта ПЦР):
ДНК из тканей эмбрионов, инкубированных в течение 18 дней, очищали согласно инструкциям производителя мининабора DNA QIAamp. Фрагмент вируса птичьего лейкоза, интегрированный в геноме, амплифицировали ПЦР с использованием следующих пар праймеров:
Олигонуклеотиды (157-158):
Прямой: 5'-GGTGTAAATATCAAAATTATC (SEQ ID №1)
Обратный: 5'-CGGTTAAAATACGAATAGAGA (SEQ ID №2)
Олигонуклеотиды (78-81):
Прямой: 5'-CTATGAGCAGTTACGAGGGTC (SEQ ID №3)
Обратный: 5'-CGGACCAACAGGCTAGTCTC (SEQ ID №4)
Продукты амплификации (ампликоны) имели длину, соответственно, 3106 и 1004 пар нуклеотидов (пн). Специфичность праймера 157 является более высокой для ДНК курицы полосатый плимутрок, чем для ДНК белого леггорна. Получаемые ампликоны подвергались расщеплению ферментом Hincll.
Анализ ПЦР с обратной транскрипцией:
РНК были очищены согласно инструкциям из набора выделения РНК Promega SV total RNA isolation kit. Вся РНК была выделена из эмбрионов после 5 дней инкубации, костный мозг - из эмбрионов бедренной кости, инкубированных в течение 15 дней, яичко - из взрослой курицы. РНК из клеток BR15 была выделена согласно инструкциям из набора Qiagen RNeasy kit. РНК были обратно транскрибированы согласно инструкциям AMV Reverse transcriptase kit и случайным праймерам Promega. Амплификацию путем ПЦР проводили, используя следующие праймеры.

Инъекции клеток в реципиентный эмбрион:
Когда использовалось облучение, реципиентные эмбрионы получали, подвергая недавно отложенные неинкубированные яйца действию 4 Грей Х-лучей от источника-ускорителя. К эмбрионам имели доступ через вырезанное отверстие вдоль яйца. Оболочка была удалена перемалыванием. Мембрану оболочки поддерживали во влажном состоянии путем добавления капли PBS. Мембрану оболочки разрезали, чтобы подвергнуть действию эмбрион непосредственно перед инъекцией клеток. 3 мл клеток в культуральной среде вводили в подзародышевую полость реципиентного эмбриона, используя микропипетку.
Отверстие закрывали, совмещая две части мембраны оболочки, предварительно погруженную в белок. Когда мембраны оболочки высушивали, отверстия тщательно закрывали с помощью хирургической нити. Яйца инкубировали в обычных термостатах при 37,5°C и 50%-ной относительной влажности и поворачивали на 90° каждый час в течение 18 дней. Яйца затем переносили в обычный инкубатор с температурой 37°C и 85%-ной относительной влажностью до вылупления. Фенотипические и соматические химеры оценивали в эмбрионах после 18 дней инкубации. Наследуемый вклад донорских клеток оценивали путем скрещивания инъецированных птиц с курами полосатый плимутрок.
ПРИМЕР 2: Выделение и размножение куриных клеток ES
Куриные зародышевые стволовые клетки выделяли из недавно отложенных яиц. В среднем 200 эмбрионов собирали вместе и засевали на слой питающих клеток облученных фибробластов мыши. Фактически, Etches с соавторами (1996 Mol. Reprod. Dev. 45:291-288) показали, что значительно больше соматических химер наблюдалось после инъекции курице клеток бластодермы, совместно культивируемых с фибробластами мыши. Из первичного засева в пассажи 3-5, клетки бластодермы выращивали в полной культуральной среде, составленной на основе DMEM-F12, дополненной 10% эмбриональной сывороткой теленка (JRH), 0,16 мМ бета-меркаптоэтанолом (SIGMA), 1% заменимыми аминокислотами (Biowhittaker), 1 мМ пируватом натрия (Biowhittaker), 2 мМ L-глутамином (Biowhittaker), 1 нг/мл IGF-1 (TEBU), 1 нг/мл CNTF (Eurobio), 1 нг/мл IL-6 (Eurobio), 1 нг/мл IL-6R (TEBU), 1 нг/мл SCF (TEBU), 1 нг/мл бычьего FGF (Peprotech), 1% пенистрептомицином (Biowhittaker). Затем после нескольких пассажей некоторые факторы роста удаляли и клетки выращивали в минимальной культуральной среде, чтобы избежать дифференцировки. Факторами роста, которые удаляли, являлись либо (SCF и FGF), либо (SCF, FGF, IL-6, IL-6R).
Культуральная среда для выращивания куриных клеток ES, чтобы избежать дифференцировки, включает основную среду (то есть DMEM-F12), дополненную 10% эмбриональной сывороткой теленка (JRH), 0,16 мМ бета-меркаптоэтанолом (SIGMA), 1% заменимыми аминокислотами (Biowhittaker), 1 мМ пируватом натрия (Biowhittaker), 2 мМ L-глутамином (Biowhittaker), и дополненную 1 нг/мл IGF-1, 1 нг/мл CNTF, 1 нг/мл IL-6, 1 нг/мл IL-6R, 1% пенистрептомицином. Альтернативно, культуральная среда для выращивания куриных клеток ES, чтобы избежать дифференцировки, включает основную среду (то есть DMEM-F12), дополненную 10% эмбриональной сывороткой теленка (JRH), 0,16 мМ бета-меркаптоэтанолом (SIGMA), 1% заменимыми аминокислотами (Biowhittaker), 1 мМ пируватом натрия (Biowhittaker), 2 мМ L-глутамином (Biowhittaker) и дополненную 1 нг/мл IGF-1, 1 нг/мл CNTF, 1% пенистрептомицином (Biowhittaker).
Куриные клетки ES могли быть выделены и размножены из различных пород кур (таблица 1).
Исследование статуса ES in vitro выделенных и размноженных клеток основывалось на ряде биологических критериев, которые, как было показано, являлись специфичными для мышиных и человеческих клеток ES: свойство самообновления, морфология клеток, экспрессия специфичных для стволовых клеток маркерных генов и тотипотентность клеток, то есть их способность дифференцироваться in vitro в различные виды клеток и in vivo осуществлять вклад в строение эмбриона. Характеристики роста большинства изолятов были идентичны таковым, наблюдаемым у куриных клетки бластодермы, поддерживаемых более года в культуре (Фиг.1), указывая на их потенциальную возможность неопределенного самообновления. Клетки бластодермы росли как колонии. Они представляли собой округлые клетки, с большим ядром и малой цитоплазмой (Фиг.2, BR22p2 & BR22p3). Интересно, наблюдалось, что морфология клеток бластодермы развивалась во время периода культуры от сильно связанных клеток (Фиг.2 BR22p2 & BR22p3) к более диссоциированным клеткам с более свободными связями (Фиг.2, BR29p12). Клетки с более свободными связями могли быть стабилизированы в культуре длительного срока в минимальной питательной среде. Клетки различных морфологии были дополнительно охарактеризованы по экспрессии специфичных для стволовых клеток маркерных генов и по их способности осуществлять вклад в строение эмбриона.
Клетки ES обычно определяются по экспрессии различных маркерных генов, ЕСМА-7 (Kemleret al. 1981 J. Embryol. Exp. Morphol. 64:45-60), SSEA-1 (Solter and Knowles, 1978 Proc. Natl. Acad. Sci. USA 75(11):5565-5569), EMA-1 (Hahnel and Eddy, 1986 J. Reprod. Immunol. 10(2)89-110); наличию специфичных ферментативных активностей, теломеразы и активности щелочной фосфатазы и отсутствию маркерных генов дифференцированных клеток, таких как TROMA-1. Экспрессия маркерных генов EMA-1 и SSEA-1 и активность щелочной фосфатазы оценивали на in vitro размноженных клетках бластодермы. Морфология клеток бластодермы, изменяющаяся во время периода культуры, маркерные гены, специфичные для зародыша (Tsunekawa et al, 2000 Development 127:2741-2750), мезодерма (Wilkinson et al, 1990, Nature 343:657-659) и кроветворные клетки (Uchida et al, 1994 Blood 83:3758-3779) были добавлены к учету для завершения исследования. Поскольку антитела к Brachyury, Thy-1 и vasa не были доступны, транскрипцию соответствующих генов оценивали ПЦР с обратной транскрипцией. Это исследование было выполнено в течение продолжительного периода культуры и в отношении различных морфологии. SSEA-1 и EMA-1 оставались экспрессирующимися в течение всего длительного периода культуры (Фиг.3). Активность щелочной фосфатазы оставалась также стабильной в течение того же самого периода культуры (Фиг.4).
Фиг.5 иллюстрирует развитие экспрессии маркерных генов дифференцировки, в то время как клетки поддерживаются в культуре. мРНК vasa присутствовала в значительном количестве в мужских гонадах, как и ожидалось (Фиг.5, дорожка 3). Она не была обнаружена в эмбрионах стадии Х (дорожка 4), хотя зародышевые клетки присутствуют в эмбрионах стадии X. Ген vasa слабо, однако воспроизводимо экспрессировался в клетках, поддерживаемых в культуре (дорожки 18-36). Отсутствие транскриптов Vasa в эмбрионах стадии Х могло бы быть объяснено недостаточной чувствительностью ПЦР с обратной транскрипцией. Экспрессия гена vasa в клетках, размноженных in vitro, могла бы означать либо что эти клетки имеют компетентность зародышевой линии, либо что зародышевые клетки, которые присутствуют в эмбрионах стадии X, были размножены in vitro. мРНК Brachyury, маркерного гена происхождения мезодермы, была уже обнаружена в эмбрионах стадии Х (эмбрионы из недавно отложенных яиц) (Фиг.5, дорожка 4). Экспрессия увеличилась, в то время как клетки поддерживались в культуре (Фиг.5, BR8 дорожки 12 и 13; BR 15 дорожки 19-26; BR18 дорожки 27-30 и BR19 дорожки 32-34). Кроветворные клетки происходили из мезодермы. мРНК Thy-1, маркерного гена кроветворных клеток, была также обнаружена в клетках, поддерживаемых в культуре (дорожки 7, 8; 11, 12, 13; 16-24; 27-34). HNK1, маркерный ген клеток нервного гребня птенца, экспрессировался клетками бластодермы. Экспрессия HNK1 оставалась стабильной, в то время как клетки поддерживались в культуре (данные не показаны). Маркерные гены недифференцированных клеток экспрессировались в течение всего периода культуры (данные не показаны). Культивируемые клетки бластодермы экспрессировали маркерные гены недифференцированных клеток, а также маркерные гены клеток нервного гребня и мезодермы. Неожиданно, ген vasa, который, как думали, был специфичным для зародышевых клеток, транскрибировался в клетках ES.
Тотипотентность in vitro размноженных куриных клеток была проверена путем оценки их способности способствовать in vivo восстановлению эмбриона.
Эксперимент был выполнен с различным числом куриных клеток ES, инъецированных в куриный реципиентный эмбрион, чтобы определить эффекты на уровне химеры. Воздействие облучения реципиентного эмбриона на эффективности колонизации было также изучено. Четыре параметра были выбраны, чтобы контролировать эффект инъекций и облучения: (i) жизнеспособность эмбрионов; (ii) процент фенотипических химер (процент эмбрионов с окрашенными перьями); (iii) степень фенотипических химер (процент окрашенных перьев); (iv) процент соматических химер (химер по тканям, отличным от перьев).
300, 5000, 15000 или 30000 донорских клеток ES инъецировали в подзародышевую полость недавно отложенных реципиентных эмбрионов, либо предварительно подвергнутых гамма-облучению, либо необлученных. Инъецированные яйца инкубировали в нормальных условиях. Культивируемые клетки бластодермы инъецировали каждую неделю между 14 и 43 днями культуры, чтобы определить развитие потенциальных возможностей колонизации в течение времени культивирования. Все эмбрионы были проанализированы на 18 день инкубации.
Культивируемые клетки бластодермы (донорские клетки) были от окрашенных пород полосатый плимутрок или S86N, которые являются гомозиготным рецессивом (ii) при доминирующем белом локусе I. Донорские клетки были инъецированы в реципиентные эмбрионы из породы белый леггорн (порода реципиента), которая является гомозиготной доминантой в локусе I. Соматическая химера могла быть идентифицирована по наличию черного низа. Тем не менее, был разработан подход ПЦР ПДРФ для того, чтобы отличить профили генетического фингерпринтинга от донорских клеток и реципиентных эмбрионов (Фиг.6). Профиль ПЦР ПДРФ реципиентной породы является профилем с 1 или 2 полосами в зависимости от индивида. Профиль ПЦР ПДРФ донорской породы является профилем с 3 полосами. Химерные ткани идентифицировали по профилю с 3 полосами, типичному для донора. Затем было возможно определить, обладали ли инъецированные клетки способностью колонизировать другие, нежели перья, ткани. Как было сделано для экспрессии специфичных маркерных генов, была изучена способность in vitro колонизации, в то время как клетки поддерживались в культуре длительного срока, а также в соответствии с клеточными морфологиями.
Несколько фенотипических (то есть животных с перьями, колонизированными клетками донорской породы) и соматических химер курицы (то есть животных с тканями, отличных от перьев, колонизированными клетками донорской породы), было идентифицировано. Было показано, что донорские клетки присутствовали в производной всех трех слоев зародыша, включая гонады. Эти результаты демонстрируют, что in vitro размноженные куриные клетки ES, полученные согласно способу по изобретению, могут внедряться и воссоздать различные ткани реципиентного эмбриона, включая гонады.
Неожиданно, авторы изобретения показывают, что инъекция большего количества клеток по сравнению с количеством, рекомендуемым в предшествующем уровне техники (то есть приблизительно 300 - 500 облученных клеток), не влияет на жизнеспособность эмбрионов. Кроме того, процент фенотипических химер значительно увеличивается, когда большое количество клеток (то есть больше чем 15000 и в конечном счете приблизительно 30000) инъецируют независимо от наличия или отсутствия стадии облучения. 30000 инъецированных клеток не являются верхним пределом и рассматривают инъекцию большего количества клеток, при этом единственное ограничение состоит в том, чтобы реципиентный эмбрион мог выжить и развиваться после введения этих клеток. Авторы изобретения показывают, что инъекция 15000 клеток в облученные реципиентные эмбрионы и инъекция 30000 клеток в необлученные эмбрионы дают наилучшие результаты и специфично дают более высокий процент эмбрионов, химерных в гонадах.
Авторы изобретения показывают, что используемый диапазон радиации не влияет на жизнеспособность куриных эмбрионов. Кроме того, кажется, что потенциальная возможность колонизации не зависит от продолжительности культивирования куриных клеток бластодермы (данные не показаны).
В целом, данные подтверждают мнение, что in vitro выделенные и размноженные клетки ES представляют собой истинные зародышевые стволовые клетки.
ПРИМЕР 3: Передача по зародышевой линии куриными клетками ES
С использованием самых лучших разработанных методик инъекции получали 9% от инъецированных птиц как химерные в гонадах (данные не показаны). Для изучения проблемы передачи по зародышевой линии совокупность из 584 животных создали путем инъекции культивированных клеток в реципиентные эмбрионы в соответствии с наилучшими методиками, которые, как показано, позволяют достичь оптимальной колонизации гонад. Фенотипические химеры у птиц распространяются из нескольких перьев при вылуплении, а затем теряются, в больше чем 95% во взрослом состоянии (Фиг.7 и Таблица 2).
Куриц, инъецированных клетками полосатого плимутрока, скрещивали с петухами полосатого плимутрока, чтобы оценить вклад донорской линии в зародышевую линию. Передачу по зародышевой линии оценивали посредством изучения распределения черного и желтого потомства. Исследовали потомство 221 курицы. Из 16006 птиц F1 5 птенцов имели переменный процент белых перьев (один умер до вылупления), и 1 птенец имел пигментирование оперения, типичное для полосатого плимутрока (Фиг.8А). Описание куриц, производящих потомство с пигментированием оперения, подобного полосатому плимутроку, и описание условий инъекции представлены в Таблице 3. Даже после 59 дней культивирования клетки оставались способными колонизировать зародышевую линию. Передача по зародышевой линии не коррелировала с высоким процентом фенотипических химер курицы. Действительно, мать подобного полосатому плимутроку птенца была белой. Оценивали потенциальное число инъецированных ПЗК, предполагая, что 50 ПЗК (Eyal-Giladi et al, 1976) присутствуют в эмбрионах на стадии X. Конечное число ПЗК было рассчитано согласно фактору разбавления, следующему из последовательных пассажей клеток и концентрации и объема суспензии клеток, инъецированной реципиентному эмбриону.
Четыре (4) из 5 птенцов потомства F1 (16006 птиц) дожили до взрослого состояния. Эти 4 курицы были осеменены спермой петухов полосатый плимутрок. Потомство курицы 5664-5665 было подобное полосатому плимутроку (Фиг.8В и Таблица 4). Среди потомства других 3 куриц были подобные полосатому плимутроку и подобные белому леггорну птенцы (Таблица 4).
Авторы изобретения предложили способ культивирования клеток ES курицы. Размножение клеток бластодермы было документировано только для пород куриц белый леггорн и полосатый плимутрок (Pain et al, 1996 Dev. 122(8) 2339-2348), Petitte et al, 1990 108(1): 185-189, Zhu et al, 2005 Nat. Biotechnol. 23(9): 1159-1169). Способ культивирования, разработанный в этом исследовании, в частности, сочетание специфичных факторов роста и его изменение в течение времени, позволил воспроизводимо выделять и размножать клетки различных пород кур. Эффективность размножения находилась в зависимости от породы - результат, сочетающийся с различием пород во введении линий клеток ES, как описано для мыши (Kawase et al, 1994 Int. J. Dev. Biol. 38(2); 385-390). Интересно и в отличие от мыши, тотипотентность клеток ES курицы, поддерживаемых в культуре длительного срока, поддерживается недостаточностью нескольких факторов роста. То есть те куриные клетки ES действительно сохраняют тотипотентность в культуре длительного срока в полной культуральной среде, а также в полной среде, лишенной факторов роста, таких как IL-6, IL-6R, SCF и FGF. Отмечают, что человеческие клетки ES не могут также поддерживаться в условиях культивирования, установленных для мыши клетки ES.
Pain с соавторами (1996) описали, что в культуре длительного срока (больше чем 160 дней) куриных клеток бластодермы большие колонии маленьких клеток, сильно скученных в агрегаты с типичными ES-подобными морфологическими признаками, подобны таковым клеток ES мыши. В отличие от этого, морфология клеток бластодермы курицы, которые авторы изобретения поддерживали в культуре длительного срока, не остается такой устойчивой и изменяется от клеток с круглой формой, которые были сильно связаны, до клеток с более свободными связями. Это морфологическое изменение было последовательным и независимым от породы кур. Это изменение в морфологии не воздействовало на свойство самообновления, специфичное для клеток ES. Потенциальная детерминация клеток в различные линии клеток направлялась (i) биохимической характеристикой клеток иммунофлюоресценцией или ПЦР с обратной транскрипцией; (ii) методикой переноса генов для достижения биологического свойства культивируемых клеток. Клетки были охарактеризованы относительно маркерных генов, специфичных для всех трех зародышевых слоев, эктодермы, мезодермы и эндодермы. Были выбраны маркерные гены, являющиеся показателем очень ранней дифференцировки. Ни одна из морфологии не представляла специфичную комбинацию маркерных генов. Могли быть обнаружены маркерные гены недифференцированных клеток, маркерные гены всех трех зародышевых слоев, а также маркерный ген зародышевой линии, такой как vasa. He было изменения экспрессии маркерных генов, специфичного для изменения морфологии. Даже клетки с наиболее дифференцированной морфологией экспрессировали маркерные гены, специфичные для клеток ES, и не экспрессировали маркерные гены дифференцировки.
Размноженные in vitro суспензии клеток были введены в реципиентные эмбрионы. Пигментация перьев следовала из переноса пигментов из меланоцитов в стержень перьев. Меланоциты происходили из клеток нервного гребня туловища эмбриона. Дифференцировка клеток нервного гребня происходит очень рано при развитии эмбриона.
Пигментирование оперения белых реципиентных эмбрионов, инъецированных клетками черной породы кур, не могло бы отразить тотипотентность инъецированных клеток, но могло бы указать на то, что клетки, превратившиеся в меланоциты, были в состоянии присоединиться к клеткам меланобласта реципиента. Таким образом, исследование вклада инъецированных клеток в реципиентный эмбрион не было ограничено наблюдением за оперением, но включало и производные тканей всех трех зародышевых слоев. Фенотипическая и соматическая химеры были получены с каждой из основных морфологии клеток, наблюдаемых в культуре (столбики, комки и кометы), при этом поддерживая недифференцированный статус клеток независимо от морфологии. Интересно, что гонады были также колонизированы инъецированными клетками.
Окончательное доказательство ES статуса клетки представляет собой передачу по зародышевой линии. 1 F0 (инъецированная) курица (0,3%) поддерживала передачу по зародышевой линии. Из 16 птенцов потомства этой курицы 1 птенец F1 был подобен полосатому плимутроку (6,25%). Все птенцы F2 от курицы F1 имели фенотип полосатого плимутрока, который показывает, что приобретение донорских признаков устойчиво через несколько поколений. Половина потомства куриц F1, которые имели различный процент черных перьев, была подобна полосатому плимутроку, а другая половина имела фенотип белого леггорна, как ожидалось из законов наследования Менделя.
Таким образом, авторы изобретения демонстрируют компетентность зародышевой линии клеток бластодермы курицы. Клетки бластодермы курицы, таким образом, пригодны для разработки переноса генов у птиц.
ПРИМЕР 4: Выделение и размножение клеток ES утки:
4.1 - Исходный материал
Яйца утки
Яйца утки Пекинских пород GL30 были получены из GRIMAUD FRERES Selection (La Corbiere, Roussay, France). Родительские утки были привиты от Escherichia coli (аутогенная вакцина Coli 01 & 02), Pasteurella multocida (Landavax), вирусного гепатита утки (Hepatovax), Erysipelothrix rhusiopathiae (Ruvax), птичьего метапневмовируса (Nemovac), Salmonella typhimurium & Enteridis (аутогенная вакцина), Riemerella antipestifer (аутовакцина Riemerella), птичьего метапневмовируса (NoblLis RTV инактивированная) и Erysipelothrix rhusiopathiae (Ruvax). После получения оплодотворенные яйца Пекинской утки были подвергнуты дезинфекции в ванне с гипохлоридом с последующей дезактивацией Fermacidal (Thermo), чтобы избежать риска загрязнения, связанного с пылью, присутствующей на оболочке.
Питающие клетки
Клетки мышиного происхождения (клетки STO) использовались как питающий слой, чтобы поддерживать мультипотентность стволовых клеток утки. Эти питающие клетки были митотически инактивированы облучением гамма-лучами (45-55 Грей) прежде, чем засеяны на пластик. Эта доза радиации является сублетальной дозой, которая индуцирует точную остановку клеточного цикла, но все еще разрешает продукцию факторов роста и внеклеточного матрикса, необходимые для стимулирования клеточного роста недифференцированных клеток. Линия клеток STO была произведена A. Bernstein, Институт Рака Онтарио, Торонто, Канада из непрерывной линии SIM (инбредные мыши Sandos) зародышевых фибробластов мыши и она была предоставлена Американской коллекцией типовых культур (АТСС) (номер продукта STO: CRL-1503, номер партии 1198713). Два раза в неделю приготовляли свежие питающие слои. По экспоненте клетки были диссоциированы и подсчитаны. Часть клеток была засеяна для поддержания жизнеспособных культур, а другая часть была облучена. Для облучения мы приготовили суспензию клеток в концентрации 10×106клеток/мл в пробирках. Клетки были подвергнуты действию доз по 45-55 Грей и были засеяны на пластик. После засевания кюветы или чашки, покрытые инактивированными питающими клетками, использовали в течение максимум 5 дней.
Среда
Среда GTM-3 (SIGMA, каталожный номер G9916)
DMEM-HamF12 (Cambrex, каталожный номер ВЕ04-687)
Добавки
Глутамин (Cambrex, каталожный номер ВЕ17-605Е)
Антибиотики: пенициллин/стрептомицин (Cambrex, каталожный номер ВЕ17-602Е))
Заменимые аминокислоты (Cambrex, каталожный номер ВЕ13-114Е)
Пируват натрия (Cambrex, каталожный номер BE 13-115)
Витамины (Cambrex, каталожный номер 13-607С)
Бета-меркаптоэтанол (SIGMA, каталожный номер М7522)
Дрожжевой экстракт (SAFC, каталожный номер 58902С)
Факторы
Использовались шесть различных рекомбинантных факторов:
- Рекомбинантный человеческий реснитчатый нейротрофический фактор (CNTF) (Peprotech Inc, каталожный номер 450-13)
- Рекомбинантный человеческий инсулиноподобный фактор I (IGF1) (Peprotech Inc, каталожный номер 100-11)
- Рекомбинантный человеческий интерлейкин-6 (IL6) (Peprotech Inc, каталожный номер 200-06)
- Рекомбинантный человеческий растворимый рецептор интерлейкина-6 (slL6r) (Peprotech Inc, каталожный номер 200-06R)
- Рекомбинантный человеческий фактор стволовых клеток (SCF) (Peprotech Inc, каталожный номер 300-07)
- Рекомбинантный Человеческий основной фактор роста фибробласта (bFGF) (Peprotech Inc, каталожный номер 100-18В)
Все те факторы, за исключением IL6r, произведены бактериях Е.coli. Растворимый IL6r экспрессировали в инфицированных вирусом клетках HEK293.
Эмбриональная бычья сыворотка
Необлученная эмбриональная бычья сыворотка (FBS) (JRH, каталожный номер 12003)
Необлученная сыворотка, используемая в программе, была собрана и произведена в Австралии.
Животные, используемые для сбора, были осмотрены USDA и были пригодными для бойни. Она была добавлена в среду во время культивирования птичьих стволовых клеток. Эта партия не была подвергнута облучению, чтобы избежать деструкции важных белков или компонентов, которые могут быть существенными для поддержания стволовых клеток в культуре.
Облученная сыворотка (JRH, каталожный номер 12107)
Облученная партия, используемая в этой программе, была собрана в Соединенных Штатах. Эта облученная партия была добавлена как добавка в питательную среде DMEM, используемую для культивирования клеток STO (питающих клеток). Эти клетки не требуют как стволовые клетки определенного качества сыворотки для роста и поддержания в культуре. Чтобы минимизировать высокую концентрацию сыворотки в среде, мы адаптировали клетки STO, чтобы они росли в присутствии только 4% FBS.
4.2 - Способ выделения и культивирования клеток ES утки
Приблизительно 360 оплодотворенных яиц утки были вскрыты, желтки были отделены от белка во время вскрытия. Эмбрионы были удалены из желтка при помощи малой гигроскопичной фильтровальной бумаги (бумага Whatmann 3М), предварительно вырезанной в форме перфорированного кольца при помощи компостер. Диаметр перфорации составляет приблизительно 5 мм. Эти малые кольца стерилизовали сухим нагревом в течение приблизительно 30 минут в сушильном шкафу. Практически, в течение стадии сбора эмбрионов, малое бумажное кольцо размещалось на поверхности желтка и помещалось по центру на эмбрионе, который таким образом был окружен бумажным кольцом. Последнее затем вырезали при помощи маленьких ножниц и удаленное целиком помещали в чашку Петри, наполненную PBS. Эмбрионы, таким образом извлеченные кольцом, очищали от избытка желтка в среде и зародышевые диски, таким образом не содержащие избытка вителлина, были собраны пипеткой Пастера.
Эмбрионы утки помещали в 50 мл пробирки, содержащие PBS 1X. Эмбрионы утки затем механически разделяли, промывали PBS и засевали на инактивированный слой питающих клеток STO в полную культуральную среду при 39°C, 7,5% CO2. Питающие клетки засевали в 6-луночные планшеты или чашки в концентрации примерно 2,7×104 клеток/см2. Полная культуральная среда составлена из безсывороточной питательной среды DMEM-Ham F12, дополненной 10% эмбриональной бычьей сывороткой, IGF1, CNTF, и необязательно IL-6, IL-6R, SCF и бычьим FGF, до конечной концентрации 1 нг/мл, и 1% заменимыми аминокислотами, 1% смесью имеющихся в продаже витаминов, пируватом натрия до конечной концентрации 0,1 мМ, бета-меркаптоэтанолом до конечной концентрации 0,5 мМ, глутамином до конечной концентрации 2,1 мМ, пенициллином до конечной концентрации 100 U/мл, стрептомицином до конечной концентрации 100 мкг/мл и дрожжевым экстрактом 1Х. Быстро при пассаже 4, смесь антибиотиков больше не добавляли в среду.
Клетки ES утки культивировали в DMEM-Ham F12 полной культуральной среде до пассажа 4. После пассажа 4, основную среду меняли и полную среду DMEM-Ham F12 заменяли любой из:
- средой GTM-3, дополненной 10% эмбриональной бычьей сывороткой и IGF1 и CNTF до конечной концентрации 1 нг/мл, 1% заменимыми аминокислотами, 1% смесью имеющихся в продаже витаминов, пируватом натрия до конечной концентрации 0,1 мМ, бета-меркаптоэтанолом до конечной концентрации 0,5 мМ, глутамином до конечной концентрации 2,1 мМ и дрожжевым экстрактом 1Х; или
- средой GTM-3, дополненной 10% эмбриональной бычьей сывороткой и IGF1, CNTF, IL-6, IL-6R, SCF, FGF до конечной концентрации 1 нг/мл, 1% заменимыми аминокислотами, 1% смесью имеющихся в продаже витаминов, пируватом натрия до конечной концентрации 0,1 мМ, бета-меркаптоэтанолом до конечной концентрации 0,5 мМ, глутамином до конечной концентрации 2,1 мМ и дрожжевым экстрактом 1Х.
Клетки ES утки далее культивировали по меньшей мере в течение 14 пассажей в этой новой культуральной среде без дифференцировки.
Реферат
Изобретение относится к области биотехнологии, конкретно к культивированию зародышевых стволовых (ES) клеток птиц и может быть использовано для получения трансгенных птиц. Способ культивирования ES клеток птиц предусматривает: а) суспендирование ES клеток, происходящих от диска бластодермы оплодотворенного неинкубированного птичьего яйца в культуральной среде, включающей основную культуральную среду, дополненную факторами роста и животной сывороткой; b) засевание суспензии ES клеток, полученных на стадии а), на слой питающих клеток и дальнейшее культивирования указанных клеток ES. При этом единственными факторами роста, дополняющими указанную культуральную среду, являются инсулиноподобный фактор роста 1 (IGF-1) и реснитчатый нейротрофический фактор (CNTF). Изобретение позволяет оптимизировать состав среды для культивирования ES клеток птиц, которая позволяет поддерживать характерные признаки ES клеток и предотвратить их дифференциацию. 16 з.п. ф-лы, 9 ил., 4 табл., 4 пр.
Формула
a) суспендирования клеток ES, происходящих от диска бластодермы оплодотворенного неинкубированного птичьего яйца (яиц) в культуральной среде, включающей основную культуральную среду, дополненную факторами роста и животной сывороткой;
b) засевания суспензии клеток ES, полученных на стадии а), на слой питающих клеток и дальнейшего культивирования указанных клеток ES,
в котором единственными факторами роста, дополняющими указанную культуральную среду, являются инсулиноподобный фактор роста 1 (IGF-1) и реснитчатый нейротрофический фактор (CNTF).

Комментарии