Способ получения установившейся эмбриональной зародышевой клеточной линии птиц, линия куриных эмбриональных зародышевых клеток, способ получения соматических или половых химер, способ трансфекции чужеродного гена в эмбриональные зародышевые клетки - RU2215029C2
Код документа: RU2215029C2
Чертежи





Описание
Область, к которой относится изобретение
Настоящее изобретение относится к способу получения установившейся линии плюрипотентных
эмбриональных зародышевых клеток птиц и к линии плюрипотентных эмбриональных зародышевых клеток птиц.
Предпосылки создания изобретения
Линии эмбриональных стволовых (ЭС) клеток
представляют собой недифференцированные и плюрипотентные клетки, происходящие от эмбрионов на стадии развития бластоцистов или морулы. Хотя предполагается, что ЭС клетки могут быть широко использованы,
например, в исследованиях в области биологии развития, в анализах свойств тотипотентных клеток и в технологии направленной доставки генов для разведения генетически модифицированного крупного
рогатого скота, однако были получены лишь мышиные ЭС клетки с подтвержденной передачей зародышевой линии (Evans, M. J. & Kaufman, M.H., Nature, 292, 154-156 (1981); Bradley et al., Nature, 309,
255-256 (1984)), и использование ЭС клеток для разведения крупного рогатого скота пока еще нереально из-за ограничений в передаче зародышевой линии у других видов, а не только у мышей (First, N.L. et
al., Reprod. Feril. Dev., 6, 553-562 (1994); Wheeler, M. B. , Reprod. Feril. Dev., 6, 563-568 (1994); Giles J.R. et al., Mol. Reprod. Dev. , 36, 130-138 (1993) и Doetschman, Т.С. et al., Dev. Biol.
127, 224-227 (1988).
Недавно в качестве альтернативного источника плюрипотентных стволовых клеток были получены примордиальные зародышевые клетки (ПЗК), которые являются предшественниками сперматозоидов или яйцеклеток, развивающихся после наступления половой зрелости. Указанные стволовые клетки, происходящие от ПЗК, называются эмбриональными зародышевыми (ЭЗ) клетками (Resnik, J.L. et al. , Nature, 359, 550-551 (1992) и Matsui, Y. et al., Cell, 70, 841-847 (1992)). Мышиные ПЗК были успешно культивированы на культуре митотически-инактивированных клеток STO, в которую были добавлены три основных фактора роста: фактор стволовых клеток (SCF), фактор ингибирования лейкоза (LIF) и основной фактор роста фибробластов (bFGF) (Godin, et al., Mol. Reprod. Feril. Dev., 36, 130-138 (1991); Doici, S. et al., Nature 352, 809-811 (1991); Matsui, Y. et al., Nature 353, 750-752 (1991) и Resnik, J.L. et al., Nature 359, 550-551 (1992)). Резник и др. сообщают, что после субкультивирования мышиные ПЗК продолжают пролифирировать и образуют колонии клеток, похожих на ЭС клетки (Resnik, J.L. et al., Nature, 359, 550-551 (1992)). Лабовский и др. продемонстрировали, что линии мышиных ЭЗ клеток обладают плюрипотентностью, необходимой для передачи зародышевой линии in vivo (Labosky, P.A. et al., Development, 120, 3197-3204 (1994)).
Что касается коровьих и свиных ЭЗ клеток, то были охарактеризованы такие отличительные признаки, как морфология, активность щелочной фосфатазы и образование эмбриоидного тела (Cherny, R.A. et al., Reprod. Fertil. Dev., 6, 569-575 (1994); Shim, H. et al., Biol. Reprod., 57, 1189-1095 (1997); Piedrahita, J.A. et al. J. Reprod. Fertil., 52, 245-254 (1997)). Однако передача зародышевой линии не была установлена у этих видов.
Pain и др. сообщили, что были получены стволовые клетки птиц с множеством морфогенетических потенциальных возможностей, которые поддерживались in vitro в долгоживущей культуре бластодермальных клеток. Однако о продуцировании плюрипотентных ЭЗ клеток, происходящих от ПЗК, у каких-либо видов, не относящихся к млекопитающим, ничего раньше не сообщалось.
У птиц ПЗК сначала развиваются из эпибласта и мигрируют в гипобласт прозрачной зоны (герминативный серп) на стадии 4 приблизительно через 18-19 часов после начала инкубации (Swift, C.H., Am. J. Anat., 15, 483-516 (1914); Hamburger V. & Hamilton, H.L., J. Morphol. 88, 49-92 (1951) и Eyal-Giladi, H. & Kochav, S. et al., Dev. Biol, 49, 321-337 (1976)). ПЗК перемещаются из герминативного серпа в кровоток на стадии развития 10-12 (Ando Y. & Fujimoto, Т. , Dev. Growh. Differ., 25, 345-32 (1983) и Ukeshima, A. et al., J. Electron. Microsc. , 40, 124-128 (1991)) и циркулируют в сосудистой системе вплоть до стадии развития 17 (через 2,5 дня после начала инкубации), когда они достигают области половых гребней, где они, наконец, концентрируются и образуют колонии (Nieuwkoop, P. D. & Sutasurya, L.A., In Primordial Germ Cells in the Chrodates, 113-127 (1979)). Этот путь миграции и последующие процессы развития резко отличаются от подобных процессов, происходящих у млекопитающих.
Allioli и др. сообщают, что куриные ПЗК, выделенные из гонад, могут пролиферировать в течение нескольких дней в условиях культивирования in vitro (Allioli, N. et al. , Dev. Biol., 165, 30-37 (1994)). Chang и др. культивировали куриные ПЗК из гонад на стромальных клетках полового гребня в течение 5 дней (Chang, I. et al., Cell. Biol. Int. 19, 569-676 (1995)). Эти культивированные гонадные ПЗК обладают способностью мигрировать в половой гребень при их повторном инъецировании в эмбрионы реципиента. Недавно Chang и др. продуцировали кур с половым химеризмом путем инъекции гонадных ПЗК, которые были культивированы in vitro в течение 5 дней (Chang, I. et al., Cell. Biol. Int., 21, 495-499 (1997)).
Кроме того, в РСТ WO 99/06534 описан метод получения ЭЗ клеток путем культивирования ПЗК, выделенных из крови эмбриона на стадии 13-14, в среде, в которую были добавлены LIF, bFGF, SCF и IGF-1 без использования питающего слоя. Однако количество кровяных ПЗК, получаемых из эмбриона, то есть примерно 100 клеток/эмбрион, гораздо меньше, чем количество гПЗК, которое составляет более чем 1000 клеток/эмбрион, а также выделение кровяных ПЗК из крови эмбриона представляет определенные трудности. Кроме того, хотя ПЗК были культивированы без использования питающего слоя, они прикреплялись к стенке сосуда для культивирования и претерпевали морфологическое изменение только через 3 или 4 пассажа. В соответствии с этим предполагается, что полученные из них ЭЗ клетки могут быть уже дифференцированными. Более того, ЭЗ клетки были оценены только по их щелочно-фосфатазной активности в целях иллюстрации их плюрипотентности, но не были оценены по другим свойствам, а следовательно, точно не установлено, являются ли указанные ЭЗ клетки действительно установившимися. Кроме того, в данной работе отсутствуют какие-либо упоминания или предположения о том, что ЭЗ клетки обладают способностью к дифференцировке in vitro и in vivo, которая является отличительным признаком установившихся ЭЗ клеток, а также о том, что эти клетки постоянно пролиферируют после нескольких пассажей.
Таким образом, существует необходимость в разработке линии ЭЗ клеток, передающих чужеродный ген через множество поколений, что позволяло бы разводить трансгенный рогатый скот с использованием трансфекции и направленной доставки чужеродного гена.
Краткое описание изобретения
В соответствии с этим целью настоящего изобретения является разработка способа получения линии плюрипотентных
эмбриональных зародышевых (ЭЗ) клеток птиц.
Другой целью настоящего изобретения является получение линии плюрипотентных эмбриональных зародышевых (ЭЗ) клеток птиц.
В
соответствии с одним из своих аспектов настоящее изобретение относится к способу получения установившейся линии эмбриональных зародышевых клеток птиц, включающему следующие стадии:
(a)
культивирования примордиальных зародышевых клеток (ПЗК), выделенных из птичьей эмбриональной гонады в среде, в которую были добавлены фактор роста клеток и фактор ингибирования дифференцировки, для
получения колоний ЭЗ клеток;
(b) культивирования ЭЗ клеток в среде, описанной в стадии (а), с использованием питающего слоя вплоть до образования колоний ЭЗ клеток;
(c) выделения и
субкультивирования ЭЗ клеток в среде, описанной в стадии (а), с получением установившейся ЭЗ клеточной линии.
В другом своем аспекте настоящее изобретение относится к получению линии куриных эмбриональных зародышевых клеток, обладающей свойствами, в основном, идентичными свойствам клеточной линии, депонированной под номером доступа KCLRF-ВР-00026.
Краткое описание
графического материала
Вышеуказанные и другие цели и отличительные признаки настоящего изобретения будут ясны из нижеследующего описания изобретения и прилагаемого к нему графического
материала, где:
на фиг. 1а показаны морфологические признаки колоний куриных ЭЗ клеток после 3 пассажей на куриных эмбриональных фибробластах (фиг.1а: масштаб - 50 мкм; и фиг.1b: масштаб - 25
мкм);
на фиг. 2 представлена PAS-реактивность в колониях ЭЗ клеток после 4 пассажей;
на фиг. 3 представлены результаты скрининга с использованием антител против SSEA-1 колоний ЭЗ
клеток, образованных после 4 пассажей;
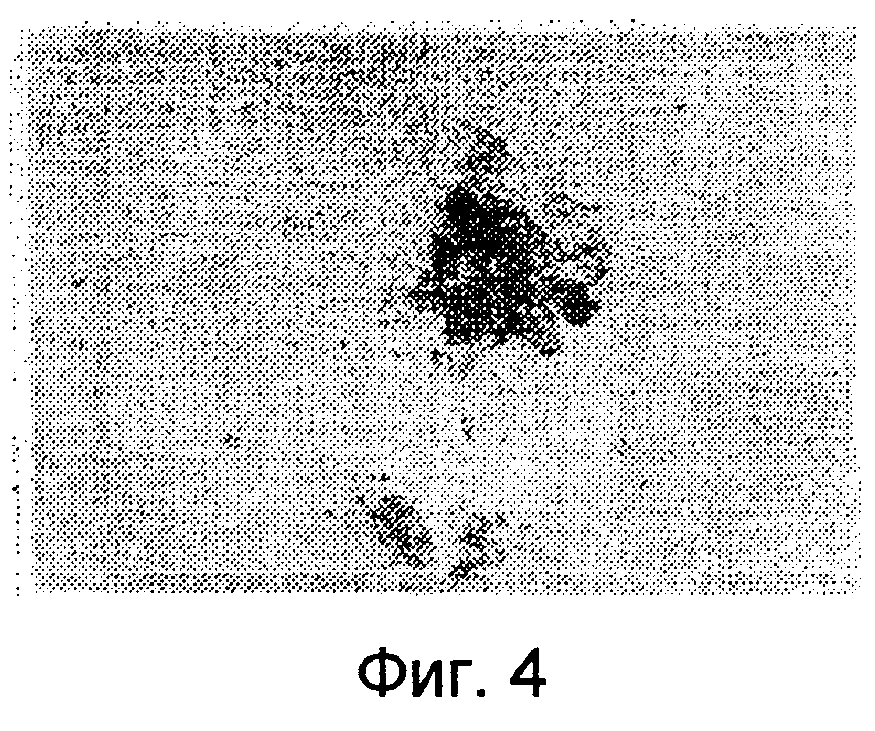
на фиг. 4 представлены результаты анализа на пролиферацию колоний ЭЗ клеток, окрашенных после 8 пассажей;
на фиг.5а показаны эмбриоидные тела,
образованные от куриных ЭЗ клеток в суспензионной культуре через 8 дней; а на фиг.5b-5d представлены результаты иммуногистохимических анализов эмбриоидных тел с использованием антител против актина,
α-1-фектопротеина и S100 соответственно;
на фиг. 6а изображены типичные куры породы "корейский огол" (Korean Ogol), имеющие черное оперенье; а на фиг.6b показаны куры с соматическим
химеризмом, имеющие белые пятна вокруг клюва и на груди;
на фиг. 7 представлены результаты ПЦР-анализа на соматический и половой химеризм.
Подробное описание изобретения
Осуществление способа настоящего изобретения для установления линии эмбриональных зародышевых (ЭЗ) клеток птиц начинается с выделения примордиальных зародышевых клеток (ПЗК) птицы. Такой птицей
может быть индейка, курица, перепел, фазан или утка. ПЗК могут быть выделены из эмбриональных гонад на ранней стадии развития птичьего эмбриона, на стадии 14-36 (от 50 часов до 10 дней после начала
инкубации), а предпочтительно на стадии 24-30 (4-6,5 дней после начала инкубации). Для этого, например, выделяют эмбриональную гонаду кур породы белый леггорн на стадии 28, а затем ткань гонады
диссоциируют в трипсин-EDTA с получением суспензии, содержащей гонадные примордиальные зародышевые клетки (гПЗК). Однако стадия развития эмбриона не ограничивается указанными стадиями, если только
этого не требуют цели настоящего изобретения, и может варьировать в зависимости от вида птицы или конкретного органа, ткани и мембраны, из которых были выделены ПЗК.
Выделенные ПЗК культивируют при температуре от 37 до 42oС в атмосфере, содержащей 5% СО2, в среде, содержащей факторы роста клеток и фактор ингибирования дифференцировки, до тех пор, пока ЭЗ клетки не будут образовывать колонии. Предпочтительной средой является среда DMEM (модифицированная по способу Дульбекко среда Игла; Gibco BRL cat#, 10313-021) или ее функциональный эквивалент.
Примерами факторов роста клеток, которые могут быть использованы в настоящем изобретении, являются фактор стволовых клеток (SCF), основной фактор роста фибробластов (bFGF), интерлейкин-II (IL-II), инсулинподобный фактор роста-I (IGF-I) и их смесь. Репрезентативным фактором ингибирования дифференцировки является фактор ингибирования лейкоза (LIF). Культуральная среда может, кроме того, содержать сыворотку млекопитающего, птичью сыворотку или дополнительный ингредиент, выбранный из группы, состоящей из пирувата натрия, глутамина, β-меркаптоэтанола и их смеси.
Культуральной средой является предпочтительно среда DMEM, в которую добавлены 0,1-30% фетальной бычьей сыворотки (FBS), 0,2-20% куриной сыворотки, 0,1-100 мМ пирувата натрия, 0,2-200 мМ глутамина, 0, 55-5500 мкМ β-меркаптоэтанола, 0,05-500 нг/мл SCF, 0,1-1000 ед./мл LIF, 0,1-1000 нг/мл bFGF, 0,0004-4 нг/мл IL-II и 0,1-1000 нг/мл IGF-I.
Колонии ЭЗ клеток, образованные на данной среде, разделяют на отдельные ЭЗ клетки, например, путем повторного пипетирования, и ЭЗ клетки выделяют, суспендируют в среде, например в среде, описанной выше, а затем культивируют при 37-42oС в течение 7-10 дней на питающем слое до тех пор, пока не будут образовываться колонии клеток, обнаруживающих морфологические признаки, характерные для линии ЭЗ клеток. В качестве питающего слоя может быть использован птичий эмбриональный фибробласт, при этом наиболее предпочтительным является митотически-активный эмбриональный фибробласт птиц (CEF) или птичий фибробласт.
Полученные ЭЗ клетки пассируют через интервалы 7-10 дней в той же самой среде, указанной выше, для получения установленной линии эмбриональных зародышевых клеток. Полученная таким образом линия эмбриональных зародышевых клеток может поддерживаться в течение периода времени более чем 4 месяца путем повторного субкультивирования.
Настоящее изобретение также относится к линии куриных ЭЗ клеток, продуцированных способом настоящего изобретения.
Морфология колоний линии куриных ЭЗ клеток является многослойной и эти колонии хорошо очерчены. Каждая куриная ЭЗ клетка состоит из большого ядра и относительно малого количества цитоплазмы подобно отдельно взятым морфологиям мышиных и свиных ЭС клеток и ЭЗ клеток (Wobus, A.M. et al., Exp. Cell. Res. 152, 212-2199 (1984); Matsui, Y. et al., Cell, 70, 841-847 (1992); Resnik, J. L. et al., Nature, 359, 550-551 (1992); Shim, H. et al., Biol. Reprod, 57, 1089-1095 (1997) и Piedrahita, J.A. et al., Biol. Reprod., 58, 1321-1329 (1998). Однако морфология куриных ЭЗ клеток слегка отличается от морфологии мышиных ЭС или ЭЗ клеток тем, что почти все указанные колонии имеют правильную круглую форму, и тем, что выступающие темные ядра, наблюдаемые у других видов, не являются явно различимыми. По своей физиологии, развитию и дифференцировке зародышевых клеток птицы отличаются от млекопитающих, а следовательно, по своей форме, адгезивным свойствам и другим признакам куриные ЭЗ клетки отличаются от мышиных ЭЗ клеток.
Куриные ЭЗ клетки сохраняют свойства гонадных ПЗК и недифференцированных стволовых клеток. Куриные ЭЗ клетки экспрессируют антиген SSEA-1 и в суспензионной in vitro-культуре они успешно развиваются в эмбриоидные тела, которые дифференцируются в клетки различных типов. Кроме того, в эксперименте с использованием кур было подтверждено, что куриные ЭЗ клетки пролиферируют и дифференцируются в различные ткани, включая гонаду, в процессе развития эмбриона и, таким образом, эти клетки являются плюрипотентными in vivo.
Одна из линий эмбриональных половых клеток кур, полученных в соответствии с настоящим изобретением, была депонирована 22 сентября 1999 Корейской научно-исследовательской организацией по исследованию клеточных линий (KCLRF)(Адрес: Cancer Research Institute, Seoul National University College of Medicine, #28, Yongon-dong, Chongno-gu, Seoul, 110-744, Republic of Korea) в рамках Будапештского договора о международном предоставлении депозита микроорганизма для проведения патентной экспертизы под номером доступа KCLRF-BP-00026.
Соматическая химера или химера зародышевой линии может быть продуцирована путем микроинъекции ЭЗ клеток в яйцо, а предпочтительно в его зародышевую полость или в кровеносный сосуд. Более предпочтительно ЭЗ клетка может быть введена путем микроинъекции в зародышевую полость яйца на стадии Х или в кровеносный сосуд яйца на стадии 13-17.
Нужный чужеродный ген может быть трансфецирован и введен в куриные ЭЗ клетки настоящего изобретения путем электропорации или с помощью липосомы, а стабильно трансфецированные куриные ЭЗ клетки могут быть отобраны путем их пассирования в среде, содержащей антибиотик.
Таким образом, линия куриных ЭЗ клеток настоящего изобретения может быть использована для продуцирования трансгенных кур и для исследований по дифференцировке зародышевых клеток и геномному импринтингу.
Для дополнительной иллюстрации настоящего изобретения ниже приводятся примеры, не ограничивающие его объема.
Кроме того, процентные соотношения, представленные ниже для смеси твердого вещества в другом твердом веществе, жидкости в жидкости и твердого вещества в жидкости, даны в мас./мас., об./об. и мас./об. соответственно, если это не оговорено особо.
Пример 1: Выделение ПЗК и создание условий культивирования для получения линии куриных ЭЗ клеток
(Стадия 1) Выделение ПЗК
Оплодотворенные яйца породы кур "белый леггорн", полученные из Колледжа сельскохозяйственных и биологических наук, Национальный университет в Сеуле, инкубировали в
течение 5,5 дней (вплоть до стадии 28) при 37,5oС и относительной влажности 60-70%. Эмбрион экстрагировали из оплодотворенного яйца на стадии 28 и промывали в 100 мм-чашках Петри фосфатным
солевым буфером (PBS), не содержащим магния, для удаления желтка и крови. Полученный эмбрион переносили в чашки Петри, покрытые черным воском, и из него пинцетом выделяли эмбриональные гонады. Ткань
гонады разделяли на отдельные гонадные примордиальные зародышевые клетки (гПЗК) путем обработки 0,25% трипсином-0,05% EDTA. Затем для инактивации трипсина-EDTA добавляли DMEM (модифицированную по
способу Дульбекко среду Игла, Gibco BRL, USA), содержащую 10% FBS (фетальную бычью сыворотку, Gibco, USA) и гПЗК собирали центрифугированием.
(Стадия 2) Установление условий
культивирования
В среду для культивирования ЭЗ (эмбриональных зародышевых) клеток (то есть в среду DMEM) добавляли один или несколько факторов роста, выбранных из фактора стволовых клеток
(SCF), фактор ингибирования лейкоза (LIF) и основного фактора роста фибробластов (bFGF). Сообщалось, что SCF, LIF и bFGF являются факторами роста, играющими важную роль в выживании и пролиферации ПЗК
у мышей (Resnik, J.L. et al., Nature, 359, 550-551 (1992); Donovan, P.J., Curr. Top. Dev. Biol. , 29, 189-225 (1994)). Помимо этих трех факторов, к среде добавляли факторы, связанные с ростом, такие
как интерлейкин-II (IL-II) и инсулин-подобный фактор роста-I (IGF-I). гПЗК, полученные на стадии 1, суспендировали в культуральной среде, в которую были добавлены различные комбинации вышеуказанных
факторов, а затем инкубировали при 37oС в атмосфере, содержащей 5% СO2, до тех пор, пока не образовывались колонии ЭЗ клеток.
Тесты показали, что образование колоний ЭЗ клеток не происходит в отсутствие IL-II и IGF-I. Поэтому IL-II и IGF-I имеют существенное значение для выживания и пролиферации куриных ЭЗ клеток.
Пример 2: Культивирование
куриных ЭЗ клеток
ЭЗ клетки, полученные, как описано в Примере 1, высевали в 24-луночный культуральный планшет, содержащий среду с ЭЗ клеточной культурой, состоящую из DMEM (Gibco, USA), в
которую были добавлены 10% FBS, 2% куриной сыворотки (Gibco, USA), 1мМ пирувата натрия, 2 мМ L-глутамина, 5,5•10-5 мкМ β-меркаптоэтанола, 100 мкг/мл стрептомицина, 100 ед./мл
пенициллина, 5 нг/мл человеческого фактора стволовых клеток (hSCF; Sigma, USA), 10 ед./мл мышиного фактора ингибирования лейкоза (mLIF; Sigma, USA), 10 нг/мл основного бычьего фактора роста
фибробластов (bFGF; Sigma, USA), 0,04 нг/мл человеческого интерлейкина-II (hIL-II) и 10 нг/мл человеческого инсулин-подобного фактора роста-I (IGF-I; Sigma, USA), и инкубировали в инкубаторе в течение
7-10 дней при 37oС в атмосфере с 5% СO2, в результате чего продуцировали колонии ЭЗ клеток, расположенных на слое стромальных клеток полового гребня (GRSC). Эти колонии куриных
ЭЗ клеток отделяли от слоя GRSC осторожным пипетированием и собирали центрифугированием при 200•g в течение 5 минут. Собранные ЭЗ клетки суспендировали в DMEM и распределяли по свежему
24-луночному планшету вместе с куриными эмбриональными фибробластами (CEF), которые не были митотически инактивированы. Колонии ЭЗ клеток пассировали через 7-10 дней в условиях, описанных выше. Эти
колонии поддерживались за время проведения вплоть до 10 пассажей и пролиферировали в течение 4 месяцев при повторном субкультивировании.
На фиг. 1а и 1b показаны колонии куриных ЭЗ клеток после 3 пассажей на куриных эмбриональных фибробластах (CEF) (фиг.1а: масштаб - 50 мкм и фиг.1b: масштаб - 25 мкм). Морфология куриных ЭЗ клеток слегка отличалась от морфологии мышиных ЭС или ЭЗ клеток. Почти все колонии куриных ЭЗ клеток имели правильную круглую форму и не были тесно связаны с питающим слоем CEF. В противоположность мышиным ЭС или ЭЗ клеткам куриные ЭЗ клетки не были плотно упакованы, а поэтому было нетрудно различить отдельные компоненты клетки. По своей морфологии эти колонии были многослойными и их границы четко вырисовывались. Куриная ЭЗ клетка состояла из большого ядра и относительно небольшого количества цитоплазмы, в то время как ее ядрышко не было заметно.
Пример 3: Характеризация ЭЗ клеток
Для определения наличия у ЭЗ
клеток отличительных признаков плюрипотентных клеток были проведены анализы на присутствие гликогенов и эпитопа SSEA-1, а также на активность щелочной фосфатазы и способность к пролиферации и
дифференцировке in vitro.
(1) Окрашивание периодной кислотой (PAS) по Шиффу
Колонии ЭЗ клеток, полученных после 4 пассажей, как описано в Примере 2, фиксировали на планшете в
1% растворе глутаральдегида в течение 5 минут и два раза промывали равным объемом фосфатного солевого буфера (PBS). Колонии ЭЗ клеток погружали на 5 минут в раствор периодной кислоты (Sigma, USA) при
комнатной температуре, а затем промывали равным объемом PBS. Колонии ЭЗ клеток затем погружали на 15 минут в раствор Шиффа (Sigma, USA) при комнатной температуре, а затем два раза промывали равным
объемом PBS. Полученные колонии ЭЗ клеток наблюдали под инвертированным микроскопом. Куриные ПЗК могут быть легко идентифицированы с помощью PAS-реакции, в результате которой окрашиваются гликогены
цитоплазмы (Meyer, D. B. , Dev. Biol., 10, 154-190 (1964)). Как можно видеть на фиг.2, ЭЗ клетки после 4 пассажей могут быть окрашены посредством PAS-реакции, хотя это окрашивание является
относительно слабым.
(2) Скрининг с помощью антитела против SSEA-1
Эпитоп SSEA-1 является характерным признаком для недифференцированных мышиных ЭЗ клеток и служит критерием
для идентификации плюрипотентных стволовых клеток (Solter, D. et al. , Proc. Natl. Acad. Sci., 75, 5565-5596 (1978)). Для определения наличия у ЭЗ клеток отличительных признаков плюрипотентных клеток
был проведен анализ на присутствие эпитопа SSEA-1.
Колонии ЭЗ клеток, полученные после 4 пассажей, как описано в Примере 2, фиксировали на планшете в 1% растворе глутаральдегида в течение 5 минут и два раза промывали равным объемом фосфатного солевого раствора (PBS). Асцитическую жидкость моноклонального антитела против SSEA-1 (МС-480; Solter, D. et al., Proc. Natl. Acad. Sci., 75, 5565-5596 (1978)) получали из банка гибридом (Development Studies Hibridoma Bank, Iowa University U.S.A.), 1000-кратно разводили PBS и добавляли к колониям ЭЭ клеток. Полученные колонии ЭЗ клеток подвергали реакции со щелочной фосфатазой, конъюгированной с авидином/биотином (Vector Lab. USA), а затем с субстратом щелочной фосфатазы BCIP/NBT (набор субстратов щелочной фосфатазы BCIP/NBT IV, Vector Lab. USA). Реакцию прекращали добавлением 10 мМ EDTA (рН 8,0).
Как можно видеть на фиг.3, все ЭЗ клетки после 4 пассажей являются положительными по окрашиванию SSEA-1, что свидетельствует о том, что эпитоп SSEA-1 экспрессируется куриными ЭЗ клетками.
(3) Анализ на пролиферацию
Колонии ЭЗ клеток, полученных после 8 пассажей, как описано в Примере
2, выдерживали в растворе, содержащем бромдезоксиуридин (BrdU, аналог тимидина) при 37oС в течение 1 часа и два раза промывали равным объемом PBS. Полученные колонии ЭЗ клеток окрашивали с
помощью набора для анализа на пролиферацию клеток (Amersham, UK), а затем подвергали контрастному PAS-окрашиванию путем повторения процедуры (1). Колонии ЭЗ клеток, содержащих включенный в них BrdU,
детектировали с использованием любого моноклонального антитела против BrdU и системы пероксидазы/DAB (Amersham, UK).
На фиг. 4 представлен результат анализа на пролиферацию колоний ЭЗ клеток, окрашенных после 8 пассажей. Как видно на фиг.4, ЭЗ клетки после 8 пассажей находятся в состоянии непрерывной пролиферации.
(4) Анализ на активность щелочной фосфатазы
Щелочно-фосфатазную активность колоний ЭЗ клеток, полученных после 4 пассажей, как описано в Примере 2, измеряли с использованием набора субстратов щелочной фосфатазы IV (Vector Lab., USA).
Полученный результат показал, что ЭЗ клетки обладают крайне слабой щелочно-фосфатазной активностью и эта активность не увеличивается во время субкультивирования.
В соответствии с работой Swartz W.J., Anat. Rec., 202, 379-385 (1982) щелочно-фосфатазная активность птичьих ПЗК может наблюдаться уже через 2 дня после начала инкубации, но не после вхождения ПЗК в половой гребень, что дает основание предположить, что щелочно-фосфатазная активность гонадных ПЗК, а также пассированных из них ЭЗ клеток является действительно очень слабой.
(5)
Анализ на дифференцировку in vitro и иммуногистохимический анализ
Для того чтобы определить, могут ли эмбриоидные тела происходить от куриных ЭЗ клеток, колонии ЭЗ клеток, полученные после 4
пассажей, как описано в примере 2, мягко перемешивали и центрифугировали с получением отдельных выделенных ЭЗ клеток. Указанные ЭЗ клетки суспендировали в среде для культивирования ЭЗ клеток, не
содержащей mLIF, а затем помещали в неадгезивные бактериологические чашки Петри. Среду заменяли через день в течение 8 дней и ежедневно наблюдали за морфологией клеток.
На фиг.5а показаны эмбриоидные тела, образованные из куриных ЭЗ клеток в суспензии через 8 дней.
Образованные таким образом эмбриоидные тела собирали, а затем распределяли по 96-луночному планшету для последующего прикрепления к нему и дифференцировки. Полученные клетки подвергали иммуногистохимическому анализу с использованием антител против мышцеспецифического актина (Dako, USA), эндодермоспецифического α-1-фектопротеина (Dako, USA) и экзодермоспецифического S100 (Dako, USA) вместе с набором DAKO LSAB и системой пероксидазы, конъюгированной с авиди-ном/биотином.
На фиг.5b-5d, проиллюстрированы результаты иммуногистохимических анализов эмбриоидных тел с использованием антител против актина, α-1-фектопротеина и S100 соответственно. Как можно видеть на фиг.5b-5d, ЭЗ клетки обладают способностью к дифференцировке in vitro в клетки различных типов, например эндодермальную, мезодермальную и эктодермальную линии.
Пример 4:
Продуцирование химерных кур
Эмбрионы кур породы "корейский огол" на стадии развития Х или 13-17 (Eyal-Giladi, H. et al., Dev. Biol, 49, 321-337 (1976)) были использованы как реципиенты.
Боковую часть или острый конец каждого яйца курицы породы пробивали для создания небольшого окошка, а затем удаляли скорлуповую оболочку.
ЭЗ клетки, полученные после 3 или 4 пассажей, как описано в Примере 2, суспендировали в среде для культивирования ЭЗ клеток при концентрации 103 клеток/мкл, а затем 2 мкл полученной суспензии инъецировали в зародышевую полость или в кровеносный сосуд яйца с помощью микропипетки. Яйца, инъецированные с использованием CEF, использовали в качестве контроля. Отверстие каждого яйца герметично закрывали двойным слоем парафиновой пленки, а затем яйца укладывали острыми концами на дно инкубатора для их вылупления. Вылупившихся цыплят выращивали в течение 3 месяцев и получали соматических химерных кур.
Из 45 яиц, эмбрионы которых были подвергнуты манипуляциям, 8 яиц были вылупившимися и из восьми цыплят 3 цыпленка (37,5%) по своему внешнему виду были химерными. Среди химерных цыплят два белых пятнистых цыпленка были выведены из эмбрионов, в которые были инъецированы ЭЗ клетки от 3 пассажей, а один цыпленок был выведен из эмбриона, в который были инъецированы ЭЗ клетки от 4 пассажей. У 3 цыплят степень белой пятнистости значительно варьировала. У контрольных цыплят белого оперения не наблюдалось.
На фиг. 6а показана пара типичных кур породы "корейский огол", имеющих черное оперение; а на фиг.6b показана соматически химерная курица, имеющая белые пятна вокруг шеи и на груди. Белый цвет оперения породы "белый леггорн" обусловлен присутствием доминантного гена, ответственного за ингибирование пигментации, (I/I), а цвет оперенья кур породы "корейский огол" обусловлен присутствием рецессивного гена, ответственного за пигментацию, (i/i). В соответствии с этим вышеуказанные результаты дают основание предполагать, что ЭЗ клетки породы "белый леггорн" обладают способностью к дифференцировке in vivo в эмбрионе-реципиенте кур породы "корейский огол", а следовательно, эти ЭЗ клетки являются плюрипотентными in vivo. Для подтверждения соматического химеризма кур были получены образцы геномных ДНК путем феноловой экстракции из мышцы, сердца, печени и гонады 5 цыплят, которые погибли во время высиживания, и эти образцы подвергали ПЦР-анализу с использованием праймеров, специфичных для SCAR белого леггорна (SCAR - амплифицированная область, характерная для данной последовательности), имеющих нуклеотидные последовательности SEQ ID NO:1 (прямой праймер) и SEQ ID NO:2 (обратный праймер).
ПЦР-реакции проводили в объеме 25 мкл с использованием 50-100 нг геномной ДНК, 0,2 мМ каждого dNTP, 10 мМ КСl, 1,5 мМ MgCL2, 0,4 пмоль прямого праймера, 0,4 пмоль обратного праймера и 1 единицу полимеразы Taq. ПЦР-протокол состоял из 45 циклов, которые проводили в контролируемом микрокомпьютером нагревательном блоке (Perkin-Elmer Cetus) и каждый из которых включал этапы: денатурации - 1 минута при 94oС, отжига - 1 минута при 60oС и удлинения праймера - 2 минуты при 72oС. Полученный ДНК-фрагмент, специфичный для белого леггорна, составлял приблизительно 3 т.п.н. На фиг.7 показаны результаты ПЦР-анализа на соматический химеризм: дорожки 1, 5, 9, 13 и 17 - ПЦР-продукты, полученные с использованием ДНК печени; дорожки 2, 6, 10, 14 и 18 - с использованием ДНК мышцы; дорожки 3, 7, 11, 15 и 19 - с использованием ДНК сердца; дорожки 4, 8, 12, 16 и 20 - с использованием ДНК гонады; дорожка 21 - с использованием геномной ДНК кур породы "корейский огол"; дорожка 22 - с использованием геномной ДНК породы "белый леггорн" и дорожка 23 - без использования матрицы. Как можно видеть на фиг.7, соматический химеризм у отдельных особей варьируется; для одного из 5 цыплят во всех образцах ткани (печени, сердца, мышцы и гонад) наблюдался соматический химеризм. Инъецированные ЭЗ клетки входили в гонады двух вылупившихся цыплят и в сердце всех цыплят; а у двух цыплят обнаруживался соматический химеризм только в сердце. Эти результаты указывают на то, что куриные ЭЗ клетки могут претерпевать дифференцировку и входить in vivo в различные ткани, включая гонады.
Пример 5: Трансфекция чужеродного гена в ПЗК или ЭЗ клетки и их отбор
Ген-репортер (GFP или Lac Z) трансфецировали в ПЗК или ЭЗ клетки путем электропорации и с помощью липосомы
соответственно. Эффективность трансфекции гена составляет примерно 80% в случае использования электропорации и 30% в случае использования липосомы. Трансфецированные ПЗК или ЭЗ клетки пассировали в
среде DMEM, содержащей 350 мкг/мл неомицина, для отбора стабильно трансфецированных ПЗК или ЭЗ клеток.
Хотя описание настоящего изобретения относится к вышеописанным конкретным вариантам его осуществления, следует отметить, что каждый специалист может внести в настоящее изобретение различные модификации и изменения, которые также входят в объем изобретения, определенный в прилагаемой формуле изобретения.
Реферат
Изобретение относится к биотехнологии и может быть использовано для получения установившейся эмбриональной зародышевой линии птиц. Способ получения установившейся линии эмбриональных зародышевых (ЭЗ) клеток птиц (в частности, кур) включает стадии: культивирования примордиальных зародышевых клеток (ПЗК), выделенных из птичьей эмбриональной гонады, в среде, дополненной добавленным фактором роста клеток и фактором ингибирования дифференцировки, для получения колоний ЭЗ клеток; культивирования ЭЗ клеток в среде с использованием питающего слоя вплоть до образования колоний ЭЗ клеток и выделения и субкультивирования ЭЗ клеток в среде с получением установившейся ЭЗ клеточной линии. Соматические или половые химеры получают путем инъекции линии клеток в яйцо. Чужеродный ген трансфицируют в линию клеток с помощью электропорации или липосомы. Изобретение позволяет разрабатывать метод разведения трансгенных животных. 4 с. и 15 з.п.ф-лы, 12 ил.


Комментарии