Гуманизированные m-csf мыши - RU2730643C2
Код документа: RU2730643C2
Чертежи











Описание
Область техники
Изобретение относится к генетически модифицированным мышам, содержащим ген, кодирующий белок M-CSF человека, и мышам, которые содержат дополнительные модификации, способствующие приживлению гемопоэтических клеток человека.
Уровень техники
Развитие животных моделей для изучения заболеваний человека в значительной степени способствовало пониманию механизмов, лежащих в основе некоторых заболеваний, включая рак. В настоящее время признано, что животные модели, в частности, мыши, являются превосходными кандидатами для оценки качества и эффективности лекарственных препаратов и возможностей терапии. В то время как использование этих суррогатных моделей для изучения биологии и болезней человека в значительной степени оправдано (вследствие этических и технических ограничений на проведение экспериментального лечения на людях), в результате исследований стала актуальной проблема, связанная с возможными ограничениями экстраполирования данных от мышей к людям (Mestas J, Hughes СС. (2004) Of mice и not men: differences between mouse и human immunology. J Immunol. 172: 2731-2738).
В течение многих лет существует необходимость в создании гуманизированных мышиных моделей с целью преодоления этих ограничений. Напряженная работа нескольких групп исследователей успешно продемонстрировала возможность изучения биологии и заболеваний человека на мышах. Поскольку наличие функциональной и эффективной иммунной системы у реципиентов приводит к уничтожению трансплантированных тканей/клеток человеческого происхождения, использование генетических мутантов, лишенных клеток адаптивной иммунной системы, таких как Т, В и NK-клетки, значительно способствует успеху гуманизированной мышиной модели. Исходя из этого, наиболее эффективные варианты гуманизированных мышиных моделей включают NOD-SCID и Balb/c штаммы, у которых отсутствуют гены активации рекомбинации (RAG), общей гамма-цепи (γС, также известный как "рецептор интерлейкина 2, гамма", или IL2rg), бета2 микроглобин (В2М) и перфорин 1(Prf1) (Shultz LD, et al. (2007) Humanized mice in translational biomedical research, Nat. Rev. Immunol. 7: 118-130). Проведенные в течение нескольких последних десятилетий исследования показали возможность трансплантации нескольких типов тканей человека, включая лейкоциты периферической крови, клетки эмбриональной печени, эмбриональной кости, эмбрионального тимуса, эмбриональных лимфатических узлов, васкуяризированной кожи, сегментов артерий, а также мобилизованных гемопоэтических стволовых клеток или гемопоэтических стволовых клеток пуповинной крови (ГСК) некоторым гуманизированным мышам (Macchiarini F., et al. (2005) Humanized mice: are we there yet? J. Exp. Med. 202: 1307-1311). Считается, что этот подход обеспечит улучшенные модельные системы, поскольку данные, полученные от человеческих клеток, имеющихся в этих мышах, могут отражать физиологию человеческой системы. Главным направлением исследований в этой области является создание мышей с полной гемопоэтической системой и функциональной иммунной системой человеческого происхождения. Несмотря на то, что в создании мышей с ослабленным иммунитетом и человеческими Т-лимфоцитами, В-лимфоцитами, NK-клетками и дендритными клетками (DCs) достигнут значительный прогресс, в этой области еще остается несколько сложных проблем, одной из которых является недостаточная миелоидная дифференцировка у гуманизированных мышей.
Интересно отметить, что в формировании человеческих Т-клеток, В-клеток, NK-клеток и дендритных клеток (DCs) из гемопоэтических стволовых клеток (ГСК) у гуманизированных мышей были достигнуты большие успехи. Введение человеческих ГСК этим мышам, в дополнение к индивидуальному гематопоэтическому компартменту, приводило к восстановлению лимфоидных органов, таких как тимус и селезенка. Тем не менее, количества миелоидных клеток, в частности, гранулоцитов, макрофагов, эритроцитов и мегакариоцитов, являются очень низкими - результат, вероятно, обусловленный неэффективным миелопоэзом из человеческих ГСК у этих мышей (Shultz et al. (2007); Macchiarini et al. (2005)). Принимая во внимание тот факт, что клетки миелоидного происхождения (такие как эритроциты и мегакариоциты) имеют жизненно важное значение для нормального функционирования кровеносной системы, а гранулоциты и макрофаги крайне важны для развития системы адаптивного иммунитета, создание гуманизированных мышей с эффективным человеческим миелопоэзом имеет огромное значение.
Таким образом, в данной области техники существует необходимость в генетически модифицированных мышах, способных к улучшенному человеческому миелопоэзу в результате приживления человеческих ГСК (Manz MG. Human-hemato-lymphoid-system mice: opportunities и challenges. Immunity. 2007 May; 26(5): 537-41).
Раскрытие изобретения
Предоставляются генетически модифицированные мыши, содержащие нуклеиновокислотную последовательность, кодирующую белок M-CSF человека. Также предоставляются генетически модифицированные мыши, содержащие нуклеиновокислотную последовательность, кодирующую белок M-CSF человека, которым сделана пересадка человеческих клеток, таких как гемопоэтические клетки человека, и способы создания таких «привитых» мышей (т.е. мышей с пересаженными человеческими клетками). Эти мыши находят целый ряд применений, таких как моделирование иммунной болезни человека и инфекции болезнетворными микроорганизмами; при in vivo поиске веществ, которые модулируют развитие и/или активность гемопоэтических клеток, например, в нормальном состоянии или в болезненном состоянии; при in vivo поиске веществ, токсичных для гемопоэтических клеток; при скрининге in vivo веществ, которые предотвращают, уменьшают или аннулируют токсические эффекты токсических веществ на гемопоэтические клетки; при скрининге in vivo человеческих гемопоэтических клеток, полученных от индивидуума, для прогнозирования чувствительности индивидуума к лечению заболевания и т.д.
В некоторых аспектах изобретения предоставляется гуманизированная M-CSF мышь, причем гуманизированный M-CSF содержит нуклеиновокислотную последовательность, которая кодирует белок M-CSF человека и функционально связана с регуляторной последовательностью 5' мышиного M-CSF локуса структурных генов, например, промотором M-CSF мыши, 5'UTR и т.д. В некоторых вариантах осуществления мышь содержит две копии нуклеиновокислотной последовательности. В некоторых вариантах осуществления нуклеиновокислотная последовательность располагается в геноме мыши внутри локуса M-CSF мыши. В некоторых вариантах осуществления нуклеиновокислотная последовательность функционально связана с эндогенным промотором M-CSF мыши в локусе M-CSF мыши, т.е. мышь представляет собой M-CSFh/m мышь. В некоторых вариантах осуществления мышь содержит два аллеля, в которых нуклеиновокислотная последовательность располагается в геноме мыши внутри локуса M-CSF мыши. В некоторых вариантах осуществления нуклеиновокислотная последовательность обоих аллелей функционально связана с эндогенным промотором М-CSF мыши в локусе M-CSF мыши, т.е. мышь является M-CSFh/h мышью. В некоторых вариантах осуществления гуманизированная M-CSF мышь содержит нулевую мутацию (нуль-мутацию), по меньшей мере, в одном аллеле M-CSF мыши. В некоторых вариантах осуществления гуманизированная M-CSF мышь содержит нуль-мутацию в обеих аллелях M-CSF мыши. В некоторых таких вариантах осуществления нуль-мутация представляет собой делецию экзонов 2-9 M-CSF мыши.
В некоторых вариантах осуществления мышь экспрессирует человеческий M-CSF в костном мозге, селезенке, крови, печени, мозге, легких, семенниках и почках. В некоторых вариантах осуществления количество экспрессированного человеческого М-CSF практически равно количеству мышиного M-CSF, экспрессированного у мыши дикого типа. В некоторых вариантах осуществления мезенхимальные стромальные клетки костного мозга гуманизированной M-CSF мыши экспрессируют количество человеческого M-CSF, которое практически равно количеству мышиного M-CSF, экспрессированного мезенхимальными стромальными клетками костного мозга мыши дикого типа. В некоторых вариантах осуществления гуманизированная M-CSF мышь имеет физиологическую концентрацию M-CSF в крови и/или ткани. В некоторых вариантах осуществления мышь экспрессирует как мышиный M-CSF, так и человеческий M-CSF. В других вариантах осуществления единственный M-CSF, который экспресирует мышь, является человеческим M-CSF.
В некоторых вариантах осуществления мышь секретирует достаточное количество человеческого M-CSF для дифференцировки привитых человеческих гемопоэтических стволовых клеток в человеческие моноциты, человеческие макрофаги и человеческие остеокласты. В некоторых вариантах осуществления мышь секретирует эффективное количество M-CSF, для стимулирования развития человеческих макрофагов из человеческих моноцитов, которое происходит в результате приживления человеческих гемопоэтических стволовых клеток у мыши. В некоторых вариантах осуществления мышь секретирует эффективное количество M-CSF, чтобы стимулировать развитие человеческой гемопоэтической стволовой клетки в монобласт, монобласта в человеческий промоноцит, человеческого промоноцита в человеческий моноцит и человеческого моноцита в человеческий макрофаг у мыши, которой привили человеческие гемопоэтическимиестволовые клетки. В некоторых вариантах осуществления эффективное количество человеческого M-CSF, секретированного у мыши, практически является одинаковым с количеством мышиного M-CSF, секретированного мышью дикого типа, для достижения соответствующего результата (например, эффективное количество мышиного M-CSF для стимуляции развития мышиного макрофага из мышиного моноцита).
В некоторых вариантах осуществления контроль транскрипции и трансляции человеческого M-CSF у генетически модифицированной мыши аналогичен или практически аналогичен контролю транскрипции и трансляции мышиного M-CSF у мыши, у которой отсутствует модификация ее эндогенного мышиного M-CSF гена.
В некоторых вариантах осуществления физиологическая концентрация человеческого M-CSF у гуманизированной мыши M-CSF возникает в результате секреции человеческого M-CSF теми же типами клеток, которые секретируют мышиный M-CSF у мыши дикого типа, которая имеет мышиный M-CSF ген и не имеет нуклеиновой кислоты, кодирующей человеческий M-CSF белок. Другими словами, одна или более изоформ М-CSF экспрессируются в рамках нормального тканеспецифичного и эволюционного профиля.
В некоторых вариантах осуществления мышь экспрессирует изоформу человеческого M-CSF, выбранную из протеогликана M-CSF, гликопротеина M-CSF и М-CSF клеточной поверхности и их комбинации. В одном варианте осуществления мышь экспрессирует, по меньшей мере, две из изоформ в рамках нормального тканеспецифичного и эволюционного профиля. В отдельном варианте осуществления мышь экспрессирует человеческий протеогликан CSF-1 и человеческий гликопротеин М-CSF и человеческий M-CSF клеточной поверхности.
В некоторых вариантах осуществления мышь содержит человеческие макрофаги, которые не являются макрофагами, полученными из Т-клеток тимуса. В некоторых вариантах осуществления мышь содержит человеческие макрофаги, которые обнаруживают M-CSF-зависимое образование подосом, вызванное человеческим M-CSF, экспрессированным у мыши.
В некоторых вариантах осуществления мышь является гомозиготной по нуль-мутации Rag2. В некоторых вариантах осуществления мышь является гомозиготной по нуль-мутации IL2rg. В некоторых вариантах осуществления мышь является гомозиготной по нуль-мутации Rag2 и IL2rg. В некоторых вариантах осуществления мышь содержит человеческие клетки. В некоторых вариантах осуществления человеческие клетки представляют собой гемопоэтические клетки.
В некоторых аспектах изобретения предоставляется мышиная модель иммунной системы человека, мышиная модель, содержащая 2 нулевых аллеля Rag2, 2 нулевых аллеля IL2rg, нуклеиновокислотную последовательность, которая кодирует человеческий M-CSF белок, функционально связанная с промотором гена M-CSF мыши, и человеческие гемопоэтические клетки. Другими словами, мышь представляет собой «привитую» Rag2-/- IL2rg-/-M-CSF мышь, где hM-CSF обозначает, что мышь содержит, по меньшей мере, одну нуклеиновую кислоту, кодирующую ген M-CSF человека. В некоторых вариантах осуществления «привитая» Rag2-/-IL2rg-/- hM-CSF мышь представляет собой мышь штамма BALB/c, содержащую эти генетические модификации. В некоторых вариантах осуществления мышь также содержит другие генетические модификации.
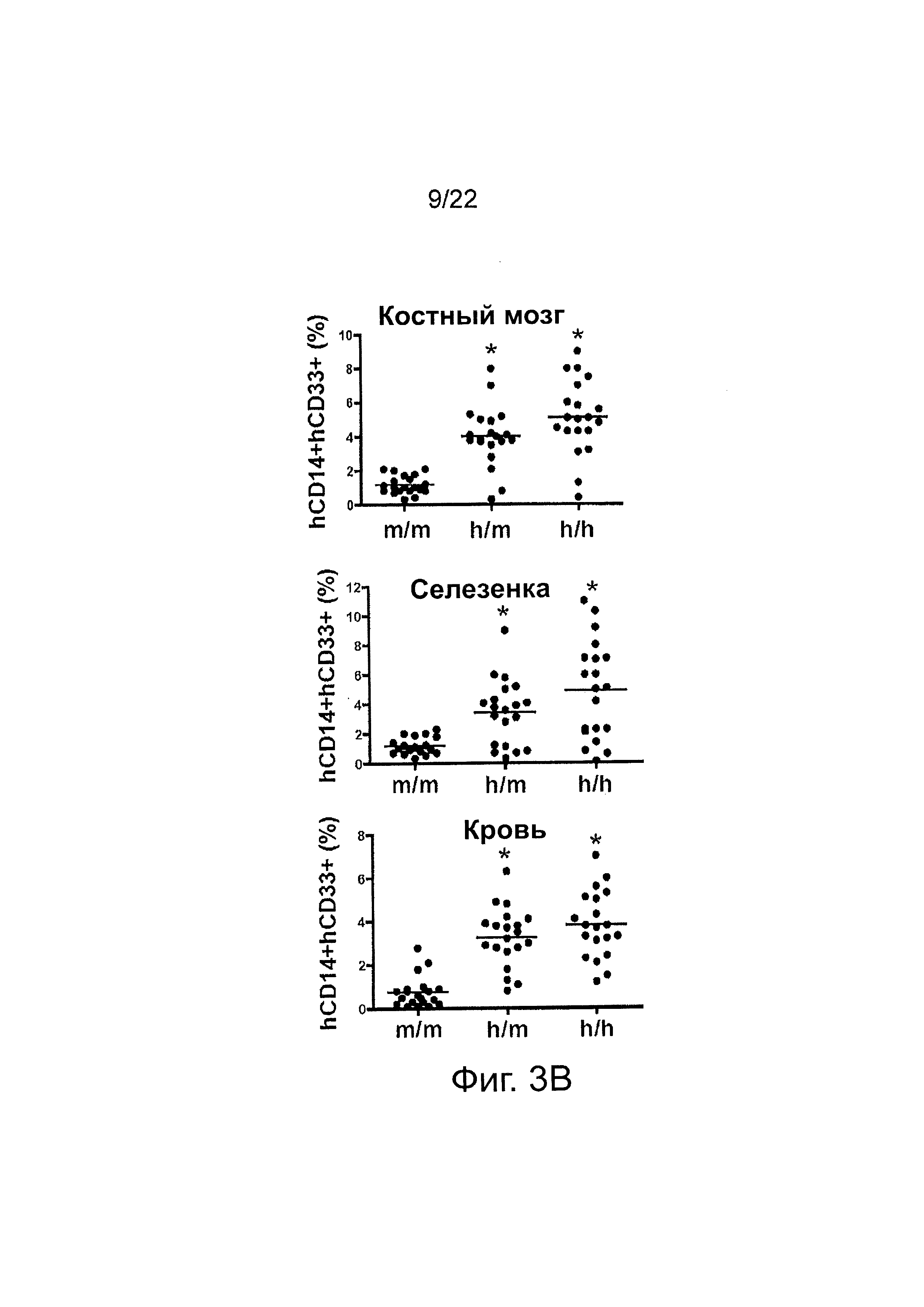
В некоторых вариантах осуществления у «привитой» Rag2-/-IL2rg-/- hM-CSF мыши в возрасте около 12 недель наблюдается повышенное количество человеческих CD14+CD33+ (hCD14+CD33+) клеток в костном мозге, селезенке и периферической крови по сравнению с мышью, содержащей человеческие гемопоэтические клетки, которые экспрессируют мышиный M-CSF, а не человеческий M-CSF. В определенном варианте осуществления увеличение hCD14+CD33+ клеток костного мозга по сравнению с мышью, экспрессирующей только мышиный M-CSF, составляет примерно от 5 до 15 раз, в одном варианте осуществления примерно от 12 до 14 раз. В определенном варианте осуществления увеличение hCD14+CD33+ клеток селезенки по сравнению с мышью, содержащей человеческие гемопоэтические клетки, которые экспрессируют только мышиный M-CSF, составляет примерно от 2 до 6 раз, в одном варианте осуществления примерно от 5 до 6 раз. В определенном варианте осуществления увеличение hCD14+CD33+ клеток периферической крови по сравнению с мышью, содержащей человеческие гемопоэтические клетки, которые экспрессируют только мышиный M-CSF, составляет примерно от 2 до 8 раз, в одном варианте осуществления примерно от 5 до 7 раз.
В некоторых вариантах осуществления у «привитой» Rag2-/-IL2rg-/- hM-CSF мыши в возрасте около 12 недель наблюдается уровень hCD14+CD33+ клеток моноцитарно/макрофагальной линии дифференцировки в крови, составляющий примерно от 15 до 40%, в одном варианте осуществления примерно 30%. В одном варианте осуществления генетически модифицированная «привитая» мышь в возрасте около 16 недель демонстрирует уровень hCD14+CD33+ клеток моноцитарно/макрофагальной линии дифференцировки в крови, составляющий примерно от 15 до 30%, в одном варианте осуществления примерно 22%. В одном варианте осуществления генетически модифицированная «привитая» мышь в возрасте около 20 недель демонстрирует уровень hCD14+CD33+ клеток моноцитарно/макрофагальной линии дифференцировки в крови, составляющий примерно от 5 до 15%, в одном варианте осуществления примерно 10%. В одном варианте осуществления генетически модифицированная «привитая» мышь в возрасте около 20 недель демонстрирует уровень hCD14+CD33+ клеток моноцитарно/макрофагальной линии дифференцировки в крови, который примерно от 4 до 8 раз выше, чем уровень у «привитой» мыши, экспрессирующей мышиный M-CSF, а не человеческий M-CSF, в одном варианте осуществления примерно в 6 раз выше.
В некоторых вариантах осуществления «привитая» Rag2-/-IL2rg-/- hM-CSF мышь в возрасте около 12 недель демонстрирует уровень hCD14+CD33+CD45+ клеток в печени, который примерно в 1,5-6 раз выше, чем у «привитой» мыши, экспрессирующей мышиный M-CSF, а не человеческий M-CSF. В одном варианте осуществления генетически модифицированная «привитая» мышь в возрасте около 12 недель демонстрирует уровень hCD14+CD33+CD45+ клеток в легких, который примерно в 1,5-10 раз выше, чем у «привитой» мыши, экспрессирующей мышиный M-CSF, а не человеческий M-CSF. В одном варианте осуществления генетически модифицированная «привитая» мышь в возрасте около 12 недель демонстрирует уровень человеческих hCD14+CD33+CD45+ клеток в брюшной полости или коже, который примерно в 2-3 раза выше, чем у «привитой» мыши, экспрессирующей мышиный M-CSF, а не человеческий M-CSF.
В некоторых вариантах осуществления «привитая» Rag2-/-IL2rg-/- hM-CSF мышь демонстрирует ответ на введение LPS, который примерно в 1,5-6 раз выше относительно процентного содержания hCD14+CD33+ клеток в печени, чем мышь, у которой отсутствует человеческий M-CSF, в одном варианте осуществления примерно в 2-4 раза; в легких LPS-ответ относительно клеток hCD14+CD33+ является примерно 1,5-10-кратным, в одном варианте осуществления примерно 2-3-кратным; в коже LPS-ответ относительно hCD14+CD33+ является 2-5-кратным, в одном варианте осуществления примерно 3-4-кратным; в брюшной полости LPS-ответ относительно hCD14+CD33+ является 2-5-кратным, в одном варианте осуществления примерно 3-4-кратным.
В некоторых вариантах осуществления «привитая» Rag2-/-IL2rg-/- hM-CSF мышь демонстрирует в ответ на стимуляцию LPS усиленный ответ провоспалительных цитокинов, причем усиление по сравнению с генетически модифицированной и «привитой» мышью, у которой отсутствует ген hM-CSF, составляет примерно от 2, по меньшей мере, до 5 раз относительно уровня активации и/или дифферецировки типа клеток, который чувствителен к провоспалительному цитокину.
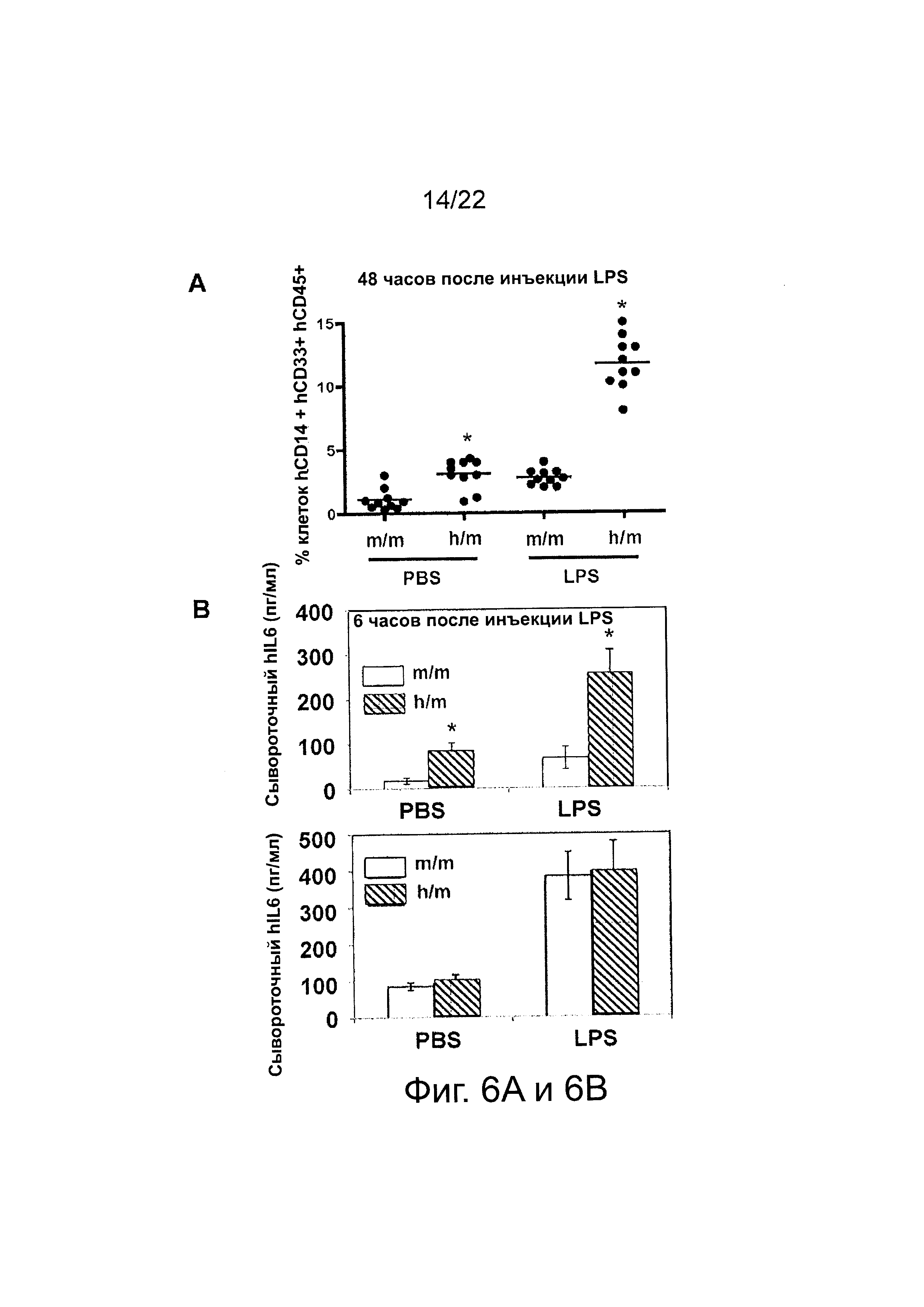
В некоторых вариантах осуществления «привитая» Rag2-/-IL2rg-/- hM-CSF мышь демонстрирует увеличенную выработку hCD14+CD33+hCD45+ клеток в селезенке примерно через 48 часов после введения LPS, причем увеличение составляет примерно от 2 до 5 раз, в одном варианте осуществления примерно от 4 до 5 раз, по сравнению с «привитой» мышью, экспрессирующей мышиный M-CSF, а не человеческий M-CSF.
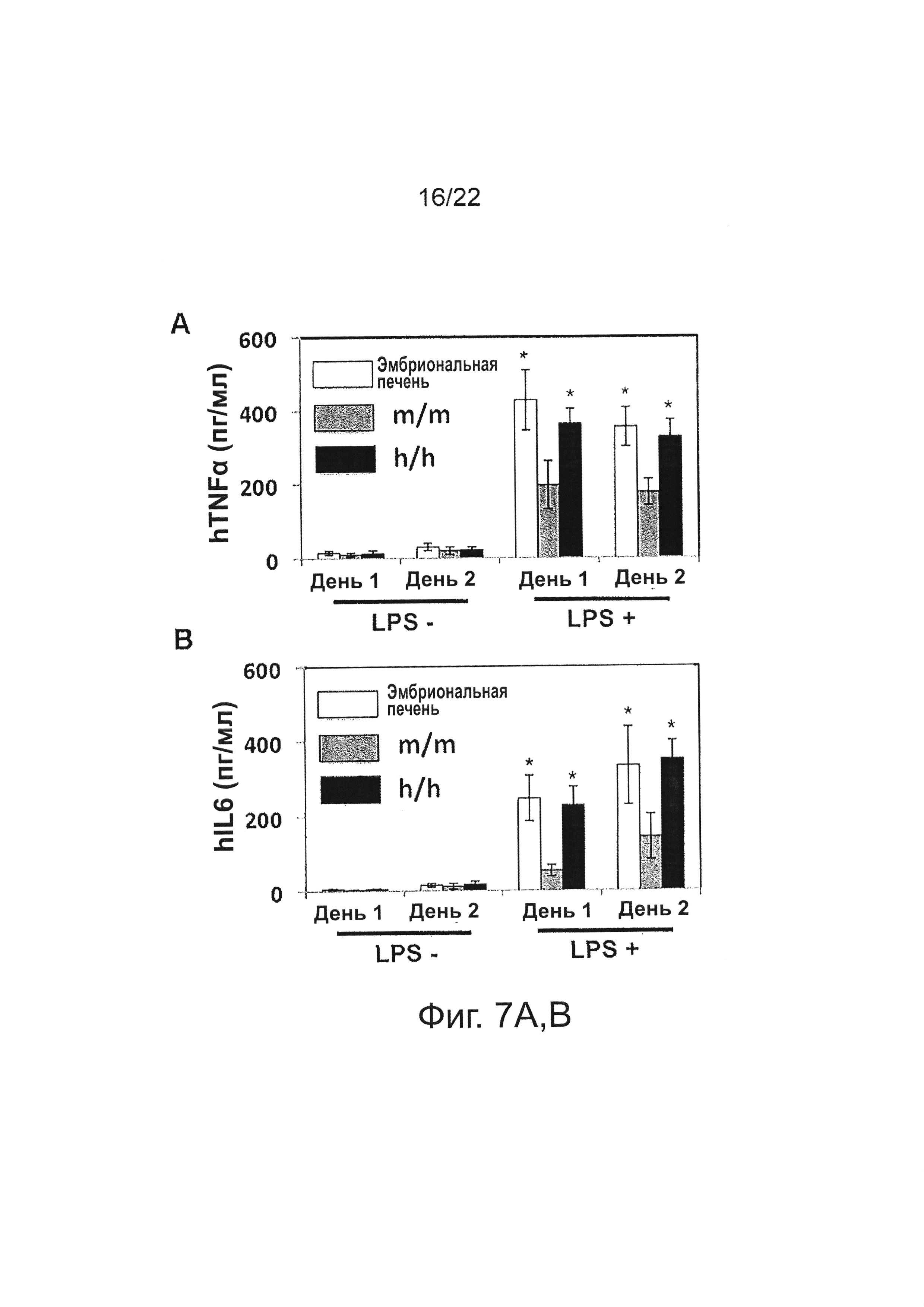
В некоторых вариантах осуществления «привитая» Rag2-/-IL2rg-/- hM-CSF мышь демонстрирует повышенную выработку человеческого сывороточного IL-6 в ответ на LPS, причем уровень hIL-6 примерно через 6 часов после введения LPS увеличивается примерно в 2-5 раз по сравнению с «привитой» мышью, экспрессирующей мышиный М-CSF, а не человеческий M-CSF, в одном варианте осуществления примерно в 3-4 раза.
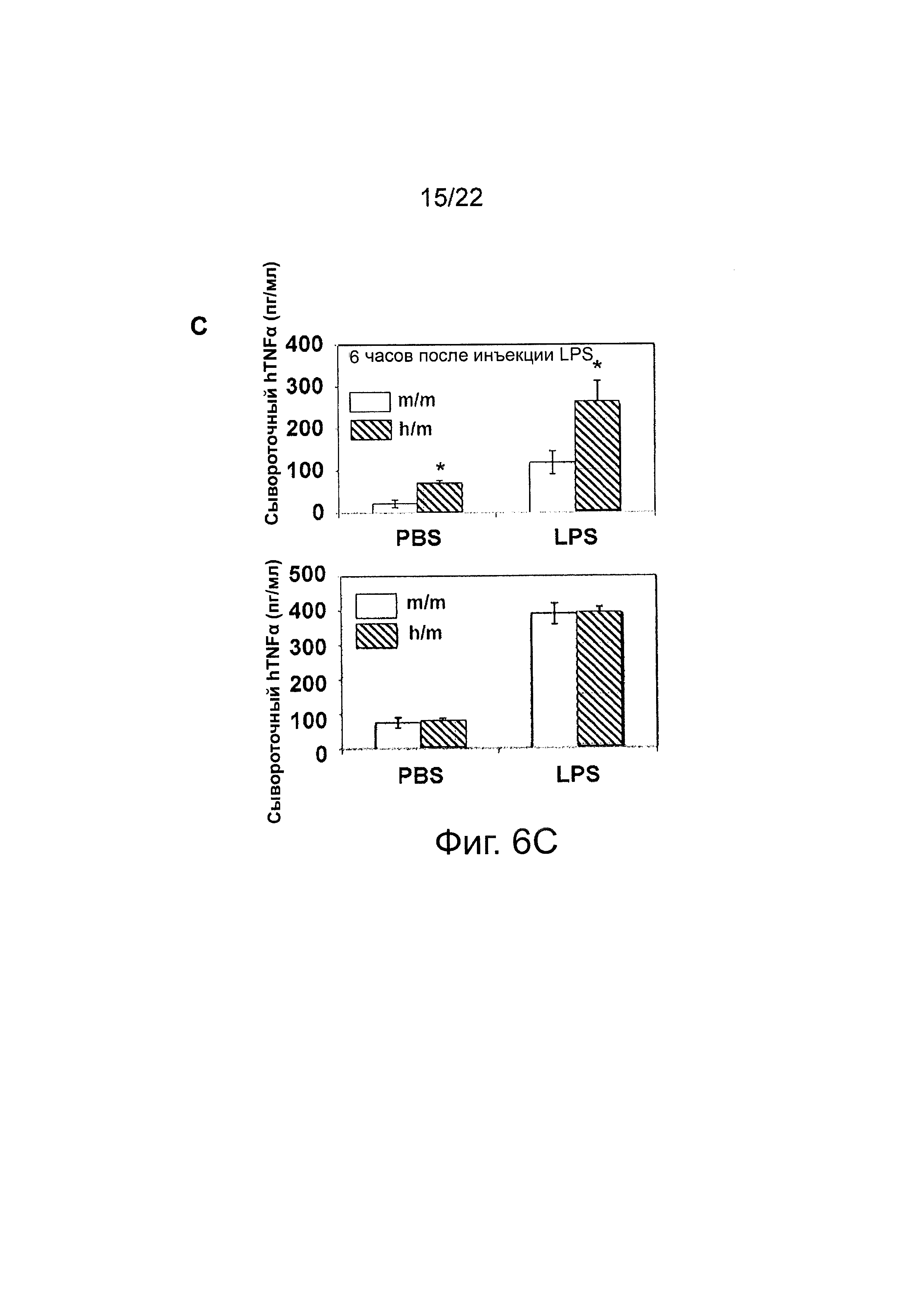
В некоторых вариантах осуществления «привитая» Rag2-/-IL2rg-/- hM-CSF мышь демонстрирует повышенную выработку человеческого сывороточного TNFα в ответ на LPS, причем уровень hTNFα примерно через 6 часов после введения LPS увеличивается примерно в 2-4 раза по сравнению с «привитой» мышью, которая экспрессирует мышиный M-CSF, а не человеческий M-CSF, в одном варианте осуществления примерно в 2-3 раза.
В некоторых вариантах осуществления моноцит и/или макрофаг, полученный от «привитой» Rag2-/-IL2rg-/- hM-CSF мыши, после LPS-стимуляции демонстрирует in vitro секрецию hTNFα, которая примерно в 2-3 раза выше, чем у «привитой» мыши, экспрессирующей мышиный M-CSF, а не человеческий M-CSF.
В некоторых вариантах осуществления моноцит и/или макрофаг, полученный от «привитой» Rag2-/-IL2rg-/- hM-CSF мыши, после LPS-стимуляции демонстрирует in vitro секрецию hIL-6, которая примерно в 2-4 раза выше, чем у «привитой» мыши, экспрессирующей мышиный M-CSF, а не человеческий M-CSF.
В некоторых вариантах осуществления моноцит и/или макрофаг, полученный от «привитой» Rag2-/-lL2rg-/- hM-CSF мыши, после стимуляции poly I:C in vitro демонстрирует секрецию hIFNα, которая примерно в 3-6 раз выше, чем у «привитой» мыши, экспрессирующей мышиный M-CSF, а не человеческий M-CSF.
В некоторых вариантах осуществления моноцит и/или макрофаг, полученный от «привитой» Rag2-/-lL2rg-/- hM-CSF мыши, после стимуляции poly I:C in vitro демонстрирует секрецию hIFΝβ, которая примерно в 2-3 раза выше, чем у «привитой» мыши, экспрессирующей мышиный M-CSF, а не человеческий M-CSF.
В некоторых вариантах осуществления человеческий моноцит и/или макрофаг, полученный от «привитой» Rag2-/-IL2rg-/- hM-CSF мыши, демонстрирует повышенный фагоцитоз по сравнению с «привитой» мышью, экспрессирующей мышиный M-CSF, а не человеческий M-CSF. В одном варианте осуществления скорость фагоцитоза увеличивается примерно в два раза, как определено по включению меченых бактерий при 37°С в течение 60-минутного периода времени, по сравнению с человеческими клетками от «привитой» мыши, экспрессирующей мышиный M-CSF, а не человеческий M-CSF. В одном варианте осуществления, скорость фагоцитоза, как определено выше, в два раза или более превышает скорость человеческих клеток от «привитой» мыши, которая экспрессирует мышиный M-CSF, а не человеческий M-CSF, например, в 2 раза, в 3 раза или в 4 раза или более.
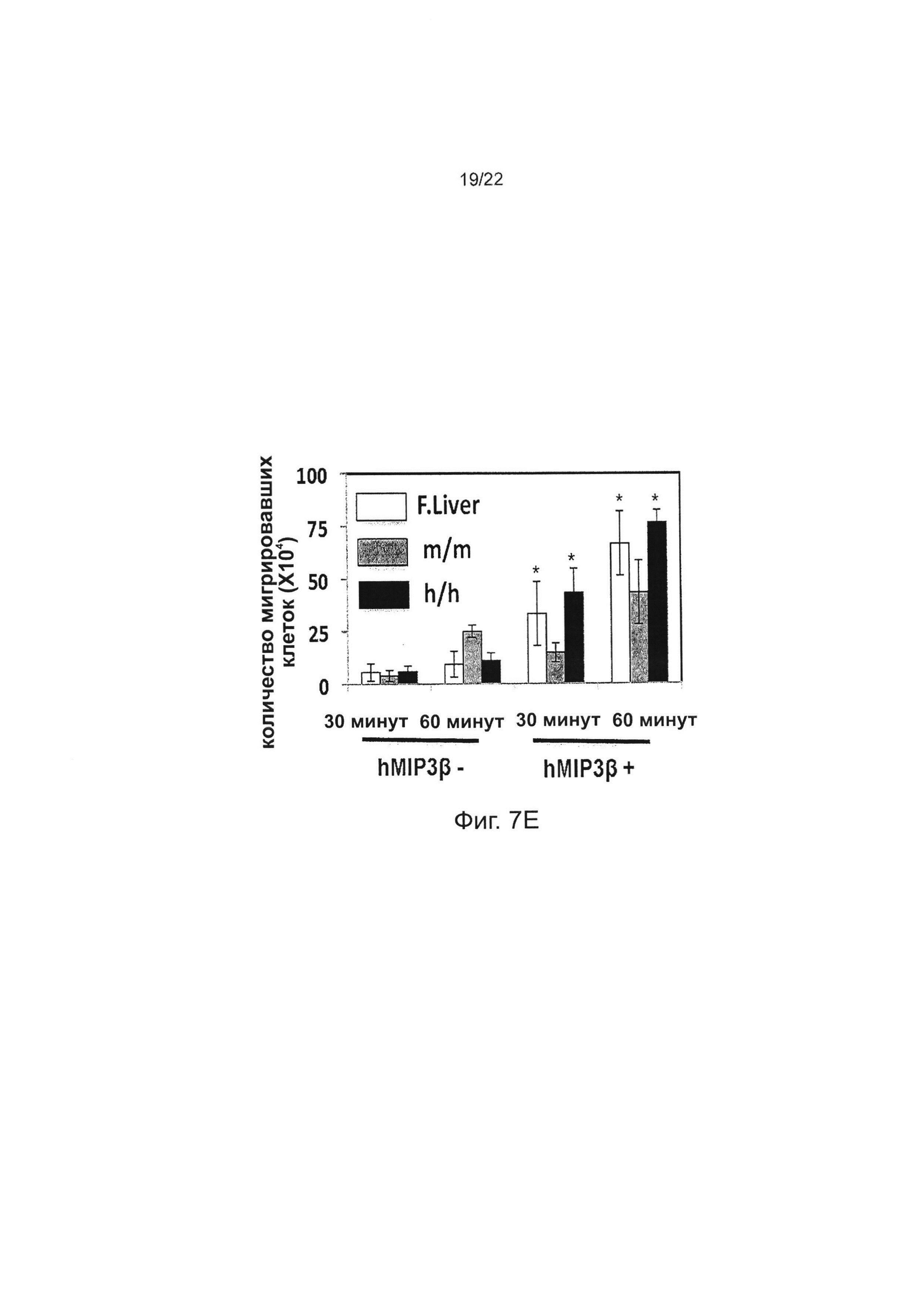
В некоторых вариантах осуществления человеческий моноцит и/или макрофаг, полученный от «привитой» Rag2-/-IL2rg-/- hM-CSF мыши, демонстрирует повышенный хемотаксис in vitro в ответ на Μip3β по сравнению с «привитой» мышью, которая экспрессирует мышиный M-CSF, а не человеческий M-CSF. В одном варианте осуществления увеличение составляет примерно от 1,5 до 3 раз или более, например, около 1,5 раз, 2 раз, 3 раз, 4 раз или более, как измерено по числу мигрировавших клеток через 30 или 60 минут после воздействия Μip3β, по сравнению с человеческим моноцитом и/или макрофагом от «привитой» мыши, экспрессирующей мышиный M-CSF, а не человеческий M-CSF.
В некоторых вариантах осуществления человеческий моноцит и/или макрофаг, полученный от «привитой» Rag2-/-IL2rg-/-M-CSFh мыши, демонстрирует in vitro секрецию hIFNα в ответ на стимуляцию poly I:С, которая примерно в 3-6 раз выше, чем у «привитой» мыши, экспрессирующей мышиный M-CSF, но не человеческий M-CSF F.
В некоторых вариантах осуществления человеческий моноцит и/или макрофаг, полученный от «привитой» Rag2-/-IL2rg-/- hM-CSF мыши, демонстрирует in vitro повышенную регуляцию костимулирующей молекулы в ответ на стимуляцию LPS. В одном варианте осуществления костимулирующую молекулу выбирают из человеческого CD40, человеческого CD80, человеческого CD86, человеческого HLA-DR и их комбинации.
В некоторых аспектах изобретения предоставляется генетически модифицированная «привитая» мышь, при этом мышь содержит трансплантат человеческих гемопоэтических клеток, является Rag2-/-Il2rg-/-, содержит нулевой аллель мышиного M-CSF и содержит нуклеиновокислотную последовательность, кодирующую человеческий M-CSF в эндогенном локусе M-CSF, причем мышь демонстрирует увеличение или увеличенное количество человеческих миелоидных клеток по сравнению с мышью, экспрессирующей мышиный M-CSF, а не человеческий M-CSF.
В некоторых вариантах осуществления увеличение составляет, по меньшей мере, удвоение числа hCD14+CD33+ клеток в какой-либо части тела мыши, выбранной из костного мозга, селезенки и периферической крови. В отдельном варианте осуществления увеличение представляет собой троекратное увеличение hCD14+CD33+ клеток. В другом варианте осуществления увеличение является увеличением числа hCD14+CD33+ клеток в 4-5 раз или более.
В некоторых вариантах осуществления увеличение является 2-3-кратным увеличением количества hCD14+CD33+hCD45+ клеток в части тела мыши, выбранной из кожи и брюшной полости.
В некоторых вариантах осуществления увеличение является 1,5-10-кратным увеличением количества hCD14+CD33+hCD45+ клеток в части тела мыши, выбранной из печени и легких.
В некоторых вариантах осуществления увеличение является 4-5-кратным увеличением количества hCD14+CD33+hCD45+ клеток селезенки примерно через 48 часов после LPS-стимуляции.
В некоторых вариантах осуществления увеличение является 2-4-кратным увеличением сывороточного hIL-6, стимулированного LPS, или сывороточного hTNFα, стимулированного LPS.
В некоторых вариантах осуществления увеличение является 2-3-кратным увеличением миграции hCD14+CD33+ клеток, стимулированных человеческим ΜΙΡ3β, in vitro.
В некоторых аспектах изобретения предоставляется мышиная модель патогена человека, мышиная модель, содержащая 2 нулевых аллеля Rag2, 2 нулевых аллеля IL2rg, нуклеиновокислотную последовательность, кодирующую человеческий M-CSF белок, функционально связанный с промотором M-CSF гена мыши, человеческие гемопоэтические клетки и заражение патогеном человека. Другими словами, мышь представляет собой привитую Rag2-/-IL2rg-/- hM-CSF мышь, которая была инфицирована патогеном человека. В некоторых вариантах осуществления патоген является вирусом, грибком или бактерией. В некоторых вариантах осуществления вирус представляет собой вирус человеческого или свиного или птичьего гриппа. В некоторых вариантах осуществления бактерия представляет собой микобактерию, например, Mycobacterium tuberculosis (M. tuberculosis). В некоторых вариантах осуществления бактерия представляет собой энтеробактерию, например, Salmonella typhi (S. typhi).
В некоторых аспектах изобретения предоставляется плюрипотентная, индуцированная плюрипотентная или тотипотентная мышиная клетка, содержащая нуклеиновокислотную последовательность, кодирующую человеческий M-CSF белок, функционально связанный с промотором M-CSF гена мыши. В одном варианте осуществления мышиная клетка представляет собой мышиную ES клетку.
В некоторых аспектах изобретения предоставляется мышиный эмбрион, содержащий нуклеиновокислотную последовательность, кодирующую человеческий М-CSF белок, функционально связанный с промотором M-CSF гена мыши.
В некоторых аспектах изобретения предоставляется нацеливающая конструкция для нацеливания на ген M-CSF мыши, содержащая (а) лежащие выше и ниже (по ходу транскрипции) нацеливающие «плечи», комплементарные или в основном комплементарные лежащим выше и ниже (по ходу транскрипции) нуклеотидным последовательностям или (i) нуклеиновокислотной последовательности, кодирующей мышиный белок M-CSF, или (ii) нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей мышиный белок M-CSF; (b) человеческую нуклеиновокислотную последовательность, кодирующую человеческий белок M-CSF или его фрагмент, или нуклеотидную последовательность, кодирующую комплемент бежа M-CSF человека или его фрагмент; и, (с) маркер и/или селекционную кассету.
В некоторых аспектах изобретения предоставляется человеческая иммунная клетка от описанной здесь мыши. В одном варианте осуществления человеческую иммунную клетку выбирают из человеческого моноцита и человеческого макрофага. В одном варианте осуществления человеческую иммунную клетку выбирают из человеческой NK-клетки, человеческой В-клетки и человеческой Т-клетки.
В некоторых аспектах изобретения предоставляется антитело, кодированное человеческой нуклеотидной последовательностью от описанной здесь мыши. В одном варианте осуществления антитело выбирают из антитела IgA, IgD, IgE, IgM или IgG изотипа.
В некоторых аспектах изобретения предоставляется нуклеотидная последовательность, кодирующая последовательность иммуноглобулина человека, при этом нуклеотидную последовательность получают от «привитой» гуманизированной М-CSF мыши в соответствии с изобретением. В одном варианте осуществления нуклеотидная последовательность кодирует человеческий вариабельный участок гена иммуноглобулина человека или его фрагмент. В одном варианте осуществления нуклеотидная последовательность кодирует вариабельный участок TCR человека или его фрагмент.
В некоторых аспектах изобретения предоставляется способ создания гуманизированной M-CSF мыши, экспрессирующей биологически активный человеческий M-CSF. В некоторых вариантах осуществления способ включает контактирование плюрипотентной стволовой клетки мыши, например, ES клетки или iPS клетки, с нуклеиновокислотной последовательностью, содержащей кодирующую последовательность белка M-CSF человека или его фрагмента, и культивирование плюрипотентной стволовой клетки в условиях, которые способствуют интеграции нуклеиновокислотной последовательности в геном мыши; создание мыши из мышиной ES клетки, которая содержит нуклеиновокислотную последовательность, кодирующую белок M-CSF человека; и содержание мыши в условиях, подходящих для того, чтобы у мыши происходила экспрессия человеческого M-CSF за счет M-CSF-гена человека. В некоторых вариантах осуществления нуклеиновокислотная последовательность интегрируется в геном случайным образом. В других вариантах осуществления нуклеиновокислотная последовательность интегрируется в целевой локус. В некоторых таких вариантах осуществления целевой локус представляет собой эндогенный локус M-CSF мыши, например, нуклеиновокислотную последовательность, содержащую кодирующую последовательность белка M-CSF человека, фланкируют последовательностями, которые гомологичны эндогенному локусу M-CSF мыши, и нуклеиновокислотную последовательность интегрируют в эндогенный локус M-CSF мыши путем гомологичной рекомбинации. В некоторых вариантах осуществления мышь является гомозиготной по нулевой мутации Rag2. В некоторых вариантах осуществления мышь является гомозиготной по нулевой мутации IL2rg. В некоторых вариантах осуществления мышь является гомозиготной по нулувой мутации Rag2 и IL2rg, т.е. является Rag2-/-IL2rg-/-.
В некоторых аспектах изобретения предоставляется способ создания гуманизированной M-CSF мыши, содержащей гемопоэтическую систему человека. В некоторых вариантах осуществления данный способ включает трансплантацию гуманизированной M-CSF мыши, например, Rag2-/-IL2rg-/- hM-CSF мыши или сублетально облученной hM-CSF мыши, популяции клеток, содержащей гемопоэтические прогениторные клетки человека. В некоторых вариантах осуществления гемопоэтические прогениторные клетки человека представляют собой CD34+ клетки. В некоторых вариантах осуществления гемопоэтические прогениторные клетки человека представляют собой CD133+ клетки. В некоторых вариантах осуществления гемопоэтические прогениторные клетки человека представляют собой плюрипотентные стволовые клетки, например, ES клетки или iPS клетки. В некоторых вариантах осуществления источником популяции клеток, содержащим гемопоэтические прогениторные клетки человека, является эмбриональная печень. В некоторых вариантах осуществления, источником клеток является костный мозг. В некоторых вариантах осуществления источником клеток является периферическая кровь. В некоторых вариантах осуществления, источником клеток является in vitro популяция клеток.
В некоторых аспектах изобретения предоставляется способ создания мыши, инфицированной патогеном человека. В некоторых вариантах осуществления способ включает воздействие патогена человека на гуманизированную M-CSF мышь, содержащую гемопоэтические клетки человека, например, привитую Rag2-/-IL2rg-/- hM-CSF мышь, или привитую сублетально облученную мышь, и содержание мыши в условиях, достаточных для того, чтобы патоген человека инфицировал мышь. В некоторых вариантах осуществления патоген человека представляет собой патоген человека, который не заражает мышь, у которой отсутствует одна или более описанных в документе генетических модификаций. В некоторых вариантах осуществления патоген человека представляет собой патоген человека, который не является патогенным для мыши, у которой отсутствует одна или более описанных в этом документе генетических модификаций.
В некоторых аспектах изобретения предоставляется способ создания биологически активного человеческого M-CSF у мыши, способ, включающий создание гуманизированной M-CSF мыши, экспрессирующей биологически активный человеческий M-CSF, как описано выше и где-либо еще в этом документе. В некоторых вариантах осуществления способ включает очистку биологически активного человеческого M-CSF из крови, например, сыворотки, или ткани мыши. В некоторых вариантах осуществления способ включает получение клетки, которая экспрессирует биологически активный человеческий M-CSF, от мыши, культивирование клетки в условиях, достаточных для экспрессии и секреции клеткой биологически активного человеческого M-CSF, и выделение секретированного биологически активного человеческого M-CSF. Следует отметить, что в этом аспекте изобретения не требуется, чтобы мышь имела какие-либо другие генетические модификации, и что мышь используется для создания препаратов определенных иммунных клеток человека. В связи с этим, в некоторых аспектах изобретения предоставляется выделенный, биологически активный человеческий M-CSF, полученный от трансгенной мыши.
В некоторых аспектах изобретения предоставляется способ создания активированного моноцита человека или активированного макрофага человека в мыши, включающий воздействие на гуманизированную M-CSF мышь с привитыми гемопоэтическими клетками человека иммуностимулятора, обеспечивающего активацию моноцитов или макрофагов человека у мыши, и выделение из мыши моноцитов человека или макрофагов человека, при этом фракция активированных моноцитов или активированных макрофагов приблизительно в два-пять раз больше, чем полученная от «привитой» мыши, которая не является гуманизированной M-CSF мышью, т.е. у которой отсутствует ген M-CSF человека. В некоторых вариантах осуществления иммуностимулятор представляет собой эндотоксин. В отдельном варианте осуществления эндотоксин представляет собой LPS.
В некоторых аспектах изобретения предоставляется способ скрининга вещества-кандидата с активностью, модулирующей функцию гемопоэтических клеток человека. В некоторых вариантах осуществления способ включает контактирование гуманизированной M-CSF мыши, «привитой» гемопоэтическими клетками человека, например, «привитой» Rag2-/-IL2rg-/- hM-CSF мыши или «привитой» hM-CSF сублетально облученной мыши, с веществом-кандидатом; и сравнение функции гемопоэтических клеток в мышиной модели, которая контактировала с веществом-кандидатом, с функцией гемопоэтических клеток в мышиной модели, которая не контактировала с веществом-кандидатом; при этом изменение функции гемопоэтических клеток у мыши, которая контактировала с веществом-кандидатом, указывает на то, что вещество-кандидат изменяет гемопоэтическую клеточную функцию.
В некоторых аспектах изобретения предоставляется способ определения эффекта вещества на патоген человека, включающий воздействие на привитую гуманизированную M-CSF мышь, например, привитую Rag2-/-IL2rg-/- hM-CSF мышь или привитую hM-CSF сублетально облученную мышь, эффективного количества патогена человека, причем эффективное количество патогена представляет собой количество патогена, необходимое для заражения мыши; обеспечение возможности заражения мыши патогеном; измерение показателя инфекции в течение некоторого времени в присутствии вещества; и сравнение этих измерений с измерениями, полученными от «привитой» гуманизированной M-CSF мыши, которая не подвергалась действию вещества. В некоторых вариантах осуществления вещество используется до воздействия патогена на мышь, например, чтобы определить защитный эффект. В некоторых вариантах осуществления вещество используется одновременно с воздействием патогена на мышь, например, для определения защитного или терапевтического эффекта. В некоторых вариантах осуществления вещество используется после воздействия патогена на мышь, например, для определения терапевтического эффекта. В некоторых вариантах осуществления в результате воздействия патогена у мыши повышается клеточный и/или гуморальный иммунный ответ, который воспроизводит заражение человека, подвергнутого действию патогена. В некоторых вариантах осуществления патоген человека представляет собой патоген, который не инфицирует мышь, у которой отсутствует одна или более описанных генетических модификаций. В некоторых вариантах осуществления патоген человека представляет собой патоген, который инфицирует мышь дикого типа, причем мышь дикого типа после заражения не воспроизводит иммунный ответ, который повышается у человека в ответ на патоген. В некоторых вариантах осуществления вирус является вирусом человеческого, свиного или птичьего гриппа. В некоторых вариантах осуществления бактерия является микобактерией, например, Mycobacterium tuberculosis (M. tuberculosis). В некоторых вариантах осуществления бактерия является энтеробактерией, например, Salmonella typhi (S. typhi). В некоторых вариантах осуществления мышь подвергается воздействию известного количества единиц патогена человека, и показателем заражения является количество инфекционных единиц патогена человека в жидкости тела или ткани мыши. В некоторых вариантах осуществления показателем заражения является титр в биологической жидкости мыши. В некоторых вариантах осуществления показателем заражения является образование гранулемы. В некоторых таких вариантах осуществления гранулема является гранулемой легких. В некоторых таких вариантах осуществления гранулема является хорошо выраженной гранулемой.
В некоторых аспектах изобретения предоставляется способ определения действия вещества на патоген человека, включающий воздействие на привитую гуманизированную M-CSF мышь, например, привитую Rag2-/-IL2rg-/- hM-CSF мышь или привитую hM-CSF сублетально облученную мышь, эффективного количества антигена патогена человека, при этом эффективное количество антигена представляет собой количество антигена, необходимое для оказания содействия клеточному и/или гуморальному иммунному ответу у мыши; предоставление возможности развития клеточного и/или гуморального ответа; измерение показателя клеточного и/или гуморального ответа в течение некоторого времени в присутствии вещества; и сравнение этого измерения с измерением, полученным от «привитой» гуманизированной M-CSF мыши, которую не подвергали воздействию вещества. В некоторых вариантах осуществления вещество используется перед воздействием на мышь антигена из патогена человека, например, для определения защитного действия вещества. В некоторых вариантах осуществления вещество используется одновременно с воздействием на мышь антигена из патогена человека, например, для определения защитного или терапевтического действия вещества. В некоторых вариантах осуществления вещество используется после воздействия на мышь антигена из патогена человека, например, для определения терапевтического действия вещества. В некоторых вариантах осуществления в результате воздействия патогена человека у мыши повышается клеточный и/или гуморальный иммунный ответ, который воспроизводит (моделирует) заражение человека, подвергнутого действию патогена.
В некоторых вариантах осуществления антиген является антигеном из патогена человека, который не инфицирует мышь, у которой отсутствует одна или более описанных здесь генетических модификаций. В других вариантах осуществления антиген является антигеном из патогена человека, который инфицирует мышь дикого типа, причем мышь дикого типа после заражения не воспроизводит иммунный ответ, который повышается у человека в ответ на патоген. В некоторых вариантах осуществления патоген является вирусом, грибком или бактерией. В некоторых вариантах осуществления вирус является вирусом человеческого или свиного или птичьего гриппа. В некоторых вариантах осуществления бактерия является микобактерией, например, Mycobacterium tuberculosis (M. tuberculosis). В некоторых вариантах осуществления бактерия является энтеробактерией, например, Salmonella typhi (S. typhi).
В некоторых аспектах изобретения предоставляется способ скрининга веществ-кандидатов на токсичность по отношению к гемопоэтическим клеткам человека. В некоторых вариантах осуществления способ включает контактирование гуманизированной M-CSF мыши, «привитой» гемопоэтическими клетками человека, например, «привитой» Rag2-/-IL2rg-/- hM-CSF мыши, с веществом-кандидатом; и сравнение жизнеспособности и/или функции гемопоэтических клеток у мыши, которая контактировала с веществом-кандидатом, с жизнеспособностью и/или функцией гемопоэтических клеток у гуманизированной M-CSF мыши, «привитой» гемопоэтическими клетками человека, которая не контактировала с веществом-кандидатом; причем уменьшение жизнеспособности и/или ухудшение функции гемопоэтических клеток у мыши, которая контактировала с веществом-кандидатом, указывает на то, что вещество-кандидат является токсичным для гемопоэтических клеток.
В некоторых аспектах изобретения предоставляется способ скрининга веществ-кандидатов в отношении их способности защищать гемопоэтические клетки человека от токсического вещества, уменьшать эффекты токсического вещества на гемопоэтические клетки человека, или отменять воздействия токсического вещества на гемопоэтические клетки человека. В некоторых вариантах осуществления способ включает контактирование гуманизированной M-CSF мыши, «привитой» гемопоэтическими клетками человека, например, «привитой» Rag2-/-IL2rg-/- hM-CSF мыши или «привитой» hM-CSF сублетально облученной мыши, с токсическим веществом; контактирование мыши с веществом-кандидатом; и сравнение жизнеспособности и/или функции гемопоэтических клеток у мыши, которая контактировала с веществом-кандидатом, с жизнеспособностью и/или функцией гемопоэтических клеток у гуманизированной M-CSF мыши, «привитой» человеческими гемопоэтическими клетками, которая не контактировала с веществом-кандидатом; причем увеличение жизнеспособности и/или функции гемопоэтических клеток в мышиной модели, которая контактировала с веществом-кандидатом, указывает на то, что вещество-кандидат защищает гемопоэтические клетки от токсического вещества.
В некоторых аспектах изобретения предоставляется способ прогнозирования (предсказания) чувствительности индивидуума к лечению терапевтическим средством. В некоторых вариантах осуществления способ включает контактирование гуманизированной M-CSF мыши, «привитой» человеческими гемопоэтическими клетками, полученными от индивидуума, например, «привитой» Rag2-/-IL2rg-/- hM-CSF мыши или «привитой» сублетально облученной hM-CSF мыши, с терапевтическим средством; и сравнение жизнеспособности и/или функции гемопоэтических клеток в мышиной модели, которая контактировала с веществом-кандидатом, с жизнеспособностью и/или функцией гемопоэтических клеток у гуманизированной M-CSF мыши, «привитой» человеческими гемопоэтическими клетками, которая не контактировала с веществом-кандидатом; причем изменение жизнеспособности и/или функции гемопоэтических клеток у мыши, которая контактировала с веществом-кандидатом, указывает на то, что индивидуум будет отвечать на лечение терапевтическим средством.
Краткое описание фигур
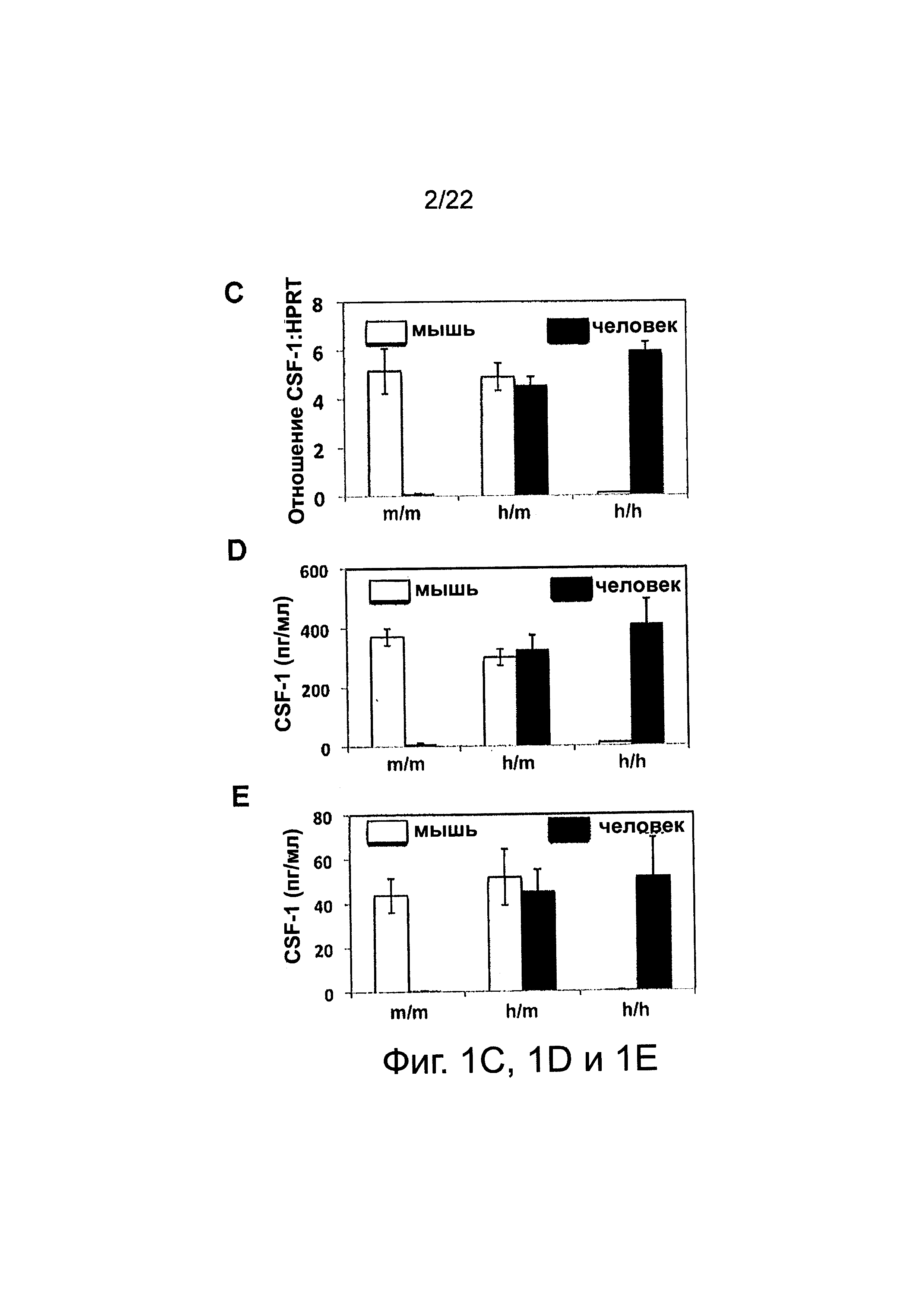
Фиг. 1 иллюстрирует (для мезенхимальных стромальных клеток костного мозга) (А) экспрессию M-CSF; указанные органы были выделены из M-CSFm/m и M-CSFh/h, была выделена РНК и проведен ПЦР анализ с обратной транскрипцией с использованием специфических праймеров как к мышиному M-CSF (верх) так и к человеческому M-CSF (середина); уровень HPRT (низ) использовали в качестве контроля внесения кДНК; данные представляют результаты 2 независимых экспериментов. (В) Были выделены указанные органы от M-CSFh/m, была выделена РНК и проведен анализ с использованием праймеров, специфичных или к мышиному M-CSF (верх) или человеческому M-CSF (середина). РНК, выделенная из печени мыши или из эмбриональной печени человека, служила положительным контролем для мышиных и человеческих пар праймеров, соответственно, в качестве отрицательных контролей служило отсутствие RT и матрицы ПЦР реакции. Данные представляют результаты 2х независимых экспериментов. (С) Выделяли ассоциированные с костью стромальные клетки от M-CSFm/m, M-CSFm/h и М-CSFh/h мышей и культивировали in vitro в течение 10 дней, клетки лизировали, выделяли РНК и проводили анализ ПЦР в реальном времени с использованием или мыше M-CSF (белые столбики) или человеко M-CSF (черные столбики) специфичных праймеров; показаны средние значения из образцов; «усы» указывают ±SEM; количество внесенной кДНК нормировали в соответствии с уровнем экспрессии HPRT (гипоксантингуанин фосфорибозил трансфераза); данные представляют результаты 2х независимых экспериментов; и, (D) ассоциированные с костью стромальные клетки от M-CSFm/m, М-CSFm/h и M-CSFh/h мышей выделяли и культивировали in vitro в течение 10 дней, супернатанты культур клеток собирали и секретированные уровни мышиного (белые) и человеческого (черные столбики) M-CSF количественно оценивали с использованием видоспецифичных M-CSF наборов ELISA; показаны средние значения из трех образцов; «усы» указывают±SEM; данные представляют результаты 2х независимых экспериментов. (Ε) у мышей M-CSFm/m, M-CSFh/m, и M-CSFh/h была взята кровь, и были измерены сывороточные уровни человеческого и мышиного M-CSF с помощью ELISA. Показаны средние значения трех образцов; «усы» указывают ±SEM.
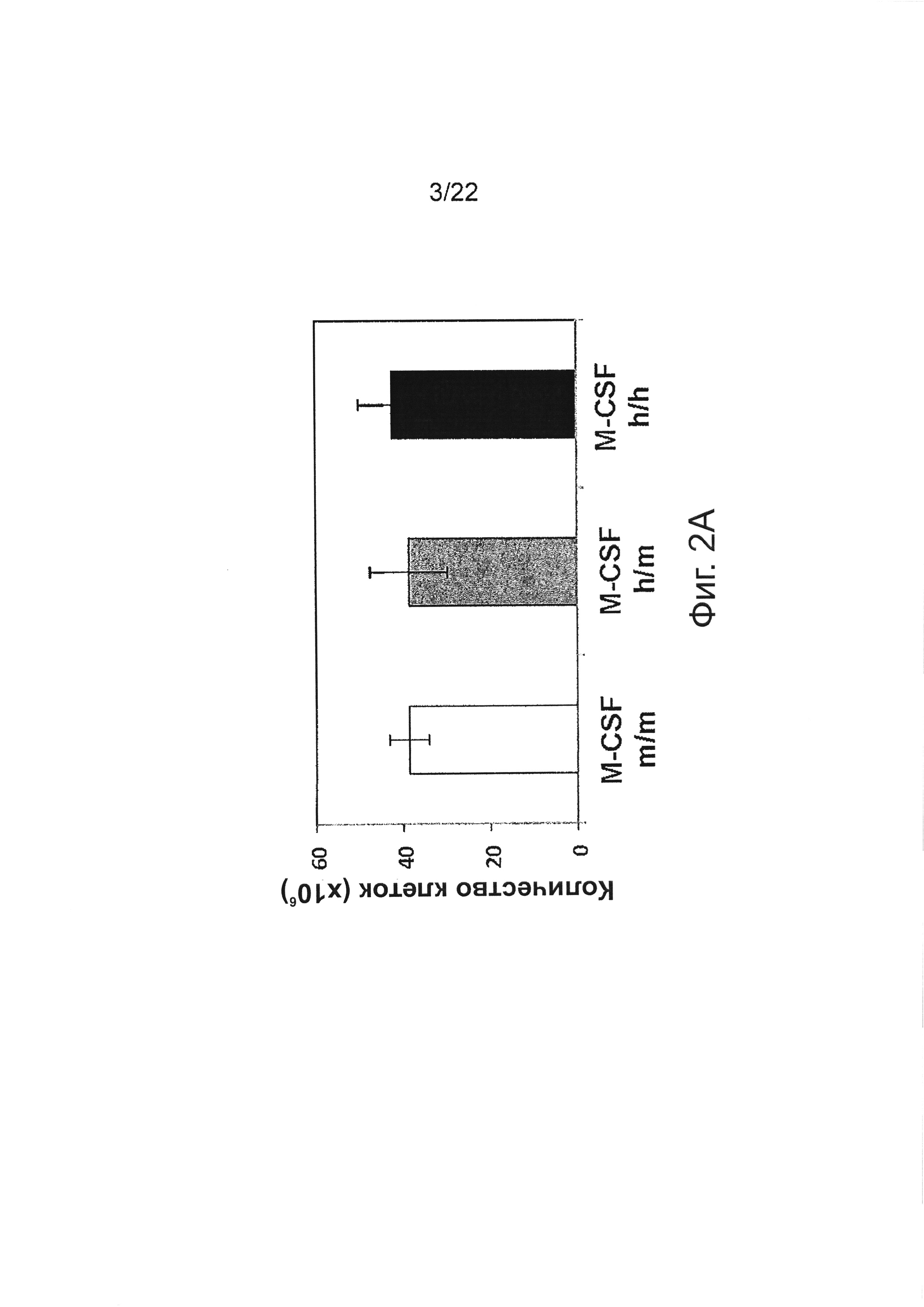
Фиг. 2А показывает абсолютное число клеток костного мозга (ВМ) M-CSFm/m, М-CSFm/h и M-CSFh/h мышей, как среднее на животное (две большеберцовых и малоберцовых кости); каждая группа содержит n=5 мышей в возрасте 4 недели; «усы» указывают ±SEM; данные представляют результаты 3х независимых экспериментов.
Фиг. 2В иллюстрирует анализ методом проточной цитометрии суспензии окрашенных единичных клеток костного мозга (верх), селезенки (середина) и периферической крови (PB), полученных от M-CSFm/m, M-CSFm/h и M-CSFh/h мышей; окраска Gr1 и CD11b антителами.
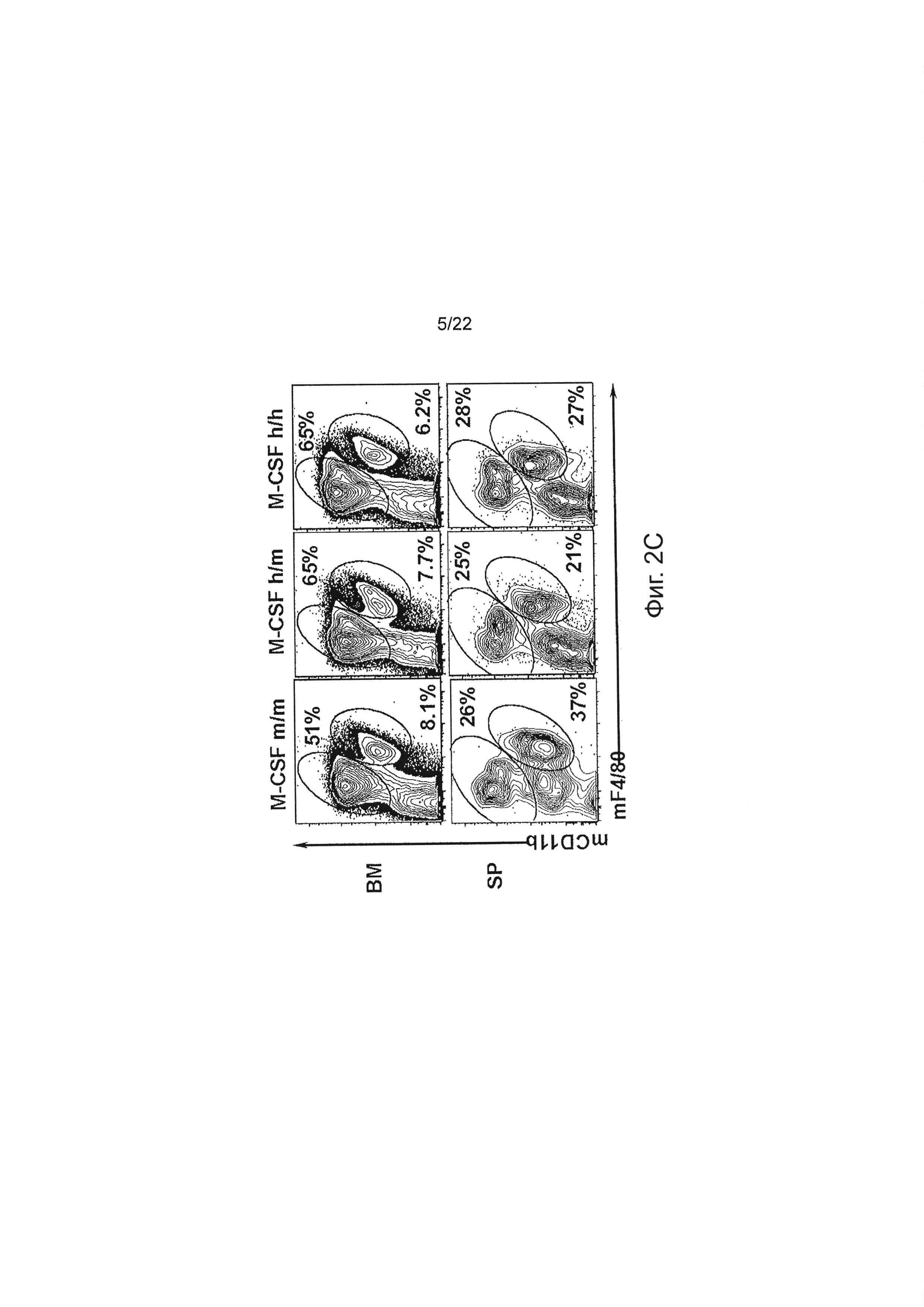
Фиг. 2С иллюстрирует анализ методом проточной цитометрии суспензии окрашенных единичных клеток костного мозга (верх) и селезенки (середина), полученных от M-CSFm/m, M-CSFm/h и M-CSFh/h мышей; окраска F4/80 и CD11b антителами.
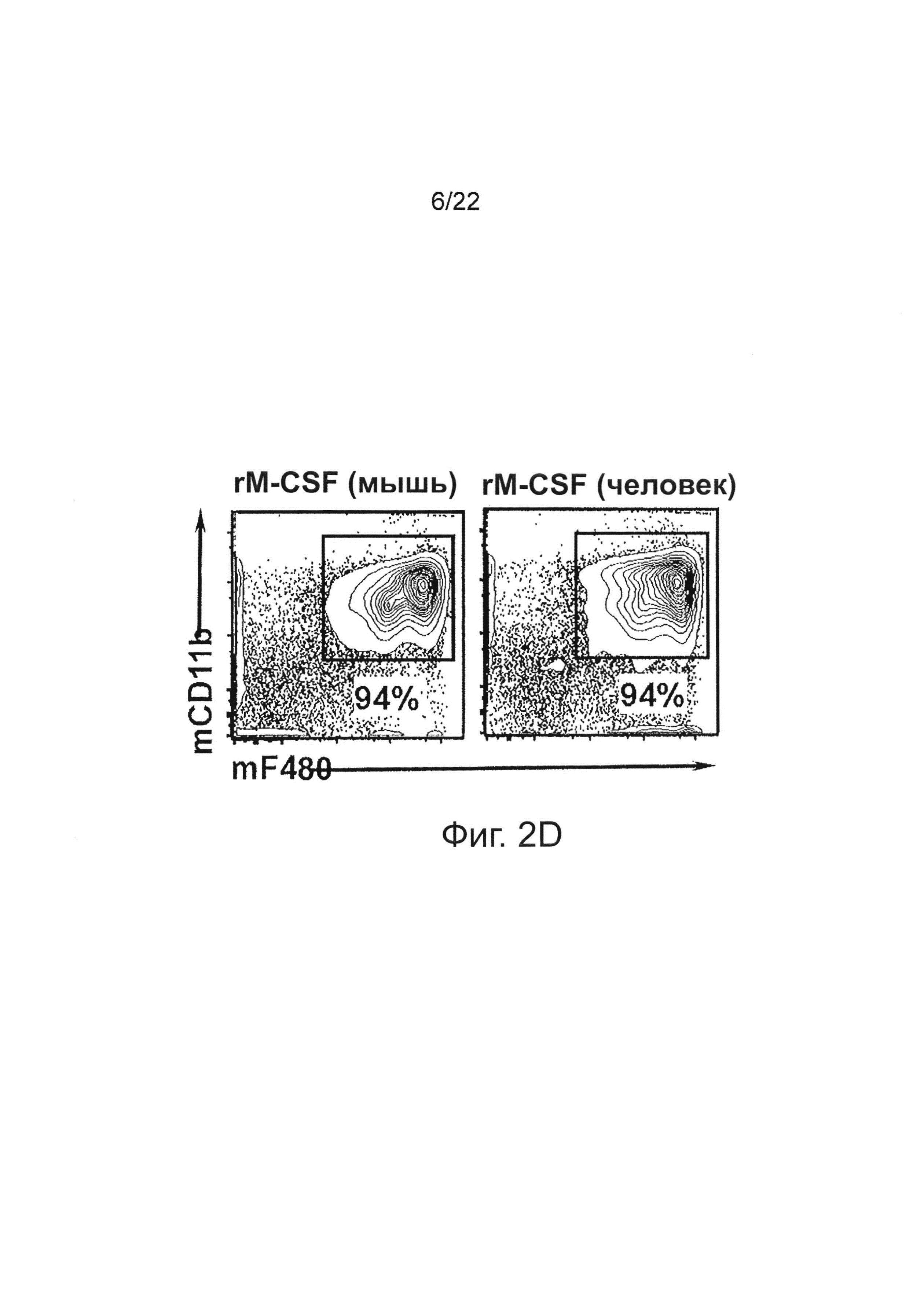
Фиг. 2D иллюстрирует анализ методом проточной цитометрии выделенных клеток костного мозга, которые культивировали в присутствии рекомбинантного мышиного М-CSF (слева) или человеческого M-CSF (справа) в течение 7 дней; клетки были окрашены F4/80 и CD11b антителами.
Фиг. 2Е иллюстрирует анализ методом проточной цитометрии выделенных клеток костного мозга, которые культивировали в присутствии рекомбинантного мышиного М-CSF (закрашенные) или человеческого M-CSF (незакрашенные) в течение 7 дней; клетки были окрашены указанными поверхностными маркерами.
Фиг. 3А иллюстрирует результаты проточной цитометрии суспензий единичных клеток костного мозга (верх), селезенки (середина) и периферической крови (PB) из человеческих CD34+ клеток, трансплантированных M-CSFm/m, M-CSFm/h и M-CSFh/h мышам; окрашивание CD45, CD14 и CD33 человеческими антителами; клетки, являющиеся человеческими CD45+, были предварительно отобраны (pre-gated) и разделены, исходя из экспрессии CD14 и CD33.
Фиг. 3В иллюстрирует относительные частоты встречаемости человеческих CD45+CD14+CD33+ клеток костного мозга (верх), селезенки (середина) и периферической крови (PB); абсолютное число клеток костного мозга было определено как среднее на животное (две большеберцовых и малоберцовых кости), а клетки периферической крови были определены на мл объема крови; каждая группа содержит n=20 мышей; каждый символ представляет отдельную мышь, горизонтальные полосы указывают средние значения; данные представляют результаты 5ти независимых экспериментов.
Фиг. 3С иллюстрирует абсолютные частоты встречаемости человеческих CD45+CD14+CD33+ клеток костного мозга (верх), селезенки (середина) и периферической крови (PB); абсолютное число клеток костного мозга было определено как среднее на животное (две большеберцовых и малоберцовых кости), а клетки периферической крови были определены на мл объема крови; каждая группа содержит n=20 мышей; каждый символ представляет отдельную мышь, горизонтальные полосы указывают средние значения; данные представляют результаты 5ти независимых экспериментов.
Фиг. 4А иллюстрирует анализ методом проточной цитометрии окрашенных клеток из человеческих CD34+ клеток, трансплантированных M-CSFm/m, M-CSFm/h и M-CSFh/h мышам, кровь была взята через 12, 16 и 20 недель после трансплантации; клетки были окрашены CD45, CD14 и CD33 человеческими антителами; клетки, являющиеся человеческими CD45+, были предварительно отобраны (pre-gated) и разделены, исходя из экспрессии CD14 и CD33.
Фиг. 4В иллюстрирует относительные частоты встречаемости человеческих CD45+CD14+CD33+ клеток; каждая группа содержит n=10 мышей; каждый символ представляет отдельную мышь, горизонтальные полосы указывают средние значения; данные представляют результаты 3х независимых экспериментов.
Фиг. 5 представляет анализ результатов проточной цитометрии M-CSFm/m, М-CSFm/h и M-CSFh/h мышей, привитых человеческими CD34+ клетками, через 12 недель после трансплантации, когда мышей забивали и проводили перфузию с использованием PBS; были изъяты печень (А), легкие (В) и кожа (С) и приготовлены суспензии единичных клеток; клетки брюшной полости (D) собирали, используя аспирацию с PBS; клетки окрашивали человеческими CD45, CD14 и CD33 антителами, и исследовали методом проточной цитометрии; каждый символ представляет отдельную мышь, горизонтальные полосы указывают средние значения; данные представляют результаты 3х независимых экспериментов.
Фиг. 6 иллюстрирует результаты стимуляции LPS. (A) M-CSFm/m и M-CSFm/h мышам были трансплантированы человеческие CD34+ клетки, и через 12 недель после трансплантации внутрибрюшинно (i.p.) был введен LPS. Через 48 часов мышей забивали и определяли частоты встречаемости человеческих CD45+CD14+CD33+ клеток в селезенке; в качестве контролей служили мыши, которым вводили PBS; каждый символ представляет отдельную мышь, горизонтальные полосы указывают средние значения. (В), (С) M-CSFm/m и M-CSFm/h мышам были трансплантированы человеческие CD34+ клетки, и через 12 недель после трансплантации был введен LPS (i.p.). Через шесть часов мышей забивали, и количественно определяли уровни сывороточных человеческого (справа) и мышиного (слева) IL-6 и TNFα при помощи ELISA; в качестве контролей служили мыши, которым вводили PBS; показаны средние значения трех параллельных проб; «усы» указывают ±SEM.
Фиг. 7А (hTNFα) и 7В (hIL-6) иллюстрируют способность моноцитов/макрофагов секретировать провоспалительные цитокины in vitro после стимуляции LPS. Человеческие CD45+CD14+CD33+ клетки были выделены из селезенки M-CSFm/m и M-CSFh/h мышей, которым были трансплантированы человеческие CD34+ клетки, через 12 недель после трансплантации; человеческие CD45+CD14+CD33+ клетки, полученные из эмбриональной печени, служили в качестве контролей; клетки стимулировали in vitro LPS в течение 24 или 48 часов, супернатанты культур клеток собирали и количественно определяли уровни человеческих TNFα (А) и IL-6 (В) с помощью ELISA; показаны средние значения трех параллельных проб; «усы» указывают ±SEM.
Фиг. 7С иллюстрирует уровни мРНК интерферона-α и интерферона-β в ответ на тримуляцию poly I:С. Человеческие CD45+CD14+CD33+ клетки стимулировали poly I:С в течение 6 или 12 часов и количественно определяли уровни мРНК IFNα (слева) и IFNβ (справа) при помощи ПЦР в реальном времени; показаны средние значения двух параллельных проб; «усы» указывают±SEM
Фиг. 7D иллюстрирует фагоцитоз, миграцию и способность к активации клеток, полученных от привитых мышей. Человеческие CD45+CD14+CD33+ клетки выделяли из гуманизированных мышей и инкубировали с FITC-мечеными бактериями при 37°С в течение 30 или 60 минут, измерения проводили при помощи проточной цитометрии; клетки, инкубированные с FITC-мечеными бактериями на льду, служили в качестве контролей. Незакрашенные гистограммы представляют клетки от M-CSFm/m мышей, испещренные точками гистограммы представляют клетки от M-CSFh/h мышей, и закрашенные гистограммы представляют клетки из эмбриональной печени человека.
Фиг. 7Е иллюстрирует хемотаксис клеток в ответ на ΜΙΡ3β. Человеческие CD45+CD14+CD33+ клетки, выделенные из M-CSFm/m мышей, M-CSFh/h мышей и эмбриональной печени человека, содержали в верхних ячейках, и среду, содержащую МЕР3β, добавляли в нижние ячейки; клетки инкубировали в течение 30 или 60 минут, затем подсчитывали число клеток, мигрировавших из верхних ячеек в нижние ячейки, и наносили данные на график; показаны средние значения двух параллельных проб; «усы» ±SEM
Фиг. 7F иллюстрирует повышенную активацию человеческих моноцитов/макрофагов из привитых мышей по признаку повышенной регуляции hCD40, hCD80, hCD86, и hHLA-DR после in vitro LPS-стимуляции. Человеческие CD45+CD14+CD33+ клетки, выделенные от M-CSFm/m мышей, M-CSFh/h мышей и эмбриональной печени человека культивировали в присутствии или в отсутствие LPS; после 24 часов стимуляции клетки окрашивали указанными поверхностными маркерами и проводили измерения при помощи проточной цитометрии. Незакрашенные гистограммы представляют клетки от M-CSFm/m мышей, испещренные точками гистограммы представляют клетки от M-CSFh/h мышей, и закрашенные гистограммы представляют клетки эмбриональной печени человека.
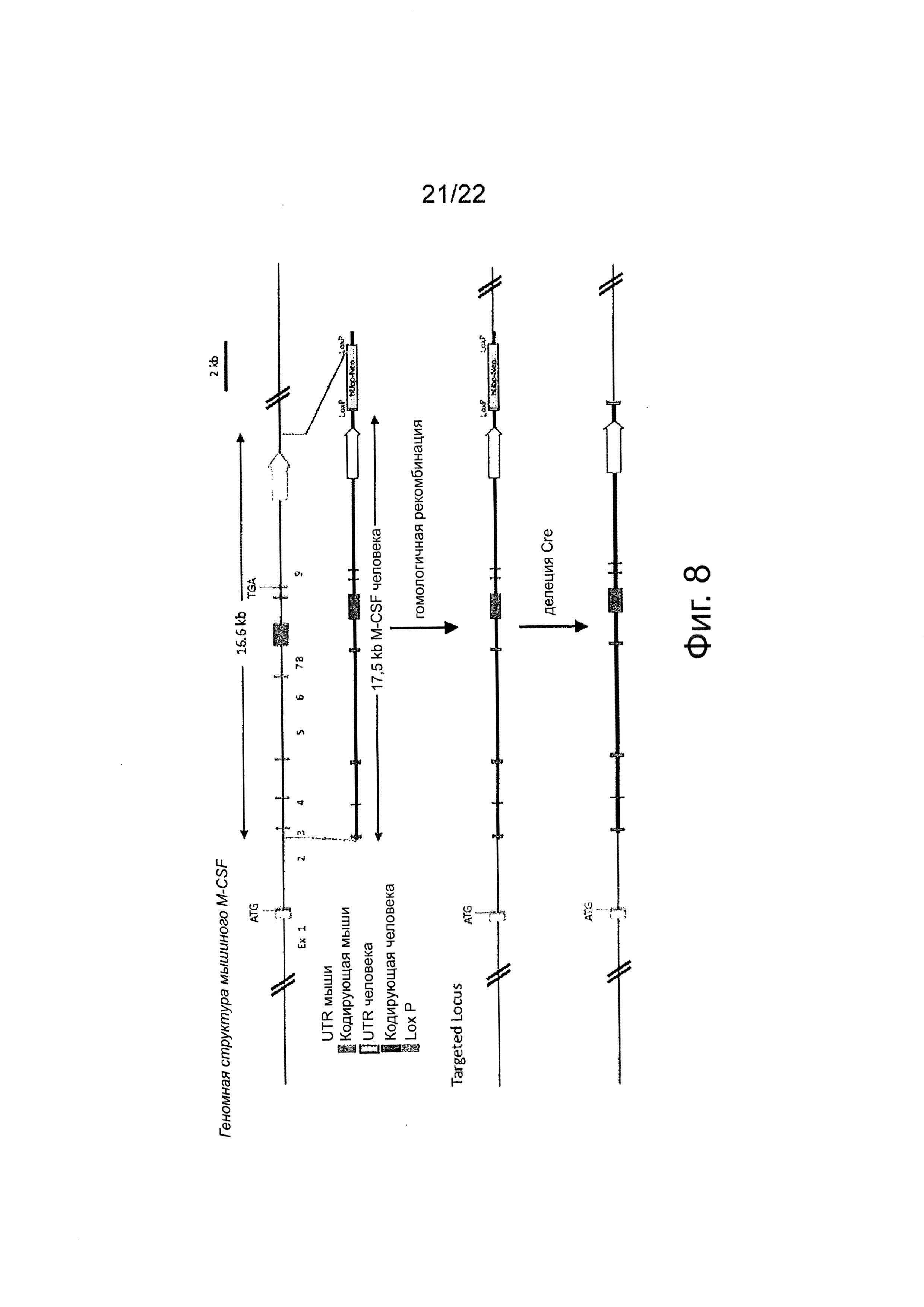
Фиг. 8 предоставляет схематичное изображение мышиного M-CSF локуса, указывающее относительное расположение экзонов 1-9, и конечного целевого аллеля с М-CSF геном человека.
Фиг. 9А,В иллюстрирует частоты встречаемости компартмента ГСК и компартмента миелоидных предшественников у M-CSFm/m, M-CSFh/m и M-CSFh/h мышей. Клетки костоного мозга от M-CSFm/m, M-CSFm/h и M-CSFh/h мышей окрашивали антителами к маркерам линии дифференцировки (lineage), c-Kit, Seal, CD150, CD48, CD16/32 и CD34 и анализировали при помощи проточной цитометрии. (A) Lineage- клетки (верх) были отобраны и выделены по признаку экспрессии Sea1 и c-Kit (середина). Lineage-Sca1+c-Kit+ (LSK) клетки были отобраны и выделены по признаку экспрессии CD150 и CD48 (низ). (В) Lineage- клетки были предварительно отобраны и выделены по признаку экспрессии Sea1 и c-Kit (top). Lineage- c-Kit+Sca1- клетки были отобраны и выделены по признаку экспрессии CD16/32 и CD34 (низ).
Подробное описание изобретения
Перед описанием настоящих способов и композиций, следует понимать, что это изобретение не ограничивается отдельным описанным способом или композицией, и в силу этого, конечно, может варьировать. Также следует понимать, что используемая в этом описании терминология служит только в целях описания отдельных вариантов осуществления и не имеет ограничительного характера, поскольку объем настоящего изобретения будет ограничиваться только прилагаемой формулой изобретения.
Если не указано иное, все технические и научные термины, используемые в этом описании, имеют то же значение, какое обычно понятно специалисту в области техники, к которой относится это изобретение. Несмотря на то, что при применении или испытании настоящего изобретения могут быть использованы любые способы и материалы, аналогичные или эквивалентные описанным здесь, далее описаны конкретные способы и материалы. Все публикации, упомянутые в этом описании, включены в это описание посредством ссылок, чтобы раскрыть и описать способы и/или материалы, в связи с которыми публикации процитированы. Следует понимать, что настоящее раскрытие заменяет собой любое раскрытие включенной публикации в тех случаях, когда имеется противоречие.
При чтении данного раскрытия специалисту в данной области техники очевидно, что каждый из отдельных вариантов осуществления, описанных и проиллюстрированных в этом описании, имеет отдельные компоненты и признаки, которые могут быть без труда отделены от или скомбинированы с признаками любого из нескольких других вариантов осуществления в пределах объема и сущности настоящего изобретения. Любой изложенный способ может реализовываться в перечисленном порядке этапов или любом другом порядке, который логически возможен.
Необходимо отметить, что используемые здесь и в прилагаемой формуле изобретения формы единственного числа включают формы множественного числа объекта кроме тех случаев, когда контекст ясно диктует иное. Таким образом, например, ссылка на "клетку" включает множество таких клеток, а ссылка на "пептид" включает ссылку на один или более пептидов и их эквивалентов, например, полипептиды, известные специалистам в данной области техники, и так далее.
Обсуждаемые в этом описании публикации предоставляются исключительно для их раскрытия до даты подачи настоящей заявки. Ничто в этом описании не должно истолковываться как допущение, что настоящее изобретение не вправе предшествовать такой публикации на основании более раннего создания настоящего изобретения.
Предоставляются генетически модифицированные мыши, содержащие нуклеиновокислотную последовательность, кодирующую человеческий M-CSF белок. Также предоставляются генетически модифицированные мыши, содержащие нуклеиновокислотную последовательность, кодирующую человеческий M-CSF белок, которым были трансплантированы человеческие клетки, такие как человеческие гемопоэтические клетки, и способы создания таких «привитых» мышей. Эти мыши находят целый ряд применений, таких как моделирование иммунного заболевания человека и инфекции патогеном; при скрининге in vivo веществ, модулирующих развитие и/или активность гемопоэтических клеток, например, в нормальном состоянии или в болезненном состоянии; при скрининге in vivo веществ, токсичных для гемопоэтических клеток; при скрининге in vivo веществ, которые предотвращают, уменьшают или снимают токсические эффекты токсических веществ на гемопоэтические клетки; при in vivo скрининге человеческих гемопоэтических клеток, полученных от индивидуума для определения чувствительности индивидуума к терапии заболевания и т.д.
Гуманизированные m-csf мыши
В некоторых аспектах изобретения предоставляется гуманизированная M-CSF мышь. Под гуманизированной M-CSF мышью или "hM-CSF мышью" имеется в виду мышь, содержащая нуклеиновокислотную последовательность, которая кодирует белок M-CSF человека. Под белком M-CSF человека имеется в виду белок, который является человеческим M-CSF или является белком в значительной степени идентичным человеческому M-CSF, например, является на 80% или более идентичным, 85% или более идентичным, 90% или более идентичным, или 95% или более идентичным человеческому M-CSF, например, на 97%, 98% или 99% идентичным человеческому белку M-CSF. Нуклеиновокислотная последовательность, кодирующая человеческий M-CSF белок, таким образом, представляет собой полинуклеотид, который содержит кодирующую последовательность бежа M-CSF человека, т.е. человеческий M-CSF или белок, который в значительной степени идентичен человеческому M-CSF. M-CSF (также известный как CSF-1, "колониестимулирующий фактор 1") является цитокином, который контролирует образование, дифференцировку и функцию макрофагов. Полипептидная последовательность человеческого M-CSF и нуклеиновокислотная последовательность, кодирующая человеческий M-CSF, могут быть найдены по учетному номеру Genbank NM_000757.5 (вариант 1), NM_172210.2 (вариант 2), и NM_172212.2 (вариант 4). Геномный локус, кодирующий белок M-CSF человека, может быть найден в геноме человека на Хромосоме 1; NC_000001.10 (110453233-110472355). Белковая последовательность кодируется в этом локусе экзонами с 1 по 8, тогда как экзон 9 содержит нетранслируемую последовательность. В связи с этим, нуклеиновокислотная последовательность, содержащая кодирующую последовательность человеческого М-CSF, содержит один или более экзонов 1-8 гена M-CSF человека. В ряде случаев нуклеиновокислотная последовательность также содержит компоненты геномного локуса M-CSF человека, например, интроны, 3' и/или 5' нетранслируемые последовательности (UTRs). В ряде случаев нуклеиновокислотная последовательность содержит полностью все участки геномного локуса M-CSF человека. В ряде случаев нуклеиновокислотная последовательность содержит экзон 2 геномного локуса M-CSF человека до 633 нуклеотида (nt), расположенного в направлении 3' (ниже) от некодирующего экзона 9.
У гуманизированных M-CSF мышей, настоящей заявки, нуклеиновокислотная последовательность, кодирующая белок M-CSF человека, функционально связана с одной или более регуляторными последовательностями гена M-CSF мыши. Регуляторные последовательности M-CSF мыши представляют собой такие последовательности геномного локуса M-CSF мыши, которые регулируют экспрессию мышиного M-CSF, например, 5' регуляторные последовательности, например, промотор M-CSF, 5' нетранслируемый участок (UTR) M-CSF, и т.д.; 3' регуляторные последовательности, например, 3'UTR; и энхансеры, и т.д. Мышиный M-CSF расположен на хромосоме 3 приблизительно в положениях 107,543,966-107,563,387, а кодирующая последователность M-CSF мыши может быть найдена по учетному номеру Genbank NM_007778.4 (изоформа 1), NM_001113529.1 (изоформа 2) и NM_001113530.1 (изоформа 3). Регуляторные последовательности M-CSF мыши хорошо охарактеризованы в данной области, и могут быть без труда определены при помощи методов in silico, например, по вышеупомянутым учетным номерам Genbank на браузере UCSC Genome Browser, во всемирной сети Интернет на genome.ucsc.edu или при помощи экспериментальных методов, как описано ниже и в данной области техники, например, Abboud et al. (2003) Analysis of the Mouse CSF-1 Gene Promoter in a Transgenic Mouse Model. J. Histochemistry и Cytochemistry 51(7): 941-949, раскрытие которой включено в это описание путем отсылки. В ряде случаев, например, когда нуклеиновокислотная последовательность, кодирующая белок M-CSF человека, расположена в геномном локусе M-CSF мыши, регуляторные последовательности, функционально связанные с последовательностью, кодирующей человеческий CSF, являются эндогенными, или нативными, для генома мыши, т.е. они присутствовали в геноме мыши до интеграции человеческих нуклеиновокислотных последовательностей.
В ряде случаев гуманизированная M-CSF мышь создается путем случайной интеграции, или вставки, человеческой нуклеиновокислотной последовательности, кодирующей белок M-CSF человека, или ее фрагмента, т.е. "нуклеиновокислотной последовательности M-CSF человека", или "последовательности M-CSF человека", в геном. Как правило, в таких вариантах осуществления расположение нуклеиновокислотной последовательности, кодирующей белок M-CSF человека, в геноме неизвестно. В других случаях гуманизированная M-CSF мышь создается путем нацеленной интеграции, или вставки, нуклеиновокислотной последовательности M-CSF человека в геном, путем, например, гомологичной рекомбинации. При гомологичной рекомбинации полинуклеотид «вставляется» в геном хозяина в целевой локус при одновременном удалении геномного материала хозяина, например, 50 пар оснований (по) или более, 100 по или более, 200 по или более, 500 по или более, 1 тпо или более, 2 тпо или более, 5 тпо или более, 10 тпо или более, 15 тпо или более, 20 тпо или более, или 50 тпо или более геномного материала из целевого локуса. Так, например, у гуманизированной M-CSF мыши, содержащей нуклеиновокислотную последовательность, которая кодирует белок M-CSF человека, созданной путем нацеливания нуклеиновокислотной последовательности M-CSF человека в локус M-CSF мыши, нуклеиновокислотная последовательность M-CSF человека может полностью или частично заместить последовательность мыши, например, экзоны и/или интроны, в локусе M-CSF. В некоторых таких случаях нуклеиновокислотная последовательность M-CSF человека интегрируется в локус M-CSF мыши так, что экспрессия последовательности М-CSF человека регулируется нативными, или эндогенными, регуляторными последовательностями в локусе M-CSF мыши. Другими словами, регуляторная последовательность(и), с которой функционально связана нуклеиновокислотная последовательность, кодирующая белок M-CSF человека, являются нативными M-CSF регуляторными последовательностями в локусе M-CSF мыши.
В ряде случаев интеграция последовательности M-CSF человека не влияет на транскрипцию гена, в который интегрировалась последовательность M-CSF человека. Например, в том случае, если последовательность M-CSF человека интегрируется в кодирующую последовательность как интеин, или последовательность M-CSF человека содержит 2А пептид, последовательность M-CSF человека будет транскрибироваться и транслироваться одновременно с геном, в который последовательность M-CSF человека интегрировалась. В других случаях, интеграция последовательности M-CSF человека препятствует транскрипции гена, в который последовательность M-CSF человека интегрировалась. Например, при интеграции последовательности M-CSF человека путем гомологичной рекомбинации, кодирующая последовательность в локусе интеграции может быть удалена полностью или частично, так, что вместо нее транскрибируется последовательность M-CSF человека. В некоторых таких случаях, интеграция последовательности M-CSF человека вызывает нуль-мутацию, и следовательно, (образование) нулевого аллеля. Нулевой аллель представляет собой мутантную копию гена, у которой полностью отсутствует нормальная функция этого гена. Это может являться результатом полного отсутствия продукта гена (белка, РНК) на молекулярном уровне или экспрессии нефункционального продукта гена. На фенотипическом уровне нулевой аллель не отличается от делеции всего локуса.
В ряде случаев гуманизированная M-CSF мышь содержит одну копию нуклеиновокислотной последовательности, кодирующей белок M-CSF человека. Например, мышь может быть гетерозиготной по нуклеиновокислотной последовательности. Другими словами, один аллель в локусе будет содержать нуклеиновокислотную последовательность, тогда как другие будут представлять собой эндогенные аллели. Например, как обсуждалось выше, в ряде случаев нуклеиновокислотная последовательность M-CSF человека интегрируется в локус M-CSF мыши так, что образуется нулевой аллель мышиного M-CSF. В некоторых таких вариантах осуществления гуманизированная M-CSF мышь может являться гетерозиготной по отношению к кодирующей нуклеиновокислотной последовательности, т.е. гуманизированная M-CSF мышь содержит один нулевой аллель мышиного M-CSF (аллель, содержащий нуклеиновокислотную последовательность) и один эндогенный аллель M-CSF (дикого типа или иной). Другими словами, мышь является M-CSFh/m мышью, где "h" указывает аллель, содержащий человеческую последовательность, a "m" указывает эндогенный аллель. В других случаях, гуманизированная M-CSF мышь содержит две копии нуклеиновокислотной последовательности, кодирующей белок М-CSF человека. Например, мышь может являться гомозиготной по нуклеиновокислотной последовательности, т.е. оба аллеля в локусе в диплоидном геноме будут содержать нуклеиновокислотную последовательность, т.е. гуманизированная M-CSF мышь содержит два нулевых аллеля мышиного M-CSF (аллель, содержащий нуклеиновокислотную последовательность). Другими словами, мышь является M-CSFh/h мышью.
Следует отметить, что у гуманизированных M-CSF мышей, например, таких как описанные выше, мыши M-CSFh/h и M-CSFh/m, наблюдаюся нормальное, или дикого типа, развитие и функция макрофагов и моноцитов и тканей, которые образуются из клеток макрофагальной линии, например, костной. Например, гуманизированные мыши имеют нормальные свойства зубов и костей, а также нормальное содержание костного мозга, частоту встречаемости миелоидных клеток в костном мозге, селезенке и периферической крови и частоту встречаемости макрофагов в костном мозге и селезенке.
В ряде случаев гуманизированная M-CSF мышь содержит другие генетические модификации. Например, гуманизированная M-CSF мышь может содержать, по меньшей мере, один нулевой аллель гена Rag2 ("активирующий рекомбинацию ген 2", кодирующая последовательность которого может быть найдена по Genbank Accession No. 1.NM_009020.3). В некоторых вариантах осуществления, гуманизированная M-CSF мышь содержит два нулевых аллеля Rag2. Другими словами, гуманизированная M-CSF мышь является гомозиготной по нулевому аллелю Rag2. В другом примере, гуманизированная M-CSF мышь содержит, по меньшей мере, один нулевой аллель гена IL2rg ("гамма-рецептор интерлейкина 2", также известный как общая гамма-цепь или γС, кодирующая последовательность которого может быть найдена по учетному номеру Genbank 1.NM_013563.3). В некоторых вариантах осуществления гуманизированная M-CSF мышь содержит два нулевых аллеля IL2rg. Другими словами, является гомозиготной по нулевому аллелю IL2rg. В некоторых вариантах осуществления мышь содержит нулевой аллель и Rag2 и IL2rg, т.е. является Rag2-/- IL2RG-/-. Также рассматриваются другие генетические модификации. Например, гуманизированная M-CSF мышь может содержать модификации других генов, связанных с развитием и/или функционированием гемопоэтических клеток и иммунной системы, например, замещение того или другого гена мыши на нуклеиновокислотную последовательность, кодирующую человеческий ортолог. Дополнительно или альтернативно гуманизированная M-CSF мышь может содержать модификации генов, связанных с развитием и/или функционированием других клеток и тканей, например, генов, связанных с болезнями или нарушениями у человека, или генами, которые при модификации у мыши обеспечивают мышиные модели болезней и нарушений у человека.
В некоторых аспектах изобретения гуманизированной M-CSF мыши, например, Rag2-/-IL2rg-/- hM-CSF мыши или сублетально облученной hM-CSF мыши, приживляют, или трансплантируют, клетки. Клетки могут представлять собой митотические клетки или постмитотические клетки и включают такие, представляющие интерес клетки, как плюрипотентные стволовые клетки, например, ES клетки, iPS клетки и эмбриональные зародышевые клетки; и соматические клетки, например, фибробласты, гемопоэтические клетки, нейроны, мышечные клетки, клетки кости, сосудистые эндотелиальные клетки, клетки кишечника и тому подобное, и их линейно-специфические прародители и предшественники. Популяции клеток, представляющие особый интерес, включают те, которые содержат гемопоэтические стволовые или прогениторные клетки, которые будут восстанавливать или участвовать в работе гемопоэтической системы гуманизированной M-CSF мыши, например, лейкоциты периферической крови, клетки эмбриональной печени, эмбриональной кости, эмбрионального тимуса, эмбриональных лимфатических сосудов, васкуляризированной кожи, сегментов артерий и очищенные гемопоэтические стволовые клетки, например, мобилизованные ГСК или ГСК пуповинной крови. Клетки могут происходить от любых видов млекопитающих, например, мышей, грызунов, собак, кошек, коров, овец, приматов, человека и т.д. Клетки могут происходить от установленных клеточных линий или могут быть первичными клетками, при этом термины "первичные клетки", "первичная линия клеток" и "первичные культуры" используются в этом описании взаимозаменяемо для обозначения клеток и культур клеток, полученных от субъекта и растущих in vitro в течение ограниченного количества пассажей, т.е. удвоений культуры. Например, первичные культуры представляют собой культуры, которые могли пассироваться 0 раз, 1 раз, 2 раза, 4 раза, 5 раз, 10 раз или 15 раз, но не достаточно раз для прохождения критической стадии. Как правило, первичные клеточные линии настоящего изобретения поддерживаются in vitro в течение менее 10 пассажей.
В том случае, если клетки являются первичными клетками, они могут быть собраны у индивидуума любым подходящим способом. Клетки крови, например, лейкоциты, могут быть собраны путем афереза, лейкоцитафереза, разделения в градиенте плотности и т.д. В качестве другого примера, клетки кожи, мышц, спинного мозга, селезенки, печени, поджелудочной железы, легких, кишечника, ткани желудка и т.д. могут быть собраны при помощи биопсии. Для диспергирования или суспендирования собранных клеток может использоваться подходящий раствор. Таким раствором, как правило, будет сбалансированный солевой раствор, например, физиологический раствор, PBS, сбалансированный солевой раствор Хенкса и т.д., в целях удобства дополненный эмбриональной телячьей сывороткой или другими природными факторами, в сочетании с соответствующим буферным раствором в низкой концентрации, как правило, от 5-25 мМ. Подходящие буферные растворы включают HEPES, фосфатные буферные растворы, лактатные буферные растворы и т.д.
В ряде случаев гетерогенная клеточная популяция будет трансплантироваться гуманизированной мыши. В других случаях популяция клеток, обогащенная определенным типом клеток, например, прогениторными клеками, например, гемопоэтическими прогениторными клеками, будет приживляться гуманизированной мыши. Обогащение популяции целевых клеток может проводиться при помощи любого подходящего метода разделения. Например, целевые клетки могут обогащаться методами культивирования. В таких методах культивирования в культуру, как правило, добавляются определенные ростовые факторы и питательные вещества, которые способствуют выживанию и/или пролиферации одной популяции клеток более чем другим. Другие условия культивирования, которые влияют на выживание и/или пролиферацию, включают рост на прикрепленном или неприкрепленном субстрате, культивирование в течение определенных промежутков времени и т.д. Такие условия культивирования хорошо известны в данной области техники. В качестве другого примера целевые клетки могут обогащаться путем отделения целевых клеток от исходной популяции при помощи методов аффинного разделения. Методы аффинного разделения могут включать магнитное разделение с использованием магнитных гранул, покрытых аффинным реагентом, аффинную хроматографию, "пэннинг" аффинными реагентом, прикрепленным к твердой матрице, например, чашке, цитотоксические агенты, присоединенные к аффинному реагенту или используемые одновременно с аффинным реагентом, например, комплемент и цитотоксины, или другие подходящие методы. Методы, обеспечивающие тщательное разделение, включают флуоресцентно активируемые сортеры клеток, которые могут иметь различные степени сложности, такие как наличие множества цветовых каналов, каналы, детектирующие низкоугловое и приглушенное светорассеяние, каналы сопротивления и т.д. Клетки могут отбираться в противовес мертвым клеткам путем использования красителей, связывающихся с мертвыми клетками (например, пропидиум йодид). Могут использоваться любые методы, не наносящие излишний ущерб жизнеспособности целевых клеток.
Например, при использовании методов аффинного разделения клетки, которые не являются целевыми для трансплантации, могут быть извлечены из популяции путем взаимодействия популяции с аффинными реагентами, которые специфически распознают и селективно связывают маркеры, которые не экспрессируются на целевых клетках. Например, для того, чтобы обогатить популяцию гемопоэтических прогениторных клеток, можно извлечь клетки, экспрессирующие маркеры зрелых гемопоэтических клеток. Дополнительно или альтернативно положительная селекция и разделение могут проводиться путем взаимодействия популяции с аффинными реагентами, которые специфически распознают и селективно связывают маркеры, относящиеся к гемопоэтическими прогениторными клетами, например, CD34, CD133 и т.д. Под "селективным связыванием" подразумевается, что молекула предпочтительно связывается с представляющей интерес мишенью или связывается с целевой молекулой с большей аффинностью, чем с другими. Например, антитело будет связываться с молекулой, содержащей эпитоп, к которому оно специфично, и не будет связываться с посторонними эпитопами. В некоторых вариантах осуществления аффинный реагент может являться антителом, т.е. антителом, специфичным к CD34, CD133 и т.д. В некоторых вариантах осуществления аффинный реагент может являться специфическим рецептором или лигандом для CD34, CD133 и т.д., например, пептидным лигандом и рецептором; эффекторной и рецепторной молекулами, Т-клеточным рецептором специфичным к CD34, CD133 и т.д. и тому подобным. В некоторых вариантах осуществления могут использоваться множественные аффинные реагенты, специфичные к целевым маркерам.
Антитела и Т-клеточные рецепторы, которые находят применение как аффинные реагенты, могут быть моноклональными или поликлональными и могут вырабатываться трансгенными животными, иммунизированными животными, иммортализованными В-клетками человека и животных, клетками, трансфицированными ДНК-векторами, кодирующими антитело или Т-клеточный рецептор и т.д. Подробности получения антител и возможности их использования в качестве специфических связывающих элементов хорошо известны специалистам в данной области техники. Особенно интересным является использование меченых антител в качестве аффинных реагентов. Удобно, когда эти антитела коньюгированы с меткой для использования при разделении. Метки включают магнитные гранулы, которые создают возможность прямого разделения; биотин, который может быть удален при помощи авидина или стрептавидина, связанного с подложкой; флюорохромы, которые могут применяться при использовании флуоресцентно активируемого сортера клеток; или тому подобное, для обеспечения легкости отделения определенного типа клеток. Подходящие для применения флюорохромы включают фикобилипротеины, например, фикоэритрин и аллофикоцианины, флюоресцеин и техасский красный. Часто каждое антитело помечается отдельным флюорохромом для обеспечения независимой сортировки по каждому маркеру.
Исходная популяция клеток взаимодействует с аффинным реагентом(ми) и инкубируется в течение периода времени, достаточного для связывания доступных поверхностных антигенов. Инкубация обычно составляет, по меньшей мере, около 5 минут и обычно менее, чем примерно 60 минут. Желательно иметь достаточную концентрацию антител в реакционной смеси, такую, что эффективность разделения не ограничивается недостатком антител. Подходящая концентрация определяется титрованием, однако, как правило, будет составлять разведение антитела в объеме суспензии клеток, равное приблизительно 1:50 (т.е. 1 часть антитела к 50 частям реакционного объема), приблизительно 1:100, приблизительно 1:150, приблизительно 1:200, приблизительно 1:250, приблизительно 1:500, приблизительно 1:1000, приблизительно 1:2000 или приблизительно 1:5000. Среда, в которой суспендируют клетки, будет любой средой, которая поддерживает жизнеспособность клеток. Предпочтительной средой является фосфатно-солевой буферный раствор, содержащий от 0,1 до 0,5% BSA или 1-4% козьей сыворотки. Различные среды доступны коммерчески и могут использоваться в соответствии с особенностями клеток, включая модифицированную по способу Дульбекко среду Игла (dMEM), сбалансированный солевой раствор Хенкса (HBSS), физиологический раствор, фосфатно-солевой буфер модифицированный Дульбекко (dPBS), RPMI, среда Искова, PBS с 5 мМ ЭДТА и т.д., часто дополненные эмбриональной телячьей сывороткой, BSA, HSA, козьей сывороткой и т.д.
Клетки в находящейся в контакте популяции, помеченые аффинным реагентом, отбираются любым удобным методом аффинного разделения, например, как описано выше или как известно в данной области техники. После разделения, отделенные клетки могут быть собраны в любой подходящей среде, которая поддерживает жизнеспособность клеток, обычно имеющей «подушку» из сыворотки на дне пробирки. Различные среды доступны коммерчески и могут использоваться в соответствии с особенностями клеток, включая dMEM, HBSS, dPBS, RPMI, среду Искова и т.д., часто дополненную эмбриональной телячьей сывороткой.
Таким способом получают композиции, высокообогащенные целевым типом клеток, например, гемопоэтическими клетками. Клетки будут составлять около 70%, около 75%, около 80%, около 85% около 90% или более композиции клеток, около 95% или более обогащенной композиции клеток, и будут предпочтительно составлять около 95% или более обогащенной композиции клеток. Другими словами, композиция будет в значительной степени чистой композицией целевых клеток.
Клетки для трансплантации гуманизированной M-CSF мыши, являются они гетерогенной популяцией клеток или обогащенной гетерогенной популяцией, могут трансплантироваться немедленно. Альтернативно, клетки могут быть заморожены при температурах жидкого азота и храниться в течение долгих периодов времени, после размораживания их можно использовать повторно. В таких случаях клетки обычно замораживают в составе из 10% ДМСО, 50% сыворотки, 40% среды с добавлением буфера или некоторых других подобных жидкостей, какие обычно используются в данной области техники для хранения клеток при таких температурах замораживания, и размороживают способом, широко известным в данной области техники для размораживания замороженных культивируемых клеток. Дополнительно или альтернативно клетки могут культивироваться in vitro в различных условиях культивирования. Среда для культивирования может быть жидкой или полужидкой, например, содержащей агар, метилцеллюлозу и т.д. Клеточная популяция может быть удобно ресуспендирована в соответствующей питательной среде, такой как DMEM в модификации Искова или RPMI-1640, как правило, дополненной эмбриональной телячьей сывороткой (приблизительно 5-10%), L-глутамином, тиолом, в частности, 2-меркаптоэтанолом, и антибиотиками, например, пенициллином и стрептомицином. Культура может содержать ростовые факторы, к которым чувствительны клетки. Ростовые факторы, указанные в этом описании, представляют собой молекулы, оказывающие содействие выживанию, росту и/или дифференцировке клеток, как в культуре, так и в интактной ткани посредством специфического действия на трансмембранный рецептор. Ростовые факторы включают полипептиды и неполипептидные факторы.
Клетки могут быть генетически модифицированы перед трансплантацией гуманизированной M-CSF мыши, например, для того, чтобы обеспечить наличие селектируемого или отслеживаемого маркера, вызвать генетический дефект в клетках (например, для моделирования заболевания), исправить генетический дефект или эктопическую экспрессию гена в клетках (например, для определения будет ли такая модификация иметь влияние на течение заболевания) и т.д. Клетки могут быть генетически модифицированы путем трансфекции или трансдукции подходящим вектором, гомологичной рекомбинации или другим подходящим методом, так что они экспрессируют целевой ген или антисмысловую мРНК, siRNA или рибозимы для блокирования экспрессии нежелательного гена. В данной области техники известны разные методы введения нуклеиновых кислот в целевые клетки. Для того, чтобы доказать, что клетки генетически модифицированы, могут использоваться различные методы. Геном клеток может быть расшеплен и может использоваться с или без амплификации. Может использоваться полимеразная цепная реакция; гель-электрофорез; рестрикционный анализ; Саузерн-блоттинг, Нозерн-блоттинг и Вестерн-блоттинг; секвенирование или тому подобное. Общие методы молекулярной и клеточной биохимии для этих и других целей, раскрытые в этой заявке, можно найти в таких общепринятых руководствах, как Molecular Cloning: A Laboratory Manual, 3rd Ed. (Sambrook et al., Cold Spring Harbor Laboratory Press 2001); Short Protocols in Molecular Biology, 4th Ed. (Ausubel et al. eds., John Wiley & Sons 1999); Protein Methods (Bollag et al., John Wiley & Sons 1996); Nonviral Vectors for Gene Therapy (Wagner et al. eds., Academic Press 1999); Viral Vectors (Kaplift & Loewy eds., Academic Press 1995); Immunology Methods Manual (I. Lefkovits ed., Academic Press 1997); и Cell и Tissue Culture: Laboratory Procedures in Biotechnology (Doyle & Griffiths, John Wiley & Sons 1998), раскрытия которых включены в это описание путем отсылки. Реагенты, векторы для клонирования и наборы для генетических манипуляций, упомянутых в этом описании, доступны от таких коммерческих производителей, как BioRad, Stratagene, Invitrogen, Sigma-Aldrich, и ClonTech.
Клетки могут трансплантироваться гуманизированной M-CSF мыши любым подходящим способом, включая, например, внутрипеченочное введение, введение в хвостовую вену, ретроорбитальное введение и тому подобное. Как правило, трансплантируется приблизительно 0,5×105-2×106 плюрипотентных или прогениторных клеток, например, приблизительно 1×105-1×106 клеток или приблизительно 2×105-5×105 клеток. В ряде случаев мышь является сублетально облученной до трансплантации человеческих клеток. Другими словами, мышь подвергается воздействию сублетальной дозы излучения, например, как описано в разделе Примеры ниже и как хорошо известно в данной области техники. Затем «привитая» гуманизированная M-CSF мышь содержится в лабораторных условиях содержания животных в течение, по меньшей мере, 1 недели, например, 1 недели или более, или двух недель или более, иногда 4 недель или более, и в некоторых случаях 6 недель или более, для обеспечения достаточного восстановления иммунной системы приживленными клетками.
Как показано в разделе Примеры ниже, у гуманизированных M-CSF мышей наблюдается значительно увеличенная способность к приживлению и поддержанию гемопоэтических стволовых клеток человека по сравнению с другими штаммами мышей, которые были созданы для этой цели, и другими M-CSF трансгенными мышами. Например, внутрипеченочная пересадка гемопоэтических стволовых и прогениторных клеток (CD34+), полученных из эмбриональной печени человека, новорожденным мышам приводит к более эффективной дифференцировке и увеличенным частотам встречаемости человеческих моноцитов/макрофагов в костном мозге, селезенке, периферической крови, легких, печени и брюшной полости. Значительная доля человеческих CD14+CD33+ клеток наблюдается около 16-20 недель. В частности, у гуманизированных M-CSF мышей, которым пересажены гемопоэтические клетки, наблюдается одна или более, в некоторых случаях, две или более, в ряде случаев, три или более, в некоторых случаях четыре или более, в некоторых случаях все из следующих особенностей: они экспрессируют человеческий M-CSF в костном мозге, селезенке, крови, печени, мозге, легких, семенниках и почках на уровне, сравнимом с экспрессией мышиного M-CSF у мышей дикого типа; наблюдается частота встречаемости hCD14+CD33+ клеток селезенки, которая в 2-6 раз выше, чем hCD14+CD33+ y «привитой» мыши, которая не экспрессирует hM-CSF; наблюдается частота встречаемости hCD14+CD33+ клеток периферической крови, которая в 2-8 раз выше, чем hCD14+CD33+ у «привитой» мыши, которая не экспрессирует hM-CSF; наблюдается уровень hCD14+CD33+ клеток моноцитарно/макрофагальной линии дифференцировки в крови приблизительно от 15 до приблизительно 40%; наблюдается уровень hCD14+CD33+ клеток моноцитарно/макрофагальной линии дифференцировки в крови приблизительно от 5 до 15% в возрасте приблизительно 20 недель; наблюдается ответ на введение LPS, который приблизительно в 1.5-6 раз выше по отношению к процентному содержанию hCD14+CD33+ клеток в печени, чем у мышей, у которых отсутствует человеческий M-CSF; наблюдается увеличенная продукция hCD14+CD33+hCD45+ клеток в селезенке приблизительно через 48 часов после введения LPS, причем увеличение составляет приблизительно от 2 до 5 раз по сравнению с «привитой» мышью, у которой отсутствует hM-CSF; наблюдается увеличенная продукция сывороточного человеческого IL-6 в ответ на LPS, причем уровень hIL-6 приблизительно через 6 часов после введения LPS увеличивается приблизительно в 2-5 раз по сравнению с «привитой» мышью, у которой отсутствует hM-CSF; наблюдается in vitro секреция hTNFα моноцитом и/или макрофагом после стримуляции LPS, которая приблизительно в 2-3 раза выше, чем у «привитой» мыши, у которой отсутствует ген hM-CSF; наблюдается in vitro секреция hIL-6 моноцитом и/или макрофагом после стримуляции LPS, которая приблизительно в 2-4 раза выше, чем у «привитой» мыши, у которой отсутствует ген hM-CSF; наблюдается in vitro секреция hlFNα моноцитом и/или макрофагом после стримуляции I:С, которая приблизительно в 3-6 раз выше, чем у «привитой» мыши, у которой отсутствует ген hM-CSF; наблюдается in vitro секреция hIFΝβ моноцитом и/или макрофагом при стримуляции I:С, которая приблизительно в 3-6 раз выше, чем у «привитой» мыши, у которой отсутствует ген hM-CSF; наблюдается увеличенный фагоцитоз по сравнению с генетически модифицированной и «привитой» мышью, у которой отсутствует ген hM-CSF; наблюдается повышенный хемотаксис in vitro в ответ на Μip3β по сравнению с генетически модифицированной «привитой» мышью, у которой отсутствует ген hM-CSF; и наблюдается повышенная регуляция in vitro ко-стимуляторной молекулы в ответ на LPS-стимуляцию, где ко-стимуляторную молекулу выбирают из CD40 человека, CD80 человека, CD86 человека, HLA-DR человека и их комбинации.
Практическая ценность
Гуманизированные M-CSF мыши и гуманизированные M-CSF мыши с трансплантированными человеческими гемопоэтическими клетками, например, «привитые» Rag2-/-IL2rg-/- hM-CSF мыши, и необязательно другие генетические модификации находят различное применение. Например, эти мыши обеспечивают подходящую систему для моделирования иммунных заболеваний человека и патогенов человека. Например, мыши используются для моделирования злокачественных болезней кроветворной системы человека, возникающих из ранней гемопоэтической клетки человека, например, из гемопоэтической стволовой или прогениторной клетки человека. В качестве другого примера, мыши используются для изучения патогенов человека, например, вирусов, грибов и бактерий, которые в норме не заражают мышей.
Один такой пример патогена человека, который в норме не инфицирует мышей, представляет собой возбудитель брюшного тифа, S. typhi. Брюшной тиф поражает более 21 миллиона человек во всем мире, главным образом в развивающихся странах, ключая приблизительно 400 случаев в год в Соединенных Штатах. Брюшной тиф лечили многими лекарственными средствами - амоксициллином, ампициллином, цефотаксимом, цефтриаксоном, цефтазимидом, хлоамфениколом, ципрофлоксацином, ко-тримоксазолом, эртапенемом, имипенемом, фторхинолонами (например, ципрофлоксацином, гатифлоксацином, офлоксацином), стрептомицином, сульфадиазином, сульфаметоксазолом, тетрациклином и их комбинациями. Рецидивирующие инфекции являются обычным явлением, что ограничивает управление течением заболевания с помощью антибиотикотерапии. Кроме того, при инфекциях S. typhi также широко распространена множественная лекарственная устойчивость.
Необходимы новые терапевтические средства, новые вакцины и новые способы проверки эффективности терапевтических средств и вакцин. Например, мышь, которую можно заразить S. typhi, можно было бы использовать для обнаружения новых терапевтических средств и новых вакцин. Новые терапевтические средства и новые вакцины могли бы проходить тестирование на таких мышах, например, путем определения количества S. typhi у мыши (в крови или конкретной ткани) в ответ на лечение предполагаемым анти-S. typhi средством, или путем введения мыши предполагаемой вакцины с последующим введением инфекционной S. typhi и наблюдением за изменением инфекционности в результате инокулирования предполагаемой вакцины по сравнению с контрольной мышью, не получившей вакцину, но зараженной S. typhi.
Гуманизированная M-CSF мышь с трансплантированными человеческими гемопоэтическими клетками, например, Rag2-/-IL2rg-/- hM-CSF мышь, подходит для изучения патогенов человека, т.е. патогенов, которые заражают человека; ответа иммунной системы человека на заражение патогенами человека; и эффективности средств при защите от и/или лечении инфекции патогенами человека. Патоген может представлять собой вирус, грибок или бактерию и т.д. Неограничивающие примеры вирусных патогенов включают вирус человеческого, свиного или птичьего гриппа. Неограничивающие примеры бактериальных патогенов включают микобактерию, например, Mycobacterium tuberculosis (M. tuberculosis) и энтеробактерию, например, Salmonella typhi (S. typhi).
Например, «привитые» гуманизированные M-CSF мыши удобны в качестве нечеловеческой животной модели инфекции S. typhi. Для сравнения, мыши дикого типа и другие известные мыши с нарушенным иммунитетом (например, мыши, нокаутные по RAG1/RAG2) не могут быть инфицированы S. typhi. Как обсуждается выше, описанные здесь «привитые» мыши с человеческим M-CSF демонстрируют улучшенное приживление человеческих клеток по сравнению с «привитыми» мышами, которые не содержат белок M-CSF человека. Это улучшение является достаточным для поддержания продуктивного заражения S. typhi, то есть способности S. typhi воспроизводиться у мыши, т.е. S. typhi может «внедряться» и воспроизводиться в одной или более клетках зараженной мыши. В отдельном варианте осуществления S. typhi может размножаться у мыши, по меньшей мере, неделю, 10 дней, две недели, три недели или четыре недели после первоначального внедрения или инфекционного воздействия S. Typhi. Другими словами, титр S. typhi или уровень в крови мыши или, по меньшей мере, в одной ткани, может сохраняться, по меньшей мере, неделю, 10 дней, две недели, три недели или четыре недели после инфекционного воздействия S. typhi. Примеры способов заражения мышей S. typhi и оценки инфекции можно найти, например, в опубликованной заявке США №2011/0200982, раскрытие которой включено в описание путем отсылки.
В качестве другого примера, «привитые» гуманизированные M-CSF мыши, например, «привитые» Rag2-/-IL2rg-/- hM-CSF мыши, удобны в качестве нечеловеческой животной модели инфекции М. tuberculosis. Улучшенное приживление человеческих гемопоэтических клеток у мышей, содержащих нуклеиновую кислоту, которая кодирует белок M-CSF человека, является достаточным для поддержания продуктивного заражения М. tuberculosis, то есть способности M. Tuberculosis воспроизводиться у мыши, т.е. М. tuberculosis может «внедряться» и воспроизводиться в одной или более клетках зараженной мыши. В некоторых таких вариантах осуществления у мыши проявляется антимикобактериальный иммунный ответ на человеческую патогенную микобактерию, при этом ответ включает опосредованное человеческими иммунными клетками образование гранулемы, которая содержит человеческую иммунную клетку. В некоторых таких вариантах осуществления гранулема является гранулемой легких. В некоторых таких вариантах осуществления гранулема является хорошо выраженной гранулемой. Примеры способов заражения мышей М. tuberculosis и оценки инфекции можно найти, например, в опубликованной заявке США №2011/0200982, раскрытие которой включено в описание путем отсылки.
Специалисту в данной области техники хорошо известны другие примеры патогенов человека, которые не инфицируют мышь, экспрессирующую человеческий М-CSF и, в ряде случаев, одну или более других генетических модификаций, например, как описано здесь, или которые инфицируют мышей дикого типа, но при этом мышь дикого типа после заражения не является моделью иммунного ответа, который появляется у человека в ответ на патоген.
Такие мышиные модели инфекции патогеном удобны в исследованиях, например, чтобы лучше понять развитие инфекции у человека. Подобные мышиные модели инфекции также удобны для обнаружения лекарственных средств, например, для установления веществ-кандидатов, защищающих от инфекции или вылечивающих инфекцию.
Гуманизированные M-CSF мыши, «привитые» человеческими гемопоэтическими клетками, обеспечивают удобную систему для скрининга веществ-кандидатов с другой желаемой активностью in vivo, а также, например, веществ, которые способы модулировать (т.е.., оказывать соедйствие или подавлять) развитие и/или активность гемопоэтических клеток, например, активность В-клеток, Т-клеток, NK-клеток, макрофагов, нейтрофилов, эозинофилов, базофилов и т.д., например, в норме или в болезненном состоянии, например, для установления новых терапевтических средств и/или лучшего понимания молекулярных основ развития и функционирования иммунной системы; веществ, которые токсичны для гемопоэтических клеток, например, В-клеток, Т-клеток, NK-клеток, макрофагов, нейтрофилов, эозинофилов, базофилов и т.д. и их предшественников; и веществ, которые предотвращают, уменьшают или отменяют токсические эффекты токсических веществ на гемопоэтические клетки, например, В-клетки, Т-клетки, NK-клетки, макрофаги, нейтрофилы, эозинофилы, базофилы и т.д. и их предшественники; и т.д. В качестве еще одного примера, описанные здесь генетически модифицированные мыши предоставляют систему, удобную для определения чувствительности индивидуума к терапии заболевания, например, обеспечивая площадку in vivo для скрининга чувствительности иммунной системы индивидуума к веществу, например, терапевтическому средству, чтобы предсказать чувствительность индивидуума к этому веществу.
При скрининговых исследованиях в отношении биологически активных веществ, гуманизированные M-CSF мыши, например, Rag2-/-IL2rg-/- hM-CSF мыши, которым были приживлены гемопоэтические клетки человека, и, в ряде случаев, зараженные патогенами человека, или клетки, предназначенные для пересадки гуманизированной M-CSF мыши, контактируют с целевым веществом-кандидатом, и действие вещества-кандидата оценивается путем контролирования одного или более параметров. Эти параметры могут отражать жизнеспособность клеток, например, общее количество гемопоэтических клеток или количество гемопоэтических клеток отдельного типа, или апоптотическое состояние клеток, например, количество фрагментаций ДНК, количество клеток с блеббингом, количество фосфатидилсерина на поверхности клетки, и тому подобные методы, хорошо известные в данной области техники. Альтернативно или дополнительно, параметры могут отражать способность клеток к дифференцировке, например, количественные соотношения дифференцированных клеток и дифференцированных типов клеток. Альтернативно или дополнительно, параметры могут отражать функцию клеток, например, выработанные клетками цитокины и хемокины, способность клеток проникать в место заражения, способность клеток модулировать, т.е. оказывать содействие или подавлять, активность других клеток in vitro или in vivo и т.д. Другие параметры могут отражать степень инфекции патогеном у животного, например, титр патогена у мыши, наличие гранулемы у мыши и т.д.
Параметрами являются компоненты клетки, поддающиеся количественному измерению, в особенности компоненты, которые могут быть точно измерены, желательно в системе с высокой пропускной способностью. Критерий может быть любым компонентом клетки или продуктом клетки, включая поверхностную детерминанту клетки, рецептор, белок или их конформационные или посттрансляционные модификации, липид, углеводород, органическую или неорганическую молекулу, нуклеиновую кислоту, например, мРНК, ДНК и т.д. или часть, полученную от такого компонента клетки, или их комбинации. Притом, что большинство параметров будет предоставлять количественное показание, в некоторых случаях приемлем полуколичественный или качественный результат. Показания могут включать отдельные определенные значения, или могут включать среднее, значение медианы, или изменение и т.д. Обычно из множества одинаковых исследований получают ряд значений показаний для каждого параметра. Следует ожидать изменчивости (вариабельности), при этом ряд значений для каждого набора исследуемых параметров получают при помощи стандартных статистических методов в сочетании с обычным статистическим методом, используемым для получения отдельных значений.
Вещества-кандидаты, представляющие интерес для скрининга, включают известные и неизвестные соединения, которые охватывают многочисленные классы химических соединений, в первую очередь органические молекулы, которые могут включать органометаллические молекулы, неорганические молекулы, генетические последовательности, вакцины, антибиотики или другие средства, предположительно имеющие свойства антибиотиков, пептиды, полипептиды, антитела, разрешенные к применению человеком фармацевтичесвие средства и т.д. Важным аспектом изобретения является оценка веществ-кандидатов, включая проверку токсичности; и тому подобное.
Вещества-кандидаты включают органические молекулы, содержащие функциональные группы, необходимые для структурных взаимодействий, в частности водород-связывающие группы, и, как правило, включают, по меньшей мере, амино, карбонильную, гидроксильную или карбоксильную группу, часто по меньшей мере две из функциональных химических групп. Вещества-кандидаты часто включают циклические углеродные или гетероциклические структуры и/или ароматические или полиароматические структуры, замещенные одной или более из вышеперечисленных функциональных групп. Вещества-кандидаты также обнаруживаются среди биомолекул, включая пептиды, полинуклеотиды, сахариды, жирные кислоты, стероиды, пурины, пиримидины, их производные, структурные аналоги или их комбинации. Включаются фармакологически активные лекарственные средства, генетически активные молекулы и т.д. Представляющие интерес соединения включают химиотерапевтические средства, гормоны или антагонисты гормонов и т.д Примеры фармацевтических средств, подходящих для изобретения, описаны в "The Pharmacological Basis of Therapeutics," Goodman и Gilman, McGraw-Hill, New York, N.Y., (1996), Ninth edition. Также включаются токсины и биологические и химические боевые отравляющие вещества, например, смотри Somani, S.M. (Ed.), "Chemical Warfare Agents," Academic Press, New York, 1992).
Вещества-кандидаты, представляющие интерес для скрининга, также включают нуклеиновые кислоты, например, нуклеиновые кислоты, которые кодируют миРНК, мшРНК, антисмысловые молекулы или микроРНК, или нуклеиновые кислоты, которые кодируют полипептиды. Доступно множество векторов, подходящих для переноса нуклеиновых кислот в целевые клетки. Векторы могут поддериваться эписомально, например, как плазмиды, миникольцевые ДНК, полученные на основе вирусов векторы, такие как цитомегаловирус, аденовирус и т.д., или они могут интегрироваться в геном клетки-мишени посредством гомологичной рекомбинации или произвольной интеграции, например, полученные на основе ретровирусов векторы, такие как MMLV, HIV-1, ALV и т.д. Векторы могут быть доставлены непосредственно в предметные клетки. Другими словами, плюрипотентные клетки контактируют с векторами, содержащими целевую нуклеиновую кислоту, так что векторы поглощаются данными клетками.
Способы контактирования клеток, например, клеток в культуре или клеток мыши с нуклеиновокислотными векторами, такие как электропорация, кальций-фосфатная трансфекция и липофекция, хорошо известны в данной области техники. Альтернативно, целевая нуклеиновая кислота может быть предоставлена клеткам посредством вируса. Другими словами, клетки контактируют с вирусными частицами, содержащими целевую нуклеиновую кислоту. В частности, ретровирусы, например, лентивирусы, являются, подходящими для способа изобретения. Обычно используемые ретровирусные векторы являются "дефектными", т.е. неспособными продуцировать вирусные белки, необходимые для продуктивного заражения. То есть, для репликации вектора требуется развитие (культивирование) в упаковочной линии клеток. Для образования вирусных частиц, содержащих целевую нуклеиновую кислоту, ретровирусные нуклеиновые кислоты, содержащие нуклеиновую кислоту, упаковываются в вирусный капсид при помощи упаковочной линии клеток. Различные упаковочные линии клеток обеспечивают включение различных белков оболочки в капсид, этот белок оболочки определяет специфичность вирусной частицы для клеток. Белки оболочки могут быть, по меньшей мере, трех типов экотропные, амфотропные и ксенотропные. Ретровирусы, упакованные экотропными белками оболочки, например, MMLV, способны заражать большинство мышиных и крысиных типов клеток, и образуются путем использования экотропных упаковочных линий клеток, таких как BOSC23 (Pear et al. (1993) P.N.A.S. 90: 8392-8396). Ретровирусы, несущие амфотропные белки оболочки, например, 4070А (Danos et al, supra.), способны заражать большинство типов клеток млекопитающих, включая людей, собак и мышей, и образуются при использовании амфотропных упаковочных линий клеток, таких как РА12 (Miller et al. (1985) Mol. Cell. Biol. 5: 431-437); PA317 (Miller et al. (1986) Mol. Cell. Biol. 6: 2895-2902); GRIP (Danos et al. (1988) PNAS 85: 6460-6464). Ретровирусы, упакованные ксенотропными белками оболочки, например, AKR env, способны заражать большинство типов клеток млекопитающих, за исключением мышиных клеток. Соответствующая упаковочная линия клеток может использоваться для обеспечения нацеливания упакованных вирусных частиц на целевые клетки - в некоторых случаях, трансплантированные клетки, а в некоторых случаях, клетки хозяина, т.е. гуманизированные M-CSF.
Векторы, используемые для предоставления целевой нуклеиновой кислоты предметным клеткам, будут, как правило, содержать подходящие промоторы для запуска экспрессии, то есть транскрипционной активации целевой нуклеиновой кислоты. Это может включать промоторы, действующие повсеместно, например, CMV-b-actin промотор, или индуцибельные промоторы, такие как промоторы, которые активны в определенных популяциях клеток или которые отвечают на присутствие таких лекарственных средств, как тетрациклин. Под транскрипционной активацией подразумевается, что транксрипция будет увеличиваться в клетке-мишени выше исходного уровня, по меньшей мере, приблизительно в 10 раз, по меньшей мере, приблизительно в 100 раз, еще чаще, по меньшей мере, приблизительно в 1000 раз. Кроме того, векторы, используемые для доставки факторов перепрограммирования в клетки, могут включать гены, которые впоследствии должны быть удалены, например, с использованием системы рекомбиназы, такой как Cre/Lox, или клетки, экспрессирующие их, могут быть разрушены, например, путем включения генов, обеспечивающих возможность селективной токсичности, таких как вирус герпеса ТК, bcl-xs и т.д.
Вещества-кандидаты, представляющие интерес для скрининга, также включают полипептиды. Такие полипептиды необязательно могут быть соединены с полипептидным доменом, который увеличивает растворимость продукта. Домен может быть связан с полипептидом посредством определенного сайта расщепления протеазы, например, последовательности TEV, которая расщепляется протеазой TEV. Линкер также может включать одну или более гибких последовательностей, например, от 1 до 10 остатков глицина. В некоторых вариантах осуществления расщепление гибридного белка осуществляется в буферном растворе, который поддерживает растворимость продукта, например, в присутствии от 0,5 до 2 M мочевины, в присутствии полипептидов и/или полинуклеотидов, увеличивающих растворимость и тому подобное. Представляющие интерес домены включают эндосомолитические домены, например, НА домен гриппа; и другие полипептиды, которые содействуют продукции, например, IF2 домен, GST домен, GRPE домен и т.п. Дополнительно или альтернативно такие полипептиды могут быть включены в состав для улучшения стабильности. Например, пептиды могут быть пегилированы, поскольку полиэтиленоксигруппа обеспечивает увеличение времени жизни в кровотоке. Полипептиды могут быть соединены с другим полипептидом, чтобы обеспечить дополнительную функциональность, например, для увеличения in vivo стабильности. В большинстве случаев такие «слитые партнеры» представляют собой стабильные белки плазмы, которые могут, например, продлевать in vivo время полужизни в плазме полипептида, если он присутствует как «слитый», в частности, когда такой стабильный белок плазмы представляет собой константный домен иммуноглобулина. В большинстве случаев, когда стабильный белок плазмы в норме встречается в мультимерной форме, например, иммуноглобулины или липопротеины, в которых одинаковые или разные полипептидные цепи обычно связываются с помощью дисульфидной и/или нековалентной связи с образованием составного полипептида из нескольких цепей, слитые формы, содержащие полипептид, также будут продуцироваться и использоваться как мультимер, имеющий в основном ту же самую структуру как предшественник стабильного белка плазмы. Эти мультимеры будут однородными в отношении полипептидного агента, который они содержат, или они могут содержать более одного полипептидного агента.
Полипептиды-кандидаты могут вырабатываться эукариотическими клетками или могут вырабатываться прокариотичесикими клетками. Дополнительно они могут быть подвергнуты разворачиванию, например, с помощью тепловой денатурации, восстановления DTT и т.д., а в дальнейшем могут подвергаться рефолдингу с использованием методов, известных в данной области техники. Представляющие интерес модификации, не изменяющие первичную последовательность, включают химическое получение производных полипептидов, например, ацилирование, ацетилирование, карбоксилирование, амидирование и т.д. Также включаются модификации в форме гликозилирования, например, созданные модификацией профилей гликозилирования полипептида в ходе синтеза и процессинга или в дополнительных стадиях обработки; например, при воздействии на полипептид ферментов, влияющих на гликозилирование, такого как гликозилирующие или дегликозилирующие ферменты млекопитающих. Также включаются последовательности, имеющие фосфорилированные аминокислотные остатки, например, фосфотирозин, фосфосерин или фосфотреонин. Полипептиды могут быть модифицированы с использованием обычных методов молекулярной биологии и синтетической химии для того, чтобы улучшить их устойчивость к протеолитичекой деградации или оптимизировать свойства растворимости или привести их в состояние более подходящее для терапевтичекого средства. Аналоги таких полипептидов включают полипептиды, содержащие остатки, отличные от природных L-аминокислот, например, D-аминокислоты или неприродные синтетические аминокислоты. D-аминокислоты могут быть замещенными по некоторым или всем аминокислотным остаткам.
Полипетид-кандидат можно получить путем синтеза in vitro, используя обычные известные в данной области техники методы. Доступны различные коммерческие установки для синтеза, например, автоматизированные синтезирующие устройства от компании Applied Biosystems, Inc., Beckman и т.д. При использовании синтезаторов природные аминокислоты могут замещаться неприродными аминокислотами. Конкретная последовательность и способ получения будут определяться удобством, экономическими показателями, необходимой чистотой и т.п. Альтернативно, полипетид-кандидат может быть выделен и очищен в соответствии с обычными методами рекомбинантного синтеза. Может быть приготовлен лизат из клеток экспрессирующего хозяина, лизат можно очистить с использованием HPLC, эксклюзионной хроматографии, гель-электрофореза, аффинной хроматографии или другого метода очистки. В основном, использующиеся композиции будут включать, по меньшей мере, 20% по весу желаемого продукта, еще чаще, по меньшей мере, около 75% по весу, предпочтительно, по меньшей мере, около 95% по весу, и для терапевтических целей обычно, по меньшей мере, около 99,5% по весу, относительно загрязняющих веществ (примесей), связанных со способом получения продукта и его очисткой. Как правило, процентное отношение основывается на общем белке.
В некоторых случаях, полипептиды-кандидиты, которые подвергаются скринингу, представляют собой антитела. Термин "антитело" или "фрагмент антитела" включает какую-либо молекулярную структуру, содержащую полипептидную цепь, со специфической формой, которая точно соответсует эпитопу и распознает эпитоп, причем одно или более нековалентных связывающих взаимодействий стабилизируют комплекс между молекулярной структурой и эпитопом. Специфическое или селективное соответствие данной структуры и ее специфического эпитопа иногда называется совместимостью "замок и ключ". Первичная молекула антитела представляет собой иммуноглобулин, и все типы иммуноглобулинов, IgG, IgM, IgA, IgE, IgD и т.д., из всех источников, например, человека, грызуна, кролика, коровы, овцы, свиньи, собаки, другого млекопитающего, цыпленка, других птиц и т.д., считаются "антителами". Атитела, используемые в настоящем изобретении, могут быть или поликлональными антителами или моноклональными антителами. Антитела обычно находятся в среде, в которой культивируются клетки.
Вещества-кандидаты можно получить из целого ряда источников, включая библиотеки синтетических или природных соединений. Например, доступны многочисленные способы случайного и направленного синтеза широкого спектра органических соединений, включая биомолекулы, включая экспрессию случайных олигонуклеотидов и олигопептидов. Альтернативно, библиотеки природных соединений в форме бактериальных, грибковых, растительных и животных экстрактов являются доступными или их легко получить. Кроме того, природные или полученные синтетическим путем библиотеки и соединения можно легко модифицировать с помощью общепринятых химических, физических и биохимических способов и использовать для получения комбинаторных библиотек. Более того, известные фармакологические средства могут быть подвергнуты направленным или случайным химическим модификациям, таким как ацилирование, алкилирование, этерификация, амидификация и т.д. для получения структурных аналогов.
Скрининг веществ-кандидатов по биологической активности осуществляют путем введения вещества, по меньшей мере, в один или обычно множество образцов, иногда совместно с образцами, не имеющими данного средства. Измеряется изменение параметров в ответ на вещество, а результат оценивается путем сравнения с контрольными культурами, например, в присутствии и при отсутствии средства, с результатами, полученными с другими средствами, и т.д. В случаях, когда скрининг осуществляется для выявления веществ-кандидатов, которые будут предотвращать, уменьшать или отменять эффекты токсического агента, скрининг, как правило, проводится в присутствии токсического вещества, причем токсический агент добавляется в момент, наиболее подходящий для получения результатов. Например, в случаях, когда определяется защитная/профилактическая способность вещества-кандидата, вещество-кандидат может добавляться до токсического агента, одновременно с токсическим агентом или после обработки токсическим агентом. В качестве другого примера, в случаях, когда определяется способность вещества-кандидата отменять (обращать) эффекты токсического агента, вещество-кандидат может добавляться после обработки токсическим агентом. Как указано выше, в ряде случаев, образец представляет собой гуманизированную M-CSF мышь, которой были приживлены («привиты») клетки, т.е. вещество-кандидат «доставляется» в гуманизированную M-CSF мышь, которой были приживлены клетки. В ряде случаев, образец представляет собой подлежащие приживлению клетки, т.е. клетки снабжаются веществом-кандидатом перед трансплантацией.
В том случае, если вещество-кандидат подлежит введению непосредственно мыши, вещество может вводиться с помощью любого из ряда хорошо известных в данной области техники способов введения мышам пептидов, малых молекул и нуклеиновых кислот. Например, вещество может вводиться перорально, через слизистую, местно, внутрикожно или путем инъекции, например, внутрибрюшинной, подкожной, внутримышечной, внутривенной или внутричерепной инъекции и т.п. Вещество может вводиться в буферном растворе, или оно может быть включено в любую из целого ряда композиций, например, путем сочетания с подходящей фармацевтически приемлемой основой. "Фармацевтически приемлемые основы" могут представлять собой основы, одобренные контрольным органом Правительства штата или Федеральным правительством или перечисленные в Фармакопее США или другой общепризнанной фармакопее для использования у млекопитающих, таких как человек. Термин "основа" относится к разбавителю, адьюванту, эксципиенту или носителю, с которым соединение изобретения заключено в состав для введения млекопитающему. Такие фармацевтические основы могут являться липидами, например, липосомами, например, липосомными дендримерами; жидкостями, такими как вода и масла, включая жидкости нефтяного, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобное, физиологический раствор; гуммиарабик, желатин, крахмальную пасту, тальк, кератин, коллоидная окись кремния, мочевину и тому подобное. Кроме того, могут использоваться вспомогательные средства, стабилизирующие вещества, загустители, смазывающие и красящие вещества. Фармацевтические композиции могут быть заключены в состав препаратов в твердой, полужидкой, жидкой или газообразной формах, таких как таблетки, капсулы, пудры, гранулы, мази, растворы, суппозитории, препараты для инъекций и ингаляций, гели, микросферы и аэрозоли. Вещество после введения может распространяться системно или может быть локализовано при применении местного введения, интрамурального введения, или может использоваться имплант для поддержания активной дозы в месте имплантации. Активное вещество может заключаться в состав для проявления немедленного действия или в состав для замедленного высвобождения. При некоторых условиях, в частности, при использовании в центральной нервной системе, может быть необходимо ввести вещества в состав, предназначенный для преодоления гематоэнцефалического барьера (ВВВ). Одна из стратегий доставки лекарственного средства через гематоэнцефалический барьер (ВВВ) предусматривает прохождение ВВВ, или с помощью осмотических средств, таких как маннитол или лейкотриены, или биохимически путем использования таких вазоактивных веществ, как брадикинин. Нарушающее ВВВ средство может вводиться совместно с активным веществом при введении композиции с помощью внутрисосудистой инъекции. Другие стратегии прохождения ВВВ могут предусматривать использование эндогенных транспортных систем, включая опосредованный Кавеолином-1 трансцитоз, использование носителей-переносчиков, таких как глюкоза и аминокислотные переносчики, рецептор-опосредованный трансцитоз инсулина или трансферрина и активные выводящие переносчики, такие как р-гликопротеин. Для использования в изобретении активные транспортные молекулы также могут быть коньюгированы с терапевтическими соединениями с целью облегчения транспорта через эндотелиальную стенку кровеносных сосудов. Альтернативно, доставка средств может происходить путем местной доставки, например путем внутриоболочечной доставки, например, в резервуар Оммайя (смотри, например, патенты США №5,222,982 и 5385582, включенные в описание путем отсылки); путем болюсной инъекции, например, шприцем, например, в стекловидное тело или интракраниально; путем непрерывной инфузии, например, путем катетеризации, например, с конвекцией (смотри, например, заявку США №20070254842, включенную в это описание путем отсылки); или путем имплантации устройства, после чего к нему обратимо прикрепляется вещество (смотри, например, патентные заявки США 20080081064 и 20090196903, включенные в это описание путем отсылки).
Если вещество(а) предоставляются клеткам перед трансплантацией, вещества в целях удобства добавляются в раствор или легкорастворимую форму в среду клеток в культуре. Вещества могут добавляться в проточную систему (в виде струи) с перерывами или непрерывно, или альтернативно, путем добавления разовой дозы (болюса) соединения однократно или с определенным шагом, к другому постоянно текущему раствору. В проточной системе используются две жидкости, где одна является физиологически нейтральным раствором, а другая является тем же раствором с добавленным исследуемым соединением. Первая жидкость омывает клетки, за которой следует вторая. В методе с использованием одного раствора болюс исследуемого соединения добавляется в объем среды, окружающей клетки. Общие концентрации компонентов среды для культивирования не должны значительно изменяться при введении болюса, или между двумя растворами в проточном способе.
Параллельно может выполняться множество анализов с различными концентрациями вещества, чтобы получить различные ответы на различные концентрации. Как известно в данной области техники, для определения эффективной концентрации вещества обычно используется диапазон концентраций, полученный в результате разведений 1:10, или соответственно другой log шкале. При необходимости концентрации можно дополнительно оптимизировать с помощью второй серии разведений. Как правило, одна из этих концентраций служит отрицательным контролем, т.е. при нулевой концентрации или ниже уровня обнаружения вещества, или при такой концентрации вещества или ниже, которая не дает поддающегося обнаружению изменения фенотипа.
Анализ ответа клеток гуманизированной M-CSF мыши на вещество-кандидат может проводиться в любой момент времени после обработки веществом. Например, клетки могут быть проанализированы через 1, 2 или 3 дня, иногда 4, 5 или 6 дней, иногда 8, 9 или 10 дней, иногда 14 дней, иногда 21 день, иногда 28 дней, иногда 1 месяц или более после контакта с веществом-канидатом, например, через 2 месяца, 4 месяца, 6 месяцев или более. В некоторых вариантах осуществления анализ включает анализ в многочисленных временных точках. Выбор временной точки(ек) для анализа будет основываться на типе проводимого анализа, что очевидно специалисту в данной области техники.
Анализ может включать измерение любых описанных здесь или известных в данной области техники параметров для определения жизнеспособности клеток, пролиферации клеток, особенностей клеток, морфологии клеток и функционирования клеток, в частности, так как они могу относиться к иммунным клеткам. Например, может использоваться проточная цитометрия для определения общего количества гемопоэтических клеток или количества гемопоэтических клеток определенного типа. Могут осуществляться гистохимические или иммуногистохимические анализы для определения апоптотического состояния клеток, например, терминальное дезоксиуридиновое мечение концов dUTP (TUNEL) для измерения фрагментации ДНК, или иммуногистохимический анализ для обнаружения связывания Аннексина V с фосфатидилсерином на клеточной поверхности. Проточная цитометрия также может использоваться для оценки процентного содержания дифференцированных клеток и типов дифференцированных клеток, например, для определения способности гемопоэтических клеток дифференцироваться в присутствии вещества. ELISA, Вестерн-блоттинг и Нозерн-блоттинг могут проводиться для определения уровней цитокинов, хемокинов, имуноглобилинов и т.д., экспрессирующихся у «привитых» гуманизированных M-CSF мышей, например, для оценки функционирования приживленных клеток. Также может быть проведен анализ in vivo с целью проверки функционирования иммунных клеток, а также анализы, имеющие отношение к определенным заболеваниям или расстройствам, представляющим интерес, таким как диабет, аутоиммунное заболевание, реакция «трансплантат против хозяина», AMD и т.д. Смотри, например, Current Protocols in Immunology (Richard Coico, ed. John Wiley & Sons, Inc. 2012) и Immunology Methods Manual (I. Lefkovits ed., Academic Press 1997), раскрытие которых включено в это описание путем отсылки.
Так, например, предоставляется способ определения воздействия вещества на патоген человека, включающий воздействие на «привитую» гуманизированную M-CSF мышь, например, «привитую» Rag2-/-IL2rg-/- hM-CSF мышь, эффективного количества патогена человека, эффективное количество патогена является количеством патогена, необходимым для того, чтобы вызвать заражение мыши; обеспечение возможности заражения мыши патогеном; измерение показателя заражения в течение некоторого времени в присутствии вещества; и сравнение этого измерения с измерением у «привитой» гуманизированной M-CSF мыши, не подвергавшейся действию вещества. Вещество определяется как антипатогенное вещесто, например, анти-S. typhi веществом, в том случае, если оно уменьшает количество патегена в крови или ткани мыши, по меньшей мере, наполовину после однократного введения или двух или более введений вещества в течение выбранного периода времени.
В качестве другого примера предоставляется способ определения, обладает ли изолят патогена или представляющий интерес штамм лекарственной устойчивостью, например, множественной лекарственной устойчивостью. В таких способах «привитая» гуманизированная M-CSF мышь, например, «привитая» Rag2-/-IL2rg-/- hM-CSF мышь, подвергается действию эффективного количества изолята патогена человека или интересующего штамма, эффективное количество патогена является количеством патогена, необходимым для заражения мыши; обеспечивается возможность заражения мыши патогеном; показатель инфекции, например, титр изолята или интересующего штамма в крови или ткани мыши, способность изолята или интересующего штамма поддерживать инфекцию у мыши или способность изолята или интересующего штамма воспроизводиться после введения лекарственного средства, измеряется в присутствии лекарственного средства; и это измерение сравнивается с измерением, полученным у «привитой» гуманизированной M-CSF мыши, зараженной патогенном, но не подвергавшейся действию исследуемого вещества. Примеры лекарственных средств, представляющих интерес, включают амоксициллин, ампициллин, цефотаксим, цефтриаксон, цефтазидим, хлорамфеникол, ципрофлоксацин, ко-тримоксазол, эртапенем, имипенем, фторхинолоны (например, ципрофлоксацин, гатифлоксацин, офлоксацин), стрептомицин, сульфадиазин, сульфаметоксазол, тетрациклин и их комбинацию. В отдельном варианте осуществления введение лекарственного средства или комбинации лекарственных средств происходит, по меньшей мере, через неделю, 10 дней, две недели, три недели или четыре недели после вызывающего заражение воздействия изолята или интересующего штамма.
Другие примеры использования мышей, являющихся предметом изобретения, предоставлены в других местах данного описания. Дополнительные варианты применения генетически модифицированных и «привитых» мышей, описанные в этом раскрытии, будут очевидны специалисту в данной области техники после прочтении этого раскрытия.
РЕАГЕНТЫ, УСТРОЙСТВА И НАБОРЫ
Также предоставляются реагенты, устройства и их наборы для применения на практике одного или более из вышеописанных способов. Предметные реагенты, устройства и их наборы могут в значительной степени варьировать.
В некоторых вариантах осуществления реагенты или наборы будут содержать одно или более веществ для использования в описанных способах. Например, набор может содержать гуманизированную мышь M-CSF. Набор может содержать реагенты для разведения гуманизированных M-CSF мышей, например, праймеры, и, в ряде случаев, реагенты для генотипирования гуманизированных M-CSF мышей. Набор может содержать гемопоэтические клетки человека или обогащенную популяцию гемопоэтических прогениторньгх клеток человека для трансплантации гуманизированной M-CSF мыши, или реагенты для приготовления популяции гемопоэтических клеток или обогащенной популяции гемопоэтических клеток человека для трансплантации гуманизированной M-CSF мыши. Другие реагенты могут включать реагенты для определения жизнеспособности и/или функции гемопоэтических клеток, например, в присутствии/отсутствие вещества-кандидата, например, одного или более антитела, специфичного к маркерам, которые экспрессируются различными типами гемопоэтических клеток, или реагенты для обнаружения определенного цитокина, хемокина и т.д. Другие реагенты могут включать культуральную среду, культуральные добавки, матриксные композиции и тому подобное.
В дополнение к вышеуказанным компонентам наборы будут дополнительно включать инструкции, касающиеся применения способов. Эти инструкции могут присутствовать в наборах в различных формах, одна или более из которых может находиться в наборе. Одна форма, в которой могут находиться эти инструкции, представляет собой информацию, напечатанную на подходящем носителе или субстрате, например, листе или листах бумаги, на которых напечатана информация, в упаковке набора, на листке-вкладыше в упаковку и т.д. Другим способом является носитель, который можно прочитать с помощью компьютера, например, дискета, CD и т.д., на котором записана информация. Еще одним способом, который может встречаться, является адрес веб-сайта, с помощью которого можно получить информацию с удаленного сайта через интернет. В наборах могут присутствовать любые удобные устройства.
ПРИМЕРЫ
Следующие примеры используются для того, чтобы предоставить специалистам в данной области техники полное раскрытие и описание того, как применять и использовать настоящее изобретение, и не предназначаются для ограничения рамок того, что изобретатели рассматривают в качестве их изобретения, они также не имеют в виду, что представленные далее эксперименты представляют собой все взможные эксперименты или единственные проделанные эксперименты. Были сделаны усилия для обеспечения точности в отношении используемых чисел (например, количеств, температуры и т.д.), однако, должны учитываться некоторые экспериментальные ошибки и отклонения. Если не указано иное, части представляют весовые части, молекулярная масса является средней молекулярной массой, температура выражена в градусах Цельсия, а давление является атмосферным или примерно атмосферным.
Колониестимулирующий фактор-1(CSF-1) или макрофагальный колониестимулирующий фактор (M-CSF) представляет собой один из первых открытых цитокинов, способствующих гематопоэзу. Предполагают, что в гемопотической системе M-CSF специфически воздействует на миелоидные предшественники, начиная со стадии общего миелоидного предшественника (СМР), и способствует дифференцировке CMPs в моноцитарно/макрофагальном направлении дифференцировки (Sherr, С.J. et al. (1988) Macrophage colony-stimulating factor, CSF-1, и its proto-oncogene-encoded receptor, Cold Spring Harb. Symp. Quant. Biol. 53 Pt 1: 521-530). Кроме того, M-CSF необходим для выживания, адгезии и подвижности макрофагов (Pixley, F.J., и Stanley, E.R. (2004) CSF-1 regulation of the wandering macrophage: complexity in action, Trends Cell Biol. 14: 628-638; Socolovsky, M. et al. (1998) Cytokines in hematopoiesis: specificity и redundancy in receptor function, Adv. Protein Chem. 52: 141-198; Stanley, E.R. et al. (1997) Biology и action of colony--stimulating factor-1, Mol. Reprod. Dev. 1997; 46: 4-10). Помимо ключевой роли в миелоидной дифференцировке, M-CSF жизненно необходим для дифференцировки остеокластов, для дифференцировки, выживания и пролиферации клеток женских половых путей и для образования плаценты (Pixley et al. (2004); Socolovsky et al. (1998); Stanley et al. (1997)). M-CSF вырабатывается целым рядом клеток клеток, включая фибробласты, стромальные клетки костного мозга (ВМ), активированные Т-клетки и макрофаги и секреторные эпителиальные клетки. M-CSF подает сигналы через M-CSF рецептор (Fms; CD115), связывание M-CSF с его рецептором приводит к фосфорилированию тирозина Fms и последующему фосфорилированию нескольких белков клетки-хозяина, таких как Grb2, She, Sos1 и р85 (Pixley et al. (2004); Stanley et al. (1997); Rohrschneider, L.R. et al. (1997) Growth и differentiation signais regulated by the M-CSF receptor, Mol. Reprod. Dev. 46: 96-103; Yeung, Y.G. и Stanley, E.R. (2003) Proteomic approaches to the analysis of early events in colony-stimulating factor-1 signal transduction, Mol. Cell. Proteomics 2: 1143-1155).
Изобретатели предположили, что дефектная дифференцировка миелоидных клеток человека у гуманизированных мышей может происходить из-за отсутствия специфических сигналов, способствующих миелоидной дифференцировке. Для ее подтверждения изобретатели создали новое поколение гуманизированных мышей, способных к секреции человеческого M-CSF на физиологическом уровне из соответствующих тканей. Анализ этих гуманизированных M-CSF мышей как качественно, так и количественно показал нормальную экспрессию человеческого M-CSF. Анализ гуманизированных M-CSF мышей «привитых» человеческими CD34+ клетками выявил увеличенные частоты встречаемости человеческих моноцитов/макрофагов в различных тканях. Более того, у человеческих моноцитов/макрофагов, полученных от этих мышей, наблюдались улучшенные функциональные свойства.
Описанные здесь гуманизированные M-CSF мыши демонстрируют повышенную частоту встречаемости и функции человеческих миелоидных клеток. Вставка человеческого M-CSF в локус M-CSF мыши Balb/c мышей, лишенных активирующего рекомбинацию гена 2 (Rag2; Genbank Accession No. 1.NM_009020.3) и гамма-цепи (γс, также известный как "рецептор интерлейкина 2, гамма-цепь" или IL2RG; учетный номер Genbank 1.NM_013563.3) (Balb/c Rag2-/- γс-/- мыши) приводила к достоверной экспрессии человеческого M-CSF у этих мышей как качественно, так и количественно. Внутрипеченочное введение (перенос) гемопоэтических стволовых и прогениторных клеток, полученных из эмбриональной печени человека (CD34+), гуманизированным М-CSF (M-CSFh/h) новорожденным мышатам приводило к более эффективной дифференцировке и повышенной частоте встречаемости человеческих моноцитов/макрофагов в костном мозге, селезенке и периферической крови. Кроме того, у M-CSFh/h мышей наблюдались длительная способность поддерживать человеческую моноцитарно/макрофагальную дифференцировку даже через 20 недель после трансплантации. Более того, M-CSFh/h мыши содержат резидентные человеческие моноциты/макрофаги в различных тканях, включая печень и легкие, в отличие от контрольных немодифицированных мышей. Человеческие моноциты/макрофаги, полученные от гуманизированных M-CSF мышей, также проявляют повышенные функциональные свойства, такие как миграция, фагоцитоз, активация и ответ на LPS.
Пример 1: Препараты клеток, аналитические методы и анализы
Выделение CD34+ клеток и трансплантация. Образцы эмбриональной печени человека были получены из хранилища тканей эмбриональной печени человека в Albert Einstein College of Medicine, Bronx, NY и из Advance Biosciences Resources, Inc., Alameda, CA. Все эксперименты с использованием человеческих тканей проводились при согласовании с Комитетом по исследованиям Йельского университета.
Для выделения CD34+ клеток человека образцы эмбриональной печени однократно промывали PBS и разрезали на небольшие кусочки, обрабатывали коллагеназой D (100 нг/мл) при 37°С в течение 45 минут. Готовили суспензии отдельных клеток, и мононуклеарные клетки выделяли при помощи центрифугирования в градиенте плотности (среда для фракционирования лимфоцитов, MP biomedicals). CD34+ клетки были выделены после обработки клеток анти-человеческими CD34 микрогранулами с последующей технологией MACS™ (Miltenyi Biotech).
Для трансплантации новорожденные мышата (1 день после рождения) были сублетально облучены двумя отдельными дозами (2×150 сГр) с интервалом 4 часа, а затем 1×105-2×105 очищенных CD34+ клеток человека в 20 мкл PBS вводили в печень при помощи иглы 22 размера (Hamilton Company, Reno, NV).
Выделение и культивирование мезенхимальных стромальных клеток (MSC). Выделяли длинные кости мыши и вымывали клетки костного мозга сильной струей жидкости. Кости разрезали на куски и расщепляли при помощи коктейля коллагеназ D и Ρ (25 нг/мл) в течение 45 минут при 37°С. Выделяли суспензию клеток и высевали на чашки в присутствии среды для культивирования MSC (Stem Cell Technologies). Через 2 недели культивирования клетки CD45-Scal+CD90+ выделяли и культивировали.
Антитела и проточная цитометрия. Суспензии единичных клеток анализировали методом проточной цитометрии при помощи программного обеспечения FACS Calibur или LSRII и CELLQUEST™, программного обеспечения FACS DIVA™ (BD Biosciences, San Jose, CA) или программного обеспечения FLOWJO™ (Tree Star, Inc., Ashland, OR), соответственно. Сортировку клеток определенных субпопуляций проводили при помощи клеточного сортера FACS ARIA™ (BD Biosciences, San Jose, CA).
В исследовании были использованы следующие человеческие антитела: CD11b, CD14, CD33, CD34, CD38, CD40, CD45, CD80, CD86, CD90 и HLA-DR.
В исследовании были использованы следующие мышиные антитела: CD11b, CD40, CD45, CD80, CD86, F4/80, Gr1, H2Kd и IAd.
Культура клеток. Для дифференцировки мышиных макрофагов костного мозга клетки высевали в 6-луночные планшеты в присутствии DMEM с 10% FCS и необходимыми добавками (2мМ L-глутамин, 1% пенициллин-стрептомицин и 1мМ незаменимых аминокислот). Клетки обрабатывали рекомбинантным мышиным M-CSF (10 нг/мл) или рекомбинантным человеческим M-CSF (10 нг/мл) в течение 7 дней. Супернатант культуры клеток удаляли один раз в три дня, и замещали свежей средой и цитокинами.
Для исследования макрофагов человека, например, активации, фагоцитоза и миграции, 2×105 CD45+CD14+CD33+ клеток селезенки сортировали и культивировали in vitro в среде DMEM с 15% человеческой АВ сыворотки и необходимыми добавками (2 мМ L-глутамин, 1% пенициллин-стрептомицин и 1 мМ незаменимых аминокислот).
Анализ активации, фагоцитоза и миграции. Для стимуляции LPS in vivo мышам вводили внутрибрюшинно (i.p.) LPS (100 нг/г веса тела). Для стимуляции LPS in vitro к клеткам добавляли LPS (10 нг/мл) и культивировали в течение 1 или 2 дней. Для стимуляции poly I:C in vitro клетки культивировали в присутствии poly I:С (10 мкг/мл) в течение 6 или 12 часов.
Анализ фагоцитоза проводили с использованием коммерчески доступного набора для анализа фагоцитоза VYBRANT™ (Invitrogen) согласно инструкции изготовителя.
Анализ миграции проводили с использованием коммерчески доступного набора для анализа хемотаксической миграции клеток QCM™ (Millipore) согласно инструкции изготовителя.
Выделение РНК и ПЦР в реальном времени. Тотальную РНК выделяли с использованием коммерчески доступной системы (RNEASY™ Mini kit, Qiagen). кДНК синтезировали с использованием oligo dT праймера и обратной транскриптазы (Roche). ПЦР реакцию проводили в двух повторностях с использованием систем 7500 real time PCR и power SYBR™ Green PCR master mix (Applied Biosystems) согласно инструкциям изготовителя с использованием следующих геноспецифических пар праймеров: Человеческий CSF1 (прямой:

ELISA. Для количественных исследований цитокинов собирали сыворотку крови или супернатанты культур клеток и проводили анализ ELISA с использованием коммерчески доступных наборов human IL6 и human TNF ELISA (Ray Biotech, Inc., GA) согласно инструкциям изготовителя.
Гистология. Твердые органы фиксировали в 4% PFA. Зафиксированные органы заключали в парафин (Blue RiBbon; Surgipath Medical Industries). Блоки рассекали, и 5-μм срезы окрашивали Н&Е, а затем накрывали покровными стеклами стандартными методами. Срезы хранили без какой-либо среды. При комнатной температуре получали цифровые изображения с помощью оптического микроскопа Zeiss Axio Imager.Al (с линзами объектива 2× и 10×), камеры AxioCam MRc5 и программного обеспечения для обработки изображений Axio Vision 4.7.1 (Carl Zeiss Microimaging LLC).
Статистический анализ. Данные представлены как среднее ±SEM. Статистическая значимость оценивалась при помощи двустороннего t-критерия Стьюдента. Значения Ρ>0,05 считали не имеющими статистической значимости, а значения Ρ<0,05 были представлены как *.
Пример 2: Генетически модифицированные мыши для приживления
Стратегия «нок-ин» M-CSF человека. Нацеливающая конструкция для замещения нуклеиновокислотной последовательности M-CSF мыши на нуклеиновокислотную последовательность M-CSF человека (VELOCIGENE® Allele регистрационный номер 5093) за один нацеливающий этап была сконструирована с использованием технологии VELOCIGENE®, как описано ранее (Valenzuela et al. (2003) High-throughput engineering of the mouse genome coupled with high-resolution expression analysis, Nat. Biotechnol. 21:652-659). ДНК M-CSF мыши и человека были получены из бактериальной искусственной хромосомы (ВАС) RPCI-23, клон 373В18, и из ВАС RPCI-11, клон 101М23, соответственно. Кратко, RAG2+/- γс-/-мышиные эмбриональные стволовые клетки (ES), полученные от коммерчески доступной клеточной линии V17 ES (BALB/c × 129 F1) электропорировали линеаризованной нацеливающей конструкцией, образованной методом клонирования с восстановлением разрыва (gap repair cloning) и содержащей расположенные в направлениях 3' и 5' плечи, гомологичные мышиному М-SCF, фланкирующие 17,5 тпо последовательности M-CSF человека протяженностью от экзона 2 до 633 нукл в направлении 5' от некодирующего экзона 9, и фланкированной loxP селекционной кассетой. Мышиные ES клетки, несущие гетерозиготную делецию гена M-CSF, определяли путем скрининга на предмет утраты аллеля при помощи 2 TaqMan qPCR зондов, которые распознавали последовательности в интроне 2 (TUF праймер, 5'-CCAGGAATGTCCACTATGGATTC-3' (SEQ ID NO: 13); TUP зонд, 5' ACTGCTCCTTGACCCTGCTCTGACTCA-3' (SEQ ID NO: 14); TUR праймер, 5'-TGGGCTGACTTCCCAAAGG-3' (SEQ ID NO: 15)) и в 3' фланкирующей последовательности (TDF праймер, 5'-TTAGGTGCTAGTAGGCTGGAAAGTG-3' (SEQ ID NO: 16); TDP зонд, 5'-TGCAATCGCAGCTTCTCTCCTTACTAGGCT-3 (SEQ ID NO: 17)'; TDR праймер, 5'-AATAGGAAGAACGAACAGGTCTAATACC-3' (SEQ ID NO: 18)) гена Csf1 мыши. Одновременное замещение гена мыши геном CSF1 человека было подтверждено с помощью TaqMan зонда «приобретения аллеля» (Gain-of-Allele), которые обнаруживали одну копию последовательности в интроне 2 CSF1 (прямой праймер, 5'-GCTGCTTGCCTGGGTTAGTG-3' (SEQ ID NO: 19); зонд, 5'-TGCCCAGGAACATCAACCACTGATTCTG-3' (SEQ ID NO: 20); обратный праймер, 5'-GAGGGACAGCAGACCTCAGAAG-3' (SEQ ID NO: 21)) и одну копию кассеты устойчивости к неомицину (neor) (прямой праймер, 5'-GGTGGAGAGGCTATTCGGC-3' (SEQ ID NO: 22); зонд, 5'-TGGGCACAACAGACAATCGGCTG-3' (SEQ ID NO: 23); обратный праймер, 5'-GAACACGGCGGCATCAG-3' (SEQ ID NO: 24); смотри фиг. 8. Зонды qPCR, распознающие последовательность CSF1, не амплифицируют ДНК генома мыши. Аналогичные зонды использовались для подтверждения генотипов мышей, полученных из целевых ES клеток. Cre-опосредованное удаление селекционной кассеты подтверждалась neor TaqMan зондом. Все наборы праймер-зонд были поставлены Biosearch Technologies. Зонды были помечены 6-карбоксифлюоресцеином (FAM) на их 5' концах и BHQ-1 на их 3' концах.
Затем проводили электропорацию корректно нацеленных ES клеток вектором, транзиентно экспрессирующим Cre, для удаления селекционной кассеты. Клоны ES клеток-мишеней без селекционной кассеты вводили в мышиный эмбрион на стадии 8 клеток по методу VELOCMOUSE® (Poueymirou et al. (2007)). VELOCIMICE® (F0 мыши, полностью полученные из донорных ES клеток), несущие гуманизированный ген M-CSF (VG 5093), были определены путем генотипирования на предмет потери мышиного аллеля и приобретения человеческого аллеля с использованием модификации метода анализа аллелей (Valenzuela et al. (2003)).
Содержание мышей. Balb/c-Rag2-/- γс-/-M-CSFm/m, Balb/c-Rag2-/- γс-/-M-CSFh/m и Balb/c-Rag2-/- γc-/-M-CSFh/h мышей содержали в специальных стерильных условиях в виварии Йельского Университета. Все эксперименты на мышах были одобрены Институциональным Комитетом по Содержанию и Использованию Животных Йельского Университета.
Создание гуманизированных M-CSF мышей. Чтобы подтвердить, что физиологическая экспрессии человеческого M-CSF у мыши приводит к улучшенной дифференцировке человеческих макрофагов у гуманизированных мышей, для экспрессии человеческого M-CSF были созданы Balb/c Rag2-/- γс-/- мыши. Штамм Balb/c с отсутствием Rag2-/- γс-/- служит успешной модельной системой для исследований иммунной системы человека у мышей (Traggiai Ε et al. (2004) Development of a human adaptive immune system in cord blood cell-transplanted mice, Science 304: 104-107). Для того, чтобы избежать супрафизиологической экспрессии человеческого M-CSF у этих мышей, была принята стратегия замещения кодирующей последовательности M-CSF мыши на человеческий аналог. Для замещения за один нацеливающий этап большей части открытой рамки считывания M-CSF кодирующей последовательностью M-CSF человека (VELOCIGENE® Allele регистрационный номер 5093) была создана конструкция (фиг. 8) с использованием технологии VELOCIGENE®, как описано ранее (Valenzuela et al. (2003)). Следует отметить, что промотор и другие регуляторные элементы (такие как 5'UTR) мыши в этом векторе были сохранены. Линеаризованный нацеливающий вектор вводили в Balb/c × 129 Rag 2+/- γс-/- эмбриональные стволовые клетки путем электропорации. Корректно нацеленные ES клетки-мишени далее электропорировали вектором, транзиентно экспедирующим Cre, для удаления селекционной кассеты. Целевые ES клеточные клоны без селекционной кассеты вводили в мышиный эмбрион на стадии 8 клеток по методу VELOCIMOUSE® (Poueymirou et al. (2007)). VELOCIMICE® (F0 мыши полностью полученные из донорных ES клеток), несущие гуманизированный ген M-CSF (VG 5093), были определены путем генотипирования на предмет потери мышиного аллеля и приобретения человеческого аллеля с использованием модификации метода анализа аллелей (Valenzuela et al. (2003)). Путем последовательного скрещивания потомков были созданы химерные мыши Balb/c Rag2-/- γс-/- и мыши с переданной зародышевой линией (germline transmitted mice) с мышиным и человеческим M-CSF (M-CSFm/h; гетерозиготный нок-ин) и только человеческим M-CSF (M-CSFh/h; гомозиготный нок-ин).
Характеристика гуманизированных M-CSF мышей. Оценивали экспрессию человеческого M-CSF у гуманизированных M-CSF мышей. Для исследования брали органы M-CSFm/m или M-CSFh/h мышей и анализировали экспрессию мРНК мышиного и человеческого M-CSF с использованием видоспецифичных праймеров. Как показано на фиг. 1А и 1B, M-CSF экспрессируется в большинстве проанализированных органов, включая костный мозг, селезенку, кровь, печень, мозг, легкие, семенники и почки. Однако в тимусе и коже экспрессия M-CSF не была обнаружена. Следует отметить, что профиль экспрессии мышиного и человеческого M-CSF был сравним у M-CSFm/m и M-CSFh/h мышей, соответственно. Далее количественно определяли уровни экспрессии мышиного и человеческого M-CSF у M-CSFm/m, M-CSFm/h и M-CSFh/h мышей. Выделяли мезенхимальные стромальные клетки костного мозга (MSCs) и количественно определяли уровни экспрессии мРНК M-CSF при помощи ПЦР в реальном времени (фиг. 1С) и (секретированного) белка M-CSF при помощи ELISA (фиг. 1D). M-CSFm/m мыши экспрессировали только мышиный M-CSF, M-CSFm/h мыши экспрессировали и мышиный и человеческий M-CSF и M-CSFh/h мыши экспрессировали только человеческий M-CSF. Уровень экспрессии человеческого M-CSF был сравним с мышиным M-CSF. В соответствии с этими данными, анализ CSF-1 в сыворотке показал сравнимые уровни экспрессии белка CSF-1 у m/m, h/m, и h/h мышей (фиг. 1Е). Гемизиготность не приводит к уменьшению уровней экспрессии гена и белка, указывая на то, что уровни дозы гена по-видимому не являются ограничивающими для этого цитокина.
Для выяснения, приводит ли замещение мышиного M-CSF человеческим M-CSF к вредным воздействиям, в особенности на кости и гемопоэз, анализировали M-CSFh/h мышей разного возраста. Ранее проведенные исследования подтвердили, что у мышей с дефектным сигнальным путем М-CSF (



Возможным объяснением нормального гемопоэза и развития костей у M-CSFh/h мышей может служить то, что человеческий M-CSF перекрестно реагирует с мышиными клетками. Чтобы это проверить, выделенные от M-CSFm/m клетки костного мозга культивировали в присутствии рекомбинантного мышиного M-CSF или рекомбинантного человеческого M-CSF. Тогда как клетки костного мозга, культивируемые в отсутствие цитокина не выживали, клетки, культивируемые в присутствии человеческого или мышиного M-CSF обнаруживали сравнимые уровни дифференцировки in vitro (фиг. 2d). Анализ этих дифференцированных in vitro макрофагов в отношении экспрессии ко-стимуляторных молекул и МНС показал сравнимые уровни этих молекул в присутствии человеческого или мышиного M-CSF (фиг. 2е). В соответствии с полученными нами результатами, проведенные ранее исследования подтвердили, что человеческий M-CSF является активным в мышиных клетках-мишенях, тогда как мышиный M-CSF не реагирует перекрестно с человеческими клетками (Sieff, СА. (1987) Hematopoietic growth factors, J. Clin. Invest. 79: 1549-1557).
Пример 3: Дифферецировка человеческих моноцитов/макрофагов у гуманизированных M-CSF мышей
Чтобы оцкенить влияние гуманизирования M-CSF, сублетально облученным новорожденным Rag2-/- γс-/-M-CSFm/m, Rag2-/- γc-/- M-CSFh/m и Rag2-/- γс-/- M-CSFh/h мышатам внутрипеченочно (i.h) трансплантировали ~ 2×105 очищенных CD34+ клеток эмбриональной печени человека. Затем через 8 недель после трансплантации у реципиентов была взята кровь для подтверждения происхождения клеток от донора (на основании экспрессии человеческого CD45). Через двенадцать недель после трансплантации реципиентов забивали и брали для исследований их костноый мозг, селезенкуе и периферическую кровь. Анализ показал увеличение относительных и абсолютных частот встречаемости CD14+CD33+ клеток моноцитарно/макрофагальной линии дифференцировки в костном мозге, селезенке и периферической крови и M-CSFh/m и M-CSFh/h мышей по сравнению с M-CSFm/m мышами (фиг. 3А-С). Несмотря на то, что у M-CSFh/m мышей наблюдались увеличенные частоты встречаемости CD14+CD33+ клеток, максимальные частоты встречаемости CD14+CD33+ клеток были обнаружены у M-CSFh/h мышей. Интересно, что, в дополнение к этому увеличению, частоты встречаемости CD14-CD33+ клеток также были увеличены в костном мозге, селезенке и периферической крови M-CSFh/m и M-CSFh/h мышей (фиг. 3А).
Чтобы проанализировать, поддерживают ли мыши с «нок-ин» человеческого М-CSF длительный человеческий миелопоэз, проводили анализ реципиентов через 12, 16 и 20 недель после трансплантации. Тогда как у M-CSFm/m мышей количество человеческих CD14+CD33+ клеток моноцитарно/макрофагальной линии дифференцировки было уменьшено незначительно через 16 недель и уменьшено значительно через 20 недель после трансплантации, у M-CSFh/m и M-CSFh/h мышей значительное процентное содержание человеческих CD14+CD33+ клеток наблюдалось даже через 16 и 20 недель. Тем не менее, максимальные частоты встречаемости человеческих CD14+CD33+ клеток наблюдались у M-CSFh/h мышей (фиг. 4А и 4В).
Далее определяли, поддерживают ли гуманизированные M-CSF мыши эффективную дифференцировку тканевых макрофагов человека. С этой целью проводили перфузию мышей M-CSFm/m, M-CSFm/h и M-CSFh/h с использованием PBS, и для анализа брали их органы (включая печень, легкие и кожу). Клетки брюшной полости получали путем промывания брюшной полости PBS. Готовили суспензии единичных клеток и вычисляли частоты встречаемости человеческих CD14+CD33+ клеток. Как и предполагалось, частоты встречаемости человеческих CD14+CD33+ клеток были достоверно увеличены в печени, легких и брюшной полости M-CSFm/h и M-CSFh/h мышей. Однако анализ эксплантов кожи показал сравнимые частоты встречаемости человеческих CD14+CD33+ клеток у M-CSFm/m и M-CSFm/h мышей, несмотря на то, что в эксплантах кожи M-CSFh/h мышей наблюдалось достоверное увеличение этих клеток (фиг. 5). Взятые в совокупности, эти данные свидетельствуют о том, что экспрессия человеческого M-CSF у мышей улучшает дифференцировку миелоидно/макрофагального направления человеческих ГСК.
Пример 4: Функционирование человеческих моноцитов/макрофагов у гуманизированных M-CSF мышей
Чтобы выяснить, нормально ли функционируют человеческие CD14+CD33+ моноциты/макрофаги у гуманизированных M-CSF мышей, были проведены функциональные исследования как in vivo так in vitro. Сублетально облученным M-CSFm/m и M-CSFm/h мышатам вводили CD34+ клетки эмбриональной печени и через 12 недель после трансплантации оценивали полученный донорный гемопоэз путем введения мышам-реципиентам LPS или PBS. Через 2 дня после введения LPS анализировали частоты встречаемости человеческих CD14+CD33+ клеток в селезенке реципиентов. По сравнению с группой, которой вводили PBS, введение LPS вызывало лишь умеренное увеличение клеток моноцитарно/макрофагальной линии дифференцировки у M-CSFm/m мышей, в то время как введение LPS M-CSFm/h мышам показало увеличение человеческих CD14+CD33+ клеток в селезенке в несколько раз (фиг. 6А). Далее были проверены возможности этих клеток вырабатывать провоспалительные цитокины в ответ на стимуляцию LPS in vivo.
LPS вводили M-CSFm/m и M-CSFm/h мышам, «привитым» человеческими CD34+ клетками. Через шесть часов после введения у мышей брали кровь и определяли сывороточные уровни человеческого и мышиного IL6 и TNFα при помощи ELISA. В соответствии с повышенной частотой встречаемости моноцитов/макрофагов у гуманизированных M-CSF мышей, у M-CSFm/h мышей были обнаружены повышенные уровни IL6 и TNFα человека. Несмотря на то, что исходные уровни этих цитокинов были выше у M-CSFm/h мышей, LPS-стимуляция приводила к повышению уровней IL6 и TNFα человека в сыворотке (фиг. 6В и 6С). Далее была проанализирована способность моноцитов/макрофагов (полученных от гуманизированных M-CSF мышей) секретировать провоспалительные цитокины in vitro. Человеческие CD14+CD33+ клетки выделяли из селезенки M-CSFm/m или M-CSFh/h мышей через 12 недель после восстановления человеческими CD34+ клетками и стимулировали LPS in vitro в течение 24 или 48 часов. Уровни цитокинов IL-6 и TNFα в супернатантах культур клеток оценивали при помощи ELISA. В соответствии с данными, полученными in vivo, CD14+CD33+ клетки M-CSFh/h мышей в ответ на LPS секретировали повышенные уровни этих цитокинов (фиг. 7А и 7В). Аналогично, человеческие CD14+CD33+ клетки гуманизированных M-CSF мышей в ответ на стимуляцию poly I:С экспрессировали мРНК интерферона-α и интерферона-β на повышенном уровне (фиг. 7С). Наконец, были проанализированы характеристик фагоцитоза, миграции и активации человеческих моноцитов/макрофагов гуманизированных M-CSF мышей. Человеческие CD14+CD33+ клетки, полученные от М-CSFh/h мышей, восстановленных человеческими CD34+, продемонстрировали повышенную способность к фагоцитозу (фиг. 7D) и увеличенный хемотаксис в ответ на хемокин Μip3β (фиг. 7Е). Как и ожидалось, человеческие моноциты/макрофаги M-CSFh/h мышей демонстрировали повышенную активацию, исходя из оценки повышенной регуляции ко-стимуляторных молекул, включая CD40, CD80 и CD86, и HLA-DR в ответ на стимуляцию LPS in-vitro (фиг. 7F). В целом, у человеческих моноцитов/макрофагов, дифференцировавшихся у гуманизированных мышей в присутствии человеческого М-CSF, наблюдаются повышенные функциональные характеристики.
Создание мышей с полностью восстановленной и функциональной гемопоэтической/иммунной системой человеческого происхождения являлось сложной задачей в этой области. В настоящее время созданы 3 мышиных штамма (NOD-scid γс-/-, [NSG], NOD/Shi-scid γс-/- [NOG], и Balb/c-Rag2-/- γс-/-). Несмотря на преимущества, которыми наделен каждый из этих штаммов, человеческий гемопоэз у этих мышей был неполноценным.
Для преодоления этой главной технической трудности ген CSF-1 мыши был заменен его человеческим аналогом. Это привело к эффективной дифференцировке человеческих макрофагов у мышей, преобразованных человеческими гемопоэтическими и прогениторными клетками. Анализ гуманизированных CSF-1 мышей показал эффективную дифференцировку человеческих моноцитов/макрофагов в костном мозге, селезенке и периферической крови. Более того, человеческие макрофаги были обнаружены в некоторых других тканях, включая легкие и печень, у этих мышей, что указывает на то, что присутствие CSF-1 у гуманизированных мышей является достаточным для оказания содействия (активизирования) дифференцировки человеческих тканевых макрофагов. Дополнительно, описанные здесь функциональные исследования человеческих моноцитов/макрофагов, полученные от CSF1m/m и CSF1h/h мышей, свидетельствуют о том, что клетки CSF1h/h мышей лучше выполняли такие функции, как фагоцитоз, миграция, активация и секреция цитокинов. На основании полученных результатов можно сделать вывод о лучшем функционировании моноцитов/макрофагов, которые дифференцируются в присутствии человеческого CSF-1.
Для создания новой линии Balb/c-Rag2-/- γс-/- мышей, экспрессирующих человеческий CSF-1, использовалась генноинженерная технология VELOCIGENE®. В соответствии с этим, кодирующий участок CSF-1 мыши был замещен человеческим аналогом без нарушения регуляторных элементов, таких как промотор, гена
Роль CSF-1 в дифференцировке мышиных макрофагов была точно установлена. У мышей, лишенных или CSF-1


Изложенное выше только иллюстрирует принципы изобретения. Следует иметь в виду, что специалисты в данной области техники будут способны создать разные варианты, которые, хотя и не описаны подробно или не показаны в описании, воплощают принципы изобретения и включаются в его объем и сущность. Более того, все упомянутые в описании примеры и условный язык прежде всего предназначаются для понимания принципов изобретения и идей, вносимых изобретателями для продвижения данной области техники, и их следует рассматривать как неограниченные такими конкретно изложенными примерами и условиями. Более того, все изложенные в описании утверждения, принципы, аспекты и варианты осуществления изобретения, а также их конкретные примеры, как предполагается, включают их структурные и функциональные эквиваленты. Кроме того, предполагается, что такие эквиваленты включают и известные в настоящее время эквиваленты и эквиваленты, которые будут созданы в будущем, т.е., любые созданные элементы, которые выполняют ту же самую функцию, вне зависимости от структуры. Следовательно, объем настоящего изобретения не ограничиваются иллюстративными вариантами осуществления, показанными и описанными здесь. Точнее, существо и объем настоящего изобретения излагается в прилагаемых пунктах формулы изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Murphy, Andrew J.
Stevens, Sean
Rathinam, Chozhavendan
Eynon, Elizabeth
Manz, Markus
Flavell, Richard
<120> Humanized M-CSF Mice
<130> REGN-002WO
<150> 61/442,946
<151> 2011-02-15
<160> 24
<170> FastSEQ for Windows Version 4.0
<210> 1
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> synthetic oligonucleotide
<400> 1
tactgtagcc acatgattgg ga 22
<210> 2
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> synthetic oligonucleotide
<400> 2
cctgtgtcag tcaaaggaac 20
<210> 3
<211> 18
<212> DNA
<213> Artificial Sequence
<220>
<223> synthetic oligonucleotide
<400> 3
cgacatggct gggctccc 18
<210> 4
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> synthetic oligonucleotide
<400> 4
cgcatggtct catctattat 20
<210> 5
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> synthetic oligonucleotide
<400> 5
gtactgcaga atctctcctt tctcctg 27
<210> 6
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> synthetic oligonucleotide
<400> 6
gtgtctagat ctgacaacct cccaggcaca 30
<210> 7
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> synthetic oligonucleotide
<400> 7
ttgtgcttct ccactacagc 20
<210> 8
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> synthetic oligonucleotide
<400> 8
ctgtaagtct gttaatgaag 20
<210> 9
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> synthetic oligonucleotide
<400> 9
aaggacctct cgaagtgttg gata 24
<210> 10
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> synthetic oligonucleotide
<400> 10
catttaaaag gaactgttga caacg 25
<210> 11
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> synthetic oligonucleotide
<400> 11
cttcctcctc ctgaggagtc 20
<210> 12
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> synthetic oligonucleotide
<400> 12
cctgaccaag gaaagcaaag 20
<210> 13
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> synthetic oligonucleotide
<400> 13
ccaggaatgt ccactatgga ttc 23
<210> 14
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> synthetic oligonucleotide
<400> 14
actgctcctt gaccctgctc tgactca 27
<210> 15
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<223> synthetic oligonucleotide
<400> 15
tgggctgact tcccaaagg 19
<210> 16
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> synthetic oligonucleotide
<400> 16
ttaggtgcta gtaggctgga aagtg 25
<210> 17
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> synthetic oligonucleotide
<400> 17
tgcaatcgca gcttctctcc ttactaggct 30
<210> 18
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<223> synthetic oligonucleotide
<400> 18
aataggaaga acgaacaggt ctaatacc 28
<210> 19
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> synthetic oligonucleotide
<400> 19
gctgcttgcc tgggttagtg 20
<210> 20
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<223> synthetic oligonucleotide
<400> 20
tgcccaggaa catcaaccac tgattctg 28
<210> 21
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> synthetic oligonucleotide
<400> 21
gagggacagc agacctcaga ag 22
<210> 22
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<223> synthetic oligonucleotide
<400> 22
ggtggagagg ctattcggc 19
<210> 23
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> synthetic oligonucleotide
<400> 23
tgggcacaac agacaatcgg ctg 23
<210> 24
<211> 17
<212> DNA
<213> Artificial Sequence
<220>
<223> synthetic oligonucleotide
<400> 24
gaacacggcg gcatcag 17
<---
Реферат
Изобретение относится к области биохимии, в частности к гуманизированной мыши, которая содержит последовательность нуклеиновой кислоты, кодирующую человеческий белок M-CSF и функционально связанную с эндогенным промотором мышиного гена M-CSF в локусе M-CSF мыши, а также к способам её создания. Также раскрыты способы скрининга вещества на наличие активности, модулирующей функцию гемопоэтических клеток человека в гуманизированной M-CSF мыши, предусматривающие использование вышеописанной мыши. Изобретение позволяет эффективно получать гуманизированных мышей, экспрессирующих человеческий белок M-CSF в костном мозге, селезенке, крови, печени, мозге, легких, семеннике и почке. 5 н. и 50 з.п. ф-лы, 9 ил., 4 пр.
Формула
Документы, цитированные в отчёте о поиске
Применение рецептора edg2 на модели сердечно-сосудистой недостаточности у животных

Комментарии