Вакцина для производства продукции животноводства - RU2723031C2
Код документа: RU2723031C2
Чертежи





Описание
Область изобретения
Изобретение касается живой вакцины для защиты от бактериальной кишечной инфекции.
Предпосылки создания изобретения
Ссылка на любой предшествующий уровень техники в описании не является подтверждением или предположением того, что этот предшествующий уровень техники является составной частью общего знания в какой-либо юрисдикции, или что от специалиста в данной области техники было бы разумно ожидать, что этот предшествующий уровень техники может быть понят или рассмотрен как родственный и/или объединяемый с другими частями известного уровня техники.
Нетифозная Salmonella (NTS) представляет собой самое большое бремя болезней пищевого происхождения в Соединенных Штатах, вызывающее большинство инфекций, госпитализаций и смертей, с ежегодным числом зарегистрированных случаев заболеваний, составляющим 1,03 миллиона. Размер экономических потерь, связанных с этим заболеванием, поражает, причем только медицинские расходы достигают более $ 11 млрд в год, плюс значительные дополнительные расходы, понесенные пищевой промышленностью (отзыв продуктов, судебные процессы, снижение потребительского доверия) и государством, местными и федеральными агентствами здравоохранения в связи со вспышками NTS. Ежегодно в мире количество случаев нетифозной Salmonella оценивается в 93,8 миллионов и 55000 из них - смертельные; эта инфекция стала ведущей причиной бактериемии в странах Африки к югу от Сахары, где уровень вызванной ею смертности достигает 25%.
Связанный с Salmonella урон, наносимый здоровью и экономике, может ухудшиться в любой момент вследствие длительного применения антибиотиков, которое привело к появлению штаммов с множественной лекарственной устойчивостью, которые распространились во всем мире, например, S. Typhimurium DT104 за последние два десятилетия вызвал несколько вспышек болезней пищевого происхождения, при этом он устойчив к четырем из пяти антибиотиков, наиболее часто используемых в ветеринарной медицине (тетрациклину, бета-лактамам, аминогликозидам и сульфаниламидам). Такие штаммы с множественной лекарственной устойчивостью часто связаны с еще большим числом госпитализаций и бактериемий, а их поддержание в природе может происходить при очень низких концентрациях антибиотиков, которые обычно встречаются в окружающей среде, в том числе, в грунтовых водах. Кроме того, новый класс карбапенем-резистентных энтеробактерий, устойчивых к β-лактамам, фторхинолонам и аминогликозидам, был выделен из организма пациента в 2009г., и такая устойчивость теперь широко распространена среди Грамм-отрицательных патогенов, включая Salmonella. Помимо этого, недавно (в 2012г.) из природных микробных популяций, полученных от сельскохозяйственного скота, была выделена 'гипервирулентная' Salmonella. Эти гипервирулентные штаммы в 100 раз более опасны, чем большинство клинических изолятов, в большей степени способны вызывать гибель вакцинированных животных, и их невозможно обнаружить с использованием стандартных лабораторных методов вследствие их быстрого перехода в менее вирулентное состояние в условиях ex vivo. В совокупности эти данные подтверждают мнение о том, что бремя болезней, вызываемых Salmonella, может ухудшиться в любой момент в связи с потенциальным появлением более вирулентных штаммов с множественной лекарственной устойчивостью, которые трудно контролировать с помощью имеющихся в настоящее время антибиотиков.
Salmonella enterica передается фекально-оральным путем и состоит из шести подвидов, которые подразделяются на более чем 2500 сероваров (серологических вариантов) на основании углеводного, липополисахаридного (LPS) и жгутикового состава, при этом подвид enterica включает в себя более 99% изолятов болезнетворных микроорганизмов человека. Инфекция S. enterica может приводить к любому из четырех различных синдромов заболевания: энтероколиту/поносу, бактериемии, кишечной (тифозной) лихорадке и хроническому бессимптомному носительству. Многие серовары заразны как для людей, так и животных, при этом тяжесть заболевания зависит от собственно серовара, вирулентности штамма и восприимчивости хозяина.
Усилия по борьбе с Salmonella в животноводстве по-прежнему сталкиваются со многими трудностями по следующим причинам: 1) большинство инфекций сельскохозяйственных животных являются субклиническими; 2) вспышки заболевания являются спорадическими и часто вызваны специфическими серотипами, хотя многие серотипы свойственны для данной конкретной местности производства продукции животноводства; 3) устойчивость в окружающей среде представляет собой постоянный источник инфекции для скота; 4) недавнее появление более вирулетных вариантов штаммов, от которых могут погибать вакцинированные животные; 5) некоторые штаммы, полученные от больных сальмонеллезом пациентов, отличаются от штаммов животного происхождения; и 6) мероприятия по контролю инфекции и экологические события могут увеличить воздействия болезнетворных микроорганизмов и/или подрывать иммунитет хозяина.
Вакцинация представляет собой рациональный подход к любому плану обеспечения безопасности пищевых продуктов, снижения воздействия болезнетворных микроорганизмов в самом начале цепи производства пищевых продуктов [1]. Однако иммунитет, предоставляемый обычными вакцинами, ограничивается узким кругом близкородственных штаммов, и для борьбы внутри хозяйства требуется разработка вакцин, которые дают защиту от многих патогенных серотипов [1]. Последние достижения привели к разработке модифицированных живых пререкрестно-защитных вакцин против Salmonella, многие из которых содержат мутации в глобальных регуляторных сетях, которые способствуют производству антигена; и которые также пригодны для экспрессии гетерологичных антигенов [2-6]. Молекулярная основа эффективности пререкрестно-защитных вакцин не очень понятна. Среди параметров, возможно имеющих влияние, можно перечислить: экспрессию нескольких антигенов, общих для патогенных серотипов; уменьшение поствакцинальной иммуносупрессии; направленное удаление иммунодоминантных антигенов, чтобы сделать доступными эпитопы с перекрестно-защитной функцией; секрецию III типа рекомбинантных антигенов; и/или замедленное ослабление вакцины для усиления стимуляции иммунного ответа (обсуждается в [1, 3, 7, 8]).
Модифицированная живая ослабленная S. enterica, серовар Typhimurium, которая содержит в себе мутации с потерей функции, может быть полезна для предоставления защиты против многообразия сальмонеллы. Число локусов, которое можно рассмотреть с точки зрения осуществления применимой мутации с потерей функции, огромно, так же как и число применимых мутаций в каждом локусе. Некоторые примеры локусов для осуществления потери функции включают локусы, которые участвуют в присоединении, вторжении и внутри- и внеклеточной выживаемости бактерий (включая многие гены, кодирующие белки, участвующие в процессах обмена веществ). Некоторые мутации гена, кодирующего ДНК-аденинметилазу (dam), способны создавать защиту против многообразия сальмонелл. Они, по всей видимости, хорошо переносятся при применении в качестве модифицированных живых вакцин у мышей [2, 9], домашней птицы [10, 11], овец [12] и телят [13-15]. Стимулирование иммунитета происходит быстро, и вакцину можно вводить, используя доставку с питьевой водой, что снижает стоимость иммунизации и стресс у поголовья скота при ее выполнении [12, 16].
Коммерческий успех любой вакцины зависит от терапевтического индекса, отношения безопасность/токсичность, при этом безопасность имеет особое значение в случае модифицированных живых вакцин, которые потенциально могут вновь приобрести повышенную вирулентность. В целом, вакцина должна отвечать 4 категориям безопасности, чтобы подходить для рассмотрения в качестве кандидата для коммерческого применения в производстве продукции животноводства. Соответствующие безопасные фенотипы: сниженное i) выделение вакцины в среду; ii) выделение в среду штамма для проверочного заражения; iii) персистентность в системных тканях (печень/селезенка); и iv) устойчивость в окружающей среде.
Понятно, что при предоставлении ослабленного штамма, содержащего мутации потери функции, важно, чтобы улучшенный за счет соответствующих мутаций профиль безопасности не снижал эффективности вакцины с точки зрения предоставляемой ею защиты. В конце концов, предметом поиска является мутация, которая не уменьшает персистентность низкого уровня инфекции в иммунизированном индивидууме, и которая не увеличивает персистентность иммуногена в окружающей среде, когда патоген выделяется в окружающую среду иммунизированным животным.
Сложно предсказать, какие мутации с потерей функции более полезны для ослабления, особенно учитывая, что данные о иммуногенности и возврате (реверсии) к патогенности, относящиеся к каждому локусу и мутации, получены из разных лабораторных систем.
Еще одна трудность связана с потребностью выбирать более чем один локус для мутации, чтобы предотвратить возврат (реверсию) к патогенному фенотипу в случае утраты по меньшей мере одной мутации с потерей функциональности. При таком подходе требуется просочетать по меньшей мере 2 локуса из большого перечня локусов-кандидатов, но при этом действовать практически без указания на то, будет ли конкретная комбинация увеличивать или уменьшать вероятность реверсии, или она скорее повысит или понизит иммуногенность получаемой ослабленной вакцины.
Существует потребность в ослабленной живой вакцине для защиты от инфицирования Salmonella.
Также существует потребность в ослабленной живой вакцине для защиты от инфицирования сальмонеллой, которая имеет фенотип с улучшенной безопасностью.
Существует потребность в ослабленной живой вакцине, которая не имеет тенденции к выделению в среду животным, которая имеет минимальную устойчивость в окружающей среде в случае выделения ее животным, и которая сохраняет приемлемый уровень устойчивого нахождения в животном для того, чтобы вызывать иммунитет.
Краткое описание изобретения
Изобретение стремится улучшить или решить одну или более из вышеупомянутых проблем, ограничений или потребностей и в одном из вариантов осуществления предлагает кишечную бактерию, включающую:
- первая мутация с потерей функции в гене, кодирующем ДНК-аденинметилазу (здесь и далее - dam) и
- вторая мутация с потерей функции в гене, выбранном из группы, состоящей из: sifA, spvB и mgtC.
В дополнительном варианте осуществления предложена вакцина, включающая:
- кишечную бактерию, как описано выше; и
- носитель, разбавитель, наполнитель или адъювант.
В следующем варианте осуществления предложен способ профилактики или лечения бактериального кишечного заболевания или состояния, включая стадию предоставления вакцины, как описано выше, индивидууму, которому необходима профилактика или лечение бактериального кишечного заболевания или состояния.
В следующем варианте осуществления предложен способ получения набора иммуногенов, пригодных для применения в вакцине для профилактики или лечения бактериального кишечного заболевания или состояния, включающий в себя:
- предоставление кишечной бактерии, содержащей в себе мутацию с потерей функции в dam,
- введение мутации с потерей функции в ген бактерии, выбранный из группы, состоящей из: sifA, spvB и mgtC.
В следующем варианте осуществления предложен способ получения набора иммуногенов, пригодных для применения в вакцине для профилактики или лечения бактериального кишечного заболевания или состояния, включающий в себя:
- предоставление кишечной бактерии, содержащей в себе мутацию с потерей функции, выбранную из группы, состоящей из: sifA, spvB и mgtC.
- введение мутации с потерей функции в dam ген бактерии.
Краткое описание графических материалов
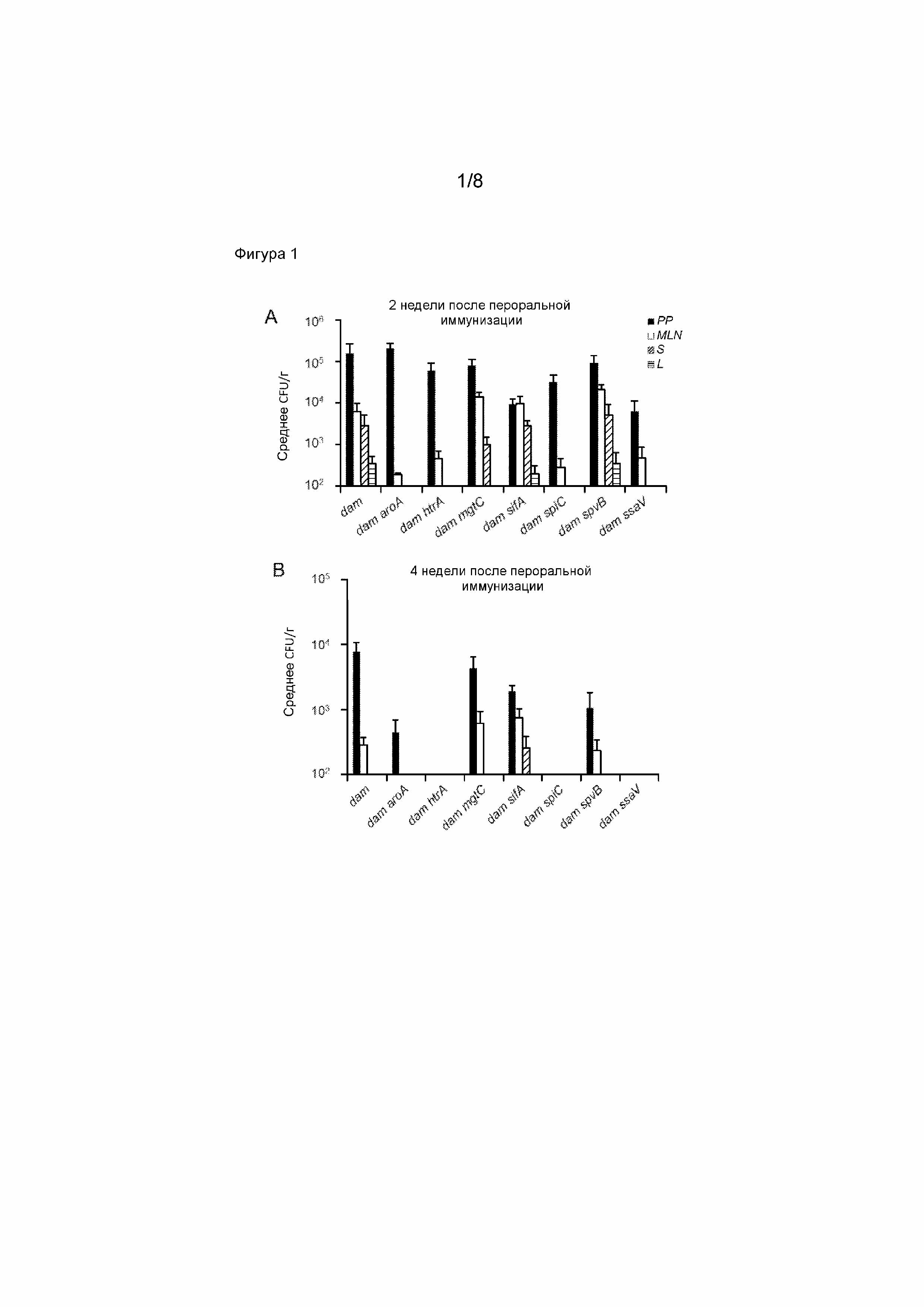
Фигура 1.Оценка Salmonella вакцин-кандидатов с двойной мутацией в dam с точки зрения колонизации и персистентности в слизистых и системных тканях. Мышам BALB/c проводили пероральную иммунизацию, используя S. Typhimurium UK-1 damΔ232 вакцины-кандидаты с двойной мутацией (dam aroA [MT3138], dam htrA [MT3142], dam mgtC [MT3146], dam sifA [MT3150], dam spiC [MT3154], dam spvB [MT3158], dam ssaV [MT3162]) или родительский UK-1 damΔ232 штамм вакцины (MT3134) (109 CFU). Через 2 недели (A) и 4 недели (B) после пероральной иммунизации, бактерии, выделенные из пейеровых бляшек (PP), брыжеечных лимфатических узлов (MLN), печени (L) и селезенки (S) исследовали на предмет формирования колониеобразующих единиц (CFU) на среде LB. Пороги определения: PP, MLN, селезенка < 100 CFU; печень < 50 CFU.
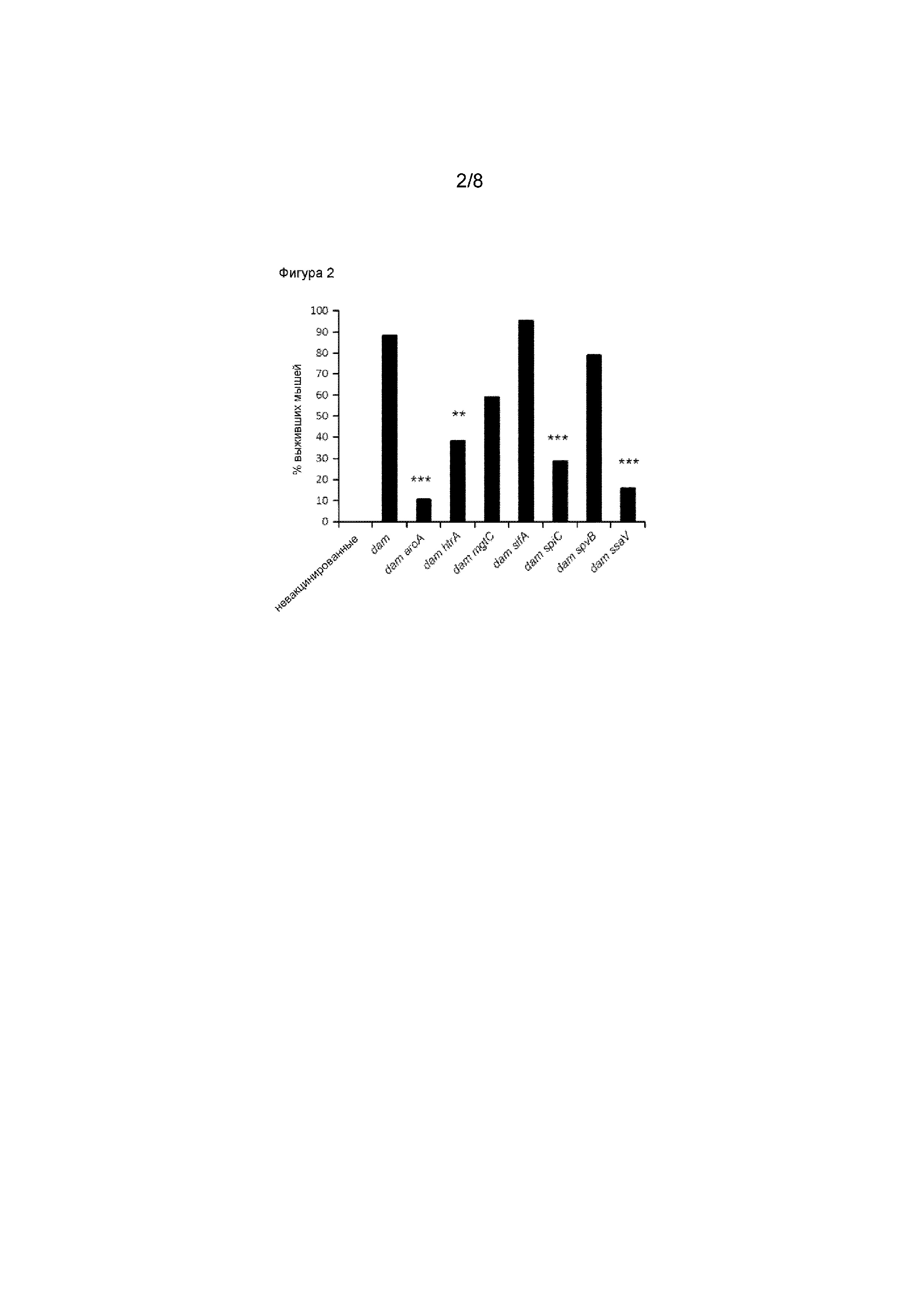
Фигура 2.Оценка эффективности гомологичного штамма Salmonella вакцин-кандидатов с двойной мутацией в dam. Мышам BALB/c проводили пероральную иммунизацию, используя S. Typhimurium UK-1 damΔ232 вакцины-кандидаты с двойной мутацией (dam aroA [MT3138], dam htrA [MT3142], dam mgtC [MT3146], dam sifA [MT3150], dam spiC [MT3154], dam spvB [MT3158], dam ssaV [MT3162]) или родительский UK-1 damΔ232 штамм вакцины (MT3134) (109 CFU). Через одиннадцать недель после иммунизации, проводили проверочное инфицирование вакцинированных мышей, используя пероральную дозу 200 LD50 гомологичного штамма дикого типа S. Typhimurium UK-1 (χ3761). Все мыши, не прошедшие вакцинацию, погибли к 21 дню после заражения. Различия в соотношении мышей, выживших после вирулентного заражения, были проанализированы с использованием модели логистической регрессии (Genstat 15th edition [34]). Вакцинация обеспечивает существенный уровень защиты (P < 0,01). Сходный уровень защиты был получен с помощью dam вакцин, включающих в себя вторые делеции mgtC, sifA и spvB, по сравнению с родительской dam вакциной. Значительное снижение эффективности dam вакцины наблюдали после введения вторых делеций aroA, htrA, spiC и ssaV (** P < 0,01; *** P < 0,001).
Фигура 3.Оценка гетерологичной перекресно-защитной эффективности Salmonella вакцин-кандидатов с двойной мутацией в dam. Мышам BALB/c (от16 до 25 в когорте) проводили пероральную иммунизацию, используя S. Typhimurium UK-1 damΔ232 вакцины-кандидаты с двойной мутацией (dam mgtC [MT3146], dam sifA [MT3150], dam spvB [MT3158]; 109 CFU). Через одиннадцать недель после иммунизации, проводили проверочное инфицирование вакцинированных мышей, используя пероральную дозу 100 LD50 гетерологичных Salmonella серотипов, имеющих клиническую значимость для отрасли животноводства (S. Dublin 8895 [крупный рогатый скот], S. Bovismorbificans 225 [овцы], S. Typhimurium 131 [овцы]). Все мыши, не прошедшие вакцинацию, погибли к 21 дню после заражения. Различия в соотношении мышей, выживших после вирулентного заражения, были проанализированы с использованием модели логистической регрессии (Genstat 15th Edition [34]). Вакцинация каждой из dam вакцин, включающей в себя вторые делеции mgtC, sifA и spvB, обеспечивает существенный уровень защиты против исследованных гомологичного и гетерологичного штаммов для проверочного заражения (*** P < 0,001).
Фигура 4.Оценка безопасности вакцин (реверсия к 2-AP устойчивости) Salmonella dam вакцин-кандидатов с двойной мутацией. Мышей BALB/c внутрибрюшинно инфицировали, используя 105 CFU вакцин-кандидатов с двойной мутацией S. Typhimurium UK-1 damΔ232 (dam mgtC [MT3146], dam sifA [MT3150], dam spvB [MT3158]) или dam UK-1 родительский штамм вакцины [MT3134]. Число 2-AP чувствительных (незакрашенные квадратики) или 2-AP устойчивых (закрашенные квадратики) Salmonella организмов в селезенке (A) или печени (B) подсчитывали на 5 день после инфицирования. Символы значения CFU ниже нуля представляют собой число мышей, у которых бактериальная нагрузка в селезенке и печени была ниже порога определения (< 25 CFU). Статистическая значимость персистентности S. Typhimurium UK-1 dam вакцин с двойной мутацией (2-APs) и реверсии к повышенной вирулентности (2-APr) по сравнению с родительским SalmonelladamΔ232 штаммом вакцины определяли, используя дисперсионный анализ (* P < 0,05).
Фигура 5.Оценка выделения вакцины с фекалиями Salmonella вакцин-кандидатов с двойной мутацией в dam. Устойчивые к канамицину производные S. Typhimurium UK-1 damΔ232 вакцин-кандидатов с двойной мутацией, dam mgtC (MT3183), dam sifA (MT3184), dam spvB (MT3186) и dam UK-1 родительский штамм (MT3180) использовали для вакцинации мышей BALB/c пероральным путем (109 CFU). Фекалии собирали индивидуально от каждой мыши и помещали для подсчета CFU/г в LB чашки с канамицином 50 μг/мл на 2, 4, 7, 11, 14 и 21 день после иммунизации. Выделения с фекалиями Salmonella dam вакцин-кандидатов с двойной мутацией по сравнению с родительским Salmonella damΔ232 штаммом вакцины анализировали, используя REML анализ повторных измерений. Значимыми оказались, как вакцина, так и время, прошедшее после вакцинации (* P < 0,05). Никаких существенных различий в выделении с фекалиями между различными вакцинами с двойной делецией в dam не наблюдали. Приведены значения, полученные с использованием модели, предсказывающей среднее число CFU/г в фекалиях мышей после вакцинации. Порогом определения является 60 CFU.
Фигура 6.Выделение с фекалиями штаммов для проверочного инфицирования у мышей, иммунизированных Salmonella вакцинами-кандидатами с двойной мутацией в dam. Устойчивые к канамицину производные S. Typhimurium UK-1 damΔ232 вакцин-кандидатов с двойной мутацией, dam mgtC (MT3183), dam sifA (MT3184), dam spvB (MT3186) и dam UK-1 родительский штамм (MT3180) использовали для вакцинации мышей BALB/c пероральным путем (109 CFU). Клиренс штамма вакцины в фекалиях был достигнут через четыре недели после иммунизации. Через одиннадцать недель после иммунизации, проводили проверочное инфицирование вакцинированных мышей, используя дозу 100 LD50 устойчивого к канамицину производного дикого типа S. Typhimurium UK-1 (MT2315;107 CFU). Фекалии собирали индивидуально от каждой мыши и высеивали для подсчета CFU/г в LB чашки с канамицином 50 μг/мл на 2, 4, 7, 11, 14 и 21 день после иммунизации. Выделение с фекалиями штамма дикого типа для проверочного инфицирования после проверочного инфицирования вакцинированных мышей анализировали, используя REML анализ повторных измерений. Значимыми оказались, как вакцина, так и время, прошедшее после вакцинации (* P < 0,05), при этом наблюдали тенденцию к значительному взаимодействию между временем и вакциной (P=0,075). Попарное сравнение показало значительные различия между группами при разных временах после вирулентного проверочного инфицирования; a=выделение вакцин с двойной делецией было значительно меньшим по сравнению с выделением родительской dam вакйины; b=выделение dam sifA и dam spvB вакцин было меньше, чем выделение less родительской dam вакцины, и выделение dam sifA было значительно меньше, чем выделение dam mgtC и dam spvB вакцин; c=выделение dam sifA и dam spvB вакцин было значительно меньше, чем выделение dam mgtC и dam spvB вакцин, и выделение dam spvB вакцины было значительно меньше, чем выделение dam mgtC вакцины; d=выделение dam sifA, dam spvB и dam mgtC вакцин было значительно меньше, чем выделение dam spvB вакцины. Приведенные значения представляют собой предсказанные моделью средние значения CFU штамма дикого типа для проверочного инфицирования в фекалиях после проверочного инфицирования. Порогом определения является 60 CFU.
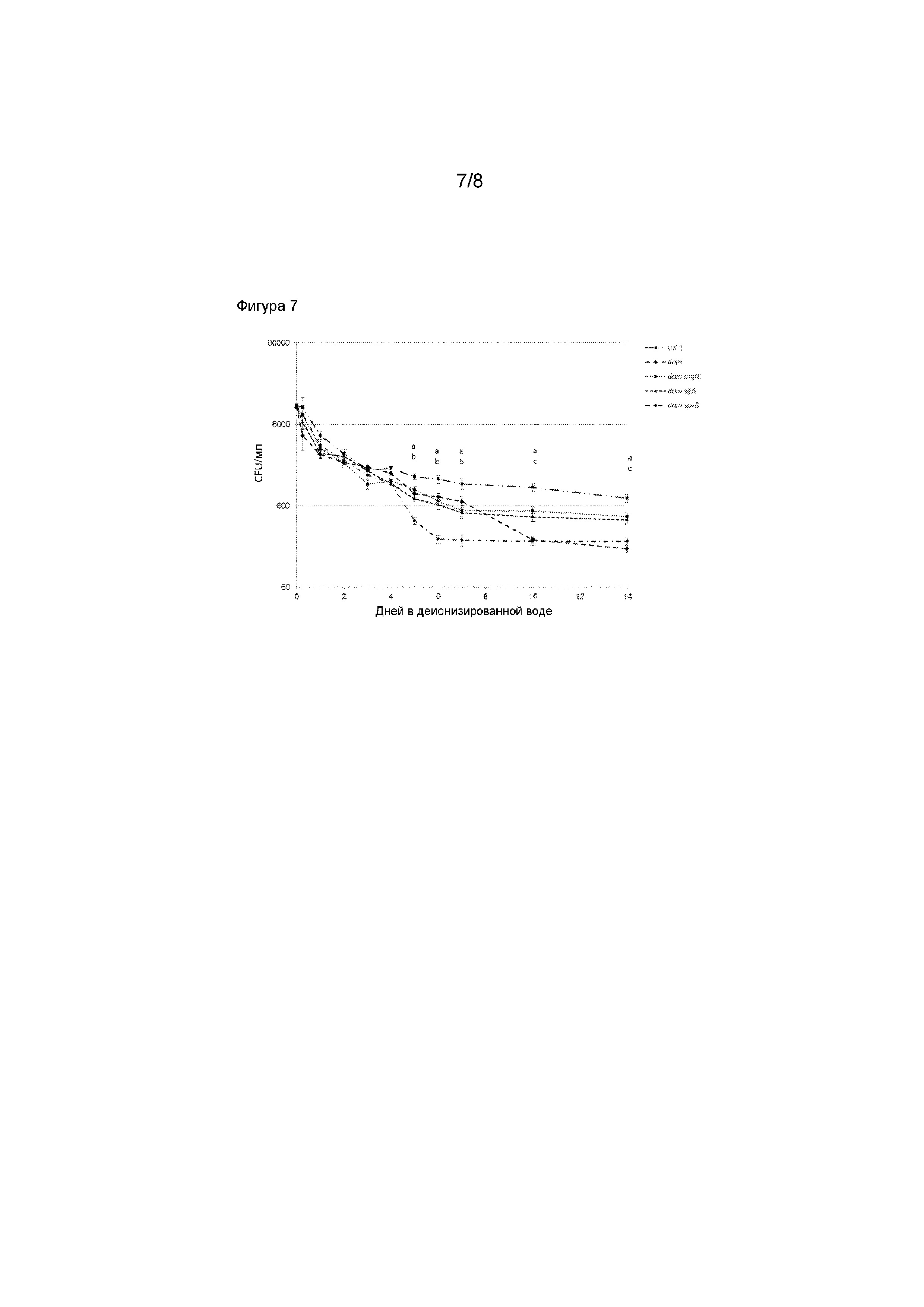
Фигура 7. Оценка устойчивости вакцины в окружающей среде (в деионизированной воде) Salmonella вакцинами-кандидатами с двойной мутацией в dam. Устойчивые к канамицину производные S. Typhimurium UK-1 damΔ232 вакцин-кандидатов с двойной мутацией, dam mgtC (MT3183), dam sifA (MT3184), dam spvB (MT3186) и dam UK-1 родительский штамм (MT3180) использовали для инфицирования 20 мл деионизированной воды (104 CFU/мл). Анализы трех параллельных проб проводили в 50 мл конических пробирках с неплотными крышками при комнатной температуре. Образцы встряхивали и высевали для подсчета CFU/мл за период продолжительностью две недели в указанные временные точки. Приведенные значения представляют собой среднее CFU/мл, причем колонка ошибок указывает ± стандартную ошибку среднего (SEM). Зависимость числа CFU/мл в воде от времени анализировали, используя REML анализ повторных измерений. Наблюдали сильную зависимоcть между группой вакцины и временем (P < 0,001). Попарное сравнение показало значительные различия между группами при разных временах ( P < 0,05). a=все вакцины имеют более низкое CFU/мл, чем родительский UK-1 штамм дикого типа; b=CFU/мл для dam Δ232 штамма значительно меньше, чем CFU/мл для dam mgtC,dam sifA и dam spvB штаммов; c=CFU/мл для dam Δ232 и dam spvB штаммов были значительно меньше, чем для dam sifA и dam mgtC штаммов.
Фигура 8. Оценка устойчивости вакцины в окружающей среде (в фекалиях овец) Salmonella вакцинами-кандидатами с двойной мутацией в dam. Двадцатипроцентное содержание сухого вещества фекалий получали путем добавления 20 мл деионизированной воды к 5 г высушенных овечих фекалий (подарок от Barbara Byrne, University of California, Davis; [32,33]). В 20%-ное сухое вещество фекалий высевали (104 CFU/мл) устойчивые к канамицину производные S. Typhimurium UK-1 damΔ232 вакцин-кандидатов с двойной мутацией, dam mgtC (MT3183), dam sifA (MT3184), dam spvB (MT3186) или dam UK-1 родительский штамм (MT3180). Анализы трех параллельных проб проводили в 50 мл конических пробирках с неплотными крышками при комнатной температуре. Образцы встряхивали и высевали для подсчета CFU/мл за период продолжительностью две недели в указанные временные точки. Приведенные значения представляют собой среднее CFU/мл, причем колонка ошибок указывает ± стандартную ошибку среднего (SEM). Зависимость числа CFU/мл в фекалиях от времени анализировали, используя REML анализ повторных измерений. Наблюдали сильную зависимость между группой вакцины и временем (P < 0,001). Попарное сравнение показало значительные различия между группами при разных временах (P < 0.05). CFU/мл для всех штаммов вакцин было меньше, чем для родительского UK-1 дикого типа для всех временных точек, за исключением дней 1 и 6. a=dam sifA значительно меньше, чем dam, dam mgtC и dam spvB; b=dam sifA значительно меньше, чем dam и dam mgtC; c=dam sifA значительно меньше, чем dam mgtC; d=dam spvB значительно меньше, чем dam mgtC; e=dam spvB значительно меньше, чем dam; f=dam mgtC значительно меньше, чем dam.
Подробное описание вариантов осуществления
Как обсуждалось ранее, кишечное бактериальное заболевание, например, гастроэнтерит и другие состояния, характеризующиеся диареей, и обезвоживание, по-прежнему остаются основными проблемами в промышленном животноводстве. Инфекция, вызываемая Salmonella, и сальмонеллез вызывают особую обеспокоенность. На сегодняшний день все попытки предотвратить или лечить эти состояния у сельскохозяйственных животных имели ограниченный успех, либо вследствие ограниченной иммуногенности вакцины, либо вследствие присущего ей профиля безопасности. Особую обеспокоенность вызывают вакцины, которые животное выделяет в среду, и которые устойчивы в окружающей среде.
Проблема состоит в предоставлении ослабленной бактерии, которая будет достаточно сильной, чтобы обладать персистентностью в организме сельскохозяйственного животного, тем самым обеспечивая иммунитет, и которая обладает ограниченной способностью к выделению в среду и персистентностью в фекалиях, и в целом в окружающей среде, например, на кормовой площадке или в другой части цепи промышленного животноводства. Необходимость в обеспечении двойной мутации для предотвращения реверсии к патогенному фенотипу является задачей более сложного уровня, особенно в случае, когда приходится иметь дело с очень большим числом генов-кандидатов для инактивации.
Изобретатели стремились разработать кишечную бактерию, пригодную в качестве живых иммуногенов, например, в ослабленной вакцине, которые улучшают профиль безопасности или фенотип с точки зрения меньшей вероятности реверсии к патогенному фенотипу, меньшей вероятности выделения в среду и меньшей вероятности устойчивости в окружающей среде. Из длинного перечня потенциальных локусов-кандидатов изобретатели выделили 3 локуса, которые можно было использовать для введения мутации с потерей функции в dam инактивированного штамма для получения ослабленного микроорганизма, который имеет требуемый профиль безопасности и при этом сохраняет иммунногенность, позволяющую осуществлять защиту или лечение от широкого спектра кишечных бактерий, и в частности, широкого спектра Salmonella.
A. Определения
'Мутация с потерей функции' в основном относится к мутации в гене, которая полностью или частично подавляет соответствующую функцию гена в определенном биологическом процессе. Мутации с потерей функции, представляющие интерес, это те, которые прерывают жизненный цикл кишечных бактерий в хозяине, при этом не нарушая иммуногенный профиль бактерий.
'Кишечные бактерии' в общем случае относится к бактериям кишечника или кишок. Определенный интерес представляют 'Enterobacteriaceae' - большое семейство Грамм-негативных кишечных бактерий, которое включает такие патогенные бактерии, как Salmonella, Escherichia coli, Yersinia pestis, Klebsiella и Shigella. Другие болезнетворные бактерии этого семейства включают в себя Proteus, Enterobacter, Serratia и Citrobacter.
'Salmonella' представляет собой кишечные бактерии в Enterobacteriaceae.
'dam' относится к гену, кодирующему ДНК-аденинметилазу, также известную как дезоксиаденозин-метилаза, ДНК-аденинметил-трансфераза или дезоксиаденозил-метилтрансфераза. Примером инвентарного номера S. Typhimurium dam гена является NCBI инвентарный номер: 1255007. Обозначением локуса этого гена является STM3484.
'sifA' относится к гену, кодирующему секретируемый эффекторный белок SifA. Примером инвентарного номера S. Typhimurium sifA гена является NCBI инвентарный номер 1252742. Обозначением локуса этого гена является STM 1224.
'spvB' относится к гену, кодирующему Salmonella белок В вирулентной плазмиды (SpvB). Примером инвентарного номера S. Typhimurium spvB гена является NCBI инвентарный номер 1256199. Обозначением локуса этого гена является PSLT039.
'mgtC' относится к гену, кодирующему Mg(2+) транспортный белок С ATФазы - MgtC. Примером инвентарного номера S. Typhimurium mgtC гена является NCBI инвентарный номер 1255288. Обозначением локуса этого гена является STM3764.
'Ослабленный', например, в "ослабленные бактерии", обычно относится к модификации бактерии, при которой уменьшается вирулентность бактерии, но по-прежнему сохраняется ее жизнеспособность (т.е. она является «живой»), чтобы она могла реплицироваться хотя и с меньшей скоростью или в других условиях. Ослабление изменяет инфекционный агент так, что он становится безвредным или менее вирулентным. Обычно ослабление в значительной степени не снижает иммуногенность соответствующих бактерий.
'Вакцина', как правило, относится к композиции, содержащей иммуноген, то есть вещество, способное вызывать иммунный ответ. Обычно вакцина используется для иммунизации, профилактики или обеспечения защиты от инфекции или проявления соответствующего симптома под воздействием патогенного организма, в частности, когда происходит воздействие в виде заражения. Вакцину можно применять для профилактики или лечения состояния. Вакцину можно применять, чтобы минимизировать вероятность инфицирования патогенным организмом.
'Бактериальное кишечное заболевание или состояние', как правило, относится к состоянию, возникающему в результате инфицирования индивидуума кишечными бактериями. Такое состояние может включать следующие симптомы: воспаление пищеварительной системы, обезвоживание, диарею, лихорадку. Сальмонеллез является таким примером бактериального кишечного заболевания или состояния.
'Иммузация' в данном контексте обычно означает процесс, путем которого иммунная система субъекта укрепляется против иммуногена. Ослабленные микроорганизмы Salmonella данного изобретения имеют применение в иммунизации субъекта против Salmonella и тем самым предотвращают инфицирование другими, более вирулентными сероварами Salmonella.
'Ген' в данном контексте означает кодирующую последовательность и ее регуляторные последовательности, такие как промотерные и терминаторные сигналы.
'Содержать, включать в себя' и вариации этого термина, такие как 'содержащий, включающий', 'содержит, включает в себя' и 'содержащийся, включаемый', не предназначены исключать дополнительные добавки, компоненты, целые числа или стадии.
Данными изобретателями было найдено, что определенные комбинации мутаций с потерей функции в генах Salmonella предоставляют определенное преимущество при получении ослабленных штаммов Salmonella, которые применяются в качестве ослабленных вакцин для придания иммунитета против вирулентных или патогенных серотипов Salmonella.
В частности, изобретатели обнаружили, что введение мутации в гены sifA, spvB и mgtC в штамме Salmonella, также имеющем мутацию с потерей функции в гене dam, приводит к получению микроорганизмов, которые можно безопасно вводить субъектам, безопасны для окружающей среды и сохраняют способность давать защиту от гетерологичных патогенных серотипов Salmonella.
Настоящее изобретение также предлагает живой ослабленный микроорганизм Salmonella, где указанный микроорганизм содержит в себе мутацию с потерей функции в гене dam и по меньшей мере еще одну мутацию с потерей функции в гене, выбранном из группы, состоящей из: sifA, spvB и mgtC.
В определенном варианте осуществления микроорганизм согласно данному изобретению имеет мутацию с потерей функции в dam и дополнительную мутацию с потерей функции в sifA. В этом варианте осуществления микроорганизм или кишечные бактерии могут не содержать мутацию в spvB или mgtC.
Ослабленные микроорганизмы Salmonella настоящего изобретения можно получать по известным методикам, например, путем делеционного мутагенеза, инсерционной инактивации или замены одного или нескольких нуклеотидов в генах-мишенях. Опытный специалист поймет, что гены-мишени не обязательно должны подвергаться мутации, при условии, что экспрессия неизмененного гена нарушается каким-либо образом. Например, мутацию можно произвести выше по цепи от гена-мишени, например, в промотерной или регуляторной области.
В одном варианте осуществления мутации с потерей функции, встроенные в гены dam, sifA, mgtC и spvB, представляют собой делеции внутри рамки считывания. Использование делеций внутри рамки считывания в том, что транскрибирование ниже по цепи гена не нарушается.
Другие пригодные методики включают использование вектора-"самоубийцы", содержащего в себе мутантный ген и селективный маркер. Вектор-"самоубийцу" встраивают в микроорганизм Salmonella, несущий в себе генную последовательность дикого типа (хотя, как понятно специалисту, он может содержать в себе одну или несколько мутаций в другом локусе) путем конъюгирования. Ген дикого типа заменяют мутантным геном путем гомологичной рекомбинации, и мутантный микроорганизм определяют, используя селективный маркер. Другие пригодные методики описаны, например, в WO 1996/17951.
Специалист также легко сможет определить, привела ли произведенная мутация к потере функции, или же функция гена нарушена. Например, ген mgtC ответственен за выживание Salmonella в среде с низкой концентрацией магния.
Мутации с потерей функции, введенные в ген dam и любой один из генов sifA, spvB или mgtC, эффективны для ослабления микроорганизма.
Предпочтительно микроорганизм представляет собой кишечную бактерию, в частности, патогенную кишечную бактерию, такую как член семейства Enterobacteriacea.
Особенно предпочтительно микроорганизм представляет собой Salmonella. Специалисту понятно, что любое число серотипов Salmonella, которые обычно являются вирулентными или патогеннными, можно обрабатывать с помощью указанных выше методик с целью получения ослабленных штаммов. Например, микроорганизмы Salmonella могут принадлежать широкому разнообразию сероваров Salmonella enterica подвида Enterica, включая, но не ограничиваясь ими, серовары S. Typhimurium, S. Enteritidis, S. Dublin, S. Newport, S. Choleraesuis или S. Bovismorbificans. В особенно предпочтительном варианте осуществления мутации с потерей функции введены в микроорганизм S. Typhimurium.
В еще одном дополнительном предпочтительном варианте осуществления ослабленный микроорганизм представляет собой S. Typhimurium, имеющий мутации с потерей функции обоих генах dam и sifA.
Изобретатели обнаружили, что микроорганизмы настоящего изобретения особенно пригодные для использования в вакцинах для иммунизации субъектов против вирулентных серотипов Сальмонеллы и минимизации вероятности инфицирования вирулентными серотипами. В частности, изобретатели обнаружили, что по сравнению с Salmonella, имеющей мутации с потерей функции в других комбинациях генов, Salmonella, имеющая мутиции в гене dam, а также в любом из генов sifA, spvB или mgtC, демонстрировала улучшенную безопасность вакцины в субъекте, проходящем иммунизацию, а также в окружающей среде.
Таким образом, в дополнительном аспекте настоящее изобретение предоставляет композицию вакцины для стимулирования иммунного ответа у субъекта на кишечные бактерии, предпочтительно на патогенные бактерии, такие как Salmonella. Композиция вакцины содержит живой ослабленный микроорганизм Salmonella в количестве, достаточном для вызова иммунного ответа у субъекта, и пригодный носитель или разбавитель, где указанный ослабленный микроорганизм содержит в себе мутацию с потерей функции в гене dam и по меньшей мере еще одну мутацию с потерей функции в гене, выбранном из группы, состоящей из: sifA, spvB и mgtC.
В особенно предпочтительном варианте осуществления композиция вакцины содержит количество живой ослабленной Salmonella, содержащей в себе мутацию с потерей функции в обоих генах dam и sifA.
При составлении композиций вакцин ослабленные микроорганизмы могут присутствовать в композиции вместе с любым пригодным разбавителем. Например, композиции могут содержать любой пригодный адъювант. Кроме того, композиции могут быть приспособлены для нескольких путей введения. Предпочтительные пути введения включают пероральный, через слизистую оболочку (например, через нос) или системный (например, парентеральную инъекцию), а вакцины представляют собой живые ослабленные микроорганизмы Salmonella. В одном определенном варианте осуществления композиции вакцины могут быть предложены для введения в питьевую воду или корм, или на кормовую площадку субъекта, которому они должны быть доставлены.
Число ослабленных микроорганизмов, находящихся в композициях вакцин, может быть легко определено опытным специалистом в зависимости от предполагаемого пути введения композиции вакцины и субъекта, которому она должна быть доставлена.
Конкретные подходящие носители или разбавители, используемые в композициях вакцин, не имеют решающего значения для настоящего изобретения и являются общепринятыми в данной области. Примеры разбавителей включают в себя: буфер для буферизации против желудочной кислоты в желудке, такие как цитратный буфер (рН 7,0), содержащий сахарозу, бикарбонатный буфер (рН 7,0) сам по себе или бикарбонатный буфер (рН 7,0), содержащий аскорбиновую кислоту, лактозу и, необязательно, аспартам. Примеры носителей включать: белки, например, белки обезжиренного молока; сахар, например, сахарозу; или поливинилпирролидон.
Данными изобретателями было найдено, что введение ослабленных микроорганизмов настоящего изобретения или композиций вакцин, содержащих их, субъекту придает устойчивость этому субъекту к последующему инфицированию диким типом или патогенным сероваром.
Соответственно, в еще одном аспекте настоящее изобретение предлагает способ профилактики инфицирования вирулентным штаммом Salmonella, причем указанный способ включает в себя:
- введение субъекту, нуждающемуся в этом:
- некоторое количество живого ослабленного микроорганизма Salmonella, где указанный микроорганизм содержит в себе мутацию с потерей функции в гене dam и по меньшей мере еще одну мутацию с потерей функции в гене, выбранном из группы, состоящей из: sifA, spvB и mgtC, или
- композиции вакцины, содержащей живой ослабленный микроорганизм Salmonella и пригодный носитель или разбавитель, где указанный ослабленный микроорганизм содержит в себе мутацию с потерей функции в гене dam и по меньшей мере еще одну мутацию с потерей функции в гене, выбранном из группы, состоящей из: sifA, spvB и mgtC.
- где количество введенного микроорганизма или вакцины достаточно для того, чтобы вызвать иммунный ответ у субъекта.
Следует понимать, что в рамках профилактики инфицирования вирулентным штаммом Сальмонеллы данное изобретение также предлагает способ иммунизации субъекта против инфицирования вирулентным сероваром Сальмонеллы.
Ослабленные микроорганизмы данного изобретения и композиции вакцин, содержащие их, пригодны для иммунизации субъекта против инфицирования вирулентными и патогенными сероварами Salmonella, которое обычно приводит к сальмонеллезу. Ослабленные микроорганизмы данного изобретения и композиции вакцин, содержащие их, особенно пригодны для иммунизации любого животного, восприимчивого к инфицированию микроорганизмами Salmonella. Например, в некоторых вариантах осуществления субъекты, которым можно проводить иммунизацию, могут быть людьми. А еще, субъекты, которым можно проводить иммунизацию, могут быть видами, относящимися к ветеринарии, и сельскохозяйственным скотом. Примеры субъектов, подлежащих иммунизации в соответствии с настоящим изобретением, включают свиней, овец, телят, крупный рогатый скот, оленей, коз, верблюдов, лошадей, цыплят, индеек, уток, перепелов и т.д.
Количество или число ослабленных микроорганизмов Salmonella или вакцины могут быть легко определены специалистом. Обычно вводят от примерно 102 CFU до примерно 1010 CFU, предпочтительно от примерно 105 до примерно 1010 CFU микроорганизмов. Вводимая доза обычно меняется в зависимости от пути введения. Специалисту понятно, что эффективная доза в случае вакцины, вводимой парентерально (например, путем внутривенной, внутрибрюшинной или подкожной инъекции), вероятно, будет меньше, чем для аналогичных вакцин, которые вводят перорально, например, с питьевой водой или в пищей.
Под "иммунизирующим количеством" в данном контексте понимают количество, которое способно вызывать защитный иммунный ответ у субъекта, который получает ослабленный микроорганизм или вакцину, содержащую его. Иммунный ответ может быть гуморальным, со стороны слизистой оболочки, местным и/или клеточным иммунным ответом. Кроме того, как будет понятно специалисту, требуемое количество ослабленного микроорганизма или вакцины будет также зависеть от возраста, веса и других факторов, относящихся к субъекту, проходящему иммунизацию.
Специалисту понятно, что с целью получения достаточного числа живых ослабленных микроорганизмов, описанных в данном документе, может быть необходимо культивировать этот микроорганизм в подходящих условиях. Например, в зависимости от предполагаемого пути администрации микроорганизма, может быть необходимо культивировать микроорганизм в аэробных или анаэробных условиях. Специалист может легко определить соответствующие условия для культивирования. Кроме того, может быть желательно после получения достаточного числа микроорганизмов в культуре (например, после того, как микроорганизм достигает log-фазы роста) культуру очистить, удалить какие-либо элементы ростовой среды, которые не предназначены для включения в последующее использование микроорганизма.
Соответственно, в одном варианте осуществления настоящего изобретения предложена культура живого ослабленного микроорганизма Salmonella, как описано выше.
Культуру, содержащую ослабленный микроорганизм Salmonella, можно очищать, чтобы ее можно было использовать в последующих применениях, включающих применение в качестве вакцины или производстве композиции вакцины, которые вызывают иммунный ответ у субъекта к микроорганизму Salmonella.
Следует принять во внимание, что очищенную культуру можно подвергать сублимационной сушке, замораживать или восстанавливать в зависимости от предполагаемого последующего применения культуры.
Дополнительные аспекты настоящего изобретения и дополнительные варианты осуществления аспектов, описанных в предыдущих параграфах, станут очевидными из последующего описания, приведенного в качестве примера и со ссылкой на прилагаемые графические материалы.
Следует понимать, что изобретение, раскрытое и определенное в данном описании, распространяется на все альтернативные комбинации двух или более отдельных признаков, упомянутых или очевидных из текста или графических материалов. Все эти различные комбинации составляют различные альтернативные аспекты настоящего изобретения.
ПРИМЕРЫ
1. Материалы и методы
1.1. Бактериальные штаммы и условия выращивания
Изоляты Salmonella животных были получены в результате различных вспышек, индивидуальных случаев или представляют собой образцы, поступившие в диагностические лаборатория в ходе наблюдений [31]. Вирулентный S. Typhimurium UK-1 использовали во всех сравнительных исследованиях [17]. Если не указано иное, бактерии получали из культур с неподвижной фазой, аэрированной при 37oC, содержащей среду Лурия-Бертани (LB) [18]. Антибиотики использовали при следующих концентрациях: канамицин (Kn), 50 μг/мл, ампициллин (Ap), 50 μг/мл.
1.2. Конструирование S. Typhimurium dam вакцин-кандидатов, содержащих в себе дополнительную ослабляющую мутацию
S. Typhimurium UK-1 Δdam конструировали путем проведения внутри рамки считывания делеции 300 н.п. определенной последовательности dam, названной damΔ232 [19], с использованием стандартных генетических протоколов [20]. Полученный S. Typhimurium UK-1 damΔ232 штамм (MT3134) продемонстрировал чувствительность к аналогу пурина - 2-аминопурину (2-AP), токсичному для штаммов, у которых отсутствует нефункциональная ДНК-аденинметилаза [21, 22], и его использовали в качестве родительского Salmonelladam штамма вакцины во всех исследованиях. Вторые делеционные мутации, ослабляющие вирулентность, производили в родительском S. Typhimurium UK-1 damΔ232 штамме, используя вектор-"самоубийцу" pCVD442, как описано в [20], получая конструкцию из делеций в рамке определенной кодирующей последовательности в следующих генах-мишенях: dam aroA (MT3138; удаление 1056 н.п.); dam htrA (MT3142; удаление 1341 н.п.); dam mgtC (MT3146; удаление 606 н.п.); dam sifA (MT3150; удаление 807 н.п.); dam spiC (MT3154; удаление 306 н.п.); dam spvB (MT3158; удаление 1563 н.п.); и dam ssaV (MT3162; удаление 1959 н.п.). Полученные генетические конструкции подтверждены с помощью ПЦР с использованием праймеров, которые фланкируют удаленные последовательности.
1.3. Исследование вирулентности и защитной эффективности
Пероральная и внутрибрюшинная полулетальная доза Lethal Dose50 (LD50): Дозу, вызывающую гибель 50% инфицированных животных, определяли с помощью перорального (через желудочный зонд) и внутрибрюшинного (i.p., IP) путей инфицирования по меньшей мере 10 мышей [30, 19]. Исследуемые штаммы Сальмонеллы и сравнительный штамм дикого типа S. Typhimurium 14028 выращивали с течение суток в среде LB. Бактериальные клетки, повторно суспендированные в 0,2 мл 0,2M Na2HPO4 с pH 8,1 или 0,1 мл 0.15M NaCl (для перорального и i.p. введения, соответственно), использовали для инфицирования мышей, которых ежедневно осматривали для выявления заболеваемости и смертности в течение максимум 3 недель после инфицирования. Значения пероральной и i.p. LD50 для S. Typhimurium UK-1 составляет 105 и < 10 организмов, соответственно [30]. Во всех исследованиях вирулентности использовали мышей BALB/c возрастом от шести до восьми недель. Исследование защитной эффективности. Мышей перорально иммунизировали, используя S. Typhimurium dam штаммы вакцин при дозе 109 CFU [30, 19]. Чтобы избежать переходных, неспецифических перекрестно-защитных иммунных реакций вследствие персистентности штамма вакцины в тканях хозяина [23-25], проверочное инфицирование иммунизированных мышей вирулентной Salmonella проводили только через 4-5 недель после осуществления клиренса штамма вакцины в слизистых (пейеровых бляшках, брыжеечных лимфатических узлах) и системных тканях (печень; селезенка) иммунизированных животных. Через одиннадцать недель после иммунизации мышам проводили проверочное пероральное инфицирование вирулентным Salmonella enterica серотипом при дозе инфицирования, в 100-200 раз превышающей LD50. После проверочного инфицирования мышей осматривали ежедневно для выявления заболеваемости и смертности в течение максимум 3 недель с момента проверочного инфицирования.
1.4. Конструирование устойчивых к антибиотикам производных Salmonella вакцин-кандидатов с целью исследования выделения вакцины и штамма для проверочного инфицирования в среду с фекалиями и персистентности в деионизированной воде и овечьих фекалиях
Устойчивые к канамицину (Knr) производные S. Typhimurium UK-1 damΔ232 вакцин-кандидатов с двойной мутацией конструировали для исследования выделения вакцины в среду с фекалиями. Штамм S. Typhimurium MT2057 представляет собой Knr производное сравнительного штамма 14028 дикого типа, содержащего Lac+ MudJ транскрипционное слияние, кодирующее Knr, которое используется, чтобы отличить его от других Salmonella, которые по своей природе являются Lac- [19, 26]. Фаг P22, выращенный на донорном штамме MT2057, использовали для преобразования реципиента - Salmonella dam вакцин-кандидатов - в устойчивую к канамицину форму [18], получая KnrS. Typhimurium UK-1 damΔ232 вакцины-кандидаты с двойной мутацией - dam mgtC (MT3183), dam sifA (MT3184), dam spvB (MT3186) и dam UK-1 родительский штамм (MT3180). Выделение штамма вакцины в среду. Мышей BALB/c вакцинировали пероральным путем, используя KnrS. Typhimurium UK-1 dam вакцины-кандидаты с двойной мутацией (109 CFU). Фекалии собирали индивидуально от каждой мыши и высеивали для подсчета CFU/г в LB чашки с канамицином 50 μг/мл на 2, 4, 7, 11, 14 и 21 день после иммунизации. выделение в среду штамма для проверочного инфицирования. Мышей BALB/c вакцинировали пероральным путем, используя KnrS. Typhimurium UK-1 dam вакцины-кандидаты с двойной мутацией (109 CFU). Клиренс штамма вакцины в фекалиях наблюдали через четыре недели после иммунизации. Через одиннадцать недель после иммунизации, проводили проверочное инфицирование вакцинированных мышей, используя дозу 100 LD50 Knr производного S. Typhimurium UK-1 (MT2315; 107 CFU). Фекалии собирали индивидуально от каждой мыши и высеивали для подсчета CFU/г в LB чашки с канамицином 50 μг/мл на 2, 4, 7, 11, 14 и 21 день после иммунизации. Персистентность в деионизированной воде и овечьих фекалиях. Двадцатипроцентное содержание сухого вещества фекалий получали путем добавления 20 мл деионизированной воды к 5 г высушенных овечьих фекалий (подарок от Barbara Byrne, University of California, Davis; [27, 28]). В деионизированную воду (20 мл) и 20% овечьих фекалий высевали Knr производные S. Typhimurium UK-1 damΔ232 вакцин-кандидатов с двойной мутацией, dam mgtC (MT3183), dam sifA (MT3184), dam spvB (MT3186) или родительский dam UK-1 штамм (MT3180) (2 x105 CFU). Анализы трех параллельных проб проводили в 50 мл конических пробирках с неплотными крышками при комнатной температуре. Образцы встряхивали и высевали для подсчета CFU за период продолжительностью две недели.
1.5. Статистический анализ
Данные непрерывных повторных измерений анализировали с использованием модели остаточного (или ограниченного) максимального правдоподобия (REML) (Genstat, 15th Edition, VSN International, UK, [34]). Одну случайную величину - модель повторных измерений, подбирали для факторов время и лечение при переменном CFU. Тест Вальда по распределению хи-квадрат использовали для определения значимых отдельных действий и или значимых взаимодействий между факторами. Любые не имеющие значимости условия удаляли из модели и анализ повторяли. После анализа данные представляли в виде предсказанных на основе модели средних. Предсказанные средние - это те, которые получены из подогнанной модели, и не из необработанной выборки средних. Это важно, поскольку предсказанные средние представляют средние, подогнанные к общему набору переменных, тем самым позволяя проводить обоснованное сравнение средних. Значение P менее 0,05 считали статистически значимым. Число CFU, находящихся в тканях при аутопсии, было проанализировано с помощью дисперсионного анализа (ANOVA, Genstat, 15th Edition, VSN International, UK). Различия между индивидуальными средними, рассчитанные с использованием REML и ANOVA, определяли путем расчета приближенного минимального значимого различия (LSD). Разница средних, превышающая рассчитанное LSD, считали значимым.
Биномные данные (выделение в среду [да/нет] и результат [живой/мертвый]) анализировали, используя модель логистической регрессии (Genstat, 15th Edition, VSN International, UK, [34]). Вакцина была приспособлена к модели. Общую значимость оценивали, используя статистический тест Вальда (P < 0,05). Значимость постоянных эффектов (вакцины) оценивали по полученным значением t-критерия по сравнению с контрольной группой. Значения P менее 0,05 считали статистически значимыми.
1.6. Заявление по этике
Все эксперименты на животных проводили, следуя Руководящим принципам Национальных институтов здравоохранения по содержанию и уходу за лабораторными животными, и осуществляли в соответствии с институциональными правилами после соответствующего рассмотрения и утверждения Комитетом по содержанию и использованию лабораторных животных Университета Калифорнии, Санта-Барбара.
2. Результаты
2.1. Конструирование Salmonella dam вакцин-кандидатов, содержащих вторую мутацию, ослабляющую вирулентность
Коммерческий успех модифицированных живых вакцин зависит от терапевтического индекса, отношения безопасность/эффективность, и таким образом, вторые мутации, ослабляющие вирулентность, были проведены в S.enterica сероваре Typhimurium dam вакцины для усовершенствования безопасности вакцины. Чувствительное к антибиотику, производное родительского штамма UK-1 с делецией в dam конструировали, чтобы исключить потенциальный перенос устойчивости к антибиотикам к другим микробным штаммам (Материалы и методы). Полученный S. Typhimurium UK-1 damΔ232 (MT3134) использовали в качестве родительской исходной вакцины во всех исследованиях. Вторые мутации, ослабляющие вирулентность, были затем проведены в S. Typhimurium UK-1 damΔ232 с целью улучшения безопасности (Материалы и методы). Эти мутации были нацелены на гены, участвующие во внутриклеточном и/или системном выживании, включая aroA (биосинтез аминокислот); htrA (ответ на стресс); mgtC (транспорт магния); sifA, spiC, ssaV (Salmonella Pathogenicity Island- 2 (SPI-2); и spvB (продуцирование цитоксинов). Полученные Salmonella dam вакцины-кандидаты с двойной мутацией - dam aroA, dam htrA, dam mgtC, dam sifA, dam spiC, dam spvB, dam ssaV, затем оценивали с точки зрения улучшения соотношения безопасность/эффективность по сравнению с родительским Salmonella dam штаммом вакцины.
2.2. Оценка Salmonella вакцин-кандидатов с двойной мутацией в dam с точки зрения колонизации и персистентности в слизистых и системных тканях.
Главным опасением при введении вторых мутаций, ослабляющих вирулентность, в модифицированные живые вакцины является возможная потеря эффективности из-за снижения воздействия антигена, как следствие ускоренного клиренса вакцины. Так, S. Typhimurium UK-1 damΔ232 вакцины-кандидаты с двойной мутацией, dam aroA, dam htrA, dam mgtC, dam sifA, dam spiC, dam spvB, dam ssaV, испытывали для выявления тех из них, которые имеют показатели колонизации и персистентности, сходные с таковыми у родительского S. Typhimurium UK-1 damΔ232 штамма вакцины. Мышей BALB/c перорально инфицировали Salmonella dam вакцинами-кандидатами с двойной мутацией (109 CFU) и колонизацию/персистентность штаммов вакцины исследовали в слизистых (пейеровых бляшках, брыжеечных лимфатических узлах) и системных тканях (печень; селезенка) через 2 и 4 недели после инфицирования (Фигура 1). Salmonella dam вакцины-кандидаты с двойной мутацией классифицировали на две группы, Класс I: те, которые демонстрировали колонизацию/персистентность, сходные с родительской S. Typhimurium UK-1 damΔ232 вакциной-кандидатом с одной мутацией (dam mgtC; dam sifA; dam spvB); и Класс II: те, которые демонстрировали колонизацию/персистентность, сходные с родительской Salmonella dam вакциной (dam aroA, dam htrA, dam spiC, dam ssaV). Эти данные показывают, что вакцины-кандидаты Класса I вакцин имеют низкий уровень персистентности в тканях хозяина, в то время как вакцины-кандидаты Класса II вакцин продемонстрировали быстрый клиренс у вакцинированных животных.
2.3. Оценка эффективности Salmonella вакцин-кандидатов с двойной мутацией в dam.
Salmonelladam вакцин-кандидатов с двойной мутацией (Класс I и Класс II) исследовали с целью выяснения, необходим или нет низкий уровень персистентности для того, чтобы вызвать ответ иммунной системы, сходный с ответом, вызываемым родительской Salmonella dam вакциной. Мышей BALB/c перорально иммунизировали каждой из семи Salmonella dam вакцин-кандидатов с двойной мутацией (109 CFU). Чтобы избежать переходных, неспецифических перекрестно-защитных иммунных реакций вследствие персистентности штамма вакцины в тканях хозяина [23-25], проверочное инфицирование иммунизированных мышей вирулентной Salmonella проводили только через 4-5 недель после осуществления клиренса штамма вакцины в слизистых (пейеровых бляшках, брыжеечных лимфатических узлах) и системных тканях (печень; селезенка) иммунизированных животных. Через одиннадцать недель после иммунизации мышам проводили проверочное пероральное инфицирование вирулентным родительским S. Typhimurium UK-1 штаммом при дозе инфицирования в 200 раз превышающей LD50. Мыши, иммунизированные всеми (3 из 3) вакцинами-кандидатами Класса I (dam mgtC, dam sifA, dam spvB) демонстрировали стойкую защиту против вирулентного гомологичного проверочного инфицирования, сходную с той, которую получали, используя родительский S. Typhimurium UK-1 damΔ232 штамм (Фигура 2). Напротив, ни одна из (0 из 4) вакцин-кандидатов Класса II (dam aroA, dam htrA, dam spiC, dam ssaV), которые обладали ускоренным клиренсом, не давала сколько-нибудь значительной защиты от вирулентного гомологичного проверочного инфицирования по сравнению с родительским S. Typhimurium UK-1 damΔ232 штаммом (**P < 0,01, *** P < 0,001).
Вакцины-кандидаты Класса I исследовали на их способность давать перекрестную защиту от гетерологичных штаммов, как это было показано для Salmonella dam штаммов вакцины в мышиных [2, 9], пернатых [10, 11], овечьих [12] и бычьих [13-15] моделях сальмонеллеза. Мышей BALB/c перорально иммунизировали вакцинами-кандидатами Класса I (dam mgtC, dam sifA или dam spvB; 109 CFU). Через одиннадцать недель после иммунизации мышам проводили проверочное инфицирование относящимися к отрасли животноводства патогенными Salmonella штаммами, полученными от овец (S. Bovismorbificans 174, S. Typhimurium 131) и крупного рогатого скота (S. Dublin 8895), содержащими серогруппы C2-C3, B и D, соответственно. Все 3 вакцины-кандидаты Класса I придавали стойкую перекрестную защиту от трех исследованных гетерологичных вирулентных штаммов (Фигура 3; *** P< 0,001), сходную с уровнями перекрестной защиты, демонстрируемой ранее против этих 3 гетерологичных штаммов для проверочного заражения у мышей, прошедших вакцинацию S. Typhimurium 14028 damΔ232 штаммом вакцины [2]. Эти данные согласуются с гипотезой о том, что низкий уровень персистентности вакцин-кандидатов Класса I в тканях хозяина (dam mgtC, dam sifA и dam spvB) может обеспечить стабильный источник антигенов в течение времени, необходимого для перехода к развитию сильного адаптивного иммунного ответа [2,9,19].
2.4. Оценка безопасности вакцины путем исследования устойчивости к реверсии к 2-AP.
Реверсия к повышенной вирулентности является проблемой для всех модифицированных живых вакцин. Вакцины-мутанты Salmonella dam способны к реверсии в более вирулентное состояние после i.p. (но не перорального) инфицирования путем приобретения мутации(й) в генах направленной метилом репарации ошибочно спаренных оснований [29]. Такую реверсию можно оценить, используя аналог пурина 2-аминопурин (2-AP), токсичному для бактерий, у которых отсутствует Dam функция [21]. То есть родительский dam штамм (2-APS) можно исследовать в отношении реверсии к 2-APr (в качестве потенциального показателя повышенной вирулентности) в системных тканях [29]. Мышам BALB/c проводили i.p. инфицирование Salmonelladam вакцинами-кандидатами с двойной мутацией, dam mgtC, dam sifA, dam spvB или родительским S. Typhimurium UK-1 damΔ232 штаммом (103 CFU). Через пять дней после инфицирования бактерии, выделенный из печени и селезенки, исследовали на предмет 2-APs (персистентности) и реверсии к 2-APr фенотипу (Фигура 4). Все три вакцины-кандидаты (dam mgtC, dam sifA, dam spvB) продемонстрировали в значительной степени сниженную колонизацию/персистентность (2-APs) и сниженную реверсию к 2-AP устойчивости, относящиеся к селезенке/печени, по сравнению с этими параметрами родительского S. Typhimurium UK-1 damΔ232 штамма (* P < 0,05).
2-Apr производные Salmonella dam вакцин-кандидатов с двойной мутацией и родительской dam UK-1 вакцины, выделенные из селезенок инфицированных мышей, оценивали (перорально и i.p.) с использованием анализа вирулентности по полулетальной дозе (LD50). Значения пероральной и i.p. LD50 для дикого типа UK-1 составляют 105 и <10 CFU, соответственно. Пероральные LD50 всех 2-APr изолятов, полученных для Salmonella dam вакцин-кандидатов с двойной мутацией (11 из 11) или родительской Salmonella dam вакцины (5 из 5), были авирулентными при пероральном введении (Таблица 2). В отличие от этого, все (11 из 11) 2-APr изоляты, полученные для Salmonella dam вакцин-кандидатов с двойной мутацией были сильно ослаблены при i.p. инфицировании, в то время как полученные из родительской dam вакцины (5 из 5) были связаны с реверсией в более вирулентное состояние, как было показано ранее [29]. Эти данные указывают на то, что Salmonella dam mgtC, dam sifA и dam spvB штаммы вакцины демонстрируют значительно улучшенную безопасность, о чем свидетельствует их неспособность произвести вирулентные ревертанты во время инфекционного процесса в отличие от Salmonella dam вакцины.
2.5. Оценка Salmonella вакцин-кандидатов с двойной мутацией в dam с точки зрения выделения вакцины и штамма для проверочного инфицирования в среду.
Сниженное выделение в среду вакцины и штамма для проверочного инфицирования у вакцинированных животных является желательным направлением развития безопасности вакцин. Устойчивые к канамицину производные S. Typhimurium UK-1 damΔ232 вакцин-кандидатов с двойной мутацией конструировали для использования в исследовании выделения штамма вакцины и штамма для проверочного инфицирования с фекалиями инфицированных животных. Мышам BALB/c проводили иммунизацию либо Salmonella dam вакцинами-кандидатами с двойной мутацией (dam mgtC [MT3183]; dam sifA [MT3184]; dam spvB [MT3186]), либо родительским dam UK-1 штаммом (MT3180) пероральным путем (109 CFU). Выделение штамма вакцины в среду. Фекальные гранулы получали и исследовали на Knr бактерии в дни 2, 4, 7, 11, 14 и 21 после инфицирования. Все Salmonelladam вакцинами-кандидатами с двойной делецией продемонстрировали существенно сниженное выделение вакцины с фекалиями по сравнению с родительским S. Typhimurium UK-1 damΔ232 штаммом (Фигура 5; P < 0,05). Выделение в среду штамма для проверочного инфицирования. Через одиннадцать недель после иммунизации, проводили проверочное инфицирование вакцинированных мышей, используя дозу 100 LD50 Knr производногоS. Typhimurium UK-1 (MT2315;107 CFU). Фекальные гранулы получали и исследовали на Knr бактерии в дни 2, 4, 7, 11, 14 и 21 после инфицирования. Штаммы Salmonella dam mgtC, dam sifA и dam spvB продемонстрировали существенное снижение выделения штамма для проверочного инфицирования в среду по сравнению с родительской S. Typhimurium UK-1 damΔ232 вакциной с течение периода 3 недель, при этом штаммы dam sifA и dam spvB показали сниженное выделение в среду с 4 по 21 день (Фигура 6; P<0,05). Эти данные указывают на то, что вакцинация с использованием Salmonella dam вакцин-кандидатов с двойной мутацией приводит к меньшему выделению вакцины с фекалиями по сравнению с родительской Salmonella dam вакциной, и вакцинация вакциной с двойной делецией обеспечивает более устойчивое ослабление выделения в среду сальмонеллы дикого типа после вирулентного проверочного инфицирования, чем родительская dam вакцина.
2.6. Оценка устойчивости в окружающей среде (в деионизированной воде и овечьих фекалиях) Salmonella dam штаммов вакцин с двойной мутацией
Salmonella dam вакцины-кандидаты с двойной мутацией оценивали с точки зрения устойчивости в окружающей среде в деионизированной воде и овечьих фекалиях. Деионизированная вода. В деионизированную воду высевали Knr производные либо Salmonelladam вакцин-кандидатов с двойной мутацией (dam mgtC [MT3183], dam sifA [MT3184], dam spvB [MT3186]), либо родительский dam UK-1 штамм (MT3180) (104 CFU) (Фигура 7). Образцы воды высевали для подсчета CFU/г за период продолжительностью две недели. Все (3 из 3) Salmonella dam вакцины-кандидаты с двойной мутацией и родительский dam штамм продемонстрировали существенно сниженную жизнеспособность в деионизированной воде в течение 2 недель инкубирования по сравнению с UK-1 штаммом дикого типа (Фигура 7; P<0,05). Кроме того, низкий уровень персистентности в воде может быть совместим с введением вакцины через воду в поильнике. Овечьи фекалии. В двадцать процентов сухого материала овечьих фекалий высевали Knr производные либо Salmonelladam вакцин-кандидатов с двойной мутацией (dam mgtC [MT3183], dam sifA [MT3184], dam spvB [MT3186]), либо родительский dam UK-1 штамм (MT3180) (104 CFU). Образцы фекалий высевали для подсчета CFU/г за период продолжительностью две недели. Все (3 из 3) Salmonella dam вакцины-кандидаты с двойной мутацией продемонстрировали существенно сниженную жизнеспособность в овечьих фекалиях в течение 2 недель инкубирования по сравнению с UK-1 штаммом дикого типа за период инкубирования продолжительностью 2 недели (Фигура 8; P<0,05). Кроме того, Salmonella dam sifA продемонстрировали существенно сниженную жизнеспособность в овечьих фекалиях по сравнению с другими 3 исследованными штаммами вакцины (P <0,05). Эти данные указывают на то, что Salmonella вакцины-кандидаты демонстрируют сниженную устойчивость в окружающей среде как в деионизированной воде, как и в овечьих фекалиях по сравнению с UK-1 штаммом дикого типа.
3. Обсуждение
Несмотря на надлежащую практику животноводства, сальмонеллез продолжает оставаться серьезной проблемой в интенсивных производственных системах, которые способствуют фекально-оральному пути передачи инфекции. Заболевание главным образом вызвано увеличением воздействия патогенных микроорганизмов и восприимчивостью к болезни. Колебания в условиях окружающей среды вызывают изменения в патогенной нагрузке из окружающей среды и впоследствии - инфицирование организма-хозяина. Физиологические изменения, связанные с беременностью и отелом увеличивают восприимчивость к болезни, так же как и несформировавшийся иммунный статус новорожденных. Практика ведения хозяйства также может негативно сказаться на иммунитете организма-хозяина с кумулятивными факторами стрессовой нагрузки, испытываемыми скотом на ферме (собор, пригон скота на рынок, лишение пищи и воды перед транспортировкой), во время транспортировки (лишение пищи и воды, экологический стресс) и при продаже из загонов (перемешивание с другим скотом, воздействие патогенных микроорганизмов).
Вакцинация сельскохозяйственного скота против сальмонеллеза представляет собой эффективный подход к предотвращению болезней, поскольку от препятствует контаминации пищевых продуктов и воды в самом начале цепочки, что уменьшает воздействие со стороны патогенных микроорганизмов, передачу инфекции, болезни животных и прямое контаминацию полученных на основе скота пищевых продуктов и непрямую контаминацию фруктовых и овощных пищевых продуктов загрязненной водой.
Оптимально, сельскохозяйственный скот должен быть привит на фермах, где его разводят, чтобы создать иммунитет до появления факторов стрессовой нагрузки скота и воздействия возбудителем, связанных с продажей, транспортировкой, а также в период высокого риска после перевода на кормовую площадку. Задача состоит в том, чтобы убедить производителей, которые поставляют скот на кормовые площадки, вакцинировать животных до продажи, поскольку затраты в связи с болезнью скота понесены не по месту положения его разведения, что в теперешней практике приводит к иммунизации скота в высокий период риска сразу же после перевода на кормовую площадку.
Если доступный по цене и эффективный продукт становится доступным для коммерческого сектора, то вакцина может широко применяться во всем производственном животноводстве, поскольку вакцинация проста, понятна производителям, и, вероятно, будет принята, и таким образом, может играть решающую роль в успехе любого комплексного плана обеспечения безопасности пищевых продуктов.
В качестве потенциального средства для решения этой проблемы было показано, что модифицированные живые вакцины Salmonella dam эффективны и хорошо переносятся скотом, прошедшим иммунизацию [10-15], и могут быть введены с питьевой водой [12, 16]. Однако особое значение в случае живых вакцин имеют безопасность, выделение в среду и устойчивость в окружающей среде.
В данном документе вторые мутации, ослабляющие вирулентность, были проведены в Salmonelladam штамме с целью скрининга вакцин-кандидатов, которые были бы безопасны для животного и окружающей среды, и сохраняли бы способность поддерживать перекрестно-защитную эффективность. S. Typhimurium dam sifA продемонстрировал улучшенную безопасность вакцины, сниженное выделение в среду вакцины и штамма для проверочного инфицирования, сниженную устойчивость в окружающей среде и придал низкий уровень персистентности в тканях хозяина, который был достаточным для поддержания перекрестной защиты от гетерологичных патогенных серотипов сальмонеллы, ведущим свое происхождение от инфицированного скота [31]. Эти данные указывают на то, что Salmonelladam sifA демонстрирует благоприятный терапевтический индекс (безопасность/эффективность) для коммерческих применений, поддерживая улучшенную безопасность как вакцин, так и в окружающей среде, а также способны вызывать перекрестный защитный иммунитет к патогенным серотипам.
В данном документе безопасность вакцины была испытана на прошедших вакцинацию животных и в условиях, имитирующих условия в окружающей среде. Штаммы вакцины сальмонеллы dam mgtC, dam sifA и dam spvB имеют низкий уровень персистентности в тканях хозяина, который связан с поддержанием перекрестного защитного иммунитета к гетерологичным патогенным серотипам, ведущим свое происхождение от инфицированного скота. Кроме того, вакцыны Salmonelladam sifA продемонстрировали улучшенную безопасность вакцины (выделение вакцины в среду; выделение в среду штамма для проверочного заражения; персистентность в системных тканях; устойчивость в окружающей среде), при этом сохраняя устойчивую эффективность против вирулентного проверочного инфицирования против гомологичных и гетерологичных патогенных серотипов. Так, Salmonelladam sifA вакцина-кандидат демонстрирует значительное повышение безопасности без снижения перекрестно-защитной эффективности и может показать себя безопасным, эффективным и дешевым средством для перорального дозирования сельскохозяйственным животным, не имеющим при этом существенной устойчивости в окружающей среде.
(LD50)
a Независимо изолированные, отобранные in vivo, устойчивые к 2-аминопурину (2-APr) производные Salmonella dam мутантные штаммы вакцин изолировали из селезенок инфицированных мышей, и оценивали с точки зрения пероральной и внутрибрюшинной (IP) вирулентности в не подвергавшихся экспериментам мышах [29]. Анализ LD50 для каждого из этих штаммов сравнивали с анализом, проведенном на штамме дикого типа (UK-1). IP LD50 определяли путем инфицирования пяти мышей на каждую проверочную дозу; пероральный LD50, выполненный с помощью желудочного зонда, определяли путем инфицирования десяти мышей на каждую проверочную дозу. Значения перорального и IP LD50 для дикого типа UK-1 составляют 105 и <10 CFU, соответственно [30]. Выживших мышей оценивали > 2 недель после инфицирования.
Список литературы
[1] Mahan MJ, Heithoff DM, House JK. Salmonella cross-protective vaccines: fast-forward to the next generation of food safety. Future Microbiol. 2012;7:805-8.
[2] Heithoff DM, Enioutina EY, Bareyan D, Daynes RA, Mahan MJ. Conditions that diminish myeloid-derived suppressor cell activities stimulate cross-protective immunity. Infect Immun. 2008;76:5191-9.
[3] Hegazy WAH, Hensel M. Salmonella enterica as a vaccine carrier. Future Microbiol. 2012;7:111-27.
[4] Kong Q, Yang J, Liu Q, Alamuri P, Roland KL, Curtiss III R. Effect of deletion of genes involved in lipopolysaccharide core and O-antigen synthesis on virulence and immunogenicity of Salmonella enterica serovar Typhimurium. Infect Immun. 2011;79:4227-39.
[5] Li Y, Wang S, Scarpellini G, Gunn B, Xin W, Wanda SY, et al. Evaluation of new generation Salmonella enterica serovar Typhimurium vaccines with regulated delayed attenuation to induce immune responses against PspA. Proc Natl Acad Sci USA. 2009;106:593-8.
[6] Nagy G, Palkovics T, Otto A, Kusch H, Kocsis B, Dobrindt U, et al. "Gently rough": the vaccine potential of a Salmonella enterica regulatory lipopolysaccharide mutant. J Infect Dis. 2008;198:1699-706.
[7] Curtiss R, Xin W, Yuhua L, Kong W, Wanda SY, Gunn B, et al. New technologies in using recombinant attenuated Salmonella vaccine vectors. Crit Rev Immunol. 2010;30:255-70.
[8] Singh B. Salmonella vaccines for animals and birds and their future perspective. Open Vaccine J. 2009;2:100-12.
[9] Heithoff DM, Enioutina EY, Daynes RA, Sinsheimer RL, Low DA, Mahan MJ. Salmonella DNA adenine methylase mutants confer cross-protective immunity. Infect Immun. 2001;69:6725-30.
[10] Dueger EL, House JK, Heithoff DM, Mahan MJ. Salmonella DNA adenine methylase mutants elicit protective immune responses to homologous and heterologous serovars in chickens. Infect Immun. 2001;69:7950-4.
[11] Dueger EL, House JK, Heithoff DM, Mahan MJ. Salmonella DNA adenine methylase mutants prevent colonization of newly hatched chickens by homologous and heterologous serovars. Intl J Food Microbiol. 2003a;80:153-9.
[12] Mohler VL, Heithoff DM, Mahan MJ, Walker KH, Hornitzky MA, Gabor L, et al. Protective immunity conferred by a DNA adenine methylase deficient Salmonella enterica serovar Typhimurium vaccine when delivered in-water to sheep challenged with Salmonella enterica serovar Typhimurium. Vaccine. 2011;29:3571-82.
[13] Dueger EL, House JK, Heithoff DM, Mahan MJ. Salmonella DNA adenine methylase mutants elicit early and late onset protective immune responses in calves. Vaccine. 2003;21:3249-58.
[14] Mohler V, Heithoff D, Mahan M, Walker K, Hornitzky M, McConnell C, et al. Cross-protective immunity in calves conferred by a DNA adenine methylase deficient Salmonella enterica serovar Typhimurium vaccine. Vaccine. 2006;24:1339.
[15] Mohler V, Heithoff D, Mahan M, Walker K, Hornitzky M, Shum L, et al. Cross-protective immunity conferred by a DNA adenine methylase deficient Salmonella enterica serovar Typhimurium vaccine in calves challenged with Salmonella serovar Newport. Vaccine. 2008;26:1751-8.
[16] Mohler V, Heithoff D, Mahan M, Hornitzky M, Thomson P, House J. Development of a novel in-water vaccination protocol for DNA adenine methylase deficient Salmonella enterica serovar Typhimurium vaccine in adult sheep. Vaccine. 2012;30:1481-91.
[17] Hassan JO, Curtiss R, 3rd. Development and evaluation of an experimental vaccination program using a live avirulent Salmonella typhimurium strain to protect immunized chickens against challenge with homologous and heterologous Salmonella serotypes. Infect Immun. 1994;62:5519-27.
[18] Davis RW, Botstein D, Roth JR. Advanced bacterial genetics. Plainview, N. Y.: Cold Spring Harbor Laboratory Press; 1980.
[19] Heithoff DM, Sinsheimer RL, Low DA, Mahan MJ. An essential role for DNA adenine methylation in bacterial virulence [see comments]. Science. 1999;284:967-70.
[20] Donnenberg MS, Kaper JB. Construction of an eae deletion mutant of enteropathogenic Escherichia coli by using a positive-selection suicide vector. Infect Immun. 1991;59:4310-7.
[21] Glickman B, van den Elsen P, Radman M. Induced mutagenesis in dam- mutants of Escherichia coli: a role for 6- methyladenine residues in mutation avoidance. Mol Gen Genet. 1978;163:307-12.
[22] Julio S, Heithoff D, Provenzano D, Klose K, Sinsheimer R, Low D, et al. DNA Adenine methylase is essential for viability and plays a role in the pathogenesis of Yersinia pseudotuberculosis and Vibrio cholerae. Infect Immun. 2001;69:7610-5.
[23] Harrison JA, Villarreal-Ramos B, Mastroeni P, Demarco de Hormaeche R, Hormaeche CE. Correlates of protection induced by live Aro- Salmonella typhimurium vaccines in the murine typhoid model. Immunology. 1997;90:618-25.
[24] Hormaeche CE, Joysey HS, Desilva L, Izhar M, Stocker BA. Immunity conferred by Aro- Salmonella live vaccines. Microb Pathog. 1991;10:149-58.
[25] Hormaeche CE, Mastroeni P, Harrison JA, Demarco de Hormaeche R, Svenson S, Stocker BA. Protection against oral challenge three months after i.v. immunization of BALB/c mice with live Aro Salmonella typhimurium and Salmonella enteritidis vaccines is serotype (species)-dependent and only partially determined by the main LPS O antigen. Vaccine. 1996;14:251-9.
[26] Conner CP, Heithoff DM, Julio SM, R.L. S, Mahan MJ. Differential patterns of acquired virulence genes distinguish Salmonella strains. Proc Natl Acad Sci U S A 1998.;95:4641-5.
[27] Griggs T. Determining forage dry matter concentration with a microwave oven AG/Forage & Pasture/2005-01. 2005.
[28] Pitt R, Brusewitz G, Chase L, Collins M. Forage moisture determination. NRAES (59)(Cooperative Extension). 1993.
[29] Heithoff D, Badie G, Julio S, Enioutina E, Daynes R, Sinsheimer R, et al. In vivo-selected mutations in methyl-directed mismatch repair suppress the virulence attenuation of Salmonella dam mutant strains following intraperitoneal, but not oral, infection of naïve mice. J Bacteriol. 2007;189:4708-17.
[30] Heithoff DM, Shimp WR, House JK, Xie Y, Weimer BC, Sinsheimer RL, et al. Intraspecies variation in the emergence of hyperinfectious bacterial strains in nature. PLoS Pathogens. 2012;8:e1002647.
[31] Heithoff DM, Shimp WR, Lau PW, Badie G, Enioutina EY, Daynes RA, et al. Human Salmonella clinical isolates distinct from those of animal origin. Appl Environ Microbiol. 2008;74:1757-66.
[32] Griggs T. Determining forage dry matter concentration with a microwave oven AG/Forage & Pasture/2005-01. 2005.
[33] Pitt R, Brusewitz G, Chase L, Collins M. Forage moisture determination. NRAES (59)(Cooperative Extension). 1993.
[34] International V. GenStat for Windows 15th Edition VSN International, Hemel Hempstead, UK. 2012
Реферат
Изорбретение относится к биотехнологии и представляет собой микроорганизмдля предотвращения или снижения вероятности инфицирования субъекта вирулентным микроорганизмом, где указанный микроорганизм содержит в себе мутацию с потерей функции в генеи по меньшей мере еще одну мутацию с потерей функции в гене, выбранном из группы, состоящей из,иИзобретение позволяет предотвратить и снизить вероятность инфицирования субъекта вирулентным микроорганизмом7 н. и 10 з.п. ф-лы, 8 ил., 2 табл., 3 пр.
Формула
Документы, цитированные в отчёте о поиске
Днк-вакцины против опухолевого роста и способы ихприменения

Комментарии