Генетическая кассета, содержащая кодон-оптимизированные нуклеотидные последовательности генов hexa и hexв, и фармацевтическая композиция для лечения болезни тея-сакса - RU2723187C1
Код документа: RU2723187C1
Чертежи





Описание
Изобретение относится к области генной инженерии в целом, более точно - к кодон-оптимизированным нуклеотидным последовательностям генов HEXA и HEXB, разделенных последовательностью 2А пептидов или IRES, генетическим кассетам, содержащим кодон-оптимизированные нуклеотидные последовательности генов HEXA и HEXВ, и фармацевтической композиции для лечения болезни Тея-Сакса. Может быть использовано для лечения как животных, так и человека. Более детально заявленное техническое решение относится к геннотерапевтическим лекарственным препаратам, предназначенным для лечения метаболических заболеваний центральной нервной системы (ЦНС), более точно - для лечения лизосомной болезни накопления Тея-Сакса (БТС).
Далее в целях исключения неоднозначного понимания текста заявителем приведены использованные в заявочном материале термины и их расшифровка:
БТС — болезнь Тея-Сакса;
ГЭБ — гемато-энцефалический барьер;
кДНК — комплементарная дезоксирибонуклеиновая кислота;
мРНК — матричная рибонуклеиновая кислота;
Саморасщепляющиеся 2А пептиды — класс пептидов длиной 18–22 аминокислот, которые располагаются между двумя целевыми пептидами и обеспечивают их расщепление друг от друга во время синтеза белка путем рибосомного скиппинга;
ЦНС — центральная нервная система;
E2A — саморасщепляющийся 2А пептид из equine rhinitis virus, применяющийся для соединения двух генов в одну генетическую кассету;
F2A — саморасщепляющийся 2А пептид из foot-and-mouth disease virus, применяющийся для соединения двух генов в одну генетическую кассету;
GCS — глюкозилцерамид-синтаза;
HEXA — ген, кодирующий α-субъединицу фермента β-гексозаминидазы А;
HEXB — ген, кодирующий β-субъединицу фермента β-гексозаминидазы А;
HexA — β-гексозаминидаза А;
IRES — внутренний сайт входа рибосомы, который обеспечивает трансляцию, независимую от 5'-конца РНК и применяется для соединения двух генов в одну генетическую кассету;
P2A — саморасщепляющийся 2А пептид из porcine teschovirus-1, применяющийся для соединения двух генов в одну генетическую кассету;
T2A — саморасщепляющийся 2А пептид из thosea asigna virus, применяющийся для соединения двух генов в одну генетическую кассету.
Краткая суть болезни Тея-Сакса сводится к мутации гена, кодирующего недостающий у пациентов фермент β-гексозаминидазу А, которая (мутация гена) в свою очередь приводит к нарушениям работы нервной системы и, как следствие, к нейродегенерации.
Заявленное техническое решение основывается на изначальной идее того, что использование заявленного технического решения на основе кодон-оптимизированных нуклеотидных последовательностей генов HEXA и HEXB может послужить для модификации мононуклеарных клеток крови человека, после чего модифицированные мононуклеарные клетки крови человека обретают способность секретировать недостающий у пациентов фермент β-гексозаминидазу А и довести его концентрации (фермента) до требуемого уровня, с возможностью восстановления в полной мере жизнедеятельности пациента, т.е. полного излечения от наследственного заболевания, которое на дату представления заявочных материалов является неизлечимым. Указанный технический результат становится возможным вследствие использования неочевидного для специалистов подхода, использованного заявителем. Указанный подход основан на том, что мононуклеарные клетки крови человека способны преодолевать биологические барьеры человека, а средства, которые могли бы обеспечить таковое действие, не способны преодолевать гемато-энцефалические барьер. Данное препятствие не было преодолено в мире на дату представления заявочных материалов, вследствие чего и не представлялась принципиальная возможность излечения данного неизлечимого заболевания.
Заявленное же техническое решение предоставляет возможность решения такого технического и не разрешимого противоречия (непреодолимого препятствия) и представляет возможность полного излечения заболевания Тея-Сакса, считающегося неизлечимым на дату представления заявочных материалов, что позволяет сделать логически обоснованный вывод о соответствии заявленного технического решения не только критерию мировая новизна, но и критерию изобретательский уровень. В соответствии с заявленным техническим решением мононуклеарные клетки, будучи трансдуцированными генетическим вектором, содержащим генетическую кассету с кодон-оптимизированными нуклеотидными последовательностями генов HEXA и HEXB, обеспечивают возможность преодоления гемато-энцефалического барьера, что и позволяет доставлять необходимый фермент в нервную систему пациента, вследствие чего, по мнению заявителя, обеспечивается возможность исключить как таковой процесс нейродегенерации, что, в свою очередь, обеспечивает полное излечение пациентов.
В результате реализации заявленного технического решения становится возможным решать практически нереализуемую на дату подачи заявки проблему, такую, как доставка лекарственных препаратов в ЦНС, что было обусловлено невозможностью многих лекарственных препаратов преодолевать гемато-энцефалический барьер (ГЭБ).
Таким образом, краткая сущность заявленного технического решения заключается в разработке кодон-оптимизированных нуклеотидных последовательностей генов, кодирующих α и β субъединицы β-гексозаминидазы А (HEXA и HEXB, соответственно), а также мультицистронных кассет HEXA-P2A-HEXB, HEXA-E2A-HEXB, HEXA-F2A-HEXB, HEXA-T2A-HEXB и HEXA-IRES-HEXB, созданных на их (генов) основе, для терапии лизосомных болезней накопления, в частности болезни Тея-Сакса. Ген HEXA кодирует α-субъединицу и ген HEXB кодирует β-субъединицу фермента β-гексозаминидазы А.
Использование этих двух генов по отдельности не представляется целесообразным, так как целый фермент образуется только после соединения двух субъединиц.
Субъединицы по отдельности работать не могут, так как способны работать по своей природной сущности исключительно в паре.
Поэтому для достижения заявленной цели необходима совместная доставка двух генов, объединенных в генетическую кассету за счет использования в заявленном техническом решении общеизвестного способа (метода).
Для этого заявитель предлагает использование мультицистронных генетических кассет, где объединяются два гена через последовательности P2A, E2A, F2A, T2A или IRES.
Такая генетическая кассета обеспечивает совместную доставку и совместный синтез двух субъединиц одного фермента. После доставки этих генов (HEXA и HEXB) в клетку пациента, внутри клетки происходит синтез полноценного фермента и его секреция в ЦНС пациента, после чего возникает терапевтический эффект полного выздоровления.
Заявленное техническое решение более детально заключается в разработке кодон-оптимизированных нуклеотидных последовательностей, кодирующих α и β субъединицы β-гексозаминидазы А и их сочетаний в виде генетичекой кассеты, для получения заявленной фармацевтической композиции.
Использование заявленных генов (генетичекой кассеты) позволяет восстановить нарушенную экспрессию и/или функцию фермента β-гексозаминидазы А в центральной нервной системе и вызвать полное излечение у пациентов с болезнью Тея-Сакса.
На дату подачи заявленного технического решения в мире существует проблема терапии болезни Тея-Сакса (БТС), входящей в группу лизосомных болезней накопления, которая на дату представления заявочных материалов является неизлечимой.
БТС обусловлена мутациями в гене HEXA. При дефиците β-гексозаминидазы А GM2 ганглиозид накапливается внутри лизосом, которые образуют характерные включения внутри клеток, так называемые мембранные цитоплазматические тельца, представляющие собой сильно растянутые лизосомы, заполненные ганглиозидами [Ferreira, C.R. and W.A. Gahl, Lysosomal storage diseases. Transl Sci Rare Dis, 2017. 2(1-2): p. 1-71].
Из исследованного заявителем уровня техники известно, что в нервных клетках регистрируется самая высокая концентрация GM2 ганглиозида, следовательно, дефицит β-гексозаминидазы А наиболее сильно влияет на нервную систему, что характеризуется умственной и моторной задержкой у пациентов. Частота встречаемости данного заболевания - 1 на 320 тыс. новорожденных (частота носителей 1 на 250). Описано более 130 различных мутаций (частичная делеция, мутации при сплайсинге, нонсенс мутации, миссенс мутации) гена HEXA, которые приводят к нарушению транскрипции, трансляции, фолдинга, димеризации мономеров и каталитической функции β-гексозаминидазы А [Myerowitz, R., Tay-Sachs disease-causing mutations and neutral polymorphisms in the Hex A gene. Hum Mutat, 1997. 9(3): p. 195-208]. При БТС наблюдаются острая нейродегенерация и воспалительные процессы в ЦНС. Характерными особенностями БТС являются мышечная слабость, атаксия и другие проблемы с движением, речевые проблемы и психические расстройства.
Решение указанной проблемы представляется актуальным ввиду отсутствия на дату представления настоящей заявки лекарственных средств, предназначенных для эффективного лечения БТС. В настоящее время лечение БТС сводится исключительно к облегчению симптомов, а в случае поздних форм болезни к задержке её развития.
На дату представления заявочных материалов заявителем выявлено несколько вариантов терапии данного заболевания, включающие несколько известных терапевтических методов, направленных на:
- снижение субстрата (GM2-ганглиозида),
- трансплантацию костного мозга,
- гемопоэтических стволовых клеток,
- применение противовоспалительных препаратов,
- восстановление экспрессии функционального фермента с использованием генной терапии.
Терапия снижения субстрата подразумевает использование небольших молекул, например, препарата Zavesca® (миглустат) для замедления скорости биосинтеза гликолипидов.
Миглустат представляет небольшую молекулу иминосахара, действующую как конкурентный ингибитор фермента глюкозирцерамидсинтазы, который катализирует первый фиксированный этап синтеза гликосфинголипидов, и может проникать через гемато-энцефалический барьер (ГЭБ).
Клинические исследования показали значительную концентрацию миглустата в спинномозговой жидкости у исследуемых пациентов с инфантильной формой, однако это не привело к остановке неврологического ухудшения у пациентов, но авторы рекомендуют использование миглустата для профилактики макроцефалии [Maegawa, G.H., et al., Substrate reduction therapy in juvenile GM2 gangliosidosis. Mol Genet Metab, 2009. 98 (1-2): p. 215-24; Bembi, B., et al., Substrate reduction therapy in the infantile form of Tay-Sachs disease. Neurology, 2006. 66 (2): p. 278-80].
В 2005 году впервые была применена трансплантации костного мозга (ТКМ) с последующей терапией снижения субстрата для лечения пациента с БТС. ТКМ и применение препарата Zavesca® (миглустат) через 23 месяца после трансплантации привело к увеличению активности β-гексозаминидазы А в лейкоцитах и плазме, однако не предотвратило усугубление неврологических нарушений [Jacobs, J.F., et al., Allogeneic BMT followed by substrate reduction therapy in a child with subacute Tay-Sachs disease. Bone Marrow Transplant, 2005. 36 (10): p. 925-6].
Попытки коррекции мутаций гена HEXA при помощи методов генной и клеточной инженерии начались еще в середине 1990 годов. Основной проблемой в генной терапии БТС является выбор вектора и способа доставки терапевтических генов, позволяющих преодолеть ГЭБ и имеющих минимальное количество побочных эффектов.
Большие успехи были достигнуты в разработке подходов для генной терапии БТС с использованием векторов на основе адено-ассоциированных вирусов (ААВ) [Gray-Edwards, H.L., et al., Adeno-Associated Virus Gene Therapy in a Sheep Model of Tay-Sachs Disease. Hum Gene Ther, 2018. 29(3): p. 312-326]. Однако вектора на основе ААВ ограничены в своей емкости (от 2,1 до 4,5 т.п.н.) и не могут нести кДНК сразу двух генов, HEXA и HEXB, а эффективность ко-трансдукции значительно меньше, чем трансдукция одной конструкцией. Это является ограничивающим фактором использования данных векторов, поскольку для эффективного восстановления секреции отсутствующего гетеродимерного изофермента β-гексозаминидазы А нужна экспрессия обеих субъединиц, α и β [Tropak, M.B., et al., Construction of a hybrid beta-hexosaminidase subunit capable of forming stable homodimers that hydrolyze GM2 ganglioside in vivo. Mol Ther Methods Clin Dev, 2016. 3: p. 15057].
Golebiowski с соавторами провели исследование безопасности использования ААВ, кодирующих α и β субъединицы β-гексозаминидазы А, на нормальных киномолгусских макаках [Golebiowski, D., et al., Direct Intracranial Injection of AAVrh8 Encoding Monkey beta-N-Acetylhexosaminidase Causes Neurotoxicity in the Primate Brain. Hum Gene Ther, 2017. 28(6): p. 510-522]. Показано, что у большинства обезьян с внутричерепной инфузией ААВ развивалась дискинезия, атаксия и потеря ловкости. Животные, получившие высокую дозу ААВ, в конечном итоге стали апатичными. Время появления симптомов зависело от дозы, при этом наиболее выраженная доза вызывала симптомы в течение месяца после инфузии. Гистологический анализ показал наличие тяжелого некроза белого и серого вещества вдоль инъекционной дорожки, реактивную сосудистую сеть и присутствие нейронов с гранулированным эозинофильным материалом. Несмотря на нейротоксичность, в таламусе отмечалось резкое увеличение активности β-гексозаминидазы А [Golebiowski, D., et al., Direct Intracranial Injection of AAVrh8 Encoding Monkey beta-N-Acetylhexosaminidase Causes Neurotoxicity in the Primate Brain. Hum Gene Ther, 2017. 28(6): p. 510-522]. Авторы предположили, что тяжелая нейротоксичность может быть связана со сверхэкспрессией β-гексозаминидазы А.
Таким образом, вышеописанные методы лечения БТС являются неэффективными и актуален поиск новых препаратов и методов лечения БТС. На дату предоставления заявочных материалов, Zavesca® остается единственным лицензированным препаратом, применяемым при БТС, однако его использование не показывает значимый лечебный эффект.
Заявителем проведен анализ существующего уровня техники по научной и патентной информации в области терапии БТС и выявлен ряд аналогов, которые используются в настоящее время для облегчения симптомов и для остановки усугубления нейродегенерации.
Из исследованного уровня техники выявлен ряд функциональных аналогов (по назначению), применяющихся для лечения практически не излечимых на дату представления заявочных материалов известных в мире лизосомных болезней накопления.
Из исследованного уровня техники выявлен способ лечения пациентов с лизосомными болезнями накопления по патенту РФ № 2665381 «Внутрижелудочковая доставка ферментов при лизосомных болезнях накопления». Сущностью известного технического решения является способ профилактики или лечения лизосомной болезни накопления, которая вызвана дефицитом фермента у пациента, включающий внутрижелудочковое введение фермента в головной мозг пациента, при этом введение одной дозы фермента занимает более трех часов. Способ по п. 1, где введение одной дозы фермента занимает более четырех часов, более пяти часов, более шести часов, более семи часов или более восьми часов. Способ по п. 1, где указанная профилактика или лечение включает введение фермента в боковые желудочки и/или в четвертый желудочек головного мозга. Способ по п. 1, где введенного пациенту количества фермента достаточно для снижения уровня фермента в печени, легких, селезенке или почках пациента. Способ по п. 1, где профилактика или лечение включает мониторинг уровней сфингомиелина у пациента и введение дополнительного фермента в ответ на зарегистрированные уровни фермента. Способ по п. 1, где фермент вводят с помощью постоянного катетера. Способ по п. 1, где введение включает множественные инфузии. Способ по любому из пп. 1-7, где лизосомная болезнь накопления является синдромом мукополисахаридоза типа I и фермент является альфа-L-идуронидазой. Способ по любому из пп. 1-7, где лизосомная болезнь накопления является синдромом мукополисахаридоза типа II и фермент является идуронат-2-сульфатазой. Способ по любому из пп. 1-7, где лизосомная болезнь накопления является болезнью Гоше и фермент является глюкоцереброзидазой. Способ по любому из пп. 1-7, где лизосомная болезнь накопления является болезнью Помпе и фермент является альфа-глюкозидазой. Способ по любому из пп. 1-7, где лизосомная болезнь накопления является классической поздней инфантильной болезнью Баттена (CLN2) и фермент является трипептидилпептидазой.Способ по любому из пп. 1-7, где лизосомная болезнь накопления является одним из заболеваний, указанных в таблице 1, и фермент является соответствующим дефектным ферментом, указанным в таблице 1.
Таким образом, в изобретении в целом описывается метод патогенетической терапии путем внутрижелудочковой доставки недостающих ферментов. Применимость настоящего метода показали на модельных животных одного из лизосомных болезней накопления — болезни Нимана-Пика А или В. Кислую сфингомиелиназу вводили интравентрикулярно медленно, в течение трех часов. Эффект достигается за счет снижения патологического уровня субстрата кислой сфингомиелиназы как в тканях головного мозга, так и в висцеральных органах. Предполагается, что введение таким методом других ферментов, недостающих при лизосомных болезнях накопления, включая БТС, позволит добиться аналогичных результатов. Однако авторы не приводят примеры такого использования при других патологиях.
Известный метод введения позволяет устранить главную проблему лечения болезней ЦНС, а именно - преодоление ГЭБ.
Однако существенным недостатком известного метода является то, что интравентрикулярное введение (т.е. введение лекарственных препаратов в желудочки головного мозга путем хирургического вмешательства) влечет множество побочных эффектов, включая плохую диффузию препарата, нарушение целостности тканей мозга и т.д.
Для предотвращения такого существенного недостатка насущной необходимостью является разработка препарата, способ применения которого не требует механических вмешательств, например, использование веществ, проходящих ГЭБ физиологическим путем, без нарушения его целостности.
Использование генетической кассеты по пункту 2 формулы настоящего изобретения, которая (генетическая кассета) состоит из кодон-оптимизированных генов HEXA и HEXB по пункту 1 формулы настоящего изобретения, совместно с фармацевтической композицией по пункту 3 формулы настоящего изобретения позволяет модифицировать мононуклеарные клетки пациентов с болезнью Тея-Сакса (БТС), после чего полученные клетки будут выделять полноценный фермент, состоящий из двух субъединиц, которые кодируют гены по пунктам 1 и 2 формулы настоящего изобретения, и доставлять в ЦНС этот недостающий пациентам фермент. Таким образом, настоящее техническое решение позволяет решить одну из главных проблем терапии болезни Тея-Сакса, а именно - преодоление гемато-энцефалического барьера без нарушения его целостности.
Из исследованного уровня техники выявлено изобретение по патенту РФ № 2645675 «Ингибиторы глюкозилцерамид-синтазы», сущностью которого является способ лечения субъекта, которому поставлен диагноз болезни лизосомного накопления, включающий введение указанному субъекту эффективного количества соединения, представленного следующей структурной формулой,

или его фармацевтически приемлемая соль, где: n равно 1 или 2; m равно 0 или 1; p равно 1; t равно 0; y равно 1; z равно 0 или 1; E представляет собой О; X1 представляет собой CR1, когда m равно 1, или N, когда m равно 0; X2 представляет собой О, -NH или -CH2-; X3 представляет собой О или -NH; X4 представляет собой CR4R5 или CH2CR4R5; X5 представляет собой прямую связь, О или (C1-С6)-алкилоксигруппу; R1 представляет собой Н, CN, (C1-С6)-алкилкарбонил или (С1-С6)-алкил; R4 и R5 являются независимо выбранными из Н, (C1-С6)-алкила, или совместно с углеродом, к которому они присоединены, они образуют спиро-(С3-С10)-циклоалкильное кольцо или спиро-(С3-С10)-циклоалкоксильное кольцо; R6 представляет собой -Н, -CN, или (C1-С6)-алкил; А1 представляет собой (С6-С12)-арил, (С2-С9)-гетероарил, содержащий 1 или 2 гетероатома, выбранных из группы, включающей N, О и S, или бензо-(С2-С9)-гетероциклоалкил, содержащий 1 или 2 гетероатома, выбранных из О, где указанный (С6-С12)-арил, (С2-С9)-гетероарил или бензо-(С2-С9)-гетероциклоалкил необязательно замещен одним или более заместителями, выбранными из группы, включающей галоген, (C1-С6)-алкил, (C1-С6)-алкенил, и (C1-С6)-алкоксигруппу; А2 представляет собой Н, (С3-С10)-циклоалкил, (C6-C12)-арил или (С2-С9)-гетероарил, содержащий 1 или 2 гетероатома, выбранных из группы, включающей N, О и S, где указанный (С3-С10)-циклоалкил, (С6-С12)-арил или (С2-С9)-гетероарил необязательно замещен одним или более заместителями, выбранными из группы, включающей галоген, (C1-С6)-алкил, необязательно, замещенный 1-3 галогенами, CN и (C1-С6)-алкилоксигруппу, необязательно, замещенную 1-3 галогенами; при условии, что когда n равно 1; t равно 0; y равно 1; z равно 1; X2 представляет собой NH; Е представляет собой О; X3 представляет собой NH; А2 представляет собой Н и X5 представляет собой прямую связь; А1 не является незамещенным фенилом, галогенфенилом или изопропенилфенилом; при условии, что когда n равно 1; t равно 0; y равно 1; z равно 1; X2 представляет собой О; Е представляет собой О; X3 представляет собой NH; А1 представляет собой (С6-С12)-арил и X5 представляет собой прямую связь; А2 представляет собой Н и R4 представляет собой Н, тогда R5 не является циклогексилом; и при условии, что когда n равно 1; t равно 0; y равно 1; z равно 1; X2 представляет собой NH; Е представляет собой О; X3 представляет собой CH2; оба радикала R4 и R5 представляют собой водород; А2 представляет собой Н и X5 представляет собой прямую связь; тогда А1 не является незамещенным фенилом. Способ по п. 1, где n равно 1; t равно 0; y равно 1 и z равно 1. Способ по п. 1, где m равно 1 и X1 представляет собой CR1. Способ по п. 1, где m равно 0 и X1 представляет собой N. Способ по п. 1, где m равно 1; Е представляет собой О; X2 представляет собой О и X3 представляет собой NH. Способ по п. 1, где А1 представляет собой (С2-С9)-гетероарил, содержащий 1 или 2 гетероатома, выбранных из группы, включающей N, О и S. Способ по п. 6, где А1 представляет собой тиофен, тиазол, изотиазол, фуран, пиридин или пиримидин. Способ по п. 1, где n равно 1 или 2; t равно 0; y равно 1; z равно 0 или 1; X1 представляет собой CR1; m равно 1; p равно 1; Е представляет собой О; X2 представляет собой О; X3 представляет собой NH; R1 представляет собой Н; каждый из радикалов R4 и R5 независимо представляет собой метил; R6 представляет собой водород или метил; А1 представляет собой (С2-С9)-гетероарил, содержащий 1 или 2 гетероатома, выбранных из группы, включающей N, О и S; X5 представляет собой прямую связь или О, и А2 представляет собой (С6-С12)-арил. Способ по п. 1, где соединение представлено следующей структурной формулой

или его фармацевтически приемлемая соль. Способ по п. 1, где соединение представлено следующей структурной формулой

или его фармацевтически приемлемая соль. Способ по п. 1, где указанная болезнь лизосомного накопления является результатом дефекта в гликосфинголипидном пути. Способ по п. 11, где указанная болезнь лизосомного накопления является выбранной из группы, включающей болезнь Гоше, болезнь Фабри, GM1-ганглиозидоз, дефицит активатора GM2, болезнь Тея-Сакса и болезнь Сандхоффа. Способ по п. 12, где указанная болезнь лизосомного накопления представляет собой болезнь Фабри. Способ по п. 12, где указанная болезнь лизосомного накопления представляет собой болезнь Гоше типа 2 или болезнь Гоше типа 3. Способ по п. 1, дополнительно включающий введение указанному субъекту терапевтически эффективного количества лизосомного фермента. Способ по п. 15, где указанный лизосомный фермент является выбранным из группы, включающей глюкоцереброзидазу и альфа-галактозидазу А. Способ по п. 16, где указанный лизосомный фермент представляет собой альфа-галактозидазу А. Способ по п. 16, где указанный лизосомный фермент представляет собой глюкоцереброзидазу. Способ уменьшения активности глюкозилцерамид-синтазы (GCS) у пациента, которому поставлен диагноз расстройства лизосомного накопления, включающий введение эффективного количества соединения, как определено в п. 1, либо в виде монотерапии, либо в сочетании с ферментозаместительной терапией. Способ лечения заболевания или расстройства, опосредуемого глюкозилцерамид-синтазой (GCS), или заболевания или расстройства, в которые вовлечена GCS, у субъекта, нуждающемся в таком лечении, включающий введение указанному субъекту эффективного количества соединения, как определено в п. 1. Способ уменьшения накопления материала, производимого GCS, у пациента, которому поставлен диагноз болезни лизосомного накопления, включающий введение эффективного количества соединения, как определено в п. 1, либо в виде монотерапии, либо в сочетании с ферментозаместительной терапией. Соединение, представленное следующей структурной формулой,

или его фармацевтически приемлемая соль, где n, m, p, t, y, z, Е, X1, X2, X3, X4, X5, R1, R6, А1 и А2 представляют собой значения, определенные в п. 1; и R4 и R5 независимо выбирают из (C1-С6)-алкила; при условии, что когда n равно 1; t равно 0; y равно 1; z равно 1; X2 представляет собой NH; Е представляет собой О; X3 представляет собой NH; А2 представляет собой Н и X5 представляет собой прямую связь; А1 не является незамещенным фенилом, галогенфенилом или изопропенилфенилом. Соединение по п. 22, где каждый радикал R4 и R5 представляет собой метил. Соединение по п. 23, где n равно 1 или 2; t равно 0; y равно 1; z равно 0 или 1; X1 представляет собой CR1; m равно 1; p равно 1; Е представляет собой О; X2 представляет собой О; X3 представляет собой NH; R1 представляет собой Н; каждый из радикалов R4 и R5 независимо представляет собой метил; R6 представляет собой водород или метил; R6 представляет собой -Н или метил; А1 представляет собой (С2-С9)-гетероарил, содержащий 1 или 2 гетероатома, выбранных из группы, включающей N, О и S; X5 представляет собой прямую связь или О; и А2 представляет собой (С6-С12)-арил. Соединение, представленное следующей структурной формулой,
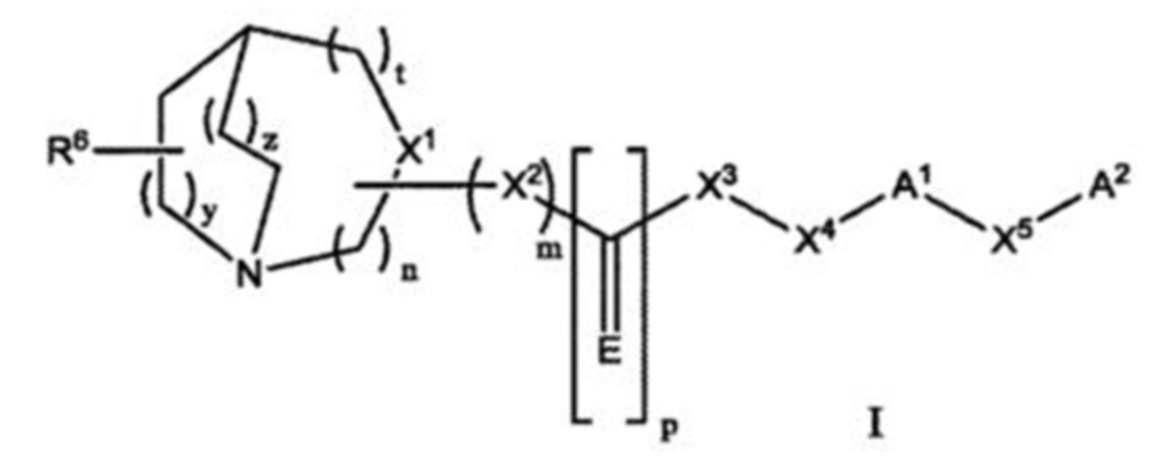
или его фармацевтически приемлемая соль, где n, m, p, t, у, z, Е, X1, X2, X3, X4, X5, R1, R6 и А1 представляют собой значения, определенные в п. 1; R4 и R5 совместно с углеродом, к которому они присоединены, они образуют (С3-С10)-циклоалкильное кольцо или (С3-С10)-циклоалкоксильное кольцо; и А2 представляет собой (С3-С10)-циклоалкил, (С6-С12)-арил или (С2-С9)-гетероарил, содержащий 1 или 2 гетероатома, выбранных из группы, включающей N, О и S, где указанный (С3-С10)-циклоалкил, (С6-С12)-арил или (С2-С9)-гетероарил необязательно замещен одним или более заместителями, выбранными из группы, включающей галоген, (C1-С6)-алкил, необязательно замещенный 1-3 галогенами; CN и (C1-С6)-алкилоксигруппу, необязательно замещенную 1-3 галогенами. Соединение по п. 22 или 25, где n равно 1; t равно 0; y равно 1 и z равно 1. Соединение по п. 22 или 25, где m равно 1 и X1 представляет собой CR1. Соединение по п. 22 или 25, где m равно 1; Е представляет собой О; X2 представляет собой О и X3 представляет собой NH. Соединение по п. 22 или 27, где А1 представляет собой (С2-С9)-гетероарил, содержащий 1 или 2 гетероатома, выбранных из группы, включающей N, О и S. Соединение по п. 29, где А1 представляет собой тиофен, тиазол, изотиазол, фуран, пиридин или пиримидин. Соединение, представленное следующей структурной формулой,

или его фармацевтически приемлемая соль. Соединение, представленное следующей структурной формулой,
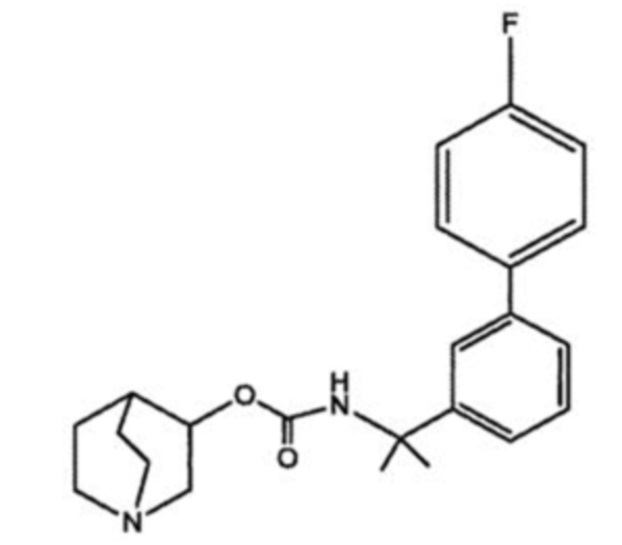
или его фармацевтически приемлемая соль. Фармацевтическая композиция для лечения заболевания или расстройства, опосредуемого глюкозилцерамид-синтазой (GCS), или заболевания или расстройства, к которому GCS имеет отношение, содержащая эффективное количество соединения по любому из пп. 22-32 и по меньшей мере один фармацевтически приемлемый носитель.
Таким образом, в изобретении в целом описывается способ использования ингибиторов глюкозилцерамид-синтазы для предотвращения синтеза гликолипидов при лизосомных болезнях накопления.
Недостатком известного технического решения является, во-первых, отсутствие специфичности для БТС. К тому же исследования эффективности использования данного препарата при БТС не проводились. К примеру, ранее описанный препарат миглустат, который показывает высокую эффективность при многих лизосомных болезнях накопления, при БТС не оказал терапевтического действия.
Во-вторых, известное техническое решение не решает причину возникновения заболевания БТС, а именно - мутацию и дисфункцию фермента β-гексозаминидазы А.
Для решения таких проблем необходимо провести исследования с использованием специфических терапевтических агентов, направленных именно на лечение БТС, а не всех лизосомных болезней накопления, а также искать пути решения восстановления функции недостающего фермента. Известные проблемы решаются путем использования генных препаратов, содержащих гены, кодирующие недостающий фермент.
Использование генетической кассеты по пункту 2 формулы настоящего изобретения, которая состоит из кодон-оптимизированных генов HEXA и HEXB по пункту 1 формулы настоящего изобретения совместно с фармацевтической композицией по пункта 4 формулы настоящего изобретения позволяет получить полный фермент и восстановить его функцию в ЦНС. Таким образом, настоящее техническое решение действует на саму причину возникновения заболевания, а именно - на недостаток фермента β-гексозаминидазы А. Также настоящее техническое решение действует специфически именно на заболевание Тея-Сакса, так как предполагает использование гена, в котором имеется мутация конкретно у пациентов с болезнью Тея-Сакса (БТС). Таким образом, техническое решение исключает не специфичность лечения пациентов с БТС, а также предотвращает появление заболевания в корне.
Из исследованного уровня выявлено изобретение по международной заявке WO2014061735 «Novel high-functioning enzyme having altered human β-hexosaminidase B substrate specificity, and having protease resistance applied thereto», сущностью которого является β-субъединица человеческой β-гексозаминидазы дикого типа, содержащая измененную аминокислотную последовательность, где последовательно заменяются 312-318 аминокислоты глицином, серином, глутаминовой кислотой, пролином, серином, глицином и треонином соответственно. Белок по п.1, в котором 452-я аминокислота замещена аспарагином и / или 453-я аминокислота замещена аргинином. Белок по п.2, соответствующий следующему: белок, содержащий аминокислотную последовательность, представленную SEQ ID NO: 6; белок представляющий человеческую β-гексозаминидазу дикого типа, обладающий активностью α-субъединицы и обладающий устойчивостью к протеазе, содержащий аминокислотную последовательность, представленную SEQ ID NO: 6, где удалены, замещены или добавлены от 1 до нескольких аминокислот, однако аминокислотная последовательность на сайте замещения является идентичной аминокислотной последовательности, представленной в SEQ ID NO: 6; белок, белок представляющий человеческую β-гексозаминидазу дикого типа, обладающий активностью α-субъединицы и обладающий устойчивостью к протеазе, имеющей по меньшей мере 90% идентичности с аминокислотной последовательностью, представленной в SEQ ID NO: 6. Белок, содержащий гомодимер белка по любому из пп.1-3; ген, кодирующий белок по любому из пп.1-3. Рекомбинантный вектор, содержащий ген по п.5. Трансформант, содержащий рекомбинантный вектор по п.6. Способ получения белка, обладающего активностью α-субъединицы человеческой β-гексозаминидазы дикого типа, обладающей устойчивостью к протеазе из культуры, полученной путем культивирования трансформанта из п. 7. Фармацевтическая композиция для лечения болезни Тея-Сакса, содержащая белок по любому из пп.1-4. Фармацевтическая композиция для лечения болезни Тея-Сакса, содержащая ген по п.5. Фармацевтическая композиция для лечения болезни Сандхоффа, содержащая белок по любому из пп.1-4. Фармацевтическая композиция для лечения болезни Сандхоффа, содержащая ген по п.5. Способ лечения болезни Тея-Сакса, включающий: белок по любому из пп.1-4, ген по п.5 или фармацевтическая композиция для лечения болезни Тея-Сакса по п.9 или 10. Способ лечения болезни Сандхоффа, включающий: белок по любому из пп.1-4, ген по п.5 или фармацевтическая композиция для лечения болезни Сандхоффа по п.11 или 12.
Таким образом, в изобретении в целом описывается использование фермента с модифицированной субстратной специфичностью β-гексозаминидазы человека с устойчивостью к протеазе.
Недостатком известного технического решения является то, что фермент не способен преодолевать ГЭБ. Поэтому требуется интравентрикулярное, интрапаренхимальное или интрацеребральное введение такого препарата, что ведет к плохой диффузии и другим побочным эффектам.
Решением такой проблемы может стать использование систем доставки, позволяющих преодолевать биологические барьеры организма человека, например, путем использования клеточно-опосредованной доставки фермента, как предложено заявителем.
В настоящем техническом решении предполагается использование генетической кассеты по пункту 2 формулы настоящего изобретения, состоящей из кодон-оптимизированных последовательностей генов HEXA и HEXB по пункту 1 формулы настоящего изобретения совместно с фармацевтической композицией по пункту 4 формулы настоящего изобретения, что позволяет модифицировать клетки пациентов с болезнью Тея-Сакса (БТС). Таким образом, настоящее техническое решение позволяет доставлять фермент клеточно-опосредованно в ЦНС и получить полный фермент и восстановить его функцию в ЦНС. Таким образом, настоящее техническое решение действует на саму причину возникновения заболевания, а именно - на замену мутантного фермента β-гексозаминидазы А на здоровый в ЦНС.
Таким образом, из исследованного уровня техники заявителем выявлены аналоги только по назначению. Аналогов заявленных кодон-оптимизированных нуклеотидных последовательностей генов, кодирующих α и β субъединицы β-гексозаминидазы А (HEXA и HEXB, соответственно), а также мультицистронных кассет HEXA-P2A-HEXB, HEXA-E2A-HEXB, HEXA-F2A-HEXB, HEXA-T2A-HEXB и HEXA-IRES-HEXB, созданных на основе описанных выше генов по заявленной генетической последовательности заявителем не выявлено, в связи с чем формула изобретения составлена без ограничительной части.
Целью и техническим результатом заявленного технического решения является разработка кодон-оптимизированных нуклеотидных последовательностей генов, кодирующих α и β субъединицы β-гексозаминидазы А (HEXA и HEXB, соответственно), а также мультицистронных кассет HEXA-P2A-HEXB, HEXA-E2A-HEXB, HEXA-F2A-HEXB, HEXA-T2A-HEXB и HEXA-IRES-HEXB, созданных на основе описанных выше генов, для терапии лизосомных болезней, в частности болезни Тея-Сакса.
Сущностью заявленного технического решения является генетическая кассета, содержащая кодон-оптимизированные нуклеотидные последовательности генов HEXA и HEXВ, представленные SEQ ID NO:1 и SEQ ID NO:2 соответственно, разделенные нуклеотидной последовательностью IRES или кодирующей P2А, E2А, F2А или T2А пептид, для экспрессии β-гексозаминидазы А в клетке млекопитающего, фармацевтическая композиция для лечения болезни Тея-Сакса, содержащая рекомбинантную плазмиду с генетической кассетой по п. 1 в эффективном количестве, предназначенную для экспрессии в клетках млекопитающих с возможностью создания лентивирусных векторов, способных генетически модифицировать клетки млекопитающих с интеграцией в геном, и фармацевтически допустимые вспомогательные вещества.
Заявленное техническое решение поясняется графическими материалами, представленными на Фиг.1 – Фиг.5.
На Фиг. 1 показана общая ферментативная активность β-гексозаминидазы А в кондиционированной среде клеток HEK293T, трансфицированных плазмидой pLX303-HEXA-Р2A-HEXB. По оси X указаны образцы кондиционированной среды, собранной от нативных клеток HEK293T (обозначение — контроль), клеток HEK293T, трансфицированных плазмидой pLX303-Katushka2S (обозначение — pLX303-Katushka2S), клеток HEK293T, трансфицированных плазмидой pLX303-HEXA-Р2A-HEXB, содержащей нуклеотидные последовательности SEQ ID NO: 1 и SEQ ID NO: 2 (обозначение — pLX303-HEXA-Р2A-HEXB), а по оси Y показана относительная общая ферментативная активность β-гексозаминидазы А.
На Фиг. 2 показана ферментативная активность α субъединицы β-гексозаминидазы А в кондиционированной среде клеток HEK293T, трансфицированных плазмидой pLX303-HEXA-Р2A-HEXB. По оси X указаны образцы кондиционированной среды, собранной от нативных клеток HEK293T (обозначение — контроль), клеток HEK293T, трансфицированных плазмидой pLX303-Katushka2S (обозначение — pLX303-Katushka2S), клеток HEK293T, трансфицированных плазмидой pLX303-HEXA-Р2A-HEXB, содержащей нуклеотидные последовательности SEQ ID NO: 1 и SEQ ID NO: 2 (обозначение — pLX303-HEXA-Р2A-HEXB), а по оси Y показана относительная общая ферментативная активность β-гексозаминидазы А.
На Фиг. 3 показаны результаты вестерн блот анализа экспресии α субъединицы β-гексозаминидазы А (HEXA) в генетически модифицированных плазмидой pLX303-HEXA-2A-HEXB клетках НЕК293T, где 1 — нетрансфицированные клетки НЕК293T, 2 — клетки НЕК293T, трансфицированные плазмидой pLX303-Katushka2S, 3 — клетки НЕК293T, трансфицированные плазмидой pLX303-HEXA-Р2A-HEXB, содержащей нуклеотидные последовательности SEQ ID NO: 1 и SEQ ID NO: 2. Нормализация результатов проведена по количеству белка β-актина.
На Фиг. 4 показаны результаты вестерн блот анализа экспресии β субъединицы β-гексозаминидазы А (HEXB) в генетически модифицированных клетках НЕК293T, где 1 — нетрансфицированные клетки НЕК293T, 2 — клетки НЕК293T, трансфицированные плазмидой pLX303-Katushka2S, 3 — клетки НЕК293T, трансфицированные плазмидой pLX303-HEXA-Р2A-HEXB, содержащей нуклеотидные последовательности SEQ ID NO: 1 и SEQ ID NO: 2. Нормализация результатов проведена по количеству белка β-актина.
На Фиг. 5 показаны результаты анализа активности α субъединицы β-гексозаминидазы А в плазме крови крыс после внутривенного введения МКПК, генетически модифицированных лентивирусом, содержащим нуклеотидные последовательности SEQ ID NO: 1 и SEQ ID NO: 2. Таким образом, графические материалы, иллюстрирующие примеры конкретного выполнения заявленного технического решения доказывают возможность достижения заявленных технических результатов, а именно:
- общая ферментативная активность β-гексозаминидазы А в кондиционированной среде клеток HEK293T, трансфицированных плазмидой pLX303-HEXA-Р2A-HEXB, увеличивается на 35 %;
- ферментативная активность α-субъединицы β-гексозаминидазы А в кондиционированной среде клеток HEK293T, трансфицированных плазмидой pLX303-HEXA-Р2A-HEXB, увеличивается в 10 раз;
- вестерн-блот анализ показывает наличие экспресии α-субъединицы β-гексозаминидазы А (HEXA) в генетически модифицированных плазмидой pLX303-HEXA-2A-HEXB клетках НЕК293T;
- вестерн-блот анализ показывает наличие экспресии β-субъединицы β-гексозаминидазы А (HEXB) в генетически модифицированных клетках НЕК293T;
- активности α субъединицы β-гексозаминидазы А в плазме крови крыс после внутривенного введения МКПК, генетически модифицированных лентивирусом LV-HEXA-2A-HEXB, содержащим нуклеотидные последовательности SEQ ID NO: 1 и SEQ ID NO: 2 показывает значительное увеличение активности на 3-9 сутки после введения генетически модифицированных клеток.
Поставленная цель и заявленный технический результат достигается путем синтеза генетической мультицистронной кассеты, содержащей оптимизированные по кодонному составу нуклеотидные последовательности генов HEXA и HEXB, разделенные нуклеотидной последовательностью саморасщепляющегося 2А пептида, например, P2A, E2A, F2A, T2A или нуклеотидной последовательностью IRES.
При этом следует отметить, что способ получения генетической кассеты не является предметом предполагаемого изобретения, т.к. реализуется посредством с применения известных технологий.
Под нуклеотидной последовательностью IRES понимается внутренний сайт входа рибосомы, который обеспечивает трансляцию, независимую от 5'-конца РНК. Во время трансляции, после окончания синтеза первого гена, происходит диссоциация рибосомы, после этого в области IRES собирается новый комплекс инициации трансляции и начинается синтез следующего белка. IRES были обнаружены у многих вирусов, например, у пикорнавирусов, лентивирусов, флавивирусов, а также у бактерий и эукариот.
Под саморасщепляющимися 2А пептидами понимается класс пептидов длиной 18–22 аминокислот, которые располагаются между двумя целевыми пептидами и обеспечивают их расщепление друг от друга во время синтеза белка путем рибосомного скиппинга. Названия 2А пептидов исходят от наименований вирусов, в которых они были обнаружены. Например, F2A получен из вируса ящура (foot-and-mouth disease virus), E2A - equine rhinitis virus, P2A - porcine teschovirus-1, T2A - Thosea asigna virus.
В биологических исследованиях IRES и 2А пептиды используются для создания мультицистронных векторов с целью ко-экспресии (совместной экспрессии) нескольких генов.
Далее заявителем приведено описание осуществления заявленного технического решения.
Заявленное изобретение осуществляется в 5 этапов в нижеприведённой последовательности, а именно:
1 этап: оптимизация кодонного состава нуклеотидных последовательностей генов HEXA и HEXB.
2 этап: создание донорной плазмиды.
3 этап: клонирование заявленной последовательности HEXA-P2A-HEXB из донорной плазмиды в экспрессионную векторную плазмиду.
4 этап: анализ функциональной активности кодон-оптимизированных последовательностей генов HEXA и HEXB на клеточных культурах in vitro.
5 этап: анализ функциональной активности кодон-оптимизированных последовательностей генов HEXA и HEXB на лабораторных животных.
Далее заявителем приведено подробное описание этапов осуществления заявленного технического решения.
1 этап. Оптимизация кодонного состава нуклеотидных последовательностей генов HEXA и HEXB.
Производят кодонную оптимизацию нуклеотидных последовательностей генов. Для оптимизации кодонного состава генов HEXA и HEXB используют известные алгоритмы, например, OptimumGene (GeneScript, США), который учитывает различные факторы, влияющие на уровни экспрессии генов, такие, как смещение кодонов, GC-состав, содержание CpG-динуклеотидов, вторичную структуру мРНК, тандемные повторы, сайты рестрикции, которые могут помешать клонированию, преждевременные сайты полиаденилирования, дополнительные минорные сайты связывания с рибосомой.
В качестве матрицы для кодонной оптимизации используют нуклеотидные последовательности мРНК генов HEXA (GeneBank #AF486837.1, 576 пар нуклеотидов (п.н.)) и HEXB (GeneBank #AY429472.1, 270 п.н.). Дикий тип нуклеотидных последовательностей кодирующей части генов HEXA и HEXB содержит тандем редких кодонов, которые могут остановить трансляцию или снизить ее эффективность. При оптимизации кодонного состава дикого типа гена HEXA улучшается индекс адаптации кодонов CAI (англ. Codon Adaptation Index) с 0,77 до 0,93. При оптимизации кодонного состава дикого типа гена HEXB улучшается индекс адаптации кодонов CAI с 0,71 до 0,93.
Для увеличения стабильности мРНК оптимизируют GC-состав путем удаления протяженных участков с высоким содержанием GC-пар. Кроме того, в процессе оптимизации удаляют потенциальные цис-действующие сайты.
Заявителем установлено, что в результате кодонной оптимизации аминокислотные последовательности генов HEXA и HEXB не изменяются и составляют 481 и 541 аминокислотных остатков, соответственно.
Далее проводят синтез de novo нуклеотидных последовательностей кДНК генов HEXA (SEQ ID NO: 1) и HEXB (SEQ ID NO: 2), разделенных общеизвестными нуклеотидными последовательностями саморасщепляющегося пептида, из ряда 2А, P2A, E2A, F2A, T2A или нуклеотидной последовательностью IRES.
2 этап. Создание донорной плазмиды.
Создают донорную плазмиду, например pUC57-HEXA-P2A-HEXB, содержащую нуклеотидные последовательности SEQ ID NO: 1 и SEQ ID NO: 2, разделенные нуклеоидной последовательностью Р2А пептида, путем субклонирования оптимизированных по кодонному составу нуклеотидных последовательностей генов HEXA и HEXB, разделенных нуклеотидной последовательностью P2A пептида, в плазмидный вектор pUC57 (Addgene, США) по сайтам рестрикции HindIII и XbaI. Правильность сборки генетической конструкции pUC57-HEXA-P2A-HEXB подтверждается рестрикционным анализом и секвенированием нуклеотидных последовательностей генов HEXA и HEXB.
3 этап. Клонирование заявленной последовательности HEXA-P2A-HEXB из донорной плазмиды в экспрессионную векторную плазмиду.
Проводят субклонирование генов HEXA и HEXB (SEQ ID NO: 1 и SEQ ID NO: 2), разделенных последовательностью P2A пептида, из плазмиды pUC57-HEXA-2A-HEXB в экспрессионный плазмидный вектор, например, лентивирусный плазмидный вектор pLX303 (AddGene, США). Клонирование генов из донорной плазмиды pUC57-HEXA-Р2A-HEXB в экспрессионный вектор pLX303 проводят путем LR-рекомбинации (по технологии Gateway, Invitrogen, США).
Реакцию LR-рекомбинации проводят при комнатной температуре. В 1,5 мл пробирке смешивают 150 нг вектора-донора pUC57-HEXA-Р2A-HEXB, 150 нг вектора-реципиента pLX303, 1,5 мкл буфера ТЕ pH 8,0, 1 мкл смеси ферментов LR Clonase (Invitrogen, США), перемешивают пипетированием. Смесь инкубируют в течение, например, 16 часов при комнатной температуре, например, 25°С. После инкубации к смеси добавляют 1 мкл фермента протеиназы-K (Invitrogen, США) и перемешивают пипетированием. Смесь инкубируют в течение, например, 10 минут при 37°С в термостате. Для бактериальной трансформации используют 1,5–2 мкл рекомбинационной смеси. В предварительно охлажденную 1,5 мл пробирку добавляют 50 мкл раствора компетентных клеток из 50 мл пробирки и 2 мкл рекомбинационной смеси. Раствор компетентных клеток с рекомбинационной смесью держат на льду в течение, например, 30 минут, после чего клетки подвергаются тепловому шоку на водяной бане при 42°С в течение, например, 30 секунд, по прошествии которых пробирки с трансформированными клетками незамедлительно переносятся обратно на лед. Затем к клеткам добавляют 250 мкл среды LS-LB и инкубируют в шейкере в течение, например, 1 часа при 37°С. После инкубации бактерии высевают на селективную среду, содержащую ампициллин в концентрации 100 мг/мл.
Выросшие колонии проверяют на наличие плазмидного вектора pLX303-HEXA-Р2A-HEXB со вставкой целевых генов с помощью ПЦР-скринига по стандартной методике с использованием геноспецифичных праймеров. Результаты выделения плазмидной ДНК анализируют методом электрофореза в 1 % агарозном геле.
Дальнейшая работа проводится с колониями, выросшими на селективной среде с ампициллином. Отдельную бактериальную колонию иннокулируют в 15 мл пробирку, содержащую 5 мл среды с канамицином (в концентрации 100 мг/мл) и инкубируют в термостате в течение, например, 14–16 часов при 37°С с интенсивным перемешиванием, после чего биомассу используют для выделения плазмидной ДНК по стандартным общеизвестным протоколам.
4 этап. Анализ функциональной активности кодон-оптимизированных последовательностей генов HEXA и HEXB на клеточных культурах in vitro.
Функциональная активность кодон-оптимизированных последовательностей генов HEXA и HEXB в составе генетической конструкции pLX303-HEXA-Р2A-HEXB подтверждают анализом экспрессии трансгенов in vitro. Для этого проводят генную модификацию (трансфекцию) клеточной линии НЕК293Т с помощью генетической конструкции pLX303-HEXA-Р2A-HEXB. Трансфекцию проводят, например, трансфекционным реагентом TurboFect (Thermo Fisher Scientific, США) в соответствии с методикой, рекомендуемой производителем.
Для оценки экспрессии генов HEXA и HEXB в трансфицированных клетках НЕК293Т проводят субстратный тест на активность фермента и вестерн-блот анализ.
Сбор кондиционированной среды из лунок с клетками НЕК293Т, трансфицированных pLX303-HEXA-P2A-HEXB, проводят через 24 часа после трансфекции. Среду из лунок в объеме, например, 1 мл переносят в 1,5 мл пробирки и центрифугируют в течение, например, 1 минуты при максимальных оборотах для удаления клеточных обломков (дебриса). Супернатант переносят в чистые 1,5 мл пробирки и используют для определения ферментативной активности белка.
Для определения ферментативной активности образцы супернатанта переносят в 96-луночный планшет по 60 мкл на лунку. Добавляют субстраты по 25 мкл на лунку. Используют флуоресцентные субстраты 3,2 мM 4-метилумбеллиферил-β-D-глюкуронид гидрат (с англ. 4-methylumbelliferyl-β-D-glucopyranosiduronic acid, MUG) (Кат. №M9130, Sigma-Aldrich, США) для анализа общей активности β-гексозаминидазы А и 3.2 мM калиевая соль 4-метилумбеллиферил-6-сульфо-2-ацетамидо-2-дезокси-β-D-глюкопиранозида (с англ. 4-methylumbelliferyl 6-sulfo-2-acetamido-2-deoxy-β-D-glucopyranoside potassium salt, MUGS) (Кат. №M335000, Toronto Research Chemicals, Канада) для анализа активности α субъединицы β-гексозаминидазы А. Субстраты заранее растворяют в цитратно-фосфатном буфере pH = 4,2. Инкубируют, например, 1 час при 37 °С. Реакцию останавливают добавлением 200 мкл глицин-карбонатного буфера (0,17 М глицин, 0,17 М карбонат натрия) в каждую лунку.
Уровень флуоресценции измеряют с помощью спектрофотометра Infinite M200Pro (Tecan Trading AG, Швейцария) (поглощение — 365 нм, испускание — 450 нм).
Тест на ферментативную активность показал, что общая активность β-гексозаминидазы А в клетках, трансфицированных pLX303-HEXA-Р2A-HEXB, выше на 35%, чем в нативных клетках (контроль) и клетках, трансфицированных плазмидой pLX303-Katushka2S (плазмида для анализа эффективности генетической модификации, кодирующая репортерный ген дальне-красного флуоресцентного белка Katushka2S) (Фиг. 1), а активность α субъединицы β-гексозаминидазы А в клетках, трансфицированных pLX303-HEXA-Р2A-HEXB, выше примерно в 10 раз по сравнению с нативными клетками (контроль) и клетками, трансфицированными плазмидой pLX303-Katushka2S (Фиг. 2).
Белковые лизаты клеток НЕК293Т, трансфицированных плазмидой pLX303-HEXA-Р2A-HEXB, анализируют с помощью вестерн-блот анализа.
По результатам анализа заявителем получены ожидаемые размеры α и β субъединиц β-гексозаминидазы А примерно 50 кДа и 60 кДа, соответственно (Фиг. 3 и 4).
5 этап. Анализ функциональной активности кодон-оптимизированных последовательностей генов HEXA и HEXB на лабораторных животных.
На основе полученной плазмиды pLX303-HEXA-Р2A-HEXB получают рекомбинантный лентивирус LV-HEXA-Р2А-HEXB.
Для этого проводят ко-трансфекцию с использованием кальций-фосфатного метода тремя плазмидами (оболочечная pCMV-VSV-G (addgene #8454), упаковочная pCMVR8.74 (addgene #22036) и векторная) пакующей линии клеток HEK293FT. Сбор вирусного супернатанта проводят 3 раза через каждые 12 часов. Супернатанты объединяют и хранят при 4°С. По завершению сбора супернатанты центрифугируют в течение, например, 5 минут при 1500 об/мин и фильтруют через нейлоновый фильтр с размером пор 0,22 мкм.
Концентрирование рекомбинантных лентивирусных частиц проводили методом ультрацентрифугирования в ультрацентрифуге Optima™ L-90K (Beckman Coulter, США) с ускорением 26000 об/мин в течение, например, 2 часов при температуре 4°C. Осадок рекомбинантного лентивируса ресуспендируют в 500 мкл культуральной среды, содержимое переносят в криопробирку и хранят при минус 80°C.
Полученным рекомбинантным лентивирусом LV-HEXA-Р2А-HEXB проводили генетическую модификацию (трансдукцию) мононуклеарных клеток пуповинной крови (МКПК) человека, после чего генетически модифицированные МКПК внутривенно вводили лабораторным крысам, после чего анализировали активность α субъединицы HexA в плазме крови испытуемых крыс.
Для этого из крови здорового человека (донора) выделяют МКПК. Непосредственно после выделения МКПК высевают в 35 мм чашки Петри для суспензионных клеток в количестве 2,5 млн. Далее клетки инфицируют полученными рекомбинантным лентивирусом LV-HEXA-Р2А-HEXB (с множественностью инфекции 10) с добавлением протамина сульфата до конечной концентрации 10 мкг/мл. После добавления рекомбинантного лентивируса, клетки инкубируют в течение 6 часов при 37 °С во влажной атмосфере, содержащей 5% CO₂. После чего клетки, генетически модифицированные рекомбинантным лентивирусом LV-HEXA-Р2А-HEXB МКПК, собирают, отмывают фосфатно-солевым буфером и ресуспендируют в физиологическом растворе. Полученные клетки вводят лабораторным крысам в хвостовую вену в количестве 2,5 млн в 500 мкл физиологического раствора.
До введения генетически модифицированных МКПК необходимо забрать образец плазмы крови экспериментальных крыс в качестве контроля.
После введения генетически модифицированных МКПК через 2, 3, 6, 9, 30 суток забирают плазму крови лабораторных крыс.
После сбора образцов плазмы крови проводят тест на определение ферментативной активности α субъединицы β-гексозаминидазы А. Для этого образцы плазмы переносят в 96-луночный планшет по 30 мкл на лунку. Добавляют субстраты по 25 мкл на лунку. После этого добавляют флуоресцентный субстрат 3.2 мM MUGS (Кат. №M335000, Toronto Research Chemicals, Канада) для анализа активности α субъединицы β-гексозаминидазы А. Субстраты заранее растворяют в цитратно-фосфатном буфере pH = 4,2. Инкубируют, например, 1 час при 37°С.
Уровень флуоресценции измеряют с помощью спектрофотометра Infinite M200Pro (Tecan Trading AG, Швейцария) (поглощение — 365 нм, испускание — 450 нм). Результаты были нормализованы относительно фоновой флуоресценции в образцах плазмы.
Результаты, описанные на Этапах 1-5, приведены на Фиг. 1-5.
Из данных, приведенных на Фиг. 1, видно, что общая активность β-гексозаминидазы А в кондиционированной среде клеток HEK293T, трансфицированных pLX303-HEXA-2A-HEXB, выше на 35%, чем в кондиционированной среде нативных клеток HEK293T (контроль) и клеток HEK293T, трансфицированных плазмидой pLX303-Katushka2S. Такие результаты доказывают функциональность кодон-оптимизированных последовательностей генов HEXA и HEXB, экспрессируемых генетически модифицированными плазмидой pLX303-HEXA-2A-HEXB клетками HEK293T.
Из данных, приведенных на Фиг. 2, видно, что активность α субъединицы β-гексозаминидазы А в клетках HEK293T, трансфицированных pLX303-HEXA-2A-HEXB, выше в 10 раз по сравнению с нативными клетками HEK293T и клетками HEK293T, трансфицированными плазмидой pLX303-Katushka2S. Такие результаты доказывают функциональность кодон-оптимизированной последовательности гена HEXA, экспрессируемой генетически модифицированными плазмидой pLX303-HEXA-2A-HEXB клетками HEK293T.
Из данных, приведенных на Фиг. 3, видно наличие выраженной специфичной полосы иммунопреципитата, соответствующей ожидаемой молекулярной массе α-субъединицы белка HexA – 50 кДа. Таким образом, показана экспрессия белка HEXA в генетически модифицированных клетках НЕК293T плазмидой pLX303-HEXA-Р2A-HEXB, содержащей нуклеотидные последовательности SEQ ID NO: 1 и SEQ ID NO: 2.
Из данных, приведенных на Фиг. 4, видно наличие выраженной специфичной полосы иммунопреципитата, соответствующей ожидаемой молекулярной массе β-субъединицы белка HexA – 60 кДа. Таким образом, показана экспрессия белка HEXB в генетически модифицированных клетках НЕК293T плазмидой pLX303-HEXA-Р2A-HEXB, содержащей нуклеотидные последовательности SEQ ID NO: 1 и SEQ ID NO: 2.
Из данных, приведенных на Фиг. 5, видно, что после введения генетически модифицированных МКПК в плазме крови крыс увеличивается активность α субъединицы β-гексозаминидазы А. Наиболее высокая активность детектируется на 6–9 сутки после введения. Таким образом, эксперименты на лабораторных крысах показали эффективность использования SEQ ID NO: 1 и SEQ ID NO: 2 для повышения активности α субъединицы β-гексозаминидазы А, что доказывает их функциональность.
Рекомбинантные плазмидные конструкции, созданные на основе кодон-оптимизированных последовательностей генов HEXA и HEXB, а также с использованием нуклеотидных последовательностей IRES, 2A, P2A, E2A, F2A или T2A пептидов, могут быть использованы в составе фармацевтической композиции для получения готовой лекарственной формы генного препарата. Фармацевтическая композиция дополнительно может содержать вещества, повышающие эффективность генетической модификации мононуклеарных или стволовых клеток (например, протамина сульфат) в случае реализации генно-клеточного метода лечения. Способ использования фармацевтической композиции заключается во введении человеку (или животным) таким способом и в таком количестве, которые обеспечат лечебный эффект в зависимости от нозологической формы и медицинских показаний. Фармацевтическая композиция может вводиться местно - внутримышечно, системно - внутривенно, внутриартериально, аэрозольно, в виде генно- клеточной трансплантации или трансфузии после in vitro обработки различных аутологичных клеток, например, гемопоэтических и их более дифференцированных производных, мезенхимных, сосудисто-стромальной фракции и др. Хотя указанные способы введения широко известны из уровня техники, для специалиста в данной области техники очевидно, что могут быть совершены различные изменения и произведены эквивалентные замены, и такие изменения и замены не выходят за рамки настоящего изобретения.
Таким образом, из вышеизложенного можно сделать общий вывод, что заявителем достигнуты поставленные цели и заявленный технический результат, а именно разработаны;
- кодон-оптимизированные нуклеотидные последовательности генов, кодирующие α и β субъединицы β-гексозаминидазы А (HEXA и HEXB, соответственно),
- мультицистронные кассеты HEXA-P2A-HEXB, HEXA-E2A-HEXB, HEXA-F2A-HEXB, HEXA-T2A-HEXB и HEXA-IRES-HEXB, созданные на их (генов) основе, для терапии лизосомных болезней, в частности болезни Тея-Сакса,
- фармацевтическая композиция для лечения болезни Тея-Сакса, содержащая рекомбинантную плазмиду с генетической кассетой в эффективном количестве и фармацевтически допустимые вспомогательные вещества.
При этом в примерах конкретного выполнения экспериментально доказано, что использование заявленного технического решения на основе кодон оптимизированных последовательностей генов HEXA и HEXB (SEQ ID NO: 1 и SEQ ID NO: 2) позволяет остановить нейродегенерацию.
Заявленное изобретение может быть полезно также и при лечении других лизосомных болезнях накопления, к примеру, при болезни Санхоффа, с использованием заявленного подхода.
Заявленное техническое решение удовлетворяет критерию «новизна», предъявляемому к изобретениям, так как из исследованного уровня техники не выявлены источники, в которых описаны признаки, совпадающие по исполняемой ими функции и форме выполнения этих признаков, перечисленные в формуле изобретения, включая характеристику назначения.
Заявленное техническое решение удовлетворяет критерию «изобретательский уровень», предъявляемому к изобретениям, поскольку из исследованного уровня техники заявителем не выявлены технические решения, характеризующиеся использованием генетической конструкции, содержащей кодон-оптимизированные кДНК α и β субъединиц β-гексозаминидазы А (SEQ ID NO: 1 и SEQ ID NO: 2) для использования в терапии БТС, а именно, остановки нейродегенерации. Кроме того, заявленное техническое решение, по мнению заявителя, не является очевидным для специалиста, так как обеспечивает реализацию задачи по лечению практически неизлечимого на дату представления заявочных материалов заболевания Тея-Сакса (БТС).
Заявленное техническое решение удовлетворяет критерию «промышленная применимость», предъявляемому к изобретениям, так как оно может быть использовано в промышленных масштабах для создания препаратов, предназначенных для лечения болезни Тея-Сакса (БТС), а также некоторых других лизосомных болезней накопления, к примеру, болезни Сандхоффа, с использованием заявленного подхода.
--->
Перечень последовательностей
SEQ ID NO: 1
<110> Казанский (Приволжский) федеральный университет
<120> Кодон-оптимизированные нуклеотидные последовательности генов HEXA и HEXB, генный препарат для лечения болезни Тея-Сакса
<160> 2
<210> 1
<211> 1620
<212> DNA
<213> Artificial Sequence
<400> 1
atgacctctt cccgcctgtg gttttccctg ctgctggctg ctgcttttgc cggacgagct 60
accgccctgt ggccttggcc tcagaatttc cagaccagcg accagcggta cgtgctgtat 120
ccaaacaatt tccagtttca gtacgatgtg agctccgccg cacagccagg atgctccgtg 180
ctggacgagg ccttccagcg gtatagagat ctgctgtttg gctctggcag ctggcccaga 240
ccttacctga ccggatggcc acaccaggcc tatcccgtgt tcctgggcaa gaggcacaca 300
ctggagaaga acgtgctggt ggtgtctgtg gtgaccccag gctgcaatca gctgcccaca 360
ctggagagcg tggagaacta caccctgaca atcaatgacg atcagtgtct gctgctgtcc 420
gagacagtgt ggggcgccct gagaggcctg gagacatttt cccagctggt gtggaagtct 480
gccgagggca ccttctttat caacaagaca gagatcgagg acttcccacg gtttccccac 540
agaggcctgc tgctggatac cagcaggcac tacctgcccc tgtctagcat cctggacaca 600
ctggatgtga tggcctataa caagctgaac gtgttccact ggcacctggt ggacgatcct 660
agctttccat acgagtcctt cacctttcca gagctgatgc gcaagggctc ttacaatccc 720
gtgacccaca tctatacagc ccaggacgtg aaggaagtga tcgagtatgc aaggctgagg 780
ggcatccggg tgctggcaga gttcgatacc cctggacaca cactgagctg gggaccaggc 840
atccctggcc tgctgacccc ttgctactcc ggctctgagc caagcggcac attcggccca 900
gtgaacccct ccctgaacaa tacctacgag tttatgtcta cattctttct ggaggtgtcc 960
agcgtgttcc ctgactttta tctgcacctg ggcggcgacg aggtggattt cacctgttgg 1020
aagtccaatc cagagatcca ggactttatg cgcaagaagg gcttcggcga ggacttcaag 1080
cagctggagt ctttctacat ccagacactg ctggacatcg tgagctccta cggcaagggc 1140
tatgtggtgt ggcaggaggt gtttgacaac aaggtgaaga tccagcccga taccatcatc 1200
caagtgtggc gggaggatat ccctgtgaat tatatgaagg agctggagct ggtgacaaag 1260
gcaggcttcc gcgccctgct gagcgcccct tggtacctga accggatctc ctatggccca 1320
gactggaagg atttctacat cgtggagcca ctggcctttg agggaacccc tgagcagaag 1380
gccctggtca tcggaggaga ggcctgcatg tggggcgagt atgtggacaa cacaaatctg 1440
gtgcctaggc tgtggccaag ggcaggagca gtggcagaga gactgtggtc taataagctg 1500
accagcgatc tgacattcgc ctacgagcgg ctgtcccact ttagatgtga gctgctgagg 1560
agaggggtcc aggcacagcc actgaatgtc gggttttgcg aacaggagtt tgaacagact 1620
SEQ ID NO: 2
<110> Казанский (Приволжский) федеральный университет
<120> Кодон-оптимизированные нуклеотидные последовательности генов HEXA и HEXB, генный препарат для лечения болезни Тея-Сакса
<160> 2
<210> 2
<211> 1671
<212> DNA
<213> Artificial Sequence
<400> 2
atggaactgt gcggactggg actgcctcga cctcctatgc tgctggccct gctgctggct 60
actctgctgg ctgctatgct ggctctgctg acccaggtgg ccctggtggt gcaggtggca 120
gaggcagcaa gggcaccttc cgtgtctgcc aagccaggac ctgccctgtg gccactgcca 180
ctgtccgtga agatgacacc aaacctgctg cacctggccc ccgagaattt ctacatcagc 240
cactccccta actccaccgc aggaccatct tgcacactgc tggaggaggc cttccggaga 300
taccacggct atatcttcgg cttttataag tggcaccacg agcccgccga gtttcaggcc 360
aagacccagg tgcagcagct gctggtgagc atcacactgc agtccgagtg tgacgccttc 420
ccaaatatca gctccgatga gagctacacc ctgctggtga aggagccagt ggccgtgctg 480
aaggcaaacc gcgtgtgggg cgccctgagg ggcctggaga cattcagcca gctggtgtac 540
caggactcct atggcacctt tacaatcaat gagtccacaa tcatcgactc tcctcgcttt 600
agccaccggg gcatcctgat cgatacctct cggcactacc tgccagtgaa gatcatcctg 660
aagacactgg atgccatggc cttcaacaag tttaatgtgc tgcactggca catcgtggac 720
gatcagtctt tcccttacca gagcatcacc tttccagagc tgagcaataa gggctcttac 780
agcctgtccc acgtgtatac accaaacgac gtgcggatgg tcatcgagta tgccaggctg 840
cgcggcatca gagtgctgcc agagttcgat accccaggac acacactgtc ctggggcaag 900
ggccagaagg acctgctgac cccctgctac tctcggcaga acaagctgga tagcttcggc 960
cctatcaacc caacactgaa taccacatat agctttctga ccacattctt taaggagatc 1020
tccgaggtgt tccccgacca gtttatccac ctgggcggcg atgaggtgga gttcaagtgt 1080
tgggagtcta atcctaagat ccaggacttt atgagacaga agggcttcgg caccgacttc 1140
aagaagctgg agtctttcta catccagaag gtgctggaca tcatcgccac aatcaacaag 1200
ggcagcatcg tgtggcagga ggtgtttgac gataaggcaa agctggcacc aggaaccatc 1260
gtggaagtgt ggaaggatag cgcctatcct gaggagctgt ccagggtgac agcctctggc 1320
tttcccgtga tcctgtccgc cccttggtac ctggacctga tctcttatgg ccaggattgg 1380
cgcaagtact ataaggtgga gccactggac ttcggaggaa cccagaagca gaagcagctg 1440
tttatcggag gagaggcctg cctgtgggga gagtacgtgg atgccaccaa tctgacacca 1500
agactgtggc ctagggcatc cgccgtggga gagagactgt ggtctagcaa ggacgtgagg 1560
gatatggacg atgcctatga ccgcctgacc cggcacagat gtaggatggt ggaaaggggg 1620
attgccgctc agcctctgta cgcaggatac tgtaaccacg agaatatg
<---
Реферат
Изобретение относится к области биотехнологии, конкретно к генотерапевтическим лекарственным препаратам на основе β-гексозаминидазы А, и может быть использовано для лечения лизосомной болезни накопления Тея-Сакса (БТС). Сконструирована кассета экспрессии, содержащая кодон-оптимизированные нуклеотидные последовательности генов HEXA и HEXВ, разделенные нуклеотидной последовательностью IRES или кодирующей P2А, E2А, F2А или T2А пептид, для экспрессии β-гексозаминидазы А в клетке млекопитающего. Кассету экспрессии используют в составе лентивирусного экспрессионного вектора в фармацевтической композиции. Изобретение позволяет восстановить нарушенную экспрессию и/или функцию фермента β-гексозаминидазы А в центральной нервной системе, что окажет положительный эффект у пациентов с болезнью Тея-Сакса. 2 н.п. ф-лы, 5 ил.
Формула
Документы, цитированные в отчёте о поиске
Внутрижелудочковая доставка ферментов при лизосомных болезнях накопления

Комментарии