Конъюгаты полипептидного токсина и антитела, соединенных ковалентной связью - RU2682754C2
Код документа: RU2682754C2
Чертежи













































































































Описание
В данном документе описаны комплексы, содержащие полипептидный токсин и антитело, где компоненты комплекса ковалентно связаны друг с другом посредством одной связи. Также описаны способы получения ковалентных комплексов и их применение.
Уровень техники
Ограничением доступных в настоящее время платформ для доставки на основе гаптенов является нековалентная связь между гаптеном и средством доставки. В применениях, для которых желательна стабильная связь между средством доставки и полезной нагрузкой, нековалентные комплексы средства доставки и полезной нагрузки могут быть непригодными, так как нековалентно связанная полезная нагрузка может диссоциировать от средства доставки.
Это может представлять определенную проблему для токсичных полезных нагрузок, которые должны быть направлены, например, к опухолям и которые оказывают неблагоприятные эффекты (т.е. неспецифическую токсичность) в случае преждевременного высвобождения полезной нагрузки из нацеленного средства доставки.
Для решения этих недостатков описаны различные подходы. Тем не менее, ни одна из этих методик не обеспечивает надежной и универсальной платформы, которая смогла бы доставлять токсичные полезные нагрузки, особенно токсичные полипептиды, без нецелевой активности.
Одним из подходов является слияние полезной нагрузки с группами, которые стабилизируют полезную нагрузку. Примерами таких групп являются человеческий сывороточный альбумин или Fc-области человеческого иммуноглобулина. Этот подход применим ко многим линейным полипептидам, которые состоят из природных аминокислотных остатков и которые допускают модификации либо на С-конце, либо на N-конце без потери их биологической активности. Полипептиды, которые являются циклическими, сшитыми, содержат неприродные аминокислотные остатки или дополнительные модификации, не могут быть получены рекомбинантно в виде гибридных полипептидов. Тем не менее, такие полипептиды могут быть желаемым выбором для терапевтического применения, так как они часто превосходят "нормальные" линейные пептиды с точки зрения устойчивости к протеазам, активности и специфичности. Но эти гибриды теряют адресную доставку.
Одним из подходов к улучшению ФК/стабильности и биофизического поведения терапевтических полипептидов, который также может быть применен к тем полипептидам, которые являются циклическими, сшитыми или содержат неприродные структуры, является химическая или ферментативная конъюгация с полимерами, например, путем ПЭГилирования (ПЭГ означает полиэтиленгликоль) или ГЭСилирования (ГЭС означает гидроксиэтилированный крахмал). Тем не менее, такие модификации часто приводят к значительному снижению биологической активности полипептида и при определенных обстоятельствах могут быть причиной проблем с безопасностью или токсичностью. Кроме того, эти модификации теряют нацеливающую группу.
Основным недостатком большинства существующих методик химического связывания для стабилизации или модуляции ФК терапевтических полипептидов является их сложность. Наряду с этапом химического связывания эти способы приводят во многих случаях в образованию смеси полипептидных производных, которые связаны с ФК-модулирующей группой с неопределенной стехиометрией и/или в неопределенных позициях. Кроме того, используемые в настоящее время методики полипептидной модификации часто приводят к сильному уменьшению или даже полной потере биологической активности терапевтического полипептида. Кроме того, трудно предсказать фармакологические свойства и/или возможные пути деградации химических конъюгатов.
Metz S., et al. (Proc. Natl. Acad. Sci. USA 108 (2011) 8194-8424) докладывают о биспецифических дигоксигенин-связывающих антителах для нацеленной доставки полезной нагрузки. Модуляция ФК гаптенилированных пептидов путем нековалентного комплексообразования с антителом описана в Hoffmann, Е., et al. (J. Contr. Rel. 171 (2013) 48-56). В WO 2012/093068 сообщается о фармацевтической композиции комплекса анти-Dig-антитела и дигоксигенина, который конъюгирован с пептидом. Сравнение рекомбинантных иммунотоксинов против опухолевых клеток, экспрессирующих антиген LeY, влияние аффинности, размера и стабильности описано в Bera et al. (Bioconjug. Chem. 9 (1998) 736-743). Lee H Pai et al. сообщают о противоопухолевой активности иммунотоксинов, полученных из моноклонального антитела В3 и различных форм экзотоксина псевдомонад (Proc. Natl. Acad. Sci. USA 88 (1991) 3358-3362).
В US 5804371 сообщается о гаптен-меченных пептидах и их применении в качестве иммунологического способа обнаружения. Дигоксигенин-меченный пептид (брадикинин) и его применение в хемилюминесцентном иммуноферментном анализе брадикинина в воспаленных тканях описаны в Decarie A., et al. (Peptides 15 (1994) 511-518).
В WO 2004/065569 описаны многофункциональные антитела.
В WO 2014/006124 описаны ковалентно связанные конъюгаты антигена и антитела.
Сущность изобретения
Было обнаружено, что при формировании ковалентной связи между гаптенилированным полипептидным токсином и антителом против гаптена можно достичь стабилизации и улучшения ФК-свойств полипептидного токсина. Эта ковалентная связь образуется между первым остатком цистеина, введенным в вариабельную область антигаптенового антитела (искусственный остаток цистеина антитела), и вторым остатком цистеина, присутствующим или введенным в полипептидный токсин ((искусственный) остаток цистеина полипептида).
Искусственный остаток цистеина антитела находится в одной из CDR (от англ. complementarity-determining region - участок, определяющий комплементарность) в антигаптеновом антителе, но не мешает гаптенсвязывающим свойствам антигаптенового антитела. (Искусственный) остаток цистеина полипептида находится в непосредственной близости (близкое пространственное расстояние) от искусственного остатка цистеина антитела, когда гаптен гаптенилированного полипептидного токсина связывается с антигаптеновым антителом. Это позволяет формироваться ковалентной связи между гаптенилированным полипептидным токсином и антигаптеновым антителом.
Было обнаружено, что (искусственный) остаток цистеина полипептида может быть включен в аминокислотную последовательность полипептидного токсина и, таким образом, находится в кодирующей области самого полипептидного токсина в отличие от введения остатка цистеина в линкер, который соединяет полипептидный токсин и гаптен.
Ожидается, что после рекомбинантной продукции и искусственный остаток цистеина антитела, и (искусственный) остаток цистеина полипептида будут по меньшей мере частично "заблокированы" в дисульфиде с другим остатком цистеина или глутатиона. Тем не менее, неожиданно было обнаружено, что при смешивании рекомбинантно полученного антигаптенового антитела, содержащего искусственный цистеин, и гаптенилированного полипептидного токсина, содержащего (искусственный) цистеин без необходимости дополнительных реагентов образуется стабильная дисульфидная связь за счет спонтанно расположенной реакции дисульфидного перемешивания. Ковалентные конъюгаты антитела и полипептидного токсина являются полностью функциональными с точки зрения связывания и специфичности доставки (нацеливания), а также функциональности полипептидного токсина (т.е. цитотоксической активности по отношению к опухолевым клеткам) с преимуществом того, что они являются более стабильными в кровотоке, чем нековалентные комплексы. Было обнаружено, что дисульфидная связь, связывающая антитело и полипептидный токсин, расщепляется внутри клетки, и полипептидный токсин таким образом специфически высвобождается внутри клетки из ковалентного комплекса.
Один из аспектов, описанный в данном документе, представляет собой (ковалентный) конъюгат гаптенилированного полипептида и антигаптенового антитела, в котором дисульфидная связь формируется между остатком цистеина, расположенным либо до, либо после остатка лизина, который используется для гаптеновой конъюгации полипептида, и остатком цистеина в CDR2 антитела, где CDR2 определен в соответствии с Kabat.
В одном предпочтительном воплощении полипептид представляет собой полипептидный токсин.
В одном воплощении остаток цистеина находится на расстоянии от 1 до 3 остатков до или после остатка лизина, который используется для гаптеновой конъюгации. В этом воплощении остаток цистеина находится в одной из позиций N минус 3, N минус 2, N минус 1, N плюс 1, N плюс 2 или N плюс 3 по отношению к остатку лизина (N).
В одном воплощении остаток цистеина находится на расстоянии двух остатков до (т.е. в позиции N минус 2 по отношению к остатку лизина) или после (т.е. в позиции N плюс 2 по отношению к остатку лизина) остатка лизина, который используется для гаптеновой конъюгации.
В одном воплощении остаток лизина, который используется для гаптеновой конъюгации, находится в пределах десяти N-концевых аминокислотных остатков полипептида.
В одном воплощении полипептид содержит ровно один остаток лизина в своей аминокислотной последовательности.
Один из аспектов, описанный в данном документе, представляет собой (ковалентный) конъюгат гаптенилированного полипептидного токсина и антигаптенового антитела, в котором дисульфидная связь формируется между остатком цистеина, расположенным на расстоянии от 1 до 3 остатков до или после остатка лизина, который используется для гаптеновой конъюгации полипептидного токсина, и остатком цистеина в CDR2 антитела, где CDR2 определен в соответствии с Kabat.
Один из аспектов, описанный в данном документе, представляет собой (ковалентный) конъюгат гаптенилированного полипептида и антигаптенового антитела, в котором дисульфидная связь формируется между остатком цистеина, расположенным в полипептиде, и остатком цистеина в CDR2 антитела, где CDR2 определен в соответствии с Kabat, при этом полипептид содержит ровно один остаток лизина в своей аминокислотной последовательности.
В одном предпочтительном воплощении полипептид представляет собой полипептидный токсин.
В одном воплощении остаток цистеина в полипептиде, который является частью дисульфидной связи, расположен либо до, либо после остатка лизина, который используется для гаптеновой конъюгации.
В одном воплощении остаток цистеина находится на расстоянии от 1 до 3 остатков до или после лизина, который используется для гаптеновой конъюгации. В этом воплощении остаток цистеина находится в одной из позиций N минус 3, N минус 2, N минус 1, N плюс 1, N плюс 2 или N плюс 3 по отношению к остатку лизина (N).
В одном воплощении остаток цистеина находится на расстоянии двух остатков до (т.е. в позиции N минус 2 по отношению к остатку лизина) или после (т.е. в позиции N плюс 2 по отношению к остатку лизина) остатка лизина, который используется для гаптеновой конъюгации.
В одном воплощении остаток лизина, который используется для гаптеновой конъюгации, находится в пределах десяти N-концевых аминокислотных остатков полипептида.
Любой гаптен может быть использован в конъюгатах и способах, описанных в данном документе, в дериватизации с помощью линкера, который делает возможной правильную пространственную ориентацию остатка цистеина в полипептиде ((искусственный) остаток цистеина полипептида) и остатка цистеина в CDR2 антитела (искусственный остаток цистеина антитела), между которыми формируется дисульфидная связь.
В одном из воплощений антигаптеновое антитело специфически связывается с гаптеном гаптенилированного полипептида (антигаптеновое антитело).
В одном воплощении CDR2 является CDR2 тяжелой цепи.
В одном воплощении гаптенилированный полипептид содержит гаптен, линкер и полипептид. В одном воплощении полипептид также конъюгирован с полезной нагрузкой.
В одном воплощении полипептид представляет собой полипептидный токсин. В одном воплощении полипептидный токсин представляет собой РЕ25.
В одном воплощении остаток цистеина в CDR2 тяжелой цепи антитела находится в позиции 52, или позиции 52а, или позиции 52b, или позиции 52с, или позиции 52d, или позиции 53 в соответствии с нумерацией вариабельного домена тяжелой цепи согласно Kabat.
В одном воплощении остаток цистеина в тяжелой цепи CDR2 антитела находится в позиции 52а, или позиции 52b, или позиции 52с, или позиции 53 в соответствии с нумерацией вариабельного домена тяжелой цепи Kabat.
В одном воплощении остаток цистеина в CDR2 тяжелой цепи антитела находится в позиции 52b или в позиции 53 в соответствии с нумерацией вариабельного домена тяжелой цепи согласно Kabat.
В одном воплощении антитело представляет собой биспецифическое антитело, обладающее первой специфичностью связывания в отношении негаптенового антигена и второй специфичностью связывания в отношении гаптеном.
В одном воплощении негаптеновый антиген представляет собой антиген клеточной поверхности. В одном воплощении антиген клеточной поверхности представляет собой антиген, ассоциированный с опухолью.
В одном воплощении биспецифическое антитело представляет собой полноразмерное антитело. В одном воплощении одна тяжелая цепь биспецифического антитела содержит мутацию типа "замок", а соответствующая другая цепь содержит мутацию типа "ключ".
В одном воплощении биспецифическое антитело представляет собой полноразмерное антитело, с которым на каждом С-конце слит scFv или scFab либо непосредственно, либо через пептидный линкер.
В одном воплощении всех аспектов антитело представляет собой гуманизированное или человеческое антитело.
В одном воплощении константная область антитела относится к подклассу IgG1 или подклассу IgG4.
В одном воплощении антитело имеет константную область подкласса IgG1 с аланином в позиции 234 и 235 и с глицином в позиции 329 с нумерацией согласно ЕС-индексу Kabat.
В одном воплощении антитело имеет константную область класса IgG4 с пролином в позиции 228, глутаминовой кислотой в позиции 235 и глицином в позиции 329 с нумерацией согласно ЕС-индексу Kabat.
В одном воплощении конъюгат содержит ровно одну дисульфидную связь в CDR2 тяжелой цепи.
В одном воплощении дисульфидная связь формируется без добавления окислительно-восстановительных агентов.
В одном из воплощений антиген или гаптен конъюгирован с полипептидом через линкер. В одном из воплощений линкер представляет собой непептидный линкер. В одном из воплощений линкер представляет собой карбоксиметильный линкер или капроновокислотный линкер.
В одном воплощении гаптен представляет собой биотин, или теофиллин, или дигоксигенин, или карборан, или флуоресцеин, или бромдезоксиуридин. В одном воплощении гаптен представляет собой биотин или дигоксигенин.
Один из аспектов, описанных в данном документе, представляет собой фармацевтическую композицию, содержащую конъюгат, описанный в данном документе, и фармацевтически приемлемый носитель.
Конъюгат, описанный в данном документе, для применения в качестве лекарственного средства.
Конъюгат, описанный в данном документе, для лечения рака.
Конъюгат, описанный в данном документе, для лечения вирусного заболевания.
Одним из аспектов, описанных в данном документе, является применение конъюгата, описанного в данном документе, в производстве лекарственного средства.
Одним из аспектов, описанных в данном документе, является применение конъюгата, описанного в данном документе, для повышения стабильности полипептида.
Одним из аспектов, описанных в данном документе, является применение конъюгата, описанного в данном документе, для уменьшения или устранения нецелевых токсических эффектов полипептида.
Одним из аспектов, описанных в данном документе, является применение конъюгата, описанного в данном документе, для увеличения активности полипептида.
Одним из аспектов, описанных в данном документе, является применение конъюгата, описанного в данном документе, для увеличения периода полужизни полипептида in vivo.
Одним из аспектов, описанных в данном документе, является применение конъюгата, описанного в данном документе, в лечении заболевания.
Одним из аспектов, описанных в данном документе, является способ лечения индивидуума, имеющего заболевание, включающий введение индивидууму эффективного количества конъюгата, описанного в данном документе.
Одним из аспектов, описанных в данном документе, является способ лечения заболевания у индивидуума, включающий введение индивидууму эффективного количества конъюгата, описанного в данном документе.
В одном воплощении заболевание представляет собой рак.
Одним из аспектов, описанных в данном документе, является способ получения конъюгата, описанного в данном документе и содержащего комбинацию антитела с искусственным остатком цистеина антитела и гаптенилированного полипептида с (искусственным) остатком цистеина полипептида, где альфа-углеродный атом искусственного остатка цистеина в антителе находится на расстоянии примерно от 10 до 11 ангстрем от атома полипептидного токсина, с которым слит линкер.
Один из аспектов, описанный в данном документе, представляет собой способ получения конъюгата, описанного в данном документе, включающий этапы
- объединения в растворе антитела, которое специфически связывается с гаптеном и которое имеет искусственный остаток цистеина антитела в CDR2, с гаптенилированным полипептидом, содержащим (искусственный) остаток цистеина полипептида,и
- выделения конъюгата из раствора.
Одним из аспектов, описанных в данном документе, является биспецифическое антитело для нацеленной доставки гаптенилированного соединения к клетке-мишени, где указанное биспецифическое антитело обладает первым сайтом связывания, который специфически связывается с гаптенилированным полипептидом, и второй специфичностью связывания, которая специфична в отношении маркера клеточной поверхности данной клетки.
В одном воплощении дисульфидная связь формируется между остатком цистеина, расположенным либо до, либо после остатка лизина, который используется для гаптеновой конъюгации полипептида, и остатком цистеина в CDR2 антитела, где CDR2 определен в соответствии с Kabat.
В одном воплощении остаток цистеина находится на расстоянии от 1 до 3 остатков до или после лизина, который используется для гаптеновой конъюгации. В этом воплощении остаток цистеина находится в одной из позиций N минус 3, N минус 2, N минус 1, N плюс 1, N плюс 2 или N плюс 3 по отношению к остатку лизина.
В одном воплощении остаток цистеина находится на расстоянии двух остатков до (т.е. в позиции N минус 2 по отношению к остатку лизина) или после (т.е. в позиции N плюс 2 по отношению к остатку лизина) остатка лизина, который используется для гаптеновой конъюгации.
В одном воплощении остаток лизина, который используется для гаптеновой конъюгации, находится в пределах десяти N-концевых аминокислотных остатков полипептида.
В одном воплощении полипептид содержит ровно один остаток лизина в своей аминокислотной последовательности.
Описание графических материалов
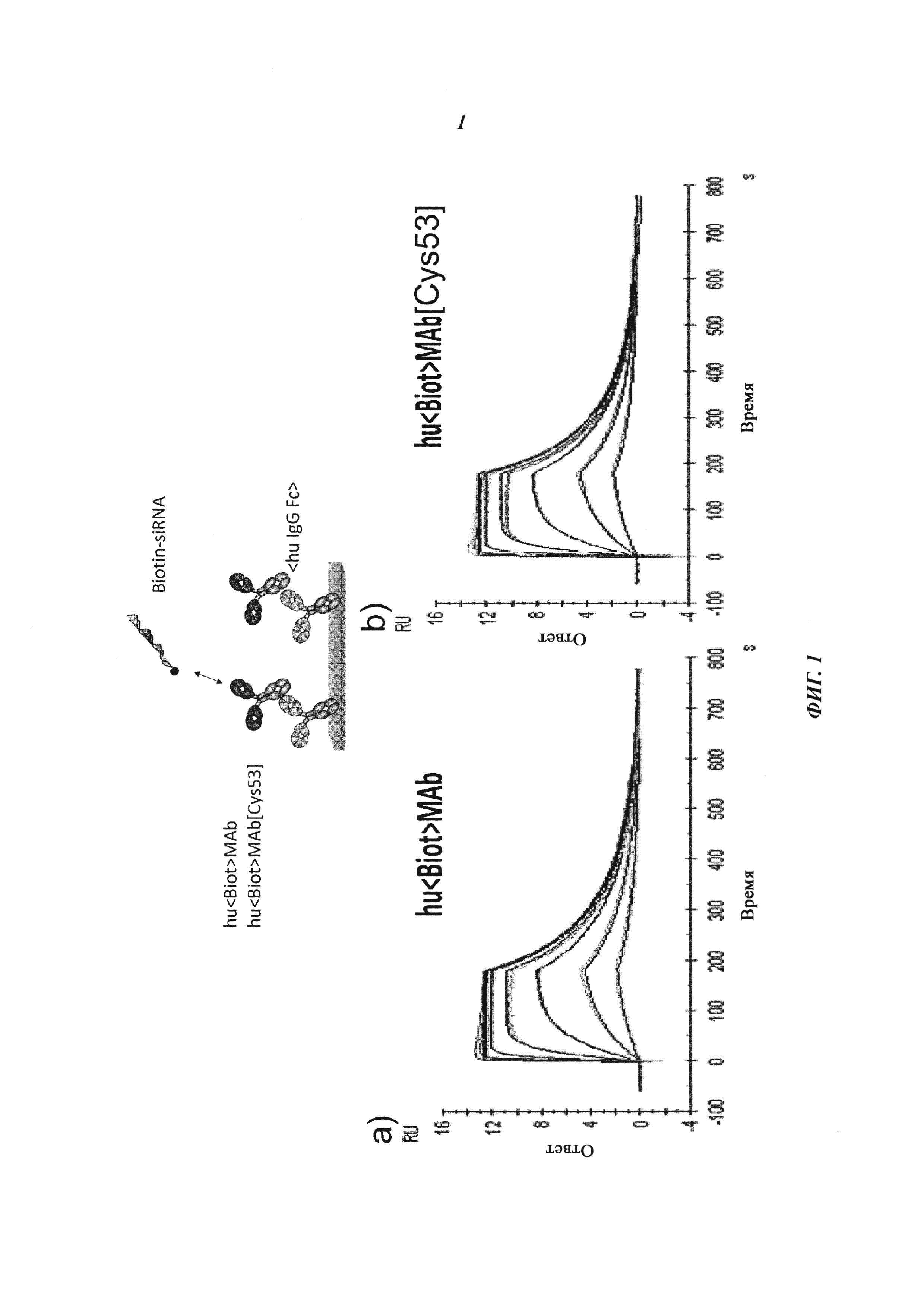
Фиг. 1: Сравнение связывания рекомбинантных гуманизированных антибиотиновых антител с введенной мутацией VH53C и без нее. Связывающие свойства анализировали с помощью технологии поверхностного плазмонного резонанса (surface plasmon resonance, SPR) с использованием инструмента BIAcore Т100 или BIAcore 3000. а) гуманизированное антибиотиновое антитело. Связывание биотинилированной миРНК с гуманизированным антибиотиновым антителом, KD=624 пМ; b) гуманизированное Cys53-мутированное антибиотиновое антитело. Связывание биотинилированной миРНК, KD составляет 643 пМ; концентрации миРНК: 0,14, 0,41, 1,23, 3,70, 11,1, 33,3 и 100 нМ; концентрация антибиотинового антитела: 2 нМ; сенсорный чип СМ3; связывание антитела через антитело против человеческого IgG Fc

Фиг. 2: Введение функциональных групп SH в гаптен, а также в антитело в соответствующих позициях позволяет антителу и гаптену формировать ковалентную связь между ними, образуя конъюгат.
Фиг. 3: Схема SDS-PAGE характера полос при собственной флуоресценции (без дополнительного окрашивания геля SDS-PAGE):
А: Если между антителом и конъюгатом "гаптен-флуорофор" не образуется ковалентная связь, то как в восстанавливающих, так и в невосстанавливающих условиях может быть обнаружена одна полоса собственной флуоресценции с молекулярной массой свободного конъюгата "гаптен-флуорофор".
В: Если между антителом и конъюгатом "гаптен-флуорофор" образуется ковалентная связь, то в невосстанавливающих условиях может быть обнаружена одна полоса собственной флуоресценции с комбинированной молекулярной массой антитела и конъюгата "гаптен-флуорофор". В восстанавливающих условиях дисульфидные мостики в конъюгате антитела и конъюгата "гаптен-флуорофор" (гаптенилированного соединения) расщепляются, и можно обнаружить одну полосу собственной флуоресценции с молекулярной массой свободного конъюгата "гаптен-флуорофор".
Фиг. 4: Формирование конъюгата гаптен-связанных Cys-мутированных антител с гаптен-Cys-флуоресцентно-меченными конъюгатами (гаптенилированным соединением) в присутствии окислительно-восстановительных активных агентов: окислительный агент (глутатион дисульфид, GSSG) и восстановительный агент (дитиоэритрит, DTE): Комплексообразование с антителом и последующее ковалентное связывание в определенных позициях обнаруживали по сигналам флуоресценции в анализе SDS-PAGE. Анализы SDS-PAGE в невосстанавливающих (верхние изображения) и восстанавливающих (нижние изображения) условиях проводили, как описано в примере 11. Ковалентно связанные с антителом гаптены могут быть обнаружены как сигналы большего размера, связанные с белками, в соответствующих позициях в невосстанавливающих условиях. Эти сигналы отделяются от белка при восстановлении и видны как небольшие группы в восстанавливающих условиях.
Слева: изображение флуоресценции
Справа: окрашивание Кумасси синим
Серия 1: антидигоксигениновое антитело с мутацией 52bC
Серия 2: антидигоксигениновое антитело с остатком дикого типа в позиции 52b
(A) ковалентное связывание с 3 мМ DTE и 10 мМ GSSG;
(B) ковалентное связывание с 0,3 мМ DTE и 1 мМ GSSG;
(C) ковалентное связывание с 0,03 мМ DTE и 0,1 мМ GSSG.
Фиг. 5: Формирование комплекса гаптенсвязывающих Cys-мутированных антител с гаптен-Cys-флуоресцентно-меченными конъюгатами в присутствии исключительно окислительного агента (глутатион дисульфид, GSSG), но в отсутствие восстановительного агента или в отсутствие обоих: комплексообразование с антителом и последующее ковалентное связывание в определенных позициях обнаруживали по сигналам флуоресценции в анализе SDS-PAGE. Анализы SDS-PAGE в невосстанавливающих (верхние изображения) и восстанавливающих (нижние изображения) условиях проводили, как описано в примере 12. Ковалентного связанные с антителом гаптенов могут быть обнаружены как сигналы большего размера, связанные с белками, в соответствующих позициях в невосстанавливающих условиях. Эти сигналы отделяются от белка при восстановлении и видны как небольшие группы в восстанавливающих условиях.
Слева: изображение флуоресценции
Справа: окрашивание Кумасси синим
Серия 1: антидигоксигениновое антитело с мутацией 52bC
Серия 2: антидигоксигениновое антитело с остатком дикого типа в позиции 52b
(A) без добавок;
(B) ковалентное связывание с 1 мМ GSSG;
(C) ковалентное связывание с 0,1 мМ GSSG.
Фиг. 6: Рентгеноструктура мышиного антибиотинового антитела в комплексе с биоцитинамидом. Аминокислотные остатки, которые взаимодействуют с биоцитинамидом, показаны в каркасном представлении.
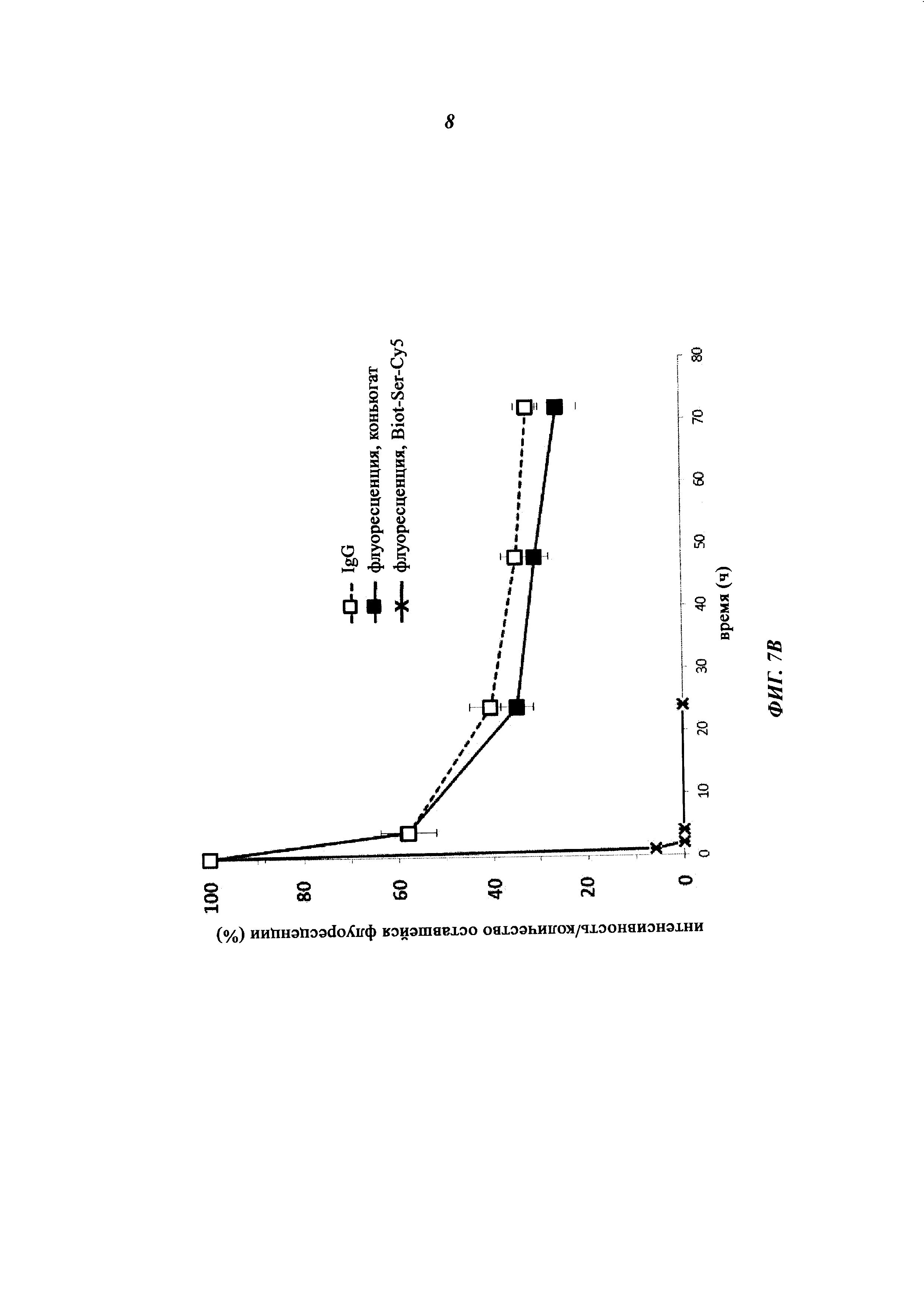
Фиг. 7: Результаты ФК-исследования крови in vivo с ковалентными конъюгатами и нековалентными комплексами по сравнению с не состоящим в комплексе антигеном/гаптеном; показана относительная оставшаяся интенсивность флуоресценции (%, заштрихованные знаки) для Cy5-опосредованной флуоресценции нековалентных биотин-Cy5-комплексов (фиг. 7А) и ковалентных (SS-мостики) конъюгатов (фиг. 7В), а также не состоящего в комплексе биотина-Ser-Cy5 (звездочка); сигнал флуоресценции в момент времени t=0,08 ч принят за 100%; кроме того, показано относительное оставшееся количество человеческого IgG в образцах сыворотки крови мышей (незаштрихованные метки); концентрация сывороточного IgG (мг/мл) в момент времени t=0,08 ч принята за 100%.
Фиг. 8: Вестерн-блот для определения количества дигоксигенилированного PYY-полипептида в сыворотке мышей.
Фиг. 9: Анализ аффинного комплексообразования гаптенилированных соединений с антигаптеновыми антителами.
Комплексообразование с антителом и последующее ковалентное связывание в определенных позициях направляется сигналами флуоресценции в анализах SDS-PAGE, которые были проведены, как описано в примере 19.
Слева: флуоресцентное изображение с невосстановленными (левая сторона геля) и восстановленными (правая сторона геля) образцами.
Справа: окрашивание Кумасси синим.
1: гуманизированное антидигоксигениновое антитело плюс биотин-Cys-Cy5
2: гуманизированное антидигоксигениновое антитело VH52bC плюс биотин-Cys-Cy5
3: гуманизированное антибиотиновое антитело плюс биотин-Cys-Cy5
4: гуманизированное антибиотиновое антитело VH53C плюс биотин-Cys-Cy5
Белые стрелки отмечают избыточный (несвязанный) биотин-Cys-Cy5, который значительно выше, когда используется антидигоксигениновое антитело VH52bC, потому что в данном случае реакция конъюгации не управляется аффинностью.
Фиг. 10: Позиции цистеина и дисульфидные паттерны в пределах Fab-области, необходимые для формирования Dig-связывающего антитела с дополнительным цистеином в позиции 52b для гаптен-опосредованного сайт-направленного ковалентного связывания с полезной нагрузкой. (А) Цистеины и дисульфидный паттерн в доменах VH (от англ. variable heavy - вариабельная область тяжелой цепи) и СН1 (от англ. constant heavy - константный домен тяжелой цепи) и в доменах VL (от англ. variable light - вариабельная область легкой цепи) и CL (от англ. constant light - константный домен легкой цепи), которые необходимы для формирования функциональных Fab-фрагментов. (В) Цистеины и дисульфидный паттерн в доменах VH и СН1 и в доменах VL и CL, которые необходимы для формирования функциональных Fab-фрагментов с дополнительным цистеином в позиции 52b для гаптен-опосредованного сайт-направленного ковалентного связывания с полезной нагрузкой. (С и D) Потенциал для формирования неправильных дисульфидных связей в пределах домена VH варианта VH52b, что привело бы к формированию неправильно свернутых нефункциональных антител. Е) Пример потенциально неправильной междоменной дисульфидной связи в пределах Fv-области варианта VH52b, которая привела бы к формированию неправильно свернутых нефункциональных антител.
Фиг. 11: Позиции цистеина и дисульфидные паттерны, необходимые для формирования Dig-связывающего стабилизированного дисульфидными связями одноцепочечного Fv с дополнительным цистеином в позиции 52b для гаптен-опосредованного сайт-направленного ковалентного связывания с полезной нагрузкой. (А) Цистеины в доменах VH и VL, которые необходимы для формирования функциональных scFv, dsscFv и 52b-мутированных dsscFv. (В) Правильный паттерн дисульфидных связей, который должен быть сформирован для создания функциональных scFv, dsscFv и 52b-мутированных dsscFv. (С) Потенциал для формирования неправильных дисульфидных связей, что привело бы к формированию неправильно свернутых нефункциональных scFv. (D) Потенциал для формирования неправильных дисульфидных связей, что привело бы к формированию неправильно свернутых нефункциональных dsscFv. (Е) Потенциал для формирования неправильных дисульфидных связей, что привело бы к формированию неправильно свернутых нефункциональных 52b-мутированных dsscFv.
Фиг. 12: Состав производного биспецифического антитела LeY-Dig в качестве средства доставки для ковалентно связанных полезных нагрузок.
Фиг. 13: Экспрессия и очистка производных биспецифических антигаптеновых антител для направленной доставки ковалентно связанных полезных нагрузок.
(А) Для вестерн-блот-анализов клеточные культуральные супернатанты подвергали SDS-PAGE (гель NuPAGE 4-12% Bis-Tris Gel (1,0 мм × 12 лунок) (Invitrogen; кат. № NP0322), и затем белки переносили на Immobilon Transfer Membranes (Immobilon-P), PVDF с размером пор: 0,45 мкм. Производные антител обнаруживали с помощью козлиного антитела против человеческой легкой цепи каппа в конъюгации с щелочной фосфатазой (аффинно очищено), Sigma (кат. № А3813), в разведении 1:1000, и козлиного антитела против человеческого IgG (Fc-специфического) в конъюгации с щелочной фосфатазой (Sigma, кат. № А9544) в разведении 1:1000. Субстрат BCIP/NBT-Blue Liquid Substrate (Sigma, кат. № B3804) использовали для проведения вестерн-блота. Дорожка 1 - маркер молекулярной массы; дорожки 2 и 3 - контрольное антитело с немодифицированной тяжелой цепью; дорожка 4 - биспецифическое антитело LeY-Dig (52bC) с удлиненной Н-цепью.
(B) SDS-PAGE-анализы (гель NuPAGE от 4 до 12% Bis-Tris) и последующее окрашивание Кумасси бриллиантовым синим демонстрирует чистоту белковых препаратов и визуализирует полипептидные цепи, связанные с IgG, с кажущимися молекулярными размерами, которые соответствуют их расчетным молекулярным массам. Дорожка 1 - маркер молекулярной массы; дорожка 2 - биспецифическое антитело LeY-Dig(52bC) с удлиненной Н-цепью, восстанавливающие условия; дорожка 3 - биспецифическое антитело LeY-Dig(52bC) с удлиненной тяжелой цепью; невосстанавливающие условия.
(C) Эксклюзионная хроматография (Superdex 200) демонстрирует гомогенность и отсутствие агрегатов в белковых препаратах производного биспецифического антитела Ley-Dig(52bC) после очищения на белке А.
Фиг. 14: Относительная оставшаяся интенсивность флуоресценции (%) для Cy5-опосредованной флуоресценции нековалентных Dig-Cy5-комплексов и ковалентных (связанных дисульфидными мостиками) конъюгатов, а также не состоящего в комплексе Dig-Cy5; сигнал флуоресценции в момент времени t=0,08 ч принят за 100%; кроме того, показано относительное оставшееся количество человеческого IgG в образцах мышиной сыворотки; сывороточная концентрация IgG (мг/мл) в момент времени t равного 0,08 ч принята за 100%.
Фиг. 15: Фармакокинетика в условиях, подобных in vivo, Cy5-опосредованной флуоресценции нековалентных биотин-Cy5-комплексов и ковалентных (связанных дисульфидными мостиками) конъюгатов, а также не состоящего в комплексе биотина-Cy5, определяемой путем неинвазивной визуализации глаз; заштрихованный ромб: биотин-Cy5, заштрихованный квадрат: биотин-Cy5 плюс антибиотиновое антитело (комплекс); треугольник: конъюгат Cy5-биотин-антибиотиновое антитело.
Фиг. 16: а) Состав, структура и молекулярная масса теофиллин-Cys-Cy5; b) эксклюзионная хроматографии демонстрирует чистоту и гомогенность очищенных вариантов теофиллин-связывающего антитела; пик №2 показывает очищенный продукт, отсутствие пика №1 указывает на то, что такие препараты не содержат агрегатов; с) формирование ковалентных комплексов между теофиллин-связывающими антителами и теофиллин-Cys-Cy5, как показано в невосстанавливающем (левые дорожки) и в восстанавливающем (правые дорожки) SDS-PAGE; Cy5 появляется в сочетании с Н-цепью в невосстанавливающих условиях только в образцах, содержащих теофиллин-Cys-Cy5 и Cys-мутированное антитело, эти ковалентные конъюгаты распадаются в восстанавливающих условиях (правые дорожки); дорожка 1: маркер молекулярной массы; с 2 по 4 невосстанавливающие условия - 2: антитеофиллиновое антитело (без Cys-мутации) плюс теофиллин-Cys-Cy5 (комплекс); 3: антитеофиллиновое антитело-cys_55 плюс теофиллин-Cys-Cy5 (конъюгат); 4: антитеофиллиновое антитело-cys_54 плюс теофиллин-Cys-Cy5 (конъюгат); с 5 по 7 восстанавливающие условия - 5: антитеофиллиновое антитело (без Cys-мутации) плюс теофиллин-Cys-Cy5 (комплекс); 6: антитеофиллиновое антитело-cys_55 плюс теофиллин-Cys-Cy5 (конъюгат); 7: антитеофиллиновое антитело-cys_54 плюс теофиллин-Cys-Cy5 (конъюгат).
Фиг. 17: Формирование ковалентных комплексов между биотин-связывающими антителами и биотин-Cys-Cy5 демонстрируется в невосстанавливающем и восстанавливающем SDS-PAGE; реакцию связывания проводили в мышиной сыворотке при температуре 37°С в течение 1 часа. Cy5 появляется в сочетании с Н-цепью в невосстанавливающих условиях только в образцах, содержащих биотин-Cys-Cy5 и Cys-мутированное антитело; эти ковалентные конъюгаты распадаются в восстанавливающих условиях (правые дорожки); дорожка 1: маркер молекулярной массы; 2-3 невосстанавливающие условия - 2: антибиотиновое антитело (без Cys мутаций) плюс биотин-Cys-Cy5 (комплекс); 3: антибиотиновое антитело-Cys плюс биотин-Cys-Cy5 (конъюгат); 4-5 восстановление - 5: антибиотиновое антитело (без мутации Cys) плюс биотин-Cys-Cy5 (комплекс); 6: антибиотиновое антитело-Cys плюс биотин-Cys-Cy5 (конъюгат).
Фиг. 18: Фармакокинетика in vivo Cy5-опосредованной флеоресценции нековалентных биотин-Cy5-комплексов и ковалентных (связанных дисульфидными мостиками) конъюгатов, а также не состоящего в комплексе биотина-Cy5, определяемой путем неинвазивной визуализации глаз; заштрихованный ромб: биотин-Cy5, заштрихованный круг: биотин-Cy5, введенный через 24 часа после введения антибиотинового антитела (образование комплекса in vivo); заштрихованный квадрат: биотин-Cys-Cy5, введенный через 24 часа после введения антибиотинового антитела-Cys (образование конъюгата in vivo).
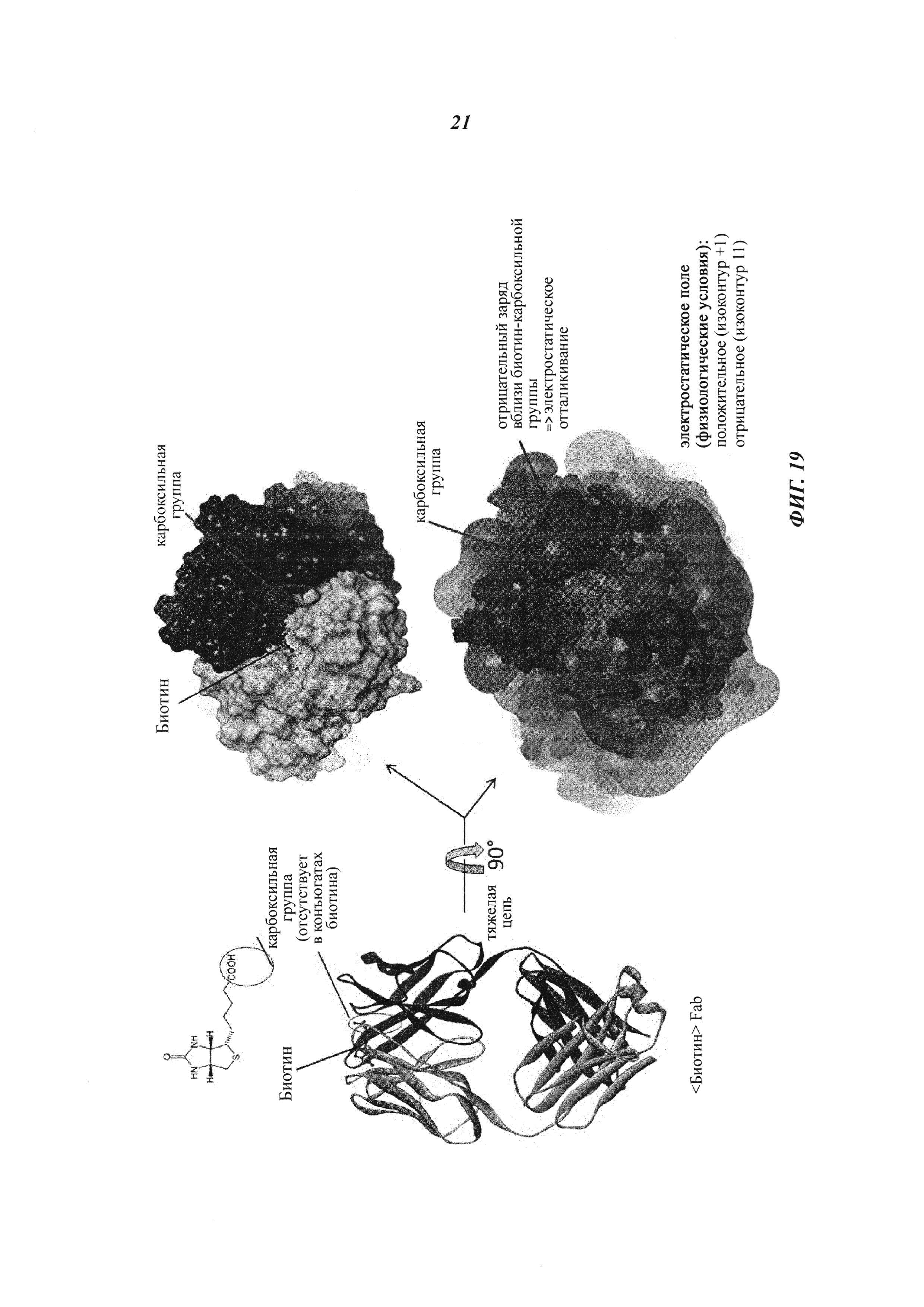
Фиг. 19: Белковую структуру мышиного Fab-фрагмента антибиотинового антитела определяли в комплексе с биоцитинамидом: состоящий в комплексе гаптен расположен в непосредственной близости от отрицательно заряженного кластера аминокислот; биотин, который в качестве гаптена дериватизован путем связывания с полезной нагрузкой на его карбоксильной группе, связывается с хорошей эффективностью, поскольку в этой позиции нет зарядного отталкивания (из-за отсутствия СООН-группы); напротив, свободный (нормальный) биотин не может эффективно связываться с антителом, так как его карбоксильная группа будет находиться в непосредственной близости от этого отрицательно заряженного кластера, и, следовательно, возникает отталкивание.
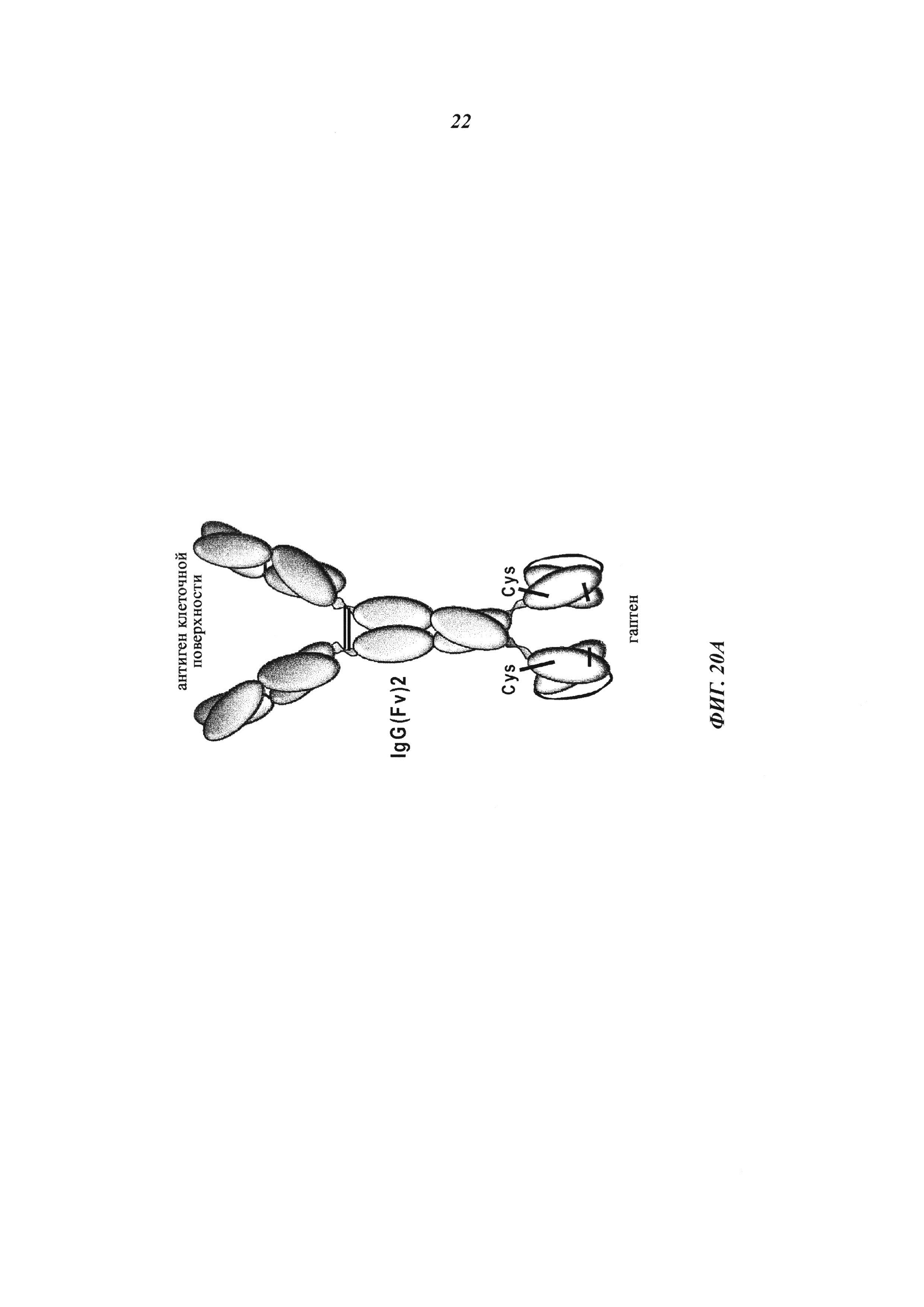
Фиг. 20: (А) Схема антигаптеновых биспецифических антител для направленной доставки полипептидных токсинов; стабилизированные дисульфидными связями scFv, которые связывают гаптены, рекомбинантно слиты с тяжелыми цепями (С-конец домена СН3), в качестве альтернативы также возможно слияние с С-концами Fab-фрагментов или с другими позициями рекомбинантных связывающих модулей. Последовательности, кодирующие биспецифическое антитело, были получены с помощью генного синтеза (Geneart, Германия), субклонированы в экспрессионные векторы, получены и очищены, как описано (Metz, S., et al., Proc. Natl. Acad. Sci. USA 108 (2011) 8194-8199). Гуманизированный dsscFv антитела с 19 по 11 (Metz et al. и WO 27209) использовали в качестве дигоксигенин-связывающей группы; VH и VL вводили в Fab-ветви IgG, и последовательности Fab-форматов были получены из LeY-связывающего антитела В3 (см. Metz et al.).
(В) Экспрессия и очистка биспецифических антител: профили SEC и SDS-PAGE, демонстрирующие чистоту и гомогенность препаратов биспецифических антител; для временной экспрессии плазмидами, кодирующими легкие и тяжелые цепи или Fab-Fv-гибриды, котрансфицировали клетки НЕК293, культивировали в бессывороточной среде, супернатанты осветляли через семь дней после трансфекции путем центрифугирования и фильтрации через фильтр с размером пор 0,22 мкм, биспецифические антитела очищали на белке A (IgG-Fv) с последующей SEC на колонке Superdex200 HiLoad 26/60 (GE Healthcare), уравновешенной раствором, содержащим 20 мМ гистидин, 140 мМ NaCl, рН 6,0, концентрацию белка определяли по оптической плотности при 280 нм с 320 нм в качестве фона, гомогенность очищенных белков подтверждали с помощью SDS-PAGE.
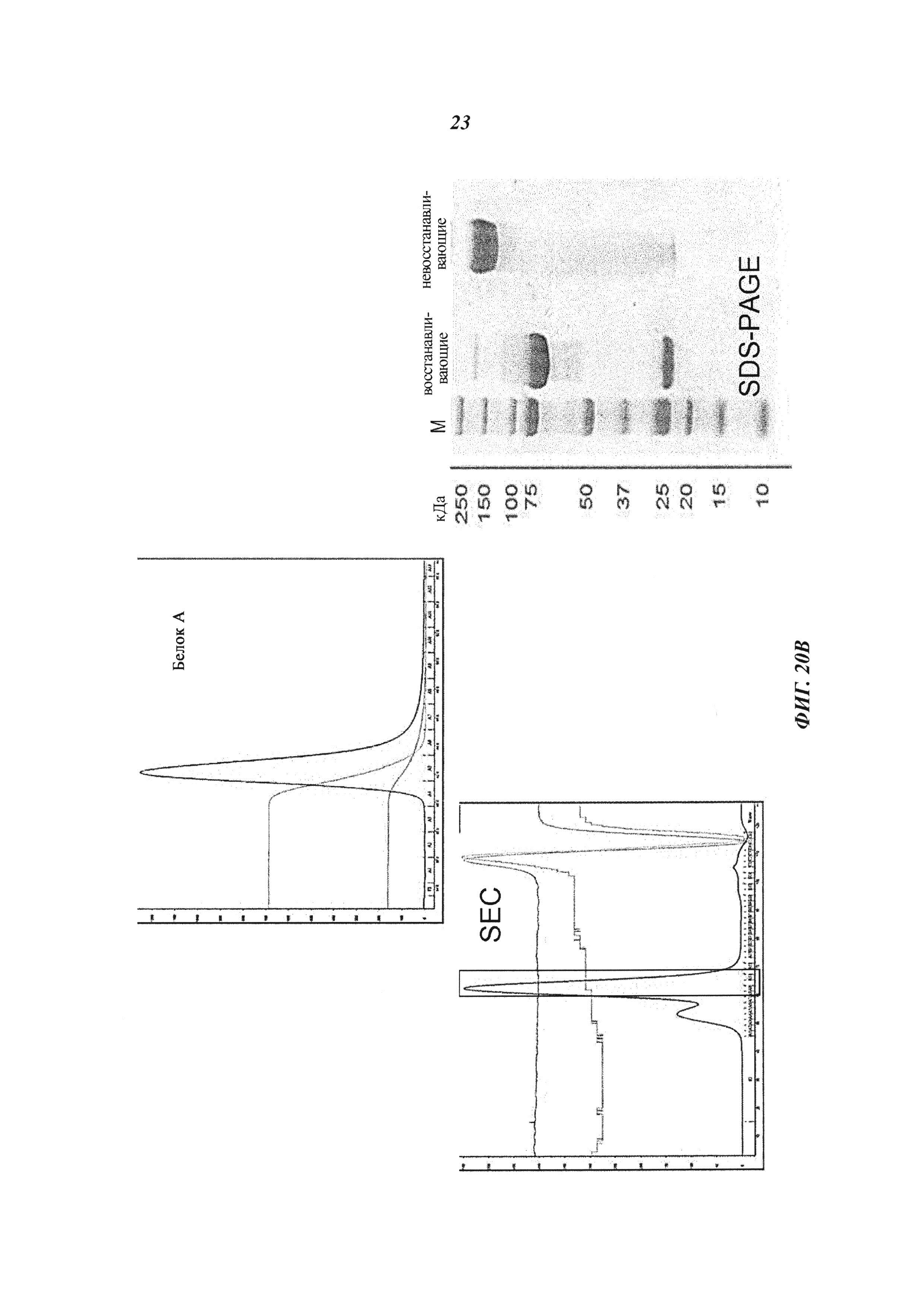
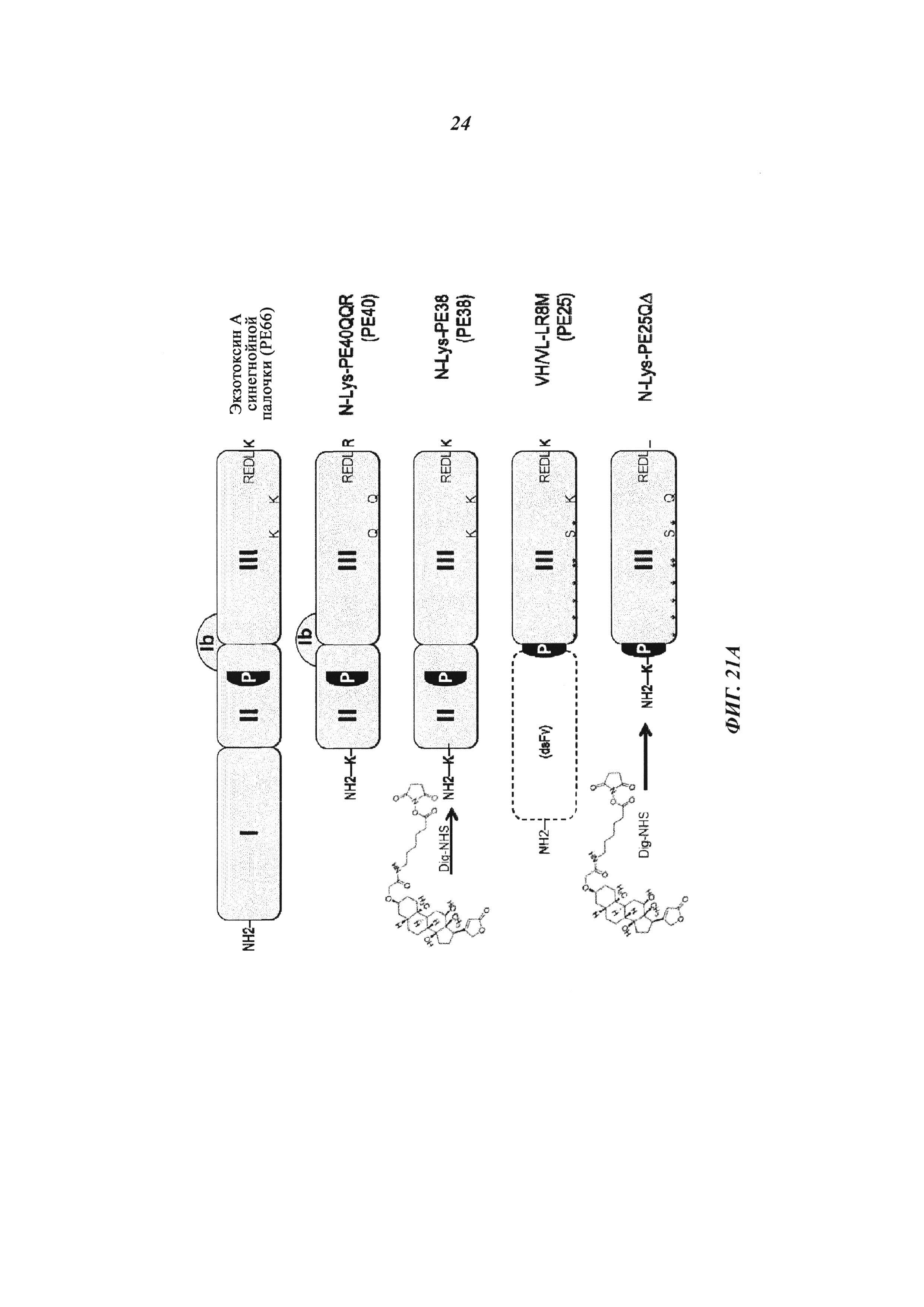
Фиг. 21: (А): Производные экзотоксина псевдомонад (Pseudomonas exotoxin, РЕ); доменный состав РЕ и вариантов РЕ и создание нового варианта РЕ25 (NLys-PE25SQΔ) для сайт-направленного дигоксигенилирования; РЕ25 становится дигоксигенилированным с помощью Dig-NHS на первичных аминогруппах боковых цепей лизина; N-конец белков также может быть мишенью для NHS-опосредованной дигоксигенин-конъюгации; РЕ25 (NLysPE25SQΔ) содержит аминокислотную последовательность (N-концевую) NH2-MLQGTKLMAEE (SEQ ID NO 193), слитую с аминокислотами с 274 по 284 (сайт процессинга домена II), а затем с аминокислотами с 394 по 612 (домен III) из РЕ (pdb 1IKQ_A); кроме того, позиции 406, 432, 467, 490, 513, 548, 590, 592 подвергали мутированию, как в производном токсина LR8M (Hansen, J.K. et al., J. Immunotherapy 33 (2010) с 297 по 304), лизин в позиции 606 заменяли на глутамин, а последнюю аминокислоту РЕ (лизин 613) удаляли; аминоконцевую последовательность изменяли путем замены остатка Lys на Ser в S-PE25, путем замены остатка Gly на Cys в NCK-PE25 и путем замены остатка Met на Cys в NKC-PE25; кодирующие последовательности для этих производных были получены с помощью генного синтеза (Geneart, Германия) или мутагенеза и вставлены в векторы для индуцируемой экспрессии в Е. coli.
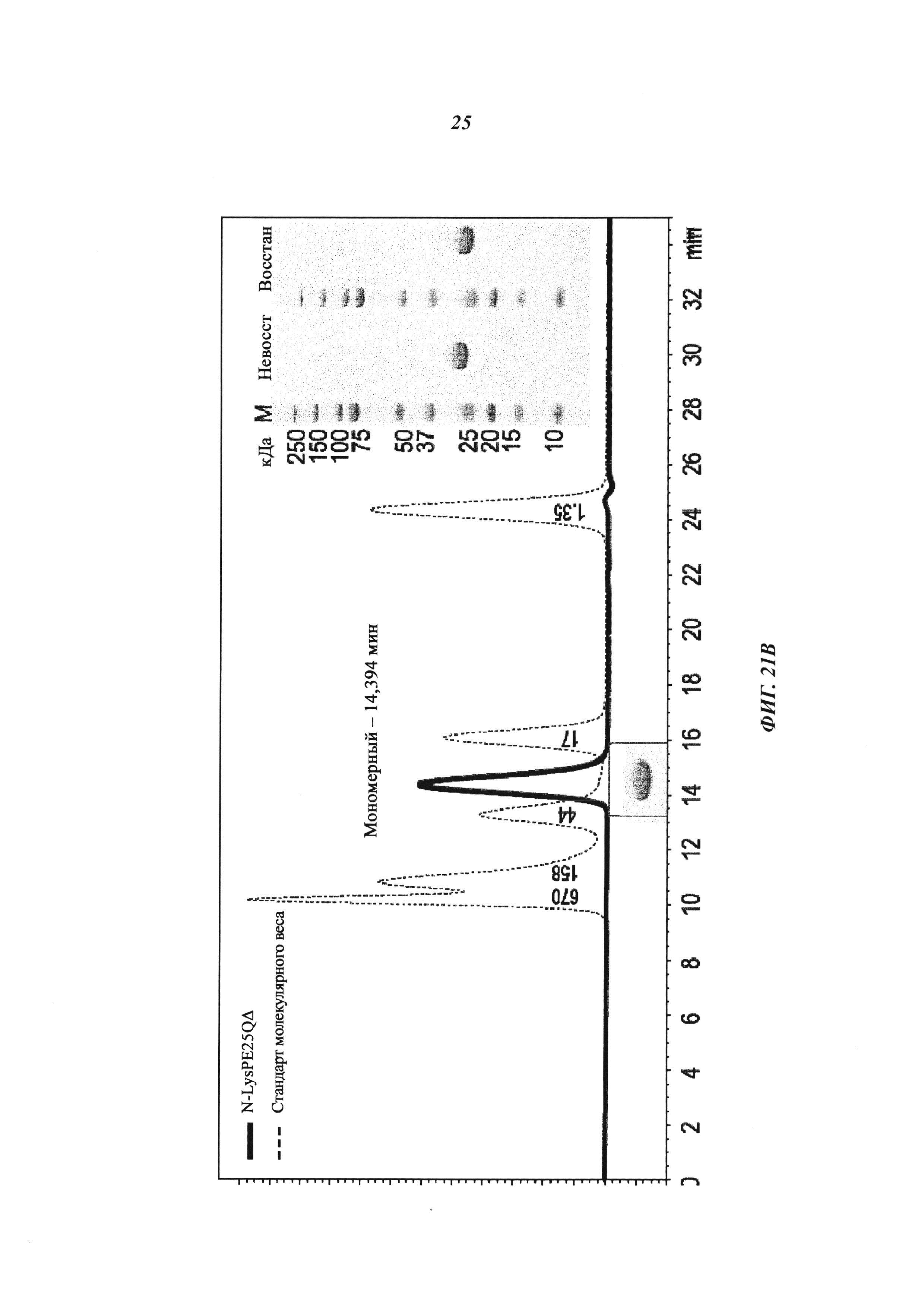
(B): Экспрессия и очистка производных экзотоксина псевдомонад: белки секретировались в периплазму и подвергались очистке с помощью методик, описанных ранее (Debinski, W. and Pastan, I., Cancer Res. 52 (1992) 5379-5385; Debinski, W. and Pastan, I., Bioconjug. Chem. 5 (1994) 40-46); препараты периплазмы, полученные с помощью осмотического шока из собранных бактерий, загружали на Q-сефарозу для захвата полипептидного токсина; полипептидный токсин элюировали градиентом соли, подвергали SEC, получая мономерный полипептидный токсин с низким уровнем агрегатов и небольшими белковыми примесями; проводили SEC и фракции токсина сохраняли в PBS. Гомогенность очищенных белков подтверждали путем SEC и SDS-PAGE.
(C): N-концевые последовательности РЕ25, S-PE25, NKC-PE25 и NCK-PE25: N-концевой метионин, который кодируется старт-кодоном ATG, указан в скобках, поскольку он может быть удален при посттрансляционном процессинге в Е. coli, Остаток лизина, который становится связанным с гаптеном, выделен жирным шрифтом, а дополнительный цистеин до или после этого лизина выделен подчеркиванием.
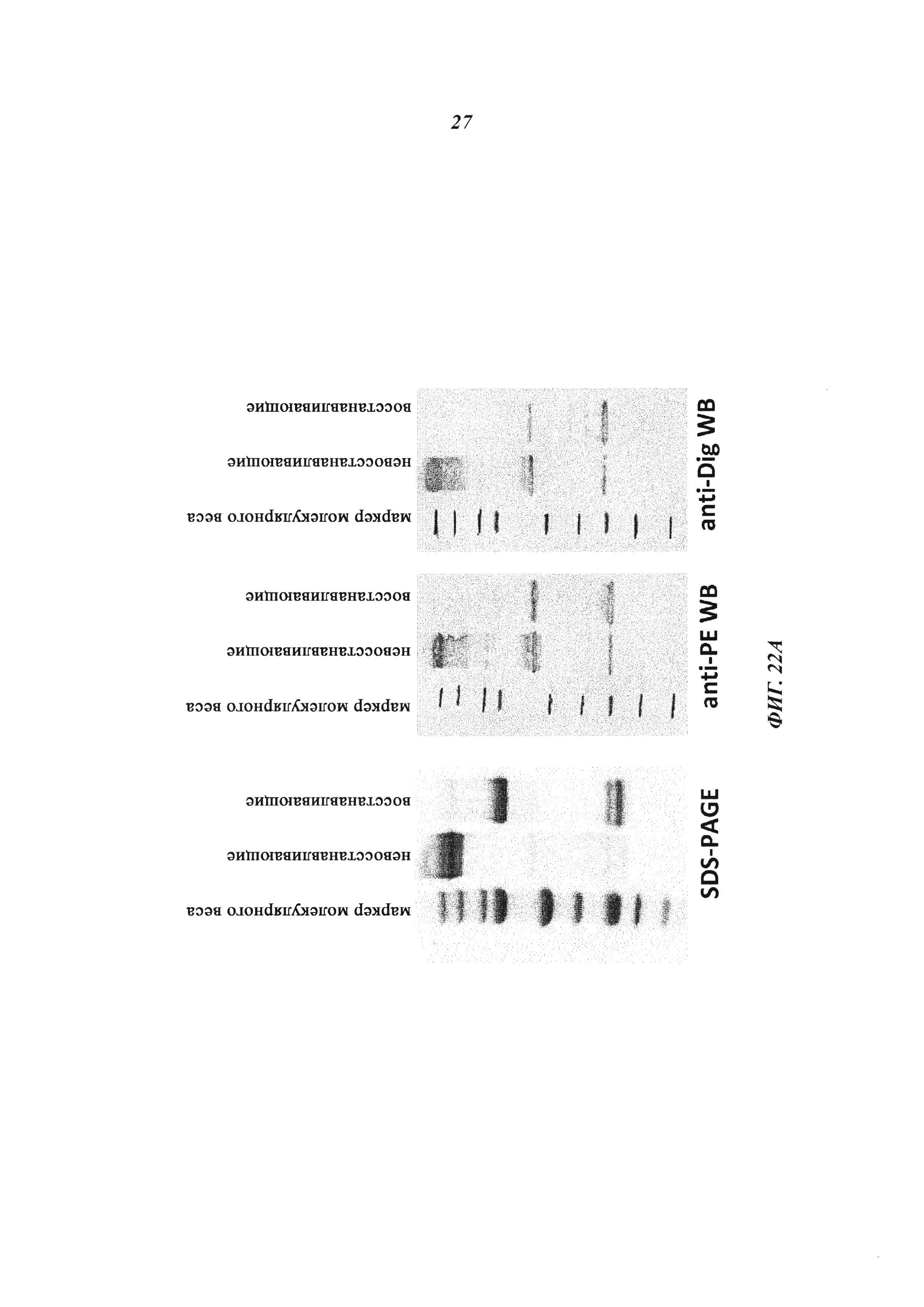
Фиг. 22: (А): Комплексообразование и ковалентное связывание антитела и токсина: восстановленные и невосстановленные образцы ковалентных комплексов, содержащие NKC-PE25, разделяли с помощью SDS-PAGE (гель NuPAGE от 4 до 12% Bis-Tris (1,0 мм × 10 лунок) и либо визуализировали путем окрашивания Кумасси синим, либо подвергали вестерн-блоту с Immobilon PVDF Transfer Membranes (Immobilon-P), размер пор: 0,45 мкм (средняя и правая панель). Вестерн-блот-анализ с поликлональными анти-РЕ-антителами (кроличье антитело против экзотоксина А псевдомонад (Sigma, кат. № Р2318), разведенное 1:1000, а затем козлиное антитело против кроличьего IgG (целая молекула) в конъюгате с щелочной фосфатазой (Sigma, кат. № А3687), разведенное 1:1000) показан на средней панели. Вестерн-блот-анализ с мышиным моноклональным антидигоксигениновым антителом MAK
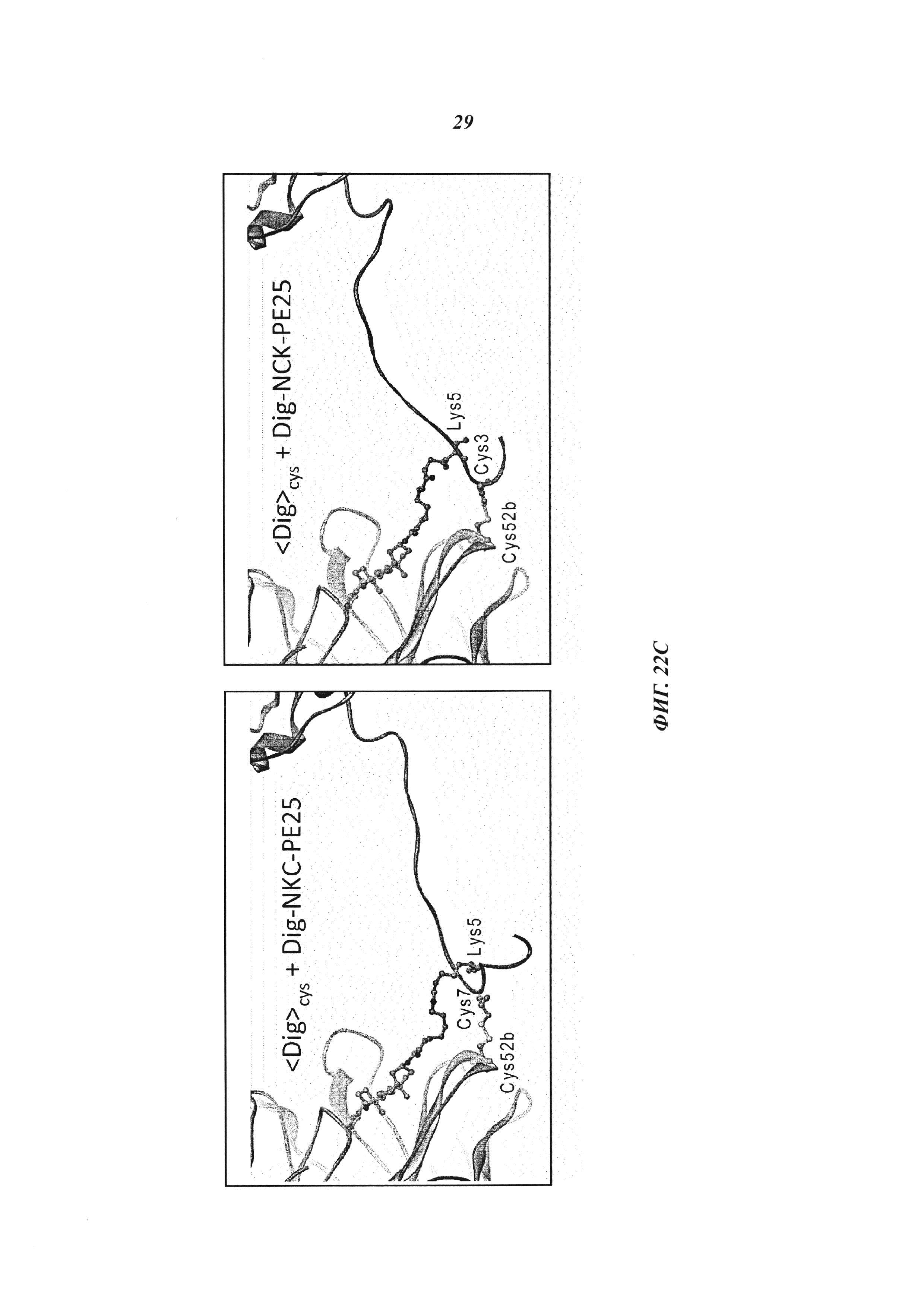
(B): Комплексообразование и ковалентное связывание антидигоксигенинового антитела и дигоксигенилированного полипептидного токсина: модель компонентов дигоксигенилированного РЕ25 (DIG-PE25) в комплексе с дигоксигенин-связывающим Fv была создан путем соединения структурной модели "дигоксигениновый спейсер:антидигоксигениновое антитело" (PDB_3RA7, 1) со структурой РЕ25 (PDB_1K2N и 1IKQ, вторая часть линкера взята из 1ikq); дигоксигенин соответствующего размера, присоединенный через аминокапроновокислотный спейсер к единственному лизину РЕ25, соединяет обе структуры;
(C): также показаны структурные модели, которые показывают возможные конфигурации ковалентной связи между дополнительными цистеинами VH антидигоксигенинового антитела и цистеином в NKC-PE25 или NCK-PE25.
Фиг. 23: Опосредованная биспецифическим антителом направленная доставка токсина: анализы пролиферации клеток (BrdU) проводили для того, чтобы проанализировать токсическое влияние на опухолевые клетки; LeY-экспрессирующие клетки MCF-7 в течение 48 часов подвергали воздействию только токсина (верхняя панель) или комплексов "носитель-токсин" в формате IgG-Fv (нижняя панель).
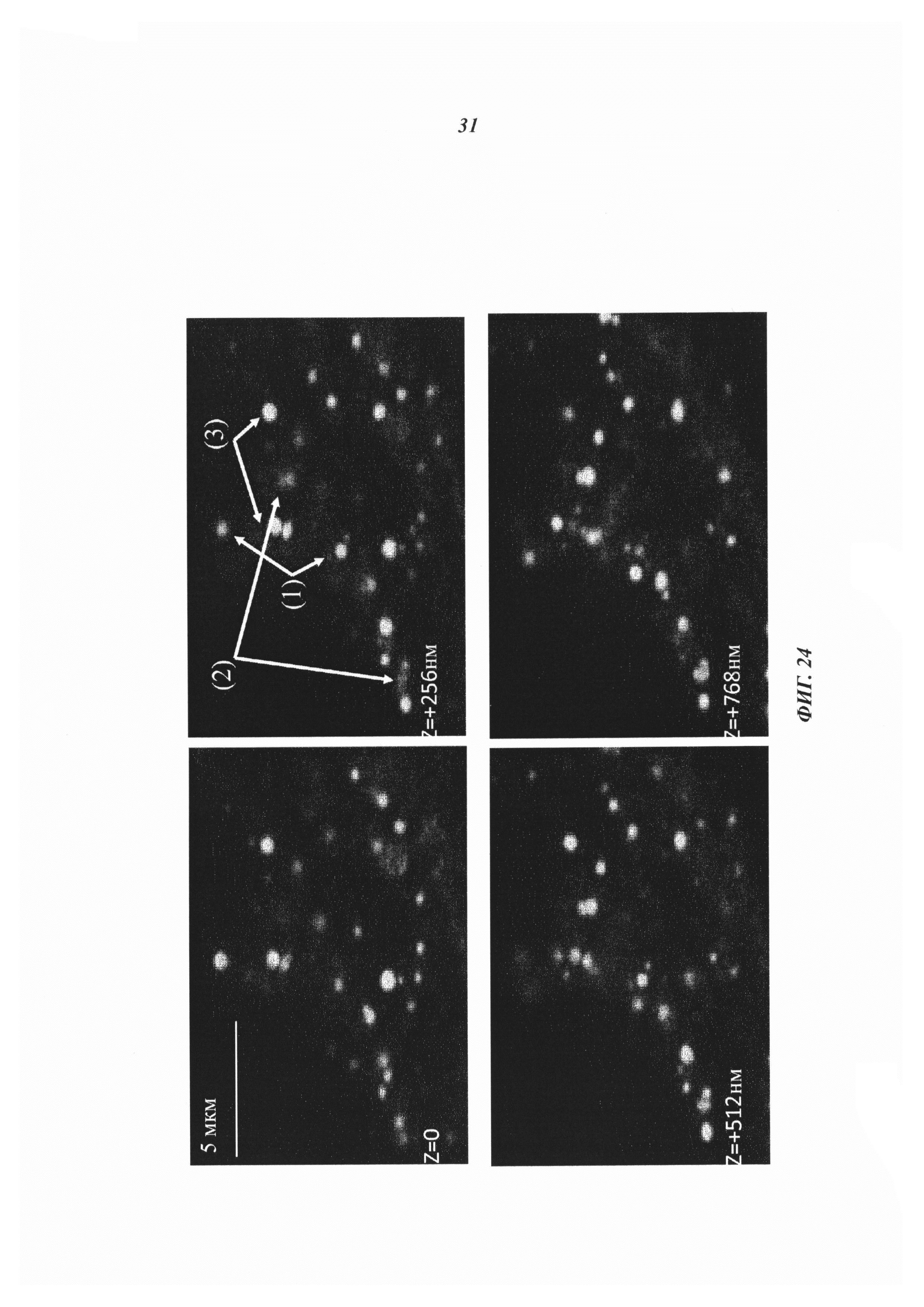
Фиг. 24: Нацеленные на клетки биспецифические антитела высвобождали расположенную на гаптене и соединенную дисульфидными связями полезную нагрузку в пределах клеток-мишеней. Конфокальноая микроскопия показывает bsAb-направленную доставку дисульфид-конъюгированной биотин-Cys-Cy5-полезной нагрузки к клеткам и в клетки MCF-7. bsAb обнаруживают с помощью Alexa-меченных huFc-связывающих антител, полезную нагрузку Bio-Cys-Cy5 определяют по ее флуоресценции. Совместная локализация bsAb и полезной нагрузки обозначается смешанным цветом (3), изолированное bsAb появляется в цвете 1 (1), а биотин без антитела появляется в цвете 2 (2). Изображения (через 6 часов после нанесения LeY-BsAb на LeY-экспрессирующие клетки MCF7) показывают отделение биотина от комплексов в моменты времени, когда носитель bsAb является еще достаточно неповрежденным для обнаружения вторичными антителами.
Подробное описание изобретения
I. Определения
"Акцепторная человеческая каркасная область" в контексте данного изобретения является каркасной областью, включающей аминокислотную последовательность каркасной области вариабельного домена легкой цепи (VL) или каркасной области вариабельного домена тяжелой цепи (VH), полученной из каркасной области человеческого иммуноглобулина или человеческой консенсусной каркасной области, как определено ниже. Акцепторная человеческая каркасная область, "полученная из" каркасной области человеческого иммуноглобулина или консенсусной человеческой каркасной области, может содержать одну и ту же аминокислотную последовательность, или она может содержать аминокислотные замены. В некоторых воплощениях число аминокислотных замен составляет 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее или 2 или менее. В некоторых воплощениях человеческая акцепторная каркасная область VL по своей последовательности идентична последовательности каркасной области VL человеческого иммуноглобулина или последовательности консенсусной человеческой каркасной области.
Термин "аминокислота" обозначает группу карбокси-α-аминокислот, либо встречающихся в природе, т.е. таких, которые непосредственно или в форме предшественника могут быть закодированы нуклеиновой кислотой, либо неприродных. Отдельные природные аминокислоты кодируются нуклеиновыми кислотами, состоящими из трех нуклеотидов, так называемыми кодонами или триплетами оснований. Каждая аминокислота кодируется по меньшей мере одним кодоном. Это известно как "вырождение генетического кода". Термин "аминокислота", используемый в данной заявке, обозначает природные карбокси-α-аминокислоты, включая аланин (трехбуквенный код: Ala, однобуквенный код: А), аргинин (Arg, R), аспарагин (Asn, N), аспарагиновую кислоту (Asp, D), цистеин (Cys, С), глутамин (Gln, Q), глутаминовую кислоту (Glu, Е), глицин (Gly, G), гистидин (His, Н), изолейцин (Ile, I), лейцин (Leu, L), лизин (Lys, K), метионин (Met, М), фенилаланин (Phe, F), пролин (Pro, Р), серин (Ser, S), треонин (Thr, Т), триптофан (Trp, W), тирозин (Tyr, Y) и валин (Val, V). Примеры неприродных аминокислот включают, но не ограничиваясь ими, Aad (альфа-аминоадипиновую кислоту), Abu (аминомасляную кислоту), Ach (альфа-аминоциклогексанкарбоновую кислоту), Аср (альфа-аминоциклопентанкарбоновую кислоту), Асрс (1-аминоциклопропан-1-карбоновую кислоту), Aib (альфа-аминоизомасляную кислоту), Aic (2-аминоиндан-2-карбоновую кислоту; также называемую 2-2-Aic), 1-1-Aic (1-аминоиндан-1-карбоновую кислоту), (2-аминоиндан-2-карбоновую кислоту), аллилглицин (AllylGly), аллоизолейцин (алло-Ile), Asu (альфа-аминопробковую кислоту, 2-аминоктандиовую кислоту), Bip (4-фенилфенилаланинкарбоновую кислоту), BnHP ((2S,4R)-4-гидроксипролин), Cha (бета-циклогексилаланин), Cit (цитруллин), циклогексилглицин (Chg), циклопентилаланин, бета-циклопропилаланин, Dab (1,4-диаминомасляне. кислоте), Dap (1,3-диаминопропионовую кислоту), р(3,3-дифенилаланинкарбоновую кислоту), 3,3-дифенилаланин, ди-н-пропилглицин (Dpg), 2-фурилаланин, гомоциклогексилаланин (HoCha), гомоцитруллин (HoCit), гомоциклолейцин, гомолейцин (HoLeu), гомоаргинин (HoArg), гомосерин (HoSer), гидроксипролин, Lys(Ac), (1) Nal (1-нафтилаланин), (2) Nal (2-нафтилаланин), 4-МеО-Арс (1-амино-4-(4-метоксифенил)циклогексан-1-карбоновую кислоту), норлейцин (Nle), Nva (норвалин), оматин, 3-Pal (альфа-амино-3-пиридилаланинкарбоновую кислоту), 4-Pal (альфа-амино-4-пиридилаланинкарбоновую кислоту), 3,4,5,F3-Phe (3,4,5-трифторфенилаланин), 2,3,4,5,6,F5-Phe (2,3,4,5,6-пентафторфенилфенилаланин), Pqa (4-оксо-6-(1-пиперазинил)-3(4Н)-хиназолинуксусную кислоту (CAS 889958-08-1)), пиридилаланин, хинолилаланин, саркозин (Sar), тиазолилаланин, тиенилаланин, Tic (альфа-амино-1,2,3,4-тетрагидроизохинолин-3-карбоновую кислоту), Tic(OH), Tle (трет-бутилглицин) и Tyr(Ме).
Термин "антитело" в данном документе используется в самом широком смысле и охватывает различные структуры антител, в том числе, но не ограничиваясь ими, моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител, до тех пор, пока они проявляют ye;ye. антигенсвязывающую активность.
Термин "фрагмент антитела" означает молекулу, отличающуюся от интактного антитела, которая содержит часть интактного антитела, связывающуюся с антигеном, с которым связывается интактное антитело. Примеры фрагментов антител включают, но не ограничиваясь ими, Fv, Fab, Fab', Fab'-SH, F(ab')2; димеры; линейные антитела; одноцепочечные молекулы антител (например, scFv); и мультиспецифические антитела, образованные из фрагментов антител.
Термин "биотин", сокращенно "BI", обозначает 5-[(3aS,4S,6aR)-2-оксогексагидро-1Н-тиено [3,4-d]имидазол-4-ил]пентановую кислоту. Биотин также известен как витамин Н или кофермент R.
Термин "биспецифические антитела" обозначает антитела, которые обладают двумя различными (антиген/гаптен) специфичностями связывания. В одном воплощении биспецифические антитела, описанные в данном документе, являются специфическими в отношении двух различных антигенов, т.е. гаптенового и ненаптенового антигена.
Термин "химерное" антитело относится к антителу, в котором часть тяжелой и/или легкой цепи получена из конкретного источника или вида, в то время как остальная часть тяжелой и/или легкой цепи получена из другого источника или вида.
Термин "класс" антитела относится к типу константного домена или константной области, которой обладает его тяжелая цепь. Есть пять основных классов антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть разделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются α, δ, ε, γ и μ, соответственно.
Термин "полипептидный токсин", используемый в данном документе, относится к веществу, которое ингибирует или предотвращает клеточную функцию и/или вызывает гибель или разрушение клеток. Полипептидные токсины включают, но не ограничиваясь ими, ферменты и их фрагменты, такие как нуклеолитические ферменты; токсины, такие как ферментативно активные токсины бактериального, грибного, растительного или животного происхождения, включая их фрагменты и/или варианты, цитотоксины (например, экзотоксин псевдомонад, рицин, абрин, дифтерийный токсин и т.п. ), ферменты, факторы роста, факторы транскрипции.
Термин "дигоксигенин", сокращенно "Dig", обозначает 3-[(3S,5R,8R,9S,10S,12R,13S,14S,17R)-3,12,14-тригидрокси-10,13-диметил-1,2,3,4,5,6,7,8,9,11,12,15,16,17-тетрадекагидро-циклопента[а]-фенантрен-17-ил]-2Н-фуран-5-он (CAS №1672-46-4). Дигоксигенин (Dig) представляет собой стероид, обнаруживаемый исключительно в цветах и листьях растений Digitalis purpurea, Digitalis orientalis и Digitalis lanata (наперстянки) (Polya, G., Biochemical targets of plant bioactive compounds, CRC Press, New York (2003) p. 847).
Термин "эффекторные функции" обозначает биологические активности, приписываемые Fc-области, которая варьирует в зависимости от класса антитела. Примеры эффекторных функций антител включают: C1q-связывание и комплемент-зависимую цитотоксичность (CDC); Fc-рецепторное связывание; антитело-зависимую клеточную цитотоксичность (ADCC); фагоцитоз; понижающую регуляцию рецепторов клеточной поверхности (например, В-клеточного рецептора); и В-клеточную активацию.
Понятие "эффективное количество" агента, например, фармацевтической композиции, относится к количеству, эффективному в дозах и в течение периода времени, необходимого для достижения желаемого терапевтического или профилактического результата.
Расщепление антител папаином образует два идентичных антигенсвязывающих фрагмента, называемых "Fab"-фрагментами, каждый с одним антигенсвязывающим сайтом, и оставшийся "Fc"-фрагмент, название которого отражает его способность легко кристаллизоваться. Обработка пепсином образует Р(ab')2-фрагмент, который имеет два антигенсвязывающих сайта и все еще способен к сшиванию антигена.
Fab-фрагмент также содержит константный домен легкой цепи и первый константный домен (СН1) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов добавлением нескольких остатков на карбокси-конце домена СН1 тяжелой цепи, включая один или более чем один цистеин из шарнирной области антитела. Fab'-SH в данном документе является обозначением для Fab', в котором остаток цистеина(ов) константных доменов несет одну свободную тиольную группу. F(ab')2-фрагменты антител первоначально были получены в виде пары Fab'-фрагментов, которые имеют шарнирные цистеины между ними. Также известны другие химические группировки фрагментов антител.
"Fv" представляет собой минимальный фрагмент антитела, который содержит полный антигенраспознающий и антигенсвязывающий сайт. Эта область состоит из димера вариабельных доменов одной тяжелой и одной легкой цепи, которые находятся в жесткой нековалентной ассоциации. Именно в этой конфигурации три гипервариабельные области из каждого вариабельного домена взаимодействуют, определяя антигенсвязывающий сайт на поверхности димера VH-VL. В совокупности шесть гипервариабельных областей придают антигенсвязывающую специфичность антителу. Тем не менее, даже одиночный вариабельный домен (или половина Fv, содержащая только три гипервариабельные области, специфичные для антигена) обладает способностью распознавать и связывать антиген, хотя и с меньшей аффинностью, чем целый сайт связывания.
Термин "Fc-область" в данном документе используется для определения С-концевой области тяжелой цепи иммуноглобулина, которая содержит по меньшей мере часть константной области. Термин включает Fc-области с нативной последовательностью или вариантные Fc-области. В одном воплощении Fc-область тяжелой цепи человеческого IgG продолжается от Cys226 или от Pro230 до карбоксильного конца тяжелой цепи. Тем не менее, С-концевой лизин (Lys447) Fc-области может присутствовать или отсутствовать. Если в данном документе не указано иное, то нумерация аминокислотных остатков в Fc-области или константной области осуществляется в соответствии с системой нумерации ЕС, также называемой индексом ЕС, как описано в Kabat, Е.А. et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991), NIH Publication 91-3242.
Термин "флуоресцеин", сокращенно "FLUO", обозначает 6-гидрокси-9-(2-карбоксифенил)-(3Н)-ксантен-3-он, альтернативно 2-(6-гидрокси-3-оксо-(3Н)-ксантен-9-ил)бензойную кислоту. Флуоресцеин также известен как резорцинофталеин, C.I. 45350, растворитель желтый 94, D&C желтый №7, Angiofluor, японский желтый 201 или желтое мыло.
Термин "каркасная область", сокращенно "FR" (от англ. - framework region), относится к аминокислотным остаткам вариабельного домена тяжелой и легкой цепи за исключением остатков гипервариабельной области (HVR, от англ. hypervariable region). FR вариабельного домена обычно состоит из четырех FR-доменов: FR1, FR2, FR3 и FR4. Соответственно, последовательности HVR и FR обычно идут в следующей последовательности в VH (или VL): FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
Термин "искусственный остаток цистеина" обозначает аминокислотный остаток цистеина, который был сконструирован в родительском антителе или полипептидном токсине, который имеет тиольную функциональную группу (SH) и не спаривается во внутримолекулярный дисульфидный мостик. Тем не менее, свободная аминокислота цистеин может быть спарена в межмолекулярный дисульфидный мостик, например, с глутатионом.
Термин "полноразмерное антитело" означает антитело, имеющее структуру, которая по существу подобна структуре нативного антитела, или имеющее тяжелые цепи, которые содержат Fc-область, определенную в данном описании. Нативные антитела IgG представляют собой гетеротетрамерные гликопротеины размером примерно 150000 дальтон, состоящие из двух одинаковых легких цепей и двух одинаковых тяжелых цепей, которые связаны дисульфидными мостиками. От N-конца к С-концу каждая тяжелая цепь имеет вариабельную область (VH), которая также называется вариабельным тяжелым доменом или вариабельным доменом тяжелой цепи, а затем три константных домена (СН1, СН2 и СН3). Аналогичным образом, от N-конца к С-концу каждая легкая цепь имеет вариабельную область (VL), также называемую вариабельным легким доменом или вариабельным доменом легкой цепи, за которым следует константный легкий домен (CL). Легкая цепь антитела могут относиться к одному из двух типов, называемых каппа (κ) и лямбда (λ), на основании аминокислотной последовательности ее константного домена.
"Полноразмерное антитело" представляет собой антитело, содержащее домен VL и VH, а также константный домен легкой цепи (CL) и константные домены тяжелой цепи, СН1, СН2 и СН3. Константные домены могут быть константными доменами с природной последовательностью (например, константные домены с человеческой нативной последовательностью) или вариантами их аминокислотной последовательности. Полноразмерное антитело может иметь одну или более чем одну "эффекторную функцию", которая относится к таким биологическим активностям, которые присущи константной Fc-области (Fc-область с нативной последовательностью или Fc-области с вариантной аминокислотной последовательностью) антитела. Примеры эффекторных функций антитела включают C1q-связывание; комплемент-зависимую цитотоксичность (CDC); Fc-рецепторное связывание; антитело-зависимую клеточную цитотоксичность (ADCC); фагоцитоз; и понижающую регуляцию рецепторов клеточной поверхности, таких как В-клеточный рецептор и BCR.
Термин "гаптен" обозначает небольшую молекулу, которая может вызвать иммунный ответ только при присоединении к большому носителю, такому как белок. Иллюстративными гаптенами являются анилин, о-, м- и п-аминобензойная кислота, хинон, гистамин-сукцинил-глицин (HSG), гидралазин, галотан, индий-DTPA, флуоресцеин, биотин, дигоксигенин, теофиллин, динитрофенол и бромдезоксиуридин. В одном воплощении гаптен представляет собой биотин, или дигоксигенин, или теофиллин, или карборан, или бромдезоксиуридин.
Термин "гаптенилированный полипептидный токсин" означает молекулу, состоящую из гаптена, который ковалентно связан с полипептидным токсином. Активированные гаптеновые производные часто используются в качестве исходных материалов для получения таких конъюгатов. В одном воплощении гаптен представляет собой дигоксигенин, и он конъюгирован (в одном воплощении через свою 3-гидрокси-группу) с полипептидным токсином через линкер. В одном воплощении линкер содержит а) одну или более чем одну (в одном воплощении от трех до шести) метилен-карбокси-метил-группу (-СН2-С(O)-), и/или b) от 1 до 10 (в одном воплощении от 1 до 5) аминокислотных остатков (в одном воплощении выбранных среди глицина, серина, глутамата, β-аланина, γ-аминомасляной кислоты, ε-аминокапроновой кислоты или лизина), и/или с) одно или более чем одно (в одном из воплощений одно или два) соединение, имеющее структурную формулу NH2-[(CH2)nO]xCH2-CH2-COOH, где n равен 2 или 3, а х равен 1-10, в одном воплощении 1-7. Последний элемент образует (по меньшей мере частично) линкер (часть) формулы -NH-[(CH2)nO]xCH2-CH2-C(O)-. Одним из примеров такого соединения является, например, 12-амино-4,7,10-триоксадодекановая кислота (образующая TEG- (триэтиленгликолевый) линкер). Линкер обладает стабилизирующим и солюбилизирующим эффектом, так как он содержит заряды или/и может образовывать водородные мостики. Кроме того, он может стерически облегчать связывание антигаптенового антитела с гаптен-конъюгированным полипептидным токсином. В одном из воплощений линкер расположен на боковой цепи аминокислоты полипептидного токсина (например, конъюгирован с боковой цепью лизина через аминогруппу). В одном из воплощений линкер расположен на амино-конце или на карбокси-конце полипептидного токсина. Положение линкера на полипептиде, как правило, выбирают в такой области, где биологическая активность полипептидного токсина не затрагивается. Поэтому точная позиция присоединения линкера зависит от полипептидного токсина и релевантных структурных элементов, которые ответственны за биологическую активность. Биологическая активность полипептидного токсина, к которому присоединяется гаптен, может быть проверена в анализе in vitro.
Термины "клетка-хозяин", "клеточная линия-хозяин" и "клеточная культура-хозяин" используются взаимозаменяемо и относятся к клеткам, в которые была введена экзогенная нуклеиновая кислота, включая потомство таких клеток. Клетки-хозяева включают "трансформанты" и "трансформированные клетки", которые включают первичные трансформированные клетки и потомство, полученное из них, независимо от числа пассажей. Потомство может не быть полностью идентичным родительской клетке по содержанию нуклеиновых кислот, а может содержать мутации. Мутантное потомство, которое имеет такую же функцию или биологическую активность при скрининге или селекции, как у исходно трансформированной клетки, включено в данный документ.
"Человеческое антитело" является таким антителом, которое обладает аминокислотной последовательностью, которая соответствует антителу, продуцируемому человеком или человеческой клеткой или полученному из нечеловеческого источника, который использует репертуар человеческих антител или других последовательностей, кодирующих человеческие антитела. Это определение человеческого антитела, в частности, исключает гуманизированное антитело, содержащее нечеловеческие антигенсвязывающие остатки.
"Гуманизированное" антитело относится к химерному антителу, содержащему аминокислотные остатки из нечеловеческих HVR и аминокислотные остатки из человеческих FR. В некоторых воплощениях гуманизированное антитело будет содержать по существу все из по меньшей мере одного, а обычно двух вариабельных доменов, в которых все или по существу все HVR (например, CDR) соответствуют таковым в нечеловеческом антителе, и все или по существу все FR соответствуют таковым в человеческом антителе. Гуманизированное антитело, возможно, может содержать по меньшей мере часть константной области антитела, полученной из человеческого антитела. "Гуманизированная форма" антитела, например, нечеловеческого антитела, относится к антителу, которое подверглось гуманизации.
Термины "гипервариабельная область" или "HVR", используемые в данном документе, относятся к каждой из областей вариабельного домена антитела, которые являются гипервариабельными в последовательности ("области, определяющие комплементарность" или "CDR") и/или формируют структурно определенные петли ("гипервариабельные петли") и/или содержат контактирующие с антигеном остатки ("антигенные контакты"). Как правило, антитела содержат шесть HVR, три в VH (Н1, Н2, Н3) и три в VL (L1, L2, L3).
HVR в данном документе включают
(a) гипервариабельные петли, возникающие на аминокислотных остатках с 26 по 32 (L1), с 50 по 52 (L2), с 91 по 96 (L3), с 26 по 32 (Н1), с 53 по 55 (Н2) и с 96 по 101 (Н3). (Chothia, С. and Lesk, A.M., J. Mol. Biol. 196 (1987) 901-917);
(b) CDR, возникающие на аминокислотных остатках с 24 по 34 (L1), с 50 по 56 (L2), с 89 по 97 (L3), с 31 по 35b (Н1), с 50 по 65 (Н2) и с 95 по 102 (Н3) (Kabat, Е.А. et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991), NIH Publication 91-3242);
(c) антигенные контакты, возникающие на аминокислотных остатках с 27с по 36 (L1), с 46 по 55 (L2), с 89 по 96 (L3), с 30 по 35b (Н1), с 47 по 58 (Н2) и с 93 по 101 (Н3) (MacCallum et al. J. Mol. Biol. 262: 732-745 (1996)); и
(d) комбинации (a), (b), и/или (с), включая аминокислотные остатки HVR с 46 по 56 (L2), с 47 по 56 (L2), с 48 по 56 (L2), с 49 по 56 (L2), с 26 по 35 (Н1), с 26 по 35b (Н1), с 49 по 65 (Н2), с 93 по 102 (Н3) и с 94 по 102 (Н3).
"Индивидуум" или "субъект" является млекопитающим. Млекопитающие включают, но не ограничиваясь ими, домашних животных (например, коров, овец, кошек, собак и лошадей), приматов (например, людей и приматов, таких как обезьяны), кроликов и грызунов (например, мышей и крыс). В некоторых воплощениях индивидуум или субъект является человеком.
"Изолированное" антитело является таким антителом, которое было выделено из компонента его природной среды. В некоторых воплощениях антитело очищают до чистоты более 95% или 99%, определенной, например, с помощью электрофореза (например, SDS-PAGE, изоэлектрофокусировки (IEF), капиллярного электрофореза) или хроматографии (например, ионнообменной или обращено-фазовой HPLC). Обзор методик оценки чистоты антител см., например, в Flatman, S. et al., J. Chromatogr. В 848 (2007) 79-87.
Понятие "изолированной" нуклеиновой кислоты относится к нуклеиновокислотной молекуле, которая была выделена из компонента ее природной среды. Изолированная нуклеиновая кислота включает нуклеиновокислотную молекулу, содержащуюся в клетках, которые обычно содержат данную нуклеиновокислотную молекулу, но нуклеиновокислотная молекула находится вне хромосомы или в том месте хромосомы, которое отличается от ее природной хромосомной локализации.
Термин "моноклональное антитело", используемый в данном документе, относится к антителу, полученному из популяции по существу гомогенных антител, т.е. популяции антител, состоящей из отдельных антител, которые являются идентичными и/или связывают один и тот же эпитоп, за исключением возможных вариантных антител, например, содержащих встречающиеся в природе мутации или образованных во время производства препарата моноклонального антитела, которые, как правило, могут присутствовать в незначительных количествах. В отличие от препаратов поликлональных антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело в препарате моноклонального антитела направлено против одной единственной детерминанты на антигене. Таким образом, указатель "моноклональное" указывает на характер антитела, которое было получено из популяции по существу гомогенных антител, и не должен быть истолкован как требующий получения антитела каким-либо конкретным способом. Например, моноклональные антитела, используемые в соответствии с данным изобретением, могут быть получены с помощью различных методик, включая, но не ограничиваясь ими, гибридомную методику, рекомбинантные ДНК-методики, методики фагового дисплея, а также методики с использованием трансгенных животных, содержащих все или часть человеческих иммуноглобулиновых локусов, и такие методики и другие иллюстративные методики получения моноклональных антител описаны в данном документе.
Термин "моноспецифическое антитело" обозначает антитело, которое имеет один или более чем один сайт связывания, каждый из которых имеет одну и ту же специфичность связывания, т.е. связывается с одним и тем же антигеном или гаптеном.
"Голое антитело" относится к антителу, которое не конъюгировано с гетерологичной группировкой (например, цитотоксической группировкой) или радиоактивной меткой. Голое антитело может присутствовать в фармацевтической композиции.
Понятие "вкладыш в упаковку" используется для обозначения инструкций, обычно включаемых в коммерческие упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозировке, введении, комбинированной терапии, противопоказаниях и/или предупреждениях, касающихся применения таких терапевтических продуктов.
"Родительское антитело" представляет собой антитело, содержащее аминокислотную последовательность, в которой один или более чем один аминокислотный остаток замещен одним или более чем одним остатком цистеина. Родительское антитело может содержать нативную последовательность или последовательность дикого типа. Родительское антитело может иметь уже существующие модификации аминокислотной последовательности (такие как добавления, удаления и/или замены) по отношению к другой нативной, дикого типа или модифицированной форме антитела. Родительское антитело специфически связывается с гаптеном. Родительское антитело дополнительно может быть направлено также против антигена-мишени, представляющей интерес, например, биологически важного полипептида. Также предполагаются антитела, направленные против неполипептидных антигенов.
Термин "fMLP" обозначает трипептид, состоящий из N-формилметионина, лейцина и фенилаланина. В одном воплощении эффекторная группировка представляет собой fMLP или его производное.
"Процент (%) идентичности аминокислотной последовательности" по отношению к референсной полипептидной последовательности определяется как процент аминокислотных остатков в кандидатной последовательности, которые идентичны аминокислотным остаткам в референсной полипептидной последовательности после выравнивания последовательностей и введения при необходимости пробелов для достижения максимального процента идентичности последовательностей, и без учета любых консервативных замен как части идентичности последовательности. Выравнивание с целью определения процента идентичности аминокислотных последовательностей может быть достигнуто различными способами, которые доступны специалистам в данной области, например, с использованием общедоступного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определить соответствующие параметры для выравнивания последовательностей, в том числе любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Тем не менее, для целей данного изобретения значения % идентичности аминокислотных последовательностей получают с использованием компьютерной программы для сравнивания последовательностей ALIGN-2. Компьютерная программа для сравнивания последовательностей ALIGN-2 была разработана Genentech, Inc., и исходный код был подан с пользовательской документацией в бюро авторских прав США, Вашингтон, округ Колумбия, 20559, где он был зарегистрирован под номером TXU510087. Программа ALIGN-2 находится в открытом доступе от Genentech, Inc., Саут-Сан-Франциско, Калифорния, или может быть скомпилирована из исходного кода. Программа ALIGN-2 должна быть скомпилирована для применения на операционной системе UNIX, включая цифровую UNIX V4.0D. Все параметры сравнивания последовательностей установлены программой ALIGN-2 и не меняются.
В ситуациях, когда ALIGN-2 используется для сравнивания аминокислотных последовательностей, % идентичности аминокислотной последовательности данной аминокислотной последовательности А с данной аминокислотной последовательностью В (альтернативно можно сказать, что данная аминокислотная последовательность А имеет или содержит определенный % идентичности аминокислотной последовательности с данной аминокислотной последовательностью В) вычисляется следующим образом:
100 × доля X/Y,
где X обозначает число аминокислотных остатков, оцененных как идентичные совпадения с помощью программы для выравнивания последовательностей ALIGN-2 при выравнивании в этой программе А и В, и где Y обозначает общее число аминокислотных остатков в В. Следует иметь в виду, что если длина аминокислотной последовательности А не равна длине аминокислотной последовательности В, то % идентичности аминокислотной последовательности А с В не будет равен % идентичности аминокислотной последовательности В с А. Если специально не указано иное, то все значения % идентичности аминокислотной последовательности, используемые в данном описании, получены так, как описано в предыдущем абзаце, с использованием компьютерной программы ALIGN-2.
Термин "фармацевтическая композиция" относится к препарату, который находится в такой форме, чтобы обеспечить биологическую активность активного ингредиента, содержащегося в нем, и который не содержит дополнительных компонентов, которые являются неприемлемо токсичными для субъекта, которому будет осуществляться введение композиции.
Понятие "фармацевтически приемлемого носителя" относится к ингредиенту в фармацевтической композиции, помимо активного ингредиента, который является нетоксичным для субъекта. Фармацевтически приемлемые носители включают, но не ограничиваясь ими, буфер, эксципиент, стабилизатор или консервант.
Термин "полипептид" обозначает полимер, состоящий из аминокислот, соединенных пептидными связями, полученный природным или синтетическим путем. Полипептиды менее примерно 20 аминокислотных остатков могут называться "пептидами", в то время как молекулы, состоящие из двух или более полипептидов или содержащие один полипептид из более чем 100 аминокислотных остатков могут называться "белками". Полипептид также может содержать неаминокислотные компоненты, такие как углеводные группы, ионы металлов или сложные эфиры карбоновых кислот.Неаминокислотные компоненты могут быть добавлены клеткой, в которой экспрессируется полипептид, и могут варьировать в зависимости от типа клетки. Полипептиды определяются в данном документе с точки зрения структуры их аминокислотного остова или нуклеиновых кислот, кодирующих их же. Добавления, такие как углеводные группы, как правило, не уточняются, но, тем не менее, они могут присутствовать. Полипептид, используемый в данном изобретении, содержит по меньшей мере три аминокислотных остатка. Один аминокислотный остаток представляет собой остаток цистеина для формирования дисульфидной связи с антигаптеновым антителом, и один аминокислотный остаток представляет собой остаток лизина для конъюгации с гаптеном. Третий аминокислотный остаток полипептида в гаптенилированном полипептиде представляет собой либо i) один аминокислотный остаток для конъюгации с полезной нагрузкой, либо ii) полипептид. Также возможен вариант, что сам полипептид является частью более крупного полипептида с биологической активностью, такого как, например, полипептидный токсин.
Все полипептидные последовательности записаны в соответствии с общепринятой конвенцией, где альфа-N-концевой аминокислотный остаток расположен слева, а альфа-С-концевой аминокислотный остаток расположен справа. Используемый в данном документе термин "N-конец" относится к свободной альфа-аминогруппе аминокислоты в полипептиде, а термин "С-конец" относится к свободному альфа-карбоновокислотному концу аминокислоты в полипептиде. Полипептид, который имеет с N-конца группу, относится к полипептиду, несущему группу на альфа-аминном азоте N-концевого аминокислотного остатка. Аминокислота, которая имеет на N-конце группу, относится к аминокислоте, несущей группу на альфа-аминном азоте.
Стереохимия альфа-углерода аминокислот и аминоацильных остатков в полипептидах, описанных в данном документе и в прилагаемой формуле изобретения, является природной или "L"-конфигурацией, если иное не указано с помощью префикса "D", например, D-Ala или N-Me-D-Ile, или не записано в нижнем регистре, например, a, i, l, (D-версии Ala, Ile, Leu). Обозначения "R" и "S" Кана-Ингольда-Прелога используются для указания стереохимии хиральных центров в некоторых ацильных заместителях на N-конце полипептидов. Обозначение "R,S" обозначает рацемическую смесь двух энантиомерных форм. Эта номенклатура следует той, что описана в Cahn, R.S., et al., Angew. Chem. Int. Ed. Engl. 5 (1966) 385-415.
Термин "одноцепочечный Fv", сокращенно "scFv", обозначает фрагмент антитела, который содержит VH- и VL-домены антитела, где эти домены присутствуют в одной полипептидной цепи. В одном воплощении полипептид Fv также содержит полипептидный линкер между VH- и VL-доменами, который позволяет scFv формировать нужную структуру для связывания антигена. Обзор scFv см., например, в Plueckthun, The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore (Eds), Springer-Verlag, New York, pp. 269-315 (1994).
Термин "теофиллин", сокращенно "THEO", обозначает 1,3-диметил-7Н-пурин-2,6-дион. Теофиллин также известен как диметилксантин.
Термин "лечение" (и его грамматические варианты, такие как "лечить") обозначает клиническое вмешательство в попытке изменить естественное развитие заболевания у индивидуума, которого лечат, и которое может быть выполнено либо для профилактики, либо в ходе клинической патологии. Желательные эффекты лечения включают, но не ограничиваясь ими, предотвращение возникновения или рецидива заболевания, ослабление симптомов, уменьшение любого прямого или косвенного патологического последствия заболевания, предотвращение метастазирования, уменьшение скорости прогрессирования заболевания, улучшение или временное облегчение болезненного состояния, достижение ремиссии или улучшение прогноза. В некоторых воплощениях антитела, которые описаны в данном документе, используются для задержки развития заболевания или замедления прогрессии заболевания.
Термин "х-валентный", например, "одновалентный", или "двухвалентный", или "трехвалентный", или "четырехвалентный", означает наличие определенного числа сайтов связывания, т.е. "х", в молекуле антитела. Таким образом, термины "двухвалентный", "четырехвалентный", и "шестивалентный" означают наличие двух сайтов связывания, четырех сайтов связывания и шести сайтов связывания, соответственно, в молекуле антитела. Эти биспецифические антитела, описанные в данном документе, являются по меньшей мере "двухвалентными" и могут быть "трехвалентными" или "поливалентными" (например, "четырехвалентными" или "шестивалентными"). В одном воплощении биспецифическое антитело, описанное в данном документе, является двухвалентным, трехвалентным или четырехвалентным. В одном воплощении биспецифическое антитело является двухвалентным. В одном воплощении биспецифическое антитело является трехвалентным. В одном воплощении биспецифическое антитело является четырехвалентным.
В некоторых аспектах и воплощениях антитела, описанные в данном документе, имеют два или более двух сайтов связывания и являются биспецифическими. Т.е. эти антитела могут быть биспецифическими даже в тех случаях, когда имеется более двух сайтов связывания (т.е. антитело является трехвалентным или поливалентным). Термин "биспецифические антитела" включает, например, поливалентные одноцепочечные антитела, так димерные и тримерные антитела, а также антитела, имеющие структуру константных доменом полноразмерных антител, с которыми через один или более чем один пептидный линкер связаны дополнительные антигенсвязывающие сайты (например, одноцепочечный Fv, домен VH и/или домен VL, Fab или (Fab)2). Антитела могут быть полноразмерными антителами от одного вида, либо они могут быть химеризированными или гуманизированными. В антителе с более чем двумя антигенсвязывающими сайтами некоторые сайты связывания могут быть идентичными до тех пор, пока белок имеет сайты связывания для двух различных антигенов. Т.е. в то время как первый сайт связывания является специфичным для гаптена, второй сайт связывания является специфичным для негаптенового антигена, и наоборот.
Термин "вариабельная область" обозначает домен тяжелой или легкой цепи антитела, который участвует в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) нативного антитела, как правило, имеют аналогичную структуру, при этом каждый домен содержит четыре консервативные каркасные области (FR) и три гипервариабельные области (HVR). (См., например, Kindt, T.J. et al., Kuby Immunology, 6th ed., W.H. Freeman and Co., N.Y. (2007), page 91). Один VH- или VL-домен может быть достаточным для придания антигенсвязывающей специфичности. Кроме того, антитела, которые связывают конкретный антиген, могут быть выделены с помощью VH- или VL-домена из антитела, которое связывается с антигеном, для скрининга библиотеки комплементарных VL- или VH-доменов, соответственно. См., например, Portolano, S. et al., J. Immunol. 150 (1993) 880-887; Clackson, T. et al., Nature 352 (1991) 624-628).
Термин "вектор" обозначает нуклеиновокислотную молекулу, способную размножать другую нуклеиновую кислоту, с которой она связана. Этот термин включает вектор как самореплицирующуюся нуклеиновокислотную структуру, а также как вектор, включенный в геном клетки-хозяина, в которую он был введен. Некоторые векторы способны направлять экспрессию нуклеиновых кислот, с которыми они функционально связаны. Такие векторы называют в данном документе "экспрессионными векторами".
II. Конъюгаты, описанные в данном документе
Цепь А псевдомонадного экзотоксина (Pseudomonas exotoxin, РЕ), представляет собой полипептид размером 66 кДа, состоящий из 613 аминокислотных остатков. Она построена из трех функциональных доменов: домена I, N-концевого связывающего рецептор домена, который связывается с эукариотическими клетками; домена II, который отвечает за интернализацию и который становится протеолитически процессированным II; и домена III, который является С-концевым и высвобождается в цитоплазму после процессинга. Домен III АДФ-рибозилирует eEF2, что вызывает ингибирование синтеза белка и последующую гибель клетки.
Состав различных усеченных вариантов РЕ показан на Фиг. 21А. В усеченном варианте NLysPE38 связывающий клетку домен I и домен IB удалены. Эта молекула сама по себе имеет очень низкую цитотоксическую активность. NLysPE38 содержит остаток лизина, расположенный вблизи его N-конца (Nlys), который может быть химически модифицирован путем NHS-химической реакции. Недавно было показано, что в контексте стабилизированных дисульфидными мостиками Fv-гибридов (dsscFv-гибридов) большая часть домена II также может быть удалена без потери активности до тех пор, пока сайт процессинга сохраняется. Размер усеченного варианта токсина в таких гибридных белках составляет примерно 25 кДа. Усеченные варианты токсина по-прежнему содержат остатки лизина в домене III. В усеченном варианте токсина NlysPE40QQR лизины домена III были заменены глутамином и/или аргинином, чтобы уменьшить риск инактивации домена III аминомодифицирующими реагентами, такими как NHS, например, при химической конъюгации усеченного варианта токсина. В данном документе описан усеченный вариант РЕ NLysPE25SQΔ, в котором домены I и IB, а также большая часть домена II удалены (группировка токсина из CD22-LR8M), и который содержит лизин вместо серина или глутамина в домене III. Кроме того, в нем удален С-концевой лизин, и он имеет аминоконцевое удлинение N-Lys. NLysPE25SQΔ является довольно небольшой группировкой токсина, которая содержит только один лизин на N-конце. Первичный амин этого лизина (и N-конца) можно модифицировать с помощью NHS-реагентов, не затрагивая другие позиции токсина.
Для создания производных токсина, которые содержат дополнительный цистеин для гаптен-опосредованного ковалентного связывания с биспецифическим антителом, цистеин был помещен в NLysPE25SQΔ либо до, либо после остатка лизина, который используется для гаптеновой конъюгации.
В одном аспекте данное изобретение основано на обнаружении того факта, что ковалентный конъюгат, содержащий гаптенилированный полипептид и антигаптеновое антитело, которое специфически связывается с гаптеном, может быть получен путем формирования дисульфидной связи между правильно размещенным остатком цистеина в полипептиде и остатком цистеина в вариабельном домене антитела, особенно в CDR2 антитела, где CDR2 определен согласно нумерации вариабельного домена тяжелой цепи в соответствии с Kabat.
В некоторых воплощениях антиген представляет собой гаптен. В одном воплощении гаптен представляет собой биотин, или дигоксигенин, или флуоресцеин, или теофиллин, или карборан.
В одном воплощении гаптенилированный полипептид представляет собой конъюгат, содержащий гаптен, линкер и полипептидный токсин. В одном воплощении гаптен представляет собой биотин, или дигоксигенин, или флуоресцеин, или теофиллин, или карборан, или бромдезоксиуридин. В одном воплощении полипептид представляет собой полипептидный токсин.
Ковалентные конъюгаты гаптенилированного полипептида и антигаптенового антитела могут придавать полипептиду хорошие биофизические свойства и улучшенные PK-свойства. Кроме того, в случае использования биспецифического антитела конъюгаты могут быть использованы для нацеливания полипептида на клетки, которые демонстрируют антиген, распознаваемый второй специфичностью связывания биспецифического антитела. Такие конъюгаты обладают одной антигаптеновой специфичностью связывания и одной специфичностью связывания в отношении (негаптенового) антигена. Стехиометрическое отношение молекул антител к гаптенилированным полипептидным молекулам зависит от формата биспецифического антитела и может составлять 1:1, 1:2, 2:1, 2:2, 2:4 и 4:2 (антитело: гаптенилированный полипептид).
Желательно, чтобы полипептид сохранял хорошую биологическую активность несмотря на конъюгацию с гаптеном, а также конъюгацию с антигаптеновым антителом. Кроме того, желательно (в случае биспецифических нацеленных модулей), чтобы на клеточной поверхности сайт связывания мишени биспецифического антитела сохранял свою специфичность связывания и аффинность в присутствии ковалентно конъюгированного гаптенилированного полипептида.
Для формирования ковалентного конъюгата между антигаптеновым антителом и гаптенилированным полипептидом оба соединения должны быть модифицированы путем введения реакционноспособной группы. После связывания гаптена антигаптеновым антителом две реакционноспособные группы оказываются в непосредственной близости дот друга, позволяя сформироваться ковалентной связи. В одном воплощении модификация представляет собой введение тиольной функциональной группы в каждое из соединений. В одном воплощении тиольное соединение представляет собой остаток цистеина.
Позиция для мутирования должна удовлетворять одновременно двум требованиям: (i) позиции для связывания должны быть в непосредственной близости от области связывания, чтобы использовать эффект позиционирования гаптена для направленного связывания, и (ii) позиция мутации и связывания должна быть расположена таким образом, чтобы не влиять на связывание самого гаптена. Эти требования для поиска подходящей позиции по факту "противоречат" друг к другу, потому что требованию (i) лучше всего удовлетвояет позиция, близкая к сайту связывания, в то время как требование (ii) наиболее безопасно достигается с помощью позиций, которые удалены от сайта связывания.
Несмотря на эти практически взаимоисключающие требования, в антигаптеновом антителе были выявлены позиции, которые могут быть мутированы без влияния на позиционирование гаптена и которые, тем не менее, одновременно делают возможным направленное ковалентное связывание.
Первая позиция находится в позиции VH52b или в позиции VH53, соответственно, в соответствии с нумерацией вариабельного домена тяжелой цепи по Kabat. Если антитело имеет короткую CDR2-область VH, которая не имеет прерывистых остатков, таких как 52а, 52с, 52с и 52d, то позиция представляет собой 53 (нумерация и выравнивание в соответствии со схемой нумерации и правилами Kabat для вариабельного домена тяжелой цепи антитела). Если антитело имеет длинную CDR2-область VH, содержащую остатки 52а и 52b, а также, возможно, дополнительные остатки, такие как 52с и 52d и т.д., то позиция представляет собой 52b (нумерация и выравнивание в соответствии со схемой нумерации и правил Kabat для вариабельного домена тяжелой цепи антитела).
Вторая позиция находится в позиции VH28 согласно нумерации Kabat.
Например, в структуре антидигоксигенинового антитела гаптен связан в глубоком кармане, образованном гидрофобными остатками. В данном кристаллографическом исследовании был использован флуоресцентный конъюгат дигоксигенин-Cy5, в котором флуорофор, а также линкер между дигоксигенином и Cy5, не были видны в структуре из-за высокой гибкости и приводили к нарушению в кристалле. Тем не менее, линкер и Cy5 прикреплялся к O32 дигоксигенина, который указывает в направлении CDR2 тяжелой цепи. Расстояние между O32 дигоксигенина и Сα аминокислотного остатка в позиции 52b в соответствии с Kabat составляет примерно 10,5
Было обнаружено, что данная позиция является "универсальной" позицией, т.е данная позиция применима к любому (антигаптеновому) антителу и, таким образом, не требуется начинать с нуля каждый раз, когда нужно модифицировать новое (антигаптеновое) антитело путем получения кристаллической структуры и определения соответствующей позиции, которая делает возможным гаптен-позиционированное ковалентное связывание.
Соответственно, неожиданно можно использовать мутацию VH52bC или VH53C в соответствии со схемой нумерации Kabat для каждого анализируемого гаптенсвязывающего антитела. Несмотря на то, что антитела и структуры их связывающих карманов весьма разнообразны, было показано, что мутация VH52bC/VH53C может быть использована для ковалентного присоединения гаптенов/гаптенилированных соединений к антителам, которые связываются с этим гаптеном (таких как, например дигоксигенин, биотин, флуоресцеин, теофиллин, а также бромдезоксиуридин). Таким образом, также было обнаружено, что замена на цистеин аминокислотного остатка в позиции VH52b/VH53 согласно нумерации Kabat, который находится внутри CDR2 тяжелой цепи антитела, применима и к другим (антигаптеновым) антителам без дополнительной необходимости структурного дизайна или знания специфических структур антител и без вмешательства в связывающие свойства, присущие вариабельным доменам антитела.
Антитела, модифицированные, как описано в данном документе, сохраняют гаптенсвязывающую способность своего родительского (т.е. дикого типа) антигаптенового антитела. Таким образом, антигаптеновое антитело, содержащее искусственный остаток цистеина антитела, в одном из воплощений специфически связывается с гаптеном.
Термин "антитело, которое связывается с" означает, что антитело может формировать комплекс с антигеном специфическим образом. Специфическое связывание может быть обнаружено в анализе in vitro, например, в анализе плазмонного резонанса (BIAcore, GE-Healthcare, Упсала, Швеция). Аффинность формирования комплекса определяется понятиями ka (константа скорости ассоциации соединений с формированием комплекса), kD (константа диссоциации, диссоциация комплекса) и KD (kD/ka). Связывание или специфическое связывание означает аффинность связывания (KD) примерно 10-8 М или менее, в одном воплощении от примерно 10-8 М до примерно 10-13 М, в одном воплощении от примерно 10-9 М до примерно 10-13 М. Таким образом, антитело, которое связывается с гаптеном с формированием комплекса, как описано в данном документе, специфически связывается с гаптеном с аффинностью связывания (KD) примерно 10-8 моль/л или менее, в одном воплощении от примерно 10-8 моль/л до примерно 10-13 моль/л, в одном воплощении от примерно 10-9 моль/л до 10-13 моль/л.
Было обнаружено, что формирование ковалентной связи между цистеин-модифицированным антигаптеновым антителом и цистеин-модифицированным полипептидом, конъюгированным с гаптеном, происходит после связывания антитела с гаптеном без необходимости добавления восстанавливающих и/или окисляющих агентов, если сформировавшаяся связь представляет собой дисульфидную связь. Таким образом, дисульфидный мостик между двумя соединениями формируется спонтанно при формировании нековалентного комплекса. Таким образом, способ формирования ковалентного комплекса, описанного в данном документе, просто требует смешать два соединения. Единственным предварительным условием для формирования дисульфидных связей является правильная ориентация двух соединений относительно друг друга.
Антигаптеновые антитела, содержащие искусственный остаток цистеина антитела, могут быть сайт-специфически и эффективно связаны с гаптенилированным полипептидом, содержащим искусственный остаток цистеина полипептида.
Замена аминокислотного остатка в позиции VH52b и VH53, соответственно, (в соответствии со схемой нумерацией Kabat) на остаток цистеина давала производные антител с последовательностями вариабельного домена тяжелой цепи, которые перечислены в SEQ ID NO 20 и 28 для антидигоксигенинового антитела-VH52bC, в SEQ ID NO 84 и 92 для антитеофиллинового антитела-VH53C, в SEQ ID NO 52 и 60 для антибиотинового антитела-VH53C, и в SEQ ID NO 108 для антифлуоресцеинового антитела-VH52bC.
Замена аминокислотного остатка вариабельного домена тяжелой цепи в позиции VH28 (в соответствии со схемой нумерацией Kabat) на остаток цистеина давала производные антител с последовательностями вариабельного домена тяжелой цепи, которые перечислены в SEQ ID NO 116, 124, 132, 140, 148, 156 и 164, соответственно.
В одном воплощении антидигоксигениновое антитело характеризуется тем, что содержит по меньшей мере одну, две, три, четыре, пять или шесть CDR, выбранных среди (a) CDR1 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 09 или 25, (b) CDR2 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 10 или 26, (с) CDR3 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 11 или 27, (d) CDR1 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 13 или 29, (е) CDR2 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 14 или 30, и (f) CDR3 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 15 или 31.
В одном воплощении антибиотиновое антитело характеризуется тем, что содержит по меньшей мере одну, две, три, четыре, пять или шесть CDR, выбранных среди (a) CDR1 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 41 или 57, (b) CDR2 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 42 или 58, (с) CDR3 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 43 или 59, (d) CDR1 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 45 или 61, (е) CDR2 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 46 или 62, и (f) CDR3 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 47 или 64.
В одном воплощении антифлуоресцеиновое антитело характеризуется тем, что содержит по меньшей мере одну, две, три, четыре, пять или шесть CDR, выбранных среди (a) CDR1 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 105 или 113, (b) CDR2 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 106 или 114, (с) CDR3 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 107 или 115, (d) CDR1 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 109 или 117, (е) CDR2 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 110 или 118, и (f) CDR3 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 111 или 119.
В одном воплощении антитеофиллиновое антитело характеризуется тем, что содержит по меньшей мере одну, две, три, четыре, пять или шесть CDR, выбранных среди (a) CDR1 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 73 или 89, (b) CDR2 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 74 или 90, (с) CDR3 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 75 или 91, (d) CDR1 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 77 или 93, (е) CDR2 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 78 или 94, и (f) CDR3 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 79 или 95.
В одном воплощении антидигоксигениновое антитело характеризуется тем, что содержит (а) домен VH, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности CDR VH, выбранные среди (i) CDR1 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 09 или 25, (ii) CDR2 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 10 или 26, и (iii) CDR3 тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO 11 или 27, и (b) домен VL, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности CDR VL, выбранные среди (i) CDR1 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 13 или 29, (ii) CDR2 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 14 или 30, и (с) CDR3 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 15 или 31.
В одном воплощении антибиотиновое антитело характеризуется тем, что содержит (а) домен VH, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности CDR VH, выбранные среди (i) CDR1 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 41 или 57, (ii) CDR2 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 42 или 58, и (iii) CDR3 тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO 43 или 59, и (b) домен VL, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности CDR VL, выбранные среди (i) CDR1 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 45 или 61, (ii) CDR2 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 46 или 62, и (с) CDR3 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 47 или 63.
В одном воплощении антифлуоресцеиновое антитело характеризуется тем, что содержит (а) домен VH, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности CDR VH, выбранные среди (i) CDR1 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 105 или 113, (ii) CDR2 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 106 или 114, и (iii) CDR3 тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO 107 или 115, и (b) домен VL, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности CDR VL, выбранные среди (i) CDR1 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 109 или 117, (ii) CDR2 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 110 или 118, и (с) CDR3 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 111 или 119.
В одном воплощении антитеофиллиновое антитело характеризуется тем, что содержит (а) домен VH, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности CDR VH, выбранные среди (i) CDR1 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 73 или 89, (ii) CDR2 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 74 или 90, и (iii) CDR3 тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO 75 или 91, и (b) домен VL, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности CDR VL, выбранные среди (i) CDR1 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 77 или 93, (ii) CDR2 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 78 или 94, и (с) CDR3 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 79 или 95.
В одном из воплощений антидигоксигениновое антитело, и/или антибиотиновое антитело, и/или антитеофиллиновое антитело представляет собой гуманизированное антитело.
В одном из воплощений антидигоксигениновое антитело содержит такие CDR, как в любом из указанных выше воплощений, а также содержит человеческую акцепторную каркасную область, например, человеческую каркасную область иммуноглобулина или человеческую консенсусную каркасную область.
В одном из воплощений антибиотиновое антитело содержит такие CDR, как в любом из указанных выше воплощений, а также содержит человеческую акцепторную каркасную область, например, человеческую каркасную область иммуноглобулина или человеческую консенсусную каркасную область.
В одном из воплощений антитеофиллиновое антитело содержит такие CDR, как в любом из указанных выше воплощений, а также содержит человеческую акцепторную каркасную область, например, человеческую каркасную область иммуноглобулина или человеческую консенсусную каркасную область.
В одном из воплощений антидигоксигениновое антитело характеризуется тем, что содержит последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100% идентичность последовательности с аминокислотной последовательностью SEQ ID NO 04, или 12, или 20, или 28. В некоторых воплощениях последовательность VH, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность, содержит замены (например, консервативные замены), вставки или делеции по отношению к референсной последовательности, но антидигоксигениновое антитело, содержащее эту последовательность, сохраняет способность к связыванию с дигоксигенином. В некоторых воплощениях в SEQ ID NO 01, или 09, или 17, или 25 в общей сложности от 1 до 10 аминокислот были замещены, вставлены и/или удалены. В некоторых воплощениях замены, вставки или делеции возникают в областях вне CDR (т.е. в FR). Возможно, антидигоксигениновое антитело содержит последовательность VH в SEQ ID NO 01, или 09, или 17, или 25, включая посттрансляционные модификации этой последовательности.
В одном из воплощений антидигоксигениновое антитело характеризуется тем, что содержит последовательность вариабельного домена легкой цепи (VL), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100% идентичность последовательности с аминокислотной последовательностью SEQ ID NO 08, или 16, или 24, или 32. В некоторых воплощениях последовательность VL, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность, содержит замены (например, консервативные замены), вставки или делеции по отношению к референсной последовательности, но антидигоксигениновое антитело, содержащее эту последовательность, сохраняет способность к связыванию с дигоксигенином. В некоторых воплощениях в SEQ ID NO 08, или 16, или 24, или 32 в общей сложности от 1 до 10 аминокислот были замещены, вставлены и/или удалены. В некоторых воплощениях замены, вставки или делеции возникают в областях вне CDR (т.е. в FR). Возможно, антидигоксигениновое антитело содержит последовательность VL в SEQ ID NO 08, или 16, или 24, или 32, включая посттрансляционные модификации этой последовательности.
В одном из воплощений антибиотиновое антитело характеризуется тем, что содержит последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100% идентичность последовательности с аминокислотной последовательностью SEQ ID NO 36, или 44, или 52, или 60. В некоторых воплощениях последовательность VH, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность, содержит замены (например, консервативные замены), вставки или делеции по отношению к референсной последовательности, но антибиотиновое антитело, содержащее эту последовательность, сохраняет способность к связыванию с биотином. В некоторых воплощениях в SEQ ID NO 36, или 44, или 52, или 60, в общей сложности от 1 до 10 аминокислот были замещены, вставлены и/или удалены. В некоторых воплощениях замены, вставки или делеции возникают в областях вне CDR (т.е. в FR). Возможно, антидигоксигениновое антитело содержит последовательность VH в SEQ ID NO 36, или 44, или 52, или 60, включая посттрансляционные модификации этой последовательности.
В одном из воплощений антифлуоресцеиновое антитело характеризуется тем, что содержит последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100% идентичность последовательности с аминокислотной последовательностью SEQ ID NO 108 или 116. В некоторых воплощениях последовательность VH, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность, содержит замены (например, консервативные замены), вставки или делеции по отношению к референсной последовательности, но антифлуоресцеиновое антитело, содержащее эту последовательность, сохраняет способность к связыванию с флуоресцеином. В некоторых воплощениях в SEQ ID NO 108 или 116 в общей сложности от 1 до 10 аминокислот были замещены, вставлены и/или удалены. В некоторых воплощениях замены, вставки или делеции возникают в областях вне CDR (т.е. в FR). Возможно, антидигоксигениновое антитело содержит последовательность VH в SEQ ID NO 108 или 116, включая посттрансляционные модификации этой последовательности.
В одном из воплощений антитеофиллиновое антитело характеризуется тем, что содержит последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100% идентичность последовательности с аминокислотной последовательностью SEQ ID NO 68, или 76, или 84, или 92. В некоторых воплощениях последовательность VH, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность, содержит замены (например, консервативные замены), вставки или делеции по отношению к референсной последовательности, но антитеофиллиновое антитело, содержащее эту последовательность, сохраняет способность к связыванию с теофиллином. В некоторых воплощениях в SEQ ID NO 68, или 76, или 84, или 92, в общей сложности от 1 до 10 аминокислот были замещены, вставлены и/или удалены. В некоторых воплощениях замены, вставки или делеции возникают в областях вне CDR (т.е. в FR). Возможно, антидигоксигениновое антитело содержит последовательность VH в SEQ ID NO 68, или 76, или 84, или 92, включая посттрансляционные модификации этой последовательности.
В одном из воплощений антидигоксигениновое антитело содержит такие VH, как в любом из указанных выше воплощений, и такие VL, как в любом из указанных выше воплощений. В одном из воплощений антитело содержит последовательности VH и VL в SEQ ID NO 04, или 12, или 20, или 28, и SEQ ID NO 08, или 16, или 24, или 32, соответственно, включая посттрансляционные модификации этих последовательностей.
В одном из воплощений антибиотиновое антитело содержит такие VH, как в любом из указанных выше воплощений, и такие VL, как в любом из указанных выше воплощений. В одном из воплощений антитело содержит последовательности VH и VL в SEQ ID NO 36, или 44, или 52, или 60, и SEQ ID NO 40, или 48, или 56, или 64, соответственно, включая посттрансляционные модификации этих последовательностей.
В одном из воплощений антифлуоресцеиновое антитело содержит такие VH, как в любом из указанных выше воплощений, и такие VL, как в любом из указанных выше воплощений. В одном из воплощений антитело содержит последовательности VH и VL в SEQ ID NO 108 или 116 и SEQ ID NO 112 или 120, соответственно, включая посттрансляционные модификации этих последовательностей.
В одном из воплощений антитеофиллиновое антитело содержит такие VH, как в любом из указанных выше воплощений, и такие VL, как в любом из указанных выше воплощений. В одном из воплощений антитело содержит последовательности VH и VL в SEQ ID NO 68 или 76, или 84, или 92, и SEQ ID NO 72 или 80 или 88 или 96, соответственно, включая посттрансляционные модификации этих последовательностей.
Еще одной позицией, которая была определена как точка модификации, является позиция VH28 согласно нумерации Kabat.
Замена аминокислоты в позиции VH28 в соответствии с Kabat на цистеин образует производные антител с последовательностями вариабельной области тяжелой цепи, которые перечислены в SEQ ID NO 124 и 132 для антидигоксигенинового антитела-VH28C, SEQ ID NO 156 и 164 для антитеофиллинового антитела-VH28C, SEQ ID NO 140 и 148 для антибиотинового антитела VH28C, и SEQ ID NO 116 для антифлуоресцеинового антитела-VH28C.
Анализ ESI-MS показывает, что ковалентная конъюгация антитела с гаптенилированными терапевтическими пептидами приводит к образованию конъюгата определенного размера, который больше, чем размер антитела, не состоящего в комплексе, или пептида, не состоящего в комплексе.




Аффинность антитела
В некоторых воплощениях антитело само по себе, описанное в данном документе, или антитело в комплексе, описанном в данном документе, имеет константу диссоциации (Kd) менее или равно 10 нМ, менее или равно 1 нМ, менее или равно 0,1 нМ, менее или равно 0,01 нМ или менее или равно 0,001 нМ (например, примерно 10-8 М или менее, например, от примерно 10-8 М до примерно 10-13 М, например, от примерно 10-9 М до примерно 10-13 М).
В одном воплощении Kd определяется в анализе связывания антигена радиоактивной меткой (radiolabeled antigen binding assay, RIA), выполняемом с Fab-версией антитела, представляющего интерес, и его антигеном, как описано далее. Аффинность связывания Fab в растворе с антигеном измеряется путем уравновешивания Fab с минимальной концентрацией (125I)-меченого антигена в присутствии серии титров немеченого антигена, затем захвата связанного антигена на покрытом анти-Fab-антителом планшете (см., например, Chen, Y. et al., J. Mol. Biol. 293 (1999) 865-881). Чтобы создать условия для анализа, многолуночные планшеты MICROTITER® (Thermo Scientific) покрывали в течение ночи анти-Fab-антителом захвата (Cappel Labs) в концентрации 5 мкг/мл в 50 мМ растворе карбоната натрия (рН 9,6), а затем блокировали 2% (вес/объем) бычьим сывороточным альбумином в PBS в течение 2-5 часов при комнатной температуре (примерно 23°С). В неадсорбирующем планшете (Nunc №269620) смешивали 100 пМ или 26 пМ [125I]-антиген с серийными разведениями Fab, представляющего интерес (например, в соответствии с оценкой анти-VEGF-антитела, Fab-12, в Presta, L.G. et al., Cancer Res. 57 (1997) 4593-4599). Затем Fab, представляющий интерес, инкубировали в течение ночи; тем не менее, инкубация может продолжаться в течение более долгого периода (например, примерно 65 часов), чтобы гарантировать достижение равновесия. После этого смеси переносили в планшет для захвата и инкубировали при комнатной температуре (например, в течение одного часа). Затем раствор удаляли и планшет промывали восемь раз с помощью 0,1% полисорбата 20 (Tween-20®) в PBS. Когда планшеты высыхали, в них добавляли 150 мкл/лунка сцинтиллянта (MICROSCINT-20™; Packard), и проводили анализ на гамма-счетчике TOPCOUNT™ (Packard) в течение 10 минут. Концентрации каждого Fab, которые давали 20% от максимального связывания или меньше, выбирали для применения в анализах конкурентного связывания.
В соответствии с другим воплощением величину Kd определяли с помощью поверхностного плазмонного резонанса с использованием BIACORE®-2000 или BIACORE®-3000 (BIAcore, Inc., Пискатавэй, Нью-Джерси) при 25°С на СМ5-чипах с иммобилизованным антигеном в количестве примерно 10 единиц ответа (RU). Вкратце, биосенсорный чип с карбоксиметилированным декстраном (СМ5, BIACORE, Inc) активировали N-этил-N'-(3-диметиламинопропил)карбодиимида гидрохлоридом (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями производителя. Антиген разводили в 10 мМ растворе ацетата натрия, рН 4,8, до концентрации 5 мкг/мл (примерно 0,2 мкМ) перед введением со скоростью потока 5 мкл/мин для достижения примерно 10 единиц ответа (RU) связанного белка. После введения антигена вводили 1 М этаноламин для блокировки непрореагировавших групп. Для кинетических измерений двукратные серийные разведения Fab (от 0,78 нМ до 500 нМ) вводили в PBS с 0,05% поверхностно-активного вещества полисорбата 20 (TWEEN-20™) (PBST) при 25°С со скоростью потока примерно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) рассчитывали с помощью простой модели связывания Ленгмюра 1:1 (программное обеспечение BIACORE® Evaluation Software версии 3.2) путем одновременной подгонки сенсограмм ассоциации и диссоциации. Константу равновесия диссоциации (Kd) рассчитывали как отношение koff/kon (см., например, Chen, Y. et al., J. Mol. Biol. 293 (1999) 865-881). Если on-скорость превышала 106 M-1 с-1 в анализе поверхностного плазмонного резонанса, описанном выше, то on-скорость могла быть определена с помощью методики тушения флуоресценции, которая измеряет увеличение или уменьшение интенсивности флуоресцентного излучения (возбуждение =295 нм; эмиссия =340 нм; 16 нм полосовой фильтр) при 25°С с 20 нМ антитела против антигена (Fab-форма) в PBS, рН 7,2, в присутствии возрастающих концентраций антигена, измеряемых спектрометром, таком как спектрофотометр, оборудованный системой быстрого смешивания, с последующей остановкой (stop-flow) (Aviv Instruments) или спектрофотометр SLM-AMINCO™ серии 8000 (ThermoSpectronic) со встряхивающейся кюветой.
Фрагменты антител
В некоторых воплощениях специфичность связывания в конъюгате, описанном в данном документе, представляет собой фрагмент антитела. Фрагменты антител включают, но не ограничиваясь ими, Fab-, Fab'-, Fab'-SH-, F(ab')2-, Fv- и scFv-фрагменты, а также другие фрагменты, описанные ниже. Обзор определенных фрагментов антител см. в Hudson, P.J. et al., Nat. Med. 9 (2003) 129-134. Обзор scFv-фрагментов см., например, в Plueckthun, A., In; The Pharmacology of Monoclonal Antibodies, Vol. 113, Rosenburg and Moore (eds.), Springer-Verlag, New York (1994), pp. 269-315; см. также WO 93/16185; и в патентах США №№5571894 и 5587458. Для обсуждения Fab- и Р(ab')2-фрагментов, содержащих рецепторсвязывающие антигенные детерминанты реутилизации и имеющих повышенный период полужизни in vivo, см. патент США №5869046.
Димерные антитела представляют собой фрагменты антител с двумя антигенсвязывающими сайтами, которые могут быть двухвалентными или биспецифическими. См., например, ЕР 0404097; WO 1993/01161; Hudson, P.J. et al., Nat. Med. 9 (2003) 129-134; и Holliger, P. et al., Proc. Natl. Acad. Sci. USA 90 (1993) 6444-6448. В Hudson, P.J. et al., Nat. Med. 9 (2003) 129-134) также описаны тримерные и тетрамерные антитела.
Однодоменные антитела представляют собой фрагменты антител, содержащие все или часть вариабельных доменов тяжелой цепи или все или часть вариабельных доменов легкой цепи антитела. В некоторых воплощениях однодоменное антитело является человеческим однодоменным антителом (Domantis, Inc., Уолтем, Массачусетс; см., например, US 6248516).
Фрагменты антител могут быть получены с помощью различных методик, включая, но не ограничиваясь ими, протеолитическое расщепление интактного антитела, а также продукцию рекомбинантными клетками-хозяевами (например, Е. coli или фагом), как описано в данном документе.
Химерные и гуманизированные антитела
В некоторых воплощениях антитело в конъюгате, представленном в данном документе, является химерным антителом. Некоторые химерные антитела описаны, например, в US 4816567; и в Morrison, S.L. et al., Proc. Natl. Acad. Sci. USA 81 (1984) 6851-6855. В одном примере химерное антитело содержит нечеловеческую вариабельную область (например, вариабельную область, полученную от мыши, крысы, хомяка, кролика или примата, например, обезьяны) и человеческую константную область. В другом примере химерное антитело представляет собой антитело "с переключением класса", в котором класс или подкласс был изменен в сравнении с родительским антителом. Химерные антитела включают их антигенсвязывающие фрагменты.
В некоторых воплощениях химерное антитело представляет собой гуманизированное антитело. Как правило, нечеловеческое антитело гуманизируют, чтобы уменьшить иммуногенность для людей, сохраняя при этом специфичность и аффинность родительского нечеловеческого антитела. Как правило, гуманизированное антитело содержит один или более чем один вариабельный домен, в котором HVR, например, CDR (или их части), получены из нечеловеческого антитела, a FR (или их части) получены из последовательностей человеческого антитела. Гуманизированное антитело, возможно, также будет содержать по меньшей мере часть человеческой константной области. В некоторых воплощениях некоторые FR-остатки в гуманизированном антителе замещают соответствующими остатками из нечеловеческого антитела (например, антитела, из которого получены HVR-остатки), например, для восстановления или повышения специфичности или аффинности антитела.
Гуманизированные антитела и способы их получения приведены, например, в Almagro, J.С. and Fransson, J., Front. Biosci. 13 (2008) 1619-1633, а также описаны, например, в Riechmann, I. et al., Nature 332 (1988) 323-329; Queen, C. et al., Proc. Natl. Acad. Sci. USA 86 (1989) 10029-10033; патентах США №№5821337, 7527791, 6982321 и 7087409; Kashmiri, S.V. et al., Methods 36 (2005) 25-34 (описывает прививание SDR (a-CDR)); Padlan, E.A., Mol. Immunol. 28 (1991) 489-498 (описывает "перекладку"); Dall'Acqua, W.F. et al., Methods 36 (2005) 43-60 (описывает "перетасовку FR"); и Osbourn, J. et al., Methods 36 (2005) 61-68 и Klimka, A. et al., Br. J. Cancer 83 (2000) 252-260 (описывают подход "направляемой селекции" к перетасовке FR).
Человеческие каркасные области, которые могут быть использованы для гуманизации, включают, но не ограничиваясь ими: каркасные области, выбранные с помощью методики "наилучшего соответствия" (см., например, Sims, M.J. et al., J. Immunol. 151 (1993) 2296-2308); каркасные области, полученные из консенсусной последовательности человеческих антител конкретной подгруппы вариабельных областей легкой или тяжелой цепей (см., например, Carter, P. et al., Proc. Natl. Acad. Sci. USA 89 (1992) 4285-4289; и Presta, L.G. et al., J. Immunol. 151 (1993) 2623-2632); человеческие зрелые (соматически мутантные) каркасные области или человеческие зародышевые каркасные области (см., например, Almagro, J.С. and Fransson, J., Front. Biosci. 13 (2008) 1619-1633); и каркасные области, полученные при скрининге FR-библиотеки (см., например, Baca, М. et al., J. Biol. Chem. 272 (1997) 10678-10684, и Rosok, M.J. et al., J. Biol. Chem. 271 (19969 22611-22618).
Человеческие антитела
В некоторых воплощениях антитело в конъюгате, представленном в данном документе, является человеческим антителом. Человеческие антитела могут быть получены с помощью различных методик, известных в данной области. Человеческие антитела в целом описаны в van Dijk, М.А. and van de Winkel, J.G., Curr. Opin. Pharmacol. 5 (2001) 368-374 и Lonberg, N., Curr. Opin. Immunol. 20 (2008) 450-459.
Человеческие антитела могут быть получены путем введения иммуногена трансгенному животному, которое было модифицировано таким образом, чтобы продуцировать интактные человеческие антитела или интактные антитела с человеческими вариабельными областями в ответ на антигенную стимуляцию. Такие животные, как правило, содержат все или часть локусов человеческого иммуноглобулина, которые заменяют локусы эндогенного иммуноглобулина или которые присутствуют вне хромосом или интегрированы случайным образом в хромосомы животного. У таких трансгенных мышей эндогенные локусы иммуноглобулина, как правило, инактивированы. Обзор способов получения человеческих антител с помощью трансгенных животных см. в Lonberg, N., Nat. Biotech. 23 (2005) 1117-1125. См. также, например, US 6075181 и US 6150584, описывающие методику XENOMOUSE™; US 5770429, описывающий методику HUMAB®; US 7041870, описывающий методику K-М MOUSE®, и US 2007/0061900, описывающий методику VELOCIMOUSE®). Человеческие вариабельные области из интактных антител, полученные с помощью таких животных, могут быть дополнительно модифицированы, например, путем объединения с другой человеческой константной областью.
Человеческие антитела также могут быть получены с помощью методик на основании гибридом. Были описаны линии клеток человеческой миеломы и мышиной-человеческой гетеромиеломы для получения человеческих моноклональных антител (см., например, Kozbor, D., J. Immunol. 133 (1984) 3001-3005; Brodeur, B.R. et al., Monoclonal Antibody Production Techniques and Applications, Marcel Dekker, Inc., New York (1987), pp. 51-63; и Boerner, P. et al., J. Immunol. 147 (1991) 86-95). Человеческие антитела, полученные с помощью человеческой В-клеточной гибридомной методики, также описаны в Li, J. et al., Proc. Natl. Acad. Sci. USA 103 (2006) 3557-3562. Дополнительные методики включают те, которые описаны, например, в патенте США №7189826 (описывает продукцию моноклональных человеческих антител IgM на гибридомных клеточных линиях) и Ni, J., Xiandai Mianyixue 26 (2006) 265-268 (описывает человек-человеческие гибридомы). Методика человеческих гибридом (методика триомы) также описана в Vollmers, Н.Р. and Brandlein, S., Histology and Histopathology 20 (2005) 927-937 и в Vollmers, Н.Р. and Brandlein, S., Methods and Findings in Experimental and Clinical Pharmacology 27 (2005) 185-191.
Человеческие антитела также могут быть получены путем выделения последовательностей вариабельных областей Fv-клонов, выбранных из библиотек фагового дисплея человеческого происхождения. Такие последовательности вариабельного домена затем могут быть объединены с нужным человеческим константным доменом. Методики отбора человеческих антител из библиотек антител описаны ниже.
Антитела, полученные из библиотек
Антитела в конъюгате, описанном в данном документе, могут быть выделены путем скрининга комбинаторных библиотек на антитела с нужной активностью или активностями. Например, в данной области известны различные способы создания библиотек фагового дисплея и скрининга таких библиотек антител, обладающих желаемыми характеристиками связывания. Такие методики описаны, например, в Hoogenboom, H.R. et al., Methods in Molecular Biology 178 (2001) 1-37, а также, например, the McCafferty, J. et al., Nature 348 (1990) 552-554; Clackson, T. et al., Nature 352 (1991) 624-628; Marks, J.D. et al., J. Mol. Biol. 222 (1992) 581-597; Marks, J.D. and Bradbury, A., Methods in Molecular Biology 248 (2003) 161-175; Sidhu, S.S. et al., J. Mol. Biol. 338 (2004) 299-310; Lee, C.V. et al., J. Mol. Biol. 340 (2004) 1073-1093; Fellouse, F.A., Proc. Natl. Acad. Sci. USA 101 (2004) 12467-12472; и Lee, C.V. et al., J. Immunol. Methods 284 (2004) 119-132.
В некоторых методиках фагового дисплея репертуар VH- и VL-генов отдельно клонировали с помощью полимеразной цепной реакции (ПЦР) и рекомбинировали в случайном порядке в фаговые библиотеки, которые затем могут быть подвергнуты скринингу в отношении антигенсвязывающего фага, как описано в Winter, G. et al., Ann. Rev. Immunol. 12 (1994) 433-455. Фаг, как правило, представляет фрагменты антитела либо как одноцепочечные Fv-фрагменты (scFv), либо как Fab-фрагменты. Библиотеки из иммунизированных источников обеспечивают высокоаффинные антитела к иммуногену без необходимости конструирования гибридом. Альтернативно, может быть клонирован наивный репертуар (например, от человека), чтобы получить единый источник антител к широкому спектру чужих, а также собственных антигенов без какой-либо иммунизации, как описано в Griffiths, A.D. et al., EMBO J. 12 (1993) 725-734. Наконец, наивные библиотеки также могут быть получены синтетически путем клонирования неперестроенных сегментов V-гена из стволовых клеток и с использованием ПЦР-праймеров, содержащих случайную последовательность для кодирования высоко вариабельных CDR3-областей и для выполнения перестройки in vitro, как описано Hoogenboom, H.R. and Winter, G., J. Mol. Biol. 227 (1992) 381-388. Патентные публикации, описывающие фаговые библиотеки человеческих антител, включают, например: US 5,750,373 и US 2005/0079574, US 2005/0119455, US 2005/0266000, US 2007/0117126, US 2007/0160598, US 2007/0237764, US 2007/0292936 и US 2009/0002360.
Антитела или фрагменты антител, выделенные из библиотек человеческих антител, считаются в данном документе человеческими антителами или фрагментами человеческих антител.
Форматы антител
Описанные выше антитела и фрагменты антител можно объединить множеством различных способов для создания различных форматов антител.
Например, один или более чем один из scFv-фрагментов антитела может быть слит с С-концом одной или более чем одной из полипептидных цепей полного антитела. В частности, scFv-фрагмент антитела может быть слит с С-концом каждой тяжелой цепи или с С-концом каждой легкой цепи.
Например, один или более чем один из Fab-фрагментов антитела может быть слит с С-концом одной или более чем одной из полипептидных цепей полного антитела. В частности, Fab-фрагмент антитела может быть слит с С-концом каждой тяжелой цепи или с С-концом каждой легкой цепи.
Например, один scFv и один Fab-фрагмент антитела может быть слит с N-концами Fc-области антитела.
Например, один scFv или Fab-фрагмент антитела может быть слит с N-концом Fc-области антитела, и один scFv или Fab-фрагмент антитела может быть слит с С-концом соответствующей другой цепи Fc-области антитела.
Мультиспецифические антитела
В недавнем прошлом было разработано широкое разнообразие форматов рекомбинантных антител, например, тетравалентные биспецифические антитела, путем слияния, например, формата антитела IgG и одноцепочечных доменов (см., например, Coloma, M.J., et al., Nature Biotech. 15 (1997) 159-163; WO 2001/077342; и Morrison, S.L., Nature Biotech. 25 (2007) 1233-1234).
Также было разработано несколько других форматов, в которых осевая структура антитела (IgA, IgD, IgE, IgG или IgM) уже не сохранялась, например, димерные, тримерные или тетрамерные антитела, миниантитела, несколько одноцепочечных форматов (scFv, бис-scFv), которые способны связывать два или более двух антигенов (Holliger, P., et al., Nature Biotech. 23 (2005) 1126-1136; Fischer, N.,

Все такие форматы используют линкеры либо для слияния остова антитела (IgA, IgD, IgE, IgG или IgM) с другим связывающим белком (например, scFv), либо для слияния, например, двух Fab-фрагментов или scFv (Fischer, N., and

В WO 2007/024715 описаны иммуноглобулины с двойным вариабельным доменом в качестве сконструированных поливалентных и мультиспецифических связывающих белков. Способ получения биологически активных димеров антител описан в US 6897044. Поливалентная конструкция Fv-антитела, имеющая по меньшей мере четыре вариабельных домена, которые связаны друг с другом через пептидные линкеры, описана в US 7129330. Димерные и многомерные антигенсвязывающие структуры представлены в US 2005/0079170. Трех- или четырехвалентный моноспецифичный антигенсвязывающий белок, содержащий три или четыре Fab-фрагмента, связанных друг с другом ковалентно с помощью связывающей структуры, который не является природным иммуноглобулином, описан в US 6511663. В WO 2006/020258 описаны четырехвалентные биспецифические антитела, которые могут быть эффективно экспрессированы в прокариотических и эукариотических клетках и могут быть использованы в терапевтических и диагностических способах. Способ выделения или, предпочтительно, синтеза димеров, которые связаны по меньшей мере одной межцепочечной дисульфидной связью, от димеров, которые не связаны по меньшей мере одной межцепочной дисульфидной связью, из смеси, содержащей два типа полипептидных димеров, описан в US 2005/0163782. Биспецифические четырехвалентные рецепторы описаны в US 5959083. Сконструированные антитела с тремя или более функциональными антигенсвязывающими сайтами описаны в WO 2001/077342.
Мультиспецифические и поливалентные антигенсвязывающие полипептиды описаны в WO 1997/001580. В WO 1992/004053 описаны гомоконъюгаты, как правило, полученные из моноклональных антител класса IgG, которые связываются с той же антигенной детерминантой, ковалентно связанной путем синтетического сшивания. Олигомерные моноклональные антитела с высокой авидностью в отношении антигена описаны в WO 1991/06305, где олигомеры, как правило, класса IgG, секретируются с двумя или более иммуноглобулиновыми мономерами, связанными вместе, с формированием четырехвалентных или шестивалентных IgG-молекул. В US 6350860 описаны конструкции овечьих антител и сконструированных антител, которые могут быть использованы для лечения заболеваний, в которых активность интерферона-гамма является патогенной. В US 2005/0100543 представлены доступные для нацеливания конструкции, которые являются поливалентными носителями биспецифических антител, т.е. каждая молекула конструкции, доступной для нацеливания, может служить в качестве носителя двух или более биспецифических антител. Генетически сконструированные биспецифические четырехвалентные антитела описаны в WO 1995/009917. В WO 2007/109254 описаны стабилизированные связывающие молекулы, состоящие из или содержащие стабилизированный scFv.
В некоторых воплощениях антитело, представленное в данном документе, или антитело в конъюгате является мультиспецифическим антителом, например, биспецифическим антителом. Мультиспецифические антитела представляют собой моноклональные антитела, которые обладают специфичностью связывания по меньшей мере с двумя различными сайтами. В некоторых воплощениях одна из специфичностей связывания является специфичностью для гаптена, а другая для любого другого (негаптенового) антигена. Биспецифические антитела также могут быть использованы для локализации цитотоксических агентов на клетках. Биспецифические антитела могут быть получены в виде полноразмерных антител или фрагментов антител.
Методики изготовления мультиспецифических антител включают, но не ограничиваясь ими, рекомбинантную коэкспрессию двух пар тяжелых цепей и легких цепей иммуноглобулина, имеющих различные специфичности (см. Milstein, С. and Cuello, А.С., Nature 305 (1983) 537-540, WO 93/08829, и Traunecker, A. et al., EMBO J. 10 (1991) 3655-3659), и инженерию типа "ключ в замке" (см., например, патент США №5731168). Мультиспецифические антитела также могут быть получены за счет использования инженерных электростатических перемешивающих влияний для изготовления Fc-гетеродимерных молекул (WO 2009/089004); поперечного сшивания двух или более антител или фрагментов (см., например, патент США №4676980, и Brennan, М. et al., Science 229 (1985) 81-83); использования лейциновых застежек для получения биспецифических антител (см., например, Kostelny, S.A. et al., J. Immunol. 148 (1992) 1547-1553); использования методики "димерного антитела" для изготовления фрагментов биспецифических антител (см., например, Holliger, P. et al., Proc. Natl. Acad. Sci. USA 90 (1993) 6444-6448); и использования одноцепочечных Fv-димеров (sFv) (см., например, Gruber, М et al., J. Immunol. 152 (1994) 5368-5374); и получения триспецифических антител, как описано, например, в Tutt, A. et al., J. Immunol. 147 (1991) 60-69).
В одном воплощении СН3-домены тяжелой цепи биспецифического антитела изменены по методике "ключ в замке", которая подробно описана в нескольких примерах, например, в WO 96/027011, WO 98/050431, Ridgway, J.В., et al., Protein Eng. 9 (1996) 617-621; Merchant, A.M., et al., Nat Biotechnol 16 (1998) 677-681. В этом способе взаимодействующие поверхности двух СН3-доменов изменены таким образом, чтобы увеличить гетеродимеризацию обеих тяжелых цепей, содержащих эти два СН3-домена. Каждый из двух СН3-доменов (двух тяжелых цепей) может быть "ключом", а другой "замком". Введение дисульфидного мостика стабилизирует гетеродимеры (Merchant, A.M., et al., Nature Biotech 16 (1998) 677-681; Atwell, S., et al., J. Mol. Biol. 270 (1997) 26-35) и увеличивает выход.
В одном воплощении всех аспектов биспецифическое антитело характеризуется тем, что
- СН3-домен одной тяжелой цепи и СН3-домен другой тяжелой цепи встречаются на контактной поверхности, которая включает исходную контактную поверхность между СН3-доменами антитела;
где указанная контактная поверхность изменена таким образом, чтобы способствовать формированию биспецифического антитела, где изменение характеризуется тем, что
a) СН3-домен одной тяжелой цепи изменен так,
что в исходной контактной поверхности СН3-домена одной тяжелой цепи, которая встречается с исходной контактной поверхностью СН3-домена другой тяжелой цепи в биспецифическом антителе,
аминокислотный остаток заменен аминокислотным остатком, имеющим больший объем боковой цепи, тем самым формируя выступ в контактной поверхности СН3-домена одной тяжелой цепи, который может быть расположен в полости на контактной поверхности СН3-домена другой тяжелой цепи
и
b) СН3-домен другой тяжелой цепи изменен так,
что в исходной контактной поверхности второго СН3-домена, которая встречается с исходной контактной поверхностью первого СН3-домена в биспецифическом антителе,
аминокислотный остаток заменен на аминокислотный остаток, имеющий меньший объем боковой цепи, тем самым формируя полость в контактной поверхности второго СН3-домена, в которой может быть расположен выступ на контактной поверхности первого СН3-домена.
Таким образом, антитела, описанные в данном документе, в одном из воплощений характеризуются тем, что
- СН3-домен первой тяжелой цепи полноразмерного антитела и СН3-домен второй тяжелой цепи полноразмерного антитела встречаются на контактной поверхности, которая содержит изменение в исходной контактной поверхности между СН3-доменами антитела;
где i) в СН3-домене первой тяжелой цепи
аминокислотный остаток заменен аминокислотным остатком, имеющим больший объем боковой цепи, тем самым формируя выступ в контактной поверхности СН3-домена одной тяжелой цепи, который может быть расположен в полости на контактной поверхности СН3-домена другой тяжелой цепи
и где ii) в СН3-домене второй тяжелой цепи
аминокислотный остаток заменен на аминокислотный остаток, имеющий меньший объем боковой цепи, тем самым формируя полость в контактной поверхности второго СН3-домена, в которой может быть расположен выступ на контактной поверхности первого СН3-домена.
В одном воплощении аминокислотный остаток, имеющий боковую цепь большего объема, выбран из группы, состоящей из аргинина (R), фенилаланина (F), тирозина (Y), триптофана (W).
В одном воплощении аминокислотный остаток, имеющий боковую цепь меньшего объема, выбран из группы, состоящей из аланина (А), серина (S), треонина (Т), валина (V).
В одном воплощении оба СН3-домена также изменены путем введения цистеина (С) в качестве аминокислоты в соответствующих позициях каждого СН3-домена, так что между двумя СН3-доменами может быть сформирован дисульфидный мостик.
В одном воплощении биспецифическое антитело содержит мутацию T366W в СН3-домене "цепи-ключа" и мутации T366S, L368A, Y407V в СН3-домене "цепи-замка". Также может быть использован дополнительный межцепочечный дисульфидный мостик между СН3-доменами (Merchant, А.М, et al., Nature Biotech 16 (1998) 677-681), например, путем введения мутации Y349C в СН3-домен "цепи-ключа" и мутации Е356С или мутации S354C в СН3-домен "цепи-замка" (нумерация в соответствии с ЕС-индексом согласно Kabat et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991)).
В одном воплощении биспецифическое антитело содержит мутации Y349C, T366W в одном из двух СН3-доменов и мутации Е356С, T366S, L368A, Y407V в другом из двух СН3-доменов. В одном воплощении биспецифическое антитело содержит мутации Y349C, T366W в одном из двух СН3-доменов и мутации S354C, T366S, L368A, Y407V в другом из двух СН3-доменов (дополнительная мутация Y349C в одном СН3-домене и дополнительная мутация Е356С или S354C в другом СН3-домене для формирования межцепочечного дисульфидного мостика) (нумерация в соответствии с ЕС-индексом Kabat; (Kabat, Е.А., et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991))). Альтернативно или дополнительно, также могут быть использованы и другие методики типа "ключ в замке", такие как описанные в ЕР 1870459А1. Другим примером биспецифического антитела являются мутации R409D; K370E в СН3-домене "цепи-ключа" и мутации D399K; E357K в СН3-домене "цепи-замка" (нумерация в соответствии с ЕС-индексом Kabat; (Kabat, Е.А., et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991))).
В одном воплощении биспецифическое антитело содержит мутацию T366W в СН3-домене "цепи-ключа" и мутации T366S, L368A, Y407V в СН3-домене "цепи-замка", и дополнительно мутации R409D; K370E в СН3-домене "цепи-ключа" и мутации D399K; E357K в СН3-домене "цепи-замка".
В одном воплощении биспецифическое антитело содержит мутации Y349C, T366W в одном из двух СН3-доменов и мутации S354C, T366S, L368A, Y407V в другом из двух СН3-доменов, или биспецифическое антитело содержит мутации Y349C, T366W в одном из двух СН3-доменов и мутации S354C, T366S, L368A, Y407V в другом из двух СН3-доменов, и дополнительно мутации R409D; K370E в СН3-домене "цепи-ключа" и мутации D399K; E357K в СН3-домене "цепи-замка". Такие мутации типа "ключа" и "замка" в СН3-домене, как правило, используются в человеческих константных областях тяжелой цепи SEQ ID NO 169, SEQ ID NO 170, SEQ ID NO 171 или SEQ ID NO 172 (человеческие аллотипы подкласса lgG1 (европейцы и афроамериканцы или мутанты L234A/L235A, и L234A/L235A/P329G), SEQ ID NO 173, SEQ ID NO 174 или SEQ ID NO 175 (человеческий подкласс IgG4 или мутанты S228P, L235E и S228P/L235E/P329G) (нумерация в соответствии с ЕС-индексом согласно Kabat et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991).
В одном воплощении биспецифическое антитело содержит человеческие константные области тяжелой цепи SEQ ID NO 169, SEQ ID NO 170, SEQ ID NO 171 или SEQ ID NO 172, SEQ ID NO 173, SEQ ID NO 174 или SEQ ID NO 175, также включающие такие мутации типа "ключа" и "замка" в СН3-домене (например, мутации Y349C, T366W в одном из двух СН3-доменов и мутации S354C, T366S, L368A, Y407V в другом из двух СН3-доменов) (нумерация в соответствии с ЕС-индексом согласно Kabat et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991).
Разработанные антитела с тремя и более чем тремя функциональными антигенсвязывающими сайтами, в том числе "антитела Octopus", также включены в данный документ (см., например, US 2006/0025576).
Антитело или фрагмент в данном документе также включает "Fab двойного действия", или "DAF" (Dual Acting Fab), содержащий антигенсвязывающий сайт, который связывается с гаптеном, а также с другим, отличным от него, антигеном (см. US 2008/0069820, например).
Антитело или фрагмент в данном документе также включает мультиспецифические антитела, описанные в WO 2009/080251, WO 2009/080252, WO 2009/080253, WO 2009/080254, WO 2010/112193, WO 2010/115589, WO 2010/136172, WO 2010/145792 и WO 2010/145793.
В одном воплощении первая специфичность связывания биспецифического антитела относится к гаптену, а вторая специфичность связывания относится к негаптеновому антигену. В одном воплощении негаптеновый антиген выбран среди лейкоцитарных маркеров, CD2, CD3, CD4, CD5, CD6, CD7, CD8, CD11a,b,c, CD13, CD14, CD18, CD19, CD22, CD23, CD27 и его лиганда, CD28 и его лигандов В7.1, В7.2, В7.3, CD29 и его лиганда, CD30 и его лиганда, CD40 и его лиганда, gp39, CD44, CD45 и изоформ, CD56, CD58, CD69, CD72, CTLA-4, LFA-1 и TCR; антигенов гистосовместимости, МНС класса I или II, антигенов Льюиса Y, SLex, SLey, SLea и SLeb; интегринов, VLA-1, VLA-2, VLA-3, VLA-4, VLA-5, VLA-6, αVβ3 и LFA-1, Мас-1 и p150,95, αVβ1, gpIIbIIIa, αR β3, α6β4, αVβ5, αVβ6 и αV 62 7; селектинов, L-селектина, Р-селектина и Е-селектина и их связывающих рецепторов VCAM-1, ICAM-1, ICAM-2 и LFA-3; интерлейкинов, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14 и IL-15; рецепторов интерлейкинов, выбранных из группы, состоящей IL-1R, IL-2R, IL-3R, IL-4R, IL-5R, IL-6R, IL-7R, IL-8R, IL-9R, IL-10R, IL-11R, IL-12R, IL-13R, IL-14R и IL-15R; хемокинов, выбранных из группы, состоящей из PF4, RANTES, MIP1α, МСР1, NAP-2, Groα, Groβ и IL-8; факторов роста, выбранных из группы, состоящей из TNF-альфа, TGF-бета, TSH, VEGF/VPF, VEGFA, VEGFB, VEGF111, VEGF121, VEGF165, VEGF189, VEGF206, PTHrP, семейства EGF, семейства PDGF, эндотелина, фиброзина (FSF-1), человеческого ламинина и гастрин-высвобождающего пептида (GRP), PLGF, HGH, HGHR; рецепторов факторов роста, выбранных из группы, состоящей из TNF-альфа-R, RGF-бета-R, TSHR, VEGFR/VPFR, EGFR, PTHrPR, семейства PDGFR, EPO-R, GCSF-R и других гемопоэтических рецепторов; рецепторов интерферона, выбранных из группы, состоящей из IFNCαR, IFNβR и IFNλR; Ig и его рецепторов, выбранных из группы, состоящей из IgE, FcγRI и FcγRII; опухолевых антигенов, выбранных из группы, состоящей из her2-neu, муцина, СЕА и эндосиалина; аллергенов, выбранных из группы, состоящей из антигена клеща домашней пыли, антигенов lol р1 (трава) и урушиола; вирусных полипептидов, выбранных из группы, состоящей из CMV-гликопротеинов В, Н и gCIII, оболочечных гликопротеинов HIV-1, оболочечных гликопротеинов RSV, оболочечных гликопротеинов HSV, оболочечных гликопротеинов HPV, поверхностных антигенов семейства гепатитов; токсинов, выбранных из группы, состоящей из псевдомонадного эндотоксина и остеопонтина/уропонтина, змеиного яда, яда пауков, конотоксина и пчелиного яда; факторов крови, выбранных из группы, состоящей из комплемента C3b, комплемента С4а, комплемента C4b-9, резус-фактора, фибриногена, фибрина и миелин-связанного ингибитора роста; и ферментов, выбранных из группы, состоящей из полипептида, переносящего эфиры холестерина, мембраносвязанных матричных металлопротеиназ и декарбоксилазы глутаминовой кислоты (GAD).
Варианты антител
В некоторых воплощениях рассматриваются варианты аминокислотных последовательностей антител, представленных в данном документе. Например, может быть желательным улучшение аффинности связывания и/или других биологических свойств антитела. Варианты аминокислотной последовательности антитела могут быть получены путем внесения соответствующих модификаций в нуклеотидную последовательность, кодирующую антитело, или путем пептидного синтеза. Такие модификации включают, например, делеции и/или вставки и/или замены остатков в аминокислотных последовательностях антитела. Можно использовать любую комбинацию делеций, вставок и замен, чтобы получить конечную конструкцию, при условии, что конечная конструкция обладает нужными характеристиками, например, связыванием антигена.
а) Варианты с заменой, вставкой и делецией
В некоторых воплощениях предложены варианты антител, имеющие одну или более чем одну аминокислотную замену. Сайты для мутагенеза путем замен, представляющие интерес, включают HVR и FR. Аминокислотные замены могут быть введены в антитело, представляющее интерес, и продукты могут быть проверены на желаемую активность, например, на сохранившееся/улучшенное связывание антигена, снижение иммуногенности или улучшение ADCC или CDC.
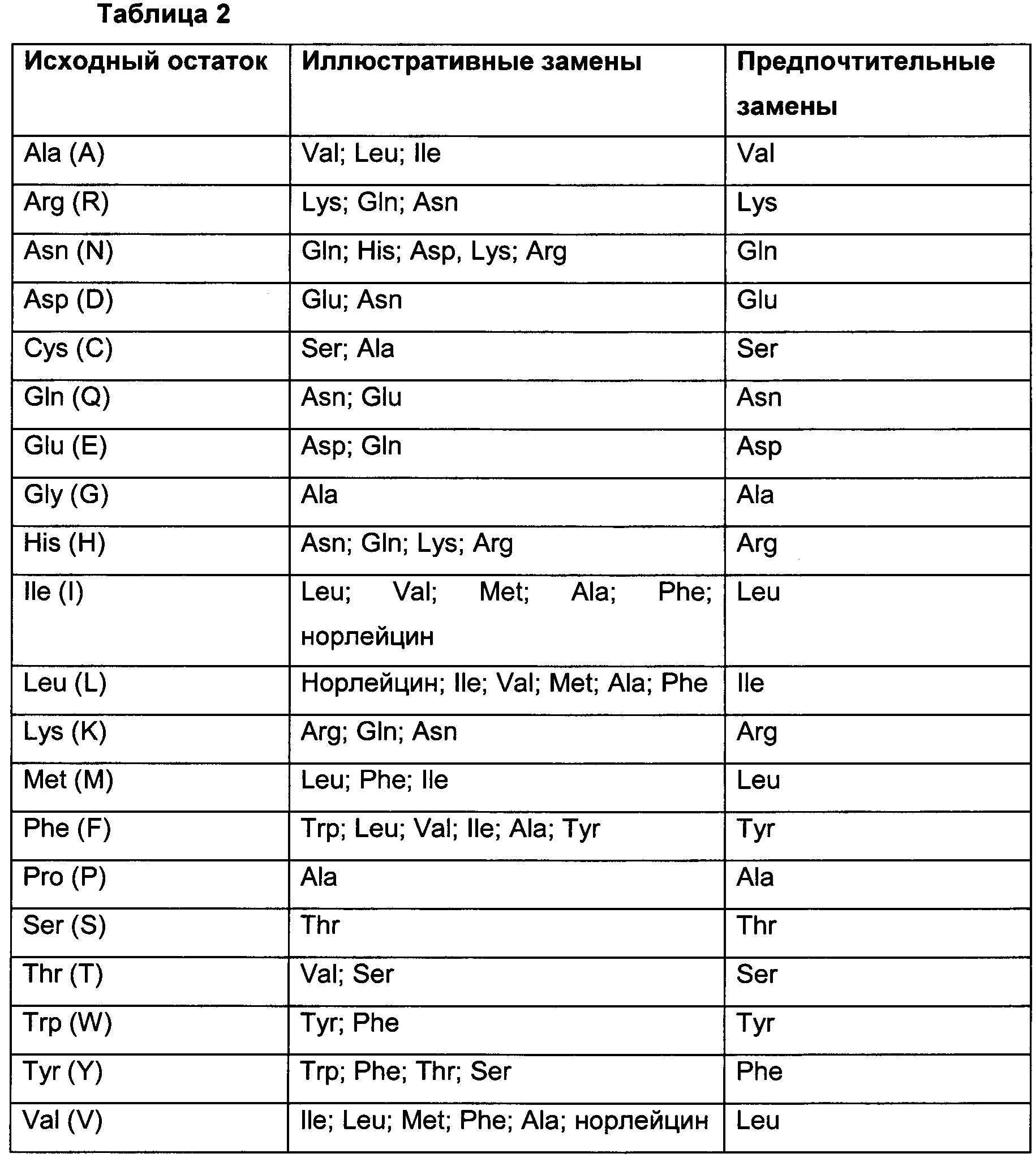
Аминокислоты могут быть сгруппированы в соответствии с общими свойствами боковой цепи:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислые: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены влекут за собой замену члена одного из этих классов на член другого класса.
Один тип варианта с заменой предполагает замену одного или более чем одного остатка гипервариабельной области родительского антитела (например, гуманизированного или человеческого антитела). Как правило, полученный вариант(ы), выбранный для дальнейшего изучения, будет иметь модификации (например, улучшения) в определенных биологических свойствах (например, повышенную аффинность, сниженную иммуногенность) относительно родительского антитела и/или будет иметь по существу сохранившиеся определенные биологические свойства родительского антитела. Примером варианта с заменой является антитело с созревшей аффинностью, которое можно легко получить, например, с помощью методик созревания аффинности на основе фагового дисплея, таких как описанные в данном документе. Вкратце, один или более чем один остаток HVR подвергается мутированию, и вариантные антитела выставляют на фаге и проверяют на конкретную биологическую активность (например, аффинность связывания).
Изменения (например, замены) могут быть сделаны в HVR, например, для улучшения аффинности антитела. Такие изменения могут быть сделаны в "горячих точках" HVR, т.е. в остатках, кодируемых кодонами, которые подвергаются мутации с высокой частотой в ходе процесса соматического созревания (см., например, Chowdhury, P.S., Methods Mol. Biol. 207 (2008) 179-196), и/или в SDR (a-CDR) с получением вариантного VH или VL, исследуемого на аффинность связывания. Созревание аффинности путем конструирования и повторного выбора из вторичных библиотек было описано, например, в Hoogenboom, H.R. et al. in Methods in Molecular Biology 178 (2002) 1-37. В некоторых воплощениях созревания аффинности разнообразие вводится в вариабельные гены, выбранные для созревания, с помощью любой из разнообразных методик (например, ПЦР с внесением ошибок, перестановки цепей или олигонуклеотид-направленного мутагенеза). Затем создается вторичная библиотека. Затем эту библиотеку подвергают скринингу для выявления любых вариантов антител с нужной аффинностью. Другой способ внесения разнообразия включает HVR-направленные подходы, в которых несколько остатков HVR (например, от 4 до 6 остатков за один раз) рандомизируют. HVR-остатки, участвующие в связывании антигена, могут быть конкретно выявлены, например, с помощью сканирующего аланином мутагенеза или моделирования. CDR3 тяжелой цепи и CDR3 легкой цепи, в частности, часто становятся мишенями.
В некоторых воплощениях замены, вставки или делеции могут возникать в одном или более чем одном HVR до тех пор, пока такие изменения не вызывают существенного снижения способности антитела связывать антиген. Например, консервативные изменения (например, консервативные замены, предложенные в данном документе), которые существенно не снижают аффинность связывания, могут быть сделаны в HVR. Такие изменения могут быть вне "горячих точек" HVR или SDR. В некоторых воплощениях вариантных VH- и VL-последовательностей, приведенных выше, каждый HVR либо не меняется, либо содержит не более чем одну, две или три аминокислотные замены.
Способ, который может быть использован для выявления остатков или областей антитела, которые могут быть мишенями мутагенеза, называется "сканирующим аланином мутагенезом" и описан в Cunningham and Wells (1989) Science, 244:1081-1085. В этом способе остаток или группа остатков-мишеней (например, заряженные остатки, такие как Arg, Asp, Lys, His и Glu) определяют и заменяют нейтральной или отрицательно заряженной аминокислотой (например, аланином или полиаланином), чтобы определить, влияют ли они на взаимодействие антитела с антигеном. В местах аминокислот, демонстрирующих функциональную чувствительность к первоначальным заменам, могут быть введены другие замены. Альтернативно или дополнительно определяют кристаллическую структуру комплекса "антиген-антитело" для выявления точек контакта между антителом и антигеном. Такие контактные остатки и соседние остатки могут стать мишенями или могут быть устранены в качестве кандидатов на замену. Варианты можно подвергнуть скринингу, чтобы определить, проявляют ли они нужные свойства.
Вставки в аминокислотную последовательность включают амино- и/или карбокси-концевые слияния длиной от одного остатка до полипептидов, содержащих сто или до остатков, а также вставки внутри последовательности длиной от одного или множества аминокислотных остатков. Примеры концевых вставок включают антитела с N-концевым остатком метионина. Другие варианты молекулы антитела со вставками включают слияние N- или С-конца антитела с ферментом (например, ADEPT) или полипептидом, который увеличивает время полужизни антитела в сыворотке.
b) Варианты гликозилирования
В некоторых воплощениях антитело, представленное в данном документе или содержащееся в конъюгате, описанном в данном документе, изменяют для увеличения или уменьшения степени, в которой антитело гликозилировано. Добавление к антителу или удаление сайтов гликозилирования может быть удобно проведено путем изменения аминокислотной последовательности таким образом, чтобы создавался или удалялся один или более чем один сайт гликозилирования.
Если антитело содержит Fc-область, то углевод, прикрепленный к ней, может быть изменен. Нативные антитела, продуцируемые клетками млекопитающих, обычно содержат разветвленный двухантенный олигосахарид, как правило, прикрепленный с помощью N-связи к Asn297 СН2-домена Fc-области. См., например, Wright, A. and Morrison, S.L., TIBTECH 15 (1997) 26-32). Олигосахарид может включать различные углеводы, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, прикрепленную к GlcNAc в "стволе" двухантенной олигосахаридной структуры. В некоторых воплощениях модификации олигосахаридов в антителе изобретения могут быть сделаны для того, чтобы получить варианты антитела с определенными улучшенными свойствами.
В одном воплощении предложены варианты антитела, имеющие углеводную структуру, в которой отсутствует фукоза, прикрепленная (напрямую или опосредованно) к Fc-области. Например, количество фукозы в таком антителе может составлять от 1% до 80%, от 1% до 65%, от 5% до 65% или от 20% до 40%. Количество фукозы определяется путем вычисления среднего количества фукозы в сахарной цепи на Asn297 по отношению к сумме всех гликоструктур, прикрепленных к Asn 297 (например, сложных, гибридных и высокоманнозных структур), измеренного путем масс-спектрометрии MALDI-TOF, как описано, например, в WO 2008/077546. Asn297 относится к остатку аспарагина, расположенному примерно в позиции 297 в Fc-области (ЕС-нумерация остатков Fc-области); тем не менее, Asn297 также может быть расположен в позиции примерно ±3 аминокислоты до или после позиции 297, т.е. между позициями 294 и 300, в связи с минорными изменениями последовательности в антителах. Такие варианты фукозилирования могут иметь улучшенные ADCC-функции (см., например, US 2003/0157108; US 2004/0093621). Примеры публикаций, связанных с "дефукозилированными" или "фукозодефицитными" вариантами антител, включают: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO 2005/053742; WO 2002/031140; Okazaki, A. et al., J. Mol. Biol. 336 (2004) 1239-1249; Yamane-Ohnuki, N. et al., Biotech. Bioeng. 87 (2004) 614-622. Примеры клеточных линий, способных продуцировать дефукозилированные антитела, включают СНО-клетки Lec13, дефицитные по белковому фукозилированию (Ripka, J. et al., Arch. Biochem. Biophys. 249 (1986) 533-545; US 2003/0157108; и WO 2004/056312, в частности, пример 11), и нокаутные клеточные линии, такие как СНО-клетки с нокаутом гена альфа-1,6-фукозилтрансферазы, FUT8 (см., например, Yamane-Ohnuki, N. et al., Biotech. Bioeng. 87 (2004) 614-622; Kanda, Y. et al., Biotechnol. Bioeng. 94 (2006) 680-688; и WO 2003/085107).
Также предложены варианты антител с олигосахаридами с симметричным разветвлением, например, в которых двухантенный олигосахарид, присоединенный к Fc-области антитела, разделен пополам посредством GlcNAc. Такие варианты антител могут обладать уменьшенным фукозилированием и/или улучшенной ADCC-функцией. Примеры таких вариантов антител описаны, например, в WO 2003/011878; патенте США №6602684, а также в US 2005/0123546. Также предусмотрены варианты антител по меньшей мере с одним остатком галактозы в олигосахариде, прикрепленном к Fc-области. Такие варианты антител могут обладать улучшенной CDC-функцией. Такие варианты антител описаны, например, в WO 1997/30087; WO 1998/58964; и WO 1999/22764.
с) варианты Fc-области
В некоторых воплощениях в Fc-область антитела, предложенного в данном документе, может быть введена одна или более чем одна аминокислотная модификация с получением, тем самым, варианта Fc-области. Вариант Fc-области может содержать последовательность человеческой Fc-области (например, человеческой Fc-области IgG1, IgG2, IgG3 или IgG4), содержащую аминокислотную модификацию (например, замену) в одной или более чем одной аминокислотной позиции.
В некоторых воплощениях изобретение предусматривает вариант антитела, который обладает некоторыми, но не всеми эффекторными функциями, что делает его желательным кандидатом для применений, в которых время полужизни антитела in vivo является важным, а еще некоторые эффекторные функции (такие как комплемент и ADCC) являются не необходимыми или вредными. Можно провести анализ цитотоксичности in vitro и/или in vivo, чтобы подтвердить уменьшение/истощение CDC- и/или ADCC-активности. Например, можно провести анализы Fc-рецепторного (FcR) связывания для того, чтобы убедиться, что антитело не связывает FcγR (и, следовательно, скорее всего не обладает ADCC-активностью), но сохраняет FcRn-связывающую способность. Первичные клетки для опосредования ADCC, NK-клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гемопоэтических клетках суммирована в таблице 3 на странице 464 в Ravetch, J.V. and Kinet, J.P., Annu. Rev. Immunol. 9 (1991) 457-492. Неограничивающие примеры анализов in vitro для оценки ADCC-активности молекулы, представляющей интерес, описаны в патенте США №5500362 (см., например, Hellstrom, I. et al., Proc. Natl. Acad. Sci. USA 83 (1986) 7059-7063; и Hellstrom, I. et al., Proc. Natl. Acad. Sci. USA 82 (1985) 1499-1502); патенте США №5821337 (см. Bruggemann, M. et al., J. Exp. Med. 166 (1987) 1351-1361). Альтернативно, могут быть использованы нерадиоактивные способы анализа (см., например, нерадиоактивный анализ цитотоксичности ACTI™ для проточной цитометрии (CellTechnology Inc., Маунтин-Вью, Калифорния); и нерадиоактивный анализ цитотоксичности CytoTox 96® (Promega, Мэдисон, Висконсин)). Используемые эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (РВМС) и натуральные киллеры (NK-клетки). Альтернативно или дополнительно ADCC-активность молекулы, представляющей интерес, можно оценить in vivo, например, на животной модели, такой как описана в Clynes, R. et al., Proc. Natl. Acad. Sci. USA 95 (1998) 652-656. Также можно выполнить анализы Clq-связывания, чтобы подтвердить, что антитело не может связывать C1q и, следовательно, не обладает CDC-активностью. См., например, C1q- и С3с-связывающий ELISA в WO 2006/029879 и WO 2005/100402. Для оценки активации комплемента можно выполнить анализ CDC (см., например, Gazzano-Santoro, Н. et al., J. Immunol. Methods 202 (1996) 163-171; Cragg, M.S. et al., Blood 101 (2003) 1045-1052; и Cragg, M.S. and M.J. Glennie, Blood 103 (2004) 2738-2743). Определение FcRn-связывания и клиренса/периода полужизни in vivo также можно проводить с использованием способов, известных в данной области (см., например, Petkova, S.B. et al., Int. Immunol. 18 (2006) 1759-1769).
Антитела со сниженной эффекторной функцией включают таковые с заменой одного или более чем одного из остатков Fc-области среди 238, 265, 269, 270, 297, 327 и 329 (патент США №6737056). Такие Fc-мутанты включают Fc-мутанты с заменами в двух или более аминокислотных позициях среди 265, 269, 270, 297 и 327, включая так называемый "DANA" Fc-мутант с заменой остатков 265 и 297 на аланин (патент США №7332581).
Описаны некоторые варианты антител с улучшенным или уменьшенным FcR-связыванием. (См., например, патент США №6737056; WO 2004/056312, и Shields, R.L. et al., J. Biol. Chem. 276 (2001) 6591-6604).
В некоторых воплощениях вариант антитела содержит Fc-область с одной или более чем одной аминокислотной заменой, которая улучшает ADCC, например, с заменами в позициях 298, 333 и/или 334 в Fc-области (ЕС-нумерация остатков).
В некоторых воплощениях в Fc-области сделаны изменения, которые приводят к измененному (т.е. повышенному или пониженному) C1q-связыванию и/или комплементзависимой цитотоксичности (CDC), например, как описано в патенте США №6194551, WO 99/51642 и в Idusogie, Е.Е. et al., J. Immunol. 164 (2000) 4178-4184.
Антитела с повышенным периодом полужизни и повышенным связыванием с неонатальным Fc-рецептором (FcRn), который отвечает за перенос материнских IgG к плоду (Guyer, R.L. et al., J. Immunol. 117 (1976) 587-593, и Kim, J.K. et al., J. Immunol. 24 (1994) 2429-2434), описаны в US 2005/0014934. Эти антитела содержат Fc-область с одной или более чем одной заменой, которая улучшает связывание Fc-области с FcRn. Такие Fc-варианты включают варианты с заменами в одном или более чем одном остатке Fc-области: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434, например, с заменой остатка 434 в Fc-области (патент США №7371826).
См. также Duncan, A.R. and Winter, G., Nature 322 (1988) 738-740; патент США №5648260; патент США №5624821 и WO 94/29351, касающиеся других примеров вариантов Fc-области.
d) Цистеин-инженерные варианты антител
В некоторых воплощениях может быть желательным создание цистеин-инженерных антител, например, "тиоМКА" ("thioMAbs"), в которых один или более чем один из остатков антитела замещен на остаток цистеина. В конкретных воплощениях замещенные остатки находятся в доступных сайтах антитела. При замещении этих остатков цистеином реактивные тиольные группы, таким образом, располагаются в доступных участках антитела и могут быть использованы для конъюгирования антитела с другими группировками, такими как лекарственные группировки или линкер-лекарственные группировки, для образования иммуноконъюгата, как описано далее. В некоторых воплощениях один или более чем один из следующих остатков может быть замещен цистеином: V205 (нумерация по Kabat) легкой цепи; А118 (ЕС-нумерация) тяжелой цепи; и S400 (ЕС-нумерация) Fc-области тяжелой цепи. Цистеин-инженерные антитела могут быть получены, как описано, например, в патенте США №7521541.
е) Производные антител
В некоторых воплощениях антитело, представленное в данном документе, может быть дополнительно модифицировано так, чтобы содержать дополнительные небелковые группировки, которые известны в данной области и легко доступны. Группировки, пригодные для дериватизации антитела, включают, но не ограничиваясь ими, водорастворимые полимеры. Неограничивающие примеры водорастворимых полимеров включают полиэтиленгликоль (ПЭГ), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимеры этилена/малеинового ангидрида, полиаминокислоты (гомополимеры или статистические сополимеры) и декстран или поли(н-винилпирролидон)полиэтиленгликоль, гомополимеры полипропиленгликоля, сополимеры полипропиленоксида/этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. Полиэтиленгликоля пропиональдегид может давать преимущества в производстве благодаря его стабильности в воде. Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Число полимеров, присоединенных к антителу, может варьировать, и если присоединено больше одного полимера, то они могут быть одинаковыми или различными молекулами. Как правило, число и/или тип полимеров, используемых для получения производных, может быть определен на основании соображений, включая, но не ограничиваясь ими, конкретные свойства или функции антитела, которые будут улучшены, будет ли использоваться производное антитела в терапии при определенных состояниях и т.д.
В другом воплощении предложены конъюгаты антитела и небелковой группировки, которая может селективно нагреваться при воздействии радиации. В одном воплощении небелковая группировка представляет собой углеродную нанотрубку (Kam, N.W. et al., Proc. Natl. Acad. Sci. USA 102 (2005) 11600-11605). Излучение может быть любой длины волны, включая, но не ограничиваясь ими, длины волн, которые не повреждают обычные клетки, но нагревают небелковую группировку до температуры, при которой клетки, ближайшие к небелковой группировке антитела, погибают.
Полезная нагрузка
Термин "полезная нагрузка" означает любую молекулу или комбинацию молекул, активность которых нужно доставить (в) и/или локализовать на клетке. Полезные нагрузки включают, но не ограничиваясь ими, метки, полипептидные токсины (например, псевдомонадный экзотоксин, рицин, абрин, дифтерийный токсин и т.п. ), ферменты, факторы роста, факторы транскрипции, лекарственные средства, радионуклиды, лиганды, антитела, липосомы, наночастицы, вирусные частицы, цитокины и т.п.
Гаптенилированные соединения
Гаптенилированный полипептид, описанный выше, может быть дополнительно конъюгирован, если полипептид сам по себе не представляет одну из молекул, с терапевтическим агентом (лекарственным средством), полипептидным токсином (например, таким токсином как доксорубицин или коклюшный токсин), флуорофором, таким как флуоресцентный краситель типа. флуоресцеина или родамина, хелатирующим агентом для визуализации или радиотерапевтическим металлом, пептидильной или непептидильной меткой или меткой для обнаружения или агентом, модифицирующим клиренс, таким как различные изомеры полиэтиленгликоля, пептидом, который связывается с третьим компонентом, или другим углеводным или липофильным агентом. Конъюгация может происходить либо непосредственно, либо с помощью промежуточного линкера.
а) Терапевтический агент (лекарственное средство)
Лекарственная группировка (D) конъюгата "гаптен-лекарственное средство" (ADC, гаптенилированное лекарственное средство) может представлять собой любое соединение, группировку или группу, которая имеет цитотоксическое или цитостатическое действие. Лекарственные группировки включают: (i) химиотерапевтические агенты, которые могут функционировать как ингибиторы микротрубочек, ингибиторы митоза, ингибиторы топоизомеразы или интеркаляторы ДНК; (ii) полипептидные токсины, которые могут функционировать ферментативно; и (iii) радиоизотопы.
Примеры лекарственных группировок включают, но не ограничиваясь ими, мейтансиноид, ауристатин, доластатин, трихотецен, СС1065, калихеамицин и другие энедииновые антибиотики, таксан, антрациклин и стереоизомеры, изостеры, их аналоги или производные.
Полипептидные токсины включают дифтерийную А-цепь, фрагменты дифтерийного токсина без связывающей активности, цепь А экзотоксина (из Pseudomonas aeruginosa), цепь А рицина (Vitetta et al (1987) Science, 238:1098), цепь А абрина, цепь А модецина, альфа-сарцин, белки Aleurites fordii, белки диантины, белки Phytolaca americana (PAPI, PAPII и PAP-5), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены (WO 93/21232).
Терапевтические радиоизотопы включают 32Р, 33Р, 90Y, 125I, 131I, 131In, 153Sm, 186Re, 188Re, 211At, 212B, 212Pb и радиоактивные изотопы Lu.
Радиоактивный изотоп или другие метки могут быть встроены известными способами (Frakeret et al (1978) Biochem. Biophys. Res. Commun. 80: 49-57; "Monoclonal Antibodies in Immunoscintigraphy" Chatal, CRC Press 1989). Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) является примером хелатирующего агента для конъюгации радионуклида с комплексом (WO 94/11026).
b) Метки
Гаптенилированный полипептид также может содержать гаптенилированную метку. Может быть использована любая группировка-метка, которую можно ковалентно присоединить к гаптену (см., например, Singh et al (2002) Anal. Biochem. 304:147-15; Harlow E. and Lane, D. (1999) Using Antibodies: A Laboratory Manual, Cold Springs Harbor Laboratory Press, Cold Spring Harbor, N.Y.; Lundblad R.L. (1991) Chemical Reagents for Protein Modification, 2nd ed. CRC Press, Boca Raton, Fla.). Метка может функционировать следующим образом: (i) обеспечивать обнаруживаемый сигнал; (ii) взаимодействовать со второй меткой для модификации обнаруживаемого сигнала, образуемого первой или второй меткой, например чтобы дать FRET (флуоресцентный резонансный перенос энергии); (iii) влиять на подвижность, например, электрофоретическую подвижность, или на клеточную проницаемость по заряду, гидрофобности, форме или другим физическим параметрам, или (iv) предоставлять группировку захвата, например, для модуляции ионного комплексообразования.
Конъюгаты, содержащие гаптенилированный полипептид и метку, описанную в данном документе, могут быть использованы в диагностических анализах, например, для обнаружения экспрессии антигена, представляющего интерес, в конкретных клетках, тканях или сыворотке. Для диагностических применений будет использоваться биспецифическое антитело, у которого первая специфичность связывания направлена на мишень, а вторая специфичность связывания направлена на гаптенилированную метку. Гаптенилированный полипептид, как правило, метят детектируемой группировкой. Доступны многочисленные метки, которые в целом могут быть разделены на следующие категории:
(a) радиоизотопы (радионуклиды), такие как 3Н, 11С, 14С, 18F, 32Р, 35S, 64Cu, 68Gn, 86Y, 89Zr, 99ТС, 111In, 123I, 124I, 125I, 131I, 133Хе, 177Lu, 211At или 131Bi. Меченные радиоизотопами конъюгаты могут быть использованы в экспериментах с рецептор-нацеленной визуализацией. Гаптенилированный полипептид также может быть помечен лигандными реагентами, которые связывают, хелатируют или в противном случае образуют комплекс с радиоизотопным металлом, с использованием методик, описанных в Current Protocols in Immunology, (1991) Volumes 1 and 2, Coligen et al, Ed. Wiley-Interscience, New York, N.Y., Pubs. Хелатирующие лиганды, которые могут образовывать комплекс с ионом металла, включают DOTA, DOTP, DOTMA, DTPA и ТЕТА (Macrocyclics, Даллас, Техас). Радионуклиды могут быть нацелены через комплексообразование с комплексом, описанным в данном документе (Wu et al, Nature Biotechnology 23(9) (2005) 1137-1146). Рецептор-нацеленная визуализация с помощью меченных радионуклидом комплексов может обеспечить маркер пути активации за счет обнаружения и количественной оценки прогрессивного накопления комплексов или соответствующих терапевтических антител в опухолевой ткани (Albert et al (1998) Bioorg. Med. Chem. Lett. 8:1207-1210).
Металл-хелатные комплексы, пригодные в качестве меток для экспериментов с визуализацией (US 2010/0111856; US 5342606; US 5428155; US 5316757; US 5480990; US 5462725; US 5428139; US 5385893; US 5739294; US 5750660; US 5834456; Hnatowich et al, J. Immunol. Methods 65 (1983) 147-157; Meares etal, Anal. Biochem. 142 (1984) 68-78; Mirzadeh et al, Bioconjugate Chem. 1 (1990) 59-65; Meares et al, J. Cancer (1990), Suppl. 10:21-26; Izard et al, Bioconjugate Chem. 3 (1992) 346-350; Nikula et al, Nucl. Med. Biol. 22 (1995) 387-90; Camera et al, Nucl. Med. Biol. 20 (1993) 955-62; Kukis et al, J. Nucl. Med. 39 (1998) 2105-2110; Verel et al., J. Nucl. Med. 44 (2003) 1663-1670; Camera et al, J. Nucl. Med. 21 (1994) 640-646; Ruegg et al, Cancer Res. 50 (1990) 4221-4226; Verel et al, J. Nucl. Med. 44 (2003) 1663-1670; Lee et al, Cancer Res. 61 (2001) 4474-4482; Mitchell, et al, J. Nucl. Med. 44 (2003) 1105-1112; Kobayashi et al Bioconjugate Chem. 10 (1999) 103-111; Miederer et al, J. Nucl. Med. 45 (2004) 129-137; DeNardo et al, Clinical Cancer Research 4 (1998) 2483-90; Blend et al, Cancer Biotherapy & Radiopharmaceuticals 18 (2003) 355-363; Nikula et al J. Nucl. Med. 40 (1999) 166-76; Kobayashi et al, J. Nucl. Med. 39 (1998) 829-36; Mardirossian et al, Nucl. Med. Biol. 20 (1993) 65-74; Roselli et al, Cancer Biotherapy & Radiopharmaceuticals, 14 (1999) 209-20).
(b) Флуоресцентные метки, такие как хелаты редкоземельных металлов (хелаты европия), типы флуоресцеина, включая FITC, 5-карбоксифлуоресцеин, 6-карбоксифлуоресцеин; типы родамина, включая TAMRA; дансил; лиссамин; цианины; фикоэритрины; Texas Red; и их аналоги. Флуоресцентные метки могут быть конъюгированы с полипептидом с использованием методик, раскрытых, например, в Current Protocols in Immunology, см. выше. Флуоресцентные метки и флуоресцентно меченные реагенты включают те, которые коммерчески доступны от компании Invitrogen/Molecular Probes (Eugene, Орегон, США) и Pierce Biotechnology, Inc. (Рокфорд, Иллинойс).
Метки для обнаружения, такие как флуоресцентные метки и хемилюминесцентные метки (Briggs et al "Synthesis of Functionalised Fluorescent Dyes and Their Coupling to Amines and Amino Acids," J. Chem. Soc, Perkin-Trans. 1 (1997) 1051-1058), обеспечивают обнаруживаемый сигнал и, как правило, применимы для мечения, особенно со следующими свойствами: (i) меченый конъюгат должен производить очень высокий сигнал с низким фоном, чтобы небольшие количества конъюгата могли быть чувствительно обнаружены как в бесклеточных, так и в клеточных анализах; и (ii) меченый конъюгат должен быть фотостабилен, чтобы флуоресцентный сигнал можно было наблюдать, контролировать и регистрировать без заметного фотообесцвечивания. Для применений, включающих связывание на клеточной поверхности меченых конъюгатов с мембранами или клеточными поверхностями, особенно живых клеток, метки должны (iii) иметь хорошую растворимость в воде для достижения эффективной концентрации конъюгата и чувствительности обнаружения и (iv) быть нетоксичными для живых клеток, так чтобы не нарушить нормальные метаболические процессы клеток или не привести к преждевременной гибели клеток.
(с) различные метки-ферментные субстраты доступны или описаны (см., например US 4275149). Фермент, как правило, катализирует химическое изменение хромогенного субстрата, которое может быть измерено с использованием различных методик. Например, фермент может катализировать изменение цвета в субстрате, что можно измерить спектрофотометрически. Альтернативно, фермент может изменять флуоресценцию или хемилюминесценцию субстрата. Хемилюминесцентный субстрат становится электронно-возбужденным в результате химической реакции и затем может испускать свет, который можно измерить (с помощью хемилюминометра, например), или давать энергию флуоресцентному акцептору. Примеры ферментных меток включают, люциферазу (например, люциферазу светлячка и бактериальную люциферазу; US 4737456), люциферин, 2,3-дигидрофталазиндионы, малатдегидрогеназу, уреазу, пероксидазу, такую как пероксидаза хрена (HRP), щелочную фосфатазу (АР), 3-галактозидазу, глюкоамилазу, лизоцим, оксидазы сахаридов (например, оксидазу глюкозы, оксидазу галактозы и глюкозо-6-фосфатдегидрогеназу), гетероциклические оксидазы (такие как уриказу и ксантиноксидазу), лактопероксидазу, микропероксидазу и т.п. Методики конъюгации ферментов с полипептидами описаны в O'Sullivan et al "Methods for the Preparation of Enzyme-Antibody Conjugates for use in Enzyme Immunoassay", in Methods in Enzym. (ed. by J. Langone & IT Van Vunakis), Academic Press, New York, 73 (1981) 147-166.
Примеры комбинаций "фермент-субстрат" (US 4275149, US 4318980) включают, например:
(i) пероксидазу хрена (HRP) с перекисью водорода в качестве субстрата, где перекись водорода окисляет предшественник красителя (например, ортофенилендиамин (OPD) или 3,3',5,5'-тетраметилбензидингидрохлорид (ТМВ));
(ii) щелочную фосфатазу (АР) с пара-нитрофенилфосфатом в качестве хромогенного субстрата; а также
(iii) 3-D-галактозидазу (3-D-Gal) с хромогенным субстратом (например, п-нитрофенил-3-D-галактозидазой) или флуорогенным субстратом 4-метилумбеллиферил-3-D-галактозидазой.
Меченый гаптенилированный полипептид, описанный в данном документе, может быть использован в любом известном способе анализа, таком как ELISA, анализы конкурентного связывания, прямые и непрямые сэндвич-анализы и анализы иммунопреципитации (Zola, Monoclonal Antibodies: A Manual of Techniques (1987) pp. 147-158, CRC Press, Inc.).
Меченые гаптенилированные полипептиды, описанные в данном документе, могут быть использованы в качестве биомаркеров и зондов для визуализации с помощью различных способов и методик биомедицинской и молекулярной визуализации, таких как: (i) MRI (MPT, магнитно-резонансная томография); (ii) MicroCT (компьютерная томография); (iii) SPECT (ОФЭКТ, однофотонная эмиссионная компьютерная томография); (iv) PET (ПЭТ, позитронно-эмиссионная томография) Tinianow, J. et al Nuclear Medicine and Biology, 37(3) (2010) 289-297; Chen et al, Bioconjugate Chem. 15 (2004) 41-49; US 2010/0111856; (v) биолюминесценция; (vi) флуоресценция; и (vii) ультразвук. Иммуносцинтиграфия представляет собой процедуру визуализации, в которой животному или человеку вводят конъюгаты, меченные радиоактивными веществами, и получают изображения мест в организме, где локализуется конъюгат (US 6528624). Биомаркеры для визуализации можно объективно измерить и оценить как показатель нормальных биологических процессов, патогенных процессов или фармакологических ответов на терапевтическое вмешательство. Биомаркеры могут быть нескольких типов: маркеры 0 типа являются природными маркерами заболевания и коррелируют в течение продолжительного времени с известными клиническими показателями, например, МРТ-оценка синовиального воспаления при ревматоидном артрите; маркеры I типа записывают эффект вмешательства в соответствии с механизмом действия, даже если механизм не может быть связан с клиническим исходом; маркеры II типа функционируют в качестве суррогатных конечных точек, где изменение или сигнал от биомаркера предсказывает клиническое преимущество для "валидации" целевого ответа, например, эрозия кости при ревматоидном артрите, измеренная с помощью КТ. Таким образом, биомаркеры визуализации могут обеспечить фармакодинамическую (PD) терапевтическую информацию об: (i) экспрессии белка-мишени, (ii) связывании терапевтического агента с белком-мишенью, т.е. селективности, и (iii) фармакокинетических данных о клиренсе и периоде полужизни. Преимущества биомаркеров для визуализации in vivo по сравнению с лабораторными биомаркерами включают: неинвазивность, количественную оценку, оценку целого организма, повторные дозировки и оценку, т.е. несколько временных точек, и потенциально переносимые эффекты с доклинических (мелкие животные) на клинические (человек) результаты. Для некоторых применений биовизуализация вытесняет или минимизирует число экспериментов на животных в доклинических исследованиях.
Способы мечения пептидов хорошо известны. См. Haugland (2003) Molecular Probes Handbook of Fluorescent Probes and Research Chemicals, Molecular Probes, Inc.; Brinkley (1992) Bioconjugate Chem. 3:2; Garman, (1997) Non-Radioactive Labeling: A Practical Approach, Academic Press, London; Means (1990) Bioconjugate Chem. 1:2; Glazer et al Chemical Modification of Proteins. Laboratory Techniques in Biochemistry and Molecular Biology (T. S. Work and E. Work, Eds.) American Elsevier Publishing Co., New York; Lundblad, R. L. and Noyes, С.M. (1984) Chemical Reagents for Protein Modification, Vols. I and II, CRC Press, New York; Pfleiderer, G. (1985) "Chemical Modification of Proteins", Modern Methods in Protein Chemistry, H. Tschesche, Ed., Walter DeGruyter, Berlin and New York; и Wong (1991) Chemistry of Protein Conjugation and Cross-linking, CRC Press, Boca Raton, Fla.); DeLeon-Rodriguez et al, Chem. Eur. J. 10 (2004) 1149-1155; Lewis et al, Bioconjugate Chem. 12 (2001) 320-324; Li et al, Bioconjugate Chem. 13 (2002) 110-115; Mier et al Bioconjugate Chem. 16 (2005) 240-237.
Конъюгаты антител
Антитело в конъюгате, описанном выше, может быть также конъюгировано, если оно само по себе не является одной из молекул, с терапевтическим агентом (лекарственным средством), полипептидным токсином (например, таким токсином как доксорубицин или коклюшный токсин), флуорофором, таким как флуоресцентная метка типа флуоресцеина или родамина, хелатирующим агентом для визуализации или радиотерапевтическим металлом, пептидильной или непептидильной меткой или меткой для обнаружения или агентом, модифицирующим клиренс, таким как различные изомеры полиэтиленгликоля, пептидом, который связывается с третьим компонентом, или другим углеводным или липофильным агентом.
Иммуноконъюгаты
Данное изобретение также предусматривает иммуноконъюгаты, содержащие антитело, описанное в данном документе, или конъюгат, описанный в данном документе, конъюгированный с одним или более чем одним цитотоксическим агентом, таким как химиотерапевтические агенты или лекарственные средства, ингибирующим рост агентом, токсином (например, белковыми токсинами, ферментативно активными токсинами бактериального, грибкового, растительного или животного происхождения или их фрагментами) или радиоактивным изотопом.
В одном воплощении иммуноконъюгат является конъюгатом "антитело-лекарственное средство" (ADC), в котором антитело конъюгировано с одним или более чем одним лекарственным средством, включая, но не ограничиваясь ими, мейтансиноид (см. US 5208020, US 5416064 и ЕР 0425235 В1); ауристатин, такой как монометилауристатиновые лекарственные группировки DE и DF (ММАЕ и MMAF) (см. US 5635483, US 5780588 и US 7498298); доластатин; калихеамицин или его производное (см. патенты US 5712374, US 5714586, US 5,739,116, US 5767285, US 5770701, US 5770710, US 5773001 и US 5877296; Hinman, L.M. et al., Cancer Res. 53 (1993) 3336-3342; и Lode, H.N. et al., Cancer Res. 58 (1998) 2925-2928); антрациклины, такие как дауномицин или доксорубицин (см. Kratz et al., Current Med. Chem. 13:477-523 (2006); Jeffrey et al., Bioorganic & Med. Chem. Letters 16:358-362 (2006); Torgov et al., Bioconj. Chem. 16:717-721 (2005); Nagy et al., Proc. Natl. Acad. Sci. USA 97:829-834 (2000); Dubowchik et al., Bioorg. & Med. Chem. Letters 12:1529-1532 (2002); King et al., J. Med. Chem. 45:4336-4343 (2002); и патент США №6630579); метотрексат; виндезин; таксаны, такие как доцетаксел, паклитаксел, ларотаксел, тезетаксел и ортатаксел; трихотецен; и СС1065.
В другом воплощении иммуноконъюгат включает антитело, описанное в данном документе, конъюгированное с ферментативно активным токсином или его фрагментом, включая, но не ограничиваясь ими, дифтерийную цепь А, несвязывающие активные фрагменты дифтерийного токсина, цепь А экзотоксина (из Pseudomonas aeruginosa), цепь А рицина, цепь А абрина, цепь А модецина, альфа-сарцин, белки Aleurites fordii, белки диантины, белки Phytoiacca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Saponaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трихотецены.
В другом воплощении иммуноконъюгат включает антитело, описанное в данном документе, или комплекс, описанный в данном документе, конъюгированный с радиоактивным атомом с образованием радиоконъюгата. Для получения радиоконъюгатов доступно множество радиоактивных изотопов. Примеры включают At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu. Когда радиоконъюгат используется для обнаружения, он может содержать радиоактивный атом для сцинтиграфических исследований, например, TC99m или I123, или спиновую метку для визуализации путем ядерного магнитного резонанса (NMR) (также известного как магнитно-резонансная томография, MRI), такую как снова йод-123, йод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Конъюгаты антитела и цитотоксического агента могут быть получены с использованием множества бифункциональных связывающих белки агентов, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин может быть получен, как описано в Vitetta, E.S. et al., Science 238 (1987) 1098-1104. Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксксная кислота (MX-DTPA) является примером хелатирующего агента для конъюгации радионуклида с антителом. См. WO94/11026. Линкер может представлять собой "расщепляемый линкер", облегчающий высвобождение цитотоксического лекарственного агента в клетке. Например, может быть использован кислотно-лабильный линкер, чувствительный к пептидазе линкер, фотолабильный линкер, линкер, содержащий диметил или дисульфид (Chari, R.V. et al., Cancer Res. 52 (1992) 127-131; патент США №5208020).
Иммуноконъюгаты или ADC в данном документе прямо предусматривают, но не ограничиваясь ими, такие конъюгаты, полученные с помощью сшивающих реагентов, включая, но не ограничиваясь ими, BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, МРВН, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC, сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоат), которые коммерчески доступны (например, от Pierce Biotechnology, Inc., Рокфорд, Иллинойс, США).
Гаптенилированный полипептидный токсин
Гаптен в конъюгате, описанном в данном документе, в одном из воплощений конъюгирован с цитотоксическим агентом, таким как, например, токсин, такой как доксорубицин или коклюшный токсин. Такой конъюгат обозначается как гаптенилированный полипептидный токсин. Конъюгация может быть проведена либо напрямую, либо с помощью промежуточного линкера.
Полипептидный токсин в одном из воплощений представляет собой белковый токсин, который может функционировать ферментативно. Белковые токсины включают дифтерийную цепь А, несвязывающие активные фрагменты дифтерийного токсина, цепь А экзотоксина (от Pseudomonas aeruginosa), цепь А рицина, цепь А абрина, цепь А модецина, альфа-сарцин, белки Aleurites fordii, белки диантины, белки Phytoiacca americana (PAPI, РАРII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Saponaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трихотецены (WO 93/21232).
Конъюгаты между гаптеном и полипептидным токсином можно получить с использованием различных бифункциональных связывающих белки агентов, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин может быть получен, как описано в Vitetta, E.S. et al., Science 238 (1987) 1098-1104. Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксксная кислота (MX-DTPA) является примером хелатирующего агента для конъюгации радионуклида с антителом. См. WO 94/11026. Линкер может представлять собой "расщепляемый линкер", облегчающий высвобождение цитотоксического лекарственного агента в клетке. Например, может быть использован кислотно-лабильный линкер, чувствительный к пептидазе линкер, фотолабильный линкер, линкер, содержащий диметил или дисульфид (Chari, R.V. et al., Cancer Res. 52 (1992) 127-131; патент США №5208020).
В одном воплощении гаптенилированный полипептидный токсин получен с использованием сшивающих реагентов, включая, но не ограничиваясь ими, BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, МРВН, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC, сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоат), которые коммерчески доступны (например, от Pierce Biotechnology, Inc., Рокфорд, Иллинойс, США).
Линкер
Термин "линкер" обозначает бифункциональную или многофункциональную группировку, которая может быть использована для конъюгации (связывания) гаптена с полипептидом. Гаптенилированные полипептиды могут быть стандартно получены с помощью линкера, имеющего реакционноспособную функциональную группу для связывания с полипептидом и гаптеном.
В одном из воплощений линкер имеет реакционноспособный сайт, который имеет электрофильного группу, которая может вступать в реакцию с нуклеофильной группой, присутствующей на полипептиде. Цистеин-тиольная группа, например, может вступать в реакцию с электрофильной группой на линкере и формировать ковалентную связь с линкером. Используемые электрофильные группы включают, но не ограничиваясь ими, другие тиольные, малеимидные и галоацетамидные группы (см., например, способы конъюгации на странице 766 в Klussman et al, Bioconjugate Chemistry 15(4) (2004) 765-773).
Примеры тиол-реакционноспособных функциональных групп включают, но не ограничиваясь ими, тиол, малеимид, альфа-галоацетил, активированные сложные эфиры, такие как сукцинимидные эфиры, 4-нитрофенилэфиры, пентафторфенилэфиры, тетрафторфенилэфиры, ангидриды, хлорангидриды, сульфонилхлориды, изоцианаты и изотиоцианаты.
Линкер может содержать аминокислотные остатки, которые связывают гаптен с полипептидом. Аминокислотные остатки могут формировать дипептидный, трипептидный, тетрапептидный, пентапептидный, гексапептидный, гептапептидный, октапептидный, нонапептидный, декапептидный, ундекапептидный или додекапептидный блок. Аминокислотные остатки включают как природные остатки, так и неприродные аминокислотные аналоги, такие как, например, цитруллин или β

В другом воплощении линкер имеет реакционноспособную функциональную группу, которая имеет нуклеофильного группу, которая может вступать в реакцию с электрофильной группой, присутствующей на гаптене. Используемые электрофильные группы включают, но не ограничиваясь ими, альдегидные и кетоновые карбонильные группы. Гетероатом нуклеофильной группы линкера может вступать в реакцию с электрофильной группой на гаптене или полипептиде и формировать ковалентную связь с гаптеном или полипептидом. Используемые нуклеофильные группы на линкере включают, но не ограничиваясь ими, гидразид, оксим, амино, гидразин, тиосемикарбазон, гидразинкарбоксилат и арилгидразид. Электрофильная группа на гаптене обеспечивает удобный сайт для присоединения к линкеру.
Как правило, линкеры пептидного типа могут быть получены путем формирования пептидной связи между двумя или более аминокислотами и/или пептидными фрагментами. Такие пептидные связи могут быть получены, например, в соответствии с методикой синтеза в жидкой фазе (Е. Schroder and K. Lubke "The Peptides", volume 1 (1965) 76-136, Academic Press), которая хорошо известна в области химии пептидов.
В другом воплощении линкер может быть замещен группами, которые модулируют растворимость или реакционную способность. Например, заряженный заместитель, такой как сульфонат (SO3-) или аммоний, или полимер, такой как ПЭГ, может повышать растворимость реагента в воде и облегчать реакцию связывания линкерного реагента с гаптеном или полипептидом, или облегчать реакцию связывания в зависимости от используемого пути синтеза.
Конъюгаты, содержащие гаптен и полипептид, описанный в данном документе, прямо предусматривают, но не ограничиваясь ими, комплексы, полученные с линкерными реагентами: ВМРЕО, BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, МРВН, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB, и SVSB (сукцинимидил-(4-винилсульфон)бензоат), включая бис-малеимидные реагенты: DTME, ВМВ, BMDB, ВМН, ВМОЕ, ВМ(РЕО)3 и ВМ(РЕО)4, которые коммерчески доступны от Pierce Biotechnology, Inc. Бис-малеимидные реагенты позволяют присоединить, например, тиольную группу к тиолсодержащей лекарственной группировке, метке или линкерному промежуточному продукту в последовательной или параллельной форме. Другие функциональные группы, помимо малеимидной, которые реагируют, например, с тиольной группой, включают йодацетамид, бромацетамид, винилпиридин, дисульфид, пиридилдисульфид, изоцианат и изотиоцианат.
Иллюстративные линкеры включают валин-цитруллиновый (val-cit или vc) дипептидный линкерный реагент, имеющий малеимидную растяжку и пара-аминобензилкарбамоильный (РАВ) самоотщепляющийся спейсер, и Phe-Lys (Mtr) дипептидный линкерный реагент, имеющий малеимидную растяжку и пара-аминобензильный самоотщепляющийся спейсер.
Цистеин-тиольные группы являются нуклеофильными и способны вступать в реакцию с формированием ковалентных связей с электрофильными группами на линкерных реагентах и гаптенилированных соединениях, включая: (i), активные сложные эфиры, такие как сложные эфиры NHS, сложные эфиры HOBt, галогенформиаты и галогениды кислот; (ii) алкильные и бензильные галогениды, такие как галогенацетамиды; (iii) альдегиды, кетоны, карбоксильные и малеимидные группы; и (iv) дисульфиды, включая пиридилдисульфиды, через сульфидный обмен. Нуклеофильные группы на гаптенилированном соединении включают, но не ограничиваясь ими: аминные, тиольные, гидроксильные, гидразидовые, оксимовые, гидразиновые, тиосемикарбазоновые, гидразинкарбоксилатные и арилгидразидные группы, способные реагировать с формированием ковалентных связей с электрофильными группами на линкерных группировках и линкерных реагентах.
III. Нуклеиновая кислота
ДНК, кодирующая аминокислотную последовательность варианта антитела, описанного в данном документе или содержащегося в конъюгате, описанном в данном документе, может быть получена различными способами, известными в данной области. Эти способы включают, но не ограничиваясь ими, получение путем сайт-направленного (или олигонуклеотид-опосредованного) мутагенеза, мутагенеза путем ПЦР и кассетного мутагенеза ранее полученной ДНК, кодирующей полипептид. Варианты рекомбинантных антител могут быть сконструированы также путем манипуляций с рестрикционными фрагментами или ПЦР с удлинением с перекрыванием с помощью синтетических олигонуклеотидов. Мутагенные праймеры кодируют замену(ы) кодона цистеина. Стандартные методики мутагенеза могут быть использованы для создания ДНК, кодирующей такие модифицированные сконструированные антитела. Общее руководство можно найти в Sambrook et al., Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989; и в Ausubel et al Current Protocols in Molecular Biology, Greene Publishing and Wiley-lnterscience, New York, N.Y., 1993.
IV. Экспрессия и очистка
Полипептиды и антитела могут быть получены с использованием рекомбинантных способов и композиций, например, описанных в US 4816567. В одном воплощении предложена выделенная нуклеиновая кислота, кодирующая полипептид и антитело, описанное в данном документе. Такая нуклеиновая кислота может кодировать аминокислотную последовательность, содержащую VL, и/или аминокислотную последовательность, содержащую VH антитела (например, легкую и/или тяжелую цепи антитела), или аминокислотную последовательность полипептида.
В одном воплощении предложен один или более чем один вектор (например, экспрессионный вектор), содержащий такую нуклеиновую кислоту. В другом воплощении предложена клетка-хозяин, содержащая такую нуклеиновую кислоту. В одном таком воплощении клетка-хозяин содержит (например, была трансформирована ими): (1) вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и аминокислотную последовательность, содержащую VH антитела, или (2) первый вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и второй вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VH антитела. В одном воплощении клетка-хозяин является эукариотической, например, клеткой яичника китайского хомячка (СНО) или лимфоидной клеткой (например, Y0, NS0, Sp2/0). В одном воплощении предложен способ получения антитела, который включает культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую антитело, описанное выше, в условиях, подходящих для экспрессии антитела, и, возможно, извлечение антитела из клетки-хозяина (или культуральной среды клетки-хозяина).
Для рекомбинантной продукции антитела, описанного в данном документе, нуклеиновую кислоту, кодирующую антитело, например, описанное выше, выделяют и встраивают в один или более чем один вектор для дальнейшего клонирования и/или экспрессии в клетке-хозяине. Такая нуклеиновая кислота может быть легко выделена и секвенирована с использованием стандартных процедур (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелые и легкие цепи антитела).
Подходящие клетки-хозяева для клонирования или экспрессии векторов, кодирующих антитела, включают прокариотические или эукариотические клетки, описанные в данном документе. Например, антитела могут быть получены в бактериях, в частности, когда не нужны гликозилирование и Fc-эффекторные функции. Для экспрессии фрагментов антитела и полипептидов в бактериях см., например, US 5648237, US 5789199 и US 5840523. (См. также Charlton, K.А., In: Methods in Molecular Biology, Vol. 248, Lo, B.K.C. (ed.), Humana Press, Totowa, NJ (2003), pp. 245-254, где описывается экспрессия фрагментов антител в Е. coli). После экспрессии антитело может быть выделено из массы бактериальных клеток в растворимой фракции и может быть далее очищено.
Помимо прокариотов для векторов, кодирующих антитела, подходящими клонирующими или экспрессирующими хозяевами являются эукариотические микроорганизмы, такие как нитчатые грибы или дрожжи, включая штаммы грибов и дрожжей, у которых пути гликозилирования являются "гуманизированными", что приводит к продукции антитела с частично или полностью человеческим характером гликозилирования. См. Gerngross, T.U., Nat. Biotech. 22 (2004) 1409-1414; и Li, Н. et al., Nat. Biotech. 24 (2006) 210-215.
Подходящие клетки-хозяева для экспрессии гликозилированного антитела также получают из многоклеточных организмов (беспозвоночных и позвоночных). Примеры клеток беспозвоночных включают клетки растений и насекомых. Были идентифицированы многочисленные бакуловирусные штаммы, которые могут быть использованы в сочетании с клетками насекомых, в частности, для трансфекции клеток Spodoptera frugiperda.
Культуры растительных клеток также могут быть использованы в качестве хозяев. См., например, US 5959177, US 6040498, US 6420548, US 7125978 и US 6417429 (описывающие технологию PLANTIBODIES™ для получения антител в трансгенных растениях).
Клетки позвоночных животных также могут быть использованы в качестве хозяев. Например, могут быть использованы клеточные линии млекопитающих, адаптированные к росту в суспензии. Другими примерами используемых клеточных линий-хозяев от млекопитающих являются линия почки обезьяны CV1, трансформированная SV40 (COS-7); человеческая эмбриональная почечная линия (293 или клетки 293, описанные, например, в Graham, F.L. et al., J. Gen Virol. 36 (1977) 59-74); клетки почек детенышей хомяка (ВНК); мышиные клетки Сертоли (ТМ4-клетки, описанные, например, в Mather, J.P., Biol. Reprod. 23 (1980) 243-252); клетки почки обезьяны (CV1); клетки почки африканской зеленой обезьяны (VERO-76); клетки шейки матки человеческой карциномы (HELA); клетки почки собаки (MDCK); клетки печени крысы buffalo (BRL 3А); клетки легких человека (W138); клетки печени человека (Hep G2); клетки опухоли молочной железы мыши (ММТ 060562); TRI-клетки, описанные, например, в Mather, J.P. et al., Annals N.Y. Acad. Sci. 383 (1982) 44-68; клетки MRC 5; и клетки FS4. Другие используемые линии клеток-хозяев от млекопитающих включают клетки яичника китайского хомячка (СНО), в том числе DHFR- СНО-клетки (Urlaub, G. et al., Proc. Natl. Acad. Sci. USA 77 (1980) 4216-4220); и клеточные линии миеломы, такие как Y0, NS0 и Sp2/0. Обзор некоторых линий клеток-хозяев от млекопитающих, подходящих для продукции антител, см., например, в Yazaki, P. and Wu, A.M., Methods in Molecular Biology, Vol. 248, Lo, B.K.C. (ed.), Humana Press, Totowa, NJ (2004), pp. 255-268.
V. Фармацевтические композиции
Фармацевтические композиции, содержащие конъюгат, описанный в данном документе, получают путем смешивания такого конъюгата, имеющего требуемую степень чистоты, с одним или более чем одним из возможных фармацевтически приемлемых носителей (Remington's Pharmaceutical Sciences, 16th edition, Osol, A. (ed.) (1980)), в форме лиофилизированных композиций или водных растворов. Фармацевтически приемлемые носители, как правило, нетоксичны для реципиентов в используемых дозах и концентрациях и включают, но не ограничиваясь ими: буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмония хлорид; гексаметония хлорид; бензалкония хлорид; бензетония хлорид; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцин; циклогексанол, 3-пентанол и м-крезол); низкомолекулярные (менее чем примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как EDTA; сахара, такие как сахарозу, маннит, трегалозу или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, Zn-белковые комплексы); и/или неионные поверхностно-активные вещества, такие как полиэтиленгликоль (ПЭГ). Иллюстративные фармацевтически приемлемые носители в данном документе также включают интерстициальные агенты, диспергирующие лекарственные средства, такие как растворимые нейтрально-активные гиалуронидазные гликопротеины (sHASEGP), например, человеческие растворимые гиалуронидазные гликопротеины РН-20, такие как rhuPH20 (HYLENEX®, Baxter International, Inc.). Некоторые примеры sHASEGP и способы их применения, в том числе rhuPH20, описаны в US №2005/0260186 и US №2006/0104968. В одном аспекте sHASEGP комбинирован с одной или более чем одной дополнительной гликозамингликаназой, такой как хондроитиназа.
Иллюстративные лиофилизированные композиции антител описаны в US 6267958. Водные композиции антител включают те, которые описаны в US 6171586 и WO 2006/044908, последние композиции включают гистидин-ацетатный буфер.
Композиция в данном документе может также содержать более чем один активный ингредиент, необходимый при лечении по конкретным показаниям, особенно с дополняющими активностями, которые не влияют друг на друга. Такие активные ингредиенты соответствующим образом присутствуют в комбинации в количествах, которые эффективны для данной цели.
Активные ингредиенты могут быть заключены в микрокапсулы, полученные, например, с помощью методик коацервации или путем межфазной полимеризации, например, в гидроксиметилцеллюлозные или желатиновые микрокапсулы и полиметилметакрилатные микрокапсулы, соответственно, в коллоидных системах доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсиях. Такие методики раскрыты в Remington's Pharmaceutical Sciences 16th edition, Osol, A. (ed.), (1980).
Могут быть изготовлены препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие антитело или конъюгат, при этом матрицы находятся в виде формованных изделий, например пленок или микрокапсул.
Композиции, используемые для введения in vivo, обычно являются стерильными. Стерильность может быть легко достигнута, например, путем фильтрации через стерилизующие фильтрационные мембраны.
VI. Терапевтические способы и композиции
Любой из конъюгатов, описанных в данном документе, может быть использован в терапевтических способах.
В одном аспекте предложено применение конъюгата, описанного в данном документе, в качестве лекарственного средства. В другом аспекте предложено применение конъюгата, описанного в данном документе, для лечения заболевания. В некоторых воплощениях предложено применение конъюгата, описанного в данном документе, в способе лечения. В некоторых воплощениях предложено применение конъюгата, описанного в данном документе, в способе лечения индивидуума, включающем введение индивидууму эффективного количества конъюгата, описанного в данном документе. В одном таком воплощении этот способ также включает введение индивидууму эффективного количества по меньшей мере одного дополнительного терапевтического агента, например, как описано ниже. "Индивидуум" в соответствии с любым из вышеописанных воплощений может быть человеком.
В другом аспекте данное изобретение предусматривает применение конъюгата, описанного в данном документе, в производстве или изготовлении лекарственного средства. В одном воплощении лекарственное средство предназначено для лечения заболевания. В другом воплощении лекарственное средство предназначено для применения в способе лечения заболевания, включающем введение индивидууму с заболеванием эффективного количества лекарственного средства. В одном таком воплощении способ также включает введение индивидууму эффективного количества по меньшей мере одного дополнительного терапевтического агента, например, как описано ниже. "Индивидуум" в соответствии с любым из вышеописанных воплощений может быть человеком.
В другом аспекте данное изобретение предусматривает способ лечения заболевания. В одном воплощении способ включает введение индивидууму с таким заболеванием эффективного количества конъюгата, описанного в данном документе. В одном таком воплощении способ также включает введение индивидууму эффективного количества по меньшей мере одного дополнительного терапевтического агента, как описано ниже. "Индивидуум" в соответствии с любым из вышеописанных воплощений может быть человеком.
В другом аспекте изобретение предлагает фармацевтические композиции, содержащие любой из конъюгатов, описанных в данном документе, например, для применения в любом из указанных выше терапевтических способов. В одном воплощении фармацевтическая композиция содержит любой из конъюгатов, описанных в данном документе, и фармацевтически приемлемый носитель. В другом воплощении фармацевтическая композиция содержит любой из конъюгатов, описанных в данном документе, и по меньшей мере один дополнительный терапевтический агент, например, как описано ниже.
Конъюгаты, описанные в данном документе, могут быть использованы в терапии по отдельности или в комбинации с другими агентами. Например, конъюгат, описанный в данном документе, может быть введен совместно по меньшей мере с одним дополнительным терапевтическим агентом.
Такие комбинированные терапии, отмеченные выше, охватывают комбинированное введение (когда два или более двух терапевтических агентов включены в одну и ту же или в раздельные композиции), а также раздельное введение, и в этом случае введение антитела согласно изобретению может происходить до, одновременно и/или после введения дополнительного терапевтического агента и/или адъюванта. Конъюгаты, описанные в данном документе, также могут быть использованы в сочетании с лучевой терапией.
Конъюгат, описанный в данном документе (и любой из дополнительных терапевтических агентов), может быть введен с помощью любых подходящих средств, в том числе путем парентерального, внутрилегочного и интраназального, и, если желательно местное лечение, внутриочагового введения. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Дозирование может быть осуществлено любым подходящим способом, например, с помощью инъекций, таких как внутривенные или подкожные инъекции, частично в зависимости от того, является ли введение кратковременным или хроническим. В данном описании рассматриваются различные схемы дозировок, включая, но не ограничиваясь ими, одно или множество введений в различные временные точки, болюсное введение и импульсную инфузию.
Конъюгаты, описанные в данном документе, будут объединнены со вспомогательными веществами в композицию, дозированы и введены в соответствии с надлежащей медицинской практикой. Факторы, подлежащие рассмотрению в этом контексте, включают конкретное нарушение, подлежащее лечению, конкретное млекопитающее, подлежащее лечению, клиническое состояние отдельного пациента, причину нарушения, место доставки агента, способ введения, схему введения и другие факторы, известные практикующим врачам. Конъюгат не обязательно, но может быть включен в композицию с одним или более чем одним агентом, используемым в настоящее время для профилактики или лечения рассматриваемого нарушения. Эффективное количество таких других агентов зависит от количества конъюгата, присутствующего в композиции, от типа заболевания или лечения и от других факторов, описанных выше. Как правило, они используются в тех же дозах и с теми же путями введения, как описано в данном документе, или в дозировках 1-99% от описанных в данном документе, или в любой дозировке и любым путем, который является эмпирически/клинически подходящим.
Для профилактики или лечения заболевания подходящая доза конъюгата, описанного в данном документе, (при использовании его в одиночку или в комбинации с одним или более чем одним дополнительным терапевтическим агентом) будет зависеть от типа заболевания, подлежащего лечению, от типа конъюгата, от тяжести и течения заболевания, от того, вводят ли конъюгат с профилактической или терапевтической целью, от предыдущей терапии, истории болезни пациента и ответа на конъюгат, а также по усмотрению лечащего врача. Конъюгат вводят пациенту подходящим образом одномоментно или серийно. В зависимости от типа и тяжести заболевания изначальной кандидатной дозировкой конъюгата для введения пациенту может быть дозировка примерно от 1 мкг/кг до 15 мг/кг (например, от 0,5 мг/кг до 10 мг/кг) в зависимости от того, например, вводится ли оно в ходе одного или более отдельных введений или путем непрерывной инфузии. Одна типичная суточная доза может варьировать от примерно 1 мкг/кг до 100 мг/кг или более в зависимости от указанных выше факторов. В случае повторных введений в течение нескольких дней или дольше в зависимости от состояния лечение, как правило, может быть продолжено до нужного подавления симптомов заболевания. Один из примеров дозировки конъюгата будет находиться в диапазоне от примерно 0,05 мг/кг до примерно 10 мг/кг. Таким образом, пациенту может быть введена одна или более чем одна доза примерно 0,5 мг/кг, 2,0 мг/кг, 4,0 мг/кг или 10 мг/кг (или любая их комбинация). Такие дозы можно вводить периодически, например, каждую неделю или каждые три недели (например, так, чтобы пациент получал от примерно двух до примерно двадцати или, например, примерно шесть доз конъюгата). Может быть введена первоначальная более высокая нагрузочная доза, а потом одна или более чем одна более низкая доза. Тем не менее, могут использоваться и другие режимы дозирования. Прогресс этой терапии легко контролировать с помощью обычных методик и анализов.
Необходимо понимать, что любая из описанных выше композиций или терапевтических способов может быть проведен с использованием иммуноконъюгата согласно изобретению вместо или в дополнение к антителу или конъюгату, описанному в данном документе.
VII. Продукты производства
В другом аспекте изобретения предусматривается продукт производства, содержащий материалы, используемые для лечения, профилактики и/или диагностики нарушений, описанных выше. Продукт производства содержит контейнер и этикетку или вкладыш в упаковку, прикрепленный или связанный с контейнером. Подходящие контейнеры включают, например, бутылки, флаконы, шприцы, пакеты для внутривенно вводимых растворов и т.д. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик. Контейнер содержит композицию саму по себе или в сочетании с другой композицией, эффективной для лечения, профилактики и/или диагностики состояния, и может иметь стерильное входное отверстие (например, контейнер может представлять собой пакет для внутривенно вводимого раствора или флакон с пробкой, прокалываемой иглой для подкожной инъекции). По меньшей мере один активный агент в композиции представляет собой антитело или комплекс, описанный в данном документе. На этикетке или вкладыше в упаковку указывается, что композиция используется для лечения выбранного состояния. Кроме того, продукт производства может включать: (а) первый контейнер с композицией, содержащейся в нем, где композиция содержит антитело или комплекс, описанный в данном документе; и (b) второй контейнер с композицией, содержащейся в нем, где композиция также содержит цитотоксический или другой терапевтический агент. Продукт производства в этом воплощении изобретения может также содержать вкладыш в упаковку, указывающий, что композиции могут быть использованы для лечения конкретного состояния. Альтернативно или дополнительно продукт производства может также включать второй (или третий) контейнер, содержащий фармацевтически приемлемый буфер, например, бактериостатическую воду для инъекций (BWFI), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Он также может включать другие материалы, желательные с коммерческой и потребительской точки зрения, в том числе другие буферы, разбавители, фильтры, иглы и шприцы.
VIII. Конкретные воплощения
1. (Ковалентный) конъюгат гаптенилированного полипептида и антигаптенового антитела, в котором дисульфидная связь формируется между остатком цистеина, находящимся до или после остатка лизина в полипептиде, который используется для гаптеновой конъюгации, и остатком цистеина в CDR2, антитела, где CDR2 определен в соответствии с Kabat.
2. Конъюгат по п. 1, в котором остаток цистеина находится на расстоянии 1-3 остатков до или после остатка лизина, который используется для гаптеновой конъюгации.
3. Конъюгат по любому из пп. 1-2, в котором полипептид представляет собой полипептидный токсин.
4. Конъюгат по любому из пп. 1-3, в котором CDR2 представляет собой CDR2 тяжелой цепи.
5. (Ковалентный) конъюгат, содержащий гаптенилированный полипептидный токсин и антигаптеновое антитело,
где полипептидный токсин конъюгирован с гаптеном на остатке лизина,
где гаптенилированный полипептидный токсин конъюгирован с антигаптеновым антителом через дисульфидную связь,
где дисульфидная связь образуется между
i) остатком цистеина в гаптенилированном полипептидном токсине, который находится на расстоянии одного или двух остатков либо до, либо после остатка лизина, который используется для гаптеновой конъюгации, и
ii) остатком цистеина в CDR2 тяжелой цепи антитела, где CDR2 определен в соответствии с Kabat.
6. Конъюгат по любому из пп. 1-5, в котором указанный полипептид содержит ровно один остаток лизина в своей аминокислотной последовательности.
7. (Ковалентный) конъюгат гаптенилированного полипептида и антигаптенового антитела, в котором дисульфидная связь формируется между остатком цистеина в полипептиде и остатком цистеина в тяжелой цепи CDR2 антитела, где CDR2 определен в соответствии с Kabat, и где полипептид содержит ровно один остаток лизина в своей аминокислотной последовательности.
8. Конъюгат по любому из пп. 1-7, в котором остаток цистеина находится на расстоянии двух остатков до (т.е. в позиции N-2 по отношению к остатку лизина) или после (т.е. в позиции N плюс 2 по отношению к остатку лизина) остатка лизина, который используется для гаптеновой конъюгации
9. Конъюгат по любому из пп. 1-8, в котором остаток лизина, который используется для гаптеновой конъюгации, находится в пределах десяти N-концевых аминокислотных остатков полипептида.
10. Конъюгат по любому из пп. 1-9, в котором антигаптеновое антитело специфически связывается с гаптеном гаптенилированного полипептида (антигаптенового антитела).
11. Конъюгат по любому из пп. 1-10, в котором гаптенилированный полипептид содержит гаптен, линкер и полипептид.
12. Конъюгат по любому из пп. 1-10, в котором указанный полипептид конъюгирован с гаптеном через карбоксиметил-группу или капроновокислотный спейсер.
13. Конъюгат по любому из пп. 1-12, в котором альфа-углеродный атом остатка цистеина в CDR2 антитела находится на расстоянии примерно 10-11 ангстрем от атома остатка лизина в полипептиде, с которым конъюгирован гаптен (где гаптен конъюгирован с полипептидом либо непосредственно, либо через линкер).
14. Конъюгат по любому из пп. 1-13, в котором полипептид также конъюгирован с полезной нагрузкой.
15. Конъюгат по любому из пп. 1-14, в котором полипептидный токсин представляет собой РЕ25.
16. Конъюгат по любому из пп. 1-14, в котором полипептидный токсин представляет собой гуманизированный (деиммунизированный) вариант РЕ25.
17. Конъюгат по любому из пп. 1-16, в котором остаток цистеина в CDR2 тяжелой цепи антитела находится в позиции 52, или позиции 52а, или позиции 52b, или позиции 52с, или позиции 52d, или позиции 53 в соответствии с нумерацией вариабельного домена тяжелой цепи Kabat.
18. Конъюгат по любому из пп. 1-17, в котором остаток цистеина в тяжелой цепи CDR2 антитела находится в позиции 52а, или позиции 52b, или позиции 52с, или позиции 53 в соответствии с нумерацией вариабельного домена тяжелой цепи Kabat.
19. Конъюгат по любому из пп. 1-18, в котором остаток цистеина в CDR2 тяжелой цепи антитела находится в позиции 52b или в позиции 53 в соответствии с нумерацией вариабельного домена тяжелой цепи Kabat.
20. Конъюгат по любому из пп. 1-19, в котором антитело представляет собой биспецифическое антитело, обладающее первой специфичностью связывания с негаптеновым антигеном и второй специфичностью связывания с гаптеном.
21. (Ковалентный) конъюгат, содержащий гаптенилированный полипептидный токсин и биспецифическое антитело,
где биспецифическое антитело обладает первой специфичностью связывания с негаптеновым антигеном и второй специфичностью связывания с гаптеном,
где полипептидный токсин конъюгирован с гаптеном на остатке лизина,
где гаптенилированный полипептидный токсин конъюгирован с антигаптеновым антителом через дисульфидную связь,
где дисульфидная связь образуется между
i) остатком цистеина в гаптенилированном полипептидном токсине, который находится на расстоянии двух остатков либо до, либо после остатка лизина, который используется для гаптеновой конъюгации, и
ii) остатком цистеина в позиции 52b или 53 в CDR2 тяжелой цепи антитела, где CDR2 определен в соответствии с Kabat.
22. Конъюгат по любому из пп. 1-21, в котором стехиометрическое отношение молекул антител к гаптенилированным полипептидным молекулам составляет 1:1, или 1:2, или 2:1, или 2:2, или 2:4, или 4:2 (антитело: гаптенилированный полипептид)
23. Конъюгат по любому из пп. 1-22, в котором негаптеновый антиген представляет собой антиген клеточной поверхности.
24. Конъюгат по п. 23, в котором антиген клеточной поверхности представляет собой антиген, ассоциированный с опухолью.
25. Конъюгат по любому из пп. 1-24, в котором биспецифическое антитело представляет собой полноразмерное антитело.
26. Конъюгат по п. 25, в котором одна тяжелая цепь биспецифического антитела содержит мутацию типа "замок", а соответствующая другая цепь содержит мутацию типа "ключ".
27. Конъюгат по любому из пп. 1-26, в котором биспецифическое антитело представляет собой полноразмерное антитело, в котором на каждом С-конце scFv или scFab слит либо непосредственно, либо через пептидный линкер.
28. Конъюгат по любому из пп. 1-27, в котором антитело представляет собой гуманизированное или человеческое антитело.
29. Конъюгат по любому из пп. 1-28, в котором константная область антитела относится к подклассу IgG1 или подклассу IgG4.
30. Конъюгат по любому из пп. 1-29, в котором антитело имеет константную область подкласса IgG1 с аланином в позиции 234 и 235 и с глицином в позиции 329 с нумерацией согласно ЕС-индексу Kabat.
31. Конъюгат по любому из пп. 1-29, в котором антитело имеет константную область класса IgG4 с пролином в позиции 228, глутаминовой кислотой в позиции 235 и глицином в позиции 329 с нумерацией согласно ЕС-индексу Kabat.
32. Конъюгат по любому из пп. 1-31, в котором конъюгат содержит ровно одну дисульфидную связь в CDR2 тяжелой цепи.
33. Конъюгат по любому из пп. 1-32, в котором дисульфидная связь формируется без добавления окислительно-восстановительных агентов.
34. Конъюгат по любому из пп. 1-33, в котором гаптен конъюгирован с полипептидом через линкер.
35. Конъюгат по п. 34, в котором линкер представляет собой непептидный линкер.
36. Конъюгат по любому из пп. 1-35, в котором гаптен представляет собой биотин, или теофиллин, или дигоксигенин, или карборан, или флуоресцеин, или бромдезоксиуридин.
37. Конъюгат по любому из пп. 1-36, в котором антидигоксигениновое антитело характеризуется тем, что содержит по меньшей мере одну, две, три, четыре, пять или шесть CDR, выбранных среди (a) CDR1 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 09 или 25, (b) CDR2 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 10 или 26, (с) CDR3 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 11 или 27, (d) CDR1 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 13 или 29, (е) CDR2 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 14 или 30, и (f) CDR3 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 15 или 31.
38. Конъюгат по любому из пп. 1-36, в котором антибиотиновое антитело характеризуется тем, что содержит по меньшей мере одну, две, три, четыре, пять или шесть CDR, выбранных среди (a) CDR1 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 41 или 57, (b) CDR2 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 42 или 58, (с) CDR3 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 43 или 59, (d) CDR1 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 45 или 61, (е) CDR2 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 46 или 62, и (f) CDR3 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 47 или 64.
39. Конъюгат по любому из пп. 1-36, в котором антифлуоресцеиновое антитело характеризуется тем, что содержит по меньшей мере одну, две, три, четыре, пять или шесть CDR, выбранных среди (a) CDR1 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 105 или 113, (b) CDR2 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 106 или 114, (с) CDR3 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 107 или 115, (d) CDR1 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 109 или 117, (е) CDR2 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 110 или 118, и (f) CDR3 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 111 или 119.
40. Конъюгат по любому из пп. 1-36, в котором антитеофиллиновое антитело характеризуется тем, что содержит по меньшей мере одну, две, три, четыре, пять или шесть CDR, выбранных среди (a) CDR1 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 73 или 89, (b) CDR2 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 74 или 90, (с) CDR3 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 75 или 91, (d) CDR1 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 77 или 93, (е) CDR2 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 78 или 94, и (f) CDR3 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 79 или 95.
41. Конъюгат по любому из пп. 1-36, в котором антидигоксигениновое антитело характеризуется тем, что содержит по меньшей мере одну, две, три, четыре, пять или шесть CDR, выбранных среди (a) CDR1 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 09 или 25, (b) CDR2 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 10 или 26, (с) CDR3 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 11 или 27, (d) CDR1 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 13 или 29, (е) CDR2 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 14 или 30, и (f) CDR3 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 15 или 31.
42. Конъюгат по любому из пп. 1-36, в котором антибиотиновое антитело характеризуется тем, что содержит (а) домен VH, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности CDR VH, выбранные среди (i) CDR1 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 41 или 57, (ii) CDR2 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 42 или 58, и (iii) CDR3 тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO 43 или 59, и (b) домен VL, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности CDR VL, выбранные среди (i) CDR1 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 45 или 61, (ii) CDR2 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 46 или 62, и (с) CDR3 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 47 или 63.
43. Конъюгат по любому из пп. 1-36, в котором антифлуоресцеиновое антитело характеризуется тем, что содержит (а) домен VH, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности CDR VH, выбранные среди (i) CDR1 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 105 или 113, (ii) CDR2 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 106 или 114, и (iii) CDR3 тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO 107 или 115, и (b) домен VL, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности CDR VL, выбранные среди (i) CDR1 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 109 или 117, (ii) CDR2 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 110 или 118, и (с) CDR3 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 111 или 119.
44. Конъюгат по любому из пп. 1-36, в котором антитеофиллиновое антитело характеризуется тем, что содержит (а) домен VH, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности CDR VH, выбранные среди (i) CDR1 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 73 или 89, (ii) CDR2 тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO 74 или 90, и (iii) CDR3 тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO 75 или 91, и (b) домен VL, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности CDR VL, выбранные среди (i) CDR1 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 77 или 93, (ii) CDR2 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 78 или 94, и (с) CDR3 легкой цепи, содержащей аминокислотную последовательность SEQ ID NO 79 или 95.
45. Конъюгат по любому из пп. 1-36, в котором антидигоксигениновое антитело, и/или антибиотиновое антитело, и/или антитеофиллиновое антитело представляет собой гуманизированное антитело.
46. Конъюгат по любому из пп. 1-36, в котором антидигоксигениновое антитело содержит такие CDR, как в любом из указанных выше пп., а также содержит человеческую акцепторную каркасную область, например, человеческую каркасную область иммуноглобулина или человеческую консенсусную каркасную область.
47. Конъюгат по любому из пп. 1-36, в котором антибиотиновое антитело содержит такие CDR, как в любом из указанных выше пп., а также содержит человеческую акцепторную каркасную область, например, человеческую каркасную область иммуноглобулина или человеческую консенсусную каркасную область.
48. Конъюгат по любому из пп. 1-36, в котором антитеофиллиновое антитело содержит такие CDR, как в любом из указанных выше пп., а также содержит человеческую акцепторную каркасную область, например, человеческую каркасную область иммуноглобулина или человеческую консенсусную каркасную область.
49. Конъюгат по любому из пп. 1-36, в котором антидигоксигениновое антитело характеризуется тем, что содержит последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с аминокислотной последовательностью SEQ ID NO 04, или 12, или 20, или 28.
50. Конъюгат по п. 49, в котором последовательность VH, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность, содержит замены (например, консервативные замены), вставки или делеции по сравнению с референсной последовательностью, но антидигоксигениновое антитело, содержащее эту последовательность, сохраняет способность к связыванию с дигоксигенином.
51. Конъюгат по любому из пп. 49-50, в котором в SEQ ID NO 01, или 09, или 17, или 25 в общей сложности от 1 до 10 аминокислот были замещены, вставлены и/или удалены.
52. Конъюгат по любому из пп. 49-51, в котором замены, вставки или делеции возникают в областях вне CDR (т.е. в FR). Возможно, антидигоксигениновое антитело содержит последовательность VH в SEQ ID NO 01, или 09, или 17, или 25, включая посттрансляционные модификации этой последовательности.
53. Конъюгат по любому из пп. 1-36, в котором антидигоксигениновое антитело характеризуется тем, что содержит последовательность вариабельного домена легкой цепи (VL), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с аминокислотной последовательностью SEQ ID NO 08, или 16, или 24, или 32.
54. Конъюгат по п. 53, в котором последовательность VL, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность, содержит замены (например, консервативные замены), вставки или делеции по сравнению с референсной последовательностью, но антидигоксигениновое антитело, содержащее эту последовательность, сохраняет способность к связыванию с дигоксигенином.
55. Конъюгат по любому из пп. 53-54, в котором в SEQ ID NO 08, или 16, или 24, или 32 в общей сложности от 1 до 10 аминокислот были замещены, вставлены и/или удалены. В некоторых пп. замены, вставки или делеции возникают в областях вне CDR (т.е. в FR).
56. Конъюгат по любому из пп. 53-55, в котором антидигоксигениновое антитело содержит последовательность VL в SEQ ID NO 08, или 16, или 24, или 32, включая посттрансляционные модификации этой последовательности.
57. Конъюгат по любому из пп. 1-36, в котором антибиотиновое антитело характеризуется тем, что содержит последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с аминокислотной последовательностью SEQ ID NO 36, или 44, или 52, или 60.
58. Конъюгат по п. 57, в котором последовательность VH, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность, содержит замены (например, консервативные замены), вставки или делеции по сравнению с референсной последовательностью, но антибиотиновое антитело, содержащее эту последовательность, сохраняет способность к связыванию с биотином.
59. Конъюгат по любому из пп. 57-58, в котором в SEQ ID NO 36, или 44, или 52, или 60 в общей сложности от 1 до 10 аминокислот были замещены, вставлены и/или удалены.
60. Конъюгат по любому из пп. 57-59, в котором замены, вставки или делеции возникают в областях вне CDR (т.е. в FR).
61. Конъюгат по любому из пп. 57-60, в котором антибиотиновое антитело содержит последовательность VH в SEQ ID NO 36, или 44, или 52, или 60, включая посттрансляционные модификации этой последовательности.
62. Конъюгат по любому из пп. 1-36, в котором антифлуоресцеиновое антитело характеризуется тем, что содержит последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с аминокислотной последовательностью SEQ ID NO 108 или 116.
63. Конъюгат по п. 62, в котором последовательность VH, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность, содержит замены (например, консервативные замены), вставки или делеции по сравнению с референсной последовательностью, но антифлуоресцеиновое антитело, содержащее эту последовательность, сохраняет способность к связыванию с флуоресцеином.
64. Конъюгат по любому из пп. 62-63, в котором в SEQ ID NO 108 или 116 в общей сложности от 1 до 10 аминокислот были замещены, вставлены и/или удалены.
65. Конъюгат по любому из пп. 62-64, в котором замены, вставки или делеции возникают в областях вне CDR (т.е. в FR).
66. Конъюгат по любому из пп. 62-65, в котором антифлуоресцеиновое антитело содержит последовательность VH в SEQ ID NO 108 или 116, включая посттрансляционные модификации этой последовательности.
67. Конъюгат по любому из пп. 1-36, в котором антитеофиллиновое антитело характеризуется тем, что содержит последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с аминокислотной последовательностью SEQ ID NO 68, или 76, или 84, или 92.
68. Конъюгат по п. 67, в котором последовательность VH, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность, содержит замены (например, консервативные замены), вставки или делеции по сравнению с референсной последовательностью, но антитеофиллиновое антитело, содержащее эту последовательность, сохраняет способность к связыванию с теофиллином.
69. Конъюгат по любому из пп. 67-68, в котором в SEQ ID NO 68, или 76, или 84, или 92, в общей сложности от 1 до 10 аминокислот были замещены, вставлены и/или удалены.
70. Конъюгат по любому из пп. 67-69, в котором замены, вставки или делеции возникают в областях вне CDR (т.е. в FR).
71. Конъюгат по любому из пп. 67-70, в котором антитеофиллиновое антитело содержит последовательность VH в SEQ ID NO 68, или 76, или 84, или 92, включая посттрансляционные модификации этой последовательности.
72. Конъюгат по любому из пп. 1-36, в котором антидигоксигениновое антитело характеризуется тем, что содержит такие VH, как описано в пп. выше, и такие VL, как описано в пп. выше.
73. Конъюгат по любому из п. 72, в котором антитело содержит последовательности VH и VL в SEQ ID NO 04, или 12, или 20, или 28, и SEQ ID NO 08, или 16, или 24, или 32, соответственно, включая посттрансляционные модификации этих последовательностей.
74. Конъюгат по любому из пп. 1-36, в котором антибиотиновое антитело характеризуется тем, что содержит такие VH, как описано в пп. выше, и такие VL, как описано в пп. выше.
75. Конъюгат по любому из п. 74, в котором антитело содержит последовательности VH и VL в SEQ ID NO 36, или 44, или 52, или 60, и SEQ ID NO 40, или 48, или 56, или 64, соответственно, включая посттрансляционные модификации этих последовательностей.
76. Конъюгат по любому из пп. 1-36, в котором антифлуоресцеиновое антитело характеризуется тем, что содержит такие VH, как описано в пп. выше, и такие VL, как описано в пп. выше.
77. Конъюгат по любому из п. 76, в котором антитело содержит последовательности VH и VL в SEQ ID NO 108 или 116 и SEQ ID NO 112 или 120, соответственно, включая посттрансляционные модификации этих последовательностей.
78. Конъюгат по любому из пп. 1-36, в котором антитеофиллиновое антитело содержит такие VH, как описано в пп. выше, и такие VL, как описано в пп. выше.
79. Конъюгат по любому из п. 78, в котором антитело содержит последовательности VH и VL в SEQ ID NO 68, или 76, или 84, или 92, и SEQ ID NO 72, или 80, или 88, или 96, соответственно, включая посттрансляционные модификации этих последовательностей.
80. Фармацевтическая композиция, содержащая конъюгат по любому из пп. 1-79 и фармацевтически приемлемый носитель.
81. Конъюгат по любому из пп. 1-79 для применения в качестве лекарственного средства.
82. Конъюгат по любому из пп. 1-79 для лечения рака.
83. Конъюгат по любому из пп. 1-79 для лечения вирусного заболевания.
84. Применение конъюгата по любому из пп. 1-79 в производстве лекарственного средства.
85. Применение конъюгата по любому из пп. 1-79 для повышения стабильности полипептида.
86. Применение конъюгата по любому из пп. 1-79 для уменьшения или устранения нецелевых токсических эффектов полипептида.
87. Применение конъюгата по любому из пп. 1-79 для увеличения активности полипептида.
88. Применение конъюгата по любому из пп. 1-79 для увеличения периода полужизни полипептида in vivo.
89. Применение конъюгата по любому из пп. 1-79 в лечении заболевания.
90. Способ лечения индивидуума, имеющего заболевание, включающий введение индивидууму эффективного количества конъюгата по любому из пп. 1-79.
91. Способ лечения заболевания у индивидуума, включающий введение индивидууму эффективного количества конъюгата по любому из пп. 1-79.
92. Способ по п. 91, где заболевание представляет собой рак.
93. Способ получения конъюгата по любому из пп. 1-79, содержащего комбинацию антитела, включающего искусственный остаток цистеина антитела, и гаптенилированного полипептида, включающего искусственный остаток цистеина полипептида, где альфа-углеродный атом искусственного остатка цистеина антитела находится на расстоянии примерно 10-11 ангстрем от атома полипептида, с которым слит линкер.
94. Способ получения конъюгата по любому из пп. 1-79, содержащий этапы
- объединения в растворе антитела, которое специфически связывается с гаптеном и которое имеет искусственный остаток цистеина антитела в CDR2, с гаптенилированным полипептидом, содержащим искусственный остаток цистеина полипептида, и
- выделения конъюгата из раствора.
95. Биспецифическое антитело для нацеленной доставки гаптенилированного соединения к клетке-мишени, где биспецифическое антитело обладает первым сайтом связывания, который специфически связывается с гаптенилированным полипептидом, и второй специфичностью связывания, которая специфически направлена на маркер клеточной поверхности.
96. Биспецифическое антитело по п. 95, в котором дисульфидная связь формируется между остатком цистеина, расположенным либо до, либо после остатка лизина, который используется для гаптеновой конъюгации полипептида, и остатком цистеина в CDR2 антитела, где CDR2 определен в соответствии с Kabat.
97. Биспецифическое антитело по любому из пп. 95-96, в котором остаток цистеина находится на расстоянии от 1 до 3 остатков до или после лизина, который используется для гаптеновой конъюгации. В этом воплощении остаток цистеина находится в одной из позиций N минус 3, N минус 2, N минус 1, N плюс 1, N плюс 2 или N плюс 3 по отношению к остатку лизина.
98. Биспецифическое антитело по любому из пп. 95-97, в котором остаток цистеина находится на расстоянии двух остатков до (т.е. в позиции N минус 2 по отношению к остатку лизина) или после (т.е. в позиции N плюс 2 по отношению к остатку лизина) остатка лизина, который используется для гаптеновой конъюгации.
99. Биспецифическое антитело по любому из пп. 95-98, в котором остаток лизина, который используется для гаптеновой конъюгации, находится в пределах десяти N-концевых аминокислотных остатков полипептида.
100. Биспецифическое антитело по любому из пп. 95-99, в котором полипептид содержит ровно один остаток лизина в своей аминокислотной последовательности.
Раскрытие всех ссылок, приведенных в данном документе, включено в данный документе посредством ссылки.
Следующие примеры, графические материалы и последовательности приведены для того, чтобы помочь пониманию данного изобретения, истинный объем которого изложен в прилагаемой формуле изобретения. Нужно понимать, что в изложенных процедурах могут быть сделаны модификации без отклонения от сущности данного изобретения.
Примеры
Синтез гаптенилированных соединений, используемых в примерах, был описан в РСТ/ЕР 2013/064100 и WO 2012/093068.
Пример 1
Кристаллизация и определение рентгенографической структуры связывающей области мышиной антидигоксигениновой Fv-области в присутствии дигоксигенина и связывающей области мышиной антибиотиновой Fv-области в присутствии биотина
Определение структуры Fab-фрагмента дигоксигенин-связывающего антитела было подробно описано в WO 2011/003557 и WO 2011/003780, а также опубликовано (3RA7) в Metz, S. et al., Proc. Natl. Acad. Sci. USA 108 (2011) 8194-8199.
Была определена структура мышиного антибиотинового антитела. Таким образом, Fab-фрагменты были получены путем протеазного расщепления очищенных IgG, а затем очищены с помощью хорошо известных в данной области способов (расщепление папаином).
Для кристаллизации апо-Fab-фрагмент (очищенные Fab) в 20 мМ His-HCl, 140 мМ NaCl, рН 6,0, концентрировали до 13 мг/мл. Кристаллизацию капель проводили при 21°С путем смешивания 0,2 мкл раствора белка с 0,2 мкл раствора резервуара в экспериментах с диффузией паров в сидячей капле. Кристаллы появлялись из раствора, содержащего 0,1 М Tris, рН 8,5, 0,01 М хлорид кобальта, 20% поливинилпирролидон K15, в течение 5 дней и вырастали до конечного размера 0,3 мм × 0,06 мм × 0,03 мм в течение 8 дней.
Кристаллы собирали, используя 15% глицерин в качестве криопротектора, а затем мгновенно замораживали в жидком азоте. Дифракционные изображения получали с помощью детектора Pilatus 6М при температуре 100К на пучке света X10SA от источника света Swiss Light Source, обрабатывали с помощью программ XDS (Kabsch, W., J. Appl. Cryst. 26 (1993) 795-800) и масштабировали с SCALA (получен от BRUKER AXS), получая данные с разрешением 2,22
Стандартные кристаллографические программы из пакета программного обеспечения ССР4 использовали для определения структуры путем молекулярного замещения с PDB 3PQP в качестве модели поиска, чтобы вычислить электронную плотность, а также уточнить рентгеноструктуру (ССР4, Collaborative Computational Project, Acta Crystallogr. D, 760-763 (1994)). Структурные модели перестраивали в электронной плотности с использованием COOT (Emsley, P., et al. Acta Crystallogr. D Biol. Crystallogr. 60 (2010) 486-501). Координаты уточняли с помощью REFMAC5 (Murshudov, G.N., et al. Acta Crystallogr. D Biol. Crystallogr. 53 (1997) 240-55) и autoBUSTER (Global Phasing Ltd.).


Для кристаллизации Fab-фрагмента в комплексе с биотиновым производным апокристаллы Fab-фрагмента, используемые для экспериментов с замачиванием, получали из 0,8 М янтарной кислоты в течение 3 дней после скрининга и выращивали до конечного размера 0,25 мм × 0,04 мм × 0,04 мм в течение 5 дней. Биоцитинамид растворяли в концентрации 100 мМ в воде. Затем соединение разводили до рабочей концентрации 10 мМ в растворе для кристаллизации и наносили на кристаллы в капле кристаллизации. Кристаллы промывали три раза с помощью 2 мкл 10 мМ раствора соединения и, наконец, инкубировали в течение 16 ч с биоцитинамидом при температуре 21°С.
Кристаллы собирали, используя 15% глицерин в качестве криопротектора, а затем мгновенно замораживали в жидком азоте. Дифракционные изображения получали с помощью детектора Pilatus 6М при температуре 100К на пучке света X10SA от источника света Swiss Light Source, обрабатывали с помощью программ XDS (Kabsch, W., J. Appl. Cryst. 26 (1993) 795-800) и масштабировали с SCALA (получен от BRUKER AXS), получая данные с разрешением 2,35
Стандартные кристаллографические программы из пакета программного обеспечения ССР4 использовали для определения структуры путем молекулярного замещения с координатами апо-Fab-фрагмента в качестве модели поиска, чтобы вычислить электронную плотность, а также уточнить рентгеноструктуру с разрешением 2,5
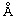

Результат экспериментального определения структуры показан на Фиг. 6. Кристаллическая форма комплекса содержала четыре независимых комплекса "биоцитинамид: анти-биотин-Fab" в асимметричном блоке, при этом биоцитинамид связывался аналогичным образом всеми Fab-молекулами. Биоцитинамид связывается в кармане, образованном CDR1 и CDR3 тяжелой цепи и всеми тремя CDR легкой цепи. Связывающий карман лиганда определяется остатками ASN29, ASP31, THR32, РНЕ33, GLN35, TRP99 и TRP106 из тяжелой цепи и ASN31, TYR32, LEU33, SER34, TYR49, SER50, РНЕ91 и TYR96 из легкой цепи. Биотиновая головная группа формирует водородные связи с остатками CDR2 и CDR1 на одном конце кармана: N3 биоцитинамида взаимодействует с гидроксильным кислородом Ser50, тогда как O22 находится в контакте с азотом остовного амида того же остатка. Кроме того, O22 биоцитинамида также связан водородными связями с кислородом гидроксильной группы Ser34. Кроме того, между биоцитинамидом и ароматическими боковыми цепями, выстилающими связывающий карман, наблюдаются гидрофобные взаимодействия. Амидная связь на конце алифатического (СН2)4-хвоста биотина укладывается на РНЕ33 в CDR1 тяжелой цепи и стабилизируется за счет дополнительной водородной связи с азотом остовного амида в РНЕ33 и с Asp31. Это позиционирует амидный азот, который является сайтом связывания с активным блоком, таким образом, что атомы, которые следуют за азотом, направлены в сторону от кармана связывания в направлении растворителя.
Результаты экспериментального определения области связывания при разрешении 2,5
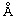
Пример 2
Определение и создание антигаптенового антитела с введенными функциональными группами для ковалентной конъюгации
Проводили дериватизацию гуманизированных последовательностей VH и VL антигаптенового антитела, описанного выше, чтобы создать соединения, которые позволяют ковалентно связывать антигены/гаптены с антителом в определенной позиции.
Экспериментально определенную структуру антидигоксигенинового Fab-фрагмента, связанного с дигоксигенином (3RA7) (Metz, S. et al., Proc. Natl. Acad. Sci. USA 108 (2011) 8194-8199), использовали для идентификации позиций, в которых изменения позволяют происходить сайт-направленной реакции связывания между антителом и его комплексообразующим антигеном/гаптеном. Структуру антибиотинового Fab-фрагмента, связанного с биоцитинамидом (см. пример 5), использовали для подтверждения правильной позиции введенного остатка цистеина в биотинсвязывающий фрагмент антитела и получали доказательство общей применимости идентифицированной позиции (позиций).
Позиции, которые будут мутированы, должны отвечать одновременно двум требованиям: (i) позиции для связывания должны находиться в непосредственной близости от области связывания, чтобы использовать эффект позиционирования антигена/гаптена для направленного связывания, и (ii) позиция мутации и связывания должна быть расположена таким образом, чтобы не влиять на связывание самого антигена/гаптена. Эти требования для поиска подходящей позиции по факту "противоречат" друг к другу, потому что требованию (i) лучше всего удовлетворяет позиция, близкая к сайту связывания, в то время как требование (ii) наиболее безопасно достигается с помощью позиций, которые удалены от сайта связывания.
Несмотря на эти практически исключающие требования, мы смогли выявить позиции, которые могут быть мутированы без влияния на позиционирование гаптена и которые, тем не менее, одновременно делают возможным направленное ковалентное связывание гаптенилированного соединения.
Первая позиция находится в позиции VH52b или VH53 в соответствии с нумерацией по Kabat в зависимости от фактической длины CDR2 соответствующего антитела. В структуре антидигоксигенинового антитела гаптен связан в глубоком кармане, образованном гидрофобными остатками. В данном кристаллографическом исследовании был использован флуоресцентный конъюгат "дигоксигенин-Cy5", где флуорофор, а также линкер между дигоксигенином и Cy5 не были видны в структуре из-за высокой гибкости и приводили к нарушению в кристалле. Тем не менее, линкер и Cy5 прикрепляются к O32 дигоксигенина, который указывает в направлении CDR2 тяжелой цепи. Расстояние между O32 (см. выше) дигоксигенина и Сα аминокислотного остатка в позиции 52b в соответствии с нумерацией Kabat составляет 10,5
Замена аминокислоты в позиции VH52b/VH53 на Cys давала производные антитела с последовательностями вариабельной области тяжелой цепи, которые перечислены как SEQ ID NO 20 и 28 для антидигоксигенинового антитела-VH52bC, SEQ ID NO 84 и 92 для антитеофиллинового антитела-VH53C, SEQ ID NO 52 и 60 для антибиотинового антитела-VH53C и SEQ ID NO 108 для антифлуоресцеинового антитела-VH52bC.
Еще одной позицией, которая была определена в качестве точки модификации, является позиция VH28 согласно нумерации Kabat.
В результате мы ввели цистеин в позицию Kabat VH28. Замещение аминокислоты в позиции VH28 на Cys дало производные антитела с последовательностями вариабельной области тяжелой цепи, которые перечислены в SEQ ID NO 124 и 132 для антидигоксигенинового антитела-VH28C, SEQ ID NO 156 и 164 для антитеофиллинового антитела-VH28C, SEQ ID NO 140 и 148 для антибиотинового антитела-VH28C и SEQ ID NO 116 для антифлуоресцеинового антитела-VH28C.
Было обнаружено, что одна из этих позиций является "универсальной" позицией, т.е. эта позиция применима к любому антителу, и, таким образом, не требуется начинать с нуля каждый раз, когда нужно изменить новое антитело путем получения кристаллической структуры и определения соответствующей позиции, которая делает возможным гаптен-позиционированное ковалентное связывание.
Мутация VH52bC или VH53C, соответственно, согласно нумерации вариабельной области тяжелой цепи Kabat может быть использована для каждого гаптенсвязывающего антитела (антигаптенового антитела). Несмотря на то, что антитела и структуры их связывающих карманов весьма разнообразны, было показано, что мутация VH52bC/VH53C может быть использована для ковалентного присоединения антигенов/гаптенов к антителам, которые связывают дигоксигенин, биотин, флуоресцеин, а также теофиллин.
Связывающие группировки, которые состоят из этих последовательностей, могут быть экспрессированы и очищены с помощью стандартной хроматографии на белке А и эксклюзионной хроматографии (см. пример 3). Полученные молекулы были полностью функциональны и сохраняли аффинность к их родственным гаптенам таким же образом, как и их немодифицированные родительские молекулы. Это было продемонстрировано с помощью экспериментов поверхностного плазмонного резонанса (SPR) (см. пример 4).
Пример 3
Сборка, экспрессия и очистка рекомбинантных антигаптеновых антител
Мышиные и гуманизированные вариабельные области антигаптенового антитела были объединены с константными областями человеческого происхождения для формирования моно- или биспецифических химерных или гуманизированных антител.
Для создания моноспецифических гуманизированных антигаптеновых антител и биспецифических гуманизированных антигаптеновых антител, которые специфически связываются с гаптеном, а также с другой негаптеновой мишенью (например, рецепторными тирозинкиназами или IGF-1R) требуется (i) разработка и определение аминокислотных и нуклеотидных последовательностей для таких молекул, (ii) экспрессия этих молекул в трансфицированных культивируемых клетках млекопитающих, и (iii) очистка этих молекул из супернатантов трансфицированных клеток. Эти этапы выполняли, как было описано ранее в публикации WO 2012/093068.
Как правило, для создания гуманизированного антитела класса IgG, которое обладает специфичностью связывания (исходного) мышиного антигаптенового антитела, гуманизированную последовательность VH сливали в рамке считывания с N-концом СН1-шарнир-СН2-СН3 человеческой Fc-области подкласса IgG1. Аналогичным образом, гуманизированную последовательность VL сливали в рамке считывания с N-концом человеческой константной области CLkappa.
Для того чтобы создать производные биспецифических антител, которые обладают гаптенсвязывающей специфичностью, а также специфичностью к другим мишеням, антигаптеновое антитело, scFv- или Fab-фрагмент сливали в рамке считывания с С-концом тяжелой цепи описанных ранее антител. Во многих случаях применяемый антигаптеновый scFv дополнительно стабилизировали введением дисульфидной связи VH44-VL100, которая была описана ранее (например, Reiter, Y., et al., Nature biotechnology 14 (1996) 1239-1245).
Экспрессионные плазмиды
Экспрессионные плазмиды, содержащие экспрессионные кассеты для экспрессии тяжелой и легкой цепей, по отдельности собирали в векторы для экспрессии в клетках млекопитающих.
Таким образом, генные сегменты, кодирующие отдельные элементы, соединяли, как описано выше.
Общие сведения касательно нуклеотидных последовательностей человеческих легких и тяжелых цепей, из которых может быть выведено использование кодонов, даны в: Kabat, Е.А., et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991), NIH Publication No 91-3242.
Транскрипционный блок для легкой κ-цепи состоит из следующих элементов:
- немедленный ранний энхансер и промотор из человеческого цитомегаловируса (hCMV),
- синтетическая 5'-UT-область, включающая последовательность Козака,
- сигнальная последовательность тяжелой цепи мышиного иммуноглобулина, включающая интрон сигнальной последовательности,
- клонированная кДНК вариабельной области легкой цепи, собранная с уникальным сайтом рестрикции Bsml на 5'-конце и сайтом-донором для сплайсинга и уникальным сайтом рестрикции Notl на 3'-конце,
- геномная константная область человеческого κ-гена, включающая энхансер интрона 2 κ-цепи мышиного Ig (Picard, D., and Schaffner, W. Nature 307 (1984) 80-82), и
- сигнальная последовательность κ-полиаденилирования иммуноглобулина человека ("поли А").
Транскрипционный блок для тяжелой γl-цепи состоит из следующих элементов:
- немедленный ранний энхансер и промотор из человеческого цитомегаловируса (hCMV),
- синтетическая 5'-UT-область, включающая последовательность Козака,
- модифицированная сигнальная последовательность тяжелой цепи мышиного иммуноглобулина, включающая интрон сигнальной последовательности,
- клонированная кДНК моноспецифической вариабельной области тяжелой цепи или клонированная кДНК биспецифического гибрида scFv-вариабельная тяжелая цепь, собранная с уникальным сайтом рестрикции Bsml на 5'-конце и сайтом-донором для сплайсинга и уникальным сайтом рестрикции Notl на 3'-конце,
- геномная константная область человеческого γ1-гена, включающая μ-энхансер мышиного Ig (Picard, D., and Schaffner, W. Nature 307 (1984) 80-82), и
- сигнальная последовательность полиаденилирования γ1-иммуноглобулина человека ("поли А").
Помимо экспрессионной кассеты легкой κ-цепи или тяжелой γ1-цепи эти плазмиды содержат
- ген устойчивости к гигромицину,
- сайт начала репликации, oriP, из вируса Эпштейна-Барр (EBV),
- сайт начала репликации из вектора pUC18, который делает возможной репликацию этой плазмиды в Е. coli, и
- ген β-лактамазы, который придает устойчивость к ампициллину в Е. coli.
Методики рекомбинантной ДНК
Клонирование проводили с использованием стандартных методик клонирования, описанных в Sambrook и др., 1999 (см. выше). Все молекулярно-биологические реагенты были коммерчески доступны (если не указано иное) и использовались в соответствии с инструкциями производителя.
ДНК, которая содержит кодирующие последовательности, мутации или дополнительные генетические элементы, была синтезирована в Geneart AG, Регенсбург.
ДНК-последовательности определяли с помощью секвенирования двунитевой ДНК, проведенного на SequiServe (SequiServe GmbH, Германия).
Анализ ДНК и белковой последовательности и управление данными о последовательности
Программу Vector NTI Advance версии 9.0 использовали для создания последовательности, картирования, анализа, аннотирования и иллюстрации.
Экспрессия антигаптеновых антител и их производных
Антигаптеновые антитела экспрессировали путем временной трансфекции клеток почек эмбриона человека 293 (НЕК293) в суспензии. Для этого легкие и тяжелые цепи соответствующих моно- или биспецифических антител встраивали в экспрессионные векторы, несущие маркеры селекции в прокариотах и эукариотах, описанные выше. Эти плазмиды амплифицировали в Е. coli, очищали, а затем использовали для временной трансфекции. Стандартные методики культивирования клеток использовали для процедур с клетками, как описано в Current Protocols in Cell Biology (2000), Bonifacino, J.S., Dasso, M., Harford, J.В., Lippincott-Schwartz, J. and Yamada, K.M. (eds.), John Wiley & Sons, Inc.
Клетки культивировали в соответствующей среде для экспрессии при 37°С/8% CO2. В день трансфекции клетки высевали в свежей среде с плотностью 1-2×106 жизнеспособных клеток/мл. ДНК-комплексы с реагентами для трансфекции готовили в среде Opti-MEM I (Invitrogen, США), содержащей 250 мкг плазмидной ДНК с тяжелой и легкой цепями в молярном соотношении 1:1, в конечном объеме для трансфекции 250 мл. Клеточные культуральные супернатанты, содержащие моноспецифические или биспецифические антитела, осветляли через 7 дней после трансфекции путем центрифугирования со скоростью 14000 g в течение 30 мин и фильтрации через стерилизующий фильтр (0,22 мкм). Супернатанты хранили при -20°С до очистки.
Для определения концентрации антител и производных в клеточных культуральных супернатантах применяли аффинную HPLC-хроматографию. Для этого клеточный культуральный супернатант, содержащий моно- или биспецифическое антитело или их производные, которые связываются с белком А, наносили на колонку Applied Biosystems Poros А/20 в растворе, содержащем 200 мМ KH2PO4, 100 мМ цитрат натрия, рН 7,4. Элюирование с хроматографического материала проводили путем подачи раствора, содержащего 200 мМ NaCl, 100 мМ лимонную кислоту, рН 2,5. Использовали HPLC-систему UltiMate 3000 (Dionex). Элюированный белок количественно оценивали с помощью УФ-поглощения и интеграции площади пиков. Очищенное антитело IgG1 служило в качестве стандарта.
Очистка антигаптеновых антител, которые связывают дигоксигенин, Флуоресцеин, теофиллин или биотин
Через семь дней после трансфекции собирали клеточные супернатанты НЕК 293. Рекомбинантное антитело (или производные), содержащееся в них, очищали из супернатантов в два этапа путем аффинной хроматографии с использованием аффинной хроматографии на белке A-Sepharose™ (GE Healthcare, Швеция) и эксклюзионной хроматографии Superdex200. Вкратце, содержащие антитело осветленные культуральные супернатанты наносили на колонку MabSelectSuRe с белком А (5-50 мл), уравновешенную PBS-буфером (10 мМ Na2HPO4, 1 мМ KH2PO4, 137 мМ NaCl и 2,7 мМ KCl, рН 7,4). Несвязанные белки отмывали уравновешивающим буфером. Антитела (или их производные) элюировали с помощью 50 мМ цитратного буфера, рН 3,2. Содержащие белок фракции нейтрализовали с помощью 0,1 мл 2 М Tris-буфера, рН 9,0. Затем элюированные белковые фракции объединяли, концентрировали на устройстве с фильтрованием центрифугированием Amicon (MWCO: 30 К, Millipore) и наносили на гель-фильтрационную колонку Superdex200 HiLoad 26/60 (GE Healthcare, Швеция), уравновешенную раствором, содержащим 20 мМ гистидин, 140 мМ NaCl, рН 6,0. Белковую концентрацию очищенных антител и их производных определяли путем определения оптической плотности (OD) при 280 нм, используя OD при 320 нм в качестве фоновой коррекции и коэффициент молярной экстинкции, рассчитанный на основании аминокислотной последовательности в соответствии с Расе et. al., Protein Science 4 (1995) 2411-2423. Фракции мономерных антител объединяли, мгновенно замораживали и хранили при -80°С. Часть образцов была использована для последующего белкового анализа и характеризации.
Гомогенность антител подтверждали путем SDS-PAGE в присутствии и в отсутствие восстанавливающего агента (5 мМ 1,4-дитиотреитола) и окрашивания Кумасси бриллиантовым синим. Использовали гель-систему NuPAGE® Pre-Cast (Invitrogen, США) в соответствии с инструкцией производителя (4-20% Tris-глициновые гели).
После SDS-PAGE в восстанавливающих условиях были выявлены полипептидные цепи, связанные с IgG, с кажущимися молекулярными размерами, аналогичными расчетным молекулярным массам. Уровни экспрессии всех конструкций были проанализированы с помощью белка А. Средний выход белка в таких экспериментах с неоптимизированной временной экспрессией составлял от 6 мг до 35 мг очищенного белка на литр клеточного культурального супернатанта.
Пример 4
Связывание рекомбинантного гуманизированного антибиотинового антитела с биотин-меченным соединением (гаптенилированным соединением)
Для того чтобы определить, привела ли процедура гуманизации и последующее введение цистеиновых мутаций к образованию производных, которые сохранили полную связывающую активность, были проведены следующие эксперименты.
Связывающие свойства рекомбинантных производных антибиотинового антитела анализировали с помощью технологии двуслойной интерферометрии (BLI), используя инструмент Octet QK (Fortebio Inc.). Эта система широко используется в изучении молекулярных взаимодействий. BLI-технология основана на измерении характера интерференции белого света, отраженного от поверхности биосенсорного наконечника, и внутреннего референса. Связывание молекул на биосенсорном наконечнике приводит к смещению интерференционной картины, что можно измерить. Для того чтобы проанализировать, уменьшает ли описанная выше процедура гуманизации способность антибиотинового антитела связываться с биотином, непосредственно сравнивали свойства химерного и гуманизированного вариантов антитела в отношении их способности связываться с биотинилированным белком. Исследования связывания проводили путем захвата антибиотинового антитела на биосенсорах через анти-hulgG Fc-антитело захвата (anti-hulgG Fc antibody Capture (AHC) Biosensors (Fortebio Inc.)). Вначале биосенсоры инкубировали в растворе антитела с концентрацией 0,5 мг/мл в растворе, содержащем 20 мМ гистидин, 140 мМ NaCl, рН 6,0, в течение 1 мин. После этого биосенсоры инкубировали в течение 1 мин в 1× PBS, рН 7,4, для достижения стабильной базальной линии. Связывание измеряли, инкубируя биосенсоры, покрытые антителами, в растворе, содержащем биотинилированный белок в концентрации 0,06 мг/мл в 20 мМ гистидине, 140 мМ NaCl, рН 6,0, в течение 5 мин. Диссоциацию контролировали в течение 5 мин в 1× PBS, рН 7,4. Полученные кривые связывания для химерных и гуманизированных антибиотиновых антител сравнивали напрямую.
Гуманизированный вариант антитела показал такое же или даже улучшенное связывание биотинилированного антигена, чем химерное антитело. То же самое справедливо и для гуманизированного антитела с мутацией Cys в позиции VH53 согласно Kabat. Биотинилированный белок показал остаточное неспецифическое связывание с биосенсорами, которое уменьшалось, когда биосенсоры были покрыты герцептином, который не связывает биотин. Таким образом, функциональность антибиотинового антитела сохранялась у его гуманизированного варианта (который определяется последовательностями, показанными в SEQ ID NO 44 и 48, SEQ ID NO 60 и 64).
Поверхностный плазмонный резонанс
Измерение поверхностного плазмонного резонанса проводили на инструменте Biacore® Т200 (GE Healthcare Biosciences AB, Швеция) при 25°C. Примерно 4300 единиц ответа (RU) системы захвата (10 мкг/мл противочеловеческого антитела захвата (Fc IgG) из набора Human Antibody Capture Kit, BR-1008-39, GE Healthcare Biosciences AB, Швеция) связывали с чипом СМ3 (GE Healthcare, BR-1005-36) при рН 5,0 с использованием стандартного набора для аминного связывания, поставляемого компанией GE Healthcare (BR-1000-50). Рабочим буфером для аминного связывания был HBS-N (10 мМ HEPES, рН 7,4, 150 мМ NaCl, GE Healthcare, BR-1006-70). Рабочим буфером и буфером для разведения в последующем анализе связывания был PBS-T (10 мМ фосфатный буферный раствор, содержащий 0,05% Tween 20), рН 7,4. Гуманизированное антибиотиновое антитело захватывали путем введения 2 нМ раствора в течение 60 секунд со скоростью потока 5 мкл/мин. Биотинилированную миРНК разводили в PBS-T в концентрациях 0,14-100 нМ (серийное разведение 1:3). Связывание измеряли путем введения каждой из концентраций в течение 180 секунд со скоростью потока 30 мкл/мин, время диссоциации составляло 600 секунд. Поверхность подвергали регенерации путем 30-секундного промывания 3 М раствором MgCl2 со скоростью потока 5 мкл/мин. Данные оценивали с помощью программного обеспечения BIAevaluation (GE Healthcare Biosciences AB, Швеция). Влияние объема образца на смещение показателей преломления корректировали путем вычитания ответа, полученного от поверхности с противочеловеческим Fc IgG. Пустые введения также вычитали (= двойной референс). Для расчета KD и кинетических параметров использовали модель Ленгмюра 1:1.
Кинетический анализ связывания с помощью поверхностного плазмонного резонанса (SPR) проводили для гуманизированного антибиотинового антитела SEQ ID NO 44 и 48 и гуманизированного антибиотинового антитела VH53C SEQ ID NO 60 и 64. Антибиотиновые антитела в концентрации 2 нМ захватывали противочеловеческим IgG Fc-антителом, которое было связано с сенсорным чипом СМ3. Связывание биотинилированной миРНК (ММ: 13868 Да) регистрировали в концентрациях 0,41, 1,23, 3,7, 11,1, 33,3, 100 и 300 нМ. Измерения проводили в двух повторах. Рассчитанный KD для гуманизированного антибиотинового антитела и гуманизированного антибиотинового антитела VH53C составлял 0,633 нМ и 0,654 нМ, соответственно.
Пример 5
Создание нековалентных комплексов гаптенилированных соединений с антигаптеновыми антителами
Общий способ:
Создание комплексов антигаптеновых антител с гаптенилированными соединениями (= гаптены, конъюгированные с полезной нагрузкой) должно приводить к образованию определенных комплексов, и это должно гарантировать, что соединение (= полезная нагрузка) в этих комплексах сохраняет свою активность. Для создания комплексов гаптенилированных соединений с соответствующим антигаптеновым антителом гаптенилированное соединение растворяли в H2O до конечной концентрации 1 мг/мл. Антитело концентрировали до конечной концентрации 1 мг/мл (4,85 мкМ) в буфере, содержащем 20 мМ гистидин, 140 мМ NaCl, рН 6,0. Гаптенилированную полезную нагрузку и антитело смешивали в молярном соотношении 2:1 (соединение к антителу) путем пипетирования вверх и вниз и инкубировали в течение 15 минут при комнатной температуре.
Альтернативно, гаптенилированное соединение растворяли в 100% DMF до конечной концентрации 10 мг/мл. Антитело концентрировали до конечной концентрации 10 мг/мл в 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Гаптенилированное соединение и антитело смешивали в молярном соотношении 2,5:1 (соединение к антителу) путем пипетирования вверх и вниз и инкубировали в течение 60 минут при комнатной температуре и встряхивании 350 об/мин.
Иллюстративный способ формирования комплексов гаптенилированных флуоресцентных меток и антигаптеновых антител - нековалентный комплекс "дигоксигенин-Cy5"
Гуманизированное и мышиное антидигоксигениновое антитело или производные биспецифического антидигоксигенинового антитела использовали в качестве компонента "антитело". Для создания комплексов дигоксигенилированного Cy5 с антидигоксигениновыми антителами конъюгат "Cy5-дигоксигенин" растворяли в PBS до конечной концентрации 0,5 мг/мл. Антитело использовали в концентрации 1 мг/мл (примерно 5 мкМ) в буфере, содержащем 20 мМ гистидин и 140 мМ NaCl, рН 6. Дигоксигенилированный Cy5 и антитело смешивали в молярном соотношении 2:1 (дигоксигенилированный Cy5 к антителу). В результате этой процедуры получали гомогенный препарат комплексов определенного состава.
Реакцию комплексообразования можно контролировать путем определения флуоресценции (650/667 нм) флуорофора, ассоциированного с антителом, на эксклюзионной колонке. Результаты этих экспериментов показывают, что комплексообразование происходит только тогда, когда антитело обладает специфичностью связывания в отношении дигоксигенина. Антитела без специфичности связывания в отношении дигоксигенина не связывают конъюгат "дигоксигенин-Cy5". Увеличение сигнала можно наблюдать для двухвалентных антидигоксигениновых антител до тех пор, пока соотношение конъюгата "дигоксигенин-Cy5" к антителу составляет 2:1. После этого зависимость сигналов флуоресценции от состава достигает плато.
Иллюстративный способ формирования комплексов гаптенилированных флуоресцентных меток и антигаптеновых антител - комплекс биотин-Cy5/химерное антибиотиновое антитело (человеческое подкласса IgG)
Для создания комплексов биотин-производных-Cy5 (биотин-Cys-Cy5), содержащих цистеинилированный линкер, 0,16 мг биотина-Cys-Cy5 растворяли в 100% DMF до концентрации 10 мг/мл. 1 мг антитела использовали в концентрации 10,1 мг/мл (примерно 69 мкМ) в буфере, содержащем 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Биотин-Cys-Cy5 и антитело смешивали в молярном соотношении 2,5:1 (биотин-Cys-Cy5 к антителу) и инкубировали в течение 60 мин при комнатной температуре, встряхивая при 350 об/мин. Полученный конъюгат анализировали с помощью SDS-PAGE, как описано в примере 6а. Обнаружение флуоресценции проводили, как описано в примере 6а.
Иллюстративный способ формирования конъюгатов биотинилированных флуоресцентных меток и антибиотиновых антител - биотин-Ser-Cy5/гуманизированное антибиотиновое антитело
Для создания комплексов биотин-производного-Cy5 (биотин-Ser-Cy5), содержащих остаток серина в линкере, 0,61 мг биотина-Ser-Cy5 растворяли в растворе, содержащем 20 мМ гистидин, 140 мМ NaCl, рН 6,0, до концентрации 10 мг/мл. 18,5 мг гуманизированного антибиотинового антитела использовали в концентрации 10 мг/мл (примерно 69 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Биотин-Ser-Cy5 и антитело смешивали в молярном соотношении 2,5:1 (биотин-Ser-Cy5 к антителу) и инкубировали в течение 60 минут при комнатной температуре, встряхивая при 350 об/мин. Затем образец подвергали эксклюзионной хроматографии с помощью препаративной колонки с высокой загрузкой Superdex 200 16/60 (GE Healthcare) со скоростью потока 1,5 мл/мин, используя в качестве подвижной фазы раствор, содержащий 20 мМ гистидин, 140 мМ NaCl, рН 6,0. Пиковые фракции собирали и анализировали путем SDS-PAGE на предмет чистоты. Соотношение метки и антитела рассчитывали: (1) измеряя оптическую плотность образцов при длине волны 280 нм (белок) и 650 нм (Cy5); (2) используя формулу: А650 меченого белка/ε(Cy5)*концентрация белка (М) = моли метки на моль белка, где ε(Cy5)=250000 М-1см-1, А650 комплекса =47,0 а концентрация белка составляет 86,67 мкМ. Полученное отношение молекул метки и антитела составляло 2,17, что указывает на то, что все паратопы антитела насыщены молекулами биотина-Cy5.
Иллюстративный способ формирования комплексов гапетинилированных полипептидов и антигаптеновых антител - комплекс дигоксигенин-PYY(3-36)/антидигоксигениновое антитело
Для создания нековалентных комплексов дигоксигенилированных полипептидов с антидигоксигениновым антителом полученное из мышиной гибридомы антитело (лиофилизат из 10 мМ KPO4, 70 мМ NaCl; рН 7,5) растворяли в 12 мл воды и диализовали против раствора, содержащего 20 мМ гистидин, 140 мМ NaCl, рН 6,0, получая 300 мг (2×10-6 моль) в 11 мл буфера (с=27,3 мг/мл). Конъюгат дигоксигенин-PYY(3-36) (11,57 мг, 4×10-6 моль, 2 экв.) добавляли в 4 порциях по 2,85 мг в течение 1 ч и инкубировали в течение еще 1 ч при комнатной температуре. После завершения реакции комплесообразования комплексы очищали путем эксклюзионной хроматографии на колонке Superdex 200 26/60 GL (320 мл) в растворе, содержащем 20 мМ гистидин, 140 мМ NaCl, рН 6,0, со скоростью потока 2,5 мл/мин. Элюированный комплекс собирали во фракции объемом 4 мл, объединяли и стерилизовали через фильтр 0,2 мкм, получая 234 мг комплекса в концентрации 14,3 мг/мл. Аналогичным образом для создания комплексов гуманизированного антидигоксигенинового антитела концентрацию антитела доводили до 10,6 мг/мл (9,81 мг, 6,5×10-8 моль в 0,93 мл) в растворе, содержащем 20 мМ гистидин, 140 мМ NaCl, рН 6,0. Добавляли 0,57 мг =1,97×10-7 моль =3,03 экв. дигоксигенилированного полипептида (DIG-PYY) к раствору антитела в виде лиофилизата. Полипептид и антитело инкубировали в течение 1,5 ч при комнатной температуре. Избыток полипептида удаляли путем эксклюзионной хроматографии на колонке Superose 6 10/300 GL в растворе, содержащем 20 мМ гистидин,, 140 мМ NaCl, рН 6,0, со скоростью потока 0,5 мл/мин. Элюированный комплекс собирали во фракции объемом 0,5 мл, объединяли и стерилизовали через фильтр 0,2 мкм, получая 4,7 мг комплекса в концентрации 1,86 мг/мл.
Полученный комплекс гаптенилированного полипептида и антигаптенового антитела был определен как мономерная IgG-подобная молекула благодаря появлению одного пика при эксклюзионной хроматографии. Полученный комплекс был определен как мономерная IgG-подобная молекула, несущая два дигоксигенин-PYY-производных на одну молекулу антитела. Определенный состав этих пептидных комплексов подтверждали путем эксклюзионной хроматографии, которая также показала отсутствие белковых агрегатов. Определенный состав (и соотношение полипептида к белку 2:1) этих биспецифических пептидных комплексов также подтверждали путем SEC-MALS (эксклюзионная хроматография - многоугловое рассеяние света). Для анализа SEC-MALS 100-500 мкг соответствующего образца наносили на эксклюзионную колонку Superdex 200 10/300 GL со скоростью потока 0,25-0,5 мл/мин в 1× PBS с рН 7,4 в качестве подвижной фазы. Рассеяние света обнаруживали с помощью детектора Wyatt MiniDawn TREOS/QELS, показатель преломления измеряли с помощью детектора Wyatt Optilab rEX. Полученные данные анализировали с использованием программного обеспечения ASTRA (версия 5.3.4.14). Результаты SEC-MALLS-анализа дают информацию о массе, радиусе и размере комплекса. Эти данные затем сравнивали с данными для соответствующего антитела, не состоящего в комплексе. Результаты этих экспериментов показывают, что воздействие дигоксигенилированного-PYY на антидигоксигениновое антитело приводит к формированию комплексов, которые содержат два дигоксигенин-PYY-производных на одну молекулу антитела. Таким образом, дигоксигенилированный PYY может находиться в виде комплекса с антидигоксигениновым антителом на определенных сайтах (связывающей области) и в определенной стехиометрии.
Характеризация комплекса путем поверхностного плазмонного резонанса давала дополнительные доказательства того, что реакция комплексообразования образовывала определенные и полностью сосотоящие в комплексе молекулы. Антидигоксигениновое антитело может быть связано с SPR-чипом, что приводит к увеличению сигнала. Последующее добавление дигоксигенин-PYY-конъюгата приводит к дальнейшему увеличению сигнала до тех пор, пока все сайты связывания не становятся полностью занятыми. В этих условиях добавление большего дигоксигенин-PYY не увеличивает сигнал дальше. Это указывает на то, что реакция комплексообразования специфична, и что сигналы не вызваны неспецифической липкостью дигоксигенилированного полипептида.
Иллюстративный способ формирования комплексов гапетинилированных полипептидов и антигаптеновых антител - комплекс "Ac-PYY-PEG3-Cys-β-Ala-Biot/химерное антибиотиновое антитело"
Для создания нековалентных комплексов биотинилированного-PYY-полипептида, содержащих цистеинилированный линкер, 0,19 мг Ac-PYY-PEG3-Cys-β-Ala-Biot растворяли в 100% DMF до концентрации 10 мг/мл. Антитело использовали в концентрации 10,7 мг/мл (примерно 73 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY-PEG3-Cys-β-Ala-Biot и антитело смешивали в молярном соотношении 2,5:1 (Ac-PYY-PEG3-Cys-β-Ala-Biot к антителу) и инкубировали в течение 60 минут при комнатной температуре, встряхивая при 350 об/мин. Полученный комплекс был определен как мономерная IgG-подобная молекула благодаря появлению одного пика при эксклюзионной хроматографии (95% мономер). Полученный комплекс также анализировали путем SDS-PAGE и затем вестерн-блот-анализа. 10 мкг комплекса смешивали с 4× LDS-буфером для образцов (Invitrogen) и инкубировали при 95°С в течение 5 мин. Образец наносили на 4-12% Bis-Tris полиакриламидный гель (NuPAGE, Invitrogen) и запускали форез на 35 мин при 200 В и 120 мА. Молекулы, которые разделялись на полиакриламидном геле, переносили на PVDF-мембрану (размер пор 0,2 мкм, Invitrogen) в течение 40 мин при 25 В и 160 мА. Мембрану блокировали в 1% (вес/объем) обезжиренном молоке в 1× PBST (1× PBS плюс 0,1% Tween 20) в течение 1 ч при комнатной температуре. Мембрану промывали 3 раза в течение 5 мин в 1× PBST, а затем инкубировали со стрептавидин-РОD-конъюгатом (2900 Ед/мл, Roche), который использовали в разведении 1:2000. Обнаружение стрептавидин-POD, связанной с биотином на мембране, проводили с использованием субстрата для вестерн-блота Lumi-Light Western Blotting Substrate (Roche).
Иллюстративный способ формирования комплексов гапетинилированных полипептидов и антигаптеновых антител - комплекс "Ac-PYY-PEG3-Cys-PEG2-Biot)/химерное антибиотиновое антитело"
Для создания нековалентных комплексов биотинилированного-PYY-полипептида, содержащих цистеинилированный линкер, 0,16 мг Ac-PYY-PEG3-Cys-PEG2-Biot растворяли в 100% DMF до концентрации 10 мг/мл. Антитело использовали в концентрации 10,7 мг/мл (примерно 73 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY-PEG3-Cys-PEG2-Biot и антитело смешивали в молярном соотношении 2,5:1 (Ac-PYY-PEG3-Cys-PEG2-Biot к антителу) и инкубировали в течение 60 минут при комнатной температуре, встряхивая при 350 об/мин. Путем эксклюзионной хроматографии полученный комплекс был определен как 63% мономерной IgG-подобной молекулы и 37% димерных растворимых агрегатов. Полученный комплекс также анализировали путем SDS-PAGE и последующего вестерн-блот-анализа. 10 мкг комплекса смешивали с 4× LDS-буфером для образцов (Invitrogen) и инкубировали при 95°С в течение 5 мин. Образец наносили на 4-12% Bis-Tris полиакриламидный гель (NuPAGE, Invitrogen) и запускали форез на 35 мин при 200 В и 120 мА. Молекулы, которые разделялись на полиакриламидном геле, переносили на PVDF-мембрану (размер пор 0,2 мкм, Invitrogen) в течение 40 мин при 25 В и 160 мА. Мембрану блокировали в 1% (вес/объем) обезжиренном молоке в 1× PBST (1× PBS плюс 0,1% Tween 20) в течение 1 ч при комнатной температуре. Мембрану промывали 3 раза в течение 5 мин в 1× PBST, а затем инкубировали со стрептавидин-POD-конъюгатом (2900 Ед/мл, Roche), который использовали в разведении 1:2000. Обнаружение стрептавидин-POD, связанной с биотином на мембране, проводили с использованием субстрата для вестерн-блота Lumi-Light Western Blotting Substrate (Roche).
Иллюстративный способ формирования комплексов гапетинилированных полипептидов и антигаптеновых антител - комплекс "Ac-PYY(PEG3-Cys-PEG2-5-Fluo)/химерное антифлуоресцеиновое антитело"
Для создания нековалентных комплексов флуоресцеин-конъюгированного-PYY-полипептида, содержащих цистеинилированный линкер, 0,33 мг Ac-PYY(PEG3-Cys-PEG2-5-Fluo растворяли в 100% DMF до концентрации 10 мг/мл. Антитело использовали в концентрации 9,99 мг/мл (примерно 68 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY(PEG3-Cys-PEG2-5-Fluo и антитело смешивали в молярном соотношении 2,5:1 (Ac-PYY(PEG3-Cys-PEG2-5-Fluo) к антителу) и инкубировали в течение 60 минут при комнатной температуре, встряхивая при 350 об/мин. Полученный комплекс был определен как 76% мономерной IgG-подобной молекулы и 24% димерных растворимых агрегатов. Полученный комплекс также анализировали путем SDS-PAGE и последующего обнаружения флуоресцеин-связанной флуоресценции в полиакриламидном геле. 8 мкг комплекса смешивали с 4× LDS-буфером для образцов (Invitrogen) и инкубировали при 95°С в течение 5 мин. Флуоресцеин-связанную флуоресценцию регистрировали с помощью утройства Lumilmager F1 (Roche) при длине волны возбуждения 645 нм.
Пример 6
Создание определенных ковалентных конъюгатов гаптенилированных меток или полипептидов с антигаптеновым антителом VH52bC/VH53C в присутствии окислительно-восстановительных агентов
Иллюстративный способ формирования конъюгатов гаптенилированных флуоресцентных меток и антигаптеновых антител - Dig-Cys-Ahx-Cy5/антидигоксигениновое антитело VH52bC
Создание ковалентных конъюгатов антигаптеновых антител и гаптенилированных флуоресцентных меток, содержащих цистеиновый линкер, приводит к образованию определенных конъюгатов, где формируется дисульфидный мостик в определенном положении между VH52bC в CDR2 антигаптенового антитела и цистеином в линкере между гаптеном и флуоресцентной меткой. Реакцию конъюгации проводили в присутствии окислительно-восстановительных реагентов. Dig-Cys-Ahx-Cy5 растворяли в растворе, содержащем 20 мМ гистидин, 140 мМ NaCl, рН 6,0. Растворение облегчали путем добавления по каплям 10% (объем/объем) уксусной кислоты. Конечную концентрацию доводили до 0,4 мг/мл. Антидигоксигениновое антитело VH52bC в растворе, содержащем 20 мМ гистидин, 140 мМ NaCl, рН 6,0, доводили до концентрации 10 мг/мл. Антидигоксигениновое антитело использовали в качестве контроля и проводили процедуру таким же образом, как с антидигоксигениновым антителом VH52bC. 4,7 нмоль каждого антитела смешивали с 2,5 молярными эквивалентами Dig-Cys-Ahx-Cy5. Этого достигали путем добавления 11,7 нмоль этого вещества в 4 порциях (2,9 нмоль каждая) каждые 15 мин. В промежутке между этими добавлениями образцы инкубировали при 25°С в условиях осторожного встряхивания. После добавления последней порции 0,64 нмоль каждого комплекса антитело-Dig-Cys-Ahx-CyS переносили в буфер, содержащий следующие окислительно-восстановительные реагенты: 3 мМ DTE (дитиоэритритол) плюс 10 мМ GSSG (окисленный глутатион), 0,3 мМ DTE плюс 1 мМ GSSG и 0,03 мМ DTE плюс 0,1 мМ GSSG. Все образцы инкубировали в течение 15 мин в этих условиях. После инкубации образцы разделяли поровну (по 0,34 нмоль) и готовили для SDS-электрофореза в геле. Для этого добавляли 4× LDS-буфер для образцов (Invitrogen). Для каждого образца также получали восстановленный вариант путем добавления восстанавливающего агента 10× NuPAGE (Invitrogen). Все образцы инкубировали при 70°С в течение 5 мин, затем подвергали электрофорезу в от 4 до 12% Bis-Tris полиакриламидном геле (NuPAGE, Invitrogen) с 1× буфером MOPS (Invitrogen). Cy5-связанную флуоресценцию в геле обнаруживали с помощью устройства Lumilmager F1 (Roche) при длине волны возбуждения 645 нм. После обнаружения флуоресценции гель окрашивали с помощью SimplyBlue SafeStain (Invitrogen). Гели показаны на Фиг. 4.
Формирование сайт-специфических дисульфидных связей было показано для антидигоксигенинового антитела VH52bC (Фиг. 8, гели в верхней части, дорожки 1 А-С) с низким сигналом фоновой флуоресценции при использовании антидигоксигенинового антитела без цистеина в CDR2 (дорожки 2 А-С). Фоновые сигналы в контрольных реакциях можно объяснить связыванием Dig-Cys-AHX-Cy5 с цистеинами, которые обычно вовлечены в формирование межцепочных дисульфидных связей антитела. Возрастающие количества окислительно-восстановительных реагентов существенно восстанавливают дисульфидные связи, которые соединяют тяжелые и легкие цепи антител, образуя главным образом


Иллюстративный способ формирования конъюгатов гаптенилированных флуоресцентных меток и антигаптеновых антител - Dig-Cys-Cy5/ антидигоксигениновое антитело VH52bC
Dig-Cys-Cy5 растворяли в 8,3 мМ HCl, 10% (объем/объем) DMF до конечной концентрации 3,25 мг/мл. Антидигоксигениновое антитело VH52bC в растворе, содержащем 20 мМ гистидин, 140 мМ NaCl, рН 6,0, доводили до концентрации 15 мг/мл. Антидигоксигениновое антитело использовали в качестве контроля, и проводили процедуру таким же образом, как с антидигоксигениновым антителом VH52bC. 13,3 нмоль каждого антитела смешивали с 2 молярными эквивалентами Dig-Cys-Cy5 до конечной концентрации антитела 10 мг/мл в присутствии 1 мМ GSH (восстановленный глутатион) и 5 мМ GSSG (окисленный глутатион). Этого достигали путем добавления 26,6 нмоль этого вещества в 2 порциях каждые 5 мин. В промежутке между этими добавлениями образцы инкубировали при комнатной температуре в условиях осторожного встряхивания. После добавления последней порции образцы инкубировали в течение 1 часа при комнатной температуре. Эффективность реакции связывания оценивали с помощью SDS-PAGE и последующей регистрации Cy5-связанного флуоресцентного сигнала. 5, 10 и 20 мкг каждого образца готовили для SDS-PAGE. Для этого добавляли 4× LDS-буфер для образцов (Invitrogen). Все образцы инкубировали при 70°С в течение 5 мин, затем подвергали электрофорезу в 4-12% Bis-Tris полиакриламидном геле (NuPAGE, Invitrogen) с 1× буфером MOPS (Invitrogen). Cy5-связанную флуоресценцию в геле обнаруживали с помощью устройства Lumilmager F1 (Roche) при длине волны возбуждения 645 нм. После обнаружения флуоресценции гель окрашивали с помощью SimplyBlue SafeStain (Invitrogen).
Иллюстративный способ формирования конъюгатов гапетинилированных полипептидов и антигаптеновых антител - PEG3-PYY(PEG3-Cys-4Abu-Dig)/гуманизированное антидигоксигениновое антитело VH52bC
Для создания конъюгатов дигоксигенин-производного-PYY-полипептида, содержащих цистеинилированный линкер, 1,4 мг PEG3-PYY(PEG3-Cys-4Abu-Dig) растворяли в 100% DMF до концентрации 10 мг/мл. 1 мг антитела использовали в концентрации 10 мг/мл (примерно 68 мкМ) в буфере, состоящем из 5 мМ Tris-HCl, 1 мМ EDTA, 1 мМ GSH, 5 мМ GSSG, рН 8,2. PEG3-PYY(PEG3-Cys-4Abu-Dig) и антитело смешивали в молярном соотношении 2:1 (PEG3-PYY(PEG3-Cys-4Abu-Dig) к антителу) и инкубировали в течение 60 минут при комнатной температуре, встряхивая при 100 об/мин. Полученный конъюгат анализировали путем масс-спектрометрии. 43% обнаруженных видов были идентифицированы как антитело, соединенное с 2 полипептидными молекулами, 46% составляло антитело, соединенное с 1 полипептидной молекулой, и 11% составляло несвязанное антитело.
Пример 7
Создание определенных ковалентных конъюгатов гаптенилированных меток и полипептидов с антигаптеновым антителом VH52bC/VH53C в отсутствие окислительно-восстановительных агентов
Для создания ковалентных, связанных дисульфидными мостиками конъюгатов антигаптенового антитела/гаптенилированного полипептида или гаптенилированной метки необходимо (i) связать гаптен (например, дигоксигенин, флуоресцеин, биотин или теофиллин) с помощью линкера, содержащего подходящую реакционноспособную группу (такую как, например, цистеин, малеимид), с полипептидом или меткой, которая позволяет полипептиду экспонироваться на поверхности антитела и, следовательно, сохранять свою активность, и (ii) создать ковалентные сайт-специфические конъюгаты гаптенилированных полипептидов с антигаптеновым антителом с цистеиновой мутацией (= антитело VH52bC/VH53C), где биологическая активность полипептида сохраняется, и (iii) провести реакцию в отсутствие восстанавливающего агента для того, чтобы избежать восстановления межцепочечных дисульфидных мостиков в антителе.
Общий способ:
Создание конъюгатов антигаптеновых антител с гаптенилированными соединениями будет приводить к образованию конъюгатов с определенной стехиометрией, и можно быть уверенным, что соединение в этих конъюгатах сохраняет свою активность. Для создания конъюгатов гаптенилированных соединений с соответствующим антигаптеновым антителом гаптенилированное соединение растворяли в 100% DMF до конечной концентрации 10 мг/мл. Антигаптеновое антитело VH52bC/VH53C доводили до концентрации 10 мг/мл в растворе, содержащем 50 мМ Tris-HCl, 1 мМ EDTA, рН=8,2. Гаптенилированное соединение и антигаптеновое антитело VH52bC/VH53C смешивали в молярном соотношении 2,5:1 (соединение к антителу) путем пипетирования и инкубировали в течение 60 минут при комнатной температуре, встряхивая при 350 об/мин.
Полипептид, конъюгированный с гаптеном через цистеин-содержащий линкер, далее называется гаптен-Cys-полипептидом или полипептид-Cys-гаптеном. Полипептид может иметь либо свободный N-, либо кэппированный N-конец, например с ацетил-группой (Ас-полипептид-Cys-гаптен) или ПЭГ-остатком (ПЭГ-полипептид-Cys-гаптен).
Флуоресцентная метка, конъюгированная через цистеин-содержащий линкер, далее называется метка-Cys-гаптеном или метка-Cys-красителем.
Иллюстративный способ формирования конъюгатов гаптенилированных флуоресцентных меток и антигаптеновых антител - Dig-Cys-Ahx-Cy5/антидигоксигениновое антитело VH52bC
Образцы получали точно так, как описано в примере 6а, с той разницей, что комплексы антитело-Dig-Cys-Ahx-Cy5 переносили в буфер, либо не содержащий окислительно-восстановительных соединений, либо содержащий 0,1 мМ GSSG (окисленный глутатион) или 1 мМ GSSG. Полученные флуоресцентно отсканированные и окрашенные Кумасси полиакриламидные гели показаны на фиг. 5. Все три условия показывают аналогичную специфичность для формирования сайт-специфических дисульфидных связей (фиг. 5, верхние гели, дорожки 1 А-С) с низким уровнем фоновых реакций (фиг. 5, дорожки 2 А-С). Это подтверждает, что формирование дисульфидной связи может быть достигнуто без необходимости восстанавливающих агентов. Это значительно стабилизирует антитело/уменьшает распад антитела, так как по сравнению с примером 6 регистрируются только остаточные количества


Иллюстративный способ формирования конъюгатов гаптенилированных флуоресцентных меток и антигаптеновых антител - Dig-Cys-Cy5/антидигоксигениновое антитело VH52bC
Образцы получали точно так, как описано в примере 6b, с той разницей, что 13,3 нмоль антитела смешивали с 2 молярными эквивалентами Dig-Cys-Cy5 при конечной концентрации антитела 10 мг/мл в отсутствие окислительно-восстановительных реагентов.
Иллюстративный способ формирования конъюгатов гаптенилированных флуоресцентных меток и антигаптеновых антител - биотин-Cys-Cy5/химерное антибиотиновое антитело VH53C
Для создания конъюгатов биотин-производного-Cy5, содержащих цистеинилированный линкер, 0,16 мг биотин-Cys-Cy5 растворяли в 100% DMF до концентрации 10 мг/мл. 1 мг антибиотинового антитела VH53C использовали в концентрации 9,7 мг/мл (примерно 68 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Биотин-Cys-Cy5 и антитело смешивали в молярном соотношении 2,5:1 (Ас-биотин-Cys-Cy5 к антителу) и инкубировали в течение 60 минут при комнатной температуре, встряхивая при 350 об/мин. Полученный конъюгат анализировали путем SDS-PAGE, как описано в примере 6а. Обнаружение флуоресценции проводили так, как описано в примере 6а.
Иллюстративный способ формирования конъюгатов гаптенилированных флуоресцентных меток и антигаптеновых антител - биотин-Cys-Cy5/гуманизированное антибиотиновое антитело VH53C
Для создания конъюгатов биотин-производного-Cy5, содержащих цистеинилированный линкер, 0,16 мг биотин-Cys-Cy5 растворяли в 100% DMF до концентрации 10 мг/мл. 1 мг гуманизированного антибиотинового антитела VH53C использовали в концентрации 7,4 мг/мл (примерно 51 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Биотин-Cys-Cy5 и антитело смешивали в молярном соотношении 2,5:1 (Ac-Biotin-Cys-Cy5 к антителу) и инкубировали в течение 60 минут при комнатной температуре, встряхивая при 350 об/мин. Полученный конъюгат анализировали путем SDS-PAGE, как описано в примере 6а. Обнаружение флуоресценции проводили так, как описано в примере 6а.
Иллюстративный способ формирования конъюгатов гапетинилированных полипептидов и антигаптеновых антител - Ac-PYY(PEG3-Cys-4Abu-Dig)/гуманизированное антидигоксигениновое антитело VH52bC
Для создания конъюгатов дигоксигенин-проивзодного-PYY-полипептида, содержащих цистеинилированный линкер, 2,4 мг Ac-PYY(PEG3-Cys-4Abu-Dig) растворяли в 20% ацетате до концентрации 5 мг/мл. 10 мг гуманизированного антидигоксигенинового антитела VH52bC (68,4 нмоль) использовали в концентрации 19,5 мг/мл (примерно 133 мкМ) в буфере, состоящем из 20 мМ гистидина, 140 мМ NaCl, рН 6,0. Ac-PYY(PEG3-Cys-4Abu-Dig) и антитело смешивали в молярном соотношении 2:1 (Ac-PYY(PEG3-Cys-4Abu-Dig) к антителу) и инкубировали в течение 60 минут при комнатной температуре, встряхивая при 100 об/мин. Полученный конъюгат анализировали путем масс-спектрометрии. 7,4% обнаруженных видов были идентифицированы как антитело, соединенное с 2 пептидными молекулами, 40% составляло антитело, соединенное с 1 пептидной молекулой, и 52% составляло несвязанное антитело.
Иллюстративный способ формирования конъюгатов гапетинилированных полипептидов и антигаптеновых антител - Ac-PYY(PEG3-Cys-βAla-Biot)/химерное антибиотиновое антитело VH53C
Для создания конъюгатов биотин-производного-PYY-полипептида, содержащих цистеинилированный линкер, 0,19 мг Ac-PYY(PEG3-Cys-βAla-Biot) растворяли в 100% DMF до концентрации 10 мг/мл. 1 мг химерного антибиотинового антитела VH53C использовали в концентрации 9,7 мг/мл (примерно 67 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY[PEG3-Cys-βAla-Biot и антитело смешивали в молярном соотношении 2,5:1 (Ac-PYY[PEG3-Cys-βAla-Biot] к антителу) и инкубировали в течение 60 минут при комнатной температуре, встряхивая при 350 об/мин. Полученный конъюгат анализировали путем масс-спектрометрии. 87,7% обнаруженных видов были идентифицированы как антитело, соединенное с 2 пептидными молекулами, 12,3% составляло антитело, соединенное с 1 пептидной молекулой.
Иллюстративный способ формирования конъюгатов гапетинилированных полипептидов и антигаптеновых антител - Ac-PYY(PEG3-Cys-PEG2-Biot)/химерное антибиотиновое антитело VH53C
Для создания конъюгатов биотин-производного-PYY-полипептида, содержащих цистеинилированный линкер, 0,16 мг Ac-PYY(PEG3-Cys-PEG2-Biot) растворяли в 100% DMF до концентрации 10 мг/мл. 1 мг химерного антибиотинового антитела VH53C использовали в концентрации 9,9 мг/мл (примерно 68 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY[PEG3-Cys-PEG2-Biot и антитело смешивали в молярном соотношении 2,5:1 (Ac-PYY[PEG3-Cys-PEG2-Biot] к антителу) и инкубировали в течение 60 минут при комнатной температуре, встряхивая при 350 об/мин. Полученный конъюгат анализировали путем масс-спектрометрии. 100% обнаруженных видов были идентифицированы как антитело, соединенное с 2 пептидными молекулами.
Иллюстративный способ формирования конъюгатов гаптенилированных полипептидов и антигаптеновых антител - Ac-PYY(PEG3-Cys-βAla-Biot/гуманизированное антибиотиновое антитело VH53C
Для создания конъюгатов биотин-производного-PYY-полипептида, содержащих цистеинилированный линкер, 0,06 мг Ac-PYY(PEG3-Cys-βAla-Biot) растворяли в 100% DMF до концентрации 10 мг/мл. 0,8 мг гуманизированного антибиотинового антитела VH53C использовали в концентрации 9 мг/мл (примерно 62 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY[PEG3-Cys-βAla-Biot и антитело смешивали в молярном соотношении 2,5:1 (Ac-PYY[PEG3-Cys-βAla-Biot] к антителу) и инкубировали в течение 60 минут при комнатной температуре, встряхивая при 350 об/мин. Полученный конъюгат анализировали путем масс-спектрометрии. 62,2% обнаруженных видов были идентифицированы как антитело, соединенное с 2 пептидными молекулами, 33,9% составляло антитело, соединенное с 1 пептидной молекулой, и 3,9% составляло несвязанное антитело.
Иллюстративный способ формирования конъюгатов гапетинилированных полипептидов и антигаптеновых антител - Ac-PYY(PEG3-Cys-PEG2-Biot)/гуманизированное антибиотиновое антитело VH53C
Для создания конъюгатов биотин-производного-PYY-полипептида, содержащих цистеинилированный линкер, 0,08 мг Ac-PYY(PEG3-Cys-PEG2-Biot) растворяли в 100% DMF до концентрации 10 мг/мл. 0,8 мг гуманизированного антибиотинового антитела VH53C использовали в концентрации 9 мг/мл (примерно 62 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY[PEG3-Cys-PEG2-Biot и антитело смешивали в молярном соотношении 2,5:1 (Ас-PYY[PEG3-Cys-PEG2-Biot] к антителу) и инкубировали в течение 60 минут при комнатной температуре, встряхивая при 350 об/мин. Полученный конъюгат анализировали путем масс-спектрометрии. 71,4% обнаруженных видов были идентифицированы как антитело, соединенное с 2 пептидными молекулами, 26% составляло антитело, соединенное с 1 пептидной молекулой, и 2,5% составляло несвязанное антитело.
Иллюстративный способ формирования конъюгатов гапетинилированных полипептидов и антигаптеновых антител - Ac-PYY(PEG3-Cys-PEG2-Fluo)/антифлуоресцеиновое антитело VH52bC
Для создания конъюгатов биотин-производного-PYY-полипептида, содержащих цистеинилированный линкер, 0,33 мг Ac-PYY[PEG3-Cys-PEG2-Fluo растворяли в 100% DMF до концентрации 10 мг/мл. 1 мг антифлуоресцеинового антитела VH52bC использовали в концентрации 9,3 мг/мл (примерно 63 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY[PEG3-Cys-PEG2-Fluo и антитело смешивали в молярном соотношении 2,5:1 (Ac-PYY[PEG3-Cys-PEG2-Fluo] к антителу) и инкубировали в течение 60 минут при комнатной температуре, встряхивая при 350 об/мин. Полученный конъюгат анализировали путем масс-спектрометрии. 95% обнаруженных видов были идентифицированы как антитело, соединенное с 2 пептидными молекулами, 5% составляло антитело, соединенное с 1 пептидной молекулой.
Иллюстративный способ формирования конъюгатов гапетинилированных полипептидов и антигаптеновых антител - Ac-PYY(PEG3-Cys-PEG2-Fluo)/антифлуоресцеиновое антитело VH28C
Для создания конъюгатов биотин-производного-PYY-полипептида, содержащих цистеинилированный линкер, 0,33 мг Ac-PYY[PEG3-Cys-PEG2-Fluo растворяли в 100% DMF до концентрации 10 мг/мл. 1 мг антифлуоресцеинового антитела VH28C использовали в концентрации 9,5 мг/мл (примерно 63 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY[PEG3-Cys-PEG2-Fluo и антитело смешивали в молярном соотношении 2,5:1 (Ac-PYY[PEG3-Cys-PEG2-Fluo] к антителу) и инкубировали в течение 60 минут при комнатной температуре, встряхивая при 350 об/мин. Полученный конъюгат анализировали путем масс-спектрометрии. 100% обнаруженных видов были идентифицированы как антитело, соединенное с 2 пептидными молекулами.
Пример 8
Создание ковалентных комплексов "теофиллин - антитеофиллиновое антитело"
Чтобы оценить формирование ковалентных комплексов антител, которые используют теофиллин и теофиллин-связывающие антитела, такие как гаптен-распознающие системы, создавали теофиллин-Cys-Cy5 в качестве флуоресцентной полезной нагрузки, стандартно применяя технологии синтеза и очистки, которые были описаны для дигоксигенин-Cys-Cy5 или биотин-Cys-Су5, за исключением того, что гаптен был заменен на теофиллин (см. пример 8). Состав производного теофиллина-Cys-Cy5, которое было синтезировано, показан на фиг. 16а. Чтобы продемонстрировать формирование ковалентного дисульфида, создавали теофиллин-связывающие антитела, которые содержали разработанный Cys в позиции 54 или 55 вариабельной области тяжелой цепи (Cys антитеофиллинового антитела). Чистота этих антител показана иллюстративно для варианта Y54C на фиг. 16b. Эти производные антител подвергали комплексообразованию с теофиллин-Cys-Cy5, а затем подвергали SDS-PAGE в невосстанавливающих и в восстанавливающих условиях, как описано в примере 12. В невосстанавливающих условиях связанный дисульфидным мостиком и состоящий в комплексе с антитеофиллиным антителом Cy5 обнаруживался в геле по флуоресценции, ассоциированной с Н-цепью, таким же образом, как описано в примере 12. Это изображено на фиг. 16с, где показано, что ковалентные комплексы между антителом были сформированы в результате простой нагрузочной реакции таким же образом, как дисульфиды, которые наблюдались при использовании дигоксигенина, флуоресцеина или биотина в качестве гаптена. Эти комплексы диссоциировали, как и ожидалось, после восстановления, т.е. высвобождали полезную нагрузку из Н-цепи только тогда, когда дисульфид становился восстановленным (Фиг. 16с).
Пример 9
Создание ковалентных комплексов гаптен-антитело в условиях, подобных in vivo, и доказательства направленного формирования дисульфидных связей in vivo
Для оценки формирования ковалентных комплексов гаптен-антитело в условиях, подобных in vivo, антибиотиновые антитела-Cys инкубировали при 37°С в мышиной сыворотке с биотин-Cys-Cy5 в течение 60 мин. Затем антитело захватывали из мышиной сыворотки с помощью белка А. После этого захваченные антитела подвергали SDS-PAGE в невосстанавливающих и в восстанавливающих условиях, как описано в примере 12. Связанный дисульфидным мостиком и состоящий в комплексе с антителом Cy5 обнаруживался в геле по флуоресценции, ассоциированной с Н-цепью, таким же образом, как описано в примере 12. На фиг. 17 показано, что ковалентные комплексы между антителом формируются в сыворотке при температуре 37°С, т.е. в условиях, напоминающих условия in vivo. Эти комплексы диссоциировали, как и ожидалось, после восстановления, т.е. полезная нагрузка высвобождалась из Н-цепи только тогда, когда дисульфид становился восстановленным (фиг. 17). Наблюдение того, что при гаптен-позиционировании направленная дисульфидная связь между антителом и полезной нагрузкой может быть сформирована даже в присутствии сыворотки, является неожиданным, так как сыворотка содержит большое количество белков, пептидов и других соединений (которые могут мешать реакциям формирования дисульфидных связей). Наблюдение того, что при гаптен-позиционировании направленная дисульфидная связь между антителом и полезной нагрузкой может быть сформирована в сыворотке крови при 37°С, также открывает возможность применения этой ФК-модулирующей системы в условиях предварительного нацеливания: отдельное применение антитела и гаптен-полезной нагрузки, а затем сборка комплексов с антителом in vivo и последующее формирование дисульфидной связи.
Для дальнейшей оценки потенциальных применений в "предварительном нацеливании" in vivo определяли фармакокинетику биотин-Cy5 в условиях предварительного нацеливания путем неинвазивной методики с оптической визуализацией глаз животных, как описано в примере 18. В этих экспериментах присутствие Cy5 определяли неинвазивно путем оптической томографии глаза животных, которая показала флуоресценцию Cy5 в капиллярах. Значения Су5-опосредованной флуоресценции, которые мы обнаружили в глазу мыши через 10 минут после введения биотина-Cy5, были приняты за значение 100%, и значения флуоресценции, измеренные в последующие моменты времени, были выражены относительно него. В этом эксперименте 1 мг антитела (или антибиотинового антитела, или антибиотинового Cys-антитела (= Cys-мутант антибиотинового антитела)) вводили за 24 часа до введения биотина-Cy5 и начинали визуализацию глаза. В контрольной группе предварительно не вводили антибиотиновое антитело.
Результаты этих экспериментов показаны на фиг. 18: биотин-Cy5 у животных, которым предварительно не вводили антитело, элиминировался с коротким периодом полужизни в сыворотке и низкими уровнями воздействия (ромбы). Уровни в сыворотке и период полужизни биотина-Cy5, который вводили животным, за 24 ч до этого получившим антибиотиновое антитело (без Cys-мутации), были значительно повышены. Это показывает, что антитело захватывает его антиген (с полезной нагрузкой) в кровотоке и пролонгирует период полужизни антигена (а равно и конъюгированной полезной нагрузки) в сыворотке. Относительный сывороточный уровень и период полужизни биотина-Cys-Cy5, который был введен в животным, за 24 часа до этого получившим антибиотиновое Cys-антитело (т.е. антитело с Cys-мутацией, описанное в данном документе для ковалентного связывания с полезной нагрузкой), возросли еще сильнее. В этих образцах относительные уровни Cy5 были не только выше, чем уровни соединений, не включенных в комплекс, но также выше, чем уровни Cy5, включенных в комплекс (но без дисульфидных связей). Таким образом, состоящие в комплексе с гаптеном и связанные дисульфидными связями полезные нагрузки (которые формируются в условиях предварительного нацеливания in vivo) являются более стабильными в кровотоке и могут достигать более высоких уровней воздействия, чем полезные нагрузки, состоящие в нековалентном комплексе.
Пример 10
Полипептиды в конъюгатах и в комплексах с сохраненными функциональными способностями антигаптенового антитела
Ранее было показано, что полипептиды, которые являются частью нековалентных конъюгатов гаптен-полипептид и состоят в комплексах с антигаптеновыми антителами, сохраняют функциональные способности (WO 2011/003557, WO 2011/003780 и WO 2012/093068). Чтобы продемонстрировать, что связанные пептиды сохраняют функциональные способности также и при ковалентном дисульфидном связывании, сравнивали биологическую активность полипептидов, состоящих в комплексе с антидигоксигениновым антителом, и биологическую активность их дисульфидных конъюгатов с антидигоксигениновым антителом VH52bC.
Терапевтически необходимая функциональная способность PYY-производных пептидов заключается в связывании и нарушении передачи сигнала от родственного рецептора NPY2. Передача сигнала через рецептор NPY2 участвует и/или регулирует метаболические процессы.
Для оценки того, влияет ли комплексообразование или SS-конъюгирование полипептида Dig-PYY с антидигоксигениновым антителом или конъюгация полипептида Dig-Cys-PYY с антидигоксигениновым антителом VH52bC, соответственно, на его активность, мы оценивали его способность ингибировать форсколин-стимулированное накопление цАМФ в клетках НЕК293, экспрессирующих рецептор NPY2 (анализ цАМФ).
В следующей таблице 6 приведены результаты цАМФ-анализов, которые были выполнены для оценки биологической активности PYY(3-36), его Y2-рецептор-специфического модифицированного аналога moPYY, его Dig-варианта, состоящего в комплексе с антителом, и его дисульфид-конъюгированного Dig-Cys-производного.

Для цАМФ-агонистического анализа были использованы следующие материалы: 384-луночный планшет; Tropix cAMP-Screen Kit; cAMP ELISA System (Applied Biosystems, кат. № T1505; CS 20000); Forskolin (Calbiochem, кат. №344270.); клетки: HEK293/hNPY2R; ростовая среда: среда Игла в модификации Дульбекко (D-MEM, Gibco); 10% фетальная бычья сыворотка (FBS, Gibco), инактивированная нагреванием; 1% пенициллин/стрептомицин (пенициллин 10000 ед/мл: стрептомицин 10000 мг/мл, Gibco); 500 мкг/мл G418 (Geneticin, Gibco, кат. №11811-031); и среда для посева: DMEM/F12 без фенола красного (Gibco); 10% FBS (Gibco, кат. №10082-147), инактивированная нагреванием; 1% пенициллин/стрептомицин (Gibco, кат. №15140-122); 500 мкг/мл G418 (Geneticin, Gibco, кат. №11811-031).
Для выполнения анализа в первый день среду удаляли и монослой клеток промывали 10 мл PBS на колбу (Т225). После декантации PBS использовали 5 мл Versene (Gibco, кат. №1504006) для открепления клеток (5 мин при 37°С). Колбу осторожно постукивали и клеточную суспензию сливали. Каждую колбу промывали 10 мл среды для посева и центрифугировали со скоростью 1000 об/мин в течение 5 мин. Суспензию объединяли и подсчитывали. Суспензию ресуспендировали в среде для посева при плотности 2,0×105 клеток/мл для HEK293/hNPY2R. 50 мкл клеток (HEK293/hNPY2R - 10000 клеток/лунка) переносили в 384-луночный планшет с помощью многоканального дозатора. Планшеты инкубировали при 37°С в течение ночи. На второй день клетки проверяли на наличие 75-85% конфлюэнтности. Среды и реагенты согревали до комнатной температуры. Перед разведением стоковый раствор стимулирующего соединения в диметилсульфоксиде (DMSO, Sigma, кат. №D2650) согревали до 32°С в течение 5-10 мин. Разведения готовили в среде DMEM/F12 с 0,5 мМ 3-изобутил-1-метилксантином (IBMX, Calbiochem, кат. №410957) и 0,5 мг/мл бычьего сывороточного альбумина. Конечная концентрация DMSO в среде для стимуляции составляла 1,1% при концентрации форсколина 5 мкМ. Клеточную среду удаляли путем осторожного переворачивания планшета с клетками на бумажное полотенце. В каждую лунку помещали 50 мкл среды для стимуляции (каждую концентрацию вносили в четырех повторах). Планшеты инкубировали при комнатной температуре в течение 30 мин и клетки проверяли под микроскопом на предмет токсичности. Через 30 минут после обработки среду для стимуляции удаляли и добавляли 50 мкл/лунка лизирующего буфера Assay Lysis Buffer (предоставлен в наборе Tropix). Планшеты инкубировали в течение 45 мин при 37°С. 20 мкл лизата переносили из планшетов для стимуляции в планшеты (384-луночные), предварительно покрытые антителами из набора Tropix. Добавляли 10 мкл АР-конъюгата и 20 мкл анти-цАМФ-антитела. Планшеты инкубировали при комнатной температуре в условиях встряхивания в течение 1 часа. Затем планшеты промывали 5 раз промывочным буфером, по 70 мкл на лунку для каждой промывки. Планшеты просушивали до высыхания. Добавляли 30 мкл/лунка раствора субстрата/энхансера CSPD/Sapphire-II RTU и инкубировали в течение 45 мин при комнатной температуре (в условиях встряхивания). Измеряли сигнал 1 сек/лунка в люминометре (VICTOR-V).
Результаты этих анализов (таб. 6) показывают, что модифицированное пептидное производное moPYY имеет пренебрежимо низкую активность по сравнению с PYY дикого типа. Значение IC50 в цАМФ-анализе составляла 0,09 нМ для дикого типа PYY и 0,14 нМ для модифицированного аналога. Ковалентная дисульфидная конъюгация привела к небольшому снижению биологической активности. Значение IC50 составляло 5-36 нМ для конъюгата. Неожиданно ковалентный дисульфидный конъюгат был в 2 раза более активным, чем нековалентный комплекс со значением IC50 10,91 нмоль.
Пример 11
Стабильность в сыворотке комплексов биотинилированного Cy5 с гуманизированным антибиотиновым антителом по сравнению с ковалентными конъюгатами биотинилированного Cy5 с гуманизированным антибиотиновым антителом VH53C
Целью описанной методики модификации пептида является улучшение терапевтической применимости пептидов. Основными узкими местами для терапевтического применения пептидов в настоящее время являются ограниченная стабильность in vivo и/или короткий период полужизни в сыворотке и быстрый клиренс. ФК-параметры конъюгатов флуорофоров с антителами определяли in vivo и сравнивали с ФК нековалентных комплексов антител и флуорофоров. Для этого (i) антибиотиновое антитело VH53C ковалентно конъюгировали с биотинилированным флуорофором Biot-Cys-Cy5, (ii) получали нековалентный комплекс антибиотинового антитела с биотинилированным флуорофором Biot-Cy5, (iii) ковалентно конъюгированные и состоящие в нековалентном комплексе соединения вводили животных и (iv) с течением временем измеряли в сыворотке у этих животных концентрации соединений путем определения флуоресценции Cy5 (А650) и концентрации соответствующего антитела путем ИФА, который специфически распознает гуманизированное антитело.
Процедура эксперимента
Для анализа влияния небольшого флуоресцентного субстрата на ФК-параметры комплексообразования с антителом шести самкам мышей (линия NRMI) вводили 13 нмоль конъюгата "Cy5-биотин/гуманизированное антибиотиновое антитело VH53C" или соответствующего соединения, состоящего в нековалентном комплексе с антителом, или флуоресцентного соединения в одиночку в растворе, содержащем 20 мМ гистидин/140 мМ NaCl, рН 6,0. Образцы крови объемом примерно 0,1 мл отбирали в следующие моменты времени: 0,08 ч, 4 ч и 48 ч для мыши 1, 2 и 3 в первой группе, и 0,08 ч, 24 ч и 72 ч для мыши 1, 2 и 3 во второй группе. Образцы сыворотки в объеме по меньшей мере 50 мкл получали после инкубации в течение 1 ч при комнатной температуре путем центрифугирования (9300 g, 3 мин, 4°С). Образцы сывороток хранили при -80°С.
Для определения количества соединения в сыворотке крови в заданные моменты времени использовали флуоресцентные свойства Cy5: Cy5-связанную флуоресценцию в образцах сыворотки измеряли в кварцевых кюветах объемом 120 мкл при комнатной температуре на спектрофотометре Cary Eclipse Fluorescence Spectrophotometer (Varian). Длина волны возбуждения составляла 640 нм, эмиссию измеряли при 667 нм. Образцы сыворотки разводили в 1× PBS для достижения соответствующего диапазона интенсивности излучения. В качестве пустого зонда использовали сыворотку крови от мыши, не получавшей соединение, в таком же разведении в 1× PBS, как и соответствующий образец, и этот образец не показал никакого сигнала флуоресценции.
На фиг. 7 показаны результаты анализа с использованием ковалентных конъюгатов, нековалентных комплексов и не состоящих в комплексе гаптен-Cy5. Данные представлены в виде относительных (%) уровней Cy5-опосредованной флуоресценции, нормированной по сывороточным уровням (пикам) через 5 мин после введения. Для соединения сравнительно небольшой молекулярной массы биотин-Ser-Cy5, не состоящий в комплексе, быстро исчезал из сыворотки. Через час после введения по-прежнему обнаруживалось только 6% той флуоресценции, которая была введена и выявлялась в сыворотке через 5 минут.В более поздние моменты времени, а именно через 2 ч, 4 ч и 24 ч после инъекции, Cy5-опосредованные сигналы не обнаруживались.
Для соединения, состоящего в комплексе с антителом, через четыре часа после введения в сыворотке все еще было обнаружено примерно 50% флуоресценции от введенной (уровень через 5 минут принят за 100%). Уровни Cy5-опосредованной флуоресценции также были обнаружены в более поздние моменты времени: через 2 часа значение составляло примерно 22% от обнаруживаемого через 5 минут, через 48 часов оно составляло примерно 12% от обнаруживаемого после введения, и через 72 часа оно все еще выявлялось на уровне 8%. Конъюгированное с антителом соединение показало значительно более длительный период полужизни in vivo, чем соединение, состоящее в комплексе с антителом. Через четыре часа после введения в сыворотке по-прежнему обнаруживалось 58% флуоресценции от введенной (уровень через 5 минут принят за 100%) (коэффициент в 1,16 раз выше, чем для соединения, состоящего в комплексе с антителом). Через 24 часа в сыворотке обнаруживалась Cy5-опосредованная флуоресценция на уровне 35% (коэффициент 1,6), через 48 часов - 31% (коэффициент 2,6), а через 72 часа - 26% (коэффициент 3,3). Сопоставимое снижение флуоресценции для состоящих в комплексе и конъюгированных соединений в течение первых 24 часов этих экспериментов можно объяснить ранним распределением, которое является одинаковым для комплексов и конъюгатов. Через 24 часа за разницу отвечает стабильность конъюгированных с антителами соединений in vivo.
Для определения количества человеческого антитела IgG в сыворотке в заданные моменты времени был использован следующий принцип анализа: человеческие антитела IgG1 в образцах сыворотки захватывали на твердой фазе (микротитровальные планшеты Maxisorb®, NUNC-Immuno™), покрытой моноклональным антителом IgG против человеческой каппа-цепи. Образцы сыворотки разводили 1:105 и 1:106, и 100 мкл этих разведений вносили в лунки. После инкубации лунки промывали 3 раза с использованием каждый раз 300 мкл PBS/0,05% Tween 20. Обнаружение человеческих IgG-антител проводили сначала путем добавления 100 мкл IgG против человеческого CH1-домена, который дигоксигенилирован на С-конце, в концентрации 0,25 мкг / мл. После промывания 3 раза с использованием каждый раз 300 мкл 1× PBS/0,05% Tween 20 добавляли 100 мкл Fab-фрагмента антидигоксигенинового антитела, конъюгированного с пероксидазой хрена (HRP), в концентрации 25 мЕд/мл. И, наконец, в каждую лунку добавляли по 100 мкл ABTS®. После 30-минутной инкубации при температуре окружающей среды измеряли экстинцию (OD) при 405 нм и 492 нм [405/492] в коммерческих микротитровальных планшетах ELISA Reader (например, Tecan Sunrise).
На фиг. 7 показаны сывороточные уровни Bio-Cy5, а также сывороточные уровни человеческого IgG у мышей, получавших комплексы и конъюгаты "антитело-биотин-Cy5". Данные представлены в виде относительных (%) уровней человеческого IgG, нормированных по (пику) сывороточным уровням через 5 минут после введения. Относительные сывороточные уровни человеческого IgG как для комплексов, так и для конъюгатов "антитело-гаптен" находятся на одной линии с относительной флуоресценцией, измеренной для конъюгатов "антитело-гаптен". Таким образом, соединение "биотин-Cys-Су5" показало стабильность in vivo, аналогичную конъюгированному антителу, что означает, что конъюгаты "антитело-гаптен" остаются интактными in vivo. Это явно не относится к комплексам "антитело-гаптен", для которых относительная Cy5-опосредованная флуоресценция уменьшается быстрее, чем относительные сывороточные уровни человеческого IgG. Это означает, что комплексы высвобождают полезную нагрузку с течением времени in vivo.
Таким образом, стабильность гаптенилированных соединений in vivo значительно увеличивается при связывании антигаптеновым антителом. Тем не менее, комплексы "антитело-гаптен" не являются полностью стабильными in vivo, поскольку снижение сывороточных уровней гаптен-Cy5 является более быстрым, чем снижение уровней антитела в сыворотке. Это не относится к конъюгатам "антитело-гаптен-Cy5", которые демонстрируют поведение in vivo, аналогичное нормальным антителам IgG.
Сывороточная кинетика Dig-пептида (сравнение нековалентного комплекса и ковалентного конъюгата)
Для анализа влияния дигоксигенилированного полипептида на ФК-параметры комплексообразования с антителом и конъюгации с антителом двум самкам мышей (линии NRMI) вводили 32,1 нмоль полипептида или соответствующего полипептида, состоящего в нековалентном комплексе с антителом, в 20 мМ гистидине/140 мМ NaCl, рН 6,0. Мыши имели вес 23 г и 25 г для MAK-DIG-PYY и 28 г и 26 г для DIG-PYY. После этого отбирали образцы крови в объеме примерно 0,1 мл в следующие моменты времени: через 0,08 ч, 2 ч и 24 ч для мыши 1 и через 0,08 ч, 4 ч и 24 ч для мыши 2. Образцы сыворотки в объеме по меньшей мере 40 мкл получали после инкубации в течение 1 ч при комнатной температуре путем центрифугирования (9300 g, 3 мин, 4°С). Образцы сывороток хранили при -80°С.
Определение количества дигоксигенилированного пептида в сыворотке крови в заданные моменты времени было трудным по сравнению с обнаружением Dig-Cy5, поскольку не было доступных прямых средств для обнаружения полипептида в образцах сыворотки. Поэтому для обнаружения дигоксигенилированного пептида в сыворотке был разработан анализ на основе вестерн-блота. На первом этапе образцы разделяли на SDS-PAGE в восстанавливающих условиях. Поскольку подготовка образцов включала воздействие на сыворотки высокой концентрации SDS и восстанавливающих агентов, образующие комплекс Dig-полипептидные конъюгаты могут высвобождаться из (полностью денатурированного/несвернутого) антидигоксигенинового антитела, в то время как ковалентные конъюгаты остаются связанными. Чтобы опосредовать высвобождение полипептида из нековалентного комплекса с антителом и выделить отдельные компоненты на SDS-PAGE, 2 мкл каждого образца сыворотки разводили в 18 мкл 20 мМ гистидина/140 мМ NaCl, рН 6,0, смешивали с 6,7 мкл 4× LDS-буфера для образцов и 3 мкл 10× восстанавливающего агента (NuPAGE, Invitrogen) в течение 5 мин при 95°С. В качестве контроля использовали 2 мкл сыворотки от мыши той же линии, не получавшей соединение. Образцы наносили на 4-12% Bis-Tris гель (NuPAGE, Invitrogen) и форез проводили при 200 В/120 мА в течение 20 минут с использованием 1× MES (Invitrogen) в качестве рабочего буфера. Затем разделенные полипептиды переносили на PVDF-мембрану (размер пор 0,22 мкм, Invitrogen) с использованием системы XCell Sure Lock® Mini-Cell (Invitrogen) в течение 40 мин при 25 В/130 мА. Мембраны блокировали в 1% обезжиренном молоке в 1× PBS плюс 1% Tween20 (PBST) в течение 1 ч при комнатной температуре. Затем дигоксигенилированные полипептиды обнаруживали на мембране с помощью антидигоксигенинового антитела. Для этого антидигоксигениновое антитело наносили на мембраны в концентрации 13 мкг/мл в 10 мл 1% обезжиренного молока/PBST на 2 ч при комнатной температуре. Мембраны промывали 3 раза по 5 мин в 1× PBST. Fab-фрагменты противомышиного IgG, соединенные с POD из набора LumiLightPLUS Western Blotting Kit (Roche) наносили в разведении 1:25 в 10 мл 1% обезжиренного молока/PBST на 1 ч при комнатной температуре. Мембраны промывали 3 раза по 5 мин в 1× PBST. Обнаружение проводили путем инкубации мембраны в 4 мл субстрата для вестерн-блота LumiLight в течение 5 мин при комнатной температуре. Хемилюминесценцию обнаруживали с помощью Lumilmager F1 (Roche) с временем экспозиции 20 мин.
Результаты этих анализов показаны на фиг. 8А и В. Было определено наличие/количество дигоксигенин-полипептида в мышиной сыворотке в различные моменты времени. Мыши, которые получали пептиды, состоящие в комплексе с антителом (Фиг. 8 слева), показали сильные сигналы в самый ранний момент времени (через 5 мин после введения). Эти сигналы четко определялись, что показано размером и расположением на блоте контроля. В сыворотках мышей, которые получали полипептиды, состоящие в комплексе с антителом, сигналы, связанные с полипептидами, были наиболее сильными в ранние моменты времени и постепенно уменьшались. Тем не менее, полипептид все еще хорошо обнаруживался с хорошим сигналом во всех временных точках и даже через 24 часа после введения.
У мышей, которые получали полипептид, не состоящий в комплексе, очень слабый сигнал, ассоциируемый с небольшим полипептидом, обнаруживался даже в самый ранний момент времени. На фиг. 8 справа показано, что в условиях нормальной экспозиции ни один свободный полипептид не виден на блоте. Контрастное усиление блота показало наличие некоторого полипептида через 5 мин после введения, тем не менее, только в следовых количествах. В более поздние моменты времени полоса полипептида не обнаруживалась.
Можно видеть, что не состоящий в комплексе полипептид имеет очень короткий период полужизни в сыворотке мышей. Мыши, которые получали те же полипептиды, но в форме комплекса с антителом, показывали наличие этих полипептидов в сыворотке крови в течение увеличенного периода времени. Через 24 ч после введения полипептид все еще можно было определить в сыворотке этих мышей.
Пример 12
Период полужизни в сыворотке ковалентно связанных комплексов "дигоксигенин-антитело" и дигоксигенин-связанных IgG
Чтобы проанализировать, улучшает ли дополнительно ФК-свойства ковалентное комплексообразование в плане нековалентно связанных гаптеновых комплексов, ФК-параметры комплексов "антидигоксигениновое антитело-дигоксигенин-Cy5", а также ковалентно связанных конъюгатов [антидигоксигениновое антитело-Cys]-[дигоксигенин-Cys-Cy5] определяли in vivo. Таким образом, дигоксигенин-Cy5 определяли, используя его флуоресценцию (А650), а соответствующее антитело определяли с помощью ELISA, который специфически распознает гуманизированное антитело. Дигоксигенин-Cy5 был применен как низкомолекулярный "суррогат" гаптен-связанных пептидов, потому что его флуоресцентные свойства позволяют его легко и точно обнаруживать его в сыворотке.
Таким же образом, как описано для биотина-Cy5 или биотина-Cys-Cy5 (см. пример 16), дигоксигенин-Cy5 или в комплексе с антителом или дополнительно антитело-Cys-связанный дигоксигенин-Cy5 внутривенно вводили самкам мышей NRMI, а затем собирали кровь через 0,08 ч, 2 ч, 4 ч и 24 ч. Значения Cy5-опосредованной флуоресценции, полученные у обеих мышей через 5 минут после введения (t=0,08 ч), были приняты за 100%, и значения флуоресценции, измеренные в последующие временные точки, выражали относительно него.
Результаты этих экспериментов показывают, что для дигоксигенина-Cy5 через 2 часа после введения было обнаружено менее 10% от введенной флуоресценции (значение через 5 минут). В более поздние моменты времени, а именно через 4 часа и 24 часа после введения, соответственно, Cy5-опосредованные сигналы обнаружены не были (фиг. 14). В отличие от не состоящих в комплексе соединений, соединение, которое состоит в комплексе с антителом, было обнаружен на значительно более высоких уровнях, а также в более поздние моменты времени (фиг. 14). Это указывает на то, что образование комплекса с антитела значительно увеличивает период полужизни низкомолекулярного соединения дигоксигенина-Cy5 в сыворотке. Кроме того, ковалентно связанные полезные нагрузки проявляют большую ФК-пролонгацию по сравнению с нековалентно связанными комплексами. Прямое сравнение уровней дигоксигенина-Cy5 и уровней антитела показало потерю полезной нагрузки из антитела с течением времени, и уровни Cy5 уменьшались быстрее, чем уровни антитела. Напротив, ковалентно связанные дигоксигенин-конъюгаты показали почти идентичные периоды полужизни Cy5 и IgG в сыворотке (фиг. 14). Это указывает на то, что связанные дисульфидными связями полезные нагрузки остаются стабильно соединенными с антителами, в то время как нековалентные комплексы диссоциируют с течением времени.
Пример 13
Периоды полужизни в сыворотке и уровни воздействия ковалентно связанных комплексов "гаптен-антитело" и комплексов, которые присоединены только через гаптенсвязывающий сайт
Чтобы проанализировать, улучшает ли ковалентное комплексообразование ФК-свойства нековалентно связанных гаптеновых комплексов, определяли ФК комплекса антибиотинового антитела с биотином-Cy5, а также ковалентно связанного конъюгата [антибиотиновое антитело-Cys]-[биотин-Cys-Cy5] in vivo. Присутствие Cy5 определяли неинвазивно путем оптической визуализации глаза животных, которая показала флуоресценцию Cy5 в капиллярах. Значения Cy5-опосредованной флуоресценции, которые мы обнаружили в глазу у мышей через 10 минут после введения, были приняты за 100%, и значения флуоресценции, измеренные в последующие моменты времени, выражали относительно него. Результаты этих экспериментов показаны на фиг. 15: не состоящий в комплексе биотин-Cy5 сам по себе имеет короткий период полужизни в сыворотке и низкие уровни воздействия. Соединение, состоящее в комплексе с антителом, которое не было ковалентно связано, обнаруживалось на значительно более высоких уровнях и с увеличенным периодом полужизни. Кроме того, ковалентно связанные полезные нагрузки демонстрировали большую ФК-пролонгацию, а также более высокие уровни в сыворотке крови по сравнению с нековалентно связанными комплексами. Это указывает на то, что состоящие в комплексе с гаптеном и связанные дисульфидными связями полезные нагрузки являются более стабильными в кровотоке и могут достигать более высоких уровней воздействия, чем полезные нагрузки, состоящие в нековалентном комплексе.
Пример 14
Пептидное комплексообразование и ковалентная конъюгация с антителами, которые связывают различные гаптены
Применение гаптенсвязывающих модулей для соединения гаптенилированных соединений (= полезных нагрузок) с нацеленными носителями является одной из технических возможностей, с помощью которых можно реализовать гаптен-опосредованную доставку. Эта концепция может быть расширена за счет дополнительных гаптенов или других групп, которые захватывают соединения и связывают их с нацеливающим модулем. Например, для доставки или стабилизации полипептида моно- или биспецифические антитела, которые связывают дигоксигенин или другие гаптены, могут быть применены для стабилизации и ФК-оптимизации терапевтических полипептидов.
Предпосылками для применения в качестве полипептид-захватывающих модулей является (i) то, что связывание соединений с гаптеном не сильно мешает активности полипептида, и (ii) возможность эффективного связывания/комплексообразования антитела с гаптенилированными соединениями.
Гаптен-направленное связывание является необходимым условием для эффективного ковалентного связывания гаптенилированных меток или полипептидов с антигаптеновым цистеинилированным антителом.
Чтобы показать, что управляемое аффинностью комплексообразование гаптенилированных соединений с антигаптеновыми антителами является необходимым условием для эффективного формирования дисульфидных связей, биотин-Cys-Cy5 инкубировали с гуманизированным антидигоксигениновым антителом и гуманизированным антидигоксигениновым антителом VH53C. Инкубацию биотина-Cys-Cy5 с гуманизированным антибиотиновым антителом и гуманизированным антибиотиновым антителом VH53C проводили в качестве контрольной реакции.
0,13 мг биотина-Cys-Cy5 растворяли в 100% DMF до концентрации 10 мг/мл. 0,7 мг каждого антитела использовали в концентрации 6,7 мг/мл (примерно 46 мкМ) в буфере, содержащем 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Биотин-Cys-Cy5 и антитела смешивали в молярном соотношении 2,5:1 (Ас-биотин-Cys-Cy5 к антителу) и инкубировали в течение 60 мин при комнатной температуре, встряхивая со скоростью 350 об/мин. Полученный комплекс/конъюгат далее анализировали с помощью SDS-PAGE и последующего обнаружения Cy5-связанной флуоресценции в полиакриламидном геле. 15 мкг комплекса/конъюгата смешивали с 4× LDS-буфером для образцов (Invitrogen) и инкубировали при 95°С в течение 5 мин. Субсвязанную флуоресценцию регистрировали с помощью устройства Lumilmager F1 (Roche) при длине волны возбуждения 645 нм.
Невосстановленные образцы показали формирование ковалентных сайт-специфических дисульфидных связей для гуманизированного антибиотинового антитела VH53C (фиг. 17, дорожка 4) с очень низким сигналом фоновой флуоресценции при использовании гуманизированного антибиотинового антитела без цистеина в CDR2 (фиг. 17, дорожка 3). Биотин-Cys-Cy5 также ковалентно связывался с гуманизированным антидигоксигениновым антителом VH52bC (фиг. 17, дорожка 2) с низким фоновым сигналом при использовании гуманизированного антидигоксигенинового антитела (фиг. 17, дорожка 1), но со значительно более низкой эффективностью. Это можно понять по избытку биотина-Cys-Cy5, который обнаруживался в нижней части геля (стрелки). В случае гуманизированного антидигоксигенинового антитела VH52bC может быть обнаружен значительно более несвязанный биотин-Cys-Cy5 (дорожка 2), чем в случае гуманизированного антибиотинового антитела VH53C (дорожка 4). При восстановлении образцов вблизи тяжелых и легких цепей антитела Cy5-связанная флуоресценция не обнаруживалась, указывая на то, что ковалентная связь действительно формируется за счет дисульфидного мостика. Окрашивание Кумасси каждого геля показывает, что общее количество белка в каждой дорожке было равным.
Пример 15
Гаптен-направленное связывание является необходимым условием для эффективного ковалентного связывания гаптенилированных меток или полипептидов с антигаптеновым цистеинилированным антителом
Чтобы показать, что управляемое аффинностью комплексообразование гаптенилированных соединений с антигаптеновыми антителами является необходимым условием для эффективного формирования дисульфидных связей, негаптенилированный пептид Ac-PYY (Ac-PYY(PEG3-Cys-4Abu-NH2) (Biosynthan 1763.1, SEQ ID NO 178) инкубировали с гуманизированным антидигоксигениновым антителом VH52bC и гуманизированным антидигоксигениновым антителом. 1,4 мг Ac-PYY(PEG3-Cys-4Abu-NH2) растворяли в 100% DMF до концентрации 10 мг/мл. 2 мг каждого антитела использовали в концентрации 11-13 мг/мл (примерно 75-89 мкМ) в буфере, содержащем 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY(PEG3-Cys-4Abu-NH2) и антитела смешивали в молярном соотношении 2,1:1 (Ac-PYY(PEG3-Cys-4Abu-NH2) к антителу). Пептид добавляли тремя порциями и раствор перемешивали при 500 об/мин с помощью мешалки. Между добавлениями образцы инкубировали в течение 5 мин при 200 об/мин. После добавления последней порции образцы инкубировали в течение 1 ч при комнатной температуре и 200 об/мин.
Полученный комплекс/конъюгат был определен как 97% мономерной IgG-подобной молекулы и 3% димерных растворимых агрегатов для конъюгата "Ас-PYY(PEG3-Cys-4Abu-NH2): гуманизированное антидигоксигениновое антитело VH52bC" и как 100% мономер для комплекса "Ac-PYY(PEG3-Cys-4Abu-NH2): гуманизированное антидигоксигениновое антитело" с помощью эксклюзионной хроматографии. Кроме того, полученный комплекс/конъюгат анализировали с помощью масс-спектрометрии. Для конъюгата "Ac-PYY(PEG3-Cys-4Abu-NH2): гуманизированное антидигоксигениновое антитело VH52bC" 17% обнаруженных видов были идентифицированы как антитело, соединенное с 2 пептидными молекулами, 51% были идентифицированы как антитело, соединенное с 1 пептидной молекулой, и 32% были идентифицированы как антитело без связанного пептида. Для комплекса "Ac-PYY(PEG3-Cys-4Abu-NH2): гуманизированное антидигоксигениновое антитело" 100% антитела были несвязанными.
Пример 16
Дисульфидные паттерны, которые необходимы для формирования правильно свернутых функциональных гаптенсвязывающих антител с цистеиновой мутацией для ковалентного связывания с полезной нагрузкой
Гаптенсвязывающие модули для ковалентного связывания соединения/полезной нагрузки могут состоять из "стандартных" антител, таких как IgG, содержащих дополнительные остатки цистеина, которые делают возможным ковалентное присоединение гаптенилированных соединений/полезных нагрузок. Способ, описываемый в данном документе, вводит необходимые функциональные группы (цистеины) в свернутые домены, структура и последовательность которых обеспечивает основу для функциональности антител. Правильное формирование определенных дисульфидных связей внутри, а также между доменами антител имеет важное значение для формирования и поддержания правильной структуры и функциональности. На фиг. 10(A) показан дисульфидный паттерн, который необходим для формирования функциональных связывающих ветвей, таких как Fab немодифицированных антител, а на фиг. 10(B) показан дисульфидный паттерн, который необходим для поддержания структуры и функциональности производных мутированного антитела VH52cB/VH53C. Для поддержания надлежащего дисульфидного паттерна дополнительный цистеин, который был введен в домен VH, должен быть незанятым и не должен влиять на соседние цистеины или реагировать с ними. На фиг. 10(C) и 10(D) показано, что добавление дополнительных цистеинов дает возможность формироваться неправильным дисульфидам в пределах VH-доменов в процессе биосинтеза таких молекул. Тот факт, что позиция VH52bC/VH53C находится в пределах домена VH (и довольно близко к другим цистеинам), увеличивает риск того, что неправильные дисульфиды могут быть сформированы в процессе биосинтеза тяжелой цепи. Еще одна потенциальная проблема заключается в том, что VH- и VL-домены объединяются в секреторном пути в один Fv-фрагмент.Секреторный путь включает перестройку окислительно-восстановительных условий и ферментную перестройку дисульфидных связей. Таким образом, потенциал для введения неправильных дисульфидов путем добавления мутации VH52bC/VH53C может "распространяться" также на дисульфиды легкой цепи (что иллюстративно показано на фиг. 10(E)). Это дополнительно увеличивает риск получения/создания неправильно свернутых нефункциональных молекул. Поэтому довольно удивительно, что несмотря на эти риски могут быть экспрессированы и получены хорошие количества гомогенных функциональных производных антител, которые содержат мутацию VH52bC/VH53C и которые способны ковалентно соединяться с гаптенилированными соединениями/полезными нагрузками.
Пример 17
Составление и получение антигаптеновых, стабилизированных дисульфидными связями, одноцепочечных Fv-фрагментов с цистеиновой мутацией для ковалентного связывания
Гаптенсвязывающие модули для ковалентного связывания соединения/полезной нагрузки могут состоять из "стандартных" антител, таких как IgG. Альтернативно, они могут быть модифицированными группами, такими как рекомбинантные Fv- или Fab-фрагменты, или их производными. Одноцепочечные Fv-фрагменты часто применяются в качестве альтернативы полноразмерным антителам, особенно в случаях, когда требуется малый размер модуля, или когда для создания би- или мультиспецифических производных антител желательны дополнительные связывающие модули. Одним из примеров антигаптеновых Fv-производных групп, которые были созданы, является стабилизированный дисульфидными связями одноцепочечный Fv, который связывается с и ковалентно соединяет дигоксигенилированные соединения/полезные нагрузки. Стабилизированный дисульфидными связями одноцепочечный Fv с Dig-связывающей специфичностью был получен путем соединения VH- и VL-доменов антидигоксигенинового антитела друг с другом через гибкий Gly- и Ser-богатый линкер. Эти VH- и VL-домены несли в дополнение цистеиновые мутации в позиции 44 VH-домена и в позиции 100 VL-домена (позиции в соответствии с Kabat et al.). Эти дополнительные цистеины формируют стабильную межмолекулярную дисульфидную связь между VH и VL. Это стабилизирует scFv, как было описано ранее (например, Reiter, Y., et al., Nature Biotechnology 14 (1996) 1239-1245).
Кроме того, еще один цистеин был введен в VH в позиции 52b или 53, соответственно, в соответствии с нумерацией Kabat для добавления ковалентно связывающей функциональной группы к Fv-фрагменту.
Тем не менее, введение такой мутации в стабилизированные дисульфидными мостиками Fv-фрагменты является гораздо более сложной задачей, чем помещение их в полноразмерные антитела. Одноцепочечные Fv-фрагменты по своей природе менее стабильны, чем полноразмерные IgG или Fab-фрагменты, поскольку они не имеют константных доменов в качестве стабилизирующих и усиливающих гетеродимеризацию групп. Стабильность можно придать путем помещения дополнительных цистеиновых мутаций в Fv, таких как дисульфид VH44-VL100. Тем не менее, этот принцип стабилизации работает только тогда, когда дисульфид формируется в правильных позициях между правильными цистеинами. Таким образом, в дополнение к определенным внутридоменным дисульфидам (одному в VH и одному в VL) должен сформироваться один единственный определенный правильный междоменный дисульфид. Дисульфидные связи между несоответствующими цистеинами будут создавать неправильно свернутые нестабильные и нефункциональные молекулы. Принимая во внимание, что стабилизированный дисульфидными связями Fv-фрагмент содержит 6 цистеинов, теоретически может быть сформирована 21 различная дисульфидная связь, но только правильная комбинация трех определенных дисульфидов будет формировать функциональный стабилизированный dsscFv. Эта проблема усугубляется добавлением другого свободного цистеина в VH-домен. Стабилизированный dsscFv, желательно, содержит два определенных внутридоменных дисульфида (по одному в VH и VL), один определенный междоменный дисульфид (между VH и VL), а также один свободный цистеин для связывания гаптенилированного соединения/полезной нагрузки (в VH в позиции 52b/53). Принимая во внимание, что стабилизированный дисульфидными связями Fv-фрагмент с дополнительной цистеиновой мутацией для ковалентного связывания содержит 7 цистеинов, теоретически может быть образовано много различных дисульфидных связей, но только правильная комбинация трех определенных дисульфидов с точной позицией свободного цистеина в VH52bC/VH53C приведет к образованию функционального, стабилизированного и способного к ковалентному связыванию dsscFv. Еще одна проблема заключается в том, что дополнительный свободный цистеин (VH52b/VH53) находится в непосредственной близости от цистеина VH44, который является не природным цистеином, а мутацией, введенной для дисульфидной стабилизации. VH44C необходима для формирования правильного междоменного дисульфида, и, не связываясь с конкретной теорией, полагают, что этот дисульфид формируется после независимого сворачивания и сборки VH и VL. Близость VH44C и VH52bC/VH53C усугубляет риск того, что внутридоменный дисульфид не будет формироваться правильным образом. Но было обнаружено, что могут быть получены функциональные, стабилизированные дисульфидной связью, одноцепочечные Fv-модули, которые связывают дигоксигенин и одновременно способны ковалентно соединяться с дигоксигенилированной полезной нагрузкой. Состав стабилизированной дисульфидной связью одноцепочечной Fv-молекулы, которая содержит правильные дисульфиды и свободный цистеин в правильной позиции, а также сравнение ее с нежелательными неправильно свернутыми молекулами, показаны на фиг. 11. Последовательности, которые кодируют вариабельные области легкой цепи и модифицированные вариабельные области тяжелой цепи этого Dig-связывающего dsscFv с мутацией VH52bC производного Fv-антитела, перечислены под номерами SEQ ID NO 190 (VH) и SEQ ID NO 189 (VL). Успешное создание таких dsscFv в качестве модулей для создания производных биспецифических антител описано в примере 23 (ниже), а также показано на фиг. 13(A), 13(В) и 13(C).
Пример 18
Составление, экспрессия и очистка производных биспецифического антигаптенового антитела для направленной доставки ковалентно связанных соединений/полезных нагрузок
Были созданы биспецифические антитела, которые содержат модули гаптенсвязывающего антитела для ковалентного связывания соединения/полезной нагрузки. Эти антитела дополнительно содержат связывающие модули, которые включают нацеливание на другие антигены. Применение таких биспецифических антител включает специфическое нацеливание гаптенилированных соединений/полезных нагрузок на клетки или ткани, которые несут целевой антиген. Одним из примеров таких молекул, которые были получены, является биспецифическое антитело со связывающими областями, которые распознают ассоциированный с опухолью углеводный антиген LeY, и одновременно со стабилизированными дисульфидными связями Fv, которые связываются и ковалентно соединяют дигоксигенилированные соединения/полезные нагрузки. Таким образом, стабилизированные дисульфидными связями одноцепочечные Fv были соединены с помощью гибких Gly- и Ser-богатых связывающих пептидов к С-концами СН3-доменов антитела LeY, что приводило к образованию четырехвалентных молекул с двумя LeY-связывающими ветвями и дополнительно двумя дигоксигенин-связывающими группами. Дигоксигенин-связывающие группы несли дисульфидную связь VH44-VL100, которая была ранее описана (например, Reiter, Y., et al., Nature Biotechnology 14 (1996) 1239-1245). Дигоксигенин-связывающая группа содержала также мутацию VH52bC для ковалентного связывания. Последовательности, кодирующие легкую цепь и модифицированную тяжелую цепь этого производного LeY-Dig-антитела, перечислены под номерами SEQ ID NO 191 и SEQ ID NO 192. Состав производного биспецифического LeY-Dig-антитела как средства доставки для ковалентно связанных соединений/полезных нагрузок схематически показан на фиг. 12.
Биспецифические молекулы были созданы с помощью методик молекулярной биологии, экспрессированы путем секреции из культивируемых клеток, а затем очищены из культуральных супернатантов таким же образом, как описано выше. На фиг. 13(A) показано наличие модифицированной Н-цепи и L-цепи этого биспецифического LeY-Dig (52bC)-антитела в клеточных культуральных супернатантах, визуализированное в вестерн-блот-анализах, которые выявляют L-цепи и Н-цепи антитела. На фиг. 13(B) показана гомогенность этих антител после очистки путем SDS-PAGE в присутствии восстанавливающего агента. Окрашивание SDS-PAGE бриллиантовым синим Кумасси визуализирует полипептидные цепи, связанные с IgG, с кажущимися молекулярными размерами, аналогичными их расчетным молекулярным массам. На фиг. 13(C) показан SEC-профиль биспецифического LeY-Dig (52bC)-антитела после очистки на белке А, который демонстрирует гомогенность и отсутствие агрегатов в белковых препаратах. Таким образом, биспецифические антитела, которые содержат нацеленные модули, а также модули для ковалентного связывания гаптенилированных соединений/полезных нагрузок, могут быть получены и очищены до гомогенности.
Пример 19
Определение рентгеноструктуры Fab-фрагментов мышиного антибиотинового антитела в комплексе с биоцитинамидом
Белковую структуру Fab-фрагмента мышиного антибиотинового антитела определяли в комплексе с биоцитинамидом. Таким образом, кристаллы Fab-фрагмента выращивали в 0,8 М янтарной кислоте с последующей зарядкой кристаллов антител биоцитинамидом (разводили до рабочей концентрации 10 мМ в растворе для кристаллизации, наносили на кристаллы в капле кристаллизации). Кристаллы промывали три раза с помощью 2 мкл 10 мМ раствора биоцитинамида и, наконец, инкубировали в течение 16 ч с биоцитинамидом при температуре 21°С, собирали, используя 15% глицерин в качестве криопротектора, а затем мгновенно замораживали в жидком азоте. Обработанные дифракционные данные давали структуру белка с разрешением 2,5
Пример 20
Антигаптеновые биспецифические антитела
Биспецифические антитела распознают ассоциированные с опухолью антигены клеточной поверхности, такие как LeY, и одновременно связывают гаптены, такие как, например, дигоксигенин (Dig). На фиг. 20А показан состав биспецифических антител, основанных на описанном ранее формате, полученном из полноразмерного IgG (см. выше Metz et al., WO 2012/093068): функциональные группы, связывающие антиген клеточной поверхности, расположены в двух Fab-ветвях IgG-группировки; два дополнительных scFv, рекомбинантно слитые с С-концами тяжелых цепей, имеют гаптенсвязывающую активность. scFv-модули несут дополнительные стабилизирующие межцепочечные дисульфидные связи для стабилизации Fv и уменьшения агрегации (от VHCys44 к VLCys100). Кроме того, антигаптеновое антитело имеет искусственный остаток цистеина в позиции VH52b или VH53 согласно нумерации Kabat в зависимости от фактической длины CDR2 соответствующего антитела, чтобы формировать ковалентную дисульфидную связь между биспецифическим антигаптеновым антителом и полипептидным токсином.
Последовательности L- и Н-цепей Dig-VH Cys-содержащего биспецифического антитела, которое связывает LeY и Dig, перечислены в SEQ ID NO 198 и SEQ ID NO 199.
Эти биспецифические антитела временно продуцировали в клетках НЕК293 в суспензии и очищали из культуральных супернатантов, как описано ранее (см. выше Metz et al., WO 2012/093068). Плазмидами, кодирующими легкие и тяжелые цепи или Fab-Fv-гибриды, котрансфицировали суспензионные клетки НЕК293, которые культивировали в бессывороточной среде. Супернатанты осветляли через семь дней после трансфекции путем центрифугирования и фильтрации через фильтр с размером пор 0,22 мкм. Биспецифические антитела очищали с помощью белка, а затем на колонке SEC (Superdex200 HiLoad 26/60, GE Healthcare), уравновешенной раствором, содержащим 20 мМ гистидин, 140 мМ NaCl, рН 6,0. Концентрацию белка определяли по оптической плотности при 280 нм, используя в качестве фона 320 нм, гомогенность очищенных белков подтверждали путем SDS-PAGE.
Состав, чистота и гомогенность полученных препаратов биспецифических антител (SEC и SDS PAGE), которые были использованы в данном исследовании, показаны на фиг. 20В.
Пример 21
Получение правильных дисульфидов и доступных цистеинов в биспецифических антигаптеновых антителах
Гаптенсвязывающие модули для ковалентного связывания с полипептидным токсином состоят из "стандартных" антител, таких как IgG, которые содержат один или более чем один дополнительный остаток цистеина для формирования дисульфидной связи с гаптенилированным полипептидным токсином. Способ, описанный в данном документе, вводит необходимые функциональные возможности (цистеины) в свернутые домены, структура и последовательность которых обеспечивают основу для функциональных возможностей антитела. Правильное формирование определенных дисульфидных связей внутри, а также между доменами антител, имеет важное значение для формирования и поддержания правильной структуры и функциональности. На фиг. 10(A) показан дисульфидный паттерн, который необходим для формирования функциональных связывающих ветвей, таких как Fab немодифицированных антител, а на фиг. 10(B) показан дисульфидный паттерн, который необходим для поддержания структуры и функциональности производного мутированного антитела VH52cB/VH53C. Для поддержания надлежащего дисульфидного паттерна дополнительный цистеин, который был введен в домен VH, должен быть незанятым внутрицепочечными дисульфидными связями и не должен влиять на соседние цистеины или реагировать с ними. На фиг. 10(C) и 10(D) показано, что добавление искусственных цистеиновых остатков дает возможность формироваться неправильным дисульфидам в пределах VH-доменов в процессе биосинтеза таких молекул. Тот факт, что позиция VH52bC/VH53C находится в пределах VH-домена, фактически в CDR2 (и довольно близко к другим цистеинам), увеличивает риск того, что неправильные дисульфиды могут быть сформированы в процессе биосинтеза тяжелой цепи. Еще одна потенциальная проблема заключается в том, что VH- и VL-домены объединяются в секреторном пути в один Fv-фрагмент. Секреторный путь включает перестройку окислительно-восстановительных условий и ферментную перестройку дисульфидных связей. Таким образом, потенциал для введения неправильных дисульфидов путем добавления мутации VH52bC/VH53C может "распространяться" также на дисульфиды легкой цепи (что иллюстративно показано на фиг. 10(E)). Это дополнительно увеличивает риск получения/создания неправильно свернутых нефункциональных молекул. Поэтому довольно удивительно, что несмотря на эти риски могут быть экспрессированы и получены хорошие количества гомогенных функциональных производных антител, которые содержат мутацию VH52bC/VH53C и которые способны ковалентно соединяться с гаптенилированным полипептидным токсином.
Проблема правильной сборки дисульфидов при сохранении правильного свободного цистеина усугубляется при создании биспецифического антитела. Для создания антигаптеновых стабилизированных дисульфидными связями одноцепочечных Fv-фрагментов с цистеиновой мутацией для ковалентного связывания гаптенсвязывающие модули для ковалентного связывания полипептидного токсина могут состоять из "стандартных" антител, таких как IgG. Альтернативно, они могут представлять собой фрагменты антител, такие как Fv- или Fab-фрагменты, или их производные. Одноцепочечные Fv-фрагменты часто применяются в качестве альтернативы полноразмерным антителам, особенно в случаях, когда требуется малый размер модуля, или когда для создания би- или мультиспецифических производных антител нужны дополнительные связывающие модули. Одним из примеров антигаптеновых Fv-производных групп, которые были созданы, является стабилизированный дисульфидными связями одноцепочечный Fv, который связывается и ковалентно соединяет дигоксигенилированные полипептидные токсины. Стабилизированный дисульфидными связями одноцепочечный Fv с дикогсигенин-связывающей специфичностью был получен путем соединения VH- и VL-доменов антидигоксигенинового антитела друг с другом через гибкий GS-линкер. Эти VH- и VL-домены дополнительно несли цистеиновые мутации в позиции 44 VH-домена и в позиции 100 VL-домена (позиции в соответствии с Kabat et al.). Эти дополнительные цистеины формируют стабильную межмолекулярную дисульфидную связь между VH и VL. Это стабилизирует scFv, как было описано ранее (например, Reiter, Y., et al., Nature Biotechnology 14 (1996) 1239-1245).
Кроме того, еще один цистеин был введен в VH в позиции 52b или 53, соответственно, в соответствии с нумерацией Kabat для добавления к Fv-фрагменту ковалентно связывающей функциональной группы. Тем не менее, введение такой мутации в стабилизированные дисульфидными мостиками Fv-фрагменты является гораздо более сложной задачей, чем помещение их в полноразмерные антитела. Одноцепочечные Fv-фрагменты по своей природе менее стабильны, чем полноразмерные IgG или Fab-фрагменты, поскольку они не имеют константных доменов в качестве стабилизирующих и усиливающих гетеродимеризацию групп. Стабильность можно придать путем помещения в Fv дополнительных цистеиновых мутаций, таких как дисульфид VH44-VL100. Тем не менее, этот принцип стабилизации работает только тогда, когда дисульфид формируется в правильных позициях между правильными цистеинами. Таким образом, в дополнение к определенным внутридоменным дисульфидам (одному в VH и одному в VL) должен сформироваться один единственный определенный правильный междоменный дисульфид. Дисульфидные связи между несоответствующими цистеинами будут создавать неправильно свернутые нестабильные и нефункциональные молекулы. Принимая во внимание, что стабилизированный дисульфидными связями Fv-фрагмент содержит 6 цистеинов, теоретически может быть сформирована 21 различная дисульфидная связь, но только правильная комбинация трех определенных дисульфидов будет формировать функционально стабилизированный, одноцепочечный, стабилизированный дисульфидными связями Fv-фрагмент (dsscFv). Эта проблема усугубляется добавлением другого свободного цистеина в VH-домен. Стабилизированный дисульфидными связями Fv-фрагмент (dsscFv), желательно, содержит два определенных внутридоменных дисульфида (по одному в VH и VL), один определенный междоменный дисульфид (между VH и VL), а также один свободный цистеин для связывания гаптенилированного соединения/полезной нагрузки (в VH в позиции 52b/53). Принимая во внимание, что стабилизированный дисульфиднями связями Fv-фрагмент с дополнительной цистеиновой мутацией для ковалентного связывания содержит 7 цистеинов, теоретически может быть образовано много различных дисульфидных связей, но только правильная комбинация трех определенных дисульфидов с точной позицией свободного цистеина в VH52bC/VH53C приведет к функциональному, стабилизированному и способному к ковалентному связыванию dsscFv. Еще одна проблема заключается в том, что дополнительный свободный цистеин (VH52b/VH53) находится в непосредственной близости от цистеина VH44, который является не природным цистеином, а мутацией, введенной для дисульфидной стабилизации. VH44C необходима для формирования правильного междоменного дисульфида. Не связываясь с конкретной теорией, полагают, что этот дисульфид формируется после независимого сворачивания и сборки VH и VL. Близость VH44C и VH52bC/VH53C усугубляет риск того, что внутридоменный дисульфид не будет формироваться правильным образом. Но было обнаружено, что могут быть получены функциональные, стабилизированные дисульфидными связями, одноцепочечные Fv-модули, которые связывают дигоксигенин и одновременно способны ковалентно соединяться с дигоксигенилированными полипептидными токсинами. Состав стабилизированной дисульфидными связями одноцепочечной Fv-молекулы, которая содержит правильные дисульфиды и свободный цистеин в правильной позиции, а также сравнение ее с нежелательными неправильно свернутыми молекулами, показаны на фиг. 11.
Пример 22
Гаптенилированные производные псевдомонадного экзотоксина
Псевдомонадный экзотоксин представляет собой полипептид размером 66 кДа, который связывается своим N-концевым доменом I с эукариотическими клетками, интренализируется, подвергается протеолитическому процессингу в домене II и высвобождает С-концевой домен III в цитоплазму. Этот домен АДФ-рибозилирует eEF2, что вызывает ингибирование синтеза белка и последующую гибель клетки. Укороченные варианты, включая те, которые используются в данном изобретении в качестве полипептидного токсина, показаны на фиг. 21: в молекуле NLysPE38 удален связывающийся с клеткой домен I и домен IB (Weldon, J.E. and Pastan, I., FEBS Journal 278 (2011) 4683-4700; Debinski, W. and Pastan, I., Cancer Res. 52 (1992) 5379-5385). Эта молекула сама по себе имеет очень низкую цитотоксическую активность. NLysPE38 содержит лизин, расположенный вблизи ее N-конца (N-Lys), который может быть химически модифицирован путем NHS-химической реакции. Недавно было показано, что в контексте dsscFv-гибридов большая часть домена II также может быть удалена без потери активности до тех пор, как сохраняется сайт процессинга (Weldon, J.E. and Pastan, I., FEBS Journal 278 (2011) 4683-4700; Hansen, J.K., et al., J. Immunother. 33 (2010) 297-304; Pastan, I., et al., Leukemia & Lymphoma 52 (2011) Supp. 2:87-90). Размер токсина в таких гибридных белках составляет приблизительно 25 кДа. Укороченные токсины все еще содержат остаток лизина в домене III. В описанном выше токсине NlysPE38QQR лизин домена III заменен на глутамин или аргинин (Debinski, W. and Pastan, I., Cancer Res. 52 (1992) 5379-5385; Debinski, W. and Pastan, I., Bioconjug. Chem. 5 (1994) 40-46) для уменьшения риска инактивации домена III аминомодифицирующими реагентами, такими как NHS. В данном документе описан новый вариант полипептидного токсина NLysPE25SQΔ, в котором удалены домен I и IB, а также большая часть домена II (группировка токсина CD22-LR8M (Pastan, I., et al., Leukemia & Lymphoma 52 (2011) Supp. 2:87-90)), а лизин в домене III заменен на серии или глутамин (NlysPE40QQR-аналогичные мутации). Кроме того, С-концевой лизин удален, и имеется амино-концевое удлинение лизином (NlysPE38). Таким образом, NLysPE25SQΔ представляет собой сравнительно небольшую группировку токсина, которая содержит только один лизин на N-конце. Первичный амин этого лизина (и того, который на N-конце) можно модифицировать с помощью NHS-реагентов, не затрагивая другие позиции токсина. NLysPE25SQΔ (РЕ25) был получен в Е. coli и очищен из периплазмы путем анионообменной и эксклюзионной хроматографии для удаления агрегатов и низкомолекулярных примесей, как описано ранее для NLysPE38 (Debinski, W. and Pastan, I., Cancer Res. 52 (1992) 5379-5385; Debinski, W. and Pastan, I., Bioconjug. Chem. 5 (1994) 40-46). Гомогенные препараты без агрегатов могут быть получены с хорошим выходом (>1 г/л культуры, анализ SDS-PAGE на фиг. 21В). Для дигоксигенилированного NLysPE25SQΔ активный эфир дигоксигенин-NHS применяли для модификации первичных аминогрупп лизина. N-конец белков также может служить в качестве мишени для NHS-опосредованной дигоксигенин-конъюгации. Чтобы при последующем формировании ковалентного комплекса биспецифического антитела и полипептидного токсина избежать влияния стерических препятствий между двумя объемными партнерами, между дигоксигенином и NHS, т.е. между дигоксигенином и полипептидным токсином, был помещен короткий, но гибкий линкер. В оставшейся части этого документа NLysPE25SQΔ называется РЕ25.
Для создания производных полипептидного токсина, которые содержат дополнительный цистеин для гаптен-опосредованного ковалентного связывания с биспецифическим антителом, в РЕ25 вводили цистеин либо до, либо после остатка лизина, который используется для гаптеновой конъюгации. Эти производные РЕ получали и очищали таким же образом, как и РЕ25. Вариант РЕ25, который содержит искусственный остаток цистеина полипептида перед остатком лизина, используемого для гаптеновой конъюгации, называется NCK-PE25, а вариант РЕ25, который содержит искусственный остаток цистеина полипептида после остатка лизина, используемого для гаптеновой конъюгации, называется NKC-PE25. Сравнение последовательностей РЕ25, NCK-PE25 и NKC-PE25 показано на фиг. 21С.
Последовательность РЕ25 указана в SEQ ID NO 194. Последовательность производного S-PE25, в котором лизин заменен на серии, указана в SEQ ID NO 195.
Последовательность NKC-PE25 указана в SEQ ID NO 196. Последовательность NCK-PE25 указана в SEQ ID NO 197.
Пример 23
Ковалентное связывание токсинов с нацеливающими носителями
Производные РЕ25 подвергали взаимодействию с дигоксигенин-карбоксиметил-NHS-эфиром (DE3836656, Metz et al., см. выше). Затем небольшие непрореагировавшие соединения и продукты реакции (NHS) отделяли от дигоксигенилированного полипептидного токсина размером 25 кДа путем пропускания реакционной смеси через колонку PD10 с последующей стерильной фильтрацией. Перед соединением с антителом дигоксигенилированные полипептидные токсины восстанавливали с помощью DTE, а затем удаляли восстанавливающий агент путем повторного пропускания через колонку PD10. Затем получали комплексы, содержащие биспецифическое антитело и дигоксигенилированный полипептидный токсин, путем инкубации дигоксигенилированных полипептидных токсинов в течение 10 мин при комнатной температуре с антидигоксигениновым биспецифическим антителом в буферном водном растворе при концентрации (биспецифического антитела) от 10 до 30 мг/мл. Из-за двухвалентности антидигоксигениновой группировки в гибридах IgG-Fv дигоксигенилированные полипептидные токсины использовали в молярном соотношении 2:1 (полипептидный токсин к биспецифическому антителу). Образованные комплексы очищали с помощью хроматографии на белке А (для удаления свободного токсина), а затем использовали без дополнительной модификации для анализов. Анализы SDS-PAGE в невосстанавливающих и восстанавливающих условиях и последующее обнаружение группировок токсина с помощью вестерн-блот-анализов (Фиг. 22) продемонстрировали формирование связанных дисульфидными связями комплексов биспецифического антитела и полипептидного токсина: в сильно денатурирующих условиях (SDS; кипячение), в невосстанавливающих условиях токсин появляется в виде высокомолекулярной полосы, которая представляет собой тяжелую цепь с ковалентно связанным токсином. Таким образом, токсин стабильно и ковалентно связан с биспецифическим антителом. В восстанавливающих условиях токсин отделяется от антитела и мигрирует соответственно его меньшей молекулярной массе. Это может быть продемонстрировано путем обнаружения полипептидного токсина с помощью анти-РЕ-антител, а также с помощью антидигоксигениновых антител в вестерн-блот-анализе. Это также подтверждает, что стабильное связывание биспецифического антитела с полипептидным токсином обусловлено специфическим формированием сконструированной дисульфидной связи. Модель с относительными размерами и составом компонентов дигоксигенилированного РЕ25, NCK-PE25 и NKC-PE25, которые образуют комплексы и стабильно связаны дисульфидными связями с дигоксигенин-связывающей группировкой антитела, показана на фиг. 22В и С.
Пример 24
Доставка полипептидного токсина, опосредованная ковалентным комплексом
Чтобы оценить функциональные возможности, специфичность и эффективность ковалентных конъюгатов, описанных в данном документе, в доставке полипептидных токсинов, клетки MCF-7 подвергали воздействию ковалентных конъюгатов биспецифического антитела и полипептидного токсина. MCF7 экспрессируют антиген LeY на своей поверхности и являются чувствительными к иммунотоксинам, полученным из РЕ, которые связывают LeY (Metz et al., см. выше). Жизнеспособность и пролиферацию этих клеток оценивали с помощью анализов, которые определяют метаболическую активность или клеточную пролиферацию, оба способа хорошо известны специалистам в данной области. Чтобы определить жизнеспособность клеток при воздействии токсинов, определяли клеточное содержание АТФ (которое отражает метаболическую активность) с помощью анализа Cell Titer Glo (CTG) через 48 часов или 72 часа после добавления конъюгатов биспецифического антитела, нацеленного на клеточную поверхность, и полипептидного токсина. Воздействие полипептидного токсина на пролиферацию измеряли с помощью анализов встраивания BrdU (бромдезоксиуридина) (т.е. синтез ДНК) через 48 часов или 72 часа после добавления конъюгатов биспецифического антитела, нацеленного на клеточную поверхность, и полипептидного токсина. Все анализы проводили в трех повторах в 96-луночных планшетах на субконфлюентных культурах. Результаты BrdU-анализа, представленные на фиг. 23, показывают, что инкубация клеток MCF-7 с конъюгатами биспецифического антитела, нацеленного на клеточную поверхность, и полипептидного токсина, содержащими производное РЕ25, показала заметное направленное дозозависимое снижение пролиферации.
Это свидетельствует о том, что конъюгаты биспецифического антитела, нацеленного на клеточную поверхность, и полипептидного токсина, описанные в данном документе, являются полностью функциональными с точки зрения связывания и специфичности доставки (нацеливания) и функциональности полезной нагрузки (например, цитотоксической активности в отношении опухолевых клеток) с тем преимуществом, что они более стабильны, чем нековалентные комплексы биспецифического антитела и гаптенилированного полипептидного токсина.
Пример 25
Разделение антитела и гаптенилированного полипептида в везикулярных компартментах
Ковалентные комплексы, описанные в данном документе, могут быть доставлены к клеткам и в клетки с помощью биспецифических антител, нацеленных на клетки (bsAb), которые обладают антигаптеновой специфичностью связывания. Для некоторых полипептидов необходимо, чтобы эти комплексы входили в цитоплазму или другие внутриклеточные компартменты. К ним относятся, например цитотоксические группы, применяемые в терапии рака. Полипептиды, которые доставляются с помощью bsAb, нацеленных на клетки, должны высвобождаться внутри клеток-мишеней.
Чтобы выявить внутриклеточное высвобождение, использовали биспецифическое антитело LeY-Dig(52bC) (см. примеры 18 и 20), которое связывается с антигеном LeY и несет биотин-связывающие группы, такие как стабилизированные дисульфидными связями одноцепочечные Fv-добавления. Инкубация с биотин-Cys-Cy5 приводила к формированию ковалентных дисульфид-конъюгированных комплексов. Антиген LeY распространен на клетках рака молочной железы, он интернализуется, и производные LeY-связывающего антитела, как было показано ранее, доставляют полезную нагрузку на клетки и в клетки (например, MCF7). Анализ путем конфокальной микроскопии с использованием Alexa-меченных вторичных антител для обнаружения bsAb и флуоресценции для обнаружения Cy5 показал, что ковалентный конъюгат связывается и интернализуется клетками MCF7 (Фиг. 24). Можно видеть, что bsAb и биотин не остаются соединенными в клетках, так как отделение биотина от антитела можно наблюдать в течение долгого времени, например, через шесть часов после введения. Отделенное bsAb было визуализировано с помощью вторичных антител, которым необходимы интактные растяжки/домены BsAb для обнаружения. Таким образом, наблюдаемое внутриклеточное высвобождение полезной нагрузки вызвано в основном внутриклеточным восстановлением и диссоциацией гаптена.
Реферат
Изобретение относится к области биохимии, в частности к конъюгату для нацеленной доставки полипептидного токсина. Также раскрыта фармацевтическая композиция, содержащая указанный конъюгат. Изобретение обладает эффективной нацеленной доставкой полипептидного токсина. 2 н. и 10 з.п. ф-лы, 25 пр., 6 табл., 24 ил.
Формула
Документы, цитированные в отчёте о поиске
Антитела против ephb4 и способы их применения
Конъюгаты гептен-носитель и их применение

Комментарии