Сайт-направленная модификация fviii - RU2423380C2
Код документа: RU2423380C2
Чертежи










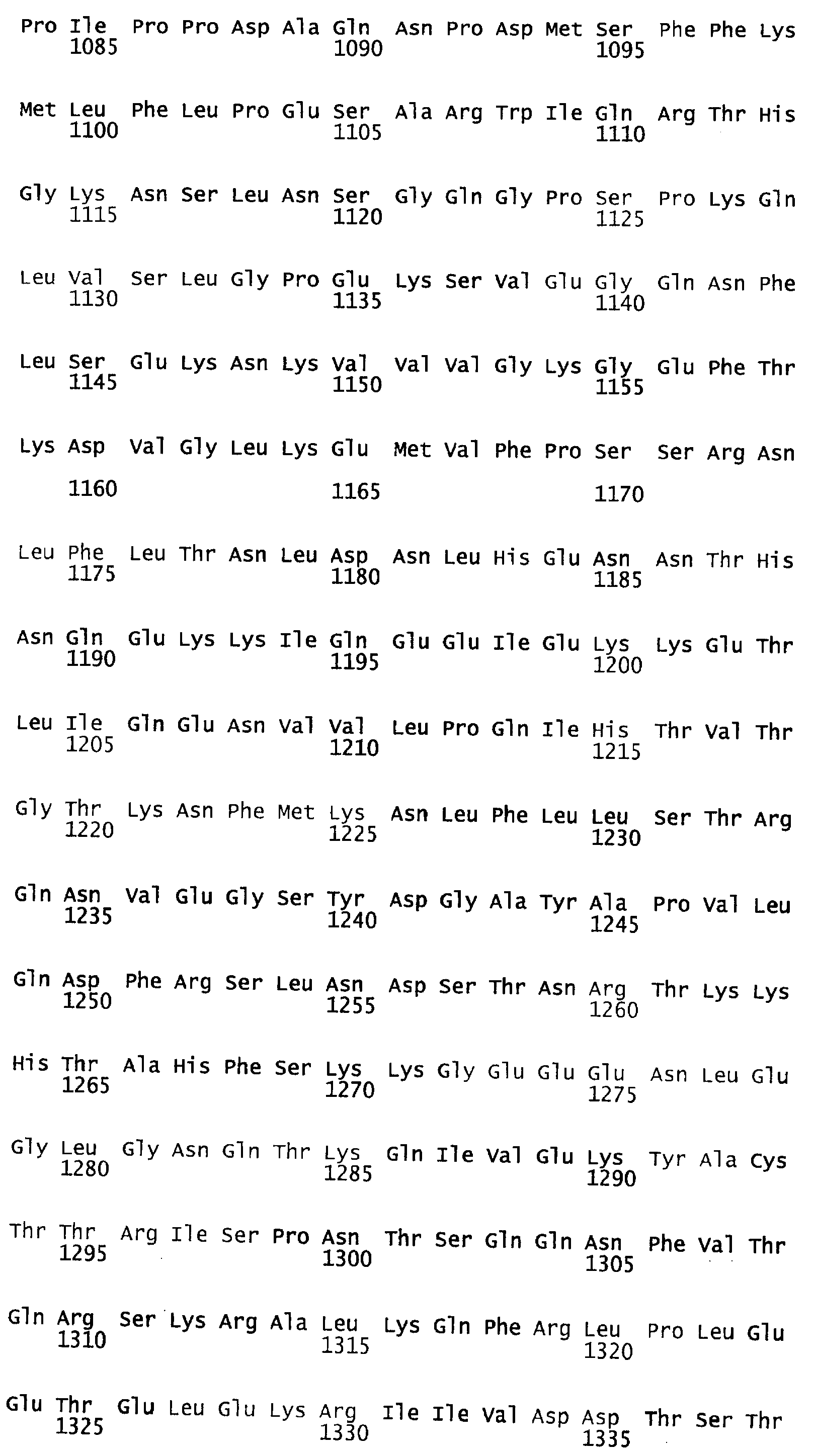
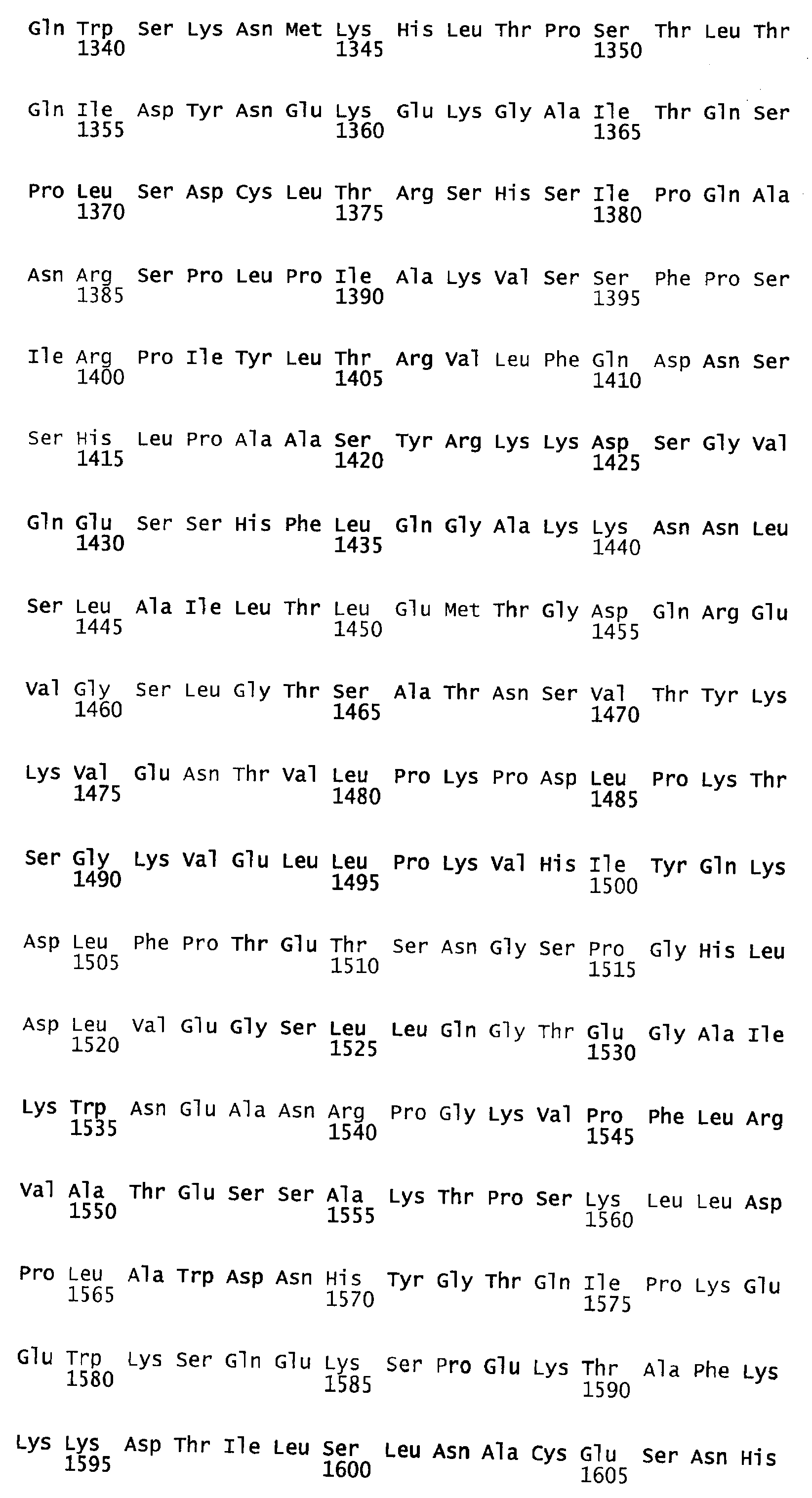
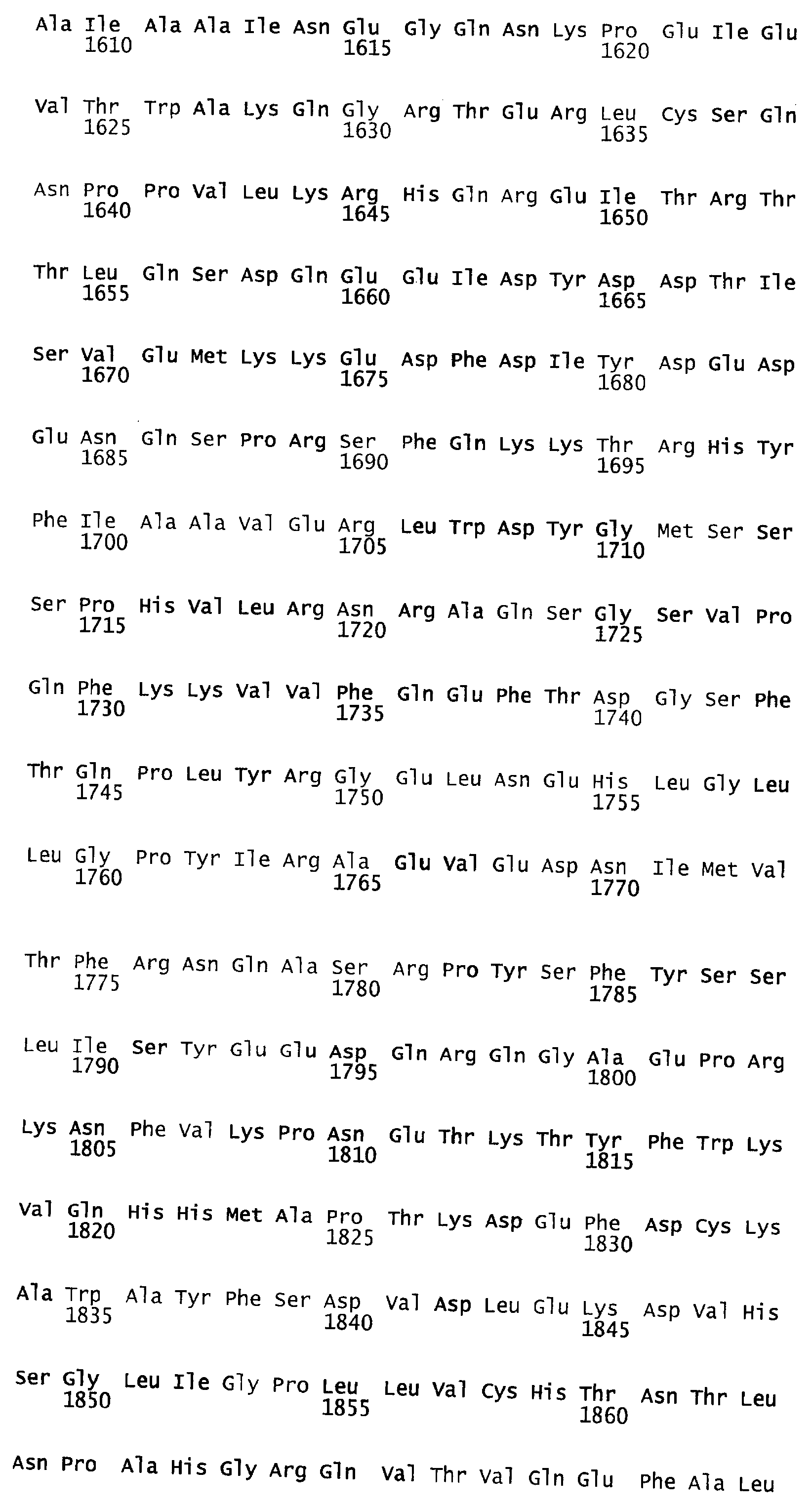
































Описание
Перекрестная ссылка
Данная заявка имеет преимущество приоритета по заявке №60/627277 на патент США, поданной 12 ноября 2004 г., которая полностью включена здесь посредством ссылки.
Область изобретения
Данное изобретение относится к мутеинам фактора VIII (FVIII), которые обладают возможностью связываться в предварительно заданном сайте с одним или более биосовместимыми полимерами, такими как полиэтиленгликоль. Кроме того, предлагаются основанные на них составы, дозировки и способы их введения в терапевтических целях. Эти модифицированные варианты FVIII и основанные на них композиции и способы пригодны для выбора метода лечения лиц, пораженных гемофилией А, в котором частота введения препарата уменьшена и иммуногенный ответ снижен.
Уровень техники
Гемофилия А является наиболее общим наследственным нарушением свертываемости крови с оценкой встречаемости одно на 5000 мужчин. Она вызывается дефицитом или структурными дефектами FVIII, основном компоненте природного пути свертывания крови. Современное лечение гемофилии А включает внутривенное введение человечьего FVIII. Человечий FVIII производят рекомбинантным методом в виде одноцепочечной молекулы размером приблизительно 300 кДа. Она состоит из структурных доменов А1-А2-В-А3-С1-С2 (Thompson, 2003, Semin. Hematol. 29, pp.11-22). Продукт-предшественник преобразуется в две полипептидные цепочки размерами 200 кДа (тяжелая) и 80 кДа (легкая) в аппарате Гольджи, при этом две цепочки удерживаются вместе посредством ионов металлов (Kaufman et al., 1988, J. Biol. Chem. 263, p.6352; Andersson et al., 1986, Proc. Natl. Acad. Sci. 83, p.2979).
Домен В мутеина FVIII представляется необязательным, поскольку FVIII с делетированным доменом В (BDD, А1-А2-тяжелая цепь 90 кДа плюс легкая цепь 80 кДа) также проявляет эффективность при заместительной терапии гемофилии А. Последовательность FVIII с делетированным В-доменом содержит делецию всех, кроме 14-ти, аминокислот В-домена.
Пациентов с гемофилией А в настоящее время лечат внутривенным введением FVIII по необходимости или путем профилактической терапии, назначаемой несколько раз в неделю. При профилактическом лечении дается 15-25 ME фактора VIII на 1 кг веса тела три раза в неделю. Это постоянно требуется пациенту. Ввиду короткого времени полувыведения у человека, FVIII должен вводиться часто. Несмотря на крупный размер в более чем 300 кДа протеина полной длины FVIII имеет у людей период полувыведения только около 11 часов (Ewenstein et al., 2004, Semin. Hematol. 41, pp.1-16). Необходимость частого внутривенного введения создает огромные барьеры в соблюдении больными режима и схемы лечения. Для пациентов было бы более удобным, если бы был разработан FVIII-продукт, который имеет более длительный период полувыведения и, следовательно, требует менее частого введения. Кроме того, если бы период полувыведения был увеличен, могла бы быть уменьшена стоимость лечения, поскольку в результате могло бы потребоваться меньшее количество доз.
Дополнительным недостатком существующей терапии является то, что примерно у 25-30% пациентов вырабатываются антитела, которые ингибируют активность FVIII (Saenko et al., 2002, Haemophilia 8, pp.1-11). Главные эпитопы ингибиторных антител локализованы внутри домена А2 на остатках 484-508, домена A3 на остатках 1811-1818 и домена С2. Выработка антител препятствует использованию FVIII при заместительной терапии, вынуждая эту группу пациентов искать еще более дорогое лечение с помощью высокодозировочного рекомбинантного фактора VIII и иммуноустойчивой терапии.
В последующих исследованиях были идентифицированы FVIII-эпитопы ингибиторных антител. При исследовании 25-ти ингибиторных образцов плазмы было обнаружено, что 11 из них связаны с фрагментом А3С1С2, вызванным тромбином и имеющим легкую цепь размером 73 кДа, 4 связаны с доменом А2, а 10 - с обоими фрагментами (Fulcher, С. et al., 1985, Proc. Natl. Acad. Sci. 2(22), pp.7728-32). В другом исследовании шесть из восьми ингибиторов домена А2 пациентов были нейтрализованы рекомбинантным А2-полипептидом (Scandella, D. et al., 1993, Blood 82(6), pp.1767-75). Эпитопы для шести из девяти ингибиторов пациентов отмечены на остатках 379-538 домена А2 (Scandella, D. et al., 1988, Proc. Natl. Acad. Sci. 85(16), pp.6152-6). Эпитоп для 18-ти ингибиторов с тяжелой цепью был определен в той же N-концевой области размером 18,3 кДа домена А2 (Scandella, D. et al., 1989, Blood 74(5), pp.1618-26).
Активная рекомбинантная гибридная молекула человек/свинья мутеина FVIII, полученная замещением остатков 387-604 домена А2 человека гомологичной последовательностью свиньи, проявляла устойчивость к ингибитору А2 пациента (Lubin, I. et al., 1994, J. Biol. Chem. 269(12), pp.8639-41) и устойчивость к мышиному моноклональному антителу mАВ 413 IgG, которое конкурирует с ингибиторами А2 пациента в связывании с А2 (Scandella, D. et al., 1992, Thromb Haemost. 67(6), рр.665-71). В дальнейшем этот эпитоп домена А2 был обнаружен в остатке 484-508 домена А2, когда в результате экспериментов было выявлено, что мАВ 413 IgG и четыре ингибитора пациента не ингибируют гибридный человек/свинья мутеин FVIII, в котором остатки 484-508 домена А2 были замещены соответствующими остатками домена А2 свиньи (Healey, J. et al., 1995, J. Biol. Chem. 270(24), pp.14505-9). Такой гибридный FVIII также был более устойчивым, по крайней мере, у половины из 23 пациентов, у которых исследовалась плазма (Barrow, R. et al., 2000, Blood 95(2), pp.564-8). При аланин-сканирующем мутагенезе был идентифицирован остаток 487 как основной для связывания со всеми пятью тестированными ингибиторами пациентов, несмотря на то что все остатки 484, 487, 489 и 492 являлись важными для взаимодействия с мАВ 413 IgG (Lubin, I., J. Biol. Chem. 272(48), pp.30191-5). Титры ингибиторных антител у мыши, получавшей мутант R484A/R489A/P492, а не мутант R484A/R489A, были значительно ниже, чем у мыши, получавшей контрольный человеческий BDD FVIII (Parker, E. et al., 2004, Blood 104(3), pp.704-10). Таким образом, область 484-508 домена А2, по-видимому, является сайтом связывания для ингибиторов с активностью FVIII.
Другой проблемой традиционной терапии, помимо иммунного ответа на FVIII, является то, что она требует частого введения дозы из-за короткого периода полувыведения FVIII in vivo. Были исследованы механизмы выведения FVIII из кровотока.
Выведение FVIII из кровотока частично объясняется специфическим связыванием с протеином, родственным рецептору липопротеина низкой плотности (LRP) и печеночному рецептору выведения с широкой лигандной специфичностью (Oldenburg et al., 2004, Haemophilia 10 Suppl 4, pp.133-139). Недавно было также показано, что рецептор липопротеина низкой плотности (LDL) играет некоторую роль в выведении FVIII, например, посредством совместного с LRP действия по регулированию уровней FVIII в плазме (Bovenschen et al., 2005, Blood 106, pp.906-910). Оба взаимодействия облегчаются связыванием с гепарин сульфат протеогликанами (HSPGs) поверхности клеток. Период полувыведения из плазмы у мыши может быть пролонгирован до 3,3 раза, когда блокирован LRP, или в 5,5 раза, когда блокированы как LRP, так и HSPGs поверхности клеток (Sarafanov et al., 2001, J. Biol. Chem. 276, pp.11970-11979). Предполагается, что HSPGs аккумулируют FVIII на клеточной поверхности и предоставляют его LRP. Сайты связывания LRP на FVIII локализованы на остатках 484-509 А2 (Saenko et al., 1999, J. Biol. Chem. 274, pp.37685-37692), остатках 1811-1818 A3 (Bovenschen et al., 2003, J. Biol. Chem. 278, pp.9370-9377) и эпитопе в домене С2 (Lenting et al., 1999, J. Biol. Chem. 274, pp.23734-23739).
Кроме того, FVIII выводится из кровотока под действием протеаз. Чтобы понять этот эффект, нужно понять механизм, посредством которого FVIII вовлечен в свертывание крови. FVIII, связанный с фактором фон Виллебранда (vWF), циркулирует, как гетеродимер, состоящий из тяжелой и легкой цепей. vWF-связывание происходит на остатках 1649-1689 FVIII (Foster et al., 1988, J. Biol. Chem. 263, pp.5230-5234) и части доменов С1 (Jacquemin et al., 2000, Blood 96, pp.958-965) и С2 (Spiegel, P. et al., 2004, J. Biol. Chem. 279(51), pp.53691-8). FVIII активируется тромбином, который расщепляет пептидные связи после остатков 372, 740 и 1689, производя гетеротример из доменов А1, А2 и А3-С1-С2 (Pittman et al., 2001, Proc. Natl. Acad. Sci. 276, pp.12434-12439). По завершении активации FVIII диссоциирует от vWF и накапливается на поверхности клеток тромбоцитов посредством связывания с фосфолипидом. Фосфолипидное связывание включает остатки 2199, 2200, 2251 и 2252 FVIII (Gilbert et al., 2002, J. Biol. Chem. 277, pp.6374-6381). Там он связывается с коагуляционным фактором IX (FIX) через взаимодействие с остатками 558-565 (Fay et al., 1994, J. Biol. Chem. 269, pp.20522-20527) и остатками 1811-1818 FVIII (Lenting et al., 1996, J. Biol. Chem. 271, pp.1935-1940) и с коагуляционным фактором Х (FX) через взаимодействие с остатками 349-372 FVIII (Nogami et al., 2004, J. Biol. Chem. 279, pp.15763-15771) и действует как кофактор для FIX-активации FX, существенного компонента природного пути свертывания крови. Активированный FVIII (F Villa) частично инактивируется протеазой, которая активируется протеином С (АРС) через расщепление FVIII после остатков 336 и 562 (Regan et al., 1996, J. Biol. Chem. 271, pp.3982-3987). Однако предполагаемым основным фактором инактивации является диссоциация домена А2 от доменов A1 и А3-С1-С2 (Fay et al., 1991, J. Biol. Chem. 266, pp.8957-8962).
Одним из методов, который, как было продемонстрировано, увеличивает in vivo период полувыведения протеина, является ПЭГ-илирование. ПЭГ-илирование представляет собой ковалентное присоединение длинноцепочечных молекул полиэтиленгликоля (ПЭГ) к протеину или другой молекуле. ПЭГ может иметь линейную форму или разветвленную форму, чтобы получить различные молекулы с различными свойствами. Помимо увеличения периода полувыведения пептидов или протеинов ПЭГ-илирование используется для уменьшения образования антител, защиты протеина от протеазного расщепления и сохранения материала вне почечного фильтрата (Hams et al., 2001, Clinical Pharmacokinetics 40, pp.539-51). Кроме того, ПЭГ-илирование может также увеличивать общую стабильность и растворимость протеина. Наконец, поддерживаемая концентрация ПЭГ-илированных протеинов в плазме может уменьшать степень побочных эффектов посредством уменьшения провалов в пиковых уровнях лекарственного средства, снимая, таким образом, необходимость введения сверхфизиологических уровней протеина на ранних временных отрезках.
С различной степенью успеха опробовались случайные модификации FVIII, полученные путем направленного воздействия первичных аминов (N-концевой и лизины) крупными полимерами, такими как ПЭГ и декстран (WO 94/15625, патент US 4970300, патент US 6048720). Наиболее яркое улучшение, опубликованное в патентной заявке в 1994 г. (WO 94/15625), показало 4-кратное увеличение периода полувыведения, однако за счет 2-кратной потери активности после реакции FVIII полной длины с 50-кратным избытком ПЭГ. В WO 2004/075923 раскрываются конъюгаты FVIII и полиэтиленгликоля, которые образуются через случайные модификации. В прошлом случайно ПЭГ-илированные протеины, такие как интерферон-альфа (Kozlowski et al., 2001, BioDrugs 15, pp.419-429), одобрялись в качестве терапевтических средств.
Однако этот подход, основанный на случайных модификациях, является более проблематичным относительно гетеродимерного FVIII. FVIII имеет сотни потенциальных сайтов ПЭГ-илирования, включая 158 лизинов, два N-конца и множество гистидинов, серинов, треонинов и тирозинов, каждый из которых потенциально мог бы быть ПЭГ-илированным реагентами, первоначально нацеленными на первичные амины. Например, было показано, что главным позиционным изомером для ПЭГ-илированного интерферона Альфа-2b является гистидин (Wang et al., 2000, Biochemistry 39, pp.10634-10640). Кроме того, результатом гетерогенной обработки полноразмерного FVIII может являться смесь исходного материала, которая в дальнейшем делает ПЭГ-илированные продукты более сложными. Дополнительным недостатком неконтролирования сайта ПЭГ-илирования на FVIII является потенциальное снижение активности, в тех случаях когда ПЭГ должен был присоединиться на или вблизи основных активных сайтов, особенно в тех случаях, когда более чем один ПЭГ или единичный ПЭГ крупного размера конъюгирует с FVIII. Поскольку случайное ПЭГ-илирование постоянно производит большое количество ПЭГ-илированных продуктов, очистка с целью получения именно моноПЭГ-илированных продуктов приведет к коренному снижению выхода этих продуктов. Наконец, огромная гетерогенность профиля продукта будет делать почти невозможным непрерывный синтез и исследование каждой серии. Поскольку товарное производство требует постоянного, хорошо исследованного продукта, гетерогенность продукта является барьером для коммерциализации. Ввиду всех этих причин желателен более определенный метод ПЭГ-илирования FVIII.
В недавнем обзоре (Kochendoerfer, G., Curr. Opin. Chem. Biol. 2005, доступно он-лайн с 15 окт. 2005, прямой предметный идентификатор doi: 10.1016/j.cbpa.2005.10.007) были обобщенны различные стратегии сайт-направленного ПЭГ-илирования протеинов. Один из подходов включает введение неприродной аминокислоты в протеины посредством химического синтеза или рекомбинантной экспрессии, за которыми следует добавление производного ПЭГ, который будет специфично реагировать с неприродной аминокислотой. Например, неприродная аминокислота может быть такой, которая содержит кетогруппу, которая не встречается в нативных протеинах. Однако химический синтез таких крупных протеинов, как FVIII, невозможен. Современный предел пептидного синтеза составляет около 50 остатков. Для получения больших частей полипептида можно лигировать несколько пептидов, но, чтобы получить хотя бы FVIII с делетированным В-доменом, потребовалось бы более 20 лигирований, в результате чего выход продукта составлял бы менее 1% даже при идеальных условиях реакции. Рекомбинантная экспрессия протеинов с неприродными аминокислотами ограничена, главным образом, экспрессионными системами немлекопитающих. Полагают, что данный подход является проблематичным для крупного и сложного протеина, такого как FVIII, экспрессия которого необходима в системах млекопитающих.
Другой подход к сайт-направленному ПЭГ-илированию протеинов заключается в направленном воздействии амина N-конца основной цепи ПЭГ-альдегидами. При этом процессе требуется низкий рН для достижения специфичности относительно других аминных групп, который, однако, несовместим с узким интервалом почти нейтрального рН, необходимого для стабильности FVIII (Wang et al., 2003, International J. Pharmaceutics 259, pp.1-15). Более того, N-концевое ПЭГ-илирование FVIII может не привести к улучшению периода полувыведения из плазмы, если эта область не участвует в выведении из плазмы. В действительности, N-концевая область легкой цепи FVIII вовлечена в связывание с vWF, протеином-носителем, который является основным для сохранения FVIII при кровообращении. При N-концевой модификации фактора FVIII наиболее важная связь с vWF может быть разрушена или ослаблена. Таким образом, N-концевое ПЭГ-илирование FVIII может оказать противоположный эффект уменьшения периода полувыведения FVIII из плазмы.
WO 90/12874 раскрывает сайт-специфическую модификацию человеческого IL-3, колониестимулирующего фактора гранулоцитов и эритропоэтиновых полипептидов путем введения цистеина или заменой им другой аминокислоты с последующим добавлением лиганда, который содержит сульфгидрильную реактивную группу. Лиганд избирательно присоединяется к цистеиновым остаткам. Модификация FVIII или какого-либо его варианта не раскрывается.
По причинам, сформулированным выше, существует необходимость в улучшенном варианте FVIII, который обладает большей длительностью действия in vivo и пониженной иммуногенностью, сохраняя, в то же время, функциональную активность. Кроме того, желательно, чтобы такой протеин производился как гомогенный продукт надежным способом.
Краткая сущность изобретения
Целью настоящего изобретения является обеспечение конъюгированного с биосовместимым полимером функционального полипептида FVIII, имеющего улучшенные фармакокинетические и терапевтические свойства.
Другой целью настоящего изобретения является обеспечение конъюгированного с биосовместимым полимером протеина FVIII с делетированным В-доменом, имеющего улучшенные фармакокинетические свойства.
Еще одной целью изобретения является обеспечение конъюгированного с биосовместимым полимером функционального полипептида FVIII, имеющего ослабленное связывание с протеином, родственным рецептору липопротеина низкой плотности (LRP), рецептором липопротеина низкой плотности (LDL), гепарин-сульфат протеогликанами (HSPGs) и/или ингибиторными антителами против FVIII.
Еще одной целью настоящего изобретения является обеспечение улучшенного варианта FVIII, который обладает большей длительностью действия in vivo и уменьшенной иммуногенностью и который возможно производить как гомогенный продукт надежным способом.
В одном аспекте изобретения обеспечивается конъюгат, имеющий прокоагулянтную активность фактора FVIII, включающий функциональный полипептид фактора FVIII, ковалентно соединенный на одном или более своих предварительно заданных сайтах с одним или более биосовместимыми полимерами, где предварительно заданный сайт не является N-концевым амином. Изобретение также включает способ получения этого конъюгата, предусматривающий мутирование нуклеотидной последовательности, которая кодирует функциональный полипептид фактора FVIII, с целью замещения в предварительно заданном сайте последовательностью, кодирующей цистеиновый остаток; экспрессию мутированной нуклеотидной последовательности для получения модифицированного цистеином мутеина; очистку мутеина; реагирование мутеина с биосовместимым полимером, который активирован для реагирования с полипептидами по существу только на введенных цистеиновых остатках таким образом, чтобы образовался конъюгат; и очистку конъюгата. Изобретение также направлено на фармацевтические композиции, включающие конъюгат и фармацевтически приемлемый адъювант, и на способы лечения гемофилии путем введения терапевтически эффективных количеств этих фармацевтических композиций млекопитающему, которое нуждается в них.
Изобретение также относится к способу сайт-направленного ПЭГ-илирования мутеина фактора FVIII, включающему (а) экспрессию сайт-направленного мутеина фактора FVIII, где мутеин имеет цистеиновое замещение в аминокислотном остатке на наружной поверхности мутеина фактора FVIII и этот цистеин кэпирован; (b) контактирование цистеинового мутеина с восстановителем при условиях, в которых цистеиновый мутеин мягко восстанавливается и отделяется кэп; (с) удаление кэпа и восстановителя из цистеинового мутеина; и (d) обработку, по крайней мере, спустя около 5 минут после удаления восстановителя, цистеинового мутеина с помощью ПЭГ, содержащего сульфгидрильный связывающий фрагмент при условиях, в которых образуется ПЭГ-илированный мутеин фактора FVIII.
Краткое описание фигур чертежей
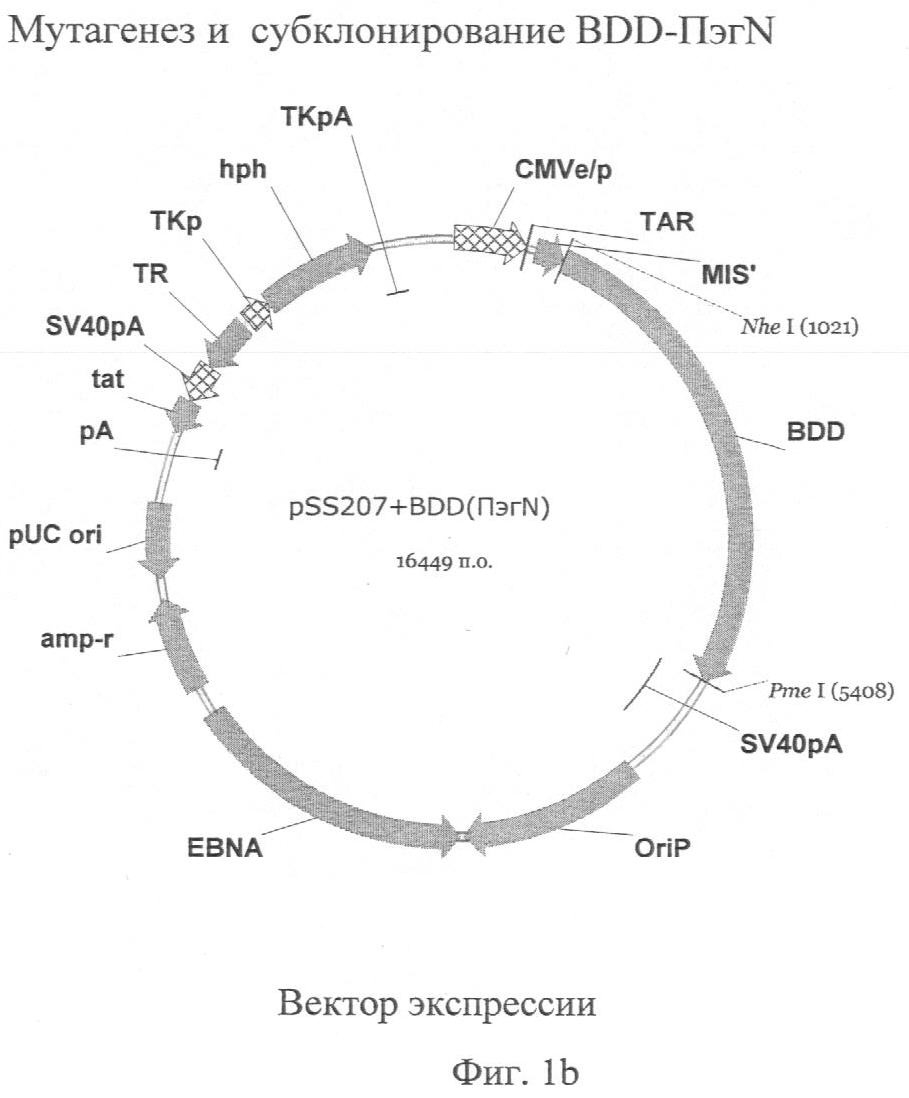
Фиг.1. Карты векторов и стратегия мутагенеза для ПЭГ-мутеинов.
Фиг.2. Профиль поглощения УФ при 280 нм относительно времени для ПЭГ-2-протеина, очищенного через хроматографическую колонку с моноклональными антителами к FVIII. Хроматография выполнялась с использованием хроматографической системы АКТА® Explorer 100 от Amersham Bioscience.
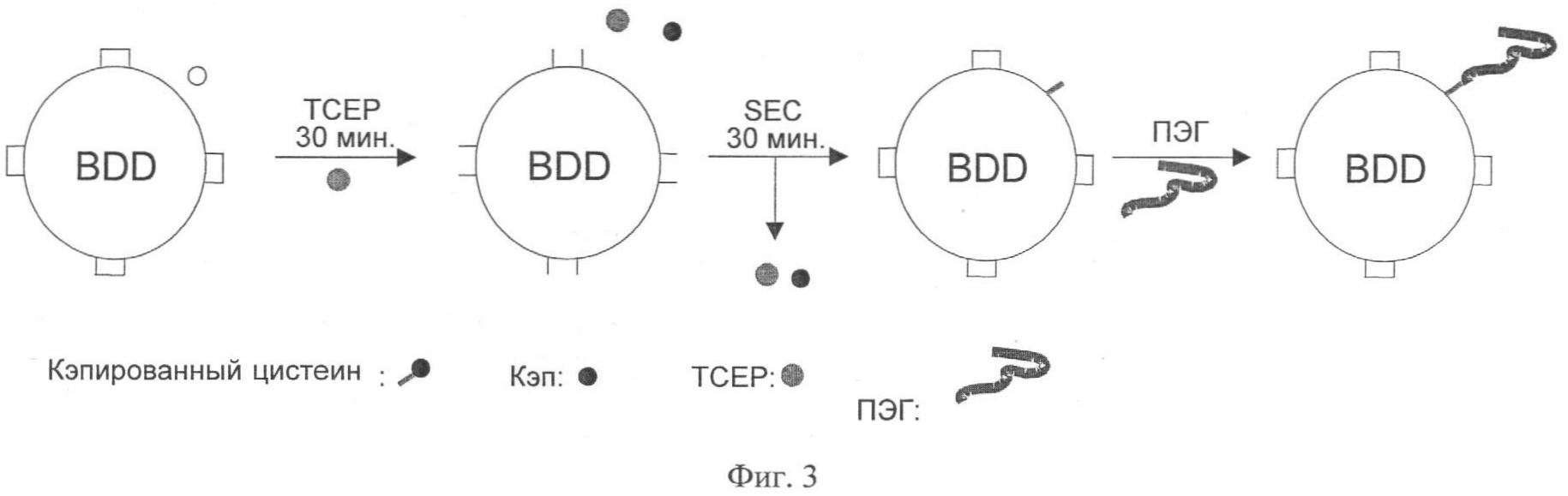
Фиг.3. Трехстадийный способ сайт-направленного ПЭГ-илирования. ПЭГ представляет собой цистеин-реактивный ПЭГ, такой как ПЭГ-малеимид. Замкнутые полоски показывают дисульфидные образования, а незамкнутые - восстановленные цистеины.
Фиг.4. Сайт-направленное ПЭГ-илирование ПЭГ2.
Фиг.5. Сайт-направленное ПЭГ-илирование ПЭГ6.
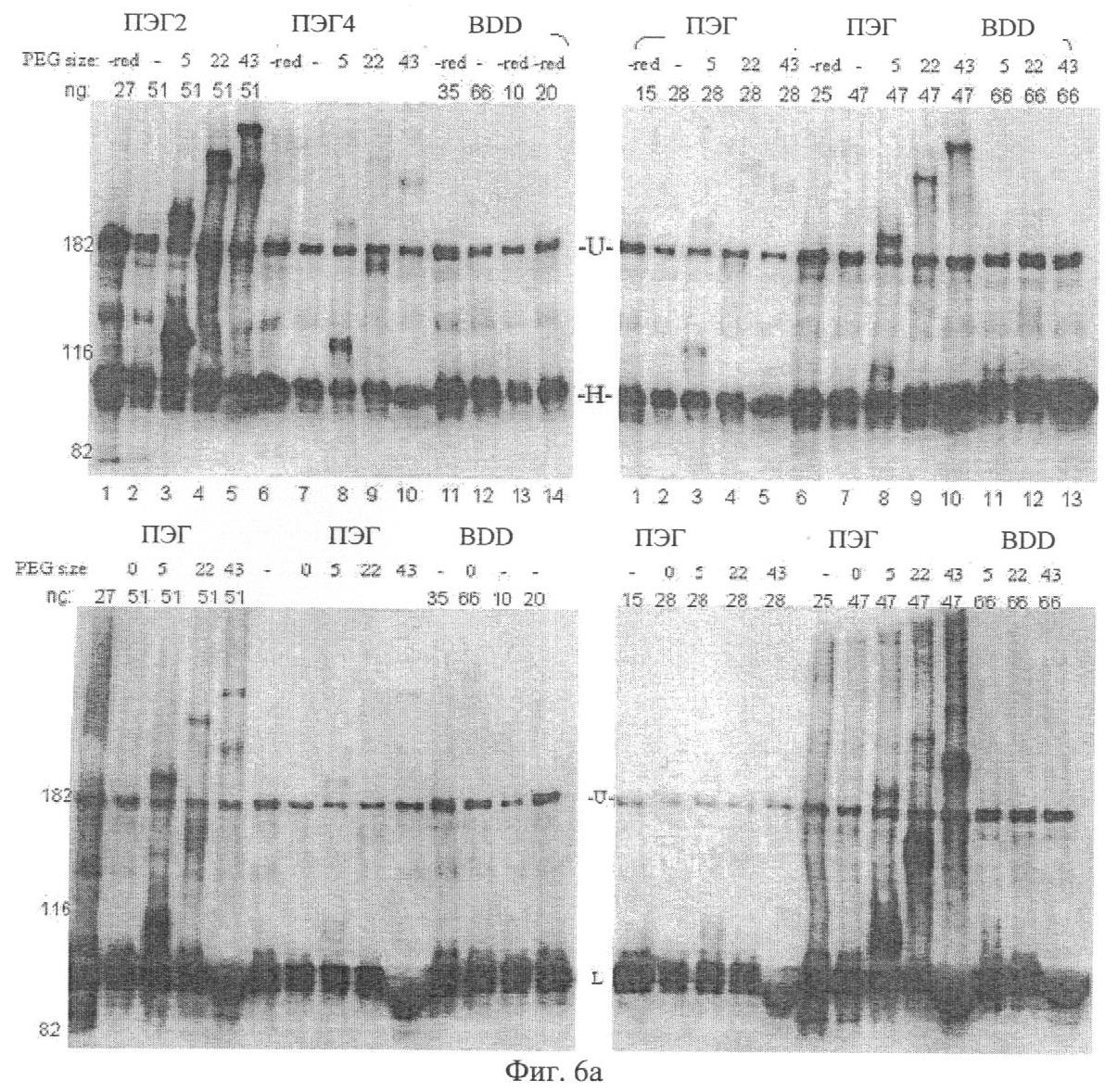
Фиг.6а. Сайт-направленное ПЭГ-илирование BDD, ПЭГ2, 4, 5 и 6. Верхние панели были окрашены антителом к тяжелой (Н) цепи, а нижние панели - антителом к легкой (L) цепи. «U» - необработанный материал, содержащий как Н, так и L.
Фиг.6b. ПЭГ-илирование ПЭГ15 и ПЭГ7 с ПЭГ2 и ПЭГ6 в качестве контроля. Сначала очищенные ПЭГ-мутеины (S) восстанавливали с помощью трис(2-карбоксиэтил)фосфин (ТСЕР) и после удаления восстановителя («R») ПЭГ-илировали с помощью ПЭГ 12 кДа («12») или 22 кДа («22»). Образцы наносили на 6%-ный Трис-глицин SDS PAGE и окрашивали антителом к тяжелой цепи (НС) на левой панели или антителом к легкой цепи (LC) на правой панели. «U» - необработанный материал, содержащий как НС, так и LC. ПЭГ-илированные полоски подцвечены точками.
Фиг.6с. ПЭГ-илирование ПЭГ2+6 с ПЭГ2 и ПЭГ6 в качестве контроля. ПЭГ2, ПЭГ6 или ПЭГ2+6 восстанавливали с помощью ТСЕР и после удаления восстановителя («R») ПЭГ-илировали с помощью ПЭГ 5 кДа («5») или 43 кДа («43»), ПЭГ2+6 также ПЭГ-илировали с использованием ПЭГ 12, 22 и 33 кДа. Образцы наносили на 6%-ный Трис-глицин SDS PAGE и окрашивали кумасси для протеинов слева или антителом к тяжелой цепи (Н) или легкой цепи (L). «U» - необработанный материал, содержащий как Н, так и L. ПЭГ-илированные полоски подцвечены точками.
Фиг.6d. ПЭГ-илирование FVIII дикого типа полной длины (KG-2) с ПЭГ2 в качестве контроля. Левый гель окрашивали кумасси для протеинов, а правый гель - йодом для ПЭГ. «BDD U» - необработанный BDD-материал, содержащий как Н, так и L. ПЭГ-илированные полоски подцвечены точками.
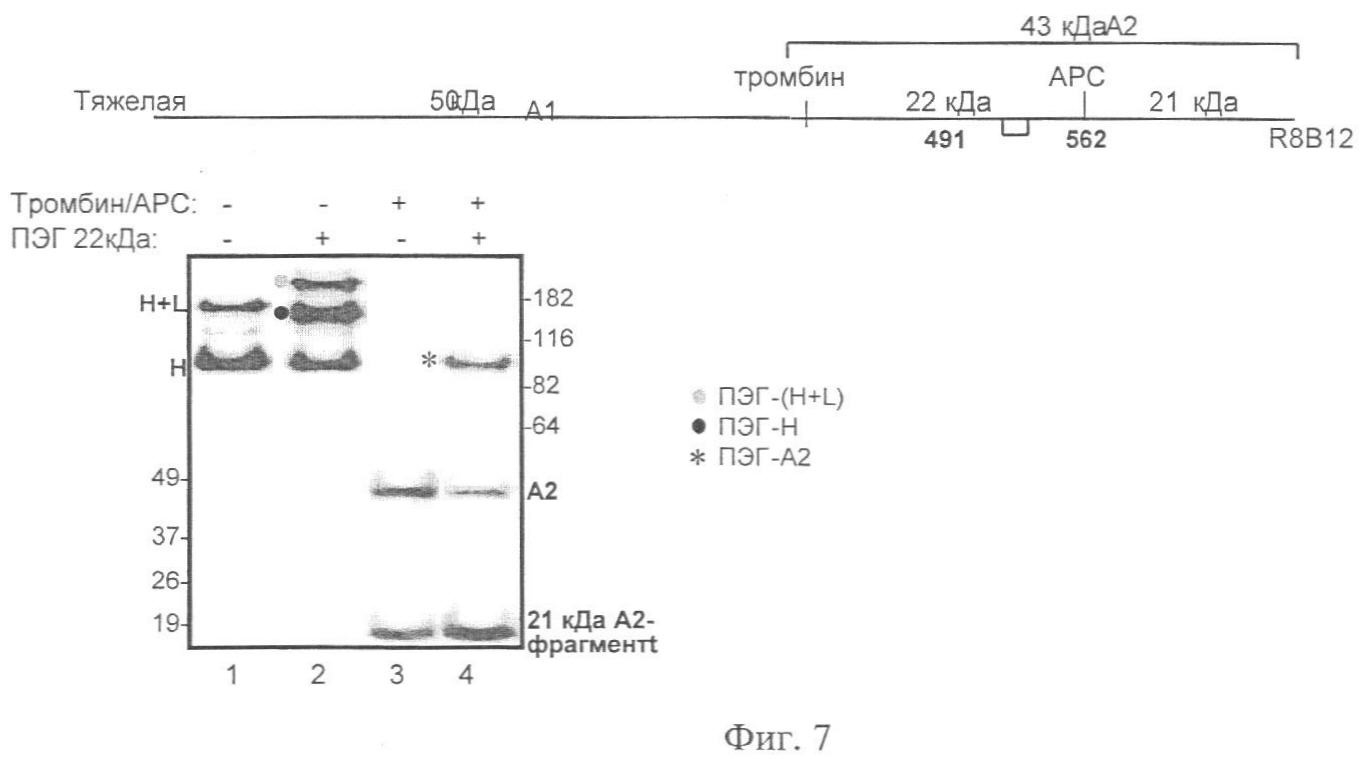
Фиг.7. Расщепление тромбином ПЭГ-илированного ПЭГ2. N-концевая половина домена А2 окрашена в голубой цвет, а С-концевая половина - в зеленый, эпитоп антитела R8B12 подцвечен темно-зеленым (правый образец FVIII). ПЭГ2 (дорожка 1) и 22 кДа-ПЭГ-илированный ПЭГ2 (дорожка 2) обрабатывали тромбином (дорожки 3 и 4 соответственно) и затем наносили на 7%-ный Трис-ацетатный гель (Invitrogen) и окрашивали антителом R8B12. Каждая дорожка содержит 50 нг FVIII.
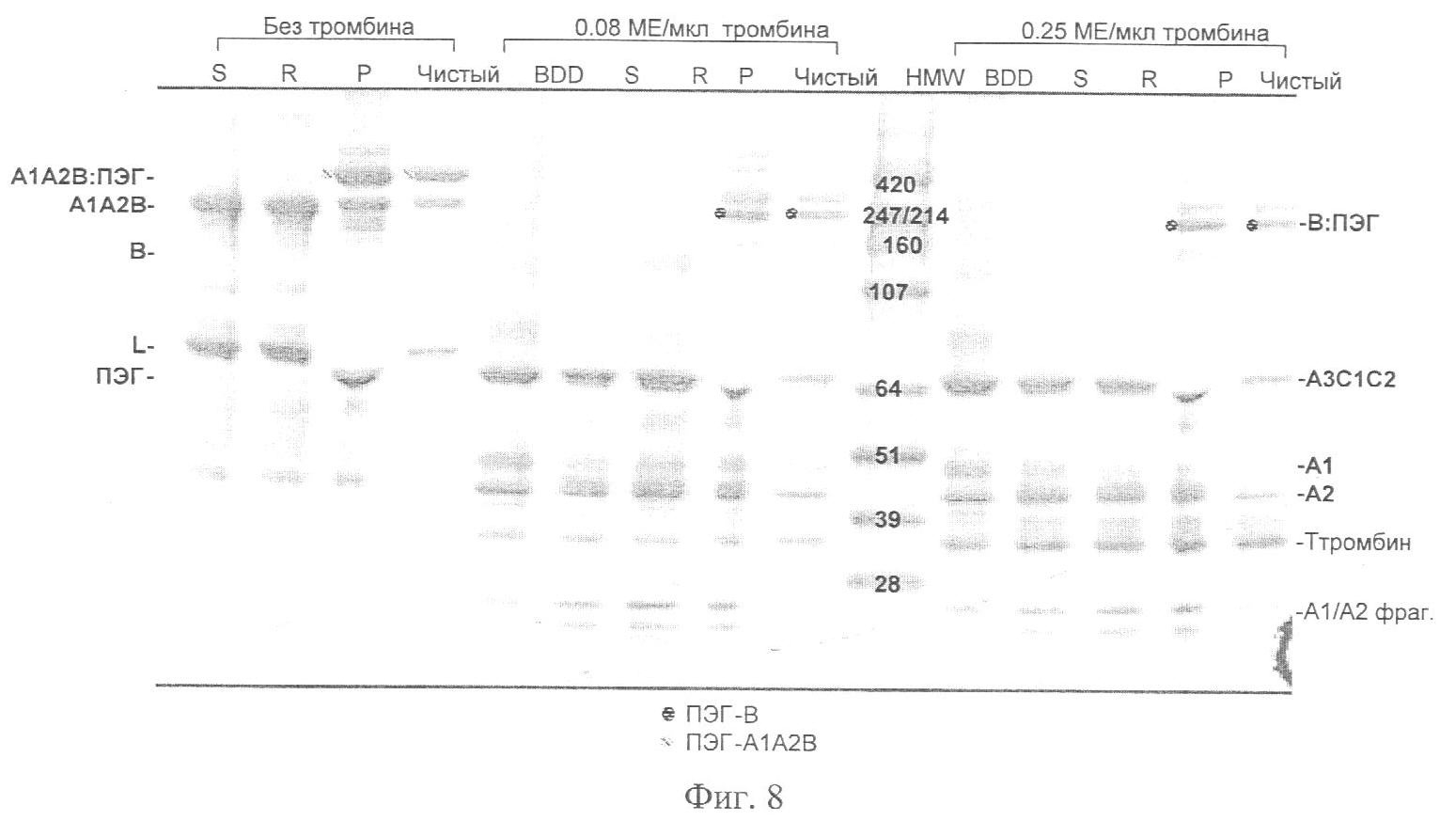
Фиг.8. Расщепление тромбином ПЭГ-илированного FVIII дикого типа полной длины (KG-2). «S» = исходный материал KG-2. «R» = восстановленный KG-2, восстановитель удален. «Р» = «R», ПЭГ-илированный ПЭГ 43 кДа. «Чистый» = «Р», очищенный от избытка ПЭГ. «L» = легкая цепь. ПЭГ-илированные полоски подцвечены точками.
Фиг.9. Окрашивание йодом ПЭГ-илированного ПЭГ2. 22- или 43 кДа-ПЭГ-илированный ПЭГ2 наносили на 6%-ный Трис-глициновый гель и окрашивали антителом R8B12 к FVIII (дорожки 1 и 2) или йодом (дорожки 3 и 4). Два пятна были выровнены в соответствии с их маркерными дорожками молекулярного веса. Дорожки 1 и 2 содержат около 30 нг FVIII, в то время как дорожки 3 и 4 содержат около 2 мкг.
Фиг.10. MALDI-масс-спектрометрический анализ ПЭГ-илированного и неПЭГ-илированного ПЭГ2. MALDI-масс-спектрометрия выполнялась на ПЭГ2 (Фиг.10а) или на 22 кДа-ПЭГ-илированном ПЭГ2 (Фиг.10b). После ПЭГ-илирования пик тяжелой (Н) цепи ПЭГ2 значительно уменьшается и появляется новый пик (Н+ПЭГ) с центром на 111 кДа (ПЭГ 22 кДа + тяжелая цепь 89 кДа). Ожидавшегося пика ПЭГ-илированной легкой (L) цепи с центром на 100 кДа (ПЭГ 22 кДа + легкая цепь 83 кДа) не обнаруживается.
Фиг.11. MALDI-масс-спектрометрия ПЭГ-илированного и неПЭГ-илированного ПЭГ2 после расщепления тромбином.
Фиг.12. MALDI-масс-спектрометрический анализ ПЭГ-илированного ПЭГ6 до и после расщепления тромбином.
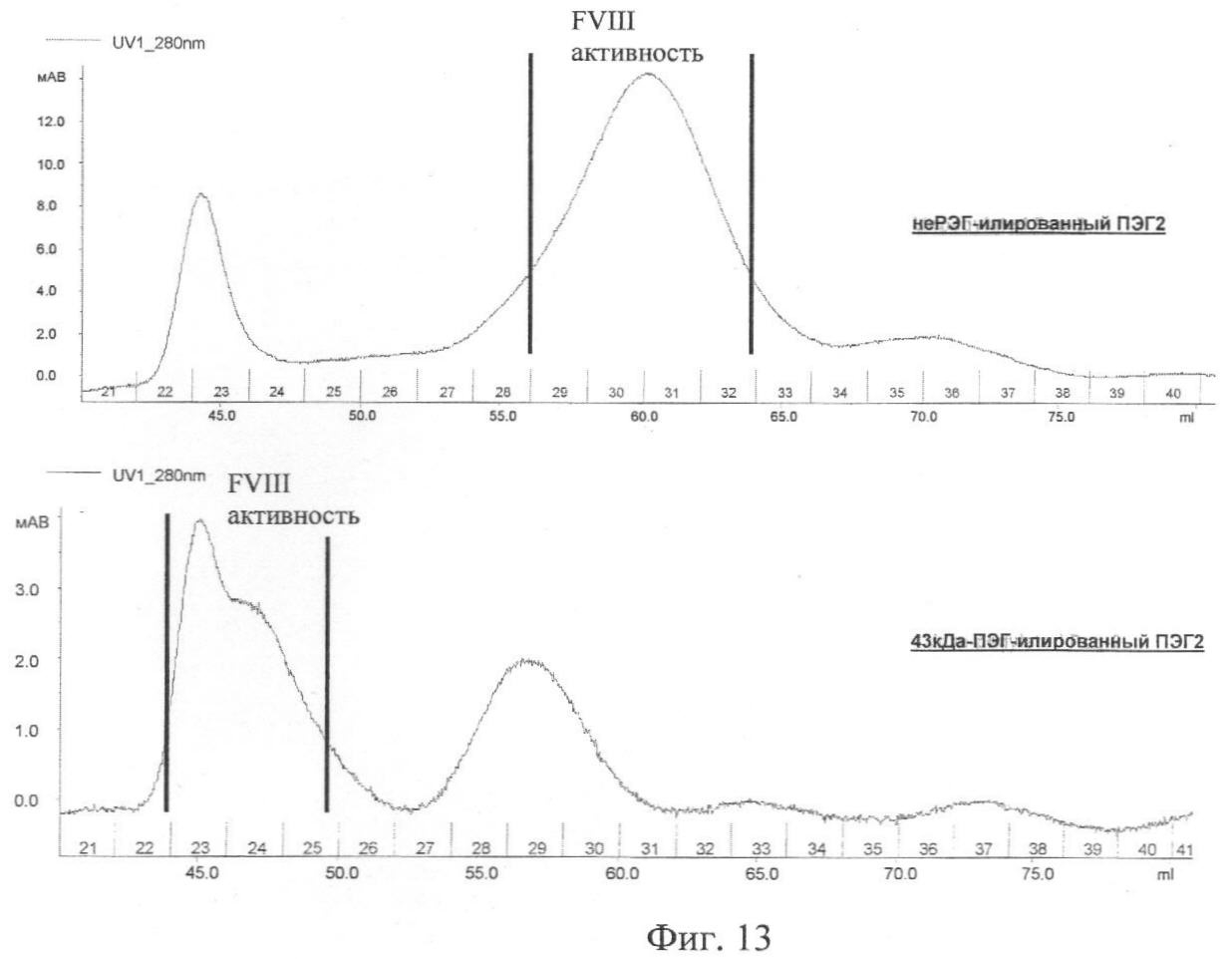
Фиг.13. Профиль поглощения УФ на 280 нм ПЭГ-илированного ПЭГ2, очищенного на колонке, используемой при гель-хроматографии.
Фиг.14. Профиль поглощения УФ на 280 нм ПЭГ-илированного и неПЭГ-илированного ПЭГ6, очищенного на катион-обменной колонке.
Фиг.15. Профиль поглощения УФ на 280 нм ПЭГ-илированного и неПЭГ-илированного ПЭГ6, на колонке, используемой в гель-хроматографии.
Фиг.16. Сравнение активности ПЭГ-илированного протеина с активностью неПЭГ-илированного протеина, измеренной хромогенным анализом и коагуляционным анализом. Очищенный FVIII полной длины представлен как KG-2. Полученный процент активности определялся делением величины образца, обработанного ПЭГ после восстановления и удаления восстановителя, на величину образца, обработанного буферным контролем, принимая во внимание результат ПЭГ-илирования.
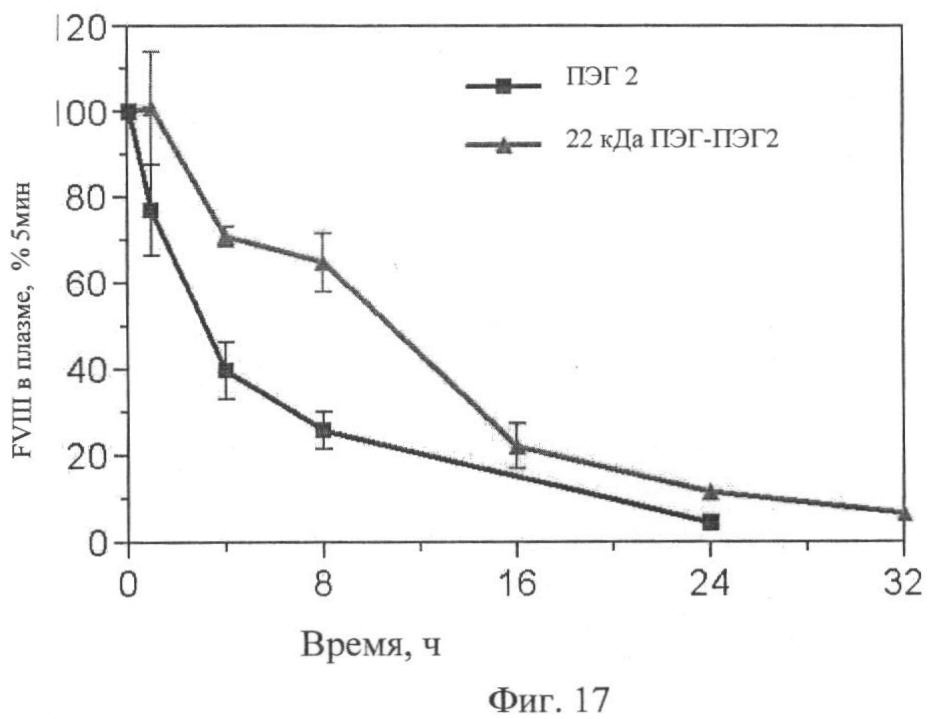
Фиг.17. Фармакокинетическое (РК) исследование кролика относительно ПЭГ-илированного ПЭГ2 в сравнении с ПЭГ2.
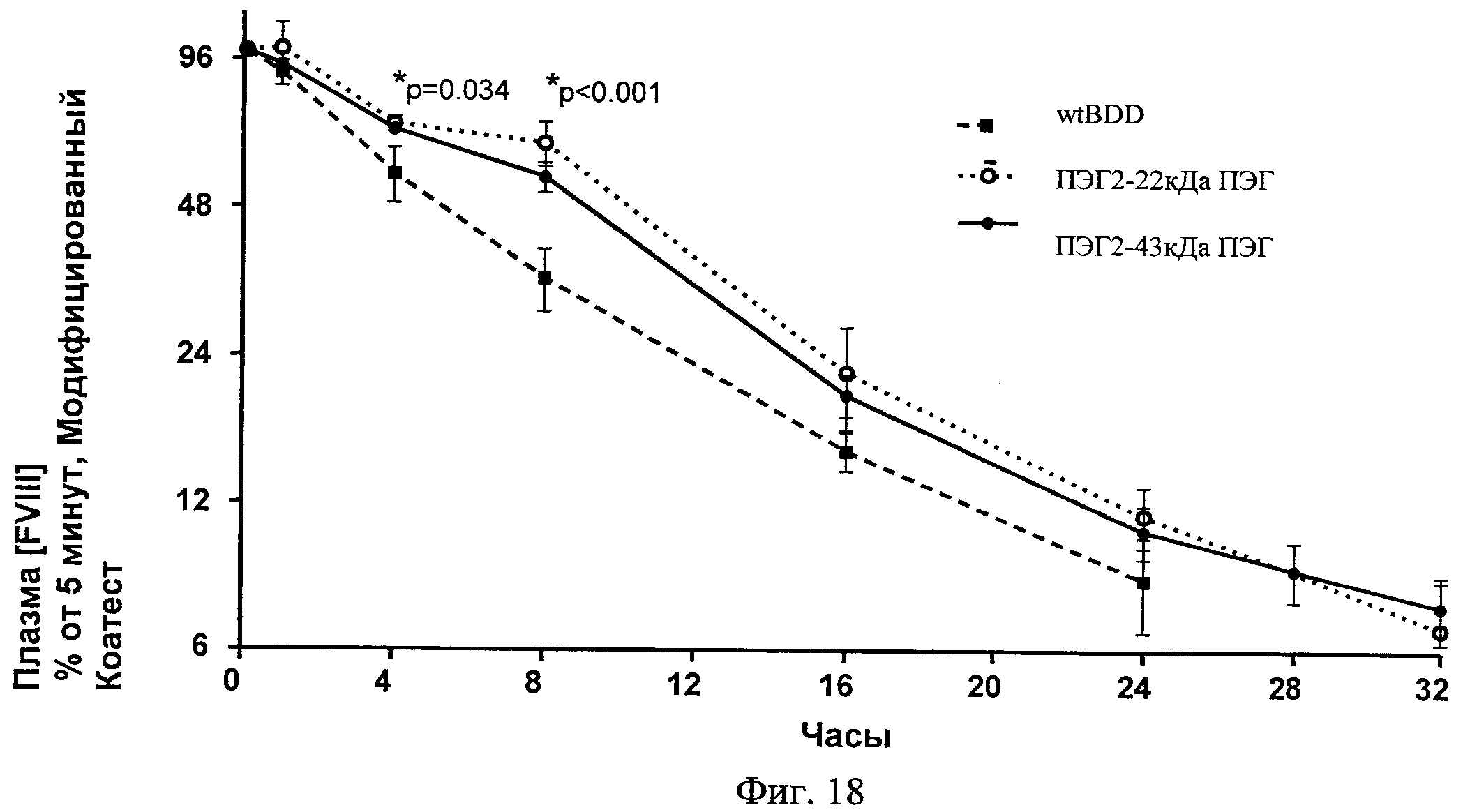
Фиг.18. РК-исследование кролика относительно ПЭГ-илированного ПЭГ2 в сравнении с BDD и ПЭГ2. Р-значения являются сравнениями между ПЭГ-илированным ПЭГ2 и BDD.
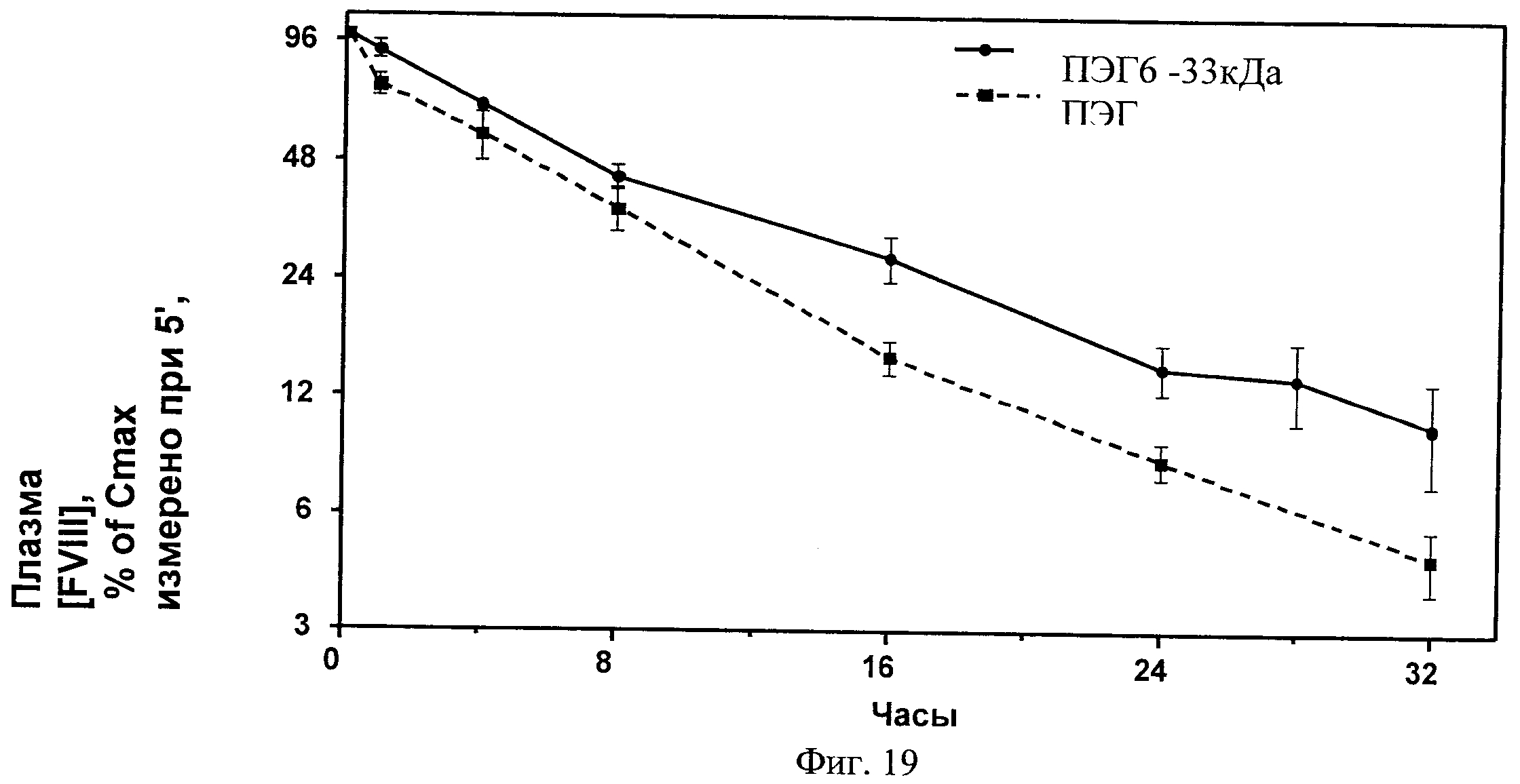
Фиг.19. РК-исследование кролика относительно ПЭГ-илированного ПЭГ6 в сравнении с BDD и ПЭГ6.
Фиг.20. РК-исследование кролика относительно ПЭГ-илированного FVIII дикого типа полной длины («fl») в сравнении с немодифицированнным FVIII fl.
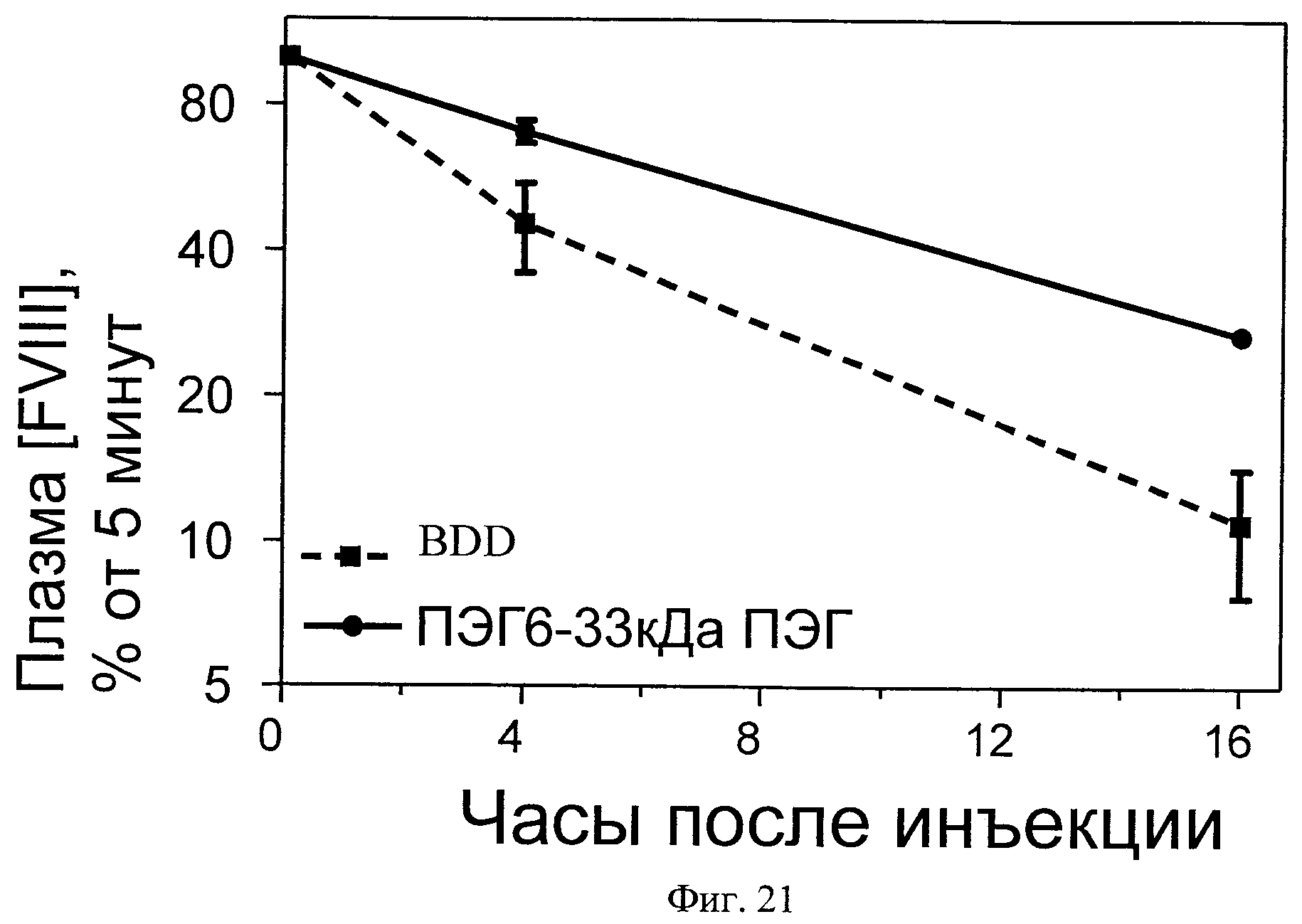
Фиг.21. РК-исследование гемофильной мыши относительно ПЭГ-илированного ПЭГ6 в сравнении с BDD и ПЭГ6.
Фиг.22. РК-исследование нормальной мыши относительно 22- и 43 кДа-ПЭГ-илированного ПЭГ2 в сравнении с BDD.
Фиг.23. РК-исследование 22 нормальной мыши относительно ПЭГ-илированного ПЭГ2 размером 22 кДа в сравнении с BDD в течение всего времени.
Фиг.24. Гистограмма сбора Гемофильного Мышиного (BDD) Фактора VIII, показывающая фармакокинетическую оценку периода полувыведения BDD-Фактора VIII у двух видов в анализе гемофильной мыши.
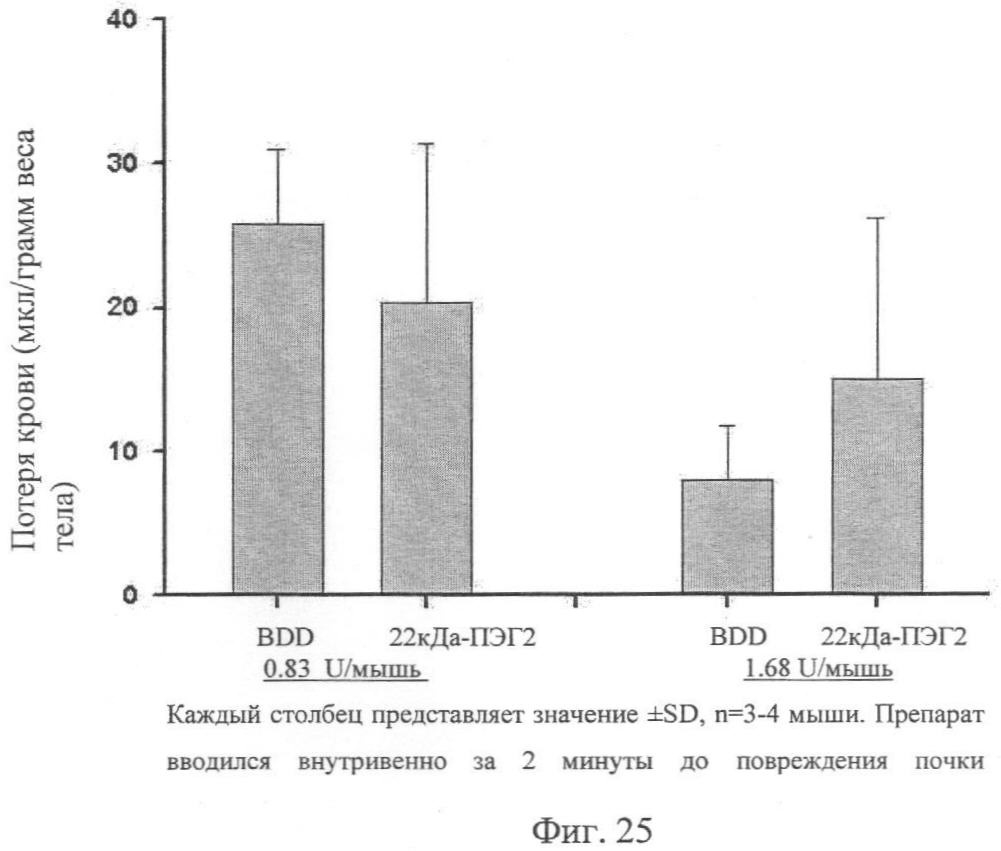
Фиг.25. Исследование разрыва почки гемофильной мыши относительно ПЭГ-илированного ПЭГ2 размером 22 кДа в сравнении с BDD. В результате обработки носителем мыши имели потерю крови 25 мкл/грамм веса тела.
Фиг.26. Хромогенная активность ПЭГ-илированного ПЭГ2 и BDD в присутствии увеличивающихся количеств антител к FVIII. Эпитоп антитела указан в скобках.
Фиг.27. Хромогенная активность ПЭГ-илированного ПЭГ2 в присутствии увеличивающихся количеств антител mAB 413 к FVIII.
Фиг.28. Хромогенная активность BDD, 43 кДа-ПЭГ-илированного ПЭГ2, 33 кДа-ПЭГ-илированного ПЭГ6 и 33 кДа-диПЭГ-илированного ПЭГ2+6 в присутствии плазмы человека, происходящей от пациентов, у которых выработались ингибиторы к FVIII. Ингибиторный титр и данные о собранной крови отмечены сверху. Две верхние панели включают данные плазмы, собранной у пациентов, разведенной в 5-405 раз. Нижняя левая панель отображает разведение 1:15 для пациентов с плазмой HRF-828. Нижняя правая панель подтверждает, что 0,064 МЕ/мл, использованные для каждого образца FVIII на двух верхних панелях, не являются дозой насыщения.
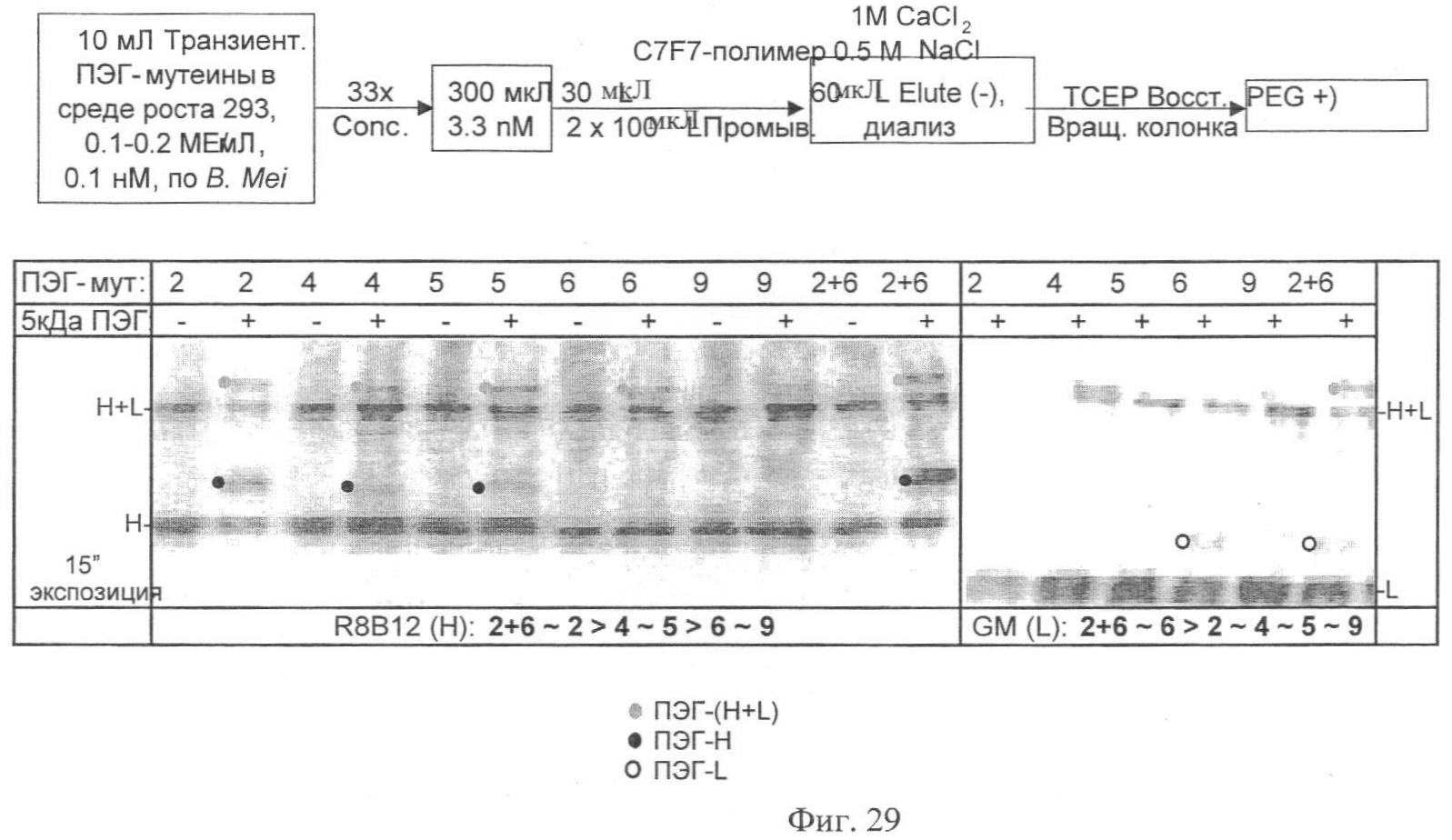
Фиг.29. Метод скрининга и подтверждение ПЭГ-илирования. Верхняя панель показывает схематический скрининг ПЭГ-илирования транзиентно экспрессируемых ПЭГ-мутеинов. Нижняя панель показывает Вестерн-анализ ПЭГ-илированных продуктов с использованием специфичного антитела к тяжелой («Н») цепи (слева) или специфичного антитела к легкой («L») цепи (справа). ПЭГ-илированные полосы подцвечены точками. «U» - необработанный материал, содержащий как Н, так и L.
Фиг.30. Скрининг ПЭГ-илирования ПЭГ15-17. Вестерн-анализ ПЭГ-илированных продуктов с использованием специфичных антител к тяжелой («Н») цепи (R8B12 и 58.12) или специфичных антител к легкой («L») цепи антител (C7F7 и GM). Все три мутеина отобраны по тяжелой цепи, с относительной эффективностью ПЭГ-илирования ПЭГ15~ПЭП6>ПЭГ17. ПЭГ-илированные полосы подцвечены точками. «U» - необработанный материал, содержащий как Н, так и L.
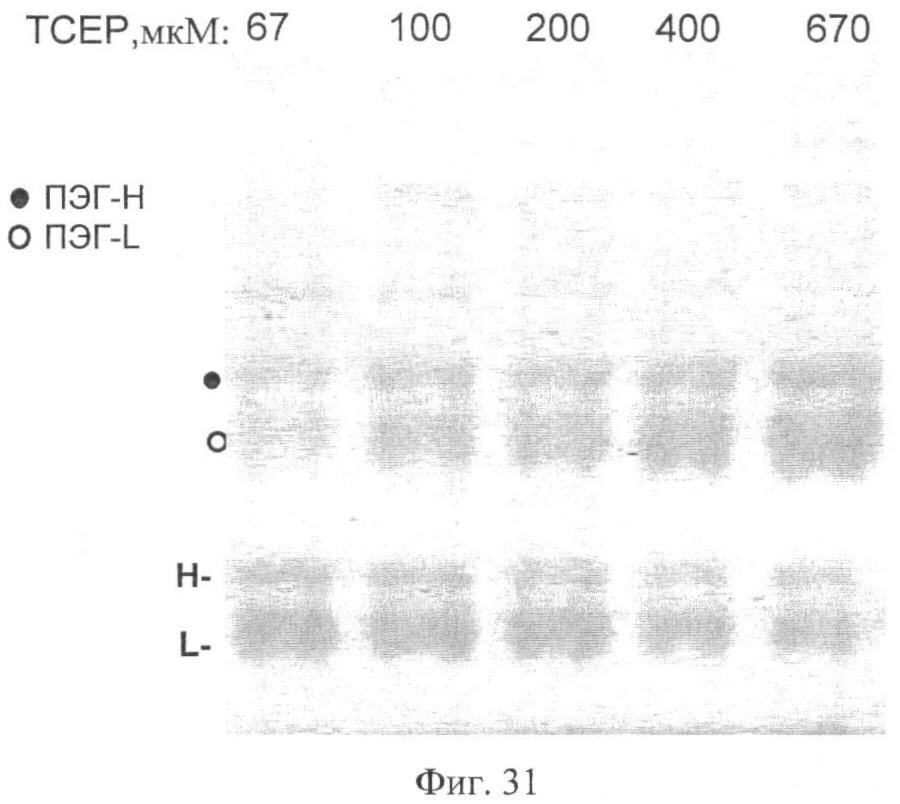
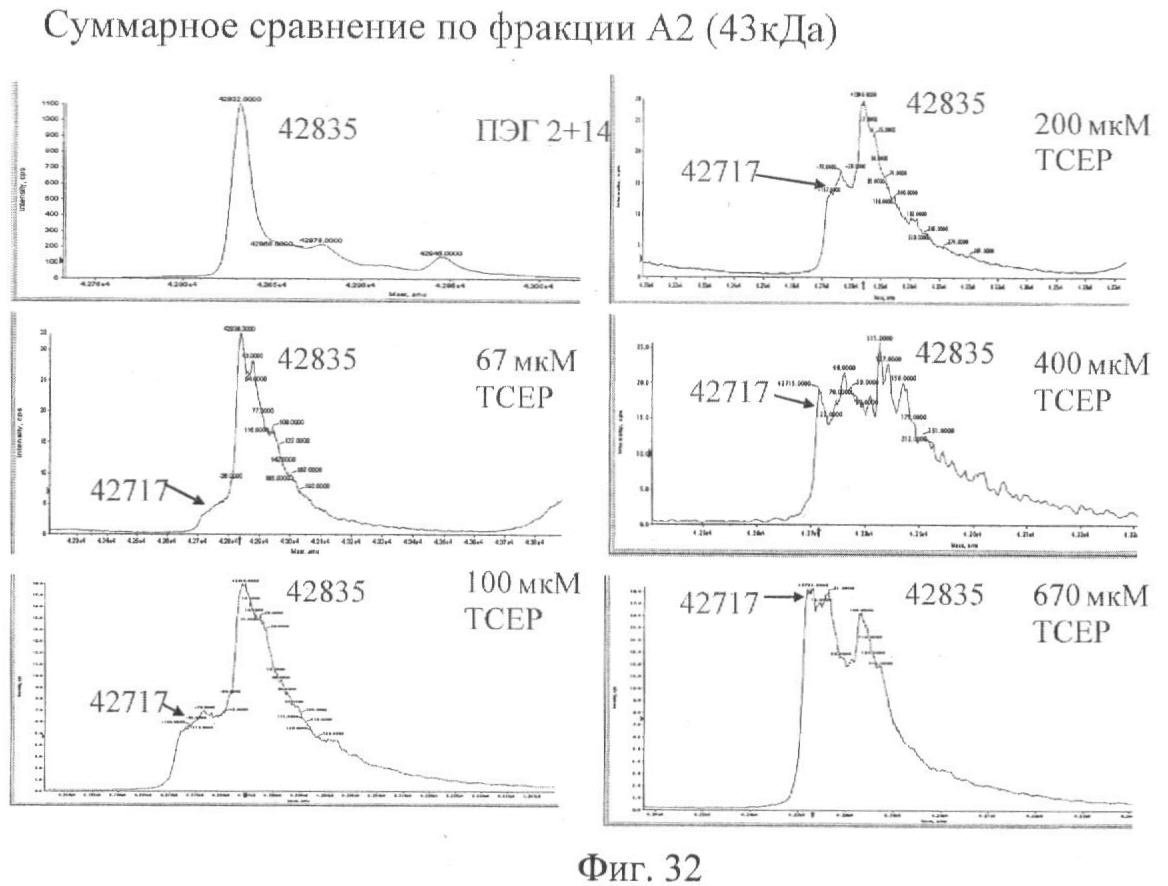
Фиг.31. Гель, показывающий ПЭГ-илирование ПЭГ2+14 как функцию концентрации восстановителя. ПЭГ2+14 обрабатывали 67-670 мкМ ТСЕР в течение 30 мин при 4°С. Восстановитель удаляли вращающейся колонкой, после чего следовало ПЭГ-илирование с помощью ПЭГ 12 кДа. Тяжелая и легкая цепи FVIII подцвечены «Н» и «L» соответственно. Две точки указывают на тяжелую и легкую ПЭГ-илированные цепи.
Фиг.32. Развернутые масс-спектры ПЭГ2+14, обработанного 67-670 мкМ ТСЕР с удаленным затем восстановителем.
Подробное описание изобретения
Настоящее изобретение основано на открытии, что полипептиды, имеющие активность FVIII, могут быть ковалентно соединены на предварительно заданном сайте, который не является N-концевым амином, с биосовместимым полимером и что такие полипептиды в значительной мере сохраняют свою коагуляционную активность. Кроме того, эти полипептидные конъюгаты имеют улучшенное время циркуляции в крови и пониженную антигенность. Конъюгаты согласно изобретению обладают преимуществом над конъюгатами, известными из уровня техники, которые имеют случайные присоединения полимера к FVIII или имеют присоединения к N-концу. Сайт-направленное присоединение позволяет конструировать модификации, которые не затрагивают области, необходимые для биологической активности и, тем самым, существенно сохраняют активность FVIII. Оно также позволяет осуществить присоединение полимеров к блоку связывания на сайтах, вовлеченных в выведение FVIII. Сайт-направленное присоединение также позволяет получить более однородный продукт, нежели гетерогенные конъюгаты, получаемые в уровне техники путем случайного присоединения полимеров. За счет того что присоединение к N-концевому амину не осуществляется, конъюгаты согласно настоящему изобретению не теряют активности при присоединении лиганда на активном сайте полипептида FVIII. Предполагается, что N-концевая область легкой цепи участвует в связывании фактора vWF с FVIII, которое является стабилизирующим связыванием в кровотоке.
Определения
Биосовместимый полимер. Биосовместимый полимер включает полиалкилен оксиды, в частности, как полиэтиленгликоль (ПЭГ), декстраны, коломиниковые кислоты или другие полимеры, основанные на углеводородах, полимеры аминокислот, производные биотина, поливиниловый спирт (PVA), поликарбоксилаты, поливинилпирролидон, сополимер этилена с ангидридом малеиновой кислоты, сополимер стирола с ангидридом малеиновой кислоты, полиоксазолин, полиакрилатморфолин, гепарин, альбумин, целлюлозы, гидролизаты хитозана, крахмалы, такие как гидроксиэтил-крахмалы и гидроксипропил-крахмалы, гликоген, агарозы и их производные, гуаровая камедь, пуллулан, инулин, ксантановая камедь, каррагенан, пектин, гидролизаты альгиновой кислоты, другие биополимеры и любые их эквиваленты. Предпочтительным является полиэтиленгликоль, и еще более предпочтительным является метоксиполиэтиленгликоль (mPEG). Другими полезными полиалкиленгликолевыми соединениями являются полипропиленгликоли (PPG), полибутиленгликоли (PBG), ПЭГ-глицидил эфиры (EpoxPEG), ПЭГ-оксикарбонилимидазол (CDI-PEG), разветвленные полиэтиленгликоли, линейные полиэтиленгликоли, вильчатые полиэтиленгликоли и многолучевые или «сверхразветвленные» полиэтиленгликоли (star-PEG).
Полиэтиленгликоль (ПЭГ). «ПЭГ» и «полиэтиленгликоль» используются здесь взаимозаменяемо и включают любой водорастворимый поли(этиленоксид). В типичном случае, ПЭГи для использования в соответствии с изобретением включают следующие структуры: «--(OCH2CH2)n--», где (n) - от 2 до 4000. Используемый здесь ПЭГ также включает «--CH2CH2-O(СН2СН2О)n--СН2СН2--» и «--(ОСН2СН2)nO--», в зависимости от того, замещены или не замещены терминальные кислороды. По всему описанию и пунктам притязаний следует помнить, что термин «ПЭГ» включает структуры, имеющие различные терминальные и «концевые кэпирующие» группы, такие, без ограничения, как гидроксильная или C1-20-алкокси группа. Термин «ПЭГ» также означает полимер, который содержит большинство, то есть более 50%, повторяющихся субъединиц --OCH2CH2--. Что касается специфических форм, ПЭГ может иметь любое число разновидностей молекулярных весов, а также структур или геометрий, таких как разветвленная, линейная, вильчатая и многофункциональная.
ПЭГ-илирование. ПЭГ-илирование - это процесс, посредством которого полиэтиленгликоль (ПЭГ) ковалентно присоединяется к молекуле, такой как протеин.
Активированная или активная функциональная группа. Когда функциональная группа, такая как биосовместимый полимер, обозначается как активированная, функциональная группа легко реагирует с электрофилом или нуклеофилом на другой молекуле.
FVIII с делетированным В-доменом (BDD). Термин BDD, используемый здесь, характеризуется наличием аминокислотной последовательности, в которой имеется делеция всех, кроме 14-ти, аминокислот В-домена FVIII. Первые 4 аминокислоты В-домена ((SFSQ, SEQ ID NO:1) связаны с 10 последними остатками В-домена (NPPVLKRHQR, SEQ ID NO:2). (Lind, P. et al., 1995, Eur. J. Biochem. 232, pp.19-27). Используемый здесь BDD имеет аминокислотную последовательность SEQ ID NO:3.
FVIII. Фактор VIII (FVIII) свертывания крови представляет собой гликопротеин, синтезируемый и выделяемый в кровоток печенью. При циркуляции крови он связывается с фактором фон Виллебранда (vWF, также известным как родственный Фактору VIII антиген) с образованием устойчивого комплекса. После активации тромбином он диссоциирует от комплекса и взаимодействует с другими факторами свертывания крови в коагуляционном каскаде, который в итоге ведет к образованию тромбов. Человечий FVIII полной длины имеет аминокислотную последовательность SEQ ID NO:4, хотя возможны аллельные варианты.
Функциональный полипептид фактора VIII. Термин «функциональный полипептид фактора VIII», используемый здесь, означает функциональный полипептид или комбинацию полипептидов, которая способна, in vivo или in vitro, корректировать недостаточность фактора VIII у человека, характеризующуюся, например, гемофилией А. В натуральном состоянии фактор VIII имеет многочисленные деградационные и процессированные формы. Как показано здесь, они происходят протеолитически из предшественника, одноцепочечного протеина. Такой одноцепочечный протеин и также различные деградационные продукты, которые имеют биологическую активность коррекции недостаточности фактора VIII у человека, будут являться функциональным полипептидом фактора VIII. Вероятно, существуют аллельные варианты. Функциональными полипептидами фактора VIII будут являться все такие аллельные вариации, гликозилированные варианты, модификации и фрагменты, приводящие к производным фактора VIII в той мере, насколько они содержат функциональный сегмент человечьего фактора VIII, и особая, характерная для человечьего фактора VIII функциональная активность остается по существу не затронутой. Эти производные фактора VIII, обладающие требуемой функциональной активностью, могут быть легко идентифицированы описанными здесь простыми in vitro-тестами. Кроме того, функциональный полипептид фактора VIII способен катализировать конверсию фактора Х в Ха в присутствии фактора IXa, кальция и фосфолипида, а также корректировать коагуляционный дефект в плазме, происходящей от пораженных гемофилией А индивидуумов. Раскрытая здесь последовательность человечьего фактора VIII, аминокислотные последовательности и их функциональные области делают очевидными для специалистов в данной области техники фрагменты, которые могут быть выделены посредством разрезания рестрикционными ферментами ДНК или протеолитической или иной деградации протеина человечьего фактора VIII.
Термин «FIX», используемый здесь, означает Коагуляционный Фактор IX, который также известен как Человечий Фактор ГХ Свертывания Крови или Тромбопластиновый Компонент Плазмы.
Теримн «FX», используемый здесь, означает Коагуляционный Фактор X, который также известен под названием Человечий Фактор Х Свертывания Крови и под эпонимом фактор Стюарта-Прауера.
Фармакокинетика. «Фармакокинетика» («РК») - это термин используется для описания свойств поглощения, распределения, метаболизма и элиминирования лекарственного средства в теле. Улучшение фармакокинетики лекарственного средства означает улучшение тех его характеристик, которые делают лекарственное средство более эффективным in vivo в качестве терапевтического агента, особенно продолжительности его полезного действия в теле.
Мутеин. Мутеин представляет собой полученный посредством генетической инженерии протеин, возникающий как результат мутации протеина или полипептида, индуцируемой в лаборатории.
Термины «протеин» и «полипептид», используемые здесь, являются синонимами.
Термин «рецептор выведения FVIII», используемый здесь, означает рецепторную область на функциональном полипептиде FVIII, которая связывается или соединяется с одной или более другими молекулами, что приводит к выведению FVIII из кровотока. Рецепторы выведения фактора VIII включают, в частности, области молекулы FVIII, которые связываются с LRP, LDL-рецептором и/или HSPG.
Обсуждение
Представляется, что любой функциональный полипептид фактора FVIII может быть мутирован в предварительно заданном сайте и затем ковалентно соединен в этом сайте с биосовместимым полимером в соответствии со способами согласно изобретению. Пригодные полипептиды являются, в частности, полноразмерным фактором FVIII с аминокислотной последовательностью, показанной в SEQ ID NO:4, и BDD FVIII, имеющим аминокислотную последовательность, показанную в SEQ ID NO:3. BDD FVIII является предпочтительным.
Биосовместимый полимер, используемый в конъюгатах согласно изобретению, может представлять собой любой из полимеров, упомянутых выше. Биосовместимый полимер выбирается для того, чтобы достичь желаемого улучшения в фармакокинетике. Например, идентичность, размер и структура полимера выбирается такой, чтобы увеличить период полувыведения полипептида, имеющего активность FVIII, из кровотока или чтобы уменьшить антигенность полипептида без нежелательного снижения его активности. Предпочтительно, полимер включает ПЭГ и еще более предпочтительно имеет, по крайней мере, 50% молекулярного веса ПЭГ. В одном варианте выполнении полимер представляет собой полиэтиленгликоль, терминально кэпированный концевым кэпирующим фрагментом, таким как гидроксил, алкокси, замещенное алкокси, алкенокси, замещенное алкенокси, алкинокси, замещенное алкинокси, арилокси и замещенное арилокси. Еще более предпочтительными являются полимеры, включающие метоксиполиэтиленгликоль. И еще более предпочтительными являются полимеры, включающие метоксиполиэтиленгликоль, имеющий размер в интервале от 3 кДа до 100 кДа, более предпочтительно - от 5 кДа до 64 кДа или от 5 кДа до 43 кДа.
Предпочтительно, полимер содержит реакционный фрагмент. Например, в одном варианте выполнения изобретения полимер содержит сульфгидрильный реакционный фрагмент, который может реагировать с цистеином функционального полипептида фактора FVIII с образованием ковалентной связи. Такие сульфгидрильные реакционные фрагменты охватывают тиол, трифлат, трезилат, азиридин, оксиран, S-пиридил или малеимидные фрагменты. Предпочтительным является малеимидный фрагмент. В одном выполнении полимер является линейным и имеет на одном конце «кэп», который является не очень сильно реактивным по отношению к сульфгидрилам (таким, как метоксисоединение), и на другом конце - сульфгидрильный реакционный фрагмент. В предпочтительном выполнении конъюгат включает ПЭГ-малеимид и имеет размер в интервале от 5 кДа до 64 кДа.
На следующих далее примерах приводятся рекомендации по отбору пригодных биосовместимых полимеров.
Сайт-направленная мутация нуклеотидной последовательности, кодирующей полипептид, имеющий активность FVIII, может быть осуществлена любым методом, известным в данной области техники. Предпочтительные методы включают мутагенез с целью введения цистеинового кодона в сайт, выбранный для ковалентного присоединения полимера. Это можно выполнить, используя коммерчески доступный набор для сайт-направленного мутагенеза, такой как набор для сайт-направленного мутагенеза Stratagene cQuickChange™ II, набор для сайт-направленного мутагенеза № K1600-1 Clontech Transformer, система для сайт-направленного мутагенеза №12397014 Invitrogen GenTaylor, набор системы для сайт-направленного мутагенеза in vitro № Q6210 Promega Altered Sites II или набор для ПЦР-мутагенеза № TAK RR016 Takara Mirus Bio LA.
Конъюгаты согласно изобретению могут быть приготовлены путем первоначального замещения кодона одной или более аминокислот на поверхности функционального полипептида FVIII кодоном цистеина с дальнейшим получением цистеинового мутеина в рекомбинантной экспрессионной системе, проведением реакции мутеина с цистеин-специфичным полимерным реагентом и очисткой мутеина.
В данном способе добавление полимера к сайту цистеина может быть выполнено за счет малеимида, функционально активного на полимере. Примеры этой технологии приводятся ниже. Количество используемого сульфгидрильного реакционного полимера должно быть, по крайней мере, эквимолярным молярному количеству цистеинов, которые должны быть произведены, а предпочтительно иметься в избытке. Предпочтительно, сульфгидрильный реакционный полимер используется, по крайней мере, в 5-кратном молярном избытке и еще более предпочтительно используется, по крайней мере, в десятикратном избытке. Другие условия, благоприятные для ковалентного присоединения, входят в объем знаний специалиста в данной области техники.
В примерах, которые следуют ниже, мутеины имеют традиционные в данной области техники названия. Полноразмерная аминокислотная последовательность зрелого фактора VIII, которая представлена в SEQ ID NO:4, является основой для придания названий мутантам. Будучи секретируемым протеином, FVIII содержит сигнальную последовательность, которая протеолитически отщепляется во время трансляционного процесса. После удаления сигнальной последовательности из 19 аминокислот первой аминокислотой секретированного FVIII-продукта является аланин.
Когда говорится о мутированных аминокислотах в BDD-FVIII, мутированные аминокислоты обозначаются в настоящем документе традиционным образом их положением в последовательности FVIII полной длины. Например, рассматриваемый ниже мутеин ПЭГ6 обозначается К1808С, поскольку в нем лизин (К) в положении, аналогичном положению 1808 в последовательности полной длины, заменен на цистеин (С).
Предварительно заданный сайт для ковалентного связывания полимера лучше всего выбирать из сайтов, расположенных на поверхности полипептида, которые не влияют на активность FVIII или другие механизмы, которые стабилизируют FVIII in vivo, такие как связывание с vWF. Кроме того, лучше выбирать такие сайты, участие которых известно в механизмах, посредством которых FVIII деактивируется или выводится из кровотока. Подробно выбор таких сайтов рассматривается ниже. Предпочтительные сайты охватывают аминокислотный остаток на или вблизи сайта связывания (а) протеина, родственного рецептору липопротеина низкой плотности, (b) гепаринсульфат протеогликана, (с) рецептора липопротеина низкой плотности и/или (d) антител, ингибирующих фактор FVIII. Выражение «на или вблизи сайта связывания» означает остаток, который находится достаточно близко к сайту связывания, так что ковалентное присоединение биосовместимого полимера к этому сайту привело бы к стерическому повреждению сайта связывания. Предполагается, что такой сайт, к примеру, находится в пределах 20 Å от сайта связывания.
В одном варианте выполнения изобретения биосовместимый полимер ковалентно присоединен к функциональному полипептиду фактора VIII на аминокислотном остатке в или вблизи (а) рецептора выведения фактора VIII, как определено выше, (b) сайта связывания протеазы, способной деградировать фактор VIII, и/или (с) сайта связывания ингибиторных антител к фактору VIII. Протеазы могут быть активированы протеином С (АРС). В другом варианте выполнения изобретения биосовместимый полимер ковалентно присоединен к функциональному полипептиду фактора VIII в предварительно заданном сайте, так что связывание протеина, родственного рецептору липопротеина низкой плотности, с полипептидом является более слабым, чем с тем же полипептидом, когда он неконъюгирован, и предпочтительно слабее более чем в два раза. В одном варианте выполнения изобретения биосовместимый полимер ковалентно присоединен к функциональному полипептиду фактора VIII в предварительно заданном сайте, так что связывание гепаринсульфат протеогликанов с полипептидом является более слабым, чем с тем же полипептидом, когда он неконъюгирован, и предпочтительно слабее более чем в два раза. В следующем варианте выполнения изобретения биосовместимый полимер ковалентно присоединен к функциональному полипептиду фактора VIII в предварительно заданном сайте, так что связывание ингибиторных антител к фактору VIII с полипептидом является более слабым, чем с тем же полипептидом, когда он неконъюгирован, предпочтительно слабее более чем в два раза, чем связывание с этим полипептидом, когда он неконъюгирован. В другом выполнении биосовместимый полимер ковалентно присоединен к функциональному полипептиду фактора VIII в предварительно заданном сайте, так что связывание рецептора липопротеина низкой плотности с полипептидом является более слабым, чем с тем же полипептидом, когда он неконъюгирован, предпочтительно слабее более чем в два раза. В другом варианте выполнения изобретения биосовместимый полимер ковалентно присоединен к функциональному полипептиду фактора VIII в предварительно заданном сайте, так что протеаза плазмы деградирует полипептид слабее, чем когда этот полипептид неконъюгирован. В следующем варианте выполнения изобретения деградация полипептида протеазой плазмы является более чем в два раза слабее, чем деградация этого полипептида, когда он неконъюгирован, при таких же самых условиях за такой же период времени.
Сродство связывания LRP, LDL и HSPG с FVIII можно определить, используя методику поверхностного плазмонного резонанса (Biacore). Например, FVIII может быть нанесен прямо или опосредованно через FVIII-антитело на Biacore™-чип, и, пропуская через чип различные концентрации LRP, можно измерить как скорость ассоциации, так и скорость диссоциации (Bovenschen N. et al., 2003, J. Biol. Chem. 278(11), pp.9370-7). Соотношение двух скоростей дает величину сродства. При ПЭГ-илировании было бы желательным двукратное, предпочтительно пятикратное, более предпочтительно десятикратное и еще более предпочтительно 30-кратное снижение сродства.
Деградация FVIII протеазой АРС может быть измерена любыми методами, известными специалистам в данной области техники.
В одном варианте выполнения изобретения биосовместимый полимер ковалентно присоединен к полипептиду в одном или более положениях аминокислот 81, 129, 377, 378, 468, 487, 491, 504, 556, 570, 711, 1648, 1795, 1796, 1803, 1804, 1808, 1810, 1864, 1903, 1911, 2091, 2118 и 2284 фактора VIII. В другом варианте выполнения изобретения биосовместимый полимер ковалентно присоединен к полипептиду в одном или более положениях аминокислот 377, 378, 468, 491, 504, 556, 1795, 1796, 1803, 1804, 1808, 1810, 1864, 1903, 1911 и 2284 фактора VIII, и (1) связывание конъюгата с протеином, родственным рецептору липопротеина низкой плотности, меньше, чем связывание неконъюгированного полипептида с протеином, родственным рецептору липопротеина низкой плотности; (2) связывание конъюгата с рецептором липопротеина низкой плотности меньше, чем связывание неконъюгированного полипептида с рецептором липопротеина низкой плотности; или (3) связывание конъюгата как с протеином, родственным рецептору липопротеина низкой плотности, так и с рецептором липопротеина низкой плотности меньше, чем связывание неконъюгированного полипептида с протеином, родственным рецептору липопротеина низкой плотности, и с рецептором липопротеина низкой плотности.
В другом варианте выполнения изобретения биосовместимый полимер ковалентно присоединен к полипептиду в одном или более положениях аминокислот 377, 378, 468, 491, 504, 556 и 711 фактора VIII, и связывание конъюгата с гепаринсульфат протеогликаном меньше, чем связывание неконъюгированного полипептида с гепаринсульфат протеогликаном. В следующем варианте выполнения изобретения биосовместимый полимер ковалентно присоединен к полипептиду в одном или более положениях аминокислот 81, 129, 377, 378, 468, 487, 491, 504, 556, 570, 711, 1648, 1795, 1796, 1803, 1804, 1808, 1810, 1864, 1903, 1911, 2091, 2118 и 2284 фактора VIII, и конъюгат имеет меньшее связывание с ингибиторными антителами к фактору VIII, чем неконъюгированный полипептид. В дальнейшем варианте выполнения изобретения биосовместимый полимер ковалентно присоединен к полипептиду в одном или более положениях аминокислот 81, 129, 377, 378, 468, 487, 491, 504, 556, 570, 711, 1648, 1795, 1796, 1803, 1804, 1808, 1810, 1864, 1903, 1911, 2091, 2118 и 2284, и предпочтительно в одном или более положениях из 377, 378, 468, 491, 504, 556, и 711 фактора VIII, и конъюгат подвергается меньшей деградации протеазой плазмы, способной деградировать фактор VIII, чем неконъюгированный полипептид. Более предпочтительно, чтобы протеаза плазмы являлась активированным протеином С.
В следующем варианте выполнения изобретения биосовместимый полимер ковалентно присоединен к фактору VIII с делетированным В-доменом в положениях аминокислот 129, 491, 1804 и/или 1808, более предпочтительно в положениях 491 или 1808. В дальнейшем варианте выполнения изобретения биосовместимый полимер присоединен к полипептиду фактора VIII в положении аминокислоты 1804 и включает полиэтиленгликоль. Предпочтительно, один или более предварительно заданных сайтов для присоединения биосовместимого полимера контролируются сайт-специфичной мутацией цистеина.
Предварительно заданными сайтами для присоединения биополимера могут являться один или более сайтов, предпочтительно один или два сайта, на функциональном полипептиде фактора VIII. В конкретных выполнениях полипептид является моноПЭГ-илированным или диПЭГ-илированным.
Изобретение также относится к способу получения конъюгата, предусматривающему мутирование нуклеотидной последовательности, которая кодирует функциональный полипептид фактора VIII, для замещения последовательности на цистеиновый кодон в предварительно заданном сайте; экспрессию мутированной нуклеотидной последовательности, чтобы произвести модифицированный цистеином мутеин; очистку мутеина; реагирование мутеина с биосовместимым полимером, который активирован для реакции с полипептидами по существу только с восстановленными цистеиновыми остатками, так что образуется конъюгат; и очистку конъюгата. Другой вариант выполнении изобретения - способ сайт-направленного ПЭГ-илирования мутеина фактора VIII, включающий: (а) экспрессию сайт-направленного мутеина фактора VIII, где мутеин имеет цистеиновое замещение аминокислотного остатка на наружной поверхности мутеина фактора VIII и этот цистеин кэпируют; (b) контактирование цистеинового мутеина с восстановителем при условиях, в которых цистеиновый мутеин мягко восстанавливается и отделяется кэп; (с) удаление кэпа и восстановителя из цистеинового мутеина; и (d) спустя, по крайней мере, около 5 минут, предпочтительно, по крайней мере, 15 минут, еще более предпочтительно, по крайней мере, 30 минут, после удаления восстановителя обрабатывают цистеиновый мутеин ПЭГом, включающим сульфгидрильный связывающий фрагмент, при таких условиях, чтобы образовался ПЭГ-илированный мутеин фактора VIII. Сульфгидрильный связывающий фрагмент ПЭГ выбирают из группы, состоящей из тиольного, трифлатного, трезилатного, азиридинового, оксиранового, S-пиридильного и малеимидного фрагментов, предпочтительно малеимида.
Изобретение также касается фармацевтических композиций для парентерального введения, включающих терапевтически эффективные количества конъюгатов настоящего изобретения и фармацевтически приемлемый адъювант. Фармацевтически приемлемые адъюванты являются веществами, которые могут добавляться к активному ингредиенту, чтобы помочь сформулировать или стабилизировать препарат и не вызвать каких-либо значительных нежелательных токсикологических эффектов у пациента. Примеры таких адьювантов хорошо известны специалистам в данной области техники и включают воду, сахара, такие как мальтоза или сахароза, альбумин, соли и т.д. Другие адъюванты описаны, например, E.W.Martin в Remington's Pharmaceutical Sciences. Такие композиции будут содержать эффективное количество описанного здесь конъюгата вместе с подходящим количеством носителя, для того чтобы приготовить фармацевтически приемлемые композиции, пригодные для эффективного введения хозяину. Например, конъюгат может быть парентерально введен лицам, страдающим гемофилией А, в дозе, которая может изменяться в зависимости от тяжести случая кровотечения. Средние дозы, вводимые внутривенно, находятся в пределах 40 единиц на килограмм по предоперационным показаниям, 15-20 единиц на килограмм при небольшом кровотечении и 20-40 единиц на килограмм, вводимых в течение 8-часового периода в качестве поддерживающей дозы.
В одном варианте выполнения изобретения способ включает замещение одной или более расположенных на поверхности BDD аминокислот цистеином, получение цистеинового мутеина в экспрессионной системе млекопитающих, восстановление цистеина, который был кэпирован во время экспрессии цистеином из среды выращивания, удаление восстановителя, чтобы дать возможность BDD-дисульфидам восстановить структуру, и реагирование с реагентом цистеин-специфичного биосовместимого полимера, такого как ПЭГ-малеимид. Примерами таких реагентов являются ПЭГ-малеимид с размерами ПЭГ 5,22 или 43 кДа, доступных от Nektar Therapeutics (Сан Карлос, Калиф.) под номерами каталога Nektar 2D2M0H01 mPEG-MAL MW 5000 Да, 2D2M0P01 mPEG-MAL MW 20 кДа, 2D3X0P01 mPEG2-MAL MW 40 кДа соответственно, или 12 либо 33 кДа, доступных от NOF Corporation (Токио, Япония) под номерами каталога NOF Sunbright ME-120MA и Sunbright МЕ-300МА соответственно. ПЭГ-илированный продукт очищают, используя ионообменную хроматографию для удаления непрореагировавшего ПЭГ и гель-хроматографию для удаления непрореагировавшего BDD. Этот метод может быть использован для идентификации и избирательной защиты от любых нежелательных взаимодействий с FVIII, таких как опосредованное рецептором выведение из кровотока, связывание ингибиторными антителами и деградация протеолитическими ферментами. Нами замечено, что ПЭГ-реагент, поставляемый Nektar или NOF как имеющий размер 5 кДа, протестированный в нашей лаборатории, оказался имеющим размер 6 кДа, и, аналогично, ПЭГ-реагент, поставляемый как линейный 20 кДа, по тестированию оказался имеющим размер 22 кДа; поставляемый как 40 кДа по тестированию имел 43 кДа; и поставляемый как 60 кДа был тестирован как имеющий 64 кДа в нашей лаборатории. Чтобы избежать путаницы, мы здесь в обсуждении используем молекулярный вес, как он был определен в нашей лаборатории, за исключением ПЭГ 5 кДа, о котором мы говорим как о имеющем размер 5 кДа, как он идентифицирован производителем.
В дополнение к цистеиновым мутациям в положениях 491 и 1808 в BDD (раскрыто выше) были осуществлены цистеиновые мутации в положениях 487, 496, 504, 468, 1810, 1812, 1813, 1815, 1795, 1796, 1803 и 1804, чтобы потенциально блокировать LRP-связывание после ПЭГ-илирования. Кроме того, чтобы после ПЭГ-илирования блокировать LRP- и HSPG-связывание, были осуществлены цистеиновые мутации в положениях 377, 378 и 556. Положения 81, 129, 422, 523, 570, 1864, 1911, 2091 и 2284 были выбраны как равнорасположенные на BDD, чтобы сайт-направленное ПЭГ-илирование ПЭГами крупного размера (>40 кДа) в этих положениях совместно с ПЭГ-илированием на нативных сайтах гликозилирования (41, 239 и 2118) и сайтах LRP-связывания полностью охватывало поверхность BDD и чтобы можно было идентифицировать новый механизм выведения из кровотока для BDD.
В одном варианте выполнения изобретения среда для культивирования клеток содержит цистеины, которые «кэпируют» цистеиновые остатки в мутеине посредством образования дисульфидных связей. При приготовлении конъюгата цистеиновый мутеин, произведенный в рекомбинантной системе, кэпируют цистеином из среды культивирования и этот кэп удаляют путем мягкого восстановления, которое освобождает кэп, перед добавлением цистеин-специфичного полимерного реагента. Другие методы, известные в данной области для сайт-специфической мутации FVIII, также могут быть использованы, поскольку они очевидны для специалиста в этой области.
Примеры
АНАЛИЗ АКТИВНОСТИ СТРУКТУРНЫХ СВЯЗЕЙ FVIII. FVIII и BDD-FVIII являются очень большими сложными молекулами со многими различными сайтами, вовлеченными в биологические реакции. Предшествующие попытки ковалентно модифицировать их, чтобы улучшить фармакокинетические свойства, имели противоречивые результаты. То, что молекулы можно было бы специфически мутировать и затем сайт-специфичным образом добавлять полимер, было неожиданным. Кроме того, неожиданными были также результаты в улучшении фармакокинетических свойств и сохранении активности, принимая во внимание, что ранее известным полимерным конъюгатам были присущи проблемы возникновения неспецифичного увеличения и уменьшения активности.
В одном варианте выполнения изобретения предусматривается сайт-направленный мутагенез с использованием цистеин-специфичных лигандов, таких как ПЭГ-малеимид. Немутированный BDD не имеет каких-либо цистеинов, доступных для реагирования с ПЭГ-малеимидом, так что только мутированное положение цистеина было бы сайтом ПЭГ-илирования. Более конкретно, BDD-FVIII содержит 19 цистеинов, 16 из которых образуют дисульфиды и остальные 3 из которых являются свободными цистеинами (McMullen et al., 1995, Protein Sci. 4, pp.740-746). Структурная модель BDD предполагает, что все 3 свободных цистеина находятся внутри структуры (Stoliova-McPhie et al., 2002, Blood 99, pp.1215-1223). Поскольку оксисленные цистеины не могут быть ПЭГ-илированы ПЭГ-малеимидами, то 16 цистеинов, которые образуют в BDD дисульфиды, не могут быть ПЭГ-илированы, пока сначала не будут восстановлены. На основании структурной модели BDD 3 свободных цистеина в BDD не могут быть ПЭГ-илированы без предварительной денатурации протеина, чтобы эти цистеины стали доступны ПЭГ-реагенту. Таким образом, неочевидно возможно достичь специфичного ПЭГ-илирования BDD ПЭГ-илированием на нативных цистеиновых остатках без серьезного изменения структуры BDD, что, весьма вероятно, приведет к нарушению его функции.
Окислительно-восстановительное состояние 4-х цистеинов в В-домене FVIII полной длины неизвестно. ПЭГ-илирование 4-х цистеинов в В-домене может быть возможным, если они не образуют дисульфидов и расположены на поверхности структуры. Однако, поскольку полноразмерная FVIII и BDD имеют сходный фармакокинетический (РК) профиль и сходные периоды полувыведения in vivo (Gruppo et al., 2003, Haemophilia 9, pp.251-260), то маловероятно, что ПЭГ-илирование В-домена приведет к улучшению периода полувыведения из плазмы, если только не окажется, что ПЭГ также защищает области, не относящиеся к В-домену.
Чтобы предварительно определить сайт полипептида, имеющего активность FVIII, для присоединения полимера, который сохранит активность фактора VIII и улучшит фармакокинетику, предлагаются следующие рекомендации, основанные на BDD-FVIII. Модификации должны быть направлены на механизмы выведения, инактивации и иммуногенные механизмы, такие как LRP, HSPG, АРС, и на сайты связывания ингибиторных антител. Структура BDD показана в Stoilova-McPhie. S. et al., 2002, Blood 99(4), pp.1215-23. Например, чтобы пролонгировать период полувыведения, можно ввести единичный ПЭГ в специфический сайт на или вблизи сайтов LRP-связывания в интервале остатков 484-509 домена А2 и в интервале остатков 1811-1818 домена A3. Введение объемного ПЭГ в эти сайты должно прервать способность FVIII связываться с LRP и уменьшить выведение FVIII из кровотока. Предполагается также, что для пролонгирования периода полувыведения без значительного влияния на активность ПЭГ может быть введен на остаток 1648, который находится на сочленении В-домена и А3-домена в молекуле полной длины, и в 14-аминокислотный линкер I BDD между доменами А2 и A3.
Специфичность ПЭГ-илирования можно достичь путем введения единичных цистеиновых остатков в домены А2 или A3, используя методики мутагенеза с помощью рекомбинантных ДНК, применяя после этого сайт-специфичное ПЭГ-илирование введенного цистеина посредством цистеин-специфичного ПЭГ-реагента, такого как ПЭГ-малеимид. Другое преимущество ПЭГ-илирования на остатках 484-509 и 1811-1818 состоит в том, что эти два эпитопа представляют два из трех главных классов ингибиторных антигенных сайтов у пациентов. Для достижения максимального эффекта улучшения периода полувыведения из кровотока и уменьшения иммуногенного ответа можно ПЭГ-илировать как А2, так A3 сайты LRP-связывания, чтобы получить диПЭГ-илированный продукт. Следует заметить, что ПЭГ-илирование внутри области 1811-1818 может привести к значительной потере активности, так как эта область вовлечена также в связывание FIX. Сайт-направленное ПЭГ-илирование внутри области 558-565 должно устранить HSPG связывание, однако может также снизить активность, поскольку эта область также связывается с FIX.
Чтобы идентифицировать новый механизм выведения FVIII, можно также ПЭГ-илировать дополнительные сайты на его поверхности. ПЭГ-илирование домена А2 может дать дополнительное преимущество в том, что домен А2 диссоциирует от FVIII после активации и, предположительно, удаляется из кровотока быстрее, чем остаток молекулы FVIII, из-за его меньшего размера. С другой стороны, ПЭГ-илированный А2 может оказаться достаточно большим, чтобы избежать выведения почками, и иметь период полувыведения из плазмы, сравнимый с таковым для остатка FVIII, и, таким образом, можно восстановить активированный FVIII in vivo.
ИДЕНТИФИКАЦИЯ САЙТОВ ПЭГ-илирования В ОБЛАСТЯХ А2 и A3. Пять положений (Y487, L491, К496, L504 и Q468, соответствующих положениям PEG1-5) в или вблизи предполагаемой области LRP-связывания А2 были выбраны в качестве примеров сайт-направленного ПЭГ-илирования, основываясь на поверхностном расположении и направлении в наружнюю сторону траектории Сα-Сβ. Кроме того, эти остатки приблизительно равноудалены друг от друга в пространственной структуре молекулы, поэтому вместе они могут представлять целую область. Восемь положений (1808, 1810, 1812, 1813, 1815, 1795, 1796, 1803, 1804, соответствующих PEG6-14) в или вблизи предполагаемой области LRP-связывания A3 были выбраны в качестве примеров для проведения сайт-направленного ПЭГ-илирования. ПЭГ6 (К1808) граничит с 1811-1818 и природным N-связанным сайтом гликозилирования в положении 1810. ПЭГ-илирование в положении 1810 (ПЭГ7) приводит к замещению сахара на ПЭГ. Мутация в положении Т 1812 ПЭГ8 также ликвидирует сайт гликозилирования. Хотя, как предсказывалось, ПЭГ9-положение (K1813) направлено вовнутрь структуры, оно было выбрано на случай, если модель структуры является неправильной. ПЭГ 10 (Y1815) является объемной гидрофобной аминокислотой внутри петли LRP-связывания и может являться основным остатком взаимодействия, поскольку гидрофобные аминокислоты обычно находятся в центре протеин-протеиновых взаимодействий. Поскольку область 1811-1818, как было указано, участвует в связывании как LRP, так и FEX, то было сделано предположение, что ПЭГ-илирование внутри этой петли может привести к пониженной активности. В связи с этим, вблизи петли 1811-1818, но не внутри ее, были сконструированы ПЭГ11-ПЭГ14 (1795, 1796, 1803, 1804), чтобы стала возможной диссоциация связывания LRP и FIX с ПЭГ разных размеров.
Чтобы одновременно блокировать оба сайта LRP-связывания, может быть осуществлено двойное ПЭГ-илирование, например, в положениях ПЭГ2 и ПЭГ6.
Так как область 558-565, как было показано, связывается как с HSPG, так и с FIX, внутри этой области сайты не создавались. Вместо этого, между областями LRP-и HSPG-связывания А2 были сконструированы ПЭГ15-ПЭГ17 (377, 378 и 556), чтобы присоединенный ПЭГ мог как препятствовать взаимодействиям, так и прерывать возможные взаимодействия между ними. Дополнительные сайты, которые расположены на поверхности и направлены наружу, могли бы быть выбраны внутри или вблизи областей LRP- и HSPG-связывания. Чтобы идентифицировать новые механизмы выведения, можно систематически ПЭГ-илировать FVIII. В дополнение к ПЭГ1-17 в качестве привязочных точек для ПЭГ-илирования можно использовать три других природных сайта гликозилирования, а именно N14, N239 и N2118, соответствующих ПЭГ 18-20, поскольку они должны быть расположены на поверхности. На BDD-модели в дополнение к сайтам функционального взаимодействия для vWF, FIX, FX, фосфолипида и тромбина были картированы области поверхности в радиусе 20 ангстрем от Сβ-атомов ПЭГ2, ПЭГ6, а также четыре сайта гликозилирования.
Затем, основываясь на их возможности охватывать почти полностью остающуюся поверхность BDD с радиусом 20 ангстрем от каждого из их Сβ-атомов, были выбраны ПЭГ21-29, соответствующие Y81, F129, К422, К523, К570, N1864, Т1911, Q2091 и Q2284. Поскольку эти положения полностью расположены на поверхности, являются внешне направленными и находятся далеко от природных цистеинов, они также были выбраны, чтобы минимизировать возможные некорректные образования дисульфидов. Радиус 20 ангстрем был выбран, так как предполагается, что крупный ПЭГ, такой как разветвленный ПЭГ 64 кДа, имеет возможность охватить сферу с радиусом около 20 ангстрем. ПЭГ-илирование ПЭГ21-29 совместно с ПЭГ2 и ПЭГ6 и сайтами гликозилирования ПЭГ 18, 19 и 20 вероятно предохранит почти полностью нефункциональную поверхность FVIII.
Положения ПЭГ-илирования, которые приводят к улучшенным свойствам, таким как улучшенный РК-профиль, более высокая стабильность или уменьшенная иммуногенность, могут быть скомбинированы, чтобы получить мультиПЭГ-илированный продукт с максимально улучшенными свойствами. ПЭГ30 и ПЭГ31 были сконструированы посредством удаления дисульфидов, расположенных на поверхности А2- и А3-доменов соответственно. Для проведения ПЭГ-илирования ПЭГ30, или С630А должен быть освобожден от своего дисульфидного партнера С711. Также, ПЭГ31, С1899А должны дать возможность С1903 быть ПЭГ-илированным.
МУТАГЕНЕЗ. Субстраты для сайт-направленного ПЭГ-илирования FVIII могут быть созданы введением цистеинового кодона в сайт, выбранный для ПЭГ-илирования. Для получения всех ПЭГ-мутантов использовали набор для сайт-направленного мутагенеза Stratagene cQuickChange™ II (набор Stratagene 200523 от Stratagene Corporation, Ла Йола, Калиф.). Метод сайт-направленного мутагенеза cQuickChange™ осуществляли, используя PfuTurbo® ДНК-полимеразу и температурный циклер. Два комплементарных олигонуклеотидных праймера, содержащих желаемую мутацию, элонгировали, используя PfuTurbo, которая не смещает праймеры. В качестве матрицы использовалась двунитевая ДНК, содержащая ген FVIII дикого типа. После множества циклов элонгации продукт расщепляли эндонуклеазой DpnI, которая специфична к метилированной ДНК. Вновь синтезированная ДНК, содержащая мутацию, не была метилированной, в то время как родительская ДНК дикого типа была метилированной. Расщепленная ДНК затем использовалась для трансформации суперкомпетентных XL-1 Blue клеток.
Эффективность мутагенеза составила почти 80%. Реакции мутагенеза осуществляли либо в pSK207+BDD C2.6, либо в pSK207+BDD (Фигура 1). Успешный мутагенез подтверждался ДНК-секвенированием, и подходящие фрагменты, содержащие мутацию, включались в основной участок вектора экспрессии млекопитающих pSS207+BDD, кодирующий FVIII. После ведения все мутации вновь подтверждались секвенированием. Для А3-мутеинов ПЭГ 6, 7, 8, 9 и 10 мутагенез проводили в векторе pSK207+BDD C2.6. После подтверждения секвенированием мутантный фрагмент KpnI/Pme субклонировали в pSK207+BDD. BDD-мутеин затем субклонировали в экспрессирующий вектор pSS207+BDD. Для А3-мутеинов ПЭГ 11, 12, 13, 14 мутагенез проводили непосредственно в векторе pSK207+BDD и подтвержденный секвенированием мутант BDD затем субклонировани в pSS207+BDD. Для А2-мутеинов ПЭГ 1, 2, 3, 4 и 5 мутагенез проводили в векторе pSK207+BDD C2.6. Подтвержденный секвенированием мутант субклонировали в pSK207+BDD, а затем в pSS207+BDD.
ПРАЙМЕРЫ (ТОЛЬКО СМЫСЛОВАЯ НИТЬ), ИСПОЛЬЗОВАННЫЕ ДЛЯ МУТАГЕНЕЗА, ПЕРЕЧИСЛЕНЫ ДЛЯ КАЖДОЙ РЕАКЦИИ:



ЭКСПРЕССИЯ МУТЕИНА. После введения в вектор, который придает устойчивость к Гигромицину В (Гигр В), ПЭГ-мутеины были трансфецированы в НКВ11-клетки (Патент США 6136599), смешанные с Реагентом для Трансфекции 293 Фектин (Invitrogen Corp. кат. №12347-019) по инструкциям производителя. Экспрессию FVIII в трехсуточный посттрансфекционный период оценивали посредством хромогенного анализа Коатест (Chromogenix Corp. кат. №821033, см. Пример 12, хромогенный анализ) (Таблица 1). Затем трансфецированные клетки помещали при селективном действии 50 мкг/мл Гигр В в ростовую среду, дополненную 5% эмбриональной бычьей сывороткой (FBS). После появления устойчивых к Гигр В колоний их собирали и скринировали на экспрессию FVIII посредством хромогенного анализа Коатест. Затем стабильные экспрессирующие FVIII клетки вносили в среду, содержащую добавку HSPG. Клетки выращивали и высевали в концентрации 1 × 106 клеток/мл в качалочные колбы со свежей средой. Культуральную жидкость (TCF), собранную по истечении 3 суток, использовали для очистки FVIII BDD-мутеинов. Активность FVIII из TCF анализировали с помощью Коатеста (Таблица 1). (N/A = анализ не проводился).
ОЧИСТКА МУТЕИНОВ. После сбора супернатанта клеточной культуры, содержащего секретированный мутеиновый протеин FVIII, супернатант фильтровали через 0,2-микронный мембранный фильтр, чтобы удалить все оставшиеся клетки. Затем супернатант концентрировали либо посредством ультрафильтрации, либо с помощью анионного обмена. Затем его направляли на иммуноаффинную колонку, где компоненты среды культивирования клеток и большинство примесных протеинов хозяйских клеток удалялись. Затем элюат с иммуноаффинной колонки буферировали диафильтрацией в буферный состав, содержащий сахарозу, и замораживали. Выход и сбор протеина через колонку с моноклональными к FVIII антителами оценивали хромогенным анализом. Образцы нагруженных, протекающих через колонку, различных элюированных фракций, полосы и диафильтрованного элюата хроматографического исследования были проанализированы на FVIII-активность (Таблица 2). Таблица 2 показывает сбор ПЭГ2-мутеина с колонки с моноклональными антителами. Антитела представляют собой антитела C7F7. Процент сбора в Таблице 2 определен с помощью хромогенного анализа. Конечный выход составлял 73%. На Фигуре 2 показан график UV-поглощения при 280 нм относительно времени для ПЭГ2-протеина, очищенного через хроматографическую колонку с моноклональными антителами к FVIII. Хроматографию осуществляли с использованием хроматографической системы АКТА® Explorer 100 от Amersham Bioscience. В этой системе используется многоволновый UV-Visible монитор и пропускная ячейка 2 мм. ПЭГ2-мутеин элюирован с колонки в присутствии высшей соли, и пик элюирования указывается как поглощением при 280 нм, так анализом активности FVIII.
ПЭГИЛИРОВАНИЕ. Нативный FVIII полной длины или BDD не может быть ПЭГ-илирован цистеин-специфичными ПЭГ без восстановления и денатурации при более чем 100-кратном избытке ПЭГ: протеиновое соотношение (данные не показаны) подтверждает гипотезу, основанную на модели структуры BDD, что все нативные цистеины образуют дисульфиды или находятся внутри FVIII. Цистеиновые FVIII-мутеины, экспрессированные и очищенные с использованием перечисленных выше стандартных протоколов, не могли бы быть ПЭГ-илированы цистеин-специфичным ПЭГ-малеимидным реагентом, предположительно, потому, что введенный FVIII-цистеин кэпирован посредством реакции с сульфгидрильными группами, такими как цистеин и β-меркаптоэтанол, присутствующими в среде роста клеток. Этот вопрос потенциально может быть решен элиминированием цистеинов и β-меркаптоэтанола из среды культивирования, но это может привести к снижению продукции FVIII, и не препятствовало бы сульфгидрилам, освобождаемым клетками, блокировать введенный FVIII-цистеин.
В другом аспекте изобретения был разработан трехстадийный метод, дающий возможность сайт-специфического ПЭГ-илирования FVIII (Фигура 3). На стадии 1 очищенный цистеиновый FVIII-мутеин в количестве около 1 мкМ мягко восстанавливали восстановителями, такими как примерно 0,7 мМ Трис(2-кабоксиэтил)фосфина (ТСЕР) или 0,07 мМ дитиотреитола (DTT), в течение 30 минут при 4°С, чтобы отделить «кэп». На стадии 2 восстановитель удаляли вместе с «кэпом» посредством метода гель-хроматографии (SEC), такого как прохождение образца через вращающуюся колонку (BioRad®), чтобы дать возможность дисульфидам FVIII реформироваться, оставляя при этом введенный цистеин свободным и восстановленным. На стадии 3 спустя, по крайней мере, 30 минут после удаления восстановителя освобожденный цистеиновый FVIII-мутеин обрабатывали, по крайней мере, 10-кратным молярным избытком ПЭГ-малеимида размерами в интервале от 5 до 64 кДа (Nektar Therapeutics и N.O.F. Corporation) в течение, по меньшей мере, 1 часа при 4°С. Этот метод дает профиль продукта, хорошо согласующийся с воспроизводимыми данными для множества реакций, повторенных различными исследователями.
Ввиду того что метод вращающейся колонки для удаления ТСЕР не является масштабным, была выбрана гель-фильтрационная хроматография с обессоливанием. Однако после проверки этого метода с использованием образца, меченного ТСЕР, было показано, что ТСЕР элюировался в измеряемом количестве в поры колонки и не прямо в солевую фракцию, как это ожидалось бы от молекулы с низким молекулярным весом. Вестерн-блот анализ показал значительный фон ПЭГ-илирования, вероятно, вследствие неполного удаления ТСЕР. В отдельных промежуточных экспериментах было показано, что очищенный C7F7-материал мог бы быть существенно очищен в дальнейшем от других примесных протеинов использованием среды анионообменной хроматографии, комбинированной с солевым градиентом. Затем было решено восстановить C7F7-материал с помощью ТСЕР, как описано выше, и потом обработать этот материал через анионообменную колонку. Вследствие различия в заряде, FVIII-протеин удерживался бы, в то время как ТСЕР протекал бы через колонку и не оставался. В то же самое время в течение элюирования в солевом градиенте FVIII-протеин очищался бы от большинства оставшихся примесных протеинов. Это означает, что позднее получающееся ПЭГ-илирование было бы теоретически более гомогенным при более чистом исходном материале. Однако после тестирования посредством образца, меченного ТСЕР, было показано, что измеримые уровни ТСЕР обнаруживались элюированными в градиенте с FVIII. Поэтому было решено после анионообменной хроматографии применить гель-фильтрационную хроматографию с обессоливанием, чтобы эти две стадии, последовательно использованные, приводили к полному удалению ТСЕР и исключению неспецифичного ПЭГ-илирования.
АНАЛИЗ ПЭГИЛИРОВАНИЯ МЕТОДОМ ЭЛЕКТРОФОРЕЗА В ПОЛИАКРИЛАМИДНОМ ГЕЛЕ С ДОДЕЦИЛСУЛЬФАТОМ НАТРИЯ (SDS-PAGE) И ВЕСТЕРН-БЛОТТИНГА. ПЭГ-илированный продукт может быть проанализирован с помощью электрофореза на восстанавливающем 6% ТрисГлицин SDS-полиакриламидном геле (Invitrogen). При продолжении электрофореза гель может быть окрашен Кумасси Голубым (Coomassie Blue) для идентификации всех протеинов или быть подвергнут стандартному Вестерн-блот протоколу для идентификации рисунка ПЭГ-илирования в различных областях FVIII. Окрашивание блота мышиным моноклональным антителом R8B12 или C7F7, созданным к С-концевой области тяжелой цепи FVIII или N-концевой области легкой цепи FVIII соответственно, должно идентифицировать ПЭГ-илирование соответствующих цепей. Окрашивание с помощью 413-антитела к области 484-509 FVIII должно определить, является ли ПЭГ-илирование действительно сайт-специфичным или нет, для мутеинов, таких как ПЭГ1-4. Аналогично, окрашивание с помощью антитела CLB-CAg А, которое распознает область 1801-1823 FVIII, должно определить, является ли ПЭГ-илирование действительно сайт-специфичным или нет, для мутеинов, таких как ПЭГ6-10.
Было показано, что ПЭГ-илирование ПЭГ2 (L491C) является избирательным для тяжелой цепи относительно легкой цепи и особенно избирательным для области 484-509 (Фигура 4), в то время как ПЭГ6 (K1808C), как было показано, является избирательным для легкой цепи относительно тяжелой цепи (Фигура 5).
Для исследования, изображенного на Фигуре 4, ПЭГ2-мутеин (дорожки 1 и 8) восстанавливали с помощью ТСЕР, после чего ТСЕР удаляли (дорожки 2 и 9) и обрабатывали с помощью 5-, 12-, 22-, 33- или 43-кДа ПЭГ-малеимида (дорожки 3-7 и 10-14). НеПЭГ-илированный FVIII исследовался в виде необработанной (H+L) и обработанных полос тяжелой (Н) и легкой (L) цепей. Все три полосы обнаруживаются на геле, окрашенном Кумасси Голубым (внизу справа), в то время как Western-окрашивание специфичными к цепи антителами показало только непрореагировавшую и соответствующую цепь. При окрашивании R8B12 (вверху слева) полоса тяжелой цепи (Н) сильно уменьшалась в интенсивности, когда ПЭГ2 обрабатывали ПЭГ-малеимидом, и создавалась новая полоса, которая оказывалась выше, чем родительская Н-полоса, пропорционально размеру ПЭГ. При окрашивании C7F7 (внизу слева) полосы легкой цепи (L) (многочисленные полосы вследствие гетерогенного гликозилирования) не изменялись в интенсивности. Необработанная H+L полоса в обоих окрашиваниях сдвинута, поскольку Н-цепь является частью необработанного FVIII. Окрашивание Кумасси также подтверждает гораздо большее ПЭГ-илирование тяжелой цепи, т.е. уменьшение интенсивности Н-полосы, чем легкой цепи. Наконец, ПЭГ-илированные полосы теряют относительно больше в интенсивности при окрашивании 413-антителом (вверху справа), чем при окрашивании с помощью R8B12, в зависимости от размера ПЭГ, предположительно, вследствие сайт-специфичного ПЭГ-илирования в 491, которое блокирует связывание 413-антитела с 484-509. Количества FVIII, нанесенного на дорожку, составляют около 30 нг для двух левых гелей, около 1000 нг для верхнего правого геля и около 2000 нг для нижнего правого геля.
Восстановление, за которым следует удаление восстановителя, не изменяет миграции FVIII (дорожка 1 по сравнению с дорожкой 2 и дорожка 8 по сравнению с дорожкой 9). Добавление 22 кДа-ПЭГ к ПЭГ2 блокирует связывание 413-антитела, что согласуется со специфичным ПЭГ-илированием в положении 491 (Фигура 4, верхний правый гель). Это также предполагает, что ПЭГ-илированный ПЭГ2 будет иметь более низкую иммуногенность у человека, потому что 413-антитело, как было показано, имеет тот же самый эпитоп, что и ингибиторные антитела к А2 человека (Scandella et al., 1992, Thromb. Haemost. 67, pp.665-71).
Для исследования, изображенного на Фигуре 5, ПЭГ6-мутеин восстанавливали с помощью ТСЕР, после чего ТСЕР удаляли (дорожки 1 и 6) и обрабатывали с помощью 5-, 12-, 22- или 33 кДа-ПЭГ-малеимида (дорожки 2-5 и 7-10). НеПЭГ-илированный FVIII исследовался в виде необработанной (H+L) и обработанных полос тяжелой (Н) и легкой (L) цепей. Ввиду мутированных остатков ПЭГ6 (K1808) на легкой цепи ПЭГ-илирование было обнаружено только на легкой цепи, но не на тяжелой. Количество FVIII, нанесенного на дорожку, составляет около 100 нг для левого геля и около 30 нг для правого геля.
BDD, который испытывался в качестве контроля, не показал какого-либо значительного ПЭГ-илирования после обработки более чем 100-кратным молярным избытком ПЭГ-малеимида, даже после описанной выше процедуры восстановления и удаления восстановителя (Фигура 6а). Этот же самый метод был применен к ПЭГ4 и ПЭГ5 (Фигура 6а). Если сравнивать с ПЭГ2, эти мутеины не были ПЭГ-илированы настолько эффективно, но они были избирательными к тяжелой цепи, подобно ПЭГ2 (L491C). Эффективность ПЭГ-илирования ПЭГ6 (К1808С) является относительно низкой, вероятно потому, что он очень близок к сайту N-связанного гликозилирования на N1810, который может блокировать ПЭГ-илирование в положении 1808. Поэтому нами был сконструирован ПЭГ7 (N1810C), чтобы удалить сайт нативного гликозилирования в 1810. ПЭГ7 показывает улучшенную эффективность ПЭГ-илирования по сравнению с ПЭГ6, если сравнивать их «голова к голове» (Фигура 6b). Аналогично, ПЭГ15 показывает несколько лучшую эффективность ПЭГ-илирования, чем ПЭГ2.
ПЭГ2+6, двойной мутант BDD, может быть ПЭГ-илирован как на тяжелой, так и на легкой цепи, поскольку ПЭГ2 является цистеиновой мутацией тяжелой цепи, в то время как ПЭГ6 представляет собой мутацию легкой цепи (Фигура 6с). Этот метод был применен также к FVIII дикого типа полной длины (Фигура 6d). ПЭГ-илирование было обнаружено для самого большого фрагмента тяжелой цепи, которая включает A1, A2 и большую часть В-домена. Рисунок ПЭГ-илирования дает основание полагать моноПЭГ-илирование, и что имеется лишь единственный ПЭГ-илированный цистеин.
АНАЛИЗ ПЭГИЛИРОВАНИЯ ПОСРЕДСТВОМ РАСЩЕПЛЕНИЯ ТРОМБИНОМ И ВЕСТЕРН-БЛОТТИНГА. ПЭГ-илированный продукт можно обработать тромбином (40 МЕ/мкг FVIII) при 37°C в течение 30 минут. Используемый тромбин содержит также АРС в качестве примеси. Расщепление тромбином приводит к появлению 50 кДа-A1- и 43 кДа-А2-домена из тяжелой цепи, в то время как расщепление АРС приводит далее к расщеплению А2-домена на фрагменты 21 и 22 кДа (Фигура 7). Окрашивание с помощью R8B12-антитела, которое распознает С-конец тяжелой цепи, будет идентифицировать только интактный А2-домен и 21 кДа-С-концевой фрагмент (FVIII 562-740). Таким образом, если ПЭГ-илирование ПЭГ2 было бы специфичным для положения 491, 43 кДа-А2-домен должен был бы быть ПЭГ-илированным, за исключением 21 кДа С-концевого фрагмента. Это было действительно подтверждено Вестерн-блоттингом для 22 кДа-ПЭГ-илированного ПЭГ2, показанным на Фигуре 7. Таким образом, посредством элиминирования ПЭГ-илирование ПЭГ2 было локализовано на N-концевом 22 кДа-фрагменте (FVIII 373-561) А2-домена. Поскольку ПЭГ-малеимид является полностью избирательным к цистеинам при рН 6,8 и единственные нативные FVIII-цистеины в области 373-561 происходят из скрытого дисульфида между 528 и 554, весьма вероятно, что ПЭГ2 ПЭГ-илирован на введенном цистеине в положении 491. Western-окрашивание обработанного тромбином ПЭГ-илированного ПЭГ2 с помощью N-концевой части антитела к тяжелой цепи FVIII не показало ПЭГ-илирования А1-домена (данные не показаны). Избирательное ПЭГ-илирование ПЭГ2 с использованием метода тромбинового расщепления было также подтверждено для ПЭГ 5, 12, 33 и 43 кДа (данные не показаны). Расщепление тромбином ПЭГ-илированного FVIII дикого типа полной длины показывает, что ПЭГ-илирован только В-домен (Фигура 8).
АНАЛИЗ ПЭГИЛИРОВАНИЯ С ПОМОЩЬЮ ОКРАШИВАНИЯ ЙОДОМ. Чтобы подтвердить, что появившиеся новые полосы, выявленные окрашиванием Кумасси Голубым и Western, действительно являются полосами, свидетельствующими о ПЭГ-илировании, было применено окрашивание йодидом бария, которое является специфичным для ПЭГ (Фигура 9). ПЭГ-илированный ПЭГ2 исследовался на 6%-ном ТрисГлициновом геле (Invitrogen) и окрашивался R8В12-антителом к тяжелой цепи или раствором йодида бария (Lee et al., Pharm Dev Technol. 1999 4:269-275). ПЭГ-илированные полосы обнаруживались между двумя пятнами, используя маркер молекулярного веса для их выравнивания, подтверждая, таким образом, ПЭГ-илирование тяжелой цепи FVIII.
АНАЛИЗ ПЭГИЛИРОВАНИЯ С ПОМОЩЬЮ MALDI-MACC-СПЕКТРОСКОПИИ. Для подтверждения ПЭГ-илирования А2-домена в тяжелой цепи образец rFVIII до и после ПЭГ-илирования анализировали посредством масс-спектрометрии с использованием лазерной десорбции/ионизации в присутствии матрикса (MALDI). Образцы смешивали и кристаллизовали на мишеневом MALDI-планшете с матриксом из синапиновой кислоты в 30% ацетонитриле, 0,1% TFA. Затем их анализировали в спектрометре Voyager DE-PRO в положительном, линейном режиме. Результаты, представленные на Фигуре 10, показали, что легкая цепь ПЭГ2 имеет центр на 83 кДа, а тяжелая цепь (НС) - на 89 кДа. Полученный для ПЭГ-илированного образца спектр показал уменьшение НС-пика и образование нового пика с центром на 111 кДа. Это подтверждает ПЭГ-илирование тяжелой цепи. Никакого ПЭГ-илирования легкой цепи (на 105 кДа) выше предела обнаружения не наблюдалось.
Затем образцы подвергали расщеплению тромбином при 20 единицах тромбина/мг FVIII при 37°С в течение 30 минут и определяли концентрацию FVIII аминокислотным анализом (Commonwealth Biotechnologies, Inc.). Тяжелая цепь была расщеплена на 48 кДа (A1) N-концевую фракцию и 43 кДа (А2) фракцию. Полученный MALDI-спектр для ПЭГ-илированного образца (Фигура 11) показывает потерю пика 43 кДа и появление нового пика 65 кДа, вследствие ПЭГ-илированного А2-домена. ПЭГ-илирование легкой цепи выше предела обнаружения снова не наблюдалось. Эти результаты вновь подтверждают ПЭГ-илирование А2-домена FVIII. Такой же самый анализ был применен для ПЭГ-илированного ПЭГ6 и подтвердил ПЭГ-илирование А3С1С2-фрагмента легкой цепи (Фигура 12).
ИЗМЕРЕНИЕ АКТИВНОСТИ
КОАГУЛЯЦИОННЫЙ АНАЛИЗ. Тест-метод свертывания FVIII:С представляет собой одностадийный анализ, основанный на активированном парциальном тромбопластиновом времени (аРТТ). В присутствии Фактора IXa, кальция и фосфолипида FVIII действует как кофактор в ферментативном превращении Фактора Х в Ха. В этом анализе разведенные тестируемые образцы инкубируют при 37°С со смесью субстрата из FVIII-дефицитной плазмы и аРТТ-реагента. К инкубированной смеси добавляют хлорид кальция, и начинается коагуляция. Между временем (в секундах), которое требуется для образования сгустка, и логарифмом концентрации FVIII:C существует обратное соотношение. Уровни активности для неизвестных образцов интерполируют, сравнивая время свертывания различных разведений тестируемого материала с кривой, построенной из серий разведений стандартного материала с известной активностью, и выражают в Международных Единицах на мл (МЕ/мл).
ХРОМОГЕННЫЙ АНАЛИЗ. Метод хромогенного анализа состоит из двух последовательных стадий, где интенсивность цвета пропорциональна активности FVIII. На первой стадии Фактор Х активируют до FXa FIXаом с помощью его кофактора, FVIIIa в присутствии оптимальных количеств ионов кальция и фосфолипидов. Избыточные количества Фактора Х таковы, что скорость активирования Фактора Х зависит единственно от количества FVIII. На второй стадии Фактор Ха гидролизует хромогенный субстрат, давая хромофор, и интенсивность цвета считывается фотометрически при 405 нм. Вычисляется значение неизвестного, и достоверность анализа проверяется с помощью статистического метода тангенса угла наклона кривой. Активность выражают в Международных Единицах на мл (МЕ/мл).
Петля 1811-1818 вовлечена в связывание с FIX, однако важность индивидуальных положений внутри этой петли не была определена. Мутеины ПЭГ7-10 обнаруживают почти идентичную специфическую хромогенную активность относительно нативного FVIII (Таблица 3). Таблица 3 показывает в процентах специфическую активность (СА) ПЭГ-мутеинов и ПЭГ-илированного ПЭГ2 или ПЭГ6 относительно BDD. СА определяли делением хромогенной, коагуляционной активности или активности vWF-связывания на суммарное антигенное значение ELISA (ТАЕ). Затем СА ПЭГ-илированных мутеинов делили на СА BDD (8 МЕ/мкг хромогенной, 5 МЕ/мкг коагуляционной и 1 vWF/TAE) и умножали на 100, чтобы получить процент СА приведенный в Таблице 3 под заголовками «хромогенная», «коагуляционная» и «vWF/TAE».
Как показано в Таблице 3, «ПЭГ2 красный» - это ПЭГ2-мутеин, который был обработан восстановителем с последующим удалением последнего. Эта процедура восстановления незначительно изменяет три функциональные активности FVIII. ПЭГ2-мутеин, конъюгированный с ПЭГ, имеющими размер в интервале от 5 кДа (ПЭГ2-5кДа) до 43 кДа (ПЭГ2-43кДа), не теряет значительного количества хромогенной активности, но имеет гораздо более низкую коагуляционную активность, когда размер ПЭГ увеличивается за пределы 5 кДа. Возможно также умеренное уменьшение vWF-связывания для ПЭГ-илированного ПЭГ2 более крупного размера.
СУММАРНЫЙ АНТИГЕННЫЙ ELISA (ТАЕ). FVIII переносят на микротитровальный планшет, который покрыт поликлональным антителом к FVIII. Связывание FVIII обнаруживается с помощью биотинилированного поликлонального антитела к rFVIII и конъюгата стрептавидин-пероксидаза хрена (КСП). Пероксидаз-стрептавидиновый комплекс дает цветовую реакцию после добавления тетраметилбензидинового (ТМВ) субстрата. Концентрации образцов интерполируют со стандартной кривой, используя модели с четырьмя подходящими параметрами. Результаты FVIII выражают в мкг/мл.
ELISA vWF-СВЯЗЫВАНИЕ. FVIII давали связываться с vWF с сильно гемофильной плазмой в растворе. Затем комплекс FVIII-vWF переносили на микротитровальный планшет, покрытый vWF-специфичным моноклональным антителом. Связывание FVIII с vWF обнаруживается с помощью биотинилированного поликлонального антитела к rFVIII и конъюгата стрептавидин-пероксидаза хрена (КСП). Пероксидаз-стрептавидиновый комплекс дает цветовую реакцию после добавления субстрата. Концентрации образцов интерполируют со стандартной кривой, используя модели с четырьмя подходящими параметрами. Результаты FVIII-связывания выражают в мкг/мл. Не было обнаружено какого-либо существенного влияния на любую из активностей после ПЭГ-илирования, которое согласовывалось бы с ПЭГ-илированием в В-домене.
ОЧИСТКА ПЭГ-илированного FVIII ИОНООБМЕННОЙ ХРОМАТОГРАФИЕЙ. ПЭГ-илированный FVIII пропускают через анион-обменную или катион-обменную колонку, где протеин связывается с колонкой, в то время как избыток свободного ПЭГ-реагента не связывается и удаляется, проходя через колонку. Затем ПЭГ-мутеин элюируют с колонки с помощью градиента хлорида натрия. Для подтверждения того что элюированные с колонки фракции содержат ПЭГ-илированный мутеин, использовали окрашенный йодидом бария 4-12% Бис-Трис-гель нагруженных, проходящих через колонку и обработанных в градиенте фракций.
ОЧИСТКА ПЭГ-илированного FVIII ГЕЛЬ-ХРОМАТОГРАФИЕЙ Анион-обменные фракции, содержащие большую часть ПЭГ2-мутеина, объединяют и концентрируют с помощью ультрафильтрации, которую затем вводят в колонку, используемой в гель-хроматографии. Затем колонку элюируют, используя буферный состав. Вследствие различия в размере и форме протеина, в зависимости от того, связан ли ПЭГ с протеином, эта колонка отделяет ПЭГ-илированный ПЭГ2-мутеин от любого из остальных ПЭГ2, которые не ПЭГ-илированы. Фракции ПЭГ-илированного FVIII-мутеина объединяют на основании наличия значительной активности FVIII, затем замораживают для последующих исследований на животных и молекулярного исследования. На Фигуре 13 сравнивается элюирование неПЭГ-илированного ПЭГ2-мутеина с элюированием 43 кДа-ПЭГ-илированного ПЭГ2-мутеина. ПЭГ-илированный ПЭГ2 элюирует значительно раньше, что указывает на увеличение его размера и формы от ковалентно присоединенного ПЭГ.
Что касается таких мутеинов, как ПЭГ6, которые показывают более низкую эффективность ПЭГ-илирования, т.е. менее 50%, то самой эффективной схемой очистки, дающей высокочистый моноПЭГ-илированный продукт, является использование комбинации катион-обменной хроматографии с последующей гель-хроматографией. Например, что касается ПЭГ6, катион-обменная хроматография очищает ПЭГ-илированный ПЭГ6 (ранее элюирующая фракция, Фигура 14) от большей части неПЭГ-илированного ПЭГ6 (позднее элюирующая фракция, Фигура 15). После этого с помощью гель-хроматографии ПЭГ-илированный протеин (ранее элюирующая фракция, Фигура 15) окончательно очищается от остатка неПЭГ-илированного протеина (позднее элюирующая фракция, Фигура 15).
ВЛИЯНИЕ РАЗМЕРА ПЭГ НА АКТИВНОСТЬ. Чтобы проверить, влияют ли размеры ПЭГ на коагуляционную и хромогенную активности FVIII после ПЭГ-илирования, очищенный FVIII полной длины, ПЭГ2, ПЭГ6 и ПЭГ 14 восстанавливали с помощью ТСЕР с последующим удалением восстановителя и реакцией с буферным контролем или ПЭГ, имеющими размер в интервале от 6 кДа до 64 кДа. Полученный ПЭГ-илированный FVIII анализировали непосредственно, без удаления избытка ПЭГ или неПЭГ-илированного FVIII. Контрольные эксперименты показали, что избыток ПЭГ не влияет на активность FVIII.
На Фигуре 16 показаны результаты этого исследования. Очищенный FVIII полной длины представлен на Фигуре 16 как KG-2. Процент активности, показанный на Фигуре 16, определяли делением величины образца, обработанного ПЭГ после восстановления и удаления восстановителя, на величину образца, обработанного буферным контролем, принимая во внимание результат ПЭГ-илирования. Результат ПЭГ-илирования сравнивали со всеми ПЭГ для любого данного FVIII-конструкта. Он составляет примерно 80% для KG-2, ПЭГ2 и ПЭГ14 и около 40% для ПЭГ6. Например, обработанный буферным контролем ПЭГ14 имеет коагуляционную активность 6,8 МЕ/мл в отличие от 3,2 МЕ/мл для 12 кДа-ПЭГ-илированного образца ПЭГ14. Однако эффективность ПЭГ-илирования составляла около 80%, и значение 3,2 МЕ/мл представляет собой агрегатную активность примерно 80% ПЭГ-илированного и 20% неПЭГ-илированного. Полагая, что неПЭГ-илированный образец имеет такую же активность, что и обработанный буферным контролем ПЭГ14, процент активности неПЭГ-илированного к ПЭГ-илированному ПЭГ14 составляет 34%=(3,2-6,8 раза 20%)/(6,8 раза 80%).
ПЭГ-илирование внутри А2- или А3-домена в положении ПЭГ2, ПЭГ6 и ПЭГ14 BDD ведет к большой потере коагуляционной активности, когда размер ПЭГ увеличивается за пределы 6 кДа. Однако ПЭГ-илирование внутри В-домена в цистеине В-домена нативного FVIII полной длины не влияет на коагуляционную активность. Интересно, что хромогенная активность всех ПЭГ-илированных конструктов не изменяется. Это может быть обусловлено различиями в анализах. Возможно, субстрат небольшого хромогенного пептида имеет более легкий доступ к ПЭГ-илированному комплексу FVIII/FIX/FX, чем субстрат более крупного протеина, используемый в коагуляционном анализе. Альтернативно, ПЭГ может влиять на активацию мутеина. Это было бы легче обнаружить с помощью одностадийного коагуляционного анализа, чем двухстадийным хромогенным анализом.
Для подтверждения наблюдаемых ПЭГ-эффектов на коагуляционную активность ПЭГ2, 6 и 14 несколько ПЭГ-илированных конструктов были очищены от избытка ПЭГ и неПЭГ-илированного материала. Поскольку ПЭГ никак не влияет на хромогенную активность, отношение хромогенной активности к коагуляционной хорошо оценивается по относительному воздействию ПЭГ на коагуляционную активность (Таблица 5). Более крупные ПЭГ в данном положении, такие как ПЭГ2 и большее количество ПЭГов, как в данном случае с конструктом ПЭГ2+6, вызывают более высокую потерю коагуляционной активности.
РК ИССЛЕДОВАНИЕ КРОЛИКА. Чтобы понять влияние ПЭГ-илирования на фармакокинетику (РК) FVIII, РК-исследования проводили на ряде видов. Для исследования были использованы NZW SPF-кролики: 10 самок, 5 кроликов в группе, 2 группы (ПЭГ2 FVIII и 22 кДа-ПЭГ-илированный ПЭГ2). Образцы разводили в стерильном PBS с конечной концентрацией 100 МЕ/мл (хромогенные единицы). Каждому кролику вводили в крайнюю ушную вену дозу в 1 мл/кг (100 МЕ/кг) разведенного тестируемого или контрольного вещества. В различное после введения время отбирали образцы крови (1 мл) в 1 мл-шприц (наполненный 100 мкл 3,8%-ного Na-цитрата) из центральной ушной артерии в заданные периоды времени после введения дозы. Образцы плазмы инкубировали R8B12-антителом к тяжелой цепи, помещенным на 96-луночный планшет, для специфичного захвата вводимого человечьего FVIII. Активность захваченного FVIII определяли хромогенным анализом (Фигура 17). ПЭГ-илированный ПЭГ2 и ПЭГ-илированный ПЭГ6 сравнивались также с BDD (Фигуры 18 и 19), при этом количество выделенных ПЭГ-илированных мутеинов из плазме стало более высоким по сравнению с количеством BDD. ПЭГ-илированный FVIII дикого типа полной длины явно не проявил такого свойства (Фигура 20).
РК ИССЛЕДОВАНИЕ МЫШИ. В качестве второго вида в РК исследованиях использовались ICR-нормальные или гемофильные, FVIII-дефицитные мыши (Taconic, Гудзон, Нью-Й.). Нормальные мыши использовались для исследования; по 5 мышей в группе за один период времени. Тестируемые материалы разводили в составном буфере до номинальной конечной концентрации 25 МЕ/мл. Каждой мыши вводили 4 мл/кг (~0,1 мл от общего объема) разведенного тестируемого материала через хвостовую вену. Образцы крови (0,45 или 0,3 мл для исследования нормальной или гемофильной мыши соответственно) отбирали в 1 мл-шприц (наполненный 50 или 30 мкл 3,8%-ного Na-цитрата для исследования нормальной или гемофильной мыши соответственно) из нижней полой вены в заданный период времени (одно животное на образец). Образцы плазмы анализировали на концентрацию FVIII, используя описанный выше метод хромогенного анализа. Большее количество ПЭГ-илированного ПЭГ6 выделяется из плазмы по сравнению с BDD или ПЭГ6 (Фигура 21). Большее количество ПЭГ-илированного ПЭГ2 выделяется из плазмы по сравнению с BDD (Фигуры 22 и 23).
СБОР (BDD) ФАКТОРА VIII ГЕМОФИЛЬНОЙ МЫШИ. Гистограмма сбора (BDD) Фактора VIII гемофильной мыши, показанная на Фигуре 24, иллюстрирует фармакокинетическую (РК) оценку периода полувыведения двух видов BDD-Фактора VIII в анализе гемофильной мыши. Этот анализ был проведен для измерения концентрации в плазме как BDD-Фактора VIII (обозначен на Фигуре 24 как «wt» или BDD-Фактора VIII дикого типа), так и ПЭГ 2+6 двойного ПЭГ-илированного варианта BDD-Фактора VIII (и идентифицированного здесь как L491C, K1808 двойной вариант BDD-Фактора VIII) в трех временных точках после внутривенного введения в мышиную модель. В то время как оценки для времени 0,8 и 4 часа были сравнимы, 16-часовая оценка заслуживает особого внимания. Что касается 16-и часов, то спустя 16 часов после введения в мышиной плазме оставалось примерно в четыре раза (400%) больше варианта двойного ПЭГ-илированного BDD Фактора VIII (ПЭГ 2+6) по сравнению с неПЭГ-илированной молекулой.
МОДЕЛЬ РАЗРЫВА ПОЧКИ. Чтобы определить, являются ли ПЭГ-илированные FVIII-мутеины эффективными для прекращения кровотечения у гемофильной мыши, использовалась модель разрыва почки. Гемофильную мышь (C57/BL6 с нарушенным FVIII-геном) анестезировали под изофлуораном и взвешивали. Обнажали нижнюю полую вену и вводили 100 мкл либо физиологического раствора, либо FVIII, используя калибровочную иглу 31-го размера. Иглу аккуратно удаляли и прилагали давление к месту инъекции на 30-45 секунд, чтобы предотвратить кровотечение. Спустя две минуты правую почку обнажали и удерживали между зажимами вдоль вертикальной оси. Используя скальпель №15, почку надрезали горизонтально на глубину 3 мм. Для обеспечения равномерности глубины повреждения почку слегка придерживали в средней части, чтобы обнажилась одинаковая ткань на каждой стороне зажима. Обнаженную поверхность почки разрезали до глубины зажима. Потерю крови подсчитывали, как описано выше. Для определения соотношения дозы и ответа FVIII на почечное кровотечение на мышах тестировались различные дозы FVIII. ПЭГ-илированный ПЭГ2 показывает сравнимую с BDD активность уменьшения потери крови после повреждения почки мыши (Фигура 25). Таким образом, хотя коагуляционная активность ПЭГ-илированного ПЭГ2 ниже, чем у BDD, данная модель разрыва почки показывает, что эффективность in vivo ПЭГ-илированного ПЭГ2 не была заметно снижена по сравнению с BDD, что согласуется с данными хромогенного анализа.
АНАЛИЗ ИНГИБИРОВАНИЯ АНТИТЕЛАМИ. Добавление полимера с высоким молекулярным весом, такого как полиэтиленгликоль (ПЭГ), специфично в положение 491 (т.е. ПЭГ2) должно уменьшать связывание с и чувствительность к mАВ 413, в значительной мере увеличивая долю ингибиторных антител у пациентов, поскольку у многих пациентов вырабатываются ингибиторные антитела к этому же самому эпитопу mАВ 413. Чтобы проверить это, увеличивающиеся количества mАВ 413 инкубировали с ненасыщающими количествами (0,003 МЕ/мл) BDD или 43 кДа-ПЭГ-илированного ПЭГ2 и тестировали на функциональную активность хромогенным анализом (Фигура 26). В качестве контроля использовали R8B12, неингибиторное антитело, и ESH4, ингибиторное антитело, нацеленное на С2-домен. ПЭГ-илированный ПЭГ2 действительно более устойчив к ингибированию mAB 413, чем BDD, и показывает сходный рисунок ингибирования в присутствии контрольных антител, которые не связываются вблизи положения 491. Кроме того, защитный эффект ПЭГ против ингибирования mAB 413 зависит от размера ПЭГ, при этом чем крупнее ПЭГ, тем сильнее эффект (Фигура 27). Чтобы проверить, является ли ПЭГ-илированный FVIII более устойчивым к ингибиторным антителам у пациентов, хромогенную активность измеряли в присутствии ряд выбранных образцов плазмы, происходящей от пациентов с гемофилией А, у которых выработались ингибиторы к FVIII. В 8 протестированных образцах плазмы пациентов 43 кДа-ПЭГ-илированный ПЭГ2 был более устойчивым к ингибированию плазмы пациентов, чем BDD в 4 образцах плазмы пациентов. Например, ПЭГ-илированный ПЭГ2, ПЭГ6 или ПЭГ2+6 показали более высокую остаточную активность, чем BDD в плазме одного пациента по сравнению с другой плазмой (Фигура 28). ДиПЭГ-илированный ПЭГ2+6, по-видимому, является более устойчивым, чем моноПЭГ-илированный ПЭГ2 или ПЭГ6. Эти результаты дают основание полагать, что ПЭГ-илированные ПЭГ-мутеины могут быть более эффективными при лечении пациентов, у которых вырабатываются ингибиторы к FVIII.
ВЫСОКОПРОИЗВОДИТЕЛЬНЫЙ СКРИНИНГ ПЭГИЛИРОВАНИЯ. Эффективность ПЭГ-илирования конкретного ПЭГ-мутеина непредсказуема, особенно ввиду того, что не имеется прямой структурной информации о BDD. Например, основываясь на структурной модели BDD, можно предсказать, что эффективность ПЭГ-илирования ПЭГ4 или ПЭГ5 должна быть очень высокой, подобно активности ПЭГ2 и ПЭГ15, поскольку все три положения находятся на поверхности и обращены кнаружи в соответствии со структурой. Таким образом, чтобы использовать ПЭГ для поиска нового механизма выведения через систематическое ПЭГ-илирование потребуется скринировать большое число мутеинов.
Чтобы быстро скринировать большое число ПЭГ-мутеинов, был разработан новый высокопроизводительный метод, с помощью которого можно проверить эффективность ПЭГ-илирования и функциональную активность ПЭГ-илированных продуктов от транзиентно трансфецированных мутеинов. Только 5-10 мл транзиентно экспрессированных ПЭГ-мутеинов с таким малым хромогенным значением FVIII, как 0,1-0,2 МЕ/мл, концентрируют примерно в 50 раз, используя устройство MWCO 30K Amicon-centra Ultra, так что концентрация FVIII достигает более 1 нМ, почти приближаясь к величине сродства антитела для взаимодействия с FVIII. Концентрированный ПЭГ-мутеин (~300 мкл) инкубируют с ~30 мкл полимера C7F7-антитела к FVIII в течение ночи при 4°С, промывают, элюируют, подвергают диализу и восстанавливают. Восстановитель удаляют и восстановленные ПЭГ-мутеины ПЭГ-илируют и исследуют с помощью Western-анализа, как описано выше (Фигуры 29 и 30). Относительная эффективность ПЭГ-илирования транзиентно экспрессированных ПЭГ-мутеинов точно соответствует таковой очищенных ПЭГ-мутеинов.
Этим методом можно скринировать множество ПЭГ-мутеинов за один-два месяца. Например, ПЭГ14 (K1804C BDD) имел, по меньшей мере, около 80% ПЭГ-илирования в легкой цепи 12 кДа-ПЭГом и не имел ПЭГ-илирования в тяжелой цепи (данные не показаны), что согласуется с K1804C-мутацией, расположенной на легкой цепи. На основании структуры BDD Сα-Сβ расстояние между K1804 и K1808 (ПЭГ6-положение) составляет только 8,4 ангстрема, и можно предположить, что введение 43 кДа-ПЭГ в это положение приведет к улучшению РК, подобному для 33 кДа-ПЭГ-илированного ПЭГ6 с намного лучшим результатом ПЭГ-илирования. Относительный результат ПЭГ-илирования для всех протестированных ПЭГ-мутеинов подытожен в Таблице 8. ПЭГ-илирование было высокоизбирательным для той конкретной цепи FVIII, где была введена цистеиновая мутация и в которой каждый мутеин с цистеином в тяжелой цепи становится ПЭГ-илированным только на тяжелой цепи, в то время как каждый мутеин с цистеином в легкой цепи становится ПЭГ-илированным только на легкой цепи. Номера мутеинов 2-31 представляют цистеиновые мутации замещения нативной аминокислоты в BDD в положении, обозначенном цистеином. ПЭГ2+6 является двойным мутеином BDD, где положения 491 и 1808 были замещены цистеинами. А1 и А2 (и В-домен для KG-2, FVIII полной длины) принадлежат тяжелой цепи, в то время как A3, С1 и С2 принадлежат легкой цепи. Эффективность ПЭГ-илирования оценивали по исследованию ПЭГ-илированных продуктов на SDS PAGE, сравнивая интенсивности ПЭГ-илированной полосы с неПЭГ-илированной полосой: +++ ~>80% результат ПЭГ-илирования, ++ ~30-70% результат, + ~10-30% результат и - ~<10% результат.
МАСС-СПЕКТРОМЕТРИЧЕСКИЙ АНАЛИЗ ВОССТАНОВЛЕННЫХ ПЭГ-МУТЕИНОВ. Чтобы определить идентичность «кэпа», который предотвращает прямое ПЭГ-илирование ПЭГ-мутеинов или FVIII полной длины, ПЭГ2+14 восстанавливали с помощью ТСЕР при концентрациях в интервале от 67 мкМ до 670 мкМ. Результат ПЭГ-илирования улучшался пропорционально увеличению количества ТСЕР (Фигура 31). Те же самые образцы анализировали также масс-спектроскопией до ПЭГ-илирования (Фигура 32). Для того чтобы получить протеиновый домен, который можно было бы изучать непосредственно, образцы расщепляли тромбином при соотношении 20 единиц/мг FVIII в течение 30 минут при 37°С. Расщепление тромбином производит А2-фрагмент, который включает остатки 372-740 и не занят сайтами гликозилирования. Расщепленные образцы вводили в систему жидкостной хроматографии с обращенной фазой С4 и элюент с колонки вводили непосредственно в квадрупольный времяпролетный масс-спектрометр через распылительный интерфейс. Масс-спектр от нижней части хроматографического пика, соответствующего А2-домену, развертывался, чтобы дать значение массы интактного протеина. До восстановления А2-домен ПЭГ2+14 давал массу, которая на 118 дальтон больше, чем предсказывалось теоретически. Когда концентрация ТСЕР увеличивается, появляется новый пик, который имеет точную предсказанную массу А2-домена. Доля этого нового пика возрастает при увеличении концентрации ТСЕР. Разница в 118 дальтон может быть отнесена на счет цистеинилирования на остатке Cys 491 через образование дисульфида с цистеином (119 Да) и инструментальной погрешности. Таким образом, это показывает, что ПЭГ-мутеины кэпированы цистеином, что предотвращает непосредственное ПЭГ-илирование.
Все раскрытые здесь ссылки включены сюда во всей их полноте.
Реферат
Изобретение относится к области молекулярной биологии и биохимии и может быть использовано в медицине. Предлагается конъюгат мутеина фактора свертывания крови VIII (FVIII), в котором не являющийся цистеином остаток в положении 41, 129, 377, 388, 468, 491, 556, 1804, 1808, 1810, 1812, 1813, 1815 и/или 2118 заменен остатком цистеина, с полиэтиленгликолем (ПЭГ), где молекула ПЭГ связана с полипептидом по мутантному цистеиновому остатку. Улучшение фармакокинетических свойств FVIII в составе конъюгата по изобретению при сохранении прокоагулянтной активности фактора позволяет предложить новые ПЭГ-илированные мутеины FVIII для получения фармацевтических композиций, предназначенных для лечения гемофилии. 4 н. и 8 з.п.ф-лы, 38 ил., 8 табл.
Формула
мутирование нуклеотидной последовательности, которая кодирует функциональный полипептид фактора VIII с SEQ ID NO:3, для замещения кодона нецистеинового аминокислотного остатка в положении 41, 129, 377, 378, 491, 468, 556, 1804, 1808, 1810, 1812, 1813, 1815 и/или 2118 согласно нумерации остатков в SEQ ID NO:4 кодоном цистеинового аминокислотного остатка;
экспрессию мутированной нуклеотидной последовательности в клетке-хозяине, которую культивируют в клеточной культуральной среде, содержащей сульфгидрильные группы;
очистку мутеина;
контактирование мутеина с восстановителем при условиях, в которых мутеин мягко восстанавливается и высвобождаются сульфгидрильные группы;
удаление высвободившихся сульфгидрильных групп и восстановителя из мутеина;
реагирование мутеина с полиэтиленгликолем, который активирован для реакции с восстановленными цистеиновыми остатками с помощью сульфгидрильного фрагмента, спустя, по меньшей мере, около 5 мин после удаления восстановителя;
очистку конъюгата.
Документы, цитированные в отчёте о поиске
Полипептиды, обладающие единственным ковалентно связанным n-концевым водорастворимым полимером
