Быстродействующий герметик и способы его применения и изготовления - RU2442612C2
Код документа: RU2442612C2
Чертежи


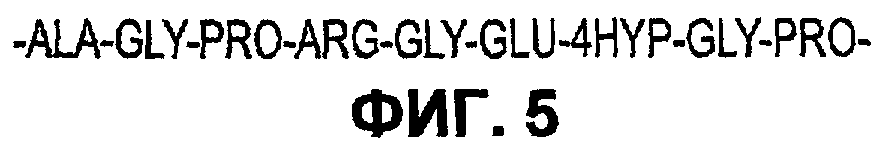





Описание
Перекрестная ссылка на родственные заявки
Настоящая заявка испрашивает приоритет заявки на патент США № 60/821190, поданной 2 августа 2006 г. Эта заявка также связана с патентами США №№ 5874500, 6063061, 6066325, 6166130 и 6458889. Содержание каждого их этих документов включено в настоящее описание в качестве ссылки.
Заявление относительно прав на изобретения, созданные в результате научных исследований и разработок, финансируемых федеральными органами, не применимо.
Ссылка на «Список последовательностей», таблицу или приложение в виде компьютерной программы составления списка, представленного на компактном диске, не применимо.
Предшествующий уровень техники
В патенте США № 5162430, выданном 10 ноября 1992 г. Rhee et al., обсуждаются конъюгаты коллагена-синтетического полимера, полученные ковалентным связыванием коллагена с синтетическими гидрофильными полимерами, такими как различные производные полиэтиленгликоля. В патенте США № 5324775, выданном 28 июня 1994 г. Rhee et al., обсуждаются различные вставочные, встречающиеся в природе, биологически совместимые с живыми тканями полимеры (такие как полисахариды), ковалентно связанные с синтетическими, не иммуногенными, гидрофильными полимерами полиэтиленгликоля. В патенте США № 5328955, выданном 12 июля 1994 г. Rhee et al., обсуждаются различные активированные формы полиэтиленгликоля и различные связи, которые можно использовать для получения конъюгатов коллагена-синтетического полимера, имеющих диапазон физических и химических свойств.
В документе под серийным № 08/403358, поданном 14 марта 1995 г., обсуждается композиция поперечно сшитого биологического материала, который получен с использованием гидрофобного агента поперечной сшивки, или смеси гидрофильных и гидрофобных поперечно сшивающих агентов. Гидрофобные поперечно сшивающие агенты могут включать любой гидрофобный полимер, который содержит или может быть химически дериватизирован для содержания двух или более сукцинимидильных групп.
В патенте США № 5580923, выданном 3 декабря 1996 г. Yeung et al., обсуждается композиция, которую можно использовать для предотвращения хирургических спаек, включающая материал подложки и противоадгезионный связывающий агент, где материал подложки, предпочтительно включающий коллаген и связывающий агент, предпочтительно включает, по меньшей мере, одну функциональную группу, реагирующую с тканью, и, по меньшей мере, одну функциональную группу, реагирующую с субстратом.
В патенте США № 5614587, выданном 25 марта 1997 г. Rhee et al., обсуждаются биоадгезионные композиции, включающие коллаген, поперечно сшитый с использованием мультифункционально активированного синтетического гидрофильного полимера, а также способы применения таких композиций для воздействия на адгезию между первой поверхностью и второй поверхностью, где, по меньшей мере, одна из первой и второй поверхности может представлять собой поверхность нативной ткани.
В японской патентной публикации № 07090241 обсуждается композиция, используемая для временной адгезии материала хрусталика к подложке для установки материала на устройство для станочной обработки, включающей смесь полиэтиленгликоля, имеющего молекулярную массу в диапазоне от 1000 до 5000, и поли-N-винилпирролидона, имеющего среднюю молекулярную массу в диапазоне от 30000 до 200000.
В документе West and Hubbell, Biomaterials (1995) 16:1153-1156 обсуждается предотвращение послеоперационных спаек с использованием фотополимеризованного гидрогеля полиэтиленгликоля-со-диакрилата молочной кислоты и физически поперечно сшитого гидрогеля полиэтиленгликоля-со-пропиленгликоля, Poloxamer 407®.
Патенты США №№ 5672336 и 5196185 описывают раневой перевязочный материал, включающий волокнистый коллаген в виде микрочастиц, имеющий размер частиц 0,5-2,0 мкм. Эта композиция в целом включает водную фазу и может не образовывать гидрогель, как описано в настоящем изобретении. В патенте США № 5698213 описан гидрогель поперечно сшитого алифатического сложного полиэфира, используемый в качестве абсорбируемого хирургического устройства и носителя для доставки лекарственных средств. В патенте США № 5674275 описан гидрогелевый клеящий агент на основе акрилата или метакрилата. В патенте США № 5306501 описан термообратимый гидрогель на основе полиоксиалкилена, который можно использовать в качестве носителя для доставки лекарственных средств.
В патентах США №№ 4925677 и 5041292 описан гидрогель, включающий белковый компонент, поперечно сшитый с полисахаридом или мукополисахаридом, и который можно использовать в качестве носителя для доставки лекарственных средств.
Биологически разлагаемые инъецируемые полимеры для доставки лекарственных средств описаны в патенте США № 5384333 и в документе Jeong et al. (1997) “Nature”, 388:860-862. Биологически разлагаемые гидрогели для регулируемой доставки высвобождаемых лекарственных средств описаны в патенте США № 4925677. Поглощаемые системы доставки лекарственных средств на основе коллагена описаны в патентах США №№ 4347234 и 4291013. Биологически совместимые пленки на основе аминополисахаридов для доставки лекарственных средств описаны в патентах США №№ 5300494 и 4946870. Растворимые в воде носители для доставки таксола описаны в патенте США № 5648506.
Полимеры использовались в качестве носителей терапевтических средств для осуществления локализованного и длительного высвобождения (Langer, et al., Rev. Macro. Chem. Phys., C23 (1), 61, 1983; Controlled Drug Delivery, Vol. I and II, Bruck, S.D., (ed.), CRC Press, Boca Raton, Fla., 1983; Leong et al., Adv. Drug Delivery Review, 1:199, 1987). Эти системы доставки терапевтических средств имитируют вливание и предоставляют возможность повышения терапевтической эффективности и сниженной системной токсичности.
Другие классы синтетических полимеров, которые были предложены для доставки лекарственных средств с регулируемым высвобождением, включают сложные полиэфиры (Pitt, et al., в документе Controlled Release of Bioactive Materials, R. Baker, Ed., Academic Press, New York, 1980); полиамиды (Sidman, et al., Journal of Membrane Science, 7:227, 1979); полиуретаны (Master, et al., Journal of Polymer Science, Polymer Symposium, 66:259, 1979); полиортоэфиры (Heller, et al., Polymer Engineereing Scient, 21:727, 1981) и полиангидриды (Leong, et al., Biomaterials, 7:364, 1986).
Содержащие коллаген композиции, которые были механически разрушены для изменения их физических свойств, описаны в патентах США №№ 5428024; 5352715 и 5204382. Эти патенты в целом относятся к волокнистым и нерастворимым коллагенам. Инъецируемая композиция коллагена описана в патенте США № 4803075. Инъецируемая композиция кости/хряща описана в патенте США № 5516532. Матрица доставки на основе коллагена, включающая сухие частицы с диапазоном размера от 5 мкм до 850 мкм, которые могут быть суспендированы в воде, и которая имеет определенную плотность заряда поверхности, описана в документе WO 96/39159. Препарат коллагена, имеющий размер частиц от 1 мкм до 50 мкм, используемый в качестве аэрозольного спрея для образования раневой повязки, описан в патенте США № 5196185. Другие патенты, описывающие коллагеновые композиции, включают патенты США №№ 5672336 и 5356614. Полимерный, не эродируемый гидрогель, который может быть поперечно сшит и инъецирован посредством шприца, описан в документе WO 96/06883.
Следующие одновременно поданные заявки, права на которые переданы правопреемнику настоящей заявки, содержат связанный предмет изобретения: заявка на патент США под серийным № 08/903674, поданная 31 июля 1997 г.; заявка на патент США под серийным № 60/050437, поданная 18 июня 1997 г.; заявка на патент США под серийным № 08/704852, поданная 27 августа 1996 г.; заявка на патент США под серийным № 08/673710, поданная 19 июня 1996 г.; заявка на патент США под серийным № 60/011898, поданная 20 февраля 1996 г.; заявка на патент США под серийным № 60/006321, поданная 7 ноября 1996 г.; заявка на патент США под серийным № 60/006322, поданная 7 ноября 1996 г.; заявка на патент США под серийным № 60/006324, поданная 7 ноября 1996 г.; и заявка на патент США под серийным № 08/481712, поданная 7 июня 1995 г. Полное описание каждой из этих заявок включено в настоящее описание в качестве ссылки. Каждая публикация, приведенная выше и в настоящем абзаце, полностью включена в настоящее описание в качестве ссылки. Имеются разнообразные материалы для использования в качестве биоадгезионных агентов, для наращивания ткани, для предотвращения послеоперационных спаек, для покрытия поверхностей синтетических имплантатов, в качестве матриц для доставки лекарственных средств, для офтальмологических видов применения и тому подобного. Кроме того, во многих случаях время отверждения этих материалов может быть меньше, чем оптимальное, тогда как для хирургических и других видов медицинского применения часто предпочтителен быстродействующий материал. В других случаях имеющиеся в настоящее время материалы могут проявлять свойства набухания, которые нежелательны для определенных видов хирургического применения. Таким образом, существует необходимость в быстродействующих материалах для применения, например, в качестве тканевого герметика для видов применения с целью гемостаза и/или герметизации ран. Было бы также желательно предоставить материалы, которые проявляют свойства минимального набухания.
Краткое описание сущности изобретения
Настоящее изобретение предоставляет композиции для достижения гемостаза или другого удерживания жидкости в условиях in vivo. Композиции по изобретению включают первый и второй поперечно сшиваемые компоненты и, по меньшей мере, один компонент, образующий гидрогель, в композиции, подходящей для применения у позвоночного для содействия удерживанию жидкости. Композиции включают быстродействующие материалы для применения, например, в качестве тканевого герметика с целью гемостаза и/или герметизации ран. Композиции проявляют свойства минимального набухания.
В первом аспекте варианты осуществления настоящего изобретения относятся к композиции, которая включает первый поперечно сшиваемый компонент, второй поперечно сшиваемый компонент, который поперечно сшивается с первым поперечно сшиваемым компонентом в условиях, обеспечивающих возможность взаимодействия, и образующий гидрогель компонент. Первый и второй поперечно сшиваемые компоненты поперечно сшиваются для образования пористой матрицы, имеющей промежутки, а образующий гидрогель компонент способен гидратироваться с образованием гидрогеля для заполнения, по меньшей мере, некоторых промежутков. В некоторых аспектах рН образующего гидрогель компонента может воздействовать на время реакции для образования матричного барьера герметика. Например, в некоторых вариантах осуществления композиция, которая включает образующий гидрогель компонент, имеющий рН 6,75, обеспечивает более длительное время реакции, чем композиция, которая включает образующий гидрогель компонент, имеющий рН 9,5.
Первый поперечно сшиваемый компонент может включать множественные нуклеофильные группы, а второй поперечно сшиваемый компонент может включать множественные электрофильные группы. В некоторых аспектах первый поперечно сшиваемый компонент включает мультинуклеофильный полиалкиленоксид, имеющий m нуклеофильных групп, а второй поперечно сшиваемый компонент включает мультиэлектрофильный полиалкиленоксид, имеющий n электрофильных групп, где каждый из m и n больше или равен двум, и где m+n больше или равно пяти. В некоторых аспектах n равно двум, а m больше или равно трем. Мультинуклеофильный полиалкиленоксид может быть тетрафункционально активированным. В некоторых аспектах m=2, а n больше или равно трем. Мультиэлектрофильный полиалкиленоксид может быть тетрафункционально активированным. В некоторых случаях и мультинуклеофильный полиалкиленоксид, и мультиэлектрофильный полиалкиленоксид являются тетрафункционально активированными. Мультинуклеофильный полиалкиленоксид может включать две или более нуклеофильные группы, например, -NH2, -SH, -H, -PH2 и/или -CO-NH-NH2. В некоторых случаях мультинуклеофильный полиалкиленоксид включает две или более первичных аминогрупп. В некоторых случаях мультинуклеофильный полиалкиленоксид включает две или более тиольные группы. Мультинуклеофильный полиалкиленоксид может представлять собой полиэтиленгликоль или его производное. В некоторых случаях полиэтиленгликоль включает две или более нуклеофильные группы, которые могут включать первичную аминогруппу и/или тиольную группу. Мультиэлектрофильный полиалкиленоксид может включать две или более электрофильные группы, такие как -CO2N(COCH2)3, -CO2H, -CHO, -CHOCO2, -N=C=O, -SO2CH-CH2, -N(COCH)2 и/или -S-S-(C5H4N). Мультиэлектрофильный полиалкиленоксид может включать две или более сукцинимидильные группы. Мультиэлектрофильный полиалкиленоксид может включать две или более малеимидильные группы. В некоторых случаях мультиэлектрофильный полиалкиленоксид может представлять собой полиэтиленгликоль или его производное.
В некоторых аспектах композиция включает полисахарид или белок. Полисахарид может представлять собой гликозаминогликан, такой как гиалуроновая кислота, хитин, хондроитинсульфат А, хондроитинсульфат В, хондроитинсульфат С, кератинсульфат, кератосульфат, гепарин или его производное. Белок может представлять собой коллаген или его производное. Мультинуклеофильный полиалкиленоксид или мультиэлектрофильный полиалкиленоксид, или и мультинуклеофильный полиалкиленоксид, и мультиэлектрофильный полиалкиленоксид могут включать связывающую группу. В некоторых случаях мультинуклеофильный полиалкиленоксид может быть представлен формулой: полимер-Q1-Xm. Мультиэлектрофильный полиалкиленоксид может быть представлен формулой: полимер-Q2-Yn. X может представлять собой электрофильную группу, а Y может представлять собой нуклеофильную группу, каждый из m и n может быть равен 2-4, m+n может быть ≤5, и каждый из Q1 и Q2 может представлять собой связывающую группу, такую как -O-(CH2)n-, -S-, -(CH2)n-, -NH-(CH2)n-, -O2C-NH-(CH2)n-, -O2C-(CH2)n-, -O2C-CR1H и/или O-R2-CO-NH. В некоторых случаях n' может быть равен 1-10, R' может представлять собой -H,-CH3, или C2H5, R2 может представлять собой -CH2- или -CO-NH-CH2-CH2-, Q1 и Q2 могут быть одинаковыми или различными или могут отсутствовать. В некоторых аспектах Y может представлять собой -CO2N(COCH2)2 или -CO2N(COCH2)2. В некоторых случаях мультинуклеофильный полиалкиленоксид или мультиэлектрофильный полиалкиленоксид, или и мультинуклеофильный полиалкиленоксид, и мультиэлектрофильный полиалкиленоксид, кроме того, включают биологически разлагаемую группу. Биологически разлагаемая группа может представлять собой лактид, гликозид, ε-капролактон, поли(α-гидроксикислоту), поли(аминокислоту) или поли(ангидрид). В некоторых аспектах образующий гидрогель компонент способен гидратироваться с образованием фрагментированного биологически совместимого гидрогеля, который включает желатин и поглощает воду при доставке в целевой участок влажной ткани. Гидрогель может включать субъединицы, имеющие размеры в диапазоне от примерно 0,01 мм до примерно 5 мм при полной гидратации, и равновесное набухание в диапазоне от примерно 400% до примерно 5000%. В некоторых случаях гидрогель имеет время разложения in vivo менее чем один год. В некоторых случаях гидрогель, по меньшей мере, частично гидратирован водной средой и включает активный агент, который может включать агент, вызывающий свертывание крови, такой как тромбин.
В другом аспекте варианты осуществления настоящего изобретения относятся к способу доставки активного агента пациенту. Способ может включать введение в участок-мишень на теле пациента некоторого количества композиции, как описано в настоящем документе. В некоторых аспектах варианты осуществления включают способ доставки герметизирующего агента пациенту. Способ может включать введение в кровоточащий участок-мишень описанной в настоящем документе композиции в количестве, достаточном для ингибирования кровотечения. В некоторых аспектах варианты осуществления включают способ доставки тромбина пациенту. Способ может включать введение в кровоточащий участок-мишень некоторого количества описанной в настоящем документе композиции в количестве, достаточном для ингибирования кровотечения.
В других аспектах, варианты осуществления настоящего изобретения охватывают композицию, которая включает мультинуклеофильный полиалкиленоксид, мультиэлектрофильный полиалкиленоксид и образующий гидрогель компонент. Мультинуклеофильный полиалкиленоксид, кроме того, может включать, по меньшей мере, одну первичную аминогруппу и, по меньшей мере, одну тиольную группу. В условиях, обеспечивающих возможность реакции, мультинуклеофильный полиалкиленоксид и мультиэлектрофильный полиалкиленоксид способны по существу к немедленной поперечной сшивке. Варианты осуществления охватывают композиции, где мультинуклеофильный полиалкиленоксид включает две или более тиольные группы, а мультиэлектрофильный полиалкиленоксид включает две или более электрофильные группы, такие как сукцинимидильная группа и/или малеимидильная группа. Варианты осуществления также охватывают композиции, где мультинуклеофильный полиалкиленоксид включает две или более нуклеофильные группы, такие как первичная аминогруппа и/или тиольная группа. Мультиэлектрофильный полиалкиленоксид может включать две или более сукцинимидильные группы. В некоторых случаях варианты осуществления также охватывают композиции, которые включают первый полиэтиленгликоль, имеющий две или более тиольные группы, второй полиэтиленгликоль, имеющий две или более сукцинимидильные группы или малеимидильные группы, и образующий гидрогель компонент. Сумма тиольных групп и сукцинимидильных или малеимидильных групп может составлять, по меньшей мере, пять, и в условиях, обеспечивающих возможность реакции, первый полиэтиленгликоль и второй полиэтиленгликоль могут быть способны по существу к немедленной поперечной сшивке. В некоторых случаях первый полиэтиленгликоль включает четыре тиольные группы, а второй полиэтиленгликоль включает четыре сукцинимидильные группы. В некоторых случаях композиция включает белок или полисахарид. Полисахарид может представлять собой гликозаминогликан, такой как гиалуроновая кислота, хитин, хондроитинсульфат А, хондроитинсульфат В, хондроитинсульфат С, кератинсульфат, кератосульфат, гепарин или его производное. Белок может представлять собой коллаген или его производное.
В другом аспекте варианты осуществления настоящего изобретения включают способ герметизации тканевого тракта. Способ может включать, по меньшей мере, частичное заполнение тканевого тракта композицией, которая включает первый поперечно сшиваемый компонент, второй поперечно сшиваемый компонент, который поперечно сшивается с первым поперечно сшиваемым компонентом в условиях, обеспечивающих возможность взаимодействия, и образующий гидрогель компонент. Первый и второй поперечно сшиваемые компоненты поперечно сшиваются для образования пористой матрицы, имеющей промежутки, а образующий гидрогель компонент способен гидратироваться с образованием гидрогеля для заполнения, по меньшей мере, некоторых промежутков. В некоторых случаях гидрогель включает субъединицы, имеющие размеры в диапазоне от примерно 0,05 мм до примерно 5 мм при полной гидратации, которые имеют равновесное набухание в диапазоне от примерно 400% до примерно 1300%, и разлагаются в тканевом тракте после периода от примерно 1 до примерно 120 дней. В некоторых случаях первый поперечно сшиваемый компонент включает множественные нуклеофильные группы, а второй полимер включает множественные электрофильные группы.
В еще одном аспекте варианты осуществления настоящего изобретения включают способ ингибирования кровотечения в участке-мишени в теле пациента. Способ может включать доставку композиции в участок-мишень в количестве, достаточном для ингибирования кровотечения, где композиция включает первый поперечно сшиваемый компонент, второй поперечно сшиваемый компонент, который поперечно сшивается с первым поперечно сшиваемым компонентом в условиях, обеспечивающих возможность взаимодействия, и образующий гидрогель компонент. Первый и второй поперечно сшиваемые компоненты могут поперечно сшиваться для образования пористой матрицы, имеющей промежутки, а образующий гидрогель компонент может быть способен гидратироваться для образования гидрогеля для заполнения, по меньшей мере, некоторых промежутков. Гидрогель может включать субъединицы, которые имеют размеры в диапазоне от примерно 0,05 мм до примерно 5 мм при полной гидратации, которые имеют равновесное набухание в диапазоне от примерно 400% до примерно 1300% и которые разлагаются в тканевом тракте после периода от примерно 1 до примерно 120 дней. Первый поперечно сшиваемый компонент может включать множественные нуклеофильные группы, а второй поперечно сшиваемый компонент может включать множественные электрофильные группы. В другом аспекте варианты осуществления настоящего изобретения включают способ доставки биологически активного вещества в участок-мишень в теле пациента. Способ может включать доставку композиции в комбинации с биологически активным веществом в участок-мишень, где композиция включает первый поперечно сшиваемый компонент, второй поперечно сшиваемый компонент, который поперечно сшивается с первым поперечно сшиваемым компонентом в условиях, обеспечивающих возможность взаимодействия, и образующий гидрогель компонент. Первый и второй поперечно сшиваемые компоненты могут поперечно сшиваться для образования пористой матрицы, имеющей промежутки, а образующий гидрогель компонент может быть способен гидратироваться для образования гидрогеля для заполнения, по меньшей мере, некоторых промежутков. Гидрогель может иметь субъединицы, имеющие размеры в диапазоне от примерно 0,05 мм до примерно 5 мм при полной гидратации, равновесное набухание в диапазоне от примерно 400% до примерно 1300%, и могут разлагаться в тканевом тракте после периода от примерно 1 до примерно 120 дней. В других случаях первый поперечно сшиваемый компонент включает множественные нуклеофильные группы, а второй поперечно сшиваемый компонент включает множественные электрофильные группы. Биологически активное вещество может представлять собой гемостатический агент, такой как тромбин.
В другом аспекте варианты осуществления настоящего изобретения включают способ доставки способной к набуханию композиции к участку-мишени в ткани. Способ может включать нанесение композиции на участок-мишень, где композиция включает первый поперечно сшиваемый компонент, второй поперечно сшиваемый компонент, который поперечно сшивается с первым поперечно сшиваемым компонентом в условиях, обеспечивающих возможность взаимодействия, и образующий гидрогель компонент. Первый и второй поперечно сшиваемые компоненты могут поперечно сшиваться для образования пористой матрицы, имеющей промежутки, а образующий гидрогель компонент может быть способен гидратироваться для образования гидрогеля для заполнения, по меньшей мере, некоторых промежутков. Гидрогель может включать субъединицы, которые имеют размеры в диапазоне от примерно 0,05 мм до примерно 5 мм при полной гидратации, которые имеют равновесное набухание в диапазоне от примерно 400% до примерно 1300% и которые разлагаются в тканевом тракте после периода от примерно 1 до примерно 120 дней. Композиция может быть гидратирована при менее чем его равновесном набухании после нанесения на участок-мишень, где она набухает до равновесной величины набухания. В некоторых аспектах первый поперечно сшиваемый компонент включает множественные нуклеофильные группы, а второй поперечно сшиваемый компонент включает множественные электрофильные группы. В некоторых аспектах участок-мишень находится в ткани, которая может представлять собой мышцу, кожу, эпителиальную ткань, гладкую, скелетную или сердечную мышцу, соединительную или опорную ткань, нервную ткань, ткань глаз и других органов чувств, сосудистую и сердечную ткань, желудочно-кишечные органы и ткани, плевру и другие легочные ткани, эндокринные железы, мужские и женские репродуктивные органы, жировую ткань, ткань печени, поджелудочной железы, лимфатической системы, хряща, кости, ротовой полости, и ткань слизистых оболочек, и ткань селезенки, и других органов брюшной полости. В некоторых аспектах участок-мишень включает полую область внутри выбранной ткани, такую как расслоение ткани, тканевой тракт, внутрипозвонковое пространство или полость тела. В некоторых случаях гидрогель имеет степень гидратации в диапазоне от 50% до 95% гидратации при равновесном набухании. В некоторых случаях гидрогель включает пластификатор, такой как полиэтиленгликоль, сорбит и глицерин. Пластификатор может присутствовать в количестве от 0,1% мас. до 30% мас. композиции гидрогелевого компонента. В некоторых случаях гидрогель включает поперечно сшитый белковый гидрогель. Белок может включать желатин, растворимый коллаген, альбумин, гемоглобин, фибриноген, фибрин, казеин, фибронектин, эластин, кератин, ламинин и их производные и комбинации. В некоторых случаях гидрогель включает поперечно сшитый полисахарид. Полисахарид может включать гликозаминогликаны, производные крахмала, производные целлюлозы, производные гемицеллюлозы, ксилан, агарозу, альгинат и хитозан и их комбинации. В некоторых случаях гидрогель включает поперечно сшитый не биологический полимер. Поперечно сшитый не биологический полимер может включать полиакрилаты, полиметакрилаты, полиакриламиды, поливиниловые каучуки, полилактид-гликолиды, поликапролактоны, полиоксиэтилены и их комбинации. В некоторых случаях гидрогель включает, по меньшей мере, два компонента, выбранных из группы, которая включает поперечно сшитые белки, поперечно сшитые полисахариды и поперечно сшитые не биологические полимеры. Гидрогель может включать гидрогелевый полимер и гидрогелевый поперечно сшивающий агент. Гидрогелевый полимер и гидрогелевый поперечно сшивающий агент могут быть подвергнуты реакции в условиях, которые обеспечивают поперечную сшивку молекул гидрогелевого полимера. В некоторых случаях гидрогель включает молекулярный поперечно сшитый гидрогелевый полимер, который был получен облучением гидрогеля в условиях, которые обеспечивают поперечную сшивку молекул гидрогелевого полимера. В некоторых случаях гидрогель включает молекулярный поперечно сшитый гидрогелевый полимер, который был получен взаимодействием мононенасыщенных и полиненасыщенных мономеров гидрогеля в условиях, которые обеспечивают поперечную сшивку молекул гидрогелевого полимера.
В еще одном аспекте варианты осуществления настоящего изобретения охватывают способ формирования трехмерной синтетической полимерной матрицы. Способ включает предоставление первого поперечно сшиваемого компонента, содержащего m нуклеофильных групп, и второго поперечно сшиваемого компонента, содержащего n электрофильных групп. Электрофильные группы взаимодействуют с нуклеофильными группами для образования с ними ковалентных связей, каждый из m и n больше или равен двум, а m+n больше или равен пяти. Способ также включает комбинирование первого поперечно сшиваемого компонента и второго поперечно сшиваемого компонента, добавление образующего гидрогель компонента к первому поперечно сшиваемому компоненту и второму поперечно сшиваемому компоненту и предоставление возможности первому поперечно сшиваемому компоненту и второму поперечно сшиваемому компоненту стать поперечно сшитыми друг с другом для образования трехмерной матрицы. Способ может также включать контакт первой тканевой поверхности и второй поверхности с первым поперечно сшиваемым компонентом, вторым поперечно сшиваемым компонентом и образующим гидрогель компонентом. В некоторых случаях вторая поверхность представляет собой поверхность нативной ткани. В некоторых случаях вторая поверхность представляет собой поверхность не нативной ткани, такой как синтетический имплантат. Синтетический имплантат может представлять собой донорскую роговицу, искусственный кровеносный сосуд, сердечный клапан, искусственный орган, костный протез, имплантируемый хрусталик, сосудистый трансплантат, стент или комбинацию стента/трансплантата. В некоторых случаях каждый из первого поперечно сшиваемого компонента, второго поперечно сшиваемого компонента и образующего гидрогель компонента наносится в порошкообразной форме на первую тканевую поверхность. В некоторых случаях каждый из первого поперечно сшиваемого компонента, второго поперечно сшиваемого компонента и образующего гидрогель компонента наносится в порошкообразной форме в одном комбинированном, смешанном, порошкообразном составе на первую тканевую поверхность. Смешанный порошкообразный состав может включать белок и/или полисахарид. Первая тканевая поверхность может находиться на или в твердой ткани или мягкой ткани. Первая тканевая поверхность может также включать, окружать или прилегать к хирургическому участку. Способ может также включать закрытие хирургического участка. В некоторых случаях смешанный порошкообразный состав включает коллаген. В некоторых случаях смешанный порошкообразный состав включает биологически активный агент. В некоторых аспектах варианты осуществления настоящего изобретения охватывают смешанную порошкообразную композицию, которая включает первый поперечно сшиваемый компонент в порошкообразной форме, имеющий множественные нуклеофильные группы, и второй поперечно сшиваемый компонент в порошкообразной форме, имеющий множественные электрофильные группы, и образующий гидрогель компонент в порошкообразной форме. В условиях, обеспечивающих возможность реакции, первый и второй поперечно сшиваемые компоненты способны по существу к немедленной поперечной сшивке.
В связанном аспекте первый поперечно сшиваемый компонент, добавленный ко второму поперечно сшиваемому компоненту, обеспечивает комбинированную композицию поперечно сшиваемых компонентов. Первый поперечно сшиваемый компонент может присутствовать в концентрации в диапазоне от примерно 5 до примерно 20% мас. комбинированной композиции поперечно сшиваемых компонентов. В некоторых случаях второй поперечно сшиваемый компонент может присутствовать в концентрации в диапазоне от примерно 0,5 до примерно 20% мас. комбинированной композиции поперечно сшиваемых компонентов. Массовое отношение первого поперечно сшиваемого компонента ко второму поперечно сшиваемому компоненту может находиться в диапазоне от примерно 45% до примерно 55%. Соответственно, массовое отношение первого поперечно сшиваемого компонента ко второму поперечно сшиваемому компоненту может составлять примерно 50%. В некоторых случаях массовое соотношение между первым и вторым поперечно сшиваемыми компонентами и образующим гидрогель компонентом может быть в пределах диапазона от примерно 28% до примерно 42% мас./мас. Соответственно, массовое соотношение между первым и вторым поперечно сшиваемыми компонентами и образующим гидрогель компонентом может быть в пределах диапазона примерно от 28% до примерно 30% мас./мас. В некоторых аспектах первый поперечно сшиваемый компонент может присутствовать в концентрации в диапазоне от примерно 0,5 до примерно 20% мас. комбинированной композиции поперечно сшиваемых компонентов. Соответственно, второй поперечно сшиваемый компонент может присутствовать в концентрации в диапазоне от примерно 0,5 до примерно 20% мас. комбинированной композиции поперечно сшиваемых компонентов. Массовое отношение первого поперечно сшиваемого компонента ко второму поперечно сшиваемому компоненту может находиться в диапазоне от примерно 45% до примерно 55%. Аналогичным образом, массовое отношение первого поперечно сшиваемого компонента ко второму поперечно сшиваемому компоненту может составлять примерно 50%.
В другом аспекте варианты осуществления настоящего изобретения относятся к наборам матричной композиции герметика. Набор может включать, например, контейнер и смешанную порошкообразную композицию, расположенную внутри контейнера. Композиция может включать первый поперечно сшиваемый компонент, имеющий множественные нуклеофильные группы, и второй поперечно сшиваемый компонент, имеющий множественные электрофильные группы. Первый поперечно сшиваемый компонент, второй поперечно сшиваемый компонент или они оба могут быть в порошкообразной форме. Набор может также включать образующий гидрогель компонент в порошкообразной форме. В обеспечивающих возможность реакции условиях первый и второй поперечно сшиваемые компоненты могут быть способны по существу к немедленной поперечной сшивке. В некоторых случаях контейнер включает цилиндрический корпус шприца и поршень шприца. Набор может также включать письменные инструкции по нанесению смешанной порошкообразной композиции на кровоточащий участок-мишень пациента. В некоторых случаях смешанный порошок включает активный агент. Активный агент может включать тромбин. В другом аспекте набор может включать коллагеновую губку или другую подходящую подложку и смешанную порошковую композицию, фиксированную на поверхности губки или подложки. Композиция может включать первый поперечно сшиваемый компонент, имеющий множественные нуклеофильные группы, и второй поперечно сшиваемый компонент, имеющий множественные электрофильные группы. Первый поперечно сшиваемый компонент, второй поперечно сшиваемый компонент или они оба могут быть в порошкообразной форме. Набор может также включать образующий гидрогель компонент в порошкообразной форме. В обеспечивающих возможность реакции условиях первый и второй поперечно сшиваемые компоненты могут быть способны по существу к немедленной поперечной сшивке.
Для более полного понимания сущности и преимуществ настоящего изобретения необходимо сослаться на следующее детальное описание, взятое в сочетании с сопровождающими чертежами.
В настоящее изобретение включено, но этим не ограничено, следующее:
1. Композиция, включающая:
первый поперечно сшиваемый компонент;
второй поперечно сшиваемый компонент, который поперечно сшивается с первым поперечно сшиваемым компонентом в условиях, обеспечивающих возможность взаимодействия; и
образующий гидрогель компонент;
где первый и второй поперечно сшиваемые компоненты поперечно сшиваются для образования пористой матрицы, имеющей промежутки, и где образующий гидрогель компонент способен гидратироваться с образованием гидрогеля для заполнения, по меньшей мере, некоторых промежутков.
2. Композиция по параграфу 1, где первый поперечно сшиваемый компонент включает множественные нуклеофильные группы, а второй поперечно сшиваемый компонент включает множественные электрофильные группы.
3. Композиция по параграфу 1, где первый поперечно сшиваемый компонент включает мультинуклеофильный полиалкиленоксид, имеющий m нуклеофильных групп, а второй поперечно сшиваемый компонент включает мультиэлектрофильный полиалкиленоксид, имеющий n электрофильных групп, где каждый из m и n больше или равен двум, и где m+n больше или равно пяти.
4. Композиция по параграфу 3, где n равно двум и где m больше или равно трем.
5. Композиция по параграфу 4, где мультинуклеофильный полиалкиленоксид является тетрафункционально активированным.
6. Композиция по параграфу 3, где m=2 и где n больше или равно трем.
7. Композиция по параграфу 6, где мультиэлектрофильный полиалкиленоксид является тетрафункционально активированным.
8. Композиция по параграфу 3, где и мультинуклеофильный полиалкиленоксид, и мультиэлектрофильный полиалкиленоксид являются тетрафункционально активированными.
9. Композиция по параграфу 3, где мультинуклеофильный полиалкиленоксид, кроме того, включает две или более нуклеофильные группы, состоящие из NH2, -SH, -H, -PH2 и -CO-NH-NH2.
10. Композиция по параграфу 3, где мультинуклеофильный полиалкиленоксид, кроме того, включает две или более первичные аминогруппы.
11. Композиция по параграфу 3, где мультинуклеофильный полиалкиленоксид, кроме того, включает две или более тиольные группы.
12. Композиция по параграфу 3, где мультинуклеофильный полиалкиленоксид представляет собой полиэтиленгликоль или его производное.
13. Композиция по параграфу 12, где полиэтиленгликоль, кроме того, включает две или более нуклеофильные группы, выбранные из группы, состоящей из первичной аминогруппы и тиольной группы.
14. Композиция по параграфу 3, где мультиэлектрофильный полиалкиленоксид, кроме того, включает две или более электрофильные группы, выбранные из группы, состоящей из
-CO2N(COCH2)3, -CO2H, -CHO, -CHOCO2, -N=C=O, -SO2CH-CH2, -N(COCH)2 и -S-S-(C5H4N).
15. Композиция по параграфу 3, где мультиэлектрофильный полиалкиленоксид, кроме того, включает две или более сукцинимидильные группы.
16. Композиция по параграфу 3, где мультиэлектрофильный полиалкиленоксид, кроме того, включает две или более малеимидильные группы.
17. Композиция по параграфу 3, где мультиэлектрофильный полиалкиленоксид представляет собой полиэтиленгликоль или его производное.
18 Композиция по параграфу 3, кроме того, включающая полисахарид или белок.
19 Композиция по параграфу 3, кроме того, включающая полисахарид, где полисахарид представляет собой гликозаминогликан.
20. Композиция по параграфу 19, где гликозаминогликан выбран из группы, состоящей из гиалуроновой кислоты, хитина, хондроитинсульфата А, хондроитинсульфата В, хондроитинсульфата С, кератинсульфата, кератосульфата, гепарина и их производных.
21. Композиция по параграфу 3, кроме того, включающая белок, где белок представляет собой коллаген или его производное.
22. Композиция по параграфу 3, где мультинуклеофильный полиалкиленоксид или мультиэлектрофильный полиалкиленоксид или и мультинуклеофильный полиалкиленоксид, и мультиэлектрофильный полиалкиленоксид, кроме того, включает (включают) связывающую группу.
23. Композиция по параграфу 3, где мультинуклеофильный полиалкиленоксид представлен формулой:
полимер-Q1-Xm
и где мультиэлектрофильный полиалкиленоксид представлен формулой:
полимер-Q2-Yn
где X представляет собой электрофильную группу, а Y представляет собой нуклеофильную группу,
где каждый из m и n равен от 2 до 4;
где m+n≤5;
где каждый из Q1 и Q2 представляет собой связывающую группу, выбранную из группы, состоящей из -O-(CH2)n-, -S-, -(CH2)n-,
-NH-(CH2)n-, -O2C-NH-(CH2)n-, -O2C-(CH2)n-, -O2C-CR1H, и O-R2-CO-NH;
где n'=1-10;
где R'=-H,-CH3 или C2H5;
где R2=-CH2- или -CO-NH-CH2CH2-, и
где Q1 и Q2 могут быть одинаковыми или различными или могут отсутствовать.
24. Композиция по параграфу 23, где Y представлен формулой:
-CO2N(COCH2)2.
25. Композиция по параграфу 23, где Y представлен формулой:
-N(COCH)2.
26. Композиция по параграфу 3, где мультинуклеофильный полиалкиленоксид или мультиэлектрофильный полиалкиленоксид или и мультинуклеофильный полиалкиленоксид, и мультиэлектрофильный полиалкиленоксид, кроме того, включает (включают) биологически разлагаемую группу.
27. Композиция по параграфу 26, где биологически разлагаемая группа выбрана из группы, состоящей из лактида, гликозида, ε-капролактона, поли(α-гидроксикислоты), поли(аминокислоты) и поли(ангидрида).
28. Композиция по параграфу 1, где образующий гидрогель компонент способен гидратироваться с образованием фрагментированного биологически совместимого гидрогеля, который включает желатин и будет поглощать воду при доставке в участок-мишень влажной ткани, и где гидрогель включает субъединицы, имеющие размеры в диапазоне от примерно 0,01 мм до примерно 5 мм при полной гидратации, и имеет равновесное набухание в диапазоне от примерно 400% до примерно 5000%.
29. Композиция по параграфу 28, где гидрогель имеет время разложения in vivo менее чем один год.
30 Композиция по любому из параграфов 28 и 29, где гидрогель, по меньшей мере, частично гидратирован водной средой и включает активный агент.
31. Композиция по параграфу 30, где активный агент представляет собой агент, вызывающий свертывание крови.
32. Композиция по параграфу 31, где агент, вызывающий свертывание крови, представляет собой тромбин.
33. Способ доставки активного агента пациенту, причем способ включает введение в участок-мишень на теле пациента некоторого количества композиции по параграфу 30.
34. Способ доставки герметизирующего агента пациенту, причем способ включает введение в кровоточащий участок-мишень некоторого количества композиции по параграфу 1, достаточного для ингибирования кровотечения.
35. Способ доставки тромбина пациенту, причем способ включает введение в кровоточащий участок-мишень некоторого количества композиции по параграфу 32, достаточного для ингибирования кровотечения.
36. Композиция, включающая мультинуклеофильный полиалкиленоксид, мультиэлектрофильный полиалкиленоксид и образующий гидрогель компонент, где мультинуклеофильный полиалкиленоксид, кроме того, включает, по меньшей мере, одну первичную аминогруппу, и, по меньшей мере, одну тиольную группу, и где в условиях, обеспечивающих возможность реакции, мультинуклеофильный полиалкиленоксид и мультиэлектрофильный полиалкиленоксид способны по существу к немедленной поперечной сшивке.
37. Композиция, включающая мультинуклеофильный полиалкиленоксид, мультиэлектрофильный полиалкиленоксид и образующий гидрогель компонент, где мультинуклеофильный полиалкиленоксид, кроме того, включает две или более тиольные группы, а мультиэлектрофильный полиалкиленоксид, кроме того, включает две или более электрофильные группы, выбранные из группы, состоящей из сукцинимидильной группы и малеимидильной группы, и где в условиях, обеспечивающих возможность реакции, мультинуклеофильный полиалкиленоксид и мультиэлектрофильный полиалкиленоксид способны по существу к немедленной поперечной сшивке.
38. Композиция, включающая мультинуклеофильный полиалкиленоксид, мультиэлектрофильный полиалкиленоксид и образующий гидрогель компонент, где мультинуклеофильный полиалкиленоксид, кроме того, включает две или более нуклеофильные группы, выбранные из группы, состоящей из первичных аминогрупп и тиольных групп, и мультиэлектрофильный полиалкиленоксид, кроме того, включает две или более сукцинимидильные группы, и где в условиях, обеспечивающих возможность реакции, мультинуклеофильный полиалкиленоксид и мультиэлектрофильный полиалкиленоксид способны по существу к немедленной поперечной сшивке.
39. Композиция, включающая первый полиэтиленгликоль, включающий две или более тиольные группы, второй полиэтиленгликоль, включающий две или более сукцинимидильные группы или малеимидильные группы, и образующий гидрогель компонент, где сумма тиольных групп и сукцинимидильных или малеимидильных групп составляет, по меньшей мере, пять, и в условиях, обеспечивающих возможность реакции, первый полиэтиленгликоль и второй полиэтиленгликоль могут быть способны по существу к немедленной поперечной сшивке.
40. Композиция по параграфу 39, где первый полиэтиленгликоль, кроме того, включает четыре тиольные группы, а второй полиэтиленгликоль, кроме того, включает четыре сукцинимидильных группы.
41. Композиция по параграфу 39, кроме того, включающая белок или полисахарид.
42. Композиция по параграфу 39, кроме того, включающая полисахарид, где полисахарид представляет собой гликозаминогликан.
43. Композиция по параграфу 42, где гликозаминогликан выбран из группы, состоящей из гиалуроновой кислоты, хитина, хондроитинсульфата А, хондроитинсульфата В, хондроитинсульфата С, кератинсульфата, кератосульфата, гепарина и его производных.
44. Композиция по параграфу 39, кроме того, включающая белок, где белок представляет собой коллаген или его производное.
45. Способ герметизации тканевого тракта, причем способ включает, по меньшей мере, частичное заполнение тканевого тракта композицией, включающей:
первый поперечно сшиваемый компонент;
второй поперечно сшиваемый компонент, который поперечно сшивается с первым поперечно сшиваемым компонентом в условиях, обеспечивающих возможность взаимодействия; и
образующий гидрогель компонент;
где первый и второй поперечно сшиваемые компоненты поперечно сшиваются для образования пористой матрицы, имеющей промежутки, а образующий гидрогель компонент способен гидратироваться с образованием гидрогеля для заполнения, по меньшей мере, некоторых промежутков, причем гидрогель включает субъединицы, имеющие размеры в диапазоне от примерно 0,05 мм до примерно 5 мм при полной гидратации, имеющие равновесное набухание в диапазоне от примерно 400% до примерно 1300%, и разлагающиеся в тканевом тракте после периода от примерно 1 до примерно 120 дней.
46. Способ по параграфу 45, где первый поперечно сшиваемый компонент включает множественные нуклеофильные группы, а второй полимер включает множественные электрофильные группы.
47. Способ ингибирования кровотечения в участке-мишени в теле пациента, причем способ включает доставку композиции в участок-мишень в количестве, достаточном для ингибирования кровотечения, где композиция включает:
первый поперечно сшиваемый компонент;
второй поперечно сшиваемый компонент, который поперечно сшивается с первым поперечно сшиваемым компонентом в условиях, обеспечивающих возможность взаимодействия; и
образующий гидрогель компонент;
где первый и второй поперечно сшиваемые компоненты поперечно сшиваются для образования пористой матрицы, имеющей промежутки, а образующий гидрогель компонент способен гидратироваться для образования гидрогеля для заполнения, по меньшей мере, некоторых промежутков, причем гидрогель включает субъединицы, имеющие размеры в диапазоне от примерно 0,05 мм до примерно 5 мм при полной гидратации, имеющие равновесное набухание в диапазоне от примерно 400% до примерно 1300%, и разлагающиеся в тканевом тракте после периода от примерно 1 до примерно 120 дней.
48. Способ по параграфу 47, где первый поперечно сшиваемый компонент включает множественные нуклеофильные группы, а второй поперечно сшиваемый компонент включает множественные электрофильные группы.
49. Способ доставки биологически активного вещества в участок-мишень в теле пациента, причем способ включает доставку композиции в комбинации с биологически активным веществом в участок-мишень, причем композиция включает:
первый поперечно сшиваемый компонент;
второй поперечно сшиваемый компонент, который поперечно сшивается с первым поперечно сшиваемым компонентом в условиях, обеспечивающих возможность взаимодействия; и
образующий гидрогель компонент;
где первый и второй поперечно сшиваемые компоненты поперечно сшиваются для образования пористой матрицы, имеющей промежутки, а образующий гидрогель компонент способен гидратироваться для образования гидрогеля для заполнения, по меньшей мере, некоторых промежутков, причем гидрогель включает субъединицы, имеющие размеры в диапазоне от примерно 0,05 мм до примерно 5 мм при полной гидратации, имеющие равновесное набухание в диапазоне от примерно 400% до примерно 1300% и разлагающиеся в тканевом тракте после периода от примерно 1 до примерно 120 дней.
50. Способ по параграфу 49, где первый поперечно сшиваемый компонент включает множественные нуклеофильные группы, а второй поперечно сшиваемый компонент включает множественные электрофильные группы.
51.Способ по параграфу 49, где биологически активное вещество представляет собой гемостатический агент.
52. Способ по параграфу 49, где биологически активное вещество представляет собой тромбин.
53. Способ доставки способной к набуханию композиции к участку-мишени в ткани, причем указанный способ включает нанесение композиции на участок-мишень, причем композиция включает:
первый поперечно сшиваемый компонент;
второй поперечно сшиваемый компонент, который поперечно сшивается с первым поперечно сшиваемым компонентом в условиях, обеспечивающих возможность взаимодействия; и
образующий гидрогель компонент;
где первый и второй поперечно сшиваемые компоненты поперечно сшиваются для образования пористой матрицы, имеющей промежутки, а образующий гидрогель компонент способен гидратироваться для образования гидрогеля для заполнения, по меньшей мере, некоторых промежутков, причем гидрогель включает субъединицы, имеющие размеры в диапазоне от примерно 0,05 мм до примерно 5 мм при полной гидратации, имеющие равновесное набухание в диапазоне от примерно 400% до примерно 1300% и разлагающиеся в тканевом тракте после периода от примерно 1 до примерно 120 дней, причем композиция гидратируется при менее чем их равновесном набухании после нанесения на участок-мишень, где они набухают до равновесной величины набухания.
54. Способ по параграфу 53, где первый поперечно сшиваемый компонент включает множественные нуклеофильные группы, а второй поперечно сшиваемый компонент включает множественные электрофильные группы.
55. Способ по параграфу 53, где участок-мишень находится в ткани, выбранной из группы, состоящей из мышцы, кожи, эпителиальной ткани, соединительной или опорной ткани, нервной ткани, ткани глаз и других органов чувств, сосудистой и сердечной ткани, желудочно-кишечных органов и ткани, плевры и другой легочной ткани, почек, эндокринных желез, мужских и женских репродуктивных органов, жировой ткани, ткани печени, поджелудочной железы, лимфатической системы, хряща, кости, ротовой полости, и ткани слизистых оболочек, и ткани селезенки, и других органов брюшной полости.
56. Способ по параграфу 55, где участок-мишень представляет собой полую область внутри выбранной ткани.
57. Способ по параграфу 56, где полая область выбрана из группы, состоящей из тканевых кист, тканевых трактов, внутрипозвонковых пространств и полостей тела.
58. Способ по параграфу 53, где гидрогель имеет степень гидратации в диапазоне от 50% до 95% гидратации при равновесном набухании.
59. Способ по параграфу 53, где гидрогель включает пластификатор.
60. Способ по параграфу 59, где пластификатор выбран из группы, состоящей из полиэтиленгликоля, сорбита и глицерина.
61. Способ по параграфу 59, где пластификатор присутствует в количестве от 0,1% мас. до 30% мас. композиции гидрогелевого компонента.
62. Способ по любому из параграфов 45-61, где гидрогель включает поперечно сшитый белковый гидрогель.
63. Способ по параграфу 62, где белок выбран из группы, состоящей из желатина, растворимого коллагена, альбуминаа, гемоглобина, фибриногена, фибрина, казеина, фибронектина, эластина, кератина, ламинина и их производных и комбинаций.
64. Способ по любому из параграфов 45-61, где гидрогель включает поперечно сшитый полисахарид.
65. Способ по параграфу 64, где полисахарид выбран из группы, состоящей из гликозаминогликанов, производных крахмала, производных целлюлозы, производных гемицеллюлозы, ксилана, агарозы, альгината и хитозана и их комбинаций.
66. Способ по любому из параграфов 45-61, где гидрогель включает поперечно сшитый не биологический полимер.
67. Способ по параграфу 66, где поперечно сшитый не биологический полимер выбран из группы, состоящей из полиакрилатов, полиметакрилатов, полиакриламидов, поливиниловых каучуков, полилактид-гликолидов, поликапролактонов, полиоксиэтиленов и их комбинаций.
68. Способ по любому из параграфов 45-61, где гидрогель включает, по меньшей мере, два компонента, выбранных из группы, состоящей из поперечно сшитых белков, поперечно сшитых полисахаридов и поперечно сшитых не биологических полимеров.
69. Способ по любому из параграфов 45-61, где гидрогель включает гидрогелевый полимер и гидрогелевый поперечно сшивающий агент, где гидрогелевый полимер и гидрогелевый поперечно сшивающий агент были подвергнуты реакции в условиях, которые обеспечивают поперечную сшивку молекул гидрогелевого полимера.
70. Способ по любому из параграфов 45-61, где гидрогель включает молекулярный поперечно сшитый гидрогелевый полимер, который был получен облучением гидрогеля в условиях, которые обеспечивают поперечную сшивку молекул гидрогелевого полимера.
71. Способ по любому из параграфов 45-61, где гидрогель включает молекулярный поперечно сшитый гидрогель, который был получен взаимодействием мононенасыщенных и полиненасыщенных мономеров гидрогеля в условиях, которые обеспечивают поперечную сшивку молекул гидрогелевого полимера.
72. Способ формирования трехмерной синтетической полимерной матрицы, включающий стадии:
предоставления первого поперечно сшиваемого компонента, содержащего m нуклеофильных групп, и второго поперечно сшиваемого компонента, содержащего n электрофильных групп, где электрофильные группы взаимодействуют с нуклеофильными группами для образования с ними ковалентных связей, где каждый из m и n больше или равен двум, а m+n больше или равно пяти;
комбинирования первого поперечно сшиваемого компонента и второго поперечно сшиваемого компонента;
добавления образующего гидрогель компонента к первому поперечно сшиваемому компоненту и второму поперечно сшиваемому компоненту;
предоставления возможности первому поперечно сшиваемому компоненту и второму поперечно сшиваемому компоненту стать поперечно сшитыми друг с другом для образования трехмерной матрицы.
73. Способ по параграфу 72, кроме того, включающий контакт первой тканевой поверхности и второй поверхности с первым поперечно сшиваемым компонентом, вторым поперечно сшиваемым компонентом и образующим гидрогель компонентом.
74. Способ по параграфу 73, где вторая поверхность представляет собой поверхность нативной ткани.
75. Способ по параграфу 73, где вторая поверхность представляет собой поверхность не нативной ткани.
76. Способ по параграфу 75, где поверхность не нативной ткани представляет собой синтетический имплантат.
77. Способ по параграфу 76, где синтетический имплантат выбран из группы, состоящей из донорской роговицы, искусственного кровеносного сосуда, сердечного клапана, искусственного органа, костного протеза, имплантируемого хрусталика, сосудистого трансплантата, стента или комбинации стента/трансплантата.
78. Способ по параграфу 72, где каждый из первого поперечно сшиваемого компонента, второго поперечно сшиваемого компонента и образующего гидрогель компонента наносят в порошкообразной форме на первую тканевую поверхность.
79. Способ по параграфу 72, где каждый из первого поперечно сшиваемого компонента, второго поперечно сшиваемого компонента и образующего гидрогель компонента наносят в порошкообразной форме в одном комбинированном, смешанном порошковом составе на первую тканевую поверхность.
80. Способ по параграфу 79, где смешанный порошковый состав, кроме того, включает белок или полисахарид.
81. Способ по параграфу 72, где первая тканевая поверхность находится на или в твердой ткани или мягкой ткани.
82. Способ по параграфу 72, где первая тканевая поверхность включает, окружает или прилегает к хирургическому участку. И где способ, кроме того, включает стадию закрытия хирургического участка.
83. Способ по параграфу 72, где смешанный порошковый состав, кроме того, включает коллаген.
84. Способ по параграфу 72, где смешанный порошковый состав, кроме того, включает биологически активный агент.
85. Смешанная порошковая композиция, включающая:
первый поперечно сшиваемый компонент, включающий множественные нуклеофильные группы, причем первый поперечно сшиваемый компонент представлен в порошковой форме;
второй поперечно сшиваемый компонент, включающий множественные электрофильные группы, причем второй поперечно сшиваемый компонент представлен в порошковой форме; и
образующий гидрогель компонент в порошковой форме;
где в условиях, обеспечивающих возможность реакции, первый и второй поперечно сшиваемые компоненты способны по существу к немедленной поперечной сшивке.
86. Смешанная порошковая композиция по параграфу 85, где первый поперечно сшиваемый компонент, добавленный ко второму поперечно сшиваемому компоненту, обеспечивает комбинированную композицию поперечно сшиваемых компонентов, и первый поперечно сшиваемый компонент присутствует в концентрации в диапазоне от примерно 0,5 до примерно 20% мас. комбинированной композиции поперечно сшиваемых компонентов.
87. Смешанная порошковая композиция по параграфу 85, где первый поперечно сшиваемый компонент, добавленный ко второму поперечно сшиваемому компоненту, предоставляет комбинированную композицию поперечно сшиваемых компонентов, а второй поперечно сшиваемый компонент присутствует в концентрации в диапазоне от примерно 0,5 до примерно 20% мас. комбинированной композиции поперечно сшиваемых компонентов.
88. Смешанная порошковая композиция по параграфу 85, где массовое отношение первого поперечно сшиваемого компонента ко второму поперечно сшиваемому компоненту находится в диапазоне от примерно 45% до примерно 55%.
89. Смешанная порошковая композиция по параграфу 85, где массовое отношение первого поперечно сшиваемого компонента ко второму поперечно сшиваемому компоненту составляет примерно 50%.
90. Смешанная порошковая композиция по параграфу 85, где массовое соотношение между первым и вторым поперечно сшиваемыми компонентами и образующим гидрогель компонентом находится в пределах диапазона от примерно 28% до примерно 42% мас./мас.
91. Смешанная порошковая композиция по параграфу 85, где массовое соотношение между первым и вторым поперечно сшиваемыми компонентами и образующим гидрогель компонентом находится в пределах диапазона от примерно 28% до примерно 30% мас./мас.
92. Смешанная порошковая композиция по параграфу 91, где первый поперечно сшиваемый компонент, добавленный ко второму поперечно сшиваемому компоненту, предоставляет комбинированную композицию поперечно сшиваемых компонентов, и первый поперечно сшиваемый компонент присутствует в концентрации в диапазоне от примерно 0,5 до примерно 20% мас. комбинированной композиции поперечно сшиваемых компонентов.
93. Смешанная порошковая композиция по параграфу 91, где первый поперечно сшиваемый компонент, добавленный ко второму поперечно сшиваемому компоненту, предоставляет комбинированную композицию поперечно сшиваемых компонентов, и второй поперечно сшиваемый компонент присутствует в концентрации в диапазоне от примерно 0,5 до примерно 20% мас. комбинированной композиции поперечно сшиваемых компонентов.
94. Смешанная порошковая композиция по параграфу 91, где массовое отношение первого поперечно сшиваемого компонента ко второму поперечно сшиваемому компоненту находится в диапазоне от примерно 45% до примерно 55%.
95. Смешанная порошковая композиция по параграфу 91, где массовое отношение первого поперечно сшиваемого компонента ко второму поперечно сшиваемому компоненту составляет примерно 50%.
96. Набор, включающий:
контейнер; и
смешанную порошковую композицию, расположенную внутри контейнера, причем композиция включает:
первый поперечно сшиваемый компонент, включающий множественные нуклеофильные группы, причем первый поперечно сшиваемый компонент представлен в порошкообразной форме;
второй поперечно сшиваемый компонент, включающий множественные электрофильные группы, причем второй поперечно сшиваемый компонент представлен в порошкообразной форме;
образующий гидрогель компонент в порошкообразной форме;
где в обеспечивающих возможность реакции условиях первый и второй поперечно сшиваемые компоненты способны по существу к немедленной поперечной сшивке.
97. Набор по параграфу 96, где контейнер включает цилиндрический корпус шприца и поршень шприца.
98. Набор по параграфу 96, кроме того, включающий письменные инструкции по нанесению смешанной порошковой композиции на кровоточащий участок-мишень пациента.
99. Набор по параграфу 96, где смешанный порошок, кроме того, включает активный агент.
100. Набор по параграфу 99, где активный агент включает тромбин.
101. Набор, включающий:
коллагеновую губку; и
смешанную порошковую композицию, фиксированную на поверхности губки, причем смешанная порошковая композиция включает:
первый поперечно сшиваемый компонент, включающий множественные нуклеофильные группы, причем первый поперечно сшиваемый компонент представлен в порошкообразной форме;
второй поперечно сшиваемый компонент, включающий множественные электрофильные группы, причем второй поперечно сшиваемый компонент представлен в порошкообразной форме; и
образующий гидрогель компонент в порошкообразной форме;
где в обеспечивающих возможность реакции условиях первый и второй поперечно сшиваемые компоненты способны по существу к немедленной поперечной сшивке.
102. Композиция для изготовления лекарственного средства, включающая:
первый поперечно сшиваемый компонент;
второй поперечно сшиваемый компонент, который поперечно сшивается с первым поперечно сшиваемым компонентом в условиях, обеспечивающих возможность взаимодействия; и
образующий гидрогель компонент;
где первый и второй поперечно сшиваемые компоненты поперечно сшиваются для образования пористой матрицы, имеющей промежутки, и где образующий гидрогель компонент способен гидратироваться с образованием гидрогеля для заполнения, по меньшей мере, некоторых промежутков.
103. Композиция по параграфу 102, где первый поперечно сшиваемый компонент включает множественные нуклеофильные группы, а второй поперечно сшиваемый компонент включает множественные электрофильные группы.
104. Композиция по параграфу 103, где первый поперечно сшиваемый компонент включает мультинуклеофильный полиалкиленоксид, имеющий m нуклеофильных групп, а второй поперечно сшиваемый компонент включает мультиэлектрофильный полиалкиленоксид, имеющий n электрофильных групп, где каждый из m и n больше или равен двум, и где m+n больше или равно пяти.
105. Композиция по параграфу 104, где n равно двум и где m больше или равно трем.
106. Композиция по параграфу 105, где мультинуклеофильный полиалкиленоксид является тетрафункционально активированным.
107. Композиция по параграфу 104, где m=2 и где n больше или равно трем.
108. Композиция по параграфу 107, где мультиэлектрофильный полиалкиленоксид является тетрафункционально активированным.
109. Композиция по параграфу 104, где и мультинуклеофильный полиалкиленоксид, и мультиэлектрофильный полиалкиленоксид являются тетрафункционально активированными.
110. Композиция по параграфу 104, где мультинуклеофильный полиалкиленоксид, кроме того, включает две или более нуклеофильные группы, состоящие из NH2, -SH, -H, -PH2 и -CO-NH-NH2.
111. Композиция по параграфу 104, где мультинуклеофильный полиалкиленоксид, кроме того, включает две или более первичные аминогруппы.
112. Композиция, включающая:
коллагеновую губку, включающую нативные коллагеновые волокна; и
смешанную порошковую композицию, фиксированную на поверхности губки, причем смешанная порошковая композиция включает:
первый поперечно сшиваемый компонент, включающий множественные нуклеофильные группы, причем первый поперечно сшиваемый компонент представлен в порошкообразной форме и включает примерно 10% смешанного порошка;
второй поперечно сшиваемый компонент, включающий множественные электрофильные группы, причем второй поперечно сшиваемый компонент представлен в порошкообразной форме и включает примерно 10% смешанного порошка; и
образующий гидрогель компонент в порошкообразной форме, включающий примерно 80% смешанного порошка;
где в обеспечивающих возможность реакции условиях первый и второй поперечно сшиваемые компоненты способны по существу к немедленной поперечной сшивке для образования пористой матрицы, имеющей промежутки, и образующий гидрогель компонент способен гидратироваться для образования гидрогеля для заполнения, по меньшей мере, некоторых из промежутков.
Краткое описание чертежей
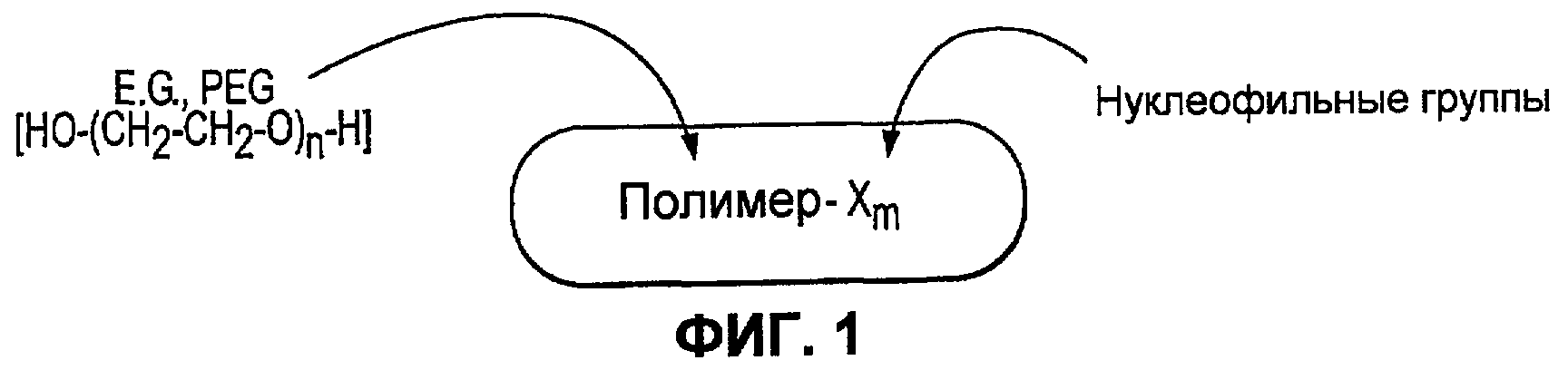
Фиг.1 иллюстрирует первый поперечно сшиваемый компонент в соответствии с некоторыми вариантами осуществления настоящего изобретения.
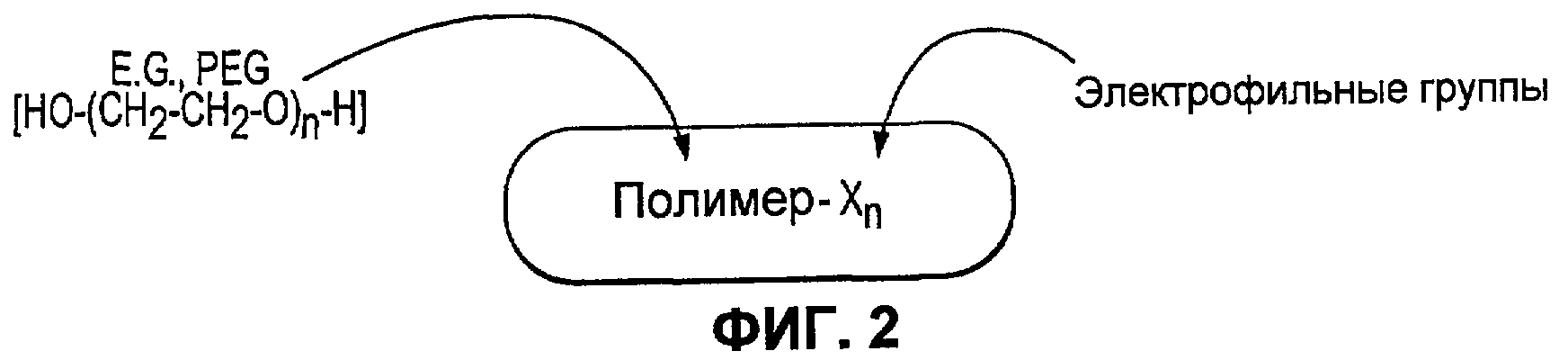
Фиг.2 иллюстрирует второй поперечно сшиваемый компонент в соответствии с некоторыми вариантами осуществления настоящего изобретения.
На фиг.3 показано образование поперечно сшитой матричной композиции из гидрофильного полимера в соответствии с некоторыми вариантами осуществления настоящего изобретения.
На фиг.4 показано образование поперечно сшитой матричной композиции из гидрофобного полимера в соответствии с некоторыми вариантами осуществления настоящего изобретения.
Фиг.5 иллюстрирует субъединицу образующего гидрогель компонента в соответствии с некоторыми вариантами осуществления настоящего изобретения.
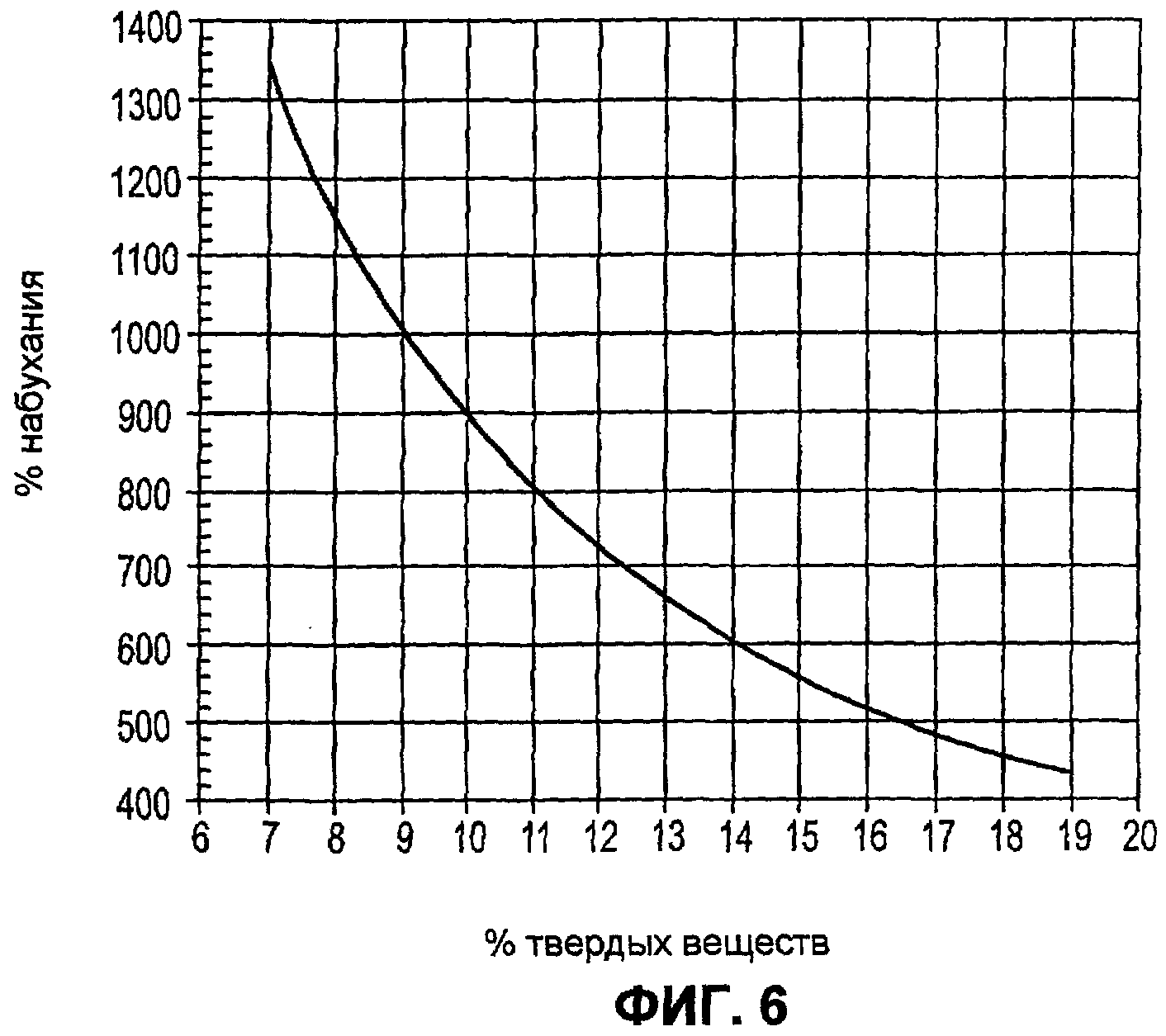
Фиг.6 иллюстрирует корреляцию между процентом набухания и процентом твердых веществ фрагментированного поперечно сшитого полимерного геля, используемого в качестве образующего гидрогель компонента в композиции герметика в соответствии с некоторыми вариантами осуществления настоящего изобретения.
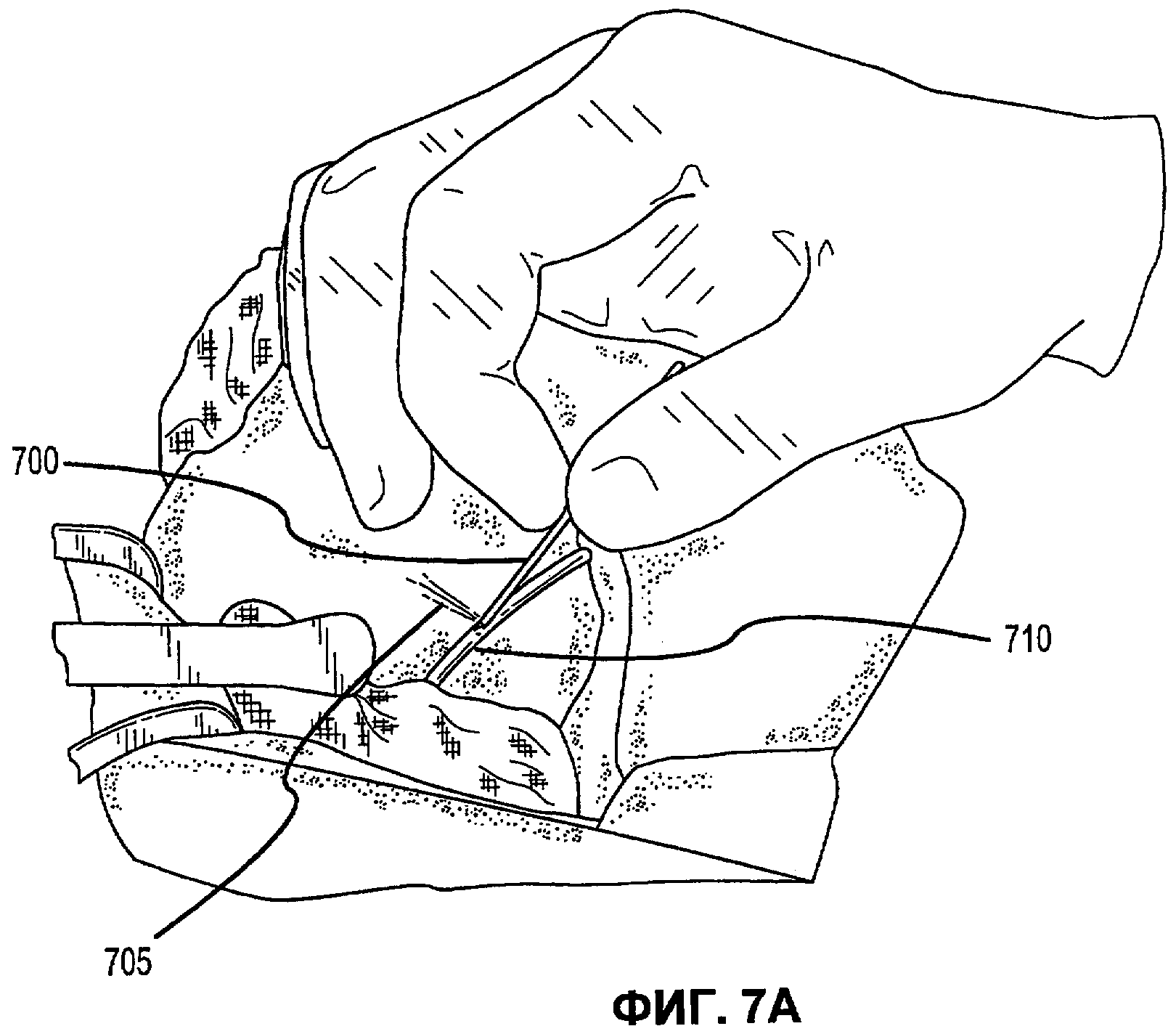
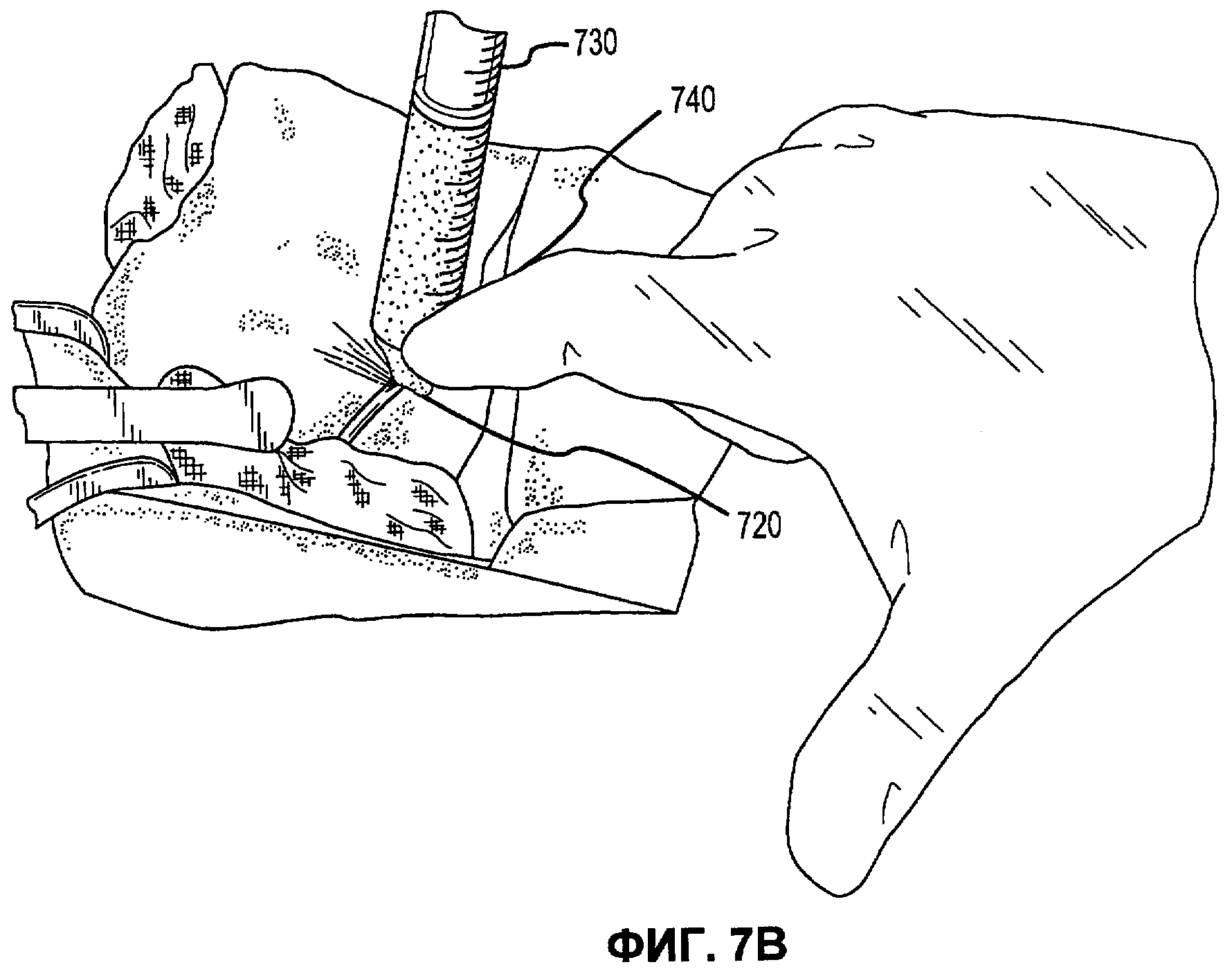
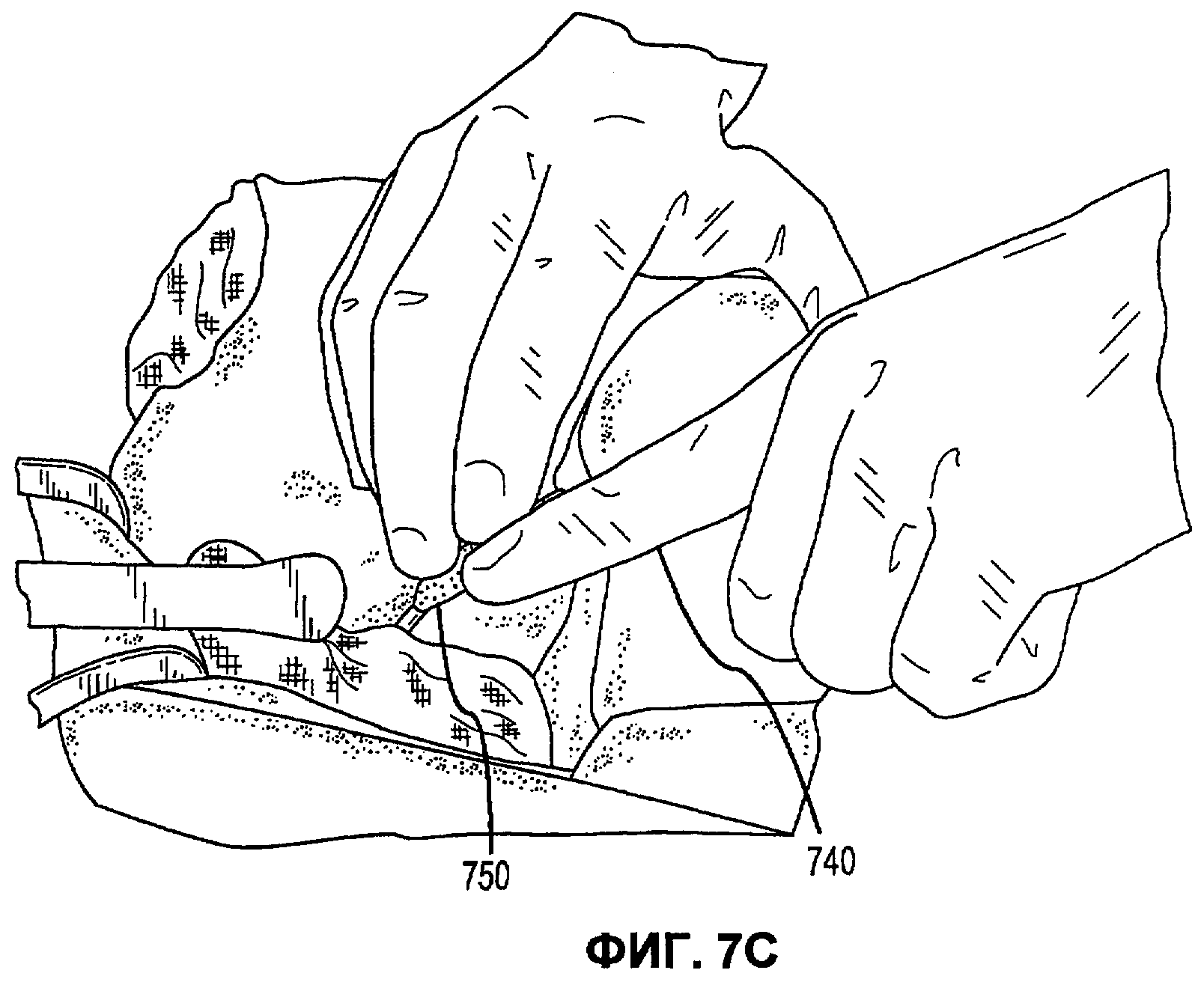
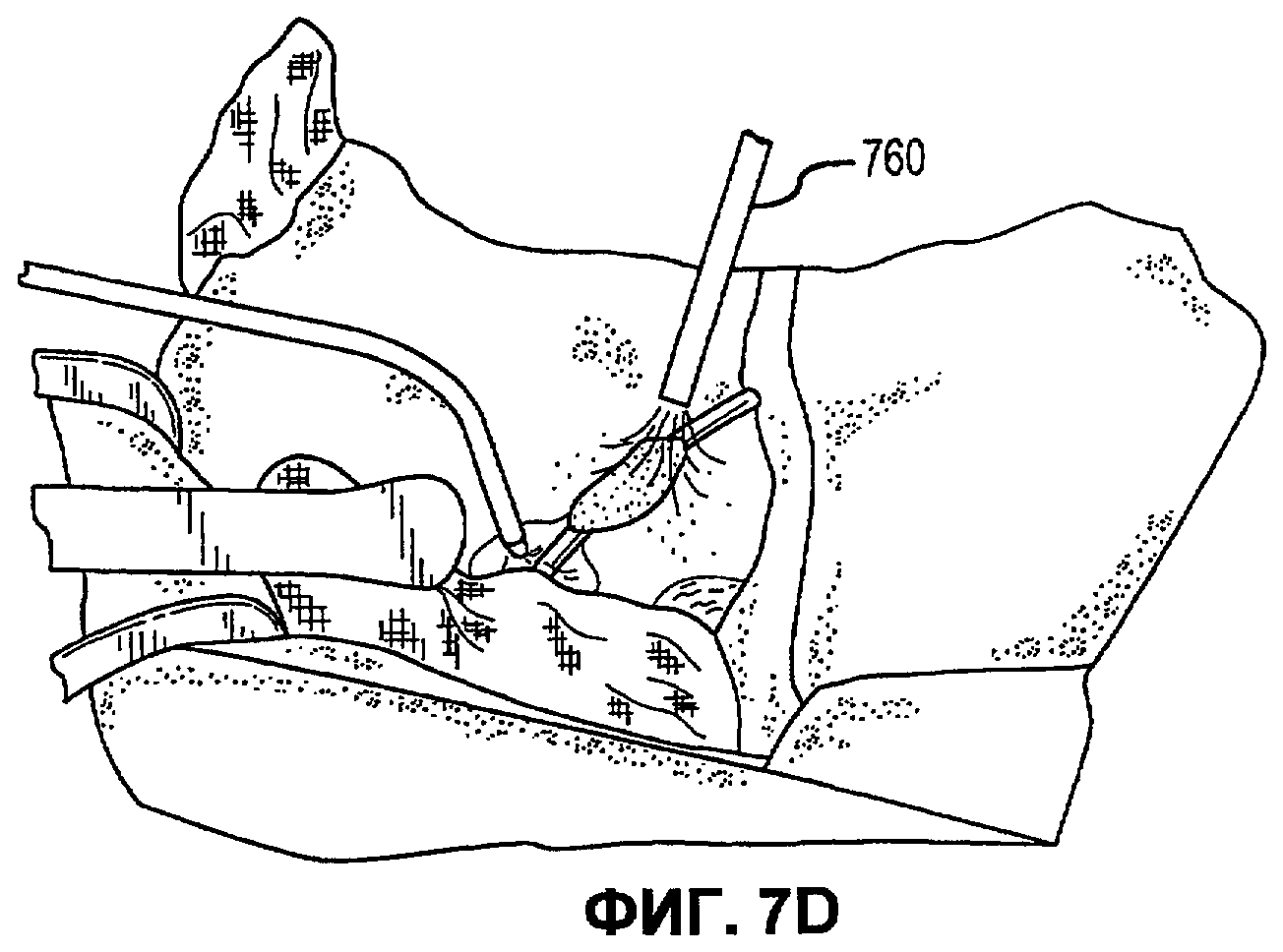
Фиг.7А-Е иллюстрируют наложение матричной композиции герметика для обработки прокола селезеночной артерии в соответствии с вариантами осуществления настоящего изобретения.
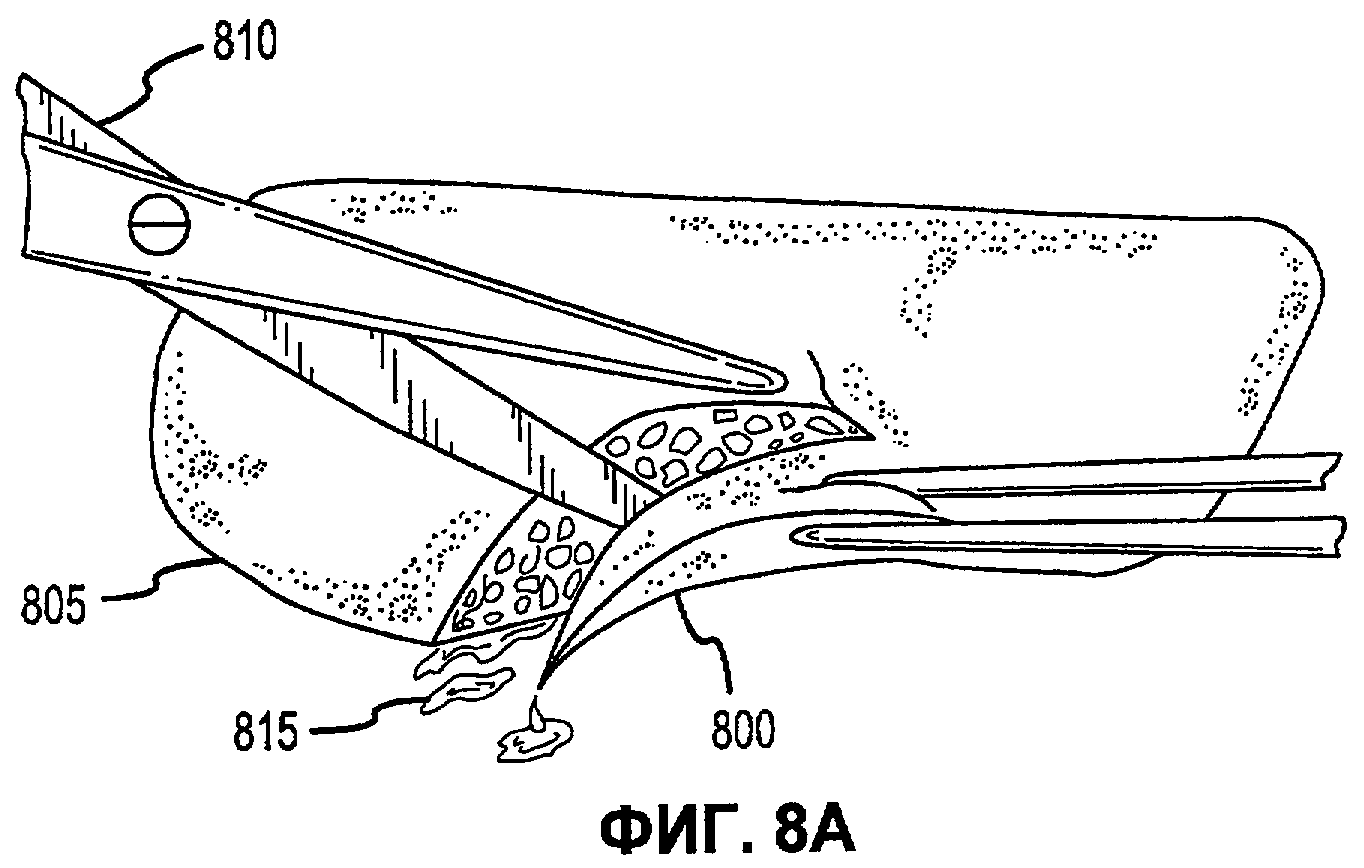
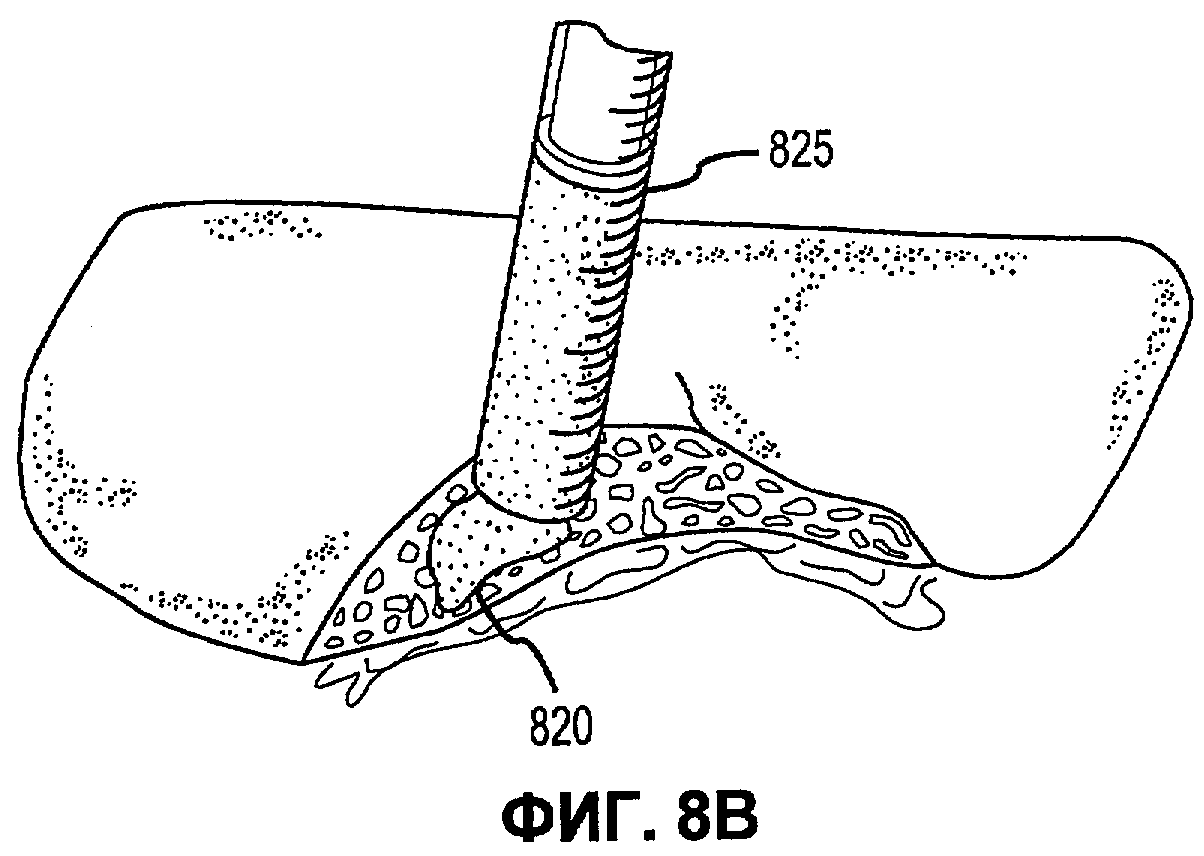
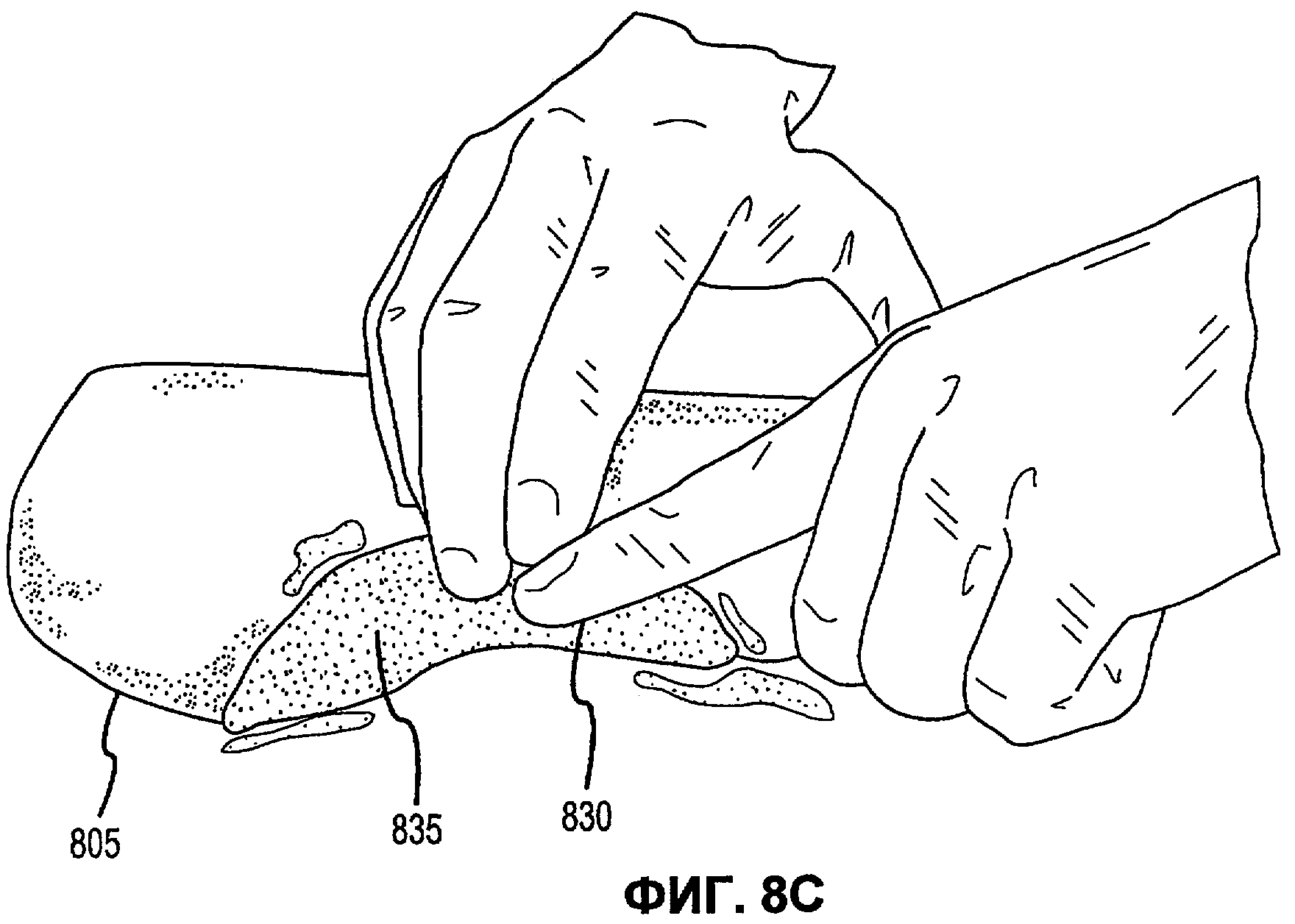
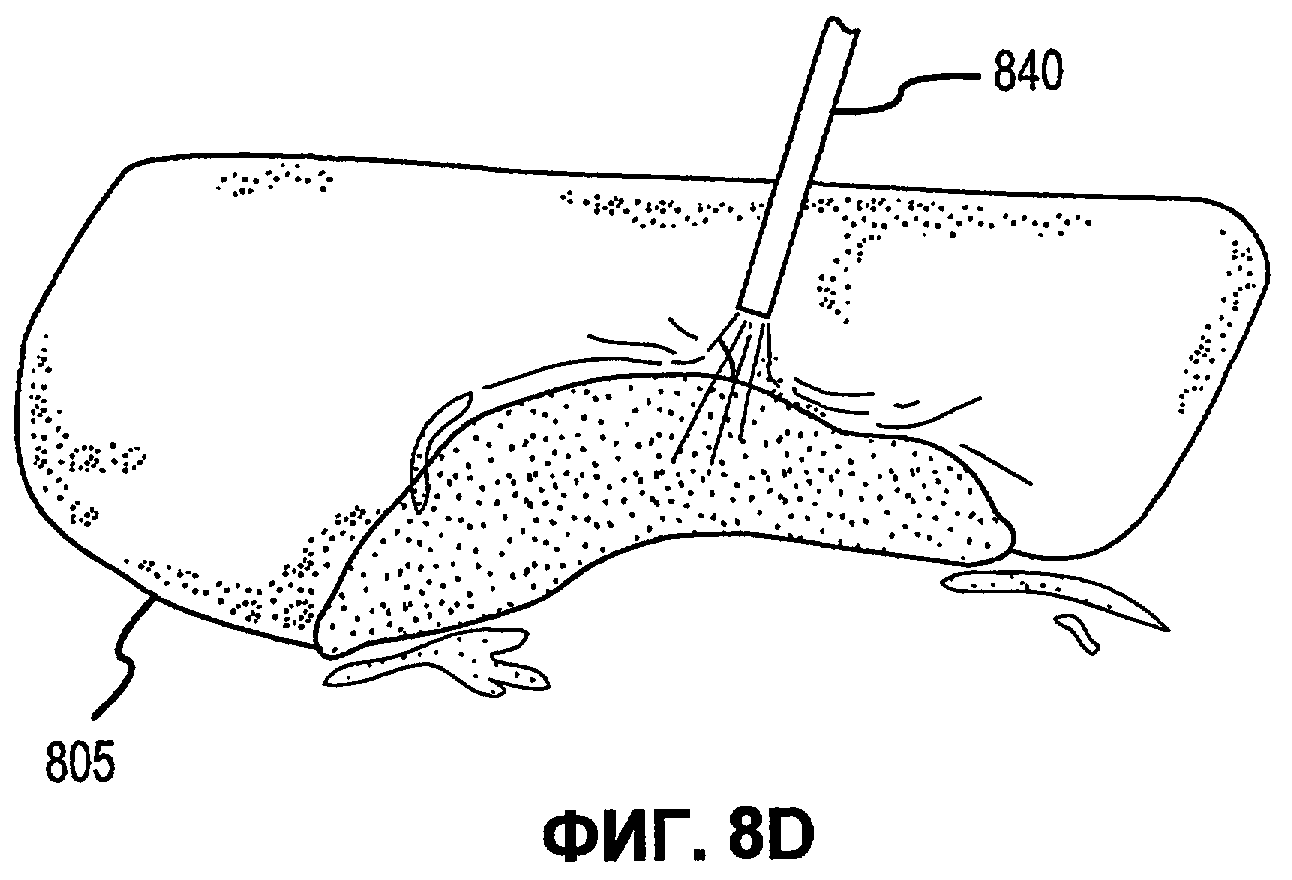
Фиг.8А-Е иллюстрируют наложение матричной композиции герметика для обработки участка резекции печени в соответствии с вариантами осуществления настоящего изобретения.
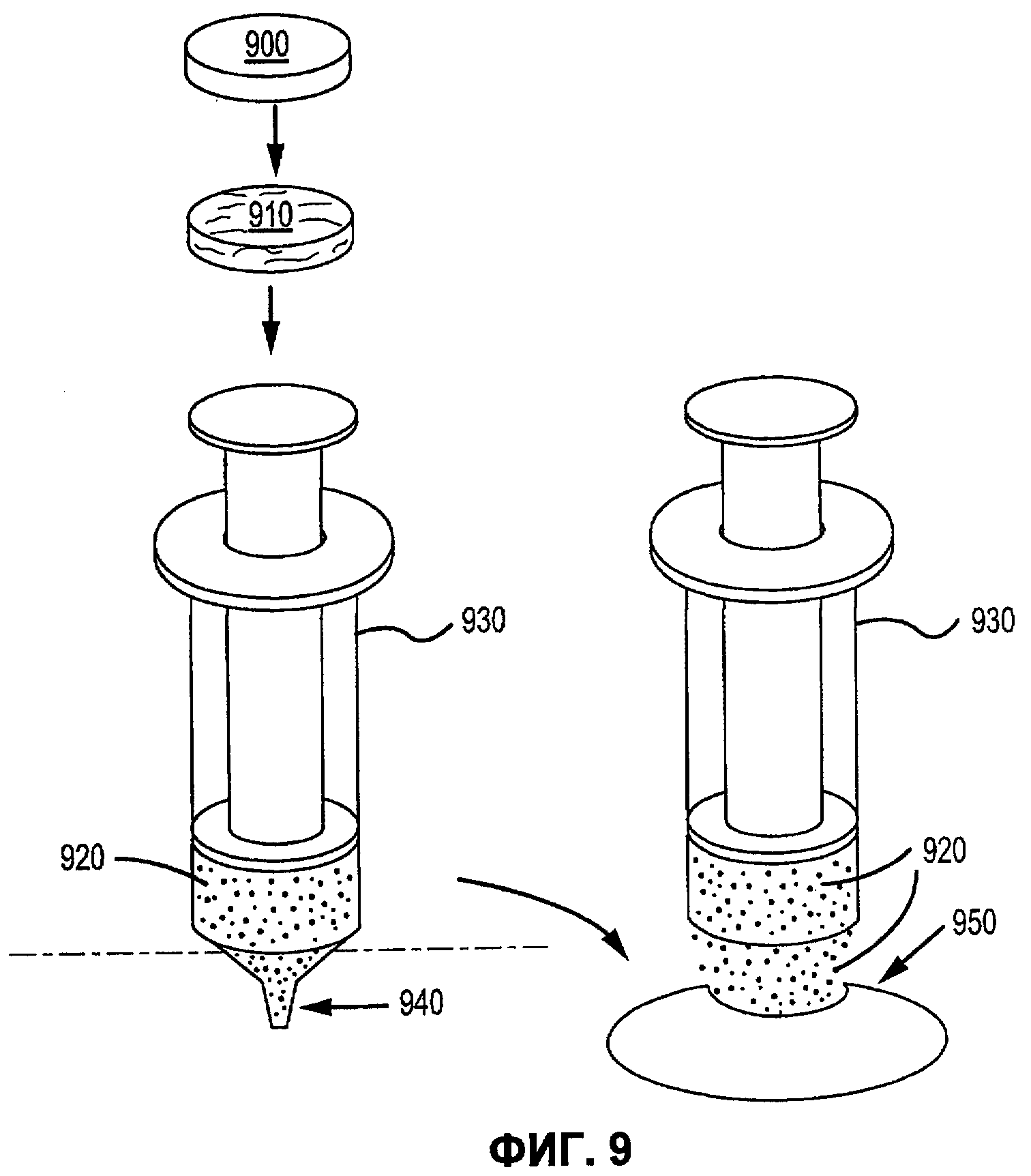
Фиг.9 иллюстрирует переработку и упаковку матричной композиции герметика в соответствии с вариантами осуществления настоящего изобретения.
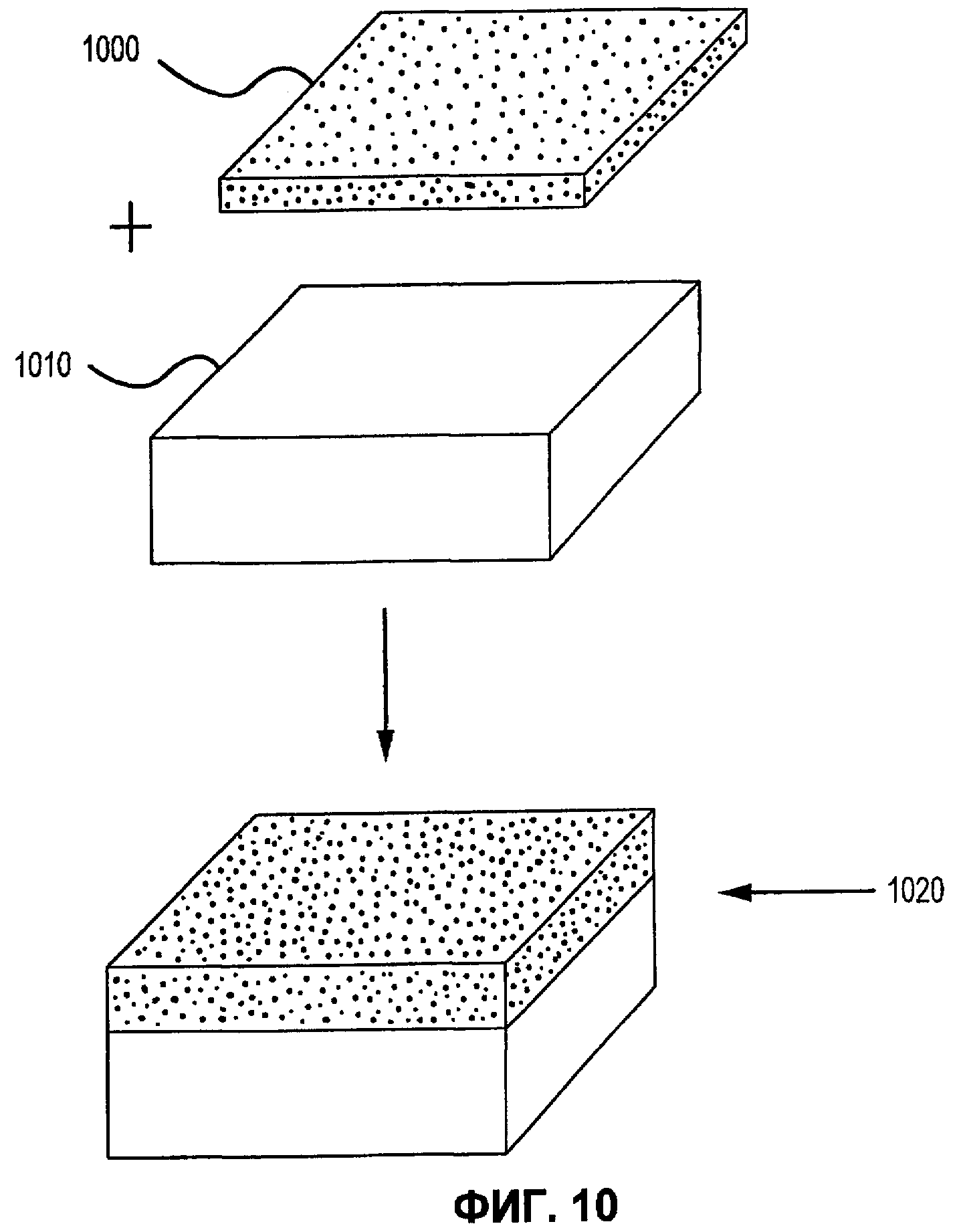
Фиг.10 иллюстрирует переработку и упаковку матричной композиции герметика в соответствии с вариантами осуществления настоящего изобретения.
Фиг.11 иллюстрирует воздействие концентрации PEG (полиэтиленгилколя) на прочность геля в соответствии с вариантами осуществления настоящего изобретения.
Фиг.12 иллюстрирует воздействие концентрации PEG на отношение набухания в соответствии с вариантами осуществления настоящего изобретения.
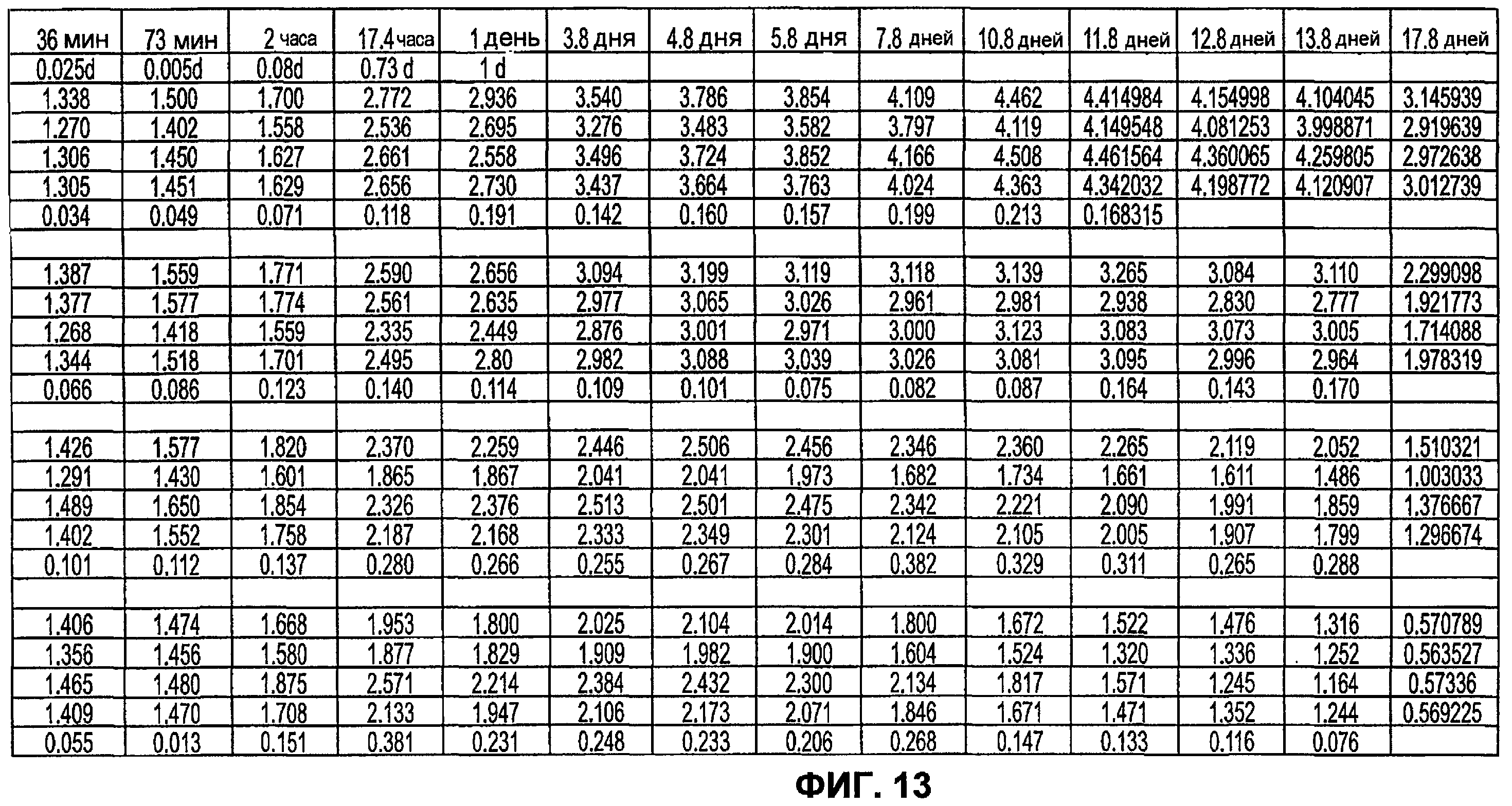
Фиг.13 иллюстрирует воздействие концентрации PEG на отношение набухания в соответствии с вариантами осуществления настоящего изобретения.
Фиг.14 иллюстрирует воздействие концентрации PEG на отношение набухания в соответствии с вариантами осуществления настоящего изобретения.
Подробное описание изобретения
В соответствии с некоторыми вариантами осуществления, настоящее изобретение относится к сухим матричным композициям герметика для достижения гемостаза или другого удерживания жидкости в условиях in vivo герметизацией нарушения целостности или дефекта ткани. Композиции по некоторым вариантам осуществления изобретения включают первый и второй поперечно сшиваемые компоненты и, по меньшей мере, один образующий гидрогель компонент, в сухой композиции, подходящей для наложения на ткань позвоночного для содействия удерживанию жидкости. Первый и второй компоненты в композициях по изобретению взаимодействуют в условиях in vivo для образования поперечно сшитой матрицы, тогда как образующий гидрогель компонент быстро поглощает биологическую жидкость, проходящую через участок нарушения целостности ткани, а также усиливает полученный в итоге физический барьер матрицы герметика, образованный после поперечной сшивки первого и второго компонентов. Как описано в настоящей заявке, «матричные композиции герметика» могут относиться к композициям по изобретению перед нанесением на участок ткани in vivo, «барьер матрицы герметика» может относиться к полученному в итоге барьеру матрицы после контакта композиций по изобретению с биологическими жидкостями, и первый и второй компоненты поперечно сшиваются для образования пористой поперечно сшитой матрицы, содержащей гидрогель. Матричные композиции герметика можно получить в разнообразных формах, включая порошки, брикеты, прокладки и тому подобные. Варианты осуществления в виде брикетов включают образцы порошка матричной композиции герметика, которые были подвергнуты нагреванию или обжигу для образования агрегированного тела. Варианты осуществления в виде прокладки включают образцы порошка матричной композиции герметика, помещенные на губку, такую как коллагеновая губка или другая подложка, которая затем подвергается термической обработке для создания затвердевшего порошка, наплавляемого на губку или подложку.
Хотя настоящее изобретение можно использовать для удерживания биологических жидкостей, не являющихся кровью (например, лимфы или спинномозговой жидкости), матрицу герметика, образованную композициями некоторых вариантов осуществления настоящего изобретения, можно также назвать «гемостатической матрицей», так как это представляет собой первичное применение, описанное в настоящей заявке.
В дополнение к обеспечению быстрого гемостаза и барьера с высокой адгезией к окружающим тканям, матрица герметика по некоторым вариантам осуществления настоящего изобретения имеет несколько преимуществ перед ранее описанными материалами, используемыми для достижения гемостаза. Во-первых, матрицу герметика по некоторым вариантам осуществления настоящего изобретения можно применять в условиях, где участок повреждения ткани достаточно влажный (например, при быстро просачивающихся или бьющих струей артериальных кровотечениях, таких как при абразивной или режущей травме внутреннего органа). При сравнении, многие композиции для гемостаза, выпускаемые в настоящее время, требуют относительно сухого участка для должной адгезии композиции и поддержания гемостаза. Например, в некоторых случаях смеси PEG могут помещаться в участок с быстрым кровотечением, однако вероятно, что они могут быть смыты. Аналогичным образом, в некоторых случаях определенные желатиновые композиции могут гидратироваться в участках с быстрым кровотечением, однако существует вероятность того, что их удерживание в участке может быть затруднительным. Было обнаружено, что препараты, которые включают первый поперечно сшиваемый компонент, второй поперечно сшиваемый компонент и образующий гидрогель компонент, могут обеспечить получение материала, который в условиях, обеспечивающих возможность взаимодействия, остается неподвижным даже при существенном кровотечении, с образованием механически устойчивого подобного сгустку материала для остановки кровотечения. Во-вторых, матрица герметика по некоторым вариантам осуществления настоящего изобретения действует путем физической герметизации участка нарушения целостности ткани без расчета на какую-либо эндогенную способность к свертыванию у позвоночного. Таким образом, матрицу герметика можно использовать у позвоночных с низкой концентрацией фибриногена в их крови, или даже с заменителями крови, которые не содержат фибриноген. Например, первый и второй поперечно сшиваемые компоненты объединяются с образующим гидрогель компонентом и наносятся на кровоточащую поверхность, при этом может произойти синергическое взаимодействие между поперечно сшиваемыми компонентами и образующим гидрогель компонентом. В соответствии с некоторыми вариантами осуществления, первый и второй поперечно сшиваемые компоненты могут в присутствии образующего гидрогель компонента вступать в реакцию и поперечно сшиваться в кровоточащем участке-мишени для образования относительно жесткой сети. Соответственно, образующий гидрогель компонент может заполнять относительно жесткую сеть и опосредовать образование физического герметика.
В соответствии с некоторыми вариантами осуществления настоящего изобретения, матричные композиции герметика можно получить, смешивая первый поперечно сшиваемый компонент со вторым поперечно сшиваемым компонентом и образующим гидрогель компонентом в условиях, при которых первый и второй поперечно сшиваемые компоненты не осуществляют поперечную сшивку (т.е. отсутствие влаги, должный рН, температура и т.д.). После контакта с биологической жидкостью или в других условиях, обеспечивающих возможность взаимодействия, первый и второй поперечно сшиваемые компоненты поперечно сшиваются для образования пористой матрицы, имеющей промежутки, а образующий гидрогель компонент гидратируется для образования гидрогеля, заполняющего, по меньшей мере, некоторые промежутки. Необязательно, поперечно сшиваемые компоненты могут также поперечно сшиваться с образующим гидрогель компонентом и/или окружающими тканями.
I. Поперечно сшиваемые компоненты матрицы герметика
Часто первый поперечно сшиваемый компонент содержит две или более нуклеофильные группы, а второй поперечно сшиваемый компонент содержит две или более электрофильные группы, способные ковалентно связываться с нуклеофильными группами на первом поперечно сшиваемом компоненте. Первый и второй компоненты могут поперечно сшиваться для образования пористой матрицы. Иллюстративные первый и второй компоненты и пористые матрицы описаны в патентах США №№ 5874500, 6166130 6312725, 6328229 и 6458889, содержание которых включено в настоящее описание в качестве ссылки.
Первый и второй компоненты обычно выбирают так, чтобы они не были иммуногенными и сами по себе могли не требовать «кожного теста» перед началом лечения. Кроме того, эти компоненты и образующий гидрогель компонент могут быть выбраны для противодействия ферментному расщеплению матричными металлопротеиназами (например, коллагеназой) для обеспечения более длительного нахождения с сохранением эффекта in vivo, чем имеющиеся в настоящее время коллагеновые композиции. Альтернативно, первый и второй компоненты и образующие гидрогель компоненты могут быть выбраны так, чтобы выводиться или подвергаться резорбции во время заживления раны во избежание образования фиброзной ткани вокруг матрицы герметика in vivo.
В одном варианте осуществления первый компонент может представлять собой синтетический полимер, содержащий множественные нуклеофильные группы (представленные ниже как “X”), которые могут взаимодействовать со вторым компонентом в виде синтетического полимера, содержащим множественные электрофильные группы (представленные ниже как “Y”), приводя к получению ковалентно связанной полимерной сети, следующим образом:
полимер-Xm + полимер-Yn → полимер-Z-полимер
где
m≥2, n≥2, и m+n≥5;
X = -NH2, -SH, -H, -PH2, -CO-NH-NH2 и т.д., и могут быть одинаковыми или различными;
Y = -CO2N(COCH2)2, -CO2H, -CHO, -CHOCO2, -N=C=O, -SO2CH=CH2,
-N(COCH)2, -S-S-(C5H4N) и т.д., и могут быть одинаковыми или различными; и
Z = функциональная группа, образованная в результате соединения нуклеофильной группы (X) и электрофильной группы (Y).
Как отмечено выше, X и Y могут быть одинаковыми или различными, т.е. первый компонент может иметь две различные нуклеофильные группы и/или второй компонент может иметь две различные электрофильные группы. Иллюстративный первый компонентный полимер или первый поперечно сшиваемый компонент показан на фиг.1. Иллюстративный второй компонентный полимер или второй поперечно сшиваемый компонент показан на фиг.2.
Основная цепь первого и второго компонентных полимеров может представлять собой алкиленоксид, в частности, этиленоксикид, пропиленоксид и их смеси. Примеры дифункциональных алкиленоксидов могут быть представлен как
X-полимер-X Y-полимер-Y
где X и Y представляют собой, как определено выше, а термин «полимер» представляет -(CH2CH2O)n или -(CH(CH3)CH2O)n- или
-(CH2CH2O)n-(CH(CH3)CH2O)n-.
Функциональная группа X или Y обычно связана с основной цепью полимера связывающей группой (представленной ниже как “Q”), многие из таких групп известны или возможны. Хотя компоненты по изобретению имеют две или более функциональные группы, представленные ниже примеры для простоты показывают только одну функциональную группу и полученную в результате поперечную сшивку. Существует много способов получения различных функционализированных полимеров, некоторые из которых перечислены ниже:
полимер-Q1-X + полимер-Q2-Y → Q1-Z-Q2-полимер
где
n = 1-10 в каждом случае;
R1 = H, CH3, CH2H5,...CpH2p+1;
R2 = CH2, CO-NH-CH2CH2.
Q1 и Q2 могут быть одинаковыми или различными.
Например, когда Q2 = -OCH2CH2 (в этом случае нет Q1); Y =
-CO2N(COCH2)2, а X = -NH2, -SH или -OH, то итоговые реакции и группы Z будут следующими:
полимер-NH2 + полимер-OCH2CH2CO2-N(COCH2)2 → -NH-OCH2CH2CO-полимер(амид)
полимер-SH + полимер-OCH2CH2CO2-N(COCH2)2 → -S-OCH2CH2CO-полимер(сложный тиоэфир)
полимер-OH + полимер-OCH2CH2CO2-N(COCH2)2 → -O-OCH2CH2CO-полимер(эфир)
Дополнительная группа, представленная ниже как “D”, может быть вставлена между полимером и связывающей группой для увеличения разрушения поперечно сшитой полимерной композиции in vivo, например, для использования при видах применения для доставки лекарственных препаратов:
полимер-D-Q-X + полимер-D-Q-Y → полимер-D-Q-Z-Q-D-полимер-
Некоторые полезные биологически разлагаемые группы “D” включают лактид, гликолид, ε-капролактон, поли(α-гидроксикислоту), поли(аминокислоты), поли(ангидрид) и различные ди- или трипептиды.
А. Первый и второй компоненты с полимерными основными цепями
Как отмечено выше, для получения композиций по настоящему изобретению, полезно предоставить первый компонентный полимер, содержащий две или более нуклеофильные группы, такие как первичные аминогруппы или тиольные группы, и второй компонентный полимер, содержащий две или более электрофильные группы, способные ковалентно связываться с нуклеофильными группами на первом компонентном полимере. Первый и второй компонентные полимеры могут быть синтетическими.
Термин «полимер», используемый в отношении первого и второго компонентных полимеров, относится, наряду с другими, к полиалкилам; ди-, три-, олиго- и полиаминокислотам; и три-, олиго- или полисахаридам.
Термин «синтетический полимер», используемый в отношении первого и второго компонентных полимеров, охватывает полимеры, которые не встречаются в естественных условиях и которые получают посредством химического синтеза. Сами встречающиеся в природе белки, такие как коллаген, и встречающиеся в природе полисахариды, такие как гиалуроновая кислота, могут быть исключены. Включены синтетический коллаген и синтетическая гиалуроновая кислота и их производные. Синтетические полимеры, содержащие или нуклеофильные, или электрофильные группы, охватывают «многофункционально активированные синтетические полимеры». Термин «многофункционально активированные» (или просто» активированные») может относиться к синтетическим полимерам, которые были или не были химически модифицированы для того, чтобы иметь две или более нуклеофильные или электрофильные группы, которые способны взаимодействовать друг с другом (т.е. нуклеофильные группы взаимодействуют с электрофильными группами) для образования ковалентных связей. Типы многофункционально активированных синтетических полимеров включают дифункционально активированные, тетрафункционально активированные и разветвленные в форме звезды полимеры.
Многофункционально активированные синтетические полимеры для применения в настоящем изобретении часто содержат, по меньшей мере, две или, по меньшей мере, три функциональные группы для образования трехмерной поперечно сшитой сети с синтетическими полимерами, содержащими множественные нуклеофильные группы (т.е. «мультинуклеофильные полимеры»). Другими словами, они обычно, по меньшей мере, дифункционально активированы или трифункционально или тетрафункционально активированы. Если первый синтетический полимер представляет собой дифункционально активированный синтетический полимер, то второй синтетический полимер обычно содержит три или более функциональные группы для получения трехмерной поперечно сшитой сети. И первый, и второй компонентные полимеры может содержать, по меньшей мере, три функциональные группы.
В. Первый компонентный полимер
Первые компонентные полимеры, содержащие множественные нуклеофильные группы, также в целом относятся в настоящем описании к «мультинуклеофильным полимерам». Для использования в настоящем изобретении мультинуклеофильные полимеры часто содержат, по меньшей мере, две или, по меньшей мере, три нуклеофильные группы. Если используется синтетический полимер, содержащий лишь две нуклеофильные группы, синтетический полимер, содержащий три или более электрофильные группы, часто будет использоваться для получения трехмерной поперечно сшитой сети.
Мультинуклеофильные полимеры для использования в композициях и способах по настоящему изобретению включают синтетические полимеры, которые содержат или были модифицированы для содержания множественных нуклеофильных групп, таких как первичные аминогруппы и тиольные группы. Такие мультинуклеофильные полимеры могут включать (i) синтетические полипептиды, которые были синтезированы для содержания двух или более первичных аминогрупп или тиольных групп, и (ii) полиэтиленгликоли, которые были модифицированы для содержания двух или более первичных аминогрупп или тиольных групп. В целом, взаимодействие тиольной группы с электрофильной группой имеет тенденцию протекать медленнее, чем взаимодействие первичной аминогруппы с электрофильной группой.
Мультинуклеофильные полипептиды могут представлять собой синтетические полипептиды, которые были синтезированы для включения аминокислот, содержащих первичные аминогруппы (такие как лизин) и/или аминокислоты, содержащие тиольные группы (такие как цистеин). Например, первый компонентный полимер может представлять собой дилизин, трилизин, кватрализин, пентализин или дицистеин, трицистеин, кватрацистеин, пентациллин, или олигопептиды или полипептиды, включающие два или более лизинов или цистеинов и других аминокислот (например, глицина, аланина), предпочтительно, не гидрофобных аминокислот. Часто используется поли(лизин), синтетически получаемый полимер аминокислоты лизина (молекулярная масса 145). Были получены поли-(лизины), имеющие примерно от 6 до примерно 4000 первичных аминогрупп, соответствующих молекулярным массам от примерно 870 до примерно 580000. Поли(лизин)ы варьирующихся молекулярных масс выпускаются компанией Peninsula Laboratories, Inc. (Belmont, Calif.).
Полиэтиленгликоль может быть химически модифицирован для содержания множественных первичных амино- или тиольных групп, в соответствии со способами, описанными, например, в главе 22 Poly(ethylene Glycol) Chemistry: Biotechnical and Biomedical Applications, J. Milton Harris, ed., Plenum Press, N.Y. (1992). Полиэтиленгликоли, которые были модифицированы для содержания двух или более первичных аминогрупп, относятся в настоящем описании к «мультиамино PEG». Полиэтиленгликоли, которые были модифицированы для содержания двух или более тиольных групп, относятся в настоящем описании к «мультитиол PEG». Используемый в настоящем описании термин «полиэтиленгликоль (полиэтиленгликоли)» включает модифицированный или дериватизированный полиэтиленгликоль (полиэтиленгликоли).
Различные формы мультиамино PEG выпускаются компаниями Shearwater Polymers (Huntsville, Ala.) и Texaco Chemical Company (Houston, Tex.) под названием “Jeffamine”. Мультиамино PEG, которые можно использовать в настоящем изобретении, включают диамины (серии “D”) и триамины (серии “T”) Jeffamine Texaco, которые содержат соответственно две или три первичные аминогруппы на молекулу.
Полиамины, такие как этилендиамин (H2N-CH2CH2-NH2), тетраметилендиамин (H2N-(CH2)4-NH2), пентаметилендиамин (кадаверин) (H2N-(CH2)5-NH2), гексаметилендиамин (H2N-(CH2)6-NH2), бис(2-гидроксиэтил)амин (HN-CH2CH2-OH)2), бис(2)аминоэтил)амин (HN-(CH2CH2NH2)2), и трис(2-аминоэтил)амин (N-(CH2CH2NH2)3), могут также использоваться в качестве первого компонентного синтетического полимера, содержащего множественные нуклеофильные группы.
С. Второй компонентный полимер
Вторые компонентные полимеры, содержащие множественные электрофильные группы, также относятся в настоящем описании к «мультиэлектрофильным полимерам». Для использования в настоящем изобретении мультиэлектрофильные полимеры часто содержат, по меньшей мере, две, или, по меньшей мере, три электрофильные группы для образовании трехмерной поперечно сшитой сети с мультинуклеофильными полимерами.
Мультиэлектрофильные полимеры для использования в композициях по изобретению могут представлять собой полимеры, которые содержат две или более сукцинимидильные группы, способные образовывать ковалентные связи с нуклеофильными группами на других молекулах. Сукцинимидильные группы являются высокореактивными с материалами, содержащими первичные
амино(-NH2) группы, такие как мультиамино PEG, поли(лизин) или коллаген. Сукцинимидильные группы являются несколько менее реактивными с материалами, содержащими тиол(-SH)группы, такие как мультитиол PEG или синтетические полипептиды, содержащие множественные остатки цистеина.
Используемый в настоящем описании термин «содержащие две или более сукцинимидильные группы» предназначен для охвата полимеров, которые имеются в продаже и содержат две или более сукцинимидильные группы, а также те, которые химически дериватизированы для содержания двух или более сукцинимидильных групп. Используемый в настоящем описании термин «сукцинимидильная группа» предназначен для охвата сукцинимидильных групп и других таких вариантов «родовой» сукцинимидильной группы. Присутствие части в виде сульфита натрия на сульфосукцинимидильной группе служит для увеличения растворимости полимера.
D. Гидрофильные полимеры для использования в качестве основных цепей первого и второго компонента
Гидрофильные полимеры и, в частности, различные полиэтиленгликоли можно использовать в основных цепях первого и второго компонентного полимера в соответствии с некоторыми вариантами осуществления настоящего изобретения. Используемый в настоящем описании термин «PEG» охватывает полимеры, имеющие повторяющуюся структуру (OCH2CH2)n.
Структура для тетрафункционально активированной формы PEG показана на фиг.3, как и обобщенный продукт реакции, полученный взаимодействием тетрафункционально активированного PEG с мультиамино PEG. Как изображено на чертеже, сукцинимидильная группа представляет собой пятичленную кольцевую структуру, представленную как -N(COCH2)2. На фиг.3, символ ^^^ обозначает открытую химическую связь.
Варианты осуществления включают взаимодействие тетрафункционально активированного PEG суксцинимидилглутарата, называемого в настоящем описании SG-PEG, с мультиамино PEG, и полученные посредством этого продукты реакции. Другая активированная форма PEG называется PEG суксцинимидилпропионатом (SE-PEG). Варианты осуществления включают тетрафункционально активированный SE-PEG и продукт реакции, полученный взаимодействием его с мультиамино PEG. В некоторых вариантах осуществления имеются три повторяющиеся группы CH2 на любой стороне PEG. Другие варианты осуществления охватывают конъюгат, который включает связь «простого эфира», которая меньше подвержена гидролизу. Он отличается от конъюгата, показанного на фиг. 3, где предоставлена связь сложного эфира. Связь сложного эфира подвержена гидролизу в физиологических условиях. Вариантами осуществления настоящего изобретения предусмотрены другие функционально активированные формы полиэтиленгилколя, а также конъюгаты, образованные взаимодействием тетрафункционально активированных PEG с мультиамино PEG. В некоторых вариантах осуществления конъюгат включает и эфирную, и амидную связь. Эти связи устойчивы в физиологических условиях.
Другая функционально активированная форма PEG называется PEG сукцинимидилсукцинамидом (SSA-PEG). Варианты осуществления включают тетрафункционально активированную форму этого соединения и продукт реакции, полученный взаимодействием с мультиамино PEG. Эти и родственные соединения можно также использовать в композициях в соответствии с вариантами осуществления изобретения. Варианты осуществления также охватывают конъюгат, который включает «амидную» связь, которая, подобно описанной ранее связи простого эфира, меньше подвержена гидролизу и поэтому является более устойчивой, чем связь сложного эфира. Еще одна активированная форма PEG предоставлена в варианте осуществления соединения, называемого PEG сукцинимидилкарбонат (SC-PEG). Варианты осуществления включают тетрафункционально активированный SC-PEG и конъюгат, образованный взаимодействием с мультиамино PEG.
Как обсуждалось выше, активированные производные полиэтиленгликоля для использования в вариантах осуществления изобретения могут содержать сукцинимидильные группы в качестве реактивной группы. Однако другие активирующие группы могут быть присоединены в участках вдоль длины молекулы PEG. Например, PEG может быть дериватизирован для образования функционально активированного пропиоальдегида PEG (A-PEG). Варианты осуществления включают тетрафункционально активированную форму, а также конъюгат, образованный взаимодействием A-PEG с мультиамино PEG. Связь может называться связью -(CH2)m-NH, где m = 1-10.
Еще одна форма активированного полиэтиленгликоля представляет собой функционально активированный простой глицидиловый эфир PEG (E-PEG). Варианты осуществления включают тетрафункционально активированное соединение, а также конъюгат, образованный его взаимодействием с мультиамино PEG. Другое активированное производное полиэтиленгликоля представляет собой функционально активированный PEG-изоцианат (I-PEG). Варианты осуществления включают конъюгат, образованный взаимодействием его с мультиамино PEG. Другое активированное производное полиэтиленгликоля представляет собой функционально активированный PEG-винилсульфон (V-PEG). Варианты осуществления включают конъюгат, образованный взаимодействием его с мультиамино PEG.
Мультифункционально активированные полиэтиленгликоли для использования в композициях и другие варианты осуществления настоящего изобретения могут включать полиэтиленгликоли, содержащие сукцинимидильные группы, такие как SG-PEG и SE-PEG, которые могут быть в трифункционально или тетрафункционально активированной форме. Многие из активированных форм полиэтиленгликоля, описанных выше, в настоящее время выпускаются компаниями Shearwater Polymers, Huntsville, Ala., и Union Carbide, South Charleston, W.Va.
Е. Дериватизация первого и второго компонентных полимеров для содержания функциональных групп
Определенные полимеры, такие как поликислоты, могут быть дериватизированы для содержания двух или более функциональных групп, таких как сукцинимидильные группы. Поликислоты для использования в настоящем изобретении включают, без ограничения, трикарбоновые кислоты на основе триметилолпропана, тетракарбоновые кислоты на основе ди(триметиллолпропана), гептандиоевую кислоту, октандиоевую кислоту (суберовую кислоту) и гексадекандиоевую кислоту (тапсовую кислоту). Многие из этих поликислот выпускаются компанией DuPont Chemical Company.
В соответствии с общим способом, поликислоты могут быть химически дериватизированы для содержания двух или более сукцинимидильных групп взаимодействием с соответствующим молярным количеством N-гидроксисукцинимида (NHS) в присутствии N,N'-дициклогексилкарбодиимида (DCC).
Полиспирты, такие как триметилолпропан и ди(триметилолпропан), могут быть превращены в форму карбоновой кислоты с использованием различных способов, затем далее дериватизированы взаимодействием с NHS в присутствии DCC для получения соответственно трифункционально и тетрафункционально активированных полимеров, как описано в заявке на патент США под серийным № 08/403358. Поликислоты, такие как гептандиоевая кислота (HOOC-(CH2)2-COOH), октандиоевая кислота (HOOC-(CH2)2-COOH), и гексадекандиоевая кислота (HOOC-(CH2)14-COOH), дериватизируются добавлением сукцинимидильных групп для получения дифункционально активированных полимеров.
Полиамины, такие как этилендиамин (H2N-CH2CH2-NH2), тетраметилендиамин (H2N-(CH2)4-NH2), пентаметилендиамин (кадаверин) (H2N-(CH2)5-NH2), гексаметилендиамин (H2N-(CH2)6-NH2), бис(2-гидроксиэтил)амин (HN-(CH2CH2OH)2), бис(2)аминоэтил)амин (HN-(CH2CH2NH2)2), и трис(2-аминоэтил)амин (N-(CH2CH2NH2)3), могут быть химически дериватизированы в поликислоты, которые могут затем быть дериватизированы для содержания двух или более сукцинимидильных групп взаимодействием с соответствующими молярными количествами N-гидроксисукцинимида в присутствии DCC, как описано в заявке на патент США под серийным № 08/403358. Многие из этих полиаминов выпускаются компанией DuPont Chemical Company.
В некоторых вариантах осуществления первый поперечно сшиваемый компонент (например, мультиамино PEG) присутствует в концентрации в диапазоне от примерно 0,5 до примерно 20% мас. всей композиции поперечно сшиваемого компонента, а второй поперечно сшиваемый компонент присутствует в концентрации в диапазоне от примерно 0,5 до примерно 20% мас. всей композиции поперечно сшиваемого компонента. Например, конечная композиция поперечно сшиваемого компонента, имеющая общую массу 1 г (1000 мг), могла бы содержать от примерно 5 до примерно 200 мг первого поперечно сшиваемого компонента (например, мультиамино PEG), и от примерно 5 до примерно 200 мг второго поперечно сшиваемого компонента.
В некоторых вариантах осуществления массовое отношение первого поперечно сшиваемого компонента ко второму поперечно сшиваемому компоненту находится в диапазоне от примерно 20% до примерно 80%. В родственных вариантах осуществления отношение находится в диапазоне от примерно 45% до примерно 55%. В некоторых случаях отношение составляет примерно 50%. Массовое отношение определяется на основании теста прочности геля. Первый поперечно сшиваемый компонент и второй поперечно сшиваемый компонент могут иметь одинаковую молекулярную массу.
II. Образующие гидрогель компоненты для использования в матричной композиции герметика
Образующие гидрогель компоненты для использования в соответствии с настоящим изобретением могут включать поглощаемые биологически совместимые молекулярные поперечно сшитые гели и гидрогели, как осуждается в патентах США №№ 4640834; 5209776; 5292362; 5714370; 6063061 и 6066325, которые включены в настоящее описание в качестве ссылки. Материалы, изготовленные по методикам, описанным в этих патентах, выпускаются под торговой маркой FLOSTEAL от Baxter Healthcare Corporation в наборе для смешивания с раствором тромбина для применения в качестве гемостатического агента. Альтернативно, в изобретении в качестве образующих гидрогель компонентов можно использовать любые гидратируемые поперечно сшитые полимеры. Например, можно использовать альгинаты, агарозы, желатины (например, порошок SURGIFOAMTM) или другие синтетические, основанные на углеводородах или белке гидратируемые поперечно сшитые полимеры. Первичными характеристиками полезных образующих гидрогель компонентов являются биологическая совместимость, быстрое всасывание и удерживание жидкости. Таким образом, хотя полиакриламиды могут использоваться в изобретении в качестве образующего гидрогель компонента, это не было бы предпочтительно вследствие низкой биологической совместимости при многих видах внутреннего применения. Часто гидратируемые поперечно сшитые полимеры для применения в качестве образующего гидрогель компонента имеют размер частиц от примерно 70 до примерно 300 мкм, и рН - от примерно 6,8 до примерно 9,5. Образующие гидрогель компоненты могут обеспечить механическую устойчивость первому и второму поперечно сшиваемым компонентам, в частности, когда матрица герметика подвергается воздействию сил, давлений или разведений.
В некоторых вариантах осуществления массовое соотношение между первым и вторым поперечно сшиваемыми компонентами и образующим гидрогель компонентом находится в пределах диапазона от примерно 28% до примерно 42% мас./мас. В некоторых случаях композиция может содержать концентрацию комбинированных первого и второго поперечно сшиваемых компонентов от примерно 5% до примерно 75% общей массы композиции и концентрацию образующего гидрогель компонента от примерно 95% до примерно 25% общей массы композиции. Соответственно, композиция может содержать концентрацию комбинированных первого и второго поперечно сшиваемых компонентов, которая составляет от примерно 5% до примерно 40% общей массы композиции, и концентрацию образующего гидрогель компонента от примерно 95% до примерно 60% общей массы композиции. Аналогичным образом, композиция может содержать концентрацию комбинированных первого и второго поперечно сшиваемых компонентов, которая составляет от примерно 10% до примерно 30% общей массы композиции, и концентрацию образующего гидрогель компонента от примерно 90% до примерно 70% общей массы композиции. Например, композиция может содержать примерно 20% комбинированных первого и второго поперечно сшиваемых компонентов и примерно 80% образующего гидрогель компонента. В некоторых вариантах осуществления комбинированная композиция первого и второго поперечно сшиваемых компонентов может иметь фиксированное массовое соотношение 50:50%, и отношение мас./мас. комбинированной композиции первого и второго поперечно сшиваемых компонентов к образующему гидрогель компоненту может быть в диапазоне от примерно 20% до примерно 30%. Отношение мас./мас. комбинированной композиции первого и второго поперечно сшиваемых компонентов к образующему гидрогель компоненту можно выбрать на основании теста прочности/адгезии геля. Образующий гидрогель компонент может действовать в качестве поглотителя для обеспечения полусухой поверхности для полимеризации первого и второго поперечно сшиваемых компонентов.
Варианты осуществления по настоящему изобретению охватывают наборы сухой матричной композиции герметика, которые включают поперечно сшиваемые компоненты и образующий гидрогель компонент в количествах в соответствии с этими соотношениями.
В соответствии с некоторыми вариантами осуществления, термин «биологически совместимые» относится к материалам, которые соответствуют критериям в стандарте # ISO 10993-1, распространенном Международной Организацией Стандартизации (NAMSA, Northwood, Ohio). В соответствии с некоторыми вариантами осуществления, термин «поглощаемые» относится к композициям, которые разлагаются или солюбилизируются при помещении непосредственно в участок-мишень в теле пациента (и не защищены внутри устройства имплантата, такого как имплантат молочной железы) в течение периода времени менее чем один год, обычно от 1 до 120 дней. Протоколы для измерения поглощения и разложения известны. В соответствии с некоторыми вариантами осуществления, термин «молекулярные поперечно сшитые» относится к материалам, которые включают молекулы полимера (т.е. отдельные цепи), которые присоединены мостиками, составленными или элементом, группой или соединением, где атомы основной цепи молекул полимера соединены первичными химическими связями. Поперечная сшивка может осуществляться разнообразными путями, как будет более детально обсуждено ниже.
В соответствии с некоторыми вариантами осуществления, термин «гидрогель» охватывает композиции, которые включают однофазный водный коллоид, в котором биологический или не биологический полимер, как детальнее определено ниже, поглощает воду или водный буфер. Гидрогель может включать множественные подсети, где каждая подсеть представляет собой молекулярный поперечно сшитый гидрогель, имеющий размеры, которые зависят от степени гидратации и находятся в пределах диапазонов, указанных выше. Часто гидрогели будут иметь мало свободной воды или не иметь ее, т.е. воду нельзя удалить из гидрогеля простой фильтрацией.
«Процент набухания» можно определить как сухую массу, вычтенную из влажной массы, и деленную на сухую массу и умноженную на 100, где влажную массу измеряют после того, как смачивающий агент был насколько возможно полностью удален с внешней поверхности материала, например, фильтрацией, и где сухую массу измеряют после воздействия повышенной температуры в течение времени, достаточного для выпаривания смачивающего агента, например, 2 часов при 120°С.
«Равновесное набухание» можно определить как процент набухания при равновесии после того, как гидратируемый материал поперечно сшитого полимера был погружен в смачивающий агент в течение периода времени, достаточного для того, чтобы содержание воды стало постоянным, обычно от 18 до 24 часов.
«Участок-мишень» обычно представляет собой положение, в которое предстоит доставить матричную композицию герметика, обычно, место нарушения целостности или дефекта ткани. Часто участок-мишень будет представлять собой представляющий интерес участок ткани, но в некоторых случаях матричную композицию герметика можно вводить или подавать в место около представляющего интерес участка, например, когда материал набухает in situ для покрытия представляющего интерес участка.
Гидратируемые поперечно сшитые полимеры для использования в качестве образующих гидрогель компонентов, по меньшей мере, в некоторых вариантах осуществления настоящего изобретения, могут образовываться из биологических и не биологических полимеров. Подходящие биологические полимеры включают белки, такие как желатин, растворимый коллаген, альбумин, гемоглобин, казеин, фибриноген, фибрин, фибронектин, эластин, кератин, ламинин, и их производные и комбинации. Аналогичным образом подходит растворимый не волокнистый коллаген. Иллюстративные составы желатина представлены ниже. Другие подходящие биологические полимеры включают полисахариды, такие как гликозаминогликаны (например, гиалуроновая кислота и хондроитинсульфат), производные крахмала, ксилан, производные целлюлозы, производные гемицеллюлозы, агароза, альгинат, хитозан, и их производные и комбинации. Подходящие не биологические полимеры можно выбрать, чтобы они были разлагаемы любым из двух механизмов, т.е. (1) разрушением основной полимерной цепи или (2) разложением боковых цепей, которое приводит к растворимости в воде. Иллюстративные не биологические полимеры включают синтетические полимеры, такие как полиакрилаты, полиметакрилаты, полиакриламиды, поливиниловые каучуки, полилактид-гликолиды, поликапролактоны, полиоксиэтилены и их производные и комбинации.
Молекулы гидратируемого поперечно сшитого полимера для использования в качестве образующих гидрогель компонентов могут быть поперечно сшиты любым образом, подходящим для образования водного гидрогеля. Например, эти полимерные молекулы могут быть поперечно сшиты с использованием би- или полифункциональных поперечно сшивающих агентов, которые ковалентно присоединяются к двум или более цепям молекул полимера. Иллюстративные бифункциональные поперечно сшивающие агенты включают альдегиды, эпоксиды, сукцинимиды, карбодиимиды, малеимиды, азиды, карбонаты, изоцианаты, дивинилсульфон, спирты, амины, имидаты, ангидриды, галиды, силаны, диазоацетат, азиридины и им подобные. Альтернативно, поперечная сшивка может быть достигнута использованием окислителей и других агентов, таких как периодаты, которые активируют боковые цепи или части на полимере с тем, чтобы они могли взаимодействовать с другими боковыми цепями или частями для образования поперечно сшивающих связей. Дополнительный способ поперечной сшивки включает воздействие на полимеры излучением, таким как гамма-излучение, для активации бокового полимера для обеспечения возможности реакций поперечной сшивки. Подходят также способы дегидротермической поперечной сшивки. Дегидротермическую поперечную сшивку желатина можно достичь, выдерживая его при повышенной температуре, обычно 120°С, в течение периода, по меньшей мере, 8 часов. Увеличение степени поперечной сшивки, которое проявляется снижением процента набухания при равновесии, можно достичь подъемом температуры удерживания, увеличением времени удерживания или их комбинацией. Оперирование под пониженным давлением может ускорить реакцию поперечной сшивки. Предпочтительные способы для поперечной сшивки молекул желатина описаны ниже.
Гидрогели могут включать пластификатор для увеличения ковкости, гибкости или скорости разложения гидрогеля. Пластификатор может представлять собой спирт, такой как полиэтиленгликоль, сорбит или глицерин. Часто пластификатором может быть полиэтиленгликоль, имеющий молекулярную массу в диапазоне примерно от 200 до 1000 Да или имеющий молекулярную массу 400 Да. Пластификаторы могут присутствовать в гидрогеле в количестве от примерно 0,1% мас. до примерно 10% мас., предпочтительно, от 1% мас. до 5% мас. полимерной композиции. Пластификаторы могут быть особенно благоприятны для использования с гидрогелями, имеющими высокое содержание твердых веществ, обычно выше 10% мас. композиции (без пластификатора).
Иллюстративные способы получения молекулярных поперечно сшитых желатинов следующие. Желатин получают и помещают в водный буфер для образования не поперечно сшитого геля, обычно имеющего содержание твердых веществ от примерно 1% до примерно 70% мас., или от примерно 3% до примерно 10% мас. Желатин поперечно сшивается обычно воздействием глутаральдегида (например, от 0,01% до 0,05% мас./мас., в течение ночи при 0-15°С в водном буфере), периодата натрия (например, 0,05 М, выдерживая при температуре от 0°С до 8°C в течение 48 часов) или 1-этил-3-(3-диметиламинопропил)карбодиимида (“EDC”) (например, от 0,5% до 1,5% мас./мас., в течение ночи при комнатной температуре), или воздействием облучения гамма-лучами или электронным пучком примерно от 0,3 до 3 мегарад. Альтернативно, частицы желатина могут быть суспендированы в спирте, таком как метиловый спирт или этиловый спирт, при содержании твердых веществ примерно от 1% до примерно 70% мас., или примерно от 3% до примерно 10% мас., и поперечно сшиты под воздействием поперечно сшивающего агента, обычно, глутаральдегида (например, от 0,01% до 0,1% мас./мас., в течение ночи при комнатной температуре). В случае альдегидов рН обычно поддерживают на уровне примерно от 6 до примерно 11 или примерно от 7 до примерно 10. При поперечной сшивке глутаральдегидом поперечные сшивки образуются посредством оснований Шиффа, которые могут стабилизироваться последующим восстановлением, например, обработкой боргидридом натрия. После поперечной сшивки полученные гранулы можно промывать в воде и, необязательно, споласкивать в спирте, сушиться и ресуспендировать до желаемой степени гидратации в водной среде, имеющей желаемые буфер и рН. Полученные гидрогели можно затем загружать в аппликатор по настоящему изобретению, как детальнее описано ниже. Альтернативно, гидрогели могут механически разрушаться перед поперечной сшивкой или после нее, так же как детальнее описано ниже.
Ниже описаны иллюстративные способы получения композиций молекулярного поперечно сшитого желатина, имеющих равновесные процентные набухания в диапазоне примерно от 400% до примерно 1300%, или примерно от 600% до примерно 950%. Желатин получают и помещают в водный буфер (обычно при рН примерно от 6 до примерно 17, или при рН примерно от 7 до примерно 10), содержащий поперечно сшивающий агент в растворе (часто глутаральдегид, обычно в концентрации от 0,01% до 0,1% мас./мас.) для образования геля, обычно имеющего содержание твердых веществ от 1% до 70% мас., обычно от 3% до 10% мас. Гель тщательно смешивается и выдерживается в течение ночи при температуре от 0°С до 15°С, пока происходит поперечная сшивка. Затем его промывают три раза деионизированной водой, дважды спиртом, предпочтительно, метиловым спиртом, этиловым спиртом или изопропиловым спиртом, и ему дают возможность высохнуть при комнатной температуре. Необязательно, гель может быть обработан боргидридом натрия для дальнейшей стабилизации поперечной сшивки. В некоторых случаях образующий гидрогель компонент может включать желатин, имеющий, например, большое количество глициновых остатков (например, 1 в 3 расположенных каждом третьем остатке), пролиновых остатков и 4-гидроксипролиновых остатков. Иллюстративная субъединица желатина показана на фиг. 5. Варианты осуществления желатина включают молекулы, имеющие следующую аминокислотную композицию: глицин 21%, пролин 12%, гидроксипролин 12%, глутаминовая кислота 10%, аланин 9%, аргинин 8%, аспарагиновая кислота 6%, лизин 4%, серин 4%, лейцин 3%, валин 2%, фенилаланин 2%, треонин 2%, изолейцин 1%, гидроксилизин 1%, метионин и гистидин <1% и тирозин <0,5%. Фиг.6 иллюстрирует корреляцию между процентом набухания и процентом твердых веществ варианта осуществления фрагментированного поперечно сшитого полимерного геля, используемого в качестве образующего гидрогель компонента в композиции герметика.
Молекулярные поперечно сшитые гидрогели предпочтительно механически разрушаются при периодическом процессе перед использованием в качестве образующего гидрогель компонента. Первичным назначением этой стадии механического разрушения является создание множества субъединиц гидрогеля, имеющих размер, который усиливает способность заполнять и набивать пространство, в которое он доставляется. Без механического разрушения молекулярным поперечно сшитым гидрогелям будет трудно принимать форму и заполнять целевые пространства неправильной формы, подвергающиеся обработке. Путем разрушения гидрогеля до субъединиц меньшего размера такие пространства можно заполнить гораздо эффективнее, в то же время сохраняя механическую целостность и продолжительность существования поперечно сшитого гидрогеля.
Молекулярную поперечную сшивку полимерных цепей гидрогеля можно выполнить перед или после его механического разрушения. Гидрогели можно механически разрушить при циклических операциях, таких как смешивание, пока композиция гидрогеля разрушается на субъединицы, имеющие размер в указанном выше диапазоне от 0,01 мм до 5,0 мм. Другие периодические процессы механического разрушения включают прокачку через гомогенизатор, или мешалку, или через насос, который сжимает, растягивает или сдвигает гидрогель до уровня, который превышает вызывающий разлом предел текучести гидрогеля. В некоторых случаях экструзия полимерной композиции вызывает превращение гидрогеля из по существу непрерывной сети, т.е. сети, которая распространяется по размерам первоначальной массы гидрогеля, в коллекцию подсетей или субъединиц, имеющих размеры в указанных выше диапазонах.
В предпочтительном в настоящее время варианте осуществления гидратируемый поперечно сшитый полимер может быть первоначально получен (например, распылительной сушкой) и/или может быть механически разрушен перед поперечной сшивкой, обычно перед гидратацией, для образования гидрогеля. Гидратируемый поперечно сшитый полимер может быть предоставлен в виде мелко раздробленного или порошкообразного твердого вещества, которое может быть разрушено дальнейшим размолом для предоставления частиц, имеющих желательный размер, обычно узко ограниченный в пределах небольшого диапазона. Могут также выполняться дополнительные стадии отбора и модификации по размеру, такие как просеивание, циклонная классификация и т.д. Для иллюстративных желатиновых материалов, описанных ниже, размер сухих частиц находится предпочтительно в диапазоне примерно от 0,01 мм до примерно 1,5 мм, предпочтительнее, примерно от 0,05 мм до примерно 1,0 мм. Иллюстративное распределение размера частиц будет таково, что более чем примерно 95% мас. частиц находится в диапазоне примерно от 0,05 мм до примерно 0,7 мм. Способы измельчения полимерного исходного материала включают гомогенизацию, размол, коацервацию, помол, струйный помол, и им подобные. Порошкообразный полимерный исходный материал может также формироваться распылительной сушкой. Распределение размера частиц можно дополнительно регулировать и сузить обычными методиками, такими как просеивание, агрегация, дополнительный размол и им подобными.
Сухой порошкообразный твердый материал может затем суспендироваться в водном буфере, как описано в других разделах настоящего описания, и подвергаться поперечной сшивке. В других случаях гидратируемый поперечно сшитый полимер может суспендироваться в водном буфере, поперечно сшиваться и затем сушиться. Поперечно сшитый, высушенный полимер может затем разрушаться, и разрушенный материал в последующем может ресуспендироваться в водном буфере. Во всех случаях полученный материал включает поперечно сшитый гидрогель, имеющий дискретные подсети, имеющие указанные выше размеры.
Гидратируемые поперечно сшитые полимеры, используемые в качестве образующих гидрогель компонентов, после механического разрушения будут обычно поглощаемыми, т.е. они будут подвергаться биологическому разложению в теле пациента, в течение периода менее чем один год, обычно от 1 до 120 дней, предпочтительно, от 1 до 90 дней, а предпочтительнее, от 2 до 30 дней после их начального наложения. Методики измерения длительности времени, требуемого для резорбции, известны.
III. Получение и применение одной группы вариантов осуществления матричных композиций герметика: комбинация пористой матрицы и гидратируемого поперечно сшитого полимера
Композиции в соответствии с настоящим изобретением включают первый поперечно сшиваемый компонент, комбинированный со вторым поперечно сшиваемым компонентом, которые способны поперечно сшиваться для образования пористой матрицы, имеющей промежутки, которая комбинируется с гидратируемым поперечно сшитым полимером, способным гидратироваться с образованием гидрогеля для заполнения, по меньшей мере, некоторых из промежутков. Следует понимать, что композиции по настоящему изобретению можно использовать для разнообразных биомедицинских видов применения, включая каждый из видов применения, обсужденных выше, со ссылкой на изменение (1) первого и второго компонентов (т.е. пористой матрицы); и (2) гидратируемого поперечно сшитого полимера. Например, такие композиции могут действовать в качестве механического герметика для остановки или ингибирования кровотечения быстрым образованием физического барьера для крови. Соответственно, некоторые варианты осуществления настоящего изобретения могут дать результаты без прямого «гемостатического» эффекта (например, биохимического эффекта на каскад свертывания, вовлекающего инициаторы свертывания).
Образующий гидрогель компонент может служить в качестве абсорбента (например, для крови и других жидкостей и тканей). Путем поглощения крови образующий гидрогель компонент может обеспечить поддержание более высокой концентрации первого и второго поперечно сшиваемых компонентов в участке обработки и может обеспечить полусухую поверхность первого и второго поперечно сшиваемых компонентов для поперечной сшивки друг с другом и с окружающими тканями. В некоторых вариантах осуществления первый и второй компоненты могут поперечно сшиваться в то же самое время, когда образующий гидрогель компонент абсорбирует кровь. Эта абсорбция и поперечная сшивка происходят в пределах нескольких секунд, и полученный в результате барьер из матрицы герметика может достичь полной прочности через период от 30 минут до одного часа.
В целом, матричные композиции герметика являются «сухими», хотя может присутствовать некоторое минимальное содержание влаги, например, в образующем гидрогель компоненте. В некоторых случаях можно частично предварительно гидратировать гидратируемый поперечно сшитый полимер перед нанесением, хотя это может быть необходимо делать при более высоком рН, чем физиологический рН, или в других условиях, которые предотвратят поперечную сшивку первого и второго компонентов перед нанесением на участок-мишень. Часто матричные композиции герметика будут в форме порошка или слитой спекшейся массы.
Концентрации первого компонента и второго компонента, используемых для получения матричных композиций герметика, могут варьироваться в зависимости от ряда факторов, включая типы и молекулярные массы определенных используемых поперечно сшиваемых компонентов и желаемого конечного применения. В некоторых вариантах осуществления массовое отношение первого и второго компонентов к образующему гидрогель компонентов находится в диапазоне от 10 до 50% мас./мас., от 15 до 45% мас./мас., от 20 до 42% мас./мас., от 30 до 40% мас./мас., и от 28 до примерно 42% мас./мас. В некоторых вариантах осуществления размеры частиц для первого и второго полимеров могут находиться в диапазоне от примерно 50 до примерно 90 мкм. В некоторых вариантах осуществления, размеры частиц для гидратируемого поперечно сшитого полимера могут находиться в диапазоне примерно от 250 до примерно 400 мкм.
В некоторых вариантах осуществления первый и второй компоненты могут быть предоставлены в форме сухих частиц или порошка. В этой форме первый и второй компоненты могут смешиваться вместе, а далее могут смешиваться с образующим гидрогель компонентом, также в форме сухих частиц или порошка. Смешивание компонентов может осуществляться любым средством механического смешивания, таким как смешивание лопастью мельницы. Полученный в результате сухой порошок матричной композиции герметика может затем упаковываться в различные контейнеры, например, картонные коробки, оболочки, флаконы и им подобные. Смешивание и заполнение может производиться в асептических условиях или матричную композицию герметика можно стерилизовать после упаковки, например, гамма-облучением. Варианты осуществления изобретения в виде сухого порошка затем готовы к применению. Первый и второй поперечно сшиваемые полимеры вступят во взаимодействие для поперечной сшивки в физиологических условиях (например, при рН крови), и, таким образом, трехкомпонентная матричная композиция герметика может непосредственно наноситься на желательный участок в сухой форме для герметизации тканевого дефекта при условии, что присутствует достаточное количество гидратирующей биологической жидкости. Таким образом, порошкообразную матричную композицию герметика можно просто высыпать на участок-мишень тканевого дефекта или в него и удерживать на месте (например, марлевым тампоном или хирургической перчаткой) до образования барьера из матрицы герметика. Это, в частности, полезно и удобно в ситуациях возникновения травм (например, в комплекте для оказания неотложной помощи или на поле боя), где желательно использование готового к применению продукта, который можно использовать при различных размерах тканевого дефекта.
В других вариантах осуществления первый и второй компоненты и образующий гидрогель компонент могут быть иммобилизованы на опоре или подложке, образующей «прокладку матрицы герметика». В этих вариантах осуществления предоставляется опора, такая как коллагеновая губка. И затем матричная композиция герметика фиксируется на опоре для использования. Ввиду того, что матричные композиции герметика легко связываются с тканями, органическими материалами и синтетическими материалами, эти варианты осуществления могут иметь преимущество в том, что для нанесения матричной композиции герметика можно использовать подложку, с которой легче манипулировать. Ввиду того, что относительно небольшое количество матричной композиции герметика, относительно тонкий слой матричной композиции герметика может быть фиксирован к подложке, например, в представленных ниже примерах, лишь примерно 0,5-1,0 г матричной композиции герметика, фиксированной на поверхности, создавали прокладку 3 см × 3 см с очень хорошими гемостатическими свойствами. Как будет понятно специалистом в области хирургии, эти варианты осуществления желательны в ситуациях, где предвидится размер тканевого дефекта, и когда желательны улучшенные характеристики манипулирования, по сравнению с порошком. Подобно вариантам осуществления в виде сухого порошка, варианты осуществления матричной композиции герметика в виде прокладки матрицы герметика можно накладывать на тканевой дефект без дополнительной подготовки прижиманием прокладки к тканевому дефекту той стороной, где находится матричная композиция герметика, до тех пор, пока не произойдет поперечная сшивка поперечно сшиваемых компонентов.
Подложка для вариантов осуществления в виде прокладки матрицы герметика по изобретению может представлять собой любой биологически совместимый материал. Хотя в настоящей заявке детально описаны коллагеновые подложки, можно использовать другие материалы для подложек. Например, можно использовать другие белковые или полисахаридные материалы подложки, которые являются биологически совместимыми. Эти материалы подложки могут разлагаться in vivo приблизительно с такой же скоростью, как барьер матрицы герметика, или могут разлагаться со скоростями, которые отличаются от скорости разложения барьера матрицы герметика. Коллагеновые губки и их получение хорошо известны в области хирургии, и получение и манипулирование коллагеном полностью описаны ниже. Аналогичным образом, можно использовать губки, полученные из фибрина. Можно также использовать материалы на основе углеводородов, такие как целлюлоза (для видов наружного применения) или хитозан. Кроме того, можно использовать биологически совместимые и биологически разлагаемые синтетические полимеры. Специалистам в области хирургии будет понятно, что для подложек в вариантах осуществления в виде прокладки матрицы герметика по изобретению можно использовать формы, отличные от губок. Например, можно использовать листок или пленку коллагена или других материалов. Кроме того, подложка может принимать любую полезную форму, такую как конусы, полушария, стержни, клинья и им подобные, для предоставления прокладки, которая будет больше приближаться к форме тканевого дефекта. Например, прокладка матрицы герметика, в которой используется коллагеновая губка конической формы, может быть полезна при лечение огнестрельной раны.
Обычно, такие подложки будут действовать в качестве структурного или механического компонента. Подложки могут иметь некоторую степень пористости для обеспечения возможности просачивания крови или других жидкостей в подложку и обеспечения увеличенного контакта с композициями. Такие конструкции могут иметь фактор набухания примерно от 1,3× до примерно 1,5× и поэтому могут быть идеальными для хирургических видов применения. Например, композиции на коллагеновой подложке можно использовать в нейрохирургии для герметизации твердой мозговой оболочки, где избыточное набухание может оказывать нежелательное давление на мозг. В целом, подложки должны быть достаточно гибкими для соответствия профилю типичного тканевого дефекта и должны иметь свойства, обеспечивающие легкое манипулирование в условиях хирургического вмешательства.
Матричные композиции герметика могут быть иммобилизованы на подложке различными средствами. В некоторых вариантах осуществления, описанных ниже, легкое нагревание достаточно для иммобилизации порошкообразных матричных композиций герметика, содержащих первый и второй компоненты из 4-ветьевого PEG и образующего гидрогель компонента из поперечно сшитого желатина. В этих вариантах осуществления порошкообразная матричная композиция герметика помещалась на коллагеновую губку и нагревалась до 60-70°С примерно в течение 1-2 минут. При этой температуре сухая порошковая матрица слегка плавилась, фиксируя ее на поверхности коллагеновой губки. Альтернативно, матричная композиция герметика может фиксироваться на подложке с использованием связывающих агентов или других эксципиентов, известных в фармацевтических областях. В целом, методика, используемая для фиксации матричной композиции герметика на подложке, будет зависеть от первого и второго компонентов и образующего гидрогель компонента матричной композиции герметика. Способ, используемый для фиксации матричной композиции герметика на подложке, не должен значимо уменьшать способность первого и второго компонентов поперечно сшиваться при воздействии физиологических условий, или способность образующего гидрогель компонента поглощать биологические жидкости.
В других вариантах осуществления матричная композиция герметика может быть сформирована в листок или пленку без подложки. Такое профилирование матричной композиции герметика может быть достигнуто путем использования описанных выше способов фиксации матричной композиции герметика на подложке для вариантов осуществления в виде прокладки матрицы герметика.
IV. Добавление дополнительных компонентов в матричную композицию герметика
В дополнительных вариантах осуществления настоящего изобретения, в матричной композиции герметика по изобретению могут добавляться компоненты, отличные от первого и второго поперечно сшиваемых компонентов и образующего гидрогель компонента. В целом, эти дополнительные компоненты могут смешиваться с первым и вторым поперечно сшиваемыми компонентами в сухой форме. Дополнительные компоненты могут дополнительно увеличить механическую прочность или иным образом улучшить функцию матричных композиций герметика по изобретению для определенных видов применения. Например, поскольку волокнистый коллаген является непрозрачным и менее липким, чем не волокнистый коллаген, он может иногда быть менее предпочтительным для использования в биоадгезионных композициях. Однако, как описано в патенте США № 5614587, волокнистый коллаген или смеси не волокнистого и волокнистого коллагена могут быть предпочтительны для использования в адгезионных композициях, предназначенных для длительного нахождения in vivo. Различные деацетилированные и/или десульфатированные производные гликозаминогликана могут быть включены в композицию таким же образом, как описано выше для коллагена.
Встречающиеся в природе белки, такие как коллаген, и производные различных встречающихся в природе полисахаридов, таких как гликозаминогликаны, могут быть включены в барьер матрицы герметика, когда первый и второй компоненты по изобретению взаимодействуют в физиологических условиях для поперечной сшивки. Когда эти другие компоненты также содержат функциональные группы, которые будут взаимодействовать с функциональными группами на синтетических полимерах, то их присутствие во время поперечной сшивки первого и второго компонентов в участке-мишени приведет к образованию матрицы из поперечно сшитого синтетического полимера - встречающегося в природе полимера. В частности, когда встречающийся в природе полимер (белок или полисахарид) также содержит нуклеофильные группы, такие как первичные аминогруппы, электрофильные группы, на втором поперечно сшиваемом компоненте будут взаимодействовать с первичными аминогруппами на этих компонентах, а также нуклеофильными группами на первом поперечно сшиваемом компоненте для того, чтобы эти другие компоненты стали частью барьера матрицы герметика.
В целом, гликозаминогликаны обычно химически дериватизированы деацетилированием, десульфатированием или обоими способами, для содержания первичных аминогрупп, доступных для взаимодействия с электрофильными группами на втором поперечно сшиваемом компоненте. Гликозаминогликаны, которые могут быть дериватизированы в соответствии с любым или обоими из указанных выше способов, включают следующие: гиалуроновую кислоту, хондроитинсульфат А, хондроитинсульфат В (дерматансульфат), хондроитинсульфат С, хитин (может быть дериватизирован в хитозан), кератансульфат, кератосульфат и гепарин. Дериватизация гликозаминогликанов деацетилированием и/или десульфатированием и ковалентное связывание полученных производных гликозаминогликана с синтетическими гидрофильными полимерами описаны в дополнительных деталях в уступленном обычным порядком, принятом к рассмотрению патенте США № 5510418, содержание которого включено в настоящее описание в качестве ссылки.
Аналогичным образом, электрофильные группы на втором поперечно сшиваемом компоненте могут взаимодействовать с первичными аминогруппами на лизиновых остатках или тиольными группами на цистеиновых остатках определенных встречающихся в природе белков. Обогащенные лизином белки, такие как коллаген и его производные, особенно способны к взаимодействию с электрофильными группами на синтетических полимерах. Используемый в настоящем описании термин «коллаген» предназначен для охвата коллагена любого типа, из любого источника, включая, без ограничения, коллаген, экстрагированный из ткани или полученный рекомбинантно, аналоги коллагена, производные коллагена, модифицированные коллагены и денатурированные коллагены, такие как желатин. Ковалентное связывание коллагена с синтетическими гидрофильными полимерами детально описано в уступленном обычным порядком патенте США № 5162430, выданном 10 ноября 1992 Rhee et al.
В целом, в композициях по изобретению можно использовать коллаген из любого источника; например, коллаген можно экстрагировать и очищать из источника, которым является человек или другое млекопитающее, такого как дерма коров или свиней и плацента человека, или может быть получен рекомбинантно или другим способом. Получение очищенного, по существу не антигенного коллагена в растворе из кожи коров хорошо известно в данной области. В патенте США № 5428022, выданном 27 июня 1995 г. Palefsky et al., раскрыты способы экстракции и очистки коллагена из плаценты человека. В патенте США № 5667839 раскрыты способы получения рекомбинантного человеческого коллагена в молоке трансгенных животных, включая трансгенных коров. Используемый в настоящем описании термин «коллаген» или «коллагеновый материал» относится ко всем формам коллагена, включая те, которые были переработаны или модифицированы другим образом.
Коллаген любого типа, включая без ограничения типы I, II, III, IV или их любую комбинацию, можно использовать в композициях по изобретению, хотя часто предпочтителен тип I. Можно использовать любой коллаген, содержащий ателопептид или телопептид; однако когда используется коллаген из ксеногенного источника, такого как бычий коллаген, часто предпочтителен ателопептидный коллаген, ввиду его сниженной иммуногенности по сравнению с коллагеном, содержащим телопептид.
В композициях по изобретению можно использовать коллаген, который ранее не был поперечно сшит такими способами, как тепло, облучение или химические поперечно сшивающие агенты, а также можно использовать ранее поперечно сшитый коллаген. Не поперечно сшитый алопептидный волокнистый коллаген выпускается компанией Collagen Corporation (Palo Alto, Calif) в концентрациях коллагена приблизительно 35 мг/мл и 65 мг/мл под торговыми названиями соответственно Zyderm®-I Collagen и Zyderm-II Collagen. Глутаральдегидный поперечно сшитый ателопептидный волокнистый коллаген выпускает компания Collagen Corporation в концентрации коллагена приблизительно 35 мг/мл под торговым названием Zyplast®-I Collagen. Коллагены для использования в настоящем изобретении представлены в целом в сухой, лиофилизированной порошковой форме.
Ввиду его липкой консистенции, не волокнистый коллаген обычно используется в композициях по изобретению, которые предназначены для использования в качестве биологических клеящих агентов. Термин «не волокнистый коллаген» охватывает любой материал модифицированного или не модифицированного коллагена, который представлен по существу в не волокнистой форме при рН 7, как указывает оптическая прозрачность водной суспензии коллагена.
Коллаген, который уже представлен в не волокнистой форме, можно использовать в композициях по изобретению. Используемый в настоящем описании термин «не волокнистый коллаген» предназначен для охвата типов коллагена, которые являются не волокнистыми в нативной форме, а также коллагенов, которые были химически модифицированы так, чтобы они были в не волокнистой форме при нейтральном рН или приблизительно нейтральном pH. Типы коллагена, которые являются не волокнистыми (или микроволокнистыми) в нативной форме, включают типы IV, VI и VII.
Химически модифицированные коллагены, которые представлены в не волокнистой форме при нейтральном рН, включают сукцинилированный коллаген и метилированный коллаген, каждый из которых может быть получен в соответствии со способами, описанными в патенте США № 4164559, выданном 14 августа 1979 г. Miyata et al., который полностью включен в настоящее описание в качестве ссылки. Метилированный коллаген, ввиду присущей ему липкости, обычно используется в биоадгезионных композициях, как описано в патенте США № 5614587.
Коллагены для использования в матричных композициях герметика по настоящему изобретению могут исходно использоваться в волокнистой форме, а затем им может быть придана не волокнистая форма добавлением одного или нескольких агентов, разрушающих упорядоченную структуру. Агент, разрушающий упорядоченную структуру, обычно присутствует в количестве, достаточном для придания коллагену по существу не волокнистой формы при рН 7, как описано выше. Агенты, разрушающие упорядоченную структуру для применения в настоящем изобретении, включают, без ограничения, различные биологически совместимые спирты, аминокислоты, неорганические соли и углеводороды, причем особенно предпочтительны биологически совместимые спирты. Предпочтительные биологически совместимые спирты включают глицерин и пропиленгликоль. В некоторых случаях биологически не совместимые спирты, такие как этанол, метанол и изопропанол, могут быть нежелательны для использования в первом и втором полимерах по настоящему изобретению, ввиду их потенциально повреждающих воздействий на организм пациента, получающего их. Примеры аминокислот включают аргинин. Примеры неорганических солей включают хлорид натрия и хлорид калия. Хотя при осуществлении настоящего изобретения можно использовать такие углеводороды, как различные сахара, включая сахарозу, они не так предпочтительны, как другие типы агентов, разрушающих упорядоченную структуру, потому что они могут оказывать цитотоксические эффекты in vivo.
Для применения при адгезии ткани, в дополнение к герметизации, для содействия клеточной адгезии может быть также желательно включение в матричную композицию герметика белков, таких как альбумин, фибрин или фибриноген. Кроме того, введение гидроколлоидов, таких как карбоксиметилцеллюлоза, может содействовать адгезии и/или способности набухания ткани.
Матричные композиции герметика по настоящему изобретению могут также включать один или несколько дополнительных биологически активных агентов или соединений. В одном варианте осуществления для предотвращения адгезии в участке дефекта ткани к матричной композиции герметика можно добавить биологически активные агенты, такие как производные таксола. В других вариантах осуществления к матрице герметика могут быть добавлены биологически активные агенты, такие как антибиотик или противомикробные агенты, для применения, например, в ситуациях ран, вызванных травмой (например, ножевых или пулевых ран), где патогенные организмы могут поступать в участок дефекта ткани или рану. В других вариантах осуществления, биологически активные агенты, такие как факторы роста, могут быть доставлены из композиции в местный участок ткани для содействия заживлению и регенерации ткани. В других вариантах осуществления, агенты свертывания крови, такие как тромбин, могут добавляться для дополнительного улучшения герметизации и регенерации ткани путем активации каскада свертывания. Иллюстративные биологически активные компоненты включают, без ограничения, белки, углеводороды, нуклеиновые кислоты и неорганические и органические биологически активные молекулы, такие как ферменты, антибиотики, антинеопластические средства, бактериостатические средства, средства против образования спаек (такие как производные таксола), бактерицидные средства, противовирусные средства, гемостатические агенты, местные анестетики, противовоспалительные средства, гормоны, антиангиогенные средства, антитела, нейромедиаторы, психоактивные препараты, препараты, воздействующие на репродуктивные органы, и олигонуклеотиды, такие как антисмысловые олигонуклеотиды. Используемый в настоящем описании термин «биологически активный агент» или «активный агент» охватывает органические или неорганические молекулы, которые оказывают биологические эффекты in vivo. Примеры активных агентов включают, без ограничения, ферменты, антагонисты или агонисты рецепторов, гормоны, факторы роста, аутогенный костный мозг, антибиотики, средства против образования спаек, противомикробные средства, другие фармацевтические средства и антитела. Термин «активный агент» также предназначен для охвата комбинаций или смесей двух или более активных агентов, как определено выше.
Такие биологически активные компоненты будут обычно присутствовать в относительно низких концентрациях, обычно ниже 10% мас. композиций, обычно, ниже 5% мас., а часто ниже 1% мас. Два или более таких активных агентов могут быть объединены в одной композиции и/или две или более композиции могут использоваться для доставки различных активных компонентов, где указанные компоненты могут взаимодействовать в участке доставки. Иллюстративные гемостатические агенты включают тромбин, фибриноген и факторы свертывания. Гемостатические агенты, подобные тромбину, могут добавляться в концентрациях в диапазоне, например, примерно от 50 до примерно 10000 единиц тромбина на 1 мл гидрогеля, или примерно от 100 до примерно 1000 единиц тромбина на 1 мл гидрогеля.
Композиции первого и второго поперечно сшитых полимеров можно также получить с содержанием различных агентов визуализации, таких как йод или сульфат бария, или фтор, для содействия визуализации композиций после введения с помощью соответственно рентгена или19F-MRI (магнитно-резонансной визуализации).
Предпочтительные активные агенты для использования в композициях по настоящему изобретению включают факторы роста, такие как трансформирующие факторы роста (TGF), факторы роста фибробластов (FGF), факторы роста, полученные из тромбоцитов (PDGF), эпидермальные факторы роста (EGF), активированные пептиды соединительной ткани (CTAP), остеогенные факторы и биологически активные аналоги, фрагменты и производные таких факторов роста. Особенно предпочтительны члены семейства супергенов трансформирующего фактора роста (TGF), которые представляют собой многофункциональные регуляторные белки. Члены семейства супергенов TGF включают бета-трансгенформирующие факторы роста (например, TGF-β1, TGF-β2, TGF-β3); костные морфогенетические белки (например, BMP-1, BMP-2, BMP-3, BMP-4, BMP-5, BMP-6, BMP-7, BMP-8, BMP-9); связывающие гепарин факторы роста (например, фактор роста фибробластов (FGF), эпидермальный фактор роста (EGF), факторы роста, полученные из тромбоцитов (PDGF), инсулиноподобный фактор роста (IGF); ингибины (например, ингибин А, ингибин В); дифференцирующие факторы роста (например, GDF1); и активины (например, активин А, активин В, активин АВ).
Факторы роста можно выделить из нативных или натуральных источников, таких как клетки млекопитающих, или их можно получить синтетически, например, методами рекомбинантной ДНК, или различными химическими способами. Кроме того, можно использовать аналоги, фрагменты или производные этих факторов, при условии, что они проявляют, по меньшей мере, некоторую часть биологической активности нативной молекулы. Например, аналоги можно получить экспрессией генов, измененной сайт-специфическим мутагенезом или другими методами генной инженерии.
Биологически активные агенты могут быть включены в матричную композицию герметика смешиванием. В одном варианте осуществления активные агенты могут примешиваться к порошкообразным матричным композициям герметика в сухой или лиофилизированной форме. В другом варианте осуществления эта смесь может быть фиксирована на твердой подложке, такой как коллаген, как описано выше для матричных композиций герметика. В других вариантах осуществления агенты могут быть включены в матричные композиции герметика, как описано выше, связыванием этих агентов с функциональными группами на первом или втором компонентных синтетических полимерах. Способы ковалентного связывания биологически активных агентов, таких как факторы роста, с использованием функционально активированных полиэтиленгликолей, описаны в уступленном обычным порядком патенте США № 5162430, выданном 10 ноября 1992 Rhee et al. Такие композиции предпочтительно включают связи, которые могут легко подвергаться биологическому разложению, например, в результате ферментного разложения, приводя к высвобождению активного агента в ткань-мишень, где он окажет свой желательный терапевтический эффект.
Простой способ включения биологически активных агентов, содержащих нуклеофильные группы, в композицию поперечно сшитого полимера включает смешивание активного агента с первым компонентом, вторым компонентом и образующим гидрогель компонентом перед введением в сухом состоянии. После нанесения матричной композиции герметика на дефект ткани и контакта с биологической жидкостью биологически активный агент будет взаимодействовать со вторым компонентом и за счет поперечной сшивки внедряться в пористую поперечно сшитую матрицу первого в второго компонентов по мере того, как образующий гидрогель компонент поглощает биологическую жидкость. Эта процедура приведет к ковалентному связыванию активного агента с частью матрицы в виде поперечно сшитого компонентного полимера барьера из матрицы герметика, который образуется, давая высокоэффективную композицию длительного высвобождения.
Тип и количество используемого активного агента будет зависеть, наряду с другими факторами, от конкретного участка и подлежащего лечению состояния и биологической активности и фармакокинетики выбранного активного агента.
V. Применение матричных композиций герметика в качестве биологических клеящих агентов
Матричные композиции герметика по настоящему изобретению являются в целом адгезионными и прочно связываются с тканями, поскольку электрофильные группы второго поперечно сшиваемого компонента взаимодействуют с нуклеофильными группами коллагена в ткани участка-мишени. Некоторые пористые матричные композиции по изобретению могут иметь необычно высокую липкость. Таким образом, в дополнение к использованию в качестве барьерной матрицы для гемостаза, матричные композиции герметика по настоящему изобретению можно использовать в качестве биологических клеящих агентов для связи с влажными или смоченными тканями в физиологических условиях. Используемые в настоящем описании термины «биоклей», «биологический клей» и «хирургический клей» могут использоваться взаимозаменяемо для охвата биологически совместимых композиций, способных воздействовать на временное или постоянное сцепление между поверхностями двух нативных тканей или между поверхностью нативной ткани и поверхностью не нативной ткани или поверхностью синтетического имплантата.
В общем способе воздействия на сцепление первой поверхности со второй поверхностью матричную композицию герметика (например, в форме сухого порошка или листка) наносят на первую поверхность. Затем первая поверхность контактирует со второй поверхностью, предпочтительно сразу, для осуществления адгезии между двумя поверхностями. По меньшей мере, одна из первой и второй поверхностей представляет собой предпочтительно поверхность нативной ткани. Когда в композиции используется механически устойчивый образующий гидрогель компонент, такой как поперечно сшитый желатин, использованный в примерах, то полученная пористая матрица проявляет повышенную механическую прочность, в отличие от композиции, содержащей только первый и второй поперечно сшиваемые компоненты. Таким образом, также увеличивалась прочность адгезии между двумя тканевыми поверхностями, поскольку менее вероятно, что слой пористой матрицы между тканями отделится внутри под воздействием физиологических механических нагрузок.
Две поверхности могут удерживаться вместе вручную или с использованием других соответствующих средств, хотя реакция поперечной сшивки происходит до завершения. Поперечная сшивка обычно завершается в пределах 5-60 минут после нанесения матричной композиции герметика. Однако время, требуемое для завершения поперечной сшивки, зависит от ряда факторов, включая типы и молекулярные массы первого и второго поперечно сшиваемых компонентов и, наиболее конкретно, эффективные концентрации двух компонентов в участке-мишени (т.е. более высокие концентрации приводят к более коротким периодам поперечной сшивки).
По меньшей мере, одна из первой и второй поверхностей представляет собой предпочтительно поверхность нативной ткани. Используемый в настоящем описании термин «нативная ткань» охватывает биологические ткани, которые являются нативными для организма определенного получающего лечение пациента. Используемый в настоящем описании термин «нативная ткань» охватывает биологические ткани, которые были приподняты или удалены из одной части тела пациента для имплантации в другую часть тела того же пациента (такие как аутотрансплантат кости, аутотрансплантаты кожных лоскутов и т.д.). Например, композиции некоторых вариантов осуществления изобретения можно использовать для сцепления кусочка ткани из одной части тела пациента с другой частью тела пациента, как в случае лечения пострадавшего от ожоговой травмы.
Другая поверхность может представлять собой поверхность нативной ткани, поверхность не нативной ткани или поверхность синтетического имплантата. Используемый в настоящем описании термин «не нативная ткань» охватывает биологические ткани, которые удалены из организма пациента-донора (который может относиться к тому же виду, что и пациент-реципиент, или к другому виду) для имплантации в тело пациента-реципиента (например, трансплантат ткани и органа). Например, композиции поперечно сшитого полимера по настоящему изобретению можно использовать для фиксации ксенотрансплантата сердечного клапана в сердце пациента и герметизации вокруг сердечного клапана для предотвращения утечки.
Используемый в настоящем описании термин «синтетический имплантат» охватывает любой биологически совместимый материал, предназначенный для имплантации в тело пациента, не охватываемый представленными выше определениями нативной ткани и не нативной ткани. Синтетические имплантаты включают, например, искусственные кровеносные сосуды, сердечные клапаны, искусственные органы, костные протезы, имплантируемые хрусталики, сосудистые трансплантаты, стенты и комбинации стента/трансплантата и т.д.
VI. Применение матричных композиций герметика для предотвращения спаек
Другим видом применения композиций герметика по изобретению является покрытие ткани для предотвращения образования спаек после операции или травмы внутренних тканей или органов. В общем способе покрытия ткани для предотвращения образования спаек после операции первый и второй синтетические полимеры смешиваются с гидратируемым поперечно сшиваемым полимером или предварительно смешиваются, затем тонкий слой реакционной смеси наносится на ткани, включающие, окружающие и/или прилегающие к участку операции, до того как произойдет существенная поперечная сшивка между нуклеофильными группами на первом синтетическом полимере и электрофильными группами на втором синтетическом полимере. Нанесение реакционной смеси на участок ткани может осуществляться экструзией, обрызгиванием или посыпкой, нанесением кистью, распылением (как описано выше) для порошковых композиций, помещением тонкой пленки или листка матричной композиции герметика на ткань или любым другим удобным средством.
После нанесения реакционной смеси на участок-мишень предоставляется возможность продолжения поперечной сшивки in situ перед закрытием хирургического размера. После достижения равновесия поперечной сшивкой ткани, которые сближаются до контакта с покрытой тканью, не прилипнут к покрытым тканям. В этот момент хирургический участок можно закрыть, используя обычные средства (шовные нити и т.д.).
В целом, композиции, которые достигают полной поперечной сшивки в пределах относительно короткого периода времени (т.е. 5-15 минут после смешивания первого синтетического полимера и второго синтетического полимера), могут быть предпочтительны для использования при предотвращении хирургических спаек с тем, чтобы хирургический участок можно было закрыть относительно вскоре после завершения хирургической процедуры. Кроме того, предпочтительно, чтобы гидратируемый поперечно сшитый полимер с относительно высокой механической прочностью использовался в композициях, таких как перекрестно сшитый желатин, используемый в примерах, для увеличения механической устойчивости покрытия.
В следующих примерах описано получение и характеристика первого поперечно сшиваемого компонента со вторым поперечно сшиваемым компонентом и образующим гидрогель компонентом для формирования матричных композиций герметика, и они изложены так, чтобы предоставить средним специалистам в данной области полное описание того, как реализовать предпочтительные варианты осуществления конъюгатов, композиций и устройств, и не предназначены для ограничения объема того, что заявители считают своим изобретением. Были предприняты усилия для обеспечения точности в отношении используемых числовых параметров (например, количеств, температуры, молекулярной массы и т.д.), но следует учитывать некоторые экспериментальные ошибки и отклонения. Если нет других указаний, части представляют собой части по массе, молекулярная масса представляет собой средневзвешенную молекулярную массу, температура представлена в градусах Цельсия, а давление находится на уровне атмосферного или около него.
VII. Примеры
Пример 1: Композиции первого и второго компонентов для использования в матрице герметика: Получение композиций поперечно сшитого мультиамино PEG
Получали следующие маточные растворы различных ди-амино PEG. Десять (10) граммов Jeffamine ED-2001 (полученного от компании Texaco Chemical Company, Houston, Tex.) растворяли в 9 мл воды. Десять (10) граммов Jeffamine ED-4000 (также полученного от компании Texaco Chemical Company, Houston, Tex.) растворяли в 9 мл воды. 0,1 г ди-амино PEG (молекулярная масса 3400, полученного от компании Shearwater Polymers, Huntsville, Ala.) растворяли в 300 мкл воды. Каждый из полученных выше трех растворов ди-амино PEG смешивали с водными растворами трифункционально активированного SC-PEG (TSC-PEG, молекулярная масса 5000, также полученного от компании Shearwater Polymers), как представлено ниже в таблице 1.
Растворы ди-амино PEG и TSC-PEG смешивали, используя смешивание из шприца в шприц. Каждый из материалов выдавливали из шприца и давали возможность отвердеть в течение 1 часа при 37˚С. Каждый из материалов образовывал гель. В целом, гели становились мягче с увеличением содержания воды; самыми твердыми были гели, содержащие самое маленькое количество водного растворителя (воды или PBS (солевого раствора с фосфатным буфером)).
Пример 2: Композиции первого и второго компонентов для использования в матрице герметика: Получение композиций поперечно сшитого поли(лизина)
Десять (10) миллиграммов гидробромида поли-L-лизина (молекулярная масса 8000, полученного от компании Peninsula Laboratories, Belmont, Calif.) в 0,1 мл фосфатного буфера (0,2М, рН 6,6) смешивали с 10 мг тетрафункционально активированного SE-PEG (молекулярная масса 10000, полученного от компании Shearwater Polymers, Huntsville, Ala.) в 0,1 мл PBS. Композиция почти немедленно образовывала гель.
Пример 3: Композиции первого и второго компонентов для использования в матрице герметика: Воздействие рН на образование составов тетра-амино PEG/тетра SE-PEG
В чашках Петри получали гели, включающие различные концентрации тетра-амино PEG и тетра SE-PEG, при рН 6, 7 и 8. После смешивания тетра-амино PEG и тетра SE-PEG чашки повторно наклоняли; временем гелеобразования считали момент, когда состав переставал течь. Воздействие рН на время гелеобразования различных составов тетра-амино PEG/тетра SE-PEG при комнатной температуре показано ниже в таблице 2.
Время, требуемое для образования геля, уменьшалось с увеличением рН и увеличением концентраций тетра-амино PEG и тетра SE-PEG.
Пример 4: Оценка материалов образующего гидрогель компонента и способы поперечной сшивки и измерения процента набухания
Частицам желатина давали возможность набухать в водном буфере (например, 0,2М фосфате натрия, рН 9,2), содержащем поперечно сшивающий агент (например, от 0,005 до 0,5% мас. глутаральдегида). Реакционную смесь держали в холодильнике в течение ночи и затем ополаскивали три раза деионизированной водой, дважды этиловым спиртом и давали возможность высохнуть при окружающей температуре. Высушенный, поперечно сшитый желатин ресуспендировали в водном буфере при низкой концентрации твердых веществ (2-3%) при окружающей температуре в течение фиксированного периода времени. Буфер был в существенном избытке по отношению к концентрации, необходимой для равновесного набухания, и присутствовали две фазы (фаза гидрогеля и буфер). Затем суспензию, содержащую влажный гидрогель, фильтровали подачей вакуума на мембрану фильтра с номинальной отсечкой 0,8 мкм (Millipore, Bedford, Mass.). После удаления лишнего буфера регистрировали комбинированную массу удержанного влажного гидрогеля и влажной мембраны фильтра. Затем гидрогель и мембрану сушили приблизительно при 120°С в течение, по меньшей мере, двух часов, и регистрировали комбинированную массу высушенного остатка гидрогеля и высушенной мембраны фильтра. Также выполняли несколько измерений образцов влажной мембраны фильтра без остатка гидрогеля и высушенной мембраны фильтра без гидрогеля и использовали для выведения чистой массы влажного гидрогеля и сухого гидрогеля. Затем «процент набухания» оценивали следующим образом:
процент набухания = 100 × [(влажная масса гидрогеля - сухая масса гидрогеля)/сухая масса гидрогеля]
Измерения набухания проводили, по меньшей мере, в трех повторениях и усредняли для каждого образца желатина. Величину процента набухания для образцов, ресуспендированных в буфере в течение 18-24 ч перед измерением влажной массы, определяли как «равновесное набухание».
Полученные материалы поперечно сшитого желатина проявляли величины равновесного набухания в диапазоне от 400% до 1300%. Степень равновесного набухания зависела от способа и степени поперечной сшивки.
Пример 5: Образующие гидрогель компоненты для использования в матрице герметика: Фрагментированный гидратируемый поперечно сшитый полимерный продукт, составленный из желатина, поперечно сшитого с использованием EDC
Желатину (Atlantic Gelatin, General Foods Corp., Woburn, Mass.) давали возможность раствориться в дистиллированной воде при 1-10% твердых веществ (мас./мас.) (предпочтительно, при 8%) при 70°С. Затем добавляли 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC) (Sigma, St. Louis, Mo.) в количестве от 0,2% до 3,5% (или от 0,2% до 0,3%). Полученный гидрогель, образовавшийся после перемешивания, оставляли при комнатной температуре на один час. Гидрогель сушили, используя лиофилизирующее устройство Freezone 12 (Labconco, Mo.), и тонко размалывали, используя блендер Waring Blender модели No. 31BC91 (VWR, Willard, Ohio). Затем высушенную полимерную композицию загружали в шприцы и уравновешивали буфером. По данным определения, равновесное набухание составляло, по меньшей мере, 1000%. Результаты показаны в таблице 3.
Пример 6: Образующие гидрогель компоненты для использования в матрице герметика: Фрагментированный гидратируемый поперечно сшитый полимерный продукт, составленный из желатина и поли(L)глутаминовой кислоты, поперечно сшитый с использованием EDC
Желатину (Atlantic Gelatin, General Foods Corp., Woburn, Mass.) давали возможность раствориться в дистиллированной воде при 1-10% твердых веществ (мас./мас.) (предпочтительно, при 6-8%) при 70°С. Затем добавляли 0-10% (мас./мас.) (предпочтительно, 2-5%) поли(L)глутаминовой кислоты (PLGA) (Sigma, St. Louis, Mo) и 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC) (Sigma, St. Louis, Mo.) в количестве от 0,2% до 3,5% (или от 0,2% до 0,4%). Полученный гидрогель, образовавшийся после перемешивания, оставляли при комнатной температуре на один час. Гидрогелю давали возможность набухнуть в избытке солевого раствора в течение фиксированного периода времени (например, 20 ч). Затем гидрогель фильтровали подачей вакуума на мембрану фильтра (Millipore, Bedford, Mass.). По данным определения, равновесное набухание составляло, по меньшей мере, 1500%. Результаты показаны в таблице 4.
Пример 7: Образующие гидрогель компоненты для использования в матрице герметика: Получение фрагментированного гидратируемого поперечно сшитого полимерного гидрогеля
Дерму коров (Spears Co., PA) перемешивали в водном растворе гидроксида натрия (Spectrum Chemical Co., CA) (от 0,1М до 1,5М или от 0,4 до 1,2М) в течение периода от 1 до 18 часов (или от 1 до 4 часов) при температуре от 2°С до 30°С (предпочтительно, от 22°С до 30°С). Затем суспензию дермы нейтрализовали, используя неорганическую кислоту, такую как хлористоводородная кислота, фосфорная кислота или серная кислота (Spectrum Chemical Co., CA), и затем нейтрализованную жидкую фазу отделяли от нерастворимой дермы фильтрацией через сито. Затем дерму промывали не пирогенной водой и спиртом, таким как изопропиловый спирт (Spectrum Chemical Co., CA). После 3-12 промываний, дерму суспендировали в не пирогенной воде, и водную суспензию дермы можно затем нагреть до 50-90°С, предпочтительно, от 60°С до 80°С для термического желатинирования дермы. Во время цикла желатинирования рН водной суспензии дермы доводили и регулировали для поддержания на уровне от рН 3 до рН 11, или от рН 7 до рН 9. Также, нерастворимую дерму в суспензии можно разрушить перемешиванием и/или гомогенизацией. Разрушение может происходить до или после цикла термического желатинирования. Термическое желатинирование проводили в течение 1-6 часов. После желатинирования суспензию осветляли фильтрацией. Суспензию желатина обезвоживали сушкой на воздухе при 15-40°С, предпочтительно, 20-35°С. Затем сухой желатин, где «сухой» подразумевает содержание влаги менее чем 20% мас., разрушали размолом.
Сухой желатин добавляли к холодному (от 5°С до 15°С) водному раствору, содержащему глутаральдегид (Amresco Inc., OH) в количестве от 0,0025% до 0,075% мас. при рН от 7 до 10. Концентрация желатина в этом растворе составляла от 1% до 10% мас. Глутаральдегид поперечно сшивает гранулы желатина в течение периода от одного до 18 часов, после чего желатин отделяли от водной фазы фильтрацией или осаждением. Затем частицы желатина добавляли к водному раствору, содержащему от 0,00833% до 0,0667% мас. боргидрида натрия (Spectrum Chemical Co., CA) и в данном случае при концентрации желатина от 1% до 10% мас. и рН, составляющем от 7 до 12, или от 7 до 9. Через 1-6 часов поперечно сшитый желатин отделяли от водной фазы фильтрацией или осаждением. Затем желатин можно ресуспендировать в не пирогенной воде при концентрации желатина, составляющей от 1% до 10% мас., для удаления остаточных поперечно сшивающих и восстанавливающих агентов с последующим отделением от водной фазы фильтрацией или осаждением. Конечный сбор поперечно сшитого желатина проводили на сетке или сите фильтра, и желатин окончательно споласкивали не пирогенной водой. Затем влажный, поперечно сшитый желатин помещали в сушильную камеру при 15°С- 40°С. Сухой, поперечно сшитый желатин (т.е. поперечно сшитый желатин с содержанием влаги ниже 20% мас.) удаляли из сушильной камеры и затем размалывали, используя механическую, размалывающую мельницу, для получения порошка с типичным распределением размера частиц от 0,020 мм до 2,000 мм.
Пример 8: Быстродействующий сухой порошок гемостатического герметика
Быстродействующий сухой порошок гемостатического герметика получали комбинированием первого поперечно сшиваемого компонента, второго поперечно сшиваемого компонента и образующего гидрогель компонента. Первый поперечно сшиваемый полимер (PEG-A) представлял собой порошок PEG-сукцинимидила, второй поперечно сшиваемый полимер (PEG-B) представлял собой порошок PEG-тиола, и образующий гидрогель компонент представлял собой порошок поперечно сшитого желатина.
Пример 9: Прокладка быстродействующего сухого герметика
Прокладку быстродействующего сухого герметика получали комбинированием первого поперечно сшиваемого компонента, второго поперечно сшиваемого компонента и образующего гидрогель компонента. Полученную композицию, порошкообразную матричную композицию герметика, помещали на лиофилизированную коллагеновую губку и нагревали до 60-70°С примерно 1-2 минуты. Сухая порошковая матрица слегка плавилась при этой температуре и фиксировалась на поверхности коллагеновой губки, таким образом, формируя прокладку матрицы герметика. Альтернативно, матричная композиция герметика может фиксироваться на подложке с использованием связывающих агентов или других эксципиентов, известных в фармацевтических областях. В целом, методика, используемая для фиксации матричной композиции герметика на подложке, может зависеть от первого и второго компонентов и образующего гидрогель компонента матричной композиции герметика. Варианты осуществления прокладки матрицы герметика по настоящему изобретению обеспечивают удобный формат, посредством которого матричными композициями герметика можно манипулировать и доставлять в хирургический участок губкой или другим подходящим опорным средством.
Пример 10: Порошок герметика для обработки прокола селезеночной артерии
Фиг.7А-Е иллюстрируют наложение матричной композиции герметика для обработки прокола селезеночной артерии в соответствии с вариантами осуществления настоящего изобретения. Свинье вводили гепарин до уровня, приблизительно втрое превышающего исходный уровень. Как изображено на фиг.7А, прокол селезеночной артерии хирургически производили у свиньи иглой 18 калибра 700. После прокола, из артерии 710 наблюдалось профузное кровотечение 705. Как показано на фиг.7В и 7С, приблизительно 700 мг порошка матричной композиции герметика 720 наносили на участок прокола посредством шприца 730 и осторожно прижимали или приставляли к участку на 2 минуты, используя палец в перчатке 740. Порошок герметика образовывал свернутый сгусток 750, который, по наблюдению, вызывал адекватную остановку кровотечения. Участок орошали через 5 минут после нанесения орошающим устройством 760, как показано на фиг.7D, и избыток порошковой композиции смывали. Когда свернутый сгусток схватывали пинцетом, оказалось, что он достаточно хорошо сцепился с тканью и имел хорошую целостность. Как показано на фиг.7Е, свернутый сгусток 750 удаляли через 44 минуты после наложения отслоением пинцетом 770, и наблюдалось возобновившееся кровотечение 715.
Пример 11: Порошок герметика для обработки участка резекции печени
Фиг.8А-Е иллюстрируют наложение матричной композиции герметика для обработки участка резекции печени в соответствии с вариантами осуществления настоящего изобретения. Свинье вводили гепарин до уровня, приблизительно втрое превышающего исходный уровень. Как изображено на фиг.8А, кончик 800, или край, средней доли печени 805 резецировали у свиньи, используя ножницы 810. После резекции из участка наблюдалось профузное кровотечение 815. Как изображено на фиг.8В, приблизительно 6 мл (2 г) матричной композиции герметика 820 наносили на участок и удерживали на месте кончиком шприца 825 в течение 2 минут. Как показано на фиг.8С, палец в перчатке можно использовать для прижимания или удерживания порошка в участке повреждения. Порошок герметика образовывал свернутый сгусток 835, который, по наблюдению, вызывал адекватную остановку кровотечения. Участок орошали через 8 минут после нанесения орошающим устройством 840, как показано на фиг.8D. Когда свернутый сгусток схватывали пинцетом, оказалось, что он достаточно хорошо сцепился с тканью и имел хорошую целостность. Свернутый сгусток 835 удаляли через 28 минут после наложения отслоением пинцетом 845, и наблюдалось возобновившееся кровотечение 850.
Пример 12: Порошок герметика для обработки повреждения селезенки
Повреждение селезенки вызывали хирургически у свиньи пробойником для биопсии ткани диаметром 6 мм, и сердцевину ткани удаляли ножницами. Свинье вводили гепарин до уровня, приблизительно в 2,5 раза превышающего исходный уровень. После пробивки ткани из селезенки наблюдалось профузное кровотечение. Приблизительно 700 мг (2 мл) порошка матричной композиции герметика наносили на участок прокола, используя край шприца емкостью 12 мл. Для удерживания материала на месте, не использовали прижимание. Порошок герметика образовывал свернутый сгусток, который, по наблюдению, вызывал адекватную остановку кровотечения. Участок орошали через 4 минуты после нанесения. Когда свернутый сгусток схватывали пинцетом, оказалось, что он достаточно хорошо сцепился с тканью и имел хорошую целостность. Свернутый сгусток удаляли через 25 минут после наложения отслоением, и наблюдалось возобновившееся кровотечение.
Пример 13: Тест механического напряжения
Барьер из матрицы герметика получали взаимодействием 0,60-0,65 г порошка матричной композиции герметика с 1 мл плазмы свиньи в пластиковой пресс-форме. Смеси дали возможность отвердеть при комнатной температуре в течение приблизительно 30 минут. Оба конца блока геля размером 3×1×0,3 см связывали лентой с цианокрилатным клеем для создания пространств захвата с целью растягивания (1×1 см). Концы ленты захватывали предварительно установленными зажимами. Для применения теста нормального напряжения к гелю прямоугольной формы до разлома использовали тестер Chatillon TCD2000 для определения предела прочности на разрыв. Максимальную силу (N) и отклонение при максимальной нагрузке (мм) измеряли для растяжения геля до разрыва. Эффективная площадь поверхности геля составила 1×0,3 см, а исходная, эффективная длина геля составила 1 см. Предел прочности на разрыв геля герметика составлял приблизительно 15,3 Н/см2. Аналогичный тест выполняли на композиции геля, включающей первый поперечно сшиваемый компонент и второй поперечно сшиваемый компонент, в отсутствие образующего гидрогель компонента, и наблюдаемый предел прочности на разрыв составлял приблизительно 5,1 Н/см2.
Пример 14: Тест прочности при отслоении
В некоторых вариантах осуществления смешанный порошок включает первый и второй поперечно сшиваемые компоненты и образующий гидрогель компонент и является самостоятельно полимеризуемым при его растворении в физиологической жидкости, такой как кровь или другая биологическая жидкость. Материал может плотно сцепляться с тканью или другим участком нанесения путем ковалентного связывания. Механическую прочность сцепления с тканью можно исследовать, используя механический зажим для отслоения матрицы герметика от ткани, такой как кожа. В этом примере множественные тесты предела прочности на разрыв после образования барьеров из матрицы герметика проводили следующим образом. Получали серию трехкомпонентных порошков, включающих первый поперечно сшиваемый компонент (тетра-сукцинимидилглутарат простого пентаэритритолполи(этиленгликолевого) эфира) и второй поперечно сшиваемый компонент (тетра-тиол простого пентаэритритолполи(этиленгликолевого) эфира), и поперечно сшитый желатин (FloSealTM), смешиванием поперечно сшиваемых компонентов и поперечно сшитого желатина в трех различных концентрациях (10%, 20% и 30% поперечно сшиваемого компонента). Примерно от 0,40 г до примерно 0,45 г трехкомпонентного порошка добавляли примерно к 0,6 мл свиной плазмы в пластиковую пресс-форму размером 3×1×0,3 см поверх образца куриной кожи, и давали возможность отвердеть при комнатной температуре в течение приблизительно 60 минут. Барьер из матрицы герметика образовывался и плотно сцеплялся с кожей. Образованный барьер из матрицы герметика приклеивали к пластине, которая укреплялась зажимами к тестеру Chatillon TCD2000. Максимальную пиковую силу (Н) измеряли при отслоении кожи от барьера из матрицы герметика. Наблюдалось, что увеличение прочности сцепления почти линейно коррелировалось с увеличением концентрации смеси PEG (первого и второго поперечно сшиваемых компонентов). Результаты показаны в таблице 4А.
Пример 15: Получение волокнистого коллагена для губчатой подложки слитой прокладки
Первый образец волокнистого коллагена получали следующим образом. 40 г NaOH растворяли в 450 мл Н2О при температуре 25°С. К раствору NaOH добавляли приблизительно 50 г тонких срезов коровьей дермы. Дерму перемешивали в течение 80 минут. Раствор NaOH декантировали и дерму промывали Н2О. Дерму растворяли 2М HCl для доведения рН до диапазона от 2,3 до 2,4. Перемешивание продолжали в течение 18 часов. 1250 мл густого коллагена в растворе (CIS) титровали до рН 7,25 1М NaOH при 18°С. Коллагеновое волокно формировалось в течение периода 10 часов, и проводили фильтрацию. 240 мл осаждали при рН 7,4 и поперечно сшивали 33 мкл 25% раствора глутаральдегида (GA) при 8°С в течение 23 часов. Волокнистый коллаген лиофилизировали рецептурным циклом, используя лиофилизатор Virtis.
Второй образец волокнистого коллагена получали следующим образом. Волокнистый коллаген поперечно сшивали, используя 240 г вязкого раствора (например, CIS). Раствор разбавляли добавлением 60 мл Н2О. рН повышали до 9,2 добавлением примерно 1,8 мл 2М NaOH. Температуру раствора доводили до 8°С и добавляли 33 мкл 25% GA. Раствор перемешивали в течение 23 часов, и получали примерно 54 г осажденных волокон. Волокнистый коллаген лиофилизировали рецептурным циклом, используя лиофилизатор Virtis.
Пример 16: Устранение буферного действия образующего гидрогель компонента
В некоторых вариантах осуществления может быть желательно удаление соли фосфата из образующего гидрогель компонента, такого как FloSealTM, с тем, чтобы на рН образующего гидрогель компонента можно было легко влиять окружающей жидкостью. Поперечная сшивка in situ образующего гидрогель компонента может помочь сцеплению соединения матрицы герметика с тканью после нанесения. В некоторых случаях сцепление может быть более эффективным при определенных уровнях рН. Например, некоторые материалы на основе желатина могут подвергаться более быстрому сцеплению при величинах рН ниже чем 6 или 7. FloSealTM промывали Н2О в соотношении 1:50, и рН суспензии доводили или подкисляли 0,01M HCl или 0,1М NaOH до уровня рН от 2 до 7. Влажную лепешку желатина фильтровали и сушили в термостате с принудительной воздушной продувкой при 32°С в течение 12-20 часов и подвергали мелкому размолу пестиком в ступке. Высушенный желатиновый порошок добавляли к раствору смешанного PEG для поперечной сшивки in situ. Суспензию смешивали в течение 30 секунд и сразу наносили на поверхность бумаги для взвешивания, полностью насыщенной 25 мМ фосфатного буфера при рН 7,4. Регистрировали величины времени полимеризации, и результаты показаны в таблице 5.
Пример 17: Получение лепешки PEG
В одном варианте осуществления 0,8 г порошка PEG-сукцинимида и 0,8 г порошка PEG-тиола тщательно смешивали встряхиванием и помещали в колбу с круглым дном емкостью 100 мл, которая была полностью заряжена N2. Смешанный порошок плавили в масляной бане при 40-50°С при осторожном ручном перемешивании в течение 30 минут и давали возможность охладиться. Твердую пленку удаляли из колбы, используя шпатель. В другом варианте осуществления смешанный порошок PEG-сукцинимида и PEG-тиола растворяли в кислотном растворе коллагена (например, 0,3%) или желатина (например, 2%) и лиофилизировали. Считается, что волокнистый коллаген или желатин может помочь разрыхлить матрицу и улучшить манипулирование лепешкой PEG.
В сравнительной композиции, 1,2 г коллагенового волокна растворяли в 100 мл HCl при рН 2, нагревали в водяной бане при 35°С в течение 1-2 часов и разбавляли HCl при рН 2 для достижения продукта 0,3% CIS. 0,2 г PEG-сукцинимида и 0,2 г PEG-тиола растворяли в 2 мл 0,3% CIS. Полученную смесь выливали в лоток и лиофилизировали посредством 22-часового цикла для получения лепешки PEG. В еще одном варианте осуществления 2 г желатина растворяли в 100 мл HCl при рН 2 в водяной бане при 35°С. 4 г двухкомпонентной смеси порошка PEG растворяли в 2 мл раствора желатина и лиофилизировали для получения лепешки PEG.
В связанном варианте осуществления лепешки PEG получали лиофилизированными смешанными растворами PEG-SG, PEG-SH и коллагена при рН 2,0. Исследования на животных выполняли на подвергнутых экскориации печеночных капсулах на модели у свиней после введения гепарина. На поверхность печени, которая медленно кровоточила, добавляли 2 капли 0,2М фосфатного буфера (рН 9,0). Кусочек лепешки помещали на участок без какого-либо сдавливания. Через 5 и 10 минут тестировали адгезию каждой из лепешек PEG к участку. Наблюдалось, что активность PEG-SG не была снижена во время процесса получения и что лепешки PEG сцеплялись с подвергнутой экскориации печеночной тканью ковалентным связыванием. Композиция и эффективность in vivo испытанных образцов представланы в таблице 6.
Пример 18: Порошкообразный материал лепешки PEG
400 мг предварительно смешанного CoSealTM, 1 г FloSealTM (например, рН от 7,1 до 9,5; диаметр частиц от 70 до 400 мкм) и 2-3 мл Н2О объединяли в смешанную пасту и лиофилизировали при 22-часовом цикле для образования лепешки. Как изображено на фиг.9, лепешку 900 затем разламывали 910, раздавливали, получая разрушенный порошкообразный материал 920 и помещали в шприц 930 (например, шприц емкостью 5 мл или 10 мл). Кончик 940 гильзы шприца удаляли лезвием, порошковую смесь 920 наносили на участок повреждения 950 и активность герметика наблюдали in situ. Иллюстративные результаты обсуждаются в примерах 10-12. В другом варианте осуществления лепешку получали из трехкомпонентной суспензии, как показано в таблице 7.
Результаты испытания на иллюстративных составах в соответствии с некоторыми вариантами осуществления выявили следующие характеристики, показанные в таблице 8.
Пример 19 Получение слитых прокладок из матричной композиции герметика
Прокладки PEG получали предварительными смесями расплавленного FloSealTM. Трехкомпонентные порошки получали смешиванием порошка FloSealTM с различными величинами рН и предварительно смешанным CoSealTM (например, обоих компонентов PEG в форме порошка), в соответствии с различными массовыми соотношениями. Лиофилизированные коллагеновые губки использовали в качестве опорной подложки для нанесения расплавленной трехкомпонентной смеси. В одном варианте осуществления, как изображено на фиг.10, 0,5-1 г матричной композиции герметика 1000 помещали поверх отрезка губки 1010 размером 3×3 см2. Губку и матрицу герметика подвергали термической обработке в печи при 60-70°С в течение 1-2 минут и давали возможность охладиться в эксикаторе для минимизации или предотвращения контакта с воздухом. Наблюдали, что порошок матрицы герметика образовывал шероховатую пленку и прикреплялся к губке для образования слитой прокладки 1020. В связанных вариантах осуществления получали несколько губок, причем каждая имела размеры 3×3×0,3 см2. Некоторые губки покрывали трехкомпонентной смесью первого и второго поперечно сшиваемых компонентов и образующего гидрогель компонента. Некоторые губки покрывали только двухкомпонентной смесью первого и второго поперечно сшиваемых компонентов. Все слитые прокладки испытывали in situ на участке повреждения печени. Результаты показаны в таблице 9.
В связанных вариантах осуществления получали несколько порошкообразных композиций. Некоторые композиции включали трехкомпонентную смесь первого и второго поперечно сшиваемых компонентов и образующего гидрогель компонента. Некоторые композиции включали только двухкомпонентную смесь первого и второго поперечно сшиваемых компонентов. Все композиции были испытаны in situ на участке повреждения печени. Результаты показаны в таблице 10.
Пример 20: Воздействие γ-облучения на эффективность in vivo
Получали порошкообразные матричные композиции герметика и матричные композиции герметика, наложенные на губку, и некоторые из них подвергали γ-облучению для определения воздействий γ-лучей на эффективность in vivo. Эффекты не наблюдались, как показано в таблице 11.
Пример 21: Влияние рН на эффективность in vivo
Выполняли исследования in vivo для оценки воздействия величин рН образующего гидрогель компонента и оценки способов ручного наложения на поперечную сшивку in situ. Сравнивали FloSealTM с рН 6,75 в первой композиции герметика и FloSealTM с рН 9,5 во второй композиции герметика. В некоторых случаях матричную композицию герметика вручную прижимали к повреждению, а в других случаях матричную композицию герметика наносили или помещали на повреждение без удерживания. Оказалось, что композиция, имеющая FloSealTM с рН 6,75, обеспечивала время реакции примерно на 10-30 секунд медленнее, чем композиция, имеющая FloSealTM с рН 9,5. Иллюстративные результаты исследования показаны в таблице 12. Считается, что рН образующего гидрогель компонента может играть роль на ранних стадиях реакции поперечной сшивки. рН образующего гидрогель компонента может воздействовать на скорость образования геля во влажной среде (например, когда уже происходит кровотечение). В некоторых случаях если поперечная сшивка не происходит достаточно быстро, то композиция герметика может отталкиваться от участка повреждения.
Пример 22: Использование SURGIFOAMTM в качестве образующего гидрогель компонента
Перемешивали смеси порошкообразного СОН102 (простого тетракис-[1-(1'-оксо-5'-сукцинилпентат)-2-поли(оксиэтилен)гликолевого] эфира пентаэритритола), порошкообразного СОН206 (простого тетракис-[меркаптоэтил-поли(оксиэтилен)гликолевого] эфира пентаэритритола) и поглощаемого желатинового порошка SURGIFOAMTM (Ethicon, Somerville, NJ) в соотношениях 1:1:2, 1:1:4 и 1:1:8 по массе и заполняли в модифицированные шприцы емкостью 5 мл. Полученные смеси представляли собой по существу сухие, свободно текучие порошки. Для каждой композиции 2 грамма наносили с легким сжатием на хирургически созданное повреждение печени свиньи (размером приблизительно 1 см × 1 см × 0,3 см глубиной). Для каждой из композиций сжатие прекращали через одну минуту. СОН102 и СОН206 в каждой композиции взаимодействовали друг с другом во влажной среде повреждения, создавая поперечно сшитый гидрогель, который включал порошок SURGIFOAMTM и физически герметизировал участок повреждения. Кровотечение не наблюдалось ни из одного из обработанных композициями участков. После орошения обработанных повреждений солевым раствором через 5 минут после наложения возобновления кровотечения не наблюдали. Обследование обработанных участков через 2 часа также не выявило кровотечения.
Пример 23: Эффективность in vivo матричной композиции герметика со средством, вызывающим свертывание
Получали порошок матричной композиции герметика, содержащий FloSealTM и CoSealTM (предварительно смешанные) в массовом соотношении 4:1. В некоторых вариантах осуществления это соотношение обеспечивает степень поперечной сшивки, эффективную для достижения желательных уровней химической полимеризации и адгезии композиции к ткани. Порошок тромбина добавляли в различных концентрациях к порошку матричной композиции герметика. Полученную смесь испытывали в исследовании на животных, которое включало измерение балльных оценок кровотечения в квадратах ткани печени и сравнение гемостатической эффективности полученной смеси с матричными композициями герметика, которые не содержали тромбин.
Испытуемые материалы включали 0,1 г простого тетракис[меркаптоэтилполи(оксиэтиленового)] эфира пентаэритритола, 0,1 г простого тетракис-[1-(1'-оксо-5'-сукцинимидилпентаноат)-2-поли(оксиэтилен)гликолевого] эфира пентаэритритола, 0,8 г частиц поперечно сшитого желатина (FloSealTM) и различные концентрации (5k, 2,5k, 1,25k и 0,625k ед./г) тромбина. В эксперименте смешивания 4 компонента полученной смеси смешивали барабанной мешалкой. В эксперименте восстановления растворением 4 мл раствора тромбина (1250 ед./мл) смешивали с 0,8 г FloSeal и затем лиофилизировали в течение 22 часов. Затем высушенную смесь смешивали с порошком CoSealTM, используя барабанную мешалку. Без связи с определенной теорией, считается, что восстановленный растворением состав тромбина содержит молекулы тромбина, которые проникли в матрицу FloSealTM с тем, чтобы тромбин мог оставаться в барьере матрицы герметика для усиления гемостатической эффективности. В эксперименте с прокладкой прокладку получали помещением полученной четырехкомпонентной смеси (матричной композиции герметика плюс тромбина) поверх губки Gelfoam, плавлением смеси и предоставлением ей возможности охладиться и затвердеть. Температуру термостата устанавливали на уровень примерно от 60°С до примерно 65°С примерно на одну минуту.
В тесте in vivo животному вводили гепарин с целью активации времени свертывания для достижения уровня свертывания, в 3-5 раз превышающего исходный уровень. Составы исследовали на кровоточащем пространстве квадрата ткани печени (1см × 1 см × 0,2 см), которое было хирургически создано на печени свиньи. Повреждение орошали сразу после регистрации результатов через 5 минут для удаления избыточного порошка. Балльные оценки областей обработанных повреждений проводили через 1, 5, 10 и 30 минут. Материалы полимеризировались после контакта с кровью и затем плотно сцеплялись с повреждением. Барьер матрицы герметика механически герметизировал кровоточащие области для действия в качестве механического герметика связыванием с тканями. В тесте in vivo тромбин нагревали примерно при 60°С в течение 5 минут и было обнаружено, что он полностью активен. В полученной прокладке Gelfoam, было обнаружено, что активность тромбина была утрачена.
Результаты однократной оценки in vivo представлены в таблице 13. Кровотечение из повреждений оценивали в баллах от «0» при отсутствии кровотечения до «4» при тяжелом кровотечении. На основании наблюдавшихся балльных оценок кровотечения, при всех испытанных образцах не было выявлено кровотечение. При добавлении тромбина к матричной композиции герметика не наблюдали значимого преимущества. Использование тромбина не проявило никаких выгод при первичном гемостазе, хотя оно может усилить вторичный гемостаз/образование сгустка и заживление раны.
Пример 24: Влияние концентрации PEG на прочность геля
Влияние концентрации PEG на прочность геля показано в таблице 14 и на фиг.11, в соответствии с одним вариантом осуществления настоящего изобретения. Тесты на растяжение проводили после образования геля. Гели получали предоставлением возможности взаимодействия трехкомпонентного порошка (например, матричной композиции герметика, которая включает первый и второй поперечно сшиваемые компоненты и образующий гидрогель компонент) в пластиковых пресс-формах (3×1×0,3 см). Свиную плазму (1 мл, Baxter, животное номер S-264) добавляли к порошку матричной композиции герметика (0,60-0,65 г) для инициации образования геля, затем давали возможность отвердеть при комнатной температуре в течение приблизительно 30 минут. Оба конца геля были прикреплены липкой лентой с использованием цианоакрилатного клея для создания пространств захвата для разъединения (1×1 см). На основании теста на растяжение измеряли максимальную силу (Н) и отклонение при максимальной нагрузке (см), необходимые для растяжения геля до разрыва. Эффективная площадь поверхности составляла 1×0,3 см. Первоначальная эффективная длина геля составляла 1,0 см. Приложение нормального растяжения тестером Chatillon TCD200 к куску геля прямоугольной формы до его разрыва было определяющим фактором растягивающего напряжения. Результаты теста показали, что более высокая концентрация полимера может увеличить прочность геля матричной композиции герметика.
Пример 25: Влияние концентрации PEG на отношение набухания
Влияние концентрации PEG на отношение набухания показано на фиг.12, 13 и 14 в соответствии с одним вариантом осуществления настоящего изобретения. Исследования набухания проводили для характеристики гелей матричной композиции герметика. При контакте с водной средой гидрофильный полимер набухает с образованием гидрогеля. После образования геля молекулы воды свободно диффундируют через достаточно рыхлую сеть, образованную набухшими частицами FloCealTM. После дальнейшего добавления воды контакты СОН102-СОН206 разрушаются, и отдельные молекулы полимера растворяются в воде. Гели матричной композиции герметика получали смешиванием CoSealTM и FloSealTM при четырех различных концентрациях (5%, 10%, 20% и 30% мас./мас.) полимера и взаимодействиями с одинаковым количеством свиной плазмы (1,7 мл/г порошков). Гель отверждался в течение 30 минут и затем ему давали возможность набухать в солевом растворе при комнатной температуре. Периодически буфер дренировали и определяли массу остающегося геля. Контролировали изменение массы геля. Отношение набухания, Q, рассчитывали по следующему уравнению:
Q = W*/W
где W* представляет собой влажную массу, а W представляет собой исходную массу. Отношение набухания увеличивалось с увеличением концентрации полимера. Без связи с какой-либо определенной теорией, видимое снижение отношения набухания может трактоваться как потеря материала геля, поскольку гель медленно эродируется. Конец эксперимента оценивается в баллах как время, когда гель разрушается на несколько маленьких кусочков или становится таким слизистым и слабым, что невозможно декантировать из геля свободный буфер. Вода продолжает проникать по направлению к сердцевине и, наконец, гель превращается в вязкий раствор PEG и частиц желатина. Для полного разрушения материалов потребовалось примерно 2-3 недели (фиг.14). Представляется, что процентное содержание CoSealTM в порошке матричной композиции герметика может оказывать глубокое воздействие на устойчивость геля матричной композиции герметика. Скорость растворения геля матричной композиции герметика варьируется в зависимости от степени поперечной сшивки полимеров. Результаты показали, что более высокая концентрация CoSealTM может обусловить более сильную устойчивость геля и может также вызвать большее набухание. Можно ожидать, что относительная продолжительность существования такого геля in vitro одинакова с таковой in vivo.
Описанные выше примеры предоставляют вполне достаточную иллюстрацию того, что композиции в соответствии с настоящим изобретением могут быть эффективными герметиками. Композиции могут полимеризоваться in situ физиологической жидкостью или кровью и могут очень плотно герметизировать или сцепляться с тканью.
Хотя в целях ясности и понимания описанное выше изобретение было в определенных деталях описано в качестве иллюстрации и примера, будет очевидно, что определенные изменения и модификации могут быть осуществлены в пределах объема прилагаемой формулы изобретения. Все обсужденные в настоящем описании патенты, публикации, статьи, книги и другие справочные материалы во всех случаях включены в настоящее описание в качестве ссылки.
Пример 26: Оценка гемостатических свойств определенных составов на экспериментальных моделях животных
Состав № 334-77
1 грамм порошка PEG-A простого тетракис[меркаптоэтилполиоксиэтилен]эфира пентаэритритола, молекулярная масса 10000), 1 г порошка PEG-B (простого тетракис-[1-(1'-оксо-5'-сукцинимидилпентаноат)-2-поли(оксиэтилен)гликолевого] эфира пентаэритритола, молекулярная масса 10000) и 8 г FloSealTM помещали во флакон для смешивания (емкостью 50 мл) и загружали в барабанную мешалку Inversina Tumbler Mixer для смешивания. Смесь трех компонентов перемешивали в течение 10 минут до полного смешивания. Шесть шприцев (емкостью 5 мл) заполняли примерно 1,5 г смеси.
Состав № 334-77-1
1,5 г образца состава № 334-77 помещали на кусочек Gelfoam (3×4 см2, прессованная гелевая пена, изготовленная компанией Upjohn, NDC 0009-0353-01). Gelfoam с помещенным поверх образцом подвергали термической обработке в вакуумной печи при 60-65°С в течение 1 мин до тех пор, пока образец не начинал плавиться. Затем материалу давали возможность охладиться и затвердеть. Два кусочка полученной лепешки на Gelfoam помещали в мешочек со вставленным осушителем и герметично укупоривали.
Состав № 334-77-4
1,5 г образца состава № 334-77 помещали на кусочек коллагеновой губки и подвергали термической обработке. Губки получали легкой поперечной сшивкой волокон коллагена раствором глутаральдегида (5k м.д.) и лиофилизацией раствора коллагена (1,0%), используя лиофилизаторы VirTis Genesis Freeze Dryers. На коллагеновую прокладку (3×4 см2) осторожно наслаивали 1,5 г образца состава № 334-77, затем нагревали в вакуумной печи при 60-65°С в течение 1 мин до тех пор, пока образец не начинал плавиться. Затем материалу давали возможность охладиться и затвердеть. Каждую полученную коллагеновую прокладку помещали в мешочек со вставленным осушителем и герметично укупоривали.
Методы
Хирургические процедуры
Животных (кролики NZW, самки, масса тела приблизительно 3 кг) наркотизировали и внутривенно вводили гепарин в дозе 4000 МЕ/кг за 30 минут до частичной резекции печени.
Модель резекции печени
Выполняли срединную лапаротомию и обнажали левую долю печени и пережимали. Производили резекцию части левой латеральной доли печени. Кровотечение контролировалось наложением испытуемого образца. Время наложения и отверждения стандартизировали, чтобы оно не превышало 300 секунд. Гемостатический зажим удаляли через 5 минут, когда ожидалось достижение первичного гемостаза.
Модель абразии печени
Выполняли срединную лапаротомию и обнажали левую долю печени. На поверхности доли печени производили экскориацию, создавая поверхностное круговое повреждение диаметром 2 см и глубиной 2 мм. Это осуществляли, используя сверлильный инструмент с установленным шлифовальным диском (сверлильный абразивный инструмент PROXXON FBS 230/E; размер мелких твердых частиц Р40, скорость вращения 5000/мин). Полученное таким образом кровотечение из мелких сосудов или капилляров или просачивание крови лечили одним из составов.
После прохождения периода наблюдения в течение 15 минут левую долю печени возвращали в ее исходное положение в брюшной полости. Если гемостаз был достигнут, то брюшную полость закрывали и производили резекцию сальника (Syntofil® 2/0). Разрез мышц и кожи зашивали отдельно, используя два уровня прерывистых швов нитями Syntofil® 2/0.
Через 24 часа животных умерщвляли при анестезии передозировкой пентобарбитала натрия (приблизительно 320 мг внутривенно/животное). После эвтаназии выполняли вскрытие. Брюшную полость визуально исследовали для выявления присутствия крови и/или сгустков крови в результате повторного кровотечения. Кровь и/или сгустки крови в случае их присутствия собирали тампонами, используя предварительно взвешенные хирургические тампоны, и определяли массу. Если гемостаз не был достигнут, то животных умерщвляли передозировкой пентобарбитала натрия (приблизительно 320 мг внутривенно/животное) и оценивали только первичные исходы.
Результаты
Целью настоящего исследования была оценка гемостатических свойств составов № 334-77, № 334-77-1 и № 334-77-4). Использовали две очень жесткие модели гемостаза: (1) резекция печени и (2) модель экскориации поверхности печени у кроликов при введении высокой дозы гепарина.
После наложения порошка состава № 334-77 на кровоточащую рану была обнаружена необходимость вспомогательного действия прижимания состава к поверхности раны для получения гемостаза. Было трудно достичь этого давления сухой хирургической латексной перчаткой, поскольку порошок больше сцеплялся с перчаткой, чем с поверхностью раны. Однако легче было оказывать давление влажной перчаткой. Состав образовывал плотно прилегающую мембрану после вступления в контакт с влагой крови. Состав после наложения во многих случаях приводил к гемостазу, даже в жестких моделях, использованных в этом примере. Если гемостаз полностью не достигался после первого наложения и имелось просачивание крови из-под образовавшегося слоя, то было трудно адекватно прекратить кровотечение просто нанесением большего количества состава № 334-77. Может быть трудно ограничить наложение состава только на место, где требуется остановить кровотечение, поскольку если не соблюдается достаточная предосторожность, то порошкообразный состав может попасть в брюшную полость и сцепиться с тканями брюшной полости. Поэтому целесообразно правильное нанесение состава № 334-77.
Напротив, состав № 344-77-4 легко наносился слоем постоянной толщины по большой площади ткани и с достаточным давлением для получения гемостаза. Состав № 344-77-4 с подложкой из прокладки из нативного коллагена оставался сцепленным с долей печени после наложения и действовал в качестве гемостатического средства и клея, приклеивая прокладку к ране и капсуле печени. Такая биологически разлагаемая подложка может повысить эффективность порошкового компонента при достижении гемостаза. Биологически разлагаемая подложка может также придать гибкость составу, обеспечивая возможность сгибания состава по краям резекции во время наложения. Этим составов лечили двух животных, одно на модели экскориации поверхности и одно на модели резекции. Быстро достигаемый гемостаз был получен на обеих моделях. Выжило только животное, получавшее лечение на модели повреждения поверхности при отсутствии послеоперационных кровотечений в течение 24 ч. Через 24 ч коллагеновый слой еще находился на участке нанесения. У животного, получавшего лечение на модели резекции, кровотечение продолжалось в течение ночи до его гибели, и слой отсоединился. Различие между двумя экспериментами состояло в том, что в первом слой прижимался к ране в сухом состоянии, а во втором использовали давление влажным марлевым тампоном. Данные показаны в таблице 15.
Реферат
Изобретение относится к медицине. Описаны композиции, способы и наборы для применения с целью герметизации поврежденных участков тканей. Композиции получают комбинированием первого поперечно сшиваемого компонента со вторым поперечно сшиваемым компонентов для образования пористой матрицы, имеющей промежутки, и комбинированием пористой матрицы с образующим гидрогель компонентом для заполнения, по меньшей мере, некоторых из промежутков. Композиции проявляют свойства минимального набухания. 2 н. и 13 з.п. ф-лы, 16 табл., 14 ил.
Формула
первый поперечно сшиваемый компонент, который представляет собой полиалкиленоксид;
второй поперечно сшиваемый компонент, который представляет собой полиалкиленоксид, который поперечно сшивается с первым поперечно сшиваемым компонентом в условиях, обеспечивающих возможность взаимодействия; и
образующий гидрогель компонент, который представляет собой любой из белка, полисахарида или небиологического полимера;
где первый и второй поперечно сшиваемые компоненты поперечно сшиваются для образования пористой матрицы, имеющей промежутки, и где образующий гидрогель компонент способен гидратироваться с образованием гидрогеля для заполнения, по меньшей мере, некоторых промежутков.
контейнер; и
сухую смешанную порошковую композицию, расположенную внутри контейнера, причем композиция включает:
первый поперечно сшиваемый компонент, который представляет собой полиалкиленоксид, включающий множественные нуклеофильные группы, причем первый поперечно сшиваемый компонент представлен в порошковой форме;
второй поперечно сшиваемый компонент, который представляет собой полиалкиленоксид, включающий множественные электрофильные группы, причем второй поперечно сшиваемый компонент представлен в порошковой форме;
образующий гидрогель компонент, который представляет собой любой из белка, полисахарида или небиологического полимера, в порошковой форме;
где в обеспечивающих возможность реакции условиях первый и второй поперечно сшиваемые компоненты способны, по существу, к немедленной поперечной сшивке.
Документы, цитированные в отчёте о поиске
Ковалентное и нековалентное сшивание гидрофильныхполимеров и адгезивные композиции, полученные с ними

Комментарии