Композиция для лечения гиперлипидемии, содержащая производное оксинтомодулина - RU2642267C2
Код документа: RU2642267C2
Чертежи































Описание
Область техники
Настоящее изобретение относится к композиции для предупреждения или лечения гиперлипидемии, жировой болезни печени или артериосклероза, содержащей производное оксинтомодулина в качестве активного ингредиента, и к способу лечения гиперлипидемии, жировой болезни печени или артериосклероза с использованием этой композиции.
Предшествующий уровень техники
За последние годы в Корее в результате экономического роста и преобразования пищевых привычек по западному образцу увеличились потребление жиров из продуктов питания и число метаболических заболеваний, таких как гиперлипидемия, диабет, гипертензия, артериосклероз и жировая болезнь печени, которые возникают в результате недостаточной физической нагрузки.
Гиперлипидемия относится к состоянию, ассоциированному с повышенными уровнями липидов в крови, таких как свободный холестерин, сложные эфиры холестерина, фосфолипиды и триглицериды. Гиперлипидемия может проявляться в трех формах: (1) гиперхолестеринемия, (2) гипертриглицеридемия и (3) комбинированная гиперлипидемия (гиперхолестеринемия и гипертриглицеридемия). Гиперлипидемию обычно классифицируют на первичную гиперлипидемию и вторичную гиперлипидемию. Первичная гиперлипидемия обычно вызывается генетическими дефектами, в то время как вторичная гиперлипидемия вызывается различными болезненными состояниями, лекарственными средствами и диетическими привычками. Кроме того, гиперлипидемия также вызывается комбинацией причин первичной и вторичной гиперлипидемии. В качестве критериев диагностики гиперлипидемии обычно используют уровень общего холестерина 220 мг/дл или выше и уровень триглицеридов 150 мг/дл или выше.
Существуют различные формы холестерина, которые естественным образом встречаются у млекопитающих. Известен холестерин низкой плотности (LDL), который является опасным для здоровья, и известно, что увеличение LDL-холестерина увеличивает риск заболевания сердца (Assman et al., Am. J. Card, 1996). Кроме того, холестерин высокой плотности (HDL) считается хорошим холестерином и является необходимым для здоровья, так как он предупреждает артериосклероз или т.п.
Хотя сама по себе гиперлипидемия не проявляет особые симптомы, избыточные липиды в крови прилипают к стенкам кровеносного сосуда с уменьшением размера кровеносного сосуда и вызывают артериосклероз посредством воспалительных реакций. По этой причине может иметь место ишемическая болезнь сердца, сердечнососудистое заболевание, непроходимость периферических кровеносных сосудов и т.д. (Е. Falk et al., Circulation, 1995). Кроме того, избыточные липиды крови накапливаются в ткани печени и, таким образом, могут вызывать жировую болезнь печени. Жировая инфильтрация печени относится к состоянию, при котором отношение жиров к массе печени составляет более 5%. Жировая инфильтрация печени может быть вызвана не только избыточным потреблением жиров, но также и потреблением алкоголя.
Современные способы, которые используют для снижения уровней липидов в крови, включают диетическую терапию, лечебную физкультуру и лекарственную терапию. Однако диетическую терапию или лечебную физкультуру трудно строго контролировать и выполнять, а их терапевтический эффект также ограничен.
Лекарственные средства для снижения уровней липидов, разработанные до настоящего времени, включают секвестрант желчных кислот, снижающие уровень холестерина лекарственные средства, такие как ингибиторы HMG-CoA (гидроксиметилглутарил кофермент А) редуктазы, играющие важную роль в биосинтезе холестерина, снижающие уровень триглицеридов лекарственные средства, такие как производные фиброевой кислоты и никотиновая кислота, и т.д. Однако сообщалось, что эти лекарственные средства имеют побочные эффекты, такие как гепатотоксичность, желудочно-кишечное расстройство и канцерогенез. Таким образом, существует настоятельная необходимость в разработке лекарственных средств, которые можно использовать для лечения гиперлипидемии и родственных заболеваний (например артериосклероза и жировой болезни печени), имеющих при этом незначительные побочные эффекты.
В последнее время в качестве кандидата для таких лекарственных средств обратил на себя внимание оксинтомодулин. Оксинтомодулин получают из преглюкагона, и он представляет собой пептид, который может связываться с рецептором как глюкагоноподобного пептида-1 (GLP-1), так и глюкагона с выполнением двойной функции. Вследствие таких характеристик оксинтомодулин был изучен в отношении различных целей, включая лечение ожирения, гиперлипидемии и жировой болезни печени. Однако оксинтомодулин имеет проблему, поскольку его следует вводить в высокой дозе, так как он имеет короткий период полувыведения in vivo, и его активность является недостаточной для применения в лечении ожирения, гиперлипидемии и жировой болезни печени.
Исходя из этого, авторы настоящего изобретения разработали производное оксинтомодулина, обладающее повышенной активностью по сравнению с нативным оксинтомодулином, и обнаружили, что производное оксинтомодулина снижало содержание и соотношение липидов в крови у модели хомяка с индуцированной гиперлипидемией, указывая на то, что это производное можно эффективно применять для лечения гиперлипидемических заболеваний, таким образом осуществляя настоящее изобретение.
Описание изобретения
Техническая проблема
Цель настоящего изобретения заключается в представлении композиции для предупреждения или лечения гиперлипидемии, жировой болезни печени или артериосклероза, которая содержит производное оксинтомодулина в качестве активного ингредиента.
Другая цель настоящего изобретения заключается в представлении способа лечения гиперлипидемии, жировой болезни печени или артериосклероза, включающего стадию введения субъекту производного оксинтомодулина.
Еще одна цель настоящего изобретения заключается в то, чтобы предложить применение производного оксинтомодулина в изготовлении лекарственного средства для предупреждения или лечения гиперлипидемии, жировой болезни печени или артериосклероза.
Техническое решение
Для достижения указанных выше целей в одном аспекте настоящего изобретения предложена композиция для предупреждения или лечения гиперлипидемии, жировой болезни печени или артериосклероза, которая содержит производное оксинтомодулина в качестве активного ингредиента.
При использовании в описании изобретения термин "оксинтомодулин" относится к пептиду, получаемому из преглюкагона, который является предшественником глюкагона. В настоящем изобретении подразумевается, что оксинтомодулин включает нативный оксинтомодулин и его предшественник, аналог (производное), фрагмент и вариант. Предпочтительно, оксинтомодулин имеет аминокислотную последовательность SEQ ID NO: 1 (HSQGTFTSDYSKYLDSRRAQDFVQWLMNTKRNRNNIA).
При использовании в данном описании термин "вариант оксинтомодулина" означает пептид, который имеет один или более чем один аминокислотный остаток, отличный от такового аминокислотной последовательности нативного оксинтомодулина, и имеет функцию активирования рецепторов GLP-1 и глюкагона. Вариант оксинтомодулина может быть получен посредством любого из замены, добавления, делеции, модификации нескольких аминокислот нативного оксинтомодулина или комбинации этих способов.
При использовании в данном описании термин "производное оксинтомодулина" относится к пептиду, производному пептида или миметику пептида, который получен посредством добавления, делеции или замены нескольких аминокислот нативного оксинтомодулина и который может активировать как рецептор GLP-1, так и рецептор глюкагона до высокого уровня в сравнении с уровнем, активируемым нативным оксинтомодулином.
При использовании в данном описании термин "фрагмент оксинтомодулина" относится к фрагменту, имеющему добавление или делецию одной или более чем одной аминокислоты на амино- или карбокси-конце нативного оксинтомодулина, в котором добавленные аминокислоты также могут представлять собой не встречающиеся в природе аминокислоты (например аминокислоту D-типа). Такие аминокислоты обладают функцией регулирования уровней глюкозы в крови in vivo.
Способы получения варианта, производного и фрагмента оксинтомодулина можно применять по отдельности или в комбинации. Например, настоящее изобретение включает пептид, который имеет одну или более чем одну аминокислоту, отличную от таковой в нативном пептиде, и дезаминирование N-концевых аминокислотных остатков и обладает функцией активирования как рецептора GLP-1, так и рецептора глюкагона.
Аминокислоты, указанные в данном описании, сокращают согласно правилам системы условных обозначений IUPAC-IUB следующим образом:
В настоящем изобретении производное оксинтомодулина охватывает любой пептид, который получен посредством замены, добавления, делеции или посттрансляционной модификации (например метилирования, ацилирования, убиквитинирования или внутримолекулярного ковалентного связывания) аминокислот в аминокислотной последовательности SEQ ID NO: 1 и который может активировать рецепторы как глюкагона, так и GLP-1. При замене или добавления аминокислот могут быть использованы не только 20 аминокислот, обычно обнаруживаемых в белках человека, но также и атипичные или не встречающиеся в природе аминокислоты. Коммерческие поставщики атипичных аминокислот включают Sigma-Aldrich, ChemPep Inc. и Genzyme Pharmaceuticals. Пептиды, содержащие эти аминокислоты и атипичные пептидные последовательности, могут быть синтезированы и приобретены у коммерческих поставщиков, например American Peptide Company, или Bachem (USA), или Anygen (Korea).
В конкретном воплощении настоящего изобретения производное оксинтомодулина по настоящему изобретению представляет собой новый пептид, содержащий аминокислотную последовательность следующей формулы 1:
[Формула 1]
R1-Х1-X2-GTFTSD-X3-X4-X5-X6-X7-X8-X9-X10-Х11-Х12-Х13-Х14-Х15-Х16-X17-X18-X19-X20-X21-X22-X23-X24-R2 (SEQ ID NO: 54), где
R1 представляет собой гистидин, дезаминогистидил, диметилгистидил (N-диметилгистидил), бета-гидроксиимидазопропионил, 4-имидазоацетил, бета-карбоксиимидазопропионил или тирозин;
X1 представляет собой Aib (аминоизомасляную кислоту), d-аланин, глицин, Sar (N-метилглицин), серии или d-серин;
Х2 представляет собой глутаминовую кислоту или глутамин;
Х3 представляет собой лейцин или тирозин;
Х4 представляет собой серии или аланин;
Х5 представляет собой лизин или аргинин;
Х6 представляет собой глутамин или тирозин;
Х7 представляет собой лейцин или метионин;
Х8 представляет собой аспарагиновую кислоту или глутаминовую кислоту;
Х9 представляет собой глутаминовую кислоту, серии, альфа-метилглутаминовую кислоту или делетирован;
Х10 представляет собой глутамин, глутаминовую кислоту, лизин, аргинин или серин или делетирован;
X11 представляет собой аланин, аргинин или валин или делетирован;
Х12 представляет собой аланин, аргинин, серин или валин или делетирован;
Х13 представляет собой лизин, глутамин, аргинин или альфа-метилглутаминовую кислоту или делетирован;
Х14 представляет собой аспарагиновую кислоту, глутаминовую кислоту или лейцин или делетирован;
Х15 представляет собой фенилаланин или делетирован;
Х16 представляет собой изолейцин или валин или делетирован;
Х17 представляет собой аланин, цистеин, глутаминовую кислоту, лизин, глутамин или альфа-метилглутаминовую кислоту или делетирован;
Х18 представляет собой триптофан или делетирован;
Х19 представляет собой аланин, изолейцин, лейцин, серии или валин или делетирован;
Х20 представляет собой аланин, лизин, метионин, глутамин или аргинин или делетирован;
Х21 представляет собой аспарагин или делетирован;
Х22 представляет собой аланин, глицин или треонин или делетирован;
Х23 представляет собой цистеин или лизин или делетирован;
Х24 представляет собой пептид, имеющий от 2 до 10 аминокислот, состоящих из комбинации аланина, глицина и серина, или делетирован; и
R2 представляет собой KRNRNNIA (SEQ ID NO: 35), GPSSGAPPPS (SEQ ID NO: 36), GPSSGAPPPSK (SEQ ID NO: 37), HSQGTFTSDYSKYLD (SEQ ID NO: 38), HSQGTFTSDYSRYLDK (SEQ ID NO: 39), HGEGTFTSDLSKQMEEEAVK (SEQ ID NO: 40) или делетирован (за исключением случая, когда аминокислотная последовательность формулы 1 идентична аминокислотной последовательности SEQ ID NO: 1).
С целью увеличения активности оксинтомодулина дикого типа в отношении рецептора глюкагона и рецептора GLP-1 производное оксинтомодулина по настоящему изобретению может быть замещено 4-имидазоацетилом, полученным посредством делетирования альфа-углерода гистидина в положении 1 аминокислотной последовательности SEQ ID NO: 1, дезаминогистидилом, полученным посредством делетирования N-концевой аминогруппы, диметилгистидилом (N-диметилгистидилом), полученным посредством модификации N-концевой аминогруппы при помощи двух метильных групп, бета-гидроксиимидазопропионилом, полученным посредством замещения N-концевой аминогруппы гидроксильной группой, или бета-карбоксиимидазопропионилом, полученным посредством замещения N-концевой аминогруппы карбоксильной группой. Кроме того, область связывания с рецептором GLP-1 может быть заменена аминокислотами, которые усиливают гидрофобные и ионные связи или их комбинацию. Участок последовательности оксинтомодулина может быть заменен аминокислотной последовательностью GLP-1 или эксендина-4 для увеличения активности рецептора GLP-1.
Кроме того, участок последовательности оксинтомодулина может быть заменен последовательностью, которая стабилизирует альфа-спираль. Предпочтительно, аминокислоты в положениях 10, 14, 16, 20, 24 и 28 аминокислотной последовательности формулы 1 могут быть заменены аминокислотами или производными аминокислот, состоящими из Tyr(4-Ме), Phe, Phe(4-Me), Phe(4-Cl), Phe(4-CN), Phe(4-NO2),Phe(4-NH2), Phg, Pal, Nal, Ala(2-тиенил) и Ala (бензотиенил), которые, как известно, стабилизируют альфа-спираль, и нет никаких ограничений по типу и числу встраиваемых стабилизирующих альфа-спираль аминокислот или производных аминокислот.
Предпочтительно, аминокислоты в положениях 10 и 14, 12 и 16, 16 и 20, 20 и 24, и 24 и 28 аминокислотной последовательности также могут быть заменены глутаминовой кислотой или лизином для того, чтобы происходило образование колец, и нет никакого ограничения по числу встраиваемых колец. Наиболее предпочтительно, производное оксинтомодулина может иметь аминокислотную последовательность, выбранную из числа следующих формул 1-6.
В конкретном воплощении производное оксинтомодулина по настоящему изобретению представляет собой новый пептид, содержащий аминокислотную последовательность следующей формулы 2, полученную посредством замены аминокислотной последовательности оксинтомодулина на аминокислотную последовательность эксендина или GLP-1:
[Формула 2]
R1-A-R3 (SEQ ID NO: 55).
В другом конкретном воплощении производное оксинтомодулина по настоящему изобретению представляет собой новый пептид, содержащий аминокислотную последовательность следующей формулы 3, которая получена посредством связывания участка аминокислотной последовательности оксинтомодулина и участка аминокислотной последовательности эксендина или GLP-1 через подходящий аминокислотный линкер:
[Формула 3]
R1-B-C-R4 (SEQ ID NO: 56).
В еще одном конкретном воплощении производное оксинтомодулина по настоящему изобретению представляет собой новый пептид, содержащий аминокислотную последовательность следующей формулы 4, где участок аминокислотной последовательности оксинтомодулина заменен аминокислотой, способной усиливать аффинность связывания в отношении рецептора GLP-1, например, Leu в положении 26, который связывается с рецептором GLP-1 посредством гидрофобного взаимодействия, заменен гидрофобным остатком Не или Val:
R1-SQGTFTSDYSKYLD-D1-D2-D3-D4-D5-LFVQW-D6-D7-N-D8-R3
[Формула 4]
(SEQ ID NO: 57).
В еще одном конкретном воплощении производное оксинтомодулина по настоящему изобретению представляет собой новый пептид, содержащий аминокислотную последовательность следующей формулы 5, где часть аминокислотной последовательности нативного оксинтомодулин делетирована, добавлена или заменена, на другие аминокислоты для увеличения способностей нативного оксинтомодулина активировать рецептор GLP-1 и рецептор глюкагона:
R1-Е1-QGTFTSDYSKYLD-E2-E3-RA-E4-E5-FV-E6-WLMNT-E7-R5
[Формула 5]
(SEQ ID NO: 58).
В формулах 2-5 R1 является таким же, как описано в формуле 1;
А выбран из группы, состоящей из
SQGTFTSDYSKYLDSRRAQDFVQWLMNT (SEQ ID NO: 41),
SQGTFTSDYSKYLDEEAVRLFIEWLMNT (SEQ ID NO: 42),
SQGTFTSDYSKYLDERRAQDFVAWLKNT (SEQ ID NO: 43),
GQGTFTSDYSRYLEEEAVRLFIEWLKNG (SEQ ID NO: 44),
GQGTFTSDYSRQMEEEAVRLFIEWLKNG (SEQ ID NO: 45),
GEGTFTSDLSRQMEEEAVRLFIEWAA (SEQ ID NO: 46) и
SQGTFTSDYSRQMEEEAVRLFIEWLMNG (SEQ ID NO: 47);
В выбран из группы, состоящей из
SQGTFTSDYSKYLDSRRAQDFVQWLMNT (SEQ ID NO: 41),
SQGTFTSDYSKYLDEEAVRLFIEWLMNT (SEQ ID NO: 42),
SQGTFTSDYSKYLDERRAQDFVAWLKNT (SEQ ID NO: 43),
GQGTFTSDYSRYLEEEAVRLFIEWLKNG (SEQ ID NO: 44),
GQGTFTSDYSRQMEEEAVRLFIEWLKNG (SEQ ID NO: 45),
GEGTFTSDLSRQMEEEAVRLFIEWAA (SEQ ID NO: 46),
SQGTFTSDYSRQMEEEAVRLFIEWLMNG (SEQ ID NO: 47),
GEGTFTSDLSRQMEEEAVRLFIEW (SEQ ID NO: 48) и
SQGTFTSDYSRYLD (SEQ ID NO: 49);
С представляет собой пептид, имеющий от 2 до 10 аминокислот, состоящих из комбинации аланина, глицина и серина;
D1 представляет собой серин, глутаминовую кислоту или аргинин;
D2 представляет собой аргинин, глутаминовую кислоту или серин;
D3 представляет собой аргинин, аланин или валин;
D4 представляет собой аргинин, валин или серин;
D5 представляет собой глутамин, аргинин или лизин;
D6 представляет собой изолейцин, валин или серин;
D7 представляет собой метионин, аргинин или глутамин;
D8 представляет собой треонин, глицин или аланин;
Е1 представляет собой серин, Aib, Sar, d-аланин или d-серин;
Е2 представляет собой серин или глутаминовую кислоту;
Е3 представляет собой аргинин или лизин;
Е4 представляет собой глутамин или лизин;
Е5 представляет собой аспарагиновую кислоту или глутаминовую кислоту;
Е6 представляет собой глутамин, цистеин или лизин;
Е7 представляет собой цистеин или лизин или делетирован;
R3 представляет собой KRNRNNIA (SEQ ID NO: 35), GPSSGAPPPS (SEQ ID NO: 36) или GPSSGAPPPSK (SEQ ID NO: 37);
R4 представляет собой HSQGTFTSDYSKYLD (SEQ ID NO: 38), HSQGTFTSDYSRYLDK (SEQ ID NO: 39) или HGEGTFTSDLSKQMEEEAVK (SEQ ID NO: 40); и
R5 представляет собой KRNRNNIA (SEQ ID NO: 35), GPSSGAPPPS (SEQ ID NO: 36) или GPSSGAPPPSK (SEQ ID NO: 37) или делетирован (за исключением случая, когда аминокислотные последовательности формул 2-5 идентичны аминокислотной последовательности SEQ ID NO: 1).
Предпочтительно, производное оксинтомодулина по настоящему изобретению может представлять собой новый пептид следующей формулы 6.
[Формула 6]
R1-Х1-X2-GTFTSD-X3-X4-X5-X6-X7-X8-X9-X10-Х11-Х12-Х13-Х14-Х15-Х16-X17-X18-X19-X20-X21-X22-X23-X24-R2 (SEQ ID NO: 59),
где R1 представляет собой гистидин, дезаминогистидил, 4-имидазоацетил или тирозин;
X1 представляет собой Aib (аминоизомасляную кислоту), глицин, серии или d-серин;
Х2 представляет собой глутаминовую кислоту или глутамин;
Х3 представляет собой лейцин или тирозин;
Х4 представляет собой серии или аланин;
Х5 представляет собой лизин или аргинин;
Х6 представляет собой глутамин или тирозин;
Х7 представляет собой лейцин или метионин;
Х8 представляет собой аспарагиновую кислоту или глутаминовую кислоту;
Х9 представляет собой глутаминовую кислоту или альфа-метилглутаминовую кислоту или делетирован;
Х10 представляет собой глутамин, глутаминовую кислоту, лизин или аргинин или делетирован;
X11 представляет собой аланин или аргинин или делетирован;
Х12 представляет собой аланин или валин или делетирован;
Х13 представляет собой лизин, глутамин, аргинин или альфа-метилглутаминовую кислоту или делетирован;
Х14 представляет собой аспарагиновую кислоту, глутаминовую кислоту или лейцин или делетирован;
Х15 представляет собой фенилаланин или делетирован;
Х16 представляет собой изолейцин или валин или делетирован;
Х17 представляет собой аланин, цистеин, глутаминовую кислоту, глутамин или альфа-метилглутаминовую кислоту или делетирован;
Х18 представляет собой триптофан или делетирован;
Х19 представляет собой аланин, изолейцин, лейцин или валин или делетирован;
Х20 представляет собой аланин, лизин, метионин или аргинин или делетирован;
Х21 представляет собой аспарагин или делетирован;
Х22 представляет собой треонин или делетирован;
Х23 представляет собой цистеин, лизин или делетирован;
Х24 представляет собой пептид, имеющий от 2 до 10 аминокислот, состоящих из глицина, или делетирован; и
R2 представляет собой KRNRNNIA (SEQ ID NO: 35), GPSSGAPPPS (SEQ ID NO: 36), GPSSGAPPPSK (SEQ ID NO: 37), HSQGTFTSDYSKYLD (SEQ ID NO: 38), HSQGTFTSDYSRYLDK (SEQ ID NO: 39) или HGEGTFTSDLSKQMEEEAVK (SEQ ID NO: 40) или делетирован (за исключением случая, когда аминокислотная последовательность формулы 6 идентична аминокислотной последовательности SEQ ID NO: 1).
Более предпочтительно, производное оксинтомодулина по настоящему изобретению может быть выбрано из группы, состоящей из пептидов SEQ ID NO: 2-34. Еще более предпочтительно, производное оксинтомодулин по настоящему изобретению может представлять собой производное оксинтомодулина, описанное в Таблице 1 из Примера 2-1.
В одном примере настоящего изобретения получали производные оксинтомодулина, имеющие аминокислотные последовательности SEQ ID NO: 2-34, соответственно, и было обнаружено, что производные оксинтомодулина демонстрировали превосходные активности в отношении рецептора GLP-1 и рецептора глюкагона по сравнению с нативным оксинтомодулином (Пример 2). Другими словами, из вышеуказанных результатов можно увидеть, что производное оксинтомодулина по настоящему изобретению показывало превосходные терапевтические эффекты в отношении гиперлипидемии, жировой болезни печени или артериосклероза посредством активирования рецептора GLP-1 и рецептора глюкагона.
Производные оксинтомодулина по настоящему изобретению присутствуют в форме конъюгатов, содержащих различные полимеры, для улучшения терапевтического эффекта и периода полувыведения производных in vivo.
Конъюгат по настоящему изобретению демонстрирует увеличение продолжительности эффектов по сравнению с нативным оксинтомодулином, и длительно действующие конъюгаты включают оксинтомодулин, полученный посредством модификации, замены, добавления или делеции аминокислот нативного оксинтомодулина, оксинтомодулин, конъюгированный с биоразлагаемым полимером, таким как полиэтиленгликоль (ПЭГ), оксинтомодулин, конъюгированный с полисахаридом, таким как альбумин, антителом, эластином, фибронектином или хитином или с длительно действующим белком, таким как фрагмент иммуноглобулина, оксинтомодулин, конъюгированный с жирной кислотой, имеющей способность связываться с альбумином in vivo, или оксинтомодулин, инкапсулированный в биоразлагаемые наночастицы, и тип длительно действующего конъюгата, который используют в настоящем изобретении, не ограничен.
Предпочтительно, конъюгат представляет собой конъюгат, где производное оксинтомодулина, имеющее аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2-34, связано с Fc-областью иммуноглобулина через непептидильный полимер.
Fc-область иммуноглобулина представляет собой биоразлагаемый полипептид, который метаболизируется in vivo, и, таким образом, является безопасным для применения в качестве носителя для лекарственного средства. Fc-область иммуноглобулина имеет низкую молекулярную массу по сравнению с целой молекулой иммуноглобулина и, таким образом, является полезной с точки зрения получения, очистки и выхода конъюгатов. Кроме того, поскольку между антителами аминокислотная последовательность отличается, а участок Fab показывает высокую негомогенность, его отсутствие может значительно увеличивать гомогенность вещества, а также может снижать вероятность индуцирования антигенных свойств в крови.
При использовании в данном описании термин "Fc-область иммуноглобулина" относится к белку, который содержит константную область 2 тяжелой цепи (СН2) и константную область 3 тяжелой цепи (СН3) иммуноглобулина, исключая вариабельные области тяжелой цепи и легкой цепи, константную область 1 тяжелой цепи (СН1) и константную область 1 легкой цепи (CL1) иммуноглобулина. Он может дополнительно содержать шарнирную область в константной области тяжелой цепи. Также Fc-область иммуноглобулина по настоящему изобретению может представлять собой расширенную Fc-область, содержащую часть или всю константную область 1 тяжелой цепи (СН1) и/или константную область 1 легкой цепи (CL1), исключая вариабельные области тяжелой цепи и легкой цепи, при условии, что он обладает эффектом, который является по существу равным эффекту нативного белка или лучше. Также Fc-область иммуноглобулина может представлять собой область, имеющую делецию участка сравнительно длинной аминокислотной последовательности, соответствующей СН2 и/или СН3. Конкретно, Fc-область иммуноглобулина по настоящему изобретению может содержать 1) СН1-домен, СН2-домен, СН3-домен и СН4-домен, 2) СН1-домен и СН2-домен, 3) СН1-домен и СН3-домен, 4) СН2-домен и СН3-домен, 5) комбинацию одного или более чем одного домена и шарнирную область иммуноглобулина (или участок шарнирной области) или 6) димер каждого домена константных областей тяжелой цепи и константной области легкой цепи.
Fc-область иммуноглобулина по настоящему изобретению включает нативную аминокислотную последовательность и производное (мутант) этой последовательности. При использовании в данном описании термин "производное аминокислотной последовательности" относится к последовательности, которая отличается от нативной аминокислотной последовательности вследствие делеции, инсерции, неконсервативной или консервативной замены одного или более чем одного аминокислотного остатка нативной аминокислотной последовательности или их комбинации. Например, в случае Fc IgG аминокислотные остатки в положениях 214-238, 297-299, 318-322 или 327-331, которые, как известно, являются важными для связывания, могут быть использованы в качестве подходящих сайтов для модификации.
Кроме того, возможны другие различные производные, включая такое производное, которое имеет делецию области, способной образовывать дисульфидную связь, или делецию некоторых аминокислотных остатков на N-конце нативного Fc или добавление остатка метионина на N-конце нативного Fc. Кроме того, для устранения эффекторных функций, делеция может иметь место в сайте связывания комплемента, таком как C1q-связывающий сайт и сайт ADCC (антителозависимой клеточно-опосредованной цитотоксичности). Способы получения таких производных последовательности Fc-области иммуноглобулина раскрыты в международных патентных публикациях №WO 97/34631 и WO 96/32478.
Замены аминокислот в белках и пептидах, которые в основном не изменяют активность белков или пептидов, известны в данной области техники (Н. Neurath, R.L. Hill, The Proteins, Academic Press, New York, 1979). Наиболее часто встречающимися заменами являются Ala/Ser, Val/lle, Asp/Glu, Thr/Ser, Ala/Gly, Аlа/Thr, Ser/Asn, Ala/Val, Ser/Gly, Thy/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/lle, LeuA/al, Ala/Glu и Asp/Gly, в обоих направлениях. Кроме того, Fc-область может быть при необходимости модифицирована посредством фосфорилирования, сульфатирования, акрилирования, гликозилирования, метилирования, фарнезилирования, ацетилирования, амидирования и т.п.
Вышеописанные производные Fc демонстрируют биологическую активность, идентичную активности Fc-области по настоящему изобретению, или имеют повышенную структурную устойчивость к нагреванию, рН или т.п.
Кроме того, эта Fc-область может быт получена из нативных форм, выделенных из людей и других животных, включая коров, коз, свиней, мышей, кроликов, хомяков, крыс и морских свинок, или она может представлять собой их рекомбинанты или производные, полученные из трансформированных животных клеток или микроорганизмов. В данном описании изобретения Fc-область может быть получена из нативного иммуноглобулина посредством выделения целого иммуноглобулина из живого организма человека или животного и обработки его протеиназой. Когда целый иммуноглобулин подвергают обработке папаином, он расщепляется на Fab- и Fc-области, а когда целый иммуноглобулин подвергают обработке пепсином, он расщепляется на pF'c- и F(аb)2-фрагменты. Fc или pF'c могут быть выделены с использованием эксклюзионной хроматографии или т.п. Предпочтительно, имеющая происхождение из человека Fc-область представляет собой рекомбинантную Fc-область иммуноглобулина, полученную из микроорганизма.
Кроме того, Fc-область иммуноглобулина по настоящему изобретению может находиться в форме, имеющей нативные сахарные цепи либо увеличенные или уменьшенные по сравнению с нативной формой сахарные цепи, или может находиться в дегликозилированной форме. Увеличение, уменьшение или удаление сахарных цепей Fc иммуноглобулина может быть достигнуто посредством обычных способов, таких как химический способ, ферментативный способ и способ генной инженерии с использованием микроорганизма. Fc-область, полученная посредством удаления сахарных цепей из Fc, демонстрирует значительное уменьшение аффинности связывания с частью C1q первого компонента комплемента С1 и уменьшение или потерю антителозависимой клеточно-опосредованной цитотоксичности или комлементзависимой цитотоксичности и, таким образом, не индуцирует ненужные иммунные ответы in vivo. В связи с этим Fc-область иммуноглобулина в дегликозилированной или агликозилированной форме может быть более подходящей для цели настоящего изобретения в качестве носителя лекарственного средства.
При использовании в данном описании изобретения термин "дегликозилирование" относится к ферментативному удалению сахарных группировок из Fc-области, а термин "агликозилирование" относится к негликозилированной Fc-области, продуцируемой в прокариотах, предпочтительно Е. coli.
В то же время Fc-область иммуноглобулина может иметь происхождение из людей или других животных, включая коров, коз, свиней, мышей, кроликов, хомяков, крыс и морских свинок, и предпочтительно из людей.
Кроме того, Fc-область иммуноглобулина может иметь происхождение из IgG, IgA, IgD, IgE, IgM или их комбинации или гибрида. Предпочтительно, она имеет происхождение из IgG или IgM, которые входят в число наиболее часто встречающихся белков в крови человека, и наиболее предпочтительно из IgG, который, как известно, усиливает периоды полувыведения лиганд-связывающих белков.
При использовании в данном описании термин "комбинация" означает, что полипептиды, кодирующие одноцепочечные Fc-области иммуноглобулина одинакового происхождения, связаны с одноцепочечным полипептидом другого происхождения с образованием димера или мультимера. Конкретно, димер или мультимер может быть образован из двух или более фрагментов, выбранных из группы, состоящей из фрагментов IgG Fc, IgA Fc, IgM Fc, IgD Fc и IgE Fc.
При использовании в данном описании термин "гибрид" означает, что последовательности, соответствующие двум или более Fc-фрагментам иммуноглобулина разного происхождения, присутствуют в одноцепочечной Fc-области иммуноглобулина. В настоящем изобретении возможными являются различные формы гибрида. Другими словами возможен гибрид, состоящий из 1-4 доменов, выбранных из группы, состоящей из СН1, СН2, СН3 и СН4 из IgG Fc, IgM Fc, IgA Fc, IgE Fc и IgD Fc, и он может включать шарнир.
В то же время IgG может быть разделен на подклассы lgG1, lgG2, lgG3 и lgG4, и в настоящем изобретении также возможна комбинация или гибрид этих подклассов. Предпочтительно, IgG представляет собой подкласс lgG2 и lgG4, и наиболее предпочтительно он представляет собой Fc-область lgG4, которая по существу не имеет эффекторных функций, таких как комплементзависимая цитотоксичность (CDC).
Другими словами наиболее предпочтительная Fc-область иммуноглобулина, которую используют в настоящем изобретении в качестве носителя лекарственного средства, представляет собой Fc-область, имеющая происхождение из человеческого lgG4. Имеющая происхождение из человека Fc-область является более предпочтительной, чем Fc-область, имеющая происхождение не из человека, которая может действовать как антиген в организме человека и вызывать нежелательные иммунные ответы, такие как продуцирование новых антител против антигена.
При использовании в данном описании термин "непептидильный полимер" относится к биосовместимому полимеру, содержащему две или более чем две повторяющиеся единицы, связанные друг с другом посредством любой ковалентной связи вместо пептидной связи. В настоящем изобретении непептидильный полимер может быть использован взаимозаменяемо с непептидильным линкером.
Непептидильный полимер, который можно использовать в настоящем изобретении, может быть выбран из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, сополимера этиленгликоль/пропиленгликоль, полиоксиэтилированного полиола, поливинилового спирта, полисахаридов, декстрана, поливинилэтилового эфира, биоразлагаемых полимеров, таких как PLA (поли(молочная кислота)) и PLGA (поли(молочная-гликолевая) кислота), липидных полимеров, хитинов, гиалуроновой кислоты и их комбинаций. Предпочтительно, непептидильный полимер представляет собой полиэтиленгликоль. Кроме того, его производные, известные в данной области техники, и производные, которые могут быть легко получены посредством способа, известного в данной области техники, включены в объем настоящего изобретения.
Пептидный линкер, который используют в слитом белке, полученном посредством общепринятого способа слияния в рамке, имеет недостатки, поскольку он легко расщепляется протеиназой in vivo, и, таким образом, как и следовало ожидать, не может быть получен достаточный эффект увеличения периода полувыведения активного лекарственного средства из сыворотки посредство носителя. Однако в настоящем изобретении полимер, имеющий устойчивость к протеиназе, может быть использован для сохранения периода полувыведения пептида из сыворотки аналогичным таковому периоду для носителя. Поэтому любой непептидильный полимер может быть использован без ограничения в настоящем изобретении до тех пор, пока он является полимером, обладающим вышеупомянутой функцией, т.е. полимером, имеющим устойчивость к протеиназе in vivo. Непептидильный полимер имеет молекулярную массу в диапазоне от 1 до 100 кДа и предпочтительно от 1 до 20 кДа. Непептидильный полимер по настоящему изобретению, который связан с Fc-областью иммуноглобулина, может представлять собой один вид полимера или комбинацию различных полимеров.
Непептидильный полимер, который используют в настоящем изобретении, может иметь реакционноспособную группу, способную связываться с Fc-областью иммуноглобулина и белковым лекарственным средством. Реакционноспособную группу на обоих концах непептидильного полимера предпочтительно выбирают из группы, состоящей из реакционноспособной альдегидной группы, пропиональдегидной группы, бутиральдегидной группы, малеимидной группы и производного сукцинимида.
Производное сукцинимида может представлять собой сукцинимидилпропионат, гидроксисукцинимидил, сукцинимидилкарбоксиметил, или сукцинимидилкарбонат. В частности, когда непептидильный полимер имеет реакционноспособную альдегидную группу на обоих своих концах, неспецифические реакции могут быть минимизированы, а физиологически активный полипептид и иммуноглобулин могут быть эффективно соединены с одним и с другим концом непептидильного полимера, соответственно. Конечный продукт, созданный посредством восстановительного алкилирования при помощи альдегидной связи, является гораздо более стабильным, чем продукт, соединенный посредством амидной связи. Альдегидная реакционно-способная группа селективно связывается с N-концом при низком значении рН и может образовывать ковалентную связь с остатком лизина при высоком значении рН, таком как рН 9,0.
Реакционноспособные группы на обоих концах непептидильного полимера могут быть одинаковыми или разными. Например, непептидильный полимер может иметь малеимидную группу на одном конце и альдегидную группу, пропиональдегидную группу или бутиральдегидную группу на другом конце. Когда полиэтиленгликоль, имеющий реакционноспособную гидроксильную группу на обоих своих концах, используют в качестве непептидильного полимера, гидроксильная группа может быть активирована до различных реакционноспособных групп посредством известных химических реакций, или может быть использован полиэтиленгликоль, имеющий доступную в продаже модифицированную реакционноспособную группу, для получения длительно действующего конъюгата по настоящему изобретению.
Конъюгат по настоящему изобретению может представлять собой конъюгат, в котором один конец непептидильного полимера и другой связаны с аминной группой или тиоловой группой Fc-области иммуноглобулина и производного оксинтомодулина, соответственно.
Непептидильный полимер по настоящему изобретению имеет функциональную группу на обоих концах, которые могут быть связаны либо с Fc-областью иммуноглобулина, либо с белковым лекарственным средством. Функциональные группы могут представлять собой альдегидную группу, пропиональдегидную группу, бутиральдегидную группу, малеимидную группу и производное сукцинимида (т.е. сукцинимидилпропионат, гидроксисукцинимидил, сукцинимидилкарбоксиметил или сукцинимидилкарбонат), но не ограничены этим.
Реакционноспособные группы на обоих концах линкера, который представляет собой непептидильный полимер, могут быть одинаковыми или разными. Например, непептидильный полимер может иметь малеимидную группу на одном конце и альдегидную группу, пропиональдегидную группу или бутиральдегидную группу на другом конце. Например, когда непептидильный полимер имеет реакционноспособную альдегидную группу на одном конце и реакционноспособную малеимидную группу на другом конце, неспецифические реакции могут быть минимизированы, а физиологически активный полипептид и иммуноглобулин могут быть эффективно соединены с обоими концами непептидильного полимера. Согласно одному воплощению настоящего изобретения, конъюгат синтезировали посредством связывания оксинтомодулина или его производного с Fc-областью иммуноглобулина через ковалентную связь с использованием непептидильного полимера ПЭГ, содержащего только пропиональдегидную группу либо как малеимидную группу, так и альдегидную группу.
Фармацевтическую композицию по настоящему изобретению можно применять для предупреждения или лечения гиперлипидемии, жировой болезни печени или артериосклероза.
При использовании в данном описании термин "предупреждение" относится ко всем действиям, которые подавляют или задерживают развитие целевого заболевания. При использовании в данном описании термин "предупреждение" означает введение производного оксинтомодулина по настоящему изобретению для подавления или задерживания развития гиперлипидемии, жировой болезни печени или артериосклероза, которые проявляют увеличение общего холестерина в крови и уровней холестерина низкой плотности и уменьшение уровней холестерина высокой плотности.
При использовании в данном описании термин "лечение" относится ко всем действиям, которые облегчают, улучшают или ослабляют симптомы развивающегося заболевания. При использовании в данном описании термин "лечение" означает введение производного оксинтомодулина по настоящему изобретению для облегчения, улучшения или ослабления гиперлипидемии, жировой болезни печени или артериосклероза, которые проявляют увеличение уровней общего холестерина и холестерина низкой плотности и уменьшение уровней холестерина высокой плотности в крови.
При использовании в данном описании термин "гиперлипидемия" относится к состоянию, ассоциированному с аномально повышенными уровнями липидов в крови, таких как свободный холестерин, сложные эфиры холестерина, фосфолипиды и триглицериды. Хотя гиперлипидемия сама по себе не проявляет особые симптомы, избыточные липиды в крови прилипают к стенкам кровеносного сосуда с уменьшением размера кровеносного сосуда и вызывают артериосклероз посредством воспалительных реакций. По этой причине может иметь место ишемическая болезнь сердца, сердечнососудистое заболевание, непроходимость периферических кровеносных сосудов и т.д.
Таким образом, фармацевтическую композицию по настоящему изобретению можно применять для лечения не только гиперлипидемии, жировой болезни печени или артериосклероза, но также ишемической болезни сердца, сердечно-сосудистого заболевания или непроходимости периферических кровеносных сосудов.
При использовании в данном описании термин "жировая болезнь печени" относится к состоянию, при котором отношение жиров к массе печени составляет более 5%. В настоящем изобретении жировые болезни печени включают неалкогольную жировую болезнь печени (НЖБП), алкогольную жировую болезнь печени, связанную с питанием жировую болезнь печени, связанную с голоданием жировую болезнь печени, связанную с ожирением жировую болезнь печени, связанную с диабетом жировую болезнь печени или стеатогепатит. Подразумевается, что неалкогольная жировая болезнь печени включает первичную и вторичную неалкогольную жировую болезнь печени, но может, предпочтительно, представлять собой неалкогольную жировую болезнь печени, возникающую в результате первичной гиперлипидемии, диабета или ожирения.
Кроме того, в настоящем изобретении подразумевается, что неалкогольная жировая болезнь печени включает простой стеатоз, неалкогольный стеатогепатит и фиброз печени и цирроз печени, которые возникают в результате развития таких заболеваний.
Артериосклероз относится к сосудистому заболеванию, при котором образуется атерома в результате отложения холестерина в эндотелии кровеносных сосудов и пролиферации эндотелиальных клеток.
В одном примере настоящего изобретения длительно действующий конъюгат производного оксинтомодулина получали посредством связывания производного оксинтомодулина с Fc-областью иммуноглобулина ковалентной связью с использованием полиэтиленгликоля, и полученный конъюгат вводили животным моделям хомяков, имеющим гиперлипидемию, индуцированную потреблением рациона с высоким содержанием жира. В результате было показано, что группа, которой вводили длительно действующий конъюгат производного оксинтомодулина по настоящему изобретению, показала значительное уменьшение уровней триглицеридов (ТГ) в крови (Фиг. 1), значительное уменьшение уровней общего холестерина в крови (Фиг. 2) и значительное уменьшение уровней холестерина низкой плотности (LDL) в крови по сравнению с животными моделями с индуцированной гиперлипидемией. Кроме того, наблюдали, что группа, которой вводили длительно действующий конъюгат производного оксинтомодулина по настоящему изобретению, показала значительное увеличение уровней холестерина высокой плотности (HDL) в крови (Фиг. 4) и значительное увеличение отношения HDL-холестерин/LDL-холестерин в крови (Фиг. 5) по сравнению с животными моделями с индуцированной гиперлипидемией.
Кроме того, видно, что длительно действующий конъюгат производного оксинтомодулина по настоящему изобретению показал уменьшение уровней общего холестерина в крови (Фиг. 6) и уменьшение уровней LDL-холестерина и триглицеридов в крови (Фиг. 7) по сравнению с VICTOZA®, который представляет собой имеющийся в продаже длительно действующий аналог GLP-1. Кроме того, видно, что введение длительно действующего конъюгата производного оксинтомодулина по настоящему изобретению показало увеличение уровня HDL-холестерина в крови и отношения HDL/LDL-холестерина по сравнению с введением VICTOZA® (Фиг. 8 и 9). Конкретно, длительно действующий конъюгат пептида SEQ ID NO: 25 с Fc показал значительное увеличение уровней HDL в крови и отношения HDL/LDL-холестерина по сравнению с VICTOZA®.
Другими словами, производное оксинтомодулина по настоящему изобретению снижает уровни липидов в крови и, таким образом, может применяться в качестве агента для лечения гиперлипидемии, жировой болезни печени или артериосклероза. Кроме того, конъюгат по настоящему изобретению обладает превосходной способностью активировать рецептор GLP-1 и рецептор глюкагона по сравнению с нативным оксинтомодулином и показывает увеличенный период полувыведения in vivo из крови, и, таким образом, его активность может сохраняться in vivo в течение пролонгированного периода времени.
Производное оксинтомодулина по настоящему изобретению может увеличивать активность фактора (протеинкиназы С-ζ, или PKC-ζ), регулирующего активность ферментов, которые вовлечены в липолиз жиров, и увеличивать экспрессию фактора (Glut2), который вовлечен в липолиз жиров, посредством чего лечат гиперлипидемию, жировую болезнь печени или артериосклероз, но объем настоящего изобретения не ограничивается вышеуказанным механизмом действия.
Фармацевтическая композиция по настоящему изобретению может дополнительно содержать фармацевтический агент, проявляющий предупредительные или терапевтические эффекты в отношении гиперлипидемии, жировой болезни печени или артериосклероза. Конкретно, композиция по настоящему изобретению может дополнительно содержать фармацевтический агент, известный в качестве агента для лечения гиперлипидемии, жировой болезни печени или артериосклероза, с целью введения фармацевтического агента в комбинации с производным по настоящему изобретению.
Таким образом, композицию по настоящему изобретению можно вводить саму по себе или в комбинации с другими лекарственными средствами для предупреждения или лечения гиперлипидемии, жировой болезни печени или артериосклероза.
При использовании в данном описании термин "введение" означает ввод данного вещества пациенту посредством любого подходящего способа. Производное по настоящему изобретению можно вводить любым общепринятым путем до тех пор, пока оно может достигать ткани-мишени. Конкретно, производное по настоящему изобретению можно вводить внутрибрюшинно, внутривенно, внутримышечно, подкожно, чрескожно, перорально, местно, интраназально, внутрилегочно или ректально, но не ограничиваясь этим. Однако, так как пептид расщепляется при введении перорально, пероральную композицию предпочтительно изготавливают так, чтобы активный ингредиент был покрыт или защищен от разрушения в желудке. Предпочтительно, композицию по настоящему изобретению можно вводить в инъецируемой форме. Кроме того, фармацевтическую композицию по настоящему изобретению можно вводить с использованием любой системы, способной доставлять активный ингредиент к клеткам-мишеням.
Фармацевтическая композиция, содержащая производное оксинтомодулина по настоящему изобретению, может дополнительно содержать фармацевтически приемлемый носитель. Фармацевтически приемлемые носители для перорального введения включают связующее вещество, смазывающее вещество, разрыхлитель, эксципиент, солюбилизатор, диспергирующий агент, стабилизатор, суспендирующий агент, краситель и ароматизатор. Фармацевтически приемлемые носители для инъецируемых препаратов включают буфер, консервант, анальгетик, солюбилизатор, изотонический агент и стабилизатор. Фармацевтически приемлемые носители для местного введения включают основу, эксципиент, смазывающее вещество и консервант.
Фармацевтическая композиция по настоящему изобретению может быть изготовлена в различных лекарственных формах с использованием вышеуказанных фармацевтически приемлемых носителей. Например, фармацевтическая композиция для перорального введения может быть изготовлена в виде таблеток, пастилок, капсул, эликсиров, суспензий, сиропов, облаток или т.п. Фармацевтическая композиция для инъецируемых препаратов может быть представлена в форме ампулы со стандартной дозой или многодозового контейнера. Фармацевтическая композиция также может быть изготовлена в виде растворов, суспензий, таблеток, драже, капсул и препаратов с замедленным высвобождением.
В то же время примеры носителя, эксципиента и разбавителя, подходящих для композиции, включают лактозу, декстрозу, сахарозу, сорбит, маннит, ксилит, эритрит, мальтит, крахмал, гуммиарабик, альгинат, желатин, фосфат кальция, силикат кальция, целлюлозу, метилцеллюлозу, микрокристаллическую целлюлозу, поливинилпирролидон, воду, метилгидроксибензоат, пропилгидроксибензоат, тальк, магния стеарат и минеральные масла. Кроме того, фармацевтическая композиция по настоящему изобретению может дополнительно содержать наполнители, антикоагулянты, смазывающие вещества, увлажнители, ароматизаторы, консервант и т.п.
Дозу фармацевтической композиции по настоящему изобретению определяют в соответствии с типом активного ингредиента вместе с различными факторами, такими как заболевание, подлежащее лечению, путь введения, возраст, пол и масса пациента и тяжесть заболевания.
Фармацевтическая композиция по настоящему изобретению имеет продолжительный in vivo период полувыведения и высокую эффективность, и, таким образом, количество и частота введения фармацевтической композиции может быть значительно снижена.
В другом воплощении в настоящем изобретении предложен способ лечения гиперлипидемии, жировой болезни печени или артериосклероза, включающий стадию введения субъекту производного оксинтомодулина по настоящему изобретению.
Вышеупомянутые оксинтомодулин, гиперлипидемия, жировая болезнь печени и артериосклероз являются такими, как описано выше.
При использовании в данном описании термин "субъект" относится к субъекту с подозрением на наличие гиперлипидемии, жировой болезни печени или артериосклероза. Конкретно, указанный термин обозначает млекопитающих, включая людей, крыс и домашних животных, которые имеют вышеупомянутое заболевание или имеют риск его развития. Кроме того, субъектом может являться любой субъект, которого можно лечить посредством производного оксинтомодулина по настоящему изобретению.
Терапевтический способ по настоящему изобретению может включать введение фармацевтически эффективного количества фармацевтической композиции, содержащей конъюгат. Суммарную суточную дозу композиции можно определить при помощи соответствующей медицинской оценки врачом, и композицию можно вводить один раз или несколько раз. Однако, принимая во внимание цель настоящего изобретения, конкретная терапевтически эффективная доза композиции для любого конкретного пациента может варьироваться в зависимости от различных факторов, хорошо известных в области медицины, включающих вид и степень ответа, которого необходимо достигнуть, конкретных композиций на основании того, используются ли в них другие агенты или нет, возраста, массы тела, состояния здоровья, пола и рациона пациента, времени и пути введения, скорости секреции композиции, продолжительности лечения, других лекарственных средств, используемых в комбинации или одновременно с композицией по настоящему изобретению, и других факторов, известных в области медицины.
В еще одном аспекте в настоящем изобретении предложен способ получения конъюгата производного оксинтомодулина.
Способ получения может включать стадии: (1) ковалентного связывания непептидильного полимера, имеющего реакционноспособную альдегидную, малеимидную или сукцинимидную группу, с аминной или тиоловой группой пептида производного оксинтомодулина; (2) отделения пептида производного оксинтомодулина, имеющего непептидильный полимер, ковалентно соединенный с ним в положениях, отличных от амино-конца, от реакционной смеси стадии (1); и (3) ковалентного соединения Fc-области иммуноглобулина с другим концом связанного непептидильного полимера, получая посредством этого пептидный конъюгат, содержащий Fc-область иммуноглобулина и пептид производного оксинтомодулина, связанные с одним и с другим концом непептидильного полимера, соответственно.
Более конкретно, способ получения может включать стадии: 1) ковалентного связывания непептидильного полимера, имеющего реакционноспособную альдегидную группу и реакционноспособную малеимидную группу на одном и на другом его конце, соответственно, с цистеиновым остатком производного оксинтомодулина; (2) отделения производного оксинтомодулина, имеющего непептидильный полимер, ковалентно связанный с цистеиновым остатком, от реакционной смеси стадии (1); и (3) ковалентного соединения Fc-области иммуноглобулина с другим концом связанного непептидильного полимера, получая посредством этого пептидный конъюгат, содержащий Fc-область иммуноглобулина и пептид производного оксинтомодулина, связанные с одним и с другим концом непептидильного полимера, соответственно.
В еще одном аспекте в настоящем изобретении предложено применение производного оксинтомодулина в изготовлении лекарственного средства для предупреждения или лечения гиперлипидемии, жировой болезни печени или артериосклероза.
Полезные эффекты изобретения
Производное оксинтомодулина по настоящему изобретению имеет высокую способность активировать рецептор GLP-1 и рецептор глюкагона по сравнению с нативным оксинтомодулином и проявляет эффекты снижения уровней общего холестерина, холестерина низкой плотности и триглицеридов в крови, которые были повышена посредством использования рациона с высоким содержанием жира, и увеличения уровней холестерина высокой плотности и отношения холестерин высокой плотности/холестерин низкой плотности. Таким образом, производное оксинтомодулина по настоящему изобретению можно эффективно применять для лечения гиперлипидемии и родственных заболеваний.
Краткое описание графических материалов
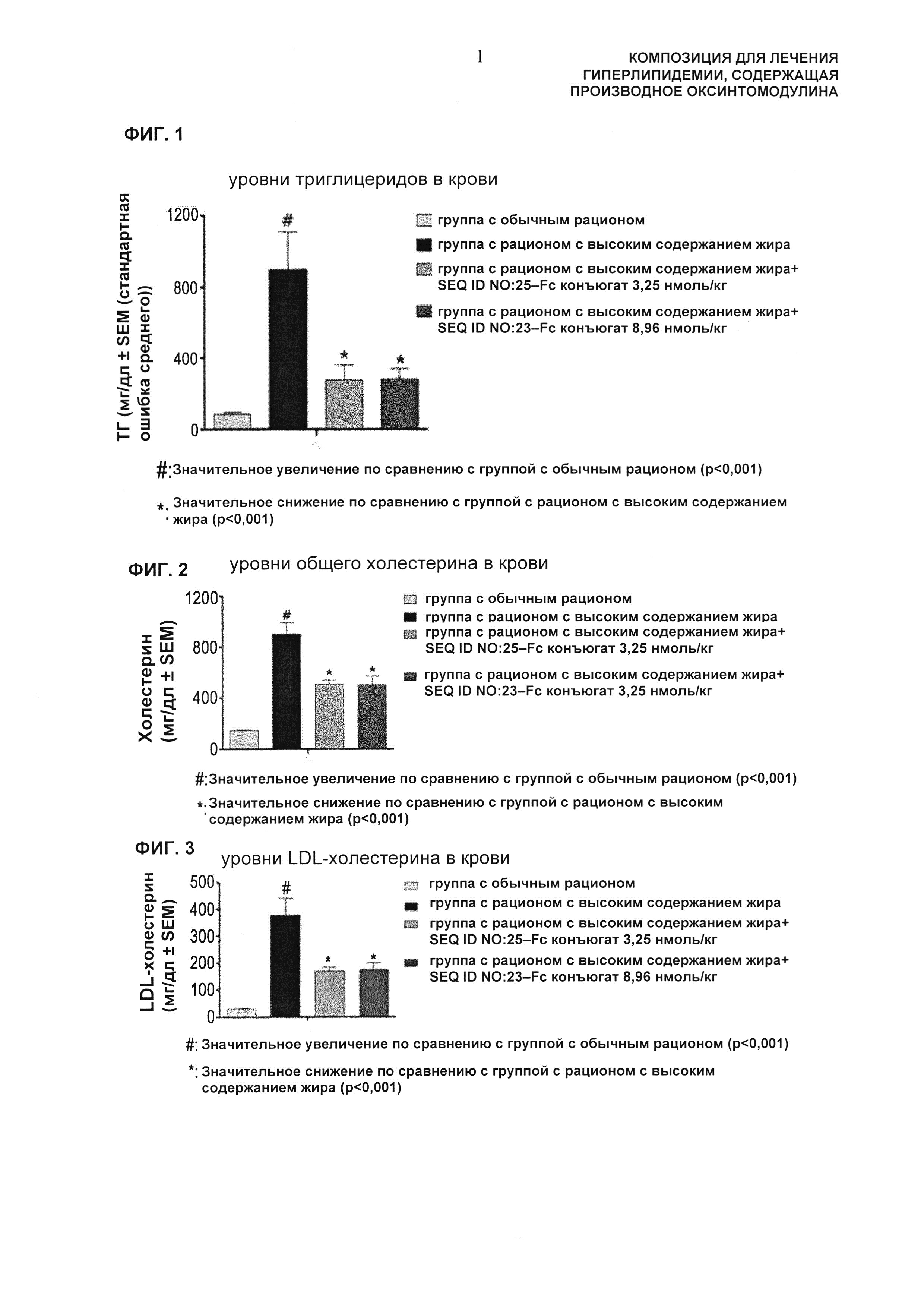
Фиг. 1 представляет собой диаграмму, показывающую изменение уровней триглицеридов в крови, вызванное введением хомякам с гиперлипидемией, индуцированной рационом с высоким содержанием жира, длительно действующего производного оксинтомодулина ("#": указывает на значительное увеличение по сравнению с группой с обычным рационом, доверительный интервал 99,9% (р<0,001); "*": указывает на значительное уменьшение по сравнению с группой с рационом с высоким содержанием жира, доверительный интервал 99,9% (р<0,001)).
Фиг. 2 представляет собой диаграмму, показывающую изменение уровней общего холестерина в крови, вызванное введением хомякам с гиперлипидемией, индуцированной рационом с высоким содержанием жира, длительно действующего производного оксинтомодулина ("#": указывает на значительное увеличение по сравнению с группой с обычным рационом, доверительный интервал 99,9% (р<0,001); "*": указывает на значительное уменьшение по сравнению с группой с рационом с высоким содержанием жира, доверительный интервал 99,9% (р<0,001)).
Фиг. 3 представляет собой диаграмму, показывающую изменение уровней LDL-холестерина в крови, вызванное введением хомякам с гиперлипидемией, индуцированной рационом с высоким содержанием жира, длительно действующего производного оксинтомодулина ("#": указывает на значительное увеличение по сравнению с группой с обычным рационом, доверительный интервал 99,9% (р<0,001); "*": указывает на значительное уменьшение по сравнению с группой с рационом с высоким содержанием жира, доверительный интервал 99,9% (р<0,001)).
Фиг. 4 представляет собой диаграмму, показывающую изменение уровней HDL-холестерина в крови, вызванное введением хомякам с гиперлипидемией, индуцированной рационом с высоким содержанием жира, длительно действующего производного оксинтомодулина ("*": указывает на значительное увеличение по сравнению с группой с рационом с высоким содержанием жира, доверительный интервал 99% (р<0,01)).
Фиг. 5 представляет собой диаграмму, показывающую изменение уровней HDL/LDL-холестерина в крови, вызванное введением хомякам с гиперлипидемией, индуцированной рационом с высоким содержанием жира, длительно действующего производного оксинтомодулина ("*": показывает значительное увеличение по сравнению с группой с рационом с высоким содержанием жира, доверительный интервал 95% (р<0,05)).
Фиг. 6 представляет собой диаграмму, показывающую изменение уровней общего холестерина в крови, вызванное введением хомякам с гиперлипидемией, индуцированной рационом с высоким содержанием жира, VICTOZA® или длительно действующего производного оксинтомодулина ("***";
указывает на значительное уменьшение по сравнению с группой с рационом с высоким содержанием жира, доверительный интервал 99,9% (р<0,001)).
Фиг. 7 представляет собой диаграмму, показывающую изменение уровней LDL-холестерина в крови, вызванное введением хомякам с гиперлипидемией, индуцированной рационом с высоким содержанием жира, VICTOZA® или длительно действующего производного оксинтомодулина ("***": указывает на значительное уменьшение по сравнению с группой с рационом с высоким содержанием жира, доверительный интервал 99,9% (р<0,001)).
Фиг. 8 представляет собой диаграмму, показывающую изменение уровней HDL-холестерина в крови, вызванное введением хомякам с гиперлипидемией, индуцированной рационом с высоким содержанием жира, VICTOZA® или длительно действующего производного оксинтомодулина ("*": указывает на значительное уменьшение по сравнению с группой с рационом с высоким содержанием жира, доверительный интервал 95% (р<0,05)).
Фиг. 9 представляет собой диаграмму, показывающую изменение уровней HDL/LDL-холестерина в крови, вызванное введением хомякам с гиперлипидемией, индуцированной рационом с высоким содержанием жира, VICTOZA® или длительно действующего производного оксинтомодулина ("**": указывает на значительное уменьшение по сравнению с группой с рационом с высоким содержанием жира, доверительный интервал 99% (р<0,01)).
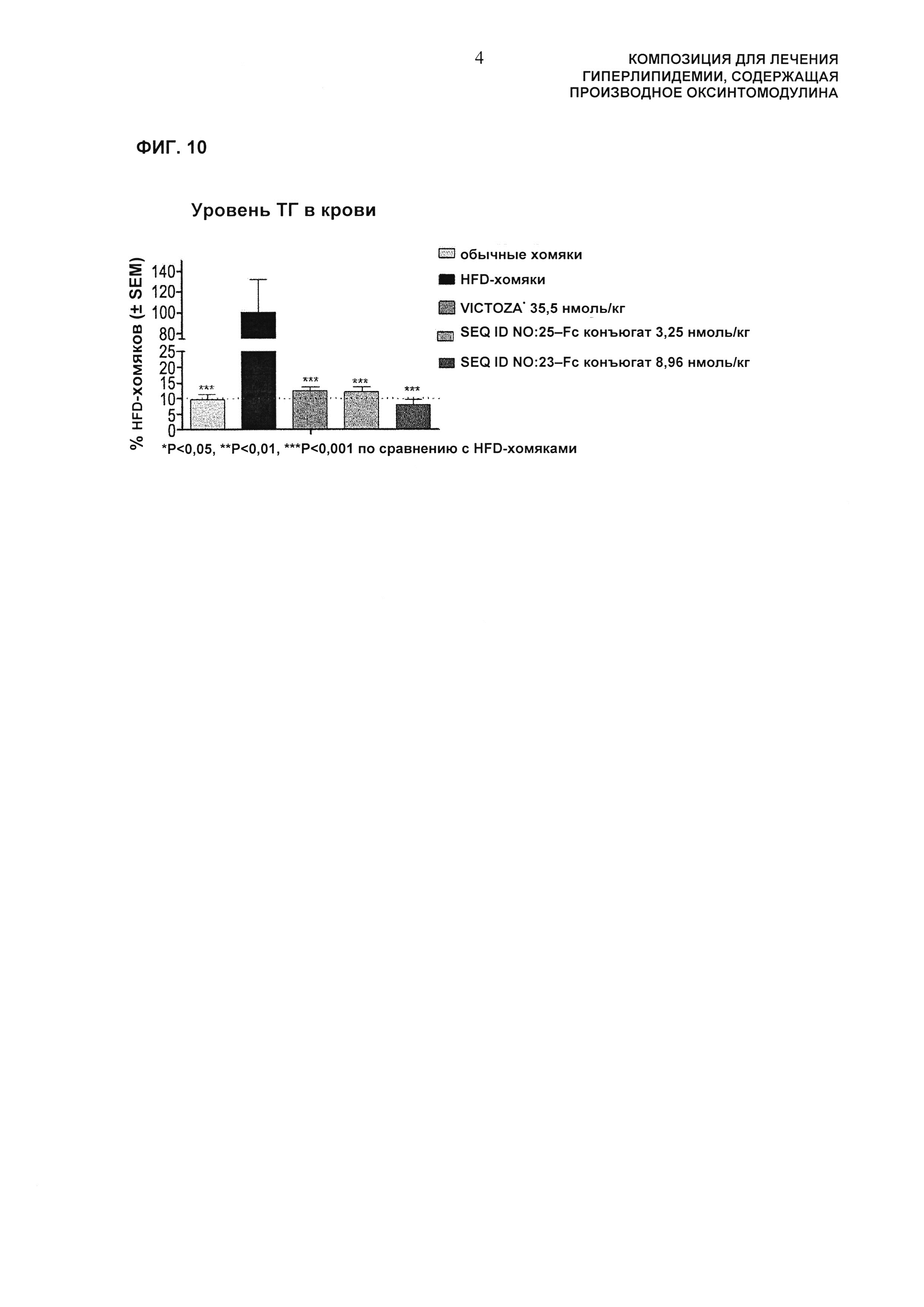
Фиг. 10 представляет собой диаграмму, показывающую изменение уровней триглицеридов в крови, вызванное введением хомякам с гиперлипидемией, индуцированной рационом с высоким содержанием жира, VICTOZA® или длительно действующего производного оксинтомодулина ("***": указывает на значительное уменьшение по сравнению с группой с рационом с высоким содержанием жира, доверительный интервал 99,9% (р<0,001)).
Форма осуществления изобретения
Ниже настоящее изобретение будет описано более подробно со ссылкой на примеры. Следует понимать, однако, что эти примеры предназначены только для иллюстративных целей и не предназначены для ограничения объема настоящего изобретения.
Пример 1: Получение клеточной линии для активации in vitro
Пример 1-1: Получение клеточной линии, показывающей цАМФ(циклический аденозинмоноФосФат)-ответ к GLP-1
Используя участок, соответствующий ORF (открытой рамке считывания) кДНК (OriGene Technologies, Inc. USA) гена рецептора GLP-1 человека в качестве матрицы, выполняли ПЦР (полимеразную цепную реакцию) с использованием обратного и прямого праймеров, содержащих сайт расщепления HindIII и сайт расщепления EcoRI, соответственно, посредством этого получая продукт ПЦР.
Прямой праймер: 5'-CCCGGCCCCCGCGGCCGCTATTCGAAATAC-3' (SEQ ID NO: 50).
Обратный праймер: 5'-GAACGGTCCGGAGGACGTCGACTCTTAAGATAG-3' (SEQ ID NO: 51).
Продукт ПЦР клонировали в векторе экспрессии x0GC/dhfr известной животной клетки, конструируя посредством этого рекомбинантный вектор X0GC/GLP-1R.
Рекомбинантный вектор X0GC/GLP-1R вводили в клеточную линию СНО (яичника китайского хомячка) DG44, культивированную в среде ОМЕМ(среда Игла, модифицированная по Дульбекко)/Р12 (10% FBS (фетальная бычья сыворотка)), используя липофектамин (Invitrogene, USA), с получением трансформанта. Трансформант инкубировали в селективной питательной среде, содержащей 1 мг/мл G418 и 10 нМ метотрексата, и из нее отбирали моноклональные клеточные линии. Затем клеточную линию, показывающую хороший зависимый от концентрации цАМФ-ответ к GLP-1, окончательно отбирали из моноклональных клеточных линий.
Пример 1-2: Получение клеточной линии, показывающей цАМФ-ответ к глюкагону
Используя участок, соответствующий ORF (открытой рамке считывания) кДНК (OriGene Technologies, Inc. USA) гена рецептора глюкагона человека в качестве матрицы, выполняли ПЦР с использованием обратного и прямого праймеров, содержащих сайт расщепления EcoRI и сайт расщепления XhoI, соответственно, получая посредством этого продукт ПЦР.
Прямой праймер: 5'-CAGCGACACCGACCGTCCCCCCGTACTTAAGGCC-3' (SEQ ID NO: 52).
Обратный Праймер: 5'-CTAACCGACTCTCGGGGAAGACTGAGCTCGCC-3' (SEQ ID NO: 53).
Продукт ПЦР клонировали в векторе экспрессии известной животной клетке x0GC/dhfr, конструируя посредством этого рекомбинантный вектор x0GC/GCGR.
Рекомбинантный вектор x0GC/GCGR вводили в клеточную линию СНО DG44, культивированную в среде DMEM/F12 (10% FBS), используя липофектамин (Invitrogene, USA), с получением трансформанта. Трансформант инкубировали в селективной питательной среде, содержащей 1 мг/мл G418 и 10 нМ метотрексата, и отбирали из нее моноклональные клеточные линии. Затем клеточную линию, показывающую хороший зависимый от концентрации цАМФ-ответ к глюкагону, окончательно отбирали из моноклональных клеточных линий.
Пример 2: In vitro активность производных оксинтомодулина
Пример 2-1: Синтез производных оксинтомодулина
С целью измерения in vitro активностей производных оксинтомодулина, производны оксинтомодулина, имеющие аминокислотные последовательности, показаны в Таблице 1 ниже.


В Таблице 1 выше аминокислоты, выделенными жирным шрифтом, означают образование кольца, а аминокислоты, указанные X, означают альфа-метилглутаминовую кислоту, которая представляет собой неприродную аминокислоту. Кроме того, СА означает 4-имидазоацетил, DA означает дезаминогистидил, Aib означает аминоизомасляную кислоту, a (d)S означает d-серин.
Пример 2-2: Измерение активностей производных оксинтомодулина in vitro
С целью измерения эффектов пептидов против ожирения измеряли активности клеток in vitro с использованием трансформантов, полученных в Примерах 1-1 и 1-2.
Каждый из трансформантов был трансформирован таким образом, чтобы он экспрессировал каждый из генов рецептора GLP-1 и рецептора глюкагона человека в СНО, и являлся подходящим для измерения активностей GLP-1 и глюкагона. Таким образом, активности каждого из производных оксинтомодулина измеряли, используя каждый из трансформантов.
Конкретно, каждый из трансформантов пассировали два или три раза в неделю и клетки распределяли в каждую лунку 96-луночного планшета с плотностью 1×105 клеток/лунка и культивировали в течение 24 часов.
Культивированные клетки промывали буфером KRB (буфер Кребса-Рингера), суспендировали в 40 мл 1 мМ 1 ВМХ(изобутилметилксантин)- содержащего буфера KRB и затем оставляли при комнатной температуре в течение 5 минут. Каждый из оксинтомодулина и производных оксинтомодулина (SEQ ID NO: 2-6, 8, 10-13, 17, 18, 23-25, 27, 28 и 32-34) последовательно разбавляли пятикратно от 1000 нМ до 0,02 нМ, и 40 миллилитров каждого из разбавлений добавляли к клеткам, которые затем инкубировали в СО2-инкубаторе при 37°С в течение 1 часа. Затем для разрушения клеток добавляли 20 мл буфера для лизиса клеток и измеряли концентрацию цАМФ в каждом из клеточных лизатов, используя набор для анализа цАМФ (Molecular Device, USA). Из результатов измерения вычисляли значения ЕС50 и сравнивали друг с другом (Таблица 2).
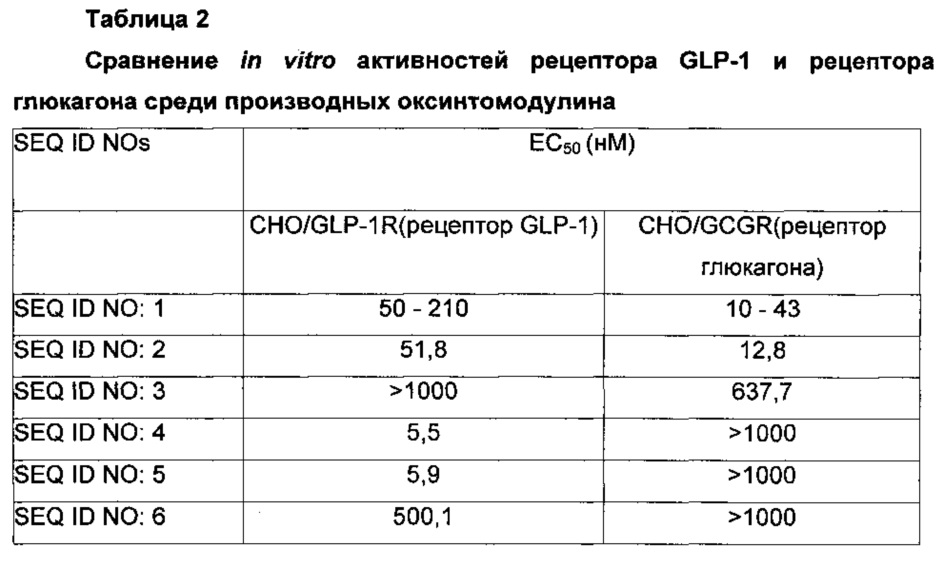

Как можно видеть в Таблице 2 выше, производные оксинтомодулина показывали превосходные активности in vitro GLP-1 и глюкагона по сравнению с оксинтомодулином SEQ ID NO: 1.
Известно, что оксинтомодулин обладает эффектом лечения гиперлипидемии, жировой болезни печени или артериосклероза посредством активирования рецептора GLP-1 и рецептора глюкагона. Производные оксинтомодулина по настоящему изобретению имеют превосходную активность для активирования рецептора GLP-1 и рецептора глюкагона по сравнению с нативным оксинтомодулином и, таким образом, могут применяться для лечения гиперлипидемии и жировой болезни печени и артериосклероза, связанного с гиперлипидемией, вместо нативного оксинтомодулина.
Пример 3: Получение конъюгата, содержащего производное оксинтомодулина (SEQ IP NO: 23) с Fc иммуноглобулина (производное оксинтомодулина 23, конъюгированное с Fc иммуноглобулина)
С целью пэгилирования цистеинового остатка в положении 24 производного оксинтомодулина с SEQ ID NO: 23 при помощи MAL-10K-ALD ПЭГ (NOF., Japan), производное оксинтомодулина (SEQ ID NO: 23) и MAL-10K-ALD ПЭГ оставляли взаимодействовать друг с другом в молярном соотношении 1:3 при концентрации белка 3 мг/мл при комнатной температуре в течение 3 часов. Реакцию осуществляли в 50 мМ Трис-буфере (рН 8,0), содержащем 1 М гуанидин. После завершения реакции реакционный раствор очищали с использованием SOURCE S при следующих ниже условиях, получая посредством этого оксинтомодулин, монопэгилированный в цистеине: колонка: SOURCE S, скорость потока: 2,0 мл/мин, градиент: А 0→100% 50 мин В (А: 20 мМ Na-цитрат, рН 3,0+45% этанол, В: А+1 М KCl)).
Затем очищенное монопэгилированное производное оксинтомодулина (SEQ ID NO: 23) и Fc иммуноглобулина оставляли взаимодействовать друг с другом в молярном соотношении 1:5 при концентрации белка 20 мг/мл при 4°С в течение 16 часов. Реакцию осуществляли в 100 мМ фосфатно-калиевом буфере (рН 6,0), содержащем 20 мМ SCB (цианборгидрид натрия) в качестве восстанавливающего агента. После завершения реакции реакционный раствор очищали при следующих ниже условиях, получая посредством этого конъюгат, содержащий производное оксинтомодулина (SEQ ID NO: 23) и иммуноглобулин: колонка: SOURCE 15Q, скорость потока: 2,0 мл/мин, градиент: А 0→4% 1 мин, В→20% 80 мин В (А: 20 мМ Трис-HCl, рН 7,5, В: А+1 М NaCl)); SOURCE ISO колонка: SOURCE ISO, скорость потока: 2,0 мл/мин, градиент: В 0→100% 100 мин А, (А: 20 мМ Трис-HCl, рН 7,5, В: А+1,1 М AS).
Пример 4: Получение конъюгата. содержащего производное оксинтомодулина (SEQ ID NO: 25) с Fc иммуноглобулина (производное оксинтомодулина 25, конъюгированное с Fc иммуноглобулина)
С целью пэгилирования цистеинового остатка в положении 30 производного оксинтомодулина с SEQ ID NO: 25 при помощи MAL-10K-ALD ПЭГ, производное оксинтомодулина (SEQ ID NO: 25) и MAL-10K-ALD ПЭГ оставляли взаимодействовать друг с другом в молярном соотношении 1:3 при концентрации белка 3 мг/мл при комнатной температуре в течение 3 часов. Взаимодействие выполняли в 50 мМ Трис-буфере (рН 8,0), содержащем 1 М гуанидин. После завершения реакции реакционный раствор очищали с использованием SOURCE S при следующих ниже условиях, получая посредством этого оксинтомодулин, монопэгилированный в цистеине: колонка: SOURCE S, скорость потока: 2,0 мл/мин, скорость потока: А 0→100% 50 мин В (А: 20 мМ Na-цитрат, рН 3,0+45% этанол, В: А+1 М KCl).
Затем очищенное монопэгилированное производное оксинтомодулина (SEQ ID NO: 25) и Fc иммуноглобулина оставляли взаимодействовать друг с другом в молярном соотношении 1:5 при концентрации белка 20 мг/мл при 4°С в течение 16 часов. Реакцию осуществляли в 100 мМ фосфатно-калиевом буфере (рН 6,0), содержащем 20 мМ SCB в качестве восстанавливающего агента. После завершения реакции реакционный раствор очищали при следующих ниже условиях, получая посредством этого конъюгат, содержащий производное оксинтомодулина (SEQ ID NO: 25) и иммуноглобулин: SOURCE 15Q колонка: SOURCE 15Q, скорость потока: 2,0 мл/мин, скорость потока: А 0→4% 1 мин В→20% 80 мин В (А: 20 мМ Трис-HCl, рН 7,5, В: А+1 М NaCl); и Source ISO колонка: SOURCE ISO, скорость потока: 2,0 мл/мин, скорость потока: В 0→100% 100 мин А (А: 20 мМ Трис-HCl, рН 7,5, В: А+1,1 М AS).
Пример 5: Действие длительно действующего оксинтомодулина на снижение липидов у модели гиперлипидемии на хомяках
Пример 5-1: Группировка исследуемых животных
8-недельных самцов хомяков (золотистые сирийские хомяки, 120-130 г) приобретали у Vital River China. Известно, что хомяки показывают профили липидов в крови, сходные с человеческими, в отличие от других грызунов и чувствительны к рациону с высоким содержанием жиров.
Животным давали возможность доступа к стерилизованному рациону с высоким содержанием жира (Purina 5001, содержащий 11,5% кукурузного масла, 11,5% кокосового масла, 0,5% холестерина и 0,25% дезоксихолата; Dyets, Bethlehem, РА) или стандартный рацион для грызунов (низкое содержание жира, 2018; Harlan Teklad, Madison, WI). Группе с нормальным рационом давали возможность доступа к фильтрованной и УФ-стерилизованной водопроводной воде, а группе с рационом с высоким содержанием жира давали возможность доступа к воде, содержащей 10% фруктозы. Животных содержали в камере для разведения, отвечающей стандартам GLP (надлежащей лабораторной практики) с циклом 12-ч свет/12-ч темнота (освещение: с 6 утра до 6 вечера), и все экспериментальные процедуры выполняли согласно стандартным принципам экспериментов на животных. Введение лекарственного средства начинали через 3 недели после индукции гиперлипидемии и животных разделяли на четыре группы (n=6), как показано в Таблице 3 ниже.
Таблица 3

Конкретно, группу 1 (нормальная группа) кормили нормальным кормом, и ей вводили подкожно 5 мл/кг фосфатно-солевой буферный раствор Дульбекко (DPBS, Sigma) один раз или более в неделю.
Группу 2 (группа с индуцированной гиперлипидемией) кормили с использованием рациона с высоким содержанием жира для индуцирования гиперлипидемии, и затем ей вводили подкожно 5 мл/кг фосфатно-солевой буферный раствор Дульбекко (DPBS, Sigma) один раз или более в неделю.
Группу 3 (группа с индуцированной гиперлипидемией плюс группа с введенным 3,25 нмоль/кг SEQ ID NO: 25-Fc конъюгатом) кормили с использованием рациона с высоким содержанием жира для индуцирования гиперлипидемии, и затем ей вводили 3,25 нмоль/кг SEQ ID NO: 25-Fc конъюгата (полученного в Примере 4) один раз в неделю в дозе для инъекции 5 мл/кг.
Группу 4 (группа с индуцированной гиперлипидемией плюс группа с введенным 8,96 нмоль/кг SEQ ID NO: 23-Fc конъюгатом) кормили с использованием рациона с высоким содержанием жира для индуцирования гиперлипидемии, и затем ей вводили 8,96 нмоль/кг SEQ ID NO: 23-Fc конъюгата (полученного в Примере 3) один раз в неделю с дозой для инъекции 5 мл/кг.
Солевой раствор или лекарственное средство вводили каждой группе (n=6) в течение 2 недель и затем анализировали его воздействия на снижение уровней липидов.
Пример 5-2: Анализ воздействия длительно действующего конъюгата производного оксинтомодулина на снижение уровней липидов
С целью изучения воздействия длительно действующего конъюгата производного оксинтомодулина на снижение уровней липидов у хомяков выполняли следующий эксперимент.
Кровь собирали от хомяков, которым вводили или не вводили длительно действующее производное оксинтомодулина, как описано в Примере 5-1, и анализировали уровни липидов в крови, используя HITACHI 7020. Результаты анализа показаны на Фиг. 1-5.
На Фиг. 1-5 показано изменение уровней триглицеридов в крови (Фиг. 1), изменение уровней общего холестерина в крови (Фиг. 2), изменение уровней LDL-холестерина (Фиг. 3), уровней HDL-холестерина в крови (Фиг. 4) и изменение отношения холестерина HDL/LDL в крови (Фиг. 5). Полученные результаты обрабатывали статистически и вычисляли средние значения и стандартные отклонения от средних значений. В рамках проверки значимости между группами (n=6) данные обрабатывали статистически, применяя критерий Даннета одностороннего дисперсионного анализа, и значение р<0,05 считали статистически значимым.
Конкретно, в результатах измерения уровней триглицеридов в крови было видно, что в случае хомяков, питавшихся с использованием рациона с высоким содержанием жира, уровни триглицеридов значительно увеличивались, но когда хомякам вводили длительно действующее производное оксинтомодулина (SEQ ID NO: 25-Fc конъюгат или SEQ ID NO: 23-Fc конъюгат), уровни триглицеридов значительно понижались (Фиг. 1).
В результатах измерения уровней общего холестерина в крови было видно, что в случае хомяков, питавшихся с использованием рациона с высоким содержанием жира, уровни общего холестерина в крови значительно увеличивались, но когда хомякам вводили длительно действующее производное оксинтомодулина (SEQ ID NO: 25-Fc конъюгат или SEQ ID NO: 23-Fc конъюгат), уровни общего холестерина в крови значительно понижались (Фиг. 2).
В результатах измерения уровней LDL-холестерина в крови было видно, что в случае хомяков, питавшихся с использованием рациона с высоким содержанием жира, уровни LDL-холестерина в крови значительно увеличивались, но когда хомякам вводили длительно действующее производное оксинтомодулина (SEQ ID NO: 25-Fc конъюгат или SEQ ID NO: 23-Fc конъюгат), уровни LDL-холестерина холестерина в крови значительно понижались (Фиг. 3).
В результатах измерения уровней HDL-холестерина в крови группа с введенным SEQ ID NO: 25-Fc конъюгатом или SEQ ID NO: 23-Fc конъюгатом показала значительное увеличение уровней HDL-холестерина в крови по сравнению с группой хомяков с рационом с высоким содержанием жира (Фиг. 4).
В результатах измерения уровней HDL/LDL-холестерина в крови группа с введенным SEQ ID NO: 25-Fc конъюгатом или SEQ ID NO: 23-Fc конъюгатом значительное увеличение отношения HDL/LDL-холестерина в крови по сравнению с группой хомяков с рационом с высоким содержанием жира (Фиг. 5).
Из вышеуказанных результатов можно видеть, что конъюгат производного оксинтомодулина по настоящему изобретению, содержащий Fc-область иммуноглобулина, ковалентно связанную с производным оксинтомодулина посредством ПЭГ, предупреждает накопление триглицеридов и холестерина низкой плотности (LDL) в крови и, таким образом, может эффективно применяться для лечения гиперлипидемии или связанных с ней жировой болезни печени или артериосклероза.
Пример 6: Анализ эффектов известного длительно действующего аналога GLP-1 и длительно действующего конъюгата производного оксинтомодулина
VICTOZA® представляет собой длительно действующий глюкагоноподобный пептид-1, аналог GLP-1, который в настоящее время продается в качестве агента для лечения диабета и, как известно, обладает эффектами в лечении ожирения и увеличения уровней HDL-холестерина.
Эффект понижения уровней липидов сравнивали между конъюгатом производного оксинтомодулина и известным VICTOZA®.
Как описано в Примере 5, хомяков разделяли на нормальную группу хомяков и группы хомяков, питавшихся с использованием рациона с высоким содержанием жира. Хомякам нормальной группы вводили подкожно 5 мл/кг DPBS один раз или более в неделю. Хомяков групп, питавшихся с использованием рациона с высоким содержанием жира, разделяли в группу с вводимым подкожно 5 мл/кг DPBS один раз или более в неделю, группу с вводимым подкожно 35,5 нмоль/кг VICTOZA® один раз или более в неделю, группу с вводимым подкожно 3,25 нмоль/кг SEQ ID NO: 25-Fc конъюгатом и группу с вводимым подкожно 8,96 нмоль/кг SEQ ID NO: 23-Fc конъюгатом и анализировали уровни липидов в крови в группах.
В результате можно было видеть, что введение длительно действующего конъюгата производного оксинтомодулина по настоящему изобретению (SEQ ID NO: 25-Fc конъюгат или SEQ ID NO: 23-Fc конъюгат) показывало уменьшение уровней общего холестерина в крови (Фиг. 6) и уменьшение уровня LDL-холестерина в крови (Фиг. 7) по сравнению с введением имеющегося в продаже VICTOZA®.
Кроме того, можно было видеть, что введение длительно действующего конъюгата производного оксинтомодулина по настоящему изобретению (SEQ ID NO: 25-Fc конъюгат или SEQ ID NO: 23-Fc конъюгат) показывало увеличение уровней HDL-холестерина в крови и отношения холестерина HDL/LDL по сравнению с введением VICTOZA® (Фиг. 8 и 9). Конкретно, длительно действующий SEQ ID NO: 25-Fc конъюгат показывал значительное увеличение уровней HDL-холестерина в крови и отношения холестерина HDL/LDL по сравнению с VICTOZA®.
Кроме того, введение длительно действующего конъюгата производного оксинтомодулина по настоящему изобретению (SEQ ID NO: 25-Fc конъюгат или SEQ ID NO: 23-Fc конъюгат) показывало уменьшение уровней триглицеридов в крови по сравнению с введением VICTOZA®.
Из вышеуказанных результатов можно видеть, что длительно действующий конъюгат производного оксинтомодулина по настоящему изобретению проявляет понижающий липиды эффект, который равен эффекту известного VICTOZA® или выше него, и, таким образом, конъюгат можно эффективно применять в качестве агента для лечения гиперлипидемии, жировой болезни печени или артериосклероза.
Реферат
Настоящее изобретение относится к области биотехнологии, конкретно к композициям на основе конъюгата производного оксинтомодулина, и может быть использовано в медицине для снижения уровней липидов в крови при предупреждении или лечении гиперлипидемии, жировой болезни печени или артериосклероза. Получают производное оксинтомодулина с SEQ ID NO: 24, 25 или 26, слитое с Fc-областью иммуноглобулина через непептидильный полимер, который ковалентно связывает производное оксинтомодулина и Fc-область иммуноглобулина. Изобретение позволяет получить конъюгат производного оксинтомодулина, обладающего высокой способностью активировать рецептор GLP-1 и рецептор глюкагона по сравнению с природным оксинтомодулином и позволяющего эффективно снижать уровни общего холестерина, холестерина низкой плотности и триглицеридов в крови, которые были повышены вследствие рациона с высоким содержанием жира, и повышать уровни холестерина высокой плотности и соотношения холестерин высокой плотности/холестерин низкой плотности. 3 н. и 10 з.п. ф-лы, 10 ил., 3 табл., 6 пр.

Комментарии