Применение пептида, усиливающего секрецию соматотропного гормона, в качестве адъюванта вакцины - RU2768134C2
Код документа: RU2768134C2
Чертежи


Описание
Настоящее изобретение относится к области молекулярной биологии и иммунологии, а именно к разработке вакцин и адъювантов для них. В частности, настоящее изобретение относится к применению пептида, усиливающего секрецию соматотропного гормона, выбранного из синтетического пептида, высвобождающего соматотропный гормон, GHRP-6 и его структурного аналога A233, в качестве молекулярного адъюванта для вакцин.
Уровень техники
Вещества, усиливающие секрецию соматотропного гормона, (GHS) (Davenport et al. 2005, Pharmacol. Rev. 57: 541-546) представляют собой семейство химических соединений, которое включает в себя пептидильные и непептидильные молекулы, которые стимулируют секрецию соматотропного гормона (СТГ) in vitro и in vitro (Tannenbaum and Bowers, 2001, Endocrine 14: 21-27).
Грелин является эндогенным лигандом рецептора веществ, усиливающих секрецию соматотропного гормона (GHS-R) (Kojima et al., 1999, Nature 402: 656-660). Он участвует во многих процессах, включая, среди прочего, регулирование энергетического баланса, аппетита, метаболических сигналов (Dixit and Taub, 2005, Exp. Gerontoly 40: 900-910). Кроме того, он оказывает противовоспалительное действие, модулирует фагоцитоз и способствует тимопоэзу, а также ослаблению септического шока (Hattori, 2009, J. Clin. Endocrinol. Metab. 86: 4284-4291).
Помимо стимуляции секреции СТГ, GHS регулируют аппетит и увеличение веса у млекопитающих, птиц и рыб (Kaiya et al., 2008, Comp. Biochem. Physiol. A 149: 109-128). Они также обладают кардиозащитными свойствами, улучшая показатели сердечной функции в нескольких исследованиях in vivo и подавляя пролиферацию раковых клеток (Locatelli и Rossoni, 1999, Endocrinol. 140: 4024-4031; Tivesten and Bollano, 2000, Endocrinol. 141: 60 -66; Cassoni et al., 2001, J. Clin. Endocrinol. Metab. 86: 1738-1745). Кроме того, они участвуют в таких процессах, как воспаление и старение (Hattori, 2009, J. Clin. Endocrinol. Metab. 86: 4284-4291).
Известно, что гексамер GHRP-6 (аминокислотная последовательность которого представляет собой His-D-Trp-Ala-Trp-D-Phe-Lys-NH2) является чрезвычайно мощным и безопасным химическим соединением, вызывая высвобождение соматотропного гормона у млекопитающих и птицы (Bowers et al., 1984, Endocrinol. 114: 1537-45), а также у ракообразных (Европейский патент NO:EP1477181 B1).
У животных моделей были описаны примеры противовоспалительного действия грелина (Smith et al., 2005, Trends Endocrinol. Metab. 16, 436-442). В большинстве этих исследований было высказано предположение, что использование ацилированного грелина подавляло экспрессию и/или выработку провоспалительных цитокинов, вне зависимости от патологии или дозы, и применяемой схемы лечения (Baatar et al., 2011, Molecular and Cellular Endocrinology 340: 44-58). Ранее выдвигались предроложения о его роли в снижении смертности и воспалительных эффектов, вызываемых липополисахаридами (ЛПС), как in vivo, так и in vitro, а также сепсиса у модельных грызунов (Dixit et al., 2004, J. Clin. Invest. 114: 57-66; Taub, 2007, Vitam. Horm. 77: 325-346).
В исследованиях, проводимых на мышиной модели хронического воспаления, грелин и синтетический агонист GHRP-2 значительно ингибировали высвобождение интерлейкина 6 (IL-6) и азотной кислоты из активированных макрофагов и ослабляли артрит (Granado et al., 2005, Am. J. Physiol. Endocrinol. Metab. 288: E486-E492). Кроме того, аналогичные исследования, которые были проведены, подтверждили противовоспалительные эффекты этих химических соединений (González-Rey et al., 2006, Gastroenterol. 130 (6), 1707-1720).
В работе, выполненной Lofti и сотрудниками в 2011 году (Lofti et al., 2011, Kafkas Univ Vet Fak Derg 17 (6): 949-952), инъекция грелина в яйцеклетку оказала влияние на количество лейкоцитов в крови недавно вылупившихся цыплят.При дозе 100 нг на 10-й день инкубации это привело к увеличению количества гетерофилов, базофилов и эозинофилов, а также к соотношения гетерофилов/лимфоцитов, в то же время это приводило к уменьшению количество лимфоцитов.
В случае костистых рыб исследования in vitro показали, что обработка лейкоцитов радужной форели (Oncorhynchus mykiss) грелином увеличивает продукцию супероксид-аниона, уровни рибонуклеиновой кислоты СТГ-мессенджера и супероксиддисмутазы в этих клетках (Yada et al., 2006, Endocrinol. 189: 57-65). В этом исследовании сообщалось, что предшествующая инкубация с антагонистом рецептора вещества, усиливающего секрецию соматотропного гормона, [D-Lys3]-GHRP-6, и иммуно-нейтрализация СТГ снижали выработку этих активных форм кислорода (O2•-), что свидетельствует о том, что действие грелина на лейкоциты опосредуются секрецией соматотропного гормона (Yada et al., 2007, Endocrinol. 152: 353-358). С другой стороны, исследования in vitro, проведенные с аналогом пептида GHRP-6, усиливающего секрецию соматотропного гормона, A233, показали, стимуляцию продуцирования индикаторов фагоцитарной активности, таких как супероксидный анион, в лейкоцитах тилапии (Oreochromis sp.) (Martínez et al., 2012, J. of Endocrinol. 214: 409-419). В том же исследовании было доказано, что введение А233 в иммерсионных ваннах стимулирует параметры антиоксидантной защиты с помощью фермента супероксиддисмутазы у личинок тилапии (Oreochromis sp.), а также титры лектина и антипротеазную активность. В других экспериментах, проведенных на молоди тилапии, перорально получавшей GHRP-6, наблюдалось увеличение титров лектина и количества интраэпителиальных лимфоцитов слизистой оболочки желудка (Martínez et al., 2016, Aquaculture 452 304-310). Этот последний параметр относится к врожденной иммунной системе, неспецифичен и не связан с введением определенного антигена.
Защитный иммунитет против различных патогенов требует ответов, которые могут быть получены с помощью соответствующего адъюванта вакцины (Awate et al., 2013, Frontiers in Immunology 4: 1-10). Поэтому необходимо выявить и разработать новые адъюванты, чтобы разрабатывать вакцины против патогенов, которые до сих пор были невосприимчивы к традиционным стратегиям вакцинации, и преодолеть ограничения нескольких доступных лицензированных адъювантов (Harandi et al., 2010, Vaccine 28(12): 2363-6; Pérez et al., 2012, Braz J Med Biol Res 45(8): 681-92).
Многие адъюванты потенцируют сильный неспецифичный воспалительный ответ, повышают иммуногенность совместно вводимых антигенов, но могут также вызывать нежелательные эффекты, в этих случаях необходимо разработать новые адъюванты, которые вызывают более специфичный и прямой иммунный ответ, чтобы получить оптимальную и безопасную защиту, обеспечиваемую вакцинами.
Подробное описание изобретения
Настоящее изобретение решает вышеупомянутую проблему, предлагая адъювант, способный эффективно усиливать иммунный ответ на совместно вводимый антиген. Настоящее изобретение относится к применению пептида, усиливающего секрецию соматотропного гормона, идентифицированного как SEQ ID NO: 1 (GHRP-6) или SEQ ID NO: 2 (A233), в качестве молекулярного адъюванта при изготовлении вакцины, которая применяется в различных стратегиях иммунизации. В одном варианте осуществления настоящего изобретения указанная вакцина используется для профилактики заболеваний, вызванных инфекционными агентами. В конкретном варианте осуществления изобретения эти заболевания поражают млекопитающих, птиц или рыб; и инфекционные агенты могут быть в числе прочего вирусами, бактериями и эктопаразитами.
В контексте настоящего изобретения термин «молекулярный адъювант» относится к веществу, способному положительно модулировать иммунный ответ против вакцинного антигена, что приводит к усилению этого ответа. На сегодняшний день нет исследований, демонстрирующих или предполагающих применение грелина или его аналогов в качестве молекулярного адъюванта. Напротив, было предложено применение грелина для лечения воспалительных заболеваний (González-Rey et al., 2006, Gastroenterology 130 (6), 1707-1720; Baatar et al., 2011, Mol Cell Endocrinol 340: 44-58). Принимая во внимание эту известную информацию, неожиданным является эффект, обнаруженный в настоящем изобретении, который демонстрирует, что введение GHRP-6 или A233 в комбинации с вакцинным антигеном стимулирует специфичный иммунный ответ против указанного антигена.
В другом варианте осуществления изобретения также описана вакцинная композиция, содержащая пептид, усиливающий секрецию соматотропного гормона, идентифицированный как SEQ ID NO: 1 (GHRP-6) или SEQ ID NO: 2 (A233), по меньшей мере, вакцинный антиген и фармакологически приемлемые носители или разбавители. Вакцинная композиция согласно настоящему изобретению может содержать другие химические соединения, которые действуют как вакцинные адъюванты, которые известны специалистам в данной области техники. В число этих адъювантов входят, например, соли алюминия и масляные адъюванты.
Чтобы проиллюстрировать различные варианты осуществления изобретения, вакцинные композиции, раскрытые в этих вариантах, включают различные антигены и пептиды GHRP-6 или A233. В число антигенов, которые комбинируются с GHRP-6 или его структурным аналогом A233, входят овальбумин (OVA), капсидный белок вируса Денге-2 (C2), пептид pP0 из Rhipicephalus sanguineus (Rodríguez-Mallón et al., 2012; Vaccine 30: 1782-1789), химерный белок P0-my32 (слитый полипептид двух антигенов Lepeophtheirus salmonis) и слитый полипептид P0 из L. salmonis и T-клеточных эпитопов (P0-TT). Не ограничивая настоящее изобретение, композиции вводили мышам, птицам и рыбам, и впервые был продемонстрирован адъювантный эффект для указанных пептидов, усиливающих секрецию соматотропного гормона. Неожиданно было обнаружено, что введение GHRP-6 или A233 в сочетании с антигеном повышает уровни антиген-специфичных антител у нескольких видов животных.
В одном варианте осуществления изобретения вакцинный антиген выбран из группы, состоящей из пептидов, белков, вирусов и аттенуированных бактерий. В одном предпочтительном варианте осуществления изобретения указанные вакцины вводят млекопитающим, птицам или рыбе. В более предпочтительном варианте осуществления изобретения вакцинную композицию настоящего изобретения вводят перорально или путем инъекции. В конкретном варианте осуществления изобретения в вакцинной композиции пептид SEQ ID NO: 1 или SEQ ID NO: 2 находится в концентрации 50-600 мкг/кг комбикорма, когда вакцина вводится перорально рыбам.
Настоящее изобретение также относится к способу усиления иммунного ответа против вакцинного антигена, который характеризуется введением эффективного количества пептида, усиливающего секрецию соматотропного гормона, идентифицированного как SEQ ID NO: 1 (GHRP-6) или SEQ ID NO: 2 (A233), в качестве молекулярного адъюванта указанных антигенов. В одном варианте осуществления изобретения вакцинный антиген используется для предотвращения заболеваний, вызываемых инфекционными агентами. В конкретном варианте осуществления указанного способа пептид с последовательностью SEQ ID NO: 1 или SEQ ID NO: 2 используют в дозе 50-600 мкг/кг комбикорма, когда вакцинный антиген и адъювантный пептид вводят перорально. В другом варианте осуществления указанного способа пептид с последовательностью SEQ ID NO: 1 или SEQ ID NO: 2, используют в дозе 0,1-40 мкг/г массы тела животного, если вакцинный антиген и пептид, действующий в качестве молекулярного адъюванта, вводят инъекцией. Для целей настоящего изобретения пептиды GHRP-6 и A233, известные как пептиды, усиливающего секрецию СТГ, получают химическим синтезом.
Как показано в различных вариантах осуществления изобретения, увеличение иммунного ответа против представляющего интерес антигена повышает уровень защиты от различных инфекционных агентов, включая вирусные, бактериальные и эктопаразитные возбудители.
Краткое описание чертежей.
Фигура 1. Гуморальный ответ у мышей, иммунизированных OVA, GHRP-6 и адъювантом Фрейнда, или OVA и адъювантом Фрейнда. А. Титры иммуноглобулина G (IgG) в группах, иммунизированных подкожным путем (подкожно). B. Титры IgG в группах, иммунизированных внутрибрюшинным путем (внутрибрюшинно). Представлены медиана и стандартное отклонение в каждой группе. ** обозначает p<0,0014; *** обозначает p<0,001.
Фигура 2. Гуморальный ответ у мышей, иммунизированных OVA, GHRP-6 и адъювантом Фрейнда, подкожно и внутрибрюшинно. (Группы 3 и 4 соответственно); или OVA и адъювантом Фрейнда, подкожно и внутрибрюшинно (группы 5 и 6 соответственно). A. Титры IgG1. B. Титры IgG2a. Представлены медиана и стандартное отклонение в каждой группе. ** обозначает р<0,0014; *** обозначает р<0,001.
Фигура 3. Титры IgG у мышей, иммунизированных пептидом А233, OVA и адъювантом Фрейнда; или OVA и адъювантом Фрейнда, внутрибрюшинным способом. Показаны уровни антител, обнаруженных в сыворотке, полученной на 22-й день графика иммунизации. Представлены медиана и стандартное отклонение в каждой группе. ** обозначает р<0,0014.
Фигура 4. Титры IgG (обнаруженые на 28-й день графика иммунизации) в группах, иммунизированных С2 и алюминием; или C2, GHRP-6 и алюминием, подкожным способом. Представлены медиана и стандартное отклонение в каждой группе. * обозначает р<0,05.
Фигура 5. Титры IgG у мышей, иммунизированных Р0 и адъювантом Фрейнда; или P0, GHRP-6 и адъювантом Фрейнда, внутрибрюшинным способом в день 36 графика иммунизации. Представлены медиана и стандартное отклонение в каждой группе. * обозначает р<0,05.
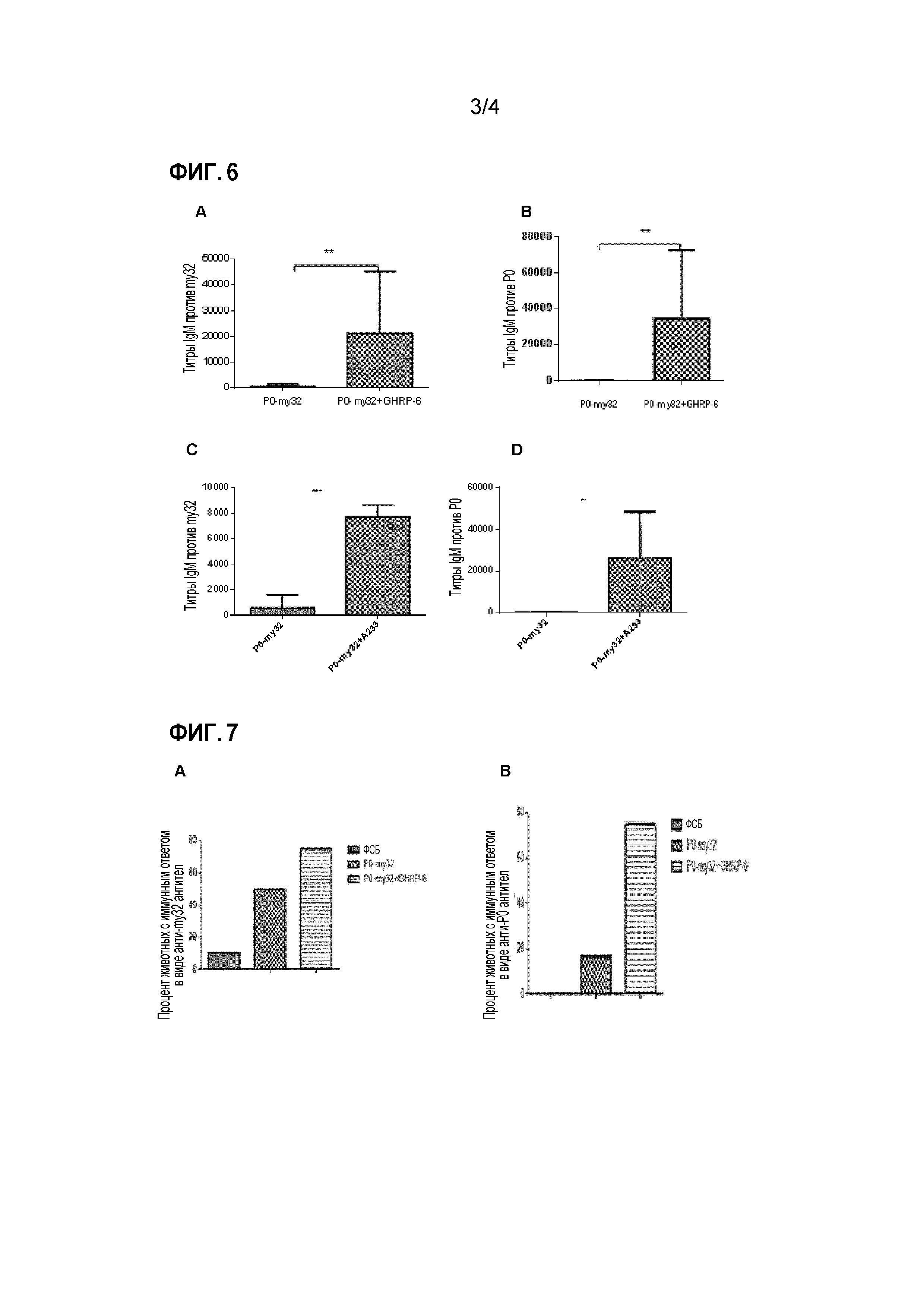
Фигура 6. Титры иммуноглобулина М (IgM) у тилапии, иммунизированной P0-my32 или P0-my32 в комбинации с GHRP-6 или пептидом A233, обнаруженные на 28-й день эксперимента, иммуногены вводили внутрибрюшинно. А. и С.Титры IgM против my-32. B и D. Титры IgM против P0. На А и В показаны титры у животных, получавших лечение с или без GHRP-6, а на С и D представлены титры у животных, получавших лечение с или без А233. Представлены медиана и стандартное отклонение в каждой группе. * обозначает р<0,01; ** обозначает р<0,0014; *** обозначает р<0,001.
Фигура 7. Процент тилапии с титрами IgM более 1:1000 после иммунизации препаратом P0-my32, включающим Montanide ISA 50 или P0-my32, включающим GHRP-6 и Montanide ISA 50, на 28-й день эксперимента. A. Процент животных, ответивших на анти-my32. B. Процент животных, ответивших на P0.
Фигура 8. Ответ антител IgM у клариевого сома, иммунизированного P0-TT или P0-TT в присутствии GHRP-6 или пептида A233, на 28-й день эксперимента, где рыбу иммунизировали внутрибрюшинно. А. Титры анти-Р0 антител в группах оценочного эксперимента с GHRP-6 в качестве адъюванта. B. Титры анти-P0 антител в группах оценочного эксперимента с A233 в качестве адъюванта. Все иммуногены были объединены с Montanide ISA 50.
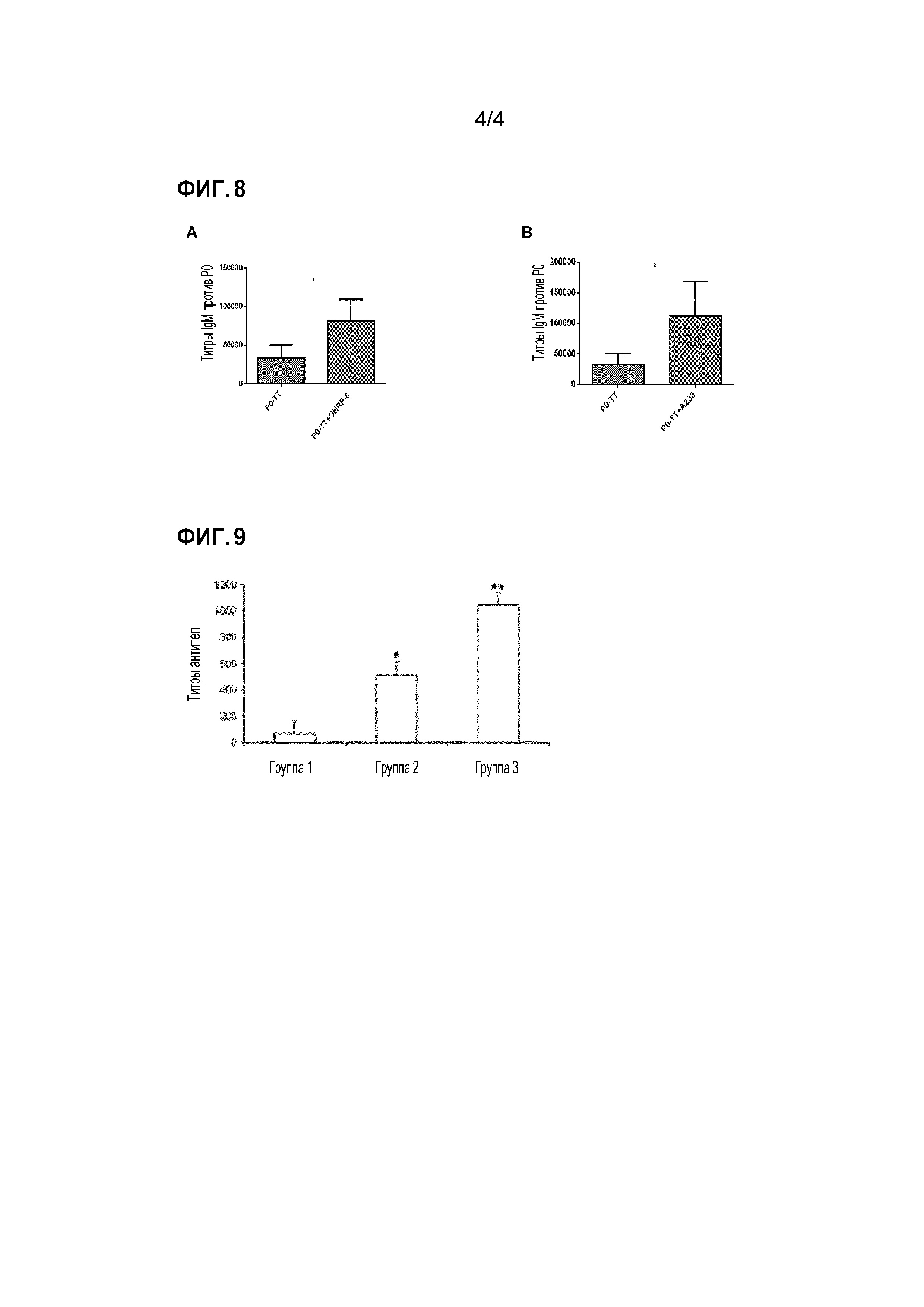
Фигура 9. Титры агглютинирующих антител против Aeromonas hydrophila у карпа обыкновенного. Значения оси Y представляют медианное значение ± стандартную ошибку. * обозначает р<0,05; ** обозначает р<0,01. Группа 1: Инъекция ФСБ, Группа 2: инъекция инактивированных формалином клеток A. hydrophila, Группа 3: инъекция инактивированных формалином клеток A. hydrophila и GHRP-6 (20 мкг на рыбу). Все иммуногены были объединены с Montanide ISA 50.
Примеры
Пример 1. Влияние совместного введения GHRP-6 на гуморальный иммунный ответ против OVA
В этом эксперименте было использовано тридцать шесть самок мышей линии BALB/c. Животных распределили на шесть опытных групп по 6 животных в каждой. Три группы иммунизировали подкожно, а остальные - внутрибрюшинно. Во всех группах иммуногены эмульгировали с адъювантом Фрейнда.
Группа 1: Плацебо (фосфатно-солевой буфер, сокращенно ФСБ). подкожное введение.
Группа 2: Плацебо (ФСБ). внутрибрюшинное введение.
Группа 3: GHRP-6 в дозе 10 мкг/животное и OVA в дозе 5 мкг/животное. подкожное введение.
Группа 4: GHRP-6 в дозе 10 мкг/животное и OVA в дозе 5 мкг/животное. внутрибрюшинное введение.
Группа 5: OVA 5 мкг/животное. подкожное введение.
Группа 6: OVA 5 мкг/животное. внутрибрюшинное введение.
Мыши получали 150 мкл иммуногена во всех группах, которые вводили животным в дни 1 и 15 графика иммунизации. Забор крови проводили в дни 0 (неиммунная сыворотка), 8, 15, 22, 36, 43 и 50. Оценивали общие титры IgG, IgG1 и IgG2a. Полный адъювант Фрейнда (ПАФ) использовали при первой иммунизации, а неполный адъювант Фрейнда (НАФ) - при следующей иммунизации.
Животные группы, подкожно иммунизированной GHRP-6 и OVA, имели более высокие титры (со статистической значимостью: p<0,05), чем у животных, получавших OVA без GHRP-6 тем же путем, в дни 22, 36, 43 и 50 эксперимента (Фигура 1А). Животные, которым вводилм те же иммуногены, но внутрибрюшинным способом, имели такое же поведение на 36 и 43 дни эксперимента (Фигура 1В).
Титры IgG1 и IgG2a определяли в сыворотке, полученной на 36-й день, в группах, иммунизированных OVA с или без GHRP-6, подкожным и внутрибрюшинным способом. (Фигуры 2А и 2В). Не наблюдалось значимых различий в титрах IgG2a между группами, получавшими GHRP-6, и группами, которые не получали указанный пептид, усиливающий секрецию соматотропного гормона, для обоих способов введения (Фигура 2А и 2 В). Значимые различия наблюдались для IgG1 в случае обоих способов введения, будучи выше в группах, вакцинированных в присутствии GHRP-6.
Отношение IgG1/IgG2a как показатель дифференциальной реактивности к ответу Th2 или Th1, соответственно, было значительно выше в группе, иммунизированной внутрибрюшинным способом, с OVA в присутствии GHRP-6 и адъюванта Фрейнда, по сравнению с группой, которой вводили только OVA и адъювант Фрейнда. Это соотношение показано в таблице 1, где данные представляют собой среднее отношение IgG1/IgG2a, соответствующее шести животным в группе.
Таблица 1. Соотношение IgG1/IgG2a в обеих группах, иммунизированных внутрибрюшинным способом введения.
* означает значимые различия р<0,05.
Пример 2. Влияние совместного введения пептида A233 на гуморальный иммунный ответ против OVA.
Чтобы оценить, оказывает ли пептид A233 адъювантное действие на OVA, использовали 18 самок мышей линии BALB/c. Мыши получали 150 мкл иммуногена во всех группах внутрибрюшинным способом введения, которые давали животным в дни 1 и 15 графика иммунизации. Образцы крови отбирали в дни 0 (неиммунная сыворотка), 8, 15, 22, 36, 43 и 50. Оценивали титры общего IgG, присутствующего в сыворотке. Животных иммунизировали 5 мкг OVA/животное и 10 мкг A233/животное (Группа 2) или 5 мкг OVA/животное (Группа 3). Контрольной группе вводили ФСБ (Группа 1). Все иммуногены были эмульгированы с адъювантом Фрейнда.
У животных, которым инъецировали OVA и пептид A233, наблюдалось значительное увеличение титров анти-OVA-антител по сравнению с животными, иммунизированными только OVA, на 22-й день схемы иммунизации (Фигура 3).
Пример 3. Влияние совместного введения GHRP-6 на гуморальный иммунный ответ против антигена C2.
Антиген С2, капсидный белок вируса Денге, был получен в виде рекомбинантного белка в Escherichia coli с молекулярной массой 15 кДа. Для оценки гуморального и клеточного иммунного ответа у мышей, вакцинированных С2, в присутствии или в отсутствие GHRP-6 были отобраны 24 самки мышей линии BALB/c в возрасте 6 недель. Они были распределены на 3 группы. Каждое животное получало иммуноген согласно своей опытной группе:
Группа 1: 10 мкг С2
Группа 2: 10 мкг С2, вводимого совместно с 10 мкг GHRP-6.
Группа 3: ФСБ
Во всех группах иммуногены дополнительно содержали гидроксид алюминия, также известный как квасцы. Иммунизации проводили подкожным способом в дни 0, 15 и 30 графика иммунизации. Образцы крови отбирали в дни 0 (до иммунизации), 7, 16, 21, 28 и 35, чтобы оценить общие титры IgG.
На Фигуре 4 показано, что на 28-й день графика иммунизации группа 2, получавшая С2 и GHRP-6, показала значительное увеличение титра анти-С2 IgG по сравнению с группой 1, получавшей С2 и адъювантный гидроксид алюминия, без GHRP-6.
Пример 4. Влияние совместного введения GHRP-6 на гуморальный иммунный ответ против пептида P0 R. sanguineus.
Пептид P0 представляет собой фрагмент, соответствующий области меньшей идентичности по последовательности между рибосомальным белком P0 клеща R. sanguineus и его хозяином-млекопитающим. Для оценки гуморального иммунного ответа, стимулируемого совместным введением GHRP-6 и P0, было отобрано 24 самки мышей линии BALB/c 6-недельного возраста, которые были разделены на три группы по 8 мышей. Каждое животное получало 150 мкл иммуногена путем внутрибрюшинного введения в дни 1, 15 и 29 графика иммунизации. В первой иммунизации использовали ПАФ, а НАФ использовали в двух других введениях.
Группа 1. Контроль (ФСБ)
Группа 2. 100 мкг Р0.
Группа 3. 100 мкг P0 совместно вводили с 200 мкг GHRP-6.
Образцы крови отбирали в дни 0 (неиммунная сыворотка), 8, 16, 21, 28, 36, 43, 50 и 58, чтобы определить уровни общего IgG. У животных, иммунизированных P0, в присутствии GHRP-6 наблюдалось значительное увеличение титров IgG по сравнению с животными, которые не получали GHRP-6, как видно на Фигуре 5, где показано уровни анти-P0 антитела на 36 дней графика иммунизации.
Пример 5. Влияние совместного введения GHRP-6 или пептида A233 на гуморальный иммунный ответ против белка P0-my32 у тилапии (Oreochromis sp.)
Химерный белок P0-my32 был получен путем клонирования комплементарной дезоксирибонуклеиновой кислоты (кДНК), кодирующей 35-аминокислотный пептид рибосомального белка P0 L. salmonis, слитой с N-концевым концом кДНК, кодирующей белок my32 того же эктопаразита (Carpio et al., 2013; Exp. Parasitol 135: 188-199), в вектор, предназначенный для индуцированной экспрессии представляющих интерес генов в бактерии-хозяине E.coli. Этот белок был синтезирован в бактерии и очищен в виде слитого белка с гистидиновой меткой с помощью аффинной хроматографии с хелатом металла.
Для выполнения эксперимента по иммунизации были сформированы 6 опытных групп мальков мужского пола Oreochromis niloticus, по 15 животных в каждой. Во всех группах иммуноген вводили внутрибрюшинно с Montaide ISA 50 в качестве адъюванта. Опытные группы получали следующие иммуногены:
Группа 1: ФСБ
Группа 2: P0-my32 (1 мкг/г веса рыбы)
Группа 3: P0-my32 (1 мкг/г веса рыбы) совместно с 20 мкг GHRP-6
Группа 4: P0-my32 (1 мкг/г веса рыбы) совместно с 20 мкг A233
Группа 5: P0-my32 (1 мкг г веса рыбы). Рыбу в этой группе кормили комбикормом, содержащим 100 мкг GHRP-6 на кг корма, два раза в день, за одну неделю до и одну неделю после инъекционного введения my32.
В ходе эксперимента рыбу в группах 1-4 кормили два раза в день сбалансированным коммерческим комбикормом, не содержащим лекарственных препаратов, из расчета 1% от их массы тела. Иммунизации проводили в дни 0 и 14 графика. Образцы крови отбирали в дни 0, 21, 28 и 35 от начала эксперимента.
У тилапии, инъецированной P0-my32 в присутствии GHRP-6, наблюдалось увеличение титров антител IgM против my32 по сравнению с группой, инъецированной P0-my32. Это увеличение было статистически значимым, как показано на Фигуре 6А, где показаны уровни антител в сыворотках, выделенных на 28 день. Такой же эффект наблюдался для титра анти-P0 IgM (Фигура 6 В). Совместное введение А233 с химерным антигеном также позволило увеличить титры IgM по отношению к двум компонентам по сравнению с контрольной группой (Фигуры 6С и 6D). Группа, которой вводили P0-my32 и одновременно давали комбикорм, содержащий GHRP-6, также показала увеличение титров по сравнению с группой, которой вводили химерный белок, которой давали немодифицированный корм (Таблица 2).
Таблица 2. Влияние совместного введения GHRP-6 в корм на титры анти-my32 и анти-P0 IgM
* означает значимые различия между группами р<0,05.
Кроме того, в группе, которой вводили содержащий GHRP-6 иммуноген путем внутрибрюшинной инъекции, (Группа 3), число отвечающих на вакцинацию животных с титрами IgM более 1:1000 было выше для обоих компонентов химерного белка по сравнению с группой, получавшей P0-my32, но не получавшей пептид GHRP-6 (Группа 2). Это видно на Фигурах 7А и 7 В.
Пример 6. Влияние совместного введения GHRP-6 или A233 и белка P0-TT на гуморальный иммунный ответ у клариевого сома (Clarias gariepinus).
Химерный белок P0-TT основан на: a) пептиде pP0, состоящем из 35 аминокислот, соответствующих области, менее консервативной между рибосомальным белком P0 L. salmonis и тем же белком в одном из его хозяев, Salmo salar и b) двух Т-клеточных эпитопах, происходящих из вируса кори и столбнячного анатоксина, соответственно. Для эксперимента были сформированы 4 опытных группы C. gariepinus, по 12 животных в каждой. Этих животных внутрибрюшинно иммунизировали 1 мкг белка P0-TT на грамм веса животного (Группа 2) или той же дозой химерного белка P0-TT (1 мкг/г веса животного), вводимыми одновременно с 20 мкг или GHRP-6 или A233 на животное (Группы 3 и 4 соответственно), в общем объеме 120 мкл. Контрольная группа (Группа 1) получала такой же объем ФСБ. Иммуногены, соответствующие всем группам, эмульгировали с масляным адъювантом Montanide ISA 50. Иммунизацию проводили в тех же условиях, в дни 0 и 14 графика введения. Образцы крови брали в дни 0, 21, 28 и 35, от начала эксперимента.
У клариевых сомов, иммунизированных P0-TT и GHRP-6, наблюдалось увеличение титров антител против P0 IgM по сравнению с группой, которой вводили P0-TT без пептида GHRP-6, что имело статистическую значимость на 28 день (Фигура 8А). Тот же эффект наблюдался для титров, полученных после введения P0-TT и A233 (Фигура 8B).
Пример 7. Демонстрация адъювантного действия GHRP-6 на гуморальный иммунный ответ карпа обыкновенного (Cyprinus carpio) против бактерии Aeromonas hydrophila.
Эксперимент проводили с карпами (C. carpio) массой 40±10 г. Эти животные содержались в 600-литровых аквариумах при температуре 28±2°C. Были сформированы три опытные группы по 10 карпов в каждой, которым внутрибрюшинно вводили следующие иммуногены:
Группа 1: ФСБ+Montanide ISA 50.
Группа 2: Инактивированные клетки A. hydrophila (1×108 колониеобразующих единиц, сокращенно КОЕ)+Montanide ISA 50.
Группа 3: Инактивированные клетки A. hydrophila (1×108 КОЕ)+20 мкг GHRP-6/на рыбу + Montanide ISA 50.
Рыбу инъецировали в дни 0 и 14, и образцы крови брали из хвостовой вены в дни 0 и 21. Результаты показали, что титры агглютинирующих антител против A. hydrophila были значительно выше в группе, иммунизированной бактерией и GHRP-6, по сравнению с группой, иммунизированной бактерией без пептида GHRP-6 (Фигура 9). Эти результаты подтверждают действие GHRP-6 в качестве молекулярного адъюванта у рыб. Получение клеток A. hydrophila и измерение титров антител проводили в соответствии с ранее описанной методикой (Yin et al. ((1996) Fish & Shellfish Immunol. 6, 57-69).
Пример 8. Эксперимент с контролируемым заражением на рыбах, иммунизированных инактивированной бактерией Aeromonas hydrophila и инактивированной бактерией, вводимой совместно с пептидом GHRP-6.
Эксперимент проводили с обыкновенным карпом (C. carpio) массой 30±5 г. Эти животных содержали в 250-литровых аквариумах при температуре 30±2°C. Были сформированы три опытные группы, по 20 карпов в каждой, и животным внутрибрюшинно вводили:
Группа 1: ФСБ + Montanide ISA 50
Группа 2: Инактивированные клетки A. hydrophila (1×108 КОЕ) + Montanide ISA 50
Группа 3: Инактивированные клетки A. hydrophila (1×108 КОЕ) + 20 мкг GHRP-6/ на рыбу + Montanide ISA 50.
Рыбу инъецировали в дни 0 и 14. Заражение проводили на 21 день путем внутрибрюшинной инъекции летальной дозы 50 (ЛД50) бактерии, и смертность в каждой группе регистрировали в течение 7 дней. Относительную выживаемость (ОВ) рассчитывали как:
ОВ(%) = (% смертности в контроле - % смертности иммунизированных животных)/(% смертности в контроле)×100.
В результате 65% ОВ было получено в Группе 2 и 95% ОВ в Группе 3, демонстрируя, что введение GHRP-6 увеличивает выживаемость у рыб, вакцинированных и зараженных патогеном.
Пример 9. Демонстрация адъювантного действия GHRP-6 на гуморальный иммунный ответ цыплят на бычий сывороточный альбумин.
В этом эксперименте использовали пятнадцать новорожденных цыплят-бройлеров, гибрида EB34 Cronish × White Plymoth Rock, и они были разделены на три опытные группы по 5 животных в каждой. Животных иммунизировали внутрибрюшинным способом, на 12 и 18 дни схемы иммунизации, 5 мкг БСА на животное (Группа 2) или 5 мкг БСА и 20 мкг GHRP-6 на животное (Группа 3). Контрольная группа (Группа 1) была иммунизирована ФСБ. Уровни антител IgY в сыворотке крови определяли на 25 день эксперимента. Были выявлены статистически значимые различия между титрами антител у животных из группы, иммунизированной БСА, и группы, получавшей БСА и GHRP-6 (Таблица 3).
Таблица 3. Ответ антиген-специфичных антител IgY в сыворотке крови кур, иммунизированных БСА.
Данные показывают среднее и стандартное отклонение максимальных значений оптической плотности, определенных методом непрямого ИФА.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> CENTRO DE INGENIERIA GENETICA Y BIOTECNOLOGIA
<120> Применение пептида, усиливающего секрецию соматотропного
гормона, в качестве адъювант вакцины
<130> Адъюванты, усиливающие секрецию соматотропного гормона
<140>
<141>
<150> CU 2016-0161
<151> 2016-11-01
<160> 2
<170> Патентная версия 2.1
<210> 1
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: GHRP-6,
Trp(2) и Phe(5) являются D-аминокислотами
<220>
<221> Модифицированные_остатки
<222> (6)
<223> Амидирование
<400> 1
His Trp Ala Trp Phe Lys
1 5
<210> 2
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: пептид
A233, содержит лактамную связь между Lys и Asp
<400> 2
Gly Lys Phe Asp Leu Ser Pro Glu His Gln
1 5 10
<---
Реферат
Изобретение относится к применению GHRP-6 и его структурного аналога в качестве молекулярных адъювантов для вакцин. Вакцины могут быть использованы для профилактики заболеваний, вызываемых инфекционными агентами, такими как вирусы, бактерии и эктопаразиты, которые поражают млекопитающих, птиц и водные организмы. GHRP-6 и его аналог A233 эффективны в качестве адъювантов, когда они комбинируются с данным антигеном, так как они усиливают специфичный иммунный ответ против него. 3 н. и 6 з.п. ф-лы, 9 ил., 3 табл., 9 пр.
Формула
Документы, цитированные в отчёте о поиске
Соединения, представляющие собой пептидные аналоги стимуляторов секреции гормона роста, и содержащие их препараты

Комментарии