Соединения, представляющие собой пептидные аналоги стимуляторов секреции гормона роста, и содержащие их препараты - RU2416618C2
Код документа: RU2416618C2
Чертежи













Описание
Область техники
Настоящее изобретение может быть отнесено к области рационального дизайна биологически активных молекулярных образований, регулирующих метаболическую активность и клеточную защиту организмов. Более конкретно изобретение может быть отнесено к области соединений, представляющих собой пептидные аналоги стимуляторов секреции гормона роста, чья активность включает, но не ограничена ими: контролируемое высвобождение гормона роста, кардиопротекцию, увеличение функционального ответа кардиоваскулярной системы, нейропротекцию, регуляцию и контроль аппетита, потребления жира и энергетический метаболизм.
Уровень техники
Синтетические стимуляторы секреции гормона роста (GH) состоят из семейства лигандов, включающих пептидные и непептидные молекулы, впервые описанные Momany и Bowers перед выделением синтетических пептидов GH-высвобождающего гормона (GHRH) из 6 и 7 аминокислот с получением в результате потенциальных GH-высвобождающих пептидов (GHRP); такие пептиды были описаны до того, как стало известно об их функции в организме или пути их действия. Мутационные исследования и in vivo и in vitro эксперименты обнаружили два расположения аминокислот L-D и D-L, разделенные одной аминокислотой, действующей в качестве спейсера, их рассматривали как оптимальные для GH-высвобождающей активности, и пептид (His-D-Trp-Ala-D-Trp-Phe-NH2) был адаптирован для высвобождения GH в концентрации 10-30 нг/мл с получением пептида известного как GHRP-6 (His-D-Trp-Ala-Trp-D-Phe-Lys-NH2), где остаток Lys необходим только для улучшения in vivo активности, поскольку считается, что он не является функциональным in vitro (Momany F.A., Bowers C.Y. et al. (1981) Design, synthesis and biological activity of peptides which release growth hormone, in vitro. Endocrinology, 108:31-39).
Были открыты другие аналогичные пептиды: в 1983 Bowers et al. открыли два GHRP-6-аналогичных пептида, GHRP-2 (D-Ala-D-β-Nal-Ala-Trp-D-Phe-Lys-NH2) и GHRP-1 (Ala-His-D-β-Nal-Ala-Trp-D-Phe-Lys-NH2). Эти три стимулятора секреции демонстрировали высвобождение GH и увеличение высвобождения GH in vitro из инкубированного гипофизарного гипоталамуса, полученного индивидуально из гипофиза, демонстрируя, что гипоталамусный импульс является важным при таком действии, также было продемонстрировано даже для людей, что при синергическом действии GHRP и GHRH высвобождается больше GH, чем при индивидуальном действии каждого из них (Bowers C.Y. (1993) GH-releasing peptides: structure and kinetics. J Pediatr Endocrinol, 6(1):21-31).
На основе пептида, известного как GHRP-2, были получены новые циклические пептиды путем замены N-концевого D-Ala на аминокислоту, имеющую боковую цепь, связанную с другой аминокислотой, вставленной между D-Phe и Lys. Один их таких пептидов (D-Lys-D-β-Nal-Ala-Trp-D-Phe-Glu-Lys-NH2) был получен в результате с 10-кратно увеличенной активностью in vitro и со сравнимой эффективностью in vivo по отношению к GHRP-6 (McDowel R.S. et al. (1995) Growth hormone secretagogues: characterization, efficacy, and minimal bioactive conformation. PNAS USA, 92(24):11165-11169). Эксперименты были завершены структурными исследованиями раствора DL циклических пептидов, которые привели к заключению, что введение D-аминокислот в пептидные соединения были, по существу, необходимы для того, чтобы получить желаемую активность. Другие исследования были направлены на обнаружение активных молекул с увеличенной пероральной биодоступностью и более продолжительным временем выведения с получением в итоге открытий новых молекул GHRP и других не пептидных молекул. В 1993 году был впервые описан стимулятор секреции GH (Smith R.G. et al. (1993) A nonpeptidyl growth hormone secretagogue. Science, 260:1640-43) и позднее опубликован синтез не пептидных молекул с большим потенциалом - GHS, MK-067, обладающих большей биодоступностью и способных стимулировать секрецию GH через 24 часа после единичной дозы перорального введения (Patchett A.A., Nargund R.P. et al. (1995) Design and biological activities of L-163, 191 (MK-0677): a potent, orally active growth hormone secretagogue. PNAS USA, 92:7001-7005; Smith R.G., Van der Ploeg L.H. et al. (1997) Peptidomimetic regulation of growth hormone secretion. Endocr. Rev, 18:621-645). Сравнительно недавно была создана другая молекула (EP1572), представляющая собой пептидомиметик GHS с селективной и потенциальной активностью высвобождения GH, демонстрирующая потенциал связывания рецептора стимулятора секреции GH (GHS-R) в тканях человека и животного, подобная таким, как грелин и пептидная молекула GHS, индуцирующие значительное увеличение GH после подкожного введения новорожденным крысам (Broglio F., Boutignon F. et al. (2002) EP1572: a novel peptido-mimetic GH secretagogue with potent and selective GH-releasing activity in man. J Endocrinol Invest, 25:RC26-RC28).
В 1999 году грелин был открыт в виде пептида из 28 аминокислот, который продуцируется главным образом в желудке, однако его мРНК также обнаруживается в некоторых других тканях. Он продуцируется в желудке с помощью клеток Х/А, которые являются основной популяцией эндокринных клеток в кислотопродуцирующей слизистой оболочке. Грелин также обнаруживается в дугообразном ядре гипоталамуса, где РНК присутствует в NPY и AGRP нейронах, вовлеченных в контроль аппетита и энергетического баланса (Kojima M., Hosoda H. et al. (1999) Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature, 402:656-60; Nakazato M., Murakami N. et al. (2001) A role for ghrelin in the central regulation of feeding. Nature, 409:194-198). Его РНК также локализуется в поджелудочной железе и кишечнике. Он циркулирует в кровотоке взрослых людей в концентрации 100-120 fmol/ml, что предполагает, что он секретируется клетками желудка и может действовать по эндокринному пути. Также было опубликовано о продуцировании грелина в неопластических тканях (Takaya K., Ariyasu H. et al. (2000) Ghrelin strongly stimulates growth hormone release in humans. J. Clin. Endocrinol. Metab, 85:4908-11; Papotti M. et al. (2001) Substantial production of ghrelin by a human medullary thyroid carcinoma cell line. J Clin Endoc. Metab, 86:4984-4990).
Другие исследования на животных продемонстрировали, что секреция грелина является пульсирующей и более ассоциирована с потребностью организма в GH-стимулах (Tolle V., Bassant M.H. et al. (2002) Ultradian rhythmicity of ghrelin secretion in relation with GH, feeding behaviour, and sleep wake patterns in rats. Endocrinology, 143:1353-1361).
Грелин представляет собой первый природный гормон, обнаруженный с гидроксильной группой одного из серинов, ацилированной с помощью октановой кислоты. Эта модификация была описана, как существенная для связывания с GHS-R1a, а также для способности высвобождения GH, и возможно для других эндокринных процессов.
Не ацилированный грелин циркулирует в больших количествах, чем ацилированный, хотя не было описано прямого эндокринного процесса, он рассматривается как задействованный в других не эндокринных функциях, подобных кардиососудистым эффектам, кардиопротективным, антипролиферативным и цитопротективным эффектам в целом, возможно опосредованным путем связывания с другими субтипами молекул GHS-R (Matsumoto M., Hosoda H. et al. (2001) Structure-activity relationship of ghrelin: pharmacological study of ghrelin peptides. Biochem Biophys Res Commun, 287:142-146; Hosoda H., Kojima M. et al. (2000) Ghrelin and des-acyl ghrelin: two major forms of rat ghrelin peptide in gastrointestinal tissue. Biochem Biophys Res Commun, 279:909-913; Cassoni P., Papotti M. et al. (2001) Identification, characterization, and biological activity of specific receptors for natural (ghrelin) and synthetic growth hormone secretagogues and analogs in human breast carcinomas and cell lines. J Clin Endocrinol Metab, 86:1738-1745).
Существует другой эндогенный лиганд для молекулы GHS-R1a, который может быть выделен из эндокринной слизистой оболочки желудка, дес-Gln14-грелин, полученный в результате альтернативного процессинга гена грелина с потерей Gln14, и также как с грелином, был проведен эксперимент такого же процесса ацилирования остатка Ser3.
Исследования, проведенные с некоторыми аналогами грелина, обладающими третьим остатком, модифицированным с помощью некоторых алифатических или ароматических групп, и с некоторыми короткими пептидами, выделенными из боковой цепи грелина, продемонстрировали, что гидрофобные группы в остатке 3 являются существенными для активности. Также наблюдалось, что короткие сегменты, содержащие первые пять остатков грелина, способны к активации рецептора с эффективностью, сравнимой с эффективностью цельного пептида. Было продемонстрировано, что тетрапептиды обладают меньшим потенциалом, и фрагменты, лишенные N-концевой части, были не способны к активации рецептора (Bednarek M.A., Feighner S.D. et al. (2000) Structure-Function Studies on the New Growth Hormone-Releasing Peptide, Ghrelin: Minimal Sequence of Ghrelin Necessary for Activation of Growth Hormone Secretagogue Receptor 1a. J Med Chem, 43: 4370-4376; Silva Elipe M.V., Bednarek M.A. et al. (2001) 1H NMR structural analysis of human ghrelin and its six truncated analogs. Biopolymers, 59:489-501). Такие исследования предполагают, что полная последовательность грелина не является существенной для активности, и Gly-Ser-Ser(н-октаноил)-Phe представляет собой активный фрагмент при проявлении его активности как агониста молекулы GHS-R1a.
До и после открытия грелина были приложены большие усилия для обнаружения малых молекул и производных, которые могут выступать в роли лигандов для GHS-R. Большое количество патентов описывает молекулы такого типа (US Патенты 3239345; 4036979; 4411890; 5492916, 5494919; 5559128; 5663171; 5721250; 5721251; 5723616; 5726319; 5767124; 5798337; 5830433; 5919777; 6034216; 6548501; 6559150; 6576686; 6686359; Международные Патенты: WO 6548501; 6559150; 6576686; 6686359; Intl Pats: WO (89/07110; 89/07111; 92/07578; 93/04081; 94/11012; 94/13696; 94/19367; 95/11029; 95/13069; 95/14666; 95/17422; 95/17423; 95/34311; 96/02530; 96/15148; 96/22996; 96/22997; 96/24580; 96/24587; 96/32943; 96/33189; 96/35713; 96/38471; 97/00894; 97/06803; 97/07117; 97/09060; 97/11697; 97/15191; 97/15573; 97/21730; 97/22004; 97/22367; 97/22620; 97/23508; 97/24369; 97/34604; 97/36873; 97/38709; 97/40023; 97/40071; 97/41878; 97/41879; 97/43278; 97/44042; 97/46252; 98/03473; 98/10653; 98/18815; 98/22124; 98/46569; 98/51687; 98/58947; 98/58948; 98/58949; 98/58950; 99/08697; 99/09991; 99/36431; 99/39730; 99/45029; 99/58501; 99/64456; 99/65486, 99/65488; 00/01726; 00/10975; 01/47558; 01/92292; 01/96300; 01/97831) (Carpino, P. (2002) Recent developments in ghrelin receptor (GHS-. R1a) agonists and antagonists Exp. Opin. Then Patents 12:1599-1618). После такой всесторонней проверки были описаны другие соединения как антагонисты GHS-R (US 2005/288316 и WO 2005/048916), и были описаны другие соединения, которые связывались с GHS-R и использовались для разнообразных целей (WO 2005/046682; WO 2005/039625; JP 2003/335752; US 2004/009984; US 2003/130284; WO 03/004518). Сравнительно недавно были добавлены к существующему ряду соединений новые типы макроциклических соединений с главной целью - выступать в роли агонистов GHS-R, не вызывая высвобождения GH (US 2006/025566).
GHS-R представляет собой белок класса А сопряженного с G-белком рецептора, экспрессирующийся от одного гена в хромосомном локусе 3q26.2 человека. Были идентифицированы два типа кДНК как результат альтернативного процессинга пре-мРНК (McKee K.K., Tan C.P. et al. (1997) Cloning and characterization of two human G protein-coupled receptor genesi (GPR38 and GPR39) related to the growth hormone secretagogue and neurotensin receptors. Genomics, 46:426-434; McKee K.K., Palyha O.C. et al. (1997) Molecular analysis of rat pituitary and hypothalamic growth hormone secretagogue receptors. Mol Endocrinol, 11:415-423; US 6242199; WO 97/21730). кДНК 1а кодирует рецептор из 366 аминокислот, содержащий семь трансмембранных сегментов (GHS-R1a). кДНК1b кодирует укороченный белок (GHS-R1b), содержащий 289 аминокислот и пять трансмембранных сегментов. Хотя роль GHS-R1b еще не известна, была установлена его экспрессия в некоторых эндокринных и не эндокринных тканях (Howard A.D., Feighner S.D. et al. (1996) A receptor in pituitary and hypothalamus that functions in growth hormone release. Science, 273:974-977; Gnanapavan S., Kola B. et al. (2002) The tissue distribution of the mRNA of ghrelin and subtypes of its receptor, GHS-R, in humans. J Clin Endocrinol Metab. 87:2988; Smith R.G., Leonard R. et al. (2001) Growth hormone secretagogue receptor family members and ligands. Endocrine, 14:9-14).
Человеческий белок GHS-R1a имеет 96% и 93% идентичности с соответствующими белками крысы и свиньи, и было показано близкое родство между последовательностями GHS-R1a человека и рыбы telosteous. Такие открытия позволяют предположить, что белок GHS-R1a обладает высокой межвидовой консервативностью, и, возможно, несет существенную биологическую функцию. (Palyha O.C., Feighner S.D. et al. (2000) Ligand activation domain of human orphan growth hormone (GH) secretagogue receptor (GHS-R) conserved from pufferfish to humans. Mol Endocrinol. 14:160-169).
Связывание грелина и синтетической молекулы GHS с GHS-R1a активирует сигнальный путь фосфолипазы С с увеличением концентрации инозитол-1,4,5 трифосфата (IP3) и активацией протеин киназы С (PKS), с последующим высвобождением Ca2+ из внутриклеточных компартментов. Активация белка GHS-R также ингибирует каналы К+, дающие возможность поглощения Ca2+ через потенциалозависимые каналы L-типа, но не Т-типа. В отличие от GHS-R1a белок GHS-R1b не связывается или реагирует на GHS, и его функция еще не известна (Chen C, Wu D. et al. (1996) Signal transduction systems employed by synthetic GH-releasing peptides in somatotrophs. J Endocrinol. 148:381-386; Casanueva F.F., Dieguez C. (1999) Neuroendocrine regulation and actions of leptin. Front Neuroendocrinol, 20:317-363; Howard A.D., Feighner S.D. et al. (1996) A receptor in pituitary and hypothalamus that functions in growth hormone release. Science, 273:974-977).
Синтетическая молекула GHS, грелин и его природная изоформа (дес-Gln14-грелин) связывается с высокой степенью аффинности с GHS-R1a, и эффективность замещения мембранно-связанных меченных белков [35S] MK-0677 или [125I][Tyr4]грелина коррелирует с концентрацией, требующейся для стимуляции высвобождения GH (Muccioli G., Papotti M. et al. (2001) Binding of 1251-labeled ghrelin to membranes from human hypothalamus and pituitary gland. J Endocrinol Invest. 24:RC7-RC9; Hosoda H., Kojima M. et al. (2000) Purification and characterization of rat des-Gln14-ghrelin, a second endogenous ligand for the growth hormone secretagogue receptor. J Biol Chem, 275:21995-22000).
Для определения существенных структурных характеристик грелина, необходимых для связывания и активации GHS-R1a, исследовали короткие пептиды грелина в клетках HEK-293, экспрессирующих человеческий белок GHS-R1a, наблюдая, что N-концевые пептиды грелина из 4 и 5 аминокислот были способны к активации рецептора. На основе этих полученных in vitro результатов установили, что пептид Gly-Ser-Ser(n-октаноил)-Phe по существу требуется для активации рецептора (Van der Lely A.J., Tschop M. et al. (2004) Biological, Physiological, Pathophysiological, and Pharmacological Aspects of Ghrelin. Endocrine Reviews, 25(3):426-457). Первые 7 аминокислот грелина являются консервативными среди всех исследованных видов, однако способность грелиновых производных активировать GHS-R1a в трансфецированных клетках, как оказалось, не указывает на способность стимулировать высвобождение GH в соматотропных клетках, недавно было продемонстрировано, что (1-4) и (1-8) октаноил грелин не способны стимулировать высвобождение GH у крыс и не эффективны при замещении меченного [125I][Tyr4]грелина из сайта связывания в препаратах мембран клеток слизистой оболочки или гипоталамуса человека (Torsello A., Ghe C et. al. (2002) Short ghrelin peptides neither displace ghrelin binding in vitro nor stimulate GH release in vivo. Endocrinology, 143:1968-1971). Другое исследование, проведенное на тех же клетках, экспрессирующих GHS-R1a человека или свиньи, обнаружило, что аденозин также активирует рецептор, но подобно коротким грелиновым аналогам не может стимулировать секрецию GH, предполагается, что аденозин представляет собой частичный агонист GHS-R1a, связанный с другим сайтом рецептора, отличным от сайта MK-0677 и GHRP-6 (Smith R.G., Griffin P.R. et. al. (2000) Adenosine: a partial agonist of the growth hormone secretagogue receptor. Biochem Biophys Res Commun, 276:1306-1313). Сравнительно недавно было опубликовано, что GHS-R1a также может связываться с користатином (CST), при этом нейропептид, гомологичный соматостатину, (SS), не способен сам по себе распознавать GHS-R1a (Deghenghi R., Papotti M. et. al. (2001) Cortistatin, but not somatostatin, binds to growth hormone secretagogue (GHS) receptors of human pituitary gland. J Endocrinol Invest, 24:RC1-RC3). GHS-R1a экспрессируется в дугообразном ядре и в соматотропных клетках слизистой оболочки, которые являются критическими зонами для активностей грелина и синтетической молекулы GHS, связанных с нейроэндокринной стимуляцией и со стимуляцией аппетита (Willesen M.G., Kristensen P., Romer J. (1999) Co-localization of growth hormone secretagogue receptor and NPY mRNA in the arcuate nucleus of the rat. Neuroendocrinology, 70:306-316; Bluet-Pajot M.T., Tolle V. et. al. (2001) Growth hormone secretagogues and hypothalamic networks. Endocrine, 14:1-8; Shintani M., Ogawa Y. et. al. (2001) Ghrelin, an endogenous growth hormone secretagogue, is a novel orexigenic peptide that antagonizes leptin action through the activation of hypothalamic neuropeptide Y/Y1 receptor pathway. Diabetes, 50:227-232). Грелин и синтетическая молекула GHS стимулируют экспрессию маркеров активности нейронов (c-fos и EGR-1) в нейронах дугообразного ядра. мРНК молекулы GHS-R1a детектировали во внешних областях гипоталамуса, подобных зубчатому изгибу и областям СА2 и СА3 гипоталамуса, в компактной части черного вещества и в вентральной тегментальной области, в дорсальных и срединных ядрах Raphe, в ядре Edinger-Westphal, в соединительной ткани (bridge) и в продолговатом мозге, что указывает возможные роли вне гипоталамуса. мРНК также была обнаружена в некоторых периферических органах, таких как желудок, кишечник, поджелудочная железа, почки, сердце, аорта, в некоторых аденомах человека и в некоторых неопластических образованиях легкого, желудка и поджелудочной железы человека (Hewson A.K., Dickson S.L. (2000) Systemic administration of ghrelin induces Fos and Egr-1 proteins in the hypothalamic arcuate nucleus of fasted and fed rats. J Neuroendochnol, 12:1047-1049; Muccioli G., Ghe et. al. (1998) Specific receptors for synthetic GH secretagogues in the human brain and pituitary gland. J Endocrinol, 157:99-106; Guan X.M., Yu H. et. al. (1997) Distribution of mRNA encoding the growth hormone secretagogue receptor in brain and peripheral tissues. Brain Res Mol Brain Res, 48:23-29;; Mori K., Yoshimoto et. al. (2000) Kidney produces a novel acylated peptide, ghrelin. FEBS Lett, 486:213-216; Nagaya N., Miyatake K. et. al. (2001) Hemodynamic, renal, and hormonal effects of ghrelin infusion in patients with chronic heart failure. J Clin Endocrinol Metab, 86:5854-5859; Korbonits M., Bustin S.A. et. al. (2001) The expression of the growth hormone secretagogue receptor ligand ghrelin in normal and abnormal human pituitary and other neuroendocrine tumours. J Clin Endocrinol Metab, 86:881-887; Papotti M., Cassoni P. et. al. (2001) Ghrelin-producing endocrine tumors of the stomach and intestine. J Clin Endocrinol Metab, 86:5052-5059).
Грелин и GHS обладают высокой аффинностью связывания с GHS-R1a. Однако существуют очевидные данные о других дополнительных сайтах для GHS. Специфичные сайты для Tyr-Ala-гексарелина и других GHS с подобной плотностью рецептора, по меньшей мере, равной плотности, обнаруженной в слизистой оболочке, были обнаружены в клетках сердца человека и крысы и во многих других не эндокринных периферических тканях, подобных легким, артериям, скелетным мышцам, почкам и печени (Muccioli G., Ghe C et. al. (1998) Specific receptors for synthetic GH secretagogues in the human brain and pituitary gland. J Endocrinol, 157:99-106; Muccioli G., Broglio F. et. al. (2000) Growth hormone-releasing peptides and the cardiovascular system. Ann Endocrinol (Pahs), 61:27-31; Bodart V., Bouchard J.F. et. al. (1999) Identification and characterization of a new growth hormone-releasing peptide receptor in the heart. Circ Res, 85:796-802; Katugampola S., Davenport A. (2003) Emerging roles for orphan G protein-coupled receptors in the cardiovascular system. Trends Pharmacol Sci, 24:30-35; Ghigo E., Arvat E. et. al. (2001) Biologic activities of growth hormone secretagogues in humans. Endocrine, 14:87-93; Papotti M., Ghe C, Cassoni P. et. al. (2000) Growth hormone secretagogue binding sites in peripheral human tissues. J Clin Endocrinol Metab, 85:3803-3807). Такие сайты связывания продемонстрировали низкую степень аффинности связывания с грелином, и, возможно, они не принадлежат грелиновым рецепторам, но принадлежат рецепторам пептидов, аналогичных грелину. Белок GHS-R, локализованный в ткани сердца, имеет больший молекулярный вес (84 кДа), чем GHS-R1а, и их последовательности не имеют гомологии, предсказанная аминокислотная последовательность для белка рецептора, локализованного в ткани сердца, является подобной последовательности CD36 (Papotti M., Ghe C. et. al. (2000) Growth hormone secretagogue binding sites in peripheral human tissues. J Clin Endocrinol Metab, 85:3803-3807; Bodart V., Febbraio M. et. al. (2002) CD36 mediates the cardiovascular action of growth hormone-releasing peptides in the heart. Circ R&s, 90:844-849). Функциональное значение рецепторов GHS периферических тканей и их обнаружение в кардиоваскулярной системе предполагает, что такие сайты связывания модулируют кардиопротективные активности пептидных молекул GHS.
Грелин и другие синтетические стимуляторы секреции стимулируют высвобождение GH соматотропными клетками in vitro, возможно, путем деполяризации мембраны и путем увеличения секретируемого GH на клетку, опубликовано также о стимулирующем эффекте GHS на синтез GH. (Kojima M., Hosoda H. et. al. (1999) Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature, 402:656-660; Sartor O., Bowers C.Y., Chang D. (1985) Parallel studies of His-DTrp-Ala-Trp-DPhe-Lys-NH2 and human pancreatic growth hormone releasing factor-44-NH2 in rat primary pituitary cell monolayer culture. Endocrinology, 116:952-957; Bowers C.Y., Sartor A.O. et. al. (1991) On the actions of the growth hormone-releasing hexapeptide, GHRP. Endocrinology, 128:2027-2035; Wu D., Chen C, et al. (1994) The effect of GH-releasing peptide-2 (GHRP-2 or KP 102) on GH secretion from primary cultured ovine pituitary cells can be abolished by a specific GH-releasing factor (GRF) receptor antagonist. J Endocrinol, 140:R9-R13;).
Ранние исследования продемонстрировали, что GHS стимулировал секрецию GH с использованием другого рецептора и сигнального пути GHRH: Антагонист GHRH рецептора ингибирует вызванную белком GHRH секрецию GH, но высвобождение GHRH, стимулированное стимуляторами секреции и предполагаемыми антагонистами GHS-R, не влияет на высвобождение GH в ответ на GHRH, белок GHRP-6 не конкурирует с GHRH за связывание с сайтами GHRH, как обнаружено с помощью анализа связывания рецептора, существует дополнительный эффект на высвобождение GH при совместном введении GHS и GHRH, и не существует кросс-десенсибилизации между GHRH и GHS в отношении высвобождения GH (Wu D., Chen C. et al. (1994) The effect of GH-releasing peptide-2 (GHRP-2 or KP102) on GH secretion from primary cultured ovine pituitary cells can be abolished by a specific GH-releasing factor (GRF) receptor antagonist. J Endocrinol, 140:R9-13; Thorner M.O., Hartman M.L. et al. (1994) Current status of therapy with growth hormone-releasing neuropeptides. Savage MO, Bourguignon J, Grossman AB (eds). Frontiers in Paediatric Neuroendocrinology, 161-167).
Активность молекулы GHS - высвобождения GH сильнее в препаратах клеток слизистой оболочки-гипоталамуса, чем в выделенной слизистой оболочке, что согласуется с очевидностью факта более сильных эффектов in vivo стимуляции GH. (Mazza E., Ghigo E. et. al. (1989) Effect of the potentiation of cholinergic activity on the variability in individual GH response to GH-releasing hormone. J Endocrinol Invest, 12:795-798; Bowers C.Y., Sartor A.O. et. al. (1991) On the actions of the growth hormone-releasing hexapeptide, GHRP. Endocrinology, 128:2027-2035; Clark R.G., Carlsson M.S. et. al. (1989) The effects of a growth hormone-releasing peptide and growth hormone releasing factor in conscious and anaesthetized rats. J Neuroendocrinol, 1:249-255).
На уровне гипоталамуса грелин и GHS действуют на GHRH-секреторных нейронах, и повышенный уровень GHRH наблюдался в циркуляции слизистой оболочки воротной вены после введения GHS овце (Conley L.K., Teik J.A. et. al. (1995)" Mechanism of action of hexarelin and GHRP-6: analysis of the involvement of GHRH and somatostatin in the rat. Neuroendocrinology, 61:44-50; Guillaume V., Magnan E. et. al. (1994) Growth hormone (GH)-releasing hormone secretion is stimulated by a new GH-releasing hexapeptide in sheep. Endocrinology, 135:1073-1076).
Для GHS требуется GHRH для полного выражения его эффекта высвобождения GH, у человека ответ на GH ингибируется антагонистами рецептора GHRH и с помощью разрыва связи слизистой оболочки-гипоталамуса. (Bluet-Pajot M.T., Tolle V. et al. (2001) Growth hormone secretagogues and hypothalamic networks. Endocrine, 14:1-8; 148:371-380; Popovic V., Miljic D. et al. (2003) Ghrelin main action on the regulation of growth hormone release is exerted at hypothalamic level. J Clin Endocrinol Metab, 88:3450-3453). Пациенты с дефицитом GHRH рецептора не демонстрируют увеличения секреции GH в виде ответа на GHS-стимуляцию, но сохраняют способность увеличения уровня кортизола, ACTH и PRL после GHS-стимуляции (Maheshwari H.G., Pezzoli S.S. et al. (2002) Pulsatile growth hormone secretion persists in genetic growth hormone-releasing hormone resistance. Am J Physiol Endocrinol Metab, 282:E943-E951; Maheshwari H.G., Rahim A. et al. (1999) Selective lack of growth hormone (GH) response to the GH-releasing peptide hexarelin in patients with GH-releasing hormone receptor deficiency. J Clin Endocrinol Metab, 84:956-959; Gondo R.G., Aguiar-Oliveira M.H., Hayashida C.Y. et al. (2001) Growth hormone-releasing peptide-2 stimulates GH secretion in GH-deficient patients with mutated GH-releasing hormone receptor. J Clin Endocrinol Metab, 86:3279-3283). Для животных и людей доказана очевидность индуцируемой GHS и GHRH гомологичной, но не гетерологичной десенсибилизации, GHS-активность гомологичной десенсибилизации была продемонстрирована во время инфузии GHS, но не при периодическом ежедневном пероральном или назальном введении пептида в течение более, чем 15 дней (Ghigo E., Arvat E. et al. (1994) Growth hormone-releasing activity of hexarelin, a new synthetic hexapeptide, after intravenous, subcutaneous, intranasal, and oral administration in man. J Clin Endocrinol Metab, 78:693-698; Ghigo E., Arvat E. et al. (1996) Short-term administration of intranasal or oral hexarelin, a synthetic hexapeptide, does not desensitize the growth hormone responsiveness in human aging. Eur J Endocrinol, 135:407-412). С другой стороны, парентеральное, внутриназальное или пероральное введение GHS увеличивает спонтанное пульсирование GH и повышает уровень IGF-1 у взрослых субъектов молодого возраста, так же как у детей и субъектов пожилого возраста (Chapman I.M., Bach M.A. et al. (1996) Stimulation of the growth hormone (GH)-insulin-like growth factor I axis by; daily oral administration of a GH secretagogue (MK-677) in healthy elderly subjects; J Clin Endocrinol Metab, 81:4249-4257; Copinschi G., Van Onderbergen A. et al. (1996) Effects of a 7-day treatment with a novel, orally active, growth hormone (GH) secretagogue, MK-0677, on 24-hour GH profiles, insulin-like growth factor I, and adrenocortical function in normal young men. J Clin Endocrinol Metab, 81:2776-2782; Laron Z., Frenkel J. et al. (1995) Intranasal administration of the GHRP hexarelin accelerates growth in short children. Clin Endocrinol (Oxf), 43:631-635).
Грелин способен стимулировать аппетит у крыс, и это свойство может быть опосредовано синтезом NPY и AGRP. Внутрижелудочковый грелин также способен аннулировать анорексигенные эффекты лептина, и установлено, что существует конкурентное взаимодействие между этими двумя пептидами при влиянии на контроль гомеостаза аппетита и энергии. Циркулирующие концентрации грелина у крысы повышены натощак и понижены после кормления или приема глюкозы (Shintani M., Ogawa Y. et al. (2001) Ghrelin, an endogenous growth hormone secretagogue, is a novel orexigenic peptide that antagonizes leptin action through the activation of hypothalamic neuropeptide Y/Y1 receptor pathway. Diabetes, 50:227-32; Nakazato M., Murakami N. et al. (2001) A role for ghrelin in the central regulation of feeding. Nature, 409(6817): 194-198; Tschbp M., Smiley D.L., Heiman M.L. (2000) Ghrelin induces adiposity in rodents. Nature, 407:908-13).
GHS также стимулирует аппетит и набор веса. Периодическая обработка с помощью GHRP-2 стимулирует накопление жировой ткани у NPY-дефицитных мышей и увеличивает экспрессию в гипоталамусе мРНК AGRP у контрольных мышей (Torsello, A., Luoni, M. et al. (1998) Novel hexarelin analogs stimulate feeding in the rat through a mechanism not involving growth hormone release. Eur. J. Pharmacol, 360:123-129; Ghigo, E., Arvat, E. et al. (1999) Endocrine and non-endocrine activities of growth hormone secretagogues in humans. Horm. Res, 51:9-15; Tschop, M., Statnick, et al. (2002) GH-releasing peptide-2 increases fat mass in mice lacking NPY: indication for a crucial mediating role of hypothalamic agouti-related protein. Endocrinology, 143:558-568).
Результатом введения грелина крысам является прибавление веса и повышение аппетита при значительном увеличении жировой ткани без наблюдаемых изменений в безжировой массе, костной ткани или в стимуляции роста. Липогенный эффект грелина является независимым от действия GH, и он может быть обнаружен у генетически модифицированной GH-дефицитной крысы. GH вызывает увеличение потребления энергии и вызывает удаление жира, что дает возможность находиться в балансе с грелином, грелин увеличивает жировую ткань и GH не дает возможности уменьшать безжировую ткань (Nakazato M., Murakami N. et al. (2001) A role for ghrelin in the central regulation of feeding. Nature, 409(6817):194-198; Wren A.M., Small C.J. et al. (2000) The novel hypothalamic peptide ghrelin stimulates food intake and growth hormone secretion. Endocrinology, 141(11):4325-4328; Tschop M., Smiley D.L., Heiman M.L. (2000) Ghrelin induces adiposity in rodents. Nature, 407:980-913).
У страдающих от ожирения индивидуумов уровень грелина уменьшен и не уменьшается после приема пищи, такое состояние является обратимым, поскольку потеря веса и грелина обозначают, что уровень в плазме является повышенным. Уровень грелина в плазме негативно коррелирует с индексом веса тела, весом жира тела, уровнем ожирения и уровнем в плазме инсулина, глюкозы и лептина (English P.J., Ghatei M.A. et. al. (2002) Food fails to suppress ghrelin levels in obese humans. J Clin Endocrinol Metab, 87(6):2984; Tschop M., Weyer C. et. al. (2001) Circulating ghrelin levels are decreased in human obesity. Diabetes, 50(4):707-9).
Было опубликовано, что недостаточность GH у пациентов, страдающих ожирением, становится обратимой после продолжительной диеты и заметной потери веса. Хроническое увеличение свободных жирных кислот и гиперинсулинизм, ассоциированные с низким уровнем грелинамогут играть важную роль, которая связана с причиной недостаточности GH при ожирении (Maccario M., Tassone F., Grottoli S., Rossetto R., Gauna C, Ghigo E. (2002) Neuroendocrine and metabolic determinants of the adaptation of GH/IGF-I axis to obesity. Ann Endocrinol (Paris), 63(2 Pt 1): 140-144). Поскольку было обнаружено, что грелин является адипогенным и вызывающим аппетит, можно рассмотреть роль его антагонистов при лечении ожирения, однако последствия такого антагонизма представляют собой понижение секреции GH и ассоциированы с увеличением массы жира (Jorgensen J.O., Vahl N., (1996) Influence of growth hormone and androgens on body composition in adults. Horm Res, 45:94-98). При продолжительном времени введения агонистов или антагонистов грелина обнаружится, какой из двух эффектов является доминирующим и определится его влияние на энергетический баланс.
У человека, страдающего ожирением, циркулирующая концентрация грелина понижена и негативно коррелирует с жировой тканью тела и циркулирующим уровнем инсулина и лептина (Taschöp M., Weyer C. et al. (2001) Circulating ghrelin levels are decreased in human obesity. Diabetes, 50:707-9).
Ось GH/IGF-1 играет очень важную роль во время кардио-развития и для поддержания структуры и функции сердца; повреждение сердечно-сосудистого действия является одним из симптомов дефицита GH, который может быть ликвидирован с помощью GH-терапии (Sacca L, Cittadini A, Fazio S (1994) Growth hormone and the heart. Endocr Rev 15:555-573; Caidahl K. Eden S. Bengtsson BA 1994 Cardiovascular and renal effects of growth hormone. Clin Endocrinol (Oxf) 40:393-400).
Существуют экспериментальные данные, демонстрирующие улучшение действия сердечной мышцы благодаря GH, среди них много исследований, использующих модель инфаркта миокарда (MI) у крыс, обработка которых после MI с помощью GH приводила в результате к повышению объема систолического выброса, кардиоспособности и другим систолическим изменениям вместе с продолжительной вазодилатацией и понижению общего периферического сопротивления благодаря действию GH/IGF-1, что, возможно, вносит вклад в улучшение сокращаемости миакарда (Timsit J. Riou B. et al. 1990 Effects of chronic growth hormone hypersecretion on intrinsic contractility, energetics, isomyosin pattern and myosin adenosine triphosphate activity of rat left ventricle. J Clin Invest 86:507-515; Tajima M. et al. (1999) Treatment with growth hormone enhances contractile reserve and intracellular calcium transients in myocytes from rats with post infarction heart failure. Circulation 99:127-134).
С другой стороны, модели животных с избытком GH проявляют замену на изоформу миозина с низкой активностью аденозин трифосфата, они могут понижать потребление энергии в процессе сокращения (Timsit J. Riou B. et al. (1990) Effects of chronic growth hormone hypersecretion on intrinsic contractility, energetics, isomyosin pattern and myosin adenosine triphosphate activity of rat left ventricle. J Clin Invest 86:507-515).
Существуют некоторые исследования кардио- и периферических эффектов GH и/или IGF-1, среди них положительные клинические данные, указывающие на будущую роль GH/IGF-1 в сердечно-сосудистой терапии (Fazio S., Sabatini D. et al. (1996) A preliminary study of growth hormone in the treatment of dilated cardiomyopathy. N Engl J Med, 334:809-814).
В некоторых in vivo исследованиях показано, что некоторые синтетические молекулы GHS и грелин обладают кардиопротективными свойствами, улучшая некоторые функциональные кардиоизменения, и имеют эффект, сравнимый с GH. Исходя из вероятности гемодинамики параметров гексарелина вместе с вероятностью гемодинамики параметров GH можно предположить, что воздействие GHS опосредована действием GH, однако недавние исследования поддерживают прямое воздействие на сердце (Locatelli V., Rossoni G., (1999) Growth Hormone independent cardioprotective effects of hexarelin in the rat. Endocrinology, 140:4024-4031; Tivesten A., Bollano E., (2000) The growth hormone secretagogue hexarelin improves cardiac function in rats after experimental myocardial infarction. Endocrinology, 141:60-66).
GHS-R1a мРНК была обнаружена в аорте и сердце, и ее присутствие также увеличивается в культуре кардиомиоцитов после их пре-инкубации с гексарелином (Gnanapavan S., Kola B. et al. (2002) The tissue distribution of the mRNA of ghrelin and subtypes of its receptor, GHS-R, in humans. J Clin Endocrinol Metab, 87: 2988-2991; Nagoya N., Kojima M. et al. (2001) Hemodynamic and hormonal effects of human ghrelin in healthy volunteers. Am J Physiol Regul Integr Comp Physio}, 280: R1483-R1487; Pang J.-J., Xu R.-K. et al. (2004) Hexarelin protects rat cardiomyocytes from angiotensin ll-induced apoptosis in vitro. Am J Physiol Heart Circ Physiol, 286(3): H1063-1069).
Специфичные сайты связывания грелина были идентифицированы в сердце крысы и артериях человека, где плотность рецептора увеличивается при атеросклерозе, и радиоактивно-меченная пептидная молекула GHS была обнаружена специфически связанной с клетками миокарда крысы и некоторыми сердечно-сосудистыми тканями человека (желудочком, предсердием, аортой, коронарными тканями, сонной артерией, эндокардом и полой веной) в большем количестве, чем со слизистой оболочкой (Katugampola S.D. (2001) [125l-His(9)]-ghrelin, a novel radioligand for localising GHS orphan receptors in human and rat tissue: up-regulation of receptors with atherosclerosis. Br J Pharmacol, 134:143-149; Ong H., McNicoll N. et al. (1998) Identification of a pituitary growth hormone-releasing peptide (GHRP) receptor subtype by photo affinity labeling. Endocrinology, 139:432-435; Bodart V., McNicoll N. et al. (1999) Identification and characterization of a new GHRP receptor in the heart. Circ Res, 85:796-808; Papotti M., Ghe C. et al. (2000) Growth hormone secretagogue binding site in periferical human tissues. J Clin Endocrinol Metab, 85: 3803-3807).
Хотя введение больших фармакологических доз пептидной молекулы GHS индуцирует абсолютное, но временное сужение сосудов в перфундированном сердце крысы с использованием молодых крыс с индуцированным дефицитом GH путем иммунизации с помощью GHRH, также было обнаружено, что гексарелин может защитить против нарушения миокарда, индуцированного при ишемии и реперфузии, такие защитные активности ассоциированы с высвобождением простациклина и достижением вазапрессорной активности Ангиотензина II (Bodart V., Febbario M. et al. (2000) CD36 mediates the cardiovascular action of growth hormone-releasing peptides in the heart. Circ Res, 90:844-849; de Gennaro Colonna V., Rossoni G. et al. (1997) Hexarelin, a growth hormone-releasing peptide, discloses protectant activity against cardiovascular damage in rats with isolated growth hormone deficiency. Cardiologia, 42:1165-1172; de Gennaro Colonna V. et al. (1997) Cardiac ischemia and impairment of vascular endothelium function in hearts from growth hormone-deficient rats: protection by hexarelin. Eur J Pharmacol, 334:201-207).
Подобные результаты получены со старыми крысами, где обработка с помощью гексарелина приводила в результате к серьезной защите против пост-ишемической желудочковой дисфункции. Полное восстановление кардиофункции наблюдалось при реперфузии, и одновременное уменьшение уровня креатинкиназы подтверждало целостность мембран сердца, и предохранение от слабости сокращений, следующих за повторным доступом кислорода. Протективный эффект гексарелина также был продемонстрирован путем продуцирования 6-кето-PGF1a и путем восстановления коронарной васкулярной реактивности по отношению к Ангиотензину II (Rossoni G., de Gennaro Colonna V. et al. (1998) Protectant activity of hexarelin or growth hormone against post ischemic ventricular dysfunction in hearts from aged rats. J Cardiovasc Pharmacol, 32:260-265; Rossoni G., de Gennaro Colonna V. et al. (1998) Protectant activity of hexarelin or growth hormone against post ischemic ventricular dysfunction in hearts from aged rats. J Cardiovasc Pharmacol, 32:260-265; Locatelli V., Rossoni G. et al. (1999) Growth hormone-independent cardioprotective effects of hexarelin in the rat. Endocrinology, 140:4024-4031). Исследования на гипофизэктомированных крысах продемонстрировали кардиопротективный эффекты GHS, независимые от GH и опосредованные специфичными для миокарда рецепторами (Locatelli V., Rossoni G. et. al. (1999) Growth hormone-independent cardioprotective effects of hexarelin in the rat. Endocrinology, 140:4024-4031; Bodart V., McNicoll N. et al. (1999) Identification and characterization of a new GHRP receptor in the heart. Circ Res, 85:796-808).
Гексарелин повышает объем систолического выброса, кардиоспособность и уменьшает общее периферическое сопротивление после индукции инфаркта миокарда у крыс возрастом 4 недели, использованных в качестве модели. Хотя механизм инотропной активности синтетической молекулы GHS еще не ясен, существует очевидность увеличения сокращения папиллярной мышцы, при воздействии на эндотелиальные клетки или нервные окончания (Tivesten A., Bollano et al. (2000) The growth hormone secretagogue Hexarelin improve cardiac function in rats after experimental myocardial infarction. Endocrinology, 141:60-66; Bedendi I., Gallo M.P. et al. (2001) Role of endothelial cells in modulation of contractility induced by hexarelin in rat ventricle. Life Sci, 69:2189-2201)
Грелин не разделяет всех кардиоваскулярных воздействий синтетической молекулы GHS, грелин обеспечивает слабую защиту для сердца, предполагая, что эффекты синтетической молекулы GHS возникают благодаря связыванию и активации GHS-специфичных сайтов. Исследования с помощью меченного [125I]Tyr-Ala-гексарелина обнаружили в миокарде крысы и в кардиоваскулярных тканях человека много сайтов связывания, отличных от сайтов GHSR-1a, что предполагает существование другого рецептора с последовательностью, подобной последовательности CD36, опосредующего коронарные воздействия синтетической молекулы GHS (Torsello A., Bresciani E. et al. (2003) Ghrelin plays a minor role in the physiological control of cardiac function in the rat. Endocrinology, 144:1787-1792; Muccioli G., Broglio F. et al. (2000) Growth hormone-releasing peptides and the cardiovascular system. Ann Endocrinol (Paris) 61:27-31; Bodart V., Febbraio M. et al. (2002) CD36 mediates the cardiovascular action of growth hormone-releasing^ peptides in the heart. Circ Res, 90:844-849). Хотя грелин является наименее активным на коронарном уровне, он представляет другие кардиоваскулярные эффекты. Грелин имеет большой потенциал in vivo и in vitro сосудорасширяющего эффекта, такое воздействие грелина направлено на мышцы, отличные от поперечно-полосатых, с потенциалом, сравнимым с потенциалом натрийуретических пептидов. У людей, представляющих собой пациентов с атеросклерозом, наблюдается повышенный уровень рецепторов грелина, предполагается, что он играет роль компенсации при повышенном сужении сосудов, наблюдаемом при таком состоянии (Okumura H., Nagaya N. et al. (2002) Vasodilatory effect of ghrelin, an endogenous peptide from the stomach. J Cardiovasc Pharmacol, 39:779-783; Wiley K.E., Davenport A.P. (2002) Comparison of vasodilators in human internal mammary artery: ghrelin is a potent physiological antagonist of endothelin-1. Br. J. Pharmacol, 136:1146-1152; Katugampola S.D. (2001) [125l-His(9)]-ghrelin, a novel radioligand for localising GHS orphan receptors in human and rat tissue: up-regulation of receptors with atherosclerosis. Br J Pharmacol, 134:143-149).
В других исследованиях продемонстрировано, что гексарелин, ацилированный грелин и даже грелин могут предотвращать индуцируемую доксорубицином клеточную смерть кардиомиоцитов H9c2 и эндотелиальных клеток, возможно стимулируя внутриклеточные сигналы, подобные активации ERK1/2 и PI 3-киназы АКТ (Baldanzi G., Filigheddu N. et. al. (2002) Ghrelin and des-acyl ghrelin inhibit cell death in cardiomyocytes and endothelial cells through ERK1/2 and PI 3-kinase/AKT. J Cell Biol, 159:1029-1037; Filigheddu N., Fubini A. et al. (2001) Hexarelin protects H9c2 cardiomyocytes from doxorubicin-induced cell death. Endocrine, 14:113-119).
Исследования in vivo на кардиомиоцитах и эндотелиальных клетках предполагает, что антиапоптозные эффекты GHS опосредованы ERK и AKT и путем ингибирования активации каспазы 3 и экспрессии BAX, увеличивающих экспрессию BCL-2 (Pang J.J., Xu R.K. et al. (2004) Hexarelin protects rat cardiomyocytes from angiotensin ll-induced apoptosis in vitro. Am J Physiol Heart Circ Physiol, 286:H1063-H1069). Такие данные усиливают гипотезу существования другого субтипа GHS-R, так как неацилированный грелин не активирует GHS-R1a.
Грелин и GHS действительно обладают кардиоваскулярной активностью у людей, их введение здоровым добровольцам и пациентам с хронической сердечной недостаточностью уменьшает систематическое васкулярное сопротивление и увеличивает кардиоспособность и объем систолического выброса с уменьшением значения артериального давления, но без демонстрации каких-либо изменений сердечного ритма, давления на срединную пульмонарную артерию или капиллярное пульмонарное давление (Nagaya N., Kojima M. et al. (2001) Hemodynamic and hormonal effects of human ghrelin in healthy volunteers. Am J Physiol Regul Integr Comp Physiol, 280:R1483-R1487; Enomoto M., Nagaya N. et al. (2003) Cardiovascular and hormonal effects of subcutaneous administration of ghrelin, a novel growth hormone-releasing peptide, in healthy humans. Clin Sci (Lond), 105:431-435).
Также наблюдалось, что некоторые трофические факторы, включающие GH и IGF-1, обладают нейропротективными свойствами во время второй фазы in vivo гипоксийной ишемии (HI), и было показано, что активация пути PI3K с фосфорилированием АКТ представляет собой медиатор коэффициента выживаемости нейронов, индуцируемой in vitro с помощью факторов роста, фосфорилированный белок АКТ стимулирует клеточную выживаемость и может ингибировать апоптоз путем инактивации некоторых антиапоптозных мишеней, подобных Bad, гликоген синтетазе 3 бета (GSK3β), каспазе 9 или модификациям транскрипционного фактора. (Kulik G., Klippel A., Weber M.J. (1997). Antiapoptotic signalling by the insulin-like growth factor I receptor, phosphatidylinositol 3-kinase, and Akt. Mol Cell Biol, 17:1595-1606).
Другой путь, активируемый факторами роста, представляет собой MAPK p42/44 ERK. Было обнаружено, что ERK-активация ингибирует индуцированный гипоксией апоптоз, за исключением того, что было продемонстрировано, что у новорожденных крыс нейропротекция BDNF опосредуется с помощью активации MAPK/ERK и с помощью обработки IGF-1 после того, как HI активирует Akt и ERK (Buckley S., Driscoll B. et al. (1999) ERK activation protects against DNA damage and apoptosis in hyperoxic rat AEC2. AmJPhysiol, 277:159-166; Han B.H., Holtzman D.M. (2000) BDNF protects the neonatal brain from hypoxic-ischemic injury in vivo via the ERK pathway. J Neurosci, 20:5775-5781).
Гексарелин уменьшает повреждение мозга на in vivo модели HI. Эта защита связана с фосфорилированием AKT и GSK3β, что указывает на возможность вовлечения пути PI3K, с наблюдением его протективного эффекта в коре головного мозга, в гипокампе таламуса, но не в стриатуме, пространственное распределение защиты коррелирует с локализацией GH-рецептора и гексарелина (Brywe K.G., Leverin A.-L. et al. (2005) Growth Hormone Releasing Peptide Hexarelin reduces neonatal brain injury and alters Akt/Glycogen Synthase Kinase-3B phosphorylation. Endocrinology, 146: 4665-4672; Lobi e P.E., Garcia-Aragon J. et al. (1993) Localization and ontogeny of growth hormone receptor gene expression in the central nervous system. Dev Brain Res, 74:225-233; Scheepens A., Sirimanne E.S. et al. (2001) Growth hormone as a neuronal rescue factor during recovery from CNS injury. Neuroscience, 104:677-687). Такие открытия позволяют предположить, что протективный эффект гексарелина может быть опосредован GH, и гексарелин разделяет обычные пути для клеточной защиты, так как мРНК GHS-R была обнаружена в некоторых структурах мозга. Введение GHRP-6 взрослым крысам при физиологических условиях продемонстрировало увеличение уровня IGF-1 в гипоталамусе, мозжечке, гипокампе, но не в коре головного мозга, хотя это возможно из-за увеличения экспрессии IGF-1, тот же эффект не был обнаружен у крыс, обработанных с помощью гексарелина через 24 часа после HI, с другой стороны, если IGF-1 является важным медиатором эффектов гексарелина, можно было бы также ожидать его влияния на уменьшение повреждения мозга в стриатуме, поскольку там присутствуют рецепторы IGF-1 (Frago L.M., Paneda C, Dickson S.L. et al. (2002) Growth hormone (GH) and GH-releasing peptide-6 increase brain insulin-like growth factor-l expression and activate intracellular signalling pathways involved in neuroprotection. Endocrinology, 143:4113-4122; Guan J., Williams C. et al. (1993) The effects of IGF-1 treatment after hypoxic-ischemic brain injury in adult rats. J Cereb Blood Flow Metab, 13:609-616). Гексарелин также активирует путь PI3K в центральной нервной системе (CNS) после HI, но он не влияет на ERK-фосфорилирование, IGF-1, напротив, активирует оба пути - ERK и PI3K.
Гексарелин увеличивает фосфорилирование рецептора IGF-1 в отсутствии обычной индукции IGF-1, увеличение фосфорилирования может происходить благодаря трансактивации рецептора с помощью гексарелина или эндогенного лиганда. Ранее было опубликовано, что агонисты GPCR, подобные ангиотензину-II, тромбину и эндотелину, могут стимулировать IGF-1 и/или АКТ (Sumitomo M., Milowsky M.I. et al. (2001) Neutral endopeptidase inhibits neuropeptide-mediated transactivation of the insulin-like growth factor receptor-Akt cell survival pathway. Cancer Res, 61:3294-3298; Zahradka P., Litchie B. et al. (2004) Transactivation of the insulin-like growth factor-l receptor by angiotensin II mediates downstream signalling from the angiotensin II type 1 receptor to phosphatidylinositol 3-kinase. Endocrinology, 145:2978-2987).
Нейропротективный эффект гексарелина, как оказалось, не опосредуется, главным образом, с помощью индукции оси GH/IGF-1, хотя увеличение сигнала от рецептора IGF-1 может вносить вклад в уменьшение повреждения мозга.
Подробное описание изобретения
Несмотря на огромную работу в этой области, описанную в состоянии уровня техники, однако, является очевидным, что все соединения, представляющие собой миметики грелина, и такие соединения непептидной природы не способны охватить все возможные функции, свойственные грелину в организме, с предпочтением применения соединений пептидной природы, имеющих большее структурное подобие, описание таких пептидных аналогов, однако, ограничено применением синтетических аминокислот с D-стехиометрией в составе композиций.
Принимая во внимание важность пептидных стимуляторов секреции в ранее описанных функциях и способность таких соединений при эндокринных и не эндокринных функциях в большом разнообразии организмов, систем и клеток, в настоящем изобретении описываются сначала эффекты химических молекул пептидной природы с внутренними циклами и состоящими только из аминокислот с L-стехиометрией с хиральным атомом углерода, способных, благодаря их химической структуре, к проявлению функций, подобных тем, что свойственны грелину, дес-ацил грелину и другим пептидным молекулам GHS, включающим, но не ограниченным способностью высвобождения GH, кардиопротекцией и, вообще, функциональным улучшением сердечной мышцы и ретикулоэндотелиальной системы, причем нейропротекция включает не только мозг, но все клетки нервной системы, и контроль и регуляцию аппетита, включающих регуляцию жирового и энергетического метаболизма.
Пептидные химические соединения, описанные в изобретении, имеют структуру, дающую им возможность выполнять требования связывания специфичных для грелина рецепторов и, в то же время, описанных рецепторов для связывания других стимуляторов секреции, представляющих все вышеуказанные функции.
В частном варианте осуществления изобретение относится к химическим молекулам, имеющим следующую структуру:
I. [Aa1…Aan]X1[Ab1…Abn]X2[Ac1…Acn]Adn
где Aa представляют собой L-аминокислоты, выбранные из ряда [Cys, Gly, Ser, His, Ala, Leu, Met или Thr], варьирующие в комбинациях из 1-4 остатков, Ab представляют собой L-аминокислоты, выбранные из ряда [Pro, Ile, Ala, Phe, Trp, Lys, Asp, Asn, Glu, Gln, Gly, Leu, Met, Tyr или Thr], варьирующие в комбинациях из 1-4 остатков, Ac представляют собой L-аминокислоты, выбранные из ряда [Arg, Leu, Pro, Val, Thr, Glu, His, Gln, Asn, Asp, Trp, Tyr, Phe, Ser, Ala, Gly или Ile], варьирующие в комбинации из 1-5 остатков, и Ad представляют собой природные или синтетические L-аминокислоты без ограничения в количестве, X1 и X2 представляют собой природные или синтетические L-аминокислоты с боковыми цепями, ковалентно присоединенными с образованием внутреннего цикла с использованием любой химической реакции для прямого связывания или с использованием связывающего соединения в качестве мостика.
Соединения, принадлежащие к структурным классам, продемонстрированы в следующем списке:
Где подчеркнутые аминокислоты являются связанными боковыми цепями.
Вышеуказанные молекулы были описаны для определения функции с помощью всестороннего молекулярного моделирования рецептора грелина человека с использованием объединенных методов гомологичного моделирования, молекулярных динамик и методов всестороннего конформационного поиска.
После того как был смоделирован рецептор, были построены модели связывания на основе моделирования грелина и других стимуляторов секреции, на основе взаимодействий рецептора-лиганда была построена виртуальная библиотека, содержащая несколько тысяч структур, обладающих такими характеристиками для осуществления конформационного анализа, и был осуществлен глобальный докинг-эксперимент против модели рецептора.
На основе этого анализа был выбран ряд соединений, представляющих некоторые структурные семейства, которые были химически синтезированы и тестированы с помощью некоторых in vivo и in vitro систем, после проведения биологических анализов соединения реоптимизировали и генерировали новые библиотеки, после чего повторяли структурный анализ для поиска большего воздействия на биологические системы, обладающие более специфичными структурными закономерностями.
Изобретение также включает любой гомологичный вариант вышеуказанных соединений. Под термином «гомологичный вариант» следует понимать любую молекулу химической природы с подобием 70% или более аминокислотной последовательности с теми последовательностями, что описаны в этом изобретении (страница 21), включая синтетические аминокислоты со структурой, которая дает возможность осуществления того же эффекта, что и у описанных здесь соединений.
В другом предпочтительном варианте осуществления изобретения фармацевтическая композиция содержит одно или более из описанных соединений или их разрешенных солей вместе с приемлемыми добавками или носителями для целей применения. Также частью настоящего изобретения является применение соединений для производства лекарственных средств, пищевых добавок или других составов для применения у человека или животного в виде аквакультуры или других активностей, используемых для разведения или других нужд животных, in vivo, in vitro, для применения в приспособлениях, ассоциированных с телом, или в приспособлениях для контролируемого высвобождения в среду, ассоциированных с ролью, подобной роли других GHS, непосредственно связанных или нет с их ролью в эндокринной системе.
Молекулы, описанные здесь, были определены по способности к взаимодействию с рецептором грелина человека, но нельзя исключать других белков, не имеющих подобной структуры аминокислотной последовательности, но имеющих способность связываться с этим типом соединений и влиять любым способом на их биологическую роль путем активации, стимуляции, репрессии, конкурирования или синергизма с другими субстратами или с помощью любого механизма, описанного или нет, но экспериментально подтвержденного.
Для определения химических соединений, описанных в изобретении, было осуществлено молекулярное моделирование рецептора грелина человека с использованием объединенных методов гомологичного моделирования, молекулярных динамик и методов всестороннего конформационного поиска. После того как был смоделирован рецептор, были построены модели связывания на основе моделирования грелина и других стимуляторов секреции, на основе взаимодействий рецептора-лиганда была построена виртуальная библиотека, содержащая несколько тысяч структур, обладающих такими характеристиками для осуществления конформационного анализа, и был осуществлен глобальный докинг-эксперимент против модели рецептора.
На основе этого анализа был выбран ряд соединений, представляющих некоторые структурные семейства, которые были химически синтезированы и тестированы с помощью некоторых in vivo и in vitro систем, после проведения биологических анализов соединения реоптимизировали и генерировали новые библиотеки, после чего повторяли структурный анализ с другим раундом молекулярного докинга с рецептором для выделения структурных закономерностей, химическую природу соединений второго раунда оптимизировали для достижения более высоких значений величин рассчитанной энергии связывания, находящихся в пределе между -58 и -32 кДж/моль, и анализировали снова для поиска соединений с большим воздействием на биологические системы и имеющих более специфичные структурные взаимодействия. В результате репрезентативной селекции синтезировали 18 таких соединений с энергией связывания лучше, чем -40 кДж/моль, очищали с использованием Жидкостной Хроматографии с Высоким Разрешением, анализировали с помощью Масс-спектрометрии и оценивали in vivo и in vitro эффективность.
Описание фигур
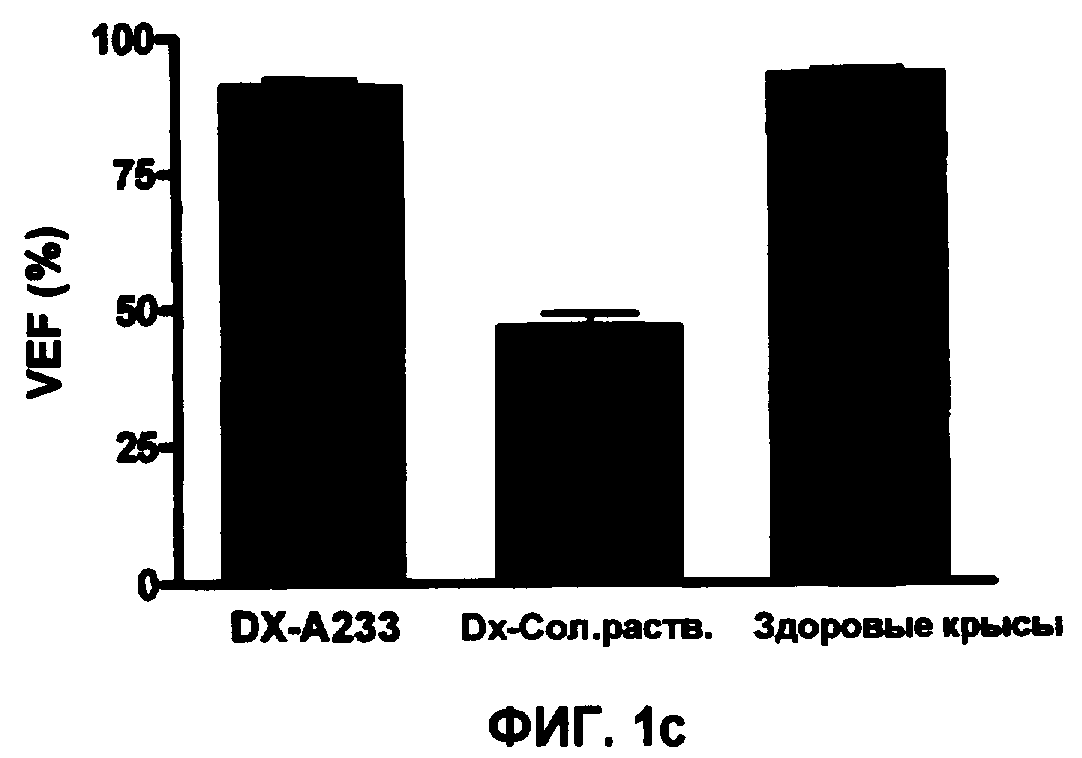
Фиг.1 - Эффекты обработки соединениями А221(а), А228(b) и A223(c) в предотвращении повреждения миокарда, индуцированного Доксорубицином (Dx).
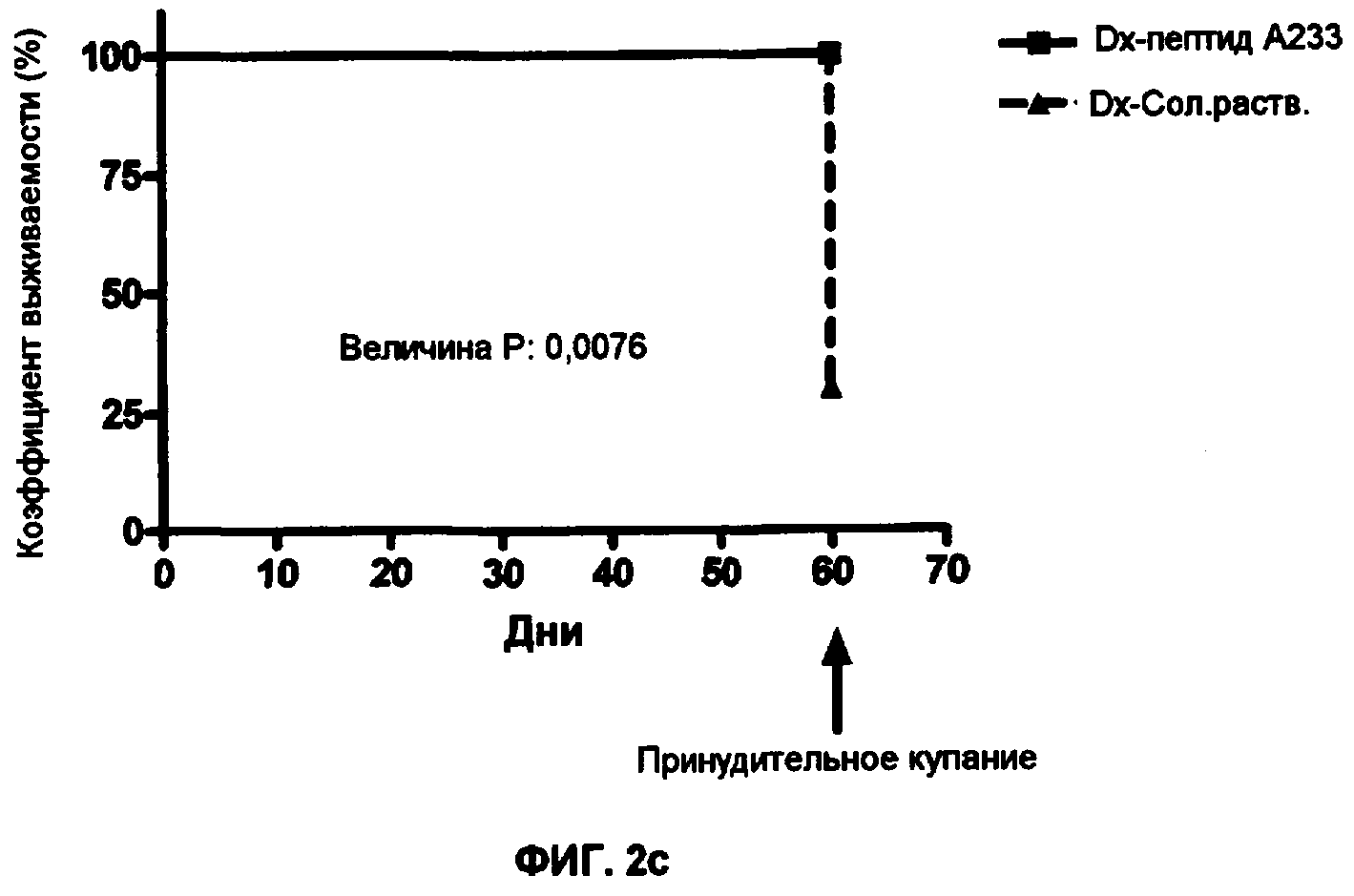
Фиг.2 - Протективный эффект соединений А221(а), А228(b) и A223(c) на вызванный стресс крыс, обработанных с помощью Dx.
Фиг.3 - Эффекты обработки соединениями А221(а), А228(b) и A223(c) в течение времени, и реверсия индуцированной Доксорубицином обширной кардиомиопатии у обработанных групп с дозами, которые находятся в пределе от 100 до 500 мкг/кг веса животного.
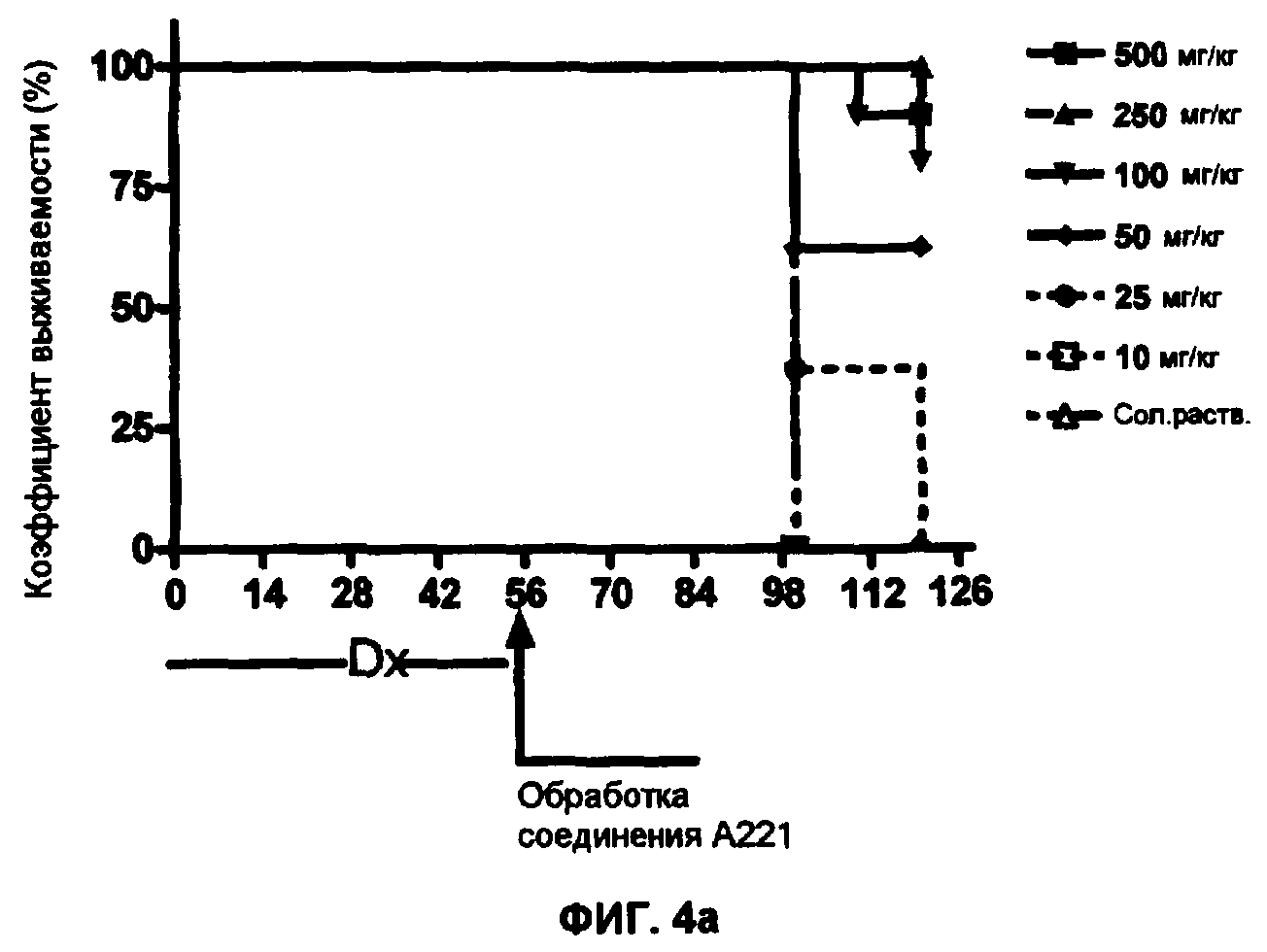
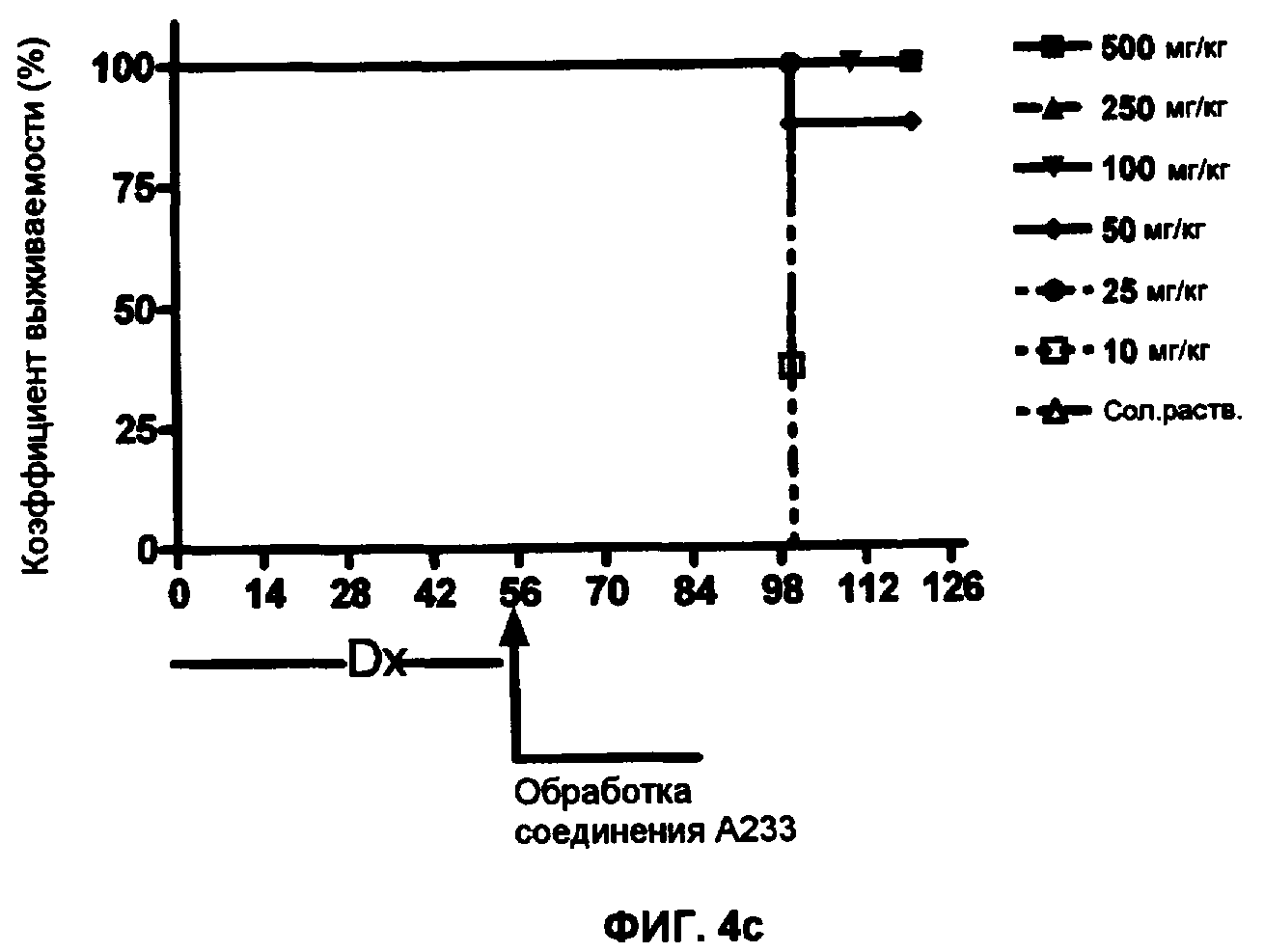
Фиг.4 - Эффекты обработки соединениями А221(а), А228(b) и A223(c) на выживаемость животных с индуцированной доксорубицином (Dx) обширной кардиомиопатии.
ПРИМЕРЫ
Настоящее изобретение объясняется в следующих примерах.
Пример 1
Селекция соединений с помощью in silico молекулярного моделирования
Соединения, полученные во втором цикле компьютерной оценки, как описано выше, были оптимизированы для получения лучших значений величины энергии связывания и более специфичных закономерностей при связывании рецептора, было выбрано 18 репрезентативных соединений с энергиями лучше, чем -40 кДж/моль, как продемонстрировано в таблице 1.
Пример 2
Предотвращение смерти клеток PC12, индуцированной удалением NGF
Клетки РС12 культивировали в 75 см2- культуральных флаконах в среде DMEM, содержащей 5% бычью фетальную сыворотку и 10% сыворотку лошади с 50 мкг/мл гентамицина. Клетки инкубировали при 37ºС в присутствии 5% СО2. Для индукции дифференцировки клетки переносили в покрытые полилизином 96-луночные платы с плотностью 1×104, инкубировали в среде DMEM с добавлением NGF в течение 7 дней с заменой среды каждые 2-3 дня. После дифференцировки клетки инкубировали соединениями, представляющими собой пептидные аналоги GHS, в различных концентрациях в течение 72 часов. Выживаемость и пролиферацию клеток определяли с использованием анализа нерадиоактивной цитотоксичности и пролиферации от Promega-Cell Titer 96 на основе превращения 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразол бромида (МТТ) в спектрофотометрически детектируемый продукт. После удаления NGF удаляли среду и добавляли 15 мкл растворенного в DMEM красителя, после инкубации при 37ºС в течение 4 часов добавляли 100 мкл стоп-раствора и измеряли поглощение при 570 нм.
Соединения продемонстрировали зависимый от концентрации эффект нейропротекции, IC50 для каждого из соединений показан в таблице 2.
Пример 3
Предотвращение индуцированного повреждения нейронов путем добавления пероксида водорода к первичной культуре нейронов
Первичные культуры зернистых клеток мозжечка были получены от крыс Wistar возрастом 7-9 дней. После быстрого препарирования мозжечки крыс опускали в холодный раствор и удаляли менингеальные мембраны, каждый орган переносили 2-3 мл раствора свежеприготовленной среды и, наконец, разрезали на части. Клетки диссоциировали с использованием пипетку Пастера и фильтровали сквозь нейлоновую мембрану 40 mu.M (Falcon, Franclin Lakes, N.J.). Количество выживших клеток определяли с помощью подсчета клеток в гемацитометре с использованием трипанового синего в качестве маркера. Клетки культивировали в 96-луночных платах, покрытых полилизином, с плотностью 6250 клеток в объеме конечном 200 мл. Культуры поддерживали при 37ºС в 5% СО2, через 24 часа добавляли 10 мкл цитозин арабинофуранозы (AraC; Sigma) для ингибирования пролиферации клеток, отличных от нейронов.
Способность предотвращения повреждения нейронов тестировали с добавлением 500 мкМ пероксида водорода в различные концентрации соединений, представляющих собой пептидные аналоги GHS. Выживаемость клеток определяли с использованием анализа нерадиоактивной цитотоксичности и пролиферации - Cell Titer 96 (Promega).
Соединения продемонстрировали зависимый от концентрации эффект нейропротекции, IC50 для каждого из соединений показан в таблица 3.
Пример 4
Демонстрация биологической активности соединений, представляющих собой пептидные аналоги GHS, у рыбы
Уровень мРНК IGF-1 определяли в печени внутрибрюшинно инъецированных тилапий, наблюдая также изменение уровня GH с течением времени, демонстрируя что соединения, представляющих собой пептидные аналоги GHS, способны стимулировать у рыбы уровень GH в кровотоке и повышать уровень мРНК IGF-1 после инъекции соединений, как продемонстрировано в таблице 4.
Пример 5
Эксперимент на мальках тилапии, обработанных с помощью соединений, представляющих собой пептидные аналоги GHS:
5.1 Ускорение роста тилапий, подвергнутых внутрибрюшинной (ip) обработке с помощью соединений, представляющих собой пептидные аналоги GHS.
Соединения растворяли в растворе натрий-фосфатного буфера (PBS) и проводили инъекции дважды в неделю в течение трех недель в концентрации 0,1 мкг/г сырого веса рыбы (gbw). Соединения применяли индивидуально к группе из 10 самцов тилапий со средним весом 60,41±10,36 г, и контрольная группа со средним весом 60,58±19,67 г получала только раствор PBS в качестве контроля, с измерением среднего веса каждую неделю, всех животных в эксперименте метили с помощью микрочипов (Stoelting Co. Wood Dale, USA) для удобства идентификации. Увеличение веса получали у группы, подвергнутой обработке с превышением 165% относительно контрольной группы, как продемонстрировано в таблице 5.
В том же эксперименте исследовали присутствие моногенных Trichodinics и Гельминтов у животных, используемых в анализе для сравнения и наблюдения за распространением инвазии патогенных агентов в группе, подвергнутой обработке.
Таблица 6 демонстрирует сравнение с животными, не подвергнутыми обработке, которое показывает в среднем шесть пересечений.
5.2 Стимуляция роста личинок тилапии (Oreochromis sp) с помощью иммерсионных ванн с применением соединений, представляющих собой пептидные аналоги GHS.
Эксперименты стимуляции роста личинок тилапии (Oreochromis sp) осуществляли, дважды в неделю оценивая группы из 100 личинок со средним весом 0,0 г, с использованием соединений, представляющих собой пептидные аналоги GHS, в концентрации 100 мкг/Л, и используя время иммерсионной ванны, равное 1 часу. После трехнедельного курса получили наивысшую стимуляцию роста, составившую 155% от среднего веса по отношению к контрольной группе, которая получала иммерсионные ванны из раствора PBS, как продемонстрировано в таблице 7.
Во время этого эксперимента также наблюдали за уровнем лизоцима, и увеличение уровня этого маркера иммунитета было получено у животных, подвергнутых обработке, как продемонстрировано в таблице 8.
Пример 6
Рост креветок v Litopenaeus vanamei путем погружения в раствор соединений, представляющих собой пептидные аналоги GHS
Личинки креветок были подвергнуты четырем погружениям в течение одного часа каждые три дня с различными соединениями, представляющими собой пептидные аналоги GHS в концентрации 0,1 г/Л. Контрольная группа была подвергнута погружениям с той же частотой в 1 мг/Л BSA.
В результате наблюдалось, что у группы, подвергнутой обработке, качество личинок улучшилось с прибавлением 120-150% по весу и 10-25% по размеру, как продемонстрировано в таблице 9, показывающей также большее количество женских особей и ростральных модификаций. Кроме того, было обнаружено, что вообще в группе, подвергнутой обработке, животные имели меньшее содержание мышечной воды и имели лучшие величины соотношений РНК/ДНК, белок/ДНК, демонстрирующие большую активацию метаболизма в личинках, подвергнутых обработке.
Эксперимент также осуществляли в условиях продуцирования для соединений А221, А228 и А233 с превышением на 20% выживаемости по сравнению с контролями, с поддержанием стимуляции веса на 110% и размера на 30%, демонстрируя у животных, подвергнутых обработке, лучшую гомогенность при распределении размера с коэффициентом вариации только 30% и 8% по весу и размеру, соответственно, в отличие от группы, не подвергнутой обработке, где эти коэффициенты составили 77% и 30%.
Пример 7
Стимуляция роста креветок с помощью пищевых добавок, содержащих соединения, представляющие собой пептидные аналоги GHS
Соединения, представляющие собой пептидные аналоги GHS, были включены в количестве 1% в диету ракообразных в пост-личиночной фазе. Litopenaeus vanamei в пост-личиночной фазе кормили с помощью вышеуказанной диеты параллельно с контрольной группой, получающей добавку в виде 1% BSA. Эффект измеряли с помощью оптического микрометра и взвешивали животных с точностью до 0,1 мг.
При добавлении соединения получали увеличение размера на 30-40% по сравнению с контрольной группой, как продемонстрировано в таблице 10.
7.1 Инкапсуляция Artemia salina
Соединения, представляющие собой пептидные аналоги GHS, были биоинкапсулированы в Artemia, чтобы служить кормом для Litopenaeus vanamei в пост-личиночной фазе. Для инкапсуляции соединения добавляли в концентрации 10 mh/L в течение часа, собирали и промывали. Животных кормили четыре раза в день в течение одного месяца, в то время как контрольная группа получала корм с BSA, инкапсулированном в Artemia. Эффект измеряли с помощью оптического микрометра и взвешивали животных с точностью до 0,1 мг. Инкапсулированные соединения способствовали увеличению роста животных на 30-40% по отношению к контрольной группе с достаточно значительным различием (р<0,001), как продемонстрировано в таблице 11.
Пример 8
Кардиопротективный эффект у крыс, подвергнутых обработке с помощью соединений, представляющих собой пептидные аналоги GHS
Для воспроизведения физиопатогенных эффектов Обширной Кардиомиопатии (DCM) самки крыс Wistar весом 160 г были подвергнуты обработке с помощью 2 мкг/кг Доксорубицина (Dx) в течение 8 недель. Группа этих крыс также параллельно была подвергнута обработке с соединениями А221, А228 или А233 внутрибрюшинно в концентрации 500 мкг/кг в течение 8 недель Dx-обработки, другая группа, подвергнутая обработке с Dx, также получала солевой раствор в качестве плацебо, и в качестве контроля эксперимента использовали другую группу здоровых крыс Wistar того же возраста, которых не подвергали обработке. Через 8 недель обработки всех крыс тестировали с помощью эхокардиограммы для тестирования желудочковой функциональности и оценки желудочковой фракции выброса (VEF). Как видно из фиг.1, крысы, получающие параллельно с Dx соединения А221(1а), А228(1b) или A233(1c) имели слегка модифицированные VEF по отношению к контрольным здоровым крысам, напротив, группа, получающая плацебо, страдала падением VEF, крысы были подвергнуты купанию в воде с температурой 4ºС в течение 30 минут, как продемонстрировано на фиг.2, животные, подвергнутые обработке Dx с соединениями А221(2а), А228(21b) или A233(2c) имели 100% выживаемости, а животные, подвергнутые обработке Dx с солевым раствором, имели 45% выживаемости (р=0,0043).
Результаты предполагают, что защита с помощью соединений А221, А228 и А233 не только поддерживает VEF, но также осуществляет сопротивление сердца к вызванному стрессу.
Пример 9
Кардиопротективный эффект и реверсия Обширной Кардиомиопатии (DCM) у крыс с помощью соединений, представляющих собой пептидные аналоги GHS
Для оценки того, существует ли какой-либо дозо-респонсивный эффект и реверсия DCM, крысы Wistar были подвергнуты обработке с помощью 2 мг/кг Доксорубицина (Dx) в течение 8 недель, после обработки выбирали всех крыс с падением VEF выше, чем 40%, разделяли на группы из n=8 и подвергали обработке с различными дозами соединений А221, А228 и А233, как следует далее:
500 мкг/кг
250 мкг/кг
100 мкг/кг
50 мкг/кг
25 мкг/кг
10 мкг/кг
Солевой раствор
Уточнение групп на основе доз А221
Как продемонстрировано на фиг.3, через две недели после обработки с соединениями А221 (3а), А228 (3b) или А233 (3с) происходила частичная реверсия DCM в пределе концентраций соединений 50-500 мкг/кг, но через 4 недели обработки реверсия DCM завершалась в группах, получающих соединения А221, А228 или А233 пределе концентраций соединений 100-500 мкг/кг, дозировка 50 мкг/мл оказалась неэффективной для общего восстановления VEF, но так или иначе эффективной для уменьшения смертности в группе по отношению к животным, получающим плацебо или по отношению к группам, подвергнутым обработкам с соединениями с меньшими концентрациями, при которых не восстанавливается VEF, и при которых животные выживают меньшее количество дней после окончания обработки (Фиг.4, а А221, b А228 и с А233).
Пример 10
Стимуляция роста у цыплят, обработанных соединениями - пептидными аналогами GHS, вводимыми подкожно
Соединения разводили в PBS и инъецировали дважды в неделю, в течение трех недель, при концентрации 0,1 мкг/г веса тела. Соединения вводили отдельно группе из 10 цыплят мужского пола со средним весом 191,20±2,2 г. Контрольной группе, состоящей из 10 цыплят мужского пола со средним весом 192,17±1,8 г, вводили только один PBS. Средний вес измеряли каждую неделю. Всех животных в эксперименте маркировали микрочипами (Stoelting Co. Wood Dale, USA). Как можно видеть в Таблице 12 ниже, повышение веса (максимально до 170%) наблюдали у цыплят, которым вводили соединения по изобретению, в отличие от цыплят, которым вводили только PBS.
Пример 11
Композиции
Фармацевтические композиции:
Были получены стабильные, лиофилизированные композиции, имеющие, по меньшей мере, 95% чистоту пептидов. Композиции содержат пептиды, описанные в настоящем изобретении и буферную систему для поддержания рН в диапазоне 4,0-7,4, на основе фосфата, ацетата, цитрата, цитрата-фосфата или сукцината с ионной силой от 0,1 до 100 мМ. Вспомогательные вещества, используемые для поддержания тоничности, включают солевой раствор, глицерин, маннит, декстрозу и трегалозу. Препарат включает в качестве хелатообразующего агента эффективное количество EDTA в диапазоне концентраций от 0,1 до 10 мг/мл, и также некоторое количество сахара, сахарного спирта, неионного детергента или аминокислоты, или их смеси для придания устойчивости пептидам от потери чистоты и биодоступности. Такими вспомогательными веществами могут быть сахароза, лактоза, глюкоза, фруктоза, маннит, сорбит, полисорбат 20, полисорбат 80, метионин, цистеин, аланин, глицин и гистидин при конентрации от 0,01 до 100 мг/мл. Для пептидов с большими гидрофобными группами может потребоваться использование сорастворителей. Примеры таких сорастворителей включают этанол, пропиленгликоль, полиэтиленгликоль и глицерин.
Наконец, для лиофилизированных продуктов добавляют эффективное количество наполнителя, выбранного из полиэтиленгликоля, маннита, декстрана и глицина при концентрации от 1 до 100 мг/мл. Для предупреждения адсорбции композиций на поверхности упаковочного контейнера, которая включает поверхность стеклянного или пластмассового пузырька и резиновой пробки, используют вспомогательные вещества, примеры которых включают полисорбат 20 и 80.
В этих композициях пептиды, описанные в настоящем изобретении, демонстрируют стабильность в течение, по меньшей мере, 3 месяцев как при температуре 4°С, так и при температуре 37°С, как подтверждено анализами с помощью ВЭЖХ и масс-спектрометрии.
Например, одна из таких композиций содержит:
Композиции для применения в ветеринарии;
Композиции, имеющие, по меньшей мере, 90% чистоту пептидов, могут быть получены смешением различных компонентов для того, чтобы гарантировать стабильность пептидов во время хранения композиций, и их подходящие физические свойства. Некоторые из этих компонентов служат для сохранения биологической активности пептидов в этих композициях до тех пор, пока эта композиция не будет введена животным.
Например, композиция 1 содержит:
Композиция 2 содержит:
Реферат
Изобретение относится к области биотехнологии, а именно к химическим молекулам пептидной природы для стимуляции роста и/или проявления устойчивости к заболеваниям у аквакультуры или другой животной продукции. Раскрыто применение химических молекул пептидной природы, а также описана фармацевтическая композиция для стимуляции секреции гормона роста и композиция, применяемая в ветеринарии для стимуляции роста и/или проявления устойчивости к заболеваниям у аквакультуры или другой животной продукции. Химические пептидные соединения получают способами молекулярного моделирования in silico, чья структура дает им возможность осуществлять те же функции, как у стимуляторов секреции пептида гормона роста. Предложенное изобретение позволяет получать химические соединения пептидной природы для стимуляции роста и/или проявления устойчивости к заболеваниям у аквакультуры или другой животной продукции. 5 н. и 3 з.п. ф-лы, 12 ил., 12 табл.

Комментарии