Композиция, содержащая два антитела, сконструированных так, чтобы они обладали пониженной и повышенной эффекторной функцией - RU2650788C2
Код документа: RU2650788C2
Чертежи





































































































































Описание
Область техники, к которой относится изобретение
Настоящее изобретение в целом относится к иммунотерапии. Более конкретно изобретение относится к направленным против антигенов иммуноконъюгатам и к антителам со сконструированной Fc-областью, предназначенным для совместного применения в качестве иммунотерапевтических агентов. Кроме того, изобретение относится к фармацевтическим композициям, содержащим комбинации указанных иммуноконъюгатов и антител, и к способам их применения для лечения заболевания.
Предпосылки создания изобретения
В различных клинических ситуациях часто требуется деструкция индивидуальной клетки или конкретного типа клеток. Например, основной задачей при терапии рака является специфическое разрушение опухолевых клеток с сохранением при этом в интактном и неповрежденном состоянии здоровых клеток и тканей.
Перспективным путем достижения этой цели является индукция иммунного ответа против опухоли, который принуждает иммунные эффекторные клетки, такие как естественные клетки-киллеры (NK) или цитотоксические Т-лимфоциты (CTL), атаковать и разрушать опухолевые клетки. Эффекторные клетки можно активировать с помощью различных стимулов, включая целый ряд цитокинов, которые индуцируют передачу сигналов посредством связывания с их рецепторами на поверхности иммунных клеток. Например, применение интерлейкина-2 (IL-2), который среди прочего стимулирует пролиферацию и активацию цитотоксических Т-клеток и NK-клеток, разрешено для лечения метастатической почечно-клеточной карциномы и злокачественной меланомы. Однако быстрый клиренс из крови и отсутствие специфичности в отношении опухоли обусловливают необходимость системного введения высоких доз цитокинов для достижения достаточной для активации иммунного ответа или противоопухолевого действия концентрации цитокина в области локализации опухоли. Такие высокие уровни обладающих системным действием цитокинов могут приводить к проявлению серьезной токсичности и нежелательных реакций, что имеет место также в случае IL-2. Таким образом, для применения в противораковой терапии требуется специфическое введение цитокинов в опухоль или микроокружение опухоли. Для этой цели можно конъюгировать цитокин с обеспечивающим направленный перенос фрагментом, например, антителом или фрагментом антитела, специфическим в отношении опухолевого антигена. Дополнительным преимуществом указанных иммуноконъюгатов является их удлиненное время полужизни в сыворотке по сравнению с неконъюгированным цитокином. Их способность повышать до максимума иммуностимулирующую активность в области опухоли, при этом сводя до минимума их системные побочные действия при применении в низкой дозе, делает содержащие цитокины иммуноконъюгаты оптимальными иммунотерапевтическим агентами.
Другой путь активации эффекторных клеток включает вовлечение активирующих Fc-рецепторов, которые находятся на их поверхности, с помощью Fc-фрагмента иммуноглобулинов или рекомбинантных слитых белков, содержащих Fc-область. Так называемые эффекторные функции антитела, которые опосредуются его Fc-областью, являются важным механизмом действия противораковой иммунотерапии на основе антител. Антитело-обусловленная клеточнозависимая цитотоксичность, т.е. деструкция сенсибилизированных антителом клеток-мишеней (например, опухолевых клеток) с помощью NK-клеток, запускается, когда антитело, связанное с поверхностью клетки, взаимодействует с Fc-рецепторами на NK-клетке. NK-клетки экспрессируют FcγRIIIa (CD16a), который распознает иммуноглобулины IgG1- или IgG3-подкласса. Другие эффекторные функции включают антитело-обусловленный клеточнозависмый фагоцитоз (ADCP) и комплементзависимую цитотоксичность (CDC), а варьируют в зависимости от класса и подкласса антитела, поскольку различные типы иммунных клеток несут различные группы Fc-рецепторов, которые распознают различные типы и подтипы константных доменов тяжелых цепей иммуноглобулинов (например, константные домены тяжелых цепей α, δ, γ, ε или μ, соответствующие IgA-, IgD-, IgE-, IgG- или IgM-классу антител соответственно). Для повышения эффекторных функций антител применяли различные стратегии. Например, у Shields и др., J Biol Chem 9(2), 2001, сс. 6591-6604 продемонстрировано, что аминокислотные замены в положениях 298, 333 и/или 334 Fc-области (EU-нумерация остатков) повышает связывание антител с FcγIIIa-рецептором и ADCC. Другие варианты антител, имеющие аминокислотные модификации в Fc-области и обладающие повышенной способностью связываться с Fc-рецептором и эффекторной функцией, описаны например, в US №6737056, WO 2004/063351 и WO 2004/099249. Альтернативно этому, для достижения повышенной способности связываться с Fc-рецептором и эффекторной функции можно изменять гликозилирование антитела. Антитела IgG1-типа, которые представляют собой антитела, наиболее часто применяемые для противораковой иммунотерапии, имеют консервативный N-связанный сайт гликозилирования на Asn 297 в каждом СН2-домене Fc-области. Два комплексных биантенных олигосахарида, присоединенных к Asn 297, «спрятаны» между СН2-доменами, образуя обширные контакты с полипептидным каркасом, и их присутствие имеет решающее значение для антитела касательно эффекторных функций, включая антитело-обусловленную клеточнозависимую цитотоксичность (ADCC) (Lifely и др., Glycobiology 5, 1995, сс. 813-822; Jefferis и др., Immunol Rev 163, 1998, сс. 59-76; Wright и Morrison, Trends Biotechnol 15, 1997, сс. 26-32). В опытах по конструированию белков установлено, что FcγR взаимодействует с нижней шарнирной областью СН2-домена IgG (Lund и др., J Immunol 157, 1996, сс. 4963-4969)). Однако для связывания FcγR требуется также присутствие олигосахаридов в СН2-области (Lund и др., J Immunol 157, 1996, сс. 4963-4969; Wright и Morrison, Trends Biotech 15, 1997, сс. 26-31), это позволяет предположить, что либо олигосахарид и полипептид оба непосредственно входят в сайт взаимодействия, либо олигосахарид требуется для поддержания активной конформации полипептида СН2. Таким образом, модификацию олигосахаридной структуры можно использовать в качестве средств повышения аффинности взаимодействия между IgG1 и FcγR и для повышения ADCC-активности антитела IgG1-подтипа. У Umaña и др., Nat Biotechnol 17, 1999, сс. 176-180 и в US №6602684 (WO 99/54342) (содержание которых полностью включено в настоящее описании в качестве ссылок) продемонстрировано, что сверхэкспрессия β(1,4)-N-ацетилглюкозаминилтрансферазы III (GnTIII), т.е. гликозилтрансферазы, которая катализирует образование бисекционных олигосахаридов в клетках яичника китайского хомячка (СНО), существенно повышает in vitro ADCC-активность антител, продуцируемых в этих клетках. Сверхэкспрессия GnTIII в клеточных линиях-продуцентах приводит к получению антител, обогащенных бисекционными олигосахаридами, которые, как правило, являются также нефукозилированными и относятся к гибридному типу. Если помимо GnTIII в клеточных линиях-продуцентах имеет место сверхэкспрессия маннозидазы II (ManII), то получают антитела, обогащенные бисекционными нефукозилированными олигосахаридами комплексного типа (Ferrara и др., Biotechn Bioeng 93, 2006, сс. 851-861). Для обоих типов антител характерна значительно повышенная ADCC по сравнению с антителами и немодифицированными гликанами, но только антитела, в которых большинство N-гликанов относятся к комплексному типу, обладают способностью индуцировать значительную комплементзависимую цитотоксичность (Ferrara и др., Biotechn Bioeng 93, 2006, сс. 851-861). Имеющим решающим значение фактором для повышения ADCC-активности, по-видимому, является элиминация фукозы из наиболее глубоко лежащего N-ацетилглюкозаминного остатка олигосахаридного ядра, что повышает связывание Fc-домена IgG с FcγRIIIa (Shinkawa и др., J Biol Chem 278, 2003, сс. 3466-3473). Другие методы получения антител со сниженным фукозилированием включают, например, экспрессию в клетках-хозяевах с дефицитом α(1,6)-фукозилтрансферазы (Yamane-Ohnuki и др., Biotech Bioeng 87, 2004, сс. 614-622; Niwa и др., J Immunol Methods 306, 2006, сс. 151-160).
Несмотря на успехи, достигнутые в области противораковой терапии благодаря применению свободных цитокинов, в области противораковой терапии существует постоянная необходимость в иммуноконъюгатах или сконструированных антителах в качестве новых эффективных и безопасных путей лечения.
Краткое изложение сущности изобретения
При создании настоящего изобретения было обнаружено, что комбинация этих двух стратегий, т.е. одновременная стимуляция эффекторных клеток содержащими цитокины иммуноконъюгатами и антителами, сконструированными таким образом, чтобы они обладали повышенными эффекторными функциями, значительно повышает эффективность противораковой иммунотерапии.
Таким образом, в настоящем изобретении предложена комбинация (а) иммуноконъюгата, который содержит первое антитело, сконструированное таким образом, чтобы оно обладало пониженной эффекторной функцией, и эффекторный фрагмент, и (б) второе антитело, сконструированное таким образом, чтобы оно обладало повышенной эффекторной функцией, для применения при лечении заболевания у индивидуума, который нуждается в этом. В одном из вариантов осуществления изобретения цитокин выбирают из группы, состоящей из IL-2, GM-CSF, IFN-α и IL-12. В конкретном варианте осуществления изобретения эффекторный фрагмент представляет собой IL-2. В другом варианте осуществления изобретения эффекторный фрагмент представляет собой IL-12. В другом конкретном варианте осуществления изобретения эффекторный фрагмент IL-2 представляет собой мутантный эффекторный фрагмент IL-2, который содержит по меньшей мере одну аминокислотную мутацию, прежде всего аминокислотную замену, которая снижает или элиминирует аффинность мутантного эффекторного фрагмента IL-2 к α-субъединице рецептора IL-2, но сохраняет аффинность мутантного эффекторного фрагмента IL-2 к рецептору IL-2 с промежуточной аффинностью по сравнению с немутантным эффекторным фрагментом IL-2. В конкретном варианте осуществления изобретения мутантный эффекторный фрагмент IL-2 содержит одну, две или три аминокислотные замены в одном, двух или трех положении(ях), выбранном(ых) из положений, которые соответствуют остатку 42, 45 и 72 человеческого IL-2 (SEQ ID NO: 1). В более конкретном варианте осуществления изобретения мутантный эффекторный фрагмент IL-2 содержит три аминокислотные замены, в положениях, которые соответствуют остатку 42, 45 и 72 человеческого IL-2. В еще более конкретном варианте осуществления изобретения мутантный эффекторный фрагмент IL-2 представляет собой человеческий IL-2, содержащий аминокислотные замены F42A, Y45A и L72G. В некоторых вариантах осуществления изобретения мутантный эффекторный фрагмент IL-2 дополнительно содержит аминокислотную мутацию в положении, соответствующем положению 3 человеческого IL-2, которая элиминирует сайт O-гликозилирования IL-2. В конкретном варианте осуществления изобретения мутантный эффекторный фрагмент IL-2 содержит аминокислотную последовательность SEQ ID NO: 2. В одном из вариантов осуществления изобретения эффекторный фрагмент представляет собой одноцепочечный эффекторный фрагмент.
В одном из вариантов осуществления изобретения первое антитело представляет собой полноразмерное антитело IgG-класса, прежде всего полноразмерное антитело IgG1-подкласса. В одном из вариантов осуществления изобретения эффекторный фрагмент объединен амино- или карбоксиконцевой пептидной связью с первым антителом. В одном из вариантов осуществления изобретения эффекторный фрагмент объединен аминоконцевой пептидной связью с первым антителом. В одном из вариантов осуществления изобретения эффекторный фрагмент слит на его N-конце с С-концом одной из тяжелых цепей первого антитела. В конкретном варианте осуществления изобретения иммуноконъюгат содержит не более одного эффекторного фрагмента. В одном из вариантов осуществления изобретения иммуноконъюгат практически состоит из эффекторного фрагмента и первого антитела, которые сцеплены с помощью одной или нескольких пептидных связей. В конкретном варианте осуществления изобретения иммуноконъюгат содержит эффекторный фрагмент, прежде всего одноцепочечный эффекторный фрагмент, и первое антитело, прежде всего полноразмерное антитело IgG-класса, в котором эффекторный фрагмент слит на его аминоконцеовой аминокислоте с карбоксиконцом одной из тяжелых цепей первого антитела, необязательно через пептидный линкер. В некоторых вариантах осуществления изобретения первое антитело содержит в Fc-области модификацию, усиливающую гетеродимеризацию двух неидентичных тяжелых цепей иммуноглобулина. В конкретном варианте осуществления изобретения указанная модификация представляет собой модификацию типа «knob-in-hole» (обеспечение взаимодействия по типу «выступ-во впадину»), которая включает модификацию, приводящую к образованию «выступа» в одной из тяжелых цепей иммуноглобулина, и модификацию, приводящую к образованию «впадины» в другой одной из двух тяжелых цепей иммуноглобулина. В одном из вариантов осуществления изобретения первое антитело содержит модификацию в поверхности раздела между двумя тяжелыми цепями иммуноглобулина в СН3-домене, при этом, I) в СН3-домене одной тяжелой цепи аминокислотный остаток заменяют на аминокислотной остаток, имеющий больший объем боковой цепи, создавая тем самым выпуклость («выступ») на поверхности раздела СН3-домена одной тяжелой цепи, которая может помещаться в полость «впадина» в поверхности раздела СН3-домена другой тяжелой цепи, и II) в СН3-домене другой тяжелой цепи аминокислотный остаток заменяют на аминокислотный остаток, имеющий меньший объем боковой цепи, создавая тем самым полость («впадину») в поверхности раздела второго СН3-домена, в которую может помещаться выпуклость («выступ») на поверхности раздела первого СН3-домена. В одном из вариантов осуществления изобретения первое антитело содержит аминокислотную замену T366W и необязательно аминокислотную замену S354C в одной из тяжелых цепей иммуноглобулина, и аминокислотные замены T366S, L368A, Y407V и необязательно Y349C в другой одной тяжелой цепи иммуноглобулина. В конкретном варианте осуществления изобретения эффекторный фрагмент слит с амино- или карбоксиконцевой аминокислотой тяжелой цепи иммуноглобулина, которая содержит модификацию, приводящую к образованию «выступа».
В одном из вариантов осуществления изобретения пониженную эффекторную функцию первого антитела выбирают из группы, включающей пониженную способность связываться с активирующим Fc-рецептором, пониженную ADCC, пониженный ADCP, пониженную CDC и пониженную секрецию цитокинов. В одном из вариантов осуществления изобретения пониженная эффекторная функция представляет собой пониженную способность связываться с активирующим Fc-рецептором. В одном из вариантов осуществления изобретения активирующий Fc-рецептор представляет собой человеческий рецептор. В одном из вариантов осуществления изобретения активирующий Fc-рецептор представляет собой Fcγ-рецептор. В конкретном варианте осуществления изобретения активирующий Fc-рецептор выбирают из группы, включающей FcγRIIIa, FcγRI и FcRγIIa. В одном из вариантов осуществления изобретения активирующий Fc-рецептор представляет собой FcγRIIIa, прежде всего человеческий FcγRIIIa. В одном из вариантов осуществления изобретения пониженная эффекторная функция представляет собой пониженную ADCC. В одном из вариантов осуществления изобретения пониженная эффекторная функция представляет собой пониженную способность связываться с активирующим Fc-рецептором и пониженную ADCC.
В одном из вариантов осуществления изобретения первое антитело конструируют путем интродукции одной или нескольких аминокислотных мутаций в Fc-область. В конкретном варианте осуществления изобретения аминокислотные мутации представляют собой аминокислотные замены. В конкретном варианте осуществления изобретения первое антитело, прежде всего человеческое полноразмерное антитело IgG1-подкласса, содержит аминокислотную замену в положении Р329 тяжелых цепей иммуноглобулина (EU нумерация). В более конкретном варианте осуществления изобретения аминокислотная замена представляет собой Р329А или P329G, прежде всего P329G. В одном из вариантов осуществления изобретения антитело содержит дополнительную аминокислотную замену в положении, выбранном из S228,
Е233, L234, L235, N297 и Р331 тяжелых цепей иммуноглобулина. В более конкретном варианте осуществления изобретения дополнительная аминокислотная замена представляет собой S228P, Е233Р, L234A, L235A, L235E, N297A, N297D или P331S. В конкретном варианте осуществления изобретения антитело содержит аминокислотные замены в положениях Р329, L234 и L235 тяжелых цепей иммуноглобулина (EU нумерация). В более конкретном варианте осуществления изобретения антитело содержит аминокислотные замены L234A, L235A и P329G (LALA P329G) в тяжелых цепях иммуноглобулина.
В некоторых вариантах осуществления изобретения первое антитело направлено против антигена, присутствующего на опухолевой клетке или в окружении опухолевой клетки. В конкретном варианте осуществления изобретения первое антитело направлено против антигена, выбранного из группы, включающей фибробласт-активирующий белок (FAP), А1-домен тенасцина-С (TNC A1), А2-домен тенасцина-С (TNC А2), экстра-домен В фибронектина (EDB), карциноэмбриональный антиген (СЕА) и ассоциированный с меланомой хондроитинсульфат-протеогликан (MCSP). В конкретном варианте осуществления изобретения первое антитело направлено против СЕА. В другом конкретном варианте осуществления изобретения первое антитело направлено против FAP.
В одном из вариантов осуществления изобретения повышенную эффекторную функцию второго антитела выбирают из группы, включающей повышенную способность связываться с активирующим Fc-рецептором, повышенную ADCC, повышенный ADCP, повышенную CDC и повышенную секрецию цитокинов. В одном из вариантов осуществления изобретения повышенная эффекторная функция представляет собой повышенную способность связываться с активирующим Fc-рецептором. В конкретном варианте осуществления изобретения активирующий Fc-рецептор выбирают из группы, включающей FcγRIIIa, FcγRI и FcRγIIa. В одном из вариантов осуществления изобретения активирующий Fc-рецептор представляет собой FcγRIIIa. В одном из вариантов осуществления изобретения повышенная эффекторная функция представляет собой повышенную ADCC. В одном из вариантов осуществления изобретения повышенная эффекторная функция представляет собой повышенную способность связываться с активирующим Fc-рецептором и повышенную ADCC.
В одном из вариантов осуществления изобретения второе антитело конструируют путем интродукции одной или нескольких аминокислотных мутаций в Fc-область. В конкретном варианте осуществления изобретения аминокислотные мутации представляют собой аминокислотные замены. В одном из вариантов осуществления изобретения второе антитело конструируют путем модификации гликозилирования в Fc-области. В конкретном варианте осуществления изобретения модификация гликозилирования в Fc-области представляет собой повышенное относительное содержание нефукозилированных олигосахаридов в Fc-области по сравнению с не подвергнутым инженерии антителом. В еще более конкретном варианте осуществления изобретения повышенное относительное содержание нефукозилированных олигосахаридов в Fc-области составляет по меньшей мере 20%, предпочтительно по меньшей мере 50%, наиболее предпочтительно по меньшей мере 70% нефукозилированных олигосахаридов в Fc-области. В другом конкретном варианте осуществления изобретения модификация гликозилирования в Fc-области представляет собой повышенное относительное содержание бисекционнных олигосахаридов в Fc-области по сравнению с не подвергнутым инженерии антителом. В еще более конкретном варианте осуществления изобретения повышенное относительное содержание бисекционных олигосахаридов в Fc-области составляет по меньшей мере 20%, предпочтительно по меньшей мере 50%, наиболее предпочтительно по меньшей мере 70% бисекционных олигосахаридов в Fc-области. В еще более конкретном варианте осуществления изобретения модификация гликозилирования в Fc-области представляет собой повышенное относительное содержание бисекционных нефукозилированных олигосахаридов в Fc-области по сравнению с не подвергнутым инженерии антителом. Предпочтительно второе антитело содержит по меньшей мере примерно 25%, по меньшей мере примерно 35% или по меньшей мере примерно 50% бисекционных нефукозилированных олигосахаридов в Fc-области. В конкретном варианте осуществления изобретения второе антитело конструируют таким образом, чтобы оно имело повышенное относительное содержание нефукозилированных олигосахаридов в Fc-области по сравнению с не подвергнутым инженерии антителом. Повышенное относительное содержание нефукозилированных олигосахаридов в Fc-области антитела приводит к получению антитела, обладающего повышенной эффекторной функцией, прежде всего повышенной ADCC. В конкретном варианте осуществления изобретения нефукозилированные олигосахариды представляет собой бисекционные нефукозилированные олигосахариды.
В одном из вариантов осуществления изобретения второе антитело представляет собой полноразмерное антитело IgG-класса, прежде всего полноразмерное антитело IgG1-подкласса. В некоторых вариантах осуществления изобретения второе антитело направлено против антигена, присутствующего на опухолевой клетке. В конкретном варианте осуществления изобретения второе антитело направлено против антигена, выбранного из группы, включающей CD20, рецептор эпидермального фактора роста (EGFR), HER2, HER3, рецептор инсулиноподобного фактора роста 1 (IGF-1R), c-Met, содержащий CUB-домен белок-1 (CDCP1), карциноэмбриональный антиген (СЕА) и ассоциированный с меланомой хондроитинсульфат-протеогликан (MCSP).
В конкретном варианте осуществления изобретения второе антитело представляет собой антитело к CD20, сконструированное таким образом, чтобы оно имело повышенное относительное содержание нефукозилированных олигосахаридов в Fc-области по сравнению с не подвергнутым инженерии антителом. Пригодные антитела к CD20 описаны в WO 2005/044859, которая полностью включена в настоящее описание в качестве ссылки. В другом конкретном варианте осуществления изобретения второе антитело представляет собой антитело к EGFR, сконструированное таким образом, чтобы оно имело повышенное относительное содержание нефукозилированных олигосахаридов в Fc-области по сравнению с не подвергнутым инженерии антителом. Пригодные антитела к EGFR описаны в WO 2006/082515 и WO 2008/017963, каждая из которых полностью включена в настоящее описание в качестве ссылки. В другом конкретном варианте осуществления изобретения второе антитело представляет собой антитело к IGF-1R, сконструированное таким образом, чтобы оно имело повышенное относительное содержание нефукозилированных олигосахаридов в Fc-области по сравнению с не подвергнутым инженерии антителом. Пригодные антитела к IGF-1R описаны в WO 2008/077546, которая полностью включена в настоящее описание в качестве ссылки. В другом конкретном варианте осуществления изобретения второе антитело представляет собой антитело к СЕА, сконструированное таким образом, чтобы оно имело повышенное относительное содержание нефукозилированных олигосахаридов в Fc-области по сравнению с не подвергнутым инженерии антителом. Пригодные антитела к СЕА описаны в публикации РСТ WO 2011/023787, которая полностью включена в настоящее описание в качестве ссылки. В еще одном конкретном варианте осуществления изобретения второе антитело представляет собой антитело к HER3, сконструированное таким образом, чтобы оно имело повышенное относительное содержание нефукозилированных олигосахаридов в Fc-области по сравнению с не подвергнутым инженерии антителом. Пригодные антитела к HER3 описаны в публикации РСТ WO 2011/076683, которая полностью включена в настоящее описание в качестве ссылки. В еще одном конкретном варианте осуществления изобретения второе антитело представляет собой антитело к CDCP1, сконструированное таким образом, чтобы оно имело повышенное относительное содержание нефукозилированных олигосахаридов в Fc-области по сравнению с не подвергнутым инженерии антителом. Пригодные антитела к CDCP1 описаны в публикации РСТ WO 2011/023389, которая полностью включена в настоящее описание в качестве ссылки. В одном из вариантов осуществления изобретения второе антитело конструируют так, чтобы оно имело модифицированное гликозилирование в Fc-области по сравнению с не подвергнутым инженерии антителом, путем получения антитела в клетке-хозяине, обладающей измененной активностью одной или нескольких гликозилтрансфераз.
В одном из вариантов осуществления изобретения второе антитело конструируют таким образом, чтобы оно имело повышенное относительное содержание нефукозилированных олигосахаридов в Fc-области по сравнению с не подвергнутым инженерии антителом, путем получения антитела в клетке-хозяине, обладающей повышенной активностью β(1,4)-N-ацетилглюкозамилтрансферазы III (GnTIII). В конкретном варианте осуществления изобретения клетка-хозяин дополнительно обладает повышенной активностью α-маннозидазы II (ManII). В другом варианте осуществления изобретения второе антитело конструируют таким образом, чтобы оно имело повышенное относительное содержание нефукозилированных олигосахаридов в Fc-области по сравнению с не подвергнутым инженерии антителом, путем получения антитела в клетке-хозяине, обладающей пониженной активностью α(1,6)-фукозилтрансферазы.
В одном из вариантов осуществления изобретения заболевание представляет собой нарушение, которое можно лечить путем стимуляции функции эффекторных клеток. В одном из вариантов осуществления изобретения заболевание представляет собой нарушение пролиферации клеток. В конкретном варианте осуществления изобретения заболевание представляет собой рак. В конкретном варианте осуществления изобретения рак выбирают из группы, включающей рак легкого, колоректальный рак, рак почки, рак предстательной железы, рак молочной железы, рак головы и шеи, рак яичника, рак головного мозга, лимфому, лейкоз и рак кожи. В одном из вариантов осуществления изобретения индивидуум представляет собой млекопитающее. В конкретном варианте осуществления изобретения индивидуум представляет собой человека.
Конкретным вариантом осуществления изобретения является комбинация
(а) иммуноконъюгата, содержащего первое полноразмерное антитело IgG-класса, сконструированное таким образом, чтобы оно обладало пониженной эффекторной функцией, путем интродукции одной или нескольких аминокислотных мутаций в Fc-область, и цитокин, в котором эффекторный фрагмент слит на его аминоконцевой аминокислоте с карбоксиконцом одной из тяжелых цепей первого антитела, необязательно через пептидный линкер, и
(б) второго полноразмерного антитела IgG-класса, сконструированного таким образом, чтобы оно обладало повышенной эффекторной функцией, путем модификации гликозилирования в Fc-области, предназначенная для применения при лечении заболевания у индивидуума, который нуждается в этом. Другим объектом изобретения является фармацевтическая композиция, содержащая (а) иммуноконъюгат, который содержит первое антитело, сконструированное таким образом, чтобы оно обладало пониженной эффекторной функцией, и эффекторный фрагмент, и (б) второе антитело, сконструированное таким образом, чтобы оно обладало повышенной эффекторной функцией, в фармацевтически приемлемом носителе.
Изобретение относится также к применению (а) иммуноконъюгата, который содержит первое антитело, сконструированное таким образом, чтобы оно обладало пониженной эффекторной функцией, и эффекторный фрагмент, и (б) второго антитела, сконструированного таким образом, чтобы оно обладало повышенной эффекторной функцией, для приготовления лекарственного средства, предназначенного для лечения заболевания у индивидуума.
В изобретении предложен также способ лечения заболевания у индивидуума, заключающийся в том, что вводят индивидууму комбинацию (а) иммуноконъюгата, который содержит первое антитело, сконструированное таким образом, чтобы оно обладало пониженной эффекторной функцией, и эффекторный фрагмент, и (б) второго антитела, сконструированного таким образом, чтобы оно обладало повышенной эффекторной функцией, в терапевтически эффективном количестве.
В изобретении предложен также способ стимуляции функции эффекторных клеток у индивидуума, заключающийся в том, что вводят индивидууму комбинацию (а) иммуноконъюгата, который содержит первое антитело, сконструированное таким образом, чтобы оно обладало пониженной эффекторной функцией, и эффекторный фрагмент, и (б) второго антитела, сконструированного таким образом, чтобы оно обладало повышенной эффекторной функцией, в количестве, эффективном в отношении стимуляции функции эффекторных клеток.
Следующим объектом изобретения является набор, предназначенный для лечения заболевания, который содержит в одном и том же или в различных контейнерах (а) иммуноконъюгат, который содержит первое антитело, сконструированное таким образом, чтобы оно обладало пониженной эффекторной функцией, и эффекторный фрагмент, и (б) второе антитело, сконструированное таким образом, чтобы оно обладало повышенной эффекторной функцией, и (в) необязательно листовку-вкладыш в упаковку с напечатанными инструкциями по применению комбинированного лечения в качестве способа лечения заболевания.
Должно быть очевидно, что иммуноконъюгат и второе антитело, используемые в фармацевтической композиции, применении, способах и наборе, предлагаемых в изобретении, могут обладать любой из особенностей, индивидуально или в сочетании, описанной в предыдущих параграфах касательно вторых антител и иммуноконъюгатов, предлагаемых в изобретении.
Краткое описание чертежей
На чертежах показано:
на фиг. 1 - данные, полученные для иммуноконъюгата 28Н1 IgG-IL-2, мишенью которого является FAP (А), или не имеющего специфической мишени («ненаправленного») иммуноконъюгата DP47GS IgG-IL-2 (Б), содержащих четырехмутантный (qm) IL-2, у которого отсутствует способность связываться с CD25, и анти-EGFR GlycoMab (созданное с использованием гликоинженерии МАт), при тестировании в отношении SCID-мышей, которым инъецировали интралингвально клетки человеческой карциномы головы и шеи линии FaDu. Из представленных данных следует, что комбинация, включающая иммуноконъюгат 28Н1 IgG-IL2 qm, но не иммуноконъюгат DP47GS IgG-IL2, и анти-EGFR GlycoMab, опосредовала повышенную эффективность в понятиях удлиненной медианы выживаемости по сравнению с индивидуальным применением соответствующего иммуноконъюгата или анти-EGFR GlycoMab (см. пример 1);
на фиг. 2 - данные о полном уничтожении опухолевых клеток линии А549 с использованием РВМС (Е : Т = 10:1, 4 ч), которые предварительно обрабатывали 0,57 нМ (А) или 5,7 нМ (Б) иммуноконъюгатом 28Н1 IgG-IL2 qm, мишенью которого является FAP или IL-2 (пролейкин) или не обрабатывали указанными субстанциями, в присутствии применяемого в различных концентрациях анти-EGFR GlycoMab (см. пример 2);
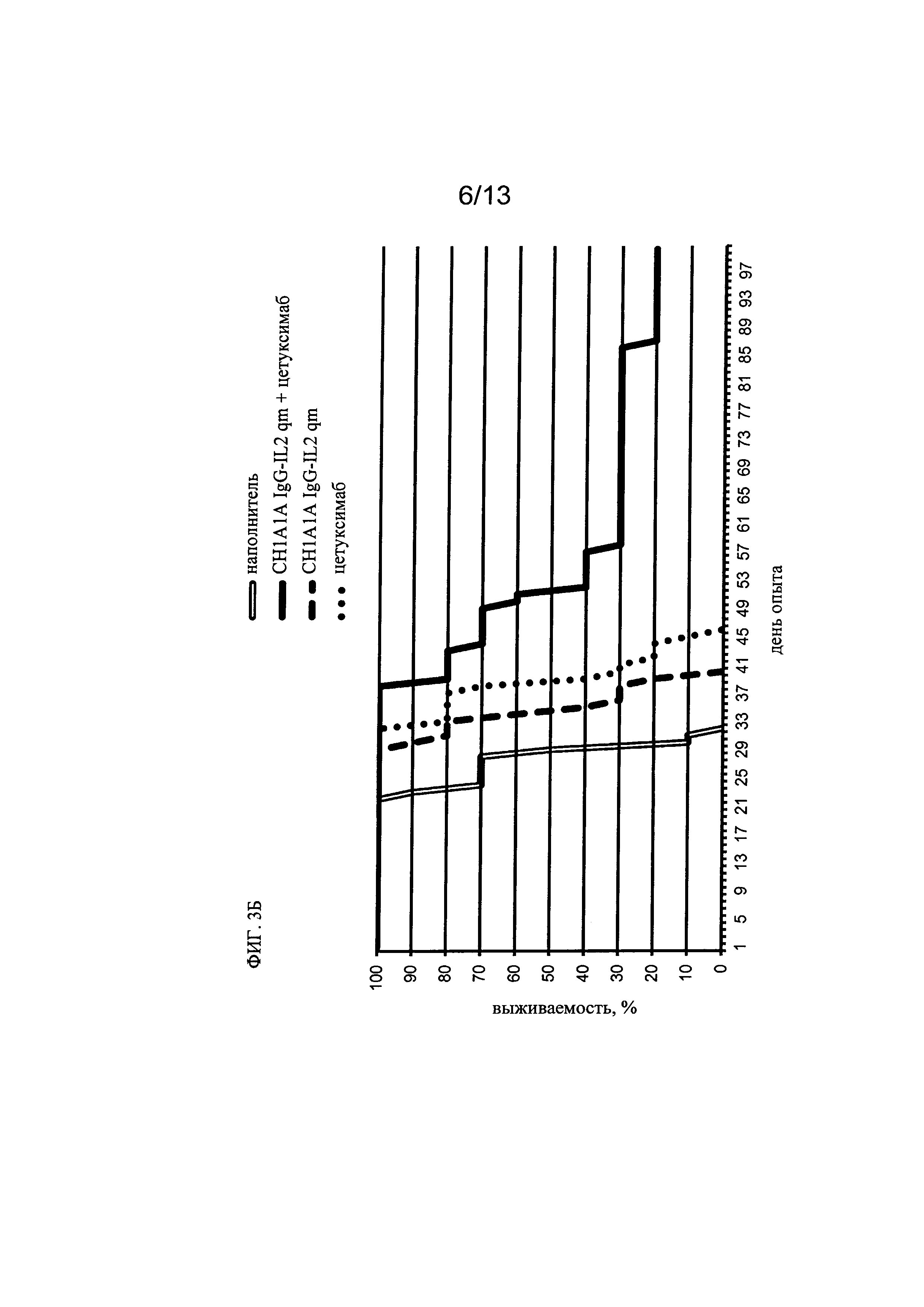
на фиг. 3 - данные, полученные для иммуноконъюгата СН1А1А IgG-IL-2, мишенью которого является СЕА, содержащего четырехмутантный (qm) IL-2, у которого отсутствует способность связываться с CD25, и анти-EGFR GlycoMab (А) или цетуксимаба (Б), при тестировании в отношении трансгенных по FcγRIII SCID-мышей, которым инъецировали внутрь селезенки клетки человеческой колоректальной карциномы линии LS174T. Из представленных данных следует, что комбинация иммуноконъюгата СН1А1А IgG-IL2 qm и анти-EGFR GlycoMab опосредовала повышенную эффективность в понятиях удлиненной медианы выживаемости и общей выживаемости по сравнению с индивидуальным применением соответствующего иммуноконъюгата, анти-EGFR GlycoMab или цетуксимаба, а также комбинации иммуноконъюгата СН1А1А IgG-IL2 qm и цетуксимаба (см. пример 3);
на фиг. 4 - данные, полученные для иммуноконъюгата СН1А1А IgG-IL-2, мишенью которого является СЕА, содержащего четырехмутантный (qm) IL-2, у которого отсутствует способность связываться с CD25, и анти-EGFR GlycoMab (А) или цетуксимаба (Б), при тестировании в отношении трансгенных по FcγRIII SCID-мышей, которым инъецировали внутривенно клетки человеческой карциномы легкого линии А549. Из представленных данных следует, что комбинация иммуноконъюгата СН1А1А IgG-IL2 qm и анти-EGFR GlycoMab опосредовала повышенную эффективность в понятиях удлиненной медианы выживаемости и общей выживаемости по сравнению с индивидуальным применением соответствующего иммуноконъюгата или анти-EGFR GlycoMab, a также комбинации иммуноконъюгата СН1А1А IgG-IL2 qm и цетуксимаба (см. пример 4);
на фиг. 5 - данные, полученные для иммуноконъюгата СН1А1А IgG-IL-2, содержащего четырехмутантный (qm) IL-2, мишенью которого является СЕА, у которого отсутствует способность связываться с CD25, и анти-Her3 GlycoMab при тестировании в отношении трансгенных по FcγRIII SCID-мышей, которым инъецировали внутрь селезенки клетки человеческой колоректальной карциномы линии LS174Т. Из представленных данных следует, что комбинация иммуноконъюгата СН1А1А IgG-IL2 qm и анти-Her3 GlycoMab опосредовала повышенную эффективность в понятиях удлиненной медианы выживаемости по сравнению с индивидуальным применением соответствующего иммуноконъюгата или анти-Her3 GlycoMab (см. пример 5);
на фиг. 6 - данные, полученные для иммуноконъюгата 28Н1 IgG-IL-2, мишенью которого является FAP, содержащего четырехмутантный (qm) IL-2, у которого отсутствует способность связываться с CD25, и анти-EGFR GlycoMab, при тестировании в отношении трансгенных по FcγRIII SCID-мышей, которым инъецировали внутрь почки клетки человеческой почечной карциномы линии ACHN. Из представленных данных следует, что комбинация иммуноконъюгата СН1А1А IgG-IL2 qm и анти-EGFR GlycoMab опосредовала повышенную эффективность в понятиях удлиненной медианы выживаемости и общей выживаемости по сравнению с индивидуальным применением анти-EGFR GlycoMab или анти-EGFR GlycoMab в комбинации с Proleukin® (см. пример 6);
на фиг. 7 - обобщенные данные об уничтожении LS174Т-клеток с использованием РВМС после обработки только анти-Her3 GlycoMab (левая панель), только иммуноконъюгатом СН1А1А IgG-IL-2 qm (правая панель) или комбинацией иммуноконъюгата СН1А1А IgG-IL-2 qm с анти-Her3 GlycoMab (правая панель);
на фиг. 8 - данные об экспрессии CD25 (А) или CD69 (Б) на NK-клетках после обработки только анти-Her3 GlycoMab (левая панель), только иммуноконъюгатом СН1А1А IgG-IL-2 qm (правая панель) или комбинацией иммуноконъюгата СН1А1А IgG-IL-2 qm с анти-Her3 GlycoMab (правая панель).
Подробное описание изобретения
Первым объектом настоящего изобретения является комбинация (а) иммуноконъюгата, который содержит первое антитело, сконструированное таким образом, чтобы оно обладало пониженной эффекторной функцией, и эффекторный фрагмент, и (б) второго антитела, сконструированного таким образом, чтобы оно обладало повышенной эффекторной функцией, предназначенная для применения при лечении заболевания у индивидуума, который нуждается в этом.
В изобретении предложен также способ лечения заболевания у индивидуума, заключающийся в том, что вводят индивидууму комбинацию (а) иммуноконъюгата, который содержит первое антитело, сконструированное таким образом, чтобы оно обладало пониженной эффекторной функцией, и эффекторный фрагмент, и (б) второго антитела, сконструированного таким образом, чтобы оно обладало повышенной эффекторной функцией, в терапевтически эффективном количестве.
В изобретении предложен также способ стимуляции функции эффекторных клеток у индивидуума, заключающийся в том, что вводят индивидууму комбинацию (а) иммуноконъюгата, который содержит первое антитело, сконструированное таким образом, чтобы оно обладало пониженной эффекторной функцией, и эффекторный фрагмент, и (б) второго антитела, сконструированного таким образом, чтобы оно обладало повышенной эффекторной функцией, в количестве, эффективном в отношении стимуляции функции эффекторных клеток.
Определения
Понятия, применяемые в настоящем описании, имеют значения, общепринятые в данной области, если ниже специально не указано иное.
В контексте настоящего описания понятие «иммуноконъюгат» относится к молекуле полипептида, которая включает по меньшей один эффекторный фрагмент и антитело. В некоторых вариантах осуществления изобретения иммуноконъюгат содержит не более одного эффекторного фрагмента. В частности, иммуноконъюгаты, предлагаемые в изобретении, практически состоят из одного эффекторного фрагмента и антитела, сцепленных с помощью одного или нескольких пептидных линкеров. Конкретные иммуноконъюгаты, предлагаемые в изобретении, представляют собой слитые белки, т.е. компоненты иммуноконъюгата сцеплены пептидными связями.
В контексте настоящего описания понятие «контрольное антитело» относится к антителу, которое может существовать без эффекторных фрагментов. Например, при осуществлении сравнения иммуноконъюгата IgG-IL2, представленного в настоящем описании, с контрольным антителом в качестве контрольного антитела применяют свободный IgG, если иммуноконъюгат IgG-IL2 и молекула свободного IgG могут оба спецфически связываться с одной и той же антигенной детерминантой.
В контексте настоящего описания понятие «антигенная детерминанта» является синонимом понятий «антиген» и «эпитоп» и относится к сайту (например, участку, состоящему из смежных аминокислот, или конформационной конфигурации, состоящей из различных областей несмежных аминокислот) на полипептидной макромолекуле, с которой связывается антитело с образованием комплекса антитело-антиген. Пригодные антигенные детерминанты могут присутствовать, например, на поверхностях опухолевых клеток, на поверхностях инфицированных вирусом клеток, на поверхностях других больных клеток, в свободном состоянии в сыворотке крови и/или во внеклеточном матриксе (ЕСМ).
Понятие «специфически связывается» означает, что связывание является избирательным в отношении антигена и его можно отличать от нежелательных или неспецифических взаимодействий. Способность антитела связываться со специфической антигенной детерминантой можно определять с помощью твердофазного иммуноферментного анализа (ELISA) или других методик, известных специалисту в данной области, например, с помощью методики на основе поверхностного плазменного резонанса (осуществляя анализ с помощью устройства BIAcore) (Liljeblad и др., Glyco J 17, 2000, сс. 323-329), и традиционных анализов связывания (Heeley, Endocr Res 28, 2002, сс. 217-229).
Понятия «анти- [антиген] антитело (антитело к антигену)» и «антитело, которое связывается с [антигеном]» относятся к антителу, которое обладает способностью связываться с соответствующим антигеном с достаточной аффинностью, в результате чего антитело можно применять в качестве диагностического и/или терапевтического агента для направленного воздействия на антиген. В одном из вариантов осуществления изобретения уровень связывания антитела к антигену с неродственным белком составляет менее чем примерно 10% от связывания антитела с антигеном при оценке, например, с помощью радиоиммуноанализа (РИА). В некоторых вариантах осуществления изобретения антитело, которое связывается с [антигеном], имеет константу диссоциации (KD) ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ (например, 10-8 М или менее, например, от 10-8 М до 10-12 М, например, от 10-9 М до 10-13 М).
Понятие «аффинность» относится к суммарной силе всех нековалентных взаимодействий между индивидуальным сайтом связывания молекулы (например, антитела) и ее партнера по связыванию (например, антигена). Если не указано иное, то в контексте настоящего описания понятие «аффинность связывания» относится к присущей компонентам связывающейся пары (например, антителу и антигену) аффинности связывания, отражающей взаимодействие по типу 1:1. Аффинность молекулы Х к ее партнеру Y можно, как правило, характеризовать с помощью константы диссоциации (KD), которая представляет собой отношение констант скорости реакции диссоциации и ассоциации (koff и kon соответственно). Так, эквивалентные аффинности могут соответствовать различным константам скорости, если соотношение констант скорости остается таким же. Аффинность можно оценивать общепринятыми методами, известными в данной области, включая представленные в настоящем описании. Конкретным методом измерения аффинности является поверхностный плазменный резонанс (SPR).
Согласно одному из вариантов осуществления изобретения величину KD измеряли методом поверхностного плазменного резонанса с помощью устройства BIACORE® T100 (фирма GE Healthcare) при 25°C с использованием лиганда (например, рецептора эффекторного фрагмента, Fc-рецептора или антигена-мишени), иммобилизованного на СМ5-чипах. В целом, метод состоял в следующем: биосенсорные чипы из карбоксиметилированного декстрана (СМ5, фирма GE Healthcare) активировали с помощью гидрохлорида N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимида (NHS) согласно инструкциям поставщика. Рекомбинантный лиганд разводили 10 мМ ацетатом натрия, рН 5,5 до концентрации 0,5-30 мкг/мл перед инъекцией со скоростью потока 10 мкл/мин для достижения примерно 100-5000 единиц ответа (RU) связанного белка. После инъекции лиганда инъецировали 1 М этаноламин для блокады непрореагировавших групп. Для кинетических измерений инъецировали трех- или пятикратные серийные разведения иммуноконъюгата (диапазон от ~0,01 до 300 нМ) в буфере HBS-EP+ (фирма GE Healthcare, 10 мМ HEPES, 150 мМ NaCl, 3 мМ ЭДТК, 0,05% сурфактанта Р20, рН 7,4) при 25°С со скоростью потока примерно 30-50 мкл/мин. Скорость реакции ассоциации (kon) и реакции диссоциации (koff) рассчитывали с использованием простой модели связывания Ленгмюра 1:1 (программа BIACORE® T100 Evaluation Software, версия 1.1.1) путем одновременной аппроксимации сенсограмм ассоциации и диссоциации. Константу равновесия реакции диссоциации (KD) рассчитывали как соотношение koff/kon (см., например, Chen и др., J Mol Biol 293, 1999, сс. 865-881).
Понятие «пониженное связывание (пониженная способность к связыванию)», например, пониженная способность к связыванию с Fc-рецептором или CD25, относится к снижению аффинности касательно соответствующего взаимодействия, измеренной, например, с помощью SPR. Для ясности следует отметить, что понятие включает также снижение аффинности до нуля (или ниже предела обнаружения аналитического метода), т.е. полную элиминацию взаимодействия. И, наоборот, «повышенное связывание (повышенная способность к связыванию)» относится к повышению аффинности связывания касательно соответствующего взаимодействия.
В контексте настоящего описания понятия «первый» и «второй» касательно антител, эффекторных фрагментов и т.д. применяют с целью удобства разделения, когда присутствует более одного типа каждого из фрагментов. Применение этих понятий не подразумевает их конкретный порядок или ориентацию в иммуноконъюгате, если специально не указано иное.
В контексте настоящего описания понятие «эффекторный фрагмент» относится к полипептиду, например, белку или гликопротеину, который оказывает влияние на клеточную активность, например, через трансдукцию сигналов или посредством других клеточных путей. Таким образом, эффекторный фрагмент, предлагаемый в изобретении, может быть ассоциирован с опосредуемой рецептором передачей сигналов, что приводит к передаче сигнала от наружной части клеточной мембраны, модулируя ответ в клетке, которая несет один или несколько рецепторов для эффекторного фрагмента. В одном из вариантов осуществления изобретения эффекторный фрагмент может вызывать цитотоксический ответ в клетках, несущих рецепторы для эффекторного фрагмента. В другом варианте осуществления изобретения эффекторный фрагмент может вызывать пролиферативный ответ в клетках, несущих один или несколько рецепторов для эффекторного фрагмента. В другом варианте осуществления изобретения эффекторный фрагмент может вызывать дифференцировку клеток, несущих один или несколько рецепторов эффекторного фрагмента. В другом варианте осуществления изобретения эффекторный фрагмент может изменять экспрессию (т.е. может обладать способностью осуществлять повышающую регуляцию или понижающую регуляция) эндогенного клеточного белка в клетках, несущих рецепторы для эффекторного фрагмента. Примерами эффекторных фрагментов являются (но, не ограничиваясь только ими) цитокины, факторы роста, гормоны, ферменты, субстраты и кофакторы. Эффекторный фрагмент может быть ассоциирован с антителом в различных конфигурациях с образованием иммуноконъюгата.
В контексте настоящего описания понятие «цитокин» относится к молекуле, которая опосредует и/или регулирует биологическую или клеточную функцию или процесс (например, иммунитет, воспаление и гематопоэз). Понятие «цитокин» в контексте настоящего описания относится к «лимфокинам», «хемокинам», «монокинам» и «интерлейкинам». Примерами пригодных для применения цитокинов являются (но, не ограничиваясь только ими) GM-CSF, IL-1α, IL-1β, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-10, IL-12, IFN-α, IFN-β, IFN-γ, MIP-1α, MIP-1β, TGF-β, TNF-α и TNF-β. Конкретные цитокины представляют собой IL-2 и IL-12. В контексте настоящего описания подразумевается также, что понятие «цитокин» включает также варианты цитокина, содержащие одну или несколько аминокислотных мутаций в аминокислотных последовательностях соответствующего цитокина дикого типа, такие, например, как варианты IL-2, описанные у Sauvé и др., Proc Nati Acad Sci USA 88, 1991, сс. 4636-4640; Ни и др., Blood 101, 2003, сс. 4853-4861 и в публикации патента США №2003/0124678; у Shanafelt и др., Nature Biotechnol 18, 2000, сс. 1197-1202; Heaton и др., Cancer Res 53, 1993, сс. 2597-2602 и в US №5229109; в публикации патента США №2007/0036752; WO 2008/0034473; WO 2009/061853; или указанные выше или ниже в настоящем описании.
В контексте настоящего описания понятие «одноцепочечная» относится к молекуле, содержащей аминокислотные мономеры, связанные линейно посредством пептидных связей. В одном из вариантов осуществления изобретения эффекторный фрагмент представляет собой одноцепочечный эффекторный фрагмент. Примерами одноцепочечных эффекторных фрагментов являются (но, не ограничиваясь только ими) цитокины, факторы роста, гормоны, ферменты, субстраты и кофакторы. Когда эффекторный фрагмент представляет собой цитокин, и представляющий собой интерес цитокин в норме в естественных условиях существует в виде мультимера, то каждая субъединица мультимерного цитокина последовательно кодируется одной цепью эффекторного фрагмента. Таким образом, примерами пригодных для применения одноцепоченых эффекторных фрагментов являются (но, не ограничиваясь только ими) GM-CSF, IL-1α, IL-1β, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-10, IL-12, IFN-α, IFN-β, IFN-γ, MIP-1α, MIP-1β, TGF-β, TNF-α и TNF-β.
В контексте настоящего описания понятие «применяемый в качестве контроля эффекторный фрагмент» относится к неконъюгированному эффекторному фрагменту. Например, при осуществлении сравнения содержащего IL-2 иммуноконъюгата, предлагаемого в настоящем изобретении, и применяемого в качестве контроля эффекторного фрагмента, применяемый в качестве контроля эффекторный фрагмент представляет собой свободный неконъюгированный IL-2. Аналогично этому, например, при осуществлении сравнения содержащего IL-12 иммуноконъюгата и применяемого в качестве контроля эффекторного фрагмента, применяемый в качестве контроля эффекторный фрагмент представляет собой свободный неконъюгированный IL-12 (например, существующий в виде гетеродимерного белка, в котором субъединицы р40 и р35 соединены только дисульфидной(ыми) связью(ями)).
В контексте настоящего описания понятие «рецептор (для) эффекторного фрагмента» относится к полипептидной молекуле, которая обладает способностью специфически связываться с эффекторным фрагментом. Например, когда эффекторный фрагмент представляет собой IL-2, рецептор для эффекторного фрагмента, который связывается с IL-2 (например, с иммуноконъюгатом, который содержит IL-2), представляет собой рецептор IL-2. Аналогично этому, например, когда IL-12 представляет собой эффекторный фрагмент иммуноконъюгата, то рецептором для эффекторного фрагмента является рецептор IL-12. Когда рецепторный фрагмент специфически связывается более чем с одним рецептором, все рецепторы, которые специфически связываются с эффекторным фрагментом, представляют собой «рецепторы эффекторного фрагмента» для указанного эффекторного фрагмента.
В контексте настоящего описания понятие «антитело» применяют в его наиболее широком смысле, и оно включает антитела различной структуры, включая (но, не ограничиваясь только ими) моноспецифические антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела), и фрагменты антител, если они сохраняют требуемую антигенсвязывающую активность и содержат Fc-область или область, эквивалентную Fc-области иммуноглобулина.
Понятия «полноразмерное антитело», «интактное антитело» и «полное антитело» в контексте настоящего описания применяют взаимозаменяемо, и они относятся к антителу, имеющему структуру практически сходную со структурой нативного иммуноглобулина.
Понятие «иммуноглобулин» относится к белку, имеющему структуру встречающегося в естественных условиях антитела. Например, иммуноглобулины IgG-класса представляют собой гетеротетрамерные гликопротеины с молекулярной массой примерно 150000 Да, состоящие из двух легких цепей и двух тяжелых цепей, связанных дисульфидными мостиками. В направлении от N-конца к С-концу каждая тяжелая цепь содержит вариабельную область (VH), которую называют также вариабельным тяжелым доменом или вариабельным доменом тяжелой цепи, за которой расположены три константных домена (СН1, СН2 и СН3), которые называют также константной областью тяжелой цепи. Аналогично этому, в направлении от N- конца к С-концу каждая легкая цепь содержит вариабельную область (VL), которую называют также вариабельным легким доменом или вариабельным доменом легкой цепи, за которой расположен константный домен легкой цепи (CL), который называют также константной областью легкой цепи. Тяжелая цепь иммуноглобулина может относиться к одному из пяти типов, обозначенных как α (IgA), δ (IgD), ε (IgE), γ (IgG) или μ (IgM), некоторые из которых дополнительно подразделяют на подтипы, например, γ1 (IgG1), γ2 (IgG2), γ3 (IgG3), γ4 (IgG4), α1 (IgA1) и α2 (IgA2). Легкая цепь иммуноглобулина может относиться к одному из двух типов, обозначенных как каппа (κ) и лямбда (λ), на основе аминокислотной последовательности ее константного домена. Иммуноглобулин, как правило, состоит из двух молекул Fab и Fc-области, которые соединены через шарнирную область иммуноглобулина.
Понятие «фрагмент антитела» относится к молекуле, отличной от интактного антитела, которая содержит часть интактного антитела, связывающуюся с антигеном, с которым связывается интактное антитело. Примерами фрагментов антител являются (но, не ограничиваясь только ими) Fv, Fab, Fab', Fab'-SH, F(ab')2, димерные антитела, линейные антитела, одноцепочечные молекулы антител (например, scFv), однодоменные антитела и мультиспецифические антитела, образованные из фрагментов антител. Обзор некоторых фрагментов антител см., например, у Hudson и др., Nat Med 9, 2003, сс. 129-134. Обзор scFv-фрагментов см., например, у Plückthun в: The Pharmacology of Monoclonal Antibodies, т. 113, под ред. Rosenburg и Moore, изд-во Springer-Verlag, New York, 1994, сс. 269-315; см. также WO 93/16185; и US №№5571894 и 5587458. Обсуждение Fab- и F(ab')2-фрагментов, содержащих остатки эпитопа, связывающегося с рецептором спасения, и обладающих удлиненным временем полужизни in vivo, см. в US №5869046. Димерные антитела (диабоди) представляют собой фрагменты антител с двумя антигенсвязывающими сайтами, которые могут быть двухвалентными или биспецифическими (см., например, ЕР 404097; WO 1993/01161; Hudson и др., Nat Med 9, 2003, сс. 129-134; и Hollinger и др., Proc Nati Acad Sci USA 90, 1993, сс. 6444-6448. Тримерные (триабоди) и тетрамерные (тетрабоди) антитела описаны также у Hudson и др., Nat Med 9, 2003, сс. 129-134. Однодоменные антитела представляют собой фрагменты антител, содержащие весь вариабельный домен тяжелой цепи или его часть или весь вариабельный домен легкой цепи антитела или его часть. В некоторых вариантах осуществления изобретения однодоменное антитело представляет собой человеческое однодоменное антитело (фирма Domantis, Inc., Waltham М.А.; см., например, US №6248516 В1). Фрагменты антител можно создавать с помощью различных методик, включая (но, не ограничиваясь только ими) протеолитическое расщепление интактного антитела, а также получать с использованием рекомбинантных клеток-хозяев (например, Е.coli или фага), как указано в настоящем описании.
Понятие «антигенсвязывающий домен» относится к части антитела, которая содержит область, специфически связывающуюся и являющуюся комплементарной части антигена или полному антигену. Антигенсвязывающий домен может представлять собой, например, один или несколько вариабельных доменов антитела (которые называют также вариабельными областями антитела). Предпочтительно антигенсвязывающий домен содержит вариабельную область легкой цепи (VL) антитела и вариабельную область тяжелой цепи (VH) антитела.
Понятие «вариабельная область» или «вариабельный домен» относится к домену тяжелой или легкой цепи антитела, который участвует в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL соответственно) нативного антитела, как правило, имеют сходные структуры, при этом каждый домен содержит четыре консервативных каркасных участка (FR) и три гипервариабельных участка (HVR) (см., например, Kindt и др., Kuby Immunology, 6-ое изд., изд-во W.H. Freeman and Co., 2007, с. 91). Одного VH- или VL-домена может быть достаточно для обеспечения специфичности связывания антигена.
Понятие «гипервариабельный участок» или «HVR» в контексте настоящего описания относится к каждому из участков вариабельного домена антитела, последовательности которых являются гипервариабельными, и/или которые образуют структуры в виде петель («гипервариабельные петли»). Как правило, нативные четырехцепочечные антитела содержат шесть HVR; три в VH (H1, H2, Н3) и три в VL (L1, L2, L3). HVR, как правило, содержат аминокислотные остатки из гипервариабельных петель и/или из «определяющих комплементарность участков» (CDR), последние отличаются наиболее выраженной вариабельностью последовательности и/или участвуют в распознавании антигенов. Кроме CDR1, присутствующего в VH, CDR, как правило, содержат аминокислотные остатки, которые образуют гипервариабельные петли. Понятие «гипервариабельные участки» (HVR) относится также к «определяющим комплементарность участкам» (CDR), и в контексте настоящего описания эти понятия используются взаимозаменяемо касательно положений вариабельной области, которые формируют антигенсвязывающие области. Эта конкретная область описана у Kabat и др., U.S. Dept. of Health and Human Services, «Sequences of Proteins of Immunological Interest», 1983 и у Chothia и др., J. Mol. Biol. 196, 1987, сс. 901-917, причем эти определения относятся к перекрывающимся аминокислотным остаткам или поднаборам аминокислотных остатков при их сравнении друг с другом. Однако в контексте настоящего описания подразумевается возможность применения любого определения CDR антитела или его вариантов. Соответствующие аминокислотные остатки, из которых состоят CDR, как они определены в каждой из процитированных выше ссылок, представлены в сравнении ниже в таблице 1. Точные номера остатков, которые образуют конкретный CDR, могут варьироваться в зависимости от последовательности и размера CDR. Специалисты в данной области на основе данных об аминокислотной последовательности вариабельной области антитела легко могут определять, какие остатки входят в конкретный CDR.

Кэбот с соавторами предложили также систему нумерации (номенклатуру) последовательностей вариабельных областей, которую можно применять для любого антитела. Обычный специалист в данной области может однозначно применять эту систему «нумерации по Кэботу» к любой последовательности вариабельной области, не имея никаких экспериментальных данных, кроме сведений о самой последовательности. В контексте настоящего описания понятие «нумерация по Кэботу» относится к системе нумерации, описанной у Kabat и др., «Sequence of Proteins of Immunological Interest», изд-во U.S. Dept. of Health and Human Services, 1983. Если не указано иное, то ссылки на нумерацию положений конкретных аминокислотных остатков в вариабельной области антитела даны в соответствии с системой нумерации по Кэботу.
Нумерация полипептидных последовательностей в «Перечне последовательностей» (т.е. SEQ ID NO: 3, 4, 5, 6, 7, 8, 9 и т.д.) не представляет собой нумерацию в соответствии с системой Кэбота. Однако в компетенции обычного специалиста в данной области является превращение нумерации последовательностей в «Перечне последовательностей» в нумерацию по Кэботу.
«Каркасный участок» или «FR» включает остатки вариабельного домена, отличные от остатков гипервариабельных участков (HVR). FR вариабельного домена, как правило, представлены четырьмя FR-доменами: FR1, FR2, FR3 и FR4. Таким образом, последовательности HVR и FR, как правило, расположены в VH (или VL) в следующем порядке: FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
Понятие «класс» антитела относится к типу константного домена или константной области, содержащегося(щейся) в тяжелой цепи. Существует пять основных классов антител: IgA, IgD, IgE, IgG и IgM, а некоторые из них можно дополнительно подразделять на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелых цепей, соответствующие различным классам иммуноглобулинов, обозначают как α, δ, ε, γ и μ соответственно.
В контексте настоящего описания понятие «Fc-домен» или «Fc-область» относится к С-концевой области тяжелой цепи иммуноглобулина, которая содержит по меньшей мере часть константной области. Понятие относится к последовательностям нативных Fc-областей и вариантов Fc-областей. Хотя пограничные последовательности Fc-области в тяжелой цепи IgG могут слегка варьироваться, как правило, Fc-область тяжелой цепи человеческого IgG простирается от Cys226 или от Pro230 до карбоксильного конца тяжелой цепи. Однако С-концевой лизин (Lys447) Fc-области может либо присутствовать, либо отсутствовать. Если специально не указано иное, то нумерация аминокислотных остатков в Fc-области или константном участке соответствует системе EU-нумерации, которую называют также EU-индекс, описанной у Kabat и др., Sequences of Proteins of Immunological Interest, 5-ое изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
Подразумевается, что «область, эквивалентная Fc-области иммуноглобулина» включает встречающиеся в естественных условиях аллельные варианты Fc-области иммуноглобулина, а также варианты, имеющие изменения, приводящие к заменам, добавлениям или делециям, но которые не снижают существенно способность иммуноглобулина опосредовать эффекторные функции (такие как антитело-обусловленная клеточнозависимая цитотоксичность). Например, одну или несколько аминокислот можно изымать путем делеции из N-конца или С-конца Fc-области иммуноглобулина без существенной потери биологической функции. Указанные варианты можно отбирать согласно общим правилам, известным в данной области, так, чтобы они оказывали минимальное воздействие на активность (см., например, Bowie и др., Science 247, 1990, сс. 1306-1310).
«Модификация, усиливающая гетеродимеризацию» представляет собой манипуляцию с пептидным каркасом или посттрансляционные модификации полипептида, например, тяжелой цепи иммуноглобулина, которая уменьшает или препятствует ассоциации полипептида с идентичным полипептидом с образованием гомодимера. В контексте настоящего описания модификация, усиливающая гетеродимеризацию, включает, прежде всего, различные модификации, осуществляемые с каждым из двух полипептидов, которые требуются для образования димера, при этом, модификации дополняют друг друга таким образом, чтобы усиливать ассоциацию двух полипептидов. Например, модификация, усиливающая гетеродимеризацию, может изменять структуру или заряд одного или обоих полипептидов, требуемых для образования димера, таким образом, чтобы улучшать их ассоциацию стерически или электростатически соответственно. Гетеродимеризация имеет место между двумя неидентичными полипептидами, такими как две тяжелые цепи иммуноглобулина, при этом дополнительные компоненты иммуноконъюгата слитых с каждой из тяжелых цепей (например, эффекторного фрагмента) не являются одинаковыми. В иммуноконъюгатах, предлагаемых в настоящем изобретении, модификация, усиливающая гетеродимеризацию, затрагивает тяжелую(ые) цепь(и), в частности, в Fc-области. В некоторых вариантах осуществления изобретения модификация, усиливающая гетеродимеризацию, представляет собой аминокислотную мутацию, в частности, аминокислотную замену. В конкретном варианте осуществления изобретения модификация, усиливающая гетеродимеризацию, представляет собой индивидуальную аминокислотную мутацию, в частности, аминокислотную замену, в каждой из двух тяжелых цепей иммуноглобулина.
Понятие «эффекторные функции», используемое в настоящем описании, относится к видам биологической активности, присущим Fc-области антитела, которые варьируются в зависимости от изотипа антитела. Примерами эффекторных функций антитела являются: способность связываться с C1q и комплементзависимая цитотоксичность (CDC), способность связываться с Fc-рецептором, антитело-обусловленная клеточнозависимая цитотоксичность (ADCC), антитело-обусловленный клеточнозависимый фагоцитоз (ADCP), секреция цитокинов, опосредованное иммунным комплексом поглощение антигена антигенпрезентирующими клетками, понижающая регуляция рецепторов клеточной поверхности (например, В-клеточного рецептора); и активация В-клеток.
В контексте настоящего описания понятие «эффекторные клетки» относится к популяции лимфоцитов, которые экспонируют рецепторы для эффекторного фрагмента, например, рецепторы для цитокинов, и/или Fc-рецепторы на своей поверхности, через которые они связывают эффекторный фрагмент, например, цитокин и/или Fc-область антитела и принимают участие в деструкции клеток-мишеней, например, опухолевых клеток. Эффекторные клетки могут, например, опосредовать цитотоксические действия или фагоцитоз. Эффекторные клетки включают (но, не ограничиваясь только ими) эффекторные Т-клетки, такие как цитотоксические CD8+-Т-клетки, CD4+-Т-клетки-хелперы, γδ-Т-клетки, NK-клетки, лимофкинактивированные клетки-киллеры (LAK) и макрофаги/моноциты. В зависимости от схемы экспрессии их рецептора могут встречаться различные подпопуляции эффекторных клеток, т.е. (а) клетки, которые экспрессируют рецепторы для конкретного эффекторного фрагмента, но не экспрессируют Fc-рецепторы и которые стимулируются иммуноконъюгатами, но не антителами, предлагаемыми в изобретении (например, Т-клетки, экспрессирующие IL-2-рецепторы); (б) клетки, которые экспрессируют Fc-рецепторы, но не экспрессируют рецепторы для конкретного эффекторного фрагмента и которые стимулируются антителами, но не стимулируются иммуноконъюгатами, предлагаемыми в изобретении; и (в) клетки, которые экспрессируют и Fc-рецепторы, и рецепторы для конкретного эффекторного фрагмента и которые одновременно стимулируются антителами и иммуноконъюгатами, предлагаемыми в изобретении (например, NK-клетки, которые экспрессируют FcγIII-рецепторы и IL-2-рецепторы).
В контексте настоящего описания подразумевается, что понятия «конструирование, сконструированный, инженерия» включают любую манипуляцию с пептидным каркасом или посттрансляционные модификации встречающегося в естественных условиях или рекомбинантного полипептида или его фрагмента. Инженерия включает модификации аминокислотной последовательности, схемы гликозилирования или группы боковых цепей индивидуальных аминокислот, а также комбинации указанных подходов. Инженерия, прежде всего с приставкой «глико», а также «инженерия гликозилирования (гликоинженерия)» (конструирование схемы гликозилирования) включает метаболическое конструирование механизма гликозилирования клетки, в том числе генетические манипуляции, касающиеся путей олигосахаридного синтеза, с целью получения измененного гликозилирования гликопротеинов, экспрессируемых в клетках. Кроме того, конструирование схемы гликозилирования включает воздействия мутаций и клеточного окружения на гликозилирование. В одном из вариантов осуществления изобретения инженерия гликозилирования представляет собой изменение гликозилтрансферазной активности. В конкретном варианте осуществления изобретения инженерия позволяет изменять активность глюкозаминилтрансферазы и/или активность фукозилтрансферазы. Инженерию гликозилирования можно использовать для получения «клетки-хозяина, обладающей повышенной GnTIII-активностью» (например, клетки-хозяина, которую подвергали манипуляции с целью экспрессии повышенных уровней одного или нескольких полипептидов, обладающих активностью β(1,4)-N-ацетилглюкозамилтрансферазы III (GnTIII), «клетки-хозяина, обладающей повышенной ManII-активностью» (например, клетки-хозяина, которую подвергали манипуляции с целью экспрессии повышенных уровней одного или нескольких полипептидов, обладающих активностью α-маннозидазы II (ManII)) или «клетки-хозяина, обладающей пониженной α(1,6) фукозилтрансферазной активностью» (например, клетки-хозяина, которую подвергали манипуляции с целью экспрессии пониженных уровней α(1,6)-фукозилтрансферазы).
В контексте настоящего описания подразумевается, что понятие «аминокислотная мутация» относится к аминокислотным заменам, делециям, инсерциям и модификациям. Можно применять любую комбинацию замены, делеции, инсерции и модификации для создания конечной конструкции при условии, что конечная конструкция обладает требуемыми характеристиками, например, пониженной способностью связываться с Fc-рецептором. Аминокислотная последовательность с делениями и инсерциями включает амино- и/или карбоксиконцевые делеции и инсерции аминокислот. Конкретными аминокислотными мутациями являются аминокислотные замены. Для изменения, например, характеристик связывания с Fc-областью, наиболее предпочтительными являются неконсервативные аминокислотные замены, т.е. замена одной аминокислоты на другую аминокислоту, имеющую другие структурные и/или химические свойства. Аминокислотные замены включают замену на не встречающиеся в естественных условиях аминокислоты или на производные встречающихся в естественных условиях двадцати стандартных аминокислот (например, на 4-гидроксипролин, 3-метилгистидин, орнитин, гомосерин, 5-гидроксилизин). Аминокислотные мутации можно создавать с помощью генетических или химических методов, хорошо известных в данной области. Генетические методы могут включать сайтнаправленный мутагенез, ПЦР, синтез генов и т.п. Подразумевается, что можно применять также методы изменения боковой группы аминокислоты, отличные от методов генетической инженерии, такие как химическая модификация. Для обозначения одной и той же аминокислотной мутации можно использовать различные обозначения. Например, замену пролина в положении 329 Fc-домена на глицин можно обозначать как 329G, G329, G329. P329G или Pro329Gly.
«Процент (%) идентичности аминокислотной последовательности» относительно полипептидной референс-последовательности определяют как процент аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в полипептидной референс-последовательности, после выравнивания последовательностей и интродукции при необходимости брешей для достижения максимального процента идентичности последовательностей, и при этом какие-либо консервативные замены не учитываются при оценке идентичности последовательностей. Сравнительный анализ для определения процента идентичности аминокислотных последовательностей можно осуществлять различными путями, которые находятся в компетенции специалиста в данной области, например, с использованием публично доступных компьютерных программ, таких как программа BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определять соответствующие параметры для выравнивания последовательностей, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Однако для целей настоящего изобретения величину % идентичности аминокислотных последовательностей получают с использованием предназначенной для сравнения последовательностей компьютерной программы ALIGN-2. Предназначенная для сравнения последовательностей компьютерная программа ALIGN-2 разработана фирмой Genentech, Inc., и исходный код помещен на хранение вместе с документацией для пользователя в U.S. Copyright Office, Washington D.C., 20559, где он зарегистрирован под регистрационным номером U.S. Copyright Registration № TXU510087. Программа ALIGN-2 представляет собой публично доступную программу фирмы Genentech, Inc., Южный Сан-Франциско, шт. Калифорния, или ее можно компилировать из исходного кода. Программу ALIGN-2 можно компилировать для применения в операционной системе UNIX, включая цифровую версию UNIX V4.0D. В программе ALIGN-2 все параметры для сравнения последовательностей являются заданными и не должны изменяться. В ситуациях, когда ALIGN-2 применяют для сравнения аминокислотных последовательностей, % идентичности аминокислотных последовательностей данной аминокислотной последовательности А относительно или по сравнению с данной аминокислотной последовательностью Б (которую другими словами можно обозначать как данная аминокислотная последовательность А, которая имеет или отличается определенным % идентичности аминокислотной последовательности относительно или по сравнению с данной аминокислотной последовательностью Б), рассчитывают следующим образом:
100 × частное X/Y,
где Х обозначает количество аминокислотных остатков, оцененных программой сравнительного анализа последовательностей ALIGN-2 как идентичные совпадения при сравнительном анализе последовательностей А и Б с помощью указанной программы, и где Y обозначает общее количество аминокислотных остатков в Б. Должно быть очевидно, что, когда длина аминокислотной последовательности А не равна длине аминокислотной последовательности Б, то % идентичности аминокислотной последовательности А относительно аминокислотной последовательности Б не должен быть равен % идентичности аминокислотной последовательности Б относительно аминокислотной последовательности А. Если специально не указано иное, то в контексте настоящего описания все величины % идентичности аминокислотных последовательностей получают согласно процедуре, описанной в последнем из предшествующих параграфов, с помощью компьютерной программы ALIGN-2.
В контексте настоящего описания понятия «клетка-хозяин», «клеточная линия-хозяин» и «клеточная культура-хозяин» используются взаимозаменяемо, и они относятся к клеткам, в которые интродуцирована экзогенная нуклеиновая кислота, включая потомство указанных клеток. К клеткам-хозяевам относятся «трансформанты» и «трансформированные клетки», которые включают первичные трансформированные клетки, а также потомство, выведенное из них, независимо от количества пересевов. Потомство может не быть строго идентичным родительской клетке по составу нуклеиновых кислот, а может нести мутации. Под данное понятие подпадает мутантное потомство, которое обладает такой же функцией или биологической активностью, что и отобранная путем скрининга или селекции исходная трансформированная клетка. Клетка-хозяин представляет собой клеточную систему любого типа, которую можно применять для создания антител и иммуноконъюгатов, предлагаемых в настоящем изобретении. В одном из вариантов осуществления изобретения клетку-хозяина конструируют так, чтобы можно было получать антитело с модифицированными олигосахаридами. В некоторых вариантах осуществления изобретения клетки-хозяева можно подвергать манипуляциям для экспрессии повышенных уровней одного или нескольких полипептидов, обладающих активностью β(1,4)-N-ацетилглюкозамилтрансферазы III (GnTIII). В некоторых вариантах осуществления изобретения клетки-хозяева подвергают дополнительным манипуляциям для экспрессии повышенных уровней одного или нескольких полипептидов, обладающих активностью α-маннозидазы II (ManII). Клетки-хозяева включают культивируемые клетки, например, культивируемые клетки млекопитающих, такие как (но, не ограничиваясь только ими) СНО-клетки, BHK-клетки, NS0-клетки, SP2/0-клетки, клетки миеломы линии YO, клетки мышиной миеломы линии Р3Х63, PER-клетки, РЕR.С6-клетки или клетки гибридомы, клетки дрожжей, клетки насекомых и клетки растений, но также клетки, находящиеся в трансгенном животном, трансгенном растении или в культивируемой растительной или животной ткани.
В контексте настоящего описания понятие «полипептид, обладающий GnTIII-активностью» относится к полипептидам, которые обладают способностью катализировать добавление остатка N-ацетилглюкозамина (GlcNAc) в β-1-4-связи к β-связанному маннозиду триманнозильного ядра N-связанных олигосахаридов. Понятие относится к слитым полипептидам, которые обладают ферментативной активностью, подобной, но не обязательно идентичной, активности β(1,4)-N-ацетилглюкозаминилтрансферазы III, также известной под названием β-1,4-маннозил-гликопротеин-4-бета-N-ацетилглюкозаминилтрансфераза (КФ 2.4.1.144) согласно номенклатуре Комитета Международного союза по биохимии и молекулярной биологии (Committee of the International Union of Biochemistry and Molecular Biology (NC-IUBMB)), при оценке с помощью конкретного биологического анализа как в случае зависимости от дозы, так и без зависимости от дозы. В случае, когда существует зависимость от дозы, фермент не должен быть обязательно идентичен GnTIII, а скорее он должен быть практически подобен ей в отношении зависимости данной активности от дозы по сравнению с GnTIII (т.е. полипептид-«кандидат» должен обладать более высокой активностью или не более чем примерно в 25 раз пониженной активностью, предпочтительно не более чем примерно в 10 раз пониженной активностью, и еще более предпочтительно не более чем примерно в 3 раза пониженной активностью по сравнению с GnTIII.). В конкретных вариантах осуществления изобретения полипептид, обладающий GnTIII-активностью, представляет собой слитый полипептид, содержащий каталитический домен GnTIII и домен локализации в комплексе Гольджи гетерологичного полипептида, присутствующего в комплексе Гольджи. В частности, домен локализации в комплексе Гольджи представляет собой домен локализации маннозидазы II или GnTI, наиболее предпочтительно домен локализации маннозидазы II. Альтернативно этому, домен локализации в комплексе Гольджи выбирают из группы, включающей: домен локализации маннозидазы I, домен локализации GnTII и домен коровой α1,6-фукозилтрансферазы. Методы создания указанных слитых полипептидов и их применение для получения антител с повышенными эффекторными функциями описаны в WO 2004/065540, предварительной заявке на патент США №60/495142 и в публикации заявки на патент США №2004/0241817, полное содержание которых специально включено в настоящее описание в качестве ссылки.
В контексте настоящего описания понятие «домен локализации в комплексе Гольджи» относится к аминокислотной последовательности расположенного в комплексе Гольджи полипептида, который ответствен за «заякоривание» полипептида в области, находящейся внутри комплекса Гольджи. Как правило, домены локализации содержат аминоконцевые «хвосты» фермента.
В контексте настоящего описания понятие «полипептид, обладающий ManII-активностью» относится к полипептидам, которые обладают способностью катализировать гидролиз концевых 1,3- и 1,6-связанных остатков α-D-маннозы в разветвленном промежуточном продукте, т.е. GlcNAcMan5GlcNAc2-меннозе, N-связанных олигосахаридов. Они включают полипептиды, которые обладают ферментативной активностью, сходной, но не обязательно идентичной с активностью α-маннозидазы II комплекса Гольджи, известной также как маннозилолигосахарид 1,3-1,6-α-маннозидаза II (КФ 3.2.1.114) согласно номенклатуре Комитета Международного союза по биохимии и молекулярной биологии (NC-IUBMB).
«Активирующий Fc-рецептор» представляет собой Fc-рецептор, который после взаимодействия с Fc-областью антитела осуществляет процесс передачи сигналов, которые стимулируют несущую рецептор клетку осуществлять эффекторные функции. Активирующие Fc-рецепторы включают FcγRIIIa (CD16a), FcγRI (CD64), FcγRIIa (CD32) и FcαRI (CD89).
Антитело-обусловленная клеточнозависимая цитотоксичность (ADCC) представляет собой иммунный механизм, приводящий к лизису сенсибилизированных антителом клеток-мишеней иммунными эффекторными клетками. Клетки-мишени представляют собой клетки, с которыми антитела или их фрагменты, содержащие Fc-область, специфически связываются, как правило, через область белка, которая является N-концевой относительно Fc-области. В контексте настоящего описания понятие «повышенная/пониженная ADCC» относится или к увеличению/снижению количества лизированных в данный момент времени клеток-мишеней при данной концентрации антитела в среде, окружающей клетки-мишени, путем указанного выше механизма ADCC, и/или к снижению/повышению концентрации антитела в среде, окружающей клетки-мишени, необходимой для достижения лизиса данного количества клеток-мишеней в данное время с помощью механизма ADCC. Повышение/понижение ADCC-активности сравнивают относительно ADCC, опосредуемой таким же антителом, которое получено с помощью такого же типа клеток-хозяев с использованием одинаковых стандартных методов получения, очистки, приготовления композиций и хранения (которые известны специалистам в данной области), но которые не подвергали инженерии. Например, повышение ADCC, опосредуемой антителом, полученным в клетках-хозяевах, сконструированных так, чтобы они имели измененную схему гликозилирования (например, так, чтобы они экспрессировали гликозилтрансферазу, GnTIII или другие гликозилтрансферазы), с помощью методов, указанных в настоящем описании, сравнивают с ADCC, опосредуемой таким же антителом, полученным с помощью такого же типа не подвергнутых инженерии клеток-хозяев.
Под «антителом, обладающим повышенной/пониженной антитело-обусловленной клеточнозависимой цитотоксичностью (ADCC)» подразумевается антитело, обладающее повышенной/пониженной ADCC при определении с помощью любого приемлемого метода, известного обычным специалистам в данной области. Один из приемлемых методов анализа in vitro ADCC заключается в том, что:
1) для анализа применяют клетки-мишени, для которых известно, что они экспрессируют антиген-мишень, распознаваемый антигенсвязывающим фрагментом антитела;
2) для анализа в качестве эффекторных клеток используют человеческие мононуклеарные клетки периферической крови (РВМС), выделенные из крови произвольно выбранных здоровых доноров;
3) анализ осуществляют с помощью следующего протокола:
I) РВМС выделяют с помощью стандартных методов центрифугирования в градиенте плотности и суспендируют 5×106 клеток/мл в RPMI-среде для культуры клеток;
II) выращивают клетки-мишени с помощью стандартных методов культивирования тканей, собирают на экспоненциальной фазе роста, когда жизнеспособность составляет более 90%, промывают в RPMI-среде для культуры клеток, меченной 100 мкКи51Cr, дважды промывают с помощью среды для культуры клеток и ресуспендируют в среде для культуры клеток с плотностью 105 клеток/мл;
III) переносят по 100 мкл указанной выше конечной суспензии клеток-мишеней в каждую лунку 96-луночного титрационного микропланшета;
IV) готовят серийные разведения с концентрацией антитела от 4000 до 0,04 нг/мл в среде для культуры клеток и добавляют 50 мкл образовавшихся растворов антитела к клеткам-мишеням в 96-луночном титрационном микропланшете, оценивая в трех повторностях различные концентрации антител, охватывающие весь указанный выше диапазон концентраций;
V) для создания контролей с максимальным высвобождением (MR) используют 3 дополнительные лунки в планшете, которые содержат меченые клетки-мишени, с добавлением 50 мкл 2 об. % водного раствора неионогенного детергента (Nonidet, фирма Sigma, Сент-Луис), вместо раствора антитела (указанного в п. IV, выше);
VI) для создания контролей со спонтанным высвобождением (SR), используют 3 дополнительные лунки в планшете, которые содержат меченые клетки-мишени, с добавлением 50 мкл RPMI-среды для культуры клеток вместо раствора антитела (указанного в п. IV, выше);
VII) затем 96-луночный титрационный микропланшет центрифугируют при 50×g в течение 1 мин и инкубируют в течение 1 ч при 4°С;
VIII) добавляют в каждую лунку по 50 мкл суспензии РВМС (указанной в п. I, выше), получая соотношение эффекторные клетки : клетки-мишени 25:1, и планшеты помещают в инкубатор в атмосферу, содержащую 5% СО2, и выдерживают при 37°С в течение 4 ч;
IX) собирают бесклеточный супернатант из каждой лунки и количественно оценивают выделенную в процессе эксперимента радиоактивность (ER) с помощью счетчика гамма-лучей;
X) рассчитывают процент специфического лизиса для каждой концентрации антитела согласно формуле (ER-MR)/(MR-SR)×100, где ER обозначает среднюю радиоактивность, рассчитанную (см. п. IX, выше) для указанной концентрации антитела, MR означает среднюю радиоактивность, рассчитанную (см. п. IX, выше) для MR-контролей (см. п. V, выше), а SR означает среднюю радиоактивность, рассчитанную (см. п. IX, выше) для SR-контролей (см. п. VI, выше);
4) «повышенную/пониженную ADCC» определяют либо как увеличение максимального процента специфического лизиса, обнаруженного для указанного выше диапазона концентраций антитела, и/или как снижение/повышение концентрации антитела, необходимой для достижения половины от максимального процента специфического лизиса, обнаруженного для указанного выше диапазона концентраций антитела. Повышение/понижение ADCC оценивают относительно измеренной тем же самым методом ADCC, опосредованной таким же антителом, продуцированным в том же типе клеток-хозяев, с использованием одних и тех же стандартных методов получения, очистки, приготовления композиций и хранения, которые хорошо известны специалистам в данной области, но который не подвергали инженерии.
В контексте настоящего описания понятие «комбинация» (и его грамматические вариации, такие как «объединять» или «объединение») относится к комбинациям иммуноконъюгата и антитела, предлагаемого в изобретении, в которой иммуноконъюгат и антитело находятся в одном и том же или различных контейнерах, в одной и той же или разных фармацевтических препаративных формах, которые вводят вместе или раздельно, вводят одновременно или последовательно, в любом порядке и вводят одинаковыми или различными путями, при условии, что иммуноконъюгат и антитело могут одновременно проявлять их биологические действия в организме, т.е. одновременно стимулировать эффекторные клетки. Например, «объединение» иммуноконъюгата и антитела, предлагаемого в изобретении, может подразумевать первоначальное введение иммуноконъюгата в конкретной фармацевтической препаративной форме с последующим введением антитела в другой фармацевтической препаративной форме или наоборот.
Понятие «эффективное количество» агента относится к количеству, необходимому для обеспечения физиологического изменения в клетке или ткани, в которую его вводят.
Понятие «терапевтически эффективное количество» агента, например, фармацевтической композиции, относится к количеству, эффективному при применении в дозах и в течение периодов времени, необходимых для достижения требуемого терапевтического или профилактического результата. Терапевтически эффективное количество агента, например, элиминирует, снижает, замедляет, минимизирует или предупреждает нежелательные явления заболевания. Терапевтически эффективное количество комбинации нескольких действующих веществ может представлять собой терапевтически эффективное количество каждого из действующих веществ. Альтернативно этому, для снижения побочных действий, вызываемых лечением, терапевтически эффективное количество комбинации нескольких действующих веществ может представлять собой количества индивидуальных действующих веществ, которые являются эффективными в отношении достижения аддитивного, сверхаддитивного или синергетического действия, и которые в комбинации являются терапевтически эффективными, но которые могут представлять собой субтерапевтические количества одного или нескольких действующих веществ при их индивидуальном применении.
«Индивидуум» или «субъект» представляет собой млекопитающее. Млекопитающие представляют собой (но, не ограничиваясь только ими) одомашненных животных (например, коровы, овцы, кошки, собаки и лошади), приматов (например, люди и приматы кроме человека, такие как мартышки), кроликов и грызунов (например, мыши и крысы). Предпочтительно индивидуум или субъект представляет собой человека.
Понятие «фармацевтическая композиция» относится к препарату, который находится в такой форме, что он обеспечивает биологическую активность входящего в его состав действующего вещества, которое должно обладать эффективностью, и который не содержит дополнительных компонентов, обладающих неприемлемой токсичностью для индивидуума, которому следует вводить композицию.
«Фармацевтически приемлемый носитель» относится к ингредиенту в фармацевтической композиции, отличному от действующего вещества, который является нетоксичным для индивидуума. Фармацевтически приемлемые носители включают (но, не ограничиваясь только ими) буфер, эксципиент, стабилизатор или консервант.
В контексте настоящего описания понятие «лечение» (и его грамматические вариации, такие как «лечить» или «процесс лечения») относится к клиническому вмешательству с целью изменения естественного течения болезни у индивидуума, подлежащего лечению, и его можно осуществлять либо для профилактики или в процессе развития клинической патологии. Требуемыми действиями лечения являются (но, не ограничиваясь только ими) предупреждение возникновения или рецидива болезни, облегчение симптомов, уменьшение любых прямых или косвенных патологических последствий болезни, предупреждение метастазов, снижение скорости развития болезни, облегчение или временное ослабление болезненного состояния и ремиссия или улучшение прогноза. В некоторых вариантах осуществления изобретения иммуноконъюгаты, предлагаемые в изобретении, применяют для задержки развития болезни или замедления прогрессирования болезни.
Понятие «листовка-вкладыш в упаковку» в контексте настоящего описания относится к инструкциям, которые обычно помещают в поступающие в продажу упаковки терапевтических продуктов и которые содержат информацию о показаниях, применении, дозе, пути введения, комбинированной терапии, противопоказаниях и/или мерах предосторожности при применении указанных терапевтических продуктов.
Иммуноконъюгаты
Иммуноконъюгаты, которые можно применять согласно изобретению, представляют собой полипептидные молекулы, которые содержат эффекторный фрагмент и антитело, сконструированное таким образом, чтобы оно обладало пониженной эффекторной функцией по сравнению с соответствующим не подвергнутым инженерии антителом.
Иммуноконъюгаты можно получать путем химической конъюгации или путем экспрессии эффекторного фрагмента с антителом, или путем экспрессии эффекторного фрагмента и антитела в виде слитого белка (см., например, Nakamura и Kubo, Cancer 80, 1997, сс. 2650-2655 и Becker и др., Рrос Nati Acad Sci USA 93, 1996, сс. 7826-7831). Для применения согласно настоящему изобретению, как правило, предпочтительными являются иммуноконъюгаты, экспрессируемые в виде слитых белков. Таким образом, в некоторых вариантах осуществления изобретения эффекторный фрагмент объединен амино- или карбоксиконцевой пептидной связью с антителом (т.е. иммуноконъюгат представляет собой слитый белок). В таких иммуноконъюгатах эффекторный фрагмент может, например, быть слит с тяжелой или легкой цепью иммуноглобулина. Наиболее предпочтительными согласно настоящему изобретению являются иммуноконъюгаты, содержащие полноразмерное антитело IgG-класса, прежде всего полноразмерное антитело IgG1-подкласса.
В одном из вариантов осуществления изобретения эффекторный фрагмент представляет собой одноцепочечный эффекторный фрагмент. В одном из вариантов осуществления изобретения эффекторный фрагмент представляет собой цитокин. Антитела и эффекторные фрагменты иммуноконъюгата включают антитела и эффекторные фрагменты, подробно описанные выше и ниже в настоящем описании. Антитело иммуноконъюгата может быть направлено против различных молекул-мишеней (например, антигенной детерминанты на белковой молекуле, которая экспрессируется на опухолевой клетке или в строме опухоли). Примерами антител являются (но, не ограничиваясь только ими) антитела, представленные в настоящем описании. Как указано в настоящем описании, наиболее предпочтительные иммуноконъюгаты, как правило, обладают одним или несколькими из следующих свойств: высокая специфичность действия, пониженная токсичность, хорошая технологичность и/или повышенная стабильность, прежде всего по сравнению с иммуноконъюгатами различных конфигурацией, мишенью которых являются те же самые антигенные детерминанты и которые несут одинаковые эффекторные фрагменты. Конкретные иммуноконъюгаты, предназначенные для применения согласно настоящему изобретению, описаны также в публикации РСТ WO 2012/146628, полное содержании которой включено в настоящее описание в качестве ссылки.
Форматы иммуноконъюгатов
Иммуноконъюгаты, описанные в публикации РСТ WO 2012/146628, содержат не более одного эффекторного фрагмента. Таким образом, в конкретном варианте осуществления изобретения иммуноконъюгат, предназначенный для применения согласно настоящему изобретению, содержит не более одного эффекторного фрагмента. В конкретном варианте осуществления изобретения эффекторный фрагмент представляет собой одноцепочечный эффекторный фрагмент. Антитело, входящее в иммуноконъюгаты, предлагаемые в изобретении, представляет собой, прежде всего полноразмерное антитело IgG-класса, более конкретно полноразмерное антитело IgG1-подкласса. В одном из вариантов осуществления изобретения антитело является человеческим. В других вариантах осуществления изобретения антитело является гуманизированным или химерным. В одном из вариантов осуществления изобретения антитело содержит человеческую Fc-область, более предпочтительно Fc-область человеческого IgG, наиболее предпочтительно Fc-область человеческого IgG1. Антитела, которые можно применять согласно изобретению, могут содержать константную область тяжелой гамма-1-цепи человеческого Ig, представленную в SEQ ID NO: 124 (т.е. антитела представляют собой человеческие антитела IgG1-подкласса).
В одном из вариантах осуществления изобретения эффекторный фрагмент объединен амино- или карбоксиконцевой пептидной связью с антителом. В одном из вариантов осуществления изобретения иммуноконъюгат практически состоит из эффекторного фрагмента и антитела, прежде всего антитела IgG-класса, более конкретно антитела IgG1-подкласса, которые сцеплены с помощью одного или нескольких пептидных линкеров. В конкретном варианте осуществления изобретения эффекторный фрагмент слит на его аминоконцевой аминокислоте с карбоксиконцевой аминокислотой одной из тяжелых цепей иммуноглобулина, необязательно через пептидный линкер.
В некоторых вариантах осуществления изобретения, прежде всего, в которых иммуноконъюгат содержит только один эффекторный фрагмент, антитело содержит в Fc-области модификацию, усиливающую гетеродимеризацию двух неидентичных тяжелых цепей иммуноглобулина. Сайт наиболее сильного белок-белкового взаимодействия двух полипептидных цепей Fc-области человеческого IgG находится в СН3-домене Fc-области. Таким образом, в одном из вариантов осуществления изобретения указанная модификация находится в СН3-домене Fc-области. В конкретном варианте осуществления изобретения указанная модификация представляет собой модификацию типа «knob-in-hole», которая включает модификацию, приводящую к образованию «выступа» в одной из тяжелых цепей иммуноглобулина и к образованию «впадины» в другой одной из тяжелых цепей иммуноглобулина. Технология «knob-into-hole» описана, например, в US №5731168; US №7695936; у Ridgway и др., Prot Eng 9, 1996, сс. 617-621 и Carter, J Immunol Meth 248, 2001, cc. 7-15). В целом, метод включает интродукцию выпуклости («выступ») на поверхности раздела первого полипептида и соответствующей полости («впадина») в поверхности раздела второго полипептида, в результате выпуклость может помещаться в полость, усиливая тем самым образование гетеродимера и препятствуя образованию гомодимера. Выпуклости конструируют путем замены аминокислот с небольшими боковыми цепями на поверхности раздела первого полипептида на аминокислоты с более крупными боковыми цепями (например, на тирозин или триптофан). Компенсирующие полости идентичного или сходного размера с выпуклостями конструируют в поверхности раздела второго полипептида путем замены аминокислот с крупными боковыми цепями на аминокислоты с менее крупными боковыми цепями (например, аланин или треонин). Выпуклость и полость можно создавать путем изменения нуклеиновой кислоты, кодирующей полипептиды, например, с помощью сайтнаправленного мутагенеза, или посредством синтеза пептидов. В конкретном варианте осуществления изобретения модификация, приводящая к получению «выступа», представляет собой аминокислотную замену T366W в одной из двух тяжелых цепей иммуноглобулина, а модификация, приводящая к получению «впадины», представляет собой аминокислотные замены T366S, L368A и Y407V в другой одной из двух тяжелых цепей иммуноглобулина (EU нумерация). В более конкретном варианте осуществления изобретения тяжелая цепь иммуноглобулина, содержащая модификацию, приводящую к получению «выступа», дополнительно содержит аминокислотную замену S354C, а тяжелая цепь иммуноглобулина, содержащая модификацию, приводящую к образованию «впадины», дополнительно содержит аминокислотную замену Y349C. Интродукция этих двух остатков цистеина приводит к образованию дисульфидного мостика между двумя тяжелыми цепями, дополнительно стабилизирующего димер (Carter, J Immunol Methods 248, 2001, cc. 7-15).
В конкретном варианте осуществления изобретения эффекторный фрагмент слит с карбоксиконцевой аминокислотой тяжелой цепи иммуноглобулина, которая содержит модификацию, приводящую к образованию «выступа».
В альтернативном варианте осуществления изобретения модификация, усиливающая гетеродимеризацию двух неидентичных полипептидных цепей, представляет собой модификацию, опосредующую определяемые электростатическим действием воздействия, например, описанные в публикации РСТ WO 2009/089004. В целом, указанный метод включает замену одного или нескольких аминокислотных остатков на поверхности раздела двух полипептидных цепей на заряженные аминокислотные остатки, в результате чего образование гомодимера становится электростатически невыгодным, а гетеродимеризация становится электростатически выгодной.
Fc-область придает иммуноконъюгату предпочтительные фармакокинетические свойства, включая продолжительное время полужизни в сыворотке, что обеспечивает хорошее накопление в ткани-мишени и предпочтительное соотношение распределений в ткани-крови. Однако в то же время она может приводить к нежелательной направленности иммуноконъюгата к клеткам, которые экспрессируют Fc-рецепторы, а не к предпочтительным несущим антиген клеткам. Кроме того, совместная активация путей передачи сигналов Fc-рецептора может приводить к высвобождению цитокинов, что в сочетании с эффекторным фрагментом и продолжительным временем полужизни иммуноконъюгата, приводит к избыточной активации цитокиновых рецепторов и серьезным побочным действиям при системном введении. В соответствии с этим описано, что с иммуноконъюгатами, содержащими канонический IgG-IL-2, связаны реакции на инфузию (см., например. King и др., J Clin Oncol 22, 2004, сс. 4463-4473).
Таким образом, антитело, входящее в иммуноконъюгат, создают таким образом, чтобы оно обладало пониженной эффекторной функцией о сравнению с соответствующим не подвергнутым инженерии антителом. В конкретных вариантах осуществления изобретения пониженная эффекторная функция представляет собой пониженную способность связываться с активирующим Fc-рецептором. В одном из указанных вариантов осуществления изобретения антитело содержит в его Fc-области одну или несколько аминокислотных мутаций, которые снижают аффинность связывания иммуноконъюгата с активирующим Fc-рецептором. Как правило, одна или несколько одинаковых аминокислотных мутаций присутствует(ют) в каждой из двух тяжелых цепей иммуноглобулина. В одном из вариантов осуществления изобретения указанная аминокислотная мутация снижает аффинность связывания иммуноконъюгата с активирующим Fc-рецептором по меньшей мере в 2 раза, по меньшей мере в 5 раз или по меньшей мере в 10 раз. Согласно вариантам осуществления изобретения, в которых имеет место более одной аминокислотной мутации, которые снижают аффинность связывания иммуноконъюгата с активирующим Fc-рецептором, комбинация указанных аминокислотных мутаций может снижать аффинность связывания иммуноконъюгата с активирующим Fc-рецептором по меньшей мере в 10 раз, по меньшей мере в 20 раз или даже по меньшей мере в 50 раз. В одном из вариантов осуществления изобретения иммуноконъюгат, содержащий сконструированное антитело, характеризуется аффинностью, составляющей менее чем 20%, в частности, менее чем 10%, более предпочтительно менее чем 5% от аффинности связывания с активирующим Fc-рецептором, характерной для иммуноконъюгата, содержащего не подвергнутое инженерии антитело. В конкретном варианте осуществления изобретения активирующий Fc-рецептор представляет собой Fcγ-рецептор, более конкретно FcγRIIIa-, FcγRI- или FcγRIIa-рецептор. Предпочтительно уменьшается связывание с каждым из этих рецепторов. Согласно некоторым вариантам осуществления изобретения снижается также аффинность связывания с компонентом системы комплемента, в частности, аффинность связывания с C1q. Согласно одному из вариантов осуществления изобретения не снижается аффинность связывания с неонатальным Fc-рецептором (FcRn). Практически такое же связывание с FcRn, т.е. сохранение аффинности связывания антитела с указанным рецептором, достигается, когда антитело (или иммуноконъюгат, содержащий указанное антитело) характеризуется аффинностью связывания с FcRn, составляющей более чем примерно 70% от аффинности связывания с FcRn не подвергнутого инженерии антитела (или иммуноконъюгата, содержащего не подвергнутую инженерии форму антитела). Антитела или иммуноконъюгаты, содержащие указанные антитела, могут характеризоваться аффинностью, составляющей более чем примерно 80% и даже более чем примерно 90% от указанной выше аффинности. В одном из вариантов осуществления изобретения аминокислотная мутация представляет собой аминокислотную замену. В одном из вариантов осуществления изобретения антитело, прежде всего человеческое антитело IgG1-подкласса, содержит аминокислотную замену в положении Р329 в тяжелой цепи иммуноглобулина (EU нумерация). В более конкретном варианте осуществления изобретения аминокислотная замена представляет собой Р329А или P329G, прежде всего P329G. В одном из вариантов осуществления изобретения антитело содержит дополнительную аминокислотную замену в положении, выбранном из S228, Е233, L234, L235, N297 и Р331, в тяжелой цепи иммуноглобулина. В более конкретном варианте осуществления изобретения дополнительная аминокислотная замена представляет собой S228P, Е233Р, L234A, L235A, L235E, N297A, N297D или P331S. В конкретном варианте осуществления изобретения антитело содержит аминокислотные замены в положениях Р329, L234 и L235 в тяжелой цепи иммуноглобулина (EU нумерация). В более конкретном варианте осуществления изобретения антитело содержит аминокислотные замены L234A, L235A и P329G (LALA P329G) в тяжелой цепи иммуноглобулина. Такая комбинация аминокислотных замен практически полностью аннулирует связывание с Fcγ-рецептором молекулы человеческого IgG и, как следствие, понижает эффекторную функцию, включая антитело-обусловленную клеточно-зависимую цитотоксичность (ADCC), как это описано в публикации WO 2012/130831, которая полностью включена в настоящее описание в качестве ссылки. В WO 2012/130831 описаны также методы получения указанных мутантных антител и методы определения их свойств, таких как связывание с Fc-рецептором или эффекторные функции.
Мутантные антитела можно получать с помощью аминокислотной делеции, замены, инсерции или модификации, используя генетические или химические методы, хорошо известные в данной области. Генетические методы могут включать сайтспецифический мутагенез кодирующей последовательности ДНК, ПЦР, синтез генов и т.п. Правильность нуклеотидных замен можно подтверждать, например, секвенированием.
Связывание с Fc-рецепторами можно легко определять, например, с помощью ELISA или с помощью поверхностного плазмонного резонанса (SPR) с использованием стандартной инструментальной базы, такой как устройство BIAcore (фирма GE Healthcare), и Fc-рецепторов, которые можно получать путем рекомбинантной экспрессии. В настоящем описании представлен приемлемый указанный анализ связывания. Альтернативно этому, аффинность связывания антител или иммуноконъюгатов, содержащих антитело, которое связывается с Fc-рецепторами, можно оценивать, используя клеточные линии, которые, как известно, экспрессируют конкретные Fc-рецепторы, такие как NK-клетки, экспрессирующие FcγIIIa-рецептор.
В некоторых вариантах осуществления изобретения антитело иммуноконъюгата конструируют так, чтобы оно обладало пониженной эффекторной функцией, в частности, пониженной ADCC, по сравнению с не подвергнутым инженерии антителом.
Эффекторную функцию антитела или иммуноконъюгата, содержащего антитело, можно измерять методами, известными в данной области. Приемлемый анализ для оценки ADCC представлен в настоящем описании. Другие примеры анализов in vitro, предназначенных для оценки ADCC-активности представляющей интерес молекулы, описаны в US №5500362; у Hellstrom и др., Proc Nati Acad Sci USA 83, 1986, сс. 7059-7063 и Hellstrom и др., Proc Nati Acad Sci USA 82, 1985, сс. 1499-1502; US №5821337; у Bruggemann и др., J Exp Med 166, 1987, сс. 1351-1361. Альтернативно этому, можно применять методы, основанные на нерадиоактивном анализе (см., например, ACTI™ - нерадиоактивный анализ цитотоксичности с помощью проточной цитометрии (фирма CellTechnology, Inc. Маунтин-Вью, шт. Калифорния); и CytoTox 96® - нерадиоактивный анализ цитотоксичности (фирма Promega, Мэдисон, шт. Висконсин)). Приемлемыми эффекторными клетками для таких анализов являются мононуклеарные клетки периферической крови (РВМС) и естественные клетки-киллеры (NK). В альтернативном или дополнительном варианте ADCC-активность представляющей интерес молекулы можно оценивать in vivo, например, например, с использованием созданных на животных моделей, описанных у Clynes и др., Proc Nati Acad Sci USA 95, 1998, сс. 652-656.
В некоторых вариантах осуществления изобретения изменяют связывание антитела с компонентом системы комплемента, в частности с C1q. Таким образом, в некоторых вариантах осуществления изобретения, в которых антитело конструируют так, чтобы оно обладало пониженной эффекторной функцией, указанная пониженная эффекторная функция включает пониженную CDC. Можно осуществлять анализы связывания C1q для решения вопроса о том, может ли иммуноконъюгат связываться с C1q и, как следствие, обладает ли он CDC-активностью (см., например, анализы связывания с C1q и С3с с помощью ELISA, описанные в WO 2006/029879 и WO 2005/100402). Для оценки активации комплемента можно осуществлять анализ CDC (см., например, Gazzano-Santoro и др., J Immunol Methods 202, 1996, с. 163; Cragg и др., Blood 101, 2003, сс. 1045-1052 и Cragg и Glennie, Blood 103, 2004, сс. 2738-2743).
В некоторых вариантах осуществления изобретения иммуноконъюгат содержит один или несколько сайтов протеолитического расщепления, локализованных между эффекторным фрагментом и антителом. Компоненты иммуноконъюгата можно соединять непосредственно или через различные линкеры, прежде всего пептидные линкеры, содержащие одну или несколько аминокислот, как правило, примерно 2-20 аминокислот, которые указаны в настоящем описании или известны в данной области. Приемлемыми неиммуногенными пептидными линкерами являются, например, пептидные линкеры (G4S)n, (SG4)n or G4(SG4)n, в которых n, как правило, обозначает число между 1 и 10, как правило, между 2 и 4.
Антитела иммуноконъюгатов
Входящее в иммуноконъюгат антитело, предлагаемое в изобретении, как правило, представляет собой молекулу иммуноглобулина, которая связывается со специфической антигенной дереминантной и обладает способностью направлять субстанцию, с которой оно связано (например, эффекторный фрагмент) к сайту-мишени, например, к специфическому типу опухолевой клетки или стромы опухоли, которая несет антигенную детерминанту. Иммуноконъюгат может связываться с антигенными детерминантами, которые присутствуют, например, на поверхности опухолевых клеток, на поверхности инфицированных вирусом клеток, на поверхности других больных клеток, которые находятся в свободном состоянии в сыворотке крови и/или во внеклеточном матриксе (ЕСМ).
Примерами опухолевых антигенов являются (но, не ограничиваясь только ими) MAGE, MART-1/Melan-A, gp100, дипептидилпептидаза IV (DPPIV), белок, связывающий аденозиндеаминазу (ADAbp), циклофилин 0, антиген, ассоциированный с колоректальным раком (CRC)-C017-1A/GA733, карциноэмбриональный антиген (СЕА) и его иммуногенные эпитопы САР-1 и CAP-2, etv6, aml1, простатический антиген (PSA) и его иммуногенные эпитопы PSA-1, PSA-2 и PSA-3, простатический специфический мембранный антиген (PSMA), Т-клеточный рецептор/CD3-зета-цепь, семейство MAGE опухолевых антигенов (например, MAGE-A1, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-A5, MAGE-A6, MAGE-A7, MAGE-A8, MAGE-A9, MAGE-A10, MAGE-АН, MAGE-А12, MAGE-Xp2 (MAGE-B2), MAGE-Хр3 (MAGE-B3), MAGE-Xp4 (MAGE-B4), MAGE-C1, MAGE-C2, MAGE-C3, MAGE-C4, MAGE-C5), семейство GAGE опухолевых антигенов (например, GAGE-1, GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE-7, GAGE-8, GAGE-9), BAGE, RAGE, LAGE-1, NAG, GnT-V, MUM-1, CDK4, тирозиназа, р53, семейство MUC, HER2/neu, p21ras, RCAS1, α-фетопротеин, Е-кадхерин, α-катенин, β-катенин и γ-катенин, p120ctn, gp100 Pmel117, FRAME, NY-ESO-1, cdc27, белок аденоматозного полипоза coli (АРС), фодрин, коннексин 37, Ig-идиотип, p15, gp75, ганглиозиды GM2 и GD2, вирусные продукты, такие как белки человеческого вируса папилломы, семейство Smad опухолевых антигенов, lmp-1, P1A, кодируемый EBV ядерный антиген (EBNA)-l, гликогенфосфолипаза головного мозга, SSX-1, SSX-2 (НОМ-MEL-40), SSX-1, SSX-4, SSX-5, SCP-1 и СТ-7 и с-erbB-2. Примерами вирусных антигенов являются (но, не ограничиваясь только ими) гемагглютинин вируса гриппа, LMP-1 вируса Эпштейна-Барра, гликопротеин вируса гепатита С Е2, gp160 ВИЧ, и gp120 ВИЧ. Примерами антигенов ЕСМ являются (но, не ограничиваясь только ими) синдекан, гепараназа, интегрины, остеопонтин, белки семейства link, кадхерины, ламинин, ламинин типа EGF, лектин, фибронектин, белки семейства notch, тенасцин и матриксин. Иммуноконъюгаты, предлагаемые в изобретении, могут связываться со следующими специфическими антигенами клеточной поверхности, включающими (но, не ограничиваясь только ими): FAP, Her2, EGFR, IGF-1R, CD2 (Т-клеточный поверхностный антиген), CD3 (гетеромультимер, ассоциированный с TCR), CD22 (В-клеточный рецептор), CD23 (низкоаффинный IgE-рецептор), CD25 (α цепь IL-2 рецептора), CD30 (цитокиновый рецептор), CD33 (поверхностный антиген клеток миелоидного ряда), CD40 (рецептор фактора некроза опухолей), IL-6R (1b6-рецептор), CD20, MCSP, c-Met, содержащий CUB-домен белок-1 (CDCP1) и PDGFβR (рецептор тромбоцитарного фактора роста β).
В некоторых вариантах осуществления изобретения антигенсвязывающий фрагмент направлен против антигена, присутствующего на опухолевой клетке или в окружении опухолевой клетки. В конкретном варианте осуществления изобретения антигенсвязывающий фрагмент направлен против антигена, выбранного из группы, включающей фибробласт-активирующий белок (FAP), А1-домен тенасцина-С (TNC A1), A2-домен тенасцина-С (TNC A2), экстрадомен В фибронектина (EDB), карциноэмбриональный антиген (СЕА) и ассоциированный с меланомой хондроитинсульфат-протеогликан (MCSP).
Антитело может представлять собой антитело любого типа или его фрагмент, который сохраняет специфичность связывания с антигенной детерминантой и содержит Fc-область. В одном из вариантов осуществления изобретения антитело представляет собой полноразмерное антитело. Наиболее предпочтительными антителами являются иммуноглобулины IgG-класса, в частности, IgG1-подкласса.
В одном из вариантов осуществления изобретения иммуноконъюгат содержит антитело, которое является специфическим в отношении A1- и/или А4-домена тенасцина (TNC-A1 или TNC-A4, или TNC-A1/A4). В конкретном варианте осуществления изобретения антитело иммуноконъюгата содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо SEQ ID NO: 8, либо SEQ ID NO: 9, либо их сохраняющим функциональность вариантам. В другом конкретном варианте осуществления изобретения антитело иммуноконъюгата содержит последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо SEQ ID NO: 6, либо SEQ ID NO: 7, либо их сохраняющим функциональность вариантам. В более конкретном варианте осуществления изобретения антитело иммуноконъюгата содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо SEQ ID NO: 8, либо SEQ ID NO: 9, либо их сохраняющим функциональность вариантам, и последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо SEQ ID NO: 6, либо SEQ ID NO: 7, либо их сохраняющим функциональность вариантам.
В одном из вариантов осуществления изобретения иммуноконъюгат содержит антитело, которое является специфическим в отношении А2-домена тенасцина (TNC-A2). В конкретном варианте осуществления изобретения антитело иммуноконъюгата содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 5, SEQ ID NO: 71, SEQ ID NO: 73, SEQ ID NO: 75, SEQ ID NO: 77, SEQ ID NO: 79, SEQ ID NO: 81, SEQ ID NO: 83 и SEQ ID NO: 85, или их сохраняющим функциональность вариантам. В другом конкретном варианте осуществления изобретения антитело иммуноконъюгата содержит последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 3, SEQ ID NO: 4; SEQ ID NO: 70, SEQ ID NO: 72, SEQ ID NO: 74, SEQ ID NO: 76, SEQ ID NO: 78, SEQ ID NO: 80, SEQ ID NO: 82 и SEQ ID NO: 84, или их сохраняющим функциональность вариантам. В более конкретном варианте осуществления изобретения антитело иммуноконъюгата содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 5, SEQ ID NO: 71, SEQ ID NO: 73, SEQ ID NO: 75, SEQ ID NO: 77, SEQ ID NO: 79, SEQ ID NO: 81, SEQ ID NO: 83 и SEQ ID NO: 85, или их сохраняющим функциональность вариантам, и последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 3, SEQ ID NO: 4; SEQ ID NO: 70, SEQ ID NO: 72, SEQ ID NO: 74, SEQ ID NO: 76, SEQ ID NO: 78, SEQ ID NO: 80, SEQ ID NO: 82 и SEQ ID NO: 84, или их сохраняющим функциональность вариантам.
В одном из вариантов осуществления изобретения иммуноконъюгат содержит антитело, которое является специфическим в отношении фибробласт-активирующего белка (FAP). В конкретном варианте осуществления изобретения антитело иммуноконъюгата содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, состоящей из SEQ ID NO: 12, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 21, SEQ ID NO: 23, SEQ ID NO: 25, SEQ ID NO: 27, SEQ ID NO: 29, SEQ ID NO: 31, SEQ ID NO: 33, SEQ ID NO: 35, SEQ ID NO: 37, SEQ ID NO: 39, SEQ ID NO: 41, SEQ ID NO: 43, SEQ ID NO: 45, SEQ ID NO: 47, SEQ ID NO: 49, SEQ ID NO: 51, SEQ ID NO: 53, SEQ ID NO: 55, SEQ ID NO: 57, SEQ ID NO: 59, SEQ ID NO: 61, SEQ ID NO: 63, SEQ ID NO: 65, SEQ ID NO: 67 и SEQ ID NO: 69, или их сохраняющим функциональность вариантам. В другом конкретном варианте осуществления изобретения антитело иммуноконъюгата содержит последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, состоящей из: SEQ ID N0: 10, SEQ ID NO: 11, SEQ ID NO: 13, SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 24, SEQ ID NO: 26, SEQ ID NO: 28, SEQ ID NO: 30, SEQ ID NO: 32, SEQ ID NO: 34, SEQ ID NO: 36, SEQ ID NO: 38, SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66 и SEQ ID NO: 68, или их сохраняющим функциональность вариантам. В более конкретном варианте осуществления изобретения антитело иммуноконъюгата содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, состоящей из SEQ ID NO: 12, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 21, SEQ ID NO: 23, SEQ ID NO: 25, SEQ ID NO: 27, SEQ ID NO: 29, SEQ ID NO: 31, SEQ ID NO: 33, SEQ ID NO: 35, SEQ ID NO: 37, SEQ ID NO: 39, SEQ ID NO: 41, SEQ ID NO: 43, SEQ ID NO: 45, SEQ ID NO: 47, SEQ ID NO: 49, SEQ ID NO: 51, SEQ ID NO: 53, SEQ ID NO: 55, SEQ ID NO: 57, SEQ ID NO: 59, SEQ ID NO: 61, SEQ ID NO: 63, SEQ ID NO: 65, SEQ ID NO: 67 и SEQ ID NO: 69, или их сохраняющим функциональность вариантам, и последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, состоящей из: SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 13, SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 24, SEQ ID NO: 26, SEQ ID NO: 28, SEQ ID NO: 30, SEQ ID NO: 32, SEQ ID NO: 34, SEQ ID NO: 36, SEQ ID NO: 38, SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66 и SEQ ID NO: 68, или их сохраняющим функциональность вариантам. В другом конкретном варианте осуществления изобретения антитело иммуноконъюгата содержит последовательность вариабельной области тяжелой цепи SEQ ID NO: 12 и последовательность вариабельной области легкой цепи SEQ ID NO: 11. В другом конкретном варианте осуществления изобретения антитело иммуноконъюгата содержит последовательность вариабельной области тяжелой цепи SEQ ID NO: 17 и последовательность вариабельной области легкой цепи SEQ ID NO: 16. В другом конкретном варианте осуществления изобретения антитело иммуноконъюгата содержит последовательность вариабельной области тяжелой цепи SEQ ID NO: 47 и последовательность вариабельной области легкой цепи SEQ ID NO: 46. В другом конкретном варианте осуществления изобретения антитело иммуноконъюгата содержит последовательность вариабельной области тяжелой цепи SEQ ID NO: 63 и последовательность вариабельной области легкой цепи SEQ ID NO: 62. В другом конкретном варианте осуществления изобретения антитело иммуноконъюгата содержит последовательность вариабельной области тяжелой цепи SEQ ID NO: 67 и последовательность вариабельной области легкой цепи SEQ ID NO: 66. В другом конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в настоящем изобретении, содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 125 или ее сохраняющим функциональность вариантам, и полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% or 100% идентична SEQ ID NO: 126 или ее сохраняющим функциональность вариантам, и полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 129 или ее сохраняющим функциональность вариантам. В другом конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в настоящем изобретении, содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 127 или ее сохраняющим функциональность вариантам, полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 128 или ее сохраняющим функциональность вариантам, и полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 129 или ее сохраняющим функциональность вариантам. В другом конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в настоящем изобретении, содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 130 или ее сохраняющим функциональность вариантам, полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 131 или ее сохраняющим функциональность вариантам, и полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 132 или ее сохраняющим функциональность вариантам.
В одном из вариантов осуществления изобретения иммуноконъюгат содержит антитело, которое является специфическим в отношении ассоциированного с меланомой хондроитинсульфат-протеогликана (MCSP). В конкретном варианте осуществления изобретения антитело иммуноконъюгата содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности либо SEQ ID NO: 86, либо SEQ ID NO: 122, либо их сохраняющим функциональность вариантам. В другом конкретном варианте осуществления изобретения антитело иммуноконъюгата содержит последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности либо SEQ ID NO: 87, либо SEQ ID NO: 123, либо их сохраняющим функциональность вариантам. В более конкретном варианте осуществления изобретения антитело иммуноконъюгата содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательность либо SEQ ID NO: 86, либо SEQ ID NO: 122, либо их сохраняющим функциональность вариантам, и последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% or 100% идентична последовательности либо SEQ ID NO: 87, либо SEQ ID NO: 123, либо их сохраняющим функциональность вариантам. В более конкретном варианте осуществления изобретения антитело иммуноконъюгата содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 86, и последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 87. В другом конкретном варианте осуществления изобретения антитело иммуноконъюгата содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 122, и последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 123.
В одном из вариантов осуществления изобретения иммуноконъюгат содержи антитело, которое является специфическим в отношении карциноэмбрионального антигена (СЕА). В конкретном варианте осуществления изобретения антитело иммуноконъюгата содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 114 или ее сохраняющему функциональность варианту. В другом конкретном варианте осуществления изобретения антитело иммуноконъюгата содержит последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 115 или ее сохраняющему функциональность варианту. В более конкретном варианте осуществления изобретения антитело иммуноконъюгата содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 114 или ее сохраняющему функциональность варианту, и последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 115 или ее сохраняющему функциональность варианту. В другом конкретном варианте осуществления изобретения иммуноконъюгат, предлагаемый в настоящем изобретении, содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 136 или ее сохраняющему функциональность варианту, полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 137 или ее сохраняющему функциональность варианту, и полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 138 или ее сохраняющему функциональность варианту.
Иммуноконъюгаты, предлагаемые в изобретении, включают иммуноконъюгаты, содержащие последовательности, которые по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичны последовательностям, представленным в SEQ ID NO: 3-87, 108-132 и 136-138, включая их функциональные фрагменты или варианты. Иммуноконъюгаты, предлагаемые в изобретении, содержат также антитела, содержащие последовательности SEQ ID NO: 3-127 с консервативными аминокислотными заменами. Как должно быть очевидно, в последовательностях SEQ ID NO: 126, 128, 131, 134 и 137 последовательность представленного в настоящем описании мутанта IL-2 (см. SEQ ID NO: 2) можно заменять на последовательность человеческого IL-2 (см. SEQ ID NO: 1).
Эффекторные фрагменты иммуноконъюгатов
Эффекторные фрагменты, предназначенные для применения в изобретении, представляют собой, как правило, полипептиды, которые влияют на клеточную активность, например, через пути трансдукции сигналов. Таким образом, эффекторный фрагмент иммуноконъюгата, применяемого согласно изобретению, может быть ассоциирован с опосредуемой рецептором передачей сигналов, что приводит к передаче сигнала от наружной части клеточной мембраны, модулируя ответ в клетке. Например, эффекторный фрагмент иммуноконъюгата может представлять собой цитокин. В конкретном варианте осуществления изобретения эффекторный фрагмент представляет собой одноцепочечный эффекторный фрагмент, представленный в настоящем описании. В одном из вариантов осуществления изобретения эффекторный фрагмент, как правило, одноцепочечный эффекторный фрагмент иммуноконъюгата, предлагаемого в изобретении, представляет собой цитокин, выбранный из группы, состоящей из: IL-2, GM-CSF, IFN-α и IL-12. В одном из вариантов осуществления изобретения эффекторный фрагмент представляет собой IL-2. В другом варианте осуществления изобретения одноцепочечный эффекторный фрагмент иммуноконъюгата представляет собой цитокин, выбранный из группы, состоящей из: IL-8, MIP-1α, MIP-1β и TGF-β.
В одном из вариантов осуществления изобретения эффекторный фрагмент, прежде всего одноцепочечный эффекторный фрагмент иммуноконъюгата, представляет собой IL-2. В конкретном варианте осуществления изобретения эффекторный фрагмент IL-2 может обусловливать один или несколько клеточных ответов, выбранных из группы, включающей: пролиферацию активированного Т-лимфоцита, дифференцировку активированного Т-лимфоцита, активность цитотоксической Т-клетки (CTL), пролиферацию активированной В-клетки, дифференцировку активированной В-клетки, пролиферацию естественной клетки-киллера (NK), дифференцировку NK-клетки, секрецию цитокинов активированной Т-клеткой или NK-клеткой и противоопухолевую цитотоксичность NK/лимфоцит-активированных клеток-киллеров (LAK). В некоторых вариантах осуществления изобретения эффекторный фрагмент IL-2 представляет собой мутантный эффекторный фрагмент IL-2, содержащий по меньшей мере одну аминокислотную мутацию, которая снижает или элиминирует аффинность мутантного эффекторного фрагмента IL-2 к α-субъединице IL-2-рецептора (которую обозначают также как CD25), но сохраняет аффинность мутантного эффекторного фрагмента IL-2 к IL-2-рецептору с промежуточной аффинностью (который состоит из β- и γ-субъединиц IL-2-рецептора), по сравнению с немутантным эффекторным фрагментом IL-2. В одном из вариантов осуществления изобретения аминокислотные мутации представляют собой аминокислотные замены. В конкретном варианте осуществления изобретения мутантный эффекторный фрагмент IL-2 содержит одну, две или три аминокислотные замены в одной, двух или трех положении(ях), выбранных из положений, которые соответствуют остаткам 42, 45 и 72 человеческого IL-2 (SEQ ID NO: 1). В более конкретном варианте осуществления изобретения мутантный эффекторный фрагмент IL-2 содержит три аминокислотные замены в положениях, соответствующих остаткам 42, 45 и 72 человеческого IL-2. В еще более конкретном варианте осуществления изобретения, мутантный эффекторный фрагмент IL-2 представляет собой человеческий IL-2, содержащий аминокислотные замены F42A, Y45A и L72G. В одном из вариантов осуществления изобретения мутантный эффекторный фрагмент IL-2 дополнительно содержит аминокислотную мутацию в положении, соответствующем положению 3 человеческого IL-2, которая элиминирует сайт 0-гликозилирования IL-2. Конкретно, указанная дополнительная аминокислотная мутация представляет собой аминокислотную замену, приводящую к замещению остатка треонина на остаток аланина. Последовательность четырехмутантного (QM) IL-2, содержащего аминокислотные замены Т3А, F42A, Y45A и L72G, представлена в SEQ ID NO: 2. Приемлемые мутантные молекулы IL-2 описаны более подробно в публикации PCT WO 2012/107417.
Мутантные молекулы IL-2, которые можно применять в качестве эффекторных фрагментах в иммуноконъюгатах, можно получать путем делеции, инсерции или модификации, используя генетические или химические методы, известные в данной области. Генетические методы могут включать сайтнаправленный мутагенез, ПЦР, синтез генов и т.п. Правильность нуклеотидных замен можно подтверждать, например, секвенированием. Пригодная для этой цели нуклеотидная последовательность нативного IL-2 описана в Taniguchi и др.. Nature 302, 1983, сс. 305-310), а нуклеиновую кислоту, кодирующую человеческий IL-2, можно получать из публичных депозитариев, таких как Американская коллекция типовых культур (Роквилл, шт. Мэриленд). Приведенная в качестве примера последовательность человеческого IL-2 представлена в SEQ ID NO: 1. Замена или инсерция может затрагивать встречающиеся в естественных условиях, а также не встречающиеся в естественных условиях аминокислотные остатки. Для аминокислотной модификации применяют хорошо известные методы химической модификации, такие как добавление или удаление сайтов гликозилирования или присоединений углеводов и т.п.
В одном из вариантов осуществления изобретения эффекторный фрагмент, прежде всего одноцепочечный эффекторный фрагмент иммуноконъюгата, представляет собой GM-CSF. В конкретном варианте осуществления изобретения эффекторный фрагмент GM-CSF может вызывать пролиферацию и/или дифференцировку гранулоцита, моноцита или дендритной клетки. В одном из вариантов осуществления изобретения эффекторный фрагмент, прежде всего одноцепочечный эффекторный фрагмент иммуноконъюгата, представляет собой IFN-α. В конкретном варианте осуществления изобретения эффекторный фрагмент IFN-α может вызывать один или несколько клеточных ответов, выбранных из группы, включающей: ингибирование вирусной репликации в зараженной вирусом клетке и повышающую регуляцию экспрессии молекул главного комплекса гистосовместимости I (ГКГ I). В другом конкретном варианте осуществления изобретения эффекторный фрагмент IFN-α может ингибировать пролиферацию опухолевой клетки. В одном из вариантов осуществления изобретения эффекторный фрагмент, прежде всего одноцепочечный эффекторный фрагмент иммуноконъюгата, представляет собой IL-12. В конкретном варианте осуществления изобретения эффекторный фрагмент IL-12 может вызывать один или несколько клеточных ответов, выбранных из группы, включающей: пролиферация NK-клетки, дифференцировка NK-клетки, пролиферация Т-клетки и дифференцировка Т-клетки. В одном из вариантов осуществления изобретения эффекторный фрагмент, прежде всего одноцепочечный эффекторный фрагмент иммуноконъюгата, представляет собой IL-8. В конкретном варианте осуществления изобретения эффекторный фрагмент IL-8 может вызывать хемотаксис нейтрофилов. В одном из вариантов осуществления изобретения эффекторный фрагмент, прежде всего одноцепочечный эффекторный фрагмент иммуноконъюгата, представляет собой MIP-1α. В конкретном варианте осуществления изобретения эффекторный фрагмент MIP-1α может вызывать хемотаксис моноцитов и Т-лимфоцитов. В одном из вариантов осуществления изобретения эффекторный фрагмент, прежде всего одноцепочечный эффекторный фрагмент иммуноконъюгата, представляет собой MIP-1β. В конкретном варианте осуществления изобретения эффекторный фрагмент MIP-1β может вызывать хемотаксис моноцитов и Т-лимфоцитов. В одном из вариантов осуществления изобретения эффекторный фрагмент, прежде всего одноцепочечный эффекторный фрагмент иммуноконъюгата, представляет собой TGF-β. В конкретном варианте осуществления изобретения эффекторный фрагмент TGF-β может вызывать один или несколько клеточных ответов, выбранных из группы, включающей: хемотаксис моноцитов, хемотаксис макрофагов, повышающую регуляцию экспрессии IL-1 в активированных макрофагах и повышающую регуляцию экспрессии IgA в активированных В-клетках.
Антитела для комбинации с иммуноконъюгатами
Согласно изобретению антитела, предназначенные для применения в комбинации с иммуноконъюгатами, конструируют таким образом, чтобы они обладали повышенной эффекторной функцией. Антитела, которые согласно настоящему изобретению, применяют в комбинации с иммуноконъюгатами, включают антитела или фрагменты антител, которые связываются со специфической антигенной детерминантной, например, специфическим опухолевым антигеном, и содержат Fc-область. В некоторых вариантах осуществления изобретения антитело направлено против антигена, присутствующего на опухолевой клетке. Конкретными антигенами-мишенями антител, которые можно применять согласно настоящему изобретению, являются антигены, экспрессируемые на поверхности опухолевых клеток, включая (но, не ограничиваясь только ими) расположенные на клеточной поверхности рецепторы, такие как рецептор эпидермального фактора роста (EGFR), рецепторы инсулиноподобного фактора роста (IGFR) и рецепторы тромбоцитарного фактора роста (PDGFR), простатический специфический мембранный антиген (PSMA), карциноэмбриональный антиген (СЕА), дипептидилпептидазу IV (DPPIV), (CD26, DPPIV), FAP, HER2/neu, HER-3, Е-кадхерин, CD20, ассоциированный с меланомой хондроитинсульфат-протеогликан (MCSP), c-Met, содержащий CUB-домен белок-1 (CDCP1) и антиген карциномы сквамозных клеток (плоскоклеточной карциномы) (SCCA).
В конкретном варианте осуществления изобретения антитело направлено против антигена, выбранного из группы, включающей CD20, рецептор эпидермального фактора роста (EGFR), HER2, HER3, рецептор инсулиноподобного фактора роста-1 (IGF-1R), карциноэмбриональный антиген (СЕА), c-Met, содержащий CUB-домен белок-1 (CDCP1) и ассоциированный с меланомой хондроитинсульфат-протеогликан (MCSP). В одном из вариантов осуществления изобретения антитело представляет собой мультиспецифическое антитело, направленное против двух или большего количества антигенов, выбранных из группы, включающей CD20, рецептор эпидермального фактора роста (EGFR), HER2, HER3, рецептор инсулиноподобного фактора роста-1 (IGF-1R), карциноэмбриональный антиген (СЕА), c-Met, содержащий CUB-домен белок-1 (CDCP1) и ассоциированный с меланомой хондроитинсульфат-протеогликан (MCSP).
Специфические антитела к CD20, которые можно применять согласно настоящему изобретению, представляют собой гуманизированные антитела IgG-класса к CD20 типа II, которые имеют связывающую специфичность мышиного антитела B-Lyl (Poppema и Visser, Biotest Bulletin 3, 1987, сс. 131-139). Наиболее предпочтительным является гуманизированное антитело IgG-класса к CD20 типа II, которое содержит
а) в вариабельном домене тяжелой цепи CDR1, имеющий SEQ ID NO: 88, CDR2, имеющий SEQ ID NO: 89, и CDR3, имеющий SEQ ID NO: 90, и
б) в вариабельном домене легкой цепи CDR1, имеющий SEQ ID NO: 91, CDR2, имеющий SEQ ID NO: 92, и CDR3, имеющий SEQ ID NO: 93.
В частности, каркасные участки вариабельной области тяжелой цепи (FR) FR1, FR2 и FR3 указанного антитела представляют собой последовательности человеческого FR, кодируемые последовательностью человеческой зародышевой линии VH1_10, FR4 вариабельной области тяжелой цепи указанного антитела представляет собой последовательность человеческого FR, кодируемую последовательностью человеческой зародышевой линии JH4, каркасные участки (FR) FR1, FR2 и FR3 вариабельной области легкой цепи антитела представляют собой последовательности человеческого FR, кодируемые последовательностью человеческой зародышевой линии VK_2_40, FR4 вариабельной области легкой цепи антитела представляет собой человеческую последовательность FR, кодируемую последовательностью человеческой зародышевой линии JK4.
Более конкретно, антитело к CD20, которое можно применять согласно настоящему изобретению, содержит вариабельный домен тяжелой цепи, имеющий SEQ ID NO: 94, и вариабельный домен легкой цепи, имеющий SEQ ID NO: 95.
Указанные антитела к CD20 описаны в WO 2005/044859, которая полностью включена в настоящее описание в качестве ссылки.
Специфические антитела к EGFR, которые можно применять согласно настоящему изобретению, представляют собой гуманизированные антитела IgG-класса, которые имеют связывающую специфичность крысиного антитела ICR62 (Modjtahedi и др., Br J Cancer 67, 1993, сс. 247-253). Наиболее ценным является гуманизированное антитело к EGFR IgG-класса, которое содержит
а) в вариабельном домене тяжелой цепи CDR1, имеющий SEQ ID NO: 96, CDR2, имеющий SEQ ID NO: 97, и CDR3, имеющий SEQ ID NO: 98, и
б) в вариабельном домене легкой цепи CDR1, имеющий SEQ ID NO: 99, CDR2, имеющий SEQ ID NO: 100, и CDR3, имеющий SEQ ID NO: 101.
Более конкретно, антитело к EGFR, которое можно применять согласно настоящему изобретению, содержит вариабельный домен тяжелой цепи, имеющий SEQ ID NO: 102, и вариабельный домен легкой цепи, имеющий SEQ ID NO: 103.
Указанные антитела к EGFR описаны в WO 2006/082515 и WO 2008/017963, каждая из которых полностью включена в настоящее описание в качестве ссылки.
Другие приемлемые гуманизированные антитела к EGFR IgG-класса, которые можно применять согласно изобретению, включают цетуксимаб/IMC-С225 (Erbitux®, описан у Goldstein и др., Clin Cancer Res 1, 1995, сс. 1311-1318), панитумумаб/ABX-EGF (Vectibix®, описан у Yang и др., Cancer Res 59, 1999, сс. 1236-1243, Yang и др., Critical Reviews in Oncology/Hematology 38, 2001, cc. 17-23 (2001)), нимотузумаб/h-R3 (TheraCim®, описан у Mateo и др., Immunotechnology 3, 1997, сс. 71-81; Crombet-Ramos и др., Int J Cancer 101, 2002, сс. 567-575, Boland и Bebb, Expert Opin Biol Ther 9, 2009, сс. 1199-1206), матузумаб/EMD 72000 (описан у Bier и др., Cancer Immunol Immunother 46, 1998, сс. 167-173, Kirn, Curr Opin Mol Ther 6, 2004, сс. 96-103), и залутумумаб/2F8 (описан у Bleeker и др., J Immunol 173, 2004, сс. 4699-4707, Lammerts van Bueren, PNAS 105, 2008, сс. 6109-6114).
Специфические антитела к IGF-1R, которые можно применять согласно настоящему изобретению, описаны в WO 2005/005635 и WO 2008/077546, полное содержание каждой из которых включено в настоящее описание в качестве ссылки, и ингибируют связывание инсулиноподобного фактора роста-1 (IGF-1) и инсулиноподобного фактора роста-2 (IGF-2) с рецептором инсулиноподобного фактора роста-1 (IGF-1R).
Антитела к IGF-1R, которые можно применять согласно изобретению, предпочтительно представляют собой моноклональные антитела, а также химерные антитела (человеческий константный домен), гуманизированные антитела и наиболее предпочтительно полностью человеческие антитела. Конкретные антитела к IGF-1R, которые можно применять согласно изобретению, связываются с человеческим IGF-1R, конкурируя с антителом 18, т.е. они связываются с тем же эпитопом IGF-1R, что и антитело 18, которое описано в WO 2005/005635. Конкретные антитела к IGF-1R отличаются также аффинностью к IGF-1R, составляющей 10-8 М (KD) или менее, прежде всего, примерно от 10-9 до 10-13 М, и предпочтительно отличается не поддающимся выявлению ингибированием в зависимости от концентрации связывания инсулина с инсулиновым рецептором.
Конкретные антител к IGF-1R, которые можно применять согласно изобретению, содержат гипервариабельные участки (определяющие комплементарность области (CDR), имеющие следующие последовательности:
а) тяжелой цепи антитела, которая содержит в качестве CDR CDR1, CDR2 и CDR3, имеющие SEQ ID NO: 104 или 106;
б) легкой цепи антитела, которая содержит в качестве CDR CDR1, CDR2 и CDR3, имеющие SEQ ID NO: 105 или 107.
В частности, антитела к IGF-1R, которые можно применять согласно изобретению, содержат аминокислотную последовательность вариабельного домена тяжелой цепи антитела SEQ ID NO: 104 и аминокислотную последовательность вариабельного домена легкой цепи антитела SEQ ID NO: 105 или аминокислотную последовательность вариабельного домена тяжелой цепи антитела SEQ ID NO: 106 и аминокислотную последовательность вариабельного домена легкой цепи антитела SEQ ID NO: 107.
Конкретные антитела к IGF-1R, которые можно применять согласно изобретению, можно получать из клеточных линий гибридом
Другими пригодными антителами к IGF-1R, которые можно применять согласно изобретению, являются, например, полностью человеческое МАт IgG1-подкласса циксутумумаб/IMC-А12 (описан у Burtrum и др., Cancer Res 63, 2003, сс. 8912-8921; Rowinsky и др., Clin Cancer Res 13, 2007, сс. 5549-5555, полностью человеческое МАт IgG1-подкласса AMG-479 (описано у Beltran и др., Mol Cancer Ther 8, 2009, сс. 1095-1105; Tolcher и др., J Clin Oncol 27, 2009, сс. 5800-5807), гуманизированное МАт IgG1-подкласса MK-0646/h7C10 (описано у Goetsch и др., hit J Cancer 113, 2005, сс. 316-328; Broussas и др., Int J Cancer 124, 2009, сс. 2281-2293; Hidalgo и др., J Clin Oncol 26, 2008, реферат 3520; Atzori и др., J Clin Oncol 26, 2008, реферат 3519), гуманизированное МАт IgG1-подкласса AVE1642 (описано у Descamps и др., Br J Cancer 100, 2009, сс. 366-369; Tolcher и др., J Clin Oncol 26, 2008, реферат 3582; Moreau и др., Blood 110, 2007, реферат 1166; Maloney и др., Cancer Res 63, 2003, сс. 5073-5083), полностью человеческое МАт IgG2-подкласса фигитумумаб/СР-751,871 (Cohen и др., Clin Cancer Res 11, 2005, сс. 2063-2073; Haluska и др., Clin Cancer Res 13, 2007, сс. 5834-5840; Lacy и др., J Clin Oncol 26, 2008, сс. 3196-3203; Gualberto и Karp, Clin Lung Cancer 10, 2009, сс. 273-280, полностью человеческое МАт IgG1 SCH-717454 (описано в WO 2008/076257 или у Kolb и др., Pediatr Blood Cancer 50, 2008, cc. 1190-1197), МАт 2.13.2. (описано в US №7037498 (WO 2002/053596)) или полностью человеческое МАт IgG4-подкласса BIIB022.
Специфические антитела к СЕА, которые можно применять согласно настоящему изобретению, представляют гуманизированные антитела IgG-класса, которые имеют связывающую специфичность мышиного антитела PR1A3 (Richman и Bodmer, Int J Cancer 39, 1987, сс. 317-328). Наиболее предпочтительным является гуманизированное антитело к СЕА IgG-класса, которое содержит
а) в вариабельном домене тяжелой цепи CDR1, имеющий SEQ ID NO: 108, CDR2, имеющий SEQ ID NO: 109, и CDR3, имеющий SEQ ID NO: 111, и
б) в вариабельном домене легкой цепи CDR1, имеющий SEQ ID NO: 111, CDR2, имеющий SEQ ID NO: 112, и CDR3, имеющий SEQ ID NO: 113.
Более конкретно, антитело к СЕА, которое можно применять согласно настоящему изобретению, содержит вариабельный домен тяжелой цепи, имеющий SEQ ID NO: 114, и вариабельный домен легкой цепи, имеющий SEQ ID NO: 115.
Указанные антитела к СЕА описаны в публикации РСТ WO 2011/023787, которая полностью включена в настоящее описание в качестве ссылки.
Специфические антитела к HER3, которые можно применять согласно настоящему изобретению, представляют собой гуманизированные антитела IgG-класса, такие как МАт 205.10.1, МАт 205.10.2 и МАт 205.10.3, прежде всего МАт 205.10.2, описанные в публикации РСТ WO 2011/076683. Наиболее предпочтительным является гуманизированное антитело к HER3 IgG-класса, которое содержит
а) в вариабельном домене тяжелой цепи CDR1, имеющий SEQ ID NO: 139, CDR2, имеющий SEQ ID NO: 140, и CDR3, имеющий SEQ ID NO: 141, и
б) в вариабельном домене легкой цепи CDR1, имеющий SEQ ID NO: 143, CDR2, имеющий SEQ ID NO: 144, и CDR3, имеющий SEQ ID NO: 145.
Более конкретно, антитело к HER3, которое можно применять согласно настоящему изобретению, содержит вариабельный домен тяжелой цепи, имеющий SEQ ID NO: 142, и вариабельный домен легкой цепи, имеющий SEQ ID NO: 146.
Специфические антитела к CDCP1, которые можно применять согласно настоящему изобретению, представляют собой гуманизированные антитела IgG-класса, выведенные из антитела CUB4 (регистрационный номер DSM АСС 2551 (DSMZ), которое описано в публикации РСТ WO 2011/023389.
Примеры антител к MCSP, которые можно применять согласно настоящему изобретению, описаны в европейской заявке на патент ЕР 11178393.2. Наиболее предпочтительным является гуманизированное антитело к MCSP IgG-класса, которое содержит
а) в вариабельном домене тяжелой цепи CDR1, имеющий SEQ ID NO: 116, CDR2, имеющий SEQ ID NO: 117, и CDR3, имеющий SEQ ID NO: 118, и
б) в вариабельном домене легкой цепи CDR1, имеющий SEQ ID NO: 119, CDR2, имеющий SEQ ID NO: 120, и CDR3, имеющий SEQ ID NO: 121.
Более конкретно, антитело к MCSP, которое можно применять согласно настоящему изобретению, содержит вариабельный домен тяжелой цепи, имеющий SEQ ID NO: 122, и вариабельный домен легкой цепи, имеющий SEQ ID NO: 123.
В одном из вариантов осуществления изобретения антитело представляет собой полноразмерное антитело IgG-класса. В конкретном варианте осуществления изобретения антитело представляет собой антитело IgG1-подкласса. В одном из вариантов осуществления изобретения антитело содержит человеческую Fc-область, более предпочтительно Fc-область человеческого IgG, наиболее предпочтительно Fc-область человеческого IgG1. Антитела, которые можно применять согласно изобретению, такие как антитела к IGF-1R, к EGFR и к CD20, описанные выше, могут содержать константную область тяжелой гамма-1-цепи человеческого Ig, представленную в SEQ ID NO: 124 (т.е. антитела представляют собой человеческие антитела IgG1-подкласса).
Антитела, которые можно применять согласно настоящему изобретению, конструируют таким образом, чтобы они обладали повышенной эффекторной функцией по сравнению с соответствующим не подвергнутым инженерии антителом. В одном из вариантов осуществления изобретения антитело конструируют таким образом, чтобы оно обладало повышенной эффекторной функцией, т.е. повышенной по меньшей мере в 2 раза, по меньшей мере в 10 раз или даже по меньшей мере в 100 раз эффекторной функцией, по сравнению с соответствующим не подвергнутым инженерии антителом. Повышенная эффекторная функция может представлять собой (но, не ограничиваясь только ими) повышенную(ые) одну или несколько из следующих функций: повышенная способность связываться с Fc-рецептором, повышенная способность связываться с C1q и комплементзависимая цитотоксичность (CDC), повышенная антитело-обусловленная клеточнозависимая цитотоксичность (ADCC), повышенный антитело-обусловленный клеточнозависимый фагоцитоз (ADCP), повышенная секреция цитокинов, повышенное опосредованное иммунным комплексом поглощение антигена антигенпрезентирующими клетками, повышенная способность связываться с NK-клетками, повышенная способность связываться с макрофагами, повышенная способность связываться с моноцитами, повышенная способность связываться с полиморфоядерными клетками, повышенная непосредственная передача сигнала, индуцирующего апоптоз, повышенное перекрестное связывание связанных с мишенью антител, повышенное созревание дендритных клеток или повышенное Т-клеточное примирование.
В одном из вариантов осуществления изобретения одну или несколько повышенных эффекторных функций выбирают из группы, включающей повышенную способность связываться с Fc-рецептором, повышенную CDC, повышенную ADCC, повышенный ADCP и повышенную секрецию цитокинов. В одном из вариантов осуществления изобретения повышенная эффекторная функция представляет собой повышенную способность связываться активирующим с Fc-рецептором. В одном из указанных вариантов осуществления изобретения аффинность связывания с активирующим Fc-рецептором повышают по меньшей мере в 2 раза, прежде всего по меньшей мере в 10 раз по сравнению с аффинностью связывания соответствующего не подвергнутого инженерии антитела. В конкретном варианте осуществления изобретения активирующий Fc-рецептор выбирают из группы, включающей FcγRIIIa, FcγRI и FcγRIIa. В одном из вариантов осуществления изобретения активирующий Fc-рецептор представляет собой FcγRIIIa, прежде всего человеческий FcγRIIIa. В другом варианте осуществления изобретения повышенная эффекторная функция представляет собой повышенную ADCC. В одном из указанных вариантов осуществления изобретения ADCC повышают по меньшей мере в 10 раз, прежде всего по меньшей мере в 100 раз по сравнению с ADCC, опосредуемой соответствующим не подвергнутым инженерии антителом. В следующем варианте осуществления изобретения повышенная эффекторная функция представляет собой повышенную способность связываться с активирующим Fc-рецептором и повышенную ADCC.
Повышенную эффекторную функцию можно измерять методами, известными в данной области. Приемлемый анализ для оценки ADCC представлен в настоящем описании. Другие примеры анализов in vitro, предназначенных для оценки ADCC-активности представляющей интерес молекулы, описаны в US №5500362; у Hellstrom и др., Proc Nati Acad Sci USA 83, 1986, сс. 7059-7063 и Hellstrom и др., Proc Nati Acad Sci USA 82, 1985, сс. 1499-1502; US №5821337; у Bruggemann и др., J Exp Med 166, 1987, сс. 1351-1361. Альтернативно этому, можно применять методы, основанные на нерадиоактивном анализе (см., например, ACTI™ - нерадиоактивный анализ цитотоксичности с помощью проточной цитометрии (фирма CellTechnology, Inc. Маунтин-Вью, шт. Калифорния); и CytoTox 96® - нерадиоактивный анализ цитотоксичности (фирма Promega, Мэдисон, шт. Висконсин)). Приемлемыми эффекторными клетками для таких анализов являются мононуклеарные клетки периферической крови (РВМС) и естественные клетки-киллеры (NK). В альтернативном или дополнительном варианте ADCC-активность представляющей интерес молекулы можно оценивать in vivo, например, например, с использованием созданных на животных моделей, описанных у Clynes и др., Proc Nati Acad Sci USA 95, 1998, сс. 652-656. Связывание с Fc-рецепторами можно легко определять, например, с помощью ELISA или с помощью поверхностного плазменного резонанса (SPR) с использованием стандартной инструментальной базы, такой как устройство BIAcor (фирма GE Healthcare), и Fc-рецепторов, которые можно получать путем рекомбинантной экспрессии. Согласно конкретному варианту осуществления изобретения аффинность связывания с активирующим Fc-рецептором измеряют с помощью поверхностного плазменного резонанса, используя устройство BIACORE® Т 100 (фирма GE Healthcare) при 25°С. Альтернативно этому, аффинность связывания антител с Fc-рецепторами можно оценивать с использованием клеточных линий, которые, как известно, экспрессируют конкретные Fc-рецепторы, таких как NK-клетки, которые экспрессируют FcγIIIa-рецептор. Можно осуществлять анализы связывания C1q для решения вопроса о том, может ли антитело связываться с C1q и, как следствие, обладает ли оно CDC-активностью (см., например, анализы связывания с C1q и С3с с помощью ELISA, описанные в WO 2006/029879 и WO 2005/100402). Для оценки активации комплемента можно осуществлять анализ CDC (см., например, Gazzano-Santoro и др., J Immunol Methods 202, 1996, с. 163; Cragg и др., Blood 101, 2003, сс. 1045-1052 и Cragg и Glennie, Blood 103, 2004, сс. 2738-2743).
Повышенная эффекторная функция может являться, например, результатом гликоинженерии Fc-области или интродукции аминокислотных мутаций в Fc-область антитела. В одном из вариантов осуществления изобретения антитело конструируют путем интродукции одной или нескольких аминокислотных мутаций в Fc-область. В конкретном варианте осуществления изобретения аминокислотные мутации представляют собой аминокислотные замены. В еще более конкретном варианте осуществления изобретения аминокислотные замены находятся в положениях 298, 333 и/или 334 Fc-области (EU-нумерация остатков). Другие приемлемые аминокислотные мутации описаны, например, у Shields и др., J Biol Chem 9(2), 2001, сс. 6591-6604; US №6737056; WO 2004/063351 и WO 2004/099249. Мутантные Fc-области можно получать путем аминокислотной делеции, замены, инсерции или модификации с помощью генетических или химических методов, хорошо известных в данной области. Генетические методы могут включать сайтнаправленный мутагенез, ПЦР, синтез генов и т.п. Правильность нуклеотидных замен можно подтверждать, например, секвенированием.
В другом варианте осуществления изобретения антитело конструируют путем модификации гликозилирования в Fc-области. В конкретном варианте осуществления изобретения антитело конструируют таким образом, чтобы оно обладало повышенным относительным содержанием нефукозилированных олигосахаридов в Fc-области по сравнению с не подвергнутым инженерии антителом. Повышенное относительное содержание нефукозилированных олигосахаридов в Fc-области антитела приводит к созданию антитела, обладающего повышенной эффекторной функцией, прежде всего повышенной ADCC.
В более конкретном варианте осуществления изобретения по меньшей мере примерно 20%, примерно 25%, примерно 30%, примерно 35%, примерно 40%, примерно 45%, примерно 50%, примерно 55%, примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90%, примерно 95% или примерно 100%, предпочтительно по меньшей мере примерно 50%, более предпочтительно по меньшей мере примерно 70% N-связанных олигосахаридов в Fc-домене антитела являются нефукозилированными. Нефукозилированные олигосахариды могут быть гибридного или комплексного типа.
В другом конкретном варианте осуществления изобретения антитело конструируют таким образом, чтобы оно обладало повышенным относительным содержанием бисекционных олигосахаридов в Fc-области по сравнению с не подвергнутым инженерии антителом. В более конкретном варианте осуществления изобретения по меньшей мере примерно 10%, примерно 15%, примерно 20%, примерно 25%, примерно 30%, примерно 35%, примерно 40%, примерно 45%, примерно 50%, примерно 55%, примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90%, примерно 95% или примерно 100%, предпочтительно по меньшей мере примерно 50%, более предпочтительно по меньшей мере примерно 70% N-связанных олигосахаридов в Fc-домене антитела являются бисекционными. Бисекционные олигосахариды могут быть гибридного или комплексного типа.
В следующем конкретном варианте осуществления изобретения антитело конструируют таким образом, чтобы оно обладало повышенным относительным содержанием бисекционных нефукозилированных олигосахаридов в Fc-области по сравнению с не подвергнутым инженерии антителом. В более конкретном варианте осуществления изобретения по меньшей мере примерно 10%, примерно 15%, примерно 20%, примерно 25%, примерно 30%, примерно 35%, примерно 40%, примерно 45%, примерно 50%, примерно 55%, примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90%, примерно 95% или примерно 100%, предпочтительно по меньшей мере примерно 15%, более предпочтительно по меньшей мере примерно 25%, по меньшей мере примерно 35% или по меньшей мере примерно 50% N-связанных олигосахаридов в Fc-домене антитела являются бисекционными нефукозилированными. Бисекционные нефукозилированные олигосахариды могут быть гибридного или комплексного типа.
Структуры олигосахаридов в Fc-области антитела можно анализировать методами, хорошо известными в данной области, например, методом MALDI TOF-масс-спектрометрии, описанным у Umana и др., Nat Biotechnol 17, 1999, сс. 176-180 или Ferrara и др., Biotechn Bioeng 93, 2006, сс. 851-861. Процент нефукозилированных олигосахаридов представляет собой количество олигосахаридов, у которых отсутствуют остатки фукозы, относительно всех олигосахаридов, присоединенных к Asn 297 (например, комплексных, гибридных, с высоким содержанием маннозы структур), и идентифицированных в обработанном N-гликозидазой F образце, которое измеряют с помощью MALDI-TOF-MC. Asn297 обозначает остаток аспарагина, локализованный в положении 297 в Fc-области (согласно EU-нумерации остатков в Fc); однако Asn297 может быть локализован в пределах примерно ±3 аминокислоты в обратном или прямом направлении относительно положения 297, т.е. между положениями 294 и 300, что связано с минорными вариациями последовательностей антител. Аналогично определяют процент бисекционных или бисекционных нефукозилированных олигосахаридов.
В одном из вариантов осуществления изобретения антитело конструируют таким образом, чтобы оно обладало модифицированным гликозилированием в Fc-области по сравнению с не подвергнутым инженерии антителом, путем получения антитела в клетке-хозяине с измененной активностью одной или нескольких гликозилтрансфераз. Гликозилтрансферазы включают, например, β(1,4)-N-ацетилглюкозамилтрансферазу III (GnTIII), β(1,4)-галактозилтрансферазу (GalT), β(1,2)-N-ацетилглюкозамилтрансферазу I (GnTI), β(1,2)-N-ацетилглюкозамилтрансферазу II (GnTII) и α(1,6)-фукозилтрансферазу. В конкретном варианте осуществления изобретения антитело конструируют таким образом, чтобы оно имело повышенное относительное содержание нефукозилированных олигосахаридов в Fc-области по сравнению с не подвергнутым инженерии антителом, путем получения антитела в клетке-хозяине, обладающей повышенной активностью β(1,4)-N-ацетилглюкозамилтрансферазы III (GnTIII). В еще более предпочтительном варианте осуществления изобретения клетка-хозяин имеет также повышенную активность α-маннозидазы II (ManII). Методология гликоинженерии, которую можно использовать для создания путем гликоинженерии антител, предлагаемых в настоящем изобретении, описана более подробно у Umana и др., Nat Biotechnol 17, 1999, сс. 176-180; Ferrara и др., Biotechn Bioeng 93, 2006, сс. 851-861; WO 99/54342 (U.S. №6602684; EP 1071700); WO 2004/065540 (публикация патента США №2004/0241817; ЕР 1587921), WO 03/011878 (публикация патента США №2003/0175884), содержание каждого из которых полностью включено в настоящее описание в качестве ссылки. Антитела, подвергнутые гликоинженерии с использованием указанной методологии, в контексте настоящего описании обозначают как GlycoMab.
Как правило, любой тип линии культивируемых клеток, включая указанные в настоящем описании клеточные линии, можно применять для получения антител к TNC A2 с измененной схемой гликозилирования. Конкретные клеточные линии включают СНО-клетки, BHK-клетки, NSO-клетки, SP2/0-клетки, клетки миеломы линии YO, клетки мышиной миеломы линии Р3Х63, PER-клетки, PER.С6-клетки или клетки гибридомы и другие клетки млекопитающих. В некоторых вариантах осуществления изобретения клетки-хозяева подвергали манипуляциям, приводящим к экспрессии повышенных уровней одного или нескольких полипептидов, обладающих активностью β(1,4)-N-ацетилглюкозамилтрансферазы III (GnTIII). В некоторых вариантах осуществления изобретения клетки-хозяева подвергали дополнительным манипуляциям для обеспечения повышенных уровней экспрессии одного или нескольких полипептидов, обладающих активностью α-маннозидазы II (ManII). В конкретном варианте осуществления изобретения полипептид, обладающий GnTIII-активностью, представляет собой слитый полипептид, который сдержит каталитический домен GnTIII и домен локализации в комплексе Гольджи гетерологичного полипептида, присутствующего в комплексе Гольджи. В частности, указанный домен локализации в комплексе Гольджи представляет собой домен локализации в комплексе Гольджи маннозидазы II. Методы создания указанных слитых полипептидов и их применение для получения антител с повышенными эффекторными функциями описаны у Ferrara и др., Biotechn Bioeng 93, 2006, сс. 851-861 и в WO 2004/065540, полное содержание которых включено в настоящее описание в качестве ссылки.
Клетки-хозяева, которые содержат кодирующую последовательность антитела, которое можно применять согласно изобретению, и/или кодирующую последовательность полипептидов, обладающих гликозилтрансферазной активностью, и которые экспрессируют биологически активные генные продукты, можно идентифицировать, например, с помощью гибридизации ДНК-ДНК или ДНК-РНК; по присутствию или отсутствию функций определенных «маркерных» генов; путем оценки уровня транскрипции, измеряемого по экспрессии соответствующих мРНК-транскриптов в клетке-хозяине; или путем выявления генного продукта с помощью иммуноанализа или по его биологической активности, т.е. с помощью методов, хорошо известных в данной области. Активность GnTIII или ManII можно определять, например, применяя лектин, который связывается с продуктами биосинтеза GnTIII или ManII соответственно. Примером указанного пектина является лектин Е4-РНА, который связывается предпочтительно с олигосахаридами, содержащими двурассекающий GlcNAc. Продукты биосинтеза (т.е. специфические олигосахаридные структуры) полипептидов, обладающих активностью GnTIII или ManII, можно выявлять также с помощью масс-спектрометрического анализа олигосахаридов, высвобождающихся из гликопротеинов, которые продуцируются клетками, экспрессирующими указанные полипептиды. В альтернативном варианте можно использовать функциональный анализ, в котором измеряют повышенную эффекторную функцию и/или повышенную способность связываться с Fc-рецептором, опосредуемую антителами, которые продуцируются клетками, созданными с использованием полипептидов, обладающих активностью GnTIII или ManII.
В другом варианте осуществления изобретения антитело конструируют таким образом, чтобы оно имело повышенное относительное содержание нефукозилированных олигосахаридов в Fc-области по сравнению с не подвергнутым инженерии антителом, путем получения антитела в клетке-хозяине с пониженной α(1,6)-фукозилтрансферазной активностью. Клетка-хозяин с пониженной α(1,6)-фукозилтрансферазной активностью может представлять собой клетку, в которой ген α(1,6)-фукозилтрансферазы разрушен или деактивирован иным образом, например, «выключен» (см. Yamane-Ohnuki и др., Biotech Bioeng 87, 2004, с. 614; Kanda и др., Biotechnol Bioeng 94(4), 2006, сс. 680-688; Niwan др., J Immunol Methods 306, 2006, сс. 151-160).
Другими примерами клеточных линий, которые обладают способностью продуцировать дефукозилированные антитела, являются Lee 13 СНО-клетки с дефицитом белкового фукозилирования (Ripka и др., Arch. Biochem. Biophys. 249, 1986, сс. 533-545; заявка на патент США № US 2003/0157108 и WO 2004/056312, прежде всего в примере 11). Антитела, которые можно применять согласно настоящему изобретению, можно подвергать гликоинженерии, приводящей к присутствию у них пониженного количества фукозных остатков в Fc-области, с использованием методик, описанных в ЕР 1176195 Al, WO 03/084570, WO 03/085119 и опубликованных заявках на патент США №№2003/0115614, 2004/093621, 2004/110282, 2004/110704, 2004/132140, US №6946292 (на имя фирмы Kyowa), например, путем снижения или элиминации активности белка-транспортера ГДФ-фукозы, в клетках-хозяевах, которые применяют для получения антитела.
Подвергнутые гликоинженерии антитела, которые можно применять согласно изобретению, можно получать также в системах экспрессии, которые продуцируют модифицированные гликопротеины, например, описанных в WO 2003/056914 (фирма GlycoFi, Inc.) или WO 2004/057002 и WO 2004/024927 (на имя фирмы Greenovation).
Методы рекомбинации
Методы получения антител и иммуноконъюгатов, которые можно применять согласно настоящему изобретению, хорошо известны в данной области и описаны, например, в WO 2012/146628, WO 2005/044859, WO 2006/082515, WO 2008/017963, WO 2005/005635, WO 2008/077546, WO 2011/023787, WO 2011/076683, WO 2011/023389 и WO 2006/100582. Принятые методы получения поликлональных антител и моноклональных антител хорошо известны в данной области (см., например, Harlow и Lane, «Antibodies: a Laboratory Manual», изд-во Cold Spring Harbor Laboratory, 1988).
He встречающиеся в естественных условиях антитела или их фрагменты можно создавать с помощью твердофазного пептидного синтеза, можно получать с помощью методов рекомбинации (например, описанных в US №4186567) или можно получать, например, путем скрининга комбинаторных библиотек, содержащих вариабельные области тяжелых цепей и вариабельные области легких цепей (см., например, US №5969108 на имя McCafferty). Для рекомбинантного получения иммуноконъюгатов и антител, которые можно применять согласно настоящему изобретению, один или несколько полинуклеотидов, кодирующих иммуноконъюгат или антитело, выделяют и встраивают в один или несколько векторов для дополнительного клонирования и/или экспрессии в клетке-хозяине. Указанные полинуклеотиды легко можно выделять и секвенировать с помощью общепринятых процедур. Методы, хорошо известные специалистам в данной области, можно применять для конструирования экспрессионных векторов, содержащих кодирующую последовательность иммуноконъюгата или антитела наряду с приемлемыми контролирующими транскрипцию/трансляцию сигналами. Эти методы включают технологии рекомбинантной ДНК in vitro, методы синтеза и рекомбинации/генетической рекомбинации in vivo (см., например, методы, описанные у Maniatis и др., Maniatis и др., Molecular Cloning A Laboratory Manual, изд-во Cold Spring Harbor Laboratory, N.Y., 1989; и Ausubel и др., Current Protocols in Molecular Biology, изд-во Greene Publishing Associates and Wiley Interscience, N.Y., 1989).
Иммуноконъюгаты, которые можно применять согласно изобретению, можно экспрессировать с одного полинуклеотида, который кодирует полный иммуноконъюгат, или с нескольких (например, с двух или большего количества) полинуклеотидов, которые совместно экспрессируют. Полипептиды, кодируемые совместно экспрессируемыми полинуклеотидами, можно объединять, например, дисульфидными мостками или другими путями с получением функционального иммуноконъюгата. Например, компонент антитела, представляющий собой легкую цепь, можно кодировать с помощью полинуклеотида, отделенного от того, который кодирует компонент иммуноконъюгата, содержащий тяжелую цепь антитела и эффекторный фрагмент. При совместной экспрессии полипептиды тяжелой цепи должны объединяться с полипептидами легкой цепи для образования антитела.
Клетки-хозяева, пригодные для репликации и для поддержания экспрессии рекомбинантных белков, хорошо известны в данной области. Такие клетки можно трансфектировать или трансдуцировать соответствующим образом конкретным экспрессионным вектором и можно выращивать в большем количестве содержащие вектор клетки с целью внесения в ферментеры для крупномасштабных процессов получения белков в достаточных для клинических применений количествах. Приемлемыми клетками-хозяевами являются прокариотические микроорганизмы, такие как Е.coli, или различные эукариотические клетки, такие как клетки яичника китайского хомячка (СНО), клетки насекомых или т.п.Например, рекомбинантные белки можно получать в бактериях, в частности, когда отсутствует потребность в гликозилировании. После экспрессии белок можно выделять из пасты бактериальных клеток в растворимую фракцию и можно дополнительно очищать. Помимо прокариот, в качестве хозяев для клонирования или экспрессии векторов, которые кодируют белок, можно использовать эукариотические микроорганизмы, такие как нитчатые грибы или дрожжи, включая штаммы грибов и дрожжей, пути гликозилирования которых были «гуманизированы», что позволяет получать белок с частично или полностью человеческой схемой гликозилирования (см. Gemgross, Nat. Biotech. 22, 2004, сс. 1409-1414 и Li и др., Nat. Biotech. 24, 2006, сс. 210-215). Клетки-хозяева, которые можно использовать для экспрессии (гликозилированных) белков, получают также из многоклеточных организмов (беспозвоночных и позвоночных животных). Примерами клеток беспозвоночных являются клетки насекомых, а также можно применять клетки растений. Были идентифицированы многочисленные бакуловирусные штаммы и соответствующие пригодные для них в качестве хозяев клетки насекомых, прежде всего для трансфекции клеток Spodoptera frugiperda. В качестве хозяев можно применять также культуры растительных клеток (см., например, US №№5959177, 6040498, 6420548, 7125978 и 6417429 (описание технологии PLANTIBODIES™ для получения антител в трансгенных растениях). В качестве хозяев можно применять также клетки позвоночных животных. Например, можно использовать клеточные линии млекопитающих, которые адаптированы к росту в суспензии. Другими примерами приемлемых линий клеток-хозяев млекопитающих являются линия клеток почки обезьяны С VI, трансформированная с помощью SV40 (COS-7); линия клеток почки эмбриона человека (293 или клетки линии 293, субклонированные с целью выращивания в суспензионной культуре, Graham и др., J. Gen. Virol., 36, 1977, с. 59); клетки почки детеныша хомяка (ВНК); клетки Сертоли мыши (ТМ4-клетки, описанные, например, у Mather, Biol. Reprod., 23, 1980, сс. 243-251); клетки почки обезьяны (CV1); клетки почки африканской зеленой мартышки (VERO-76,); клетки карциномы шейки матки человека (HELA); клетки почки собаки (MDCK); клетки печени бычьей крысы (BRL 3А); клетки легкого человека (W138); клетки печени человека (Нер G2); клетки опухоли молочной железы мыши (ММТ 060562); клетки TRI, описанные, например, у Mather и др., Annals N.Y. Acad. ScL, 383, 1982, сс. 44-68); клетки MRC 5 и клетки FS4. Другими ценными линиями клеток-хозяев млекопитающих являются клетки яичника китайского хомячка (СНО), включая dhfr--CHO-клетки (Urlaub и др., Proc. Natl. Acad. Sci. USA, 77, 1980, с. 4216); и клеточные линии миеломы, такие как Y0, NS0, P3X63 и Sp2/0. Обзор конкретных линий клеток-хозяев млекопитающих, которые можно применять для производства белка, см., например, у Yazaki и Wu, в: Methods in Molecular Biology под ред. В.K.С. Lo, изд-во Humana Press, Totowa, NJ, т. 248, 2003, сс. 255-268. Клетки-хозяева включают культивируемые клетки, например, культивируемые клетки млекопитающих, клетки дрожжей, клетки насекомых, клетки бактерий и клетки растений (но не ограничиваясь только ими), а также клетки, находящиеся в организме трансгенного животного, трансгенного растения или культивируемой растительной или животной ткани. В одном из вариантов осуществления изобретения клетка-хозяин представляет собой эукариотическую клетку, предпочтительно клетку млекопитающего, такую как клетка яичника китайского хомячка (СНО), клетка почки человеческого эмбриона (HEK) или лимфоидная клетка (например, клетка Y0, NS0, Sp20).
Если антитело или иммуноконъюгат предназначено/предназначен для применения на человеке, то можно использовать химерные формы антител, в которых константные области антитела получают из человеческого антитела. Гуманизированную или полностью человеческую форму антитела можно получать также с помощью методов, хорошо известных в данной области (см., например, US №5565332 на имя Winter). Для осуществления гуманизации можно применять различные методы, такие как (но, не ограничиваясь только ими) (а) трансплантация нечеловеческих (например, из антитела-донора) CDR в человеческий (например, антитело-реципиент) каркасный участок и константные области, сохраняющие или не сохраняющие имеющие решающее значение остатки каркасного участка (например, остатки, важные для сохранения хорошей антигенсвязывающей аффинности или функций антитела), (б) трансплантация только нечеловеческих определяющих специфичность участков (SDR или а-CDR; остатки имеют решающее значение для взаимодействия антитело-антиген) в человеческий каркасный участок и константные области, или (в) трансплантация полных нечеловеческих вариабельных доменов, но их «маскировка» напоминающим человеческий сегментом путем замены поверхностных остатков. Обзор гуманизированных антител и методов их получения см., например, у Almagro и Fransson, Front Biosci 13, 12008, сс. 1619-1633, и они описаны также, например, у Riechmann и др.. Nature 332, 1988, сс. 323-329; Queen и др., Proc Nati Acad Sci USA 86, 1989, сс. 10029-10033; US №№5821337, 7527791, 6982321 и 7087409; Jones и др., Nature 321, 1986, сс. 522-525; Morrison и др., Proc Nati Acad Sci 81, 1984, сс. 6851-6855; Morrison и Oi, Adv Immunol 44, 1988, сс. 65-92; Verhoeyen и др., Science 239, 1988, сс. 1534-1536; Padlan, Molec Immun 31(3), 1994, сс. 169-217; Kashmiri и др., Methods 36, 2005, сс. 25-34) (описание трансплантации SDR (a-CDR)); Padlan, Mol Immunol 28, 1991, сс. 489-498 (описание «повторного покрытия»); Dall'Acqua и др.. Methods 36, 2005, сс. 43-60 (описание «перестановки FR») и Osbourn и др.. Methods 36, 2005, сс. 61-68, и Klimka и др., Br J Cancer 83, 2000, сс. 252-260 (описание подхода на основе «целенаправленной селекции» для перестановки FR). Человеческие антитела и человеческие вариабельные области можно получать с помощью различных методик, известных в данной области. Человеческие антитела описаны в целом у van Dijk и van de Winkel, Curr Opin Pharmacol 5, 2001, сс. 368-374 и Lonberg, Curr Opin Immunol 20, 2008, сс. 450-459. Человеческие вариабельные области могут образовывать часть человеческих моноклональных антител или могут быть получены из них с помощью метода гибридом (см., например. Monoclonal Antibody Production Techniques and Applications, изд-во Marcel Dekker, Inc., New York, 1987, сс. 51-63). Человеческие антитела и человеческие вариабельные области можно получать также путем введения иммуногена трансгенному животному, которое модифицировано таким образом, что может продуцировать интактные человеческие антитела или интактные антитела с человеческими вариабельными областями в ответ на контрольное заражение антигеном (см., например, Lonberg, Nat Biotech 23, 2005, cc. 1117-1125). Человеческие антитела и человеческие вариабельные области можно создавать также путем выделения последовательностей вариабельных областей Fv-клона, отобранных из человеческих фаговых дисплейных библиотек (см., например, Hoogenboom и др. в: Methods in Molecular Biology, под ред. O'Brien и др., изд-во Human Press, Totowa, NJ, 178, 2001, cc. 1-37); и McCafferty и др., Nature 348, 552-554; Clackson и др., Nature 352, 1991, сс. 624-628). Фаг, как правило, экспонирует фрагменты антител либо в виде одноцепочечных Fv-(scFv)-фрагментов, либо в виде Fab-фрагментов.
В некоторых вариантах осуществления изобретения антитела, которые можно применять согласно настоящему изобретению, конструируют таким образом, чтобы они обладали повышенной аффинностью связывания, используя например, методы, которые описаны в публикации заявки на патент США №2004/0132066, полное содержание которой включено в настоящее описании в качестве ссылки. Способность антител, которые можно применять согласно изобретению, связываться со специфической антигенной детерминантной, можно определять либо с помощью твердофазного иммуноферментного анализа (ELISA), либо других методик, известных специалисту в данной области, например, с помощью метода поверхностного плазмонного резонанса (осуществляя анализ с использованием системы BIACORE T100) (Liljeblad и др., Glyco J 17, 2000, сс. 323-329), и традиционных анализов связывания (Heeley, Endocr Res 28, 2002, сс. 217-229).
Антитела и иммуноконъюгаты, полученные с помощью представленных в настоящем описании методов, можно очищать с использованием известных в данной области методик, таких как жидкостная хроматография высокого разрешения, ионообменная хроматография, гель-электрофорез, аффинная хроматография, гель-фильтрация и т.п.Фактические условия, применяемые для очистки конкретного белка, должны зависеть, в частности, от таких факторов, как чистый заряд, гидрофобность, гидрофильность и т.д., и они должны быть очевидны специалисту в данной области.
Фармацевтические композиции
Другим объектом изобретения является фармацевтическая композиция, содержащая (а) иммуноконъюгат, который содержит первое антитело, сконструированное таким образом, чтобы оно обладало пониженной эффекторной функцией, и эффекторный фрагмент, и (б) второе антитело, сконструированное таким образом, чтобы оно обладало повышенной эффекторной функцией, в фармацевтически приемлемом носителе. Указанные фармацевтические композиции можно применять, например, в любом из терапевтических способов, описанных ниже.
Фармацевтические композиции иммуноконъюгата и антитела, обладающего повешенной эффекторной функцией, представленные в настоящем описании, получают путем смешения указанного иммуноконъюгата и антитела, имеющих требуемую степень чистоты, с одним или несколькими необязательными фармацевтически приемлемыми носителями (Remington's Pharmaceutical Sciences, 18-e изд., изд-во Mack Printing Company, 1990), в форме лиофилизированных композиций или водных растворов. Фармацевтически приемлемые носители, как правило, являются нетоксичными для реципиентов в используемых дозах и концентрациях, они включают (но, не ограничиваясь только ими): буферы, такие как фосфатный, цитратный буферы, а также буферы на основе других органических кислот; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; хлорид бензетония; фенол; бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол и мета-крезол); полипептиды с низкой молекулярной массой (содержащие менее приблизительно 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поли(винилпирролидон); аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТК; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; содержащие металл комплексы (например, комплексы Zn-белок); и/или неионогенные поверхностно-активные вещества, такие как полиэтиленгликоль (ПЭГ). В контексте настоящего описания примеры фармацевтически приемлемых носителей включают также диспергирующие агенты интерстициальных лекарственных средств, такие как растворимые активные в нейтральной среде гликопротеины гиалуронидаз (sHASEGP), например, человеческие растворимые гликопротеины гиалуронидазы РН-20, такие как rhuPH20 (HYLENEX®, фирма Baxter International, Inc.). Некоторые примеры sHASEGP и методы их применения, в том числе rhuPH20, описаны в публикациях патентов США 2005/0260186 и 2006/0104968. Согласно одному из объектов изобретения sHASEGP объединяют с одним или несколькими дополнительными гликозаминогликаназами, такими как хондроитиназы.
Примеры лиофилизированных препаративных форм описаны в US №6267958. Водные препаративные формы включают описанные в US №6171586 и WO 2006/044908, указанные в последнем документе препаративные формы включают гистидин-ацетатный буфер.
Фармацевтическая композиция, представленная в настоящем описании, может содержать дополнительные действующие вещества, если это необходимо для конкретного подлежащего лечению показания, предпочтительно вещества с дополнительными видами активности, которые не оказывают отрицательного воздействия друг на друга. Например, если заболевание, подлежащее лечению, представляет собой рак, то может оказаться желательным дополнительно включать одно или несколько противораковых средств, например, химиотерапевтическое средство, ингибитор пролиферации опухолевых клеток или активатор апоптоза опухолевых клеток. Такие действующие вещества должны присутствовать в комбинации в количествах, эффективных для решения поставленной задачи.
Действующие вещества можно включать также в микрокапсулы, например, полученные с помощью методов коацервации или межфазной полимеризации, например в гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли(метилметакрилатные) микрокапсулы соответственно, в коллоидные системы введения лекарственного средства (например, в липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методы описаны в Remington's Pharmaceutical Sciences, 16-е изд., под ред. A. Osol, 1980.
Можно приготавливать препараты с замедленным высвобождением. Приемлемыми примерами препаратов с замедленным высвобождением являются полупроницаемые матрицы из твердых гидрофобных полимеров, включающие антитело, такие матрицы представляют собой изделия определенной формы, например, пленки или микрокапсулы.
Композиции, предназначенные для применения in vivo, как правило, должны быть стерильными. Стерильность можно легко обеспечивать, например, путем фильтрации через стерильные фильтрующие мембраны.
Способы лечения
Представленную в настоящем описании комбинацию, содержащую (а) иммуноконъюгат, который содержит первое антитело, сконструированное таким образом, чтобы оно обладало пониженной эффекторной функцией, и эффекторный фрагмент, и (б) второе антитело, сконструированное таким образом, чтобы оно обладало повышенной эффекторной функцией, можно применять в терапевтических методах.
Одним из объектов изобретения является комбинация, содержащая (а) иммуноконъюгат, который содержит первое антитело, сконструированное таким образом, чтобы оно обладало пониженной эффекторной функцией, и эффекторный фрагмент, и (б) второе антитело, сконструированное таким образом, чтобы оно обладало повышенной эффекторной функцией, для применения в качестве лекарственного средства. Следующими объектами изобретения является комбинация, содержащая (а) иммуноконъюгат, который содержит первое антитело, сконструированное таким образом, чтобы оно обладало пониженной эффекторной функцией, и эффекторный фрагмент, и (б) второе антитело, сконструированное таким образом, чтобы оно обладало повышенной эффекторной функцией, для применения при лечении заболевания. Некоторыми вариантами осуществления изобретения является комбинация, содержащая (а) иммуноконъюгат, который содержит первое антитело, сконструированное таким образом, чтобы оно обладают пониженной эффекторной функцией, и эффекторный фрагмент, и (б) второе антитело, сконструированное таким образом, чтобы оно обладало повышенной эффекторной функцией, для применения в способе лечения. Некоторыми вариантами осуществления изобретения является комбинация, содержащая (а) иммуноконъюгат, который содержит первое антитело, сконструированное таким образом, чтобы оно обладало пониженной эффекторной функцией, и эффекторный фрагмент, и (б) второе антитело, сконструированное таким образом, чтобы оно обладало повышенной эффекторной функцией, для применения в способе лечения страдающего заболеванием индивидуума, заключающемся в том, что вводят индивидууму в терапевтически эффективном количестве комбинацию. В одном из таких вариантов осуществления способ заключается также в том, что вводят индивидууму в терапевтически эффективном количестве по меньшей мере одно дополнительное терапевтическое средство, например, указанное ниже. Следующими вариантами осуществления изобретения является комбинация, содержащая (а) иммуноконъюгат, который содержит первое антитело, сконструированное таким образом, чтобы оно обладало пониженной эффекторной функцией, и эффекторный фрагмент, и (б) второе антитело, сконструированное таким образом, чтобы оно обладало повышенной эффекторной функцией, для применения с целью стимуляции функции эффекторных клеток. Некоторыми вариантами осуществления изобретения является комбинация, содержащая (а) иммуноконъюгат, который содержит первое антитело, сконструированное таким образом, чтобы оно обладало пониженной эффекторной функцией, и эффекторный фрагмент, и (б) второе антитело, сконструированное таким образом, чтобы оно обладало повышенной эффекторной функцией, для применения в способе стимуляции функции эффекторных клеток у индивидуума, заключающемся в том, что вводят индивидууму в эффективном количестве комбинацию для стимуляции функции эффекторных клеток. «Индивидуум» в контексте любого из указанных выше вариантов осуществления изобретения представляет собой млекопитающее, предпочтительно человека. «Заболевание» в контексте любого из указанных выше вариантов осуществления изобретения представляет собой заболевание, которое можно лечить путем стимуляции функции эффекторных клеток. В некоторых вариантах осуществления изобретения заболевание представляет собой нарушение клеточной пролиферации, прежде всего рак.
Следующим объектом изобретения является применение комбинации, содержащей (а) иммуноконъюгат, который содержит первое антитело, сконструированное таким образом, чтобы оно обладало пониженной эффекторной функцией, и эффекторный фрагмент, и (б) второе антитело, сконструированное таким образом, чтобы оно обладало повышенной эффекторной функцией, для приготовления или создания препарата лекарственного средства. В одном из вариантов осуществления изобретения лекарственное средство предназначено для лечения заболевания. В другом варианте осуществления изобретения лекарственное средство предназначено для применения в способе лечения заболевания, заключающегося в том, что вводят лекарственное средство страдающему заболеванием индивидууму в терапевтически эффективном количестве. В одном из таких вариантов осуществления изобретения способ заключается также в том, что в том, что вводят индивидууму в терапевтически эффективном количестве по меньшей мере одно дополнительное терапевтическое средство, например, описанное ниже. В другом варианте осуществления изобретения лекарственное средство предназначено для стимуляции функции эффекторных клеток. В следующем варианте осуществления изобретения лекарственное средство предназначено для применения в способе стимуляции функции эффекторных клеток у индивидуума, заключающемся в том, что вводят индивидууму лекарственное средство в количестве, эффективном для стимуляции функции эффекторных клеток. «Индивидуум» в контексте любого из указанных выше вариантов осуществления изобретения представляет собой млекопитающее, предпочтительно человека. «Заболевание» в контексте любого из указанных выше вариантов осуществления изобретения представляет собой заболевание, которое можно лечить путем стимуляции функции эффекторных клеток. В некоторых вариантах осуществления изобретения заболевание представляет собой нарушение клеточной пролиферации, прежде всего рак.
Следующим объектом изобретения является способ лечения заболевания. В одном из вариантов осуществления изобретения способ заключается в том, что вводят страдающему заболеванием индивидууму в терапевтически эффективном количестве комбинацию, содержащую (а) иммуноконъюгат, который содержит первое антитело, сконструированное таким образом, чтобы оно обладало пониженной эффекторной функцией, и эффекторный фрагмент, и (б) второе антитело, сконструированное таким образом, чтобы оно обладало повышенной эффекторной функцией. В одном из таких вариантов осуществления изобретения способ заключается также в том, что вводят индивидууму в терапевтически эффективном количестве по меньшей мере одно дополнительное терапевтическое средство, описанное ниже. «Индивидуум» в контексте любого из указанных выше вариантов осуществления изобретения представляет собой млекопитающее, предпочтительно человека. «Заболевание» в контексте любого из указанных выше вариантов осуществления изобретения представляет собой заболевание, которое можно лечить путем стимуляции функции эффекторных клеток. В некоторых вариантах осуществления изобретения заболевание представляет собой нарушение клеточной пролиферации, прежде всего рак.
Следующим объектом изобретения является способ стимуляции функции эффекторных клеток у индивидуума. В одном из вариантов осуществления изобретения способ заключается в том, что вводят индивидууму в эффективном количестве комбинацию, содержащую (а) иммуноконъюгат, который содержит первое антитело, сконструированное таким образом, чтобы оно обладало пониженной эффекторной функцией, и эффекторный фрагмент, и (б) второе антитело, сконструированное таким образом, чтобы оно обладало повышенной эффекторной функцией, для стимуляции функции эффекторных клеток. В одном из вариантов осуществления изобретения «индивидуум» представляет собой млекопитающее, прежде всего человека.
Следующим объектом изобретения является фармацевтическая композиция, содержащая любую из комбинаций, содержащих (а) иммуноконъюгат, который содержит первое антитело, сконструированное таким образом, чтобы оно обладало пониженной эффекторной функцией, и эффекторный фрагмент, и (б) второе антитело, сконструированное таким образом, чтобы оно обладало повышенной эффекторной функцией, представленных в настоящем описании, например, для применения в любом из вышеуказанных терапевтических способов. В одном из вариантов осуществления изобретения фармацевтическая композиция содержит комбинацию, содержащую (а) иммуноконъюгат, который содержит первое антитело, сконструированное таким образом, чтобы оно обладало пониженной эффекторной функцией, и эффекторный фрагмент, и (б) второе антитело, сконструированное таким образом, чтобы оно обладало повышенной эффекторной функцией, и фармацевтически приемлемый носитель. В другом варианте осуществления изобретения фармацевтическая композиция содержит любую из комбинаций, представленных в настоящем описании, и по меньшей мере одно дополнительное терапевтическое средство, например, указанное ниже.
Согласно любому из указанных выше вариантов осуществления изобретения заболевание представляет собой нарушение, которое можно лечить путем стимуляции функции эффекторных клеток. Комбинации, предлагаемые в изобретении, можно применять для лечения болезненных состояний, на которые оказывает благоприятное воздействие стимуляция иммунной системы хозяина, прежде всего состояний, при которых требуется повышенный клеточный иммунный ответ. Они могут включать болезненные состояния, при которых иммунный ответ хозяина является недостаточным или имеет место его дефицит. Болезненные состояния, при которых можно применять комбинации, предлагаемые в изобретении, представляют собой, например, опухоль или инфекцию, при которых клеточный иммунный ответ может представлять собой имеющий решающее значение механизм для специфического иммунитета. Конкретные болезненные состояния, при которых можно применять комбинации, предлагаемые в настоящем изобретении, включают рак, в частности, почечно-клеточную карциному или меланому; иммунодефицит, в частности у ВИЧ-положительных пациентов, пациентов с иммуносупрессией, хроническую инфекцию и т.п. В некоторых вариантах осуществления изобретения заболевание представляет собой нарушение клеточной пролиферации. В конкретном варианте осуществления изобретения заболевание представляет собой рак, в частности, рак, выбранный из группы, включающей рак легкого, колоректальный рак, рак почки, рак предстательной железы, рак молочной железы, рак головы и шеи, рак яичника, рак головного мозга, лимфому, лейкоз и рак кожи.
Комбинации, предлагаемые в изобретении, при лечении можно применять индивидуально или в сочетании с другими средствами. Например, комбинацию, предлагаемую в изобретении, можно применять совместно по меньшей мере с одним дополнительным терапевтическим средством. В некоторых вариантах осуществления изобретения дополнительное терапевтическое средство представляет собой противораковое средством, например, химиотерапевтическое средство, ингибитор пролиферации опухолевых клеток или активатор апоптоза опухолевых клеток.
Комбинированные терапии, указанные в настоящем описании, предусматривают совместное введение антитела и иммунокоъюгата (когда два или большее количество терапевтических средств включены в одну и ту же или различные композиции) и раздельное введение, в каждом случае введение антитела можно осуществлять до, одновременно и/или после введения дополнительного терапевтического средства и/или адъюванта. Комбинации, предлагаемые в изобретении, можно объединять также с лучевой терапией.
Комбинацию, предлагаемую в изобретении (и любое дополнительное терапевтическое средство) можно вводить любыми приемлемыми путями, включая парентеральный, внутрилегочный и интраназальный и при необходимости применять для местной обработки, введения в повреждение. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Антитело и иммуноконъюгат можно вводить одинаковыми или различными путями. Дозирование можно осуществлять любым приемлемым путем, например, путем инъекций, таких как внутривенные или подкожные инъекции, в зависимости, в том числе, от того, является ли лечение кратковременным или хроническим. Можно применять различные схемы дозирования, включая (но, не ограничиваясь только ими) однократное введение или несколько введений в различные моменты времени, болюсное введение и пульсирующую инфузию.
Комбинации, предлагаемые в изобретении, можно включать в состав композиций, дозировать и вводить в соответствии с надлежащей клинической практикой. Рассматриваемые в этом контексте факторы включают конкретное нарушение, подлежащее лечению, конкретное млекопитающее, подлежащее лечению, клиническое состояние индивидуального пациента, причину нарушения, область введения агента, метод введения, схему введения и другие факторы, известные практикующим медикам. Комбинации можно, но это не является обязательным, включать в препаративную форму в сочетании с одним или несколькими другими агентами, которые в настоящее время применяют для предупреждения или лечения рассматриваемого нарушения. Эффективное количество указанных других агентов зависит от количества антитела и иммуноконъюгата, присутствующих в препаративной форме, типа нарушения или лечения и других указанных выше факторов. Их, как правило, применяют в таких же дозах и с использованием таких же путей введения, которые указаны в настоящем описании, или в количестве, составляющем от 1 до 99% от дозы, указанной в настоящем описании, или в любой дозе и с помощью любого пути, которые по данным эмпирической/клинической оценки являются пригодными.
Для предупреждения или лечения заболевания приемлемая доза антитела и иммуноконъюгата (при их применении в комбинациях, предлагаемых изобретении, необязательно в сочетании с одним или несколькими другими дополнительными терапевтическими средствами), должна зависеть от типа заболевания, подлежащего лечению, типа антитела и иммуноконъюгата, серьезности и течения болезни, применяют ли комбинацию для профилактических или терапевтических целей, предшествующей терапии, истории болезни пациента и ответа на антитело и/или иммуноконъюгат и предписания лечащего врача. Антитело и иммуноконъюгат можно вводить пациенту однократной или в виде серий обработок.
В зависимости от типа и серьезности заболевания возможная начальная доза антитела для введения пациенту, например, с использованием одного или нескольких индивидуальных введений или с помощью непрерывной инфузии, может составлять примерно от 1 мкг/кг до 15 мг/кг (например, 0,1-10 мг/кг). Типичная суточная доза может составлять от примерно 1 мкг/кг до 100 мг/кг или более в зависимости от отмеченных выше факторов. Для повторных введений в течение нескольких дней или более продолжительного периода в зависимости от состояния лечение, как правило, должно продолжаться до достижения требуемого подавления имеющихся симптомов заболевания. В качестве примера, доза антитела может составлять от примерно 0,05 до примерно 10 мг/кг. Так, пациенту можно вводить одну или несколько доз, составляющих примерно 0,5, 2,0, 4,0 или 10 мг/кг (или любую их комбинацию). Указанные дозы можно вводить прерывисто, например, каждую неделю или каждые три недели (например, таким образом, чтобы пациент получал от примерно двух до примерно двадцати или, например, примерно шесть доз антитела). Можно вводить начальную более высокую ударную дозу, после которой применять одну или несколько более низких доз. Примером схемы дозирования является введение начальной ударной дозы, составляющей примерно 4 мг/кг, с последующим еженедельным введением поддерживающей дозы антитела, составляющей примерно 2 мг/кг. Указанное относится и к дозе иммуноконъюгата, подлежащего применению в комбинациях, предлагаемых в изобретении. Однако можно использовать другие схемы введения доз. Успех такой терапии легко оценивать с помощью общепринятых методик и анализов.
Изделия
Другим объектом изобретения является изделие, которое содержит продукты, применяемые для лечения, предупреждения и/или диагностирования указанных выше нарушений. Изделие представляет собой контейнер и этикетку или листовку-вкладыш в упаковку, которая размещена на контейнере или прилагается к нему. Приемлемыми контейнерами являются, например банки, пузырьки, шприцы, пакеты для внутривенного (IV) раствора и т.д. Контейнеры можно изготавливать из различных материалов, таких как стекло или пластмасса. Контейнер содержит композицию, которая сама по себе или в сочетании с другой композицией является эффективной для лечения, предупреждения и/или диагностирования состояния, и может иметь стерильный порт доступа (например, контейнер может представлять собой пакет для внутривенного раствора или пузырек, снабженный пробкой, которую можно прокалывать с помощью иглы для подкожных инъекций). По меньшей мере одно действующее вещество в композиции представляет собой антитело, предлагаемое в изобретении, подлежащее применению в комбинациях, предлагаемых в изобретении. Другим действующим веществом является иммуноконъюгат, подлежащий применению в комбинациях, предлагаемых в изобретении, который может входить в ту же композицию и контейнер, что и антитело, или может находиться в другой композиции и в другом контейнере. На этикетке или листовке-вкладыше в упаковку указано, что композицию применяют для лечения выбранного состояния.
Одним из объектов изобретения является набор, предназначенный для лечения заболевания, содержащий в одном и том же или в отдельных контейнерах (а) иммуноконъюгат, который содержит первое антитело, сконструированное таким образом, чтобы оно обладало пониженной эффекторной функцией, и эффекторный фрагмент, и (б) второе антитело, сконструированное таким образом, чтобы оно обладало повышенной эффекторной функцией, и необязательно дополнительно содержит (в) листовку-вкладыш в упаковку, которая содержит напечатанные инструкции по применению комбинированной терапии в качестве метода лечения заболевания. Кроме того, набор может содержать (а) первый контейнер с композицией, находящейся в нем, где композиция содержит антитело, сконструированное таким образом, чтобы оно обладало повышенной; (б) второй контейнер с композицией, находящейся в нем, где композиция содержит иммуноконъюгат, который содержит антитело, сконструированное таким образом, чтобы оно обладало пониженной эффекторной функцией, и эффекторный фрагмент; и необязательно (в) третий контейнер с композицией, находящейся в нем, где композиция содержит дополнительное цитотоксическое или другое терапевтическое средство. В этом варианте осуществления изобретения набор, предлагаемый в изобретении, может дополнительно содержать листовку-вкладыш в упаковку, которая содержит информацию о том, что композиции можно использовать для лечения конкретного состояния. В альтернативном или дополнительном варианте изделие может включать также третий (или четвертый) контейнер с фармацевтически приемлемым буфером, таким как бактериостатическая вода для инъекций (БСВИ), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Кроме того, оно может включать другие продукты, необходимые с коммерческой точки зрения и с точки зрения потребителя, в частности, другие буферы, разбавители, фильтры, иглы и шприцы.
Примеры
Ниже представлены примеры способов и композиций, предлагаемых в изобретении. Как должно быть очевидно, при воплощении изобретения на практике можно применять различные другие варианты осуществления изобретения с учетом представленного выше описания изобретения в целом.
Общие методы
Гликоинженерия Fc-области антитела позволяет обеспечивать повышенную аффинность связывания с человеческими FcγRIII-рецепторами, что в свою очередь транслируется в индукцию повышенной ADCC и противоопухолевой эффективности. Человеческие FcγRIII-рецепторы экспрессируются на макрофагах, нейтрофилах и естественных клетках-киллерах (NK), дендритных клетках и γδ Т-клетках. У мышей, которые представляет собой вид, наиболее широко применяемый для доклинического тестирования эффективности, мышиный FcγRIV, т.е. мышиный гомолог человеческого FcγRIIIa, присутствует на макрофагах и нейтрофилах, но отсутствует на NK-клетках. Таким образом, эти модели не в полной степени отражают любое ожидаемое повышение эффективности созданных с помощью гликоинженерии антител. При создании изобретения были созданы мыши, трансгенные по человеческому FcγRIIIa (CD16a), отличающиеся стабильной экспрессией человеческого CD16a на мышиных NK-клетках в крови, лимфоидной ткани и опухолях. Кроме того, уровень экспрессии человеческого CD16a на нестимулированных NK-клетках в крови указанных трансгенных мышей отражает уровень экспрессии, обнаруженный у человека. При создании изобретения было также установлено, что понижающая регуляции человеческого FcγRIIIa на ассоциированных с опухолью NK-клетках после терапии с использованием антитела, коррелирует с противоопухолевой активностью. И, наконец, при создании изобретения была выявлена существенно более высокая эффективность лечения с использованием созданных с помощью гликоинженерии антител на моделях опухолей при применении указанной новой линии мышей по сравнению с их негативными по человеческому CD16 однопометниками.
Пример 1
Модель, полученная с помощью ксенотрансплантата карциномы головы и шеи линии FaDu
Иммуноконъюгаты 28Н1 IgG-IL2, мишенью которых является FAP, и «ненаправленные» иммуноконъюгаты DP47GS IgG-IL2, содержащие четырехмутантный (qm) IL-2 (SEQ ID NO: 125, 126, 129 и SEQ ID NO: 133-135, соответственно) и анти-EGFR GlycoMab (SEQ ID NO: 102 и 103) тестировали в отношении клеточной линии карциномы головы и шеи линии FaDu, которую интралингвально инъецировали SCID-мышам. С помощью ИГХ (иммуногистохимии) свежезамороженной ткани установлено, что эта модель опухоли является FAP-позитивной. Клетки FaDu первоначально получали из АТСС (Американская коллекция типовых культур) и после размножения помещали во внутренний банк клеток фирмы Glycart. Линию опухолевых клеток культивировали общепринятым методом в среде DMEM, содержащей 10% FCS (фирма Gibco), при 37°С в насыщенной водяными парами атмосфере с 5% СО2. Полученный in vitro пассаж 9, жизнеспособность клеток в котором составляла 95,8%, применяли для осуществления интралингвальной инъекции. Двадцать мкл клеточной суспензии (2×105 FaDu-клеток в среде AimV (фирма Gibco)) инъецировали интралингвально. Самок мышей линии SCID (фирма Taconics, Дания), возраст которых в начале эксперимента составлял 8-9 недель, содержали в специальных условиях без патогенов с суточными циклами 12 ч света/12 ч темноты согласно принятым руководствам (GV-Solas; Felasa; TierschG). Протокол экспериментального исследования был рассмотрен и одобрен местными органами управления (Р 2008016). После доставки животных выдерживали в течение одной недели для акклиматизации к новому окружению и для обследования. В течение всего периода времени регулярно осуществляли мониторинг состояния здоровья. Мышам инъецировали интралингвально в день 0 опыта по 2×105 FaDu-клеток, их произвольно разделяли на группы и взвешивали. Через 1 неделю после инъекции опухолевых клеток мышам инъецировали i.v. иммуноконъюгат 28Н1 IgG-IL2 qm, иммуноконъюгат DP47GS IgG-IL2 qm, анти-EGFR GlycoMab, комбинацию иммуноконъюгата 28Н1 IgG-IL2 qm и анти-EGFR GlycoMab или комбинацию иммуноконъюгата DP47GS IgG-IL2 qm и анти-EGFR GlycoMab один раз в неделю в течение 4 недель. Всем мышам инъецировали i.v. по 200 мкл соответствующего раствора. Информация о дозах представлена в таблице 2. Мышам из обработанной наполнителем группы инъецировали ЗФР, а мышам из групп обработки инъецировали иммуноконъюгат 28Н1 IgG-IL2 qm, иммуноконъюгат DP47GS IgG-IL2 qm, анти-EGFR GlycoMab, комбинацию иммуноконъюгата 28Н1 IgG-IL2 qm и анти-EGFR GlycoMab или комбинацию иммуноконъюгата DP47GS IgG-IL2 qm и анти-EGFR GlycoMab. Для получения соответствующего количества иммуноконъюгата в 200 мкл маточные растворы разводили при необходимости ЗФР. На фиг. 1А продемонстрировано, что только комбинация иммуноконъюгата 28Н1 IgG-IL2, мишенью которого является FAP, и анти-EGFR GlycoMab опосредовала повышенную эффективность в понятиях удлиненной медианы выживаемости по сравнению с индивидуальным применением иммуноконъюгата 28Н1 IgG-IL2 qm или анти-EGFR GlycoMab. В противоположность этому, комбинация «ненаправленного» DP47GS IgG-IL2 qm и анти-EGFR GlycoMab не превышала эффективность агентов при их индивидуальном применении (фиг. 1Б).

Пример 2
In vitro усиление киллерной активности NK-клетки с помощью содержащих IL-2 иммуноконъюгатов
Для определения воздействия иммуноконъюгатов на NK-клетки при создании изобретения оценивали уничтожение опухолевых клеток с помощью обработки иммуноконъюгатами, прежде всего иммуноконъюгатами, содержащими IL-2 в качестве эффекторного фрагмента. Для этой цели мононуклеарные клетки периферической крови (РВМС) выделяли с помощью стандартных процедур, используя Histopaque-1077 (фирма Sigma Diagnostics Inc., Сент-Луис, шт.Миссури, США). В целом, метод состоял в следующем: венозную кровь собирали с помощью гепаринизированных шприцев у здоровых доноров. Кровь разводили в соотношении 2:1 ЗФР, не содержащим кальций и магний, и наслаивали на Histopaque-1077. Градиент центрифугировали при 450×g в течение 30 мин при комнатной температуре (КТ) без перерыва. Собирали содержащую РВМС интерфазу, и отмывали в целом три раза ЗФР (350×g, затем 300×g в течение 10 мин при КТ).
Выделенные РВМС инкубировали в течение 45 ч с IL-2 (пролейкин) или с содержащими IL-2 иммуноконъюгатами, добавленными к клеточному супернатанту. Затем РВМС выделяли и применяли для оценки опосредуемой анти-EGFR GlycoMab ADCC в отношении А549-клеток при соотношении Е : Т 10:1 в течение 4 ч. Уничтожение клеток-мишеней оценивали путем количественного определения выделения лактатдегидрогеназы (LDH) в клеточные супернатанты (набор фирмы Roche для оценки цитотоксичности на основе LDH). На фиг. 2 представлены данные об уничтожении в целом опухолевых клеток А549 с помощью РВМС, которые предварительно обрабатывали 0,57 нМ (А) или 5,7 нМ (Б) иммуноконъюгатом 28Н1 IgG-IL2 qm, мишенью которого является FAP, или IL-2 (пролейкин), или оставляли без предварительной обработки, в присутствии взятого в различных концентрациях анти-EGFR GlycoMab. На графиках продемонстрировано, что предварительная обработка эффекторных клеток иммуноконъюгатом приводила при возрастании концентраций GlycoMab к значительному повышению уничтожения клеток-мишеней по сравнению с необработанными эффекторными клетками.
Пример 3
Модель, полученная с помощью ксенотрансплантата колоректальной карциномы линии LS174T
Иммуноконъюгат СН1А1А IgG-IL2 qm, мишенью которого является СЕА (SEQ ID NO: 136-138), анти-EGFR GlycoMab (SEQ ID NO: 102 и 103) и цетуксимаб тестировали в отношении клеточной линии человеческой колоректальной карциномы LS174T, которую инъецировали внутрь селезенки мышам линии SCID, трансгенным по человеческому FcγRIII. С помощью ИГХ свежезамороженной ткани установлено, что эта модель опухоли является СЕА-позитивной. Клетки LS174T (клетки человеческой карциномы ободочной кишки) первоначально получали из ЕСАСС (Европейская коллекция клеточных культур) и после размножения помещали во внутренний банк клеток фирмы Glycart. Клеки LS174T культивировали в среде Игла MEM, содержащей 10% FCS (фирма РАА Laboratories, Австрия), 1% глютамакса и 1% содержащей заменяемые аминокислоты среды MEM (фирма Sigma). Клетки культивировали при 37°С в насыщенной водяными парами атмосфере с 5% СО2. Полученный in vitro пассаж 9 или 23, жизнеспособность клеток в котором составляла 99%, применяли для осуществления внутриселезеночной инъекции. Делали небольшой разрез в левой брюшной области анестезированных SCID-мышей, трангенных по FcγRIII. По 30 мкл клеточной суспензии (2×106 LSI 74Т-клеток в среде AimV) инъецировали через брюшную стенку непосредственно под капсулу селезенки. Кожные ранения закрывали с помощью скобок или рассасывающихся швов. Самок трансгенных по FcγRIII мышей линии SCID (фирма Taconics, Дания), возраст которых в начале эксперимента составлял 8-9 недель, содержали в специальных условиях без патогенов с суточными циклами 12 ч света/12 ч темноты согласно принятым руководствам (GV-Solas; Felasa; TierschG). Протокол экспериментального исследования был рассмотрен и одобрен местными органами управления (Р 2008016). После доставки животных выдерживали в течение одной недели для акклиматизации к новому окружению и для обследования. В течение всего периода времени регулярно осуществляли мониторинг состояния здоровья. Мышам инъецировали внутриселезеночно в день 0 опыта 2×106 LS174Т-клеток, их произвольно разделяли на группы и взвешивали. Через 1 неделю после инъекции опухолевых клеток мышам инъецировали i.v. иммуноконъюгат СН1А1А IgG-IL2 qm, анти-EGFR GlycoMab, цетуксимаб, комбинацию иммуноконъюгата СН1А1А IgG-IL2 qm и анти-EGFR GlycoMab или комбинацию иммуноконъюгата СН1А1А IgG-IL2 qm и цетуксимаба один раз в неделю в течение 3 недель. Всем мышам инъецировали i.v. по 200 мкл соответствующего раствора. Информация о дозах представлена в таблице 3. Мышам из обработанной наполнителем группы инъецировали ЗФР, а мышам из групп обработки инъецировали иммуноконъюгат СН1А1А IgG-IL2 qm или анти-EGFR GlycoMab, цетуксимаб, комбинацию иммуноконъюгата СН1А1А IgG-IL2 qm и анти-EGFR GlycoMab или комбинацию иммуноконъюгата СН1А1А IgG-IL2 qm и цетуксимаба. Для получения соответствующего количества иммуноконъюгата в 200 мкл маточные растворы разводили при необходимости ЗФР. На фиг. 3 и в таблицах 3А и 3Б продемонстрировано, что комбинация иммуноконъюгата СН1А1А IgG-IL2 qm и анти-EGFR GlycoMab опосредовала повышенную эффективность в понятиях удлиненной медианы выживаемости и общей выживаемости по сравнению с индивидуальным применением иммуноконъюгата СН1А1А IgG-IL2 qm, индивидуальным применением анти-EGFR GlycoMab, индивидуальным применением цетуксимаба или применением комбинации иммуноконъюгата СН1А1А IgG-IL2 qm и цетуксимаба.



Пример 4
Модель, полученная с помощью ксенотрансплантата рака легкого линии А549
Иммуноконъюгат СН1А1А IgG-IL2 qm, мишенью которого является СЕА (SEQ ID NO: 136-138), анти-EGFR GlycoMab (SEQ ID NO: 102 и 103) и цетуксимаб тестировали в отношении клеточной линии человеческого немелкоклеточного рака легких (NSCLC) А549, которую инъецировали i.v. мышам линии SCID, трансгенным по человеческому FcγRIII.
Клетки немелкоклеточного рака легких линии А549 сначала получали из АТСС (CCL-185) и после размножения помещали во внутренний банк клеток фирмы Roche-Glycart. Линию опухолевых клеток культивировали общепринятым методом в среде DMEM, содержащей 10% FCS (фирма Gibco), при 37°С в насыщенной водяными парами атмосфере с 5% СО2. Полученный in vitro пассаж 8, жизнеспособность клеток в котором составляла 97-98%, применяли для трансплантации. 5×106 клеток на животное инъецировали i.v. в хвостовую вену в 200 мкл среды для культуры клеток Aim V (фирма Gibco).
Самок мышей SCID-FcγRIII (фирма Roche-Glycart; Швейцария), возраст которых в начале эксперимента составлял 8-9 недель (выведены на фирме Charles Rivers, Лион, Франция) содержали в специальных условиях без патогенов с суточными циклами 12 ч света/12 ч темноты согласно принятым руководствам (GV-Solas; Felasa; TierschG). Протокол экспериментального исследования был рассмотрен и одобрен местными органами управления (Р 2008016). После доставки животных выдерживали в течение одной недели для акклиматизации к новому окружению и для обследования. В течение всего периода времени регулярно осуществляли мониторинг состояния здоровья.
Мышам инъецировали i.v. в день 0 опыта 5×106 А549-клеток, их произвольно разделяли на группы и взвешивали. Через 1 неделю (фиг. 4А) или две недели (фиг. 4Б) после инъекции опухолевых клеток мышам инъецировали i.v. иммуноконъюгат СН1А1А IgG-IL2 qm, анти-EGFR GlycoMab, цетуксимаб, комбинацию иммуноконъюгата СН1А1А IgG-IL2 qm и анти-EGFR GlycoMab или комбинацию иммуноконъюгата СН1А1А IgG-IL2 qm и цетуксимаба один раз в неделю в течение 3 недель. Всем мышам инъецировали i.v. по 200 мкл соответствующего раствора. Информация о дозах представлена в таблице 4. Мышам из обработанной наполнителем группы инъецировали ЗФР, а мышам из групп обработки инъецировали иммуноконъюгат СН1А1А IgG-IL2 qm или анти-EGFR GlycoMab, цетуксимаб, комбинацию иммуноконъюгата СН1А1А IgG-IL2 qm и анти-EGFR GlycoMab или комбинацию иммуноконъюгата СН1А1А IgG-IL2 qm и цетуксимаба. Для получения соответствующего количества иммуноконъюгата в 200 мкл маточные растворы разводили при необходимости ЗФР.
На фиг. 4 и в таблицах 4А и 4Б продемонстрировано, что комбинация иммуноконъюгата СН1А1А IgG-IL2 qm и анти-EGFR GlycoMab опосредовала повышенную эффективность в понятиях удлиненной медианы выживаемости и общей выживаемости по сравнению с индивидуальным применением соответствующего иммуноконъюгата, анти-EGFR GlycoMab или цетуксимаба, а также применением комбинации иммуноконъюгата СН1А1А IgG-IL2 qm и цетуксимаба.



Пример 5
Модель, полученная с помощью ксенотрансплантата колоректальной карциномы линии LS174T
Иммуноконъюгат СН1А1А IgG-IL2 qm, мишенью которого является СЕА (SEQ ID NO: 136-138), анти-Her3 GlycoMab (SEQ ID NO: 142 и 146) тестировали в отношении клеточной линии человеческой колоректальной карциномы LS174T, которую инъецировали внутрь селезенки мышам линии SCID, трансгенным по человеческому FcγRIII.
Клетки LS174T (клетки человеческой карциномы ободочной кишки) первоначально получали из ЕСАСС (Европейская коллекция клеточных культур) и после размножения помещали во внутренний банк клеток фирмы Roche-Glycart. Клетки LS174T культивировали в среде Игла MEM, содержащей 10% FCS (фирма РАА Laboratories, Австрия), 1% глютамакса и 1% содержащей заменяемые аминокислоты среды MEM (фирма Sigma). Клетки культивировали при 37°С в насыщенной водяными парами атмосфере с 5% СО2. Полученный in vitro пассаж 21, жизнеспособность клеток в котором составляла 97,9%, применяли для осуществления внутриселезеночной инъекции. Делали небольшой разрез в левой брюшной области анестезированных SCID-мышей, трангенных по FcγRIII. По 30 мкл клеточной суспензии (2×106 LS174T-клеток в среде AimV) инъецировали через брюшную стенку непосредственно под капсулу селезенки. Кожные ранения закрывали с помощью рассасывающихся швов.
Самок трансгенных по FcγRIII мышей линии SCID (фирма Roche-Glycart, Швейцария), возраст которых в начале эксперимента составлял 8-9 недель, содержали в специальных условиях без патогенов с суточными циклами 12 ч света/12 ч темноты согласно принятым руководствам (GV-Solas; Felasa; TierschG). Протокол экспериментального исследования был рассмотрен и одобрен местными органами управления (Р 2008016). После доставки животных выдерживали в течение одной недели для акклиматизации к новому окружению и для обследования. В течение всего периода времени регулярно осуществляли мониторинг состояния здоровья.
Мышам инъецировали внутриселезеночно в день 0 опыта 2×106 LS174Т-клеток, их произвольно разделяли на группы и взвешивали. Через 1 неделю после инъекции опухолевых клеток мышам инъецировали i.v. иммуноконъюгат СН1А1А IgG-IL2 qm, анти-Her3 GlycoMab, комбинацию иммуноконъюгата СН1А1А IgG-IL2 qm и анти- Her3 GlycoMab один раз в неделю в течение 3 недель.
Всем мышам инъецировали i.v. по 200 мкл соответствующего раствора. Информация о дозах представлена в таблице 5. Мышам из обработанной наполнителем группы инъецировали ЗФР, а мышам из групп обработки инъецировали иммуноконъюгат СН1А1А IgG-IL2 qm или анти-Her3 GlycoMab или комбинацию иммуноконъюгата СН1А1А IgG-IL2 qm и анти-Her3 GlycoMab. Для получения соответствующего количества иммуноконъюгата в 200 мкл маточные растворы разводили при необходимости ЗФР.
На фиг. 5 и в таблице 5А продемонстрировано, что комбинация иммуноконъюгата СН1А1А IgG-IL2 qm и анти-Her3 GlycoMab опосредовала повышенную эффективность в понятиях удлиненной медианы выживаемости по сравнению с индивидуальным применением иммуноконъюгата СН1А1А IgG-IL2 qm или анти-Her3


Пример 6
Модель, полученная с помощью ксенотрансплантата почечной карциномы линии ACHN
Иммуноконъюгаты 28Н1 IgG-IL2, мишенью которых является FAP, содержащие четырехмутантный (qm) IL-2 (SEQ ID NO: 125, 126, 129) и анти-EGFR GlycoMab (SEQ ID NO: 102 и 103) тестировали в отношении клеточной линии почечной карциномы ACHN, которую инъецировали внутрь почки мышам линии SCID, трансгенных по человеческому FcγRIII.
ACHN-клетки (клетки человеческой почечной аденокарциномы) первоначально получали из АТСС (Американская коллекция типовых культур) и после размножения помещали во внутренний банк клеток фирмы Roche-Glycart. ACHN-клетки культивировали в DMEM, содержащей 10% FCS. Клетки культивировали при 37°С в насыщенной водяными парами атмосфере с 5% СО2. Полученный in vitro пассаж 22, жизнеспособность клеток в котором составляла 96,4%, применяли для осуществления инъекции внутрь почки. Делали небольшой разрез (2 см) в правой боковой области и перитонеальной стенке анестезированных SCID-мышей, трангенных по FcγRIII. По 50 мкл клеточной суспензии (1×106 ACHN-клеток в среде AimV) инъецировали в область, расположенную ниже на 2 мм относительно капсулы почки. Ранения кожи и перитонеальной стенки закрывали с помощью рассасывающихся швов.
Самок трансгенных по FcγRIII мышей линии SCID (фирма Roche-Glycart, Швейцария), возраст которых в начале эксперимента составлял 8-9 недель, содержали в специальных условиях без патогенов с суточными циклами 12 ч света/12 ч темноты согласно принятым руководствам (GV-Solas; Felasa; TierschG). Протокол экспериментального исследования был рассмотрен и одобрен местными органами управления (Р 2008016). После доставки животных выдерживали в течение одной недели для акклиматизации к новому окружению и для обследования. В течение всего периода времени регулярно осуществляли мониторинг состояния здоровья.
Мышам инъецировали внутрь почки в день 0 опыта 1×106 ACHN-клеток, их произвольно разделяли на группы и взвешивали. Через 1 неделю после инъекции опухолевых клеток мышам инъецировали i.v. наполнитель, анти-EGFR GlycoMab, комбинацию иммуноконъюгата 28Н1 IgG-IL2 и анти-EGFR GlycoMab или комбинацию Proleukin® и анти-EGFR GlycoMab. Анти-EGFR GlycoMab и иммунокоъюгат 28Н1 IgG-IL2 вводили один раз в неделю в течение 3 недель. Proleukin® инъецировали ежедневно с понедельника по пятницу в течение 3 недель.
Всем мышам инъецировали i.v. по 200 мкл соответствующего раствора. Информация о дозах представлена в таблице 6. Мышам из обработанной наполнителем группы инъецировали ЗФР, а мышам из групп обработки инъецировали анти-EGFR GlycoMab, комбинацию иммуноконъюгата 28Н1 IgG-IL2 и анти-EGFR GlycoMab или комбинацию Proleukin® и анти-EGFR GlycoMab.
Для получения соответствующего количества иммуноконъюгата в 200 мкл маточные растворы разводили при необходимости ЗФР.
На фиг. 6 и в таблице 6А продемонстрировано, что комбинация иммуноконъюгата 28Н1 IgG-IL2 и анти-EGFR GlycoMab опосредовала повышенную эффективность в понятиях удлиненной медианы выживаемости и общей выживаемости по сравнению с индивидуальным применением анти-EGFR GlycoMab и комбинации Proleukin® и анти-EGFR GlycoMab.


Пример 7
In vitro усиление киллерной активности NK-клетки и экспрессии CD25 и CD69 на NK-клетке с помощью содержащих IL-2 иммуноконъюгатов
Также как в примере 2, при создании изобретения оценивали уничтожение опухолевых клеток (LS174T) с помощью NK-клеток при обработке иммуноконъюгатом, прежде всего иммуноконъюгатом, содержащими IL-2 в качестве эффекторного фрагмента, и GlycoMab, в данном случае анти-Her3 GlycoMab. Уничтожение клеток-мишеней определяли, оценивая высвобождение LDH в клеточный супернатант.
РВМС выделяли из свежей крови. В целом, метод состоял в следующем: кровь разводили в соотношении 3:1 ЗФР. Примерно 30 мл смеси кровь/ЗФР наслаивали на 15 мл Histopaque (фирма Sigma) и центрифугировали при 450×g в течение 30 мин без перерыва. Лимфоциты собирали с помощью 5-миллилитровой пипетки в 50-миллилитровые пробирки, содержащие ЗФР. Пробирки заполняли до 50 мл ЗФР и центрифугировали при 350×g в течение 10 мин. Супернатант отбрасывали, дебрис ресуспендировали в 50 мл ЗФР и центрифугировали при 300×g в течение 10 мин. Стадию промывки однократно повторяли. Клетки подсчитывали и ресуспендировали в предварительно нагретой среде RPMI, содержащей 1% глутамина и 10% FCS, из расчета 1×106 клеток на мл. Клетки инкубировали в течение ночи при 37°С. На следующий день клетки собирали и подсчитывали.
Клетки LS174T (ЕСАСС №87060401) представляют собой клеточную линию аденокарциномы ободочной кишки человека кавказской расы. Клетки культивировали в среде ЕМЕМ, содержащей 1% глутамина, 1% заменимых аминокислот и 10% FCS, и разделяли каждые 2-3 дня до достижения конфлюэнтности. LS174T-клетки отделяли с помощью трипсина. Клетки подсчитывали и определяли их жизнеспособности. Жизнеспособность клеток до анализа составляла 99,4%. Клетки ресуспендировали в соответствующей среде из расчета 0,3×106 на мл. 100 мкл клеточной суспензии высевали в 96-луночный планшет для культуры клеток и инкубировали в течение ночи при 37°С. На следующий день супернатант удаляли из клеток. Затем в соответствующие лунки добавляли по 50 мкл разведенного анти-Her3 GlycoMab (SEQ ID NO: 142 и 146) в концентрации 1000 нг/мл, 100 нг/мл и 10 нг/мл или среду. Затем добавляли из расчета 50 мкл на лунку иммуноконъюгата СН1А1А IgG-IL2 qm, мишенью которого является СЕА (SEQ ID NO: 136-138), в указанных концентрациях (см. фиг. 7) или среду. После инкубации в течение 10 мин при комнатной температуре добавляли по 100 мкл РВМС из расчета 3×106 клеток на лунку или среду до достижения конечного объема 200 мкл на лунку. Клетки инкубировали в течение 24 ч в инкубаторе. После инкубации планшет центрифугировали в течение 4 мин при 400×g и супернатант собирали. Использовали по 50 мкл на лунку супернатанта для оценки высвобождения LDH (набор фирмы Roche для оценки цитотоксичности на основе LDH). Оставшийся супернатант хранили при -20°С до дальнейшего применения. Клетки ресуспендировали в FACS-буфере и хранили при 4°С до начала FACS-окрашивания (см. ниже).
На фиг. 7 представлены обобщенные данные об уничтожении LS174T-клеток с использованием РВМС после обработки только анти-Her3 GlycoMab (левая панель), только иммуноконъюгатом СН1А1А IgG-IL-2 qm (правая панель) или комбинацией иммуноконъюгата СН1А1А IgG-IL-2 qm с анти-Her3 GlycoMab (правая панель).
РВМС собирали через 24 ч и применяли для FACS-анализа экспрессии CD25 и CD69 на NK-клетках. Клетки центрифугировали в течение 4 мин при 400×g и однократно промывали ЗФР, содержащим 0,1% БСА (FACS-буфер). Затем к клеткам добавляли по 20 мкл на лунку смеси антител. Клетки инкубировали в течение 30 мин в холодильнике. Затем клетки промывали дважды FACS-буфером и ресуспендировали, добавляя по 200 мкл на лунку FACS-буфера, содержащего 2% PFA. Анализ осуществляли, используя устройство фирмы BD FACS Fortessa и следующую смесь антител: CD3 РЕ/Cy7 (фирма BioLegend, №300420; разведенное в соотношении 1:40), CD56 АРС (фирма BioLegend, №318310; разведенное в соотношении 1:20), CD69 Brilliant Violet 421 (фирма BioLegend, №310929; разведенное в соотношении 1:40), CD25 РЕ (фирма BD Bioscience, №557138; разведенное в соотношении 1:20).
На фиг. 8 представлены данные об экспрессии CD25 (А) или CD69 (Б) на NK-клетках после обработки только анти-Her3 GlycoMab (левая панель), только иммуноконъюгатом СН1А1А IgG-IL-2 qm (правая панель) или комбинацией иммуноконъюгата СН1А1А IgG-IL-2 qm с анти-Her3 GlycoMab (правая панель).
Хотя выше изобретение описано достаточно подробно с помощью иллюстраций и примеров, приведенных для целей лучшего его понимания, описание и примеры не должны рассматриваться как ограничивающие объем изобретения. Все процитированные в настоящем описании патентные и научные публикации полностью включены в него в качестве ссылки.
Реферат
Изобретение относится к биохимии. Описана комбинация иммуноконъюгата, который содержит(i) первое антитело, направленное на фибробласт-активирующий белок (FAP) и включающее вариабельную область тяжелой цепи SEQ ID NO: 12 и вариабельную область легкой цепи SEQ ID NO: 11, вариабельную область тяжелой цепи SEQ ID NO: 17 и вариабельную область легкой цепи SEQ ID NO: 16, вариабельную область тяжелой цепи SEQ ID NO: 47 и вариабельную область легкой цепи SEQ ID NO: 46, вариабельную область тяжелой цепи SEQ ID NO: 63 и вариабельную область легкой цепи SEQ ID NO: 62 или вариабельную область тяжелой цепи SEQ ID NO: 67 и вариабельную область легкой цепи SEQ ID NO: 66 или направленное на карциноэмбриональный антиген (СЕА) и включающее вариабельную область тяжелой цепи SEQ ID NO: 114 и вариабельную область легкой цепи SEQ ID NO: 115, где первое антитело представляет собой полноразмерное антитело IgG-класса и включает аминокислотные замены L234A, L235A и P329G (EU-нумерация, представленная у Кэбота) в тяжелых цепях иммуноглобулина, и(ii) молекулу мутантного человеческого IL-2, содержащую аминокислотные замены F42A, Y45A и L72G,и второго антитела, выбранного из группы(i) антитела IgG-класса, направленного на рецептор эпидермального фактора роста (EGFR), содержащего вариабельный домен тяжелой цепи SEQ ID NO: 102 и вариабельный домен легкой цепи SEQ ID NO: 103, где антитело сконструировано таким образом, чтобы оно имело повышенное соотношение нефуколизированных олигосахаридов в Fc-области по сравнению с несконструированным антителом,(ii) антитела IgG-класса к HER3, содержащего вариабельный домен тяжелой цепи SEQ ID NO: 142 и вариабельный домен легкой цепи SEQ ID NO: 146, где антитело сконструировано таким образом, чтобы оно имело повышенное соотношение нефуколизированных олигосахаридов в Fc-области по сравнению с несконструированным антителом, и(iii) цетуксимаба,для применения при лечении рака у нуждающегося в этом индивидуума. Кроме того, описаны фармацевтическая композиция для лечения рака, содержащая описанную комбинацию, и способы применения описанной комбинации, такие как способы лечения рака и стимуляции функции эффекторных клеток у индивидуума. Изобретение позволяет удлинить медиану выживаемости и/или общей выживаемости по сравнению с индивидуальными компонентами или комбинациями с Пролейкином. 6 н. и 7 з.п. ф-лы, 8 ил., 6 табл., 7 пр.
Формула
Документы, цитированные в отчёте о поиске
Оптимизированные fc-варианты, имеющие измененное связывание с fcγr, и способы их получения

Комментарии