Оптимизированные fc-варианты, имеющие измененное связывание с fcγr, и способы их получения - RU2337107C2
Код документа: RU2337107C2
Чертежи
























































Описание
Эта заявка является частичным продолжением заявки под №10/672280, зарегистрированной в США 26 сентября 2003 года, которая заявляет права в соответствии с 35 U.S.С. §119(е) на все преимущества предварительной заявки под №60/477839, зарегистрированной в США 12 июня 2003 года, предварительной заявки под №60/467606, зарегистрированной в США 2 мая 2003 года, предварительной заявки под №60/414433, зарегистрированной в США 27 сентября 2002 года, и предварительной заявки под №60/442301, зарегистрированной в США 23 января 2003 года, и является частичным продолжением заявки под №10/379392, зарегистрированной в США 3 марта 2003 года. Содержание этих заявок включено сюда путем отсылки во всей своей полноте.
Область техники, к которой относится изобретение
Это изобретение имеет отношение к новым оптимизированным вариантам Fc, к конструкторским способам их получения и к их применению, в особенности, в терапевтических целях.
Уровень техники
Антитела представляют собой иммунологические белки, которые связывают специфический антиген. У большинства млекопитающих, включая людей и мышей, антитела построены из спаренных тяжелых и легких полипептидных цепей. Каждая цепь собирается из индивидуальных доменов иммуноглобулина (Ig), и, таким образом, для таких белков используют родовое понятие «иммуноглобулин». Каждая цепь собирается из двух различных участков, относящихся к вариабельной и константной областям. Легкая и тяжелая цепи вариабельной области демонстрируют значительное различие между антителами в последовательности и отвечают за связывание с антигеном-мишенью. Константные области демонстрируют меньшие различия в последовательности и отвечают за связывание с большим количеством природных белков для достижения значимых биохимических эффектов. У человека существуют пять классов антител, включающих IgA (которые включают подклассы IgA1 и IgA2), IgD, IgE, IgG (которые включают подклассы IgG1, IgG2, IgG3 и IgG4) и IgM. Характерной особенностью этих классов антител являются их константные области, хотя более тонкие различия могут существовать и в V-области. Фигура 1 показывает антитело IgG1, используемое здесь в качестве примера, чтобы описать основные структурные черты иммуноглобулинов. Антитела IgG представляют собой тетрамерные белки, состоящие из двух тяжелых цепей и двух легких цепей. Тяжелая цепь IgG состоит из четырех иммуноглобулиновых доменов, соединенных от N-конца к С-концу в порядке VH-Сγ1-Сγ2-Сγ3, относящихся к вариабельному домену тяжелой цепи, константному домену гамма-1, константному домену гамма-2 и константному домену гамма-3 соответственно. Легкая цепь IgG состоит из двух иммуноглобулиновых доменов, соединенных от N-конца к С-концу в порядке VL-CL, относящихся к вариабельному домену легкой цепи и константному домену легкой цепи соответственно.
Вариабельная область антитела содержит антиген-связывающие детерминанты молекулы и, таким образом, обуславливает специфичность антитела в отношении антигена-мишени. Вариабельная область называется так потому, что она наиболее сильно различается по последовательности от других антител внутри одного и того же класса. Наибольшие различия в последовательности обнаруживаются в гипервариабельных участках (участках, определяющих комплементарность (CDR)). Всего существует 6 участков CDR, по три на каждую тяжелую и легкую цепи, обозначаемые как VHCDR1, VHCDR2, VHCDR3, VLCDR1, VLCDR2 и VLCDR3. Вариабельный участок, находящийся вне участков CDR, относится к каркасному участку (FR). Среди различных антител наблюдают различия последовательности в участках FR, хотя и не такие существенные, как в участках CDR. В целом, это характерное строение антител обеспечивает стабильный каркас (участок FR), на основе которого значительное разнообразие связывания антигенов (CDR) может использоваться иммунной системой для достижения специфичности для широкого множества антигенов. Для множества фрагментов вариабельных областей различных организмов доступно некоторое количество структур, определенных с высоким разрешением, некоторые из них находятся в свободном виде, а некоторые находятся в комплексе с антигенами. Последовательность и структурные особенности вариабельных областей антител хорошо охарактеризованы (Morea et al., 1997, Biophys Chem 68:9-16; Morea et al., 2000, Methods 20:267-279), консервативные свойства антител позволили разработать множество инженерных технологий для производства антител (Maynard et al., 2000, Annu Rev Biomed Eng 2:339-376). Например, возможно пересадить CDR от одного антитела, например, мышиного антитела, на каркасный участок другого антитела, например, человеческого антитела. Этот процесс, называемый в этой области техники «гуманизацией», позволяет получить менее иммуногенные терапевтические антитела из антител, не имеющих отношения к человеческим. Фрагменты, включающие вариабельную область, могут существовать в отсутствие других областей антитела; такие фрагменты включают, например, антиген-связывающий фрагмент (Fab), включающий VH-Cγ1 и VH-CL; вариабельный фрагмент (Fv), включающий VH и VL; одноцепочечный вариабельный фрагмент (scFv), включающий VH и VL, связанные между собой в одну и ту же цепь, а также множество других фрагментов вариабельной области (Little et al., 2000, Immunol Today 21:364-370).
Участок антитела Fc взаимодействует с различными рецепторами Fc и лигандами, которые сообщают ему множество важных функциональных возможностей, так называемых эффекторных функций. В иммуноглобулинах IgG участок Fc, как показано на Фигуре 1, включает иммуноглобулиновый домен Сγ2 и Сγ3 и N-концевой шарнир, ведущий в Cγ2. Важное семейство рецепторов Fc класса IgG включает рецепторы Fc-гамма (FcγR). Эти рецепторы осуществляют связь между антителами и клеточными механизмами иммунной системы (Raghavan et al., 1996, Annu Rev Cell Dev Biol 12:181-220; Ravetch et al., 2001, Annu Rev Immunol 19:275-290). У людей это семейство белков включает FcγRI (CD64), включающий изоформы FcγRIa, FcγRIb и FcγRIc; FcγRII (CD32), включающий изоформы FcγRIIa (включающий аллотипы Н131 и R131), FcγRIIb (включающий FcγRIIb-1 и FcγRIIb-2) и FcγRIIc; FcγRIII (CD16), включающий изоформы FcγRIIIa (включающий аллотипы V158 и F158), и FcγRIIIb (включающий аллотипы FcγRIIIb-NA1 и FcγRIIIb-NA2) (Jefferis et al., 2002, Immunol Lett 82:57-65). Эта рецепторы обычно имеют внеклеточный домен, который опосредует связывание с Fc, мембранно-связанный участок и внутриклеточный домен, который может опосредовать некоторые сигнальные события внутри клетки. Эти рецепторы экспрессируются в различных иммунных клетках, включающих моноциты, макрофаги, нейтрофилы, дендритные клетки, эозинофилы, тучные клетки, тромбоциты, В-клетки, большие зернистые лимфоциты, клетки Лангерганса, натуральные киллеры и γγ Т-клетки. Образование комплекса Fc/FcγR направляет эти эффекторные клетки к местам связывания антигенов, что обычно приводит к передаче сигнала в клетках и важным последующим иммунным ответам, таким как высвобождение воспалительных медиаторов, активация В-клеток, эндоцитоз, фагоцитоз и цитотоксическая атака. Способность опосредовать цитотоксическую и фагоцитарную эффекторные функции является потенциальным механизмом, с помощью которого антитела разрушают клетки-мишени. Опосредованная клетками реакция, в которой неспецифические цитотоксические клетки, экспрессирующие FcγR, узнают антитело, связанное с клеткой-мишенью, и затем вызывают лизис клетки-мишени, называется зависимой от антител цитотоксичностью в отношении клеток-мишеней (ADCC) (Raghavan et al., 1996, Annu Rev Cell Dev Biol 12:181-220; Gheitie ey al., 2000, Annu Rev Immunol 18:739-766; Ravetch et al., 2001, Annu Rev Immunol 19:275-290). Опосредованную клетками реакцию, в которой неспецифические цитотоксические клетки, экспрессирущие FcγR, узнают антитело, связанное с клеткой-мишенью, и затем вызывают фагоцитоз клетки-мишени, называют зависимым от антител фагоцитозом клеток-мишеней (ADCP). Был определен ряд структур внеклеточных доменов FcγR человека, включающих FcγRsIIa (код доступа в базе данных PDB 1H9V) (Sonderman et al., 2001, J Mol Biol 309:737-749) FcγRsIIIa (код доступа в базе данных PDB 1FCG) (Maxwell et al., 1999, Nat Struc Biol 6:437-442), FcγRsIIb (код доступа в базе данных PDB 2FCB) (Sondennann et al., 1999, Embo J 18:1095-1103); и FcγRsIIIb (код доступа в базе данных PDB 1E4J) (Sondermann et al., 2000, Nature 406:267-273). Все FcγR связывает один и тот же участок Fc в N-концевом участке домена Сγ2 и предшествующего шарнирного участка, показанных на фигуре 2. Это взаимодействие хорошо охарактеризовано структурно (Sondermann et al., 2001, J Mol Biol 309:737-749), и было определено несколько структур Fc человека, связывающихся с внеклеточным доменом FcγRsIIIb человека (Sondermann et al., 2000, Nature 406:267-273) (код доступа в базе данных PDB 1IIS и 1IIX) (Radaev et al., 2001, J Biol Chem 276:16469-16477), а также структура комплекса человеческого IgE Fc/FcεRIα (код доступа в базе данных PDB 1F6A) (Garman et al., 2000, Nature 406:259-266).
Различные подклассы IgG обладают различным сродством к FcγR, обычно IgG1 и IgG3 лучше связываются с рецепторами, чем IgG2 и IgG4 (Jefferis et al., 2002, Immunol Lett. 82:57-65). Все FcγR связываются с одним и тем же участком Fc IgG, но с различным сродством: FcγRI, связывающий с самой высокой аффинностью, имеет Kd для IgG1, равную 10-8 М, тогда как рецепторы с низкой аффинностью, FcγRII и FcγRIII, связываются при 10-6 М и 10-5 М соответственно. Внеклеточные домены FcγRIIIa и FcγRIIIb идентичны на 96%, однако FcγRIIIb не имеет внутриклеточного сигнального домена. Кроме того, поскольку FcγRI, FcγRIIa/c и FcγRIIIa являются положительными регуляторами активации, запускаемой иммунным комплексом, они характеризуются наличием внутриклеточного домена, в состав которого входит мотив иммунорецепторной тирозин-зависимой активации (ITAM), FcγRIIb имеет в своем составе мотив иммунорецепторного тирозин-зависимого ингибирования (ITIM) и поэтому является ингибитором. Таким образом, первые рецепторы относятся к активирующим рецепторам, а FcγRIIb относится к ингибирующим рецепторам. Рецепторы также различаются по характеру и уровням экспрессии на различных иммунных клетках. Еще один уровень сложности состоит в существовании полиморфизма FcγR в человеческом протеоме. Особенно важным полиморфизмом с клиническим значением являются формы V158/F158 FcγRIIIa. IgG1 человека связывается с более высокой аффинностью с аллотипом V158 по сравнению с аллотипом F158. Показано, что различие в аффинности и предположительно влияние этого различия на ADCC и/или ADCP являются существенным показателем эффективности антитела к CD20 ритуксимаба (Rituxan®, зарегистрированная торговая марка корпорации IDEC Pharmaceuticals Corporation). Пациенты с аллотипом V158 благоприятно реагируют на лечение ритуксимабом, однако пациенты с аллотипом F158, обладающим более низкой аффиностью, слабо отвечают на такое лечение (Cartron et al., 2002, Blood 99:754-758). Приблизительно 10-20% людей являются гомозиготами V158/V158, 45% являются гетерозиготами V158/F158 и 35-45% людей являются гомозиготами F158/F158 (Lehmbecher et al., 1999, Blood 94:4220-4232; Cartron et al., 2002, Blood 99:754-758). Таким образом, 80-90% людей являются слабо реагирующими, так как у них есть, по меньшей мере, одна аллель F158 FcγRIIIa.
Перекрывающийся, но индивидуальный участок на Fc, показанный на фигуре 1, служит контактной поверхностью при взаимодействии с белком комплемента C1q. Тем же самым способом, при котором связывание Fc/FcγR опосредует ADCC, связывание Fc/C1q опосредует зависимую от комплемента цитотоксичность (CDC). Чтобы сформировать комплекс С1, C1q образует комплекс с сериновыми протеазами С1r и C1s. C1q способен к связыванию с шестью антителами, хотя для активации каскада комплемента достаточно связывания с двумя IgG. Подобно взаимодействию Fc с FcγR различные подклассы IgG обладают различной аффинностью к C1q, обычно IgG1 и IgG3 лучше связываются с FcγR, чем IgG2 и IgG4 (Jefferis et al., 2002, Immunol Lett. 82:57-65). В настоящее время сведения о структуре комплекса Fc/C1q отсутствуют, однако, в результате мутагенезных исследований было картировано место связывания IgG человека с C1q для участка, включающего остатки D270, К322, К326, Р329 и Р331 и Е333 (Idusogie et al., 2000, J Immunol 164:4178-4184; Idusogie et al., 2001, J Immunol 166:2571-2575).
Участок на Fc между доменами Cγ2 и Сγ3, показанный на фигуре 1, опосредует взаимодействие с неонатальным рецептором FcRn, связывание которого приводит к рециркуляции эндоцитированного антитела из эндосомы обратно в кровяное русло (Raghavan et al., 1996, Annu Rev Cell Dev Biol 12:181-220; Ghetie et al., 2000, Annu Rev Immunol 18:739-766). Этот процесс, сопряженный с исключением почечной фильтрации из-за большого размера полноразмерной молекулы, приводит к тому, что время полужизни антител в сыворотке благоприятно составляет диапазон от одной до трех недель. Связывание Fc с FcRn также играет ключевую роль в транспорте антител. Участок связывания для FcRn на Fc также является участком, в котором связываются бактериальные белки А и G. Прочное связывание с помощью этих белков обычно используется в качестве способа очистки антител при применении белок А- или белок G-аффинной хроматографии во время очистки белков. Таким образом, точное воспроизведение этого участка на Fc очень существенно как для клинических свойств антител, так и для их очистки. Имеющиеся в распоряжении структуры крысиного комплекса Fc/FcRn (Martin et al., 2001, Mol Cell 7:867-877) и комплексов с белками А и G (Deisenhofer et al., 1981, Biochemistry 20:2361-2370; Sauer-Eriksson et al., 1995, Structure 3:265-278; Tashiro et al., 1995, Curr Opin Struct Biol 5:471-481) обеспечивают понимание того, как происходит взаимодействие Fc с этими белками.
Ключевой чертой Fc-участка является консервативное N-гликозилирование, показанное на фигуре 1, которое обнаруживают на остатке N297. Этот углевод или олигосахарид, как его иногда называют, играет особую структурную и функциональную роль в антителе, что является одной из принципиальных причин, по которой антитела должны продуцироваться с применением экспрессионных систем млекопитающих. Без намерения быть ограниченными определенной теорией, полагают, что структурная роль этого углевода состоит в стабилизации или солюбилизации Fc, так как он определяет специфический угол или степень гибкости между доменами Cγ3 и Сγ2, удерживает два домена Сγ2 от агрегации с еще одним через центральную ось; или в комбинации этих эффектов. Для эффективного связывания Fc с FcγR и C1q эта модификация необходима, и изменения в составе углевода при остатке N297 или его удаление влияет на связывание с этими бежами (Umana et al., 1999, Nat Biotechnol 17:176-180; Davies et al., 2001, Biotechnol Bioeng 74:288-294; Mimura et al., 2001, J Biol Chem 276:45539-45547; Radaev et al., 2001, J Biol Chem 276:16478-16483; Shields et al., 2001, J Biol Chem 276:6591-6604; Shields et al., 2002, J Biol Chem 277:26773-26740; Simmons et al., 2002, J Immunol Methods 263:133-147). Однако углевод образует малый (если вообще образует) специфический контакт с FcγR (Radaev et al., 2001, J Biol Chem 276:16469-16477), что указывает на то, что функциональная роль углевода при N297 в опосредовании Fc/FcγR связывания может осуществляться через структурную роль, которую он играет в определении конформации Fc. Это подтверждается набором кристаллических структур четырех различных гликоформ Fc, которые показывают, что состав олигосахарида сильно воздействует на конформацию Сγ2 и, как результат этого, на взаимодействие Fc/FcγR (Krapp et al., 2003, J Mol Biol 325:979-989).
Характерные черты антител, обсужденные выше, - специфичность по отношению к мишени, способность опосредовать иммунные эффекторные механизмы и большое полувремя жизни в сыворотке крови - делают антитела мощным терапевтическим средством. Моноклональные антитела применяются в терапевтических целях для лечения многих состояний, включающих рак, воспаление и сердечно-сосудистые заболевания. В настоящее время на рынке существует свыше десятка продуктов антител и сотни продуктов в стадии разработки. В дополнение к антителам имеется антитело-подобный белок, представляющий собой слитый Fс, роль которого в исследованиях и терапии все время увеличивается (Chamow et al., 1996, Trends Biotechnol 14:52-60; Ashkenazi et al., 1997, Curr Opin Immunol 9:195-200). Слитый Fc представляет собой белок, в котором один или несколько полипептидов функционально связаны с Fc. Слитый Fc объединяет Fc-участок антитела и, следовательно, его благоприятные эффекторные функции и фармакокинетику со связывающим мишень участком рецептора, лиганда или другого белка или белкового домена. Роль последнего состоит в том, что он опосредует узнавание мишени, и, таким образом, он является функциональным аналогом вариабельной области антитела. Из-за структурного и функционального перекрывают слитых с Fc белков с антителами обсуждение антител в настоящем изобретении прямо распространяется на слитые с Fc белки.
Несмотря на такое широкое применение, антитела не оптимизированы для клинического использования. Двумя существенными недостатками антител являются их субоптимальная противораковая эффективность и высокие производственные требования. На устранение этих недостатков было направлено настоящее изобретение.
Сγществует ряд возможных механизмов, с помощью которых антитела разрушают опухолевые клетки, включающих антипролиферацию посредством блокирования необходимых для роста метаболических путей; внутриклеточную передачу сигнала, приводящую к апоптозу; усиленную понижающую регуляцию и/или усиленный оборот рецепторов; CDC, ADCC, ADCP и стимуляцию адаптивного иммунного ответа (Cragg et al., 1999, Curr Opin Immunol 11:541-547; Giennie et al., 2000, Immunol Today 21:403-410). Противоопухолевая эффективность может быть обусловлена комбинацией этих механизмов, и оказывается, что их относительная важность в клинической терапии является зависящей от рака. Несмотря на этот арсенал противоопухолевых средств, активность антител в качестве противоопухолевых средств является неудовлетворительной, в частности, из-за их высокой стоимости. Данные о реакции пациентов, страдающих опухолями, показывают, что моноклональные антитела обеспечивают лишь незначительное улучшение в терапевтическом успехе по сравнению с обычной цитотоксической химиотерапией одним-единственным средством. Например, только половина из всех пациентов с рецидивной неходжкинской лимфомой начальной стадии чувствительны к терапии антителом к CD20 ритуксимабом (McLaughlin et al., 1998, J Clin Oncol 16:2825-2833). Из 166 клинических пациентов 6% продемонстрировали полную чувствительность и 42% продемонстрировали частичную чувствительность со средней продолжительностью ответа, составляющей приблизительно 12 месяцев. Трастузумаб (Herceptin®, зарегистрированная торговая марка фирмы Genentech), антитело к HER2/neu, применяемое для лечения метастатического рака молочной железы, обладает меньшей эффективностью. Доля полного ответа при использовании трастузумаба для 222 протестированных пациентов составила только 15%, где было 8 полных и 26 частичных ответов, а средняя продолжительность ответа и выживания составила от 9 до 13 месяцев (Cobleigh et al., 1999, J Clin Oncol 17:2639-2648). В настоящее время для противораковой терапии любое небольшое улучшение в уровне смертности определяется как успех. Таким образом, существует значительная необходимость в увеличении способности антител разрушать раковые клетки-мишени.
Многообещающим способом увеличения противоопухолевой активности антител является усиление их способности опосредовать цитотоксические эффекторные функции, такие как ADCC, ADCP и CDC. Важность эффекторных функций, опосредованных FcγR, для противораковой активности была продемонстрирована на мышах (Clynes et al., 1998, Proc Natl Acad Sci USA 95:652-656; Clynes et al., 2000, Nat Med 6:443-446), и аффинность связывания Fc с определенными FcγR коррелировала в клеточных исследованиях с целевой цитотоксичностью (Shields et al., 2001, J Biol Chem 276:6591-6604; Presta et al., 2002, Biochem Soc Trans 30:487-490; Shields et al., 2002, J Biol Chem 277:26733-26740). Кроме того, наблюдали корреляцию между клинической эффективностью у людей и их аллотипам по полиморфным формам FcγRIIIa с высокой (V158) и низкой (F158) аффинностью (Cartron et al., 2002, Blood 99:754-758). Вместе эти данные позволяют предположить, что антитело с участком Fc, оптимизированным под связывание с определенными FcγR, может лучше опосредовать эффекторные функции и, таким образом, более эффективно разрушать раковые клетки пациентов. Баланс между активирующими и ингибирующими рецепторами заслуживает особого внимания, и оптимальная эффекторная функция может быть обусловлена участием Fc с увеличенной аффиностью по отношению к активирующим рецепторам, например, FcγRI, FcγRII/c и FcγRIIIa и, кроме того, с пониженной аффиностью к ингибирующему рецептору FcγRIIb. Кроме того, так как FcγR могут опосредовать поглощение антигена и процессинг с помощью антигенпрезентирующих клеток, увеличенная аффинность Fc/FcγR также может улучшить эффективность терапии антителами, вызывая адаптивный иммунный ответ.
Для различных целей на Fc проводили мутагенные исследования с помощью обычно производимых замен на аланин (так называемое аланиновое сканирование) или с помощью замен, определяемых гомологией последовательностей (Duncan et al., 1988, Nature 332:563-564; Lund et al., 1991, J Immunol 147:2657-2662; Lund et al., 1992, Mol Immunol 29:53-59; Jefferis et al., 1995, Immunol Lett 44:111-117; Lund et al., 1995, Faseb J 9:115-119; Jefferis et al., 1996, Immunol Lett 54:101-104; Lund et al., 1996, J Immunol 157:4963-4969; Armour et al., 1999, Eur J Immunol 129:2613-2624; Shields et al., 2001, J Biol Chem 276:6591-6604; Jefferis et al., 2002, Immunol Lett 82:57-65) (US 5624821; US 5885573; PCT WO 00/42072; PCT WO 99/58572). Большинство замен уменьшает или ликвидирует связывание с FcγR. Однако при получении вариантов Fc с высокой аффинностью к FcγR (см., например, US 5624821 и PCT WO 00/46072) был достигнут некоторый успех. Например, Winter et al. заменяли аминокислотный остаток в положении 235 мышиного антитела IgG2b (мутация глутаминовой кислоты на лейцин), что увеличивало связывание мышиного антитела с человеческим FcγRI в 100 раз (Duncan et al., 1988, Nature 332:563-564) (US 5624821). Shields et al. использовали аланиновый сканирующий мутагенез, чтобы картировать остатки Fc, важные для связывания с FcγR, с последующей заменой выбранных остатков с помощью неаланиновых мутаций (Shields et al., 2001, J Biol Chem 276:6591-6604; Presta et al., 2002, Biochem Soc Trans 30:487-490) (PCT WO 00/42072). Несколько мутаций, подробно описанных в этом исследовании и включающих S298A, Е333А и K334А, показали улучшенное связывание с активирующим рецептором FCγRsIIIa и уменьшенное связывание с ингибирующим рецептором FCγRIIb. Эти мутации были объединены, чтобы получить варианты с двойной и тройной мутацией, которые демонстрируют аддитивное улучшение в связывании. Наилучший вариант, раскрытый в этом исследовании, - тройной мутант S298A/E333A/K334A с приблизительно 1,7-кратным увеличением связывания с F158 FcγRIIIa, с 5-кратным уменьшением связывания с FcγRIIb и 2,1-кратным увеличением ADCC.
Увеличенная аффинность Fc к FCγR также была достигнута при применении сконструированных гликоформ, созданных с помощью экспрессии антител в сконструированных или вариантных клеточных линиях (Umana et al., 1999, Nat Biotechnol 17:176-180; Davies et al., 2001, Biotechnol Bioeng 74:288-294; Shields et al., 2002, J boil Chem 277:26733-26740; Shinkawa et al., 2003, J Biol Chem 278:3466-3473). Этот подход приводил к значительному увеличению способности антител связываться с FcγRIIIa и опосредовать ADCC. Хотя существуют практические ограничения, такие как эффективность роста экспрессирующих линий в условиях крупномасштабного производства, этот подход для увеличения аффинности Fc/FcγR и эффекторной функции очень обнадеживает. Действительно, объединение этих альтернативных технологий производства гликоформ с вариантами Fc настоящего изобретения может обеспечить аддитивные или синергические эффекты для оптимальной эффекторной функции.
Хотя существует необходимость в более значительной эффекторной функции, для некоторых видов терапии антителами было бы желательно иметь сниженную или полностью ликвидированную эффекторную функцию. Это часто бывает в случае терапевтических антител, механизм действия которых включает блокирование или антагонизм, но не гибель клеток, несущих антиген-мишень. В этих случаях уменьшение количества клеток-мишеней нежелательно и может рассматриваться как побочный эффект. Например, способность антител к CD4 блокировать CD4-рецепторы на Т-клетках делает их эффективным противовоспалительным средством, помимо этого, их способность рекрутировать FcγR-рецепторы также направляет иммунную атаку против клеток-мишеней, что приводит к уменьшению количества Т-клеток (Reddy et al., 2000, J Immunol 164:1925-1933). Эффекторная функция также может быть проблемой для антител с радиоактивной меткой, называемых радиоконъюгатами, и антител, конъюгированных с токсинами, называемых иммунотоксинами. Эти лекарственные средства можно применять для разрушения раковых клеток, но рекрутирование иммунных клеток посредством взаимодействия Fc с FcγR-рецепторами приводит здоровые иммунные клетки в непосредственную близость к летальной нагрузке (радиация или токсин), что приводит к истощению нормальной лимфоидной ткани наравне с раковыми клетками-мишенями (Hutchins et al., 1995, Proc Natl Acad Sci USA 92:11980-11984; White et al., 2001, Annu Rev Med 52:125-145). Эту проблему можно обойти, используя изотипы IgG, которые плохо связывают комплемент или эффекторные клетки, например IgG2 и IgG4. Альтернативным решением является разработка вариантов Fc с пониженным или полностью ликвидированным связыванием (Alegre et al., 1994, Transplantatio 57:1537-1543; Hutchins et al., 1995, Proc Natl Acad Sci USA 92:11980-11984; Armour et al., 1999, Eur J Immunol 129:2613-2624; Reddy et al., 2000, J Immunol 164:1925-1933; Xu et al., 2000, Cell Immunol 200:16-26; Shields et al., 2001, J Biol Chem 276:6591-6604) (US 6194551; US 5885573; PCT WO 99/58572). Критическое соображение для уменьшения или ликвидации эффекторной функции состоит в том, что другие важные свойства антител не должны быть нарушены. Варианты Fc должны конструироваться таким образом, чтобы в них не только исчезало связывание с FcγR и/или Cq1, но также поддерживалась стабильность антител, растворимость и структурная целостность, а также способность взаимодействовать и с другими важными лигандами Fc, такими как FcRn и белками А и G.
Настоящее изобретение направлено на исправление другого большого недостатка антител, а именно на высокие требования, предъявляемые к их производству (Garber et al., 2001, Nat Biotechnol 19:184-185; Dove et al., 2002, Nat Biotechnol 20:777-779). Антитела должны экспрессироваться в клетках млекопитающих, и в настоящее время антитела, имеющиеся в продаже, вместе с другими биотерапевтическими средствами, пользующимися высоким спросом, по существу, поглощают всю доступную производственную мощность. Несмотря на создание сотен биопрепаратов, большую часть которых составляют антитела, существует срочная необходимость в более действенных и более дешевых способах производства. Последствия недостаточной производственной мощности при выпуске антител трояки. Во-первых, это драматическим образом повышает стоимость товаров для поставщиков, которая затем будет перенесена на пациента. Во-вторых, она мешает промышленному производству апробированных продуктов на основе антител, ограничивая доступность высоковостребованной терапии для пациентов. И, наконец, так как клинические испытания требуют большого количества белка, который пока еще не является прибыльным, недостаточное обеспечение задерживает прогресс нарастающего поступления антител на рынок.
При попытке смягчить эту проблему были исследованы альтернативные способы производства. Трансгенные растения и животные рассматриваются как более дешевые и более производительные продуцирующие системы (Chad et al., 2001, Curr Opin Biotechnol 12:188-194). Такие экспрессионные системы, однако, могут продуцировать профили гликозилированные, отличающиеся существенным образом от человеческих гликопротеинов. Это может привести к снижению или даже полной потере эффекторной функции, потому что, как было описано выше, структура углевода может существенным образом воздействовать на связывание FcγR и комплемента. Потенциально более серьезной проблемой с гликоформами, не имеющими отношения к человеку, может быть иммуногенность; углеводы являются ключевым источником антигенности для иммунной системы, и присутствие гликоформ, не имеющих отношения к человеку, дает значительный шанс появления антител, которые нейтрализуют терапию или, еще хуже, вызывают неблагоприятные иммунные реакции. Таким образом, эффективность и безопасность антител, продуцированных трансгенными растениями и животными, остается неясной. Экспрессия бактериями является другим привлекательным способом решения проблемы продукции антител. Экспрессия в бактериях, например в Е.coli, обеспечивает доходный и высокоемкий способ продуцирования белков. Для сложных белков, таких как антитела, существует несколько препятствий для бактериальной экспрессии, включающих фолдинг и сборку этих сложных молекул, образование правильных дисульфидных связей и растворимость, стабильность и функциональность в отсутствие гликозилирования, так как белки, экспрессированные в бактериях, не гликозилируются. Полноразмерные негликозилированные антитела, которые связывают антиген, были успешно экспрессированы в Е.coli (Simmons et al., 2002, J Immunol Methods 263:133-147), и, таким образом, фолдинг, сборка и образование правильных дисульфидных связей в антителах, экспрессированных в бактериях, возможны в отсутствие эукариотического аппарата шаперонов. Однако максимальная выгода экспрессированных в бактериях антител в терапии затруднена из-за потери гликозилирования, что приводит к потере эффекторной функции и может привести к плохой стабильности и растворимости. Это может создавать проблему для композиций при высоких концентрациях, применяемых в течение продолжительного периода, необходимого для клинического использования.
Агликозилированный Fc с подходящими свойствами в растворе и способностью опосредовать эффекторные функции мог бы обеспечить возможность альтернативных способов продукции, описанных выше. После преодоления структурных и функциональных недостатков агликозилированного Fc антитела могут продуцироваться в бактериях и трансгенных растениях и животных с уменьшенным риском иммуногенности и с эффекторной функцией для клинических применений, в которых цитотоксичность является желаемой, как, например, при раке. Настоящее изобретение описывает применение способов конструирования белков для разработки стабильных растворимых вариантов Fc с эффекторными функциями. В настоящее время такие варианты Fc не существуют в этой области техники.
Подведем краткий итог: существует потребность в антителах с улучшенными терапевтическими свойствами. Конструирование оптимизированных или улучшенных вариантов Fc является перспективным подходом для удовлетворения этой потребности. Тем не менее, значительной помехой для конструирования вариантов Fc с желаемыми свойствами является трудность прогнозирования того, какие аминокислотные модификации из огромного числа возможностей приведут к желаемой цели, это также сопряжено с неэффективной продукцией и способами скрининга антител. Действительно, одна из принципиальных причин для недостаточного успеха предшествующих исследований состояла в том, что до сих пор подходы к конструированию Fc включали выбранные наугад способы, такие как аланиновое сканирование или продукцию гликоформ с использованием различных экспрессионных штаммов. В этих исследованиях сделанные модификации Fc были выполнены полностью или частично случайным образом в надежде получить варианты с выгодными свойствами. Настоящее изобретение обеспечивает разнообразие способов конструирования, многие из которых основаны на более сложных и результативных технологиях, которые могут применяться для того, чтобы преодолеть эти помехи в целях разработки вариантов Fc, оптимизированных в отношении желаемых свойств. Описанные способы конструирования обеспечивают желаемую стратегию для руководства модификацией Fc, способы компьютерного скрининга для разработки пригодных вариантов Fc, подходов для создания библиотеки для определения перспективных вариантов для экспериментального исследования и набор способов экспериментального производства и скрининга для определения вариантов Fc с пригодными свойствами.
Раскрытие изобретения
Настоящее изобретение обеспечивает варианты Fc, оптимизированные в отношении целого ряда терапевтически значимых свойств. Эти варианты Fc обычно включены в состав вариантного белка, который преимущественно включает антитело или слитый Fc.
Цель настоящего изобретения состоит в обеспечении новых положений в последовательности Fc, в которых можно осуществить аминокислотные модификации для того, чтобы получить оптимизированные варианты Fc. Указанные положения в Fc включают остатки 230, 240, 244, 245, 247, 262, 263, 266, 273, 275, 299, 302, 313, 323, 325, 328 и 332, в которых нумерация остатков в Fc-участке соответствует индексу EU в базе данных Kabat. Настоящее изобретение описывает любые аминокислотные модификации в любом из указанных новых положений в последовательности Fc, сделанные для того, чтобы получить оптимизированный вариант Fc.
Другой целью настоящего изобретения является обеспечение вариантов Fc, которые были отобраны с помощью расчетов. Отобранный с помощью вычислений вариант Fc представляет собой вариант, прогнозированный с помощью расчетов вычислительного скрининга, описанных здесь, который обладает значительно более высоким потенциалом по сравнению с вариантом, оптимизированным для желаемых свойств, но выбранным случайным образом. В этом случае расчеты вычислительного скрининга выполняют функцию предварительного исследования или служат суррогатной заменой экспериментального отбора и, таким образом, указанные отобранные с помощью вычислений варианты Fc рассматриваются как новаторские.
Еще одной целью настоящего изобретения является обеспечение вариантов Fc, которые были охарактеризованы с помощью одного или нескольких экспериментальных способов, описанных здесь. В одном из воплощений указанные варианты Fc включают, по меньшей мере, одну аминокислотную замену в положении, выбранном из группы, состоящей из: 230, 233, 234, 235, 239, 240, 241, 243, 244, 245, 247, 262, 263, 264, 265, 266, 267, 269, 270, 272, 273, 274, 275, 276, 278, 283, 296, 297, 298, 299, 302, 313, 318, 320, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334 и 335, где нумерация остатков в Fc-участке соответствует индексу EU в базе данных Kabat. В одном из воплощений указанные варианты Fc включают, по меньшей мере, одну аминокислотную замену в положении, выбранном из группы, состоящей из: 221, 222, 224, 227, 228, 230, 231, 223, 233, 234, 235, 236, 237, 238, 239, 240, 241, 243, 244, 245, 246, 247, 249, 250, 258, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 278, 280, 281, 283, 285, 286, 288, 290, 291, 293, 294, 295, 296, 297, 298,299, 300, 302, 313, 317, 318, 320, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336 и 428, где нумерация остатков в Fc-участке соответствует индексу EU в базе данных Kabat. В предпочтительном воплощении указанные варианты Fc включают, по меньшей мере, одну замену, выбранную из группы, состоящей из: Р230А, E233D, L234D, L234E, L234N, L234Q, L234T, L234H, L234Y, L234I, L234V, L234F, L235D, L235S, L235N, L235Q, L235T, L235H, L235Y, L235I, L235V, L235F, S239D, S239E, S239N, S239Q, S239F, S239T, S239H, S239Y, V240I, V240A, V240T, V240M, F241W, F241L, F241Y, F241E, F241R, F243W, F243L, F243Y, F243R, F243Q, Р244Н, Р245А, P247V, P247G, V262I, V262A, V262T, V262E, V263I, V263A, V263T, V263M, V264L, V264I, V264W, V264T, V264R, V264F, V264M, V264Y, V264E, D265G, D265N, D265Q, D265Y, D265F, D265V, D265I, D265L, D265H, D265T, V266I, V266A, V266T, V266M, S267Q, S267L, S267T, S267H, S267D, S267N, Е269Н, E269Y, E269F, E269R, Е269Т, E269L, E269N, D270Q, D270T, D270H, E272S, Е272К, E272I, E272Y, V273I, К274Т, К274Е, K274R, K274L, K274Y, F275W, N276S, N276E, N276R, N276L, N276Y, Y278T, Y278E, Y278K, Y278W, E283R, Y296E, Y296Q, Y296D, Y296N, Y296S, Y296T, Y296L, Y296I, Y296H, N297S, N297D, N297E, А298Н, T299I, T299L, Т299А, T299S, T299V, Т299Н, T299F, Т299Е, V302I, W313F, E318R, К320Т, K320D, K320I, К322Т, К322Н, V323I, S324T, S324D, S324R, S324I, S324V, S324L, S324Y, N325Q, N325L, N325I, N325D, N325E, N325A, N325T, N325V, N325H, K326L, K326I, К326Т, A327N, A327L, A327D, А327Т, L328M, L328D, L328E, L328N, L328Q, L328F, L328I, L328V, L328T, L328H, L328A, P329F, A330L, A330Y, A330V, A330I, A330F, A330R, А330Н, A330S, A330W, А330М, P331V, Р331Н, I332D, I332E, I332N, I332Q, I332T, I332H, I332Y, I332A, ЕЗЗЗТ, Е333Н, E333I, E333Y, K334I, К334Т, K334F, T335D, T335R и T335Y, где нумерация остатков в Fc-участке соответствует индексу EU в базе данных Kabat. В наиболее предпочтительном воплощении указанные варианты Fc выбраны из группы, состоящей из: V264L, V264I, F241W, F241L, F243W, F243L, F241L/F243L/V262I/V264I, F241W/F243W, F241W/F243W/V262A/V264A, F241L/V262I, F243L/V264I, F243L/V262I/V264W, F241Y/F243Y/V262T/V264T, F241E/F243R/V262E/V264R, F241E/F243Q/V262T/V264E, F241R/F243Q/V262T/V264R, F241E/F243Y/V262T/V264R, L328M, L328E, L328F, I332E, L328MA332E, Р244Н, Р245А, P247V, W313F, P244H/P245A/P247V, P247G; V264M332E, F241E/F243R/V262E/V264R/I332E, F241E/F243Q/V262T/V264E/I332E, F241R/F243Q/V262T/V264R/I332E, F241E/F243Y/V262T/V264R/I332E, 8298А/I332Е, 8239Е/I332Е, S239Q/I332E, S239E, D265G, D265N, S239E/D265G, S239E/D265N, S239E/D265Q, Y296E, Y296Q, T299I, A327N, S267Q/A327S, S267L/A327S, A327L, P329F, A330L, A330Y, I332D, N297S, N297D, N297S/I332E, N297D/I332E, N297E/I332E, D265Y/N297D/I332E, D265Y/N297D/T299L/I332E, D265F/N297E/I332E, L328I/I332E, L328Q/I332E, I332N, I332Q, V264T, V264F, V240I, V263I, V266I, T299A, T299S, T299V, N325Q, N325L, N3251, S239D, S239N, S239F, S239D/I332D, S239D/I332Е, 8239D/I332Н, S239D/I332Q, 8239Е/I332Q, 8239Е/I332N, S239E/I332Q, S239N/I332D, 8239Н/I332Е, S239N/I332N, S239N/I332Q, S239Q/I332D, S239Q/I332N, S239Q/I332Q, Y296D, Y296N, F241Y/F243Y/V262T/V264T/N297D/I332E, А330L/I332Е, V264I/А330L/I332Е, А330L/I332Е, V264I/A330L/I332E, L234D, L234E, L234N, L234Q, L234T, L234H, L234Y, L234I, L234V, L234F, L235D, L235S, L235N, L235Q, L235T, L235H, L235Y, L235I, L235V, L235F, S239T, S239H, S239Y, V240A, V240T, V240M, V263A, V263T, V263M, V264M, V264Y, V266A, V266T, V266M, E269H, E269Y, E269F, E269R, Y296S, Y296T, Y296L, Y296I, A298H, T299H, A330V, A330I, A330F, A330R, A330H, N325D, N325E, N325A, N325T, N325V, N325H, L328D/I332E, L328Е/I332Е, L328N/I332Е, L328Q/I332Е, L328V/I332E, L328Т/I332Е, L328Н/I332Е, L328I/I332E, L328A, I332T, I332H, I332Y, I332A, S239E/V264I/I332E, S239Q/V264I/I332E, S239E/V264I/A330Y/I332E, S239E/V264I/S298A/A330Y/I332E, S239D/N297D/I332E, S239Е/N297D/I332Е, S239D/D265V/N297D/I332E, S239D/D265I/N297D/I332E, S239D/D265L/N297D/I332E, S239D/D265F/N297D/I332E, S239D/D265Y/N297D/I332E, S239D/D265H/N297D/I332E, S239D/D265T/N297D/1332E, V264E/N297D/I332E, Y296D/N297D/I332E, Y296E/N297D/I332E, Y296N/N297D/I332E, Y296Q/N297D/I332E, Y296H/N297D/I332E, Y296T/N297D/I332E, N297D/T299V/I332Е, N297D/T299I/I332E, N297D/T299L/I332E, N297D/T299F/I332E, М297D/T299Н/I332Е, N297D/T299E/I332E, N297D/A330Y/I332E, N297D/S298A/A330Y/I332E, S239D/A330Y/I332E, S239N/A330Y/I332E, S239D/A330L/I332E, S239N/A330L/332E, V264I/S298A/I332E, S239D/S298A/I332E, S239N/S298A/I332E, S239D/V264I/I332E, S239D/V264I/S298A/I332E, S239D/V264I/A330L/I332E, L328N, L328H, S239DA332E/A330I, N297DA332E/S239D/A330L, P230A, E233D, P230A/E233D, Р230А/Е233D/I332Е, S267T, S267H, S267D, S267N, E269T, E269L, E269N, D270Q, D270T, D270H, E272S, E272K, E272I, E272Y, V273I, K274T, K274E, K274R, K274L, K274Y, F275W, N276S, N276E, N276R, N276L, N276Y, Y278T, Y278E, Y278K, Y278W, E283R, V302I, E318R, K320T, K320D, K320I, K322T, K322H, V323I, S324T, S324D, S324R, S324I, S324V, S324L, S324Y, K326L, K326I, K326T, A327D, A327T, A330S, A330W, A330M, P331V, P331H, Е333Т, Е333Н, E333I, E333Y, K334I, K334T, K334F, T335D, T335R, T335Y, L234I/L235D, V240I/V266I, S239D/A330Y/I332E/L234I, S239D/A330Y/I332E/L235D, S239D/A330Y/I332E/V240I, S239D/A330Y/I332E/V264T, S239D/A330Y/I332E/V266I, 82390/А330V/I332Е/К326Е, S239D/A330Y/I332E/K326T, S239D/N297D/I332E/A330Y, S239D/N297D/I332E/A330Y/F241 S/F243H/V262T/V264T, S239D/N297D/I332E/L235D и S239D/N297D/I332E/K326E, где нумерация остатков в Fc-участке соответствует индексу EU в базе данных Kabat.
Еще одной целью настоящего изобретения является обеспечение вариантов Fc, которые выбраны из группы, состоящей из: D221K, D221Y, К222Е, K222Y, Т223Е, Т223К, Н224Е, H224Y, Т225Е, Т225, Т225К, T225W, Р227Е, Р227К, P227Y, P227G, Р228Е, Р228К, P228Y, P228G, Р230Е, P230Y, P230G, А231Е, А231К, A231Y, А231Р, A231G, Р232Е, Р232К, P232Y, P232G, E233N, E233Q, Е233К, E233R, E233S, Е233Т, Е233Н, Е233А, E233V, E233L, E233I, E233F, Е233М, E233Y, E233W, E233G, L234K, L234R, L234S, L234A, L234M, L234W, L234P, L234G, L235E, L235K, L235R, L235A, L235M, L235W, L235P, L235G, G236D, G236E, G236N, G236Q, G236K, G236R, G236S, G236T, G236H, G236A, G236V, G236L, G236I, G236F, G236M, G236Y, G236W, G236P, G237D, G237E, G237N, G237Q, G237K, G237R, G237S, G237T, G237H, G237V, G237L, G237I, G237F, G237M, G237Y, G237W, G237P, P238D, Р238Е, P238N, P238Q, Р238К, P238R, P238S, Р238Т, Р238Н, P238V, P238L, P238I, P238F, Р238М, P238Y, P238W, P238G, S239Q, S239K, S239R, S239V, S239L, S239I, S239M, S239W, S239P, S239G, F241D, F241E, F241Y, F243E, K246D, К246Е, К246Н, K246Y, D249Q, D249H, D249Y, R255E, R255Y, E258S, Е258Н, E258Y, T260D, Т260Е, Т260Н, T260Y, V262E, V262F, V264D, V264E, V264N, V264Q, V264K, V264R, V264S, V264H, V264W, V264P, V264G, D265Q, D265K, D265R, D265S, D265T, D265H, D265V, D265L, D265I, D265F, D265M, D265Y, D265W, D265P, S267E, S267Q, S267K, S267R, S267V, S267L, S267I, S267F, S267M, S267Y, S267W, S267P, H268D, Н268Е, H268Q, Н268К, H268R, Н268Т, H268V, H268L, H268I, H268F, Н268М, H268W, Н268Р, H268G, Е269К, E269S, E269V, E269I, Е269М, E269W, Е269Р, E269G, D270R, D270S, D270L, D270I, D270F, D270M, D270Y, D270W, D270P, D270G, P271D, Р271Е, P271N, P271Q, Р271К, P271R, P271S, Р271Т, Р271Н, Р271А, P271V, P271L, P271I, P271F, Р271М, P271Y, P271W, P271G, E272D, E272R, Е272Т, Е272Н, E272V, E272L, E272F, Е272М, E272W, Е272Р, E272G, K274D, K274N, K274S, К274Н, K274V, К2741, K274F, К274М, K274W, К274Р, K274G, F275L, N276D, N276T, N276H, N276V, N276I, N276F, N276M, N276W, N276P, N276G, Y278D, Y278N, Y278Q, Y278R, Y278S, Y278H, Y278V, Y278L, Y278I, Y278M, Y278P, Y278G, D280K, D280L, D280W, D280P, D280G, G281D, G281K, G281Y, G281P, V282E, V282K, V282Y, V282P, V282G, Е283К, Е283Н, E283L, E283Y, Е283Р, E283G, V284E, V284N, V284T, V284L, V284Y, H285D, Н285Е, H285Q, Н285К, H285Y, H285W, N286E, N286Y, N286P, N286G, K288D, К288Е, K288Y, K290D, K290N, К290Н, K290L, K290W, P291D, Р291Е, P291Q, Р291Т, Р291Н, P291I, P291G, R292D, R292E, R292T, R292Y, E293N, E293R, E293S, Е293Т, Е293Н, E293V, E293L, E293I, E293F, Е293М, E293Y, E293W, Е293Р, E293G, Е294К, E294R, E294S, Е294Т, Е294Н, E294V, E294L, E294I, E294F, Е294М, E294Y, E294W, Е294Р, E294G, Q295D, Q295E, Q295N, Q295R, Q295S, Q295T, Q295H, Q295V, Q295I, Q295F, Q295M, Q295Y, Q295W, Q295P, Q295G, Y296K, Y296R, Y296A, Y296V, Y296M, Y296G, N297Q, N297K, N297R, N297T, N297H, N297V, N297L, N297I, N297F, N297M, N297Y, N297W, N297P, N297G, S298D, S298E, S298Q, S298K, S298R, S298I, S298F, S298M, S298Y, S298W, T299D, Т299Е, T299N, T299Q, Т299К, T299R, T299L, T299F, Т299М, T299Y, T299W, Т299Р, T299G, Y300D, Y300E, Y300N, Y300Q, Y300K, Y300R, Y300S, Y300T, Y300H, Y300A, Y300V, Y300M, Y300W, Y300P, Y300G, R301D, R301E, R301H, R301Y, V303D, V303E, V303Y, S304D, S304N, S304T, S304H, S304L, V305E, V305T, V305Y, К317Е, K317Q, E318Q, Е318Н, E318L, E318Y, K320N, K320S, К320Н, K320V, K320L, K320F, K320Y, K320W, К320Р, K320G, K322D, K322S, K322V, K322I, K322F, K322Y, K322W, К322Р, K322G, S324H, S324F, S324M, S324W, S324P, S324G, N325K, N325R, N325S, N325F, N325M, N325Y, N325W, N325P, N325G, К326Р, А327Е, А327К, A327R, А327Н, A327V, A327I, A327F, А327М, A327Y, A327W, А327Р, L328D, L328Q, L328K, L328R, L328S, L328T, L328V, L328I, L328Y, L328W, L328P, L328G, P329D, Р329Е, P329N, P329Q, Р329К, P329R, P329S, Р329Т, Р329Н, P329V, P329L, P329I, Р329М, P329Y, P329W, P329G, А330Е, A330N, А330Т, АЗЗОР, A330G, P331D, P331Q, P331R, Р331Т, P331L, P331I, P331F, Р331М, P331Y, P331W, I332K, I332R, 13328, I332V, I332L, I332F, I332M, I332W, I332P, I332G, E333L, E333F, Е333М, Е333Р, К334Р, T335N, T335S, Т335Н, T335V, T335L, T335I, T335F, Т335М, T335W, Т335Р, T335G, I336E, I336K, I336Y, S337E, S337N и S337H, где нумерация остатков в Fc-участке соответствует индексу EU в базе данных Kabat.
Еще одной целью настоящего изобретения является обеспечение варианта Fc, который связывается с более высокой аффинностью с одним или несколькими FcγR. В одном из воплощений указанные варианты Fc обладают аффинностью к FcγR, которая больше чем в один раз по сравнению с исходным полипептидом Fc. В альтернативном воплощении указанные варианты Fc имеют аффинность к FcγR, которая более чем в пять раз выше по сравнению с исходным полипептидом Fc. В предпочтительном воплощении указанные варианты Fc имеют аффинность, которая от 5 до 300 раз выше по сравнению с исходным полипептидом Fc. В одном из воплощений указанные варианты Fc включают, по меньшей мере, одну аминокислотную замену в положении, выбранном из группы, состоящей из: 230, 233, 234, 235, 239, 240, 243, 264, 266, 272, 274, 275,276, 278, 302, 318, 324, 325, 326, 328, 330, 332 и 335, где нумерация остатков в Fc-участке соответствует индексу EU в базе данных Kabat. В предпочтительном воплощении указанные варианты Fc включают, по меньшей мере, одну аминокислотную замену, выбранную из группы, состоящей из: Р230А, E233D, L234E, L234Y, L234I, L235D, L235S, L235Y, L235I, S239D, S239E, S239N, S239Q, S239T, V240I, V240M, F243L, V264I, V264T, V264Y, V266I, E272Y, К274Т, К274Е, K274R, K274L, K274Y, F275W, N276L, Y278T, V302I, E318R, S324D, S324I, S324V, N325T, K326I, К326Т, L328M, L328I, L328Q, L328D, L328V, L328T, A330Y, A330L, A330I, I332D, I332E, I332N, I332Q, T335D, T335R и T335Y, где нумерация остатков в Fc-участке соответствует индексу EU в базе данных Kabat. В наиболее предпочтительном воплощении указанные варианты Fc выбирают из группы, состоящей из: V264I, F243L/V264I, L328M, I332E, L328M/I332E, V264I/I332E, S298А/I332Е, S239Е/I332Е, S239Q/I332E, S239E, A330Y, I332D, L328I/I332E, L328Q/I332E, V264T, V240I, V266I, S239D, S239D/I332D, S239D/I332E, S239D/I332N, S239D/I332Q, S239E/I332D, 8239Е/I332N, S239E/I332Q, S239N/I332D, S239N/I332E, S239Q/I332D, А330Y/I332Е, V264I/А330Y/I332Е, A330L/I332E, V264I/А330L/I332Е, L234E, L234Y, L234I, L235D, L235S, L235Y, L235I, S239T, V240M, V264Y, A330I, N325T, L328D/I332E, L328V/I332E, L328T/I332E, L328I/I332E, S239E/V264I/I332E, S239Q/V264I/I332E, S239E/V264I/A330Y/I332E, S239D/A330Y/I332E, S239N/A330Y/I332E, S239D/A330L/I332E, S239N/A330L/I332E, V264I/S298A/I332E, S239D/S298A/I332E, S239N/S298A/I332E, S239D/V264I/I332E, S239D/V264I/S298A/I332E, S239D/V264I/A330L/I332E, S239D/I332E/A330I, Р230А, P230A/E233D/I332E, E272Y, К274Т, К274Е, K274R, K274L, K274Y, F275W, N276L, Y278T, V302I, E318R, S324D, S324I, S324V, K326I, К326Т, T335D, T335R, T335Y, V240I/V266I, S239D/A330Y/I332E/L234I, S239D/A330Y/I332E/L235D, S239D/A330Y/I332E/V240I, S239D/A330Y/I332E/V264T, S239D/A330Y/I332E/K326E и S239D/A330Y/I332E/K326T, где нумерация остатков в Fc-участке соответствует индексу EU в базе данных Kabat.
Еще одной целью настоящего изобретения является обеспечение варианта Fc, который имеет соотношение кратности изменения для FcγRIIIa к кратности изменения для FcγRIIb, превышающее 1:1. В одном из воплощений указанные варианты Fc имеют соотношение кратности изменения для FcγRIIIa к кратности изменения для FcγRIIb, превышающее 11:1. В предпочтительном воплощении указанные варианты Fc имеют соотношение кратности изменения для FcγRIIIa к кратности изменения для FcγRIIba, находящееся в диапазоне от 11:1 до 86:1. В одном из воплощений указанные варианты Fc включают, по меньшей мере, одну аминокислотную замену в положении, выбранном из группы, состоящей из: 234, 235, 239, 240, 264, 296, 330 и 332, где нумерация остатков в Fc-участке соответствует индексу EU в базе данных Kabat. В предпочтительной воплощении указанные варианты Fc включают, по меньшей мере, одну аминокислотную замену, выбранную из группы, состоящей из: L234Y, L234I, L235I, S239D, S239E, S239N, S239Q, V240A, V240M, V264I, V264Y, Y296Q, A330L, A330Y, A330I, I332D и I332E, где нумерация остатков в Fc-участке соответствует индексу EU в базе данных Kabat. В наиболее предпочтительном воплощении указанные варианты Fc выбирают из группы, состоящей из: I332E, V264I/I332E, S239Е/I332Е, S239Q/I332E, Y296Q, A330L, A330Y, I332D, S239D, S239D/I332E, А330Y/I332Е, V264I/A330Y/I332E, А330L/I332Е, V264I/А330L/I332Е, L234Y, L234I, L235I, V240A, V240M, V264Y, A330I, S239D/A330L/I332E, S239D/S298A/I332E, S239N/S298А/I332Е, S239D/V264I/I332E, S239D/V264I/S298A/I332E и S239D/V264I/A330L/I332E, где нумерация остатков в Fc-участке соответствует индексу EU в базе данных Kabat.
Еще одной целью настоящего изобретения является обеспечение вариантов Fc, которые в присутствии эффекторных клеток опосредуют эффекторные функции более эффективно. В одном из воплощений указанные варианты Fc опосредуют ADCC, которая выше той, которая опосредуется исходным полипептидом Fc. В предпочтительном воплощении указанные варианты Fc опосредуют ADCC, которая более чем в 5 раз выше цитотоксичности, опосредуемой исходным полипептидом Fc. В наиболее предпочтительном воплощении указанные варианты Fc опосредуют ADCC, которая от 5 до 1000 раз выше цитотоксичности, опосредуемой исходным полипептидом Fc. В одном из воплощений указанные варианты Fc включают, по меньшей мере, одну аминокислотную замену в положении, выбранном из группы, состоящей из остатков: 230, 233, 234, 235, 239, 240, 243, 264, 266, 272, 274, 275, 276, 278, 302, 318, 324, 325, 326, 328, 330, 332 и 335, где нумерация остатков в Fc-участке соответствует индексу EU в базе данных Kabat. В предпочтительном воплощении указанные варианты Fc включают, по меньшей мере, одну аминокислотную замену, выбранную из группы, состоящей из: Р230А, E233D, L234E, L234Y, L234I, L235D, L235S, L235Y, L235I, S239D, S239E, S239N, S239Q, S239T, V240I, V240M, F243L, V264I, V264T, V264Y, V266I, E272Y, К274Т, К274Е, K274R, K274L, K274Y, F275W, N276L, Y278T, V302I, E318R, S324D, S324I, S324V, N325T, K326I, К326Т, L328M, L328I, L328Q, L328D; L328V, L328T, A330Y, A330L, A330I, I332D, I332E, I332N, I332Q, T335D, T335R и T335Y, где нумерация остатков в Fc-участке соответствует индексу EU в базе данных Kabat. В наиболее предпочтительном воплощении указанные варианты Fc выбирают из группы, состоящей из: V264I, F243L/V264I, L328M, I332E, L328M/I332E, V264I/I332Е, S298A/I332E, S239E/I332E, S239Q/I332E, S239E, A330Y, I332D, L328I/I332E, L328Q/I332E, V264T, V240I, V266I, S239D, S239D/I332D, S239D/I332E, S239D/I332N, S239D/I332Q, S239E/I332D, S239E/I332N, S239Е/I332Q, S239N/I332D, S239N/1332E, S239Q/1332D, А330Y/I332Е, V264I/А330Y/I332Е, А330L/I332Е, V264I/А330L/I332Е, L234E, L234Y, L234I, L235D, L235S, L235Y, L235I, S239T, V240M, V264Y, A330I, N325T, L328D/I332E, L328V/I332E, L328T/I332E, L328I/I332E, S239E/V264I/I332E, S239Q/V264I/I332E, S239E/V264I/A330Y/I332E, S239D/А330Y/I332Е, S239N/A330Y/I332E, S239D/A330L/I332E, S239N/A330L/I332E, V264I/S298A/I332E, S239D/S298А/I332Е, S239N/S298A/I332E, S239D/V264I/I332E, S239D/V264I/S298A/I332E, S239D/V264I/A330L/I332E, S239D/I332Е/А330I, Р230А, P230A/E233D/I332E, E272Y, K274T, K274E, K274R, K274L, K274Y, F275W, N276L, Y278T, V302I, E318R, S324D, S324I, S324V, K326I, K326T, T335D, T335R, T335Y, V240I/V266I, S239D/A330Y/I332E/L234I, S239D/A330Y/I332E/L235D, S239D/A330Y/I332E/V240I, S239D/A330Y/I332E/V264T, S239D/А330Y/I332Е/К326Е и S239D/A330Y/I332E/K326T, где нумерация остатков в Fc-участке соответствует индексу EU в базе данных Kabat.
Еще одной целью настоящего изобретения является обеспечение вариантов Fc, которые связываются с более слабой аффинностью с одним или несколькими FcγR. В одном из воплощений указанные варианты Fc включают, по меньшей мере, одну аминокислотную замену в положении, выбранном из группы, состоящей из остатков: 230, 233, 234, 235, 239, 240, 241, 243, 244, 245, 247, 262, 263, 264, 265, 266, 267, 269, 270, 273, 276, 278, 283, 296, 297, 298, 299, 313, 323, 324, 325, 327, 328, 329, 330, 332 и 333, где нумерация остатков в Fc-участке соответствует индексу EU в базе данных Kabat. В предпочтительном воплощении указанные варианты Fc включают, по меньшей мере, одну аминокислотную замену, выбранную из группы, состоящей из: Р230А, E233D, L234D, L234N, L234Q, L234T, L234H, L234V, L234F, L234I, L235N, L235Q, L235T, L235H, L235V, L235F, L235D, S239E, S239N; S239Q, S239F, 8239Н, S239Y, V240A, V240T, F241W, F241L, F241Y, F241E, F241R, F243W, F243L, F243Y, F243R, F243Q, Р244Н, Р245А, P247V, P247G, V262I, V262A, V262T, V262E, V263I, V263A, V263T, V263M, V264L, V264I, V264W, V264T, V264R, V264F, V264M, V264E, D265G, D265N, D265Q, D265Y, D265F, D265V, D265I, D265L, D265H, D265T, V266A, V266T, V266M, S267Q, S267L, Е269Н, E269Y, E269F, E269R, Е269Т, E269L, E269N, D270Q, D270T, D270H, V273I, N276S, N276E, N276R, N276Y, Y278E, Y278W, E283R, Y296E, Y296Q, Y296D, Y296N, Y296S, Y296T, Y296L, Y296I, Y296H, N297S, N297D, N297E, А298Н, T299I, T299L, Т299А, T299S, T299V, Т299Н, T299F, Т299Е, W313F, V323I, S324R, S324L, S324Y, N325Q, N325L, N3251, N325D, N325E, N325A, N325V, N325H, A327N, A327L, L328M, L328E, L328N, L328Q, A327D, А327Т, L328F, L328H, L328A, L328N, L328H, P329F, A330L, A330V, A330F, A330R, А330Н, I332N, I332Q, I332T, I332H, I332Y, I332A, Е333Т и Е333Н, где нумерация остатков в Fc-участке соответствует индексу EU в базе данных Kabat. В наиболее предпочтительном воплощении указанные варианты Fc выбирают из группы, состоящей из: V264L, F241W, F241L, F243W, F243L, F241L/F243L/V262I/V264I, F241W/F243W, F241W/F243W/V262A/V264A, F241L/V262I, F243L/V262I/V264W, F241Y/F243Y/V262T/V264T, F241E/F243R/V262E/V264R, F241E/F243Q/V262T/V264E, F241R/F243Q/V262T/V264R, F241E/F243Y/V262T/V264R, L328M, L328E, L328F, Р244Н, Р245А, P247V, W313F, P244H/P245A/P247V, P247G, F241E/F243R/V262E/V264R/I332E, F241E/F243Y/V262T/V264R/I332E, D265G, D265N, S239E/D265G, S239E/D265N, S239E/D265Q, Y296E, Y296Q, T299I, A327N, S267Q/A327S, S267L/A327S, A327L, P329F, A330L, N297S, N297D, N297S/I332E, I332N, I332Q, V264F, V263I, T299A, T299S, T299V, N325Q, N325L, N3251, S239N, S239F, S239N/I332N, S239N/I332Q, S239Q/I332N, S239Q/I332Q, Y296D, Y296N, L234D, L234N, L234Q, L234T, L234H, L234V, L234F, L235N, L235Q, L235T, L235H, L235V, L235F, S239H, S239Y, V240A, V263T, V263M, V264M, V266A, V266T, V266M, E269H, E269Y, E269F, E269R, Y296S, Y296T, Y296L, Y296I, A298H, T299H, A330V, A330F, A330R, А330Н, N325D, N325E, N325A, N325V, N325H, L328E/I332E, L328N/I332E, L328Q/I332E, L328Н/I332Е, L328A, I332T, I332H, I332Y, I332A, L328N, L328H, E233D, P230A/E233D, E269T, E269L, E269N, D270Q, D270T, D270H, V273I, N276S, N276E, N276R, N276Y, Y278E, Y278W, E283R, V323I, S324R, S324L, S324Y, A327D, A327T, Е333Т, Е333Н и L234I/L235D, где нумерация остатков в Fc-участке соответствует индексу EU в базе данных Kabat.
Еще одной целью настоящего изобретения является обеспечение вариантов Fc, которые в присутствии эффекторных клеток опосредуют ADCC менее эффективно. В одном из воплощений указанные варианты Fc включают, по меньшей мере, одну аминокислотную замену в положении, выбранном из группы, состоящей из остатков: 230, 233, 234, 235, 239, 240, 241, 243, 244, 245, 247, 262, 263, 264, 265, 266, 267, 269, 270. 273, 276, 278, 283, 296, 297, 298, 299, 313, 323, 324, 325, 327, 328, 329, 330, 332, и 333, где нумерация остатков в Fc-участке соответствует индексу EU в базе данных Kabat. В предпочтительном воплощении указанные варианты Fc включают, по меньшей мере, одну аминокислотную замену в положении, выбранном из группы, состоящей из: Р230А, E233D, L234D, L234N, L234Q, L234T, L234H, L234V, L234F, L234I, L235N, L235Q, L235T, L235H, L235V, L235F, L235D, S239E, S239N, S239Q, S239F, S239H, S239Y, V240A, V240T, F241W, F241L, F241Y, F241E, F241R, F243W, F243L, F243Y, F243R, F243Q, Р244Н, Р245А, P247V, P247G, V262I, V262A, V262T, V262E, V263I, V263A, V263T, V263M, V264L, V264I, V264W, V264T, V264R, V264F, V264M, V264E, D265G, D265N, D265Q, D265Y, D265F, D265V, D265I, D265L, D265H, D265T, V266A, V266T, V266M, S267Q, S267L, Е269Н, E269Y, E269F, E269R, Е269Т, E269L, E269N, D270Q, D270T, D270H, V273I, N276S, N276E, N276R, N276Y, Y278E, Y278W, E283R, Y296E, Y296Q, Y296D, Y296N, Y296S, Y296T, Y296L, Y296I, Y296H, N297S, N297D, N297E, А298Н, T299I, T299L, Т299А, T299S, T299V, Т299Н, T299F, Т299Е, W313F, V323I, S324R, S324L, S324Y, N325Q, N325L, N3251, N325D, N325E, N325A, N325V, N325H, A327N, A327L, L328M, L328E, L328N, L328Q, A327D, А327Т, L328F, L328H, L328A, L328N, L328H, P329F, A330L, A330V, A330F, A330R, А330Н, I332N, I332Q, I332T, I332H, I332Y, I332A, Е333Т и Е333Н, где нумерация остатков в Fc-участке соответствует индексу EU в базе данных Kabat. В наиболее предпочтительном воплощении указанные варианты Fc выбирают из группы, состоящей из: V264L, F241W, F241L, F243W, F243L, F241L/F243L/V262I/V264I, F241W/F243W, F241W/F243W/V262A/V264A, F241L/V262I, F243L/V262I/V264W, F241Y/F243Y/V262T/V264T, F241E/F243R/V262E/V264R, F241E/F243Q/V262T/V264E, F241R/F243Q/V262T/V264R, F241E/F243Y/V262T/V264R, L328M, L328E, L328F, Р244Н, Р245А, P247V, W313F, P244H/P245A/P247V, P247G, F241E/F243R/V262E/V264R/I332E. F241E/F243Y/V262T/V264R/I332E, D265G, D265N, S239E/D265G, S239E/D265N, S239E/D265Q, Y296E, Y296Q, T299I, A327N, S267Q/A327S, S267L/A327S, A327L, P329F, A330L, N297S, N297D, N297S/I332E, I332N, I332Q, V264F, V263I, Т299А, T299S, T299V, N325Q, N325L, N325I, S239N, S239F, S239N/I332N, S239N/I332Q, S239Q/I332N, S239Q/I332Q, Y296D, Y296N, L234D, L234N, L234Q, L234T, L234H, L234V, L234F, L235N, L235Q, L235T, L235H, L235V, L235F, S239H, S239Y, V240A, V263T, V263M, V264M, V266A, V266T, V266M, Е269Н, E269Y, E269F, E269R, Y296S, Y296T, Y296L, Y296I, А298Н, Т299Н, A330V, A330F, A330R, А330Н, N325D, N325E, N325A, N325V, N325H, L328E/I332E, L328N/I332E, L328Q/I332E, L328H/I332E, L328A, I332T, I332H, I332Y, I332A, L328N, L328H, E233D, P230A/E233D, Е269Т, E269L, E269N, D270Q, D270T, D270H, V273I, N276S, N276E, N276R, N276Y, Y278E, Y278W, E283R, V323I, S324R, S324L, S324Y, A327D, А327Т, Е333Т, Е333Н и L234I/L235D, где нумерация остатков в Fc-участке соответствует индексу EU в базе данных Kabat.
Еще одной целью настоящего изобретения является обеспечение вариантов Fc, которые обладают улучшенными функциональными свойствами и/или свойствами в растворе по сравнению с агликозилированной формой исходного полипептида Fc. Улучшенная функциональность в настоящем тексте включает, но не ограничивается только ею, аффинность связывания с лигандом Fc. Улучшенные свойства в растворе в настоящем тексте включают, но не ограничиваются только ими, стабильность и растворимость. В одном из воплощений указанные агликозилированные варианты Fc связываются с FcγR с аффиностью, которая сравнима или более высокая по сравнению с гликозилированным исходным полипептидом Fс. В альтернативном воплощении указанные варианты Fс связываются с FcγR с аффинностью, которая составляет 0,4 от аффинности гликозилированной формы исходного полипептида Fc. В одном из воплощений указанные варианты Fc включают, по меньшей мере, одну аминокислотную замену в положении, выбранном из группы, состоящей из остатков: 239, 241, 243, 262, 264, 265, 296, 297, 330 и 332, где нумерация остатков в Fc-участке соответствует индексу EU в базе данных Kabat. В предпочтительном воплощении указанные варианты Fc включают аминокислотную замену, выбранную из группы, состоящей из: S239D, S239E, F241Y, F243Y, V262T, V264T, V264E, D265Y, D265H, D265V, D265I, Y296N, N297D, A330Y и I332E, где нумерация остатков в Fc-участке соответствует индексу EU в базе данных Kabat. В наиболее предпочтительном воплощении указанные варианты Fc выбирают из группы, состоящей из: N297D/I332E, F241Y/F243Y/V262T/V264T/N297D/I332E, S239D/N297D/I332E, S239E/N297D/I332E, S239D/D265Y/N297D/I332E, S239D/D265H/N297D/I332E, V264Е/N297D/I332Е, Y296N/N297D/I332E, N297D/A330Y/I332E, S239D/D265V/N297D/I332E, S239D/D265I/N297D/I332E и N297D/S298A/A330Y/I332E, где нумерация остатков в Fc-участке соответствует индексу EU в базе данных Kabat.
Настоящее изобретение также предоставляет способы конструирования вариантов Fc. Целью настоящего изобретения является предоставление стратегии конструирования, которую можно применять для контроля над оптимизацией Fc. Кроме того, целью настоящего изобретения является предоставление компьютерных способов скрининга, которые можно применять для конструирования вариантов Fc. Еще одной целью настоящего изобретения является предоставление способов создания библиотек для экспериментального тестирования. Кроме того, целью настоящего изобретения является обеспечение экспериментальных способов производства и скрининга для получения оптимизированных вариантов Fc.
Настоящее изобретение предоставляет изолированные нуклеиновые кислоты, кодирующие варианты Fc, описанные здесь. Настоящее изобретение обеспечивает векторы, включающие указанные нуклеиновые кислоты, которые дополнительно могут быть функционально связаны с регуляторными последовательностями. Настоящее изобретение обеспечивает клетки-хозяева, включающие векторы, и способы получения и выделения вариантов Fc.
Настоящее изобретение обеспечивает новые антитела и слитые Fc, которые включают варианты Fc, подробно описанные здесь. Указанные новые антитела и слитые Fc могут найти применение в терапевтических продуктах.
Настоящее изобретение обеспечивает композиции, включающие антитела и слитые Fc, которые включают варианты Fc, описанные здесь, и физиологически или фармацевтически приемлемый носитель или разбавитель.
Настоящее изобретение предполагает терапевтическое или диагностическое применение антител и слитых Fc, которые включают варианты Fc, описанные здесь.
Краткое описание фигур
Фигура 1. Структура и функция антитела. Показана модель полноразмерного человеческого антитела IgG1, смоделированного при использовании структуры гуманизированного фрагмента Fab с кодом доступа 1СЕ1 в базе данных PDB (James et al., 1999, J Mol Biol 289:293-301) и структуры Fc-фрагмента человеческого IgG1 с кодом доступа 1DN2 в базе данных PDB (DeLano et al., 2000, Science 287:1279-1283). Подвижный шарнир, который связывает участки Fab и Fc, не показан. IgG1 представляет собой гомодимер, состоящий из гетеродимеров, составленных из двух легких цепей и двух тяжелых цепей. Домены Ig, которые включают антитело, отмечены и включают VL и CL в легкой цепи и VH, С-гамма-1 (Сγ1), С-гамма-2 (Сγ2) и С-гамма-3 (Сγ3) для тяжелой цепи. Участок Fc отмечен. Места связывания важных белков отмечены и включают место связывания антигена в вариабельной области и места связывания FcγR, FcRn, C1q и белков А и G в участке Fc.
Фигура 2. Структура 1IIS комплекса Fc/FcγIIIb. Fc показан на схеме в виде серой ленты, a FcγIIIb показан в виде черной ленты. Углевод при N297 показан в виде черных палочек.
Фигура 3. Аминокислотная последовательность тяжелой цепи антитела алемтузумаба (Campath®, зарегистрированная торговая марка фирмы Pharmaceuticals LP) (SEQ ID NO:1), иллюстрирующая последовательно пронумерованные положения (2 строки над аминокислотной последовательностью) и положения, пронумерованные в соответствии с индексом EU базы данных Kabat (2 строки под аминокислотной последовательностью). Приблизительное начало Ig-доменов VH1, Cγ1, шарнира, Сγ2 и Сγ3 также отмечены над нумерацией аминокислот. В некоторых положениях Fc наблюдали полиморфизм, включающий, но не ограниченный остатками с номерами по системе Kabat 270, 272, 312, 356 и 358, и, таким образом, могут быть слабые различия между настоящей последовательностью и последовательностями, известными в уровне техники.
Фигура 4. Остатки из экспериментальной библиотеки, отображенные на структуре 1IIS комплекса Fc/FcγRIIIb. Fc показан в виде серой ленты, a FcγRIIIb показан в виде черной ленты. Остатки из экспериментальной библиотеки показаны черным цветом, углевод при остатке N297 окрашен в серый цвет.
Фигура 5. Последовательность Fc человеческого IgG1 (SEQ ID NO:2), показывающая положения, важные для конструирования вариантов Fc экспериментальной библиотеки. Последовательность включает шарнирный участок, домен Cγ2 и домен Сγ3. Номера остатков даны в соответствии с индексом EU базы данных Kabat. Подчеркнуты положения, относящиеся к экспериментальной библиотеке. Так как в некоторых положениях Fc наблюдали полиморфные мутации, могут быть слабые различия между настоящей последовательностью и последовательностями, известными ранее в этой области техники.
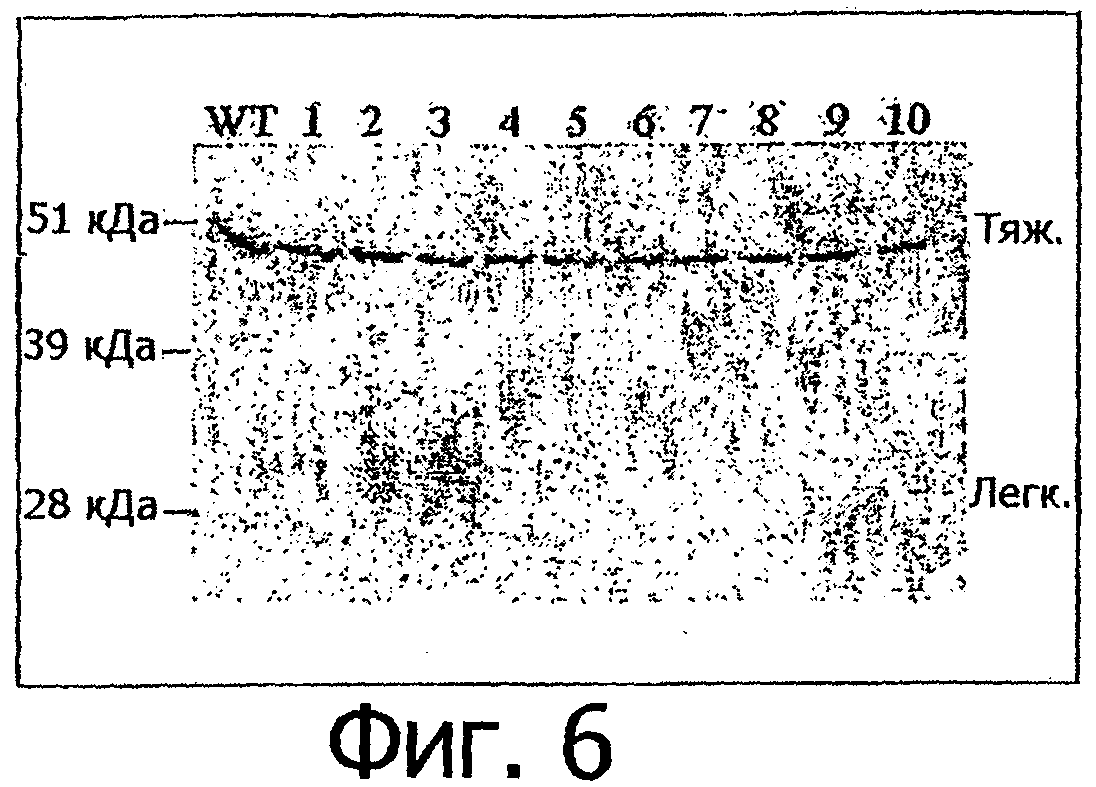
Фигура 6. Экспрессия варианта Fc и белков дикого типа (WT) алемтузумаба в клетках 293Т. Плазмиды, содержащие гены тяжелых цепей алемтузумаба (WT или вариантов), были трансфицированы совместно с плазмидой, содержащей ген легкой цепи алемтузумаба. Среду собирали через 5 дней после трансфекции. Для каждого трансфицированного образца 10 мкл среды помещали на ПААГ-гель в присутствии додецилсульфата натрия (SDS) для вестерн-блот-анализа. Зонд для вестерн-блот-анализа представлял собой козьи антитела к иммуноглобулинам человека IgG, конъюгированные с пероксидазой (Jackson Immuno Research, номер по каталогу 109-035-088). WT: дикий тип алемтузумаба; 1-10: варианты алемтузумаба. Н и L обозначают тяжелую и легкую цепь антитела соответственно.
Фигура 7. Очистка алемтузумаба с помощью хроматографии с использованием белка А. Белки алемтузумаба WT экспрессировали в клетках 293Т и среду собирали через 5 дней после трансфекции. Среду разводили 1:1 с помощью забуференного фосфатом физиологического раствора (PBS) и очищали на колонке с белком A (Pierce, номер по каталогу 20334). О: исходный образец до очистки; FT: проскок; Е: элюция; С: концентрированный полученный образец. Левая часть фигуры показывает окрашивание с помощью Simple Blue ПААГ-геля в присутствии SDS, правая часть фигуры показывает вестерн-блоттинг, окрашенный с применением козьих антител к иммуноглобулинам человека IgG, конъюгированных с пероксидазой.
Фигура 8. Продукция дегликозилированных антител. Алемтузумаб дикого типа и его варианты экспрессировали в клетках 293Т и очищали с помощью хроматографии на колонке с белком А. Антитела инкубировали с пептид-N-гликозидазой (+PNGase F) при 37°С в течение 24 часов. Для каждого антитела в параллель анализировали образец, обработанный в отсутствие фермента (-PNGase F). WT: дикий тип алемтузумаба; #15, #16, #17, #18, #22: варианты алемтузумаба F241E/F243R/V262E/V264R, F241E/F243Q/V262T/V264E, F241R/F243Q/V262T/V264R, F241E/F243Y/V262T/V264R и I332E соответственно. Более быстрая миграция образцов, обработанных с помощью PNGase F, по отношению к ложно обработанным образцам демонстрирует дегликозилированные тяжелые цепи.
Фигура 9. Алемтузумаб, экспрессированный в клетках 293Т, связывает свой антиген. Антигенный пептид CD52, слитый с GST, был экспрессирован в Е.coli BL21 (DE3) при индукции IPTG. Как неиндуцированные, так и индуцированные образцы подвергали электрофоретическому разделению в ПААГ-геле в присутствии SDS и переносили на PVDF-мембрану. В качестве первичных антител для вестерн-блот-анализа использовали как алемтузумаб фирмы Sotec (α-CD52, фирма Sotec) (конечная концентрация 2,5 нг/мкл) или среду трансфицированных клеток 293Т (Campath, фирма Xencor) (конечная концентрация алемтузумаба приблизительно 0,1-2 нг/мкл), а в качестве вторичных антител использовали козьи антитела к иммуноглобулинам IgG человека, конъюгированные с пероксидазой. М: предварительно окрашенный маркер; U: неиндуцированный образец для GST-CD52; I: индуцированный образец для GST-CD52.
Фигура 10. Экспрессия и очистка внеклеточного участка V158 FcγRIIIa человека. Несущий метку FcγRIIIa трансфицировали в клетки 293Т и среду, содержавшую секретируемый FcγRIIIa, собирали через 3 дня и очищали, используя аффинную хроматографию. 1: среда; 2: проскок; 3: промывание; 4-8: серийные элюции. Показаны простое синее окрашивание ПААГ-геля в присутствии SDS при помощи Simple Blue и результаты вестерн-блот-анализа. Для вестерн-блот-анализа мембрану обрабатывали антителами к GST.
Фигура 11. Связывание выбранных вариантов Fс алемтузумаба из экспериментальной библиотеки с V158 FcγRIIIa человека по результатам определения с помощью анализа AlphaScreen™, описанного в Примере 2. В присутствии конкурирующего антитела (вариант Fc или алемтузумаб WT) наблюдали характерную кривую ингибирования по уменьшению люминесцентного сигнала. В качестве отрицательного контроля использовали только забуференный фосфатом физиологический раствор (PBS). Данные по связыванию нормировали по максимуму и минимуму люминесцентного сигнала для каждой индивидуальной кривой, определяя базовые линии при низких и высоких концентрациях антител соответственно. Кривые представляют собой аппроксимацию данных в модели с одним местом конкурентного связывания, полученную методом нелинейной регрессии. Эта аппроксимация предоставляет для каждого антитела величину IC50, проиллюстрированную для WT и S239D с помощью пунктирных линий.
Фигура 12. Анализ AlphaScreen™, демонстрирующий связывание выбранных вариантов Fc алемтузумаба с FcγIIb человека. Данные по связыванию нормировали по максимальной и минимальной базовым линиям для каждого индивидуального антитела, кривые представляют собой аппроксимацию данных в модели с одним местом конкурентного связывания. В качестве отрицательного контроля использовали PBS.
Фигуры 13а и 13б. Анализ AlphaScreen™, демонстрирующий связывание выбранных вариантов Fc алемтузумаба (фигура 13а) и трастузумаба (фигура 13б) с Val158 FcγRIIIa человека. Данные по связыванию нормировали по максимальной и минимальной базовым линиям для каждого индивидуального антитела, кривые представляют собой аппроксимацию данных в модели с одним местом конкурентного связывания. В качестве отрицательного контроля использовали PBS.
Фигуры 14а и 14б. Анализ AlphaScreen™, измеряющий связывание с V158 FcγRIIIa человека выбранных вариантов Fc в контексте трастузумаба. Данные по связыванию нормировали по максимальной и минимальной базовым линиям для каждого индивидуального антитела, кривые представляют собой аппроксимацию данных в модели с одним местом конкурентного связывания. В качестве отрицательного контроля использовали PBS.
Фигуры 15а и 15б. Анализ AlphaScreen™, измеряющий связывание с V158 FcγRIIIa человека выбранных вариантов Fc в контексте ритуксимаба (фигура 15а) и цетуксимаба (фигура 15б). Данные по связыванию нормировали по максимальной и минимальной базовым линиям для каждого индивидуального антитела, кривые представляют собой аппроксимацию данных в модели с одним местом конкурентного связывания. В качестве отрицательного контроля использовали PBS.
Фигуры 16а и 16б. Анализ AlphaScreen™, сравнивающий связывание выбранных вариантов алемтузумаба по Fc с V158 FcγRIIIa человека (фигура 16а) и FcγIIb человека (фигура 16б). Данные по связыванию нормировали по максимальной и минимальной базовым линиям для каждого индивидуального антитела, кривые представляют собой аппроксимацию данных в модели с одним местом конкурентного связывания. В качестве отрицательного контроля использовали PBS.
Фигура 17. Анализ AlphaScreen™, измеряющий связывание выбранных вариантов Fc в контексте трастузумаба с V158 FcγRIIIa человека. Данные по связыванию нормировали по максимальной и минимальной базовым линиям для каждого индивидуального антитела, кривые представляют собой аппроксимацию данных в модели с одним местом конкурентного связывания. В качестве отрицательного контроля использовали PBS.
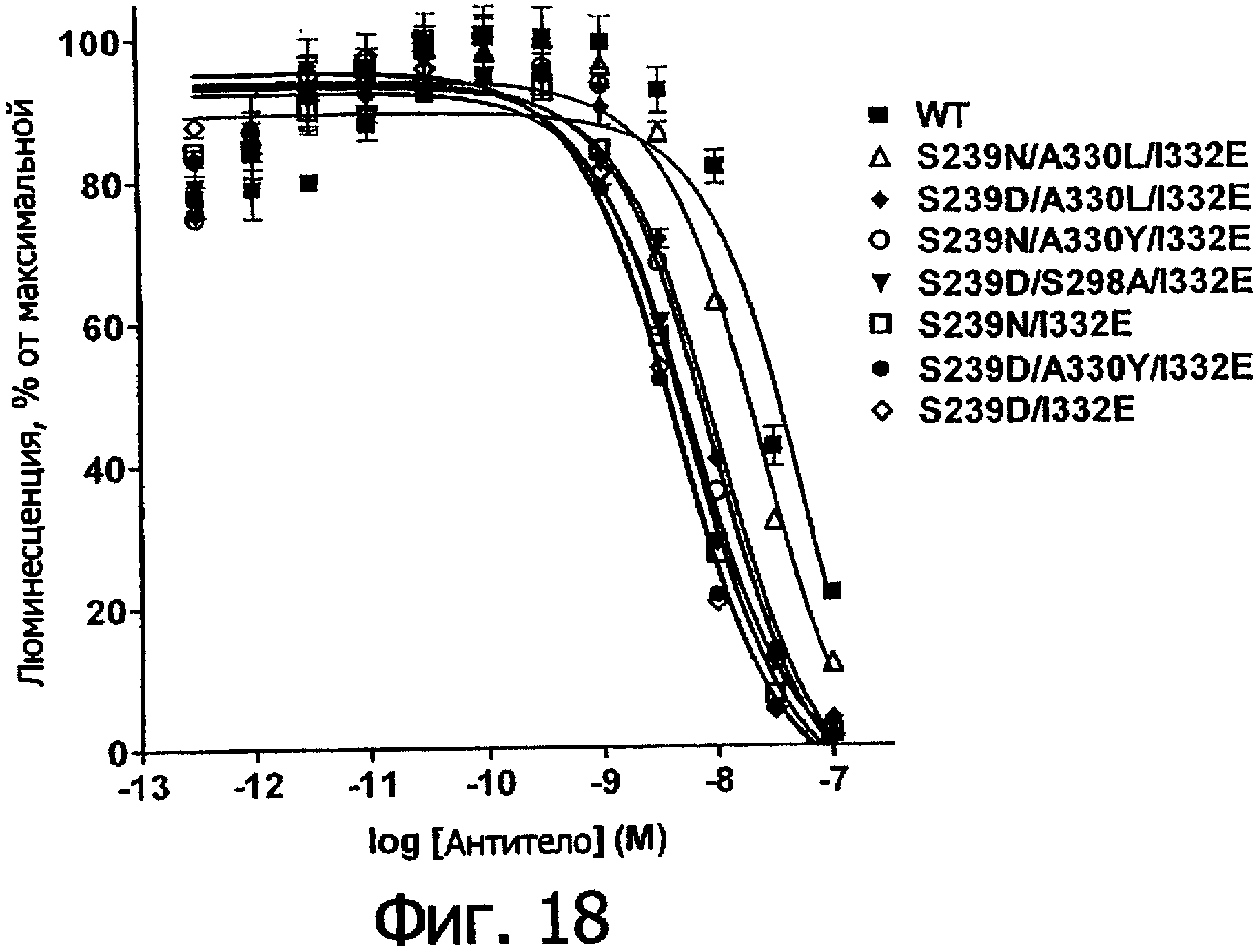
Фигура 18. Анализ AlphaScreen™, показывающий связывание выбранных вариантов Fc алемтузумаба с R131 FcγRIIa человека. Данные по связыванию нормировали по максимальной и минимальной базовым линиям для каждого индивидуального антитела, кривые представляют собой аппроксимацию данных в модели с одним местом конкурентного связывания. В качестве отрицательного контроля использовали PBS.
Фигуры 19ы и 19б. Анализ AlphaScreen™, показывающий связывание выбранных вариантов Fc алемтузумаба с V159 FcγRIIIa человека. Данные по связыванию нормировали по максимальной и минимальной базовым линиям для каждого индивидуального антитела, кривые представляют собой аппроксимацию данных в модели с одним местом конкурентного связывания. В качестве отрицательного контроля использовали PBS.
Фигура 20. Анализ AlphaScreen™, показывающий связывание выбранных агликозилированных вариантов Fc алемтузумаба с V158 FcγRIIIa человека. Данные по связыванию нормировали по максимальной и минимальной базовым линиям для каждого индивидуального антитела, кривые представляют собой аппроксимацию данных в модели с одним местом конкурентного связывания. В качестве отрицательного контроля использовали PBS.
Фигура 21. Анализ AlphaScreen™, сравнивающий связывание с V158 FcγRIIIa человека выбранных вариантов Fc алемтузумаба в гликозилированной (закрашенные символы, сплошные линии) и дегликозилированной форме (открытые символы, пунктирные линии). Данные по связыванию нормировали по максимальной и минимальной базовым линиям для каждого индивидуального антитела, кривые представляют собой аппроксимацию данных в модели с одним местом конкурентного связывания. В качестве отрицательного контроля использовали PBS.
Фигуры 22а-22б. Анализ AlphaScreen™, показывающий связывание выбранных вариантов Fc алемтузумаба с V158 (фигура 22а) и F158 (фигура 22б) аллотипами FcγRIIIa человека. Данные по связыванию нормировали по максимальной и минимальной базовым линиям для каждого индивидуального антитела, кривые представляют собой аппроксимацию данных в модели с одним местом конкурентного связывания. В качестве отрицательного контроля использовали PBS.
Фигуры 23а-23г. Фигуры 23а и 23б показывают корреляцию между константами диссоциации Kd в анализе SPR и величинами IC50 в анализе AlphaScreen™ из данных связывания выбранных вариантов Fc алемтузумаба с V158 FcγRIIIa (фигура 23а) и F158 FcγRIIIa (фигура 23б). Фигуры 23в и 23г показывают корреляцию между кратностью изменения связывания усовершенствованным вариантом по сравнению с диким типом в анализе SPR и в анализе AlphaScreen™ для связывания выбранных вариантов Fc алемтузумаба с V158 FcγRIIIa (фигура 23в) и F158 FcγRIIIa (фигура 23г). Данные по связыванию представлены в таблице 63. Линии, проведенные через экспериментальные точки, представляют собой линейную аппроксимацию данных, значения r2 показывают уровень значимости этих аппроксимаций.
Фигуры 24а-25б. Клеточные анализы ADCC выбранных вариантов Fc в контексте алемтузумаба. ADCC измеряли, применяя способ анализа цитотоксичности DELFIA® EuTDA (Perkin Elmer, МА), как описано в Примере 7, применяя клетки-мишени лимфомы DoHH-2 и 59-кратный избыток мононуклеарных клеток периферической крови (РМВС) человека. Фигура 24а представляет собой столбцовую диаграмму, показывающую исходные данные по флуоресценции для указанных антител алемтузумаба в концентрации 10 нг/мл. Столбик РВМС указывает базальный уровень цитотоксичности в отсутствие антитела. Фигура 24б показывает зависимость ADCC от концентрации антитела для указанных антител алемтузумаба, нормированную по минимуму и максимуму флуоресцентного сигнала для каждой индивидуальной кривой, полученной из базовых линий, определенных при низких и высоких концентрациях антител соответственно. Кривые представляют собой аппроксимацию данных в модели сигмоидальной зависимости эффекта от дозы, полученную с помощью метода нелинейной регрессии.
Фигуры 25а-25. Клеточные анализы ADCC выбранных вариантов Fc в контексте трастузумаба. ADCC измеряли, применяя способ анализа цитотоксичности DELFIA® EuTDA (Perkin Elmer, МА), как описано в Примере 7, применяя клетки-мишени карциномы молочной железы ВТ474 и Sk-Br-3 и 59-кратный избыток клеток РМВС человека. Фигура 25а представляет собой столбцовую диаграмму, показывающую исходные данные по флуоресценции для указанных антител трастузумаба в концентрации 1 нг/мл. Столбик РВМС указывает базальный уровень цитотоксичности в отсутствие антитела. Фигуры 25б и 25в показывают зависимость ADCC от концентрации антитела для указанных антител трастузумаба, нормированную по минимуму и максимуму флуоресцентного сигнала для каждой индивидуальной кривой, полученной из базовых линий, определенных при низких и высоких концентрациях антител соответственно. Кривые представляют собой аппроксимацию данных в модели сигмоидальной зависимости эффекта от дозы, полученную с помощью метода нелинейной регрессии.
Фигуры 26а-26в. Клеточные анализы ADCC выбранных вариантов Fc в контексте ритуксимаба. ADCC измеряли, применяя способ анализа цитотоксичности DELFIA® EuTDA (Perkin Elmer, МА), как описано в Примере 7, применяя клетки-мишени лимфомы WIL2-S и 59-кратный избыток клеток РМВС человека. Фигура 26а представляет собой столбцовую диаграмму, показывающую исходные данные по флуоресценции для указанных антител ритуксимаба в концентрации 1 нг/мл. Столбик РВМС указывает базальный уровень цитотоксичности в отсутствие антитела. Фигуры 26б и 26в показывают зависимость ADCC от концентрации антитела для указанных антител ритуксимаба, нормированную по минимуму и максимуму флуоресцентного сигнала для каждой индивидуальной кривой, полученной из базовых линий, определенных при низких и высоких концентрациях антител соответственно. Кривые представляют собой аппроксимацию данных в модели сигмоидальной зависимости эффекта от дозы, полученную с помощью метода нелинейной регрессии.
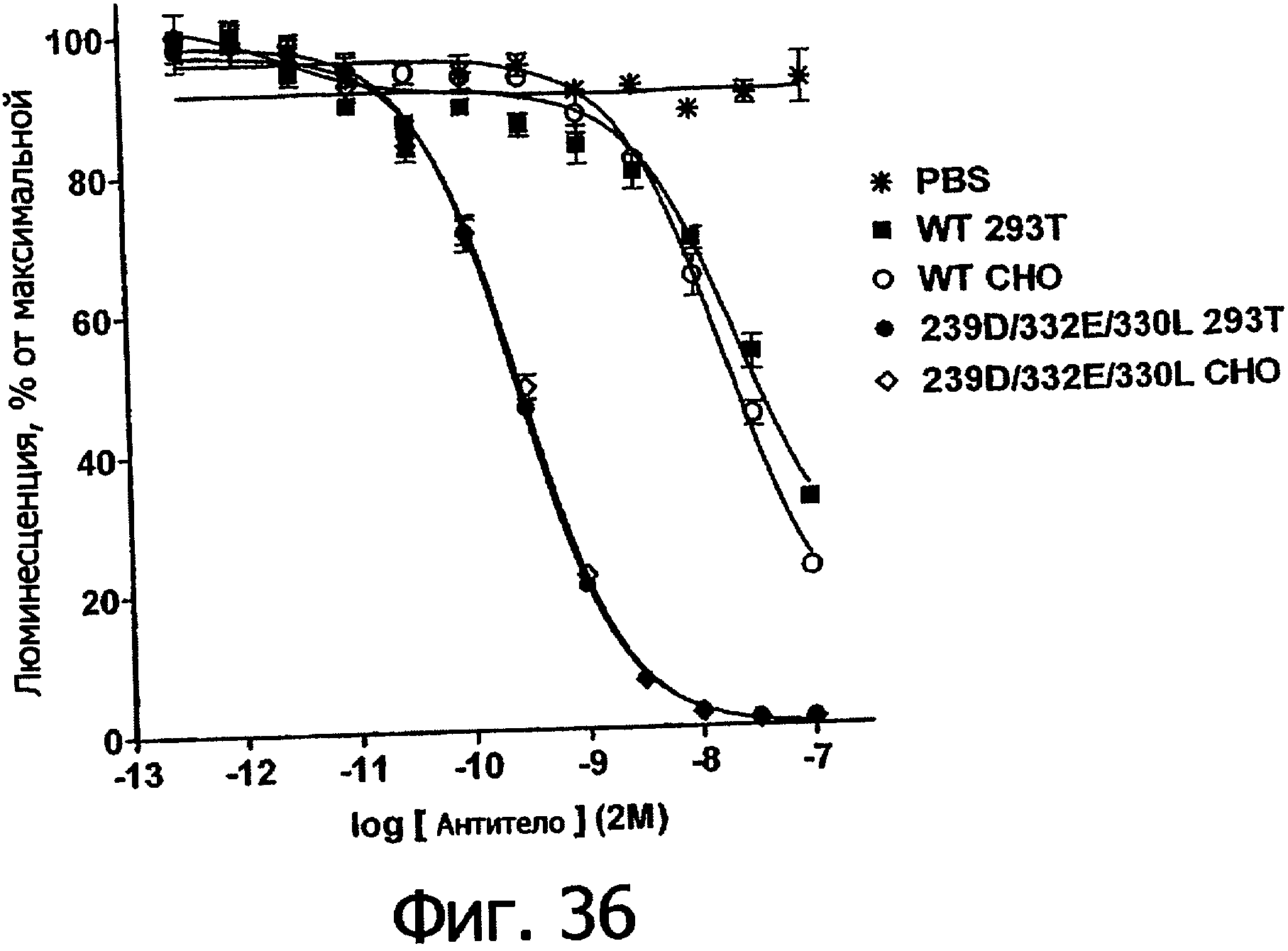
Фигуры 27а-27б. Клеточный анализ ADCC выбранных вариантов Fc трастузумаба (Фигура 27а) и ритуксимаба (Фигура 27б), демонстрирующий повышение активности и эффективности. В том и другом анализе в качестве эффекторных клеток использовали гомозиготные клетки F158/F158 FcγRIIIa PCMB при 25-кратном избытке по отношению к клеткам-мишеням, которые в случае анализа трастузумаба были клетками Sk-Br-3, а в случае анализа ритуксимаба были клетками WIL2-S. Данные были пронормированы по абсолютному значению минимального лизиса в анализе, определенному при измерении флуоресцентного сигнала клеток-мишеней в присутствии только клеток РВМС (отсутствие антител), и по абсолютному значению максимального лизиса в анализе, определенному при измерении флуоресцентного сигнала клеток-мишеней в присутствии тритона Х-100, как описано в Примере 7.
Фигура 28. Клеточный анализ ADCC выбранных вариантов Fc трастузумаба, направленных против различных клеточных линий, экспрессирующих различные уровни антигена-мишени Her2/neu. Анализы ADCC проводили, как описано в Примере 7, с различными клеточными линиями, экспрессирующими от увеличенного до низкого уровней рецептора Her2/neu, включающими Sk-Br-3 (1×106 копий), SkOV3 (˜1×105), OVCAR3 (˜1×104) и MCF-7 (˜3×103 копий). Клетки РМВС человека, аллотипированные как гомозиготные по F158/F158 FcγRIIIa, применяли в 25-кратном избытке по отношению к клеткам-мишеням. Столбцовая диаграмма демонстрирует данные по ADCC для WT и вариантов Fc в зависимости от указанных клеточных линий, нормированные по минимальному и максимальному флуоресцентному сигналу, полученному при минимальном лизисе (только PBMCs) и максимальном лизисе (тритон Х-100).
Фигура 29. Клеточные анализы выбранных вариантов Fc трастузумаба с применением натуральных клеток-киллеров (NK) в качестве эффекторных клеток и измерение высвобождения LDH для слежения за лизисом клеток. Клетки NK, аллотипированные как гетерозиготы V158/F158 FcγRIIIa, были в 8-кратном избытке по отношению к клеткам-мишеням карциномы молочной железы Sk-Br-3, уровень цитотоксичности измеряли, применяя набор LDH Cytotoxicity Detection в соответствии с протоколом фирмы-производителя (Roche Diagnostics GmbH, Penzberg, Germany). График демонстрирует зависимость ADCC от концентрации антител для указанных антител трастузумаба, нормированную по минимуму и максимуму флуоресцентного сигнала для каждой индивидуальной кривой, полученной из базовых линий, определенных при низких и высоких концентрациях антител соответственно. Кривые представляют собой аппроксимацию данных в модели сигмоидальной зависимости эффекта от дозы, полученную с помощью метода нелинейной регрессии.
Фигура 30. Клеточные анализы ADCC выбранных вариантов. Анализ ADCC проводили, как описано в Примере 8, с помощью проточной цитометрии, используя стратегию совместного мечения. В качестве эффекторных клеток использовали дифференцированные макрофаги, а в качестве клеток-мишеней использовали клетки Sk-Br-3. Процент случаев фагоцитоза представлял собой число совместно меченных клеток (макрофаги + Sk-Br-3) по отношению к общему числу клеток Sk-Br-3 в популяции (фагоцитированные клетки + нефагоцитированные клетки).
Фигуры 31а-31в. Способность выбранных вариантов Fc опосредовать связывание и активацию комплемента. Фигура 31а демонстрирует результаты анализа AlphaScreen™, измеряющего связывание выбранных вариантов Fc алемтузумаба с C1q. Данные по связыванию были пронормированы по верхней и нижней базовым линиям для каждого индивидуального антитела, кривые представляют собой аппроксимацию данных в модели с одним местом конкурентного связывания. Фигуры 31б и 31в демонстрируют клеточный анализ, измеряющий способность выбранных вариантов Fc ритуксимаба опосредовать CDC. Анализы CDC проводили, используя Аламаровый синий для слежения за лизисом опсонизированных Fc-вариантом ритуксимаба и WT-ритуксимабом клеток лимфомы WIL2-S, вызванным человеческим сывороточным комплементом (Quidel, San Diego, CA). Для указанных антител ритуксимаба показана зависимость опосредованного комплементом лизиса от концентрации антител, которая была пронормирована по минимуму и максимуму флуоресцентного сигнала для каждой индивидуальной кривой, полученным из базовых линий, определенных при низких и высоких концентрациях антител соответственно. Кривые представляют собой аппроксимацию данных в модели сигмоидальной зависимости эффекта от дозы, полученную с помощью метода нелинейной регрессии.
Фигура 32. Измерение связывания выбранных вариантов Fc алемтузумаба с бактериальным белком А в анализе AlphaScreen™, как описано в Примере 10. Данные по связыванию нормировали по максимальной и минимальной базовым линиям для каждого индивидуального антитела, кривые представляют собой аппроксимацию данных в модели с одним местом конкурентного связывания. В качестве отрицательного контроля использовали PBS.
Фигура 33. Измерение связывания выбранных вариантов Fc алемтузумаба с человеческим FcRn в анализе AlphaScreen™, как описано в Примере 10. Данные по связыванию нормировали по максимальной и минимальной базовым линиям для каждого индивидуального антитела, кривые представляют собой аппроксимацию данных в модели с одним местом конкурентного связывания. В качестве отрицательного контроля использовали PBS.
Фигуры 34а и 34б. Измерение связывания выбранных вариантов Fc алемтузумаба (фигура 34а) и трастузумаба (фигура 34б) с мышиным FcγRIII в анализе AlphaScreen™, как описано в Примере 11. Данные по связыванию нормировали по максимальной и минимальной базовым линиям для каждого индивидуального антитела, кривые представляют собой аппроксимацию данных в модели с одним местом конкурентного связывания. В качестве отрицательного контроля использовали PBS.
Фигура 35. Клеточные анализы ADCC выбранных вариантов Fc в составе трастузумаба с применением мышиных PBMCs в качестве эффекторных клеток. ADCC измеряли, применяя способ анализа цитотоксичности UHLF1A® EuTDA (Perkin Elmer, МА), применяя клетки-мишени карциномы Sk-Br-3 и 8-кратный избыток клеток РМВС мыши. Столбцовая диаграмма показывает исходные данные по флуоресценции для указанных антител трастузумаба в концентрации 10 нг/мл. Столбик РВМС указывает базальный уровень цитотоксичности в отсутствие антитела, и столбик ТХ указывает на полный лизис клеток в присутствии тритона Х-100.
Фигура 36. Измерение связывания выбранных вариантов Fc трастузумаба, экспрессированных в клетках 293Т и СНО, с человеческим VI58 FcγRIIIa в анализе AlphaScreen™, как описано в Примере 12. Данные по связыванию нормировали по максимальной и минимальной базовым линиям для каждого индивидуального антитела, кривые представляют собой аппроксимацию данных в модели с одним местом конкурентного связывания. В качестве отрицательного контроля использовали PBS.
Фигуры 37а-37б. Синергия вариантов Fc и сконструированных гликоформ. Фигура 37а представляет результаты анализа AlphaScreen™, показывающие связывание V158 FcγRIIIa с WT и вариантом Fc (V209, S239/I332E/A330L) трастузумаба, экспрессированных в клетках 293Т, СНО и Lee-13 СНО. Данные нормировали по максимальной и минимальной базовым линиям для каждого антитела, кривые представляют собой аппроксимацию данных в модели с одним местом конкурентного связывания. В качестве отрицательного контроля использовали PBS. Фигура 37б представляет результаты клеточного анализа ADCC, показывающие способность клеток 93Т, СНО и Lec-13 CHO, экспрессирующих трастузумаб WT и его вариант V209, опосредовать ADCC. ADCC измеряли, применяя способ анализа цитотоксичности DELFIA®EuTDA, как описано ранее, с помощью клеток-мишеней карциномы молочной железы Sk-Вк-3. Для указанных антител трастузумаба показана зависимость ADCC от концентрации антител, которая была пронормирована по минимуму и максимуму флуоресцентного сигнала для каждой индивидуальной кривой, полученной из базовых линий, определенных при низких и высоких концентрациях антител соответственно. Кривые представляют собой аппроксимацию данных в модели сигмоидальной зависимости эффекта от дозы, полученную с помощью метода нелинейной регрессии.
Фигуры 38а-38в. Последовательности усовершенствованных антител к CD20. Последовательности легкой и тяжелой цепей ритуксимаба (SEQ ID Nos: 3 и 4) представлены на фигуре 38а и фигуре 38б соответственно и были взяты из транслированной последовательности №3 патента US 5736137. Важные положения на фигуре 38а выделены жирным шрифтом, они включают S239, V240, V264, Е272, К274, N297, S298, К326, А330 и I332. Фигура 38в демонстрирует последовательности тяжелой цепи усовершенствованного антитела к CD20 с вариабельными положениями, обозначенными жирным шрифтом как X1, Х2, Х3, Х4, Х5, Х6, Х7, X8, Z1 и Z2 (SEQ ID NO:5). Таблица, расположенная под последовательностью, представляет возможные замены в этих положениях. Последовательности усовершенствованного антитела к CD20 включают, по меньшей мере, одну аминокислоту, не входящую в состав WT, выбранную из группы возможных замен для X1, Х2, Х3, Х4, Х5, Х6, Х7 и X8. Эти последовательности усовершенствованного антитела к CD20 могут также включать замены Z1 и/или Z2. Эти положения пронумерованы в соответствии с индексом EU в соответствии с базой данных Kabat, и, таким образом, не соответствуют последовательному порядку в последовательности.
Осуществление изобретения
Чтобы изобретение было полностью понятным, ниже приведены некоторые определения. Предполагается, что эти определения охватывают грамматические эквиваленты.
Термин «ADCC», или «зависимая от антител опосредованная клетками цитотоксичность», который используют в тексте, означает опосредованную клетками реакцию, в которой неспецифические цитотоксические клетки, экспрессирующие FcγR, распознают антитела, связанные на клетке-мишени, и впоследствии вызывают лизис клетки-мишени.
Термин «ADCP», или «зависимый от антител опосредованный клетками фагоцитоз», который используют в тексте, означает опосредованную клетками реакцию, в которой неспецифические цитотоксические клетки, экспрессирующие FcγR, распознают антитела, связанные на клетке-мишени, и впоследствии вызывают фагоцитоз клетки-мишени.
Термин «модификация аминокислот», который используют в тексте, означает замену, вставку и/или делецию в полипептидной последовательности. Замена в данном случае является предпочтительной модификацией аминокислот. «Замена аминокислоты» или «замена» означают замещение аминокислоты в определенном положении в исходной полипептидной последовательности на другую аминокислоту. Например, замена I332E относится к вариантному полипептиду, в данном случае к варианту Fc, в котором изолейцин в положении 332 замещается на глутаминовую кислоту.
«Антитело» означает белок, включающий один или несколько полипептидов, в основном, кодированных всеми или частью известных генов иммуноглобулинов. Известные гены иммуноглобулинов, например, у человека включают каппу (κ), лямбду (λ) и генетические локусы тяжелых цепей, которые вместе образуют мириады генов вариабельных участков и также включают гены константных участков: мю (υ), дельта (δ), гамма (γ), сигма (ε) и альфа (α), которые кодируют изотипы IgM, IgD, IgG, IgE и IgA соответственно. Здесь подразумевают, что термин «антитело» включает в себя полноразмерные антитела и фрагменты антител и может относиться к природному антителу из любого организма, сконструированному антителу или рекомбинантному антителу, созданному для экспериментальных, терапевтических или иных целей, как описано ниже. Как известно специалистам, термин «антитело» включает фрагменты антител, такие как Fab, Fab', F(ab')2, Fv, scFv или другие антиген-связывающие частичные последовательности антител, которые или производятся с помощью модификации целых антител или синтезируются de novo с применением технологий рекомбинантных ДНК. Особенно предпочтительными являются полноразмерные антитела, которые включают варианты Fc, как описано здесь. Термин «антитело» включает моноклональные и поликлональные антитела. Антитела могут быть антагонистами, агонистами, нейтрализующими, ингибирующими или стимулирующими антителами.
Антитела настоящего изобретения могут не иметь отношения к человеческим антителам, могут быть химерными, гуманизированными или полностью человеческими. Описание общего представления о химерных или гуманизированных антителах смотрите в работе Clark et al., 2000, см. также ссылки, приведенные там (Clark, 2000, Immunol Today 21:397-402). Химерные антитела включают вариабельный участок антитела, не являющегося антителом человека, например домены VH и VL мышиного или крысиного происхождения, функционально связанные с константной областью человеческого антитела (см, например, U.S. Patent №4816567). В предпочтительном воплощении антитела настоящего изобретения гуманизированы. Термин «гуманизированное» антитело, который здесь используют, означает антитело, включающее каркасную часть (FR) антитела человека и один или более участков, определяющих комплементарность (гипервариабельный участок, CDR), из антитела, не являющегося человеческим (обычно мышиного или крысиного). Антитело, не являющееся человеческим антителом и предоставляющее CDR, называется «донором», а человеческий иммуноглобулин, предоставляющий каркас, называется «акцептором». Гуманизация принципиально зависит от пересадки донорных CDR на акцепторные (человеческие) каркасные участки VL и VH (Winter US 5225539). Эта стратегия обозначается как «пересадка CDR». «Обратная мутация» выбранных аминокислотных остатков акцепторного каркасного участка на соответствующие донорные аминокислотные остатки часто необходима для восстановления аффинности, которая теряется в исходной конструкции при пересадке (US 5530101; US 5585089; US 5693761; US 5693762; US 6180370; US 5859205; US 5821337; US 6054297; US 6407213). Оптимально гуманизированное антитело также будет включать, по меньшей мере, часть константной области иммуноглобулина, обычно принадлежащей иммуноглобулину человека, и, следовательно, будет включать человеческий Fc-фрагмент. Способы гуманизирования антител, не являющихся антителом человека, хорошо известны специалистам и, по существу, могут быть выполнены по методу Уинтера и соавторов (Jones et al., 1986, Nature 321:522-525; Riechmann et al., 1988, Nature 332:323-329; Verhoeyen et al., 1988, Science, 239:1534-1536). Дополнительные примеры гуманизированных мышиных или крысиных моноклональных антител также известны специалистам в этой области, это, например, антитела, связывающие белок С человека (O'Connor et al., 1998, Protein Eng 11:321-8), рецептор интерлейкина-2 (Queen et al., 1989, Proc Natl Acad Sci USA 86:10029-33) и рецептор 2 эпидермального фактора роста человека (Carter et al., 1992, Proc Natl Acad Sci USA 89:4285-9). В альтернативном воплощении антитела настоящего изобретения могут быть полностью человеческими, то есть аминокислотные последовательности антител являются полностью или большей частью человеческими. В этой области техники известны способы создания полностью человеческих антител, включающие применение трансгенных мышей (Bruggemann et al., 1997, Curr Opin Biotechnol 8:455-458) или библиотек человеческих антител, сопряженное со способами селекции (Griffiths et al., 1998, Curr Opin Biotechnol 9:102-108).
В понятие «антитело», в частности, включены агликозилировавнные антитела. Термин «агликозилированное антитело», который используют в тексте, означает антитело, которое лишено углевода, присоединенного в положении 297 фрагмента Fc, где нумерация осуществляется в соответствии с системой индекса EU в базе данных Kabat. Агликозилированное антитело может быть дегликозилированным антителом, то есть антителом, у которого удален Fc-углевод, например, химически или энзиматически. В качестве альтернативы агликозилированное антитело может быть негликозилированным или негликозилируемым антителом, то есть антителом, которое было экспрессировано без углевода Fc, например, в результате мутации одного или нескольких остатков, кодирующих профиль гликозилирования, или в результате экспрессии в организме, который не присоединяет углеводы к белкам, например, в бактериях.
В определение «антитело», в частности, включено полноразмерное антитело, которое включает фрагмент варианта Fc. Под «полноразмерным антителом» здесь подразумевают структуру, которая создает природную биологическую форму антитела, включающую вариабельную и константную области. Например, у большинства млекопитающих, включая людей и мышей, полноразмерное антитело класса IgG является тетрамером и состоит из двух одинаковых пар двух иммуноглобулиновых цепей, каждая пара имеет одну легкую и одну тяжелую цепь, каждая легкая цепь включает иммуноглобулиновые домены VL и CL а каждая тяжелая цепь включает иммуноглобулиновые домены VH, Cγ1, Сγ2 и Сγ3. У некоторых млекопитающих, например у верблюдов и лам, IgG антитела могут включать только две тяжелые цепи, каждая тяжелая цепь включает вариабельный домен, прикрепленный к Fc-фрагменту. Термин «IgG» используют здесь для обозначения полипептида, принадлежащего к классу антител, которые, в основном, кодируются известным геном гамма-иммуноглобулина. У людей этот класс включает IgG1, IgG2, IgG3 и IgG4. У мышей этот класс включает IgG1, IgG2a, IgG2b и IgG3.
Термины «аминокислота» или «идентичность аминокислоты» используют здесь для обозначения одной из 20 встречающихся в природе аминокислот или любых их неприродных аналогов, которые могут присутствовать в специфическом определенном положении. Термин «белок» здесь означает, по меньшей мере, две ковалентно связанные аминокислоты, термин включает в себя белки, полипептиды, олигопептиды и пептиды. Белок может быть составлен из встречающихся в природе аминокислот и пептидных связей или синтетических пептидоподобных структур, то есть «аналогов», например, пептидов (смотри Simon et al., 1992, Proc Natl Acad Sci USA 89(20):9367), в частности, если пациенту вводятся LC-пептиды. Таким образом, термины «аминокислота» или «пептидный остаток» означают здесь как встречающиеся в природе, так и синтетические аминокислоты. Например, в соответствии с целями изобретения аминокислоты гомофенилаланин, цитруллин и норлейцин являются рассматриваемыми аминокислотами. «Аминокислоты» также включают остатки аминокислот, такие как пролин и гидроксипролин. Боковая цепь может быть как в (R) так и в (S) конфигурации. В предпочтительном воплощении аминокислоты находятся в (S) или L-конфигурации. Если используют не встречающиеся в природе боковые цепи, то можно применять неаминокислотные заместители, например, для того, чтобы предупредить или замедлить деградацию in vivo.
Термин «способ вычислительного скрининга» здесь означает любой способ конструирования одной или более мутаций в белке с применением указанного способа для оценки энергии взаимодействий в случае потенциальной замены боковой цепи аминокислоты друг с другом и/или с остальной частью белка. Следует принять во внимание, что оценка энергии взаимодействий, в дальнейшем именуемая расчетом энергии, имеет отношение к некоторым способам оценки одной или нескольких модификаций аминокислот. Указанный способ может включать физические или химические энергетические термины или может включать энергетические термины, основанные на совокупности знаний, статистике, последовательности и тому подобное. Вычисления, которые составляют способ компьютерного скрининга, относятся здесь к «расчетам вычислительного скрининга».
Термин «эффекторная функция» здесь означает биохимическое событие, которое происходит в результате взаимодействия Fc-фрагмента антитела с Fc-рецептором или лигандом. Эффекторные функции включают, но не ограничиваются ADCC, ADCP и CDC. «Эффекторная клетка» здесь означает клетку иммунной системы, которая экспрессирует один или несколько рецепторов Fc и является посредником для одной или нескольких эффекторных функций. Эффекторные клетки включают, но не ограничиваются только ими, моноциты, макрофаги, нейтрофилы, дендритные клетки, эозинофилы, тучные клетки, тромбоциты, В-клетки, большие зернистые лимфоциты, клетки Лангерганса, натуральные клетки-киллеры (NK) и γγ Т-клетки, которые могут происходить из любого организма, включая, но не ограничиваясь людьми, мышами, крысами, кроликами и обезьянами. Термин «библиотека» здесь означает набор вариантов Fc любой формы, включающий, но не ограниченный перечисленными, список последовательностей аминокислот и нуклеиновых кислот и список замен нуклеиновых кислот и аминокислот в различных положениях, физическую библиотеку, включающую нуклеиновые кислоты, которые кодируют библиотеку последовательностей, или физическую библиотеку, включающую вариантные белки Fc, как в очищенном, так и неочищенном виде.
Термины «Fc», «Fc-фрагмент», «Fc-полипептид» и т.д. означают здесь, как описано выше, антитело, которое включает полипептиды, включающие константную область антитела за исключением первого константного участка иммуноглобулинового домена. Таким образом, Fc относится к двум последним константным участкам иммуноглобулиновых доменов IgA, IgD и IgG и к последним трем константным участкам иммуноглобулиновых доменов IgE и IgM и к подвижному N-концевому шарниру этих доменов. Fc IgA и IgM могут включать цепь J. Как показано на фигуре 1 для IgG, Fc включает иммуноглобулиновые домены С-гамма-2 и С-гамма-3 (Cγ2 и Сγ3) и шарнир между С-гамма-1 (Сγ1) и С-гамма-2 (Cγ2). Несмотря на то что поверхности раздела Fc-участка могут различаться, Fc-фрагмент тяжелой цепи человеческого IgG обычно включает остатки С226 или Р230 на С-конце, где нумерация соответствует индексу EU базы данных Kabat. Fc может иметь отношение к этому участку в изолированном виде или к участку в контексте антитела, фрагмента антитела или слитого Fc. Fc может быть антителом, слитым Fc, белком или белковым доменом, включающим Fc. Особенно предпочтительны варианты Fc, которые являются не встречающимися в природе вариантами Fc.
Термин «слитый Fc», который используют в описании, означает белок, в котором один или несколько полипептидов функционально связаны с участком Fc или его производным. Слитый Fc здесь является синонимом терминов «иммуноадгезин», «слитый Ig», «химера Ig» и «рецепторный глобулин», использовавшихся ранее (Chamow et al., 1996, Trends Biotechnol 14:52-60; Ashkenazi et al., 1997 Curr Opin Immunol 9:195-200). Слитый Fc объединяет в себе Fc-фрагмент иммуноглобулина с «партнером по слиянию», который, в основном, может быть любым белком или небольшой молекулой. Роль части слитого Fc, не являющейся Fc-фрагментом, то есть партнера по слиянию, состоит в опосредовании связывания с мишенью, таким образом, партнер по слиянию является функциональным аналогом вариабельных областей антитела. В сущности, любой белок или небольшая молекула могут быть присоединены к Fc для создания слитого Fc. Белковые партнеры по слиянию не ограничиваются данными примерами, но могут включать связывающий участок рецептора-мишени, адгезионную молекулу, лиганд, белок, цитокин, хемокин или какой-либо другой белок или белковый домен. Небольшая молекула в качестве партнера по слиянию может включать любое терапевтическое средство, которое направляет слитый Fc к терапевтической мишени. Такими мишенями могут быть любые молекулы, предпочтительно внеклеточный рецептор, который вовлечен в заболевание. Двумя семействами поверхностных рецепторов, которые являются мишенями для некоторых апробированных низкомолекулярных лекарств, являются G-белок-зависимые рецепторы (GPCR) и ионные каналы, включающие К+-, Na+-, Са+-каналы. В настоящее время приблизительно у 70% всех лекарственных препаратов, продающихся по всему миру, мишенью являются GPCR. Таким образом, варианты Fc настоящего изобретения могут быть слиты с небольшой молекулой, мишенью которой являются, например, один или несколько рецепторов GABA, пуринергические рецепторы, адренергические рецепторы, гистаминэргические рецепторы, опиоидные рецепторы, хемокиновые рецепторы, глутаматные рецепторы, никотиновые рецепторы, 5НТ-(серотониновые) рецепторы и эстрогеновые рецепторы. Партнер по слиянию может быть небольшой молекулой, имитирующей белок, который нацелен на терапевтически полезную мишень. Характерные примеры отдельных лекарственных препаратов, которые могут применяться в качестве партнеров по слиянию с Fc, можно найти в работе L.S. Goodman et al., Eds., Goodman and Oilman's The Pharmacological Basis of Therapeutics (McGraw-Hill, New York, ed. 9, 1996). Партнеры по слиянию включают не только небольшие молекулы и белки, которые связываются с известными мишенями имеющихся лекарственных препаратов, но и орфановые рецепторы, которые пока еще не являются мишенями для лекарственных препаратов. Завершение проектов по расшифровке генома и протеома послужило движущей силой в открытии лекарственных препаратов, и эти проекты привели к открытию орфановых рецепторов. Существует огромный потенциал для признания этих новых молекул мишенями для лекарственных препаратов и для развития терапии белками и небольшими молекулами, которые нацелены на эти рецепторы. Эти терапевтические белки и небольшие молекулы рассматриваются в качестве партнеров для слитых Fc, в которых применяют варианты Fc настоящего изобретения. Множество линкеров, определенных и описанных ниже, может быть использовано для ковалентного присоединения Fc к партнеру по слиянию для создания слитого Fc.
Термины «гамма-рецептор Fc» или «FcγR», которые здесь используют, означают любого представителя семейства белков, которые связывают Fc-фрагмент антитела IgG и которые кодируются, главным образом, генами FcγR. У людей это семейство включает, но не ограничивается только ими, FcγRI (CD64), включающий изоформы FcγRIa, FcγRIb и FcγRIc; FcγRII (CD32), включающий изоформы FcγRIIa (включающий аллотипы H131 и R131), FcγRIIb (включающий FcγRIIb-1 и FcvRIIb-2) и FcγRIIc; и FcγRIII (CD16), включающий изоформы FcγRIIIa (включающий аллотипы V158 и F158), и FcγRIIIb (включающий аллотипы FcγRIIIb-NA1 и FcγRIIIb-NA2) (Jefferis et al., 2002, Immunol Lett 82:57-65), а также любые неисследованные человеческие FcγR или изоформы или аллотипы FcγR. FcγR может происходить из любого организма, включая людей, мышей, крыс, кроликов и обезьян, но не ограничиваясь ими. Мышиные FcγR включают, но не ограничиваются перечисленными, FcγRI (CD64), FcγRII (CD32), FcγRIII (CD16) и FcγRIII-2 (CD16-2), также как и любые невыявленные мышиные FcγR, или изоформы, или аллотипы FcγR.
Термин «лиганд Fc», который здесь используют, означает молекулу, предпочтительно полипептид из любого организма, который связывает Fc-фрагмент антитела с образованием комплекса Fc-лиганд. Лиганды Fc включают, но не ограничиваются только ими, FcγR, FcγRn, C1q, С3, маннан-связывающий лектин, маннозный рецептор, стафилококковый белок А, стрептококковый белок G и вирусный FcγR. Лиганды Fc также включают гомологи рецептора Fc (FcRH), которые относятся к семейству рецепторов Fc, гомологичных FcγR (Davis et al., 2002, Immunological Reviews 190:123-136). Лиганды Fc могут включать невыявленные молекулы, которые связываются c Fc.
Термин «IgG», который здесь используют, означает полипептид, принадлежащий к классу антител, которые, в основном, кодируются известным геном гамма-иммуноглобулина. У людей этот класс включает IgG1, IgG2, IgG3 и IgG4. У мышей этот класс включает IgG1, IgG2a, IgG2b, IgG3. «Иммуноглобулин (Ig)» означает здесь белок, включающий один или несколько полипептидов, в основном, кодируемых генами иммуноглобулинов. Иммуноглобулины включают антитела, но не ограничиваются только ими. Иммуноглобулины могут включать несколько структурных форм, включающих, но не ограниченных ими, полноразмерные антитела, фрагменты антител и отдельные домены иммуноглобулинов. Термин «иммуноглобулиновый (Ig) домен» здесь означает фрагмент иммуноглобулина, который существует как обособленный структурный элемент, как может быть оценено специалистом в области белковой структуры. Ig-домены обычно имеют характерную топологию сворачивания в форме сэндвича. Известными Ig-доменами IgG-класса антител являются VH, Cγ1, Cγ2, Сγ3, VL и CL.
Термины «исходный полипептид» или «полипептид-предшественник» (включающие исходный Fc или его предшественники), которые используют в тексте, означают полипептид, который впоследствии модифицируют для создания варианта. Указанный исходный полипептид может быть полипептидом, встречающимся в природе, или вариантной или сконструированной разновидностью встречающегося в природе полипептида. Исходный полипептид может относиться как к собственно полипептиду, к композиции, которая включает исходный полипептид, или к последовательности аминокислот, которая его кодирует. Соответственно, термин «исходный полипептид Fc», который здесь используют, означает немодифицированный полипептид Fc, который затем модифицируют для создания вариантного антитела.
Как было отмечено выше, определенные положения в молекуле Fc могут быть изменены. Термин «положение», который здесь используют, означает определенное место в последовательности белка. Положения могут быть пронумерованы последовательно или в соответствии с установленным форматом, например, в соответствии с индексом EU в базе данных Kabat. Например, положение 297 - это положение в человеческом антителе IgG1. Соответствующие положения определяют, как описано выше, главным образом, путем выравнивания с другими исходными последовательностями.
Термин «остаток», который здесь используют, означает положение в белке и ассоциированную с ним аминокислотную идентичность. Например, аспарагин-297 (также называемый Asn297, также называемый N297) является остатком антитела IgG1 человека.
Термин «антиген-мишень», который здесь используют, означает молекулу, которая специфически связывается с вариабельной областью определенного антитела. Антиген-мишень может быть белком, углеводом, липидом или другим химическим соединением.
Термин «клетка-мишень», который здесь используют, означает клетку, которая экспрессирует антиген-мишень.
Термин «вариабельная область», который здесь используют, означает часть иммуноглобулина, которая включает один или несколько Ig-доменов, в основном кодируемых любым из Vκ-, Vλ- и/или VH-генов, которые содержат генетические локусы каппа, лямбда и локус тяжелой цепи иммуноглобулина соответственно.
Термин «вариантный полипептид», который здесь используют, означает полипептидную последовательность, которая отличается от исходной полипептидной последовательности из-за, по меньшей мере, одной аминокислотной модификации. Вариантный полипептид может относиться к собственно полипептиду, к композиции, которая включает полипептид, или к последовательности аминокислот, которая его кодирует. Предпочтительно, когда вариантный полипептид имеет, по меньшей мере, одну аминокислотную модификацию по сравнению с исходным полипептидом, например приблизительно от одной до приблизительно десяти аминокислотных модификаций и предпочтительно приблизительно от одной до приблизительно пяти аминокислотных модификаций по сравнению с исходным полипептидом. Последовательность вариантного полипептида здесь предпочтительно имеет, по меньшей мере, 80%-ную гомологию с исходной полипептидной последовательностью, наиболее предпочтительно, по меньшей мере, примерно 90%-ную гомологию, более предпочтительно, по меньшей мере, примерно 95%-ную гомологию. Соответственно, термин «вариант Fc», который здесь используют, обозначает последовательность Fc, которая отличается от исходной полипептидной последовательности Fc из-за, по меньшей мере, одной аминокислотной модификации. Вариант Fc может включать Fc-фрагмент или может существовать в контексте антитела, слитого Fc или другого полипептида, который, по существу, кодируется Fc. Термин «вариант Fc» может относиться к собственно Fc, к композиции, которая включает вариантный полипептид Fc, или к последовательности аминокислот, которая его кодирует. В предпочтительном воплощении вариантные белки изобретения включают вариант Fc, как здесь описано, и также могут включать антитело (и его соответствующие производные) с вариантом Fc или белок, слитый с Fc, который включает вариант Fc. Кроме того, в некоторых случаях Fc является вариантом, если его сравнивают с Fc дикого типа, или «исходным» вариантом.
Для всех положений, обсуждаемых в настоящем изобретении, нумерация тяжелой цепи иммуноглобулина соответствует индексу EU (Kabat et al., 1991, Sequences of Proteins of Immunological Interest, 5th Ed., United States Public Health Service, National Institutes of Health, Bethesda). Выражение «индекс EU в соответствии с базой данных Kabat» относится к нумерации остатков в антителе IgG1 EU человека.
Варианты Fc настоящего изобретения могут быть оптимизированы в отношении множества свойств. Свойства, которые могут быть оптимизированы, включают, но не ограничиваются увеличением или уменьшением аффинности к FcγR. В предпочтительном воплощении варианты Fc настоящего изобретения оптимизированы для того, чтобы увеличить их аффинность к активирующему FcγR человека, предпочтительно к FcγRI, FcγRIIa, FcγRIIc, FcγRIIIa и FcγRIIIb, наиболее предпочтительно к FсγRIIIa. В другом предпочтительном воплощении варианты Fc оптимизированы для того, чтобы снизить их аффинность к ингибирующему рецептору FcγRIIb человека. Ожидается, что эти предпочтительные воплощения обеспечат антитела и слитые Fc с усиленными терапевтическими свойствами для людей, например, с усиленной эффекторной функцией и более высокой противораковой эффективностью. В другом воплощении варианты Fc настоящего изобретения оптимизированы таким образом, что у них понижена или ликвидирована аффинность к FcγR человека, включая, но не ограничиваясь FcγRI, FcγRIIa, FcγRIIb, FcγRIIc, FcγRIIIa и FcγRIIIb. Как ожидается, эти воплощения обеспечат антитела и слитые Fc с усиленными терапевтическими свойствами для людей, например, с пониженной эффекторной функцией и пониженной токсичностью. Предпочтительные воплощения включают оптимизацию связывания Fc с FcγR человека, однако, в альтернативных воплощениях варианты Fc настоящего изобретения обладают увеличенной или пониженной аффинностью к FcγR из организмов, не являющихся человеком, включающих, но не ограниченных мышами, крысами, кроликами и обезьянами. Варианты Fc, у которых оптимизировано связывание с FcγR, не относящимся к человеческим, могут применяться в экспериментах. Например, мышиные модели пригодны для множества болезней и позволяют испытывать свойства, такие как эффективность, токсичность и фармакокинетику определенного кандидата в лекарственное средство. Как известно специалистам, раковые клетки могут быть привиты или введены в мышь для имитации рака у людей, этот процесс известен как ксенотрансплантация. Испытание антител или слитых Fc, которые включают варианты Fc, оптимизированные для одного или нескольких мышиных FcγR, может обеспечивать полезную информацию относительно эффективности антитела или слитого Fc, их механизмов действия и т.п. Варианты Fc настоящего изобретения также могут быть оптимизированы для усиления функциональности и/или повышения растворимости в агликозилированном виде. В предпочтительном воплощении агликозилированные варианты Fc настоящего изобретения связывают лиганд Fc с большей аффинностью, чем агликозилированная форма исходного полипептида Fc. Указанные выше лиганды Fc включают, но не ограничиваются только ими, FcγR, C1q, FcRn и белки А и G, которые могут быть из любого источника, включающего, но не ограниченного человеком, мышью, крысой, кроликом или обезьяной, но предпочтительным источником является человек. В другом предпочтительном воплощении варианты Fc оптимизируют, чтобы они стали более стабильными и/или более растворимыми, чем агликозилированная форма исходного полипептида Fc. Вариант Fc, сконструированный или спрогнозированный в отношении проявления любых упомянутых выше оптимизированных свойств, называется здесь «оптимизированным вариантом Fc».
Варианты Fc настоящего изобретения могут происходить из исходных полипептидов Fc, которые сами могут происходить из большого количества источников. Исходный полипептид Fc может быть кодирован, главным образом, генами Fc из любого организма, включающего, но не ограниченного людьми, мышами, крысами, кроликами, двугорбыми и одногорбыми верблюдами, ламами, обезьянами, предпочтительными организмами являются млекопитающие и наиболее предпочтительными - люди и мыши. В предпочтительном воплощении исходный полипептид Fc входит в состав антитела, называемого исходным антителом. Исходное антитело может быть полностью человеческим, полученным, например, с применением трансгенных мышей (Bruggemann et al., 1997, Curr Opin Biotechnol 8:455-458) или с применением библиотек человеческих антител, сопряженным с методами селекции (Griffiths et al., 1998, Curr Opin Biotechnol 9:102-108). Исходное антитело не обязательно должно быть природного происхождения. Например, исходное антитело может быть сконструированным антителом, включающим, но не ограниченным только ими, химерные антитела и гуманизированные антитела (Clark, 2000, Immunol Today 21:397-402). Исходное антитело может быть сконструированным вариантом антитела, который, по существу, кодируется одним или несколькими генами природных антител. В одном из воплощений аффинность исходного антитела развивалась во времени, что известно в этой области техники. Альтернативно, антитело модифицировали другим способом, как например, описано в заявке USSN 10/339788, поданной 3 марта 2003 года.
Варианты Fc настоящего изобретения могут, по существу, кодироваться генами иммуноглобулинов, принадлежащих к любому из классов антител. В предпочтительном воплощении варианты Fc настоящего изобретения находят свое применение в антителах или слитых Fc, которые включают последовательности, принадлежащие классу антител IgG, включающему IgG1, IgG2, IgG3 или IgG4. В альтернативном воплощении варианты Fc настоящего изобретения находят применение в антителах или слитых Fc, которые включают последовательности, принадлежащие классам антител IgA (включая подклассы IgA1 и IgA2), IgD, IgE, IgG или IgM. Варианты Fc настоящего изобретения могут включать несколько белковых цепей. Поэтому настоящее изобретение может применяться в антителе или слитом Fc, которые являются мономерами или олигомерами, включая гомо- и гетероолигомеры.
В предпочтительном воплощении антитела настоящего изобретения основаны на последовательностях человека, и, таким образом, последовательности антител человека применяют как «основные» последовательности, с которыми сравнивают другие последовательности, такие как крысиные, мышиные и обезьяньи. Для установления гомологии с первичной последовательностью или структурой аминокислотную последовательность предшественника или исходного полипептида Fc прямо сравнивают с последовательностью Fc человека, описанной в тексте. После процедуры выравнивания последовательностей с помощью одной или нескольких программ установления гомологии, известных специалистам в этой области (например, с использованием остатков, консервативных у различных видов), допускающих при необходимости существование вставок и делеций, чтобы сохранить выравнивание (то есть избежать исключения консервативных остатков из-за случайных вставок и делеций), определяют аминокислотные остатки, эквивалентные определенным аминокислотам в первичной последовательности Fc человека. Выравнивание консервативных остатков предпочтительно должно сохранять 100% таких остатков. Однако выравнивание более чем 75% или не менее 50% консервативных остатков также достаточно для определения эквивалентных остатков (иногда называющихся «соответствующими остатками»). Эквивалентные остатки можно также установить с помощью определения гомологии на уровне третичной структуры для полипептида Fc, для которого третичная структура уже установлена. Эквивалентными называют остатки, для которых атомные координаты двух или нескольких атомов основной цепи определенного аминокислотного остатка в исходном полипептиде или предшественнике (N на N, СА на СА, С на С, О на О) при выравнивании находятся в пределах 0,13 нм и предпочтительно в пределах 0,1 нм. Выравнивание достигается после того, как наилучшую модель ориентировали и расположили таким образом, чтобы обеспечить максимальное перекрывание атомных координат, относящихся к атомам белка полипептида Fc, которые не являются атомами водорода.
Варианты Fc настоящего изобретения могут быть скомбинированы с другими модификациями Fc, включающими, но не ограниченными модификациями, которые изменяют эффекторную функцию или взаимодействие с одним или несколькими лигандами Fc. Такое объединение может обеспечить дополнительные, синергические или новые свойства антител или слитых Fc. В одном из воплощений варианты Fc настоящего изобретения могут быть объединены с другими известными вариантами Fc (Duncan et al., 1988, Nature 332:563-564; Lund et al., 1991, J Immunol 147:2657-2662; Lund et al., 1992, Mol Immunol 29:53-59; Alegre et al., 1994, Transplantation 57:1537-1543; Hutchins et al., 1995, Proc Natl Acad Sci USA 92:11980-11984; Jefferis et al., 1995, Immunol Lett 44:111-117; Lund et al., 1995, Faseb J 9:115-119; Jefferis et al., 1996, Immunol Lett 54:101-104; Lund et al., 1996, J Immunol 157:4963-4969; Armour et al., 1999, Eur J Immunol 29:2613-2624; Idusogie et al., 2000, J Immunol 164:4178-4184; Reddy et al., 2000, J Immunol 164:1925-1933; Xu et al., 2000, Cell Immunol 200:16-26; Idusogie et al., 2001, J Immunol 166:2571-2575; Shields et al., 2001, J Biol Chem 276:6591-6604; Jefferis et al., 2002, Immunol Lett 82:57-65; Presta et al., 2002, Biochem Soc Trans 30:487-490; Hinton et al., 2004, J Biol Chem 279:6213-6216) (US 5624821; US 5885573; US 6194551; PCT WO 00/42072; PCT WO 99/58572; US 2004/0002587 A1). В альтернативном воплощении варианты Fc настоящего изобретения включены в антитело или слитый Fc, которые включают одну или несколько сконструированных гликоформ. Термин «сконструированная гликоформа», который здесь используют, означает углеводную композицию, которая ковалентно присоединена к полипептиду Fc, где указанная углеводная композиция отличается химически от той, которая включена в исходный полипептид Fc. Сконструированные гликоформы могут быть полезными для многих целей, включающих, но не ограниченных увеличением или снижением эффекторной функции. Сконструированные гликоформы могут быть созданы с помощью множества способов, известных в этой области техники (Umana et al., 1999, Nat Biotechnol 17:176-180; Davies et al., 2001, Biotechnol Bioeng 74:288-294; Shields et al., 2002, J Biol Chem 277:26733-26740; Shinkawa et al., 2003, J Biol Chem 278:3466-3473); (US 6,602,684; USSN 10/277,370; USSN 10/113,929; PCT WO 00/61739A1; PCT WO 01/29246A1; PCT WO 02/31140A1; PCT WO 02/30954A1); (технология Potelligent™ [Biowa, Inc., Princeton, NJ]; технология конструирования гликозилирования GlycoMAb™ [GLYCART biotechnology AG, Zurich, Switzerland]). Многие из этих методик основаны на регулировании уровня фукозилированных и/или разветвленных олигосахаридов, которые ковалентно присоединены к Fc-фрагменту, например, с помощью экспрессии полипептида Fc в различных организмах или клеточных линиях, сконструированных или сделанных иным способом (например, в клетках Lee-13 СНО или клетках крысиной гибридомы YB2/0), с помощью регулирования белков, вовлеченных в путь гликозилирования (например, FUT8 [α1,6-фукозилтрансфразы] и/или β1-4-N-ацетилглюкозаминилтрансферазы III [GnTIII]) или с помощью модификации углевода(ов) после экспрессии полипептида Fc. Сконструированная гликоформа обычно имеет отношение к различным углеводам или олигосахаридам, поэтому полипептид Fc, например антитело или слитый Fc, могут включать сконструированную гликоформу. Альтернативно, сконструированная гликоформа может иметь отношение к полипептиду Fc, который содержит отличный углевод или олигосахарид. Поэтому объединение вариантов Fc настоящего изобретения с другими модификациями Fc, а также с неизвестными модификациями Fc, предусматривается в целях создания новых антител или слитых Fc с оптимизированными свойствами.
Варианты Fc настоящего изобретения могут найти применение в антителе. Термин «антитело настоящего изобретения», который здесь используют, означает антитело, которое включает вариант Fc настоящего изобретения. В действительности, настоящее изобретение может найти применение в любом белке, который включает Fc, и поэтому применение вариантов Fc настоящего изобретения не ограничено антителами. Варианты Fc настоящего изобретения могут найти применение в слитом Fc. Термин «слитый Fc настоящего изобретения», который здесь используют, относится к слитому Fc, который включает вариант Fc настоящего изобретения. Слитые Fc могут включать вариант Fc настоящего изобретения, функционально связанный с цитокином, растворимым рецепторным доменом, молекулой адгезии, лигандом, ферментом, пептидом или другим белком или белковым доменом, и включает, но не ограничивается слитыми Fc, описанными в патентах US 5,843,725; US 6,018,026; US 6,291,212; US 6,291,646; US 6,300,099; US 6,323,323; PCT WO 00/24782; и в Chamow et al., 1996, Trends Biotechnol 14:52-60; Ashkenazi et al., 1997, Curr Opin Immunol 9:195-200.
Практически любой антиген может являться мишенью для антител и слитых Fc настоящего изобретения, включая, но не ограничиваясь следующим списком белков, субъединиц, доменов, мотивов и эпитопов, принадлежащих следующему перечню белков: CD2, CD3, CD3E, CD4, CD11, CD11a, CD14, CD16, CD18, CD19, CD20, CD22, CD23, CD25, CD28, CD29, CD30, CD32, CD33 (белок р67), CD38, CD40, CD40L, CD52, CD54, CD56, CD80, CD147, GD3, IL-1, IL-1R, IL-2, IL-2R, IL-4, IL-5, IL-6, IL-6R, IL-8, IL-12, IL-15, IL-18, IL-23, интерферон-альфа, интерферон-бета, интерферон-гамма; TNF-alpha, TNF-beta-2, TNF-c, TNF-alphabeta, TNF-RI, TNF-RII, FasL, CD27L, CD30L, 4-1BBL, TRAIL, RANKL, TWEAK, APRIL, BAFF, LIGHT, VEGI, OX40L, TRAIL рецептор-1, A1 аденозиновый рецептор, рецептор лимфотоксина-бета, TACI, BAFF-R, EPO, LFA-3, ICAM-1, ICAM-3, EpCAM, интегрин-бета-1, интегрин-бета-2, интегрин-альфа-4/бета-7, интегрин-альфа-2, интегрин-альфа-3, интегрин-альфа-4, интегрин-альфа-5, интегрин-альфа-6, интегрин-альфа-V, интегрин-альфа-V-бета-3, FGFR-3, фактор роста кератиноцита, VLA-1, VLA-4, L-селектин, анти-Id, Е-селектин, HLA, HLA-DR, CTLA-4, рецептор Т-клеток, В7-1, В7-2, VNR-интегрин, TGF-beta-1, TGF-beta-2, эотаксин-1, BLyS (стимулятор В-лимфоцитов), комплемент С5, IgE, фактор VII, CD64, CBL, NCA 90, EGFR (ErbB-1), Her2/neu (ErbB-2), Her3 (ErbB-3), Her4 (Erb-4), тканевой фактор, VEGF, VEGFR, эндотелиновый рецептор, VLA-4, гаптен NP-cap или NIP-cap, рецептор Т-клеток альфа/бета, Е-селектин, дигоксин, плацентарная щелочная фосфатаза (PLAP) и тестикулярная PLAP-подобная щелочная фосфатаза, трансферриновый рецептор, раково-эмбриональный антиген (СЕА), СЕАСАМ5, HMFG, РЕМ, муцин MUC1, MUC18, гепараназа I, миозин сердца человека, ассоциированный с опухолью гликопротеин-72 (TAG-72), ассоциированный с опухолью антиген СА 125, простатический специфический мембранный антиген (PSMA), высокомолекулярный ассоциированный с меланомой антиген (HMW-MAA), ассоциированный с карциномой антиген, G-копротеин IIb/IIIa (GPIIb/IIIa), ассоциированный с опухолью антиген, экспрессирующий Y-зависимый углевод Lewis, gH гликопротеин оболочки цитомегаловируса человека (HCMV), HIV gp120, HCMV, респираторно-синцитиальный вирус RSV F, RSVF Fgp, интегрин VNR, IL-8, цитокератиновый ассоциированный с опухолью антиген, НерВ gp120, CMV, gpIIbIIIa, петля HIV IIIB gp120 V3, Fgp респираторно-синцитиального вируса (RSV), gD гликопротеин вируса Herpex simplex (HSV), gB гликопротеин HSV, gB гликопротеин оболочки HCMV и токсин Clostridium perfringens.
Специалистам в этой области техники будет понятно, что упомянутый выше список мишеней относится не только к специфическим белкам и биомолекулам, но и к биохимическому пути или путям, которые их включают. Например, ссылка на CTLA-4 в качестве антигена-мишени подразумевает, что лиганды и рецепторы, которые составляют Т-клеточный костимулирующий путь, включающий CTLA-4, В7-1, В7-2, CD28 и другие неизвестные лиганды и рецепторы, которые связывают эти белки, также являются мишенями. Таким образом, термин «мишень», который здесь используют, относится не только к специфическим биомолекулам, но и к ряду белков, которые взаимодействуют с указанной мишенью и участниками биохимического пути, которому принадлежит указанная мишень. Специалисты в этой области техники дополнительно поймут, что любой из указанных выше антигенов-мишеней, лиганды или рецепторы, которые их связывают, или другие участники соответствующего биохимического пути могут быть эффективно присоединены к вариантам Fc настоящего изобретения для создания слитого Fc. Так, например, слитый Fc, который нацелен на EGFR, может быть сконструирован путем функционального связывания варианта Fc с EGF, TGFα или любым другим лигандом, исследованным или неизвестным, который связывается с EGFR. Таким образом, фактически любой полипептид, как то лиганд, рецептор или любой другой белок или белковый домен, включающий, но не ограниченный указанными выше мишенями и белками, которые составляют соответствующие биохимические пути, могут быть функционально связаны с вариантами Fc настоящего изобретения для разработки слитого Fc.
Для некоторых антител и слитых Fc, которые апробированы для применения, проходят клинические испытания или находятся на стадии разработки, могут быть полезны варианты Fc настоящего изобретения. Указанные выше антитела и слитые Fc называются здесь «клиническими продуктами и кандидатами». Таким образом, в предпочтительном воплощении варианты Fc настоящего изобретения могут найти применение в ряде клинических продуктов и кандидатов. Например, для некоторых антител, мишенью которых является CD20, могут быть полезны варианты Fc настоящего изобретения. Например, варианты Fc настоящего изобретения могут найти применение в антителах, которые в значительной степени сходны с ритуксимабом (Rituxan®, IDEC/Genentech/Roche) (смотри, например, US 5,736,137), химерным антителом к CD20, одобренным для лечения неходжкинской лимфомы; HuMax-CD20, антителом к CD20, в настоящее время разрабатываемым компанией Genmab, антителом к CD20, описанным в патенте US 5500362, АМЕ-133 (Applied Molecular Evolution), hA20 (hnmunomedic. Inc.) и HumaLYM (Intracel). Для некоторых антител, мишенью которых являются члены семейства рецепторов эпидермального фактора роста, включающих EGFR (ErbB-1), Her2/neu (ErbB-2), Неr3 (ErbB-3), Неr4 (Erb-4), могут быть полезны варианты Fc настоящего изобретения. Например, варианты Fc настоящего изобретения могут найти применение в антителе, которое в значительной степени сходно с трастузумабом (Herceptin®, Genentech) (смотри, например, US 5677171), гуманизированным антителом к Her2/neu, одобренным для лечения рака молочной железы; пертузумабом (rhuMab-2C4, Omnitarg™), в настоящее время разрабатываемым компанией Genentech; антителом к Нег2, описанным в US 4753894; цетуксимабом (Erbitux®, undone) (US 4943533; PCT WO 96/40210), химерным антителом к EGFR, проходящим клинические испытания для применения при множестве видов рака; ABX-EFG (US 6235883), в настоящее время разрабатываемым компанией Abgenix/hnmunex/Amgen; HuMax-EGFr (USSN 10/172,317), в настоящее время разрабатываемым компанией Genmab; 425, EMD55900, EMD62000 и EMD72000 (Merck KGaA) (US 5558864; Murthy et al., 1987, Arch Biochem Biophys. 252(2):549-60; Rodeck et al, 1987, J Cell Biochem. 35(4):315-20; Kettleborough et al., 1991, Protein Eng. 4(7):773-83); ICR62 (Institute of Cancer Research) (PCT WO 95/20045; Modjtahedi et al., 1993, J Cell Biophys. 1993, 22(1-3):129-46; Modjtahedi et al., 1993, Br J Cancer. 1993, 67(2):247-53; Modjtahedi et al., 1996, BrJ Cancer, 73(2):228-35; Modjtahedi et al., 2003, Int J Cancer, 105(2):273-80); TheraCIM hR3 (YM Biosciences, Canada and Centro de Immunologia Molecular, Cuba (US 5,891,996; US 6,506,883; Mateo et al., 1997, Immunotechnology, 3(1):71-81); моноклональными антителами 806 (Ludwig Institute for Cancer Research, Memorial Sloan-Kettering) (Jungbluth et al., 2003, Proc Natl Acad Sci USA. 100(2):639-44); KSB-102 (KS Biomedix); MR1-1 (IVAX, National Cancer Institute) (PCT WO 0162931A2) и SC100 (Scancell) (PCT WO 01/88138). В другом предпочтительном воплощении варианты Fc настоящего изобретения могут найти применение в алемтузумабе (Campath®, Millenium), гуманизированном моноклональном антителе, в настоящее время одобренном для лечения хронического В-клеточного лимфоцитарного лейкоза. Варианты Fc настоящего изобретения могут найти применение во множестве антител или слитых Fc, которые в значительной степени сходны с другими клиническими продуктами и кандидатами, включающими, но не ограниченными ими, муромонаб-СD3 (Orthoclone ОКТ3®), антитело к CD3, разработанное компанией Ortho Biotech/Johnson & Johnson, ибритумомаб тиуксетан (Zevalin®), антитело к CD20, разработанное компанией IDEC/Schering AG, гемтузумаб озогамицин (Mylotarg®), антитело к CD33 (белок р67), разработанное компанией Celltech/Wyeth, алефасепт (Amevive®), антитело к LFA-3, слитое с Fc, разработанное компанией Biogen, абциксимаб (ReoPro®), разработанный компанией Centocor/Lilly, басиликсимаб (Simultec®), разработанный компанией Novartis, паливизумаб (Sinagis®), разработанный компанией MedImmune, инфликсимаб (Remicade®), антитело к TNF-alpha, разработанное компанией Centocor, адалимумаб (Humira®), антитело к TNF-alpha, разработанное компанией Abbott, Humicade™, антитело к TNF-alpha, разработанное компанией Celltech, этанерцепт (Enbrel®), антитело к TNF-alpha, слитое с Fc, разработанное компанией hnmunex/Amgen, ABX-CBL, антитело к CD147, разрабатываемое компанией Abgenix, ABX-IL8, антитело к IL8, разрабатываемое компанией Abgenix, ABX-MA1, антитело к MUC, разрабатываемое компанией Abgenix, пемтумомаб (R1549,90Y-muHMFG1), антитело к MUC1 разрабатываемое компанией Antisoma, Therex (R1550), антитело к MUC1, разрабатываемое компанией Antisoma, AngioMab (AS1405), разрабатываемый компанией Antisoma, HuBC-1, разрабатываемый компанией Antisoma, Thioplatin (AS1407), разрабатываемый компанией Antisoma, Antegren® (натализумаб), антитело к альфа-4-бета-1 (VLA-4) и альфа-4-бета-7, разрабатываемое компанией Biogen, моноклональные антитела VLA-1, антитело к интегрину VLA-1, разрабатываемое компанией Biogen, моноклональные антитела LTBR, антитело к лимфотоксиновому бета-рецептору (LTBR), разрабатываемое компанией Biogen, CAT-152, антитело к TGFβ2, разрабатываемое компанией Cambridge Antibody Technology, J695, антитело к IL-12, разрабатываемое компанией Cambridge Antibody Technology and Abbott, CAT-192, антитело к TGFβ1, разрабатываемое компанией Cambridge Antibody Technology and Genzyme, CAT-213, антитело к эотаксину-1, разрабатываемое компанией Cambridge Antibody Technology, LymphoStat-B™ анти-Blys антитело, разрабатываемое компанией Cambridge Antibody Technology and Human Genome Sciences Inc., моноклональные антитела TRAIL-R1, антитело к TRAIL-R1, разрабатываемое компанией Cambridge Antibody Technology and Human Genome Sciences me., Avastin™ (бевацизумаб, rhuMAb-VEGF), антитело к VEGF, разрабатываемое компанией Genentech, антитело к семейству рецепторов HER, разрабатываемое компанией Genentech, Anti-Tissue Factor (ATF), антитело к тканевому фактору, разрабатываемое компанией Genentech, Xolair™ (омализумаб), антитело к иммуноглобулинам IgE, разрабатываемое компанией Genentech, Раптива™ (ефализумаб), антитело к CD-11, разрабатываемое компаниями Genentech и Хота, антитело MLN-02 (ранее называвшееся LDP-02), разрабатываемое компаниями Genentech и Millenium Pharmaceuticals, HuMax CD4, антитело к CD4, разрабатываемое компанией Genmab, HuMax-IL15, антитело к IL15, разрабатываемое компаниями Genmab и Amgen, HuMax-Inflam, разрабатываемый компаниями Genmab и Medarex, HuMax-Cancer, антитело к гепараназе I, разрабатываемое компаниями Genmab, Medarex и Oxford GcoSciences, препарат HuMax-Lymphoma, разрабатываемый компаниями Genmab и Amgen, HuMax-TAC, разрабатываемый компанией Genmab, IDEC-131, антитело к CD40L, разрабатываемое компанией IDEC Pharmaceuticals, IDEC-151 (кленоликсимаб), антитело к CD4, разрабатываемое компанией IDEC Pharmaceuticals, IDEC-114, антитело к CD80, разрабатываемое компанией ЮЕС Pharmaceuticals, IDEC-152, антитело к CD23, разрабатываемое компанией ЮЕС Pharmaceuticals, антитела к фактору, ингибирующему миграцию макрофагов (MIF), разрабатываемые компанией ШЕС Pharmaceuticals, BEC2, анти-идиотипическое антитело, разрабатываемое компанией Imclone, IMC-1C11, антитело к KDR, разрабатываемое компанией Imclone, DC 101, антитело к flk-1, разрабатываемое компанией Imclone, антитела к VE-кадгерину, разрабатываемые компанией Imclone, CEA-Cide™ (лабетузумаб), антитело к раково-эмбриональному антигену (СЕА), разрабатываемое компанией Immunomedics, LymphoCide™ (эпратузумаб), антитело к CD22, разрабатываемое компанией Immunomedics, AFP-Cide, разрабатываемый компанией Immunomedics, MyelomaCide, разрабатываемый компанией Immunomedics, LkoCide, разрабатываемый компанией Immunomedics, ProstaCide, разрабатываемый компанией Immunomedics, MDX-010, антитело к CTLA4, разрабатываемое компанией Medarex, MDX-060, антитело к CD30, разрабатываемое компанией Medarex, MDX-070, разрабатываемое компанией Medarex, MDX-018, разрабатываемое компанией Medarex, Osidem™ (IDM-1) и антитело к Нег2, разрабатываемое компаниями Medarex и hnmuno-Designed Moleculas, HuMax™-CD4, антитело к CD-4, разрабатываемое компаниями Medarex и Genmab, HuMax-IL15, антитело к IL15, разрабатываемое компаниями Medarex и Genmab, CNTO 148, анти-TNFα антитело, разрабатываемое компаниями Medarex и Centocor/J&J, CNTO 1275, анти-цитокиновое антитело, разрабатываемое компанией Centocor/J&J, MOR101 и MOR102, антитела к внутриклеточной адгезионной молекуле-1 (ICAM-1) (CD54), разрабатываемые компанией MorphoSys, MOR201, антитело к рецептору 3 фактора роста фибробластов (FGFR-3), разрабатываемое компанией MorphoSys, Nuvion® (висилизумаб), антитело к CD-3, разрабатываемое компанией Protein Design Labs, HuZaF™, антитело к интерферону-гамма, разрабатываемое компанией Protein Design Labs, антитело к интегрину
Применение вариантов Fc в упомянутых выше клинических продуктах и кандидатах, включающих антитела и слитые Fc, не означает, что оно ограничено их точным составом. Варианты Fc настоящего изобретения могут быть включены в вышеупомянутые клинические кандидаты и продукты или в антитела и слитые Fc, которые в значительной степени схожи с ними. Варианты Fc настоящего изобретения могут быть включены в разновидности упомянутых выше клинических кандидатов и продуктов, которые являются гуманизированными, созревшими по аффинности, сконструированными или модифицированными другим способом. Кроме того, для создания нового антитела или слитого Fc, которые включают варианты Fc настоящего изобретения, необязательно применять полипептиды упомянутых выше клинических продуктов и кандидатов целиком; например, можно применять только вариабельную область антитела, являющегося клиническим продуктом или кандидатом, существенно сходную вариабельную область или гуманизированную, созревшую по аффинности, сконструированную или модифицированную разновидности вариабельной области. В другом воплощении варианты Fc настоящего изобретения могут найти применение в антителе или слитом Fc, которые связываются с тем же эпитопом, антигеном, лигандом или рецептором, с которыми связывается один из упомянутых выше клинических продуктов и кандидатов.
Варианты Fc настоящего изобретения могут найти применение в широком диапазоне антител и слитых Fc-продуктов. В одном из воплощений антитело или слитый Fc настоящего изобретения является терапевтическим, диагностическим или исследовательским реагентом, предпочтительно терапевтическим. Альтернативно, антитела и слитые Fc настоящего изобретения могут применяться для сельскохозяйственных или промышленных целей. В альтернативном воплощении варианты Fc настоящего изобретения составляют библиотеку, которая может быть подвергнута экспериментальному скринингу. Эта библиотека может представлять собой список последовательностей нуклеиновых кислот или аминокислот или может быть физическим набором нуклеиновых кислот или полипептидов, которые кодируют библиотеку последовательностей. Варианты Fc могут найти применение в составе антител, которые могут быть моноклональными или поликлональными. Антитела и слитые Fc настоящего изобретения могут быть агонистами, антагонистами, нейтрализующими, ингибирующими или стимулирующими антителами. В предпочтительном воплощении антитела и слитые Fc настоящего изобретения применяют для уничтожения клеток-мишеней, которые несут антиген-мишень, например раковых клеток. В альтернативном воплощении антитела и слитые Fc настоящего изобретения применяют для того, чтобы блокировать антиген-мишень, быть антагонистами или агонистами антигена-мишени, например чтобы быть антагонистами для цитокина или цитокинового рецептора. В другом предпочтительном воплощении антитела и слитые Fc настоящего изобретения применяют для того, чтобы блокировать антиген-мишень, быть антагонистами или агонистами антигена-мишени и чтобы уничтожать клетки-мишени, несущие антиген-мишень.
Варианты Fc настоящего изобретения могут применяться в различных терапевтических целях. В предпочтительном воплощении вариантные белки Fc вводят пациентам для лечения антитело-зависимого расстройства. Термин «пациент» в целях настоящего изобретения включает как людей, так и других животных, предпочтительно млекопитающих и наиболее предпочтительно людей. Таким образом, антитела и слитые Fc настоящего изобретения применяют как при лечении людей, так и в ветеринарии. В предпочтительном воплощении пациент является млекопитающим и в наиболее предпочтительном воплощении пациент является человеком. Термин «лечение» в настоящем изобретении означает как терапевтическое лечение, так и профилактику или меры подавления болезни или расстройства. Так, например, успешное введение антитела или слитого Fc перед приступом болезни приводит к лечению болезни. Другой пример: успешное введение оптимизированного антитела или слитого Fc после клинического проявления заболевания для борьбы с симптомами заболевания включает лечение болезни. «Лечение» также охватывает введение оптимизированного антитела или слитого Fc белка после появления заболевания для ликвидации болезни. Успешное введение средства после начала и развития клинических симптомов с вероятным ослаблением клинических симптомов и, возможно, улучшением состояния пациента включает в себя лечение заболевания. Термин «нуждающийся в лечении» относится как к млекопитающим, у которых уже есть заболевание или расстройство, так и к тем, кто склонен к заболеванию или расстройству, включая тех, у которых болезнь или расстройство должны быть предупреждены. Термины «антитело-зависимое расстройство» или «антитело-чувствительное расстройство», или «состояние», или «заболевание» здесь означают расстройство, которое может быть улучшено введением фармацевтической композиции, включающей антитело или слитый Fc настоящего изобретения. Антитело-зависимые расстройства включают, но не ограничиваются ими, аутоиммунные заболевания, иммунологические заболевания, инфекционные заболевания, воспалительные заболевания, неврологические заболевания, онкологические и неопластические заболевания, включающие рак. Термины «рак» и «раковый» имеют отношение или описывают физиологическое состояние у млекопитающих, которое обычно характеризуют неконтролируемым клеточным ростом. Примеры рака включают, но не ограничиваются ими, карциному, лимфому, бластому, саркому (включающую липосаркому), нейроэндокринные опухоли, мезотелиому, шваному, менингиому, аденокарциному, меланому и лейкоз или лимфоидные злокачественные новообразования. Более детальные примеры таких раковых опухолей включают плоскоклеточный рак (например, плоскоклеточный рак эпителия), рак легких, включающий мелкоклеточный рак легких, немелкоклеточный рак легких, аденокарциному легких и сквамозную карциному легких, рак брюшины, гепатоклеточный рак, рак желудка, включающий рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, цервикальный рак, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак ободочной кишки, рак прямой кишки, колоректальный рак, эндометриальную или маточную карциному, карциному слюнных желез, рак почки, рак простаты, рак вульвы, рак щитовидной железы, печеночную карциному, анальную карциному, карциному пениса, рак яичек, рак пищевода, опухоли желчного пузыря и протоков, а также рак головы и шеи. Кроме этого, варианты Fc настоящего изобретения можно применять для лечения состояний, включающих, но не ограниченных ими, застойную сердечную недостаточность (CHF), васкулит, розецею, акне, экзему, миокардит и другие состояния миокарда, системную красную волчанку, диабет, спондилопатию, синовиальные фибробласты, строму костного мозга; потерю кости; болезнь Пагета, остеокластому; множественную миелому; рак молочной железы; остеопароз; недостаточное питание, периодонтальное заболевание, болезнь Гаучера, гистоцитоз клеток Лангерганса, повреждение спинного мозга, острый септический артрит, остеомаляцию, синдром Кушинга, моноостотическую фиброзную дисплазию, полиостотическую фиброзную дисплазию, периодонтальную реконструкцию и костные трещины; саркоидоз; множественную миелому; остеолитический рак кости, рак молочной железы, рак легких, рак почки и рак прямой кишки; костное метастазирование, боли в костях, гормональную злокачественную гиперкальцемию, анкилозирующий спондилит и другие спондилоартропатии; отторжение трансплантата, вирусные инфекции, гематологическую неоплазию, опухолеподобные состояния, например лимфому Ходжкина (лимфому Беркитта, мелколимфоцитарную лимфому/хронический лимфоцитарный лейкоз, грибовидный микоз, лимфому клеток мантии, фолликулярную лимфому, диффузную В-крупноклеточную лимфому, периферическую лимфому, лейкемию волосяных клеток, лимфоплазмоцитарную лейкемию), опухоли клеток-предшественников лимфоцитов, включающие острый В-клеточный лимфобластный лейкоз/лимфому и острый Т-клеточный лимфобластный лейкоз/лимфому, тимому, опухоли зрелых Т- и NK-клеток, включая периферийные Т-клеточные лейкемии, лейкемию из зрелых Т-клеток/Т-клеточную лимфому и крупногранулярный лимфоцитарный лейкоз, гистоцитоз клеток Лангерганса, миелоидные неоплазии, такие как острые миелогенные лейкозы (AML), включающие AML с признаками созревания, AML без дифференциации, острый промиелоцитарный лейкоз, острый миеломоноцитарный лейкоз и острые моноцитарные лейкозы, синдромы миелодисплазии и хронические миелопролиферативные расстройства, включающие хронический миелогенный лейкоз, опухоли центральной нервной системы, включающие опухоли мозга (глиому, нейробластому, астроцитому, медуллобластому, эпендиому и ретинобластому), солидные опухоли (рак носоглотки, базальную клеточную карциному, рак поджелудочной железы, рак желчного протока, саркому Капоши, рак яичек, рак матки, влагалища или шейки матки, рак яичников, первичный рак печени или эндометриальный рак и опухоли сосудистой системы (ангиосаркому и гемангиоперицитому), остеопорозы, гепатиты, HIV, AIDS, спондилоартриты, ревматические артриты, воспалительные заболевания кишечника (IBD), сепсис или септический шок, болезнь Крона, псориаз, склеродерму, реакция «трансплантат против хозяина» (GVHD), отторжение аллогенного островкового имплантата, гематологические новообразования, такие как множественная миелома (ММ), синдром миелодисплазии (MDS) и острый миелогенный лейкоз (AML), воспаление, сопутствующее опухолям, повреждение периферического нерва или демиелинизирующие заболевания.
В одном из воплощений антитело или слитый Fc настоящего изобретения вводится пациенту с заболеванием, включающим неправильную экспрессию белка. В рамках настоящего изобретения это означает включение заболеваний и расстройств, характеризующихся наличием аберрантных белков, например, из-за изменений количества присутствующего белка, наличием мутантного белка или обоих этих условий. Избыток может быть вызван любой причиной, включающей, но не ограниченной избыточной экспрессией на молекулярном уровне, эффектом пролонгированного или аккумулированного присутствия в месте действия или увеличенной активностью белка по сравнению с нормой. В это определение включены заболевания и расстройства, характеризующиеся снижением белка. Это снижение может быть вызвано любой причиной, включающей, но не ограниченной пониженной экспрессией на молекулярном уровне, сокращенным или пониженным присутствием в месте действия, мутантной формой белка или понижением активности белка по сравнению с нормой. Такой избыток или снижение уровня белка могут быть измерены в сравнении с нормальной экспрессией по присутствию или активности белка, и упомянутое выше измерение может играть важную роль в разработке и/или клинических испытаниях антител и слитых Fc настоящего изобретения.
В одном воплощении антитело или слитый Fc настоящего изобретения является единственным терапевтически активным средством, вводимым пациенту. Альтернативно, антитело или слитый Fc настоящего изобретения вводят в сочетании с одним или несколькими терапевтическими средствами, включающими, но не ограниченными ими, цитотоксические средства, химиотерапевтические средства, цитокины, средства, ингибирующие рост, антигормональные средства, ингибиторы киназ, антиангиогенные средства, кардиопротекторы или другие терапевтические средства. Такие молекулы подходящим образом представлены в комбинации в количествах, которые эффективны для намеченных целей. Опытный практик в области медицины может эмпирически установить подходящую дозу или дозы других, пригодных здесь, терапевтических средств. Антитела и слитые Fc настоящего изобретения могут быть введены в сочетании с одним или несколькими другими терапевтическими режимами. Например, антитело или слитый Fc настоящего изобретения могут быть введены пациенту вместе с химиотерапией, радиотерапией или одновременно вместе с химиотерапией и радиотерапией. В одном из воплощений антитело и слитый Fc настоящего изобретения могут быть введены в сочетании с одним или несколькими антителами или слитыми Fc, которые могут содержать или не содержать вариант Fc настоящего изобретения.
В одном воплощении антитела и слитые Fc настоящего изобретения вводят вместе с химиотерапевтическим средством. Термин «химиотерапевтическое средство», который здесь используют, означает химическое соединение, пригодное для лечения рака. Примеры химиотерапевтических средств включают, но не ограничиваются ими, алкилирующие средства, такие как тио-ТЭФ и циклофосфамид (CYTOXAN™); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включающие альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилолмеламин; азотистые производные иприта, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлорэтамин, мехлорэтаминоксид гидрохлорид, мелфалан, новембипин, фенестерин, преднимустин, трофосфамид, производное урацила и азотистого иприта; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, такие как аклациномицины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, калихеамипин, карабицин, каминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин, эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин, 5-FU; андрогены, такие как калюстерон, дромостанолон пропионат, эпитиостанол, мепитиостан, тестолактон; антиадренэргические средства, такие как аминоглутетимид, митотан, трилостан; восполнители фолиевой кислоты, такие как фролиновая кислота; ацеглатон; гликозид алдофосфамида; аминолевулиновую кислоту; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демецоклцин; диазиквон; эльформитин; эллиптиния ацетат; этоглюцид; нитрат галлия; гидроксимочевину; лентинан; лонидамин; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; подофиллиновую кислоту; 2-этилгидразид; прокарбазин; PSK®; разоксан; сизофуран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2"-трихлортриэтиламин; уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ara-С»); пиклофосфамид; тио-ТЭФ; таксаны, например паклитаксел (TAXOL®, Bristol-Myers Squibb Oncology, Princeton, N.J.) и доцетаксел (TAXOTERE®, Rhne-Poulenc Rorer, Antony, France); хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платину; этопозид (VP-16); ифосфамид; митомицин С; митоксантрон; винкристин; винорелбин; навельбин; новантрон; тенипозид; дауномицин; аминоптерин; кселоду; ибандронат; СРТ-11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноевую кислоту; эсперамицины; капецитабин; ингибитор тимидилатсинтазы (такой как Томудекс); ингибиторы сох-2, такие как целикоксиб (CELEBREX®) и МК-0966 (VIOXX®); и фармацевтически приемлемые соли, кислоты или производные любого из вышеперечисленных веществ. В это определение также включены антигормональные средства, которые влияют на регулирование и ингибирование действия гормонов на опухоли, сюда относят антиэстрогены, включающие, например, тамоксифен, ралоксифен, 4(5)-имидазолы, ингибирующие ароматазу, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY 117018, онапристон и торемифен (Фарестон); антиандрогены, такие как флутамид, нилутамид, бикалютамид, леупролид, госерелин; и фармацевтически приемлемые соли, кислоты или производные любого из вышеперечисленных веществ.
Химиотерапевтическое или другое цитотоксическое средство может быть введено как пролекарственное средство. Термин «пролекарственное средство», который здесь используют, означает предшественника или производную форму фармацевтически активного вещества, которое менее цитотоксично для клеток опухоли по сравнению с исходным лекарственным средством, и оно способно к энзиматической активации или превращению в более активную исходную форму. Смотрите, например, Wilman, 1986, Biochemical Society Transaction, 615th Meeting Belfast, 14:375-382; and Stella et al., "Prodrugs: A Chemical Approach to Targeted Drug Delivery", Directed Drug Delivery, Borchardt et al., (ed.): 247-267, Humana Press, 1985. Пролекарства, которые могут найти применение в настоящем изобретении, включают, но не ограничиваются ими, фосфатсодержащие пролекарства, тиофосфатсодержащие пролекарства, сульфатсодержащие пролекарства, пептидсодержащие пролекарства, пролекарства с модифицированной D-аминокислотой, гликозилированные пролекарства, бета-лактамсодержащие пролекарства, факультативно замещенные феноксиацетамидсодержащие пролекарства или факультативно замещенные фениладетамид-содержащие пролекарства; 5-фторцитозин и другие 5-фторуридин-пролекарства, которые могут быть превращены в более активную, цитотоксичную свободную форму лекарства. Примеры цитотоксичных лекарств, которые могут быть производными пролекарственной формы для применения с антителами и слитыми Fc настоящего изобретения, включают, но не ограничиваются любыми из вышеупомянутых химиотерапевтических агентов.
Применение антител и слитых Fc настоящего изобретения может быть скомбинировано с другими терапевтическими режимами. Например, в одном из воплощений пациент, подвергающийся действию антитела или слитого Fc, может также принимать радиационную терапию. Радиационная терапия может быть проведена в соответствии с протоколами, обычно применявшимися специалистами в этой области. Такая терапия включает радиоактивный цезий, иридий, йод или кобальт, но не ограничивается только ими. Радиационная терапия может включать облучение всего тела или может быть локально направлена на специфическое место или ткань, во внутреннюю часть или на поверхности тела, такие как легкие, мочевой пузырь или простата. Обычно радиационную терапию принимают периодически в течение приблизительно 1-2 недель. Однако радиационную терапию можно принимать и более длительный период времени. Например, пациенты с раком головы или шеи могут принимать радиационную терапию приблизительно 6-7 недель. По усмотрению радиационную терапию можно принимать или в виде единичной дозы, или в виде многократных последовательных доз. Квалифицированные врачи-профессионалы могут эмпирически определить подходящую дозу или дозы радиационной терапии, полезной в этом случае. В соответствии с другим воплощением изобретения для обработки раковых клеток ex vivo применяют антитело или слитый Fc настоящего изобретения и один или несколько видов противораковой терапии.
Полагают, что такое воздействие ex vivo может быть полезным при трансплантации костного мозга и, в особенности, при трансплантации собственного костного мозга. Например, воздействие на клетки или ткань (ткани), содержащие раковые клетки, с помощью антитела или слитого Fc и одного или нескольких видов противораковой терапии, описанных выше, можно применять для уменьшения или для значительного уменьшения количества раковых клеток перед трансплантацией в пациента-реципиента. Конечно же, полагают, что антитела и слитые Fc настоящего изобретения можно применять еще и в комбинации с другими техническими приемами, такими как хирургия.
В одном из альтернативных воплощений антитела и слитые Fc настоящего изобретения вводят вместе с цитокином. Термин «цитокин», используемый здесь, означает родовое понятие для белков, высвобождаемых одной клеточной популяцией, которые действуют на другие клетки как межклеточные медиаторы. Примерами таких цитокинов являются лимфокины, монокины и традиционные пептидные гормоны. К цитокинам относятся гормон роста, например гормон роста человека, N-метионильный гормон роста человека и бычий гормон роста; паратгормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, например фоликулстимулирующий гормон (FSH), тироидстимулирующий гормон (TSH) и лютеинизирующий гормон (LH); печеночный фактор роста; фактор роста фибробластов; пролактин; плацентарный лактоген; фактор некроза опухолей-альфа и -бета; Мюллерова ингибирующая субстанция; мышиный гонадотропин-ассоциированный пептид; ингибин; активин; эндотелиальный фактор роста; интегрин; тромбопоэтин (ТРО), факторы роста нервов, например NGF-beta; фактор роста тромбоцитов; трансформирующие факторы роста (TGFs), например TGF-alpha и TGF-beta; инсулиноподобный фактор роста I и II; эритропоэтин (ЕРО); остеоиндуктивные факторы; интерфероны, например интерферон-альфа, -бета и -гамма; колониестимулирующие факторы (CSFs), например макрофаг-колониестимулирующий фактор (M-CSF), гранулоцит-макрофаг-колониестимулирующий фактор (GM-CSF) и гранулоцит-колониестимулирующий фактор (G-CSF); интерлейкины (ILs), например IL-1, IL-lalpha, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12; IL-15, фактор некроза опухолей, например TNF-alpha или TNF-beta; и другие полипептидные факторы, включающие LIF и лиганд Kit (KL). Используемый здесь термин «цитокин» включает белки из природных источников или из рекомбинантных клеточных культур и биологически активные эквиваленты цитокинов с природными последовательностями.
Для введения вместе с антителами и слитыми Fc настоящего изобретения могут найти применение множество других терапевтических средств. В одном из воплощений антитело и слитый Fc вводят вместе с антиангиогенным средством. Термин «антиангиогенное средство», который здесь используют, означает соединение, которое блокирует или в некоторой степени мешает развитию кровяных сосудов. Антиангиогенное средство, например, может быть небольшой молекулой или белком, например антителом, слитым Fc или цитокином, которые связываются с фактором роста или рецептором фактора роста, вовлеченными в стимуляцию ангиогенеза. Предпочтительным антиангиогенным средством настоящего изобретения является антитело, которое связывается с сосудисто-эндотелиальным фактором роста (VEGF). В другом воплощении антитело или слитый Fc вводятся вместе с терапевтическим средством, которое включает или усиливает адаптивный иммунный ответ, например с антителом, мишенью которого является CTLA-4. В другом воплощении антитело или слитый Fc вводится вместе с ингибитором тирозинкиназы. Термин «ингибитор тирозинкиназы», который здесь используют, означает молекулу, которая до некоторой степени ингибирует тирозинкиназную активность тирозинкиназы. Примеры таких ингибиторов включают, но не ограничиваются ими, хиназолины, такие как PD 153035,4-(-3-хлоранилино)хиназолин; пиридопиримидины; пирролопиримидины, такие как CGP59326, CGP60261 и CGP 62706; пиразолопиримидины, 4-(фениламино)-7Н-пирроло(2,3-с1)пиримидины; куркумин (диферулоилметан, 4,5-бис(4-фторанилино)фталимид); тирфостины, содержащие нитротиофеновые компоненты; PD-0183805 (Wartner-Lambert); антисмысловые молекулы (например, те, которые связываются с нуклеиновой кислотой, кодирующей ErbB); хиноксалины (US 5,804,396); трифостины (US 5,804,396); ZD6474 (Astra Zeneca); PTK-787 (Novartis/Schering AG); ингибиторы pan-ErbB, такие как С 1-1033 (Pfizer); аффинитак (ISIS 3521; Isis/Lilly); иматинибмезилат (STI571, Gleevec®; Novards); PKI 166 (Novartis); GW2016 (Glaxo SmithKline); C1-1033 (Pfizer); EKB-569 (Wyeth); семаксиниб (Sugen); ZD6474 (AstraZeneca); PTK-787 (Novartis/Schering AG); INC-1C11 (Imclone), или те, которые описаны в любой из следующих патентных публикаций: US 5,804,396; РСТ WO 99/09016 (American Cyanamid); PCT WO 98/43960 (American Cyanamid); РСТ WO 97/38983 (Warner-Lambert); РСТ WO 99/06378 (Warner-Lambert); РСТ WO 99/06396 (Warner-Lambert); РСТ WO 96/30347 (Pfizer, Inc); РСТ WO 96/33978 (AstraZeneca); РСТ WO 96/3397 (AstraZeneca); РСТ WO 96/33980 (AstraZeneca), гефитиниб (IRESSA™, ZD1839. AstraZeneca) и OSI-774 (Tarceva™, OSI Pharmaceuticals/Genentech).
Для создания слитых Fc (смотри определение выше) или конъюгатов с антителом или слитым Fc (смотри определение ниже) в настоящем изобретении могут найти применение разнообразные линкеры. Термины «линкер», «линкерная последовательность», «спэйсер», «соединяющая последовательность» или их грамматические эквиваленты здесь означают молекулу или группу молекул (мономер или полимер), которые соединяют две молекулы и часто служат для фиксации двух молекул в предпочтительной конфигурации. Для ковалентного соединения молекул может быть использовано несколько стратегий. Они включают, но не ограничиваются только ими, полипептидные связи между N- и С-концами белков или белковых доменов, соединение с помощью дисульфидных связей и соединение с помощью химических межмолекулярных сшивающих реагентов. В одном аспекте этого изобретения линкер является пептидной связью, созданной с помощью рекомбинантной техники или пептидного синтеза. Выбор подходящего линкера для каждого специального случая, когда две полипептидные цепи должны быть соединены, зависит от различных параметров, включающих, но не ограниченных только ими, природу двух полипептидных цепей (например, являются ли они природными олигомерами), расстояние между N- и С-концами, которые должны быть соединены, если оно известно, и/или устойчивость линкера к протеолизу и окислению. Кроме того, линкер может включать аминокислотные остатки, которые обеспечивают гибкость. Таким образом, линкерный пептид может преимущественно включать следующие аминокислотные остатки: Gly, Ser, Ala или Thr. Линкерный пептид должен иметь длину, достаточную для соединения двух молекул таким образом, чтобы они принимали правильную конформацию относительно друг друга и чтобы они сохраняли желаемую активность. Подходящая для этой цели длина включает, по меньшей мере, один и не более 30 аминокислотных остатков. Предпочтительно линкер включает по длине приблизительно от 1 до 30 аминокислот с предпочтительными линкерами из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 и 20 аминокислот по длине. Кроме того, аминокислотные остатки, выбранные для включения в линкерный пептид, должны проявлять свойства, которые не влияют существенным образом на активность полипептида. Таким образом, линкерный пептид, в целом, не должен иметь заряд, который может быть несовместим с активностью полипептида или может мешать внутреннему сворачиванию, или формированию связей, или другим взаимодействиям с аминокислотными остатками в одном или нескольких мономерах, которые могут серьезно затруднять связывание рецепторных мономерных доменов. Полезные линкеры включают глицин-сериновые полимеры (включающие, например, (GS)n, (GSGGS)n (SEQ ID NO:6) и (GGGGS)n (SEQ ID NO:7) и (GGGS)n (SEQ ID NO:8), где n - целое число, как минимум единица), глицин-аланиновые полимеры, аланин-сериновые полимеры и другие гибкие линкеры, такие как связка для колеблющегося калиевого канала, и большое разнообразие других гибких линкеров, как будет понятно специалистам в этой области техники. Предпочтение отдается глицин-сериновым полимерам, так как обе эти аминокислоты относительно неструктурированны и, таким образом, могут служить в качестве нейтральной связки между компонентами. Во-вторых, серин гидрофилен и поэтому способен делать растворимой глициновую цепь, которая могла бы свернуться в глобулу. В-третьих, показано, что подобные цепи эффективны в связывании субъединиц рекомбинантных белков, таких как одноцепочечные антитела. Подходящие линкеры также могут быть идентифицированы с помощью скрининга баз данных известных трехмерных структур для поиска встречающихся в природе мотивов, которые могут служить мостиком между двумя полипептидными цепями. В предпочтительном воплощении линкер не является иммуногенным, когда его вводят пациенту-человеку. Таким образом, линкеры можно выбирать так, чтобы они обладали низкой иммуногенностью или предположительно имели низкую иммуногенность. Например, можно выбрать линкер, существующий в природе у человека. В предпочтительном воплощении линкер имеет последовательность шарнирного участка антитела, которая является последовательностью, связывающей Fab- и Fc-фрагменты антитела; альтернативно, линкер имеет последовательность, которая включает часть шарнирного участка, или последовательность, которая в значительной степени похожа на шарнирный участок антитела. Другой путь получения подходящего линкера - это оптимизация простого линкера, например (Gly4Ser)n, с помощью случайного мутагенеза. Альтернативно, после того как подходящий полипептидный линкер определен, можно создать дополнительные линкерные полипептиды, чтобы выбрать аминокислоты, которые наиболее оптимально взаимодействуют со связываемыми доменами. Другие типы линкеров, которые можно применить в настоящем изобретении, включают искусственные полипептидные линкеры и интегрины. В другом воплощении дисульфидные связи сконструированы таким образом, что соединяют две молекулы. В другом воплощении линкеры являются химическими межмолекулярными сшивающими агентами. Например, можно применять разнообразные бифункциональные агенты, связывающие белок, включающие, но не ограниченные только ими, N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)пиклогексан-1-карбоксилат, иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат солянокислый), активные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидо соединения (такие как бис-(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-бензоилдиазоний)-этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин с рицином может быть получен, как описано в работе Vitetta et al., 1971, Science 238:1098. Химические линкеры делают возможным хелатирование изотопа. Например, меченная углеродом-14 1-изотиоцианатбензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) является типичным примером хелатирующего агента для конъюгации радионуклеотида с антителом (смотри РСТ WO 94/11026). Линкер может быть способен к расщеплению, тем самым облегчая освобождение цитотоксичного лекарства в клетке. Например, можно применять кислотолабильный линкер, линкер, чувствительный к пептидазе, диметильный линкер или дисульфид-содержащий линкер (Chari et al., 1992, Cancer Research 52: 127-131). Альтернативно, множество небелковых полимеров, включающих, но не ограниченных только ими, полиэтиленгликоль (PEG), полипропиленгликоль, полиоксиалкилены или сополимеры полиэтиленгликоля и полипропиленгликоля, могут найти применение в качестве линкеров, которые, в свою очередь, могут найти применение для сшивания Fc вариантов настоящего изобретения с партнерами по слиянию для создания слитых Fc или для соединения антител и слитых Fc настоящего изобретения в конъюгаты.
В одном из воплощений антитело и слитый Fc настоящего изобретения конъюгированы или функционально связаны с другим терапевтическим средством, называемым здесь «конъюгатом». Конъюгат может быть цитотоксичным агентом, химиотерапевтическим агентом, цитокином, антиангиогенными средствами, ингибитором тирозинкиназы, токсином, радиоизотопом или другим терапевтически активным средством. Химиотерапевтические агенты, цитокины, антиангиогенные средства, ингибиторы тирозинкиназы и другие терапевтические средства описаны выше, и все эти упомянутые терапевтические средства могут найти применение в качестве конъюгатов с антителами или слитыми Fc. В альтернативном воплощении антитело или слитый Fc конъюгированы или функционально связаны с токсином, включающим, но не ограниченным только ими, небольшие молекулы токсинов и энзиматически активные токсины бактериального, грибкового, растительного или животного происхождения, включая их фрагменты и/или варианты. Небольшие молекулы токсинов включают, но не ограничиваются ими, калихеамицин, мэйтансин (US 5208020), трихотен и СС1065. В одном из воплощений изобретения антитело или слитый Fc конъюгированы с одной или несколькими молекулами мэйтансина (например, приблизительно от 1 до приблизительно 10 молекул мэйтансина на молекулу антитела). Мэйтансин может, например, быть превращен в May-SS-Me, который может восстанавливаться до May-SH3 и реагировать с модифицированным антителом или слитым Fc (Chari et al., 1992, Cancer Research 52: 127-131) для создания конъюгата «мэйтансиноид-антитело» или «мэйтансиноид-слитый Fc». Другой интересующий нас конъюгат включает антитело или слитый Fc, конъюгированный с одной или несколькими молекулами калихеамицина. Калихеамициновое семейство антибиотиков способно продуцировать разрывы двуспиральной ДНК в концентрациях ниже пикомолярных. Структурные аналоги калихеамицина, которые можно применить, включают, но не ограничиваются ими, γ11, α21, α3, N-ацетил-γ11, PSAG и θ11 (Hinman et al., 1993, Cancer Research 53:3336-3342; Lode et al., 1998, Cancer Research 58:2925-2928) (US 5714586; US 5712347; US 5264586; US 5773001). Аналоги доластатина 10, такие как ауристатин Е (АЕ) и монометилауристатин Е (ММАЕ) могут найти применение в качестве конъюгатов с вариантами Fc настоящего изобретения (Doronina et al., 2003, Nat Biotechnol 21(7):778-84; Francisco et al., 2003 Blood 102(4); 1458-65). Полезные энзиматически активные токсины включают, но не ограничиваются ими, цепь А дифтерийного токсина, не связывающиеся активные фрагменты дифтерийного токсина, цепь А экзотоксина (из Pseudomonas aerugimsa), цепь А рицина, цепь А абрина, цепь А модецина, альфа-сарцин, белки из Aleurites fordii, белки диантина, белки из Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор из Momordica charantia, курцин, кротин, ингибитор из Saponaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трихотецены (смотрите, например, РСТ WO 93/21232). В настоящем изобретении, кроме того, рассматривается конъюгат или слитый белок, образующийся из антитела или слитого Fc настоящего изобретения и соединения с нуклеолитической активностью, например рибонуклеазы или ДНК-эндонуклеазы, такой как дезоксирибонуклеаза (Dnase).
В другом воплощении антитело или слитый Fc настоящего изобретения может быть конъюгирован или эффективно присоединен к радиоизотопу для формирования радиоконъюгата. Для получения радиоконъюгатов антител и слитых Fc имеется множество радиоактивных изотопов. Примеры включают, но не ограничиваются ими, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32 и радиоактивные изотопы Lu.
В еще одном воплощении антитело и слитый Fc настоящего изобретения могут быть конъюгированы с «рецептором» (таким как стрептавидин) при использовании для предварительного мечения опухолей, когда пациенту вначале вводят конъюгат «антитело-рецептор» или «слитый Fc-рецептор» и затем удаляют несвязавшийся конъюгат из крови с помощью очищающего средства, а затем вводят «лиганд» (например, авидин), который конъюгирован с цитотоксичным средством (например, радионуклидом). В альтернативном воплощении антитело или слитый Fc конъюгированы или функционально связаны с ферментом для того, чтобы применить зависимую от антитела опосредованную ферментами терапию предшественниками лекарственных средств (Antibody Dependent Enzyme Mediated Prodrug Therapy или ADEPT). ADEPT можно применять с помощью конъюгации или функционального связывания антитела или слитого Fc к ферменту, активирующему предшественник лекарственного средства, который превращает предшественник лекарственного средства (например, пептидилхимиотерапевтическое средство, смотри РСТ WO 81/01145) в активное противораковое лекарственное средство (смотри, например, РСТ WO 88/07378 и US 4975278). Ферментный компонент иммуноконъюгата, полезный для ADEPT, включает любой фермент, способный влиять на пролекарственное средство таким образом, чтобы превратить его в более активную цитотоксичную форму. Ферменты, которые полезны в способе этого изобретения, включают, но не ограничиваются ими, щелочную фосфатазу, применяемую для превращения фосфат-содержащих пролекарственных средств в свободные лекарственные средства; арилсульфатазу, применяемую для превращения сульфатсодержащих пролекарственные средства в свободные лекарственные средства; цитозиндезаминазу, применяемую для превращения нетоксичного 5-фторпитозина в противораковое лекарственное средство, 5-фторурацил; протеазы, такие как протеаза Serratia, термолизин, субтилизин, карбоксипептидазы и катепсины (такие как катепсины В и L), которые полезны при превращении пептид-содержащих предшественников лекарственных средств в свободные лекарственные средства; D-аланилкарбоксипептидазы, полезные при превращении предшественников лекарственных средств, содержащих D-аминокислотные заместители; углевод-расщепляющие ферменты, такие как бета-галактозидаза и нейраминидаза, полезные при превращении гликозилированных продуктов в свободные лекарственные средства; бета-лактамазу, полезную при превращении производных лекарственных средств, содержащих альфа-лактамы, в свободные лекарственные формы; и пенициллинамидазы, такие как амидаза пенициллина V или амидаза пенициллина G, полезные при превращении в свободные лекарства производных лекарственных средств, у которых феноксиацетильная или фенилацетильная группы присоединены по атомам азота в аминах соответственно. Альтернативно, антитела с ферментативной активностью, также известные специалистам как «абзимы», могут быть использованы для превращения пролекарственных средств изобретения в свободные активные лекарственные средства (смотри, например, Massey, 1987, Nature 328: 457-458). Для доставки абзима к популяции опухолевых клеток могут быть приготовлены конъюгаты «антитело-абзим» и «слитый Fc-абзим».
Здесь предусмотрены другие модификации антител и слитых Fc настоящего изобретения. Например, антитело или слитый Fc могут быть присоединены к одному из множества небелковых полимеров, например к полиэтиленгликолю (PEG), полипропиленгликолю, полиоксиалкиленам или сополимерам полиэтиленгликоля и полипропиленгликоля.
Здесь предусмотрены фармацевтические композиции, рецептура которых включает антитело или слитый Fc настоящего изобретения и одно или несколько терапевтически активных средств. Композиции, включающие антитела и слитые Fc настоящего изобретения, приготавливают для хранения путем смешивания указанного антитела или слитого Fc, имеющих желаемую степень чистоты, с дополнительными фармацевтически приемлемыми носителями, наполнителями или стабилизаторами (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed., 1980) в виде лиофилизированных составов или водных растворов. Приемлемые носители, наполнители или стабилизаторы в применяемых дозировках и концентрациях не токсичны по отношению к реципиентам и включают буферы, такие как фосфорная, лимонная, уксусная и другие органические кислоты; антиоксиданты, включающие аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмонийхлорид; хлорид гексония; хлорид бензалкония, хлорид бензетония; фенол, бутиловый или бензиновый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцин; пиклогексанол; 3-пентанол и м-крезол); низкомолекулярные (менее чем приблизительно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие средства, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; заменители сахара и другие вкусовые средства; наполнители, такие как микрокристаллическая целлюлоза, лактоза, кукурузный и другие крахмалы; связывающие средства; добавки; красящие средства; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок) и/или неионные поверхностно-активные вещества, такие как TWEEN™, PLURONIC™ или полиэтиленгликоль (PEG). В предпочтительном воплощении фармацевтическая композиция, которая включает антитело и слитый Fc настоящего изобретения, находится в водорастворимой форме, а также вместе с фармацевтически приемлемыми солями, которые, как предполагают, включают и кислотно-кислые, и основно-аддитивные соли. «Фармацевтически приемлемые кислотно-аддитивные соли» относятся к тем солям, которые сохраняют биологическую эффективность свободных оснований и которые не представляют собой соединения, нежелательные в биологическом или каком-то другом смысле, образованные неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., а также органическими кислотами, такими как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, виннокаменная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфокислота, салициловая кислота и т.п. «Фармацевтически приемлемые основно-аддитивные соли» включают соли неорганических оснований, такие как натриевые, калиевые, литиевые, аммониевые, кальциевые, магниевые, железные, цинковые, медные, марганцевые, алюминиевые соли и т.п. Особенно предпочтительны аммониевые, калиевые, натриевые, кальциевые и марганцевые соли. Соли фармацевтически приемлемых органических нетоксичных оснований включают соли первичных, вторичных и третичных аминов, замещенных аминов, включая замещенные амины, встречающиеся в природе, циклических аминов и основных ионообменных смол, таких как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин и этаноламин. Композиции, применяемые для введения in vivo, предпочтительно являются стерильными. Это легко сделать с помощью фильтрации через стерильные фильтрационные мембраны или другими способами.
Антитела и слитые Fc, подробно описанные здесь, могут также находиться в составе иммунолипосом. Липосома представляет собой небольшую частицу, включающую различные типы липидов, фосфолипидов и/или поверхностно-активных веществ, которую применяют для доставки терапевтического средства млекопитающему. Липосомы, включающие антитело или слитый Fc, приготовлены способами, известными специалистам, такими как описаны в работе Epstein et al., 1985, Proc Natl Acad Sciu USA, 82:3688; Hwang et al., 1980, Proc Natl Acad Sciu USA, 77:4030; US 4485045; US 4544545; и РСТ WO 97/38731. Липосомы с увеличенным временем циркуляции раскрыты в патенте US 5013556. Компоненты липосомы обычно организованы в бислой, сходный с организацией липидов в биологических мембранах. Особенно полезные липосомы могут быть созданы с помощью обратнофазного выпаривания при использовании липидной композиции, включающей фосфатидилхолин, холестерин и PEG-производное фосфатидилэтаноламина (PEG-PE). Липосомы экструдируют через фильтры с порами определенного размера для получения липосом нужного диаметра. Внутри липосомы может дополнительно содержаться химиотерапевтическое средство или другое терапевтически активное средство (Gabizon et al., 1989, J National Cancer Inst 81:1484).
Антитела, слитые Fc и другие терапевтически активные средства могут также быть помещены в микрокапсулы, приготовленные способами, включающими, но не ограниченными ими, технику коацервации, межфазовую полимеризацию (например, с использованием гидроксиметилцеллюлозы или желатиновых микрокапсул, или капсул из поли-(метилметацилата), коллоидную систему доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокалсулы) и макроэмульсии. Такие методики подробно раскрыты в работе Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed., 1980. Можно приготовить препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы твердого гидрофобного полимера, где матрицы имеют определенную форму, например, пленки или микрокапсул. Примеры матриц с замедленным высвобождением включают полиэфиры, гидрогели (например, поли(2-гидроксиэтил-метакрилат) или поливиниловый спирт), полилактиды (US 3773919), сополимеры L-глутаминовой кислоты и гамма-этил-L-глутамата, неразрушаемый этилен-винилацетат, разрушаемые сополимеры молочной и гликолевой кислот, такие как LUPRON DEPOT™ (которые представляют собой вводимые с помощью инъекций микросферы, включающие сополимер молочной и гликолевой кислот и леупролид ацетат), поли-D-(-)-3-гидроксимасляную кислоту и ProLease® (коммерчески доступный препарат фирмы Alkermes), который является системой доставки лекарств, основанной на применении микросфер, включающих желаемые биоактивные молекулы, включенные в матрицу поли-DL-лактид-ко-гликолида (PLG).
Концентрация терапевтически активного антитела или слитого Fc настоящего изобретения в композиции может варьироваться от приблизительно 0,1 до 100% вес. В предпочтительном воплощении концентрация антитела или слитого Fc находится в диапазоне от 0,003 до 1,0 М. Для лечения пациента можно вводить терапевтически эффективную дозу антитела или слитого Fc настоящего изобретения. Термин «терапевтически эффективная доза» здесь означает дозу, которая производит те самые действия, для которых ее вводят. Точная доза будет зависеть от цели лечения и устанавливается специалистом с использованием известных методик. Дозировка может составлять от 0,01 до 100 мг/кг веса тела или более, например 0,1, 1, 10 или 50 мг/кг веса тела, предпочтительно от 1 до 10 мг/кг. Как известно специалистам в этой области техники, может понадобиться корректировка, учитывающая деградацию антитела или слитого Fc, соотношение системной доставки против доставки в определенные участки тела и учитывающая уровень синтеза новых протеаз, а также возраст, вес тела, общее состояние здоровья, пол, питание, время введения, взаимодействие лекарств и тяжесть состояния, и это может быть выяснено специалистами в процессе рутинной экспериментальной работы.
Введение фармацевтической композиции, включающей антитело и слитый Fc настоящего изобретения, предпочтительно в форме стерильного водного раствора, может быть осуществлено многими способами, включающими, но не ограниченными только ими, пероральный, подкожный, внутривенный, внутриносовой, внутриушной, чрескожный, местный (например, при применении гелей, мазей, лосьонов, кремов и т.д.), внутрибрюшинный, внутримышечный, внутрилегочный (например, при применении метода ингаляции AERx®, коммерчески доступного от компании Aradigm, или при применении системы доставки в легкие Inhance™, коммерчески доступной от компании Inhale Terapeutics), вагинальный, парентеральный, ректальный или внутриглазной способы введения. В некоторых случаях, например при лечении ран, воспаления и т.п., антитело или слитый Fc можно непосредственно применять в виде раствора или аэрозоля. Как известно специалистам в этой области техники, фармацевтическая композиция может быть составлена соответствующим образом в зависимости от способа введения.
Способы конструирования
Настоящее изобретение обеспечивает способы конструирования, которые могут быть применены для создания вариантов Fc. Принципиальное препятствие, которое затрудняло предыдущие попытки конструирования, состоит в том, что были возможны только случайные попытки модификации, отчасти из-за неэффективности стратегий и способов конструирования и из-за низкопроизводительного характера получения и скрининга антител. Настоящее изобретение описывает способы конструирования, которые преодолевают эти недостатки. Рассматриваются разнообразные стратегии конструирования антител, способы компьютерного скрининга, способы создания библиотек и способы экспериментального получения и скрининга. Эти стратегии, подходы, технологии и способы могут быть применены индивидуально или в различных сочетаниях для конструирования оптимизированных вариантов Fc.
Стратегия конструирования
Наиболее эффективным подходом для получения вариантов Fc, которые оптимизированы в отношении желаемых свойств, является направление усилий по конструированию навстречу этой цели. Таким образом, настоящее изобретение обучает стратегиям конструирования, которые могут применяться для конструирования оптимизированных вариантов Fc. Применение стратегии конструирования подразумевает контроль за конструированием Fc, но не означает, что вариант Fc ограничен определенным оптимизированным свойством на основании стратегии конструирования, примененной для его конструирования. На первый взгляд это может показаться противоречащим интуитивным представлениям; тем не менее, правильность этого утверждения проистекает из огромной сложности тонких взаимодействий, которые определяют структуру, стабильность, растворимость и функцию белков и белок-белковых комплексов. Хотя и можно направить усилия на предсказание того, какие положения в белке, какие остатки, взаимодействия и т.п. важны для целей конструирования, очень часто критические характеристики остаются непредсказуемыми. Будет ли воздействие на белковую структуру, стабильность, растворимость и функцию благоприятным или неблагоприятным, часто предвидеть невозможно. Кроме того, существует огромное количество модификаций аминокислот, которые губительны или вредны для белков. Поэтому часто лучший подход к конструированию состоит в создании белковых вариантов, которые сфокусированы, главным образом, на цели конструирования, но не вызывают губительных последствий. В этом случае главная цель стратегии дизайна может состоять в создании качественного разнообразия. На упрощенном уровне это может быть представлено как накопление случайностей в чью-либо пользу. Приведем пример: нарушения, связанные с углеводом Fc, или нарушения определенного угла между доменами, как описано ниже, являются обоснованными стратегиями конструирования для создания оптимизированных вариантов Fc, несмотря на тот факт, что не в полной мере понятно, как углевод и угол между доменами определяют свойства Fc. С помощью уменьшения количества губительных для белка аминокислотных модификаций, которые выбраковываются, то есть с помощью скрининга разнообразия свойств, эти стратегии конструирования применяются на практике. Таким образом, истинной ценностью стратегий конструирования, раскрытых в настоящем изобретении, является их способность направлять усилия по конструированию навстречу созданию полезных вариантов Fc. Конкретная ценность любого из полученных вариантов определяется после экспериментирования.
Предоставляется одна из стратегий конструирования для конструирования вариантов Fc, в которой взаимодействие Fc с некоторым лигандом Fc изменено с помощью конструирования аминокислотных модификаций в области контакта Fc и указанного лиганда Fc. Лиганды Fc здесь могут включать, но не ограничиваться ими, FcγR, C1q, FcRn, белки А или G и т.п. С помощью исследования энергетически выгодных замен в положениях Fc, которые сильно влияют на область контакта связывания, могут быть сконструированы варианты, которые представляют собой образец новых конформаций в области контакта, некоторые из них могут улучшать связывание с лигандом Fc, другие могут ухудшать связывание с лигандом Fc, третьи могут обладать другими полезными свойствами. Такие новые конформаций в области контакта могут быть результатом, например, прямого взаимодействия с остатками лиганда Fc, которые формируют область контакта, или косвенных эффектов, вызванных аминокислотными модификациями, нарушающими боковую цепь или конформации остова молекулы. Можно выбрать вариабельные положения, которые, как считают, играют важную роль в определении конформации области контакта. Например, можно выбрать вариабельные положения как набор остатков, которые находятся на определенном расстоянии, например на расстоянии 5 ангстрем (Å), предпочтительно они находятся на расстоянии от 1 до 10 Å от остатков, осуществляющих прямой контакт с лигандом Fc.
Предоставляется дополнительная стратегия конструирования для создания вариантов Fc, в которых оптимизирована конформация углевода Fc в положении N297. Термин «оптимизация», используемый в данном контексте, подразумевает наличие конформационных и композиционных изменений в углеводе при остатке N297, которые приводят к появлению желаемого свойства, например к увеличенной или сниженной аффинности к FcγR. Такая стратегия поддержана наблюдением того, что структура и конформация углевода драматически влияют на связывание Fc/FcγR и Fc/C1q (Umana et al., 1999, Nat Biotechnol 17:176-180; Davies et al., 2001, Biotechnol Bioeng 74:288-294; Mimura et al., 2001, J Biol Chem 276:45539-45547; Radaev et al., 2001, J Biol Chem 276:16478-16483; Shields et al., 2002, J Biol Chem 277:26733-26740; Shinkawa et al., 2003, J Biol Chem 278:3466-3473). Однако углевод осуществляет неспецифические контакты с FcγR. С помощью исследования энергетически выгодных замен в положениях, которые взаимодействуют с углеводом, можно сконструировать качественное разнообразие вариантов, которые представляют собой образцы новых конформации углевода, некоторые из них могут улучшить, а другие ослабить связывание с одним или несколькими лигандами Fc. Оказалось, что, несмотря на то что большинство мутаций вблизи области контакта Fc/углевод изменяют конформацию углевода, было показано, что некоторые мутации изменяют состав гликозилирования (Lund et al., 1996, J Immunol 157:4963-4969; Jefferis et al., 2002, Immunol Lett 82:57-65).
Предоставляется другая стратегия конструирования для создания вариантов Fc, у которых оптимизирован угол между доменами Cγ2 и Cγ3. Термин «оптимизация», так как он используется в данном контексте, предназначен для описания конформационных изменений угла между доменами Cγ2 и Сγ3, которые приводят к желаемому свойству, например увеличенной или сниженной аффинности к FcγR. Этот угол является важным определяющим фактором аффинности Fc/FcγR (Radaev et al., 2001, J Biol Chem 276:16478-16483), и несколько мутаций в положениях, отдаленных от области контакта Fc/FcγR, потенциально влияют на связывание, модулируя его (Shields et al., 2001, J Biol Chem 276:6591-6604). С помощью исследования энергетически выгодных замен в положениях, которые, как оказалось, играют ключевую роль в определении угла между Сγ2-Сγ3 и в гибкости доменов относительно друг друга, можно спроектировать качественное разнообразие вариантов, которые представляют собой образец новых углов и уровней гибкости, некоторые из которых могут быть оптимизированы в отношении нужного свойства Fc.
Предоставляется другая стратегия конструирования для создания вариантов Fc, в которых Fc сконструирован с потерей структурной и функциональной зависимости от гликозилирования. Эта стратегия конструирования включает оптимизацию структуры, стабильности, растворимости и/или функции Fc (например, аффинности Fc к одному или нескольким лигандам Fc) в отсутствие углевода в положении N297. В одном из подходов положения, которые экспонированы в растворитель в отсутствии гликозилирования, конструируют таким образом, что они становятся устойчивыми, структурно согласуются со структурой Fc и не имеют тенденции к агрегации. Сγ2 - единственный непарный Ig-домен в антителе (смотри фигуру 1). Поэтому углевод при остатке N297 закрывает экспонированный в растворитель гидрофобный участок, который обычно является областью контакта при белок-белковом взаимодействии с другими доменами Ig, поддерживая стабильность и структурную целостность Fc и предохраняя домены Сγ2 от агрегации через центральную ось. Подходы к оптимизации агликозилированного Fc могут включать, но не ограничиваются ими, проектирование аминокислотных модификаций, которые увеличивают стабильность агликозилированного Fc и/или его растворимость, путем включения полярных и/или заряженных остатков, которые повернуты внутрь по направлению к оси димера Сγ2-Сγ2, и с помощью аминокислотных модификаций, которые непосредственно увеличивают область контакта в комплексе агликозилированный Fc/FcγR или область контакта агликозилированного Fc с некоторым другим лигандом Fc.
Предоставляется дополнительная стратегия дизайна для создания вариантов Fc, в которых оптимизирована конформация домена. Термин «оптимизация», так как он используется в данном контексте, предназначен для описания конформапионных изменений угла домена Сγ2, которые приводят к нужному свойству, например увеличенной или пониженной аффинности к FcγR. С помощью исследования энергетически выгодных замен в положениях Сγ2, которые сильно воздействуют на конформацию Сγ2, можно сконструировать качественное разнообразие вариантов, которые представляют собой образцы новых конформаций Сγ2, некоторые из которых могут достигать поставленной цели. Такие новые конформаций Сγ2 могут быть, например, результатом альтернативных конформаций остова молекулы, принимаемых вариантом. Можно выбрать вариабельные положения, которые, как считают, играют важную роль в определении структуры, стабильности, растворимости, упругости, функции Сγ2 и т.п. Например, можно сконструировать остатки гидрофобной сердцевины Сγ2, которые представляют собой остатки Сγ2, частично или полностью изолированные от растворителя. Альтернативно, можно рассмотреть вклад остатков, не имеющих отношения к сердцевине, или остатков, которые считаются важными для определения структуры остова, стабильности или упругости.
Предоставляется дополнительная стратегия конструирования для оптимизации Fc, в котором связывание с FcγR, комплементом или каким-либо другим лигандом Fc изменено с помощью модификаций, которые модулируют электростатические взаимодействия между Fc и указанным лигандом Fc. О таких модификациях можно размышлять как об оптимизации глобальных электростатических характеристик Fc, эти модификации включают замену нейтральных аминокислот на заряженные аминокислоты, замену заряженных аминокислот на нейтральные аминокислоты или замену заряженных аминокислот на аминокислоты противоположного заряда (то есть инверсию заряда). Такие модификации могут применяться, чтобы вызвать изменения в аффинности связывания между Fc и одним или несколькими лигандами Fc, например FcγR. В предпочтительном воплощении выбирают положения, в которых электростатические замены могут повлиять на связывание, применяя один из множества хорошо известных способов расчета электростатических потенциалов. В простейшем воплощении изобретения для вывода электростатических потенциалов, являющихся функцией от положения в белке, используют закон Кулона. Дополнительные воплощения включают применение пересчета Дебая-Хюкеля для оценки эффектов ионной силы, а в более сложных воплощениях применяют расчеты Пуассона-Больцмана. Такие электростатические расчеты могут выделить положения и предположить определенные аминокислотные модификации для достижения поставленной цели. В некоторых случаях эти замены могут предугадать различное влияние на связывание с различными лигандами Fc, например, усиление связывания с активирующими FcγR и одновременное снижение аффинности связывания с ингибирующими FcγR.
Способ вычислительного скрининга
Принципиальная преграда на пути получения полезных вариантов Fc - это сложность предсказания, какие именно аминокислотные модификации из огромного количества возможных достигнут поставленной цели. Действительно, одна из главных причин того, что предыдущие попытки конструирования Fc потерпели неудачу в получении вариантов Fc со значимой клинической ценностью, состоит в том, что подходы к конструированию Fc до настоящего времени включали подходы, основанные на выборе наугад. Настоящее изобретение обеспечивает способы компьютерного скрининга, которые способны количественно и системно конструировать варианты Fc. Эти способы обычно используют функции подсчета атомных уровней, отбор ротамеров боковой цепи и передовые методы оптимизации для точного установления взаимосвязи между последовательностью, структурой и функцией белка. Вычислительный скрининг дает возможность исследования полного пространства возможностей для последовательности в намеченных положениях, фильтруя полученное огромное разнообразие данных. Библиотеки вариантов, которые отбирают с помощью компьютерного скрининга, эффективно обогащены стабильными, правильно свернутыми и функциональными последовательностями, позволяющими осуществлять активную оптимизацию Fc для поставленной цели. Из-за ограничений, накладываемых перекрывающимися последовательностями на белковую структуру, стабильность, растворимость и функцию, большое количество кандидатов в библиотеки занимают «непродуктивное» пространство последовательностей. Например, большая часть пространства последовательностей кодирует несвернутые, неправильно свернутые, не полностью свернутые, частично свернутые или агрегированные белки. Это имеет особое значение для конструирования Fc, потому что домены Ig представляют собой небольшие структуры из β-складок, конструирование которых, как показано, крайне сложно (Quinn et al., 1994, Proc Natl Acad Sci USA 91:8747-8751; Richardson et al., 2002, Proc Natl Acad Sci USA 99:2754-2759). Даже на первый взгляд безвредные замены на поверхности β-складки могут привести к тяжелым конфликтам при укладке, значительно нарушающим равновесие сворачивания (Smith et al., 1995, Science 270:980-982); в этой связи, аланин хуже всех образует β-складки (Minor et al., 1994, Nasture 371:264-276). Определяющим фактором стабильности и специфичности β-складки является тонкий баланс между чрезвычайно большим количеством тонких взаимодействий. Вычислительный скрининг дает возможность создания библиотек, которые, в первую очередь, составлены из продуктивного пространства последовательностей, и, как результат, увеличивает шансы идентификации белков, которые оптимизированы в отношении поставленной цели. В сущности, вычислительный скрининг приводит к увеличению процента успеха, таким образом, понижая количество вариантов, которые должны быть отобраны экспериментально. Дополнительным препятствием при конструировании Fc является необходимость активного проектирования зависимых или сопряженных мутаций. Например, наибольшее увеличение аффинности комплекса Fc/FcγR до сих пор наблюдалось для варианта S298A/E333A/K334A, полученного комбинированием трех лучших связывающих элементов, полученных отдельно при аланиновом сканировании (Shieldis et al., 2001, J Biol Chem 276:6591-6604). Вычислительный скрининг способен к созданию такого тройного варианта в одном эксперименте, а не в трех отдельных, и, кроме того, он способен тестировать функциональность 20 аминокислот в этих положениях, вместо только одного аланина. Вычислительный скрининг справляется с такой сложной задачей путем сведения комбинаторной проблемы к уровню, поддающемуся экспериментальной трактовке.
В широком смысле вычислительный скрининг имеет четыре стадии: 1) выбор и подготовку шаблонной структуры или структур белка, 2) выбор различных положений, аминокислот, рассматриваемых в этих позициях, и/или выбор ротамеров для моделирования рассматриваемых аминокислот, 3) расчет энергии и 4) комбинаторную оптимизацию. Более подробно процесс вычислительного скрининга может быть описан следующим образом. В качестве исходной точки используют трехмерную структуру белка. Определяют положения для оптимизации, которые могут быть расположены по всей длине последовательности белка или на ее фрагменте(ах). Выбирают аминокислоты, которые будут рассмотрены в каждом положении. В предпочтительном воплощении каждая рассматриваемая аминокислота может быть представлена в виде дискретного набора возможных конформаций, называемых ротамерами. Рассчитывают энергии взаимодействия между каждой рассматриваемой аминокислотой и каждой другой рассматриваемой аминокислотой и остатком белка, включающим остов белка и инвариантные остатки. В предпочтительном воплощении рассчитывают энергии взаимодействия между ротамером боковой цепи каждой рассматриваемой аминокислоты и ротамером боковой цепи каждой другой рассматриваемой аминокислоты и остатком белка, включающим остов белка и инвариантные остатки. Затем для идентификации самой низкоэнергетической последовательности и/или низкоэнергетических последовательностей используют один или несколько алгоритмов комбинаторного поиска.
В предпочтительном воплощении используют способ вычислительного скрининга, в значительной степени схожий с технологией Protein Design Automation® (PDA®), описанной в US 6188965; US 6269312; US 6403312, USSN 09/782004; USSN 09/927790; USSN 10/218102; PCT WO 98/07254; PCT WO 01/40091; PCT WO 02/25588. В другом предпочтительном воплощении используют способ вычислительного скрининга, в значительной степени схожий с технологией Sequence Prediction Algorithm™ (SPA™), описанной в работе Raha et al., 2000, Protein Sci 9:1106-1119, USSN 09/877 695, USSN 10/071859. В другом предпочтительном воплощении используется способ вычислительного скрининга, описанный в заявке USSN 10/339788, зарегистрированной 3 марта 2003 года под названием «Оптимизация антитела». В некоторых воплощениях используют комбинации различных способов вычислительного скрининга, включающих сочетание техники PDA® и SPA™, а также сочетание этих вычислительных способов с другими способами конструирования. Подобным образом эти вычислительные способы можно применять одновременно или по отдельности, в любом порядке.
Шаблонную структуру применяют в качестве входящих данных при расчетах вычислительного скрининга. Термин «шаблонная структура» обозначает здесь координаты структуры части или всего белка, предназначенного для оптимизации. Шаблонная структура может быть любым белком, для которого известна или может быть рассчитана, установлена, смоделирована, создана или определена трехмерная структура (то есть трехмерные координаты для набора атомов белка). Трехмерные структуры белков могут быть установлены с помощью способов, включающих, но не ограниченных ими, кристаллографический метод с применением рентгеновских лучей, метод ядерного магнитного резонанса (ЯМР), моделирование de novo и моделирование по гомологии. Если оптимизация необходима для белка, структура которого экспериментально не установлена, можно создать подходящую структурную модель, которая может служить в качестве шаблона для расчетов компьютерного скрининга. Способы создания моделей гомологии белков известны в этой области техники, и эти способы находят применение в настоящем изобретении. Смотри, например, Luo et al., 2002, Protein Sci 11: 1218-1226, Lehmann & Wyss, 2001, Curr Opin Biotechnol 12(4):371-5; Lehmann et al., 2000, Biochim Biophys Acta 1543(2):408-415; Rath & Davison, 2000, Protein Sci, 9(12):2457-69; Lehmann et al., 2000, Protein Eng 13(1):49-57; Desjarlais & Berg, 1993, Proc Natl Acad Sci USA 90(6):2256-60; Desjarlais & Berg, 1992, Proteins 12(2): 101-4; Henikoff & Henikoff, 200, Adv Protein Chem 54:73-97; Henikoff & Henikoff, 1994, J Mol Biol 243(4):574-8; Morea et al., 2000, Methods 20:267-269. Белок-белковые комплексы также можно получить, используя способы стыковки. Подходящие белковые структуры, которые могут служить в качестве шаблонной структуры, включают, но не ограничиваются только ими, все структуры, найденные в базе данных Protein Data Base, собранной и обслуживаемой лабораторией Research Collaboratory for Structural Bioinformatics (RCSB, ранее Brokhaven National Lab).
Шаблонная структура может быть белком, который встречается в природе, или сконструированным белком. Шаблонная структура может быть белком, который, по существу, кодируется белком из любого организма, предпочтительно из человека, мыши, крысы, кролика и обезьяны. Шаблонная структура может включать любое количество структурных форм белка. В предпочтительном воплощении шаблонная структура включает Fc-фрагмент или домен, или часть Fc. В альтернативном предпочтительном воплощении шаблонная структура включает Fc или домен, или часть Fc, связанные с одним или несколькими лигандами Fc, предпочтительно в виде комплекса Fc/FcγR. Fc в шаблонной структуре может быть гликозилирован или негликозилирован. Шаблонная структура может включать более чем одну белковую цепь. Шаблонная структура может дополнительно включать небелковые компоненты, включающие, но не ограниченные только ими, небольшие молекулы, субстраты, кофакторы, металлы, молекулы воды, простетические группы, полимеры и углеводы. В предпочтительном воплощении шаблонная структура является множеством или набором шаблонных белков, например группой структур, таких как структуры, полученные методом ЯМР. Альтернативно, набор шаблонных структур создается из набора родственных белков или структур или из искусственно созданных групп. Состав и источник шаблонной структуры зависит от поставленной цели. Например, для увеличения аффинности комплекса Fc/FcγR человека в качестве шаблона можно применять структуру комплекса Fc/FcγR или ее производные. Альтернативно, в качестве шаблона можно применять структуру несвязанного Fc. Если цель состоит в усилении аффинности Fc человека к мышиному FcγR, шаблонной структурой может быть структура или модель Fc человека, связанного с мышиным FcγR.
Шаблонную структуру можно модифицировать или изменить до проведения конструкторских расчетов. Разнообразные способы получения шаблонной структуры описаны в US 6188965; US 6269312; US 6403312; USSN 09/782004; USSN 09/927790; USSN 09/877695; USSN 10/071859; USSN 10/218102; PCT WO 98/07254; PCT WO 01/40091; PCT WO 02/25588. Например, в предпочтительном воплощении точно известные атомы водорода могут быть добавлены, если они не включены, в структуру. В альтернативном воплощении минимизация энергии структуры проводится для ослабления напряжения, включая напряжение, возникающее вследствие ван-дер-ваальсовых взаимодействий, невыгодных углов связей и невыгодной длины связей. Альтернативно, шаблонную структуру изменяют, используя другие способы, например вручную, включая направленные или случайные пертурбации. Также возможно модифицировать шаблонную структуру во время более поздних стадий вычислительного скрининга, в том числе во время расчета энергии и комбинаторной оптимизации. В другом воплощении шаблонную структуру не модифицируют до или в течение расчетов вычислительно скрининга.
После того как шаблонная структура была получена, выбирают вариабельные положения. Термин «вариабельное положение», который используют в тексте, означает положение, в котором идентичность аминокислоты в расчетах вычислительного скрининга может быть изменена. Как известно в этой области техники, возможность аминокислотных модификаций, рассматриваемых только в определенных вариабельных положениях, уменьшает сложность расчетов и дает возможность вычислительному скринингу наиболее прямо приспосабливаться к целям конструирования. В расчетах вычислительного скрининга один или несколько остатков могут находиться в вариабельных положениях. Положениями, выбранными в качестве вариабельных, могут быть те, которые вносят вклад или предположительно содействуют оптимизации свойства белка, например аффинности Fc к FcγR, стабильности Fc, растворимости Fc и так далее. Остатки в вариабельных положениях могут вносить полезный или неблагоприятный вклад в специфическое свойство белка. Например, остаток на поверхности контакта Fc/FcγR может быть вовлечен в опосредованное связывание, и, таким образом, это положение в расчетах конструирования, имеющего целью улучшения аффинности Fc/FcγR, может изменяться. В другом примере остаток, у которого экспонирована гидрофобная боковая цепь, может быть причиной неблагоприятной агрегации, и, таким образом, это положение может изменяться в различных расчетах конструирования, имеющего целью улучшить растворимость. Вариабельными положениями могут быть те положения, которые напрямую вовлечены во взаимодействия, которые определяют особые свойства белка. Например, можно определить, что место связывания FcγR на Fc включает все остатки, которые контактируют со специфическим FcγR. Под «контактом» здесь подразумевается некоторое химическое взаимодействие между, по меньшей мере, одним атомом остатка Fc и, по меньшей мере, одним атомом связанного FcγR с химическим взаимодействием, включающим, но не ограниченным ван-дер-ваальсовыми взаимодействиями, водородными связями, электростатическими взаимодействиями и гидрофобными взаимодействиями. В альтернативном воплощении вариабельные положения могут включать такие положения, которые не напрямую вовлечены в свойство белка, то есть такие положения могут быть проксимальными для остатков, для которых известно или предполагается, что они вносят вклад в свойство Fc. Например, можно определить, что место связывания FcγR в молекуле Fc включает все остатки Fc, находящиеся на определенном расстоянии, например на расстоянии 4-10 Å от любого остатка Fc, который находится в ван-дер-ваальсовом контакте с FcγR. Таким образом, для вариабельных положений в этом случае можно выбрать не только остатки, непосредственно контактирующие с FcγR, но также те контактирующие остатки, которые соприкасаются с FcγR и, таким образом, влияют на связывание не напрямую. Выбранные специфические положения зависят от применяемой стратегии конструирования.
Одно или несколько положений в шаблонной структуре, которые не являются вариабельными, могут быть «плавающими». Термин «плавающее положение», употребляемый в тексте, означает положение, в котором при способе вычислительного скрининга разрешено изменять конформацию аминокислоты, но не идентичность аминокислоты. Например, «плавающими» положениями могут быть положения, которые находятся на небольшом расстоянии, например на расстоянии Å Е, от вариабельного положения. В альтернативном воплощении изобретения «плавающее» положение может занимать идентичность аминокислоты, не принадлежащая исходному белку. Такое воплощение может применяться в настоящем изобретении, например, когда целью является оценить энергетические и структурные последствия специфической мутации.
Положения, которые не являются вариабельными или «плавающими», относятся к фиксированным. Термин «фиксированное положение», употребляемый в тексте, означает положение, в котором идентичность аминокислоты и ее конформация остаются в неизменном состоянии в способе вычислительного скрининга. Положения, которые могут фиксироваться, включают остатки, для которых неизвестно или не предполагается, что они могут быть вовлечены в свойство белка, которое предстоит оптимизировать. В этом случае предположение состоит в том, что изменения этих положений либо дадут мало пользы, либо вовсе не приведут к успеху. Фиксированные положения могут также включать положения, в которых остатки, как известно или предполагается, важны для поддержания подходящего фолдинга, структуры, стабильности, растворимости и/или биологической функции. Например, положения могут быть фиксированными для остатков, которые взаимодействуют с определенным лигандом Fc или остатками, которые кодируют участок гликозилирования, чтобы гарантировать, что связывание с лигандом Fc или специфическое гликозилирование не будут нарушены. Подобным образом, если оптимизируется стабильность, может быть выгодно зафиксировать положения, которые прямо или косвенно взаимодействуют с лигандом Fc, например FcγR, так чтобы не нарушить связывание. Фиксированные положения могут также включать важные для структуры остатки, такие как цистеиновые остатки, участвующие в образовании дисульфидных мостиков, остатки, критичные для задания конформации остова молекулы, такие как пролин или глицин, критичные остатки, дающие водородные связи, и остатки, которые образуют выгодные для упаковки взаимодействия.
Следующим шагом в вычислительном скрининге является выбор набора возможных аминокислотных идентичностей, которые рассматриваются в качестве кандидатов для каждого индивидуального вариабельного положения. Этот набор возможных аминокислот в этом тексте обозначают как «рассматриваемые аминокислоты» в вариабельном положении. Термин «аминокислоты», употребляемый в тексте, относится к набору из 20 природных аминокислот и любых неприродных аминокислот или к их синтетическим аналогам. В одном из воплощений настоящего изобретения рассматриваются все 20 природных аминокислот. Альтернативно, в конкретном вариабельном положении рассматривается подгруппа аминокислот или даже только одна аминокислота. Специалисты в этой области техники должны принять во внимание, что при компьютерных расчетах в вариабельных положениях выгодно рассматривать только определенные аминокислотные идентичности, так как это снижает комбинаторную сложность исследования. Кроме того, рассмотрение только определенных аминокислот в вариабельных положениях может быть полезным для целевых расчетов при определенных стратегиях конструирования. Например, для оптимизации растворимости агликозилированного Fc может быть выгодно учитывать только полярные аминокислоты, рассматриваемые как возможные кандидаты для замены полярных остатков в Fc, которые экспонированы в раствор в отсутствие углевода. Неприродные аминокислоты, включающие синтетические аминокислоты, и аналоги природных аминокислот также могут быть рассматриваемыми аминокислотами. См., например, Chin et al., 2003, Science, 301(5635):964-7; и Chin et al., 2003, Chem Biol. 10(6):511-9.
Чтобы выбрать аминокислоты, рассматриваемые в качестве кандидатов в каждом положении, можно применять огромное количество способов. Например, набор рассматриваемых аминокислот в конкретном вариабельном положении можно выбрать на основании степени доступности растворителю. Гиброфобные или неполярные аминокислоты обычно находятся во внутренней части или сердцевине белка, которые недоступны или почти недоступны для растворителя. Поэтому в вариабельных положениях сердцевины может быть выгодно рассматривать только неполярные или, в основном, неполярные аминокислоты, например, аланин, валин, изолейцин, лейцин, фенилаланин, тирозин, триптофан и метионин. Гидрофильные или полярные аминокислоты обычно расположены на внешней части или поверхности белков, которая обладает значительной доступностью для растворителя. Поэтому в вариабельных положениях поверхности может быть выгодно рассматривать только полярные или, в основном, полярные аминокислоты, например, аланин, серин, треонин, аспарагиновую кислоту, аспарагин, глутамин, глутаминовую кислоту, аргинин, лизин и гистидин. Некоторые положения частично экспонированы или частично погружены, и не ясно, являются ли они положениями сердцевины белка или его поверхности. Поэтому в таких вариабельных положениях на границе раздела может быть выгодно рассматривать как полярные, так и неполярные аминокислоты, такие как аланин, серин, треонин, аспарагиновую кислоту, аспарагин, глутамин, глутаминовую кислоту, аргинин, лизин, гистидин, валин, изолейцин, лейцин, фенилаланин, тирозин, триптофан и метионин. Определение степени доступности растворителю в вариабельных положениях может быть достигнуто с помощью субъективной оценки или визуального обследования шаблонной структуры с помощью специалиста в области структурной биологии белков или с помощью множества алгоритмов, известных в этой области техники. Выбор типов аминокислот, которые рассматриваются в качестве возможных кандидатов в вариабельных положениях, может быть выполнен полуавтоматически или может быть полностью определен с помощью вычислительных способов, таких как расчет доступности площади поверхности для растворителя или применение алгоритмов, которые оценивают ориентацию векторов Сα-Сβ относительно поверхности, доступной растворителю, как в общих чертах отмечено в патентах US 6188965; 6269312; US 6403312; USSN 09/782004; USSN 09/927790; USSN 10/218102; PCT WO 01/40091 и РСТ WO 02/25558. В одном из воплощений изобретения каждое вариабельное положение можно четко классифицировать как положение в сердцевине, на поверхности или границе раздела или систематизировать как имеющее существенное сходство с сердцевиной, поверхностью или границей раздела.
В альтернативном воплощении изобретения выбор набора аминокислот, которым разрешено находиться в вариабельных положениях, может управляться гипотезой. Предположение по каждому типу аминокислоты, которые должны рассматриваться в вариабельном положении, может происходить с помощью субъективной оценки или визуального обследования шаблонной структуры специалистом в области структурной биологии белков. Например, если ожидается, что в вариабельном положении предпочтительным может быть взаимодействие с помощью водородных связей, в качестве кандидатов можно рассматривать полярные остатки, которые обладают способностью образовывать водородные связи, даже если это положение находится в сердцевине белка. Подобным образом, если ожидают, что в вариабельном положении может быть благоприятным взаимодействие гидрофобной упаковки, можно рассматривать неполярные остатки, которые обладают способностью формировать благоприятные упаковывающие взаимодействия, даже если эти остатки находятся на поверхности. Другие примеры управляемых гипотезами приближений могут включать вопросы гибкости остова молекулы или свертывания белка. Как известно в этой области техники, некоторые остатки, например пролин, глицин и цистеин, играют важную роль в структуре и стабильности белков. Глицин обеспечивает большую гибкость остова, чем все другие аминокислоты, пролин накладывает ограничения на структуру сильнее всех других аминокислот, а цистеин может образовывать дисульфидные связи. Следовательно, для достижения желаемого результата конструирования может оказаться полезным включение одного или нескольких типов этих аминокислот. Альтернативно, может быть полезно исключить один или несколько типов аминокислот из списка рассматриваемых аминокислот.
В альтернативном воплощении можно выбирать группы аминокислот, чтобы максимально увеличить покрытие. В этом случае в вариабельных положениях можно рассматривать дополнительные аминокислоты со свойствами, схожими со свойствами аминокислот в шаблонной структуре. Например, если остаток в вариабельном положении шаблонной структуры представляет собой крупный гидрофобный остаток, в этом положении можно рассматривать дополнительные крупные гидрофобные аминокислоты. Альтернативно, можно выбирать группы аминокислот, чтобы максимально увеличить разнообразие. В этом случае в варибельных положениях можно рассматривать аминокислоты со свойствами, отличающимися от свойств аминокислот в шаблонной структуре. Например, если остаток в вариабельном положении в шаблоне является крупным гидрофобным остатком, то можно рассматривать небольшие, полярные и т.п. аминокислоты.
Как известно в этой области техники, некоторые способы вычислительного скрининга во время конструкторских расчетов требуют только установления идентичности рассматриваемых аминокислот. То есть не требуется информации, относящейся к структуре или возможной структуре боковых цепей аминокислот. Другие предпочтительные способы используют набор дискретных структур боковых цепей, называемых ротамерами, которые рассматриваются для каждой аминокислоты. Таким образом, в каждом вариабельном и «плавающем» положении можно рассмотреть набор ротамеров. Ротамеры можно получить из опубликованных библиотек ротамеров (например, смотри Lovel et al., 2000, Proteins: Structure Function and Genetics 40:389-408; Dunbrack & Cohen, 1997, Protein Science 6:1661-1681; DeMaeyer et al., 1997, Folding and Design 2:53-66; Tuffery et al., 1991, J Biomol Struct Dyn 8:1267-1289, Ponder & Richards, 1987, J Mol Biol 193:775-791). Как известно в этой области техники, библиотеки ротамеров могут быть зависящими от основной цепи или не зависящими от основной цепи. Ротамеры также могут быть получены при помощи молекулярной механики или из расчетов ab initio, а также с применением других способов. В предпочтительном воплощении используют гибкую модель ротамеров (смотри Mendes et al., 1999, Proteins: Structure, Function, and Genetics 37:530-543). Сходным образом, можно применять искусственно полученные ротамеры или можно расширить набор, выбранный для каждой аминокислоты и/или для каждого вариабельного положения. В одном из воплощений, по меньшей мере, одну структуру, не являющуюся низкоэнергетической, включают в список ротамеров. В альтернативном воплощении ротамер остатка в вариабельном положении шаблонной структуры включают в список ротамеров, разрешенных в этом вариабельном положении. В альтернативном воплощении, в каждом вариабельном положении обеспечивается только идентичность каждой аминокислоты, и для конструкторских расчетов не применяют никакие специфические конформационные состояния каждой аминокислоты. Таким образом, использование ротамеров не является обязательным для проведения компьютерного скрининга.
Для управления выбором вариабельных положений и/или выбором рассматриваемых аминокислот в вариабельных положениях можно использовать экспериментальную информацию. Как известно в этой области техники, эксперименты по мутагенезу часто проводят для того, чтобы выяснить роль некоторых остатков в структуре и функции белков, например, чтобы выяснить, какие остатки в белках играют роль в определении стабильности или какие остатки создают поверхность контакта в белок-белковых взаимодействиях. Данные, полученные из таких экспериментов, являются полезными в настоящем изобретении. Например, вариабельные положения для усиления аффинности Fc/FcγR могли включать все положения, для которых было показано, что мутация влияет на связывание. Сходным образом, результаты такого эксперимента можно применять для управления выбором разрешенных типов аминокислот в вариабельных положениях. Например, если обнаружено, что определенные типы аминокислотных замен являются полезными, можно рассматривать аналогичные типы тех же аминокислот. В одном из воплощений в вариабельных положениях можно рассматривать дополнительные аминокислоты со свойствами, схожими со свойствами аминокислот, для которых было установлено, что их присутствие является полезным. Например, если было обнаружено, что экспериментальная мутация в вариабельном положении области контакта Fc/FcγR с заменой на крупный гидрофобный остаток является благоприятной, при компьютерном скрининге пользователь может сделать выбор и включить дополнительные крупные гидрофобные аминокислоты в это положение. Как известно в этой области техники, для получения списка или списков аминокислотных замен, полезных для выбранного свойства, технология дисплея и другие способы скрининга могут быть объединены со случайным мутагенезом. Такой список или списки, полученные в результате такой экспериментальной работы, находят применение в настоящем изобретении. Например, положения, для которых в таких экспериментах было показано, что они не являются вариабельными, могут быть исключены как вариабельные положения в расчетах компьютерного скрининга, тогда как положения, для которых было показано, что они являются более подходящими для мутаций или подходящим образом реагируют на мутацию, могут быть выбраны в качестве вариабельных положений. Подобным образом, результаты подобных экспериментов могут быть использованы для скрининга разрешенных типов аминокислот в вариабельных положениях. Например, если некоторые типы аминокислот чаще появляются в экспериментальной выборке, можно рассмотреть схожие с данными аминокислотами типы. В одном из воплощений в вариабельных положениях можно рассматривать дополнительные аминокислоты со свойствами, схожими с теми аминокислотами, для которых было экспериментально найдено, что они являются полезными. Например, если обнаружено, что выбранные мутации в вариабельных положениях, которые расположены на поверхности контакта Fc/FcγR, являются незаряженными полярными аминокислотами, пользователь может включить в это положение дополнительные незаряженные полярные аминокислоты или, возможно, заряженные полярные аминокислоты.
Информация о последовательностях также может быть использована, чтобы управлять выбором вариабельных положений и/или выбором аминокислот, рассматриваемых в вариабельных положениях. Как известно в этой области техники, некоторые белки имеют схожий структурный каркас и гомологичны по последовательности. Эту информацию можно применить для проникновения в суть каждого положения в семействе белков. Как известно в этой области техники, для определения того, какие из белковых остатков являются консервативными, а какие - неконсервативными, часто проводят выравнивание последовательностей. То есть с помощью сравнения или противопоставления выравниваний последовательностей белков можно изучить уровень вариабельности в положении, а также можно определить типы аминокислот, которые естественным образом занимают эти положения. Полученные в результате такого анализа данные являются полезными в настоящем изобретении. Использование информации о последовательностях для выбора вариабельных положений и рассматриваемых аминокислот в вариабельных положениях дает несколько преимуществ. Основным преимуществом при выборе вариабельных положений с использованием информации о последовательностях является то, что можно проникнуть в суть того, какие положения наиболее толерантны к мутациям, а какие - нет. Таким образом, информация о последовательностях может помочь в достижении того, что качественное разнообразие, т.е. мутации, которые не являются разрушительными для структуры белка, его стабильности и т.д., отбирается вычислительным путем. Те же преимущества относятся к применению информации о последовательностях для выбора типов аминокислот, рассматриваемых в вариабельных положениях. То есть набор аминокислот, который имеет место в выравнивании последовательностей белков, может рассматриваться как предварительно отобранный эволюцией и имеющий наибольший шанс быть совместимым со структурой белков, стабильностью, растворимостью, функцией и т.д. в отличие от случайного набора. Таким образом, с помощью вычислений отбирается более высокое качественное разнообразие. Вторым преимуществом использования информации о последовательностях для выбора типов аминокислот, рассматриваемых в вариабельных положениях, является то, что некоторые выравнивания могут предоставлять последовательности, которые могут оказаться менее иммуногенными, чем случайные последовательности. Например, в том случае, когда оптимизированный белок применяется в качестве терапевтического средства для человека, если аминокислоты, рассматриваемые в данном вариабельном положении, являются набором аминокислот, которые оказываются в этом положении при выравнивании последовательностей белков человека, то можно думать, что эти аминокислоты могли быть предварительно отобраны природой, чтобы не вызывать вовсе или вызывать слабый иммунный ответ в том случае.
Источники последовательностей могут быть совершенно различными и включают в себя одну или несколько известных баз данных, включающих, но не ограниченных перечисленными источниками: базу данных Kabat (Johnson & Wu, 2001, Nucleic Acids Res 29:205-206; Johnson & Wu, 2000, Nucleic Acids Res 28:214-218), базу данных IMGT (IMGT, международную систему ImMunoGeneTics information system®; Lefranc et al., 1999, Nucleic Acids Res 27:209-212; Ruiz et al., 2000 Nucleic Acids Res 28:219-221; Lefranc et al., 2001, Nucleic Acids Res 29:207-209; Lefranc et al., 2003, Nucleic Acids Res 31:307-310), а также базы данных: VBASE, SwissProt, GenBank и Entrez и EMBL Nucleotide Sequence Database. Информацию о последовательностях белков можно получить, собрать и/или создать из выравниваний последовательностей существующих в природе белков из любого организма, включающего млекопитающих, но не ограниченного только ими. Информацию о последовательностях белков можно получить из частной базы данных. Существует большое количество программ выравнивания последовательностей белков и способов, известных в этой области техники, которые применяют в настоящем изобретении для создания выравниваний последовательностей белков, которые включают Fc и лиганды Fc.
После того как было проведено выравнивание последовательностей, информацию о последовательностях можно использовать для контроля над отбором вариабельных положений. Подобная информация о последовательностях может иметь отношение к природной или неприродной вариабельности данного положения. Вариабельность в этом тексте необходимо отличать от вариабельного положения. Вариабельность имеет отношение к той степени, в которой данное положение при выравнивании последовательностей демонстрирует вариации в типах аминокислот, которые там находятся. Вариабельное положение, повторим еще раз, - это положение, выбранное пользователем для того, чтобы изменить идентичность аминокислоты во время расчетов компьютерного скрининга. Вариабельность может быть определена качественно специалистом в области биоинформатики. Также существуют способы, известные в этой области техники, для количественного определения вариабельности, которые могут найти применение в настоящем изобретении. Наиболее предпочтительное воплощение измеряет информационную энтропию или энтропию Шэннона. Вариабельные положения могут быть выбраны на основе информации о последовательностях, полученной из последовательностей близкородственных белков, или из последовательностей, родственных в меньшей степени.
Применение информации о последовательностях для выбора вариабельных положений находит широкое применение в настоящем изобретении. Например, если положение на поверхности контакта Fc/FcγR в шаблонной структуре занимает триптофан, и триптофан наблюдается в этом положении в более чем 90% последовательностей при выравнивании, будет выгодно оставить эту позицию фиксированной. В отличие от этого случая, если обнаружено, что другое положение области контакта обладает большим уровнем вариабельности, например, если в этом положении наблюдают пять различных аминокислот с приблизительной частотой в 20%, то это положение может быть выбрано как вариабельное положение. В другом воплощении визуальное исследование аминокислотных последовательностей белка может заменить или помочь визуальному исследованию структуры белка. Информацию о последовательностях также можно использовать для контроля над выбором аминокислот, рассматриваемых в вариабельных положениях. Подобная информация о последовательностях может иметь отношение к выяснению того, как часто аминокислота, аминокислоты или типы аминокислот (например, полярные и неполярные, заряженные и незаряженные) оказываются в данном положении. В одном из воплощений набор аминокислот, рассматриваемых в вариабельном положении, может включать набор аминокислот, которые наблюдаются в этом положении при выравнивании последовательностей. Таким образом, информация, полученная при выравнивании специфических положений в последовательности, прямо используется для создания списка аминокислот, рассматриваемых в вариабельном положении в расчетах вычислительного скрининга. Такая стратегия широко известна в этой области техники; смотри, например, Lehmann & Wyss, 2001, Curr Opin Biotechnol 12(4):371-5; Lehmann et al., 2000, Biochim Biophys Acta 1543(2):408-415; Rath & Davidson, 2000, Protein Sci, 9(12):2457-69; Lehmann et al., 2000, Protein Eng 13(1):49-57; Desjarlais & Berg, 1993, Proc Natl Acad Sci USA 90(6):2256-60; Desjarlais & Berg, 1992, Protein 12(2):101-4; Henikoff & Henikoff, 2000, Adv Protein Chem 54:73-97; Henikoff & Henikoff, 1994, J Mol Biol 243(4):574-8. В альтернативном воплощении набор аминокислот, рассматриваемых в вариабельном положении или положениях, может включать набор аминокислот, которые чаще всего наблюдаются при выравнивании последовательностей. Таким образом, чтобы определить, гарантирует ли частота встречаемости аминокислоты или типа аминокислот их включение в набор аминокислот, которые рассматриваются в вариабельном положении, применяют определенные критерии. Как известно в этой области техники, выравнивание последовательностей может быть проанализировано с помощью статистических методов для подсчета разнообразия последовательностей в любом положении при выравнивании, а также частоты и вероятности встречаемости каждой аминокислоты в каком-либо положении. Подобные данные затем могут быть использованы для определения того, какой тип аминокислот следует рассматривать. В простейшем воплощении частоту встречаемости рассчитывают путем сложения числа случаев, когда аминокислоту обнаруживают в положении выравнивания, а затем делят их на общее количество последовательностей в выравнивании. В других воплощениях вклад каждой последовательности, положения или аминокислоты в процедуру подсчета взвешивают с помощью множества возможных технологий. В предпочтительном воплощении вклад каждой выравниваемой последовательности в статистику частоты появления взвешивают в соответствии со взвешиванием ее разнообразия относительно других последовательностей при выравнивании. Общепринятой стратегией для достижения этого является система взвешивания последовательностей, рекомендованная Henikoff и Henikoff (Henikoff & Henikoff, 2000, Adv Protein Chem 54:73-97; Henikoff & Henikoff, 1994, J Mol Biol 243(4):574-8). В предпочтительном воплощении вклад каждой последовательности в статистику зависит от степени ее сходства с последовательностью-мишенью, т.е. при использовании шаблонной структуры последовательности с более высокой степенью сходства с последовательностью-мишенью имеют более высокий вес. Примеры меры сходства включают, но не ограничиваясь перечисленными примерами, идентичность последовательностей, оценку сходства BLOSUM, оценку сходства по матрице РАМ и оценку BLAST. В альтернативном воплощении вклад каждой последовательности в статистику зависит от ее известных физических и функциональных свойств. Эти свойства включают, но не ограничиваются только ими, температурную и химическую стабильность, вклад в активность и растворимость. Например, когда при оптимизации растворимости агликозилированного Fc те последовательности при выравнивании, для которых известно, что они являются более растворимыми (например, смотри Ewert et al., 2003, J Mol Biol 325:531-553), внесут более весомый вклад в расчетные частоты.
Независимо от того, какой критерий был применен для выбора набора аминокислот в выравнивании последовательностей, которые будут рассматриваться в вариабельных положениях, использование информации о последовательностях для выбора рассматриваемых аминокислот находит широкое применение в настоящем изобретении. Например, чтобы оптимизировать растворимость Fc с помощью замены экспонированных неполярных поверхностных остатков, рассматриваемые аминокислоты могут быть выбраны как набор аминокислот или подгруппа таких аминокислот, которые отвечают некоторому критерию, наблюдаемые в этом положении в выравнивании белковых последовательностей. В другом примере одна или несколько аминокислот могут быть субъективно добавлены или удалены из списка аминокислот, полученного при выравнивании последовательностей, чтобы максимально увеличить покрытие. Например, дополнительные аминокислоты со свойствами, сходными с теми, которые обнаруживают при выравнивании последовательностей, можно рассматривать в вариабельных положениях. Например, если при выравнивании последовательностей обнаружено, что положение Fc, для которого известно или предполагается, что оно связывает FcγR, включает незаряженные полярные аминокислоты, пользователь может сделать выбор и включить в это положение при расчетах вычислительного скрининга дополнительные незаряженные полярные аминокислоты или, возможно, заряженные полярные аминокислоты.
В одном из воплощений информацию, полученную при выравнивании последовательностей, комбинируют с расчетом энергии, как обсуждается ниже. Например, для создания оценочной функции из информации о последовательностях можно вывести псевдоэнергии. Применение зависящей от последовательности оценочной функции может помочь значительно снизить сложность вычислений. Тем не менее, как признано специалистами в этой области техники, применение только одной зависящей от последовательности оценочной функции может быть недостаточным, так как информация о последовательностях зачастую отражает вводящие в заблуждение корреляции между мутациями, которые на самом деле могут структурно конфликтовать. Таким образом, в предпочтительном воплощении используется или только основанный на структуре способ расчета энергии, или этот способ используется в комбинации с зависящей от последовательности оценочной функцией. То есть предпочтительные воплощения не основываются только на информации, полученной при выравнивании последовательностей, в качестве стадии анализа.
Расчет энергии представляет собой процесс, с помощью которого оценивают модификации аминокислот. Энергию взаимодействия считают при помощи одной или нескольких оценочных функций. Для расчета энергии в настоящем изобретении находят применение разнообразные оценочные функции. Оценочные функции могут включать любое количество потенциалов, которые в этом тексте обозначаются как энергетические термины оценочной функции, включающих, но не ограниченных перечисленными, потенциал Ван-дер-Ваальса, потенциал водородной связи, потенциал сольватации атомов или другие модели сольватации, потенциал, характеризующий склонность к формированию вторичной структуры, электростатический потенциал, торсионный потенциал и энтропийный потенциал. Для оценки каждого вариабельного или плавающего положения применяют, по меньшей мере, один энергетический термин, несмотря на то что энергетические термины могут различаться в зависимости от положения, рассматриваемых аминокислот и других учитываемых параметров. В одном из воплощений применяют оценочную функцию, использующую один энергетический термин. В наиболее предпочтительном воплощении энергии рассчитывают с использованием оценочной функции, которая включает несколько энергетических терминов, например, описание взаимодействий ван-дер-ваальсовых, сольватационных, электростатических и водородных связей, а также их комбинации. В дополнительных воплощениях дополнительные энергетические термины включают, но не ограничиваются перечисленными, энтропийные термины, торсионные энергии и энергии, основанные на совокупности знаний.
Разнообразные оценочные функции описаны в US 6188965; US 6269312; US 6403312; USSN 09/782004; USSN 09/927790; USSN 09/877695; USSN 10/071859, USSN 10/218102; PCT WO 98/07254; PCT WO 01/40091 и РСТ WO 02/25588. Как признано специалистами в этой области техники, оценочные функции не должны быть ограничены только физико-химическими энергетическими терминами. Например, основанные на совокупности знаний потенциалы могут найти применение в методологии компьютерного скрининга настоящего изобретения. Такие основанные на совокупности знаний потенциалы могут быть выведены из статистических данных по последовательности белка и/или структуре, включающих, но не ограниченных ими, эмпирические потенциалы соответствия между трехмерной структурой и последовательностью белка («threading potential»), эталонные энергии, псевдоэнергии, энергии, основанные на гомологиях, и систематические смещения последовательности, выведенные из выравнивания последовательностей. В предпочтительном воплощении оценочную функцию модифицируют таким образом, чтобы включить в нее модели иммуногенности, такие как функции, полученные из данных по связыванию пептидов с МНС (главный комплекс гистосовместимости), которые могут быть использованы для идентификации потенциально иммуногенных последовательностей (смотри, например, USSN 09/903378; USSN 10/039170; USSN 60/222697; USSN 10/339788; PCT WO 01/21823; и РСТ WO 02/00165). В одном из воплощений информация, полученная при выравнивании последовательностей, может быть применена для оценки аминокислотных замен. Например, для предположений или количественных оценок аминокислотных мутаций в методологии вычислительного скрининга настоящего изобретения может быть использовано сравнение последовательностей белков независимо от того, является ли источником указанных белков человек, обезьяна, мышь или кто-либо другой. В одном из воплощений, как известно в этой области техники, одну или несколько оценочных функций можно оптимизировать или «тренировать» в процессе вычислительного анализа, а затем анализ повторяют, используя оптимизированную систему. Такие видоизмененные оценочные функции могут быть получены путем, например, «тренировки» оценочной функции с помощью экспериментальных данных. Как признано специалистами в этой области техники, в качестве оценочных функций можно применять несколько силовых полей, которые включают в себя один или несколько энергетических терминов. Силовые поля включают в себя, но не ограничиваются перечисленными, ab initio или квантово-механические силовые поля, полуэмпирические силовые поля и молекулярно-механические силовые поля. Оценочные функции, которые основаны на совокупности знаний, или те, в которых используют статистические методы, могут найти применение в настоящем изобретении. Эти способы могут быть использованы, чтобы оценить соответствие между последовательностью и трехмерной структурой белка, и, следовательно, могут быть использованы для оценки аминокислотных замен в отношении привязанности к белковой структуре. В одном из воплощений для вычислительного скрининга последовательностей с помощью индивидуального подсчета баллов для мутантных последовательностей могут быть использованы молекулярно-динамические расчеты.
Существует множество способов представить аминокислоты таким образом, чтобы было возможно эффективно подсчитать энергию. В предпочтительном воплощении рассматриваемые аминокислоты представлены в виде ротамеров, как было описано ранее, и рассчитывается энергия (или оценка) взаимодействия каждого возможного ротамера в каждом вариабельном или плавающем положении с другими вариабельными или плавающими ротамерами, с остатками в фиксированном положении, а также со структурой остова молекулы и любыми атомами, не имеющими отношения к белку. В предпочтительном воплощении рассчитываются два класса энергий взаимодействия каждого ротамера боковой цепи в каждом вариабельном и плавающем положении: энергия взаимодействия между ротамером и фиксированными атомами («единичные» энергии) и энергия взаимодействия между ротамерами в вариабельном и плавающем положениях и всеми другими возможными ротамерами в каждом другом вариабельном и плавающем положении («двойная» энергия). В альтернативном воплощении единичные и двойные энергии рассчитываются для фиксированных положений, а также для вариабельных и плавающих положений. В альтернативном воплощении рассматриваемые аминокислоты не представляют в виде ротамеров.
Важной частью вычислительного скрининга является определение одной или нескольких последовательностей, которые обладают благоприятной балльной оценкой, т.е. низкой энергией. Определение набора последовательностей с низкой энергией среди очень большого количества возможностей является нетривиальной задачей, и чтобы решить ее, применяют комбинаторный алгоритм оптимизации. Необходимость в комбинаторном алгоритме оптимизации проиллюстрирована с помощью изучения некоторого количества возможностей, которые рассматриваются при обычных расчетах вычислительного скрининга. Дискретная природа наборов ротамеров позволяет использовать простой расчет количества возможных ротамерных последовательностей для определенной задачи конструирования. Остов длиной n с m возможными ротамерами в каждом положении будет иметь mn возможных ротамерных последовательностей, это число экспоненциально возрастает при увеличении длины последовательности. Для очень простых вычислений можно проверить каждую возможную последовательность, чтобы определить оптимальную последовательность и/или одну или несколько выгодных последовательностей. Однако для типичной задачи конструирования количество возможных последовательностей (примерно 1080 или более) является достаточно большим, так что проверка каждой возможной последовательности становится труднообрабатываемой задачей. Чтобы определить оптимальную последовательность и/или одну или несколько полезных последовательностей, можно использовать разнообразные комбинаторные алгоритмы оптимизации. Комбинаторные алгоритмы оптимизации могут быть разделены на два класса: (1) те, которые при схождении гарантированно восстанавливают конфигурацию с глобальным минимумом энергии, и (2) те, которые не гарантируют восстановления конфигурации с глобальным минимумом энергии, но которые всегда дают какое-либо решение. Примеры первого класса алгоритмов включают, но не ограничиваются перечисленными, алгоритм исключения тупиков (Dead-End Elimination, DEE) и метод ветвей и границ (Branch & Bound, B&B) (включая также метод ветвей и завершения, Branch and Terminate) (Gordon & Mayo, 1999, Structure Fold Des 7:1089-98). Примеры алгоритмов второго класса включают, но не ограничиваются ими, алгоритм Монте-Карло (МС), алгоритм самосогласованного поля усредненных величин (Self-consistent mean field, SCMF), алгоритм Больцмана (Metropolis et al., 1953, J Chem Phys 21:1087), имитационный отжиг simulated annealing (Kirkpatrick et al., 1983, Science, 220:671-680), генетический алгоритм (GA) и алгоритм FASTER (Fast and Accurate Side-Chain Topology and Energy Refinement, быстрое и точное уточнение топологии боковых цепей и энергии) (Desmet, et al., 2002, Proteins, 48:31-43). Комбинаторный алгоритм оптимизации можно применять поодиночке или в сочетании с другим комбинаторным алгоритмом оптимизации.
В одном из воплощений настоящего изобретения стратегия применения комбинаторного алгоритма оптимизации состоит в том, чтобы найти конфигурацию глобального минимума энергии. В альтернативном воплощении стратегия состоит в том, чтобы найти одну или несколько последовательностей с низкой энергией или найти благоприятные последовательности. В альтернативном воплощении стратегия состоит в том, чтобы найти конфигурацию глобального минимума энергии, а затем найти одну или несколько последовательностей с низкой энергией или найти благоприятные последовательности. Например, как подчеркнуто в заявке USSN 6269312, предпочтительные воплощения используют алгоритм исключения тупиков (DEE), а затем метод Монте-Карло. В других воплощениях используют алгоритмы поиска табу или их комбинируют с алгоритмом DEE и/или методом Монте-Карло, среди прочих методов поиска (смотри Modem Heuristic Search Methods, изданные V.J.Rayward-Smith et al., 1996, John Wiley & Sons Ltd.; USSN 10/218102; и РСТ WO 02/25588). В другом предпочтительном воплощении может быть использован генетический алгоритм; смотри, например, USSN 09/877695 и USSN 10/071859. Еще в одном примере, наиболее полно описанном в патентных документах US 6188965; US 6269312; US 6403312; USSN 09/782004; USSN 09/927790; USSN 10/218102; РСТ WO 98/07254; РСТ WO 01/40091 и РСТ WO 02/25588, можно достичь глобального оптимума, а затем провести дальнейшую вычислительную обработку, которая приведет к созданию дополнительных оптимизированных последовательностей. В простейшем воплощении конструкторские расчеты не являются комбинаторными. То есть для индивидуальной оценки аминокислотных замен в одном-единственном вариабельном положении применяют энергетические расчеты. Для других расчетов предпочтительно оценивать аминокислотные замены в более чем одном вариабельном положении. В предпочтительном воплощении все возможные энергии взаимодействия рассчитывают перед комбинаторной оптимизацией. В предпочтительном альтернативном воплощении при необходимости энергии могут быть рассчитаны в процессе комбинаторной оптимизации.
Создание библиотек
Настоящее изобретение предоставляет способы создания библиотек, которые затем могут быть отобраны экспериментально для того, чтобы выделить оптимизированные варианты Fc. Термин «библиотека», который используют здесь, означает набор из одного или нескольких вариантов Fc. Библиотека может иметь отношение к набору вариантов в любой форме. В одном из воплощений библиотека представляет собой список последовательностей нуклеиновых кислот или аминокислот, или список замен в вариабельном положении нуклеиновых кислот или аминокислотной последовательности. Например, примеры, приведенные ниже, используемые для иллюстрации настоящего изобретения, предоставляют библиотеки в виде аминокислотных замен в вариабельных положениях. В одном из воплощений библиотека представляет собой список, состоящий, по меньшей мере, из одной последовательности и представляющий варианты Fc, оптимизированные в отношении желаемого свойства. Например, смотри работу Filikov et al., 2002, Protein Sci 11:1452-1461 и Luo et al., 2002, Protein Sci 11:1218-1226. В альтернативном воплощении библиотеку можно определить как комбинаторный список, означающий, что для каждого вариабельного положения создан список аминокислотных замен, с учетом того, что каждая замена должна быть скомбинирована со всеми другими запланированными заменами во всех других вариабельных положениях. В этом случае увеличение комбинаций всех возможностей во всех вариабельных положениях приведет к большой заданной в явном виде библиотеке. Библиотека может иметь отношение к физической композиции полипептидов, которые включают участок Fc, или некоторый домен, или фрагмент участка Fc. Таким образом, библиотека может иметь отношение к физическому строению антител или слитых Fc, как в очищенной, так и неочищенной формах. Библиотека может иметь отношение к физическому строению нуклеиновых кислот, которые кодируют последовательность библиотеки. Указанные выше нуклеиновые кислоты могут быть генами, кодирующими участников библиотеки, генами, кодирующими участников библиотеки вместе с любыми другими функционально связанными нуклеиновыми кислотами, или экспрессионными векторами, кодирующими членов библиотеки вместе с функционально связанными регуляторными последовательностями, селективными маркерами, слитыми конструкциями и/или другими элементами. Например, библиотека может быть набором экспрессионных векторов млекопитающих, которые кодируют участников библиотеки Fc, белковые продукты которых могут быть впоследствии экспрессированы, очищены и подвергнуты экспериментальному скринингу. В другом примере библиотека может быть дисплейной библиотекой. Такая библиотека могла бы, например, включать набор экспрессионных векторов, которые кодируют участников библиотеки, функционально связанных с некоторым партнером по слиянию, которые делают возможным фаговый дисплей, рибосомный дисплей, дрожжевой дисплей, дисплей на поверхностности бактерий и т.п.
Библиотеку можно создать с использованием результирующей последовательности или последовательностей, полученных вычислительным скринингом. Как было описано выше, созданные с помощью вычислений библиотеки значительно обогащены стабильными, правильно уложенными и функциональными последовательностями по сравнению с библиотеками, созданными случайным образом. Как результат, вычислительный скрининг увеличивает шансы идентификации белков, которые оптимизированы в отношении желаемой цели. Набор последовательностей в библиотеке, в основном, но не всегда, значительно отличается от исходной последовательности, хотя в некоторых случаях библиотека содержит исходную последовательность. Как известно в этой области техники, существует множество способов создания библиотеки из результатов расчетов вычислительного скрининга. Например, способы создания библиотек, описанные в патентных документах US 6403312; USSN 09/782004; USSN 09/927790; USSN 10/218102; PCT WO 01/40091 и РСТ WO 02/25588, находят применение в настоящем изобретении. В одном из воплощений в библиотеку могут быть включены последовательности, имеющие балльные оценки в некотором диапазоне относительно последовательности глобального оптимума. Например, в качестве библиотеки можно использовать все последовательности, находящиеся в пределах 10 ккал/моль относительно последовательности с самой низкой энергией. В альтернативном воплощении могут быть использованы последовательности, имеющие балльные оценки, которые попадают в некоторый диапазон относительно последовательностей одного или нескольких локальных минимумов. В предпочтительном воплощении библиотечные последовательности получают из отфильтрованного набора. Такой список или набор может быть получен различными способами, как известно в этой области техники, например с использованием алгоритмов, таких как алгоритм Монте-Карло, В&В или SCMF. Например, первые 103 или 105 последовательностей в отфильтрованном наборе могут составить библиотеку. Альтернативно, общее число последовательностей, определенное с помощью комбинации всех мутаций, может быть использовано в качестве критерия отсечения для библиотеки. Предпочитаемые величины общего числа рекомбинантных последовательностей находятся в промежутке от 10 до 1020, диапазон особенно предпочтительных величин составляет от 100 до 109. Альтернативно, отсечение может осуществляться при достижении определенного количества мутаций в каждом положении. В некоторых воплощениях последовательности, которые не соответствуют критерию отсечения, включают в библиотеку. Это может быть полезным в некоторых случаях, например для оценки подходов к созданию библиотеки, для обеспечения контрольных величин или сравнений или для испытания дополнительного пространства последовательностей. Например, исходная последовательность может быть включена в библиотеку, даже если она не соответствует критерию отсечения.
Алгоритмы кластеризации могут быть полезны для классификации последовательностей, полученных с помощью способов вычислительного скрининга, в репрезентативные группы. Например, способы выделения кластеров и их применение, описанные в патентных документах USSN 10/218102 и РСТ WO 02/25588, находят применение в настоящем изобретении. Репрезентативные группы могут быть составлены, например, на основании сходства. Измерения сходства включают, но не ограничиваются перечисленными, сходство последовательности и энергетическое сходство. Таким образом, результирующие последовательности, полученные с помощью вычислительного скрининга, могут быть сгруппированы вокруг локального минимума и называются здесь кластеризованными наборами последовательностей. Например, наборы последовательностей, которые находятся близко в пространстве последовательностей, можно отличить от других наборов. В одном из воплощений охват внутри одного набора или внутри подмножества кластеризованных наборов может быть максимизировано путем включения в библиотеку некоторого количества, большей части или всех последовательностей, которые составляют один или несколько кластеризованных наборов последовательностей. Например, может быть полезным максимизировать охват в одном, двух или трех самых низкоэнергетических кластеризованных наборах путем включения большей части последовательностей этих наборов в библиотеку. В альтернативном воплощении разнообразие среди кластеризованных наборов последовательностей может быть испытано путем включения в библиотеку только подмножества последовательностей, входящих в каждый кластеризованный набор. Например, все или большая часть кластеризованных наборов могут быть широко проанализированы путем включения в библиотеку последовательности с наименьшей энергией из каждого кластеризованного набора.
Информация о последовательностях может быть использована для контроля или фильтрации результатов вычислительного скрининга при создании библиотеки. Как обсуждалось выше, уровень вариабельности в каком-либо положении и типы аминокислот, которые в естественном состоянии находятся в этом положении, можно наблюдать путем сравнения и противопоставления выравниваний белковых последовательностей. Данные, полученные таким анализом, полезны в настоящем изобретении. Были обсуждены преимущества использования информации о последовательностях, и эти преимущества в равной степени применимы к использованию информации о последовательностях для контроля над созданием библиотек. Набор аминокислот, который наблюдается при выравнивании последовательностей, может рассматриваться как предварительно отобранный эволюцией и имеющий по сравнению с произвольным набором более высокий шанс соответствовать структуре белка, стабильности, растворимости, функции и иммуногенности. Разнообразие источников последовательностей, так же как и способов создания выравнивания последовательностей, которые были обсуждены выше, находят применение при использовании информации о последовательностях для контроля над созданием библиотек. Подобно тому, как было описано выше, для определения важности или веса некоторых остатков в выравнивании могут быть применены различные критерии. Эти способы также находят применение при использовании информации о последовательностях для контроля над созданием библиотек. Использование информации о последовательностях для контроля над созданием библиотек из результатов вычислительного скрининга находит широкое применение в настоящем изобретении. В одном из воплощений информация о последовательностях используется для фильтрации последовательностей, являющихся результатом вычислительного скрининга. То есть некоторые замены удаляют из выходных данных вычислительного скрининга для создания библиотек. Например, выходные данные расчетов вычислительного скрининга или сами расчеты могут быть отфильтрованы таким образом, чтобы библиотека включала в себя только те аминокислоты или подгруппы тех аминокислот, которые отвечают определенным критериям, например, которые наблюдаются в определенном положении при выравнивании последовательностей. В альтернативном воплощении информацию о последовательностях используют для добавления последовательностей в выходные данные вычислительного скрининга. То есть информацию о последовательностях используют для контроля над отбором дополнительных аминокислот, которые добавляют в выходные данные для создания библиотеки. Например, результирующий набор аминокислот для заданного положения, полученный из расчетов вычислительного скрининга, может быть расширен для того, чтобы включить одну или несколько аминокислот, которые наблюдаются в этом положении при выравнивании белковых последовательностей. В альтернативном воплощении на основании информации, полученной при выравнивании последовательностей, можно добавить или удалить из выходных данных вычислительного скрининга одну или несколько аминокислот, чтобы максимально увеличить охват или разнообразие. Например, в библиотеку могут быть добавлены дополнительные аминокислоты со свойствами, сходными с аминокислотами, обнаруженными при выравнивании последовательностей. Например, если обнаружено, что при выравнивании последовательностей в положении находятся незаряженные полярные аминокислоты, то в это положение в библиотеке можно включить дополнительные незаряженные полярные аминокислоты.
Библиотеки могут быть далее обработаны для получения последующих библиотек. В этом случае выходные данные расчетов вычислительного скрининга или расчеты могут рассматриваться как первичная библиотека. Эту первичную библиотеку можно объединить с другими первичными библиотеками, полученными в результате других вычислений, или с другими библиотеками, обработать, применяя последующие расчеты, информацию о последовательностях или другие анализы, или обработать экспериментально для создания следующей библиотеки, которую здесь мы называем вторичной библиотекой. Как будет ясно из этого описания, использование информации о последовательностях для контроля или фильтрации библиотек, обсуждаемых выше, является одним из способов получения вторичных библиотек из первичных библиотек. Создание вторичных библиотек дает пользователю больший контроль над параметрами библиотеки. Это позволяет проводить более эффективный экспериментальный скрининг, а также может позволить осуществлять обратную связь с экспериментальными результатами для более легкой интерпретации, обеспечивая более эффективный цикл разработка/экспериментирование.
Существует большое количество способов создания вторичных библиотек из первичных библиотек. Например, смотри патентные документы USSN 10/218102 и РСТ WO 02/25588, которые описывают способы создания вторичных библиотек, которые находят применение в настоящем изобретении. Обычно существует некоторая стадия отбора, в которой библиотека каким-то образом проходит обработку. Например, в одном из воплощений проводят стадию отбора, в которой для создания вторичной библиотеки выбирают некоторый набор первичных последовательностей. В альтернативном воплощении стадия отбора является вычислительной стадией, опять же в предпочтительном варианте, включающей стадию отбора, в которой выбирают некоторую подгруппу из первичной библиотеки и затем подвергают ее последующему вычислительному анализу, включающему как последующий вычислительный скрининг, так и такие методики, как перетасовка или рекомбинация in silico (смотри, например, патенты US 5830721; US 5811238; US 5605793; и US 5837458), метод ошибающейся ПЦР (error-prone PCR), например, использующий модифицированные нуклеотиды; известные техники мутагенеза, включающие применение мультикассет; и перетасовку ДНК (Crameri et al., 1998, Nature 391:288-291; Coco et al., 2001, Nat Biotechnol 19:354-9; Coco et al., 2002, Nat Biotechnol, 20:1246-50), гетерогенные образцы ДНК (US 5939250); ITCHY (Ostermeier et al., 1999, Nat Biotechnol 17:1205-1209); StEP (Zhao et al., 1998, Nat Biotechnol 16:258-261), GSSM (US 6171820 и US 5965408); гомологичную рекомбинацию in vivo, сборку генов с помощью лигаз, ПЦР комплементарных концов, слитые конструкции РНК-пептид (Roberts & Szostak, 1997, Proc Natl Acad Sci USA 94:12297-12302); дисплей на поверхности клеток дрожжей бактерий (Lu et al., 1995, Biotechnology 13:366-372); Seed & Aruffo, 1987, Proc Natl Acad Sci USA 84(10):3365-3369; Boder & Wittrup, 1997, Nat Biotechnol 15:553-557). В альтернативном воплощении стадия отбора происходит как экспериментальная стадия, например любые из стадий скрининга библиотек, описанные ниже, в которых некоторые подгруппы первичной библиотеки выбирают, а затем экспериментально рекомбинируют, например, с использованием одного из прямых эволюционных методов, описанных ниже, для формирования вторичной библиотеки. В предпочтительном воплощении первичную библиотеку создают и подвергают обработке, как в общих чертах описано в патенте US 6403312.
Создание вторичной и последующих библиотек находит широкое применение в настоящем изобретении. В одном из воплощений различные первичные библиотеки могут быть объединены для создания вторичной или последующих библиотек. В другом воплощении вторичные библиотеки могут быть созданы с помощью испытания разнообразия последовательностей в высокоизменчивых или в высококонсервативных положениях. Первичную библиотеку можно проанализировать, чтобы определить, какие положения аминокислот в белке-шаблоне обладают повышенной частотой мутаций, а какие положения обладают низкой частотой мутаций. Например, положения в белке, которые демонстрируют высокое разнообразие мутаций при вычислительном скрининге, могут быть зафиксированы в последующем цикле расчетов конструирования. Отфильтрованный набор того же размера, что и первый, должен теперь демонстрировать разнообразие в положениях, которые в значительной степени были консервативными в первой библиотеке. Альтернативно, вторичную библиотеку можно создать путем варьирования аминокислот в положениях, которые обладают большим количеством мутаций, в то время как положения, которые не обладают количеством мутаций, превышающем определенную частоту, оставляют неизменными.
Это обсуждение не предназначено для того, чтобы ограничить создание библиотек, следующих после первичных библиотек, вторичными библиотеками. Как будет ясно в дальнейшем, первичные и вторичные библиотеки могут быть далее подвергнуты обработке для создания третичных библиотек, четвертичных библиотек и так далее. В этом случае создание библиотек является итеративным процессом. Например, третичные библиотеки могут быть созданы с помощью различных дополнительных стадий, применяемых к одной или нескольким вторичным библиотекам; например, можно провести дальнейшую вычислительную обработку, вторичные библиотеки можно объединить или можно объединить подгруппы различных вторичных библиотек. В предпочтительном воплощении третичные библиотеки можно создать с помощью объединения вторичных библиотек. Например, первичные и/или вторичные библиотеки, в которых анализировали различные части белка, можно объединить для создания третичной библиотеки, которая интерпретирует объединенные части белка. В альтернативном воплощении варианты из первичной библиотеки можно объединить с вариантами из другой первичной библиотеки, чтобы обеспечить объединенную третичную библиотеку при более низких вычислительных затратах, чем при создании очень длинного отфильтрованного набора. Эти комбинации могут быть использованы, например, для анализа больших белков, в особенности больших мультидоменных белков, примером которых может служить Fc. Таким образом, вышеизложенное описание процесса создания вторичных библиотек подходит для создания любых библиотек, следующих за первичной библиотекой, завершающим результатом будет конечная библиотека, которую можно подвергнуть экспериментальному скринингу для получения белковых вариантов, оптимизированных в отношении запланированных целей. Эти примеры не предназначены для ограничения создания вторичных библиотек каким-либо частным случаем применения или теорией функционирования в настоящем изобретении. Скорее эти примеры предназначены для иллюстрации того, что создание вторичных библиотек и последующих библиотек, таких как третичные библиотеки и так далее, очень полезно в методологии вычислительного скрининга для создания библиотек.
Экспериментальное получение и скрининг
Настоящее изобретение обеспечивает способы получения и скрининга библиотек вариантов Fc. Описанные способы не ограничивают настоящее изобретение каким-либо конкретным применением или теорией функционирования. Скорее, предоставленные способы предназначены проиллюстрировать основные черты того, как можно создать и экспериментально отобрать один или несколько вариантов Fc или одну или несколько библиотек вариантов Fc для того, чтобы получить оптимизированные варианты Fc. Варианты Fc можно получать и подвергать скринингу в любом контексте, либо в контексте участка Fc, как четко определено здесь, либо в контексте домена, или его фрагмента, или более крупных полипептидов, которые включают Fc, например антитело или слитый Fc. Основные методы молекулярной биологии антител, экспрессии, очистки и скрининга описаны в книге Antibody Engineering, под редакцией Duebel & Kontermann, Springer-Verlag, Heidelberg, 2001 и в работе Hayhurst & Georgiou, 2001, Curr Opin Chem Biol 5:683-689; Maynard & Georgiou, 2000, Annu Rev Biomed Eng 2:339-76; Antibodies: A Laboratory Manual by Harlow & Lane, New York: Cold Spring Harbor Laboratory Press, 1968.
В одном из воплощений настоящего изобретения для создания нуклеиновых кислот, которые кодируют последовательности участников библиотеки и которые могут затем быть клонированы в клетки-хозяева, экспрессированы и при необходимости проанализированы, применяли последовательности библиотеки. Следовательно, можно сделать нуклеиновые кислоты и, в частности, ДНК, которые кодируют каждую последовательность белка-члена библиотеки. Эти способы выполняют, применяя хорошо известные процедуры. Например, разнообразные методы, которые могут найти применение в настоящем изобретении, описаны в книге Molecular Cloning - A Laboratory Manual, 3nd Ed. (Maniatis, Cold Spring Harbor Laboratory Press, New York, 2001) и Current Protocols in Molecular Biology (John Wiley & Sons). Как признается специалистами в этой области техники, создание точных последовательностей для библиотек, включающих большое количество последовательностей, потенциально является дорогим делом и требует много времени. Поэтому существует множество технологий, которые можно применять для того, чтобы рационально создавать библиотеки настоящего изобретения. Такие способы, которые могут найти применение в настоящем изобретении, описаны или содержатся в ссылках в патентных документах US 6403312, USSN 09/782004, UCCN 09/927790, USSN 10/218102, PCT WO 01/40091 PCT WO 02/25588. Такие способы включают, но не ограничиваются перечисленными, методы сборки генов, метод на основе ПЦР и методы, включающие вариации ПЦР, методы, основанные на лигазной цепной реакции, методы пулов олигонуклеотидов, например, которые применяются при синтетической перетасовке, методы ошибающейся амплификации и методы, в которых применяют олигонуклеотиды вместе со случайными мутациями, методы классического направленного мутагенеза, кассетный мутагенез и другие способы амплификации и синтеза генов. Как известно в этой области техники, существует множество имеющихся в продаже наборов и методов для сборки генов, мутагенеза, субклонирования в векторах и т.п., и такие продукты могут найти применение в настоящем изобретении для создания нуклеиновых кислот, кодирующих варианты Fc, которые являются членами библиотеки.
Варианты Fc настоящего изобретения можно продуцировать путем культивирования клеток-хозяев, трансформированных нуклеиновой кислотой, предпочтительно экспрессионным вектором, включающим нуклеиновую кислоту, кодирующую варианты Fc, в подходящих условиях для индукции или вызывания экспрессии белка. Условия, подходящие для экспрессии, будут различаться в зависимости от выбора экспрессионного вектора и клетки-хозяина и могут быть легко установлены специалистами в этой области техники путем проведения рутинных экспериментов. Может быть использовано огромное разнообразие подходящих клеток-хозяев, включающих, но не ограниченных перечисленными, клетки млекопитающих, бактерии, клетки насекомых и дрожжей. Например, множество клеточных линий, которые могут найти применение в настоящем изобретении, описаны в каталоге клеточных линий АТСС®, доступном от American Type Culture Collection.
В предпочтительном воплощении варианты Fc экспрессируют в экспрессионных системах млекопитающих, включающих системы, в которых экспрессионные конструкции вводят в клетки млекопитающих, применяя вирусы, например ретровирусы и аденовирусы. Можно использовать любые клетки млекопитающих, но предпочтительно использовать клетки человека, мышей, крыс, хомяков и обезьян. Подходящие клетки включают клетки, известные в научных исследованиях, включающие, но не ограниченные перечисленными, Т-клетки Jurkat, клетки NIH3T3, СНО, COS и 293. В альтернативном предпочтительном воплощении белки библиотеки экспрессируют в бактериальных клетках. Бактериальные экспрессионные системы хорошо известны в этой области техники и включают Escherichia coli (E.coli), Bacillus subtilis, Streptococcus cremoris и Streptococcus lividans. В альтернативных воплощениях варианты Fc продуцируют в клетках насекомых или в клетках дрожжей. В альтернативном воплощении варианты Fc экспрессируют in vitro, применяя бесклеточные системы трансляции. Системы трансляции in vitro, происходящие как из прокариотических клеток (например, клетки E.coli), так и из эукариотических клеток (например, клетки зародышей пшеницы, ретикулоциты кролика), доступны в продаже и могут быть выбраны на основании уровня экспрессии и функциональных свойств интересующего белка. Например, как признается специалистами в этой области техники, трансляция in vitro необходима для некоторых методик дисплея, например для дисплея на рибосомах. Кроме того, варианты Fc можно продуцировать с помощью методов химического синтеза.
Нуклеиновые кислоты, кодирующие варианты Fc настоящего изобретения, могут быть включены в экспрессионный вектор для экспрессии белка. Для экспрессии белков можно применять множество экспрессионных векторов. Экспрессионные векторы могут включать самореплицирующиеся внехромосомные векторы или векторы, которые интегрируются в геном хозяина. Экспрессионные векторы конструируют таким образом, чтобы они были совместимы с типом клетки-хозяина. Таким образом, экспрессионные векторы, которые находят применение в настоящем изобретении, включают, но не ограничиваются перечисленными, те векторы, которые дают возможность осуществлять экспрессию в клетках млекопитающих, бактерий, насекомых, дрожжей и в системах in vitro. Как известно в этой области техники, имеется множество экспрессионных векторов, которые могут найти применение в настоящем изобретении для экспрессии вариантных белков Fc, которые доступны либо в продаже, либо еще каким-либо способом.
Экспрессионные векторы обычно включают белок, функционально связанный с контрольными или регуляторными последовательностями, селективными маркерами и партнерами по слиянию и/или дополнительными элементами. Термин «функционально связанный», используемый здесь, означает, что нуклеиновую кислоту ставят в функциональную зависимость от другой нуклеотидной последовательности. Обычно эти экспрессионные векторы включают транскрипционные или трансляционные регуляторные нуклеиновые кислоты, функционально связанные с нуклеиновой кислотой, кодирующей вариант Fc, и обычно подходят для клеток-хозяев, применяемых для экспрессии белка. В общем, транскрипционные и трансляционные регуляторные последовательности могут включать в себя промоторные последовательности, участки связывания рибосомы, последовательности начала и конца транскрипции, последовательности начала и конца трансляции и энхансерные или активаторные последовательности. Как известно в этой области техники, экспрессионные векторы обычно содержат селективный ген или маркер, позволяющий осуществить селекцию трансформированных клеток-хозяев, содержащих экспрессионный вектор. Селективные гены хорошо известны в этой области техники и будут различаться в зависимости от используемой клетки-хозяина.
Fc варианты могут быть функционально связаны с партнером по слиянию, чтобы обеспечить таргетинг экспрессированного белка, очистку, скрининг, дисплей и т.д. Партнеры по слиянию могут быть присоединены к последовательности варианта Fc с помощью линкерных последовательностей. Последовательность линкера обычно будет включать небольшое количество аминокислот, обычно не превышающее десяти, хотя также можно применять и более длинные линкеры. Обычно последовательности линкеров выбирают таким образом, чтобы они были гибкими и были устойчивыми к деградации. Как признается специалистами в этой области техники, в качестве линкера можно применять любую последовательность из большого их разнообразия. Например, распространенная линкерная последовательность включает аминокислотную последовательность GGGGS (SEQ ID NO:7). Партнер по слиянию может быть последовательностью для таргетинга или сигнальной последовательностью, которая направляет вариантный белок Fc и любой из ассоциированных с ним партнеров по слиянию в желаемое клеточное местоположение или во внеклеточное пространство. Как известно в этой области техники, определенные сигнальные последовательности могут метить белок так, чтобы он секретировался в ростовую среду или в периплазматическое пространство, расположенное между внутренней и внешней мембранами клетки. Партнер по слиянию также может быть последовательностью, кодирующей пептид или белок, который позволяет провести очистку и/или скрининг. Такие партнеры по слиянию включают в себя, но не ограничены перечисленными, полигистидиновые метки (His-tags) (например, Н6 и Н10 или другие метки, используемые в системах аффинной хроматографии на иммобилизованном металле (IMAC) (например, в никелевых аффинных колонках), слитые GST, слитые МВР, метки Strep-tag, последовательности-мишени биотинилирования BSP бактериального фермента BirA и эпитопные метки, являющиеся мишенями антител (например, метки c-myc, метки Flag и т.п.). Как признается специалистами в этой области техники, такие метки могут быть полезными при очистке, скрининге и для того, и другого. Например, вариант Fc может быть очищен с помощью His-метки путем иммобилизации на Ni+2-аффинную колонку, а затем, после очистки, та же самая His-метка может быть использована для иммобилизации антитела на планшете, покрытом Ni+2, для проведения анализа ELISA или других анализов связывания (как описано ниже). Партнер по слиянию может обеспечить применение способа селекции для отбора вариантов Fc (смотри ниже). Партнеры по слиянию, которые обеспечивают возможность применения различных способов селекции, хорошо известны в этой области техники, и все они находят применение в настоящем изобретении. Например, с помощью слияния членов библиотеки вариантов Fc с белковым продуктом гена III можно применять метод фагового дисплея (Кау et al., Phage display of peptides and proteins: a laboratory manual. Academic Press, San Diego, CA, 1996; Lowman et al., 1991, Biochemistry 30:10832-10838; Smith, 1985, Science 228:1315-1317). Партнеры по слиянию могут обеспечить получение меченых вариантов Fc. Альтернативно, партнеры по слиянию могут связываться со специфической последовательностью экспрессионного вектора, обеспечивая возможность партнеру по слиянию и ассоциированному с ним варианту Fc ковалентно или нековалентно связываться с нуклеиновой кислотой, которая их кодирует. Например, патентные документы USSN 09/642574; USSN 10/080376; USSN 09/792630; USSN 10/023208; USSN 09/792626; USSN 10/082671; USSN 09/953351; USSN 10/097100; USSN 60/366658; PCT WO 00/22906; PCT WO 01/49058; PCT WO 02/04852; PCT WO 02/04853; PCT WO 02/08023; PCT WO 01/28702 и PCT WO 02/07466 описывают как раз такого партнера по слиянию и методику, которые могут найти применение в настоящем изобретении.
Способы введения экзогенной нуклеиновой кислоты в клетки-хозяева широко известны в этой области техники и будут изменяться в зависимости от используемых клеток-хозяев. Методики включают в себя, но не ограничиваются перечисленными, трансфекцию, опосредованную декстраном, кальций-фосфатное осаждение, обработку хлоридом кальция, трансфекцию, опосредованную полибреном, слияние протопластов, электропорацию, инфицирование вирусом или фагом, инкапсуляцию полинуклеотида(ов) в липосомы и прямую микроинъекцию ДНК в ядро. В случае клеток млекопитающих трансфекция может быть или временной, или постоянной.
В предпочтительном воплощении вариантные белки Fc очищают или выделяют после экспрессии. Белки можно выделить или очистить с помощью многочисленных способов, известных специалистам в этой области техники. Стандартные способы очистки включают хроматографические методы, включающие обмен ионов, гидрофобные взаимодействия, аффинность, сортировку по размерам или гельфильтрацию и хроматографию с обращенной фазой, которые проводят при атмосферном давлении или при высоком давлении с использованием таких систем, как FPLC и HPLC. Способы очистки также включают электрофорез, иммунологические способы, осаждение, диализ и изоэлектрофокусирование. Также являются полезными ультрафильтрационные и диафильтрационные способы, сопровождающиеся концентрированием белков. Как хорошо известно в этой области техники, разнообразные природные белки связываются с Fc и антителами, и эти белки могут найти применение в настоящем изобретении для очистки вариантов Fc. Например, бактериальные белки А и G связываются с участком Fc. Аналогичным образом, бактериальный белок L связывается с участком Fab некоторых антител, так же как и антиген, являющийся мишенью для антитела. Очистку часто можно проводить при помощи определенного партнера по слиянию. Например, вариантные белки Fc могут быть очищены при помощи глутатионовой смолы, если используется слитый GST; при помощи Ni+2-аффинной хроматографии, если используется His-tag, или при помощи иммобилизированного антитела против метки Flag при применении метки Flag. Для ознакомления с подходящими способами очистки смотри Protein Purification: Principles and Practice, 3rd Ed., Scopes, Springer-Verlag, NY, 1994. Степень необходимой очистки различается в зависимости от способа скрининга или применения вариантов Fc. В некоторых случаях в очистке нет необходимости. Например, в одном из воплощений, если варианты Fc секретируются, скрининг можно проводить прямо из среды. Как известно в этой области техники, некоторые способы селекции не включают очистку белков. Таким образом, например, если библиотеку вариантов Fc создают в виде библиотеки фагового дисплея, очистку белков можно не проводить.
Варианты Fc могут быть отобраны при помощи различных способов, включающих, но не ограниченных перечисленными, способы, в которых применяют анализы in vitro, анализы in vivo, клеточные анализы и селекционные методики. В процедурах скрининга могут применяться автоматические и высокопроизводительные технологии скрининга. В скрининге могут применяться партнер по слиянию или метка. Применение партнера по слиянию обсуждалось выше. Термин «метка» означает здесь, что вариант Fc настоящего изобретения включает в себя один или несколько элементов, изотопов или химических соединений, присоединенных для того, чтобы сделать возможным детектирование при скрининге. В основном, метки бывают трех классов: а) иммунные метки, которые могут быть эпитопом, включенным в качестве партнера по слиянию, который узнается антителом; б) изотопные метки, которые могут быть радиоактивными или тяжелыми изотопами; и в) метки - небольшие молекулы, которые могут включать флуоресцентные или колориметрические красители или молекулы, такие как биотин, который дает возможность использовать другие способы мечения. Метки могут быть включены в соединения в любое положение и могут быть введены in vitro или in vivo во время экспрессии белка.
В предпочтительном воплощении в анализе in vitro отбирают функциональные и/или биофизические свойства вариантов Fc. Анализы in vitro предоставляют широкое поле для скрининга интересующих свойств. Свойства вариантов Fc, которые могут быть отобраны, включают в себя, но не ограничиваются перечисленными, стабильность, растворимость и аффинность к лигандам Fc, например к FcγR. Множество свойств можно отбирать одновременно или по отдельности. Белки могут быть очищенными или неочищенными в зависимости от требований, предъявляемых к анализу. В одном из воплощений отбором является качественный или количественный анализ связывания вариантов Fc с белковой или небелковой молекулой, для которой известно или предполагается, что она связывается с вариантом Fc. В предпочтительном воплощении отбор представляет собой анализ измерения связывания с антигеном-мишенью для антител или слитых Fc. В альтернативном предпочтительном воплощении отбор представляет собой анализ связывания вариантов Fc с лигандом Fc, включающим, но не ограниченным перечисленными, семейство FcγR, неонатальный рецептор FcRn, белок комплемента C1q и белки А и G бактерий. Указанные лиганды Fc могут происходить из любого организма, но предпочтительными являются лиганды Fc из человека, мышей, крыс, кроликов и обезьян. Анализы связывания могут быть проведены с применением целого ряда способов, известных в этой области техники, включающих, но не ограниченных перечисленными, анализы, основанные на FRET (резонансный перенос энергии флуоресценции) и BRET (резонансный перенос энергии биолюминесценции), AlphaScreen™ (гомогенный анализ близости с применением усиленной люминесценции), сцинтилляционный анализ близости, ELISA (иммуноферментный анализ), SPR (поверхностно-плазмонной резонанс, также известный как BIACORE®), калориметрию изотермического титрования, дифференциальную сканирующую калориметрию, гель-электрофорез и хроматографию, включающую гельфильтрацию. Эти и другие способы могут использовать преимущества некоторых партнеров по слиянию или меток вариантов Fc. В анализах могут быть использованы разнообразные способы детекции, включающие, но не ограниченные перечисленными, хромогенные, флуоресцентные, люминесцентные и изотопные метки.
Биофизические свойства вариантных белков Fc, например стабильность или растворимость, могут быть отобраны с помощью разнообразных способов, известных в этой области техники. Стабильность белка можно определить с помощью измерения термодинамического равновесия между уложенным и развернутым состояниями. Например, вариантные белки Fc настоящего изобретения могут быть развернуты с помощью химического денатурирующего соединения, нагревания или рН, и за этим переходом можно следить с помощью способов, включающих, но не ограниченных перечисленными, спектроскопию кругового дихроизма, флуоресцентную спектроскопию, абсорбционную спектроскопию, спектроскопию ЯМР, калориметрию и протеолиз. Как признано специалистами в этой области техники, кинетические параметры переходов уложенного и развернутого состояния также могут быть прослежены с помощью этих и других технологий. Растворимость и общая структурная целостность вариантного белка Fc может быть охарактеризована качественно и количественно с помощью широкого спектра способов, известных в этой области техники. Способы, которые могут найти применение в настоящем изобретении для характеристики биофизических свойств вариантных белков Fc, включают гель-электрофорез, хроматографию, такую как эксклюзионную хроматографию и обращенно-фазовую высокоэффективную жидкостную хроматографию, масс-спектрометрию, ультрафиолетовую абсорбционную спектроскопию, флуоресцентную спектроскопию, спектроскопию кругового дихроизма, калориметрию изотермического титрования, дифференциальную сканирующую калориметрию, аналитическое ультрацентрифугирование, динамическое светорассеяние, протеолиз и межмолекулярное сшивание, измерение мутности, анализ задержки на фильтре, иммунологические анализы, анализ связывания флуоресцентных красителей, анализ окрашивания белков, микроскопию и детекцию агрегатов с помощью анализа ELISA или другого анализа связывания. Возможен также структурный анализ с применением кристаллографических методов, использующих рентгеновские лучи, и ЯМР-спектроскопии. В одном из воплощений стабильность и/или растворимость могут быть измерены путем определения количества белкового раствора после прохождения определенного периода времени. В этом анализе белок может подвергаться или не подвергаться каким-либо экстремальным условиям, например повышению температуры, низким значениям рН или воздействию денатурирующего средства. Так как обычно для функции необходим стабильный, растворимый и/или правильно уложенный/структурированный белок, указанные функциональные анализы и анализы связывания также обеспечивают возможность выполнить такое измерение. Например, раствор, включающий вариант Fc, мог бы быть проанализирован на его способность связывать антиген-мишень, затем подвергнут нагреванию в течение одного или нескольких установленных промежутков времени и снова проанализирован на связывание с антигеном. Так как не ожидается, что развернутый и агрегированный белок способен связывать антиген, величина остаточной активности позволяет измерить стабильность и растворимость вариантов Fc.
В предпочтительном воплощении библиотеку отбирают, применяя один или несколько анализов на основе клеток или анализов in vivo. Для таких анализов вариантные белки Fc, очищенные или неочищенные, обычно добавляют экзогенно, так чтобы клетки были подвергнуты воздействию определенного варианта или пула вариантов, принадлежащих библиотеке. Эти анализы обычно, но не всегда, основаны на функции антител или слитых Fc, включающих вариант Fc, которая представляет собой способность антитела или слитого Fc связывать антиген-мишень и опосредовать некоторые биохимические события, например эффекторную функцию, ингибирование связывания лиганда/рецептора, апоптоз и т.п. Такие способы часто включают мониторинг ответа клеток на антитело или слитый Fc, например, такого как выживание клеток, клеточная смерть, изменение в клеточной морфологии или активация транскрипции, например клеточная экспрессия природного гена или репортерного гена. Например, в таких анализах можно измерять способность вариантов Fc вызывать ADCC, ADCP или CDC. Для некоторых анализов, кроме клеток-мишеней, необходимо добавлять дополнительные клетки или компоненты, например сывороточный комплемент или эффекторные клетки, такие как моноциты периферической крови (РВМС), натуральные клетки-киллеры NK, макрофаги и др. Такие дополнительные клетки могут происходить из любого организма, но предпочтительно, чтобы они были клетками человека, мышей, крыс, кроликов и обезьян. Антитела и слитые Fc могут вызвать апоптоз некоторых клеточных линий, экспрессирующих антиген-мишень для этих антител, или они могут опосредовать атаку на клетки-мишени с помощью иммунных клеток, которые были добавлены для анализа. В этой области техники известны способы мониторинга клеточной смерти или жизнеспособности, и они включают применение красителей, иммунохимических, цитохимических и радиоактивных реагентов. Например, анализ с окрашиванием каспаз дает возможность измерять уровень апоптоза, а поглощение и высвобождение радиоактивных субстратов или флуоресцентных красителей, таких как Аламаровый синий, позволяет наблюдать за клеточным ростом или клеточной активацией. В предпочтительном воплощении применяют способ анализа цитотоксичности DELFIA®EuTDA-based cytotoxicity assay (Perkin Elmer, MA). Альтернативно, за мертвыми или поврежденными клетками-мишенями можно следить с помощью высвобождения одного или нескольких природных внутриклеточных белков, например лактатдегидрогеназы. Активация транскрипции также может служить способом анализа функции в клеточных измерениях. В этом случае за ответом можно следить с помощью природных генов или белков, которые могут регулироваться с помощью активации, например можно измерить высвобождение определенных интерлейкинов, или, альтернативно, ответ может быть опосредован репортерной конструкцией. Клеточные анализы могут также включать измерение морфологических изменений клеток в ответ на присутствие варианта Fc. Типы клеток в таких анализах могут быть прокариотическими или эукариотическими, и можно применять разнообразные клеточные линии, которые известны в этой области техники.
Альтернативно, отбор с использованием клеток проводят с помощью клеток, которые были трансформированы или трансфицированы с помощью нуклеиновой кислоты, кодирующей варианты Fc. То есть вариантные белки Fc не добавляют экзогенно к клеткам. Например, в одном из воплощений в отборе, основанном на применении клеток, применяют метод дисплея на клеточной поверхности. Можно применять партнера по слиянию, который делает возможным дисплей вариантов Fc на поверхности клеток (Witrrup, 2001, Curr Opin Biotechnol, 12:395-399). Способы дисплея на клеточной поверхности, которые находят применение в настоящем изобретении, включают, но не ограничиваются перечисленными, дисплей на бактериях (Georgiou et al., 1997. Nat Biotechnol 15:29-34; Geourgiou et al., 1993, Trends Biotechnol 11:6-10; Lee et al., 2000, Nat Biotechnol 18:645-648; Jun et al., 1998, Nat Biotechnol 16:576-80), на дрожжах (Boder & Wittrup, 2000, Methods Enzymol 328:430-44; Boder & Wittmp, 1997, Nat Biotechnol 15:653-557), на клетках млекопитающих (Whitehorn et al., 1995, Biotechnology 13:1215-1219). В альтернативном воплощении вариантные белки Fc не представляются на клеточной поверхности, а предпочтительно отбираются внутриклеточно или в некоторых других клеточных компартментах. Например, в настоящем изобретении могут найти применение экспрессия в периплазме и цитометрический скрининг (Chen et al., 2001, Nat Biotechnol 19:537-542), метод комплементации фрагментов белка (Johnsson & Varshavsky, 1994, Proc Natl Acad Sci USA 91:10340-10344., Pelletier at al., 1998, Proc Natl Acad Sci USA 95:12141-12146) и скрининг дрожжевых двойных гибридов (Fields & Song, 1989, Nature 340:245-246). Альтернативно, если полипептид, который включает варианты Fc, например антитело или слитый Fc, наделяет клетки некоторыми преимуществами селективного роста, то такое свойство может быть использовано для скрининга или отбора вариантов Fc.
Как известно в этой области техники, подгруппа способов скрининга позволяет отбирать полезных участников библиотеки. Указанные способы здесь обозначаются как "способы селекции", и эти способы находят применение в настоящем изобретении для скрининга библиотек вариантов Fc. Если библиотеки подвергают скринингу с помощью способа селекции, то размножают, выделяют и наблюдают только тех участников библиотеки, которые являются полезными, то есть которые отвечают определенным критериям селекции. Считают, что в связи с получением только наиболее подходящих вариантов такие способы позволяют осуществлять скрининг библиотек, которые более масштабны по сравнению с библиотеками, которые отбирают с помощью способов, анализирующих индивидуальную пригодность участников библиотеки. Селекцию можно осуществить любым способом, методикой или с помощью партнера по слиянию, который ковалентно или нековалентно связывает фенотип варианта Fc с его генотипом, то есть функцию варианта Fc с нуклеиновой кислотой, которая его кодирует. Например, использование в качестве способа селекции метода фагового дисплея становится возможным при слиянии участников библиотеки с белком гена III. В этом случае селекцию или получение вариантных белков, которые соответствуют определенным критериям, например аффинности связывания с FcγR, применяют для отбора или получения нуклеиновой кислоты, которая их кодирует. После выделения ген или гены, кодирующие варианты Fc, могут быть впоследствии амплифицированы. Этот процесс выделения и амплификации, обозначаемый как пэннинг, может быть повторен и позволяет обогатить библиотеку полезными вариантами Fc. В конце концов, секвенирование присоединенной нуклеиновой кислоты позволяет идентифицировать ген.
В этой области техники известно множество способов селекции, которые можно применять в настоящем изобретении для скрининга библиотек вариантов Fc. Они включают, но не ограничиваются перечисленными способами, метод фагового дисплея (Phage display of peptides and proteins: a laboratory manual, Kay et al., 1996 Academec Press, San Diego, CA, 1996; Lowman et al., 1991, Biochemistry 30:10832-10838; Smith, 1985, Science 228:1315-1317) и его модификации, такие как метод селективного инфицирования фагом (Malmborg et al., 1997, J Mol Biol 273:544-551), метод селективного инфицирующего фага (Krebber et al., 1997, J Mol Biol 268:619-630) и пэннинг запаздывающей инфективности (Benhar et al., 200, J Mol Biol 301:893-904), дисплей на клеточной поверхности (Wittrup, 2001, Curr Opin Biotechnol, 12:395-399), дисплей на бактериях (Georgiou et al., 1997, Nat Biotechnol 15:29-34; Geourgiou et al., 1993, Trends Biotechnol 11:6-10; Lee et al., 2000, Nat Biotechnol 18:645-648; Jun et al., 1998, Nat Biotechnol 16:576-80), на дрожжах (Boder & Wittrup, 2000, Methods Enzymol 328:430-44; Boder & Wittrup, 1997, Nat Biotechnol 15:553-557) и на клетках млекопитающих (Whitehom et al., 1995, Biotechnology 13:1215-1219), a также технологии дисплея in vitro (Amstutz et al., 2001, Curr Opin Biotechnol 12:400-405), такие как дисплей на полисомах (Matheakis et al., 1994, Proc Natl Acad Sci USA 91:9022-9026), дисплей на рибосомах (Hanes et al., 1997 Proc Natl Acad Sci USA 94:4937-4942), дисплей на мРНК (Roberts & Szostak, 1997, Proc Natl Acad Sci USA 94:12297-12302; Nemoto et al., 1997, FEBS Lett 414:405-408) и система дисплея инактивации рибосомы (Zhow et al., 2002, J Am Chem Soc 124:538-543).
Другие способы селекции, которые могут найти применение в настоящем изобретении, которые не зависят от дисплея, такие как способы in vivo, включающие, но не ограниченные перечисленными, экспрессию в периплазме и цитометрический скрининг (Chen et al., 2001, Nat Biotechnol 19:537-542), анализ комплементации белковых фрагментов (Johnsson & Varshavsky, 1994, Proc Natl Acad Sci USA 91:10340-10344; Pelletier et al., Proc Natl Acad Sci USA 95:12141-12146) и скрининг дрожжевых двойных гибридов (Fields & Song, 1989, Nature 340:245-246), применяемый в селективном режиме (Visintin et al., 1999, Proc Natl Acad Sci USA 96:11723-11728). В альтернативном воплощении селекцию возможно проводить с помощью партнера по слиянию, который связывается со специфической последовательностью экспрессионного вектора, таким образом ковалентно или нековалентно связывая партнера по слиянию и ассоциированного с ним члена библиотеки вариантов Fc с нуклеиновой кислотой, кодирующей их. Например, патентные документы USSN 09/642574; USSN 10/080376; USSN 09/792630; USSN 10/023208; USSN 09/792626; USSN 10/082671; USSN 09/953351; USSN 10/097100; USSN 60/366658; PCT WO 00/22906; PCT WO 01/49058; PCT WO 02/04852; PCT WO 02/04853; PCT WO 02/08023; PCT WO 01/28702 и РСТ WO 02/07466 описывают такого партнера по слиянию и технику, которая может найти применение в настоящем изобретении. В альтернативном воплощении селекция in vivo может происходить в том случае, если полипептид, включающий вариант Fc, такой как антитело или слитый Fс, наделяет клетки некоторыми преимуществами роста, воспроизведения или выживаемости.
Подгруппа способов селекции, обозначаемых как "направленная эволюция", представляет собой способы, которые включают соединение или скрещивание полезных последовательностей во время селекции, иногда с помощью включения новых мутаций. Как признается специалистами в этой области техники, способы направленной эволюции могут способствовать идентификации наиболее полезных последовательностей библиотеки и могут увеличивать разнообразие отбираемых последовательностей. В этой области техники известно множество способов направленной эволюции, которые могут найти применение в настоящем изобретении для скрининга библиотек вариантов Fс и которые включают, но не ограничиваются перечисленными, перетасовку ДНК (РСТ WO 00/42561 A3; РСТ WO 01/70347 A3), перетасовку экзонов (US 6365377; Kolkman & Stemmer, 2001, Nat Biotechnol 19:423-428), перетасовку семейства (Crameri et al., 1998, Nature 391:288-291; US 6376246), RACHITT™ (Coco et al, 2001, Nat Biotechnol 19:354-359; PCT WO 02/06469), STEP и случайный прайминг рекомбинации in vitro (Zhao et al., 1998, Nat Biotechnol 16:258-261; Shao et al., 1998, Nucleic Acids Res 26:681-683), сборку генов, зависимую от экзонуклеазы (US 6352842; US 6361974), метод Gene Site Saturation Mutagenesis™ (US 6358709), метод Gene Reassembly™ (US 6358709), SCRATCHY (Lutz et al., 2001, Proc Natl Acad Sci USA 98:11248-11253), способы фрагментации ДНК (Kikuchi et al., Gene 236:159-167), перетасовку одноцепочечной ДНК (Kikuchi et al., 2000, Gene 243:133-137) и технологию конструирования белков направленной эволюцией AMEsystem™ (прикладная молекулярная эволюция) (US 5824514; US 5817483; US 5814476; US 5763192; US 5723323).
Биологические свойства антител и слитых Fc, которые включают варианты Fc настоящего изобретения, можно охарактеризовать в экспериментах на клетках, тканях или целом организме. Как известно в этой области техники, лекарственные препараты часто испытывают на животных, включающих, но не ограниченных перечисленными, мышей, крыс, кроликов, собак, кошек, свиней и обезьян, для того, чтобы определить эффективность лекарств для лечения болезней или в моделях заболеваний; или чтобы измерить фармакокинетику, токсичность и другие свойства. Указанные животные могут обозначаться как модели заболеваний. Терапевтические средства часто испытывают на мышах, включающих, но не ограниченных перечисленными, безволосых мышей, мышей SCID, ксенотрансплантантных мышей и трансгенных мышей (включая нокины и нокауты). Например, антитело или слитый Fc настоящего изобретения, которые предназначены в качестве противораковых терапевтических средств, могут быть испытаны на модели мыши с раковым заболеванием, например на ксенотрансплантантной мыши. В этом способе опухоль или линию клеток опухоли прививают или вводят с помощью инъекции в мышь и впоследствии мышь лечат с помощью терапевтического средства для того, чтобы определить способность антитела или слитого Fc уменьшать или подавлять рост опухоли. Такой эксперимент может предоставить очень важные сведения для определения потенциала указанного антитела или слитого Fc при использовании в качестве терапевтического средства. Любой организм, желательно млекопитающее, может быть использован в испытаниях. Например, в связи с тем, что генетически обезьяны схожи с человеком, они могут быть подходящими терапевтическими моделями и, таким образом, могут быть использованы для тестирования эффективности, токсичности, фармакокинетики или других свойств антител и слитых Fc настоящего изобретения. Для апробации в качестве лекарственных средств в конечном итоге требуются испытания антител и слитых Fc настоящего изобретения на людях, и, конечно, поэтому такие эксперименты предусмотрены. Таким образом, антитела и слитые Fc настоящего изобретения могут быть испытаны на людях для определения терапевтической эффективности, токсичности, фармакокинетики и/или других клинических свойств.
Примеры
Ниже представлены примеры, иллюстрирующие настоящее изобретение. Это не означает, что приведенные примеры ограничивают объем настоящего изобретения любыми частными способами применения или теориями функционирования.
Во всех положениях, обсуждаемых в настоящем изобретении, нумерация соответствует индексу EU в базе данных Kabat (Kabat et at., 1991, Sequences of Proteins of Immunological Interest, 5 th Ed., United States Public Health Service, National Institutes of Health, Bethesda). Специалисты в этой области техники признают, что эта договоренность включает непоследовательную нумерацию в определенных областях последовательности иммуноглобулинов, что позволяет нормировать ссылки относительно консервативных положений в семействах иммуноглобулинов. Таким образом, положения любого предоставленного иммуноглобулина, определяемые с помощью индекса EU, не обязательно совпадают с последовательной нумерацией. Фигура 3 демонстрирует схемы последовательной нумерации и нумерации в соответствии с индексом EU для антитела алемтузумаба, чтобы проиллюстрировать этоп принцип более четко. Необходимо также отметить, что в некоторых положениях Fc по системе Kabat, включающих, но не ограниченных перечисленными: 270, 272, 312, 315, 356, 358, наблюдался полиморфизм, и, таким образом, возможны небольшие различия между последовательностью настоящего изобретения и последовательностями, ранее опубликованными в научной литературе.
Пример 1. Вычислительный скрининг и разработка библиотек Fc
Расчеты вычислительного скрининга проводили для разработки оптимизированных вариантов Fc. Варианты Fc были отобраны с помощью вычислительного скрининга, сконструированы и экспериментально исследованы с помощью нескольких циклов вычисление/эксперимент. Для каждого успешного цикла экспериментальные данные обеспечивали обратную связь со следующим набором расчетов вычислительного скрининга и конструирования библиотек. Все расчеты вычислительного скрининга и разработка библиотек представлены в Примере 1. Для каждого набора расчетов представлена таблица, в которой отображены результаты и приведена релевантная информация и параметры.
В качестве шаблонной структуры для расчетов компьютерного скрининга применяют несколько различных структур Fc, связанного с внеклеточным доменом FcγR. Общедоступные структуры комплекса Fc/FcγR включали код доступа в базе данных PDB 1Е4К (Sondermann et al., 2000, Nature 406:267-273) и коды доступа в базе данных PDB 1IIS и 1IIX (Radaev at al., 2001, J Biol Chem 276:16469-16477). Внеклеточные участки FcγRIIIb и FCγRIIIa на 96% идентичны, и поэтому использование структуры Fc/FcγRIIIb практически эквивалентно использованию FcγRIIIa. Однако для некоторых расчетов с помощью моделирования мутации D129G в структурах 1IIS и 1Е4К (относящихся к шаблонным структурам D129G 1IIS и 1Е4К) была сконструирована более точная шаблонная структура Fс/FсγRIIIа. Кроме того, структуры Fc человека, связанного с внеклеточным доменом FcγRIIb человека, F158 FcγRIIIa человека и FcγRIII мыши были смоделированы с использованием стандартных методов, доступной информации о последовательности FcγR, указанных структур Fc/FcγR, а также информации о структуре несвязанных комплексов (код доступа в базе данных PDB 1H9V) (Sondermann et al., 2001, J Mol Biol 309:737-749) (код доступа в базе данных PDB 1FCG) (Maxwell et al., 1999, Nat Struct Biol 6:437-442), FcγRIIb (код доступа в базе данных PDB 2FCB) (Sondermann et al., 1999, Embo J 18:1095-1103) и FcγRIIIb (код доступа в базе данных PDB 1E4J) (Sodermann et al., 2000, Nature 406:267-273).
Вариабельные положения и аминокислоты, рассматриваемые в этих положениях, были выбраны при помощи визуального осмотра упомянутых выше структур Fc/FcγR и FcγR и при помощи информации о доступности для растворителя и последовательности. Информация о последовательностях Fcs и FcγR была особенно полезной при определении вариабельных положений, замены в которых могли обеспечить различающиеся аффинности для активирующих и ингибирующих рецепторов. Фактически все положения Сγ2 подвергали вычислительному скринингу. Структура Fс представляет собой гомодимер, состоящий из двух тяжелых цепей (отмеченные цепи А и B в структурах 1IIS, 1IIX и 1Е4К), каждая из которых включает шарнирный участок и домены Cγ2-Cγ3 (показано на фигуре 2). Так как FcγR (помеченная цепь С в структурах 1IIS, 1IIX и 1Е4К) связывается ассиметрично с гомодимером Fc, каждая цепь при конструкторских расчетах часто рассматривалась по отдельности. Для некоторых расчетов остатки Fc и/или FcγR, расположенные наиболее близко к остаткам в вариабельных положениях, были «плавающими», то есть для конформационных корректировок в расчетах конструкции белка было разрешено изменять конформацию аминокислоты, но не идентичность аминокислоты. Ниже приведена таблица для каждой значимой серии расчетов. Рассматриваемые аминокислоты обычно принадлежали к группам Core, Core XM, Surface, Boundary, Boundary XM и All 20, если специально не указано что-нибудь другое. Эти группы определяются следующим образом: Core (сердцевина) = аланин, валин, изолейцин, лейцин, фенилаланин, тирозин, триптофан и метионин; Core XM = аланин, валин, изолейцин, лейцин, фенилаланин, тирозин и триптофан; Surface (поверхность) = аланин, серин, треонин, аспарагиновая кислота, аспарагин, глутамин, глутаминовая кислота, аргинин, лизин и гистидин; Boundary (граница раздела) = аланин, серин, треонин, аспарагиновая кислота, аспарагин, глутамин, глутаминовая кислота, аргинин, лизин, гистидин, валин, изолейцин, лейцин, фенилаланин, тирозин, триптофан и метионин; Boundary XM = Boundary = аланин, серин, треонин, аспарагиновая кислота, аспарагин, глутамин, глутаминовая кислота, аргинин, лизин, гистидин, валин, изолейцин, лейцин, фенилаланин, тирозин и триптофан; АН 20 = все 20 природных аминокислот.
Большинство расчетов проводили в соответствии с одним или двумя основными типами способов вычислительного скрининга. В одном из способов конформацию аминокислот в вариабельных положениях представляли в виде набора ротамеров боковых цепей, не зависящих от основной цепи, которые получали из библиотеки ротамеров Dunbrack & Cohen (Dunbrack et al., 1987, Protein Sci 6:1661-1681). Энергии всех возможных комбинаций рассматриваемых аминокислот в выбранных вариабельных положениях были рассчитаны, используя термины силового поля, описывающие ван-дер-ваальсовы, сольватационные, электростатические взаимодействия и взаимодействие через водородные связи, и оптимальную (основное состояние) последовательность определяли, используя алгоритм исключения тупиков (Dead End Elimination, DEE). Как принято специалистами в этой области техники, последовательность с предсказанной минимальной энергией необязательно на самом деле будет иметь минимальную энергию из-за ошибок, главным образом, в оценочной функции, сопряженных с тем, что едва определяемые конформационные различия в белках могут привести к драматическим различиям в стабильности. Однако вероятно, что предсказанная последовательность основного состояния ближе к реальному основному состоянию; таким образом, можно исследовать дополнительное множество полезных последовательностей с помощью оценки энергии последовательностей, которые находятся близко в пространстве последовательностей, и по энергии вокруг предсказанного основного состояния. Чтобы достичь этого, а также создать множество последовательностей для библиотеки, для оценки энергий 1000 похожих последовательностей вокруг предсказанного основного состояния был использован алгоритм Монте-Карло (МС). Число последовательностей из набора из 1000 последовательностей, которые включают ту самую аминокислоту в том самом вариабельном положении, обозначается как заселенность для такой замены, и это число может отражать, насколько предпочтительной является это замена. Этот вычислительный способ скрининга в значительной степени близок к методу Protein Design Automation® (PDA®), как описано в патентах US 6188965; US 6269312; US 6403312; USSN 09/782004; USSN 09/927790; USSN 10/218102; PCT WO 98/07254; PCT WO 01/40091 и PCT WO 02/25558, и для облегчения описания во всех примерах называется PDA® технологией. Таблицы, представляющие эти расчеты, приводят для каждого вариабельного положения на обозначенной цепи (столбец 1) аминокислоты, рассматриваемые в каждом вариабельном положении (столбец 2), идентичность аминокислоты Fc WT в каждом вариабельном положении (столбец 3), идентичность аминокислоты в каждом вариабельном положении последовательности основного состояния согласно алгоритму DEE (столбец 4) и набор аминокислот и соответствующую заселенность, которые наблюдаются в выходных данных алгоритма Монте-Карло (столбец 5). Например, в первой строке таблицы 1, приведенной ниже, если положение 328 изменяют, используя аминокислоты границы раздела в виде набора вариабельных остатков для этого положения, аминокислота L, встречающаяся 330 раз, стоит на первом месте среди 1000 последовательностей, М встречается 302 раза и т.д.
В других расчетах использовали генетический алгоритм (GA) для отбора низкоэнергетических последовательностей, причем энергии рассчитывали во время каждого цикла «эволюции» для тех последовательностей, которые отбирались для анализа. Конформации аминокислот в вариабельных и «плавающих» положениях были представлены в виде набора ротамеров боковых цепей, которые получали из библиотеки независимых от основной цепи ротамеров, используя модель гибкого ротамера (Mendes et al., 1999, Proteins 37:530-543). Энергии рассчитывали, используя термины силового поля, описывающие ван-дер-ваальсовы, сольватационные, электростатические взаимодействия и взаимодействие через водородные связи. Эти расчеты привели к получению списка из 300 последовательностей, для которых было предсказано, что они являются низкоэнергетическими. Чтобы облегчить анализ этих результатов и создание библиотеки, 300 результирующих последовательностей были кластеризованы с помощью вычислений в 10 групп со сходными последовательностями, используя алгоритм иерархического группирования ближайших соседей, связанных одной связью, чтобы отнести последовательности к соответствующим группам на основе оценки сходства (Diamond, 1995, Acta Cryst D51:127-135). To есть все последовательности внутри группы являются более похожими на все другие последовательности внутри одной и той же группы и менее похожи на последовательности из других групп. Последовательность с самой низкой энергией из каждой из этих десяти групп используется как типичный представитель каждой группы и представляется в качестве результатов. Этот способ вычислительного скрининга в значительной степени похож на технологию Sequence Prediction Algorithm™ (SPA™), как описано в работе (Raha et al., 2000, Protein Sci 9:1106-1119); USSN 09/877, 695 и USSN 10/071,859, и для простоты описания в примерах называется технологией SPA™. Таблицы, в которых представлены результаты таких расчетов, представляют для каждого вариабельного положения на обозначенной цепи (столбец 1) аминокислоты, рассматриваемые в каждом вариабельном положении (столбец 2), идентичность аминокислоты Fc WT в каждом вариабельном положении (столбец 3) и идентичность аминокислоты в вариабельных положениях для последовательности с самой низкой энергией из каждой кластеризованной группы (столбцы 4-13).
Вычислительный скрининг был применен для конструирования энергетически предпочтительных взаимодействий на поверхности контакта Fc/FcγR в группах вариабельных положений, которые опосредуют или потенциально опосредуют связывание с FcγR. Так как поверхность связывания включает большое количество остатков Fc на двух различных цепях и так как FcγR связывается с Fc несимметрично, остатки были сгруппированы в различные наборы взаимодействующих вариабельных положений и конструировались в раздельных сериях расчетов. Во многих случаях эти наборы выбирали как группы остатков, которые считались связанными, то есть энергия одного или нескольких остатков зависела от идентичности одного или нескольких других остатков. Использовали различные шаблонные структуры, и во многих случаях в расчетах исследовали замены на обеих цепях. Для многих наборов вариабельных положений расчеты выполняли с использованием обоих способов вычислительного скрининга, PDA™- и SPA™-технологий. Результаты этих расчетов и релевантность представлены ниже в таблицах 1-30. Релевантные параметры и информация, включающие сведения об использованном способе вычислительного скрининга, использованной шаблонной структуре, сведения о том, имела или нет в своем составе эта структура углевод и какие остатки могли бы быть «плавающими», представлены под каждой таблицей. Например, таблица 2 представляет результаты расчетов, сделанных с помощью метода PDA™, в которых остатки 120,132 и 134 на цепи С (рецептор FcγR) были «плавающими».
В композиции настоящего изобретения включены антитела, в состав которых входят любые из перечисленных аминокислотных остатков, находящихся в перечисленных положениях, либо сами по себе, либо в любой комбинации (характерные предпочтительные комбинации перечислены в формуле изобретения, разделе «Раскрытие изобретения» и на чертежах). Одной из предпочтительных комбинаций являются перечисленные аминокислотные остатки в перечисленных положениях в основном состоянии (иногда называемом здесь «глобальным решением», отличающемся от дикого типа). Кроме того, также включены комбинации из числа белков, рассчитанных при помощи SPA™, представленных как внутри одних и тех же таблиц, так и в разных таблицах. Следует отметить, что предполагается, что остатки, не перечисленные в данных таблицах, не изменялись и, таким образом, оставались диким типом. Например, по данным расчетов SPA™, представленным в таблице 4, столбец 4 (представляющий кластер 1) показывает, что белок с шестью перечисленными аминокислотами в шести перечисленных положениях (например, столбец 4) является единственным белком с последовательностью дикого типа, за исключением 239Е, 265G, 267S, 269Y и 299S). Таким образом, каждый из этих индивидуальных белков включен в настоящее изобретение. Альтернативно, положения остатков и отдельных аминокислот в тех положениях можно комбинировать между столбцами внутри таблицы или между таблицами. Кроме того, необходимо отметить, что хотя в каждой таблице указано, присутствует или нет углевод, присутствие или отсутствие указанных атомов в расчетах вычислительного скрининга не означает, что варианты Fc, разработанные с помощью таких вычислений, предполагается применять только к агликозилированному или гликозилированному Fc. Таким образом, хотя расчеты, приведенные в таблице 1, были выполнены в отсутствие углеводных атомов в шаблонной структуре, результирующие предсказанные замены могут быть полезными в гликозилированном или агликозилированном антителе или слитом Fc.
Целью расчетов вычислительного скрининга при конструировании вариантов Fc было оптимизировать конформацию углевода при N297 и домена Cγ2. С помощью исследования предпочтительных замен в положениях, которые взаимодействуют с углеводом, можно сконструировать варианты, которые представляют собой образцы новых, потенциально предпочтительных конформаций углеводов. Остатки Fc F241, F243, V262 и V264 опосредуют взаимодействие Fc/углевод и, таким образом, являются положениями-мишенями. Результаты этих конструкторских расчетов приведены в таблице 28.
Целью расчетов вычислительного скрининга при конструировании вариантов Fc было оптимизировать угол между доменами Сγ3 и Сγ2. Оказалось, что остатки Р244, Р245, Р247 и W313, которые находятся на поверхности контакта Сγ2/Сγ3, играют ключевую роль в определении угла между Сγ2-Сγ3 и подвижности доменов относительно друг друга. С помощью исследования предпочтительных замен в этих положениях можно сконструировать варианты, которые представляют собой образцы новых, потенциально предпочтительных углов и уровней подвижности. Результаты этих конструкторских расчетов приведены в таблице 29.
Дополнительно к приведенным выше расчетам, выполненным с помощью способов вычислительного скрининга PDA® и SPA™, чтобы с помощью вычислений отобрать варианты Fc, были использованы дополнительные расчеты, использовавшие только электростатический потенциал. Расчеты, сделанные с использованием закона Кулона и пересчета Дебая-Хюкеля, выявили ряд положений в Fc для аминокислотных замен, которые могли бы благоприятно повлиять на связывание с одним или несколькими FcγR, включая положения, для которых замена нейтральной аминокислоты на отрицательно заряженную аминокислоту может усилить связывание с FсγRIIIа и для которых замена положительно заряженной аминокислоты на нейтральную или отрицательно заряженную аминокислоту может усилить связывание с FcγRIIIa. Эти результаты представлены в таблице 30.
Расчеты вычислительного скрининга проводили для того, чтобы оптимизировать агликозилированные Fc, то есть чтобы оптимизировать структуру, стабильность, растворимость Fc и аффинность Fc/FcγR в отсутствие углевода при N297. Целью конструкторских расчетов было создание предпочтительных замен в составе шаблонной структуры агликозилированного Fc в остатке 297, в ближайшем к нему остатке, остатках, расположенных на поверхности контакта Fc/FcγR, и остатках, расположенных на поверхности контакта Fc/углевод. Вариабельные положения были сгруппированы в различные наборы взаимодействующих вариабельных положений и подвергались конструированию в отдельных сериях расчетов; применяли различные шаблонные структуры. Для многих наборов вариабельных положений расчеты проводили с использованием двух способов вычислительного скрининга, PDA® и SPA™. Результаты этих расчетов и сопутствующая информация приведены ниже в таблицах 31-53.
Расчеты вычислительного скрининга проводили для того, чтобы оптимизировать агликозилированные Fc с помощью разработки полезных замен в остатках, которые экспонированы в растворитель в отсутствие гликозилирования, так, чтобы они были стабильными, поддерживали структуру Fc и не демонстрировали тенденции к агрегации. Углевод при N297 тщательно закрывает экспонированный гидрофобный участок, который в норме был бы поверхностью контакта для белок-белковых взаимодействий с другим доменом Ig, поддерживая стабильность и структурную целостность Fc и удерживая домены Сγ2 от агрегации через центральную ось. Ключевыми остатками для конструирования являются F241, F243, V262 и V264, которые находятся позади углевода на Сγ2, в дополнение к остаткам, таким как L328, 1332 и 1336, которые представлены экспонированными неполярными остатками, обращенными внутрь по направлению к противоположному домену Сγ2, которые рассматривались в расчетах, представленных ранее. Важность этих остатков Сγ2 подтверждается указанием на то, что соответствующие остатки в домене Сγ3 при выравнивании последовательности или опосредуют неполярное взаимодействие между двумя доменами Сγ3, или погружены в сердцевину Сγ3. Результаты этих конструкторских расчетов приведены в таблице 53.
В заключительной серии расчетов, чтобы оценить замену всех выбранных вариабельных положений с помощью всех 20 аминокислот, применяли способ вычислительного скрининга SPA™. Определяли конформацию ротамера с самой низкой энергией для всех 20 аминокислот и эту энергию считали энергией замены для определенной аминокислоты в определенном вариабельном положении. Эти расчеты, таким образом, предоставляли энергию замены для каждой из 20 аминокислот в каждом вариабельном положении. В расчетах применяли различные шаблонные структуры, включающие различные комплексы Fc/FcγRIIIb (1IIS, 1IIX, 1Е4К), смоделированный комплекс Fc/FcγRIIb, не образующий комплекса Fc(1DN2); и, таким образом, эти расчеты были полезны для широкого спектра целей конструирования, направленных как на агликозилированные, так и гликозилированные формы Fc, включая оптимизацию аффинности Fc/FcγR, аффинности к C1q, стабильности Fc, растворимости Fc, конформации углевода и конформации шарнира. Кроме этого, так как эти расчеты дают энергии как для благоприятных, так и для неблагоприятных замен, они контролируют замены, которые могут привести к дифференциальному связыванию с активирующими рецепторами FcγR по сравнению с ингибирующими FcγR. Применяли различные шаблонные структуры и с помощью расчетов исследовали замены на обеих цепях. Результаты этих расчетов и сопутствующая информация приведены в Таблицах 54-60 в конце описания. В столбце 1 перечислены вариабельные положения на цепи А и В шаблонной структуры. В столбце 2 перечислены названия аминокислоты дикого типа в каждом вариабельном положении. Оставшиеся 20 столбцов предоставляют значения энергии для каждой из 20 природных аминокислот (показаны в верхней строке). Все замены были пронормированы в соответствии с заменой с самой низкой энергией, которая была принята за нулевую энергию. Например, в таблице 54 для L235 в цепи А серин является замещением с самой низкой энергией, и замещение L235A со значением 0,9 ккал/моль менее стабильно по сравнению с L235S. Значения для крайне высоких энергий были приняты за 20 ккал/моль для энергий в диапазоне 20-50 ккал/моль и за 50 ккал/моль для энергий, превышающих 50 ккал/моль. Благоприятными считались замены, если они обладали самой низкой энергией в каждом положении, и замены, которые имели небольшие различия в энергии по сравнению с заменой с самой низкой энергией, например замены в пределах 1-2,1-3,1-5 или 1-10 ккал/моль.
Результаты конструкторских расчетов, представленные в таблицах 1-60, были использованы для конструирования серий библиотек вариантов Fc для экспериментального производства и скрининга. Экспериментальные библиотеки были сконструированы в последовательных циклах вычислительного и экспериментального скрининга. Конструирование последующих библиотек Fc включало отбор по принципу обратной связи наиболее полезного из предыдущих библиотек и, таким образом, обычно включало комбинации вариантов Fc, которые демонстрировали полезные свойства в предыдущем отборе. Полный набор вариантов Fc, которые были сконструированы и экспериментально протестированы, показан в таблице 61. В этой таблице в первой строке перечислены вариабельные положения, в последующих строках указаны аминокислоты в тех же вариабельных положениях WT и в вариантах Fc. Например, вариант 18 (идентификационный номер последовательности SEQ ID NO:26) имеет следующие четыре мутации: F241E, F243Y, V262T и V264R. Остатки в вариабельных положениях, которые составляют эту серию вариантов Fc, проиллюстрированы структурно на фигуре 4 и представлены в составе последовательности Fc человеческого IgG1 (SEQ ID NO:2) на фигуре 5.
Пример 2. Экспериментальное получение и скрининг библиотек Fc
Большую часть экспериментов на вариантах Fc проводили в контексте противоракового антитела алемтузумаба (Campath®, зарегистрированная торговая марка Ilex Pharmaceuticals LP). Алемтузумаб связывает короткий линейный эпитоп в составе своего антигена-мишени CD52 (Hale et al, 1990. Tissue Antigens 35:118-127; Hale, 1995, Immunotechnology 1:175-187). Алемтузумаб был выбран в качестве первичного шаблона для конструирования, так как его эффективность отчасти обусловлена его способностью рекрутировать эффекторные клетки (Dyer et al., 1989. Blood 73:1431-1439; Friend et al., 1991, Transplant Proc 23:2253-2254; Hale et al., 1998, Blood 92:4581-4590; Glennie et al., 2000, Immunil Today 21:403-410), и потому, что получение и применение его антигена в анализах связывания являются относительно простыми. Чтобы оценивать оптимизированные варианты Fc настоящего изобретения в контексте других антител, выбранные варианты Fc оценивались в составе антитела к CD20 ритуксимаба (Rituxan®, зарегистрированная торговая марка ЮЕС Pharmaceuticals Corporation), в антителе к Неr2 трастузумабе (Herceptin®, зарегистрированная торговая марка Genetech) и в антителе к EGFR цетуксимабе (Erbitux®, зарегистрированная торговая марка Imclone). Применение алемтузумаба, ритуксимаба и трастузумаба для целей скрининга не означает, что настоящее изобретение ограничивается каким-либо конкретным типом антитела.
Гены полноразмерных легкой (VL-CL и тяжелой (VH-Сγ1-Сγ2-Сγ3) цепей антитела IgG1 алемтузумаба, ритуксимаба и трастузумаба для облегчения субклонирования были сконструированы с подходящими рестрикционными сайтами на концах. В качестве матрицы для мутагенеза Fc-участка был использован клон VH-Сγ1-Сγ2-Сγ3 в pcDNA3.1Zeo. Мутации вводили в клон с помощью методов мутагенеза, основанных на ПЦР. Варианты Fc были секвенированы, чтобы подтвердить правильность последовательности. Плазмиды, включающие ген тяжелой цепи (VH-Сγ1-Сγ2-Сγ3) (дикий тип или варианты) были совместно трансфицированы с плазмидой, включающей ген легкой цепи (VL-CL), в клетки 293T. Среду собирали через 5 дней после трансфекции. За экспрессией иммуноглобулина следили путем скрининга супернатанта культур трансфектом с помощью вестерн-блоттинга, используя козьи антитела к иммуноглобулинам IgG человека, конъюгированные с пероксидазой (Jackson hnnnmoResearch, номер по каталогу 109-035-088). Фигура 6 демонстрирует экспрессию алемтузумаба дикого типа и вариантов 1-10 в клетках 293Т. Антитела были очищены из супернатанта с использованием аффинной хроматографии на колонке с белком A (Pierce, номер по каталогу 20334). Фигура 7 демонстрирует результаты очистки алемтузумаба WT. Варианты антитела Fc демонстрируют сходную экспрессию и очистку, что и антитела WT. Некоторые варианты Fc были дегликозилированы для того, чтобы определить их растворимость и функциональные свойства в отсутствие углевода. Чтобы получить дегликозилированные формы, очищенные антитела алемтузумаба инкубировали с пептид-N-гликозидазой (PNGase F) при 37°С в течение 24 часов. Фигура 8 представляет результаты электрофореза в ПААГ в присутствии SDS, подтверждающие дегликозилирование нескольких вариантов Fc и алемтузумаба WT.
Чтобы подтвердить функциональную целостность алемтузумаба, продуцированного в этих условиях, в Е.coli BL21 (DE3) в условиях индукции IPTG экспрессировали антигенный пептид CD52, слитый с GST. Как неиндуцированные, так и индуцированные образцы разгоняли на электрофорезе в ПААГ в присутствии SDS и переносили на мембрану PVDF. Для вестерн-блот-анализа в качестве первичных антител применяли или алемтузумаб фирмы Sotec (конечная концентрация 2,5 нг/мкл), или среду трансфицированных клеток 293Т (конечная концентрация алемтузумаба - примерно 0,1-0,2 нг/мкл), а в качестве вторичных антител - козьи антитела к иммуноглобулинам IgG человека, конъюгированные с пероксидазой. Фигура 9 представляет эти результаты. Способность связывать антиген-мишень подтверждает структурную и функциональную целостность экспрессированного алемтузумаба. Ожидается, что варианты Fc, которые имеют ту же вариабельную область, что и алемтузумаб, сохраняют сравнимую аффинность связывания антигена.
Чтобы провести отбор на связывание Fc/FcγR, внеклеточные участки V158 FcγRIIIa человека, F158 FcγRIIIa человека, FcγRIIb человека, FcγRIIa человека и FcγRIII мыши экспрессировали и очищали. Фигура 10 демонстрирует электрофорез в ПААГ в присутствии SDS, который показывает результаты экспрессии и очистки V158 FcγRIIIa человека. Внеклеточный участок этого рецептора был получен методом ПЦР в клоне, полученном из Коллекции генов млекопитающих (Mammalian Gene Collection, MGC:22630). Рецептор был слит с глутатион-3-трансферазой (GST) для обеспечения возможности скрининга. Меченый FcγRIIIa трансфицировали в клетки 293Т и среду, содержавшую секретируемый FcγRIIIa, собирали через 3 дня и очищали. Для вестерн-блот-анализа мембрану обрабатывали антителами к GST в качестве зонда.
Для всех сконструированных вариантов Fc измеряли аффинность связывания с FcγRIIIa и FcγRIIb, используя анализ AlphaScreen™ (Amplified Luminescent Proximity Homogeneous Assay (ALPHA), PerkinElmer, Wellesley, MA), нерадиоактивный люминесцентный анализ близости, основанный на применении бусин. Возбуждение лазером донорных бусин возбуждает кислород, который в случае близко расположенных акцепторных бусин вызывает каскад хемилюминеспентных событий, приводящих в конце концов к эмиссии флуоресценции при 520-620 нм. Анализ AlphaScreen™ применяли в качестве конкурентного способа анализа для скрининга вариантов Fc. С помощью стандартных методов для присоединения к донорным бусинам, содержащим стрептавидин, биотинилировали антитело алемтузумаб WT; рецептор FcγR, меченный GST, присоединяли к акцепторным бусинам, хелатирующим глутатион. В отсутствие конкуренции вариантов Fc антитело WT и FcγR взаимодействовали и давали сигнал при 520-620 нм. Добавление немеченых вариантов Fc приводило к конкуренции при взаимодействии WT Fc/FcγR и количественному уменьшению флуоресценции, дающему возможность определить относительные аффинности связывания. Все варианты Fc подвергали скринингу на связывание с V158 FcγRIIIa с использованием анализа AlphaScreen™. Варианты Fc подвергали скринингу в контексте или алемтузумаба, или трастузумаба, и выбранные варианты Fc подвергали скринингу также в контексте ритуксимаба и цетуксимаба. Выбранные варианты Fc затем отбирали по связыванию с FcγRIIb, а также с другими FcγR и лигандами Fc.
Фигура 11 демонстрирует данные анализа AlphaScreen™ по связыванию выбранных вариантов Fc с V158 FcγRIIIa человека. Данные по связыванию нормировали по максимуму и минимуму люминесцентного сигнала для каждой индивидуальной кривой, определяя базовые линии при низких и высоких концентрациях антител соответственно. Данные аппроксимировали в модели с одним местом конкурентного связывания, используя метод нелинейной регрессии, и эти аппроксимации представлены кривыми на фигуре. Эти аппроксимации дают 50%-ную ингибирующую концентрацию (IC50) (то есть концентрацию, необходимую для 50%-ного ингибирования) для каждого антитела, приведенную в качестве примера в виде пунктирных линий на фигуре 11, таким образом аппроксимации делают возможным количественное определение относительных аффинностей связывания. На фигуре алемтузумаб WT имеет IC50, равную (4,63×10-9)×(2)=9,2 нМ, тогда как S239D имеет IC50, равную (3,98×10-10)×(2)=0,8 нМ. Таким образом, алемтузумаб S239D связывает V158 FcγRIIIa человека в 9,2 нМ/0,8 нМ=11,64 раза более прочно, чем алемтузумаб WT. Сходные расчеты также были выполнены для связывания FcγRIIb человека, и примеры этих результатов анализа AlphaScreen™ по связыванию показаны на фигуре 12. Таблица 62 представляет данные анализа AlphaScreen™ по измерению кратности увеличения или ухудшения связывания вариантов Fc с V158 FcγRIIIa человека (колонка 3) и с FcγRIIb человека (колонка 4) по сравнению с исходным антителом. Для этих данных кратность, превышающая 1, указывает на улучшение аффинности связывания, а кратность, которая меньше 1, указывает на ухудшение аффинности связывания по отношению к WT Fc. Данные 1-206 и 217-218 были получены в контексте алемтузумаба, за исключением тех, которые помечены звездочкой (*) и которые были протестированы в контексте трастузумаба. Все данные 207-216 и 219-303 были получены в контексте трастузумаба.
Пример 3. Селективно улучшенное связывание с FcγR
Некоторое количество многообещающих вариантов Fc с оптимизированными свойствами было получено при скрининге на связывание с FcγRIIIa и FcγRIIb. Таблица 62 представляет варианты Fc, которые связываются с FcγRIIIa более прочно и, таким образом, являются кандидатами для улучшения эффекторной функции антител и слитых Fc. Они включают ряд вариантов, которые включают замены в 239, 264, 272, 274, 330 и 332 положениях. Фигуры 13а и 13б демонстрируют данные по связыванию некоторых из этих вариантов Fc, полученные в анализе AlphaScreen™. Большинство этих вариантов Fc обеспечивают более значительное усиление связывания с FcγRIIIa сверх того, что демонстрируют S298A/E332A/K334A (SEQ ID NO:45).
Для того чтобы исследовать масштабы их применимости, выбранные варианты Fc были подвергнуты скринингу в контексте множества антител. Данные по связыванию в анализе AlphaScreen™ выбранных вариантов Fc с V158 FcγRIIIa человека в составе трастузумаба, ритуксимаба и цетуксимаба показаны на фигурах 14а, 14б, 15а и 15б. Вместе с данными для алемтузумаба на фигуре 13 результаты показывают значительное усиление связывания независимо от контекста антитела, и, следовательно, варианты Fc настоящего изобретения широко применимы для антител и слитых Fc.
Получены варианты Fc, которые демонстрируют дифференциально усиленное связывание с FcγRIIIa по сравнению с FcγRIIb. Как обсуждалось, оптимальная эффекторная функция может быть результатом таких вариантов Fc, в которых аффинность к активирующим FcγRs выше, чем аффинность к ингибирующим FcγRIIb.
Данные анализа AlphaScreen™ по прямому сравнению связывания FcγRIIIa и FcγRIIb с двумя вариантами Fc в виде профиля специфичности показаны на фигуре 16а и 16б. Это понятие можно определить количественно как кратность увеличения или кратность уменьшения аффинности к активирующему FcγR (таблица 62, столбец 3), деленную на кратность увеличения или кратность уменьшения аффинности к ингибирующему FcγR (таблица 62, столбец 4), которая обозначается здесь как соотношение кратности FcγRIIIa и кратности FcγRIIb: FcγRIIIa-fold:FcγRIIb-fold ratio. Это значение приведено в столбце 5 таблицы 62. Таблица 62 демонстрирует, что варианты Fc обеспечивают этот профиль специфичности, причем соотношение FcγRIIIa-fold:FcγRIIb-fold ratio может быть таким высоким, как 86:1.
Некоторые из наиболее обещающих вариантов Fc настоящего изобретения в отношении усиления эффекторной функции обладают как значительным увеличением аффинности к FcγRIIIa, так и благоприятным соотношением FcγRIIIa-fold:FcγRIIb-fold ratio. Они включают, например, S239D/I332E (SEQ ID NO:95) (FcγRIIIa-fold=56, FcγRIIIa-fold:FcγRIIb-fold ratio=3), S239D/A330Y/I332E (SEQ ID NO:212) (FcγRIIIa-fold=130), S239D/A330L/I332E (SEQ ID NO:214) (FcγRIIIa-fold=139, FcγRIIIa-fold:FcγRIIb-fold ratio=18) S239D/S298A/I332E (SEQ ID NO:217) (FcγRIIIa-fold=295, FcγRIIIa-fold:FcγRIIb-fold ratio=48). Фигура 17 демонстрирует данные анализа AlphaScreen™ по связыванию этих и других вариантов Fc с V158 FcγRIIIa человека.
Так как существует целый ряд FcγR, дающих вклад в эффекторную функцию, может быть целесообразным подвергнуть дополнительному скринингу варианты Fc по отношению к другим рецепторам. Фигура 18 демонстрирует результаты анализа AlphaScreen™ по связыванию выбранных вариантов Fc с R131 FcγRIIa человека. Как видно, указанные выше варианты с благоприятными усилением связывания и профилем специфичности также демонстрируют усиленное связывание с этим активирующим рецептором. Использование FcγRIIIa, FcγRIIb и FcγRIIc для скрининга не означает, что экспериментальное тестирование должно быть ограничено именно этими конкретными FcγR; предполагается, что другие FcγR, включающие и не ограниченные огромным множеством изоформ и аллотипов, FcγRI, FcγRII и FcγRIII человека, мыши, крысы, обезьяны и т.п., как было описано ранее, также подходят для скрининга.
Вместе взятые, данные по связыванию FcγR, приведенные на фигурах 11-18 и в таблице 62, показывают, что ряд замен в положениях 234, 235, 239, 240, 243, 264, 266, 272, 274, 278, 325, 328, 330 и 332 являются многообещающими кандидатами для улучшения эффекторной функции антител и слитых Fc. Так как комбинации некоторых этих замен обычно приводят к аддитивному или синергическому улучшению связывания, ожидается, что пока неисследованные комбинации вариантов Fc, приведенных в таблице 62, также дадут благоприятные результаты. Таким образом, предусмотрены все комбинации вариантов Fc в таблице 62. Подобным образом, комбинации любого из вариантов Fc в таблице 62 с другими обнаруженными или необнаруженными вариантами Fc также могут предоставить благоприятные свойства, и эти комбинации также предусмотрены. Кроме того, из этих результатов можно ожидать, что другие замены в положениях 234, 235, 239, 240, 243, 264, 266, 325, 328, 330 и 332 также могут обеспечить благоприятное усиление связывания и специфичности и, таким образом, предусматриваются замены в этих положениях, отличные от тех, которые представлены в таблице 62.
Пример 4. Пониженное связывание с FcγR
Как уже обсуждалось, хотя существует необходимость в более выраженной эффекторной функции, для некоторых случаев терапии антителами было бы желательно, чтобы эффекторная функция была сниженной или отсутствовала вовсе. У некоторых вариантов Fc в таблице 62 связывание с FcγR значительно снижено или отсутствует, и, следовательно, такие варианты могут применяться в антителах или слитых Fc, для которых эффекторная функция является нежелательной. Данные анализа AlphaScreen™ по связыванию для таких вариантов показаны на фигурах 19а и 19б. Эти варианты Fc, а также их применение в комбинации, при желании могут найти применение для устранения эффекторной функции, например, в антителах и слитых Fc, механизм действия которых включает блокаду или антагонизм, но не уничтожение клеток, несущих антиген-мишень.
Пример 5. Агликозилированные варианты Fc
Как уже обсуждалось, целью данных экспериментов было получение оптимизированных агликозилированных вариантов Fc. Несколько вариантов Fc обеспечивают значительный прогресс в отношении достижения этой цели. Так как N297 является местом гликозилирования, замещение в этом положении приводит к получению агликозилированного Fc. Несмотря на то, что все другие варианты Fc, которые включают замещение N297, полностью теряют способность связываться с FcγR, N297D/I332E (SEQ ID NO:71) обладает значительной связывающей аффинностью к FcγRIIIa, что показано в таблице 62 и проиллюстрировано на фигуре 20. В отсутствие структуры высокого разрешения для этого варианта точная причина такого результата остается непонятной, хотя предсказания вычислительного скрининга предполагают, что это потенциально происходит из-за комбинации новых благоприятствующих взаимодействий Fc/FcγR и благоприятствующих электростатических свойств. Действительно, можно предвидеть другие электростатические замены для дальнейшей оптимизации агликозилированного Fc. В таблице 62 показано, что другие агликозилированные варианты Fc, такие как S239D/N297D/I332E (SEQ ID NO:188) и N297D/A330Y/I332E (SEQ ID NO:210), обеспечивают усиление связывания, которое приводит к аффинности для FcγRIIIa, составляющей 0,28 и 0,43 от значения для гликозилированного алемтузумаба дикого типа. Предусматриваются комбинации этих вариантов с другими вариантами Fc, которые усиливают связывание FcγR, с целью получения агликозилированных вариантов Fc, которые связывают один или более FcγR с аффинностью, которая приблизительно такая же или даже лучше, чем у гликозилированного исходного Fc. Дополнительная серия перспективных вариантов Fc обеспечивает улучшение стабильности и растворимости в отсутствие углевода. Варианты Fc, которые включают замены в положениях 241, 243, 262 и 264, то есть в положениях, которые не опосредуют связывание с FcγR, но определяют поверхность контакта между углеводом и Fc, теряют способность к связыванию FcγR, преимущественно потому, что они нарушают конформацию углевода. В дегликозилированной форме, однако, варианты Fc F241E/F243R/V262E/V264R (SEQ ID NO:13), F241E/F243Q/V262T/V264E (SEQ ID NO:24), F241R/F243Q/V262T/V264R (SEQ ID NO:25) и F241E/F243Y/V262T/V264R (SEQ ID NO:26) демонстрируют более сильное связывание с FcγRIIIa по сравнению с гликозилированной формой, как это показано на фигуре 21 с помощью результатов анализа AlphaScreen™. Этот результат указывает на то, что эти позиции являются ключевыми для оптимизации структуры, стабильности, растворимости и функции агликозилированного Fc. Вместе взятые, эти результаты предполагают, что конструирование белков может применяться для восстановления благоприятных функциональных и растворимых свойств антител и слитых Fc в отсутствие углевода, и подготавливают почву для агликозилированных антител и слитых Fc с благоприятными растворимыми свойствами и полной функциональностью, которые включают замены в этих и других положениях Fc.
Пример 6. Аффинность вариантов Fc к полиморфным формам FcγRIIIa
Как обсуждалось выше, важным параметром опосредованной Fc эффекторной функции является аффинность Fc как к V158-, так и к F158-полиморфным формам FcγRIIIa, Данные анализа AlphaScreen™ по сравнительному связыванию выбранных вариантов с двумя аллотипами рецепторов представлены на фигуре 22а (V158 FсγRIIIа) и фигуре 22б (F158 FcγRIIа). Как можно видеть, все варианты улучшают связывание с обоими аллотипами FcγRIIIа. Эти результаты указывают на то, что варианты Fc настоящего изобретения с усиленной эффекторной функцией будут широко применимы ко всей популяции пациентов, и что повышение клинической эффективности потенциально станет наиболее значительной для популяции пациентов с низким ответом на терапию, которые нуждаются в ней наиболее сильно.
Аффиности связывания FcγR этими вариантами Fc были дополнительно исследованы с помощью поверхностного плазменного резонанса (SPR) (Biacore, Uppsala, Sweden). SPR является чувствительным и чрезвычайно количественным методом, позволяющим измерить аффинности связывания при белок-белковых взаимодействиях, и этот метод был использован для эффективного измерения связывания Fc/FcγR (Radaev et al., 2001, J Biol Chem 276:16478-16483). Метод SPR, таким образом, предоставляет прекрасный дополнительный к измерению AlphaScreen™ способ анализа связывания. Меченный His V158 FcγRIIIa был иммобилизован на чип для SPR, и WT и вариант Fc антитела алемтузумаб пропускали над чипом в диапазоне концентраций. Константы связывания находили с помощью аппроксимации данных с помощью стандартного метода аппроксимации кривых. В таблице 63 представлены константы диссоциации (Kd) для связывания выбранных вариантов Fc с V158 FcγRIIIa и F158 FcγRIIIa, полученные при использовании метода SPR; полученные константы сравнивали с величинами IC50, полученными с помощью анализа AlphaScreen™. Разделив величины Kd и IC50 для каждого варианта на значения для алемтузумаба WT, находят коэффициент улучшения (Fold) констант варианта по сравнению с WT.
Данные SPR подтверждают улучшение аффинности к FcγRIIIa, обнаруженной в анализе AlphaScreen™. Таблица 63 также демонстрирует превосходство V264I/I332E (SEQ ID NO:38) и I332Е (SEQ ID NO:30) над S298A/E333A/K334A (SEQ ID NO:45), в то время как S298A/E333A/K334A (SEQ ID NO:45) улучшает связывание Fc с V158 и F158 FcγRIIIa в 1,7 раза и 4,7 раза соответственно, I332E (SEQ ID NO:30) демонстрирует улучшение связывания в 2,2 раза и 10,1 раза соответственно, и V264I/I332E (SEQ ID NO:38) демонстрирует улучшение связывания в 4 раза и 14 раз соответственно. Заслуживает внимания тот факт, что аффинность V264I/I332E (SEQ ID NO:38) по отношению к F158 FcγRIIIa (52 нМ) лучше, чем у WT по отношению к V158-аллотипу (68 нМ), что позволяет предположить, что вариант Fc, также как и варианты с даже более сильно выраженным улучшением связывания, может обеспечить клиническую эффективность антител для пациентов с низким уровнем ответа, чтобы достигнуть уровень, который в настоящее время доступен для пациентов с высоким уровнем ответа. Корреляция между измерениями связывания методом SPR и анализом AlphaScreen™ показана на фигурах 23а-23г. Фигуры 23а и 23б показывают корреляции Kd - IC50 для связывания с V158 FcγRIIIa и F158 FcγRIIIa соответственно, а фигуры 23в и 23г демонстрируют корреляцию коэффициента улучшения связывания с V158 FcγRIIIa и F168 FcγRIIIa соответственно. Хорошая аппроксимация этих данных прямым линиям (r2=0,9, r2=0,84, r2=0,98 и r2=0,90) подтверждает точность измерений AlphaScreen™ и обосновывает применение этого анализа для определения относительных аффинностей связывания FcγR вариантами Fc.
Также были получены данные SPR по связыванию выбранных вариантов Fc трастузумаба с V158 FcγRIIIa, F168 FcγRIIIa и FcγRIIb. Эти данные приведены в таблице 64. Протестированные варианты показывают значительное усиление связывания с активирующими рецепторами FcγRIIIa, с более чем в 100 раз прочным связыванием, обнаруженным для взаимодействия S239D/I332E/S298A (SEQ ID NO:217) с F158 FcγRIIIa. Кроме того, для самых лучших вариантов, связывающих FcγRIIIa, соотношение F158 FcγRIIIa/FcγRIIb составляло 3-4.
Пример 7. ADCC с использованием вариантов Fc
Для того чтобы определить влияние на эффекторную функцию, на выбранных вариантах Fc проводили клеточный анализ ADCC. ADCC измеряли с помощью способа анализа цитотоксичности DELFIA®EuTDA (Perkin Elmer, MA) с очищенными моноцитами периферической крови человека (PBMCs) в качестве эффекторных клеток. Клетки-мишени нагружали BATDA при концентрации 1×106 клеток/мл, промывали 4 раза и высевали на 96-луночный планшет в концентрации 10000 клеток/лунку. Затем клетки-мишени опсонизировали, используя вариант Fc или антитела WT в указанных конечных концентрациях. Человеческие РВМС, выделенные из лейкоцитной пленки, добавляли при указанном избытке по отношению к клеткам-мишеням, и планшет инкубировали при 37°С в течение 4 часов. Совместно культивированные клетки центрифугировали при 500 g, супернатанты переносили в отдельные планшеты и инкубировали с раствором Eu, и измеряли относительную флуоресценцию с помощью ридера Packard Fusion™ α-FP (Packard Biosciences, IL). Образцы измеряли в трех повторах, чтобы обеспечить оценку ошибки (n=3, +/- станд. отклон.). РВМС аллотипировали на аллотипы V158 и F158, используя метод ПЦР.
Анализ ADCC проводили на вариантах Fc и на алемтузумабе WT с помощью клеток-мишеней лимфомы DoHH-2. Фигура 24а представляет собой столбчатую диаграмму, показывающую ADCC этих белков при концентрации антитела 10 нг/мл. Результаты показывают, что варианты Fc алемтузумаба I332E (SEQ ID NO:30), V264I (SEQ ID NO:11) и I332E/V264I (SEQ ID NO:38) обладали значительно улучшенной ADCC по сравнению с алемтузумабом WT, с относительным усилением ADCC, пропорциональным улучшению их связывания с FcγRIIIa, как показано в анализе AlphaScreen™ и SPR. Зависимость ADCC от концентрации антитела показана на фигуре 24б. Данные по связыванию были пронормированы по минимальному и максимальному сигналу флуоресценции для каждой индивидуальной кривой, который был получен с помощью базовых линий при низкой и высокой концентрации антител соответственно. Данные были аппроксимированы сигмоидальной моделью зависимости доза-ответ с помощью нелинейной регрессии, которая представлена в виде кривой на фигуре. Аппроксимация позволяет определить эффективную полумаксимальную концентрацию (ЕС50) (т.е. концентрацию, необходимую для достижения 50%-ного эффекта), которая дает относительное увеличение ADCC для каждого варианта Fc. Значения ЕС50 для этих данных по связыванию аналогичны величинам IC50, полученным из данных конкурентного анализа AlphaScreen™, и производные этих значений, таким образом, аналогичны тем, которые описаны в примере 3 и на фигуре 11. На фигуре 24б логарифмы log(EC50), полученные из результатов аппроксимации данных, для алемтузумаба WT (SEQ ID NO:2) и его вариантов V264I/I332E (SEQ ID NO:38) и S239D/I332E (SEQ ID NO:95) составляли 0,99, 0,60 и 0,49 соответственно, и поэтому их соответствующие значения ЕС50 равны 9,9, 4,0 и 3,0. Таким образом, V264I/I332E (SEQ ID NO:38) и S239D/I332E (SEQ ID NO:95) обеспечивают соответственно 2,5- и 3,3-кратное усиление ADCC по сравнению с алемтузумабом WT при использовании экспрессированного клетками РСВМ гетерозиготного V158/F158 FcγRIIIa. Эти данные суммированы ниже в таблице 65.
Чтобы определить, широко ли применимо это усиление ADCC к антителам, выбранные варианты Fc оценивали в контексте трастузумаба и ритуксимаба. Анализ ADCC проводили на вариантах Fc и трастузумабе WT с помощью двух линий клеток-мишеней карциномы молочной железы ВТ474 и Sk-Br-3. Фигура 25а представляет столбцовую диаграмму, иллюстрирующую ADCC при концентрации антитела 1 нг/мл. Результаты показывают, что варианты трастузумаба V264I (SEQ ID NO:11) и V264I/I332E (SEQ ID NO:38) обеспечивают значительно увеличенную ADCC по сравнению с трастузумабом WT, с относительным увеличением ADCC, пропорциональным улучшению их связывания с FcγRIIIa, как было показано с помощью анализа AlphaScreen™ и SPR. Фигуры 25б и 25в показывают зависимости ADCC от концентрации антитела для выбранных вариантов Fc. Значения ЕС50, полученные из аппроксимации этих данных, и относительные коэффициенты усиления ADCC представлены ниже в таблице 66. Значительное увеличение ADCC наблюдается для вариантов трастузумаба I332E (SEQ ID NO:30) в комбинации с A330L (SEQ ID NO:65) и A330Y (SEQ ID NO:66). Кроме того, вариант S239D/A330L/I332E (SEQ ID NO:214) обеспечивает значительное усиление ADCC, которое выше в 300 раз для клеток РВМС, экспрессирующих гомозиготный F158/F158 FcγRIIIa, по сравнению с трастузумабом WT и вариантом S298A/E333A/K334A (SEQ ID NO:45), что согласуется с данными по связыванию с FcγR, полученными с помощью анализа AlphaScreen™ и SPR.
Анализ ADCC проводили на ритуксимабе V264I/I332E (SEQ ID NO:38), WT (SEQ ID NO:2) и S298A/E333A/K334A (SEQ ID NO:45) с использованием клеток-мишеней лимфомы WIL2-S. Фигура 26а представляет столбцовую диаграмму, показывающую ADCC этих белков при концентрации антитела 1 нг/мл. Результаты показывают, что ритуксимаб V264I/I332E (SEQ ID NO:38) обеспечивает значительное усиление ADCC по сравнению с ритуксимабом WT, а также превосходит S298A/E333A/K334A (SEQ ID NO:45), что согласуется с данными по улучшению связывания с FcγRIIIa, полученными с помощью анализа AlphaScreen™ и SPR. Фигуры 26б и 26в показывают зависимости ADCC от концентрации антитела для выбранных вариантов Fc. Значения ЕС50, полученные из аппроксимации этих данных, и относительные коэффициенты усиления ADCC представлены ниже в таблице 67. Как видно, ритуксимаб S239D/I332E/A330L (SEQ ID NO:214) обеспечивает более чем 900-кратное улучшение ЕС50 по сравнению с WT в клетках РВМС, экспрессирующих гомозиготный F159/F158 FcγRIIIa. Различия в усилении ADCC, наблюдаемые для алемтузумаба, трастузумаба и ритуксимаба, обусловлены применением различных клеток РВМС, различных антител и различных линий клеток-мишеней.
До сих пор данные по ADCC нормировали таким образом, что нижнюю и верхнюю базовые линии для каждого полипептида Fc устанавливали по минимуму и максимуму флуоресцентного сигнала для этого индивидуального полипептида Fc, который обычно является флуоресцентным сигналом, наблюдаемым при самой низкой и самой высокой концентрации антитела соответственно. Хотя представление данных таким способом дает возможность простого визуального сравнения относительных значений ЕС50 для различных антител (в этом причина их представления таким способом), теряется важная информация, имеющая отношение к абсолютному уровню эффекторной функции, достигаемой каждым полипептидом Fc. Фигуры 27а и 27б представляют данные клеточного анализа ADCC для трастузумаба и ритуксимаба соответственно, которые были пронормированы в соответствии с абсолютным минимальным лизисом при анализе, обеспечиваемым флуоресцентным сигналом клеток-мишеней в присутствии только клеток РВМС (нет антител), и абсолютным максимальном лизисом при анализе, обеспечиваемым флуоресцентным сигналом клеток-мишеней в присутствии Тритона Х-100. Графики показывают, что антитела различаются не только по значениям их ЕС50, отражающим их относительную активность, но также по максимальному уровню ADCC, достигаемому с помощью антител при насыщающих концентрациях, отражающему их относительную эффективность. До сих пор эти два термина, активность и эффективность, использовали достаточно свободно при обсуждении желаемых клинических свойств. В настоящем экспериментальном контексте, однако, они означают индивидуальные параметры, и поэтому здесь точно определены. Термин «активность», так как он применяется в настоящем экспериментальном контексте, означает величину ЕС50 антитела или слитого Fc. Термин «эффективность», так как он применяется в настоящем экспериментальном контексте, означает максимально возможную эффекторную функцию антитела или слитого Fc при насыщающих концентрациях. В дополнение к значительным изменениям активности, описанным ранее, фигуры 27а и 27б показывают, что варианты Fc настоящего изобретения обеспечивают более чем 100%-ное увеличение эффективности по сравнению с трастузумабом WT и ритуксимабом WT.
Критическим параметром, определяющим клиническую эффективность противораковых антител, является уровень экспрессии антигена-мишени на поверхности опухолевых клеток. Таким образом, главным клиническим преимуществом вариантов Fc, которые усиливают ADCC может, быть то, что они делают возможным таргетинг опухолей, которые экспрессируют более низкий уровень антигена. Чтобы проверить эту гипотезу, антитела трастузумаба WT и его варианты Fc были протестированы на их способность опосредовать ADCC против различных клеточных линий, экспрессирующих различные уровни антигена-мишени Her2/neu. Анализ ADCC проводили с различными клеточными линиями, экспрессирующими от повышенного до низкого уровня рецептора Her2/neu, включающими Sk-Br-3 (1×106 копий), SkOV3 (˜1×105 копий), OVCAR3 (˜1×104копий) и MCF-7 (˜1×103 копий), применяя набор для определения цитотоксичности DELFIA EuTDA (PerkinElmer, Boston, MA). Клетки-мишени нагружали с помощью BATDA в виде одной партии в течение 25 минут, промывали несколько раз с помощью среды и рассевали по 10000 клеток на лунку в 96-луночные планшеты. Клетки-мишени опсонизировали в течение 15 минут различными антителами при различных концентрациях (конечная концентрация изменялась от 100 нг/мл до 0,0316 нг/мл ступенчато через интервалы в 1/2 log и включала контроль без обработки). Человеческие клетки РВМС, выделенные из лейкоцитной пленки и аллотипированные как гомозиготные F158/F158 FcγRIIIa, затем добавляли к опсонизированным клеткам в 25-кратном избытке и совместно культивировали при 37°С в течение 4 часов. После этого планшеты центрифугировали, супернатанты удаляли и обрабатывали с помощью раствора Eu3+, и с помощью ридера Packard Fusion™ α-FP HT (PerkinElmer, Boston, MA) измеряли относительные единицы флуоресценции (коррелирующие с уровнем лизиса клеток). Эксперимент проводили в трех повторах. Фигура 28 демонстрирует данные ADCC в отношении четырех различных клеточных линий Her2/neu+при сравнении трастузумаба WT и его варианта Fc. Варианты S239D/I332E (SEQ ID NO:95) и S239D/I332E/A330L (SEQ ID NO:214) обеспечивают значительное усиление ADCC по сравнению с трастузумабом WT при высоком, умеренном и низком уровне экспрессии антигена-мишени. Этот результат позволяет предположить, что варианты Fc настоящего изобретения могут расширить терапевтические границы противораковых антител.
Натуральные клетки-киллеры (NK) представляют собой субпопуляцию клеток, присутствующих в клетках РВМС, которые, как предполагают, играют важную роль в ADCC. В клеточном анализе ADCC были протестированы выбранные варианты Fc, в котором в качестве эффекторных клеток применялись натуральные клетки-киллеры (NK), а не клетки РВМС. В этом анализе для отслеживания лизиса клеток применяли не EuTDA, а высвобождение эндогенной лактатдегидрогеназы (LDH). Фигура 29 показывает, что варианты Fc демонстрируют значительное усиление ADCC, если в качестве эффекторных клеток применяют клетки NK. Кроме того, вместе с результатами предыдущих анализов эти данные указывают на то, что варианты Fc настоящего изобретения демонстрируют значительное усиление ADCC независимо от типа эффекторных клеток или применяемого способа обнаружения.
Пример 8. ADCP с использованием вариантов Fc
Другой важной эффекторной функцией, опосредованной FcγR, является ADCP. Фагоцитоз раковых клеток-мишеней может не только привести к непосредственному разрушению клеток-мишеней, но из-за того, что фагоцитоз является потенциальным механизмом для поглощения антигена и процессинга с помощью антигенпрезентирующих клеток, повышенная ADCP может также улучшать способность антитела или слитого Fc вызывать адаптивный иммунный ответ. Поэтому была исследована способность вариантов Fc настоящего изобретения опосредовать ADCP. Моноциты выделяли из гетерозиготных V158/F158 FcγRIIIa клеток РВМС с помощью градиента перколла. После культивирования в течение одной недели в присутствии 0,1 нг/мл дифференцированные макрофаги отделяли с помощью ЕДТА/PBS и метили с помощью липофильного флуорофора РКН26 в соответствии с протоколом фирмы-производителя (Sigma, St Louis, Мо). Клетки-мишени Sk-Br-3 метили с помощью РКН67 (Sigma, St Louis, Mo), рассеивали в 96-луночный планшет в концентрации 20000 клеток/лунку и обрабатывали заданными конечными концентрациями трастузумаба WT и его варианта Fc. Макрофаги, меченные РКН26, затем добавляли к опсонизированным меченым клеткам Sk-Br-3 в концентрации 20000 клеток/лунку и затем клетки совместно культивировали в течение 18 часов до обработки клеток для анализа результатов с помощью проточной флуориметрии с двойным мечением. Процент случаев фагоцитоза определяли как отношение числа клеток, помеченных РКН76 и РКН26 (макрофаг + клетка Sk-Br-3), к общему числу клеток Sk-Br-3 в популяции (фагоцитированные клетки + нефагоцитированные клетки) после 10000 подсчетов. Фигура 30 демонстрирует данные сравнения трастузумаба WT и его варианта Fc при различных концентрациях антител. Результаты указывают на то, что вариант S239D/I332E/A330L (SEQ ID NO:214) обеспечивает значительное усиление ADCP по сравнению с трастузумабом WT.
Пример 9. Связывание комплемента и активация с помощью вариантов Fc
Белок комплемента C1q связывается с участком, расположенным на Fc, который находится в непосредственной близости с местом связывания FcγR, и поэтому было разумно определить, сохраняют ли варианты Fc свою способность связывать и активировать комплемент. Чтобы измерить связывание выбранных вариантов Fc с белком комплемента C1q, применяли анализ AlphaScreen™. Анализ проводили с биотинилированным антителом алемтузумабом WT, присоединенным к донорным бусинам со стрептавидином, как описано в примере 2, и применяя C1q, непосредственно связанный с акцепторными бусинами. Данные по связыванию вариантов ритуксимаба V264I (SEQ ID NO:11), I332E (SEQ ID NO:30), S239E (SEQ ID NO:48) и V264I/I332E (SEQ ID NO:38), представленные на фигуре 31а, указывают на то, что связывание C1q является незатронутым. Клеточный анализ CDC проводили с выбранными вариантами Fc, чтобы исследовать, сохраняют ли варианты Fc способность активировать комплемент. Чтобы следить за лизисом клеток лимфомы WILL-2S (Quidel, San Diego, СА), опсонизированных Fc-вариантом ритуксимаба или ритуксимабом WT, вызываемым сывороточным комплементом человека, применяли краситель Аламаровый синий. Данные, представленные на фигуре 31б, показывают, что CDC является незатронутым для Fc-вариантов ритуксимаба S239E (SEQ ID NO:48), V264I (SEQ ID NO11) и V264I/I332E (SEQ ID NO38). В противоположность этому фигура 31в демонстрирует, что в случае варианта Fc S239D/I332E/A330L (SEQ ID NO:214) CDC полностью пропадает, тогда как вариант S239E/I332E (SEQ ID NO:95) опосредует CDC, сравнимую с ритуксимабом WT. Эти результаты указывают на то, что конструирование белков может применяться для того, чтобы дифференцировать различные эффекторные функции. Такой контроль не только делает возможным продукцию антител и слитых Fc со свойствами, задуманными специально для желаемых клинических последствий, но также обеспечивает уникальный набор реагентов, чтобы с их помощью экспериментально исследовать биологию эффекторных функций.
Пример 10. Связывание вариантов Fc с белком А и FcRn
Как обсуждалось выше, бактериальные белки А и G и неонатальный рецептор Fc FcRn связываются с Fc-участком между доменами Сγ2 и Сγ3. Белок А часто применяют для очистки антител, а FcRn играет ключевую роль в фармакокинетике и транспорте антител. Поэтому было важно исследовать способность вариантов Fc настоящего изобретения связывать белок А и FcRn. Для измерения связывания выбранных вариантов Fc с белком А и FcRn человека применяли анализ AlphaScreen™, используя биотинилированные антитела алемтузумаба WT, присоединенные к донорным бусинам со стрептавидином, как описано в примере 2, и используя белок А и FcRn, непосредственно связанные с акцепторными бусинами. Данные по связыванию приведены на фигуре 32 и 33 для белка А и FcRn соответственно. Результаты указывают на то, что шарнирный участок Сγ2-Сγ3 не затрагивается заменами в Fc, и важно, что способность вариантов Fc связывать белок А и FcRn не изменяется.
Пример 11. Способность вариантов Fc связывать мышиные рецепторы FcγR
Оптимизация Fc по отношению к рецепторам FcγR, не являющимся рецепторами человека, может быть полезной для экспериментального тестирования вариантов Fc на животных моделях. Например, при тестировании у мышей (например, у безволосых мышей, мышей SCID, ксенотрансплантантных мышей и/или трансгенных мышей) антитела и слитые Fc, которые включают варианты Fc, оптимизированные в отношении одного или нескольких мышиных рецепторов FcγR, могут обеспечить ценной информацией относительно клинической эффективности, механизма действия и т.п. Чтобы оценить, могут ли варианты Fc настоящего изобретения быть полезными в таких экспериментах, с помощью анализа AlphaScreen™ измеряли аффинность выбранных вариантов Fc к мышиному FcγRIII. Анализ AlphaScreen™ проводили, применяя биотинилированный алемтузумаб WT, присоединенный к донорным бусинам со стрептавидином, как описано в примере 2, и меченный с помощью GST мышиный FcγRIII, присоединенный к хелатирующим глутатион акцепторным бусинам, экспрессированный и очищенный, как описано в примере 2. Эти данные по связыванию представлены на фигуре 34а и 34б в контексте алемтузумаба и трастузумаба соответственно. Результаты показывают, что некоторые варианты Fc, которые усиливают связывание с FcγRIII человека, также усиливают связывание с мышиным FcγRIII. Усиление эффекторной функции у мыши с помощью вариантов Fc исследовали с помощью указанного выше клеточного анализа ADCC с использованием мышиных, нежели человеческих клеток РВМС. Фигура 35 демонстрирует, что варианты трастузумаба S239D/I332E/A330L (SEQ ID NO:214) обеспечивают значительное усиление ADCC по сравнению с WTв присутствии мышиных иммунных клеток. Этот результат указывает на то, что варианты Fc настоящего изобретения или другие варианты Fc, оптимизированные в отношении FcγRIII, не являющихся рецепторами человека, могут найти применение в экспериментах, в которых используют животные модели.
Пример 12. Испытание вариантов Fc, экспрессированных в клетках СНО
Несмотря на то, что варианты Fc настоящего изобретения были экспрессированы в клетках 293Т в целях скрининга, крупномасштабную продукцию антител обычно проводят в клеточной линии яичников китайского хомячка (СНО). Чтобы оценить свойства вариантов Fc, экспрессируемых СНО, выбранные варианты Fc и алемтузумаб WT экспрессировали в клетках СНО и очищали, как описано в примере 2. Фигура 36 демонстрирует данные анализа AlphaScreen™ по сравнительному связыванию варианта Fc и алемтузумаба WT, экспрессированных клетками СНО и 293Т, с V158 FcγRIII человека. Результаты указывают на то, что варианты Fc настоящего изобретения демонстрируют сравнимое по величине усиление связывания FcγRIII, если они экспрессируются в клетках 293Т или СНО.
Пример 13. Улучшение вариантов Fc в штамме, отрицательном по фукозе
Комбинации вариантов Fc настоящего изобретения с другими модификациями Fc предусматриваются с целью создания новых антител или слитых Fc с оптимизированными свойствами. Выгодно объединить варианты Fc настоящего изобретения с другими модификациями Fc, включающими модификации, которые изменяют эффекторную функцию или взаимодействие с одним или несколькими лигандами Fc. Такие комбинации могут обеспечить аддитивные, синергические или новые свойства антител или слитых Fc. Например, существует несколько способов для конструирования различных гликоформ Fc, которые изменяют эффекторную функцию. Сконструированные гликоформы могут образовываться с помощью множества способов, известных в этой области техники, многие из этих технологий основаны на контролировании уровня фукозилированных и/или разветвленных олигосахаридов, которые ковалентно присоединены к участку Fc. Один из способов конструирования гликоформ Fc заключается в экспрессии полипептида Fc в клеточной линии, которая продуцирует измененные гликоформы, например, в клетках Lee-13 СНО. Чтобы исследовать свойства вариантов Fc, комбинированных со сконструированными гликоформами, трастузумаб WT и V209 (S239D/I332E/A330L) (SEQ ID NO:214) были экспрессированы в клетках Lec-13 CHO и очищены, как описано выше. Фигура 37а демонстрирует данные анализа AlphaScreen™ по связыванию, сравнивающие связывание V158 FcγRIII человека с трастузумабом WT и V209, экспрессированных в клетках 293Т, CHO и Lec-13. Результаты показывают, что существует значительный синергизм между сконструированными гликоформами, продуцированными этой клеточной линией, и вариантами Fc настоящего изобретения. Результаты клеточного анализа ADCC, представленные на фигуре 37б, подтверждают этот результат. Вместе эти данные указывают на то, что другие модификации Fc, в частности сконструированные гликоформы, могут быть объединены с вариантами Fc настоящего изобретения для того, чтобы создавать антитела и слитые Fc с оптимальными эффекторными функциями.
Пример 14. Терапевтическое применение вариантов Fc
Ряд вариантов Fc, описанных в настоящем изобретении, имеют существенный потенциал для улучшения терапевтической эффективности противораковых антител. В целях иллюстрации ряд вариантов Fc настоящего изобретения были включены в последовательность антитела ритуксимаба. Легкая цепь (SEQ ID NO:3) и тяжелая цепь (SEQ ID NO:4) ритуксимаба WT, описанные в патенте US 5736137, представлены на фигурах 38а и 38б. Усовершенствованные последовательности антитела к CD20 (SEQ ID NO:5) приведены на фигуре 38в. Усовершенствованные последовательности антитела к CD20 включают, по меньшей мере, аминокислотные последовательности, не относящиеся к WT, выбранные из группы, включающей X1, Х2, Х3, Х4, Х5, Х6, X7 и X8. Эти усовершенствованные последовательности антитела к CD20 также могут включать замену Z1 и Z2. Применение здесь ритуксимаба является исключительно примером и не ограничивает применения вариантов Fc только этим антителом или любым другим конкретным антителом или слитым Fc.
Пример 15. Полный структурный/функциональный анализ специфичности комплекса Fc/лиганд Fc
Из результатов этих экспериментов ясно, что конструирование белков является мощным инструментом для разработки замен в Fc, которые значительно изменяют их биологическую функцию и специфичность. Зная, какую непревзойденную клиническую ценность имеют антитела и слитые Fc, способы конструирования белков настоящего изобретения можно применять для регулирования клинических свойств этих важных биотерапевтических средств. Такие потенциальные возможности, однако, требуют более полного понимания взаимоотношений между структурой и функцией Fc и лигандов Fc. Кроме того, отсутствие доступной информации о детерминантах специфичности комплекса Fc/лиганд Fc означает, что невозможно в качестве целевой задачи эффективно создавать варианты Fc со всеми желаемыми свойствами. Таким образом, вероятно, что, несмотря на энергичные экспериментальные усилия, описанные в настоящем изобретении, существуют терапевтически полезные варианты Fc, которые не были разработаны, и биохимические свойства вариантов Fc, которые остаются неоткрытыми. В равной степени важным для получения новых вариантов Fc для биотерапевтического применения является способность улучшать прогностическую ценность способа конструирования, тем самым позволяя еще более эффективно идентифицировать варианты. Для достижения этих целей была проведена более тщательная характеристика биологии Fc/лиганд Fc. Она включала: 1) расширение первичного скрининга для включения всех значимых лигандов Fc и 2) увеличение числа вариантов Fc для исследования большего набора замен во всех значимых положениях Fc. Вместе этот широкий подход даст возможность более тщательной разработки полезных вариантов Fc, обеспечит большее понимание специфичности и биологии комплекса Fc/лиганд Fc и обеспечит более широкий набор данных для того, чтобы позволить провести доскональную количественную оценку прогностической ценности способов конструирования.
Расширение первичного скрининга
Чтобы лучше охарактеризовать структурные и функциональные детерминанты специфичности Fc, первичный отбор был расширен, чтобы включить все значимые лиганды Fc. Таким образом, все варианты Fc параллельно тестируются на связывание с FcγRI, FcγRIIa, FcγRIIb, FcγRIIc, FcγRDIa (изоформа Val158), FcRn и C1q. Как описано выше, был использован анализ AlphaScreen™. Все варианты Fc отбирались в контексте или алемтузумаба, или трастузумаба в соответствии с таблицей 62. Таблица 68 (см. в конце описания) демонстрирует пример параллельного отбора для серии замен в положениях 234 и 235 Fc. В этой таблице светло-серый цвет указывает на то, что аффинность комплекса вариант Fc/лиганд Fc составляет 0,5 или менее по сравнению с аффинностью WT, серый цвет средней насыщенности указывает на то, что аффинность комплекса вариант Fc/лиганд Fc составляет диапазон 0,5-2,0 по сравнению с аффинностью WT, темно-серый цвет указывает на то, что аффинность комплекса вариант Fc/лиганд Fc увеличивается в два раза и более, и белый цвет указывает на то, что взаимодействие Fc/лиганд Fc не измеряли или что результаты не позволяют точно определить аффинность. Таким образом, варианты Fc объединяют в группы, в которых связывание с данным лигандом Fc значительно уменьшается, существенно не меняется и значительно увеличивается. Визуализация данных таким способом обеспечивает структурно/функциональное картирование Fc, давая возможность прямой интерпретации результатов для каждого положения, так что полезные и интересные варианты могут быть эффективно идентифицированы, и так что прогностическая ценность способа конструирования может быть оценена практически.
Ряд замен в положениях 234 и 235 демонстрируют различные специфичности связывания с различными лигандами Fc. Хотя различия в некоторых случаях являются едва уловимыми, результаты указывают на то, что действительно возможно сконструировать специфичность Fc к различным лигандам Fc даже на поверхности контакта с FcγR, где целый ряд высоко гомологичных рецепторов связываются в одном и том же месте. Другие варианты Fc, которые обеспечивают более отчетливые различия в аффинности, представлены в таблице 69 (см. в конце описания).
Эти данные еще более убедительно демонстрируют, что возможно регулировать специфичность Fc в отношении лигандов Fc, часто с помощью очень незначительных мутационных различий. Например, вариант A330Y/I332E (SEQ ID NO:112) усиливает связывание со всеми рецепторами FcγR, в особенности с FcγRIIIa, а также с FcRn, хотя сохраняет на том же уровне связывание с C1q. Однако вариант A330L/I332E (SEQ ID NO:114) демонстрирует усиленное связывание с FcγRI и FcγRIIIa, но сохраняет аффинность WT для рецепторов FcγRII. В противоположность этому мутации в положении L328 обеспечивают преимущественное усиление связывания с рецепторами FcγRII по сравнению с FcγRI и FcγRIIIa. В случае варианта L328Е/I332Е (SEQ ID NO:172) аффинность для всех рецепторов FcγRII повышается, тогда как вариант L328T/I332E (SEQ ID NO:176) обеспечивает четкое усиление профиля специфичности в ряду FcγRIIc>FcγRIIb>FcγRIIa. В противоположность этому вариант L328A значительно усиливает связывание с FcγRIIa, но обеспечивает аффинность WT для всех других рецепторов FcγR, включающих FcγRIIb и FcγRIIc. Из этих результатов ясно, что очень незначительные мутационные различия могут обеспечить существенные различия в специфичности. Таким образом, такие коллекции вариантов Fc, представленные здесь, не только дадут возможность продукции антител и слитых Fc, которые обладают эффекторной функцией, предназначенной для желаемых целей, но они также обеспечивают уникальный набор реагентов, чтобы с их помощью экспериментально исследовать биологию эффекторных функций.
Расширение набора вариантов Fc
Из-за неполной информации, имеющей отношение к структурным и функциональным детерминантам взаимодействия Fc/лиганд Fc, невозможно активно конструировать Fc для всех желаемых целей оптимизации. Отчетливые различия в специфичности, наблюдаемые в таблицах 68 и 69, к различным рецепторам FcγR в большей степени обусловлены энергичным подходом к скринингу настоящего изобретения, эти варианты Fc с их особенными свойствами не были сконструированы целенаправленно из-за того, что отсутствует структурная информация о связывании Fc с различными рецепторами FcγR, а также отсутствует понимание того, каким образом структура и подвижность шарнира оказывают воздействие на связывание с FcγR. Действительно, решение исследовать большое количество и многообразие замен в положениях 234 и 235 было основано на знании того, что они расположены близко к месту связывания Fc/FcγR, что мутации в этих положениях влияют на связывание с FcγR и что в соответствии с расчетами вычислительного скрининга в этих положениях допустимо большое количество и многообразие замен. В целом, отсутствие информации о структуре детерминант специфичности Fc/FcγR, отсутствие информации о структуре высокого разрешения для комплекса Fc/C1q и невозможность рассчитать непрямые эффекты замен на связывание Fc/лиганд Fc - все это вместе несомненно приводит к тому, что все интересные и потенциально полезные варианты Fc не будут исследованы с помощью существующих в настоящее время способов конструирования. Чтобы наиболее полно разработать полезные варианты Fc, а также получить более полную картину структурных и функциональных детерминант связывания Fc/лиганд Fc, был расширен набор вариантов Fc для исследования более широкого спектра мутаций. Все положения Fc в местах связывания с рецепторами FcγR и C1q или рядом с ними, выбранные с помощью визуального осмотра имеющихся в наличии структур и с помощью информации, предоставленной результатами предшествующего скрининга вариантов Fc, были полностью заполнены таким образом, что были сконструированы все возможные замены, которые не были прежде протестированы. В положениях Fc, значительно отдаленных от мест связывания FcγR и C1q, была сконструирована подгруппа выбранных замен на основании предсказанных в ранее описанных расчетах вычислительного скрининга значений энергий и на основе доступных данных о существующих вариантах Fc. Этот новый набор вариантов Fc в общем количестве 576 штук представлен в таблице 70.
Все ссылки в явном виде включены в заявку путем отсылки.
Несмотря на то, что частные воплощения настоящего изобретения было описаны выше в целях иллюстрации, тем, кто является специалистами в этой области техники, очевидно, что в деталях можно осуществлять множество модификаций, не приводящих к отступлению от рамок изобретения, как это описано в прилагаемой формуле изобретения.































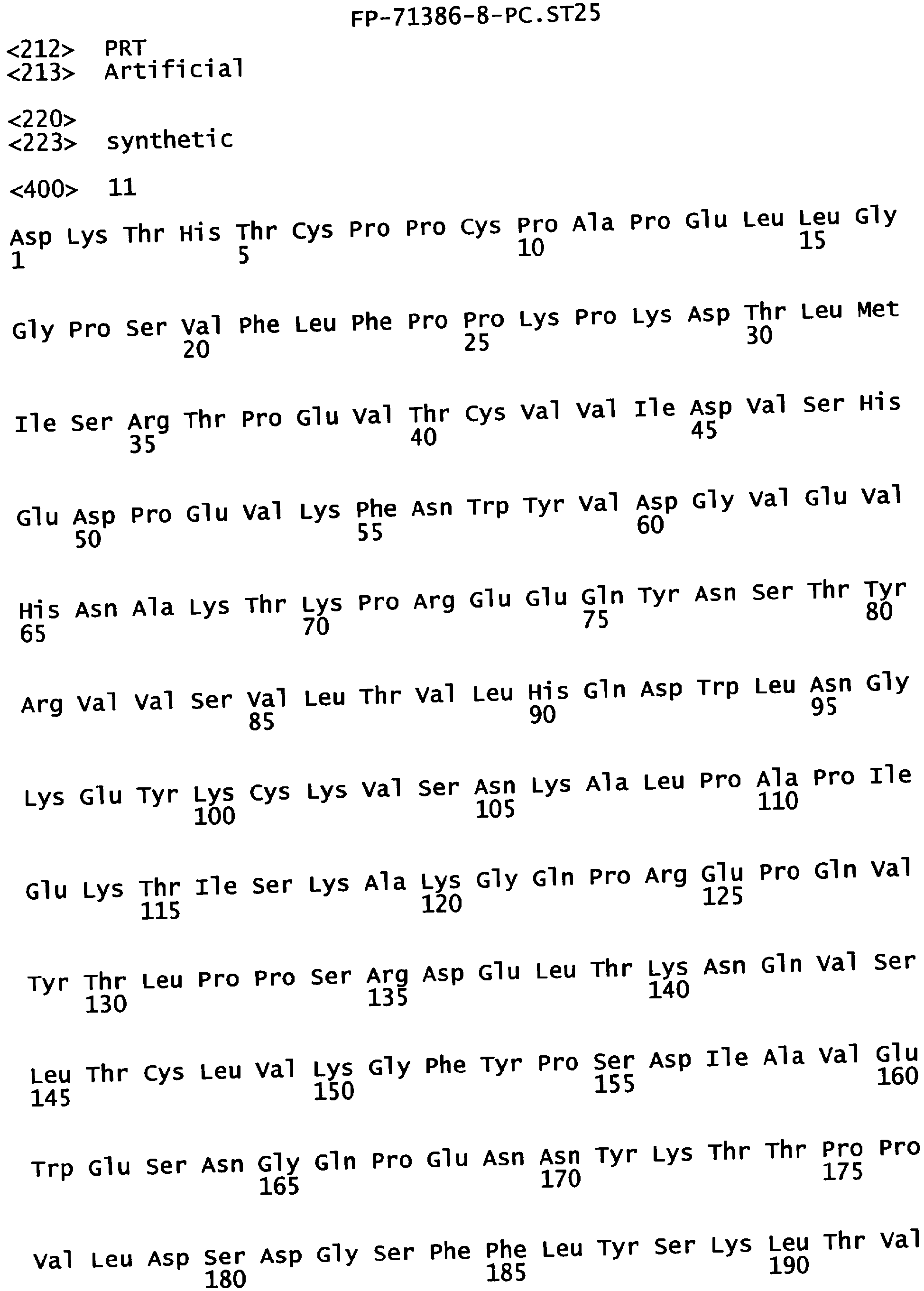


















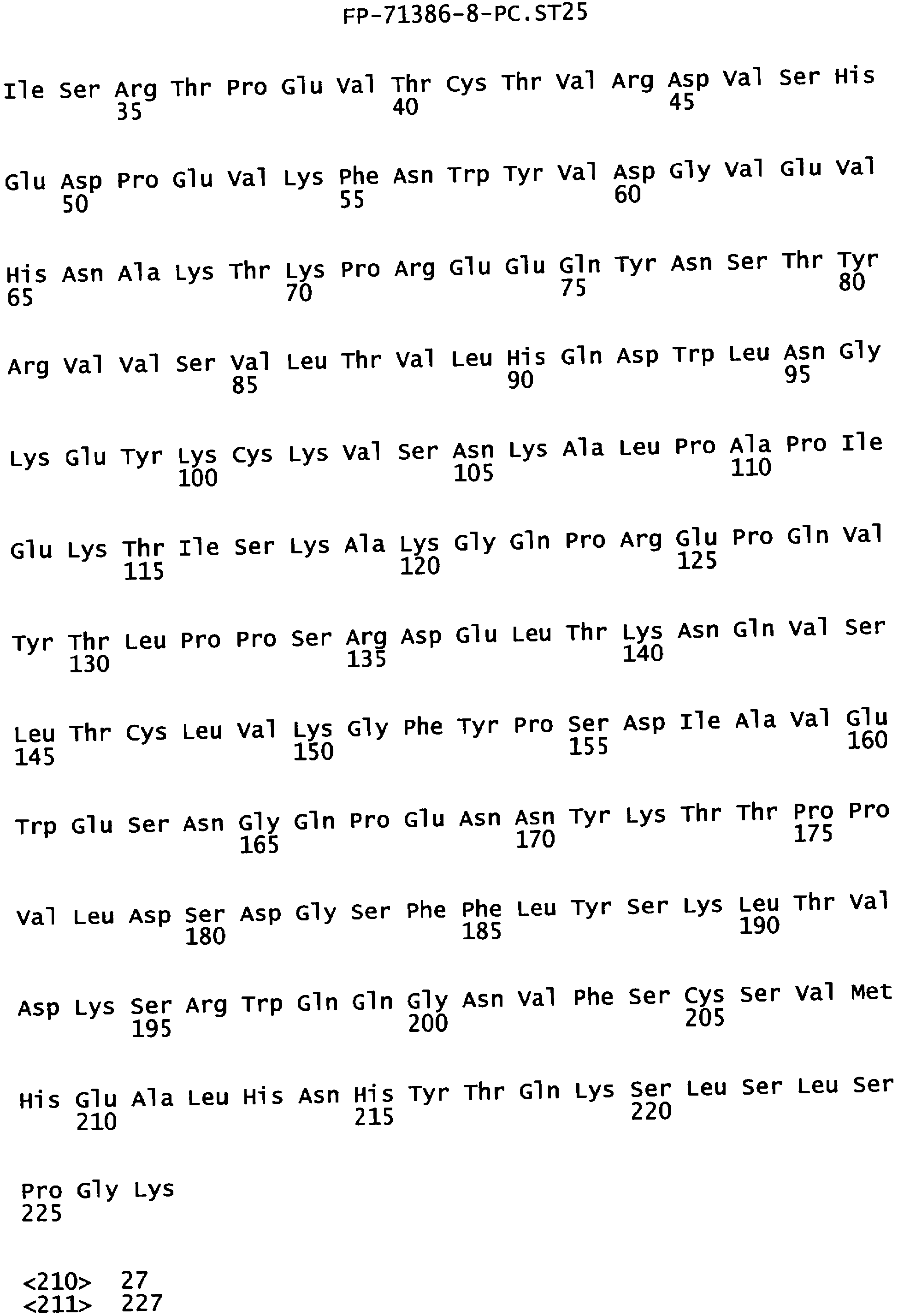






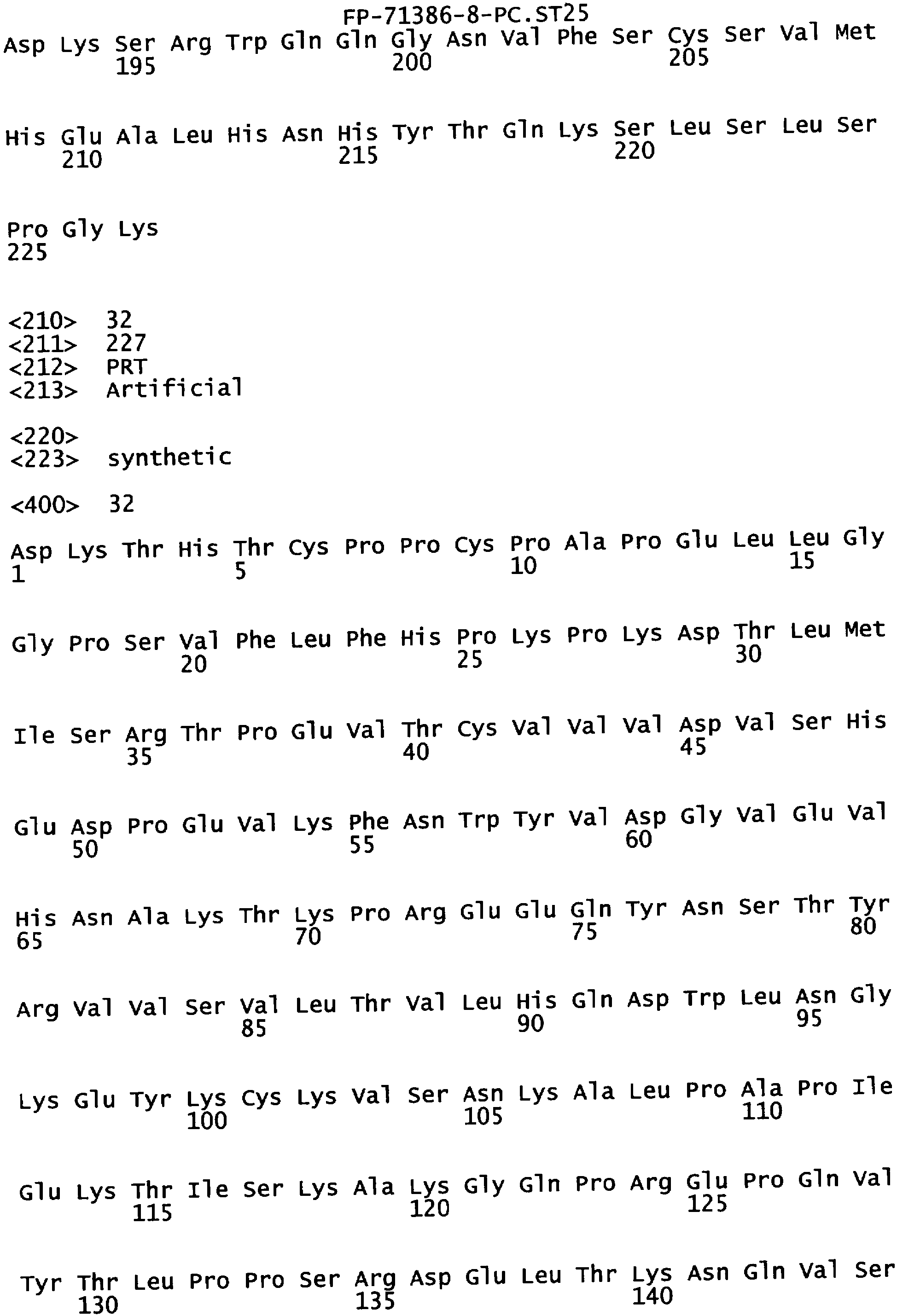




















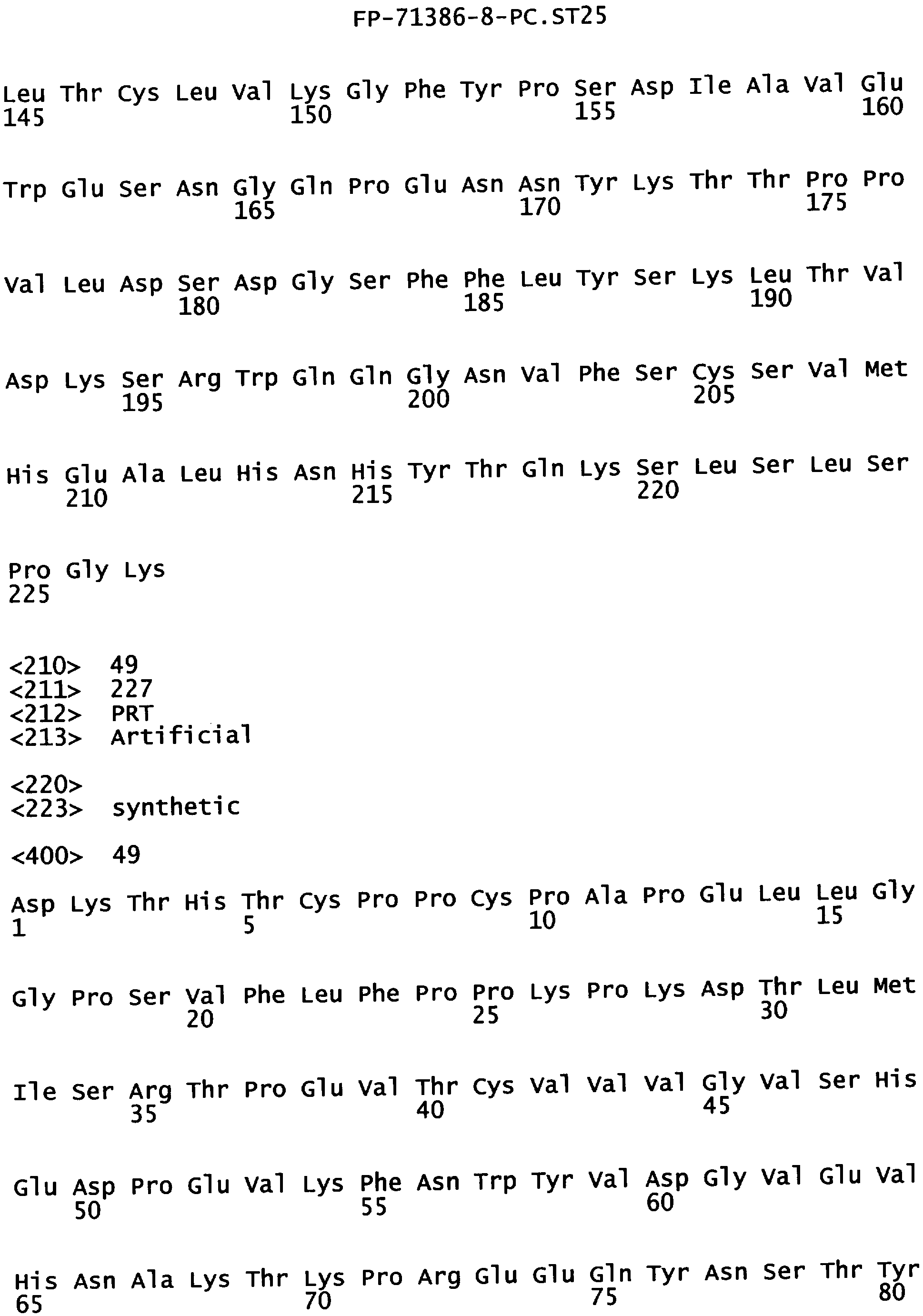

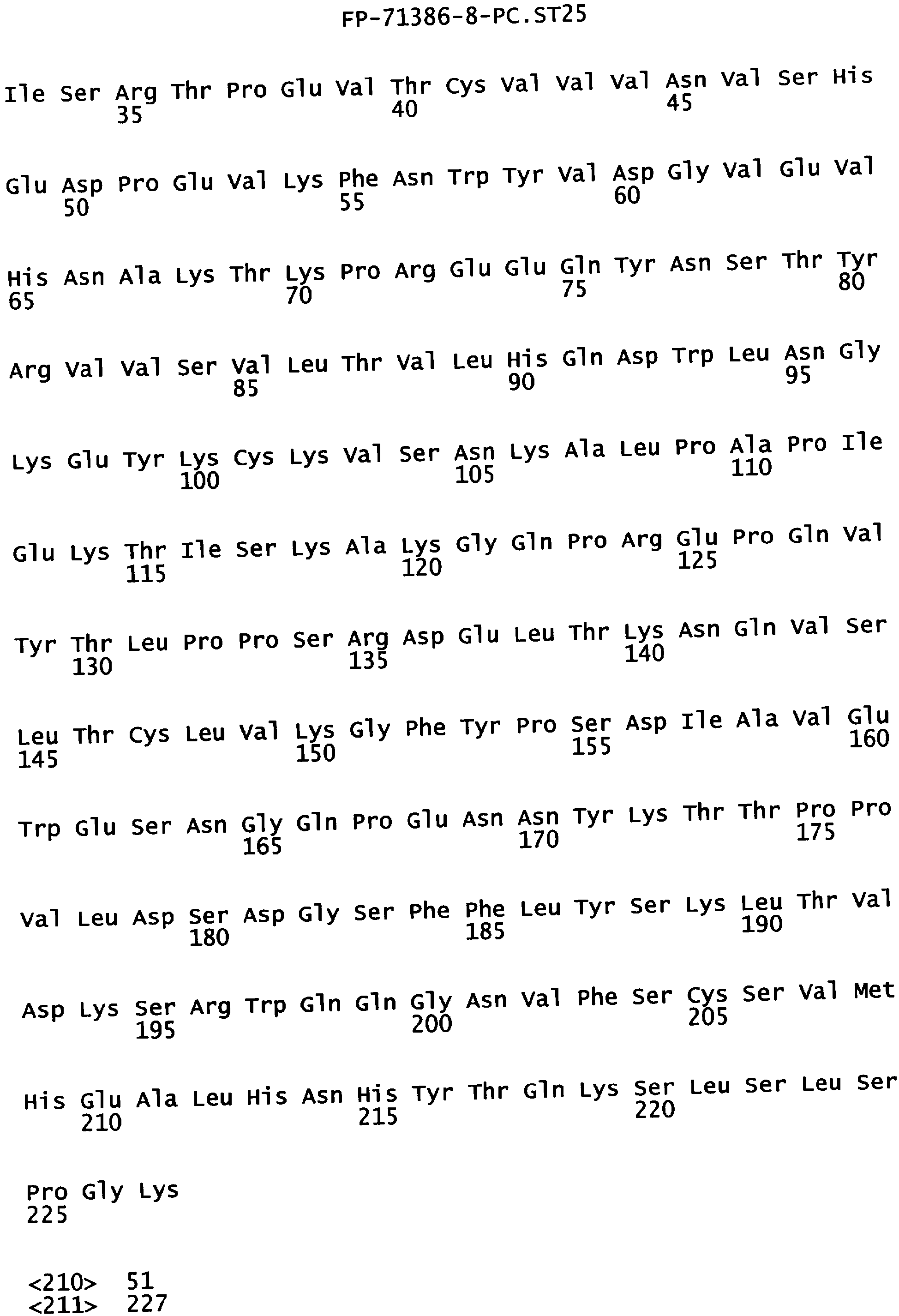










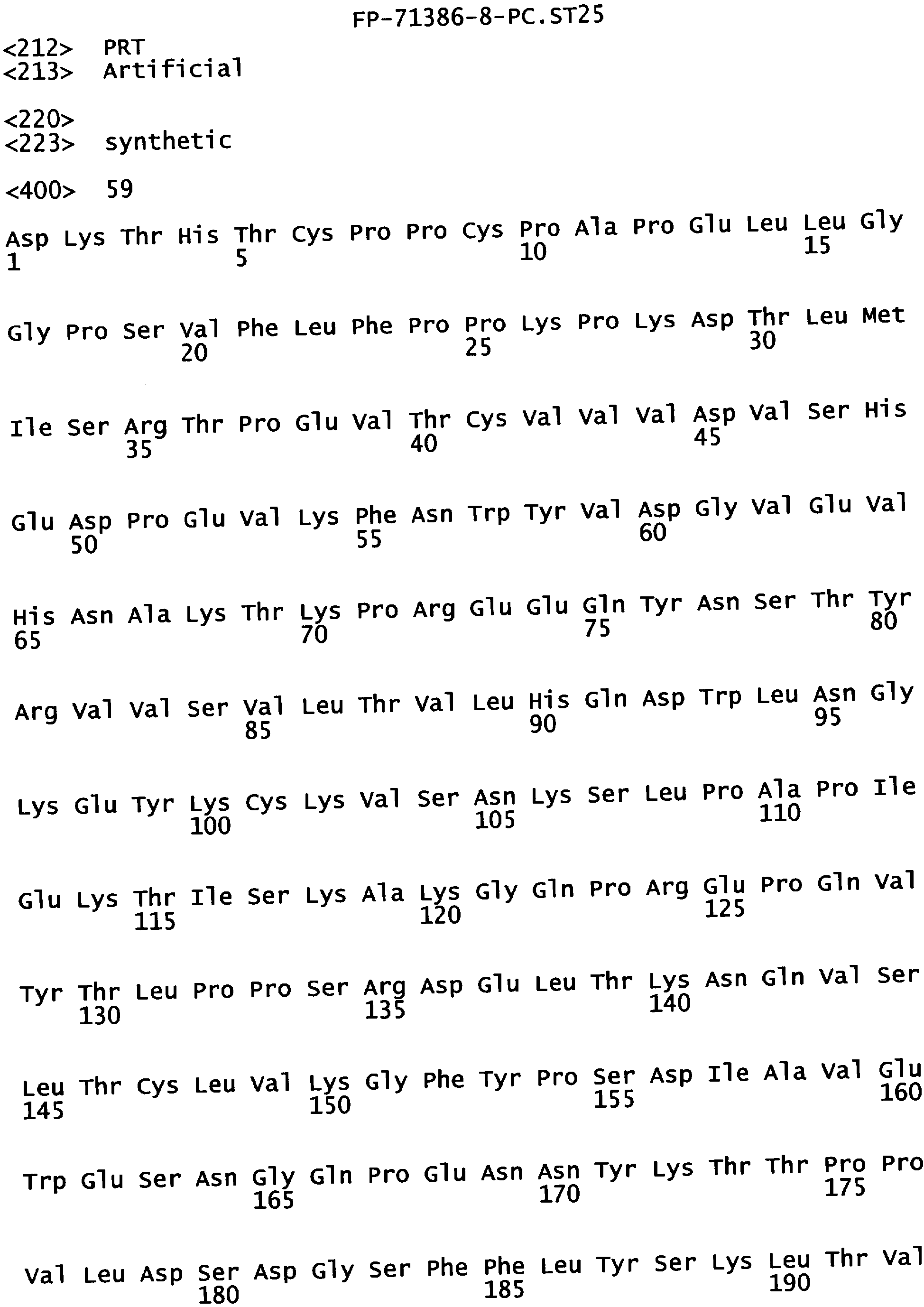



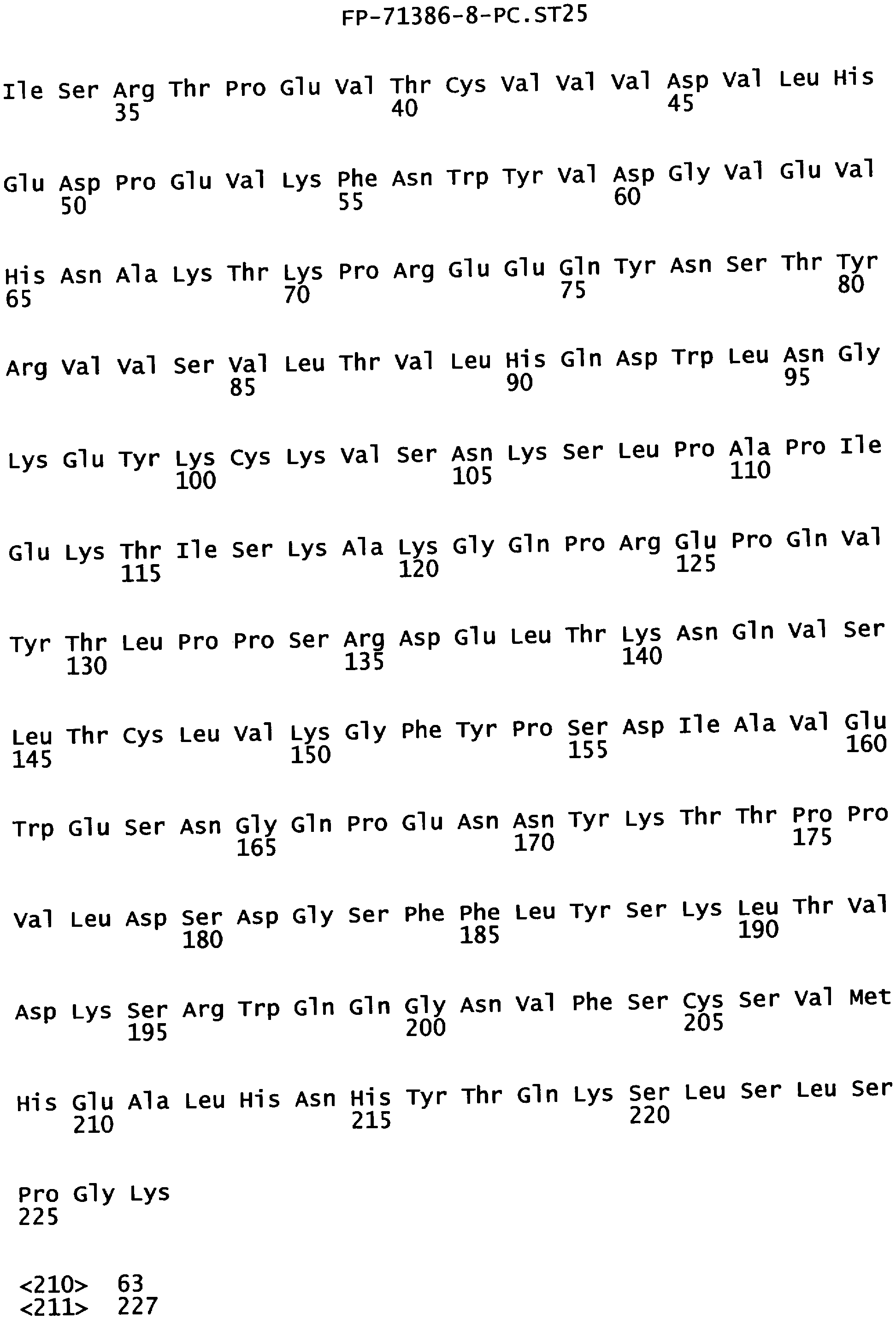










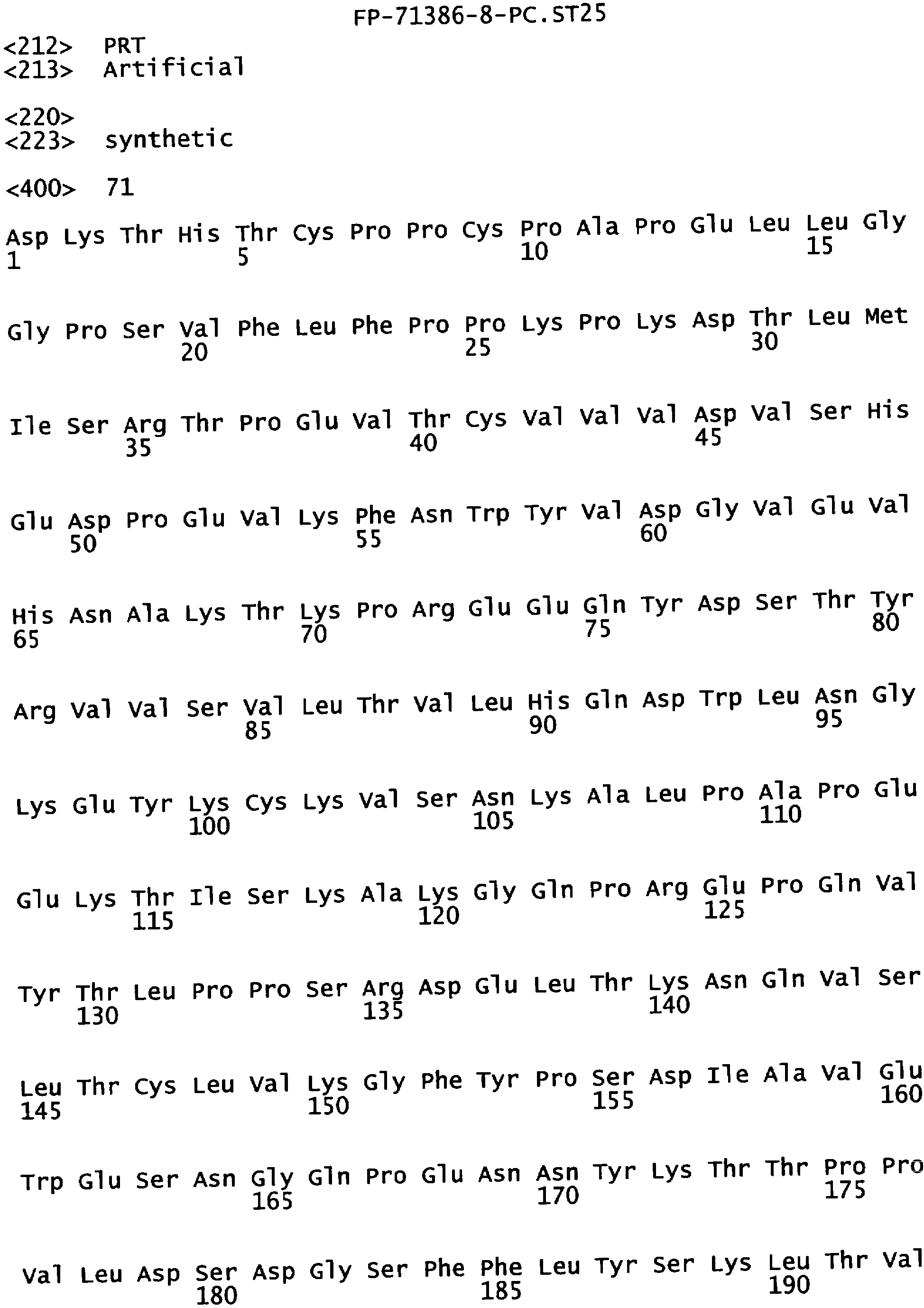

































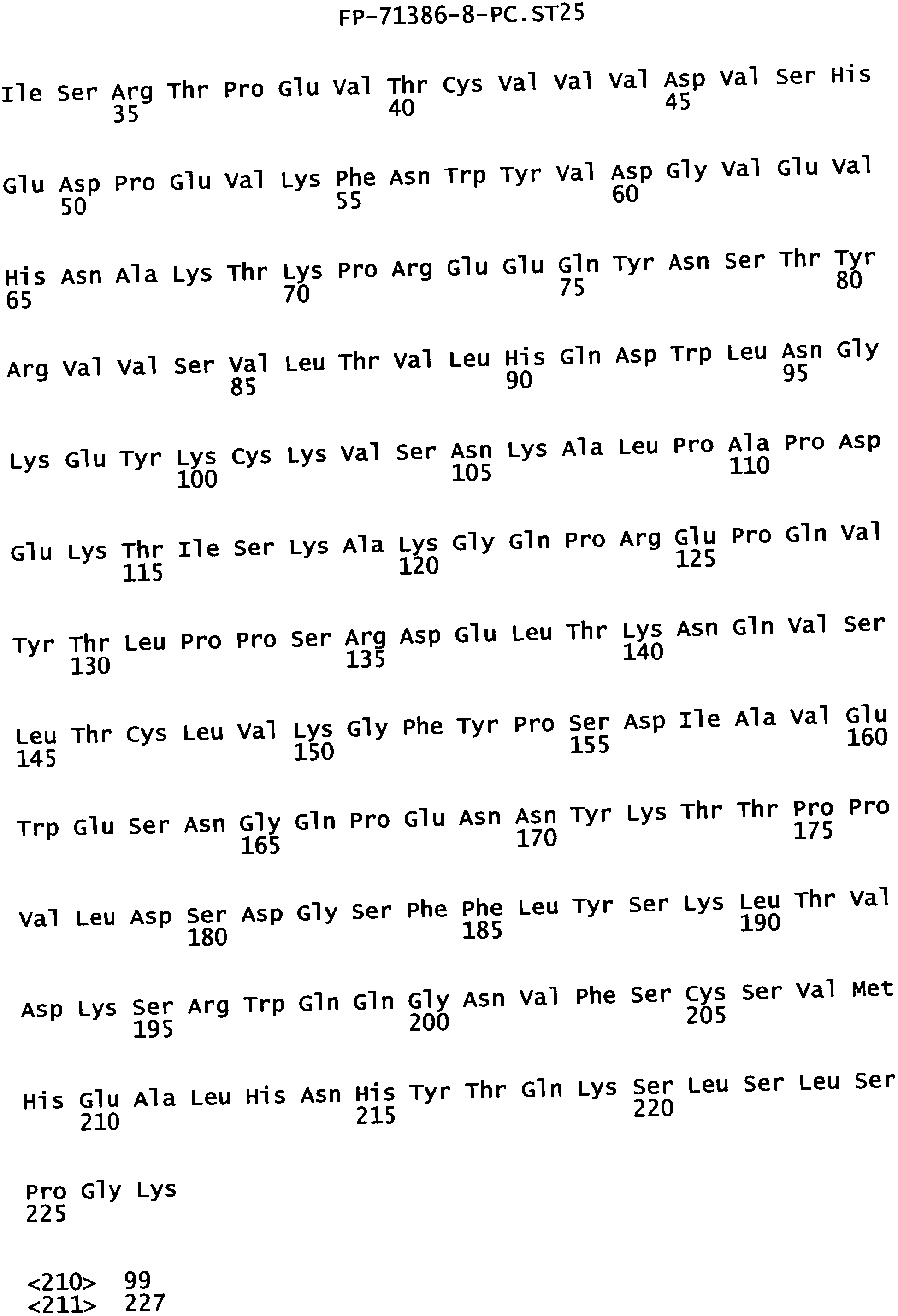










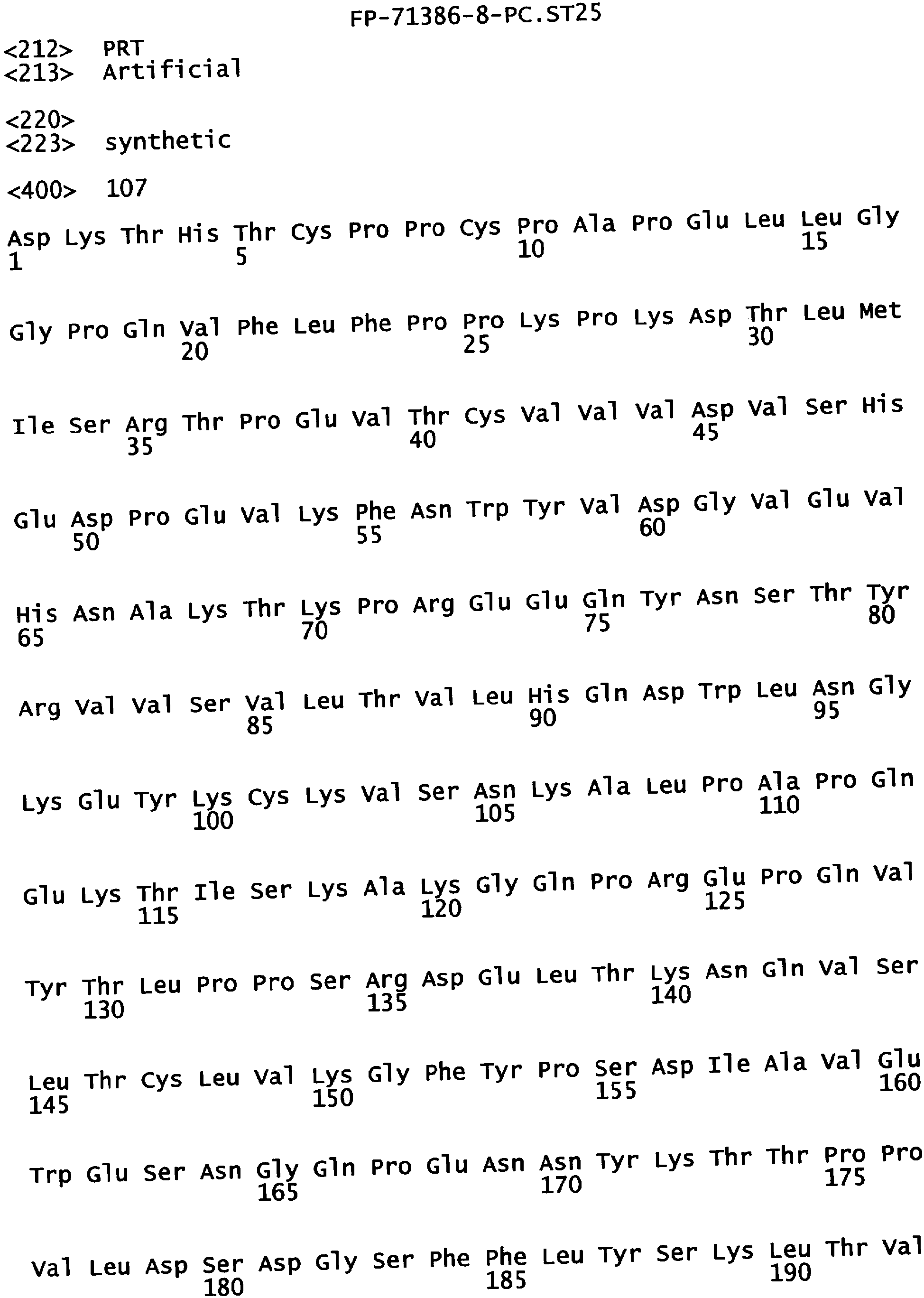















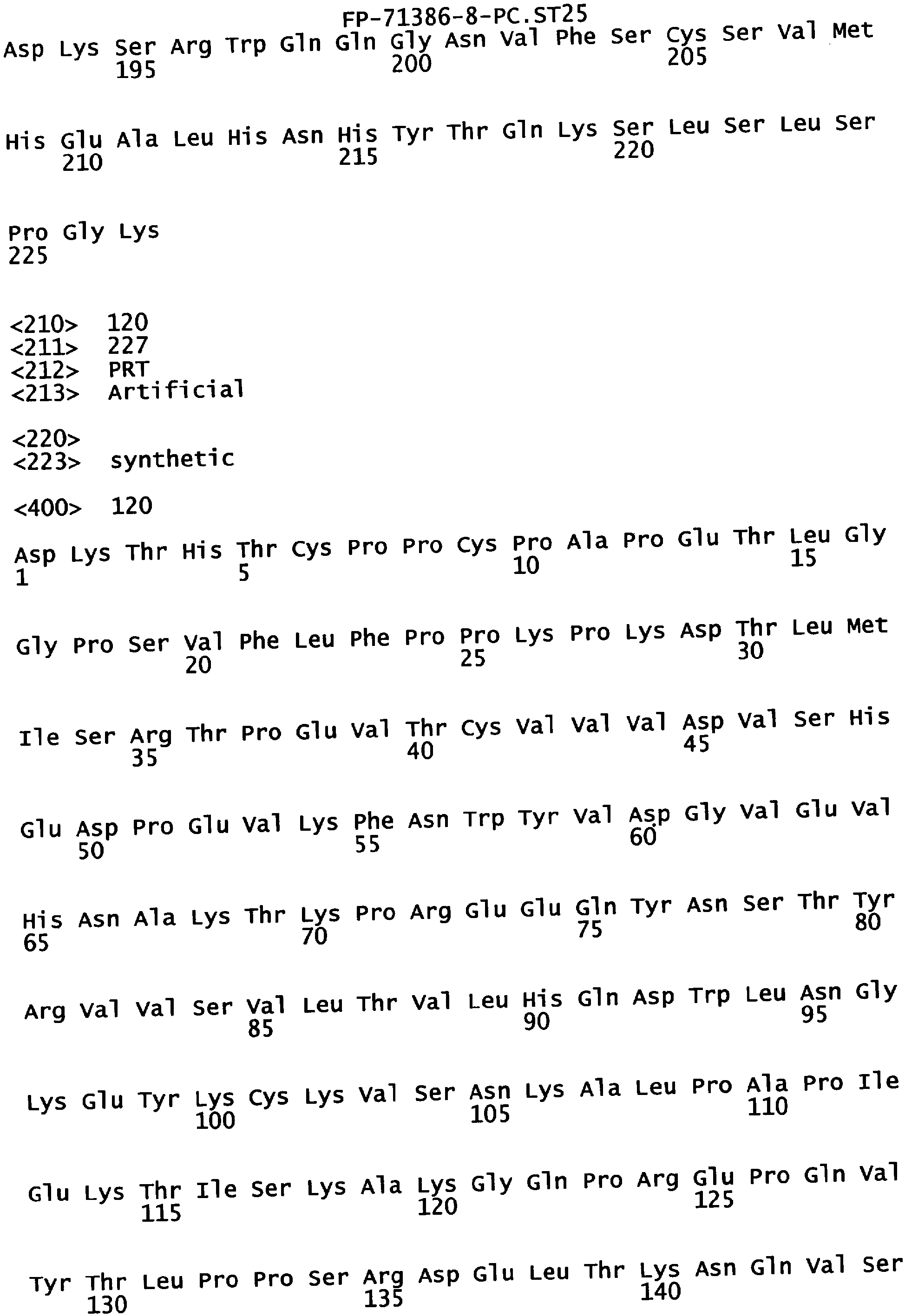












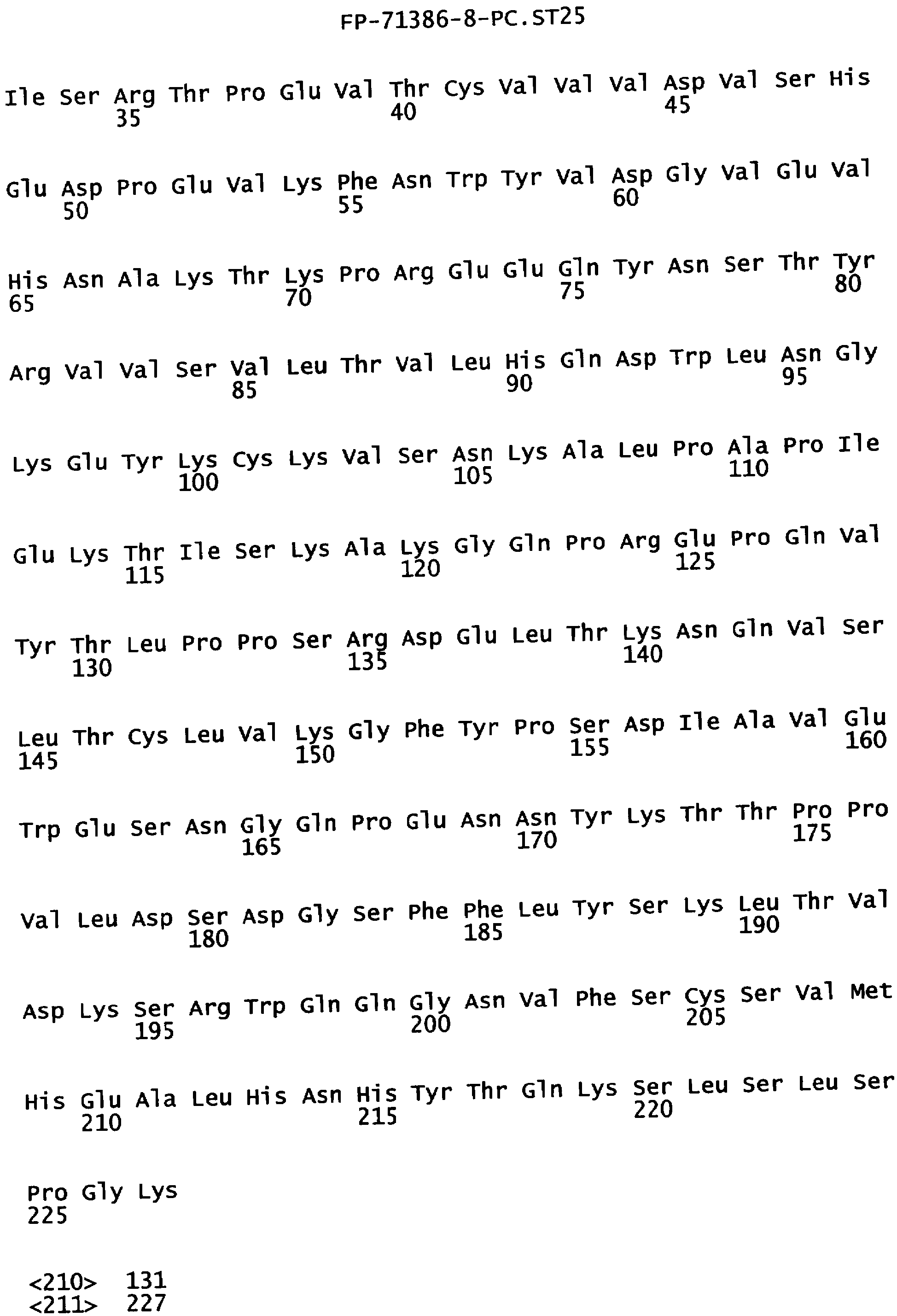




















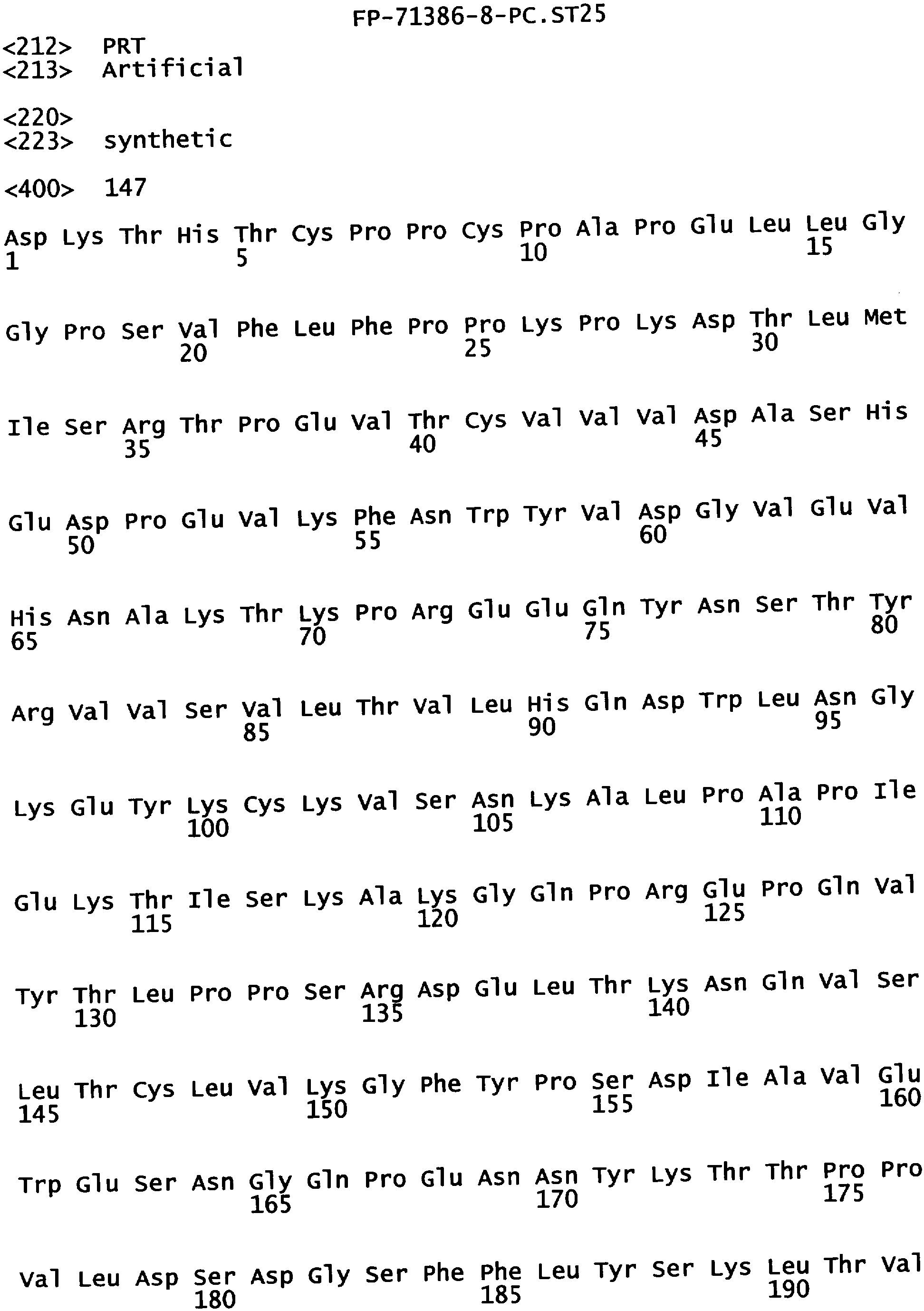


















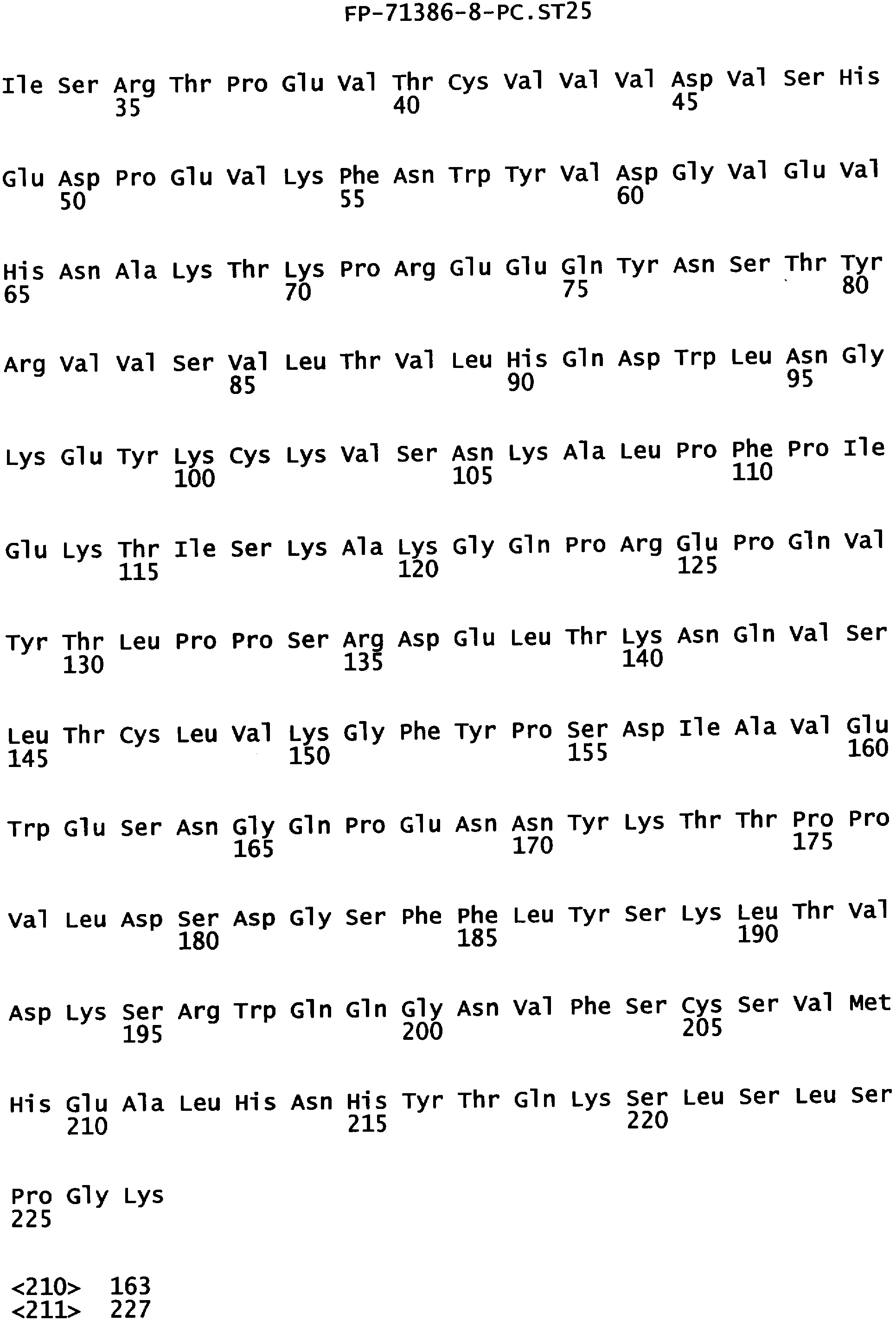


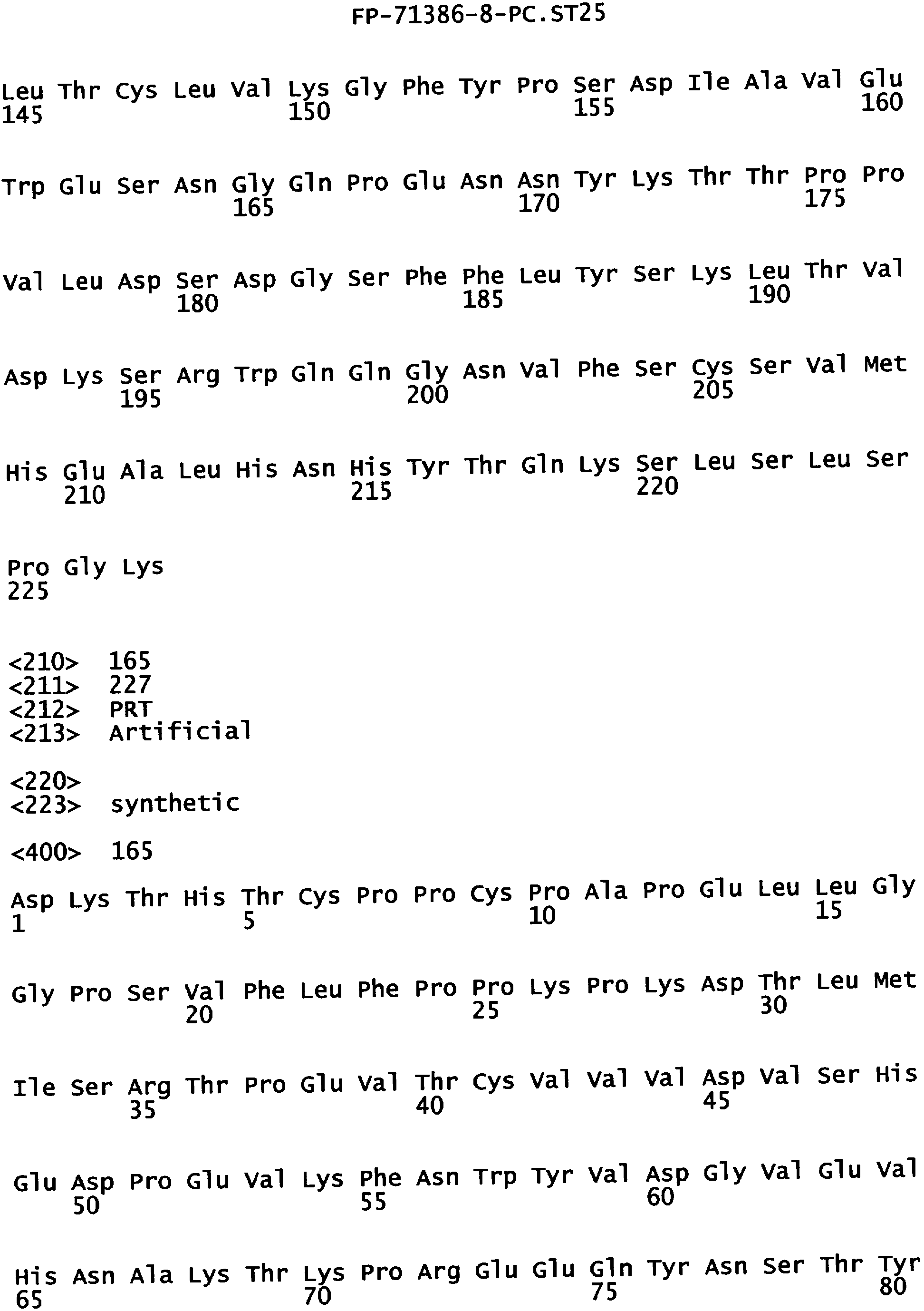

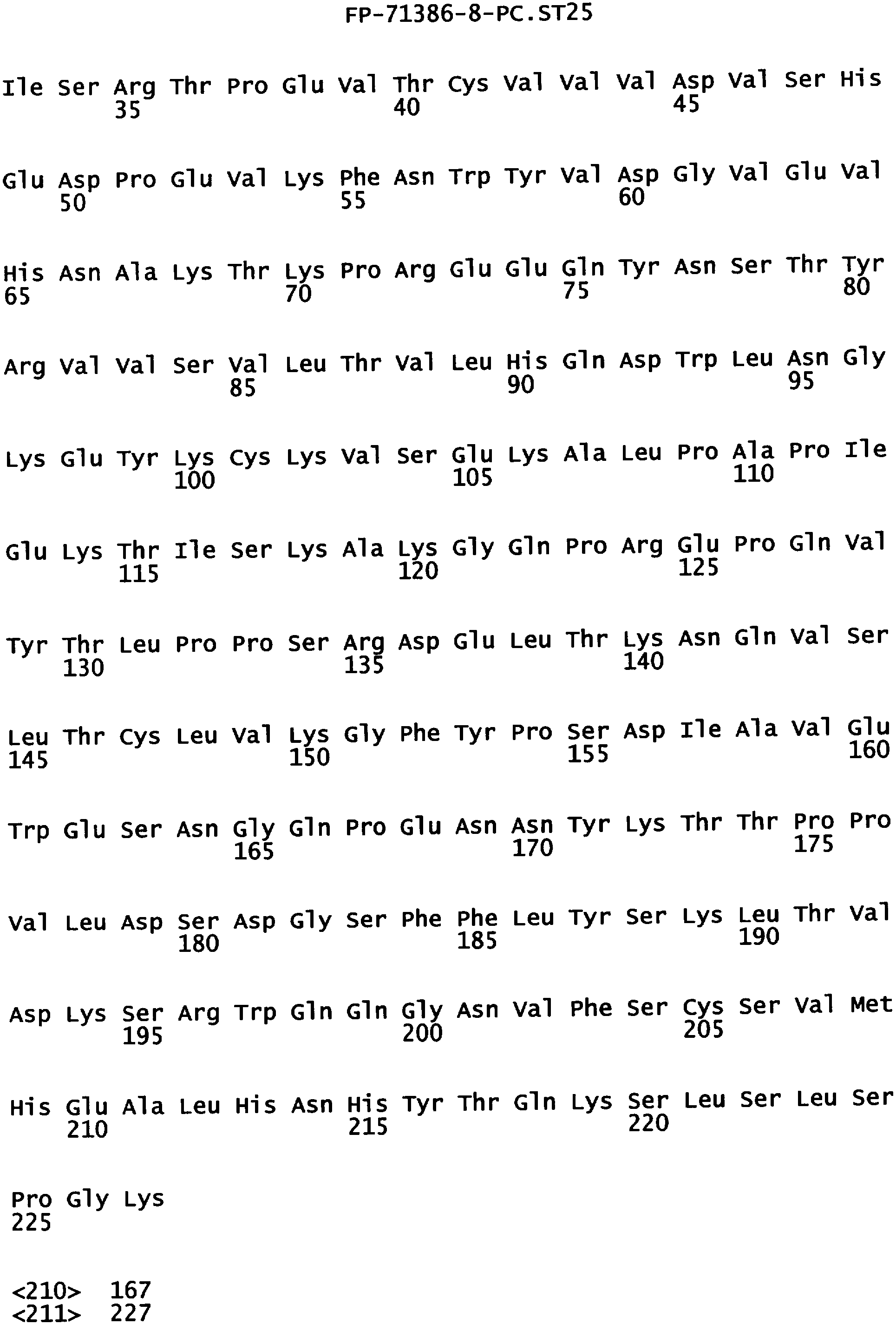


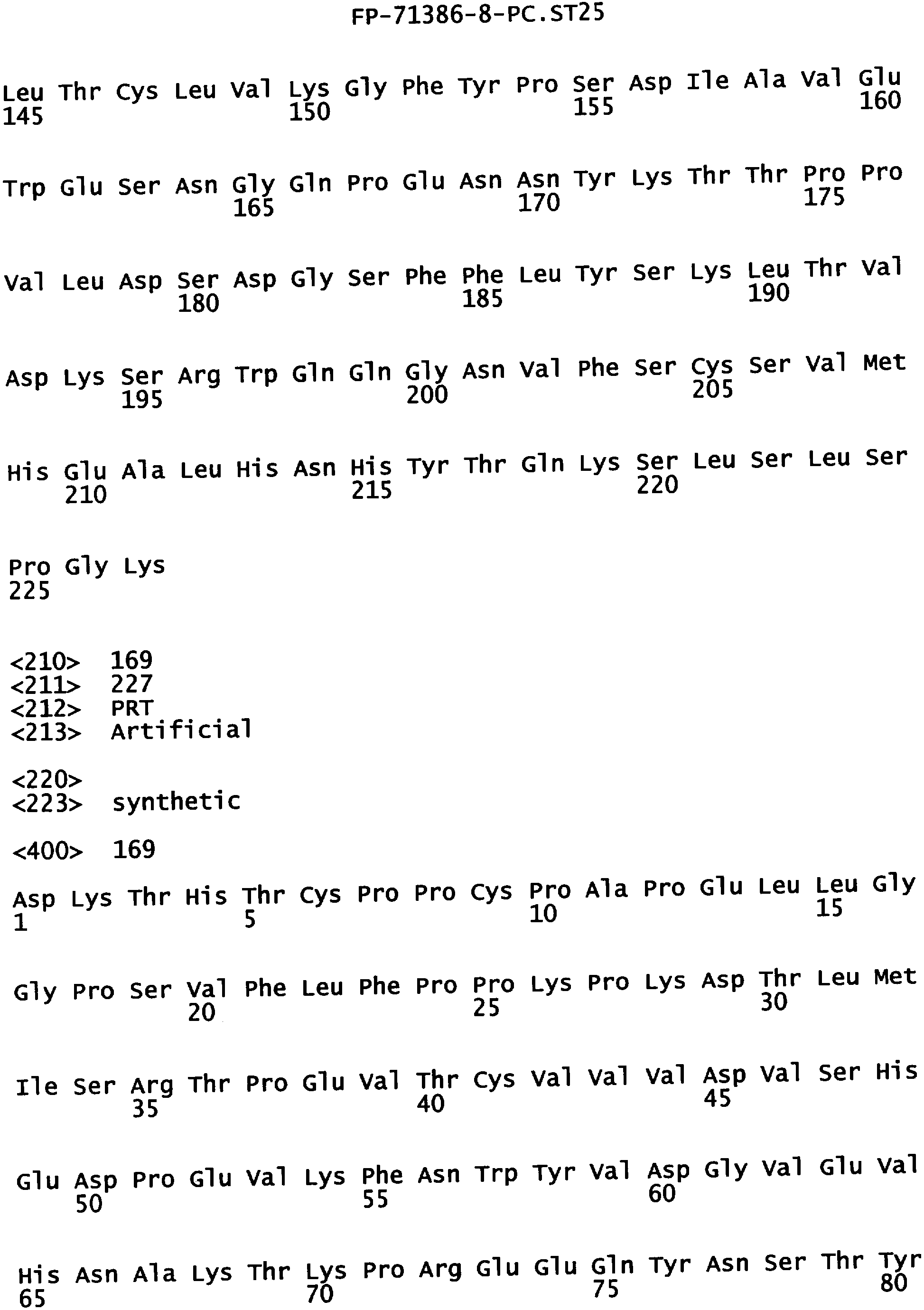


























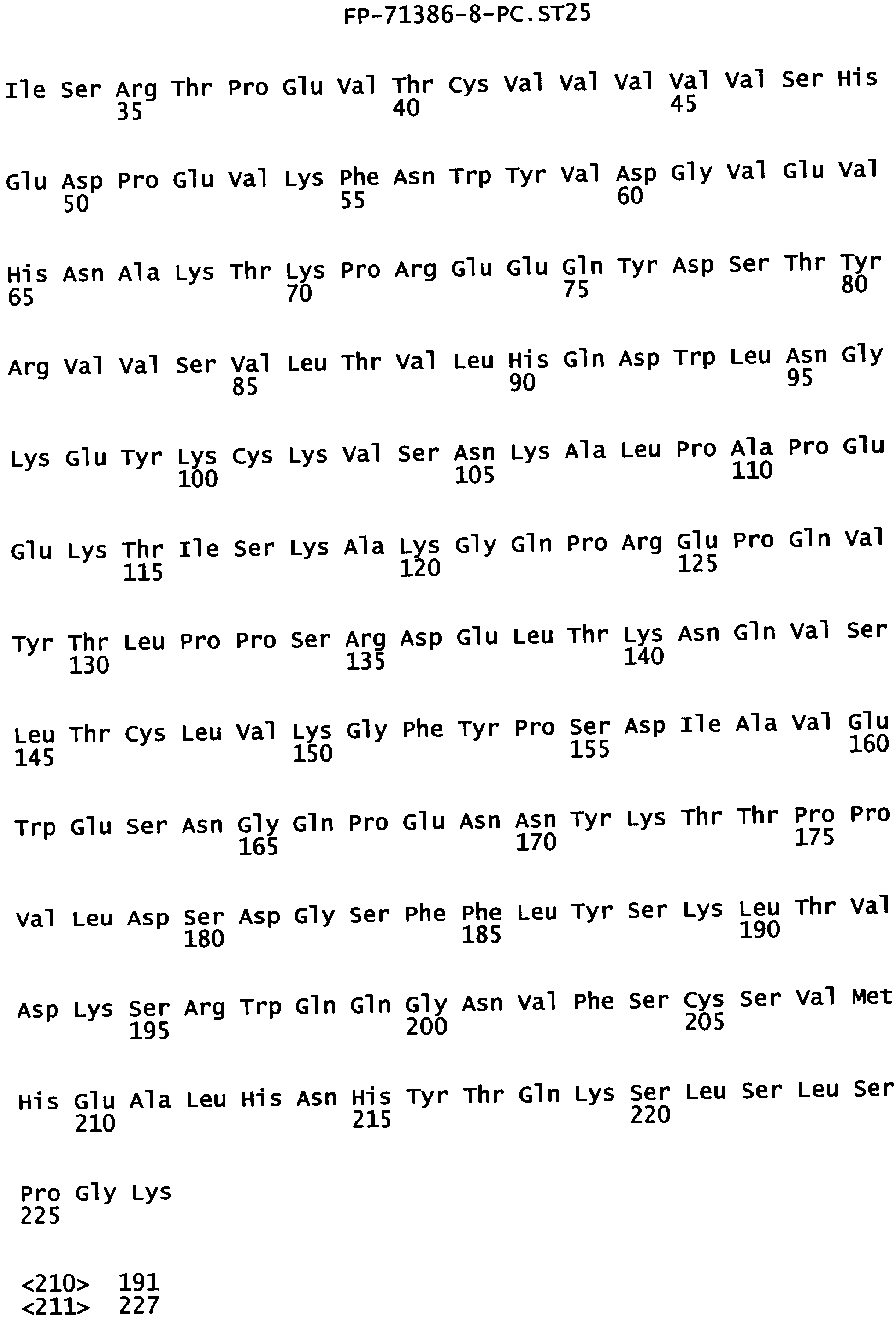


































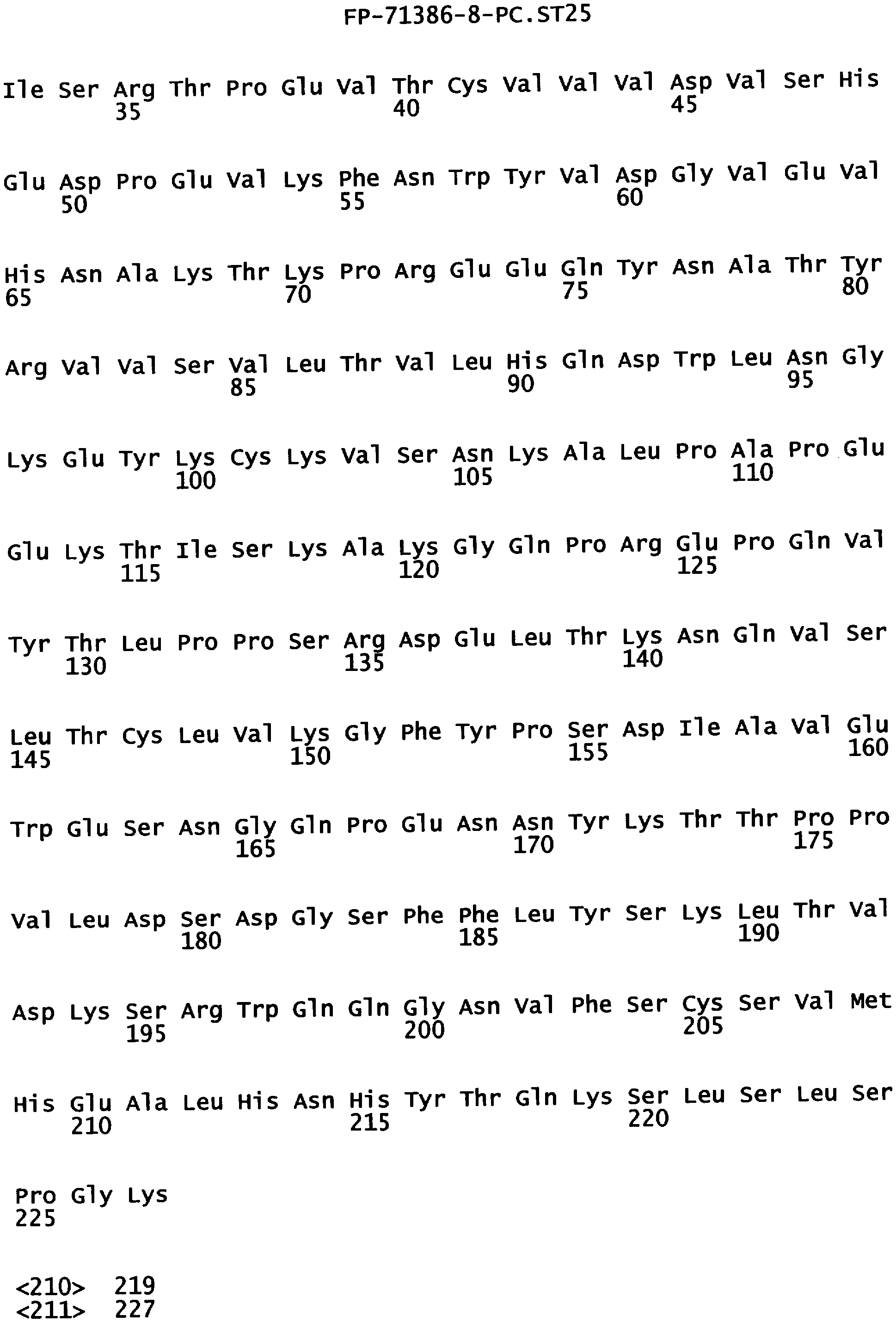
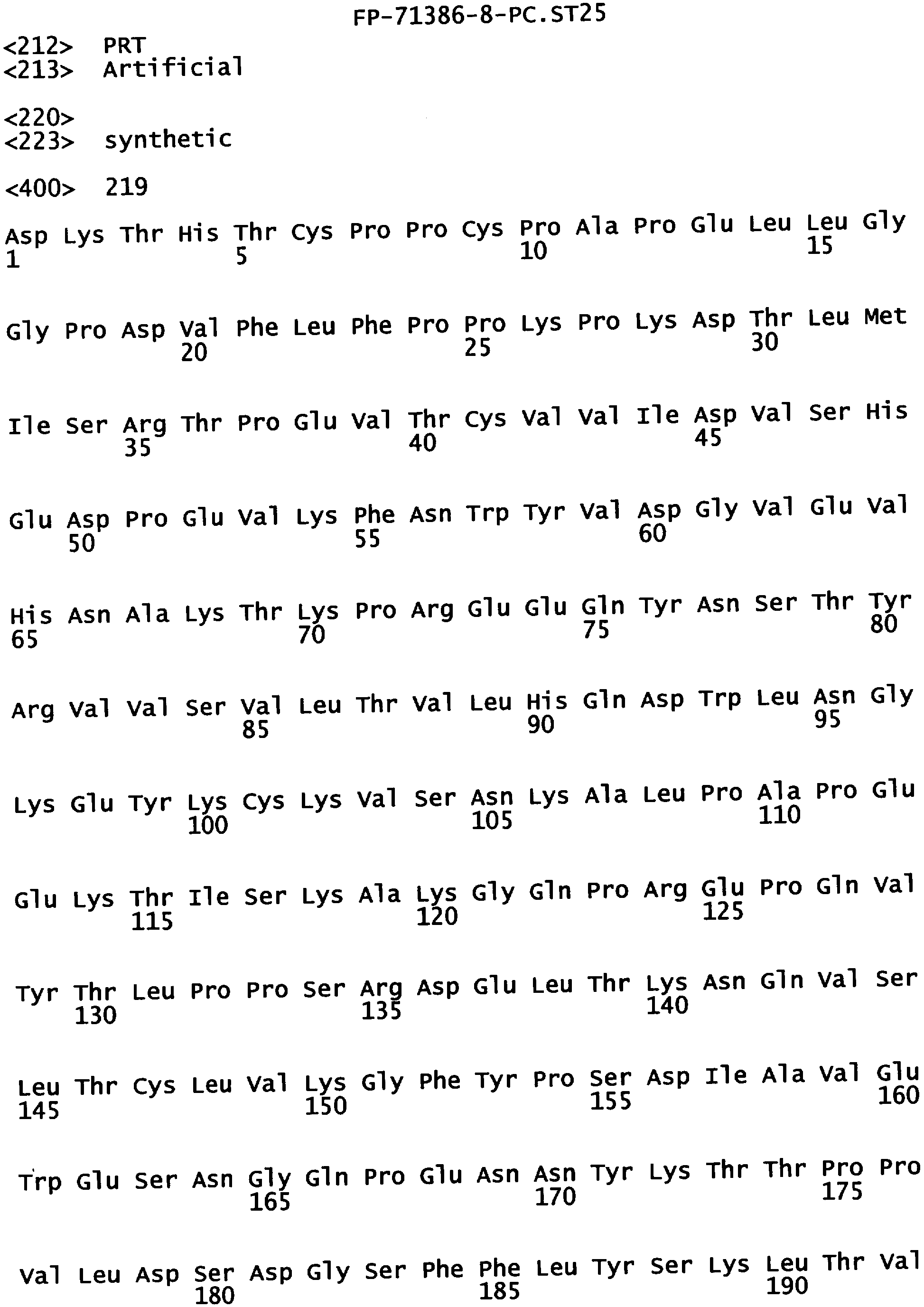


















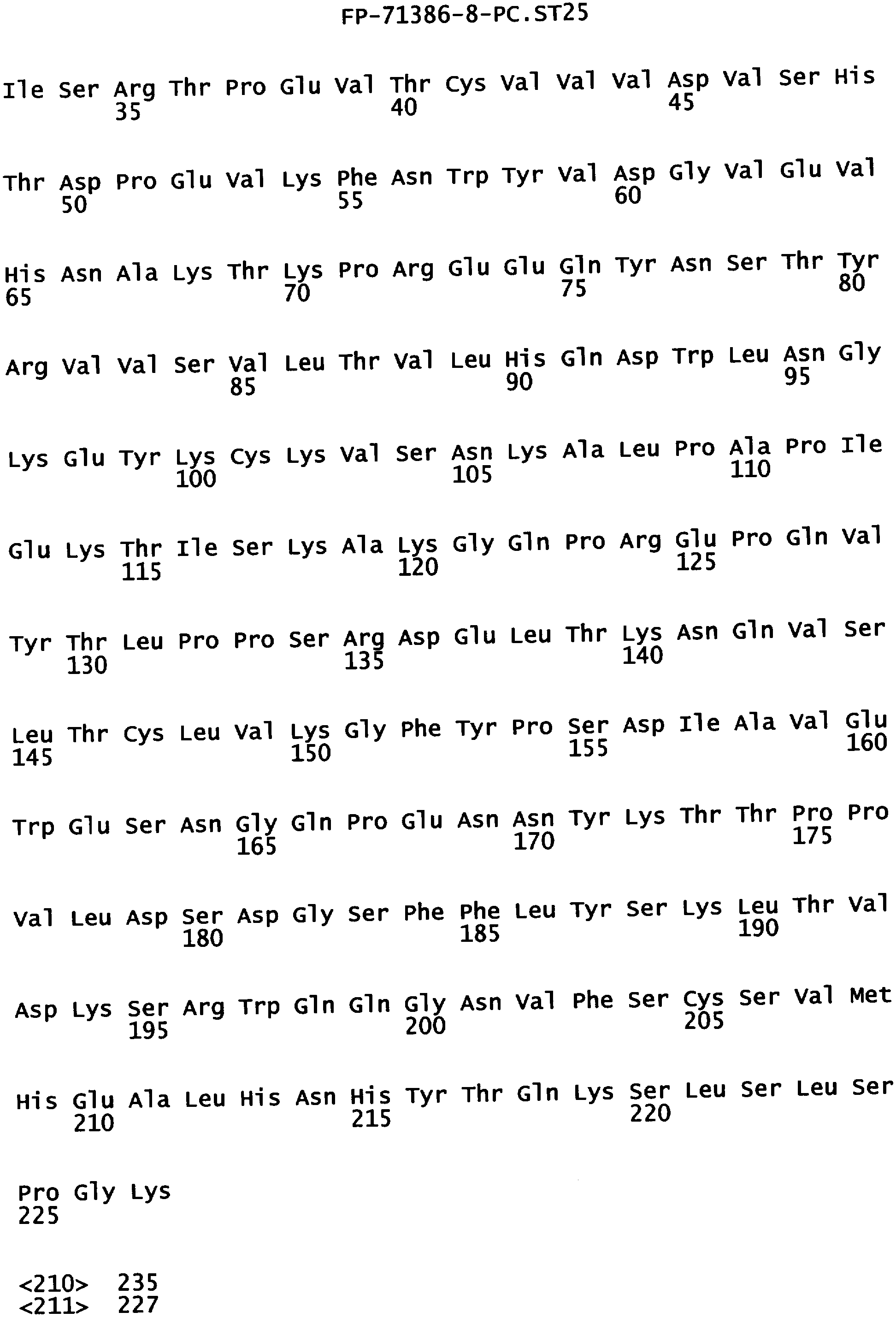









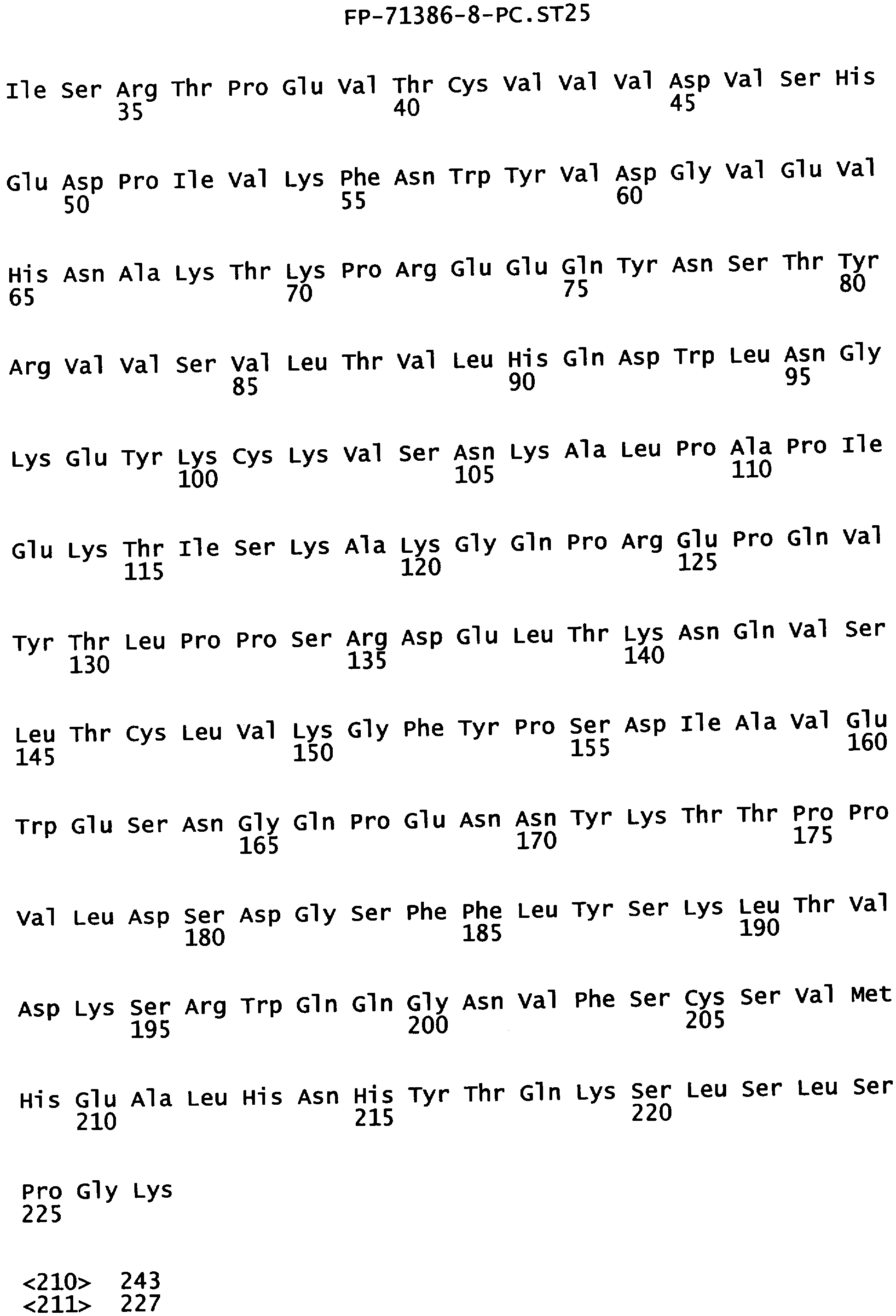












































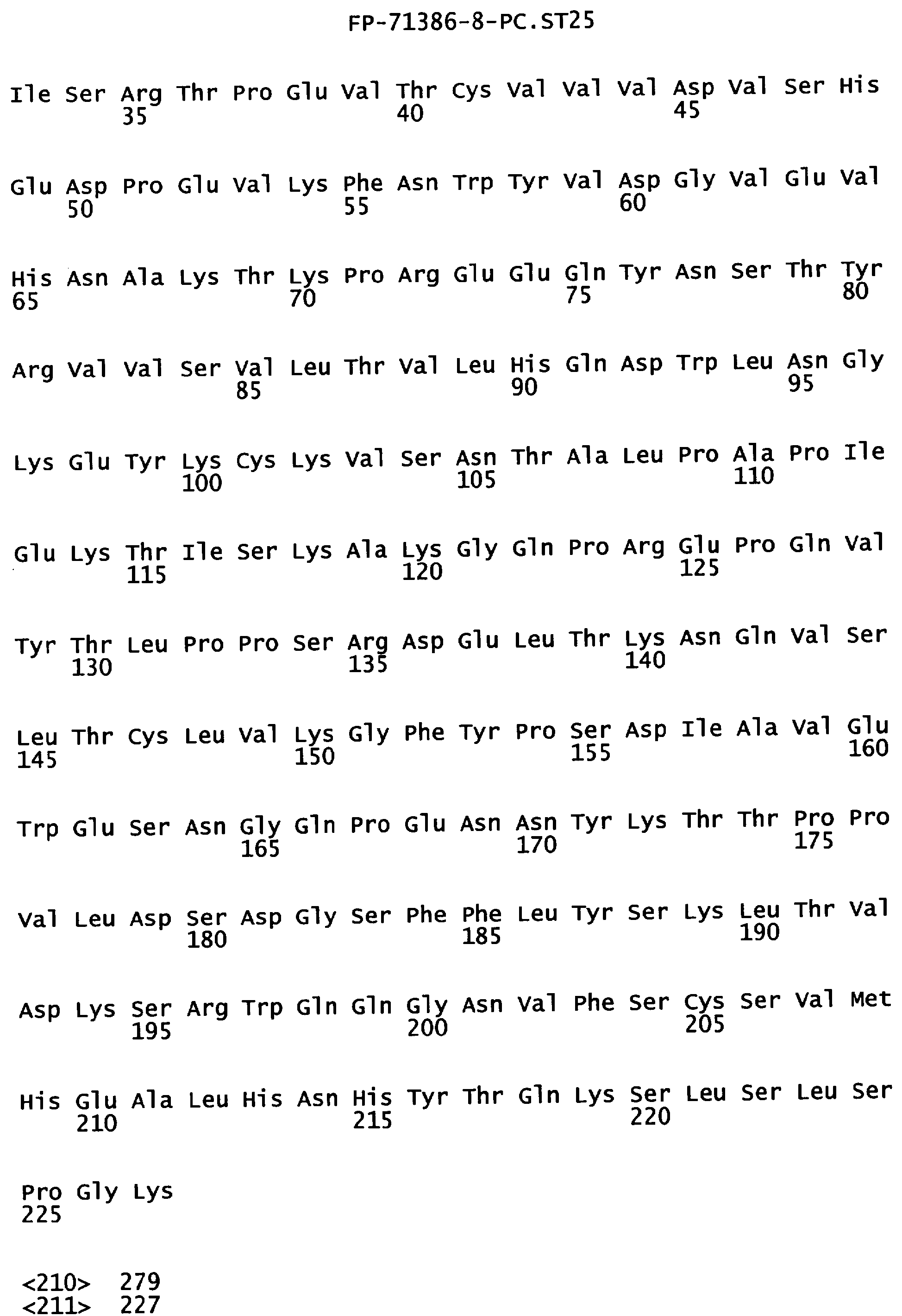















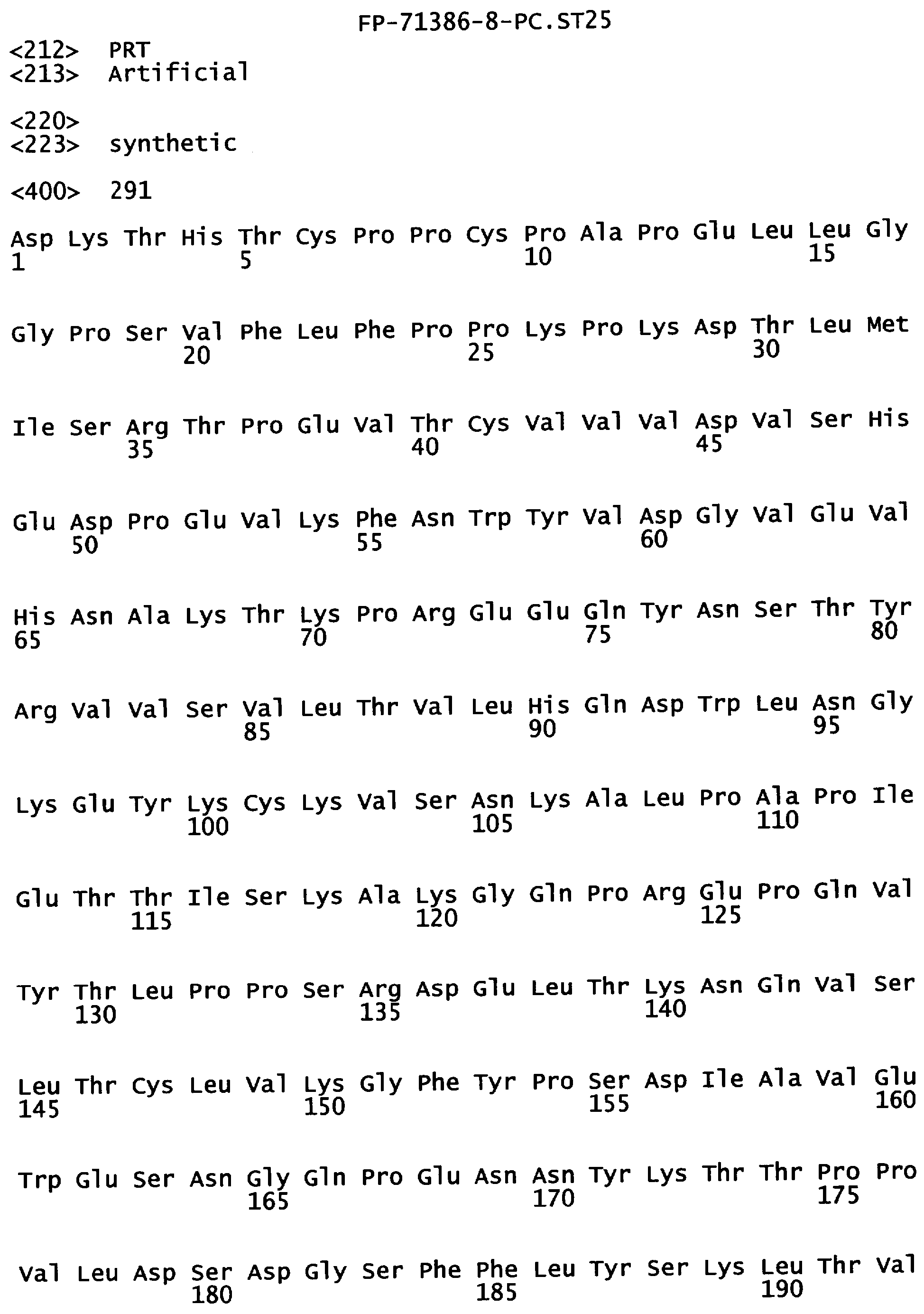


















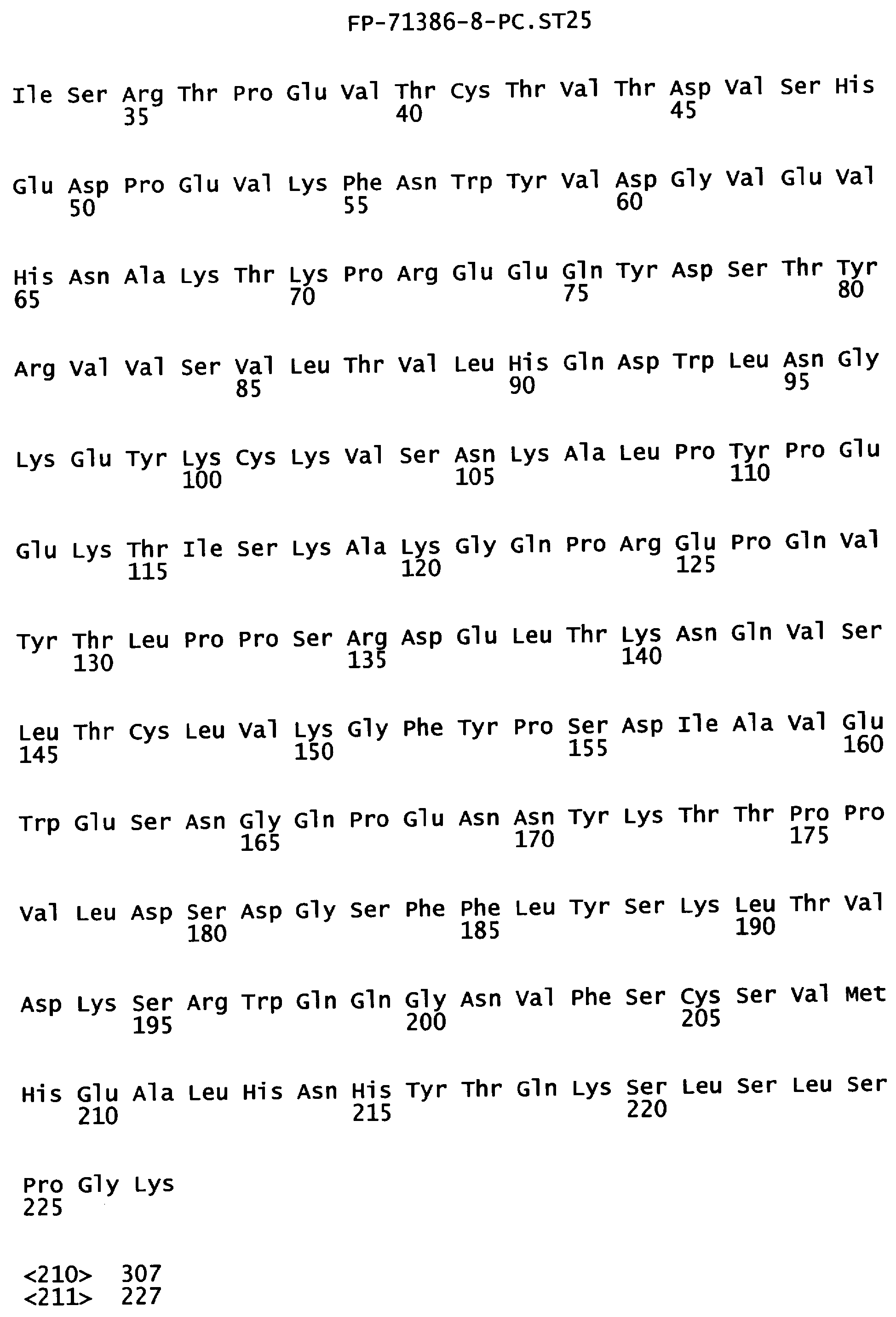



Реферат
Изобретение касается оптимизированных Fc-вариантов исходного полипептида Fc, демонстрирующих измененное связывание с FcγR, являющимся Fc-рецептором, предпочтительно человека. Оптимизированные варианты Fc содержат по меньшей мере одну аминокислотную модификацию в Fc-участке исходного полипептида Fc. Указанное измененное связывание представляет собой увеличение аффинности варианта Fc к FcγR. Изобретение касается фармацевтической композиции, демонстрирующей измененное связывание с FcγR, на основе оптимизированного Fc-варианта и фармацевтически приемлемого носителя. Изобретение касается также способа лечения млекопитающего, имеющего антитело-зависимое расстройство, с использованием оптимизированного Fc. Изобретение обеспечивает варианты Fc, оптимизированные в отношении целого ряда терапевтически значимых свойств. 3 н. и 40 з.п. ф-лы, 59 ил., 70 табл.

Комментарии