Векторы, условно экспрессирующие терапевтические белки, клетки-хозяева, содержащие указанные векторы, и их применение - RU2612788C2
Код документа: RU2612788C2
Чертежи


























































































































































































































Описание
УРОВЕНЬ ТЕХНИКИ
Область техники
[0001] Настоящее изобретение относится к области генной терапии для лечения заболеваний и расстройств, например, рака, лизосомных болезней накопления, заболеваний глаз, заболеваний печени или инфекционные заболевания. Согласно одному из вариантов реализации в соответствии с настоящим изобретением предложено конструирование иммунных клеток или клеток для поддерживающей терапии (TSC) для экспрессии одного или более терапевтического белка (например, иммуномодулятора) и применение указанных клеток в качестве терапевтических средств. Согласно еще одному варианту реализации настоящее изобретение включает вектор, например, аденовирусный, для условной экспрессии описанных в настоящей заявке терапевтических белков (например, иммуномодуляторов), например, IL-12, TNF-альфа, и способы применения таких векторов.
Уровень техники
[0002] Интерлейкин-12 (IL-12) является представителем семейства цитокинов I типа, вовлеченного в содействие ряду биологических процессов, включая, но не ограничиваясь перечисленными, защитный иммунный ответ и подавление образования опухолей (Abdi et al., 2006; Adorini, 1999; Adorini, 2001; Adorini et al., 2002; Adorini et al., 1996; Akhtar et al., 2004; Akiyama et al., 2000; A1-Mohanna et al., 2002; Aliberti et al., 1996; Allavena et al., 1994; Alii и Khar, 2004; Alzona et al., 1996; Amemiya et al., 2006; Araujo et al., 2001; Arulanandam et al., 1999; Athie et al., 2000; Athie-Morales et al., 2004; Bertagnolli et al., 1992; Bhardwaj et al., 1996; Biedermann et al., 2006; Brunda и Gately, 1994; Buchanan et al., 1995; Romani et al., 1997; Rothe et al., 1996; Satoskar et al., 2000; Schopf et al., 1999; Thomas et al., 2000; Tsung et al., 1997; Wolf et al., 1994; Yuminamochi et al., 2007). Все больше данных свидетельствует о том, что IL-12 может быть перспективной мишенью для борьбы с заболеваниями человека (например, раком).
[0003] Несмотря на тот факт, что IL-12 остается перспективным противораковым терапевтическим агентом ввиду мощной активности, поддерживающей противоопухолевые NK-клетки 1 типа, CD4+-T-клетки и CD8+-Т-клетки (Trinchieri, 2003), описанная токсичность рекомбинантного человеческого IL-12 (rhIL-12) у пациентов (Atkins et al., 1997), а также ограниченность соответствующих требованиям GMP источников rhIL-12 для клинического применения, препятствовали успешному внедрению основанных на IL-12 терапевтических подходов. Таким образом, представляется логичным, что геннотерапевтический подход может представлять собой более безопасный, более разумный вариант лечения. Действительно, первая стадия клинических испытаний по внедрению внутриопухолевой или перитуморальной доставки рекомбинантных вирусных (Sangro et al., 2004; Triozzi et al., 2005) или плазмидных IL-12 кДНК (Heinzerling et al., 2005), или модифицированных по гену IL-12 аутологичных фибробластов (Kang et al., 2001) оказалась безопасной и хорошо переносилась.
[0004] Тем не менее, объективные клинические ответы у пациентов с меланомой или разнообразными карциномами, получающих такую генную терапию, были редкими, изменчивыми, неустойчивыми и в значительной степени сосредоточенными на участке лечения (Heinzerling et al., 2005; Kang et al., 2001; Sangro et al., 2004; Triozzi et al., 2005). В случаях, когда регрессия заболевания была частичной или полной, было отмечено увеличение частоты встречаемости проникающих в опухолевые ткани лимфоцитов (Heinzerling и др., 2005; Sangro и др., 2004) и увеличение уровней циркулирующих опухолеспецифических CD8+-T-клеток (Heinzerling et al., 2005), что указывает на улучшение перекрестного примирования антиген-специфичных Т-клеток у этих пациентов.
[0005] Так как перекрестное примирование специфичных Т-клеток лучше всего осуществляется дендритными клетками (ДК), которые служат естественным, но регулируемьм источником IL-12 (Berard et al., 2000), недавно представленные данные о превосходной доклинической эффективности основанной на ДК генной терапии IL-12 представляют большой интерес (Satoh et al., 2002; Tatsumi et al., 2003; Yamanaka et al., 2002). Например, было показано, что внутриопухолевая (внуториопухолевая; i.t.) инъекция ДК, сконструированных для синтеза IL-12p70 (посредством рекомбинантной аденовирусной инфекции) приводит к значительному усилению перекрестного примирования популяции высокореактивных опухолеспецифичных CD8+-Т-клеток совместно с отторжением опухоли в мышиных моделях (Tatsumi et al., 2003). Учитывая прежнее применение рекомбинантного аденовируса, кодирующего mIL-12 под CMV-промотором (rAd.cIL12, (Tatsumi et al., 2003)), определяющим фактором было продуцирование IL-12 сконструированными ДК, следовательно, иммунологическое воздействие этого цитокина, на ранних этапах - в опухолевом образовании, а затем в дренирующих опухоль лимфатических узлах, не может быть оценено в отношении терапевтического результата. Таким образом, существует необходимость в ДК, сконструированных для условной экспрессии IL-12 с целью регулирования как уровней трансгенной экспрессии, так и временного распределения трансгенной активации. В соответствии с настоящим изобретением предложено применение таких клеток с перспективным терапевтическим результатом.
[0006] Многие из указанных терапевтических белков, в настоящее время проходящих доклинические или клинические исследования, не обнаруживают вредных побочных эффектов при наличии в организме пациента до экспрессии последовательности нуклеиновой кислоты в клетке-хозяине пациента или в подходящем физиологическом контексте. Тем не менее, некоторые белки, такие как фактор некроза опухоли (TNF, ФНО), вызывают побочные эффекты при экспрессии вне нормальной физиологической ткани или контекста (например, при действии на нецелевые ткани). Системное или даже местное введение этого белка чрезвычайно токсично для многих неопухолевых типов клеток, и может способствовать анафилаксии и кахексии. Кроме того, длительное воздействие TNF-альфа может приводить к совершенно иным клеточным ответам, чем кратковременная стимуляция. По этим причинам безопасные и эффективные методики противораковой TNF-альфа терапии оставались недостижимыми.
[0007] В связи с проблемами, связанными с генной экспрессией генов посредством векторных композиций, содержащих белок, кодируемый представляющей интерес последовательностью нуклеиновой кислоты, по-прежнему существует необходимость улучшения передачи векторных композиций, которые будут применяться для прямых инъекций или для клеточной терапии.
[0008] Лизосомные болезни накопления (ЛБН) представляют собой класс наследственных генетических заболеваний, терапию которых в настоящее время проводят только белковыми терапевтическими средствами в форме ферментной заместительной терапии.
[0009] ЛБН представляют собой группу из 49 генетически наследуемых заболеваний, характеризующихся дефицитом одного или более лизосомального фермента, что приводит к накоплению нерасщепленных макромолекул внутри лизосом. Накопление этих побочных продуктов вызывает увеличение лизосом в клетках, что приводит к повреждению и дегенерации клеток. Накопленное повреждение органов и тканей приводит к прогрессивному ухудшению физического и/или психического состояния, и, в конечном итоге, к смерти. Диагноз обычно ставят в раннем детстве. Тяжесть индивидуального заболевания варьирует и коррелирует с уровнями остаточной активности фермента, синтезируемого дефектным геном.
[0010] Заболеваемость ЛБН составляет примерно 1 случай на 5000 человек (130000 случаев во всем мире). Тяжесть варьирует и коррелирует с уровнями остаточной активности фермента, синтезируемого дефектным геном. Пациенты с тяжелыми формами доживают только до подросткового возраста, в то время как пациенты с менее тяжелыми формами могут доживать до взрослого возраста.
[0011] Ферментная заместительная терапия представляет собой единственный существующий способ терапии ЛБН. Терапия заключается в системной инфузии активных белков, направляющихся в лизосомы и расщепляющих накапливающиеся ненужные молекулы. Примеры белковых терапевтических средств для ЛБН включают фабразим (Fabrazyme) (Genzyme) для болезни Фабри, Элапразу (Elaprase) (Shire) для МПС II, Myozome (Genzyme) для болезни Помпе и церезим (Cerezyme) (Genzyme) для болезни Гоше.
[0012] Ферментной заместительной терапии присущи определенные недостатки, такие как необходимость посттрансляционной модификации белков; замещающие ферменты отличаются коротким периодом полураспада in viva; у пациентов развивается иммунный ответ на замещающие ферменты. Таким образом, в данной области техники по-прежнему существует потребность в альтернативе ферментной заместительной терапии для лечения лизосомальных болезней накопления.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0013] В соответствии с настоящим изобретением предложен рекомбинантный вектор, кодирующий белок(белки), обладающий(е) функцией(ями) одного или более терапевтического белка (например, иммуномодулятора), под контролем одного или более промотора. Согласно одному из вариантов реализации указанный один или более промотор является условным. Согласно еще одному варианту реализации указанный один или более промотор является конститутивным. Согласно еще одному варианту реализации указанный вектор представляет собой аденовирусный вектор, кодирующий белок (белки), удаленный из промотора, который может быть условно активирован путем введения растворимого низкомолекулярного лиганда, в частности, диацилгидразинов (например, RG-115819, RG-115830 или RG-115932). Такой вектор позволяет контролировать экспрессию белка(ов) иммунными клетками, TSC и при прямом инъецировании векторов, содержащих терапевтические белки (например, иммуномодуляторы).
[0014] Согласно одному из вариантов реализации в соответствии с настоящим изобретением предложен вектор для условной экспрессии белка(ов), обладающего(их) функцией(ями) одного или более терапевтического белка (например, иммуномодулятора), содержащий полинуклеотид, кодирующий генный переключатель, причем указанный полинуклеотид, кодирующий генный переключатель, содержит (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, причем указанную по меньшей мере одну последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, и (2) полинуклеотид, кодирующий один или более белок, обладающий функцией терапевтического белка (например, иммуномодулятора), связанный с промотором, который активируется указанным лиганд-зависимым транскрипционным фактором. Согласно одному из вариантов реализации указанный терапевтический белок (например, иммуномодулятор) выбирают из IL-1, IL-2, IL-3, IL-4, IL-5, IL-7, IL-8, IL-9, IL-10R DN или их субъединицы, IL-15, IL-18, IL-21, IL-23, IL-24, IL-27, ГМКСФ, IFN-альфа (ИФН-альфа), IFN-гамма (ИФН-гамма), CCL3 (MIP-1a), CCL5 (RANTES), CCL7 (МСР3), XCL1 (лимфотактина), CXCL1 (MGSA-альфа), CCR7, CCL19 (MIP-3b), CXCL9 (MIG), CXCL10 (IP-10), CXCL12 (SDF-1), CCL21 (6С-кина), OX40L, 4-1BBL, CD40, CD70, GITRL, LIGHT, b-дефенсина, HMGB1, Flt3L, IFN-бета (ИФН-бета), TNF-альфа, dnFADD, TGF-альфа, PD-L1, интерферирующей РНК, антисмыслового олигонуклеотида PD-L1, TGFbRII DN, ICOS-L, S100, CD40L, р53, сурвивина, гибрида р53-сурвивин, MAGE3, PSA и PSMA.
[0015] Согласно еще одному варианту реализации в соответствии с настоящим изобретением предложен вектор для экспрессии белка(ов), обладающего(их) функцией(ями) одного или более терапевтического белка (например, иммуномодулятора) и белок, обладающий функцией IL-12, содержащий полинуклеотид, кодирующий генный переключатель, причем указанный полинуклеотид содержит (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, причем указанную по меньшей мере одну последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, (2) полинуклеотид, кодирующий указанный(е) белок(белки), обладающий(е) функцией(ями) указанного одного или более терапевтического белка (например, иммуномодулятора), и (3) полинуклеотид, кодирующий белок, обладающий функцией IL-12; причем по меньшей мере один полинуклеотид по (2) и (3) связан с промотором, который активируется указанным лиганд-зависимым транскрипционным фактором.
[0016] Согласно некоторым вариантам реализации вектор, предложенный в соответствии с настоящим изобретением, условно экспрессирует TNF-альфа. Согласно определенным вариантам реализации указанный вектор, например, аденовирусный вектор, условно экспрессирующий один или более белок, обладающий функцией терапевтического белка (например, иммуномодулятора), например, TNF-альфа, также содержит последовательность нуклеиновой кислоты, кодирующую сигнальный пептид. Указанный сигнальный пептид может быть с оптимизированным составом кодонов. Согласно другим вариантам реализации указанный вектор дополнительно содержит 5’ нетранслируемую область (UTR), 3’-регуляторную область, либо их обе, и улучшает экспрессию и/или общий выход белка.
[0017] В соответствии с настоящим изобретением также предложен способ получения популяции клеток, например, иммунных клеток или TSC, экспрессирующих белок(белки), обладающий(е) функцией одного или более терапевтического белка (например, иммуномодулятора) посредством модификации (например, трансфекции, электропорации и т.д.) указанных клеток рекомбинантным вектором, условно экспрессирующим белок(белки), обладающий(е) функцией(ями) указанного одного или более терапевтического белка (например, иммуномодулятора), согласно которому указанный вектор содержит полинуклеотид, кодирующий генный переключатель, причем указанный полинуклеотид содержит (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, где указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, и (2) полинуклеотид, кодирующий один или более белок, обладающий функцией терапевтического белкового (например, иммуномодулирующего) модулятора, связанный с промотором, который активируется указанным лиганд-зависимым транскрипционным фактором.
[0018] Согласно еще одному варианту реализации в соответствии с настоящим изобретением предложен способ получения популяции клеток, например, иммунных клеток или TSC, экспрессирующих белки, обладающие функцией(ями) одного или более терапевтического белка (например, иммуномодулятора) и белок, обладающий функцией IL-12, посредством модификации указанных клеток рекомбинантным вектором, содержащим полинуклеотид, кодирующий генный переключатель, причем указанный полинуклеотид содержит (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, где указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, (2) полинуклеотид, кодирующий указанный белок(белки), обладающий(е) функцией(ями) указанного одного или более терапевтического белка (например, иммуномодулятора), и (3) полинуклеотид, кодирующий белок, обладающий функцией IL-12; причем по меньшей мере один полинуклеотид по (2) и (3) связан с промотором, который активируется указанным лиганд-зависимым транскрипционным фактором.
[0019] Согласно некоторым вариантам реализации в соответствии с настоящим изобретением предложен способ увеличения экспрессии терапевтического белка (например, иммуномодулятора), например, TNF-альфа, экспрессии иРНК или экспрессии белка, включающий получение вектора, условно экспрессирующего один или более белок, обладающий функцией терапевтического белка (например, иммуномодулятора) и одну или более регуляторную последовательность, причем указанная одна или более регуляторная последовательность улучшает экспрессию указанных терапевтических белков (например, иммуномодуляторов), в частности, TNF-альфа.
[0020] В соответствии с настоящим изобретением также предложена популяция клеток, например, иммунных клеток или TSC, экспрессирующих белок(белки), обладающий(е) функцией одного или более терапевтического белка (например, иммуномодулятора), которые были модифицированы (например, трансфицированы, электропорированы, и т.д.) рекомбинантным вектором, условно экспрессирующим белок(белки), обладающий(е) функцией(ями) указанного одного или более терапевтического белка (например, иммуномодулятора), причем указанный вектор содержит полинуклеотид, кодирующий генный переключатель, причем указанный полинуклеотид содержит (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, где указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, и (2) полинуклеотид, кодирующий один или более белок, обладающий функцией терапевтического белка (например, иммуномодулятора), связанный с промотором, который активируется указанным лиганд-зависимым транскрипционным фактором.
[0021] Согласно еще одному варианту реализации в соответствии с настоящим изобретением предложена популяция клеток, например, иммунных клеток или TSC, экспрессирующих белки, обладающие функцией(ями) одного или более терапевтического белка (например, иммуномодулятора) и белок, обладающий функцией IL-12, которые были модифицированы рекомбинантным вектором, содержащим полинуклеотид, кодирующий генный переключатель, причем указанный полинуклеотид содержит (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, где указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, (2) полинуклеотид, кодирующий указанный белок(белки), обладающий(е) функцией(ями) указанного одного или более терапевтического белка (например, иммуномодулятора) и (3) полинуклеотид, кодирующий белок, обладающий функцией IL-12; причем по меньшей мере один полинуклеотид по (2) и (3) связан с промотором, который активируется указанным лиганд-зависимым транскрипционным фактором.
[0022] Согласно еще одному варианту реализации в соответствии с настоящим изобретением предложена композиция, содержащая две или более популяции клеток, предложенных в соответствии с настоящим изобретением, например, иммунных клеток или TSC, причем каждая популяция клеток в указанной композиции экспрессирует один или более терапевтический белок (например, иммуномодулятор), отличный от одного или более терапевтического белка (например, иммуномодулятора), экспрессирующегося в другой(их) популяции(ях) клеток в указанной композиции. Согласно одному из вариантов реализации указанная композиция содержит две популяции клеток. Согласно еще одному варианту реализации указанная композиция содержит более чем две популяции клеток. Согласно еще одному варианту реализации указанная композиция содержит три популяции клеток. Согласно еще одному варианту реализации указанная композиция содержит четыре популяции клеток.
[0023] Согласно еще одному варианту реализации в соответствии с настоящим изобретением предложена сконструированная in vitro клетка, например, иммунная клетка или TSC, содержащая вектор, содержащий полинуклеотид, кодирующий генный переключатель, причем указанный полинуклеотид содержит (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, где указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, и (2) полинуклеотид, кодирующий белок, обладающий функцией терапевтического белка (например, иммуномодулятора), связанный с промотором, который активируется указанным лиганд-зависимым транскрипционным фактором. Согласно еще одному варианту реализации в соответствии с настоящим изобретением предложена сконструированная in vitro клетка, например, иммунная клетка или TSC, содержащая вектор, содержащий полинуклеотид, кодирующий генный переключатель, причем указанный полинуклеотид содержит (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, где указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, (2) полинуклеотид, кодирующий белок, обладающий функцией терапевтического белка (например, иммуномодулятора), и (3) полинуклеотид, кодирующий белок, обладающий функцией IL-12; причем по меньшей мере один полинуклеотид по (2) и (3) связан с промотором, который активируется указанным лиганд-зависимым транскрипционным фактором.
[0024] Согласно еще одному варианту реализации в соответствии с настоящим изобретением предложена композиция, содержащая две или более популяции in vitro сконструированных клеток, например, иммунных клеток или TSC, предложенных в соответствии с настоящим изобретением, причем каждая из указанных популяций in vitro сконструированных клеток в указанной композиции содержит вектор, содержащий полинуклеотид, кодирующий генный переключатель, причем указанный полинуклеотид содержит (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, где указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, и (2) полинуклеотид, кодирующий белок, обладающий функцией терапевтического белка (например, иммуномодулятора), связанный с промотором, который активируется указанным лиганд-зависимым транскрипционным фактором, и где каждая популяция in vitro сконструированных клеток в указанной композиции экспрессирует один или более терапевтический белок (например, иммуномодулятор), отличный от одного или более терапевтического белка (например, иммуномодулятора), экспрессирующегося в другой(их) популяции(ях) in vitro сконструированных клеток в указанной композиции. Согласно одному из вариантов реализации в соответствии с настоящим изобретением предложена композиция, содержащая две или более популяции in vitro сконструированных клеток, например, иммунных клеток или TSC, где каждая из указанных популяций клеток содержит вектор, содержащий полинуклеотид, кодирующий генный переключатель, причем указанный полинуклеотид содержит (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, где указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, (2) полинуклеотид, кодирующий белок, обладающий функцией терапевтического белка (например, иммуномодулятора), и (3) полинуклеотид, кодирующий белок, обладающий функцией IL-12; причем по меньшей мере один полинуклеотид по (2) и (3) связан с промотором, который активируется указанным лиганд-зависимым транскрипционным фактором. Согласно одному из вариантов реализации указанная композиция содержит две популяции in vitro сконструированных клеток. Согласно еще одному варианту реализации указанная композиция содержит более чем две популяции in vitro сконструированных клеток. Согласно еще одному варианту реализации указанная композиция содержит три популяции in vitro сконструированных клеток. Согласно еще одному варианту реализации указанная композиция содержит четыре популяции in vitro сконструированных клеток.
[0025] В соответствии с настоящим изобретением также предложена фармацевтическая композиция, содержащая популяцию клеток, например, иммунных клеток или TSC, согласно описанию в настоящей заявке, или композиция, подходящая для прямой инъекции указанных экспрессионных векторов в отсутствие популяции клеток, т.е. непосредственно инъецируемая.
[0026] Согласно одному из вариантов реализации полинуклеотид, кодирующий один или более белок, обладающий функциями иммуномодулятора, находится под контролем промотора генного переключателя, а полинуклеотид, кодирующий белок, обладающий функцией IL-12, находится под контролем конститутивного промотора. Согласно еще одному варианту реализации и полинуклеотид, кодирующий белок(белки), обладающий функциями указанных терапевтических белков (например, иммуномодуляторов), и полинуклеотид, кодирующий белок, обладающий функцией IL-12, находятся под контролем мультицистронного промотора указанного генного переключателя. Согласно еще одному варианту реализации полинуклеотид, кодирующий белок(белки), обладающий(е) функцией указанных терапевтических белков (например, иммуномодуляторов), находится под контролем промотора генного переключателя, а полинуклеотид, кодирующий белок, обладающий функцией IL-12, находится под контролем условного промотора, отличного от промотора генного переключателя. Согласно еще одному варианту реализации система генной регуляции полинуклеотида, кодирующего белок(белки), обладающий(е) функцией указанных терапевтических белков (например, иммуномодуляторов) и система генной регуляции полинуклеотида, обладающего функцией IL-12, являются ортогональными. Согласно еще одному варианту реализации системы генной регуляции каждого полинуклеотида, кодирующего каждый белок, являются ортогональными.
[0027] Согласно одному из вариантов реализации в соответствии с настоящим изобретением также предложен способ лечения раковых заболеваний, таких как, не ограничиваясь перечисленными, меланомные опухоли, глиомные опухоли, рак почки и рак предстательной железы, а также раковые заболевания, перечисленные в настоящей заявке в таблице 1. Показана противоопухолевая эффективность генной терапии IL-12B исследованиях на животных моделях при применении в форме рекомбинантного кДНК-вектора (Faure et al., 1998; Sangro et al., 2005), и даже большая при применении генно-модифицированных ДК (Satoh et al., 2002; Svane et al., 1999; Tatsumi et al., 2003; Yamanaka et al., 2002). Хотя к настоящему моменту в ходе первой стадии клинических испытаний генной терапии L-12 на человеке с применением плазмид или вирусных векторов и не удалось добиться стойких объективных клинических ответов на фоне рака (Heinzerling et al., 2005; Kang et al., 2001; Sangro et al., 2004; Triozzi et al., 2005), генная терапия согласно описанию в настоящей заявке обеспечивает перспективный терапевтический метод.
[0028] Согласно одному из вариантов реализации в соответствии с настоящим изобретением предложен способ лечения опухоли у млекопитающего, включающий следующие этапы:
(а) введение внутриопухолево в микроокружение опухоли, в окружающую опухоль область или системно популяции иммунных клеток, TSC или векторов, предложенных в соответствии с настоящим изобретением (или их комбинации), in vitro сконструированных для условной экспрессии одного или более белка, обладающего функцией терапевтического белка (например, иммуномодулятора); и
(b) введение указанному млекопитающему терапевтически эффективного количества активирующего лиганда;
с индуцированном, таким образом, экспрессии белка, обладающего функцией терапевтического белка (например, иммуномодулятора), и лечением указанной опухоли.
[0029] Согласно одному из вариантов реализации в настоящем изобретении предложен способ лечения опухоли у млекопитающего, включающий следующие этапы:
(a) введение внутриопухолево в микроокружение опухоли популяции иммунных клеток или TSC, сконструированных in vitro для условной экспрессии одного или более белка, обладающего функцией терапевтического белка (например, иммуномодулятора); и
(b) введение указанному млекопитающему терапевтически эффективного количества активирующего лиганда;
с индуцированном, таким образом, экспрессии белка, обладающего функцией указанных терапевтических белков (например, иммуномодуляторов) и лечение указанной опухоли.
[0030] Согласно еще одному варианту реализации настоящего изобретения предложен способ лечения опухоли у млекопитающего, включающий следующие этапы:
(a) введение внутриопухолево в микроокружение опухоли двух или более популяций иммунных клеток или TSC, сконструированных in vitro для условной экспрессии одного или более белка, обладающего функцией терапевтического белка (например, иммуномодулятора), причем каждая популяция иммунных клеток или TSC экспрессирует отличный набор из одного или более терапевтического белка (например, иммуномодулятора); и
(b) введение указанному млекопитающему терапевтически эффективного количества одного или более активирующего лиганда;
с индуцированном, таким образом, экспрессии белков, обладающего функцией указанных терапевтических белков (например, иммуномодуляторов) и лечение указанной опухоли.
[0031] Согласно еще одному варианту реализации настоящего изобретения предложен способ лечения опухоли у млекопитающего, включающий следующие этапы:
(a) введение внутриопухолево в микроокружение опухоли популяции иммунных клеток или TSC, сконструированных т vitro для условной экспрессии одного или более белка, обладающего функцией терапевтического белка (например, иммуномодулятора) и белка, обладающего функцией IL-12, причем по меньшей мере один из белков, обладающих функцией терапевтического белка (например, иммуномодулятора) или IL-12, находится под контролем условного промотора, который активируется лигандом; и
(b) введение указанному млекопитающему терапевтически эффективного количества указанного активирующего лиганда;
с индуцированном, таким образом, экспрессии белка, обладающего функцией терапевтического белка (например, иммуномодулятора) и/или белка, обладающего функцией IL-12, и лечением указанной опухоли.
[0032] Согласно еще одному варианту реализации настоящего изобретения предложен способ лечения опухоли у млекопитающего, включающий следующие этапы:
(а) введение внутриопухолево в микроокружение опухоли двух или более популяций иммунных клеток или TSC, сконструированных in vitro для условной экспрессии одного или более белка, обладающего функцией терапевтического белка (например, иммуномодулятора) и белка, обладающего функцией IL-12, причем каждая популяция иммунных клеток или TSC экспрессирует отличный набор из одного или более белка, обладающего функцией терапевтического белка (например, иммуномодулятора), причем по меньшей мере один из указанных белков, обладающих функцией терапевтического белка (например, иммуномодулятора) или IL-12, находится под контролем условного промотора, который активируется лигандом; и
(b) введение указанному млекопитающему терапевтически эффективного количества одного или более активирующего лиганда;
с индуцированном, таким образом, экспрессии белка, обладающего функцией указанных терапевтических белков (например, иммуномодулятора) и/или белка, обладающего функцией IL-12, и лечением указанной опухоли.
[0033] Согласно еще одному варианту реализации настоящего изобретения предложен способ лечения заболевания или расстройства у млекопитающего, включающий следующие этапы:
(a) введение указанному млекопитающему популяции модифицированных клеток, которые модифицированы для условной экспрессии одного или более белка, обладающего функцией терапевтического белка (например, иммуномодулятора); и
(b) введение указанному млекопитающему терапевтически эффективного количества активирующего лиганда;
с индуцированном, таким образом, экспрессии белка, обладающего функцией терапевтического белка (например, иммуномодулятора), и лечением указанного заболевания или расстройства.
[0034] Согласно еще одному варианту реализации настоящего изобретения предложен способ лечения заболевания или расстройства у млекопитающего, включающий следующие этапы:
(a) введение указанному млекопитающему двух или более популяций модифицированных клеток, которые модифицированы для условной экспрессии одного или более белка, обладающего функцией терапевтического белка (например, иммуномодулятора), причем каждая популяция модифицированных клеток экспрессирует отличный набор из одного или более терапевтического белка (например, иммуномодулятора); и
(b) введение указанному млекопитающему терапевтически эффективного количества одного или более активирующего лиганда;
с индуцированном, таким образом, экспрессии белков, обладающего функцией указанных терапевтических белков (например, иммуномодуляторов), и лечением указанного заболевания или расстройства.
[0035] Согласно еще одному варианту реализации настоящего изобретения предложен способ лечения заболевания или расстройства у млекопитающего, включающий следующие этапы:
(a) введение указанному млекопитающему популяции модифицированных клеток, которые модифицированы для условной экспрессии одного или более белка, обладающего функцией терапевтического белка (например, иммуномодулятора), и белка, обладающего функцией IL-12, причем по меньшей мере один из указанных белков, обладающих функцией терапевтического белка (например, иммуномодулятора) или IL-12, находится под контролем условного промотора, который активируется лигандом; и
(b) введение указанному млекопитающему терапевтически эффективного количества указанного активирующего лиганда;
с индуцированном, таким образом, экспрессии белка, обладающего функцией терапевтического белка (например, иммуномодулятора) и/или белка, обладающего функцией IL-12, и лечением указанного заболевания или расстройства.
[0036] Согласно еще одному варианту реализации настоящего изобретения предложен способ лечения заболевания или расстройства у млекопитающего, включающий следующие этапы:
(а) введение указанному млекопитающему двух или более популяций модифицированных клеток, которые модифицированы для условной экспрессии одного или более белка, обладающего функцией терапевтического белка (например, иммуномодулятора), и белка, обладающего функцией IL-12, причем каждая популяция модифицированных клеток экспрессирует отличный набор из одного или более белка, обладающего функцией терапевтического белка (например, иммуномодулятора), причем по меньшей мере один из указанных белков, обладающих функцией терапевтического белка (например, иммуномодулятора) или IL-12, находится под контролем условного промотора, который активируется лигандом; и
(b) введение указанному млекопитающему терапевтически эффективного количества одного или более активирующего лиганда;
с индуцированном, таким образом, экспрессии белка, обладающего функцией указанных терапевтических белков (например, иммуномодуляторов) и/или белка, обладающего функцией IL-12, и лечением указанного заболевания или расстройства.
[0037] В соответствии с настоящим изобретением также предложен способ определения эффективности терапии на основе сконструированных клеток, например, иммунных клеток или TSC, путем измерения уровня экспрессии или активности ИФН-гамма у пациента до начала терапии, с получением, таким образом, контрольного уровня, и последующего введения клеток, сконструированных для экспрессии одного или более белка, обладающего функциями терапевтического белка (например, иммуномодулятора) и, необязательно, белка, обладающего функцией IL-12, введения эффективного количества активирующего лиганда, последующего измерения уровня экспрессии ИФН-гамма для получения экспериментального уровня, и сравнения контрольного уровня с экспериментальным для определения, эффективен ли терапевтический режим.
[0038] Также настоящее изобретение включает способ лечения опухоли, уменьшения размеров опухоли или предотвращения образования опухоли у нуждающегося в этом млекопитающего, включающий (а) введение терапевтически эффективного количества вектора, условно экспрессирующего по меньшей мере один терапевтический белок (например, иммуномодулятор), в частности, IL-12, TNF-альфа, у указанного млекопитающего, (b) введение указанному млекопитающему терапевтически эффективного количества одного или более активирующего лиганда, причем указанный активирующий лиганд активирует экспрессию белка, обладающего функцией терапевтического белка (например, иммуномодулятора), с индуцированном, таким образом, экспрессии белка, обладающего функцией терапевтического белка (например, иммуномодулятора), и лечением указанной опухоли.
[0039] Согласно одному из вариантов реализации настоящего изобретения предложен способ определения эффективности терапевтического режима, основанного на in vitro сконструированных клетках, например, иммунных клетках или TSC, у пациента, включающий:
(a) измерение уровня экспрессии или уровня активности, либо обоих, интерферона-гамма (ИФН-гамма) в первом биологическом образце, полученном перед введением in vitro сконструированных клеток от нуждающегося в этом пациента, с получением, таким образом, контрольного уровня;
(b) введение нуждающемуся в этом пациенту клеток, in vitro сконструированных для условной экспрессии одного или более белка, обладающего функциями терапевтического белка (например, иммуномодулятора) и, необязательно, белка, обладающего функцией IL-12;
(c) введение указанному нуждающемуся в этом пациенту эффективного количества активирующего лиганда;
(d) измерение уровня экспрессии или уровня активности, или обоих, ИФН-гамма во втором биологическом образце, полученном после введения in vitro сконструированных иммунных клеток и активирующего лиганда от указанного нуждающегося в этом пациента, с получением, таким образом, экспериментального уровня; и
(e) сравнение контрольного и экспериментально определенного уровней ИФН-гамма, причем увеличение экспериментального уровня экспрессии, активности или и того, и другого, ИФН-гамма относительно контрольного уровня означает, что терапевтический режим эффективен для указанного нуждающегося в нем пациенте.
[0040] Согласно одному из вариантов реализации настоящего изобретения предложен способ лечения опухоли, уменьшения размеров опухоли или предотвращения образования опухоли у нуждающегося в этом млекопитающего, включающий: (а) введение внутриопухолево в микроокружение опухоли вектора для условной экспрессии белка(ов), обладающего(их) функцией(ями) одного или более терапевтического белка (например, иммуномодулятора); указанный вектор содержит полинуклеотид, кодирующий генный переключатель, причем указанный полинуклеотид содержит (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, и (2) полинуклеотид, кодирующий один или более белок, обладающий функцией терапевтического белка (например, иммуномодулятора), функционально связанный с промотором, который активируется указанным лиганд-зависимым транскрипционным фактором, причем указанный один или более терапевтический белок (например, иммуномодулятор) выбран из IL-1, IL-2, IL-3, IL-4, IL-5, IL-7, IL-8, IL-9, IL-10R DN или их субъединиц, IL-15, IL-18, IL-21, IL-23, IL-24, IL-27, ГМКСФ, ИФН-альфа, ИФН-гамма, ИФН-альфа 1, ИФН альфа 2, IL-15-R-альфа, CCL3 (MIP-1a), CCL5 (RANTES), CCL7 (МСР3), XCL1 (лимфотактина), CXCL1 (MGSA-альфа), CCR7, CCL19 (MIP-3b), CXCL9 (MIG), CXCL10 (IP-10), CXCL12 (SDF-1), CCL21 (6С-кин), OX40L, 4-1BBL, CD40, CD70, GITRL, LIGHT, b-Дефенсина, HMGB1, Flt3L, ИФН-бета, TNF-альфа, dnFADD, БЦЖ, TGF-альфа, PD-L1 интерферирующих РНК, антисмыслового олигонуклеотида PD-L1, TGFbRII DN, ICOS-L, S100, CD40L, OX40L, р53, сурвивина, гибрида р53-сурвивин, MAGE3, PSA и PSMA, причем указанный вектор не содержится в клетке; и (b) введение указанному млекопитающему терапевтически эффективного количества одного или более активирующего лиганда; с индуцированном, таким образом, экспрессии указанного одного или более белка, обладающего функциями терапевтического белка (например, иммуномодулятора), и лечением указанной опухоли.
[0041] В соответствии с настоящим изобретением также предложен способ лечения заболевания у нуждающегося в этом млекопитающего, включающий: (а) введение указанному млекопитающему вектора для условной экспрессии белка(ов), причем указанный вектор содержит полинуклеотид, кодирующий генный переключатель, причем указанный полинуклеотид содержит (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, где указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, и (2) полинуклеотид, кодирующий один или более белок, функционально связанный с промотором, который активируется указанным лиганд-зависимым транскрипционным фактором, при этом указанный вектор не содержится в клетке; и (b) введение указанному не являющемуся человеком животному терапевтически эффективного количества одного или более активирующего лиганда; с индуцированном, таким образом, экспрессии указанного одного или более белка и лечением указанного заболевания.
[0042] В соответствии с настоящим изобретением также предложен способ лечения лизосомальной болезни накопления у нуждающегося в этом млекопитающего, включающий: (а) введение указанному млекопитающему вектора для условной экспрессии одного или более белка, где указанный вектор содержит полинуклеотид, кодирующий генный переключатель, причем указанный полинуклеотид содержит (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, где указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, и (2) полинуклеотид, кодирующий один или более белок, функционально связанный с промотором, который активируется указанным лиганд-зависимым транскрипционным фактором, при этом, указанный вектор не содержится в клетке до введения in vivo; и (b) введение указанному млекопитающему терапевтически эффективного количества одного или более активирующего лиганда; с индуцированном, таким образом, экспрессии указанного одного или более белка и лечением указанной лизосомальной болезни накопления.
[0043] В соответствии с настоящим изобретением также предложен способ лечения заболевания печени у нуждающегося в этом млекопитающего, включающий: (а) введение указанному млекопитающему вектора для условной экспрессии белка(ов), согласно которому указанный вектор содержит полинуклеотид, кодирующий генный переключатель, причем указанный полинуклеотид содержит (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, где указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, и (2) полинуклеотид, кодирующий один или более белок, функционально связанный с промотором, который активируется указанным лиганд-зависимым транскрипционным фактором, причем указанный вектор не содержится в клетке до введения in vivo; и (b) введение указанному не являющемуся человеком животному терапевтически эффективного количества одного или более активирующего лиганда; с индуцированном, таким образом, экспрессии указанного одного или более белка и лечением указанного заболевания печени.
ПОДРОБНОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0044] На Фиг.1 приведена плазмидная карта экспрессионной системы с регулируемым промотором для бицистронного транскрипта, кодирующего hIL-12.
[0045] На Фиг.2 приведена плазмидная карта экспрессионной системы с регулируемым промотором для бицистронного транскрипта, кодирующего hIL-21 и hIL-15.
[0046] На Фиг.3 приведена плазмидная карта экспрессионной системы с регулируемым промотором для бицистронного транскрипта, кодирующего mIL-12.
[0047] На Фиг.4 приведена плазмидная карта экспрессионной системы с регулируемым промотором для бицистронного транскрипта, кодирующего mIL-21 и mIL-15.
[0048] На Фиг.5 приведена плазмидная карта экспрессионной системы с регулируемым промотором hIL-21.
[0049] На Фиг.6 приведена плазмидная карта экспрессионной системы с регулируемым промотором mIL-21.
[0050] На Фиг.7 приведена плазмидная карта экспрессионной системы с регулируемым промотором для трицистронного транскрипта, кодирующего hIL-12 и hIL-21.
[0051] На Фиг.8 приведена плазмидная карта экспрессионной системы с регулируемым промотором для трицистронного транскрипта, кодирующего mIL-12 и mIL-21.
[0052] На Фиг.9 показана структура вектора rAd.RheoIL12, в котором области Е1 и Е3 удалены, и область Е1 заменена на компоненты терапевтической системы RheoSwitch® Therapeutic System (RTS)-IL-12. Блок, помеченный как «IL12» соответствует кодирующим последовательностям IL-12p40 и IL-12p35, разделенным IRES.
[0053] На Фиг.10 приведена сводная таблица трансляционных, посттранскрипционных, трансляционных и пост-трансляционных процессов.
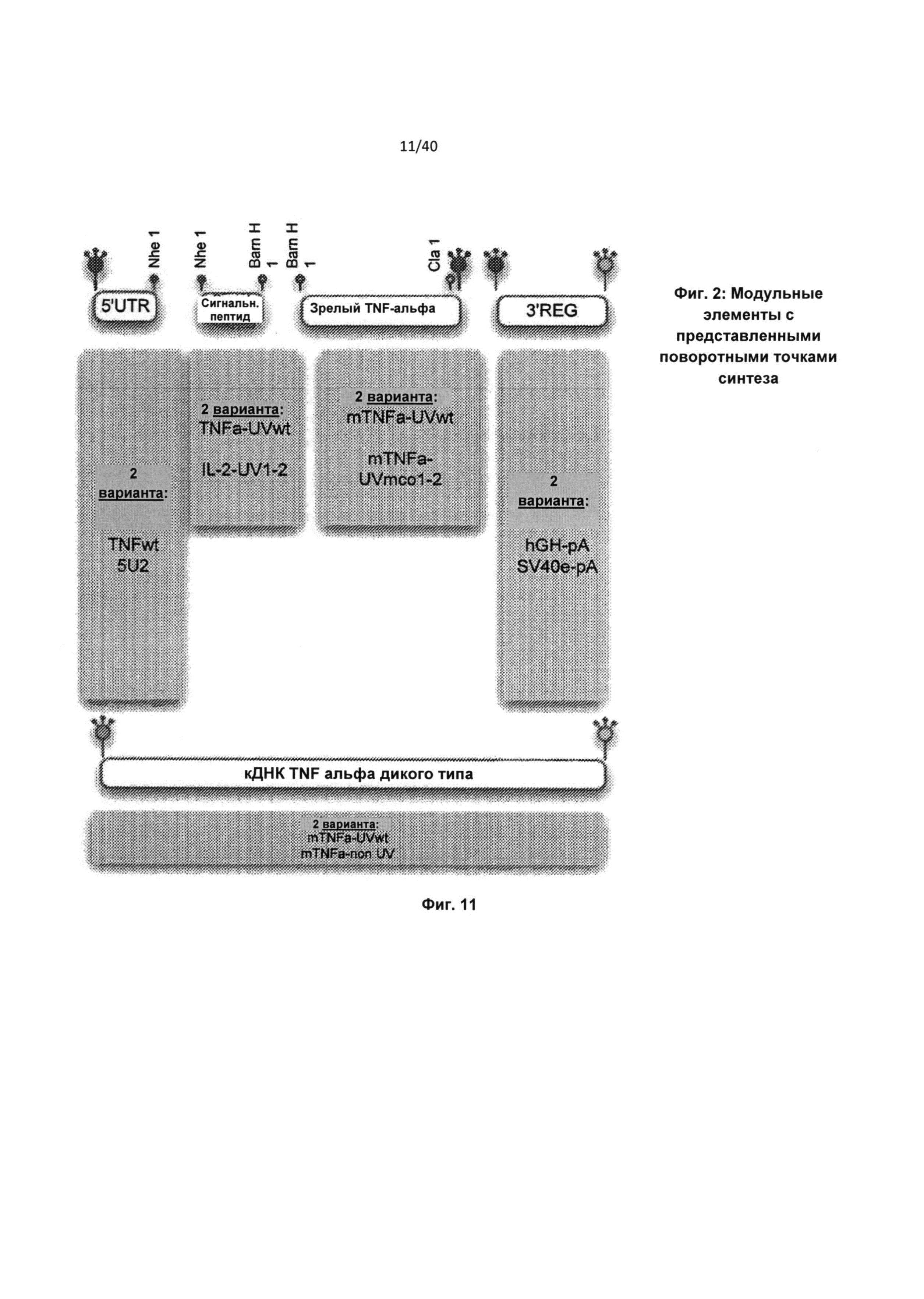
[0054] На Фиг.11 приведены модульные элементы с изображенными поворотными точками синтеза.
[0055] На Фиг.12 приведена схематическая диаграмма аденовирус-совместимого остова ULTRAVECTOR® с переключателем и индуцируемым модульным синтетическим геном.
[0056] На Фиг.13 приведена карта аденовирусного вектора (Вектор 43318) регулируемой промоторной экспрессионной системы, содержащей 5’ UTR TNFwt, сигнальный пептид TNFwtUV, открытую рамку считывания (ORF) TNFwtUV и 3’ регуляторную область SV40e+рА.
[0057] На Фиг.14 приведена карта аденовирусного вектора (Вектор 43319) регулируемой промоторной экспрессионной системы, содержащей TNFwt 5’ UTR, сигнальный пептид TNFoptUV, TNFopt UV ORF и 3’регуляторную область SV40e+рА.
[0058] На Фиг.15 приведена карта аденовирусного вектора (Вектор 43320) регулируемой промоторной экспрессионной системы, содержащей TNFwt 5’ UTR, сигнальный пептид IL-2optUV, TNFoptUV ORF и 3’ регуляторную область SV40e+рА.
[0059] На Фиг.16 приведена карта аденовирусного вектора (Вектор 43321) регулируемой промоторной экспрессионной системы, содержащей 5U2 5’ UTR, сигнальный пептид TNFwtUV, TNFwtUV ORF и 3’ регуляторную область SV40e+рА.
[0060] На Фиг.17 приведена карта аденовирусного вектора (Вектор 43322) регулируемой промоторной экспрессионной системы, содержащей 5U2 5’ UTR, сигнальный пептид TNFoptUV, TNFoptUV ORF и 3’ регуляторную область SV40e+рА.
[0061] На Фиг.18 приведена карта аденовирусного вектора (Вектор 43323) регулируемой промоторной экспрессионной системы, содержащей 5U2 5’ UTR, сигнальный пептид IL-2optUV, TNFoptUV ORF и 3’ регуляторную область SV40e+рА.
[0062] На Фиг.19 приведена карта аденовирусного вектора (Вектор 43324) регулируемой промоторной экспрессионной системы, содержащей TNFwt 5’ UTR, сигнальный пептид TNFwtUV, TNFwtUV ORF и 3’ регуляторную область hGH+рА.
[0063] На Фиг.20 приведена карта аденовирусного вектора (Вектор 43325) регулируемой промоторной экспрессионной системы, содержащей TNFwt 5’ UTR, сигнальный пептид TNFoptUV, TNFoptUV ORF и 3’ регуляторную область hGH+рА.
[0064] На Фиг.21 приведена карта аденовирусного вектора (Вектор 43326) регулируемой промоторной экспрессионной системы, содержащей TNFwt 5’ UTR, сигнальный пептид IL-2optUV, TNFoptUV ORF и 3’ регуляторную область hGH+рА.
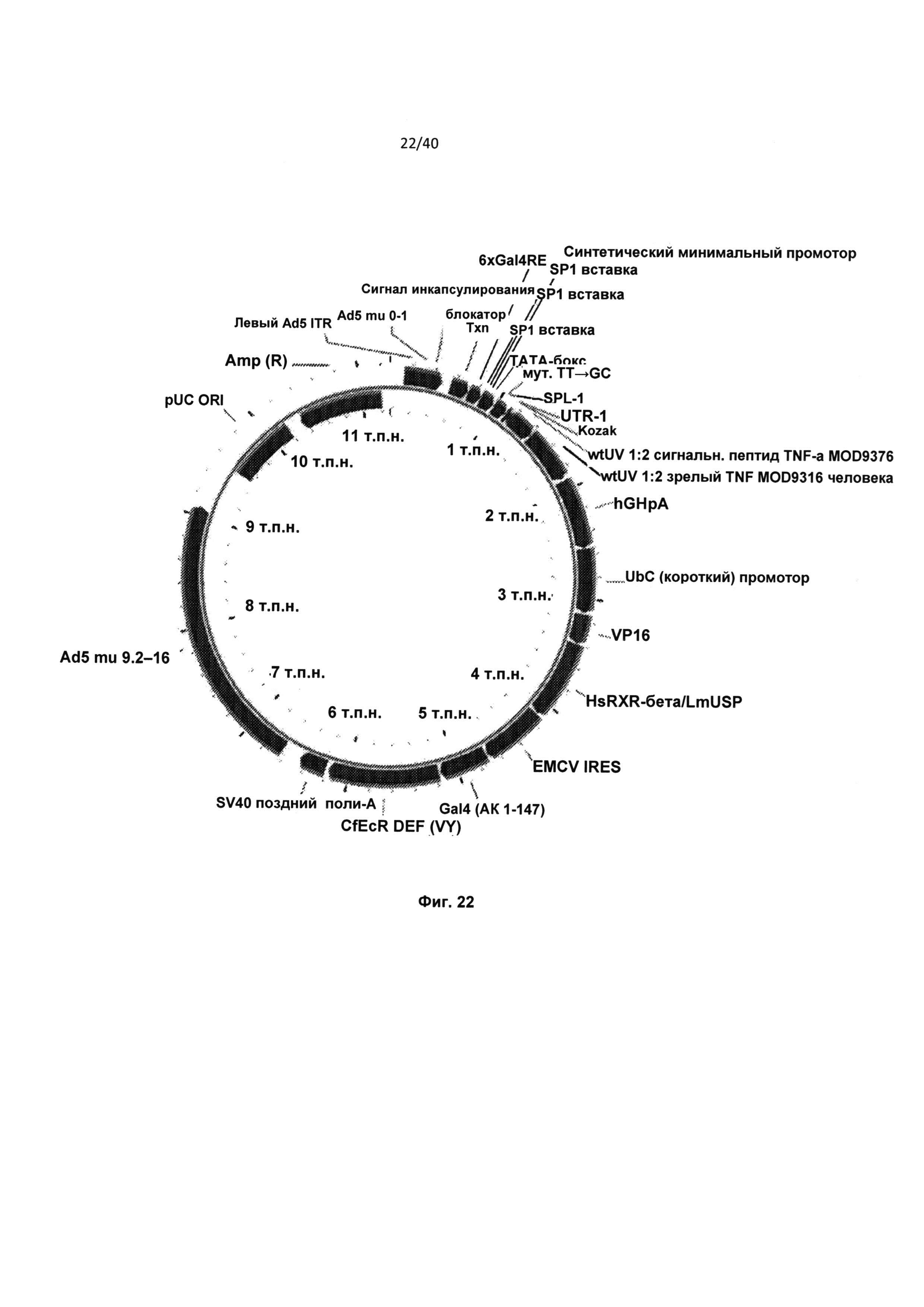
[0065] На Фиг.22 приведена карта аденовирусного вектора (Вектор 43327) регулируемой промоторной экспрессионной системы, содержащей 5U2 5’ UTR, сигнальный пептид TNFwtUV, TNFwtUV ORF и 3’ регуляторную область hGH+рА.
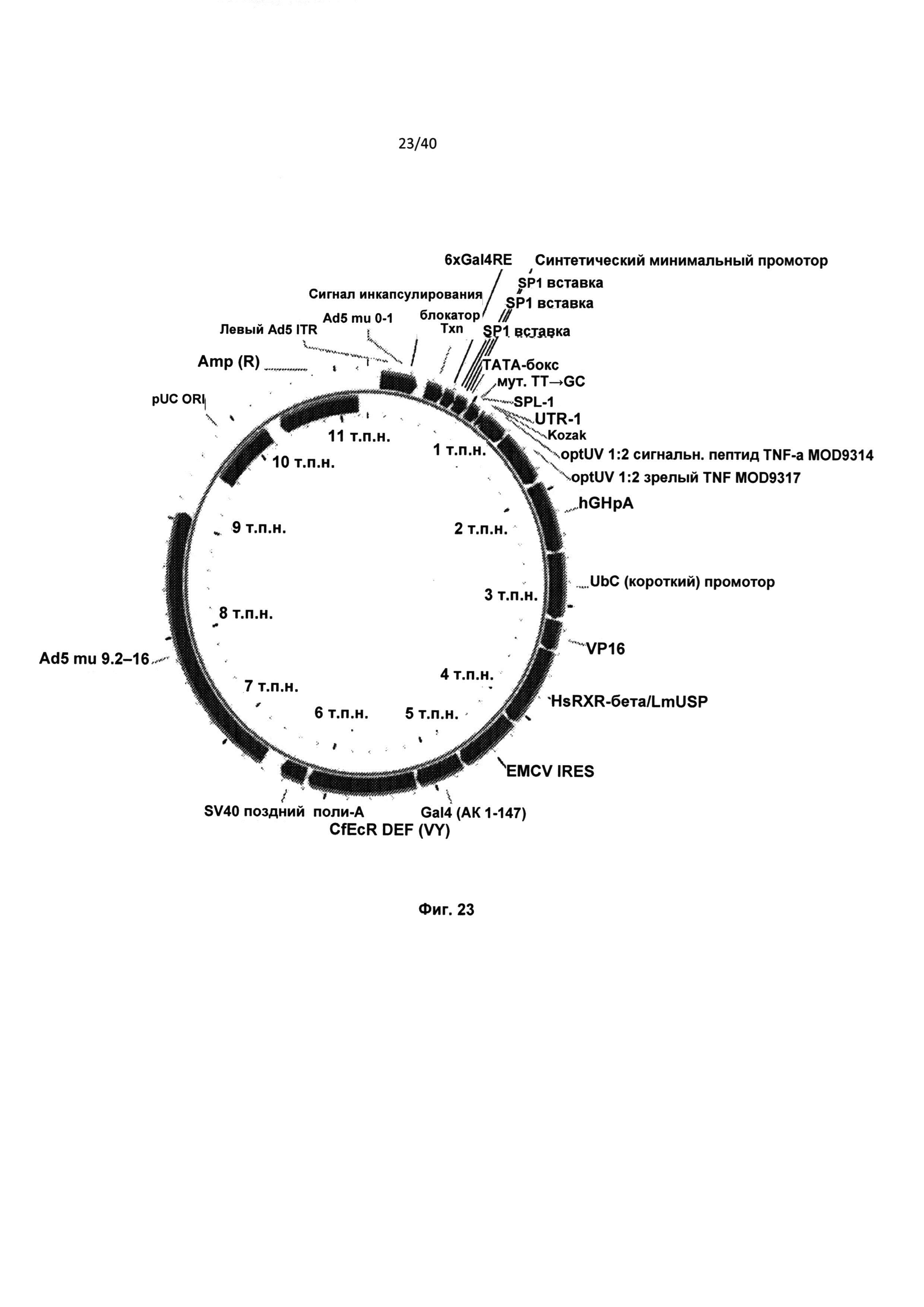
[0066] На Фиг.23 приведена карта аденовирусного вектора (Вектор 43328) регулируемой промоторной экспрессионной системы, содержащей 5U2 5’ UTR, сигнальный пептид TNFwtUV, TNFwtUV ORF и 3’-регуляторную область hGH+рА.
[0067] На Фиг.24 приведена карта аденовирусного вектора (Вектор 43329) регулируемой промоторной экспрессионной системы, содержащей 5U2 5’ UTR, сигнальный пептид TNFwtUV, TNFwtUV ORF и 3’-регуляторную область hGH+рА.
[0068] На Фиг.25 приведена карта аденовирусного вектора (Вектор 43533) регулируемой промоторной экспрессионной системы, содержащей TNFwt 5’ UTR, сигнальный пептид TNFwtUV, TNFwtUV ORF, и TNFwt 3’ UTR.
[0069] На Фиг.26 приведена карта аденовирусного вектора (Вектор 43534) регулируемой промоторной экспрессионной системы, содержащей TNFwt 5’ UTR, полную ORF TNF и TNFwt 3’ UTR.
[0070] На Фиг.27 приведен график, показывающий нормализованные уровни секретируемого белка TNF-альфа после трансфицирования клеток НЕК293 векторами с различными компонентами РТ3 (-/+) индукция лигандом RHEOSWITCH®.
[0071] На Фиг.28 приведен график, показывающий нормализованные уровни секретируемого белка TNF-альфа после трансфицирования клеток СНО-K1 векторами с различными компонентами РТ3 (-/+) индукция лигандом RHEOSWITCH®.
[0072] На Фиг.29 показаны изменения кратности уровней секреции TNF-альфа после трансфицирования клеток HEK293.
[0073] На Фиг.30 показаны различия в секреции белков между 5U2 5’ UTR и wtUV TNF-альфа 5’ UTR.
[0074] Фиг.31 представляет собой линейный график, отражающий исследование зависимости доза-эффект для Ad-RTS-IL-12 в мышиной модели меланомы B16FO. Мыши получали одну инъекцию Ad-RTS-IL-12 на 12 день в дозировке 1ее7; 1ее8; 1ee9; 5ee9; 1ee10; 5ee10 вирусных частиц (в.ч.)), лиганд доставлялся с кормом, начиная с 11-й дня. По оси x отложены дни после инокуляции опухолевых клеток, по оси у отложен объем опухоли. Уровни доз оказывали существенный противоопухолевый эффект. Указан % сокращения опухоли по сравнению с контролем.
[0075] Фиг.32 представляет собой линейный график, который отражает изменение массы тела в ходе исследования. Изменения обозначены как % от массы тела на оси y.
[0076] Фиг.33А и 33В представляют собой линейные графики, отражающие противоопухолевую активность (Фиг.33А) и безопасность (Фиг.33В) Ad-RTS-mIL12 в модели мышиной карциномы легких Льюис (LLC). Опухоль легких Льюис выращивали подкожно у иммунокомпетентных мышей C57b/6. Когда опухоль достигала требуемого размера, начинали лечение. Животные получали одну дозу AdRTS-mIL12 (1e10 вирусных частиц) на 6, 9, 13 день после инокуляции опухолевых клеток. Ad-RTS-mIL12 с активатором демонстрировал выраженную противоопухолевую активность относительно контрольных животных. Серьезной токсичности отмечено не было.
[0077] Фиг.34А и 34В представляют собой линейные графики, отражающие эффективность (Фиг.34А) и безопасность (Фиг.34В) в мышиной модели меланомы (B16F0), в которой животных обрабатывали Ad-RTS-mIL12. Опухоль развивалась п/к на боковой поверхности тела мышей С57Ы6. Одну дозу Ad-RTS-mIL12 (1е10 вирусных частиц) вводили внутриопухолево (интратуморальо, i.t.) на 13 день после инокуляции клеток (стрелка). Лиганд-активатор (50, 100, 250, 500, 750 и 1000 мг/кг) вводили за 24 ч до инъекции вектора до конца эксперимента. Подавление роста опухоли измеряли в процентах и сравнивали с контрольными животными. Ad-RTS-IL12 показал благоприятный терапевтический эффект с широким окном дозировок активатора. Лечение переносилось хорошо.
[0078]. Фиг.35А и 35В представляют собой линейные графики, отражающие эффективность (Фиг.35А) и безопасность (Фиг.35В) Ad-RTS-mIL12 в мышиной модели рака толстой кишки (CT26Luc). Мышиную опухоль толстой кишки выращивали подкожно на участке боковой поверхности тела мышей Balb/C. Животным делали внутриопухолевые инъекции (i.t.) дважды Ad-RTS-mIL12 в дозировке 1е10в.ч./100 мкл на 11 и 18 день после инокуляции клеток (стрелка). Активатор начинали давать за 24 ч до инъекции вектора. Объем опухоли и масса тела отслеживались в течение всего эксперимента. Обработка Ad-RTS-mIL12 приводила к выраженному подавлению роста опухоли (100%) относительно контрольных животных. Примечательно, что у всех животных, получавших Ad-RTS-mIL12 плюс активаторы, опухоли отсутствовали.
[0079] Фиг.36А и 36В представляют собой линейные графики, отражающие эффективность (Фиг.36А) и безопасность (Фиг.36В) Эффективность Ad-RTS-mIL12 при модели рака поджелудочной железы (PAN02). Мышам с подкожной опухолью PAN02 вводили внутриопухолево (i.t.) одну дозу Ad-RTS-mIL12 в дозировке 1е10 вирусных частиц/100 мкл на 7 и 14 день (стрелка) после инокуляции опухолевых клеток. Корм с активатором давали животным начиная с дня накануне введения вектора и до конца эксперимента. Контрольная или получающая только вектор группа получала только нормальный корм для грызунов. Результат указывает на то, что Ad-RTS-IL12 проявляет значительную противоопухолевую активность (97%) относительно контрольных животных. Серьезных изменений массы тела в результате терапии Ad-RTS-IL12 обнаружено не было.
[0080] Фиг.37 представляет собой карту вектора AD-RTS-mIFN альфа.
[0081] Фиг.38 представляет собой карту вектора AD-RTS-mTNF альфа.
[0082] Фиг.39А и 39В представляют собой линейные графики, отражающие эффективность (Фиг.39А) и безопасность (Фиг.39 В) Ad-RTS-mIL12 в модели рака груди (4Т1). Опухоли 4Т1 выращивали подкожно (п/к) на боковой поверхности тела мышей BALB/C. Мыши с опухолью были случайным образом разделены на четыре группы по 5 животных в каждой; контроль без лечения, только лиганд-активатор (L), только Ad-RTS-mIL12 и Ad-RTS-mIL12 с лигандом-активатором. Одну инъекцию Ad-RTS-mIL12 вводили внутриопухолево (i.t.) в дозировке 1е10 вирусных частиц/100 мкл ФСБ в три различных момента времени (стрелка). Указанный лиганд-активатор вводили мышам с кормом за 24 ч до инъекции вектора и до конца эксперимента. Размеры опухолей (объем) и масса тела (%) показаны как среднее±SE. Животные, не получавшие лечение (контрольные) демонстрировали быстрый рост опухоли. Лечение только с лигандом-активатором или с тремя дозами Ad-RTS-mIL12 без лиганда-активатора несколько подавляло рост опухоли, на 22% и 35%, соответственно, относительно контроля. Примечательно, что лечение Ad-RTS-IL12 плюс лиганд-активатор приводило к значительному подавлению роста опухоли, на 82% по сравнению с контрольными животными, не получавшими лечение. Значительной потери массы тела не наблюдалось ни при одном варианте лечения.
[0083] Фиг.40 представляет собой карту вектора для интерферона альфа-2а.
[0084] ПОДРОБНОЕ ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Терапевтические белки Цитокины
[0085] Полинуклеотидные последовательности интерлейкина 1 (IL-1), представляющего собой цитокины, важные для воспалительного ответа против инфекции, имеются в общедоступных базах данных под номерами доступа М28983 (IL-1α человека); М15330 (IL-1β человека); AF201830 (IL-1δ человека); AF201831 (IL-1ε человека); AF201832 (1L-1ζ человека); AF201833 (IL-1η человека); NMJH0554 (IL-1α мыши); NM_008361 (IL-1β мыши); NM_019451 (L-1δ мыши); NM_019450 (IL-1f6 мыши); NM_027163 (IL-1f6 мыши); NM_153511 (IL-1f9 мыши); NM_204524 (куриный IL-1β); NM_017019 (IL-1α крысы); и NM_031512 (IL-1β крысы); указанные последовательности включены в настоящую заявку посредством ссылок.
[0086] Аминокислотные последовательности интерлейкина 1 (IL-1) имеются в общедоступных базах данных под номерами доступа ААА59134 (IL-1α человека); ААА59135 (IL-1β человека); AAF25210 (IL-1δ человека); AAF25211 (IL-1ε человека); AAF25212 (1L-1ζ человека); AAF25213 (IL-1η человека); NP_034684 (мышиный IL-1α); NP_032387 (мышиный IL-1β); NP_062324 (мышиный L-1δ); NP_062323 (мышиный IL-1f6); NP_081439 (мышиный IL-1f8); NP_705731 (мышиный IL-1f9); NP_989855 (куриный IL-1β); NP_058715 (крысиный IL-1α); и NP_113700 (крысиный IL-1β); указанные последовательности включены в настоящую заявку посредством ссылок. Laurent et al., Psychiatr. Genet. 7:103 (1997) идентифицировали полиморфные мутации в гене интерлейкина-1 бета человека.
[0087] Полинуклеотидные последовательности интерлейкина 2 (IL-2), который принадлежит к семейству цитокинов, включая IL-4, IL-7, IL-9, IL-15, и IL-21, имеются в общедоступных базах данных под номерами доступа U25676 (человека); NM_008366 (мышиный); NMJ204153 (куриный); и NM_053836 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[0088] Аминокислотные последовательности интерлейкина 2 (IL-2) имеются в общедоступных базах данных под номерами доступа ААА70092 (человека); NP_032392 (мышиный); NP_989484 (куриный); и NP_446288 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[0089] Liu et al., Appl. Biochem. Biotechnol. 133:77 (2006) получили мутантный IL-2 человека, a Lorberboum et al., J. Biol. Chem. 265:16311 (1990) описывают получение химерного IL-2.
[0090] Полинуклеотидные последовательности интерлейкина 4 (IL-4), который представляет собой цитокин, индуцирующий дифференцировку необученных хелперных Т-клеток в Th2-клетки, имеются в общедоступных базах данных под номерами доступа М23442 (человека); NM_021283 (мышиный); NM_001007079 (куриный); и NM_201270 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[0091] Аминокислотные последовательности интерлейкина 4 (IL-4) имеются в общедоступных базах данных под номерами доступа ААА59150 (человека); NP_067258 (мышиный); NP_001007080 (куриный); и NP_958427 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[0092] Kawashima et al., J. Med. Genet. 35: 502 (1998) описывают полиморфизмы гена IL-4, связанные с атопическим дерматитом.
[0093] Интерлейкин 7 (IL-7) представляет собой цитокин, важный для развития В- и Т-клеток. Полинуклеотидные последовательности IL-7 имеются в общедоступных базах данных под номерами доступа J04156 (человека); NM_008371 (мышиный); NM_001037833 (куриный); и NM_013110 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[0094] Аминокислотные последовательности интерлейкина 7 (IL-7) имеются в общедоступных базах данных под номерами доступа ААА59156 (человека); NP_032397 (мышиный); NP_001032922 (куриный); и NP_037242 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[0095] Feng et al., Genetics 775:545 (2007) идентифицировали точечные мутации IL-7, приводящие к функциональному дефициту.
[0096] Интерлейкин 9 (IL-9) представляет собой цитокин, синтезируемый Т-клетками и представляет собой регулятор гемопоэтических клеток. Полинуклеотидные последовательности IL-9 имеются в общедоступных базах данных под номерами доступа NM_000590 (человека); NM_008373 (мышиный); NM_001037825 (куриный); и NM_001105747 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[0097] Аминокислотные последовательности интерлейкина 9 (IL-9) имеются в общедоступных базах данных под номерами доступа NP_000581 (человека); NP_032399 (мышиный); NP_001032914 (куриный); и NP_001099217 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[0098] IL-12 представляет собой цитокин, способный действовать как фактор роста для активированных Т- и NK-клеток, повышать лизирующую активность NK/лимфокин-активированных киллерных клеток, и стимулировать синтез ИФН-гамма дремлющими мононуклеарными клетками периферической крови (МКПК). Полинуклеотидные последовательности IL-12 имеются в общедоступных базах данных под номерами доступа NM_000882 (IL12A человека); NM_002187 (IL12B человека); NM_008351 (мышиный IL12a); NM_008352 (мышиный IL12b); NM_213588 (куриный IL12A); NM_213571 (куриный IL12B); NM_053390 (крысиный IL12a); и NM_022611 (крысиный IL12b); указанные последовательности включены в настоящую заявку посредством ссылок.
[0099] Аминокислотные последовательности интерлейкина 12 (IL-12) имеются в общедоступных базах данных под номерами доступа NP_000873 (IL12A человека); NP_002178 (IL12B человека); NP_032377 (мышиный IL12a); NP_032378 (мышиный IL12b); NP_998753 (куриный IL12A); NP_998736 (куриный IL12B); NP_445842 (крысиный IL12a); и NP_072133 (крысиный IL12b); указанные последовательности включены в настоящую заявку посредством ссылок.
[00100] Интерлейкин 15 (IL-15) представляет собой цитокин, регулирующий активацию и пролиферацию Т-клеток и естественных киллеров. Полинуклеотидные последовательности IL-15 имеются в общедоступных базах данных под номерами доступа U14407 (человека); NM_008357 (мышиный); EU334509 (куриный); и AF015719 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00101] Аминокислотные последовательности интерлейкина 15 (IL-15) имеются в общедоступных базах данных под номерами доступа ААА21551 (человека); NP_032383 (мышиный); ABY55312 (куриный); и ААВ94536 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00102] Интерлейкин 18 (IL-18), цитокин, синтезируемый макрофагами, совместно с интерлейкином 12 индуцирующий клеточно-опосредованный иммунитет при инфекции микробными продуктами. Полинуклеотидные последовательности IL-18 имеются в общедоступных базах данных под номерами доступа U90434 (человека); NM_008360 (мышиный); EU747333 (куриный); и AY258448 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00103] Аминокислотные последовательности интерлейкина 18 (IL-18) имеются в общедоступных базах данных под номерами доступа ААВ50010 (человека); NP_032386 (мышиный); АСЕ79188 (куриный); и ААР 14669 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00104] Полинуклеотидные последовательности интерлейкина 21 (IL-21), который представляет собой цитокин, оказывающий мощные регуляторные эффекты на клетки иммунной системы, включая естественные киллерные клетки и цитотоксические Т-клетки, индуцируя клеточную пролиферацию, имеются в общедоступных базах данных под номерами доступа AF254069 (человека); NM_021782 (мышиный); NM_001024835 (куриный); и NM_001108943 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00105] Аминокислотные последовательности интерлейкина 21 (IL-21) имеются в общедоступных базах данных под номерами доступа AAG29348 (человека); NP_068554 (мышиный); NP_001020006 (куриный); и NP_001102413 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00106] Интерлейкин 27 (IL-27) представляет собой цитокин, играющий важную роль в регуляции активности В- и Т-лимфоцитов. Полинуклеотидные последовательности IL-27 имеются в общедоступных базах данных под номерами доступа AY099296 (человека); NM_145636 (мышиный); и ХМ_344962 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00107] Аминокислотные последовательности интерлейкина 27 (IL-27) имеются в общедоступных базах данных под номерами доступа ААМ34498 (человека); NP_663611 (мышиный); и ХР_3 44963 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00108] Полинуклеотидные последовательности интерферона бета 1 (IFNB1), который является представителем группы белков интерферонов, связывающихся со специфичными рецепторами клеточной поверхности (IFNAR), и стимулирует как противовирусный ответ как макрофагов, так и естественных киллерных (NK) клеток, имеются в общедоступных базах данных под номерами доступа NM_002176 (человека); NM_010510 (мышиный); NM_001024836 (куриный); и NM_019127 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00109] Аминокислотные последовательности интерферона бета 1 (IFNB1) имеются в общедоступных базах данных под номерами доступа NP_002167 (человека); NP_034640 (мышиный); NP_001020007 (куриный); и NP_062000 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00110] Интерферон гамма (ИФН-гамма) представляет собой растворимый цитокин который является единственным интерфероном типа II и обладает противовирусной, иммунорегуляторной и противоопухолевой активностью. Полинуклеотидные последовательности ИФН-гамма имеются в общедоступных базах данных под номерами доступа NM_000619 (человека); NM_008337 (мышиный); и NM_138880 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00111] Аминокислотные последовательности интерферона гамма (ИФН-гамма) имеются в общедоступных базах данных под номерами доступа NP_000610 (человека); NP_032363 (мышиный); и NP_620235 (крысиный) последовательности которых включены в настоящую заявку посредством ссылок.
[00112] Полинуклеотидные последовательности фактора некроза опухоли (TNF-альфа), который представляет собой многофункциональный провоспалительный цитокин, секретируемый преимущественно моноцитами/макрофагами, оказывающий влияние на липидный обмен, коагуляцию, инсулинорезистентность и эндотелиальную функцию, имеются в общедоступных базах данных под номерами доступа Х02910 (человека); NM_013693 (мышиный); и ВС107671 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00113] Аминокислотные последовательности TNF-альфа имеются в общедоступных базах данных под номерами доступа САА26669 (человека); NP_038721 (мышиный); и AAI07672 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00114] TNF-альфа человека (в настоящей заявке обозначаемый аббревиатурой hTNF-альфа или просто hTNF) представляет собой цитокин человека, существующий в растворимой форме (sTNF-альфа) массой 17 кДа и мембраносвязанной форме (tmTNF-альфа) массой 26 кДа, биологически активная форма которого составлена тримером нековалентно связанных молекул массой 17 кДа. Структура hTNF-альфа описана например, у Pennica, D., et al. (1984) Nature 372:724-729; Davis, J. M., et al. (1987) Biochemistry 26:1322-1326; и Jones, E. Y., et al. (1989) Nature 338:225-228. TNF-альфа может связываться с TNF-рецептором типа 1 (TNFR-1) или TNF-рецептором типа 2 (TNFR-2) и вовлечен в регуляцию иммунных клеток, индуцирование апоптоза или воспаления, или ингибирование образования опухолей или вирусной репликации. Клеточные сигнальные каскады, стимулируемые связыванием TNF/TNFR, описаны, например, у Wajant, H., et al. (2003) Cell Death Differ. 10(1): 45-65 или Chen, G„ et al. (2002) Science 296: 1634-5.
[00115] Полный полипептид TNF-альфа человека состоит из цитоплазматического домена, трансмембранного домена и внеклеточного домена. Полипептидная последовательность 233аа была определена как полипептидная последовательность TNF-альфа человека и в настоящей заявке упоминается как SEQ ID NO; 37, которая содержит цитоплазматический домен из аминокислот 1-35 SEQ ID NO:37, трансмембранный домен из аминокислот 36-56 SEQ ID NO:37, и внеклеточный домен из аминокислот 57-233 SEQ ID NO:37. SEQ ID NO:37 представляет собой нуклеотидную последовательность, кодирующую SEQ ID NO:35 или 36. Варианты TNF-альфа человека включают, не ограничиваясь перечисленными, полипептиды с одной или более из следующих мутаций: L105S, R108W, L112F, A160V, S162F, V167A, Е222К, F63S, PSD84-86VNR или E183R.
Хемокины
[00116] Хемокиновый (С-мотив) лиганд 1 (XCL1, также известный как лимфотактин) является хемотаксическим для CD4+- и CD8+-T-клеток, но не для моноцитов, и индуцирует увеличение уровня внутриклеточного кальция в лимфоцитах периферической крови. Полинуклеотидные последовательности XCL1 имеются в общедоступных базах данных под номерами доступа NM_002995 (человека); NM_008510 (мышиный); и NM_134361 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00117] Аминокислотные последовательности XCL1 имеются в общедоступных базах данных под номерами доступа NP_002986 (человека); NP_032536 (мышиный); и NP_599188 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок. В патенте США №6,022,534 описан лимфотактин и применение для привлечения либо цитотоксических Т-клеток и/или NK-клеток, и/или индуцирования пролиферации или резидентных клеток. Описаны также способы выделения и применения антитела к лимфотактину, а также гибридного белка XCL1.
[00118] Полинуклеотидные последовательности СС хемокинового лиганда 3 (CCL3), также известного как макрофагальный белок воспаления-1 (MIP-1), который представляет собой так называемый монокин (тип цитокина, синтезируемый в основном моноцитами и макрофагами), вовлеченный при остром воспалении в рекрутинг и активацию полиморфноядерных лейкоцитов, имеются в общедоступных базах данных под номерами доступа NM_002983 (человека); NM_011337 (мышиный); и NM_013025 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00119] Аминокислотные последовательности CCL3 имеются в общедоступных базах данных под номерами доступа NP_002974 (человека); NP_035467 (мышиный); и NP_037157 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00120] Полинуклеотидные последовательности CCL5 (RANTES), который представляет собой провоспалительный цитокин, вовлеченный в воспаление и астму, имеются в общедоступных базах данных под номерами доступа AF043341 (человека); NM_013653 (мышиный); и NM_031116 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00121] Аминокислотные последовательности CCL5 имеются в общедоступных базах данных под номерами доступа ААС03541 (человека); NP_038681 (мышиный); и NP_112378 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00122] Полинуклеотидные последовательности лиганда СС-хемокинов 7 (CCL7), который представляет собой хемокин, вовлеченный в рекрутинг макрофагов при воспалении и раковой инвазии, имеются в общедоступных базах данных под номерами доступа NM_006273 (человека); NM_013654 (мышиный); и NM_001007612 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00123] Аминокислотные последовательности CCL7 имеются в общедоступных базах данных под номерами доступа NP_006264 (человека); NP_038682 (мышиный); и NP_001007613 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00124] Хемокиновый (СХС мотив) лиганд 9 (CXCL9, также известный как MIG) представляет собой Т-клеточный хемоаттрактант, индуцируемый гамма интерфероном. Полинуклеотидные последовательности CXCL9 имеются в общедоступных базах данных под номерами доступа NM_002416 (человека); NM_0108599 (мышиный); и NM_145672 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00125] Аминокислотные последовательности CXCL9 имеются в общедоступных базах данных под номерами доступа NP_002407 (человека); NP_032625 (мышиный); и NP_663705 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00126] Хемокиновый (С-Х-С мотив) лиганд 10 (CXCL10) представляет собой небольшой цитокин, участвующий в хемоаттракции клеток в иммунной системе, адгезии Т-клеток к эндотелиальным клеткам, противоопухолевой активности и ангиогенезе. Полинуклеотидные последовательности CXCL10 имеются в общедоступных базах данных под номерами доступа Х02530 (человека); NM_021274 (мышиный); и ВС058444 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00127] Аминокислотные последовательности хемокинового (С-Х-С мотив) лиганда 10 (CXCL10) имеются в общедоступных базах данных под номерами доступа САА26370 (человека); NP_067249 (мышиный); и ААН58444 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00128] Хемокиновый (С-Х-С мотив) лиганд 12 (CXCL12), также известный как происходящий из стромальных клеток фактор 1 (SDF-1), представляет собой небольшой цитокин, принадлежащий семейству интеркринов, представители которого активируют лейкоциты и часто стимулируются провоспалительными стимулами, такими как ЛПС, TNF или IL1. Полинуклеотидные последовательности CXCL12 имеются в общедоступных базах данных под номерами доступа NM_000609 (человека); NM_001012477 (мышиный); NMJ204510 (куриный); и NM_001033883 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00129] Аминокислотные последовательности CXCL12 имеются в общедоступных базах данных под номерами доступа NP_000600 (человека); NP_001012495 (мышиный); NP_989841 (куриный); и NP_001029055 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00130] Hansson et al., Microbes and Infection 5:841 (2006) описывают, что взаимодействие между хемокиновым (С-С мотив) рецептором 7 (CCR7) и хемокиновым (С-С мотив) лигандом 19 (CCL19, также известным как MIP-3β) критически важно для получения первичных иммунных ответов. Полинуклеотидные последовательности CCR7 имеются в общедоступных базах данных под номерами доступа NM_001838 (человека); и NM_007719 (мышиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00131] Аминокислотные последовательности CCR7 имеются в общедоступных базах данных под номерами доступа NP_001829 (человека); и NP_031745 (мышиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00132] Полинуклеотидные последовательности CCL19 имеются в общедоступных базах данных под номерами доступа NM_006274 (человека); и NM_011888 (мышиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00133] Аминокислотные последовательности CCL19 имеются в общедоступных базах данных под номерами доступа NP_006265 (человека); и NP_036018 (мышиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00134] Полинуклеотидные последовательности СС хемокинового лиганда 21 (CCL21), - общеизвестного лиганда для CCR7, необходимого для достижения CD4+-, но не СВ8+-Т-клетками «точки» стационарного состояния; изменения в экспрессии CCL21 могут изменять восприимчивость к аутоиммунитету, - имеются в общедоступных базах данных под номерами доступа АВ002409 (человека); NM_011335 (мышиный CCL21a); NM_011124 (мышиный CCL21b); и NM_023052 (мышиный CCL21 с); последовательности которых включены в настоящую заявку посредством ссылок.
[00135] Аминокислотные последовательности CCL21 имеются в общедоступных базах данных под номерами доступа ВАА21817 (человека); NP_035465 (мышиный CCL21a); NP_035254 (мышиный CCL21b); и NP_075539 (мышиный CCL21c); указанные последовательности включены в настоящую заявку посредством ссылок.
[00136] Интерлейкин-8 (IL-8) представляет собой хемокин, также называемый нейтрофил-активирующим пептидом-1 или SCYB8, является пептидом тканевого происхождения, секретируемым несколькими типами клеток в ответ на воспалительные стимулы. В патентах США №6133426 и 6177980 описаны аминокислотные и полипуклеотидные последовательности гуманизированных анти-IL-8 антител. Полинуклеотидная последовательность IL-8 человека присутствует в общедоступной базе данных под номером доступа NM_000584; указанная последовательность включена в настоящую заявку посредством ссылки.
[00137] Аминокислотная последовательность IL-8 человека присутствует в общедоступной базе данных под номером доступа NP_000575; указанная последовательность включена в настоящую заявку посредством ссылки.
Факторы роста
[00138] Гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF, ГМКСФ) представляет собой цитокин, функционирующий как фактор роста белых клеток крови, стимулирует стволовые клетки продуцировать гранулоциты (нейтрофилы, эозинофилы и базофилы) и моноциты. Полинуклеотидные последовательности ГМКСФ имеются в общедоступных базах данных под номерами доступа M11734 (человека); NM_009969 (мышиный); EU520303 (куриный); NM_001037660 (крысиный Csf2ra); и NMJ33555 (крысиный Csf2rb); указанные последовательности включены в настоящую заявку посредством ссылок.
[00139] Аминокислотные последовательности гранулоцитарно-макрофагального колониестимулирующего фактора (ГМКСФ) имеются в общедоступных базах данных под номерами доступа ААА52122 (человека); NP_034099 (мышиный); АСВ11534 (куриный); NP_001032749 (крысиный Csf2ra); и NP_598239 (Csf2rb); указанные последовательности включены в настоящую заявку посредством ссылок.
[00140] Полинуклеотидные последовательности лиганда FMS-связанной тирозинкиназы (лиганд FLT3/FLK2, Flt3L), который способен функционировать в качестве рецептора фактора роста на гематопоэтических стволовых клетках, клетках-предшественниках или и тех, и тех, имеются в общедоступных базах данных под номерами доступа U04806 (человека); и NM_013520 (мышиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00141] Аминокислотные последовательности лиганда FLT3/FLK2 (Flt3L) имеются в общедоступных базах данных под номерами доступа ААА17999 (человека); и NP_038548 (мыши); указанные последовательности включены в настоящую заявку посредством ссылок.
[00142] Полинуклеотидная последовательность трансформирующего фактора роста, альфа (TGF-альфа), который повышающе регулируется при некоторых раковых заболеваниях у человека, способен обратимо трансформировать фенотип культур клеток, имеется в общедоступных базах данных под номерами доступа NM_001099691 (человека); NM_031199 (мышиный); NM_001001614 (куриный); и NM_012671 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00143] Аминокислотные последовательности TGF-альфа имеются в общедоступных базах данных под номерами доступа NP_001093161 (человек); NP_112476 (мышиный); NP_001001614 (куриный); и NP_036803 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
Адъюванты
[00144] Бета-дефенсины представляют собой антимикробные пептиды, задействованные во врожденном иммунном ответе против многих грам-отрицательных и грам-положительных бактерий, грибов и вирусов. Полинуклеотидные последовательности бета-дефенсинов имеются в общедоступных базах данных под номерами доступа Х92744 (hBD-1 человека); AJ000152 (hBD-2 человека); AF217245 (бета-дефенсин-3 человека); AJ314835 (бета-дефенсин-4 человека); АВ089180 (hBD-5 человека); AY122466 (дефенсин бета 106, DEFB106 человека); AF540979 (бета-дефенсин 107, DEFB107 человека); AF529416 (бета-дефенсин, DEFB108 человека); DQ012014 (бета-дефенсин 110, DEFB110 человека); DQ012015 (бета-дефенсин 111, DEFB111 человека); DQ012016 (бета-дефенсин 112, DEFB112 человека); DQ012017 (бета-дефенсин 113, DEFB113 человека); DQ012018 (бета-дефенсин 114, DEFB114 человека); DQ012019 (бета-дефенсин 115, DEFB115 человека); DQ012020 (бета-дефенсин 116, DEFB116 человека); DQ012021 (бета-дефенсин 117, DEFB117 человека); NM_007843 (мышиный дефенсин бета 1); NM_010030 (мышиный дефенсин бета 2, Defb2); NM_013756 (мышиный дефенсин бета 3, Defb3); NM_019728 (мышиный дефенсин бета 4, Defb4); NM_030734 (мышиный дефенсин бета 5, Defb5); NM_054074 (мышиный дефенсин бета 6, Defb6); NM_139220 (мышиный дефенсин бета 7); NM_153108 (мышиный дефенсин бета 8, Defb8); NM_139219 (мышиный дефенсин бета 9, Defb9); и NM_139225 (мышиный дефенсин бета 10, Defb10); последовательности которых включены в настоящую заявку посредством ссылок.
[00145] Аминокислотные последовательности бета-дефенсинов имеются в общедоступных базах данных под номерами доступа САА63405 (hBD-1 человека); САВ65126 (hBD-2 человека); AAF73853 (бета-дефенсин-3 человека); САС85520 (бета-дефенсин-4 человека); ВАС10630 (hBD-5 человека); ААМ93908 (дефенсин бета 106, DEFB106 человека); AAN33115 (бета-дефенсин 107, DEFB107 человека); AAQ09525 (бета-дефенсин, DEFB108 человека); AAY59750 (бета-дефенсин 110, DEFB110 человека); AAY59751 (бета-дефенсин 111, DEFB111 человека); AAY59752 (бета-дефенсин 112, DEFB112 человека); AAY59753 (бета-дефенсин 113, DEFB113 человека); AAY59754 (бета-дефенсин 114, DEFB114 человека); AAY59755 (бета-дефенсин 115, DEFB115 человека); AAY59756 (бета-дефенсин 116, DEFB116 человека); AAY59757 (бета-дефенсин 117, DEFB117 человека); NP_031869 (мышиный дефенсин бета 1); NP_034160 (мышиный дефенсин бета 2, Defb2); NP_038784 (мышиный дефенсин бета 3, Defb3); NP_062702 (мышиный дефенсин бета 4, Defb4); NP_109659 (мышиный дефенсин бета 5, Defb5); NP_473415 (мышиный дефенсин бета 6, Defb6); NP_631966 (мышиный дефенсин бета 7, Defb7); NP_694748 (мышиный дефенсин бета 8, Defb8); NP_631965 (мышиный дефенсин бета 9, Defb9); и NP_631971 (мышиный дефенсин бета 10, Defb10); указанные последовательности включены в настоящую заявку посредством ссылок. См. также патент США №5242902 для ознакомления с дополнительными пептидными последовательностями дефенсинов человека и мыши.
[00146] Группа белков с высокой подвижностью бокс-1 (HMGB1) представлена негистоновыми хромосомными белками, функционирующими как цитокины, опосредуя местные и системные ответы на некротическую гибель клеток и рак, инвазию патогенов, травмы и сепсис.Полинуклеотидные последовательности белков HMGB1 имеются в общедоступных базах данных под номерами доступа NM_002128 (человека); NM_010439 (мышиный); NM_204902 (куриный); и NM_012963 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00147] Аминокислотные последовательности группы белков с высокой подвижностью бокс-1 (HMGB1) имеются в общедоступных базах данных под номерами доступа NP_002119 (человека); NP_034569 (мышиный); NP_990233 (куриный); и NP_037095 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00148] Фагоцитарные белки S100 опосредуют воспалительные ответы и рекрутируют воспалительные клетки к участкам повреждения ткани, и являются представителями молекул связанного с повреждением молекулярного паттерна (DAMP), важных для врожденного иммунитета. См. Foell et al., J. Leukocyte Biol. 81:1 (2006). Полинуклеотидные последовательности белков S100 имеются в общедоступных базах данных под номерами доступа ВС014392 (S100 A1 человека); ВС002829 (S100 А2 человека); ВС012893 (S100 A3 человека); ВС016300 (S100 А4 человека); Z18954 (S100D человека); ВС001431 (S100 А6 человека); ВС 034687 (S100 А7 человека); ВС005928 (S100 А8 человека); ВС047681 (S100 А9 человека); ВС015973 (S100 А10 человека); D38583 (кальгиззарин человека); NM_011309 (мышиный S100a1); NM_009115 (мышиный S100b); NM_013650 (мышиный S100a8); NM_009114 (мышиный S100a9); NMJ)11310 (мышиный S100a3); NM_011311 (мышиный S100a4); и NM_011312 (мышиный S100a5); указанные последовательности включены в настоящую заявку посредством ссылок.
[00149] Аминокислотные последовательности белков S100 имеются в общедоступных базах данных под номерами доступа ААН14392 (S100 A1 человека); ААН02829 (S100 А2 человека); ААН12893 (S100 A3 человека); ААН16300 (S100 А4 человека); САА79479 (S100D человека); ААН01431 (S100 А6 человека); ААН34687 (S100 А7 человека); ААН05928 (S100 А8 человека); ААН47681 (S100 А9 человека); ААН15973 (S100 А10 человека); ВАА07597 (кальгиззарин человека); NP_035439 (мышиный S100a1); NP_033141 (мышиный S100b); NP_038678 (мышиный S100a8); NP_033140 (мышиный S100a9); NP_035440 (мышиный S100a3); NP_035441 (мышиный S100a4); и NP_035442 (мышиный S100a5); указанные последовательности включены в настоящую заявку посредством ссылок.
[00150] Маннан, растительный полисахарид, который представляет собой полимер сахара маннозы, подходит для получения иммунного ответа. В патенте США №5807559 описаны иммуногенные конъюгаты маннана, которые могут подходить для получения Т-клеточного иммунитета против опухолеассоциированных углеводных структур или против углеводных структур, экспрессируемых на инфекционных агентах и/или инфицированных клетках хозяина. В патенте США №5773425 описано применение маннана для облегчения симптомов и/или лечения вирусных заболеваний и увеличения иммунного ответа.
[00151] Бациллу Кальмета-Герена (БЦЖ), живую ослабленную бактерию рода Mycobacterium, применяют в качестве вакцины для предотвращения тяжелого и летального туберкулеза. В патенте США №7393541 описано получение адъювантной вакцины для получения in vivo опосредованного Т-клетками иммунного ответа на микобактерии у пациента-млекопитающего. См. также Hubbard, Collins, Infect. Immun. 59(2): 570. В патенте США №5292513 описан способ примирования макрофагов in vivo у пациентов, нуждающихся в увеличенной бактерицидной и противовирусной активности, посредством убитой нагреванием БЦЖ. Полная последовательность генома БЦЖ имеется в общедоступной базе данных под номером доступа NC_008769 (M. bovis BCG str. Pasteur 1173Р2, полный геном).
[00152] Бактериальные липополисахариды (ЛПС, LPS) представляют собой эндотоксины, индуцирующий сильный иммунный ответ на инфекцию грам-отрицательными бактериями. В патенте США №4148877 описано фракционирование ЛПС из бактериальной культуры и применение указанной фракции в качестве лекарственного средства, чтобы вызвать устойчивость к бактериальной инфекции. В патенте США №5292513 описан способ примирования макрофагов in vivo у пациентов, нуждающихся в увеличенной бактерицидной и противовирусной активности, посредством ЛПС.
Ко-стимулирующие молекулы (позитивные)
[00153] Лиганд OX40 (OX40L) принадлежит члену 4 (Tnfsf4) надсемейства (лигандов) факторов некроза опухоли, экспрессируется на дендритных клетках и способствует Th2-клеточной дифференцировке. Полинуклеотидные последовательности лиганда 0Х40 имеются в общедоступных базах данных под номерами доступа Х79929 (человека); U12763 (мышиный); и AF037067 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00154] Аминокислотные последовательности лиганд OX40 (OX40L) имеются в общедоступных базах данных под номерами доступа САА56284 (человека); ААА21871 (мышиный); и ААС67236 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00155] Лиганд 4-1ВВ (4-1BBL) принадлежит члену 9 (Tnfsf9) надсемейства (лигандов) факторов некроза опухоли, который представляет собой трансмембранный гликопротеин 2 типа и экспрессируется на активированных Т-лимфоцитах. Полинуклеотидные последовательности 4-1BBL имеются в общедоступных базах данных под номерами доступа NM_003811 (человека); NM_009404 (мышиный); и AY332409 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00156] Аминокислотные последовательности лиганда 4-1ВВ (4-1BBL) имеются в общедоступных базах данных под номерами доступа NP_003802 (человека); NP_033430 (мышиный); и AAQ01228 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00157] Белок CD40 принадлежит надсемейству рецепторов факторов некроза опухолей членом 5, необходимым для опосредования широкого спектра иммунных и воспалительных ответов, в том числе зависимого от Т-клеток переключения класса иммуноглобулинов, развития В-клеточной памяти и формирования зародышевого центра. Полинуклеотидные последовательности белков CD40 имеются в общедоступных базах данных под номерами доступа Х60592 (человека); NMJ70701 (мышиный); NM_204665 (куриный); и NMJ34360 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00158] Аминокислотные последовательности белков CD40 имеются в общедоступных базах данных под номерами доступа САА43045 (человека); NP_733802 (мышиный); NP_989996 (куриный); и NP_599187 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00159] CD40L (CD40 лиганд, или CD 154) экспрессируется преимущественно на активированных Т-клетках и является представителем надсемейства молекул TNF. Он связывается с CD40 на антиген-презентирующих клетках. CD40L играет роль ко-стимулирующей молекулы и индуцирует активацию в антиген-презентирующих клетках совместно со стимуляцией Т-клеточных рецепторов молекулами МНС на указанных антиген-презентирующих клетках. У CD40L три партнера для связывания: CD40, интегрин а5β1 и αIIbβ3. Последовательности CD40L имеются в общедоступных базах данных под номерами доступа NM_000074 и МР_000065 (человек) и NM_011616 и NP_035746 (мышиный).
[00160] Связанный с семейством индуцируемых глюкокортикоидами рецепторов фактора некроза опухолей белок (GITR) может индуцировать эффективный опухолевый иммунитет через стимуляцию Т-клеток. Введение моноклонального анти-GITR антитела (mAb) может провоцировать мощный опухолеспецифичный иммунитет и устранял развившиеся опухоли, не вызывая явного аутоиммунного заболевания. См. Ко et al., J. Exp.Med. 7: 885 (2005). В патенте США №6503184 B1 описано антитело анти-GITR.
[00161] Полинуклеотидные последовательности лиганда GITR (GITRL) имеются в общедоступных базах данных под номерами доступа AY358868 (человека); и AY359852 (мышиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00162] Аминокислотные последовательности лиганда GITR (GITRL) имеются в общедоступных базах данных под номерами доступа AAQ89227 (человека); и AAQ55265 (мышиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00163] Связывающий медиатор проникновения вируса герпеса (HVEM) лиганд (HSVgD), также обозначаемый р30, или LIGHT, является представителем семейства TNF, вовлеченным в ко-стимуляцию Т-клеток. У LIGHT два рецептора, рецептор медиатора проникновения вируса герпеса (HVEM) и рецептор лимфотоксина-р (LT-pr). Являясь лигандом для HVEM, HSVgD активирует Т-клетки, действуя как ко-стимулирующий фактор на Т-клетки, что приводит к Т- клеточной пролиферации и секреции цитокинов. См. патент США №7118742 для ознакомления с полинуклеотидными и аминокислотными последовательностями LIGHT. В патенте США 5654174 описан вариант белка gD с удаленными карбокси-концевыми остатками.
[00164] CD70 представляет собой цитокин, который связывается с CD27. Он участвует в активации Т-клеток. Индуцирует пролиферацию ко-стимулированных Т-клеток и стимулирует образование цитолитических Т-клеток. Полинуклеотидные последовательности CD70 имеются в общедоступных базах данных под номерами доступа NM_001252 (человека); NM_011617 (мыши); и NM_001106878 (крысы); указанные последовательности включены в настоящую заявку посредством ссылок.
[00165] Аминокислотные последовательности CD70 имеются в общедоступных базах данных под номерами доступа NP_001243 (человека); NP_035747 (мышиный); и NP_001100348 (крысиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00166] ICOS-L представляет собой лиганд специфического для Т-клеток рецептора клеточной поверхности ICOS и действует как ко-стимулирующий сигнал для Т-клеточной пролиферации и секреции цитокинов. ICOS-L также индуцирует В-клеточную пролиферацию и дифференцировку в плазмоциты. ICOS-L может играть важную роль в опосредовании местных тканевых ответов на воспалительные состояния, а также в модуляции вторичного иммунного ответа путем ко-стимуляции функции памяти Т-клеток. Полинуклеотидные последовательности ICOS-L имеются в общедоступных базах данных под номерами доступа NM_015259 (человека); и NM_015790 (мышиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00167] Аминокислотные последовательности ICOS-L имеются в общедоступных базах данных под номерами доступа NP_056074 (человека); и NP_056605 (мышиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00168] Белок PD-L1 (также известный как CD274) экспрессируется в активированных моноцитах, Т- и В-клетках. PD-L1 повышающе регулируется в моноцитах при обработке ИФН-гамма, и в дендритных клетках и кератиноцитах при обработке ИФН-гамма, наряду с другими активаторами. Полинуклеотидные последовательности белков PD-L1 имеются в общедоступных базах данных под номерами доступа NM_014143 (человека); и NM_021893 (мышиный); указанные последовательности включены в настоящую заявку посредством ссылок.
[00169] Аминокислотные последовательности белков PD-L1 имеются в общедоступных базах данных под номерами доступа NP_054862 (человека); и NP_068693 (мышиный); указанные последовательности включены в настоящую заявку посредством ссылок.
Ко-стимулирующая молекула (негативная)
[00170] Цитотоксический Т-лимфоцит-связанный антиген 4 (CTLA4) является представителем надсемейства иммуноглобулинов и представляет собой ко-стимулирующую молекулу, экспрессирующуюся в активированных Т-клетках. В патентах США №7034121 и 6984720 описаны способы получения и применения антител к CTLA4. В патенте США 6984720 также описаны аминокислотные последовательности тяжелой и легкой цепей анти-CTLA4 антитела.
[00171] Молекулы PD-1 являются представителями надсемейства иммуноглобулиновых генов, которые связываются с лигандом PD-1 (PD-L1). Связывание рецептора PD-1 на Т-клетке PD-L1 передает в клетку ко-стимулирующий сигнал, который удерживает клетки от прохождения клеточного цикла, и стимулирует Т-клеточную пролиферацию. Подавление взаимодействия между PD-L1 и рецептором на Т-клетке анти-PD-L1 антителом приводит к понижающему регулированию иммунного ответа, называемого энергией иммунных клеток. В патенте США №7029674 описан способы получения и последовательность анти-PD-L1 антитела.
[00172] PD-L2 в основном известен как лиганд для PD-1 (или гомолога человека PDCD1). Тем не менее, PD-12, как сообщалось, вовлечен в ко-стимулирующий сигнал, необходимый для пролиферации Т-лимфоцитов и синтеза ИФН-гамма PDCD1-независимым образом. Взаимодействие с PDCD1 подавляет Т-клеточную пролиферацию, блокируя прогрессию клеточного цикла и синтез цитокинов. Yamazaki et al., J. of Immunol. 169: 5538 (2002) и Ansari et al., J. Exp.Med. 198: 63 (2003) описывают получение моноклональных анти-PD-L2 антител.
Обратные иммуносупрессанты (Ингибиторы толерантности)
[00173] Трансформирующий фактор роста бета (TGF-β) представляет собой многофункциональный белок, регулирующий клеточную пролиферацию и дифференцировку, взаимодействуя с одним из двух трансмембранных серин/треонинкиназных рецепторов, I типа и II типа. См. Chen et al., Science 28: 1335 (1993). TGF-рецептор II типа (TGFR2) фосфорилирует и активирует рецепторы I типа, которые аутофосфорилируются, а затем связывают и активируют транскрипционные регуляторы SMAD. Lynch MA et al., Cancer Res. 58:4227 (1998) описывают мутации гена рецептора II типа трансформирующего фактора роста β (TGFBR2), связанные с карциномами яичника человека. Brand et al., J. Biol. Chem. 268:11500-11503 (1993) описывают, что удаление предсказанного цитоплазматического серин/треонин-киназного домена (нуклеотиды 1172-2036 TGFpR2 кДНК H2-3FF, имеются в общедоступных базах данных под номерами доступа М85079, и аминокислотная последовательность, имеющаяся под номером доступа ААА61164) нарушает экспрессию всех трех TGF-β-(1, 2 и 3)-зависимых генов. TGF-β синтезируется в большинстве опухолей человека и подавляет опухолевый антиген-специфический клеточный иммунитет.Foster et al., J. Immunother. 31:500 (2008) описывают, что экспрессия доминантно-негативного TGFpR2 в цитотоксических Т-лимфоцитах может приводить к устойчивости к ингибирующему влиянию TGF-β.
[00174] TGFp действует синергистически с TGFa при индуцировании трансформации. Он также действует как негативный аутокринный фактор роста. Дисрегуляция активации и сигнализации TGF? может приводить к апоптозу. Ziyadeh et al., Proc. Natl. Acad. Sci. 97: 8015 (2000) описывают, что введение анти-TGFβ антитела может предотвращать почечную недостаточность и гломерулосклероз у мышей db/db, модели диабета II типа, при которой развивается явная нефропатия. Способы получения и применения моноклональных TGFp антител описаны в заявке на патент США №6419928. Barcellos-Hoff et al., Am J. Pathol. 147:5 (1995) также описывают способ получения TGFp-антитела. Аминокислотные и нуклеотидные последовательности конструкций гибридного белка TGFβ описаны а патенте США №6756215.
[00175] IL-10 представляет собой цитокин, синтезируемый активированными Th2 клетками, В-клетками, кератиноцитами, моноцитами и макрофагами. IL-10 подавляет синтез ряда цитокинов, включая ИФН-гамма, IL-2, IL-3, TNF и ГМКСФ, синтезируемый активированными макрофагами и хелперными Т-клетками. IL-10 подходит для стимуляции роста и дифференцировки активированных В-клеток человека, подавляя Th1-ответы, т.о. предотвращая отторжение трансплантатов и опосредованные Т-клетками аутоиммунные заболевания. O’Farrell et al., EMBO J, 17:1006 (1998); Kanbayashi et al., Cell Immunol. 171:153 (1996); Fukushima et al., Br. J. Ophthalmol. 90:1535 (2006); и van Lent et at, Ann. Rheum. Dis. 66:334 (2007) описывают получение анти-IL10 антитела. В патенте США №7326567 описана полинуклеотидная последовательность IL-10 антитела. В патенте США №5837232 описан способ лечения опосредованного В-клетками аутоиммунного расстройства с помощью анти-IL-10 антител.
[00176] Белки семейства супрессоров цитокиновой сигнализации (SOCS) образуют часть классической системы с обратной связью, регулирующей передачу цитокинового сигнала. Alexander et al. Cell 98: 597 (1999) описывают, что супрессор цитокиновой сигнализации 1 (SOCS1) представляет собой важнейший ингибитор интерферон-гамма сигнализации и предотвращает потенциально фатальное действие этого цитокина в неонатальном периоде. В публикации Hilton et al., Proc. Natl. Acad. Sci. USA 95-114 (1999) обсуждается вовлеченность SOCS1 в негативную регуляцию цитокинов, передающих сигнал через JAK/STAT3 путь. Публикация Ohya et al. J. Biol. Chem. 272: 27178 (1997) описывают, что белки SOCS, по всей видимости, являются основным регулятором сигнализации интерлейкина 6 (IL-6) и фактора ингибирования лейкемии (LIF). В патенте США №6534277 описан способ получения и применения антитела анти-SOCS1, в котором последовательность нуклеиновой кислоты, кодирующую SOCS1 антитело, вводят в клетки таким образом, что указанное антитело экспрессируется клетками или их потомками, а указанные рекомбинантные клетки затем вводят in vivo для получения терапевтического эффекта. В патентах США №6323317 и 7049418 также описаны антитела анти-SOCS1.
[00177] TGF-α представляет собой митогенный полипептид, способный связываться с рецептором EGF и действовать синергистически с TGF-β, способствуя субстрат-независимой клеточной пролиферации в мягком агаре. Ellis et al., N. Engl. J. Med. 377:158 (1987) указывают, что TGF-a играет роль в некоторых паранеопластических проявлениях меланомы. В патенте США №4742003 и у Xian et al., The J. of Histochem. & Cytochem. 47:949 (1999) описаны способы получения анти-TGF-α антител.
[00178] И рецептор фактора некроза опухолей (TNFR1), и Fas содержат цитоплазматический Fas-ассоциированный белок с доменом смерти (FADD), который имеет важное значение для Fas- и TNF-индуцированной сигнализации для запрограммированной клеточной гибели (апоптоза) и олигомеризации рецепторов. Идентифицирован белок млекопитающих, получивший название FADD, способный связываться с цитоплазматической областью или доменом рецептора Fas, и подавляющий опосредованный FAS апоптоз. Полинуклеотидная последовательность FADD присутствует в общедоступной базе данных под номером доступа U24231, а аминокислотная последовательность - под номером доступа ААА86517; они включены в настоящую заявку посредством ссылок. Фрагмент FADD или кодирующая его нуклеиновая кислота, представляющий(ая) собой доминантно-негативный ингибитор функционально интактного природного FADD, описан в заявке на патент США №6562797 В1.
[00179] р53 (также известный как белок 53, или опухолевый белок 53), представляет собой белок-супрессор опухолевого роста, который у человека кодируется геном ТР53. р53 важен для многоклеточных организмов, где регулирует клеточный цикл и, таким образом, функционирует в качестве супрессора опухолевого роста, вовлеченного в предотвращение рака. Аминокислотные и полинуклеотидные последовательности р53 можно найти под номерами доступа NM_00546 и NP_000537 (человека) и NM_011640 и NP_035770 (мыши).
[00180] Сурвивин является представителем семейства ингибиторов апоптоза. Белок сурвивин функционирует как ингибитор каспазной активации, приводя, таким образом, к негативной регуляции апоптоза, или запрограммированной клеточной смерти. Это было показано путем разрушения путей индукции сурвивина, что приводит к стимуляции апоптоза и уменьшению роста опухоли. Белок сурвивин интенсивно экспрессируется в большинстве опухолей человека и фетальных тканей, но совершенно отсутствует в окончательно дифференцировавших клетках. Этот факт, таким образом, делает сурвивин идеальной мишенью для терапии рака, так как при этом раковые клетки являются мишенями, а нормальные клетки не затрагиваются. Экспрессия сурвивина также в значительной степени регулируется клеточным циклом; экспрессируется рн только в фазе G2-M. Известно, что сурвивин локализуется в митотическом веретене за счет взаимодействия с тубулином во время митоза и может вносить вклад в регуляцию митоза. Регуляция сурвивина, по всей видимости, связана с белком р53. Аминокислотные и полинуклеотидные последовательности р53 можно найти под номерами доступа NM_001012270 и NP_001012270 (человека) и NM_001012273 и NP_001012273 (мышиный).
[00181] Аминокислотная последовательность меланома-ассоциированного антигена-3 (MAGE3) имеет номер доступа Р43357-1 (UniParc).
[00182] Простатоспецифический антиген (PSA) представляет собой белок, синтезируемый клетками предстательной железы. PSA присутствует в небольших количествах в сыворотке крови мужчин со здоровой предстательной железой, но часто его уровень увеличен при раке предстательной железы и при других расстройствах простаты.
[00183] Простатоспецифический мембранный антиген (PSMA) представляет собой интегральный мембранный гликопротеин типа 2, обнаруживаемый в тканях простаты и некоторых других тканях. Он представляет собой возможную терапевтическую мишень при раке предстательной железы.
ОПИСАНИЕ ПЕРЕЧНЯ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[00184] SEQ ID NO:1 представляет собой полинуклеотидную последовательность конструкции, кодирующей mIL-12 и m-IL21.
[00185] SEQ ID NO:2 представляет собой полинуклеотидную последовательность конструкции, кодирующей hIL-12 и hIL-21.
[00186] SEQ ID NO:3 представляет собой полинуклеотидную последовательность конструкции, кодирующей mIL-21 и mIL-15.
[00187] SEQ ID NO:4 представляет собой полинуклеотидную последовательность конструкции, кодирующей mIL-12.
[00188] SEQ ID NO:5 представляет собой полинуклеотидную последовательность конструкции, кодирующей hIL-21 и hIL-15.
[00189] SEQ ID NO:6 представляет собой полинуклеотидную последовательность конструкции, кодирующей hIL-21.
[00190] SEQ ID NO:7 представляет собой полинуклеотидную последовательность конструкции, кодирующей mIL-21.
[00191] SEQ ID NO:8 представляет собой полинуклеотидную последовательность конструкции, кодирующей hIL-21.
[00192] SEQ ID NO:9 представляет собой полинуклеотидную последовательность, кодирующую mIL-21.
[00193] SEQ ID NO:10 представляет собой аминокислотную последовательность mIL-21.
[00194] SEQ ID NO:11 представляет собой полинуклеотидную последовательность, кодирующую mIL-15.
[00195] SEQ ID NO:12 представляет собой аминокислотную последовательность mIL-15.
[00196] SEQ ID NO:13 представляет собой полинуклеотидную последовательность, кодирующую mp40 mIL-12.
[00197] SEQ ID NO:14 представляет собой аминокислотную последовательность mp40 из mIL-12.
[00198] SEQ ID NO:15 представляет собой полинуклеотидную последовательность, кодирующую mp35 mIL-12.
[00199] SEQ ID NO:16 представляет собой аминокислотную последовательность mp35 mIL-12.
[00200] SEQ ID NO:17 представляет собой полинуклеотидную последовательность, кодирующую hIL-21.
[00201] SEQ ID NO:18 представляет собой аминокислотную последовательность hIL-21.
[00202] SEQ ID NO:19 представляет собой полинуклеотидную последовательность, кодирующую hIL-15.
[00203] SEQ ID NO:20 представляет собой аминокислотную последовательность hIL-15.
[00204] SEQ ID NO:21 представляет собой полинуклеотидную последовательность, кодирующую р40 hIL-12.
[00205] SEQ ID NO:22 представляет собой аминокислотную последовательность р40 hIL-12.
[00206] SEQ ID NO:23 представляет собой полинуклеотидную последовательность, кодирующую р35 hIL-12.
[00207] SEQ ID NO:24 представляет собой аминокислотную последовательность р35 hIL-12.
[00208] SEQ ID NO:25 представляет собой последовательность нуклеиновой кислоты экдизон-отвечающего элемента, обнаруживаемого у Drosophila.
[00209] SEQ ID NO:26 представляет собой последовательность нуклеиновой кислоты отвечающего элемента экдизона, обнаруживаемого у Drosophila melanogaster.
[00210] SEQ ID NO:27 представляет собой последовательность нуклеиновой кислоты отвечающего элемента экдизона, обнаруживаемого у Drosophila melanogaster.
[00211] SEQ ID NO:28 представляет собой сайт рестрикции фермента хоминг-эндонуклеазы (НЕ) (I-SceI)
[00212] SEQ ID NO:29 представляет собой последовательность ДНК аденовирусного вектора, содержащий кодирующую последовательность IL-12 человека: Ad-RTS-hIL-12 (SP1-RheoIL-12).
[00213] SEQ ID NO:30 представляет собой последовательность нуклеиновой кислоты 5’ UTR TNF дикого типа человека.
[00214] SEQ ID NO:31 представляет собой последовательность нуклеиновой кислоты 5U2 5’ UTR.
[00215] SEQ ID NO:32 представляет собой последовательность нуклеиновой кислоты с оптимизированным составом кодонов, кодирующую сигнальный пептид IL-2.
[00216] SEQ ID NO:33 представляет собой последовательность нуклеиновой кислоты дикого типа, кодирующую сигнальный пептид TNF-альфа человека.
[00217] SEQ ID NO:34 представляет собой нуклеотидную последовательность с оптимизированным составом кодонов, кодирующую сигнальный пептид TNF-альфа человека.
[00218] SEQ ID NO:35 представляет собой последовательность нуклеиновой кислоты дикого типа, кодирующую TNF-альфа человека.
[00219] SEQ ID NO:36 представляет собой последовательность нуклеиновой кислоты с оптимизированным составом кодонов, кодирующую TNF-альфа человека.
[00220] SEQ ID NO:37 представляет собой аминокислотную последовательность TNF-альфа человека.
[00221] SEQ ID NO:38 представляет собой последовательность нуклеиновой кислоты 3’-регуляторной области, содержащую нуклеотидную последовательность, кодирующую сигнал полиаденилирования SV40.
[00222] SEQ ID NO:39 представляет собой последовательность нуклеиновой кислоты 3’-регуляторной области, содержащий нуклеотидную последовательность, кодирующую сигнал полиаденилирования гормона роста человека.
[00223] SEQ ID NO:40 представляет собой последовательность нуклеиновой кислоты, содержащую 3’ UTR дикого типа TNF-альфа человека.
[00224] SEQ ID NO:41 представляет собой последовательность нуклеиновой кислоты AtoC-мутанта 3’ UTR TNF-альфа человека.
[00225] SEQ ID NO:42 представляет собой последовательность нуклеиновой кислоты 3’ UTR GAST человека.
[00226] SEQ ID NO:43 представляет собой последовательность нуклеиновой кислоты синтетической 3’-регуляторной области.
[00227] SEQ ID NO:44 представляет собой последовательность нуклеиновой кислоты 5’ UTR GAPDH человека.
[00228] SEQ ID NO:45 представляет собой дикого типа последовательность нуклеиновой кислоты SP инсулина.
[00229] SEQ ID NO:46 представляет собой последовательность нуклеиновой кислоты дикого типа, кодирующую сигнальный пептид FGF-19 человека.
[00230] SEQ ID NO:47 представляет собой последовательность нуклеиновой кислоты вектора 43318.
[00231] SEQ ID NO:48 представляет собой последовательность нуклеиновой кислоты вектора 43319.
[00232] SEQ ID NO:49 представляет собой последовательность нуклеиновой кислоты вектора 43320.
[00233] SEQ ID NO:50 представляет собой последовательность нуклеиновой кислоты вектора 43321.
[00234] SEQ ID NO:51 представляет собой последовательность нуклеиновой кислоты вектора 43322.
[00235] SEQ ID NO:52 представляет собой последовательность нуклеиновой кислоты вектора 43323.
[00236] SEQ ID NO:53 представляет собой последовательность нуклеиновой кислоты вектора 43324.
[00237] SEQ ID NO:54 представляет собой последовательность нуклеиновой кислоты вектора 43325.
[00238] SEQ ID NO:55 представляет собой последовательность нуклеиновой кислоты вектора 43326.
[00239] SEQ ID NO:56 представляет собой последовательность нуклеиновой кислоты вектора 43327.
[00240] SEQ ID NO:57 представляет собой последовательность нуклеиновой кислоты вектора 43328.
[00241] SEQ ID NO:58 представляет собой последовательность нуклеиновой кислоты вектора 43329.
[00242] SEQ ID NO:59 представляет собой последовательность нуклеиновой кислоты вектора 43533.
[00243] SEQ ID NO:60 представляет собой последовательность нуклеиновой кислоты вектора 43534.
[00244] SEQ ID NO:61 представляет собой последовательность нуклеиновой кислоты вектора VVN2823 (Ad-RTS-hIL-12).
[00245] SEQ ID NO:62 представляет собой последовательность нуклеиновой кислоты вектора VVN2539 (Ad-RTS-mIL-12).
ОПРЕДЕЛЕНИЯ
[00246] Если не указано иное, все используемые в настоящей заявке термины, относящиеся к данной области техники, обозначения и другие научные термины и терминология имеют общепринятые значения, понятные специалистам в области техники, к которой относится данное изобретение. В некоторых случаях термины, имеющие общепринятые значения, определены в настоящем описании для ясности и/или в качестве справочного материала и для лучшего понимания; включение таких определений в настоящее описание не должно быть обязательно истолковано как означающее существенные отличия от общепринятых в данной области техники значений. Общепринятые определения терминов молекулярной биологии и/или способы и/или протоколы можно найти в Rieger et al., Glossary of Genetics: Classical and Molecular («Глоссарий классической и молекулярной генетики»), 5-е изд.. Springer- Verlag: New York, 1991; Lewin, Genes V, Oxford University Press: New York, 1994; Sambrook et al., Molecular Cloning, A Laboratory Manual («Молекулярное клонирование: лабораторное руководство») (3d ed. 2001) и Ausubel et al., Current Protocols in Molecular Biology («Современные протоколы молекулярной биологии») (1994). При необходимости, процедуры, связанные с применением коммерчески доступных наборов и/или реагентов, как правило, осуществляются в соответствии с рекомендациями и/или протоколами и/или параметрами, приведенными производителем, если не указано иное.
[00247] Термином «выделенный» согласно целям настоящего изобретения обозначается биологический материал (клетка, нуклеиновая кислота или белок), который был выделен из исходной среды (среды, в которой он естественным образом присутствует). Например, полинуклеотид, присутствующий в естественном состоянии в растении или животном, выделенным не является, однако то же самый полинуклеотид, отделенный от смежных нуклеиновых кислот, в составе которых он естественным образом находится, считается «выделенным».
[00248] Термин «очищенный» относительно биологических материалов не обязательно означает, что указанный материал находится в абсолютно чистой форме, исключающей присутствие других соединения. Это скорее относительное определение.
[00249] Термины «нуклеиновая кислота», «молекула нуклеиновой кислоты», «олигонуклеотид», «нуклеотид» и «полинуклеотид» применяются взаимозаменяемо и относятся к фосфоэфирной полимерной форме рибонуклеозидов (аденозина, гуанозина, уридина или цитидина; «молекулы РНК») или дезоксирибонуклеозидов (дезоксиаденозина, дезоксигуанозина, дезокситимидина или дезоксицитидина; «молекулы ДНК»), или любых их фосфоэфирных аналогов, таких как фосфотиоаты и сложные тиоэфиры, либо в одноцепочечной форме, либо в виде двуцепочечной спирали. Существуют двуцепочечные ДНК-ДНК, ДНК-РНК и РНК-РНК спирали. Термин «молекула нуклеиновой кислоты», и, в частности, молекула ДНК или РНК, относится только к первичной и вторичной структуре указанной молекулы, и не ограничен какими-либо конкретными третичными формами. Таким образом, указанный термин включает двуцепочечную ДНК, обнаруживаемую, в частности, в линейных и кольцевых молекулах ДНК (например, рестрикционных фрагментах), плазмидах, сверхспиральной ДНК и хромосомах. Говоря о структуре конкретной двуцепочечной молекулы ДНК, последовательности могут, быть описаны в настоящей заявке согласно обычной практике, при которой указываются только последовательности направления 5’→3’ вдоль нетранскрибируемой цепи ДНК (т.е. цепи, имеющей гомологичную иРНК последовательность). «Молекула рекомбинантной ДНК» представляет собой молекулу ДНК, подвергшуюся молекулярно-биологической обработке. ДНК включает, не ограничиваясь перечисленными, кДНК, геномную ДНК, плазмидную ДНК, синтетическую ДНК и полусинтетическую ДНК.
[00250] Термин «фрагмент» в отношении полинуклеотидных последовательностей относится к нуклеотидной последовательности уменьшенной длины относительно исходной нуклеиновой кислоты и содержащей в рамках общей области нуклеотидную последовательность, идентичную исходной нуклеиновой кислоте. Такой фрагмент нуклеиновой кислоты согласно настоящему изобретению может быть при необходимости включен в больший полинуклеотид, частью которого он является. Такие фрагменты содержат, или, как вариант, состоят из олигонуклеотидов, длина которых составляет от по меньшей мере 6, 8, 9,10,12, 15, 18, 20, 21, 22, 23, 24, 25, 30, 39, 40, 42, 45, 48, 50, 51, 54, 57, 60, 63, 66, 70, 75, 78, 80, 90, 100, 105, 120, 135, 150, 200, 300, 500, 720, 900, 1000, 1500, 2000, 3000, 4000, 5000 или более последовательных нуклеотидов нуклеиновой кислоты согласно настоящему изобретению.
[00251] Используемый в настоящей заявке термин «выделенный фрагмент нуклеиновой кислоты» относится к полимеру РНК или ДНК, одноцепочечному или двуцепочечному, необязательно содержащему синтетические, искусственные или измененные нуклеиновые основания. Выделенный фрагмент нуклеиновой кислоты в форме полимера ДНК может состоять из одного или более сегмента кДНК, геномной ДНК или синтетической ДНК.
[00252] Термин «ген» относится к полинуклеотиду, содержащему нуклеотиды, которые кодируют функциональную молекулу, включая функциональные молекулы, получаемые только транскрипцией (например, биологически активные виды РНК) или транскрипцией и трансляцией (например, полипептид). Термин «ген» охватывает нуклеиновые кислоты кДНК и геномной ДНК. «Ген» также относится к фрагменту нуклеиновой кислоты, экспрессирующему специфичную РНК, белок или полипептид, включая регуляторные последовательности, предшествующие (5’ некодирующие последовательности) и следующие за (3’ некодирующие последовательности) кодирующей последовательностью. Термин «природный ген» относится к гену, обнаруживаемому в природе с его собственными регуляторными последовательностями. Термин «химерный ген» относится к любому гену, не являющемуся природным геном, содержащему регуляторную и/или кодирующую последовательности, не обнаруживаемые вместе в природе. Соответственно, химерный ген может содержать регуляторные последовательности и кодирующие последовательности, происходящие из различных источников, или регуляторные последовательности и кодирующая последовательности, происходящие из того же источника, но расположенные отличным от обнаруживаемого в природе образом. Химерный ген может содержать кодирующие последовательности, происходящие из различных источников и/или регуляторные последовательности, происходящие из различных источников. Термин «эндогенный ген» относится к природному гену, расположенному в геноме организма в его естественном месте. Термин «экзогенный» ген или «гетерологичный» ген относится к гену, в норме не обнаруживаемому в указанном организме-хозяине, и введенному в указанный организм-хозяин путем переноса генов. Экзогенные гены могут включать природные гены, встроенные в ненативный организм, или химерные гены. «Трансген» представляет собой ген, который был введен в геном с помощью техники трансформации. Например, ген интерлейкина-12 (IL-12) кодирует белок IL-12. IL-12 представляет собой гетеродимер 35-кДа субъединицы (р35) и 40-кДа субъединицы (р40), соединенных посредством дисульфидной связи с образованием полностью функционального IL-12р70. Указанный ген IL-12 кодирует обе субъединицы -р35 и р40.
[00253] «Гетерологичный ДНК» относится к ДНК, не присутствующей в данной клетке от природы, или не присутствующей в хромосомном сайте указанной клетки. Указанная гетерологичная ДНК может включать ген, экзогенный для данной клетки.
[00254] Термин «геном» включает хромосомную, а также митохондриальную, хлоропластную и вирусную ДНК или РНК.
[00255] Молекула нуклеиновой кислоты является «гибридизуемой» с другой молекулой нуклеиновой кислоты, такой как кДНК, геномной ДНК или РНК, если одноцепочечную форму указанной молекулы нуклеиновой кислоты возможно отжечь с другой молекулой нуклеиновой кислоты при соответствующих условиях температуры и ионной силы раствора. Условия для гибридизации и отмывки общеизвестны и их примеры приведены у Sambrook et al. в Molecular Cloning: A Laboratory Manual («Молекулярное планирование: лабораторное руководство»), второе изд.. Cold Spring Harbor Laboratory Press, Cold Spring Harbor (1989), в частности, в главе 11 и входящей в нее таблице 11.1). Температурные условия и ионная сила определяют «жесткость» гибридизации.
[00256] Жесткость условий может быть подобрана как для скрининга умеренно сходных фрагментов, таких как гомологичные последовательности дальнородственных организмов, так и для очень похожих фрагментов, таких как гены, которые дублируют функциональные ферменты близкородственных организмов. Для предварительного скрининга гомологичных нуклеиновых кислот, можно применять низкую жесткость условий гибридизации, соответствующую Tm=55°, например, 5Х SSC, 0,1% SDS, 0,25% молока, без формамида; или 30% формамида, 5Х SSC, 0,5% SDS. Умеренная жесткость условий гибридизации соответствует более высокой Tm, например, 40% формамида с 5Х или 6Х SSC. Высокая жесткость условий гибридизации соответствует наиболее высокой Tm, например, 50% формамида, 5Х или 6Х SSC.
[00257] Для гибридизации требуется, чтобы указанные две нуклеиновые кислоты содержали комплементарные последовательности, хотя допустимы и некомплементарные основания, в зависимости от жесткости гибридизации. Термин «комплементарный» применяют для описания взаимоотношений между нуклеиновыми основаниями, способными к гибридизации друг с другом. Например, если говорить о ДНК, аденозин комплементарен тимину, а цитозин комплементарен гуанину. Соответственно, настоящее изобретение также охватывает выделенные фрагменты нуклеиновых кислот, комплементарные полным последовательностям согласно описываемым или применяемым в соответствии с настоящим изобретением, а также указанные существенно сходные последовательности нуклеиновых кислот.
[00258] Согласно одному из вариантов реализации полинуклеотиды обнаруживают, применяя условия гибридизации, включающие этап гибридизации при Tm, равной 55°С, и применение условий, описанных выше. Согласно другим вариантам реализации Tm составляет 60°С, 63°С или 65°С.
[00259] Постгибридизационные отмывки также определяют жесткость условий. В одном из комплексов условий применяют серию отмывок, начинающаяся с 6Х SSC, 0,5% SDS при комнатной температуре в течение 15 минут (мин), затем отмывку повторяют с 2Х SSC, 0,5% SDS при 45°С в течение 30 мин, и затем повторяют дважды с 0,2Х SSC, 0,5% SDS при 50°С в течение 30 мин. В одном из комплексов жестких условий применяют более высокие температуры, при этом отмывки идентичны описанным выше, за исключением того, что температуру двух последних отмывок по 30 мин в 0,2Х SSC и 0,5% SDS повышают до 60°С. В другом комплексе очень жестких условий применяют две последних отмывки в 0, 1X SSC и 0.1% SDS при 65°C.
[00260] Подходящая жесткость гибридизации нуклеиновой кислоты зависит от длины указанной нуклеиновой кислоты и степени комплементации, общеизвестных в данной области техники переменных. Чем больше степень сходства или гомологии между двумя нуклеотидными последовательностями, тем выше значение Tm для гибридов нуклеиновой кислоты, содержащих такие последовательности. Относительная стабильность (соответствующая более высоким Tm) гибридизации нуклеиновых кислот уменьшается в следующем порядке: РНК:РНК, ДНК:РНК, ДНК:ДНК. Для гибридов, длина которых составляет более 100 нуклеотидов, разработаны уравнения для вычисления Tm (см. Sambrook et al., выше, 9.50-0.51). Для гибридизации с более короткими нуклеиновыми кислотами, т.е. олигонуклеотидами, расположение некомплементарных участков важнее, и длина указанного олигонуклеотида определяет его специфичность (см. Sambrook et al., выше, 11.7-11.8).
[00261] Согласно одному из вариантов реализации полинуклеотиды определяют, используя условия гибридизации, включающие этап гибридизации с концентрацией соли менее чем 500 ммоль и при по меньшей мере 37°С, и этап отмывания в 2Х SSPE при температуре по меньшей мере 63°С.Согласно еще одному варианту реализации условия гибридизации включают концентрацию соли менее чем 200 ммоль и температуру, равную по меньшей мере 37°С, на этапе гибридизации. Согласно еще одному варианту реализации условия гибридизации включают 2Х SSPE и 63°С как для этапа гибридизации, так и для этапа отмывки.
[00262] Согласно еще одному варианту реализации длина гибридизуемой нуклеиновой кислоты составляет по меньшей мере приблизительно 10 нуклеотидов. Предпочтительно, минимальная длина гибридизуемой нуклеиновой кислоты составляет по меньшей мере приблизительно 15 нуклеотидов; например, по меньшей мере приблизительно 20 нуклеотидов; например, по меньшей мере 30 нуклеотидов. Кроме того, специалисту в данной области техники будет ясно, что необходимые температура и концентрация соли в отмывающем растворе могут быть подобраны согласно таким факторам, как длина зонда.
[00263] Термин «зонд» относится к одноцепочечной молекуле нуклеиновой кислоты, способной спариваться с комплементарной одноцепочечной целевой нуклеиновой кислотой с образованием двуцепочечной молекулы.
[00264] Используемый в настоящей заявке термин «олигонуклеотид» относится к короткой нуклеиновой кислоте, гибридизуемой с молекулой геномной ДНК, молекулой кДНК, плазмидной ДНК или молекулой иРНК. Олигонуклеотиды могут быть мечеными, как, например,32Р-нуклеотиды или нуклеотиды, с которыми ковалентно конъюгирована метка, такая как биотин. Меченый олигонуклеотид можно применять в качестве зонда для обнаружения присутствия нуклеиновой кислоты. Олигонуклеотиды (один из них или оба могут быть мечеными) можно применять в качестве ПЦР-праймеров, либо для клонирования полной длины или фрагмента нуклеиновой кислоты, для секвенирования ДНК, либо для обнаружения присутствия нуклеиновой кислоты. Олигонуклеотид также можно применять для формирования тройной спирали с молекулой ДНК. Как правило, олигонуклеотиды получают синтетическим способом, предпочтительно на синтезаторе нуклеиновых кислот. Соответственно, могут быть получены олигонуклеотиды с не встречающимися в природе аналогами фосфодиэфирных связей, такими как тиоэфирные связи и т.д.
[00265] Термин «праймер» относится к олигонуклеотиду, который гибридизуется с целевой последовательностью нуклеиновой кислоты с образованием области двуцепочечной нуклеиновой кислоты, который может служить точкой инициации синтеза ДНК при подходящих условиях. Такие праймеры могут применяться в полимеразной цепной реакции или для секвенирования ДНК.
[00266] «Полимеразная цепная реакция» обозначается аббревиатурой ПЦР и относится к in vitro способам ферментативного амплифицирования конкретной последовательности нуклеиновой кислоты. ПЦР включает повторяющиеся серии температурных циклов, где каждый цикл включает три этапа: денатурацию матричной нуклеиновой кислоты для разделения цепей целевой молекулы, отжиг одноцепочечного олигонуклеотидного ПЦР-праймера с матричной нуклеиновой кислотой и удлинение указанного(ных) отожженного(ных) праймера(ов) ДНК-полимеразой. ПЦР позволяет обнаружить присутствие целевой молекулы и, при подходящих для количественного или полуколичественного анализа условиях, определить относительное количество целевой молекулы в стартовом пуле нуклеиновых кислот.
[00267] «Полимеразная цепная реакция с обратной транскрипцией» обозначается аббревиатурой ОТ-ПЦР и относится к in vitro способам для ферментативного получения целевой кДНК молекулы или молекул из молекулы или молекул РНК с последующей ферментативной амплификацией конкретной последовательности нуклеиновой кислоты, либо последовательности в рамках целевой молекулы или молекул кДНК согласно приведенному выше описанию. ОТ-ПЦР также позволяет обнаруживать присутствие целевой молекулы и, при подходящих для количественного или полуколичественного анализа условиях, определять относительное количество указанной целевой молекулы в стартовом пуле нуклеиновых кислот.
[00268] «Кодирующая последовательность» или «кодирующая область» ДНК относится к двуцепочечной последовательности ДНК, которая кодирует полипептид и может быть транскрибирована и транслирована в полипептид в клетке, ex vivo, in vitro или in vivo, при помещении под контроль подходящих регуляторных последовательностей. Термин «подходящие регуляторные последовательности» относится к нуклеотидным последовательностям, расположенным в обратном (3’-5’) направлении (5’-некодирующие последовательности) от кодирующей последовательности, внутри кодирующей последовательности, либо в прямом (5’-3’) направлении (3’-некодирующие последовательности) от кодирующей последовательности, и влияющим на транскрипцию, процессинг или стабильность РНК, или на трансляцию связанной с ними кодирующей последовательности. Регуляторные последовательности могут включать промоторы, трансляционные лидерные последовательности, интроны, последовательности узнавания участков полиаденилирования, сайты процессинга РНК, сайты связывания эффекторов и шпилечные структуры. Границы кодирующей последовательности определяются стартовым кодоном на 5’ (амино) конце и кодоном терминации трансляции на 3’ (карбоксильном) конце. Кодирующая последовательность может включать, не ограничиваясь перечисленным, прокариотические последовательности, кДНК из иРНК, последовательности геномной ДНК и даже синтетические последовательности ДНК. В том случае, если кодирующая последовательность предназначена для экспрессии в эукариотической клетке, сигнал полиаденилирования и последовательность терминации транскрипции расположены, как правило, в направлении 3’ от кодирующей последовательности.
[00269] «Открытая рамка считывания» обозначается аббревиатурой ORF и относится к длине последовательности нуклеиновой кислоты - ДНК, кДНК или РНК, которая содержит сигнал начала трансляции или кодон инициации, такой как ATG или AUG, и терминирующий кодон, и потенциально может быть транслирована в полипептидную последовательность.
[00270] Термин «голова-к-голове» применяется в настоящей заявке для описания ориентации двух полинуклеотидных последовательностей друг относительно друга. Два полинуклеотида располагаются с ориентацией «голова-к-голове», если 5’-конец кодирующей цепи одного полинуклеотида смежен с 5’-концом кодирующей цепи другого полинуклеотида, так что транскрипция каждого полинуклеотида протекает в направлении от 5’-конца другого полинуклеотида. Термин «голова-к-голове» может обозначаться аббревиатурой (5’)-к-(5*), а также может обозначаться символами (←→) или (3’←5’5’→3’).
[00271] Термин «хвост-к-хвосту» применяют в настоящей заявке для описания ориентации двух полинуклеотидных последовательностей друг относительно друга. Два полинуклеотида располагаются с ориентацией «хвост-к-хвосту», если 3’-конец кодирующей цепи одного полинуклеотида смежен с 3’-концом кодирующей цепи другого полинуклеотида, так что транскрипция каждого полинуклеотида протекает в направлении навстречу другому полинуклеотиду. Термин «хвост-к-хвосту» может обозначаться аббревиатурой (3’)-к-(3’), а также может обозначаться символами (→←) или (5’→3’3’←5’).
[00272] Термин «голова к хвосту» применяют в настоящей заявке для описания ориентации двух полинуклеотидных последовательностей друг относительно друга. Два полинуклеотида располагаются с ориентацией «голова к хвосту», если 5’-конец кодирующей цепи одного полинуклеотида смежен с 3’-концом кодирующей цепи другого полинуклеотида, так что транскрипция каждого полинуклеотида протекает в том же направлении, что и транскрипция другого полинуклеотида. Термин «голова к хвосту» может обозначаться аббревиатурой (5’)-к-(3’), а также может обозначаться символами (→→) или (5’→3’5’→3’).
[00273] Термин «даунстрим» («в направлении 3’»; «по ходу транскрипции») относится к нуклеотидной последовательности, расположенной в направлении 3’ относительно исходной нуклеотидной последовательности. В частности, под нуклеотидными последовательностями, расположенными в направлении 3’ («даунстрим-последовательностями»), как правило, понимаются последовательности, следующие за точкой начала транскрипции. Например, кодон инициации трансляции гена расположен в направлении 3’ (в направлении «даунстрим») от сайта старта транскрипции.
[00274] Термин «апстрим» («в направлении 5’»; «в обратном направлении») относится к нуклеотидной последовательности, расположенной в направлении 5’ относительно исходной нуклеотидной последовательности. В частности, под расположенными в направлении 5’ нуклеотидными последовательностями («апстрим-последовательностями») понимаются, как правило, последовательности, расположенные с 5’ стороны кодирующей последовательности или точки начала транскрипции. Например, большинство промоторов расположены в направлении 5* от сайта старта транскрипции.
[00275] Термины «рестрикционная эндонуклеаза» и «рестрикционный фермент» применяются взаимозаменяемо и относятся к ферменту, связывающемуся с определенной нуклеотидной последовательностью в составе двуцепочечной ДНК и расщепляющему ее.
[00276] Термин «гомологичная рекомбинация» относится к встраиванию экзогенной последовательности ДНК в другую молекулу ДНК, например, встраиванию вектора в хромосому. Предпочтительно, указанный вектор нацелен на специфический хромосомный сайт для гомологичной рекомбинации. Для специфической гомологичной рекомбинации указанный вектор должен содержать достаточно длинные области гомологии с последовательностью указанной хромосомы, чтобы было возможным комплементарное связывание и встраивание указанного вектора в указанную хромосому. Более длинные области гомологии и более высокие степени сходства последовательностей могут увеличивать эффективность гомологичной рекомбинация.
[00277] Для размножения полинуклеотида согласно настоящему изобретению могут применяться несколько способов, известных в данной области техники. После того, как обеспечены подходящая хозяйская система и условия роста, рекомбинантные экспрессионные векторы могут быть размножены и получены в большом количестве. Согласно приведенному в настоящей заявке описанию, подходящие экспрессионные векторы включают, не ограничиваясь перечисленными, следующие векторы или их производные: вирусы человека и животных, такие как вирус осповакцины или аденовирус; вирусы насекомых, такие как бакуловирус; дрожжевые векторы; бактериофаговые векторы (например, лямбда), и плазмидные и космидные ДНК векторы, наряду с другими.
[00278] Термин «вектор» относится к любому «проводнику» для клонирования и/или переноса нуклеиновой кислоты в клетку-хозяин. Вектор может представлять собой репликон, к которому присоединен сегмент другой ДНК таким образом, чтобы обеспечивать репликацию указанного присоединенного сегмента. Термин «репликон» относится к любому генетическому элементу (например, плазмиде, фагу, космиде, хромосоме, вирусу), функционирующему как автономная единица репликации ДНК in vivo, т.е. способному к репликации под собственным контролем. Термин «вектор» включает как вирусные, так и невирусные проводники для введения нуклеиновой кислоты в клетку in vitro, ex vivo или in vivo. Большое количество известных в данной области техники векторов можно применять для манипуляций с нуклеиновыми кислотами, встраивания отвечающих элементов и промоторов в гены, и т.д. Подходящие векторы включают, например, плазмиды или модифицированные вирусы, в том числе, например, бактериофаги, такие как производные фага лямбда, или плазмиды, такие как производные плазмид pBR322 или pUC, или вектор Bluescript. Другим примером подходящих для применения в соответствии с настоящим изобретением векторов является система ULTRA VECTOR® Production System (Intrexon Corp., Блэксбург, Виргиния) согласно описанию в WO 2007/038276. Например, встраивание фрагментов ДНК, соответствующих отвечающим элементам и промоторам в подходящий вектор может быть выполнено путем лигирования подходящих фрагментов ДНК в выбранный вектор, имеющий комплементарные липкие концы. Как вариант, концы указанной молекулы ДНК могут быть модифицированы при помощи ферментов, или любой участок может быть доставлен с помощью дотирующих нуклеотидных последовательностей (линкеров) в концы указанной ДНК. Такие векторы могут быть сконструированы так, чтобы содержать гены селектируемых маркеров, обеспечивающие отбор клеток со встроенным в клеточный геном указанным маркером. Такие маркеры позволяют идентифицировать и/или отбирать клетки-хозяева, включающие и экспрессирующие белки, кодируемые указанным маркером.
[00279] Вирусные векторы, и, в частности, ретровирусные векторы, уже применялись для широкого спектра приложений доставки генов в клетки, а также у живых пациентов-животных. Вирусные векторы, которые могут применяться, включают, не ограничиваясь перечисленными, векторы на основе ретровирусов, аденоассоциированных вирусов, поксвирусов, бакуловирусов, вируса коровьей оспы, вируса простого герпеса, вируса Эпштейна-Барр, аденовируса, геминивируса и колимовируса. Невирусные векторы включают плазмиды, липосомы, электростатически заряженные липиды (питофектины), ДНК-белковые комплексы и биополимеры. Помимо нуклеиновой кислоты вектор может дополнительно содержать одну или более регуляторную область и/или селектируемые маркеры, подходящие для отбора, подсчета и мониторинга результатов переноса нуклеиновой кислоты (перенос в какие ткани, продолжительность экспрессии и т.д.).
[00280] Термин «плазмида» относится к экстрахромосомному элементу, часто несущему ген, не являющийся частью центрального метаболизма указанной клетки, и, как правило, находящемуся в форме кольцевой двуцепочечной молекулы ДНК. Такие элементы могут представлять собой автономно реплицирующиеся последовательности, интегрирующие в геном последовательности, фаговые или нуклеотидные последовательности, линейные, кольцевые или сверхспиральные, из одно- или двуцепочечной ДНК или РНК, полученные из любого источника, в котором ряд нуклеотидных последовательностей были объединены или рекомбинированы с получением уникальной конструкции, способной встраивать промоторный фрагмент и ДНК последовательность выбранного генного продукта, наряду с подходящей 3’ нетранслируемой последовательностью, в клетку.
[00281] Термин «клонирующий вектор» относится к «репликону», который представляет собой единицу длины нуклеиновой кислоты, предпочтительно ДНК, который реплицируется последовательно и который содержит точку начала репликации, такому как плазмида, фаг или космида, к которому может быть присоединен другой сегмент нуклеиновой кислоты таким образом, чтобы приводить к репликации присоединенного сегмента. Клонирующие векторы могут быть способны к репликации в одном типе клеток и экспрессии в другом («челночный вектор»). Клонирующие векторы могут содержать одну или более последовательность, которая можно применять для отбора клеток, содержащих указанный вектор и/или один или более сайт множественного клонирования для встраивания представляющий интерес последовательности.
[00282] Термин «экспрессионный вектор» относится к вектору, плазмиде или проводнику, сконструированных так, чтобы обеспечивать экспрессию встроенной последовательности нуклеиновой кислоты. Клонированный ген, т.е. встроенная последовательность нуклеиновой кислоты, как правило, помещен под контроль контрольных элементов, таких как промотор, минимальный промотор, энхансер, или т.п. Области контроля инициации или промоторы, которые подходят для управления экспрессией нуклеиновой кислоты в нужной клетке-хозяине, многочисленны и известны специалистам в данной области техники. Практически любой промотор, способный к управлению экспрессией этих генов, можно применять в экспрессионном векторе, включая, но не ограничиваясь перечисленными, вирусные промоторы, бактериальные промоторы, промоторы животного происхождения, промоторы млекопитающих, синтетические промоторы, конститутивные промоторы, тканеспецифичные промоторы, связанные с патогенезом или заболеванием промоторы, специфичные для развития промоторы, индуцируемые промоторы, светорегулируемые промоторы; CYC1, HIS3, GAL1, GAL4, GAL10, ADH1, PGK, PH05, GAPDH, ADC1, TRP1, URA3, LEU2, ENO, TPI, промоторы щелочной фосфатазы (подходящие для экспрессии в Saccharomyces)’, промотор АОХ1 (подходящий для экспрессии в Pichia); β-лактамаза, промоторы lac, ara, tet, trp, lPL, lPR, T7, tac и trc (подходящие для экспрессии в Escherichia coli); светорегулируемые, специфичные для семени, специфичные для пыльцы, специфичные для яичников, вируса мозаики цветной капусты 35S, минимальный промотор CMV 35S, промотор вируса мозаики прожилок маниоки (CsVMV), связывающего хлорофилл a/b белка, рибулозо-1,5-бисфосфаткарбоксилазы, специфичные для побегов, специфичные для корней, хитиназные, стресс-индуцируемые, палочковидного тунгровируса риса, растительный суперпромотор, лейцинаминопептидазы картофеля, промоторы нитратредуктазы, маннопинсинтазы, нопалинсинтазы, убиквитина, белка зеина и антоцианов (подходящие для экспрессии в растительных клетках); известные в данной области техники промоторы животного происхождения и промоторы млекопитающих, включая, но не ограничиваясь перечисленными, область раннего промотора SV40 (SV40e), промотор, содержащийся в 3’ длинном концевом повторе (LTR) вируса саркомы Рауса (RSV), промоторы Е1А или большой поздний промотор (MLP) генов аденовирусов (Ad), ранний промотор цитомегаловируса (CMV), промотор тимидинкиназы (ТК) вируса простого герпеса (HSV), промотор бакуловируса IE1, промотор фактора элонгации 1 альфа (EF1), промотор фосфоглицераткиназы (PGK), промотор убиквитина (Ubc), промотор альбумина, регуляторные последовательности промотора и областей транскрипционного контроля металлотионеина-L мыши, универсальные промоторы (HPRT, виментина, α-актина, тубулина и т.п.), промоторы промежуточных филаментов (десмина, нейрофиламентов, кератина, GFAP и т.п.), промоторы терапевтических генов (типов MDR, CFTR или фактора VIII и т.п.), связанные с патогенезом или заболеванием промоторы, и промоторы, демонстрирующие тканеспецифичность и применявшиеся у трансгенных животных, такие как контрольная область гена эластазы I, активная в ацинозных клетках поджелудочной железы; контрольная область гена инсулина, активная в бета-клетках поджелудочной железы, контрольная область гена иммуноглобулина, активная в лимфоидных клетках, контрольная область вируса опухоли молочной железы мышей, активная в тестикулярных клетках, клетках молочной железы, лимфоидных и тучных клетках; гена альбумина, контрольные области Аро AI и Аро AII, активные в печени, контрольная область гена альфа- фетопротеина, активная в печени, контрольная область гена альфа 1-антитрипсина, активная в печени, контрольная область гена бета-глобина, активная в миелоидных клетках, контрольная область гена основного белка миелина, активная в олигодендроцитах мозга, контрольная область гена легкой цепи миозина-2, активная в скелетных мышцах, и контрольная область гена гонадотропного рилизинг-гормона, активная в гипоталамусе, промотор пируваткиназы, промотор виллина, промотор связывающего жирные кислоты в кишечнике белка, промотор α-актина гладкомышечных клеток, и т.п. Кроме того, такие экспрессионные последовательности могут быть модифицированы добавлением энхансера или регуляторных последовательностей и т.п.
[00283] Векторы могут быть введены в требуемые клетки-хозяева при помощи известных в данной области техники способов, например, трансфекции, электропорации, микроинъекции, трандукции, слияния клеток, ДЭАЭ-декстрана, преципитация фосфатом кальция, липофекции (лизосомного слияния), применения генной пушки или переносчика ДНК-векторов (см., например, Wu et al., J. Biol. Chem. 267:963 (1992); Wu et al., J. Biol. Chem. 263:14621 (1988); и Hartmut et al., заявка на патент Канады №2012311).
[00284] Полинуклеотид согласно настоящему изобретению может также быть введен in vivo путем липофекции. За последнее десятилетие применение липосом для инкапсуляции и трансфекции нуклеиновых кислот все больше возрастало in vitro. Для получения липосом для in vivo трансфекции гена, кодирующего маркер могут применяться синтетические катионные липиды, направленные на снижение трудностей и рисков, связанных с опосредованной липосомами трансфекцией (Felgner et al., Proc. Natl. Acad. Sci. USA. 84:7413 (1987); Mackey et al., Proc. Natl. Acad. Sci. USA 55:8027 (1988); и Ulmer et al., Science 25P:1745 (1993)). Указанное применение катионных липидов может способствовать инкапсуляции негативно заряженных нуклеиновых кислот, а также слиянию с отрицательно заряженными клеточными мембранами (Felgner et al., Science 337:387 (1989)). В частности, подходящие соединения липидов и композиций для трансфекции нуклеиновых кислот описаны в WO 95/18863, WO 96/17823 и патенте США 5459127. Применение липофекции для введения экзогенных генов в конкретные органы in vivo имеет определенные практические преимущества. Одним из благоприятных аспектов является молекулярное нацеливание липосом на конкретные клетки. Ясно, что направленная трансфекция в определенных типах клеток особенно предпочтительна в тканях, гетерогенных по составу клеток, таких как поджелудочная железа, печень, почка и головной мозг. Липиды могут быть химически соединены с другими молекулами для нацеливания (Mackey et al. 1988, выше). Нацеливаемые пептиды, например, гормоны или нейротрансмиттеры, и белки, такие как антитела, или непептидные молекулы могут быть соединены с липосомами химически.
[00285] Другие молекулы также подходят для содействия трансфекции нуклеиновой кислоты in vivo, такие как катионные олигопептиды (например, WO 95/21931), пептиды, полученные из ДНК-связывающих белков (например, WO 96/25508), или катионный полимер (например, WO 95/21931).
[00286] Также возможно введение вектора in vivo в виде плазмиды с «голой» ДНК (см. патенты США №5693622, 5589466 и 5580859). Можно также применять основанные на рецептор-опосредованном введении ДНК подходы (Curiel et al., Hum. Gene Ther. J:147 (1992); и Wu et al., J. Biol. Chem. 262:4429 (1987)).
[00287] Термин «трансфекция» относится к поглощению экзогенной или гетерологичной РНК или ДНК клеткой. Клетка «трансфицирована» экзогенной или гетерологичной РНК или ДНК, если такая РНК или ДНК была введена в указанную клетку. Клетка «трансформирована» экзогенной или гетерологичной РНК или ДНК, если трансфицированная РНК или ДНК приводит к фенотипическому изменению. Трансформирующая РНК или ДНК может быть интегрирована в хромосомную ДНК (ковалентно связана), входя в геном указанной клетки.
[00288] «Трансформация» относится к переносу фрагмента нуклеиновой кислоты в геном организма-хозяина, приводящему к генетически стабильному наследованию. Организмы-хозяева, содержащие трансформированный фрагмент нуклеиновой кислоты, называются «трансгенными», или «рекомбинантными», или «трансформированными» организмами.
[00289] Кроме того, рекомбинантный вектор, содержащий полинуклеотид согласно настоящему изобретению, может включать одну или более точку начала репликации в клетках-хозяевах, в которых должна происходить их амплификация или экспрессия, маркеры или селектируемые маркеры.
[00290] Под «селектируемым маркером» понимают идентифицирующий фактор, обычно антибиотик или ген устойчивости к химическому воздействию, селектируемый для основании эффекта маркерного гена, т.е. устойчивости к антибиотику, устойчивости к гербицидам; колориметрические маркеры, ферменты, флуоресцентные маркеры и т.п., где указанный эффект используют для отслеживания наследования представляющей интерес нуклеиновой кислоты и/или выявления клетки или организма, наследующих представляющую интерес нуклеиновую кислоту. Примеры генов селектируемых маркеров, известных и применяемых в данной области техники, включают: гены устойчивости к ампициллину, стрептомицину, гентамицину, канамицину, гигромицину, гербициду биалафосу, сульфонамиду, и т.д.; и гены, которые применяют в качестве фенотипических маркеров, т.е. регуляторные гены антоцианов, гена изопентил-трансферазы и т.п.
[00291] Термин «репортерный ген» относится к нуклеиновой кислоте, кодирующей идентифицирующий фактор, который возможно идентифицировать на основании эффекта указанного репортерного гена, причем указанный эффект применяют для отслеживания наследования нуклеиновой кислоты, представляющий интерес, идентификации клетки или организма, наследующих указанную представляющую интерес нуклеиновую кислоту и/или для оценки индукции генной экспрессии или транскрипции. Примеры репортерных генов, известных и применяемых в данной области техники, включают гены: люциферазы (Luc), зеленого флуоресцентного белка (GFP), хлорамфеникол-ацетилтрансферазы (CAT), β-галактозидазы (LacZ), β-глюкуронидазы (Gus) и т.п. Гены селектируемых маркеров также могут считаться репортерными генами.
[00292] Термины «промотор» и «промоторная последовательность» используются взаимозаменяемо и относятся к ДНК-последовательности, способной контролировать экспрессию кодирующей последовательности или функциональная РНК. Как правило, кодирующая последовательность расположена в направлении 3’ от промоторной последовательности. Промоторы могут быть получены полностью из природного гена, или состоять из различных элементов, происходящих из различных промоторов, обнаруживаемых в природе, или даже содержать сегменты синтетической ДНК. Специалистам в данной области техники будет понятно, что различные промоторы могут направлять экспрессию гена в различных тканях или клеточных типах, или на разных стадиях развития, либо в ответ на различные условия среды или физиологические условия. Промоторы, которые приводят к экспрессии гена в большинстве типов клеток в большинстве случаев, как правило, называются «конститутивным промотором». Промоторы, которые приводят к экспрессии гена в конкретном типе клеток, обычно называют «клеточно-специфичными» или «тканеспецифичными промоторами». Промоторы, которые приводят к экспрессии гена на конкретной стадии развития или клеточной дифференцировки, обычно называют «специфичными для развития промоторами» или «специфичные для клеточной дифференцировки промоторами». Промоторы, индуцированные и приводящие к экспрессии гена после экспонирования указанной клетки или ее обработки агентом, биологической молекулой, химическим веществом, лигандом, светом или т.п., индуцирующим указанный промотор, обычно называют «индуцируемыми промоторами» или «регулируемыми промоторами». Также подразумевается, что, поскольку в большинстве случаев точные границы регуляторных последовательностей не были полностью определены, фрагменты ДНК различной длины могут иметь одинаковую промоторную активность.
[00293] Любой вектор из предложенных в соответствии с настоящим изобретением необязательно содержит промотор, описанный в настоящем документе. Согласно одному из вариантов реализации указанный промотор представляет собой промотор из перечисленных в таблице 1 настоящей заявки.
[00294] Любой вектор из предложенных в соответствии с настоящим изобретением необязательно содержит тканеспецифичный промотор. Согласно одному из вариантов реализации указанный тканеспецифичный промотор представляет собой тканеспецифичный промотор, описанный в настоящем документе. Согласно еще одному варианту реализации указанный тканеспецифичный промотор представляет собой тканеспецифичный промотор из перечисленных в таблице 2 настоящей заявки.
[00295] Промоторная последовательность, как правило, связана на 3’ конце сайтом инициации транскрипции и продолжается в 3’-5’ направлении (к 5’-концу) до достижения минимального числа оснований или элементов, необходимого для инициации транскрипции на поддающихся обнаружению уровнях, отличных от фонового. В составе промоторной последовательности присутствует сайт инициации транскрипции (удобно определяемый, например, картированием с помощью нуклеазы S1), а также белок-связывающие домены (консенсусные последовательности), отвечающие за связывание РНК-полимеразы.
[00296] Термин «терапевтический переключающий промотор» («TSP») относится к промотору, который контролирует экспрессию компонента генного переключателя. Генные переключатели и их различные компоненты подробно описаны в других разделах настоящей заявки. В определенных вариантах реализации TSP является конститутивным, т.е. постоянно активен. Конститутивный TSP может быть либо конститутивно-универсальным (т.е., как правило, не нуждающимся для функционирования в дополнительных факторах или регуляторах, в любой ткани или клетке) или конститутивно-тканеспецифичными или клеточноспецифичными (т.е., как правило, не нуждающимся для функционирования в дополнительных факторах или регуляторах, в тканях конкретного типа или клетках конкретного типа). В определенных вариантах реализации TSP, предложенные в соответствии с настоящим изобретением, активируется при условиях, связанных с заболеванием, расстройством или состоянием. В определенных вариантах реализации настоящего изобретения в тех случаях, когда вовлечены два или более TSP, указанные промоторы могут представлять собой комбинацию конститутивных и активируемых промоторов. Используемый в настоящей заявке термин «промотор, активируемый при условиях, связанных с заболеванием, расстройством или состоянием» включает без ограничения специфичные для болезни промоторы, промоторы, реагирующие на конкретные физиологические состояния, свойственные периоду развития состояния, дифференцировку или патологические состояния, промоторы, реагирующие на специфические биологические молекулы, и промоторы, специфичные для конкретной ткани или типа клеток, связанных с заболеванием, расстройством или состоянием, например, с опухолевой тканью или злокачественными клетками. TSP могут содержать последовательность встречающихся в природе промоторов, модифицированные последовательности, происходящие из встречающихся в природе промоторов, или синтетические последовательности (например, встраивание отвечающего элемента в последовательность минимального промотора для изменения чувствительности указанного промотора).
[00297] Кодирующая последовательность находится «под контролем» транскрипционных и трансляционных контрольных последовательностей в клетке, если РНК-полимераза транскрибирует указанную кодирующую последовательность в иРНК, которая затем подвергается транс-сплайсингу (если указанная кодирующая последовательность содержит интроны) и транслируется в белок, кодируемый указанной кодирующей последовательностью.
[00298] Термин «транскрипционные и трансляционные контрольные последовательности» относятся к ДНК-регуляторным последовательностям, таким как промоторы, энхансеры, терминаторы и т.п., которые обеспечивают экспрессию кодирующей последовательности в клетке-хозяине. В эукариотических клетках контрольными последовательностями являются сигналы полиаденилирования.
[00299] Термин «отвечающий элемент» относится к одному или более цис-регуляторному ДНК элементу, который придает промотору чувствительность, опосредованную взаимодействием с ДНК-связывающими доменами транскрипционного фактора. Последовательность такого элемента ДНК может быть либо палиндромом (совершенным или несовершенным) или состоять из последовательностей-мотивов или полусайтов, разделенных варьирующим числом нуклеотидов. Указанные полусайты могут быть сходными или идентичными и располагаться либо в виде прямых или инвертированных повторов, либо в виде одиночного полусайта или мультимеров смежных полусайтов в тандеме. Указанный отвечающий элемент может содержать минимальный промотор, выделенный из различных организмов, в зависимости от природы указанной клетки или организма, в которую(ый) встраивают указанный отвечающий элемент. ДНК-связывающий домен транскрипционного фактора связывается, в присутствии или в отсутствие лиганда, с последовательностью ДНК отвечающего элемента для инициации или подавления транскрипции даунстрим-гена(ов), находящего(их)ся под контролем данного отвечающего элемента. Примеры последовательностей ДНК отвечающих элементов природного рецептора экдизона включают: RRGG/TTCANTGAC/ACYY (SEQ ID NO:25) (см. Cherbas et. al., гены Dev. 5:120 (1991)); AGGTCAN(n)AGGTCA, где N(n) может представлять собой один или более спейсерный нуклеотид (SEQ ID NO:26) (см. D’Avino et al., Mol. Cell. Endocrinol. 113’A (1995)); и GGGTTGAATGAATTT (SEQ ID NO:27) (см. Antoniewski et al., Mol. CellBiol. 14:4465 (1994)).
[00300] Термин «функционально связанный» относится к связи последовательности нуклеиновой кислоты с одиночным фрагментом нуклеиновой кислоты, такой, что функция одного зависит от другого. Например, промотор функционально связан с кодирующей последовательностью, если он способен влиять на экспрессию указанной кодирующей последовательности (т.е. что указанная кодирующая последовательность находится под транскрипционным контролем указанного промотора). Кодирующие последовательности могут быть функционально связаны с регуляторными последовательностями в смысловой или антисмысловой ориентации.
[00301] Используемый в настоящей заявке термин «экспрессия» относится к транскрипции и стабильной аккумуляции смысловой (иРНК) или антисмысловой РНК, полученной из нуклеиновой кислоты или полинуклеотида. Термин «экспрессия» может также относиться к трансляции иРНК в белок или полипептид.
[00302] Термины «кассета», «экспрессионная кассета» и «кассета генной экспрессии» относятся к сегменту ДНК, который может быть встроен в нуклеиновую кислоту или полинуклеотид в специфических сайтах рестрикции или путем гомологичной рекомбинации. Указанный сегмент ДНК содержит полинуклеотид, который кодирует представляющий интерес полипептид, и указанная кассета и сайты рестрикции сконструированы таким образом, чтобы обеспечивать встраивание указанной кассеты в верную рамку считывания для транскрипции и трансляции. Термин «кассета для трансформации» относится к специфическому вектору, содержащему полинуклеотид, который кодирует представляющий интерес полипептид, и включающему, помимо указанного полинуклеотида, элементы, способствующие трансформации конкретной клетки-хозяина. Кассеты, экспрессионные кассеты, кассеты генной экспрессии и кассеты для трансформации согласно данному изобретению могут дополнительно содержать элементы, позволяющие повышать экспрессию полинуклеотида, кодирующего представляющий интерес полипептид в клетке-хозяине. Такие элементы могут включать, не ограничиваясь перечисленными: промотор, минимальный промотор, энхансер, отвечающий элемент, терминаторную последовательность, полиаденилирующую последовательность и т.п.
[00303] Согласно целям данного изобретения термин «генный переключатель» относится к комбинации отвечающего элемента, связанного с промотором, и основанной на лиганд-зависимом транскрипционном факторе системе, в присутствии одного или более лиганда модулирующей экспрессию гена, в который встроены указанный отвечающий элемент и промотор. Термин «полинуклеотид, кодирующий генный переключатель» относится к комбинации отвечающего элемента, связанного с промотором, и полинуклеотида, кодирующего лиганд-зависимую основанную на транскрипционном факторе систему, которая в присутствии одного или более лиганда модулирует экспрессию гена, в который встроены указанные отвечающий элемент и промотор.
[00304] Указанные терапевтические переключающие промоторы согласно настоящему изобретению могут представлять собой промотор, подходящий для лечения, облегчения или предотвращения специфического заболевания, расстройства или состояния. Примеры включают без ограничения промоторы генов, демонстрирующих увеличение экспрессии только в период специфического заболевания, расстройства или состояния, и промоторы генов, демонстрирующих увеличение экспрессии при определенных условиях в клетке (например, пролиферация, апоптоз, изменение рН, степень окисления, уровень кислорода). Согласно некоторым вариантам реализации, если указанный генный переключатель содержит более чем одну последовательность транскрипционного фактора, специфичность терапевтических способов может быть увеличена путем комбинирования специфичного для болезни или состояния промотора с тканеспецифичным или специфичным для определенного типа клеток промотором для ограничения тканей, где экспрессируется указанный терапевтический продукт. Таким образом, тканеспецифичные или специфичные для определенного типа клеток промоторы охвачены определением терапевтического переключающего промотора.
[00305] Представляя собой пример специфичных для болезни промоторов, подходящие промоторы для лечения рака включают промоторы онкогенов. Примеры классов онкогенов включают, не ограничиваясь перечисленными, факторы роста, рецепторы факторов роста, протеинкиназы, регуляторы запрограммированной гибели клеток и транскрипционные факторы. Конкретные примеры онкогенов включают, не ограничиваясь перечисленными, sis, erb В, erb B-2, ras, abl, myc и bcl-2 и TERT. Примеры других связанных с раком генов включают гены опухолесвязанных антигенов и другие гены со сверхэкспрессией в неопластических клетках (например, MAGE-1, карциноэмбрионального антигена, тирозиназы, простатоспецифического антигена, простатоспецифического мембранного антигена, р53, MUC-1, MUC-2, MUC-4, HER-2/neu, T/Tn, MART-1, gplOO, GM2, Tn, sTn и антигена Томсена-Фриденрейха (TF)).
[00306] Примеры промоторных последовательностей и других регуляторных элементов (например, энхансеров), известных в данной области техники и подходящих в качестве терапевтических переключающих промоторов для настоящего изобретения раскрыты в источниках, перечисленных в таблицах 1 и 2, наряду с заболеваниями/расстройствами (таблица 1) или тканеспецифичностью (таблица 2), связанными с каждым промотором. Последовательности промоторов, раскрытые в указанных источниках, включены в настоящую заявку во всей полноте посредством ссылок.
[00307] Полинуклеотид, кодирующий любой белок из перечисленных в таблице 1, может также быть экспрессирован с применением вектора согласно настоящему изобретению с промотором, не являющимся терапевтическим промотором.
[00308] Другие гены, демонстрирующие изменения в уровнях экспрессии в период специфических заболеваний или расстройств и таким образом способные быть источником промоторов, подходящих для применения в соответствии с настоящим изобретением, включают без ограничения гены (вместе с соответствующими заболеваниями/расстройствами), перечисленные в таблице 3.
[00309] После того, как идентифицирован ген с паттерном экспрессии, который модулируется во время заболевания, расстройства или состояния, в генном переключателе, предложенном согласно настоящему изобретению, может быть использован промотор указанного гена. Последовательности многих генов, включая промоторную область, известны в данной области техники и имеются в общедоступных базах данных, например, в GenBank. Таким образом, когда подходящий ген идентифицирован, может быть легко идентифицирована и получена указанная промоторная последовательность. Другой аспект настоящего изобретения направлен на идентификацию подходящих генов, промотор которых может быть выделен и помещен в генный переключатель. Идентичность генов, следовательно, может не иметь решающего значения для конкретных вариантов реализации настоящего изобретения, при условии, что указанный промотор может быть выделен и применен в последующих режимах или условиях среды. Настоящее изобретение, таким образом, включает применение промоторов генов, которые еще будут идентифицированы. После того как подходящие гены идентифицированы, определение генетических последовательностей, необходимых для функционирования промотора, становится вопросом рутинных навыков или экспериментов. Существует даже несколько коммерческих протоколов, помогающих в определении промоторной области представляющих интерес генов. К примеру. Ding et al. недавно выявили промоторную последовательность нового гена Sprouty4 (Am. J. Physiol. Lung Cell. Mol. Physiol. 287: L52 (2004); указанный источник включен в настоящую заявку посредством ссылки) путем постепенного удаления 5’-фланкирующей последовательности гена Sprouty4 человека. Вкратце, после определения сайта инициации транскрипции были получены ПЦР-фрагменты с применением стандартных ПЦР-праймеров для клонирования сегментов указанного 5’-фланкирующего сегмента однонаправленным образом. Полученные сегменты были клонированы в люциферазный репортерный вектор, и люциферазную активность измеряли для определения промоторной области гена Sprouty4 человека.
[00310] Другой пример протокола для получения и валидации генных промоторов включает следующие этапы: (1) взятие образцов пораженных болезнью/не пораженных болезнью клеток/тканей сходного/одинакового типа ткани; (2) выделение общей РНК или иРНК из указанных образцов; (3) проведение дифференциального анализа на микрочипах пораженных болезнью/не пораженных болезнью РНК; (4) идентификация кандидатных специфических для болезни транскриптов; (5) идентификация геномных последовательностей, связанных со специфическими для болезни транскриптами; (6) взятие или синтез последовательности ДНК в обратном (3’-5’) и в прямом (5’-3’) направлении от предсказанного сайта старта транскрипции специфического для болезни транскрипта; (7) конструирование и получение промоторных репортерных векторов с применением ДНК различной длины, полученных на этапе 6; и (8) тестирование промоторных репортерных векторов в пораженных болезнью/не пораженных болезнью клетках/тканях, а также в других клетках/тканях.
[00311] Источник промотора, встраиваемого в генный переключатель, может быть природным или синтетическим; указанный источник промотора не ограничивает объем описанного в настоящей заявке изобретения. Другими словами, указанный промотор может быть непосредственно клонирован из клеток, или указанный промотор может быть заранее клонирован из другого источника, или указанный промотор может быть синтезирован.
Системы переключения генов
[00312] Генный переключатель может представлять собой любой генный переключатель, регулирующий генную экспрессию добавлением или удалением специфического лиганда. Согласно одному из вариантов реализации указанный генный переключатель представляет собой такой, что уровень генной экспрессии зависит от имеющегося уровня лиганда. Примеры комплексов лиганд-зависимых транскрипционных факторов, подходящих для генных переключателей согласно настоящему изобретению, включают без ограничения представителей надсемейства ядерных рецепторов, активируемых соответствующими им лигандами {например, глюкокортикоид, эстроген, прогестин, ретиноид, экдизон, и их аналоги и миметики), и гТТА, активируемые тетрациклином. В одном из аспектов настоящего изобретения указанный генный переключатель представляет собой основанный на EcR генный переключатель. Примеры таких систем включают без ограничения системы, описанные в патентах США №6258603, 7045315, опубликованных заявках на патент США №№2006/0014711, 2007/0161086, и опубликованной заявке на международный патент №WO 01/70816. Примеры систем на основе гибридного рецептора экдизона описаны в заявке на патент США №7091038, опубликованных заявках на патент США №№2002/0110861, 2004/0033600, 2004/0096942, 2005/0266457 и 2006/0100416, и опубликованных заявках на международный патент №№ WO 01/70816, WO 02/066612, WO 02/066613, WO 02/066614, WO 02/066615, WO 02/29075 и WO 2005/108617, каждая из которых включен в настоящую заявку во всей полноте посредством ссылки. Примером нестероидной агонист-регулируемой системы на основе экдизона является экспрессионная система RheoSwitch® Mammalian Inducible Expression System (New England Biolabs, Ипсвич, Массачусетс). В другом аспекте настоящего изобретения генный переключатель основан на гетеродимеризации FK506-связывающего белка (FKBP) с белком, ассоциированным с FKBP-рапамицином (FRAP), и регулируется через рапамицин или его не-иммуносупрессивные аналоги. Примеры таких систем включают без ограничения ARGENT™ Transcriptional Technology (ARIAD Pharmaceuticals, Кембридж, Массачусетс) и системы описанные в патентах США №6015709, 6117680,6479653, 6187757 и 6649595.
[00313] Согласно одному из вариантов реализации указанный генный переключатель содержит одну последовательность транскрипционного фактора, кодирующую комплекс лиганд-зависимого транскрипционного фактора под контролем терапевтического переключающего промотора. Указанная последовательность транскрипционного фактора может кодировать комплекс лиганд-зависимого транскрипционного фактора, представляющий собой встречающийся в природе или искусственный комплекс лиганд-зависимого транскрипционного фактора. Искусственный транскрипционный фактор представляет собой такой фактор, где природная последовательность транскрипционного фактора была изменена, например, мутацией указанной последовательности или комбинированием доменов из различных транскрипционных факторов. Согласно одному из вариантов реализации указанный транскрипционный фактор содержит лиганд-связывающий домен ядерного рецептора группы Н. Согласно одному из вариантов реализации указанный лиганд-связывающий домен ядерного рецептора группы Н происходит из рецептора экдизона, универсального рецептора (UR), орфанного рецептора 1 (OR-1), ядерный рецептор стероидных гормонов 1 (NER-1), взаимодействующего с рецептором ретиноида Х белка-15 (RIP-15), X рецептора печени β (LXRβ), подобного рецептору стероидных гормонов белка (RLD-1), Х рецептора печени (LXR), Х рецептора печени α (LXRα), фарнезоид-х-рецептора (FXR), рецептор-взаимодействующего белка 14 (RIP-14), или рецептора фарнезола (HRR-1). Согласно еще одному варианту реализации указанный LBD ядерного рецептора группы Н происходит из рецептора экдизона.
А. Основанный на экдизоне генный переключатель
[00314] EcR и другие ядерные рецепторы группы Н являются представителями надсемейства ядерных рецепторов, всем представителям которого, как правило, свойственно присутствие аминоконцевого трансактивирующего домена (AD, также равнозначно называемого «ТА» или «TD»), необязательно слитого с партнером по гетеродимеризации (HP) с образованием коактивирующего белка (CAP); ДНК-связывающего домена (DBD) и LBD, слитого с указанным DBD через шарнирную область с образованием лиганд-зависимого транскрипционного фактора (LTF). Используемый в настоящей заявке термин «ДНК-связывающий домен» охватывает минимальную полипептидную последовательность ДНК-связывающего белка и далее до полной длины ДНК-связывающего белка, при условии, что указанный ДНК-связывающий домен функционирует, связываясь с определенным отвечающим элементом. Представителям надсемейства ядерных рецепторов также свойственно присутствие четырех или пяти доменов: А/В, С, D, Е, и некоторым представителям - F (см. US 4981784 и Evans, Science 240:889 (1988)). Термин «А/В» домен соответствует домену трансактивации, «С» соответствует ДНК-связывающему домену, «D» соответствует шарнирной области, и «Е» соответствует лиганд-связывающему домену. Некоторые представители указанного семейства могут дополнительно содержать еще один трансактивирующий домен со стороны карбоксильного конца LBD, соответствующий «F».
[00315] По имеющимся данным, следующая полипептидная последовательность представляет собой полипептидную последовательность рецептора экдизона (рецептора экдистероида) (рецептора 20-гидрокси-экдизона) (рецептора 20Е) (EcRH) (член 1 группы Н подсемейства 1 ядерных рецепторов) и имеет номер доступа Р34021 в Genbank.
[00316] Рецептор экдизона (878аа) Drosophila melanogaster (плодовой мушки) (SEQ ID NO:5)


[00317] DBD свойственно присутствие двух цистеиновых цинковых пальцев, между которыми располагаются два аминокислотных мотива, Р-бокс и D-бокс, которые придают специфичность отвечающим элементам. Такие домены могут быть либо нативными, либо модифицированными, либо гибридами различных доменов гетерологичных рецепторных белков. EcR, как субпопуляция семейства ядерных рецепторов, также обладает менее точно определенными областями, отвечающими за характеристики гетеродимеризации. Так как домены ядерных рецепторов по своей природе являются модульными, LBD, DBD и AD могут взаимозаменяться.
[00318] Согласно еще одному варианту реализации указанный транскрипционный фактор содержит AD, DBD, который узнает отвечающий элемент, связанный с терапевтическим белком или терапевтическим полинуклеотидом, экспрессию которого требуется модулировать; и LBD ядерного рецептора группы Н. Согласно определенным вариантам реализации указанный LBD ядерного рецептора группы Н содержит мутацию замещения.
[00319] Согласно еще одному варианту реализации указанный генный переключатель содержит первую последовательность транскрипционного фактора, например, CAP, под контролем первого терапевтического переключающего промотора (TSP-1) и вторую последовательность транскрипционного фактора, например, LTF, под контролем второго терапевтического переключающего промотора (TSP-2), причем белки, кодируемые указанной первой последовательностью транскрипционного фактора и указанной второй последовательностью транскрипционного фактора, взаимодействуют с образованием белкового комплекса (LDTFC), т.е. основанный на «двойном переключении», или «двугибридный», генный переключатель. Указанные первая и вторая TSP могут быть одинаковыми или разными. Согласно данному варианту реализации присутствие в генном переключателе двух различных TSP, необходимых для экспрессии терапевтической молекулы, увеличивает специфичность данного терапевтического способа (см. Фиг.2). На Фиг.2 также продемонстрирована возможность модификации указанного терапевтического генного переключателя для лечения любого заболевания, расстройства или состояния, просто встраиванием подходящих TSP.
[00320] Согласно еще одному варианту реализации, и первая, и вторая последовательность транскрипционного фактора, например, CAP или LTF, находятся под контролем одного терапевтического переключающего промотора (например TSP-1 на рис.1). Активация данного промотор приведет к получению и CAP, и LTF с одной открытой рамкой считывания. Это может быть достигнуто применением транскрипционного линкера, такого как IRES-сайт (участок внутренней посадки рибосом). Согласно данному варианту реализации обе части указанного комплекса лиганд-зависимого транскрипционного фактора синтезируются при активации TSP-1. TSP-1 может быть конститутивным промотором или активироваться только при условиях, связанных с указанным заболеванием, расстройством или состоянием.
[00321] Согласно еще одному варианту реализации одна последовательность транскрипционного фактора, например, LTF, находится под контролем терапевтического переключающего промотора, активирующегося только при условиях, связанный с указанным заболеванием, расстройством или состоянием (например, TSP-2 или TSP-3 на рис.4), а другая последовательность транскрипционного фактора, например, CAP, находится под контролем конститутивного терапевтического переключающего промотора (например, TSP-1 на рис.4). Согласно данному варианту реализации одна часть указанного комплекса лиганд-зависимого транскрипционного фактора присутствует конститутивно, в то время как вторая часть синтезируется только при условиях, ассоциированных с указанным заболеванием, расстройством или состоянием.
[00322] Согласно еще одному варианту реализации одна последовательность транскрипционного фактора, например, CAP, находится под контролем первой TSP (например, TSP-1 на рис.3), а два или более других вторых последовательностей транскрипционного фактора, например, LTF-1 и LTF-2, находятся под контролем различных TSP (например, TSP-2 и TSP-3 на рис.3). Согласно данному варианту реализации каждый из указанных LTF может содержать отличный DBD, который узнает отличные фактор-регулируемые промоторные последовательности {например, DBD-A связывается с отвечающим элементом, связанным с фактор-регулируемым промотором-1 (FRP-1), a DBD-B связывается с отвечающим элементом, связанным с фактор-регулируемым промотором-2 (FRP-2). Каждый из указанных фактор-регулируемых промоторов может быть функционально связан с отличным терапевтическим геном. Таким образом, комплексное лечение может проводиться одновременно.
[00323] Согласно одному из вариантов реализации указанная первая последовательность транскрипционного фактора кодирует полипептид, содержащий AD, DBD, который узнает отвечающий элемент, связанный с последовательностью терапевтического продукта, экспрессию которого требуется модулировать; и LBD ядерного рецептора группы Н, а вторая последовательность транскрипционного фактора кодирует транскрипционный фактор, содержащий ядерный рецептор LBD, выбранный из ретиноид-Х рецептора (RXR) позвоночных, RXR беспозвоночных, белка ultraspiracle (USP) или гибридного ядерного рецептора, содержащего по меньшей мере два различных полипептидных фрагмента лиганд-связывающего домена ядерных рецепторов, выбранных из RXR позвоночных, RXR беспозвоночных и USP (см. WO 01/70816 А2 и US 2004/0096942 А1). «Партнерский» лиганд-связывающий домен ядерного рецептора может также содержать мутацию усечения, делеционную мутацию, мутацию замещения или другую модификацию.
[00324] Согласно еще одному варианту реализации указанный генный переключатель содержит первую последовательность транскрипционного фактора, кодирующую первый полипептид, содержащий LBD ядерного рецептора и DBD, который узнает отвечающий элемент, связанный с последовательностью терапевтического продукта, экспрессию которого требуется модулировать, и вторую последовательность транскрипционного фактора, кодирующую второй полипептид, содержащий AD и LBD ядерного рецептора, причем один из указанных LBD ядерного рецептора представляет собой LBD ядерного рецептора группы Н. Согласно одному из вариантов реализации указанный первый полипептид практически не содержит AD, а указанный второй полипептид практически не содержит DBD. Согласно целям настоящего изобретения выражение «практически не содержит» означает, что рассматриваемый белок не содержит последовательности рассматриваемого домена в достаточной мере для того, чтобы обеспечить активацию или связывающую активность.
[00325] В другом аспекте настоящего изобретения первая последовательность транскрипционного фактора кодирует белок, содержащий партнера по гетеродимеризации и AD («CAP»), а вторая последовательность транскрипционного фактора кодирует белок, содержащий DBD и LBD («LTF»),
[00326] В том случае, если только один LBD ядерного рецептора представляет собой LBD группы Н, другой LBD ядерного рецептора может происходить из любого другого ядерного рецептора, формирующего димер с LBD группы Н. Например, если LBD ядерного рецептора группы Н представляет собой LBD EcR, другой, «партнерский» LBD ядерного рецептора может происходить из EcR, RXR позвоночных, RXR беспозвоночных, белка ultraspiracle (USP) или гибридного ядерного рецептора, содержащего по меньшей мере два различных полипептидных фрагмента LBD ядерных рецепторов, выбранных из RXR позвоночных, RXR беспозвоночных или USP (см. WO 01/70816 А2, заявка на международный патент №РСТ/US02/05235, и US 2004/0096942 А1, включенные в настоящую заявку посредством ссылок во всей полноте). «Партнерский» лиганд-связывающий домен ядерного рецептора может дополнительно содержать мутацию усечения, делеционную мутацию, мутацию замещения или другую модификацию.
[00327] Согласно одному из вариантов реализации LBD RXR позвоночных происходит из RXR человека Homo sapiens, мыши Mus musculus, крысы Rattus norvegicus, курицы Gallus gallus, свиньи Sus scrofa domestica, лягушки Xenopus laevis, данио-рерио Danio rerio, оболочника Polyandrocarpa misakiensis или медузы Tripedalia cysophora.
[00328] Согласно одному из вариантов реализации лиганд-связывающий домен RXR беспозвоночных происходит из полипептида ultraspiracle саранчи Locusta migratoria («LmUSP»), гомолога 1 RXR иксодового клеща Amblyomma americanum («AmaRXR1»), гомолога 2 RXR иксодового клеща Amblyomma americanum («AmaRXR2»), гомолога RXR манящего краба Celuca pugilator («CpRXR»), гомолога RXR жука Tenebrio molitor («TmRXR»), гомолога RXR медоносной пчелы Apis mellifera («AmRXR»), гомолога RXR тли Myzus persicae («MpRXR») или гомолога RXR не двукрылых/не чешуекрылых.
[00329] Согласно одному из вариантов реализации гибридный LBD RXR содержит по меньшей мере два полипептидных фрагмента, выбранных из полипептидного фрагмента RXR позвоночных видов, полипептидного фрагмента RXR беспозвоночных видов, или полипептидного фрагмента гомолога RXR не двукрылых/не чешуекрылых беспозвоночных видов. Лиганд-связывающий домен гибридного RXR для применения в соответствии с настоящим изобретением может содержать полипептидные фрагменты RXR по меньшей мере двух различных видов, или, если вид один и тот же, указанные два или более полипептидных фрагмента могут происходить из двух или более различных изоформ полипептидного фрагмента RXR указанного вида. Такие гибридные LBD RXR описаны, например, в WO 2002/066614.
[00330] Согласно одному из вариантов реализации указанный гибридный лиганд-связывающий домен RXR содержит по меньшей мере один полипептидный фрагмент RXR позвоночных видов и один полипептидный фрагмент RXR беспозвоночных видов.
[00331] Согласно еще одному варианту реализации указанный лиганд-связывающий домен гибридного RXR содержит по меньшей мере один полипептидный фрагмент RXR позвоночных видов и один полипептидный фрагмент гомолога RXR не двукрылых/не чешуекрылых беспозвоночных видов.
[00332] Указанный лиганд при сочетании с LBD ядерного(ых) рецептора(ов), которые, в свою очередь, связаны с отвечающим элементом FRP, связанным с последовательностью терапевтического продукта, обеспечивает внешний временной контроль экспрессии последовательности терапевтического продукта. Механизм связывания или порядок, в котором различные компоненты согласно настоящему изобретению связываются друг с другом, т.е. например, лиганд с LBD, DBD с отвечающим элементом, AD с промотором и т.д., не принципиальны.
[00333] В частном примере связывание указанного лиганда с LBD ядерного рецептора группы Н и его партнерским LBD ядерного рецептора позволяет экспрессию последовательности терапевтического продукта. Этот механизм не исключает возможности связывания лиганда с ядерным рецептором группы Н (GHNR) или его партнером, и образования в результате активных гомодимерных комплексов (например GHNR+GHNR или партнер+партнер). Предпочтительно, один или более указанных рецепторных доменов варьирует, производя гибридный генный переключатель. Как правило, один или более из трех указанных доменов, DBD, LBD и AD, могут быть выбраны из источника отличного от источника других доменов, так что гибридные гены и получаемые гибридные белки оптимизированы в выбранной клетке-хозяине или организме для трансактивационной активности, комплементарного связывания указанного лиганда и распознавания специфического отвечающего элемента. Кроме того, сам указанный отвечающий элемент может быть модифицирован или замещен отвечающими элементами других ДНК-связывающих белковых доменов, таких как GAL-4 белок дрожжей (см. Sadowski et al., Nature 335:563 (1988)) или LexA белок Escherichia coli (см. Brent et al., Cell 43:729 (1985)), или синтетическими отвечающими элементами, для специфического направленного взаимодействия с белками, сконструированными, модифицированными и отобранными для таких специфических взаимодействий (см., например. Kirn et al., Proc. Natl. Acad. Sci. USA, 94:3616 (1997)), для соответствия гибридным рецепторам. Другим преимуществом двугибридных систем является то, что они позволяют выбирать промотор, применяемый для запуска генной экспрессии согласно требуемому конечному результату. Такой двойной контроль может быть, в частности, важен в областях применения генной терапии, особенно при получении цитотоксических белков, так как позволяет контролировать и сроки экспрессии, и клетки, в которых происходит экспрессия. Когда гены, функционально связанные с подходящим промотором, введены в клетки пациента, экспрессия экзогенных генов контролируется присутствием системы, предложенной в соответствии с настоящим изобретением. Промоторы могут быть конститутивно или индуцируемо регулируемыми, или могут быть тканеспецифичными (т.е. экспрессироваться только в определенном типе клеток) или специфичными для определенных стадий развития организма.
[00334] ДНК-связывающий домен первого гибридного белка связывается, в присутствии или в отсутствие лиганда, с последовательностью ДНК отвечающего элемента для инициации или подавления транскрипции даунстрим-гена(ов), находящего(их)ся под контролем этого отвечающего элемента.
[00335] Функциональные LDTFC, например, комплекс EcR, могут включать также дополнительный(е) белок(белки), такие как иммунофилины. Дополнительные представители белков семейства ядерных рецепторов, известных как транскрипционные факторы (такие как DHR38 или betaFTZ-1), могут также быть лиганд-зависимыми или независимыми партнерами EcR, USP и/или RXR. Дополнительно могут требоваться другие кофакторы, такие как белки, общеизвестные как коактиваторы (также известные, как адаптеры или медиаторы). Такие белки не связываются сиквенс-специфичным образом с ДНК и не участвуют в основной транскрипции. Они могут осуществлять свое действие на активацию транскрипции посредством различных механизмов, включая стимуляцию ДНК-связывания активаторов, воздействуя на структуру хроматина или опосредуя взаимодействия активатор-комплекс инициации. Примеры таких коактиваторов включают RIP140, TIF1, RAP46/Bag-1, ARA70, SRC-1/NCoA-1, TIF2/GRIP/NCoA-2, ACTR/AIB1/RAC3/pCIP а также связывающий белок отвечающего элемента В промискуитентного коактиватора С, СВР/р300 (для справки см. Glass et al., Curr. Opin. Cell Biol. 9:222 (1997)). Также для эффективного ингибирования транскрипционной активации в отсутствие лиганда могут требоваться белковые кофакторы, общеизвестные как корепрессоры (также известные как репрессоры, сайленсеры или медиаторы сайленсинга). Такие корепрессоры могут взаимодействовать с несвязанным с лигандом EcR, что приводит к сайленсингу активности в отвечающем элементе. Имеющиеся данные указывают на то, что связывание лиганда изменяет конформацию рецептора, что приводит к высвобождению корепрессора и рекрутингу описанных выше коактиваторов, тем самым отменяя их активность в качестве сайленсеров. Примеры корепрессоров включают N-CoR и SMRT (для справки, см. Horwitz et al., Mol Endocrinol. 70:1167 (1996)). Такие кофакторы могут либо быть эндогенными для клетки или организма, либо могут быть добавлены экзогенно в качестве трансгенов для экспрессии регулируемым либо нерегулируемьм образом.
В. Генный переключатель на основе рапамицина
[00336] В соответствии с настоящим изобретением также предложена система переключения генов, в которой используют РК50б-связывающий белок в качестве комплекса лиганд-зависимого транскрипционного фактора и рапамицин в качестве лиганда. Согласно одному из вариантов реализации конструкция, кодирующая указанный генный переключатель, содержит
(a) первый полинуклеотид, кодирующий первый гибридный белок, который связывается с рапамицином или его аналогом, и который содержит по меньшей мере один домен РК50б-связывающего белка (FKBP) и по меньшей мере один белковый домен, гетерологичный ему, причем указанный FKBP домен содержит пептидную последовательность, выбранную из:
(1) встречающегося в природе FKBP
(2) варианта встречающегося в природе FKBP, в котором до 10 аминокислотных остатков было удалено, встроено или замещено замещающими аминокислотами, и
(3) FKBP, кодируемый последовательностью ДНК, которая селективно гибридизуется с последовательностью ДНК, кодирующей FKBP по (1) или (2);
(b) второй полинуклеотид, кодирующий второй гибридный белок, который образует комплекс как с (а) рапамицином или аналогом рапамицина так и (b) указанным первым гибридным белком, и который содержит по меньшей мере один РКВР:рапамицин связывающий (FRB) домен и по меньшей мере один белковый домен, гетерологичный ему, причем указанный FRB-домен содержит пептидную последовательность, выбранную из:
(4) встречающегося в природе FRB-домена,
(5) вариант встречающегося в природе FRB-домена, в котором до 10 аминокислотных остатков было удалено, встроено или замещено замещающими аминокислотами, и
(6) FRB-домен, кодируемый последовательностью ДНК, которая селективно гибридизуется с последовательностью ДНК, кодирующей FRB по (4) или (5).
[00337] В этой системе генного переключения каждый из указанных первых полинуклеотидов и указанных вторых полинуклеотидов находится под контролем одного или более терапевтического переключающего промотора согласно описанию, приведенному в настоящей заявке. Кроме того, в определенных вариантах реализации по меньшей мере один белковый домен, гетерологичный FKBP и/или FRB-доменам в указанном первом и втором гибридном белках, может представлять собой один или более «рабочий», или «эффекторный» домен. Эффекторные домены могут быть выбраны из широкого спектра белковых доменов, включая ДНК-связывающие домены, домены активации транскрипции, домены клеточной локализации и сигнальные домены (т.е. домены, которые способны, при группировке или мультимеризации, к запуску клеточного роста, пролиферации, дифференцировки, апоптоза, генной транскрипции и т.д.).
[00338] Согласно определенным вариантам реализации один гибридный белок содержит по меньшей мере один ДНК-связывающий домен (например, GAL4 или ZFHD1 ДНК-связывающий домен), а другой гибридный белок содержит по меньшей мере один домен активации транскрипции (например, VP16 или рб5, домен активации транскрипции). Лиганд-опосредованное связывание указанного гибридного белка представляет образование комплекса транскрипционного фактора и ведет к инициации транскрипции целевого гена, связанного с последовательностью ДНК, распознаваемой (т.е. способной к связыванию с) ДНК-связывающим доменом на одном из указанных гибридных белков. Информация, касающаяся указанной генной экспрессионной системы, а также указанного лиганда, раскрыта в патентах США №6187757 В1, 6649595 В1, 6509152 В1, 6479653 В1 и 6117680 B1.
[00339] Согласно другим вариантам реализации настоящего изобретения предложена система генного переключения, которая содержит полинуклеотиды, кодирующие два гибридных белка, самоаггрегирующих в отсутствие лиганда, при этом: (а) указанный первый гибридный белок содержит условно агрегирующий домен, который связывается с выбранным лигандом и доменом активации транскрипции, и (b) указанный второй гибридный белок, содержащий условно агрегирующий домен, который связывается с выбранным лигандом и ДНК-связывающим доменом, и (с) в отсутствие лиганда, указанные клетки экспрессируют ген, функционально связанный с регуляторной ДНК, с которой связывается указанный ДНК-связывающий домен. Модифицированные клетки, содержащие указанную систему генного переключения, дорастают в присутствии указанного лиганда до количества, достаточного для репрессии указанного гена. Удаление лиганда индуцирует экспрессию кодируемого белка, что вызывает гибель клеток. Нуклеиновые кислоты, кодирующие указанные два гибридных белка, находятся под контролем по меньшей мере одного условного промотора. Указанная генная экспрессионная система, где использованы условно агрегирующие домены, раскрыта в публикации США №2002/0048792.
С. Система генного переключения на основе прокариотического репрессора/оператора
[00340] Согласно одному из вариантов реализации настоящего изобретения предложена система генного переключения, содержащая (а) первый полинуклеотид, кодирующий трансактиваторный гибридный белок, содержащий прокариотический тетрациклиновый («tet») репрессор и белковый домен эукариотического активатора транскрипции; и (b) второй полинуклеотид, кодирующий терапевтический белок или терапевтический полипептид, причем указанный второй полинуклеотид функционально связан с минимальным промотором и по меньшей мере одной последовательностью tet-оператора. Указанный первый полинуклеотид, кодирующий трансактиваторный гибридный белок, может содержать терапевтический переключающий промотор согласно приведенным в настоящей заявке описаниям. Экспрессия летального белка повышающе регулируется в отсутствие тетрациклина, (см., например, Gossen et al. (1992) Proc. Natl. Acad. Sci. 89: 5547-5551; Gossen et al. (1993) TIBS 18: 471-475; Furth et al. (1994) Proc. Natl. Acad. Sci. 91: 9302-9306; и Shockett et al. (1995) Proc. Natl. Acad. Sci. 92: 6522-6526). Экспрессионная система TetO раскрыта в заявке на патент США №5464758 В1.
[00341] Согласно еще одному варианту реализации указанная система генного переключения содержит лактозные («Lac») системы репрессор-оператор из бактерии Escherichia coll. Система генного переключения, предложенная в настоящем изобретении, может дополнительно содержать (а) первый полинуклеотид, кодирующий трансактиваторный гибридный белок, содержащий прокариотический lac I репрессор и домен белка эукариотического активатора транскрипции; и (b) второй полинуклеотид, кодирующий терапевтический белок или терапевтический полипептид, причем указанный второй полинуклеотид функционально связан с терапевтическим переключающим промотором. В Lac-системе lac-оперон инактивируется в отсутствие лактозы или синтетических аналогов, таких как изопропил-Ь-В-тиогалактозид.
[00342] Дополнительные системы генного переключения включают описанные в следующих источниках: US 7091038; WO 2004078924; ЕР 1266015; US 20010044151; US 20020110861; US 20020119521; US 20040033600; US 20040197861; US 20040235097; US 20060020146; US 20040049437; US 20040096942; US 20050228016; US 20050266457; US 20060100416; WO 2001/70816; WO 2002/29075; WO 2002/066612; WO 2002/066613; WO 2002/066614; WO 2002/066615; WO 2005/108617; US 6258603; US 20050209283; US 20050228016; US 20060020146; EP 0965644; US 7304162; US 7304161; MX 234742; KR 10-0563143; AU 765306; AU 2002-248500; и AU 2002-306550.
D. Комбинации систем генного переключения
[00343] В соответствии с настоящим изобретением предложены композиции нуклеиновых кислот, модифицированные клетки и биореакторы, содержащие две или более системы генного переключения, содержащие различные комплексы лиганд-зависимых транскрипционных факторов, которые активируются эффективными количествами одного или более лиганда, причем указанные две или более системы генного переключения содержат первый генный переключатель и второй генный переключатель, оба из которых селективно индуцируют экспрессию одного или более терапевтического полипептида или терапевтического полинуклеотида, при связывании с одним или более лигандом. В объем настоящего изобретения входят любые количества и/или комбинации систем генного переключения.
[00344] Согласно одному из вариантов реализации настоящего изобретения предложена композиция нуклеиновых кислот, включающая:
а. первую систему генного переключения, которая содержит:
i первую кассету генной экспрессии, содержащую полинуклеотид, кодирующий первый гибридный полипептид, который содержит:
1. домен трансактивации, который активирует фактор-регулируемый промотор функционально связанный с полинуклеотидом, кодирующим терапевтический полипептид или терапевтический полинуклеотид; и
2. партнерский домен гетеродимера,
ii. вторую кассету генной экспрессии, содержащую полинуклеотид, кодирующий второй гибридный полипептид, который содержит:
1. ДНК-связывающий домен, который узнает фактор-регулируемый промотор, функционально связанный с полинуклеотидом, кодирующим терапевтический полипептид или терапевтический полинуклеотид; и
2. лиганд связывающий домен; и
iii. третью кассету генной экспрессии, содержащую полинуклеотид, кодирующий терапевтический полипептид или терапевтический полинуклеотид, включающий:
1. фактор-регулируемый промотор, который активируется трансактивирующим доменом второго гибридного полипептида; и
2. полинуклеотид, кодирующий терапевтический полипептид или терапевтический полинуклеотид, и
b. вторую генную экспрессионную систему, которая содержит:
L первую кассету генной экспрессии, содержащую полинуклеотид, кодирующий первый гибридный полипептид, который содержит:
1. домен трансактивации, который активирует фактор-регулируемый промотор, функционально связанный с полинуклеотидом, кодирующим терапевтический полипептид или терапевтический полинуклеотид; и
2. партнерский домен гетеродимера,
iii. вторую кассету генной экспрессии, содержащую полинуклеотид, кодирующий второй гибридный полипептид, который содержит:
1. ДНК-связывающий домен, который узнает фактор-регулируемый промотор, функционально связанный с полинуклеотидом, кодирующим терапевтический полипептид или терапевтический полинуклеотид; и
2. лиганд связывающий домен; и
iii. третью кассету генной экспрессии, содержащую полинуклеотид, кодирующий терапевтический полипептид или терапевтический полинуклеотид, включающий:
1. фактор-регулируемый промотор, который активируется трансактивирующим доменом второго гибридного полипептида; и
2. полинуклеотид, кодирующий терапевтический полипептид или терапевтический полинуклеотид.
[00345] Множественно-индуцируемые генные экспрессионные системы обеспечивают экспрессию конкретного терапевтического полинуклеотида или терапевтического полипептида при условиях, связанных с различными заболеваниями, расстройствами или состояниями, или экспрессию множества терапевтических полипептидов или терапевтических полинуклеотидов либо в тех же условиях, связанных с тем же заболеванием, расстройством или состоянием, либо в других условиях, связанных с другими заболеваниями, расстройствами или состояниями.
[00346] Согласно определенным вариантам реализации указанная комбинация двух или более систем генного переключения может представлять собой (1) систему экспрессии генов с двойным переключением на основе рецептора экдизона и (2) генный переключатель с одиночным переключением на основе рецептора экдизона. Согласно другим вариантам реализации указанная комбинация может представлять собой (1) генный переключатель с одиночным или с двойным переключением на основе рецептора экдизона и (2) генный переключатель на основе рапамицина. Как вариант, указанная комбинация систем генного переключения может представлять собой две идентичных системы генного переключения на основе рапамицина, описанных выше. Любые возможные комбинации систем генного переключения входят в объем настоящего изобретения. Примеры экдизонных систем двойного переключения могут быть найдены, например, в WO 2002/29075 и US 2002/0110861.
Лиганды
[00347] Используемый в настоящей заявке термин «лиганд» относительно основанных на LDTFC генных переключателей, например, генных переключателей на основе EcD комплекса, описывает малые растворимые молекулы, способные активировать переключение гена для стимуляции экспрессии кодируемого им полипептида. Указанный лиганд комплекса лиганд-зависимого транскрипционного фактора согласно настоящему изобретению связывается с указанным белковым комплексом, содержащим один или более лиганд-связывающий домен, партнерский домен гетеродимера, ДНК-связывающий домен и домен трансактивации. Выбор лиганда для активации комплекса лиганд-зависимого транскрипционного фактора зависит от применяемого типа генного переключателя.
[00348] Примеры лигандов включают без ограничения экдистероид, такой как экдизон, 20-гидроксиэкдизон, понастерон А, муристерон А и т.п., 9-цис-ретиноевую кислоту, синтетические аналоги ретиноевой кислоты, N,N’-диацилгидразины, такие как описанные в патентах США №6013836; 5117057; 5530028; и 5378726 и в опубликованных заявках на патент США №2005/0209283 и 2006/0020146; оксадиазолины согласно описанию в опубликованной заявке на патент США №2004/0171651; дибензоилалкилцианогидразины, такие как описанные в заявке на европейский патент №461809; N-алкил-N,N’-диароилгидразины, такие как описанные в заявке на патент США №5225443; N-ацил-N-алкилкарбонилгидразины, такие как описанные в заявке на европейский патент №234994; N-ароил-N-алкил-N’-ароилгидразины, такие как описанные в заявке на патент США №4985461; амидокетоны, такие как описанные в опубликованной заявке на патент США №2004/0049037; каждый из которых включен в настоящую заявку посредством ссылки; и другие сходные материалы, включая 3,5-ди-трет-бутил-4-гидрокси-N-изобутил-бензамид, 8-O-ацетилгарпагид, оксистерины, 22(R) гидроксихолестерин, 24(S) гидроксихолестерин, 25-эпоксихолестерин, Т0901317, 5-альфа-6-альфа-эпоксихолестерин-3-сульфат (ECHS), 7-кетохолестерин-3-сульфат, фамезол, желчные кислоты, 1,1-бисфосфоновые сложные эфиры, ювенильный гормон III и т.п. Примеры диацилгидразиновых лигандов, подходящих для применения в соответствии с настоящим изобретением, включают RG-115819 (3,5-диметил-бензойная кислота N-(1-этил-2,2-диметил-пропил)-N’-(2-метил-3-метокси-бензоил)-гидразид), RG-115932 ((R)-3,5-диметил-бензойная кислота N-(1-трет-бутил-бутил)-N’-(2-этил-3-метокси-бензоил)-гидразид), и RG-115830 (3,5-Диметил-бензойная кислота N-(1-трет-бутил-бутил)-N’-(2-этил-3-метокси-бензоил)-гидразид). См., например, заявку на патент США, порядковый №12/155111, и заявку РСТ №PC 17 US 2008/006757, обе из которых включены в настоящую заявку во всей полноте посредством ссылок.
[00349] Например, лиганд для генного переключателя на основе рецептора экдизона может быть выбран из любых подходящих лигандов. Как встречающиеся в природе экдизон или аналоги экдизона (например, 20-гидроксиэкдизон, муристерон А, понастерон А, понастерон В, понастерон С, 26-йодопонастерон А, инокостерон или 26-мезилинокостерон), так и не-стероидные индукторы могут применяться в качестве лиганда для генного переключателя согласно настоящему изобретению. В патенте США №6379945 В1 описан стероидный рецептор насекомых, выделенный из Heliothis virescens («HecR»), который способен действовать в качестве генного переключателя, чувствительного как к стероидным, так и к определенным нестероидным индукторам. Нестероидные индукторы имеют явное преимущество перед стероидными в этой и многих других системах, которые отвечают как на стероиды, так и на нестероидные индукторы, по ряду причин, включая, например: более низкую себестоимость, метаболическую стабильность, отсутствие у насекомых, растений или млекопитающих, и экологическую приемлемость. В патенте США №6379945 В1 описано применение двух дибензоилгидразинов, 1,2-дибензоил-1-трет-бутил-гидразина и тебуфенозида (N-(4-этилбензоил)-N’-(3,5-диметилбензоил)-N’-трет-бутил-гидразина) в качестве лигандов для основанного на экдизоне генного переключателя. Также в настоящее изобретение включены в качестве лигандов другие дибензоилгидразины, такие как описанные в патенте США №5117057 В1. Применение тебуфенозида в качестве химического лиганда рецептора экдизона Drosophila melanogaster также раскрывается в заявке на патент США №6147282. Дополнительные неограничивающие примеры экдизонных лигандов представлены 3,5-ди-трет-бутил-4-гидрокси-N-изобутил-бензамидом, 8-O-ацетилгарпагидом, 1,2-диацилгидразином, N’-замещенным-N,N’-двузамещенным гидразином, дибензоилалкилцианогидразином, N-замещенным-N-алкил-N,N-диароилгидразином, N-замещенным-N-ацил-N-алкилом, карбонилгидразином или N-ароил-N’-алкил-N’-ароилгидразином. (См. патент США №6723531).
[00350] Согласно одному из вариантов реализации лиганд для основанной на экдизоне генной системе переключения представляет собой диацилгидразиновый лиганд или хиральный диацилгидразиновый лиганд. Лигандами для применения в указанной системе генного переключения могут быть соединения по формуле I

где А представляет собой алкокси, арилалкилокси или арилокси;
В представляет собой необязательно замещенный арил или необязательно замещенный гетероарил; и
R1 и R2 представляют собой независимо друг от друга необязательно замещенный алкил, арилалкил, гидроксиалкил, галогеноалкил, необязательно замещенный циклоалкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный гетероцикл, необязательно замещенный арил или необязательно замещенный гетероарил;
или их фармацевтически приемлемые соли, гидраты, кристаллические формы или аморфные формы.
[00351] Согласно еще одному варианту реализации указанный лиганд может представлять собой энантиомерно обогащенные соединения по формуле II

где
А представляет собой алкокси, арилалкилокси, арилокси, арилалкил, необязательно замещенный арил или необязательно замещенный гетероарил;
В представляет собой необязательно замещенный арил или необязательно замещенный гетероарил; и
R1 и R2 представляют собой, независимо друг от друга, необязательно замещенный алкил, арилалкил, гидроксиалкил, галогеноалкил, необязательно замещенный циклоалкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный гетероцикл, необязательно замещенный арил или необязательно замещенный гетероарил;
при условии, что R1 не идентичен R2;
где абсолютная конфигурация у асимметрического атома углерода, несущего R1 и R2, - преимущественно S;
или их фармацевтически приемлемые соли, гидраты, кристаллические формы или аморфные формы.
[00352] Согласно определенным вариантам реализации указанный лиганд может представлять собой энантиомерно обогащенные соединения по формуле III
где
А представляет собой алкокси, арилалкилокси, арилокси, арилалкил, необязательно замещенный арил или необязательно замещенный гетероарил;
В представляет собой необязательно замещенный арил или необязательно замещенный гетероарил; и
R1 и R2 представляют собой, независимо друг от друга, необязательно замещенный алкил, арилалкил, гидроксиалкил, галогеноалкил, необязательно замещенный циклоалкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный гетероцикл, необязательно замещенный арил или необязательно замещенный гетероарил;
при условии, что R1 не идентичен R2;
где абсолютная конфигурация у асимметрического атома углерода, несущего R1 и R2, - преимущественно R;
или их фармацевтически приемлемые соли, гидраты, кристаллические формы или аморфные формы.
[00353] Согласно одному из вариантов реализации лиганд может представлять собой (R)-3,5-диметил-бензойной кислоты N-(1-трет-бутил-бутил)-N’-(2-этил-3-метокси-бензоил)-гидразид с энантиомерным избытком по меньшей мере 95%, или его фармацевтически приемлемые соль, гидрат, кристаллическую форму или аморфную форму.
[00354] Диацилгидразиновые лиганды по формуле I и хиральные диацилгидразиновые лиганды по формуле II или III при применении с системой генного переключения на основе экдизона обеспечивают способ внешней временной регуляции экспрессии терапевтического полипептида или терапевтического полинуклеотида согласно настоящему изобретению. См. заявку на патент США №12/155111, поданную 29 мая 2008 г., включенную в настоящую заявку во всей полноте посредством ссылки.
[00355] Лиганды, применяемые в настоящем изобретении, могут образовывать соли. Используемый в настоящей заявке термин «соль(и)» означает кислые и/или основные соли образованные неорганическими и/или органическими кислотами и основаниями. Кроме того, если соединение по формуле I, II или III содержит и основной фрагмент и кислотный фрагмент, могут образоваться цвиттерионы («внутренние соли»), включенные в указанный используемый в настоящей заявке термин «соль(и)». Применяют фармацевтически приемлемые (т.е. нетоксичные, физиологически приемлемые) соли, хотя другие соли также могут подходить, например, для этапов выделения или очищения, которые могут проводиться при получении. Соли соединений по формуле I, II или III могут быть образованы, например, реакцией соединения с некоторым количеством кислоты или основания, таким как эквивалентное количество, в среде, например, такой, в которой осаждается указанная соль, или в водной среде с последующей лиофилизацией.
[00356] Лиганды, которые содержат основной фрагмент, могут образовывать соли с разнообразными органическими и неорганическими кислотами. Типовые соли присоединения кислоты включают ацетаты (такие как образованные уксусной кислотой или тригалоуксусной кислотой, например, трифторуксусной кислотой), адипинаты, альгинаты, аскорбаты, аспартаты, бензоаты, бензолсульфонаты, бисульфаты, бораты, бутираты, цитраты, камфораты, камфорсульфонаты, циклопентанпропионаты, биглюконаты, додецилсульфаты, этансульфонаты, фумараты, глюкогептаноаты, глицерофосфаты, гемисульфаты, гептаноаты, гексаноаты, гидрохлориды (образованные соляной кислотой), гидробромиды (образованные бромистым водородом), гидроиодиды, 2-гидроксиэтансульфонаты, лактаты, малеаты (образованные малеиновой кислотой), метансульфонаты (образованные метансульфокислотой), 2-нафталинсульфонаты, никотинаты, нитраты, оксалаты, пектинаты, персульфаты, 3-фенилпропионаты, фосфаты, пикраты, пивалаты, пропионаты, салицилаты, сукцинаты, сульфаты (такие как образованные серной кислотой), сульфонаты (такие как упомянутые в настоящей заявке), тартраты, тиоцианаты, толуолсульфонаты, такие как тозилаты, ундеканоаты, и т.п.
[00357] Лиганды, которые содержат кислотный фрагмент, могут образовывать соли с разнообразными органическими и неорганическими основаниями. Типовые основные соли включают соли аммония, соли щелочных металлов, такие как натриевые, литиевые, калийные соли, соли щелочных металлов, такие как кальциевые и магниевые, соли органических оснований (например, органических аминов), такие как бензатины, дициклогексиламины, гидрабамины (образованные N,N-бис (дегидроабиэтил) этилендиамином), N-метил-D-глюкамины, N-метил-D-глюкамиды, трет-бутил амины и соли аминокислот, таких как аргинин, лизин и т.п.
[00358] Неограничивающими примерами лигандов для индуцируемой генной экспрессионной системы, в которой применяют FK506-связывающий домен, являются FK506, циклоспорин А, или рапамицин. FK506, рапамицин, и их аналоги раскрыты в патентах США №6649595 В2 и 6187757. См. также патенты США №7276498 и 7273874.
[00359] Лиганды, описанные в настоящей заявке, могут вводиться отдельно или как часть фармацевтической композиции, содержащей фармацевтически приемлемый носитель. Согласно одному из вариантов реализации указанные фармацевтические композиции представлены в форме растворов, суспензий, таблеток, капсул, мазей, эликсиров или композиций для инъекций.
[00360] Согласно одному из вариантов реализации вектор и способы, предложенные в соответствии с настоящим изобретением, можно применять для экспрессии полинуклеотида, который кодирует белок, включающий, не ограничиваясь перечисленным, цитокин, иммуномодулятор, фактор свертывания, антитело или фрагмент антитела, рецептор фактора некроза опухоли (TNFR), такой как этанерцепт, эритропоэтин, альфа-1 антитрипсин, интерферон (IFN, ИФН), интерферон альфа, интерферон бета, интерферон гамма, интерферон-бета-1a, интерферон-бета-1b. Фактор VII, Фактор VIII, Фактор IX, антитромбин III, белок вируса гепатита В, гормон, например, гормон роста (GH), гормон роста человека (hGH), паратиреоидный гормон (РН), тиреостимулирующий гормон (TSH), GCSF или их фрагменты, ГМКСФ или его фрагмент.
[00361] Согласно одному из вариантов реализации полинуклеотид, кодирующий антитело кодирует моноклональное антитело.
[00362] Согласно еще одному варианту реализации вектор и способы, предложенные в соответствии с настоящим изобретением, можно применять для экспрессии нуклеиновой кислоты в качестве вакцины. В соответствии с настоящим изобретением также предложена вакцинная композиция, содержащая вектор или экспрессионную систему согласно настоящему изобретению. Согласно еще одному варианту реализации указанная вакцинная композиция содержит адъювант.
[00363] Термин «на основе рецептора экдизона» в отношении генного переключателя означает генный переключатель, содержащий по меньшей мере функциональную часть встречающегося в природе или синтетического лиганд-связывающего домена рецептора экдизона и регулирующий генную экспрессию в ответ на лиганд, который связывается с указанным лиганд-связывающим доменом рецептора экдизона. Примеры экдизон-зависимых систем описаны в патентах США №7091038 и 6258603. Согласно одному из вариантов реализации указанная система представляет собой терапевтическую систему RheoSwitch® (RheoSwitch® Therapeutic System, RTS), которая содержит два гибридных белка, DEF домены мутагенизированного рецептора экдизона (EcR), слитые с ДНК-связывающим доменом Gal4, и EF-домены гибридного RXR, слитые с доменом активации транскрипции VP16, экспрессирующиеся под контролем конститутивного промотора, как показано на Фиг.1.
[00364] Термины «модулировать» и «модулирует» означают индуцирование, понижающее регулирование или ингибирование нуклеиновой кислоты или генной экспрессии, что приводит, соответственно, к индукции, снижению или ингибированию синтеза белка или полипептида.
[00365] Полинуклеотиды или векторы согласно настоящему изобретению могут дополнительно содержать по меньшей мере один промотор, подходящий для запуска экспрессии гена в клетке-хозяине.
[00366] Энхансеры, которые могут применяться во вариантах реализации настоящего изобретения, включают, не ограничиваясь перечисленными: энхансер SV40, энхансер цитомегаловируса (CMV), энхансер фактора элонгации 1 (EF1), дрожжевые энхансеры, энхансеры вирусных генов и т.п.
[00367] Области контроля терминации, т.е. терминирующие последовательности или последовательности полиаденилирования, также могут происходить из различных генов, нативных для предпочтительных хозяев. Как вариант, сайт терминации может не быть обязателен, однако наиболее предпочтительно, если он включен. Согласно одному из вариантов реализации указанная область контроля терминации может состоять или происходить из синтетической последовательности, синтетического сигнала полиаденилирования, позднего сигнала полиаденилирования SV40, сигнала полиаденилирования SV40, сигнала полиаденилирования бычьего гормона роста (ВОН), вирусных терминирующих последовательностей или т.п.
[00368] Термины «3’ некодирующие последовательности» или «З’ нетранслируемая область (UTR)» относятся к ДНК последовательности, которая расположена в прямом направлении (3’) от кодирующей последовательности и может содержать последовательности распознавания полиаденилирования [poly(А)/«поли-А»] и другие последовательности, кодирующие регуляторные сигналы, способные воздействовать на процессинг иРНК или генную экспрессию. Сигнал полиаденилирования, как правило, характеризуется влиянием на добавление участков полиадениловой кислоты к 3’ концу предшественника иРНК.
[00369] Термин «регуляторная область» относится к последовательности нуклеиновой кислоты, регулирующей экспрессию второй последовательности нуклеиновой кислоты. Регуляторная область может включать последовательности, естественным образом отвечающие за экспрессирование определенной нуклеиновой кислоты (гомологичная область) или могут включать последовательности различного происхождения, отвечающие за экспрессирование различных белков или даже синтетических белков (гетерологичная область). В частности, указанные последовательности могут представлять собой последовательности прокариотических, эукариотических или вирусных генов или полученные последовательности, стимулирующие или репрессирующие транскрипцию гена специфичным или неспецифичным образом, и индуцируемым или не-индуцируемым образом. Регуляторные области включают точки начала репликации, сайты сплайсинга РНК, промоторы, энхансеры, последовательности терминации транскрипции и сигнальные последовательности, направляющие указанный полипептид в секреторные пути клетки-мишени.
[00370] Под регуляторной областью из «гетерологичного источника» понимается регуляторная область, не связанная от природы с экспрессируемой нуклеиновой кислотой. В гетерологичные регуляторные области включены регуляторные области из различных видов, регуляторные области из другого гена, гибридные регуляторные последовательности и регуляторные последовательности, не встречающиеся в природе, но сконструированные специалистом в данной области техники.
[00371] Термин «РНК-транскрипт» относится к продукту, получающемуся в результате катализируемой РНК-полимеразой транскрипции последовательности ДНК. Если указанный РНК-транскрипт представляет собой точную комплементарную копию указанной ДНК последовательности, он называется первичным транскриптом; или же он может представлять собой РНК последовательность, получаемую при посттрансляционном процессинге первичного транскрипта, и называется зрелой РНК. «Информационная РНК (иРНК)» относится к РНК, не имеющей интронов, которая может быть транслирована клеткой в белок. «кДНК» относится к двуцепочечной ДНК, комплементарной и происходящей из иРНК. Термин «смысловая» РНК относится к РНК-транскрипту, который включает указанную иРНК и, таким образом, может быть транслирована в клеткой белок. Термин «антисмысловая РНК» относится к РНК-транскрипту, комплементарному всему или части целевого первичного транскрипта или иРНК, и блокирующему экспрессию гена-мишени. Антисмысловая РНК может быть комплементарна любой части специфичного генного транскрипта, т.е. У некодирующей последовательности, 3’ некодирующей последовательности или кодирующей последовательности. Термин «функциональная РНК» относится к антисмысловой РНК, рибозимной РНК или другой РНК, нетранслируемой, но тем не менее оказывающей влияние на клеточные процессы.
[00372] Термины «полипептид», «пептид» и «белок» используются взаимозаменяемо и относятся к полимерному соединению, состоящему из ковалентно связанных аминокислотных остатков.
[00373] Термины «выделенный полипептид», «выделенный пептид» или «выделенный белок» относятся к полипептиду или белку, практически свободному от соединений, которые обычно связаны с ним в естественном состоянии (например, другие белки или полипептиды, нуклеиновые кислоты, углеводы, липиды). Термин «выделенный» не означает исключения искусственных или синтетических смесей с другими соединениями или присутствия примесей, которые не влияют на биологическую активность, и которые могут иметь место, например, ввиду неполной очистки, добавления стабилизаторов или введения в фармацевтически приемлемые составы.
[00374] Термин «полипептид с мутацией замещения» или «мутант замещения» следует понимать как мутантный полипептид, содержащий замену по меньшей мере одной аминокислоты дикого типа, или встречающейся в природе, другой аминокислотой, относительно полипептида дикого типа, или встречающегося в природе. Полипептид с мутацией замещения может содержать только одно замещение аминокислоты дикого типа, или встречающейся в природе, и может обозначаться как полипептидный «точечный мутант» или «одноточечный мутант». Как вариант, полипептид с мутацией замещения может содержать замещение двух или более аминокислот дикого типа, или встречающихся в природе, двумя или более аминокислотами, относительно полипептида дикого типа или встречающегося в природе. Согласно настоящему изобретению, полипептид лиганд-связывающего домена ядерного рецептора группы Н, содержащий мутацию замещения, содержит замещение по меньшей мере одной аминокислоты дикого типа, или встречающейся в природе, другой аминокислотой, относительно полипептида лиганд-связывающего домена ядерного рецептора группы Н дикого типа, или встречающегося в природе.
[00375] Если полипептид с мутацией замещения содержит замещение двух или более аминокислот дикого типа, или встречающихся в природе, такое замещение может содержать либо равное количество аминокислот дикого типа, или встречающихся в природе, удаленных для замены, т.е. 2 аминокислоты дикого типа, или встречающиеся в природе, заменены на 2 аминокислоты не дикого типа, или не встречающиеся в природе, либо неравное количество аминокислот дикого типа, удаленных для замены, т.е. 2 аминокислоты дикого типа замещены одной аминокислотой не дикого типа (мутация замещения+делеция), или 2 аминокислоты дикого типа замещены тремя аминокислотами не дикого типа (мутация замещения+инсерция).
[00376] Мутанты замещения могут быть описаны с применением аббревиатурной номенклатурной системы: указываются замещенные аминокислотные остатки и их номера в исходной полипептидной последовательности, и новые замещающие аминокислотные остатки. Например, мутант замещения, в котором замещен двадцатый (20ый) аминокислотный остаток полипептида, может быть обозначен аббревиатурой «x20z», где «x» представляет собой замещаемую аминокислоту, «20» представляет собой положение аминокислотного остатка или номер в указанном полипептиде, a «z» представляет собой новую замещающую аминокислоту. Таким образом, обозначение мутанта замещения аббревиатурой «Е20А» или равнозначной аббревиатурой «Glu20Ala» означает, что указанный мутант содержит остаток Аленина (обычно обозначаемый в данной области техники аббревиатурой «А» или «А1а») вместо глютаминовой кислоты (обычно обозначаемой в данной области техники аббревиатурой «Е» или «Glu») в положении 20 указанного полипептида.
[00377] Мутация замещения может быть осуществлена с помощью любого известного в данной области техники метода мутагенеза, включая, но не ограничиваясь перечисленными, in vitro сайт-специфический мутагенез (Hutchinson et al., J. Biol. Chem. 253:6551 (1978); Zoller et al., DNA 3:479 (1984); Oliphant et al., ген 44-Л77 (1986); Hutchinson et al., Proc. Natl. Acad. Sci. USA 83:710 (1986)), применение линкеров TAB® (Pharmacia), расщепление рестрикционной эндонуклеазой/удаление и замещение фрагмента, ПЦР-опосредованный/олигонуклеотид-специфичный мутагенез и т.п.Основанные на ПЦР методы предпочтительны для сайт-специфического мутагенеза (см. Higuchi, 1989, «Using PCR to Engineer DNA» («Применение ПЦР для конструирования ДНК»), в PCR Technology; Principles and Applications for DNA Amplification («Технология ПЦР: Принципы и практическое применение ДНК-амплификации»), Н. Eriich, ed., Stockton Press, гл. 6, с.61-70).
[00378] Термин «фрагмент» по отношению к полипептиду означает полипептид, аминокислотная последовательность которого короче, чем последовательность исходного полипептида, и содержащий, на протяжении всего фрагмента таких исходных полипептидов, идентичную аминокислотную последовательность. Такие фрагменты могут, при необходимости, быть включены в больший полипептид, частью которого являются. Такие фрагменты полипептида согласно настоящему изобретению могут иметь длину по меньшей мере 2, 3, 4, 5, 6, 8, 10, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 25, 26, 30, 35, 40, 45, 50, 100, 200, 240, 300 или более аминокислот.
[00379] Термин «вариант» полипептида или белка относится к любому аналогу, фрагменту, производному или мутанту, происходящему из полипептида или белка и сохраняющему по меньшей мере одно биологическое свойство указанного полипептида или белка. В природе могут существовать различные варианты указанного полипептида или белка. Такие варианты могут представлять собой аллельные вариации, характеризующиеся различиями в нуклеотидных последовательностях структурного гена, кодирующего указанный белок, или могут вовлекать дифференциальный сплайсинг или пост-трансляционную модификацию. Специалист в данной области может получить варианты, содержащие одно или несколько аминокислотных замещений, делеций, добавлений или замен. Такие варианты могут включать, в частности: (а) варианты, где один или более аминокислотный остаток замещен консервативной или неконсервативной аминокислотой, (b) варианты, где одна или более аминокислота добавлена к полипептиду или белку, (с) варианты, где одна или более из указанных аминокислот содержит замещающую группу, и (d) варианты, где указанный полипептид или белок слит с другим полипептидом, таким как сывороточный альбумин. Методы получения таких вариантов, включая генетические (супрессии, делеций, мутации и т.д.), химические и ферментативные методы, известны специалистам в данной области техники. Согласно одному из вариантов реализации вариант полипептида содержит по меньшей мере приблизительно 14 аминокислот.
[00380] Термин «гомология» относится к проценту сходства двух полинуклеотидов или двух полипептидных фрагментов. Соответствие между последовательностями из одного и из другого фрагмента может быть установлено при помощи методов, известных в данной области техники. Например, гомология может быть определена путем прямого сравнения информации о последовательностях двух полипептидных молекул при помощи выравнивания информации о указанных последовательностях и с применением легкодоступных компьютерных программ. Как вариант, гомология может быть определена путем гибридизации полинуклеотидов в условиях образования стабильных дуплексов между гомологичными областями, с последующим расщеплением специфичной(ным) к одноцепочечным НК нуклеазой(ами) и определением размера отщепленных фрагментов.
[00381] Используемый в настоящей заявке термин «гомологичный» во всех грамматических формах и вариантах написания относится к родству белков, имеющих «общее эволюционное происхождение», включая белки надсемейств (например, надсемейства иммуноглобулинов) и гомологичные белки различных видов (например, легкая цепь миозина, и т.д.) (Reeck et al., Cell 50:667 (1987)). Такие белки (и кодирующие их гены) имеют гомологию последовательностей, отраженную в высокой степени сходства последовательностей. Тем не менее, при повсеместном употреблении и при использовании в настоящей заявке термин «гомологичный», модифицированный с помощью наречия, такого как «высоко», может относиться к сходству последовательностей, а не к общему эволюционному происхождению.
[00382] Соответственно, термин «сходство последовательностей» во всех грамматических формах относится к степени идентичности или совпадения нуклеиновых кислот или аминокислотных последовательностей белков, которые могут иметь или могут не иметь общего эволюционного происхождения (см. Reeck et al., Cell 50:667 (1987)). Согласно одному из вариантов реализации две ДНК последовательности «в значительной степени гомологичны» или «в значительной степени сходны», если по меньшей мере приблизительно 50% (например, по меньшей мере приблизительно 75%, 90%, или 95%) нуклеотидов совпадают на протяжении оговоренной длины последовательности ДНК. Последовательности, в значительной степени гомологичные, могут быть идентифицированы сравнением указанных последовательностей с применением стандартного программного обеспечения, доступного в базах данных последовательностей, или в эксперименте с саузерн-гибридизацией, например, в жестких условиях согласно определенным для этой конкретной системы. Определение подходящих условий гибридизации известно в данной области техники (см. например, Sambrook et al., 1989, выше).
[00383] Используемый в настоящей заявке термин «в значительной степени сходные» относится к фрагментам нуклеиновых кислот, в которых изменение одного или более нуклеинового основания приводит к замене одной или более аминокислоты, но не влияет на функциональные качества белка, кодируемого указанной последовательностью ДНК. «В значительной степени сходные» также относится к фрагментам нуклеиновых кислот, отличающимся тем, что изменение одного или более нуклеинового основания не влияет на способность указанного фрагмента нуклеиновой кислоты опосредовать изменение генной экспрессии антисмысловым или косупрессионным путем. «В значительной степени сходные» также относится к модификациям фрагментов нуклеиновых кислот согласно настоящему изобретению, таким как удаление или вставка одного или более нуклеинового основания, не влияющим в значительной степени на функциональные качества получающегося транскрипта. Таким образом, понятно, что изобретение охватывает не только конкретные типовые последовательности. Каждая из предполагаемых модификаций вполне укладывается в понятие рутинной для данной области техники, как и определение сохранения биологической активности кодируемыми продуктами.
[00384] Более того, специалисту в данной области техники понятно, что в значительной степени сходные последовательности, охваченные настоящим изобретением, также определены возможностью их гибридизации, в жестких условиях (0,1Х SSC, 0,1% SDS, 65°С и отмывка 2Х SSC, 0,1% SDS, а затем 0,1Х SSC, 0,1% SDS), с последовательностями, примеры которых приведены в настоящей заявке. В значительной степени сходные фрагменты нуклеиновых кислот согласно настоящему изобретению представляют собой такие фрагменты нуклеиновых кислот, последовательности ДНК которых по меньшей мере приблизительно на 70%, 80%, 90% или 95% идентичны последовательности ДНК фрагментов нуклеиновых кислот, описанных в настоящей заявке.
[00385] Две аминокислотные последовательности «в значительной степени гомологичны» или «в значительной степени сходны», если более чем приблизительно 40% аминокислот идентичны, или более чем 60% сходны (функционально идентичны). Предпочтительно, указанные сходные или гомологичные последовательности идентифицированы путем выравнивания с применением, например, программы для наложения из GCG (Genetics Computer Group, руководство по программам GCG пакета, версия 7, Мэдисон, Висконсин).
[00386] Используемый в настоящей заявке термин «Соответствующий» относится к сходным или гомологичным последовательностям, независимо от того, идентична или отличается указанная точная позиция в молекуле, сходство или гомологию которой измеряют. Выравнивание нуклеиновых кислот или аминокислотных последовательностей может включать пробелы. Таким образом, термин «соответствующий» относится к сходству последовательностей, а не нумерации аминокислотных остатков или нуклеиновых оснований.
[00387] «Существенный фрагмент» аминокислоты или нуклеотидной последовательности содержит достаточно указанной аминокислотной последовательности полипептида или нуклеотидной последовательности гена для предположительной идентификации данного полипептида или гена, либо путем оценки указанной последовательности вручную специалистом в данной области техники, либо путем автоматизированного компьютерного сравнения последовательностей и идентификации с применением алгоритмов, таких как BLAST (Basic Local Alignment Search Tool; Altschul et al., J. Mol. Biol. 275:403 (1993)); доступен на ncbi.nlm.nih.gov/BLAST/). Как правило, последовательность из десяти или более последовательных аминокислот или тридцати и более нуклеотидов необходима для предположительной идентификации полипептида или последовательности нуклеиновой кислоты как гомологичных известному белку или гену. Далее, что касается нуклеотидных последовательностей, в сиквенс-зависимых способах идентификации генов (например, гибридизация по Саузерну) и выделения (например, in situ гибридизация бактериальных колоний или бактериофаговых бляшек) могут применяться ген-специфичные олигонуклеотидные зонды, содержащие 20-30 последовательных нуклеотидов. Кроме того, короткие олигонуклеотиды длиной 12-15 оснований могут применяться в качестве праймеров для амплификации при ПЦР для получения определенного фрагмента нуклеиновой кислоты, содержащего указанные праймеры. Соответственно, «существенный фрагмент» нуклеотидной последовательности содержит достаточную часть указанной последовательности для специфической идентификации и/или выделения фрагмента нуклеиновой кислоты, содержащего указанную последовательность.
[00388] Известный в данной области техники термин «процент идентичности» представляет собой отношение между двумя или более полипептидными последовательностями или двумя или более полинуклеотидными последовательностями, определенное сравнением указанных последовательностей. В данной области техники «идентичность» также означает степень родства последовательностей между полипептидными или полинуклеотидными последовательностями, в зависимости от ситуации, определяемую по совпадению между цепочками таких последовательностей. «Идентичность» и «сходство» могут быть легко рассчитаны с помощью известных способов, включая, но не ограничиваясь перечисленными, описанные в: Computational Molecular Biology («Вычислительная молекулярная биология») (Lesk, A.M., ed.) Oxford University Press, New York (1988); Biocomputing: Informatics and Genome Projects («Биовычисления: информатика и геномные проекты») (Smith, D.W., ed.) Academic Press, New York (1993); Computer Analysis of Sequence Data, Part I («Компьютерный анализ данных о последовательностях», ч. I) (Griffin, А.M., и Griffin, H. G., eds.) Humana Press, New Jersey (1994); Sequence Analysis in Molecular Biology («Анализ последовательностей в молекулярной биологии») (von Heinje, G., ed.) Academic Press (1987); и Sequence Analysis Primer («Введение в анализ последовательностей») (Gribskov, M. и Devereux, J., eds.) Stockton Press, New York (1991). Предпочтительные способы определения идентичности разработаны так, что они показывают наилучшее совпадение между исследуемыми последовательностями. Способы определения идентичности и сходства зашифрованы в общедоступных компьютерных программах. Выравнивание последовательностей и расчеты процента идентичности могут быть проведены с применением программного обеспечения для анализа последовательностей, такого как программа Megalign из пакета для вычислительной биоинформатики LASERGENE (DNASTAR Inc., Мэдисон, Висконсин). Множественное выравнивание последовательностей может выполняться с применением способа выравнивания Clustal (Higgins et al., CABIOS. 5:151 (1989)) с параметрами по умолчанию (штраф за пропуск GAP PENALTY=10, штраф за длину пропуска GAP LENGTH PENALTY=10). Могут быть выбраны следующие параметры по умолчанию для попарного выравнивания с применением указанного способа Clustal: размер идентичного участка KTUPLE 1, штраф за пропуск GAP PENALTY=3, окно WINDOW=5 и баллы за сохраненные диагонали DIAGONBAC SAVED=5.
[00389] Термин «программное обеспечения для анализа последовательностей» относится к любому компьютерному алгоритму или программе, подходящим для анализа нуклеотидной или аминокислотной последовательности. «Программное обеспечения для анализа последовательностей » может быть коммерчески доступно или разработано независимо. Типичное программное обеспечения для анализа последовательностей включает, не ограничиваясь перечисленными, программный пакет GCG (Wisconsin Package Version 9.0, Genetics Computer Group (GCG), Мэдисон, Висконсин), BLASTP, BLASTN, BLASTX (Altschul et al., J. Mol. Biol. 275:403 (1990)) и DNASTAR (DNASTAR, Inc. 1228 S. Park St. Madison, WI 53715 USA). В контексте этой заявки предполагается, что, когда для анализа применяют программное обеспечение для анализа последовательностей, результаты указанного анализа будут основаны на «значениях по умолчанию» используемой программы, если не указано иное. Используемый в настоящей заявке термин «значения по умолчанию» означает любой набор значений или параметров, которые исходно загружаются с программным обеспечением при первом запуске.
[00390] «Химически синтезированный» относительно последовательности ДНК, означает, что входящие в его состав нуклеотиды были собраны in vitro. Может быть осуществлен ручной химический синтез ДНК с применением общеизвестных техник, либо может проводиться автоматический химический синтез с применением одного из коммерчески доступных аппаратов. Соответственно, указанные гены могут быть адаптированы для оптимальной генной экспрессии, основанной на оптимизации нуклеотидной последовательности для отражения смещения частот кодонов в клетке-хозяине. Специалист в данной области техники оценит вероятность успешной генной экспрессии, если частота использования кодонов смещена в сторону кодонов, предпочтительных для хозяина. Определение предпочтительных кодонов может быть основано на изучении генов, происходящих из указанной клетки-хозяина, если информация о последовательностях доступна.
[00391] В контексте настоящей заявке две или более индивидуально работоспособные системы генной регуляции называются «ортогональными», когда: а) модуляция каждой из данных систем соответствующим ей лигандом, в выбранной концентрации, приводит к измеряемому изменению величины экспрессии гена этой системы, и b) указанное изменение статистически значимо отличается от изменения экспрессии всех других работоспособных систем, одновременно присутствующих в клетке, ткани или организме, независимо от того, одновременно или последовательно осуществляют текущее модулирование. Предпочтительно, модуляция каждой индивидуально работоспособной системы генной регуляции приводит к изменению генной экспрессию по меньшей мере в 2 раза большему, чем все другие работоспособные системы в клетке, ткани или организме, например, по меньшей мере 5-кратному, 10-кратному, 100-кратному, или 500-кратному. В идеале, модуляция каждой из данных систем соответствующим ей лигандом в выбранной концентрации приводит к измеряемому изменению величины экспрессии гена этой системы, и отсутствию измеряемого изменения в экспрессии всех других работоспособных систем в клетке, ткани или организме. В таких случаях множественно-индуцируемая система генной регуляции называется «полностью ортогональной». Подходящие ортогональные лиганды и ортогональные системы генной экспрессии на основе рецепторов описаны в US 2002/0110861 A1.
[00392] Термин «экзогенный ген» означает ген, чужой для указанного пациента, т.е. ген, который вводят указанному пациенту посредством процесса трансформации, немутированная версия эндогенного мутированного гена, или мутированная версия эндогенного немутированного гена. Способ трансформации не принципиален для настоящего изобретения и может представлять собой любой способ, подходящий для указанного пациента, из известных специалистам в данной области техники. Экзогенные гены могут быть как природными, так и синтетическими генами, которые вводят указанному пациенту в форме ДНК или РНК, которые могут функционировать через промежуточный продукт ДНК, например, посредством обратной транскриптазы. Такие гены могут быть введены в клетки-мишени, непосредственно введены указанному пациенту, или опосредованно введены указанному пациенту с помощью переноса трансформированных клеток.
[00393] Термин «терапевтический продукт» относится к терапевтическому полипептиду или терапевтическому полинуклеотиду, который придает благоприятную функцию клетке-хозяину, в которой такой продукт экспрессируется. Терапевтические полипептиды могут включать без ограничения пептиды длиной от трех аминокислот, одно- или многоцепочечные белки и гибридные белки. Терапевтические полинуклеотиды могут включать без ограничения антисмысловые олигонуклеотиды, малые интерферирующие РНК, рибозимы и внешние вспомогательные последовательности РНК. Указанный терапевтический продукт может содержать встречающуюся в природе последовательность, синтетическую последовательность или комбинацию природной и синтетической последовательностей.
[00394] Термин «комплекс лиганд-зависимого транскрипционного фактора», или «LDTFC», относится к транскрипционному фактору, содержащему одну или более белковую субъединицу, которая способна регулировать генную экспрессию, управляемую «фактор-регулируемым промотором» согласно приведенному в настоящей заявке описанию. Модельный LDTFC представляет собой «комплекс рецептора экдизона», как правило, термин относится к гетеродимерному белковому комплексу, содержащему по меньшей мере два члена семейства ядерных рецепторов, рецептор экдизона («EcR») и белки ultraspiracle («USP») (см. Yao et al., Nature 366:476 (1993)); Yao et al., Cell 71:63 (1992)). Функциональные LDTFC, такие как комплекс EcR, могут включать также дополнительный(е) белок(белки), такие как иммунофилины. Дополнительные представители белков семейства ядерных рецепторов, известных как транскрипционные факторы (такие как DHR38, betaFTZ-1 или другие гомологи насекомых), могут также быть лиганд-зависимыми или независимьми партнерами EcR и/или USP. LDTFC, такие как комплекс EcR, могут также представлять собой гетеродимер белка EcR и гомолога белка ultraspiracle позвоночных, белка Х-рецептора ретиноевой кислоты («RXR»), или химеру USP и RXR. Термины «LDTFC» и «EcR комплекс» также охватывают гомодимерные комплексы белка EcR или USP, а также одиночные полипептиды или тримеры, тетрамеры и другие мультимеры, выполняющие ту же функцию.
[00395] LDTFC, такой как комплекс EcR, может быть активирован активным экдистероидным или нестероидным лигандом, связанным с одним из белков указанного комплекса, включая EcR, но не исключая другие белки указанного комплекса. LDTFC, такой как комплекс EcR, включает белки, являющиеся представителями надсемейства ядерных рецепторов, все представители которого характеризуются присутствием одной или более полипептидной субъединицы, содержащей аминоконцевой трансактивирующий домен («AD», «TD» или «ТА», термины, используемые в настоящей заявке взаимозаменяемо), ДНК-связывающий домен («DBD») и лиганд-связывающий домен («LBD»). AD может присутствовать в составе гибридного белка с «партнером по гетеродимеризации», или «HP». Гибридный белок, содержащий AD и HP согласно настоящему изобретению, в настоящей заявке называется «коактивирующим белком», или «CAP». Указанные DBD и LBD могут экспрессироваться как гибридный белок, в настоящей заявке называемый «лиганд-индуцируемым транскрипционным фактором» («LTF»). Гибридизованные партнеры могут быть разделены линкером, например, шарнирной областью. Некоторые представители семейства LTF могут дополнительно содержать еще один трансактивирующий домен со стороны карбоксильного конца LBD. DBD свойственно присутствие двух цистеиновых цинковых пальцев, между которыми располагаются два аминокислотных мотива, Р-бокс и D-бокс, которые придают специфичность отвечающим элементам экдизона. Такие домены могут быть различными либо нативными, либо модифицированными доменами гетерологичных рецепторных белков, либо их гибридами.
[00396] ДНК последовательности, составляющие указанный экзогенный ген, отвечающий элемент и LDTFC, например, EcR комплекс, могут быть встроены в архебактерии, прокариотические клетки, такие как Escherichia coli, Bacillus subtilis, или другие энтеробактерии, или эукариотические клетки, такие как растительные или животные клетки. Однако, так как многие белки, экспрессируемые указанным геном, процессируются в бактериях неправильно, эукариотические клетки предпочтительны. Указанные клетки могут быть в форме одиночных клеток или многоклеточных организмов. Нуклеотидные последовательности экзогенного гена, отвечающий элемент и рецепторный комплекс также могут быть встроены в виде молекул РНК, предпочтительно в форме функциональных вирусных РНК, таких как вирус табачной мозаики. Из эукариотических клеток предпочтительны клетки позвоночных животных, так как в них естественным образом отсутствуют молекулы, обеспечивающие ответ на лиганды, предложенные в настоящем изобретении, для EcR. В результате они «практически нечувствительны» к лигандам, предложенным в соответствии с настоящим изобретением. Таким образом, лиганды, подходящие для настоящего изобретения, оказывают пренебрежимо незначительные физиологические или другие эффекты на трансформированные клетки, или на организм в целом. Таким образом, клетки могут расти и экспрессировать требуемый продукт, практически не испытывая эффектов от самого по себе присутствия указанного лиганда.
[00397] Термин «комплекс рецептора экдизона», как правило, относится к гетеродимерному белковому комплексу, содержащему по меньшей мере два представителя семейства ядерных рецепторов, рецептор экдизона («EcR») и белков ultraspiracle («USP») (см. Yao et al., Nature 366:476 (1993)); Yao et al., Cell 77:63 (1992)). Функциональный комплекс EcR может включать также дополнительный(е) белок(белки), такие как иммунофилины. Дополнительные представители белков семейства ядерных рецепторов, известные как транскрипционные факторы (такие как DHR38, betaFTZ-1 или другие гомологи насекомых), могут также быть лиганд-зависимыми или независимыми партнерами для EcR и/или USP. Указанный комплекс EcR может также представлять собой гетеродимер белка EcR и гомолога белка ultraspiracle позвоночных, белка Х-рецептора ретиноевой кислоты («RXR»), или химеру USP и RXR. Термин «EcR комплекс» также охватывает гомодимерные комплексы белка EcR или USP.
[00398] Комплекс EcR может быть активирован активным экдистероидным или нестероидным лигандом, связанным с одним из белков указанного комплекса, включая EcR, но не исключая других белков указанного комплекса. Используемый в настоящей заявке термин «лиганд» относительно генных переключателей на основе EcR, описывает малые растворимые молекулы, способные активировать генный переключатель для стимуляции экспрессии кодируемого ими полипептида. Примеры лигандов включают без ограничения экдистероиды, такие как экдизон, 20-гидроксиэкдизон, понастерон А, муристерон А, и т.п., 9-цис-ретиноевую кислоту, синтетические аналоги ретиноевой кислоты, N,N’-диацилгидразины, такие как описанные в патентах США №6013836; 5117057; 5530028; и 5378726, и в опубликованных заявках на патент США №2005/0209283 и 2006/0020146; оксадиазолины согласно описанию в опубликованной заявке на патент США №2004/0171651; дибензоилалкилцианогидразины, такие как описанные в заявке на европейский патент №461809; N-алкил-N,N’-диароилгидразины, такие как описанные в заявке на патент США №5225443; N-ацил-N-алкилкарбонилгидразины, такие как описанные в заявке на европейский патент №234994; N-ароил-N-алкил-N’-ароилгидразины, такие как описанные в заявке на патент США №4985461; амидокетоны, такие как описанные в опубликованной заявке на патент США №2004/0049037; и другие сходные материалы, включая 3,5-ди-трет-бутил-4-гидрокси-N-изобутил-бензамид, 8-O-ацетилгарпагид, оксистерины, 22(R) гидроксихолестерин, 24(S) гидроксихолестерин, 25-эпоксихолестерин, Т0901317, 5-альфа-6-альфа-эпоксихолестерин-3-сульфат (ECHS), 7-кетохолестерин-3-сульфат, фамезол, желчные кислоты, 1,1-бисфосфоновые сложные эфиры, ювенильный гормон III, и т.п. Примеры диацилгидразиновых лигандов, подходящих для настоящего изобретения, включают RG-115819 (3,5-диметил-бензойной кислоты N-(1-этил-2,2-диметил-пропил)-N’-(2-метил-3-метокси-бензоил)-гадразид), RG-115932 ((R)-3,5-диметил-бензойной кислоты N-(1-трет-бутил-бутил)-N’-(2-этил-3-метокси-бензоил)-гидразид), и RG-115830 (3,5-диметил-бензойной кислоты N-(1-трет-бутил-бутил)-N’-(2-этил-3-метокси-бензоил)-гидразид). См. заявку на патент США 12/155111, поданную 29 мая 2008 г., и PCT/US 2008/006757, поданную 29 мая 2008 г., для ознакомления с дополнительными диацилгидразинами, подходящими для применения в соответствии с настоящим изобретением.
[00399] Комплекс EcR включает белки, которые являются представителями надсемейства ядерных рецепторов, всем представителям которого свойственно присутствие аминоконцевого трансактивирующего домена («ТА»), ДНК-связывающего домена («DBD»), и лиганд-связывающего домена («LBD»), разделенных шарнирной областью. Некоторые представители указанного семейства могут дополнительно содержать еще один трансактивирующий домен со стороны карбоксильного конца LBD. DBD свойственно присутствие двух цистеиновых цинковых пальцев, между которыми располагаются два аминокислотных мотива, Р-бокс и D-бокс, которые придают специфичность экдизон-отвечающим элементам. Такие домены могут быть различными либо нативными, либо модифицированными доменами гетерологичных рецепторных белков, либо их гибридами.
[00400] ДНК последовательности, составляющие указанные экзогенный ген, отвечающий элемент и комплекс EcR, могут быть встроены в архебактерии, прокариотические клетки, такие как Escherichia coli. Bacillus subtilis, или другие энтеробактерии, или эукариотические клетки, такие как растительные или животные клетки. Однако, так как многие белки, экспрессируемые указанным геном, процессируются в бактериях неправильно, эукариотические клетки предпочтительны. Указанные клетки могут быть в форме одиночных клеток или многоклеточных организмов. Нуклеотидные последовательности экзогенного гена, отвечающего элемента и рецепторного комплекса также могут быть встроены в виде молекул РНК, предпочтительно в форме функциональных вирусных РНК, таких как вирус табачной мозаики. Из эукариотических клеток предпочтительны клетки позвоночных животных, так как в них естественным образом отсутствуют молекулы, которые обеспечивают ответ на лиганды, предложенные в настоящем изобретении, для EcR. В результате они «практически нечувствительны» к лигандам, предложенным в настоящем изобретении. Таким образом, лиганды, подходящие для настоящего изобретения, оказывают пренебрежимо незначительные физиологические или другие эффекты на трансформированные клетки, или на организм в целом. Таким образом, клетки могут расти и экспрессировать требуемый продукт, практически не испытывая эффектов от самого по себе присутствия указанного лиганда.
[00401] Лиганды EcR при применении с комплексом EcR, который, в свою очередь, связан с отвечающим элементом, связанным с экзогенным геном (например, IL-12), обеспечивают способ внешней временной регуляции экспрессии экзогенного гена. Порядок, в котором различные компоненты связываются друг с другом, т.е. лиганд с рецепторным комплексом, и рецепторный комплекс с отвечающим элементом, не принципиален. Как правило, модуляция экспрессии экзогенного гена происходит в ответ на связывание указанного комплекса EcR со специфическим контрольным, или регуляторным, элементом ДНК. Белок EcR, как и другие представители семейства ядерных рецепторов, содержит по меньшей мере три домена, домен трансактивации, ДНК связывающий домен и лиганд-связывающий домен. Этот рецептор, соответствующий субпопуляции семейства ядерных рецепторов, также содержит менее четко определенные области, отвечающие за свойства гетеродимеризации. Связывание указанного лиганда с лиганд-связывающим доменом белка EcR, после гетеродимеризации с белком USP или RXR, позволяет указанным ДНК-связывающим доменам гетеродимерных белков связываться с отвечающим элементом в активированной форме, таким образом приводя к экспрессии или супрессии экзогенного гена. Этот механизм не исключает потенциального связывания лиганда с EcR или USP и формирования в результате активных гомодимерных комплексов (например, EcR+EcR или USP+USP). Согласно одному из вариантов реализации один или более из указанных рецепторных доменов может варьировать с получением гибридного генного переключателя. Как правило, один или более из трех указанных доменов может быть выбран из источника, отличного от источника других доменов, таким образом, что указанный гибридный рецептор оптимизирован под выбранную клетку-хозяина или организм для трансактивационной активности, комплементарного связывания указанного лиганда и распознавания специфического отвечающего элемента. Кроме того, сам указанный отвечающий элемент может быть модифицирован или замещен отвечающими элементами для других ДНК-связывающих белковых доменов, таких как белок GAL-4 дрожжей (см. Sadowski et al., Nature 335:563 (1988) или белок LexA из Е. coli (см. Brent et al., Cell 43:729 (1985)), для соответствия гибридным комплексам EcR. Другим преимуществом двугибридных систем является то, что они позволяют выбирать промотор, применяемый для управления генной экспрессией согласно требуемому конечному результату. Такой двойной контроль может быть, в частности, важен в областях применения генной терапии, особенно при получении цитотоксических белков, так как позволяет контролировать и сроки экспрессии, и клетки, в которых происходит экспрессия. Когда экзогенные гены, функционально связанные с подходящим промотором, введены в клетки пациента, экспрессия указанных экзогенных генов контролируется присутствием лиганда, предложенного в соответствии с настоящим изобретением. Промоторы могут быть конститутивно или индуцируемо регулируемыми, или могут быть тканеспецифичными (т.е. экспрессироваться только в определенном типе клеток) или специфичными для определенных стадий развития организма.
[00402] Согласно определенным вариантам реализации терапевтический переключающий промотор, описанный в указанных способах, является конститутивным. Согласно определенным вариантам реализации указанный терапевтический переключающий промотор активируется при условиях, связанных с заболеванием, расстройством или состоянием, например, указанный промотор активируется в ответ на заболевание, в ответ на определенное физиологическое, связанное с развитием или дифференцировкой, или патологическое состояние, и/или в ответ на одну или более специфическую биологическую молекулу; и/или указанный промотор активируется в определенном типе ткани или клеток. Согласно определенным вариантам реализации указанное заболевание, расстройство или состояние чувствительно к указанному терапевтическому полипептиду или полинуклеотиду. Например, в определенных неограничивающих вариантах реализации указанный терапевтический полинуклеотид или полипептид подходит для лечения, профилактики, облегчения, уменьшение симптомов, предотвращения прогресса или устранения болезни, расстройства или состояния, но не обязательно подразумевает выполнение любого или всех этих пунктов. Согласно определенным вариантам реализации указанные первый и второй полинуклеотиды вводят таким образом, чтобы позволить экспрессию указанного комплекса лиганд-зависимого транскрипционного фактора в условиях, связанных с болезнью, расстройством или состоянием. Согласно одному из вариантов реализации терапевтические способы осуществляют таким образом, что указанный терапевтический полипептид или терапевтический полинуклеотид экспрессируется и распространяется в организме пациента на уровне, достаточном для лечения, улучшения, или предотвращения указанного заболевания, расстройства или состояния. Используемый в настоящей заявке термин «распространяется» означает, что указанный полипептид экспрессируется и высвобождается из модифицированной клетки в достаточной мере для оказания эффекта или активности в указанном пациенте. Распространение может быть системным, местным или представлять собой любой промежуточный вариант. Например, указанные терапевтический полипептид или терапевтический полинуклеотид могут системно распространяться через кровоток или лимфатическую систему. Как вариант, указанные терапевтический полипептид или терапевтический полинуклеотид могут распространяться местно в ткани или органе, получающей(ем) лечение.
[00403] Многочисленные геномные и кДНК последовательности нуклеиновых кислот, кодирующие разнообразные полипептиды, такие как транскрипционные факторы и репортерные белки, хорошо известны в данной области техники. Специалисты в данной области техники имеют доступ к информации о последовательностях нуклеиновых кислот практически для всех известных генов, и могут либо получить указанную молекулу нуклеиновой кислоты либо непосредственно из общего банка, от организации, опубликовавшей указанную последовательность, либо применить рутинные способы получения указанной молекулы. См., например, описание номеров доступа последовательностей ниже.
[00404] Указанный генный переключатель может представлять собой любую систему генного переключения, регулирующую генную экспрессию добавлением или удалением специфического лиганда. Согласно одному из вариантов реализации указанный генный переключатель представляет собой такой, в котором уровень генной экспрессии зависит от присутствующего уровня лиганда. Примеры лиганд-зависимых транскрипционных факторов, которые могут применяться генных переключателях согласно настоящему изобретению включают без ограничения представителей надсемейства ядерных рецепторов, активируемых соответствующими им лигандами (например, глюкокортикоид, эстроген, прогестин, ретиноид, экдизон и их аналоги и миметики), и rTTA, активируемых тетрациклином. В одном из аспектов настоящего изобретения генный переключатель представляет собой генный переключатель на основе EcR. Примеры таких систем включают без ограничения системы, описанные в патентах США №6258603, 7045315, опубликованных заявках на патент США №№2006/0014711, 2007/0161086 и опубликованной заявке на международный патент №WO 01/70816. Примеры гибридных систем на основе рецептора экдизона описаны в заявке на патент США №7091038, опубликованных заявках на патент США №№2002/0110861, 2004/0033600, 2004/0096942, 2005/0266457, и 2006/0100416, и опубликованных заявках на международный патент №№WO 01/70816, WO 02/066612, WO 02/066613, WO 02/066614, WO 02/066615, WO 02/29075 и WO 2005/108617. Примером нестероидной экдизонной агонист-регулируемой системы является индуцируемая экспрессионная система млекопитающих RheoSwitch® Mammalian Inducible Expression System (New England Biolabs, Ипсвич, Массачусетс).
[00405] Согласно одному из вариантов реализации полинуклеотид, кодирующий генный переключатель, содержит одиночную последовательность транскрипционного фактора, кодирующую лиганд-зависимый транскрипционный фактор под контролем промотора. Указанная последовательность транскрипционного фактора может кодировать лиганд-зависимый транскрипционный фактор, который представляет собой встречающийся в природе или искусственный транскрипционный фактор. Искусственный транскрипционный фактор представляет собой такой, в котором природная последовательность транскрипционного фактора была изменена, например, мутацией указанной последовательности или комбинированием доменов из различных транскрипционных факторов. Согласно одному из вариантов реализации транскрипционный фактор содержит лиганд-связывающий домен (LBD) ядерного рецептора группы Н. Согласно одному из вариантов реализации указанный LBD ядерного рецептора группы Н происходит из EcR, универсального рецептора, орфанного рецептора 1, NER-1, ядерного рецептора 1 стероидных гормонов, взаимодействующего с ретиноидным Х-рецептором белка-15, Х-рецептора Р печени, подобного рецептору стероидных гормонов белка, Х-рецептора печени, X-рецептора печени α, фарнезоидного Х-рецептора, взаимодействующего с рецептором белка 14 или рецептора фарнезола. Согласно еще одному варианту реализации указанный LBD ядерного рецептора группы Н происходит из рецептора экдизона.
[00406] EcR и другие ядерные рецепторы группы Н являются представителями надсемейства ядерных рецепторов, представителям которого, как правило, свойственно присутствие аминоконцевого трансактивирующего домена (TD), ДНК-связывающего домена (DBD) и LBD, отделенного от DBD шарнирной областью. Используемый в настоящей заявке термин «ДНК-связывающий домен» включает от минимальной полипептидной последовательности ДНК-связывающего белка до полной длины ДНК-связывающего белка, длинной настолько, чтобы указанный ДНК-связывающий домен функционировал, связываясь с определенным отвечающим элементом. Представителям надсемейства ядерных рецепторов также свойственно присутствие четырех или пяти доменов: А/В, С, D, Е, и у некоторых представителей F (см. US 4981784 и Evans, Science 240-889 (1988)). «А/В» домен соответствует домену трансактивации, «С» соответствует ДНК-связывающему домену, «D» соответствует шарнирной области и «Е» соответствует лиганд-связывающему домену. Некоторые представители указанного семейства могут дополнительно содержать еще один трансактивирующий домен со стороны карбоксильного конца LBD, соответствующий «F».
[00407] DBD свойственно присутствие двух цистеиновых цинковых пальцев, между которыми располагаются два аминокислотных мотива, Р-бокс и D-бокс, которые придают специфичность отвечающим элементам. Такие домены могут быть либо нативными, либо модифицированными, либо гибридами различных доменов гетерологичных рецепторных белков. EcR, как субпопуляция семейства ядерных рецепторов, также обладает менее точно определенными областями, отвечающими за характеристики гетеродимеризации.. Так как домены ядерных рецепторов по своей природе являются модульными, указанные LBD, DBD и TD могут взаимозаменяться.
[00408] Согласно еще одному варианту реализации указанный транскрипционный фактор содержит TD, DBD, который узнает отвечающий элемент, связанный с экзогенным геном, экспрессию которого требуется модулировать; и LBD ядерного рецептора группы Н. Согласно определенным вариантам реализации указанный LBD ядерного рецептора группы Н содержит мутацию замещения.
[00409] Согласно еще одному варианту реализации полинуклеотид, кодирующий указанный генный переключатель, содержит первую последовательность транскрипционного фактора, находящуюся под контролем первого промотора, и вторую последовательность транскрипционного фактора, находящуюся под контролем второго промотора, причем белки, кодируемые указанной первой последовательностью транскрипционного фактора и указанной второй последовательностью транскрипционного фактора, взаимодействуют с образованием белкового комплекса, который функционирует как лиганд-зависимый транскрипционный фактор, т.е. генный переключатель на основе «двойного переключения», или «двугибридный». Указанные первый и второй промоторы могут быть одинаковыми или разными.
[00410] Согласно определенным вариантам реализации полинуклеотид, кодирующий генный переключатель, содержит первую последовательность транскрипционного фактора и вторую последовательность транскрипционного фактора, находящиеся под контролем промотора, причем белки, кодируемые указанной первой последовательностью транскрипционного фактора и указанной второй последовательностью транскрипционного фактора, взаимодействуют с образованием белкового комплекса, который функционирует как лиганд-зависимый транскрипционный фактор, т.е. «одиночный генный переключатель». Первая последовательность транскрипционного фактора и вторая последовательность транскрипционного фактора могут быть соединены внутренним участком посадки рибосом (IRES). Указанный IRES может представлять собой IRES EMCV.
[00411] Согласно одному из вариантов реализации первая последовательность транскрипционного фактора кодирует полипептид, содержащий TD, DBD, который узнает отвечающий элемент, связанный с экзогенным геном, экспрессию которого требуется модулировать; и LBD ядерного рецептора группы Н, а вторая последовательность транскрипционного фактора кодирует транскрипционный фактор, содержащий LBD ядерного рецептора, выбранный из LBD RXR позвоночных, LBD RXR беспозвоночных, LBD белка ultraspiracle и гибридного LBD, содержащего два полипептидных фрагмента, причем первый полипептидный фрагмент происходит из LBD RXR позвоночных, LBD RXR беспозвоночных или LBD белка ultraspiracle, а второй полипептидный фрагмент происходит из других LBD RXR позвоночных, LBD RXR беспозвоночных или LBD белка ultraspiracle.
[00412] Согласно еще одному варианту реализации указанный генный переключатель содержит первую последовательность транскрипционного фактора, кодирующую первый полипептид, содержащий LBD ядерного рецептора и DBD, который узнает отвечающий элемент, связанный с экзогенным геном, экспрессию которого требуется модулировать, и вторую последовательность транскрипционного фактора, кодирующую второй полипептид, содержащий TD и LBD ядерного рецептора, причем один из указанных LBD ядерного рецептора представляет собой LBD ядерного рецептора группы Н. Согласно одному из вариантов реализации указанный первый полипептид практически не содержит TD, а указанный второй полипептид практически не содержит DBD. Для целей настоящего изобретения «практически не содержит» означает, что искомый белок не содержит достаточной части последовательности искомого домена для того, чтобы обеспечивать активацию или связывающую активность.
[00413] В другом аспекте настоящего изобретения указанная первая последовательность транскрипционного фактора кодирует белок, содержащий партнера гетеродимеризации и TD, а вторая последовательность транскрипционного фактора кодирует белок, содержащий а DBD и а LBD.
[00414] Если только один LBD ядерного рецептора представляет собой LBD группы Н, другой LBD ядерного рецептора может происходить из любого другого ядерного рецептора, образующего димер с указанным LBD группы Н. Например, если указанный LBD ядерного рецептора группы Н представляет собой LBD EcR, другой «партнерский» LBD ядерного рецептора может происходить из EcR, RXR позвоночных, RXR беспозвоночных, белка ultraspiracle (USP) или гибридного ядерного рецептора, содержащего по меньшей мере два различных полипептидных фрагмента LBD ядерного рецептора, выбранного из RXR позвоночных, RXR беспозвоночных и USP (см WO 01/70816 А2, заявку на международный патент №PCT/US 02/05235 и US 2004/0096942 А1). «Партнерский» лиганд-связывающий домен ядерного рецептора может дополнительно содержать мутацию усечения, делеционную мутацию, мутацию замещения или другую модификацию.
[00415] Согласно одному из вариантов реализации LBD RXR позвоночных происходит из RXR человека Homo sapiens, мыши Mus musculus, крысы Rattus norvegicus, курицы Gallus gallus, свиньи Sus scrofa domestica, лягушки Xenopus laevis, данио-рерио Danio rerio, оболочника Polyandrocarpa misakiensis или медузы Tripedalia cysophora.
[00416] Согласно одному из вариантов реализации лиганд-связывающий домен RXR беспозвоночных происходит из полипептида ultraspiracle саранчи Locusta migratoria («LmUSP»), гомолога 1 RXR иксодового клеща АтЫуотта americanum («AmaRXRl»), гомолога 2 RXR иксодового клеща АтЫуотта americanum («AmaRXR2»), гомолога RXR манящего краба Celuca pugilator («CpRXR»), гомолога RXR жука Tenebrio molitor («TmRXR»), гомолога RXR медоносной пчелы Apis mellifera («AmRXR»), гомолога RXR тли Myzus persicae («MpRXR») или гомолога RXR не двукрылых/не чешуекрылых.
[00417] Согласно одному из вариантов реализации гибридный LBD RXR содержит по меньшей мере два полипептидных фрагмента, выбранных из полипептидного фрагмента RXR позвоночных видов, полипептидного фрагмента RXR беспозвоночных видов и полипептидного фрагмента гомолога RXR не двукрылых/не чешуекрылых беспозвоночных видов. Гибридный лиганд-связывающий домен RXR для применения в соответствии с настоящим изобретением может содержать по меньшей мере два полипептидных фрагмента RXR различных видов, или, если вид один и тот же, указанные два или более полипептидных фрагмента могут быть из двух или более различных изоформ полипептидных фрагментов RXR указанного вида.
[00418] Согласно одному из вариантов реализации гибридный RXR лиганд-связывающий домен содержит по меньшей мере один полипептидный фрагмент RXR позвоночных видов и один полипептидный фрагмент RXR беспозвоночных видов.
[00419] Согласно еще одному варианту реализации гибридный RXR лиганд-связывающий домен содержит по меньшей мере один полипептидный фрагмент RXR позвоночных видов и один полипептидный фрагмент гомолога RXR не двукрылых/не чешуекрылых беспозвоночных видов.
[00420] Указанный лиганд, при сочетании с LBD ядерного(ных) рецептора(ов), которые, в свою очередь, связываются с отвечающим элементом, соединенным с экзогенным геном, обеспечивает внешнее временное регулирование экспрессии указанного экзогенного гена. Механизм связывания или порядок, в котором различные компоненты согласно этому изобретению связываются друг с другом, т.е. например, лиганд с LBD, DBD с отвечающим элементом, TD с промотором, и т.д., не принципиален.
[00421] Согласно конкретному примеру связывание указанного лиганда с LBD ядерного рецептора группы Н и его партнерским LBD ядерного рецептора позволяет экспрессию экзогенного гена. Этот механизм не исключает потенциального связывания лиганда с ядерным рецептором группы Н (GHNR) или его партнером, и образования в результате активных гомодимерных комплексов (например, GHNR+GHNR или партнер+партнер). Предпочтительно, один или более из указанных рецепторных доменов варьируют с получением гибридного генного переключателя. Как правило, один или более из трех указанных доменов, DBD, LBD и TD, может быть выбран из источника, отличного от источника других доменов, таким образом, что указанные гибридные гены и получаемые в итоге гибридные белки оптимизированы согласно выбранной клетке-хозяину или организму для трансактивационной активности, комплементарного связывания указанного лиганда и распознавания специфического отвечающего элемента. Кроме того, сам указанный отвечающий элемент может быть модифицирован или замещен отвечающими элементами для других ДНК-связывающих белковых доменов, таких как белок GAL-4 дрожжей (см. Sadowski et al., Nature 335:563 (1988)) или белок LexA из Escherichia coli (см. Brent et al., Cell 43:729 (1985)), или синтетическими отвечающими элементами, специфичными для нацеленных взаимодействий с белками, сконструированными, модифицированными и отобранными для таких специфичных взаимодействий (см., например, Kim et al., Proc. Natl. Acad. Sci. USA, 94:3616 (1997)), для соответствия гибридным рецепторам.
[00422] Функциональный комплекс EcR может включать также дополнительный(ые) белок(белки), такие как иммунофилины. Дополнительные представители белков семейства ядерных рецепторов, известных как транскрипционные факторы (такие как DHR38 или betaFTZ-1), могут также быть лиганд-зависимыми или независимыми партнерами EcR, USP и/или RXR. Дополнительно могут требоваться другие кофакторы, такие как белки, общеизвестные как коактиваторы (также известные как адаптеры или медиаторы). Такие белки не связываются сиквенс-специфичным образом с ДНК и не участвуют в основной транскрипции. Они могут осуществлять свое действие на активацию транскрипции посредством различных механизмов, включая стимуляцию ДНК-связывания активаторов, воздействуя на структуру хроматина или опосредуя взаимодействия активатор-комплекс инициации. Примеры таких коактиваторов включают RIP 140, TIF1, RAP46/Bag-1, ARA70, SRC-l/NCoA-1, TIF2/GRIP/NCoA-2, ACTR/AIBl/RACS/pCIP а также связывающий белок отвечающего элемента В промискуитентного коактиватора С, СВР/р300 (для справки см. Glass et al., Curr. Opm. Cell Blol. 9:222 (1997)). Также для эффективного ингибирования транскрипционной активации в отсутствие лиганда могут требоваться белковые кофакторы, общеизвестные как корепрессоры (также известные как репрессоры, сайленсеры или медиаторы сайленсинга). Такие корепрессоры могут взаимодействовать EcR без лиганда для сайленсинга активности в отвечающем элементе. Имеющиеся данные указывают на то, что связывание лиганда изменяет конформацию рецептора, что приводит к высвобождению корепрессора и рекрутингу описанных выше коактиваторов, тем самым отменяя их активность в качестве сайленсеров. Примеры корепрессоров включают N-CoR и SMRT (для справки, см. Horwitz et al., Mol Endocrinol. 10:1167 (1996)). Такие кофакторы могут либо быть эндогенными для клетки или организма, либо могут быть добавлены экзогенно в качестве трансгенов для экспрессии регулируемым либо нерегулируемым образом.
[00423] Указанный экзогенный ген функционально связан с промотором, содержащим по меньшей мере один отвечающий элемент, который распознается DBD указанного лиганд-зависимого транскрипционного фактора, кодируемого генным переключателем. Согласно одному из вариантов реализации промотор содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, или более копий указанного отвечающего элемента. Промоторы, содержащие требуемые отвечающие элементы, могут представлять собой встречающиеся в природе промоторы или искусственные промоторы, созданные с применением техник, хорошо известных в данной области техники, например, один или более отвечающий элемент функционально связан с минимальным промотором.
[00424] Ген, кодирующий иммуномодулятор, например, IL-12, TNF-альфа, сигнальные пептиды, или любые транскрипционные факторы согласно настоящему изобретению, может также иметь оптимизированный состав кодонов. Согласно одному из вариантов реализации кодирующая область иммуномодулятора, например, IL-12, TNF-альфа, сигнального пептида или транскрипционного фактора иметь оптимизированный состав кодонов для экспрессии у человека. Специалисту в данной области техники будет понятно, что различные кодирующие области нуклеиновых кислот кодируют тот же полипептид благодаря избыточности генетического кода. Отклонения в нуклеотидной последовательности, которая содержит кодоны, кодирующие аминокислоты любой полипептидной цепи, позволяют вариации в последовательности, кодирующей ген. Так как каждый кодон состоит из трех нуклеотидов, а нуклеотиды, включающие ДНК, ограничены четырьмя конкретными основаниями, существует 64 возможных комбинации нуклеотидов, 61 из которых кодирует аминокислоты (оставшиеся три кодона кодируют сигналы окончания трансляции). «Генетический код», показывающий, какие кодоны кодируют какие аминокислоты, воспроизведен в настоящей заявке в виде таблицы 4. В результате, многие аминокислоты определяются более чем одним кодоном. Например, аминокислоты аланин и пролин кодируются четырьмя триплетами, серин и аргинин шестью, в то время как триптофан и метионин кодируются всего одним триплетом. Это вырождение позволяет составу оснований ДНК изменяться в широком диапазоне без изменения аминокислотной последовательности полипептидов, кодируемых указанной ДНК.
[00425] Подразумевается, что любой полинуклеотид, который кодирует полипептид в соответствии с настоящим изобретением, входит в объем настоящего изобретения, независимо от применяемых кодонов.
[00426] Многие организмы демонстрируют склонность к использованию определенных кодонов, кодирующих вставки определенных аминокислот в растущую полипептидную цепь. Неслучайное использование кодонов, или смещение частот использования кодонов, различия в использовании кодонов среди организмов, обеспечивается за счет вырождения генетического кода, и хорошо задокументировано для многих организмов. Смещение частот использования кодонов часто коррелирует с эффективностью трансляции информационной РНК (иРНК), которая, предположительно, в свою очередь зависит от, в частности, свойств транслируемых кодонов и доступности определенных молекул транспортной РНК (тРНК). Преобладание выбранных тРНК в клетке, как правило, отражает то, какие кодоны наиболее часто используются при синтезе пептидов. Соответственно, гены могут быть адаптированы для оптимальной генной экспрессии в данном организме, на основе оптимизации кодонов.
[00427] Полинуклеотиды получают путем включения кодонов, предпочтительных для применения в генах данного вида, в последовательность ДНК.
[00428] Учитывая большое количество доступных последовательностей генов для широкого спектра видов животных, растений и микроорганизмов, возможно вычислить относительную частоту использования кодонов. Таблицы кодонов легко доступны, например, в «Codon Usage Database» («База данных по частотам встречаемости кодонов»), доступной по ссылке http://www.kazusa.or.jp/codon/ (посещалась 30 мая 2006 г.), и эти таблицы могут быть адаптированы при помощи ряда способов. См. Nakamwa, Y., et al., «Codon usage tabulated from the international DNA sequences databases: status for the year 2000» («Таблицы частот использования кодонов по международным базам данных последовательностей ДНК: статус на 2000 год») Nucl. Кислоты Res. 28:292 (2000). Таблицы частот использования кодонов для человека, рассчитанные по выпуску 151.0 GenBank, приведены ниже в виде таблицы 5 (из http://www.kazusa.or.jp/codon/, выше). В этих таблицах использована иРНК-номенклатура, поэтому вместо тимина (Т), который входит в состав ДНК, в таблицах указан урацил (U), который входит в состав РНК. Таблицы были изменены таким образом, что частоты рассчитаны для каждой аминокислоты, а не для всех 64 кодонов.
[00429] Используя такие или сходные таблицы, средний специалист в данной области техники может применить указанные частоты к любой конкретной полипептидной последовательности и получить фрагмент нуклеиновой кислоты с кодирующей областью с оптимизированным составом кодонов, которая кодирует указанный полипептид, но использует кодоны, оптимальные для конкретного вида.
[00430] Ряд вариантов доступен для синтеза кодирующих областей с оптимизированным составом кодонов, сконструированных любым из описанных выше способов с применением стандартных и рутинных молекулярно-биологических манипуляций, хорошо известных специалистам в данной области.
[00431] Согласно одному из вариантов реализации кодирующая область, кодирующая иммуномодулятор, например, TNF-альфа, в векторе, предложенном в соответствии с настоящим изобретением, имеет оптимизированный состав кодонов. Согласно еще одному варианту реализации кодирующая область имеет оптимизированный состав кодонов для экспрессии у человека. Согласно конкретному варианту реализации TNF-альфа в соответствии с настоящим изобретением кодируется последовательностью нуклеиновой кислоты с оптимизированным составом кодонов.
[00432] Для введения полинуклеотидов в клетки in vivo или ex vivo может быть использован вектор. Указанный вектор может представлять собой, например, плазмидный вектор или одно- или двуцепочечный РНК или ДНК вирусный вектор. Такие векторы могут быть введены в клетки нуждающегося в этом пациента, например, млекопитающего, при помощи общеизвестных методик введения ДНК и РНК в клетки. Вирусные векторы могут быть репликативно-компетентными или репликативно дефектными. В последнем случае размножение вируса, как правило, происходит только в комплементарных клеток-хозяев. Используемый в настоящей заявке термин «клетка хозяина» или «хозяин» применяют для обозначения клетки согласно настоящему изобретению, содержащей один или более полинуклеотид согласно настоящему изобретению.
[00433] Таким образом, как минимум, указанные векторы должны включать полинуклеотиды согласно настоящему изобретению. Другие компоненты указанного вектора могут включать, не ограничиваясь перечисленными, селектируемые маркеры, домены модификации хроматина, дополнительные промоторы, управляющие экспрессией других полипептидов, которые могут также присутствовать на указанном векторе (например, летального полипептида), сайты геномной интеграции, сайты рекомбинации и точками встраивания молекул. Векторы могут содержать любое число таких дополнительных элементов, либо в составе, либо вне указанных полинуклеотидов, таким образом, что указанный вектор может быть адаптирован с учетом конкретных целей нужных терапевтических способов.
[00434] Согласно одному из вариантов реализации векторы, которые введены в клетки, дополнительно содержат «селектируемый маркерный ген», экспрессия которого указывает на то, что конструкция генного переключателя согласно настоящему изобретению была встроена в геном клетки-хозяина. Таким образом, ген-селектор может быть положительным маркером встраивания в геном. Хотя это и не принципиально для способов, предложенных в соответствии с настоящим изобретением, присутствие селектируемого маркерного гена позволяет специалисту отобрать популяцию живых клеток, где указанная векторная конструкция была встроена в геном клеток. Таким образом, некоторые варианты реализации настоящего изобретения включает отбор клеток, в которые был успешно встроен вектор. Используемый в настоящей заявке в отношении клеток термин «отбор» («выбор»), или его варианты, предназначен(ы) для обозначения стандартных, хорошо известных способов выбора клеток с определенными генетическими характеристиками или фенотипом. Типовые способы включают, не ограничиваясь перечисленными, культивирование клеток в присутствии антибиотиков, таких как G418, неомицин и ампициллин. Другие примеры селектируемых маркерных генов включают, не ограничиваясь перечисленными, гены, придающие устойчивость к дигидрофолатредуктазе, гигромицину или микофеноловой кислоте. Другие способы отбора включают, не ограничиваясь перечисленным, селектируемый маркерный ген, позволяющий применение тимидинкиназы, гипоксантин-гуанин фосфорибозилтрансферазы или аденинфосфорибозилтрансферазы в качестве агентов для селекции. Клетки, содержащие векторную конструкцию, содержащую ген или гены устойчивости к антибиотику, при этом будут способны переносить присутствие антибиотика в культуре. Соответственно, клетки, не содержащие векторную конструкцию, содержащую ген или гены устойчивости к антибиотику будут неспособны переносить присутствие антибиотика в культуре.
[00435] Используемый в настоящей заявке термин «домен модификации хроматина» (CMD) относится к нуклеотидным последовательностям, взаимодействующим с разнообразными белками, связанными с поддержанием и/или изменением структуры хроматина, такими как, не ограничиваясь перечисленным, инсуляторы ДНК. См. Ciavatta et al., Proc. Nat’l Acad. Sci. U.S.A., 103:9958 (2006). Примеры CMD включают, не ограничиваясь перечисленными, куриный β-глобулиновый инсулятор и куриный сверхчувствительный сайт 4 (cHS4). Применение различных CMD последовательностей между одной или более из генетических программ (т.е. промотором, кодирующей последовательностью и 3’ регуляторной областью), например, может способствовать применению дифференциальных CMD-последовательностей ДНК в качестве «мини-плеч гомологии» в комбинации с различными микроорганизмами или in vitro методиками рекомбинации для «обмена» генетическими программами между существующими мультигенными и моногенными челночными векторами. Другие примеры доменов модификации хроматина известны в данной области техники или могут быть легко определены.
[00436] Кодирующие области полинуклеотидов и нуклеиновых кислот в векторе, предложенном в соответствии с настоящим изобретением, могут быть связаны с дополнительными кодирующими областями, которые кодируют секреторные или сигнальные пептиды, направляющие секрецию иммуномодулятора, например, TNF-альфа. В соответствии с сигнальной гипотезой, белки, секретируемые клетками млекопитающих, содержат сигнальный пептид или секреторную лидерную последовательность, которая вырезается из зрелого белка при инициации выхода растущей белковой цепи из шероховатого эндоплазматического ретикулума. Полипептиды, секретируемые клетками позвоночных животных, как правило, содержат сигнальный пептид, слитый с N-концом указанного полипептида, который вырезается из первичного, или «непроцессированного» полипептида с получением секретируемой, или «зрелой», формы указанного полипептида.
[00437] Согласно одному из вариантов реализации вектор, предложенный в соответствии с настоящим изобретением, содержит полинуклеотид, кодирующий генный переключатель, причем указанный полинуклеотид содержит (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, где указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, и (2) полинуклеотид, кодирующий один или более белок, обладающий функцией иммуномодулятора, функционально связанный с промотором, который активируется указанным лиганд-зависимым транскрипционным фактором, причем указанный полинуклеотид, кодирующий один или более белок, обладающий функцией иммуномодулятора, дополнительно содержит последовательность нуклеиновой кислоты, кодирующую сигнальный пептид. Согласно еще одному варианту реализации указанный сигнальный пептид стимулирует секрецию указанного иммуномодулятора, например, TNF-альфа, кодируемого указанным вектором, по сравнению с вектором, содержащим нативный ген сигнального пептида указанного иммуномодулятора, например, ген сигнального пептида TNF-альфа дикого типа. В частности, сигнальный пептид, применяемый в соответствии с настоящим изобретением, может иметь оптимизированный состав кодонов. Согласно конкретному варианту реализации указанный сигнальный пептид кодируется геном сигнального пептида IL-2 дикого типа. Согласно другому конкретному варианту реализации указанный сигнальный пептид кодируется геном сигнального пептида IL-2 с оптимизированным составом кодонов.
[00438] Вектор, предложенный в соответствии с настоящим изобретением, может содержать различные регуляторные области, например, 5’-нетранслируемую область (5’-UTR), 3’-UTR, или их обе. Настоящее изобретение также относится к применению различных регуляторных областей для индуцирования увеличения секреции, трансляции белка, пост-трансляции, транскрипции иРНК или посттранскрипционного процесса. Под используемым в настоящей заявке термином «5’ нетранслируемая область» или «5’UTR» гена подразумевается часть гена, транскрибируемая в первичный РНК-транскрипт (пре-иРНК), и расположенная в обратном (к 5’ концу) направлении от кодирующей последовательности. Указанный первичный транскрипт представляет собой начальный РНК-продукт, содержащий интроны и экзоны, получаемый в результате транскрипции ДНК. Многие первичные транскрипты должны проходить РНК-процессинг с образованием физиологически активных видов РНК. Процессинг зрелой иРНК может включать обрезание концов, удаление интронов, кэпирование и/или вырезание индивидуальных молекул рРНК из их РНК-предшественников. 5’UTR иРНК представляет собой, таким образом, ту часть иРНК, которая не транслируется в белок и которая расположена в обратном (к 5’ концу) направлении от кодирующей последовательности. В геномной последовательности 5’UTR, как правило, определяют как область между сайтом инициации транскрипции и инициирующим кодоном. 5’-нетранслируемые области (5 ‘UTR) иРНК позвоночных могут иметь длину от нескольких десятков оснований до нескольких сотен оснований (Crowe et al., 2006 BMC Genomics 7:16). 5’UTR, применяемые в соответствии с настоящим изобретением, могут встречаться в природе или быть модифицированы таким образом, чтобы содержать одну или более последовательностей нуклеиновых кислот, в природе не являющихся последовательными (химерные последовательности), и/или могут охватывать замены, вставки, удаления и их комбинации. Согласно одному из вариантов реализации последовательность 5’UTR происходит из последовательности TNF-альфа или последовательности 5U2 дикого типа. Согласно еще одному варианту реализации последовательность 5’UTR представляет собой 5’UTR 5U2. Согласно некоторым вариантам реализации указанная 5’UTR индуцирует увеличенную экспрессию белка, например, транскрипцию иРНК, пре-транскрипцию или посттранскрипцию.
[00439] Под 3’-нетранслируемой областью (UTR)» согласно применению в соответствии с настоящим изобретением понимается последовательность ДНК, которая расположена в прямом направлении (3’) от кодирующей последовательности, и может содержать последовательности распознавания полиаденилирования [поли-А] и другие последовательности, кодирующие регуляторные сигналы, способные влиять на процессинг иРНК или генную экспрессию. Сигнал полиаденилирования, как правило, характеризуется влиянием на добавление участков полиадениловой кислоты к 3’ концу предшественника иРНК. Можно применять любую подходящую полиаденилирующую последовательность, включая синтетическую оптимизированную последовательность, а также полиаденилирующую последовательность BGH (бычий гормон роста), вирус полиомы, ТК. (тимидинкиназу), EBV (вирус Эпштейна-Барр), и папилломавирусы, включая папилломавирусы человека и BPV (бычий вирус папилломы). Согласно конкретному варианту реализации 3’-регуляторная область представляет собой полиаденилирующую последовательность SV40e (вируса саркомы-40 человека). Согласно другому конкретному варианту реализации 3’-регуляторная область представляет собой полиаденилирующую последовательность гормона роста человека.
[00440] Согласно определенным вариантам реализации сигнальный пептид и/или регуляторная область по отдельности или в комбинации могут повышать секрецию белка, транскрипцию или трансляцию по меньшей мере 2-кратно, 3-кратно, 4-кратно, 5-кратно, 6-кратно, 7-кратно, 8-кратно, 9-кратно, 10-кратно, 50-кратно, 100-кратно, 200-кратно, 300-кратно, 400-кратно или 500-кратно по сравнению с контролем, который не содержат указанного сигнального пептида и/или указанной регуляторной области. Уровень секреции белка, например, TNF-альфа, может быть нормализован по экспрессии белка, кодируемого вектором, содержащим ген дикого типа. Согласно другому конкретному варианту реализации настоящего изобретения указанный(ая) сигнальный пептид и/или регуляторная область по отдельности или в комбинации увеличивают эффективность иммуномодулятора, например, TNF-альфа, на приблизительно от 5% до приблизительно 10%, на приблизительно от 11% до приблизительно 20%, на приблизительно от 21% до приблизительно 30%, на приблизительно от 31% до приблизительно 40%, на приблизительно от 41% до приблизительно 50%, на приблизительно от 51% до приблизительно 60%, на приблизительно от 61% до приблизительно 70%, на приблизительно от 71% до приблизительно 80%, на приблизительно от 81% до приблизительно 90%, на приблизительно от 91% до приблизительно 100%, на приблизительно от 101% до приблизительно 149%, на приблизительно от 150% до приблизительно 199%, на приблизительно от 200% до приблизительно 299%, на приблизительно от 300% до приблизительно 499%, или на приблизительно от 500% до приблизительно 1000%. Согласно конкретному варианту реализации настоящее изобретение включает вектор, условно экспрессирующий иммуномодулятор, например, TNF-альфа, причем указанный вектор содержит 5’ UTR 5U2, последовательность нуклеиновой кислоты с оптимизированным составом кодонов, кодирующую сигнальный пептид IL-2, кодирующую область с оптимизированным составом кодонов, кодирующую иммуномодулятор, например, TNF-альфа, и сигнал полиаденилирования SV40e или гормона роста человека.
[00441] Согласно еще одному варианту реализации вектор, предложенный в соответствии с настоящим изобретением, содержит полинуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO:47 (Вектор 43318), SEQ ID NO:48 (Вектор 43319), SEQ ID NO:49 (Вектор 43320), SEQ ID NO:50 (Вектор 43321), SEQ ID NO:51 (Вектор 43322), SEQ ID NO:52 (Вектор 43323), SEQ ID NO:53 (Вектор 43324), SEQ ID NO:54 (Вектор 43325), SEQ ID NO:55 (Вектор 43326), SEQ ID NO:56 (Вектор 43327), SEQ ID NO:57 (Вектор 43328), и SEQ ID NO:58 (Вектор 43329). Согласно еще одному конкретному варианту реализации вектор содержит полинуклеотидную последовательность SEQ ID NO:52 (вектор 43323) или SEQ ID NO:58 (вектор 43329).
[00442] Определенные векторы для применения согласно настоящему изобретению представляют собой экспрессионные векторы, кодирующие белки или полинуклеотиды. Как правило, такие векторы содержат цис-активные контрольные области, эффективные для экспрессии в хозяине, функционально связанном с полинуклеотидом, который должен быть экспрессирован. Подходящие транс-активные факторы обеспечиваются хозяином, обеспечиваются комплементирующим вектором или обеспечиваются самим вектором при введении хозяину.
[00443] Для экспрессии белков или полинуклеотидов можно применять значительное разнообразие экспрессионных векторов. Такие векторы включают хромосомные, эписомные и происходящие из вирусов векторы, например, векторы, происходящие из бактериальных плазмид, бактериофагов, дрожжевых эписом, дрожжевых хромосомных элементов, вирусов, таких как аденоассоциированные вирусы, лентивирусы, бакуловирусы, паповавирусы, такие как SV40, вирусы осповакцины, аденовирусы, поксвирусы домашней птицы, вирусы псевдобешенства и ретровирусы, и векторы, происходящие из их комбинаций, такие как полученные из генетических элементов плазмид и бактериофагов, например, космиды и фагемиды. Все они могут применяться для экспрессии в соответствии с данным аспектом настоящего изобретения. Как правило, любой вектор, подходящий для поддержания, распространения или экспрессии полинуклеотидов или белков в хозяине, может в данном случае применяться для экспрессии.
[00444] Подходящие вирусные векторы, применяемые в соответствии с настоящим изобретением, включают, не ограничиваясь перечисленными, векторы на основе аденовирусов, ретровирусные векторы, векторы на основе вируса простого герпеса (HSV), векторы на основе парвовирусов, например, векторы на основе аденоассоциированного вируса (AAV), и AAV-аденовирусные гибридные векторы. Такие вирусные векторы могут быть получены с применением стандартных методик рекомбинантных ДНК, описанных, например, в Sambrook et al., Molecular Cloning, a Laboratory Manual, 2d edition. Cold Spring Harbor Press, Cold Spring Harbor, N.Y. (1989), и Ausubel et al., Current Protocols in Molecular Biology, Greene Publishing Associates and John Wiley & Sons, New York, N.Y. (1994).
[00445] Согласно одному из вариантов реализации вирусный вектор, предложенный в соответствии с настоящим изобретением, представляет собой аденовирусный вектор. Аденовирус (Ad) представляет собой двуцепочечный ДНК-вирус размером 36 т.п.н., который эффективно переносит ДНК in vivo во множество различных целевых типов клеток. Указанный аденовирусный вектор может быть получен в высоких титрах и может эффективно переносить ДНК в реплицирующиеся и не-реплицирующиеся клетки. Геном аденовирусного вектора может быть синтезирован с применением любых видов, штамма, подтипа, смеси видов, штаммов или подтипов, или гибридного аденовируса в качестве источника векторной ДНК. Аденовирусные культуры, которые могут быть использованы в качестве источника аденовируса, могут быть амплифицированы из аденовирусных серотипов 1-51, которые в настоящий момент доступны от American Type Culture Collection (ATCC, Манассас, Виргиния), или из любого другого серотипа аденовируса, доступного из любого другого источника. Например, аденовирус может быть из подгруппы А (например, серотипы 12, 18 и 31), подгруппы В (например, серотипы 3, 7, 11,14,16,21, 34 и 35), подгруппы С (например, серотипы 1, 2, 5 и 6), подгруппы D (например, серотипы 8, 9, 10, 13, 15, 17, 19, 20, 22-30, 32, 33, 36-39 и 42-47), подгруппы Е (серотип 4), подгруппы F (серотипы 40 и 41), либо представлять собой любой другой аденовирусный серотип. С учетом того, что геном серотипа 5 аденовируса человека (Ad5) был полностью секвенирован, аденовирусный вектор, предложенный в соответствии с настоящим изобретением, описан в настоящей заявке применительно к серотипу Ad5. Указанный аденовирусный вектор может представлять собой любой аденовирусный вектор, способный к росту в клетке, значительная часть которого (хотя и не обязательно наибольшая), происходит из генома аденовируса или основана на нем. Указанный аденовирусный вектор может быть основан на геноме любого подходящего аденовируса дикого типа. Согласно определенным вариантам реализации аденовирусный вектор происходит из генома аденовируса дикого типа группы С, в частности, серотипа 2 или 5. Аденовирусные векторы хорошо известны в данной области техники и описаны, например, в патентах США №№5559099, 5712136, 5731190, 5837511, 5846782, 5851806, 5962311, 5965541, 5981225, 5994106, 6020191 и 6113913, международных патентных заявках WO 95/34671, WO 97/21826 и WO 00/00628, и у Thomas Shenk, «Adenoviridae and their Replication» и M.S. Horwitz «Adenoviruses», главы 67 и 68, соответственно, в «Virology» под редакцией В. N. Fields и др., 3 изд.. Raven Press, Ltd., Нью Йорк (1996).
[00446] Согласно другим вариантам реализации аденовирусный вектор является репликативно-дефектным. Используемый в настоящей заявке термин «репликативно-дефектный» означает, что аденовирусный вектор содержит геном, лишенный по меньшей мере одной необходимой для репликации генной функции. Дефицитность по гену, генной функции или генной или геномной области при использовании в настоящей заявке определены как удаление достаточной части генетического материала вирусного генома, с нарушением или уничтожением функции гена, последовательность нуклеиновой кислоты которого была удалена полностью или частично. Необходимые для репликации генные функции представляют собой такие генные функции, которые требуются для репликации (т.е. размножения) репликативно-дефектного аденовирусного вектора. Необходимые для репликации генные функции кодируются, например, ранними областями аденовируса (например, областями Е1, Е2, и Е4), поздними областями (например, областями L1-L5), генами, вовлеченными в упаковку вируса (например, геном IVa2), и вирус-ассоциированные РНК (например, ВА-РНК I и/или ВА-РНК II). В дальнейших вариантах реализации указанный репликативно-дефектный аденовирусный вектор содержит аденовирусный геном, дефицитный по меньшей мере по одной необходимой для репликации генной функции одной или более области аденовирусного генома (например, двух или более областей аденовирусного генома, что дает множественно репликативно-дефектный аденовирусный вектор). Указанная одна или более область аденовирусного генома выбрана из группы, состоящей из областей Е1, Е2 и Е4. Указанный репликативно-дефектный аденовирусный вектор может быть дефицитным по меньшей мере по одной области Е1, необходимой для репликации генной функции (называемый E1-дефицитным аденовирусным вектором), в частности, дефицитным по необходимой для репликации генной функции каждой из указанных аденовирусных областей Е1А и аденовирусной области Е1В. Помимо такого дефицита (отсутствия) области Е1, рекомбинантный аденовирус дополнительно может содержать мутацию в главном позднем промоторе (MLP), что обсуждается в международной патентной заявке WO 00/00628. Согласно конкретному варианту реализации указанный вектор является дефицитным по меньшей мере по одной необходимой для репликации генной функции области Е1 и по меньшей мере части вспомогательной области Е3 (например, удаление Xba I из области Е3) (называемый E1/Е3-дефицитным аденовирусным вектором).
[00447] Согласно определенным вариантам реализации аденовирусный вектор является «множественно-дефектным», то есть указанный аденовирусный вектор является дефицитным по одной или более генной функции, требуемой для вирусной репликации, в каждой из двух или более областей указанного аденовирусного генома. Например, вышеупомянутый E1-дефицитный или Е1/Е3-дефицитный аденовирусный вектор может быть также дефицитным по меньшей мере по одной необходимой для репликации генной функции области Е4 (называемый Е1/Е4-дефицитным аденовирусным вектором). Аденовирусный вектор с полностью удаленной областью Е4 может вызывать у хозяина пониженный иммунный ответ.
[00448] Как вариант, аденовирусный вектор лишен необходимых для репликации генных функций всей или в части области Е1 и всей или в части области Е2 (называемый Е1/Е2-дефицитным аденовирусным вектором). Аденовирусные векторы, лишенные необходимых для репликации генных функций всей или в части области Е1, всей или в части области Е2, и всей или в части области Е3 также предполагаются настоящим изобретением. В том случае, если аденовирусный вектор, предложенный в соответствии с настоящим изобретением, является дефицитным по необходимой для репликации генной функции области Е2А, указанный вектор не содержит полного удаления области Е2А, которая составляет менее чем приблизительно 230 п.о. длиной. Как правило, область Е2А аденовируса кодирует DBP (ДНК связывающий белок), полипептид, требуемый для репликации ДНК. DBP состоит из 473-529 аминокислот в зависимости от серотипа вируса. Предположительно, DBP представляет собой асимметричный белок, существующий в виде вытянутого эллипсоида, состоящего из глобулярной Ct с удлиненным Nt-доменом. Исследования показывают, что Ct-домен отвечает за способность DBP связываться с нуклеиновыми кислотами, связываться с цинком и функционировать в синтезе ДНК на уровне удлинения цепи ДНК. При этом Nt-домен, предположительно, функционирует в поздней генной экспрессии как на транскрипционном, так и на пост-транскрипционном уровне, отвечает за эффективную ядерную локализацию белка, а также может быть вовлечен вусиление собственной экспрессии. Удаления в Nt-домене между аминокислотами 2-38 показали, что эта область важна для функционирования DBP (В rough et al., Virology, 196,269-281 (1993)). В то время как удаления в области Е2А, кодирующей Ct-область DBP, не оказывают эффектов на вирусную репликацию, удаления в области Е2А, которая кодирует аминокислоты 2-38 Nt-домена DBP нарушают вирусную репликацию. Согласно одному из вариантов реализации множественно репликативно-дефектный аденовирусный вектор содержит этот фрагмент области Е2А указанного аденовирусного генома. В частности, например, фрагментом области Е2А, которую требуется сохранить, является тот фрагмент области Е2А указанного аденовирусного генома, который определен 5’-концом области Е2А, а конкретно, положениями Ad5(23816)-Ad5(24032) области Е2А указанного аденовирусного генома серотипа Ad5.
[00449] Указанный аденовирусный вектор может быть дефицитным по необходимой для репликации генной функции только ранних областей указанного аденовирусного генома, только поздних областей указанного аденовирусного генома, и обеих, ранней и поздней, областей указанного аденовирусного генома. Также из аденовирусного вектора может был удален практически весь аденовирусный геном, в этом случае оставляют нетронутыми по меньшей мере либо вирусные инвертированные концевые повторы (ITR) и один или более промотор, либо вирусные ITR и сигнал упаковки (т.е. аденовирусный ампликон). Чем больше удаленная область аденовирусного генома, тем больший участок экзогенной последовательности нуклеиновой кислоты может быть встроен в геном. Например, при условии, что размер аденовирусного генома 36 т.п.н. и нетронутыми оставлены вирусные ITR и один или более промотор, в указанный аденовирус возможно встраивание экзогенного участка приблизительно 35 т.п.н. Как вариант, множественно-дефектный аденовирусный вектор, который содержит только ITR и сигнал упаковки, позволяет эффективное встраивание экзогенной последовательности нуклеиновой кислоты длиной приблизительно 37-38 т.п.н. Конечно, включение спейсерного элемента в любую из дефектных аденовирусных областей, или во все, увеличивает потенциал аденовирусного вектора для больших вставок. Подходящие репликативно-дефектные аденовирусные векторы, включая множественно-дефектные аденовирусные векторы, раскрыты в патентах США №№5851806 и 5994106, и международных патентных заявках WO 95/34671 и WO 97/21826. Согласно одному из вариантов реализации вектор для применения в способе согласно настоящему изобретению представляет собой описанный в международной патентной заявке PCT/US01/20536.
[00450] Следует учитывать, что удаление различных областей аденовирусного вектора может изменять иммунный ответ млекопитающего. В частности, удаление различных областей может снижать воспалительный ответ, производимый аденовирусным вектором. Кроме того, белок оболочки аденовирусного вектора может быть модифицирован так, чтобы понижать возможность или невозможность распознавания аденовирусного вектора нейтрализующим антителом, направленным против белка оболочки дикого типа, согласно описанию в международной патентной заявке WO 98/40509.
[00451] Аденовирусный вектор, в том случае, если он множественно репликативно-дефектный, особенно по необходимым для репликации генным функциям областей Е1 и Е4, могут включать спейсерный элемент для обеспечения роста вируса в комплементарной клеточной линии, сходный с достигаемым одиночно репликативно-дефектными аденовирусными векторами, в частности, аденовирусным вектором, дефектным по области Е1. Указанный спейсерный элемент может содержать любую последовательность или последовательности, которые имеют требуемую длину. Последовательность спейсерного элемента может быть кодирующей или некодирующей, нативной или ненативной относительно аденовирусного генома, но не восстанавливать необходимую для репликации функцию дефицитной области. В отсутствие спейсера синтез волокнистого белка и/или рост вируса множественно репликативно-дефектного аденовирусного вектора снижен(ы) по сравнению с таковым(и) одиночно репликативно-дефектного аденовирусного вектора. При этом включение указанного спейсера по меньшей мере в одну область дефицитного аденовируса, предпочтительно область Е4, может противодействовать этому снижению синтеза волокнистого белка и роста вируса. Применение спейсера в аденовирусном векторе описано в патенте США №5851806.
[00452] Конструирование аденовирусных векторов хорошо известно в данной области техники. Аденовирусные векторы могут быть сконструированы и/или очищены с применением способов, изложенных, например, в патенте США №5965358 и международных заявках на патент WO 98/56937, WO 99/15686 и WO 99/54441. Получение аденовирусных векторов для переноса генов общеизвестно в данной области техники и задействует применение стандартных молекулярно-биологических методов, таких как описанные, например, у Sambrook et at., выше, Watson et al., выше, Ausubel et al., выше, и в нескольких других источниках, упоминаемых в настоящей заявке.
[00453] Репликативно-дефектные аденовирусные векторы, как правило, синтезируют в комплементарных клеточных линиях, которые обеспечивают генные функции, не присутствующие в указанных репликативно-дефектных аденовирусных векторах, но требуемые для размножения вируса, на подходящих уровнях для получения высоких титров вирусного векторного материала. Согласно одному из вариантов реализации клеточная линия восполняет по меньшей мере одну и/или все необходимые для репликации генные функции, не присутствующие в репликативно-дефектном аденовирусе. Указанная комплементарная клеточная линия может восполнять дефицит по меньшей мере одной необходимой для репликации генной функции, кодируемой ранними областями, поздними областями, областями упаковки вируса, областями вирус-ассоциированной РНК или их комбинациями, включая все аденовирусные функции (например, позволять размножение аденовирусных ампликонов, который содержат минимальные аденовирусные последовательности, например, только инвертированные концевые повторы (ITR) и сигнал упаковки, или только ITR и аденовирусный промотор). Согласно еще одному варианту реализации комплементарная клеточная линия восполняет дефицит по меньшей мере по одной необходимой для репликации генной функции (например, двум или более необходимым для репликации генным функциям) области Е1 указанного аденовирусного генома, в частности, дефицит по необходимой для репликации генной функции каждой из областей Е1А и Е1В. Кроме того, комплементарная клеточная линия может восполнять дефицит по меньшей мере по одной необходимой для репликации генной функции области Е2 (в частности, в отношении аденовирусной ДНК-полимеразы и концевого белка) и/или Е4 указанного аденовирусного генома. Желательно, чтобы клетка, которая восполняет дефицит по области Е4, содержала последовательность гена E4-ORF6 и синтезировала белок E4-ORF6. Желательно, чтобы такая клетка по меньшей мере содержала ORF6 и не содержала других ORF области Е4 указанного аденовирусного генома. Клеточная линия предпочтительно дополнительно характеризуется тем, что содержит комплементарные гены, которые не перекрываются с указанным аденовирусным вектором, что минимизирует и практически сводит на нет возможность рекомбинирования генома указанного вектора с клеточной ДНК. Соответственно, присутствие репликативно компетентных аденовирусов (RCA) минимизируют или даже избегают его в векторных культурах, которые, таким образом, подходят для определенных терапевтических целей, в частности, для целей генной терапии. Отсутствие RCA в векторной культуре предотвращает репликацию аденовирусного вектора в некомплементарных клетках. Конструирование комплементарных клеточных линий задействует стандартные методики молекулярной биологии и культивирования клеток, такие как описанные у Sambrook et al., выше, и Ausubel et al., выше. Комплементарные клеточные линии для получения вектора для переноса генов (например, аденовирусного вектора) включают, не ограничиваясь перечисленными, клетки линии 293 (описанные, например, у Graham et al., J. Gen. Virol., 36, 59-72 (1977)), PER.C6 клетки (описанные, например, в международной патентной заявке WO 97/00326 и патентах США №№5994128 и 6033908) и клетки 293-ORF6 (описанные, например, в международной патентной заявке WO 95/34671 и у Brough etal., J. Virol., 71, 9206-9213 (1997)). Встраивание последовательности нуклеиновой кислоты в аденовирусный геном (например, область Е1 указанного аденовирусного генома) может быть облегчено с помощью известных способов, например, путем введения уникального сайта рестрикции в определенное положение указанного аденовирусного генома.
[00454] Ретровирус представляет собой РНК-вирус, способный к инфицированию широкого спектра клеток-хозяев. При инфицировании ретровирусный геном интегрируется в геном клетки-хозяина и реплицируется наряду с ДНК клетки-хозяина, постоянно синтезируя за счет этого вирусную РНК и любую последовательность нуклеиновой кислоты, встроенную в ретровирусный геном. Таким образом, при применении ретровирусов достижима долгосрочная экспрессия терапевтического(их) фактора(ов). Ретровирусы для предполагаемого применения в генной терапии относительно непатогенные, хотя существуют и патогенные ретровирусы. При использовании патогенных ретровирусов, например, вируса иммунодефицита человека (ВИЧ) или лимфотропных вирусов Т-клеток человека (HTLV), необходимо соблюдать предосторожность, изменяя вирусный геном для устранения токсичности для хозяина. Ретровирусный вектор дополнительно может быть обработан для преобразования указанного вируса в репликативно-дефектный. Таким образом, ретровирусные векторы считаются особенно подходящими для стабильного переноса генов in vivo. Лентивирусные векторы, такие как векторы на основе ВИЧ, являются примером ретровирусных векторов, применяемых для доставки генов. Известно, что, в отличие от других ретровирусов, векторы на основе ВИЧ встраивают гены-пассажиры в неделящиеся клетки и, таким образом, могут быть полезны при лечении персистирующих форм заболевания.
[00455] Вирусный вектор на основе HSV подходит для применения в качестве вектора для переноса генов для введения нуклеиновой кислоты в многочисленные типы клеток. Зрелый вирион HSV состоит из заключенного в оболочку икосаэдрического капсида с вирусным геномом, состоящим из линейной двуцепочечной молекулы ДНК размером 152 т.п.н. Большинство репликативно-дефектных HSV-векторов содержат удаления одного или более промежуточных-ранних генов для предотвращения репликации. Преимуществами HSV-вектора являются его способность входить в латентную фазу, что может приводить к долгосрочной экспрессии ДНК, и его большой вирусный ДНК-геном, в котором могут быть размещены до 25 т.п.н. вставок экзогенной ДНК. Конечно, способность HSV содействовать долгосрочному синтезу экзогенного белка потенциально неблагоприятна в отношении краткосрочных схем лечения. Как бы то ни было, средний специалист в данной области техники владеет необходимым пониманием для определения подходящего для определенной ситуации вектора. Векторы на основе HSV описаны, например, в патентах США №№5837532, 5846782, 5849572 и 5804413, и международных заявках на патент WO 91/02788, WO 96/04394, WO 98/15637 и WO 99/06583.
[00456] AAV-векторы являются вирусными векторами, представляющими особый интерес для применения в протоколах генной терапии. AAV представляет собой ДНК-вирус, не вызывающий, насколько известно, заболеваний человека. Геном AAV состоит из двух генов, rep и cap, фланкированных инвертированными концевыми повторами (ITR), которые содержат сигналы распознавания для ДНК репликации и упаковки вируса. AAV нуждается в ко-инфицировании хелперным вирусом (т.е. аденовирусом или вирусом простого герпеса), или экспрессии хелперных генов, для эффективной репликации. AAV может размножаться в широком спектре клеток-хозяев, включая клетки человека, обезьян и грызунов, в зависимости от используемого хелперного вируса. Как правило, приблизительно 96% родительского генома AAV-вектора, применяемого для введения последовательности нуклеиновой кислоты, удалено, таким образом, что остаются только ITR. Это исключает иммунологические или токсические побочные эффекты экспрессии вирусных генов. При необходимости белок rep AAV можно вводить совместно с вектором AAV, чтобы обеспечить интеграцию вектора AAV в геном клетки-хозяина. Клетки-хозяева, содержащие интегрированный геном AAV, не демонстрируют изменений в клеточном росте или морфологии (см., например, патент США №4797368). Таким образом, продленная экспрессия терапевтических факторов из векторов AAV может быть полезна при лечении персистирующих и хронических заболеваний.
[00457] Полинуклеотидная последовательность в экспрессионном векторе функционально связана с подходящей(ими) последовательностью(ями) контроля экспрессии, включая, например, промотор, направляющий транскрипцию иРНК. Представители дополнительных промоторов включают, не ограничиваясь перечисленными, конститутивные промоторы и тканеспецифичные или индуцируемые промоторы. Примеры конститутивных эукариотических промоторов включают, не ограничиваясь перечисленными, промотор гена металлотионеина I мыши (Hamer et al., J. Mol. Appl. Gen. 7:273 (1982)); TK-промотор вируса герпеса (McKnight, Cell 31:355 (1982)); ранний промотор SV40 (Benoist et al., Nature 290:304 (1981)); и промотор вируса осповакцины. Дополнительные примеры промоторов, которые могут применяться для запуска экспрессии белка или полинуклеотида, включают, не ограничиваясь перечисленными, тканеспецифичные промоторы и другие эндогенные промоторы специфических белков, таких как промотор альбумина (гепатоциты), промотор проинсулина (бета клетки поджелудочной железы) и т.п. Как правило, экспрессионные конструкции содержат сайты транскрипции, инициации и терминации, и, в транскрибируемой области, сайт связывания рибосом для трансляции. Кодирующая часть зрелых транскриптов, экспрессируемых указанными конструкциями, может включать инициатор трансляции AUG в начале и терминирующий кодон (UAA, UGA или UAG), соответствующим образом расположенный на конце полипептида, который требуется транслировать.
[00458] Кроме того, указанные конструкции могут содержать контрольные области, которые регулируют, а также вызывают экспрессию. Как правило, такие области работают за счет контроля транскрипции, например, сайтов связывания репрессоров, и энхансеров, помимо прочих.
[00459] Примеры эукариотических векторов включают, не ограничиваясь перечисленными, pW-LNEO, pSV2CAT, pOG44, pXT1 и pSG, доступные у Stratagene; pSVK3, pBPV, pMSG и pSVL, доступные от Amersham Pharmacia Biotech; и pCMVDsRed2-express, pIRES2-DsRed2, pDsRed2-Mito, и pCMV-EGFP, доступные от Clontech. Многие другие векторы общеизвестны и коммерчески доступны.
[00460] Особенно подходящие векторы, которые содержат molecular insertion pivots для быстрого встраивания и удаления элементов генетических программ, описаны в опубликованной заявке на патент США №2004/0185556, заявке на патент США №11/233,246 и опубликованных заявках на международный патент №№WO 2005/040336 и WO 2005/116231. Примером таких векторов является ULTRAVECTOR® Production System (Intrexon Corp., Блэксберг, Виргиния), согласно описанию в WO 2007/038276. Используемый в настоящей заявке термин «генетическая программа» представляет собой комбинацию генетических элементов, содержащую промотор (Р), экспрессионную последовательность (Е) и 3’ регуляторную последовательность (3), так что «РЕ3» представляет собой генетическую программу. Элементы в составе генетической программы между поворотными центрами встраивания молекул можно легко заменять, которые фланкируют каждый из элементов указанной генетической программы. Используемый в настоящей заявке термин «поворотный центр встраивания молекул» обозначает полинуклеотид, содержащий по меньшей мере два невариабельных редких или необычных сайта рестрикции, расположенных линейно. Согласно одному из вариантов реализации поворотный центр встраивания молекул содержит по меньшей мере три невариабельных редких или необычных сайта рестрикции, расположенных линейно. Как правило, любой из центров встраивания молекул не включает редкий или необычный сайт рестрикции любого другого центра встраивания молекул в составе той же генной программы. Сходные последовательности более чем из 6 нуклеотидов, на которые действует данный рестрикционный фермент, называют «редкими» сайтами рестрикции. При этом существуют сайты рестрикции из 6 п.о., которые встречаются реже, чем можно статистически предсказать; такие сайты и эндонуклеазы, расщепляющие их, называют «необычными» сайтами рестрикции. Примеры редких или необычных рестрикционных ферментов включают, не ограничиваясь перечисленными, AsiS I, Рас I, Sbf I, Fse I, Asc I, Mlu I, SnaB I, Not I, Sal I, Swa I, Rsr II, BSiW I, Sfo I, Sgr AI, Afl III, Pvu I, Ngo MIV, Ase I, Flp I, Pme I, Sda I, Sgf I, Srf I, Nm I, Acl I, Cla I, Csp45 I, Age I, Bstl107 I, BstB I, Hpa I, Aat II, EcoR V, Nhe I, Spe I, Avi II, Avr II, Mfe I, Afe I, Fsp I, Kpn I, Sea I, BspE I, Nde I, Bfr I, Xho I, Pml I, ApaL I, Kas I, Xma I, BsrB I, Nsi I, Sac II, Sac I, Bip I, PspoM I, Pci I, Stu I, Sph I, BamH I, Bsu36 I, Xba I, BbvC I, Bgl II, Nco I, Hind III, EcoR I, BsrG I и Sse87811.
[00461] Указанный вектор может дополнительно содержать сайты рестрикции для второго класса рестрикционных ферментов, называемого хоминг-эндонуклеазными (НЕ) ферментами. НЕ-ферменты содержат большие асимметричные сайты рестрикции (12-40 п.о.), и их сайты рестрикции редко встречаются в природе. Например, НЕ, известный как I-SceI, содержит сайт рестрикции 18 п.о. (5TAGGGATAACAGGGTAAT3’ (SEQ ID NO:28)), для которого предсказана встречаемость только один раз на каждые 7×1010 п.о. случайной последовательности. Такая частота возникновения эквивалентна только одному сайту в геноме, имеющем размер, в 20 раз превышающий размер генома млекопитающих. Редкая природа НЕ-сайтов значительно увеличивает вероятность того, что генный инженер может обрезать генетическую программу, не нарушая целостности указанной генетической программы, если НЕ-сайты содержатся в подходящих местах в клонирующей векторной плазмиде.
[00462] Выбор подходящих векторов и промоторов для экспрессии в клетке-хозяине представляет собой общеизвестную процедуру, а необходимые методики для конструирования и введения векторов в хозяина, а также экспрессии в хозяине, являются рутинными для данной области техники.
[00463] Введение полинуклеотидов в клетки может представлять собой временную трансфекцию, стабильную трансфекцию, или может представлять собой локус-специфическое встраивание вектора. Временная и стабильная трансфекция векторов в клетку-хозяина могут осуществляться путем кальций-фосфатной трансфекции, опосредованной ДЭАЭ-декстраном трансфекции, опосредованной катионными липидами трансфекции, электропорации, трансдукции, инфекции, или другими способами. Такие способы описаны во многих стандартных лабораторных руководствах, таких как Davis et al., Basic Methods in Molecular Biology («Основные методы молекулярной биологии») (1986); Keown et al., 1990, Methods Enzymol. 185: 527-37; Sambrook et al., 2001, Molecular Cloning, A Laboratory Manual, Third Edition, Cold Spring Harbor Laboratory Press, N.Y. Такие способы стабильной трансфекции дают в результате произвольное встраивание указанного вектора в геном указанной клетки. Далее, число копий и ориентация векторов также, в общем, случайны.
[00464] Согласно одному из вариантов реализации вектор встраивают в бионейтральный участок в геноме. Бионейтральный участок представляет собой участок в геноме, встраивание полинуклеотидов в который если и изменяет нормальное функционирование клетки, то в очень небольшой степени. Бионейтральные участки могут быть проанализированы с применением доступной биоинформатики. В данной области техники известны многие бионейтральные участки, например, ROSA-эквивалентный локус. Другие бионейтральные участки могут быть идентифицированы с применением рутинных методик, общеизвестных в данной области техники. Характеристики геномного(ых) сайта(ов) встраивания определяют с применением известных в данной области техники способов. Для контроля местоположения, количества копий и/или ориентации указанных полинуклеотидов при введении вектора в клетки, могут применяться методы локус-специфического встраивания. Способы локус-специфического встраивания общеизвестны в данной области техники и включают, не ограничиваясь перечисленными, гомологичную рекомбинацию и опосредованное рекомбиназой встраивание в геном. Конечно, при применении методов локус-специфического встраивания в способах, предложенных в настоящем изобретении, векторы могут содержать элементы, которые содействуют этому локус-специфическому встраиванию, например, но не ограничиваясь указанным, гомологичной рекомбинации. Например, векторы могут содержать один, два, три, четыре или более сайтов геномной интеграции (GIS). Используемый в настоящей заявке термин «сайт геномной интеграции» определен как часть векторной последовательности, нуклеотидная последовательность которой идентична или почти идентична частям генома в составе клеток, что позволяет встраивание указанного вектора в указанный геном. В частности, указанный вектор может содержать два геномных сайта встраивания, которые фланкируют по меньшей мере указанные полинуклеотиды. Конечно, указанные GIS могут фланкировать дополнительные элементы, или даже все элементы, присутствующие на векторе.
[00465] Согласно еще одному варианту реализации локус-специфическое встраивание может быть выполнено путем рекомбиназного сайт-специфического генетического встраивания. Вкратце, бактериальные ферменты-рекомбиназы, такие как, не ограничиваясь указанной, интеграза РЫС31, могут работать на «псевдо» сайтах рекомбинации в геноме человека. Такие псевдо-сайты рекомбинации могут быть мишенями локус-специфического встраивания с применением рекомбиназ. Рекомбиназное сайт-специфическое встраивание генов описано у Thyagarajan et al., Mol. Cell Biol. 21:3926 (2001). Другие примеры рекомбиназ и соответствующих им сайтов, которые могут применяться для рекомбиназного сайт-специфического генетического встраивания, включают, не ограничиваясь перечисленными, сериновые рекомбиназы, такие как R4 и ТР901-1, и рекомбиназы, описанные в WO 2006/083253.
[00466] Согласно еще одному варианту реализации вектор может содержать ген химической устойчивости, например, ген множественной лекарственной устойчивости mdrl, дигидрофолатредуктазы или О6-алкилгуанин-ДНК алкилтрансферазы. Указанный ген хеморезистентности может находиться под контролем конститутивного (например, CMV) или индуцируемого (например, RheoSwitch®) промотора. Согласно данному варианту реализации, если это требуется для лечения заболевания у пациента, при поддержании существования модифицированных клеток в пациенте, клиницист может применить химиотерапевтический агент для уничтожения больных клеток, в то время как указанные модифицированные клетки будут защищены от указанного агента благодаря экспрессии подходящего гена хеморезистентности и смогут и дальше применяться для лечения, облегчения или предотвращения заболевания или расстройства. Помещение указанного гена хеморезистентности под контроль индуцируемого промотора позволяет избежать ненужной экспрессии гена хеморезистентности, и в тоже время она будет возможна, если будет необходимо продолжение лечения. При этом в том случае, если болезнь поражает сами модифицированные клетки, они могут быть уничтожены индуцированном экспрессии летального полипептида согласно приведенному ниже описанию.
[00467] Способы, предложенные в соответствии с настоящим изобретением, осуществляют посредством введения полинуклеотидов, кодирующих генный переключатель и экзогенный ген, в клетки пациента. Могут применяться любые способы введения полинуклеотида в клетку, известные в данной области техники, такие как описанные выше.
[00468] Для введения полинуклеотидов в клетки ex vivo указанные клетки могут быть получены от пациента при помощи любой методики, известной в данной области техники, включая, но не ограничиваясь перечисленными, биопсию, соскобы, и хирургическое извлечение ткани. Выделенные клетки могут культивироваться в течение периода времени, достаточного для введения полинуклеотидов в клетки, например, 2, 4, 6, 8, 10, 12, 18, 24, 36, 48 часов или дольше. Способы культивирования первичных клеток в течение непродолжительных периодов времени хорошо известны в данной области техники. Например, клетки могут культивироваться в планшетах (например, в микролуночных планшетах), в прикрепленном виде или в суспензии.
[00469] Для ех vivo терапевтических способов клетки получают от пациента и культивируют при условиях, подходящих для введения полинуклеотидов в указанные клетки. После того как полинуклеотиды введены в клетки, указанные клетки инкубируют в течение периода времени, достаточного для экспрессии лиганд-зависимого транскрипционного фактора, например, 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 18 или 24 часов или дольше. В некоторый момент после введения указанных полинуклеотидов в клетки (до или после экспрессирования выраженных уровней указанного лиганд-зависимого транскрипционного фактора), указанные клетки вводят обратно указанному пациенту. Повторное введение может осуществляться любым способом, известным в данной области техники, например, внутривенной инфузией или прямой инъекцией в ткань или полость. Согласно одному из вариантов реализации наличие указанных полинуклеотидов в клетках определяют до введения указанных клеток обратно указанному пациенту. Согласно еще одному варианту реализации клетки, содержащие указанные полинуклеотиды отбирают (например, на основании присутствия селектируемого маркера в полинуклеотидах), и повторно вводят пациенту только клетки, содержащие указанные полинуклеотиды. После того как клетки повторно введены пациенту, указанному пациенту вводят лиганд, чтобы индуцировать экспрессию терапевтического полипептида или терапевтического полинуклеотида. Согласно альтернативному варианту реализации лиганд может быть добавлен к клеткам даже до того, как указанные клетки повторно вводят пациенту, таким образом терапевтический полипептид или терапевтический полинуклеотид экспрессируется до повторного введения указанных клеток. Указанный лиганд может вводиться посредством любого подходящего способа, либо системно (например, орально, внутривенно), либо местно (например, внутрибрюшинно, интратекально, интравентрикулярно, прямой инъекцией в ткань или орган, куда повторно вводят указанные клетки). Оптимальные сроки введения лиганда могут быть определены для каждого типа клеток, заболевания или расстройства с применением исключительно рутинных методик.
[00470] In vivo терапевтические способы, предложенные в соответствии с настоящим изобретением, включают прямое in vivo введение полинуклеотидов, например, аденовирусного вектора, в клетки пациента. Указанные полинуклеотиды могут быть введены указанному пациенту системно либо местно (например, в область локализации заболевания или расстройства). После того как полинуклеотиды введены пациенту, может вводиться указанный лиганд для индуцирования экспрессии терапевтического полипептида или терапевтического полинуклеотида. Указанный лиганд может вводиться посредством любого подходящего способа, либо системно (например, орально, внутривенно), либо местно (например, внутрибрюшинно, интратекально, интравентрикулярно, прямой инъекцией в ткань или орган локализации указанного заболевания или расстройства). Оптимальные сроки введения лиганда могут быть определены для каждого типа клеток, заболевания или расстройства с применением исключительно рутинных методик.
[00471] Для применения in vivo лиганды, описанные в настоящей заявке, могут быть заключены в фармацевтически приемлемые носители, такие как, например, растворы, суспензии, таблетки, капсулы, мази, эликсиры, и инъекционные композиции. Фармацевтические композиции могут содержать от 0,01% до 99% указанного лиганда по массе. Композиции могут быть представлены в однодозовых или многодозовых формах. Количество лиганда в любой определенной фармацевтической композиции зависит от эффективной дозы, т.е. дозы, необходимой, чтобы вызвать требуемую генную экспрессию или супрессию.
[00472] Подходящие пути введения указанных фармацевтических составов включают оральный, ректальный, местный (в том числе дермальный, буккальный и сублингвальный), вагинальный, парентеральный (включая подкожный, внутримышечный, внутривенный, внутриопухолевый, внутрикожный, интратекальный и эпидуральный), интравитреальный и через назально-желудочный зонд. Специалистам в данной области техники будет ясно, что путь введения будет зависеть от состояния-мишени лечения, и может варьировать в зависимости от таких факторов, как состояние реципиента.
[00473] Используемый в настоящей заявке термин «rAD.RheoIL12» относится к аденовирусному полинуклеотидному вектору, несущему ген IL-12 под контролем генного переключателя системы RheoSwitch® Therapeutic System (RTS), способному к продуцированию белка IL-12 в присутствии активирующего лиганда. Используемый в настоящей заявке термин «rAd.cIL12» относится к аденовирусному полинуклеотидному контрольному вектору, содержащему ген IL-12 под контролем конститутивного промотора.
[00474] Используемый в настоящей заявке термин «IL-12p70» относится к белку IL-12, который естественным образом содержит две субъединицы, обычно обозначаемые р40 и р35. Термин IL-12p70 охватывает гибридные белки, содержащие указанные две субъединицы IL-12 (р40 и р35), причем указанный гибридный белок может включать линкерные аминокислоты между субъединицами.
[00475] Используемый в настоящей заявке термин «белок, обладающий функцией иммуномодулятора» относится к белку, обладающему по меньшей мере 20% (например, по меньшей мере 30%, 40%, 50%, 60%, 70%, 80% или 90%) любой биоактивности иммуномодулятора, выбранного из IL-1, IL-2, IL-3, IL-4, IL-5, IL-7, IL-8, IL-9, IL-10R или их субъединицы DN, IL-15, IL-18, IL-21, IL-23, IL-24, IL-27, ГМКСФ, ИФН-альфа, ИФН-гамма, CCL3 (MIP-1a), CCL5 (RANTES), CCL7 (МСР3), XCL1 (лимфотактина), CXCL1 (MGSA-альфа), CCR7, CCL19 (MIP-3b), CXCL9 (MIG), CXCL10 (IP-10), CXCL12 (SDF-1), CCL21 (6С-кина), OX40L, 4-1BBL, CD40, CD70, GITRL, LIGHT, b-Дефенсина, HMGB1, Flt3L, ИФН-бета, TNF-альфа, dnFADD, БЦЖ, TGF-альфа, PD-L1, TGFbRII DN, ICOS-L и S100. Аналогичным образом, термин «белок, обладающий функцией IL-12» относится к белку обладающему по меньшей мере 20% (например, по меньшей мере 30%, 40%, 50%, 60%, 70%, 80% или 90%) любой биоактивности IL-12 человека. Биоактивность таких иммуномодуляторов хорошо известна. См. приведенную ниже таблицу.
[00476] Биологические функции IL-12 также общеизвестны и включают без ограничения дифференцировку необученных Т-клеток в Th1-клетки, стимуляцию роста и функции Т-клеток, синтез интерферона-гамма (ИФН-гамма) и фактора некроза опухоли-альфа (TNF-α) из Т- и естественных киллерных (NK) клеток, уменьшение опосредованной IL-4 супрессии ИФН-гамма, стимуляция цитотоксической активности NK-клеток и CD8+ цитотоксических Т-лимфоцитов, стимуляция экспрессии IL-12R-β1 и IL-12R-β2, содействие презентации опухолевых антигенов посредством повышающей регуляции молекул МНС I и II, и антиангиогенную активность. Термин «белок, обладающий функцией IL-12» охватывает мутантные последовательности IL-12 дикого типа, причем указанная последовательность дикого типа изменена посредством одного или более добавления, удаления или замены аминокислоты, а также белки, не являющиеся IL-12, которые имитируют одну или более биологическую функцию IL-12.
[00477] Используемые в настоящей заявке термины «активация» или «активировать» относятся к любому измеряемому увеличению клеточной активности генного переключателя, приводящему к экспрессии представляющего интерес гена (например, выбранного из IL-1, IL-2, IL-3, IL-4, IL-5, IL-7, IL-8, IL-9, IL-10R или их субъединицы DN, IL-15, IL-18, IL-21, IL-23, IL-24, IL-27, ГМКСФ, ИФН-альфа, ИФН-гамма, CCL3 (MIP-1a), CCL5 (RANTES), CCL7 (МСР3), XCL1 (лимфотактина), CXCL1 (MGSA-альфа), CCR7, CCL19 (MIP-3b), CXCL9 (MIG), CXCL10 (IP-10), CXCL12 (SDF-1), CCL21 (6С-кина), OX40L, 4-1BBL, CD40, CD70, GITRL, LIGHT, b-Дефенсина HMGB1, Flt3L, ИФН-бета, TNF-альфа, dnFADD, TGF-альфа, PD-L1 интерферирующих РНК, антисмыслового олигонуклеотида PD-L1, TGFbRII DN, ICOS-L и S100.
[00478] Используемые в настоящей заявке термины «лечить» или «лечение» заболевания относятся к выполнению протокола, который может включать введение одного или более препарата или in vitro сконструированных клеток млекопитающему (человеку или не человеку) с намерением смягчить признаки или симптомы этого заболевания. Таким образом, «лечить» или «лечение» не обязательно подразумевает полное устранение признаков или симптомов, не подразумевает излечение, и, в частности, включает протоколы, которые оказывают лишь незначительное действие на пациента.
[00479] Используемый в настоящей заявке термин «иммунные клетки» включает дендритные клетки, макрофаги, нейтрофилы, тучные клетки, эозинофилы, базофилы, естественные киллерные клетки и лимфоциты (например, В- и Т-клетки).
[00480] Используемые в настоящей заявке термины «дендритные клетки» и «ДК» используются взаимозаменяемо.
[00481] Используемый в настоящей заявке термин «клетки для поддерживающей терапии» (TSC) означает клетки, которые могут быть модифицированы (например, трансфицированы, электропорированы и т.д.) вектором, предложенным в соответствии с настоящим изобретением, для доставки одного или более белка, обладающего функцией иммуномодулятора и, необязательно, белка, обладающего функцией IL-12, в микроокружение опухоли. Такие TSC включают, не ограничиваясь перечисленными, стволовые клетки, фибробласты, эндотелиальные клетки и кератиноциты.
[00482] Используемые в настоящей заявке термины «w vitro сконструированные иммунные клетки», или «in vitro сконструированная популяция иммунных клеток», или «популяция сконструированных иммунных клеток», или «иммунные клетки, экспрессирующие иммуномодулятор», или «иммунные клетки, экспрессирующие IL-12», относятся к иммунным клеткам, например, дендритным клеткам, условно экспрессирующим иммуномодулятор и/или IL-12, в соответствующих случаях под контролем генного переключателя, который может быть активирован активирующим лигандом.
[00483] Используемые в настоящей заявке термины «in vitro сконструированные TSC» или «in vitro сконструированная популяция TSC» или «популяция сконструированных TSC» или «TSC, экспрессирующие иммуномодулятор» или «TSC, экспрессирующие IL-12» относятся к клеткам для поддерживающей терапии, например, стволовым клеткам, фибробластам, эндотелиальным клеткам и кератиноцитам, условно экспрессирующим иммуномодулятор и/или IL-12, в соответствующих случаях под контролем генного переключателя, который может быть активирован активирующим лигандом.
[00484] Используемый в настоящей заявке термин «модифицированная клетка» относится к клеткам, которые были изменены посредством процесса, включая, но не ограничиваясь перечисленными, трансфекции, электропорации, микроинъекции, трансдукции, слияния клеток, ДЭАЭ-декстрана, осаждения фосфатом кальция и липофекции (слияния липосом).
[00485] Используемый в настоящей заявке термин «MOI» или «кратность инфекции» относится к среднему числу аденовирусных частиц, которые инфицируют одну клетку в конкретном эксперименте (например, рекомбинантного аденовируса или контрольного аденовируса)
[00486] Используемый в настоящей заявке термин «опухоль» относится к любому доброкачественному или злокачественному клеточному росту и пролиферации, как in vivo, так и in vitro, предраковых или раковых клеток и/или тканей.
[00487] Согласно еще одному варианту реализации вектор и способы, предложенные в соответствии с настоящим изобретением, могут применяться для лечения заболевания.
[00488] Согласно еще одному варианту реализации вектор и способы, предложенные в соответствии с настоящим изобретением, могут применяться для лечения рака. Неограничивающие примеры раковых заболеваний, лечение которых может проводиться согласно настоящему изобретению, включают рак груди, рак предстательной железы, лимфому, рак кожи, рак поджелудочной железы, рак толстой кишки, меланому, злокачественную меланому, рак яичников, рак головного мозга, первичную карциному мозга, рак головы и шеи, глиому, глиобластому, рак печени, рак мочевого пузыря, немелкоклеточный рак легкого, карциному головы или шеи, карциному молочной железы, карциному яичника, карциному легкого, мелкоклеточную карциному легкого, опухоль Вильмса, карциному шейки матки, карциному яичка, карциному мочевого пузыря, карциному поджелудочной железы, карциному желудка, карциному толстой кишки, карциному предстательной железы, карциному урогенитального тракта, карциному щитовидной железы, эзофагеальную карциному, миелому, множественную миелому, карциному надпочечников, почечно-клеточную карциному, карциному эндометрия, карциному коры надпочечников, злокачественную инсулиному поджелудочной железы, злокачественную карциноидную карциному, хориокарциному, фунгоидный микоз, злокачественную гиперкальциемию, гиперплазию шейки матки, лейкемию, острый лимфоцитарный лейкоз, хроническую лимфоцитарную лейкемию, острую миелобластную лейкемию, хроническую миелобластную лейкемию, хроническую гранулоцитарную лейкемию, острую гранулоцитарную лейкемию, лейкоз ворсистых клеток, нейробластому, рабдомиосаркому, саркому Капоши, истинную полицитемию, эссенциальный тромбоцитоз, болезнь Ходжкина, неходжкинскую лимфому, саркому мягких тканей, мезотелиому, остеогенную саркому, первичную макроглобулинемию и ретинобластому, и т.п. Согласно еще одному варианту реализации вектор и способы, предложенные в соответствии с настоящим изобретением, могут применяться для лечения расстройства, связанного с обменом веществ, включая, но не ограничиваясь перечисленными, расстройство, выбранное из группы, состоящей из дислипидемии, атеросклероза, инсулинорезистентности, диабета (например, диабет I типа, диабет II типа, MODY и гестационный диабет), ожирения, нарушения толерантности к глюкозе, атероматозной болезни, гипертензии, заболевания сердца (включающего, не ограничиваясь перечисленными, коронарную болезнь сердца, инсульт, сердечную недостаточность, коронарную недостаточность и высокое кровяное давление), гиперлипидемии, нарушения толерантности к глюкозе, инсулинорезистентности, гипергликемии, гиперинсулинемии, метаболического синдрома Х (или синдрома X, или синдрома инсулинорезистентности, или синдрома Ривена, или метаболического синдрома с риском сердечно-сосудистых заболеваний), гипертензии, хронической усталости, ускоренного старения, дегенеративного заболевания, эндокринных дефектов при старении, Gm1 ганглиозидоза, болезни Моркио-В, болезни Краббе, болезни Фабри, болезни Гоше, болезни Тея-Сакса, болезни Сандхоффа, фукозидоза, нарушения обмена углеводов (например, болезни накопления гликогена), нарушения обмена аминокислот (например, фенилкетонурии, болезни кленового сиропа, глутаровой ацидемии типа 1), нарушений обмена органических кислот (например, алкаптонурия), расстройств окисления жирных кислот и митохондриального метаболизма (например, недостаточности средней цепи ацилдегидрогеназы), расстройств метаболизма порфирина (например, острой интермиттирующей порфирии), расстройств метаболизма пуринов или пиримидинов (например, синдрома Леша-Найхана), расстройств метаболизма стероидов (например, врожденной гиперплазии надпочечников), нарушений функции митохондрий (например, синдрома Кирнса-Сейра) и расстройств пероксисомальной функции (например, синдрома Цельвегера).
[00489] Согласно еще одному варианту реализации вектор и способы, предложенные в соответствии с настоящим изобретением, могут применяться для лечения аутоиммунного расстройства, включая, но не ограничиваясь перечисленными, расстройство, выбранное из группы, состоящей из ахлоргидрии, аутоиммунного хронического активного гепатита, острого рассеянного энцефаломиелита, острого геморрагического лейкоэнцефалита, болезни Аддисона, гаммаглобулинемии, агаммаглобулинемии, очаговой алопеции, амиотрофического латерального склероза, анкилозирующего спондилита, вызванного анти-ГБМ/ТБМ нефрита, антифосфолипидного синдрома, антисинтетазного синдрома, артрита, атопической аллергии, атопического дерматита, апластической анемии, аутоиммунной кардиомиопатии, аутоиммунной гемолитической анемии, аутоиммунного гепатита, аутоиммунного заболевания внутреннего уха, аутоиммунного лимфопролиферативного синдрома, аутоиммунной периферической нейропатии, аутоиммунного панкреатита, аутоиммунного полиэндокринного синдрома типа I, II, и III, аутоиммунного прогестеронового дерматита, аутоиммунной тромбоцитопенической пурпуры, аутоиммунного увеита, болезни Бало/концентрического склероза Бало, синдрома Бехчета, болезни Бергера, энцефалита Бикерстаффа, синдрома Блау, буллезного пемфигоида, болезни Кастлемена, синдрома хронической усталости и иммунной дисфункции, хронической воспалительной демиелинизирующей полинейропатии, хронического рецидивирующего мультифокального остеомиелита, синдрома Черджа-Строса, рубцующегося пемфигоида, целиакии, синдрома Когана, болезни холодовых агглютининов, недостаточности компонента 2 системы комплемента, краниального артериита, CREST-синдрома, болезни Крона, синдрома Кушинга, кожного лейкоцитокластического васкулита, болезни Дегоса, герпетиформного дерматита, дерматомиозита, сахарного диабета 1 типа, диффузного кожного системного склероза, синдрома Дресслера, дискоидной красной волчанки, экземы, связанных с артритом энтезитов, эозинофильного фасциита, приобретенного буллезного эпидермолиза, узелковой эритемы, эссенциальной криоглобулинемии смешанного типа, синдрома Эвана, прогрессирующей оссифицирующей фибродисплазии, фибромиозита, фиброзирующего альвеолита, гастрита, пемфигоида желудочно-кишечного тракта, гигантоклеточного артериита, синдрома Гудпасчера, болезни Грейвса, синдрома Гийена-Барре (GBS, СГБ), энцефалита Хашимото, тиреоидита Хашимото, гемолитической анемии, пурпуры Геноха-Шенлейна, гестационного герпеса, синдрома Хьюза (или антифосфолипидного синдрома), гипогаммаглобулинемии, идиопатических воспалительных демиелинизирующих заболеваний, идиопатического легочного фиброза, идиопатической тромбоцитопенической пурпуры, IgA-нефропатии (или болезни Бергера), миозита с включенными тельцами, воспалительной демиелинизирующей полинейропатии, ювенильного идиопатического артрита, ювенильного ревматоидного артрита, миастенического синдрома Ламберта-Итона, лейкоцитокластического васкулита, плоского лишая, склерозирующего лишая, линейной IgA болезни (LAD), болезни Лу Герига, волчаночного гепатита, красной волчанки, синдрома Маджида, болезни Меньера, микроскопического полиангиита, синдрома Миллера-Фишера, смешанного заболевания соединительной ткани, болезни Мухи-Габерманна, синдрома Макла-Уэлса, множественной миеломы, тяжелой миастении, миозита, нарколепсии, нейромиелита зрительного нерва (также - болезнь Девика), рубцующегося пемфигоида глаз, тиреоидита Орда, палиндромного ревматизма, PANDAS (связанными со стрептококком детскими аутоиммунными нервно-психическими расстройствами), паранеопластической мозжечковой дегенерации, паранеопластической мозжечковой дегенерации, синдрома Парри-Ромберга, синдрома Персонейджа-Тернера, воспаления pars plana, пемфигоида, обыкновенной пузырчатки, злокачественной анемии, перивенозного энцефаломиелита, POEMS-синдрома, узелкового периартериита, ревматической полимиалгии, полимиозита, первичного биллиарного цирроза, псориаза, псориатического артрита, гангренозной приодермии, истинной эритроцитарной аплазии, энцефалита Расмуссена, феномена Рейно, рецидивирующего полихондрита, синдрома Рейтера, ретроперитонеального фиброза, ревматоидного артрита, ревматоидной лихорадки, синдрома Шмидта, синдрома Шницлера, склерита, синдрома Шегрена, спондилоартропатии, синдрома липкой крови, болезни Стилла, подострого бактериального эндокардита (SBE, ПБЭ), синдрома Сузака, синдрома Свита, хореи Сиденгама, симпатической офтальмии, артериита Такаясу, височного артериита, синдрома Толоса-Ханта, поперечного миелита, язвенного колита, недифференцированного заболевания соединительной ткани, недифференцированной спондилоартропатии, васкулита, гранулематоза Вегенера, синдрома Вильсона и синдрома Вискотта-Олдрича.
[00490] Согласно еще одному варианту реализации вектор и способы, предложенные в соответствии с настоящим изобретением, могут применяться для лечения глазного заболевания, включая, но не ограничиваясь перечисленными, расстройство, выбранное из группы, состоящей из глаукомы, включая открытоугольную глаукому (например, первичную открытоугольную глаукому, пигментную глаукому и эксфолиативную глаукому, глаукому с низким давлением), закрытоугольную глаукому (также известную в клинике как узкоугольная глаукома, глаукому со зрачковым блоком и глаукому, вызванную блоком ресничного тела) (например, острую закрытоугольную глаукому и хроническую закрытоугольную глаукому), глаукому при аниридии, врожденную глаукому, ювенильную глауком, индуцированную ношением линз глаукому, неоваскулярную глаукому (например, с применением векторов, имеющих в составе ловушку фактора роста эндотелия сосудов (VEGF), полученный из пигментного эпителия фактор роста (PDGF), эндостатин, ангиостатин, или ангиопоэтин-1), посттравматическую глаукому, стероидную глаукому, глаукому при синдроме Стерджа-Вебера и индуцированную увеитом глаукому, диабетическую ретинопатию (например, с применением векторов, имеющих в составе ловушку VEGF, PDGF, эндостатин, ангиостатин или ангиопоэтин-1), макулярную дегенерацию (например, векторами, имеющими в составе ловушку VEGF, PDGF, эндостатин, ангиостатин, ангиопоэтин-1, член 4 подсемейства АТФ-связывающей кассеты А), макулярная дегенерация (например, с применением векторов, имеющих в составе ловушку VEGF, PDGF, эндостатин, ангиостатин, ангиопоэтин-1, член 4 подсемейства АТФ-связывающей кассеты А), неоваскуляризация хороидеи, (например, с применением векторов, имеющих в составе ловушку VEGF, PDGF, эндостатин, ангиостатин или ангиопоэтин-1), сосудистую утечку и/или отек сетчатки, бактериальный конъюнктивит, грибковый конъюнктивит, вирусный конъюнктивит, увеит, роговичные отложения, макулярный отек (например, с применением векторов, имеющих в составе ловушку VEGF, PDGF, эндостатин, ангиостатин или ангиопоэтин-1), воспалительный ответ после имплантации внутриглазных линз, синдромы увеита (например, хронический иридоциклит или хронический эндофтальмит), ретинальный васкулит (например, наблюдаемый при ревматоидном артрите, ювенильном ревматоидном артрите, системной красной волчанке, прогрессирующем системном склерозе, узелковом периартериите, гранулематозе Вегенера, височном артериите, болезни Адамантиада-Бехчета, синдроме Шегрена, рецидивирующем полихондрите и связанном с HLA-B27 спондилите), саркоидоз, болезнь Илза, острый некроз сетчатки, синдром Вогта-Коянаги-Гарада, глазной токсоплазмоз, лучевую ретинопатию, пролиферативную витреоретинопатию, эндофтальмит, глазные глаукомы (например, воспалительные глаукомы), неврит зрительного нерва, ишемическую оптическую нейропатию (например, векторами, имеющими в составе единицу 4 аллотопической NADH-дегидрогеназы), ассоциированную с щитовидной железой орбитопатию, орбитальную псевдоопухоль, синдром диспергирования пигмента (пигментную глаукому), склерит, хориоидопатию с эписклеритом (например, «синдромы белых точек», включая, но не ограничиваясь перечисленными, острую мультифокальную заднюю плакоидную эпителиопатию), ретинопатии (такие как кистоподобный макулярный отек, центральная серозная ретинопатия и синдром предполагаемого гистоплазмоза глаз (например, векторами, имеющими в составе нейротропный фактор, происходящий из глиальных клеток, периферин-2)), сосудистые заболевания сетчатки (например, диабетическая ретинопатия, болезнь Коатса и артериальную макроаневризму сетчатки), окклюзию артерии сетчатки, окклюзию вены сетчатки, ретинопатию недоношенных, пигментную дистрофию сетчатки (например, векторами, имеющими в составе специфичный для пигментного эндотелия сетчатки белок массой 65 кДа), семейную экссудативную витреоретинопатию (FEVR), идиопатическую полипообразную хориоидальную васкулопатию, эпиретинальные мембраны и катаракты макулы.
[00491] Согласно еще одному варианту реализации вектор и способы, предложенные в соответствии с настоящим изобретением, могут применяться для лечения заболеваний крови, включая, не ограничиваясь перечисленными, заболевание крови, выбранное из группы, состоящей из анемии, геморрагических гемостазиопатий и нарушений свертываемости крови (например, диссеминированное внутрисосудистое свертывание крови (DIC), гемофилия, пурпура Шенлейна-Геноха, наследственная геморрагическая телеангиэктазия, тромбоцитопения (ITP, ТТР), тромбофилия, болезнь фон Виллебранда), лейкемии (например, острый лимфоцитарный лейкоз, острый миелоцитарный лейкоз, хроническая лимфоцитарная лейкемия, хроническая миелоцитарная лейкемия), лимфомы (например, лимфома Ходжкина, неходжкинская лимфома), миелопролиферативных расстройств (например, миелофиброз, истинная полицитемия, тромбоцитемия), плазмацитарных расстройств (например, макроглобулинемия, моноклональные гаммапатии неопределенного значения, множественная миелома), расстройств селезенки, расстройств белых клеток крови (например, расстройства базофилов, расстройства эозинофилов, лимфопения, моноцитарные расстройства, нейтропения, нейтрофильный лейкоцитоз), тромбоза, тромбоза глубоких вен (DVT, ТГВ), гемохроматоза, меноррагии, серповидноклеточной анемии и талассемии.
[00492] Согласно еще одному варианту реализации вектор и способы, предложенные в соответствии с настоящим изобретением, могут применяться для лечения неврологического расстройства, которое включает, не ограничиваясь перечисленными, неврологические расстройства, выбранные из группы, состоящей из болезни Гоше, болезни Паркинсона, болезни Альцгеймера, амиотрофического латерального склероза (БАС), рассеянного склероза (MS, PC), болезни Хантингтона, атаксии Фридрейха, умеренных когнитивных нарушений, церебральной амилоидной ангиопатии, паркинсонизма, болезни телец Леви, лобно-височной деменции (FTD) множественной системной атрофии (MSA), прогрессирующего надъядерного паралича и двигательных расстройств (включая атаксию, церебральный паралич, хореоатетоз, дистонию, синдром Туретта, керниктерус), дрожательных расстройств, лейкодистрофии (включая адренолейкодистрофию, метахроматическую лейкодистрофию, болезни Канавана, болезни Александера, болезни Пелицеуса-Мерцбахера), нейронального цероидного липофусциноза, атаксии-телеангиэктазии, синдрома Ретта, альфа-синуклеопатии (например, болезни телец Леви, множественной системной атрофии, болезни Галлервордена-Шпатца или лобно-височной деменции), болезни Ниманна-Пика типа С (NPCD), спинально-церебеллярной атаксии типа 1, типа 2 и типа 3, и дентато-рубро-паллидо-люисовой атрофии (DRLPA, ДРПЛА).
[00493] Согласно еще одному варианту реализации вектор и способы, предложенные в соответствии с настоящим изобретением, могут применяться для лечения расстройства легких, включая, не ограничиваясь перечисленными, расстройства легких, выбранное из группы, состоящей из астмы, ателектаза, бронхита, ХОЗЛ (хронического обструктивного заболевания легких), эмфиземы, рака легких, мезотелиомы, пневмонии, асбестоза, аспергилломы, аспергиллеза, аспергиллеза - острого инвазивного, бронхоэктаза, облитерирующего бронхиолита с организующейся пневмонией (ВООР, ОБОП), эозинофильной пневмонии, некротической пневмонии, плеврального выпота, пневмокониоза, пневмоторакса, актиномикоза легких, легочного альвеолярного протеиноза, легочной сибирской язвы. легочной артериовенозной мальформации, фиброза легких, легочной эмболии, легочного гистиоцитоза Х (эозинофильной гранулемы), легочной гипертензии, отека легких, легочного кровотечения, легочного нокардиоза, легочного туберкулеза, веноокклюзионной болезни легких, ревматоидной болезни легкого, саркоидоза, лучевого фиброза, пневмонита гиперчувствительности, острого респираторного дистресс-синдрома (ОРДС), детского респираторного дистресс-синдрома. идиопатического фиброза легких, идиопатической интерстициальной пневмонии, лимфангиолейомиоматоза, легочного лангергансоклеточного гистиоцитоза, легочного альвеолярного протеиноза, синусита, тонзиллита, среднего отита, фарингита, ларингита, гамартомы легкого, легочной секвестрации, врожденной кистозной аденоматоидной мальформации (ВКАМ) и кистозного фиброза.
[00494] Согласно еще одному варианту реализации вектор и способы, предложенные в соответствии с настоящим изобретением, могут применяться для лечения ревматологического расстройства, которое включает, не ограничиваясь перечисленными, ревматическое расстройство, выбранное из группы, состоящей из системной красной волчанки, дерматомиозита, склеродермии, системного некротического артериита, кожного некротического венулита, ревматоидного артрита, синдрома Шегрена, феномена Рейно, синдрома Рейтера, артрита, псориатического артрита, серонегативных спондилоартропатий, синдрома Шегрена, системного склероза, дерматомиозита/полимиозита, смешанного заболевания соединительной ткани и анкилозирующего спондилита.
[00495] Согласно еще одному варианту реализации вектор и способы, предложенные в соответствии с настоящим изобретением, могут применяться для лечения инфекционного заболевания у человека, включая, но не ограничиваясь перечисленными, инфекционное заболевание, выбранное из группы, состоящей из микозов, таких как дерматофитоз (например, трихофитоз, трихофития или инфекционный лишай), «стопа атлета», паронихия, разноцветный лишай, эритразма, опрелости, грибковая пеленальная сыпь, кандидозный вульвит, кандидозный баланит, отит наружного уха, кандидоз (кожный и слизисто-кожный), хронический кандидоз слизистых оболочек (например, молочница и вагинальный кандидоз), криптококкоза, геотрихоза, трихоспории, аспергиллеза, пенициллеза, фузариоза, зигомикоза, споротрихоза, хромомикоза, кокцидиоидомикоза, гистоплазмоза, бластомикоза, паракокцидиоидомикоза, псевдоаллешериоза, мицетомы, грибковых кератитов, отомикоза, пневмоцистоза, фунгемии, вызываемых бактериями рода Acinetobacter инфекций, актиномикоза, африканского трипаносомоза, СПИДа (синдрома приобретенного иммунодефицита), амебиазиса, анаплазмоза, антракса, инфекции Arcanobacterium haemolyticum, аргентинской геморрагической лихорадки, аскаридоза, аспергиллеза, атровирусной инфекции, бабезиоза, инфекции Bacillus cereus, бактериальной пневмонии, бактериального вагиноза (БВ), инфекции Bacteroides, балантидиоза, инфекции Baylisascaris, инфекцию ВК вируса, черной пьедры, инфекции Blastocystis hominis, инфекции Borrelia, ботулизма (и детского ботулизма), бразильской геморрагической лихорадки, бруцеллеза, инфекции Burkholderia, язвы Бурули, калицивирусной инфекции (норовирус и саповирус), кандидоза, болезни кошачьих царапин, воспаления подкожной клетчатки, болезни Чагаса (американского трипаносомоза), шанкроида, ветряной оспы, хламидий, холеры, хромобластомикоза, клонорхоза, Clostridium difficile, кокцидиоидомикоза, колорадской клещевой лихорадки (CTF), простуды (острого вирусного ринофарингита; острого насморка), болезни Крейтцфельда-Якоба (CJD), криптококкоза, криптоспоридиоза, кожного синдрома "блуждающей личинки" (CLM), лихорадки Денге, диентамебиаза, дифтерии, дифиллоботриоза, дифиллоботриоза, дракункулеза, геморрагической лихорадки Эбола, эхинококкоза, эрлихиоза, энтеробиоза (остриц), инфекции Enterococcus, энтеровирусной инфекции, эпидемического тифа, инфекционной эритемы, внезапной экзантемы, фасциолопсидоза, фасциолеза, фатальной семейной бессоницы (FFI), филяриоза, инфекции Fusobacterium, газовой гангрены (клостридиального мионекроза), геотрихоза, синдрома Герстманна-Штреусслера-Шейнкера (GSS), гиардиоза, сапа, гнатостомоза, гонореи, паховой гранулемы (венерической гранулемы), инфекции стрептококка группы А, инфекции стрептококка группы В, Haemophilus influenzae, синдрома «рука-нога-рот» (HFMD), хантавирусного легочного синдрома (HPS) инфекции Helicobacter pylori, гемолитического уремического синдрома (HUS, ГУС), геморрагической лихорадки с почечным синдромом (HFRS), гепатита А, В, С, D, Е, Herpes simplex, гистоплазмоза, анкилостомоза, бокавирусной инфекции, эрлихиоза человека (Ehrlichia ewingii), гранулоцитарного анаплазмоза человека (HGA), гранулоцитарного анаплазмоза человека (HGA), моноцитарного эрлихиоза человека, вируса папилломы человека (ВПЧ), инфекции вируса парагриппа человека, гименолепидоза, инфекционного мононуклеоза Эпштейна-Барр, гриппа, изоспороза, болезни Кавасаки, кератита, инфекции Kingella kingae, куру, ласской лихорадки, легионеллеза (болезнь легионеров), легионеллеза (понтиакской лихорадки), лейшманиоза, проказы, лептоспироза, листериоза, болезни Лайма (боррелиоза Лайма), лимфатического филяриатоза (элефантиаза), лимфоцитарного хориоменингита, малярии, геморрагической лихорадки Марбург (МВЗ), кори, мелиоидоза (болезни Уитмора), менингита, менингококковой инфекции, метагонимоза, микроспоридиоза, контагиозного моллюска (МС), свинки, крысинго сыпного тифа (эндемического сыпного тифа), микоплазменной пневмонии, мицетомы, миаза, конъюнктивита новорожденных (офтальмии новорожденных), (нового) варианта болезни Крейтцфельда-Якоба (vCJD, nvCJD), нокардиоза, онхоцеркоза (речной слепоты), паракокцидиоидомикоза (южноамериканского бластомикоза), парагонимоза, пастереллеза, педикулеза волосистой части головы (головные вши), нательного педикулеза (нательные вши), лобкового педикулеза (лобковые вши, площицы), воспалительных заболеваний органов малого таза (ВЗОМТ), коклюша (коклюш), чумы, пневмококковой инфекции, пневмоцистной пневмонии (РСР), пневмонии, полиомиелита, полиомиелита, инфекции Prevotella, первичного амебного менингоэнцефалита (РАМ), прогрессивной мультифокальной лейкоэнцефалопатии, пситтакоза, Ку-лихорадки, бешенства, лихорадки крысыных укусов, инфекции респираторно-синцитиального вируса, риноспоридиоза, риновирусной инфекции, риккетсиозной инфекции, осповидного риккетсиоза, лихорадки долины Рифт (RVF), пятнистой лихорадки Скалистых гор (RMSF), ротавирусной инфекции, краснухи, сальмонеллеза, SARS (тяжелого острого респираторного синдрома), чесотки, шистосомоза, сепсиса, шигеллеза (бактериальной дизентерии), опоясывающего лишая (Herpes zoster), оспы (Variola), споротрихоза, стафилококковых пищевых отравлений, стафилококковой инфекции, стронгилоидоза, сифилиса, тениоза, тризма (спазма жевательной мышцы), Tinea barbae (трихофитии области бороды и усов). Tinea capitis (трихофитии кожи головы), Tinea corporis (трихофитии тела). Tinea cruris (трихофитии паховой и подмышечной области). Tinea manuum (трихофитии ладоней и кистей рук), дерматофитии Tinea nigra. Tinea unguium (онихомикоза), Tinea versicolor (разноцветного лишая), токсокароза (висцерального синдрома блуждающих личинок (VLM)), токсоплазмоза, трихинеллеза, трихомониаза, трихоцефалеза (власоглав), туберкулеза, туляремии, инфекции Ureaplasma urealyticum, венесуэльского энцефалита лошадей, венесуэльской геморрагической лихорадки, вирусной пневмонии, лихорадки Западного Нила, белой пьедры (Tinea blanca), инфекции Yersinia pseudotuberculosis, йерсениоза, желтой лихорадки и зигомикоза.
[00496] Согласно еще одному варианту реализации вектор и способы, предложенные в соответствии с настоящим изобретением, могут применяться для лечения одного или более заболевания у млекопитающего. В одном из аспектов указанное млекопитающее представляет собой человека. В другом аспекте указанное млекопитающее представляет собой животное, не являющееся человеком. Можно легко представить разнообразные заболевания, лечение которых может осуществляться с применением идей, предложенных в соответствии с настоящим изобретением. Такие заболевания включают, не ограничиваясь перечисленным, хроническую болезнь почек, остеоартрит, онкологические заболевания, вирусные инфекции верхних дыхательных путей, плазмоцитарный стоматит кошек, эозинофильные гранулемы кошек, инфекции вируса лейкемии кошек, инфекцию чумы собачьих, системные микотические инфекции, кардиомиопатии, мукополисахаридоз VII и инфекционное заболевание.
[00497] В одном из аспектов заболевание-мишень терапии представляет собой инфекционные заболевания животных; такие инфекционные заболевания включают, не ограничиваясь перечисленными, респираторную инфекцию крупного рогатого скота, респираторное заболевание свиней, птичий грипп, инфекционный бронхит птиц, губчатую энцефалопатию крупного рогатого скота, лейшманиоз собак, хроническую изнуряющую болезнь, вирус иммунодефицита человека (ВИЧ), гепатит, гепатит А, гепатит В, гепатит С, классическую чуму свиней, эхинококк, энзоотическую пневмонию, ИПК, ящур, ретровирус овец Jaagsiekte, вирус Мэди-Висна, мастит у животных, Microsporum canis, Orf (заболевание животных), чуму мелких жвачных животных, поксвирусные заболевания, болезнь клюва и перьев у попугаев, бешенство, средиземноморскую лихорадку (бруцеллез) или болезнь Банга или ундулирующую лихорадку, мальтийскую лихорадку, инфекционный аборт, эпизоотический аборт, отравление сальмонеллой, кишечный паратиф, бактериальную дизентерию, псевдотуберкулез, чуму, чумную лихорадку, туберкулез, вибрионную инфекцию, листериоз, болезнь Вейля (лептоспироз) или собачью лихорадку, геморрагическую желтуху (Leptospira icterohaemorrhagiae), лихорадку работников молочного производства (L. hardjo), возвратную лихорадку, клещевой возвратный тиф, спирохетозную лихорадку, бродячую лихорадку, голодный тиф, Лайм-артрит, синдром Баннварта (болезнь Лайма), клещевой менингополиневрит, хроническую мигрирующую эритему, вибрионные инфекции, колибактериоз, колитоксемию, белый понос, отечную болезнь свиней, кишечный паратиф, стафилококковый пищевой токсикоз, стафилококковый гастроэнтерит, коронавирус собак (CCV) или парвовирусный энтерит собак, вирус инфекционного перитонита кошек, вирус трансмиссионного гастроэнтерита (TGE), йерсениоз (энтерит «красный рот») Хагермана (ERMD), инфекционный некроз гемопоэтической ткани (IHN), актинобациллезную (Haemophilus) плевропневмонию свиней, болезнь Хансена, стрептотрихоз, микотический дерматит овец, мелиоидоз, болезнь Уитмора, болезнь Френсиса (туляремию), лихорадку оленьей мухи, заячью болезнь, болезнь 0’Хара, стрептобациллярную лихорадку, хейверхиллскую лихорадку, эпидемическую суставную эритему, содоку, морскую или транспортную лихорадку, геморрагическую септицемию, орнитоз, попугайную лихорадку, хламидиоз, североамериканский бластомикоз, чикагскую болезнь, болезнь Гилкриста, лихорадку кошачьих царапин, доброкачественный лимфоретикулез, доброкачественный небактериальный лимфаденит, бациллярный ангиоматоз, бациллярную печеночную пурпуру, лихорадку Q, балканский грипп, лихорадку боен, клещевую лихорадку, пневмориккетсиоз, американский клещевой тиф, клещевой сыпной тиф, везикулезный риккетсиоз, пятнистую лихорадку Кью-Гарденс, эндемический блошиный тиф, эндемический сыпной тиф, городской тиф, трихофитию, дерматофитоз, дерматофитию (Tinea), трихофитоз, микроспороз, паховую эпидермофитию, стопу атлета, Sporothrix schenckii, диморфные грибы, криптококкоз и гистоплазмоз, доброкачественную эпидермальную обезьянью оспу, ВЕМР, Herpesvirus simiae, обезьяний герпес В, венесуэльский энцефалит лошадей, летаргический энцефалит типа С, желтую лихорадку, черную рвоту (гематемезис), хантавирусный легочный синдром, корейскую геморрагическую лихорадку, эпидемическую нефропатию, эпидемическую геморрагическую лихорадку, геморрагический нефрозонефрит, лимфоцитарный хориоменингит, калифорнийский энцефалит/энцефалит, вызванный вирусом Ла Кросс, африканскую геморрагическую лихорадку, болезнь зеленых мартышек или верветок, гидрофобию, водобоязнь, инфекционный гепатит, эпидемический гепатит, эпидемическую желтуху, краснуху, корь, свиной и лошадиный грипп, чуму домашней птицы, болезнь Ньюкасла, пироплазмоз, токсоплазмоз, африканскую сонную болезнь, гамбийский трипаносомоз, родезийский трипаносомоз, болезнь Шагаса, болезнь Шагаса-Мацца, южноамериканский трипаносомоз, дизентерийную амебу, балантидную дизентерию, криптоспоридиоз, гиардиоз, кожный лейшманиоз: язву чиклеро, эспундия, пиан, угу и тропическую фрамбезию (в Америках); восточную язву, алеппский фурункул (в Старом Свете); багдадский фурункул, делийский фурункул, язву Бауру, висцеральные лейшманиозы: кала-азар, микроспоридиоз, анизакиаз, трихиноз, ангиостронгилез, эозинофильный менингит или менингоэнцефалит (A. cantonensis), абдоминальный ангиостронгилез (А. costaricensis), анкилостомоз, некатороз, анкилостомидоз, капилляриоз, бругиоз, токсокароз, эзофагостомоз, стронгилоидоз, трихостронгилез, аскаридоз, дифиллоботриоз, спарганоз, гидатидный эхинококкоз, гидатидную болезнь, эхинококковый гранулез, кистозную гидатидную болезнь, тениидоз, шистосомы и т.п.
[00498] Также предполагается лечение злокачественных заболеваний, вызываемых инфекционными возбудителями. Примеры таких заболеваний включают, не ограничиваясь перечисленными, остеосаркому, лейкемию, лимфому, лимфому Беркитта, вызываемую ЭБВ, саркому Рауса, вызываемую ретровирусом Рауса, саркому Капоши, вызываемую вирусом герпеса 8 типа, Т-клеточный лейкоз взрослых, вызываемый ретровирусом HTLV-I, или лейкоз ворсистых клеток, вызываемый HTLV-II, и многие другие опухоли и лейкемии, вызываемые инфекционными агентами и вирусами.
[00499] Согласно одному из вариантов реализации один или более белок, применяемый для лечения одного или более из перечисленных выше заболеваний включает, не ограничиваясь перечисленными, эритропоэтин, грелин, остеопротегерин, RANKL, приманки RANKL, антагонист TNF-α, антагонист IL-1, G-CSF, ГМКСФ, IFN-α (ИФН-α), IFN-γ (ИФН-γ), ангиостатин, эндостатин, TNF-α, PP1DCY-LSRLOC, β-глюкуронидазу и IL-12. Согласно еще одному варианту реализации один или более белок согласно настоящему изобретению включает, не ограничиваясь перечисленными, IL-1, IL-2, IL-12, IL-3, IL-4, IL-5, IL-7, IL-8, IL-9, IL-10R DN или их субъединицу, IL-15, IL-18, IL-21, IL-23, IL-24, IL-27, ГМКСФ, ИФН-альфа, ИФН-гамма, ИФН-альфа 1, ИФН альфа 2, IL-15-R-альфа, CCL3 (MIP-1a), CCL5 (RANTES), CCL7 (МСР3), XCL1 (лимфотактин), CXCL1 (MGSA-альфа), CCR7, CCL19 (MIP-3b), CXCL9 (MIG), CXCL10 (IP-10), CXCL12 (SDF-1), CCL21 (6С-кин), OX40L, 4-1BBL, CD40, CD70, GITRL, LIGHT, b-Дефенсин, HMGB1, Flt3L, ИФН-бета, TNF-альфа, dnFADD, БЦЖ, TGF-альфа, PD-L1 интерферирующую РНК, антисмысловой олигонуклеотид PD-L1, TGFbRII DN, ICOS-L и S100.
[00500] Согласно одному из вариантов реализации вектор, который вводят указанному млекопитающему, страдающему одним или более чем одним из указанных заболеваний, представляет собой аденовирусный вектор. Согласно одному из вариантов реализации вектор содержит полинуклеотид, кодирующий генный переключатель. В одном из аспектов генный переключатель представляет собой генный переключатель на основе EcR. Согласно еще одному варианту реализации полинуклеотид, кодирующий генный переключатель, содержит первую последовательность транскрипционного фактора под контролем первого промотора и вторую последовательность транскрипционного фактора под контролем второго промотора, причем белки, кодируемые указанной первой последовательностью транскрипционного фактора и указанной второй последовательностью транскрипционного фактора, взаимодействуют с образованием белкового комплекса, который функционирует как лиганд-зависимый транскрипционный фактор. В одном из аспектов лиганд представляет собой диацилгидразин. В другом аспекте лиганд выбирают из RG-115819, RG-115932 и RG-115830. Еще в одном аспекте лиганд представляет собой амидокетон или оксадиазолин.
[00501] Согласно еще одному варианту реализации настоящее изобретение можно применять для лечения одной или более лизосомной болезни накопления у млекопитающего. В одном из аспектов указанное млекопитающее представляет собой человека. В другом аспекте указанное млекопитающее представляет собой животное, не являющееся человеком. Примеры лизосомных болезней накопления, лечение которых может проводиться согласно настоящему изобретению, включают, не ограничиваясь перечисленными, болезнь Помпе/болезнь накопления гликогена типа II, болезнь Гоше (типа I, типа II, типа III), болезнь Фабри, мукополисахаридоз II (синдром Хантера), мукополисахаридоз VI (синдром Марото-Лами), мукополисахаридоз I, метахроматическую лейкодистрофию, нейрональные цероид-липофусцинозы или НЦЛб (атипичный позднего детского возраста, вариант с поздним началом, ранний ювенильный, финский вариант позднего детского возраста НЦЛ5, болезнь Янского-Бильшовского/НЦЛ2/ТПП1 позднего детского возраста, болезнь Куфса/НЦЛ/НЦЛ4 зрелого возраста, северную эпилепсию/вариант НЦЛ8 позднего детского возраста, болезнь Сантавуори-Халтиа/детский НЦЛ1/ППТ, бета-маннозидоз), болезнь Баттена-Шпильмейера-Вогта/ювенильный НЦЛ/НЦЛ3, синдром Санфилиппо типа А, синдром Санфилиппо типа В, синдром Санфилиппо типа С, синдром Санфилиппо типа D, МПС I синдром Гурлера, болезнь Ниманна-Пика (типа А, типа В, типа С, типа D), недостаточность фактора активации/GM2-ганглиозидоз, альфа-маннозидоз, аспартилглюкозаминурию, болезнь накопления эфиров холестерина, хронический дефицит гексозаминидазы А, цистиноз, болезнь Данона, болезнь Фарбера, фукозидоз, галактосиалидоз (синдром Гольдберга), GM1 ганглиозидоз (детский, позднего детского возраста/ювенильный, зрелого возраста/хронический), болезнь I-клеток/муколипидоз II, болезнь накопления сиаловой кислоты детского возраста/ISSD, ювенильную недостаточность гексозаминидазы А, болезнь Краббе (детской; с поздним началом), мукополисахаридозы (псевдо-полидистрофию Гурлера /муколипидоз IIIA, синдром Шейе, МПС I синдром Гурлера-Шейе, болезнь Моркио типа А/МПС IVA, болезнь Моркио типа В/МПС IVB, МПС IX недостаточность гиалуронидазы, синдром Слая (МПС VII), муколипидоз I/сиалидоза, муколипидоз IIIC, муколипидоз типа IV), множественную сульфатазную недостаточность, пикнодизостоз, болезнь Сандхоффа/взрослого возраста/GM2 ганглиозидоз, болезнь Сандхоффа/GM2 ганглиозидоз - детский, болезнь Сандхоффа/ОМ2 ганглиозидоз - ювенильный, болезнь Шиндлера, болезнь Салла, детскую болезнь накопления сиаловой кислоты, Тея-Сакса/GM2-ганглиозидоз, болезнь Вольмана, аспартилглюкозаминурию и просапозин.
[00502] Следует понимать, что синдром Санфилиппо типа А является синонимом синдром Санфилиппо типа А/МПС IIIA, синдром Санфилиппо типа В является синонимом синдром Санфилиппо типа В/МПС IIIB, синдром Санфилиппо типа С является синонимом синдром Санфилиппо типа С/МПС IIIC, синдром Санфилиппо типа D является синонимом синдром Санфилиппо типа D/МПС IIID.
[00503] Согласно одному из вариантов реализации один или более белок, экспрессируемый вектором, предложенным в соответствии с настоящим изобретением, применяемый для лечения одной или более из вышеуказанных лизосомных болезней накопления, включает, не ограничиваясь перечисленными, а-галактозидазу А, арилсульфатазу А, а-глюкозидазу, b-глюкозидазу, глюкоцереброзидазу, НЦЛб белок, ювенильный связанный с НЦЛЗ, N-сульфоглюкозамин сульфогидролазу (SGSH), a-N-ацетилглюкозаминидазу, ацетил-СоА-глюкозаминидацетилтрансфераза, N-ацетилглюкозамин-6-сульфатазу, a-L-идуронидазу, арилсульфатазу В, кислую сфингомиелиназу и идуронатсульфатазу.
[00504] Согласно одному из вариантов реализации вектор, который вводят указанному млекопитающему, страдающему одним или более чем одним из указанных лизосомных болезней накопления, представляет собой аденовирусный вектор. Согласно одному из вариантов реализации указанный вектор содержит полинуклеотид, кодирующий генный переключатель. В одном из аспектов указанный генный переключатель представляет собой генный переключатель на основе EcR. Согласно еще одному варианту реализации полинуклеотид, кодирующий генный переключатель содержит первую последовательность транскрипционного фактора под контролем первого промотора и вторую последовательность транскрипционного фактора под контролем второго промотора, причем белки, кодируемые указанной первой последовательностью транскрипционного фактора и указанной второй последовательностью транскрипционного фактора, взаимодействуют с образованием белкового комплекса, который функционирует как лиганд-зависимый транскрипционный фактор. В одном из аспектов указанный лиганд представляет собой диацилгидразин. В другом аспекте лиганд выбирают из RG-115819, RG-115932, и RG-115830. Еще в одном аспекте лиганд представляет собой амидокетон или оксадиазолин.
[00505] Согласно еще одному варианту реализации настоящее изобретение можно применять для лечения одного или более заболевания печени у млекопитающего. В одном из аспектов указанное млекопитающее представляет собой человека. В другом аспекте указанное млекопитающее представляет собой животное, не являющееся человеком. В одном из аспектов заболевание печени представляет собой гепатит В. В другом аспекте заболевание печени представляет собой гепатит С.Согласно одному из вариантов реализации белок, экспрессируемый вектором, предложенным в соответствии с настоящим изобретением, представляет собой ИФН-а. Согласно еще одному варианту реализации белок, экспрессируемый вектором, предложенным в соответствии с настоящим изобретением, представляет собой церулоплазмин при одном или более заболевании печени.
[00506] Неограничивающий пример гибридной мышиной модели печени человека для инфекции вирусом и лечения гепатита В и С раскрыт у Bissig, K.D. et al., J. din. Investigation 120: 924 (2010). Другой неограничивающий пример модели гепатоцитов человека представлен гуманизированной мышиной системой, выпускаемой Yecuris™ (Портленд, Орегон).
[00507] Неограничивающий пример модели энцефалита, подходящей для оценки противовирусного/ противоинфекционного лечения, раскрыт у O’Brien, L. et al., J. General Virology 90: 874-882 (2009).
[00508] Неограничивающие примеры моделей гриппа, подходящие для оценки противовирусного/ противоинфекционного лечения, раскрыты у Beilharz, M.W. et al., Biochemical Biophysical Research Communications 355:740-744 (2007); и Koemer, I. et al., J. Virology 81:2025-2030 (2007).
[00509] Согласно одному из вариантов реализации вектор, который вводят млекопитающему, страдающему от одного или более указанного заболевания печени, представляет собой аденовирусный вектор. Согласно еще одному варианту реализации указанный вектор не является аденовирусным вектором. Согласно еще одному варианту реализации указанный вектор представляет собой плазмиду. Согласно одному из вариантов реализации вектор содержит полинуклеотид, кодирующий генный переключатель. В одном из аспектов генный переключатель представляет собой генный переключатель на основе EcR. Согласно еще одному варианту реализации полинуклеотид, кодирующий генный переключатель содержит первую последовательность транскрипционного фактора под контролем первого промотора и вторую последовательность транскрипционного фактора под контролем второго промотора, причем белки, кодируемые указанной первой последовательностью транскрипционного фактора и указанной второй последовательностью транскрипционного фактора, взаимодействуют с образованием белкового комплекса, который функционирует как лиганд-зависимый транскрипционный фактор. В одном из аспектов лиганд представляет собой диацилгидразин. В другом аспекте лиганд выбирают из RG-115819, RG-115932 и RG-115830. Еще в одном аспекте лиганд представляет собой амидокетон или оксадиазолин.
[00510] В соответствии с настоящим изобретением предложено конструирование клеток, например, иммунных клеток и TSC, для условной экспрессии белка, обладающего функцией иммуномодулятора и, необязательно, IL-12, и терапевтические применения и/или применения для лечения рака или опухоли, или и того, и другого. In vitro сконструированные иммунные клетки и TSC, которые условно экспрессируют белок, обладающий функцией иммуномодулятора и, необязательно, IL-12, представляют собой безопасное улучшение конститутивного синтеза указанного(ых) белка(ов). Дополнительно, возможность управлять временем и уровнем экспрессии иммуномодулятора и, необязательно, IL-12, обеспечивает лучший контроль эффективности лечения. Таким образом, in vitro сконструированные иммунные клетки и TSC могут быть включены в состав фармацевтических композиций в качестве терапевтических средств для лечения рака или опухоли у человека или у не являющегося человеком организма. Как вариант, in vitro сконструированные популяции иммунных клеток, TSC или их подгрупп могут применяться в качестве носителей для условной доставки иммуномодулятора и, необязательно, синтеза белка IL-12 в определенной области (нормальной ткани, раке или опухоли) в теле человека или не являющемся человеком организме. Указанные иммунные клетки могут быть аутологичными или неаутологичными дендритными клетками. Указанные дендритные клетки могут быть выделены из костного мозга или из периферической кровеносной системы. В случае пациентов-людей, популяции дендритных клеток могут быть выделен путем лейкафереза, при котором выделяют и удаляют фракцию белых клеток крови, а другие компоненты крови реинфузируют пациенту.
[00511] Согласно еще одному варианту реализации дендритные клетки могут быть получены путем транфекции гематопоэтических стволовых клеток человека вектором, предложенным в соответствии с настоящим изобретением, экспрессирующим белок, обладающий функцией иммуномодулятора и, необязательно, белок, обладающий функцией IL-12, и дифференцировки трансфицированных стволовых клеток с получением дендритной клетки. См. патент США 6734014.
[00512] Согласно одному из вариантов реализации предложен нуклеиновокислотный аденовирусный вектор, содержащий генный переключатель, причем кодирующие последовательности VP16-RXR и Gal4-EcR, разделенные последовательностью участка внутренней посадки рибосомы (IRES) EMCV, встраивают в аденовирусный челночный вектор под контролем промотора убиквитина С человека. Например, кодирующие последовательности субъединиц IL12 р40 и р35, разделенные последовательностью IRES, и помещенные под контроль синтетического индуцируемого промотора, встроены в обратном (к 5’ концу) направлении от промотора убиквитина С промотор. В другом примере кодирующая последовательность TNF-альфа, которая помещена под контроль синтетического индуцируемого промотора, встроена в обратном (к 5’ концу) направлении от промотора убиквитина С.
[00513] Согласно еще одному варианту реализации настоящего изобретения предложен челночный вектор, несущий транскрипционные единицы (VP16-RXR и Gal4-EcR) двух гибридных белков и индуцируемых IL-12 или TNF-альфа субъединиц, рекомбинированные с аденовирусным остовом (AdEasyl) в клетках Е. coli BJ5183. После подтверждения рекомбинантного клона плазмиду, несущая геном rAd.RheoIL12 выращивают в клетках XL10-Gold, очищают от них, отщепляют плазмидный остов и упаковывают при помощи трансфекции в клетки НЕК 293 или клетки СНО.
[00514] Очищение указанного вектора для увеличения концентрации может быть осуществлено любым подходящим способом, например, очищением в градиенте плотности (например, хлорида цезия (CsCl)) или при помощи хроматографических техник (например, колоночной или объемной (со спонтанной седиментацией) хроматографией). Например, вектор, предложенный в соответствии с настоящим изобретением, может быть подвергнут двум или трем этапам очищения в градиенте плотности CsCl. Указанный вектор, например, репликативно-дефектный аденовирусный вектор, желательно очистить от клеток, инфицированных указанным репликативно-дефектным аденовирусным вектором с применением способа, который включает лизирование клеток, инфицированных аденовирусом, нанесение лизата на хроматографическую смолу, элюирование аденовируса с хроматографической смолы и сбор фракции, содержащей аденовирус.
[00515] Согласно конкретному варианту реализации полученный первичный вирусный материал амплифицируют реинфицированием клеток НЕК 293 или клеток СНО и очищают центрифугированием в градиенте плотности CsCl.
[00516] Согласно одному из вариантов реализации иммуномодулятор, например, ген TNF-альфа и/или IL-12, представляет собой генную последовательность дикого типа. Согласно еще одному варианту реализации иммуномодулятор, например, ген TNF-альфа и/или IL-12, представляет собой модифицированную генную последовательность, например, гибридную последовательность или последовательность, модифицированную для использования предпочтительных кодонов.
[00517] Согласно одному из вариантов реализации иммуномодулятор, например, ген TNF-альфа, и/или IL-12 представляет собой последовательность человека дикого типа. Согласно еще одному варианту реализации последовательность по меньшей мере на 85% идентична последовательности человека дикого типа, например, по меньшей мере на 90%, 95% или 99% идентична последовательности человека дикого типа. Согласно еще одному варианту реализации указанная генная последовательность кодирует полипептид человека. Согласно еще одному варианту реализации указанный ген кодирует полипептид, по меньшей мере на 85% идентичный полипептиду человека дикого типа, например, по меньшей мере на 90%, 95% или 99% идентичный полипептиду человека дикого типа.
[00518] Согласно одному из вариантов реализации ген IL-12 представляет собой мышиную последовательность IL-12 дикого типа. Согласно еще одному варианту реализации указанная последовательность по меньшей мере на 85% идентична мышиному IL-12 дикого типа, например, по меньшей мере на 90%, 95% или 99% идентична мышиному IL-12 дикого типа. Согласно еще одному варианту реализации последовательность гена IL-12 кодирует мышиный IL-12 полипептид. Согласно еще одному варианту реализации указанный ген кодирует полипептид, по меньшей мере на 85% идентичный мышиному IL-12 дикого типа, например, по меньшей мере на 90%, 95% или 99% идентичный мышиному IL-12 дикого типа.
[00519] ДК могут быть выделены из костного мозга человека, мыши или других млекопитающих. Дендритные клетки могут быть выделены из крови человека, мыши или других млекопитающих. В случае пациентов-людей популяции дендритных клеток могут быть выделены путем процедуры лейкафереза, известной в данной области техники, при которой фракцию белых клеток крови выделяют и удаляют, а другие компоненты крови реинфузируют пациенту. Согласно одному из вариантов реализации ДК получают из костного мозга мыши в соответствии с существующим описанием (Tatsumi et al., 2003). Вкратце, костный мозг (ВМ) мышей дикого типа или EGFP Tg культивируют в кондиционированной среде (СМ) с добавлением 1000 ед/мл рекомбинантного мышиного гранулоцитарно-макрофагального колониестимулирующего фактора и рекомбинантного mIL-4 (Peprotech, Роки Хилл, Нью Джерси) при 37°С в увлажненном инкубаторе при 5% CO2 в течение 7 дней. Затем выделяют CD11c+-ДК, например, с применением специфических бус MACSTM, по инструкциям производителя (Miltenyi Biotec, Оберн, Калифорния). CD11c+-ДК, полученные таким образом, >95% чистые на основе морфологии и ко-экспрессии CD11b, CD40, CD80 и антигенов МНС класса I и класса II.
[00520] В одном из вариантов реализации настоящего изобретения предложены сконструированные иммунные клетки и TSC, условно экспрессирующие белок, обладающий функцией иммуномодулятора и, необязательно, IL-12, подходящий для терапевтического применения для лечения рака или опухоли, или и того, и другого, в качестве генной терапии у человека или не являющегося человеком организма. Согласно одному из вариантов реализации настоящего изобретения предложены сконструированные иммунные клетки и TSC, содержащие генный переключатель.
[00521] Согласно еще одному варианту реализации настоящего изобретения предложены сконструированные иммунные клетки и TSC, содержащие по меньшей мере часть рецептора экдизона. Согласно еще одному варианту реализации настоящего изобретения предложены сконструированные иммунные клетки и TSC, содержащие генный переключатель на основе рецептора экдизона. Согласно еще одному варианту реализации настоящего изобретения предложены сконструированные иммунные клетки и TSC, содержащие RheoSwitch. Согласно еще одному варианту реализации настоящего изобретения предложен набор, содержащий сконструированные иммунные клетки и TSC, содержащие генный переключатель и лиганд, который модулирует указанный генный переключатель. Согласно еще одному варианту реализации указанные наборы дополнительно содержат диацилгидразиновый лиганд. Согласно еще одному варианту реализации указанный набор дополнительно содержит RG-115830 или RG-115932.
[00522] Согласно одному из вариантов реализации настоящего изобретения предложена сконструированная популяция иммунных клеток и TSC. Согласно одному из вариантов реализации культивируемые 7-дневные ДК обрабатывают рекомбинантным аденовирусом, кодирующим иммуномодулятор и/или IL-12, отсоединенный от конститутивного или индуцируемого промотора, или инфицируются плацебо, контрольным аденовирусным вектором (rAdψ5), в диапазоне кратности инфекции (MOI). Через 48 часов инфицированные ДК собирают и анализируют фенотип и синтез иммуномодулятора и/или IL-12 с применением специфического набора для ИФА (ELISA) (BD-PharMingen, Сан-Диего, Калифорния) с минимальной чувствительностью 62,5 пг/мл.
[00523] Согласно еще одному варианту реализации настоящего изобретения предложена in vitro сконструированная популяция иммунных клеток и TSC, содержащая вектор, например, ДНК вектор, содержащий генный переключатель, способный условно экспрессировать белок, обладающий функцией иммуномодулятора и/или IL-12, и дополнительно содержащая активирующий лиганд. Согласно еще одному варианту реализации настоящего изобретения предложен способ лечения рака, например, меланомы или глиомы, путем введения сконструированных ДК пациенту, и последующего введения указанному пациенту активирующего лиганда, такого как RG-115819, RG-115830 или RG-115932. Согласно определенным вариантам реализации настоящее изобретение относится к способу лечения рака, например, меланомы или рака предстательной железы, включающему введение аденовируса, содержащего полинуклеотид, условно экспрессирующий иммуномодулятор, например, TNF-альфа, и введение активирующего лиганда. Пациент может представлять собой человека или животное с раковым заболеванием. Способы и продукты для лечения, сконструированные клетки, наборы и лиганды применяются для терапии человека и в ветеринарии для терапии животных. Таким образом, предполагается, что указанные продукты и способы будут применяться для человека и для животных в ветеринарии.
[00524] Таким образом, согласно одному из вариантов реализации полинуклеотид, экспрессирующий иммуномодулятор, например, TNF-альфа, и активирующий лиганд вводят совместно пациенту с раковым заболеванием. Активирующий лиганд, как правило, вводят на протяжении нескольких дней, например, до и после введения указанного полинуклеотида. Если из-за иммуномодулятора, например, TNF-альфа, развиваются проявления системной токсичности, введение указанного активирующего лиганда может быть уменьшено или прекращено, чтобы снизить побочные эффекты.
[00525] Согласно еще одному варианту реализации полинуклеотид, экспрессирующий иммуномодулятор, например, TNF-альфа, и активирующий лиганд вводят совместно пациенту, страдающему от одной или более лизосомной болезни накопления, или одного или более заболевания печени. Активирующий лиганд, как правило, вводят на протяжении нескольких дней, например, до и после введения указанного полинуклеотида. В случае, если развиваются проявления системной токсичности, введение указанного активирующего лиганда может быть уменьшено или прекращено, чтобы снизить побочные эффекты.
[00526] Согласно определенным вариантам реализации настоящего изобретения предложен способ уменьшения размера опухоли, включающий введение аденовирусного вектора, который содержит полинуклеотид, условно экспрессирующий иммуномодулятор, например, TNF-альфа, и введение активирующего лиганда. Также предложен способ предотвращения образования опухоли, включающий введение аденовирусного вектора, который содержит полинуклеотид, условно экспрессирующий иммуномодулятор, например, TNF-альфа, и введение активирующего лиганда. Согласно некоторым вариантам реализации настоящего изобретения предложен способ уменьшения или облегчения одного или более симптома неопластического расстройства, включающий введение аденовирусного вектора, который содержит полинуклеотид, условно экспрессирующий иммуномодулятор, например, TNF-альфа, и введение активирующего лиганда. В частности, композиция, содержащая указанный вектор, например, аденовирусный вектор, условно экспрессирующий иммуномодулятор, может уменьшать, предотвращать или улучшать системную токсичность у получающего лечение пациента по сравнению с вектором, который конститутивно экспрессирует указанный иммуномодулятор.
[00527] Согласно определенным вариантам реализации настоящего изобретения предложен способ лечения одного или более заболевания или одной или более лизосомной болезни накопления, или одного или более заболевания печени у млекопитающих, включающий введение аденовирусного вектора, который содержит полинуклеотид, условно экспрессирующий один или более белок и введение активирующего лиганда. Согласно некоторым вариантам реализации настоящего изобретения предложен способ уменьшения или улучшения одного или более симптома одного или более заболевания или одной или более лизосомной болезни накопления, или одного или более заболевания печени у млекопитающих, включающий введение аденовирусного вектора, который содержит полинуклеотид, условно экспрессирующий иммуномодулятор, например, TNF-альфа, и введение активирующего лиганда.
[00528] Метки на основе белков уменьшают или отменяют необходимость высокоспецифичных пост-трансляционных модификаций для эффективного нацеливания (таргетинга). Подходящие метки на основе белков включают, не ограничиваясь перечисленными, таргетинг IGF2R (IGF2 (GILT)/IGF2 конструирование), таргетинг рецептора трансферрина (трансферрин, TfR-нацеливающие пептиды), и белок Tat (в которой гепарансульфат-протеогликаны (HSPG) клеточной поверхности опосредуют интернализацию Tat).
[00529] Другие белки, нацеленные на лизосому, которые могут применяться в качестве метки, включают, не ограничиваясь перечисленными, связывающий витамин D белок, фолат-связывающий белок, лактотрансферрин, связывающий половые гормоны глобулин, транстиретин, просапозин, ретинол-связывающий белок, аполипопротеин В, аполипопротеин Е, пролактин, рецептор-связанный белок (согласно одному из вариантов реализации без последовательности HNEL), природный трансферрин и мутантный трансферрин (например, мутант K225E/R651A или мутант K225E/K553A).
[00530] Согласно одному из вариантов реализации экспрессионная конструкция также кодирует одну или более репортерную последовательность, последовательность метки локализации и последовательность метки детекции. Следует понимать, что композиция согласно настоящему изобретению или способы применения указанной композиция могут быть скомбинированы с любым химиотерапевтическим агентом или агентами (например, для обеспечения комбинированных терапевтических режимов), который(е) прекращае(ю)т, уменьшае(ю)т, подавляе(ю)т или контролируе(ю)т рост неопластических клеток или опухолей in vivo. Используемые в настоящей заявке термины «химиотерапевтический агент» или «химиотерапевтические средства» следует понимать как обозначение любых терапевтических соединений, которые вводятся для лечения или предотвращения роста опухоли in vivo. В частности, химиотерапевтические агенты, совместимые с настоящим изобретением, включают как «традиционные» химиотерапевтические агенты, такие как небольшие молекулы, так и разработанные недавно биопрепараты, такие как антитела, цитокины, антисмысловые молекулы и т.д., которые применяют для уменьшения или замедления роста злокачественной клетки.
[00531] В одном из аспектов настоящего изобретения предложена фармацевтическая композиция, подходящая для введения человеку или не-человеку, содержащая популяцию in vitro сконструированных иммунных клеток или TSC, или вектор, например, аденовирусный вектор, экспрессирующий белок, обладающий функцией иммуномодулятора, например, TNF-альфа, и/или IL-12, причем указанный состав подходит для внутриопухолевого введения. Согласно еще одному варианту реализации композиция, например, фармацевтическая композиция, содержит вектор, условно экспрессирующий иммуномодулятор, например, TNF-альфа. Согласно некоторым вариантам реализации указанная композиция содержит приблизительно 1×105 или больше единиц (ед.) вектора для переноса генов. «Единица» представляет собой одну векторную частицу. Согласно определенным вариантам реализации указанная композиция содержит приблизительно 1×106единиц вектора для переноса генов (например, от приблизительно 1×107 или более единиц, приблизительно 1×108 или более единиц, или приблизительно 1×109 или более единиц). Согласно другим вариантам реализации указанная композиция содержит приблизительно 1×1010 или более ед., 1×1011 или более ед., 1×1012 или более ед., 1×1013 или более ед., 1×1014 или более ед., или 1×1015 или более ед. вектора для переноса генов, в особенности, вирусного вектора, такого как репликативно-дефектный аденовирусный вектор. Число единиц вектора для переноса генов в указанной композиции может быть определено с применением любого известного подходящего способа, например, сравнением показателей поглощения указанной композиция и показателей поглощения стандартного раствора вектора для переноса генов (т.е. раствора вектора для переноса генов с известной концентрацией), как описано ниже в настоящей заявке.
[00532] В соответствии с настоящим изобретением также предложена фармацевтическая композиция, содержащая активирующий лиганд, такой как RG-115819, RG-115830 или RG-115932, при этом указанная композиция подходит для введения интраперитонеально, перорально или подкожно.
[00533] Композиция, предложенная в соответствии с настоящим изобретением, например, композиция, содержащая сконструированные ДК, вектор (например, аденовирусный вектор), или активирующий лиганд, дополнительно может содержать фармацевтически приемлемый носитель. Указанный носитель может представлять собой любой подходящий носитель для указанных сконструированных дендритных клеток, вектора для переноса генов или активирующего лиганда. Подходящие носители для указанной композиции описаны в патенте США №6225289. Носитель как правило, жидкий, но может быть и твердым, или может представлять собой комбинацию жидких и твердых компонентов. Желательно, чтобы носитель представлял собой фармацевтически приемлемый (например, физиологически или фармакологически приемлемый) носитель {например, вспомогательное вещество или разбавитель). Фармацевтически приемлемые носители общеизвестны и легко доступны. Выбор носителя должен быть обусловлен, по меньшей мере отчасти, конкретными компонентами композиции и конкретным способом, применяемым для введения композиции. Композиция дополнительно может содержать любые другие подходящие компоненты, в особенности для увеличения стабильности указанной композиции и/или ее конечного применения. Соответственно, существует широкий спектр подходящих составов композиции, предложенной в соответствии с настоящим изобретением.
[00534] Составы, подходящие для перорального введения, включают (а) жидкие растворы, такие как эффективное количество активного ингредиента, растворенное в разбавителях, таких как вода, солевой раствор или апельсиновый сок, (b) капсулы, пакеты-саше или таблетки, каждый(ая) из которых содержит заранее установленное количество активного ингредиента, в виде твердого вещества или гранул, (с) суспензии в подходящей жидкости, и (d) подходящие эмульсии. Таблетизированные формы могут включать что-то одно или более из лактозы, маннита, кукурузного крахмала, картофельного крахмала, микрокристаллической целлюлозы, камеди, желатина, коллоидного диоксида кремния, натрия кроскармеллозы, талька, стеарата магния, стеариновой кислоты и других вспомогательных веществ, красителей, разбавителей, буферизующих агентов, увлажняющих агентов, консервантов, вкусоароматических агентов и фармакологически совместимых вспомогательных веществ. Формы для рассасывания могут содержать активный ингредиент во вкусоароматическом веществе, как правило, сахарозе и камеди или трагаканте, а также могут включать пастилки, содержащие активный ингредиент в инертной основе (такой как желатин и глицерин, или сахароза и камедь), и эмульсии, гели и т.п., содержащие, помимо активного ингредиента, вспомогательные вещества, известные в данной области техники.
[00535] Например, композиция, содержащая вектор, популяция иммунных клеток или TSC, или in vitro сконструированные клетки могут содержать буферизующий агент, такой как Трис. Согласно одному из вариантов реализации указанная композиция может содержать Трис и/или глицерин. Согласно еще одному варианту реализации указанная композиция также содержит подкисляющие вещества, анионные или неионные поверхностно-активные вещества, агенты совместимости и/или разбавители.
[00536] Составы, подходящие для введения ингаляционным путем, включают аэрозольные составы. Аэрозольные составы могут быть помещены в приемлемые распыляющие вещества под давлением, такие как дихлордифторметан, пропан, азот и т.п. Они также могут быть получены в виде составов, не находящихся под давлением, для доставки из небулайзера или аэрозольного распылителя.
[00537] Составы, подходящие для парентерального введения, включают водные и неводные изотонические стерильные инъекционные растворы, которые могут содержать антиоксиданты, буферные агенты, бактериостатические вещества и растворенные вещества, которые доводят состав до изотонического относительно крови предполагаемого реципиента, и водные и неводные стерильные суспензии, которые могут содержать суспендирующие агенты, растворители, загустители, стабилизаторы и консерванты. Указанные составы могут быть помещены в однодозные или многодозные герметичные контейнеры, такие как ампулы и флаконы, и могут храниться в обезвоженном сублимацией (лиофилизированном) состоянии, требующем только добавления стерильного жидкого вспомогательного вещества, например, воды, для приготовления инъекции непосредственно перед применением. Экстемпоральные инъекционные растворы и суспензии могут быть получены из стерильных порошков, гранул и таблеток описанных выше типов.
[00538] Составы, подходящие для анального введения, могут быть получены в виде суппозиториев смешиванием активного ингредиента с разнообразными основами, такими как эмульгирующие основы или водорастворимые основы. Составы, подходящие для вагинального введения, могут быть представлены в виде пессариев, тампонов, кремов, гелей, паст, пен или спреев, содержащих, помимо активного ингредиента, подходящие, в соответствии с известной в данной области техники информацией, носители.
[00539] Кроме того, указанная композиция может содержать дополнительные терапевтические или биологически активные агенты. Например, могут присутствовать терапевтические факторы, подходящие для лечения при определенных показаниях. Факторы, которые контролируют воспаление, такие как ибупрофен или стероиды, могут входить в состав указанной композиции для уменьшения опухания и воспаления, связанных с in vivo введением вектора для переноса генов и физиологическим дистрессом. При применении способа с указанной композицией могут вводиться супрессоры иммунной системы для уменьшения любого иммунного ответа, на сам указанный вектор для переноса генов, или связанного с расстройством. Как вариант, в указанные композиции могут быть включены усилители иммунитета для повышающей регуляции природных способов защиты организма от заболеваний. Кроме того, с указанной композицией могут вводиться цитокины для привлечения иммунных эффекторных клеток в область локализации опухоли.
[00540] Согласно конкретному описанному в настоящей заявке варианту реализации в соответствии с настоящим изобретением предложен способ лечения опухоли, включающий следующие этапы по порядку:
а. введение млекопитающему внутриопухолево популяции in vitro сконструированных иммунных клеток или TSC; и
b. введение указанному млекопитающему терапевтически эффективного количества активирующего лиганда.
[00541] Согласно одному из вариантов реализации активирующий лиганд вводят практически одновременно с композицией, содержащей in vitro сконструированные иммунные клетки или TSC или вектор, например, аденовирусный вектор, например, в течение одного часа до или после введения указанных клеток или указанной векторной композиции. Согласно еще одному варианту реализации активирующий лиганд вводят приблизительно через 24 часа или менее после введения указанных in vitro сконструированных иммунных клеток или TSC или вектора. Согласно еще одному варианту реализации активирующий лиганд вводят приблизительно через 48 часов или менее после указанных in vitro сконструированных иммунных клеток или TSC, или вектора. Согласно еще одному варианту реализации лиганд представляет собой RG-115932. Согласно еще одному варианту реализации лиганд вводят в дозировке приблизительно от 1 до 50 мг/кг/день. Согласно еще одному варианту реализации лиганд вводят в дозировке приблизительно 30 мг/кг/день. Согласно еще одному варианту реализации лиганд вводят ежедневно в течение 7-28 дней. Согласно еще одному варианту реализации лиганд вводят ежедневно в течение 14 дней. Согласно еще одному варианту реализации вводят приблизительно от 1×106 до 1×108 клеток. Согласно еще одному варианту реализации вводят приблизительно 1×107 клеток.
[00542] Согласно одному из вариантов реализации дендритные клетки сконструированы для условной экспрессии IL-2 и IL-12. IL-2 проявляет мощные иммунорегуляторные эффекты на эффекторные и регуляторные Т-, NK- и NK-T-клетки. Предполагается, что экспрессирование IL-2 и IL-12 в клетках будет приводить к реципрокной повышающей регуляции рецепторов друг друга и вызывать различные комплементарные биологические эффекты посредством отдельных сигнальных путей. Также предполагается, что комбинация IL-2 и IL-12 будет увеличивать длительность иммунной стимуляции и уменьшать эффективную дозу клеток, что может лучше переноситься животным. См. Dietrich 2002, Wigginton 2002, 2001, 1996 и Koyama, 1997, McDermott and Atkins 2008; Bemtsen et al 2008; Tarhini et al 2008; Heemskerk et al 2008; Horton et al 2008. Полинуклеотидные последовательности IL-2 можно найти под номерами доступа U25676 (человека); NM_008366 (мышиный); NM_204153 (куриный); и NM_053836 (крысиный). Полинуклеотидные последовательности IL-12 можно найти под номерами доступа NM_000882 (человека IL12A); NM_002187 (человека IL12B); NM_008351 (мышиный IL12a); NM_008352 (мышиный IL12b); NM_213588 (куриный IL12A); NM_213571 (куриный IL12B); NM_053390 (крысиный IL12a); и NM_022611 (крысиный IL12b). SEQ ID NO:13,15,21 и 23 кодируют IL-12 человека и мыши и их субъединицы.
[00543] Согласно еще одному варианту реализации дендритные клетки сконструированы для условной экспрессии IL-18 и IL-12. IL-18 индуцирует синтез ИФН-гамма и способствует развитию Т-хелперных клеток и активации NK. Кроме того, IL-18 может повышать синтез ГМКСФ и снижать синтез IL-10. Предполагается, что экспрессирование IL-18 и IL-12 снимет ограничения, наблюдаемые при введении любого из цитокинов по отдельности. Предполагается, что экспрессия IL-12 и IL-18 в дендритных клетках будет стимулировать более интенсивные специфичные Th1 ответы на опухолевые антигены, чем в случаях, когда дендритные клетки преобразованы любьм из цитокинов по отдельности.
[00544] Внутриопухолевое инъецирование ДК, сконструированных для секреции и IL-12, и IL-18, опосредовало наиболее высокие уровни синтеза INF-γ и полное отторжение опухоли (Tatsumi 2003). См. Vujanovic, 2006. См. также Coughlin, 1998, Subleski, 206, Tatsumi, 2003 и Sabel, 2007; Shiratori et al 2007; Lian et al 2007; linuma et al 2006. См. выше описание полинуклеотидных последовательностей IL-12. Полинуклеотидные последовательности IL-18 можно найти под номерами доступа U90434 (человек); NM_008360 (мышиный); EU747333 (куриный); и AY258448 (крысиный).
[00545] Согласно еще одному варианту реализации дендритные клетки сконструированы для условной экспрессии IL-15 и IL-12. IL-15 разделяет некоторые биологические функции с IL-2, что делает его потенциально подходящим для терапии рака. IL-15 стимулирует пролиферацию NK клеток и активированных Т-клеток, и поддерживает экспансию эффекторных Т-клеток. Сообщалось, что предъявление IL-15 действовало синергистически с IL-12, увеличивая синтез ИФН-гамма NK клетками. Koka, 2004; Basak 2008; Lasek et al 2004. Внутриопухолевая доставка IL-15 и IL-12 индуцировала значительную регрессию опухоли в модели меланомы (Lasek 1999). См. выше описание полинуклеотидных последовательностей IL-12. SEQ ID NO:11 и 19 кодируют IL-15 человека и мыши. На Фиг.2 и 4 представлены плазмидные карты для экспрессионных систем, которые могут применяться для IL-12 и IL-15 человека и мыши.
[00546] Согласно еще одному варианту реализации дендритные клетки сконструированы для условной экспрессии IL-21 и IL-12. IL-21 и его рецептор обладают гомологией последовательностей с IL-2 и IL-15. IL-21 способствует экспансии и созреванию NK клеток. Биологические эффекты IL-21 потенциально синергистичны с IL-12, так как обработка NK-клеток IL-21 приводит к заметной повышающей регуляции рецептора IL-12. Кроме того, IL-21 может усиливать передачу сигнала IL-12, и он содействовал увеличению синтеза ИФН-гамма. См. выше описание полинуклеотидных последовательностей IL-12. Полинуклеотидные последовательности IL-21 можно найти под номерами доступа AF254069 (человека); NM_021782 (мышиный); NM_001024835 (куриный); и NM_001108943 (крысиный). SEQ ID NO:6, 7, 8, 9, и 17 кодируют IL-21 человека и мыши. SEQ ID NO:1 и 2 представляют собой полинуклеотидные конструкции, кодирующие IL-12 и IL-21 мыши и человека. На Фиг.7 и 8 представлены плазмидные карты для экспрессионных систем, которые могут применяться для экспрессии IL-12 и IL-21 человека и мыши, соответственно.
[00547] Согласно еще одному варианту реализации дендритные клетки сконструированы для условной экспрессии TNF-альфа и IL-12. TNF-альфа представляет собой мощный активатор иммунных клеток и опосредует противоопухолевые свойства. Кроме того, TNF-альфа может действовать синергистически с IL-12, увеличивая экспрессию ИФН-гамма и рецептора IL-12 на Т-клетках. В эксперименте на животных применение и IL-12, и TNF-альфа приводило к инфильтрации опухоли DN8+-Т-клетками, выраженному синтезу ИФН-гамма и последующей регрессии опухоли. См. Sabel, 2003, 2004, 2007, Taniguchi, 1998, Lasek, 2000; и Xia et al 2008. См. выше описание полинуклеотидных последовательностей IL-12. Полинуклеотидные последовательности, кодирующие TNF-альфа, доступны под номерами доступа Х02910 (человека); NM_013693 (мышиный); и ВС107671 (крысиный).
[00548] Согласно еще одному варианту реализации дендритные клетки сконструированы для условной экспрессии IL-7 и IL-12. IL-7 является представителем семейства IL-2 и важен для Т-клеточного и В-клеточного лимфопоэза. IL-7 регулирует гомеостаз выживания и пролиферации необученных СВ8+-Т-клеток и С08+-Т-клеток памяти. Подтверждено, что IL-7 повышает синтез CTL в ответ на опухоли. Кроме того, IL-12 действует направленно на CD8+-T-клетки, повышая опосредованную IL-7 пролиферацию. Далее, сообщалось, что IL-7 и IL-12 синергистически повышают цитотоксичность CD8+-Т-клеток. Mehrotra, 1995; Sharma et al 2003; Tirapu et al 2002. Таким образом, предполагается, что коэкспрессия IL-7 и IL-12 будет обеспечивать более оптимальные противоопухолевые ответы. См. выше описание полинуклеотидных последовательностей, кодирующих IL-12. Полинуклеотидные последовательности, кодирующие IL-7, можно найти под номерами доступа J04156 (человека); NM_008371 (мышиный); NM_001037833 (куриный); и NM_013110 (крысиный).
[00549] Согласно еще одному варианту реализации дендритные клетки сконструированы для условной экспрессии ГМКСФ и IL-12. ГМКСФ регулирует дифференцировка и пролиферация гемопоэтических клеток-предшественников, и играет особенно важную роль в созревании профессиональных антиген-презентирующих клеток (АПК), таких как дендритные клетки. ГМКСФ также повышает способность дендритных клеток обрабатывать и презентировать антигены. ГМКСФ функционирует отличным от IL-12 образом, и они оба вызывают выраженные противоопухолевые ответы в испытаниях на животных. Предполагается, что комбинация IL-12 (активация Т-клеток) и ГМКСФ (активация дендритных клеток) будет приводить к более мощному противоопухолевому иммунитету. В испытаниях на животных ГМКСФ в комбинации с обработкой IL-12 существенно подавлял рост опухоли в разнообразных моделях рака. Wang, 2001; Chang, 2007; Jean, 2004; Nair, 2006; Hill 2002; Small et al 2007. В ходе клинических исследований на людях ГМКСФ+IL-12 успешно применяли для лечения пациентов с миеломой, при этом комбинированное действие обоих цитокинов приводило к снижению количества циркулирующих В-клеток. Rasmussen, 2003; Hansson, 2007; Abdalla, 2007. Предполагается, что коэкспрессия ГМКСФ и IL-12 в одной клетке позволит избежать нежелательных системных эффектов, таких как снижение количества циркулирующих В-клеток. См. выше описание полинуклеотидных последовательностей, кодирующих IL-12. Полинуклеотидные последовательности ГМКСФ можно найти под номерами доступа Ml 1734 (человека); NM_009969 (мышиный); EU520303 (куриный); NM_001037660 (крысиный Csf2ra); и NM_133555 (крысиный Csf2rb).
[00550] Согласно еще одному варианту реализации дендритные клетки сконструированы для условной экспрессии хемокина (например, CCL3 (MIP-1a), CCL5 (RANTES), CCL7 (МСР3), XCL1 (лимфотактина), CCL19 (MIP-3b), CXCL9 (MIG), CXCL10 (IP-10), CXCL12 (SDF-1), или CCL21 (6С-кин)) и IL-12. Хемокины представляют собой цитокины-хемоаттрактанты, которые регулируют миграцию и активацию лейкоцитов и других типов клеток при разнообразных воспалительных и невоспалительных состояниях. Воспалительные цитокины контролируют рекрутинг лейкоцитов при воспалении и повреждении тканей. Гомеостатические хемокины выполняют организующие функции, такие как управление миграцией лейкоцитов (например, дендритных клеток) в направлении и внутри вторичных лимфоидных органов, а также костного мозга и тимуса, на протяжении гемопоэза. В испытаниях на животных совместное внутриопухолевое инъецирование двух отдельных аденовирусов, экспрессирующих IL-12 и CXCL10, приводило к 100% регрессии опухолевых узлов, происходящих из клеточной линии СТ26 мышиной колоректальной аденокарциномы. Narvaiza et al., 2000. Emtage et al., 1999 описывают два парных рекомбинантных аденовирусных вектора, экспрессирующих либо IL2 и XCL1 (лимфотактин), либо IL-12 и XCL1. Внутриопухолевая инъекция векторов в опухоли аденокарциномы молочной железы у мышей вызывала мощный противоопухолевый ответ и влекла формирование защитного иммунитета. В других испытаниях на животных ко-трансдукция аденовирусных векторов, экспрессирующих IL-12 и CCL27 приводила к регрессии опухоли и продолжительному специфическому иммунитету. Gao et al., 2007. Таким образом, предполагается, что коэкспрессия хемокина и IL-12 согласно настоящему изобретению будет приводить к синергистической противоопухолевой активности.
[00551] Согласно еще одному варианту реализации дендритные клетки сконструированы для условной экспрессии антиангиогенного цитокина (например, IP-10 и Mig) и IL-12. IP-10 и Mig представляют собой хемоаттрактанты для Т-клеток и NK клеток, и их способность ингибировать ангиогенез зависит от NK-клеток. В ходе испытаний на животных показано, что комбинированная терапия двумя аденовирусами, один из которых экспрессирует IP 10, а другой экспрессирует IL-12, приводило к заметному противоопухолевому синергизму. Narvaiza et al., 2000. В других испытаниях аденовирусные векторы, экспрессирующие IP 10 или MIG и/или IL-12, вводили внутриопухолево в мышиной модели аденокарциномы молочной железы и фибросаркомы. Было обнаружено, что введение IP-10 или MIG в комбинации с IL-12 приводило к значительной регрессии опухоли и увеличивало продолжительность выживания животных-опухоленосителей по сравнению животными, получавшими по отдельности с IP 10, MIG, IL-12, или контрольными животными, при этом комбинация IP-10 и IL12 была наиболее эффективной. Palmer, 2001. См. также Mazzolini, 2003; и Huang 2004. Таким образом, предполагается, что коэкспрессия антиангиогенного цитокина и IL-12 будет приводить к синергической противоопухолевой активности.
[00552] Для демонстрации эффективной IL-12-опосредо ванной генной терапии применяют систему условной экспрессии кДНК, которая позволяет запускать синтез иммуномодулятора и/или IL-12 иммунными клетками или TSC в различные моменты времени после внутриопухолевой инъекции. На основании результатов, полученных для модели агрессивной меланомы В 16 на мышах C57BL/6, были сделаны следующие заключения: 1) увеличенные уровни IL-12 секретируются DC.RheoIL12 в присутствии указанного активирующего лиганда RG-115830, но не в отсутствие указанного лиганда; 2) внутриопухолевая терапия на основе DC.RheoIL12 настолько же эффективна, как и внутриопухолевая терапия на основе DC.cIL12, при условии, что RG-115830 вводят подопытным животным в течение 24 ч после инъекции ДК (при введении лиганда в более поздние моменты времени терапия RG-115830 не работает); 3) IL-12 экспрессия в ДК предположительно продлевает выживаемость этих клеток в микроокружении опухоли и ассоциирована с ббльшим количеством внутриопухолево инъецированных ДК, которые мигрируют в дренирующие опухоль лимфатические узлы; и 4) наиболее сильно коррелирующим с исходом терапии показателем иммунности является уровень опухолеспецифичных CD8+-T-клеток, перекрестие примированных в результате терапии, а не количество инъецированных ДК, поддерживаемых в микроокружении опухоли. В целом, эти данные указывают на то, что основанная на DC.IL12 терапия, вероятно, эффективна за счет положительного влияния на афферентные (перекрестное примирование) CD8+-T-клеточные эффекторы типа-1, а не на более поздние эфферентные события, такие как опосредованный инъецированными ДК рекрутинг противоопухолевых Т-клеток в микроокружение опухоли и т.д.
[00553] Перед внутриопухолевой инъекцией клетки (иммунные клетки или TSC) могут быть обработаны фактором для стимуляции активности указанных клеток. Например, клетки могут быть обработаны ко-стимулирующей молекулой, такой как позитивная ко-стимулирующая молекула, включая OX40L, 4-1BBL, CD40, CD40L, GITRL, CD70, LIGHT или ICOS-L или негативная ко-стимулирующая молекула, такая как антитела анти-СТ1А4, анти-PD-L1 или анти-PD-L2. Например, указанные клетки (например, иммунные клетки или TSC) могут быть инкубированы с клетками, экспрессирующими одну или более ко-стимулирующую молекулу, например, клетками лимфомы J588, экспрессирующими молекулу лиганда CD40. Согласно еще одному варианту реализации клетки (иммунные клетки или TSC) могут быть обработаны молекулой обратного иммуносупрессора (ингибитора толерантности), такого как анти-TGF-бета антитела (для ингибирования TGF-сигнализации в микроокружении), антитела анти-IL10, TGFbRII DN (для ингибирования TGF-сигнализации в генномодифицированных клетках), IL-10R DN, dnFADD (для ингибирования путей клеточной смерти в указанных клетках), анти-SOCS1 антитела, миРНК или ловушки (для ингибирования супрессорной цитокиновой сигнализации в указанных клетках), или анти-TGFa антитела.
[00554] Получают рекомбинантные аденовирусы, несущие полинуклеотидные последовательности, показанные на фиг.1-8. Например, hIL-21 получают котрансфекцией экспрессионного вектора hIL-21, линеаризованного рестрикционным расщеплением по участку в 5’ направлении от левой ITR, и подходящего (пример, с удаленной Е3) аденовирусного остова в пермиссивную клеточную линию, такую как клетки HEK293. Аденовирусный вектор, несущий мышиные иммуномодулирующие гены, применяют для трансдукции мышиных дендритных клеток или TSC для применения в мышиных терапевтических моделях. Для терапевтического применения у человека полинуклеотид, кодирующий человеческий гомолог иммуномодулирующего гена, встраивают в подходящий вектор. Аденовирусный вектор для терапевтического применения у человека получают в условиях, соответствующих GMP. Пример плана лечения (клинического исследования) пациентов со стадией III/IV меланомы выглядит следующим образом: лечение в этом случае включает внутриопухолевое инъецирование преобразованных аденовирусом дендритных клеток и 14 ежедневных пероральных доз активирующего препарата (лиганда). Пациентов наблюдают на протяжении от 30 дня до клинического исследования и до первой недели перед клиническим исследованием. Каждого пациента просят подписать информированное согласие до начала проведения каких-либо процедур. Исследователь информирует всех пациентов о сути, задачах, продолжительности, потенциальном вреде и процедурах, которые будут проводиться на протяжении испытания, и возможности того, что их медицинские документы могут быть рассмотрены FDA. Пациентов (общим числом от 16 до 20) случайным образом группируют в 4 когорты. Все когорты получают внутриопухолевую инъекцию до 5×107 преобразованных дендритных клеток приблизительно через 3 часа после перорального введения первой дозы указанного лиганда. Указанные 4 когорты отличаются приемом ежедневно получаемого перорально лиганда: например, когорта 1=0,01 мг/кг; когорта 2=0,3 мг/кг; когорта 3=1 мг/кг; когорта 4=3 мг/кг. На протяжении указанного курса лечения в определенные временные интервалы берут кровь для оценки фармакокинетики активирующего препарата и его основных метаболитов при однократном введении и при равновесной концентрации. Также кровь берут в определенные моменты времени для оценки гуморального и клеточного иммунного ответа на вирусный вектор, компоненты RTS и опухоль. В определенные моменты времени берут мочу и кровь для биохимического анализа сыворотки, анализа мочи и общего анализа крови (профиля безопасности). В определенные моменты времени делают биопсии опухоли и/или дренирующих лимфоузлов для оценки трансгенной экспрессии и иммунного ответа на опухоль в результате указанной терапии. Устанавливаются критерии для досрочного прекращения у пациентов в случае нежелательных явлений; указанные нежелательные явления фиксируются. Пациентов наблюдают на предмет нежелательных явлений и терапевтического результата на 1, 2, 3 и 4 месяц.
[00555] Согласно еще одному варианту реализации пациенту, нуждающемуся в лечении опухоли, (а) вводят дендритные клетки, сконструированные для экспрессии иммуномодулятора, например, иммуномодулятора, описанного в настоящей заявке, конститутивной или условной, и/или (b) вектор, экспрессирующий иммуномодулятор, например, иммуномодулятор, описанный в настоящей заявке, конститутивно или условно, инъецируют внутриопухолево указанному пациенту. Согласно одному из вариантов реализации указанные дендритные клетки сконструированы для экспрессии иммуномодулирующего Ad вектора, и, в частности, иммуномодулирующего Ad-RTS вектора. Согласно еще одному варианту реализации вектор, который вводят внутрь опухоли указанному пациенту, представляет собой иммуномодулирующий Ad-вектор, и, в частности, иммуномодулирующий Ad-RTS вектор.
[00556] Согласно еще одному варианту реализации пациенту, нуждающемуся в лечении опухоли, (а) вводят дендритные клетки, сконструированные для экспрессии IL-12, конститутивной или условной, и (b) вектор, экспрессирующий IL-12, конститутивно или условно, инъецируют внутриопухолево указанному пациенту. Согласно одному из вариантов реализации указанные дендритные клетки сконструированы для экспрессии вектора Ad-IL-12, и, в частности, вектора Ad-RTS-IL-12. Согласно еще одному варианту реализации вектор, который вводят внутрь опухоли указанному пациенту, представляет собой вектор Ad-IL-12, и, в частности, вектор Ad-RTS-IL-12.
[00557] Согласно еще одному варианту реализации пациенту, нуждающемуся в лечении опухоли, (а) вводят дендритные клетки, сконструированные для экспрессии IL-12, конститутивной или условной, и (b) указанному пациенту вводят один или более противораковый химиотерапевтический агент.Согласно одному из вариантов реализации указанные сконструированные дендритные клетки сконструированы для экспрессии вектора Ad-IL-12, и, в частности, вектора Ad-RTS-IL-12. Указанный один или более противораковый химиотерапевтический агент может быть введен до введения сконструированных дендритных клеток, после введения сконструированных дендритных клеток или одновременно с введением сконструированных дендритных клеток. Согласно еще одному варианту реализации противораковый химиотерапевтический агент представляет собой паклитаксел, производное или аналог паклитаксела, темозоломид, производное или аналог темозоломида, сунитиниб, производное или аналог сунитиниба, гемцитабин, или производное или аналог гемцитабина.
[00558] Согласно еще одному варианту реализации пациенту, нуждающемуся в лечении опухоли, (а) вводят дендритные клетки, сконструированные для экспрессии IL-12, конститутивной или условной, (b) вектор, экспрессирующий IL-12, конститутивно или условно, инъецируют внутриопухолево указанному пациенту, и (с) указанному пациенту вводят один или более противораковый химиотерапевтический агент.Согласно одному из вариантов реализации дендритные клетки сконструированы для экспрессии вектора Ad-IL-12, и, в частности, вектора Ad-RTS-IL-12. Согласно еще одному варианту реализации вектор, который вводят внутрь опухоли указанному пациенту, представляет собой вектор Ad-IL-12, и, в частности, вектор Ad-RTS-IL-12. Указанный один или более противораковый химиотерапевтический агент может быть введен до введения указанных сконструированных дендритных клеток и вектора, экспрессирующего IL-12, после введения указанных сконструированных дендритных клеток и вектора, экспрессирующего IL-12, или одновременно с введением сконструированных дендритных клеток и вектора, экспрессирующего IL-12. Согласно одному из вариантов реализации указанный противораковый химиотерапевтический агент представляет собой паклитаксел, производное или аналог паклитаксела, темозоломид, производное или аналог темозоломида, сунитиниб, производное или аналог сунитиниба, гемцитабин, или производное или аналог гемцитабина.
[00559] Согласно еще одному варианту реализации пациенту, нуждающемуся в лечении опухоли, (а) вводят дендритные клетки, сконструированные для экспрессии иммуномодулятора, например, иммуномодулятора, описанного в настоящей заявке, конститутивной или условной, и (b) указанному пациенту вводят один или более противораковый химиотерапевтический агент.Согласно одному из вариантов реализации указанные сконструированные дендритные клетки сконструированы для экспрессии Ad-иммуномодулирующего вектора, и, в частности, Ad-RTS-иммуномодулирующего вектора. Указанный один или более противораковый химиотерапевтический агент может быть введен до введения сконструированных дендритных клеток, после введения сконструированных дендритных клеток, или одновременно с введением сконструированных дендритных клеток. Согласно одному из вариантов реализации указанный противораковый химиотерапевтический агент представляет собой паклитаксел, производное или аналог паклитаксела, темозоломид, производное или аналог темозоломида, сунитиниб, производное или аналог сунитиниба, гемцитабин или производное или аналог гемцитабина.
[00560] Согласно еще одному варианту реализации пациенту, нуждающемуся в лечении опухоли, (а) вводят дендритные клетки, сконструированные для экспрессии иммуномодулятора, например, иммуномодулятора, описанного в настоящей заявке, конститутивной или условной, (b) вектор, экспрессирующий иммуномодулятор, например, иммуномодулятор, описанный в настоящей заявке, конститутивно или условно, инъецируют внутриопухолево указанному пациенту, и (с) указанному пациенту вводят один или более противораковый химиотерапевтический агент. Согласно одному из вариантов реализации дендритные клетки сконструированы для экспрессии Ad-иммуномодулирующего вектора, и, в частности, Ad-RTS-иммуномодулирующего вектора. Согласно еще одному варианту реализации вектор, который вводят внутрь опухоли указанному пациенту, представляет собой Ad-иммуномодулирующий вектор, и, в частности, Ad-RTS-иммуномодулирующий вектор. Указанный один или более противораковый химиотерапевтический агент может быть введен до введения сконструированных дендритных клеток и вектора, экспрессирующего иммуномодулятор, после введения сконструированных дендритных клеток и вектора, экспрессирующего иммуномодулятор, или одновременно с введением сконструированных дендритных клеток и вектора, экспрессирующего иммуномодулятор. Согласно одному из вариантов реализации указанный противораковый химиотерапевтический агент представляет собой паклитаксел, производное или аналог паклитаксела, темозоломид, производное или аналог темозоломида, сунитиниб, производное или аналог сунитиниба, гемцитабин или производное или аналог гемцитабина.
[00561] В любом из способов, предложенных в соответствии с настоящим изобретением, заболевание или расстройство может представлять собой заболевание или расстройство, описанное в настоящей заявке. Согласно одному из вариантов реализации заболевание или расстройство представляет собой заболевание или расстройство из перечисленных в таблице 1 настоящей заявки. Согласно еще одному варианту реализации заболевание или расстройство представляет собой заболевание или расстройство из перечисленных в таблице 3 настоящей заявки.
[00562] В любом из способов, предложенных в соответствии с настоящим изобретением, рак или опухоль может представлять собой заболевание или расстройство, описанное в настоящей заявке. Согласно одному из вариантов реализации рак или опухоль представляет собой рак или опухоль из перечисленных в таблице 1 настоящей заявки. Согласно еще одному варианту реализации рак или опухоль представляет собой рак или опухоль из перечисленных в таблице 3 настоящей заявки.
[00563] Возможно измерить эффект иммуномодулятора и/или экспрессии IL-12 на популяцию клеток путем измерения уровня экспрессии или активности цитокина типа Th1/Tc1, ИФН-гамма в полученном от пациента биологическом образце.
[00564] Для целей настоящего изобретения в соответствии с настоящим изобретением предложен способ определения эффективности терапевтических режимов, основанных на in vitro сконструированных иммунных клетках или TSC, у пациента с раком, включающий:
а. измерение уровня экспрессии или уровня активности, или обоих, интерферон-гамма (ИФН-гамма) в первом биологическом образце, полученном от пациента-человека перед введением in vitro сконструированных клеток, например, иммунных клеток или TSC, с получением таким образом контрольного уровня;
b. введение внутриопухолево указанному пациенту in vitro сконструированных клеток;
с. введение указанному пациенту эффективного количества активирующего лиганда;
d. измерение уровня экспрессии или уровня активности, или обоих, ИФН-гамма во втором биологическом образце, полученном от указанного пациента в момент времени после введения указанного активирующего лиганда, с получением таким образом данных для экспериментального уровня;и
е. сравнение контрольного уровня и экспериментального уровня ИФН-гамма, при этом данные, показывающие увеличение экспериментальных уровней экспрессии, активности, или обоих, ИФН-гамма, относительно контрольного уровня, указывают на то, что указанный режим терапевтического лечения эффективен для указанного пациента. Настоящее изобретение может также необязательно включать такие дополнительные этапы, как:
f. взятие биопсии и подсчет проникающих в опухоль лимфоцитов (TIL) и/или
g. наблюдения за регрессом опухоли в ответ на лечение.
[00565] Термин «объект» («пациент») означает интактное насекомое, растение или животное. Также предполагается, что лиганды будут также хорошо работать в том случае, когда объект представляет собой гриб или дрожжи. Животные для применения в соответствии с настоящим изобретением включают, не ограничиваясь перечисленными, позвоночных, например, млекопитающих, таких как человек, грызуны, обезьяны и другие животные, при этом люди или мыши являются более предпочтительными. Другие животные включают ветеринарных животных, таких как собаки, кошки, лошади, крупный рогатый скот, овцы, козы, свиньи и т.п.
[00566] В соответствии с настоящим изобретением также предложен способ увеличения экспрессии иммуномодулятора, например, TNF-альфа, путем введения в вектор, например, репликативно-дефектный аденовирусный вектор, одной или более регуляторной последовательности и, необязательно, нуклеиновой кислоты, кодирующей сигнальный пептид, причем указанный вектор условно экспрессирует указанный иммуномодулятор. Используемый в настоящей заявке термин «экспрессия белка» включает без ограничения транскрипцию, пост-транскрипцию, трансляцию и/или пост-трансляцию. Также в настоящее изобретение входит способ увеличения экспрессии иРНК или белка иммуномодулятора, например, TNF-альфа, включающий получение вектора, условно экспрессирующего TNF-альфа, согласно которому указанный вектор дополнительно содержит одну или более регуляторную последовательность, соединенную с полинуклеотидной последовательностью, кодирующей указанный TNF-альфа, и добавление активирующего лиганда, с индуцированном, таким образом, экспрессии указанного иммуномодулятора, причем указанная одна или более регуляторная последовательность и/или сигнальный пептид улучшает экспрессию TNF-альфа. Для настоящего изобретения были описаны различные регуляторные области, включая, но не ограничиваясь перечисленными, 5’ нетранслируемую область (5’UTR), 3’ UTR или обе. Согласно одному из вариантов реализации 5’ UTR представляет собой 5U2. 5U2 представляет собой химерный SERCA2 интрон 2 собаки с мутированным потенциальным консенсусным поли-А сайтом, с сайтом донора сплайсинга, фланкирующим 5’-конец экзона 2 и с сайтом акцептора сплайсинга, фланкирующим 3’-конец экзона 3, за которым следует фрагмент участка 5’UTR бычьего казеина. Согласно еще одному варианту реализации 3’ регуляторная область представляет собой сигнал полиаденилирования SV40 или hGH.
[00567] Согласно определенным вариантам реализации способ, предложенный в соответствии с настоящим изобретением, относится также к улучшению секреции TNF-альфа путем получения вектора, условно экспрессирующего TNF-альфа, при этом указанный вектор также содержит сигнальный пептид, с увеличением таким образом секреции TNF-альфа по сравнению с вектором, содержащим нативный ген сигнального пептида TNF-альфа, например, сигнальный пептид TNF-альфа дикого типа. В частности, сигнальный пептид, применяемый в соответствии с настоящим изобретением, имеет оптимизированный состав кодонов. Согласно конкретному варианту реализации сигнальный пептид кодируется геном сигнального пептида IL-2 дикого типа. Согласно другому конкретному варианту реализации сигнальный пептид кодируется геном сигнального пептида IL-2 с оптимизированным составом кодонов.
[00568] Без связи с теорией, предполагается, что настоящее изобретение обеспечивает применение генной терапии на основе вводимых внутриопухолево in vitro сконструированных иммунных клеток и TSC в клинических условиях, с фокусированием внимания на объективном клиническом ответе как основном конечном показателе исследования, и перекрестие примированных противоопухолевых CD8+-Т-клетках (синтезирующих ИФН-гамма) как вторичном конечном показателе исследования. Возможность включать и выключать экспрессию иммуномодулятора и/или IL-12 in vivo добавляет элемент безопасности и терапевтического контроля в лечение, при котором как сроками, так и уровнем белковой экспрессии можно управлять посредством введения лиганда, а также при котором сроки экспрессии иммуномодулятора и/или IL-12 предположительно имеют решающее значение для терапевтической эффективности указанного метода.
[00569] В соответствии с настоящим изобретением также предложено терапевтическое применение in vitro сконструированных клеток с условно экспрессируемыми генами, представляющее интерес как инновационный подход к эффективному и практичному лечению болезней человека.
[00570] В соответствии с настоящим изобретением также предложены способы лечения опухоли, уменьшения размеров опухоли или предотвращения образования опухоли у нуждающегося в этом млекопитающего, в котором вектор для условной экспрессии белка(ов), обладающий(е) функцией(ями) одного или более иммуномодулятора, который не содержится в клетке, вводят внутриопухолево в микроокружение опухоли. Согласно данному варианту реализации указанный вектор вводят в опухоль без упаковки в клетку, такую как иммунные клетки или TSC. В настоящем изобретением также предложены способы лечения заболевания у нуждающегося в этом млекопитающего, при которых вектор для условной экспрессии белка(ов), обладающий(е) функцией(ями) одного или более иммуномодулятора, не содержащегося в клетке, вводят указанному млекопитающему. Согласно данному варианту реализации вектор вводят в опухоль без упаковки в клетку, такую как иммунные клетки или TSC.
[00571] Согласно одному из вариантов реализации иммунные клетки, TSC, дендритные клетки или дендритные клетки костного мозга не вводят внутриопухолево с указанным вектором.
[00572] Согласно еще одному варианту реализации вектор, предложенный в соответствии с настоящим изобретением, который не содержится в клетках, вводят внутриопухолево одновременно, до или после внутриопухолевого введения иммунных клеток, TSC, дендритных клеток или дендритных клеток костного мозга.
[00573] Согласно одному из вариантов реализации вектор, предложенный в соответствии с настоящим изобретением, который не содержится в клетке, вводят внутриопухолево в тот же очаг, куда вводят иммунные клетки или TSC. Согласно еще одному варианту реализации вектор, предложенный в соответствии с настоящим изобретением, который не содержится в клетке, вводят внутриопухолево в очаг, отличный от того, куда вводят иммунные клетки или TSC.
[00574] Согласно одному из вариантов реализации указанный вектор вводят в тот же (те же) очаг(и) в каждом цикле введения. Согласно еще одному варианту реализации вводимый вектор не вводят в тот же (те же) очаг(и) в каждом цикле введения.
[00575] Согласно одному из вариантов реализации опухоль представляет собой любую раковую опухоль из перечисленных в настоящем описании, например, в таблицах 1 и 3. Согласно еще одному варианту реализации опухоль представляет собой меланомную опухоль, колоректальную опухоль, опухоль поджелудочной железы, опухоль молочной железы, опухоль легкого или опухоль почки. Согласно еще одному варианту реализации опухоль представляет собой злокачественную меланому. Согласно другому варианту реализации опухоль представляет собой злокачественную меланому на стадии III С или стадии IV.
[00576] Согласно одному из вариантов реализации внутриопухолевая доза составляет по меньшей мере приблизительно 1,0×109 вирусных частиц на цикл введения вектора. Согласно еще одному варианту реализации внутриопухолевая доза составляет по меньшей мере приблизительно 1,0×1010 вирусных частиц на цикл введения вектора. Согласно еще одному варианту реализации внутриопухолевая доза составляет приблизительно 1,0×109 до приблизительно 1,0×1013 вирусных частиц на цикл введения вектора. Согласно еще одному варианту реализации внутриопухолевая доза составляет приблизительно 1,0×1010 до приблизительно 1,0×1013 вирусных частиц на цикл введения вектора. Согласно еще одному варианту реализации внутриопухолевая доза составляет приблизительно 1,0×1010, приблизительно 1,0×1011, приблизительно 1,0×1012или приблизительно 1,0×1013 вирусных частиц на цикл введения вектора. Согласно одному из вариантов реализации вектор представляет собой AD-RTS-IL-12.
[00577] Согласно еще одному варианту реализации настоящего изобретения также предложены способы лечения заболевания печени у нуждающегося в этом млекопитающего, в которых вектор для условной экспрессии белка(ов), который(е) не содержатся в клетке, вводят указанному млекопитающему.
[00578] Согласно еще одному варианту реализации настоящего изобретения также предложены способы лечения лизосомной болезни накопления у нуждающегося в этом млекопитающего, в которых вектор для условной экспрессии белка(ов), который(е) не содержатся в клетке, вводят указанному млекопитающему.
[00579] Согласно еще одному варианту реализации настоящего изобретения также предложены способы лечения заболевания у нуждающегося в этом млекопитающего, не являющегося человеком, в которых вектор для условной экспрессии белка(ов), который(е) не содержатся в клетке, вводят указанному млекопитающему.
[00580] Дозировка активирующего лиганда составляет приблизительно 5-100 мг/день, например, приблизительно 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 100 мг/день. Согласно одному из вариантов реализации активирующий лиганд вводят по меньшей мере один раз в день. Согласно еще одному варианту реализации активирующий лиганд вводят один раз в день на протяжении приблизительно 14 дней.
[00581] Согласно одному из вариантов реализации по меньшей мере две дозы указанного вектора (например, приблизительно 1×1011 и 1×1012) применяют в комбинации с по меньшей мере тремя различными уровнями дозировки указанного активирующего лиганда (например, от приблизительно 5 мг/день до приблизительно 100 мг/день).
[00582] Средний специалист в данной области техники сможет оптимизировать дозировки для обеспечения диапазона эффективных уровней вектора в плазме для различных степеней активации активирующего лиганда.
[00583] Согласно одному из вариантов реализации дозировку активирующего лиганда, введенного указанному пациенту, изменяют в течение периода введения указанного активирующего лиганда во время цикла введения внутриопухолевого вектора. Согласно еще одному варианту реализации дозировку активирующего лиганда, введенного указанному пациенту, уменьшают в течение периода введения указанного активирующего лиганда во время цикла введения внутриопухолевого вектора. Согласно еще одному варианту реализации дозу активирующего лиганда, вводимого указанному пациенту, увеличивают в течение периода введения указанного активирующего лиганда во время цикла введения внутриопухолевого вектора.
[00584] Согласно одному из вариантов реализации пациент получает 2, 3, 4, 5, 6, 7, 8, 9 или 10 циклов введения внутриопухолевого вектора. Согласно еще одному варианту реализации пациент получает 3-7 циклов введения внутриопухолевого вектора. Согласно еще одному варианту реализации пациент получает 4-6 циклов введения внутриопухолевого вектора. Согласно еще одному варианту реализации пациент получает 5 или 6 циклов введения внутриопухолевого вектора. Согласно еще одному варианту реализации пациент получает 6 циклов введения внутриопухолевого вектора.
[00585] Согласно одному из вариантов реализации каждый цикл введения внутриопухолевого вектора осуществляют с интервалом 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 недель. Согласно еще одному варианту реализации каждый цикл введения внутриопухолевого вектора осуществляют с интервалом 4 недели.
[00586] Согласно одному из вариантов реализации дозировку указанного вектора изменяют в каждом последующем цикле введения внутриопухолевого вектора. Согласно еще одному варианту реализации дозировку указанного вектора уменьшают в каждом последующем цикле введения внутриопухолевого вектора. Согласно еще одному варианту реализации дозировку указанного вектора увеличивают в каждом последующем цикле введения внутриопухолевого вектора.
[00587] Согласно одному из вариантов реализации дозировки вектора и активирующего лиганда, число и длительность циклов введения внутриопухолевого вектора, частота введения вектора и частота введения активирующего лиганда приведены в таблице 8 в примере 11 настоящей заявки.
[00588] Согласно одному из вариантов реализации настоящего изобретения также предложена фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и вектор, предложенный в настоящем изобретении, который не содержится в клетке. Подходящие носители включают, не ограничиваясь перечисленными, солевой раствор, дистиллированную воду, растворы хлорида натрия, смеси хлорида натрия и неорганических солей или их сходные смеси, растворы таких материалов, как маннит, лактоза, декстран и глюкоза, растворы аминокислот, таких как глицин и аргинин, смеси растворов органических кислот или солевых растворов и растворов глюкозы, водные и неводные, изотонические стерильные инъекционные растворы, которые могут содержать антиоксиданты, хелатирующие агенты, буферы, бактериостатики и растворенные вещества, которые доводят состав до изотонического, и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты, солюбилизаторы, загущающие агенты, стабилизаторы и консерванты. Составы могут находиться в однодозовых или многодозовых герметичных контейнерах, таких как ампулы и флаконы, и могут храниться в высушенном сублимацией (лиофилизированном) состоянии, требующем для инъецирования только добавления стерильного жидкого носителя, например, воды, непосредственно перед применением.
[00589] В случае противоречия между любой идеей или утверждением из любого цитируемого в настоящей заявке источника и настоящим описанием, последнее будет иметь преимущественную силу для целей настоящего изобретения.
[00590] Все патенты, патентные заявки и публикации, цитируемые в настоящей заявке, полностью включены в заявку посредством ссылок во всей их полноте.
[00591] Следует понимать, что описанные выше варианты реализации и примеры не предназначены для ограничения в каком-либо смысле объема настоящего изобретения, и предполагается, что пунктами формулы изобретения, представленными в настоящей заявке, охвачены все варианты реализации и примеры, явно или неявно представленные в настоящей заявке.
[00592] Заявка на патент США №12/247738, озаглавленная «Engineered Dendritic Cells And Uses For Treatment Of Cancer» («Сконструированные дендритные клетки и их применение для лечения рака»), поданная 8 октября 2008 г., включена в настоящую заявку посредством ссылки во всей полноте. Заявка на патент США №12/241018, озаглавленная «Therapeutic Gene-Switch Constructs And Bioreactors For The Expression Of Biotherapeutic Molecules, And Uses Thereof» («Терапевтические конструкции для переключения генов и биореакторы для экспрессии биотерапевтических молекул»), поданная 29 сентября 2008 г., также включена в настоящую заявку посредством ссылки во всей полноте.
ПРИМЕР 1
[00593] Проводят исследование для определения дозы дендритных клеток и самого эффективного цитокина, способного вызывать опухолеспецифичные иммунные ответы и противоопухолевую активность в модели опухоли почечно-клеточного рака Renca.
[00594] В этом исследовании применяют две линии опухолевых клеток: Renca и Renca-HA. Последняя клеточная линия получена трансфекцией клеток Renca гемагглютинином (НА) вируса гриппа. Преимуществом модели Renca-HA является возможность отслеживать антиген-специфичные Т-клетки, так как и CD8-, и CD4-специфичные происходящие из НА эпитопы известны и уже применялись.
[00595] Конкретная задача - определить индукцию НА-специфичных иммунных ответов после внутриопухолевого введения дендритных клеток.
[00596] Опухоль Renca-HA развивается подкожно у мышей BALB/c. Когда опухоль становится пальпируемой, внутриопухолево инъецируют дендритные клетки. Введение дендритных клеток необходимо повторить дважды с 7-дневными интервалами, всего 3 введения.
[00597] Используются следующие группы мышей (каждая группа включает 3 мыши):
1. Не получающие лечения мыши;
2. Мыши, получающие лечение в виде 5×105 дендритных клеток, преобразованных контрольной плазмидой;
3. Мыши, получающие лечение в виде 106 дендритных клеток, преобразованных контрольной плазмидой;
4. Мыши получающие лечение в виде 5×106 дендритных клеток, преобразованных контрольной плазмидой;
5. То же, что в группах 2-4, с применением дендритных клеток, преобразованных IL-12;
6. То же, что в группах 2-4, с применением дендритных клеток, преобразованных IL-15; и
7. То же, что в группах 2-4, с применением дендритных клеток, преобразованных IL-21.
Для исследования эффекта комбинации различных цитокинов мыши получают лечение одновременно в виде:
8. 5×105 дендритных клеток, преобразованных IL-12, и 5х105 дендритных клеток, преобразованных IL-15,
9. 5×105 дендритных клеток, преобразованных IL-12 и 5х105 дендритных клеток, преобразованных IL-21, и
10. 5×105 дендритных клеток, преобразованных IL-15 и 5х105 дендритных клеток, преобразованных IL-21.
[00598] Через четыре дня после последнего введения лимфатические узлы мышей-опухоленосителей собирают, и клетки стимулируют либо соответствующим МНС класса I пептидом (для обнаружения ответов CD8+-Т-клеток), либо соответствующим МЫС класса II пептидом (для обнаружения ответов CD4+-T-клеток).
[00599] Применяют следующие виды анализа:
[00600] 1. ELISPOT IFN-γ и IL-2;
2. Т-клеточная пролиферация;
3. Обнаружение высвобождения TNFα, IL-10, IL-4 и ГМКСФ клетками лимфатических узлов.
[00601] Кроме того, оценивают NK-активность клеток лимфатических узлов с применением клеток YAC в качестве мишеней.
[00602] Параллельно клетки стимулируют анти-CD3/CD28 антителами для оценки неспецифичного ответа Т-клеток.
[00603] Определяют наиболее эффективную дозу дендритных клеток, способную индуцировать антиген-специфичные иммунные ответы.
[00604] Конкретная задача 2 - оценка противоопухолевой активности дендритных клеток, преобразованных генами цитокинов.
[00605] Только преобразованные цитокинами дендритные клетки, демонстрирующие статистически значимые уровни индукции иммунных ответов, применяют в дальнейших экспериментах.
[00606] Лечение мышей-носителей опухоли Renca-HA осуществляют согласно описанию конкретной задачи 1. Применяют одну дозу ДК, преобразованных цитокинами, проявившими специфичную активность в предыдущих экспериментах. В качестве контроля используют дендритные клетки, преобразованные контрольным аденовирусом. Для обеспечения статистической значимости каждая группа включает 10 мышей.
[00607] Оценивают рост опухоли. Опухоль Renca-HA содержит иммуногенный эпитоп, который подходит для иммунологического мониторинга и начальных испытаний противоопухолевого эффекта. При этом для верификации потенциального противоопухолевого действия лечения необходимо использовать нетрансфицированные опухолевые клетки. Таким образом, описанные выше эксперименты повторяют с применением модели опухоли Renca.
ПРИМЕР 2
[00608] Безопасность, переносимость, трансгенная функция и иммунологические эффекты внутриопухолевой(ых) инъекции(ий) преобразованных аденовирусом аутологичных дендритных клеток, сконструированных для экспрессии hIL-12 и одного или более другого иммуномодулятора под контролем RTS, у пациентов со стадией III и IV меланомы оценивают посредством таких процедур, как описанные ниже.
[00609] Исследование, в котором принимают участие пациенты с меланомой стадий III и IV, проводят на 4 когортах (группах) пациентов, каждый пациент получает одну внутриопухолевую инъекцию (в меланомную опухоль) преобразованных аденовирусом аутологичных (вводимых тому же пациенту, от которого были получены) дендритных клеток (ДК), сконструированных для экспрессии интерлейкина-12 (hIL-12) человека, и один или более другой иммуномодулятор, в дозировке 5×107 в комбинации с ежедневным пероральным приемом активирующего препарата (активирующего лиганда). В указанном исследовании применяют инъекции дендритных клеток, преобразованных ex vivo (после отбора клеток у пациентов) аденовирусным вектором для индуцируемой экспрессии IL-12 человека и одного или более другого иммуномодулятора. Синтез IL-12 и указанного одного или более или другого иммуномодулятора «включают» (индуцируют) при инъецировании ДК, посредством активации RTS пероральным введением активирующего препарата (RG-115932). Безопасность и переносимость оценивают посредством физических обследований (включая общее состояние по ECOG), измерением основных физиологических показателей, биохимического анализа сыворотки, анализа мочи, общего анализа крови, нежелательных «побочных эффектов», антител и клеточного иммунного ответа на аденовирус, компоненты RTS и активирующий препарат. Для оценки прогресса оценивают фармакокинетику при однократном введении и при равновесной концентрации/ВРМВ перорального препарата для активации и его основных метаболитов, анализ уровней hIL-12, уровни другого иммуномодулятора и клеточный иммунный ответ (Т-клетки) в биопсийных материалах целевых опухолей, дренирующих лимфатических узлах и периферическом кровотоке, а также цитокиновый профиль сыворотки.
[00610] Например, 16 пациентов со стадией III и IV меланомы разделяют на четыре когорты, где когорты 1 и 2 включают трех пациентов, а когорты 3 и 4 включают 5 пациентов. Все пациенты получают одну внутриопухолевую инъекцию 5×107аутологичных ДК, преобразованных аденовирусным вектором, кодирующим IL-12 человека и один или более другой иммуномодулятор, под контролем RTS. Например, пациентам вводят внутриопухолевую инъекцию аутологичных ДК преобразованных аденовирусным вектором, кодирующим IL-12 человека под контролем RTS и иммуномодулятор, такой как IL-15 или IL-21.
[00611] Указанные пациенты получают перорально одну ежедневную дозу активирующего препарата (когорта 1: 0,01 мг/кг, когорта 2: 0,1 мг/кг, когорта 3: 1,0 мг/кг или когорта 4: 3 мг/кг) первую дозу вводят приблизительно за 3 часа до инъекции ДК на 1 день, и продолжают в течение еще 13 последовательных дней. Пациентам, удовлетворяющим критериям для повторного курса лечения, может(могут) вводиться дополнительная(ые) инъекция(и) преобразованных аденовирусом аутологичных дендритных клеток в комбинации с 14 однократными (разовыми) ежедневными пероральными дозами активирующего препарата. Безопасность, переносимость, и функционирование дендритных клеток оценивают у всех пациентов в каждой группе когорты 1 в течение периода до 1 месяца после инъецирования in vitro сконструированных дендритных клеток, прежде чем вводить пациентам следующую максимальную дозу активирующего препарата. Исследование безопасности продолжают для всех пациентов в течение 3 месяцев после начального инъецирования сконструированных дендритных клеток, с возможностью продления периода наблюдения до в общей сложности шести месяцев с целью мониторинга безопасности пациента, в том случае, если наблюдают токсичность или указанный пациент получает дополнительную(ые) инъекцию(и) дендритных клеток.
[00612] Это исследование демонстрирует безопасность и переносимость однократной или многократных внутриопухолевой(ых) инъекции(й) преобразованных аденовирусом аутологичных дендритных клеток в комбинации с пероральным препаратом для активации у пациентов с меланомой. Исследование обеспечивает фармакокинетику при равновесной концентрации/ВРМВ указанного перорального препарата для активации. Исследование демонстрирует функциональность RTS у пациентов путем измерения экспрессии hIL-12 и экспрессии одного или более другого иммуномодулятора преобразованных аденовирусом аутологичных дендритных клеток в целевой опухоли и/или дренирующих лимфатических узлах в ответ на активацию RTS путем перорального введения активирующего препарата. Кроме того, исследование демонстрирует иммунологические эффекты преобразованных аденовирусом аутологичных дендритных клеток в отношении клеточного иммунного ответа в целевой опухоли, дренирующих лимфатических узлах и периферическом кровотоке после перорального введения активирующего препарата.
[00613] Меланома выбрана в качестве типового рака, в частности, в отношении меланомы. Показано, что среди солидных опухолей в частности меланома отвечает на иммунотерапевтические подходы, и меланомные опухоли легко доступны для внутриопухолевых инъекций и взятия биопсии. У пациентов, включенных в указанное исследование, присутствует неоперабельная меланома III или IV стадии, имеющая диаметр по меньшей мере 0,5 см, с любой толщиной опухолей, с любым числом вовлеченных лимфоузлов, транзитных метастазов или отдаленных метастазов.
Получение аденовируса, несущего систему RheoSwitch Therapeutic System, hIL-12 и один или более другой иммуномодулятор
[00614] Рекомбинантную ДНК переносят в дендритные клетки (ДК) ex vivo трансдукцией аденовирусного вектора. Для экспрессии IL-12 человека (Р70) и одного или более другого иммуномодулятора из внутриопухолево инъецируемых незрелых дендритных клеток, который обеспечивает выживание и стимулирует созревание из ДК в окружении опухоли, приводящее к их последующей миграции в дренирующие лимфатические узлы, применяют рекомбинантную ДНК. Это приводит к смещению дифференцировки Т хелперных клеток в сторону Th1-типа, а также активации опухолеспецифичных цитотоксических Т-клеток перекрестным примированием опухолевыми антигенами.
[00615] Рекомбинантная ДНК, применяемая в виде рекомбинантного аденовирусного вектора, обеспечивает экспрессию IL-12 человека и одного или более другого иммуномодулятора под контролем системы RheoSwitch® Therapeutic System (RTS). RTS содержит бицистронный транскрипт, экспрессируемый из промотора убиквитина С человека, и кодирует два гибридных белка: Gal4-EcR и VP16-RXR. Gal4-EcR представляет собой гибрид ДНК-связывающего домена (аминокислот 1-147) дрожжевого Gal4 и DEF доменов рецептора экдизона из насекомого Choristoneura fumiferana. Согласно еще одному варианту реализации RTS состоит из бицистронного транскрипта, экспрессируемого из промотора убиквитина С человека, и кодирует два гибридных белка: Gal4-EcR и VP16-RXR. Gal4-EcR представляет собой гибрид ДНК-связывающего домена (аминокислот 1-147) дрожжевого Gal4 и DEF-доменов рецептора экдизона из насекомого Choristoneura fumiferana. VP16-RXR представляет собой гибрид домена активации транскрипции HSV-VP16 и EF-доменов гибридного RXR, происходящего из последовательности человека и саранчи. Указанные последовательности Gal4-EcR и VP16-RXR разделены внутренним участком посадки рибосом (IRES) из EMCV. Эти два гибридных белка димеризуются, когда Gal4-EcR связывается с низкомолекулярным лекарственным препаратом (RG-115932) и активирует транскрипцию hIL-12 и одного или более другого иммуномодулятора из Gal4-чувствительного промотора, который содержит шесть участков связывания Gal4 и синтетический минимальный промотор. Вышеописанную транскрипционную единицу RTS помещают в прямом направлении от транскрипционных единиц hIL-12 и одного или более другого иммуномодулятора. Эту готовую кассету RTS-HiL12-иммуномодулятор встраивают в аденовирусный 5 геном в участке, где была удалена область Е1. Аденовирусный остов дополнительно лишен гена Е3. Карта аденовирусного вектора Ad-RTS-hIL-12 приведена на Фиг.8 патента US 2009/0123441 A1.
[00616] Рекомбинантный аденовирусный вектор, применяемый для этого исследования, содержит следующие типовые регуляторные элементы помимо последовательностей вирусного вектора: промотор убиквитина С человека, участок внутренней посадки рибосом, происходящий из EMCV, индуцируемый промотор, содержащий 6 копий сайтов связывания Gal4, 3 копии сайтов связывания SP-1 и синтетическую последовательность минимального промотора SV40 сайты полиаденилирования и последовательность терминации транскрипции, происходящую из гена альфа-глобина человека. Следует понимать, что в качестве альтернативы могут быть использованы другие регуляторные элементы.
[00617] Типовой рекомбинантный аденовирусный вектор Ad-RTS-hIL-12-иммуномодулятор(ы) получают следующим образом. Кодирующие последовательности рецепторных гибридных белков, VP16-RXR и Gal4-EcR, разделенных EMCV-IRES (участок внутренней посадки рибосом), встраивают в аденовирусный челночный вектор под контролем промотор убиквитина С человека (конститутивного промотора). Затем кодирующие последовательности субъединиц р40 и р35 hIL-12, разделенные IRES, и одного или более другого иммуномодулятора, помещают под контроль синтетического индуцируемого промотора, содержащего 6 копий GaM-связывающих сайтов, встроенных в обратном (к 5’ концу) направлении от промотора убиквитина С и рецепторных последовательностей. Указанный челночный вектор содержит последовательности аденовируса серотипа 5 с левого конца и до единицы карты 16 (mul6), от которой Е1 последовательности удалены и замещены последовательностями RTS, IL-12 и одного или более другого иммуномодулятора (RTS- hIL-12). Указанный челночный вектор, несущий RTS-hIL-12-иммуномодулятор(ы) проверяют посредством временной трансфекции в клетки НТ-1080 для зависимой от активирующего препарата экспрессии IL-12 и другого(их) иммуномодулятора(ов). Затем челночный вектор рекомбинируют с аденовирусным остовом ко-трансфекцией клеток НЕК 293 с получением рекомбинантного аденовирусного вектора Ad-RTS-hIL-12-иммуномодулятор(ы). Аденовирусный остов содержит в последовательности удаления от mu 0 до 9.2 на левом конце генома и гена ЕЗ. Челночный вектор и аденовирусный остов содержат перекрывающуюся последовательность от mu 9.2 до mu 16, что позволяет рекомбинацию между ними и получение рекомбинантного аденовирусного вектора. Так как указанный рекомбинантный аденовирусный вектор является дефицитным по Е1 и Е3 областям, указанный вирус репликативно-дефектен в нормальных клетках млекопитающих. При этом указанный вирус может реплицироваться в клетках НЕК 293, несущих область Е1 аденовируса-5 и таким образом обеспечивающих функционирование E1 in trans.
[00618] Типовой рекомбинантный аденовирусный вектор получают следующим образом: линеаризированный челночный вектор, несущий ДНК элементы для индуцируемой экспрессии IL12 человека и одного или более другого иммуномодулятора, и аденовирусный остов ко-трансфицируют в клетки HEK293. Рекомбинация перекрывающихся последовательностей челночного вектора и вирусного остова приводит к получению рекомбинантного аденовируса и упаковке в вирусные частицы в клетках HEK293. Клетки HEK293 выращивают в среде DMEM, содержащий эмбриональную бычью сыворотку.
[00619] Вирус для применения в планируемом исследовании, очищали центрифугированием в градиенте плотности CsCl. Рекомбинантный аденовирус подвергают двум раундам очищения бляшек и финальный посевной материал применяют для получения основного банка вируса (MVB) амплификацией в клетках HEK293 из полностью описанного основного банка клеток. Указанные MVB подвергают всесторонним стартовым испытаниям в соответствии с требованиями cGMP/GLP, в том числе на репликативно компетентный аденовирус (RCA), стерильность, микоплазму, добавочные вирусы, ретровирус, вирусы человека ВИЧ1/2, HTLV1/2, HAV, HBV, HCV, EBV, B19, CMV, HHV-6, 7 и 8, бычьи и свиные вирусы, полное секвенирование вектора и проверку функциональности AD-индуцированием экспрессии IL-12 и одного или более другого иммуномодулятора в линиях клеток человека.
[00620] Вирус из MVB можно применять для получения очищенного вируса в учреждении cGMP, и снова подвергаться испытаниям, включая идентичность, RCA, стерильность, микоплазму, добавочные вирусы, отношение количества вирусных частиц к инфекционной дозе, загрязнения ДНК клеток-хозяев, эндотоксин и белки, и проверку функциональности AD-индуцированием экспрессии IL-12 и одного или более другого иммуномодулятора в линиях клеток человека.
[00621] Подходящий способ получения рекомбинантного аденовируса также изложен у Anderson, R.D., Gene Therapy 7:1034-1038 (2000).
[00622] Подходящий способ введения рекомбинантного аденовируса в клетки-хозяева изложен у Komita, H. et al., Cancer Gene Therapy 16: 883-891 (2009)
[00623] Трансдукция аутологичных дендритных клеток аденовирусом, содержащим трансген hIL-12 и одного или более другого иммуномодулятора, и RheoSwitch® Therapeutic System (RTS)
[00624] Дендритные клетки, полученные от пациентов-людей, трансфицируют ех vivo и инъецируют в опухоль. Указанные ДК характеризуют до вирусной трансдукции на жизнеспособность, чистоту (как правило, >80% клеток демонстрируют фенотип ДК), стерильность, микоплазму и эндотоксин. После вирусной трансдукции клетки отмывают многократно для удаления любых неабсорбированных вирусов. Супернатант от последней отмывки проверяют на содержание остаточного вируса при помощи ПЦР. Так как ДК трансфицируют ех vivo аденовирусным вектором (не-интегрирующим вирусом), и продолжительность жизни ДК после внутриопухолевой инъекции и последующей миграции в дренирующие лимфатические узлы коротка, не предполагается, что вирусная ДНК будет встраиваться в любые нецелевые клетки. Протокол, применяемый для аденовирусной трансдукции ДК, предположительно дает 80-90% трансдукцию и считается очень эффективным.
[00625] Получение МКПК посредством лейкафереза: Пациенты подвергаются стандартному лейкаферезу от 90 до 120 минут на аппарате для афереза в амбулатории UPCI. Процедура лейкафереза включает взятие крови из вены на одной руке; проведение крови через центрифугу (сепаратор клеток), где ее компоненты разделяют, и один или более компонент удаляют; и возвращение оставшихся компонентов в вену пациента той же или другой руки. За один период обработки крови в устройстве для сепарации клеток забирают не более чем 15% общего объема крови пациента. В сепараторе клеток кровь разделяют на плазму, тромбоциты, белые клетки и красные клетки крови. Белые клетки крови (WBC) извлекают, а все другие компоненты возвращают в кровоток пациента. При любой возможности для этой процедуры используют две периферические IV вены. Если это невозможно, может потребоваться центральная вена. Пациент должен получить разрешение от врача на прохождение лейкафереза, и он проходит стандартный скрининг основных физиологических показателей (включая кровяное давление) до процедуры.
[00626] Обработка: После сбора лейкомассу перемещают вручную в лабораторию клинической патологии (CPL) и немедленно обрабатывают элютриационным центрифугированием в ELUTRA™. Это замкнутая система, одобренная для клинического использования. Извлекают фракцию моноцитов, после извлечения и восстановления жизнеспособности клеток их переносят в картридж Aastrom для 6-дневного культивирования в присутствии IL-4 и ГМКСФ. Все обработки и отмывки проводятся в стерильных условиях.
[00627] Стартовый посев: моноциты, восстановленные из индивидуальной лейкомассы подсчитывают в присутствии трипанового синего для определения числа жизнеспособных клеток. Чистоту моноцитов оценивают при помощи проточной цитометрии. Моноциты ресуспендируют до концентрации 5-10×106клеток/мл в бессывороточной не содержащей антибиотиков среде CellGenix, содержащей 1,000 МЕ/мл IL-4 и 1,000 МЕ/мл ГМКСФ на SOP-CPL-0166, и помещают в картридж Aastrom. Для инокуляции кассеты требуется минимальный объем загрузки 50 мл и минимальное число клеток.
[00628] Культура: Картридж Aastrom помещают в инкубатор системы Replicell System, полностью замкнутого, cGMP-совместимого автоматизированного устройства для культивирования, для получения незрелых ДК.
[00629] Сбор незрелых ДК: На 6 день картридж Aastrom извлекают из инкубатора и собирают незрелые ДК. Клетки извлекают центрифугированием на 1500 об/мин, отмывают в среде CellGenix, подсчитывают в присутствии трипанового синего и проверяют морфологические и фенотипические характеристики.
[00630] Жизнеспособность: Ее определяют, выполняя гемоцитометрический подсчет клеток в присутствии трипанового синего. Как правило, >95% собранных клеток жизнеспособны, т.е. не включают трипановый синий. Если жизнеспособность составляет менее чем 70%, указанные незрелые ДК отбраковывают.
[00631] Фенотипирование: Клетки, полученные культивированием, подсчитывают с помощью микроскопических наблюдений в гемоцитометре, и проводят предварительный дифференцированный подсчет (ДК:лимфоциты) с применением трипанового синего. Результаты дифференцированного подсчета подтверждают проточной цитометрией, пропуская ДК:лимфоциты, с применением свойственных незрелым ДК высоких значений прямого и бокового светорассеяния в качестве критерия для идентификации. Незрелые ДК обычно содержат >80% клеток с морфологией дендритных клеток и имеют фенотип ДК.
[00632] Анализ IL-12р70-потенциала: Было установлено, что зрелые ДК (зДК) способны синтезировать IL-12p70 спонтанно или при активации CD40L, с добавлением или без добавления сигналов врожденного иммунитета (например, ЛПС). Недавно был создан стандартизованный метод анализа продуцирования IL-12p70, и он применим к небольшим образцам или большим партиям ДК вакцин, полученных в разнообразных условиях. Текущий анализ потенциала состоит из двух отдельных этапов, первый этап включает ко-инкубирование ДК-респондеров с клетками J588 лимфомы, стабильно трансфицированными геном CD40 лиганда человека, в качестве стимуляторов. Второй этап включает тестирование супернатантов этих совместных культур на уровни IL-12p70, секретируемого ДК, стимулированными J558/CD40L +/- ЛПС в системе Luminex. Данный анализ потенциала обладает коэффициентом вариации (CV) между сериями 18,5% (n=30) и широким динамическим диапазоном, что облегчает оценку различных ДК-продуктов, характеризующихся значительно различающимися уровнями синтеза IL-12p70. Нормальный диапазон значений для анализа, проводимого с применением ДК продуктов, полученных из моноцитов 13 нормальных доноров, составлял 8-999 пг/мл, в среднем 270 пг/мл.
Критерии получения и высвобождения дендритных клеток
[00633] Каждую партию полученных in vitro дендритных клеток проверяют на присутствие микробного загрязнения (аэробные и анаэробные бактерии, грибы и микоплазмы), а также эндотоксина, и фенотипически и функционально описывают. Все дендритные клетки для инъецирования пациентам свежие и не подвергаются криоконсервации.
[00634] Контроль качества ДК: Оценивают стерильность, жизнеспособность, чистоту, потенциал и стабильность ДК, полученных согласно приведенному выше описанию. Разрабатывают и неукоснительно следуют критериям допуска указанной клеточных продуктов.
[00635] Жизнеспособность: Клетки, полученные культивированием, подсчитывают с помощью микроскопических наблюдений в гемоцитометре, и проводят дифференцированный подсчет (ДК:лимфоциты) с применением трипанового синего. Этот подсчет дает процент жизнеспособных клеток в тестируемой культуре. Более чем 70% жизнеспособных клеток, не включающих трипановый синий, и минимум 70% клеток, экспрессирующих HLA-DR и CD86 в качестве маркеров происходящих из моноцитов ДК, требуется для соответствия критериям допуска. Могут быть включены дополнительные маркеры для диагностического анализа, такие как CD83 и CCR7 для оценки статуса созревания ДК, и CD3 и CD 19 для оценки контаминации лимфоцитами.
[00636] Чистота: Двуцветную проточную цитометрию клеток, окрашенных ФИТЦ- и ФЭ-конъюгированными mAb, применяют для подтверждения того, что идентифицированная морфологически популяция ДК экспрессирует поверхностные антигены, определенные для ДК, и не содержит антигенов моноцитарных и Т- и В-клеточных линий. Для приготовления вакцины полученные ДК должны экспрессировать HLA-DR и CD86 и не должны экспрессировать CD3, CD 19 или CD 14. Чтобы считаться зДК, клетки должны экспрессировать CD83+ и CCR7+.
[00637] Потенциал: Для оценки потенциала ДК авторы определяют их способность синтезировать IL-12p70 согласно приведенному выше описанию.
[00638] Стерильность: ДК проверяют на культуры бактерий (аэробные и анаэробные) и грибов с применением системы BD Bactec (Becton Dickinson Co., Спаркс, Мэриленд) в лаборатории микробиологии медицинского центра университета Питтсбурга (University of Pittsburgh Medical Center Microbiology Laboratory). Окончательные результаты посева на микроорганизмы доступны через 14 дней. Перед допуском ДК к применению для получения вакцины осуществляют окрашивание по Граму, результат которого должен быть отрицательным, указывая на отсутствие микроорганизмов.
[00639] В лаборатории IMCPL проводят тесты на микоплазму с применением системы быстрого обнаружения микоплазмы в культурах тканей (Gen-Probe Mycoplasma Tissue Culture Rapid Detection System) (Gen-Probe, Inc., Сан-Диего, Калифорния), который основан на технологии гибридизации нуклеиновых кислот.Проверка на эндотоксин осуществляют с применением ЛАЛ-теста с лизатом амебоцитов Pyrogen Plus (Bio Whittaker, Inc., Уолкервилл, Мериленд). Клеточную культуру проверяют на эндотоксин в момент сбора и перед выпуском готового продукта. Приемлемый уровень эндотоксина <5EU/кг массы тела. Нетрансфицированные и трансфицированные дендритные клетки криоконсервируют для дальнейшего анализа.
[00640] Предполагается, что все преобразованные клетки экспрессируют трансген. Предположительно, транфицировано более чем 80% ДК. Продукт является биологически активным, так как природная кодирующая последовательность сохранена в трангене. Преобразованные вирусом ДК, инъецируемые в опухоль, имеют фенотип незрелых ДК и не экспрессируют IL-12 и один или более другой иммуномодулятор, до тех пор, пока не пройдут созревание, и, следовательно, на данном этапе экспрессия IL-12 и одного или более другого иммуномодулятора в основном обеспечивается трансгеном. Так как экспрессию трансгена IL-12 и одного или более другого иммуномодулятора индуцирует дозозависимым образом низкомолекулярный активирующий препарат RG-115932, возможно контролировать поддержание уровня экспрессии трансгена в преобразованных ДК на требуемых уровнях. Небольшая часть преобразованных ДК, полученных для введения пациентам-людям может тестироваться in vitro на зависимую от активирующего препарата индукцию экспрессии IL12 и одного или более другого иммуномодулятора. Экспрессия IL-12 и одного или более другого иммуномодулятора может быть проанализирована с помощью ИФА (ELISA) с чувствительностью 4 нг/мл.
[00641] Предполагается, что in vitro индукция IL-12 и одного или более другого иммуномодулятора из клеток, преобразованных вектором, применяемым в предложенном исследовании, дает приблизительно 500 нг IL-12 и одного или более другого иммуномодулятора на 106 клеток за 24 часа, по оценке ELISA. В доклинических исследованиях с применением мышиной модели меланомы внутриопухолевая инъекция 106 или более преобразованных ДК проявляет эффективность. При этом предполагается, что требуемая внутриопухолевая инъекция может проявлять эффективность при количествах ниже указанного уровня, и, таким образом, инъекции 5×107 преобразованных ДК могут применяться в качестве отправной точки для определения того, требуются ли большие или меньшие количества.
[00642] Например, in vitro, клеточные линии человека и мыши и первичные дендритные клетки, преобразованные рекомбинантным аденовирусным вектором, несущим гены IL12 и одного или более другого иммуномодулятора, демонстрируют индукцию экспрессия IL12 в ответ на активирующий препарат дозозависимым образом.
6.3. Приготовление активирующего препарата
[00643] Применяемый в настоящем изобретении активирующий препарат получают в любом из следующих составов:
(1) 100% Лабразол;
(2) Листерин-ароматизированный Лабразол (Latitude Pharmaceuticals Inc., США), содержащий (а) ментол, (b) тимол, (с) эвкалиптол, (d) аспартам, (е) натрия сахарин, (f) лимонная кислота, (g) ароматизатор «перечная мята», (h) вкусоароматическая добавка «сливки», (i) лабразол;
(3) Миглиол 812 и фосфолипон 90G (Latitude Pharmaceuticals Inc., США); или
(4) Миглиол 812, фосфолипон 90G и токоферилполиэтиленгликоля сукцинат (витамин Е) (Latitude Pharmaceuticals Inc., США).
Доставка
[00644] В то время как можно предположить разнообразные концентрации и конкретные протоколы, один из примеров лечения пациентов включает введение пациентам внутриопухолевой(ых) инъекции(й) преобразованных аутологичных дендритных клеток (AdDC) в концентрации 5×107 суспендированных в стерильном солевом растворе, сконструированных для экспрессии hIL-12 (интерлейкина-12 человека) и одного или более другого иммуномодулятора под контролем RTS, в комбинации с пероральным препаратом для активации (RG-115932).
[00645] Первый курс лечения
[00646] День 1 стационарного лечения: На 1 день проводили общее физическое обследование (включая основные физиологические показатели, массу тела и статус по ECOG). Берут мочу и кровь для исходных показателей биохимического анализа сыворотки, анализа мочи и общего анализа крови (профиль безопасности). Приблизительно за 3 часа до внутриопухолевой инъекции т vitro сконструированных дендритных клеток каждому пациенту вводят дозу активирующего препарата (когорта 1-0,01 мг/кг, 0,3 мг/кг, 1,0 мг/кг и 3 мг/кг) непосредственно после приема пищи. В 1 день для оценки фармакокинетики однократной дозы активирующего препарата и его основных метаболитов берут кровь в определенные интервалы времени (до введения дозы; через 0,5; 1; 1,5; 2; 4; 6; 8; 12; 16 и 24 часа после введения дозы AD). Каждый пациент получает одну внутриопухолевую инъекцию преобразованных аденовирусом аутологичных дендритных клеток в концентрации 5×107 клеток, сконструированных для экспрессии hIL-12 и одного или более другого иммуномодулятора под контролем RTS. Пациенты тщательно наблюдаются для выявления местных реакций в области инъекции и/или реакций гиперчувствительности. Со 2-го по 14 день в стационаре каждый пациент получает дозу активирующего препарата непосредственно после приема пищи. Основные физиологические показатели и нежелательные явления собирают ежедневно с 2 по 14 день. На 4 день ±24 часа берут биопсии опухоли и/или дренирующих лимфатических узлов приблизительно у 50% пациентов для измерения hIL-12 и клеточного иммунного ответа. На 8 день измеряют массу тела. На 8 день ±24 часа, берут биопсии опухоли и/или дренирующих лимфатических узлов у пациентов, которым не проводили биопсию на 4 день для измерения hIL-12, одного или более другого иммуномодулятора и клеточного иммунного ответа. На 4 день ±24 часа и 8 день ±24 часа берут кровь для анализа потенциальных антител и клеточного иммунного ответа против аденовируса и/или компонентов RTS. Также получают цитокиновый профиль сыворотки, чтобы определить, влияет ли на экспрессию других цитокинов лечение трансгеном hIL-12 и одного или более другого иммуномодулятора. На 8 день берут мочу и кровь для основного биохимического анализа сыворотки, анализа мочи и общего анализа крови (профиль безопасность). На 8 день берут кровь через определенные интервалы времени (до введения дозы; через 0,5; 1; 2; 4; 6; 8; 12; 16 и 24 часа после введения дозы AD) для оценки фармакокинетики при равновесной концентрации/ВРМВ активирующего препарата и его основных метаболитов.
[00647] День 14 стационара: на 14 день каждый пациент получает дозу активирующего препарата непосредственно после приема пищи. Каждый пациент проходит физическое обследование (включая основные физиологические показатели, рост, массу тела и статус по ECOG). Берут мочу и кровь для биохимического анализа сыворотки, анализа мочи и общего анализа крови (профиль безопасности). На 14 день±24 часа берут кровь для анализа потенциальных антител и клеточного иммунного ответа против аденовируса и/или компонентов RTS. Также получают цитокиновый профиль сыворотки чтобы определить, присутствует ли влияние на экспрессию других цитокинов.
[00648] В определенные моменты амбулаторного и стационарного лечения у пациентов берут кровь для измерения потенциального ответа антител и клеточного иммунного ответа на аденовирус и компоненты RTS. Получают кровь для исходного цитокинового профиля сыворотки. Блокирующий анализ инфекционности вируса AdVeGFP применяют для обнаружения ответа антител на аденовирусный вектор (Gambotto, Robins et al. 2004). Ответ антител на компоненты RTS оценивают с помощью вестерн-блоттинга и/или ELISA, используя сыворотку пациента и белки RTS, полученные из экспрессионного вектора. Кроме того, с помощью Luminex выполняют мультиплексный анализ цитокинов в сыворотке на IL-12, ИФН-гамма, IP-10, и другие Th1/Th2 цитокины, такие как IL-2, TNF-альфа, IL-4, IL-5 и IL-10. Для данных тестов на антитела и цитокины требуется приблизительно 10 мл крови.
[00649] Потенциальный ответ антител и клеточный иммунный ответ на аденовирус и/или компоненты RTS: В определенные моменты амбулаторного и стационарного лечения у пациентов берут кровь для оценки потенциального ответа антител и клеточного иммунного ответа на аденовирус, компоненты RTS и опухолевые антигены. Блокирующий анализ инфекционности вируса AdVeGFP применяют для обнаружения ответа антител на аденовирусный вектор (Nwanegbo, et al. 2004). Ответ антител на компоненты RTS оценивают с помощью вестерн-блоттинга и/или ELISA, используя сыворотку пациентов и белки RTS, полученные из экспрессионного вектора. Кроме того, с помощью Luminex выполняют мультиплексный анализ цитокинов в сыворотке на IL-12, ИФН-гамма, IP-10 и другие Th1/Th2 цитокины, такие как IL-2, TNFa, IL-4, IL-5 и IL-10. Для данных тестов на антитела и цитокины требуется приблизительно 10 мл крови.
[00650] Для анализов клеточного иммунного ответа используют приблизительно 50-60 мл крови, и из нее выделяют подгруппы CD4 и CD8 Т-клеток. Выделенные Т-клетки смешивают с аутологичными ДК, преобразованными пустым AdV вектором, векторами AdV-RTS или AdV-RTS-hIL12-иммуномодулятор(ы) в тесте ELISPOT на синтез ИФН-гамма Т-клетками, активированными антигенами, происходящими из AdV и RTS, при их наличии. Сходные тесты выполняют с применением опухолевых клеток как таковых и/или ДК, экспрессирующих общие антигены меланомы, для оценки раннего иммунного ответа на опухоль. При необходимости могут быть также выполнены дополнительные анализы.
[00651] ДИАГНОСТИКА БЕРЕМЕННОСТИ: Женщины детородного возраста проходят исследование мочи на наличие беременности во время скринингового визита и перед первым визитом в стационаре в фазе повторного курса лечения. Диагностику осуществляют по меньшей мере за 72, 48, 24 или 12 часов до введения активирующего препарата на протяжении периода как первого курса лечения, так и всех повторных курсов лечения. В случае, если результат исследования мочи на наличие беременности положительный, его подтверждают путем исследования сыворотки крови на наличие беременности. Если беременность подтверждена, пациентку не допускают к участию в клинических испытаниях или продолжению фазы повторного курса лечения. Диагностика беременности может быть повторена столько раз, сколько будет необходимо.
[00652] ИЗУЧЕНИЕ СОПУТСТВУЮЩЕЙ ЛЕКАРСТВЕННОЙ ТЕРАПИИ: При скрининговом обследовании и перед первым визитом в стационаре в фазе повторного курса лечения, каждого пациента просили предоставить список сопутствующих лекарств для определения любого возможного отношения к нежелательным явлениям, возникающим на протяжении фаз испытаний и наблюдения.
[00653] КРИТЕРИИ ДЛЯ ПОВТОРНОГО КУРСА ЛЕЧЕНИЯ: В случае, если пациент переносил предыдущую инокуляцию AdDC без нежелательных реакций, которые являются ограничивающими, и у него не наблюдалось прогрессирования заболевания или ухудшения симптомов ко времени потенциального повторного курса лечения, его рассматривали как кандидата на повторный курс лечения. Если, по мнению руководителя клинических испытаний и лечащего врача, существует потенциальная возможность благоприятного клинического результата дополнительной(ых) внутриопухолевой(ых) инъекции(ях) AdDC в комбинации с активирующим препаратом (максимальная переносимая доза из когорты 1) в течение 14 последовательных дней, указанному пациенту предлагают повторный курс лечения, при условии выполнения следующих условий:
1. Лимитирующая токсичность отсутствовала,
2. Заболевание пациента стабильно, или наблюдаются клинические и субъективные признаки улучшения, и
3. Не обнаружено ответа антител или клеточного иммунного ответа на аденовирусные компоненты системы RheoSwitch® Therapeutic System.
[00654] АНАЛИЗ ТРАНСГЕННОЙ ФУНКЦИИ И ИММУНОЛОГИЧЕСКИХ ЭФФЕКТОВ: Пункционные или эксцизионные биопсии опухолей и ассоциированных дренирующих лимфатических узлов собирают на протяжении скрининга (день -12-день -7), на 4 день, 8 день и 14 день испытания и в 1-й месяц наблюдения для оценки in vivo трансгенной экспрессии hIL-12 и одного или более другого иммуномодулятора, и клеточного иммунного ответа. Тонкоигольную аспирационную биопсию опухоли и ассоциированных дренирующих лимфатических узлов собирают на -12--7 дни и на 14 день периода повторного курса лечения для оценки in vivo трансгенной экспрессии hIL-12 и одного или более другого иммуномодулятора, и клеточного иммунного ответа. Биопсии оценивают при помощи стандартной световой микроскопии и иммуногистохимии для оценки клеточной инфильтрации Т-клеток в опухоли и дренирующие лимфатические узлы. Биопсийные препараты интерпретирует патолог, незнакомый с анамнезом испытуемого пациента. Для различения эндогенной и индуцированной экспрессии IL-12 ДК в опухоли и дренирующих лимфатических узлах применяют ОТ-ПЦР на РНК с соответствующим образом сконструированными праймерами. Кровь для определения цитокинового профиля сыворотки берут во время скрининга, на 4 день, на 8 день и на 14 день испытания, в 1-й месяц наблюдения и на -12--7 дни, 8 день и 14 день периода повторного курса лечения. Получают цитокиновый профиль сыворотки для определения, влияет ли на экспрессию других цитокинов лечение трансгеном hIL-12. С помощью Luminex выполняют мультиплексный анализ цитокинов в сыворотке на IL-12, ИФН-гамма, IP-10 и другие Th1/Th2 цитокины, такие как IL-2, TNFa, IL-4, IL-5 и IL-10. Для данных тестов на антитела и цитокины требуется приблизительно 10 мл крови
[00655] ФАРМАКОКИНЕТИКА ОДНОКРАТНОЙ ДОЗЫ И РАВНОВЕСНОЙ КОНЦЕНТРАЦИИ АКТИВИРУЮЩЕГО ПРЕПАРАТА: кровь берут в определенные моменты времени (до введения дозы; 0,5; 1; 1,5; 2; 4; 6; 8; 12; 16 и 24 часа после утренней дозы) на 1 день испытания для оценки фармакокинетики однократной дозы и на 8 день испытания для измерения фармакокинетики при равновесной концентрации/ВРМВ активирующего препарата и его основных метаболитов. Плазму исследуют при помощи ВЭЖХ для получения следующих критерии оценки фармакокинетики при равновесной концентрации активирующего препарата и основных метаболитов: Cmax (максимальная наблюдаемая концентрация в плазме), Tmax (время достижения максимальной наблюдаемой концентрации в плазме), Ctrough (минимальная наблюдаемая концентрация в плазме, вычисляемая как среднее концентраций в моменты времени 0 и 24 часа), C24h (концентрация в плазме через 24 часа), AUC24h (площадь под кривой концентрация в плазме/время с момента времени 0 до 24 часов), Ke (кажущаяся скорость элиминации), и Т112 (кажущийся период полувыведения).
[00656] Следует понимать, что описанные выше варианты реализации и примеры не предназначены для ограничения в любом отношении объема настоящего изобретения, и что формула изобретения, представленная в настоящей заявке, предназначена для схватывания всех вариантов реализации и примеров, явно или не явно представленных в настоящем документе.
ПРИМЕР 3
[00657] Матрица рационально подобранных модульных генетических компонентов может быть быстро собрана в экспрессирующие ДНК конструкции посредством применения комбинаторной трансгенной технологии, такой как ULTRAVECTOR®. Для демонстрации того, что собранные генетические компоненты, которые по отдельности влияют на транскрипционный, пост-транскрипционный, трансляционный и пост-трансляционный процесс, могут совместно воздействовать на уровень генной экспрессии, применяли технологию RheoSwitch, необязательно в комбинации с искусственными 5’UTR, различными 3’Reg + поли(А) сигналами (SV40 и hGH), сигнальными пептидами (TNF-альфа и IL-2), и схемами оптимизации кодонов (+/-) для модулирования транскрипции, повышающего способность клетки к синтезу и секреции TNF-альфа. На Фиг.11 показаны применяемые модульные элементы, и графически представлен каждый модульный элемент, фланкированный уникальными сайтами рестрикции, обеспечивающими способ точной сборки модульных комбинаций.
[00658] Модульную сборку проводили на основе ДНК-остова, сконструированного для акцепции синтетических генов. Один из примеров остова ULTRAVECTOR®, сконструированного для упаковки аденовируса, изображен на фиг.12. Комбинаторное модульное конструирование хорошо сочетается с аденовирусной доставкой терапевтического средства, так как он позволяет применять компактные регуляторные последовательности, которые могут быть короче, чем обнаруживаемые в природе.
In vitro оценка модульных комбинаций
[00659] Векторами временно трансфицировали клеточную линию HEK293T для определения, какие модульный комбинации приводят к увеличению выхода TNF-альфа. Для индукции экспрессии TNF-альфа в клетки вводили лиганд или носитель-контроль. Собирали супернатант и измеряли уровни TNF-альфа посредством ELISA. Для получения приблизительного базового дикого типа вектор 43318 содержит UV-адаптированные 5’UTR TNF-альфа дикого типа, сигнальный пептид, кодирующую последовательность и SV40pA 3’Reg. Индивидуальные изменения модулей Opt (1, 2) оптимизации кодонов сигнального пептида TNF-альфа или кодирующей последовательности зрелого белка приводят к постепенному увеличению белковой секреции (векторы 43319, 43320). Дополнительная модульная замена 5’UTR 5U2 на 5’UTR TNF-wt также повышает уровни секреции (векторы 43322, 43323). Максимальная секреция TNF-альфа достигается, когда модули 5’UTR, сигнальный пептид и кодирующая последовательность дикого типа замещены на соответствующие модули 5U2, IL2 и TNFOptUV (вектор 43329).
[00660] Чтобы продемонстрировать, что увеличение секреции TNF-альфа не зависит от типа клеток, 11 экспериментальными векторами трансфицировали клетки СНО-K1 и добавляли 2 контрольных вектора (см. Фиг.27). Вектор 43534 (Фигура 26) и вектор 43533 (Фигура 25)) содержат модули TNF-альфа дикого типа, чтобы служить в качестве контрольных. Вектор 43534 состоит из последовательности TNF-альфа дикого типа без центров сборки ULTRAVECTOR®. Примечательно, что присутствие центров сборки ULTRAVECTOR® не оказывает нежелательного эффекта на синтез и секрецию THF-альфа. В этом наборе данных авторы также демонстрируют, что замена 3’Reg TNF-альфа дикого типа либо на SV40e, либо на hGH, содержащий поли-А модули, приводит к увеличению секреции TNF-альфа. Максимальный выход TNF-альфа достигался при комбинации 5U2, сигнального пептида IL2, TNFOptUV и hGHpA. Данные по клеткам СНО-K1 указывают на ту же самую тенденцию постепенного увеличения при каждой модульной замене 5U2 в 5’UTR, сигнальном пептиде IL-2 и кодирующей последовательности TNFOptUV. Что интересно, величина увеличения немного различается для указанных двух типов клеток. Это показывает, что, в то время как модули работают сходным образом в каждом типе клеток, физиологические различия в конкретных типах клеток или тканей могут влиять на величину эффекта модульного замещения. Увеличение комбинаторной матрицы с включением большего числа модулей в каждой категории может позволить идентификацию превосходящего числа зависимых от комбинаций исследуемых типов клеток или тканей. Примеры дополнительных модулей, которые могут быть включены в матрицу большего размера, включены в виде SEQ ID NO:41-46.
ПРИМЕР 4. Оценка кандидатного терапевтического средства в модели на животных
[00661] Чтобы продемонстрировать эффективность индуцируемой оптимизированной TNF-альфа конструкции для лечения рака, например, рака простаты или рака головы и шеи, можно применять мышиную модель рака головы и шеи. Показано, что нокаут одного гена Smad4 приводит к спонтанной модели злокачественной плоскоклеточной карциномы головы и шеи человека (HNSCC). (PMID: 19841536)
[00662] В отсутствие такой линии мышей безтимусным мышам могут быть имплантированы опухолевые клетки HNSCC человека. После развития опухолей в опухоль могут с аденовирусом вводиться оптимизированные TNF-альфа конструкции. Мыши могут вводиться варьирующие дозы лиганда для регуляции уровня синтеза оптимизированного TNF-альфа. Для определения потенциальных кандидатных терапевтических средств из оптимизированной TNF-альфа конструкции измеряют опухолевую нагрузку и оценивают некроз опухоли.
ПРИМЕР 5. Пример терапевтической реализации
[00663] Сконструированный TNF-альфа трансген вводят пациенту посредством внутриопухолевой инъекции нерепликативного аденовирусного ДНК-вектора. Данная генетическая программа кодирует кодон-оптимизированный для млекопитающих зрелый цитокин, слитый с кодон-оптимизированным сигнальным пептидом для IL-2. В свою очередь, трансген cds (IL-2 SP+TNF-альфа) фланкирован 5’UTR TNF-альфа дикого типа и SV40 3’ Reg+сигнал поли(А), и его экспрессию контролируют при помощи технологии Rheo Switch путем введения тщательно «подогнанной» дозы активирующего лиганда (т.е. ДНК в виде вектора VVN-43320, см. Фиг.15). Предварительные данные показывают, что данная комбинация ДНК-элементов дает максимальную возможную индукцию секретируемого TNF-альфа, в то же время позволяя «жесткий» и «нерастекающийся» контроль его экспрессии. Т.е. неиндуцированный, основной уровень экспрессии остается низким при этой конфигурации трансгенов, и с меньшей вероятностью будет вызывать неконтролируемые, нецелевые эффекты у пациента.
[00664] В альтернативном варианте реализации настоящего изобретения сконструированный трансген TNF-альфа вводят пациенту при помощи аденовируса в модульной ДНК-конфигурации, сходной с вектором VVN-43329 (см. Фиг.24), который проявляет как высокий основной уровень экспрессии, так и максимальный уровень трансгенной экспрессии. В данной ДНК используют искусственно сконструированный 5’U2 и hGH поли(А) сигнал, а также полная оптимизация кодонов под млекопитающих и сигнальный пептид IL-2. Контроль системной токсичности у пациента достигают применением низкой множественности заражения (MOI) аденовируса во внутриопухолевой инъекции. В меньшей степени уровень экспрессии и временной контроль также модулируют посредством активирующего лиганда RheoSwitch. Дополнительный контроль распределения этого генного продукта может быть достигнут встраиванием тканеспецифичных микроРНК отвечающих элементов, которые могут препятствовать нецелевой экспрессии в жизненно важных органах, или посредством искусственно конструирования аденовирусного капсида для увеличенного тропизма.
[00665] Согласно дополнительному варианту реализации настоящего изобретения сконструированный трансген TNF-альфа сходен с ДНК VVN-43328 (Фигура 23), который предположительно придает высокую стабильность искусственной иРНК с помощью элемента 5’U2. При этом в данной конструкции не используют сигнальный пептид IL-2 для увеличения секреции, и она сохраняет последовательность дикого типа из ДНК, которая кодирует N’-конец TNF-альфа.
[00666] По неизвестным причинам высокие уровни секреции искусственного TNF-альфа вполне могут оказаться неблагоприятными для исхода у пациента независимо от контекста, в то время как природный механизм «выброса цитокинов» через металлопротеиназы может ограничивать токсичность для пациента, локализуя фактор в окружении его опухоли. Если при естественном выбросе экзогенного TNF-альфа. все же наблюдаются нецелевые эффекты, его эктодоменовый ствол может быть укорочен мутацией для недопущения солюбилизации нативными протеазами, и указанный фактор будет потенциировать активность за счет межклеточных контактов как de facto трансмембранный белок II типа. Как вариант, трансген, сходный с конструкцией, описываемой вектором VVN-43328, может кодировать конститутивно экспрессируемый TNF-альфа с мутированным стволом эктодомена, содержащим сайт расщепления экзогенной протеазой. Данная экзогенная протеаза, в свою очередь, находится под контролем промоторного элемента, управляемого посредством технологии RheoSwitch, экспрессируясь только в присутствии активирующего лиганда. Таким образом, расщепление и in vivo растворимость (но не поверхностная экспрессия) TNF-альфа контролируют посредством модульных трансгенных элементов.
ПРИМЕР 6. Противоопухолевая эффективность Ad-RTS-IL-12
[00667] Противоопухолевый эффект Ad-RTS-IL-12 оценивали в серии мышиных моделей меланомы, колоректального рака, рака поджелудочной железы, груди, легкого и почки. Типовой эксперимент по определению зависимости доза-эффект описан ниже. Иммунокомпетентным самкам мышей C57b1/6 (возрастом 6-8 недель) инокулировали подкожно раковые клетки мышиной меланомы B16F0. Через одиннадцать дней после инокуляции опухолевых клеток, когда формировались выраженные макроскопические опухолевые узлы (объем опухолей достигал в среднем приблизительно 40 мм3), мышей делили на группы по 5 животных в каждой. Формировали 9 групп, включая: получавшую солевой раствор контрольную; получавшую лиганд-активатор; получавшую только Ad-RTS-mIL12 (1ee10 в.ч.); и 6 групп получали лечение в виде различных доз вектора Ad-RTS-mIL-12 (1e7, 1e8, 1e9, 5e9, 1e10, 5e10 вирусных частиц) плюс активирующий лиганд. Мыши в лиганд-позитивных (+) группах получали 100 мг/кг лиганда-активатора в корме 2018 Teklad Global 18% Protein Rodent Diet (Harlan Laboratories) (1000 мг лиганда/кг корма) за день до введения вектора. Мыши в контрольных группах получали корм 2018 Teklad Global 18% Protein Rodent Diet. Одну дозу Ad-RTS-mIL12 в ЮОмкл ФСБ инъецировали в опухоль на 12 день. Объем опухоли и массу тела измеряли каждые 2-3 дня с применением калипера и весов, и животных наблюдали до достижения контрольными опухолями размера 2000 мм3. Данные загружали в программу для исследований на животных Study Log.
[00668] Как показано на Фиг.31, существенный противоопухолевый эффект наблюдался при дозах Ad-RTS-IL-12 выше 1ее8 в.ч. (диапазон 73-99%). Минимальная протестированная доза Ad-RTS-IL-12, 1ее7 в.ч., не проявляла противоопухолевого эффекта. В отсутствие активирующего лиганда высокая доза Ad-RTS-IL-12 1ee10 в.ч. не оказывала никакого эффекта, иллюстрируя необходимость комбинирования Ad-RTS-IL-12 и активирующего лиганда. Лечение лигандом само по себе не оказывало никакого эффекта. Таким образом, настоящее исследование демонстрирует мощные противоопухолевые эффекты, опосредованные Ad-RTS-IL-12 в комбинации с активирующим лигандом.
[00669] Анализ массы тела представлен на рис.32. Животные, получавшие максимальные дозировки (5ее10 в.ч.) Ad-RTS-IL-12, демонстрировали временную потерю веса на 19 день, но восстанавливали вес к 26 дню. У животных в других получавших лечение группах не проявлялось какой-либо очевидной связи доза-эффект, и наблюдались только незначительные изменения в увеличении массы тела.
ПРИМЕР 7. Эффективность Ad-RTS-IL-12 в модели рака легких Льюис
[00670] Самкам иммунокомпетентных мышей C57b/6 возрастом от 6 до 8 недель инокулировали подкожно (п/к) клетки мышиной карциномы легкого Льюис (LLC). Через пять дней после инокуляции клеток мышей рандомизировали и распределяли по получавшим лечение и контрольным группам (n=5), в общей сложности четырем группам - не получавшим лечения (контроль), получавшим только активатор (RG-115932), только Ad-RTS-mIL12 и Ad-RTS-mIL12 плюс активатор. Когорты, получавшие активатор (L), кормили (2018 Teklad Global 18% Protein Rodent Diet (Harlan Laboratories) кормом, смешанным с активатором (1000 мг/кг корма) ad libitum. Когорты, получавшие лечение только Ad-RTS-mIL12 или не получавшие лечения, продолжали получать обычный рацион. Лечение начинали, когда опухоль достигала 28±6 мм3. Ad-RTS-mIL12 (1е10 в.ч/100 мкл в ФСБ) вводили мышам посредством внутриопухолевой (i.t.) инъекции на 6, 9 и 13 день после инокуляции опухолевых клеток. Активирующий корм (L) мышам начинали давать за 24 ч до введения вектора. Размер опухоли и массу тела каждой мыши отслеживали с применением калипера и весов три раза в неделю до конца эксперимента. Эксперимент прекращали, когда размер опухоли у мыши превышал >1200 мм3. Данные загружали в программу для исследований на животных Study Log.
[00671] Объемы опухоли после лечения приведены на Фиг.33А. Мыши-носители опухоли легких Льюис в контрольных и получавших только активатор (L) группах демонстрировали приблизительно сходную кинетику роста опухоли. Три дозы только Ad-RTS-mIL12 приводили к умеренному росту опухоли. Важно отметить, что Ad-RTS-mIL12 с активатором (L) приводил к заметному подавлению роста опухоли (78%) относительно контрольной группы. Эти данные говорят о том, что Ad-RTS-mIL12 в присутствии активатора подавляет рост опухоли легких Льюис. Массу тела отслеживали как индикатор токсичности. Значительной потери массы тела на протяжении эксперимента не наблюдалось.
ПРИМЕР 8. Противоопухолевая эффективность Ad-RTS-IL-12 в модели меланомы
[00672] Самкам иммунокомпетентных мышей C57b/6 возрастом от 6 до 8 недель инокулировали подкожно (п/к) раковые клетки мышиной меланомы (B16F0). Через десять дней после инокуляции клеток мышей случайным образом распределяли по получающим лечение и контрольным группам (n=5), в общей сложности девяти группам: не получавшие лечения (контрольные), получавшие только активатор (L) (RG-115932); только Ad-RTS-mIL12; и Ad-RTS-mIL12 с разными дозами активирующего лиганда (50, 100, 250, 500 и 1000 мг/кг). Когорты, получавшие активатор (L), кормили кормом для грызунов 2018 Teklad Global 18% Protein Rodent Diet, смешанным с активатором (1000 мг/кг корма) adiibitum. Когорты, получавшие лечение только Ad-RTS-mIL12 или не получавшие лечения, продолжали получать обычный рацион - корм 2018 Teklad Global 18% Protein Rodent Diet. Лечение начинали, когда опухоль достигала 56±18 мм3. Мышам вводили одну дозу Ad-RTS-mIL12 (1е10 в.ч./100 мкл в ФСБ) посредством внутриопухолевой (i.t.) инъекции на 13 день после инокуляции опухолевых клеток. Корм с активатором (L) вводили мышам за 24 ч до инъекции вектора. Размер опухоли и массу тела каждой мыши отслеживали три раза в неделю с применением калипера и весов до конца эксперимента. Эксперимент прекращали, когда размер опухоли превышал >2000 мм3. Данные загружали в программу для исследований на животных Study Log.
[00673] Объемы опухоли и изменения массы тела после лечения приведены на Фиг.34А и 34В. Мыши-носители меланомных опухолей в контрольных и получавших только активатор (L) группах демонстрировали сходный агрессивный рост опухоли. Кинетика роста опухоли указывала на то, что активирующий корм не обладал противоопухолевой активностью. Незначительное подавление роста опухоли (12%) наблюдалось на 26 день, когда животные получали однократную дозу Ad-RTS-mIL12 (1е10 в.ч.) без лиганда. Обработка Ad-RTS-mIL12 плюс активатор (L) приводила к подавлению роста опухоли (73-98%) по сравнению с контрольными мышами. Однократная доза Ad-RTS-mIL12 с 50 мг/кг активатора (L) приводила к выраженному уменьшению опухоли относительно контрольных опухолей. Примечательно, что выраженная противоопухолевая активность (90-98%) была очевидна при увеличении дозы в активирующем корме от 100-1000 мг/кг, по сравнению с 50 мг/кг в активирующем корме. Эти данные ясно указывают на то, что Ad-RTS-mIL12 активен при модели меланомы и демонстрирует широкое терапевтическое окно для доз активирующего лиганда. Массу тела отслеживали как индикатор токсичности. На 13 и 17 день наблюдались незначительные временные изменения массы тела (<5%) при дозе активатора 1000 мг/кг. Значительной потери массы тела на протяжении остального времени эксперимента не наблюдалось. Изменений массы тела, связанных с дозировкой активатора, не наблюдалось. Лечение AdRTS-mIL12 в различных дозировках переносилось хорошо, при этом какие-либо признаки токсичности отсутствовали.
ПРИМЕР 9. Противоопухолевая эффективность Ad-RTS-IL-12 в модели рака толстой кишки
[00674] Самкам иммунокомпетентных мышей Balb/C в возрасте от 6 до 8 недель инокулировали подкожно (п/к) экспрессирующие люциферазу стабильные клетки мышиного рака толстой кишки (CT26Luc). Через 10 дней после инокуляции клеток мышей случайным образом распределяли по получающим лечение и контрольным группам (n=5), в общей сложности по трем группам - не получающей лечения (контрольная), получающей только активатор (L) (RG-115932) и получающей Ad-RTS-mIL12 плюс активатор. Когорты, получавшие активатор (L), кормили кормом 2018 Teklad Global 18% Protein Rodent Diet (Harlan Laboratories) смешанным с активатором (1000 мг/кг корма) ad libitum. Когорты, не получавшие лечения, по-прежнему получали корм 2018 Teklad Global 18% Protein Rodent Diet. Лечение начинали, когда опухоль достигала 40±17 мм3. Ad-RTS-mIL12 (1е10 в.ч./100 мкл в ФСБ) вводили мышам посредством внутриопухолевой (i.t.) инъекции на 11 и 18 день после инокуляции опухолевых клеток. Корм с активатором (L) вводили мышам за 24 ч до инъекции вектора. Размеры опухоли и массу тела каждой мыши отслеживали три раза в неделю с применением калипера и весов до конца эксперимента. Эксперимент прекращали, когда размер опухоли у мыши превышал >2000 мм3. Данные загружали в программное обеспечения для исследований на животных Study Log.
[00675] Изменения объема опухоли и массы тела после лечение показаны на Фиг.35А и 35В. Мыши-носители карциномы толстой кишки в контрольной и получавшей только активатор (L) группах демонстрировали сходный агрессивный рост опухоли. Кинетика роста опухоли указывала на то, что активирующий корм не ингибировал рост опухоли. Две дозы Ad-RTS-mIL12 плюс только активатор (L) приводили к полной регрессии и подавлению роста опухоли (100%) по сравнению с контрольными мышами. Примечательно, что пять из пяти животных были полностью свободны от опухолей в результате лечения Ad-RTS-mIL12. Мышей, освободившихся от опухолей после лечения Ad-RTS-mIL12, повторно провоцировали парентеральным введением клеток CT26Luc. Пяти ранее не получавшим лечения животным Balb/c также инокулировали подкожно CT26Luc, как контрольной группе. У указанных контрольных животных развивались опухолевые узлы, как и предполагалось. Важно отметить, что опухоли не развивались ни у одного из повторно провоцированных животных через четыре недели после повторного провоцирования. Это исследование указывает на то, что терапия Ad-RTS-mIL12 приводила к развитию сильного противоопухолевого иммунитета против модели агрессивного рака толстой кишки. Массу тела отслеживали в качестве индикатора токсичности. Значительной потери массы тела на протяжении эксперимента не наблюдалось.
[00676] ПРИМЕР 10. Противоопухолевая эффективность Ad-RTS-IL-12 в модели рака поджелудочной железы
[00677] Самкам иммунокомпетентных мышей С57Ы6 возрастом от 6 до 8 недель инокулировали подкожно (п/к) сингенные клетки PAN02 рака поджелудочной железы (АТСС). Через шесть дней после инокуляции клеток мышей рандомизировали в группы по пять животных в каждой, всего четыре группы - не получавшие лечения, получавшие только активатор (RG-115932), только Ad-RTS-mIL12, и Ad-RTS-mIL12 плюс активатор. Когорты, получавшие лиганд-активатор, кормили кормом 2018 Teklad Global 18% Protein Rodent Diet (Harlan Laboratories), смешанным с активатором (1000 мг/кг корм) ad libitum. Когорты, получавшие лечение только Ad-RTS-mIL12 или не получавшие лечения, продолжали получать корм 2018 Teklad Global 18% Protein Rodent Diet. Мыши получали лечение в виде одной внутриопухолевой (i.t.) инъекции Ad-RTS-mIL12 в дозировке 1е10 в.ч/100 мкл в ФСБ, на 7 день и 14 день после имплантации опухолевых клеток. Размер опухоли в момент начала лечения вектором составлял в среднем STGT мм3.
[00678] Размер опухоли и массу тела каждой мыши отслеживали три раза в неделю до конца эксперимента. Эксперимент прекращали, когда размер опухоли у мыши превышал 600 мм3. Так как панкреатические опухоли растут очень медленно, эксперимент прекращали. Рост опухоли у мышей, не получавших лечения, был обычным.
[00679] В этой модели опухоли незначительная задержка роста опухоли была замечена у мышей, получающих лечение либо только активатором, либо только Ad-RTS-mIL12. Напротив, рост опухоли у всех получающих Ad-RTS-mIL12 мышей был значительно подавлен (97%) по сравнению с таковым у контрольных мышей, которые не получали лечения. В течение всего эксперимента с применением калипера и весов измеряли массу тела в качестве меры токсичности. Животные, получавшие инъекции Ad-RTS-mIL12, не демонстрировали выраженной потери массы тела после введения, не считая временного уменьшения массы тела (<5%) на 12-13 день. Кроме того, ни у одного животного не наблюдалось патологического поведения (вялости, взъерошенной шерсти, хромоты, обезвоживания, сгорбленности и т.д.). Регрессия опухоли поддерживалась до 37 дня, когда контрольных животных умерщвляли. Данные загружали в программу для исследований на животных Study Log.
[00680] Результаты показаны на Фиг.36А и 36В.
[00681] ПРИМЕР 11. Противоопухолевая эффективность Ad-RTS-IL-12 в модели рака груди
[00682] Целью этого исследования была оценка эффективности и токсичности внутриопухолевого лечения Ad-RTS-mIL12 в мышиной модели рак груди.
[00683] Шести-восьминедельных самок мышей BalbC приобретали у Charles River Laboratories или у Harlan (США). Уход за животными и экспериментальные процедуры выполнялись в соответствии с нормами комитета по содержанию и использованию лабораторных животных Intrexon.
[00684] Клеточные линии мышиной карциномы молочной железы (4Т1) приобретали у АТСС (Манассас, Виргиния). Клетки 4Т1 культивировали на среде Roswell Park Memorial Institute (RPMI) 1640 (АТСС, Манассас, Виргиния). В среду было добавлено 10 об.% термоинактивированной эмбриональной телячьей сыворотки (ЭТС), 2-мМ L-глутамина (Atlanta Biologicals, Inc, Лоренсевилл, Джорджия), 100 МЕ/мл пенициллина G и 100 мкг/мл стрептомицина. Клетки культивировали при 37°С в 5% CO2. Все клеточные линии были стандартным образом протестированы и отсутствие микоплазмы подтверждено.
[00685] Самкам иммунокомпетентных мышей BALB/c возрастом от 6 до 8 недель инокулировали подкожно (п/к) сингенные клетки рака груди (4Т1), 1е5 клеток/50 мкл. Через восемь дней после инокуляции клеток мышей рандомизировали на группы по пять животных в каждой, всего 4 группы - не получающие лечения, получавшие только активатор, только Ad-RTS-mIL12, и Ad-RTS-mIL12 плюс активатор. Когорты, получавшие лиганд-активатор, кормили кормом для грызунов, смешанным с активатором (1000 мг/кг) ad libitum. Когорты, получавшие лечение только Ad-RTS-mIL12 или не получавшие лечения, продолжали получать стандартный рацион (Harlan Laboratories, США). Активирующий лиганд вводили в составе специального рациона, приготовленного из Harlan Teklad (из раздела специальных рационов Harlan), содержащего 1000 мг лиганда-активатора в 1 кг того же корма, который давали контрольным животным. Мыши получали лечение в виде одной внутриопухолевой (i.t.) инъекции Ad-RTS-mIL12 в дозировке 1е10 в.ч/100 мкл в ФСБ, на день 9, 12 и 14 после имплантирования опухолевых клеток. Средний объем опухоли составлял Збмм3 в момент начала лечения вектором. Размер опухоли и масса тела каждой мыши отслеживали три раза в неделю до конца эксперимента. Эксперимент прекращали, когда размер опухоли у мыши превышал >1000 мм3.
[00686] Через восемь дней после инокуляции клеток рака груди 4Т1 мышей рандомизировали и распределяли по экспериментальным и контрольным группам (n=5/группу), в общей сложности по четырем группам - не получавшей лечения (контрольная), получавшей только активатор (L), только Ad-RTS-mIL12, и Ad-RTS-mIL12 плюс активатор, как указано в Таблице ниже.
[00687] Лечение начинали, когда опухоль достигала среднего объема 36 мм3. Объемы опухоли после лечения приведены на Фиг.39А. Мыши-носители опухоли 4Т1 в контрольных, получавших Ad-RTS-IL-12 и получавших только лиганд-активатор (L) группах демонстрировали подавление роста опухоли ~20% и 35%, соответственно, на 26 день (Фиг.39А). Важно отметить, что три дозы Ad-RTS-mIL12 с лигандом-активатором приводили к заметному подавлению роста опухоли (82%), относительно контрольной группы (р<0.005). Эти данные говорят о том, что Ad-RTS-mIL12 в присутствии активатора проявляет мощную противоопухолевую активность в модели рака груди (4Т1). Массу тела отслеживали как индикатор токсичности. На протяжении эксперимента не наблюдалось значительной потери массы тела или смертей (Фиг.39В).
[00688] Результаты показывают, что прямая внутриопухолевая инъекция Ad-RTS-mIL12, плюс лиганд-активатор, высокоэффективна для индукции регрессии опухоли и безопасна в модели рака груди. Противоопухолевая активность была значимой (р<0,005) в этой модели.
[00689] ПРИМЕР 12. Клинический протокол для введения вектора Ad-RTS-IL-12 без иммунных клеток
[00690] Ниже представлен клинический протокол, который можно применять для реализации настоящего изобретения в форме введения Ad-RTS-IL-12 вектора для лечения неоперабельной злокачественной меланомы на стадии III С или IV.
[00691] Цель этого этапа 16 клинического исследования состоит в оценке безопасности и объективного ответа, уровня ответа опухоли и иммунологической и другой биологической активности в шести циклах лечения в виде внутриопухолевых инъекций Ad-RTS-IL-12 в комбинации с пероральным приемом 14 ежедневных доз активирующего лиганда. Изначально (в первом цикле) вводилась доза Ad-RTS-IL-12 1×1011 вирусных частиц (в.ч.) совместно с дозой активирующего лиганда 5 мг/день. Дозы как вирусных частиц, так и активирующего лиганда затем повышали в каждом повторном цикле лечения для каждого пациента, в соответствии с установленным расписанием (Таблица 8), при условии, что предыдущий цикл лечения переносился указанным пациентом.
[00692] В задачи указанной фазы 1b исследования входило:
[00693] 1. Оценка безопасности и переносимости повторных циклов лечения одного и того же пациента внутриопухолевыми инъекциями возрастающих доз AD-RTS-IL-12 в комбинации с возрастающими дозами активирующего лиганда у пациентов с неоперабельной злокачественной меланомой III С или IV стадии.
[00694] 2. Получение показателей эффективности с применением диагностической компьютерной томографии (критерии оценки ответа солидных опухолей (RECIST 1.1)), ПЭТ сканограмм и фотографий (в соответствии с обстоятельствами).
[00695] 3. Оценить функциональность RheoSwitch Therapeutic System™ (RTS™) у пациентов путем оценки иммунологических эффектов AD-RTS-IL-12 в комбинации с активирующим лигандом, в отношении клеточного иммунного ответа (в частности, генной экспрессии IL-12 и других цитокинов, частоты цитотоксических Т-лимфоцитов и регуляторных Т-клеток (регуляторных Т-клеток (Tregs))) и другой биологической активности (например, апоптоза и инфильтрации иммунных клеток) в инъецируемых целевой(ых) опухоли(ях), вовлеченных в опухоль дренирующих лимфатических узлах (при доступности) и в периферическом кровотоке, и соотнесения изменений иммунологических и другие биологических параметров с предварительной дозой активирующего лиганда и с ответом опухоли.
[00696] 4. Оценить степень проникновения AD-RTS-IL-12 в опухолевые клетки и в дендритные клетки и макрофаги в опухоли, для определения того, зависит ли степень поглощения вируса клетками, принявшими вирус, от дозы AD-RTS-IL-12. Определение воспалительного ответа и иммунного ответа (клеточного, например, цитотоксических лимфоцитов и регуляторных Т-клетки (Treg), и индукции цитокинов) в опухоли, вовлеченных в опухоль дренирующих лимфатических узлах (при доступности) и в периферическом кровотоке. Изменения иммунологических и других биологических параметров будут соотнесены с дозой AD-RTS-IL-12 и активирующего лиганда, и с ответом опухоли.
[00697] 5. Оценить фармакокинетический профиль на протяжении стационарной фазы каждого цикла на 8 - 9 дни в подгруппе пациентов.
[00698] 6. Оценить интервалы QT/QTc в ЭКГ, полученных мониторированием по Холтеру, у пациентов, для которых проводят оценку ФК.
[00699] Показание:
Неоперабельная злокачественная меланома стадии III С (транзитная), стадии IV (M1a, M1b или М1 с (ЛДГ≤2×ВГН) с по меньшей мере 4 доступными очагами.
[00700] План исследования:
[00701] Фаза 1b, открытое, без контрольной группы, многоцентровое исследование безопасности, переносимости, ответа опухоли (RECIST 1.1), и иммунологических и других биологических эффектов, шести циклов лечения, каждый из которых продолжается в течение 28 дней, каждый с внутриопухолевым инъецированием Ad-RTS-IL-12 в комбинации с 14 однократными ежедневными дозами активирующего лиганда, перорально. Дозировки AD-RTS-IL-12 и активирующего лиганда увеличивают в соответствии с Фиг.1 и Таблицей 1 для всех пациентов, которые перенесли предыдущий цикл лечения.
[00702] Исследуемая популяция:
[00703] Мужчины и женщины всех рас, в возрасте ≥18 лет, с неоперабельной злокачественной меланомой III С или IV стадии с общим состоянием по ECOG 0-1, имеющие минимум 4 доступных очага (максимальный диаметр ≤3 см; минимальный диаметр ≥1 см) или пальпируемых вовлеченных в опухоль лимфатических узла (максимальный диаметр ≤5 см; минимальный ≥1,5 см) для внутриопухолевых инъекций или биопсий.
[00704] Численность выборки:
[00705] В этом исследовании принимают участие минимум 12 и максимум 28 пациентов с III С или IV стадией меланомы. Все пациенты в соответствии с этим протоколом принимают участие в исследовании без контрольной группы, с индивидуально возрастающей дозой AD-RTS-IL-12 и активирующего лиганда в каждом повторном цикле лечения в соответствии с Фиг.1 и Таблицей 1, при условии, что предыдущий цикл лечения хорошо переносился.
[00706] Экспериментальный продукт:
[00707] На протяжении каждого цикла пациенты получают лечение в виде комбинации перорального активирующего лиганда и внутриопухолевой инъекции геннотерапевтического (Ad-RTS-IL-12), сконструированного для экспрессии индуцируемого hIL-12 при дозозависимом ответе на активирующий лиганд. AD-RTS-IL-12 получают в центральном месте производства, затем замораживают и посылают в подходящее место проведения клинического исследования. Все пациенты получают внутриопухолевые инъекции (одну на цикл, в ходе максимум шести циклов, разделенных периодами 4 недели) AD-RTS-IL-12 (всего приблизительно 1,0×1011 и 1,0×1012 вирусных частиц на инъекцию). Пациенты также получают одну ежедневную дозу активирующего лиганда перорально на протяжении 14 последовательных дней в ходе каждого цикла. Дозу AD-RTS-IL-12 и/или активирующего лиганда увеличивают индивидуально в начале циклов 2-6 (см. Таблица 8), для всех пациентов, которые переносили предыдущий цикл лечения. AD-RTS-IL-12 инъецируют в другой очаг в каждом цикле, а если число очагов ограничено, инъекции выполняют, последовательно чередуя их. В один из указанных минимум четырех доступных очагов инъекций не делают, так как этот очаг используют для оценки системного эффекта AD-RTS-IL-12. Дозирование пациента разнесено по меньшей мере на 24 часа. Каждую внутриопухолевую инъекцию делают однократно на протяжении цикла, приблизительно через 3 часа (±30 минут) после первой дозы активирующего лиганда.
[00708] Дозировки:
[00709] Активирующий лиганд: минимальная доза/день: 5 мг; средняя доза/день: 20 мг; максимальная доза/день: 100 мг. Активирующий лиганд вводят на протяжении первых 14 дней каждого цикла.
[00710] Ad-RTS-IL-12: доза: приблизительно 1,0×1011 или 1,0×1012 вирусных частиц/опухоль на инъекцию, суспензированных в общем объеме 0,5 мл стерильного раствора, при этом объем инъекции распределяется по всему очагу, особенно в области границы опухоли.
[00711] Лечение следующей более высокой дозой не начинают, пока не подтверждена безопасность и переносимость предыдущих этапов лечения. Если установлена МПД, дальнейшего увеличения не происходит.
[00712] Способ введения:
[00713] Активирующий лиганд: раствор в мягкой желатиновой капсуле перорально в пределах 30 минут от приема пищи;
[00714] AD-RTS-IL-12:
[00715] Инъецируют в первый день каждого цикла в один из доступных опухолевых очагов или вовлеченных в опухоль (пальпируемых) дренирующих лимфатических узлов, при необходимости.
[00716] Способ оценки состояния пациентов:
[00717] Все пациенты получают лечение в соответствии с Таблицей 8 и участвуют в несравнительном исследовании. Безопасность и переносимость тщательным образом анализируют у всех пациентов, на протяжении и после каждого цикла лечения. Увеличение дозы может иметь место только в том случае, если переносился предыдущий цикл лечения.
[00718] Продолжительность испытаний:
[00719] Данное исследование продолжают приблизительно 28 недель после скрининга для каждого пациента.
[00720] После периода до 23 дней для оценки скрининга (дни от -30 до -7), подтверждают возможность участия пациентов в указанном исследовании. На (-6)-(-2) дни выполняют исходные биопсии, а на 0 день пациентам, для которых оценивают ФК, проводят исходную оценку сердечной функции с применением мониторирования по Холтеру. На 1 день каждого цикла допущенный пациент начинает получать экспериментальное лечение (одну внутриопухолевую инъекцию AD-RTS-IL-12 и одну дозу активирующего лиганда перорально). Активирующий лиганд вводят в каждом цикле в общей сложности на протяжении 14 дней, затем следуют 14 дней отмывки и наблюдений за безопасностью. Экспериментальное лечение состоит из 6 циклов, каждый из которых продолжается в общей сложности 28 дней, включая 14 дней наблюдения. Оценку наблюдения после лечения выполняют спустя 6 недель после последней инъекций (через 4 недели после последней дозы активирующего лиганда). Определяют вирусную ДНК в крови. Если вирусная ДНК присутствует спустя 6 недель после последней инъекции, продолжают дальнейшее измерение вирусной ДНК. Однако если получено два последовательных негативных результата кПЦР для каждого источника, в дальнейшем тестировании нет необходимости.
[00721] Основные конечные показатели:
[00722] Безопасность и переносимость оценивают путем физического обследования (включая общее состояние по ECOG), по интервалу QT/QTc ЭКГ (у пациентов с ФК), основным физиологическим показателям, биохимическому анализу сыворотки, анализу мочи, общему анализу крови и сообщениях пациентов о любых нежелательных явлениях
Объективный ответ и интенсивность ответа по оценке KT-сканограмм.
[00723] Дополнительные конечные показатели:
[00724] Фармакокинетика при равновесной концентрации активирующего лиганда, в подгруппе из восьми пациентов (по четыре на уровень дозы AD-RTS-IL-12).
[00725] b. Выраженность воспалительного и иммунного ответа (клеточного, такого как цитотоксические лимфоциты и регуляторные Т-клетки (Tregs), и индукции цитокинов) в опухоли, в вовлеченных в опухоль дренирующих лимфатических узлах (при доступности) и в периферическом кровотоке, в результате лечения.
[00726] с. Соотнести изменения иммунологических и других биологических параметров с дозой AD-RTS-IL-12 и активирующего лиганда и с ответом опухоли.
[00727] d. Эффективность дополнительно оценивают по ПЭТ сканограммам и фотографиям.
[00728] е. Долгосрочное наблюдение будет продолжаться до 5 лет. Исследователь будет контактировать с пациентами ежегодно.
[00729] Критерии включения:
[00730] а. Мужчины или женщины всех рас возрастом ≥18 лет;
[00731] b. Неоперабельная меланома стадии III С (транзитная) или стадии IV (М1а, M1b, M1c с ЛДГ≤2×ВГН), возникшая из первичной меланомы кожи, слизистой оболочки или подногтевой меланомы с любой толщиной опухоли, либо из неизвестной первичной локализации;
[00732] с. Минимум 4 доступных невисцеральных очага (максимальный диаметр ≤3 см; минимальный ≥1 см) или пальпируемых вовлеченных в опухоль лимфатических узлов (максимальный диаметр ≤5 см; минимальный ≥1,5 см) для внутриопухолевых инъекций или биопсии. По меньшей мере один очаг не инъецируют.
[00733] d. Общее состояние по ECOG 0 или 1;
[00734] е. Пациенты без видимых метастазов в головной мозг по оценке с помощью контрастного МРТ сканирования во время скрининга или в пределах 30 дней до включения в исследование;
[00735] f. Адекватное исходное функционирование системы крови и органов по данным лабораторных анализов в пределах 30 дней до получения экспериментального лечения и до повторных циклов лечения и увеличения дозы активирующего лиганда, удовлетворяющих следующим условиям: концентрация гемоглобина ≥10 г/л, гранулоциты >2500/ мм3, лимфоциты >1000/ мм3, тромбоциты >100,000/ мм3, креатинин сыворотки крови <1,5×ВГН, AST, ALT, щелочная фосфатаза <2,5×ВГН, ЛДГ≤2×ВГН, сывороточный билирубин<1,5×ВГН, абсолютное число нейтрофилов >500/мм3;
[00736] g. Ожидаемая выживаемость по меньшей мере приблизительно 6 месяцев с точки зрения исследователя (преимущественно по оценке общего состояния);
[00737] h. Женщины должны находиться в постменопаузе или быть хирургически стерильны, либо использовать эффективные методы контрацепции; мужчины, не стерильные хирургически, и партнеры которых не находятся в постменопаузе или не стерильны хирургически, должны использовать эффективные методы контрацепции;
[00738] i. Нормальные показатели коагуляции по измерениям ПТВ/АЧТВ;
[00739] j. Подписанное, одобренное IRB добровольное информированное согласие.
[00740] Критерии исключения:
[00741] а. Активные острые вирусные, бактериальные или грибковые инфекции, требующие специфической терапии;
[00742] b. ВИЧ-инфекция, ввиду сомнений относительно возможности организации
эффективного иммунного ответа;
[00743] с. Активное аутоиммунное заболевание, требующее применения стероидов (>10 мг преднизолона или аналога) или другой иммуносупрессивной терапии;
[00744] d. Пациенты с выявляемыми метастазами в головной мозг во время скрининга (или в пределах 30 дней до включения в исследование), по оценке контрастных МРТ-сканограмм;
[00745] е. Пациенты с очагами >3 см (МД (LD)) или пальпируемыми, вовлеченными в опухоль лимфатическими узлами >5 см (МД);
[00746] f. Пациенты с концентрацией гемоглобина <10 г/л;
[00747] g. Присутствие висцеральных метастазов IV стадии или других отдаленных метастазов, если ЛДГ >2×ВГН;
[00748] h. Пациенты, ранее получавшие AD-RTS-IL-12 или активирующий лиганд;
[00749] i. Пациенты, ранее получавшие внутриопухолевую генную терапию.
[00750] J. Реципиенты аллотрансплантатов органов;
[00751] k. Другое сопутствующее клинически активное злокачественное заболевание, за исключением других раковых заболеваний кожи;
[00752] l. Менее чем 30 дней (до первой дозы исследуемого препарата) прошло с момента завершения предшествующей химиотерапии, гормональной терапии, лучевой терапии, иммунной терапии или любой терапии первой линии;
[00753] m. Клинически значимые цереброваскулярные болезни;
[00754] n. Присутствующая в анамнезе или сопутствующая тяжелая сердечная недостаточность (класса III или IV по классификации New York Heart Association (Кардиологической Ассоциации Нью-Йорка)) или болезнь коронарных артерий;
[00755] о. Острые медицинские состояния, такие как ишемическая болезнь сердца или легких, при которых могут быть сочтены неприемлемыми риски анестезии или оперативного лечения;
[00756] р. Присутствие в анамнезе или текущее геморрагическое нарушение или нарушение свертываемости крови;
[00757] q. Сопутствующая иммуносупрессивная терапия, такая как кортикостероиды (>10 мг преднизолона или аналога) и циклоспорин А;
[00758] r. Параллельные экспериментальные лечения или получение любого экспериментального лечения в пределах предшествующих 30 дней (до первой дозы исследуемого препарата);
[00759] s. Параллельный прием лекарственных препаратов, метаболизируемых в CYP450 3А4 пути;
[00760] t. Кормящие грудью или беременные женщины;
[00761] u. Пациенты, имеющие в анамнезе гиперчувствительность, которая может относиться к любому из компонентов продукта, например, к бензойной кислоте, которая может относиться и к активирующему лиганду, который содержит два бензольных кольца;
[00762] v. Любое медицинское или психиатрическое состояние, которое, с точки зрения исследователя, недопустимо снизит безопасность или доставку предлагаемого лечения, или будет препятствовать получению добровольного информированного согласия.
[00763] Статистические методы:
[00764] Объективный ответ (CR+PR (ПО+ЧО)) основан на изменениях размера инъецируемого(ых) и не-инъецируемого(ых) опухолевого(ых) очага(ов), а также пальпируемых вовлеченных в опухоль лимфатических узлов согласно компьютерной томографии [с использованием критериев оценки ответа солидных опухолей (RECIST 1.1)]. Для оценки изменений метаболической активности или размера (кожных очагов) применяют ПЭТ сканограммы и/или фотографии, соответственно.
[00765] Первичный анализ OB и ЧОО включает доверительный интервал, и его выполняют, когда численность выборки достигает 12, 16, 20, 24 пациентов, спустя 6 недель после лечения последнего пациента.
[00766] Измерения демографической, иммунологической и биологической активности, а также показателей безопасности, включая уровни нежелательных явлений и данные лабораторных анализов, анализируют описательно в конце наблюдения. Результаты обобщены в таблицах, графиках и списках для каждого пациента.
[00767] Для обобщения непрерывных измерений применяют описательную статистику, включая среднее, медиану, стандартное отклонение и гистограмму. Для категориальных переменных, включая ответ опухоли по объективным оценкам применяют подсчет частот. Иммунологическую и биологическую активность соотносят с противоопухолевым эффектом. Эту статистику получают по страте (размер опухолевых очагов: ≤1 см максимальный диаметр [МД], >1 см МД; размер вовлеченных ДЛУ: ≤3 см МД, >3 см МД; локализация очагов: висцеральная, невисцеральная; инъекционный статус очагов: инъецируемые, не-инъецируемые.) Получают статистику в конце каждого цикла лечения и общую. Для общего анализа объединяют наблюдения по разным стратам, но не по разным циклам.
[00768] Соблюдение стандартов:
[00769] Испытания проводятся в соответствии с текущими правилами надлежащей клинической практики (cGCP).
Список литературы
Abdalla, 2007.
Abdi K, Singh N, Matzinger P (2006). T-cell control of IL-12p75 production. Scand J Immunol 64: 83-92.
Adorini L (1999). Interleukin-12, a key cytokine in Th1-mediated autoimmune diseases. Cell Mol Life Sci 55: 1610-25.
Adorini L (2001). Interleukin 12 and autoimmune diabetes. Nat Genet 27: 131-2.
Adorini L, Gregori S, Harrison LC (2002). Understanding autoimmune diabetes: insights from mouse models. Trends Mol Med 8: 31-8.
Adorini L, Gregori S, Magram J, Trembleau S (1996). The role of IL-12 in the pathogenesis of Th1 cell-mediated autoimmune diseases. Ann NY Acad Sci 795: 208-15.
Akhtar N, Padilla ML, Dickerson EB, Steinberg H, Breen M, Auerbach R et al (2004). Interleukin-12 inhibits tumor growth in a novel angiogenesis canine hemangiosarcoma xenograft model. Neoplasia 6: 106-16.
Akiyama Y, Watanabe M, Maruyama K, Ruscetti FW, Wiltrout RH, Yamaguchi K (2000). Enhancement of antitumor immunity against В 16 melanoma tumor using genetically modified dendritic cells to produce cytokines. Gene Ther 7: 2113-21.
Al-Mohanna F, Saleh S, Parhar RS, Collison K (2002). IL-12-dependent nuclear factor-kappaB activation leads to de novo synthesis and release of IL-8 and TNF-alpha in human neutrophils. JLeukoc Biol 72: 995-1002.
Aliberti JC, Cardoso MA, Martins GA, Gazzinelli RT, Vieira LQ, Silva JS (1996). Interleukin-12 mediates resistance to Trypanosoma cruzi in mice and is produced by murine macrophages in response to live trypomastigotes. Infect Immun 64: 1961-7.
Allavena P, Paganin C, Zhou D, Bianchi G, Sozzani S, Mantovani A (1994). Interleukin-12 is chemotactic for natural killer cells and stimulates their interaction with vascular endothelium. Blood 84: 2261-8.
Alii RS, Khar A (2004). Interleukin-12 secreted by mature dendritic cells mediates activation of NK cell function. FEBS Lett 559: 71-6.
Alzona M, Jack HM, Simms PE, Ellis TM (1996). Interleukin-12 activates interferon-gamma production by targeted activation of CD30+ Т cells. Ann NY Acad Sci 795: 127-36.
Amemiya K, Meyers JL, Trevino SR, Chanh TC, Norris SL, Waag DM (2006). Interleukin-12 induces a Th1-like response to Burkholderia mallei and limited protection in BALB/cmice. Vaccine 24: 1413-20.
Araujo MI, Bliss SK, Suzuki Y, Alcaraz A, Denkers EY, Pearce EJ (2001). Interleukin-12 promotes pathologic liver changes and death in mice coinfected with Schistosoma mansoni and Toxoplasma gondii. Infect Immun 69: 1454-62.
Arulanandam BP, Van Cleave VH, Metzger DW (1999). IL-12 is a potent neonatal vaccine adjuvant. Eur J Immunol 29: 256-64.
Athie MV, Flotow H, Hilyard KL, Cantrell DA (2000). IL-12 selectively regulates STAT4 via phosphatidylinositol 3-kinase and Ras-independent signal transduction pathways. Eur J Immmol 30: 1425-34.
Athie-Morales V, Smits HH, Cantrell DA, Hilkens CM (2004). Sustained IL-12 signaling is required for Th1 development. J Immunol 172: 61-9.
Atkins MB, Robertson MJ, Gordon M, Lotze MT, DeCoste M, DuBois JS et al (1997). Phase I evaluation of intravenous recombinant human interleukin 12 in patients with advanced malignancies, din Cancer Res 3: 409-17.
Berard F, Blanco P, Davoust J, Neidhart-Berard EM, Nouri-Shirazi M, Taquet N et al (2000). Cross-priming of naive CDS Т cells against melanoma antigens using dendritic cells loaded with killed allogeneic melanoma cells. J Exp Med 192: 1535-44.
Bertagnolli MM, Lin BY, Young D, Herrmann SH (1992). IL-12 augments antigen-dependent proliferation of activated Т lymphocytes. JImmunol 149: 3778-83.
Bhardwaj N, Seder RA, Reddy A, Feldman MV (1996). IL-12 in conjunction with dendritic cells enhances antiviral CD8+CTL responses in vitro. JCUn Invest 98: 715-22.
Biedermann Т, Lametschwandtner G, Tangemann K, Kund J, Hinteregger S, Carballido-Perrig N et al (2006). IL-12 instructs skin homing of human Th2 cells. J Immunol 177: 3763-70.
Brunda MJ, Gately MK (1994). Antitumor activity of interleukin-12. Clin Immunol Immunopathol 71: 253-5.
Buchanan JM, Vogel LA, Van Cleave VH, Metzger DW (1995). Interleukin 12 alters the isotype-restricted antibody response of mice to hen eggwhite lysozyme. Int Immunol 7: 1519-28.
Chang, 2007.
Coughlin, 1998.
Dietrich 2002.
Emtage et al., "Adenoviral Vectors Expressing Lymphotactin and Interleukin 2 or Lymphotactin and Interleukin 12 Synergize to Facilitate Tumor Regression in Murine Breast Cancer Models," Hum. Gene Ther. 10: 697 (1999).
Faure F, Even J, Kourilsky P (1998). Tumor-specific immune response: current in vitro analyses may not reflect the in vivo immune status. Crit Rev Immunol 18: 77-86.
Gao et al., "Cotransduction of CCL27 gene can improve the efficacy and safety of IL-12 gene therapy for cancer," Gene Ther. 14: 491-502 (2007)
Hansson, 2007.
Heinzerling L, Burg G, Dummer R, Maier T, Oberholzer PA, Schultz J et al (2005). Intratumoral injection of DNA encoding human interleukin 12 into patients with metastatic melanoma: clinical efficacy. Hum Gene Ther 16: 35-48.
Hill 2002.
Itoh T, Storkus WJ, Gorelik E, Lotze MT (1994). Partial purification of murine tumor-associated peptide epitopes common to histologically distinct tumors, melanoma and sarcoma, that are presented by H-2Kb molecules and recognized by CD8+tumor-infiltrating lymphocytes. J Immmol 153: 1202-15.
Jean, 2004.
Kang WK, Park C, Yoon HL, Kim WS, Yoon SS, Lee MH et al (2001). Interleukin 12 gene therapy of cancer by peritumoral injection of transduced autologous fibroblasts: outcome of a phase I study. Hum Gene Ther 12: 671-84.
Koka, 2004.
Koyama, 1997
Lasek, 2000.
Mehrotra, 1995.
Narvaiza et al., "Intratumoral coinjection of two adenoviruses, one encoding the chemokine IFN-gamma-inducible protein-10 and another encoding IL-12, results in marked antitumoral synergy," J. Immunol. 164: 3112 (2000).
Nair, 2006.
Narvaiza et al., Intratumoral Coinjection of Two Adenoviruses, One Encoding the Chemokine IFN-γ-Inducible Protein-10 and Another Encoding IL-12, Results in Marked Antitumoral Synergy; V. Immunol. 164: 3112-3122 (2000).
Palmer et al., "Combined CXC chemokine and interleukin-12 gene transfer enhances antitumor activity," Gene Ther. 5:282-290 (2001).
Rasmussen, 2003.
Romani L, Puccetti P, Bistoni F (1997). Interleukin-12 in infectious diseases, din MicrobiolRev 10: 611-36.
Rothe H, Burkart V, Faust A, Kolb H (1996). Interleukin-12 gene expression mediates the accelerating effect of cyclophosphamide in autoimmune disease. Ann N YAcadSci 795: 397-9.
Sabel, 2003, 2004, 2007.
Sangro В, Mazzolini G, Ruiz J, Herraiz M, Quiroga J, Herrero I et al (2004). Phase I trial of intratumoral injection of an adenovirus encoding interleukin-12 for advanced digestive tumors. J Clin Oncol 22: 1389-97.
Sangro B, Melero I, Qian C, Prieto J (2005). Gene therapy of cancer based on interleukin 12. Curr Gene Ther 5: 573-81.
Satoh Y, Esche C, Gambotto A, Shurin GV, Yurkovetsky ZR, Robbins PD et al (2002). Local administration of IL-12-transfected dendritic cells induces antitumor immune responses to colon adenocarcinoma in the liver in mice. J Exp Ther Oncol 2: 337-49.
Satoskar AR, Rodig S, Telford SR, 3rd, Satoskar AA, Ghosh SK, von Lichtenberg F et al (2000). IL-12 gene-deficient C57BL/6 mice are susceptible to Leishmania donovani but have diminished hepatic immunopathology. Eur J Immunol 30:834-9.
Schopf LR, Bliss JL, Lavigne LM, Chung CL, Wolf SF, Sypek JP (1999). Interleukin-12 is capable of generating an antigen-specific Th1-type response in the presence of an ongoing infection-driven Th2-type response. Infect Immun 67:2166-71.
Subleski, 2006.
Svane IM, Boesen M, Engel AM (1999). The role of cytotoxic T-lymphocytes in the prevention and immune surveillance of tumors-lessons from normal and immunodeficient mice. Med Oncol 16: 223-33.
Taniguchi, 1998.
Tatsumi T, Huang J, Gooding WE, Gambotto A, Robbins PD, Vujanovic NL et al (2003). Intratumoral delivery of dendritic cells engineered to secrete both interleukin (IL)-12 and IL-18 effectively treats local and distant disease in association with broadly reactive Tc1-type immunity. Cancer Res 63: 6378-86.
Thomas GR, Chen Z, Enamorado I, Bancroft C, Van Waes С (2000). IL-12- and IL-2-induced tumor regression in a new murine model of oral squamous-cell carcinoma is promoted by expression of the CD80 co-stimulatory molecule and interferon-gamma. Int J Cancer 86: 368-74.
Trinchieri G (2003). Interleukin-12 and the regulation of innate resistance and adaptive immunity. Nat Rev Immunol 3: 133-46.
Triozzi PL, Alien КО, Carlisle RR, Craig M, LoBuglio AF, Corny RM (2005). Phase I study of the intratumoral administration of recombinant canarypox viruses expressing B7.1 and interleukin 12 in patients with metastatic melanoma, din Cancer Res 11: 4168-75.
Tsung K, Meko JB, Peplinski GR, Tsung YL, Norton JA (1997). IL-12 induces T helper 1-directed antitumor response. J Immunol 158: 3359-65.
Vujanovic, 2006.
Wang, 2001.
Wigginton 2002, 2001, 1996
Wolf SF, Sieburth D, Sypek J (1994). Interleukin 12: a key modulator of immune function. Stem Cells 12: 154-68.
Yamanaka R, Zullo SA, Ramsey J, Yajima N, Tsuchiya N, Tanaka R et al (2002). Marked enhancement of antitumor immune responses in mouse brain tumor models by genetically modified dendritic cells producing Semliki Forest virus-mediated interleukin-12. J Neurosurg 97: 611-S.
Yuminamochi E, Koike T, Takeda K, Horiuchi I, Okumura К (2007). Interleukin-12- and interferon-gamma-mediated natural killer cell activation by Agaricus blazei Murill. Immunology.
McDermott, D.F. and Atkins, M.B. (2008) Immunotherapy of metastatic renal cell carcinoma.
Cancer J.I 4, 320-324.
Bemtsen, A., Trepiakas, R., Wenandy, L., Geertsen, P.F., thor Straten, P., Andersen, M.H., Pedersen, A.E., Claesson, M.H., Lorentzen, Т., Johansen, J.S. and Svane, I.M. (2008) Therapeutic dendritic cell vaccination of patients with metastatic renal cell carcinoma: a clinical phase 1/2 trial. J. Immunother. 31, 771-780.
Tarhini, A.A., Kirkwood, J.M., Gooding, W.E., Moschos, S. and Agarwala, S.S. (2008) A phase 2 trial of sequential temozolomide chemotherapy followed by high-dose interleukin 2 immunotherapy for metastatic melanoma. Cancer. 113,1632-1640.
Heemskerk, В., Liu, K., Dudley, M.E., Johnson, L.A., Kaiser, A., Downey, S., Zheng, Z., Shelton, Т.Е., Matsuda, K., Robbins, P.F„ Morgan, R.A., Rosenberg, S.A. (2008) Adoptive cell therapy for patients with melanoma, using tumor-infiltrating lymphocytes genetically engineered to secrete interleukin-2. Hum Gene Ther. 19, 496-510.
Horton, H.M., Lalor, P.A. and Rolland, A.P. (2008) IL-2 plasmid electroporation: from preclinical studies to phase I clinical trial. Methods Mol Biol. 423, 361-372.
Shiratori, I., Suzuki, Y., Oshiumi, H., Begum, N.A., Ebihara, Т., Matsumoto, M., Hazeki, K., Kodama, K., Kashiwazaki, Y. and Seya, T. (2007) Recombinant interleukin-12 and interleukin-18 antitumor therapy in a guinea-pig hepatoma cell implant model.
Cancer Sci. 98, 1936-1942.
Lian H, Jin N, Li X, Mi Z, Zhang J, Sun L, Li X, Zheng H, Li P. (2007) Induction of an effective anti-tumor immune response and tumor regression by combined administration of IL-18 and Apoptin. Cancer Immunol Immunother. 56, 181-192.
Iinuma, H., Okinaga, K., Fukushima, R., Inaba, Т., Iwasaki, K., Okinaga, A., Takahashi, I. and Kaneko, M. (2006) Superior protective and therapeutic effects of IL-12 and IL-18 gene-transduced dendritic neuroblastoma fusion cells on liver metastasis of murine neuroblastoma. J. Immunol. 176, 3461-3469.
Basak, G.W., Zapala, L., Wysocki, P.J., Mackiewicz, A., Jakobisiak, M. and Lasek, W. (2008) Interleukin 15 augments antitumor activity of cytokine gene-modified melanoma cell vaccines in a murine model. Oncol Rep. 19, 1173-1179.
Lasek, W., Basak, G., Switaj, Т., Jakubowska, A.B., Wysocki, P.J., Mackiewicz, A., Drela, N., Jalili, A., Kaminski, R., Kozar, K. and Jakobisiak, M. (2004) Complete tumour regressions induced by vaccination with IL-12 gene-transduced tumour cells in combination with IL-15 in a melanoma model in mice. Cancer Immunol Immunother. 53, 363-372.
Xia, Y., Dai, J., Lu, P., Huang, Y., Zhu, Y. and Zhang, X. (2008) Distinct effect ofCD40 and TNF-signaling on the chemokine/chemokine receptor expression and function of the human monocyte-derived dendritic cells. Cell Mol Immunol. 5, 121-131.
Sharma, S., Batra, R.K., Yang, S.C., Hillinger, S., Zhu, L., Atianzar, K., Stricter, R.M., Riedl, K., Huang, M. and Dubinett, S.M. (2003) Interleukin-7 gene-modified dendritic cells reduce pulmonary tumor burden in spontaneous murine bronchoalveolar cell carcinoma. Hum Gene Ther. 14, 1511-1524.
Tirapu, I., Rodriguez-Calvillo, M., Qian, C., Duarte, M., Smerdou, C., Palencia, В., Mazzolini, G., Prieto, J. and Melero, I. (2002) Cytokine gene transfer into dendritic cells for cancer treatment. Curr. Gene Ther. 2, 79-89.
Small, E.J., Sacks, N., Nemunaitis, J., Urba, W.J., Dula, E., Centeno, A.S., Nelson, W.G., Ando, D., Howard, C., Borellini, F., Nguyen, M., Hege, K. and Simons, J.W. (2007) Granulocyte macrophage colony-stimulating factor-secreting allogeneic cellular immunotherapy for hormone-refractory prostate cancer. Clin Cancer Res. 13, 3883-3891.
Huang, H. and Xiang, J. (2004) Synergistic effect of lymphotactin and interferon gamma-inducible protein-10 transgene expression in T-cell localization and adoptive T-cell therapy of tumors. Int. J. Cancer. 109, 817-825.
Реферат
Настоящее изобретение относится к области генной терапии для лечения заболеваний глаз, конкретно к применению векторов для условной экспрессии одного или более терапевтического белка под контролем системы модуляции генной экспрессии в присутствии активирующего лиганда при производстве лекарственного средства, и может быть использовано в медицине. Настоящее изобретение позволяет сконструировать условно экспрессирующие векторы, которые могут применяться для лечения макулярной дегенерации или глаукомы у субъекта. 9 з.п. ф-лы, 40 ил., 8 табл., 12 пр.
Формула
Документы, цитированные в отчёте о поиске
Фармацевтическая композиция для индукции иммуннойреакции у человека

Комментарии