Фармацевтическая композиция для индукции иммуннойреакции у человека - RU2313365C2
Код документа: RU2313365C2
Чертежи





Описание
Область техники
Настоящее изобретение относится к фармацевтической композиции для индукции иммунной реакции у человека или животного. Данное изобретение относится также к способу получения аутологичных дендритных клеток, нагруженных по меньшей мере пятью антигенами рака яичка и не содержащих линиеспецифического дифференцировочного антигена или по существу не содержащих линиеспецифического дифференцировочного антигена. Настоящее изобретение относится также к выделенной линии клеток меланомы. Настоящее изобретение далее относится к применению вышеуказанной композиции в качестве иммунотерапевтической вакцины и применению аутологичных дендритных клеток в качестве антигенпредставляющих клеток в фармацевтической композиции или вакцине. Кроме того, настоящее изобретение относится к способу индукции иммунной реакции у человека или животного.
Предпосылки изобретения
Злокачественные опухоли на поздних стадиях развития являются одной из главных причин смерти у человека. До настоящего времени не было предложено эффективных методов лечения рака. Иммунотерапия рака направлена на разрушение опухолевых клеток под действием иммунологических механизмов. Иммунотерапия в сравнении с обычными методами лечения рака, такими как хирургическая операция, лучевая терапия и химиотерапия, является гораздо менее токсичной и не вызывает серьезных осложнений. Кроме того, иммунотерапия оказывает действие на разных стадиях заболевания. На начальных стадиях заболевания иммунотерапия может быть хорошим методом лечения, дополняющим хирургическое удаление первичных опухолей и направленным на предотвращение дальнейшего распространения заболевания. На поздних стадиях заболевания иммуннотерапия может быть единственно возможным методом лечения, так как обычные методы часто оказываются неэффективными.
Главной функцией иммунной системы является обнаружение и разрушение чужеродных веществ (антигенов), проникающих в организм. Иммунная система способна отличать "свое" от "чужого" и в нормальных условиях может вызывать иммунную реакцию против чужеродных или "не своих" антигенов. Несмотря на то, что раковые клетки образуются из собственных клеток организма, они распознаются иммунной системой как чужеродные. Однако такая естественная иммунная реакция является недостаточно сильной, чтобы блокировать появление и рост опухоли. Задача иммунотерапии состоит в том, чтобы усилить способность иммунной системы распознавать опухолевые клетки и создавать эффективные механизмы устранения опухоли. Двумя важными вопросами, возникающими в случае любой специфической иммунотерапии, являются выбор антигенов для направленного воздействия и оптимальное представление антигенов иммунной системе.
Опухолеассоциированные антигены (ТАА), распознаваемые цитотоксическими Т-лимфоцитами (CTL), являются наиболее эффективным компонентом для направленного воздействия, осуществляемого известными эффекторными механизмами противоопухолевого иммунитета. Существует два основных типа ТАА: уникальные антигены, которые присутствуют в незначительном количестве опухолей и поэтому не могут служить общими мишенями, и близкородственные или общие ТАА, присутствующие во многих опухолях. Три основные группы близкородственных антигенов в настоящее время считаются потенциальными мишенями для иммунотерапии и, как было установлено, индуцируют образование цитотоксических Т-лимфоцитов. Вышеуказанными тремя группами антигенов являются: антигены рака яичка (СТ-антигены), сверхэкспрессированные опухолевые антигены и линиеспецифические дифференцировочные антигены.
СТ-Антигены кодированы линиеспецифическими генами раковых или зародышевых клеток и образуют одну из наиболее крупных групп близкородственных опухолеассоциированных антигенов. СТ-Антигены первоначально были обнаружены в меланомах, а затем и во многих других злокачественных новобразованиях человека. Из всех нормальных тканей указанные антигены экспрессированы только в яичке, а в некоторых случаях - в плаценте. В нормальных клетках, экспрессирующих указанные антигены, отсутствует экспрессия молекул МНС, поэтому такие антигены обычно не распознаются Т-лимфоцитами.
СТ-Антигены являются очень привлекательной мишенью для специфической иммунотерапии рака. Результаты недавно выполненных клинических исследований свидетельствуют о регрессии опухоли у значительного числа больных с меланомой и раком мочевого пузыря в результате направленного воздействия на один специфический СТ-антиген (Nishiyama et al., 2001, Clin. Cancer Res., v. 7, pp. 23-31; Thurner et al., 1999, J. Exp. Med. v. 190, pp. 1669-1678). Известно, что Т-клетки распознают только некоторые СТ-антигены, при этом были определены соответствующие пептидные эпитопы. Однако все СТ-антигены можно считать потенциальными мишенями для иммунотерапии. Корреляция между экспрессией антигенов MAGE-A и развитием опухоли была обнаружена при целом ряде злокачественных новообразований (Brasseur et al., 1995, Int. J. Cancer, v. 63, pp. 375-380; Eura et al., 1995, Int. J. Cancer, v. 64, pp. 304-308; Katano et al., 1997, J. Surg. Oncol., v. 64, pp. 195-201; Patard et al., 1995, Int. J. Cancer, v. 64, pp. 60-64). Другая группа СТ-антигенов, в частности антигены MAGE-B, характеризуется значительно менее выраженной опухолеспецифической экспрессией по сравнению с антигенами MAGE-A. Третья группа указанных антигенов, в частности, антигены MAGE-C, характеризуются характером экспрессии, напоминающим характер экспрессии антигенов MAGE-A. В научной литературе до настоящего времени не было приведено данных, относящихся к реакции CTL против антигенов MAGE-C.
В научной литературе описано несколько белков, отличных от MAGE, которые имеют характеристики СТ-антигенов. Один из таких белков, NY-ESO-1, является одним из наиболее иммуногенных опухолевых антигенов, обнаруженных до настоящего времени. Результаты клинических исследований пептидной иммунизации больных с меланомами свидетельствуют о стабилизации заболевания и регрессии некоторых метастазов у некоторых больных (Jager et al., 2000, Proc. Natl. Acad. Sci. U.S.A., v. 97, pp. 12198-12203).
В отличие от СТ-антигенов, у сверхэкспрессированных опухолевых антигенов отсутствует строго опухолеспецифическая экспрессия, так как экспрессию указанных антигенов на низком уровне можно обнаружить в некоторых нормальных тканях помимо яичка. Создание методов иммунотерапии в отношении некоторых из указанных антигенов может быть полезным для больных раком, и в настоящее время проводятся интенсивные исследования таких антигенов как CEA, p53, HER-2/Neu, MUC-1 и альфа-фетопротеин, в качестве возможных мишеней в клинических испытаниях. Группу сверхэкспрессированных опухолевых антигенов лишь недавно начали использовать в качестве мишеней в клинических испытаниях, поэтому данные об эффективности индукции терапевтической иммунной реакции отсутствуют.
Линиеспецифические антигены, дифференцировочные антигены меланоцитов и простата-ассоциированные антигены были описаны только для двух типов рака человека: меланом и рака предстательной железы. Данная группа антигенов экспрессирована как в нормальной дифференцированной ткани, так и в двух указанных типах рака человека. В нормальной дифференцированной ткани указанные антигены очень редко индуцируют иммунную реакцию, однако такие белки становятся иммуногенными в раковых клетках, и в случае меланом можно обнаружить Т-клетки-киллеры, водействующие на дифференцировочные антигены меланоцитов. В большинстве клинических испытаний меланомы или рака предстательной железы направленному воздействию подвергаются дифференцировочные антигены.
Из всех групп опухолеассоциированных антигенов наиболее перспективные результаты использования ТАА в качестве мишеней для иммунотерапии получены для некоторых белков MAGE. Однако особенно в случае меланом вышеуказанное терапевтическое действие является нестабильным и не препятствует росту некоторых метастазов. Такие метастазы обычно не экспрессируют антигены MAGE, используемые для иммунизации (Thurner et al., 1999, J. Exp. Med., v. 190, pp. 1669-1678).
Поливалентную иммунную реакцию можно индуцировать при использовании цельных опухолевых клеток или материала, выделенного из цельных клеток. В заявке WO 9003183, патентах США №№ 5840317 и 6187306 описано несколько вакцинных препаратов на основе клеток меланомы. В патенте США № 4108983 описана вакцина против меланомы первого поколения, полученная из клеток меланомы, лизированных вирусом коровьей оспы.
В патентах США №№ 5635188 и 5030621 описана вакцина на основе антигенов клеточной поверхности, выделенных из клеток меланомы, которые помещают в культуральную среду и затем используют в качестве вакцины против меланомы. Аналогичным образом, в патенте США № 5484596 описан способ лечения рака, в соответствии с которым облученные опухолевые клетки инъецируют человеку в качестве вакцины. В патенте США № 6187306 описаны линии клеток меланомы, экспрессирующих близкородственные иммунодоминантные антигены меланомы, и способы их применения.
Важным аспектом любого лечения вакциной является способ введения вакцины. В последние годы установлено, что наиболее эффективным способом доставки антигена к Т-клеткам, особенно к наивным Т-клеткам, является использование дендритных клеток. Дендритные клетки (ДК) являются наиболее эффективными антигенпредставляющими клетками, и иммунотерапия на основе ДК уже применяется в некоторых случаях лечения рака (Kugler et al., 2000, Nat. Med., v. 6, pp. 332-336; Nestle et al., 1998, Nature (Med.), v. 4, pp. 328-332; Thurner et al., 1999, J. Exp. Med., v. 190, pp. 1669-1678) и свидетельствует о высоком потенциале такого способа иммунизации.
Одним из уникальных свойств ДК является их способность поглощать экзогенные белки в результате эндоцитоза, процессировать указанные белки и представлять их в качестве пептидных эпитопов на своей поверхности вместе с антигенами МНС класса I. Антигенпредставляющие дендритные клетки могут распознаваться цитотоксическими Т-клетками. Указанное свойство является особенно важным при введении антигенов опухолевых клеток в виде опухолевых лизатов или апоптозных тел, добавляемых экзогенно. При сравнении незрелых и зрелых ДК установлено, что высокая эндоцитарная активность характерна для незрелых дифференцирующихся ДК (Sallusto et al., 1995, J. Exp. Med. v., 182, pp. 389-400)). Возможность существования различий в эндоцитарной активности незрелых ДК ранее не рассматривалась.
В заявке WO 0127245 описан способ получения дендритных клеток-предшественников из периферической крови стандартным лейкаферезом, поверхностным центрифугированием в градиенте плотности и культивированием клеток ex vivo в бессывороточной среде в течение 40 часов без экзогенно добавляемых цитокинов.
В заявке WO 0146389 описан способ получения дендритных клеток из продуктов лейкафереза в замкнутых системах при использовании культуральной среды, не содержащей белков, отличных от человеческих. В культуральной среде используют цитокины клинической степени чистоты (IL-4 и GM-CSF), и для нагрузки ДК добавляют ТАА.
Тернер и др. (Thurner et al., 1999, J. of Immunological Methods 223:1-15) описали способ репродуцируемого получения большого числа зрелых ДК из CD14+-моноцитов при помощи двухстадийного способа, в соответствии с которым цитокины добавляют после 1-го дня культивирования.
Комбинация дендритных клеток с ТАА описана также в заявке WO 0128583, которая относится к иммунотерапевтической вакцине на основе антигенпредставляющих клеток, активированных препаратом разрушенных клеток, содержащим клеточные мембраны раковых клеток, инфицированных рекомбинантным вирусом коровьей оспы, кодирующим по меньшей мере одну иммуностимулирующую молекулу. В объем указанного изобретения входят также аутологичные ДК, представляющие смесь антигенов из линий клеток меланомы, инфицированных рекомбинантным вирусом коровьей оспы, кодирующим IL-2. В заявке WO 0129192 описан способ индукции, в случае необходимости, опухолеспецифической иммунной реакции убольного, в соответствии с которым антигенпредставляющие клетки, выделенные у указанного больного, инкубируют с мертвыми клетками, содержащими по меньшей мере один опухолевый антиген, и полученные нагруженные антигенпредставляющие клетки вводят нуждающемуся в этом больному.
Несмотря на то, что иммунотерапевтические вакцины, предназначенные для лечения рака, стали значительно лучше за последние годы, по-прежнему существует потребность в более безопасных и более эффективных композициях для применения в иммунотерапии рака. Такие вакцины должны быть поливалентными, направленно воздействующими на несколько СТ-антигенов во избежание роста вариантов с потерей антигена. Такие вакцины должны быть более безопасными, без возможного риска направленного воздействия на антигены, экспрессируемые в нормальной ткани. Указанные вакцины должны быть оптимизированы в отношении представления и доставки антигенов к Т-клеткам, при этом необходима осторожность для выбора наиболее эффективных ТАА в качестве мишеней.
Описание изобретения
Настоящее изобретение позволяет решить вышеуказанные проблемы, связанные с тщательным выбором линий клеток меланомы для получения наиболее эффективных ТАА с последующим скринингом во избежание использования любых антигенов, которые потенциально могут быть вредны больному. Кроме того, антигенпредставляющие клетки были оптимизированы в отношении эндоцитарной активности до нагрузки ДК лизатом цельных клеток меланомы.
Первым объектом настоящего изобретения является фармацевтическая композиция для индукции иммунной реакции у человека или животного, которая содержит дендритные клетки, представляющие множество антигенов рака яичка, и имеет нижеследующие отличительные особенности:
а) на дендритных клетках представлено по меньшей мере пять антигенов рака яичка и не содержат линиеспецифических дифференцировочных антигенов или по существу не содержат линиеспецифических дифференцировочных антигенов;
b) антигены рака яичка получают по меньшей мере из одной линии раковых клеток, экспрессирующих по меньшей мере пять разных антигенов рака яичка и не экспрессирующих линиеспецифических дифференцировочных антигенов или по существу не экспрессирующих линиеспецифических дифференцировочных антигенов;
с) дендритные клетки являются незрелыми (CD1a-пложительными, CD14-отрицательными и CD83-отрицательными) во время нагрузки антигенами рака яичка.
Вторым объектом настоящего изобретения является способ получения аутологичных дендритных клеток человека или животного, нагруженных по меньшей мере пятью антигенами рака яичка и не содержащих линиеспецифических дифференцировочных антигенов или по существу не содержащих линиеспецифических дифференцировочных антигенов, в котором подразумеваются следующие стадии:
а) получение по меньшей мере одной линии раковых клеток, экспрессирующих по меньшей мере пять антигенов рака яичка и не экспрессирующих линиеспецифических дифференцировочных антигенов или по существу не экспрессирующих линиеспецифических дифференцировочных антигенов;
b) получение аутологичных дендритных клеток у указанного человека или животного;
с) посев моноцитов с плотностью 5 х 106 - 20 х 106 клеток на 25 см2;
d) культивирование указанных дендритных клеток ex vivo в питательной среде без цитокинов в начальной фазе роста и в среде, содержащей цитокины, во второй фазе роста;
е) нагрузку указанных дендритных клеток по пункту d) антигенами рака яичка, полученными из лизата цельных клеток по меньшей мере одной линии раковых клеток по пункту а).
Третьим объектом настоящего изобретения является выделенная линия клеток меланомы, экспрессирующих по меньшей мере пять антигенов рака яичка и не экспрессирующих дифференцировочных антигенов меланоцитов или по существу не экспрессирующих дифференцировочных антигенов меланоцитов.
Четвертым объектом настоящего изобретения является применение множества антигенов рака яичка, получаемых из выделенной линии раковых клеток по п.28, в фармацевтической композиции или вакцинном препарате.
Пятым объектом настоящего изобретения является применение дендритных клеток в качестве антигенпредставляющих клеток в фармацевтической композиции или вакцине, где указанные дендритные клетки нагружены антигенами в незрелом состоянии на такой стадии, когда они являются CD1a-положительными, CD14-отрицательными, CD83-отрицательными, при этом дендритные клетки культивируют ex vivo в питательной среде без цитокинов в начальной фазе роста и в среде, содержащей цитокины, во второй фазе роста до нагрузки указанных дендритных клеток по меньшей мере пятью антигенами рака яичка.
Шестым объектом настоящего изобретения является способ индукции иммунной реакции у человека или животного, включающий в себя следующие стадии:
а) получение по меньшей мере одной линии раковых клеток, экспрессирующих по меньшей мере пять антигенов рака яичка и не экспрессирующих линиеспецифических дифференцировочных антигенов или по существу не экспрессирующих линиеспецифических дифференцировочных антигенов;
b) получение аутологичных дендритных клеток у указанного человека или животного;
с) культивирование указанных дендритных клеток ex vivo в питательной среде без цитокинов в начальной фазе роста и в среде, содержащей цитокины, во второй фазе роста;
d) нагрузку указанных дендритных клеток по пункту с) антигенами рака яичка, полученными из лизата цельных клеток по меньшей мере одной линии раковых клеток по пункту а);
е) введение указанных нагруженных дендритных клеток по пункту d) указанному человеку или животному.
Краткое описание чертежей
Данное изобретение подробно описано ниже со ссылкой на чертежи.
На фигуре 1 показана чувствительность к лизису ряда клонов клеток меланомы DDM-1 под действием клонов gp100 и MART-1/Melan A-специфических цитотоксических Т-лимфоцитов (CTL).
На фигуре 2 показана экспрессия дифференцировочных антигенов меланоцитов gp100 и MART-1/Melan A в трех клонах клеток меланомы, DDM-1.7, DDM-1.13 и DDM-1.29, измеренная при помощи анализа методом RT-PCR.
На фигуре 3 показана экспрессия дифференцировочного антигена меланоцита gp100 в клетках DDM-1.7 и DDM-1.29, измеренная методом иммунного окрашивания.
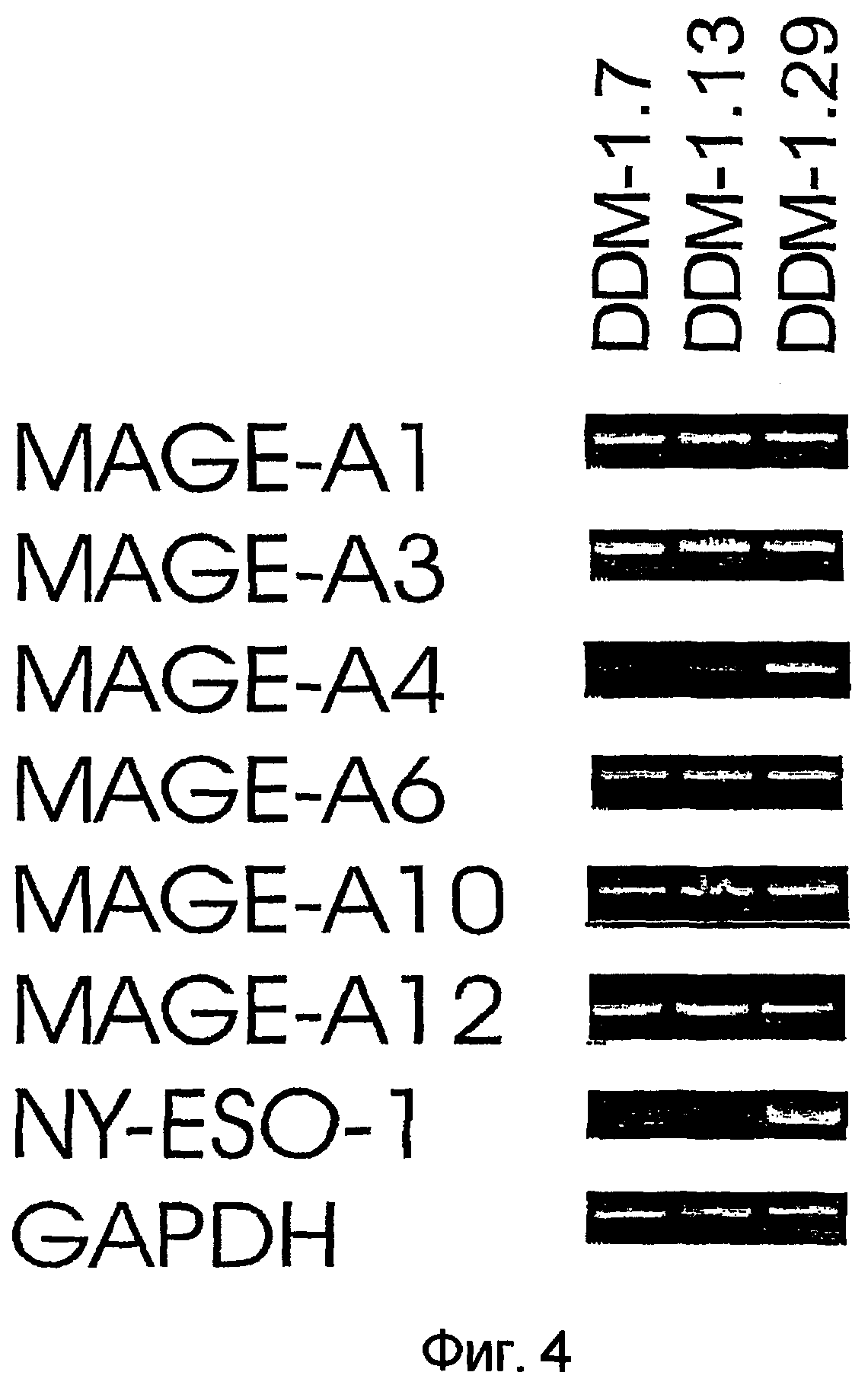
На фигуре 4 показана экспрессия MAGE-A1, MAGE-А3, MAGE-А4, MAGE-А6, MAGE-А12, NY-ESO-1 и GAPDH в трех клонах клеток меланомы, DDM-1.7, DDM-1.13 и DDM-1.29, измеренная при помощи анализа методом RT-PCR.
На фигуре 5 показана экспрессия MAGE-А и NY-ESO-1 в клетках DDM-1.13 после обработки ДНК-деметилирующим агентом 5-аза-2'-дезоксицитидином.
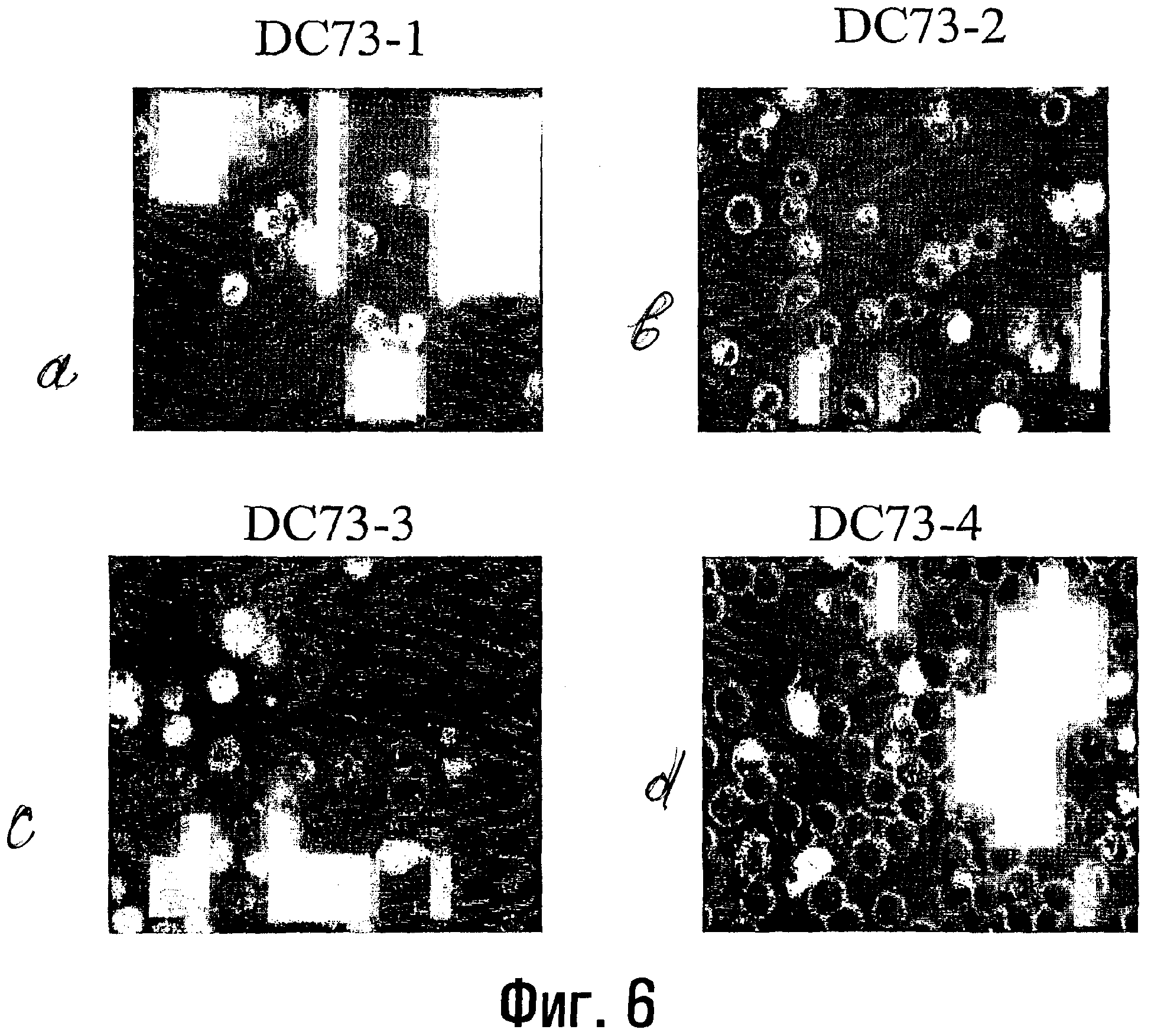
На фигуре 6 показано поглощение флуоросфер в результате эндоцитоза четырьмя культурами незрелых дендритных клеток.
На фигуре 7 показано продуцирование IFN-γ клоном gp100-специфических CTL после взаимодействия с четырьмя культурами дендритных клеток (аналогичны показанным на фиг.6), нагруженных лизатом клеток DDM-1.29.
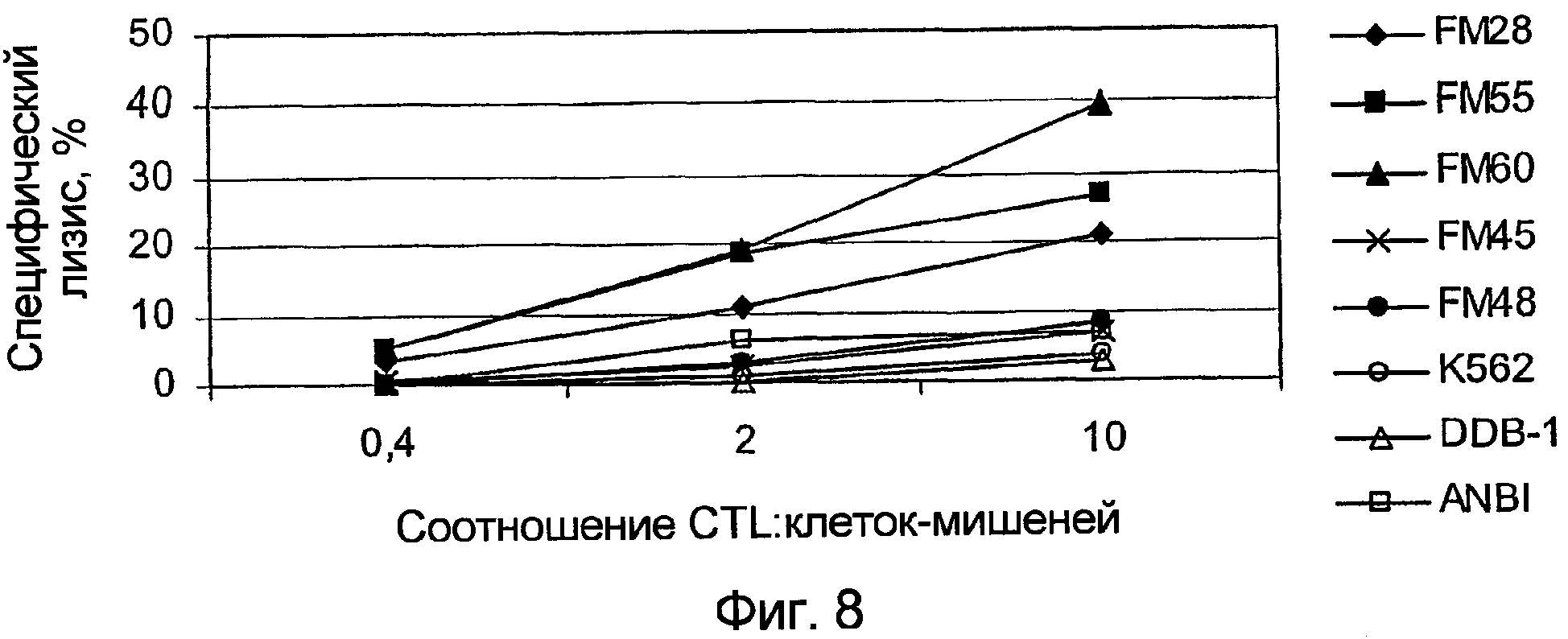
На фигуре 8 показана цитолитическая активность иммунных лимфоцитов донора ANBI против клеток меланомы, EBV-тансформированных В-клеток и клеток К562.
На фигуре 9 показана цитолитическая активность иммунных лимфоцитов донора 19/00 против линий клеток рака молочной железы и плоскоклеточного рака.
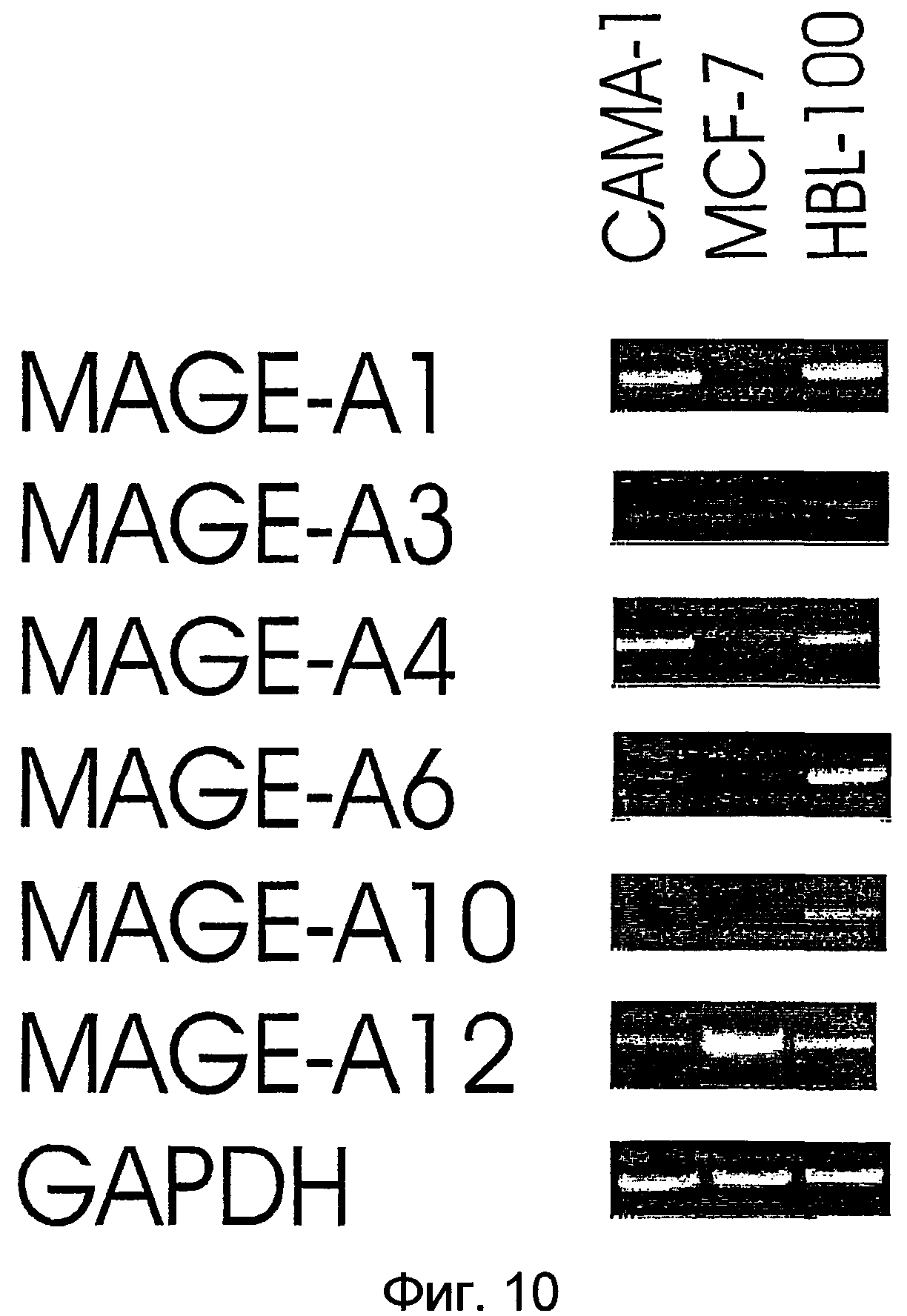
На фигуре 10 показана экспрессия генов MAGE-А и GAPDH в линиях клеток рака молочной железы, измеренная при помощи анализа методом RT-PCR.
Предпочтительные варианты осуществления изобретения
Подробному рассмотрению вариантов осуществления изобретения предшествует определение специальных терминов, относящихся к основным объектам настоящего изобретения.
Определения
Цитотоксические Т-лимфоциты: лимфоциты являются мелкими мононуклеарными белыми кровяными тельцами, присутствующими в лимфоидных тканях, циркулирующей крови и лимфе. Существует два основных функциональных типа лимфоцитов, а именно В-лимфоциты и Т-лимфоциты, которые участвуют в антигенспецифических иммунных реакциях. Т-лимфоциты (Т-клетки) представляют собой тип мелких антигенспецифических лимфоцитов, образующихся в тимусе (у млекопитающих) и присутствующих во вторичных лимфоидных тканях (таких как лимфатические узлы, селезенка) и крови, которые участвуют в клеточных иммунных реакциях и способствуют продуцированию антител. На поверхности Т-лимфоцитов имеются антигенспецифические рецепторы, которые взаимодействуют только с чужеродным антигеном, представленным им на поверхности клетки. Основными типами Т-лимфоцитов являются цитотоксические Т-клетки, которые распознают и уничтожают клетки тела, антигенно изменившиеся каким-либо образом (например, под действием вирусной инфекции), Т-клетки-хелперы, которые активируются чужеродным антигеном на поверхности антигенпредставляющих клеток и, в свою очередь, активируют соответствующие В-клетки, Т-кетки-супрессоры, участвующие в подавлении иммунных реакций и общей регуляции иммунной системы.
Антигены рака яичка (СТ-антигены): Антигены, кодируемые линиеспецифическими генами раковых и зародышевых клеток, являются одной из наиболее крупных групп близкородственных опухолеассоциированных антигенов. СТ-антигены первоначально были обнаружены в меланомах и затем - во многих других злокачественных новообразованиях человека. Из нормальных тканей СТ-антигены экспрессированы только в яичке и в некоторых случаях - в плаценте. В нормальных клетках, экспрессирующих указанные антигены, не экспрессируются молекулы МНС, поэтому такие антигены обычно не распознаются Т-лимфоцитами.
Линиеспецифические дифференцировочные антигены: группа дифференцировочных антигенов до настоящего времени описана только для меланом и рака предстательной железы. Указанные антигены являются иммуногенными только в раковых клетках, и данная группа включает в себя дифференцировочные антигены меланоцитов, такие как gp100, Melan-A/MART-1, тирозиназа, TRP-1, TRP-2, MC1R, AIM-1 и простата-ассоциированные антигены PSA (простата-специфический антиген), PSMA (простата-специфический мембранный антиген), РАР (простата-ассоциированная фосфатаза) и PSCA (антиген стволовых клеток предстательной железы).
Дифференцировочные антигены меланоцитов: группа антигенов, экспрессируемых как в нормальных дифференцированных меланоцитах, так и в меланомах. В нормальных дифференцированных меланоцитах указанные антигены очень редко индуцируют иммунную реакцию, однако указанные белки станосятся иммуногенными в раковых клетках, и в случае меланом можно обнаружить Т-клетки-киллеры, воздействующие на дифференцировочные антигены меланоцитов. Считается, что указанные белки ответственны за синтез пигмента меланина.
Дендритные клетки: тип нелимфоцитарных клеток в некоторых лимфоидных тканях, действующих в качестве антигенпредставляющих клеток в результате эндоцитоза экзогенных белков, которые затем подвергаются процессингу и представляются в виде эпитопов на поверхности этих клеток вместе с антигенами МНС класса I и II. Антигенпредставляющие дендритные клетки могут распознаваться цитотоксическими Т-клетками и Т-клетками-хелперами. Состояние созревания дендритных клеток имеет важное значение для их фагоцитарной/эндоцитарной активности. Незрелые дендритные клетки являются наиболее эффективными клетками для нагрузки антигенами.
Незрелые дендритные клетки: дендритные клетки, в которых экспрессия некоторых клеточных маркеров CD1a, CD14 и CD83 характеризуется высоким уровнем экспрессии CD1a (более 50% ДК в популяции являются CD1a-положительными), отсутствием экспрессии или низкой экспрессией CD14 (менее 15% ДК в популяции являются CD14-положительными) и низким уровнем экспрессии CD83 (менее 25% ДК в популяции являются CD83-положительными).
Экзосомы: экзосомы являются мембранными пузырьками диаметром 30-100 нм эндоцитарного происхождения, которые продуцируются и секретируются in vitro живыми клетками разного типа.
Цитокины: белки иммунной системы, которые являются модификаторами биологической реакции. Они координируют взаимодействия между антителами и Т-клетками иммунной системы и усиливают иммунную активность. Цитокины включают в себя монокины, синтезируемые макрофагами, и лимфокины, продуцируемые активированными Т-лимфоцитами и естественными клетками-киллерами. Монокины включают в себя интерлейкин (IL)-1, фактор некроза опухоли (TNF), α- и β-интерферон (IFN) и колониестимулирующие факторы. Лимфокины включают в себя IL, γ-IFN, колониестимулирующий фактор гранулоцитов-макрофагов (GM-CSF) и лимфотоксин. Эндотелиальные клетки, фибробласты и выбранные клетки других типов могут также синтезировать цитокины. Примеры приемлемых цитокинов согласно данному изобретению включают в себя IL-4, GM-CSF, IL-13, IFN-γ, Flt-31, SCF, TNF-α.
Меланома: злокачественное новообразование или опухоль разной степени тяжести, для которой характерно разрастание или образование метастазов на поздних стадиях болезни.
Нагрузка дендритных клеток: поглощение экзогенных белков в результате эндоцитоза и представление пептидных эпитопов на поверхности дендритных клеток. Иногда определяется также как "импульсное мечение".
Термин "по существу не экспрессирующий линиеспецифических/дифференцировочных антигенов меланоцитов" применительно к настоящему изобретению означает, что линия клеток рака/меланомы, используемая для получения лизата цельных клеток, не должна экспрессировать линиеспецифических/дифференцировочных антигенов меланоцитов в количествах, достаточных для стимуляции иммунной реакции против линиеспецифического/дифференцировочного антигена меланоцитов. На практике указанный термин означает, что клетки рака/меланомы не чувствительны к лизису под действием цитотоксических Т-лимфоцитов против линиеспецифических/дифференцировочных антигенов меланоцитов (лизис менее 10%, в частности менее 5%, и более конкретно - менее 2% при 4-часовом испытании на цитотоксичность), и только 1-2% клеток положительно окрашиваются антителами против линиеспецифических/дифференцировочных антигенов меланоцитов. Кроме того, количество РНК-транскриптов из генов, кодирующих линиеспецифические/дифференцировочные антигены меланоцитов, по меньшей мере примерно в 100 раз меньше в указанных линиях клеток по сравнению с высокочувствительными линиями клеток при определении полуколичественным методом RT-PCR.
Иммунная реакция: избирательная реакция, вызываемая иммунной системой позвоночных, при которой продуцируются специфические антитела и/или цитотоксические клетки против проникающих микроорганизмов, паразитов, трансплантированной ткани и многих других веществ, которые распознаются телом как чужеродные (антигены). Продуцирование антител, циркулирующих в крови, известно как гуморальная иммунная реакция, продуцирование цитотоксических клеток известно как опосредованная клетками, или клеточная, иммунная реакция.
Иммунотерапевтическая вакцина: вакцина, вводимая для лечения и/или предотвращения дальнейшего развития болезни хозяину, у которого диагностировано данное заболевание.
Аутологичные клетки: клетки, которые являются собственными клетками больного.
Аллогенный: генетически отличный, но относящийся к тому же виду.
Антигенпредставляющая клетка: специализированная лимфоидная клетка, такая как дендритная клетка, В-клетка и моноцитарная клетка, которая может вызывать активацию Т-клетки.
Моноцит: фагоцитарное белое кровяное тельце, родственное макрофагам. Моноциты являются еще одним типом антигенпредставляющих клеток, которые в основном реактивируют ранее сенсибилизированные цитотоксические Т-лимфоциты.
Дендритные клетки-предшественники: CD14+-моноциты, присутствующие в периферической крови, или CD34+-клетки, присутствующие в костном мозге или периферической крови (особенно после мобилизации).
Иммунодоминант: антиген, присутствующий в смеси с другими антигенами, преимущественно стимулирует иммунную реакцию против самого себя.
Настоящее изобретение относится к усовершенствованной лечебной композиции, предназначенной для использования, например, в качестве иммунотерапевтической вакцины. Наиболее эффективным способом доставки антигена к Т-клеткам, особенно к наивным Т-клеткам, является использование аутологичных дендритных клеток. В клинических испытаниях было использовано несколько разных опухолеассоциированных антигенов из трех групп: СТ-антигены, сверхэкспрессированные опухолевые антигены и линиеспецифические антигены, и до настоящего времени наиболее перспективные результаты были получены при использовании антигенов из группы антигенов рака яичка.
Сверхэкспрессированные опухолевые антигены, в отличие от СТ-атигенов, не характеризуются четко выраженной опухолеспецифической экспрессией, так как их экспрессию можно обнаружить в некоторых нормальных тканях, помимо яичка, хотя и в значительно меньшей степени, чем в опухолевых клетках. Такое распределение препятствует созданию сильного иммунитета по отторжению опухоли (вследствие устранения высокореактивных Т-лмфоцитов в процессе индукции толерантности), и в том случае, когда существует возможность формирования такой реакции, появляется потенциально высокий риск возникновения аутоиммунитета. Данная группа включает в себя большое число антигенов, некоторые из которых недавно стали мишенями в клинических испытаниях.
Вышеуказанные ограничения относятся также к линиеспецифическим антигенам, которые включают в себя дифференцировочные антигены. Данная группа антигенов также экспрессирована в соответствующей нормальной дифференцированной ткани, и у здоровых указанные антигены иногда могут вызвать иммунную атаку вследствие толерантности к "собственным" белкам. По неизвестным причинам такие нормальные белки становятся иммуногенными в раковых клетках, и в случае меланом Т-клетки-киллеры, воздействующие на дифференцировочные антигены меланоцитов, могут быть легко обнаружены у больных, но не у здоровых людей. В большинстве клинических испытаний, целью которых является исследование меланом или рака предстательной железы, в качестве мишени служат дифференцировочные антигены.
Цель настоящего изобретения состоит в том, чтобы избежать присутствия сверхэкспрессированных и линиеспецифических дифференцировочных антигенов в смеси антигенов, используемой для иммунизации. В случае линий клеток меланомы группа сверхэкспрессированных антигенов чрезвычайно редко индуцирует иммунную реакцию, исключая таким образом необходимость отрицательного отбора данной группы антигенов. Что касается дифференцировочных антигенов меланоцитов, то их присутствие нежелательно, а в случае наличия указанных антигенов их количество должно быть недостаточным для стимуляции иммунной реакции против самих себя (на практике это означает, что количество транскриптов РНК из генов, кодирующих дифференцировочные антигены меланоцитов, должно быть по меньшей мере примерно в 100 раз меньше в линиях клеток согласно изобретению по сравнению с высокочувствительными линиями клеток при определении полуколичественным методом RT-PCR). Следует избегать присутствия таких иммунодоминантных белков, в частности должны отсутствовать такие белки как gp100, Melan-A/MART-1 и тирозиназа.
Другая цель настоящего изобретения состоит в том, чтобы получить линии клеток, экспрессирующие по меньшей мере три, в частности по меньшей мере пять и более, СТ-антигенов, предпочтительно как можно больше СТ-антигенов, которые должны быть иммунодоминантными. Весьма удивительным является то, что такие линии клеток можно получить убольного, которые после удаления меланомы на стадии III или IV характеризуются длительным периодом ремиссии (более пяти лет), что свидетельствует об иммуногенности опухолевых клеток in vivo. Затем необходимо исследовать отдельные субклоны, полученные из таких линий клеток, на отсутствие дифференцировочных антигенов меланоцитов, в частности, gp100, Melan-A/MART-1 и тирозиназы.
Помимо иммунотерапии меланомы, настоящее изобретение относится также к способу индукции иммунной реакции у человека или животного в отношении других типов рака. Необходимым требованием является близкое сродство антигенов-мишеней и их присутствие в злокачественных новообразованиях других типов, главным образом в солидных опухолях. Такие опухоли могут, в частности, включать в себя рак прямой кишки, рак поджелудочной железы, рак молочной железы, рак яичника, рак предстательной железы, плоскоклеточный рак, рак потовых желез, почечно-клеточный рак, гепатому, рак шейки матки, рак легкого, мелкоклеточный рак легкого или рак мочевого пузыря.
Один вариант осуществления настоящего изобретения относится к фармацевтической композиции для индукции иммунной реакции у человека или животного, содержащей дендритные клетки, представляющие множество антигенов рака яичка, в которой:
а) дендритные клетки представляют по меньшей мере пять антигенов рака яичка и не содержат линиеспецифических дифференцировочных антигенов или по существу не содержат линиеспецифических дифференцировочных антигенов;
b) антигены рака яичка получают по меньшей мере из одной линии раковых клеток, экспрессирующих по меньшей мере пять разных антигенов рака яичка и не экспрессирующих линиеспецифических дифференцировочных антигенов или по существу не экспрессирующих линиеспецифических дифференцировочных антигенов;
с) дендритные клетки являются незрелыми (CD1a-положительными, CD14-отрицательными и CD83-отрицательными) во время нагрузки антигенами рака яичка.
Нагруженные дендритные клетки затем могут созревать в результате добавления факторов созревания.
Дендритные клетки являются наиболее эффективными антигенпредставляющими клетками, как было указано выше, и другим объектом настоящего изобретения является получение дендритных клеток и, в частности, аутологичных дендритных клеток, образующихся из CD14+-моноцитов, выделенных из периферической крови, или CD34+-клеток, выделенных из периферической крови или костного мозга, которые должны быть оптимизированы в отношении их эндоцитарной/фагоцитарной активности и экспрессии CD1a. Считается, что дендритные клетки обладают указанной активностью в незрелом состоянии. Для получения таких активированных клеток в большинстве случаев используют "способ на основе GM-CSF + IL-4", предложенный Саллюсто и Ланзавечия (Sallusto and Lanzavecchia, 1994, J. Exp. Med. 179:1109). К другим приемлемым цитокинам относятся IL-4, GM-CSF, IL-13, IFN-γ, Flt-31, SCF, TNF-α (Alters et al., 1999, J. Immunother., v. 22, pp. 229-236), в частности, при осуществлении настоящего изобретения цитокины выбирают из GM-CSF и IL-4.
Авторы настоящего изобретения обнаружили, что, как описано в нижеследующем примере 2, указанный способ можно оптимизировать и что культивирование ex vivo в питательной среде без цитокинов в начальной фазе роста и в свежей среде, содержащей цитокины, во второй фазе роста до нагрузки дендритных клеток позволяет получить ДК с повышенной эндоцитарной активностью. Начальная фаза роста согласно изобретению составляет 6-48 часов, в частности 12-34 часов, и еще точнее - 20-28 часов.
Ранее считалось, что эндоцитарная активность всех незрелых дендритных клеток является одинаково хорошей, независимо от метода культивирования. Авторы настоящего изобретения установили, что при использовании описанного способа для продуцирования устойчивых зрелых дендритных клеток и нагрузки дендритных клеток в незрелом состоянии до добавления факторов созревания, можно получить незрелые дендритные клетки, которые обладают оптимизированной эндоцитарной активностью.
Другой вариант осуществления настоящего изобретения относится к вышеописанной фармацевтической композиции, при получении которой дендритные клетки культивируют ex vivo в питательной среде без цитокинов в начальной фазе роста и в среде, содержащей цитокины, во второй фазе роста до нагрузки дендритных клеток по меньшей мере одним антигеном рака яичка.
Так как необходимо получить множество СТ-антигенов, в частности больше пяти СТ-антигенов, еще один вариант осуществления настоящего изобретения относится к вышеописанной фармацевтической композиции, в которой по меньшей мере пять антигенов рака яичка получают из лизата цельных клеток по меньшей мере одной линии раковых клеток, не экспрессирующих линиеспецифических дифференцировочных антигенов или по существу не экспрессирующих линиеспецифических дифференцировочных антигенов. Лизат цельных клеток можно получить несколькими способами из таких клеток как опухолевые клетки и другие типы клеток, путем разрушения клеток, например, на протяжении нескольких циклов замораживания и оттаивания. В клеточном лизате, который содержит растворимое вещество, частицы обычно удаляют путем центрифугирования и/или фильтрации.
Один конкретный вариант осуществления настоящего изобретения относится к вышеописанной фармацевтической композиции, в которой линией раковых клеток является линия клеток меланомы, а линиеспецифическими дифференцировочными антигенами являются дифференцировочные антигены меланоцитов.
В другом варианте осуществления изобретения дифференцировочные антигены меланоцитов включают в себя gp100, Melan-A/Mart-1 и тирозиназу.
Дендритные клетки, культивируемые ex vivo согласно изобретению, могут быть оптимизированы в отношении эндоцитарной активности и экспрессии CD1a и успешно введены для представления антигенов в любую композицию или вакцину, предназначенную для использования в иммунотерапии. Таким образом, еще один вариант осуществления настоящего изобретения относится к применению аутологичных дендритных клеток в качестве антигенпредставляющих клеток в фармацевтической композиции или вакцине, в соответствии с которым указанные аутологичные дендритные клетки культивируют ex vivo в питательной среде без цитокинов в начальной фазе роста и в среде, содержащей цитокины, во второй фазе роста до нагрузки незрелых дендритных клеток по меньшей мере пятью антигенами рака яичка.
Можно использовать другие способы получения представляющих антигены дендритных клеток согласно изобретению, например слияние цельных клеток. В соответствии с указанным способом осуществляют слияние дендритных клеток с линиями клеток согласно изобретению.
В другом варианте осуществления изобретения антиген представляют при помощи экзосом. Экзосомы, являясь мелкими мембранными пузырьками эндоцитозного происхождения, которые секретируются большинством клеток в культуре, ранее были рассмотрены при описании антигенпредставляющих клеток и способны стимулировать иммунные реакции in vivo (Thery et al., 2002, Nature Reviews Immunology 2:569-579).
Еще один вариант осуществления настоящего изобретения относится к способу получения аутологичных дендритных клеток, нагруженных по меньшей мере пятью антигенами рака яичка и не содержащих линиеспецифических дифференцировочных антигенов или по существу не содержащих линиеспецифических дифференцировочных антигенов, который включает в себя нижеследующие стадии:
а) получение по меньшей мере одной линии раковых клеток, экспрессирующих по меньшей мере пять антигенов рака яичка и не экспрессирующих линиеспецифических дифференцировочных антигенов или по существу не экспрессирующих линиеспецифических дифференцировочных антигенов;
b) получение аутологичных дендритных клеток у указанного человека или животного;
с) культивирование указанных дендритных клеток ex vivo в питательной среде без цитокинов в начальной фазе роста и в среде, содержащей цитокины, во второй фазе роста;
d) нагрузку указанных дендритных клеток по пункту с) антигенами рака яичка, полученными из лизата цельных клеток по меньшей мере одной линии раковых клеток по пункту а).
Дендритные клетки могут созревать после выполнения стадии d) в результате добавления факторов созревания, таких, например, как IL-1β, IL-6, TNF-α и PGE2.
Другой вариант осуществления настоящего изобретения относится к фармацевтической композиции, получаемой в результате выполнения вышеуказанных стадий а)-d), с последующим выполнением стадии созревания.
При использовании известных методов получения дендритных клеток из популяций мононуклеарных клеток трудно получить хороший выход дендритных клеток. Средний выход дендритных клеток из исходной популяции мононуклеарных клеток в соответствии с данными, приведенными ранее в научной литературе, составляет примерно 5% (Marovitch et al., 2002, J. Infect. Dis. 186:1242-1252). Чтобы получить дендритные клетки в количестве 50 х 106, которое необходимо для одного полного цикла вакцинации, нужно иметь 109 мононуклеарных клеток.
Если предположить, что концентрация клеток в процессе поглощения обычно составляет 5 х 106/мл, такое количество клеток потребует 0,2 л среды на стадии адсорбции и такое же количество среды для последующего культивирования клеток. Для получения дендритных клеток потребуется примерно 60 мкг GM-CSF и 30 мкг IL-4 и такое же большое количество пластиковой посуды для культивирования ткани. В результате стоимость вакцины будет достаточно высокой. Кроме того, чтобы выделить 109 мононуклеарных клеток из крови, потребуется до 1 л крови, которую трудно получить в таком количестве у больного, даже если брать кровь в два приема со значительными промежутками времени между ними, принимая во внимание слабое здоровье указанного больного.
Одним возможным способом является использование лейкафереза, который позволяет выделить значительное число мононуклеарных клеток. Указанный способ часто используют для получения большого числа дендритных клеток (см., например, Thurner et al., 1999, J. Immunol. Methods 223: 1-15). Однако лейкаферез является достаточно длительной и дорогостоящей процедурой, что, в свою очередь, увеличивает общую стоимость производства вакцины. Кроме того, только одного больного можно подвергать лейкаферезу на одном оборудовании для лейкафереза. Это ограничит продуктивность способов изготовления.
Альтернативно можно повысить эффективность получения дендритных клеток из моноцитов. Например, Tuyaerts et al. 2002 (J. Immunol. Methods 264:135-152) описали адаптированный вариант указанного способа получения дендритных клеток в фирме Nunc Cell Factories и сообщили об увеличении выхода дендритных клеток до 40% от исходного количества моноцитов (или 13% от исходного количества мононуклеарных клеток, так как моноциты в среднем составляют третью часть мононуклеарных клеток). Однако полученные дендритные клетки не экспрессировали маркер CD1a, который может указывать на неполную дифференцировку. Так как экспрессия CD1a имеет важное значение для достижения целей настоящего изобретения, указанный способ нельзя использовать при осуществлении данного изобретения.
Поэтому авторы настоящего изобретения оптимизировали способ получения незрелых дендритных клеток из моноцитов крови, точно контролируя увеличение эффективности превращения моноцитов в дендритные клетки, а также образование полностью компетентных незрелых дендритных клеток. В качестве системы учета образования компетентных незрелых дендритных клеток авторы настоящего изобретения выбрали следующие критерии: высокая (более 50%) экспрессия маркера CD1a, отсутствие или низкая (менее 15%) экспрессия CD14 и низкая (менее 25%) экспрессия CD83.
Результаты оптимизации, представленные в приведенных ниже примерах, свидетельствуют о важности влияния отсроченного добавления цитокинов на экспрессию маркера CD1a.
Кроме того, исследования, выполненные авторами данного изобретения, показали, что выход незрелых дендритных клеток, полученных из моноцитов, при высокой экспрессии маркера CD1a можно довести примерно до 50%, контролируя исходную концентрацию моноцитов в засеваемой популяции мононуклеарных клеток.
Таким образом, другой объект настоящего изобретения относится к способу оптимизации выхода дендритных клеток, полученных из образца мононуклеарных клеток, в соответствии с которым плотность посева моноцитов составляет 5 х 106 - 20 х 106 клеток на 25 см2 в 6-8 мл среды. При использовании колбы Т25 исходное количество моноцитов составляет 5 х 106 - 20 х 106 клеток. В конкретном варианте осуществления изобретения плотность посева составляет 6 х 106 - 15 х 106 клеток на 25 см2, более конкретно - 8 х 106 - 12 х 106 клеток на 25 см2.
В конкретном варианте осуществления изобретения на стадии а) получают по меньшей мере две линии аллогенных клеток меланомы. Число линий аллогенных клеток зависит от числа приемлемых субклонов, выделенных и исследованных на отсутствие дифференцировочных антигенов меланоцитов. Чем больше линий клеток получено, тем выше вероятность того, что в лизате цельных клеток будет представлено несколько иммунодоминантных антигенов рака яичка. В одном варианте осуществления изобретения получают по меньшей мере пять СТ-антигенов по меньшей мере из двух линий аллогенных клеток. В конкретном варианте осуществления изобретения линии аллогенных клеток выбирают из DDM-1.7 (ECACC 01112339) или DDM-1.13 (ECACC 01112338) (обе линии клеток депонированы в европейской коллекции культур животных клеток, CAMR, GB-Salisbury, Wiltshire SP4 OJG, United Kingdom, 23 ноября 2001 г.).
Другим объектом данного изобретения являются указанные конкретные линии клеток, а также другие линии клеток, экспрессирующие по меньшей мере пять СТ-антигенов и не экспрессирующие дифференцировочных антигенов или по существу не экспрессирующие дифференцировочных антигенов. Таким образом, настоящее изобретение относится к выделенной линии клеток меланомы, экспрессирующих по меньшей мере пять антигенов рака яичка и не экспрессирующих дифференцировочных антигенов меланоцитов или по существу не экспрессирующих дифференцировочных антигенов меланоцитов, и, в частности, к выделенным линиям клеток DDM-1.7 (ECACC 01112339) или DDM-1.13 (ECACC 01112338). Настоящее изобретение относится также к фармацевтической композиции или способу согласно изобретению, в котором по меньшей мере одну линию клеток меланомы выбирают из линий аллогенных клеток DDM-1.7 (ECACC 01112339) или DDM-1.13 (ECACC 01112338).
Фармацевтическая композиция при введении человеку или животному должна вызывать иммунную реакцию у указанного человека или животного, которая стимулирует продуцирование цитотоксических Т-лимфоцитов у человека или животного, поэтому еще одним объектом данного изобретения является способ индукции иммунной реакции у человека или животного, подразумевающий следующие стадии:
а) получение по меньшей мере одной линии раковых клеток, экспрессирующих антигены рака яичка и не экспрессирующих линиеспецифических дифференцировочных антигенов или по существу не экспрессирующих линиеспецифических дифференцировочных антигенов;
b) получение аутологичных дендритных клеток у указанного человека или животного;
с) культивирование указанных дендритных клеток ex vivo в питательной среде без цитокинов в начальной фазе роста и в среде, содержащей цитокины, во второй фазе роста;
d) нагрузку указанных дендритных клеток по пункту с) антигенами рака яичка, полученными из лизата цельных клеток по меньшей мере одной линии раковых клеток по пункту а);
е) введение указанных нагруженных дендритных клеток по пункту d) указанному человеку или животному.
В конкретном варианте осуществления указанного способа линией раковых клеток является клеточная линия меланоцитов, и линиеспецифическими дифференцировочными антигенами являются дифференцировочные антигены меланоцитов.
В некоторых случаях трудно получить достаточное количество аутологичных дендритных клеток у нуждающегося в этом больного. В таком случае можно ввести вещества, индуцирующие мобилизацию CD14+-моноцитов до выполнения стадии b). Указанные вещества включают в себя G-CSF и/или GM-CSF.
Дендритные клетки-предшественники, CD14+-моноциты или CD34+-кетки, можно получить из пробы крови и периферической крови. Кроме того, можно, хотя и необязательно, начинать выполнение способа с использования клеток, полученных в результате афереза.
Кроме того, предполагается, что способ согласно изобретению далее включает в себя стадию введения человеку или животному вещества, индуцирующего активацию Т-лимфоцитов после выполнения стадии е). Для подобного введения используют, например, IL-2 или IL-12.
Настоящее изобретение относится также к применению средств, способных повышать уровень экспрессии антигенов рака яичка до получения лизата цельных клеток по меньшей мере одной линии клеток меланомы. Для влияния на уровень экспрессии некоторых яичкоспецифических генов предлагается производить метилирование ДНК. Установлено, что деметилирующий агент 5-аза-2'-дезоксицитидин (5azaCdR) может индуцировать экспрессию гена MAGE-A1 в MAGE-A1-отрицательных клетках меланомы (De Smet et al., 1996, Proc. Natl. Acad. Sci. U.S.A., v. 93, pp. 7149-7153; Weber et al., 1994, Cancer Res., v. 54, pp. 1766-1771)). 5azaCdR является аналогом цитозина, который действует в качестве уничтожающего субстрата для метилтрансферазы ДНК при введении CpG-динуклеотидов в ДНК на сайте-мишени для метилирования ДНК. Деметилирование в эукариотических клетках обычно вызывает повышенную экспрессию гена in vivo. Было сделано предположение, что активация MAGE-A1 происходит в результате деметилирования промоторной области вслед за общим процессом деметилирования, который происходит во многих опухолях. Активирующий эффект 5azaCdR на экспрессию генов был продемонстрирован для других членов семейства MAGE (Lucas et al., 1998, Cancer Res., v. 58, pp. 743-752; Lurquin et al., 1997, Genomics, v. 46, pp. 397-408), для семейств генов GAGE (De Backer et al., 1999, Cancer Res., v. 59, pp. 3157-3165; Li et al., 1996, Clin. Cancer Res., v. 2, pp. 1619-1625) и LAGE (Li et al., 1996, Clin. Cancer Res., v. 2, pp. 1619-1625). Роль деметилирования в экспрессии генов MAGE в опухолевых клетках подтверждается тем, что экспрессия многих других яичкоспецифических генов, присутствие которых не было обнаружено в опухолях, не повышалась в результате обработки 5azaCdR (De Smet et al., 1997, Biochem. Biophys. Res. Commun., v. 241, pp. 653-657), и среди генов MAGE-B экспрессия в опухоли была обнаружена только для тех генов, которые были активированы в результате обработки 5azaCdR (Lurquin et al., 1997, Genomics, v. 46, pp. 397-408). Кроме того, существует хорошая корреляция между деметилированием сайтов CpG в промоторной области гена MAGE-A1 и экспресией гена (De Smet et al., 1999, Mol. Cell. Biol., v. 19, pp. 7327-7335).
Поэтому в одном варианте осуществления изобретения экспрессию СТ-антигенов повышают деметилированием ДНК, кодирующей СТ-антигены. В частности, подобное деметилирование можно вызвать обработкой 5azaCdR. Другим способом повышения экспрессии СТ-антигена может служить ингибирование деацетилирования гистона. Два вышеуказанных типа обработки можно использовать отдельно или в сочетании. Такая обработка может быть произведена только в том случае, если антигены рака яичка остаются иммунодоминантными.
Многие СТ-антигены могут быть сгруппированы в подсемейства, содержащие несколько членов (см. таблицу 1). Такими подсемействами являются MAGE-А, MAGE-В, MAGE-С, GAGE, LAGE и SSX. Что касается других антигенов, то до настоящего времени обнаружен только один отдельный член. Указанными антигенами являются BAGE, SCP-1, TSP50, TRAG-3, SAGE, IL13R альфа, СТ9 и СТр11. В соответствии с целями настоящего изобретения все СТ-атигены можно считать потенциальными мишенями для иммунотерапии.
Одной из наиболее крупных групп СТ-антигенов является группа белков MAGE, содержащая три семейства, MAGE-A, MAGE-B и MAGE-C.
Гены MAGE-A образуют семейство из 15 близкородственных генов, расположенных на длинном плече Х-хромосомы (область Xq28) (Chomez et al., 2001, Cancer Res, v. 61, pp. 5544-5551; De Plaen et al., 1994, Immunogenetics, v. 40, pp. 360-369), в которое входит первый обнаруженный ген, кодирующий антиген MAGE-A1 (ранее обозначаемый как MAGE-1) (van der Bruggen et al., 1991, Science, v. 254, pp. 1643-1647). В большинстве исследованных опухолей была обнаружена только экспрессия генов MAGE-A1, -A2, -A3, -A4, -A6 и -А12. Недавно в нескольких опухолях была обнаружена экспрессия других генов MAGE-A, включая MAGE-A11 (Jurk et al., 1998, Int. J. Cancer, v. 75, pp. 762-766)), MAGE-A10 (Huang et al., 1999, J. Immunol, v. 162, pp. 6849-6854), MAGE-A5, MAGE-A8 и MAGE-A9 (Serrano et al., 1999, Int. J. Cancer, v. 83, pp. 664-669).
Способность представлять пептидные эпитопы, распознаваемые цитотоксическими Т-лимфоцитами (CTR), была продемонстрирована для MAGE-A1 (van der Bruggen et al., 1991, Science, v. 254, pp. 1643-1647), MAGE-A2 (Visseren et al., 1997, Int. J. Cancer, v. 73, pp. 125-130), MAGE-A3 (Gaugler et al., 1994, J. Exp. Med., v. 179, pp. 921-930), MAGE-A4 (Duffour et al., 1999, Eur. J. Immunol., v. 29, pp. 3329-3337), MAGE-A6 (Tanzarella et al., 1999, Cancer Res., v. 59, pp. 2668-2674), MAGE-A10 (Huang et al., 1999, J. Immunol., v. 162, pp. 6849-6854) и MAGE-A12 (Panelli et al., 2000, J. Immunol., v. 164, pp. 4382-4392). Т-кетки-хелперы могут также распознавать антигены MAGE, при этом были идентифицированы соответствующие эпитопы антигенов MAGE-A1 и MGE-A3 (Chaux et al., 1999, J. Exp. Med., v. 189, pp. 767-778; Chaux et al., 2001, Eur. J. Immunol., v. 31, pp. 1910-1916; Manici et al., 1999, J. Exp. Med., v. 189, pp. 871-876).
Экспрессия MAGE была обнаружена во многих типах злокачественных новообразований человека. Кожные меланомы характеризуются наибольшим уровнем экспрессии MAGE (до 65% для MAGE-A3) (De Plaen et al., 1994, Immunogenetics, v. 40, pp.360-369), в то время как глазные меланомы обычно не экспрессируют MAGE (Mulcahy et al., 1996, Int. J. Cancer, v. 66, pp. 738-742). В меньшей степени антигены MAGE экспрессированы в других типах опухолей, таких как карцинома молочной железы, опухоли головы и шеи, карцинома легкого, саркомы и карциномы мочевого пузыря (см., например, van Pel et al., 1995, Immunol. Rev., v. 145, pp. 229-250). Высокий уровень экспрессии MAGE-A1 (80%) обнаружен в злокачественных гепатомах (Yamashita et al., 1996, Hepatology, v. 24, pp. 1437-1440). MAGE-A4, в отличие от других антигенов MAGE-A, экспрессирован в значительной части лимфом, включая лимфомы Ходжкина, где экспрессия данного антигена ограничена клетками Рида-Стернберга (Chambost et al., 2000, Blood, v. 95, pp. 3530-3533). Если образец опухоли является положительным в отношении MAGE-A4, уровень экспрессии указанного гена обычно очень высок.
Гены MAGE-B образуют семейство из 17 генов, расположенных в областях р21.3 и р22 Х-хромосомы, причем 8 из указанных генов являются псевдогенами (Chomez et al., 2001, Cancer Res., v. 61, pp. 5544-5551; Lucas et al., 2000, Int. J. Cancer, v. 87, pp. 55-60; Lurquin et al., 1997, Genomics, v. 46, pp. 397-408). Только два гена, MAGE-B1 и MAGE-B2, экспрессированы в значительной части опухолей разных гистологических типов. Экспрессия MAGE-B5 и MAGE-B6 обнаружена в ограниченном количестве образцов опухолей (Lucas et al., 2000, Int. J. Cancer, v. 87, pp. 55-60).
Семь членов семейства MAGE-C расположено в области Xq26-q27. Ген MAGE-C1 был обнаружен в результате анализа избирательной экспрессии генов в яичке и меланомах (Lucas et al., 1998, Cancer Res., v. 58, pp. 743-752). Характер экспрессии указанного гена сильно напоминает таковой генов MAGE-A. Еще один ген СТ7 (Chen et al., 1998, Proc. Natl. Acad. Sci. U.S.A., v. 95, pp. 6919-6923), вероятно, является другим аллелем MAGE-C1. MAGE-C2/CT10 расположен в области Xq27, но, в отличие от MAGE-C1, этот белок не имеет повторяющейся части. Третий и четвертый члены, MAGE-C3 и MAGE-C4, были обнаружены в результате поиска в базе данных (Chomez et al., 2001, Cancer Res., v. 61, pp. 5544-5551; Lucas et al., 2000, Int. J. Cancer, v. 87, pp. 55-60).
В научной литературе было описано несколько белков, отличных от MAGE, с характеристиками антигенов рака яичка. Одним из указанных белков является антиген BAGE (Boel et al., 1995, Immunity, v. 2, pp, 167-175). Характер экспрессии указанного антигена в образцах опухолей весьма схож с таковым антигенов MAGE при меньшей суммарной частоте экспрессии (22% в меланомах, 15% в карциномах мочевого пузыря, 10% в карциномах молочной железы и 8% в плоскоклеточном раке головы и шеи). Что касается антигенов MAGE, экспрессия BAGE согласуется со стадией развития опухоли. CTL может распознавать антиген BAGE, при этом обнаружены пептидные эпитопы для данного антигена.
Дополнительный антиген был обнаружен в виде HLA-Cw6-рстрицированного эпитопа, кодируемого геном GAGE-1 (Van den Eynde et al., 1995, J. Exp. Med., v. 182, pp. 689-698). Этот ген относится к большому семейству генов, включающему в себя гены GAGE-1 - GAGE-8 (Chen et al., 1998, J. Biol. Chem., v. 273, pp. 17618-17625; De Backer et al., 1999, Cancer Res., v. 59, pp. 3157-3165; Van den Eynde et al., 1995, J. Exp. Med., v. 182, pp. 689-698), гены PAGE-1 - PAGE-4 (Brinkmann et al., 1998, Proc. Natl. Acad. Sci. U.S.A., v. 95, pp. 10757-10762; Chen et al., 1998, J. Biol. Chem., v. 273, pp. 17618-17625) и гены XAGE-1 - XAGE-3 (Bringkmann et al., 1999, Cancer Res., v. 59, pp. 1445-1448). Два гена семейства GAGE, кодирующие белок, GAGE-1 и GAGE-2, экспрессированы в значительной части меланом (24%), сарком (25%), немелкоклеточного рака легкого (19%), опухолей головы и шеи (19%) и опухолей мочевого пузыря (12%).
Несколько СТ-антигенов были недавно обнаружены методом SEREX (клонирование методом серологической экспрессии библиотек рекомбинантной кДНК опухолей человека) (Sahin et al., 1995, Proc, Natl. Acad. Sci. U.S.A., v. 92, pp. 11810-11813). Один из указанных антигенов, NY-ESI01, кодированный геном CTAG (Chen et al., 1997, Cytogenet. Cell Genet., v. 79, pp. 237-240), был экспрессирован в 23 из 67 образцов меланомы, в 10 из 33 злокачественных опухолей молочной железы, в 4 из 16 злокачественных опухолей предстательной железы, в 4 из 5 злокачественных опухолей мочевого пузыря, а также в части опухолей других типов, но только в 2 из 11 культивированных линий клеток меланомы (Chen et al., 1997, Proc. Natl. Acad. Sci. U.S.A., v. 94, pp. 1914-1918). У больного с меланомой реакция CTL была ограничена HLA-A2, при этом были обнаружены три пептида, распознанные меланомоспецифической линией CTL. Было также установлено, что данный антиген индуцирует HLA-A31-рестриктированную реакцию CTL у одного больного с меланомой (Wang et al., 1998, J. Immunol., v. 161, pp. 3596-3606). Кроме того, была описана рестрикция МНС класса II Т-лимфоцитами CD4+ при обнаружении трех пептидных эпитопов (Jager et al., 2000, J. Exp. Med., v. 191, pp. 625-630). Недавно в научной литературе был описан ген, гомологичный CTAG. Данный ген LAGE-1 (Lethe et al., 1998, Int. J. Cancer, v. 76, pp. 903-908) распространен в разных опухолях подобно NY-ESO-1. Оба гена находятся в полосе q28 Х-хромосомы рядом с генами MAGE (Lethe et al., 1998, Int. J. Cancer., v. 76, pp. 903-908). NY-ESO-1 является одним из наиболее иммуногенных опухолевых антигенов, обнаруженных до настоящего времени.
В соответствии с другим вариантом осуществления настоящего изобретения, антигены рака яичка являются антигенами, выбранными из подсемейств MAGE-A, MAGE-B, MAGE-C, GAGE, LAGE, SSX.
В конкретном варианте осуществления изобретения СТ-антигены являются антигенами, выбранными из MAGE-А1, MAGE-А2, MAGE-А3, MAGE-А4, MAGE-А5, MAGE-А6, MAGE-А8, MAGE-А9, MAGE-А10, MAGE-А11, MAGE-А12, MAGE-В1, MAGE-В2, MAGE-В3, MAGE-В4, MAGE-В5, MAGE-В6, MAGE-В10, MAGE-В16, MAGE-В17, MAGE-С1, MAGE-С2, MAGE-С3, MAGE-С4, BAGE, GAGE-1, GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE-7, GAGE-8, NY-ESO-1, LAGE, PAGE-1, PAGE-2, PAGE-3, PAGE-4, XAGE-1, XAGE-2, XAGE-3, SSX-1, SSX-2, SSX-3, SSX-4, SSX-5. И в другом конкретном варианте осуществления изобретения СТ-антигены являются антигенами, выбранными из SCP-1, TSP-50, TRAG-3, SAGE, IL-13R альфа, СТр11.
В еще одном конкретном варианте осуществления изобретения СТ-антигены являются антигенами, выбранными из MAGE-А1, MAGE-А3, MAGE-А4, MAGE-А6, MAGE-А10, MAGE-А12 и NY-ESO-1.
Указанные антигены являются антигенами, которые считаются особенно пригодными для применения в настоящем изобретении, однако можно использовать и другие антигены, не указанные в данном описании, если они включают в себя множество антигенов рака яичка, в частности по меньшей мере пять, более конкретно, по меньшей мере 6 и еще конкретнее, по меньшей мере семь СТ-атигенов.
Другой вариант осуществления настоящего изобретения относится к применению вышеуказанной композиции в качестве иммунотерапевтической вакцины для лечения рака.
Одним условием применения композиций или вакцин на основе клеток меланомы является наличие у хозяина злокачественного новообразования на поздних стадиях развития. Другим условием может быть наличие первичной опухоли, и в данном случае целью лечения является не только индукция отторжения первичной опухоли, но и предотвращение развития метастазов, так как группа СТ-антигенов преимущественно экспрессирована в метастазах. Еще одним условием может быть удаление первичной опухоли или опухоли с метастазами другими методами (хирургическая операция, облучение), и в данном случае целью лечения является предотвращение повторного возникновения опухоли.
Опухоли, экспрессирующие несколько СТ-антигенов, могут быть отторгнуты или ограничены в росте с большей степенью вероятности, чем опухоли, не имеющие или имеющие только один СТ-атиген. Поэтому определение экспрессии СТ-антигенов при биопсии опухоли может иметь важное значение для прогнозирования эффективности применения универсальной вакцины на основе клеток меланомы.
ПРИМЕРЫ
Настоящее изобретение далее будет проиллюстрировано несколькими примерами, не ограничивающими объем изобретения.
Пример 1
Выделение клонов с отсутствием дифференцировочных антигенов меланоцитов из линии клеток меланомы DDM-1
Линии клеток меланомы DDM-1 получены у больного с длительным периодом ремиссии. Клетки меланомы DDM-1 клонировали, исследовали 8 клонов и обнаружили, что в них отсутствует экспрессия тирозиназы. Тирозиназа является одним из известных дифференцировочных антигенов меланоцитов. Указанные клоны (DDM-1.5, DDM-1.6, DDM-1.7, DDM-1.10, DDM-1.11, DDM-1.13, DDM-1.24 и DDM-1.25) далее испытывали в отношении экспрессии двух иммунодоминантных дифференцировочных антигенов меланоцитов, gp100 и Melan-A/MART-1.
Клетки меланомы культивировали в колбах для культивирования тканей Т75 (Nunc) в 20 мл среды RPMI 1640 (BioWhittaker), содержащей 10% фетальной телячьей сыворотки. Для использования в экспериментах по индукции иммунной реакции против дендритных клеток, нагруженных клеточным лизатом меланомы, рост клеток был адаптирован к среде, содержащей 2% сыворотки человека (HuS). Клетки собирали, для чего среду удаляли из колбы для культивирования, добавляли 5 мл 0,02% EDTA в физиологическом растворе с фосфатным буфером (PBS) без Са, Mg (BioWhittaker), инкубировали в СО2 -инкубаторе в течение 10-20 минут, добавляли 10 мл PBS и переносили отделенные клетки в центрифужную пробирку. Клетки центрифугировали с ускорением 200 g в течение 5 минут, супернатант сливали, осадок вновь суспендировали в культуральной среде, производили подсчет клеток и 1,5 х 106 клеток помещали в колбу Т75 в 20 мл культуральной среды.
Экспрессию антигенов gp100 и Melan-A/MART-1 определяли с учетом чувствительности клеток меланомы к лизису, индуцированному клонами цитотоксических Т-лимфоцитов (CTL) против указанных антигенов. В научной литературе ранее были описаны свойства указанных клонов CTL (Kirkin et al., 1999, Cancer Immunol. Immunother., v. 48, pp. 239-246). Клетки меланомы собирали вышеописанным способом, вновь суспендировали в культуральной среде, подсчитывали и 0,5 х 106 клеток каждого клона переносили в 11 мл коническую пробирку (Nunc). Клетки центрифугировали с ускорением 200 g в течение 5 минут, супернатант сливали, и осадок вновь суспендировали в 0,1 мл культуральной среды. Добавляли 0,1 мл раствора Na2CrO4 (0,1 мCi, Amersham) и клетки инкубировали на водяной бане при 37°С в течение 60 минут. Клетки трижды промывали средой RPMI-1640, и клетки-мишени доводили до концентрации 5 х 104 клеток/мл в среде RPMI-1640, содержащей 10% FCS. Цитотоксические лимфоциты использовали в концентрации 5 х 105 клеток/мл. CTL и клетки-мишены меланомы высевали в 100 мкл аликвотах в виде трех одинаковых образцов в 96-луночные титрационные микропланшеты с U-образными лунками (Nunc), центрифугировали с ускорением 200 g в течение 2 минут и инкубировали при 37°С в 5% СО2. Через 4 часа планшеты центрифугировали с ускорением 250 g в течение 3 минут, собирали 100 мкл супернатанта и определяли радиоактивность (Cobra 5005, Packard Instruments, Meriden, Conn., USA). Показатели специфического лизиса высчитывали по стандартной формуле. Результаты одного типичного эксперимента приведены на фигуре 1. Из полученных результатов следует, что только два из исследованных клонов меланомы, DDM-1.7 и DDM-1.13, полностью устойчивы к литическому воздействию CTL, что свидетельствует о возможном прекращении экспрессии указанных дифференцировочных антигенов меланоцитов в данных клонах меланомы.
Чтобы получить дополнительные доказательства утраты экспрессии данного антигена, авторы настоящего изобретения выполнили анализ экспрессии РНК, кодирующей указанные белки, методом RT-PCR. Центрифугировали 2 х 106 клеток, супернатант сливали, а осадок солюбилизировали в 0,3 мл раствора для лизиса клеток (набор для выделения РНК PurescriptR, Gentra). РНК выделяли в соответствии с инструкциями изготовителя, осаждали, добавляя два объема 100% изопропанола в раствор для лизиса, промывали 70% этанолом и повторно гидрировали в 10 мкл дистиллированной воды без РНКазы. Выделенную РНК обрабатывали ДНКазой для разрушения следовых количеств ДНК в препарате. Для этой цели использовали реагенты из набора DNA-free™ (Ambion). К образцу добавляли 1 мкл 10-кратного объема буфера, содержащего ДНКазу, и 1 мкл ДНКазы (2 ед.), смесь инкубировали в течение 30 минут при 37°С и реакцию прекращали, добавляя 1,2 мкл реагента для инактивации ДНКазы. кДНК синтезировали методом обратной транскрипции в 20 мкл общего объема, используя 10 мкл РНК. Для этой цели использовали обратную транскриптазу Super Script II, активированную затравкой олиго(dT) (Gibco DRL), в соответствии с инструкцией изготовителя. Инкубацию производили при 42°С в течение 30 минут, затем при 45°С в течение 30 минут и при 72°С в течение 2 минут. Для амплификации методом PCR использовали 1 мкл кДНК, которая находилась в однократном объеме буфера для PCR: 50 мМ KCl, 10 мМ трис/HCl (рН 9,0), 1,5 мМ MgCl2, 0,2 мМ крезола, 12% сахарозы, 0,005% альбумина бычьей сыворотки, 2,5 пМ каждой затравки, 40 мкМ dNTP (Pharmacia LKB) и 1,25 ед. (1 мкл) полимеразы AmpliTaq (Perkin-Elmer). Затравки выбирали таким образом, чтобы продукт амплификации можно было эффективно накапливать в одинаковых условиях реакции, что позволяет сравнить экспрессию в опухолевых клетках ряда выбранных антигенов в процессе одновременно выполняемых реакций. Последовательности затравок, использованных в данных экспериментах и в описанных ниже экспериментах, приведены в таблице 2. Во всех реакциях был использован метод "горячего запуска", в соответствии с которым в реакционную пробирку добавляют Taq-полимеразу и dNTP при 80°С между стадиями денатурации и отжига первого цикла. Амплификацию производили на протяжении 30-38 циклов (94°С в течение 30 секунд, 60°С в течение 30 секунд и 72°С в течение 40 секунд) с последующей обработкой при 72°С в течение 10 минут и охлаждением до 4°С. Амплификацию выполняли в системе 9600 GeneAmp PCR фирмы Perkin-Elmer. Отрицательные контрольные образцы содержали аликвоты воды вместо кДНК. GAPDH амплифицировали в виде положительного контрольного образца для осуществления реакции и оценки интенсивности экспрессии антигенов по сравнению с указанным обязательным геном. Отрицательные результаты были получены по меньшей мере дважды при использовании большего числа циклов. Продукты амплификации отделяли при электрофорезе в 2% агарозном геле при 100 В, окрашивали бромидом этидия, визуализировали в УФ-свете и регистрировали при помощи системы регистрации изображений. При выполнении полуколичественного метода RT-PCR число циклов было уменьшено до 22, что гарантировало линейное увеличение количества выбранных последовательностей в зависимости от числа циклов амплификации. Реакцию PCR выполняли при 3- или 5-кратных разведениях матричной кДНК. Интенсивность полос полученного продукта после отделения электрофорезом исследовали путем анализа изображений, нормализовали с учетом интенсивности полученного продукта GAPDH при использовании аналогичной матрицы и тех же разведений и сравнивали уровень соответствующих транскриптов РНК в разных линиях клеток.
Результаты определения экспрессии дифференцировочных антигенов меланоцитов gp100 и MART-1 в 3-х клонах клеток меланомы, DDM-1.7, DDM-1.13 и DDM-1.29, показанные на фигуре 2, ясно показывают, что уровень транскриптов РНК в клонах клеток меланомы DDM-1.7 и DDM-1.13, выращенных в 10% FCS, гораздо ниже, чем в клетках DDM-1.29, и интенсивность полос соответствующих продуктов уменьшается при серийных разведениях матричной кДНК гораздо быстрее для DDM-1.7 и DDM-1.13 по сравнению с DDM-1.29. В соответствии с результатами полуколичественного метода RT-PCR и после нормализации данных с учетом уровня транскрипции обязательного GAPDH уровень транскриптов РНК антигенов меланоцитов в DDM-1.7, DDM-1.13 составлял менее 1% соответствующего уровня в DDM-1.29. После адаптации клеток к росту в 2% сыворотке человека наблюдалось небольшое увеличение экспрессии дифференцировочных антигенов меланоцитов (не показано) по результатам RT-PCR, которое не превышало 1% соответствующего уровня в DDM-1.29.
Экспрессию gp100 в клетках, адаптированных к росту в 2% сыворотке человека, исследовали также методом иммунного окрашивания. Для этого клетки культивировали на покровных стеклах, помещенных в чашки Петри. Клетки промывали холодным PBS и фиксировали охлаждаемой льдом смесью метанол-ацетон (1:1) в течение 15 минут. После сушки покровные стекла инкубировали в PBS в течение 1 минуты и окрашивали стандартным методом, известным в данной области, с использованием в качестве первого антитела смеси антител НМВ45 и НМВ50 (NeoMarkers), в качестве вторых антител - биотинилированные антитела овцы против Ig мыши (Amersham), и в качестве третьего реагента - стрептавидин-Техас красный (Amersham). Как показано на фигуре 3, окрашивание отсутствовало в клетках DDM-1.7 по сравнению с интенсивным окрашиванием, обнаруженным в клетках DDM-1.29. Визуализация большого числа клеток показала, что очень небольшая популяция клеток (менее 1%) была положительной в культуре DDM-1.7 (не показано). В клетках DDM-1.13, выращенных в аналогичных условиях, около 1% клеток было положительно окрашено в отношении gp100 (не показано).
Чтобы определить уровни экспрессии антигенов MAGE-A и NY-ESO-1, авторы настоящего изобретения выполнили реакции RT-PCR, используя затравки для указанных антигенов (последовательности затравок приведены в таблице 2). Результаты сравнения экспрессии мРНК, кодирующей белки MAGE-А1, MAGE-А3, MAGE-А4, MAGE-А6, MAGE-А10, MAGE-А12 и NY-ESO-1, приведены на фигуре 4. DDM-1.29 экспрессирует все испытанные антигены, в то время как DDM-1.7 и DDM-1.13 экспрессируют только 4-5 указанных антигенов.
Известно, что экспрессия СТ-антигенов увеличивается при обработке клеток ДНК-деметилирующим агентом 5-аза-2'-дезоксицитидином. Авторы настоящего изобретения исследовали, можно ли повысить экспрессию белков MAGE-A и NY-ESO-1 в клоне клеток меланомы DDM-1.13 путем такой обработки. Клетки высевали в колбы для культивирования Т25 и через 24 часа добавляли 5-аза-2'-дезоксицитидин в конечной концентрации 1 мкМ. Клетки инкубировали в течение 3 дней, затем среду меняли и продолжали инкубацию еще 2 дня, после чего клетки собирали вышеописанным способом. Экспрессию антигенов определяли так, как было описано выше, при этом результаты, приведенные на фигуре 5, показывают, что после обработки клеток 5-аза-2'-дезоксицитидином увеличилась экспрессия всех испытанных СТ-антигенов.
Пример 2
Получение дендритных клеток с повышенной способностью представлять экзогенные белки
Уникальным свойством дендритных клеток является их способность представлять экзогенные белки для распознавания CD8+ CTL. Максимальная способность поглощать экзогенные белки относится к незрелой стадии дифференцировки ДК. Однако в научной литературе отсутствуют данные о прямой взаимосвязи между фагоцитарной активностью ДК и их способностью представлять поглощенные антигены для распознавания цитотоксическими Т-лимфоцитами (CTL) против указанных антигенов. Поэтому авторы настоящего изобретения выполнили исследования, целью которых является а) оптимизация получения незрелых дендритных клеток с высокой способностью поглощения экзогенных белков и b) выявление корреляции между фагоцитарной активностью дендритных клеток и их способностью представлять антигены из экзогенно вводимого клеточного лизата меланомы.
В первой серии экспериментов авторы настоящего изобретения оптимизировали получение фагоцитарных дендритных клеток путем изменения времени добавления лимфокина и использования TGF-бета 1, который, как было установлено, улучшает образование дендритных клеток из моноцитов периферической крови (Yang et al., 1999, J. Immunol., v. 163, pp. 1737-1741). Дендритные клетки обычно получали из 50 мл периферической крови доноров с положительной реакцией на HLA-A2, содержащей 25 МЕ/мл гепарина. Кровь распределяли в две 50 мл пробирки, содержащие 12,5 мл PBS без Са, Mg (далее именуемый PBS), и помещали в устройство Lymphoprep (12,5 мл в двух 50 мл пробирках). После центрифугирования (800 g, 25 минут) шприцем отбирали 10 мл верхнего слоя, пропускали через 0,2 мкм фильтр и использовали в качестве источника плазмы. Мононуклеарные клетки собирали из межфазного слоя, разводили по меньшей мере в два раза PBS и центрифугировали 6 раз, сначала при 650 g в течение 10 минут, затем при 450 g в течение 7 минут и, наконец, при 250 g в течение 5 минут. После каждого центрифугирования супернатант сливали и осадок вновь суспендировали в 5 мл PBS до полного исчезновения агрегатов клеток. Пробирку доверху заполняли свежим PBS и производили повторное центрифугирование. После последнего центрифугирования осадок вновь суспендировали в 5 мл адгезионной среды, содержащей среду RPMI 1640 с добавлением 2% плазмы, производили подсчет клеток и доводили концентрацию клеток до 5 х 106/мл. 3 мл клеточной взвеси помещали в лунки 6-луночного планшета (Falcon, без обработки ТС), заполнив в общей сложности 4 лунки, и инкубировали в СО2-инкубаторе в течение 1,5 часов. После инкубации неадгерентные клетки собирали и монослой прикрепившихся клеток дважды промывали теплой средой RPMI 1640 и 3 мл культуральной среды, содержащей среду RPMI с добавлением 1% плазмы (среда ДК). В две лунки добавляли рекомбинантный GM-CSF и IL-4 человека в концентрации 1000 ед/мл (культуры 1 и 3). После инкубации в течение ночи среду полностью заменяли в двух лунках (культуры 2 и 4). Для этого среду собирали в одну центрифужную пробирку и в каждую лунку добавляли 2,5 мл новой предварительно нагретой среды ДК. Собранные клетки центрифугировали (с ускорением 250 g, 5 минут), супернатант сливали, осадок вновь суспендировали в 1 мл предварительно нагретой среды ДК, и 0,5 мл клеточной взвеси вводили в культуры 2 и 4. К культурам 3 и 4 добавляли TGF-бета 1 в конечной концентрации, равной 100 нг/мл.
Еще через 5 дней определяли фагоцитарную активность полученных дендритных клеток. Среду RPMI 1640, содержащую 10% FCS (фетальная телячья сыворотка), вводили на 30-60 минут в несколько лунок 96-луночного планшета с плоским основанием, не обработанного ТС (Falcon), и в центрифужные пробирки. 0,5 мл каждой культуры ДК переносили в предварительно обработанные центрифужные пробирки и после центрифугирования (с ускорением 200 g, 5 минут) супернатант сливали, а осадки вновь суспендировали в 0,5 мл среды для ДК. Среду удаляли из лунок 96-луночного планшета и в лунки добавляли 0,2 мл каждой клеточной взвеси, используя по две лунки для культуры каждого типа. В каждую пробирку добавляли 10 мкл исходного раствора FluoSpheres и планшет помещали в СО2-инкубатор. Через 4 часа культуры собирали в центрифужные пробирки, предварительно обработанные вышеописанным способом, и дважды промывали, центрифугируя при 200 g в течение 5 минут в среде RPMI 1640 с 10% FCS, после чего осадки вновь суспендировали в 25 мкл среды RPMI. Пробирки ставили на лед. Клеточную взвесь в количестве 5 мкл помещали на предметные стекла, которые устанавливали во влажную камеру (обычно использовали большие чашки Петри с увлажненной бумагой) и инкубировали 10-15 минут в СО2-инкубаторе. Затем каплю клеточной взвеси накрывали 13 мм покровным стеклом и исследовали клетки под флуоресцентным микроскопом. Изображения, полученные при помощи цифровой камеры Leica DC100, переносили в компьютер и хранили в файлах точечной графики.
Результаты одного эксперимента по определению фагоцитарной активности дендритных клеток, полученных в исследованных условиях, приведены на фигуре 6. Полученные результаты показывают, что добавление GM-CSF и IL-4 на следующий день после начала культивирования, вместе с заменой всей среды, имеет существенные преимущества по сравнению с культурами, в которые GM-CSF и IL-4 добавляли в начале культивирования. Следует отметить, что в большинстве научных работ, в которых описано получение дендритных клеток, предназначенных для иммунизации в сочетании с лизатами опухолевых клеток, лимфокины добавляют в начале культивирования (см., например, Chakraborty et al., 1998, Cancer Immunol. Immunother., v. 47, pp. 58-64; Nestle et al., 1998, Nature Med., v. 4, pp. 328-332).
Результаты, приведенные на фигуре 6, также показывают, что TGF-бета 1, использованный исследователями в качестве дополнительного лимфокина в процессе получения дендритных клеток (Yang et al., 1999, J. Immunol., v. 163, pp. 1737-1741), не оказывает усиливающего действия на фагоцитарную активность дендритных клеток и фактически уменьшает фагоцитарную активность в ряде экспериментов (не показано).
Способность представлять антигенные пептиды из экзогенно добавляемых белков была исследована с использованием модели распознавания дендритных клеток, нагруженных лизатом клеток DDM-1.29 с высокими уровнями экспрессии дифференцировочного антигена меланоцитов gp100, gp100-специфическими CTL, которая была создана авторами настоящего изобретения (Kirkin et al., 1999, Cancer Immunol. Immunother., v. 48, pp. 239-246) и использована в примере 1 для обнаружения экспрессии данного антигена в других клонах клеток меланомы.
Лизат клеток DDM-1.29 получали в соответствии с приведенным выше описанием. Клетки меланомы культивировали аналогично примеру 1, дважды промывали PBS и вновь суспендировали в среде RPMI 1640 (Gibco) в количестве 107 клеток/мл. Клетки подвергали пяти циклам замораживания (жидкий азот) - оттаивания, 15 минут обрабатывали ультразвуком в ванне для ультразвуковой обработки (Metason 200, Struer), центрифугировали сначала с ускорением 800 g в течение 15 минут при 4°С, затем с ускорением 13000 g в течение 60 минут при 4°С. Супернатант собирали, фильтровали через 0,2 мкм фильтр и определяли концентрацию белка, используя реагент для анализа белка при помощи бицинхониновой кислоты (Pierce) в соответствии с инструкцией изготовителя. Концентрация белка была заключена в диапазоне 3,5-5 мг/мл. Аликвоты супернатанта хранили замороженными при -80°С.
Для нагрузки дендритных клеток опухолевым лизатом разные культуры дендритных клеток переносили в центрифужные пробирки, центрифугировали, супернатанты сливали, осадки вновь суспендировали в 2 мл среды для ДК, производили подсчет клеток и разводили клеточную взвесь до 5 х 105/мл. Клеточную взвесь в количестве 1,8 мл помещали в лунку 24-луночного планшета Falcon, не обработанного ТС, и добавляли 0,2 мл опухолевого лизата вместе с GM-CSF и IL-4 (1000 ед./мл каждого). После инкубации в течение ночи добавляли 20 нг/мл TNF-альфа. Культуры инкубировали еще 24 часа и собирали интенсивным пипетированием, переносили в предварительно обработанные центрифужные пробирки, центрифугировали при 200 g в течение 5 минут супернатанты сливали и осадки вновь суспендировали в 2 мл среды для ДК. После подсчета клеток клеточную взвесь разводили до 3 х 105 клеток/мл и 1 мл клеточной взвеси вводили в лунки 24-луночного планшета, обработанного ТС (Nunc), используя по две лунки для каждого типа культуры дендритных клеток. В одну из лунок добавляли 1 мл среды и в другую лунку добавляли 1 мл суспензии CTL (106/мл). Культуры инкубировали в течение 24 часов, после чего 1 мл супернатанта переносили в пробирку Эппендорфа, центрифугировали, супернатант переносили в другую пробирку Эппендорфа и анализировали количество полученного гамма-интерферона (IFN-γ) методом ELISA. Планшеты Immunoplate MaxiSorp (Nunc) покрывали 100 мкл очищенного моноклонального антитела против IFN-γ человека (Endogen), разводили до 2 мкг/мл в буфере для нанесения покрытия (PBS, рН 7,4) и инкубировали в течение ночи при комнатной температуре. Покрывающий раствор удаляли, добавляли 200 мкл блокирующего раствора (4% BSA в PBS) и инкубировали в течение 1 часа при комнатной температуре. Планшеты четыре раза промывали PBS, содержащим 0,05% твин-20 (промывочный буфер), и получали по два одинаковых образца, добавляя 50 мкл двукратно разбавленного эталона (рекомбинантный IFN-γ, Endogen) в культуральной среде в количестве от 15 до 1000 пг/мл. Собранные супернатанты центрифугировали с ускорением 3000 g в течение 5 минут и в трех копиях наносили 50 мкл образцы и два двукратно разбавленных эталона. Планшеты инкубировали в течение ночи при 4°С. Не промывая планшет, добавляли 50 мкл меченного биотином детектирующего антитела (меченное биотином антитело против IFN-γ, Endogen), разведенного до 0,5 мкг/мл в блокирующем растворе, и продолжали инкубацию в течение 2 часов при комнатной температуре. После четырехкратной промывки промывочным буфером добавляли 100 мкл/лунку HRP-конъюгированного стрептавидина (Genzyme), разведенного в отношении 1:1000 в блокирующем буфере, и планшеты инкубировали в течение 1 часа при комнатной температуре. Затем планшеты четыре раза промывали промывочным буфером и блоттировали на бумажной салфетке. В каждую лунку добавляли 100 мкл раствора субстрата (5 мг OPD растворяли в 11 мл цитратного буфера и добавляли 5 мкл пероксида водорода). Взаимодействие, происходившее в течение 15-40 минут при комнатной температуре, останавливали, добавляя 50 мкл 10% серной кислоты. Дифференциальную оптическую плотность измеряли при помощи спектрофотометра для прочтения планшетов методом ELISA в виде разности между значениями при 490 и 650 нм. Из полученных значений вычитывали контрольные значения, полученные при добавлении только среды для клеток вместо IFN-γ, и определяли концентрацию высвободившегося в эксперименте IFN-γ, которую выражали в пг/мл при помощи калибровочной кривой для IFN-γ, построенной на основании результатов аналогичного эксперимента.
На фигуре 7 приведены данные, полученные в одном из указанных экспериментов. Из приведенных данных следует, что максимальное специфическое продуцирование IFN-γ, представляющее собой разность между продуцированием IFN-γ в присутствии нагруженных лизатом дендритных клеток и "пустых" дендритных клеток, является максимальным для культур дендритных клеток 1 и 3, которые характеризуются максимальной фагоцитарной активностью.
Суммируя вышеизложенное, можно отметить, что способность дендритных клеток специфически стимулировать CTL антигенами, поглощенными из лизата опухолевых клеток, находится в соответствии с фагоцитарной активностью дендритных клеток, не зависит от присутствия TNF-α во время дифференцировки ДК и является максимальной в культурах ДК, в которых добавление GM-CSF и IL-4 было отсрочено на 1 день и сопровождалось заменой полной среды.
Пример 3
Образование цитотоксических Т-лимфоцитов с широким спектром противоопухолевой активности после стимуляции лимфоцитов периферической крови здоровых доноров аутологичными дендритными клетками, нагруженными лизатом, выделенным из клеток меланомы
Способность дендритных клеток, нагруженных лизатом клеток меланомы, стимулировать образование цитотоксических Т-лимфоцитов против опухолевых антигенов испытывали in vitro в смешанной культуре лимфоцитов и дендритных клеток. Дендритные клетки были получены из периферической крови здоровых доноров с положительной реакцией на HLA-А2 аналогично примеру 2. После начальной стадии адсорбции моноцитов неадсорбированные лимфоциты собирали и замораживали в аутологичной плазме с 10% ДМСО для последующего использования. Дендритные клетки, нагруженные опухолевым лизатом, собирали, облучали (6000 рад), промывали, повторно суспендировали в среде X-VIVO 15, содержащей 1% аутологичной плазмы (полная среда) в количестве 3 х 105/мл и вводили в пять лунок 24-луночных планшетов по 1 мл в каждую лунку. Остальные дендритные клетки замораживали в собранной человеческой сыворотке, содержащей 10% ДМСО. Замороженные аутологичные неадгерентные лимфоциты оттаивали, промывали один раз, подсчитывали и 15 х 106 клеток вновь суспендировали после дополнительной промывки в 5 мл полной среды, содержащей IL-7 (20 нг/мл) и IL-12 (100 пг/мл). В лунки с дендритными клетками добавляли 1 мл взвеси лимфоцитов. Через 7 дней удаляли 1 мл среды и добавляли 1 мл свежей среды, содержащей IL-7 (20 нг/мл). Через 5 дней клетки собирали, живые клетки отделяли в устройстве Lymphoprep (Nycomed, Norway), промывали и повторно суспендировали в полной среде в количестве 1,5 х 106/мл. В лунки 24-луночных планшетов вводили 1 мл взвеси лимфоцитов. Замороженные облученные дендритные клетки, нагруженные лизатом, подвергали оттаиванию, промывали один раз, повторно суспендировали в полной среде в количестве 105/мл и 1 мл добавляли в лунки с лимфоцитами. Через 2 дня удаляли 1 мл среды и добавляли 1 мл свежей среды, содержащей IL-2 (20 МЕ/мл). Процедуру повторной стимуляции повторяли каждую неделю по 2-4 раза для каждой культуры.
Литическую активность лимфоцитов определяли после 3-5 циклов стимуляции. В указанный период времени пролиферирующие лимфоциты образуют почти чистую популяцию CD3-положительных клеток с увеличивающейся после каждой повторной стимуляции долей CD8+-кеток, которая достигает 70-90% в течение одной недели после 4-5-го цикла стимуляции (фенотип клеток определяли при помощи известного в данной области анализа FACS с использованием антитела против определенных поверхностных маркеров).
Помимо вышеуказанных культур клеток меланомы, были использованы следующие линии клеток меланомы: FM28, FM55p, FM60 (HLA-A2-положительные), FM45 и FM48 (HLA-A2-отрицательные). Указанные линии клеток были описаны в научной литературе (Bartkova et al., 1996, Cancer Res., v. 56, pp. 5475-5483; Kirkin et al., 1995, Cancer Immunol. Immunother., v. 41, pp. 71-81). DDB-1 и ANBI-EBV являются линиями EBV-трансформированных лимфобластоидных клеток, полученных в лаборатории авторов данного изобретения стандартными методами, хорошо известными в данной области. Эритролейкозные клетки К562 использовали в качестве мишени для NK-опосредуемого лизиса. Линии клеток рака молочной железы MCF-7, CAMA-1, HBL-100, MDA-MB-231 (HLA-A2-положительные) и ВТ-20 (HLA-A2-отрицательные) были любезно предоставлены д-ром Per Briand, Danish Cancer Society. HLA-A2-положительные линии клеток плоскоклеточного рака SCC4 и SCC9 были получены из АТСС. Все линии клеток культивировали в среде RPMI 1640, содержащей 10% FCS. Цитотоксическую активность определяли по примеру 1. В экспериментах с использованием блокирующих антител в лунки добавляли моноклональное антитело W6/32 против обычных детерминантных молекул HLA класса I в концентрации 10 мкг/мл.
В первых экспериментах цитотоксичность испытывали в отношении панели клеток меланомы, а также EBV-трансформированных В-клеток и эритролейкозных клеток К562. NK-подобная литическая активность, определяемая лизисом клеток К562, была значительной после двух циклов стимуляции, но постепенно уменьшалась после последующих стимуляций. Чтобы обнаружить специфический CTL-оосредуемый лизис, все эксперименты по определению литической активности выполняли в присутствии 20-кратного избытка немеченых клеток К562. Результаты типичного эксперимента по определению цитотоксичности лимфоцитов, полученных у донора ANBI, после 4 циклов стимуляции дендритными клетками, нагруженными лизатом клеток DDM-1.13, показаны на фигуре 8. HLA-A2-положительные клетки меланомы лизировали до разных степеней, в то время как клетки К562, ANBI-EBV (EBV-В-клетки, полученные у того же донора), DDB-1 (аутологичные клеткам меланомы DDM-1), линии клеток меланомы FM45 и FM48 (не имеющие общих антигенов МНС класса I с клетками донора ANBI) были относительно устойчивы к лизису. Следует отметить, что HLA-A2-отрицательная линия клеток меланомы FM9, но родственная HLA-A1 донора ANBI (не показано), также чувствительна к лизису, что указывает на то, что рестрикция лизиса HLA является сложным процессом, не ограничивающимся только антигенами HLA-A2. Необработанные дендритные клетки также индуцировали пролиферацию лимфоцитов, хотя и с меньшей интенсивностью, но в таких культурах возникала только неспецифическая цитотоксичность (не показано). Отсутствие цитотоксичности против клеток DDB-1, образующихся из РВМС (моноциты периферической крови) у больного с меланомой, из которых возникают клетки меланомы DDM-1, свидетельствует о том, что аллоантигены, возможно, присутствующие в препарате лизата, не индуцируют значительную иммунную реакцию, и что возникающая иммунная реакция является главным образом опухолеспецифической. Антитело W6/32 против молекулы МНС класса I значительно подавляется, указывая на природу цитотокичности, ограниченную МНС класса I. Аналогичные результаты были получены при использовании лизата, выделенного из клона клеток меланомы DDM-1.7 (не показано).
Чтобы определить вероятность того, что распознанные антигены относятся к группе антигенов рака яичка, являющихся общими для разных типов злокачественных новообразований человека, авторы настоящего изобретения исследовали чувствительность ряда линий клеток рака молочной железы и плоскоклеточного рака к лизису под действием образовавшихся CTL. Результаты одного эксперимента приведены на фигуре 9. Три из четырех линий HLA-A2-положительных клеток рака молочной железы характеризуются чувствительностью к лизису от средней до высокой, в то время как одна линия HLA-A2-орицательных клеток была полностью устойчива к лизису. Одна из двух исследованных линий клеток плоскоклеточного рака была также чувствительна к лизису. Лизис линий клеток рака молочной железы подавлялся антителом W6/32, специфическим в отношении HLA класса I. Полученные данные показывают, что иммунизация in vitro PBL (лимфоцитами периферической крови) здорового донора с использованием аутологичных дендритных клеток, нагруженных лизатом линий клеток меланомы DDM-1.7 или DDM-1.13, индуцировала образование CTL, которые специфически распознавали опухолеассоциированные антигены, присутствующие в нескольких типах опухолей человека.
Одну возможную группу антигенов, которые могут быть распознаны CTL, полученными подобным способом, составляют антигены MAGE-A. Для выявления корреляции между экспрессией указанных антигенов и чувствительностью клеток-мишеней к образованным CTL авторы настоящего изобретения сравнили уровни экспрессии указанных антигенов в трех линиях клеток рака молочной железы, характеризующихся разной восприимчивостью к лизису. Результаты приведены на фигуре 10. Максимальное число исследованных антигенов экспрессировано в клетках HBL-100 и минимальное число экспрессировано в клетках MCF-7. Полученные результаты свидетельствуют о том, что действительно существует корреляция между числом экспрессированных генов групп MAGE-A и восприимчивостью к лизису, из чего следует, что, по-видимому, такие или аналогично регулируемые антигены являются главными мишенями для данного типа иммунизации.
Пример 4
Испытание на иммунодоминантность дифференцировочных антигенов
Две линии клеток меланомы, экспрессирующие на высоком уровне дифференцировочные антигены DDM-1.29 и на низком уровне дифференцировочные антигены DDM-1.P (вариант линии клеток DDM-1), использовали в экспериментах по образованию цитотоксических Т-лимфоцитов путем стимуляции in vitro лимфоцитов периферической крови аутологичными опухолевыми клетками в соответствии со способом, описанным Herin et al., 1987, Int. J. Cancer, v. 39, pp. 390-396. После 3 циклов еженедельной стимуляции лимфоцитов облученными опухолевыми клетками (10000 рад) культуры клеток клонировали, ограничивая разбавления, и сначала определяли литическую активность растущих клонов против исходной линии клеток меланомы при помощи испытания на высвобождение Cr51. Клоны клеток считались цитотоксическими, если их литическая активность против исходной линии клеток меланомы превышала 20%. Затем специфичность клонов цитотоксических Т-клеток испытывали в экспериментах с использованием Т2-клеток, нагруженных разными HLA-A2-рестриктированными пептидами из антигенов gp100 и MART-1. В качестве контрольных образцов использовали Т2-клетки, не обработанные пептидами. Примерно 100 клонов анализировали для каждой линии клеток меланомы. Дендритные клетки нагружали лизатами, как было описано выше, и иммунизировали аутологичные лимфоциты. Результаты, полученные при вычислении пропорции клонов CTL, распознающих дифференцировочные антигены gp100 и MART-1 при иммунизации, приведены в нижеследующей таблице 3.
Приведенные данные показывают, что дифференцировочные антигены являются иммунодоминантными. В случае высокого уровня экспрессии дифференцировочных антигенов иммунная реакция направлена главным образом на дифференцировочные антигены gp100 и MART-1, в отличие от этого иммунная реакция не индуцируется при использовании для иммунизации линии клеток, экспрессирующих дифференцировочные антигены на низком уровне. Следует отметить, что обе линии клеток индуцируют интенсивную пролиферацию аутологичных лимфоцитов при образовании большого числа клонов цитотоксических Т-клеток.
Пример 5
Фенотип дендритных клеток, полученных в разных условиях культивирования
Чтобы исследовать, каким образом разные режимы добавления лимфокинов в сочетании с заменой среды в 1-ый день будут влиять на фенотипические свойства образованных незрелых дендритных клеток, были изучены четыре разные совокупности условий роста. Дендритные клетки были получены по существу аналогично примеру 2. Ниже приведены разные условия роста:
1) цитокины (GM-CSF и IL-4) добавляли в 0-ой день сразу же после окончания стадии адсорбции, и дополнительное количество цитокинов вводили в 1-ый день без замены среды;
2) условия аналогичны группе 1, но при замене полной среды в 1-ый день с дополнительным введением цитокинов;
3) цитокины добавляли только в 1-ый день без замены среды в 1-ый день; и
4) условия аналогичны группе 3, но при замене полной среды в 1-ый день.
Условия в группе 4 соответствуют условиям, описанным Тернером и др. (1999), для образования зрелых дендритных клеток из продукта лейкафереза (в соответствии со способом Тернера оптимизация достигается только для дендритных клеток, образованных из продуктов лейкафереза, а не из только что полученных проб крови).
После инкубации в течение 5 дней клетки собирали и подсчитывали число крупных клеток в цитометре Коултера (Beckman, модель Z2), затем клетки замораживали в аутологичной плазме с добавлением 10% ДМСО для последующего анализа экспрессии поверхностного маркера методом FACS. Были использованы нижеследующие моноклональные антитела (все предоставлены фирмой BD Biosciences): CD1a-PE, CD14-FITC и CD83-PE вместе с совместимыми контрольными антителами.
Подсчет клеток свидетельствует об отсутствии разницы в выходе клеток (по числу и размеру), что хорошо согласуется с данными, приведенными Тернером и др. (Thurner et al., 1999), (J. Immunol. Methods 223:1-15), так как были использованы только морфологические критерии и выход в качестве индикатора оптимизации роста. В отличие от этого, существенное отличие наблюдалось в настоящем исследовании при измерении поверхностных маркеров (результаты одного из экспериментов приведены в таблице 4).
Начало добавления цитокинов в 1-ый день значительно повышает экспрессию маркера CD1a, не оказывая существенного влияния на экспрессию других маркеров. Кроме того, очевидно, что замена среды в 1-ый день, как было первоначально предложено Тернером и др. (1999), фактически является необязательной, так как аналогичный эффект достигается как в случае замены среды, так и без замены среды. Замена среды в 1-ый день на самом деле значительно уменьшает эндоцитарную активность дендритных клеток в незрелом состоянии. Для последующих экспериментов были выбраны условия роста с отсроченным добавлением цитокинов в 1-ый день без замены среды.
Пример 6
Оптимизация выхода дендритных клеток, продуцируемых моноцитами
В процессе вышеописанной оптимизации авторы настоящего изобретения неожиданно обнаружили, что выход дендритных клеток, получаемых из популяции мононуклеарных клеток, зависит от плотности моноцитов на стадии адсорбции. Как отмечалось ранее в большинстве опубликованных методов, при выполнении стадии адсорбции учитывалась главным образом концентрация мононуклеарных клеток, а не моноцитов. Однако мононуклеарные клетки представляют собой смесь двух популяций, а именно лимфоцитов и моноцитов, и доля каждой популяции может изменяться в значительных пределах. Именно моноциты в основном адсорбируются на пластике.
Для определения концентрации моноцитов в популяции мононуклеарных клеток авторы настоящего изобретения использовали цитометр Коултера для подсчета числа клеток, так как это позволяет также проследить за распределением клеток по размеру (Beckman, модель Z2). При подсчете были обнаружены две основные популяции клеток со средним размером 7 нм (лимфоциты) и 9 нм (моноциты), и установка соответствующего дискриминационного окна позволила определить пропорцию двух указанных популяций.
Авторы настоящего изобретения ранее обнаружили, что при плотности посева клеток 15 х 106 моноцитов в одной колбе Т25 адсорбция моноцитов является почти полной (более 90%), поэтому в выполненных экспериментах была использована плотность клеток от 12 х 106 до 20 х 106. Наблюдалось значительное изменение выхода дендритных клеток, и, пытаясь понять причину такого изменения, авторы настоящего изобретения решили соотнести выход дендритных клеток в разных экспериментах с исходной плотностью моноцитов. Результаты такого анализа пяти культур, полученных у разных доноров, прямо указывают на обратную корреляцию между эффективностью образования дендритных клеток и плотностью посеянных моноцитов.
Целью эксперимента было определение указанной взаимосвязи при посеве моноцитов, полученных у одного донора, с разной плотностью. Мононуклеарные клетки выделяли из светлого слоя кровяного сгустка (полученного из крови здорового донора) путем центрифугирования в градиентной центрифуге Lymphoprep. После выделения клеток на поверхности раздела и интенсивной промывки с целью удаления тромбоцитов мононуклеарные клетки суспендировали в культуральной среде, представляющей собой среду RPMI 1640 с добавлением 1% аутологичной обработанной гепарином плазмы, и высевали в колбы Т25 (площадь поверхности составляет 25 см2) в 7 мл среды с разными количествами мононуклеарных клеток в одной колбе (от 10 х 106 до 20 х 106 моноцитов на одну колбу). После адсорбции в течение 1 часа неадсорбированные клетки удаляли, дважды промывая предварительно подогретой культуральной средой, и в каждую колбу добавляли 7 мл свежей среды. На следующий день к культуре добавляли GM-CSF (100 нг/мл) и IL-4 (50 мкг/мл). Цитокины повторно добавляли на 3-ий день. На 5-ый день половину среды заменяли и добавляли новую порцию GM-CSF и IL-4. На 6-ой день добавляли TNF-α в концентрации, равной 20 нг/мл. Культуры собирали на 7-ой день, производили общий подсчет числа клеток, после чего клетки замораживали в аутологичной сыворотке с 10% ДМСО и хранили до выполнения анализа методом FACS. Анализ методом FACS выполняли с использованием антител CD1a и CD14.
Результаты одного из экспериментов, относящиеся к выходу дендритных клеток (крупные клетки со средним размером от 14 до 16 нм), приведены в таблице 5.
Выход дендритных клеток значительно сокращался при увеличении плотности посеянных моноцитов, составляя 50% при минимальной плотности клеток. Результаты анализа методом FACS, выполненного с использованием таких же дендритных клеток, также приведены в таблице и показывают, что не наблюдается существенного различия в пропорциях дендритных клеток, образованных при исходно разной плотности моноцитов.
Снижение исходной плотности моноцитов до уровня менее 10 х 106 клеток на колбу Т25 вызывает уменьшение экспрессии маркера CD1a (данные не приведены). Поэтому оптимальная плотность исходной популяции моноцитов, соответствующая максимальной эффективности продуцирования дендритных клеток с максимальной компетентностью (по результатам экспрессии главных маркеров ДК), примерно составляет 10 х 106 клеток на 25 см2 поверхности культуры.
На основании полученных данных можно вычислить необходимый объем пробы крови. Если предполагаемый выход дендритных клеток составляет примерно 50% от исходного числа моноцитов, потребуется только 300 мл крови для получения 50 х 106 дендритных клеток. Это значит, что одной пробы крови в количестве 300 мл должно быть достаточно для получения вакцины для двух циклов вакцинации. Требуемое количество цитокинов (21 нг для GM-CSF и 10,5 нг для IL-4) и других веществ в три раза меньше по сравнению со стандартным, неоптимизированным способом.
Таким образом, стоимость веществ, необходимых для продуцирования ДК, будет по меньшей мере в три раза ниже, и, кроме того, не нужно выполнять дорогостоящие процедуры лейкафереза.
Пример 7
Применение вакцины на основе дендритных клеток
Цикл вакцинации больных раком дендритными клетками, нагруженными лизатом двух линий клеток меланомы, которые получены способом согласно изобретению, предпочтительно должен быть определен таким образом, чтобы больные могли получить первый цикл из пяти внутрикожных вакцинаций 5 х 106 дендритными клетками с трехнедельными интервалами. При появлении клинической реакции после начального цикла вакцинаций производят второй аналогичный цикл вакцинаций. На весь период клинического испытания потребуется в общей сложности до 50 х 106 клеток. С учетом состояния больных (у большинства больных наблюдаются последние стадии развития болезни, когда все другие методы лечения являются неэффективными) важно свести до минимума число процедур взятия крови, ограничив их одной или двумя.
Реферат
Изобретение относится к иммунологии и медицине. Изобретение представляет собой фармацевтическую композицию, содержащую дендритные клетки, нагруженные по меньшей мере пятью антигенами рака яичка и не содержащие линиеспецифических дифференцировочных антигенов. Изобретение также относится к выделенным линиям клеток, экспрессирующих множество антигенов рака яичка и не экспрессирующих дифференцировочных антигенов, и к способу индукции иммунной реакции у человека при помощи указанной композиции. 9 н. и 47 з.п. ф-лы, 10 ил., 5 табл.
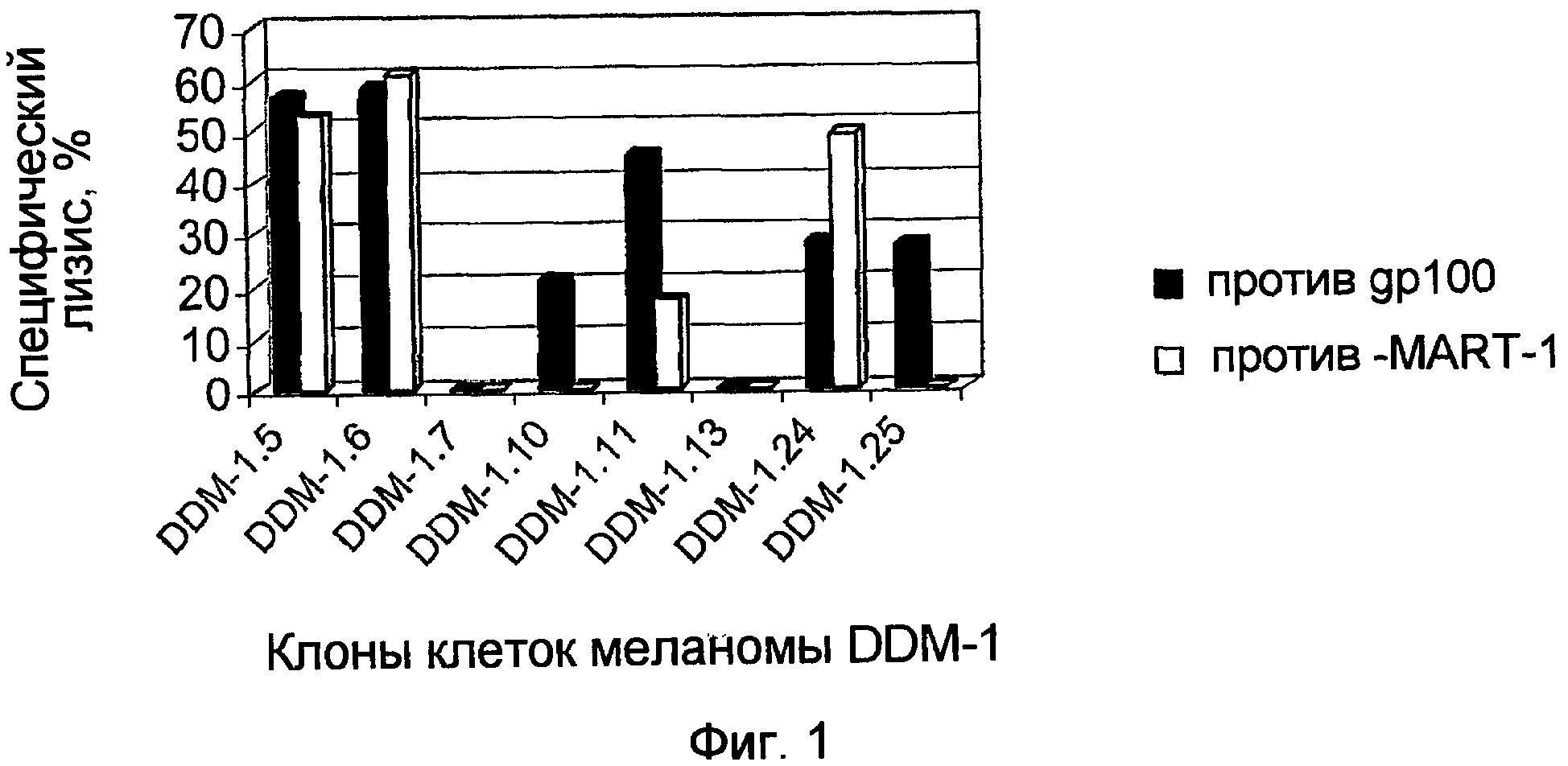
Формула
Документы, цитированные в отчёте о поиске
Композиция для индукции иммунной реакции у млекопитающего и способ введения млекопитающему активного ингредиента

Комментарии