Вакцина против интермедиата с амилоидным сворачиванием - RU2546234C2
Код документа: RU2546234C2
Чертежи









Описание
Область техники
Изобретение относится к улучшенной вакцине, которая может использоваться для лечения болезни Альцгеймера.
Уровень техники
По оценкам Всемирной Организации Здравоохранения по всему миру от болезни Альцгеймера страдает 18 миллионов человек (Vas et al. 2001). В Нидерландах болезнь Альцгеймера выявлена приблизительно у 250000 человек. Проблема возрастает с увеличением среднего возраста населения. По оценкам, затраты на уход за пациентом в лечебно-реабилитационном центре для престарелых составляют 30000-60000 евро в год (McDonnell et al. 2001). Вакцинация была бы экономически эффективной.
Болезнь Альцгеймера представляет собой нейродегенеративное расстройство (Sadowski & Wisniewski 2004, Blennow et al. 2006, Editorials Nature Med. 2006). Характеристикой заболевания является образование бляшек в мозге или в кровеносных сосудах мозга. Эти бляшки происходят из нейронного мембрано-связанного белка, амилоидного белка-предшественника. α-Спиральный фрагмент из 38-43 (обычно 42) аминокислотных остатков ферментативно отщепляется от белка, образуя таким образом пептид, называемый «растворимым Aβ», который, вероятно, вначале принимает растянутую конформацию и присутствует во всех жидкостях организма. Если растворимый Aβ достигает высокой концентрации, то он подвергается конформационным изменениям и образует агрегаты. Множество агрегатов было обнаружено in vitro или in vivo, включая множество конформеров мономера, различных типов олигомеров, произошедших из растворимых лигандов Aβ, протофибрилл, фибрилл и сфероидов (взято из Klein et al. 2004). Фибриллярный Aβ имеет кросс-бета-конформацию (Sawaya et al. 2007) и со временем откладывается в мозге с образованием нейродегенеративных бляшек.
Как оказалось, иммунизация трансгенных мышей (Schenk et al. 1999) и людей в фазе I клинического испытания (Hock et al. 2002) с использованием суспензии "пре-агрегированного" Aβ1-42 продемонстрировала лечебное действие. Антитела в человеческой иммунной сыворотке распознавали бляшки, Aβ-отложения и β-амилоидную структуру в кровеносных сосудах мозга. Антитела не распознавали амилоидного белка-предшественника или растворимого Aβ.
Недостатком "пре-агрегированной" суспензии Aβ1-42 является то, что физические свойства этого материала неясны. Однако гораздо более серьезная проблема заключается в индукции менингоэнцефалита в виде ассоциированного с вакциной побочного эффекта, проявляющегося у 6% пациентов во время фазы II клинического испытания (Check 2002, Gilman et al. 2005). Этот побочный эффект вызван клеточной воспалительной реакцией, отнесенной на счет клеточного ответа ThI на эпитопы, локализованные в центральной и в C-концевой части Aβ 1-42 (McLaurin et al. 2002, Gelinas et al. 2004). Было продемонстрировано, что оказывающие лечебное действие антитела, индуцированные с помощью Aβ1-42, направлены против N-конца (McLaurin et al. 2002, (Lee et al. 2005). Таким образом, было предложено использование усеченных по C-концу Aβ-пептидов в качестве иммуногенов (Sigurdsson et al. 2004, Lemere et al. 2006, Gevorkian et al. 2004, Lemere et al. 2007). Такие короткие пептиды являются слабоиммуногенными. С целью повышения иммуногенности множество копий пептида должны были быть конденсированы с неиммуногенными носителями (с целью индукции IgM) или с носителями, обеспечивающими гетерологичные Т-клеточные эпитопы (Agadjanyan et al. 2005, Ghochikyan et al. 2006, Maier et al. 2006 (Movsesyan et al. 2008)). Ожидалось, что ни в одном из этих конъюгатов пептид не примет конформацию остатков 4-10 при воздействии с помощью β-амилоидных олигомеров или пре-фибрилл. Таким образом, ожидается, что антитела, индуцированные усеченными пептидными конъюгатами, являются слабоспецифичными для олигомеров или пре-фибрилл.
Таким образом, все еще существует необходимость получения эффективного лекарственного средства, предпочтительно вакцины, против болезни Альцгеймера. В настоящем изобретении предлагается улучшенная вакцина, которая не обладает всеми недостатками существующих вакцин: является менее или вообще не токсичной и при этом способна индуцировать эффективный антительный ответ для иммунизации. Вакцина, предлагаемая в настоящем изобретении, представляет собой новый аналог β-амилоидного пептида.
Описание изобретения
Пептиды по изобретению
В первом аспекте изобретения предлагается пептид, включающий следующую последовательность X1X2X3VGSN-Z, X2X3VGSNK-Z или X3VGSNKG-Z, где X1 представляет собой A или G, X2 представляет собой E, G, Q или K, X3 представляет собой D или N и Z представляет собой агент, стабилизирующий изгиб, присутствующий внутри последовательности пептида X1X2X3VGSN, X2X3VGSNK или X3VGSNKG. Пептиды по изобретению представляют собой модифицированные пептиды, которые в настоящем документе следует понимать как пептиды, которые не являются природными Aβ 1-42. Z также может определяться как агент, стабилизирующий конформацию X1X2X3VGSN (SEQ ID NO:1), X2X3VGSNK (SEQ ID NO:2) или X3VGSNKG (SEQ ID NO:3), как наиболее приемлемую в Aβ 1-42, предпочтительно приемлемую в Aβ 1-42. Пептидные последовательности X1X2X3VGSN, X2X3VGSNK или X3VGSNKG, идентифицированные выше, соответствуют аминокислотам 22-28 и 23-29 соответственно из Aβ 1-42. Предпочтительная пептидная последовательность представляет собой X2X3VGSNK, которая соответствует аминокислотам 22-28 из Aβ 1-42. Различные возможные идентичности для X1, X2 и X3, указанные в настоящем документе, произошли в результате присутствия нескольких известных мутаций внутри человеческой популяции в последовательности Aβ 1-42: X2 представляет собой аминокислоту 22 и преимущественно в популяции она является E. Однако также известны мутации Арктическая (Arctic) (E22G), Голландская (Dutch) (E22Q) и Итальянская (Italian) (E22K). Недавно была идентифицирована другая мутация (E22Δ) (Tomiyama et al. 2008). X3 представляет собой аминокислоту 23, и преимущественно она является D. Однако мутация Айова (Iowa) была уже идентифицирована (D23N). Таким образом, специалисту в данной области понятно, что если позже будут идентифицированы другие мутации в определенной части Aβ 1-42, как идентифицировано в настоящем документе; т.e. аминокислоты 21-27, 22-28 или 23-29, то последовательность пептида по изобретению может быть, возможно, адаптирована так, чтобы учитывать эту позже идентифицированную мутацию.
Было протестировано несколько перекрывающихся пептидных последовательностей (см. пример). Насколько мы знаем, было обнаружено, что две из тестированных пептидных последовательностей (aк 22-28 или 23-29) способны индуцировать антительный ответ у мышей, причем антитело было способно специфично распознавать конформационный эпитоп Aβ 1-42, экспрессирующийся в виде мономера, растворимого олигомера (Haass and Selkoe 2007, Lambert et al., 2007, and Wash and Selkoe, 2007) в фибриллах или нейродегенеративных бляшках. По-видимому, распознавание олигомерного Ab является еще более критическим, чем распознавание фибриллы или бляшки, так как олигомерный Ab является более токсичным по отношению к нейронам. Выведение растворимых олигомеров быстро улучшает распознавание, в то время как бляшки все равно присутствуют. Функциональность пептида по изобретению предпочтительно тестируется, как представлено в примере 2: ELISA. Использование конъюгатов пептид-BSA в качестве антигенов покрытия в ELISA дает возможность определения анти-пептидного титра, тогда как олигомерный или фибриллярный Aβ 1-42 дает возможность детектирования специфичной кросс-реактивности. Специалисту в данной области будет понятно, что любая другая пептидная последовательность, произошедшая из Aβ 1-42 и включенная в пептид согласно изобретению и которая способна принимать конформацию X1X2X3VGSN, X2X3VGSNK или X3VGSNKG, вероятно, принимаемую Aβ 1-42, также охвачена настоящим изобретением.
В одном воплощении пептид по изобретению содержит формулу X1X2X3VGSN-Z, X2X3VGSNK-Z или X3VGSNKG-Z, где X1 представляет собой A или G, X2 представляет собой E, G, Q или K, X3 представляет собой D или N и Z представляет собой агент, стабилизирующий изгиб, присутствующий внутри последовательности пептида X1X2X3VGSN, X2X3VGSNK или X3VGSNKG.
В пептиде по изобретению является критическим, что изгиб, присутствующий внутри X1X2X3VGSN, X2X3VGSNK или X3VGSNKG, стабилизируется, поскольку нашей целью является дизайн пептида, который имитирует конформационный эпитоп, присутствующий в свернутом Aβ 1-42, который экспрессируется в виде мономера, растворимого олигомера, фибрилл или нейродегенеративных бляшек. Любой путь достижения этой стабилизации охвачен настоящим изобретением. Специалист после синтеза такого пептида по изобретению может протестировать его конформацию с помощью метода, известного из уровня техники, например с помощью ЯМР, как указано в примере 1.
В одном предпочтительном воплощении первый путь достижения этой стабилизации представляет собой циклизацию пептида по изобретению. Таким образом, предпочтительный пептид по изобретению представляет собой циклический пептид. Специалисту известно, как циклизовать пептид. Реальная реакция циклизации может быть осуществлена между любыми удовлетворяющими положениями в последовательности, включающими Z. Кроме того, реальная реакция циклизации может быть осуществлена на последовательности-предшественнике, еще не содержащей Z, но с получением Z в результате циклизации. Циклизация может проводиться путем связывания, предпочтительно путем ковалентного связывания N-концевой аминокислоты пептидной последовательности, предпочтительно X1, X2 или X3 соответственно в X1X2X3VGSN-Z, X2X3VGSNK-Z или X3VGSNKG-Z, с Z. Таким образом, C-концевая аминокислота пептидных последовательностей X1X2X3VGSN, X2X3VGSNK или X3VGSNKG не занята в циклизации. Удобно осуществлять циклизацию в твердой фазе. Например, D23, связанная посредством боковой цепи с твердой фазой, может циклизоваться с E22, что приводит к получению цикло-E22-D23 с линкером из карбоновых кислот. В другом случае D27, связанная посредством боковой цепи с твердой фазой, может циклизоваться с K28, что приводит к получению цикло-D27-K28 с амидным линкером. Предпочтительно циклизация осуществляется между аминокислотами в петле, противоположной Z, как, например, от D к G (становится N-G) или от G к K*, если Z представляет собой YNGK. Также возможна циклизация в растворе, например, от G25 к S26 или от G к K*, если Z представляет собой YNGK. Считается, что циклизация является важной для стабилизации изгиба, присутствующего внутри X1X2X3VGSN, X2X3VGSNK или X3VGSNKG.
Другой предпочтительный способ циклизации пептида представляет собой добавление цистеина в N- и C-концевые области пептидной последовательности или способ с помощью добавления цистеина в N-конец пептидной последовательности и еще одного цистеина в Z. Присутствие двух цистеинов даст возможность проведения дисульфидной циклизации, хорошо известной специалисту. В другом предпочтительном воплощении второй путь достижения этой стабилизации представляет собой использование Z. Как ранее было указано в настоящем документе, Z представляет собой агент, стабилизирующий изгиб, присутствующий внутри X1X2X3VGSN, X2X3VGSNK или X3VGSNKG в пептиде по изобретению. В предпочтительном воплощении Z стабилизирует изгиб, присутствующий внутри X1X2X3VGSN, X2X3VGSNK или X3VGSNKG, для гарантии того, что пептид, вероятно, примет конформацию свернутого Aβ 1-42. В более предпочтительном воплощении Z стабилизирует изгиб, присутствующий внутри X1X2X3VGSN, X2X3VGSNK или X3VGSNKG, для гарантии того, что эти пептиды примут конформацию свернутого Aβ 1-42. На основе исследований считается, что существует изгиб в конформации свернутого Aβ 1-42, причем изгиб по прогнозам присутствует в положении, соответствующем положению между S и N в X1X2X3VGSN, X2X3VGSNK или X3VGSNKG.
Z может представлять собой любой агент, известный специалисту, который стабилизирует изгиб, поворот или петлю. Z может быть определен как "противо-вращающий" агент с высокой вероятностью образования β-складки (Hutchinson et al., 1998; Woolfson et al., 1993). Z может представлять собой аминокислоту, олигопептид, пептид, полипептид, белок, антиген, моно- или олигосахарид и/или стероид. В предпочтительном воплощении Z представляет собой пептидный фрагмент из 8, 7, 6, 5 или 4 аминокислот, с тем большим предпочтением, чем меньше его длина. Предпочтительно пептидный фрагмент из 4-8 аминокислот представляет собой "противоскладочный" агент с высокой предрасположенностью к конформации β-складки. Предпочтительный пептидный фрагмент представляет собой тетрапептид, выбранный из группы, состоящей из YNGK, TCGV, CGNT, LCGT, LKGT, GAIK, GAIC, AIIK и AIIC. Более предпочтительно тетрапептид выбран из группы, состоящей из YNGK, TCGV, CGNT, LCGT и LKGT. Наиболее предпочтительно тетрапептид выбран из группы, состоящей из YNGK, TcGV, CGNT, LcGT и LkGT, где c=D-Cys и где k=D-Lys (см., Oomen et al. 2003; и Oomen et al. 2005). Примеры белков, которые могут использоваться для Z, представляют собой HSA, IgG и другие сывороточные белки. Примеры антигенов представляют собой (бактериальные) токсины и вирусоподобные частицы. Z также может представлять собой стероидную структуру, такую которая описана, например, в Bode et al. (2007, J.Pept.Sci., 13:702-708). Подходящая стероидная структура для использования в качестве Z включает, например, желчные кислоты и их производные, такие как, например, холевая кислота, дезоксихолевая кислота и метил-7-α-ацетокси-3α-амино-12α-амино-5β-холан-24-оат. Предпочтительно в пептидах по изобретению пептидные последовательности соединены с положениями C-3 и C-12 стероидной структуры, например, как описано у Bode et al. (2007, выше).
Z может быть соединен с пептидной последовательностью перед циклизацией и необязательно циклизуется вместе с оставшейся пептидной последовательностью. В этом воплощении Z предпочтительно представляет собой относительно короткую молекулу, подобную олигопептиду: аминокислоту, дипептид, трипептид, тетрапептид, пентапептид. В этом предпочтительном воплощении общее количество аминокислот (из пептидной последовательности, происходящей из Aβ 1-42 и из Z) предпочтительно составляет десять или одиннадцать. Еще более предпочтительно это количество составляет одиннадцать. Z может включать или состоять из аминокислоты, присутствующей в соответствующей последовательности Aβ 1-42 для выравнивания с соответствующей последовательностью X1X2X3VGSN, X2X3VGSNK или X3VGSNKG.
Альтернативно, Z может быть соединен с циклизованной пептидной последовательностью. В этом воплощении Z может представлять собой относительно более крупную молекулу, чем в предыдущем воплощении: например, полипептид или белок.
Лучшие результаты были получены при объединении обоих способов (циклизация и присутствие Z) для стабилизации пептида. Еще более предпочтительно Z связывается с пептидной последовательностью и затем циклизуется с оставшейся пептидной последовательностью. Альтернативно, Z образуется в результате реакции циклизации. В этом предпочтительном воплощении лучшие результаты были получены, когда Z представлял собой тетрапептид, определенный выше, такой как, например, YNGK. Более предпочтительно тетрапептид включает, по меньшей мере, один цистеин и лизин, чтобы была возможность селективной конъюгации пептида с молекулой-носителем, как описано ниже. Лизин, предпочтительно представляет собой модифицированный лизин, такой как Nε-(S-ацетилмеркаптоацетил)лизин (Lys-SAMA). Присутствие, по меньшей мере, одного цистеина и остатка Lys-SAMA в тетрапептиде дает возможность селективной конъюгации пептида по изобретению с сульфгидрил-реактивным носителем, таким как белок-носитель.
В наиболее предпочтительном воплощении предлагается пептид, содержащий формулу X2X3VGSNK-Z, где X2 представляет собой E, G, Q или K, X3 представляет собой D или N и Z представляет собой агент, стабилизирующий изгиб, присутствующий в X2X3VGSNK. Предпочтительно Z представляет собой YNGK, где еще более предпочтительно K в YNGK представляет собой модифицированный лизин (Lys-SAMA), чтобы была возможность селективной конъюгации пептида.
В другом наиболее предпочтительном воплощении предлагается пептид, включающий следующую последовательность X3VGSNKG-Z, где X3 представляет собой D или N и Z представляет собой агент, стабилизирующий изгиб, присутствующий в X3VGSNKG. Предпочтительно Z представляет собой YNGK, где еще более предпочтительно K в YNGK представляет собой модифицированный лизин (Lys-SAMA), чтобы была возможность селективной конъюгации пептида.
Было обнаружено, что оба пептида, пептид, включающий последовательность X2X3VGSNKGAI-Z, где X2 представляет собой E, X3 представляет собой D, и Z представляет собой модифицированный лизин (Lys-SAMA), и пептид, включающий последовательность VGSNKG-Z, где Z представляет собой модифицированный лизин (Lys-SAMA), генерируют антительные ответы на сами иммунизирующие пептиды, однако генерированные таким образом антитела неспособны к кросс-реакции с олигомерным или фибриллярным Aβ 1-42.
Пептид по изобретению может присутствовать в виде индивидуального пептида или может быть включен в сшитую молекулу, такую как сшитый белок. Пептид может быть дополнительно модифицирован путем делеции или замены одной или более аминокислот, путем удлинения на N- и/или C-конце с помощью дополнительных аминокислот или функциональных групп, которые могут улучшать биодоступность, нацеленность на T-клетки, или включают или высвобождают иммуномодулирующие вещества, которые обеспечивают адъювантные или (ко)-стимулирующие функции. Влияние этих модификаций предпочтительно тестируют на конформации синтезированного пептида. Это может быть сделано, например, с помощью ЯМР. Важно, что в полученном таким образом пептиде конформация X1X2X3VGSN, X2X3VGSNK или X3VGSNKG, такая как, вероятно, принимается Aβ 1-42, предпочтительно такая, как принимается Aβ 1-42, не модифицируется. Необязательные дополнительные аминокислоты на N- и/или C-конце предпочтительно отсутствуют в соответствующих положениях в аминокислотной последовательности белка, из которого произошел пептид, т.е в аминокислотной последовательности Aβ 1-42. Таким образом, в еще более предпочтительном воплощении с целью улучшения иммуногенности пептида по изобретению, этот пептид, предпочтительно циклический пептид, описанный выше, конъюгирован с иммуногенной молекулой носителя, предпочтительно посредством селективной связи Z и иммуногенной молекулы носителя. Такой пептид называют конъюгированным пептидом. Таким образом, в предпочтительном воплощении пептид по изобретению представляет собой конъюгированный пептид, более предпочтительно конъюгированный циклический пептид. Иммуногенная молекула носителя предпочтительно представляет собой носитель, который при конъюгации с пептидом по изобретению индуцирует иммунный ответ на пептид по изобретению при введении объекту, такому как млекопитающее. Иммуногенный носитель также может обладать адъювантной активностью, определенной в настоящем документе позже. Специалисту известно множество иммуногенных молекул носителя (Hermanson, G. T., 1996, Bioconjugate techniques. Academic Press, San Diego; Drijfhout and Hoogerhout, 2000). Подходящие иммуногенные молекулы носителя включают, например, бактериальные токсины или анатоксины, такие как экзотоксины и их варианты с уменьшенной токсичностью. Предпочтительные иммуногенные молекулы носителя включают дифтерийный анатоксин CRM197, сывороточный альбумин (например, человеческий сывороточный альбумин) и столбнячный анатоксин (Beuvery et al., 1986; Claesson et al., 2005).
Композиция
В следующем аспекте предлагается композиция, включающая пептид, определенный в настоящем документе. Такая композиция может быть фармацевтической композицией или лекарственным средством.
В следующем предпочтительном воплощении пептид или пептидная композиция дополнительно включает фармацевтическое вспомогательное вещество, и/или фармацевтически приемлемый носитель, и/или иммуномодулятор. К композиции может быть добавлен любой инертный фармацевтически приемлемый носитель и/или вспомогательное вещество. Состав лекарственных средств и использование фармацевтически приемлемых вспомогательных носителей известны и основаны на уровне техники и, например, описаны в публикации Remington; The Science and Practice of Pharmacy, 21nd Edition 2005, University of Sciences in Philadelphia.
Фармацевтическая композиция может дополнительно включать фармацевтически приемлемые стабилизирующие агенты, осмотические агенты, буферные агенты, диспергирующие агенты и т.п. Предпочтительная форма фармацевтической композиции зависит от назначенного способа введения и терапевтического применения. Фармацевтический носитель может представлять собой любое совместимое, нетоксическое вещество, подходящее для доставки активных ингредиентов, т.е. пептида, пациенту. Фармацевтически приемлемые носители для внутриносовой доставки представляют собой, в качестве примера, воду, забуферированные солевые растворы, глицерин, полисорбат 20, кремофор EL и водную смесь каприлового/капринового глицерида и могут быть забуферированы для обеспечения нейтрального pH окружающей среды. Фармацевтически приемлемые носители для парентеральной доставки представляют собой в качестве примера стерильный забуферированный 0,9% раствор NaCl или 5% глюкозу, необязательно снабженные 20% альбумином. Препараты для парентерального введения должны быть стерильными. Парентеральный путь введения активных ингредиентов согласуется с известными методами, например инъекцией или инфузией с помощью подкожного пути, внутривенного, внутрибрюшинного, внутримышечного, внутриартериального или введения внутрь пораженных тканей. Композицию по изобретению предпочтительно вводят с помощью болюсной инъекции. Типичная фармацевтическая композиция для внутримышечной инъекции должна быть сделана так, чтобы содержать, например, 1-10 мл фосфатно-буферного солевого раствора и 1-100 мкг, предпочтительно 15-45 мкг модифицированного конъюгированного пептида. Для перорального введения активный ингредиент может вводиться в жидких дозированных формах, таких как эликсиры, сиропы и суспензии. Жидкие дозированные формы для перорального введения могут содержать краситель или ароматизатор для увеличения приемлемости для пациента.
Методы получения композиций с парентеральным, пероральным или внутриносовым введением хорошо известны из уровня техники и описаны более подробно в различных источниках, например в публикации Remington's Pharmaceutical Science (15th ed., Mack Publishing, Easton, PA, 1980) (введена ссылкой в полном объеме для всех целей).
К композиции может быть добавлен любой известный иммуномодулятор, конкретно, модулятор, приводящий к получению сбалансированного Th2/Th1 ответа, подобный фосфату алюминия или гидроксиду алюминия. Предпочтительно иммуномодулятор представляет собой адъювант. Более предпочтительно композиция включает пептид, определенный ранее в настоящем документе, и, по меньшей мере, один адъювант. Определенный в настоящем документе адъювант включает любое вещество или соединение, которое при использовании в комбинации с пептидом иммунизирует млекопитающее, предпочтительно человека, стимулирует иммунную систему, таким образом вызывая, усиливая или облегчая иммунный ответ против пептида, предпочтительно без генерирования специфического иммунного ответа на адъювант сам по себе. Предпочтительные адъюванты усиливают иммунный ответ против данного антигена в количество раз, соответствующее, по меньшей мере, фактору 1,5, 2, 2,5, 5, 10 или 20, по сравнению с иммунным ответом, генерируемым против пептида при таких же условиях, но в отсутствие адъюванта. Тесты для определения статистического среднего усиления иммунного ответа против данного пептида, продуцируемого с помощью адъюванта в группе животных или людей, доступны из уровня техники. Адъювант, используемый в настоящем документе, как правило, представляет собой соединение, которое является чужеродным по отношению к млекопитающему, исключая таким образом иммуностимулирующие соединения, которые являются эндогенными для млекопитающих, такие как, например, интерлейкины, интерфероны и другие гормоны.
Композиция по настоящему изобретению может содержать, по меньшей мере, один адъювант. Адъювант, используемый в настоящем изобретении, выбирается так, чтобы не ингибировался эффект пептида. Адъюванты, используемые в настоящем изобретении, представляют собой те, которые физиологически совместимы с людьми, они включают, в частности, гидроксид алюминия, фосфат алюминия, эмульсионные адъюванты на основе масла/ПАВ, такие как МонтанидTM, в которых различные ПАВ (особенно маннитил олеат) объединяются с минеральным маслом, сквален-содержащие эмульсии, такие как MF59TM, монофосфорил липид A, или Neisseriae-мутантный липосахарид (описанный в PCT/NL98/0063).
Лекарственное средство может вводиться в виде однократного введения. Альтернативно, введение пептида, определенного ранее в настоящем документе, и/или адъюванта может повторяться по необходимости, и/или различные пептиды, и/или различные адъюванты могут вводиться последовательно. Пептид, композиция и лекарственное средство по изобретению предпочтительно включают в состав, подходящий для внутривенного или подкожного, или внутримышечного введения, хотя могут предполагаться другие пути введения, такие как чресслизистое введение или интрадермальное и/или внутрикожное введение, например, с помощью инъекции.
Согласно предпочтительному воплощению пептид, описанный в настоящем документе, предназначен для использования в качестве лекарственного средства. Более предпочтительно это лекарственное средство представляет собой вакцину против болезни Альцгеймера. Еще более предпочтительно лекарственное средство предназначено для предотвращения, отсрочки возникновения и/или лечения болезни Альцгеймера. Вакцина, определенная в настоящем документе, может использоваться для профилактической защиты против болезни Альцгеймера или для лечения этого заболевания.
В контексте изобретения организмом, или индивидуумом, или объектом может быть животное или человек. Предпочтительно организм является человеком. Предпочтительно организм, подвергаемый лечению, предрасположен к наличию высокого риска развития болезни Альцгеймера благодаря, например, потенциальной генетической предрасположенности, и/или возрасту объекта, и/или образу жизни объекта (например, привычки питания и/или отсутствие физической активности), и/или благодаря любому другому известному параметру, указывающему на то, что объект имеет высокий риск развития болезни Альцгеймера.
Следует понимать, что термин "предотвращение" включает полное предотвращение, профилактику, а также снижение риска индивидуума заболеть указанным заболеванием или снижение риска патологического состояния и отсрочки возникновения заболевания или патологического состояния. Термин "предотвращение", таким образом, также включает терапию объектов, предрасположенных к наличию риска заболеть указанным заболеванием или риска патологического состояния. Также следует понимать, что термин включает облегчение уже развившихся симптомов.
Термин "отсрочка", используемый в настоящем документе, обозначает введение в организм пептида, т.е. пациент подвергается лечению в стадии, предшествующей патологическому состоянию, когда соответствующее патологическое состояние диагностируется у пациента с помощью методов, известных из уровня техники.
Термин "терапия" или "лечение" следует понимать как проведение лечения и наблюдение пациента с целью борьбы с заболеванием, патологическим состоянием или расстройством. В контексте изобретения термин "лечение болезни Альцгеймера и/или отсрочка ее прогрессии" предпочтительно обозначает, что добавляется терапевтически эффективное количество пептида. Количество является эффективным при дозировках и в течение периодов времени, необходимых для достижения целевого терапевтического результата, т.е. лечения болезни Альцгеймера и/или замедления ее прогрессии.
Количество пептида может варьироваться согласно факторам, таким как стадия заболевания, возраст, пол и масса индивидуума и способности фармакологического агента вызывать целевой ответ у индивидуума.
Терапевтический эффект (приводящий к лечению болезни Альцгеймера и/или замедлению ее прогрессии) предпочтительно представляет собой эффект, который приводит в результате, по меньшей мере, к:
- уменьшению количества бета-бляшек, присутствующих в мозге;
- уменьшению количества растворимых Aβ-олигомеров пре-фибрилл, присутствующих в мозге; и
- уменьшению тяжести симптома, ассоциированного с болезнью Альцгеймера.
Уменьшение количества бета-бляшек, присутствующих в мозге пациента, подвергнутого лечению, предпочтительно обозначает, что количество добавленного пептида будет способно предотвратить de novo образование бета-бляшек, по меньшей мере, до некоторой степени и/или что у существующих бляшек будет, по меньшей мере, до некоторой степени ингибироваться их способность к размножению. Предпочтительно в этом контексте, депонирование бета-бляшек не будет увеличиваться у пациентов, подвергнутых лечению, в пересчете на количество бета-бляшек, идентифицированных с использованием метода воспроизведения изображения, такого как PET-сканирование (Henriksen, Yousefi et al., 2008) и/или магнитная резонансная томография (МРТ) (O'Brien, 2007). В PET-сканировании количество бета-бляшек пропорционально поглощению метки. Предпочтительно количество бета-бляшек будет уменьшаться, по меньшей мере, на 2%, 5%, 10%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или более. Еще более предпочтительно бета-бляшки не будут идентифицироваться. Специалисту известно, что визуализацию бета-бляшки следует осуществлять приблизительно, по меньшей мере, через один день, по меньшей мере, чрез одну неделю, по меньшей мере, через один месяц после вакцинации или более. (Meyer-Luehmann, Spires-Jones et al., 2008). Если необходимо, специалист может решить провести вакцинацию несколько раз и регулярно наблюдать за количеством бета-бляшек.
Уменьшение количества растворимых Aβ-олигомеров или пре-фибрилл, присутствующих в мозге пациента, подвергаемого лечению, обозначает, что количество добавляемого пептида будет способно предотвращать de novo образование растворимых Aβ-олигомеров или пре-фибрилл, по меньшей мере, до некоторой степени и/или что существующие растворимые Aβ-олигомеры или пре-фибриллы будут, по меньшей мере, до некоторой степени ингибироваться в том, что касается их способности к размножению. Предпочтительно в этом контексте, количество растворимых Aβ-олигомеров или пре-фибрилл не будет увеличиваться у пациента, подвергнутого лечению, в выражении поверхности, идентифицированной с помощью метода воспроизведения изображения, определенного выше. Предпочтительно количество растворимых Aβ-олигомеров или пре-фибрилл будет уменьшаться, по меньшей мере, на 2%, 5%, 10%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или более. Более предпочтительно количество растворимых Aβ-олигомеров или префибрилл не будет детектироваться с использованием такого метода.
В контексте изобретения растворимый Aβ-олигомер, пре-фибрилла или протофибрилла представляет собой признак сборки 2-24 Аβ-мономеров (Haas and Selkoe 2007). В контексте изобретения термин "уменьшение тяжести симптома, ассоциированного с болезнью Альцгеймера" предпочтительно обозначает улучшение познавательной способности, измеренной с помощью физиологического теста для оценки улучшения познавательной способности у пациентов, страдающих болезнью Альцгеймера.
Применение
Соответственно, в следующем аспекте предлагается применение пептида или композиции, определенной в настоящем документе, для производства лекарственного средства против болезни Альцгеймера. Предпочтительно лекарственное средство представляет собой вакцину. Более предпочтительно вакцина предназначена для предотвращения, отсрочки возникновения и/или для лечения болезни Альцгеймера.
Соответственно, в другом следующем аспекте предлагается способ предотвращения, отсрочки возникновения и/или для лечения болезни Альцгеймера путем введения нуждающемуся в этом пациенту пептида или композиции, определенной в настоящем документе.
Метод синтеза пептида
Из настоящего уровня техники известно много способов генерирования пептида по изобретению. Изобретение не ограничивается каким-либо способом генерирования пептида при условии, что генерированный пептид включает, состоит из или перекрывается с любой из данных модифицированных последовательностей, идентифицированных в настоящем документе, и обладает требуемой конформацией, определенной ранее в настоящем документе.
Соответственно, в следующем аспекте предлагается способ получения модифицированного циклического пептида, определенного в настоящем документе, причем указанный способ включает следующие стадии:
a) синтеза циклического пептида, включающего последовательность X1X2X3VGSN-Z, X2X3VGSNK-Z или X3VGSNKG-Z, где X1 представляет собой A или G, X2 представляет собой E, G, Q или K, X3 представляет собой D или N и Z представляет собой агент, стабилизирующий изгиб, присутствующий внутри пептидной последовательности X1X2X3VGSN, X2X3VGSNK или X3VGSNKG; и
b) необязательной конъюгации иммуногенной молекулы-носителя с циклическим пептидом, полученным в a), предпочтительно посредством связи Z с иммуногенной молекулой носителя.
Каждая стадия этого способа известна специалисту и подробно описана в примере.
Антитело
В следующем аспекте предлагается антитело, направленное против модифицированного (циклического) пептида по изобретению, определенного в настоящем документе. Специалисту известно, как получить такое антитело у животного. Методы генерирования антител или фрагментов антител, которые специфично связываются с данным полипептидом, описаны, например, в публикациях Harlow and Lane (1988, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY) и WO 91/19818; WO 91/18989; WO 92/01047; WO 92/06204; WO 92/18619; и US 6420113 и в списке литературы, цитированном в настоящем документе. Термин "специфичное связывание", определенный в настоящем документе, включает специфичное связывание одновременно с низкой и высокой аффинностью. Специфичное связывание может проявляться, например, с помощью антитела с низкой аффинностью или с помощью фрагмента антитела, имеющего Kd, составляющего, по меньшей мере, примерно 10-4 M. Специфичное связывание также может проявляться с помощью антитела или фрагмента антитела с высокой аффинностью, например, с помощью антитела или фрагмента антитела, имеющих Kd, составляющую, по меньшей мере, примерно 10-7 M, по меньшей мере, примерно 10-8 M, по меньшей мере, примерно 10-9 M, по меньшей мере, примерно 10-10 M, или они могут иметь Kd, составляющую, по меньшей мере, примерно 10-11 M или 10-12 M или выше.
Диагностические методы
В следующем аспекте предлагается способ диагностики нейродегенеративного заболевания или патологического состояния, такого как болезнь Альцгеймера. Способ включает определение присутствия или отсутствия бета-амилоидной бляшки (т.e. нейродегенеративной бляшки) в мозге пациента с использованием антитела, определенного в настоящем документе. Предпочтительно в способе присутствие бета-амилоидной бляшки в мозге объекта (или в его образце) является показателем того, что у объекта есть риск развития нейродегенеративного заболевания или патологического состояния, такого как болезнь Альцгеймера. Предпочтительно такой способ используется для прогнозирования или диагностики болезни Альцгеймера у пациента. В контексте изобретения диагностика обозначает или прогнозируемую оценку риска позднего развития у объекта болезни Альцгеймера, или предпочтительно оценку развития болезни Альцгеймера у объекта. В контексте изобретения объектом может быть животное или человек. Предпочтительно объектом является человек.
Согласно предпочтительному воплощению способ проводится in vitro или ex vivo в образце, полученном от объекта. Образец предпочтительно включает ткань мозга, взятую у объекта. Более предпочтительно ткань представляет собой кровеносный сосуд мозга.
Предпочтительно детектирование присутствия бета-амилоидной бляшки обнаруживается с помощью связывания антитела по изобретению с образцом мозга, которое анализируется с помощью ELISA, как объяснено в примере. Способ диагностики может быть впоследствии применен к объекту для наблюдения за развитием заболевания.
В этом документе и в его формуле изобретения глагол "включать" и его формы используются в своем не ограничивающем смысле для обозначения включения пунктов, следующих за словом, но при этом пункты, которые специфически не упомянуты, исключены. Кроме того, глагол "состоять" может быть заменен на "состоять по существу из", обозначающий, что пептид или композиция, определенные в настоящем документе, могут включать дополнительный компонент(ы), отличный от специфически идентифицированного, причем указанный компонент(ы) не изменяет уникальной характеристики по изобретению. Кроме того, ссылка на элемент с помощью неопределенного артикля "a" или "an" не исключает возможности того, что присутствует более чем один элемент до тех пор, пока из контекста не будет следовать ясное требование того, чтобы существовал один и только один из элементов. Неопределенный артикль "a" или "an", таким образом, как правило, обозначает "по меньшей мере, один".
Все ссылки на патенты и литературу, цитированные в настоящем описании, включены в полном объеме с помощью ссылки. Следующие примеры предлагаются только для иллюстративных целей и не предназначены для какого-либо ограничения рамок изобретения.
Описание чертежей
Фигура 1. Модель фибриллы Aβ1-42. A и B представляют димерную кросс-β единицу и C собранную фибриллу [Credit: Olofsson et al. 2006 J. Biol. Chem. 281, 477-483].
Фигура 2. Последовательности циклических пептидов амилоидного происхождения (K* представляет собой модифицированный остаток лизина для целей конъюгации).
Фигура 3: титры IgG-антитела суммарной мышиной сыворотки против гомологичных конъюгатов пептид-BSA. Титр составляет10log соответствующего разведения сыворотки при 50% максимальной оптической плотности при 450 нм в анализе ELISA.
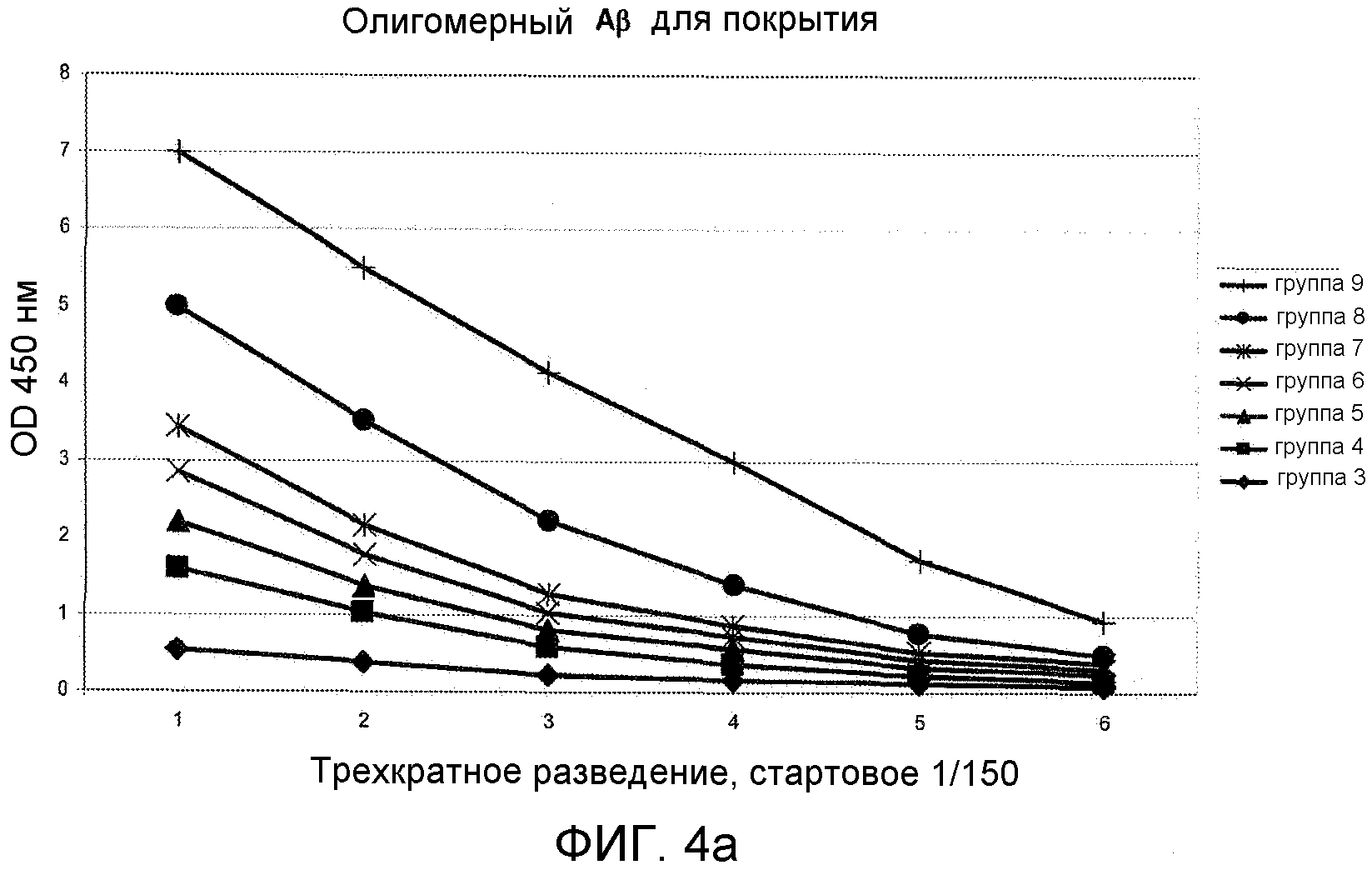
Фигура 4: OD450 нм суммарной мышиной сыворотки в виде функции от разведения с помощью олигомерного или фибриллярного Aβ 1-42 в виде покрытия.
Фигура 5: Титры IgG-антитела индивидуальной мышиной сыворотки групп 8 и 9 против олигомерного или фибриллярного Aβ 1-42. Титр представляет собой соответствующее разведение сыворотки при 50% максимальной оптической плотности при 450 нм в анализе ELISA.
Фигура 6: Иммуногистохимическое окрашивание секций мозга человека-донора 99-30 (Braak 6) вместе с мышиной сывороткой (1:300), иммунизированной с помощью конъюгата цикло[Aβ(22-28)-YNGK]/столбнячный анатоксин (a) и с помощью контрольного моноклонального антитела 6E10 (1:15000) в (b). Подобный профиль бляшек распознавался мышиной сывороткой в качестве положительного контроля. (Микроскоп: Leica DMRE, снабженный фотоаппаратом DC300).
ПРИМЕРЫ
ПРИМЕР 1: стратегия синтеза
Мы тестировали усеченные пептиды Aβ, которые не включают иммунодоминантный N-концевой B-клеточный эпитоп. Нашей целью было нацеливание антительного ответа на ранее неправильно упакованный белок Aβ.
Последовательность Aβ 1-42:
DAEFR5HDSGY10EVHHQ15KLVFF20AEDVG25SNKGA30IIGLM35VGGAAZ40IA
(SEQ ID NO:4).
Структура Aβ1-42 фибрилл была разрешена с помощью ЯМР-спектроскопии (Olofsson et al. 2006). Эксперименты на фибриллах с заменой водорода/дейтерия продемонстрировали, что участки Glu-Gly и Lys-Ala в последовательности Aβ защищены от растворителя, тогда как N-конец Asp1-Tyr10 и фрагмент из двух остатков Ser26-Asn27 являются доступными растворителю. С этим согласуются ЯМР-данные: Asp1-Tyr10 и фрагмент из двух остатков Ser26-Asn27 являются доступными растворителю. ЯМР-данные согласуются с моделью фибрилл, изображенной на Фигуре 1C. Прогнозированная структура представляет собой закрученную кросс-β конформацию. На Фигуре IA и IB продемонстрирована секция, димерная кросс-β единица. Внутри димера каждый мономер содержит два антипараллельных β-листа, которые связаны с помощью складки, состоящей из Ser26-Asn27.
На основе амилоидной фибриллярной модели (Фигура 1) мы решили получить набор из YNGK*-стабилизированных циклических 10- и 11-мерных амилоидных пептидов. На Фигуре 2 продемонстрированы целевые амилоидные декапептиды. Мы предположили, что могли бы стабилизировать конформацию коротких Aβ-пептидов путем добавления искусственной последовательности YNGK*, в которой K* представляет собой модифицированный остаток лизина для селективной конъюгации с белком-носителем, с последующей амидной циклизацией главной цепи ("голова к хвосту") (Oomen et al. (2005)). Аналогично, мы получили небольшую панель циклических декамерных и ундекамерных пептидов, охватывающих шесть или семь остатков из участка 21-31 из Aβ и YNGK* (см. Таблицу 1).
ПРИМЕР 2: специфичность некоторых из модифицированных циклизованных пептидов к конформационному эпитопу свернутого Aβ 1-42
Конъюгат столбнячного анатоксина и циклического пептида [Aβ(22-28)-YNGK*], т.e. цикло[EDVGSNKYNGK*], или пептида, определенного в виде группы 9 в Таблице 1, вызывал антитела, которые перекрестно реагировали in vitro с Aβ (l-42)-олигомерами (Фигура 4 или 5) и с Aβ(l-42)-фибриллами (Фигура 4 или 5). Эти антитела также распознавали Aβ-отложения в пораженной болезнью Альцгеймера ткани мозга (гиппокамп), полученной после смерти человека, см. Фигуру 6. Соответствующий конъюгат линейного N-ацетилированного амида пептида Ac-K*EDVGSNKYNG-NH2 индуцировал хорошие титры антипептидных антител, но генерированные антитела не распознавали олигомерного или фибриллярного Aβ. Таким образом, циклический пептид имитирует конформационный эпитоп в свернутом Aβ 1-42, который обычно не индуцирует антительный ответ. Во время системного тестирования антительного ответа на конъюгат с пептидом, определенным в виде группы 10, циклический пептид [Aβ(21-27)- YNGK*] был еще в работе.
Материалы и методы
Пептидный синтез, очистка и конъюгация
α-(2,4-диметоксибензиловый) эфир Nα-флуоренилметоксикарбонил-L-аспарагиновой кислоты (Fmoc-Asp-ODmb) конденсировали посредством его боковой цепи с полимером для синтеза амидов пептида (для дальнейшей конверсии исходной Asp в Asn). Связанная со смолой последовательность с защищенной боковой цепью GK*EDVGSNKYD(смола), в которой K* представляет собой Nε-(S-ацетилмеркаптоацетил)лизил, затем собиралась, как описано ранее (Brugghe et al., 1994). Связанный со смолой линейный пептид конвертировали в цикло[GK*EDVGSNKYD(смола)]. После снятия защиты с боковой цепи, за исключением Lys(SAMA), и отщепления от смолы цикло[GK*EDVGSNKYN] ≡ цикло[EDVGSNKYNGK*] получали пептид из группы 9 (Таблица 1). Пептиды из групп 4-8 были получены аналогично. Пептид из группы 10, цикло [AEDVGSNYNGK*], получали из связанного со смолой линейного предшественника YNGK*AEDVGSD(смола) с защищенной боковой цепью. Пептиды очищали с помощью обращенно-фазной хроматографии и охарактеризовывали с помощью масс-спектрометрии с ионным распылением (MH+обнаруженное/рассчитанное, см. Таблицу 1). Очищенные пептиды конденсировали или с бромацетилированным столбнячным анатоксином или с малеимидил-модифицированным бычьим сывороточным альбумином (BSA) (модифицирующий реагент: NHS-PEO2-Малеимид, Pierce) (Drijfhout JW et al., 2000).
Дезагрегация Aβ(l-42)
Лиофилизованный Aβ 1-42 (Anaspec) растворяли в трифторуксусной кислоте в концентрации 1 мM, оставляли при комнатной температуре в течение 1 ч и сушили под потоком азота и затем в вакууме (1 мм Hg) в течение 15 мин. Пептид затем повторно растворяли в гексафторизопропаноле в концентрации 1 мM и через 1 ч инкубации при комнатной температуре сушили, как описано выше (Zeng et al., 2001). Пептид хранили при -20°C в течение 18-20 ч.
Получение олигомерного или фибриллярного Aβ(l-42)
Дезагрегированный Aβ 1-42 растворяли в диметилсульфоксиде в концентрации 5 мM, разводили в 50 раз с помощью или фосфатно-буферного солевого раствора (PBS), pH 7,2, или с помощью 10 мM соляной кислоты. Раствор в PBS инкубировали при 4°C в течение 24 ч (с получением олигомеров), тогда как раствор в 10 mM HCl инкубировали при 37°C в течение 24 ч (с получением фибрилл) (Stine et al.).
Иммунизация мышей
Группы из восьми самок мышей Balb/c возрастом 6-8 недель иммунизировали подкожно в дни 0 и 28 с помощью или 25 мкг Aβ 1-42 в PBS без адъюванта, или с помощью 50 мкг конъюгата пептид-TTd и 75 мкг AlPO4 d PBS. Небольшие образцы сыворотки собирали в день 0. Мышей обескровливали в день 42.
ELISA
На микропланшеты (Greiner 655092) наносили покрытие в виде Aβ1-42 или конъюгатов пептид-BSA. Свежеприготовленные Aβ 1-42 олигомеры или фибриллы разводили до конечной концентрации 2,5 мкM (11,3 мкг/мл) в 0,04 M буфере карбоната/бикарбоната натрия, pH 9,7. Конъюгаты пептид-BSA в фосфатно-буферном солевом растворе, pH 7,2 (PBS), имели концентрацию суммарного белка 0,5 мкг/мл. Аликвоты (100 мкл) этих растворов переносили в лунки планшетов. Планшеты инкубировали в течение 90 мин при 37°C. Планшеты далее обрабатывали, как описано ранее (Westdijk, Van den Ijssel et al., 1997).
Иммуногистохимическое окрашивание
Использовали секции мозга человека из гиппокампа нескольких доноров с болезнью Альцгеймера (Braak 5 или 6) (Банк Мозга Нидерландов (Netherlands Brain Bank)). Криосекции (10 мкм) вырезали из нефиксированной непосредственно замороженной ткани, размораживали, сушили в течение 1 часа и хранили в герметичном боксе при -20°C. Для иммуноокрашивания секции фиксировали в 4% растворе PFA-PBS в течение 10 мин, промывали в 0,05 M фосфатном буфере (PB) в течение 10 мин с 2 сменами раствора и блокировали с помощью обычной сывороткой осла (NDS)+0,4% ТритонX100 в 0,05M PB в течение 1 часа при КТ. Блокирующий раствор выливали и добавляли разведенную мышиную сыворотку (1:300; первичное антитело) в 3% NDS+0,4% ТритонX100 в 0,05M PB и инкубировали O/N при КТ в боксе с влажными тканями. Секции промывали с помощью 0,05M PB; по меньшей мере, 30 мин с одной или более сменами раствора. Затем секции инкубировали с Ослиным-анти-Мышиным антителом ~Cy3 1:1400 в 0,05 M PB в течение 2 часов. Секции промывали с помощью 0,05M PB; по меньшей мере, 30 мин с одной или более сменами раствора. Секции запаивали в среде Vectashield вместе с DAPI (Vector). В качестве положительного контроля использовали мышиное моноклональное антитело 6E10 к бета-амилоидному пептиду 1-17 (Abeam, Cambridge, UK) (1:15000).
Список литературы
Agadjanyan MG, Ghochikyan A, Petrushina IVasilevko V, Movsesyan N, Mkrtichyan M, Saing T, and Cribbs DH, 2005. Prototype Alzheimer's disease vaccine using the immunodominant B cell epitope from β-amyloid and promiscuous T cell epitope pan HLA DR-binding peptide. J. Immunol. 174, 1580-1586.
Beuvery E.C., Roy R., Kanhai V., Jennings H.J., 1986. Characteristics of two types of meningococcal group C polysaccharide conjugates using tetanus toxoid as carrier protein. Dev.Biol. Stand. 65, 197-204.
Blennow K, de Leon MJ, and Zetterberg H, 2006. Alzheimer's disease. Lancet 368, 387-403.
Brugghe HF, Timmermans HAM, van Unen LMA, ten Hove GJ, van de Werken G, Poolman JT, and Hoogerhout P, 1994. Simultaneous multiple synthesis and selective conjugation of cyclized peptides, derived from a surface-loop of a meningococcal class 1 outer membrane protein. Int. J. Peptide Protein Res. 43, 166-172.
Check E, 2002. Nerve inflammation halts trial for Alzheimer's drug. Nature 415, 462.
Claesson B.A., Trollfors B., Lagergard T., Knutsson N., Schneerson R., Robbins J.B., 2005. Antibodies against Haemophilus influenzae type b capsular polysaccharide and tetanus toxoid before and after a booster dose of the carrier protein nine years after primary vaccination with a protein conjugate vaccine. Pediatr. Infect. Dis. J. 24, 463-464.
Drijfhout JW and Hoogerhout P, 2000. Methods of preparing peptide-carrier conjugates. In: Fmoc Solid Phase Peptide Synthesis: A Practical Approach (W.C. Chan and P.D. White, eds.). Oxford University Press, p. 229-241.
Editorials Nature Med. 2006, Vol. 12, # 7 July 2006.
Gelinas DS, DaSilva K, Fenili D, St. George-Hyslop P, and McLaurin J, 2004. Immunotherapy for Alzheimer's disease. Proc. Natl. Acad. Sci. USA 101, 14657-14662.
Gevorkian G., Petrushina I, Manoutcharian K, Ghochikyan A, Acero G, Vasilevko V, Cribbs DH, and Agadjanyan MA, 2004. Mimotopes of conformational epitopes in fibrillar β-amyloid. J. Neuroimmunol. 156, 10-20.
Ghochikyan A, Mkrtichyan M, Petrushina I, Movsesyan N, Karapetyan A, Cribbs DH, and Agadjanyan MG, 2006. Prototype Alzheimer's disease epitope vaccine induced strong Th2-type anti-Aβ antibody response with Alum to Quil A adjuvant switch. Vaccine 24, 2275-2282.
Gilman S, Roller M, Black RS, Jenkins L, Griffith SG, Fox NC, Eisner L, Kirby L, Boada Rovira M, Forette F, and Orgogozo J-M, for the AN1792(QS-21)-201 study team, 2005. Clinical effects of Aβ immunization (AN 1792) in patients with AD in an interrupted trial. Neurology 64, 1553-1562.
Haass C., Selkoe D.J., 2007. Soluble protein oligomers in neurodegeneration: lessons from the Alzheimer's amyloid beta-peptide. Nat. Rev. Mol. Cell Biol. 8, 101-112.
Henriksen G., Yousefi B.H., Drzezga A., Wester H.J., 2008. Development and evaluation of compounds for imaging of beta-amyloid plaque by means of positron emission tomography. Eur. J. Nucl. Med. Mol. Imaging 35 Suppl 1, S75-S81.
Hock C, Konietzko U, Papassotiropoulos A, Wollmer A, Streffer J, von Rotz RC, Davey G, Moritz E, and Nitsch RM, 2002. Generation of antibodies specific for beta- amyloid by vaccination of patients with Alzheimer disease. Nature Med. 8, 1270-1275.
Hutchinson E.G., Sessions R.B., Thornton J.M., Woolfson D.N., 1998. Determinants of strand register in antiparallel beta-sheets of proteins. Protein Sci. 7, 2287-2300.
Klein WL, Stine WB, and Teplow DB, 2004. Small assemblies of unmodified amyloid β-protein are the proximate neurotoxin in Alzheimer's disease. Neurobiol. Aging 25, 569-580.
Lambert M.P., Velasco P.T., Chang L., Viola K.L., Fernandez S., Lacor P.N., Khuon D., Gong Y., Bigio E.H., Shaw P., De Felice F.G., Krafft G.A., Klein W.L., 2007. Monoclonal antibodies that target pathological assemblies of Abeta. J.Neurochem. 100, 23-35.
Lee M., Bard F., Johnson-Wood K., Lee C, Hu K., Griffith S.G., Black R.S., Schenk D., Seubert P., 2005. Abeta42 immunization in Alzheimer's disease generates Abeta N-terminal antibodies. Ann.Neurol. 58, 430-435.
Lemere CA, Maier M, Jiang L, Peng Y, and Seabrook TJ, 2006. Amyloid-beta immunotherapy for the prevention and treatment of Alzheimer's disease: lessons from mice, monkeys, and humans. Rejuvenation Res. 9, 77-84. Lemere C.A., Maier M., Peng Y., Jiang L., Seabrook J.J., 2007. Novel Abeta immunogens: is shorter better? Curr.Alzheimer Res. 4, 427-436.
Maier M, Seabrook TJ, Lazo ND, Jiang L, Das P, Janus C, and Lemere CA, 2006. Short amyloid β (Aβ) immunogens reduce cerebral Aβ load and learning deficits in an Alzheimer's disease mouse model in the absence of an Aβ-specif[iota]c cellular immune response. J. Neurosci. 26, 4717-4728.
McDonnell J, Redekop WK, Van der Roer N, Goes E, Ruitenberg A, Busschbach JJ, Breteler MM, and Rutten FF, 2001. The cost of treatment of Alzheimer's disease in The Netherlands: a regression-based simulation model. Pharmacoeconomics 19, 379-390.
McLaurin J, Cecal R, Kierstead ME, Tian X, Phinney AL, Manea M, French JE, Lambermon MHL, Darabie AA, Brown ME, Janus C, Chishti MA, Home P, Westaway D, Fraser PE, Mount HTJ, Przybylski M, and St George-Hyslop P, 2002. Therapeutically effective antibodies against amyloid-beta peptide target amyloid-beta residues 4-10 and inhibit cytotoxicity and fibrillogenesis. Nature Med. 1263-1269.
Meyer-Luehmann M., Spires-Jones T.L., Prada C., Garcia-Alloza M. de C.A., Rozkalne A., Koenigsknecht-Talboo J., Holtzman D.M., Bacskai B.J., Hyman B.T., 2008. Rapid appearance and local toxicity of amyloid-beta plaques in a mouse model of Alzheimer's disease. Nature 451, 720-724.
Movsesyan N., Ghochikyan A., Mkrtichyan M., Petrushina L, Davtyan H., Olkhanud P.B., Head E., Biragyn A., Cribbs D.H., Agadjanyan M.G., 2008. Reducing AD-like pathology in 3xTg-AD mouse model by DNA epitope vaccine - a novel immunotherapeutic strategy. PLoS. ONE. 3, e2124.
O'Brien J.T., 2007. Role of imaging techniques in the diagnosis of dementia. Br. J.Radiol. 80 Spec No 2, S71-S77.
Olofsson A, Sauer-Eriksson AE, and Ohman A, 2006. The solvent protection of Alzheimer amyloid-[beta]-(l-42) fibrils as determined by solution NMR spectroscopy. J. Biol Chem. 281, 477-483.
Oomen C.J., Hoogerhout P., Bonvin A.M., Kuipers B., Brugghe H., Timmermans H., Haseley S.R. van A.L., Gros P., 2003. Immunogenicity of peptide - vaccine candidates predicted by molecular dynamics simulations. J. Mol. Biol. 328, 1083-1089.
Oomen CJ, Hoogerhout P, Kuipers B, Vidarsson G, van Alphen L, and Gros P, 2005. Crystal structure of an anti -meningococcal subtype P 1.4 PorA antibody provides basis for peptide -vaccine design. J. MoI. Biol. 351, 1070-1080.
Sadowski M and Wisniewski T, 2004. Vaccines for conformational disorders. Expert Rev. Vaccines 3, 279-290.
Sawaya MR, Sambashivan S, Nelson R, Ivanova MI, Sievers SA, Apostol M, Thompson MJ, Balbirnie M, Wiltzius JJW, McFarlane HT, Madsen A0, Riekel C, and Eisenberg D, 2007. Atomic structures of amyloid cross-beta spines reveal varied steric zippers. Nature 447, 453-457.
Schenk, Barbour R, Dunn W, Gordon G, Grajeda H, Guido T, Hu K, Huang J, Johnson- Wood K, Khan K, Kholodenko D, Lee M, Liao Z, Lieberburg I, Motter R, Mutter L, Soriano F, Shopp G, Vasquez N, Vandevert C, Walker S, Wogulis M, Yednock T, Games D, and Seubert P, 1999. Immunization with amyloid-beta attenuates Alzheimer - disease-like pathology in the PDAPP mouse. Nature 400, 173-177.
Sigurdsson EM, Knudsen E, Asuni A, Fitzer-Attas C, sage D, Quartermain D, Goni F, Frangione B, and Wisniewski T, 2004. An attenuated immune response is sufficient to enhance cognition in an Alzheimer's disease mouse model immunized with amyloid-[beta] derivatives. J. Neurosci. 24, 6277-6282.
Stine WB, Jr, Dahlgren KN, Rrafft GA, LaDu MJ, 2003. J. Biol. Chem., 278:11612.
Tomiyama T., Nagata T., Shimada H., Teraoka R., Fukushima A., Kanemitsu H., Takuma H., Kuwano R., Imagawa M., Ataka S., Wada Y., Yoshioka E., Nishizaki T., Watanabe Y., Mori H., 2008. A new amyloid beta variant favoring oligomerization in Alzheimer's-type dementia. Ann.Neurol. 63, 377-387.
Vas CJ, Rajkumar S, Tanyakitpisal P, and Chandra V, 2001. Alzheimer's disease: the brain killer. Report of the World Health Organization.
Walsh D.M., Selkoe D.J., 2007. A beta oligomers - a decade of discovery. J.Neurochem. 101, 1172-1184.
Westdijk J., Van den Ijssel, J., Thalen M., Beuvery C, Jiskoot W., 1997. Quantification of cell-associated and free antigens in Bordetella pertussis suspensions by antigen binding ELISA. J.Immunoassay 18, 267-284.
Woolfson D.N., Evans P.A., Hutchinson E.G., Thornton J.M., 1993. Topological and stereochemical restrictions in beta-sandwich protein structures. Protein Eng 6, 461-470.
Zeng H, Zhang Y, Peng L-J, Shao H, Menon NK, Yang J, Salomon AR, Freidland RP, and Zagorski MG, 2001. Nicotine and amyloid formation. Biol. Psychiatry 49, 248-257.
Реферат
Изобретение относится к области биохимии, в частности к циклическому пептиду, способному индуцировать антительный ответ. Пептид состоит из формулы XXVGSNK-Z или XVGSNKG-Z, где Хпредставляет собой E, G, Q или K, Xпредставляет собой D или N и Z представляет собой агент, стабилизирующий изгиб, присутствующий внутри последовательности пептида, при этом пептид циклизован путем ковалентного связывания N-концевой аминокислоты с Z, где Z представляет собой пептидный фрагмент YNGK. Также заявлен конъюгат, содержащий указанный циклический пептид, конъюгированный с иммуногенной молекулой носителя. Пептид и содержащий его конъюгат могут применяться для производства лекарственного средства или в качестве вакцины против болезни Альцгеймера. Также представлены способы получения циклического пептида и конъюгата. Изобретение позволяет получить улучшенную, менее токсичную вакцину против болезни Альцгеймера. 6 н. и 2 з.п. ф-лы, 11 ил., 1 табл., 2 пр.
Формула
а) синтеза линейного пептида, состоящего из последовательности X2X3VGSNK-Z или X3VGSNKG-Z, где Х2 представляет собой E, G, Q или K, Х3 представляет собой D или N и Z представляет собой агент, стабилизирующий изгиб, присутствующий внутри последовательности пептида X2X3VGSNK или X3VGSNKG, и где Z представляет собой пептидный фрагмент, состоящий из YNGK; и
b) ковалентное связывание N-концевой аминокислоты линейного пептида, полученного на этапе а), с Z с получением таким образом циклического пептида.
Документы, цитированные в отчёте о поиске
Композиции вакцин, содержащие наборы антигенов в виде амилоида бета 1-6

Комментарии