Способы лечения фиброзного рака - RU2718056C2
Код документа: RU2718056C2
Чертежи



Описание
Перекрестная ссылка на родственные заявки
В настоящей заявке испрашивается приоритет и преимущество предварительной заявки на патент США рег.№ 61/888269, поданной 8 октября 2013 года, предварительной заявки на патент США рег.№ 61/992807, поданной 13 мая 2014 года, предварительной заявки на патент США рег.№ 62/004828, поданной 29 мая 2014 года, и предварительной заявки на патент США рег.№ 62/004836, поданной 29 мая 2014 года, и содержание указанных заявок во всей своей полноте вводится в настоящее описание посредством ссылки.
Список последовательностей
Настоящая заявка содержит список последовательностей, который подан в электронном виде в формате ASCII и во всей своей полноте вводится в настоящее описание посредством ссылки. Указанная ASCII-копия была создана 6 октября 2014 под названием 104112-0022-WO1_SL.txt и имеет размер 7604 байта.
Предшествующий уровень техники
Некоторые раковые заболевания и пролиферативные состояния характеризуются разрастанием плотной соединительной ткани внутри и вокруг новообразования, которое вытесняет нормальную ткань. Такие фиброзные раковые заболевания трудно поддаются лечению, поскольку химиотерапевтические средства, в большинстве случаев, не могут проникать в плотную фиброзную строму, окружающую раковые клетки. В случае других раковых заболеваний, таких как миелофиброз, замена ткани здорового органа фиброзной тканью приводит к неадекватному функционированию органа, что, в свою очередь, вносит свой вклад в развитие симптомов рака. Даже при применении схем интенсивного лечения, резистентность фиброзных раковых заболеваний к химиотерапевтическим средствам не дает благоприятного эффекта. Следовательно, разработка новых стратегий лечения фиброзных раковых заболеваний остается актуальной.
Описание сущности изобретения
В некоторых своих аспектах настоящее изобретение относится к способу лечения фиброзного рака или повышения эффективности противораковой терапии у пациента, где указанный способ включает введение пациенту, нуждающемуся в этом, терапевтически эффективного количества агониста сывороточного амилоида Р (SAP).
В некоторых своих аспектах настоящее изобретение относится к способу лечения фиброзного рака или повышения эффективности противораковой терапии у пациента, где указанный способ включает введение пациенту, нуждающемуся в этом, терапевтически эффективного количества одного или более агонистов SAP в комбинации с одним или более дополнительными активными агентами.
В некоторых вариантах осуществления изобретения агонист SAP выбран из анти-FcγRI антитела, анти-FcγRII антитела, анти-FcγRIII антитела, перекрестносвязанного анти-FcγR антитела, агрегированного антитела IgG или перекрестносвязанного антитела IgG.
В некоторых вариантах осуществления изобретения агонист SAP выбран из небольшой молекулы, нуклеиновой кислоты или полипептида.
В некоторых вариантах осуществления изобретения агонистом SAP является полипептид SAP, такой как гликозилированный человеческий полипептид SAP. Так, например, агонист SAP может включать полипептид SAP, такой как гликозилированный человеческий полипептид SAP, например, гликозилированный человеческий полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования SAP, выделенного из человеческой сыворотки (например, человеческого SAP, содержащего N-связанную олигосахаридную цепь, где по меньшей мере одна ветвь олигосахаридной цепи заканчивается группой α2,3-связанной сиаловой кислоты). В некоторых вариантах осуществления изобретения агонистом SAP является рекомбинантный человеческий SAP (например, rhSAP). В некоторых вариантах осуществления изобретения агонист SAP включает рекомбинантный человеческий SAP, также известный специалистам как PRM-151. Duffield (2010) Drug News & Perspectives, 23(5): 305-315. rhSAP может быть, но необязательно, приготовлен в клетках CHO или в другой подходящей клеточной линии. Любые из описанных здесь способов включают, в некоторых вариантах осуществления изобретения, введение рекомбинантного человеческого SAP, известного как PRM-151.
В некоторых вариантах осуществления изобретения агонистом SAP является гликозилированный человеческий полипептид SAP, содержащий N-связанную олигосахаридную цепь, где по меньшей мере одна ветвь олигосахаридной цепи заканчивается группой α2,3-связанной сиаловой кислоты. В некоторых вариантах осуществления изобретения все сиалилированные ветви олигосахаридной цепи заканчиваются группами α2,3-связанной сиаловой кислоты. В некоторых вариантах осуществления изобретения олигосахаридная цепь, в основном, не содержит групп α2,3-связанной сиаловой кислоты. Так, например, агонист SAP может содержать такой гликозилированный человеческий полипептид SAP. В некоторых вариантах осуществления изобретения гликозилированный человеческий SAP включает рекомбинантный человеческий SAP, также называемый рекомбинантным человеческим пентраксином-2 (hPTX-2), описанным в публикации Duffield & Lupher, Drug News & Perspectives 2010, 23(5):305-315.
В некоторых вариантах осуществления изобретения полипептид SAP включает аминокислотную последовательность, которая по меньшей мере на 85% идентична последовательности SEQ ID NO:1. В некоторых вариантах осуществления изобретения полипептид SAP включает аминокислотную последовательность, которая по меньшей мере на 95% идентична последовательности SEQ ID NO:1. В некоторых вариантах осуществления изобретения полипептидом SAP является гликозилированный полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования человеческого SAP, выделенного из сыворотки. В некоторых вариантах осуществления изобретения полипептид SAP содержит пять полипептидных цепей, каждая из которых включает аминокислотную последовательность, которая по меньшей мере на 85% (по меньшей мере на 90%, 95%, 98% или даже на 100%) идентична последовательности SEQ ID NO:1.
В некоторых вариантах осуществления изобретения полипептид SAP представляет собой гибридный белок, содержащий домен SAP и один или более гетерологичных доменов. В некоторых вариантах осуществления изобретения один или более гетерологичных доменов способствуют улучшению одного или более свойств, таких как стабильность in vivo, время полужизни in vivo, поглощение/включение, локализация или распределение в ткани, образование белковых комплексов и/или очистка.
В некоторых вариантах осуществления изобретения полипептид SAP содержит один или более модифицированных аминокислотных остатков. В некоторых вариантах осуществления изобретения один или более модифицированных аминокислотных остатков представляют собой ПЭГилированную аминокислоту, пренилированную аминокислоту, ацетилированную аминокислоту, биотинилированную аминокислоту и/или аминокислоту, конъюгированную с органическим дериватизирующим агентом.
В некоторых вариантах осуществления изобретения агонист SAP вводят способом, выбранным из местного введения, введения путем инъекции, введения путем внутривенной инъекции, введения путем подкожной инъекции, введения путем ингаляции, введения с помощью депо-препарата или насоса для непрерывного высвобождения или из их комбинаций.
В некоторых вариантах осуществления изобретения указанный способ также включает введение пациенту противоракового терапевтического средства (например, дополнительного противоракового терапевтического средства).
В некоторых вариантах осуществления изобретения противораковое терапевтическое средство выбрано из химиотерапевтических средств, средств на основе антител, ингибиторов тирозинкиназы, иммуномодулирующих средств, биологических агентов и их комбинаций. При этом один дополнительный агент или множество дополнительных агентов могут быть одновременно использованы в различных схемах лечения (в одно и то же время или в различные периоды времени и/или в одних и тех же способах или в различных способах введения и/или по одной и той же схеме или по различным схемам введения доз). В некоторых вариантах осуществления изобретения лечение агонистом SAP повышает безопасность и/или эффективность лечения и/или снижает один или более побочных эффектов дополнительного противоракового терапевтического средства по сравнению с лечением, при котором дополнительное противораковое терапевтическое средство вводят в отсутствии агониста SAP. В некоторых вариантах осуществления изобретения перед введением агониста SAP у пациента (пациента, нуждающегося в лечении) наблюдается невосприимчивость к лечению противораковым терапевтическим средством, либо у этого пациента наблюдается резистентность к такому лечению, либо данный пациент не поддается такому лечению или у него наблюдается субоптимальный эффект или снижение благоприятного эффекта такого лечения, причем, введение агониста SAP в соответствии с выбранной схемой терапии приводит к улучшению клинического эффекта, обеспечиваемому агонистом SAP, и/или повышает восприимчивость к дополнительному противораковому терапевтическому средству. В некоторых вариантах осуществления изобретения, если дополнительное противораковое терапевтическое средство вводят отдельно, то лечение агонистом SAP осуществляют так, чтобы дополнительное противораковое терапевтическое средство было введено в дозе, отличающейся от рекомендованной дозы, например, это дополнительное противораковое терапевтическое средство может быть введено (или вводится) в более низкой дозе или в более высокой дозе. Такая разность в дозах может быть вычислена в зависимости от конкретной схемы лечения пациента или с учетом рекомендованной дозы или интервала введения этой дозы. в некоторых вариантах осуществления изобретения агонист SAP включает полипептид SAP, такой как гликозилированный полипептид SAP, например, гликозилированный полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования человеческого SAP, выделенного из сыворотки. В некоторых вариантах осуществления изобретения комбинация агониста SAP и дополнительного противоракового терапевтического средства показана для лечения состояния у группы или подгруппы пациентов, которым не показано лечение одним дополнительным противораковым терапевтическим средством.
В некоторых вариантах осуществления изобретения химиотерапевтическое средство выбрано из средств, которыми являются, но не ограничиваются ими: актиномицин D, альдеслейкин, алитретиноин, все транс-ретиноевые кислоты/ATRA, альтретамин, амсакрин, аспарагиназа, азацитидин, азатиоприн, бацилла Кальметта-Герена/БЦЖ, гидрохлорид бендамустина, бексаротен, бикалутамид, блеомицин, бортезомид, бусульфан, капецитабин, карбоплатин, карфилзомиб, кармустин, хлорамбуцил, цисплатин/цисплатина, кладрибин, циклофосфамид/цитофосфан, цитарабин, дакарбазин, даунорубицин/дауномицин, денилейкин дифитокс, дексразоксан, доцетаксел, доксорубицин, эпирубицин, этопозид, флударабин, фторурацил (5-FU), гемцитабин, гозерелин, гидрокортизон, гидроксимочевина, идарубицин, ифосфамид, интерферон-альфа, иринотекан CPT-11, лапатиниб, леналидомид, лейпролид, мехлоретамин/хлорметин/мустин/HN2, меркаптопурин, метотрексат, метилпреднизолон, митомицин, митотан, митоксантрон, остреотид, опрелвекин, оксалиплатин, паклитаксел, памидронат, пегаспаргаза, пегфилграстим, ПЭГ-интерферон, пеметрексед, пентостатин, фенилаланиновый аналог горчичного газа, пликамицин/митрамицин, преднизон, преднизолон, прокарбазин, ралоксифен, ромиплостим, сарграмостим, стрептозоцин, тамоксифен, темозоломид, темсиролимус, тенипозид, талидомид, тиогуанин, тиофосфамид/тиотепа, тиотепа, гидрохлорид топотекана, торемифен, третиноин, валрубицин, винбластин, винкристин, виндезин, винорелбин, вориностат, золендроновая кислота и их комбинации. В некоторых вариантах осуществления изобретения указанный способ включает введение агониста SAP и дополнительного противоракового терапевтического средства, где указанным дополнительным противораковым терапевтическим средством является химиотерапевтическое средство, например, отдельно взятое химиотерапевтическое средство или комбинация двух или более химиотерапевтических средств. В некоторых вариантах осуществления изобретения агонист SAP включает полипептид SAP, такой как гликозилированный полипептид SAP, например, полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования человеческого SAP, выделенного из сыворотки. В некоторых вариантах осуществления изобретения пациентом, нуждающимся в лечении, является пациент, страдающий раковым заболеванием, которое не поддается лечению только химиотерапией, является невосприимчивым к такой химиотерапии или восприимчивым на субоптимальном уровне, и указанный выше способ лечения повышает эффективность химиотерапии и/или восприимчивость к химиотерапии. В некоторых вариантах осуществления изобретения пациентом, нуждающимся в лечении, является пациент, у которого ранее наблюдался терапевтический эффект после проведения только химиотерапии, но у которого, такой терапевтический эффект после проведения только химиотерапии оставался на одном и том же или, в основном, на одном и том же уровне, или пациент, у которого такое лечение больше не является эффективным или его эффективность снижается. В некоторых вариантах осуществления изобретения пациентом, нуждающимся в лечении, является пациент, страдающий раком поджелудочной железы.
В некоторых вариантах осуществления изобретения агент на основе антитела выбран из таких агентов, как, но не ограничивающихся ими, алемтузумаб, бевацизумаб, цетуксимаб, фрезолимумаб, гемтузумаб, озогамицин, ибритумомаб тиуксетан, ипилимумаб, офатумумаб, панитумумаб, ритуксимаб, тозитумомаб, трастузумаб, трастузумаб DM1 и их комбинации. В некоторых вариантах осуществления изобретения указанный способ включает введение агониста SAP и дополнительного противоракового терапевтического средства, где указанным дополнительным противораковым терапевтическим средством является средство на основе антитела. В некоторых вариантах осуществления изобретения агонист SAP включает полипептид SAP, такой как гликозилированный полипептид SAP, например, полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования человеческого SAP, выделенного из сыворотки. В некоторых вариантах осуществления изобретения пациентом, нуждающимся в лечении, является пациент, страдающий раковым заболеванием, которое не поддается лечению только агентом на основе антитела, является невосприимчивым к такому лечению или восприимчивым на субоптимальном уровне, и указанный выше способ лечения повышает эффективность и/или восприимчивость пациента к лечению таким средством. В некоторых вариантах осуществления изобретения пациентом, нуждающимся в лечении, является пациент, у которого ранее наблюдался терапевтический эффект после проведения лечения только средством на основе антитела, но у которого, такой терапевтический эффект после проведения лечения только средством на основе антитела оставался на одном и том же или, в основном, на одном и том же уровне, или пациент, у которого такое лечение больше не является эффективным или его эффективность снижается. В некоторых вариантах осуществления изобретения такая комбинация показана для лечения пациентов, которым не показано лечение только средством на основе антитела.
В некоторых вариантах осуществления изобретения ингибитор тирозинкиназы выбран из таких агентов, как, но не ограничивающихся ими, акситиниб, бафетиниб, бозутиниб, цедираниб, кризотиниб, дазатиниб, эрлотиниб, гефитиниб, иматиниб, лапатиниб, нератиниб, нилотиниб, пазопаниб, понатиниб, хизартиниб, регорафениб, сорафениб, сунитиниб, вандетаниб, ваталаниб и их комбинации. В некоторых вариантах осуществления изобретения указанный способ включает введение агониста SAP и дополнительного противоракового терапевтического средства, где указанным дополнительным противораковым терапевтическим средством является ингибитор тирозинкиназы. В некоторых вариантах осуществления изобретения агонист SAP включает полипептид SAP, такой как гликозилированный полипептид SAP, например, полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования человеческого SAP, выделенного из сыворотки. В некоторых вариантах осуществления изобретения пациентом, нуждающимся в лечении, является пациент, страдающий раковым заболеванием, которое не поддается лечению конкретным ингибитором тирозинкиназы, является невосприимчивым к такому лечению или восприимчивым на субоптимальном уровне, и указанный выше способ лечения повышает эффективность и/или восприимчивость пациента к лечению таким средством. В некоторых вариантах осуществления изобретения пациентом, нуждающимся в лечении, является пациент, у которого ранее наблюдался терапевтический эффект после проведения лечения только ингибитором тирозинкиназы, но у которого такой терапевтический эффект после проведения лечения только ингибитором тирозинкиназы оставался на одном и том же или, в основном, на одном и том же уровне, или пациент, у которого такое лечение больше не является эффективным или его эффективность снижается. В некоторых вариантах осуществления изобретения такая комбинация показана для лечения пациентов, которым не показано лечение только ингибитором тирозинкиназы.
В некоторых вариантах осуществления изобретения иммуномодулирующее средство выбрано из таких агентов, как, но не ограничивающихся ими, талидомид, леналидомид, помалидомид, метотрексат, лефлуномид, циклофосфамид, циклоспорин A, миноциклин, азатиоприн, такролимус, метилпреднизолон, микофенолята мофетил, рапамицин, мизорибин, дезоксиспергуалин, брехинар, 5,6-диметилксантон-4-уксусная кислота (DMXAA), лактоферрин, поли-AU, полиI:полиC12U, поли-ICLC, имихимод, резихимод, неметилированный CpG-динуклеотид (CpG-ODN) и ипилумумаб. В некоторых вариантах осуществления изобретения указанный способ включает введение агониста SAP и дополнительного противоракового терапевтического средства, где указанным дополнительным противораковым терапевтическим средством является иммуномодулирующее средство. В некоторых вариантах осуществления изобретения агонист SAP включает полипептид SAP, такой как гликозилированный полипептид SAP, например, полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования человеческого SAP, выделенного из сыворотки. В некоторых вариантах осуществления изобретения агонист SAP включает полипептид SAP, такой как гликозилированный полипептид SAP, например, полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования человеческого SAP, выделенного из сыворотки. В некоторых вариантах осуществления изобретения пациентом, нуждающимся в лечении, является пациент, страдающий раковым заболеванием, которое не поддается лечению конкретным иммуномодулирующим средством, является невосприимчивым к такому лечению или восприимчивым на субоптимальном уровне, и указанный выше способ лечения повышает эффективность и/или восприимчивость пациента к лечению таким средством. В некоторых вариантах осуществления изобретения пациентом, нуждающимся в лечении, является пациент, у которого ранее наблюдался терапевтический эффект после проведения лечения только иммуномодулирующим средством, но у которого такой терапевтический эффект после проведения лечения только иммуномодулирующим средством оставался на одном и том же или, в основном, на одном и том же уровне, или пациент, у которого такое лечение больше не является эффективным или его эффективность снижается. В некоторых вариантах осуществления изобретения такая комбинация показана для лечения пациентов, которым не показано лечение только иммуномодулирующим средством.
В некоторых вариантах осуществления изобретения ингибитором тирозинкиназы является ингибитор Янус-киназы, выбранный из агентов, таких как, но не ограничивающихся ими, AC-430, AZD1480, барицитиниб, BMS-911453, CEP-33779, CYT387, GLPG-0634, INCB18424, лестауртиниб, LY2784544, NS-018, пакритиниб, руксолитиниб, TG101348 (SAR302503), тофацитиниб, VX-509, R-348, R723 и их комбинации. В некоторых вариантах осуществления изобретения указанный способ включает введение агониста SAP и дополнительного противоракового терапевтического средства, где указанным дополнительным противораковым терапевтическим средством является ингибитор Янус-киназы. В некоторых вариантах осуществления изобретения агонист SAP включает полипептид SAP, такой как гликозилированный полипептид SAP, например, полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования человеческого SAP, выделенного из сыворотки. В некоторых вариантах осуществления изобретения ингибитором Янус-киназы является руксолитиниб. В некоторых вариантах осуществления изобретения агонистом SAP является полипептид SAP, а ингибитором Янус-киназы является руксолитиниб. В некоторых вариантах осуществления изобретения пациентом, нуждающимся в лечении, является пациент, страдающий раковым заболеванием, которое не поддается лечению конкретным ингибитором Янус-киназы , является невосприимчивым к такому лечению или восприимчивым на субоптимальном уровне, и указанный выше способ лечения повышает эффективность и/или восприимчивость пациента к лечению таким средством. В некоторых вариантах осуществления изобретения пациентом, нуждающимся в лечении, является пациент, у которого ранее наблюдался терапевтический эффект после проведения лечения только ингибитором Янус-киназы, но у которого, такой терапевтический эффект после проведения лечения только ингибитором Янус-киназы остается на одном и том же или, в основном, на одном и том же уровне, или пациент, у которого такое лечение больше не является эффективным или его эффективность снижается. В некоторых вариантах осуществления изобретения такая комбинация показана для лечения пациентов, которым не показано лечение только ингибитором Янус-киназы. В некоторых вариантах осуществления изобретения указанным раковым заболеванием является миелофиброз.
В некоторых вариантах осуществления изобретения биологическое средство выбрано из таких агентов, как, но не ограничивающихся ими, IL-2, IL-3, эритропоэтин, G-CSF, филграстим, интерферон-альфа, бортезомиб и их комбинации.
В некоторых вариантах осуществления изобретения противораковое терапевтическое средство выбрано из таких агентов, как, но не ограничивающихся ими, AB0024, AZD1480, AT-9283, BMS-911543, CYT387, эверолимус, гивиностат, иметелстат, лестауртиниб, LY2784544, NS-018, мышьяк для перорального введения, пакритиниб, панобиностат, ПЭГ-интерферон альфа-2a, помалидомид, прациностат, руксолитиниб, TAK-901 и TG101438 (SAR302503).
В некоторых вариантах осуществления изобретения противораковым терапевтическим средством является руксолитиниб.
В некоторых вариантах осуществления изобретения пациентом, нуждающимся в лечении, является пациент, который до начала лечения агонистом SAP ранее вообще не проходил лечения и не проходил лечения другим противораковым терапевтическим средством. В некоторых вариантах осуществления изобретения после начала проведения терапии осуществляют монотерапию агонистом SAP, а в других вариантах осуществления изобретения осуществляют комбинированную терапию вместе с одним или более дополнительными противораковыми терапевтическими средствами.
В некоторых вариантах осуществления изобретения агонист SAP и один или более дополнительных активных агентов (например, дополнительных противораковых терапевтических средств) приготавливают в виде одного препарата. В некоторых вариантах осуществления изобретения агонист SAP и один или более дополнительных активных агентов вводят одновременно. В некоторых вариантах осуществления изобретения агонист SAP и один или более дополнительных активных агентов вводят в различные периоды времени для достижения перекрывающихся терапевтических эффектов у пациента. Если агонист SAP и один или более дополнительных активных агентов вводят одновременно или в различные периоды времени для достижения перекрывающихся терапевтических эффектов, то такие средства могут быть введены одним и тем же способом или различными способами (например, перорально и путем вливания).
В некоторых вариантах осуществления изобретения рак выбран из таких заболеваний, как, но не ограничивающихся ими, миелофиброз, рак желудка, рак поджелудочной железы, лимфома Ходжкина, неходжкинская лимфома, ретикулоэндотелиоз, множественная миелома, медуллобластома, миелоидный лейкоз и острый лимфоцитарный лейкоз.
В некоторых вариантах осуществления изобретения указанным раковым заболеванием является миелофиброз. В некоторых вариантах осуществления изобретения миелофиброзом является первичный миелофиброз, миелофиброз на фоне истинной полицитемии или миелофиброз на фоне илиопатической тромбоцитемии.
В некоторых вариантах осуществления изобретения раковым заболеванием является рак поджелудочной железы.
В некоторых вариантах осуществления изобретения лечением любых уже имеющихся или сопутствующих заболеваний (например, любых уже имеющихся или сопутствующих раковых заболеваний) является монотерапия с использованием SAP, например, терапия, описанная в настоящей заявке. В других вариантах осуществления изобретения лечением любых уже имеющихся или сопутствующих заболеваний (например, любых уже имеющихся или сопутствующих раковых заболеваний) является комбинированная терапия, включающая введение агониста SAP и дополнительного противоракового терапевтического средства, такого как средство, описанное в настоящей заявке. В некоторых вариантах осуществления изобретения индивидуумом, нуждающимся в лечении, является индивидуум, который ранее не проходил никакого лечения, и индивидуум, который проходил лечение агонистом SAP, таким как агонист SAP, включающий полипептид SAP, либо отдельно, либо в комбинации с дополнительным противораковым средством, то есть, индивидуум, который впервые проходил противораковую терапию. В других вариантах осуществления изобретения индивидуум, нуждающийся в лечении, ранее проходил один или более курсов лечения, которые не включали терапию или терапии с использованием SAP. В некоторых вариантах осуществления изобретения указанный индивидуум ранее проходил один или более курсов лечения, которые не включали терапию с использованием SAP, и у этого индивидуума (i) не наблюдался ответ на такую терапию или (ii) сначала наблюдался некоторый ответ, но впоследствии такой ответ больше не наблюдался, или (iii) после первоначального ответа наблюдалось снижение восприимчивости к такой терапии. В некоторых вариантах осуществления изобретения независимо от того, наблюдалось ли прекращение ответа у индивидуума на дополнительное противораковое средство или нет, в настоящем изобретении предусматривается непрерывное введение этого противоракового средства в комбинации с агонистом SAP, таким как агонист SAP, описанный в настоящей заявке.
В некоторых вариантах осуществления изобретения указанный способ включает лечение фиброзного рака, такое как лечение любого из описанных здесь раковых заболеваний, не индуцирующее или не вызывающее миелосупрессию, ассоциированную с таким лечением. Другими словами, в некоторых вариантах осуществления изобретения способы согласно изобретению не индуцируют миелосупрессию или не приводят к ее прогрессированию по сравнению с миелосупрессией, которая наблюдалась до начала лечения. Миелосупрессия может быть оценена в соответствии с общей терминологией кодирования побочных эффектов (CTCAE) по 0-5-балльной шкале (см. National Cancer Institute Common Terminology Criteria for Adverse Events v4.0, NCI, NIH, DHHS. May 29, 2009 NIH publication #09-7473). В некоторых вариантах осуществления изобретения один или более признаков миелосупрессии, таких как анемия, не прогрессируют (например, побочные эффекты, получившие баллы от 3 до 4; от 2 до 3) в результате лечения.
В некоторых вариантах осуществления изобретения лечение агонистом SAP согласно изобретению дает профиль безопасности, который подтверждает возможность применения этого агониста как в монотерапии так и в комбинированной терапии.
В некоторых вариантах осуществления изобретения лечение включает введение агониста SAP в соответствии со схемой введения доз, такой как любая из схем введения доз, описанных в настоящей заявке. В некоторых вариантах осуществления изобретения термин «введение терапевтически эффективного количества» понятен специалистам и включает введение соответствующей дозы по определенной схеме, эффективной для достижения терапевтического эффекта, как описано в протоколе клинических исследований, в полном реестре лекарственных средств, и в руководстве для исследователя, или для улучшения показателей, по существу, известных специалистам в данной области и указывающих на улучшение состояния пациентов с соответствующим заболеванием. В некоторых вариантах осуществления изобретения агонист SAP, независимо от того, вводят ли его отдельно или как часть комбинированной терапии, может быть введен в соответствии с определенной схемой введения доз, а именно, схемой введения дозы менее, чем один раз в неделю. В некоторых вариантах осуществления изобретения такое менее частое введение доз осуществляют после введения первой ударной дозы, где, например, в течение первой недели курса лечения, агонист SAP вводят несколько раз.
В некоторых вариантах осуществления изобретения лечение способствует улучшению функции органа (например, терапевтическая эффективность включает улучшение функции органа; причем, введение агониста SAP отдельно или в комбинации с другими средствами способствует улучшению функции органа). В некоторых вариантах осуществления изобретения указанным органом является костный мозг, а улучшение функции органа оценивают по повышению уровня гемоглобина и/или тромбоцитов (например, повышение одного или обоих этих показателей означает улучшение функции органа, например, в случае тромбоцитов, увеличение уровня тромбоцитов означает увеличение числа тромбоцитов у индивидуумов с низким уровнем тромбоцитов, а в случае гемоглобина, увеличение уровня гемоглобина означает повышение гемоглобина у индивидуумов с низким уровнем гемоглобина). В некоторых вариантах осуществления изобретения лечение приводит к восстановлению нормальной ткани, например, благодаря снижению степени фиброза (например, терапевтическая эффективность включает восстановление нормальной ткани). В некоторых вариантах осуществления изобретения восстановление нормальной ткани оценивают путем определения степени фиброза костного мозга.
В настоящем изобретении рассматриваются все подходящие комбинации любых признаков согласно изобретению, таких как комбинации любых аспектов и вариантов осуществления изобретения. Так, например, в настоящем изобретении указано, что любые вышеупомянутые аспекты и варианты осуществления изобретения могут быть объединены друг с другом и/или с любыми другими описанными здесь вариантами. Так, например, агонисты SAP, описанные применительно к любой комбинации функциональных и/или структурных признаков, могут быть использованы отдельно или в комбинированной терапии, проводимой любыми описанными здесь способами, подходящими для лечения любых состояний у групп пациентов или у подгрупп пациентов, как описано в настоящей заявке.
Краткое описание чертежей
Фигура 1 представляет собой каскадный график, на котором показан процент изменения размера селезенки у индивидуумов с пальпируемой селезенкой, которые проходили лечение по схеме C6D29 (цикл 6, день 29), или по окончании обследования. На оси Y показан процент изменения размера селезенки по сравнению с базовым уровнем. На оси Х показано число обследуемых индивидуумов. Как показано на фигуре 1, уменьшение размера селезенки по сравнению с базовым уровнем даже за этот период времени наблюдалось по меньшей мере у одного пациента в каждой лечебной группе (например, у пациента, проходившего монотерапию и комбинированную терапию в соответствии с двумя различными схемами введения доз).
Фигура 2 представляет собой каскадный график, на котором показан процент изменения оценок общих симптомов MPN-SAF (TSS) у индивидуумов, которые проходили лечение по схеме C6D29 (цикл 6, день 29), или по окончании обследования. На оси Y показан процент изменения MPN-SAF (TSS) по сравнению с базовым уровнем. На оси Х показано число обследуемых индивидуумов. Как показано на фигуре 2, улучшение клинических показателей по сравнению с базовым уровнем даже за этот период времени наблюдалось по меньшей мере у одного пациента в каждой лечебной группе (например, у пациента, проходившего монотерапию и комбинированную терапию в соответствии с двумя различными схемами введения доз).
На фигуре 3 представлены диаграммы рассеяния с линиями тренда, где: (A) гемоглобиновый ответ, (B) тромбоцитарный ответ, (C) процент изменения оценок общих симптомов MPN-SAF (TSS) и (D) изменение размера селезенки у пациента 101-005 в течение 24-30-недельного курса монотерапии с использованием PRM-151. В течение всего курса лечения, у этого паицента наблюдалось повышение уровня гемоглобина и увеличение числа тромбоцитов, а также снижение оценок MPN-SAF TSS и уменьшение размера селезенки, как показал анализ, проводимый в течение указанного периода времени.
На фигуре 4A показано окрашивание биоптатов костного мозга ретикулином, взятых у пациента 101-005 в начале эксперимента (левая панель 4A) и после трехмесячной монотерапии с использованием PRM-151 (правая панель 4A). В течение всего курса лечения, у этого пациента наблюдалось снижение тяжести фиброза костного мозга с балла 2 до балла 0, как было оценено в эти два момента времени. На фигуре 4В показано окрашивание биоптатов костного мозга ретикулином, взятых у пациента 108-003 в начале эксперимента (левая панель 4В), после трехмесячного лечения с использованием PRM-151 (центральная панель 4В) и после 6-месячного лечения с использованием PRM-151 (правая панель 4В). В течение всего курса лечения, у этого пациента наблюдалось снижение тяжести фиброза костного мозга с балла 3 до балла 2, а затем с балла 2 до балла 1 как было оценено в эти три момента времени.
Подробное описание изобретения
Краткий обзор
Настоящее изобретение относится к новым терапевтическим схемам лечения фиброзного рака и ассоциированного с раком фиброза с использованием полипептида SAP или агониста SAP в виде одного агента или в комбинации с противораковым терапевтическим средством.
Настоящее изобретение основано на обнаружении того факта, что полипептид SAP или агонист SAP, если они используются в виде одного агента, могут способствовать эффективному лечению некоторых видов фиброзного рака, и что комбинированные стратегии лечения могут гарантировать излечение некоторых видов фиброзного рака. Различные раковые заболевания и пролиферативные состояния характеризуются присутствием плотной фиброзной ткани. Настоящее изобретение основано на обнаружении того факта, что комбинированные стратегии лечения могут гарантировать излечение фиброзных раковых заболеваний и фиброза, ассоциированного с раком. Одна из целей терапевтического лечения заключается в предупреждении или снижении избыточной аккумуляции фиброзной ткани благодаря проникновению противораковых терапевтических средств в раковые клетки. Другой целью терапевтического лечения является восстановление нормальной функции органа путем предупреждения или снижения избыточной аккумуляции фиброзной ткани.
Как правило, событиями, приводящими к развитию фиброза, являются по меньшей мере два главных события. Одним из таких событий является пролиферация и дифференцировка фиброцитов. Фиброциты представляют собой отдельную популяцию фибробласт-подобных клеток, происходящих от моноцитов периферической крови, которые обычно проникают в участки поражения ткани и стимулируют ангиогенез и заживление ран. Фиброциты играют важную роль в образовании опухолей, а в частности, ткани стромы в опухолях. Фиброциты дифференцируются из CD14+- моноцитов периферической крови, но могут также дифференцироваться из других МКПК. Присутствие SAP, IL-12, ламинина-1, анти-FcγR антител, перекрестно-связанного IgG и/или агрегированного IgG может приводить к ингибированию или по меньшей мере к частичному замедлению этого процесса.
Вторым главным событием является образование и сохранение фиброзной ткани. Фиброзная ткань может образовываться и сохраняться благодаря дифференцировке моноцитов в фиброциты, фибробласты, макрофаги или миофибробласты; рекрутингу и пролиферации фибробластов; образованию нового внеклеточного матрикса и росту новой сосудистой ткани. При патологическом фиброзе, возникающем, например, после хронического воспаления, повреждения, озлокачествования ткани или эссенциального фиброза, наблюдается избыточное образование фиброзной ткани, которое может приводить к повреждению и деструкции ткани.
Недавно было высказано предположение, что сывороточный амилоид P (SAP) или пентраксин-2 (PTX-2) могут быть использованы в качестве терапевтического средства для лечения различных расстройств, включая расстройства, ассоциированные с фиброзом, расстройства, ассоциированные с гиперчувствительностью, аутоиммунные заболевания, мукозит и воспалительные расстройства, такие как расстройства, вызываемые микробной инфекцией. См., например, патенты США NN 8247370 и 8497243 и заявки на патент США NN 12/720845 и 12/720847. Связывание SAP с FcγR приводит к продуцированию сигнала, ингибирующего дифференцировку фиброцитов, предшественников фиброцитов, предшественников миофибробластов и/или гемопоэтических предшественников моноцитов. Использование SAP и агонистов SAP в качестве терапевтических средств для лечения фиброза описано в патентах США NN 7763256 и 8247370, которые вводятся в настоящее описание посредством ссылки. В некоторых вариантах любых описанных здесь способов указанный способ включает введение SAP, такого как SAP, содержащий полипептид SAP (см. Примеры). В некоторых вариантах осуществления изобретения SAP представляет собой рекомбинантный человеческий SAP, также называемый рекомбинантным человеческим пентраксином-2, таким как рекомбинантный человеческий SAP, продуцируемый в клетках CHO. В некоторых вариантах осуществления изобретения полипептид SAP включает человеческий полипептид SAP, такой как человеческий полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования SAP, выделенного из человеческой сыворотки.
Настоящее изобретение относится к способам лечения фиброзного рака или фиброза, ассоциированного с раком. Этот способ обычно включает введение эффективного количества антифиброзного средства, такого как полипептид SAP или агонист SAP в виде одного агента или в комбинации с эффективным количеством противоракового терапевтического средства. Полипептид SAP или агонист SAP и противораковое терапевтическое средство могут быть нацелены на различные клеточные популяции. Так, например, полипептид SAP или агонист SAP могут быть нацелены на клетки, участвующие в регуляции фиброза, а противораковое терапевтическое средство может быть нацелено на раковые клетки. В выбранных вариантах осуществления изобретения эти компоненты могут быть приготовлены или введены в виде комбинированной композиции, либо они могут быть введены отдельно и/или независимо друг от друга, например, системно или в нужный(е) участок(участки). Такие способы включают способы лечения фиброза, ассоциированного с раком, или фиброзных раковых заболеваний (например, таких фиброзных раковых заболеваний, как миелофиброз, а также раковых заболеваний молочной железы, матки, поджелудочной железы или толстой кишки, включая фиброиды, фиброму, фиброаденому и фибросаркому).
В некоторых вариантах осуществления изобретения эффективным количеством полипептида SAP или агониста SAP является количество, которое, при его введении отдельно или в комбинированной терапии, является эффективным для снижения степени фиброза по меньшей мере приблизительно на 10%, а более предпочтительно, по меньшей мере приблизительно на 15%, 20%, 25%, 30%, 35%, 40%, 45% или даже по меньшей мере приблизительно на 50% или более по сравнению со степенью фиброза у индивидуума до проведения лечения с использованием полипептида SAP или агониста SAP. В некоторых вариантах осуществления изобретения полипептид SAP или агонист SAP представляет собой SAP, содержащий полипептид SAP, который, при его введении в соответствии со схемой введения доз и при его введении отдельно или в комбинированной терапии, является эффективным для снижения степени фиброза по меньшей мере приблизительно на 10%, а более предпочтительно, по меньшей мере приблизительно на 15%, 20%, 25%, 30%, 35%, 40%, 45%, или даже по меньшей мере приблизительно на 50% или более по сравнению со степенью фиброза у индивидуума до проведения лечения с использованием SAP.
В других своих вариантах настоящее изобретение относится к способам, которые включают введение синергической комбинации полипептида SAP или агониста SAP и противоракового терапевтического средства. Используемый здесь термин «синергическая комбинация» полипептида SAP или агониста SAP и противоракового терапевтического средства означает комбинированную дозу, которая является более эффективной для терапевтического или профилактического лечения, чем аддитивная эффективность лечения, которую можно предсказать или ожидать путем сложения эффективностей отдельных компонентов, используемых в комбинации, а именно: (i) терапевтической или профилактической эффективности, достигаемой при введении полипептида SAP или агониста SAP в той же самой дозе, в которой они используются при монотерапии, и (ii) терапевтической или профилактической эффективности, достигаемой при введении противоракового средства в той же самой дозе, которая используется при монотерапии.
В одном из примеров было показано, что введение полипептида SAP или агониста SAP, где агонист SAP включает гликозилированный полипептид SAP (например, SAP, содержащий гликозилированный полипептид SAP, например, гликозилированный полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования SAP, выделенного из человеческой сыворотки; рекомбинантный человеческий SAP, такой как рекомбинантный человеческий пентраксин-2 или PRM-151), приводит к ослаблению симптомов фиброзного рака (например, миелофиброза), к улучшению данных объективного обследования и улучшения показателей для форменных элементов крови в случае их аномального содержания, например, в случае анемии, тромбоцитопении, тромбоцитоза и лейкоцитоза по сравнению с их базовыми уровнями в начале терапии. Было также показано, что введение комбинации полипептида SAP или агониста SAP, такого как агонист SAP, содержащий гликозилированный полипептид SAP (например, SAP, содержащий гликозилированный полипептид SAP, например, гликозилированный полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования SAP, выделенного из человеческой сыворотки; рекомбинантный человеческий SAP, такой как рекомбинантный человеческий пентраксин-2 или PRM-151), и противоракового терапевтического средства (например, ингибитора JAK-киназы, такого как руксолитиниб), приводит к ослаблению симптомов фиброзного рака (например, миелофиброза), к ослаблению спленомегалии и к улучшению показателей для форменных элементов крови в случае их аномального содержания, например, в случае анемии, тромбоцитопении, тромбоцитоза и лейкоцитоза по сравнению с их базовыми уровнями. Способы согласно изобретению также основаны на обнаружении того факта, что полипептид SAP или агонист SAP согласно изобретению хорошо переносятся пациентом при их введении отдельно и в комбинации с другим противораковым терапевтическим средством, и при этом не наблюдается какой-либо клинически значимой миелосупрессии, вызываемой лечением с использованием SAP или ассоциированной с таким лечением (например, не наблюдается миелосупрессии, ассоциированной с лечением). В некоторых вариантах осуществления изобретения, после лечения было достигнуто фактическое улучшение показателей в отношении миелосупрессии, такого как анемия. Комбинированная терапия не всегда является эффективной, однако, она может оказаться подходящей для пациентов, у которых наблюдается снижение эффективности при введении только одного дополнительного противоракового терапевтического средства. Кроме того, комбинированная терапия также способствует снижению некоторых побочных эффектов, которые часто наблюдаются у пациентов, проходящих лечение только одним противораковым терапевтическим средством. В этом случае, у пациентов, которые проходили лечение только руксолитинибом (ингибитором Янус-киназы) до введения SAP в соответствии с определенной схемой терапии, наблюдалось ослабление симптомов анемии и тромбоцитопении, на что указывало увеличение уровней гемоглобина и числа тромбоцитов, по сравнению с симптомами побочных эффектов, наблюдаемых у этих пациентов до введения SAP (например, по сравнению с симптомами, наблюдаемыми при лечении только ингибитором Янус-киназы). Эти результаты продемонстрировали не только эффективность SAP, используемого в монотерапии или в комбинированной терапии для лечения фиброзного рака, но также и возможность использования SAP в целях расширения терапевтического «окна» и группы пациентов при проведении другой терапии для разработки способов лечения пациентов и подгрупп пациентов, у которых стандартное лечение не давало результатов или давало неадекватные результаты, или для повышения профиля безопасности доступной терапии, которая сама по себе является эффективной. Кроме того, было показано, что введение полипептида SAP или агониста SAP, такого как SAP, содержащий гликозилированный полипептид SAP, в виде одного агента или как часть комбинированной терапии, приводит к снижению степени фиброза органов, к восстановлению функции органов и к ослаблению симптомов фиброзного рака. Способность SAP точно нацеливаться на основные участки фиброзных патологий подтверждает возможность его эффективного применения для лечения фиброза и индуцирования его обратного развития при фиброзных раковых заболеваниях широкого ряда.
Определения
Если это не оговорено особо, то все технические и научные термины, используемые в настоящей заявке, имеют значения, в основном, понятные среднему специалисту в области, к которой относится настоящее изобретение. Используемая здесь номенклатура и лабораторные процедуры по культивированию клеток, молекулярной генетике, органической химии, химии нуклеиновых кислот и гибридизации нуклеиновых кислот в общих чертах известны и широко используются специалистами. Для синтеза нуклеиновых кислот и пептидов используются стандартные методики. Эти методики и процедуры обычно осуществляют стандартными методами, известными специалистам и описанными в различных общих руководствах (например, Sambrook et al., 1989, Molecular Cloning: A Laboratory Manual, 2d ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.), указанных в описании настоящей заявки.
Употребляемые здесь артикли «а» и «an» относятся к одному или более, чем одному (то есть, по меньшей мере к одному) грамматическому объекту, с которым употребляется данный артикль. Так, например, слово «элемент», употребляемый с артиклем «an» («an element»), означает один элемент или более чем один элемент.
Используемый здесь термин «приблизительно» означает число в пределах величин плюс или минут 10% от указанного числового значения. Поэтому, термин «приблизительно 50%» означает величину в пределах от 45% до 55%.
Используемый здесь термин «по существу» означает «в основном», но не полностью. Так, например, словосочетание «по существу, аналогичный», если оно относится к нуклеотидной последовательности, означает, что данная последовательность, в основном, идентична другой указанной нуклеотидной последовательности для того же самого белка или пептида, однако, эта нуклеотидная последовательность может включать любое число замен или мутаций, которые не влияют на структуру или функцию полученного белка.
Термин «введение», если он употребляется вместе с терапевтическим средством, означает введение терапевтического средства непосредственно в ткань-мишень или нанесение этого средства на ткань-мишень, или введение терапевтического средства пациенту, где такое терапевтическое средство благоприятно влияет на ткань, в которую его вводят. Таким образом, используемый здесь термин «введение», если он употребляется вместе с полипептидом SAP или агонистом SAP, может включать, но не ограничивается ими, доставку полипептида SAP или агониста SAP индивидууму путем системного введения, например, внутривенной инъекции (например, которая может представлять собой внутривенное вливание), так, чтобы это терапевтическое средство достигало ткани-мишени. «Введение» композиции может быть осуществлено, например, внутривенно, подкожно, внутримышечно или путем инъекции в участок поражения, перорально, местно или методами, осуществляемыми в комбинации с другими известными методами. Такие комбинированные методы включают нагревание, облучение, обработку ультразвуком и использование агентов для доставки. При введении более чем одного другого терапевтического средства, такие средства могут быть введены одним и тем же или различными способами введения и/или в одно и то же время или в различные периоды времени. Как известно специалистам, такое средство может быть введено в соответствии с определенной схемой введения доз.
Термин «доставка», если он употребляется вместе с терапевтическим средством, означает введение терапевтического средства непосредственно в ткань-мишень или нанесение этого средства на ткань-мишень, или введение терапевтического средства пациенту, где такое терапевтическое средство благоприятно влияет на ткань, в которую его вводят.
Используемый здесь термин «улучшение» имеет тот смысл, что в настоящее изобретение могут быть внесены изменения, приводящие к улучшению свойств и/или физических признаков ткани, в которую доставляют или вводят лекарственное средство, или на которую наносят это лекарственное средство. Термин «улучшение» может также относиться к патологическому состоянию, и в этом случае, он означает «ослабление» симптомов патологического состояния или улучшение физических параметров, ассоциированных со снижением тяжести патологического состояния, ослаблением его симптомов или его предотвращением.
Используемый здесь термин «выделенный» означает искусственно модифицированный или удаленный из его природного окружения. Так, например, SAP, обычно присутствующий в организме животного, не является «выделенным», но синтетический полипептид SAP или полипептид SAP, который был частично или полностью отделен от компонентов его природного окружения, является «выделенным». Выделенный полипептид SAP может существовать, в основном, в очищенной форме, либо он может присутствовать в его неприродном окружении, например, в клетке, в которую он был введен.
Используемые здесь термины «миметик», «пептидный миметик» и «пептидомиметик» являются синонимами и обычно означают пептид, неполный пептид или непептидную молекулу, которые имитируют третичную связывающую структуру или активность выбранного нативного пептида или функционального домена белка (например, связывающего мотива или активного центра). Эти пептидные миметики включают рекомбинантно или химически модифицированные пептиды, а также непептидные агенты, такие как низкомолекулярные лекарственные средства-миметики, более подробно описанные ниже.
Используемый здесь термин «нуклеиновая кислота» означает полинуклеотид, такой как дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК), в соответствии с контекстом. Также очевидно, что этот термин может включать, в качестве эквивалентов, аналоги РНК или ДНК, полученные из нуклеотидных аналогов, а в некоторых вариантах осуществления изобретения одноцепочечный полинуклеотид (такой как смысловой или антисмысловой полинуклеотид) и двухцепочечный полинуклеотид.
Термин «необязательный» или «необязательно» означает, что описанные здесь события или случаи могут происходить, а могут и не происходить, и этот термин охватывает случаи, когда данное событие происходит, и случаи, когда оно не происходит.
Используемые здесь термины «пептиды», «белки» и «полипептиды» являются синонимами. Термин «очищенный белок» означает препарат белка или белков, которые были, предпочтительно, выделены из других белков или, по существу, не содержат других белков, обычно ассоциированных с указанным(ми) белком(ами), присутствующим(ми) в клетке или в клеточном лизате. Термин «по существу не содержит других клеточных белков» или «по существу не содержит других примесных белков» определяют как отдельные препараты каждого из белков, содержащих менее чем 20% (по сухой массе) примесного белка, а предпочтительно менее чем 5% примесного белка. Функциональные формы каждого из этих белков могут быть получены в виде очищенных препаратов с использованием клонированного гена как хорошо известно специалистам. Термин «очищенный» означает, что указанная молекула почти не содержит других биологических макромолекул, таких как другие белки (а в частности, не содержит других белков, которые могут значительно маскировать, снижать, скрывать или изменять свойства белков-компонентов, служащих в качестве очищенных препаратов, или их функции в рассматриваемой разведенной смеси). Используемый здесь термин «очищенный», предпочтительно, относится к биологическим макромолекулам одного и того же типа, составляющим по меньшей мере 80% по сухой массе, более предпочтительно 85 масс.%, еще более предпочтительно в пределах 95-99 масс.%, а наиболее предпочтительно по меньшей мере 99,8% по сухой массе (но при этом, могут присутствовать вода, буферы и другие небольшие молекулы, а в частности, молекулы, имеющие молекулярную массу менее, чем 5000). Используемый здесь термин «чистый» предпочтительно означает численные пределы массы вещества, определяемые вышеописанным термином «очищенный».
Термины «фармацевтически приемлемый», «физиологически допустимый» и их грамматические формы, если они относятся к композициям, носителям, разбавителям и реагентам или другим ингредиентам препарата, могут быть использованы как синонимы, и означают, что такие вещества, при их введении реципиенту, не дают каких-либо нежелательных физиологических эффектов, таких как тошнота, головокружение, сыпь, расстройство желудка или другие побочные эффекты.
Термин «фармацевтически приемлемые соли» включает кислотно-аддитивные и основно-аддитивные соли. Термин «фармацевтически приемлемая кислотно-аддитивная соль» означает соли, которые сохраняют биологическую эффективность и свойства свободных оснований и не оказывают биологического или какого-либо другого нежелательного действия, и которые образованы неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, угольная кислота, фосфорная кислота и т.п. Органические кислоты могут быть выбраны из алифатических, циклоалифатических, ароматических, аралифатических, гетероциклических, карбоновых и сульфоновых классов органических кислот, таких как муравьиная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, глюконовая кислота, молочная кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, аспарагиновая кислота, аскорбиновая кислота, глутаминовая кислота, антраниловая кислота, бензойная кислота, коричная кислота, миндальная кислота, эмбоновая кислота, фенилуксусная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота и т.п.
Используемый здесь термин «фармацевтически приемлемые соли, сложные эфиры, амиды и пролекарства» означает карбоксилатные соли, соли присоединения аминокислот, сложные эфиры, амиды и пролекарства соединений, которые используются в соответствии со стандартной медицинской практикой и могут контактировать с тканями пациентов без какой-либо нежелательной токсичности, раздражения, аллергической реакции и т.п., а также соответствуют критериям оптимального отношения «польза/риск» и являются эффективными для их применения в нужных целях, причем, указанный термин также включает, если это возможно, цвиттерионные формы соединений согласно изобретению.
Используемый здесь термин «терапевтический» относится к средству, используемому для лечения, устранения, ослабления симптомов, предупреждения или подавления нежелательного состояния или заболевания у пациента. В частности, в некоторых своих вариантах, настоящее изобретение относится к лечению рака, миелопролиферативных заболеваний или заболеваний, ассоциированных с аберрантной пролиферацией клеток.
«Терапевтически эффективное количество» или «эффективное количество» композиции представляет собой предварительно определенное количество, вводимое для достижения желаемого результата. Активность, рассматриваемая в способах согласно изобретению, включает консервативное, терапевтическое и/или профилактическое лечение, если это необходимо. Конкретная доза соединения согласно изобретению, вводимая для достижения терапевтических и/или профилактических эффектов, может быть определена в зависимости от конкретных факторов, включая, например, тип вводимого соединения, способ введения и состояние, подвергаемое лечению. Терапевтически эффективное количество соединения согласно изобретению обычно представляет собой такое количество, которое, при его введении в виде композиции, содержащей физиологически приемлемый носитель, является достаточным для достижения желаемого эффекта. Терапевтически эффективное количество может быть введено в соответствии с определенной схемой введения доз.
«N-связанные» олигосахариды представляют собой олигосахариды, которые связаны с пептидным остовом посредством аспарагина, например, аспарагин-N-ацетилглюкозаминовой связи. N-связанные олигосахариды также называются «N-гликанами». Природные N-связанные олигосахариды имеют общую пентасахаридную сердцевину Man[(α1,6-)-(Man(α1,3)]-Man(β1,4)-GlcNAc(β1,4)-GlcNAc(β1,N). Они отличаются наличием и числом ветвей (также называемых «антеннами») периферических сахаров, таких как N-ацетилглюкозамин, галактоза, N-ацетилгалактозамин, фукоза и сиаловая кислота. Эта структура может также содержать, но необязательно, сердцевинную молекулу фукозы и/или молекулу ксилозы.
Термин «сиаловая кислота» означает любой член семейства 9-углеродных карбоксилированных сахаров. Наиболее распространенным членом семейства сиаловых кислот является N-ацетил-нейраминовая кислота (часто обозначаемая Neu5Ac, NeuAc или NANA). Вторым членом такого семейства является N-гликолил-нейраминовая кислота (Neu5Gc или NeuGc), в которой N-ацетильная группа NeuAc является гидроксилированной. Третьим членом семейства сиаловых ксилот является 2-кето-3-дезокси-нонулозоновая кислота (KDN) (Nadano et al. (1986) J. Biol. Chem. 261: 11550-11557; Kanamori et al., J. Biol. Chem. 265: 21811-21819 (1990)). В это семейство также входят 9-замещенные сиаловые кислоты, такие как 9-O-C1C6-ацил-Neu5Ac, например, 9-O-лактил-Neu5Ac или 9-O-ацетил-Neu5Ac, 9-дезокси-9-фтор-Neu5Ac и 9-азидо-9-дезокси-Neu5Ac. Описание семейства сиаловых кислот можно найти, например, в публикации Varki, Glycobiology 2: 25-40 (1992); Sialic Acids: Chemistry, Metabolism and Function, R. Schauer, Ed. (Springer-Verlag, New York (1992)).
«Генетически сконструированной» или «рекомбинантной» клеткой является клетка, имеющая в своем генетическом материале одну или более модификаций. Такими модификациями являются, но не ограничиваются ими, инсерции генетического материала, делеции генетического материала и инсерция генетического материала, который находится вне хромосомы, независимо от того, является ли такой материал стабильным или нет.
Используемый здесь термин «модифицированный сахар» означает природный или неприродный углевод, который подвергают ферментативному присоединению к аминокислотному или гликозильному остатку пептида способом согласно изобретению. Модифицированный сахар выбран из ряда субстратов фермента, включая, но не ограничиваясь ими, сахарные нуклеотиды (моно-, ди- и три-фосфаты), активированные сахара (например, гликозилгалогениды, гликозилмезилаты) и сахара, которые не являются активированными и не являются нуклеотидами. «Модифицированный сахар» может быть ковалентно функционализирован «модифицирующей группой». Подходящими модифицирующими группами являются, но не ограничиваются ими, водорастворимые полимеры и не растворимые в воде полимеры, терапевтические молекулы, диагностические молекулы и биомолекулы. Сайт функционального присоединения модифицирующей группы выбирают так, чтобы это не препятствовало ферментативному присоединению «модифицированного сахара» к пептиду или гликозильному остатку пептида.
Полипептиды SAP и агонисты SAP
В одном из своих аспектов, настоящее изобретение относится к полипептидам SAP или к агонистам SAP, используемым для лечения фиброзного рака и ассоциированного с раком фиброза. Агонисты SAP включают все соединения и композиции, которые усиливают или как-либо иначе имитируют передачу сигнала эндогенного SAP, включая соединения, повышающие активность SAP. В настоящей заявке приводится описание «полипептидов SAP или агонистов SAP» или «полипептидов SAP или агонистов SAP согласно изобретению». Если это не оговорено особо, то при употреблении этих терминов подразумевается использование любых описанных здесь агонистов SAP, включая использование рекомбинантного SAP, например, пентамерного SAP, содержащего полипептид SAP, а именно, человеческий SAP, где указанный полипептид SAP имеет характер гликозилирования, отличающийся от характера гликозилирования SAP, выделенного из человеческой сыворотки. В настоящем изобретении также рассматривается применение любых описанных здесь полипептидов SAP и агонистов SAP в любых описанных здесь способах, включая их применение в монотерапии или в комбинированной терапии.
SAP
SAP или пентраксин-2 представляет собой природный сывороточный белок млекопитающих, состоящий из пяти идентичных субъединиц или протомеров, которые нековалентно связаны друг с другом и образуют дископодобный комплекс. SAP принадлежит к суперсемейству белков пентраксинов, характеризующихся циклической пентамерной структурой. Классическими короткими пентраксинами являются SAP, а также С-реактивный белок (Osmand, A.P., et al., Proc. Nat. Acad. Sci., 74: 739-743, 1997). Длинноцепочечными пентраксинами является пентраксин-3. SAP обычно синтезируется в печени, и его физиологическое время полужизни составляет 24 часа. Человеческий SAP (hSAP) циркулирует в плазме как гомопентамер, и его концентрация составляет приблизительно 20-40 мкг/мл. Последовательность субъединицы человеческого SAP описана в последовательности SEQ ID NO:1, которая соответствует аминокислотам 20-223 Genbank рег. NO. NP_001630 (сигнальная последовательность не приводится).
Ранее проводимые исследования продемонстрировали, что SAP играет важную роль в инициации и регуляции фаз иммунного ответа. Функции hSAP заключаются в его природной резистентности к микробам и в акцептировании и фагоцитозе клеточного дебриса, и вероятно, hSAP играет определенную роль в заживлении ран и подавлении фиброза. Эти функции могут включать (i) связывание с лигандами, ассоциированными с микробами и клеточным дебрисом, как указывалось выше, и с различными белками внеклеточного матрикса по Ca2+-зависимому механизму, (ii) связывание с Clq для активации комплемента посредством стимуляции опсонизации белками C3b и iC3b, (iii) связывание с Fcγ-рецепторами для инициации прямой опсонизации и последующего фагоцитоза или эндоцитоза, и (iv) последующую регуляцию функции и дифференцировки моноцитов. В соответствии с этим, молекулы hSAP локализуются на участках поражения и репарации и могут доставляться в эти участки и/или концентрироваться в этих участках посредством связывания с такими молекулами.
3D-структура hSAP была определена с помощью рентгеновской кристаллографии, и было также представлено несколько кристаллических структур, образующих комплексы с различными лигандами. Пентамерная структура hSAP имеет 5-складчатую круговую симметрию и достаточно ригидную пористость. Диаметр пентамера hSAP составляет приблизительно 100
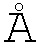
N- и C-концы являются доступными для растворителя и расположены на внутреннем крае каждой протомерной молекулы. N-конец расположен на внешнем крае каждого протомера и по периметру кольца, образованного 5 протомерами. C-конец расположен ближе к внутреннему периметру и поре пентамерного конца, но он простирается за пределы А-поверхности. N- и C-концы, присутствующие в одном протомере, расположены на расстоянии приблизительно 25
SAP, рассматриваемый в описанных здесь вариантах осуществления изобретения, включает SAP, происходящий от любого источника, такого как, например, человеческий SAP или его изомеры или аналоги, происходящие от других позвоночных или млекопитающих. Кроме того, SAP включает молекулы SAP, имеющие модификации в нативной аминокислотной последовательности PTX-2, введенные, например, посредством сайт-направленного мутагенеза. Такие модификации могут приводить к замене конкретных аминокислот и/или изменять другие признаки молекулы, но, при этом, сохранять общую пентамерную природу молекулы пентраксина. Термин «SAP» может включать пентамеры SAP и протомеры SAP. Термин «пентамер SAP» или «пентамерный SAP» означает белковый комплекс, включающий по меньшей мере пять протомеров SAP, а «протомер SAP» означает одну отдельную белковую единицу пентамера SAP. В некоторых вариантах любого из своих аспектов и вариантов настоящее изобретение включает введение агониста SAP, где указанный агонист SAP включает пентамер SAP, содержащий полипептид SAP, имеющий аминокислотную последовательность, представленную в SEQ ID NO:1. В некоторых вариантах осуществления изобретения полипептид SAP включает рекомбинантный человеческий SAP. Репрезентативный рекомбинантный человеческий SAP включает PRM-151. В некоторых вариантах осуществления изобретения агонист SAP включает рекомбинантный SAP. В общих чертах, методы получения белков, а в частности, рекомбинантного человеческого пентраксина-2, известны специалистам. Для этого могут быть отобраны клетки, подходящие для рекомбинантной экспрессии, такие как клетки насекомых или млекопитающих.
Модификация гликановой структуры на человеческом полипептиде SAP может приводить к повышению биологической активности полипептида SAP по сравнению с биологической активностью соответствующего образца SAP дикого типа, выделенного из человеческой сыворотки. SAP, выделенный из человеческой сыворотки, содержит только остатки α2,6-связанной сиаловой кислоты. В противоположность этому, рекомбинантный человеческий SAP (rhSAP), продуцируемый в клетках CHO, содержит только остатки α2,3-связанной сиаловой кислоты. В биоанализах, проводимых с использованием клеток in vitro, было продемонстрировано, что полипептиды SAP, имеющие α2,3-связанную сиаловую кислоту, обладают, соответственно, более высокой активностью, чем SAP дикого типа (то есть, SAP, содержащий α2,6-связанную сиаловую кислоту), выделенный из человеческой сыворотки. Вариант полипептида SAP согласно изобретению, используемый в качестве терапевтического средства, является более эффективным, что обусловлено его более высокой биологической активностью. Так, например, более активные варианты SAP могут быть введены в меньших дозах и/или с меньшей частотой, чем SAP дикого типа, выделенный из человеческой сыворотки. Настоящее изобретение относится к вариантам человеческих полипептидов SAP и к способам их получения. В частности, настоящее изобретение включает способы и композиции, где указанные композиции содержат сахарные остатки с добавлениями, делециями или модификациями in vitro и in vivo и используются для продуцирования человеческого полипептида SAP, имеющего нужный паттерн гликозилирования.
Варианты полипептидов SAP
В частности, настоящее изобретение относится к вариантам полипептидов сывороточного амилоида Р (SAP), используемым для лечения фиброзного рака и ассоциированного с раком фиброза. В частности, вариантами SAP согласно изобретению являются гликозилированные человеческие полипептиды SAP, содержащие одну или более N-связанных или O-связанных олигосахаридных цепей, каждая из которых независимо имеет одну, две, три, четыре или пять ветвей, заканчивающихся молекулой α2,3-связанной сиаловой кислоты. В некоторых вариантах осуществления изобретения все сиалилированные ветви N-связанных или O-связанных олигосахаридных цепей заканчиваются α2,3-связанными группами. Другими вариантами SAP согласно изобретению являются гликозилированные человеческие полипептиды SAP, содержащие N-связанные или O-связанные олигосахаридные цепи, имеющие по меньшей мере на 20%, 25%, 30%, 35% 40%, 45%, 50%, 55%, 60%, 65% 75%, 80%, 85% или даже по меньшей мере на 95% меньше молекул α2,6-связанной сиаловой кислоты, чем полипептид SAP дикого типа, происходящий от человеческой сыворотки. В некоторых вариантах осуществления изобретения N-связанные или O-связанные олигосахаридные цепи, по существу, не содержат молекул α2,6-связанной сиаловой кислоты. Гликозилированные варианты полипептидов SAP согласно изобретению могут содержать N-связанную или O-связанную олигосахаридную цепь, имеющую одну или более ветвей (например, имеющих биантеннальную, триантеннальную, тетраантеннальную, пентаантеннальную структуру и т.п.). В некоторых вариантах осуществления изобретения полипептиды SAP согласно изобретению содержат N-связанную или O-связанную олигосахаридную цепь, где одна, две, три, четыре или пять ветвей олигосахаридной цепи, по существу, не содержат галактозы и N-ацетилглюкозамина. Некоторые полипептиды SAP согласно изобретению имеют N-связанные или O-связанные олигосахаридные цепи, которые, по существу, не содержат галактозы и N-ацетилглюкозамина. В некоторых вариантах осуществления изобретения полипептиды SAP согласно изобретению содержат N-связанную или O-связанную олигосахаридную цепь, где одна, две, три, четыре или пять ветвей олигосахаридной цепи содержат один или более маннозных остатков. В некоторых вариантах осуществления изобретения полипептид SAP согласно изобретению содержит N-связанный олигосахарид, имеющий пентасахаридную сердцевину Man[(α1,6-)-(Man(α1,3)]-Man(β1,4)-GlcNAc(β1,4)-GlcNAc(β1,N)-Asn. Эта пентасахаридная сердцевина также содержит один или более остатков фукозы или ксилозы. В некоторых вариантах осуществления изобретения полипептиды SAP согласно изобретению содержат N-связанную олигосахаридную цепь, где одна, две, три, четыре или пять ветвей олигосахаридной цепи имеют структуру NeuNAc2α3Galβ4GlcNAcβ2Manα6. Полипептиды SAP согласно изобретению могут также содержать N-связанную олигосахаридную цепь, где все ветви имеют структуру NeuNAc2α3Galβ4GlcNAcβ2Manα6.
Варианты полипептидов SAP согласно изобретению могут содержать один или более «модифицированных» сахарных остатков. Модифицированные сахара заменяют в любом положении, подходящем для присоединения модифицирующей молекулы или группы, и позволяющем этому сахару функционировать в качестве субстрата для фермента, используемого для связывания модифицированного сахара с пептидом. Модифицирующая группа может быть присоединена к сахарной молекуле ферментативным способом, химическим способом или комбинированными способами с получением модифицированного сахара, например, модифицированной галактозы, фукозы или сиаловой кислоты. Модифицирующие группы, подходящие для использования в настоящем изобретении, а также способы конъюгирования этих модифицирующих групп с сахарными остатками описаны в нижеследующем разделе.
В некоторых вариантах осуществления изобретения полипептиды SAP согласно изобретению могут включать аминокислотные последовательности, которые по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентичны аминокислотной последовательности SEQ ID NO:1, как было определено с помощью компьютерной программы FASTDB, созданной на основе алгоритма, описанного Brutlag et al. (Comp. App. Biosci., 6:237-245 (1990)). В конкретном варианте осуществления изобретения параметрами, используемыми для вычисления процента идентичности и сходства выравниваемых аминокислотных последовательностей, являются: матрица=PAM 150, k-разрядная кодовая комбинация (k-tuple)=2, штраф за несоответствие=1, штраф за добавление=20, длина группы рандомизации=0, «цена» отсечки=1, штраф за пробел=5 и штраф за размер пробелов=0,05.
Полипептиды, имеющие по меньшей мере 95%-ную идентичность с последовательностью SEQ ID NO:1, могут включать полипептиды с консервативными заменами в дивергентных областях. Термин «полипептид SAP» включает функциональные фрагменты и гибридные белки, содержащие любой из этих полипептидов. Вообще говоря, полипептид SAP является растворимым в водных растворах при биологически релевантных температурах, величинах рН и величинах осмолярности. Протомеры SAP, которые нековалентно связываются друг с другом с образованием пентамерного комплекса SAP, могут иметь идентичные аминокислотные последовательности и/или посттрансляционные модификации, или, альтернативно, отдельные протомеры SAP, присутствующие в одном комплексе, могут иметь различные последовательности и/или модификации. Термин «полипептид SAP» включает полипептиды, содержащие любой природный полипептид SAP, а также любые его варианты (включая мутанты, фрагменты и гибриды). Полипептидом SAP согласно изобретению может быть рекомбинантный полипептид. В предпочтительных вариантах осуществления изобретения полипептидом SAP согласно изобретению является человеческий полипептид SAP.
В некоторых своих вариантах настоящее изобретение относится к фармацевтическим композициям, содержащим вариант полипептида SAP согласно изобретению или его функциональный фрагмент. В некоторых аспектах изобретения аминокислотная последовательность варианта SAP может отличаться от последовательности SEQ ID NO:1 присутствием одной или более консервативных или неконсервативных замен. В других аспектах изобретения аминокислотная последовательность варианта SAP может отличаться от последовательности SEQ ID NO:1 присутствием одной или более консервативных замен. Используемый здесь термин «консервативные замены» означает остатки, которые имеют физиологическое или функциональное сходство с соответствующими исходными остатками, то есть, остаток, используемый в качестве консервативной замены, и исходный остаток имеет одинаковые размеры, формы, электрические заряды и химические свойства, включая способность образовывать ковалентные или водородные связи или т.п. Предпочтительными консервативными заменами являются замены, удовлетворяющие критериям, определенным для допустимых точковых мутаций, как описано в публикации Dayhoff et al., Atlas of Protein Sequence and Structure 5:345-352 (1978 & Supp.). Примерами консервативных замен являются замены внутри следующих групп: (a) валин, глицин; (b) глицин, аланин; (c) валин, изолейцин, лейцин; (d) аспарагиновая кислота, глутаминовая кислота; (e) аспарагин, глутамин; (f) серин, треонин; (g) лизин, аргинин, метионин; и (h) фенилаланин, тирозин. Дополнительное руководство, относящееся к заменам аминокислот, которые, вероятно, ответственны за фенотипический сайленсинг, можно найти в публикации Bowie et al., Science 247:1306-1310 (1990).
Варианты полипептидов SAP и их фрагментов, которые сохраняют свою биологическую функцию, могут быть использованы в описанных здесь фармацевтических композициях и способах. В некоторых вариантах осуществления изобретения вариант полипептида SAP или его фрагмент связываются с FcγRI, FcγRIIA и/или FcγRIIIB. В некоторых вариантах осуществления изобретения вариант полипептида SAP или его фрагмент ингибируют дифференцировку одного или более фиброцитов, предшественников фиброцитов, предшественников миофибробластов и/или предшественников гемопоэтических моноцитов. Варианты SAP могут быть получены путем модификации структуры полипептида SAP в целях повышения терапевтической эффективности или стабильности (например, увеличения срока хранения ex vivo и повышения резистентности к протеолитическому расщеплению in vivo).
В некоторых аспектах изобретения варианты полипептида SAP согласно изобретению могут включать, помимо любых полипептидов, которые обычно присутствуют в полипептиде SAP, посттрансляционные модификации. Такими модификациями являются, но не ограничиваются ими, ацетилирование, карбоксилирование, гликозилирование (например, O-связанные олигосахариды, N-связанные олигосахариды и т.п.), фосфорилирование, липидизация и ацилирование. В результате этого, модифицированный полипептид SAP может содержать не-аминокислотные элементы, такие как полиэтиленгликоли, липиды, поли- или моносахариды и фосфаты.
Методы продуцирования вариантов полипептида hSAP с измененным характером N-гликозилирования описаны в заявке на патент США 12/794132, которая вводится в настоящее описание посредством ссылки.
В некоторых аспектах изобретения одна или более из описанных здесь модификаций полипептида SAP могут повышать стабильность полипептида SAP. Так, например, такие модификации могут увеличивать время полужизни полипептида SAP in vivo или снижать степень протеолитического расщепления полипептида SAP.
В некоторых аспектах изобретения вариантами полипептидов SAP согласно изобретению являются гибридные белки, имеющие по меньшей мере часть человеческого полипептида SAP и один или более гибридных доменов или гетерологичных частей. Хорошо известными примерами таких гибридных доменов являются, но не ограничиваются ими, полигистидин, Glu-Glu, глутатион-S-трансфераза (GST), тиоредоксин, белок A, G-белок и константная область тяжелой цепи иммуноглобулина (Fc), белок, связывающийся с мальтозой (MBP) или альбумин человеческой сыворотки. Гибридный домен может быть выбран так, чтобы он сообщал нужные свойства. Так, например, некоторые гибридные домены являются особенно подходящими для выделения гибридных белков с помощью аффинной хроматографии. Для аффинной очистки используются матрицы, подходящие для проведения аффинной хроматографии, такие как смолы, конъюгированные с глутатионом, амилазой, никелем или кобальтом. В другом примере гибридный домен может быть выбран так, чтобы он облегчал детектирование полипептидов SAP. Примерами таких детектирующих доменов являются различные флуоресцентные белки (например, GFP), а также «эпитопные метки», которые обычно представляют собой короткие пептидные последовательности, доступные для специфического антитела. Хорошо известными эпитопными метками, которые являются легко доступными для специфических моноклональных антител, являются FLAG, гемагглютинин вируса гриппа (HA) и c-myc-метки. В некоторых случаях, гибридные домены имеют сайт расщепления протеазой, что позволяет соответствующей протеазе частично гидролизовать гибридные белки и высвобождать рекомбинантный белок. Затем высвобожденные белки могут быть выделены из гибридного домена путем хроматографического разделения. В некоторых случаях полипептид SAP может быть присоединен к гетерологичному домену, который стабилизирует полипептид SAP in vivo. Термин «стабилизирующий» относится к какому-либо увеличению времени полужизни в сыворотке, независимо от того, наблюдается ли при этом снижение деструкции, снижение клиренса из печени и/или почек или другой фармакокинетический эффект. Известно, что гибриды с Fc-частью иммуноглобулина и сывороточного альбумина придают повышенную стабильность.
Очевидно, что различные элементы гибридных белков могут быть расположены в любом порядке, обеспечивающем нужную функциональность. Так, например, полипептид SAP может находиться у С-конца по отношению к гетерологичному домену, или альтернативно, гетерологичный домен может находиться у С-конца по отношению к полипептиду SAP. Полипептид SAP и гетерологичный домен необязательно должны быть смежными в гибридном белке, и у С- или N-конца или между доменами могут присутствовать дополнительные домены или аминокислотные последовательности (например, линкерные последовательности).
Полипептиды SAP согласно изобретению могут включать один или более «модифицированных» сахарных остатков. Модифицирующая группа может быть присоединена к сахарной молекуле ферментативным способом, химическим способом или комбинированными способами с получением модифицированного сахара, например, модифицированной галактозы, фукозы или сиаловой кислоты. В методах, проводимых с применением модифицированной сиаловой кислоты, может быть использована сиалилтрансфераза или транс-сиалидаза. Сахара могут быть замещены в любом положении, подходящем для присоединения модифицирующей молекулы и позволяющем этому сахару функционировать в качестве субстрата для фермента, используемого для связывания модифицированного сахара с пептидом.
Вообще говоря, сахарную группу и модифицирующую группу присоединяют друг к другу посредством реакционноспособных групп, которые в процессе связывания обычно превращаются в новую органическую функциональную группу или в непрореагировавшую группу. Функциональная(ые) группа(ы), реагирующая(ые) с сахаром, может (могут) присутствовать в любом положении на сахарной молекуле. Реакционноспособные группы и классы реакций, используемые для осуществления настоящего изобретения, по существу, хорошо известны специалистам в области химии биоконъюгатов. В данном случае, предпочтительными классами реакций взаимодействия с реакционноспособными сахарными группами являются реакции, которые протекают в относительно мягких условиях. Такими реакциями являются, но не ограничиваются ими, реакции нуклеофильного замещения (например, реакции аминов и спиртов с ацилгалогенидами, активными сложными эфирами), реакции электрофильного замещения (например, енаминовые реакции) и реакции присоединения углерод-углеродных связей и кратных связей углерод-гетероатом (например, реакция Михаэля, реакция присоединения Дильса-Альдера). Эти и другие подходящие реакции обсуждаются, например, в публикациях Smith and March, Advanced Organic Chemistry, 5th Ed., John Wiley & Sons, New York, 2001; Hermanson, Bioconjugate Techniques, Academic Press, San Diego, 1996; и Feeney et al., Modification of Proteins; Advances in Chemistry Series, Vol. 198, American Chemical Society, Washington, D.C., 1982.
Подходящими реакционноспособными боковыми функциональными группами, находящимися в сахарном ядре, или модифицирующими группами являются, но не ограничиваются ими: (a) карбоксильные группы и их различные производные (например, N-гидроксисукцинимидоэфиры, сложные эфиры N-гидроксибензотриазола, галогенангидриды кислоты, ацилимидазолы, тиоэфиры, п-нитрофениловые эфиры, алкильные, алкенильные, алкинильные и ароматические сложные эфиры); (b) гидроксильные группы, которые могут быть превращены, например, в сложные эфиры, простые эфиры, альдегиды и т.п.; (c) галогеналкильные группы, где галогенид может быть замещен нуклеофильной группой, такой как, например, амин, анион карбоксилата, анион тиола, карбанион или анион алкоксида, с образованием ковалентной связи между новой группой и функциональной группой атома галогена; (d) диенофильные группы, способные участвовать в реакциях Дильса-Альдера, например, малеимидогруппы; (e) альдегидные или кетоновые группы, где последующая дериватизация может осуществляться посредством образования карбонильных производных, таких как, например, имины, гидразоны, семикарбазоны или оксимы, или по таким механизмам, как реакция присоединения Гриньяра или реакция присоединения алкиллития; (f) сульфонилгалогенидные группы, участвующие в последующей реакции с аминами, например, с образованием сульфонамидов; (e) тиоловые группы, которые могут, например, превращаться в дисульфиды или реагировать с алкилгалогенидами и ацилгалогенидами; (h) аминогруппы или сульфгидрильные группы, которые могут быть, например, ацилированными, алкилированными или окисленными; (i) алкены, которые могут участвовать, например, в реакциях циклоприсоединения, реакции ацилирования, реакции присоединения Михаэля, реакции метатезиса, реакции Хека и т.п.; (j) эпоксиды, которые могут реагировать, например, с аминами и гидроксильными соединениями.
Реакционноспособные функциональные группы могут быть выбраны так, чтобы они не участвовали в реакциях, необходимых для образования реакционноспособного сахарного ядра или модифицирующей группы, или блокировали такие реакции. Альтернативно, реакционноспособная функциональная группа может быть защищена от участия в реакции путем введения защитной группы. Специалистам в данной области известны способы защиты конкретной функциональной группы так, чтобы они не влияли на ряд выбранных условий проведения реакций. Так, например, подходящие защитные группы описаны в литературе, см., например, Greene et al., Protective Groups in Organic Synthesis, John Wiley & Sons, New York, 1991.
В некоторых вариантах осуществления изобретения модифицированным сахаром является активированный сахар. Активированными модифицированными сахарами, используемыми в настоящем изобретении, обычно являются гликозиды, которые были синтетически модифицированы путем введения активированной уходящей группы. Используемый здесь термин «активированная уходящая группа» означает группу, которая может быть легко удалена в процессе регулируемых ферментами реакций нуклеофильного замещения. Многие активированные сахара известны специалистам. См., например, Vocadlo et al., In Carbohydrate Chemistry and Biology, Vol. 2, Ernst et al. Ed., Wiley-VCH Verlag: Weinheim, Germany, 2000; Kodama et al., Tetrahedron Lett. 34: 6419 (1993); Lougheed, et al., J. Biol. Chem. 274: 37717 (1999)). Примерами таких уходящих групп являются фтор, хлор, бром, тозилат, мезилат, трифлат и т.п. Предпочтительными активированными уходящими группами, используемыми в настоящем изобретении, являются группы, которые не оказывают значительного стерического затруднения в процессе ферментативного переноса гликозида на акцептор. В соответствии с этим, предпочтительными вариантами активированных гликозидных производных являются гликозилфториды и гликозилмезилаты, при этом, особенно предпочтительными являются гликозилфториды. Среди гликозилфторидов наиболее предпочтительными являются α-галактозилфторид, α-маннозилфторид, α-глюкозилфторид, α-фукозилфторид, α-ксилозилфторид, α-сиалилфторид, α-N-ацетилглюкозаминилфторид, α-N-ацетилгалактозаминилфторид, β-галактозилфторид, β-маннозилфторид, β-глюкозилфторид, β-фукозилфторид, β-ксилозилфторид, β-сиалилфторид, β-N-ацетилглюкозаминилфторид и β-N-ацетилгалактозаминилфторид.
В некоторых аспектах изобретения модифицированный сахарный остаток конъюгируют с одним или более водорастворимыми полимерами. Многие водорастворимые полимеры известны специалистам и могут быть использованы в настоящем изобретении. Термин «водорастворимый полимер» включает такие молекулы как, сахариды (например, декстран, амилоза, гиалуроновая кислота, полисиаловая кислота, гепараны, гепарины и т.п.); полиаминокислоты; нуклеиновые кислоты; синтетические полимеры (например, полиакриловая кислота, полиэфиры, например, полиэтиленгликоль); пептиды, белки и т.п. Настоящее изобретение может быть осуществлено с использованием любого водорастворимого полимера, но при одном условии, что этот полимер должен иметь положение, в котором может быть присоединена остальная часть конъюгата.
Методы и химические реакции активации водорастворимых полимеров и сахаридов, а также методы конъюгирования сахаридов и полимеров с различными молекулами описаны в литературе. Общеизвестными методами активации полимеров являются активация функциональных групп бромцианом, периодатом, глутаральдегидом, биэпоксидами, эпихлоргидрином, дивинилсульфоном, карбодиимидом, сульфонилгалогенидами, трихлортриазином и т.п. (см., R. F. Taylor, (1991), Protein Immobilisation, Fundamentals and Applications, Marcel Dekker, N.Y.; S. S. Wong, (1992), Chemistry of Protein Conjugation and Crosslinking, CRC Press, Boca Raton; G. T. Hermanson et al., (1993), Immobilized Affinity Ligand Techniques, Academic Press, N.Y.; Dunn, R. L., et al., Eds. Polymeric Drugs and Drug Delivery Systems, ACS Symposium Series Vol. 469, American Chemical Society, Washington, D.C. 1991).
В некоторых аспектах изобретения модифицированный сахарный остаток конъюгируют с одним или более не растворимыми в воде полимерами. В некоторых вариантах осуществления изобретения конъюгирование с не растворимым в воде полимером может быть осуществлено для регулируемой доставки терапевтического пептида. Полимерные системы доставки лекарственных средств известны специалистам. См., например, Dunn et al., Eds. Polymeric drugs and Drug Delivery Systems, ACS Symposium Series Vol. 469, American Chemical Society, Washington, D.C. 1991. Для специалиста в данной области очевидно, что для доставки конъюгатов согласно изобретению может быть использована, по существу, любая известная система доставки лекарственных средств.
Репрезентативными не растворимыми в воде полимерами являются, но не ограничиваются ими, полифосфазины, поливиниловые спирты, полиамиды, поликарбонаты, полиалкилены, полиакриламиды, полиалкиленгликоли, полиалкиленоксиды, полиалкилентерефталаты, поливиниловые эфиры, сложные поливиниловые эфиры, поливинилгалогениды, поливинилпирролидон, полигликолиды, полисилоксаны, полиуретаны, полиметилметакрилат, полиэтилметакрилат, полибутилметакрилат, полиизобутилметакрилат, полигексилметакрилат, полиизодецилметакрилат, полилаурилметакрилат, полифенилметакрилат, полиметилакрилат, полиизопропилакрилат, полиизобутилакрилат, полиоктадецилакрилат, полиэтилен, полипропилен, полиэтиленгликоль, полиэтиленоксид, полиэтилентерефталат, поливинилацетат, поливинилхлорид, полистирол, поливинилпирролидон, плюроники, поливинилфенол и их сополимеры.
Эти и другие обсуждаемые здесь полимеры могут быть легко получены из коммерчески доступных источников, таких как Sigma Chemical Co. (St. Louis, Mo.), Polysciences (Warrenton, Pa.), Aldrich (Milwaukee, Wis.), Fluka (Ronkonkoma, N.Y.), и BioRad (Richmond, Calif.), либо они могут быть синтезированы стандартными методами из мономеров, полученных от поставщиков. Репрезентативными биоразлагаемыми полимерами, используемыми для получения конъюгатов согласно изобретению, являются, но не ограничиваются ими, полилактиды, полигликолиды и их сополимеры, полиэтилентерефталат, полимасляная кислота, поливалериановая кислота, сополимер лактида и капролактона, сополимер лактида и гликолида, полиангидриды, полиортоэфиры и их смеси и сополимеры. В частности, могут быть использованы композиции, образующие гели, такие как композиции, включающие коллаген и плюроники.
В предпочтительном варианте осуществления изобретения один или более модифицированных сахарных остатков конъюгируют с одной или более молекулами ПЭГ.
В некоторых аспектах изобретения модифицированный сахар конъюгируют с биомолекулой. Биомолекулами согласно изобретению могут быть, но не ограничиваются ими, функциональные белки, ферменты, антигены, антитела, пептиды, нуклеиновые кислоты (например, отдельные нуклеотиды или нуклеозиды, олигонуклеотиды, полинуклеотиды и одноцепочечные и многоцепочечные нуклеиновые кислоты), лектины, рецепторы или их комбинации.
Некоторые предпочтительные биомолекулы являются, в основном, нефлуоресцентными, либо они излучают такое минимальные количество флуоресценции, которое не позволяет использовать их в качестве флуоресцентного маркера в анализе. Другие биомолекулы могут быть флуоресцентными.
В некоторых вариантах осуществления изобретения биомолекулой является нацеливающая молекула. Используемые здесь термины «нацеливающая молекула» и «нацеливающий агент» означают молекулы, которые могут селективно локализоваться в конкретной ткани или области организма. В некоторых вариантах осуществления изобретения биомолекулу отбирают для доставки полипептида SAP согласно изобретению в конкретный внутриклеточный компартмент в целях облегчения доставки этого пептида в указанный внутриклеточный компартмент по сравнению с доставкой определенного количества недериватизированного пептида в ткань. Такая локализация опосредуется специфическим распознаванием молекулярных детерминант, размером молекулы нацеливающего агента или конъюгата, ионными взаимодействиями, гидрофобными взаимодействиями и т.п. Специалистам известны и другие механизмы доставки агента в конкретную ткань или область.
В некоторых вариантах осуществления изобретения модифицированный сахар включает терапевтическую молекулу. Следует отметить, что терапевтические молекулы и биомолекулы могут совпадать по своим категориям, то есть, многие биомолекулы имеют терапевтические свойства или терапевтическую активность.
Классы полезных терапевтических молекул включают, например, нестероидные противовоспалительные лекарственные средства; стероидные противовоспалительные лекарственные средства; адъюванты; антигистаминные лекарственные средства; лекарственные средства от кашля; противозудные лекарственные средства; антихолинергические лекарственные средства; противорвотные лекарственные средства и лекарственные средства от тошноты; лекарственные средства против анорексии; лекарственные средства, стимулирующие центральную нервную систему; антиаритмические лекарственные средства; β-адренергические блокаторы; кардиотонические лекарственные средства; гипотензивные лекарственные средства; диуретики; сосудорасширяющие лекарственные средства; сосудосуживающие лекарственные средства; противоязвенные лекарственные средства; анестезирующие лекарственные средства; антидепрессанты; транквилизаторы и седативные лекарственные средства; антипсихотические лекарственные средства и противомикробные лекарственные средства.
Другими молекулами лекарственных средств, используемыми для осуществления настоящего изобретения, являются противоопухолевые лекарственные средства, цитоцидные средства, антиэстрогены и антиметаболиты. В этот класс лекарственных средств также входят радиоизотопные агенты для диагностики (например, визуализации) и терапии, и конъюгированные токсины.
Терапевтическими молекулами могут быть также гормоны; мышечные релаксанты; антиспазматические средства; средства, активирующие остеогенез; средства, модулирующие эндокринную систему; модуляторы диабета, андрогены, антидиуретики или кальцитонины.
Другими подходящими модифицирующими группами являются иммуномодулирующие средства, иммунодепрессанты и т.д. Могут быть также использованы группы с противовоспалительной активностью, такие как сулиндак, этодолак, кетопрофен и кеторолак. Специалистам известны и другие лекарственные средства, которые могут быть использованы в настоящем изобретении.
Полипептиды SAP с измененным характером N-гликозилирования, полученные способами согласно изобретению, могут быть гомогенными (то есть, в этом случае, образец полипептида SAP имеет однородную специфическую N-гликановую структуру) или, по существу, гомогенными. Термин «по существу, гомогенный» означает, что по меньшей мере приблизительно 25% (например, по меньшей мере приблизительно 27%, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 35%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 45%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 55%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 65%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90% или по меньшей мере приблизительно 95% или по меньшей мере приблизительно 99%) полипептидов SAP имеют одну и ту же специфическую N-гликановую структуру.
В некоторых вариантах осуществления изобретения варианты полипептидов SAP согласно изобретению имеют IC50 для ингибирования дифференцировки моноцитов в фиброциты in vitro, составляющую менее, чем 1/2, менее, чем 1/3, менее, чем 1/4, менее, чем 1/10 или менее, чем 1/100 от концентрации соответствующего образца SAP дикого типа, выделенного из человеческой сыворотки. В некоторых вариантах осуществления изобретения варианты полипептидов SAP согласно изобретению имеют IC50 для ингибирования дифференцировки моноцитов в фиброциты in vitro, составляющую менее, чем половину от концентрации соответствующего образца SAP дикого типа, выделенного из человеческой сыворотки. Существует множество хорошо описанных методов определения чувствительности мононуклеарныхклеток периферической крови (МКПК) или моноцитов к дифференцировке в фиброциты под действием SAP. Эти методы могут быть применены для определения относительной активности любого из вариантов полипептидов SAP согласно изобретению по сравнению с активностью образца SAP, выделенного из человеческой сыворотки, любого другого варианта полипептида SAP или другого агента, подавляющего или активирующего фиброциты. МКПК или моноциты, подходящие для их использования в этих методах, могут быть получены из различных линий тканевых культур. Альтернативно, клетки, подходящие для их использования в анализах на дифференцировку в фиброциты, могут быть получены из любого биологического образца, содержащего МКПК или моноциты. Биологический образец может быть получен из сыворотки, плазмы, здоровой ткани или фиброзной ткани. Вообще говоря, анализы на дифференцировку в фиброциты проводят путем инкубирования МКПК или моноцитов в среде с различными концентрациями полипептида SAP для определения степени дифференцировки в фиброциты. Концентрация SAP может составлять в пределах от 0,0001 мкг/мл до 1 мг/мл, а в некоторых вариантах осуществления изобретения она составляет 0,001 мкг/мл, 1,0 мкг/мл, 5 мкг/мл, 10 мкг/мл, 15 мкг/мл, 20 мкг/мл, 25 мкг/мл, 30 мкг/мл, 35 мкг/мл, 40 мкг/мл, 45 мкг/мл, 50 мкг/мл, 100 мкг/мл, 200 мкг/мл, 300 мкг/мл или 500 мкг/мл. В некоторых анализах, в среду могут быть добавлено 1-100 нг/мл hMCSF; при этом, предпочтительная концентрация hMCSF составляет 25 нг/мл. Дифференцировка МКПК и моноцитов в фиброциты может быть определена любым специалистом в данной области. Вообще говоря, фиброциты морфологически определены как адгезивные клетки, имеющие форму удлиненного веретена и овальное ядро. В некоторых анализах, эти клетки фиксируют и окрашивают Hema 3, после чего фиброциты подсчитывают путем прямого подсчета, например, на инвертированном микроскопе. Количество дифференцированных фиброцитов интерпретируется специалистами как мера восприимчивости клеток к SAP. Как описано в примерах настоящего изобретения, чем выше степень ингибирования дифференцировки в фиброциты, тем выше степень восприимчивости к SAP. Альтернативный метод оценки степени дифференцировки в фиброциты включает определение уровня экспрессии маркеров клеточной поверхности, специфичных к фиброцитам, или секретируемых фиброцитами факторов, например, цитокинов (таких как IL-1ra, ENA-78/CXCL-5, PAI-1), фибронектина, коллагена-1). Методы детектирования и/или количественной оценки маркеров клеточной поверхности или секретированных факторов хорошо известны специалистам, включая, но не ограничиваясь ими, различные методы на основе ELISA и FACS, в которых используются иммунореактивные антитела, направленные против одного или более маркеров, специфичных к фиброцитам. Как описано в примерах настоящего изобретения, определение уровня экспрессии происходящего от макрофагов хемокина (MDC) представляет собой эффективный метод определения степени дифференцировки в фиброциты.
Методы детектирования и/или характеризации N-гликозилирования (например, модифицированного N-гликозилирования) полипептида SAP включают методы, проводимые на секвенаторе ДНК (DSA), электрофорез углеводов с использованием флуорофора (FACE) или лазерная десорбция с поверхностной активацией/масс-спектрометрия с времяпролетной ионизацией (SELDI-TOF MS). Так, например, может быть проведен анализ DSA-FACE, в котором, например, гликопротеины денатурируют после иммобилизации, например, на мембране. После этого, гликопротеины могут быть восстановлены путем добавления подходящего восстановителя, такого как дитиотреитол (DTT) или β-меркаптоэтанол. Сульфгидрильные группы белков могут быть подвергнуты карбоксилированию с использованием кислоты, такой как иодуксусная кислота. Затем N-гликаны могут быть отделены от белка с использованием фермента, такого как N-гликозидаза F. N-гликаны могут быть, но необязательно, восстановлены и дериватизированы путем восстановительного аминирования. После этого дериватизированные N-гликаны могут быть подвергнуты концентрированию. Оборудованием, подходящим для анализа N-гликанов, является, например, секвенатор ДНК ABI PRISM® 377 (Applied Biosystems). Анализ данных может быть осуществлен с использованием, например, компьютерной программы GENESCAN® 3.1 (Applied Biosystems). Выделенные маннопротеины могут быть, но необязательно, подвергнуты дополнительной обработке одним или более ферментами для подтверждения их N-гликанового статуса. Репрезентативными ферментами являются, например, α-маннозидаза или α-1,2-маннозидаза. Дополнительными методами анализа N-гликана являются, например, масс-спектрометрия (например, MALDI-TOF-MS), жидкостная хроматография высокого давления (ЖХВД) на нормальной фазе, обращенно-фазовая хроматография и ионообменная хроматография (например, импульсное амперометрическое детектирование в случае, если гликаны не являются меченными, и УФ-поглощение или флуоресценция, если гликаны были соответствующим образом помечены). См. также публикации Callewaert et al. (2001) Glycobiology 11(4):275-281 и Freire et al. (2006) Bioconjug. Chem. 17(2):559-564, которые во всей своей полноте вводятся в настоящее описание посредством ссылки.
Анти-FcγR антитела, используемые в качестве агонистов SAP
В одном из своих аспектов, настоящее изобретение относится к одному или более соединениям, которые имитируют передачу сигнала SAP. В некоторых вариантах осуществления изобретения агонистами передачи сигнала SAP являются анти-FcγR антитела, где указанные антитела выбраны их антител, принадлежащих к классу анти-FcγRI антител, анти-FcγRIIА антител и анти-FcγRIII антител, которые связываются с FcγRI, FcγRIIА или FcγRIII, соответственно. Анти-FcγR антитела представляют собой антитела IgG, которые связываются с рецепторами для Fc-части антител IgG (FcγR). Анти-FcγR антитела связываются посредством своей вариабельной области, но не константной области (Fc). Анти-FcγR антитела могут принадлежать к любому изотипу. Анти-FcγR антитела могут быть также перекрестно связаны или агрегированы с другими антителами, либо не с антителами, а с какими-либо другими агентами или другими способами. Такой способ позволяет инициировать события передачи внутриклеточного сигнала с одновременной активацией FcγR. В некоторых вариантах осуществления изобретения агонистом передачи сигнала SAP может быть перекрестно связанный FcγR.
Агрегированные Fc-домены и Fc-содержащие антитела
В некоторых вариантах осуществления изобретения агонистами передачи сигнала SAP являются перекрестно связанные или агрегированные IgG. Перекрестно связанным или агрегированным IgG может быть любой IgG, способный связываться с FcγR-мишенью посредством его Fc-области, при условии, что по меньшей мере два таких антитела IgG будут физически связаны друг с другом.
Перекрестно связанными или агрегированными IgG могут быть целые антитела или их части, предпочтительно, части, функции которых заключаются в подавлении фиброзных расстройств. Так, например, такие IgG могут представлять собой любую часть антитела, способную перекрестно связываться с FcγR. Эти IgG могут представлять собой агрегированные или перекрестно связанные антитела или их фрагменты, такие как агрегированные или перекрестно связанные полноразмерные антитела, F(ab')2-фрагменты и возможно даже Fc-фрагменты.
Агрегация или перекрестное связывание антител могут быть осуществлены любым известным методом, таким как термоагрегация или химическая агрегация. При этом, допустимым может быть любой уровень агрегации или перекрестного связывания, хотя более высокий уровень агрегации может способствовать еще большему подавлению фиброзного расстройства. Антителами могут быть поликлональные или моноклональные антитела, например, антитела, продуцируемые гибридомными клетками. В композициях и методах могут быть использованы смеси антител, такие как смеси, состоящие из множества моноклональных антител, которые могут быть перекрестно связаны или агрегированы с аналогичными антителами или с различными антителами.
Пептидомиметик SAP
В некоторых вариантах осуществления изобретения агонистами SAP являются пептидомиметики. Используемый здесь термин «пептидомиметик» означает химически модифицированные пептиды и пептидоподобные молекулы, содержащие не-природные аминокислоты, пептоиды и т.п. Методы идентификации пептидомиметика хорошо известны специалистам и включают скрининг баз данных, содержащих библиотеки потенциальных пептидомиметиков. Так, например, в базе структурных данных в Кэмбридже имеется набор более чем 300000 соединений, имеющих известные кристаллические структуры (Allen et al., Acta Crystallogr. Section B, 35:2331 (1979)). Если кристаллическая структура молекулы-мишени неизвестна, то такая структура может быть идентифицирована, например, с использованием программы CONCORD (Rusinko et al., J. Chem. Inf. Comput. Sci. 29:251 (1989)). Другая база данных, Available Chemicals Directory (Molecular Design Limited, Informations Systems; San Leandro Calif.), содержит приблизительно 100000 соединений, которые являются коммерчески доступными и могут быть также скринированы для идентификации потенциальных пептидомиметиков полипептидов SAP.
Повышение активности SAP
В некоторых вариантах осуществления изобретения агонист SAP способствует повышению активности SAP. Активность SAP может быть повышена путем увеличения концентрации SAP, например, увеличения уровня транскрипции SAP, увеличения уровня трансляции SAP, повышения уровня секреции SAP, повышения стабильности РНК SAP, повышения стабильности белка SAP или снижения степени разложения белка SAP. Активность SAP может быть также повышена путем увеличения, в частности, «свободной концентрации» SAP, или, точнее говоря, его несвязанной формы, например, путем снижения концентрации эндогенных партнеров по связыванию с SAP.
Линкеры, перекрестно связывающиеся с FcγR
В некоторых вариантах осуществления изобретения белки каркасных доменов на основе фибронектина могут быть использованы в качестве агонистов SAP, которые перекрестно связываются с FcγR. Белки каркасных доменов на основе фибронектина могут содержать домен фибронектина типа III (Fn3), а в частности, десятый домен фибронектина типа III (10Fn3).
Для перекрестного связывания с FcγR могут быть получены мультимеры доменов Fn3, связывающихся с FcγR, как описано в патенте США No. 7115396.
Домены фибронектина типа III (Fn3) содержат от N-конца до С-конца бета-цепь или бета-подобную цепь A; петлю AB; бета-цепь или бета-подобную цепь B; петлю BC; бета-цепь или бета-подобную цепь C; петлю CD; бета-цепь или бета-подобную цепь D; петлю DE; бета-цепь или бета-подобную цепь E; петлю EF; бета-цепь или бета-подобную цепь F; петлю FG; и бета-цепь или бета-подобную цепь G. Петли BC, DE и FG, по своей структуре и функциям, аналогичны гипервариабельным областям (CDR), происходящим от доменов Fn3 иммуноглобулина, и могут быть сконструированы путем модификации последовательности одной или более петель BC, DE и FG так, чтобы они связывались почти с любым соединением. Методы конструирования специфически связывающих агентов были описаны в патенте США No. 7115396, где рассматриваются высокоаффинные агенты, связывающиеся с TNFα, и в публикации заявки на патент США No. 2007/0148126, где рассматриваются высокоаффинные агенты, связывающиеся с VEGFR2. Примерами каркасных белков на основе фибронектина являются АднектиныТМ (Adnexus, Bristol-Myers Squibb R&D Company).
В некоторых вариантах осуществления изобретения агонистом SAP является аптамер. Для перекрестного связывания с FcγR могут быть получены мультимеры аптамеров, связывающихся с FcγR.
Аптамеры представляют собой олигонуклеотиды, которые могут быть синтетическими или природными, и которые связываются с конкретной молекулой-мишенью, такой как белок или метаболит. Обычно, связывание осуществляется посредством взаимодействий, не являющихся классическим спариванием оснований Уотсона-Крика. Аптамеры представляют собой перспективный класс терапевтических средств, используемых в настоящее время в преклинических и клинических исследованиях. Аптамеры, подобно биологическим агентам, таким как пептиды или моноклональные антитела, обладают способностью специфически связываться с молекулярными мишенями и ингибировать, посредством такого связывания, функцию мишени. Типичным аптамером является аптамер размером 10-15 кДа (то есть, 30-45 нуклеотидов), который связывается со своей мишенью с субнаномолярной аффинностью и распознает ее среди близкородственных мишеней (например, обычно не связывается с другими белками того же генного семейства) (Griffin, et al. (1993), Gene 137(1): 25-31; Jenison, et al. (1998), Antisense Nucleic Acid Drug Dev. 8(4): 265-79; Bell, et al. (1999), In vitro Cell. Dev. Biol. Anim 35(9): 533-42; Watson, et al. (2000), Antisense Nucleic Acid Drug Dev. 10(2): 63-75; Daniels, et al. (2002), Anal. Biochem. 305(2): 214-26; Chen, et al. (2003), Proc. Natl. Acad. Sci. U.S.A. 100(16): 9226-31; Khati, et al. (2003), J. Virol. 77(23): 12692-8; Vaish, et al. (2003), Biochemistry 42(29): 8842-51).
Аптамеры обладают рядом привлекательных свойств с точки зрения их применения в качестве терапевтических средств. Аптамеры, помимо высокой аффинности и специфичностм связывания с мишенью, обладают низкой токсичностью или иммуногенностью, или вообще не обладают токсичностью или иммуногенностью как показали стандартные анализы (Wlotzka, et al. (2002), Proc. Natl. Acad. Sci. U.S.A. 99(13): 8898-902). Действительно, некоторые терапевтические аптамеры были оптимизированы и усовершенствованы на различных стадиях преклинической разработки, включая фармакокинетический анализ, характеризацию биологической эффективности в клеточных моделях и у животных с моделью заболевания, и предварительную фармакологическую оценку безопасности (Reyderman and Stavchansky (1998), Pharmaceutical Research 15(6): 904-10; Tucker et al., (1999), J. Chromatography B. 732: 203-212; Watson, et al. (2000), Antisense Nucleic Acid Drug Dev. 10(2): 63-75).
Подходящим способом получения аптамера против представляющей интерес мишени является способ, названный «Системной эволюцией лигандов посредством их экспоненциального обогащения» («Systematic Evolution of Ligands by EXponential Enrichment» («SELEX™»)). Способ SELEX™ представляет собой метод in vitro исследования эволюции молекул нуклеиновой кислоты с высокой специфичностью связывания с молекулами-мишенями, и этот способ описан, например, в заявке на патент США рег. No. 07/536428, поданной 11 июня 1990, и в настоящее время отозванной; в патенте США No. 5475096, озаглавленном «Лиганды нуклеиновой кислоты» («Nucleic Acid Ligands»), и в патенте США No. 5270163 (см. также WO 91/19813), озаглавленном «Лиганды нуклеиновой кислоты» («Nucleic Acid Ligands»). Каждый лиганд нуклеиновой кислоты, идентифицированный способом SELEX™, представляет собой специфический лиганд для данного соединения-мишени или молекулы-мишени. Способ SELEX™ основан на обнаружении того факта, что нуклеиновые кислоты могут образовывать ряд двумерных и трехмерных структур и имеют достаточное химическое разнообразие среди мономеров, действующих как лиганды (образующие специфические связывающие пары) фактически для любого химического соединения, независимо от того, является ли оно мономерным или полимерным. Молекулы любого размера или состава могут служить в качестве мишеней. Способ SELEX™, применяемый для высокоаффинного связывания, включает отбор из смеси олигонуклеотидов-кандидатов и постадийную итерацию связывания, разделения и амплификации с использованием одной и той же общей схемы отбора для достижения фактически любого желаемого признака, например, аффинности и селективности связывания. При использовании смеси нуклеиновых кислот, предпочтительно, содержащих сегмент рандомизированной последовательности, способ SELEX™ включает стадию контактирования смеси с мишенью в условиях, способствующих связыванию и отделению несвязанных нуклеиновых кислот от нуклеиновых кислот, которые специфически связываются с молекулами-мишенями; стадию диссоциации комплексов «нуклеиновая кислота-мишень»; и стадию амплификации нуклеиновых кислот, диссоциированных из комплексов «нуклеиновая кислота-мишень», с получением обогащенной лигандом смеси нуклеиновых кислот, с последующим повторением стадий связывания, разделения, диссоциации и амплификации путем проведения множества циклов, если это необходимо для получения лигандов нуклеиновой кислоты, связывающихся с молекулой-мишенью с высокой специфичностью и высокой аффинностью. SELEX™ представляет собой способ получения лиганда нуклеиновой кислоты, связывающегося с любой нужной мишенью, как описано, например, в патентах США Nos. 5475096 и 5270163 и в заявке PCT/US91/04078, которые во всей своей полноте вводятся в настоящее описание посредством ссылки.
В некоторых вариантах осуществления изобретения агонистами SAP являются Наноантитела®. Наноантитела® представляют собой происходящие от антител терапевтические белки, обладающие уникальными структурными и функциональными свойствами природных антител с тяжелой цепью. Технология Nanobody® была впервые разработана после обнаружения того факта, что у животных семейства верблюжьих (у верблюдов и лам) присутствуют полностью функциональные антитела, в которых отсутствуют легкие цепи. Эти антитела с тяжелой цепью содержат один вариабельный домен (VHH) и два константных домена (CH2 и CH3). Важно отметить, что клонированный и выделенный домен VHH представляет собой стабильный полипептид, обладающий абсолютно такой же антигенсвязывающей способностью, как и исходное антитело с тяжелой цепью. Эти VHH-домены с их уникальными структурными и функциональными свойствами служат в качестве основы для конструирования терапевтических антител нового поколения.
Фиброз, ассоциированный с раком
Ряд раковых заболеваний характеризуются наличием фиброза. В частности, полипептиды SAP или агонисты SAP согласно изобретению используются отдельно или в комбинации с противораковым терапевтическим средством для лечения рака, ассоциированного с таким фиброзом (например, фиброзных раковых заболеваний, таких как миелофиброз, рак желудка, рак поджелудочной железы, лимфома Ходжкина, неходжкинская лимфома, ретикулоэндотелиоз, множественная миелома, медуллобластома, миелоидный лейкоз, острый лимфоцитарный лейкоз и рак молочной железы, матки или толстой кишки, включая фиброиды, фибромы, фиброаденомы и фибросаркомы). В других вариантах осуществления изобретения агонист SAP согласно изобретению, такой как полипептид SAP (например, рекомбинантный человеческий полипептид SAP, такой как гликозилированный полипептид SAP), используется в монотерапии.
В некоторых вариантах осуществления изобретения полипептиды SAP или агонисты SAP согласно изобретению (например, агонист SAP, содержащий гликозилированный полипептид SAP; SAP, содержащий гликозилированный полипептид SAP; рекомбинантный человеческий SAP и т.п.) используются отдельно или в комбинации с противораковым терапевтическим средством для лечения фиброзного рака (например, фиброзных раковых заболеваний, таких как миелофиброз, рак желудка, рак поджелудочной железы, лимфома Ходжкина, неходжкинская лимфома, ретикулоэндотелиоз, множественная миелома, медуллобластома, миелоидный лейкоз, острый лимфоцитарный лейкоз и рак молочной железы, матки или толстой кишки, включая фиброиды, фибромы, фиброаденомы и фибросаркомы) путем снижения степени фиброза для восстановления функции органов. Было показано, что введение полипептида SAP или агониста SAP согласно изобретению в виде одного средства или как часть комбинированной терапии приводит к снижению тяжести фиброза органов (например, фиброза костного мозга), к улучшению и/или восстановлению функции органов и к ослаблению симптомов фиброзного рака (например, улучшению результатов клинического анализа крови (CBC)). Улучшение функции органов может быть оценено, например, путем определения повышения числа тромбоцитов и/или уровня гемоглобина у индивидуума при проведении курса лечения, например, через 12, 20, 24 или более чем через 24 недели после лечения. В некоторых вариантах осуществления изобретения, в которых указанным органом является костный мозг, лечение приводит к снижению степени фиброза органов и/или к улучшению функции органов. В некоторых вариантах осуществления изобретения фиброзным органом являются легкие, желудок, поджелудочная железа, толстая кишка, печень, почки, мочевой пузырь, молочная железа, матка, шейка матки, яичник или головной мозг. В некоторых вариантах осуществления изобретения фиброзным раком является миелофиброз.
Как описано в настоящей заявке, в некоторых вариантах осуществления изобретения включение SAP в схему терапии применяется для индивидуума, у которого наблюдается невосприимчивость и резистентность к лечению, или который в той или иной степени не поддается лечению (в отсутствии SAP), или у которого наблюдается снижение эффективности лечения. В некоторых вариантах осуществления изобретения включение SAP применяют для расширения группы пациентов, которые поддаются лечению другим терапевтическим средством (например, SAP расширяет терапевтическое «окно» или группу пациентов, проходящих лечение другим лекарственным средством). Так, например, известно, что некоторые раковые заболевания являются невосприимчивыми к химиотерапии. Не ограничиваясь какой-либо конкретной теорией, авторы лишь отмечают, что фиброз может затруднять эффективный доступ лекарственных средств в опухоль.
Как описано в настоящей заявке, в некоторых вариантах осуществления изобретения включение SAP в схему терапии применяют в целях повышения безопасности лечения, например, снижения одного или более побочных эффектов, наблюдаемых у индивидуумов, которым вводили только одно дополнительное противораковое терапевтическое средство.
В некоторых вариантах осуществления изобретения агонист SAP или полипептид SAP используют в монотерапии и/или для лечения пациентов, которые ранее не проходили какого-либо курса лечения. В некоторых вариантах осуществления изобретения агонист SAP или полипептид SAP используют для лечения пациентов, заболевание которых оценивается по определенной шкале фиброзных поражений, таких как фиброз костного мозга, оцениваемый баллом 2 или баллом 3, в соответствии с Европейским Соглашением о присвоении баллов тяжести фиброза костного мозга.
В некоторых своих аспектах настоящее изобретение включает применение полипептида SAP или агониста SAP в качестве одного средства или в комбинации с другим средством для лечения миелофиброза. Миелофиброз («МФ») представляет собой BCR-ABL1-негативное миелопролиферативное новообразование («MПН»), которое представляет собой заболевание de novo (первичное), или которому могут предшествовать истинная полицитемия («ИП») или эссенциальная тромбоцитемия («ЭТ»). Первичный миелофиброз (ПМФ) (также называемый в литературе эссенциальной миелоидной метаплазией и ангиогенной миелоидной метаплазией) представляет собой клональное поражение мультипотентных гемопоэтических клеток-предшественников моноцитарной линии дифференцировки (см. Abdel-Wahab, O. et al. (2009) Annu. Rev. Med. 60:233-45; Varicchio, L. et al. (2009) Expert Rev. Hematol. 2(3):315-334; Agrawal, M. et al. (2011) Cancer 117(4):662-76). Это заболевание характеризуется анемией, спленомегалией и экстрамедуллярным гемопоэзом, а также прогрессирующим фиброзом костного мозга и атипической мегакариоцитарной гиперплазией. Характерным признаком такого заболевания является аномальная миграция CD34+-стволовых клеток/клеток-предшественников в периферическую кровь и экстрамедуллярный эритропоэз многих органов, а в частности, в селезенке и в печени. Структура костного мозга изменяется в результате прогрессирующего фиброза, неоангиогенеза и увеличения степени отложений в кости. Средняя выживаемость при таком заболевании, с учетом идентифицированных в настоящее время прогностических факторов, составляет от менее, чем 2 лет до 15 лет (Cervantes F et al., Blood 113:2895-2901, 2009; Hussein K et al. Blood 115:496-499, 2010; Patnaik M. M. et al., Eur. J. Haematol. 84:105-108, 2010). Значительный процент пациентов с ПМФ имеет мутации приобретения функций в генах, регулирующих гемопоэз, включая ген Янус-киназы 2 (JAK2) (приблизительно 50%) (например, JAK2 V617F) или ген рецептора тромбопоэтина (MPL) (5-10%), что приводит к аномальному росту и дифференцировке мегакариоцитов. Исследования подтвердили, что клональное гемопоэтическое расстройство приводит к вторичной пролиферации фибробластов и к избыточному осаждению коллагена. Снижение степени фиброза костного мозга может приводить к ослаблению клинических признаков и симптомов, включая анемию, тромбоцитопению, лейкопению и спленомегалию.
Из литературы известно, что ингибиторы JAK2 являются подходящими для лечения и/или предупреждения миелопролиферативных расстройств. См., например, Tefferi, A. and Gilliland, D. G. Mayo Clin. Proc. 80(7): 947-958 (2005); Fernandez-Luna, J. L. et al. Haematologica 83(2): 97-98 (1998); Harrison, C. N. Br. J. Haematol. 130(2): 153-165 (2005); Leukemia (2005) 19, 1843-1844; и Tefferi, A. and Barbui, T. Mayo Clin. Proc. 80(9): 1220-1232 (2005). Однако используемые в настоящее время схемы лечения МФ не дают адекватной эффективности при лечении всех пациентов. Поэтому, разработка дополнительных схем лечения пациентов с МФ остается актуальной.
В некоторых вариантах описанных здесь способов у индивидуума был диагностирован первичный миелофиброз. В некоторых вариантах описанных здесь композиций и способов у индивидуума был диагностирован миелофиброз на фоне истинной полицитемии (пост-ИП МФ). В некоторых вариантах осуществления изобретения у индивидуума был диагностирован миелофиброз на фоне эссенциальной тромбоцитемии (пост-ЭТ МФ). В некоторых вариантах осуществления изобретения у индивидуума был установлен высокий риск развития миелофиброза. В некоторых вариантах осуществления изобретения у индивидуума был установлен промежуточный риск развития миелофиброза (такой как промежуточный уровень риска 1 или промежуточный уровень риска 2). В некоторых вариантах осуществления изобретения у индивидуума был установлен низкий риск развития миелофиброза. В некоторых вариантах осуществления изобретения у индивидуума имеется ИП или ЭТ без фиброза. В некоторых вариантах осуществления изобретения индивидуум является позитивным по замене валина 617 на фенилаланин человеческой Янус-киназы 2 (JAK2) или позитивным по мутации, соответствующей замене валина 617 на фенилаланин человеческой JAK2. В некоторых вариантах осуществления изобретения индивидуум является негативным по замене валина 617 на фенилаланин человеческой Янус-киназы 2 (JAK2) или негативным по мутации, соответствующей замене валина 617 на фенилаланин человеческой JAK2. В некоторых вариантах осуществления изобретения до начала лечения агонистом SAP или полипептидом SAP согласно изобретению у индивидуума был диагностирован фиброз костного мозга, где такой фиброз оценивается по шкале в соответствии с Европейским Соглашением о присвоении баллов тяжести фиброза костного мозга. В некоторых вариантах осуществления изобретения до начала лечения агонистом SAP или полипептидом SAP согласно изобретению у индивидуума был диагностирован фиброз костного мозга, соответствующий баллу 2 или более. В других вариантах осуществления изобретения до начала лечения агонистом SAP или полипептидом SAP согласно изобретению у индивидуума был диагностирован фиброз костного мозга, соответствующий баллу 3.
В некоторых аспектах изобретения фиброзным раком является десмопластическая опухоль, такая как рак поджелудочной железы и/или нейроэндокринные опухоли. Рак поджелудочной железы характеризуется ярко выраженной десмопластической реакцией, то есть, ключевым гистопатологическим признаком рака поджелудочной железы, ответственным за хорошо известную резистентность к химиотерапевтическим средствам. В настоящее время, такой признак рака поджелудочной железы рассматривается как альтернативная терапевтическая мишень при лечении рака поджелудочной железы. Очевидно, что полипептиды SAP и агонисты SAP согласно изобретению являются эффективными для истощения или снижения объема десмопластической стромы и/или фиброза, что делает опухоль более доступной для химиотерапии.
В некоторых аспектах изобретения фиброзом, ассоциированным с раком, является фиброз костного мозга. В некоторых вариантах осуществления изобретения фиброзное состояние костного мозга является характерным признаком хронического миелопролиферативного новообразования костного мозга, такого как первичный миелофиброз. В других вариантах осуществления изобретения фиброз костного мозга ассоциируется со злокачественным заболеванием или состоянием, вызываемым клональным пролиферативным заболеванием или гематологическим расстройством, таким как, но не ограничивающимся ими, ретикулоэндотелиоз, лимфома (лимфома Ходжкина или неходжкинская лимфома), множественная миелома или хронический миелогенный лейкоз (ХМЛ). В других вариантах осуществления изобретения фиброз костного мозга ассоциируется с метастазами солидной опухоли в костный мозг.
В некоторых вариантах осуществления изобретения фиброз ассоциируется с раковой опухолью, включая, но не ограничиваясь ими, рак желчных протоков (например, холангиокарциному), рак мочевого пузыря, рак молочной железы (например, аденокарциному молочной железы, воспалительную карциному молочной железы, папиллярную карциному молочной железы, медуллярную карциному молочной железы), рак головного мозга (например, менингиому, глиому, например, астроцитому, олигодендроглиому, медуллобластому), рак шейки матки (например, плоскоклеточную карциному шейки матки, аденокарциному шейки матки), рак прямой и ободочной кишки (например, рак толстой кишки, рак прямой кишки, аденокарциному прямой и ободочной кишки), рак пищевода, рак желудка, рак стромы желудочно-кишечного тракта (РЖКТ), рак головы и шеи (например, плоскоклеточную карциному головы и шеи), рак ротовой полости (например, плоскоклеточную карциному ротовой полости (ПКРП)), келоидные рубцы, рак почек (например, нефробластому, также известную как опухоль Вильмса, почечноклеточную карциному), рак печени (например, гепатоцеллюлярный рак (ГЦР), злокачественную гепатому), рак легких (например, бронхогенную карциному, мелкоклеточный рак легких (МКРЛ), немелкоклеточный рак легких (НМКРЛ), аденокарциному легких), лейкоз (например, острый лимфоцитарный лейкоз (ОЛЛ), острый миелогенный лейкоз (ОМЛ), хронический миелогенный лейкоз (ХМЛ), хронический лимфоцитарный лейкоз (ХЛЛ)), лимфому (например, лимфому Ходжкина (ЛХ), неходжкинскую лимфому (НХЛ), включая, но не ограничиваясь ими, фолликулярную лимфому, диффузную крупноклеточную В-клеточную лимфому (ДКБКЛ), лимфому клеток коры головного мозга (ЛКГМ)), медуллобластому, множественную миелому (MM), миелодиспластический синдром (МДС), миелопролиферативное расстройство (МПР) (например, истинную полицитемию (ИП), эссенциальную тромбоцитемию (ЭТ), ангиогенную миелоидную метаплазию (AMM), также известную как первичный миелофиброз (ПМФ), хронический нейтрофильный лейкоз (ХНЛ), гиперэозинофильный синдром (ГЭС)), нейробластому, нейрофиброму (например, нейрофиброматоз (НФ) типа 1 или типа 2, шванноматоз), рак нейроэндокринной системы (например, опухоль гастроэнтеропанкреатической нейроэндокринной системы (GEP-NET), карциноидную опухоль), остеосаркому, рак яичника (например, цистаденокарциному, эмбриональную карциному яичника, аденокарциному яичника), рак поджелудочной железы (например, аденокарциному поджелудочной железы, новообразование ткани слизистой внутрипротоковых сосочков (НТСВС)), рак предстательной железы (например, аденокарциному предстательной железы), рак кожи (например, плоскоклеточную карциному (ПКК), кератоакантому (KA), меланому, базальноклеточную карциному (БКК), дерматофиброму), опухоли мягких тканей (например, ангиолипому, ангиолейомиому, злокачественную фиброзную гистиоцитому (ЗФГ), липосаркому, злокачественную опухоль периферического нервного сплетения (ЗОПНС), хондросаркому, фибросаркому, миксосаркому, остеосаркому) и любые другие опухоли, ассоциированные с десмоплазией. В таких вариантах осуществления изобретения полипептиды SAP или агонисты SAP могут снижать степень фиброза, что будет приводить к улучшению доставки лекарственного средства и/или к увеличению продолжительности жизни.
Способы лечения
В одном из своих аспектов, настоящее изобретение относится к способам лечения фиброзного рака или ассоциированного с раком фиброза у пациента, где указанный способ включает введение пациенту, нуждающемуся в этом, терапевтически эффективного количества полипептида SAP или агониста SAP согласно изобретению, используемого отдельно или в комбинации с противораковым терапевтическим средством. Доза и частота введения могут быть определены специалистом и могут варьироваться в зависимости от симптомов, возраста и массы тела пациента и от природы и тяжести расстройства, подвергаемого лечению или профилактике. В настоящем изобретении рассматриваются схемы введения доз, которые являются эффективными для лечения миелофиброза.
Введение полипептида SAP или агониста SAP согласно изобретению отдельно или в комбинации с другим противораковым терапевтическим средством еженедельно или менее часто (например, менее чем один раз в неделю, например, раз в 4 недели) приводило к значительному ослаблению симптомов фиброзного рака. Кроме того, способы согласно изобретению были также разработаны на основе обнаружения того факта, что полипептид SAP или агонист SAP согласно изобретению хорошо переносятся пациентом при их введении отдельно и в комбинации с другим противораковым терапевтическим средством, и при этом не наблюдается какой-либо клинически значимой миелосупрессии, индуцированной введением SAP, например, миелосупрессии, ассоциированной с таким лечением.
В некоторых своих аспектах настоящее изобретение относится к способам лечения фиброзного рака или ассоциированного с раком фиброза у пациента, где указанный способ включает введение пациенту, нуждающемуся в этом, полипептида SAP или агониста SAP согласно изобретению отдельно или в комбинации с противораковым терапевтическим средством в количестве, эффективном для улучшения функционирования пораженного органа. Такое улучшение функции может быть оценено, например, по снижению степени фиброза органа, увеличению числа тромбоцитов и/или повышению уровня гемоглобина. В некоторых вариантах осуществления изобретения фиброзным органом является костный мозг. В некоторых вариантах осуществления изобретения, фиброзным раком является миелофиброз. В некоторых вариантах осуществления изобретения фиброзным органом являются легкие, желудок, поджелудочная железа, толстая кишка, печень, почки, мочевой пузырь, молочная железа, матка, шейка матки, яичник или головной мозг.
В некоторых вариантах осуществления изобретения полипептид SAP или агонист SAP вводят пациенту один или два раза в день, один или два раза в неделю, один или два раза в месяц или непосредственно до начала появления или во время появления симптомов. В некоторых вариантах осуществления изобретения полипептид SAP или агонист SAP вводят пациенту с ИП или ЭТ, у которого еще не был диагностирован фиброз, для предупреждения развития фиброза.
Дозы могут быть легко определены методами, известными специалистам, или методами, описанными в литературе или в настоящей заявке. Токсичность и терапевтическая эффективность полипептида SAP или агониста SAP может быть определена с применением стандартных фармацевтических процедур на экспериментальных животных, например, путем вычисления LD50 и ED50. ED50(эффективная доза 50) представляет собой количество лекарственного средства, необходимое для достижения конкретного эффекта у 50% популяции животных. LD50(летальная доза 50) представляет собой дозу лекарственного средства, вызывающую летальный исход у 50% выбранной группы животных.
В некоторых аспектах изобретения полипептид SAP или агонист SAP вводят в качестве одного средства для лечения фиброзного рака или ассоциированного с раком фиброза у индивидуума. В некоторых аспектах изобретения введение комбинации полипептида SAP или агониста SAP (например, варианта полипептида SAP согласно изобретению) и противоракового терапевтического средства (например, химиотерапевтического средства или ингибитора тирозинкиназы) дает синергические эффекты при лечении фиброзного рака, например, миелофиброза или рака поджелудочной железы у индивидуума. Такой способ комбинированного или совместного введения средств двух типов может быть применен для лечения индивидуумов, страдающих фиброзными раковыми заболеваниями, которые не поддавались лечению или были резистентными к лечению уже существующими методами. Описанная здесь комбинированная терапия может быть также применена для повышения эффективности лечения и/или снижения побочных эффектов при проведении противораковой терапии уже существующими методами у индивидуумов, которые не поддавались лечению такими методами.
Экспериментальная комбинированная терапия приводила к снижению негативных побочных эффектов (например, анемии и тромбоцитопении), наблюдаемых у пациентов, которым до начала лечения с использованием SAP вводили только ингибитор JAK-киназы.
В некоторых своих вариантах настоящее изобретение относится к способам лечения миелофиброза, где указанный способ включает введение агониста SAP, такого как полипептид SAP, индивидууму, нуждающемуся в этом, в определенном количестве и в соответствии с определенной схемой введения доз (например, в соответствующей дозе и в соответствующем порядке введения), эффективных для ослабления одного или более симптомов миелофиброза, где индивидуум, нуждающийся в таком введении, ранее уже проходил курс лечения ингибитором JAK-киназы, которое было прекращено из-за отсутствия нужного эффекта. Такое лечение может найти более широкое применение для пациентов, страдающих другими фиброзными раковыми заболеваниями и/или проходящих лечение другими противораковыми терапевтическими средствами.
В некоторых своих вариантах, настоящее изобретение относится к способам лечения миелофиброза, где указанный способ включает введение агониста SAP, такого как полипептид SAP, индивидууму, нуждающемуся в этом, в определенном количестве и в соответствии с определенной схемой введения доз (например, в соответствующей дозе и в соответствующем порядке введения), эффективных для ослабления одного или более симптомов миелофиброза, где индивидуум, нуждающийся в таком введении, ранее уже проходил курс лечения ингибитором JAK-киназы. В соответствии с этим, настоящее изобретение относится, в частности, к способам, в которых агонист SAP, такой как полипептид SAP, может быть использован в комбинации с ингибитором JAK-киназы для достижения терапевтического эффекта, заключающегося в ослаблении одного или более симптомов миелофиброза и превышающего терапевтический эффект, наблюдаемый при лечении миелофиброза у пациента только с использованием ингибитора JAK-киназы. В некоторых вариантах осуществления изобретения способы согласно изобретению не индуцируют миелосупрессию, ассоциированную с таким лечением (например, агонист SAP не индуцирует клинически значимую миелосупрессию и/или не приводит к увеличению уровня миелосупрессии (и может даже снижать такой уровень) по сравнению с базовым уровнем). Другими словами, в некоторых вариантах осуществления изобретения способы согласно изобретению не индуцируют миелосупрессию или не приводят к ухудшению состояния, связанного с миелосупрессией, по сравнению, например, с состоянием пациента до начала лечения. Миелосупрессия может быть оценена в соответствии с общепринятой терминологией для кодирования побочных эффектов (CTCAE) по шкале оценок от 0 до 5 (см. National Cancer Institute Common Terminology Criteria for Adverse Events v4.0, NCI, NIH, DHHS. May 29, 2009 NIH publication # 09-7473). В некоторых вариантах осуществления изобретения после проведения лечения, один или более признаков миелосупрессии, таких как анемия, не ухудшаются (например, оценки побочных эффектов не повышаются с балла 3 до балла 4 и с балла 2 до балла 3).
Термин «прекращение ответа на лечение» означает, что у индивидуума более не наблюдается какого-либо ответа на лечение или наблюдается снижение восприимчивости к лечению, в результате чего возникает необходимость в увеличении дозы, либо, в противном случае, будет наблюдаться снижение благоприятного эффекта. В некоторых вариантах осуществления изобретения индивидуум, нуждающийся в таком лечении, ранее уже проходил лечение руксолитинибом или другим ингибитором JAK-киназы, но у него наблюдалось прекращение ответа на такое лечение. В некоторых вариантах осуществления изобретения указанный способ также включает введение дополнительного противоракового терапевтического средства. В некоторых вариантах осуществления изобретения дополнительной противораковой терапией является та же самая терапия, на которую ранее у индивидуума наблюдалось прекращение ответа.
В одном из своих аспектов настоящее изобретение относится к способам лечения фиброза, ассоциированного с раком, или фиброзных раковых заболеваний, где указанные способы включают введение полипептида SAP или агониста SAP в комбинации с противораковым терапевтическим средством. Используемый здесь термин «в комбинации с...» или «совместное введение» относятся к любой форме введения, при котором второе соединение сохраняет свою эффективность в организме (например, два соединения одновременно дают у пациента благоприятный эффект, который может представлять собой синергический эффект этих двух соединений). Эффективность может не коррелировать с измеримой концентрацией данного средства в крови, в сыворотке или в плазме. Так, например, различные терапевтические соединения могут быть введены либо в одном и том же препарате, либо в отдельных препаратах, либо одновременно, либо последовательно, и в соответствии с различными схемами введения. Таким образом, у индивидуума, прошедшего такое лечение, может наблюдаться благоприятный эффект, обусловленный комбинированным действием различных терапевтических средств. Полипептид SAP или агонист SAP могут быть введены до, во время или после введения одного или более других дополнительных средств.
В некоторых вариантах осуществления изобретения полипептид SAP или агонист SAP вводят пациентам, которые уже проходили курс длительной противораковой терапии. В некоторых вариантах осуществления изобретения пациенты проходили курс длительной противораковой терапии в течение по меньшей мере 3 месяцев. В некоторых вариантах осуществления изобретения пациенты проходили курс длительной противораковой терапии в течение менее чем 3 месяцев. В некоторых вариантах осуществления изобретения пациенты проходили курс длительной противораковой терапии по меньшей мере 2 недели, по меньшей мере 3 недели, по меньшей мере 1 месяц, по меньшей мере 2 месяца, по меньшей мере 3 месяца, по меньшей мере 4 месяца, по меньшей мере 6 месяцев, по меньшей мере 7 месяцев, по меньшей мере 8 месяцев, по меньшей мере 9 месяцев, по меньшей мере 10 месяцев, по меньшей мере 11 месяцев или по меньшей мере один год. В некоторых вариантах осуществления изобретения длительной противораковой терапией является лечение с использованием ингибитора JAK-киназы, такого как руксолитиниб.
Вообще говоря, каждое терапевтическое средство вводят в дозе и/или в течение периода времени, определенных для данного конкретного средства. Конкретную комбинацию, используемую в этой схеме введения, определяют в зависимости от совместимости полипептида SAP или агониста SAP с указанным средством и/или от желаемого терапевтического эффекта.
Противораковыми терапевтическими средствами согласно изобретению могут быть, но не ограничиваются ими, химиотерапевтические средства, средства на основе антител, ингибиторы тирозинкиназы, иммуномодулирующие агенты, биологические агенты и их комбинации. Химиотерапевтическими средствами являются, но не ограничиваются ими: актиномицин D, альдеслейкин, алитретиноин, все транс-ретиноевые кислоты/ATRA, альтретамин, амсакрин, аспарагиназа, азацитидин, азатиоприн, бацилла Кальметта-Герена/БЦЖ, гидрохлорид бендамустина, бексаротен, бикалутамид, блеомицин, бортезомид, бусульфан, капецитабин, карбоплатин, карфилзомиб, кармустин, хлорамбуцил, цисплатин/цисплатина, кладрибин, циклофосфамид/цитофосфан, цитарабин, дакарбазин, даунорубицин/дауномицин, денилейкин дифитокс, дексразоксан, доцетаксел, доксорубицин, эпирубицин, этопозид, флударабин, фторурацил (5-FU), гемцитабин, гозерелин, гидрокортизон, гидроксимочевина, идарубицин, ифосфамид, интерферон-альфа, иринотекан CPT-11, лапатиниб, леналидомид, лейпролид, мехлоретамин/хлорметин/мустин/HN2, меркаптопурин, метотрексат, метилпреднизолон, митомицин, митотан, митоксантрон, остреотид, опрелвекин, оксалиплатин, паклитаксел, памидронат, пазопаниб, пегаспаргаза, пегфилграстим, ПЭГ-интерферон, пеметрексед, пентостатин, фенилаланиновый аналог горчичного газа, пликамицин/митрамицин, преднизон, преднизолон, прокарбазин, ралоксифен, ромиплостим, сарграмостим, стрептозоцин, тамоксифен, темозоломид, темсиролимус, тенипозид, талидомид, тиогуанин, тиофосфамид/тиотепа, тиотепа, гидрохлорид топотекана, торемифен, третиноин, валрубицин, винбластин, винкристин, виндезин, винорелбин, вориностат, золендроновая кислота и/или их комбинации. Средствами на основе антител являются, но не ограничиваются ими, алемтузумаб, бевацизумаб, цетуксимаб, фрезолимумаб, гемтузумаб, озогамицин, ибритумомаб тиуксетан, офатумумаб, панитумумаб, ритуксимаб, тозитумомаб, трастузумаб, трастузумаб DM1 и их комбинации. Иммуномодулирующими соединениями являются, но не ограничиваются ими, небольшие органические молекулы, которые ингибируют продуцирование TNFα и ЛПС-индуцированных моноцитарных IL1β, IL12 и IL6. В некоторых вариантах осуществления изобретения иммуномодулирующими соединениями являются, но не ограничиваются ими, метотрексат, лефлуномид, циклофосфамид, циклоспорин A, миноциклин, азатиоприн, антибиотик (например, такролимус), метилпреднизолон, кортикостероид, стероид, микофенолята мофетил, рапамицин, мизорибин, дезоксиспергуалин, брехинар, модулятор Т-клеточного рецептора или модулятор рецептора цитокина и агонсит ловушкоподобного рецептора (TLR). В некоторых вариантах осуществления изобретения иммуномодулирующими соединениями являются 5,6-диметилксантон-4-уксусная кислота (DMXAA), талидомид, леналидомид, помалидомид, лактоферрин, полиаденозин-полиуридиловая кислота (поли-AU), ринтатолимод (полиI:полиC12U; Hemispherx Biopharma), полиинозиновая-полицитидиловая кислота, стабилизированная поли-L-лизином и карбоксиметилцеллюлозой (Poly-ICLC, Hiltonol®), имихимод (3M) и резихимод (R848; 3M), неметилированный CpG-динуклеотид (CpG-ODN) и ипилумумаб. Биологическими агентами являются моноклональные антитела (MAB), CSF, интерфероны и интерлейкины. В некоторых вариантах осуществления изобретения биологическими агентами являются IL-2, IL-3, эритропоэтин, G-CSF, филграстим, интерферон-альфа, алемтузумаб, бевацизумаб, цетуксимаб, гемтузумаб, озогамицин, ибритумомаб тиуксетан, офатумумаб, панитумумаб, ритуксимаб, тозитумомаб или трастузумаб.
Ингибиторами тирозинкиназы являются, но не ограничиваются ими, акситиниб, бафетиниб, бозутиниб, целираниб, кризотиниб, дазатиниб, эрлотиниб, гефитиниб, иматиниб, лапатиниб, нератиниб, нилотиниб, пазопаниб, понатиниб, хизартиниб, регорафениб, сорафениб, сунитиниб, вандетаниб, ваталаниб и их комбинации.
В некоторых вариантах осуществления изобретения противораковыми терапевтическим средством является ингибитор JAK-киназы, такой как, но не ограничивающийся ими, AC-430, AZD1480, барицитиниб, BMS-911453, CEP-33779, CYT387, GLPG-0634, лестауртиниб, LY2784544, NS-018, пакритиниб, R-348, R723, руксолитиниб, TG101348 (SAR302503), тофацитиниб и VX-509.
В некоторых вариантах осуществления изобретения противораковыми терапевтическими средствами являются, но не ограничиваются ими, антиметаболиты (например, 5-фторурацил, цитарабин, метотрексат, флударабин и т.п.), агенты, ингибирующие микротрубочки (например, винкаалкалоиды, такие как винкристин, винбластин; таксаны, такие как паклитаксел и доцетаксел), алкилирующие агенты (например, циклофосфамид, мелфалан, кармустин, нитрозомочевины, такие как бихлорэтилнитрозомочевина и гидроксимочевина), средства на основе платины (например, цисплатин, карбоплатин, оксалиплатин, сатраплатин и CI-973), антрациклины (например, доксорубицин и даунорубицин), противоопухолевые антибиотики (например, митомицин, идарубицин, адриамицин и дауномицин), ингибиторы топоизомеразы (например, этопозид и камптотецины), агенты, ингибирующие ангиогенез (например, сунитиниб, сорафениб и бевацизумаб) или любые другие цитотоксические агенты (например, фосфат эстрамустина, преднимустин), гормоны или агонисты, антагонисты, частичные агонисты или частичные антагонисты гормонов, ингибиторы киназы (такие как иматиниб) и агенты для лучевой терапии.
Любой способ лечения согласно изобретению может быть при желании или при необходимости проведен повторно. Так, например, лечение может быть проведено периодически. Частота введения может быть определена самим специалистом. Так, например, лечение может быть осуществлено путем введения лекарственного средства один раз в неделю в течение нескольких недель или несколько раз в неделю в течение нескольких определенного периода времени (например, 3 раза в неделю в течение первой недели терапии). В некоторых вариантах осуществления изобретения после введения первой ударной дозы вводят поддерживающую дозу. В некоторых вариантах осуществления изобретения ударную дозу вводят периодически. В некоторых вариантах осуществления изобретения первую ударную дозу вводят несколько раз в неделю (например, 3 раза в течение первой недели терапии). В некоторых вариантах осуществления изобретения ударная доза может быть введена повторно через неделю, через месяц, через два месяца, через 3 месяца или через 6 месяцев, или, при необходимости, продолжают, или не продолжают, периодическое введение ударных доз с более длительными периодами между введениями этих доз. Вообще говоря, ослабление симптомов ассоциированного с раком фиброза поддерживается в течение некоторого периода времени, а предпочтительно, по меньшей мере в течение нескольких месяцев, однако, для поддержания антифибротического эффекта и/или для предупреждения рецидивов фиброза может потребоваться продолжительное периодическое введение доз полипептида SAP или агониста SAP в течение неограниченного периода времени. В течение этого периода времени, у пациента могут наблюдаться рецидивирующие симптомы, и поэтому, на данном этапе лечение может быть проведено повторно.
В некоторых своих аспектах настоящее изобретение относится к способам лечения, замедления развития и/или предупреждения миелофиброза у индивидуума, где указанные способы включают введение индивидууму эффективного количества полипептида SAP или агониста SAP или их фармацевтически приемлемой соли отдельно или в комбинации с противораковым терапевтическим средством. В некоторых вариантах осуществления изобретения у индивидуума был диагностирован миелофиброз. В некоторых вариантах осуществления изобретения у индивидуума имеется риск развития миелофиброза. В некоторых вариантах осуществления изобретения указанным индивидуумом является человек. Для лечения индивидуума с миелофиброзом может быть использован любой из описанных здесь препаратов, таких как капсулы или стандартные дозированные формы, описанные в настоящей заявке.
Миелофиброз, который может быть подвергнут лечению описанными здесь способами, включает первичный миелофиброз (PMF) и вторичный миелофиброз (например, миелофиброз на фоне истинной полицитемии (пост-ИП МФ) или эссенциальной тромбоцитемии (пост-ЭТ МФ)). Миелофиброз, который может быть подвергнут лечению описанными здесь способами, также включает миелофиброз с высоким риском развития, с промежуточным риском развития, например, с промежуточным уровнем риска 1 или промежуточным уровнем риска 2, и с низким риском развития. Методы диагностики миелофиброза различных типов известны специалистам. См., например, Cervantes et al., Blood 2009, 113(13):2895-901. В некоторых вариантах осуществления изобретения для изменения профиля риска после диагностики может оказаться полезной динамическая прогностическая модель. См., например, Passamonti et al., Blood 2010, 115:1703-1708. В некоторых вариантах осуществления изобретения у индивидуума была диагностирована пальпируемая спленомегалия. В некоторых вариантах осуществления изобретения у индивидуума с миелофиброзом селезенка выступает по меньшей мере на 5 см ниже реберного края, как было определено путем пальпации. В некоторых вариантах осуществления изобретения у индивидуума наблюдается анемия и/или тромбоцитопения и/или лейкопения. В некоторых вариантах осуществления изобретения у индивидуума отсутствует анемия, тромбоцитопения или лейкопения. В некоторых вариантах осуществления изобретения индивидуум является трансфузионно-зависимым. В некоторых вариантах осуществления изобретения индивидуум не является трансфузионно-зависимым. В некоторых вариантах осуществления изобретения у индивидуума был клинически подтвержден диагноз ПМФ по диагностическим критериям ВОЗ, или пост-ЭТ/ИП МФ, включая наличие фиброза костного мозга на стадии 2 с промежуточным риском развития -1, с промежуточным риском развития -2 или с высоким риском развития в соответствии с Международной Динамической Прогностической системой оценок IWG-MRT. В некоторых вариантах осуществления изобретения у индивидуума клинически подтвержден диагноз ПМФ по диагностическим критериям ВОЗ, или пост-ЭТ/ИП МФ, включая наличие фиброза костного мозга по меньшей мере на стадии 0 или 1 с низким риском развития, с промежуточным риском развития -1, с промежуточным риском развития -2 или с высоким риском развития в соответствии с Международной Динамической Прогностической системой оценок IWG-MRT. В некоторых вариантах осуществления изобретения у индивидуума наблюдается «префибротический» миелофиброз. В некоторых вариантах осуществления изобретения у индивидуума имеются ИП или ЭТ, и этому индивидууму вводят полипептид SAP или агонист SAP для предупреждения развития миелофиброза.
В некоторых вариантах осуществления изобретения у индивидуума, если этим индивидуумом является человек, имеется точковая мутация, соответствующая замене валина 617 на фенилаланин в Янус-киназе 2 (киназе JAK2) (JAK2V617F) или, если этот индивидуум не является человеком, то у него имеется точковая мутация, а именно, замена валина 617 на фенилаланин в Янус-киназе 2 (киназе JAK2). В некоторых вариантах осуществления изобретения если этим индивидуумом является человек, то он является негативным по замене валина 617 на фенилаланин в JAK2, а если этот индивидуум не является человеком, то он является негативным по мутации, соответствующей замене валина 617 на фенилаланин в Янус-киназе 2 (в киназе JAK2). Для того чтобы определить, является ли индивидуум позитивным или негативным по JAK2V617F, может быть проведен анализ методом полимеразной цепной реакции («ПЦР») с использованием геномной ДНК, выделенной из клеток костного мозга или клеток крови (например, лейкоцитов цельной крови). ПЦР-анализ может представлять собой аллель-специфическую ПЦР (например, аллель-специфическую количественную ПЦР) или секвенирующую ПЦР. См. публикации Kittur J et al., Cancer 2007, 109(11):2279-84 и McLornan D et al., Ulster Med J. 2006, 75(2): 112-9, каждая из которых во всей своей полноте вводится в настоящее описание посредством ссылки.
В некоторых вариантах осуществления изобретения индивидуум, проходящий лечение описанными здесь способами, ранее уже проходил лечение или проходит в данное время другую терапию или другое лечение миелофиброза. В некоторых вариантах осуществления изобретения у индивидуума не наблюдается ответа на другую терапию миелофиброза, либо у него наблюдается рецидив после проведения другой терапии миелофиброза. Проведенной ранее терапией может быть терапия с использованием ингибитора JAK2 (например, INCB018424 (также известного как руксолитиниб, поставлемый от Incyte), CEP-701 (лестауртиниба, поставляемого от Cephalon) или XL019 (поставляемого от Exelixis)) (См. Verstovsek S., Hematology Am Soc Hematol Educ Program. 2009:636-42) или терапия с использованием другого соединения, не являющегося ингибитором JAK2 (такого как гидроксимочевина). В некоторых вариантах осуществления изобретения проведенной ранее терапией может быть терапия с использованием ингибитора JAK-киназы, такого как, но не ограничивающегося ими, AC-430, AZD1480, барицитиниб, BMS-911453, CEP-33779, CYT387, GLPG-0634, лестауртиниб, LY2784544, NS-018, пакритиниб, руксолитиниб, TG101348 (SAR302503), тофацитиниб, VX-509, R-348 или R723. В некоторых вариантах осуществления изобретения индивидууму вводили руксолитиниб для лечения первичного миелофиброза, миелофиброза на фоне истинной полицитемии (пост-ИП МФ), миелофиброза на фоне эссенциальной тромбоцитемии (пост-ЭТ МФ), истинной полицитемии или эссенциальной тромбоцитемии в течение по меньшей мере трех месяцев. В некоторых вариантах осуществления изобретения индивидууму вводили руксолитиниб для лечения первичного миелофиброза, миелофиброза на фоне истинной полицитемии (пост-ИП МФ), миелофиброза на фоне эссенциальной тромбоцитемии (пост-ЭТ МФ), истинной полицитемии или эссенциальной тромбоцитемии по меньшей мере в течение менее чем трех месяцев. В некоторых вариантах осуществления изобретения индивидууму вводили руксолитиниб для лечения первичного миелофиброза, миелофиброза на фоне истинной полицитемии (пост-ИП МФ), миелофиброза на фоне эссенциальной тромбоцитемии (пост-ЭТ МФ), истинной полицитемии или эссенциальной тромбоцитемии в течение по меньшей мере трех месяцев. В некоторых вариантах осуществления изобретения после проведения длительной терапии руксолитинибом наблюдалось исчезновение по меньшей мере одного или более симптомов, что приводило к улучшению состояния индивидуума. В некоторых вариантах осуществления изобретения у индивидуума больше не наблюдалось восприимчивости руксолитинибу. В некоторых вариантах осуществления изобретения индивидуум ранее проходил другую терапию миелофиброза по меньшей мере 6 месяцев, по меньшей мере 5 месяцев, по меньшей мере 4 месяца, по меньшей мере 3 месяца, по меньшей мере 2 месяца, по меньшей мере 1 месяц, по меньшей мере 3 недели или по меньшей мере 2 недели. В некоторых вариантах осуществления изобретения у индивидуума больше не наблюдалось восприимчивости к другой терапии миелофиброза. В некоторых вариантах осуществления изобретения проводимой ранее терапией является описанная здесь противораковая терапия, и такая терапия была прервана после обнаружения в сыворотке индивидуума повышенных уровней одного или более компонентов, таких как амилаза, липаза, аспартатаминотрансфераза (AST), аланинаминотрансфераза (ALT) и/или креатинин, и/или после диагностики гематологического состояния, выбранного из группы, состоящей из анемии, тромбоцитопении и нейтропении, или по решению лечащего врача или по требованию самого пациента, вызванными какими-либо другими причинами. В некоторых вариантах осуществления изобретения доза соединения, используемого во второй терапии, является такой же, которая была введена в предыдущей терапии, или ниже. В некоторых вариантах осуществления изобретения, индивидуум не проходил какую-либо другую терапию, кроме переливания крови. В некоторых вариантах осуществления изобретения индивидуум ранее не проходил какую-либо терапию.
В некоторых вариантах осуществления изобретения полипептид SAP или агонист SAP вводят в комбинации с ингибитором JAK-киназы, таким как, но не ограничивающимся ими, AC-430, AZD1480, барицитиниб, BMS-911453, CEP-33779, CYT387, GLPG-0634, INCB18424, лестауртиниб, LY2784544, NS-018, пакритиниб, руксолитиниб, TG101348 (SAR302503), тофацитиниб, VX-509, R-348 или R723 (cм. Kontzias et al. Curr Opin Pharmacol. 2012, 12(4):464-470). В некоторых вариантах осуществления изобретения полипептид SAP или агонист SAP вводят в комбинации с агентом, который, как известно, ослабляет симптомы миелофиброза, такой как, но не ограничивающийся ими, AB0024, AZD1480, AT-9283, BMS-911543, CYT387, эверолимус, гивиностат, иметелстат, лестауртиниб, LY2784544, NS-018, мышьяк для перорального введения, пакритиниб, панобиностат, ПЭГ-интерферон альфа-2a, помалидомид, прациностат, руксолитиниб, TAK-901 и TG101438 (SAR302503) (Mesa, Leuk Lymphoma 2013, 54(2):242-251; Gupta et al. 2012, 2(3):170-186; Kucine and Levine 2011, 2(4):203-211).
Индивидуум (такой как человек) может быть подвергнут лечению путем введения полипептида SAP или агониста SAP в дозе, составляющей приблизительно от 0,1 мг/кг до 40 мг/кг. В некоторых вариантах осуществления изобретения полипептид SAP или агонист SAP вводят в дозе 10 мг/кг. В некоторых вариантах осуществления изобретения соединение вводят в дозе, составляющей приблизительно 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 0,6 мг/кг, 0,7 мг/кг, 0,8 мг/кг, 0,9 мг/кг, 1 мг/кг, 2 мг/кг, 3 мг/кг, 4 мг/кг, 5 мг/кг, 8 мг/кг, 10 мг/кг, 12 мг/кг, 15 мг/кг, 18 мг/кг, 20 мг/кг, 25 мг/кг, 30 мг/кг, 35 мг/кг или 40 мг/кг. В некоторых вариантах осуществления изобретения полипептид SAP или агонист SAP вводят в дозе, составляющей приблизительно 0,1-0,3, 0,3-0,5, 0,5-0,8, 0,8-1, 1-5, 5-10, 10-15, 15-20, 20-25, 25-30, 30-35 или 35-40 мг/кг. Соединение может быть приготовлено в виде капсулы и/или в виде стандартной дозированной формы, описанной в настоящей заявке. В некоторых вариантах осуществления изобретения соединение вводят внутривенно (IV). В некоторых вариантах осуществления изобретения соединение вводят путем инъекции (например, SubQ, IM, IP), путем ингаляции или инсуффляции (в ротовую полость или в нос) или перорально, трансбуккально, подъязычно, трансдермально, интраназально, парентерально или ректально. В некоторых вариантах осуществления изобретения агонист SAP, такой как полипептид SAP, вводят путем внутривенного вливания. В некоторых вариантах осуществления изобретения вливание каждой дозы осуществляют в течение приблизительно одного часа. Однако, вливание может быть проведено за более длительные или более короткие периоды времени (например, 30 минут, 40 минут, 45 минут, 50 минут, 55 минут, 1 час 10 минут, 1 час 15 минут, 90 минут и т.п.). Если указанный способ включает введение дополнительного противоракового терапевтического средства, то такое терапевтическое средство может быть введено одним и тем же способом или различными способами. В некоторых вариантах осуществления изобретения дополнительное противораковое терапевтическое средство вводят перорально.
Настоящее изобретение также относится к способам ослабления одного или более признаков или симптомов, ассоциированных с миелофиброзом. Так, например, лечение описанными здесь способами является эффективным для снижения размера селезенки, ослабления генерализованных симптомов (таких как быстрое насыщение, усталость, ночные выпоты, кашель и зуд), снижения баллов по общей шкале оценок всех симптомов MPN-SAF, ослабление тяжести лейкоцитоза, ослабление тяжести тромбоцитоза, ослабление тяжести анемии, ослабление тяжести тромбоцитопении, ослабление тяжести лейкопении, снижения трансфузионной зависимости, снижения аллельной нагрузки JAK2V617Fn, уменьшения числа бластных клеток периферической крови, уменьшения числа бластных клеток костного мозга, снижения степени фиброза костного мозга, ослабления зуда, ослабление тяжести кахексии и/или снижения или увеличения числа клеток костного мозга. Такое уменьшение, снижение, ослабление или улучшение может составлять по меньшей мере 5, 10, 20, 30, 40, 50, 60, 70, 80 или 90% по сравнению с уровнями, установленными до начала проведения лечения описанными здесь способами. В некоторых вариантах осуществления изобретения после проведения лечения, у индивидуума наблюдается снижение степени фиброза костного мозга. В некоторых вариантах осуществления изобретения после лечения фиброз костного мозга снижается до оценки 0. В некоторых вариантах осуществления изобретения фиброз костного мозга снижается до оценки 1. В некоторых вариантах осуществления изобретения после лечения селезенка у индивидуума становится не пальпируемой. В некоторых вариантах осуществления изобретения после лечения у индивидуума наблюдается полное исчезновение лейкоцитоза и/или тромбоцитоза. В некоторых вариантах осуществления изобретения после лечения у индивидуума наблюдается полное исчезновение анемии, тромбоцитопении и/или лейкопении. В некоторых вариантах осуществления изобретения после лечения индивидуум больше не является трансфузионно-зависимым. В некоторых вариантах осуществления изобретения после лечения у индивидуума полностью исчезает зуд. В некоторых вариантах осуществления изобретения эффективность лечения определяют по общим показателям ответа (ORR), классифицированным в соответствии с критериями, утвержденными Международной Рабочей Группой (IWG), в которые были внесены изменения, а именно, был включен критерий стабильного состояния со снижением тяжести фиброза костного мозга по меньшей мере на один балл, как признак восприимчивости к лечению. В некоторых вариантах осуществления изобретения эффективность лечения определяют по снижению тяжести фиброза костного мозга по меньшей мере на один балл в соответствии с Европейским Соглашением по присвоению баллов при оценке степени фиброза костного мозга. В некоторых вариантах осуществления изобретения эффективность лечения оценивают по изменению уровней цитокинов в плазме, включая, но не ограничиваясь ими, CRP, IL-1Ra, MIP-1β, TNFα, IL-6 и VEGF. В некоторых вариантах осуществления изобретения эффективность лечения оценивают по изменению уровней экспрессии мРНК и миРНК в МКПК. В некоторых вариантах осуществления изобретения эффективность лечения оценивают по прекращению прогрессирования ИП или ЭТ в миелофиброз. В некоторых вариантах осуществления изобретения эффективность лечения оценивают по отсутствию увеличения степени фиброза костного мозга по меньшей мере на один балл.
В некоторых вариантах осуществления изобретения лечение, проводимое описанными здесь способами (например, с использованием одного агента, то есть, полипептида SAP или агониста SAP для монотерапии или с их использованием в комбинированной терапии), является эффективным для снижения объема селезенки по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65% или по меньшей мере на 70% по сравнению с объемом, установленным до начала проведения лечения описанными здесь способами (например, по сравнению с базовым уровнем). В некоторых вариантах осуществления изобретения лечение является эффективным для снижения объема селезенки по меньшей мере на 25%. В некоторых вариантах осуществления изобретения лечение является эффективным для снижения объема селезенки по меньшей мере на 50%. В некоторых вариантах осуществления изобретения лечение является эффективным для снижения объема селезенки приблизительно на 20-70%, приблизительно на 20-60%, приблизительно на 25-60%, приблизительно на 25-55% или приблизительно на 25%-50%. В некоторых вариантах осуществления изобретения объем селезенки может быть измерен путем мануальной пальпации. При этом следует отметить, что могут быть применены и другие известные методы измерения объема селезенки такие как измерение путем визуализации методами магнитного резонанса. В некоторых своих вариантах настоящее изобретение относится к способам снижения объема селезенки у пациента, нуждающегося в этом, где указанным пациентом является пациент, страдающий миелофиброзом, и где указанный способ включает введение пациенту агониста SAP, такого как полипептид SAP, отдельно или в комбинации с дополнительным противораковым терапевтическим средством (например, ингибитором JAK-киназы) в количестве и в дозах, эффективных для снижения объема селезенки по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 50% или по меньшей мере на 55%. В некоторых вариантах осуществления изобретения, агонист SAP включает полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования человеческого SAP, выделенного из сыворотки, а дополнительным противораковым терапевтическим средством является ингибитор JAK-киназы. В некоторых вариантах осуществления изобретения ингибитором JAK-киназы является руксолитиниб. В некоторых вариантах осуществления изобретения объем селезенки снижается приблизительно на 25-55%, приблизительно на 25-50% или приблизительно на 25-40%.
В некоторых вариантах осуществления изобретения лечение, проводимое описанными здесь способами (например, с использованием одного агента, то есть, полипептида SAP или агониста SAP для монотерапии или с их использованием в комбинированной терапии), является эффективным для снижения баллов всех симптомов по анкете для оценки симптомов миелопролиферативных новообразований (MPN-SAF) по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65% или по меньшей мере на 70% по сравнению с оценкой, установленной до начала проведения лечения описанными здесь способами. См. публикацию Emanuel et al., 2012, Journal of Clinical Oncology, volume 30, number 33, pages 4098-4013, где приводится описание и обсуждение оценки всех симптомов по анкете для присвоения баллов симптомам миелопролиферативных новообразований. В некоторых вариантах осуществления изобретения лечение является эффективным для снижения баллов по всем симптомам по шкале MPN-SAF по меньшей мере на 25%. В некоторых вариантах осуществления изобретения лечение является эффективным для снижения баллов по всем симптомам по шкале MPN-SAF по меньшей мере на 50%. В некоторых вариантах осуществления изобретения симптомы были оценены на эффективность лечения по анкете MPN-SAF для пациентов (Emanuel et al. 2012, Journal of Clinical Oncology 30(33):4098-4103). В некоторых своих вариантах настоящее изобретение относится к способам снижения баллов по всем симптомам по шкале MPN-SAF у пациентов, страдающих миелофиброзом, где указанные способы включают введение пациенту агониста SAP, такого как полипептид SAP, отдельно или в комбинации с дополнительным противораковым терапевтическим средством (например, ингибитором JAK-киназы) в количестве и в дозах, эффективных для снижения баллов по всем симптомам по MPN-SAF по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 55% или по меньшей мере на 60%. В некоторых вариантах осуществления изобретения агонист SAP включает полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования человеческого SAP, выделенного из сыворотки, а дополнительным противораковым терапевтическим средством является ингибитор JAK-киназы. В некоторых вариантах осуществления изобретения ингибитором JAK-киназы является руксолитиниб. В некоторых вариантах осуществления изобретения баллы по всем симптомам по шкале MPN-SAF снижаются приблизительно на 25-60%, приблизительно на 25-55% или приблизительно на 25-50%.
В некоторых вариантах осуществления изобретения лечение, проводимое описанными здесь способами (например, с использованием одного агента, то есть, полипептида SAP или агониста SAP для монотерапии или с их использованием в комбинированной терапии), является эффективным для повышения уровней гемоглобина по меньшей мере приблизительно на 500 мг/л, 1 г/л, 2 г/л, 3 г/л или 5 г/л по сравнению с уровнями, наблюдаемыми до начала проведения лечения описанными здесь способами (например, по сравнению с базовым уровнем). В некоторых вариантах осуществления изобретения лечение является эффективным для повышения уровней гемоглобина по меньшей мере приблизительно на 500-1000 мг/л, 1-2 г/л, 2-3 г/л, или 3-5 г/л по сравнению с уровнями, наблюдаемыми до начала проведения лечения описанными здесь способами (например, по сравнению с базовым уровнем). В некоторых вариантах осуществления изобретения лечение является эффективным для повышения уровней гемоглобина на 1 г/л. В некоторых вариантах осуществления изобретения лечение является эффективным для повышения уровней гемоглобина по меньшей мере на 80 г/л, по меньшей мере на 90 г/л, по меньшей мере на 100 г/л, по меньшей мере на 110 г/л, по меньшей мере на 120 г/л, по меньшей мере на 130 г/л или по меньшей мере на 140 г/л. В некоторых вариантах осуществления изобретения лечение является эффективным для повышения уровней гемоглобина по меньшей мере приблизительно на 100 г/л. В некоторых вариантах осуществления изобретения уровни гемоглобина определяют путем проведения стандартного клинического анализа крови (CBC). Следует отметить, что определение уровней гемоглобина может быть осуществлено с применением других известных методов. В некоторых своих вариантах настоящее изобретение относится к способам повышения уровня гемоглобина у пациентов, страдающих миелофиброзом, где указанные способы включают введение пациенту агониста SAP, такого как полипептид SAP, отдельно или в комбинации с дополнительным противораковым терапевтическим средством (например, ингибитором JAK-киназы) в количестве и в дозах, эффективных для повышения уровней гемоглобина по меньшей мере приблизительно на 500 мг/л, 1 г/л, 2 г/л, 3 г/л или 5 г/л. В некоторых вариантах осуществления изобретения агонист SAP включает полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования человеческого SAP, выделенного из сыворотки, а дополнительным противораковым терапевтическим средством является ингибитор JAK-киназы. В некоторых вариантах осуществления изобретения ингибитором JAK-киназы является руксолитиниб. В некоторых вариантах осуществления изобретения уровни гемоглобина повышаются приблизительно на 500-1000 мг/л, 1-2 г/л, 2-3 г/л или 3-5 г/л. В некоторых вариантах осуществления изобретения уровни гемоглобина повышаются приблизительно по меньшей мере на 80 г/л, 90 г/л, 100 г/л, 110 г/л, 120 г/л, 130 г/л или 140 г/л.
В некоторых вариантах осуществления изобретения лечение, проводимое описанными здесь способами (например, с использованием одного агента, то есть, полипептида SAP или агониста SAP для монотерапии или с их использованием в комбинированной терапии), является эффективным для снижения трансфузии эритроцитов (RBC) по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55% или по меньшей мере на 60%, по сравнению с уровнем, установленным до начала проведения лечения описанными здесь способами. В некоторых вариантах осуществления изобретения лечение является эффективным для снижения трансфузии RBC по меньшей мере на 25%. В некоторых вариантах осуществления изобретения лечение является эффективным для трансфузии RBC по меньшей мере на 50%. В некоторых вариантах осуществления изобретения лечение является эффективным для устранения зависимости от трансфузии RBC. В некоторых своих вариантах настоящее изобретение относится к способам снижения трансфузии RBC у пациента, нуждающегося в этом, где указанным пациентом является пациент, страдающий миелофиброзом, и где указанный способ включает введение пациенту агониста SAP, такого как полипептид SAP, отдельно или в комбинации с дополнительным противораковым терапевтическим средством (например, ингибитором JAK-киназы) в количестве и в дозах, эффективных для снижения трансфузии RBC по меньшей мере приблизительно на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 55% или по меньшей мере на 60%. В некоторых вариантах осуществления изобретения агонист SAP включает полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования человеческого SAP, выделенного из сыворотки, а дополнительным противораковым терапевтическим средством является ингибитор JAK-киназы. В некоторых вариантах осуществления изобретения ингибитором JAK-киназы является руксолитиниб. В некоторых вариантах осуществления изобретения трансфузия RBC снижается приблизительно на 25-60%, приблизительно на 25-55% или приблизительно на 25-50%. В некоторых вариантах осуществления изобретения пациенту после лечения уже не требуется такая трансфузия.
В некоторых вариантах осуществления изобретения лечение, проводимое описанными здесь способами (например, с использованием одного агента, то есть, полипептида SAP или агониста SAP для монотерапии или с их использованием в комбинированной терапии), является эффективным для ослабления симптомов тромбоцитопении, если она присутствует. В некоторых вариантах осуществления изобретения такое лечение приводит к увеличению числа тромбоцитов по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80% или по меньшей мере на 100%, по сравнению с уровнем, установленным до начала проведения лечения описанными здесь способами. В некоторых вариантах осуществления изобретения такое лечение приводит к увеличению числа тромбоцитов по меньшей мере на 20%-30%, по меньшей мере на 30%-40%, по меньшей мере на 40%-50%, по меньшей мере на 50%-60%, по меньшей мере на 60%-70%, по меньшей мере на 70%-80%, по меньшей мере на 80%-90% или по меньшей мере на 90%-100% по сравнению с уровнем, установленным до начала проведения лечения описанными здесь способами. В некоторых вариантах осуществления изобретения лечение является эффективным для увеличения числа тромбоцитов по меньшей мере на 100%. В некоторых вариантах осуществления изобретения такое лечение приводит к увеличению числа тромбоцитов по меньшей мере до 40×109/л, 50×109/л, 60×109/л, 70×109/л, 80×109/л, 90×109/л или 100×109/л. В некоторых вариантах осуществления изобретения такое лечение приводит к увеличению числа тромбоцитов по меньшей мере до 50-75×109/л, 75-100×109/л или 100-150×109/л. В некоторых вариантах осуществления изобретения такое лечение приводит к увеличению числа тромбоцитов до 50×109/л. В некоторых вариантах осуществления изобретения такое лечение приводит к увеличению числа тромбоцитов до 100×109/л. В некоторых вариантах осуществления изобретения число тромбоцитов определяют путем проведения стандартного клинического анализа крови (CBC). Следует отметить, что определение числа тромбоцитов может быть осуществлено с применением других известных методов. В некоторых своих вариантах настоящее изобретение относится к способам увеличения числа тромбоцитов у пациента, нуждающегося в этом, где указанный пациент страдает миелофиброзом, и где указанные способы включают введение пациенту агониста SAP, такого как полипептид SAP, отдельно или в комбинации с дополнительным противораковым терапевтическим средством (например, ингибитором киназы JAK) в количестве и в дозах, эффективных для повышения числа тромбоцитов по меньшей мере на 25%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, или по меньшей мере 100%. В некоторых вариантах осуществления изобретения агонист SAP включает полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования человеческого SAP, выделенного из сыворотки, а дополнительным противораковым терапевтическим средством является ингибитор JAK-киназы. В некоторых вариантах осуществления изобретения ингибитором JAK-киназы является руксолитиниб. В некоторых вариантах осуществления изобретения число тромбоцитов увеличивается приблизительно на 50%-60%, 60%-70%, 70%-80%, 80%-90% или 90%-100%.
В некоторых вариантах осуществления изобретения лечение, проводимое описанными здесь способами (например, с использованием одного агента, то есть, полипептида SAP или агониста SAP для монотерапии или с их использованием в комбинированной терапии), является эффективным для снижения трансфузии тромбоцитов по меньшей мере на 25%, 30%, 40%, 50%, 60%, 75% или 100%, по сравнению с уровнем, установленным до начала проведения лечения описанными здесь способами. В некоторых вариантах осуществления изобретения такое лечение приводит к снижению трансфузии тромбоцитов по меньшей мере на 50%. В некоторых своих вариантах настоящее изобретение относится к способам снижения трансфузии тромбоцитов у пациента, нуждающегося в этом, где указанным пациентом является пациент, страдающий миелофиброзом, и где указанный способ включает введение пациенту агониста SAP, такого как полипептид SAP, отдельно или в комбинации с дополнительным противораковым терапевтическим средством (например, ингибитором JAK-киназы) в количестве и в дозах, эффективных для снижения трансфузии тромбоцитов по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60% или по меньшей мере на 70%. В некоторых вариантах осуществления изобретения агонист SAP включает полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования человеческого SAP, выделенного из сыворотки, а дополнительным противораковым терапевтическим средством является ингибитор JAK-киназы. В некоторых вариантах осуществления изобретения ингибитором JAK-киназы является руксолитиниб. В некоторых вариантах осуществления изобретения трансфузия тромбоцитов снижается приблизительно на 25%-40%, 25%-50%, 50%-70%, или 70%-100%.
В некоторых вариантах осуществления изобретения лечение, проводимое описанными здесь способами (например, с использованием одного агента, то есть, полипептида SAP или агониста SAP для монотерапии или с их использованием в комбинированной терапии) является эффективным для ослабления симптомов тромбоцитоза, если он присутствует. В некоторых вариантах осуществления изобретения такое лечение приводит к снижению числа тромбоцитов по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40% или по меньшей мере на 50%, по сравнению с уровнем, установленным до начала проведения лечения описанными здесь способами. В некоторых вариантах осуществления изобретения такое лечение приводит к снижению числа тромбоцитов по меньшей мере на 25%. В некоторых вариантах осуществления изобретения такое лечение приводит к снижению числа тромбоцитов до нормальных уровней. В некоторых вариантах осуществления изобретения число тромбоцитов определяют путем проведения стандартного клинического анализа крови (CBC). Следует отметить, что определение числа тромбоцитов может быть осуществлено с применением других известных методов. В некоторых своих вариантах настоящее изобретение относится к способам снижения числа тромбоцитов у пациента, нуждающегося в этом, где указанный пациент страдает миелофиброзом, и где указанные способы включают введение пациенту агониста SAP, такого как полипептид SAP, отдельно или в комбинации с дополнительным противораковым терапевтическим средством (например, ингибитором JAK-киназы) в количестве и в дозах, эффективных для снижения числа тромбоцитов по меньшей мере по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40% или по меньшей мере на 50%. В некоторых вариантах осуществления изобретения агонист SAP включает полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования человеческого SAP, выделенного из сыворотки, а дополнительным противораковым терапевтическим средством является ингибитор JAK-киназы. В некоторых вариантах осуществления изобретения ингибитором JAK-киназы является руксолитиниб. В некоторых вариантах осуществления изобретения число тромбоцитов снижается приблизительно на 10%-15%, по меньшей мере на 15%-25% или по меньшей мере на 25%-35%.
В некоторых вариантах осуществления изобретения лечение, проводимое описанными здесь способами (например, с использованием одного агента, то есть, полипептида SAP или агониста SAP для монотерапии или с их использованием в комбинированной терапии), является эффективным для ослабления симптомов нейтропении, если она присутствует. В некоторых вариантах осуществления изобретения такое лечение приводит к увеличению абсолютного числа нейтрофилов (ANC) по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или по меньшей мере на 100%, по сравнению с уровнем, установленным до начала проведения лечения описанными здесь способами. В некоторых вариантах осуществления изобретения такое лечение приводит к увеличению числа ANC по меньшей мере на 20%-30%, по меньшей мере на 30%-40%, по меньшей мере на 40%-50%, по меньшей мере на 50%-60%, по меньшей мере на 60%-70%, по меньшей мере на 70%-80%, по меньшей мере на 80%-90% или по меньшей мере на 90%-100% по сравнению с уровнем, установленным до начала проведения лечения описанными здесь способами. В некоторых вариантах осуществления изобретения лечение является эффективным для увеличения числа ANC по меньшей мере на 50%. В некоторых вариантах осуществления изобретения такое лечение приводит к увеличению числа ANC по меньшей мере до 1000/мкл, по меньшей мере до 1250/мкл, по меньшей мере до 1500/мкл, по меньшей мере до 1750/мкл или по меньшей мере до 2000/мкл. В некоторых вариантах осуществления изобретения такое лечение приводит к увеличению числа ANC по меньшей мере до 1250-1500/мкл, по меньшей мере до 1500-1750/мкл или по меньшей мере до 1750-2000/мкл. В некоторых вариантах осуществления изобретения такое лечение приводит к увеличению числа ANC по меньшей мере до 1500/мкл. В некоторых вариантах осуществления изобретения число ANC определяют путем проведения стандартного клинического анализа крови (CBC). Следует отметить, что определение числа ANC может быть осуществлено с применением других известных методов. В некоторых своих вариантах настоящее изобретение относится к способам увеличения числа ANC у пациента, нуждающегося в этом, где указанный пациент страдает миелофиброзом, и где указанные способы включают введение пациенту агониста SAP, такого как полипептид SAP, отдельно или в комбинации с дополнительным противораковым терапевтическим средством (например, ингибитором JAK-киназы) в количестве и в дозах, эффективных для увеличения числа ANC по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или по меньшей мере на 100%. В некоторых вариантах осуществления изобретения агонист SAP включает полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования человеческого SAP, выделенного из сыворотки, а дополнительным противораковым терапевтическим средством является ингибитор JAK-киназы. В некоторых вариантах осуществления изобретения ингибитором JAK-киназы является руксолитиниб. В некоторых вариантах осуществления изобретения число ANC увеличивается приблизительно на 20%-30%, по меньшей мере на 30%-40%, по меньшей мере на 40%-50%, по меньшей мере на 50%-60%, по меньшей мере на 60%-70%, по меньшей мере на 70%-80%, по меньшей мере на 80%-90% или по меньшей мере на 90%-100%.
В некоторых вариантах осуществления изобретения лечение, проводимое описанными здесь способами (например, с использованием одного агента, то есть, полипептида SAP или агониста SAP для монотерапии или с их использованием в комбинированной терапии), является эффективным для ослабления симптомов лейкопении, если она присутствует. В некоторых вариантах осуществления изобретения такое лечение приводит к увеличению числа лейкоцитов (WBC) по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или по меньшей мере на 100%, по сравнению с уровнем, установленным до начала проведения лечения описанными здесь способами. В некоторых вариантах осуществления изобретения такое лечение приводит к увеличению числа WBC по меньшей мере на 20%-30%, по меньшей мере на 30%-40%, по меньшей мере на 40%-50%, по меньшей мере на 50%-60%, по меньшей мере на 60%-70%, по меньшей мере на 70%-80%, по меньшей мере на 80%-90% или по меньшей мере на 90%-100% по сравнению с уровнем, установленным до начала проведения лечения описанными здесь способами. В некоторых вариантах осуществления изобретения лечение является эффективным для увеличению числа WBC по меньшей мере на 50%. В некоторых вариантах осуществления изобретения такое лечение приводит к увеличению числа WBC по меньшей мере до 4×109/л, 5×109/л, 7,5×109/л или 10×109/л. В некоторых вариантах осуществления изобретения такое лечение приводит к увеличению числа WBC до 10×109/л. В некоторых вариантах осуществления изобретения такое лечение приводит к увеличению числа WBC до нормальных уровней. В некоторых вариантах осуществления изобретения число WBC определяют путем проведения стандартного клинического анализа крови (CBC). Следует отметить, что определение числа WBC может быть осуществлено с применением других известных методов. В некоторых своих вариантах настоящее изобретение относится к способам увеличения числа WBC у пациента, нуждающегося в этом, где указанный пациент страдает миелофиброзом, и где указанные способы включают введение пациенту агониста SAP, такого как полипептид SAP, отдельно или в комбинации с дополнительным противораковым терапевтическим средством (например, ингибитором JAK-киназы) в количестве и в дозах, эффективных для повышения числа WBC по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или по меньшей мере на 100%. В некоторых вариантах осуществления изобретения агонист SAP включает полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования человеческого SAP, выделенного из сыворотки, а дополнительным противораковым терапевтическим средством является ингибитор JAK-киназы. В некоторых вариантах осуществления изобретения ингибитором JAK-киназы является руксолитиниб. В некоторых вариантах осуществления изобретения число WBC увеличивается приблизительно на 20%-30%, по меньшей мере на 30%-40%, по меньшей мере на 40%-50%, по меньшей мере на 50%-60%, по меньшей мере на 60%-70%, по меньшей мере на 70%-80%, по меньшей мере на 80%-90% или по меньшей мере на 90%-100%.
В некоторых вариантах осуществления изобретения лечение, проводимое описанными здесь способами (например, с использованием одного агента, то есть, полипептида SAP или агониста SAP для монотерапии или с их использованием в комбинированной терапии), является эффективным для ослабления симптомов лейкоцитоза, если он присутствует. В некоторых вариантах осуществления изобретения такое лечение приводит к снижению числа ANC по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60% или по меньшей мере на 70%, по сравнению с уровнем, установленным до начала проведения лечения описанными здесь способами, без снижения числа ANC до уровня ниже 1500/мкл. В некоторых вариантах осуществления изобретения такое лечение приводит к снижению числа ANC на 25%. В некоторых вариантах осуществления изобретения такое лечение приводит к снижению числа ANC на 50%. В некоторых вариантах осуществления изобретения такое лечение приводит к снижению числа ANC до нормальных уровней. В некоторых вариантах осуществления изобретения такое лечение приводит к снижению числа лейкоцитов (WBC) по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60% или по меньшей мере на 70%, по сравнению с уровнем, установленным до начала проведения лечения описанными здесь способами, без снижения числа WBC до уровней ниже низшего предела нормальных значений. В некоторых вариантах осуществления изобретения такое лечение приводит к снижению числа WBC на 25%. В некоторых вариантах осуществления изобретения такое лечение приводит к снижению числа WBC на 50%. В некоторых вариантах осуществления изобретения такое лечение приводит к снижению числа WBC до <35×109/л, <30×109/л, <25×109/л, <20×109/л или <15×109/л. В некоторых вариантах осуществления изобретения такое лечение приводит к снижению числа WBC до <25×109/л. В некоторых вариантах осуществления изобретения такое лечение приводит к снижению числа WBC до нормальных уровней. В некоторых вариантах осуществления изобретения число ANC и WBC определяют путем проведения стандартного клинического анализа крови (CBC). Следует отметить, что определение числа ANC или WBC может быть осуществлено с применением других известных методов. В некоторых своих вариантах настоящее изобретение относится к способам снижения числа ANC или WBC у пациента, нуждающегося в этом, где указанный пациент страдает миелофиброзом, и где указанные способы включают введение пациенту агониста SAP, такого как полипептид SAP, отдельно или в комбинации с дополнительным противораковым терапевтическим средством (например, ингибитором JAK-киназы) в количестве и в дозах, эффективных для снижения числа ANC или WBC по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60% или по меньшей мере на 70%, без снижения числа WBC до уровней ниже низшего предела нормальных значений. В некоторых вариантах осуществления изобретения агонист SAP включает полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования человеческого SAP, выделенного из сыворотки, а дополнительным противораковым терапевтическим средством является ингибитор JAK-киназы. В некоторых вариантах осуществления изобретения ингибитором JAK-киназы является руксолитиниб. В некоторых вариантах осуществления изобретения число ANC или WBC снижается приблизительно на 20%-30%, по меньшей мере на 30%-40%, по меньшей мере на 40%-50%, по меньшей мере на 50%-60% или по меньшей мере на 60%-70% без снижения числа WBC до уровней ниже низшего предела нормальных значений.
В некоторых вариантах осуществления изобретения лечение, проводимое описанными здесь способами (например, с использованием одного агента, то есть, полипептида SAP или агониста SAP для монотерапии или с их использованием в комбинированной терапии), является эффективным для снижения числа бластных клеток периферической крови по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60% или по меньшей мере на 70%, по сравнению с числом бластных клеток, установленным до начала проведения лечения описанными здесь способами. В некоторых вариантах осуществления изобретения такое лечение является эффективным для снижения числа бластных клеток периферической крови по меньшей мере на 50%. В некоторых вариантах осуществления изобретения такое лечение является эффективным для снижения числа бластных клеток периферической крови от ≥1 до <1. Следует отметить, что определение числа бластных клеток периферической крови может быть осуществлено любыми известными методами. В некоторых своих вариантах настоящее изобретение относится к способам снижения числа бластных клеток периферической крови у пациента, нуждающегося в этом, где указанным пациентом является пациент, страдающий миелофиброзом, и где указанный способ включает введение пациенту агониста SAP, такого как полипептид SAP, отдельно или в комбинации с дополнительным противораковым терапевтическим средством (например, ингибитором JAK-киназы) в количестве и в дозах, эффективных для снижения числа бластных клеток периферической крови по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60% или по меньшей мере на 70%. В некоторых вариантах осуществления изобретения агонист SAP включает полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования человеческого SAP, выделенного из сыворотки, а дополнительным противораковым терапевтическим средством является ингибитор JAK-киназы. В некоторых вариантах осуществления изобретения ингибитором JAK-киназы является руксолитиниб. В некоторых вариантах осуществления изобретения число бластных клеток периферической крови снижается приблизительно на 20%-30%, по меньшей мере на 30%-40%, по меньшей мере на 40%-50%, по меньшей мере на 50%-60% или по меньшей мере на 60%-70%. В некоторых вариантах осуществления изобретения число бластных клеток периферической крови снижается с ≥1 до <1.
В некоторых вариантах осуществления изобретения лечение, проводимое описанными здесь способами (например, с использованием одного агента, то есть, полипептида SAP или агониста SAP для монотерапии или с их использованием в комбинированной терапии), является эффективным для снижения степени фиброза костного мозга от балла 3 до балла 2 (например, после проведения монотерапии или комбинированной терапии с использованием полипептида SAP или агониста SAP). В некоторых вариантах осуществления изобретения такое лечение является эффективным для снижения степени фиброза костного мозга от балла 3 до балла 1. В некоторых вариантах осуществления изобретения такое лечение является эффективным для снижения степени фиброза костного мозга от балла 3 до балла 0. В некоторых вариантах осуществления изобретения такое лечение является эффективным для снижения степени фиброза костного мозга от балла 2 до балла 1. В некоторых вариантах осуществления изобретения такое лечение является эффективным для снижения степени фиброза костного мозга от балла 2 до балла 0. В некоторых вариантах осуществления изобретения такое лечение является эффективным для снижения степени фиброза костного мозга по меньшей мере на 5, 10, 20, 30, 40, 50, 60, 70, 80 или 90% по сравнению со степенью фиброза костного мозга, наблюдаемого до начала проведения лечения описанными здесь способами. Следует отметить, что определение степени фиброза костного мозга может быть осуществлено любыми известными методами. В некоторых своих вариантах настоящее изобретение относится к способам снижения степени фиброза костного мозга у пациента, нуждающегося в этом, где указанным пациентом является пациент, страдающий миелофиброзом, и где указанный способ включает введение пациенту агониста SAP, такого как полипептид SAP, отдельно или в комбинации с дополнительным противораковым терапевтическим средством (например, ингибитором JAK-киназы) в количестве и в дозах, эффективных для снижения степени фиброза костного мозга по меньшей мере на 5, 10, 20, 30, 40, 50, 60, 70, 80 или 90%. В некоторых вариантах осуществления изобретения агонист SAP включает полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования человеческого SAP, выделенного из сыворотки, а дополнительным противораковым терапевтическим средством является ингибитор JAK-киназы. В некоторых вариантах осуществления изобретения ингибитором JAK-киназы является руксолитиниб. В некоторых вариантах осуществления изобретения степень фиброза костного мозга снижается приблизительно на 20%-30%, по меньшей мере на 30%-40%, по меньшей мере на 40%-50%, по меньшей мере на 50%-60% или по меньшей мере на 60%-70%.
В некоторых вариантах осуществления изобретения лечение, проводимое описанными здесь способами (например, с использованием одного агента, то есть, полипептида SAP или агониста SAP для монотерапии или с их использованием в комбинированной терапии), является эффективным для снижения числа бластных клеток костного мозга от ≥5% до <5%. Следует отметить, что определение числа бластных клеток костного мозга может быть осуществлено любыми известными методами. В некоторых своих вариантах настоящее изобретение относится к способам снижения числа бластных клеток костного мозга у пациента, нуждающегося в этом, где указанным пациентом является пациент, страдающий миелофиброзом, и где указанный способ включает введение пациенту агониста SAP, такого как полипептид SAP, отдельно или в комбинации с дополнительным противораковым терапевтическим средством (например, ингибитором JAK-киназы) в количестве и в дозах, эффективных для снижения числа бластных клеток костного мозга по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60% или по меньшей мере на 70%. В некоторых вариантах осуществления изобретения агонист SAP включает полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования человеческого SAP, выделенного из сыворотки, а дополнительным противораковым терапевтическим средством является ингибитор JAK-киназы. В некоторых вариантах осуществления изобретения ингибитором JAK-киназы является руксолитиниб. В некоторых вариантах осуществления изобретения число бластных клеток костного мозга снижается приблизительно на 20%-30%, по меньшей мере на 30%-40%, по меньшей мере на 40%-50%, по меньшей мере на 50%-60% или по меньшей мере на 60%-70%.
В некоторых вариантах осуществления изобретения лечение является эффективным для повышения насыщенности костного мозга клетками. Такое повышение может быть по меньшей мере на 20, 30, 40, 50, 60 или 70% выше уровня, наблюдаемого до начала проведения лечения описанными здесь способами. В некоторых своих вариантах настоящее изобретение относится к способам повышения насыщенности костного мозга клетками у пациента, нуждающегося в этом, где указанным пациентом является пациент, страдающий миелофиброзом, и где указанный способ включает введение пациенту агониста SAP, такого как полипептид SAP, отдельно или в комбинации с дополнительным противораковым терапевтическим средством (например, ингибитором JAK-киназы) в количестве и в дозах, эффективных для повышения насыщенности костного мозга клетками по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60% или по меньшей мере на 70%. В некоторых вариантах осуществления изобретения агонист SAP включает полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования человеческого SAP, выделенного из сыворотки, а дополнительным противораковым терапевтическим средством является ингибитор JAK-киназы. В некоторых вариантах осуществления изобретения ингибитором JAK-киназы является руксолитиниб. В некоторых вариантах осуществления изобретения насыщенность костного мозга клетками повышается приблизительно на 20%-30%, по меньшей мере на 30%-40%, по меньшей мере на 40%-50%, по меньшей мере на 50%-60% или по меньшей мере на 60%-70%.
В некоторых вариантах осуществления изобретения лечение, проводимое описанными здесь способами (например, с использованием одного агента, то есть, полипептида SAP или агониста SAP для монотерапии или с их использованием в комбинированной терапии), дает по меньшей мере один из описанных здесь эффектов (например, снижение объема селезенки, снижение баллов по всем симптомам по шкале оценок MPN-SAF, повышение уровня гемоглобина, снижение трансфузии RBC, достижения независимости от трансфузии, ослабление симптомов тромбоцитопении, снижение трансфузии тромбоцитов, ослабление симптомов тромбоцитоза, ослабление симптомов нейтропении, ослабление симптомов лейкоцитоза, снижение числа бластных клеток периферической крови, снижение степени фиброза костного мозга, снижение числа бластных клеток костного мозга или повышения насыщенности костного мозга клетками). В некоторых вариантах осуществления изобретения лечение, проводимое описанными здесь способами, дает по меньшей мере два из описанных здесь эффектов. В некоторых вариантах осуществления изобретения лечение, проводимое описанными здесь способами, дает по меньшей мере три, четыре, пять, шесть, семь, восемь, девять или десять из описанных здесь эффектов. В некоторых вариантах, относящихся к любому из описанных здесь способов, конкретную степень ослабления симптомов или конкретный терапевтический эффект оценивают в один или более периодов времени, например, после лечения, проводимого в течение по меньшей мере 12, 18, 20 или 24 недель или более.
В некоторых вариантах осуществления изобретения лечение, проводимое описанными здесь способами (например, с использованием одного агента, то есть, полипептида SAP или агониста SAP для монотерапии или с их использованием в комбинированной терапии), дает по меньшей мере один из описанных здесь эффектов (например, снижение объема селезенки, снижение баллов по всем симптомам по шкале оценок MPN-SAF, повышение уровня гемоглобина, снижение трансфузии RBC, ослабление симптомов тромбоцитопении, снижение трансфузии тромбоцитов, ослабление симптомов тромбоцитоза, ослабление симптомов нейтропении, ослабление симптомов лейкоцитоза, снижение числа бластных клеток периферической крови, снижение степени фиброза костного мозга, снижение числа бластных клеток костного мозга или повышение насыщенности костного мозга клетками) без инициации или индуцирования клинически значимой миелосупрессии. В некоторых вариантах осуществления изобретения лечение, проводимое одним или более из описанных здесь способов, дает по меньшей мере два из описанных здесь эффектов без инициации или индуцирования клинически значимой миелосупрессии. В некоторых вариантах осуществления изобретения лечение, проводимое описанными здесь способами, дает по меньшей мере три, четыре, пять, шесть, семь, восемь, девять или десять из описанных здесь эффектов без инициации или индуцирования клинически значимой миелосупрессии. В некоторых вариантах осуществления изобретения лечение, проводимое одним или более из описанных здесь способов, не приводит к миелосупрессии. В некоторых вариантах осуществления изобретения любой из вышеописанных способов включает введение SAP, содержащего полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования человеческого SAP, выделенного из сыворотки, где указанным полипептидом является рекомбинантный человеческий SAP (например, рекомбинантный человеческий пентраксин-2, продуцируемый в клетках CHO). В некоторых вариантах осуществления изобретения любой из вышеописанных способов включает введение агониста SAP или полипептида SAP в соответствии с определенной схемой введения доз, где любой из вышеуказанных терапевтических эффектов достигается после введения доз по соответствующей схеме. В некоторых вариантах осуществления изобретения один или более из вышеуказанных терапевтических эффектов достигаются после введения доз по соответствующей схеме (например, такое введение доз осуществляют по соответствующей схеме). Улучшение любого из вышеуказанных параметров (например, ослабления симптомов) оценивают в один или более периодов времени, например, после лечения, проводимого в течение по меньшей мере 12, по меньшей мере 18, по меньшей мере 20, по меньшей мере 24 недель или более, чем 24 недель.
В некоторых своих вариантах, относящихся к любому из вышеуказанных примеров улучшения состояния пациента, например, ослабления одного или более симптомов, настоящее изобретение относится к лечению, включающему введение агониста SAP или полипептида SAP в дозе и в соответствии со схемой введения доз, эффективных для достижения терапевтического эффекта. В некоторых вариантах осуществления изобретения такая доза и схема введения доз также способствуют снижению одного или более побочных эффектов, наблюдаемых при проведении другой противораковой терапии.
В других вариантах осуществления изобретения лечение приводит к ослаблению, вместо уже имеющихся или помимо уже имеющихся симптомов, одного или более других симптомов фиброзного рака. В некоторых вариантах осуществления изобретения такое лечение приводит к снижению боли, к уменьшению размера опухоли, к снижению потери массы, к увеличению массы тела, к увеличению периодов ремиссии или к любому улучшению качества жизни пациента.
В некоторых вариантах осуществления изобретения полипептид SAP или агонист SAP вводят индивидууму по схеме введения доз, включающей введение полипептида SAP или агониста SAP по меньшей мере один раз в неделю по меньшей мере за 1 цикл, по меньшей мере за 2 цикла, по меньшей мере за 3 цикла, по меньшей мере за 4 цикла, по меньшей мере за 5 циклов, по меньшей мере за 6 циклов, по меньшей мере за 7 циклов или по меньшей мере за 8 циклов в течение периода времени 28 дней. В некоторых вариантах осуществления изобретения полипептид SAP или агонист SAP вводят индивидууму по меньшей мере один раз в неделю по меньшей мере за 6 циклов в течение периода времени 28 дней, по меньшей мере за 8 циклов в течение периода времени 28 дней, по меньшей мере за 10 циклов в течение периода времени 28 дней, по меньшей мере за 12 циклов в течение периода времени 28 дней, по меньшей мере за 15 циклов в течение периода времени 28 дней, по меньшей мере за 18 циклов в течение периода времени 28 дней или по меньшей мере за 24 цикла в течение периода времени 28 дней. В некоторых вариантах осуществления изобретения соединение вводят индивидууму по меньшей мере один раз в неделю в течение по меньшей мере одного месяца, по меньшей мере двух месяцев, по меньшей мере трех месяцев, по меньшей мере четырех месяцев, по меньшей мере пяти месяцев, по меньшей мере шести месяцев, по меньшей мере восьми месяцев, по меньшей мере одного года или по меньшей мере двух лет. В других вариантах осуществления изобретения соединение вводят через день в течение первой недели лечения. В некоторых вариантах осуществления изобретения полипептид SAP или агонист SAP вводят индивидууму по схеме введения доз, включающей введение полипептида SAP или агониста SAP один раз в 4 недели по меньшей мере за 1 цикл, по меньшей мере за 2 цикла, по меньшей мере за 3 цикла, по меньшей мере за 4 цикла, по меньшей мере за 5 циклов, по меньшей мере за 6 циклов, по меньшей мере за 7 циклов или по меньшей мере за 8 циклов в течение периода времени 28 дней или 4 недели. В некоторых вариантах осуществления изобретения полипептид SAP или агонист SAP вводят индивидууму один раз в 4 недели по меньшей мере за 6 циклов в течение периода времени 28 дней, по меньшей мере за 8 циклов в течение периода времени 28 дней, по меньшей мере за 10 циклов в течение периода времени 28 дней, по меньшей мере за 12 циклов в течение периода времени 28 дней, по меньшей мере за 15 циклов по меньшей мере в течение периода времени 28 дней, по меньшей мере за 18 циклов в течение периода времени 28 дней или по меньшей мере за 24 цикла в течение периода времени 28 дней. В некоторых вариантах осуществления изобретения соединение вводят индивидууму по меньшей мере один раз в 4 недели в течение по меньшей мере одного месяца, по меньшей мере двух месяцев, по меньшей мере трех месяцев, по меньшей мере четырех месяцев, по меньшей мере пяти месяцев, по меньшей мере шести месяцев, по меньшей мере восьми месяцев, по меньшей мере одного года или по меньшей мере двух лет, а иногда и в течение всей жизни пациента. В другом варианте осуществления изобретения полипептид SAP или агонист SAP вводят через день в течение первой недели лечения. В некоторых вариантах осуществления изобретения полипептид SAP или агонист SAP вводят в течение нескольких дней (например, в течение 1, 3 и 5 дней) через каждые 4 недели по меньшей мере за 6 циклов в течение периода времени 28 дней, по меньшей мере за 8 циклов в течение периода времени 28 дней, по меньшей мере за 10 циклов в течение периода времени 28 дней, по меньшей мере за 12 циклов в течение периода времени 28 дней, по меньшей мере за 15 циклов в течение периода времени 28 дней, по меньшей мере за 18 циклов в течение периода времени 28 дней или по меньшей мере за 24 цикла в течение периода времени 28 дней. В некоторых вариантах осуществления изобретения соединение вводят индивидууму в течение нескольких дней (например, в течение 1, 3 и 5 дней) через каждые 4 недели в течение по меньшей мере одного месяца, по меньшей мере двух месяцев, по меньшей мере трех месяцев, по меньшей мере четырех месяцев, по меньшей мере пяти месяцев, по меньшей мере шести месяцев, по меньшей мере восьми месяцев, по меньшей мере одного года или по меньшей мере двух лет, а иногда и в течение всей жизни пациента. В некоторых вариантах осуществления изобретения такая схема введения доз дает по меньшей мере один из эффектов (например, ослабление одного или более симптомов или улучшение одного или более параметров), описанных в настоящей заявке (например, снижение объема селезенки, снижение баллов по всем симптомам по шкале оценок MPN-SAF, повышение уровня гемоглобина, снижение трансфузии RBC, достижение независимости от трансфузии, ослабление симптомов тромбоцитопении, снижение трансфузии тромбоцитов, ослабление симптомов тромбоцитоза, ослабление симптомов нейтропении, ослабление симптомов лейкоцитоза, снижение числа бластных клеток периферической крови, снижение степени фиброза костного мозга, снижение числа бластных клеток костного мозга или повышение насыщенности костного мозга клетками). В некоторых вариантах осуществления изобретения такая схема введения доз дает по меньшей мере два из описанных здесь эффектов. В некоторых вариантах осуществления изобретения такая схема введения доз дает по меньшей мере три, четыре, пять, шесть, семь, восемь, девять или десять из описанных здесь эффектов. В некоторых вариантах осуществления изобретения агонистом SAP является рекомбинантный человеческий SAP.
В некоторых своих вариантах настоящее изобретение относится к способам введения агониста SAP, такого как полипептид SAP, отдельно или в комбинации с дополнительным противораковым терапевтическим средством (например, ингибитором JAK-киназы или химиотерапевтическим средством) в соответствии со схемой введения доз, включающей введение полипептида SAP или агониста SAP, а именно, введение 10 мг/кг полипептида SAP, такого как полипептид SAP, характер гликозилирования которого отличается от характера гликозилирования человеческого SAP, выделенного из сыворотки, в дни 1, 3, 5, 8, 15 и 22 цикла 1 и в дни 1, 8, 15 и 22 каждого последующего цикла в течение 28 дней. В некоторых вариантах осуществления изобретения агонист SAP включает полипептид SAP, а дополнительным противораковым терапевтическим средством является ингибитор JAK-киназы. В некоторых вариантах осуществления изобретения ингибитором JAK-киназы является руксолитиниб.
В некоторых своих вариантах настоящее изобретение относится к способам введения агониста SAP, такого как полипептид SAP, отдельно или в комбинации с дополнительным противораковым терапевтическим средством (например, ингибитором JAK-киназы) в соответствии со схемой введения доз, включающей введение полипептида SAP или агониста SAP, а именно, введение 10 мг/кг полипептида SAP или агониста SAP в дни 1, 3 и 5 цикла 1 и в день 1 каждого последующего цикла в течение 28 дней. В некоторых вариантах осуществления изобретения агонист SAP включает полипептид SAP, а дополнительным противораковым терапевтическим средством является ингибитор JAK-киназы. В некоторых вариантах осуществления изобретения ингибитором JAK-киназы является руксолитиниб.
В некоторых вариантах осуществления изобретения полипептид SAP или агонист SAP вводят несколько раз в течение первой недели (например, в дни 1, 3 и 5), а затем их вводят раз в неделю, раз в две недели, раз в три недели или раз в 4 недели. В некоторых вариантах осуществления изобретения агонист SAP вводят несколько раз в неделю, раз в неделю, раз в две недели, раз в три недели, раз в месяц, раз в два месяца, раз в три месяца, раз в шесть месяцев или по необходимости. В некоторых вариантах осуществления изобретения полипептид SAP или агонист SAP вводят путем внутривенного (IV) вливания. В некоторых вариантах осуществления изобретения полипептид SAP или агонист SAP вводят в дозе 10 мг/кг. В некоторых вариантах осуществления изобретения полипептид SAP или агонист SAP вводят в любой дозе, указанной в настоящей заявке. В некоторых вариантах осуществления изобретения полипептид SAP или агонист SAP вводят в комбинации с противораковым терапевтическим средством. В некоторых вариантах осуществления изобретения индивидууму вводили стабильную дозу противоракового терапевтического средства по меньшей мере 6 месяцев, по меньшей мере 5 месяцев, по меньшей мере 4 месяца, по меньшей мере 3 месяца, по меньшей мере 2 месяца, по меньшей мере 1 месяц, по меньшей мере 3 недели или по меньшей мере 2 недели. В некоторых вариантах осуществления изобретения индивидууму вводили стабильную дозу противоракового терапевтического средства по меньшей мере 3 месяца. В некоторых вариантах осуществления изобретения у индивидуума не наблюдалось какого-либо ослабления одного или более симптомов при проведении противораковой терапии по меньшей мере в течение 2 недель, по меньшей мере в течение 3 недель, по меньшей мере в течение 1 месяца, по меньшей мере в течение 2 месяцев, по меньшей мере в течение 3 месяцев, по меньшей мере в течение 4 месяцев, по меньшей мере в течение 5 месяцев и по меньшей мере в течение 6 месяцев. В некоторых вариантах осуществления изобретения противораковую терапию проводили с использованием описанного здесь ингибитора JAK-киназы. В некоторых вариантах осуществления изобретения ингибитором JAK-киназы является руксолитиниб. В некоторых вариантах осуществления изобретения противораковое терапевтическое средство вводили в дозе, которая ранее была определена как эффективная. В некоторых вариантах осуществления изобретения описанные здесь схемы введения доз корректировали, если это необходимо для достижения одного из описанных здесь терапевтических эффектов.
В некоторых вариантах осуществления изобретения описанные здесь способы включают введение одной или более дополнительных доз полипептида SAP или агониста SAP после достижения первоначального ответа. В некоторых вариантах осуществления изобретения последующий ответ достигался путем введения одной или более дополнительных доз полипептида SAP или агониста SAP после достижения первоначального ответа у индивидуума. Таким последующим ответом может быть дополнительный ответ (например, любой из описанных здесь ответов, которые не наблюдались ранее), сохранение первоначального ответа или повышение ответа по сравнению с первоначальным ответом. В некоторых вариантах осуществления изобретения введение одной или более дополнительных доз в значительной степени способствует сохранению первоначального ответа. В некоторых вариантах осуществления изобретения введение одной или более дополнительных доз приводит к повышению ответа по сравнению с первоначальным ответом. В некоторых вариантах осуществления изобретения введение одной или более дополнительных доз способствует достижению одного или более дополнительных ответов, которые не наблюдались ранее. В некоторых вариантах осуществления изобретения агонист SAP включает полипептид SAP, такой как рекомбинантный человеческий SAP.
В некоторых вариантах осуществления изобретения после введения полипептида SAP или агониста SAP или их фармацевтически приемлемой соли индивидууму, такому как человек, Cmax (максимальная концентрация лекарственного средства) соединения достигается приблизительно через 0,5-5 часов, приблизительно через 1,5-4,5 часов, приблизительно через 2-4 часа или приблизительно через 2,5-3,5 часов после введения дозы. В некоторых вариантах осуществления изобретения после введения указанного соединения человеку время полужизни соединения в кровотоке составляет приблизительно от 11 до 110 часов, от 20 до 90 часов, от 12 и приблизительно до 40 часов, приблизительно от 16 до 34 часов или приблизительно от 20 до 40 часов. В некоторых вариантах осуществления изобретения средняя AUC для данного соединения возрастает более, чем пропорционально с увеличением доз приблизительно от 0,1 мг до 40 мг/кг. В некоторых вариантах осуществления изобретения при введении данного соединения один раз в неделю наблюдается устойчивая аккумуляция соединения приблизительно в 1,1-5 раз, приблизительно в 1,25-4,0 раза, приблизительно в 1,5-3,5 раза или приблизительно в 2-3 раза. В некоторых вариантах осуществления изобретения при еженедельном введении данного соединения его аккумуляции не наблюдается.
Настоящее изобретение также относится к наборам для лечения фиброзного рака или фиброза, ассоциированного с раком, где указанные наборы включают один или более полипептидов SAP или агонистов SAP. В некоторых вариантах осуществления изобретения набор может включать описанное здесь противораковое терапевтическое средство, вводимое в комбинации с одним или более полипептидами SAP или агонистами SAP. Полипептиды SAP или агонисты SAP и противораковые терапевтические средства могут быть приготовлены для их совместного введения. Активные агенты данного набора могут быть введены отдельно или в комбинации. Активные агенты могут быть введены одновременно или в соответствии с различными схемами введения доз. В некоторых вариантах из любых вышеуказанных вариантов осуществления изобретения агонист SAP включает рекомбинантный человеческий SAP.
Фармацевтические препараты и композиции
В некоторых вариантах осуществления изобретения описанные здесь способы включают введение индивидууму по меньшей мере одного агониста SAP (например, варианта полипептида SAP) согласно изобретению в качестве терапевтического средства. Терапевтические средства согласно изобретению могут быть приготовлены стандартным способом с использованием одного или более физиологически приемлемых носителей или наполнителей. Так, например, терапевтические средства и их физиологически приемлемые соли и сольваты могут быть приготовлены, например, для внутривенного вливания (IV), инъекции (например, SubQ, IM, IP), ингаляции или инсуффляции (в ротовую полость или в нос) или перорально, трансбуккально, подъязычно, трансдермально, интраназально, парентерально или ректально. В некоторых вариантах осуществления изобретения терапевтические средства могут быть введены местно, например, в область, в которой присутствуют клетки-мишени, то есть, в конкретную ткань, в конкретный орган или в конкретную жидкость (например, в кровь, в цереброспинальную жидкость, в опухолевую массу и т.п.).
Настоящее изобретение также относится к применению любого полипептида SAP или агониста SAP согласно изобретению в целях приготовления лекарственного препарата для лечения или предупреждения описанного здесь расстройства или состояния у пациента, например, к применению полипептида SAP или агониста SAP в целях приготовления лекарственного препарата для лечения описанного здесь расстройства или состояния. В некоторых аспектах изобретения полипептид SAP или агонист SAP согласно изобретению может быть использован в целях приготовления фармацевтического препарата для лечения или предупреждения описанного здесь заболевания или состояния.
Терапевтические средства могут быть приготовлены для их введения различными способами, включая системное введение, местное введение или введение в определенный участок. Такие методы и препараты в общих чертах описаны в руководстве Remingtonʹs Pharmaceutical Sciences, Meade Publishing Co., Easton, PA. Для парентерального введения предпочтительной является инъекция, включая внутримышечную, внутривенную, внутрибрюшинную и подкожную инъекцию. Для инъекции, соединения могут быть приготовлены в жидких растворах, а предпочтительно, в физиологически совместимых буферах, таких как раствор Хэнкса или раствор Рингера. Кроме того, соединения могут быть приготовлены в твердой форме, которая непосредственно перед использованием может быть снова растворена или суспендирована. Могут быть также использованы и лиофилизованные формы. В некоторых вариантах осуществления изобретения терапевтические средства могут быть введены в клетку различными методами, известными специалистам, включая, но не ограничиваясь ими, инкапсуляцию в липосомах, ионтофорез или включение в другие носители, такие как гидрогели, циклодекстрины, биологически разлагаемые нанокапсулы и биоадгезивные микросферы.
Для перорального введения фармацевтические композиции могут быть приготовлены, например, в форме таблеток, пастилок или капсул, полученных стандартными методами с использованием фармацевтически приемлемых эксципиентов, таких как связывающие агенты (например, кукурузный крахмал, набухающий в холодной воде, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или гидрофосфат кальция); смазывающие вещества (например, стеарат магния, тальк или двуокись кремния); разрыхлители (например, картофельный крахмал или натрий крахмал гликолят); или смачивающие агенты (например, лаурилсульфат натрия). Таблетки могут быть покрыты хорошо известными методами. Жидкие препараты для перорального введения могут быть приготовлены, например, в виде растворов, сиропов или суспензий, либо они могут быть приготовлены в виде сухого продукта, который, перед его использованием, может быть разведен водой или другим подходящим носителем. Такие жидкие препараты могут быть приготовлены стандартными методами с использованием фармацевтически приемлемых добавок, таких как суспендирующие агенты (например, сорбитный сироп, производные целлюлозы или гидрогенизированные пищевые жиры); эмульгаторы (например, лецитин или аравийская камедь); безводные носители (например, миндальное масло, маслянистые сложные эфиры, этиловый спирт или фракционированные растительные масла); и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Эти препараты могут также содержать, если это необходимо, буферные соли, отдушки, красители и подсластители. Препараты для перорального введения могут быть соответствующим образом приготовлены для пролонгированного высвобождения активного соединения.
Для введения путем ингаляции (например, для пульмонального введения) терапевтические средства обычно получают в виде аэрозольного спрея, подаваемого из контейнеров под давлением или из аэрозольного распылителя с использованием подходящего пропеллента, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае использования аэрозоля под давлением, стандартная доза может быть доставлена с помощью клапана для введения отмеренного количества препарата. Капсулы и картриджи, состоящие, например, из желатина и используемые в ингаляторе или в инсуффляторе, могут быть изготовлены так, чтобы они содержали порошкообразную смесь соединения и подходящую порошкообразную основу, такую как лактоза или крахмал.
В способах согласно изобретению фармацевтические соединения могут быть также введены интраназально или интрабронхиально, и такие соединения могут быть приготовлены в виде инсуффляторов, порошков и аэрозолей (например, стероидных аэрозолей, см. Rohatagi (1995) J. Clin. Pharmacol. 35:1187-1193; Tjwa (1995) Ann. Allergy Asthma Immunol. 75:107-111). Так, например, аэрозольные препараты могут быть приготовлены в форме пропеллентов, подаваемых под давлением, таких как пропелленты, содержащие дихлордифторметан, пропан, азот и т.п. Эти препараты могут быть также приготовлены в виде фармацевтических композиций, не являющихся препаратами, подаваемыми под давлением, например, в виде аэрозольного распылителя или ингалятора. Обычно, введение таких препаратов осуществляют в водном фармакологически приемлемом буфере.
Фармацевтические композиции, подходящие для доставки полипептида SAP или агониста SAP в дыхательные пути (например, интраназально, путем ингаляции и т.п.), могут быть приготовлены в твердой или жидкой форме.
SAP или агонисты SAP согласно изобретению могут быть приготовлены для парентерального введения путем инъекции, например, инъекции ударной дозы, или путем непрерывного вливания. Препараты для инъекций могут быть приготовлены в виде стандартной дозированной формы, например, в ампулах или в контейнерах с дозами лекарственного средства для многократного приема, содержащего консервант. Композиции могут быть приготовлены в форме суспензий, растворов или эмульсий в маслянистых или в водных носителях и могут содержать технологические добавки, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может присутствовать в форме порошка, который перед его применением может быть разведен подходящим носителем, например, стерильной апирогенной водой.
Кроме того, полипептиды SAP или агонисты SAP согласно изобретению могут быть также приготовлены в форме депо-препаратов. Такие препараты пролонгированного действия могут быть введены путем имплантации (например, подкожно или внутримышечно) или путем внутримышечной инъекции. Так, например, терапевтические средства могут быть приготовлены с использованием подходящих полимерных или гидрофобных соединений (например, в виде эмульсии в подходящем масле) или с использованием ионообменных смол, либо они могут быть приготовлены в виде слаборастворимых производных, например, в виде слаборастворимой соли. Препаратами с регулируемым высвобождением также являются пластыри.
В некоторых вариантах осуществления изобретения описанные здесь соединения могут быть приготовлены для доставки в центральную нервную систему (ЦНС) (как описано в публикации Begley, Pharmacology & Therapeutics 104: 29-45 (2004)). Стандартными методами доставки лекарственного средства в ЦНС являются: нейрохирургические методы (например, интрацеребральная инъекция или интрацеребровентрикулярная инфузия); модификация агента на молекулярном уровне (например, продуцирование химерного гибридного белка, который содержит транспортный пептид, обладающий аффинностью по отношению к молекуле поверхности эндотелиальных клеток, в комбинации с агентом, не способным пересекать гематоэнцефалический барьер, где указанный транспортный белок способен пересекать гематоэнцефалический барьер по одному из эндогенных путей); фармакологические стратегии, направленные на повышение растворимости агентов в липиде (например, конъюгирование водорастворимых агентов с липидными или холестериновыми носителями); и транзиторное нарушение целостности BBB посредством гиперосмотического разрыва (в результате инфузии раствора маннита в сонную артерию или использования биологически активного агента, такого как пептид ангиотензин).
В некоторых вариантах осуществления изобретения полипептиды SAP или агонисты SAP согласно изобретению вводят в препарат для локального нанесения, содержащий носитель для местного применения, который обычно используется для введения лекарственного средства в определенный участок и включает любое из указанных соединений, известных специалистам. Носитель для местного применения может быть выбран так, чтобы он был подходящим для приготовления композиции в нужной форме, например, в форме мази, лосьона, крема, микроэмульсии, геля, масла, раствора или т.п., и может состоять из любого природного или синтетического вещества. При этом предпочтительно, чтобы выбранный носитель не оказывал негативного влияния на активный агент или на другие компоненты препарата для местного применения. Примерами подходящих носителей для местного применения являются вода, спирты и другие нетоксичные органические растворители, глицерин, минеральное масло, силикон, гелеобразный петролейный эфир, ланолин, жирные кислоты, растительные масла, парабены, воски и т.п.
Фармацевтические композиции (включая косметические препараты) могут содержать приблизительно от 0,00001 до 100%, например, от 0,001 до 10% или от 0,1% до 5% по массе одного или более полипептидов SAP или агонистов SAP, описанных в настоящей заявке. В некоторых препаратах для местного применения, активный агент присутствует в количестве, составляющем приблизительно в пределах от 0,25 масс.% до 75 масс.% препарата, предпочтительно, приблизительно в пределах от 0,25 масс.% до 30 масс.% препарата; более предпочтительно, приблизительно в пределах от 0,5 масс.% до 15 масс.% препарата, а наиболее предпочтительно, приблизительно в пределах от 1,0 масс.% до 10 масс.% препарата.
Лечение или предупреждение глазных болезней может быть осуществлено, например, путем системной, местной или внутриглазной инъекции терапевтических средств, или путем введения устройства для пролонгированного высвобождения терапевтических средств. Полипептиды SAP или агонисты SAP согласно изобретению могут быть доставлены в фармацевтически приемлемом офтальмическом носителе так, чтобы эти соединения контактировали с глазной поверхностью в течение периода времени, достаточного для проникновения этих соединений в роговичные и внутренние отделы глаза, такие как, например, передняя камера, конъюнктива, задняя камера, стекловидное тело, водянистая жидкость, стекловидная жидкость, роговица, радужка/ресничное тело, хрусталик, хориоидальная оболочка/сетчатка и склера. Фармацевтически приемлемым офтальмическим носителем может быть, например, мазь, растительное масло или инкапсулирующий материал. Альтернативно, указанные соединения могут быть непосредственно введены в стекловидную и водянистую жидкость. В другом альтернативном варианте осуществления изобретения указанные соединения могут быть введены системно, например, путем внутривенного вливания или внутривенной инъекции для лечения глазных болезней.
Описанные здесь терапевтические средства могут храниться в бескислородной среде в условиях, известных специалистам.
Приводимые в качестве примера композиции включают полипептид SAP или агонист SAP в комбинации с одним или более фармацевтически приемлемыми носителями и, необязательно, с другими терапевтическими ингредиентами. Носитель(и) должен (должны) быть «фармацевтически приемлемым(и)» в том смысле, что такой носитель должен быть совместимым с другими ингредиентами композиции и не должен вызывать негативные побочные эффекты у индивидуума. Такие описанные здесь носители или другие носители хорошо известны специалистам в области фармакологии. В некоторых вариантах осуществления изобретения фармацевтические композиции являются апирогенными и могут быть использованы для введения человеку. В некоторых вариантах осуществления изобретения фармацевтические композиции не вызывают раздражающего действия и могут быть использованы для введения человеку. В некоторых вариантах осуществления изобретения фармацевтические композиции не содержат аллергенов и могут быть использованы для введения человеку. Эти композиции могут быть приготовлены любыми методами, хорошо известными специалистам-фармацевтам.
В некоторых вариантах осуществления изобретения полипептид SAP или агонист SAP вводят в виде препарата пролонгированного действия, например, в виде композиции, содержащей медленно высвобождающийся полимер. Полипептид SAP или агонист SAP могут быть приготовлены с использованием носителей, которые защищают такой препарат от быстрого высвобождения. Примерами являются носитель с регулируемым высвобождением, такой как полимер, микроинкапсулированная система доставки или биоадгезивный гель. Альтернативно, пролонгированная доставка полипептида SAP или агониста SAP может быть достигнута путем включения в указанную композицию агентов, замедляющих абсорбцию, например, гидрогелей на основе моностеарата алюминия и желатина.
Способы доставки соединений нуклеиновой кислоты известны специалистам (см., например, Akhtar et al., 1992, Trends Cell Bio., 2, 139; Delivery Strategies for Antisense Oligonucleotide Therapeutics, ed. Akhtar, 1995; и публикацию заявки PCT No. WO 94/02595, Sullivan et al.). Эти протоколы могут быть применены для доставки фактически любого соединения нуклеиновой кислоты. Соединения нуклеиновой кислоты могут быть введены в клетки различными методами, известными специалистам, включая, но не ограничиваясь ими, инкапсуляцию в липосомах, ионтофорез или включение в другие носители, такие как гидрогели, циклодекстрины, биологически разлагаемые нанокапсулы и биоадгезивные микросферы. Альтернативно, комбинация нуклеиновой кислоты/носителя может быть доставлена в нужный участок путем прямой инъекции или с использованием инфузионного насоса. Другими способами доставки являются, но не ограничиваются ими, пероральное введение (в виде таблеток или драже) и/или интратекальное введение (Gold, 1997, Neuroscience, 76, 1153-1158). Другими способами доставки являются применение различных систем переноса и носителей, например, посредством конъюгатов и биологически разлагаемых полимеров. Полный обзор стратегий доставки лекарственных средств можно найти в публикациях Ho et al., 1999, Curr. Opin. Mol. Ther., 1, 336-343; Jain, Drug Delivery Systems: Technologies and Commercial Opportunities, Decision Resources, 1998; и Groothuis et al., 1997, J. NeuroVirol., 3, 387-400. Более подробное описание доставки и введения нуклеиновых кислот приводится в публикации Sullivan et al., см. выше; Draper et al., PCT WO93/23569; публикации Beigelman et al., PCT No. WO99/05094, и в публикации Klimuk et al., PCT No. WO99/04819.
В нижеследующих примерах приводится более полное описание способов применения описанного выше изобретения, а также наилучшие способы, рассматриваемые в различных аспектах настоящего изобретения. Следует отметить, что эти примеры приводятся лишь в иллюстративных целях и не должны рассматриваться как ограничение объема изобретения.
Примеры
Пример 1: Лечение миелофиброза с использованием SAP, содержащего α2,3-сиаловую кислоту и вводимого отдельно и в комбинации с руксолитинибом: результаты лечения Стадии 1 через 12 недель
Рекомбинантный человеческий SAP, в данном случае, рекомбинантный человеческий SAP, известный как PRM-151, вводили пациентам с миелофиброзом (МФ), отдельно и в комбинации с руксолитинибом (RUX), для оценки безопасности и эффективности лечения фиброза костного мозга (ФКМ). В это исследование были включены пациенты с промежуточным риском развития, Стадия-1, и стадия-2, или с высоким риском развития МФ с баллом ≥2 по шкале оценок ФКМ, либо пациенты, которые ранее не подвергались терапии, или пациенты, которым была введена стабильная доза RUX.
Двадцать семь пациентов были распределены по четырем группам, в зависимости от того, был ли PRM-151 введен в качестве монотерапии или как часть комбинированной терапии. Группа 1: i) пациенты, которые не проходили лечения МФ по меньшей мере в течение двух недель, ii) пациенты, которым вводили первоначальную ударную дозу SAP в количестве 10 мг/кг путем внутривенного вливания (вливания в течение ~1 часа) в дни 1, 3, и 5 и iii) пациенты, которым вводили дозу SAP раз в четыре недели в количестве 10 мг/кг путем внутривенного вливания (вливания в течение ~1 часа). Группа 2: i) пациенты, которые не проходили лечения МФ по меньшей мере в течение двух недель, ii) пациенты, которым вводили первоначальную ударную дозу SAP в количестве 10 мг/кг путем внутривенного вливания (вливания в течение ~1 часа) в дни 1, 3, и 5 и iii) пациенты, которым вводили дозу SAP через каждую неделю в количестве 10 мг/кг путем внутривенного вливания (вливания в течение ~1 часа). Группа 3: i) пациенты, которым вводили стабильную дозу руксолитиниба (например, руксолитиниба, в течение по меньшей мере 3 месяцев без какого-либо изменения доз) по меньшей мере в течение 12 недель, но у которых не наблюдалось улучшения состояния селезенки за последние четыре недели, ii) пациенты, которым вводили первоначальную ударную дозу SAP в количестве 10 мг/кг путем внутривенного вливания (вливания в течение ~1 часа) в дни 1, 3, и 5; iii) пациенты, которым вводили дозу SAP раз в неделю в количестве 10 мг/кг путем внутривенного вливания (вливания в течение ~1 часа), и iv) пациенты, которым перорально вводили RUX в дозе, равной дозе, вводимой в начале эксперимента. Группа 4: i) пациенты, которым вводили стабильную дозу руксолитиниба (например, руксолитиниба, в течение по меньшей мере 3 месяцев без какого-либо изменения доз) по меньшей мере в течение 12 недель, но у которых не наблюдалось улучшения состояния селезенки за последние четыре недели, ii) пациенты, которым вводили первоначальную ударную дозу SAP в количестве 10 мг/кг путем внутривенного вливания (вливания в течение ~1 часа) в дни 1, 3, и 5; iii) пациенты, которым вводили дозу SAP раз в четыре недели в количестве 10 мг/кг путем внутривенного вливания (вливания в течение ~1 часа), и iv) пациенты, которым перорально вводили RUX в дозе, равной дозе, вводимой в начале эксперимента.
Пациентов каждой группы обследовали на ослабление симптомов ФКМ и других МФ-ассоциированных осложнений, включая, например, аномальные значения параметров клинического анализа крови, спленомегалию и симптомы, оцениваемые по шкале MPN-SAF. В частности, пациентов обследовали на все показатели ответа, стратифицированные по критериям, утвержденным Международной Рабочей Группой, для миелофиброза с миелоидной метаплазией (Tefferi A, Cervantes F, Mesa R, et al. Revised response criteria for myelofibrosis: International Working Group-Myeloproliferative Neoplasms Research and Treatment (IWG-MRT) and European LeukemiaNet (ELN) consensus report. Blood. 2013; 122:1395-1398). Пациентов также обследовали на наличие побочных эффектов, на изменение степени фиброза костного мозга в соответствии с Европейским Соглашением по присвоению баллов при оценке степени фиброза костного мозга (Thiele J, Kvasnicka HM, Facchetti F, et al. European consensus on grading bone marrow fibrosis and assessment of cellularity. Haematologica 2005; 90:1128-1132), на изменение по модифицированной шкале оценок симптомов миелопролиферативного новообразования (MPN-SAF) (Emanuel et al. 2012, Journal of Clinical Oncology 30(33): 4098- 4103), а также на фармакокинетические параметры, включая, например, максимальную концентрацию лекарственного средства (Cmax), время до достижения максимальной концентрации (Tmax), площадь под кривой (AUC), клиренс и объем распределения.
После проведения 24-недельной терапии какой-либо явной миелосупрессии, ассоциированной с лечением, не наблюдалось, а у ≥2 индивидуумов наблюдались побочные эффекты, оцененные баллом ≥2, независимо от их взаимосвязи, где указанные побочные эффекты перечислены ниже в таблице 1. Цифры, указанные в каждом столбце ниже строки «Балл», означают число пациентов, у которых наблюдался побочный эффект. Пустые ячейки означают, что побочный эффект не наблюдался ни у одного из индивидуумов этой группы.
Биоптаты костного мозга были получены до проведения терапии через три месяца после проведения терапии, и полученные результаты были оценены. Улучшение состояния пациентов с ФКМ наблюдалось у 5 из 27 обследованных индивидуумов. В частности, у одного пациента, которому еженедельно вводили SAP (у пациента Группы 2), наблюдалось снижение тяжести состояния с балла 3 до балла 2 после 12-недельного лечения; у одного пациента, которому вводили SAP раз в четыре недели (у пациента Группы 1), наблюдалось снижение с балла 2 до балла 0 после 12-недельного лечения, у одного пациента, которому раз в 4 недели вводили SAP, вместе с руксолитинибом (у пациента Группы 4), и у которого ранее взятые 11 биоптатов костного мозга указывали на наличие фиброза с баллом 3, наблюдалось снижение тяжести состояния с балла 3 до балла 1 через 12 недель и до балла 2 через 24 недели, и у одного пациента, которому вводили SAP каждые 4 недели, а также руксолитиниб (у пациента Группы 4), наблюдалось снижение тяжести состояния с балла 3 до балла 2 через 12 недель и снижение с балла 2 до балла 1 через 24 недели. В соответствии с этим, пациенты с МФ показали хорошую переносимость SAP, вводимого отдельно и в комбинации с RUX. Эти данные также показали, что введение рекомбинантного человеческого SAP, отдельно в виде монотерапии, и в комбинации с RUX, может приводить к ослаблению симптомов ФКМ у пациентов с МФ. Как описано ниже, такое ослабление симптомов ФКМ наблюдалось после проведения дополнительного анализа данных во все последующие периоды лечения. Эти результаты подтвердили, что SAP может быть использован не только для снижения степени фиброза костного мозга при МФ, но также и в качестве более общего средства для снижения степени фиброза и сохранения нормальной функции тканей при других раковых заболеваниях.
Комбинированная терапия не всегда является эффективной, однако, она может оказаться подходящей для пациентов, у которых наблюдается снижение эффективности при введении только одного дополнительного противоракового терапевтического средства. Кроме того, комбинированная терапия также способствует снижению некоторых побочных эффектов, которые часто наблюдаются у пациентов, проходящих лечение только одним противораковым терапевтическим средством. В этом случае у пациентов, которые проходили лечение только руксолитинибом (ингибитором Янус-киназы) до введения SAP в соответствии с определенной схемой терапии, наблюдалось ослабление симптомов анемии и тромбоцитопении, на что указывало увеличение уровней гемоглобина и числа тромбоцитов по сравнению с побочными эффектами, наблюдаемыми у этих пациентов до введения SAP (например, по сравнению с побочными эффектами, наблюдаемыми при лечении только ингибитором Янус-киназы). Репрезентативные данные представлены в примере 3. Авторами настоящего изобретения было зарегистрировано улучшение оценок по симптомам и уменьшение размера селезенки у пациентов, которым вводили SAP и руксолитиниб, по сравнению с пациентами, которым вводили только руксолитиниб. Эти результаты продемонстрировали не только эффективность SAP, используемого в монотерапии или в комбинированной терапии для лечения фиброзного рака, но также и возможность использования SAP для расширения терапевтического «окна» и групп пациентов для проведения другой терапии, для разработки способов лечения пациентов и подгрупп пациентов, у которых стандартное лечение не давало результатов или давало неадекватные результаты, или для повышения профиля безопасности доступной терапии, которая сама по себе является эффективной.
Пример 2: Лечение миелофиброза с использованием PRM-151, вводимого отдельно и в комбинации с руксолитинибом: результаты лечения Стадии 1 через 24 недели
Демографические данные для 27 пациентов, включенных в четыре лечебных экспериментальных группы, описанных выше в примере 1, систематизированы ниже в таблице 2. В это исследование были включены пациенты с первичным миелофиброзом (ПМФ), миелофиброзом на фоне истинной полицитемии (пост-ИП МФ) или миелофиброзом на фоне эссенциальной тромбоцитемии (пост-ЭТ МФ), классифицированными как МФ с промежуточным риском развития, Промежуточный-1 и Промежуточный-2, или с высоким риском развития МФ по Динамической Международной Прогностической системе оценок (DIPSS). 15 из 27 пациентов, до их включения в программу данного исследования, подвергали лечению ингибитором JAK. Из 27 пациентов, включенных в программу исследования и прошедших такое предварительное лечение, 18 пациентов завершили лечение через 24 недели, при этом, 3-х пациентов, которые не прошли 24-недельное лечение, также продолжали обследовать. Группы пациентов были описаны выше.
Оценку клинического ответа, включая оценку размера селезенки, MPN-SAF и CBC, проводили раз в 4 недели. Биопсию костного мозга (КМ) проводили до начала лечения, через 12 недель и через 24 недели после лечения. Симптомы костного мозга по критериям IWG-MRT, и ответы костного мозга, наблюдаемые после 24-недельного лечения, систематизированы ниже в таблице 3. Один или более ответов в отношении симптомов по шкале оценок IWG-MRT наблюдались у пациентов в каждой из четырех лечебных групп, причем, было получено всего 5 подтвержденных ответов в отношении симптомов по шкале оценок IWG-MRT после анализа, проводимого через 24 недели. Авторы отмечают, что оценка ответов, необходимая для присвоения балла данному ответу, как было подтверждено IWG-MRT, является очень высокой (50% снижение оценки симптомов, сохраняющееся по меньшей мере 12 недель), и что у еще 6 пациентов наблюдалось улучшение одного или более параметров, которое было значимым, но не достигало этого конкретного порога. Даже несмотря на высокий порог в этом эксперименте, уровень ответа соответствовал уровню, достигаемому для других противораковых терапевтических средств и указывал на терапевтическую эффективность в отношении клинически значимого процента пациентов. Кроме того, у всех обследованных пациентов наблюдалось серьезное заболевание во время лечения, и все пациенты, за исключением двух, уже проходили по меньшей мере один предварительный курс лечения, который оказался безуспешным. В этом контексте, следует особенно отметить уровень отвечаемости пациентов.
У пяти пациентов наблюдалось снижение степени фиброза костного мозга на ≥1 балл. Из четырех лечебных групп, у пациентов трех лечебных групп наблюдались один или более ответов в отношении костного мозга, то есть, снижение степени фиброза костного мозга по меньшей мере на 1 балл. Так, например, 2 ответа в отношении костного мозга наблюдалось в каждой группе, которой вводили рекомбинантный человеческий SAP раз в четыре недели (Группа 1) и у группы, которой раз в четыре недели вводили рекомбинантный человеческий SAP вместе с руксолитинибом (Группа 4). У пяти пациентов наблюдалось ≥20% снижение объема селезенки, причем, у одного пациента в группе, которой еженедельно вводили рекомбинантный человеческий SAP (Группа 2), наблюдалось 50% снижение, продолжающееся 8 недель.
Стадия 1: 27 пациентов; Критерии по включению в Стадию 2 =≥1 ответ.
На фигуре 1 показан процент изменения размера селезенки у индивидуумов с пальпируемой селезенкой, которые проходили лечение по схеме C6D29 (цикл 6, день 29) или по другой схеме. У большинства обследуемых пациентов (у 10 из 13 пациентов во всех четырех лечебных группах) наблюдалось уменьшение размера селезенки по сравнению с базовым уровнем. Из 10 пациентов, у которых наблюдалось значительное уменьшение размера селезенки, 2 пациента входили в группу, которой еженедельно вводили rhSAP (Группа 2); 3 пациента входили в группу, которой раз в 4 недели вводили rhSAP (Группа 1); 1 пациент входил в группу, которой еженедельно вводили rhSAP в комбинации с руксолитинибом (Группа 3); и 4 пациента входили в группу, которой раз в 4 недели вводили rhSAP в комбинации с руксолитинибом (Группа 4). Пациентам в группах 3 и 4 вводили стабильную дозу руксолитиниба (например, руксолитиниба в течение по меньшей мере 3 месяцев без какого-либо изменения доз) по меньшей мере за 12 недель до начала эксперимента, и у этих пациентов наблюдалось прекращение уменьшения размера селезенки в последние четыре недели до начала проведения SAP-терапии. При этом следует отметить, что у восприимчивых к лечению пациентов Групп 3 и 4 (101-012, 103-001, 101-010, 101-002 и 103-004) уже был зарегистрирован максимальный ответ на проводимую ранее терапию (руксолитинибом), но тем не менее, у них и после проведения SAP-терапии в комбинации с руксолитинибом наблюдалось дальнейшее ослабление симптомов. Действительно, у пациентов 101-012, 103-001 и 101-010 наблюдалось ≥20% уменьшение размера селезенки после проведения комбинированной терапии.
На фигуре 2 показан процент изменения баллов для всех симптомов по шкале оценок MPN-SAF (TSS) у индивидуумов, проходивших лечение по схеме C6D29 (цикл 6, день 29), по окончании эксперимента или по другой схеме. У большинства обследуемых пациентов (у 10 из 18 пациентов во всех четырех лечебных группах) наблюдалось снижение баллов TSS по сравнению с базовым уровнем, а у 5 из этих пациентов, проходивших лечение по схеме Цикл 6, день 29, наблюдалось ≥50% снижение баллов для всех симптомов. У двух других индивидуумов наблюдалось 50% снижение баллов для симптомов, которое продолжалось ≥8 недель, но это снижение было менее 50% после проведения терапии по схеме Цикл 6, день 29. Из 10 пациентов, у которых наблюдался детектируемый ответ по симптомам, 1 пациент входил в группу, которой еженедельно вводили rhSAP (Группа 2), 4 пациента входили в группу, которой раз в 4 недели вводили rhSAP (Группа 1), 3 пациента входили в группу, которой еженедельно вводили rhSAP в комбинации с руксолитинибом (Группа 3), и 2 пациента входили в группу, которой раз в 4 недели вводили rhSAP в комбинации с руксолитинибом (Группа 4). Как упоминалось выше, у восприимчивых к лечению пациентов в Группах 3 и 4 (108-002, 101-011, 108-001, 101-010 и 103-001) зарегистрирован максимальный ответ на проводимую ранее терапию (руксолитинибом), но тем не менее, у них и после проведения SAP-терапии в комбинации с руксолитинибом наблюдалось дальнейшее ослабление симптомов. Действительно, у пациентов 108-002 и 101-010, то есть, у пациентов Групп 3 и 4, соответственно, наблюдалось ≥50% улучшение параметров по TSS.
У ряда пациентов во всех 4 лечебных группах наблюдалось повышение уровней гемоглобина и увеличение числа тромбоцитов, снижение трансфузии эритроцитов и снижение степени фиброза костного мозга. Снижение степени фиброза костного мозга на ≥1 балл наблюдалось у 5 пациентов через 12 или 24 недели или в том и в другом случае.
Анализ результатов 24-недельного эксперимента указывал на терапевтическую эффективность rhSAP, вводимого отдельно или в комбинации с другим противораковым средством, с очень хорошим профилем безопасности. Эти результаты продемонстрировали биологическую активность этих средств у пациентов с миелофиброзом и улучшение по всем клинически релевантным параметрам, включая степень фиброза костного мозга, уровни гемоглобина, число тромбоцитов, ослабление симптомов и объем селезенки после проведения лечения по схеме введения доз раз в неделю и раз в 4 недели. Несмотря на тяжесть заболевания у обследуемых пациентов, позитивные ответы наблюдались у пациентов всех 4 лечебных групп, даже на ранней стадии обследования и даже при высоком пороге оценок подтвержденных ответов. Лечение с использованием rhSAP является безопасным и хорошо переносилось пациентами при его введении отдельно и в комбинации с руксолитинибом, и при этом, не наблюдалось какой-либо клинически значимой миелосупрессии, индуцированной SAP-терапией или возникающей в результате этой SAP-терапии, в отличие от случаев, наблюдаемых при проведении другой терапии (например, случаев миелосупрессии, ассоциированной с лечением). Показатель отвечаемости соответствовал эффективности, наблюдаемой при введении других противораковых терапевтических средств. Улучшение состояния наблюдалось у тех пациентов, у которых заболевание либо прогрессировало после лечения одним или более известными ингибиторами JAK, либо его течение не давало положительной динамики после введения стабильной дозы руксолитиниба. Полное исчезновение фиброзной патологии у пациентов, получавших SAP, подтвердило центральный механизм действия этого белка и возможность использования агонистов SAP для лечения всех других фиброзных раковых заболеваний.
Кроме того, у 10 других пациентов, обследованных через 36 недель после проведения rhSAP-терапии, наблюдалось 3 ответа на терапию фиброза костного мозга, а у пациентов, идентифицированных как пациенты, восприимчивые к терапии, проводимой в течение 12 или 24 недель, ответная реакция организма продолжалась и после 36-недельного лечения. Это еще раз подтверждает, что пролонгированная rhSAP-терапия, проводимая отдельно или в комбинации с другим противораковым средством, давала стойкую ответную реакцию (например, наблюдались продолжительные благоприятные эффекты). Кроме того, чем дольше продолжалось лечение и обследование пациентов, тем более позитивными были ответные реакции, что указывало даже на еще более сильную ответную реакцию, чем реакция, наблюдаемая после 12-недельного лечения.
Пример 3: Репрезентативные данные для конкретного пациента
В этом репрезентативном примере приводятся данные ответной реакции у одного восприимчивого пациента. Ответы на лечение, выражающиеся в улучшении таких параметров, как уровни гемоглобина, число тромбоцитов, снижение баллов по шкале MPN-SAF TSS и размер селезенки, наблюдаемых при введении rhSAP пациенту 101-005 в течение 24 недель, представлены на фигурах 3A-D. Пациент 101-005 проходил SAP-терапию раз в 4 недели (Группа 1). Данные для этого пациента систематизированы ниже в таблице 4.
Как показано на фигуре 3, у пациента 101-005 наблюдалось повышение уровней гемоглобина и числа тромбоцитов, снижение баллов по шкале MPN-SAF TSS и уменьшение размера селезенки в течение всего курса лечения. Кроме того, у пациента 101-005 наблюдалось снижение степени фиброза костного мозга с балла 2 до балла 0 через 12 недель (фигура 4).
Пример 4: Репрезентативные данные для фиброза костного мозга
Снижение степени фиброза костного мозга на ≥1 балл наблюдалось у 5 пациентов. Репрезентативные данные по окрашиванию ретикулином, полученные для пациентов 101-005 и 108-003, представлены на фигурах 4A и 4B, соответственно. Пациенты 101-005 и 108-003 входили в Группы 1 и 4, соответственно. Биоптаты костного мозга получали до проведения терапии и через три и шесть месяцев после терапии. Результаты окрашивания ретикулином, проводимого для оценки степени фиброза костного мозга у пациента 101-005 до начала терапии и через три месяца после терапии, представлены на фигуре 4A. Как видно на фигуре 4A, у пациента 101-005 наблюдалось снижение степени фиброза костного мозга с балла 2 до балла 0 через 3 месяца. Результаты окрашивания ретикулином, проводимого для оценки степени фиброза костного мозга у пациента 108-003 до начала терапии, через три месяца после терапии и через шесть месяцев после терапии, представлены на фигуре 4В. Как видно на фигуре 4В, у пациента 108-003 наблюдалось снижение степени фиброза костного мозга с балла 3 до балла 2 через три месяца и дальнейшее снижение с балла 2 до балла 1 через шесть месяцев. Фиброз представляет собой образование избыточной фиброзной соединительной ткани в органе или в ткани в процессе их репарации или реакции. Главным компонентом фиброза является коллаген. Коллаген проявляется в виде розовой аморфной ткани при стандартном окрашивании гематоксилином и эозином. При окрашивании ретикулином обнаруживаются волокна коллагена типа 3 в виде черных нитей, и такое окрашивание применяется патологами для идентификации наличия фиброза во всех органах. Окрашивание ретикулином является главным методом оценки степени фиброза костного мозга (Thiele et al, Hematologica 2005; 90: 1128-1132.) Некоторая степень окрашивания ретикулином наблюдается в нормальном костном мозге, а в частности, на стенках кровеносных сосудов.
Наблюдаемое исчезновение (например, снижение степени) фиброза костного мозга указывает на восстановление и/или улучшение функции органа, а в данном случае, функции костного мозга. На восстановление функции костного мозга также указывает улучшение параметров полного клинического анализа крови (CBC) у данного пациента и у других пациентов.
Пример 5: Лечение миелофиброза путем проведения комбинированной терапии с использованием рекомбинантного человеческого SAP (rhSAP) и руксолитиниба
Пациентам, у которых был диагностирован миелофиброз, включая ПМФ, пост-ИП МФ или пост-ЭT-МФ, и которые получали стабильную дозу руксолитиниба в течение по меньшей мере трех месяцев без какого-либо снижения размера селезенки, вводили человеческий рекомбинантный SAP, содержащий α2,3-сиаловую кислоту и экспрессируемый в клетках CHO (rhSAP, экспрессируемый в клетках CHO; SAP, содержащий по меньшей мере одну α2,3-связь и имеющий характер гликозилирования, отличающийся от характера гликозилирования SAP, выделенного из человеческой сыворотки) в комбинации с руксолитинибом. Эффективность терапии определяли по общим показателям ответа (ORR), классифицированным в соответствии с критериями, утвержденными Международной Рабочей Группой (IWG), в которые были внесены изменения, а именно, был включен критерий стабильного состояния со снижением степени фиброза костного мозга по меньшей мере на один балл, как признак восприимчивости к терапии. Индивидуумы, восприимчивые к терапии, продолжали лечение до тех пор, пока оно давало благоприятный эффект.
Пример 6: Лечение миелофиброза с использованием рекомбинантного человеческого SAP (rhSAP)
Пациентам, у которых был диагностирован миелофиброз, включая ПМФ, пост-ИП МФ или пост-ЭT-МФ, вводили человеческий рекомбинантный SAP, содержащий α2,3-сиаловую кислоту и экспрессируемый в клетках CHO (rhSAP, экспрессируемый в клетках CHO; SAP, содержащий по меньшей мере одну α2,3-связь и имеющий характер гликозилирования, отличающийся от характера гликозилирования SAP, выделенного из человеческой сыворотки). Эффективность терапии определяли по общим показателям ответа (ORR), классифицированным в соответствии с критериями, утвержденными Международной Рабочей Группой (IWG), в которые были внесены изменения, а именно, был включен критерий стабильного состояния со снижением степени фиброза костного мозга по меньшей мере на один балл, как признак восприимчивости к лечению. Индивидуумы, восприимчивые к терапии, продолжали лечение до тех пор, пока оно давало благоприятный эффект.
Введение посредством ссылок
Все упомянутые здесь публикации и патенты во всей своей полноте вводятся в настоящее описание посредством ссылки так, как если бы каждая отдельная публикация или каждый отдельный патент были конкретно и отдельно введены в настоящее описание посредством ссылки.
Хотя в данном описании изобретения обсуждаются конкретные варианты его осуществления, однако, такие варианты приводятся лишь в иллюстративных целях и не ограничивают объема настоящего изобретения. Многие варианты будут очевидны специалистам в данной области исходя из конкретного описания и прилагаемой ниже формулы изобретения. Полный объем настоящего изобретения должен быть определен со ссылкой на формулу изобретения вместе с полным объемом ее эквивалентов и со ссылкой на описание изобретение вместе с указанными вариантами.
Список последовательностей
SEQ ID NO:1: Последовательность человеческого амилоидного сывороточного белка P
HTDLSGKVFVFPRESVTDHVNLITPLEKPLQNFTLCFRAYSDLSRAYSLFSYNTQGRDNELLVYKERVGEYSLYIGRHKVTSKVIEKFPAPVHICVSWESSSGIAEFWINGTPLVKKGLRQGYFVEAQPKIVLGQEQDSYGGKFDRSQSFVGEIGDLYMWDSVLPPENILSAYQGTPLPANILDWQALNYEIRGYVIIKPLVWV
SEQ ID NO:2: Последовательность сывороточного амилоидного белка P Gallus gallus
QEDLYRKVFVFREDPSDAYVLLQVQLERPLLNFTVCLRSYTDLTRPHSLFSYATKAQDNEILLFKPKPGEYRFYVGGKYVTFRVPENRGEWEHVCASWESGSGIAEFWLNGRPWPRKGLQKGYEVGNEAVVMLGQEQDAYGGGFDVYNSFTGEMADVHLWDAGLSPDKMRSAYLALRLPPAPLAWGRLRYEAKGDVVVKPRLREALGA
SEQ ID NO:3: Последовательность сывороточного амилоидного белка P Bos taurus
QTDLRGKVFVFPRESSTDHVTLITKLEKPLKNLTLCLRAYSDLSRGYSLFSYNIHSKDNELLVFKNGIGEYSLYIGKTKVTVRATEKFPSPVHICTSWESSTGIAEFWINGKPLVKRGLKQGYAVGAHPKIVLGQEQDSYGGGFDKNQSFMGEIGDLYMWDSVLSPEEILLVYQGSSSISPTILDWQALKYEIKGYVIVKPMVWG
SEQ ID NO:4: Последовательность сывороточного амилоидного белка Cricetulus migratorius
QTDLTGKVFVFPRESESDYVKLIPRLEKPLENFTLCFRTYTDLSRPHSLFSYNTKNKDNELLIYKERMGEYGLYIENVGAIVRGVEEFASPVHFCTSWESSSGIADFWVNGIPWVKKGLKKGYTVKTQPSIILGQEQDNYGGGFDKSQSFVGEMGDLNMWDSVLTPEEIKSVYEGSWLEPNILDWRALNYEMSGYAVIRPRVWH
Реферат
Группа изобретений относится к медицине, а именно к онкологии, и может быть использована при лечении миелофиброза. Способы по изобретению включают введение пациенту терапевтически эффективного количества агониста сывороточного амилоида Р (SAP)- гликозилированного человеческого полипептида SAP, содержащего N-связанную олигосахаридную цепь, где по меньшей мере одна ветвь олигосахаридной цепи заканчивается группой α2,3-связанной сиаловой кислоты, один или несколько раз в первой ударной дозе в течение первой недели введения, а затем один раз каждые 1-4 недели. Использование изобретений позволяет восстановить функцию костного мозга за счет снижения степень фиброза у пациентов. 4 н. и 28 з.п. ф-лы, 4 ил., 4 табл., 6 пр.
Формула
Документы, цитированные в отчёте о поиске
Способы лечения и профилактики фиброза антагонистами il-21/il-21r

Комментарии