Способы лечения и профилактики фиброза антагонистами il-21/il-21r - RU2419450C2
Код документа: RU2419450C2
Чертежи





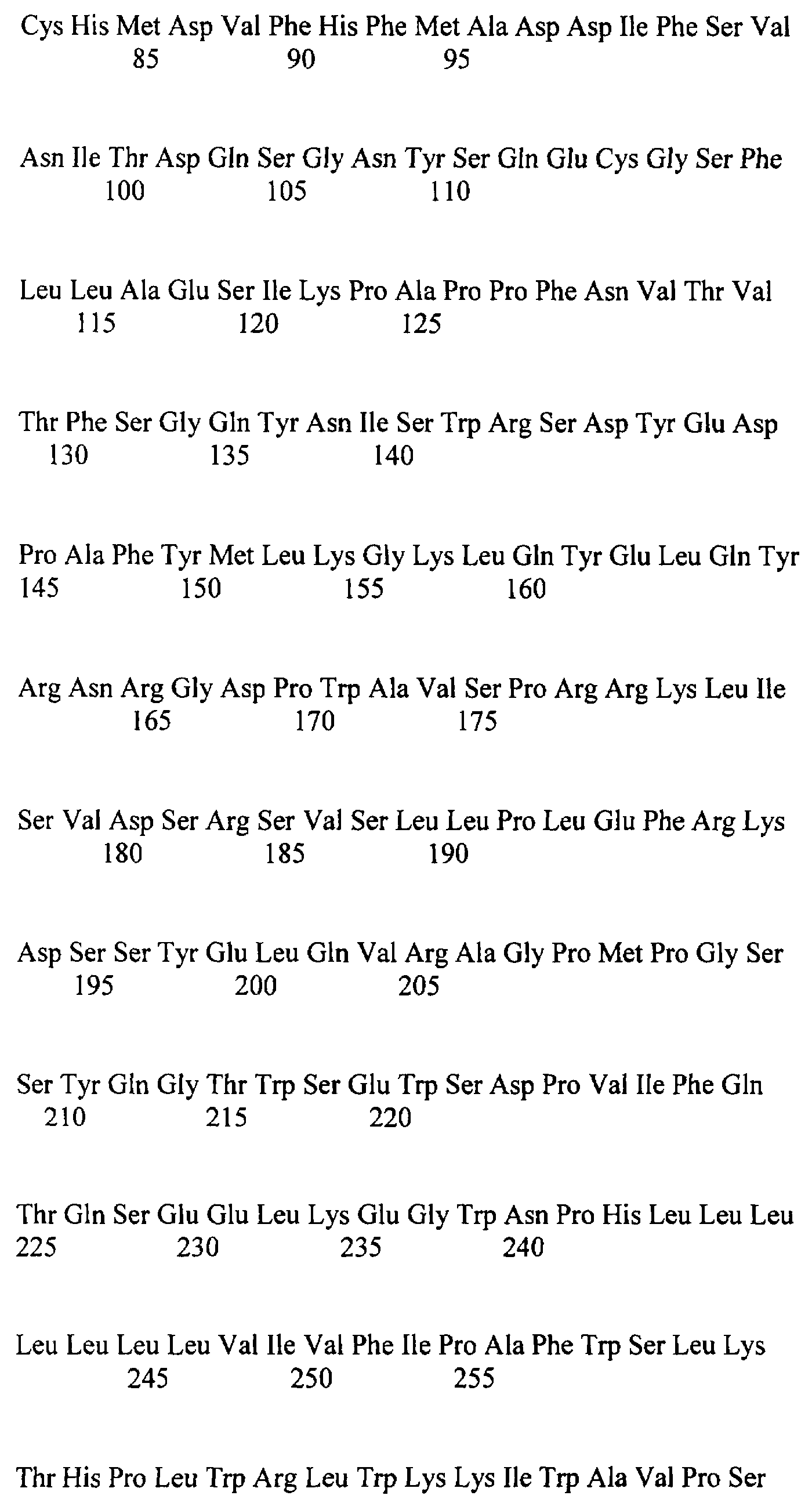






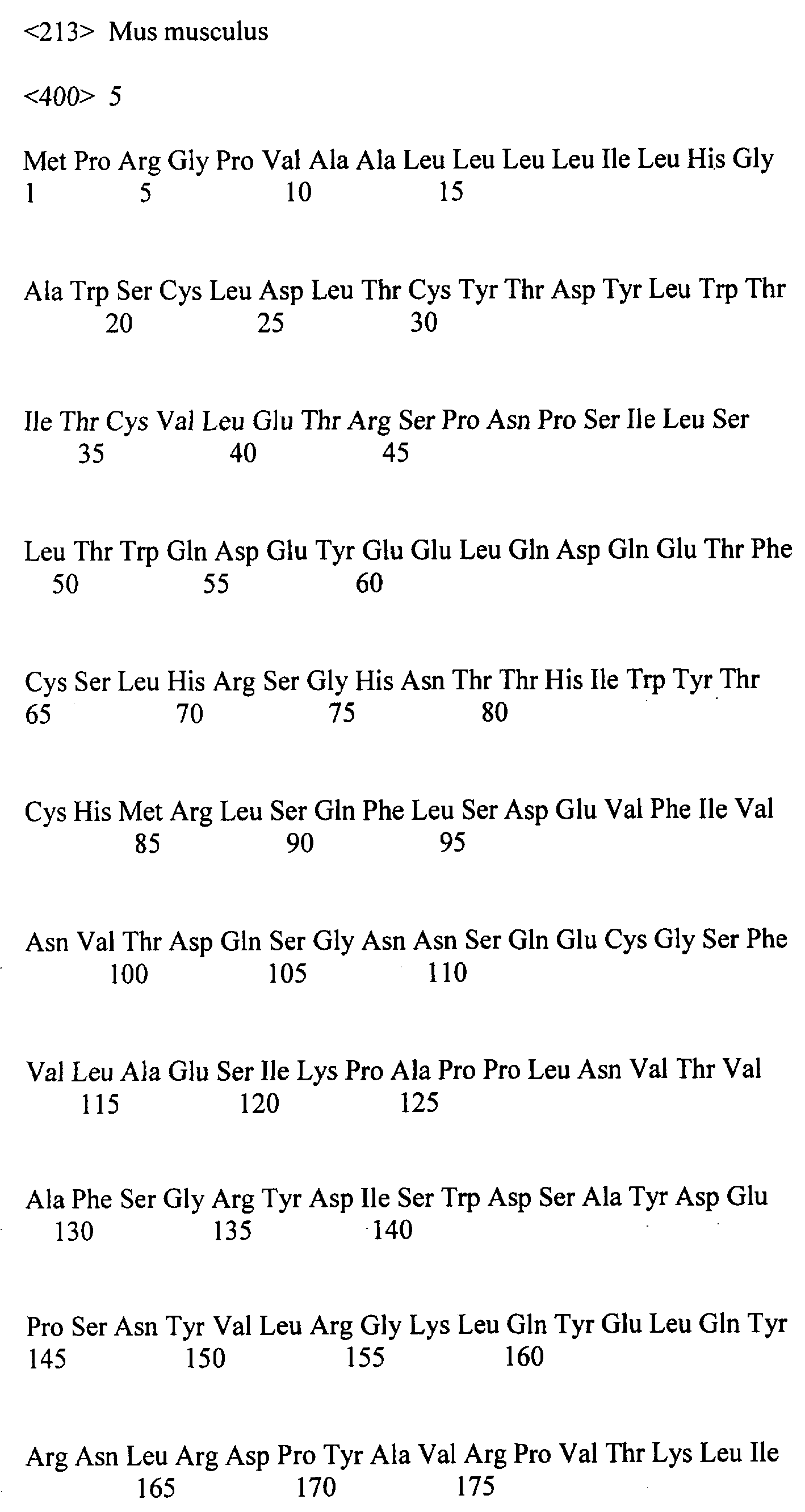




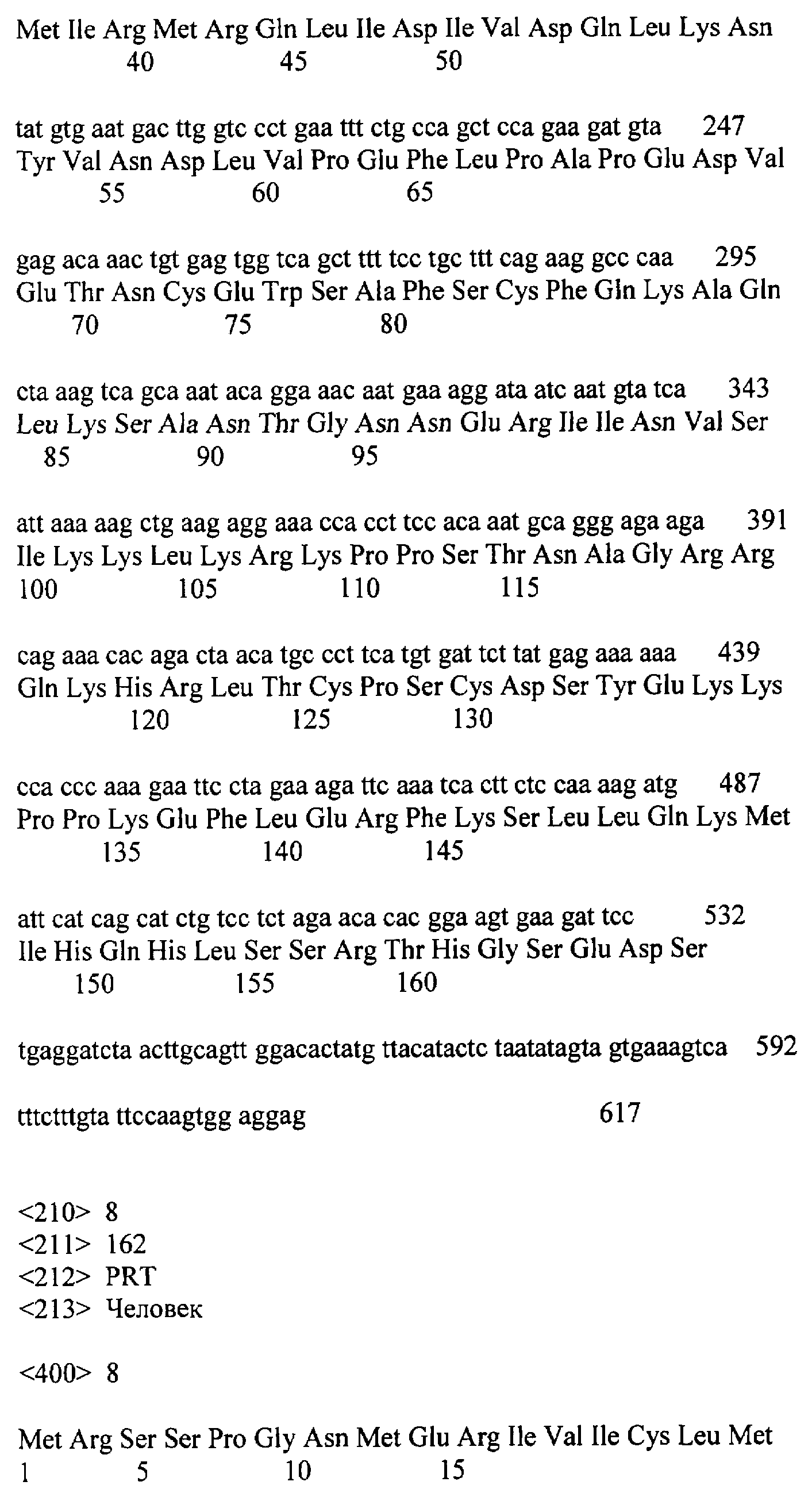
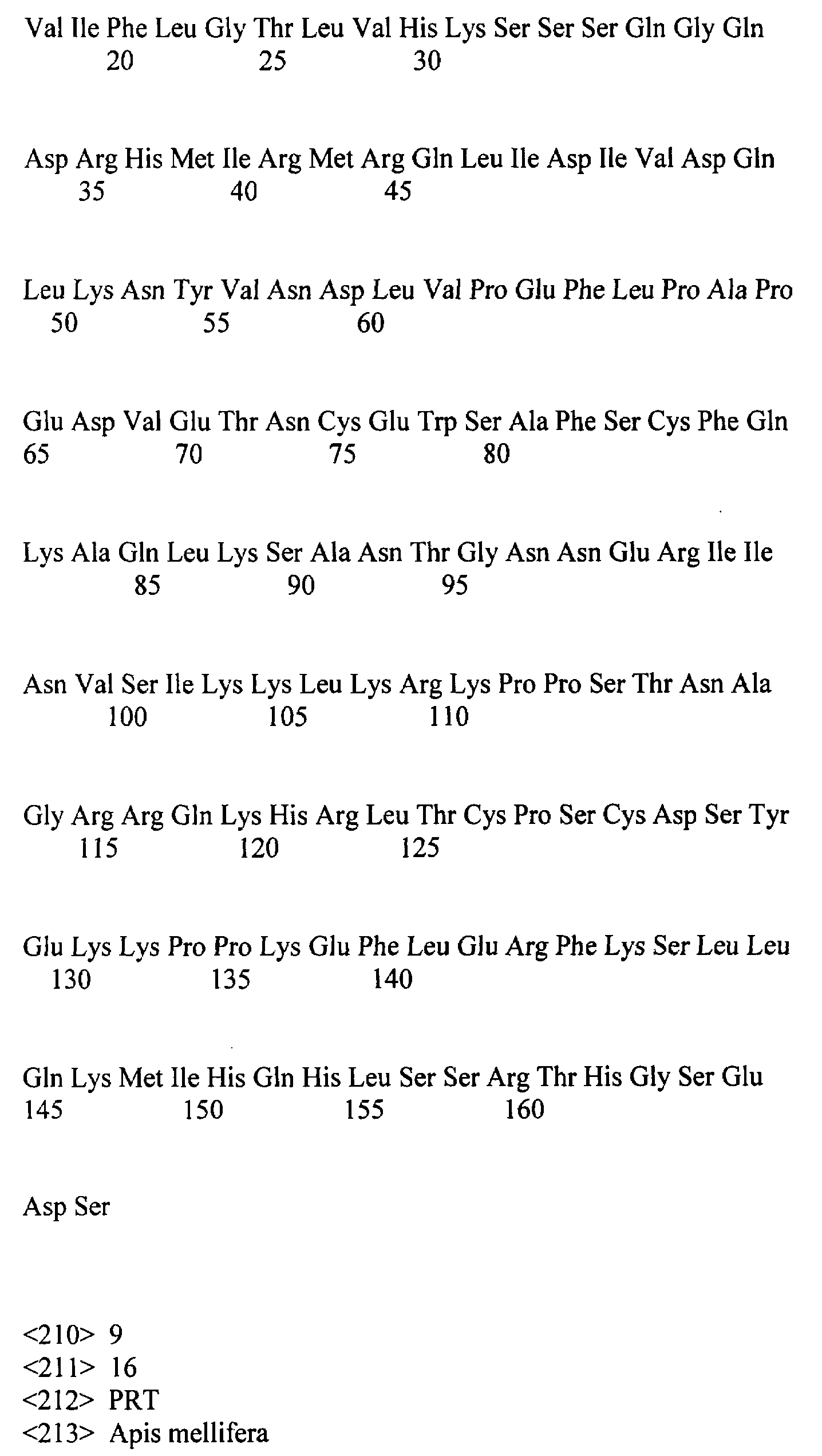


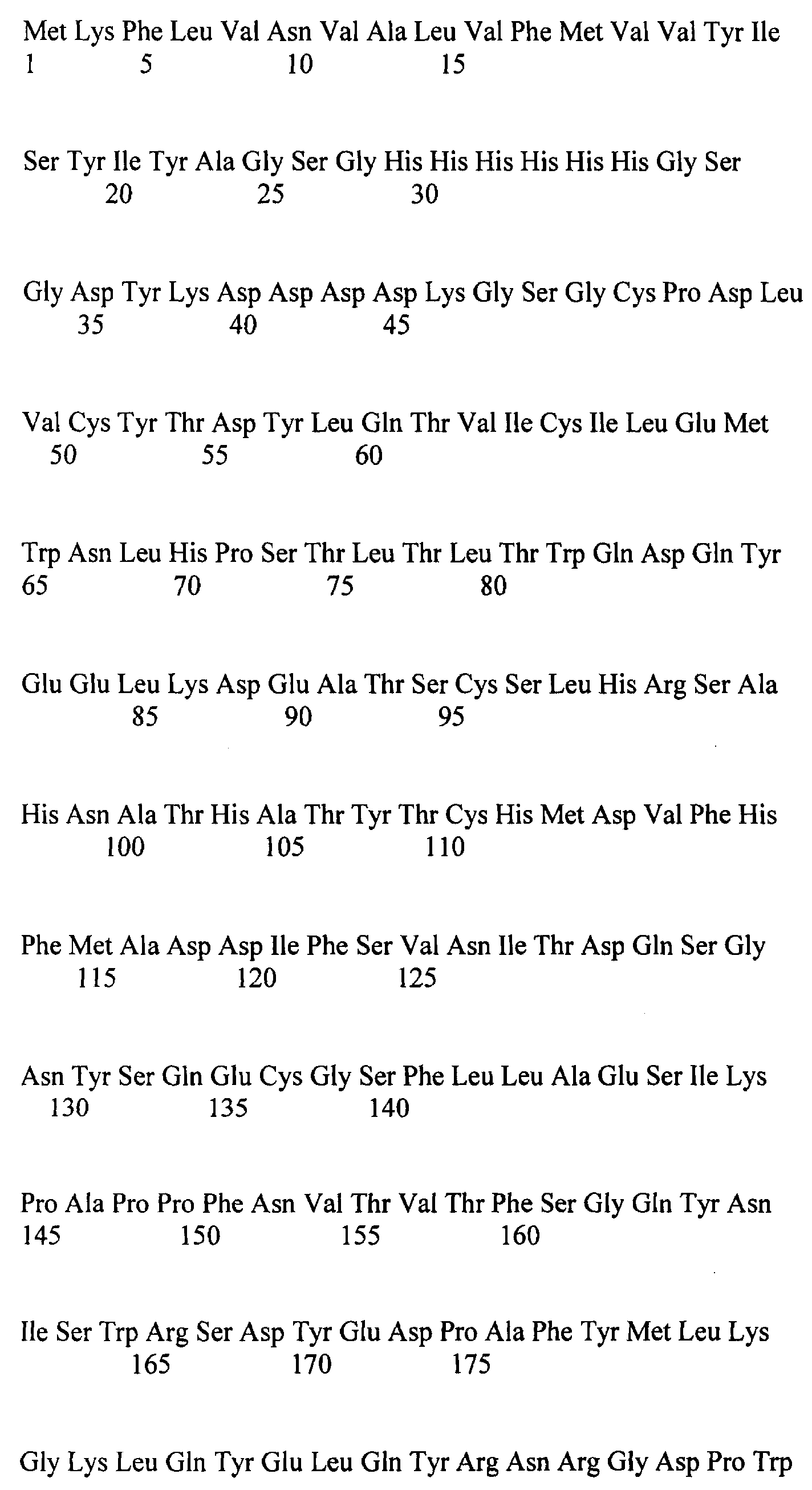
















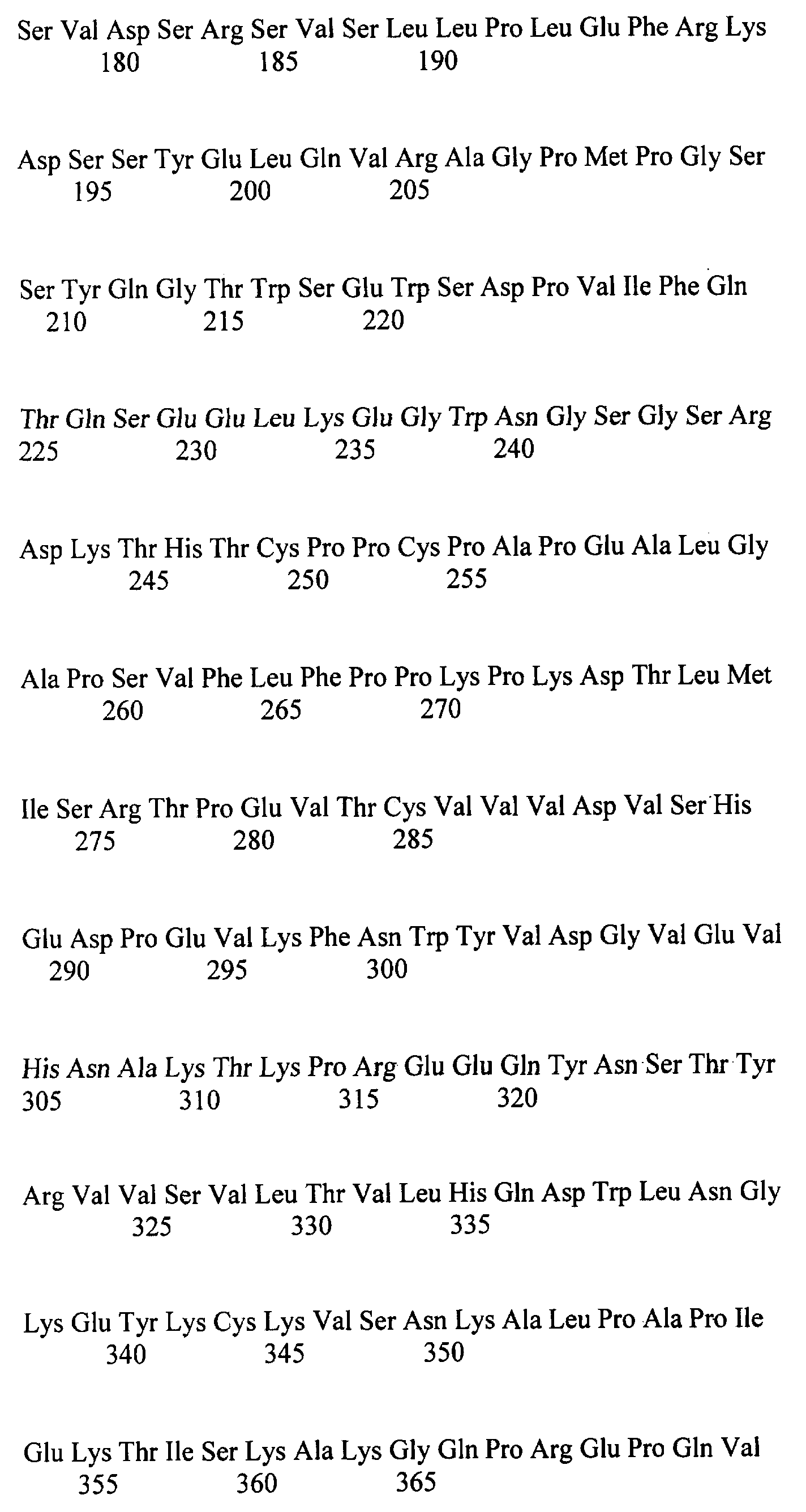

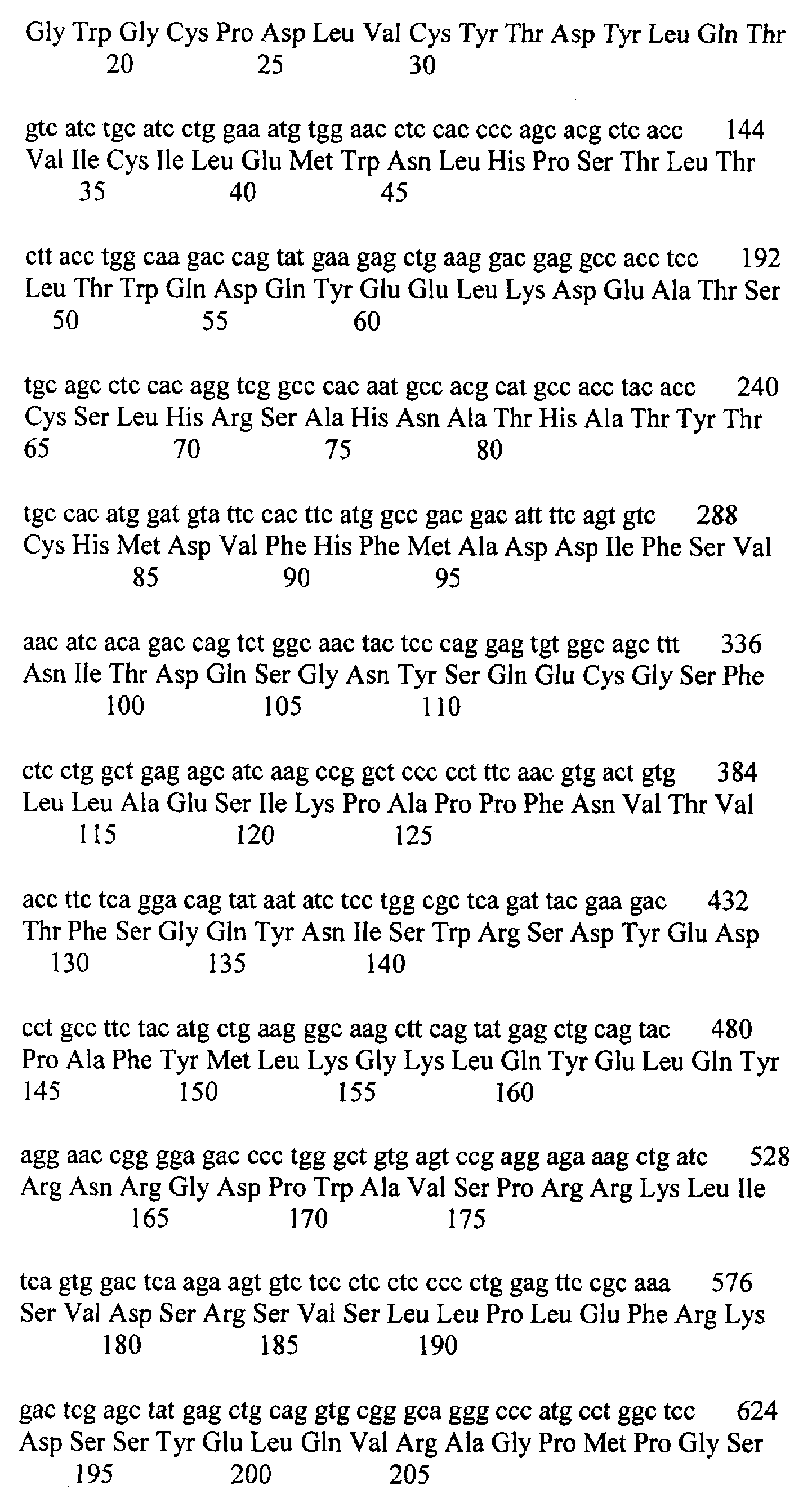
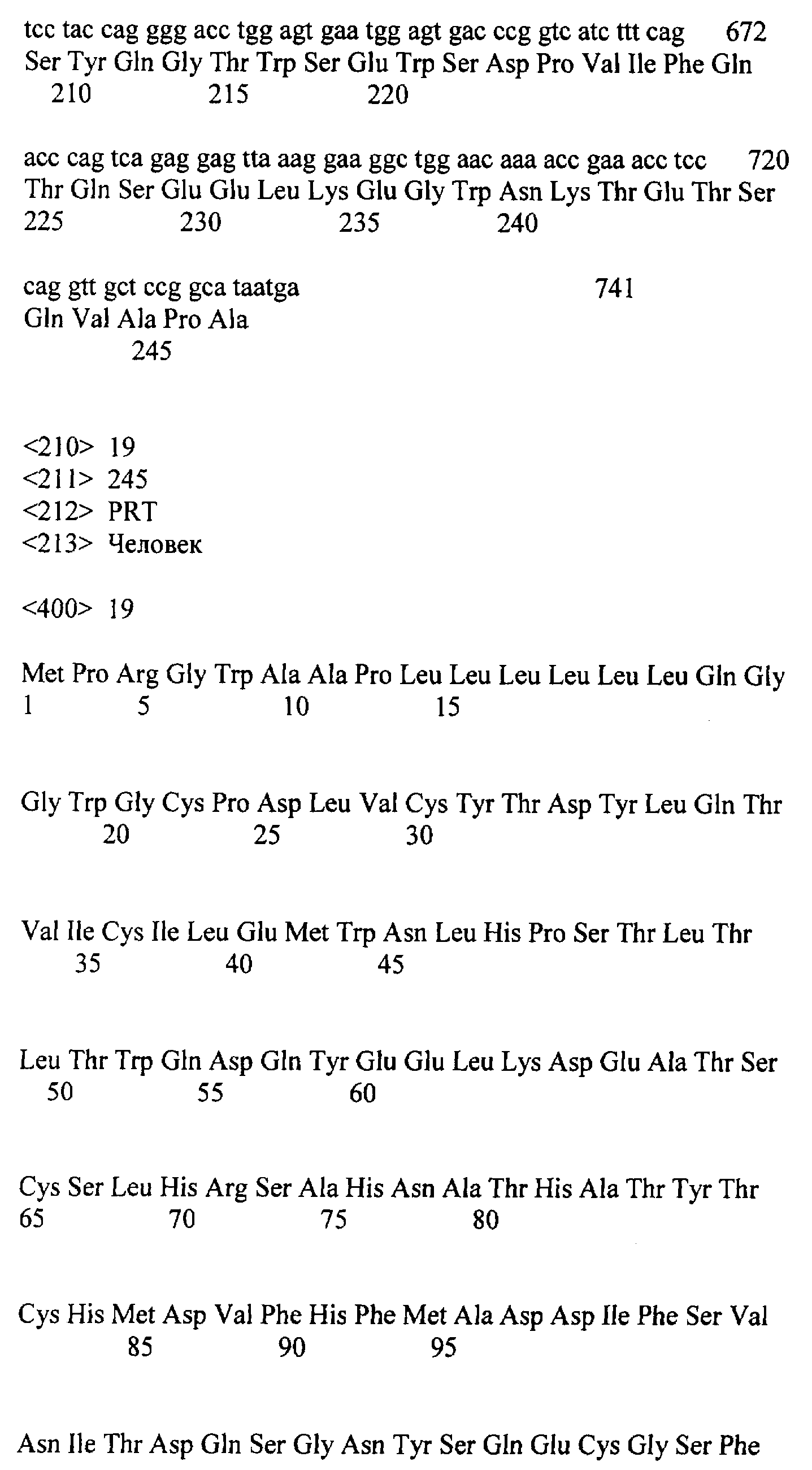


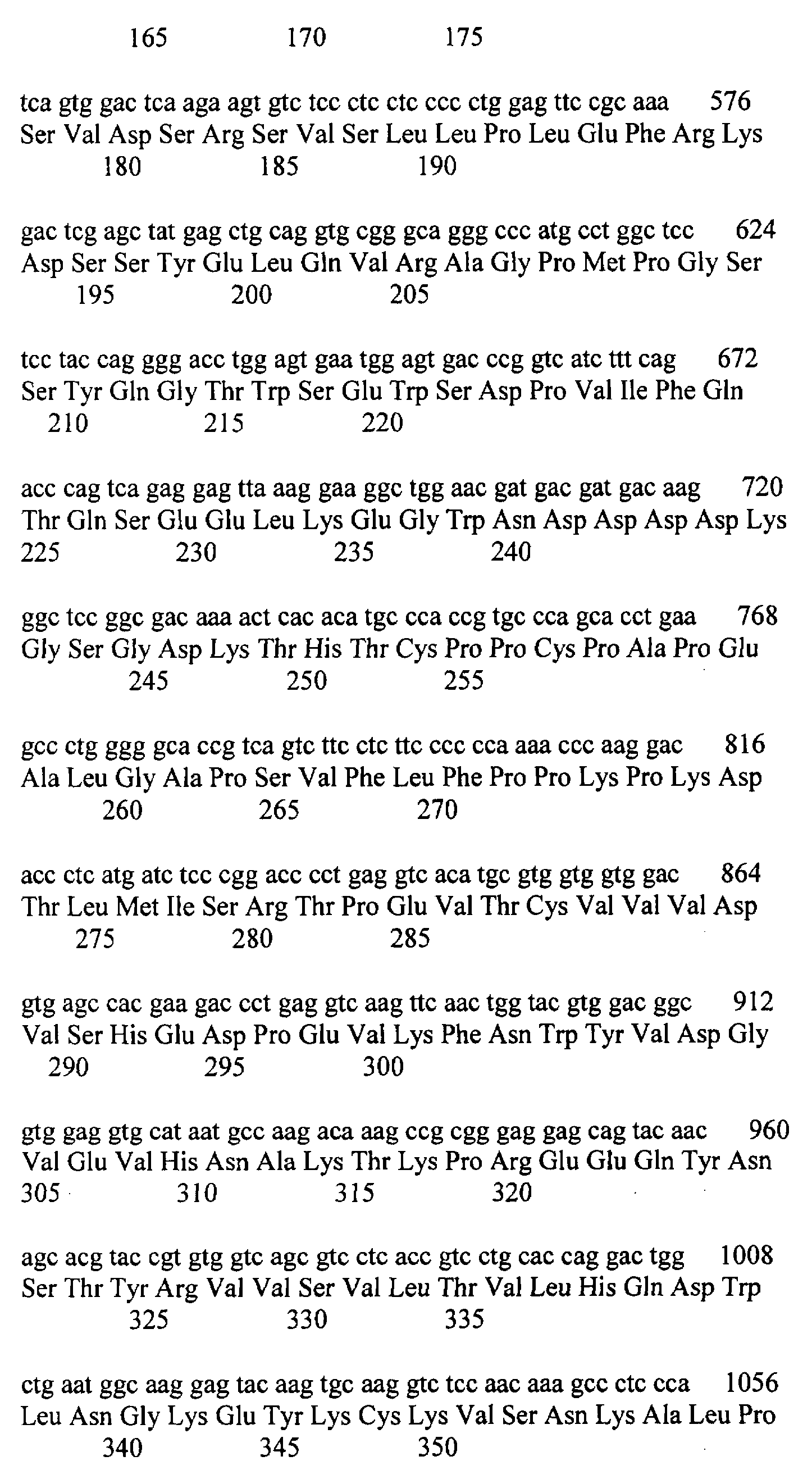



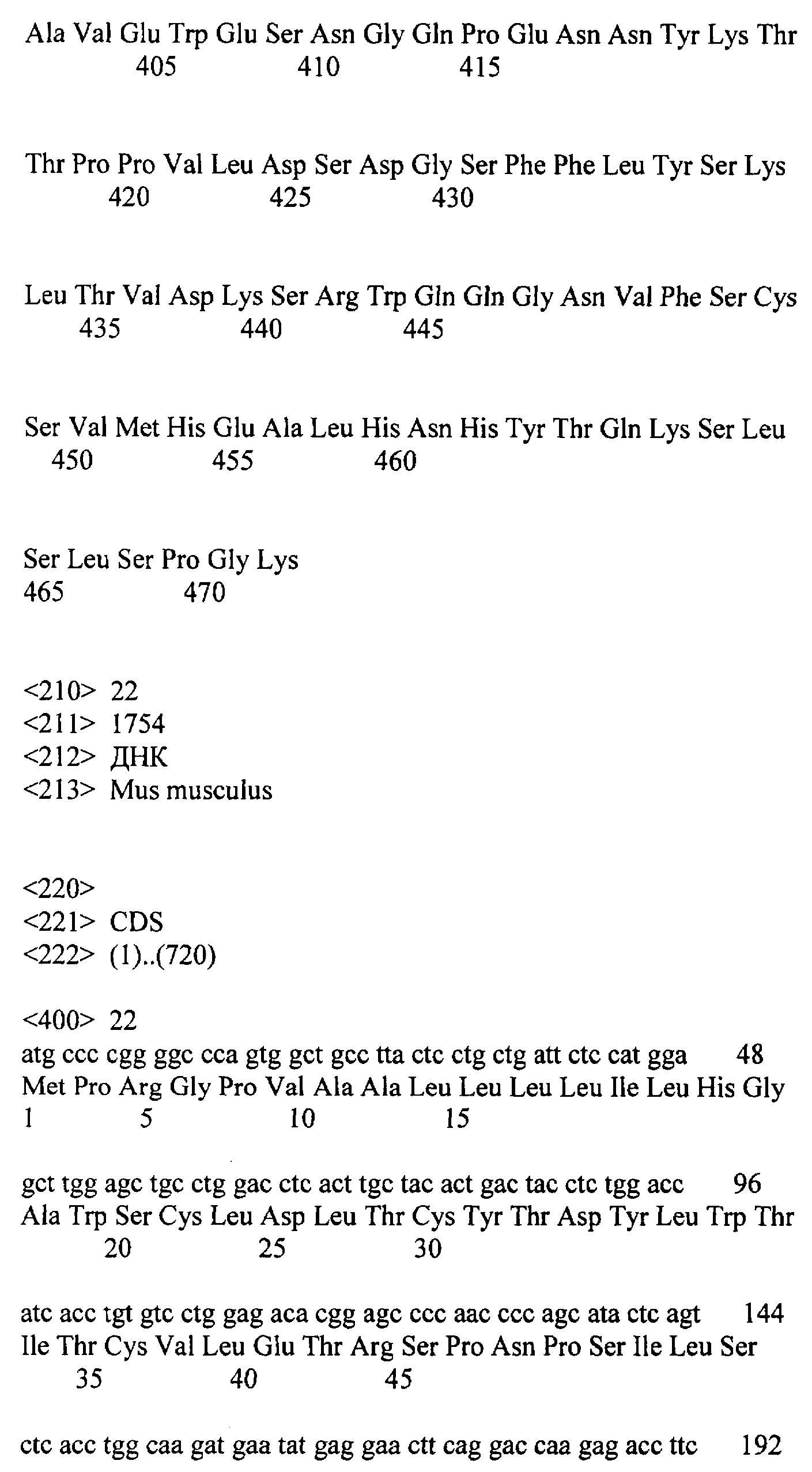




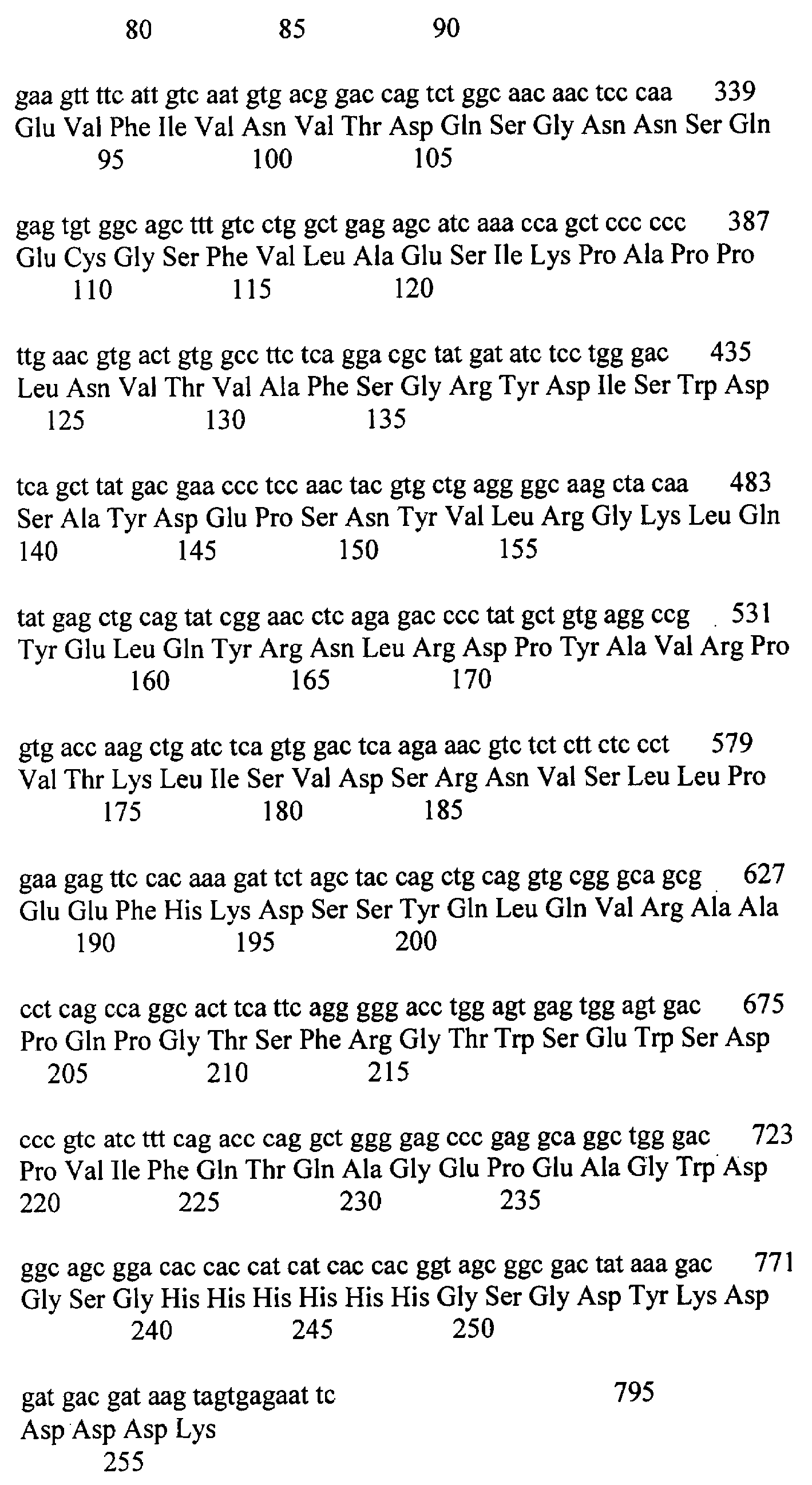
























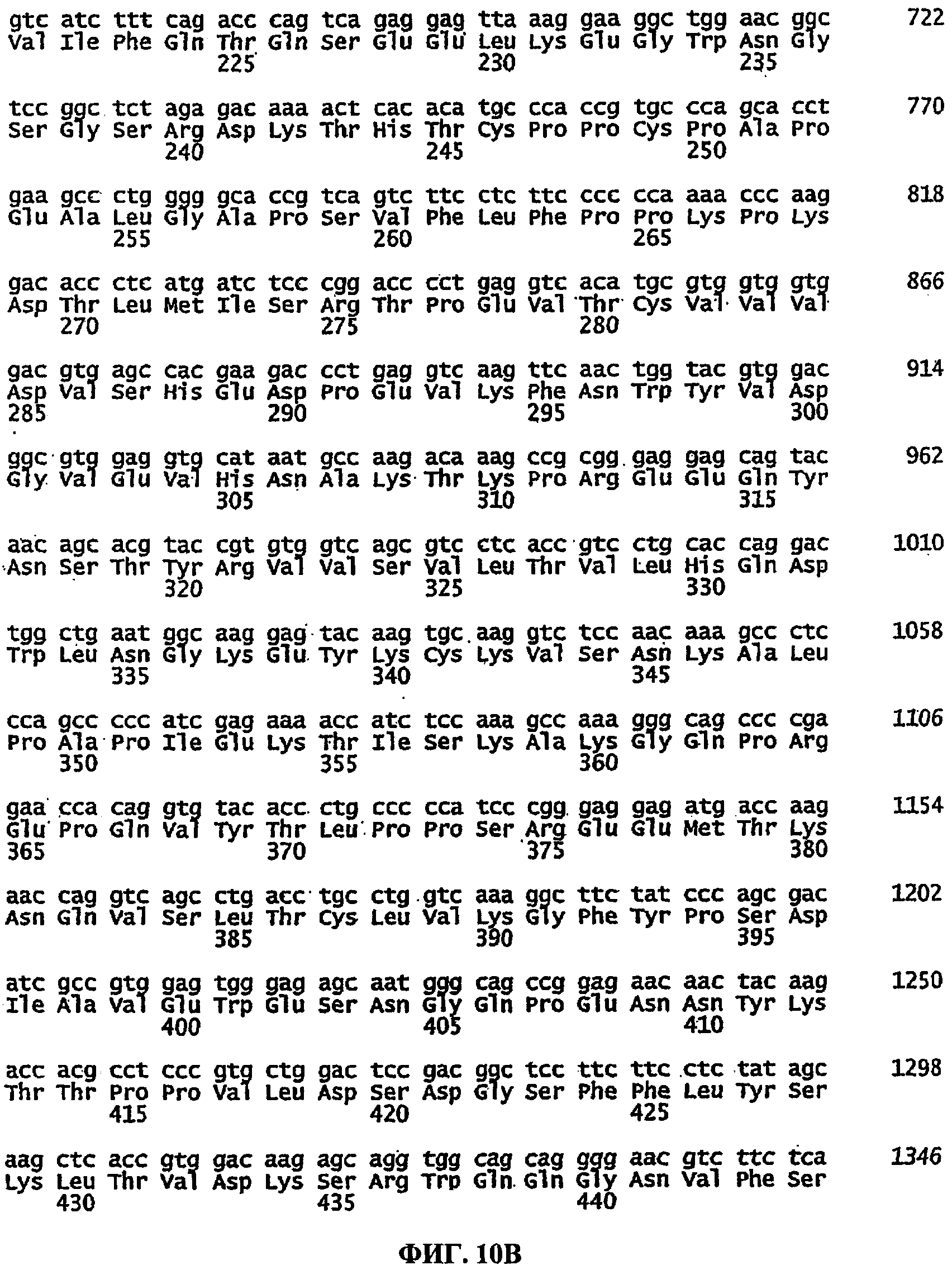



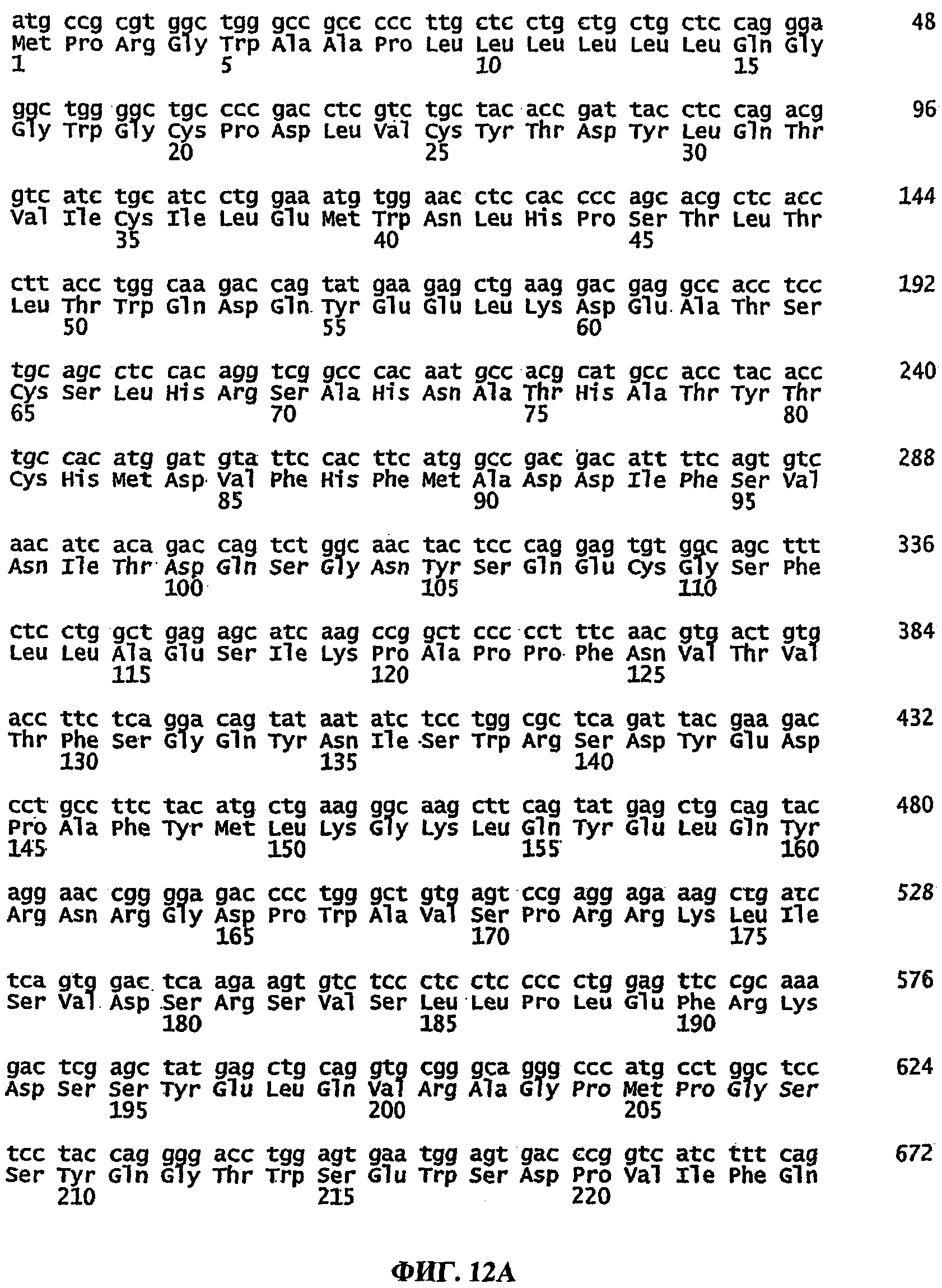






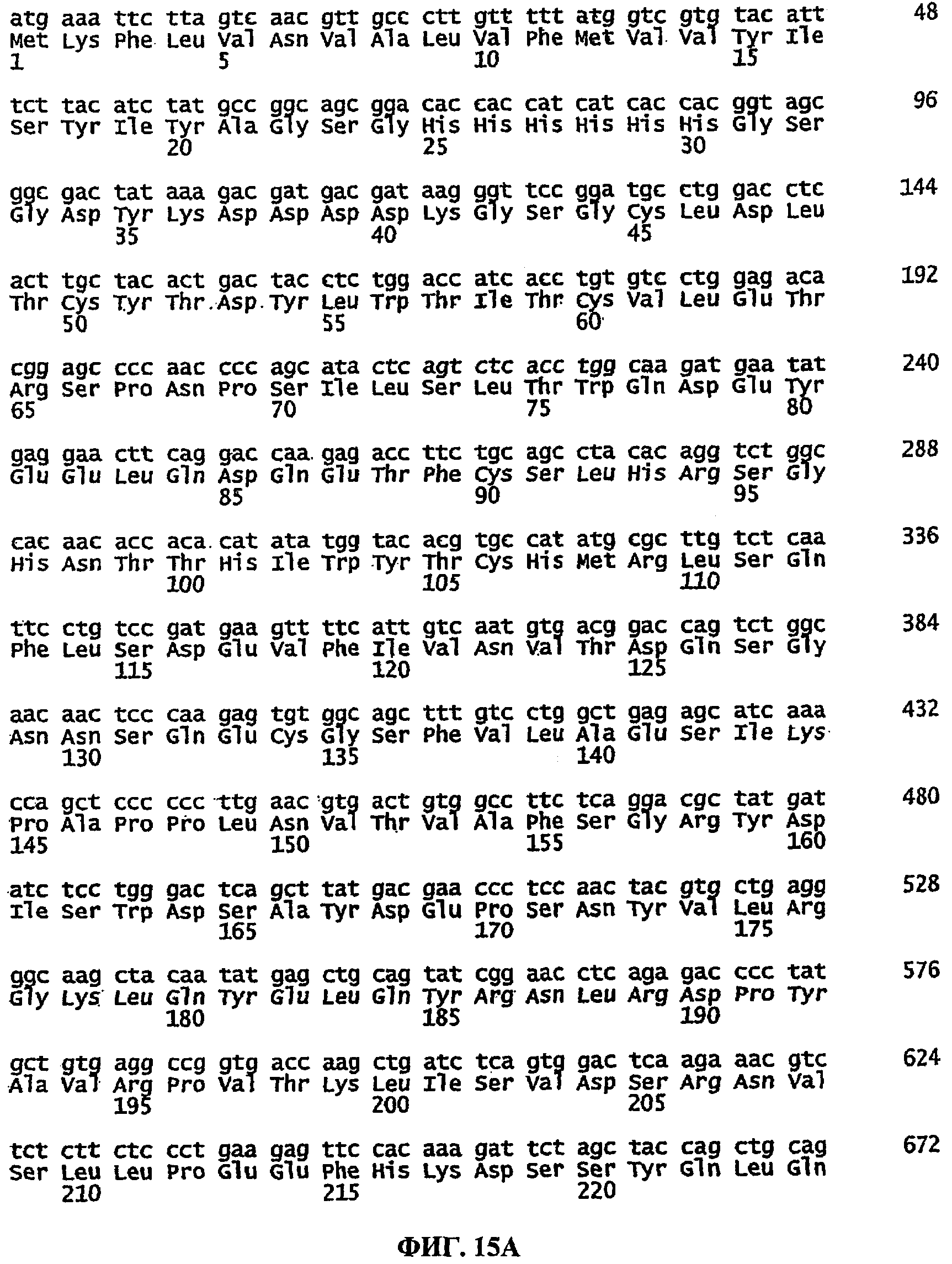















Описание
Родственные заявки
[0001] Настоящая заявка испрашивает приоритет на основании предварительной заявки на патент США №60/671,374, зарегистрированной 14 апреля 2005 г., которая полностью включена в настоящую заявку посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
Область техники
[0002] Настоящее изобретение относятся к способам лечения и профилактики фиброза и состояний, ассоциированных с фиброзом.
Уровень техники
[0003] Повреждение любого органа обычно приводит к физиологической реакции, включающей тромбоцитарный гемостаз с последующим притоком клеток воспаления и активированных фибробластов. Цитокины, продуцируемые этими типами клеток, стимулируют образование нового внеклеточного матрикса и кровеносных сосудов, которые совместно образуют грануляционную ткань. Образование фиброзной ткани является частью нормального полезного процесса заживления, следующего за повреждением; однако фиброз - это состояние, характеризующееся анормальным накоплением коллагенового матрикса после повреждения или воспаления, которое приводит к изменению структуры и функции различных тканей. Прогрессирующий фиброз почек, печени, легких, сердца, костей, костного мозга и кожи является основной причиной смерти или одним из факторов, приводящих к ней.
[0004] Многие заболевания, ассоциированные с пролиферацией фиброзной ткани, являются хроническими и часто ослабляющими здоровье. К таким заболеваниям относятся, например, болезни кожи, такие как склеродерма. Некоторые, включая легочный фиброз, могут быть летальными, поскольку существующие способы лечения дают значительные побочные эффекты и, в целом, не могут эффективно замедлить или остановить прогрессирование фиброза. Соответственно существует постоянная потребность в противофиброзных средствах.
[0005] Рецептор IL-21 (IL-21R) - это недавно открытый член семейства рецепторов цитокинов класса I (Parrish-Novak et al. (2000) Nature 408: 57-63; Ozaki et al. (2000) Proc. Natl. Acad. Sci. U.S.A. 97: 11439-44). Рецептор IL-21 демонстрирует значительную гомологию последовательности и структуры с альфа-цепью рецептора IL-4 (IL-4Ra) и располагается рядом с IL-4Rα в геномах человека и мыши, а его лиганд, IL-21, в значительной степени гомологичен цитокинам IL-2, IL-4 и IL-15 (Sivakumar et al. (2004) Immunology 112: 177-82; Habib et al. (2003) J. Allergy Clin. Immunol. 112: 1033-45). Таким образом, IL-21 и IL-21R благодаря своей гомологии с цитокинами и рецепторами, которым для функциональной сигнализации необходима гамма-цепь (γс), являются недавно описанными членами семейства (γс)-зависимых цитокинов (Vosshenrich and Di Santo (2001) Curr. Biol. 11: R175-77). Поскольку все члены γс семейства играют важные и уникальные роли в иммунной системе хозяина, растет интерес к исследованию новых функций IL-21R в процессе запускаемых антигеном иммунных реакций in vivo.
[0006] Первичные исследования функций IL-21 показали, что IL-21 оказывает антагонистическое воздействие на распространение естественных киллеров (NK-клетки) и в то же время стимулирует Т-клеточный иммунитет, включая противоопухолевый иммунитет (Ма et al. (2003) J. Immunol. 171: 608-15; Kishida et al. (2003) Mol. Ther. 8: 552-58; Di Carlo et al. (2004) /. Immunol. 172: 1540-47). Эти данные позволяют предположить, что IL-21 служит связующим звеном между реакциями врожденного и приобретенного иммунитета (Collins et al. (2003) Immunol. Res. 28: 131-40). IL-21 также регулирует функцию В-клеток и CD8+T-клеток in vivo (Ozaki et al. (2002) Science 298: 1630-34; Suto et al. (2002) Blood 100: 4565-73; Mehta et al. (2003) J. Immunol. 170: 4111-18; Pene et al. (2004) J. Immunol. 172: 5154-57; Jin et al. (2004) J. ImmunoW3: 657-65; Zengetal. (2005) J. Exp. Med. 201: 139-48).
Дополнительные исследования указывают на то, что IL-21 является цитокином ТН2, который может ингибировать дифференцировку «необученных» (naive) ТН-клеток в ТН1-клетки, секретирующие интерферон-гамма (IFN-γ; Wurster et al. (2002) J Exp. Med. 196: 969-77). Действительно, лечение экзогенным IL-21 эффективно ингибирует продукцию IFN-γ, не влияя на другие цитокины, ассоциированные с ТН1/ТН2, что указывает на высокую специфичность подавления IFN-γ интерлейкином IL-21. Поэтому предполагают, что благодаря своей способности подавлять развитие ТН1 клеток IL-21 может стимулировать ТН2 ответы (Wurster et al., выше). Тем не менее, участие IL-21R в пути передачи сигналов в ходе ТН2 ответа при ТН2-зависимых заболеваниях ранее не исследовалось.
[0007] В случая шистосомоза цитокины ТН2 играют важную роль в патогенезе заболевания (Wynn (2004) Nat.Rev. Immunol. 4: 583-594; Pearce and MacDonald (2002) Nat.Rev.Immunol. 2: 499-511). В самом деле, все мыши, дефицитные по IL-4/IL-13-, IL-4Rα и Stat6, при заражении S.mansoni демонстрируют значительно ослабленное образование гранулемы и фиброз печени (Chiaramonte et al. (1999) J. Clin. Invest. 104: 777-85; Kaplan et al. (1998) J. Immunol. 160: 1850-56; Jankovic et al. (1999) J. Immunol 163: 337-42; Fallon et al. (2000) J. Immunol. 164: 2585-91). Если учесть, что по современной классификации IL-21 является цитокином ТН2 (Wurster et al. (2002), выше; Mehta et al. (2005). Proc. Natl. Acad. Set U.S.A. 102: 2016-21), разительное сходство между рецепторами IL-4 и IL-21 (Sivakumar et al., выше; Habib et al., выше), и важное значение родственных путей передачи сигналов через IL-4Rα/Stat6 в этом заболевании, а также в других воспалительных заболеваниях, направляемых цитокинами ТН2 (Wynn (2003) Annu. Rev. Immunol. 21: 425-56), эти исследования порождают важный вопрос: играет ли сигнализация IL-21R важную роль в инициации и/или поддержании ТН2 иммунитета.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0008] Настоящее изобретение относится к способам лечения, уменьшения выраженности или профилактики фиброза или состояний, ассоциированных с фиброзом, а также способам поиска (скрининга) соединений и композиций, которые можно применять в таких способах. Настоящее изобретение обеспечивает также способы диагностики, прогнозирования и мониторинга прогрессирования (например, курс лечения) фиброза и/или состояний, ассоциированных с фиброзом. Указанные способы связаны с измерением и/или изменением уровня IL-21 и/или IL-21R (т.е. уровня активности IL-21 и/или IL-21R, уровня экспрессии IL-21 и/или IL-21R (например, уровня продуктов генов IL-21 и/или IL-21R) и/или уровня взаимодействия IL-21 с IL-21R). Настоящее изобретение, кроме того, обеспечивает антагонисты IL-21 или IL-21R для лечения фиброза и/или состояний, ассоциированных с фиброзом.
[0009] В одном варианте реализации настоящее изобретение обеспечивает способ лечения, уменьшения выраженности или профилактики фиброза или ассоциированного с фиброзом состояния у субъекта (например, человека), включающий введение указанному субъекту терапевтически эффективного количества вещества, которое снижает уровень IL-21 и/или IL-21R у субъекта. В другом варианте реализации указанное вещество представляет собой антагонист IL-21/IL-21R, выбранный из группы, состоящей из антитела против IL-21R (анти-IL-21R антитела), антитела против IL-21, антиген-связывающего фрагмента антитела против IL-21R, антиген-связывающего фрагмента антитела против IL-21 и растворимого фрагмента IL-21R. В еще одном варианте реализации указанное вещество представляет собой растворимый фрагмент IL-21R, и указанный растворимый фрагмент IL-21R содержит последовательность аминокислот, которая по меньшей мере на 90% идентична последовательности аминокислот, выбранной из группы, состоящей из аминокислот 1-538 последовательности SEQ ID NO: 2, аминокислот 20-538 последовательности SEQ ID NO: 2, аминокислот 1-235 последовательности SEQ ID NO: 2, аминокислот 20-235 последовательности SEQ ID NO: 2, аминокислот 1-236 последовательности SEQ ID NO: 2, аминокислот 20-236 последовательности SEQ ID NO: 2, аминокислот 1-529 последовательности SEQ ID NO: 5, аминокислот 20-529 последовательности SEQ ID NO: 5, аминокислот 1-236 последовательности SEQ ID NO: 5 и аминокислот 20-236 последовательности SEQ ID NO: 5. В другом варианте реализации настоящего изобретения растворимый фрагмент IL-21R связывает полипептид IL-21.
[0010] В другом варианте реализации указанное вещество представляет собой растворимый фрагмент IL-21R, и указанный растворимый фрагмент IL-21R содержит последовательность аминокислот, по существу идентичную последовательности аминокислот, соответствующей SEQ ID NO: 11, SEQ ID NO: 13, SEQ ID NO: 15, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 21, SEQ ID NO: 23, SEQ ID NO: 25 или SEQ ID NO: 27. В другом варианте реализации настоящего изобретения последовательность аминокислот растворимого фрагмента IL-21R содержит последовательность аминокислот, по существу идентичную последовательности аминокислот, соответствующей SEQ ID NO: 11 или SEQ ID NO: 13. В другом варианте реализации указанное вещество представляет собой растворимый фрагмент IL-21R, и указанный растворимый фрагмент IL-21R кодирует последовательность нуклеотидов, по существу идентичную последовательности нуклеиновой кислоты, соответствующей SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 24 или SEQ ID NO: 26. В другом варианте реализации растворимый фрагмент IL-21R кодирует последовательность нуклеотидов, которая по существу идентична последовательности нуклеиновых кислот, соответствующей SEQ ID NO: 12 или SEQ ID NO: 16.
[0011] В другом варианте реализации указанное вещество представляет собой растворимый фрагмент IL-21R, и указанный растворимый фрагмент IL-21R содержит внеклеточный домен IL-21R и Fc-фрагмент иммуноглобулина. Еще в одном варианте реализации последовательность аминокислот внеклеточного домена IL-21R содержит последовательность аминокислот, которая по меньшей мере на 90% идентична аминокислотам 1-235 последовательности SEQ ID NO: 2 или аминокислотам 20-235 последовательности SEQ ID NO: 2. В другом варианте реализации Fc-фрагмент иммуноглобулина имеет измененную функцию. В еще одном варианте реализации Fc-фрагмент иммуноглобулина имеет последовательность аминокислот, соответствующую аминокислотам 244-467 последовательности SEQ ID NO: 17.
[0012] В другом варианте реализации настоящего изобретения фиброз или ассоциированное с фиброзом нарушение поражает печень, эпидерму, эндодерму, мышцу, сухожилие, хрящ, сердце, поджелудочную железу, легкое, матку, нервную систему, яичко, яичник, надпочечник, артерию, вену, толстую кишку, тонкий кишечник, желчные протоки или желудок. В еще одном варианте реализации фиброз или ассоциированное с фиброзом нарушение представляет собой интерстициальный фиброз легких. В другом варианте реализации фиброз или ассоциированное с фиброзом нарушение является результатом заражения шистосомой. Еще в одном варианте реализации фиброз или ассоциированное с фиброзом нарушение является результатом заживления раны. В другом способе реализации заживающая рана является результатом хирургического иссечения.
[0013] В другом варианте реализации настоящее изобретение включает также введение субъекту по меньшей мере одного дополнительного терапевтического средства. В другом варианте реализации указанный по меньшей мере одно дополнительное терапевтическое средство выбирают из группы, состоящей из ингибиторов цитокинов, ингибиторов факторов роста, иммунодепрессантов, противовоспалительных агентов, ингибиторов метаболизма, ингибиторов ферментов, цитотоксических средств и цитостатических средств. В дополнительном варианте реализации настоящего изобретения указанное по меньшей мере одно терапевтическое средство выбирают из группы, состоящей из антагонистов ФНО (фактора некроза опухолей), анти-ФНО средств (средств, специфичных к ФНО), антагонистов в IL-12, антагонистов IL-15, антагонистов IL-17, антагонистов IL-18, антагонистов IL-22, средств, уменьшающих количество Т-клеток, средств, уменьшающих количество В-клеток, циклоспорина, FK506, CCI-779, этанерцепта, (etanercept), ифликсимаба (infliximab), ритуксимаба (rituximab), адалимумаба (adalimumab), преднизолона (prednisolone), азатиоприна (azathioprine), золота, сульфасалазина (sulphasalazine), гидроксихлорохина (hydroxychloroquine), миноциклина (minocycline), анакинра (anakinra), абатацепта (abatacept), метотрексата (methotrexate), лефлюномида (leflunomide), рапамицина (rapamycin), аналогов рапамицина, ингибиторов Сох-2, ингибиторов cPLA2, нестероидных противовоспалительных препаратов, ингибиторов р38, антагонистов В7.1, В7.2, ICOSL, ICOS и/или CD28 и агонистов CTLA4.
[0014] В другом примере реализации настоящее изобретение обеспечивает способ идентификации соединения для лечения, уменьшения выраженности или профилактики фиброза или ассоциированного с фиброзом нарушения у субъекта, который включает: (а) измерение уровня IL-21 и/или IL-21R в представляющих интерес клетке или образце; (b) приведение представляющих интерес клетки или образца в контакт с соединением; и (с) измерение уровня IL-21 и/или IL-21R в представляющих интерес клетке или образце после контакта с указанным соединением, где по более низкому уровню IL-21 и/или IL-21R в представляющих интерес клетке или образце после контакта по сравнению с уровнем IL-21 и/или IL-21R в представляющих интерес клетке и/или образце, которые не приводили в контакт с соединением, идентифицируют указанное соединение как соединение, полезное для лечения, уменьшения выраженности или профилактики фиброза или ассоциированного с фиброзом состояния у субъекта.
[0015] В другом примере реализации настоящее изобретение обеспечивает способ идентификации соединения для лечения, уменьшения выраженности или профилактики фиброза или ассоциированного с фиброзом нарушения у субъекта, включающий: (а) измерение уровня IL-21 и/или IL-21R в представляющих интерес клетке или образце; (b) приведение представляющих интерес клетки или образца в контакт соединением; (с) измерение уровня IL-21 и/или IL-21R в представляющих интерес клетке или образце после контакта с указанным соединением; и (d) сравнение уровня IL-21 и/или IL-21R в представляющих интерес клетке или образце после контакта с эталонным уровнем IL-21 и/или IL-21R, где по более низкому, по сравнению с эталонным уровнем IL-21 и/или IL-21R, уровню IL-21 и/или IL-21R в представляющих интерес клетке или образце после контакта идентифицируют исследуемое соединение как соединение, полезное для лечения, уменьшения выраженности или профилактики фиброза или ассоциированного с фиброзом состояния у субъекта.
[0016] В другом примере реализации настоящее изобретение обеспечивает способ мониторинга прогрессирования фиброза или ассоциированного с фиброзом состояния у субъекта, который включает: (а) измерение уровня EL-21 и/или IL-21R в представляющих интерес клетке или образце, взятых у указанного субъекта, в первый момент времени; и (b) измерение уровня EL-21 и/или IL-21R в представляющих интерес клетке или образце, взятых у указанного субъекта во второй момент времени, где более низкий уровень IL-21 и/или IL-21R в представляющих интерес клетке или образце, взятых у субъекта во второй момент времени, по сравнению с уровнем IL-21 и/или IL-21R в представляющих интерес клетке или образце, взятых у субъетка в первый момент времени, указывает на уменьшение тяжести фиброза или ассоциированного с фиброзом состояния.
[0017] В другом примере реализации настоящее изобретение обеспечивает способ прогнозирования течения фиброза или ассоциированного с фиброзом состояния у субъекта, который включает: (а) измерение уровня IL-21 и/или IL-21R в представляющих интерес клетке или образце, взятых у субъекта в первый момент времени; и (b) измерение уровня IL-21 и/или IL-21R в представляющих интерес клетке или образце, взятых у указанного субъекта во второй момент времени, где более низкий уровень IL-21 и/или IL-21R в представляющих интерес клетке или образце, взятых у субъекта, во второй момент времени по сравнению с уровнем IL-21 и/или IL-21R в представляющих интерес клетке или образце, взятых у указанного субъекта в первый момент времени, указывает на снижение вероятности того, что у субъекта разовьется фиброз или ассоциированное с фиброзом состояние, либо вероятности усиления фиброза или ассоциированного состояния у указанного субъекта.
[0018] В другом примере реализации настоящее изобретение обеспечивает способ прогнозирования течения фиброза или ассоциированного с фиброзом состояния у субъекта, который включает: (а) измерение уровня IL-21 и/или IL-21R в представляющих интерес клетке или образце, взятых у субъекта; и (b) сравнение уровня IL-21 и/или IL-21R в представляющих интерес клетке или образце, взятых у субъекта, с эталонным уровнем IL-21 и/или IL-21R, где более низкий уровень IL-21 и/или IL-21R в представляющих интерес клетке или образце, взятых у пациента, по сравнению с эталонным уровнем IL-21 и/или IL-21R указывает на пониженную вероятность развития у пациента фиброза или ассоциированного с фиброзом состояния либо на сниженную вероятность усиления фиброза или ассоциированного с фиброзом состояния у субъекта.
[0019] В другом примере реализации настоящее изобретение обеспечивает способ диагностики фиброза или ассоциированного с фиброзом состояния у субъекта, который включает: (а) измерение уровня IL-21 и/или IL-21R в представляющих интерес клетке или образце, взятых у субъекта, и (b) сравнение уровня IL-21 и/или IL-21R в представляющих интерес клетке или образце, взятых у указанного субъетка, с эталонным уровнем IL-21 и/или IL-21R, где более высокий уровень IL-21 и/или IL-21R в представляющих интерес клетке или образце, взятых у субъекта, по сравнению с эталонным уровнем IL-21 и/или IL-21R указывает на присутствие фиброза и/или ассоциированного с фиброзом состояния у субъекта.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0020] На ФИГ.1 приведена полноразмерная последовательность кДНК IL-21R/MU-1 мыши. Последовательность нуклеотидов соответствует нуклеотидам 1-2628 последовательности SEQ ID NO: 4.
[0021] На ФИГ.2А и 2В приведены последовательности аминокислот IL-21R/MU-1 мыши и человека. На ФИГ.2А приведена последовательность аминокислот EL-21R/MU-1 мыши (соответствующая аминокислотам 1-529 последовательности SEQ ID NO: 5). Аминокислоты 1-19 (жирный шрифт) представляют собой лидерную последовательность (предсказана программой SPScan с оценкой 10.1). Предсказанный трансмембранный домен (подчеркнут) обнаружен в области аминокислот 237-253 последовательности SEQ ID NO: 5. Предсказанные сигнальные мотивы включают мотив "Box 1" в области аминокислот 265-274 и мотив "Box 2" в области аминокислот 311-324 (жирный и подчеркнутый). В позициях аминокислот 281, 319, 361, 368, 397 и 510 последовательности SEQ ID NO: 5 расположены шесть остатков тирозина. Мотив WSXWS (SEQ ID NO: 3) расположен в области остатков аминокислот 214-218 (заглавные буквы, жирный шрифт). Возможные сайты «стыковки» (docking) с Stat включают остатки аминокислот 393-398 и остатки аминокислот 510-513 последовательности SEQ ID NO: 5. На ФИГ.2В изображена последовательность аминокислот IL-21R/MU-1 человека (соответствующая SEQ ID NO: 2). Указаны положения предсказанных сигнальной последовательности (аминокислоты 1-19 последовательности SEQ ID NO: 2); мотива WSXWS (аминокислоты 213-217 последовательности SEQ ID NO: 2) и трансмембранного домена (аминокислоты 236-252 (или 236-253, или 236-254) последовательности SEQ ID NO: 2 (подчеркнут)). Возможные сайты связывания JAK, сигнальные мотивы Box 1 и 2 и сайты «стыковки» со Stat указаны стрелками с подписями.
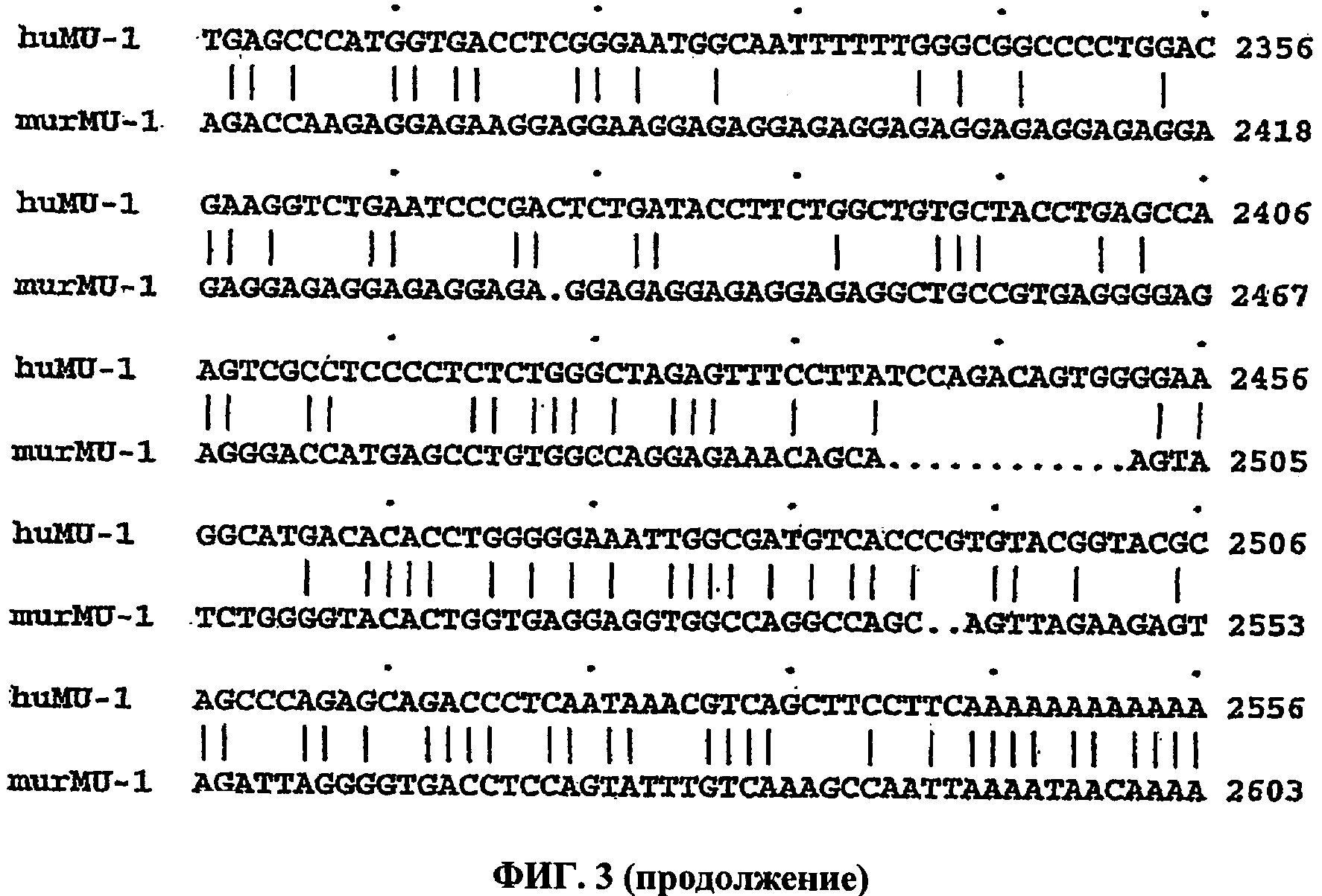
[0022] ФИГ.3 приведено GAP-сравнение последовательностей кДНК IL-21R/MU-1 человека и мыши (соответствующих нуклеотидам 1-2665 последовательности SEQ ID NO: 1 и нуклеотидам 1-2628 последовательности SEQ ID NO: 4 соответственно). huMU-1=IL-21R/MU-1 человека, murMU-1=IL-21R/MU-1 мыши. Параметры анализа: Gap weight (вес пробела)=50; Average Match (среднее совпадение)=1 0.000; Length Weight (вес длины)=3; Average Mismatch (среднее несовпадение)=0.000; Percent Identity (идентичность в процентах)=66.116.
[0023] На ФИГ.4 изображено GAP-сравнение белка IL-21R/MU-1 человека (соответствует последовательности аминокислот SEQ ID NO: 2) и белка IL-21R/MU-1 мыши (соответствует последовательности аминокислот SEQ ID NO: 5). Выравнивание осуществляли при помощи матрицы замены аминокислот BLOSUM62 (Henikoffn Henikoff(1992) Proc. Natl. Acad. Sci. U.S.A. 89: 10915-19). Параметры анализа: Gap Weight (вес пробела): 8; Average Match (среднее совпадение)=2.912; Length Weight (вес длины)=2; Average Mismatch (среднее несовпадение)=-2.003; Percent Identity (идентичность в процентах)=65.267.
[0024] На ФИГ.5 изображено множественное выравнивание последовательностей аминокислот IL-21R/MU-1 человека (соответствует SEQ ID NO: 2), IL-21R/MU-1 мыши (соответствует SEQ ID NO: 5) и бета-цепи IL-2 человека (GENBANK® Accession No. М26062). Лидерный и трансмембранный домены подчеркнуты. Консервативные мотивы рецепторов цитокинов выделены жирным шрифтом. Возможные сигнальные области указаны подчеркиванием и жирным шрифтом.
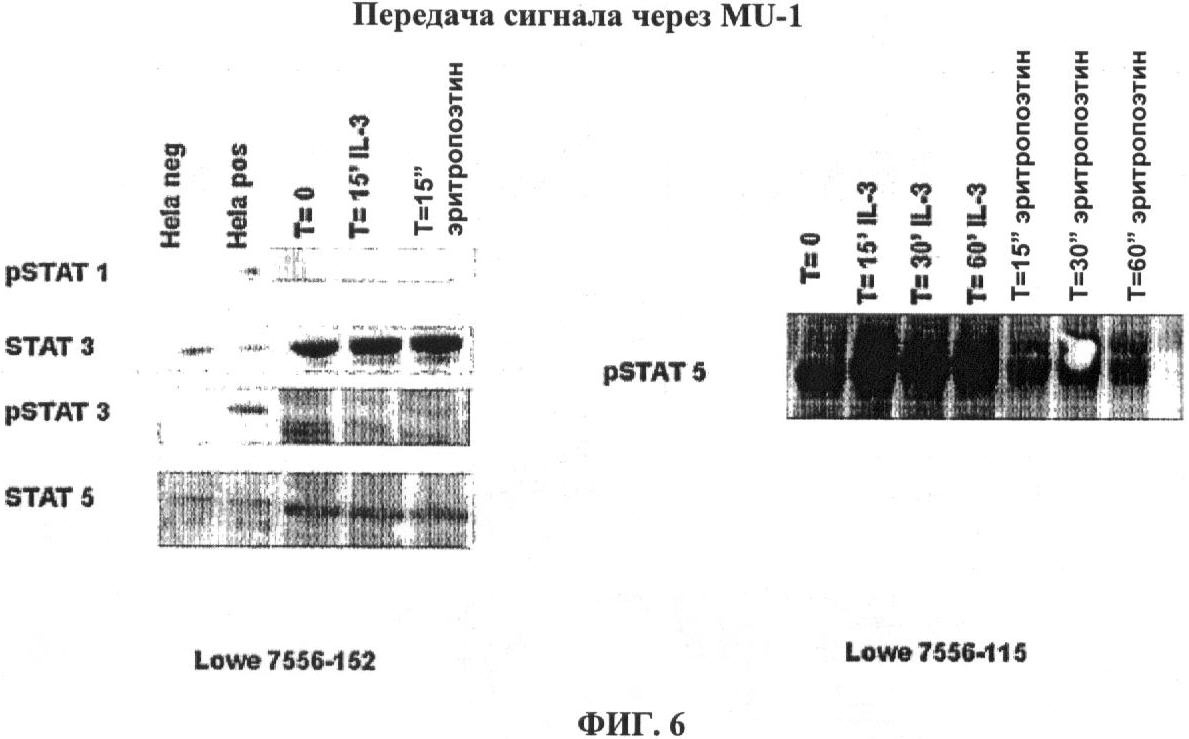
[0025] На ФИГ.6 изображена передача сигнала через IL-21R/MU-1. IL-21R/MU-1 фосфорилирует Stat 5 в клетках клона Е7, экспрессирующих рекомбинантный IL-21R/MU-1, стимулированных эритропоэтином (ЕРО). Обработка контрольных или химерных клеток BAF-3 интерлейкином IL-3 приводила к фосфорилированию Stat 3, но не Stat 1 или 5.
[0026] На ФИГ.7А-7В изображено выравнивание последовательностей нуклеотидов и аминокислот зрелого IL-21R человека, присоединенного по N-концу к лидерной последовательности медоносной пчелы и меткам His6 и Flag. Последовательности нуклеотидов и аминокислот этого рекомбинантного белка, изображенного на ФИГ.7А-7В, приведены в SEQ ID NO: 10 и SEQ ID NO: 11 соответственно. Последовательности аминокислот фрагмента зрелого IL-21R человека и фрагмента, содержащего лидер медоносной пчелы/метку His рекомбинантного белка, соответствуют аминокислотам 20-235 последовательности SEQ ID NO: 2 и аминокислотам 1-44 последовательности SEQ ID NO: 11 соответственно.
[0027] На ФИГ.8А-8С изображено: выравнивание последовательностей нуклеотидов и аминокислот внеклеточного домена IL-21R человека, присоединенного по С-концу через линкер к Fc-последовательности иммуноглобулина G1 человека (IgG1). Последовательности нуклеотидов и аминокислот этого рекомбинантного белка, изображенного на ФИГ.8А-8С, приведены в SEQ ID NO: 12 и SEQ ID NO: 13 соответственно. Последовательности аминокислот внеклеточного домена IL-21R человека, линкера и Fc-последовательности иммуноглобулина G1 человека (IgG1) соответствуют аминокислотам 1-235 последовательности SEQ ID NO: 2, аминокислотам 236-243 последовательности SEQ ID NO: 13 и аминокислотам 244-467 последовательности SEQ ID NO: 13 соответственно.
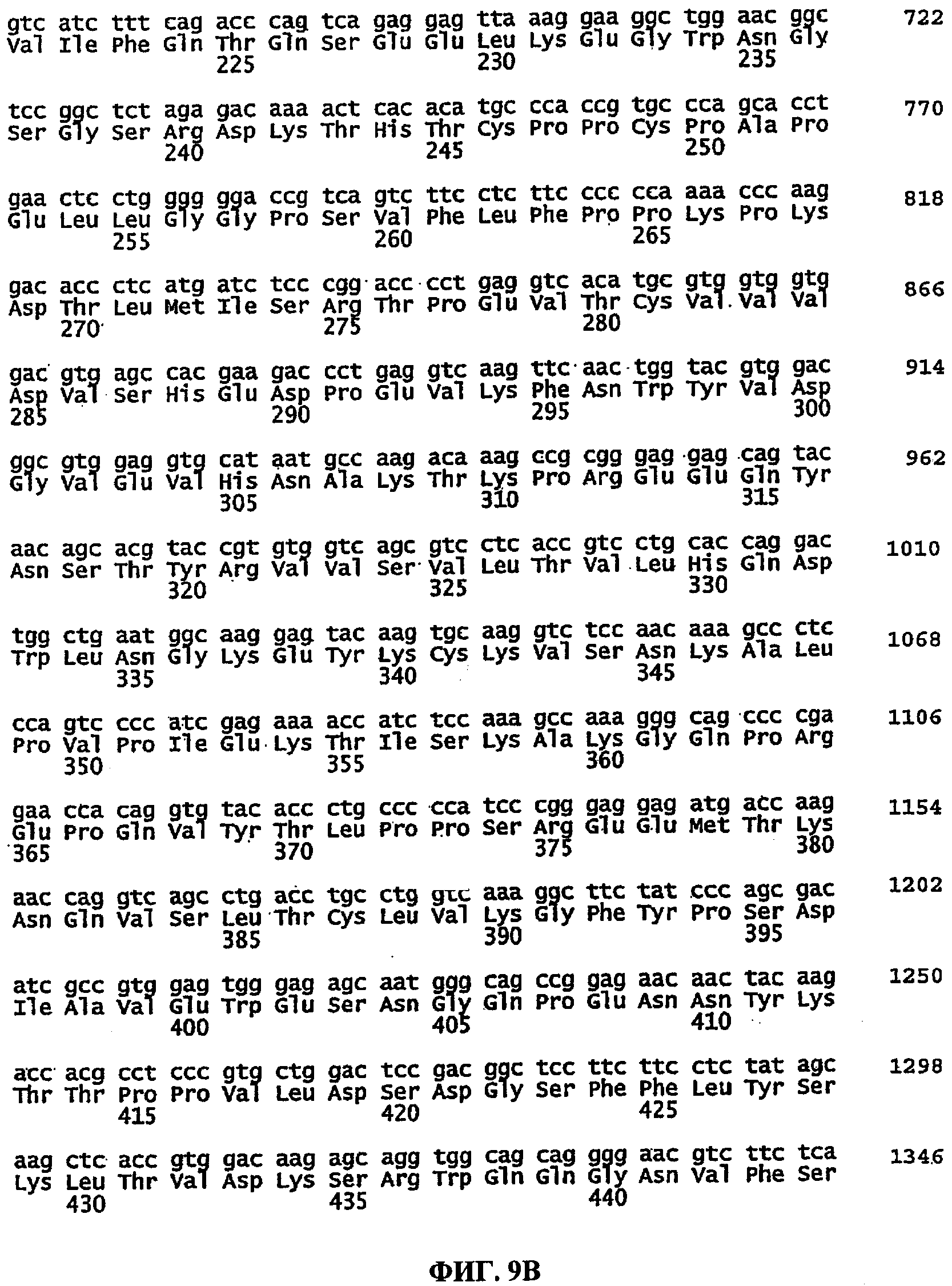
[0028] На ФИГ.9А-9С изображено выравнивание последовательностей нуклеотидов и аминокислот внеклеточного домена IL-21R человека, присоединенного по С-концу через линкер к Fc-последовательности иммуноглобулина G1 человека (IgG1) и последовательности метки His6. Последовательности нуклеотидов и аминокислот этого рекомбинантного белка, изображенного на ФИГ.9А-9С, приведены в SEQ ID NO: 14 и SEQ ID NO: 15 соответственно. Последовательности аминокислот внеклеточного домена IL-21R человека, линкера, Fc-последовательности иммуноглобулина G1 человека (IgG1) и последовательности метки His6 соответствуют аминокислотам 1-235 последовательности SEQ ID NO: 2, аминокислотам 236-243 последовательности SEQ ID NO: 15, аминокислотам 244-467 последовательности SEQ ID NO: 15 и аминокислотам 468-492 последовательности SEQ ID NO: 15 соответственно.
[0029] На ФИГ.10А-10С изображено выравнивание последовательностей нуклеотидов и аминокислот внеклеточного домена IL-21R человека, присоединенного по С-концу через линкер к мутированной Fc-последовательности иммуноглобулина G1 человека (IgG1). Fc-последовательность человека подвергали мутагенезу в остатках 254 и 257 по сравнению с диким типом, чтобы уменьшить связывание с Fc-рецептором. Последовательности нуклеотидов и аминокислот указанного рекомбинантного белка, изображенного на ФИГ.10А-10С, приведены в SEQ ID NO: 16 и SEQ ID NO: 17 соответственно. Последовательности аминокислот внеклеточного домена IL-21R человека, линкера и мутированной Fc-последовательности иммуноглобулина G1 человека (IgG1) соответствуют аминокислотам 1-235 последовательности SEQ ID NO: 2, аминокислотам 236-243 последовательности SEQ ID NO: 17 и аминокислотам 244-467 последовательности SEQ ID NO: 17 соответственно.
[0030] На ФИГ.11А-11В изображено выравнивание последовательностей нуклеотидов и аминокислот внеклеточного домена IL-21R человека, присоединенного по С-концу к последовательности родопсиновой метки. Последовательности нуклеотида и аминокислот рекомбинантного белка приведены в SEQ ID NO: 18 и SEQ ID NO: 19 соответственно. Последовательность аминокислот внеклеточного домена IL-21R человека соответствует аминокислотам 1-235 последовательности SEQ ID NO: 2.
[0031] На ФИГ.12А-12С изображено выравнивание последовательностей нуклеотидов и аминокислот внеклеточного домена IL-21R человека, соединенного с сайтом расщепления ЕК и мутированной Fc-области IgG1. Последовательности нуклеотидов и аминокислот этого рекомбинантного белка, изображенного на ФИГ.12А-12С, приведены в SEQ ID NO: 20 и SEQ ID NO: 21 соответственно. Последовательности аминокислот внеклеточного домена IL-21R человека, сайта расщепления ЕК/мутированной Fc-области IgG1, соответствуют аминокислотам 1-235 последовательности SEQ ID NO: 2 и аминокислотам 236-470 последовательности SEQ ID NO: 21 соответственно.
[0032] На ФИГ.13А-13В изображено выравнивание последовательностей нуклеотидов и аминокислот внеклеточного домена IL-21R мыши, присоединенного по С-концу к иммуноглобулину G2a мыши (IgG2a). Последовательности нуклеотидов и аминокислот приведены в SEQ ID NO: 22 и SEQ ID NO: 23 соответственно.
[0033] На ФИГ.14А-14В изображено выравнивание последовательностей нуклеотидов и аминокислот внеклеточного домена IL-21R мыши, присоединенного по С-концу к последовательностям меток Flag и His6. Последовательности нуклеотидов показаны в SEQ ID NO: 24 и SEQ ID NO: 25 соответственно.
[0034] На ФИГ.15А-15В изображено выравнивание последовательностей нуклеотидов и аминокислот (лидерная последовательность медоносной пчелы) внеклеточного домена IL-21R мыши, присоединенного по N-концу к меткам последовательностей Flag и His6. Последовательности нуклеотидов и аминокислот приведены в SEQ ID NO: 26 и SEQ ID NO: 27 соответственно.
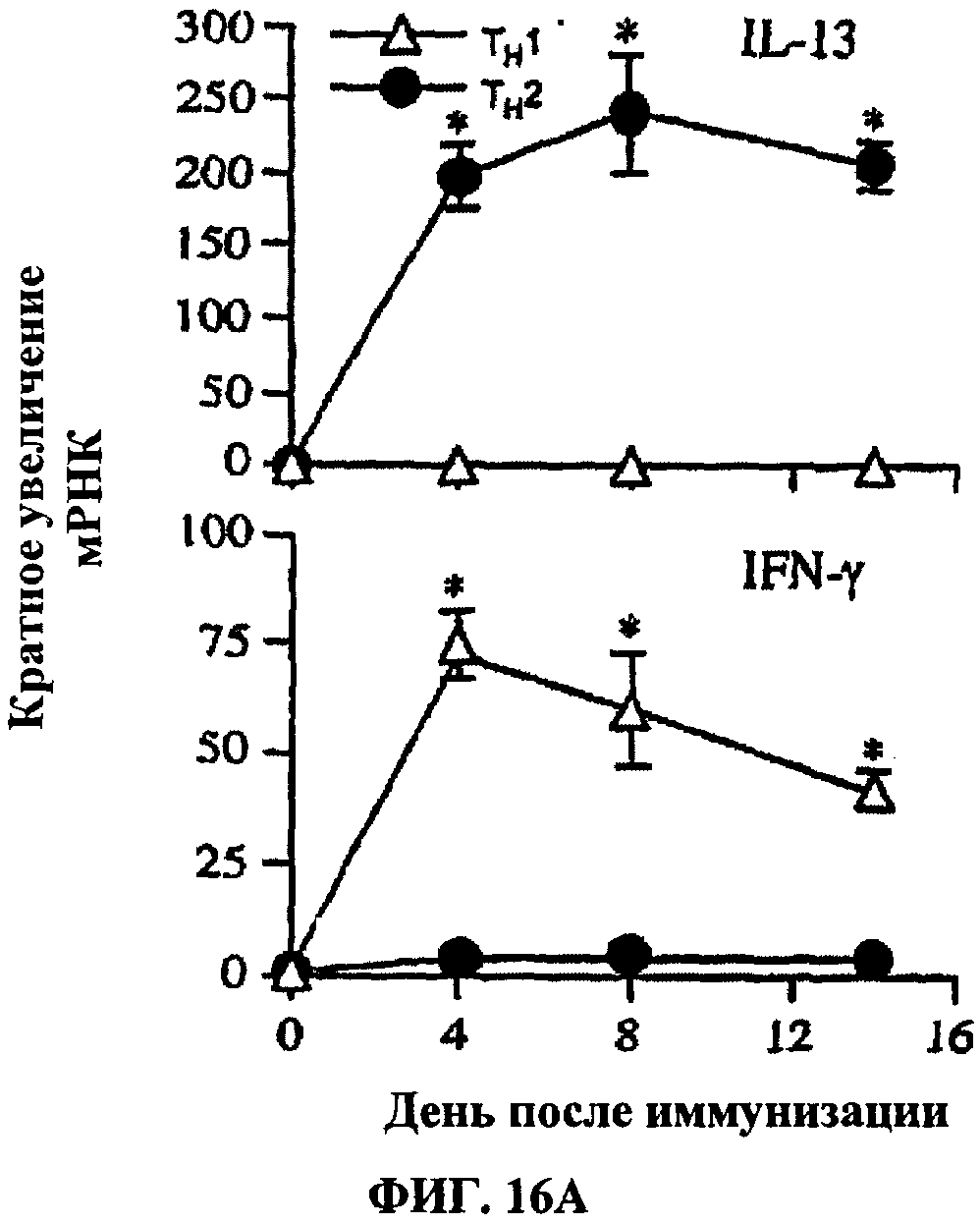
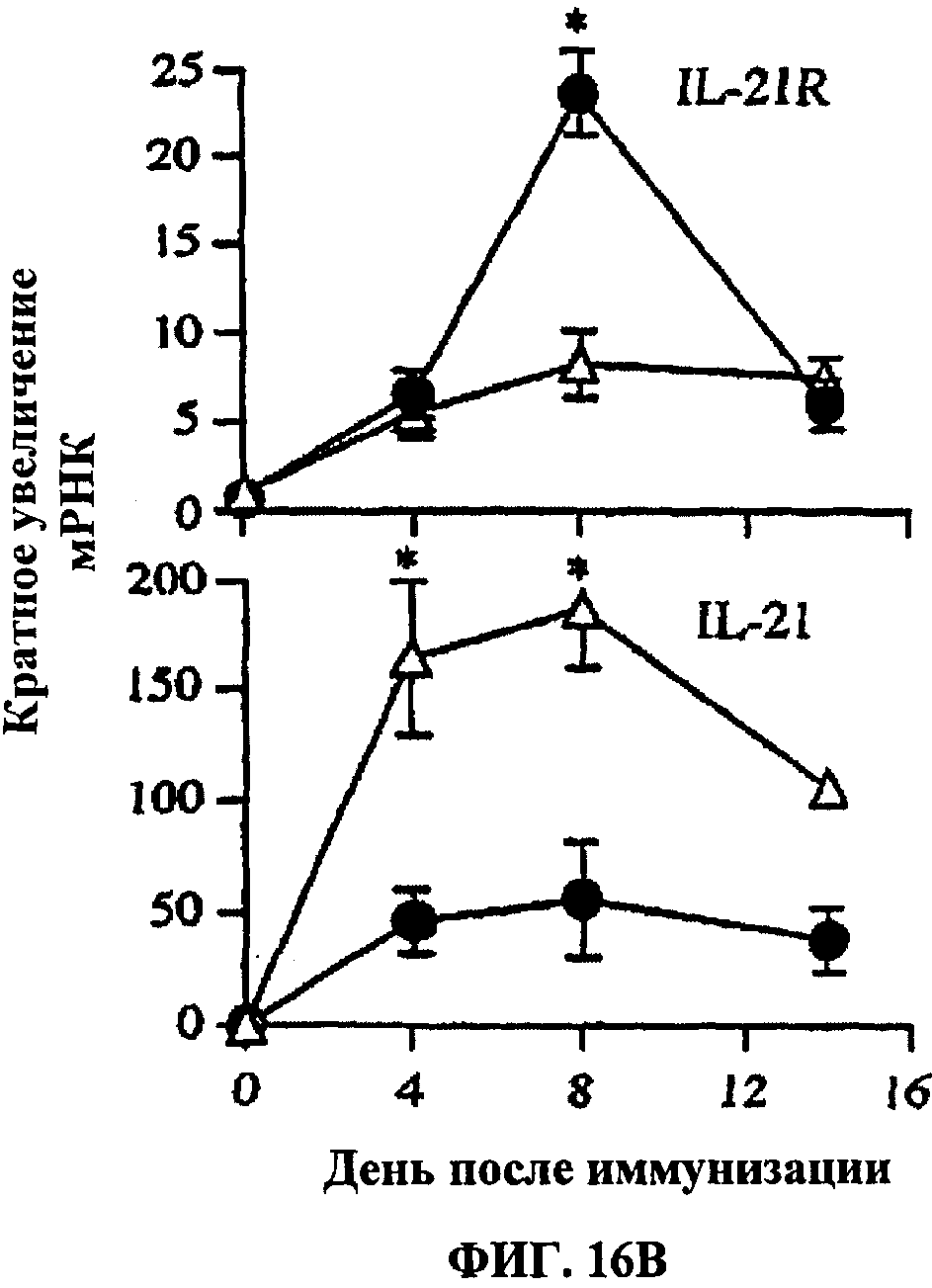
[0035] На ФИГ.16 показаны профили экспрессии IL-21 и IL-21R при высокополяризованных имунных ответах типа 1 и типа 2. Группу из пяти мышей IL-10/IL-4 КО (knock-out; TH1, Δ) и IL-10/IL-12 КО (ТН2, •) интраперитонеально сенсибилизировали яйцами S.mansoni и через 14 дней иммунизировали внутривенным путем. Отдельно готовили образцы РНК из легких для анализа способом ПЦР в реальном времени (RT-PCR) на IL-13 и IFN-γ (ФИГ.16А), и IL-21R, и IL-21 (ФИГ.16В). Средние значения ± SEM (стандартная погрешность среднего) экспрессии генов выражали как кратный прирост по сравнению с неиммунизированными контролями дикого типа после нормирования по уровню экспрессии гена HPRT (гипоксантинфосфорибозилтрансфераза - housekeeping ген). Звездочки обозначают значительные различия между группами в заданный момент времени, * р<0.05.
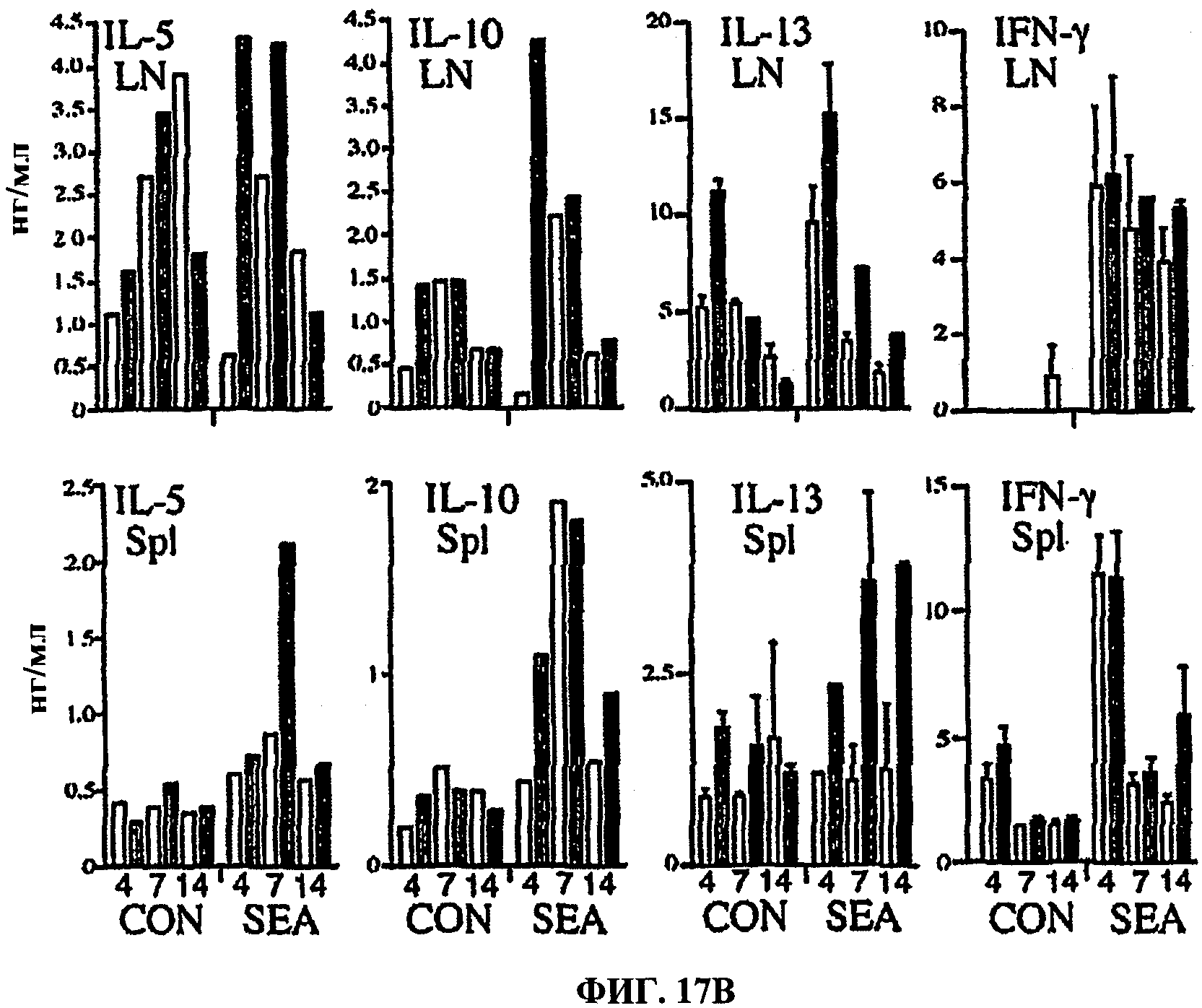
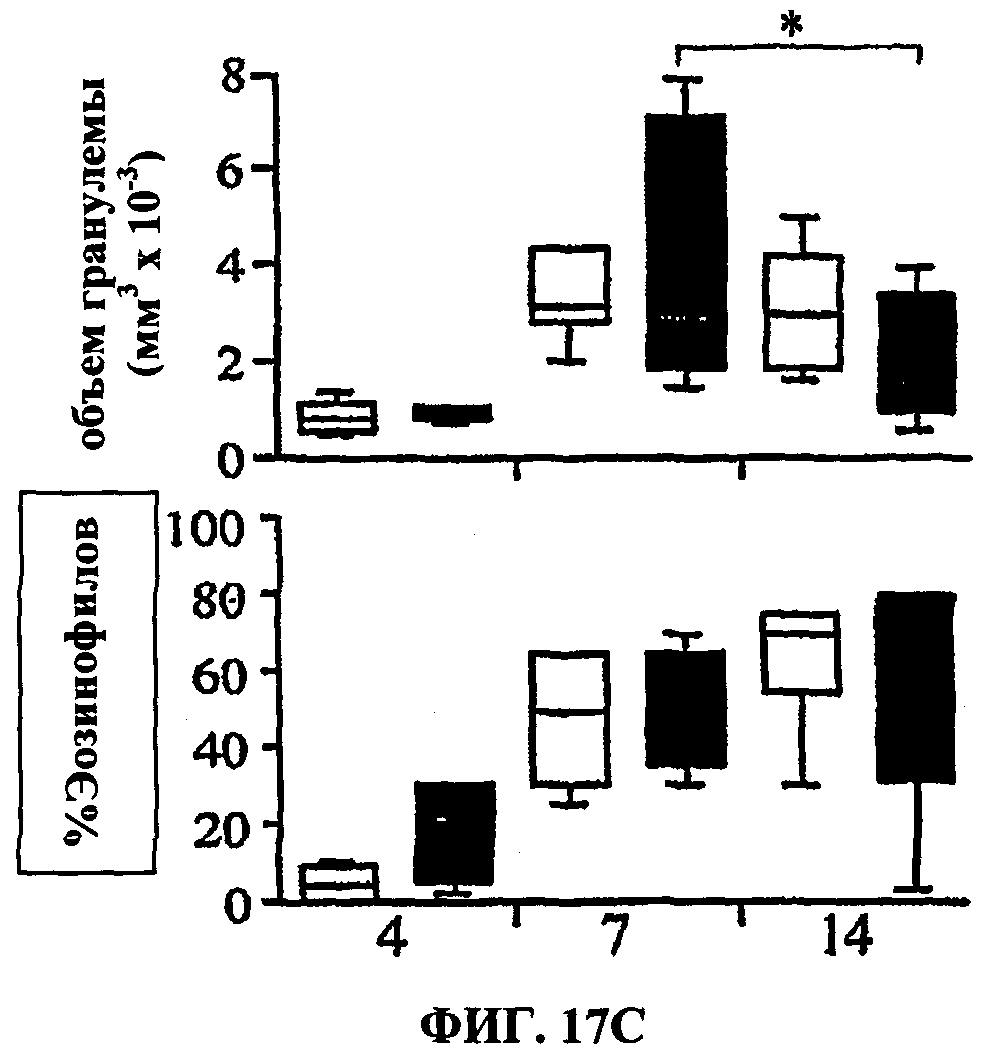
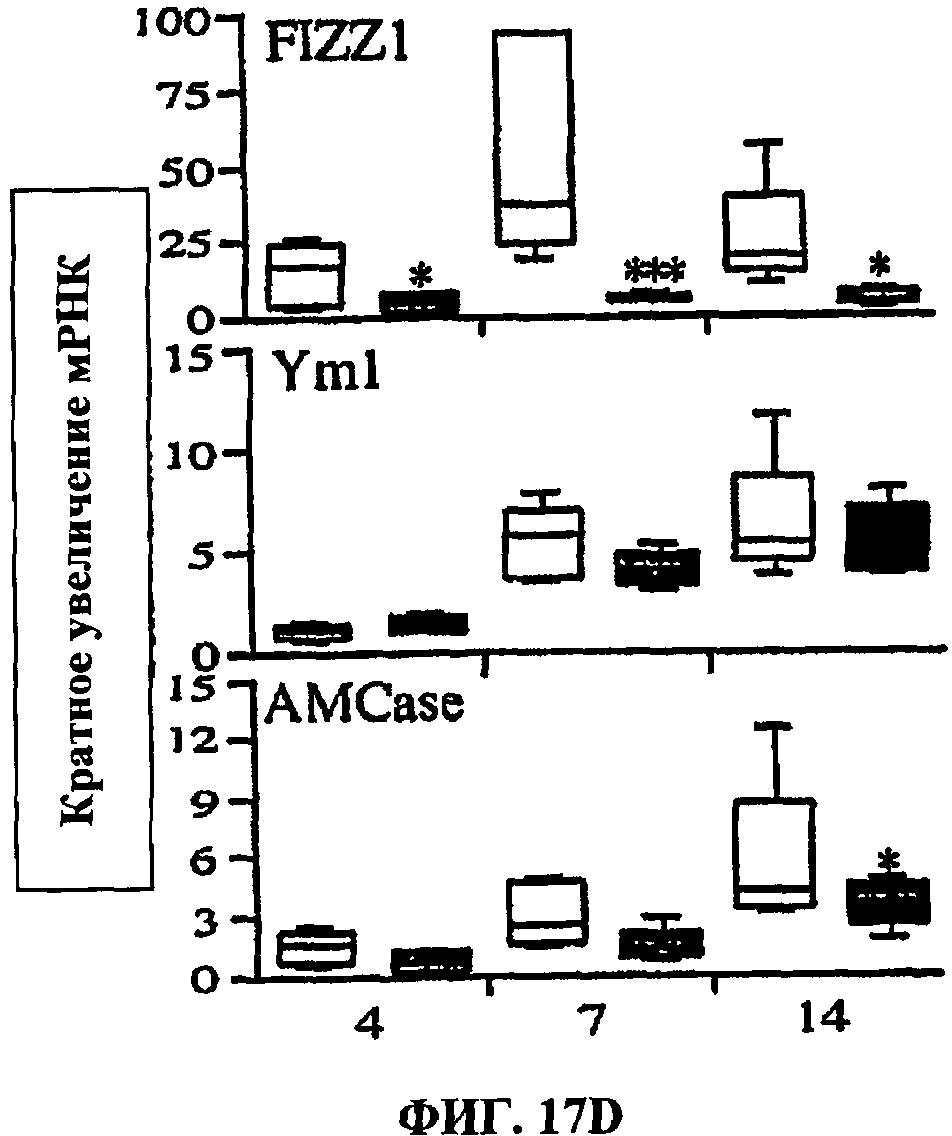
[0036] На ФИГ.17 показано, что продукция цитокинов типа 2 в легких мышей IL-21R-/-, которым ввели яйца шистосом, снижена. Группам интактных мышей дикого типа (пустые столбики) и мышей IL-21R-/- (цветные столбики) внутривенно вводили живые яйца S.mansoni и умерщвляли на 4, 7 и 14 день после инъекции. (А) Из тканей легких выделяли РНК и анализировали отдельно путем ПЦР в режиме реального времени (N=5 на группу/момент времени). Результаты показаны в виде графика «столбики с усами» со столбиками, соответствующими сумме по пяти животным, на которых показаны медианы, квартили, а также самый маленький и самый большой процентили распределения; столбики (снизу вверх) указывают 10-й, 25-й, 50-й, 75-й и 90-й процентили исследованных образцов соответственно. Звездочками обозначены значительные отличия от значений для дикого типа в заданный момент времени, * р<0.05, ** р<0.01, *** р<0.001. (В) Отбирали селезенки (Sp1) и лимфатические узлы, связанные с легкими (LN) (2 отдельные группы, 3-4 мыши на группу), и после 72-часовой инкубации в присутствии Con A (CON, 1 мкг/мл) или растворимого антигена яиц (SEA, 20 мкг/мл) анализировали суспензии отдельных клеток на IL-5, IL-10, IL-13 и IFN-γ. В нестимулированных культурах уровень цитокинов был ниже предела обнаружения. (С) Проводили количественное определение размера гранулемы под микроскопом (объем, мм3 Х 10-3) и процентного содержания эозинофилов. (D) Проводили анализ генов воспаления, регулируемых ТН2, в гранулематозной ткани легкого путем ПЦР в реальном времени. Все приведенные данные характерны по меньшей мере для двух отдельных экспериментов.
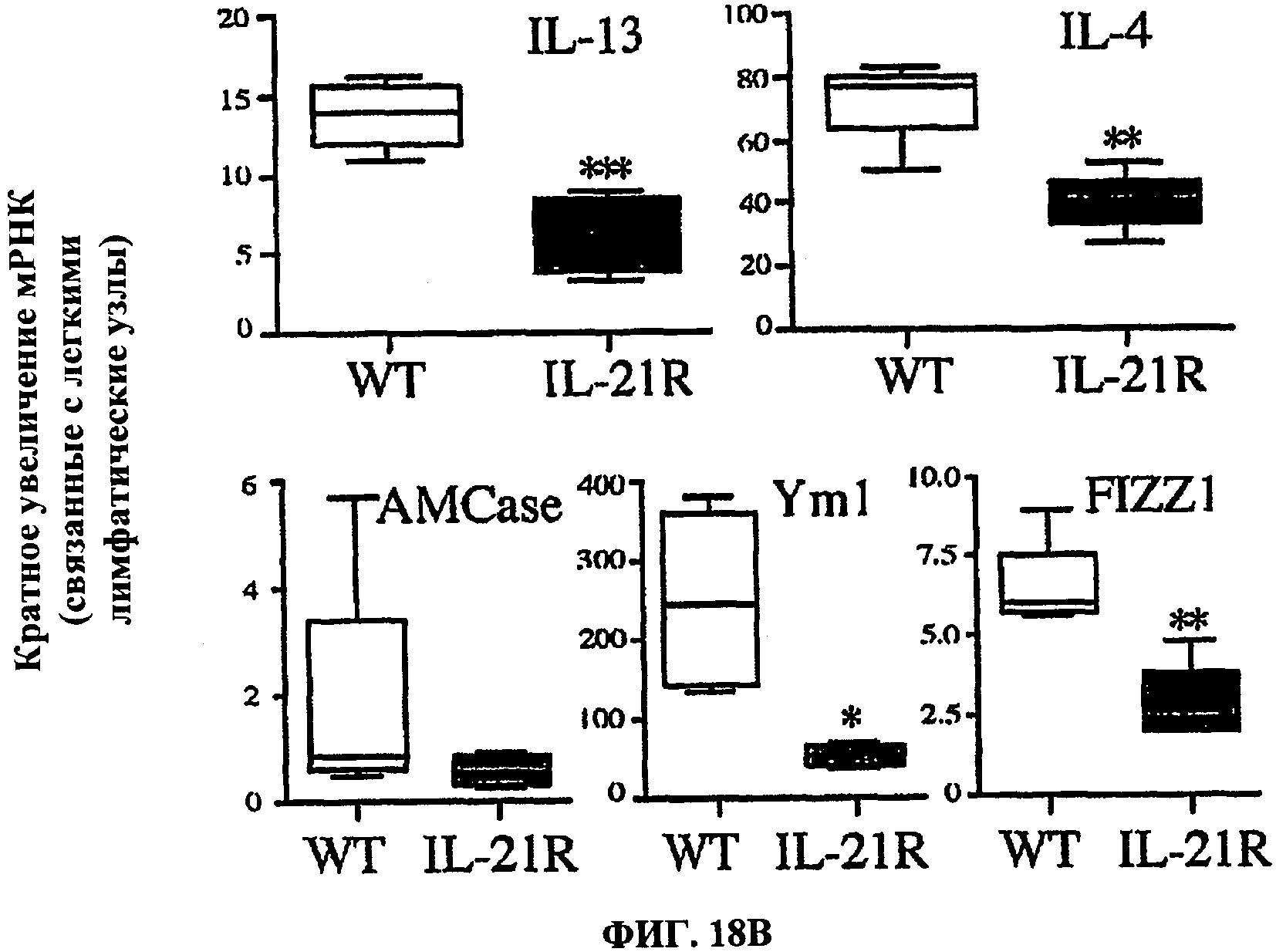
[0037] На ФИГ.18 показано, что ответ 2 типа у мышей IL-21R-/-, инфицированных N. brasiliensis, нарушен. В день 7 у отдельных инфицированных N. brasiliensis и интактных мышей C57BL/6 или IL-21R-/- брали легкие (А), связанные с легкими лимфатические узлы (LALN) (В) (5/группу лечения). Выделяли РНК и получали кДНК, как описано в подписи к ФИГ.17. мРНК анализировали отдельно на IL-13, IL-4, AMCase, Yml и FIZZl путем количественной ПЦР в режиме реального времени. Кратное изменение отражает отличия инфицированных мышей и интактных животных.
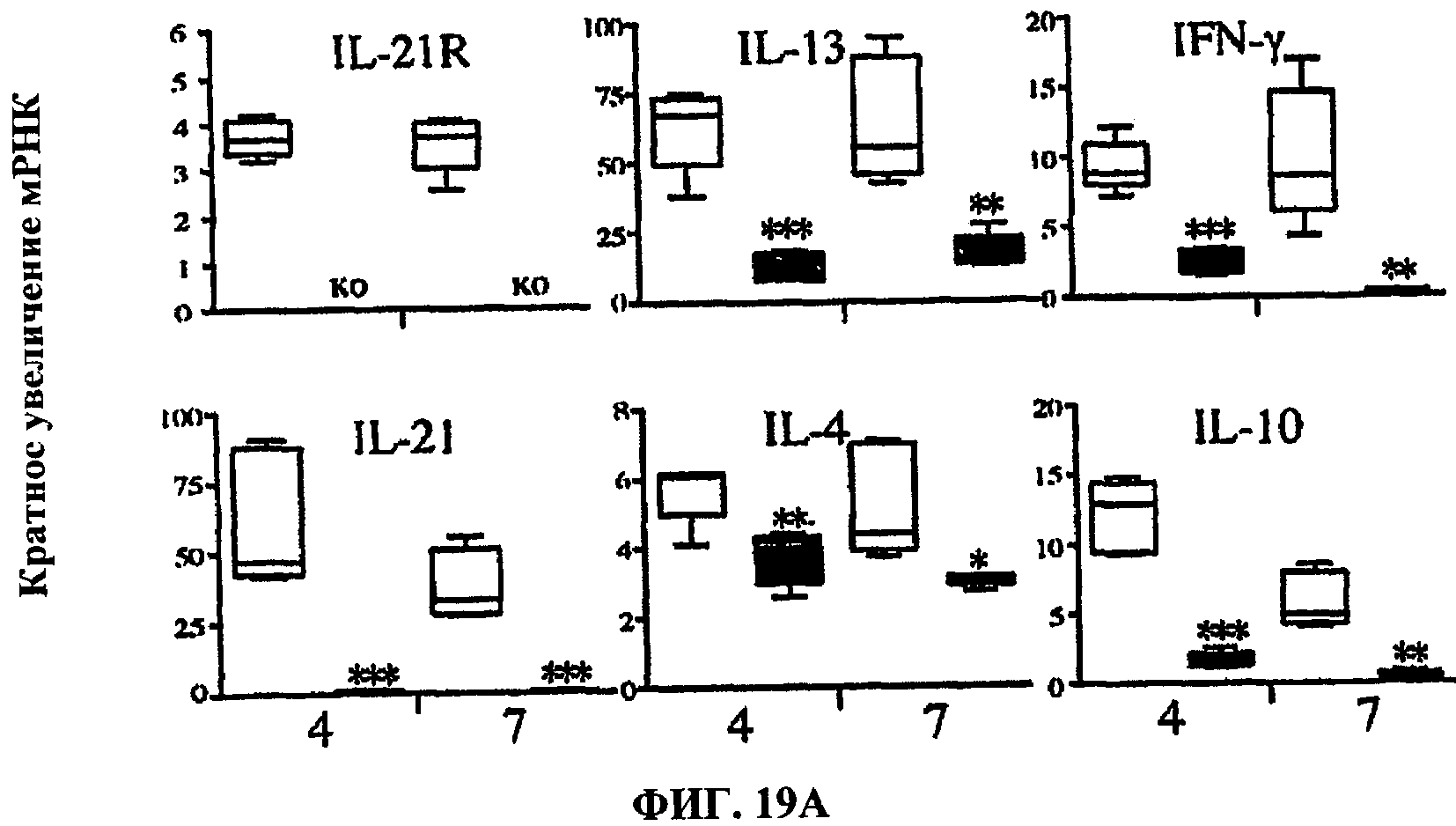
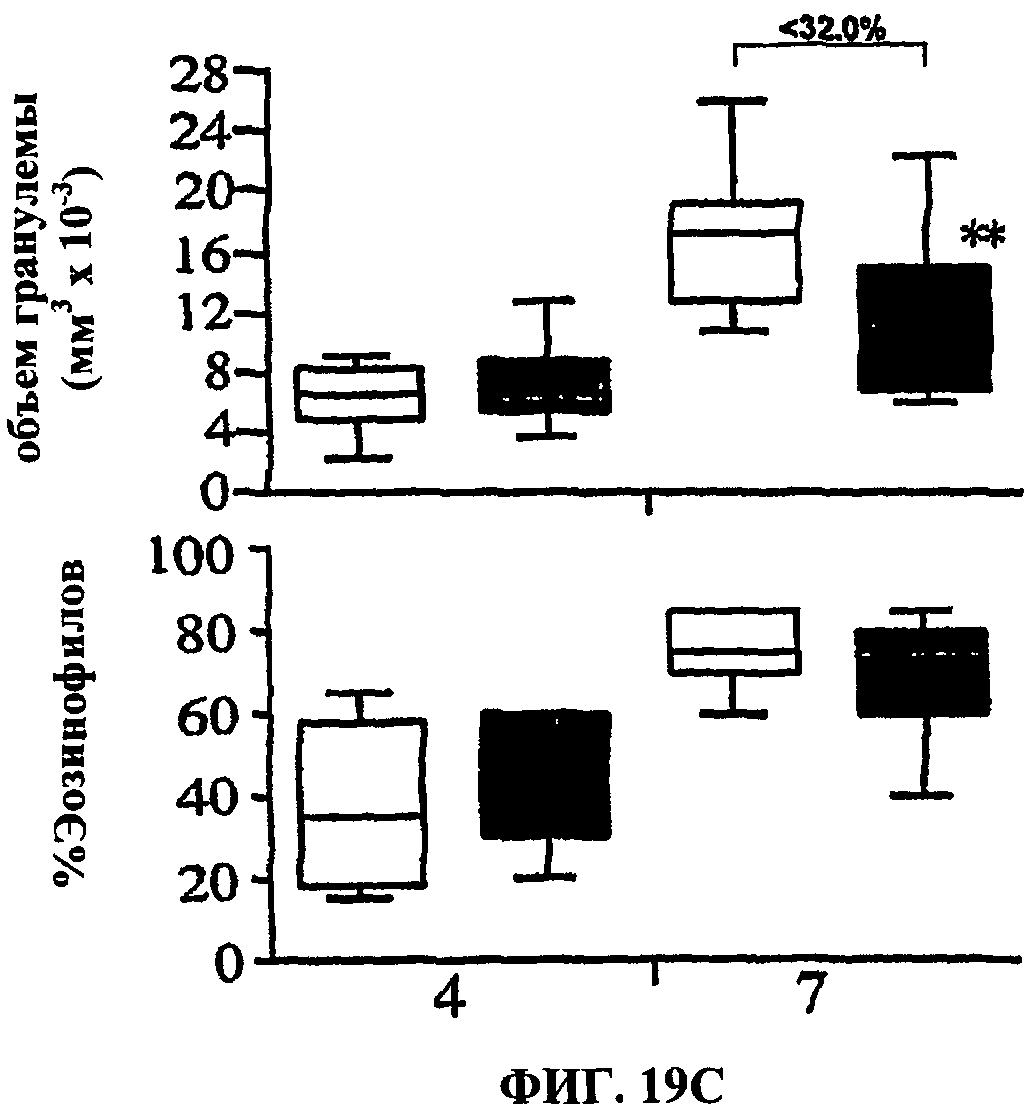
[0038] На ФИГ.19 показано, что у мышей IL-21R-/- снижена выраженность воспаления, опосредуемого цитокинами 2 типа. Мышей дикого типа (пустые столбики) и IL-21R-/- (цветные столбики) интраперитонеально сенсибилизировали яйцами S.mansoni, через две недели иммунизировали путем внутривенной инъекции живых яиц S.mansoni и умерщвляли в дни 4 и 7 после иммунизации. (А) Получали РНК из ткани легких и анализировали отдельно (N=5 на группу/момент времени) способом ПЦР в режиме реального времени, как описано выше в описании ФИГ.17. (В) Селезенки (Spl) и лимфатические узлы, связанные с легкими (LN), анализировали на IL-5, IL-10, IL-13 и IFN-γ после стимуляции антигеном (SEA) или митогеном (CON). (С) Под микроскопом количественно оценивали размер гранулемы (мм3×10-3) и процент эозинофилов у мышей дикого типа (мышей на группу: N=10, день 4; N=15, день 7) и мышей IL-21R-/- (N=11, день 4; N=16, день 7). (D) Анализ генов воспаления, регулируемых ТН2, в гранулематозной ткани легкого определяли способом ПЦР в режиме реального времени (N=5 на группу/момент времени). Звездочками отмечены значительные отличия от значений у дикого типа в заданный момент времени, * р<0.05, ** р<0.01, *** р<0.001. Приведенные данные представляют собой комбинированные результаты по 3 отдельным экспериментам.
[0039] На ФИГ.20 показано, что в отсутствие IL-21R снижается выраженность хронической болезни печени после подкожного инфицирования S.mansoni. Мышей дикого типа (пустые столбики) и IL-21R-/- (цветные столбики) инфицировали 25-30 церкариями S.mansoni. Всех животных умерщвляли на 9-й неделе (острая стадия) или 12 недели (хроническая стадия) после инфицирования. (А) Из тканей легких выделяли РНК и анализировали отдельно способом ПЦР в режиме реального времени (N=8-10 на группу/момент времени), как описано в подписи к ФИГ.17. (В) Отбирали селезенки (Spl) и лимфатические узлы брыжейки (LN) объединяли в группы по 2-4 мышам и анализировали суспензии отдельных клеток на IL-5, IL-10 и IFN-γ. Приведенные данные представляют собой среднее по трем отдельным объединенным группам. (С) Под микроскопом оценивали размер гранулемы (мм3×10-3) и процент эозинофилов в гранулемах у мышей дикого типа (мышей на группу: N=30 для недели 9, N=17 для недели 12) и мышей IL-21R-/- (мышей на группу: N=27 для недели 9, N=19 для недели 12). (D) Проводили анализ генов воспаления ТН2 в гранулематозной ткани печени способом ПЦР в режиме реального времени (N=8-10 на группу/момент времени). Приведенные данные представляют собой комбинированные результаты по 3 отдельным экспериментам, проведенным в неделю 9, и двум, проведенным в неделю 12. Звездочками обозначены значительные отличия от значений дикого типа в заданный момент времени, * р<0.05, ** р<0.01, *** р<0.001.
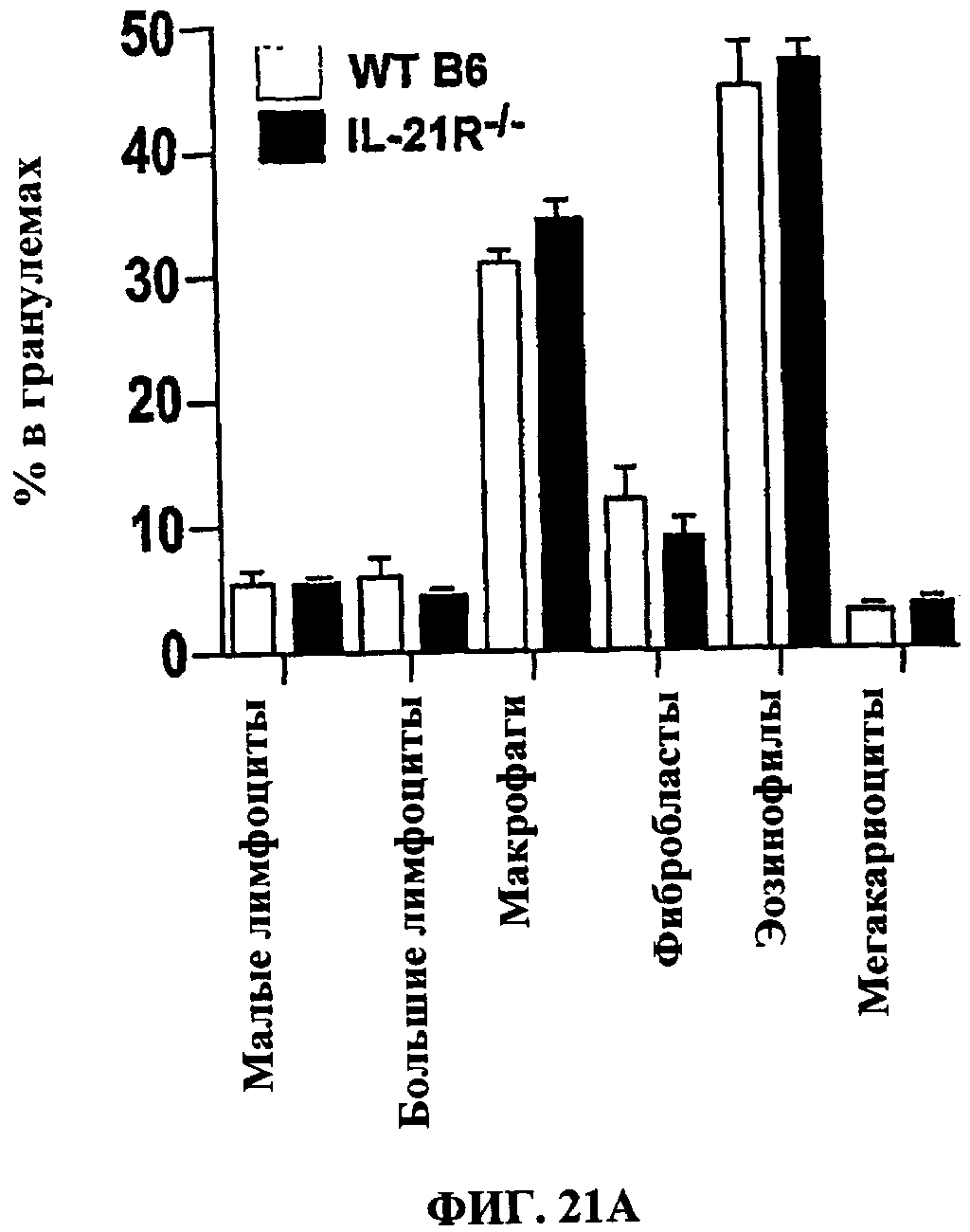
[0040] ФИГ.21 демонстрирует, что отсутствие IL-21R не меняет клеточного состава гранулемы. (А) Клеточный состав гранулемы оценивали на неделю 9 в печенях мышей дикого типа (N=10) и мышей IL-21R-/- (N=9). Показаны средние ± SEM малых лимфоцитов (Sm Lym), больших лимфоцитов (Lg Lym), макрофагов (Mac), фибробластов (Fibro), эозинофилов (Eos) и мастоцитов (Мс). (В) Лимфоциты выделяли из перфузируемых легких наивных мышей дикого типа и мышей IL-21R-/- (верхние рисунки) в день 7 после внутривенного введения 5000 яиц S.mansoni (нижние рисунки). Числа на гистограммах показывают процентные доли CD4- и CD44+ Т-клеток в общем числе лимфоцитов легких.
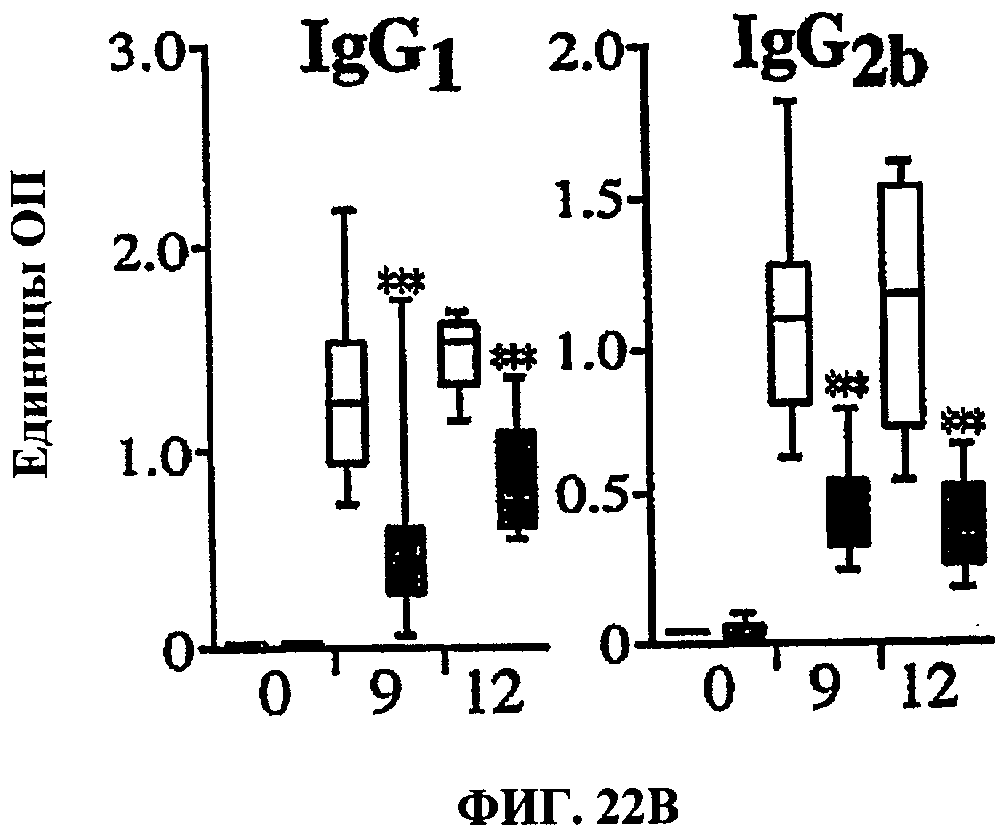
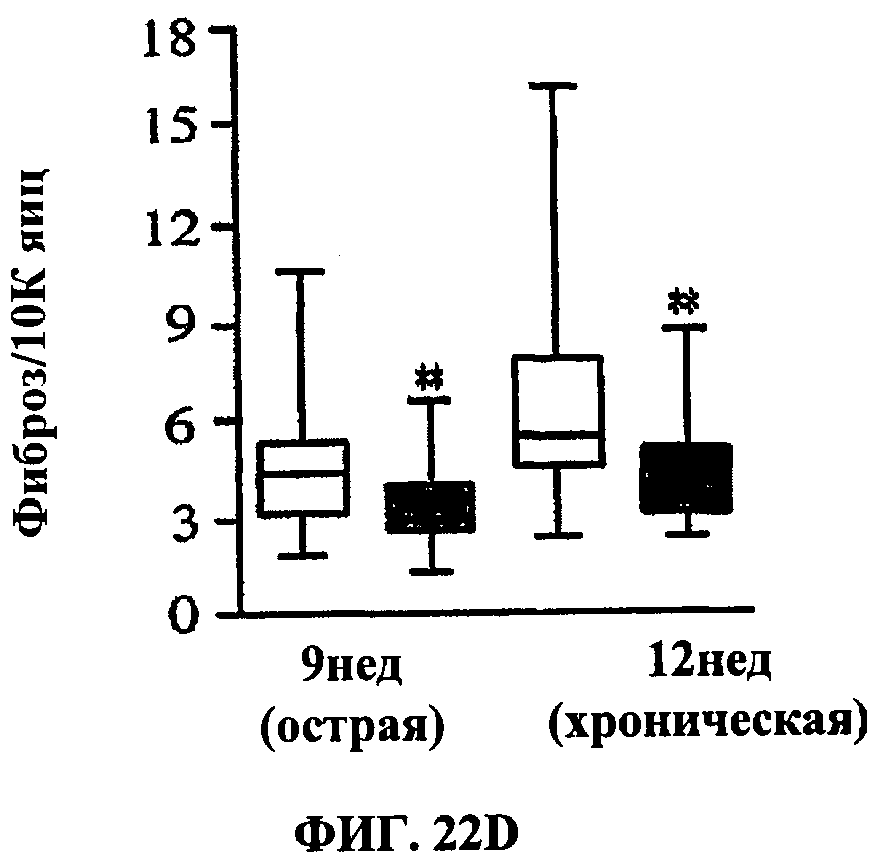
[0041] ФИГ.22 демонстрирует, что отсутствие IL-21R значительно замедляет прогрессирование фиброза, зависимого от цитокинов ТН2. Мышей дикого типа (пустые столбики) и мышей IL-21R-/- (цветные столбики) инфицировали церкариями S.mansoni. Животных умерщвляли на 9-ю неделю (острая стадия), 12-ю неделю (хроническая стадия) (панели A-D) или 29-ю неделю (поздняя хроническая стадия) (панель Е) после инфекции. (А) Для каждой группы показаны средние количества пар червей, общее число червей и яиц/пару червей в тысячах ± SE (средняя погрешность). Ни в одном эксперименте не обнаружили различий в интенсивности инфекции (n = число мышей). (В) При умерщвлении у мышей отбирали кровь и способом твердофазного иммуноферментного анализа (ELISA) определяли титры изотип-специфичных антител к SEA. (С) Значения общего IgE в сыворотки в мкг/мл. (D-F) Фиброз оценивали по количеству гидроксипролина в микромолях, определенному в печени, в расчете на 10000 яиц (панель D) или в целой печени (панели Е и F). На панели F инфицированных мышей дикого типа C57BL/6 лечили либо контрольным антителом IgG2a (cIg - пустой столбик), либо sIL-21R-Fc (цветной столбик) в течение 6 недель. Звездочками обозначены значительные отличия от значений для дикого типа в заданные моменты времени, * р<0.05, ** р<0.01, *** р<0.001.
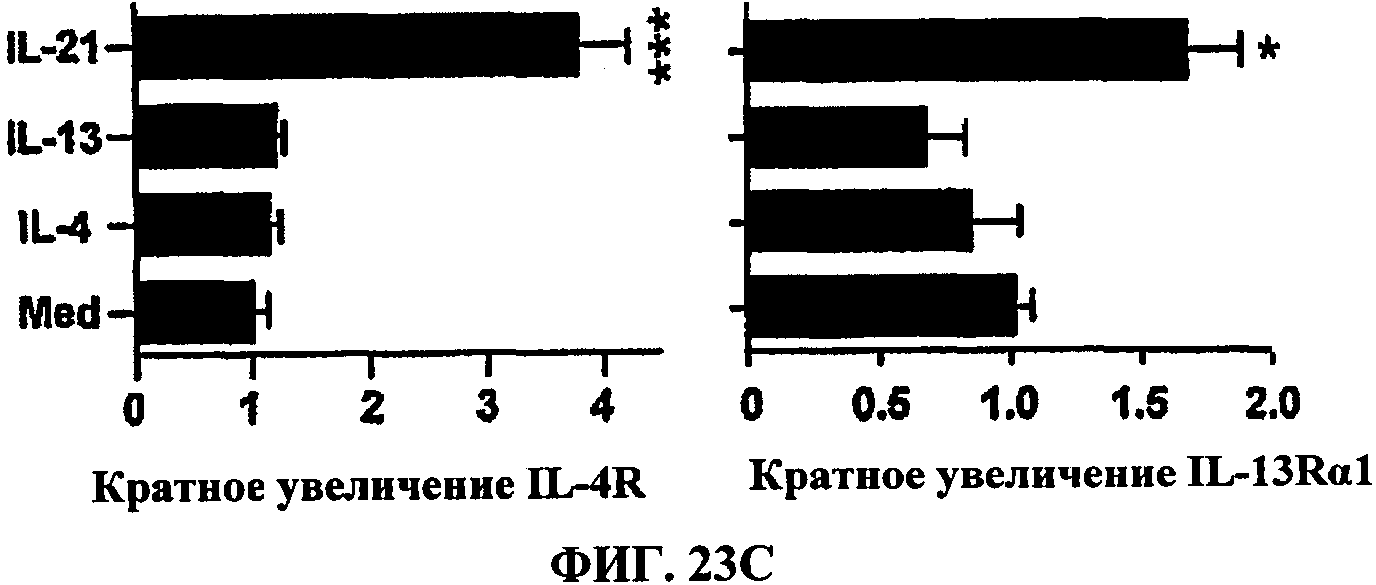
[0042] ФИГ.23 демонстрирует, что передача сигналов IL-21 стимулирует активацию макрофагов по альтернативному пути посредством изменения экспрессии рецептора IL-13. Макрофаги костного мозга в течение ночи обрабатывали различными комбинациями IL-4 (20 нг/мл), IL-13 (20 нг/мл) и IL-21 (20 нг/мл). Макрофаги, которые обрабатывали IL-4, IL-13 и IL-21, предварительно, перед введением IL-4 и IL-13, в течение 6 часов обрабатывали IL-21. Через 20 часов клетки лизировали и отдельно анализировали способом ПЦР в режиме реального времени (RT-PCR). (А) Способность IL-21 стимулировать макрофаги по альтернативному пути оценивали с помощью измерения экспрессии генов Arg-1 и FIZZ1. (В) Количественно оценивали активность аргиназы в лизатах клеток путем измерения превращения L-аргинина в мочевину (мг/дл + SEM, измерения в трипликатах). (С) Экспрессию мРНК IL-4Rct и IL-13Rccl оценивали способом ПЦР в режиме реального времени. При всех условиях мРНК IL-13Rα2 практически не удавалось обнаружить (результаты не показаны). Данные, показанные на панелях А, В и С, являются типичными примерами по 3 отдельным экспериментам. (D) Интактным мышам C57BL/6 каждый день в дни с 1-го по 6-й внутривенно вводили 5000 живых яиц S.mansoni и обрабатывали ФБР (фосфатный буферный раствор) или IL-21 (мкг/дозу). Животных (5 на группу) умерщвляли в день 7 и исследовали уровни мРНК IL-13Rα2 способом ПЦР в режиме реального времени. Результаты выражали в кратном приросте по отношению к необработанным контролям (пустой столбик). У мышей также отбирали кровь в момент умерщвления и способом твердофазного иммуноферментного анализа определяли количество sIL-13Rα2 в отдельных образцах сыворотки. Звездочками обозначены значительные отличия, * р<0.05, ** р<0.01, *** р<0.001.
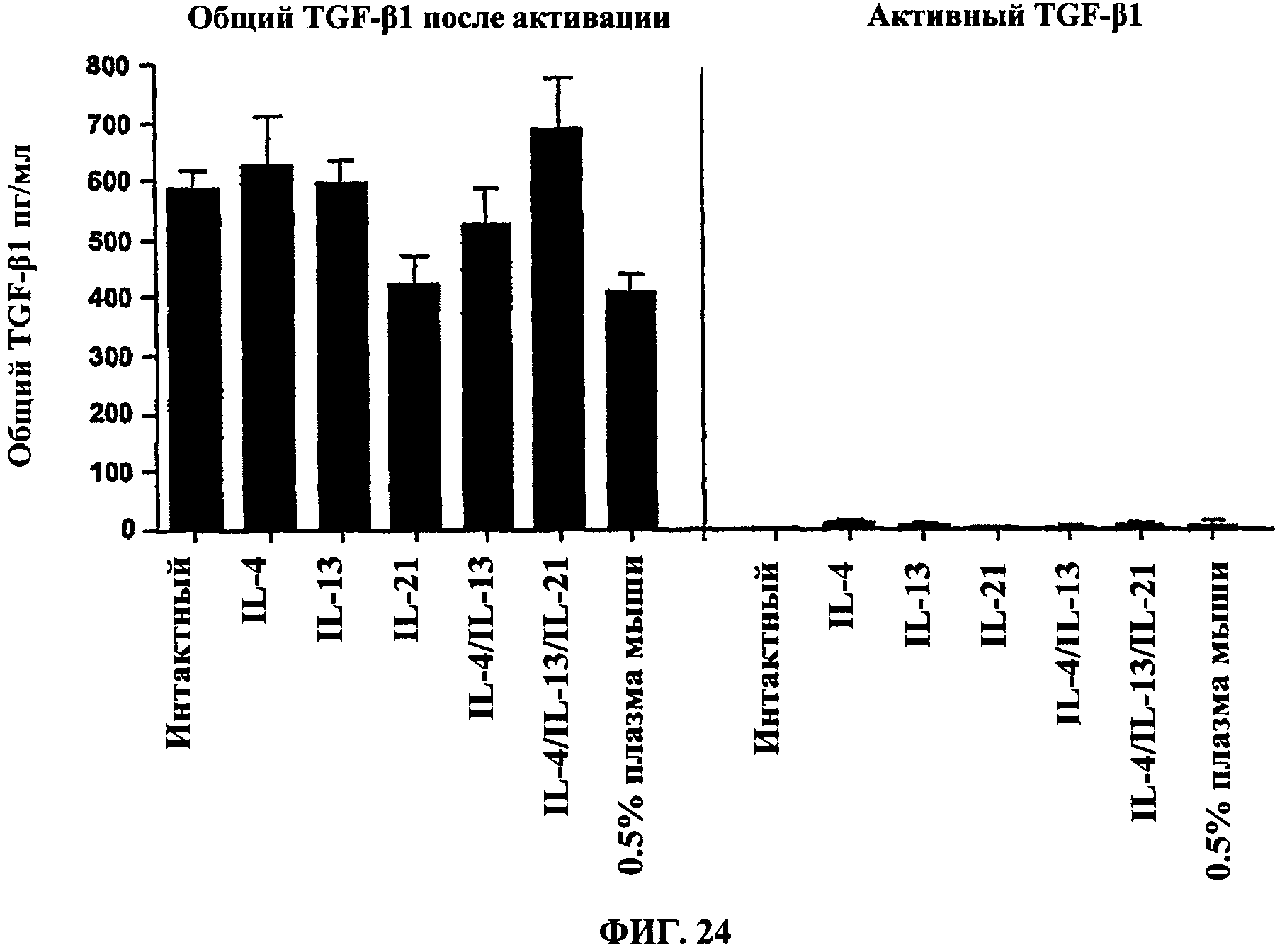
[0043] ФИГ.24 показывает, что макрофаги, активированные по альтернативному пути, не продуцируют значительных количеств активного ФНО-β1. На правой панели показано содержание активного ФНО-β1 после активации макрофагов, а на левой панели - общие уровни ФНО-β1 после активации макрофагов. Макрофаги костного мозга в течение ночи обрабатывали различными комбинациями IL-4 (20 нг/мл), IL-13 (20 нг/мл) и IL-21 (20 нг/мл). Макрофаги, которые обрабатывали IL-4, IL-13 и IL-21, предварительно, перед обработкой IL-4 и IL-13, в течение 6 часов обрабатывали IL-21. Через 20 часов после активации надосадочную жидкость анализировали способом твердофазного иммуноферментного анализа (ELISA) на общий и активный ФНО-β1. Во всех группах, за исключением клеток, обработанных только IL-21, обнаружили высокие уровни ФНО-β1 (например, сравните левые панели "IL-4" и "IL-21 "с "Необработанными"). Хотя общая экспрессия ФНО-β1 была высокой, количество активного ФНО-β1 во всех группах было минимальным (правая панель). Приведенные данные являются типичными примерами для 3-х отдельных экспериментов, давших аналогичные результаты.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0044] Чтобы исследовать роль пути передачи сигнала с участием IL-21/IL-21R в патогенезе фиброза, сравнивали иммунные ответы у мышей в отсутствие функционального IL-21R (IL-21R-/-) и мышей дикого типа с использованием различных моделей воспаления легких и печени. В одной модели интактным или сенсибилизированным антигеном животным путем внутривенных инъекций вводили живые яйца шистосомы, чтобы изучить первичное и вторичное гранулематозное воспаление легких. В другой модели мышей подкожно инфицировали церкариями S.mansoni и наблюдали развитие вызванного яйцами воспаления в печени. В другой модели мышей инфицировали N.brasiliensis. Посредством этих моделей изучали влияние IL-21R на опосредуемую цитокинами 2 типа патологию при развитии острого и хронического заболевания. Результаты демонстрируют важную роль IL-21R в формировании поляризованных ответов 2 типа in vivo, в частности, опосредуемого цитокинами 2-го типа воспаления и фиброза.
[0045] Соответственно настоящее изобретение обеспечивает способы лечения, уменьшения выраженности или профилактики фиброза или ассоциированного с фиброзом нарушения у субъекта (например, человека, например пациента, являющегося человеком) с использованием вещества (веществ), которое снижает уровень IL-21 и/или IL-21R (например, уровень экспрессии IL-21 и/или IL-21R (например, уровень продуктов генов IL-21 и/или IL-21R (т.е. белка и/или мРНК)), уровень активности IL-21 и/или IL-21R, уровень взаимодействия IL-21 с IL-21R, и т.д.) по отношению к контролю без лечения (например, контрольный субъект, пораженный фиброзом или ассоциированным с фиброзом состоянием, контрольный субъект, не пораженный фиброзом или ассоциированным с фиброзом состоянием), или по отношению к соответствующему базовому уровню. В отношении идентификации вещества (веществ), которые снижают уровень IL-21 и/или IL-21R, измерение "уровня IL-21 и/или IL-21R" включает, без ограничения, (1) измерение уровня экспрессии IL-21 и/или IL-21R (например, измерение уровня продуктов генов IL-21 и/или IL-21R (например, белка и/или соответствующей мРНК)); (2) измерение уровня активности IL-21 и/или IL-21R; и (3) измерение уровня взаимодействия IL-21 с IL-21R (например, в представляющих интерес клетке или образце, например, взятых у субъекта (например, у пациента, являющегося человеком, контрольного субъекта)). Согласно подробному описанию, приведенному ниже в настоящей заявке, примерами веществ, подходящих для лечения, уменьшения выраженности и/или предотвращения фиброза или состояний, ассоциированных с фиброзом или нарушений, являются антитела против IL-21R, антиген-связывающие фрагменты антител против IL-21R, антитела против -IL-21, антиген-связывающие фрагменты антител против IL-21 и растворимые фрагменты полипептидов IL-21R. Настоящее изобретение обеспечивает, кроме того, способы мониторинга курса лечения фиброза или ассоциированного с фиброзом нарушения, диагностики и прогнозирования фиброза или ассоциированного с фиброзом нарушения и идентификации соединений, полезных для лечения фиброза или ассоциированного с фиброзом нарушения.
[0046] В настоящей заявке термин "IL-21" или "IL-21R" обозначает любой полипептид, который является по существу идентичным природному IL-21 или белку рецептора IL-21 соответственно. Последовательности нуклеотидов или аминокислот, кодирующие интерлейкин-21 человека (IL-21) и его рецептор (IL-21R), описаны, например в WO 00/53761, WO 01/85792, Parrish-Novak et al. (2000) Nature 408: 57-63, и Ozaki et al. (2000) Proc. Natl Acad. Sci. U.S.A. 97: 11439-44. Желательно, чтобы полипептид IL-21 связывал IL-21R или полипептид IL-21R связывал IL-21, и после взаимодействия сигнальная активность пути IL-21AL-21R увеличивалась по меньшей мере на 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или более чем на 100% по сравнению с контрольными уровнями (при измерении уровня активности стандартным способом). IL-21R также известен как "MU-1," "NILR" и "zalphal1."
[0047] Вещества, которые снижают уровень IL-21 и/или IL-21R, включают любое вещество, которое снижает сигнальную активность пути IL-21/IL-21R, уровень активности IL-21 и/или IL-21R, уровень экспрессии IL-21 и/или IL-21R и/или уровень взаимодействия IL-21 и IL-21R по меньшей мере на 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100%. Оптимально, снижение уровней IL-21 и/или IL-21R можно оценивать путем измерения уменьшения степени фиброза. Вещества, которые уменьшают уровень взаимодействия IL-21 с IL-21R, включает любое вещество, которое уменьшает взаимодействие IL-21 с IL-21R на по меньшей мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100%. Указанные вышеупомянутые вещества, которые уменьшают уровень активности или экспрессии IL-21 и/или IL-21R и/или уменьшают уровень взаимодействия IL-21 с IL-21R (т.е. вещества, которые снижают уровень IL-21 и/или IL-21R), в настоящей могут заявке называться "антагонистами" IL-21 и/или IL-21R.
[0048] "Ген IL-21" или "ген IL-21R" определяется как нуклеиновая кислота, которая кодирует полипептид IL-21 или EL-21R соответственно.
[0049] "Фиброз" определяется как патологическое состояние, причиной которого является повышенная или аномальная продукция фиброзной ткани. Фиброз может возникать в любом органе, включая, например, почку, легкое, печень, кожу, центральную нервную систему, кость, костный мозг, сердечно-сосудистую систему, а также эндокринные органы или пищеварительную систему. Под "ассоциированным с фиброзом состоянием" понимают любое состояние, связанное с фиброзом. Таким образом, ассоциированное с фиброзом состояние может быть вызвано фиброзом или сопутствовать ему.
[0050] Уменьшение уровня активности IL-21 и/или IL-21R может относиться к снижению уровня или биологической активности IL-21 по отношению к уровню или биологической активности IL-21 и/или IL-21R в интактном контроле или эталонном образце (например, базовому уровню). Такой уровень или активность могут быть снижены на по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100%. Снижение активности EL-21 и/или IL-21R может также быть связано со снижением экспрессии и/или функции цитокинов 2 типа ("Th2"), что может включать изменение, например, уровней и активности IL-4, IL-13, AMCase, Yml и Fizzl/RELMα.
[0051] Снижение уровня взаимодействия IL-21 с IL-21R может относиться к уменьшению взаимодействия в обработанных клетках или образце по отношению к уровню взаимодействия IL-21 с IL-21R в необработанном контрольном или эталонном образце. Такой уровень может быть снижен по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100%. Уровень взаимодействия можно оценивать несколькими хорошо известными в молекулярной биологии способами, например способом твердофазного иммуноферментного анализа или Вестерн-блот анализа.
[0052] Снижение уровня продуктов генов IL-21 и/или IL-21R относится к снижению уровня экспрессии мРНК и/или белка в обработанных клетке или образце по отношению к уровню экспрессии гена или белка IL-21 и/или IL-21R в необработанном контроле или эталонном образце. Экспрессия может быть снижена на по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100%. Уровень экспрессии можно оценивать несколькими хорошо известными в молекулярной биологии способами, например способами Нозерн-блот (Northern blotting) или Вестерн-блот (Western blotting).
[0053] Под "лечением или снижением степени выраженности фиброза" понимают снижение уровня фиброза относительно интактного (не обработанного или не получавшего лечения) контроля, измеренное стандартным способом. Снижение фиброза можно также измерить по уменьшению выраженности любого симптома, связанного с фиброзом или ассоциированным с фиброзом состоянием. Приведенные в данном описании примеры обеспечивают примеры способов определения того, снизился ли уровень фиброза относительно контроля.
[0054] Под "лечением или уменьшением выраженности ассоциированного с фиброзом состояния (или нарушения)" понимают снижение (ослабление) такого состояния перед или после того, как оно возникло. Такое снижение или степень профилактики, измеренное по любой стандартной методике, составляет, по меньшей мере, 5%, 10%, 20%, 40%, 50%, 60%, 80%, 90%, 95% или 100% по сравнению с эквивалентным интактным контролем. Субъект, которого лечат от ассоциированного с фиброзом состояния, представляет собой лицо, у которого медицинский специалист диагностировал такое состояние. Диагноз может быть поставлен любыми подходящими средствами. Профилактику ассоциированного с фиброзом состояния можно проводить у субъекта, которому был или не был поставлен такой диагноз. Специалист в данной области поймет, что, возможно, фиброз или ассоциированное с фиброзом состояние у этих субъектов (например, пациентов) диагностировали путем стандартных тестов либо, возможно, без проведения осмотра, по присутствию одного или более факторов риска определили, что они подвержены высокому риску. Приведенные в настоящей заявке примеры показывают типичные способы определения того, снижен ли уровень ассоциированного с фиброзом нарушения по сравнению с контролем.
[0055] "Профилактика" относится к замедлению возникновения фиброза или ассоциированного с фиброзом состояния у субъекта, у которого это состояние, вероятно, может развиться.
[0056] Под "эффективным количеством" понимают количество соединения, одного или в комбинации, необходимого для лечения, снижения выраженности или профилактики фиброза или ассоциированного с фиброзом состояния у млекопитающего. Эффективное количество активного соединения (соединений) меняется в зависимости от пути введения, возраста, массы тела и общего состояния здоровья субъекта. Окончательное решение о подходящей количестве и режиме дозирования будет принимать лечащий врач или ветеринар.
[0057] Термин "по существу идентичный" применительно к белку или полипептиду означает белок или полипептид, демонстрирующий по меньшей мере 75%, но предпочтительно - 85%, более предпочтительно 90%, наиболее предпочтительно - 95% или даже 99% идентичность с эталонной последовательностью аминокислот, например, SEQ ID NO: 2, SEQ ID NO: 5, или рекомбинантному белку, такому как соответствующий последовательностям SEQ ID NO: 11, 13, 15, 17, 19, 21, 23, 25 и 27. Для белков или полипептидов длина сравниваемой последовательностей составляет обычно по меньшей мере 20 аминокислот, предпочтительно по меньшей мере 30 аминокислот, более предпочтительно по меньшей мере 40 аминокислот и наиболее предпочтительно 50 аминокислот или соответствует полноразмерному белку или полипептиду. Нуклеиновые кислоты, которые кодируют такие "по существу идентичные" белки или полипептиды, являются примерами "по существу идентичных" нуклеиновых кислот. Очевидно, что вследствие вырожденности генетического кода данный белок или полипептид могут кодировать несколько нуклеиновых кислот; такие нуклеиновые кислоты входят в объем настоящего изобретения, если они кодирую полипептид, который "по существу идентичен" эталонному полипептиду.
[0058] Нуклеиновые кислоты, соотносящиеся к настоящему изобретению, могут включать ДНК или РНК и могут быть полностью или частично синтетическими. Ссылка на последовательность нуклеотидов в настоящей заявке охватывает молекулу ДНК с указанной последовательностью (или комплементарную ей), а также включает молекулу РНК с указанной последовательностью, в которой U заменен на Т, если контекст не предполагает другое.
[0059] Выделенные полинуклеотиды, относящиеся к настоящему изобретению, можно применять в качестве зондов гибридизации и праймеров для идентификации и выделения нуклеиновых кислот с последовательностью; которая идентична или близка к последовательностям, кодирующим описанные полинуклеотиды. Способы гибридизации для идентификации и выделения нуклеиновых кислот включают полимеразную цепную реакцию (ПЦР), гибридизацию по Саузерну (Southern), гибридизацию in situ и Нозерн (Northern)-гибридизацию и хорошо известны специалистам в данной области.
[0060] Гибридизацию можно проводить в условиях различной степени жесткости. Жесткость гибридизации включает затруднения, с которыми две молекулы нуклеиновой кислоты гибридизуются друг с другом. Предпочтительно, каждый гибридизующийся полинуклеотид гибридизуется с соответствующим полинуклеотидом в условиях пониженной жесткости, более предпочтительно - в жестких условиях и наиболее предпочтительно - в условиях высокой жесткости. Примеры условий жесткости приведены ниже в Таблице 1: Условия высокой степени жесткости соответствуют условиям, которые являются по меньшей мере такими же жесткими, как, например, условия A-F; жесткие условия соответствуют условиям, которые являются по меньшей мере такими же жесткими, как, например, условия G-L; и условия пониженной степени жесткости соответствуют условиям, которые являются по меньшей мере такими же жесткими, как, например условия M-R.
[0061] Выделенные полинуклеотиды, относящиеся к настоящему изобретению, можно применять в качестве зондов и праймеров гибридизации для идентификации и выделения ДНК, имеющей последовательность, кодирующую аллельные варианты описанных полипептидов. Аллельные варианты - это встречающиеся в природе альтернативные формы описанных полинуклеотидов, которые кодируют полипептиды, которые являются идентичными или в значительной степени близкими полипептидам, кодируемым описанными полинуклеотидами. Предпочтительно, чтобы аллельные варианты обладали по меньшей мере 90% идентичностью (более предпочтительно, по меньшей мере 95% идентичностью; наиболее предпочтительно, по меньшей мере 99% идентичностью) с описанными полинуклеотидами. В качестве альтернативы, значительная близость существует в случае, когда сегменты нуклеиновой кислоты гибридизуют с описанными полинуклеотидами в условиях селективной гибридизации (например, в очень жестких условиях гибридизации).
[0062] Выделенные полинуклеотиды, имеющие отношение к настоящему изобретению, можно также применять в качестве зондов и праймеров гибридизации для того, чтобы идентифицировать и выделять ДНК, имеющие последовательности, кодирующие полипептиды, гомологичные описанным полинуклеотидам. Эти гомологи представляют собой полинуклеотиды и полипептиды, выделенные из видов, отличных от тех, из которых выделены описанные полипептиды и полинуклеотиды, либо выделенные из тех же видов, но имеющие последовательность, в значительной степени близкую описанным полинуклеотидам и полипептидам. Предпочтительно, если гомологи полипептидов обладают по меньшей мере 50%-ной гомологией последовательности (более предпочтительно, по меньшей мере 75%-ной идентичностью; наиболее предпочтительно, по меньшей мере 90%-ной идентичностью) с описанными полинуклеотидами, а гомологи полипептидов обладают по меньшей мере 30%-ной идентичностью последовательности (более предпочтительно, по меньшей мере 45%-ной идентичностью; наиболее предпочтительно, по меньшей мере 60%-ной идентичностью) с описанными полипептидами. Предпочтительно, гомологи описанных полинуклеотидов и полипептидов выделены из млекопитающих.
[0063] Расчеты "гомологии" или "идентичности последовательности" между двумя последовательностями проводят средствами, хорошо известными специалистам в данной области. Например, одно общее средство для расчета идентичности последовательности описано ниже. Последовательности выравнивают для оптимального сравнения (например, можно для оптимального выравнивания ввести пробелы в одну или обе из первой и второй последовательностей аминокислот или последовательностей нуклеиновой кислоты и разделить негомологичные последовательности в целях сравнения). В предпочтительном способе реализации длина эталонной последовательности, выравненной в целях сравнения, составляет по меньшей мере 30%, предпочтительно по меньшей мере 40%, более предпочтительно - по меньшей мере 50%, еще более предпочтительно - по меньшей мере 60% и еще более предпочтительно - по меньшей мере 70%, 80%, 90%, 100% длины эталонной последовательности. Затем сравнивают остатки аминокислот или нуклеотиды в соответствующих положениях аминокислот или нуклеотидов. Если положение в первой последовательности занимает тот же остаток аминокислоты или нуклеотид, что и остаток аминокислоты или нуклеотид в соответствующем положении второй последовательности, молекулы идентичны по этой позиции. Процентная идентичность между двумя последовательностями - это функция идентичных остатков в положениях двух последовательностях, с учетом длины каждого пробела, который необходимо ввести для оптимального выравнивания двух последовательностей.
[0064] Сравнение последовательностей и определение процентной идентичности последовательностей можно выполнить с использованием математического алгоритма. В предпочтительном способе реализации процентную идентичность между двумя последовательностями аминокислот определяют по алгоритму Нидлмана и Вюнша (Needleman and Wunsch (1970) J. Mol. Biol. 48:444-53), заложенного в программе GAP программного пакета GCG (доступен на www.gcg.com), с использованием либо матрицы Blossum 62, либо матрицы РАМ250, весов пробелов, равных 16, 14, 12, 10, 8, 6 или 4, и весов длины пробелов, равных 1, 2, 3, 4, 5 или 6. В еще одном предпочтительном способе реализации процентную идентичность между двумя последовательностями определяли с использованием программы GAP программного пакета GCG (доступен на www.gcg.com), с использованием матрицы NWSgapdna. CMP и весов пробелов, равных 40, 50, 60, 70 или 80, и весов длины, равных 1, 2, 3, 4, 5 или 6. Один предпочтительный набор параметров представляет собой матрицу оценок Blossum 62, штраф за пробел, равный 12, штраф за длину пробела, равный 4, и штраф за пробел сдвига рамки считывания, равный 5. Процентную идентичность между двумя последовательностями аминокислот или нуклеотидов можно также определить по алгоритму Майерса и Миллера (Meyers and Miller (1989) CABIOS 4: 11-17), встроенному в программу ALIGN (версия 2.0), с использованием таблицы остаточных весов РАМ120, штрафом за длину пробела, равным 12, и штрафом за пробел, равным 4.
[0065] Термин "по существу чистый" используют по отношению к нуклеиновой кислоте, полипептиду или другой молекуле, которая отделена от компонентов, которые сопутствуют ей в природе, например, генетического материала, связанных белков, мембран и остатков клеток. Обычно пептид является по существу чистым, если он по меньшей мере на 60%, 70%, 80%, 90%, 95% или даже на 99% по весу свободен от природных органических молекул, с которыми он ассоциирован в природе. Например, по существу чистый полипептид можно получить путем экстракции из природного источника, путем экспрессии рекомбинантной нуклеиновой кислоты в клетке, которая в норме не экспрессирует этот белок, или путем химического синтеза.
[0066] Термин «выделенная/изолированная ДНК» используют по отношению к ДНК, относительно или по существу свободной от генов и других последовательностей ДНК, которые фланкируют эту ДНК в природном геноме организма, из которого эта ДНК получена. Таким образом, термин "выделенная ДНК" включает, например, кДНК, клонированную геномную ДНК и синтетическую ДНК.
[0067] «Рекомбинантный полипептид или белок EL-21» или «Рекомбинантный полипептид или белок IL-21R» определяется как последовательность аминокислот IL-21 или IL-21R, или его части, например внеклеточного фрагмента IL-21R из аминокислот 1-235 последовательности SEQ ID NO: 2, связанная с другой, гетерологичной последовательностью аминокислот. В одном варианте реализации указанная вторая, гетерологичная, последовательность аминокислот представляет собой последовательность-метку. Обычные последовательности-метки представляют собой метки myc, метки his, метки flag и т.д. В другом варианте реализации указанная вторая, гетерологичная последовательность аминокислот представляет собой последовательность иммуноглобулина, например Fc-фрагмент. Такие рекомбинантные белки и полипептиды, которые описаны ниже более подробно, кодируются последовательностями нуклеиновой кислоты, называемыми "рекомбинантными генами IL-21" или "рекомбинантными генами IL-21R".
[0068] В способах скрининга термин «соединение» используют для обозначения реагентов, которые встречаются в природе или получены искусственным путем. Такие соединения могут включать, например, пептиды, полипептиды, синтетические органические молекулы, природные органические молекулы, молекулы нуклеиновых кислот, а также их компоненты и производные. Например, полезное соединение согласно настоящему изобретению уменьшает связывание IL-21 с IL-21R.
[0069] Антагонисты IL-21 и IL-21R для применения в лечении, уменьшения выраженности или профилактики фиброза или ассоциированного с фиброзом состояния могут также представлять собой низкомолекулярные соединения. Термин "низкомолекулярные соединения" относится к соединениям, которые не являются макромолекулами (см., например, Karp (2000) Bioinformatics Ontology 16: 269-85; Verkman (2004) AJP-Cell Physiol. 286: 465-74). Так, низкомолекулярными соединениями часто считают, например, соединения с массой меньше одной тысячи дальтон (например, Voet and Voet, Biochemistry, 7d ed., ed. N. Rose, Wiley and Sons, New York, 14 (1995)). Например, Davis et al. (2005) Proc. Natl. Acad. Sci. USA 102: 5981-86, используют фразу «низкомолекулярные соединения» для обозначения фолатов, метотрексата и нейропептидов, a Halpin и Harbury (2004) PLos Biology 2: 1022-30, используют эту фразу для обозначения продуктов генов, которые являются низкомолекулярными соединениями, например, ДНК, РНК и пептидов. Примеры природных и синтезированных низкомолекулярных соединений включают, без ограничения, холестеролы, нейротрансмиттеры, молекулы малых интерферирующих РНК и различные реагенты, которые можно найти в многочисленных базах данных коммерчески доступных малых молекул, например FCD (База данных химически чистых соединений), SMED (База данных взаимодействия малых молекул), ChEBI (Химические вещества, представляющие биологический интерес) и CSD (Кембриджская структурная база данных) (см., например, Alfarano et al. (2005) Nuc. Acids Res. Database Issue 33-.D416-24).
[0070] Термин "фармацевтическая композиция" означает любую композицию, которая содержит по меньшей мере одно терапевтически или биологически активное вещество и подходит для введения субъекту. Любой из таких составов можно приготовить хорошо известными в данной области способами. См., например, Remington: The Science and Practice of Pharmacy (Теория и практика фармацевтики), 21е изд., (ed. A.R.Gennaro), Lippincott Williams & Wilkins, Baltimore, MD (2005).
[0071] Настоящее изобретение обеспечивает значительные преимущества по сравнению со стандартными терапевтическими средствами для лечения или профилактики состояний, ассоциированных с фиброзом. Как описано в настоящей заявке, введение терапевтического вещества, которое снижает уровень активности или экспрессии IL-21 и/или IL-21R или уменьшает взаимодействие между IL-21 и IL-21R (т.е. снижает уровень активности IL-21 и/или IL-21R), приводит к снижению выраженности, ослаблению или профилактике фиброза или ассоциированных с фиброзом состояний. Кроме того, способы скрининга соединений, обеспечиваемые настоящим изобретением, позволяют идентифицировать новые терапевтические средства, которые изменяют травмирующий процесс, а не просто смягчают симптомы.
Фиброзные нарушения
[0072] Образование грануляционной ткани - процесс с очень тонкой регуляцией, в котором происходит повышающая регуляция экспрессии ингибиторов протеазы и белков внеклеточного матрикса и снижение экспрессии протеаз, что приводит к накоплению внеклеточного матрикса. Анормальное накопление фиброзных материалов, однако, может в итоге привести к нарушению функции органа (например, Border et al. (1994) New Engl. J. Med: 331: 1286-92). Причиной развития фиброзного состояния, индуцированного или спонтанного, по меньшей мере частично является стимуляция активности фибробластов. Приток клеток воспаления и активированных фибробластов к поврежденному органу зависит от взаимодействия с тканевым матриксом, который состоит, в основном, из коллагена. Примерами тканей, которые может поражать фиброз, являются почка, легкое, кожа, центральная нервная система, кость, костный мозг, ткани сердечно-сосудистой системы, эндокринные органы и ткани пищеварительной системы.
[0073] Способы и композиции согласно настоящему изобретению полезны для любого вида фиброза или ассоциированного с фиброзом состояния, поражающего любую ткань, включая, например, фиброз внутреннего органа или фиброзирующее заболевание кожи, а также фиброзные состояния глаз. Фиброз внутренних органов (например, печени, легкого, почки, кровеносных сосудов сердца, желудочно-кишечного тракта) возникает при таких нарушениях, как легочный фиброз, идитопатический фиброз, аутоиммунный фиброз, миелофиброз, цирроз печени, облитерирующее поражение вен, мезангиальный пролиферативный гломерулонефрит, гломерулонефрит с «полулуниями», диабетическая нефропатия, почесный интерстициальный фиброз, почечный фиброз у субъектов, получающих циклоспорин, отторжение аллотрансплантата, ВИЧ-ассоциированная нефропатия. Другие ассоциированные с фиброзом нарушения включают системный склероз, синдром эозинофилии-миалгии и ассоциированные с фиброзом нарушения ЦНС, такие как внутриглазной фиброз. Фиброзирующие нарушения кожи включают, например, склеродерму, ограниченную склеродерму, келоиды, гипертрофические шрамы, семейную кожную коллагеному и невусы соединительной ткани коллагенового типа. Фиброзные состояния глаза включают такие состояния, как диабетическая ретинопатия, послеоперационное рубцевание (например, после фильтрующей хирургии глаукомы и после операции по поводу косоглазия (страбизма)) и пролиферативные витреоретинопатии. Другие фиброзные состояния, которые можно лечить способами согласно настоящему изобретению, могут быть следствием, например, ревматоидного артрита, нарушения, связанного с продолжительной болью в суставах и нарушением функции суставов; прогрессирующего системного склероза, полимиозита, дерматомиозита, эозинофильного фасцита, ограниченной склеордермии, синдрома Рейно и полипоза носа. Как описано в настоящей заявке, антагонист пути IL-21/IL-21R можно вводить для лечения или профилактики фиброза и ассоциированных с фиброзом нарушений либо для уменьшения выраженности одного или более симптомов, связанных с этими нарушениями.
Антагонисты IL-21 или IL-21R (Антагонисты IL-21/IL-21R)
[0074] Антагонисты IL-21 или антагонисты IL-21R согласно настоящему изобретению взаимодействуют с IL-21 или IL-21R соответственно (например, IL-21 или IL-21R млекопитающих, таких как человек, крупный рогатый скот, крыса, мышь, лошадь или собака) и снижают уровень IL-21 и/или IL-21R, например уменьшают один или более видов биологической активности, связанных с IL-21 и/или IL-21R. Если это взаимодействие подразумевает прямое связывание, антагонисты связываются с IL-21 или IL-21R с высокой аффинностью (например, с константой аффинности, равной по меньшей мере приблизительно 107 М-1, предпочтительно приблизительно 108 М-1, а более предпочтительно, приблизительно от 109 М-1 до 1010 М-1 или сильнее).
[0075] Желательно, чтобы уровень IL-21 и/или IL-21R снижался на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или даже 100%. Антагонист, может, например, уменьшать активность IL-21R путем нейтрализации IL-21. Антагонист может представлять собой рекомбинантный белок, который содержит фрагмент IL-21R, присоединенным к фрагменту, не принадлежащему IL-21R, такому как Fc-область иммуноглобулина, например рекомбинантные белки, соответствующие SEQ ID NO: 11, 13, 15, 17, 19, 21, 23, 25 и 27. Другими примерами антагонистов являются антитела против IL-21R или IL-21 или их антиген-связывающие фрагменты, растворимые формы IL-21R, пептиды, ингибиторные полинуклеотиды (например, малые интерферирующие РНК (малые ингибирующие РНК), точечные полиморфизмы нуклеотидов (SNP) и аптамеры), а также низкомолекулярные соединения.
[0076] В одном варианте реализации антагонист IL-21/IL-21R представляет собой антитело против IL-21R или IL-21 либо антиген-связывающий фрагмент такого антитела. В другом способе реализации антитело представляет собой нейтрализующее антитело. При желании антитело может представлять собой моноклональное антитело или моноспецифичное антитело, которое связывает IL-21 или IL-21R, или антиген-связывающий фрагмент такого антитела (например, фрагмент Fab, F(ab')2, Fv или одноцепочечный Fv). Антитело может представлять собой антитело человека, гуманизированное, химерное или полученное in vitro антитело к полипептиду IL-21 или IL-21R.
[0077] В качестве альтернативы антагонист IL-21 или антагонист IL-21R может представлять собой полноразмерный полипептид (например, мутированную последовательность) или фрагмент полипептида IL-21 или полипептида IL-21R (например, человека). Примеры антагонистов включают, например, ингибиторный рецептор-связывающий домен полипептида IL-21 (например, человека) или внеклеточный домен IL-21R мыши или человека. Антагонист IL-21 может иметь последовательность аминокислот, которая по существу идентична (например, обладает по меньшей мере 85%, 90%, 95%, 98%, 99% процентной идентичностью) последовательности природного IL-21R (например, SEQ ID NO: 2 (человека) или SEQ ID NO: 5 (мыши)) или его фрагменту (см. Таблицу 2). В качестве альтернативы антагонист может иметь последовательность аминокислот, кодируемую последовательностью нуклеотидов, которая по существу идентична природному IL-21R млекопитающего или его фрагменту (например, SEQ ID NO: 1 (человека) или SEQ ID NO: 4 (мыши)), или последовательностью нуклеотидов, гибридизующейся с приведенными ниже последовательностями в жестких условиях, например в очень жестких условиях гибридизации (см. Таблицу 1).
[0078] Полипептид IL-21R может представлять собой растворимый полипептид, не способный к заякориванию в мембране. Такие растворимые полипептиды включают, например, полипептиды IL-21R, у которых отсутствует значительная часть мембранного домена, либо модифицированные таким образом, что мембранный домен становится нефункциональным: например, полипептид IL-21R может представлять собой растворимый фрагмент IL-21R (например, фрагмент IL-21R, содержащий внеклеточный домен IL-21R человека или мыши, включая последовательность аминокислот из приблизительно аминокислот 1-235, 1-236, 20-235 или 20-236 последовательности SEQ ID NO: 2 (человека), или из приблизительно аминокислот 1-236 или 20-236 последовательности SEQ ID NO: 5 (мыши)). Примеры антагонистов EL-21 могут иметь последовательность аминокислот, которая по существу идентична аминокислотам 20-538 последовательности SEQ ID NO: 2 (зрелый IL-21R человека), аминокислотам 1-235 последовательности SEQ ID NO: 2 (внеклеточный домен IL-21R человека), аминокислотам 1-236 последовательности SEQ ID NO: 2, аминокислотам 20-235 последовательности SEQ ID NO: 2, аминокислотам 20-236 последовательности SEQ ID NO: 2, аминокислотам 1-236 последовательности SEQ ID NO: 5 или аминокислотам 20-236 последовательности SEQ ID NO: 5.
[0079] Антагонист IL-21 согласно настоящему изобретению может кодироваться нуклеиновыми кислотами, гибридизуются с последовательностями нуклеотидов соответствующими SEQ ID NO: 1, SEQ ID NO: 4, SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 24 или SEQ ID NO: 26, в очень жестких условиях, например в условиях, показанных в Таблице 1. Выделенные полинуклеотиды, которые кодирую белки IL-21R или рекомбинантные белки, которые отличаются от последовательности нуклеотидов, указанных в SEQ ID NO: 1, 4, 10, 12, 14, 16, 18, 20, 22, 24 или 26, вследствие вырожденности генетического кода, также включены в объем настоящего изобретения. Изменения последовательностей и нуклеотидов, соответствующих SEQ ID NO: 1, 4, 10, 12, 14, 16, 18, 20, 22, 24 или 26, вызванные точечными мутациями или индуцированными модификациями, также включены в настоящее изобретение.
[0080] При желании, растворимый полипептид IL-21R может содержать или быть присоединен ко второму фрагменту, такому как полипептид (например, цепь иммуноглобулина, последовательность полипептидов GST, Lex-A или МВР). Например, рекомбинантный белок может включать фрагмент полипептида IL-21R, который способен связывать IL-21, такой как растворимый фрагмент IL-21R (например, фрагмент, содержащий внеклеточный домен IL-21R мыши или человека, такой как аминокислоты 1-235, 1-236, 20-235 или 20-236 последовательности SEQ ID NO: 2 (человека) или аминокислоты 1-236 или 20-236 последовательности SEQ ID NO: 5 (мыши)), присоединенный ко второму фрагменту (например, цепи иммуноглобулина, Fc-фрагменту, константной области тяжелой цепи различных классов иммуноглобулинов, включая IgG1, IgG2, IgG3, IgG4, IgM, IgA1, IgA2, IgD и IgE).
[0081] Желательно, чтобы антагонист IL-21 согласно настоящему изобретению уменьшал биологическую активность, связанную с природным IL-21R, включая, например, способность взаимодействовать с или связываться с полипептидом IL-21, способность ассоциировать с сигнальными молекулами, такими как γc или JAK1, способность стимулировать фосфорилирование и/или активацию белков stat (например, Stat 5 и/или Stat 3), и способность изменять (например, стимулировать или снижать) пролиферацию, дифференцировку, функцию эффекторной клетки, цитолитическую активность, секрецию цитокинов и/или выживание иммунных клеток, таких как Т-клетки (CD8+ и CD4+ Т-клетки, включая клетки Th1 и Th2 (хелперы 1 и 2)), NK-клетки (естественные киллеры), В-клетки, макрофаги и мегакариоциты.
[0082] Согласно настоящему изобретению, полипептид IL-21 представляет собой цитокин, демонстрирующий гомологию последовательности с IL-2, IL-4 и IL-15 (Parrish-Novak et al. (2000) Nature 408: 57-63). Несмотря на низкую степень гомологии последовательности между цитокинами-интерлейкинами, у цитокинов есть общий вторичный мотив, т.е., структура "four-helix-bundle" (пучок из четырех спиралей), которая является типичной для этого семейства. IL-21 экспрессируется главным образом в активированных CD4+ Т-клетках. Сообщали, что IL-21 влияет на естественные киллеры (NK), В- и Т-клетки (Parrish-Novak et al. (2000) выше; Kasaian et al. (2002) Immunity 16:559-69). IL-21 связывает IL-21R (также известный как "MU-1," "NILR" и "zalphall"). После связывания с IL-21 активация IL-21R вызывает сигнализацию Stat5 и/или Stat3 (Ozaki et al. (2000) выше).
[0083] Последовательности аминокислот полипептидов IL-21 общеизвестны. Например, последовательность нуклеотидов и последовательность аминокислот IL-21 человека доступна в базе данных GenBank Acc. No. NM_021803. Последовательность нуклеотидов IL-21 человека представлена ниже:
1 gctgaagtga aaacgagacc aaggtctagc tctactgttg gtacttatga gatccagtcc
61 tggcaacatg gagaggattg tcatctgtct gatggtcatc ttcttgggga cactggtcca
121 caaatcaagc tcccaaggtc aagatcgeca catgattaga atgegtcaac ttatagatat
181 tgttgatcag ctgaaaaatt atgtgaatga cttggtccct gaatttctgc cagctccaga
241 agatgtagag acaaactgtg agtggtcagc tttttcctgc tttcagaagg cccaactaaa
301 gtcagcaaat acaggaaaca atgaaaggat aatcaatgta tcaattaaaa agctgaagag
361 gaaaccacct tccacaaatg cagggagaag acagaaacac agactaacat gcccttcatg
421 tgattcttat gagaaaaaac cacccaaaga attcctagaa agattcaaat cacttctcca
481 aaagatgatt catcagcatc tgtcctctag aacacaegga agtgaagatt cctgaggatc
541 taacttgcag ttggacacta tgttacatac tctaatatag tagtgaaagt catttctttg
601 tattccaagt ggaggag (SEQ ID NO: 7)
[0084] Последовательность аминокислот описанного полипептида IL-21 человека представлена ниже:
MRSSPGKMERIVICLMVIFLGTLVHKSSSQGQDRHMIRMRQLIDIVDQLKNYVNDLVPEFLPAPEDVETNCEWSAFSCFQKAQLKSANTGNNERIINVSIKKLKRKPPSTNAGRRQKHRLTCPSCDSYEKKPPKEFLERFKSLLQKMIHQHLSSRTHGSEDS (SEQ ID NO: 8).
[0085] Таким образом, полипептидом IL-21 называют полипептид, который способен взаимодействовать с или связывать IL-21R и имеет одно или более следующих свойств: (i) последовательность аминокислот по существу идентична последовательности природного IL-21 млекопитающего или его фрагмента (например, SEQ ID NO: 8 (человек)); (ii) последовательность аминокислот кодируется последовательностью нуклеотидов, которая по существу идентична природной последовательности нуклеотидов IL-21 млекопитающего или ее фрагменту (например, SEQ ID NO: 7 (человека) или ее фрагмент); (iii) последовательность аминокислот кодируется последовательностью нуклеотидов, вырожденной по отношению к природной последовательности нуклеотидов IL-21 или ее фрагменту, например SEQ ID NO: 7 (человека) или ее фрагмент; или (iv) последовательность нуклеотидов, которая гибридизуется с одной из упомянутых выше последовательностей нуклеотидов в жестких условиях гибридизации.
[0086] Во всех описанных выше аспектах настоящего изобретения полипептиды IL-21 или IL-21R могут быть обеспечены в форме вариантов, представляющих собой полипептид с мутацией в последовательности природного IL-21 или IL-21R (дикого типа), которая приводит к повышению (по сравнению с немутированной последовательностью) аффинности связывания с IL-21R или IL-21 соответственно. Такие мутации могут быть полезны, например, для повышения устойчивости к протеолизу. Некоторые последовательности аминокислот в описанных последовательностях можно варьировать, не меняя значительно структуру и функцию IL-21 или IL-21R. В целом, можно заменять остатки, которые образуют третичную структуру белка IL-21 или IL-21R, при условии применения остатков, которые выполняют аналогичные функции. В других примерах, если замена происходит в некритической области, тип остатка может быть не важен. Таким образом, настоящее изобретение также включает варианты IL-21 и IL-21R, которые демонстрируют основную биологическую активность, подобную активности IL-21. Такие варианты могут содержать делеции, вставки, инверсии, повторы и замены типов (например, замена одного гидрофильного остатка другим, но не замена одного сильно гидрофильного остатка сильно гидрофобным остатком). Небольшие замены "нейтральных" аминокислот часто не оказывают существенного влияния на функцию белка (Taylor (1986) J. Theor. Biol. 119: 205-18). Консервативные замены могут включать, без ограничения, замены между остатками алифатических аминокислот, замены между остатками амидов, замены основных остатков и замены между ароматическими остатками. Дальнейшие рекомендации относительно замен аминокислот, которые, вероятно, не проявятся фенотипически (т.е., вероятно, не окажут значительного влияния на функцию), можно найти в Bowie et al. (1990) Science 247: 1306-10 и Zvelebil et al. (1987). Mol. Biol. 195: 957-61.
[0087] Антагонист IL-21 или IL-21R может представлять собой рекомбинантный белок, содержащий описанные в настоящей заявке полипептиды IL-21 или IL-21R либо их фрагменты, присоединенные ко второму фрагменту, такому как цепь иммуноглобулина, например Fc-фрагмент, последовательность эпитопа (метку), например GST или myc, и дополнительным широко известным последовательностям, таким как последовательность полипептида Lex-A или МВР. При желании рекомбинантный белок может содержать фрагмент полипептида IL-21R, который способен связывать IL-21, такой как растворимый фрагмент IL-21R (например, фрагмент IL-21R, содержащий внеклеточный домен IL-21R мыши или человека из приблизительно аминокислот 1-235, 1-236,20-235 или 20-236 последовательности SEQ ID NO: 2 (человека), или из приблизительно аминокислот 1-236 или 20-236 последовательности SEQ ID NO: 5 (мыши), или фрагмента, идентичного или по существу идентичного полипептиду, кодируемому последовательностями SEQ ID NO: 1 или 4), присоединенный ко второму фрагменту (например, цепи иммуноглобулина, Fc-фрагменту, константной области (областям) тяжелой цепи различных классов, включая: IgG1, IgG2, IgG3, IgG4, IgM, IgA1, IgA2, IgD и IgE). В качестве альтернативы Fc-последовательность человека может быть получена путем мутации одной или более аминокислот (например, мутированная в положениях 254 и 257 последовательности SEQ ID NO: 16) из природной последовательности, чтобы снизить связывание с рецептором Fc. В других способах реализации рекомбинантный белок может включать внеклеточный IL-21R мыши (приблизительно аминокислоты 1-236 или 20-235 последовательности SEQ ID NO: 5 (мыши)), присоединенный к Fc-цепи иммуноглобулина мыши (включая, без ограничения, IgG мыши, например IgG2a мыши или полученный путем мутации из IgG2a мыши).
[0088] Примеры антагонистичных рекомбинантных белков, которые можно применять в способах согласно настоящему изобретению, показаны на ФИГ.7-15. Рекомбинантный белок может содержать последовательность аминокислот, по существу идентичную SEQ ID NO: 11, SEQ ID NO: 13, SEQ ID NO: 15, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 21, SEQ ID NO: 23, SEQ ID NO: 25 или SEQ ID NO: 27, либо последовательность аминокислот, кодируемую последовательностью нуклеотидов, по существу идентичной последовательности SEQ ID NO: 10, 12, 14, 16, 18, 20, 22, 24 или 26. Один пример рекомбинантного белка содержит внеклеточный домен IL-21R человека (например, аминокислоты 1-235 последовательности SEQ ID NO: 2), присоединенный по С-концу через линкер (соответствует аминокислотам 236-243 последовательности SEQ ID NO: 17) к содержащей мутацию Fc-последовательности (соответствует аминокислотам 244-467 последовательности SEQ ID NO: 17) иммуноглобулина G1 человека (IgG1) Fc. Fc-последовательность человека была получена путем мутации в положениях 254 и 257 последовательности дикого типа, чтобы уменьшить связывание с рецептором Fc. Последовательности нуклеотидов и аминокислот показаны в SEQ DO NO: 16 и SEQ ID NO: 17 соответственно.
[0089] Второй полипептид предпочтительно является растворимым. Возможно, второй полипептид увеличивает время полужизни (например, время полужизни в сыворотке крови) связанного полипептида. При желании, указанный второй полипептид включает последовательность, которая облегчает ассоциацию рекомбинантного полипептида со вторым полипептидом IL-21R или IL-21. Второй полипептид может включать по меньшей мере одну область полипептида иммуноглобулина. Рекомбинантные полипептиды с иммуноглобулином известны в данной области и описаны, например, в Патентах США под номерами 5,225,538; 5,428,130; 5,514,582; 5,714,147 и 5,455,165.
[0090] Второй полипептид может представлять собой полноразмерный полипептид иммуноглобулина или его фрагмент (например, тяжелую цепь, легкую цепь, Fab, Fab2, Fv или Fc).
[0091] В одном примере реализации эффекторная функция второго полипептида ниже, чем эффекторная функция Fc-области тяжелой цепи иммуноглобулина дикого типа. Эффекторная функция Fc включает, например, связывание рецептора Fc, фиксацию комплемента и активность в отношении уменьшения количеств Т-клеток (см., например, Патент США №.6,136,310). Способы оценки активности в отношении уменьшения количеств Т-клеток, эффекторной функции Fc и стабильности антитела известны в данной области. В одном способе реализации второй полипептид имеет низкую аффинность к рецептору Fc либо такая аффинность отсутствует. В альтернативном способе реализации указанный второй полипептид имеет низкую аффинность к рецептору белку комплемента Clq либо такая аффинность отсутствует.
[0092] Предпочтительная последовательность второго полипептида содержит последовательность аминокислот последовательности SEQ ID NO: 6. Эта последовательность включает Fc-область. Подчеркнутые аминокислоты - это аминокислоты, отличающиеся от аминокислот, находящихся в тех же положениях последовательности иммуноглобулина дикого типа:
HTCPPCPAPEALGAPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYJIVVSVLTVLHQDWLNGKEYKCKVSNKALPVPIEKTSKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENOTKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO: 6).
[0093] Рекомбинантные белки могут дополнительно содержать линкерную последовательность (последовательности), соединяющую первый и второй фрагменты. Например, рекомбинантный белок может включать пептидный линкер длиной приблизительно 4-20 аминокислот, более предпочтительно 5-10 аминокислот и наиболее предпочтительно - длиной приблизительно 8 аминокислот. Аминокислоты в пептидном линкере могут включать, например, Gly, Ser, Asn, Thr и Ala. Таким образом, пептидный линкер может состоять из элемента Gly-Ser. В других способах реализации рекомбинантный белок включает пептидный линкер, имеющий формулу (Ser-Gly-Gly-Gly-Gly)y, где "y" равен 1, 2, 3, 4, 5, 6, 7 или 8.
[0094] В других способах реализации на N- или С-конце могут быть добавлены дополнительные последовательности аминокислот для облегчения экспрессии, обнаружения и/или выделения или очистки. Например, рекомбинантный белок IL-21/IL-21R можно присоединить к одному или более дополнительных фрагментов, например, к меткам GST (т.е. глютатион S-трансфераза), His, FLAG или myc. Например, рекомбинантный белок может дополнительно включать пептид GST, где последовательности рекомбинантного белка присоединены к С-концу последовательностей GST. Такие рекомбинантные белки облегчают очистку и идентификацию рекомбинантного белка IL-21R/MU-1. В других способах реализации на N- или С-конце рекомбинантного белка могут быть добавлены дополнительные последовательности аминокислот для облегчения экспрессии, пространственной гибкости, обнаружения и/или выделения или очистки.
[0095] Рекомбинантный белок может также содержать на N-конце гетерологичную сигнальную последовательность. Например, можно удалить нативную сигнальную последовательность IL-21R и заменить ее на сигнальную последовательность другого белка. При помощи гетерологичной сигнальной последовательности можно увеличить экспрессию и/или секрецию IL-21R в клетках определенных хозяев (например, в клетках млекопитающих). Сигнальный пептид, который можно включить в состав рекомбинантного белка, представляет собой MPLLLLLLLLPSPLHP (SEQ ID NO: 9). При желании между первым фрагментом полипептида, содержащим фрагмент IL-21R/MU-1, и вторым фрагментом полипептида можно дополнительно вставить одну или более аминокислот.
[0096] Описанные в настоящей заявке антагонисты IL-21/IL-21R могут представлять собой производные другой функциональной молекулы или быть присоединены к другой функциональной молекуле, например к другому пептиду или белку (например, фрагменту Fab'). Например, рекомбинантный белок, или антитело, или антиген-связывающая часть антитела могут быть функционально связаны (например, путем химической связи, рекомбинации гена, нековалентного присоединения или другим способом) с одним или более других молекулярных фрагментов, таких как антитело (например, биспецифическое или мультиспецифическое антитело), токсины, радиоизотопы, цитотоксические или цитостатические вещества и пр.
[0097] Химерный или рекомбинантный белок согласно настоящему изобретению можно получить, следуя стандартным методикам рекомбинантной ДНК. Например, фрагменты ДНК, кодирующие разные последовательности полипептидов, лигируют друг с другом с сохранением рамки считывания, следуя обычным методикам, например, путем использования для легирования «тупых концов» или «липких концов», ферментов рестрикции для создания соответствующих концов, соответствующего заполнения липких концов, обработки щелочной фосфатазой с целью избежать нежелательного лигирования и ферментного лигирования. В другом способе реализации рекомбинантный ген синтезируют стандартными методами с использованием автоматических ДНК-синтезаторов. В качестве альтернативы можно применять амплификацию путем ПНР с использованием «якорных» праймеров, которые обеспечивают комплементарные выступы на двух последовательных фрагментах гена, которые можно затем соединить, чтобы получить последовательность химерного гена (см., например, Ausubel et al., выше). Более того, многие векторы экспрессии, которые кодируют рекомбинантный фрагмент (например, Fc-область тяжелой цепи иммуноглобулина), можно приобрести. Кодирующую IL-21R/MU-1 или IL-21 нуклеиновую кислоту можно клонировать в такой вектор экспрессии таким образом, чтобы рекомбинантный фрагмент был лигирован с белком иммуноглобулина с сохранением рамки считывания. В некоторых способах реализации рекомбинантные полипептиды IL-21R/MU-1 или IL-21 существуют в форме олигомеров, таких как димеры или тримеры. Мономер IL-21R/MU-1 или IL-21 и/или нуклеиновые кислоты, кодирующие IL-21R/MU-1 или IL-21, можно сконструировать известными в данной области способами.
Получение нуклеиновых кислот
[0098] Выделенные полинуклеотиды согласно настоящему изобретению можно функционально соединить с последовательностью, контролирующей экспрессию, такой как векторы экспрессии рМТ2 или pED, описанные у Kaufman et al. (1991) Nuc. Acids Res. 19: 4485-90, чтобы получать полипептиды IL-21R или IL-21 (включая фрагменты и составленные из них дотированные полипептиды) рекомбинантными способами. В данной области хорошо известны многие подходящие последовательности, контролирующие экспрессию. Также известны общие способы экспрессирования рекомбинантных белков. Примеры даны в Kaufman (1990) Meth. Enzym. 185: 537-66. В настоящей заявке термин «функционально связанный» обозначает связанный с использованием ферментов или химических реагентов с целью образовать ковалентную связь выделенного полинуклеотида согласно настоящему изобретению с последовательностью, контролирующей экспрессию таким образом, чтобы полипептид IL-21R или IL-21 экспрессировали только клетки, которые трансформировали (трансфецировали) конструкцией полинуклеотид/последовательность, контролирующей экспрессию.
[0099] Термин «вектор» в настоящей заявке относится к молекуле нуклеиновой кислоты, способной транспортировать другую аминокислоту, с которой она связана. Один тип вектора представляет собой «плазмиду», что означает замкнутую двойную спираль ДНК, в которую можно лигировать дополнительные сегменты ДНК. Другой тип вектора представляет собой вирусный вектор, где дополнительные сегменты ДНК можно лигировать в геном вируса. Определенные векторы способны к автономной репликации в клетке-хозяине, в которую их можно ввести (например, бактериальный ориджин (точку инициации) репликации и векторы эписом млекопитающих). Другие векторы (например, неэписомные векторы млекопитающих) можно внедрить в геном клетки-хозяина, и они соответственно будут реплицироваться вместе с геномом клетки-хозяина. Более того, определенные векторы способны направлять экспрессию генов, с которым они функционально соединены. Такие векторы в настоящей заявке называются «рекомбинантными векторами экспрессии» (или просто "векторами экспрессии"). В целом, векторы экспрессии, которые можно применять в технологиях рекомбинантных ДНК, часто имеют форму плазмид. В настоящей заявке термин «плазмида» и «вектор» взаимозаменяемы, поскольку плазмида является наиболее часто применяемой формой вектора. Однако настоящее изобретение включает и другие формы вектора экспрессии, такие как векторы экспрессии (например, ретровирусы, неспособные к репликации, аденовирус и адено-ассоциированные вирусы), которые выполняют эквивалентные функции.
[0100] Конструкция для экспрессии рекомбинантного полипептида может содержать дополнительные последовательности, такие как регуляторные последовательности (т.е. последовательности, которые регулируют репликацию вектора, например точки инициации репликации, транскрипции, последовательности нуклеиновой кислоты, кодирующий целевой полипептид (или пептид), или экспрессию закодированного полипептида), последовательности-метки, такие как гистидин и селективные маркерные гены. Термин "регуляторная последовательность" охватывает промоторы, энхансеры и любые другие элементы, контролирующие экспрессию (например, сигналы полиаденилирования, сайты сплайсинга транскриптов), которые контролируют транскрипцию, репликацию или трансляцию. Такие регуляторные последовательности описаны, например, в Goeddel, Gene Expression Technology: Methods in Enzymology (Технология экспрессии генов: Методы в энзимологии), Academic Press, San Diego, СА (Сан-Диего, Калифорния, США) (1990). Для специалиста в данной области очевидно, что создания вектора экспрессии, включая выбор регуляторных последовательностей, будет зависеть от различных факторов, включая выбор клетки-хозяина и желаемый уровень экспрессии белка. Предпочтительные регуляторные последовательности для экспрессии в клетках-хозяевах млекопитающих включают вирусные элементы, обеспечивающие высокие уровни экспрессии белка, такие как промоторы и/или энхансеры, полученные из промотора FF-la, и участок полиаденилирования BGH цитомегаловируса (CMV) (например, промотор/энхансер CMV), вакуолизирующего вируса обезьян 40 (SV40) (например, промотор/энхансер SV40), аденовируса (например, основной поздний промотор аденовируса (AdMLP)), и полиомы. Вирусные регуляторные элементы и их последовательности описаны в, например, патентах США. 5,168,062; 4,510,245 и 4,968,615.
[0101] Рекомбинантные векторы экспрессии согласно настоящему изобретению могут нести дополнительные последовательности, такие как последовательности, которые регулируют репликацию вектора в клетках-хозяевах (например, последовательности ориджинов репликации и терминаторов), и селективные маркерные гены. Селективные маркерные гены облегчают выбор клеток, в которые введен этот вектор (см., например, Патенты США 4,399,216, 4,634,665 и 5,179,017, авторы всех Axel et al.). Например, обычно селективные маркерные гены сообщают трансфецированной или трасформированной селективным маркером клетке-хозяину устойчивости к таким соединениям, как G418 (генетицин), гидромицин или метотрексан. Предпочтительные гены селективных маркеров включают ген дигидрофолат редуктазы (DHFR) (для использования в dhfr- клетках-хозяевах с селекцией метотрексаном/амплификацией), и геном neo (для селекции по G418), и гены, сообщающие бактериям устойчивость к тетрациклину и/или ампициллину.
[0102] Можно выбрать или сконструировать подходящие векторы, содержащие регуляторные последовательности, включая последовательности промоторов, последовательности терминаторов, последовательности полиаденилирования, последовательности энхансеров, маркерные гены и другие последовательности, если это необходимо. В описанных способах можно также применять индуцированную экспрессию белков, достигаемую посредством векторов с последовательностями индуцируемого промотора, таких как индуцируемые тетрациклином векторы, например pTet-On™ и pTet-Off™ (Clontech, Пало-альто, Калифорния, США). Более подробную информацию относительно векторов экспрессии можно найти, например в Sambrook et al., выше. Многие известные методики и протоколы обращения с нуклеиновыми кислотами, например, применяемые для приготовления конструктов нуклеиновых кислот, мутагенезе, секвенировании, введении ДНК в клетки, экспрессии генов и анализе белков, также описаны выше.
[0103] Ряд типов клеток может служить подходящей клеткой-хозяином для экспрессии IL-21R/MU-1 или IL-21. Можно применять любой тип, способный экспрессировать функциональный белок IL-21R/MU-1 или IL-21 или рекомбинантные белки. Подходящие клетки-хозяева млекопитающих включают, например, клетки мартышки COS, клетки яичника китайского хомячка (СНО), клетки почки человека 293, клетки эпидермы человека А431, клетки Colo205 человека, клетки 3Т3, клетки CV-1, другие трансформированные клетки приматов, нормальные диплоидные клетки, штаммы клеток, полученные из in vitro культуры первичной ткани, первичных эксплантатов, клеток HeLa, клетки L мыши, ВНК, HL-60, U937, HaK, С3Н10Т1/2, Rat2, BaF3, 32D, FDCP-1, PC12, клетки Mix или С2С12.
[0104] Полипептид IL-21R или IL-21 или рекомбинантный белок, содержащий IL-21R или IL-21, можно также получить путем функционального соединения выделенного полинуклеотида согласно настоящему изобретению с подходящими контрольными последовательностями в одном или более векторах экспрессии насекомого и использования систем экспрессии в клетках насекомых. Материалы и методы для систем экспрессии бакуловирус/Sf9 можно приобрести в форме набора (например, набор МАХВАС®, Invitrogen, Carlsbad, Калифорния, США). Растворимые формы описанных в настоящей заявке полипептидов можно также получить в клетках насекомых с использованием подходящих выделенных полинуклеотидов, описанных выше.
[0105] В качестве альтернативы полипептид IL-21R или IL-21 или рекомбинантный белок, содержащий IL-21R или IL-21, можно продуцировать в клетках низших эукариот, таких как дрожжи, или в клетках прокариот, таких как бактерии. Подходящие штаммы дрожжей включают Saccharomyces cerevisiae, Schizosaccharomyces pombe, Kluyveromyces strains, Candida или любые штаммы дрожжей, способные экспрессировать гетерологичные белки. Подходящие штаммы бактерий включают Escherichia coli, Bacillus subtilis, Salmonella typhimurium или любые штаммы бактерий, способные экспрессировать гетерологичные белки. Экспрессия в бактериях может привести к образованию телец включения, содержащих рекомбинантный белок. Таким образом, для получения активного или более активного вещества может потребоваться рефолдинг («повторное сворачивание»). В данной области известны несколько способов получения правильно сложенных гетерологичных белков из телец включения бактерий. Такие способы обычно включают солюбилизацию белка из телец включения с последующей полной денатурацией белка посредством хаотропного агента. Если в первичной последовательности аминокислот белка присутствуют остатки цистеина, часто бывает необходимо выполнить рефолдинг в среде, которая обеспечивает правильное образование дисульфидных связей (окислительно-восстановительная система). Общие способы рефолдинга описаны в Kohno (1990) MetkEnzym. 185: 187-95, EP 0433225 и Патенте США №5,399,677.
[0106] Белок согласно настоящему изобретению (либо его фрагмент или продукт лигирования) можно также экспрессировать как продукт трансгенных животных, например, как один из компонентов молока трансгенных коров, коз, свиней или овец, которые характеризуются соматическими или зародышевыми клетками, содержащими последовательность нуклеотидов, например, кодирующую IL-21R или IL-21, либо рекомбинантный белок, содержащий IL-21R или IL-21. Соответственно белок можно получить путем выращивания культуры трансформированных клеток в условиях культивирования, необходимых для экспрессии целевого белка. Полученный в результате экспрессируемый белок можно затем очистить от культуральной среды или экстрактов клеток. Растворимые формы белка можно очистить от кондиционированной среды. Связанные с мембраной формы белка IL-21R согласно настоящему изобретению можно очистить путем приготовления общей фракции мембран из экспрессирующих клеток и экстрагирования мембран неионными детергентами, такими как TRITON® Х-100 (EMD Biosciences, Сан-Диего, Калифорния, США).
[0107] Описанные в настоящей заявке полипептиды можно очищать способами, известными специалистам в данной области. Например, белок согласно настоящему изобретению можно концентрировать при помощи коммерчески доступного фильтра для концентрирования белков, например при помощи устройств для ультрафильтрации AMICON® или PELLICON® (Millipore, Billerica, Массачусетс, США). После этапа концентрации концентрат можно нанести на матрицу для очистки, такую как среда для гель-фильтрации. В качестве альтернативы можно применять обменную смолу, например матрицу или субстрат с присоединенными группами диэтиламиноэтила (DEAE) или полиэтиленамина (PEI). Матрицы могут быть акриламидного, агарозного, декстранового, целлюлозного или других типов, применяемых обычно для очистки белков. В качестве альтернативы можно применять этап катионного обмена. Подходящие катионо-обменные вещества включают нерастворимые подложки, содержащие сульфопропильные или карбоксиметильные группы. Предпочтительными являются сульфопропильные группы (например, колонки S-SEPHAROSE®, Sigma-Aldrich, St. Louis, Миссури, США). Выделение белка IL-21R/MU-1 или рекомбинантного белка из надосадочной жидкости культуры (очистка) может также включать один или более колоночных этапов на таких аффинных смолах, как А-агароза с конканавалином, AF-HEPARIN650, гепарин-TOYOPEARL® или Cibacron blue 3GA SEPHAROSE® (Tosoh Biosciences, San Francisco, шт.Калифорния, США); или путем гидрофобной хроматографии с использованием таких смол, как фенилэфирная, бутилэфирная или пропилэфирная, либо путем иммуноаффинной хроматографии. Наконец, для дальнейшей очистки белка IL-21R/MU-1 или IL-21 можно применять один или более этапов обращено-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ) с использованием гидрофобной среды для ОФ-ВЭЖХ. Можно также использовать колонки с антителами к белку согласно настоящему изобретению в соответствии с известными способами. Для того, чтобы обеспечить существенную очистку выделенного рекомбинантного белка, можно также применять некоторые из этапов или все указанные выше этапы очистки в различных комбинациях друг с другом или с другими известными способами. Предпочтительно, выделенный белок очищают таким образом, чтобы он был по существу свободен от других белков млекопитающих.
Получение антител
[0108] Полипептиды IL-21 или IL-21R согласно настоящему изобретению можно применять для иммунизации животных с целью получения поликлональных или моноклональных антител, которые специфическим образом реагируют с IL-21 или IL-21R и регулируют экспрессию или активность IL-21 и/или IL-21R или регулируют уровень взаимодействия IL-21 с IL-21R. Такие антитела можно получить, например, применяя целые IL-21R или их фрагментов в качестве иммуногенов. Пептидные иммуногены могут дополнительно содержать остаток цистеина на карбоксильном конце и быть конъюгированы с гаптеном, таким как гемоцианин моллюска (KLH). Дополнительные пептидные иммуногены можно получить путем замены остатков тирозина на сульфатированные остатки тирозина. Способы синтеза таких пептидов известны в данной области: см., например, Merrifield (1963) J. Amer. Chem. Soc. 85: 2149-54 и Krstenansky, Мао (1987) FEBS Lett. 211: 10-16.
[0109] Моноклональные антитела человека (mAbs), специфичные к IL-21 или IL-21R, можно получить с использованием трансгенных мышей, несущих гены иммуноглобулина человека вместо генов мыши. Спленоциты, взятые у таких трансгенных мышей, иммунизированных представляющим интерес антигеном, используют для получения гибридом, которые секретируют mAbs человека со специфическими аффинностями к эпитопам белка человека (см., например, WO 91/00906, WO 91/10741, WO 92/03918, WO 92/03917, Lonberg et al. (1994) Nature 368: 856-59, Green et al. (1994) Nat. Genet. 7:13-21, Morrison et al. (1994) Proc. Natl. Acad Sci. U.S.A. 81: 6851-55 и Tuaillon et al. (1993) Proc. Natl. Acad. Sci. U.S.A. 90: 3720-24).
[0110] Моноклональные антитела можно также получать другими известными в данной области способами или по технологии рекомбинантных ДНК. Один типичный способ, называемый способом "комбинаторного дисплея антител", был разработан для идентификации и выделения фрагментов антител, обладающих конкретной антигенной специфичностью, и может применяться для получения моноклональных антител (описание комбинаторного дисплея антител можно найти, например, в Sastry et al. (1989) Proc. Natl. Acad. Sci. U.S.A. 86: 5728-32; Huse et al. (1989) Science 246: 1275-81 и Orlandi et al. (1989) Proc. Natl. Acad Sci. U.S.A. 86: 3833-37). После иммунизации животного иммуногеном описанным выше способом клонируют набор антигенов из пула В-клеток. Последовательность ДНК вариабельных областей различных популяций молекул иммуноглобулинов можно получить путем использования смеси олигомерных праймеров и ПНР. Например, смешанные олигонуклеотидные праймеры, соответствующие лидерным последовательностям 5'-конца (сигнальный пептид) и/или последовательностям рамки 1 (FR1), а также праймеры к консервативной 3' константной области можно применять для амплификации путем ПЦР вариабельных областей тяжелой и легкой цепей из рада антител мыши (Larrick et al. (1991) BioTechniques 11: 152-56). Аналогичную стратегию можно также применять для амплификации вариабельных областей тяжелой и легкой цепей из антител человека (Larrick et al. (1991) Methods: Companion to Methods in Enzymology 2: 106-10).
[0111] Химерные антитела, включая химерные цепи иммуноглобулина, можно получить по технологии рекомбинантных ДНК, известной в данной области. Например, ген, кодирующий константную область Fc молекулы моноклонального антитела мыши (или другого вида), расщепляют ферментами рестрикции, чтобы удалить область, кодирующую Fc мыши, и заменяют ее на эквивалентную часть гена, кодирующую константную область Fc человека (см. PCT/US86/02269; ЕР 184,187; ЕР 171,496; ЕР 173,494; WO 86/01533; Патент США №. 4,816,567; ЕР 125,023; Better et al. (1988) Science 240: 1041-43; Liu et al. (1987) Proc. Natl. Acad Sci. U.S.A 84: 3439-43; Liu et al. (1987) J. Immunol. 139: 3521-26; Sun et al. (1987) Proc. Natl. Acad. Sci. U.S.A. 84: 214-18; Nishimura et al. (1987) Cane. Res. 47: 999-1005; Wood et al. (1985) Nature 314: 446-49 и Shaw et al. (1988) J. Natl. Cancer List. 80: 1553-59).
[0112] При желании антитело или цепь иммуноглобулина можно гуманизировать известными в данной области способами. Гуманизированные антитела, включая гуманизированные цепи иммуноглобулина, можно получить путем замены последовательности вариабельной области Fv, которая не участвует непосредственно в связывании антигена, на эквивалентные последовательности вариабельных областей Fv человека. Общие способы получения гуманизированных антител описывает Morrison (1985) Science 229: 1202-07; Oi et al. (1986) BioTechniques 4: 214-21 и Патенты США №№5,585,089, 5,693,761 и 5,693,762. Каждый из указанных источников полностью включен в настоящую заявку посредством ссылки. Указанные способы включают выделение, манипуляции и экспрессирование последовательностей нуклеиновых кислот, которые кодируют все вариабельные области Fv иммуноглобулина или их часть, по меньшей мере одной легкой или тяжелой цепи. Источники таких нуклеиновых кислот хорошо известны специалистам в данной области, их можно получить, например, из гибридом, продуцирующих антитела к заранее определенной мишени. Рекомбинантную ДНК, кодирующую гуманизированное антитело или его фрагмент, можно затем клонировать в подходящий вектор экспрессии.
[0113] Молекулы гуманизированного антитела или антитела с привитым гипервариабельным участком можно получить путем прививки (grafting) гипервариабельного участка или замены гипервариабельного участка, при которой могут быть заменены один, два или все гипервариабельные участки иммуноглобулина. См., например, Патент США №5,225,539; Jones et al. (1986) Nature 321: 552-25; Verhoeyan et al. (1988) Science 239: 1534-36 и Beidler et al. (1988) J. Immunol. 141: 4053-60, содержание каждого из которых включено в настоящую заявку посредством ссылки. В патенте США №5,225,539 описан способ прививки гипервариабельного участка, который можно применять для получения гуманизированных антител согласно настоящему изобретению (см. также GB 2188638A). Все гипервариабельные участки конкретного антитела человека можно заменить по меньшей мере одной частью гипервариабельного участка другого вида (не человека) либо несколько гипервариабельных участков можно заменить гипервариабельными участками других видов (не человека). Необходимо заменить лишь набор гипервариабельных участков, необходимых для связывания гуманизированного антитела с заранее определенным антигеном.
[0114] Моноклональные, химерные и гуманизированные антитела, которые были модифицированы путем, например, делеции, присоединения или замены других частей антитела, например константной области, также включены в объем настоящего изобретения. Например, антитело может быть модифицировано следующим образом: (i) путем делеции константной области; (ii) путем замены константной области на другую константную область, например на константную область, которая должна увеличить время полужизни, стабильность или аффинность антитела, либо на константную область антитела другого вида или класса; или (iii) путем модификации одной или более аминокислот в константной областью с целью изменить, например, число сайтов гликозилирования, функцию эффекторной клетки, связывание рецептора Fc (FcR), фиксации комплемента и пр.
[0115] Способы модификации константной области антитела известны в данной области. Антитела с измененной функцией (например, измененной аффинностью к эффекторному лиганду, такому как FcR на клетке или компонент комплемента С1), можно получить путем замены по меньшей мере одного остатка аминокислоты в константной части антитела на другой остаток (см., например, ЕР 388,151 А1, Патенты США №5,624,821 и 5,648,260, каждый из которых полностью включен в настоящую заявку). Аналогичные типы модификаций можно также применить к иммуноглобулинам мышей и иммуноглобулинам других видов. Например, можно изменить аффинность Fc-области антитела (например, IgG, такого как IgG человека) к FcR (например, Fc R1 гамма) или к связыванию Clq путем замены конкретного остатка (остатков) на остаток (остатки), имеющие соответствующую функциональную группу в боковой цепи, либо путем введения заряженной функциональной группы, такой как глютамат или аспартат, либо, возможно, ароматического неполярного остатка, такого как фенилаланин, тирозин, триптофан или аланин (см., например, Патент США №5,624,821).
[0116] Антитела человека к IL-21 и/или IL-21R можно дополнительно получить с использованием трансгенных животных другого вида, которые в результате модификации в ответ на введение антигена продуцируют полноразмерные антитела человека, а не эндогенные антитела этого животного. См., например, публикацию РСТ WO 94/02602. Инактивируют эндогенные гены, кодирующие тяжелую и легкую цепи иммуноглобулина в хозяевах, не принадлежащих к виду Человек, и вводят в геном хозяина активные локусы, кодирующие легкую и тяжелую цепи иммуноглобулинов человека. Гены человека встраивают, например, при помощи искусственных хромосом дрожжей, содержащей необходимые сегменты ДНК человека. Затем путем перекрестного скрещивания промежуточных трансгенных животных, несущих неполный набор модификаций, получают животное, которое обеспечивает все желаемые модификации. Примером таких животных, не принадлежащих к виду человек, является мышь, которая называется е XENOMOUSE™ и описана в публикациях РСТ WO 96/33735 и WO 96/34096. Это животное продуцирует В-клетки, которые секретируют полностью человеческие иммуноглобулины. Эти антитела можно получать непосредственно из организма животного после иммунизации представляющим интерес иммуногеном в форме, например, препарата поликлонального антитела или, в качестве альтернативы, из иммортализованных В-клеток, полученных из организма животного, таких как гибридомы, продуцирующие моноклональные антитела. Дополнительно можно выделить и экспрессировать гены, кодирующие иммуноглобулины с вариабельными областями человека, чтобы непосредственно получать антитела, либо модифицировать их далее с целью получения аналогов антител, таких как, например, одноцепочечной молекулы Fv.
[0117] Для модулирования активности IL-21 и/или IL-21R можно также применять другие белок-связывающие молекулы. Такие белок-связывающие молекулы включают низкомолекулярные иммуномодулирующие фармацевтические средства (SMIP™) (Trubion Pharmaceuticals, Seattle, WA (Вашингтон, США)). SMIP представляют собой одноцепочечные полипептиды, состоящие из домена связывания родственной структуры, такой как антиген, противорецептор и т.п., полипептид с «шарнирной» областью, который либо содержит один остаток цистеина, либо не содержит ни одного остатка цистеина, и доменов СН2 и СН3 иммуноглобулина (см. также www.trubion.com). SMIP, способы их применения и приложения описаны, например, в публикациях заявок на Патент США №№2003/0118592, 2003/0133939, 2004/0058445, 2005/0136049, 2005/0175614, 2005/0180970, 2005/0186216, 2005/0202012, 2005/0202023, 2005/0202028, 2005/0202534 и 2005/0238646 и родственных патентах, каждый из которых полностью включен в настоящую заявку посредством ссылки.
[0118] Как описано в настоящей заявке, связывание нейтрализующих или ненейтрализующих антител (предпочтительно моноклональных антител) с IL-21R или IL-21 либо рекомбинантным белком, содержащим EL-21 R или IL-2, может быть полезно в лечении таких нарушений, как фиброз или ассоциированные с фиброзом состояния.
[0119] Соответственно настоящее изобретение также обеспечивает композиции, содержащие антитело, которое специфическим образом реагирует с IL-21 или IL-21R либо с рекомбинантным белком, содержащим IL-21 или IL-21R.
Способы скрининга
[0120] Полипептиды IL-21R или IL-21 либо рекомбинантные белки согласно настоящему изобретению можно также применять для скрининга с целью для выявления веществ, способных связывать IL-21 или IL-21R, а также регулировать уровень IL-21 и/или IL-21R, например уровень активности IL-21 и/или IL-21R, уровень экспрессии IL-21 и/или IL-21R (например, уровень продуктов генов IL-21 и/или IL-21R), и/или уровень взаимодействия между IL-21 и IL-21R. Тесты на связывание с применением белка согласно настоящему изобретению или его партнера по связыванию, которые могут быть свободными или иммобилизованными на подложке, хорошо известны в данной области. Способы скрининга на основе очищенных клеток или белков (в отсутствие клеток) можно применять для идентификации партнеров по связыванию и/или лигандов (природных или синтетических, например, исследуемых соединений) полипептидов IL-21R или IL-21, либо рекомбинантных белков согласно настоящему изобретению. Например, можно иммобилизовать IL-21R в очищенной форме на носителе и измерять связывание потенциальных лигандов с IL-21R.
Способы диагностики, прогнозирования и мониторинга течения фиброза и ассоциированных с фиброзом нарушений, связанных с IL-21
[0121] Настоящее изобретение обеспечивает способы диагностики, прогнозирования и мониторинга течения (например, мониторинга курса лечения) нарушений, т.е. фиброза и состояний или нарушений, ассоциированных с фиброзом, связанных с IL-21 и/или IL-21R, путем, например, обнаружения и/или измерения уровня IL-21 и/или IL-21R, где фраза "уровень IL-21 и/или IL-21R" и ее эквиваленты включают, без ограничения, (1) уровень экспрессии продуктов генов IL-21 и/или IL-21R (например, уровень белка и/или мРНК IL-21 и/или IL-21R в представляющих интерес клетке или образце); (2) уровень активности белка IL-21 и/или белка IL-21R (например, экспрессии и/или функции цитокинов Th2 в представляющих интерес клетке или образце); и (3) уровень взаимодействия IL-21 с IL-21R (например, в представляющих интерес клетке или образце). Например, настоящее изобретение обеспечивает способы диагностики, прогнозирования и мониторинга, например, путем обнаружения повышающей регуляции или понижающей регуляции продуктов гена и/или активности IL-21 и/или IL-21R, и/или путем измерения взаимодействия IL-21 с IL-21R, и т.д. (включая, без ограничения, применение таких методов у субъектов, являющихся людьми). Уровни IL-21 и/или IL-21R можно также измерять в представляющих интерес эталонных клетке или образце с целью продуцировать или получить эталонный уровень IL-21 и/или IL-21R. Также специалист в данной области может получить такой эталонный уровень другими способами, либо он может быть общеизвестен. Эти способы можно осуществлять с применением, например, упакованных диагностических наборов, содержащих по меньшей мере один элемент группы, содержащей полинуклеотид IL-21 или IL-21R (или его фрагмент); полипептид IL-21 или IL-21R (или его фрагмент и/или рекомбинантные белки, содержащие полипептид IL-21 или IL-21R); антитело к полипептиду IL-21 или IL-21R (либо его производное или антиген-связывающий фрагмент); или модуляторы полинуклеотидов и/или полипептидов IL-21 или IL-21R, описанных в настоящей заявке, которые можно применять, например в клинических условиях.
[0122] "Диагностика" или "диагностирование" обозначает определение присутствия или отсутствия патологического состояния. Способы диагностики включают, без ограничения, обнаружение повышающей регуляции уровня IL-21 и/или IL-21R посредством определения контрольного количества продуктов гена IL-21 и/или IL-21R (например, РНК, кДНК или полипептида, включая его фрагменты), путем измерения активности IL-21 и/или IL-21R и/или путем измерения уровня взаимодействия IL-21 с IL-21R, в биологическом образце, взятом у субъекта (млекопитающего или человека), и сравнения контрольного количества с, например, нормальным количеством или диапазоном (например, количество или диапазон у субъекта (субъектов), заведомо не страдающего от фиброза или ассоциированного с фиброзом состояния). Хотя конкретный способ диагностики может не дать определенного диагноза нарушения, связанного с IL-21, достаточно, чтобы способ обеспечивал объективное указание, которое помогает при диагностике.
[0123] Настоящее изобретение обеспечивает также способы прогнозирования таких нарушений путем обнаружения, например, повышающей регуляции уровней IL-21 и/или IL-21R, например, путем обнаружения повышающей регуляции продуктов генов и/или активности IL-21 и/или IL-21R, и/или путем измерения уровня взаимодействия IL-21 с IL-21R и т.д. "Прогноз" или "прогнозирование" означает предсказание возможного развития и/или тяжести патологического состояния. Способы прогнозирования включают определение контрольного количестве продукта гена IL-21 и/или IL-21R в биологическом образце, полученном у субъекта, и сравнение контрольного количества с прогностическим количеством или диапазоном (т.е. количеством или диапазоном у субъектов с различными степенями тяжести нарушений, т.е. фиброза и/или ассоциированного с фиброзом состояния, например, связанных IL-21) для уровня IL-21 и/или IL-21R. Различные количества, связанные с уровнем IL-21 и/или IL-21R в контрольном образце, соответствуют определенным прогнозам для нарушений, например, фиброза или состояний, ассоциированных с фиброзом, или нарушений, связанных с IL-21 и/или IL-21R. Определение величины уровня IL-21 и/или IL-21R при конкретном прогностическом уровне обеспечивает прогноз для субъекта.
[0124] Настоящее изобретение также обеспечивает способы мониторинга прогрессирования или течения таких нарушений, связанных с IL-21, путем определения, например, повышающей регуляции уровней IL-21 и/или IL-21R, например, путем определения повышающей регуляции продуктов генов, активности IL-21 и/или IL-21R и/или взаимодействия IL-21 с IL-21R. Способы мониторинга включают определение контрольных количеств продукта гена IL-21 в биологических образцах, взятых у субъекта в первый и второй моменты времени и сравнения этих количеств. Изменение количества продукта гена IL-21 и/или IL-21R между первым и вторым моментами времени указывает на изменение течения связанного с IL-21 нарушения, причем снижение количества указывает на ремиссию таких нарушений, а увеличение количества указывает на прогрессирование таких нарушений. Такие способы мониторинга также полезны для оценки эффективности конкретного терапевтического вмешательства у пациентов, которых лечат от фиброза или ассоциированного с фиброзом нарушения.
Измерение уровня IL-21 и/или IL-21R
[0125] В способах согласно настоящему изобретению (например, в способах скрининга и/или идентификации соединения для лечения, снижения выраженности или предотвращения фиброза или ассоциированного с фиброзом состояния, способов диагностики, прогнозирования и/или мониторинга прогрессирования фиброза или ассоциированного с фиброзом состояния, а также способов лечения, уменьшения выраженности или профилактики фиброза или ассоциированного с фиброзом состояния), описанных в настоящей заявке, уровень IL-21 и/или IL-21R (например, уровень продуктов генов, активности и/или взаимодействия IL-21 и/или IL-21) можно измерять в разнообразных биологических образцах, включая жидкости тела (например, цельную кровь, плазму и мочу), клетки (например, целые клетки, фракции клеток и экстракты клеток) и другие ткани. Биологические образцы включают срезы ткани, такие как биопсийный материал и замороженные срезы, взятые для целей гистологического исследования. Предпочтительные биологические образцы включают кровь, плазму, лимфу, биопсии ткани, мочу, спинномозговую жидкость, синовиальную жидкость и бронхоальвеолярный лаваж. Очевидно, что анализ биологического образца не обязательно требует выделения клеток или ткани у субъекта. Например, можно вводить субъекту меченные соответствующим образом вещества, которые связывают продукты генов IL-21 и/или IL-21R (например, антитела, нуклеиновые кислоты), и визуализировать их (после связывания с мишенью) стандартными методиками (например, CAT (Cambridge Antibody Technology), ЯМР (магнитно-резонансная визуализация) и ПЭТ (РЕТ, позиционная эмиссионная томография)).
[0126] В способах лечения, уменьшения выраженности или профилактики фиброза или ассоциированного с фиброзом нарушения, в способах идентификации соединения для лечения, уменьшения выраженности или профилактики фиброза или ассоциированного с фиброзом нарушения и в способах и тестах для диагностики, прогнозирования и мониторинга и согласно настоящему изобретению, уровень IL-21 и/или IL-21R обнаруживают и измеряют для получения контрольного количества. Затем контрольное количество сравнивают, например, с нормальным количеством или диапазоном. Например, количество, превышающее (например, повышенный уровень) нормальное количество или диапазон, представляет собой объективный признак для диагноза нарушений, связанных с IL-21.
[0127] Нормальные количества или фоновые уровни IL-21 и/или IL-21R можно определять для любых конкретных типов образцов и популяций. В целом, фоновые (нормальные) уровни IL-21 и/или IL-21R определяют путем измерения соответствующих уровней IL-21 и/или IL-21R в биологических образцах, взятых у нормальных (т.е. здоровых) субъектов. В качестве альтернативы можно определять уровни IL-21 и/или IL-21R путем измерения количества в здоровых клетках или тканях, взятых у того же субъекта, у которого брали больные (или предположительно больные) контрольные клетки или ткани. Уровень IL-21 и/или IL-21R (нормальное количество или контрольное количество) можно определять или выражать в расчете на клетку, общее количество белка или объем. Чтобы определить количество клеток в образце, можно измерить уровень постоянно экспрессируемого продукта гена или другого продукта гена, экспрессируемого на известном уровне, в клетках того типа, из которых был взят биологический образец.
[0128] Очевидно, что способы анализа согласно настоящему изобретению не обязательно требуют измерения абсолютных значений для уровня IL-21 и/или IL-21R, поскольку для многих приложений этих способов достаточно относительных значений. Также очевидно, что в дополнение к значению или величине уровней IL-21 и/или IL-21R можно идентифицировать измененные или анормальные уровни IL-21 и/или IL-21R или характер их экспрессии (например, мутированные транскрипты, укороченные полипептиды) по сравнению с нормальными уровнями или профилями экспрессии.
[0129] Будет ли уровень конкретного гена или белка в двух образцах увеличен (т.е. выше) или уменьшен (т.е. ниже), например значительно выше или значительно ниже заданного уровня соответственно, зависит от самого гена и, среди прочего, вариабельности его экспрессии и/или взаимодействия с лигандами у разных лиц или в разных образцах. Практический опыт в данной области техники позволяет определить, содержат ли образцы существенно близкие или разные уровни IL-21 и/или IL-21R. Чтобы определить, действительно ли два образца содержат разные уровни (выше или ниже) IL-21 и/или IL-21R, можно принять во внимание (если и где это необходимо) такие факторы, как генетические различия между особями, видами, органами, тканями или клетками. Вследствие природной гетерогенности уровней IL-21 и/или IL-21R между особями, видами, органами, тканями или клетками такие фразы, как "существенно выше" или "существенно ниже", нельзя определить как точный процент или значение, но специалист в данной области при реализации настоящего изобретения сможет уточнить их значение. Конкретные способы обнаружения и измерения количества продуктов генов, активности и взаимодействия IL-21 и/или IL-21R описаны в настоящей заявке.
Тесты для измерения количества продуктов генов IL-21 и/или IL-21R
[0130] Способы согласно настоящему изобретению включают обнаружение и измерение уровня IL-21 и/или IL-21R, например уровня продуктов генов IL-21 и/или IL-21R, уровня активности IL-21 и/или IL-21R и/или уровня взаимодействия IL-21 с IL-21R, в биологических образцах. Продукты генов IL-21 и IL-21R включают мРНК и полипептиды, причем и то, и другое можно измерять способами, хорошо известными специалистам в данной области.
[0131] Например, мРНК можно непосредственно обнаруживать и определять ее количество в тестах, основанных на гибридизации, таких как нозерн(Northern)-гибридизация, дот-слот-блот-анализ (от анг. blot - пятно, dot - точка, slot - прорезь, паз) и олигонуклеотидные чипы. Тесты на основе гибридизации - это тесты, в которых нуклеиновую кислоту - зонд гибридизуют с целевой нуклеиновой кислотой. В некоторых форматах может быть иммобилизован зонд, мишень или они оба. Иммобилизованная нуклеиновая кислота может представлять собой ДНК, РНК либо другой олигонуклеотид или полинуклеотид, и может содержать встречающиеся или не встречающиеся в природе олигонуклеотиды, аналоги нуклеотидов или остовы. Способы выбора нуклеиновой кислоты для применения в настоящем изобретении в качестве зонда (например, на основе последовательности нуклеиновой кислоты IL-21) хорошо известны в данной области.
[0132] В качестве альтернативы мРНК можно амплифицировать перед проведением обнаружения и измерения. Такие тесты на основе амплификации хорошо известны в данной области и включают полимеразную цепную реакцию (ПЦР), ПЦР с обратной транскрипцией (RT-PCR, ОТ-ПЦР), ПЦР-твердофазный иммуноферментный анализ (PCR-ELISA, ПЦР-ИФА) и лигазную цепную реакцию (ЛЦР). Специалист в данной области может легко сконструировать и получить праймеры и зонды для получения и обнаружения амплифицированных продуктов генов IL-21 (например, мРНК или кДНК) на основе последовательностей аминокислот IL-21 и/или IL-21R, не проводя ненужных экспериментов. Амплифицированные продукты генов IL-21 и/или IL-21R можно анализировать непосредственно, например, путем гель-электрофореза, путем гибридизации с нуклеиновой кислотой-зондом, путем секвенирования, путем регистрации флюоресцентного, фосфоресцентного или радиоактивного сигнала либо любым из всего разнообразия хорошо известных способов. Кроме того, специалистам в данной области известны способы усиления сигнала путем амплификации целевых последовательностей нуклеиновых кислот. Для специалиста в данной области очевидно, что какой бы способ амплификации ни применялся, для количественного определения продуктов гена (если оно необходимо) доступны разнообразные способы, известные в данной области (например, количественная ПЦР).
[0133] Полипептид IL-21 и/или IL-21R (или его фрагменты) можно обнаруживать при помощи хорошо известных иммунологических способов анализа с применением соответствующих антител против IL-21 и/или IL-21R, которые можно получить, как описано в настоящей заявке. Иммунологическими способами анализа называют способы анализа, в которых применяют антитело (например, поликлональное, моноклональное, химерное, гуманизированное, одноцепочечное scFv и/или фрагменты антител), которые специфически связывают, например полипептид IL-21 (или его фрагмент). Такие хорошо известные способы иммунологического анализа включают твердофазный иммуноферментный анализ (ELISA), радиоиммунологический анализ (РИА), иммунопреципитацию, иммунофлюоресценцию, сортировку клеток с возбужденной флюоресценцией (FACS) и Вестерн-блоттинг. Для среднего специалиста в данной области очевидно, что полипептид IL-21 можно также обнаруживать при помощи меченого полипептида (полипептидов) IL-21R. Специалист в данной области поймет, что вышеупомянутые способы можно применять для нарушений, связанных с IL-21, в частности фиброза и состояния, ассоциированного с фиброзом.
Тесты для измерения активности IL-21 и/или IL-21R
[0134] Активность IL-21/IL-21R (например, в ответ на действие антагонистов IL-21/IL-21R в качестве модуляторов продукции цитокинов и пролиферации/дифференцировки клеток) можно исследовать с использованием любого числа рутинных фактор-зависимых тестов на пролиферацию клеток для клеточных линий, включающих, без ограничения, 32D, DA2, DA1G, Т10, В9, В9/11, BaF3, MC9/G, М+(preB М+), 2Е8, RB5, DA1, 123, TI 165, НТ2, CTLL2, TF-1, Мо7е и CMK.
[0135] Способы анализа пролиферации Т-клеток или тимоцитов описаны, например, в Current Protocols in Immunology, Coligan et al. (eds.) Greene Pub. Assoc. & Wiley-Interscience, NY, NY (1991) (Глава 3, "In Vitro assays for Mouse Lymphocyte Function" (In Vitro тесты функции лимфоцитов мышей) и Глава 7, "Immunologic studies in Humans" (Иммунологические исследования у человека)); Takai et al. (1986) J. Immunol. 137: 3494-500; Bertagnolli et al. (1990) J. Immunol. 145: 1706-12; Bertagnolli et al. (1991) Cell. Immunol. 133: 327-41; Bertagnolli et al. (1992) J. Immunol. 149:3778-83; Bowman et al. (1994) J. Immunol. 152:1756-61. Тесты на продукцию цитокинов и/или пролиферацию клеток селезенки, клеток лимфатических узлов или лимфоцитов описаны, например, в "Polyclonal Т cell stimulation" (Стимуляция поликлональных Т-клеток), авторы Kruisbeek и Shevach, в Current Protocols in Immunology, Vol.1 Coligan et al. (eds.) pp.3.12.1-14, John Wiley and Sons, Toronto (1994); и "Measurement of mouse and human Interferon gamma" (Определение количества человеческого и мышиного интерферона- гамма) Schreiber, R.D. в Current Protocols in Immunology, Vol.1 Coligan et al. (eds.) pp.6.8.1-8, John Wiley and Sons, Toronto (1994).
[0136] Тесты на пролиферацию и дифференцировку гематопоэтических и лимфопоэтических клеток описаны, например, в "Measurement of Human and Murine Interleukin 2 and Interleukin 4" (измерение человеческого и мышиного интерлейкина-2 и интерлейкина-4) Bottomry et al. в Current Protocols in Immunology, Vol.1 Coligan et al. (eds.) pp.6.3.1-12, John Wiley and Sons, Toronto (1991); de Vries et al. (1991) J. Exp.Med. 173: 1205-11; Moreau et al. (1988) Nature 336: 690-92; Greenberger et al. (1983) Proc. Natl. Acad. Set U.S.A. 80: 2931-38; "Measurement of mouse and human interleukin б" (Изменение человеческого и мышиного интерлейкина-6) Nordan, R. в Current Protocols in Immunology, Vol.1 Coligan et al. (eds.) pp.6.6.1-5, John Wiley and Sons, Toronto (1991); Smith et al. (1986) Proc. Natl. Acad. Sci. U.S.A.. 83: 1857-61; "Measurement of human Interleukin 11" (Измерение человеческого интерлейкина 11) Bennett et al. in Current Protocols in Immunology, Vol.1 Coligan et al. (eds.) p.6.15.1, John Wiley and Sons, Toronto (1991); "Measurement of mouse and human Interleukin 9" (Изменение человеческого и мышиного интерлейкина-9) Ciarletta et al. in Current Protocols in Immunology, Vol.1. Coligan et al. (eds.) p.6.13.1, John Wiley and Sons, Toronto (1991).
[0137] Способы анализа (тесты) ответов клонов Т-клеток на антигены (которые позволят выявить, среди прочего, белки, которые влияют на взаимодействие между АПК и Т-клетками, а также непосредственные эффекты Т-клеток, путем измерения пролиферации и продукции цитокинов) включают, например, способы, описанные в: Current Protocols in Immunology, Coligan et al. (eds.) Greene Pub. Assoc, and Wiley-Interscience, NY, NY (1991) (Глава 3, "In Vitro assays for Mouse Lymphocyte Function"; Chapter 6, "Cytokines and their cellular receptors"; Глава 7, "Immunologic studies in Humans"); Weinberger et al. (1980) Proc. Natl. Acad. Sci. U.S.A. 77: 6091-95; Weinberger et al. (1981) Eur. J. Immunol. 11: 405-1 1; Takai et al. (1986) J. Immunol. 137: 3494-500; Takai et al. (1988) J. Immunol. 140: 508-12.
Способы измерения взаимодействия IL-21 c IL-21R
[0138] Способы обнаружения и/или измерения уровня взаимодействия IL-21 с IL-21R хорошо известны в данной области. Например, такие взаимодействия между цитокином и его рецептором можно обнаруживать и/или измерять при помощи, без ограничения, таких методик, как твердофазный иммуноферментный анализ, Вестерн-блоттинг, иммунопреципитация, анализ Biacore и т.д..
Фармацевтические композиции
[0139] В одном из аспектов настоящее изобретение относится к способу лечения, уменьшения выраженности или профилактики связанного с IL-21 нарушения, т.е. фиброза или состояния, ассоциированного с фиброзом. Способ может включать приведение популяции клеток в контакт с (например, путем введения субъекту, страдающему или подверженному риску фиброза или ассоциированного с фиброзом нарушения) веществом, которое снижает уровень активности IL 21 и/или IL 21R в организме субъекта, например антагониста IL-21 /IL-21R (например, антитела против IL-21R или против IL-21, антиген-связывающего фрагмента антитела против IL-21R, антиген-связывающего фрагмента антитела против IL-21 и растворимого фрагмента IL-21R (например, последовательность аминокислот, которая по меньшей мере на 90% идентична последовательности аминокислот, выбранной из группы, состоящей из аминокислот 1-538 последовательности SEQ ID NO: 2, аминокислот 20-538 последовательности SEQ ID NO: 2, аминокислот 1-235 последовательности SEQ ID NO: 2, аминокислот 20-235 последовательности SEQ ID NO: 2, аминокислот 1-236 последовательности SEQ ID NO: 2, аминокислот 20-236 последовательности SEQ ID NO: 2, аминокислот 1-529 последовательности SEQ ID NO: 5, аминокислот 20-529 последовательности SEQ ID NO: 5, аминокислот 1-236 последовательности SEQ ID NO: 5 и аминокислот 20-236 последовательности SEQ ID NO: 5)) в количестве, достаточном для ингибирования активности IL-21 в клетке или популяции.
[0140] Если антагонисты IL-21/DL-21R для лечения фиброза или ассоциированного с фиброзом состояния объединить с фармацевтически приемлемым носителем, их можно применять в форме фармацевтической композиции. Такая композиция может содержать, в дополнение к антагонистам IL-21/IL-21R и носителю, различные разбавители, наполнители, соли, буферы, стабилизаторы, солюбилизаторы и другие известные в данной области материалы. Термин "фармацевтически приемлемый" относится к нетоксичному материалу, который не влияет на эффективность биологической активности активного компонента(ов). Свойства носителя будут зависеть от пути введения. Свойства носителей хорошо известны в данной области.
[0141] Фармацевтическая композиция согласно настоящему изобретению может иметь форму липосомы, в которой анатагонист(ы) IL-21/IL-21R объединен с, помимо других фармацевтически приемлемых носителей, амфифильными веществами, такими как липиды, существующие в агрегированных формах мицелл, нерастворимых монослоев, жидких кристаллов или плоских слоев, которые существуют в водном растворе. Липиды, подходящие для получения липосом, включают, без ограничения, моноглицериды, диглицериды, сульфатиды, лизолецитин, фосфолипиды, сапонин, желчные кислоты и т.д. Получение таких липосомальных лекарственных форм находится в пределах уровня техники и описано, например, в Патентах США №4,235,871,4,501,728,4,837,028 и 4,737,323, каждый из которых включен в настоящую заявку по ссылке.
[0142] В настоящей заявке термин "терапевтически эффективное количество" означает общее количество каждого активного компонента фармацевтической композиции или способа, которое является достаточным для того, чтобы продемонстрировать значительную пользу для субъекта, например снижение выраженности или ослабление симптомов, предотвращение, излечивание или ускорение излечивания таких состояний. Применительно к индивидуальному активному компоненту, который вводят отдельно, этот термин относится конкретно к этому компоненту. Применительно к комбинации этот термин относится к относится к объединенному количеству активных компонентов, которые обеспечиваю терапевтический эффект при введении либо в комбинации, либо одновременно, либо последовательно.
[0143] При осуществлении способа лечения или при применении настоящего изобретения терапевтически эффективное количество антагониста IL-21/IL-21R вводят субъекту, например млекопитающему (например, человеку). В способе согласно настоящему изобретению антагонист(ы) IL-21/IL-21R можно вводить либо отдельно, либо в комбинации с другими лекарственными средствами, что ниже в настоящей заявке описано более подробно. При совместном введении с одним или более веществ антагонист IL-21 и/или IL-21R можно вводить либо одновременно, либо последовательно со вторым веществом. В случае последовательного введения лечащий врач может выбрать подходящую последовательность введения антагониста IL-21/IL-21R в комбинации с другими веществами.
[0144] Введение антагониста IL-21/IL-21R, применяемого в фармацевтической композиции согласно настоящему изобретению или для осуществления способа согласно настоящему изобретению, можно выполнять разнообразными общепринятыми способами, такими как оральный прием внутрь, ингаляция либо подкожная или внутривенная инъекция. Иногда предпочтительным является внутривенное введение субъекту. Когда терапевтически эффективное количество агониста или антагониста IL-21/IL-21R вводят орально, связывающее вещество будет иметь форму таблетки, капсулы, порошка, раствора или эликсира. В случае введения в форме таблеток фармацевтическая композиция согласно настоящему изобретению может дополнительно содержать твердый носитель, такой как желатин или адъювант. Таблетка, капсула и порошок содержат приблизительно от 5 до 95% связующего вещества, а предпочтительно приблизительно от 25 до 90% связующего вещества. В случае введения в жидкой форме можно добавлять жидкий носитель, такой как вода, вазелин, масла животного и растительного происхождения, такие как арахисовой масло (хотя необходимо принять во внимание частоту аллергий на арахисовое масло в популяции), минеральное масло, соевое масло или синтетические масла. Жидкие формы фармацевтических композиций могут далее содержать физиологический раствор, раствор декстрозы или другого сахарида либо гликоли, такие как этиленгликоль, пропиленгликоль или полиэтиленгликоль. При введении в жидкой форме фармацевтическая композиция содержит приблизительно от 0.5 до 90% по массе связующего вещества, а предпочтительно приблизительно от 1 до 50% связующего вещества.
[0145] Если терапевтически эффективное количество антагониста IL-21/IL-21R вводят путем внутривенной, кожной или подкожной инъекции, связующее вещество должно иметь форму апирогенного, пригодного для парентерального введения раствора. Получение пригодных для парентерального введения растворов белков с учетом рН, изотоничности, стабильности и т.п. находится в пределах существующего уровня техники. Предпочтительная фармацевтическая композиция для внутривенных, кожных или подкожных инъекций может содержать, в дополнение к связующему веществу, изотоническую среду, такую как раствор хлорида натрия для инъекций, раствор Рингера для инъекций, раствор декстрозы для инъекций, раствор Рингера с лактатом для инъекций и другие среды, известные в данной области. Фармацевтическая композиция согласно настоящему изобретению может также содержать стабилизаторы, консерванты, буферы, антиоксиданты и другие добавки, известные в данной области.
[0146] Количество антагониста IL-21/IL-21R в фармацевтической композиции согласно настоящему изобретению будет зависеть от природы и тяжести состояния, которое лечат, и от природы лечения, которому субъект уже подвергался ранее. Окончательно количество связующего вещества, которое следует вводить конкретному субъекту, будет определять лечащий врач. Лечащий врач начнет лечение с введения малых доз и будет следить за реакцией субъекта. Можно увеличивать дозу вводимого связующего вещества до достижения оптимального терапевтического эффекта у субъекта, а после этого следует прекратить увеличение дозировки. Предполагается, что различные фармацевтические композиции, применяемые для реализации способа согласно настоящему изобретению, будут содержать от приблизительно 0.1 мкг до приблизительно 100 мг антагониста IL-21/IL-21R на один кг массы тела.
[0147] Продолжительность внутривенного лечения с применением фармацевтической композиции согласно настоящему изобретению будет варьироваться в зависимости от тяжести нарушения, которое лечат, а также состояния и возможной идиосинкразической реакции каждого конкретного субъекта. Предполагается, что продолжительность каждого применения антагониста IL-21 /IL-21R может лежать в пределах от 12 до 24 часов непрерывного внутривенного введения. Также предусмотрено подкожное (s.c.) лечение с применением композиций согласно настоящему изобретению. Эти способы терапии можно применять ежедневно, один раз в неделю, или, более предпочтительно, один раз в две недели или один раз в месяц. Также предусмотрено, что антагонист IL-21/IL-21R может представлять собой малую молекулу (например, для орального введения), и лекарственные действия можно применять ежедневно, два раза в день, три раза в день и т.д. Окончательное решение о подходящей продолжительности внутривенного или подкожного введения лекарственных средств либо лечения малыми молекулами, а также о времени применения лечебных действий будет принимать лечащий врач.
[0148] Ожидается, что полинуклеотиды и белки согласно настоящему изобретению будут проявлять один или более из эффектов и видов биологической активности (включая связанные с описанными в настоящей заявке способами анализа (тестами)), указанных ниже. Эффекты или виды активности, описанные для белков, антител или полинуклеотидов согласно настоящему изобретению, можно обеспечить путем введения или применения таких белков или антител либо путем введения или применения полинуклеотидов, кодирующих такие белки или антитела (такие как, например, средства генной терапии или векторы, подходящие для введения ДНК).
Комбинированная терапия
[0149] В одном способе реализации при комбинированной терапии вводят фармацевтическую композицию, содержащую по меньшей мере один антагонист IL-21R/IL-21, например, антитело к IL-21R/IL-21, и по меньшей мере одно лечебное средство. Такая терапия подходит для лечения патологических состояний или нарушений, таких как иммунные и/или воспалительные нарушения. Термин "в комбинации" в данном контексте означает, что содержащую антагонист композицию и лечебное средство вводят по существу одновременно, либо в один момент, либо последовательно. При последовательном введении, в момент начала введения второго соединения, в сайте введения все еще может обнаруживаться эффективная концентрация первого соединения.
[0150] Например, комбинированная терапия может включать по меньшей мере один антагонист IL-21R/IL-21, содержащийся в одной лекарственной форме и/или вводимый совместно с по меньшей мере одним дополнительным лекарственным средством. Дополнительные средства могут включать по меньшей мере один ингибитор цитокина, ингибитор фактора роста, иммунодепрессант, противовоспалительный агент, ингибитор метаболизма, ингибитор фермента, цитотоксический агент или цитостатический агент, которые описаны ниже более подробно. В такой комбинированной терапии можно успешно применять более низкие дозировки терапевтических агентов, что позволяет избежать возможной токсичности или осложнений, связанных с различными монотерапиями. Более того, описанные в настоящей заявке лекарственные средства действуют на пути, отличные от пути IL-21/IL-21R, и поэтому ожидается, что они действуют синергетически с анатагонистами IL-21R/IL-21.
[0151] Лекарственные средства, применяемые в комбинации с анатагонистами IL-21R/IL-21, могут представлять собой средства, которые нарушают различные стадии аутоиммунного и последующего воспалительного ответа. В одном способе реализации описанный в настоящей заявке по меньшей мере один антагонист IL-21R/IL-21 можно готовить в одной лекарственной форме с и/или вводить вместе с по меньшей мере одним антагонистом цитокина и/или фактора роста. Антагонисты цитокина и/или фактора роста могут включать растворимые рецепторы, ингибиторы, являющиеся пептидами, низкомолекулярные молекулы, рекомбинантные конструкции с лигандами, антитела (которые связывают цитокины или факторы роста и их рецепторы, или другие молекулы поверхности клетки) и "противовоспалительные цитокины" и их агонисты.
[0152] Неограничивающие примеры средств, которые можно применять в комбинации в описанными в настоящей заявке антагонистами IL-21R/IL-21, включают, без ограничения, антагонисты по меньшей мере одного интерлейкина (например, IL-1, IL-2, BL-6, IL-7, IL-8, IL-12, IL-13, IL-15, IL-16, IL-17, IL-18 и IL-22); цитокина (например, ФНОα, LT (лимфотоксин), ЕМАР-II (эндотелиально-моноцитарно активирующий пептид) и GM-CSF (фактор, стимулирующий колонии гранулоцитов-макрофагов)) или фактора роста (например, FGF (фактор роста фибробластов) и PDGF (тромбоцитарный фактор роста)). Такие средства могут также включать, без ограничения, антагонисты по меньшей мере одного рецептора к интерлейкину, цитокину и фактору роста. Антагонисты IL-21R/IL-21 можно также комбинировать с ингибиторами, например, например, антител к молекулам поверхности клеток, таким как CD2, CD3, CD4, CD8, CD20 (например, ингибитор CD20 риуксимаб (RITUXAN®)), CD25, CD28, CD30, CD40, CD45, CD69, CD80 (В7.1), CD86 (В7.2), CD90 или их лиганды, включая CD154 (gp39 or CD40L), или LFA-1/ICAM-1 и VLA-4/VCAM-1 (Yusuf-Makagiansar et al. (2002) Med Res. Rev. 22: 146-67). Другие соединения, которые можно применять в комбинации с антагонистами IL-21R/IL-21, описанными в настоящей заявке, могут включать антагонисты и рецепторы к IL-1, IL-12, ФНОα, IL-15, IL-17, IL-18 и IL-22.
[0153] Примеры средств, которые можно применять в комбинированных терапевтических средствах с антагонистом IL-21R/IL-21, включают антагонисты IL-12 (такие как антитела, которые связывают IL-12 (см., например, WO 00/56772); ингибиторы рецептора IL-12 (такие как антитела к рецептору IL-12); и растворимый рецептор IL-12 и его фрагменты. Примеры антагонистов IL-15 включают антитела против IL-15 или его рецептора, растворимые фрагменты рецептора IL-15 и белки, связывающие IL-15. Примеры антагонистов IL-18 включают антитела к IL-18, растворимые фрагменты рецептора IL-18 и белки, связывающие IL-18 (IL-18BP, Mallat et al. (2001) Circ. Res. 89: E41-45). Примеры антагонистов IL-1 включают ингибиторы фермента, преобразующего интерлейкин-1 (ICE) (такие как Vx740), антагонисты IL-1 (например, IL-1RA (анакинра (KINERET™), Amgen)), sIL-1RII (Inimunex), и антитела к рецептору IL-1.
[0154] Примеры антагонистов ФНО включают антитела к ФНО (например, ФНОα человека), такие как D2E7 (анти-ФНОα антитело человека. Патент США №. 6,258,562, HUMRA™, Abbott Labs); CDP-571/CDP-870/BAY-10-3356 (гуманизированные анти-ФНОα антитела, Celltech/Pharmacia); cA2 (химерное анти-ФНОα антитело, REMICADE™, Centocor); и фрагменты анти-ФНО антитела (например, CPD870). Другие примеры включают фрагменты и производные растворимого рецептора ФНО (например, р55 или р75 человека), такие как р55 kdTNFR-IgG (рекомбинантный белок: рецептор к ФНО-IgG массой 55 кДа, LENERCEPT™) и 75 kdTNFR-IgG (рекомбинантный белок: рецептор к ФНО-IgG массой 75 кДа, ENBREL™ (этанерцепт (etanercept) - Immunex)). См., например, Van der Poll et al. (1997) Blood. 89: 3727-34; Mori et al. (1996) J. Immunol. 157: 3178-82. Другие примеры включают антагонисты ферментов (например, ингибиторы фермента, преобразующего ФНОα (ТАСЕ), такого как производное альфа-сульфонил гидроксамовой кислоты (WO 01/55112), или ингибиторы N-гидроксиформамида (GW 3333, -005 или -022, GlaxoSmithKline) и TNF-bp/s-TNFR (растворимый белок, связывающий ФНО, см., например, Lantz et al. (1991) J Clin Invest. 88:2026-31; Kapadia et al. (1995) Amer. J. Physiol. Heart Circ. Phys. 268:H517-25). Антагонисты ФНО могут представлять собой растворимые фрагменты и производные рецептора ФНО (например, р55 или р75 человека), такие как 75 kdTNFR-IgG, и ингибиторы фермента, преобразующего ФНОα (ТАСЕ).
[0155] В других способах реализации антагонисты IL-21R/IL-21, описанные в настоящей заявке, можно вводить в комбинации с по меньшей мере одним из следующего: антагонисты IL-13, такие как растворимые рецепторы IL-13 и/или антитела против IL-13; и антагонисты IL-2, такие как рекомбинантные белки IL-2 (например, DAB 486-IL-2 и/или DAB 389-IL-2 производства Seragen, см., например, Sewell et al. (1993) Arthritis Rheum. 36: 1223-33) и анти-IL-2R антитела (например, анти-Тас (гуманизированное антитело, Protein Design Labs, see Junghans et al. (1990) Cancer Res. 50: 1495-502). Другая комбинация включает антагонисты IL-21R/IL-21 в комбинации с неистощающими анти-СD4 ингибиторами, такими как IDЕС-GE9.1/SB 210396 (анти-CD4 антитело, GlaxoSmithKline). Другие комбинации включают антагонисты IL-21R/IL-21 с CD80 (В7.1) и CD86 (В7.2), антагонисты ко-стимулирующих путей (такие как антитела, растворимые рецепторы или антагонистические лиганды); гликопротеиновый лиганд Р-велектина (PSGL) и ингибиторов PSGL-1 (такие как антитела к PSGL и/или PSGL-1 и низкомолекулярные ингибиторы); вещества, истощающие Т-клетки и В-клетки (такие как анти-GD4 или анти-CD22 антитела), а также противовоспалительные цитокины и их агонисты (например, антитела). Противовоспалительные цитокины могут включать IL-4 (например, Schering-Plough Biopharma); IL-10 (например, SCH 52000, рекомбинантный IL-10, Schering-Plough Biopharma); IL-11; IL-13; и ТФРβ или их агонисты (например, агонистические антитела).
[0156] В других способах реализации по меньшей мере один антагонист IL-21R/IL-21 можно включить в одну лекарственную форму с и/или вводить совместно с по меньшей мере одним противовоспалительным лекарственным средством, иммунодепрессантом, ингибитором метаболизма или ингибитором фермента. Неограничивающие примеры препаратов или ингибиторов, которые можно применять в комбинации с антагонистами IL-21R/IL-21, описанными в настоящей заявке, включают, без ограничения, по меньшей мере одно из следующего: нестероидные противовоспалительные препараты (НСПВП) (включая, без ограничения, аспирин, салсалат, дифлюзинал, ибупрофен, кетопрофен, набуметон, пироксикам, напроксен, диклофенак, индометацин, сулиндак, толметин, этодолак, кеторолак, оксапрозин, тенидап, мелоксикам, пироксикам, ацекдофенак, толметин, тиапрофеновая кислота, нимезулид и т.д.); сульфалазин; кортикостероиды (такие как преднизолон); противовоспалительные препараты, подавляющие цитокины (CSAID); ингибиторы биосинтеза нуклеотидов (например, антагонист фолата, такой как метотрексат)); и ингибиторы биосинтеза пиримидинов, например ингибитор дигидроортат дегидрогеназы (ДГОДГ, DHODH), такой как лефлюномид (см., например, Kraan et al. (2004) Ann. Rheum. Dis. 63: 1056-61). Терапевтические препараты для применения в комбинации с антагонистами IL-21/IL-21R могут включать один или более ингибиторов НСПВП, CSAID, ДГОДГ (такие как лефлюномид) и антагонистов фолатов (таких как метотрексат).
[0157] Примеры дополнительных веществ, которые можно применять в комбинации с антагонистами IL-21/IL-21R, включают по меньшей мере одно из следующего: кортикостероиды (для орального применения, ингаляций или местных инъекций); иммунодепрессанты (такие как циклоспорин и такролимус (FK-506)); ингибитор белка mTOR (такой как сиролимус (рапамицин) или аналог и/или производное рапамицина, например эфир рапамицина, такой как CCI-779 (см., например, Elit (2002) Curr. Opin. Investig. Drugs 3: 1249-53; Huang et al. (2002) Curr. Opin. Investig. Drugs 3: 295-304)); средство, которое действует на сигнальные воспалительные цитокины, такие как TNFα и IL-1 (например, IRAK, NIK, IKK, р38 или ингибитор МАР-киназы); ингибиторы TPL-2, Mk-2 и NFKb; ингибиторы СОХ-2 (например, целекоксиб, рофекоксиб и т.д. и их варианты); ингибиторы фосфодиэстеразы (такие как Rolipram (Ролипрам)); ингибиторы фосфолипазы (например, ингибитор цитозольной фосфолипазы 2 (cPLA2), такой как аналоги трифторметил кетона (Патент США №6,350,892)); ингибиторы фактора роста клеток эндотелия сосудов (VEGF); ингибиторы рецептора VEGF, ингибиторы ангиогенеза; RAGE (рецептор для конечных продуктов гликолиза) и растворимый RAGE; агонист бета-рецептора эстрогена (ERB), антагонисты ERB-NFκb; интерферон-β (например, IFN β-1a и IFN β-1b); Copaxone (Копаксон) и кортикостероиды.
[0158] Другие полезные лечебные средства, которые можно комбинировать с антагонистом IL-21R/IL-21, включают: буденозид; эпидермальный фактор роста; аминосалицилаты; 6-меркаптопурин; азатиоприн; метронидазол; ингибиторы липоксигеназы; мезаламин; олсалазин; балсалазид; антиоксиданты; ингибиторы тромбоксана; факторы роста; ингибиторы эластазы; соединения пиридил-имидазола; предшественники преднизолона, конъюгированные с глюкоронидом или декстраном; дексаметазон или будезонид; антисмысловые фосфоротиоат олигонуклеотиды ICAM-1 (ISIS 2302; Isis Pharmaceuticals, Inc.); растворимый рецептор 1 к комплементу (ТР10; Т Cell Sciences, Inc.); месалазин замедленного высвобождения; антагонисты фактора активации тромбоцитов (PAF); кипрофлоксацин; лигноциан; циклоспорин А; гидроксихлорохин (PLAQUENIL™); миноциклин (MINOCIN™) и анакинра (KINERET™).
[0159] Выбор конкретного лечебного средства для введения в комбинации с антагонистом IL-21/IL-21R согласно настоящему изобретению будет в большой степени зависеть от таких факторов, как конкретный субъект, желаемая цель и выбранная продолжительность лечения. Такие решения находится в рамках опыта и знаний специалиста в данной области.
[0160] Дополнительные примеры терапевтических препаратов, которые можно комбинировать с антагонистом IL-21R/IL-21, включают один или более из следующих препаратов: 6-меркаптопурины (6-МР); азатиоприн; сульфасалазин; мезалазин; олсалазин; хлорохин, гидроксихлорохин (PLAQUENIL®); пенцилламин; ауротиомалат (для внутримышечного и орального применения); азатиоприн; колхицин; агонисты бета-2 адренорецептора (салбутамол, тербуталин, салметерол); ксантины (теофиллин, аминофиллин); хромогликат; недокромил; кетотифен; ипратропий; микофенолата мофетил; агонисты аденозины; антитромботические средства и адренэргические агенты.
[0161] В одном способе реализации антагонист IL-21R/IL-21 можно применять в комбинации с одним ли более антител, направленных к другим мишеням, участвующим в регуляции иммунных ответов. Неограничивающие примеры средств для лечения или предотвращения иммунных ответов, с которыми можно комбинировать антагонисты IL-21R/IL-21 согласно настоящему изобретению, включают, без ограничения, следующие: антитела против других молекул поверхности клеток, включая, без ограничения, CD25 (рецептор а к интерлейкину -2 -a), CD11a (LFA-1), CD54 (ICAM-1), CD4, CD45, CD28, CTLA4, ICOSL, ICOS, CD80 (В7.1) и/или CD86 (В7.2). В еще одном способе реализации антагонист IL-21R/IL-21 применяют в комбинации с одним или более препаратов общего иммуноподавляющего действия, такими как циклоспорин А или FK506. В другом способе реализации антагонист IL-21/IL-21R применяют в комбинации с агонистом CTLA4 (например, CTLA4 Ig - абатацепт (ORENCIA®)).
[0162] Полное содержание всех источников, патентов и опубликованных заявок на патент, ссылки на которые приведены в настоящей заявке, включены в нее по ссылке.
ПРИМЕРЫ
[0163] Приведенные ниже примеры обеспечивают иллюстративные способы реализации настоящего изобретения и никаким образом не ограничивают настоящее изобретение. Для среднего специалиста в данной области очевидны многочисленные другие способы реализации, которые включены в объем настоящего изобретения.
Пример 1: Материалы и методы
Пример 1.1: Мыши, паразитарные инфекции и препараты антигена
[0164] Самок или самцов мышей C57BL/6, C57BL/6/Ai-IL-10KO/IL-4KO и C57BL/6Ai-IL-10KO/IL-12KO получали из Taconic Farms (Germantown, NY (Нью-Йорк, США)) (Hoffmann et al. (1999) J. Immunol. 163: 927-938). Выведенные пары мышей IL-21R-/- с фоном C57BL/6 получали из колонии для разведения, размещенной в Гарвардской школе общественного здоровья (Boston, MA (Массачусетс, США)) (Kasaian et al. (2002) Immunity 16: 559-69). Всех мышей содержали в специфических беспатогенных условиях в Национальном институте Здоровья (National Institutes of Health) в виварии, одобренном американской ассоциацией по аккредитации ухода за лабораторными животными (American Association for the Accreditation of Laboratory Animal Care-approved facility). Все процедуры были одобрены комитетом по уходу и применению животных NIAED. Яйца S.mansoni извлекали из печеней инфицированных мышей (Biomedical Research Institute, Rockville, MD (Мериленд, США)). Чтобы вызвать образование синхронных первичных легочных гранулем, мышам внутривенно (i.v.) вводили 5,000 яиц. Чтобы вызвать образование вторичных гранулем, мышей сенсибилизировали путем интраперитонеального (i.p.) введения 5000 живых яиц, а затем инфицировали путем введения 5000 живых яиц i.v. (Wynn et al. (1994)/. Exp.Med. 179: 551-61). В экспериментах с инфицированием мышей инфицировали путем подкожной инъекции в хвост 25-30 церкарий Пуэрто-Риканского штамма S.mansoni (NMRT), которые получали из инфицированных моллюсков Biomphalaria glabrata (Biomedical Research Institufe, Rockville, MD (Мэриленд, США)). Растворимый антиген яиц (SEA) и препараты растворимых антигенов червей (SWAP) получали из очищенных и гомогенизированных яиц S.mansoni и взрослых паразитов описанным ранее способом (Cheever et al. (1994) J. Immunol. 153: 753-59). Всех животных в момент забоя подвергали перфузии, которая позволяет определить количество червей и яиц в тканях, как описано в других источниках (там же). Личинки Nippostrongylus brasiliensis (L3) готовили описанным ранее способом (Katona et al. (1983) J. Immunol. 130: 350-56). Мышам путем подкожной инъекции вводили 500 L3. На седьмой день после инокуляции собирали ткань легких и лимфатические узлы средостения для анализа на цитокины.
Пример 1.2: Гистопатология и фиброз
[0165] Размеры гранулем легких и печени определяли по гистологическим срезам, которые окрашивали красителем Wright's Giemsa (Histopath of America, Clinton, MD (Клинтов, Мэрилентд, США)). В каждый анализ включали около 30 гранулем на мышь. Опытный патолог оценивал процент эозинофилов, стволовых клеток и других типов клеток на одних и тех же срезах. Число яиц шистосом в кишечнике и содержания коллагена в печени, измеряемого по уровням гидроксипролина, определяли описанным ранее способом (Cheever et al., выше). В частности, коллаген печени измеряли как гидроксипролин по методике Bergman и Loxley (Bergman and Loxley (1963) Analytical Biochem. 35: 1961-65) после гидролиза 200-мг кусочка печени в 5 мл 6Н HCl при 110°С в течение 18 ч. Увеличение гидроксипролина в печени во всех экспериментах было прямо пропорционально числу яиц, а коллаген печени выражается как превышение нормального уровня коллагена печени в микромолях на 10000 яиц; (коллаген инфицированной печени - коллаген нормальной печени)/яйца в печени × 10-4 или в микромолях на пару червей. В поздние моменты хронической инфекции степень выраженности фиброза выражали как общий коллаген печени на печень. Все гистологические показатели оценивал один специалист, не информированный о плане эксперимента.
Пример 1.3: FACS-Анализ (сортировка клеток с возбужденной флюоресценцией)
[0166] Брали целые легкие и помещали в среду RPML. Ткани разрушали путем пропускания через сито с размером отверстий 7 микрон (BD Falcon, San Diego, СА (Сан-Диего, Калифорния, США) (Сан-Диего, Калифорния, США)). Суспензии отдельных клеток промывали и лизировали эритроциты путем инкубирования с лизирующим раствором ACK в течение 3 минут. Лимфоциты легких метили анти-CD4, меченными РЕ-Су5 вместе с антителами к FcR-Fc Block (оба антитела получали в BD Pharmingen, San Diego, СА (Сан-Диего, Калифорния, США)) в буфере для FACS в течение 15 мин при 4°С. После промывания клетки анализировали на приборе FACS Calibur с использованием программы FLOWJO™ (Treestar, Inc., Ashland, OR (Эшлэнд, Орегон, США)).
Пример 1.4: Эксперименты по блокированию IL-21 при помощи sIL-21R-Fc
[0167] Мышей C57BL/6 (10/группу) путем подкожной инъекции в хвост инфицировали 30-35 церкариями S.mansoni. Начиная с недели 6 после инфицирования мышей лечили либо mIL-21R-Fc (Wyeth Research), либо контрольным антителом IgG2a мыши против Е.tenella yeth Research). Каждая мышь получала одну дозу, равную 200 мкг, путем интраперитонеальной инъекции 3Х/неделю на протяжении 5 недель. Через 12 недель после инфицирования мышей умерщвляли и путем анализа на гидроксипролин оценивали фиброз печени.
Пример 1.5: Культура лимфоцитов и обнаружение цитокинов способом твердофазного иммуноферментного анализа (ELISA)
[0168] Лимфатические узлы селезенки и средостения (модель инфекции) или связанные с легкими лимфатические узлы (легочная модель) выделяли в асептических условиях и готовили суспензию отдельных клеток, как описано ранее (Hesse et al. (2000) Am. J. Pathol. 157: 945-55). Культуры инкубировали при 37°С во влажной атмосфете 5% СО2. Клетки подвергали стимуляции SEA (20 мкг/мл), SWAP (50 нг/мл), конкавалином A (Con A; 1 мкг/мл) или только средой. Через 72 часа собирали надосадочные жидкости и анализировали их на продукцию цитокинов. Измеряли количество IFN-γ, IL-5 и IL-10 путем твердофазного ИФА в модификации «сэндвич» с использованием парных антител (BD Pharmingen, San Diego, СА (Сан-Диего, Калифорния, США)), как описано выше (там же). Уровни цитокинов рассчитывали по стандартным кривым, построенным с использованием рекомбинантных цитокинов мыши (BD Pharmingen, San Diego, СА (Сан-Диего, Калифорния, США)). Уровни IL-13 измеряли с использованием наборов для твердофазного ИФА на IL-13 (R&D Systems, Minneapolis, MN (Миннеаполис, Миннесота, США)) согласно протоколу производителя. Уровни TGF-β1 измеряли с использованием аналитической системы DUOSET® ELISA для определения TGF-β1 мыши (R&D Systems, Minneapolis, MN (Миннеаполис, Миннесота, США)), следуя протоколу изготовителя. Чтобы избежать помех со стороны полученного из крупного рогатого скота TGF-β11, клетки 3 раза промывали в ФБР и культивировали в среде, содержащей 0.5% сыворотки мыши.
Пример 1.6: Выделение и очистка РНК и полимеразная цепная реакция в реальном времени
[0169] Тотальную РНК экстрагировали раздельно из ткани легкого и печени помещали в 1 мл реагента TRIZOL™ (Invitrogen, Carlsbad, CA (Карлсбад, Калифорния, США)). Образец гомогенизировали с использованием ткани, polytron (Omni International Inc., Marietta, GA (Мариетта, Джорджия, США)), и выделяли тотальную РНК, следуя рекомендациям производителя, которую подвергали дополнительной очистке и использованием набора RNEASY™ Mini Kit производства Qiagen (Qiagen Sciences, Germantown, MD (Джермантаун, Мэриленд, США)). РНК из отдельных образцов (1 мкг) подвергали обратной транскрипции с использованием SUPERSCRIPT Н™ (Invitrogen, Carlsbad, CA (Карлсбад, Калифорния, США)) и смеси олигов (dT) и случайных праймеров. Полимеразную цепную реакцию в режиме реального времени (RT-PCR) проводили на системе для детекции последовательностей ABI PRISM™ 7900 (Applied Biosystems, Foster City, CA (Фостер-Сити, Калифорния, США)). Определяли относительные количества мРНК для нескольких генов в присутствии универсальной смеси для ПЦР SYBR™ Green PCR Master Mix (Applied Biosystems, Foster City, CA (Фостер-Сити, Калифорния, США)) и способом сравнительного порогового цикла, согласно описанию Applied Biosystems для системы детекции последовательностей ABI PRISM™ 7700/7900 (Applied Biosystems, Foster City, CA (Фостер-Сити, Калифорния, США)). В этом способе уровни мРНК для каждого образца нормировали по уровням м РНК гидроксантин гуанин фосфорибозил трансферазы и затем выражали как относительное увеличение и уменьшение по сравнению с уровнями в неинфицированных контролях. Праймеры создавали с использованием ПО PRIMER EXPRESS™1 (Applied Biosystems, Foster City, CA (Фостер-Сити, Калифорния, США)). Праймеры для IL-13, IL-4, IL-10, HPRT (Hesse et al. (2001) J. Immunol. 167: 6533-44), IL-13Roc2 (Chiaramonte et al. (2003) J. Exp. Med. 197: 687-701), Yml, FIZZ1 и кислой хитиназы (AMCase) (Sandier et al., выше) были опубликованы ранее и включают:
[0170] IL-21
5' GCCAG ATCGC CTCCT GATTA 3' (смысловая) (SEQ ID NO: 28);
5' CATGC TCACA GTGCC CCTTT 3' (антисмысловая) (SEQ ID NO: 29);
[0171] IL-21R
5' CTCCC CCCTT GAACG TGACT 3' (смысловая) (SEQ ID NO: 30);
5' TTGCC CCTCA GCACG TAGTT 3' (антисмысловая) (SEQ ID NO: 31);
[0172] IFN-γ
5' AGAGC CAGAT ТАТСТ СТТTС TACCT CAG 3' (смысловая) (SEQ ID NO: 32);
5' CCTTT TTCGC CTTGC TGTTG 3' (антисмысловая) (SEQ ID NO: 33).
Пример 1.7: Анализ изотипов антител сыворотки и костномозговые макрофаги
[0173] Общее содержание IgE измеряли с использованием набора для твердофазного иммуноферментного анализа BD OPTEIA™ для определения IgE мыши (BD Biosciences Pharmingen, San Diego, CA (Сан-Диего, Калифорния, США)), следуя протоколу производителя. Титры специфичного к SEA IgG1 и специфичного к изотипу IgG2b антителу (Аb) оценивали путем непрямого твердофазного иммуноферментного анализа (ELISA). Планшеты IMMULON™ 4 (Thermo Labsystems Inc., Beverly MA (Беварли, Массачусетс, США)) покрывали 10 мкг/мл SEA (100 мкг/лунка), разбавленного в ФБР, и анализировали образцы сыворотки, используя последовательные двукратные разведения. Применяли конъюгат биотина с IgG1 кролика против AT мыши (Zymed, San Francisco, CA (Сан-Франциско, Калифорния, США)) в разведении 1:1000. После этого следовал фермент субстрата - помеченный пероксидазой стрептавидин (KPL, Gaithersburg, MD (Гайтерсберг, Мэриленд, США)) в разведении 1:1000. Конъюгированный с пероксидазой хрена IgG2b против антител мыши второго этапа (Zymed, San Francisco, CA (Сан-Франциско, Калифорния, США)) Ab применяли в разведении 1:1000. Поглощение в лунке считывали на длине волны 405 нм на считывающем устройстве VMAX™ Kinetic Microplate Reader (Molecular Devices) после добавления 100 мкл однокомпонентного субстрата пероксидазы - хромогена ABTS (KPL, Gaithersburg, MD (Гайтерсберг, Мэриленд, США)).
[0174] У самок мышей C57BL/6 выделяли костный мозг и культивировали его в чашках Петри (100×15 мм), содержащих дополненную среду DMEM (кондиционированная фибробластами L929 среда), на протяжении 6 дней. Через 6 дней клетки собирали и высаживали в концентрации 0.5×106 клеток/лунку в 24-луночные планшеты, содержащие дополненную среду DMEM (10% фетальной сыворотки, 2 мМ L-глютамина, 100 U/мл пенициллина и 100 мкг/мл стрептомицина). Клетки подвергали стимуляции IL-4, IL-13 и IL-21 (R&D, Minneapolis, MN (Миннеаполис, Миннесота, США)) на протяжении 20 часов. В некоторых способах анализа клетки предварительно обрабатывали IL-21. Клетки лизировали и очищали РНК, следуя процедуре очистки с использованием RNEASY™ (Qiagen Sciences, Germantown, MD (Джермантаун, Мэриленд, США)).
Пример 1.8: Анализ активности аргиназы
[0175] Макрофаги, полученные из костного мозга, помещали в 96-луночные культуральные планшеты в концентрации 6×105 на лунку и стимулировали в комбинациях IL-4, IL-13 и IL-21. За 6 часов до стимуляции IL-4 или IL-13 добавляли IL-21. После стимуляции клетки промывали ФБР и лизировали 0,1% раствором Triton X-100, содержащим ингибитор протеаз (Roche, Nutley, NJ (Натли, Нью-Джерси, США)). Лизаты переносили в 96-луночный планшет для ПЦР и инкубировали с 10 мМ MnCl2 и 50 мМ Tris HCl (рН 7.5) в течение 10 мин при 55°С, чтобы активировать фермент. После активации фермента в новом планшете удаляли 25 мкл лизата, добавляли 25 мкл 1М аргинина (рН 9.7) и инкубировали в течение 20 часов при 37°С. В 96-луночный планшет для твердофазного ИФА образца в дупликатах добавляли 5 мкл каждого образца вместе с 5 мкл каждого стандарта, разбавляли в идентичных условиях анализа, начиная с 100 мг/дл. Применяли реагент для определения мочевины из набора QUANTICHROM™ Urea Assay Kit (BioAssay Systems, Hayward, CA (Хейворд, Калифорния, США)) в соответствии с протоколом производителя.
Пример 1.9: Статистика
[0176] Выраженность фиброза печени (скорректированная по числу яиц) снижается при увеличении интенсивности инфекции (пары червей). Соответственно эти переменные сравнивали путем анализа ковариации с использованием логарифма общего количества яиц в печени и логарифма содержания гидроксипролина на яйцо. Переменные, которые не изменялись при изменении интенсивности инфекции, сравнивали по одностороннему критерию ANOVA или Стьюдента (Cheever et al., см. выше). Изменения экспрессии мРНК цитокинов и размер гранулемы оценивали с использованием ANOVA. Разности считали значимыми при р<0.05*, р<0.01** или р<0.001***.
Пример 2: Регуляция IL-21 и IL-21R в процессе поляризованных ответов Типа 1 и Типа 2
[0177] Чтобы исследовать регуляцию и функцию рецептора IL-21 in vivo, исследовали несколько разных экспериментальных систем Th2-зависимого воспаления, а также экспериментальную модель воспаления у нематоды (Pearce et al., выше; Wynn et al. (1994), выше). В каждом случае иммунный ответ животных дикого типа (WT) сравнивали с мышами, лишенными IL-21R (Hofiman et al., выше; Kasaian et al. (2002), выше).
[0178] По сравнению с IL-21 (Wurster et al. (2002), выше; Mehta et al. (2004) Immunol. Rev. 202: 84-95) о регуляции и функции DL-21 известно немногое. Чтобы определить, имеет ли место регуляция IL-21 и рецептора, к нему в процессе патологического ответа ТН2 in vivo применяли модель образования гранулемы под воздействием S.mansoni. Известно, что в этой модели цитокины ТН2 играют значительную роль в образовании повреждений (Pearce, MacDonald, выше). Предварительные исследования были призваны определить, связана ли экспрессия мРНК IL-21 и IL-21R с поляризованным ответом цитокинов ТН2 in vivo. Этого достигали путем использования мышей, у которых развиваются существенно избыточные ответы цитокинов ТН1 (IL-4-/-/IL-10-/-) или ТН2 (IL-12-/-/IL-10-/-) на введение яиц S.mansoni. У мышей IL-4-/-/IL-10-/- "ТН1" экспрессия мРНК IFN-γ в легких к 4 дню после иммунизации увеличивалась в 75 раз по отношению к фоновому уровню и оставалось приблизительно на уровне, приблизительно в 50 раз превышающем фоновый, вплоть до дня 14 (ФИГ.16А). У этих мышей ни в какой момент времени не удавалось обнаружить мРНК DL-13, что подтверждает предположение о высоко поляризованном воспалительном ответе ТН1. И напротив, мыши IL-12-/-/IL-10-/- "ТН2" демонстрировали 200-250-кратное увеличение количество мРНК IL-13 во все моменты времени после иммунизации, при этом уровень IFN-γ практически не изменялся или менялся незначительно. В противоположность цитокинам ТН1/ТН2, которые демонстрировали высоко поляризованный рисунок экспрессии, IL-21 не был связан с поляризованным фенотипом (ФИГ.16В). После иммунизации яйцами шистосомы уровни мРНК IL-21 повышались в обеих группах по меньшей мере в 50 раз по сравнению с фоном, хотя увеличение, наблюдаемое у ТН1-поляризованных мышей, в среднем было в 3-4 раза выше, чем у ТН2-поляризованных животных (ФИГ.16В; нижний рисунок). IL-21R также не был специфически связан с иммунным ответом ТН1 или ТН2. Однако, в отличие от IL-21, который был более выражен у животных с ответом, сдвинутым к ответу ТН1, максимальный ответ для IL-21R наблюдали у мышей со сдвинутым к ТН2 ответом (ФИГ.16В; верхний рисунок).
Пример 3: Продукция цитокинов в легких мышей, дефицитных по IL-21R, во время первичного ответа на яйца шистосомы снижена
[0179] Принимая во внимание значительное повышение экспрессии IL-21R у мышей, иммунизированных яйцами шистосом (ФИГ.16), в следующей серии экспериментов определяли, оказывала ли влияние передача сигнала через IL-21R на развитие ответа ТН2. В этих экспериментах интактным мышами дикого типа и мышам IL-21R-/- путем внутривенной инъекции вводили живые яйца шистосомы и следили за продукцией цитокинов ТН2 и регулируемых ТН2 генов в легких, селезенке и дренажных лимфатических узлах на протяжении последующих 14 дней. У мышей дикого типа экспрессия мРНК IL-21R после введения яиц быстро увеличивалась и оставалась повышенной на протяжении дня 14 (ФИГ.17А). IL-21 продемонстрировал аналогичный профиль с пиком экспрессии, возникающим в день 7 и слегка снижающимся впоследствии. Примечательно, что имело место устойчивое и значительное снижение экспрессии IL-21 у мышей IL-21R-/- в дни 7 и 14, что указывает на то, что IL-21R положительно влияет на экспрессию его собственного лиганда. С более ранними наблюдениями (Wynn et al. (1993) J. Immunol. 151: 1430-40; Vella and Pearce (1992) J. Immunol. 148: 2283-88) согласуется тот факт, что экспрессия цитокинов, ассоциированных с ТН2 IL-4 и IL-13, значительно возрастала в гранулематозных тканях мышей дикого типа, к дню 14 наблюдали возрастание в 5-15 раз. И напротив, имело место существенное снижение экспрессии мРНК IL-4 и IL-13 в тканях IL-21R-/-. Хотя между днем 4 и днем 14 после иммунизации у мышей дикого типа определяли незначительное изменение мРНК IFN-γ и IL-10, продукция IFN-γ и IL-10 у животных IL-21R-/- также снижается. Таким образом, сниженный ответ ТН2, который наблюдали у мышей IL-1R-/-, не был связан с повышенной продукцией цитокина ТН1. Снижение цитокинов ТН2 также было характерно для гранулематозных тканей, поскольку в культурах лимфатических узлов и лимфоцитов после in vitro стимуляции растворимым антигеном яиц (SEA) или митогенов (ФИГ.17В) наблюдали значительную продукцию цитокина ТН2. Фактически, SEA вызывал более мощные и устойчивые ответы IL-5, IL-10 и IL-13 в культурах лимфатических узлов, выделенных из мышей IL-21R-/-. Тем не менее, в соответствии со снижением ответа ТН2 в легких, у животных IL-21R-/- наблюдали более быстрое разрешение образования гранулемы (ФИГ.17С). Кроме того, имело место заметное снижение по нескольким генам, связанным с активацией Stat6 или макрофагов, активированных по альтернативному пути (ААМø) (Nair et al. (2005) Infect. Immun. 73: 385-94; Zhu et al. (2004) Science 304: 1678-82; Chiaramonte et al. (2003), выше; Gordon, S. (2003) Nat. Rev. Immunol. 3: 23-35), что является дополнительным свидетельством общего снижения эффекторного ответа ТН2 у мышей IL-21R-/- (ФИГ.17D).
Пример 4: Ответ ТН2 у мышей IL-21R-/- после инфицирования N. brasiliensis снижен
[0180] Чтобы определить, было ли снижение эффекторного ответа ТН2 специфичным по отношению к образованию легочной гранулемы под воздействием S.mansoni, мышей дикого типа и IL-21R-/- инфицировали кишечной нематодой N. brasiliensis. Инфекцию стимулировали путем инокуляции личинки третьей стадии (L3) под кожу. Зрелые паразиты мигрируют из сайта инокуляции и попадают в легкие через сердечно-сосудистую систему. Попав в легкие, паразиты вызывают мощный и высоко поляризованный ответ ТН2 (Urban et al. (1993) J. Immunol. 151: 7086-94), что подтверждает анализ экспрессии в легких (ФИГ.18А) и связанных с легкими лимфатических узлах (ФИГ.18В) нескольких генов, ассоциированных с ТН2. Легкие и лимфатические узлы мышей дикого типа продемонстрировали заметное увеличение экспрессии м РНК IL-4, IL-13, кислой хитиназы AMCase, FIZZ1/RELMla и Yml mRNA после инфицирования N. brasiliensis (ФИГ.18А и 18В). Однако, в согласии с моделью легочной гранулемы, в легких мышей IL-21R-/- наблюдали значительно сниженные уровни IL-4, IL-13 и кислой хитиназы AMCase, а также слегка сниженные уровни мРНК Yml и FIZZ1 (ФИГ.18А). Дренирующие лимфатические узлы продемонстрировали аналогичное снижение, хотя снижение Yml и FIZZ1 было более значительным, чем в лимфатических узлах (ФИГ.18В). Единственное другое существенное различие между двумя тканями состоит в ответе мРНК кислой хитиназы, которое было, по-видимому, ограничено легкими. Взятые вместе, эти данные подтверждают важную роль IL-21R в развитии ответа ТН2 in vivo. Примечательно, однако, что несмотря на развитие значительно измененного ответа ТН2, мыши IL-21R-/-, инфицированные N.brasiliensis, не демонстрировали значительной задержки изгнания взрослых червей (не показано).
Пример 5: Воспаление в легких мышей IL-21-/-, направляемое цитокинами типа 2, снижено
[0181] Следующая серия экспериментов была направлена на то, чтобы определить, модулирует ли IL-21R развитие вторичных ответов ТН2. Для этих экспериментов мышей дикого типа и IL-21R-/- сенсибилизировали яйцами S.mansoni и иммунизировали внутривенно 2 неделями позже. Как и ожидалось, у сенсибилизированных мышей развивался гранулематозный ответ, который в 4-5 раз превосходил (ФИГ.19С) ответ у животных, иммунизированных без предварительной сенсибилизации (ФИГ.17С). Как наблюдали в первичной модели, имело место значительное увеличение мРНК IL-21 и IL-21R в легких после воздействия яиц, хотя пик ответа IL-21 при повторной иммунизации наступал значительно раньше. IL-21R увеличивался лишь умеренно по сравнению с IL-21, хотя его уровень оставался значительно повышенным в оба момента времени, в то время как уровни мРНК IL-21 после достижения пика в день 4 снижались (ФИГ.19А). Это является свидетельством более жесткой регуляции лиганда в тканях. Также имело место заметное снижение экспрессии IL-21 у мышей IL-21R-/-, подтверждающее существование механизма мощной обратной связи между рецептором и лигандом. Из цитокинов, связанных с ТН2, наиболее устойчивый ответ давал IL-13, демонстрируя 50-100-кратное увеличение по сравнению с фоном у мышей дикого типа. Однако у мышей IL-21R-/- он снижался до уровня в 10-20 раз выше фонового, указывая на то, что для развития максимального вторичного ответа ТН2 необходим IL-21R. И снова снижение экспрессии цитокина ТН2 у мышей IL-21R-/- не сопровождалось значительным повышением IFN-γ. Фактически, экспрессия мРНК IFN-γ в легких мышей IL-21R-/- снижена. Тем не менее, нокауты продемонстрировали умеренное, но стойкое увеличение продукции IFN-γ в лимфатических узлах и селезенке, что указывает на большее общее ингибирование цитокинов ТН2 (ФИГ.19В). В соответствии с моделью первичной иммунизации яйцами снижение продукции цитокинов ТН2 и ТН1 было более выражено в гранулематозных тканях (ФИГ.19А), хотя вызванный SEA ответ ТН2 в селезенке был также частично снижен (ФИГ.19В). Значительное снижение вторичного гранулематозного воспаления согласуется с развитием более слабого ответа ТН2 в легком (ФИГ.19С). В дополнение, имело место значительное снижение экспрессии FIZZ1, Yml и кислой хитиназы AMCase (ФИГ.19D), что далее подтверждает значительное нарушение вторичных эффекторных ответов ТН2 у мышей IL-21R-/-.
Пример 6: Антитела IgG, образование гранулемы и цитокины 2 типа значительно снижены у инфицированных мышей, лишенных IL-21R
[0182] Затем, чтобы определить, необходима ли передача сигнала через IL-21 для поддержания хронического ответа с доминированием ТН2, животным подкожно вводили церкарии S.mansoni и анализировали патологические реакции и иммунные ответы в острый и хронический моменты. Как наблюдали в исследованиях легочной гранулемы, имела место заметная повышающаяся регуляция экспрессии мРНК IL-21R и IL-21 в печенях инфицированных мышей дикого типа. И наоборот, мРНК IL-21 у мышей IL-21R-/- был практически не обнаружим даже после хронической инфекции (ФИГ.20А). В острой стадии после инфицирования мыши IL-21R-/- также продемонстрировали заметное снижение экспрессии мРНК цитокина ТН2 (ФИГ.20А). Однако изменения и в этом случае были ограничены гранулематозными тканями, поскольку ответы лимфатического узла и спленоцитов в обеих группах были аналогичными ответам после стимуляции in vitro антигенами паразитов (ФИГ.20В). Единственное устойчивое различие, отмеченное в анализах, составляло 2-3-кратное снижение продукции IL-5 и IL-10 в культурах спленоцитов. У мышей IL-21R-/- на острой стадии постинфекции также развивались значительно меньшие гранулемы (ФИГ.20С), что согласуется со сниженными ответами мРНК IL-4 и IL-13 в печени (ФИГ.20А). Однако это не сопровождалось каким-либо видимым изменением процента эозинофилов в гранулемах (ФИГ.20С). Более внимательный микроскопический анализ поражений подтвердил отсутствие обнаруживаемых изменений в общем строении гранулем (ФИГ.21А). Также провели эксперименты с целью определить, является ли влияние отсутствия IL-21R на рекрутинг CD4+ Т-клеток в гранулематозные ткани специфическим. Для исследования этого вопроса использовали модель легочной гранулемы, чтобы синхронизировать рекрутинг клеток воспаления. Однако, в соответствии с результатами микроскопической оценки гранулем печени (ФИГ.21А), проценты CD4+ Т-клеток в легких у мышей дикого типа и мышей IL-21R-/- был близким как до, так и после введения яиц (ФИГ.21B). Таким образом, рекрутинг или распространение CD4+ Т-клеток, вероятно, не может объяснить снижение ответа цитокинов Th1/Th2, наблюдаемое в этих тканях. Вместо этого они, видимо, являются результатом более общего снижения воспалительного ответа в целом. Важно, что в обеих группах имело место эффективное понижающее изменение к неделе 12 после инфицирования (Pearce and MacDonald, выше). Следовательно, в момент хронической инфекции нет значительной разницы в размере гранулемы (ФИГ.20С). У «нокаутированных» мышей с хронической инфекцией наблюдали лишь минимальное нарушение ответа цитокинов ТН2 (ФИГ.20А). Заметное снижение по FIZZ1 и Yml, которое наблюдали в острой стадии, также было уменьшено у животных IL-21R-/- с хронической инфекцией (ФИГ.20D). Тем не менее, экспрессия кислой хитиназы оставалась заметно низкой в неделю 12, что позволяет сделать вывод об устойчивом сокращении по меньшей мере части ответов, направляемых ТН2, у мышей IL-21R-/- с хронической инфекцией.
[0183] Мышей IL-21R-/- также исследовали на предмет изменения уровней антител в сыворотке (ФИГ.22). В соответствии с тем, что ответы цитокинов у них подавлены (ФИГ.20А), мыши IL-21R-/- продемонстрировали значительное снижение титров специфичного к паразиту IgG1 (антитело, ассоциированное с ТН2) и IgG2b (антитело, ассоциированное с ТН1), которое сохранялось до момента развития хронической инфекции (ФИГ.22В). Интересно, однако, что это снижение не сопровождалось значительными изменениями IgE (FIG, 22C), что позволяет сделать вывод о селективном нарушении, затрагивающем только часть изотипов антител сыворотки. Было показано, что экзогенный IL-21 ингибирует продукцию IgE (Suto et al. (2002) Blood 100:4565-73), что может объяснить легкое повышение IgE у мышей IL-21R-/- с хронической инфекцией. Важно, что общее снижение реактивности 2 типа у мышей IL-21R-/- не объяснялось различиями в количестве паразитов, поскольку во все моменты времени в тканях обеих групп обнаруживали близкие количества яиц и взрослых спаренных особей (ФИГ.22А).
Пример 7: Отсутствие IL-21R замедляет прогрессирование фиброза печени
[0184] Поскольку считают, что цитокины ТН2 играют основную роль в тканевом фиброгенезе (Wynn (2004), выше), исследовали развитие и прогрессирование фиброза печени у инфицированных S.mansoni мышей IL-21R-/-. Измеряли уровень гидроксипролина, который является прямой мерой содержания коллагена, в печени в разные моменты времени после инфицирования. Как и ожидалось, у инфицированных мышей дикого типа наблюдали заметный фиброз печени (ФИГ.22D). Мыши IL-21R-/-, напротив, продемонстрировали значительно меньший фиброз в моменты времени острой и хронической инфекции. Следует отметить, что к неделе 29 после инфицирования мыши IL-21R-/- демонстрировали снижение общего коллагена печени более чем на 50% по сравнению с мышами дикого типа (ФИГ.22Е), что подтверждает важную и необходимую роль IL-21R в прогрессировании ТН2-зависимого фиброза.
[0185] Провели эксперименты с целью исследовать, способен ли ингибитор IL-21 замедлить прогрессирование фиброза у инфицированных мышей дикого типа. Для этих экспериментов группы мышей C57BL/6 подвергали действию sIL-21R-Fc или контрольного белка на протяжении периода общей продолжительностью 5 недель, начиная с недели 6 после инфицирования, приблизительное время, когда в печени начинают обнаруживаться яйца. Хотя количества паразитов и яиц в ткани в двух группах были близкими (данные не показаны), мыши, получавшие блокатор IL-21, на момент окончания эксперимента продемонстрировали снижение фиброза печени более чем на 50% (ФИГ.22F). Также была снижена экспрессия мРНК IL-4 и IL-13 в печени, а размер гранулемы был меньше приблизительно на 15% (данные не показаны). Таким образом, эти данные дополняют эксперименты, проведенные с мышами IL-21R-/-.
Пример 8: Передача сигнала через IL-21 стимулирует развитие макрофагов, активированных по альтернативному пути
[0186] Поскольку Arg-1, FIZZ1 и TGF-01 связывали с развитием фиброза, и экспрессия нескольких генов, регулируемых ТН2/Stat6, в пораженных тканях мышей IL-21R-/- была снижена (ФИГ.17-20) (см. также, Gordon, выше; Nair et al., выше), провели эксперименты с целью выяснить, имеет ли место прямая модуляция Arg-1, FIZZ1 и TGF-β1 в макрофагах после стимуляции интерлейкином IL-21. Arg-1 и FIZZ1 также являются хорошо известными маркерами макрофагов, активированных по альтернативному пути (ААМø) (Gordon, выше). Для этих исследований нарабатывали культуры макрофагов из костного мозга (ВММø), а затем стимулировали различными концентрациями IL-4, IL-13 и IL-21. Как и ожидалось, и IL-4, и IL-13 повышали экспрессию мРНК Arg-1 и FIZZ1, при использовании комбинации этих двух стимулов наблюдали аддитивный эффект (ФИГ.23А). Однако следует заметить, что хотя IL-21 не оказывал никакого влияния ни на один из генов, когда его применяли отдельно, культуры, которые готовили с IL-21, демонстрировали очень значительное увеличение экспрессии мРНК Arg-1 и FIZZ1, если их затем стимулировали IL-4 и IL-13 (ФИГ.23А). Та же комбинация существенно повышала функцию аргиназы в клетках (ФИГ.23В). И наоборот, IL-21 не оказывал влияния на уровни общего или активного TGF-β1 в надосадочных жидкостях культур (ФИГ.24). Неожиданно обработка только IL-21 значительно повышала экспрессию IL-4Rα и IL-13Rα1 (ФИГ.23С). IL-4 и IL-13, напротив, не оказывали никакого влияния, когда их применяли отдельно (ФИГ.23С), и не обнаруживали аддитивного эффекта при использовании в комбинации (не показано).
[0187] Поскольку IL-13Rα2 также может влиять на IL-13-зависимую передачу сигнала (Chiaramonte et al. (2003), выше; Mentink-Kane et al. Proc. Natl. Acad. Sci. U.S.A. 101: 586-90; Wood et al. (2003) J. Exp.Med. 197: 703-09), провели эксперименты с целью выяснить, регулирует ли IL-21 продуцирование IL-13Rα2. Поскольку IL-13Rα2 продуциреутся главным образом клетками, не участвующими в гемопоэзе, такими как фибробласты или гладкие мышцы (Chiaramonte et al. (2003), выше; Jakubzick et al. (2003) Am. J.Pathol. 162: 1475-86; Zheng et al. (2003) J. Allergy din. Immunol. I11: 720-28; Morimoto et al. (2006) J. Immunol. 176: 342-48), не удивительно, что не было свидетельств регуляции ложных рецепторов в макрофагах костного мозга (данные не показаны). Однако, когда исследовали регуляцию ложных рецепторов in vivo, IL-21 понижал экспрессию мРНК IL-13Rα2 в легких мышей, которым внутривенно вводили яйца, и значительно понижал уровни растворимого IL-13R2 в плазме этих мышей (ФИГ.23D). При совместном рассмотрении эти данные указывают на то, что IL-21 вносит свой вклад в развитие макрофагов, активированных по альтернативному пути, путем повышающей регуляции рецептора IL-4 2 типа (сигнальный рецептор) в макрофагах и одновременного понижения уровней растворимого IL-13Rα2 (ложный рецептор) в плазме. Оба механизма, вероятно, вносят вклад в повышение активации Arg-1 и FIZZ1 в макрофагах, которые получили стимуляцию IL-4/IL-13. Поэтому они обеспечивают дополнительное механистическое объяснение нарушения ответов ТН2 и ТН2-зависимого фиброза у мышей IL-21R-/-, инфицированных гельминтами.
Пример 9: Обсуждение
[0188] IL-21 был описан недавно как цитокин ТН2, который способен ингибировать дифференцировку «необученных» клеток Т-хелперов (ТН) в продуцирующие IFN-γ клетки ТН1 (Wurster et al. (2002), выше). Поскольку иммунный ответ при шистосомозе переходит из раннего IFN-γ в устойчивый доминирующий ответ ТН2 (Pearce and MacDonald, выше), исследовали влияние передачи сигнала с участием IL-21R на развитие индуцированных гельминтами ответов ТН2. Инфицирование мышей дикого типа S. tnansoni приводило к повышению экспрессии IL-21 и IL-21R в печени, что подтверждает связь передачи сигнала через IL-21 с индуцированным гельминтами иммунитетом 2 типа. В легких, однако, яйца шистосомы вызывали значительную экспрессию IL-21 в ходе ответов, поляризованных как в сторону ТН1, так и ТН2. Фактически, экспрессия IL-21 повышалась в наибольшей степени, когда иммунный ответ у мышей был поляризован в сторону ответа ТН1. Эти данные позволяют предположить, что IL-21 демонстрирует менее ограниченный профиль экспрессии, чем связанные с ТН2 цитокины. Рецептор к IL-21 также не продемонстрировал ТН1/ТН2-специфичного профиля. Однако индукция рецептора IL-21 в легких у мышей с ответом, поляризованным в сторону Th, была почти в 4 раза выше, чем у мышей с ответом поляризованным в сторону (образования) ТН1, что является первым указанием на то, что передача сигнала через IL-21R может принимать участие в регуляции опосредуемого ТН2 воспаления.
[0189] Чтобы установить, происходит ли нарушение ответа эффекторов 2 типа в отсутствие IL-21R, исследовали экспрессию нескольких генов, индукция которых происходит, в основном, в условиях поляризации в сторону ТН2. Эти гены включают ген кислой хитиназы AMCase, Yml и FIZZ1, каждый из которых, как считают, играет важную и незаменимую роль в регуляции воспаления, опосредуемого ТН2 (Zhu et al., выше; Chiaramonte et al. (2003), выше; Nair et al., выше; Mentink-Kane et al., выше; Guo et al. (2000) J. BioLChem. 275: 8032-37). Хотя и наблюдали некоторые вариации при первичном, вторичном и хроническом иммунных ответах, в каждом случае мыши IL-21R-/- демонстрировали очень значительное снижение по этим связанным с ТН2 генам. Yml и AMCase являются членами семейства белков, которые гомологичны хитиназам низших организмов (Nair et al., выше). Хотя их точная функция в иммунных реакциях остается невыясненной, считают, что они играют важные роли в хемотаксисе эозинофилов, ремоделировании тканей и фиброзе. В самом деле, недавние исследования показали, что нейтрализация кислой хитиназы может снизить выраженность направляемого аллергеном воспаления и гиперреактивности дыхательных путей, что подтверждает участие хитиназ в иммунитете, связанном с ТН2 (Zhu et al., выше). FIZZ1 также связан с фиброгенезом в тканях (Mentink-Kane et al., выше; Liu et al. (2004) J. Immunol. 173: 3425-31). Следовательно, основная функция IL-21R может состоять в регулировании механизмов заживления ранений и фиброза. Следовательно, в дополнение к участию в индуцированных гельминтами иммунных ответах IL-21R может участвовать в регулировании воспалительных нарушений, опосредуемых ТН2.
[0190] При шистосомозе отсутствие IL-21R оказывает глубокое влияние на прогрессирование нарушения. Хотя интенсивность инфекции была одинаковой у мышей дикого типа и IL-21R-/-, индуцируемый яйцами воспалительный ответ в отсутствие IL-21R был значительно снижен. Также имели место значительное снижение вторичного образования гранулемы и более быстрое разрешение первичных гранулем в легких. Совместно эти данные иллюстрируют незаменимую роль IL-21R в гранулематозном воспалении. Более ранние исследования показали, что IL-4 и IL-13 необходимы для образования лезий (Pearce and MacDonald; выше), поэтому считают, что IL-21R непосредственно или опосредованно влияет на активность этих цитокинов. Эти исследования указывают на то, что IL-21 не действует отдельно, поскольку у мышей с двоим нокаутом по IL-4/IL-10 наблюдали чрезвычайно высокие уровни IL-21, хотя у указанных животных, у которых отсутствуют ТН2, образование гранулем практически полностью прекращается (Hoffmann et al. (2000) J. Immunol. 164: 6406-16; Sandier et al. (2003) J. Immunol. 171: 3655-67). Таким образом, при формировании максимального ответа IL-21, по-видимому, действует совместно с IL-4 и IL-13. Описанные в настоящей заявке данные показывают, что нет ни обнаруживаемого изменения в клеточном составе гранулем у мышей IL-21R-/, ни специфического нарушения рекрутинга CD4+ Т-клеток. Взятые вместе, эти открытия позволяют предположить, что IL-21R регулирует развитие индуцированной паразитами патологии путем модулирования общей интенсивности эффекторного ответа ТН2.
[0191] Не считают, что IL-21 непосредственно регулирует индуцируемую IL-4 дифференцировку клеток ТН2 (Suto et al., выше; Wurster et al. (2002), выше). Вместо этого, в недавней статье было выдвинуто предположение о том, что IL-21, возможно, усиливает ответы, направляемые ТН2, путем понижающей регуляции распространения IFN-γ-продуцирующих клеток ТН1 (Wurster et al. (2002), выше). Поэтому была выдвинута теория, что ответ IFN-γ у мышей, инфицированных шистосомой, может увеличиться в отсутствие рецептора к IL-21. Хотя in vitro наблюдали небольшое увеличение в связанных с легкими лимфатических узлах, продукция IFN-γ в гранулематозных тканях была значительно снижена. Таким образом, исследования не показали, что эндогенный IL-21R играет значительную роль в подавлении продукции IFN-γ при вызванной гельминтами инфекции. Тем не менее, в то же время у мышей IL-21R-/- образовывались более слабые ответы цитокинов ТН1 и ТН2 в тканях. Значительное снижение титров антител IgG2b (связанный с ТН1) и IgG1 (связанный с ТН2) после инфицирования свидетельствует в пользу этого заключения. Также имело место снижение ТН2 на уровне мРНК как в легких, так и в лимфатических узлах после инфицирования N. brasiliensis. В самом деле, все прямые данные, полученные ex vivo, подтвердили заметное снижение экспрессии и функции цитокинов ТН2 в пораженных тканях. Тем не менее, значительное снижение продукции цитокинов ТН2 выделенными лимфоцитами после повторной стимуляции антигенов отсутствовало, что позволяет предположить, что мыши IL-21R-/- способны к формированию существенных ответов ТН2, по меньшей мере in vitro. Таким образом, описанные в настоящей заявке данные указывают на то, что IL-21R селективно увеличивает ответы ТН2 в тканях. В дополнение к стимуляции ответа ТН2, IL-21R увеличивал также продукцию IL-21. Таким образом, IL-21R, по-видимому, действует аутокринно, направляя экспрессию цитокинов ТН2 и эффекторных ответов 2 типа in vivo.
[0192] Для дальнейшего выяснения задействованных механизмов провели эксперименты с целью определить, модулирует ли IL-21 функцию макрофагов непосредственно, поскольку данные, полученные in vivo, показывают заметное снижение по нескольким генам, которые связывали с фенотипом "активации по альтернативному пути" (Gordon, выше; Mantovani et al. (2005) Immunity 23: 344-46). Макрофаги и фибробласты, демонстрирующие фенотип активации по альтернативному пути, являются основными клеточными компонентами индуцированных шистосомами гранулем, а исследования функций указывают на то, что они играют критическую роль в прогрессировании нарушения (Hesse et al. (2001), выше). И в самом деле, исследование, проведенное Brombacher et al., показало, что у мышей, у которых полностью отсутствуют макрофаги, активированные по альтернативному пути, после инфицирования S.mansoni развивается летальная патология, вызванная яйцами (Herbert et al. (2004) Immunity 20: 623-35). Кроме того, поскольку TGF-β1 из макрофагов вовлечены в механизмы опосредуемого интерлейкином IL-13 фиброза (Lee et al. (2001) J. Exp. Med. 194: 809-21; Fichtaer-Feigl et al. (2006) Nat. Med. 12: 99-106), провели эксперименты с целью выяснить, модулирует ли IL-21 продукцию TGF-β1 в макрофагах. Для исследования этого вопроса измеряли ответы мРНК Arg-1 и FIZZ1, активность аргиназы и белка TGF-β1 в макрофагах из костного мозга после стимуляции различными комбинациями IL-21, IL-4 и IL-13. Гены Arg-1 и FIZZ1 являются зависимыми от IL-4Ra/Stat6 (Liu et al., выше; Hesse et al. (2001), выше; Munder et al. (1998) J. Immunol. 160: 5347-54); следовательно, они служат функциональными маркерами активации макрофагов по альтернативному пути. Важно, что эти открытия указывают на то, что когда макрофаги подвергали действию IL-21, они становились значительно более чувствительными к активности IL-4 и IL-13 по стимуляции Arg-1 и FIZZ1. Активность аргиназы, оцениваемая по продукции мочевины, также была значительно повышена, что подтверждает роль IL-21 как важного стимула развития высокофункциональных макрофагов, активированных по альтернативному пути. IL-21, напротив, не влиял на продуцирование TGF-β1 макрофагами. Таким образом, профиброзный цитокин TGF-β1 действительно, по-видимому, вовлечен, что согласуется с более ранними исследованиями, в которых изучали роль TGF-β1 в шистосомозе (Kaviratne et al. (2004) J. Immunol. 173:4020-29). Вместо этого, IL-21 значительно повышал экспрессию IL-4Rα и IL-13Rα1 в макрофагах костного мозга и снижал продукцию растворимого ложного рецептора IL-13 in vivo, что, по-видимому, объясняет их повышенную чувствительность к IL-4 и IL-13. Таким образом, эти данные дополняют исследования in vivo с мышами IL-21R-/- и позволяют сделать предположение о том, что важная функция передачи сигнала через IL-21R состоит в усилении развития ААМø, которые вовлечены в механизмы фиброза (Hesse et а1. (2001), выше; Hesse et al. (2000), выше). Более того, поскольку было показано, что ААМø усиливает дифференцировку CD4+ ТН2-клеток (Bonecchi et al. (1998) Blood 92: 2668-71), эти данные могут также объяснить общее снижение индуцированной гельминтами активности ТН2 у мышей IL-21R-/-.
[0193] При шистосомозах у животных, отличных от человека, развитие фиброзной патологии печени является главной причиной хронических заболеваний и смертности (Pearce and MacDonald, выше; Wynn et al. (2004) Immunol. Rev. 201: 156-67). Поскольку известно, что ответ цитокинов ТН2 играет важную роль в накоплении коллагена (Wynn et al. (2004), выше), в финальной серии экспериментов исследовали влияние IL-21R на прогрессирование фиброза печени. Следует отметить, что развитие фиброза было значительно снижено у мышей IL-21R-/-, причем у мышей с нокаутом генов наблюдали снижение фиброза печени более чем на 50% к 29 недели после инфицирования. Важно, что аналогичные данные получили при введении мышам дикого типа sIL-21R-Fc. Таким образом, установили, что рецептор к IL-21 может быть новой мишенью противофиброзной терапии. В заключение, эти исследования иллюстрируют незаменимую роль IL-21R в прогрессировании заболевания, опосредуемого цитокинами ТН2. Поэтому EL-21 R следует добавить к списку важных рецепторов, которые регулируют иммунитет 2 типа и поляризацию макрофагов.
Пример 10: Профилактическое лечение
[0194] Ниже приведен неограничивающий набор примеров профилактического лечения.
[0195] Субъекту, у которого диагностировали цирроз печени, вводили рекомбинантный белок IL-21R с целью снизить накопление фиброзной ткани в печени. Рекомбинантный белок IL-21R включает аминокислоты 1-235 последовательности SEQ ID NO: 2, присоединенные С-концом через линкер (соответствующий аминокислотам 236-243 последовательности SEQ ID NO: 17) к мутированной Fc-последовательности иммуноглобулина Gl (IgGl) (соответствующей аминокислотам 244-467 последовательности SEQ ID NO: 17).
[0196] Субъекту, у которого диагностировали инфекцию шистосомой, вводят растворимый фрагмент IL-21R с целью снизить накопление фиброзной такни. Этот фрагмент состоит из аминокислот 20-538 последовательности SEQ ID NO: 2.
[0197] После хирургического вмешательства субъекту вводили антитело IL-21R с целью снизить накопление фиброзной такни, причиной которого является хирургическая операция, в процессе заживления.
[0198] Субъекту, у которого диагностировали цирроз печени, вводят антитело IL-21 с целью снизить накопление фиброзной ткани в печени.
Реферат
Группа изобретений относится к медицине и касается лечения и профилактики фиброза или состояний, ассоциированных с фиброзом. Для этого предложен способ введения пациенту терапевтически эффективного количества вещества (соединения), которое снижает уровень IL-21 и/или IL-21R. Необходимое для этого вещество устанавливают фактом снижения уровня IL-21 и/или IL-21R в представляющих интерес клетке или образце до и после приведения их в контакт с этим веществом. Предложены также способы идентификации соединений для лечения, основанные на установлении указанного снижения уровней IL-21 и/или IL-21R. Способы мониторинга прогрессирования, а также прогнозирования течения заболевания связаны с оценкой динамики уровня IL-21 и/или IL-21R в клетке или образце, взятом у субъекта, в различные периоды времени течения заболевания. Кроме того, предложен способ диагностики путем сравнения уровня IL-21 и/или IL-21R в клетке или образце, взятых у субъекта, с эталонным их уровнем. Более высокий уровень IL-21 и/или IL-21R по сравнению с эталонным уровнем указывает на фиброз и/или ассоциированное с фиброзом состояние у субъекта. Группа изобретений позволяет своевременно выявлять, контролировать течение, успешно лечить и предупреждать заболевание за счет впервые установленной роли IL-21 и/или IL-21R в возникновении и развитии фиброза различных органов и систем. 7 н. и 11 з.п. ф-лы, 2 табл., 24 ил.
Формула
(a) измерения уровня IL-21 и/или IL-21R в представляющих интерес клетке или образце;
(b) приведения представляющих интерес клетки или образца в контакт с соединением; и
(c) измерение уровня IL-21 и/или IL-21R в представляющих интерес клетке или образце после контакта с указанным соединением, при этом более низкий уровень IL-21 и/или IL-21R в представляющих интерес клетке или образце после контакта по сравнению с эталонным уровнем IL-21 и/или IL-21R идентифицирует указанное вещество, полезное для лечения, уменьшения выраженности или профилактики фиброза или ассоциированного с фиброзом состояния у субъекта.
Документы, цитированные в отчёте о поиске
Композиции и способы регуляции клеточной активности nk

Комментарии