Трипептиды - RU2669939C2
Код документа: RU2669939C2
Чертежи






Описание
Настоящее изобретение относится к трипептидным соединениям и их применению в качестве лекарственных средств, в частности в качестве противовоспалительных средств.
Лечение воспаления имеет большое значение в медицине. Однако существующих способов лечения недостаточно, или они являются проблематичными. Транзиторное воспаление является полезным механизмом, защищающим млекопитающих от инвазивных патогенных факторов. Однако неконтролируемое воспаление, вызываемое врожденным или адаптивным иммунным ответом, может приводить к повреждению тканей и боли и является первопричиной множества заболеваний, включая астму, а также других аллергических, инфекционных, аутоиммунных, дегенеративных и идиопатических заболеваний. Существующие способы лечения часто демонстрируют небольшое, запоздалое или только временное действие, нежелательные побочные эффекты и/или отсутствие селективности.
Ввиду большого количества типов воспаления и заболеваний, ассоциированных с воспалением и недостатка доступных в настоящее время лекарственных средств, существует большая необходимость в новых активных средствах для эффективного лечения этих заболеваний и их симптомов без неблагоприятных иммуносупрессорных воздействий.
В WO88/00833 описано применение трипептида Lys-Pro-Val для получения лекарственного средства для лечения воспаления.
В WO02/064131 описаны ингибирующие воспаление соединения, такие как Lys-Pro-Thr.
WO02/094856 относится к аналогам и пептидомиметикам глицил-L-пролил-L-глутаминовой кислоты (GPE)
В WO03/002593 описаны ингибиторы дипептидилпептидазы IV (DPP IV).
В WO2007/080194 описано применение ингибиторов трипептидилпептидазы II (TPP II) для увеличения эффективности лечения злокачественных опухолей посредством гамма-облучения.
В WO2007/088099 описано применение ингибиторов TPP II при лечении ишемии и нейродегенерации.
В WO2009/000296 описано применение ингибиторов TPP II при лечении аутоиммунных и воспалительных заболеваний и отторжения трансплантата.
В WO2009/000297 описано применение ингибиторов TPP II для применения в комбинации с химиотерапией при лечении злокачественной опухоли.
В WO2012/102832 описано лечение расстройств аутического спектра с применением глицил-L-2-метилпролил-L-глутаминовой кислоты.
Изобретение основано на цели получения новых соединений, которые можно использовать в качестве фармацевтически активных соединений, в частности, для борьбы с воспалением. Другой целью настоящего изобретения является предоставление таких соединений с увеличенной стабильностью и улучшенной биодоступностью, одновременно являющихся надежными и безопасными для пациентов.
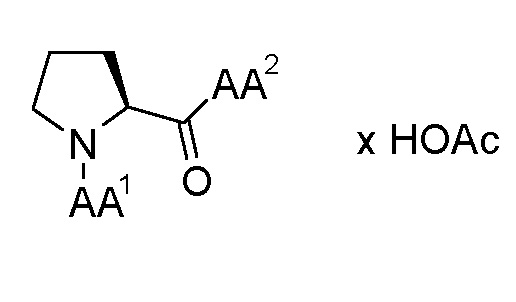
Этих целей достигают, предоставляя трипептидные соединения (далее в настоящем документе также "соединения") общей формулы (I), как представлено ниже или их сольваты или гидраты или их фармацевтически приемлемые соли:

где:
AA1 выбран из α-аминокислот, Nα-метиламинокислот и Nα,Nα-диметиламинокислот; и
AA2 выбран из α-аминоизомасляной кислоты (Aib), трет-бутилглицина, амида α-аминоизомасляной кислоты, трет-бутилглицинамида, Nα-метиламинокислот и амидов Nα-метиламинокислот.
Неожиданно выявлено, что эти новые соединения по изобретению можно эффективно использовать в качестве фармацевтически активных соединений в лекарственных средствах, в частности, для лечения воспалительных заболеваний, так как они одновременно обладают увеличенной стабильностью и улучшенной биодоступностью по сравнению с соединениями, известными на известном уровне техники. Кроме того, у них отсутствуют нежелательные побочные эффекты и безопасны для пациентов, не демонстрируя токсичности.
Термин "амид" по настоящему изобретению включает -C(O)NH2, -C(O)NHR и -C(O)NR2, где R представляет собой C1-C6 алкил. Предпочтительно термин амид означает -C(O)NH2.
Кроме того, термин C1-C6-алкил по настоящему изобретению, включает метил, этил, н- и и-пропил, н- и и-бутил, н- и и-пентил и н-и i-гексил. C6-C10-арил включает любое ароматическое C6-C10-кольцо. Предпочтительно оно представляет собой фенил. Галоген предпочтительно включает Cl, Br и I.
Кроме того, по изобретению используют следующие определения:
По изобретению предпочтительны трипептидные соединения общей формулы (1), как указано выше, где
(1) AA1 выбран из α-аминокислот, Nα-метиламинокислот и Nα,Nα-диметиламинокислот; и AA2 выбран из α-аминоизомасляной кислоты, трет-бутилглицина, амида α-аминоизомасляной кислоты и трет-бутилглицинамида, или
альтернативно, где
(2) AA1 выбран из α-аминокислот, Nα-метиламинокислот и Nα,Nα-диметиламинокислот; и AA2 выбран из Nα-метиламинокислот и амидов Nα-метиламинокислот.
Более предпочтительными по изобретению являются трипептидные соединения (далее в настоящем документе также "соединения") общей формулы (2):

где AA1 выбран из α-аминокислот, Nα-метиламинокислот и Nα,Nα-диметиламинокислот; и AA2 выбран из Nα-метиламинокислот и амидов Nα-метиламинокислот.
Эти соединения обуславливают дополнительную улучшенную эффективность, в частности при лечении воспалительных заболеваний, и увеличенные стабильность и биодоступность.
По дополнительному предпочтительному варианту осуществления изобретения в трипептидных соединениях общей формулы (1) и/или общей формулы (2) AA1 представляет собой Nα,Nα-диметиламинокислоту, а AA2 представляет собой Nα-метиламинокислоту, соответственно.
Nα-метиламинокислоты и Nα,Nα-диметиламинокислоты в определении AA1 по изобретению предпочтительно выбраны из группы, состоящей из Nα-метил-1-Nal, Nα,Nα-диметил-1-Nal, Nα-метил-2-Nal, Nα,Nα-диметил-2-Nal, Nα-метил-Abu, Nα,Nα-диметил-Abu, Nα-метил-Ala, Nα,Nα-диметил-Ala, Nα-метил-Arg, Nα,Nα-диметил-Arg, Nα-метил-Asn, Nα,Nα-диметил-Asn, Nα-метил-Cha, Nα,Nα-диметил-Cha, Nα-метил-Cit, Nα,Nα-диметил-Cit, Nα-метил-Cys, Nα,Nα-диметил-Cys, Nα-метил-Dab, Nα,Nα-диметил-Dab, Nα-метил-Dap, Nα,Nα-диметил-Dap, Sar, Nα,Nα-диметил-Gly, Nα-метил-His, Nα,Nα-диметил-His, Nα-метил-Hle, Nα,Nα-диметил-Hle, Nα-метил-Homophe, Nα,Nα-диметил-Homophe, Nα-метил-Ile, Nα,Nα-диметил-Ile, Nα-метил-Leu, Nα,Nα-диметил-Leu, Nα-метил-Lys, Nα,Nα-диметил-Lys, Nα-метил-Met, Nα,Nα-диметил-Met, Nα-метил-Nle, Nα,Nα-диметил-Nle, Nα-метил-Nva, Nα,Nα-диметил-Nva, Nα-метил-Orn, Nα,Nα-диметил-Orn, Nα-метил-Phe, Nα,Nα-диметил-Phe, Nα-метил-Phg, Nα,Nα-диметил-Phg, Nα-метил-Ser, Nα,Nα-диметил-Ser, Nα-метил-трет-бутил-Gly, Nα,Nα-диметил-трет-бутил-Gly, Nα-метил-Tic, Nα-метил-Thr, Nα,Nα-диметил-Thr, Nα-метил-Trp, Nα,Nα-диметил-Trp, Nα-метил-Tyr, Nα,Nα-диметил-Tyr, Nα-метил-Val, Nα,Nα-диметил-Val, Nα-метил-2-тиенилаланина, Nα,Nα-диметил-2-тиеналанина, Nα-метил-3-бензотиенилаланина, Nα,Nα-диметил-3-бензотиенилаланина, Nα-метил-2-пиридилаланина, Nα,Nα-диметил-2-пиридилаланина, Nα-метил-3-пиридилаланина и Nα,Nα-диметил-3-пиридилаланина. Phe можно замещать одним или несколькими заместителями, выбранными из группы -NH2, -NH(C1-C6-алкил), -N(C1-C6-алкил)2, -CH2NH2, -CH2NH(C1-C6-алкил), -CH2N(C1-C6-алкил)2, OH, галогена, -CN, CF3, -NHC(O)CH3, -C(O)CH3, -OC1-C6-алкила, -C(O)NH2 и -C1-C6-алкила.
Nα-метиламинокислоты и амиды Nα-метиламинокислот в определении AA2 по изобретению предпочтительно выбраны из группы, состоящей из Nα-метил-Abu-OH, Nα-метил-Ala-OH, Sar-OH, Nα-метил-Hle-OH, Nα-метил-Ile-OH, Nα-метил-Leu-OH, Nα-метил-Nle-OH, Nα-метил-Nva-OH, Nα-метил-Ser-OH, Nα-метил-трет-бутил-Gly-OH, Nα-метил-Thr-OH, Nα-метил-Val-OH, Nα-метил-Abu-NH2, Nα-метил-Ala-NH2, Sar-NH2, Nα-метил-Hle-NH2, Nα-метил-Ile-NH2, Nα-метил-Leu-NH2, Nα-метил-Nle-NH2, Nα-метил-Nva-NH2, Nα-метил-Ser-NH2, Nα-метил-трет-бутил-Gly-NH2, Nα-метил-Thr-NH2 и Nα-метил-Val-NH2.
α-аминокислоты по изобретению включают все аминокислоты с аминогруппой в α-положении относительно карбоксильной группы. Предпочтительно, в определение AA1 по изобретению α-аминокислоты выбраны из группы, состоящей из 1-Nal, 2-Nal, Abu, Ala, Arg, Asn, Cha, Cit, Cys, Dab, Dap, Gly, His, Hle, Homophe, Ile, Leu, Lys, Met, Nle, Nva, Orn, Phe, Phg, Ser, трет-бутил-Gly, Tic, Thr, Trp, Tyr, Val, 2-тиенилаланина, 3-бензотиенилаланина, 2-пиридилаланина и 3-пиридилаланина. Phe может быть замещен одним или несколькими заместителями, выбранными из группы -NH2, -NH(C1-C6-алкил), -N(C1-C6-алкил)2, -CH2NH2, -CH2NH(C1-C6-алкил), -CH2N(C1-C6-алкил)2, OH, галогена, -CN, CF3, -NHC(O)CH3, -C(O)CH3, -OC1-C6-алкила, -C(O)NH2 и -C1-C6-алкила. Более предпочтительно AA1 выбран из Lys, Orn, Nle и Phe.
Предпочтительные трипептидные соединения по настоящему изобретению представляют собой трипептидные соединения, где в общей формуле (1) AA1 выбран из Lys, Orn, Nle, Phe, Nα-метил-Phe, Nα,Nα-диметил-Nle и Nα,Nα-диметил-Phe, а AA2 представляет собой α-аминоизомасляную кислоту, трет-бутилглицин и амид α-аминоизомасляной кислоты.
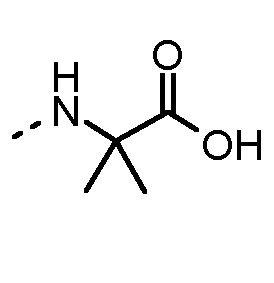
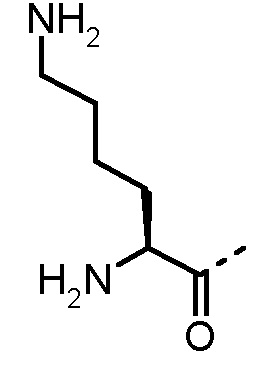
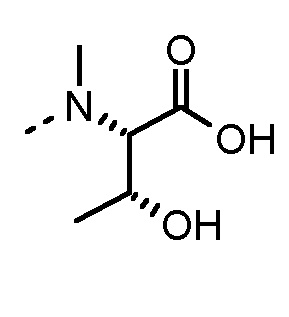
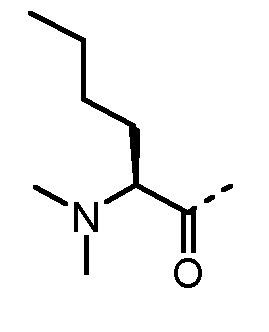
Особенно предпочтительные трипептидные соединения по настоящему изобретению выбраны из группы, состоящей из H-(L)-Lys-(D)-Pro-Aib-OH, H-(L)-Lys-(D)-Pro-Nα-метил-(L)-Thr-OH, H-(L)-Lys-(L)-Pro-Aib-OH, H-(L)-Lys-(L)-Pro-(L)-трет-бутил-Gly-OH, Nα,Nα-диметил-(L)-Lys-(D)-Pro-Nα-метил-(L)-Thr-OH, H-(L)-Lys-(L)-Pro-Aib-NH2, H-(L)-Orn-(L)-Pro-Aib-OH, H-(L)-Nle-(L)-Pro-Aib-OH, H-(L)-Phe-(L)-Pro-Aib-OH, Nα,Nα-диметил-(L)-Lys-(D)-Pro-Nα-метил-(L)-Thr-NH2, Nα,Nα-диметил-(L)-Lys-(D)-Pro-Nα-метил-(L)-Val-OH, Nα,Nα-диметил-(L)-Nle-(D)-Pro-Nα-метил-(L)-Thr-OH, Nα-метил-(D)-Phe-(L)-Pro-Aib-OH, H-(D)-Phe-(L)-Pro-Aib-OH, Nα,Nα-диметил-(L)-Phe-(L)-Pro-Aib-OH, Nα,Nα-диметил-(L)-Nle-(L)-Pro-Aib-OH или Nα,Nα-диметил-(L)-Phe-(D)-Pro-Nα-метил-(L)-Thr-OH или их сольватов или гидратов или их фармацевтически приемлемых солей.
Кроме того, соединения по изобретению можно применять в форме их кислот или их оснований или в форме их солей, в частности физиологически приемлемых солей, или в форме их сольватов, в частности их гидратов.
Фармацевтически приемлемые соли могут представлять собой соли присоединения оснований. Они включают соли соединений по изобретению с неорганическими основаниями, такими как гидроксиды щелочных металлов, гидроксиды щелочноземельных металлов, или с органическими основаниями, такими как моно-, ди- или триэтаноламин.
Дополнительно можно использовать соли присоединения кислот, в частности с неорганическими кислотами, так какими соляная кислота, серная кислота или фосфорная кислота, или с подходящими органическими карбоновыми или сульфоновыми кислотами или с аминокислотами.
Фармацевтически приемлемые соли соединений по изобретению выбирают, например, из группы, включающей хлориды, бромиды, йодиды, гидрохлориды, гидробромиды, сульфонаты, метансульфонаты, сульфаты, гидросульфаты, сульфиты, гидросульфиты, фосфаты, нитраты, метаноаты, ацетаты, пропионаты, лактаты, цитраты, глутараты, малеаты, малонаты, малаты, сукцинаты, тартраты, оксалаты, фумараты, бензоаты, п-толуолсульфонаты и/или соли аминокислот, предпочтительно протеиногенных аминокислот.
Соединения по изобретению пригодны для использования в качестве лекарственных средств. Они способны к проявлению анальгетического, жаропонижающего, противозудного, противовоспалительного и/или спазмолитического действия. Соединения и лекарственные средства, содержащие соединения, по изобретению предпочтительно применяют в способе терапевтического и/или профилактического лечения заболеваний, выбранных из группы, включающей острые и хронические воспалительные заболевания, острую и хроническую боль, зуд, гипонатриемию, отек, непроходимость кишечника, кашель и глаукому. Дополнительные заболевания, которые можно лечить по изобретению, представляют собой РС (рассеянный склероз), болезнь Паркинсона и болезнь Альцгеймера.
В предпочтительных вариантах осуществления соединения по изобретению можно использовать в частности для терапевтического и/или профилактического лечения, диагностики и/или терапии воспалительных заболеваний.
Изобретение также относится к применению соединений по изобретению для получения лекарственного средства для терапевтического и/или профилактического лечения воспалительных заболеваний.
Связанные с болью заболевания по изобретению в частности представляют собой заболевания, включающие боль вследствие воспалительных реакций (также называемые связанными с воспалительной болью заболеваниями и воспалительной болью).
Кроме того, воспалительные заболевания по изобретению выбраны из группы, включающей сердечно-сосудистое воспаление, неврологическое воспаление, воспаление тканей скелета, воспаление кожи, воспаление мышц, воспаление желудочно-кишечного тракта, воспаление глаз, воспаление уха, воспаление вследствие укусов насекомых и воспаление вследствие заживления ран; атеросклероз, ишемию, рестеноз и васкулит; астму, синдром Шегрена, воспаление легких, хроническое воспаление дыхательных путей и хроническое обструктивное заболевание легких (COPD), аллергию, псориаз, псориатический артрит, экзему, склеродермию, атопический дерматит и системную красную волчанку, артрит, синовит, остеомиелит, ревматоидный артрит, остеоартрит и анкилозирующий спондилит; септицемию и септический шок, диабет, нарушение толерантности к глюкозе, резистентность к инсулину и ожирение, колит, язвенный колит, болезнь Крона, IBD и IBS и воспалительные заболевания и состояния вследствие пролиферации опухолей, метастазы опухолей или отторжение трансплантата (болезнь "трансплантат против хозяина"; GvHD).
В частности, воспалительные заболевания выбраны из группы, включающей воспалительные заболевания желудочно-кишечного тракта, в частности воспалительные заболевания кишечника, такие как болезнь Крона и/или язвенный колит, острые или хронические воспалительные изменения с воспалением желчного пузыря, воспалительные псевдополипы, глубокий кистозный колит, кистозный пневматоз кишечника, панкреатит, аппендицит, сердечно-сосудистое воспаление вследствие атеросклероза, ишемию, рестеноз и/или васкулит, сепсис, септицемию, аллергии, астму, синдром Шегрена, воспаление легких, хроническое воспаление дыхательных путей, хроническое обструктивное заболевание легких (COPD), пролиферацию опухолей, метастазы опухолей, отторжение трансплантата, воспалительные заболевания суставов, такие как ревматоидный артрит, вульвовагинит, и/или воспалительные заболевания головного мозга, кожи, волосяных фолликулов, мочеполовых путей и глаз, синусит, тендосиновит, бурсит, тендинит, латеральный эпикондилит, адгезивный капсулит, остеомиелит, остеоартрическое воспаление, воспаление глаз, воспаление уха и/или аутоиммунное воспаление, псориаз, псориатический артрит, контактный дерматит, атопическую экзему, склеродермию и другие фиброзирующие заболевания, системную красную волчанку, крапивницу, красный плоский лишай, лимфому и/или аллергические заболевания или заболевания, характеризуемые участием тучных клеток.
Зуд (чесотка), в частности пруритоцептивный зуд, представляет собой частый симптом при заболеваниях кожи, как правило, ощущаемый в качестве типа болевого стимула. Ощущение зуда вызывает желание расчесывать пораженную область. Кожа, повреждаемая при расчесывании, дополнительно предоставляет инфекционным патогенным микроорганизмам хорошую питательную среду и нередкими являются воспаления поврежденных расчесыванием областей кожи. Кроме того, сами чесотка и расчесывание могут вызывать воспалительную реакцию. Зудные заболевания кожи и волос выбраны из группы, включающей зуд, псориаз, псориатический артрит, контактный дерматит, атопическую экзему, очаговую алопецию, склеродермию и другие фиброзирующие заболевания, системную красную волчанку, крапивницу, красный плоский лишай, лимфому и/или аллергические заболевания или заболевания, характеризуемые участием тучных клеток.
Заболевания по настоящему изобретению также включают другие заболевания, такие как гипонатриемия, отек, непроходимость кишечника, кашель, глаукому, РС (рассеянный склероз), болезнь Паркинсона и болезнь Альцгеймера.
Органы, подверженные заболеваниям, подлежащим лечению соединениями по изобретению в частности представляют собой так называемые барьерные органы, а именно желудочно-кишечный тракт, кожа, легкие, мочеполовые пути; головной мозг; ухоносоглоточные пути; зубы; скелет; печень и волосы. Особенно предпочтительные варианты осуществления изобретения относятся к лечению заболеваний барьерных органов.
Заболевания желудочно-кишечного тракта выбраны из группы, включающей синдром раздраженного кишечника, повреждения желудка, желудочно-кишечные язвы, экзогенное и эндогенное повреждение слизистой желудочно-кишечного тракта, дисфункции желудочно-кишечного тракта, аденомы, в частности в кишечнике и/или юношеские полипы.
Заболевания легких (заболевания органов дыхания) включают воспалительное заболевание легких, обструктивные заболевания легких, такие как хроническое обструктивное заболевание легких (COPD), рестриктивные заболевания легких, инфекции дыхательных путей, такие как инфекция верхних дыхательных путей, инфекция нижних дыхательных путей, злокачественные опухоли и доброкачественные опухоли, заболевания плевральной полости, легочные сосудистые заболевания и неонатальные заболевания.
Заболевания мочеполовых путей включают анальгетическую нефропатию, рак мочевого пузыря, цистоцеле (опущение мочевого пузыря), заболевание почек в конечной стадии (ESRD), гломерулонефрит, гломерулосклероз, синдром Гудпасчера, гематурия (кровь в моче), гемолитический уремический синдром, нефропатия с иммуноглобулином A (IgA), импотенция/эректильная дисфункция, интерстициальный цистит, рак почек, почечнокаменная болезнь, трансплантация почки, мужской фактор бесплодия, нефротический синдром, нейрогенный мочевой пузырь, болезнь Пейрони и поликистоз почек.
Дополнительные заболевания, которые можно лечить соединениями по настоящему изобретению, описаны в US 2011/0212882 A1, включенном в настоящий документ в качестве ссылки.
Предпочтительно трипептиды и лекарственные средства, содержащие трипептиды, используют для лечения и/или профилактики воспалительных заболеваний кожи, воспалительных заболеваний желудочно-кишечного тракта, воспалительных заболеваний (кровеносных) сосудов, аутоиммунного воспаления, аллергических реакций и/или реакций отторжения трансплантата.
Известно, что пептиды вообще и даже небольшие дипептиды, подобно карнозину, демонстрируют присущую им нестабильность (Goebel, ASB et al., Dermal Peptide Delivery Using Enhancer Molecules and Colloidal Carrier Systems - Part I: Carnosine, Skin Pharmacology & Physiology (2012), 25, 281-287). Кроме того, H-Lys-Pro-Val-OH (KPV) является очень нестабильным и легко разрушается, формируя under formation лизин-пролин-дикетопиперазин. Дополнительное преимущество соединений по изобретению является результатом того факта, что в водном растворе и в присутствии гомогенизированной ткани не наблюдают их разрушения или наблюдают сниженное разрушение.
Другим преимуществом соединений по настоящему изобретению является сниженная по сравнению с H-Lys-(D)-Pro-Thr-OH (K(D)PT) гидрофильность. Таким образом, соединения демонстрируют улучшенную проницаемость биологических барьеров. Кроме того, соединения по настоящему изобретению надежны и безопасны для пациентов. В частности, не выявлена токсичность. Таким образом, соединения по изобретению демонстрируют характеристики повышенной безопасности.
Соединения по изобретению или композиции/лекарственные средства, содержащие их, можно вводить системно или местно. Предпочтительно, соединения или композиции/лекарственные средства по изобретению вводят местно, в частности, в форме кремов, мазей, пластырей или настоек.
В контексте настоящего изобретения, термин "профилактическое лечение" следует понимать, как конкретно означающий, что соединения по изобретению можно вводить перед появлением симптомов заболеваний или при наличии риска заболевания.
Соединения по изобретению можно вводить общепринятыми способами, например, перорально, дермально, интраназально, трансмукозально, через легкие, энтерально, буккально, ректально, интрауретрально, аурально, посредством ингаляции, посредством инъекции, например, внутривенно, парентерально, интраперитонеально, интрадермально, подкожно и/или внутримышечно и/или местно, например, на болезненные области организма. Особенно предпочтительно пероральное введение.
Соединения по изобретению можно использовать в частности для получения лекарственных средств посредством введения в подходящую лекарственную форму по меньшей мере вместе с одним веществом-носителем или вспомогательным веществом, например, в форме инъекционных растворов, капель, соков, сиропов, спреев, суспензий, таблеток, наклеек, капсул, пластырей, суппозиториев, мазей, кремов, лосьонов, гелей, эмульсий, аэрозолей или в форме множества частиц, например, в форме шариков или гранул.
Кроме того, для перорального введения соединений по изобретению предпочтительны фармацевтические лекарственные формы с отсроченным высвобождением (состав с длительным высвобождением). Примеры составов с отсроченным высвобождением представляют собой таблетки с матриксом с длительным высвобождением, многослойные таблетки, покрытие, которые можно получать такими, чтоб они, например, были устойчивы к действию желудочного сока, например, покрытия на основе шеллака, капсулы с длительным высвобождением или составы с использованием биоразлагаемых полимеров, например, полимеры поли(молочной кислоты).
Для получения лекарственных средств можно использовать общепринятые физиологически приемлемые фармацевтические вспомогательные вещества, предпочтительно выбираемые из группы, включающей вещества-носители, наполнители, растворители, разбавители, средства для смачивания, эмульгаторы, красители, консерванты, дезинтегрирующие средства, смазочные средства, соли для воздействия на осмотическое давление, буферные вещества, ароматические и/или связывающие средства.
Соединения формулы (1) и формулы (2) по настоящему изобретению можно получать общеизвестными способами твердофазного синтеза пептидов, известными специалисту. Более подробное описание предоставлено в разделе примеров ниже.
Альтернативно, соединения формулы (1) и формулы (2) по настоящему изобретению также можно получать в растворе.
Краткое описание чертежей
Фигура 1 представляет собой диаграмму, которая демонстрирует анализ экспрессии генов провоспалительных цитокинов в первичных T-клетках человека. Клетки активировали PMA/иономицином и обрабатывали PBS, α-MSH, K(D)PT и примерами 3, 8 и 9, соответственно, в концентрации 10-9 M. Значения нормализованы на β-актин и представлены относительно экспрессии генов в стимулированных PBS клетках.
Фигура 2 представляет собой диаграмму, которая демонстрирует анализ экспрессии генов провоспалительных цитокинов в кератиноцитах человека (HaCaT). Клетки активировали PMA/иономицином и обрабатывали PBS, α-MSH, K(D)PT и примерами 3, 8 и 9, соответственно, в концентрации 10-9 M. Значения нормализованы на β-актин и представлены относительно экспрессии генов в стимулированных PBS клетках.
Фигура 3 представляет собой диаграмму, которая демонстрирует анализ экспрессии генов провоспалительных цитокинов в первичных T-клетках мышей. Клетки активировали PMA/иономицином и обрабатывали PBS, α-MSH, K(D)PT и примерами 3, 8 и 9, соответственно, в концентрации 10-9 M. Значения нормализованы на β-актин и представлены относительно экспрессии генов в стимулированных PBS клетках.
Фигура 4 представляет собой диаграмму, которая демонстрирует анализ экспрессии генов провоспалительных цитокинов в первичных T-клетках человека. Клетки активировали PMA/иономицином и обрабатывали PBS, α-MSH, K(D)PT, мофетилом микофенолата (MMF), дексаметазоном и примерами 5, 7, 12 и 13, соответственно, в концентрации 10-9 M. Значения нормализованы на β-актин и представлены относительно экспрессии генов в стимулированных PBS клетках.
Фигура 5 представляет собой диаграмму, которая демонстрирует анализ экспрессии генов провоспалительных цитокинов в кератиноцитах человека (HaCaT). Клетки активировали PMA/иономицином и обрабатывали PBS, α-MSH, K(D)PT, мофетилом микофенолата (MMF), дексаметазоном и примерами 5, 7, 12 и 13, соответственно, в концентрации 10-9 M. Значения нормализованы на β-актин и представлены относительно экспрессии генов в стимулированных PBS клетках.
Фигура 6 представляет собой диаграмму, которая демонстрирует анализ экспрессии генов провоспалительных цитокинов в первичных T-клетках мышей. Клетки активировали PMA/иономицином и обрабатывали PBS, α-MSH, K(D)PT, мофетилом микофенолата (MMF), дексаметазоном и примерами 5, 7, 12 и 13, соответственно, в концентрации 10-9 M. Значения нормализованы на β-актин и представлены относительно экспрессии генов в стимулированных PBS клетках.
ПРИМЕРЫ
Ниже подробно описаны примеры по изобретению. Различные символы и сокращения реагентов в них имеют следующие значения:
Аналитические способы
ВЭЖХ
Разделения посредством аналитической ВЭЖХ проводили на устройстве Abimed (D-Langenfeld) Gilson HPLC (концентрация образцов 1 мг/мл в H2O) с аналитической колонкой Reprospher C18-DE (5 мкм, 50×4,6 мм), произведенной Dr. Maisch (D-Ammerbuch). Использовали градиент воды/0,1% трифторуксусной кислоты (об./об.) (элюент A) и ацетонитрила/0,1% трифторуксусной кислоты (об./об.) (элюент B) со скоростью потока 1 мл/мин (10 мин способ).
Чистоту продуктов определяли на основе площадей пиков, определяемых при λ=214 нм.
ESI-РС
Анализ ESI-РС фракций проводили на масс-спектрометре ZQ Waters-Micromass (D-Eschborn).
Синтез пептидов, общие способы
Загрузка смолы
Все пептиды получали посредством твердофазного пептидного синтеза с использованием стратегии с Fmoc/tBu с использованием ClTCP (хлор-(2'-хлор)тритилполистирольной смолы H100 33, Rapp Polymere, Tübingen, Germany). Амиды пептидов синтезировали на амидной полистирольной смоле Rink (H100 23, Rapp).
Смолу ClTCP (емкость 1,48 ммоль/г) уравновешивали DMF в течение 10 мин и промывали DMF. В смолу добавляли раствор 1 экв. Fmoc-аминокислоты (относительно загрузки смолы) и 4 экв. DIPEA в DMF и перемешивали в течение 120 минут. Смолу отфильтровывали и промывали DMF. Смола покрывали 10 экв. метанола и 5 экв. DIPEA в DMF и промывали DMF, DCM и простым диэтиловым эфиром.
У смолы Rink (емкость 0,67 ммоль/г) снимали защиту с использованием 30% пиперидина в DMF (2×15 мин). После отмывки раствором DMF добавляли 3 экв. Fmoc-аминокислоты, 3 экв. TBTU и 6 экв. DIPEA в DMF. Смесь перемешивали в течение 180 минут. Смолу отфильтровывали и промывали DMF, DCM и простым диэтиловым эфиром. Завершенность проверяли посредством анализа с нингидрином.
После загрузки смолы плотность загрузки определяли посредством измерения оптической плотности в УФ. Поглощение молекул отщепленного Fmoc-дибензофульвена детектировали при 292 нм. Загрузка смолы для всех Fmoc-аминокислот составляла 0,5 ммоль/г, исключая N-Me-аминокислоты N-Me-Thr(tBu), трет-бутилглицин и N-Me-Val, результат замещения у которых составлял приблизительно 0,4 ммоль/г.
Способ связывания
Раствор 30% пиперидина в DMF добавляли в смолу и смесь инкубировали в течение 5 минут. Смолу отфильтровывали и способ повторяли в течение 15 минут. Смолу отфильтровывали и промывали DMF.
В смолу добавляли Fmoc-аминокислоты (3 экв.) растворяли с HOBt (3 экв.) в DMF. В смолу добавляли связывающие реагенты DIC (3 экв.) или TBTU (3 экв.) с DIPEA (6 экв.) и Fmoc-аминокислоты.
Через 180 мин (DIC) или 120 мин (TBTU) времени связывания связывающие реагенты отфильтровывали и смолу отмывали DMF, DCM и простым диэтиловым эфиром.
Связывание Fmoc-аминокислот со следующими N-Me-аминокислотами:
Смолу отмывали безводным THF и инкубировали с DIPEA (14 экв.) в безводном THF в течение 1-2 мин. Смолу отфильтровывали. Fmoc-аминокислоты (3,5 экв.) растворяли в растворе BTC в безводном THF (68 мМ). Добавляли 2,4,6-коллидин (10 экв.) и суспензию добавляли в смолу. Через 180 минут смолу отфильтровывали и промывали DCM, THF и DMF. Завершенность связывания контролировали тестом с хлоранилом.
N-концевое связывание Me2-аминокислот:
Me2-аминокислоты (3 экв.) растворяли в DMF с HOBt (3 экв.), 3 экв. HATU и DIPEA (6 экв.). Раствор добавляли в смолу и перемешивали в течение 2 часов. Смола отфильтровывали и промывали DMF, DCM и простым диэтиловым эфиром.
Отщепление
Пептиды отщепляли от смолы и снимали защиту боковых цепей трифторуксусной кислотой/TIS/водой (92,5/5/2,5) в течение 3 часов. Растворитель выпаривали в вакууме. Масло обрабатывали простым диэтиловым эфиром с осаждением и дважды промывали простым диэтиловым эфиром. Пептиды растворяли в трет-бутиловом спирте/воде (80/20) посредством обработки ультразвуком и лиофилизировали.
Для замены противоиона пептиды растворяли в уксусной кислоте (100 мг в 5 мл) и обрабатывали ультразвуком в течение 1 часа. Пептиды осаждали простым диэтиловым эфиром, декантировали, растворяли в трет-бутиловом спирте посредством обработки ультразвуком и лиофилизировали.
Все Fmoc-аминокислоты, стандартные защитные группы боковых цепей: tBu (Thr) и Boc (Lys, Orn, Dab).
Nα,Nα-диметиламинокислоты можно синтезировать, как описано в Garcia-Lopez, MT et al., Archiv der Pharmazie (1989), 322, 145-152.
Соединения, получаемые по настоящему изобретению, обобщены в таблицах 1 и 2 ниже.
БИОЛОГИЧЕСКИЕ АНАЛИЗЫ
A. Секреция цитокинов на уровне белка и экспрессии генов
Выделяли первичные T-клетки из периферической крови у здоровых добровольцев и из вторичных лимфатических органов у интактных мышей C57BL/6, соответственно. Для активации клеток их в течение 48 часов стимулировали форбол-12-миристат-13-ацетатом (PMA)/иономицином и интерфероном-гамма (IFN-γ), соответственно. Активированные клетки выделяли провоспалительные цитокины. Параллельно также активировали линию клеток кератиноцитов человека (HaCaT) PMA/иономицином и IFN-γ, соответственно. Известно, что обработка PMA/иономицином и IFN-γ, соответственно, приводит к увеличенному выделению провоспалительных цитокинов IL-1, IL-2, IL-6, IL-17, IFN-γ или TNF-α. Одновременно ингибировали выделение противовоспалительного IL-10. Через двое суток после добавления PMA/иономицина и IFN-γ, соответственно, для подтверждения активации клеток определяли индукцию секреции IL-1 в супернатанте. После этого клетки обрабатывали различными дозами (10-7 M, 10-9 M и 10-11 M) трипептидов, PBS (отрицательный контроль) и меланоцитстимулирующим гормоном альфа (α-MSH), K(D)PT, мофетилом микофенолата (MMF) и дексаметазоном, соответственно, в качестве положительных контролей. Противовоспалительные свойства трипептидов определяли через 48 часов и 72 часа после стимуляции. Для демонстрации сниженной секреции провоспалительных цитокинов в супернатанте использовали анализ FACS на основе 13-плексной системы. Наиболее существенными считали данные для IL-1, IL-2, IL-6, IL-12p70, IL-17, IFN-γ и TNF-α. Таким образом, анализ противовоспалительных свойств трипептидов предпочтительно основан на результатах, полученных для этих анализируемых веществ. Кроме того, эти результаты подтверждали посредством получения иРНК и последующего анализа ОТ-кПЦР. Этим способом определяли экспрессию генов провоспалительных маркеров, таких как IL-6, IL-17, IFN-γ и TNF-α.
В первом эксперименте показано, что конкретно примеры 3, 8 и 9 характеризуются наличием более сильного противовоспалительного действия по сравнению с положительным контролем K(D)PT. Они могли более эффективно снижать секрецию провоспалительных цитокинов в активированных первичных T-клетках мыши и человека, а также в кератиноцитах человека. Все трипептиды, указанные выше, ингибировали секрецию по меньшей мере трех из анализируемых провоспалительных цитокинов (IL-1, IL-2, IL-6, IL-17, IFN-γ или TNF-α) в большей степени, чем положительный контроль K(D)PT. Кроме того в кератиноцитах наблюдали индукцию секреции противовоспалительного цитокина IL-10 (таблицы 3-5). Обработка примерами 1 и 2 приводила к сниженной секреции провоспалительных цитокинов в кератиноцитах.
Результаты, полученные при определении данных о цитокинах в супернатантах, для примеров 3, 8 и 9 подтверждали на уровне экспрессии генов. Эксперименты ОТ-кПЦР выявили иммуномодулирующую активность примеров 3 и 8, сравнимую с K(D)PT, служившим в качестве положительного контроля. Экспрессия иРНК IL-6, IL-17, IFN-γ и TNF-α в T-клетках человека и мыши после стимуляции этими соединениями была снижена. Кроме того, обработка примерами 3, 8 и 9 ассоциирована со снижением экспрессии генов провоспалительных цитокинов в кератиноцитах HaCaT (фигуры 1-3).
Во втором эксперименте показано, что пример 12 мог снижать экспрессию провоспалительных цитокинов во всех трех клеточных моделях. Активность была сравнима с одним из K(D)PT. Обработка примерами 6 и 13 приводила к сниженной экспрессии провоспалительных цитокинов в T-клетках и кератиноцитах человека. Для примеров 5 и 7 наблюдали иммуномодулирующее действие в T-клетках человека и мыши (таблицы 6-8).
Экспрессию генов, кодирующих провоспалительные маркеры, такие как IL-6, IL-17, IFN-γ и TNF-α, определяли, как описано выше. Показано, что стимуляция примером 13 приводила к сниженной экспрессии провоспалительных маркеров во всех стимулируемых клетках (фигуры 4-6).
В третьем эксперименте T-клетки и клетки HaCaTмыши и человека стимулировали PMA/иономицином и обрабатывали примерами 14, 15, 16 и 17 в концентрации 10-7M, 10-9M и 10-11M. Концентрации цитокинов (IFN-γ, IL-17 и IL-10 для T-клеток и IFN-γ для HaCat) оценивали в супернатантах с использованием технологию Luminex. Определяли экспрессию генов, кодирующих Il-1β, IL-6 и TNF-α. Обработка примерами 14, 15, 16 и 17 приводила к сниженной экспрессии провоспалительных цитокинов IL-1β, IL-6 и TNF-α на уровне иРНК во всех тестируемых типах клеток и при всех тестируемых концентрациях. Кроме того, концентрации провоспалительных цитокинов IFN-γ и IL-17 в супернатантах снижались, тогда как концентрация противовоспалительного цитокина IL-10 возрастала. Это опять наблюдали для всех тестируемых концентраций.
Противовоспалительное и иммуномодулирующее действие выбранных примеров по настоящему изобретению сравнивали с общеизвестными иммуносупрессорами. Таким образом, клетки, активированные PMA/иономицином и IFN-γ, соответственно, стимулировали MMF или дексаметазоном. Секрецию провоспалительных цитокинов после стимуляции анализировали на уровне белка и генов (таблица 9 и фигуры 4-6). Неожиданно выявлено, что пример 13 продемонстрировал иммуномодулирующую активность большую, чем иммуномодулирующая активность, наблюдаемая для MMF.
Для биологического анализа для интерпретации полученных результатов выбирали две линии клеток человека различного происхождения. Клетки HaCaT представляют собой тип клеток, принадлежащих к иммортализованной линии кератиноцитов человека, используемой в научных исследованиях. Ее использование в исследовании обеспечивает характеристику кератиноцитов человека с использованием модели, которая является воспроизводимой и представляет линию эпителиальных клеток человека. В отличие от этого T-лимфоциты человека (T-клетки) представляют собой тип лимфоцитов (сами являясь типом лейкоцитов), который играет центральную роль в опосредованном клетками воспалении/иммунитете.
Анализы, в которых концентрация цитокинов в супернатанте была ниже предела детекции, отмечены серым. Клетки, закрашенные серым, означают анализы, в которых количественных анализ цитокинов сомнителен вследствие стимулятора.
Анализы, в которых концентрация цитокинов в супернатанте была ниже предела детекции отмечены серым. Клетки, закрашенные серым, означают анализы, в которых количественных анализ цитокинов сомнителен вследствие стимулятора. Значения для IL-22 и IL-12p70 исключены из конечного анализа противовоспалительной активности.
Анализы, в которых концентрация цитокинов в супернатанте была ниже предела детекции, отмечены серым. Клетки, закрашенные серым, означают анализы, в которых количественных анализ цитокинов сомнителен вследствие стимулятора.
* Значения для IL-2 и IFN-γ в супернатантах после активации PMA/иономицином находились выше 20000 пг/мл. Таким образом, для этих анализов получали разведение супернатантов 1:10.
Анализы, в которых концентрация цитокинов в супернатанте была ниже предела детекции, отмечены серым. Клетки, закрашенные серым, означают анализы, в которых количественных анализ цитокинов сомнителен вследствие стимулятора.
Анализы, в которых концентрация цитокинов в супернатанте была ниже предела детекции, отмечены серым. Клетки, закрашенные серым, означают анализы, в которых количественных анализ цитокинов сомнителен вследствие стимулятора.
Анализы, в которых концентрация цитокинов в супернатанте была ниже предела детекции отмечены серым. Клетки, закрашенные серым, означают анализы, в которых количественных анализ цитокинов сомнителен вследствие стимулятора.
Анализы, в которых концентрация цитокинов в супернатанте была ниже предела детекции, отмечены серым. Клетки, закрашенные серым, означают анализы, в которых количественных анализ цитокинов сомнителен вследствие стимулятора.
B. Модель васкулита у мышей
Мышам C57BL/6 проводили интрадермальную инъекцию LPS. На следующие сутки индуцировали васкулит посредством интрадермальной инъекции TNF-α. Кроме того инъецировали синий Эванса. Через 24 часа после инъекции TNF-α мышей умерщвляли. Измеряли толщину ушей, и степень васкулита оценивали посредством подсчета петехий. Содержание синего Эванса в ткани уха представляет собой маркер проницаемости сосудов. Уши анализировали гистологически, посредством FACS и ОТ-кПЦР.
Обработка соединением примера 13 (п/к) приводила к уменьшению толщины ушей и сниженному количеству петехий. При гистологической оценке наблюдали сниженное количество воспалительного инфильтрата.
C. Индуцированный имиквимодом псориаз у мышей
Псориаз у мышей Balb/c индуцируют ежесуточным местным прикладыванием имиквимода в течение 8 суток. Животное обрабатывают тестируемыми образцами (местно или системно). На сутки 9 характеризуют фенотип кожи с использованием системы клинических показателей (0 = нормальная кожа мыши; 1 = умеренное покраснение; 2 = эритема; 3 = эритема, опухание; 4 = эритема, опухание, шелушение; 5 = эритема, опухание, шелушение, (кровяные) очаги). Кожу анализируют гистологически. Лимфоузлы анализируют посредством проточной цитометрии и ОТ-кПЦР. Экспрессию иРНК в поврежденной коже анализируют посредством ОТ-кПЦР. Концентрации цитокинов в сыворотке оценивают с использованием технологии Luminex.
Обработка соединением примера 13 (в/в) приводила к уменьшению размера эпидермальных гребней по сравнению с контролем с носителем. Клинические показатели были снижены. Экспрессия иРНК IL-17, IFN-γ, IL-23, IL-36 и IL-22 в поврежденной коже была снижена. Концентрации TNF-α и IL-17 в сыворотке обработанных мышей были снижены.
Обработка соединениями примеров 14, 15, 16 и 17 (в/в) приводила к сниженному клиническому показателю и уменьшенной толщине эпидермиса. Концентрации TNF-α и IL-17 в сыворотке обработанных мышей были снижены. Экспрессия иРНК IFN-γ и IL-36 в поврежденной коже по сравнению с контролем с носителем была снижена.
D. Индуцированный DSS колит у мышей
Колит индуцируют посредством обработки мышей C57BL/6 2,5% декстрансульфатом (DSS) в питьевой воде в течение 7 суток. Мышей обрабатывают тестируемым элементом. Ежесуточно контролируют массу. На сутки 8 мышей умерщвляют. Проводят тест Hemoccult. Измеряют размер кишечника. Колит определяют с использованием системы оценки с красителями H&E. Экспрессию иРНК в образцах кишечника анализируют посредством ОТ-кПЦР.
Обработка соединением примера 13 (и/п) приводила к сниженной потере массы по сравнению с контролем с носителем. Размер кишечника был частично нормализован. При гистологической оценке наблюдали улучшение состояния заболевания. По сравнению с контролем с носителем наблюдали сниженную экспрессию иРНК LY-6G, MPO, IFN-γ, IL-6 и TNF-α.
E. Исследование кожной проницаемости
Исследования кожной проницаемости проводят с вырезанной кожей человека. Образцы ткани после операции отмывают солевым раствором и удаляют слой подкожного жира. Делают пункционную биопсию (диаметр 20 мм, 3,14 см2) и хранят при -20°C. В начале исследования проницаемости всю толщу образца кожи замораживают и высушивают тампоном. Исследования проницаемости проводят с использованием диффузионных ячеек Франца. Кремовую основу, содержащую трипептидное соединение, наносят на кожу и равномерно распределяют. Образец кожи с визуальным контролем помещают на диффузионную ячейку, которую перед этим нагревают до 32°C. Через 30, 100 и 300 мин, соответственно, оставшийся состав удаляют тампоном. После удаления из диффузионной ячейки получают три пункционных биопсии (диаметром 6 мм). Получают горизонтальные срезы, из которых экстрагируют трипептидное соединение. Содержание пептидов во всех экстрактах и акцепторной среде анализируют посредством ВЭЖХ-РС.
F. Стабильность в воде
Водные раствор трипептидного соединения (1500 мкл) с 0,02% азидом натрия или без (cпептида = 160 мкг/мл) инкубируют при 32°C и 8°C, соответственно. Через 0, 30, 100, 300 и 1000 минут отбирают образцы. Образец 100 мкл разбавляют 1900 мкл метанола, содержащими внутренний стандарт, и анализируют ВЭЖХ-РС. Все анализы проводят в трех повторениях.
Для примеров 3, 8 и 9 даже через 1000 минут разрушения не наблюдали.
G. Стабильность в присутствии гомогенизированной кожи человека
Образцы кожи человека (кожа уха, пупочная кожа и крайняя плоть младенцев) комбинируют и замораживают в жидком азоте и гомогенизируют. Полученный гомогенат кожи человека порционно (50-70 мг) переносят в пробирки для белка LoBind (2 мл) и хранят при -32°C до использования. В начали исследования стабильности гомогенат кожи человека размораживают. Добавляют водный раствор трипептидного соединения (1500 мкл) с 0,02% азидом натрия или без (cпептида = 160 мкг/мл) и смесь инкубируют при 32°C. Через 0, 30, 100, 300 и 1000 минут отбирают образцы. 100 мкл образец разбавляют 1900 мкл метанола, содержащими внутренний стандарт и анализируют посредством ВЭЖХ-РС. Все анализы проводят в трех повторениях.
Через 30 и 100 минут, соответственно, тестовый раствор все еще содержит 94-95% от исходной концентрации примера 8. Через 1000 минут наблюдали снижение 77-80% (300 мин) и 40% (без азида) и 47% (с азидом натрия), соответственно.
Через 300 минут количество примера 9 в растворе снижалось до 58% (без азида) и 63% (с азидом натрия), соответственно.
Разрушения примера 3 не наблюдали. Все образцы во все моменты времени содержали 80-90% от исходной концентрации.
Примеры фармацевтических композиций
Композиция для примера 3:
Композиция для примера 8:
Композиция для примера 3:
В качестве конкретного варианта осуществления пероральной композиции соединения по настоящему изобретению 21 мг примера 3 объединяют с достаточно мелкодисперсно измельченной лактозой с получением общего количества от 580 до 590 мг для заполнения твердой желатиновой капсулы размера 0.
Композиция для примера 9:
В качестве другого конкретного варианта осуществления пероральной композиции соединения по настоящему изобретению 17 мг примера 9 объединяют с достаточно мелкодисперсно измельченной лактозой с получением общего количества от 580 до 590 мг для заполнения твердой желатиновой капсулы размера 0.
Реферат
Изобретение относится к трипептидным соединениям общей формулы (1), где AAвыбран из Lys, Orn, Nle, Phe, N-метил-Phe, N,N-диметил-Nle, N,N-диметил-Phe и N,N-диметил-Lys; и AAвыбран из α-аминоизомасляной кислоты (Aib),-бутилглицина, амида α-аминоизомасляной кислоты, N-метил-Thr-OH, N-метил-Thr-NHи N-метил-Val-OH, и их применению в качестве лекарственных средств, в частности в качестве противовоспалительных средств. 2 н. и 6 з.п. ф-лы, 6 ил., 9 табл., 1 пр.
Формула

Документы, цитированные в отчёте о поиске
Применение по меньшей мере одного пептида в косметической композиции или для получения лекарственного средства






























Комментарии