Способы очистки клеток, производных от плюрипотентных стволовых клеток - RU2702198C2
Код документа: RU2702198C2
Чертежи



















Описание
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет в отношении предварительной заявки № 61/309193, поданной 01 марта 2010 года.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способам дифференцирования плюрипотентных стволовых клеток. В частности, в настоящем изобретении предложены способы характеризации клеток, дифференцировавших в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, на основании анализа уникальных маркеров клеточной поверхности. В настоящем изобретении также предложены способы обогащения или сортировки клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток. В настоящем изобретении также предложены способы уменьшения количества клеток, которые могут загрязнять популяции клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, сформированные способами, составляющими предмет настоящего изобретения, таким образом, снижая частоту возникновения опухолей in vivo после трансплантации.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Плюрипотентные стволовые клетки могут давать начало типам дифференцированных клеток, содержащих все соматические ткани и органы. Лечению диабета с помощью клеточной терапии способствует производство большого количества клеток, которые могут функционировать аналогично островкам поджелудочной железы человека. Таким образом, существует необходимость в получении таких клеток из плюрипотентных стволовых клеток, а также в надежных способах их очистки.
Белки и другие маркеры клеточной поверхности, которые обнаруживают на плюрипотентных стволовых клетках и производных клеточных популяциях, успешно используются для получения реагентов, предназначенных для разделения и выделения этих популяций. Маркеры клеточной поверхности также используют для дополнительной характеризации этих клеток.
В одном примере в публикации № WO2009131568 описан способ очистки энтодермальных клеток кишечника, содержащий: a) воздействие на популяцию клеток, производных от плюрипотентных стволовых клеток, содержащих клетки кишечной энтодермы, лигандом, связывающимся с маркером клеточной поверхности, который экспрессируют клетки кишечной энтодермы, причем указанный маркер клеточной поверхности выбран из группы, состоящей из CD49e, CD99, CD165 и CD334; и b) отделение клетки кишечной энтодермы от клеток, производных от плюрипотентных стволовых клеток, не связывающихся с данным лигандом, посредством чего выполняется очистка указанной клетки кишечной энтодермы.
В другом примере в публикации № WO2010000415 описано использование антитела, которое связывается с антигеном TNAP, или функциональных фрагментов этого антитела, одного или в комбинации с антителом, которое связывается с CD56, или функциональных фрагментов этого антитела для выделения стволовых клеток с потенциалом к дифференцированию адипоцитов, хондроцитов и панкреатических клеток.
В другом примере в публикации № US7371576 описано обнаружение селективного маркера клеточной поверхности, который позволяет отбирать уникальную субпопуляцию стволовых панкреатических клеток, имеющих высокую предрасположенность к дифференцированию в клетки или агрегаты инсулин-продуцирующих клеток.
В другом примере в публикации № US7585672 описан способ обогащения культуры клеток, производных от эмбриональных стволовых клеток человека, клетками энтодермальной и панкреатической линий дифференцирования, а именно способ, содержащий стадии (а) культивирования интактных колоний эмбриональных стволовых клеток человека с образованием цельных интактных эмбриоидных тел, окруженных клетками висцерального листка желточного мешка (VYS), причем эмбриональные стволовые клетки человека экспрессируют Oct-4, поверхностный стадиеспецифический эмбриональный антиген-3/4 (SSEA 3/4) и молекулу адгезии эпителиальных клеток (EpCAM); (b) культивирования эмбриональных тел, полученных на стадии (a), в условиях, способствующих дифференцированию эмбриональных тел в клеточную популяцию, содержащую клетки энтодермальной и панкреатической линий дифференцирования; (c) диспергирования клеточной популяции, полученной на стадии (b), на отдельные клетки; (d) отбора клеток, экспрессирующих SSEA 3/4, для отделения недифференцированных клеток от клеток, полученных на стадии (c); (e) отбора клеток, экспрессирующих SSEA-1, для удаления клеток VYS из числа оставшихся клеток, полученных на стадии (d); и (f) отбора клеток, экспрессирующих EpCAM, из числа оставшихся клеток, полученных на стадии (e), для обогащения клетками энтодермальной и панкреатической линий дифференцирования.
В публикации № US7585672 также описан способ обогащения культуры клеток, производных от эмбриональных стволовых клеток человека, клетками энтодермальной и панкреатической линий дифференцирования, а именно способ, содержащий стадии (а) культивирования интактных колоний эмбриональных стволовых клеток человека с образованием цельных интактных эмбриоидных тел, окруженных клетками висцерального листка желточного мешка (VYS), причем эмбриональные стволовые клетки человека экспрессируют Oct-4, поверхностный стадиеспецифический эмбриональный антиген-3/4 (SSEA 3/4) и молекулу адгезии эпителиальных клеток (EpCAM); (b) культивирования эмбриональных тел, полученных на стадии (a), в условиях, способствующих дифференцированию эмбриональных тел в клеточную популяцию, содержащую клетки энтодермальной и панкреатической линий дифференцирования; (c) обработки клеточной популяции, полученной на стадии (b), эффективной дозой фактора роста фибробластов 10 (FGF10); и (d) диспергирования клеточной популяции, полученной на стадии (c), на отдельные клетки, обогащенные клетками энтодермальной и панкреатической линий дифференцирования; (e) отбора клеток, экспрессирующих SSEA 3/4, для отделения недифференцированных клеток от клеток, полученных на стадии (d); (f) отбора клеток, экспрессирующих SSEA-1, для удаления клеток VYS из числа клеток, полученных на стадии (e); и (g) отбора клеток, экспрессирующих EpCAM, из числа оставшихся клеток, полученных на стадии (f), для обогащения клетками энтодермальной и панкреатической линий дифференцирования.
В публикации № US7585672 также описан способ обогащения для создания популяции клеток, производных от стволовых клеток, которая не обладает туморогенным потенциалом, содержащий стадии (а) культивирования интактных колоний эмбриональных стволовых клеток человека с образованием цельных интактных эмбриоидных тел, окруженных клетками висцерального листка желточного мешка (VYS), причем эмбриональные стволовые клетки человека экспрессируют Oct-4, поверхностный стадиеспецифический эмбриональный антиген-3/4 (SSEA 3/4) и молекулу адгезии эпителиальных клеток (EpCAM); (b) культивирования эмбриональных тел, полученных на стадии (a), в условиях, способствующих дифференцированию эмбриональных тел в клеточную популяцию, содержащую клетки энтодермальной и панкреатической линий дифференцирования; (c) диспергирования клеточной популяции, полученной на стадии (b), на отдельные клетки; (d) отбора клеток, экспрессирующих SSEA 3/4, для очистки недифференцированных клеток от клеток, полученных на стадии (c); (e) отбора клеток, экспрессирующих SSEA-1, для удаления клеток VYS из числа клеток, полученных на стадии (d); и (f) отбора клеток, экспрессирующих EpCAM, из числа оставшихся клеток, полученных на стадии (e), при этом полученные клетки не образуют тератом после инъекции мышам с ослабленным иммунитетом.
В другом примере в публикации № US20050260749 описан способ обогащения культуры клеток, производных от стволовых клеток, клетками энтодермальной и панкреатической линий дифференцирования, а именно способ, содержащий стадии культивирования стволовых клеток с образованием эмбриоидных тел; и отбора эмбриоидных тел для экспрессии соответствующих видоспецифических и стадиеспецифических эмбриональных антигенов клеточной поверхности и культивирования только тех эмбриоидных тел, которые не экспрессируют стадиеспецифического антигена клеточной поверхности для дифференцирования в энтодерму и панкреатические клетки.
В другом примере в публикации № US20100003749 описана выделенная популяция панкреатических стволовых клеток, причем популяция панкреатических стволовых клеток обогащена панкреатическими стволовыми клетками CD133+CD49f+.
В публикации № US20100003749 дополнительно описан способ выделения панкреатических стволовых клеток из первичной ткани поджелудочной железы путем отбора из популяции панкреатических клеток, клеток панкреатического или желудочно-кишечного происхождения CD133+, CD49f+ или CD133+CD49f+; удаления клеток CD15+, при этом оставшиеся клетки являются клетками CD15-; культивирования оставшихся клеток в бессывороточной культуральной среде, содержащей один или более факторов роста; и пролиферации оставшихся клеток в культуральной среде.
В другом примере Dorrell et al. заявляют: «Мы разработали новую панель маркеров клеточной поверхности для выделения и изучения всех основных типов клеток поджелудочной железы человека. Гибридомы отбирали после субтрактивной иммунизации мышей линии Balb/C интактными или диссоциированными островками поджелудочной железы человека и оценивали на предмет клеточной специфичности и реактивности клеточной поверхности с помощью иммуногистохимии и проточной цитометрии. Антитела выявляли по специфическому связыванию поверхностных антигенов островковых (панэндокринных или α-специфичных) и неостровковых субпопуляций клеток поджелудочной железы (экзокринных или протоковых). Эти антитела использовали по отдельности или в комбинации для выделения популяций α, β, экзокринных или протоковых клеток из первичных тканей поджелудочной железы человека методом проточной цитометрии (FACS), а также подробной характеризации клеточной композиции препаратов островков поджелудочной железы человека. Антитела также использовали для демонстрации того, что культуры, используемые для размножения человеческих островковых клеток, происходят от неэндокринных клеток, и что уровень экспрессии инсулина можно повысить до 1% от уровня экспрессии обычных островковых клеток с помощью субпопуляционной сортировки и гиперэкспрессии транскрипционных факторов Pdx-1 и ngn3, что указывает на улучшение результатов, полученных ранее в данной культуральной системе. Эти способы позволяют выполнять анализ и выделение функционально различных популяций клеток поджелудочной железы, обладающих потенциалом, необходимым для клеточной терапии» (Stem Cell Research, том 1, вып. 3, сентябрь 2008 г., стр. 155-156).
В другом примере Sugiyama et al. заявляют: «В результате мы выявили два антигена, которые назвали CD133 и CD49f, пригодные для очистки мышиных NGN3+ клеток. CD133 (также известен как проминин-1) является трансмембранным белком с неизвестной функцией и известным маркером гемопоэтических предшественников и нейронных стволовых клеток. CD49f также известен как интегрин α6 и является компонентом рецептора ламинина. Комбинируя антитела, которые распознают CD133 и CD49f, мы фракционировали четыре популяции панкреатических клеток. Иммунное окрашивание и ОТ-ПЦР подтвердили, что популяция клеток CD49fhigh CD133+ («фракция I», 50% исходных клеток) содержала главным образом дифференцированные экзокринные клетки, экспрессирующие CarbA. Фракция клеток CD49flow CD133- («фракция III», 10% исходных клеток) включала гормон+ клетки, экспрессирующие эндокринные продукты, такие как инсулин и глюкагон. В противоположность этому фракция CD49flow CD133+ (обозначаемая «фракция II», 13% исходных клеток) содержала NGN3+, но не гормон+ клетки. Приблизительно 8% клеток фракции II вырабатывали иммунноокрашиваемый NGN3. В составе фракции CD49f- CD133- («фракция IV», 25% исходных клеток) нам не удалось выявить клетки, экспрессирующие NGN3, CarbA или гормоны островков поджелудочной железы» (Diabetes, Obesity and Metabolism, том 10, вып. s4, стр. 179-185).
В другом примере Fujikawa et al.заявляют: «После сортировки CD45-TER119- GFPhigh клеток с боковым рассеянием света в этой популяции мы обнаружили незрелые клетки энтодермы, экспрессирующие α-фетопротеин и имеющие высокий потенциал роста. С помощью клонального анализа и электронной микроскопии было выявлено, что каждая отдельная клетка этой популяции может дифференцироваться не только в гепатоциты, но и в билиарные эпителиальные клетки, демонстрируя свою двунаправленную дифференцировочную активность. Анализ маркеров клеточной поверхности выявил наличие интегрина α6 и интегрина β1, но отсутствие экспрессии c-Kit и Thy1.1»(Journal of Hepatlogy, том 39, стр. 162-170).
В другом примере Zhao et al.заявляют: «В этом исследовании мы сначала выявили N-кадгерин как маркер клеточной поверхности клеток печеночной энтодермы, подходящий для их очистки из смеси производных эмбриональных стволовых клеток (hES) человека, а затем получили печеночные клетки-предшественники, используя очищенные клетки печеночной энтодермы и культивируя их вместе с мышиными эмбриональными стромальными питающими клетками (STO). Эти печеночные клетки-предшественники способны размножаться и могут быть пассированы в течение более чем 100 дней. Интересно, что они коэкспрессируют ранний печеночный маркер AFP и маркер билиарной линии дифференцирования KRT7, что позволяет предположить, что эти клетки являются общими предшественниками как гепатоцитов, так и холангиоцитов. Более того, эти клетки-предшественники могут активно размножаться, сохраняя при этом двойной потенциал дифференцирования в гепатоцитоподобные клетки и холангиоцитоподобные клетки, что подтверждается как анализом генной экспрессии, так и функциональными исследованиями. Таким образом, в данной работе предложена новая модель изучения развития печени, а также новый источник материала для клеточной терапии, основанной на использовании печеночных клеток-предшественников» (PLoS ONE4(7): e6468. doi: 10.1371/journal.pone. 0006468).
В другом примере Cai et al.заявляют: «Для дополнительного повышения тонкости очистки клеток PDX1+ мы сортировали активин A-индуцированные клетки с помощью CXCR4, который является маркером энтодермальных клеток ES-происхождения. Сортировка с помощью CXCR4 позволила обогатить популяцию энтодермальных клеток, поскольку практически все клетки в популяции CXCR4+ были положительно окрашены антителами к энтодермальному маркеру SOX17 и >90% клеток были положительны по отношению к FOXA2» (Journal of Molecular Cell BiologyAdvance Access, оригинальная публикация в электронном виде от 12 ноября 2009 г. Journal of Molecular Cell Biology 2010 2(1):50-60; doi:10.1093/jmcb/mjp037).
В другом примере Koblas et al.заявляют: «Мы обнаружили, что популяция человеческих CD133- положительных панкреатических клеток содержит эндокринные клетки-предшественники, экспрессирующие нейрогенин-3, и клетки, экспрессирующие человеческую теломеразу, ABCG2, Oct-3/4, Nanog и Rex-1, маркеры плюрипотентных стволовых клеток. Эти клетки были способны дифференцироваться в инсулин-продуцирующие клетки in vitro и секретировали C-пептид в ответ на воздействие глюкозы. На основании полученных данных мы сделали предположение о том, что CD133 является еще одним маркером клеточной поверхности, который можно использовать для выявления и выделения панкреатических эндокринных клеток-предшественников» (Transplant Proc., март 2008 г.; 40(2):415-8).
В другом примере Sugiyama et al. заявляют: «Мы обнаружили, что клетки NGN3+ экспрессировали CD133. Оказалось, что CD133 локализуется в апикальной мембране протоковых эпителиальных панкреатических клеток» (PNAS2007 104:175-180; электронная публикация до выхода в печать от 26 декабря 2006 г., doi:10.1073/pnas.0609490104).
В другом примере Kobayashi et al.заявляют: «Эмбриональный панкреатический эпителий и - позднее - протоковый эпителий, как известно, дают начало эндокринным и экзокринным клеткам формирующейся поджелудочной железы, однако никаких специфичных маркеров клеточной поверхности для этих клеток выявлено не было. В настоящей работе мы использовали агглютинин Dolichos Biflorus Agglutinin (DBA) в качестве специфичного маркера таких эпителиальных клеток в составе формирующейся поджелудочной железы у мышей. По результатам иммунофлуоресцентного анализа с использованием меченого флуоресцином DBA и клеточных маркеров, специфичных для панкреатических клеток, мы обнаружили, что DBA специфически выявляет эпителиальные, но не выявляет ни дифференцирующиеся эндокринные, ни ацинарные клетки. Мы дополнительно использовали этот маркер в иммуномагнитной системе разделения клеток (система Dynabead) для очистки таких предположительно мультипотентных клеток из смеси развивающихся панкреатических клеток. Эту процедуру можно использовать для изучения дифференцирования и отбора клеточной линии дифференцирования при формировании поджелудочной железы. Кроме того, ее также можно использовать для отбора панкреатических клеток-предшественников для потенциальной клеточной инженерии» (Biochemical and Biophysical Research Communications,том 293, вып. 2, 3 мая 2002 г., стр. 691-697).
Выявление маркеров, экспрессируемых клетками, которые являются производными плюрипотентных стволовых клеток, позволит получить больше информации об этих клетках, научиться выявлять их in vivoи in vitro и проводить их положительное обогащение in vitroдля изучения и использования. Таким образом, сохраняется потребность в инструментах, которые можно использовать для выделения и характеризации клеток, являющихся производными от плюрипотентных стволовых клеток, в частности, клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном варианте осуществления настоящего изобретения предложен способ дифференцирования популяции плюрипотентных стволовых клеток в популяцию клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, включающий в себя следующие стадии:
а. культивирование популяции плюрипотентных стволовых клеток;
b. дифференцирование популяции плюрипотентных стволовых клеток в популяцию клеток, экспрессирующих маркеры, характерные для линии дефинитивной энтодермы;
c. дифференцирование популяции клеток, экспрессирующих маркеры, характерные для линии дефинитивной энтодермы, в клетки, экспрессирующие маркеры, характерные для линии первичной кишечной трубки;
d. дифференцирование популяции клеток, экспрессирующих маркеры, характерные для линии первичной кишечной трубки, в популяцию клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы; и
e. дифференцирование популяции клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, в популяцию клеток, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток.
В одном варианте осуществления настоящего изобретения популяцию клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, трансплантируют животному, при этом клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, дают начало инсулин-продуцирующим клеткам. В одном варианте осуществления эффективность образования инсулин-продуцирующих клеток повышается за счет обогащения популяции клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, до трансплантации.
В одном варианте осуществления эффективность образования инсулин-продуцирующих клеток определяют путем измерения времени, необходимого для экспрессии С-пептида на уровне обнаружения после трансплантации.
В альтернативном варианте осуществления обогащение снижает способность трансплантируемых клеток формировать тератомы после трансплантации.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг. 1 представлена экспрессия NEUROD (панель а), NGN3 (панель b), PDX1 (панель c), NKX6.1 (панель d), NKX2.2 (панель e) и PAX4 (панель f) в популяциях клеток CD56+CD13-, CD56-CD13- и CD56-CD13+, как определяют с помощью реакции ПЦР в реальном времени. Кратность повышения экспрессии приведена в сравнении с недифференцированными эмбриональными стволовыми клетками H1.
На фиг. 2 представлена экспрессия NEUROD (панель a), NGN3 (панель b), PDX1 (панель c), NKX6.1 (панель d), NKX2.2 (панель e) и PAX4 (панель f), как определяют с помощью реакции ПЦР в реальном времени в популяциях клеток, отсортированных с использованием антитела к CD133. Кратность повышения экспрессии приведена в сравнении с недифференцированными эмбриональными стволовыми клетками H1.
На фиг. 3 представлена экспрессия NEUROD (панель a), NGN3 (панель b), PDX1 (панель c) и NKX6.1 (панель d), как определяют с помощью реакции ПЦР в реальном времени в популяциях клеток, отсортированных с использованием антитела к CD49c. Кратность повышения экспрессии приведена в сравнении с недифференцированными эмбриональными стволовыми клетками H1.
На фиг. 4 представлена экспрессия NEUROD (панель a), NGN3 (панель b), PDX1 (панель c), NKX6.1 (панель d), инсулина (панель e) и глюкагона (панель f), как определяют с помощью реакции ПЦР в реальном времени в популяциях клеток, отсортированных с использованием антител к CD56 и CD15. Кратность повышения экспрессии приведена в сравнении с недифференцированными эмбриональными стволовыми клетками H1.
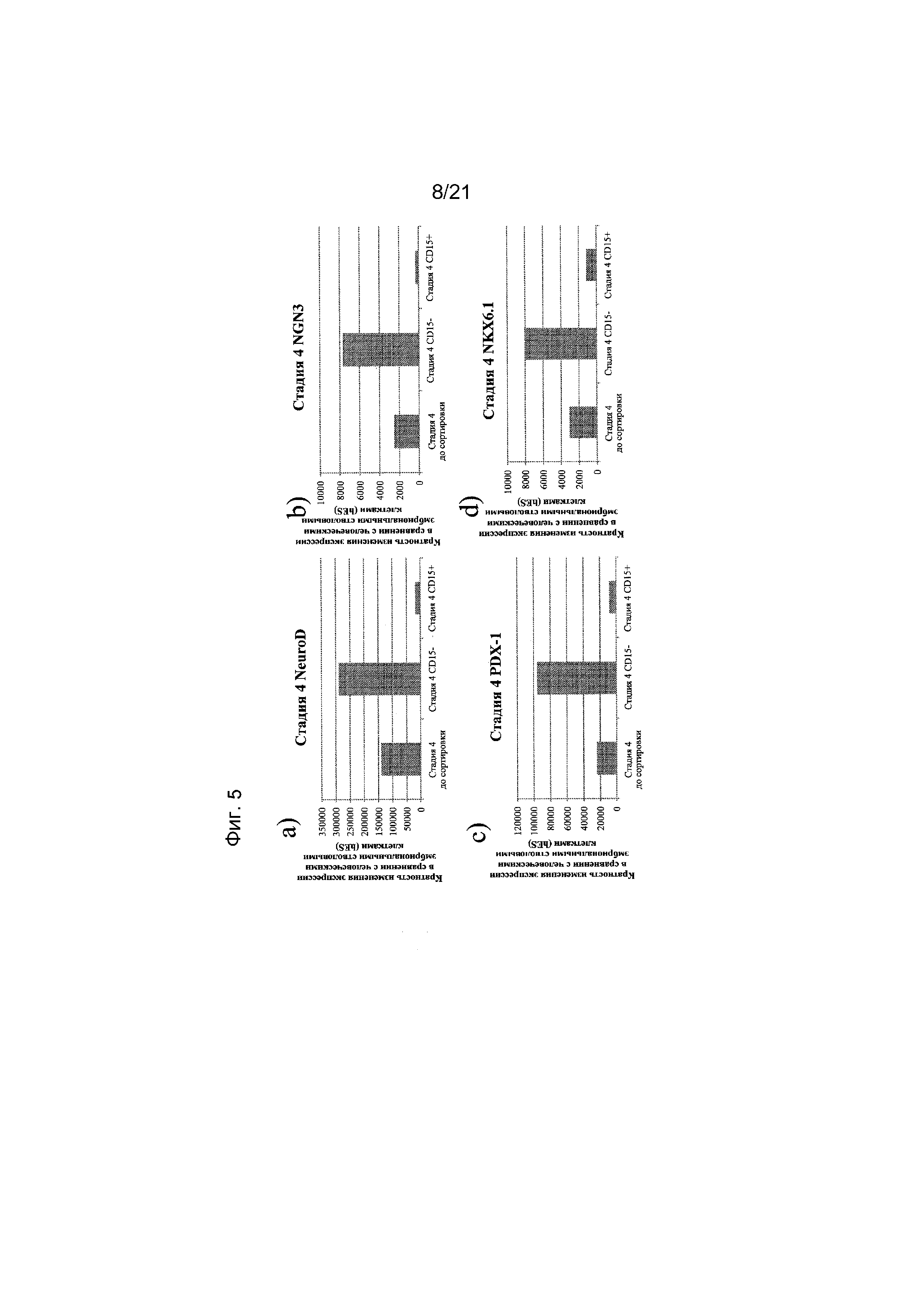
На фиг. 5 представлена экспрессия NEUROD (панель а), NGN3 (панель b), PDX1 (панель c), NKX6.1 (панель d), NKX2.2 (панель e), PAX-4 (панель f), глюкагона (панель g) и инсулина (панель h), как определяют с помощью реакции ПЦР в реальном времени в популяциях клеток, отсортированных с использованием антитела к CD15. Кратность повышения экспрессии приведена в сравнении с недифференцированными эмбриональными стволовыми клетками H1.
На фиг. 6 представлена экспрессия NEUROD (панель а), NGN3 (панель b), PDX1 (панель c), NKX6.1 (панель d), NKX2.2 (панель e), инсулина (панель f) и глюкагона (панель g), как определяют с помощью реакции ПЦР в реальном времени в популяциях клеток, отсортированных с использованием антител к CD56 и CD57. Кратность повышения экспрессии приведена в сравнении с недифференцированными эмбриональными стволовыми клетками H1.
На фиг. 7 представлена экспрессия ZIC1 (панель a), альбумина (панель b), CDX2 (панель c), NGN3 (панель d), PAX4 (панель e), NEUROD (панель f), NKX6.1 (панель g), PTF1 альфа (панель h) и PDX1 (панель i), как определяют с помощью реакции ПЦР в реальном времени в популяциях клеток, отсортированных с использованием антител к CD56 и CD184. Кратность повышения экспрессии приведена в сравнении с недифференцированными эмбриональными стволовыми клетками H1.
На фиг. 8 представлена экспрессия NEUROD (панель a), NGN3 (панель b), инсулина (панель c) и глюкагона (панель d), как определяют с помощью реакции ПЦР в реальном времени в популяциях клеток, отсортированных с использованием антитела к CD98. Кратность повышения экспрессии приведена в сравнении с недифференцированными эмбриональными стволовыми клетками H1.
На фиг. 9 представлена экспрессия NEUROD (панель a), NGN3 (панель b), PDX1 (панель c), NKX6.1 (панель d), NKX2.2 (панель e) и PAX4 (панель f), как определяют с помощью реакции ПЦР в реальном времени в популяциях клеток, отсортированных с использованием антитела к CD47. Кратность повышения экспрессии приведена в сравнении с недифференцированными эмбриональными стволовыми клетками H1.
На фиг. 10 представлена экспрессия PDX-1 (панель а), NKX6.1 (панель b), NKX2.2 (панель c), PAX-4 (панель d), PTF1a (панель e), NGN3 (панель f), инсулина (панель g) и глюкагона (панель h), как определяют с помощью реакции ПЦР в реальном времени в популяциях клеток, отсортированных с использованием антитела к CD47. Кратность повышения экспрессии приведена в сравнении с недифференцированными эмбриональными стволовыми клетками H1.
На фиг. 11 представлена экспрессия HNF4 альфа (панель а) и LIF-рецептора (панель b), как определяют с помощью реакции ПЦР в реальном времени в популяциях клеток, отсортированных с использованием антитела к LIF-рецептору. Кратность повышения экспрессии приведена в сравнении с несортированными клетками на 2 ДЕНЬ стадии II протокола дифференцирования, приведенного в примере 1.
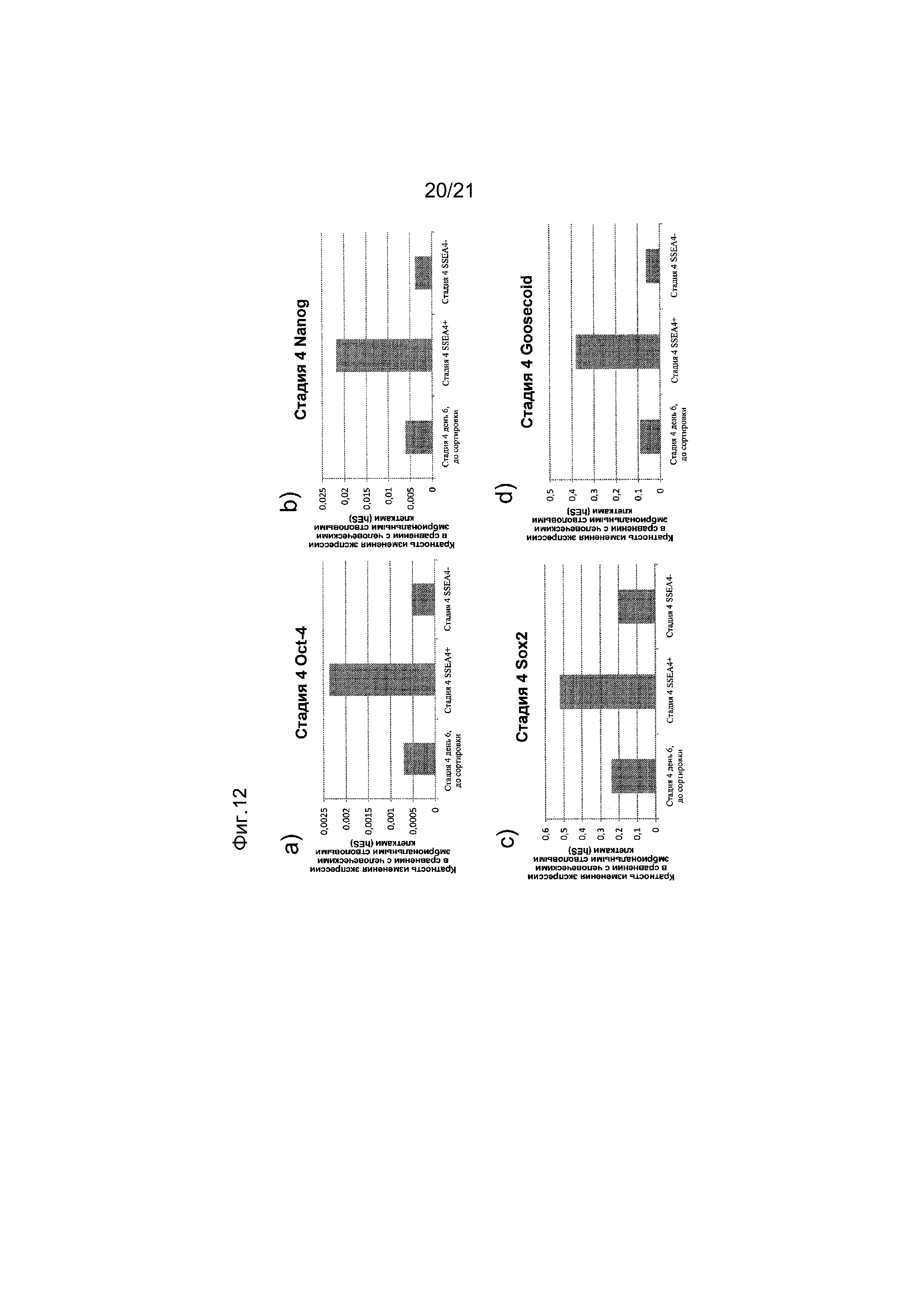
На фиг. 12 представлена экспрессия OCT4 (панель a), NANOG (панель b), SOX2 (панель c) и goosecoid (панель d), как определяют с помощью реакции ПЦР в реальном времени в популяциях клеток после удаления клеток, экспрессирующих SSEA4 с помощью магнитных бус. Кратность повышения экспрессии приведена в сравнении с недифференцированными эмбриональными стволовыми клетками H1.
На фиг. 13 представлена экспрессия OCT4 (панель а), NANOG (панель b), SOX2 (панель c) и goosecoid (панель d), как определяют с помощью реакции ПЦР в реальном времени в популяциях клеток после удаления клеток, экспрессирующих SSEA4 с помощью FACS. Кратность превышения экспрессии приведена в сравнении с недифференцированными эмбриональными стволовыми клетками H1.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для четкости описания, а не для ограничения изобретения, подробное описание изобретения разделено на следующие подразделы, описывающие или иллюстрирующие определенные особенности, варианты осуществления или области применения настоящего изобретения.
Определения
Используемый в настоящей заявке термин «β-клеточная линия дифференцирования» относится к клеткам, положительным в отношении экспрессии гена транскрипционного фактора PDX-1 и по меньшей мере одного из следующих транскрипционных факторов: NGN3, NKX2.2, NKX6.1, NEUROD, ISL1, HNF-3 бета, MAFA, PAX4 и PAX6. Клетки, экспрессирующие маркеры, характерные для β-клеточной линии дифференцирования, включают в себя β-клетки.
Термин «клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы» в настоящем документе обозначает клетки, экспрессирующие по меньшей мере один из следующих маркеров: SOX 17, GATA4, HNF-3 бета, GSC, CER1, Nodal, FGF8, Brachyury, Mix-подобный гомеобоксный белок, FGF4, CD48, эомезодермин (EOMES), DKK4, FGF17, GATA6, CD184, C-Kit, CD99 или OTX2. Клетки, экспрессирующие маркеры, характерные для линии дифференцирования в клетки дефинитивной энтодермы, включают в себя клетки-предшественники клеток первичной полоски, клетки первичной полоски, клетки мезоэнтодермы и клетки дефинитивной энтодермы.
Термин «клетки, экспрессирующие маркеры, характерные для линии первичной кишечной трубки» подразумевает клетки, экспрессирующие по меньшей мере один из следующих маркеров: HNF-1 бета или HNF-4 альфа.
Термин «клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы» в настоящем документе обозначает клетки, экспрессирующие по меньшей мере один из следующих маркеров: PDX1, HNF-1 бета, PTF-1 альфа, HNF6 или HB9. Клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, включают в себя клетки панкреатической энтодермы.
Используемый в настоящей заявке термин «клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток» относится к клеткам, экспрессирующим по меньшей мере один из следующих маркеров: NGN3, NEUROD, ISL1, PDX1, NKX6.1, PAX4 или PTF-1 альфа. Клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, включают в себя панкреатические эндокринные клетки, панкреатические клетки, экспрессирующие гормоны, и панкреатические клетки, секретирующие гормоны, а также клетки β-клеточной линии дифференцирования.
Используемый в настоящей заявке термин «дефинитивная энтодерма» относится к клеткам, обладающим характерными особенностями клеток, происходящих в процессе гаструляции от эпибласта, и формирующим желудочно-кишечный тракт и его производные. Клетки дефинитивной энтодермы экспрессируют следующие маркеры: CD184, HNF-3 бета, GATA4, SOX17, Cerberus, OTX2, goosecoid, c-Kit, CD99 и Mixl1.
Используемый в настоящей заявке термин «маркеры» означает молекулы нуклеиновых кислот или полипептидов с дифференциальной экспрессией в интересующих клетках. В данном контексте под дифференциальной экспрессией подразумевается повышение уровня экспрессии для положительного маркера и понижение уровня экспрессии для отрицательного маркера. Поддающийся обнаружению уровень маркерной нуклеиновой кислоты или полипептида в интересующих клетках оказывается значительно выше или ниже по сравнению с другими клетками, что позволяет выявлять интересующую клетку и отличать ее от других клеток с помощью любого из множества известных в данной области способов.
Термин «панкреатическая эндокринная клетка» или «клетка, экспрессирующая панкреатические гормоны» в настоящем документе относится к клеткам, способным к экспрессии по меньшей мере одного из следующих гормонов: инсулина, глюкагона, соматостатина и панкреатического полипептида.
Используемый в настоящей заявке термин «панкреатическая клетка, секретирующая гормоны» относится к клеткам, способным к секреции по меньшей мере одного из следующих гормонов: инсулина, глюкагона, соматостатина и панкреатического полипептида.
Используемый в настоящей заявке термин «клетка-предшественник клетки первичной полоски» относится к клеткам, экспрессирующим по меньшей мере один из следующих маркеров: Nodal или FGF8.
Используемый в настоящей заявке термин «клетка первичной полоски» относится к клеткам, экспрессирующим по меньшей мере один из следующих маркеров: Brachyury, Mix-подобный гомеобоксный белок или FGF4.
Стволовые клетки представляют собой недифференцированные клетки, определяемые по их способности на уровне единичной клетки как самообновляться, так и дифференцировать с образованием клеток-потомков, таких как самообновляющиеся клетки-предшественники, необновляющиеся клетки-предшественники и окончательно дифференцированные клетки. Стволовые клетки также характеризуются способностью дифференцировать in vitro в функциональные клетки различных клеточных линий дифференцирования из нескольких зародышевых листков (энтодермы, мезодермы и эктодермы), а также после трансплантации давать начало тканям, происходящим от множества зародышевых листков и вносить существенный вклад в формирование большинства или даже всех тканей после введения в бластоцисты.
По потенциалу развития стволовые клетки классифицируются следующим образом: (i) тотипотентные, то есть способные давать начало всем эмбриональным и внеэмбриональным типам клеток; (ii) плюрипотентные, то есть способные давать начало всем эмбриональным типам клеток; (iii) мультипотентные, то есть способные давать начало группе клеточных линий дифференцирования в пределах конкретной ткани, органа или физиологической системы (например, гематопоэтические стволовые клетки (HSC) могут давать таких потомков, как HSC (самообновление), олигопотентные предшественники, ограниченные клетками крови, и все типы клеток и клеточных элементов (например, тромбоциты), являющиеся нормальными компонентами крови); (iv) олигопотентные, то есть способные давать начало более ограниченному набору клеточных линий дифференцирования, чем мультипотентные стволовые клетки; и (v) унипотентные, то есть способные давать начало единственной клеточной линии дифференцирования (например, сперматогенные стволовые клетки).
Дифференцирование представляет собой процесс, при помощи которого неспециализированная (некоммитированная) или менее специализированная клетка приобретает свойства специализированной клетки, например, нервной или мышечной клетки. Дифференцированная клетка или клетка с индуцированным дифференцированием представляет собой клетку, занявшую более специализированное (коммитированное) положение в линии дифференцирования клетки. Термин «коммитированный» применительно к способу дифференцирования относится к клетке, дошедшей в процессе дифференцирования до стадии, от которой в нормальных условиях она продолжит дифференцирование до определенного типа клеток или набора типов клеток и не сможет в нормальных условиях дифференцироваться в иной тип клеток или вернуться к менее дифференцированному типу. Дедифференцированием называется процесс, во время которого клетка возвращается к менее специализированному (коммитированному) положению в линии дифференцирования. Используемый в настоящей заявке термин «линия дифференцирования» определяет наследственность клетки, то есть определяет, из какой клетки произошла данная клетка и каким клеткам она может дать начало. В линии дифференцирования клетка помещается в наследственную схему развития и дифференцирования. Маркером, специфичным для линии дифференцирования, называется характерная особенность, специфически ассоциированная с фенотипом клеток конкретной линии дифференцирования, которая может использоваться для оценки дифференцирования некоммитированных клеток в клетки данной линии дифференцирования.
Для описания клеток в процессе культивирования используют различные термины. Термин «поддержание» по существу относится к клеткам, помещенным в ростовую среду в условиях, которые способствуют росту и (или) делению клеток, в результате чего популяция клеток может расти или не расти. Термин «пассирование» означает способ изъятия клеток из одного культурального сосуда и переноса их в другой культуральный сосуд в условия, которые способствуют росту и (или) делению клеток.
Конкретная популяция клеток, или клеточная линия, иногда описывается или характеризуется числом выполненных с ней пассирований. Например, десятикратно пассированную культивируемую популяцию клеток можно описывать как культуру десятого пассирования (или культуру P10). Первичную культуру, то есть первую культуру после выделения клеток из ткани, обозначают P0. После первого пересева клетки описывают как вторичную культуру (P1, или культура первого пассажа). После второго пересева клетки превращаются в третичную культуру (P2, или культура второго пассажа) и т.д. Специалист в данной области определит, что за промежуток времени между последовательными пассированиями популяция клеток может удваиваться многократно, поэтому число удвоения популяций в культуре превышает номер пассажа. Степень размножения клеток (то есть число удвоения популяции) за промежуток времени между последовательными пассированиями зависит от многих факторов, включая, помимо прочего, плотность посева, носитель, среду, условия роста и периоды времени между пассированиями.
Обогащение клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток
В одном варианте осуществления настоящего изобретения предложен способ дифференцирования популяции плюрипотентных стволовых клеток в популяцию клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, включающий в себя следующие стадии:
а. культивирование популяции плюрипотентных стволовых клеток;
b. дифференцирование популяции плюрипотентных стволовых клеток в популяцию клеток, экспрессирующих маркеры, характерные для линии дефинитивной энтодермы;
c. дифференцирование популяции клеток, экспрессирующих маркеры, характерные для линии дефинитивной энтодермы, в клетки, экспрессирующие маркеры, характерные для линии первичной кишечной трубки;
d. дифференцирование популяции клеток, экспрессирующих маркеры, характерные для линии первичной кишечной трубки, в популяцию клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы; и
e. дифференцирование популяции клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, в популяцию клеток, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток.
В одном варианте осуществления настоящего изобретения популяцию клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, трансплантируют животному, при этом клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, дают начало инсулин-продуцирующим клеткам. В одном варианте осуществления эффективность образования инсулин-продуцирующих клеток повышается за счет обогащения популяции клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, до трансплантации.
В одном варианте осуществления эффективность образования инсулин-продуцирующих клеток определяют путем измерения времени, необходимого для экспрессии С-пептида на уровне обнаружения после трансплантации.
В альтернативном варианте осуществления обогащение снижает способность трансплантируемых клеток формировать тератомы после трансплантации.
Клетки, экспрессирующие маркеры, линии панкреатических эндокринных клеток выявляют или отбирают путем связывания антигенов, обнаруживаемых на поверхности клеток, с реагентами, которые специфически связываются с поверхностными клеточными антигенами.
В альтернативном варианте осуществления клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, дополнительно дифференцируют до трансплантации животному в инсулин-продуцирующие клетки. Инсулин-продуцирующие клетки выявляют или отбирают путем связывания антигенов, обнаруживаемых на поверхности клеток, с реагентами, которые специфически связываются с поверхностными клеточными антигенами.
В альтернативном варианте осуществления настоящего изобретения предложен способ дифференцирования популяции плюрипотентных стволовых клеток в популяцию клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, включающий в себя следующие стадии:
а. культивирование популяции плюрипотентных стволовых клеток;
b. дифференцирование популяции плюрипотентных стволовых клеток в популяцию клеток, экспрессирующих маркеры, характерные для линии дефинитивной энтодермы;
c. дифференцирование популяции клеток, экспрессирующих маркеры, характерные для линии дефинитивной энтодермы, в клетки, экспрессирующие маркеры, характерные для линии первичной кишечной трубки;
d. обогащение популяции клеток, экспрессирующих маркеры, характерные для линии первичной кишечной трубки;
e. дифференцирование популяции клеток, экспрессирующих маркеры, характерные для линии первичной кишечной трубки, в популяцию клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы; и
f. дифференцирование популяции клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, в популяцию клеток, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток.
В одном варианте осуществления настоящего изобретения популяцию клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, трансплантируют животному, при этом клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, дают начало инсулин-продуцирующим клеткам. В одном варианте осуществления эффективность образования инсулин-продуцирующих клеток повышается за счет обогащения популяции клеток, экспрессирующих маркеры, характерные для линии первичной кишечной трубки, до трансплантации.
Клетки, экспрессирующие маркеры, линии первичной кишечной трубки выявляют или отбирают путем связывания антигенов, обнаруживаемых на поверхности клеток, с реагентами, которые специфически связываются с поверхностными клеточными антигенами.
Поверхностные антигены, способствующие обогащению клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток
В одном варианте осуществления настоящего изобретения до трансплантации животному популяцию клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, обрабатывают по меньшей мере одним реагентом, который может связываться с маркером, выбранным из группы, состоящей из CD9, CD13, CD15, CD47, CD56, CD73, CD117, CD133, CD184, CD200, CD318, CD326 и SSEA4.
В одном варианте осуществления в результате обработки по меньшей мере одним реагентом получают популяцию клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, и являющихся положительными в отношении экспрессии маркера CD56 и отрицательными в отношении экспрессии маркера CD13.
В одном варианте осуществления в результате обработки по меньшей мере одним реагентом получают популяцию клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных линий, и являющихся положительными в отношении экспрессии маркера CD56 и отрицательными в отношении экспрессии маркера CD15.
В одном варианте осуществления в результате обработки по меньшей мере одним реагентом получают популяцию клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, и являющихся отрицательными в отношении экспрессии маркера CD133.
В одном варианте осуществления в результате обработки по меньшей мере одним реагентом получают популяцию клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, и являющихся отрицательными в отношении экспрессии маркера CD15.
В одном варианте осуществления в результате обработки по меньшей мере одним реагентом получают популяцию клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, и являющихся положительными в отношении экспрессии маркера CD184.
В одном варианте осуществления в результате обработки по меньшей мере одним реагентом получают популяцию клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, и являющихся отрицательными в отношении экспрессии маркера SSEA4.
Поверхностные антигены, способствующие обогащению инсулин-продуцирующих клеток
В одном варианте осуществления до трансплантации животному популяцию клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, дополнительно дифференцируют с образованием популяции инсулин-продуцирующих клеток. Популяцию инсулин-продуцирующих клеток обрабатывают по меньшей мере одним реагентом, который может связываться с маркером, выбираемым из группы, состоящей из CD47, CD56, CD57 CD98 и SSEA4.
В одном варианте осуществления в результате обработки по меньшей мере одним реагентом получают популяцию инсулин-продуцирующих клеток, являющихся положительными в отношении экспрессии маркеров CD56 и CD57. В альтернативном варианте осуществления популяция инсулин-продуцирующих клеток может быть положительной в отношении экспрессии CD98. В альтернативном варианте осуществления популяция инсулин-продуцирующих клеток может быть отрицательной в отношении экспрессии CD47.
В одном варианте осуществления в результате обработки по меньшей мере одним реагентом получают популяцию инсулин-продуцирующих клеток, являющихся отрицательными в отношении экспрессии маркера SSEA4.
CD13 экспрессирует большинство моноцитов и гранулоцитов периферической крови. Этот маркер также экспрессируется в большинстве случаев острого миелолейкоза, хронического миелолейкоза в миелоидный бластный криз, реже при лимфолейкозе, а также миелоидными клеточными линиями. CD13 также обнаруживают на нескольких типах негемопоэтических клеток, таких как фибробласты и эндотелиальные клетки, а также в растворимой форме в плазме крови. B-клетки, T-клетки, тромбоциты или эритроциты не экспрессируют CD13. CD13 играет роль в метаболизме биологически активных пептидов, в контроле роста и дифференцирования, в процессе фагоцитоза и бактерицидной/тумороцидной активности. CD13 также играет роль рецептора коронавирусов человека (HCV).
CD15 является углеводной молекулой клеточной адгезии, экспрессируемой в комплексе с гликопротеинами, гликолипидами и протеогликанами. CD15 опосредует фагоцитоз и хемотаксис, выявляется на поверхности нейтрофилов, экспрессируется у пациентов с болезнью Ходжкина, в ряде случаев хронических Β-клеточных лимфолейкозов, при остром лимфобластном лейкозе и при большинстве острых нелимфоцитарных лейкозов. Его также называют Lewis x и SSEA-1 (стадиеспецифический эмбриональный антиген 1). Он представляет собой маркер мышиных плюрипотентных стволовых клеток, в которых он играет важную роль в процессах адгезии и миграции клеток в составе эмбриона в стадии преимплантации.
CD47 является мембранным белком, отвечающим за повышение концентрации внутриклеточного кальция, которое происходит в результате присоединения клетки к внеклеточному матриксу. Этот белок также является рецептором С-концевого связывающего домена тромбоспондина и может играть роль в мембранном транспорте и при проведении сигнала внутрь клетки.
CD56, также известный под названием «молекула клеточной адгезии нервных клеток» (NCAM), является гомофильно связывающимся гликопротеином, экспрессируемым на поверхности нейронов, нейроглии, скелетной мускулатуры и естественных киллерных клеток. NCAM предположительно играет роль в межклеточной адгезии, росте нейритов, синаптической пластичности, процессах обучения и запоминания.
CD57 также известен под названием HNK-1 или Leu-7. Он является антигенным олигосахаридным фрагментом, выявляемым на внеклеточных белках определенных типов клеток. В крови CD57 обнаруживается на 15-20% мононуклеарных клеток, включая субпопуляции NK и T-клеток, но отсутствует на эритроцитах, моноцитах, гранулоцитах или тромбоцитах. Также экспрессия CD57 может быть выявлена в различных типах нервных клеток.
CD98 является гликопротеином, имеющим в составе легкую субъединицу транспортера больших нейтральных аминокислот (LAT1). LAT1 представляет собой гетеродимерный мембранный транспортный белок, предпочтительно транспортирующий нейтральные разветвленные (валин, лейцин, изолейцин) и ароматические (триптофан, тирозин) аминокислоты.
CD133 является гликопротеином, также известным под названием проминин 1 (PROM1) и встречающимся у человека и грызунов. Он является членом трансмембранных гликопротеинов пентаспанов (5-трансмембранный, 5-TM), которые специфически локализуются в клеточных протрузиях. CD133 экспрессируется в кроветворных стволовых клетках, эндотелиальных клетках-предшественниках, нейрональных и глиальных стволовых клетках. См. публикацию Corbeil et al., Biochem Biophys Res Commun285 (4): 939-44, 2001. doi:10.1006/bbrc.2001.5271. PMID 11467842.
Поверхностные антигены, способствующие обогащению клеток, экспрессирующих маркеры, характерные для линии первичной кишечной трубки
В альтернативном варианте осуществления предложен способ дифференцирования популяции плюрипотентных стволовых клеток в популяцию клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, включающий в себя следующие стадии:
а. культивирование популяции плюрипотентных стволовых клеток;
b. дифференцирование популяции плюрипотентных стволовых клеток в популяцию клеток, экспрессирующих маркеры, характерные для линии дефинитивной энтодермы;
c. дифференцирование популяции клеток, экспрессирующих маркеры, характерные для линии дефинитивной энтодермы, в клетки, экспрессирующие маркеры, характерные для линии первичной кишечной трубки;
d. обогащение популяции клеток, экспрессирующих маркеры, характерные для линии первичной кишечной трубки;
e. дифференцирование популяции клеток, экспрессирующих маркеры, характерные для линии первичной кишечной трубки, в популяцию клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы; и
f. дифференцирование популяции клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, в популяцию клеток, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток.
В одном варианте осуществления настоящего изобретения популяцию клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, трансплантируют животному, при этом клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, дают начало инсулин-продуцирующим клеткам. В одном варианте осуществления эффективность образования инсулин-продуцирующих клеток повышается за счет обогащения популяции клеток, экспрессирующих маркеры, характерные для линии первичной кишечной трубки, до трансплантации.
Популяцию клеток, экспрессирующих маркеры, характерные для линии первичной кишечной трубки, обрабатывают по меньшей мере одним реагентом, который может связываться с LIF-рецептором.
Клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, клетки, экспрессирующие маркеры, характерные для линии первичной кишечной трубки, или инсулин-продуцирующие клетки можно обогащать, удалять, выделять, разделять, сортировать и (или) очищать, как это дополнительно проиллюстрировано примерами. Термин «обогащенный» или «очищенный», которые используются в настоящем документе, либо обогащенный или очищенный вследствие удаления других известных клеточных популяций, означают, что клетки подверглись определенному процессу отбора, так что популяция является обогащенной и (или) очищенной. Также клетки считаются относительно обогащенными и (или) очищенными, то есть в популяции есть значительно большее количество дифференцированных клеток определенной линии в сравнении с другой клеточной популяцией, в сравнении с плюрипотентными стволовыми клетками до «обогащения» или «очистки» или в сравнении с оригинальной или первоначальной клеточной культурой.
Обогащение или очистка определенного типа дифференцированных клеток может включать в себя «удаление», «разделение» или «сортировку» одного или более известных типов клеток от других типов клеток. В одном варианте осуществления популяцию клеток можно очищать путем удаления нежелательных типов дифференцированных клеток. Обогащение и очистка клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, путем очистки культуры клеток от известных или неизвестных клеточных типов может иметь благоприятный эффект. Таким образом, обогащенная или очищенная популяция клеток не будет содержать связанного или присоединенного антитела. Поскольку при этом нет необходимости удалять антитело из очищенной популяции, можно оптимизировать использование обогащенных или очищенных клеток для клеточной терапии.
Способы обогащения, удаления, выделения, разделения, сортировки и (или) очистки могут включать в себя, например, выборочные условия культивирования, при этом условия культивирования неблагоприятны для любого из нежелательных типов клеток.
Способы обогащения, удаления, выделения, разделения, сортировки и (или) очистки могут также включать в себя, например, покрытые антителами магнитные бусы, аффинную хроматографию и пэннинг с антителом, присоединенным к твердому матриксу или твердой фазе, например, культуральному планшету, колонке, или другой удобный и доступный метод. Методы, обеспечивающие точное разделение клеток, включают в себя методы проточной цитометрии, которые применимы для анализа параметров клеточной поверхности и внутриклеточных параметров, для оценки изменений формы и степени гранулярности, а также для анализа бус, используемых в качестве реагентов, связанных с антителами или диагностическими пробами. Считываемые показатели анализов проточной цитометрии включают в себя, помимо прочего, средний показатель флуоресценции, ассоциированный с отдельными молекулами клеточной поверхности или цитокинами, определяемыми при связывании с флуоресцентными антителами, или усредненную интенсивность флуоресценции, среднюю интенсивность флуоресценции, вариативность интенсивности или некоторую взаимосвязь между этими параметрами.
В некоторых аспектах вариантов осуществления с аналитическими стадиями, включающими использование проточной цитометрии, минимальными параметрами или характеристиками бус являются рассеяние света (прямое и (или) боковое) и по меньшей мере один показатель флуоресценции. Проточную цитометрию можно использовать для количественной оценки параметров, таких как наличие поверхностных белков или их конформационная или посттрансляционная модификация, наличие внутриклеточных или секретируемых белков, когда пермеабилизация обеспечивает доступ для антитела (или пробы) и т.п. Методы проточной цитометрии известны специалистам в данной области и описаны в следующих публикациях: Flow Cytometry and Cell Storing (Springer Lab Manual), Radbruch, ред., Springer Verlag, 2000 г.; Ormerod, Flow Cytometry, Springer Verlag, 1999 г.; Flow Cytometry Protocols (Methods in Molecular Biology, № 91), под ред. Jaroszeski и Heller, Humana Press, 1998 г.; Current Protocols in Cytometry, под ред. Robinson et al., John Wiley & Sons, New York, N.Y., 2000 г.
Интенсивность окрашивания клеток можно контролировать с помощью проточной цитометрии, когда лазерами определяют количественный уровень флуорохрома (он пропорционален количеству маркера клеточной поверхности, связавшегося со специфическими реагентами, например, антителами). Проточную цитометрию (FACS) можно также использовать для разделения клеточных популяций на основании интенсивности связывания со специфическим реагентом, а также на основании других параметров, таких как размер клеток и показатель рассеяния света. Хотя абсолютный уровень окрашивания может быть разным в зависимости от конкретного флуорохрома и реагента, данные могут быть нормализованы по отношению к контролю. Для нормализации распределения относительно контроля каждую клетку регистрируют как отдельную точку данных, которая имеет определенную интенсивность окрашивания.
Для нормализации распределения относительно контроля каждую клетку регистрируют как отдельную точку данных, которая имеет определенную интенсивность окрашивания. Эти точки данных могут отображаться по логарифмической шкале, в которой единицы измерения представляют собой условную интенсивность окрашивания. В одном примере наиболее яркие клетки в популяции определяют клетки, которые имеют большую на 4 логарифмических показателя интенсивность окрашивания, чем клетки, имеющие самый низкий уровень окрашивания. При отображении таким способом становится ясно, что клетки, имеющие самый большой логарифмический показатель интенсивности окрашивания, являются яркими, а те, которые имеют самую низкую интенсивность, являются отрицательно окрашенными. Клетки с «низким» окрашиванием, имеющие логарифмический показатель окрашивания, равный 2-3, могут иметь уникальные свойства в сравнении с клетками с отрицательным и положительным окрашиванием. В качестве альтернативного контроля можно использовать носитель, имеющий определенную плотность маркера на поверхности, например, бусы или клеточную линию, которые обеспечивают положительный контроль интенсивности. Обозначение «низкий» указывает на то, что уровень окрашивания выше яркости контрольных образцов, окрашенных контрольным антителом такого же изотипа, но меньше интенсивности окрашивания наиболее ярко окрашенных клеток, обычно выявляемых в популяции.
Показатели выбранных параметров возможно считывать одновременно или последовательно во время одного анализа, например, при использовании флуоресцентно меченных антител к молекулам клеточной поверхности. Например, антитела могут быть помечены разными флуорохромами, флуоресцентными бусами, метками, например, квантовыми точками и т.д., позволяющими выполнять одновременный анализ до 4 или более флуоресцентных окрасок с помощью проточной цитометрии. Например, клетки считаются отрицательно окрашенными, если уровень окрашивания находится на уровне или ниже яркости контрольных образцов, окрашенных контрольным антителом такого же изотипа. В то же время «тусклое» окрашивание указывает на уровень окрашивания, который приближается к отрицательному окрашиванию, но который может быть ярче уровня окрашивания контрольным антителом такого же изотипа.
Идентификаторы отдельных клеток, например, клеток различных типов или вариантов, могут быть флуоресцентными, например, могут представлять собой окрашивание флуоресцентным соединением различных типов клеток в разной степени интенсивности и т.п., как описано выше в настоящем документе. В некоторых аспектах вариантов осуществления при необходимости смешивания двух типов клеток один из типов метят, а второй оставляют немеченым. В некоторых аспектах вариантов осуществления при необходимости оперировать тремя или более типами клеток каждый из типов может быть мечен до различных уровней интенсивности флуоресценции путем инкубации с различными концентрациями окрашивающего соединения или путем инкубации с различной продолжительностью. В качестве идентификаторов большого количества клеток можно использовать матрицу интенсивности флуоресцентного окрашивания двумя или большим количеством флуоресцентных окрасок, так что количество разных выявляемых единиц типов клеток представляет собой ряд уровней флуоресценции одного цвета, например, сукцинимидиловый эфир карбоксифлуоресцеина (CFSE), умноженное на число уровней флуоресценции второго используемого цвета, например, изотиоцианата тетраметилродамина (TRITC) и т.п., умноженное на число уровней третьей окраски и т.д. В альтернативном варианте внутренние характеристики рассеяния света, характерные для различных типов клеток, или характеристики BioMAPs тестовых параметров, включенных в анализ, можно использовать в дополнение или вместо флуоресцентных меток в качестве идентификаторов единиц клеточных типов.
В другом аспекте клетки могут быть обогащены, удалены, выделены, разделены, отсортированы и (или) очищены с использованием стандартных методик аффинного разделения или использования антител. Например, лиганд и (или) антитело могут быть конъюгированы с метками для упрощения разделения определенного типа клеток, например, с помощью магнитных бус; биотином, который связывает с высокой аффинностью с авидином или стрептавидином; флуорохромами, которые можно использовать в проточной цитометрии с сортировкой клеток; гаптенами и т.п.
В одном варианте осуществления лиганд, агент и (или) антитела, описанные в настоящем документе, могут быть напрямую или опосредованно конъюгированы с магнитным реагентом, таким как суперпарамагнитная микрочастица (микрочастица). Прямое конъюгирование к магнитной частице может быть достигнуто с помощью различных химических связывающих групп, что хорошо известно специалистам в данной области. В некоторых вариантах осуществления антитело соединено с микрочастицами с помощью боковых цепей амино- или сульфгидрильных групп и гетерофункциональных поперечно-сшивающих реагентов.
В распоряжении имеется большое число гетерофункциональных соединений для сшивания частиц. Например, можно использовать по меньшей мере N-гидроксисукцинимидный эфир 3-(2-пиридилдитио)-пропионовой кислоты (SPDP) или N-гидроксисукцинимидный эфир 4-(N-малеимидометил)-циклогексан-1-карбоновой кислоты (SMCC), которые взаимодействуют с реактивной сульфгидрильной группой антитела и реактивной аминогруппой на магнитной частице. Пример устройства для магнитного разделения описан в публикациях №№ WO 90/07380, PCT/US96/00953, а также в патенте № EP 438520, полностью включенных в настоящий документ путем ссылки.
Очищенные популяции клеток можно собирать в любую подходящую культуральную среду. Допустимые среды могут включать в себя, например, модифицированную по способу Дульбекко среду Игла (dMEM), основной солевой раствор Хэнка (HBSS), фосфатный буферный раствор Дульбекко (DPBS), среду RPMI, модифицированную по способу Искова среду Дульбекко (IMDM), фосфатный буферный раствор (PBS) с 5 мМ ЭДТК и т.д., часто с добавлением эмбриональной телячьей сыворотки (FCS), бычьего сывороточного альбумина (BSA), сывороточного альбумина человека (HSA), а также бессывороточную среду для культивирования человеческих эмбриональных стволовых клеток StemPro®hESC SFM.
В одном варианте осуществления клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, обогащают путем обработки по меньшей мере одним агентом, который выполняет отбор клеток, не экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток. В альтернативном варианте осуществления клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, обогащают путем обработки по меньшей мере одним агентом, который выполняет разделение инсулин-продуцирующих клеток.
Используя описанные в настоящем документе способы, клеточные популяции или культуры клеток, можно обогащать клеточное содержание в по меньшей мере от приблизительно 2 до приблизительно 1000 раз в сравнении с необработанными клеточными популяциями или клеточными культурами. В некоторых вариантах осуществления клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, можно обогащать клеточным содержанием в по меньшей мере от приблизительно 5 до приблизительно 500 раз в сравнении с необработанными клеточными популяциями или клеточными культурами. В других вариантах осуществления клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, можно обогащать клеточным содержанием в по меньшей мере от приблизительно 10 до приблизительно 200 раз в сравнении с необработанными клеточными популяциями или клеточными культурами. В других вариантах осуществления клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, можно обогащать клеточным содержанием в по меньшей мере от приблизительно 20 до приблизительно 100 раз в сравнении с необработанными клеточными популяциями или клеточными культурами. В других вариантах осуществления клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, можно обогащать клеточным содержанием в по меньшей мере от приблизительно 40 до приблизительно 80 раз в сравнении с необработанными клеточными популяциями или клеточными культурами. В некоторых вариантах осуществления клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, можно обогащать клеточным содержанием в по меньшей мере от приблизительно 2 до приблизительно 20 раз, в сравнении с необработанными клеточными популяциями или клеточными культурами.
Характеризация клеток, являющихся производными от плюрипотентных стволовых клеток
Формирование дифференцированных клеток из плюрипотентных стволовых клеток можно выявлять путем обнаружения экспрессии маркеров, характерных для данного типа дифференцированных клеток. В некоторых вариантах осуществления выявление и характеризация дифференцированных клеток осуществляется путем оценки экспрессии определенного маркера или различных уровней экспрессии и особенностей экспрессии более чем одного маркера.
В частности, присутствие или отсутствие, высокий или низкий уровень экспрессии одного или более маркера(-ов) может характеризовать и идентифицировать клеточный тип. Также некоторые маркеры могут иметь транзиторный характер экспрессии, когда высокая экспрессия маркера характерна для определенной стадии развития, а низкая - для другой стадии развития. Экспрессию некоторых маркеров можно выявлять путем измерения уровня маркера в клетках клеточной культуры или клеточной популяции в сравнении со стандартизированным или нормализованным контрольным маркером. Во время этого анализа оценка экспрессии маркера может быть качественной или количественной. Одним из способов количественной оценки экспрессии маркеров, продуцируемых генами, кодирующими маркер, является количественная ПЦР (К-ПЦР). Способ проведения К-ПЦР хорошо известен специалистам в данной области. Другие способы, тоже известные специалистам в данной области, также можно использовать для количественной оценки экспрессии генов. Например, экспрессию продукта маркерного гена можно определять с использованием антител, специфически распознающих данный продукт (например, с помощью Вестерн-блоттинга, проточно-цитометрического анализа и т.п.). В некоторых вариантах осуществления можно определять экспрессию маркерных генов, характерных для дифференцированных клеток. Кроме того, можно определять отсутствие значительной экспрессии таких генов.
Экспрессию тканеспецифичных генных продуктов также можно определять на уровне мРНК методом Нозерн-блоттинга, дот-блот гибридизации или инициированной обратной транскриптазой полимеразной цепной реакции (ОТ-ПЦР) с использованием специфичных для первичной нуклеотидной последовательности праймеров в стандартной реакции амплификации. Для получения дополнительной более подробной информации см. патент США № 5843780. Данные в отношении первичной последовательности отдельных маркеров, указанных в настоящем документе, могут быть получены из общедоступных баз данных, таких как GenBank.
Плюрипотентные стволовые клетки могут экспрессировать один или более стадиеспецифических эмбриональных антигенов (SSEA) 3 и 4, а также маркеры, определяемые антителами, обозначаемыми как Tra-1-60 и Tra-1-81 (Thomson et al., Science 282:1145, 1998 г.). Дифференцирование плюрипотентных стволовых клеток in vitro приводит к потере экспрессии SSEA-4, Tra 1-60 и Tra 1-81 (при наличии) и повышению экспрессии SSEA-1. В недифференцированных плюрипотентных стволовых клетках, как правило, активна щелочная фосфатаза, которую можно обнаружить путем фиксации клеток с помощью 4% параформальдегида, с последующим обнаружением с помощью Vector Red, применяемого в качестве субстрата, в соответствии с инструкциями производителя (Vector Laboratories, г. Берлингейм, штат Калифорния). Недифференцированные плюрипотентные стволовые клетки также, как правило, экспрессируют OCT4 и TERT, определяемые с помощью ОТ-ПЦР.
Маркеры, характерные для линии панкреатической энтодермы, выбирают из группы, состоящей из PDX1, HNF1 бета, PTF1 альфа, HNF6, HB9 и PROX1. Для целей настоящего изобретения пригодны клетки с экспрессией по меньшей мере одного из маркеров, характерных для линии панкреатической энтодермы. В одном аспекте настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии панкреатической энтодермы, представляет собой клетку панкреатической энтодермы.
Маркеры, характерные для линии дефинитивной энтодермы, выбирают из группы, состоящей из SOX17, GATA4, HNF3 бета, GSC, CER1, Nodal, FGF8, Brachyury, Mix-подобного гомеобоксного белка, FGF4, CD48, эомезодермина (EOMES), DKK4, FGF17, GATA6, CD184, C-Kit, CD99 и OTX2. Для целей настоящего изобретения пригодны клетки с экспрессией по меньшей мере одного из маркеров, характерных для линии дефинитивной энтодермы. В одном аспекте настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии дефинитивной энтодермы, представляет собой клетку-предшественника первичной полоски. В альтернативном аспекте клетка, экспрессирующая маркеры, характерные для линии дефинитивной энтодермы, представляет собой мезэнтодермальную клетку. В альтернативном аспекте клетка, экспрессирующая маркеры, характерные для линии дефинитивной энтодермы, представляет собой клетку дефинитивной энтодермы.
Маркеры, характерные для линии панкреатических эндокринных клеток, выбирают из группы, состоящей из NGN3, NEUROD, ISL1, PDX1, NKX6.1, PAX4, NGN3 и PTF-1 альфа. В одном варианте осуществления панкреатическая эндокринная клетка может экспрессировать по меньшей мере один из следующих гормонов: инсулин, глюкагон, соматостатин и панкреатический полипептид. Соответствующей целям настоящего изобретения является клетка, экспрессирующая по меньшей мере один из маркеров, характерных для линии панкреатических эндокринных клеток. В одном аспекте настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии панкреатических эндокринных клеток, представляет собой панкреатическую эндокринную клетку. Панкреатическая эндокринная клетка может представлять собой панкреатическую клетку, экспрессирующую гормоны. В альтернативном варианте осуществления панкреатическая эндокринная клетка может представлять собой панкреатическую клетку, секретирующую гормоны.
В одном аспекте настоящего изобретения панкреатическая эндокринная клетка представляет собой клетку, экспрессирующую маркеры, характерные для β-клеточной линии дифференцирования. Клетка, экспрессирующая маркеры, характерные для β-клеточной линии дифференцирования, экспрессирует PDX1, а также по меньшей мере один из следующих транскрипционных факторов: NGN3, NKX2.2, NKX6.1, NEUROD, ISL1, HNF3 бета, MAFA, PAX4 и PAX6. В одном аспекте настоящего изобретения клетка, экспрессирующая маркеры, характерные для β-клеточной линии дифференцирования, представляет собой β-клетку.
Плюрипотентные стволовые клетки
Характеризация плюрипотентных стволовых клеток
Плюрипотентные стволовые клетки могут экспрессировать один или более стадиеспецифических эмбриональных антигенов (SSEA) 3 и 4, а также маркеры, определяемые антителами, обозначаемыми как Tra-1-60 и Tra-1-81 (Thomson et al., Science 282:1145, 1998 г.). Дифференцирование плюрипотентных стволовых клеток in vitro приводит к потере экспрессии SSEA-4, Tra-1-60 и Tra-1-81 (при наличии) и повышению экспрессии SSEA-1. В недифференцированных плюрипотентных стволовых клетках, как правило, активна щелочная фосфатаза, которую можно обнаружить путем фиксации клеток с помощью 4% параформальдегида, с последующим обнаружением с помощью Vector Red, применяемого в качестве субстрата, в соответствии с инструкциями производителя (Vector Laboratories, г. Берлингейм, штат Калифорния). Недифференцированные плюрипотентные стволовые клетки также, как правило, экспрессируют Oct-4 и TERT, обнаруживаемые ОТ-ПЦР.
Другим желательным фенотипическим свойством выращенных плюрипотентных клеток является потенциал дифференцирования в клетки всех трех зародышевых листков: в энтодермальные, мезодермальные и эктодермальные ткани. Плюрипотентность стволовых клеток может быть подтверждена, например, путем инъекции клеток мышам с тяжелым комбинированным иммунодефицитом (SCID), фиксации образующихся тератом с использованием 4% параформальдегида и их гистологического исследования на предмет наличия клеточных типов, происходящих от трех зародышевых листков. В альтернативном варианте осуществления плюрипотентность можно определить по образованию эмбриоидных тел и их анализа на предмет присутствия маркеров, которые ассоциируются с тремя зародышевыми листками.
Выращенные линии плюрипотентных стволовых клеток могут быть кариотипированы с применением стандартного способа окрашивания с использованием красителя Гимза и сравнения с опубликованными кариотипами соответствующих видов приматов. Желательно получить клетки, имеющие «нормальный кариотип», то есть эуплоидные клетки, в которых все человеческие хромосомы присутствуют и не имеют видимых изменений.
Источники плюрипотентных стволовых клеток
К типам плюрипотентных стволовых клеток, которые можно использовать, относятся стабильные линии плюрипотентных клеток, получаемых из ткани, которая образуется после беременности, в том числе из преэмбриональной ткани (такой как бластоциста), эмбриональной ткани или ткани плода, взятой в любой момент в период беременности, как правило, но не обязательно, до срока приблизительно 10-12 недель беременности. Неограничивающими примерами являются устойчивые линии эмбриональных стволовых клеток человека или эмбриональных зародышевых клеток человека, например, линии эмбриональных стволовых клеток человека H1, H7 и H9 (WiCell). Также возможно использование описываемых в настоящей заявке композиций во время первоначального установления или стабилизации таких клеток. В этом случае исходными клетками являются первичные плюрипотентные клетки, взятые напрямую из тканей-источников. Также пригодны для целей настоящего изобретения клетки, взятые из популяции плюрипотентных стволовых клеток, ранее культивируемых в отсутствие питающих клеток, или из популяции плюрипотентных стволовых клеток, ранее культивируемых в присутствии питающих клеток. Также пригодны для целей настоящего изобретения линии мутантных эмбриональных стволовых клеток человека, такие как BG01v (BresaGen, г. Афины, штат Джорджия). Также пригодны для целей настоящего изобретения клетки, полученные из соматических клеток взрослого человека, например, клетки, описанные в публикации Takahashi et al., Cell 131: 1-12 (2007 г.).
В одном варианте осуществления эмбриональные стволовые клетки человека готовят, как описано в публикации Thomson et al. (патент США № 5843780, Science 282:1145, 1998 г.; Curr. Top. Dev. Biol. 38:133 ff., 1998 г.; Proc. Natl. Acad. Sci. USA. 92:7844, 1995 г.).
Также предполагается, что плюрипотентные стволовые клетки происходят от соматических клеток. В одном варианте осуществления плюрипотентные стволовые клетки, допустимые для использования в целях настоящего изобретения, могут быть получены в соответствии со способами, описанными Takahashi et al. (Cell 126: 663-676, 2006 г.).
В альтернативном варианте осуществления плюрипотентные стволовые клетки, допустимые для использования в целях настоящего изобретения, могут быть получены в соответствии со способами, описанными Li et al. (Cell Stem Cell 4: 16-19, 2009 г.).
В альтернативном варианте осуществления плюрипотентные стволовые клетки, допустимые для использования в целях настоящего изобретения, могут быть получены в соответствии со способами, описанными Maherali et al. (Cell Stem Cell 1: 55-70, 2007 г.).
В альтернативном варианте осуществления плюрипотентные стволовые клетки, допустимые для использования в целях настоящего изобретения, могут быть получены в соответствии со способами, описанными Stadtfeld et al. (Cell Stem Cell 2: 230-240).
В альтернативном варианте осуществления плюрипотентные стволовые клетки, допустимые для использования в целях настоящего изобретения, могут быть получены в соответствии со способами, описанными Nakagawa et al. (Nature Biotechnology 26: 101-106, 2008 г.).
В альтернативном варианте осуществления плюрипотентные стволовые клетки, допустимые для использования в целях настоящего изобретения, могут быть получены в соответствии со способами, описанными Takahashi et al. (Cell 131: 861-872, 2007 г.).
В альтернативном варианте осуществления плюрипотентные стволовые клетки, допустимые для использования в целях настоящего изобретения, могут быть получены в соответствии со способами, описанными в заявке на патент США № 61/256149, принадлежащей Centocor R&D, Inc.
Культивирование плюрипотентных стволовых клеток
В одном варианте осуществления перед культивированием в соответствии со способами, составляющими предмет настоящего изобретения, плюрипотентные стволовые клетки культивируют на слое питающих клеток или белка внеклеточного матрикса, которые различным образом поддерживают плюрипотентные стволовые клетки. Например, плюрипотентные стволовые клетки культивируют на слое питающих клеток, который поддерживает пролиферацию плюрипотентных стволовых клеток без их существенного дифференцирования. Рост плюрипотентных стволовых клеток на слое питающих клеток без дифференцирования поддерживают путем использования (i) культурального сосуда с имеющимся слоем питающих клеток; и (ii) среды, кондиционированной путем предварительного культивирования клеток иного типа, или некондиционированной среды, например, не содержащей сыворотки среды или даже среды с химически определенным составом.
В другом примере плюрипотентные стволовые клетки культивируют в культуральной системе, по существу свободной от питающих клеток, но, тем не менее, способной поддерживать пролиферацию плюрипотентных стволовых клеток без существенного дифференцирования. Рост плюрипотентных стволовых клеток в свободной от питающих клеток культуральной системе без дифференцирования поддерживают путем использования (i) адсорбированного слоя на твердом носителе, содержащего один или более белков внеклеточного матрикса; и (ii) среды, кондиционированной путем предварительного культивирования клеток иного типа, или некондиционированной среды, например, не содержащей сыворотки среды или даже среды с химически определенным составом.
В альтернативном варианте осуществления плюрипотентные стволовые клетки культивируют на поверхностно-модифицированном планшете, содержащем от по меньшей мере приблизительно 0,5% N, с суммарным содержанием O и N не ниже 17,2% и с углом смачивания по меньшей мере приблизительно 13,9 градуса, в среде, кондиционированной путем предварительного культивирования клеток иного типа, или некондиционированной среде, например, не содержащей сыворотки среде или даже среде с химически определенным составом.
Культуральная среда. Пример соответствующей целям настоящего изобретения клеточной культуральной среды приведен в публикации № US20020072117. Другой пример клеточной культуральной среды, соответствующей целям настоящего изобретения, приведен в публикации № US6642048. Другой пример клеточной культуральной среды, соответствующей целям настоящего изобретения, приведен в публикации № WO2005014799. Другой пример клеточной культуральной среды, соответствующей целям настоящего изобретения, приведен в публикации Xu et al. (Stem Cells 22: 972-980, 2004 г.). Другой пример клеточной культуральной среды, соответствующей целям настоящего изобретения, приведен в публикации № US20070010011. Другой пример клеточной культуральной среды, соответствующей целям настоящего изобретения, приведен в публикации Cheon et al. (BioReprod DOI:10.1095/biolreprod.105.046870; 19 октября 2005 г.). Другой пример клеточной культуральной среды, соответствующей целям настоящего изобретения, приведен в работе Levenstein et al. (Stem Cells 24: 568-574, 2006 г.). Другой пример клеточной культуральной среды, соответствующей целям настоящего изобретения, приведен в публикации № US20050148070. Другой пример клеточной культуральной среды, соответствующей целям настоящего изобретения, приведен в публикации № US20050233446. Другой пример клеточной культуральной среды, соответствующей целям настоящего изобретения, приведен в публикации № US6800480. Другой пример клеточной культуральной среды, соответствующей целям настоящего изобретения, приведен в публикации № US20050244962. Другой пример клеточной культуральной среды, соответствующей целям настоящего изобретения, приведен в публикации № WO2005065354. Другой пример клеточной культуральной среды, соответствующей целям настоящего изобретения, приведен в публикации № WO2005086845.
Допустимая культуральная среда также может быть приготовлена из указанных ниже компонентов, таких как, например, модифицированная по способу Дульбекко среда Игла (DMEM), Gibco № 11965-092, нокаут-среда Игла, модифицированная по способу Дульбекко (KO DMEM), Gibco № 10829-018, основная среда Хэма F12/50% DMEM, 200 мM L-глутамина, Gibco № 15039-027, раствор неосновных аминокислот, Gibco № 11140-050, β-меркаптоэтанол, Sigma № M7522, человеческий рекомбинантный основной фактор роста фибробластов (bFGF), Gibco № 13256-029.
Дифференцирование плюрипотентных стволовых клеток
В одном варианте осуществления плюрипотентные стволовые клетки размножаются в культуре, после чего их обрабатывают таким образом, чтобы индуцировать их дифференцирование в клетки иного типа. Например, плюрипотентные стволовые клетки, сформированные в соответствии со способами, составляющими предмет настоящего изобретения, могут быть дифференцированы в нервные клетки-предшественники или кардиомиоциты в соответствии со способами, описанными в публикации № WO2007030870.
В другом примере плюрипотентные стволовые клетки, сформированные в соответствии со способами, составляющими предмет настоящего изобретения, могут быть дифференцированы в гепатоциты в соответствии со способами, описанными в патенте США № 6458589.
Дифференцирование плюрипотентных стволовых клеток, сформированных способами, составляющими предмет настоящего изобретения, в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы
Плюрипотентные стволовые клетки, сформированные способами, составляющими предмет настоящего изобретения, могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, любым известным специалистам способом.
Например, плюрипотентные стволовые клетки, сформированные способами, составляющими предмет настоящего изобретения, могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, как описано в публикации D’Amour et al,Nature Biotechnology 23, 1534-1541 (2005 г.).
Например, плюрипотентные стволовые клетки, сформированные способами, составляющими предмет настоящего изобретения, могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, в соответствии со способами, описанными в публикации Shinozaki et al,Development 131, 1651-1662 (2004 г.).
Например, плюрипотентные стволовые клетки, сформированные способами, составляющими предмет настоящего изобретения, могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, в соответствии со способами, описанными в публикации McLean et al,Stem Cells 25, 29-38 (2007 г.).
Например, плюрипотентные стволовые клетки, сформированные способами, составляющими предмет настоящего изобретения, могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, в соответствии со способами, описанными в публикации D’Amour et al,Nature Biotechnology 24, 1392-1401 (2006 г.).
В другом примере плюрипотентные стволовые клетки, сформированные способами, составляющими предмет настоящего изобретения, могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, способами, раскрытыми в заявке на патент США № 11/736908, принадлежащей LifeScan, Inc.
В другом примере плюрипотентные стволовые клетки, сформированные способами, составляющими предмет настоящего изобретения, могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, способами, раскрытыми в заявке на патент США № 11/779311, принадлежащей LifeScan, Inc.
В другом примере плюрипотентные стволовые клетки, сформированные способами, составляющими предмет настоящего изобретения, могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, способами, раскрытыми в заявке на патент США № 12/493741, принадлежащей LifeScan, Inc.
В другом примере плюрипотентные стволовые клетки, сформированные способами, составляющими предмет настоящего изобретения, могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, способами, раскрытыми в заявке на патент США № 12/494789, принадлежащей LifeScan, Inc.
Образование клеток, экспрессирующих маркеры, характерные для линии дефинитивной энтодермы, может быть выявлено путем проверки на наличие маркеров до и после выполнения конкретного протокола. Плюрипотентные стволовые клетки, как правило, не экспрессируют такие маркеры. Таким образом, дифференцирование плюрипотентных клеток определяется по началу экспрессии таких маркеров.
Дифференцирование плюрипотентных стволовых клеток, сформированных способами, составляющими предмет настоящего изобретения, в клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы
Плюрипотентные стволовые клетки, сформированные способами, составляющими предмет настоящего изобретения, могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, любым известным специалистам способом.
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, способами, описанными в публикации D’Amour et al, Nature Biotechnology 24, 1392-1401 (2006 г.).
Например, клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, полученные способами, составляющими предмет настоящего изобретения, дополнительно дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, путем обработки клеток, экспрессирующих маркеры, характерные для линии дефинитивной энтодермы, фактором роста фибробластов и ингибитором сигнального пути Hedgehog KAAD-циклопамином с последующим удалением среды, содержащей фактор роста фибробластов и KAAD-циклопамин, и последующим культивированием клеток в среде, содержащей ретиноевую кислоту, фактор роста фибробластов и KAAD-циклопамин. Пример использования данного способа приведен в публикации Nature Biotechnology 24, 1392-1401 (2006 г.).
Например, клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, полученные способами, составляющими предмет настоящего изобретения, дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, путем обработки клеток, экспрессирующих маркеры, характерные для линии дефинитивной энтодермы, ретиноевой кислотой и одним фактором роста фибробластов в течение периода времени, соответствующего способам, описанным в заявке на патент США № 11/736908, принадлежащей LifeScan, Inc.
Например, клетки, экспрессирующие маркеры, характерные для линии дефинитивной энтодермы, полученные способами, составляющими предмет настоящего изобретения, дополнительно дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, путем обработки клеток, экспрессирующих маркеры, характерные для линии дефинитивной энтодермы, ретиноевой кислотой (Sigma-Aldrich, штат Миссури) и экзендином 4 и последующего удаления среды, содержащей DAPT (Sigma-Aldrich, штат Миссури) и экзендин 4 с дальнейшим культивированием клеток в среде, содержащей экзендин 1, IGF-1 и HGF. Пример использования данного способа приведен в публикации Nature Biotechnology 24, 1392-1401 (2006 г.).
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, полученные способами, составляющими предмет настоящего изобретения, дополнительно дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем обработки клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, средой, содержащей экзендин 4, а затем удаления среды, содержащей экзендин 4, с последующим культивированием клеток в среде, содержащей экзендин 1, IGF-1 и HGF. Пример использования данного способа приведен в публикации D’Amour et al, Nature Biotechnology, 2006 г.
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, полученные способами, составляющими предмет настоящего изобретения, дополнительно дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем обработки клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, средой, содержащей DAPT (Sigma-Aldrich, штат Миссури) и экзендин 4. Пример использования данного способа приведен в публикации D’Amour et al, Nature Biotechnology, 2006 г.
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, полученные способами, составляющими предмет настоящего изобретения, дополнительно дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем обработки клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, средой, содержащей экзендин 4. Пример использования данного способа приведен в публикации D’Amour et al, Nature Biotechnology, 2006 г.
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, полученные способами, составляющими предмет настоящего изобретения, дополнительно дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем обработки клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, фактором, ингибирующим сигнальный путь Notch, способами, описанными в заявке на патент США № 11/736908, принадлежащей LifeScan, Inc.
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, полученные способами, составляющими предмет настоящего изобретения, дополнительно дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем обработки клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, фактором, ингибирующим сигнальный путь Notch, способами, описанными в заявке на патент США № 11/779311, принадлежащей LifeScan, Inc.
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, полученные способами, составляющими предмет настоящего изобретения, дополнительно дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем обработки клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, фактором, ингибирующим сигнальный путь Notch, способами, описанными в заявке на патент США № 60/953178, принадлежащей LifeScan, Inc.
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, полученные способами, составляющими предмет настоящего изобретения, дополнительно дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем обработки клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, фактором, ингибирующим сигнальный путь Notch, способами, описанными в заявке на патент США № 60/990529, принадлежащей LifeScan, Inc.
Дифференцирование плюрипотентных стволовых клеток, сформированных способами, составляющими предмет настоящего изобретения, в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток
Плюрипотентные стволовые клетки, сформированные способами, составляющими предмет настоящего изобретения, могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, сформированной любым известным специалистам способом.
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, полученные способами, составляющими предмет настоящего изобретения, дополнительно дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем обработки клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, средой, содержащей экзендин 4, а затем удаления среды, содержащей экзендин 4, с последующим культивированием клеток в среде, содержащей экзендин 1, IGF-1 и HGF. Пример использования данного способа приведен в публикации D’Amour et al, Nature Biotechnology, 2006 г.
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, полученные способами, составляющими предмет настоящего изобретения, дополнительно дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем обработки клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, средой, содержащей DAPT (Sigma-Aldrich, штат Миссури) и экзендин 4. Пример использования данного способа приведен в публикации D’Amour et al, Nature Biotechnology, 2006 г.
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, полученные способами, составляющими предмет настоящего изобретения, дополнительно дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем обработки клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, средой, содержащей экзендин 4. Пример использования данного способа приведен в публикации D’Amour et al, Nature Biotechnology, 2006 г.
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, полученные способами, составляющими предмет настоящего изобретения, дополнительно дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем обработки клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, фактором, ингибирующим сигнальный путь Notch, способами, описанными в заявке на патент США № 11/736908, принадлежащей LifeScan, Inc.
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, полученные способами, составляющими предмет настоящего изобретения, дополнительно дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем обработки клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, фактором, ингибирующим сигнальный путь Notch, способами, описанными в заявке на патент США № 11/779311, принадлежащей LifeScan, Inc.
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, полученные способами, составляющими предмет настоящего изобретения, дополнительно дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем обработки клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, фактором, ингибирующим сигнальный путь Notch, способами, описанными в заявке на патент США № 60/953178, принадлежащей LifeScan, Inc.
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической энтодермы, полученные способами, составляющими предмет настоящего изобретения, дополнительно дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем обработки клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, фактором, ингибирующим сигнальный путь Notch, способами, описанными в заявке на патент США № 60/990529, принадлежащей LifeScan, Inc.
Настоящее изобретение дополнительно иллюстрируется, помимо прочего, следующими примерами.
ПРИМЕРЫ
Пример 1
Дифференцирование человеческих эмбриональных стволовых клеток линии H1 в панкреатические эндокринные клетки в отсутствие эмбриональной бычьей сыворотки
Человеческие эмбриональные стволовые клетки линии H1 при различных пассажах (от 40 до 52) культивировали на планшетах, покрытых препаратом MATRIGEL (разведение 1:30) и дифференцировали в клетки панкреатической линии дифференцирования по следующему многостадийному протоколу:
а. стадия I (дефинитивная энтодерма): человеческие эмбриональные стволовые клетки культивировали в среде RPMI с добавлением 2% обезжиренного BSA (№ по каталогу 68700, Proliant, г. Лос-Анджелес) и 100 нг/мл активина A (R&D Systems, штат Миннесота) с добавлением 20 нг/мл WNT-3a (№ по каталогу 1324-WN-002, R&D Systems, штат Миннесота) и 8 нг/мл bFGF (№ по каталогу 100-18B, PeproTech, штат Нью-Джерси) в течение одного дня. Затем клетки обработали средой RPMI с добавлением 2% BSA и 100 нг/мл активина A и 8 нг/мл bFGF в течение еще двух дней, затем
b. стадия II (первичная кишечная трубка): клетки обрабатывали RPMI + 2% обезжиренного BSA и 50 нг/мл FGF7 и 0,25 мкМ SANT-1 (№ по каталогу S4572, Sigma, штат Миссури) в течение двух-трех дней, затем
c. стадия III (задняя часть передней кишки): клетки обрабатывали средой DMEM с высоким содержанием глюкозы с добавлением ITS-X в разведении 1:200 (Invitrogen, штат Калифорния) и 0,1% BSA (LipidRich) (Invitrogen, № по каталогу 11021-045), 50 нг/мл FGF7, 0,25 мкМ SANT-1, 2 мкМ ретиноевой кислоты (RA) (Sigma, штат Миссури), 100 нг/мл Noggin (R&D Systems, штат Миннесота) и активина A в концентрации 20 нг/мл в течение четырех дней; в некоторых вариантах Noggin заменяли ингибитором AMPK 6-[4-(2-пиперидин-1-илэтокси)фенил]-3-пиридин-4-илпиразоло[1,5-а]пиримидина (Sigma, № P5499) в концентрации 2 мкМ. В других вариантах ингибитор P38 (4-[4-(4-фторфенил)-1-(3-фенилпропил)-5-пиридин-4-ил-1H-имидазол-2-ил]бут-3-ин-1-ол) (описанный в патенте США № 6521655) добавили в концентрации 2,5 мкМ, затем
d. стадия IV (панкреатический эндокринный предшественник): клетки обрабатывали средой DMEM с высоким содержанием глюкозы с добавлением ITS-X в разведении 1:200 (Invitrogen, штат Калифорния) и 0,1% BSA (Invitrogen, штат Калифорния), 100 нг/мл Noggin, 1 мкМ ингибитора ALK5 (SD-208, описан в Molecular Pharmacology 2007 72:152-161) в течение трех дней, затем
e. стадия V (панкреатические эндокринные клетки): клетки обрабатывали средой DMEM с высоким содержанием глюкозы с добавлением ITS-X в разведении 1:200 (Invitrogen, Калифорния) и 0,1% BSA (Invitrogen, штат Калифорния), 1 мкМ ингибитора II ALK5 (№ по каталогу 616452, Calbiochem, штат Калифорния) в течение семи дней, затем
f. стадия VI (зрелые панкреатические эндокринные клетки): клетки обрабатывали средой DMEM с высоким содержанием глюкозы с добавлением ITS-X в разведении 1:200 (Invitrogen, штат Калифорния) и 0,1% BSA (Invitrogen, штат Калифорния) в течение семи дней со сменой культуральной среды через день.
Пример 2
Проточно-цитометрическая характеризация и сортировка различных обогащенных линий панкреатических клеток
Для облегчения выделения и характеризации новых клеточных популяций, получаемых на различных стадиях процесса дифференцирования, описанного в примере 1, клетки, получаемые на разных стадиях, детально охарактеризовали с помощью проточной цитометрии. Полный список используемых антител и уровней экспрессии маркеров клеточной поверхности на разных стадиях дифференцирования показаны в таблице I.
Человеческие эмбриональные стволовые клетки линии H1 при различных пассажах (от 40 до 52) культивировали на планшетах, покрытых препаратом MATRIGEL, и дифференцировали в панкреатические эндокринные клетки по протоколу, описанному в примере 1.
Клетки на различных стадиях созревания (задняя часть передней кишки (стадия III), эндокринные клетки-предшественники (стадия IV), панкреатические эндокринные клетки (стадия V) или зрелые панкреатические эндокринные клетки (стадия VI)) осторожно высвобождали инкубацией в TrypLE Express (Invitrogen, № по каталогу 12604, штат Калифорния) в течение 2-3 минут при 37°C и дважды промывали в буферном растворе для окрашивания BD FACS, содержащем 2% BSA (BD № по каталогу 554657, штат Калифорния). Приблизительно 0,5-1×106 клеток ресуспендировали в 100-200 мкл блокирующего буферного раствора (0,5% человеческого гамма-глобулина, разведенного 1:4 в буферном растворе для окрашивания (BD, штат Калифорния) для окрашивания. Для окрашивания напрямую конъюгированными первичными антителами соответствующее антитело добавляли к клеткам в конечном разведении 1:20 и инкубировали клетки в течение 30 минут при 4°C. При использовании неконъюгированных антител первичные антитела добавляли к клеткам в разведении 1:50-1:100 и инкубировали клетки в течение 30 минут при 4°C, после чего дважды промывали в буферном растворе для окрашивания. Затем клетки инкубировали с соответствующими вторичными антителами в разведении 1:500. Окрашенные клетки ресуспендировали в 300 мкл буферного раствора для окрашивания и добавляли 5-10 мкл 7AAD, чтобы отличить живые клетки от мертвых, прежде чем провести анализ с использованием проточного цитометра BD FACS Canto II.
Для сортировки клеток приблизительно 30-40 миллионов клеток обрабатывали так же, как и для выполнения проточно-цитометрического анализа. Клетки окрашивали соответствующими антителами, как указано в таблице II. Клетки сортировали на две или три субпопуляции, как указано в таблице II. Цитометрические параметры для сортировки клеток определяли на основании анализа клеток, окрашенных соответствующими контрольными антителами того же изотипа. Образец отсортированных клеток анализировали для оценки чистоты популяции с последующим ПЦР-анализом экспрессии основных панкреатических маркеров. РНК выделяли с помощью набора Rneasy Mini Kit (Qiagen, штат Калифорния) и осуществляли ее забор из несортированного образца и различных фракций.
Маркеры клеточной поверхности, использованные для сортировки, были отобраны на основании результатов оценки экспрессии различных маркеров в популяциях клеток, проанализированных на разных стадиях протокола клеточного дифференцирования, описанного в примере 1. Маркеры, использованные в настоящем исследовании, описаны в таблице II. Коротко говоря, маркеры клеточной поверхности, описанные в таблице II, использовали для сортировки различных популяций клеток либо по отдельности, либо в комбинации. Образцы отсортированных клеток были отобраны для анализа экспрессии маркеров, характерных для панкреатической эндокринной линии дифференцирования с помощью реакции ПЦР в реальном времени.
Сортировка клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток
Антитела к CD56 и CD13 использовали для сортировки популяции клеток, полученных на стадии IV протокола дифференцирования, описанного в примере 1. Были идентифицированы три популяции клеток: a) CD56+CD13-, b) CD56-CD13- и c) CD56-CD13+. После сортировки популяцию CD56+CD13- обогатили приблизительно в 1,3 раза. Отсортированные клетки были значительно обогащены в отношении экспрессии маркеров, характерных для линии панкреатических эндокринных клеток, включая NEUROD, NGN3, PDX1, NKX6.1, NKX2.2 и PAX-4, в сравнении с несортированными клетками на стадии IV, или популяциями клеток CD56-CD13-, или популяциями клеток CD56-CD13+. См. фиг. 1, панели a-f.
Во второй серии экспериментов антитела к CD133 использовали для сортировки популяции клеток, полученных на стадии IV протокола дифференцирования, описанного в примере 1. Были идентифицированы две популяции клеток: a) CD133+ и b) CD133-. После сортировки популяцию CD133- обогатили приблизительно в 1,9 раз. Отсортированные клетки были значительно обогащены в отношении экспрессии маркеров, характерных для линии панкреатических эндокринных клеток, включая NEUROD, NGN3, PDX1, NKX6.1, NKX2.2 и PAX-4, в сравнении с несортированными клетками на стадии IV, или популяциями клеток CD133+. См. фиг. 2, панели a-f.
В третьей серии экспериментов антитела к CD49c использовали для сортировки популяции клеток, полученных на стадии IV протокола дифференцирования, описанного в примере 1. Были идентифицированы две популяции клеток: a) CD49cHI и b) CD49cLO. После сортировки клетки CD49cLO обогатили приблизительно в 3,1 раза. Отсортированные клетки были значительно обогащены в отношении экспрессии маркеров, характерных для панкреатической эндокринной линии дифференцирования, включая NEUROD, NGN3, PDX1 и NKX6.1, в сравнении с несортированными клетками или клетками CD49cHI. См. фиг. 3, панели a-d.
В четвертой серии экспериментов антитела к CD56 и CD15 использовали для сортировки популяции клеток, полученных на стадии IV протокола дифференцирования, описанного в примере 1. Были идентифицированы следующие популяции: а) CD56+CD15LO, b) CD56+CD15HI, c) CD15+ и d) CD15-. После сортировки популяции клеток CD15- обогатили приблизительно в 1,1 раза. Популяции клеток CD56+CD15LO были значительно обогащены в отношении экспрессии маркеров, характерных для панкреатической эндокринной линии дифференцирования, включая NEUROD, NGN3, PDX1 и NKX6.1, инсулин и глюкагон, в сравнении с несортированными клетками или популяциями клеток CD56+CD15HI. См. фиг. 4, панели a-f. Аналогичным образом, популяции клеток CD15-, отсортированных с помощью единственного маркера, были значительно обогащены в отношении экспрессии маркеров, характерных для линии панкреатических эндокринных клеток, включая NEUROD, NGN3, PDX1, NKX6.1, NKX2.2, PAX-4, глюкагон и инсулин, в сравнении с несортированными клетками или популяциями клеток CD15+. См. фиг. 5, панели a-h.
В пятой серии экспериментов антитела к CD56 и CD57 использовали для сортировки популяции клеток, полученных на стадии IV протокола дифференцирования, описанного в примере 1. Были идентифицированы две популяции клеток: a) CD56+CD57+ и b) CD56+CD57-. После сортировки популяции клеток CD56+CD57+ обогатили приблизительно в 1,9 раза. Клетки CD56+CD57+ были значительно обогащены в отношении экспрессии маркеров, характерных для линии панкреатической энтодермы, включая NEUROD, NGN3, PDX1, NKX6.1, NKX2.2, а также инсулин и глюкагон, в сравнении с несортированными клетками или популяциями клеток CD56+CD57-. См. фиг. 6, панель a-g. Аналогичные результаты наблюдали, когда популяции клеток, полученных на стадии V протокола дифференцирования, описанного в примере 1, сортировали с помощью антител к CD56 и CD57.
В шестой серии экспериментов антитела к CD56 и CD184 использовали для сортировки популяции клеток, полученных на стадии IV протокола дифференцирования, описанного в примере 1. Были идентифицированы три популяции клеток: a) CD184+, b) CD184- и c) CD56+CD184-. В таблице IV представлены результаты анализа экспрессии CD184 в клетках до и после обогащения. Популяции клеток CD184+ были обогащены в отношении экспрессии маркеров, характерных для линии панкреатических эндокринных клеток, включая PAX4, NEUROD, NKX6.1, PDX1 и PTF1 альфа. Экспрессия ZIC1, альбумина и CDX2 была снижена. См. фиг. 7, панели a-i.
Сортировка инсулин-продуцирующих клеток
Антитела к CD98 использовали для сортировки популяции клеток, полученных на стадии VI протокола дифференцирования, описанного в примере 1. Были идентифицированы две популяции клеток: a) CD98+(Hi)и b) CD98-(Lo). После сортировки популяции клеток CD98+(Hi) обогатили приблизительно в 1,6 раза. Клетки CD98+(Hi) были обогащены в отношении экспрессии NEUROD, NGN3, инсулина и глюкагона. См. фиг. 8, панели a-d.
В другой серии экспериментов антитела к CD47 использовали для сортировки популяции клеток, полученных на стадии V протокола дифференцирования, описанного в примере 1. Были идентифицированы две популяции клеток: a) CD47Hi(+) и b) CD47Lo(-). После сортировки популяции клеток CD47Lo(-) обогатили приблизительно в 3,3 раза. Клетки CD47Lo(-) были обогащены в отношении экспрессии NEUROD, NGN3, PDX1, NKX6.1, NKX2.2 и PAX4. См. фиг. 9, панели a-f.
В другой серии экспериментов антитела к CD47 использовали для сортировки популяции клеток, полученных на стадии VI протокола дифференцирования, описанного в примере 1. Были идентифицированы две популяции клеток: a) CD47Hi(+) и b) CD47Lo(-). Клетки CD47Lo(-) были обогащены в отношении экспрессии PDX-1, NKX6.1, NKX2.2, PAX-4, PTF1a, NGN3, инсулина и глюкагона. См. фиг. 10, панели a-h.
Пример 3
Сортировка клеток, экспрессирующих Lif-рецептор на стадии первичной кишечной трубки (стадия 2)
Человеческие эмбриональные стволовые клетки линии H1, пассаж 44, культивировали на планшетах, покрытых препаратом MATRIGEL, и дифференцировали в инсулин-продуцирующие клетки по следующему протоколу:
а. среда RPMI с добавлением 2% обезжиренного BSA (№ по каталогу 68700, Proliant, штат Айова), 100 нг/мл активина A (R&D Systems, штат Миннесота), 20 нг/мл WNT-3a (№ по каталогу 1324-WN-002, R&D Systems, штат Миннесота) и 8 нг/мл bFGF (№ по каталогу 100-18B, PeproTech, штат Нью-Джерси) в течение одного дня с последующей обработкой средой RPMI с добавлением 2% BSA и 100 нг/мл активина A с добавлением 8 нг/мл bFGF в течение еще двух дней (стадия 1), затем
b. RPMI + 2% BSA+50 нг/мл FGF7 + 0,25 мкМ SANT-1 (№ по каталогу S4572, Sigma, штат Миссури) в течение трех дней (стадия 2), затем
c. DMEM с высоким содержанием глюкозы с добавлением ITS-X в разведении 1:200 (Invitrogen, штат Калифорния) + 0,1% BSA (Invitrogen, штат Калифорния), 50 нг/мл FGF7 (Peprotech, штат Нью-Джерси) + 0,25 мкМ SANT-1 + 2 мкМ ретиноевой кислоты (RA) (Sigma, штат Миссури) + 100 нг/мл Noggin (R&D Systems, штат Миннесота) и 20 нг/мл активина A в течение четырех дней (стадия 3), затем
d. DMEM с высоким содержанием глюкозы с добавлением ITS-X в разведении 1:200 (Invitrogen, штат Калифорния) + 0,1% BSA (Invitrogen, штат Калифорния) + 100 нг/мл Noggin + 1 мкМ ингибитора ALK5 (SCIO120) в течение трех дней (стадия 4).
Клетки на стадии 2 диспергировали на отдельные клетки с помощью TrypLE Express (Invitrogen, г. Карлсбад, штат Калифорния) и промывали на стадии 4 основной средой (DM-Hg + ITS-X + BSA). Высвободившиеся клетки осаждали и полученный клеточный осадок суспендировали в буферном растворе для окрашивания, состоящем из 2% BSA, 0,05% азида натрия в PBS (Sigma, штат Миссури). В зависимости от ситуации, на клетках в течение 15 минут блокировали Fc-рецептор путем инкубации с 0,1%-ным раствором γ-глобулина (Sigma). Образцы (приблизительно 105 клеток) инкубировали с моноклональными антителами к Lif-рецептору, конъюгированными с фикоэритрином (PE) (R&D Systems, штат Миннесота) (5 мкл антитела на 106 клеток). Для контроля использовали неокрашенные клетки и клетки, окрашенные контрольными антителами с тем же изотипом. Инкубацию с любыми антителами проводили в течение 30 минут при 4°C, после чего клетки отмывали буферным раствором для окрашивания. Окрашенные клетки сортировали с помощью FACS Aria (BD, штат Калифорния). РНК (Rneasy Mini Kit, Qiagen, штат Калифорния) получали из образцов клеток до сортировки, фракции Lif-рецептор+ и Lif-рецептор-. Уровень и характер экспрессии Lif-рецептора представлены в таблице III.
В таблице III представлены данные, характеризующие экспрессию Lif-рецептора на 2-й и 3-й дни стадии 2. На 3-й день стадии 2 приблизительно 70% клеток экспрессируют Lif-рецептор. Как показано в таблице III, высокий уровень экспрессии Lif-рецептора был отмечен только на стадии 2, так как клетки на стадии 3 и 4 демонстрировали минимальную экспрессию Lif-рецептора. Как показано на фиг. 11 (панели a-b), клетки на стадии 2, обогащенные по уровню экспрессии Lif-рецептора, демонстрируют значительное усиление экспрессии HNF4 альфа по сравнению с несортированными клетками или клетками, не экспрессирующими Lif-рецептор. Экспрессия мРНК Lif-рецептора, которую оценивают по ПЦР в реальном времени, также была усилена в клеточной фракции, содержащей клетки, экспрессирующие Lif-рецептор.
Пример 4
Сортировка клеток с помощью магнитных бус, основанная на удалении клеток SSEA-4+, для снижения частоты образования опухолей in vivo
Экспрессия антигена SSEA4 является основным показателем плюрипотентности человеческих эмбриональных стволовых клеток, при этом экспрессия этого маркера значительно снижается в процессе клеточного дифференцирования. Тем не менее, остаточные SSEA-4-положительные клетки могут нести ответственность за образование опухолей и (или) тератом, которое наблюдается после трансплантации частично дифференцированных клеток. Для снижения частоты образования тератом были разработаны способы удаления загрязняющих клеток SSEA4+ из популяции дифференцированных клеток до трансплантации.
Человеческие эмбриональные стволовые клетки линии H1 (пассаж 40-52) дифференцировали до различных стадий протокола дифференцирования, описанного в примере 1. Чтобы оценить правильность концепции и эффективность извлечения клеток, экспрессирующих SSEA-4, сначала было проведено исследование с клетками, дифференцированными только до стадии первичной кишечной трубки (стадия 2 протокола дифференцирования, описанного в примере 1), чтобы гарантировать высокий уровень экспрессии SSEA-4. В последующих экспериментах клетки, экспрессирующие SSEA-4, извлекали из популяций клеток, дифференцированных до стадии 4 протокола дифференцирования, описанного в примере 1. См. таблицу V, в которой представлены полученные результаты. Клетки осторожно высвобождали в суспензии, инкубируя в TrypLE Express (Invitrogen, № по каталогу 12604, штат Калифорния) в течение 2-3 минут при 37°C. Для улучшения выживаемости и жизнеспособности клеток во время извлечения к клеткам до забора и во все буферные растворы, используемые для изоляции, добавляли агенты, противодействующие процессу апоптоза, включая 10 мкМ Y-27632 (№ по каталогу Y 0503, Sigma, г. Сент-Луис, штат Миссури) или 0,5 мкМ тиазовивина (№ по каталогу 04-0017, Stemgent, г. Сан-Диего, штат Калифорния).
Клетки промывали буферным раствором для выделения, состоящим из фосфатного буферного раствора (PBS), не содержащего Ca2+ и Mg2+, с добавлением 0,1% BSA и 2 мM ЭДТК. От 10 до 100×106 клеток ресуспендировали в буферном растворе для выделения, так что окончательная плотность клеток составила 5×106 клеток на 500 мкл. В 500 мкл клеток добавили двадцать пять мкл антитела к SSEA-4 и клетки инкубировали в течение 15-20 минут при комнатной температуре с осторожным покачиванием для обеспечения непрерывности перемешивания. Клетки промывали в буферном растворе для выделения, центрифугируя при 300×g в течение 8 минут. Супернатант удаляли и клетки ресуспендировали в исходном объеме буферного раствора, затем к каждым 500 мкл клеточной суспензии добавляли 50 мкл предварительно промытых бус для извлечения SSEA-4 (DynaBeads® SSEA-4, Invitrogen, № по каталогу 11160D). Клетки и бусы перемешивали и инкубировали в течение 15-20 минут при комнатной температуре с непрерывной ротацией в наклонном положении. Клетки перемешивали осторожным пипетированием и помещали на магнит на 5 минут. Супернатант, содержащий SSEA-4-отрицательные клетки, переносили в новую пробирку, и процесс повторяли 2-3 раза для удаления остаточных бус. Связанные с бусами клетки SSEA4+ высвобождали из магнитного поля и обе клеточные популяции подсчитывали и использовали во время проточно-цитометрического и ПЦР-анализа. Данные, характеризующие уровень экспрессии SSEA4 в недифференцированных клетках H1, клетках первичной кишечной трубки и клетках на стадии IV, как в сортированной, так и в несортированной клеточных фракциях, представлены в таблице V.
В популяциях клеток, выделенных на стадии II протокола дифференцирования, охарактеризованного в примере 1, 20,5% клеток экспрессировали маркеры SSEA4 до сортировки. В противоположность этому только 1,8% клеток экспрессировали SSEA4 после сортировки (таблица V). Процедура извлечения привела к удалению 91,2% SSEA-4-положительных клеток. В другом эксперименте, в котором используются эндокринные клетки-предшественники, 25,3% клеток экспрессировали SSEA-4 до извлечения, но только 0,9% экспрессировали SSEA-4 после извлечения, что означало удаление 95,5% SSEA-4-положительных клеток (таблица V). В отличие от дифференцированных клеток, 91,2% популяции недифференцированных эмбриональных стволовых клеток экспрессировали SSEA4.
Сортированные SSEA4+ клетки были значительно обогащены в отношении экспрессии маркеров плюрипотентности, включая OCT4, NANOG, SOX2 и goosecoid (фиг. 12, панели a-d).
Пример 5
Сортировка клеток SSEA4+(HI) и SSEA4-(LO) проточной цитометрией
Для изучения и подтверждения возможности извлечения клеток, обогащенных по экспрессии маркера плюрипотентности (SSEA-4+), из популяции дифференцированных клеток методом проточной цитометрией клетки дифференцировали до стадии VI, как описано в примере 1. Клетки высвобождали из культуры с помощью буферного раствора для диссоциации клеток TrypLE Express и приготавливали для сортировки, как описано в примере 2. Антитело к SSEA-4 (R&D Systems, г. Миннеаполис, штат Миннесота, № по каталогу FAB1435P) использовали для выделения двух клеточных фракций, идентифицированных как клетки SSEA-4(+)Hi и SSEA-4(-)Lo. Выделенные клеточные фракции анализировали на предмет экспрессии маркеров плюрипотентности с помощью ОТ-ПЦР, как описано в примере 4. Аналогично фракциям, извлеченным и обогащенным SSEA-4, которые были получены при разделении магнитными бусами, как описано в примере 5, сортированные клетки SSEA-4(+)Hi были значительно обогащены для экспрессии маркеров плюрипотентности OCT4, NANOG, SOX2 и goosecoid, в отличие от клеток SSEA-4(-)Lo. См. фиг. 13, панели a-d.
Пример 6
Трансплантация популяций клеток после извлечения клеток, экспрессирующих SSEA-4, in vivo
В пробных экспериментах клетки после извлечения SSEA-4-положительных клеток дифференцировали до стадии IV протокола дифференцирования, описанного в примере 1, а затем трансплантировали мышам под капсулу почки для оценки выживаемости клеток и их приживления. Данные, полученные в экспериментах с мышиными трансплантатами, представлены в таблице VI.
Мыши с тяжелым комбинированным иммунодефицитом, вызванным врожденным отсутствием клеток-киллеров (C,B-Igh-1b/GbmsTac-Prkdescid-Lystbg N7), возрастом от пяти до шести недель, были приобретены в Taconic Farms. Мышей содержали в клетках-микроизоляторах со свободным доступом к стерилизованной пище и воде. Во время подготовки к хирургической операции мыши были помечены идентификационной меткой, нанесенной на ухо, была измерена масса их тела, а также содержание глюкозы в крови с помощью ручного глюкометра (LifeScan, One Touch). Для анестезии использовали смесь изофлурана и кислорода. Шерсть на месте операции выстригли малыми ножницами, предназначенными для животных. Перед операцией мышам подкожно вводили 0,1 мг/кг бупренекса. Для подготовки место операции обработали 70%-ным изопропиловым спиртом, 10%-ным повидон-йодом и 70%-ным изопропиловым спиртом, затем с левой стороны выполнили боковой разрез кожи и мышечных слоев. Открыли левую почку, которую поддерживали во влажном состоянии путем смачивания 0,9%-ным раствором хлорида натрия. Для проникновения через почечную капсулу использовали катетер для внутривенных введений 24G×¾ дюйма, после чего иглу извлекли. Затем катетер продвинули под почечной капсулой к дистальному концу почки.
Во время предоперационной подготовки мышей клетки отцентрифугировали в микроцентрифужной пробирке объемом 1,5 мл, большую часть супернатанта удалили, оставив количество среды, достаточное только для отбора клеточного дебриса. Клетки отобрали с помощью пипетки с объемным вытеснением Rainin Pos-D, после чего пипетку перевернули, чтобы клетки могли осесть под действием силы тяжести. Излишки среды вытеснили, оставив компактный препарат клеток для трансплантации.
Для трансплантации наконечник пипетки Pos-D плотно вставили во втулку катетера и клетки выдавили через катетер под почечную капсулу на дистальном конце почки. Просвет катетера промыли небольшим объемом культуральной среды для введения оставшихся клеток, после чего катетер извлекли. Почечную капсулу загерметизировали, используя низкотемпературное прижигание, после чего почку вернули в первоначальное анатомическое положение. Мышцы сшили непрерывным швом с помощью викриловой нити 5-0, а кожу стянули клипсами для ран. После операции мышам подкожно вводили 1,0 мг/кг метакама. Мышей вывели из наркоза и им дали возможность полностью восстановиться.
После трансплантации мышей взвешивали раз в неделю, а дважды в неделю брали анализ крови для определения уровня глюкозы. На разных сроках после трансплантации мышам интраперитонеально вводили 3 г/кг глюкозы. Через 60 минут после введения глюкозы через ретроорбитальный синус отбирали кровь и помещали ее в микроцентрифужные пробирки, содержащие небольшое количество гепарина. Кровь центрифугировали, плазму собирали во вторую микроцентрифужную пробирку, замораживали на сухом льду и хранили при -80°C до проведения анализа на человеческий С-пептид. Концентрацию человеческого C-пептида определяли с помощью диагностического сверхчувствительного набора для твердофазного иммуноферментного анализа (ELISA) Mercodia/ALPCO C-peptide ELISA в соответствии с инструкциями изготовителя.
При эвтаназии осуществляли забор крови, как описано выше. Осуществляли забор трансплантата из-под почечной капсулы и анализировали с помощью количественной ПЦР в реальном времени, иммуногистохимии и патологического исследования.
Мышам, разделенным на три группы, трансплантировали по приблизительно 3,3 миллиона клеток каждой, в виде i) клеточных кластеров, ii) отдельных (неизвлеченных) клеток и iii) отдельных извлеченных клеток SSEA4. Клетки, дифференцированные до стадии IV, высвобождали из культуры осторожным соскребанием, чтобы получить небольшие клеточные кластеры, или с помощью TrypLE Express, получая суспензии отдельных клеток, для извлечения SSEA-4-положительных клеток. После извлечения SSEA-4-положительных клеток, как описано в примере 5, как клеточные кластеры, так и препараты отдельных клеток вновь помещали на планшеты с низкой степенью прилипания клеток (Costar, Corning Incorporated, г. Нью-Йорк, № по каталогу 3471) и инкубировали в течение ночи в среде для дифференцирования клеток-предшественников (стадия IV) до трансплантации. Ингибитор Y-27632 моногидрат дигидрохлорида (Sigma, № по каталогу Y0503) добавляли в культуру в течение ночи в концентрации 10 мкМ. После трансплантации мышей контролировали, как описано выше, в течение 12 недель. Выживаемость трансплантата не была явно продемонстрирована у реципиентов отдельных клеток (извлеченных или неизвлеченных), но была продемонстрирована у 2 из 5 мышей, получивших клеточные кластеры. Одна из 5 мышей, получивших клеточные кластеры, имела определяемые уровни С-пептида на 12 неделе после трансплантации. Плохая выживаемость трансплантата объяснялась сниженным качеством клеток и меньшим числом клеток, трансплантированных во время пробного эксперимента.
Многоступенчатое дифференцирование человеческих эмбриональных клеток в зрелые панкреатические эндокринные клетки, осуществляющееся через несколько промежуточных стадий, включая дефинитивную энтодерму (DE), панкреатическую энтодерму (PE) и панкреатические клетки-предшественники, ассоциируется с динамическими изменениями экспрессии маркеров клеточной поверхности. Хотя с помощью протокола дифференцирования можно формировать еще не идентифицированные гетерогенные клеточные популяции множественных линий дифференцирования, включая эктодермальные и мезодермальные клеточные типы, анализ изменений экспрессии маркеров клеточной поверхности в панкреатической дифференцировочной среде может позволить выявлять маркеры, потенциально полезные для обогащения клеток и их очистки. В таблице VII представлены итоговые результаты анализа маркеров клеточной поверхности, показывающих усиление или снижение экспрессии, что может быть полезным для отрицательного или положительного отбора клеток панкреатической энтодермы. Маркеры, экспрессия которых снижается в процессе дифференцирования, включают в себя CD117, CD133, CD181, CD184, CD200, CD221, CD326, CD55, CD57, CD9 и CD98. Маркеры, экспрессия которых возрастает в процессе дифференцирования, включают в себя CD13, CD141, CD15, CD318, CD46, CD47, CD49c, CD49e, CD56 и CD73. Такие маркеры можно использовать по отдельности или в различных комбинациях для очистки клеточных популяций, обогащенных клетками панкреатической энтодермы и клетками-предшественниками.
Пример 7
Процедуры проточно-цитометрической сортировки
Клетки на различных стадиях созревания осторожно высвобождали путем инкубации с TrypLE Express (Invitrogen, № по каталогу 12604, штат Калифорния) в течение 2-3 минут при 37°C и дважды промывали буферным раствором для окрашивания BD FACS, содержащим 2% BSA (BD, № по каталогу 554657, штат Калифорния). В зависимости от количества получаемых клеток 20-50×106 отдельных клеток ресуспендировали в 2-3 мл блокирующего буферного раствора (0,5% человеческого гамма-глобулина в разведении 1:4 в буферном растворе для окрашивания (BD, штат Калифорния)) для окрашивания. Флуорофор-конъюгированные первичные антитела добавляли к клеткам в конечном разведении 1:20 и клетки инкубировали в течение 30 минут при 4°C. После промывания окрашенные клетки ресуспендировали в 2-3 мл буферного раствора для окрашивания и добавляли 50-60 мкл 7AAD для выявления живых и мертвых клеток для анализа и сортировки клеток. Контрольные антитела к IgG того же изотипа использовали для окрашивания в качестве отрицательного контроля. Для расчета показателей компенсации флуорофора до сортировки клетки либо оставляли неокрашенными, либо окрашивали одним флуорофором, таким как изотиоцианат флуоресцеина (FITC), фикоэритрин (PE) или аллофикоцианин (APC) и ядерный краситель 7-аминоактиномицин D (7-AAD).
Сортировку клеток выполняли с помощью клеточного сортера BD FACSAria и программного обеспечения BD FACSDiva. Клетки, окрашенные контрольными антителами того же изотипа, использовали для выявления отрицательной популяции при каждой сортировке клеток. Для каждого эксперимента с сортировкой клеток показатели напряжения фотомультипликатора (PMT) устанавливали с помощью соответствующих показателей компенсации для флуорофора, чтобы получать яркую популяцию (положительные (+) или Hi) и тусклую популяцию или субпопуляцию клеток (отрицательные (-) или Lo). Как правило, положительно окрашенные клеточные популяции (+ или Hi) имели порядок трех десятков или выше (104), когда отрицательно окрашенные популяции имели порядок первого-второго десятка (102-103). Используя установленные параметры сортировки, клетки сортировали с помощью сопла 100 мкМ при скорости потока 1,0. По окончании клеточной сортировки небольшие образцы клеток анализировали для оценки чистоты сортированных клеточных субпопуляций. РНК выделяли из клеток, отобранных из числа сортированных и несортированных популяций с использованием Rneasy Mini Kit (Qiagen, штат Калифорния), для последующего анализа ОТ-ПЦР.
Публикации, цитируемые в настоящем документе, полностью включены в настоящий документ путем ссылки. Хотя различные аспекты настоящего изобретения проиллюстрированы выше путем ссылки на примеры и предпочтительные варианты осуществления, подразумевается, что сущность настоящего изобретения ограничивается не указанным выше описанием, а следующими пунктами формулы изобретения, составленными в соответствии с принципами патентного законодательства.
• Изменения, ассоциированные с маркерами клеточной поверхности, указывают на повышение или снижение уровня экспрессии маркеров клеточной поверхности по мере дифференцирования от стадии дефинитивной энтодермы (DE, стадия I) до стадии панкреатической энтодермы (PE, стадия III) и, наконец, к стадии эндокринных клеток (стадии V/VI).
Реферат
Изобретение относится к области биотехнологии, а именно к получению клеток первичной кишечной трубки. Способ включает контактирование популяции, содержащей клетки первичной кишечной трубки, полученные последовательным дифференцированием плюрипотентных стволовых клеток человека, за исключением способа, где плюрипотентные стволовые клетки человека получены путем использования эмбриона человека, с лигандом или антителом, которые связывают Lif-рецептор. Затем осуществляют отбор клеток, с которыми лиганд или антитело связываются, где клетки, с которыми лиганд или антитело связываются, являются клетками первичной кишечной трубки. Изобретение позволяет расширить арсенал технических средств. 14 з.п. ф-лы, 13 ил., 7 табл., 7 пр.
Формула
Документы, цитированные в отчёте о поиске
Дедифференцированные программируемые стволовые клетки моноцитарного происхождения и их получение и применение

Комментарии