Дифференцировка человеческих эмбриональных стволовых клеток - RU2473685C2
Код документа: RU2473685C2
Чертежи























































Описание
Область, к которой относится изобретение
Настоящее изобретение относится к способам стимуляции дифференцировки плюрипотентных стволовых клеток. В частности, настоящее изобретение относится к улучшенному способу создания панкреатической эндодермы, панкреатических гормон-экспрессирующих клеток и панкреатических гормон-секретирующих клеток. Настоящее изобретение также относится к способам стимуляции дифференцировки плюрипотентных стволовых клеток без использования фидерного клеточного подслоя.
Предшествующий уровень техники
Успехи в области клеточно-заместительной терапии сахарного диабета типа I и дефицит островков Лангерганса, необходимых для трансплантации, вызывают все возрастающий интерес к поиску источников инсулин-продуцирующих клеток или β-клеток, подходящих для трансплантации. Одним из подходов к решению этой задачи является генерирование функциональных β-клеток из плюрипотентных стволовых клеток, таких как, например, эмбриональные стволовые клетки.
При эмбриональном развитии позвоночных плюрипотентные клетки преобразуются в группу клеток, содержащих три зародышевых слоя (экдодерма, мезодерма и эндодерма), в процессе, известном как гаструляция. Такие ткани как, например, ткани щитовидной железы, тимуса, поджелудочной железы, кишечника и печени, развиваются из эндодермы через промежуточную стадию. Промежуточной стадией в этом процессе является образование дефинитивной эндодермы. Клетки дефинитивной эндодермы экспрессируют ряд маркеров, таких как HNF-3-бета, GATA4, Mixl1, CXCR4 и Sox-17.
Образование поджелудочной железы происходит в результате дифференцировки дефинитивной эндодермы в панкреатическую эндодерму. Клетки панкреатической эндодермы имеют ген, содержащий панкреатодуоденальный гомеобокс Pdx1. В отсутствие Pdx1 поджелудочная железа не развивается после образования вентральных и дорсальных «почек». Таким образом, экспрессия Pdx1 указывает на критическую стадию органогенеза поджелудочной железы. Помимо клеток других типов, зрелая поджелудочная железа содержит экзокринную ткань и эндокринную ткань. Экзокринные и эндокринные ткани образуются после дифференцировки панкреатической эндодермы.
Сообщалось, что из эмбриональных клеток мышей были получены клетки, несущие характерные признаки островковых клеток. Так, например, в публикации Lumelsky et al. (Science 292:1389, 2001) описана дифференцировка мышиных эмбриональных стволовых клеток в инсулин-секретирующие структуры, аналогичные структурам панкреатических островков. В публикации Soria et al. (Diabetes 49:157, 2000) сообщалось, что инсулин-секретирующие клетки, происходящие от мышиных эмбриональных стволовых клеток, нормализуют уровень сахара в крови у мышей с диабетом, индуцированным стрептозотоцином.
Так, например, в работе Hori et al. (PNAS 99: 16105, 2002) указывается, что обработка мышиных эмбриональных стволовых клеток ингибиторами фосфоинозитид-3-киназы (LY294002) приводит к продуцированию клеток, напоминающих β-клетки.
Другой пример можно найти в публикации Blyszczuk et al. (PNAS 100:998, 2003), где описано генерирование инсулин-продуцирующих клеток из мышиных эмбриональных стволовых клеток, конститутивно экспрессирующих Pax4.
Micallef и сотрудники сообщают, что ретиноевая кислота может регулировать коммитирование эмбриональных стволовых клеток с образованием Pdx1-позитивной панкреатической эндодермы. Ретиноевая кислота является наиболее эффективной в индуцировании экспрессии Pdx1 при ее добавлении к культурам на 4-й день после дифференцировки эмбриональных стволовых клеток, то есть в период времени, соответствующий концу стадии гаструляции в эмбрионе (Diabetes 54:301, 2005).
В работе Miyazaki et al. описана линия мышиных эмбриональных стволовых клеток, сверхэкспрессирующая Pdx1. Результаты, полученные этими исследователями, показали, что экспрессия экзогенного Pdx1 приводит к заметному увеличению уровня экспрессии генов инсулина, соматостатина, глюкокиназы, нейрогенина 3, P48, Pax6 и HNF6 в полученных дифференцированных клетках (Diabetes 53: 1030, 2004).
Skoudy и сотрудниками сообщалось, что активин A (член суперсемейства TGF-β) стимулирует экспрессию экзокринных панкреатических генов (p48 и амилазы) и эндокринных генов (Pdx1, инсулина и глюкагона) в мышиных эмбриональных стволовых клетках. Максимальный эффект наблюдался с использованием 1 нМ активина A. Исследователи также обнаружили, что ретиноевая кислота не оказывает влияния на уровень экспрессии мРНК инсулина и Pdx1, однако обработка 3 нМ FGF7 приводит к повышению уровня транскрипта для Pdx1 (Biochem. J. 379: 749, 2004).
Shiraki и сотрудниками было проведено исследование действия факторов роста, которые специфически стимулируют дифференцировку эмбриональных стволовых клеток в Pdx1-позитивные клетки. Наблюдения этих исследователей показали, что TGF-β2 вызывает воспроизводимое увеличение числа Pdx1-позитивных клеток (Genes Cells. June 2005; 10(6):503-16.).
Gordon и сотрудниками было продемонстрировано индуцирование клеток эндодермы, содержащих brachyury+/HNF-3-beta+, из мышиных эмбриональных стволовых клеток в отсутствие сыворотки и в присутствии активина вместе с ингибитором передачи Wnt-сигнала (US 2006/0003446A1).
В работе Gordon и др. (PNAS, Vol 103, page 16806, 2006) указывается, что: «для генерирования первичной полоски передней доли эмбриона требуется одновременная передача сигнала Wnt и TGF-бета/nodal/активина».
Однако мышиная модель развития эмбриональных стволовых клеток не может точно имитировать программу их развития у высших млекопитающих, таких как, например, человек.
Thomson и сотрудниками были выделены эмбриональные стволовые клетки из человеческих бластоцистов (Science 282:114, 1998). Одновременно, Gearhart и сотрудниками были получены клеточные линии человеческих эмбриональных зародышевых клеток (hEG) из ткани гонады плода (Shamblott et al., Proc. Natl. Acad. Sci. USA 95:13726, 1998). В отличие от мышиных эмбриональных стволовых клеток, дифференцировка которых может быть предотвращена путем простого культивирования с фактором ингибирования лейкоза (LIF), человеческие эмбриональные стволовые клетки должны поддерживаться только в особых условиях (патент США № 6200806; WO 99/20741; WO 01/51616).
D'Amour и сотрудниками было описано получение обогащенных культур дефинитивной эндодермы, происходящей от человеческих эмбриональных стволовых клеток, в присутствии высокой концентрации активина и низкой концентрации сыворотки (Nature Biotechnology 2005). Трансплантация этих клеток под почечную капсулу мыши приводит к их дифференцировке в более зрелые клетки, имеющие свойства, характерные для некоторых органов эндодермы. Клетки дефинитивной эндодермы, происходящие от человеческих эмбриональных стволовых клеток, могут также дифференцироваться в Pdx1-позитивные стволовые клетки после добавления FGF-10 (US 2005/0266554A1).
D'Amour и сотрудники (Nature Biotechnology-24, 1392-1401 (2006)) сообщают: «Мы разработали способ дифференцировки, который позволяет превращать человеческие эмбриональные стволовые клетки (hES) в эндокринные клетки, способные синтезировать гормоны поджелудочной железы, такие как инсулин, глюкагон, соматостатин, панкреатический полипептид и грелин. Такой способ имитирует in vivo панкреатический органогенез посредством направления клеток на путь экспрессии эндокринных гормонов посредством прохождения ими фаз, напоминающих фазы образования дефинитивной эндодермы, эндодермы трубки кишечника, эндодермы поджелудочной железы и эндокринного предшественника».
Другой пример можно найти в работе Fisk et al., в которой описана система получения панкреатических островковых клеток из человеческих эмбриональных стволовых клеток (US2006/0040387A1). В этом случае путь дифференцировки подразделяется на три стадии. Человеческие эмбриональные стволовые клетки сначала подвергают дифференцировке в эндодерму с использованием комбинации бутирата натрия и активина А. Затем клетки культивируют с антагонистами TGFβ, такими как Noggin, в комбинации с EGF или бета-целлюлином, в результате чего образуются Pdx1-позитивные клетки. Терминальная стадия дифференцировки была индуцирована никотинамидом.
Еще один пример можно найти в работе Benvenistry и др., где сообщается: «Мы пришли к выводу, что сверхэкспрессия Pdx1 приводит к усилению экспрессии большого числа генов поджелудочной железы, а для индуцирования экспрессии инсулина могут потребоваться дополнительные сигналы, которые присутствуют только in vivo» (Benvenistry et al, Stem Cells 2006; 24:1923-1930).
Поэтому в настоящее время является особенно актуальной разработка условий для получения плюрипотентных стволовых клеточных линий, которые могли бы отвечать всем современным клиническим требованиям, но при этом сохраняли бы свою способность дифференцироваться в панкреатические эндокринные клетки, панкреатические гормон-экспрессирующие клетки или панкреатические гормон-секретирующие клетки. Авторами настоящего изобретения был применен альтернативный подход для повышения эффективности дифференцировки человеческих эмбриональных стволовых клеток в панкреатические эндокринные клетки.
Описание сущности изобретения
В одном из своих вариантов настоящее изобретение относится к способу дифференцировки плюрипотентных стволовых клеток, где указанный способ включает стадии:
a. культивирования плюрипотентных стволовых клеток,
b. дифференцировки плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры линии дифференцировки дефинитивной эндодермы,
c. дифференцировки клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, и
d. дифференцировки клеток, экспрессирующих маркеры линии дифференцировки панкреатической эндодермы, в клетки, экспрессирующие маркеры линии дифференцировки клеток панкреатической эндокринной системы.
В одном из вариантов изобретения клетки, экспрессирующие маркеры линии дифференцировки дефинитивной эндодермы, подвергают дифференцировке из плюрипотентных стволовых клеток путем обработки плюрипотентных стволовых клеток любым одним из нижеследующих способов, таких как:
a. культивирование плюрипотентных стволовых клеток в среде, содержащей активин А и не содержащей сыворотки, с последующим культивированием указанных клеток с активином А и с сывороткой, а затем с активином А и с сывороткой в другой концентрации, или
b. культивирование плюрипотентных стволовых клеток в среде, содержащей активин А и не содержащей сыворотки, с последующим культивированием указанных клеток с активином А и с сывороткой в другой концентрации, или
c. культивирование плюрипотентных стволовых клеток в среде, содержащей активин А и лиганд Wnt и не содержащей сыворотки, с последующим удалением лиганда Wnt и культивированием указанных клеток с активином А и с сывороткой, или
d. культивирование плюрипотентных стволовых клеток на субстрате тканевой культуры, покрытом внеклеточным матриксом, и культивирование плюрипотентных стволовых клеток с активином А и лигандом Wnt, или
e. культивирование плюрипотентных стволовых клеток на субстрате тканевой культуры, покрытом внеклеточным матриксом; последующее культивирование плюрипотентных стволовых клеток с активином А и лигандом Wnt в первой культуральной среде, содержащей сыворотку; и культивирование плюрипотентных стволовых клеток с активином А во второй культуральной среде, содержащей сыворотку, или
f. культивирование плюрипотентных стволовых клеток на субстрате тканевой культуры, покрытом внеклеточным матриксом, последующее культивирование плюрипотентных стволовых клеток с активином А и лигандом Wnt в первой культуральной среде, содержащей сыворотку, и культивирование плюрипотентных стволовых клеток с активином А и лигандом Wnt во второй культуральной среде, содержащей сыворотку в другой концентрации.
В одном из вариантов изобретения клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, подвергают дифференцировке из клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, путем обработки клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы любым одним из нижеследующих способов, таких как:
a. обработка клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, фактором роста фибробластов и ингибитором пути передачи сигнала хеджехот («hedgehog»), с последующим удалением среды, содержащей фактор роста фибробластов и ингибитор пути передачи сигнала «хеджехот»; и культивирование клеток в среде, содержащей ретиноевую кислоту, фактор роста фибробластов и ингибитор пути передачи сигнала хеджехот, или
b. обработка клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, ретиноевой кислотой и по меньшей мере одним фактором роста фибробластов, или
c. обработка клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, ретиноевой кислотой, с последующим удалением ретиноевой кислоты, а затем обработкой клеток по меньшей мере одним фактором роста фибробластов.
В одном из вариантов изобретения клетки, экспрессирующие маркеры линии дифференцировки клеток панкреатической эндокринной системы, подвергают дифференцировке из клеток, экспрессирующих маркеры линии дифференцировки панкреатической эндодермы, путем обработки клеток, экспрессирующих маркеры линии дифференцировки панкреатической эндодермы любым одним из нижеследующих способов, таких как:
a. культивирование клеток, экспрессирующих маркеры линии дифференцировки клеток панкреатической эндодермы в среде, содержащей DAPT и эксендин 4, с последующим удалением среды, содержащей DAPT и эксендин 4; и культивирование клеток в среде, содержащей эксендин 1, IGF-1 и HGF, или
b. культивирование клеток, экспрессирующих маркеры линии дифференцировки клеток панкреатической эндодермы в среде, содержащей эксендин 4, с последующим удалением среды, содержащей эксендин 4, и культивирование клеток в среде, содержащей эксендин 1, IGF-1 и HGF, или
c. культивирование клеток, экспрессирующих маркеры линии дифференцировки клеток панкреатической эндодермы в среде, содержащей DAPT и эксендин 4, или
d. культивирование клеток, экспрессирующих маркеры линии дифференцировки клеток панкреатической эндодермы в среде, содержащей эксендин 4, или
e. обработка клеток, экспрессирующих маркеры линии дифференцировки клеток панкреатической эндодермы, фактором, ингибирующим путь передачи сигнала Notch, или
f. культивирование клеток, экспрессирующих маркеры линии дифференцировки клеток панкреатической эндодермы в среде, содержащей примерно 10 мМ - 20 мМ глюкозы и эксендин 4.
В одном из своих вариантов настоящее изобретение относится к способу лечения пациента, страдающего диабетом, где указанный способ включает стадии:
a. культивирования плюрипотентных стволовых клеток,
b. дифференцировки плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры линии дифференцировки дефинитивной эндодермы,
c. дифференцировки клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы,
d. дифференцировки клеток, экспрессирующих маркеры линии дифференцировки панкреатической эндодермы, в клетки линии β-клеточной дифференцировки, и
e. имплантации клеток линии β-клеточной дифференцировки указанному пациенту.
Краткое описание графического материала
На фигуре 1, панели a, проиллюстрирована экспрессия маркеров дефинитивной эндодермы CXCR4, GATA4, HNF-3-бета, Mix11, Sox-17 в клеточной линии человеческих эмбриональных стволовых клеток H9 после обработки 100 нг/мл активина A в течение двух, пяти и восьми дней. Экспрессию маркеров дефинитивной эндодермы оценивали на мРНК-уровне и нормализовали по уровням экспрессии в необработанных человеческих эмбриональных стволовых клетках. На панели b проиллюстрирована экспрессия маркеров эндодермы передней доли, а именно генов Cerberus, Otx-1 и Hex клеточной линии человеческих эмбриональных стволовых клеток H9 после обработки 100 нг/мл активина A в течение трех и пяти дней.
На фигуре 2 проиллюстрирована экспрессия маркеров дефинитивной эндодермы в клеточной линии человеческих эмбриональных стволовых клеток H9 после обработки 100 нг/мл активина A в течение пяти дней. Экспрессию маркеров дефинитивной эндодермы оценивали с помощью иммуногистохимического анализа. На панели (a) проиллюстрирована экспрессия Sox-17. На панели (b) проиллюстрирована экспрессия HNF-3-бета. На панели (c) проиллюстрирована экспрессия Oct3/4.
На фигуре 3 проиллюстрирована экспрессия маркеров дефинитивной эндодермы в клеточной линии человеческих эмбриональных стволовых клеток H9 после проведения постадийной дифференцировки в соответствии с протоколом. Экспрессию маркеров дефинитивной эндодермы оценивали на мРНК-уровне и нормализовали по уровням экспрессии в необработанных человеческих эмбриональных стволовых клетках. На панели (a) проиллюстрирована экспрессия GATA4. На панели (b) проиллюстрирована экспрессия Sox-17. На панели (c) проиллюстрирована экспрессия HNF-3-бета. На панели (d) проиллюстрирована экспрессия Mix11. На графике обозначение “AA” означает обработку активином A в течение одного дня (1d), трех дней (3d), пяти дней (5d) или семи дней (7d). На графике обозначение “UT” означает необработанный контроль, культивированный в течение одного дня (1d), трех дней (3d), пяти дней (5d) или семи дней (7d).
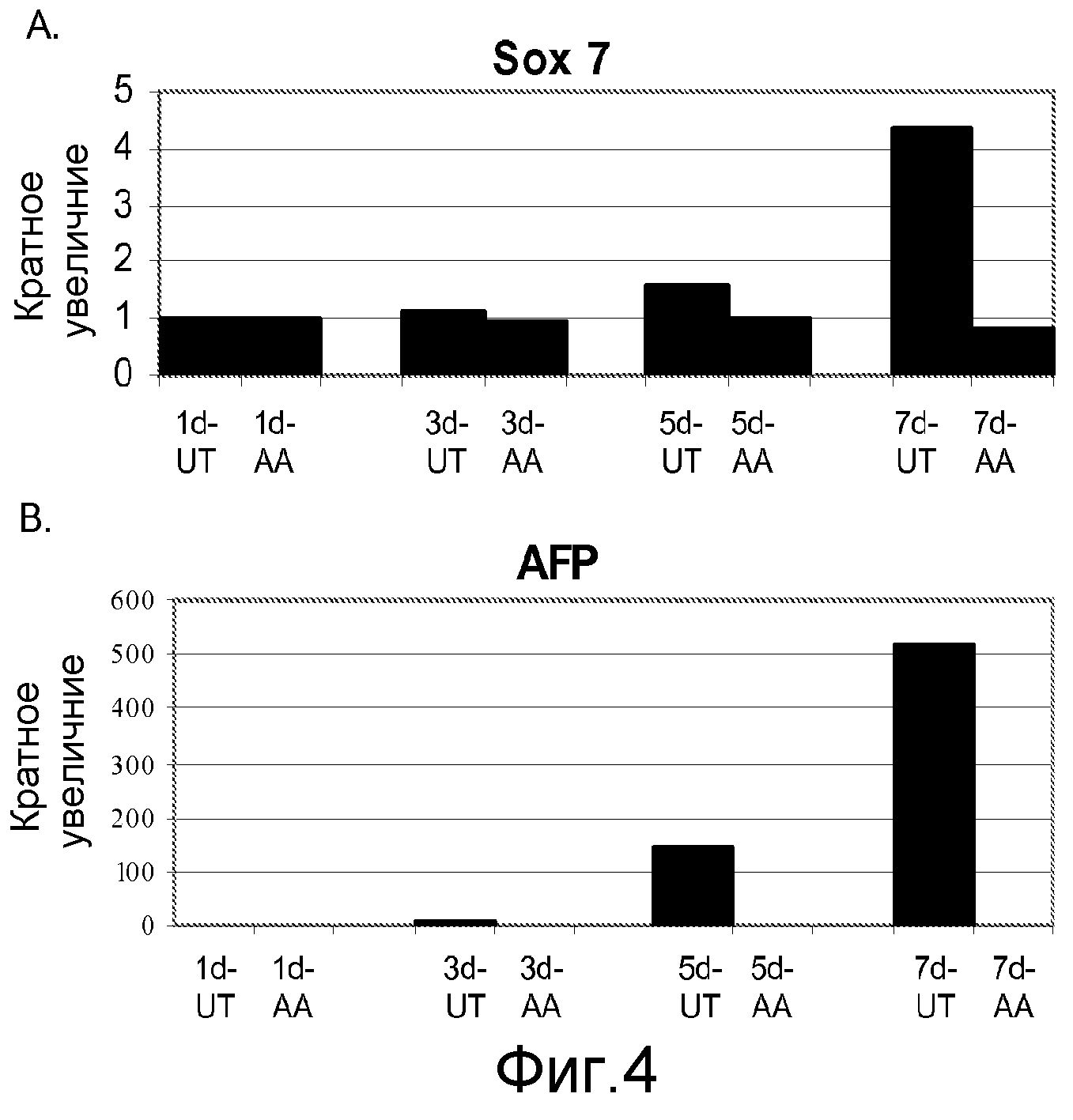
На фигуре 4 проиллюстрирована экспрессия маркеров внеэмбриональной эндодермы в клеточной линии человеческих эмбриональных стволовых клеток H9 после проведения постадийной дифференцировки в соответствии с протоколом. Экспрессию маркеров внеэмбриональной эндодермы оценивали на мРНК-уровне и нормализовали по уровням экспрессии в необработанных человеческих эмбриональных стволовых клетках. На панели (a) проиллюстрировано влияние 100 нг/мл активина А на экспрессию AFP. На панели (b) проиллюстрировано влияние 100 нг/мл активина А на экспрессию Sox-7. На графике обозначение “AA” означает обработку активином A в течение одного дня (1d), трех дней (3d), пяти дней (5d) или семи дней (7d). На графике обозначение “UT” означает необработанный контроль, культивированный в течение одного дня (1d), трех дней (3d), пяти дней (5d) или семи дней (7d).
На фигуре 5 проиллюстрирована экспрессия маркеров мезодермы и эктодермы в клеточной линии человеческих эмбриональных стволовых клеток H9 после проведения постадийной дифференцировки в соответствии с протоколом. Экспрессию маркеров мезодермы и эктодермы оценивали на мРНК-уровне и нормализовали по уровням экспрессии в необработанных человеческих эмбриональных стволовых клетках. На панели (a) проиллюстрировано влияние 100 нг/мл активина А на экспрессию Brachyury. На панели (b) проиллюстрировано влияние 100 нг/мл активина А на экспрессию Zic1. На графике обозначение “AA” означает обработку активином A в течение одного дня (1d), трех дней (3d), пяти дней (5d) или семи дней (7d). На графике обозначение “UT” означает необработанный контроль, культивированный в течение одного дня (1d), трех дней (3d), пяти дней (5d) или семи дней (7d).
На фигуре 6 проиллюстрирована экспрессия маркеров дефинитивной эндодермы Brachyury (панель а), CXCR4 (панель b), Mix11 (панель c), Sox17 (панель d), HNF-3-бета (панель e), Oct4 (панель f) в клеточной линии человеческих эмбриональных стволовых клеток H7 после обработки 100 нг/мл активина A в течение одного, трех, пяти и семи дней. Экспрессию маркеров дефинитивной эндодермы оценивали на мРНК-уровне и нормализовали по уровням экспрессии в необработанных человеческих эмбриональных стволовых клетках.
На фигуре 7 проиллюстрирована экспрессия маркеров дефинитивной эндодермы в клеточной линии человеческих эмбриональных стволовых клеток H9 в соответствии с протоколом дифференцировки. Экспрессию маркеров дефинитивной эндодермы оценивали с помощью иммуногистохимического анализа. На панелях (a) и (b) проиллюстрирована экспрессия Sox-17. На панелях (c) и (d) проиллюстрирована экспрессия HNF-3-бета. На панелях (e) и (f) проиллюстрирована экспрессия GATA4. На панелях (b), (d) и (f) проиллюстрировано контрастное окрашивание ядер реагентом DAPI. Столбцы под заголовком «обработанные» относятся к обработке активином А (100 нг/мл) в течение пяти дней. Столбцы под заголовком «необработанные» относятся к необработанному контролю.
На фигуре 8 проиллюстрирована экспрессия маркеров панкреатической эндодермы в клеточной линии человеческих эмбриональных стволовых клеток H9 в соответствии со вторым протоколом дифференцировки. Экспрессию маркеров панкреатической эндодермы оценивали с помощью ПЦР и нормализовали по уровням экспрессии в человеческих эмбриональных стволовых клетках, обработанных активином A. На панели (a) проиллюстрирована экспрессия Pdx1. На панели (b) проиллюстрирована экспрессия GLUT-2. На панели (c) проиллюстрирована экспрессия PTF1a.
На фигуре 9 проиллюстрирована экспрессия маркеров панкреатической эндодермы в клеточной линии человеческих эмбриональных стволовых клеток H9 в соответствии со вторым протоколом дифференцировки. Экспрессию маркеров панкреатической эндодермы детектировали с помощью иммуногистохимического анализа. На панели (a) проиллюстрирована экспрессия Pdx1 в необработанном контроле, а на панели (b) проиллюстрирована экспрессия Pdx1 в культуре, обработанной в соответствии с протоколом постадийной дифференцировки.
На фигуре 10 проиллюстрирована экспрессия маркеров панкреатической эндокринной системы в клеточной линии человеческих эмбриональных стволовых клеток H9 в соответствии с третьим протоколом дифференцировки. Экспрессию маркеров панкреатической эндокринной системы оценивали с помощью ПЦР и нормализовали по уровням экспрессии в человеческих эмбриональных стволовых клетках, обработанных активином A. На панели (a) проиллюстрирована экспрессия NeuroD1. На панели (b) проиллюстрирована экспрессия Ngn3. На панели (c) проиллюстрирована экспрессия инсулина. На панели (d) проиллюстрирована экспрессия Hes-1, где уровень экспрессии нормализован по уровню экспрессии в клетках панкреатической эндодермы.
На фигуре 11 проиллюстрирована экспрессия маркеров панкреатической эндодермы в клеточной линии человеческих эмбриональных стволовых клеток H9 в соответствии с протоколом дифференцировки. Экспрессию маркеров панкреатической эндодермы анализировали с помощью ПЦР и нормализовали по уровням экспрессии в человеческих эмбриональных стволовых клетках, обработанных активином A. На панели (a) проиллюстрирована экспрессия Nkx2.2. На панели (b) проиллюстрирована экспрессия Pdx1.
На фигуре 12 проиллюстрирована экспрессия Pdx 1 в клетках для каждого пассажа (P0, P1 и P2) в культуре. Экспрессию Pdx 1 анализировали с помощью ПЦР и нормализовали по уровням экспрессии в человеческих эмбриональных стволовых клетках Н9, обработанных активином A.
На фигуре 13 проиллюстрирована экспрессия маркеров гепатоцитов в клеточной линии человеческих эмбриональных стволовых клеток H9 в соответствии с третьим протоколом дифференцировки. Экспрессию маркеров гепатоцитов оценивали с помощью ПЦР и нормализовали по уровням экспрессии в человеческих эмбриональных стволовых клетках, обработанных активином A. На панели (a) проиллюстрирована экспрессия AFP. На панели (b) проиллюстрирована экспрессия альбумина.
На фигуре 14 проиллюстрирована экспрессия маркеров плюрипотентности в клеточной линии человеческих эмбриональных стволовых клеток Н9. Экспрессию маркеров плюрипотентности анализировали с помощью иммуногистохимического анализа. На панели (a) проиллюстрирована экспрессия Oct-4. На панели (b) проиллюстрирована экспрессия щелочной фосфатазы.
На фигуре 15 проиллюстрирован кариотип клеточной линии человеческих эмбриональных клеток H9. Кариотип определяли на клетках при пассаже # P36, которые культивировали на фидерных клетках-фибробластах мышиного эмбриона.
На фигуре 16 проиллюстрирована схема протокола дифференцировки согласно изобретению, где человеческие эмбриональные стволовые клетки подвергают дифференцировке в дефинитивную эндодерму в системе, не содержащей фидерного слоя.
На фигуре 17 проиллюстрирован FACS-анализ клеточной линии человеческих эмбриональных стволовых клеток H9 при пассаже # 44, культивированных при различных концентрациях матригеля и обработанных небольшим количеством (0,5-2%) сыворотки и большим количеством активина A (100 нг/мл) в течение 5 дней. Экспрессия маркера дефинитивной эндодермы CXCR4 (CD184) представлена на оси Y, а экспрессия маркера ES CD9 представлена на оси X.
На фигуре 18 проиллюстрированы данные ПЦР в реальном времени, полученные для маркеров дефинитивной эндодермы от культур клеточной линии человеческих эмбриональных стволовых клеток Н9 при пассаже 44, культивированных при разведении матригеля (■) 1:10, при разведении матригеля

На фигуре 19 представлены графики рассеяния для общей экспрессии генов в недифференцированных плюрипотентных стволовых клетках и в клетках дефинитивной эндодермы, полученных в результате дифференцировки плюрипотентных стволовых клеток. Представлены данные для культур клеточной линии человеческих эмбриональных стволовых клеток H9 при пассаже # 44, культивированных на фибробластах мышиного эмбриона (правая панель), и при пассаже # 83, культивированных на матригеле (левая панель).
На фигуре 20 проиллюстрирована экспрессия CXCR4, оцениваемая с помощью FACS, на день 5, для клеточной линии человеческих эмбриональных стволовых клеток H1 (панель a), клеточной линии человеческих эмбриональных стволовых клеток H7 (панель b) и клеточной линии человеческих эмбриональных стволовых клеток H9 (панель c), культивированных на фидерных клетках-фибробластах мышиного эмбриона, обработанных в соответствии с протоколом дифференцировки дефинитивной эндодермы, описанным в примере 4.
На фигуре 21 представлены результаты ПЦР в реальном времени для экспрессии указанных маркеров дефинитивной эндодермы в культурах клеточной линии человеческих эмбриональных стволовых клеток H7 (панель a) и клеточной линии человеческих эмбриональных стволовых клеток H9 (панель b), культивированных на фидерных клетках-фибробластах мышиного эмбриона. Результаты выражены как кратное увеличение по сравнению с недифференцированными клетками.
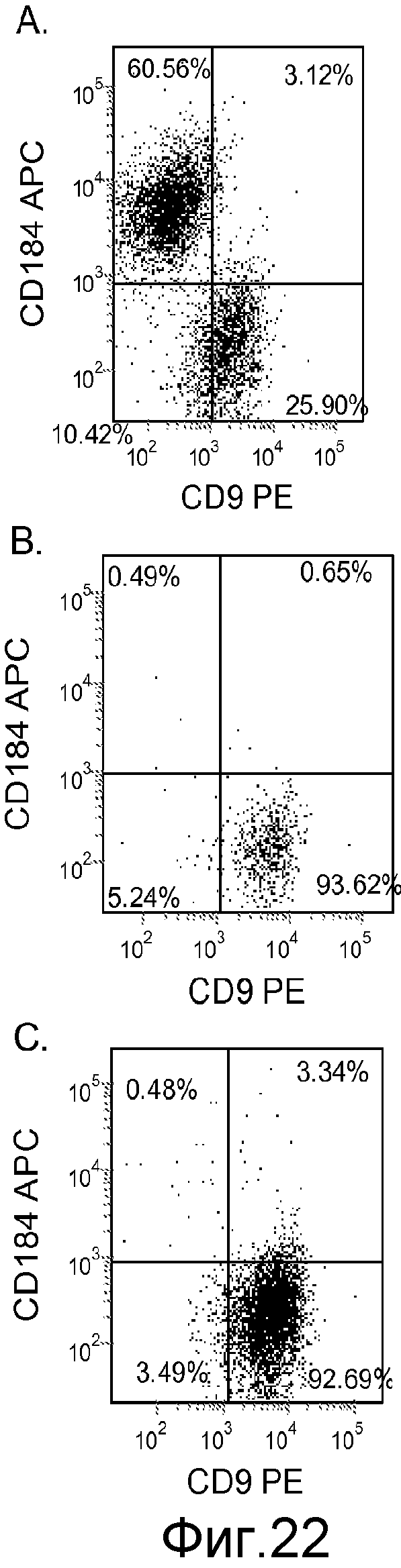
На фигуре 22 проиллюстрирована экспрессия CXCR4, оцениваемая с помощью FACS, на день 5, для клеточной линии человеческих эмбриональных стволовых клеток H1 (панель a), клеточной линии человеческих эмбриональных стволовых клеток H7 (панель b) и клеточной линии человеческих эмбриональных стволовых клеток H9 (панель c), культивированных на матригеле (при разведении 1:30) и обработанных в соответствии с протоколом дифференцировки дефинитивной эндодермы, описанным в примере 4.
На фигуре 23 представлены результаты ПЦР в реальном времени для экспрессии указанных маркеров дефинитивной эндодермы в культурах клеточной линии человеческих эмбриональных стволовых клеток H7 (панель a), клеточной линии человеческих эмбриональных стволовых клеток H9 (панель b) и клеточной линии человеческих эмбриональных стволовых клеток Н1 (панель с). Результаты выражены как кратное увеличение по сравнению с недифференцированными клетками. Клетки обрабатывали методами, описанными в примере 4.
На фигуре 24 проиллюстрирована картина фазово-контрастного окрашивания культур клеточной линии человеческих эмбриональных стволовых клеток H9 при пассаже 46 в присутствии 100 нг/мл активина A (панель a) или 100 нг/мл активина A + 20 нг/мл Wnt-3a (панель b). Клетки обрабатывали в течение пяти дней.
На фигуре 25 проиллюстрирована экспрессия CXCR4, оцениваемая с помощью FACS в культурах клеточной линии человеческих эмбриональных стволовых клеток H7 при пассаже 44 (панели a и b) и H9 при пассаже 46 (панели c и d), после обработки методами, описанными в примере 4. На панелях b и d проиллюстрировано влияние 20 нг/мл Wnt-3a на экспрессию CXCR4. На панелях a и c проиллюстрирована экспрессия CXCR4 в отсутствие Wnt-3a. Результаты получены через 5 дней после обработки.
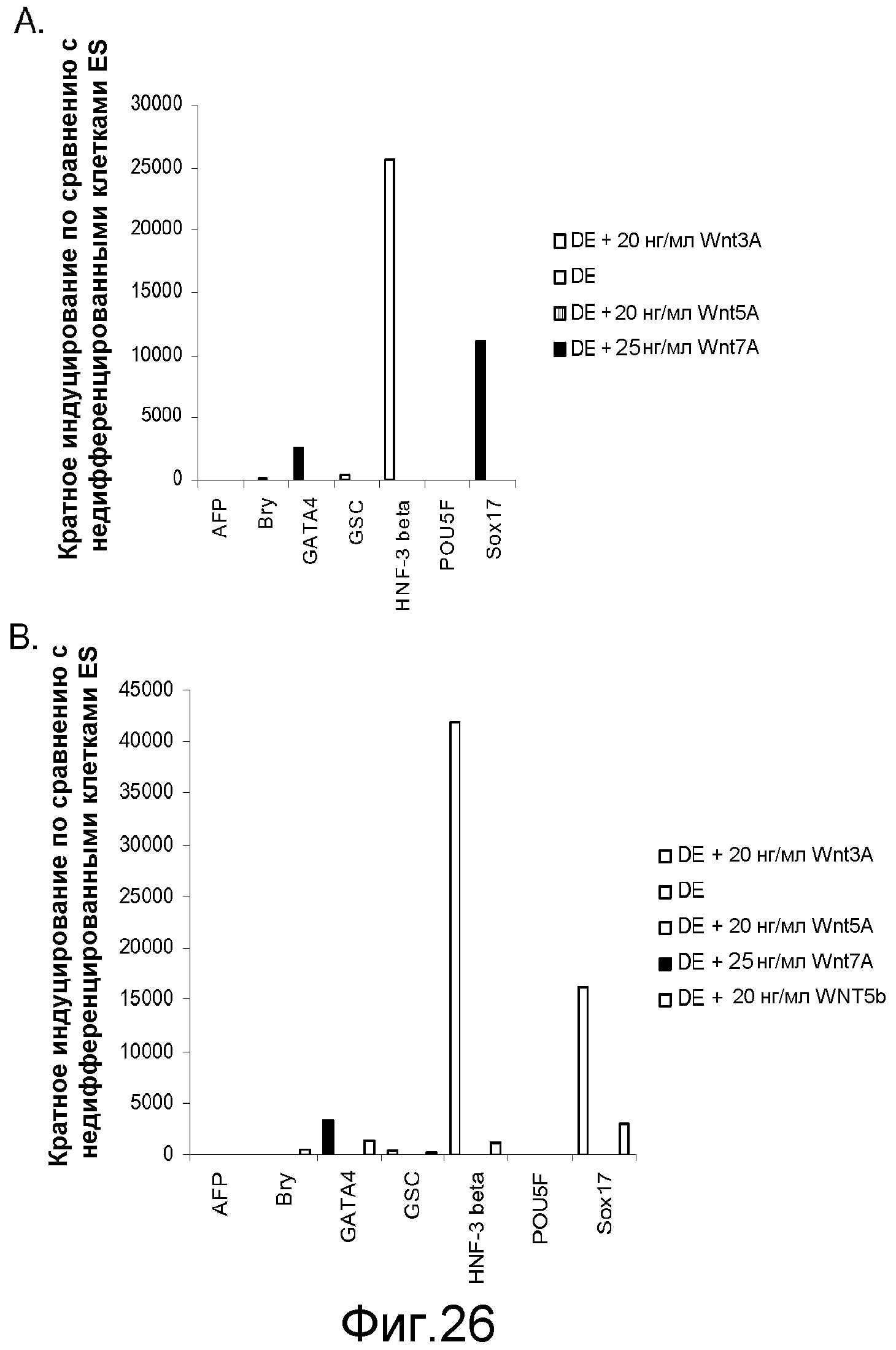
На фигуре 26 приводятся данные ПЦР в реальном времени для экспрессии указанных генов в культурах клеточной линии человеческих эмбриональных стволовых клеток H7 (панель a) и H9 (панель b). Культуры обрабатывали в соответствии с протоколом дифференцировки, описанным в примере 4. Было также протестировано влияние агонистов Wnt, а именно, Wnt-3a (20 нг/мл), Wnt-5a (20 нг/мл) и Wnt-7a (20 нг/мл), как указано на этих панелях. Клетки обрабатывали в течение 5 дней. Результаты выражены как кратность увеличения по сравнению с недифференцированными клетками.
На фигуре 27 проиллюстрирована экспрессия CXCR4 в культурах клеточной линии человеческих эмбриональных стволовых клеток Н9 при пассаже 46, оцениваемая с помощью FACS через пять дней после обработки. На панели (a) проиллюстрирована экспрессия CXCR4 в отсутствие Wnt-3a. На панели (b) проиллюстрирована экспрессия CXCR4 после обработки 10 нг/мл Wnt-3a. На панели (c) проиллюстрирована экспрессия CXCR4 после обработки 20 нг/мл Wnt-3a, а на панели (d) проиллюстрирована экспрессия CXCR4 после обработки 50 нг/мл Wnt-3a.
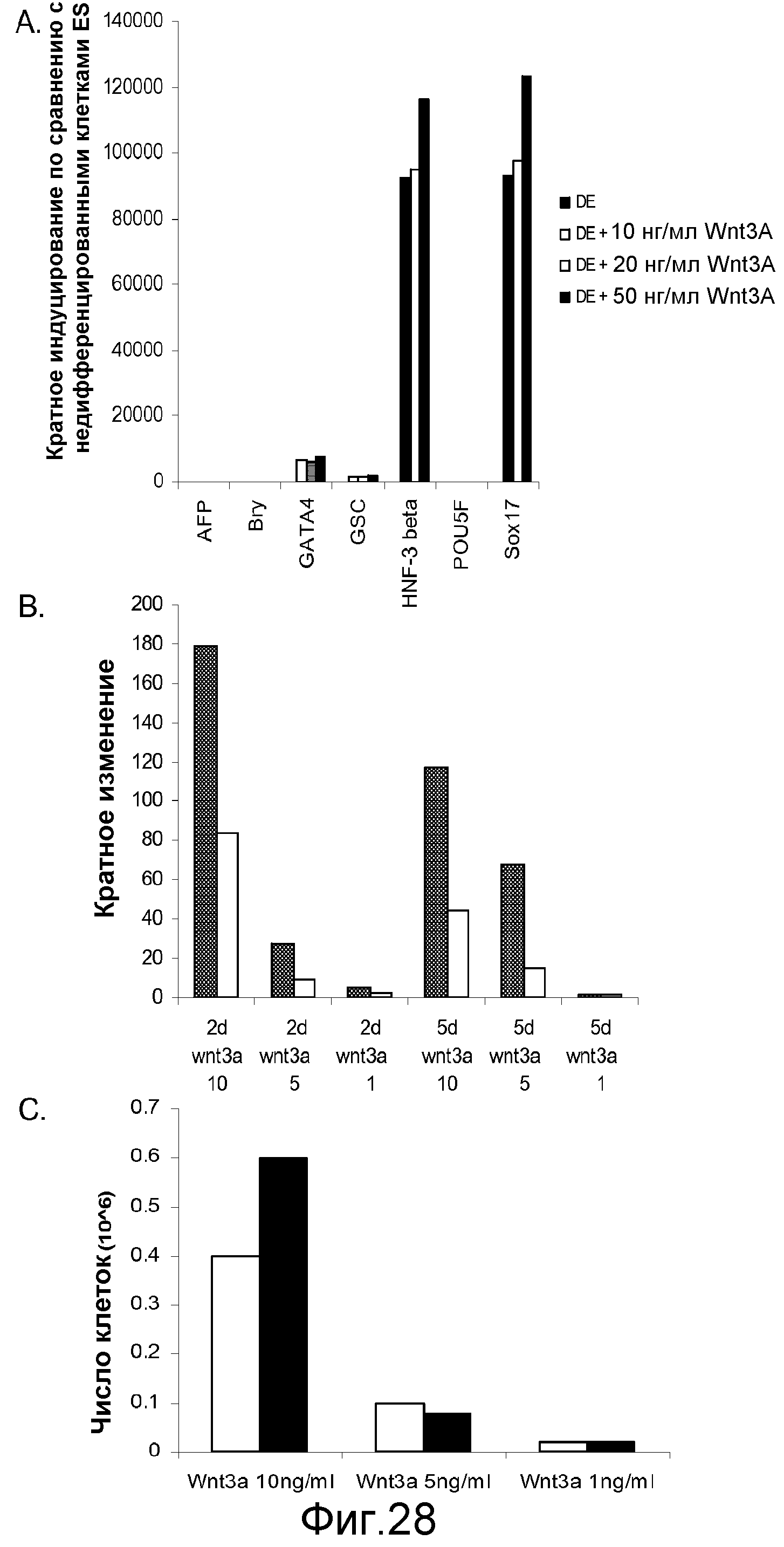
На фигуре 28 проиллюстрирована экспрессия указанных дефинитивных маркеров в культурах клеточной линии человеческих эмбриональных стволовых клеток H9 после обработки в течение 5 дней. Результаты выражены как кратное увеличение уровня экспрессии по сравнению с уровнем экспрессии в необработанных клетках, как было определено с помощью ПЦР в реальном времени. На панели (a) проиллюстрировано влияние 10, 20 и 50 нг/мл Wnt-3a на экспрессию указанных генов маркеров дефинитивной эндодермы. На панели (b) проиллюстрировано влияние 1, 5 или 10 нг/мл Wnt-3a (цифры по оси x:10, 5, 1) на экспрессию «goosecoid» (■) и CXCR4 (□) на 2-й день (2 d) и 5-й день (5 d) после обработки. На панели (c) проиллюстрировано влияние 1, 5 или 10 нг/мл Wnt-3a на число клеток на 2-й день (■) или 5-й день (□).
На фигуре 29 проиллюстрирована экспрессия CXCR4 в культурах клеточной линии человеческих эмбриональных стволовых клеток H9, оцениваемая с помощью FACS, после 5-дневной обработки в соответствии с протоколом дифференцировки, описанным в примере 4. Клетки культивировали в отсутствие Wnt-3a или ингибитора GSK-3B (панель a), 20 нг/мл Wnt-3a в течение всего 5-дневного периода (панель b), и в присутствии 1000 нМ ингибитора IX GSK-3B в течение всего 5-дневного периода (панель c), 500 нМ ингибитора IX GSK-3B в течение всего 5-дневного периода (панель d), 100 нМ ингибитора IX GSK-3B в течение всего 5-дневного периода (панель e), 10 нМ ингибитора IX GSK-3B в течение всего 5-дневного периода (панель f), 100 нМ ингибитора IX GSK-3B в течение 1-2 дней (панель g), 10 нМ ингибитора IX GSK-3B в течение 1-2 дней (панель h).
На фигуре 30 проиллюстрирована экспрессия гена маркеров дефинитивной эндодермы, оцениваемая с помощью ПЦР в реальном времени. Результаты выражали как кратность увеличения по сравнению с необработанными клетками. На панели (a) представлены данные, полученные для клеточной линии человеческих эмбриональных стволовых клеток H9 при пассаже # 48, обработанных в соответствии с протоколом дифференцировки дефинитивной эндодермы, как описано в примере 4, и содержащих Wnt-3a или ингибитор GSK-3B в указанных концентрациях и через указанные промежутки времени. На панели (b) представлены данные, полученные для клеточной линии человеческих эмбриональных стволовых клеток H9 при пассаже # 46, обработанных в соответствии с протоколом дифференцировки дефинитивной эндодермы, как описано в примере 4, и содержащих Wnt-3a или ингибитор GSK-3B в указанных концентрациях и через указанные промежутки времени.
На фигуре 31 проиллюстрирована экспрессия CXCR4, оцениваемая с помощью FACS для клеточных линий эмбриональных стволовых клеток, используемых в настоящем изобретении. На панелях (a-d) представлены данные, полученные для клеточной линии человеческих эмбриональных стволовых клеток H9 при пассаже #49. На панелях (e-f) представлены данные, полученные для клеточной линии человеческих эмбриональных стволовых клеток H1 при пассаже #46. Данные были получены через 5 дней после обработки. Клетки обрабатывали в следующих условиях: панель (a): 10 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a в течение первых двух дней; панель (b): 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a в течение первых двух дней; панель (c): 100 нг/мл активина A в течение всех пяти дней плюс 100 нМ ингибитора IX GSK-3B в течение первых двух дней; панель (d): 10 нг/мл активина A в течение всех пяти дней плюс 100 нМ ингибитора IX GSK-3B в течение первых двух дней; панель (e): 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a в течение первых двух дней; и панель (f): 10 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a в течение первых двух дней.
На фигуре 32 проиллюстрирована экспрессия генов маркеров дефинитивной эндодермы, оцениваемая с помощью ПЦР в реальном времени для культур клеточной линии человеческих эмбриональных стволовых клеток H9 при пассаже 49, обработанных 10, 50 или 100 нг/мл активина A плюс 20 нг/мл Wnt-3a: панель (a): экспрессия AFP, Bry, CXCR4, GSC, HNF-3B и POU5F (Oct-4) и панель (b): SOX-17 и GATA4. Результаты выражали как кратность увеличения по сравнению с необработанными клетками.
На фигуре 33 проиллюстрирована экспрессия CXCR4, оцениваемая с помощью FACS для клеточных линий эмбриональных стволовых клеток Н9 при пассаже 53. Данные были получены через 5 дней после обработки. Клетки обрабатывали в следующих условиях: панель (a): 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a в течение первых двух дней и 25 нг/мл BMP-4 в течение 3-5 дней; панель (b): 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a в течение первых двух дней; панель (c): 100 нг/мл активина A в течение всех пяти дней плюс 100 нМ ингибитора IX GSK-3B в течение первых двух дней; панель (d): 20 нг/мл Wnt-3a + 25 нг/мл BMP-4 в течение всех пяти дней; панель (e): 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3a + 100 нМ ингибитора IX GSK-3B в течение первых двух дней; и панель (f): 100 нг/мл активина A + 25 нг/мл BMP-4 в течение всех пяти дней. Для всех панелей на оси X представлена экспрессия CD9, а на оси Y представлена экспрессия CXCR4 (CD184).
На фигуре 34 проиллюстрирована экспрессия генов маркеров дефинитивной эндодермы, оцениваемая с помощью ПЦР в реальном времени для культур клеточной линии человеческих эмбриональных стволовых клеток H1 при пассаже 46, обработанных 10 или 100 нг/мл активина A плюс 20 нг/мл Wnt-3a или 100 нМ ингибитора IX GSK-3B: панель (a): экспрессия AFP, Bry, CXCR4, GSC и POU5F (Oct-4) и панель (b): SOX-17, HNF-3B и GATA4. Результаты выражали как кратность увеличения по сравнению с необработанными клетками.
На фигуре 35 проиллюстрирована экспрессия генов маркеров дефинитивной эндодермы, оцениваемая с помощью ПЦР в реальном времени для культур клеточной линии человеческих эмбриональных стволовых клеток H9 при пассаже 49, обработанных 50 или 100 нг/мл активина A плюс 10 или 100 нМ ингибитора GSK-3B: панель (a): экспрессия AFP, Bry, CXCR4, GSC, HNF-3B и POU5F (Oct-4) и панель (b): SOX-17 и GATA4. Результаты выражали как кратность увеличения по сравнению с необработанными клетками.
На фигуре 36 проиллюстрирована экспрессия генов маркеров дефинитивной эндодермы, оцениваемая с помощью ПЦР в реальном времени для культур клеточной линии человеческих эмбриональных стволовых клеток H9 при пассаже 53, обработанных комбинациями активина A, Wnt-3a, ингибитора GSK-3B и BMP-4 в течение пяти дней: панель (a): экспрессия AFP, Bry, CXCR4, GSC, HNF-3B и SOX7 и панель (b): SOX-17, HNF-3B и GATA4.
На фигуре 37 указаны проценты уровней экспрессии CXCR4, определенные с помощью FACS, в культурах клеточной линии человеческих эмбриональных стволовых клеток H9, обработанных в условиях, описанных в примере 22.
На фигуре 38 проиллюстрирована экспрессия маркеров дефинитивной эндодермы, оцененная с помощью FACS, в культурах клеточной линии человеческих эмбриональных стволовых клеток H9, культивированных на фибронектине (панель a) или на матригеле MATRIGELTM (панель b).
На фигуре 39 проиллюстрирована экспрессия маркеров дефинитивной эндодермы, оцененная с помощью ПЦР в реальном времени, в культурах клеточной линии человеческих эмбриональных стволовых клеток H9, культивированных на фибронектине (□) или на матригеле с низким содержанием фактора роста при разведении 1:10 (■).
На фигуре 40 проиллюстрировано влияние различных концентраций матригеля в присутствии небольшого количества сыворотки, 100 нг/мл активина A и 20 нг/мл Wnt-3a на дифференцировку человеческих эмбриональных стволовых клеток в дефинитивную эндодерму. Клетки обрабатывали методами, описанными в примере 4. Результаты выражали как уровни экспрессии указанных генов, определенные с помощью ПЦР в реальном времени.
На фигуре 41 проиллюстрирована роль Wnt-3a в образовании дефинитивной эндодермы человеческими эмбриональными стволовыми клетками, поддерживаемыми на матригеле, но дифференцированными на мышиных эмбриональных фибробластах. На панелях (a-d) представлены данные ПЦР в реальном времени для указанных генов. На панелях (e-g) представлены данные FACS для указанных условий.
На фигуре 42 проиллюстрирована дифференцировка человеческих эмбриональных стволовых клеток, культивированных на субстрате тканевой культуры, покрытом MATRIGELTM, в дефинитивную эндодерму после обработки ингибитором Wnt DKK-1. Полученные результаты представляют собой экспрессию указанных генов, оцениваемую с помощью ПЦР в реальном времени в клетках H9, обработанных методами, описанными в примере 4, в присутствии 20 нг/мл Wnt-3A плюс 100 нг/мл DKK1 (DE+DKK1), или в отсутствие DKK1 (DE).
На фигуре 43 проиллюстрировано иммунофлуоресцентное окрашивание маркеров дефинитивной эндодермы в культурах клеточной линии человеческих эмбриональных стволовых клеток H9, культивированных на субстрате тканевой культуры, покрытом матригелем, и дифференцированных в присутствии небольшого количества сыворотки плюс 100 нг/мл активина A в отсутствие Wnt-3a (панель a) или в присутствии 20 нг/мл Wnt-3a (панель b). Ecad=E-кадгерин, NCAM=N-кадгерин.
На фигуре 44 проиллюстрирована дифференцировка клеточной линии человеческих эмбриональных стволовых клеток SA002 при пассаже 38 в дефинитивную эндодерму. Клетки обрабатывали в течение пяти дней в указанных условиях и определяли экспрессию гена с помощью ПЦР в реальном времени для генов, указанных на этих панелях.
На фигуре 45 проиллюстрирована экспрессия CXCR4, оцениваемая с помощью FACS, в клеточной линии человеческих эмбриональных стволовых клеток SA002 при пассаже 38, после обработки 100 нг/мл активина A (панель a), 100 нг/мл активина A + 20 нг/мл Wnt-3a (панель b) или 100 нг/мл активина A + 100 нМ ингибитора IX GSK-3B (панель c). Клетки обрабатывали в течение пяти дней.
На фигуре 46 проиллюстрирована дифференцировка клеточной линии человеческих эмбриональных стволовых клеток Н1 при пассаже 55 в дефинитивную эндодерму на субстрате тканевой культуры, покрытом человеческой сывороткой. Клетки обрабатывали в указанных условиях и определяли экспрессию гена с помощью ПЦР в реальном времени для генов, указанных на этих панелях.
На фигуре 47 проиллюстрирована дифференцировка культур клеточной линии человеческих эмбриональных стволовых клеток Н1 при пассаже 54 на субстрате тканевой культуры, покрытом MATRIGELTM, в дефинитивную эндодерму. Действие различных ингибиторов GSK-B тестировали в соответствии с протоколом дифференцировки DE, проводимым в течение пяти дней. В течение первых двух дней обработки были оценены нижеследующие ингибиторы GSK-3B в концентрации 100 нМ, а именно: GSK-3B VIII, IX, XI и XII.
На фигуре 48 проиллюстрирована экспрессия AFP (панель a), Pdx-1 (панель b), Cdx-2 и Glut-2 (панель c) и HNF-3-бета, HNF-6 и соматостатина (панель d) в культурах клеточных линий человеческих эмбриональных стволовых клеток H9 при пассаже 49, культивированных и обработанных методами, описанными в примере 4, в присутствии 20 нг/мл Wnt-3a в течение первых двух дней обработки. После обработки клетки еще три дня обрабатывали 2% FBS плюс 1 мкМ ретиноевой кислоты, 0,1-1 мкМ TTNPB (4-[(E)-2-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталинил)-1-пропенил]бензойной кислоты (аротиноидной кислоты) или 0,1-10 мкМ AM-580 (4-[(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталинил)карбоксамидо]бензойной кислоты). Затем клетки обрабатывали в течение еще трех дней в 2% FBS плюс 20 нг/мл bFGF.
На фигуре 49 представлены результаты ПЦР в реальном времени для экспрессии маркеров дефинитивной эндодермы, указанных на панелях a и b, в культурах клеточной линии человеческих эмбриональных стволовых клеток H1, обработанных активином A и Wnt-1 в течение указанного периода времени и в указанных концентрациях.
На фигуре 50 проиллюстрирована экспрессия мРНК инсулина (панель a) и глюкагона (панель b) в культурах панкреатических эндокринных клеток, полученных после обработки клеток панкреатической эндодермы в среде DMEM/F12 или в среде DMEM с низким содержанием глюкозы. Данные представлены как результаты, полученные для двух отдельных экспериментов.
На фигуре 51 проиллюстрирована экспрессия инсулина, оцениваемая с помощью иммуноцитохимического анализа клеток, обработанных в среде DMDM с низким содержанием глюкозы (панель a), DMEM/F12 (панель b). На панели c проиллюстрировано совместное окрашивание PDX-1 и инсулина.
На фигуре 52 показано влияние концентрации глюкозы на экспрессию генов в панкреатических эндокринных клетках, происходящих от клеточной линии человеческих эмбриональных стволовых клеток H9. Гены идентифицированы на этих панелях.
На фигуре 53 проиллюстрировано высвобождение c-пептида из панкреатических эндокринных клеток, образовавшихся в присутствии 2, 10 и 20 мМ глюкозы. Клетки стимулировали IBMX или 20 мМ глюкозы.
Подробное описание изобретения
Для лучшего понимания описания, которое никоим образом не ограничивает настоящего изобретения, ниже приводится более подробное описание изобретения, которое разделено на нижеследующие подразделы, где описаны или проиллюстрированы некоторые отличительные признаки, варианты или цели применения настоящего изобретения.
Определения
Стволовые клетки представляют собой недифференцированные клетки, определенные по их способности к самообновлению и дифференцировке с продуцированием клеточного потомства на моноклеточном уровне, включая такие клетки, как самообновляющиеся клетки-предшественники, не самообновляющиеся клетки-предшественники и клетки терминальной стадии дифференцировки. Стволовые клетки также характеризуются своей способностью к дифференцировке in vitro в функциональные клетки различных линий дифференцировки из множества зародышевых слоев (эндодермы, мезодермы и эктодермы), а также способностью образовывать ткани множества зародышевых слоев после трансплантации и участвовать в образовании в основном большинства, если не всех, тканей после инъекции в бластоцисты.
Стволовые клетки классифицируют по их способности к дифференцировке и разделяют на следующие группы: (1) тотипотентные клетки, которые обладают способностью образовывать эмбриональные и внеэмбриональные клетки всех типов; (2) плюрипотентные клетки, которые обладают способностью образовывать эмбриональные клетки всех типов; (3) мультипотентные клетки, которые обладают способностью образовывать субпопуляцию клеточной линии дифференцировки, но лишь в конкретных тканях, органах или физиологических системах (например, гемопоэтические стволовые клетки (ГСК) могут продуцировать потомство, которое включает ГСК (самообновляющиеся), олигопотентные предшественники, ограниченные популяцией клеток крови, и все типы клеток и элементы (например, тромбоциты), которые являются нормальными компонентами крови); (4) олигопотентные клетки, которые, в отличие от мультипотентных стволовых клеток, обладают способностью образовывать более ограниченную субпопуляцию клеточных линий дифференцировки; и (5) унипотентные клетки, которые обладают способностью образовывать моноклеточную линию дифференцировки (например, сперматогенные стволовые клетки).
Дифференцировка представляет собой процесс, при котором неспециализированные («некоммитированные») или менее специализированные клетки приобретают признаки специализированной клетки, такой как, например, нервная клетка или мышечная клетка. Дифференцированная клетка или клетка, индуцированная дифференцировкой, представляет собой клетку, которая находится на более специализированной («коммитированной») стадии клеточной линии дифференцировки. Термин «коммитированный», если он употребляется при описании процесса дифференцировки, относится к клетке, которая проходит путь дифференцировки до определенной стадии, при которой, в нормальных условиях, эта клетка продолжает свой путь дифференцировки в клетку, принадлежащую к определенному типу клеток или к субпопуляции таких клеток, и не может, в нормальных условиях, дифференцироваться к клетку другого типа или подвергаться обратной дифференцировке в менее дифференцированную клетку. Термин «де-дифференцировка» означает процесс, при котором клетка возвращается на стадию менее специализированных (или «коммитированных») клеток данной линии дифференцировки. Используемый здесь термин «линия дифференцировки клеток» определяет наследственность данной клетки, то есть ее происхождение от тех или иных клеток и ее способность превращаться в те или иные клетки. Линия дифференцировки клеток представляет собой наследуемую схему развития и дифференцировки клеток. Термин «маркер линии дифференцировки» означает признак, специфически ассоциирующийся с фенотипом представляющей интерес клеточной линии дифференцировки, и такой маркер может быть использован для оценки дифференцировки некоммитированной клетки в клетку представляющей интерес линии дифференцировки.
Для описания клеток в культуре используются различные термины. Термин «поддерживание» обычно относится к клеткам, помещенным в среду для роста в условиях, облегчающих рост и/или деление клеток, которые могут образовывать, а могут и не образовывать, более крупную популяцию. Термин «пассаж» означает процесс забора клеток из одного сосуда для культивирования и переноса этих клеток во второй сосуд для культивирования в условиях, облегчающих рост и/или деление клеток.
Конкретная популяция клеток или клеточных линий иногда определяется или характеризуются числом пассажей. Так, например, популяция культивированных клеток, пересев которой проводится десять раз, может называться культурой Р10. Первичная культура, то есть первая культура, полученная после выделения клеток из ткани, обозначается Р0. После первого субкультивирования клетки называют вторичной культурой (P1 или пассаж 1). После второго субкультивирования эти клетки называют третичной культурой (P2 или пассаж 2) и так далее. При этом следует отметить, что во время пересева может происходить удвоение числа многих популяций, а поэтому число удвоений популяции культуры клеток превышает число пассажей. Размножение клеток (то есть число удвоений популяций) в интервалах между пассажами зависит от многих факторов, включая, но не ограничиваясь ими, плотность посева, тип субстрата, среду, условия культивирования и время между пассажами.
Термин «линия β-клеточной дифференцировки» означает клетки, позитивные по экспрессии гена, кодирующего фактор транскрипции PDX-1 и по меньшей мере один из нижеследующих факторов транскрипции: NGN-3, Nkx2.2, Nkx6.l, NeuroD, Isl-1, HNF-3-бета, MAFA, Pax4 и Pax6. Клетками, экспрессирующими маркеры β-клеточной линии дифференцировки, являются β-клетки.
Используемый здесь термин «клетки, экспрессирующие маркеры линии дифференцировки дефинитивной эндодермы» означает клетки, экспрессирующие по меньшей мере один из нижеследующих маркеров, таких как: SOX-17, GATA-4, HNF-3-бета, GSC, Cer1, Nodal, FGF8, brachyury, белок гомеобокса Mixlike, FGF4 CD48, эомезодермин (EOMES), DKK4, FGF17, GATA-6, CXCR4, C-Kit, CD99 или OTX2. Клетками, экспрессирующими маркеры линии дифференцировки дефинитивной эндодермы, являются клетки-предшественники первичной полоски, клетки первичной полоски, клетки мезоэндодермы и клетки дефинитивной эндодермы.
Используемый здесь термин «клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы» означает клетки, экспрессирующие по меньшей мере один из нижеследующих маркеров, таких как: PDX-1, HNF-1бета, HNF-3-бета, PTF-1альфа, HNF-6 или HB9. Клетками, экспрессирующими маркеры линии дифференцировки панкреатической эндодермы, являются клетки панкреатической эндодермы.
Используемый здесь термин «клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндокринной системы» означает клетки, экспрессирующие по меньшей мере один из нижеследующих маркеров, таких как: NGN-3, NeuroD, Islet-1, PDX-I, NKX6.1, Pax-4, Ngn-3 или PTF-1альфа. Клетками, экспрессирующими маркеры линии дифференцировки панкреатической эндокринной системы, являются панкреатические эндокринные клетки, панкреатические гормон-экспрессирующие клетки и панкреатические гормон-секретирующие клетки, а также клетки линии β-клеточной дифференцировки.
Используемый здесь термин «дефинитивная эндодерма» означает клетки, которые обладают свойствами клеток, образующихся из эпибласта в процессе гаструляции, и которые формируют желудочно-кишечный тракт, и их производные. Клетки дефинитивной эндодермы экспрессируют следующие маркеры: CXCR4, HNF-3-бета, GATA-4, SOX- 17, Cerberus, OTX2, goosecoid, c-Kit, CD99 и Mixl1.
Используемый здесь термин «внеэмбриональная эндодерма» означает популяцию клеток, экспрессирующих по меньшей мере один из нижеследующих маркеров: SOX-7, AFP и SPARC.
Используемый здесь термин «маркеры» означает молекулы нуклеиновой кислоты или полипептида, которые дифференциально экспрессируются в представляющей интерес клетке. В этой связи, термин «дифференциальная экспрессия» означает повышенный уровень экспрессии позитивного маркера и пониженный уровень экспрессии негативного маркера. Детектируемый уровень нуклеиновой кислоты или полипептида, используемых в качестве маркеров, в представляющих интерес клетках, является достаточно высоким или низким по сравнению с уровнем, наблюдаемым в других клетках, что позволяет идентифицировать и дифференцировать представляющие интерес клетки от других клеток любым из различных методов, известных специалистам.
Используемый здесь термин «клетка мезоэндодермы» означает клетку, экспрессирующую по меньшей мере один из нижеследующих маркеров, таких как: CD48, эомезодермин (EOMES), SOX-17, DKK4, HNF-3-бета, GSC, FGF17, GATA-6.
Используемый здесь термин «панкреатическая эндокринная клетка» или «панкреатическая гормон-экспрессирующая клетка» означает клетку, способную экспрессировать по меньшей мере один из нижеследующих гормонов, таких как инсулин, глюкагон, соматостатин, панкреатический полипептид и грелин.
Используемый здесь термин «панкреатическая гормон-секретирующая клетка» означает клетку, способную секретировать по меньшей мере один из нижеследующих гормонов, таких как инсулин, глюкагон, соматостатин и панкреатический полипептид.
Используемый здесь термин «клетка предпервичной полоски» означает клетку, экспрессирующую по меньшей мере один из следующих маркеров, таких как Nodal или FGF8.
Используемый здесь термин «клетка первичной полоски» означает клетку, экспрессирующую по меньшей мере один из следующих маркеров, таких как Brachyury, Mix-подобный белок гомеобокса или FGF4.
Выделение, размножение и культивирование плюрипотентных стволовых клеток
Характеризация плюрипотентных стволовых клеток
Плюрипотентные стволовые клетки могут экспрессировать один или несколько стадиеспецифических эмбриональных антигенов (SSEA) 3 и 4, и маркеров, детектируемых с использованием антител, обозначенных Tra-1-60 и Tra-1-81 (Thomson et al., Science 282:1145, 1998). Дифференцировка плюрипотентных стволовых клеток in vitro приводит к снижению уровня экспрессии SSEA-4, Tra-1-60 и Tra-1-81 (если она происходит) и к повышению уровня экспрессии SSEA-1. Недифференцированные плюрипотентные стволовые клетки обычно обладают щелочно-фосфатазной активностью, которая может быть детектирована путем фиксации клеток 4% параформальдегидом с последующим проявлением красителем Vector Red, используемым в качестве сусбтрата, как рекомендовано производителем (Vector Laboratories, Burlingame Calif.) Недифференцированные плюрипотентные стволовые клетки также обычно экспрессируют Oct-4 и TERT, как было обнаружено с помощью ОТ-ПЦР.
Другим желательным фенотипом культивированных плюрипотентных стволовых клеток является их способность дифференцироваться в клетки всех трех зародышевых слоев, таких как ткани эндодермы, мезодермы и эктодермы. Плюрипотентность плюрипотентных стволовых клеток может быть подтверждена, например, путем инъекции клеток мышам с тяжелым комбинированным иммунодефицитом (SCID), фиксации образовавшихся тератом с использованием 4% параформальдегида, и последующим гистологическим анализом для оценки типов клеток от трех зародышевых слоев. Альтернативно, плюрипотентность может быть определена путем создания эмбриоидных телец и анализа таких эмбриоидных телец на присутствие маркеров, ассоциированных с тремя зародышевыми слоями.
Культивированные клеточные линии плюрипотентных стволовых клеток могут быть подвергнуты кариотипированию стандартным методом G-бэндинга, и их кариотип может быть сопоставлен с опубликованными кариотипами клеток соответствующих видов приматов. При этом желательно получить клетки, которые имели бы «нормальный кариотип», что означает, что данные клетки являются эуплоидными, то есть в этих клетках присутствуют все человеческие хромосомы и отсутствуют какие-либо значительные изменения.
Источники плюрипотентных стволовых клеток
Типами плюрипотентных стволовых клеток, которые могут быть использованы, являются стабилизированные линии плюрипотентных клеток, происходящих от ткани, образованной после наступления беременности, включая пре-эмбриональную ткань (такую как, например, бластоцист), эмбриональную ткань или ткань плода, взятую в любой период времени в процессе беременности, а обычно, но необязательно, приблизительно в первые 10-12 недель беременности. Неограничивающими примерами являются стабилизированные линии человеческих эмбриональных стволовых клеток или человеческих эмбриональных зародышевых клеток, такие как, например, клеточные линии человеческих эмбриональных стволовых клеток H1, H7 и H9 (WiCell). В процессе начального развития или стабилизации таких клеток также могут быть использованы композиции согласно изобретению, и в этом случае источниками клеток могут быть первичные плюрипотентные клетки, взятые непосредственно из тканей источников. Подходящими также являются клетки, взятые из популяции плюрипотентных стволовых клеток, уже культивированных в отсутствие фидерных клеток. Могут быть также использованы и мутантные клеточные линии человеческих эмбриональных стволовых клеток, такие как, например, BG01v (BresaGen, Athens, GA).
В одном из вариантов изобретения человеческие эмбриональные стволовые клетки получают как описано в публикации Thomson et al. (патент США № 5843780; Science 282:1145, 1998; Curr. Top. Dev. Biol. 38:133 ff, 1998; Proc. Natl. Acad. Sci. U.S.A. 92:7844, 1995).
Культура плюрипотентных стволовых клеток
В одном из вариантов изобретения плюрипотентные стволовые клетки обычно культивируют различными методами на фидерном клеточном слое, который поддерживает плюрипотентные стволовые клетки. Альтернативно, плюрипотентные стволовые клетки культивируют в культуральной системе, которая, по существу, не содержит фидерных клеток, но тем не менее поддерживает пролиферацию плюрипотентных стволовых клеток, не подвергающихся какой-либо значительной дифференцировке. Рост плюрипотентных стволовых клеток в культуре, не содержащей фидерного слоя и не подвергающейся дифференцировке, поддерживают с использованием среды, кондиционированной путем предварительного ее культивирования с клетками других типов. Альтернативно, рост плюрипотентных стволовых клеток в культуре, не содержащей фидерного слоя и не подвергающейся дифференцировке, поддерживают с использованием среды с определенным химическим составом.
Так, например, в работах Reubinoff et al. (Nature Biotechnology 18:399-404 (2000)) и Thompson et al. (Science 6 November 1998: Vol. 282. no. 5391, pp. 1145-1147) описано культивирование клеточных линий плюрипотентных стволовых клеток из человеческих бластоцистов с использованием фидерного клеточного слоя мышиных эмбриональных фибробластов.
В работе Richards et al. (Stem Cells 21:546-556, 2003) была оценена панель из 11 различных фидерных клеточных слоев, взятых у взрослого человека, у плода и у новорожденных, на их способность поддерживать культуру человеческих плюрипотентных стволовых клеток. Richards и сотрудники утверждают, что «клеточные линии человеческих эмбриональных стволовых клеток, культивированных на фидерном слое фибробластов кожи взрослого индивидуума, сохраняют морфологию человеческих эмбриональных стволовых клеток и остаются плюрипотентными».
В заявке US20020072117 описаны клеточные линии, которые образуют среду, поддерживающую рост первичных плюрипотентных стволовых клеток в культуре, не содержащей фидерного слоя. Используемыми клеточными линиями были мезенхимальные и подобные фибробластам клеточные линии, полученные из эмбриональной ткани или дифференцированные из эмбриональных стволовых клеток. В заявке US20020072117 также описано применение этих клеточных линий в качестве первичного фидерного клеточного слоя.
Другой пример можно найти в работе Wang et al (Stem Cells 23: 1221-1227, 2005), где описаны методы продолжительного культивирования человеческих плюрипотентных стволовых клеток на клеточных фидерных слоях, происходящих от человеческих эмбриональных стволовых клеток.
Другой пример можно найти в работе Stojkovic et al. (Stem Cells 2005 23:306-314, 2005), где описана система фидерных клеток, образующихся в результате спонтанной дифференцировки человеческих эмбриональных стволовых клеток.
Другой пример можно найти в работе Miyamoto et al. (Stem Cells 22:433-440, 2004), где описан источник фидерных клеток, полученных из человеческой плаценты.
В работе Amit et al. (Biol. Reprod 68:2150-2156, 2003) описан фидерный клеточный слой, выделенный из крайней плоти человека.
Другой пример можно найти в работе Inzunza et al. (Stem Cells 23:544-549, 2005), где описан фидерный клеточный слой, выделенный из фибробластов крайней плоти человека после его рождения.
В патенте США 6642048 описана среда, которая поддерживает рост плюрипотентных стволовых клеток (pPS) приматов в культуре, не содержащей фидерного слоя, и клеточные линии, подходящие для получения такой среды. В патенте США 6642048 указывается: «Настоящее изобретение включает клеточные линии, подобные клеткам мезенхимы и фибробластам, и полученные из эмбриональной ткани, или клеточные линии, дифференцированные из эмбриональных стволовых клеток. Методы получения таких клеточных линий и среды для их обработки, а также методы культивирования стволовых клеток с использованием кондиционированной среды описаны и проиллюстрированы в данной заявке».
Другой пример можно найти в заявке WO2005014799, где описана кондиционированная среда для сохранения, пролиферации и дифференцировки клеток млекопитающих. В WO2005014799 указывается: «Культуральная среда, получаемая в соответствии с настоящим изобретением, кондиционирована путем сообщения ей секретирующей активности мышиных клеток, в частности, дифференцированных и иммортализованных трансгенных гепатоцитов, обозначенных MMH (мышиного гепатоцита Met)».
Другой пример можно найти в работе Xu et al (Stem Cells 22:972-980, 2004), где описана кондиционированная среда, полученная из производных человеческих эмбриональных стволовых клеток, которые были генетически модифицированы так, чтобы они сверхэкспрессировали человеческую теломеразу, принадлежащую к группе обратных транскриптаз.
Другой пример можно найти в заявке US20070010011, где описана культуральная среда определенного химического состава для поддержания плюрипотентных стволовых клеток.
Была использована альтернативная культуральная система, в которую была добавлена бессывороточная среда, содержащая факторы роста, способные стимулировать пролиферацию эмбриональных стволовых клеток. Так, например, в работе Cheon et al (BioReprod DOI: 10.1095/biolreprod.105.046870, 19 октября, 2005) описана культуральная система, которая не содержала фидера и сыворотки, и в которой эмбриональные стволовые клетки поддерживались в некондиционированной среде с заменителем сыворотки (SR), содержащей различные факторы роста, способные стимулировать самообновление эмбриональных стволовых клеток.
Другой пример можно найти в работе Levenstein et al (Stem Cells 24:568-574, 2006), в которой описаны методы длительного культивирования человеческих эмбриональных стволовых клеток в отсутствие фибробластов или кондиционированной среды с использованием среды, в которую был добавлен bFGF.
Другой пример можно найти в заявке US20050148070, в которой описан способ культивирования человеческих эмбриональных стволовых клеток в среде, имеющей определенный состав и не содержащей сыворотки и фидерных клеток фибробластов, где указанный способ включает культивирование стволовых клеток в культуральной среде, содержащей альбумин, аминокислоты, витамины, минералы, по меньшей мере один трансферрин или его заменитель, по меньшей мере один инсулин или его заменитель, где указанная культуральная среда по существу не содержит фетальной сыворотки млекопитающего и содержит по меньшей мере приблизительно 100 нг/мл фактора роста фибробластов, способного активировать рецептор передачи сигнала фактора роста фибробластов, где указанный фактор роста поставляется из источника, не являющегося фидерным слоем фибробластов, и где указанная среда поддерживает пролиферацию стволовых клеток в недифференцированном состоянии в отсутствие фидерных клеток или кондиционированной среды.
Другой пример можно найти в заявке US20050233446, где описана среда определенного состава, подходящая для культивирования стволовых клеток, включая недифференцированные примордиальные стволовые клетки приматов. В растворе указанная среда, по сравнению с культивируемыми стволовыми клетками, является, по существу, изотоничной. В данной культуре конкретная среда содержит базальную среду и каждый из таких компонентов, как bFGF, инсулин и аскорбиновая кислота в количестве, необходимом для поддержания, по существу, недифференцированного роста примордиальных стволовых клеток.
Другой пример можно найти в заявке US6800480, где указано следующее: «В одном из своих вариантов изобретение относится к культуральной среде для роста примордиальных стволовых клеток приматов, находящихся, по существу, в недифференцированном состоянии, где указанная культуральная среда включает базальную среду с низким осмотическим давлением и с низким уровнем эндотоксинов, которая является эффективной для поддержания роста примордиальных стволовых клеток приматов. Указанную базальную среду объединяют с питательной сывороткой, эффективной для поддержания роста примордиальных стволовых клеток приматов, и с субстратом, выбранным из группы, состоящей из фидерных клеток и компонента внеклеточного матрикса, происходящего от этих фидерных клеток. Указанная среда также включает заменимые аминокислоты, антиоксидант и первый фактор роста, выбранный из группы, состоящей из нуклеозидов и соли пировиноградной кислоты.»
Другой пример можно найти в заявке US20050244962, где указано следующее: «В одном из своих аспектов настоящее изобретение относится к способу культивирования эмбриональных стволовых клеток приматов. Одним из таких способов является культивирование стволовых клеток в культуре, по существу, не содержащей фетальной сыворотки млекопитающего (а также предпочтительно, по существу, не содержащей какой-либо сыворотки животного), в присутствии фактора роста фибробластов, который поставляется от источника, не являющегося фидерным слоем фибробластов. В предпочтительной форме фидерный слой фибробластов, необходимый для первоначального поддержания культуры стволовых клеток, не требует обязательного добавления достаточного количества фактора роста фибробластов».
Другой пример можно найти в заявке WO2005065354, где описана изотоническая культуральная среда определенного состава, которая, по существу, не содержит фидера и сыворотки, и которая включает: a) базальную среду; b) bFGF в количестве, достаточном для поддержания роста, по существу, недифференцированных стволовых клеток млекопитающих; с) инсулин в количестве, достаточном для поддержания роста, по существу, недифференцированных стволовых клеток млекопитающих; и d) аскорбиновую кислоту в количестве, достаточном для поддержания роста, по существу, недифференцированных стволовых клеток млекопитающих.
Другой пример можно найти в заявке WO2005086845, в которой описан способ поддержания недифференцированных стволовых клеток, где указанный способ включает обработку стволовых клеток белками, принадлежащими к членам семейства трансформирующих факторов роста бета (TGFβ); белками, принадлежащими к членам семейства факторов роста фибробластов (FGF); или никотинамидом (NIC) в количестве, достаточном для поддержания клеток в недифференцированном состоянии в течение определенного периода времени, достаточного для достижения желаемого результата.
Плюрипотентные стволовые клетки могут быть засеяны на подходящий культуральный субстрат. В одном из вариантов изобретения подходящим культуральным субстратом является компонент внеклеточного матрикса, такой как, например, компонент, происходящий от базальной мембраны, или компонент, который может образовывать часть комплекса «рецептор адгезивной молекулы - лиганд». В одном из вариантов изобретения подходящим культуральным субстратом является MATRIGEL® (Becton Dickenson). MATRIGEL® представляет собой растворимый препарат, который был получен из опухолевых клеток Энгельбрета-Хольма-Сварма, и который приобретает форму геля при комнатной температуре с образованием восстановленной базальной мембраны.
В качестве альтернативы, подходящими являются и другие компоненты внеклеточного матрикса и смеси этих компонентов. В зависимости от типа пролифирирующихся клеток, в среду может быть включен ламинин, фибронектин, протеогликан, энтактин, сульфат гепарана и т.п., взятые отдельно или в различных комбинациях друг с другом.
Плюрипотентные стволовые клетки могут быть засеяны на субстрат при соответствующем распределении и в присутствии среды, стимулирующей выживание и размножение клеток, а также сохранение их желательных свойств. Сохранение всех этих благоприятных свойств зависит от распределения посевного материала, и такие свойства могут быть легко определены специалистом в данной области.
Подходящая культуральная среда может быть составлена из нижеследующих компонентов, таких как, например, модифицированная по способу Дульбекко среда Игла (DMEM), Gibco # 11965-092; модифицированная по способу Дульбекко и дефицитная среда Игла (KO DMEM), Gibco #10829-018; среда Хемса F12/50% базальная среда DMEM; среда с 200 мМ L-глутамина, Gibco # 15039-027; раствор заменимых аминокислот, Gibco 11140-050; β-меркаптоэтанол, Sigma # M7522; основной рекомбинантный человеческий фактор роста (bFGF), Gibco # 13256-029.
Дифференцировка плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндокринной системы
Плюрипотентными стволовыми клетками, подходящими для использования в настоящем изобретении, являются, например, клеточная линия человеческих эмбриональных стволовых клеток Н9 (код NIH: WA09), клеточная линия человеческих эмбриональных стволовых клеток Н1 (код NIH: WA01), клеточная линия человеческих эмбриональных стволовых клеток H7 (код NIH: WA07) и клеточная линия человеческих эмбриональных стволовых клеток SA002 (Cellartis, Sweden). Подходящими для использования в настоящем изобретении также являются клетки, которые экспрессируют по меньшей мере один из нижеследующих маркеров плюрипотентных клеток: ABCG2, cripto, CD9, FoxD3, Connexin43, Connexin45, Oct4, Sox2, Nanog, hTERT, UTF-1, ZFP42, SSEA-3, SSEA-4, Tra 1-60, Tra 1-81.
Маркеры линии дифференцировки клеток дефинитивной эндодермы, выбирают из группы, состоящей из SOX-17, GATA4, Hnf-3-бета, GSC, Cer1, Nodal, FGF8, Brachyury, Mix-подобного белка гомеобокса, FGF4, CD48, эомезодермина (EOMES), DKK4, FGF17, GATA6, CXCR4, C-Kit, CD99 и OTX2. Подходящими для использования в настоящем изобретении являются клетки, которые экспрессируют по меньшей мере один из маркеров линии дифференцировки клеток дефинитивной эндодермы. В одном из аспектов изобретения, клеткой, экспрессирующей маркеры линии дифференцировки клеток дефинитивной эндодермы, является клетка-предшественник первичной полоски. В альтернативном аспекте изобретения клеткой, экспрессирующей маркеры линии дифференцировки клеток дефинитивной эндодермы, является клетка мезоэндодермы. В альтернативном аспекте изобретения клеткой, экспрессирующей маркеры линии дифференцировки клеток дефинитивной эндодермы, является клетка дефинитивной эндодермы.
Маркеры линии дифференцировки клеток панкреатической эндодермы выбирают из группы, состоящей из Pdx1, HNF-1бета, PTF1a, HNF-6, HB9 и PROX1. Подходящими для использования в настоящем изобретении также являются клетки, которые экспрессируют по меньшей мере один маркер линии дифференцировки клеток панкреатической эндодермы. В одном из аспектов изобретения, клеткой, экспрессирующей маркеры линии дифференцировки клеток панкреатической эндодермы, является клетка панкреатической эндодермы.
Маркеры линии дифференцировки клеток панкреатической эндокринной системы, выбирают из группы, состоящей из NGN-3, NeuroD, Islet-1, Pdx-1, NKX6.1, Pax-4, Ngn-3 и PTF-1 альфа. В одном из вариантов изобретения клетка панкреатической эндокринной системы способна экспрессировать по меньшей мере один из следующих гормонов, таких как инсулин, глюкагон, соматостатин и панкреатический полипептид. Подходящей для использования в настоящем изобретении является клетка, которая экспрессирует по меньшей мере один маркер линии дифференцировки клеток панкреатической эндокринной системы. В одном из аспектов изобретения клеткой, экспрессирующей маркеры линии дифференцировки клеток панкреатической эндокринной системы, является панкреатическая эндокринная клетка. Панкреатической эндокринной клеткой может быть клетка, экспрессирующая гормон поджелудочной железы. Альтернативно, такой панкреатической эндокринной клеткой может быть клетка, секретирующая гормон поджелудочной железы.
В одном из аспектов настоящего изобретения панкреатической эндокринной клеткой является клетка, экспрессирующая маркеры β-клеточной линии дифференцировки. Клетка, экспрессирующая маркеры β-клеточной линии дифференцировки, экспрессирует Pdx1 и по меньшей мере один из следующих факторов транскрипции: NGN-3, Nkx2.2, Nkx6.1, NeuroD, Isl-1, HNF-3 бета, MAFA, Pax4 и Pax6. В одном из аспектов изобретения клеткой, экспрессирующей маркеры β-клеточной линии дифференцировки, является β-клетка.
Образование клеток, экспрессирующих маркеры линии дефинитивной эндодермы
Плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры линии дифференцировки клеток дефинитивной эндодермы, любым известным методом или любым методом, предложенным в настоящем изобретении.
Так, например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры линии дифференцировки клеток дефинитивной эндодермы, методами, описанными в публикации D'Amour et al, Nature Biotechnology 23, 1534-1541 (2005).
Так, например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры линии дифференцировки клеток дефинитивной эндодермы, методами, описанными в публикации Shinozaki et al, Development 131, 1651-1662 (2004).
Так, например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры линии дифференцировки клеток дефинитивной эндодермы, методами, описанными в публикации McLean et al, Stem Cells 25, 29-38 (2007).
Так, например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры линии дифференцировки клеток дефинитивной эндодермы, методами, описанными в публикации D'Amour et al, Nature Biotechnology 24, 1392-1401 (2006).
Так, например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры линии дифференцировки клеток дефинитивной эндодермы, путем культивирования плюрипотентных стволовых клеток в среде, содержащей активин А в отсутствие сыворотки, а затем культивирования этих клеток в присутствии активина А и сыворотки, и культивирования этих клеток с активином А и сывороткой в другой концентрации. Пример осуществления этого метода описан в публикации Nature Biotechnology 23, 1534-1541 (2005).
Так, например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры линии дифференцировки клеток дефинитивной эндодермы, путем культивирования плюрипотентных стволовых клеток в среде, содержащей активин А в отсутствие сыворотки, а затем культивирования этих клеток с активином А и сывороткой в другой концентрации. Пример осуществления этого метода описан в публикации D'Amour et al, Nature Biotechnology, 2005.
Так, например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры линии дифференцировки клеток дефинитивной эндодермы, путем культивирования плюрипотентных стволовых клеток в среде, содержащей активин А и лиганд Wnt в отсутствие сыворотки, с последующим удалением лиганда Wnt и культивирования этих клеток с активином А и с сывороткой. Пример осуществления этого метода описан в публикации Nature Biotechnology 24, 1392-1401 (2006).
В одном из аспектов изобретения плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры линии дифференцировки клеток дефинитивной эндодермы, путем посева плюрипотентных стволовых клеток на субстрат для тканевой культуры, покрытый внеклеточным матриксом, а затем культивирования плюрипотентных стволовых клеток с активином А и лигандом Wnt в первой культуральной среде, содержащей сыворотку, в течение определенного периода времени, с последующим культивированием плюрипотентных стволовых клеток с активином А во второй культуральной среде, содержащей сыворотку в более высокой концентрации, в течение другого периода времени.
Концентрация сыворотки в первой культуральной среде, описанной выше, может составлять примерно от 0 до примерно 0,5 процентов, а время культивирования может составлять примерно от одного до трех дней. Концентрация сыворотки во второй культуральной среде, описанной выше, может составлять примерно от 0,5 до двух процентов, а время культивирования может составлять примерно от одного до четырех дней.
В альтернативном варианте изобретения плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры линии дифференцировки клеток дефинитивной эндодермы, путем посева плюрипотентных стволовых клеток на субстрат для тканевой культуры, покрытый внеклеточным матриксом, а затем культивирования плюрипотентных стволовых клеток с активином А и с лигандом Wnt в первой культуральной среде, содержащей сыворотку, в течение определенного периода времени, с последующим культивированием плюрипотентных стволовых клеток с активином А и с лигандом Wnt во второй культуральной среде, содержащей сыворотку в более высокой концентрации, в течение другого периода времени.
Концентрация сыворотки в первой культуральной среде, описанной выше, может составлять примерно от 0 до 0,5 процентов, а время культивирования может составлять примерно от одного до трех дней. Концентрация сыворотки во второй культуральной среде, описанной выше, может составлять примерно от 0,5 до двух процентов, а время культивирования может составлять примерно от одного до четырех дней.
В одном из своих вариантов настоящее изобретение относится к способу дифференцировки плюрипотентных стволовых клеток, экспрессирующих маркеры линии дифференцировки клеток дефинитивной эндодермы, где указанный способ включает стадии:
a. посева плюрипотентных стволовых клеток на субстрат для тканевой культуры, покрытый внеклеточным матриксом, и
b. культивирования плюрипотентных стволовых клеток с активином А и с лигандом Wnt.
Культивирование плюрипотентных стволовых клеток с активином А и с лигандом Wnt может быть осуществлено в одной культуральной среде. Альтернативно, культивирование плюрипотентных стволовых клеток с активином А и с лигандом Wnt может быть осуществлено отдельно или вместе в более чем одной культуральной среде. В одном из вариантов изобретения культивирование плюрипотентных стволовых клеток с активином А и с лигандом Wnt осуществляют в двух культуральных средах.
Внеклеточный матрикс
В одном из аспектов изобретения, плюрипотентные стволовые клетки культивируют и подвергают дифференцировке на субстрате для тканевой культуры, покрытом внеклеточным матриксом. Внеклеточный матрикс может представлять собой солюбилизированный препарат базальной мембраны, экстрагированный из клеток мышиной саркомы (которые поставляются компанией BD Biosciences под торговым знаком MATRIGEL). Альтернативно, таким внеклеточным матриксом может быть MATRIGEL с пониженным содержанием фактора роста. Альтернативно, внеклеточным матриксом может быть фибронектин. В альтернативном варианте изобретения плюрипотентные стволовые клетки культивируют и подвергают дифференцировке на субстрате для тканевой культуры, покрытом человеческой сывороткой.
Внеклеточный матрикс перед его нанесением на субстрат для тканевой культуры может быть разведен. Примеры подходящих методов разведения внеклеточного матрикса и его нанесения на субстрат для тканевой культуры можно найти в публикации Kleinman, H.K., et al., Biochemistry 25:312 (1986), и Hadley, M.A., et al., J. Cell. Biol. 101:1511 (1985).
В одном из вариантов изобретения таким внеклеточным матриксом является матригель. В одном из вариантов изобретения субстрат для тканевой культуры покрывают матригелем, разведенным 1:10. В альтернативном варианте изобретения субстрат для тканевой культуры покрывают матригелем, разведенным 1:15. В альтернативном варианте изобретения субстрат для тканевой культуры покрывают матригелем, разведенным 1:30. В альтернативном варианте изобретения субстрат для тканевой культуры покрывают матригелем, разведенным 1:60.
В одном из вариантов изобретения внеклеточным матриксом является матригель с низким содержанием фактора роста. В одном из вариантов изобретения субстрат для тканевой культуры покрывают матригелем с низким содержанием фактора роста и разведенным 1:10. В альтернативном варианте изобретения субстрат для тканевой культуры покрывают матригелем с низким содержанием фактора роста и разведенным 1:15. В альтернативном варианте изобретения субстрат для тканевой культуры покрывают матригелем с низким содержанием фактора роста и разведенным 1:30. В альтернативном варианте изобретения субстрат для тканевой культуры покрывают матригелем с низким содержанием фактора роста и разведенным 1:60.
Дифференцировка плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры линии дифференцировки клеток дефинитивной эндодермы, на внеклеточном матриксе с использованием одной культуральной среды
При использовании одной культуральной среды необходимо, чтобы эта среда содержала достаточно низкие концентрации некоторых факторов, стимулирующих дифференцировку плюрипотентных стволовых клеток в клетки дефинитивной эндодермы, например, таких факторов, как инсулин и IGF (как описано в заявке WO2006020919). Это может быть достигнуто путем снижения концентрации сыворотки, или альтернативно, путем использования среды с определенным химическим составом, в которой отсутствуют инсулин и IGF. Примеры такой среды с определенным химическим составом описаны в публикации Wiles et al. (Exp. Cell Res. 1999 Feb 25; 247(1):241-8).
Культуральная среда может содержать сыворотку в концентрации примерно от 0% до 10%. В альтернативном варианте концентрация может составлять примерно от 0% до 5%. В альтернативном варианте изобретения концентрация может составлять примерно от 0% до 2%. В альтернативном варианте концентрация может составлять примерно 2%.
Время культивирования с активином A и лигандом Wnt может составлять примерно от 1 дня до 7 дней. В альтернативном варианте изобретения время культивирования может составлять примерно от 1 дня до 3 дней. В альтернативном варианте изобретения время культивирования может составлять примерно 3 дня.
Активин A может быть использован в любой концентрации, подходящей для инициации дифференцировки плюрипотентных стволовых клеток. Концентрация активина может составлять примерно от 1 пг/мл до 100 мкг/мл. В альтернативном варианте изобретения концентрация может составлять примерно от 1 пг/мл до 1 мкг/мл. В другом альтернативном варианте изобретения концентрация может составлять примерно от 1 пг/мл до 100 нг/мл. В другом альтернативном варианте изобретения концентрация может составлять примерно от 50 нг/мл до 100 нг/мл. В другом альтернативном варианте изобретения концентрация может составлять примерно 100 нг/мл.
Выбор лиганда Wnt может быть оптимизирован для повышения эффективности процесса дифференцировки. Лиганд Wnt может быть выбран из группы, состоящей из Wnt-1, Wnt-3a, Wnt-5a и Wnt-7a. В одном из вариантов изобретения лигандом Wnt является Wnt-1. В альтернативном варианте изобретения лигандом Wnt является Wnt-3a.
Лиганд Wnt может иметь концентрацию примерно от 1 нг/мл до 1000 нг/мл. В альтернативном варианте изобретения концентрация может составлять примерно от 10 нг/мл до 100 нг/мл.
Одна культуральная среда может также содержать ингибитор GSK-3B. Ингибитор GSK-3B может быть выбран из группы, состоящей из ингибитора IX GSK-3B и ингибитора XI GSK-3B. В одном из вариантов изобретения ингибитором GSK-3B является ингибитор IX GSK-3B.
При культивировании плюрипотентных стволовых клеток с ингибитором GSK-3B, концентрация ингибитора GSK-3B может составлять примерно от 1 нМ до 1000 нМ. В альтернативном варианте изобретения плюрипотентные стволовые клетки культивируют с ингибитором GSK-3B в концентрации примерно от 10 нМ до 100 нМ.
Одна культуральная среда может также содержать по меньшей мере один другой дополнительный фактор, который может стимулировать образование клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, из плюрипотентных стволовых клеток. Альтернативно, по меньшей мере один другой дополнительный фактор может усиливать пролиферацию клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, генерированной способами согласно изобретению. Кроме того, по меньшей мере один другой дополнительный фактор может повышать способность клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, генерированной способами согласно изобретению, образовывать клетки других типов, или повышать эффективность любых других дополнительных стадий дифференцировки.
По меньшей мере одним дополнительным фактором может быть, например, никотинамид, члены семейства TGF-β, включая TGF-β1, 2 и 3, сывороточный альбумин, члены семейства факторов роста фибробластов, тромбоцитарный фактор роста-AA и -BB, плазма, обогащенная тромбоцитами, инсулиновый фактор роста (IGF-I, II), фактор роста-дифференцировки (GDF-5, -6, -8, -10, -11), глюкагон-подобный пептид-I и II (GLP-I и II), антитело-миметик против GLP-1 и GLP-2, эксендин-4, ретиноевая кислота, паратиреоидный гормон, инсулин, прогестерон, апротинин, гидрокортизон, этаноламин, бета-меркаптоэтанол, эпидермальный фактор роста (EGF), гастрин I и II, реагенты, образующие хелатные комплексы с медью, такие как, например, триэтиленпентамин, форсколин, Na-бутират, активин, бета-целлюлин, ITS, ноггин, фактор роста нейритов, белок nodal, вальпроевая кислота, трихостатин A, бутират натрия, фактор роста гепатоцитов (HGF), сфингозин 1, VEGF, MG 132 (EMD, CA), добавки N2 и B27 (Gibco, CA), стероидный алкалоид, такой как, например, циклопамин (EMD, CA), фактор роста кератиноцитов (KGF), белок семейства Dickkopf, экстракт бычьего гипофиза, белок, ассоциированный с неогенезом островков (INGAP), домен «indian hedgehog», домен «sonic hedgehog», ингибиторы протеосомы, ингибиторы пути Notch, ингибиторы домена «sonic hedgehog» или их комбинации.
По меньшей мере один другой дополнительный фактор роста может поставляться кондиционированной средой, полученной от панкреатических клеточных линий, таких как, например, PANC-1 (ATCC No: CRL-1469), CAPAN-1 (ATCC No: HTB-79), BxPC-3 (ATCC No: CRL-1687), HPAF-II (ATCC No: CRL-1997), клеточные линии печени, такие как, например, HepG2 (ATCC No: HTB-8065), клеточные линии тонкой кишки, такие как, например, FHs 74 (ATCC No: CCL-241), и клетки первичного или трансформированного эндотелия.
Дифференцировка плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры линий дифференцировки дефинитивной эндодермы, на внеклеточном матриксе с использованием двух культуральных сред
Дифференцировка плюрипотентных стволовых клеток в клетки линий дифференцировки дефинитивной эндодермы может быть осуществлена путем культивирования плюрипотентных стволовых клеток с активином А и с лигандом Wnt с использованием двух культуральных сред. Таким образом, дифференцировка плюрипотентных стволовых клеток может быть осуществлена путем:
a. посева плюрипотентных стволовых клеток на субстрат для тканевой культуры, покрытый внеклеточным матриксом,
b. культивирования плюрипотентных стволовых клеток с активином А и с лигандом Wnt в первой культуральной среде, и
с. культивирования плюрипотентных стволовых клеток с активином А во второй культуральной среде.
Первая культуральная среда может содержать сыворотку в низкой концентрации, а вторая культуральная среда может содержать сыворотку в более высокой концентрации, чем первая культуральная среда.
Вторая культуральная среда может содержать лиганд Wnt.
Первая культуральная среда
Первая культуральная среда должна содержать достаточно низкие концентрации некоторых факторов, стимулирующих дифференцировку плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры линии дифференцировки дефинитивной эндодермы, например, таких факторов, как инсулин и IGF (как описано в заявке WO2006020919). Это может быть достигнуто путем снижения концентрации сыворотки, или альтернативно, путем использования среды с определенным химическим составом, в которой отсутствуют инсулин и IGF. Примеры такой среды с определенным химическим составом описаны в публикации Wiles et al. (Exp. Cell Res. 1999 Feb 25; 247(1):241-8).
В первой культуральной среде концентрация сыворотки может быть ниже, чем во второй культуральной среде. Повышение концентрации сыворотки во второй культуральной среде приводит к увеличению продолжительности жизни клеток, или альтернативно, может усиливать пролиферацию клеток. Концентрация сыворотки в первой среде может составлять примерно от 0% до 10%. Альтернативно, концентрация сыворотки в первой среде может составлять примерно от 0% до 2%. Альтернативно, концентрация сыворотки в первой среде может составлять примерно от 0% до 1%. Альтернативно, концентрация сыворотки в первой среде может составлять примерно 0,5%.
При культивировании плюрипотентных стволовых клеток с активином А и лигандом Wnt с использованием по меньшей мере двух культуральных сред время культивирования в первой культуральной среде может составлять в пределах примерно от 1 дня до 3 дней.
Активин A может быть использован в любой концентрации, подходящей для инициации дифференцировки плюрипотентных стволовых клеток. Концентрация активина может составлять примерно от 1 пг/мл до 100 мкг/мл. В альтернативном варианте изобретения концентрация может составлять примерно от 1 пг/мл до 1 мкг/мл. В другом альтернативном варианте изобретения концентрация может составлять примерно от 1 пг/мл до 100 нг/мл. В другом альтернативном варианте изобретения концентрация может составлять примерно от 50 нг/мл до 100 нг/мл. В другом альтернативном варианте изобретения концентрация может составлять примерно 100 нг/мл.
Выбор лиганда Wnt может быть оптимизирован для повышения эффективности процесса дифференцировки. Лиганд Wnt может быть выбран из группы, состоящей из Wnt-1, Wnt-3a, Wnt-5a и Wnt-7a. В одном из вариантов изобретения лигандом Wnt является Wnt-1. В альтернативном варианте изобретения лигандом Wnt является Wnt-3a.
Лиганд Wnt может иметь концентрацию примерно от 1 нг/мл до 1000 нг/мл. В альтернативном варианте изобретения концентрация может составлять примерно от 10 нг/мл до 100 нг/мл.
Первая культуральная среда может также содержать ингибитор GSK-3B. Ингибитор GSK-3B может быть добавлен в первую культуральную среду, во вторую культуральную среду или в первую и во вторую культуральную среду.
Ингибитор GSK-3B может быть выбран из группы, состоящей из ингибитора IX GSK-3B и ингибитора XI GSK-3B. В одном из вариантов изобретения ингибитором GSK-3B является ингибитор IX GSK-3B.
При культивировании плюрипотентных стволовых клеток с ингибитором GSK-3B концентрация ингибитора GSK-3B может составлять примерно от 1 нМ до 1000 нМ. В альтернативном варианте изобретения плюрипотентные стволовые клетки культивируют с ингибитором GSK-3B в концентрации примерно от 10 нМ до 100 нМ.
Первая культуральная среда может также содержать по меньшей мере один другой дополнительный фактор, который может стимулировать образование клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, из плюрипотентных стволовых клеток. Альтернативно, по меньшей мере один другой дополнительный фактор может усиливать пролиферацию клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, генерированной способами согласно изобретению. Кроме того, по меньшей мере один другой дополнительный фактор может повышать способность клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, генерированной способами согласно изобретению, образовывать клетки других типов, или повышать эффективность любых других дополнительных стадий дифференцировки.
По меньшей мере одним дополнительным фактором может быть, например, никотинамид, члены семейства TGF-β, включая TGF-β1, 2 и 3, сывороточный альбумин, члены семейства факторов роста фибробластов, тромбоцитарный фактор роста-AA и -BB, плазма, обогащенная тромбоцитами, инсулиновый фактор роста (IGF-I, II), фактор роста-дифференцировки (GDF-5, -6, -8, -10, -11), глюкагон-подобный пептид-I и II (GLP-I и II), антитело-миметик против GLP-1 и GLP-2, эксендин-4, ретиноевая кислота, паратиреоидный гормон, инсулин, прогестерон, апротинин, гидрокортизон, этаноламин, бета-меркаптоэтанол, эпидермальный фактор роста (EGF), гастрин I и II, реагенты, образующие хелатные комплексы с медью, такие как, например, триэтиленпентамин, форсколин, Na-бутират, активин, бета-целлюлин, ITS, ноггин, фактор роста нейритов, белок nodal, вальпроевая кислота, трихостатин A, бутират натрия, фактор роста гепатоцитов (HGF), сфингозин 1, VEGF, MG 132 (EMD, CA), добавки N2 и B27 (Gibco, CA), стероидный алкалоид, такой как, например, циклопамин (EMD, CA), фактор роста кератиноцитов (KGF), белок семейства Dickkopf, экстракт бычьего гипофиза, белок, ассоциированный с неогенезом островков (INGAP), домен «indian hedgehog», домен «sonic hedgehog», ингибиторы протеосомы, ингибиторы пути Notch, ингибиторы «sonic hedgehog» или их комбинации.
По меньшей мере один другой дополнительный фактор может поставляться кондиционированной средой, полученной от панкреатических клеточных линий, таких как, например, PANC-1 (ATCC No: CRL-1469), CAPAN-1 (ATCC No: HTB-79), BxPC-3 (ATCC No: CRL-1687), HPAF-II (ATCC No: CRL-1997), клеточные линии печени, такие как, например, HepG2 (ATCC No: HTB-8065) и клеточные линии тонкой кишки, такие как, например, FHs 74 (ATCC No: CCL-241).
Вторая культуральная среда
Вторая культуральная среда должна содержать некоторые факторы, такие как, например, инсулин и IGF (как описано в заявке WO2006020919), в концентрации, достаточной для стимуляции выживаемости культивированных клеток. Это может быть достигнуто путем повышения концентрации сыворотки, или альтернативно, с использованием среды с определенным химическим составом, в которой концентрации инсулина и IGF выше, чем в первой культуральной среде. Примеры такой среды с определенным химическим составом описаны в публикации Wiles et al. (Exp. Cell Res. 1999 Feb 25; 247(1):241-8).
Во второй культуральной среде, имеющей более высокие концентрации сыворотки, концентрация сыворотки может составлять в пределах примерно от 0,5% до 10%. Альтернативно, концентрация сыворотки во второй культуральной среде может составлять примерно от 0,5% до 5%. Альтернативно, концентрация сыворотки во второй культуральной среде может составлять примерно от 0,5% до 2%. Альтернативно, концентрация сыворотки во второй культуральной среде может составлять примерно 2%. При культивировании плюрипотентных стволовых клеток со второй культуральной средой время культивирования может составлять в пределах примерно от 1 дня до 4 дней.
Аналогично первой культуральной среде, активин A может быть использован в любой концентрации, подходящей для инициации дифференцировки плюрипотентных стволовых клеток. Концентрация активина может составлять примерно от 1 пг/мл до 100 мкг/мл. В альтернативном варианте изобретения концентрация может составлять примерно от 1 пг/мл до 1 мкг/мл. В другом альтернативном варианте изобретения концентрация может составлять примерно от 1 пг/мл до 100 нг/мл. В другом альтернативном варианте изобретения концентрация может составлять примерно от 50 нг/мл до 100 нг/мл. В другом альтернативном варианте изобретения концентрация может составлять примерно 100 нг/мл.
Лиганд Wnt может иметь концентрацию примерно от 1 нг/мл до 1000 нг/мл. В альтернативном варианте изобретения концентрация может составлять примерно от 10 нг/мл до 100 нг/мл.
Лиганд Wnt может быть выбран из группы, состоящей из Wnt-1, Wnt-3a, Wnt-5a и Wnt-7a. В одном из вариантов изобретения лигандом Wnt является Wnt-1. В альтернативном варианте изобретения лигандом Wnt является Wnt-3a.
Вторая культуральная среда может также содержать ингибитор GSK-3B. Ингибитор GSK-3B может быть добавлен в первую культуральную среду, во вторую культуральную среду или в первую и во вторую культуральную среду.
Ингибитор GSK-3B может быть выбран из группы, состоящей из ингибитора IX GSK-3B и ингибитора XI GSK-3B. В одном из вариантов изобретения ингибитором GSK-3B является ингибитор IX GSK-3B.
При культивировании плюрипотентных стволовых клеток с ингибитором GSK-3B концентрация ингибитора GSK-3B может составлять примерно от 1 нМ до 1000 нМ. В альтернативном варианте изобретения плюрипотентные стволовые клетки культивируют с ингибитором GSK-3B в концентрации примерно от 10 нМ до 100 нМ.
Аналогично первой культуральной среде, вторая культуральная среда может также содержать по меньшей мере один другой дополнительный фактор, который может стимулировать образование клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, из плюрипотентных стволовых клеток. Альтернативно, по меньшей мере один другой дополнительный фактор может усиливать пролиферацию клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, генерированной способами согласно изобретению. Кроме того, по меньшей мере один другой дополнительный фактор может повышать способность клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, генерированной способами согласно изобретению, образовывать клетки других типов, или повышать эффективность любых других дополнительных стадий дифференцировки.
По меньшей мере одним дополнительным фактором может быть, например, никотинамид, члены семейства TGF-β, включая TGF-β1, 2 и 3, сывороточный альбумин, члены семейства факторов роста фибробластов, тромбоцитарный фактор роста-AA и -BB, плазма, обогащенная тромбоцитами, инсулиновый фактор роста (IGF-I, II), фактор роста-дифференцировки (GDF-5, -6, -8, -10, 11), глюкагон-подобный пептид-I и II (GLP-I и II), антитело-миметик против GLP-1 и GLP-2, эксендин-4, ретиноевая кислота, паратиреоидный гормон, инсулин, прогестерон, апротинин, гидрокортизон, этаноламин, бета-меркаптоэтанол, эпидермальный фактор роста (EGF), гастрин I и II, реагенты, образующие хелатные комплексы с медью, такие как, например, триэтиленпентамин, форсколин, Na-бутират, активин, бета-целлюлин, ITS, ноггин, фактор роста нейритов, белок nodal, вальпроевая кислота, трихостатин A, бутират натрия, фактор роста гепатоцитов (HGF), сфингозин 1, VEGF, MG 132 (EMD, CA), добавки N2 и B27 (Gibco, CA), стероидный алкалоид, такой как, например, циклопамин (EMD, CA), фактор роста кератиноцитов (KGF), белок семейства Dickkopf, экстракт бычьего гипофиза, белок, ассоциированный с неогенезом островков (INGAP), домен «indian hedgehog», домен «sonic hedgehog», ингибиторы протеосомы, ингибиторы пути Notch, ингибиторы «sonic hedgehog» или их комбинации.
По меньшей мере один другой дополнительный фактор может поставляться кондиционированной средой, полученной от панкреатических клеточных линий, таких как, например, PANC-1 (ATCC No: CRL-1469), CAPAN-1 (ATCC No: HTB-79), BxPC-3 (ATCC No: CRL-1687), HPAF-II (ATCC No: CRL-1997), клеточные линии печени, такие как, например, HepG2 (ATCC No: HTB-8065) и клеточные линии тонкой кишки, такие как, например, FHs 74 (ATCC No: CCL-241).
Дифференцировка клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы
Образование клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, может быть детектировано путем анализа на присутствие маркеров, осуществляемого до и после проведения конкретного протокола. Обычно плюрипотентные стволовые клетки не экспрессируют таких маркеров. Таким образом, дифференцировка плюрипотентных стволовых клеток детектируется в том случае, когда клетки начинают экспрессировать указанные маркеры.
Эффективность дифференцировки может быть оценена посредством контактирования популяции обработанных клеток с агентом (таким как антитело), который специфически распознает белковый маркер, экспрессируемый клетками, экспрессирующими маркеры линии дифференцировки дефинитивной эндодермы.
Методы оценки экспрессии белковых и нуклеиновокислотных маркеров в культивированных или в выделенных клетках известны специалистам. Такими методами являются количественная полимеразная цепная реакция с обратной транскриптазой (ОТ-ПЦР), Нозерн-блот-анализ, гибридизация in situ (см., например, руководство «Current Protocols in Molecular Biology» (Ausubel et al., eds. 2001, supplement)), и иммуноанализы, такие как иммуногистохимический анализ срезов, вестерн-блот-анализ, а для маркеров, которые являются доступными в интактных клетках, проточный цитометрический анализ (FACS) (см., например, Harlow and Lane, Using Antibodies: A Laboratory Manual, New York: Cold Spring Harbor Laboratory Press (1998)).
Примеры антител, которые могут быть использованы для детектирования некоторых белковых маркеров, приводятся в таблице 1А. При этом следует отметить, что альтернативные антитела против тех же самых маркеров, распознаваемых антителами, указанными в таблице IA, либо являются коммерчески доступными, либо могут быть легко получены специалистом. Такие альтернативные антитела могут быть также использованы для оценки уровней экспрессии маркеров в клетках, выделенных в соответствии с настоящим изобретением.
Так, например, свойства плюрипотентных стволовых клеток хорошо известны специалистам и, при этом могут быть идентифицированы другие свойства плюрипотентных стволовых клеток. Маркерами плюрипотентных стволовых клеток являются, например, один или несколько из нижеследующих экспрессируемых маркеров: ABCG2, cripto, FoxD3, Connexin43, Connexin45, Oct4, Sox2, Nanog, hTERT, UTF-1, ZFP42, SSEA-3, SSEA-4, Tra 1-60, Tra 1-81.
После обработки плюрипотентных стволовых клеток способами согласно изобретению дифференцированные клетки могут быть очищены путем контактирования обработанной популяции клеток с агентом (таким как антитело), который специфически распознает белковый маркер, такой как CXCR4, экспрессируемый клетками, экспрессирующими маркеры линии дифференцировки дефинитивной эндодермы.
Образование клеток, экспрессирующих маркеры линии дифференцировки панкреатической эндодермы
Клетки, экспрессирующие маркеры линии дифференцировки дефинитивной эндодермы, могут быть дифференцированы в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, любым методом, известным специалистам, или любым методом, предложенным в настоящей заявке.
Так, например, клетки, экспрессирующие маркеры линии дифференцировки дефинитивной эндодермы, могут быть дифференцированы в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, методами, описанными в публикации D'Amour et al, Nature Biotechnology 24, 1392-1401 (2006).
Так, например, клетки, экспрессирующие маркеры линии дифференцировки дефинитивной эндодермы, могут быть также дифференцированы в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, путем обработки клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, фактором роста фибробластов и ингибитором пути передачи сигнала хеджехот, а именно, KAAD-циклопамином, с последующим удалением среды, содержащей фактор роста фибробластов и KAAD-циклопамин, и культивированием клеток в среде, содержащей ретиноевую кислоту, фактор роста фибробластов и KAAD-циклопамин. Пример такого метода описан в публикации Nature Biotechnology 24, 1392-1401 (2006).
В одном из аспектов изобретения клетки, экспрессирующие маркеры линии дифференцировки дефинитивной эндодермы, могут быть также дифференцированы в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, путем обработки клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, ретиноевой кислотой и по меньшей мере одним фактором роста фибробластов в течение определенного периода времени. Этот период времени может составлять примерно от одного до шести дней.
В альтернативном аспекте настоящего изобретения клетки, экспрессирующие маркеры линии дифференцировки дефинитивной эндодермы, могут быть также дифференцированы в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, путем обработки клеток ретиноевой кислотой в течение определенного периода времени. Такой период времени может составлять примерно от одного до трех дней. Затем ретиноевую кислоту удаляют и клетки обрабатывают по меньшей мере одним фактором роста фибробластов в течение другого периода времени. Такой период времени может составлять примерно от одного до трех дней.
В одном из своих вариантов настоящее изобретение относится к способу дифференцировки клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, где указанный способ включает стадии:
a. культивирования клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, и
b. обработки клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, ретиноевой кислотой и по меньшей мере одним фактором роста фибробластов.
Для дифференцировки в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, осуществляемой с применением указанного способа, могут быть использованы любые клетки, экспрессирующие маркеры линии дифференцировки дефинитивной эндодермы.
В одном из вариантов изобретения клетки, экспрессирующие маркеры дефинитивной эндодермы, обрабатывают ретиноевой кислотой и по меньшей мере одним фактором роста фибробластов в течение периода времени примерно от одного до шести дней. В одном из вариантов изобретения клетки, экспрессирующие маркеры дефинитивной эндодермы, обрабатывают ретиноевой кислотой и по меньшей мере одним фактором роста фибробластов в течение примерно шести дней.
По меньшей мере один фактор роста фибробластов выбран из группы, состоящей из FGF-2, FGF-4 и FGF-10.
Для дифференцировки в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, осуществляемой с применением указанного способа, могут быть использованы любые клетки, экспрессирующие маркеры линии дифференцировки дефинитивной эндодермы.
В своем альтернативном варианте настоящее изобретение относится к способу дифференцировки клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, где указанный способ включает стадии:
a. культивирования клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы,
b. обработки клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, ретиноевой кислотой, и
с. удаления ретиноевой кислоты и последующей обработки клеток по меньшей мере одним фактором роста фибробластов.
Для дифференцировки в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, осуществляемой с применением указанного способа, могут быть использованы любые клетки, экспрессирующие маркеры линии дифференцировки дефинитивной эндодермы.
В одном из вариантов изобретения клетки, экспрессирующие маркеры дефинитивной эндодермы, обрабатывают ретиноевой кислотой в течение примерно от одного до трех дней. В одном из вариантов изобретения клетки, экспрессирующие маркеры дефинитивной эндодермы, обрабатывают ретиноевой кислотой в течение примерно трех дней. В одном из вариантов изобретения клетки, экспрессирующие маркеры дефинитивной эндодермы, обрабатывают по меньшей мере одним фактором роста фибробластов в течение примерно от одного до трех дней. В одном из вариантов изобретения клетки, экспрессирующие маркеры дефинитивной эндодермы, обрабатывают по меньшей мере одним фактором роста фибробластов в течение примерно трех дней.
По меньшей мере один фактор роста фибробластов выбран из группы, состоящей из FGF-2, FGF-4 и FGF-10.
Для дифференцировки в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, осуществляемой с применением указанного способа, могут быть использованы любые клетки, экспрессирующие маркеры линии дифференцировки дефинитивной эндодермы. В одном из вариантов изобретения клетки, экспрессирующие маркеры линии дифференцировки дефинитивной эндодермы, обрабатывают ретиноевой кислотой. Альтернативно, клетки, экспрессирующие маркеры линии дифференцировки дефинитивной эндодермы, обрабатывают FGF-2, или альтернативно, FGF-4, или альтернативно, FGF-10. В альтернативном варианте изобретения клетки, экспрессирующие маркеры линии дифференцировки дефинитивной эндодермы, обрабатывают по меньшей мере одним из нижеследующих факторов, таких как ретиноевая кислота, FGF-2, FGF-4 или FGF-10. В альтернативном варианте изобретения клетки, экспрессирующие маркеры линии дифференцировки дефинитивной эндодермы, обрабатывают ретиноевой кислотой и по меньшей мере одним из нижеследующих факторов роста фибробластов: FGF-2, FGF-4 или FGF-10. В одном из вариантов изобретения клетки, экспрессирующие маркеры линии дифференцировки дефинитивной эндодермы, обрабатывают ретиноевой кислотой и FGF-2. В другом варианте изобретения клетки, экспрессирующие маркеры линии дифференцировки дефинитивной эндодермы, обрабатывают ретиноевой кислотой и FGF-4. В другом варианте изобретения клетки, экспрессирующие маркеры линии дифференцировки дефинитивной эндодермы, обрабатывают ретиноевой кислотой и FGF-10.
Ретиноевая кислота может быть использована в концентрации примерно от 1 нМ до 1 мМ. В одном из вариантов изобретения ретиноевую кислоту используют в концентрации 1 мкМ.
FGF-2 может быть использован в концентрации примерно от 50 пг/мл до 50 мкг/мл. В одном из вариантов изобретения FGF-2 используют в концентрации 50 нг/мл.
FGF-4 может быть использован в концентрации примерно от 50 пг/мл до 50 мкг/мл. В одном из вариантов изобретения FGF-4 используют в концентрации 50 нг/мл.
FGF-10 может быть использован в концентрации примерно от 50 пг/мл до 50 мкг/мл. В одном из вариантов изобретения FGF-10 используют в концентрации 50 нг/мл.
Клетки, экспрессирующие маркеры линии дифференцировки дефинитивной эндодермы, могут быть обработаны по меньшей мере одним другим дополнительным фактором, который может стимулировать образование клеток, экспрессирующих маркеры линии дифференцировки панкреатической эндодермы. Альтернативно, по меньшей мере один другой дополнительный фактор может усиливать пролиферацию клеток, экспрессирующих маркеры линии дифференцировки панкреатической эндодермы, полученной способами согласно изобретению. Кроме того, по меньшей мере один другой дополнительный фактор может повышать способность клеток, экспрессирующих маркеры линии дифференцировки панкреатической эндодермы, полученной способами согласно изобретению, образовывать клетки других типов, или повышать эффективность любых других дополнительных стадий дифференцировки.
По меньшей мере одним дополнительным фактором может быть, например, никотинамид, члены семейства TGF-β, включая TGF-β1, 2 и 3, сывороточный альбумин, члены семейства факторов роста фибробластов, тромбоцитарный фактор роста-AA и -BB, плазма, обогащенная тромбоцитами, инсулиновый фактор роста (IGF-I, II), фактор роста-дифференцировки (GDF-5, -6, -8, -10, -11), глюкагон-подобный пептид-I и II (GLP-I и II), антитело-миметик против GLP-1 и GLP-2, эксендин-4, ретиноевая кислота, паратиреоидный гормон, инсулин, прогестерон, апротинин, гидрокортизон, этаноламин, бета-меркаптоэтанол, эпидермальный фактор роста (EGF), гастрин I и II, реагенты, образующие хелатные комплексы с медью, такие как, например, триэтиленпентамин, форсколин, Na-бутират, активин, бета-целлюлин, ITS, ноггин, фактор роста нейритов, белок nodal, вальпроевая кислота, трихостатин A, бутират натрия, фактор роста гепатоцитов (HGF), сфингозин 1, VEGF, MG 132 (EMD, CA), добавки N2 и B27 (Gibco, CA), стероидный алкалоид, такой как, например, циклопамин (EMD, CA), фактор роста кератиноцитов (KGF), белок семейства Dickkopf, экстракт бычьего гипофиза, белок, ассоциированный с неогенезом островков (INGAP), домен «indian hedgehog», домен «sonic hedgehog», ингибиторы протеосомы, ингибиторы пути Notch, ингибиторы «sonic hedgehog» или их комбинации.
По меньшей мере один другой дополнительный фактор роста может поставляться кондиционированной средой, полученной от панкреатических клеточных линий, таких как, например, PANC-1 (ATCC No: CRL-1469), CAPAN-1 (ATCC No: HTB-79), BxPC-3 (ATCC No: CRL-1687), HPAF-II (ATCC No: CRL-1997), клеточные линии печени, такие как, например, HepG2 (ATCC No: HTB-8065) и клеточные линии тонкой кишки, такие как, например, FHs 74 (ATCC No: CCL-241).
Детектирование клеток, экспрессирующих маркеры линии дифференцировки панкреатической эндодермы
Маркеры линии дифференцировки панкреатической эндодермы хорошо известны специалистам, при этом могут быть идентифицированы и другие маркеры линии дифференцировки панкреатической эндодермы. Такие маркеры могут быть использованы для подтверждения того факта, что клетки, обработанные в соответствии с настоящим изобретением, будут подвергаться дифференцировке и будут приобретать свойства линии дифференцировки панкреатической эндодермы. Маркерами линии дифференцировки панкреатической эндодермы являются один или несколько экспрессируемых факторов транскрипции, таких как, например, H1xb9, PTF-1a, PDX-1, HNF-6, HNF-1-бета.
Эффективность дифференцировки может быть оценена посредством контактирования популяции обработанных клеток с агентом (таким как антитело), который специфически распознает белковый маркер, экспрессируемый клетками, экспрессирующими маркеры линии дифференцировки панкреатической эндодермы.
Методы оценки экспрессии белковых и нуклеиновокислотных маркеров в культивированных или в выделенных клетках известны специалистам. Такими методами являются количественная полимеразная цепная реакция с обратной транскриптазой (ОТ-ПЦР), Нозерн-блот-анализ, гибридизация in situ (см., например, руководство «Current Protocols in Molecular Biology» (Ausubel et al., eds. 2001 supplement)), и иммуноанализы, такие как иммуногистохимический анализ срезов, вестерн-блот-анализ, а для маркеров, которые являются доступными в интактных клетках, проточный цитометрический анализ (FACS) (см., например, Harlow and Lane, Using Antibodies: A Laboratory Manual, New York: Cold Spring Harbor Laboratory Press (1998)).
Альтернативные антитела против маркеров, распознаваемых антителами, либо являются коммерчески доступными, либо могут быть легко получены. Такие альтернативные антитела могут быть также использованы для оценки экспрессии маркеров в клетках, выделенных в соответствии с настоящим изобретением.
Образование клеток, экспрессирующих маркеры линии дифференцировки панкреатической эндокринной системы
Клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, могут быть дифференцированы в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндокринной системы, любым методом, известным специалистам, или любым методом, описанным в настоящей заявке.
Так, например, клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, могут быть дифференцированы в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндокринной системы, методами, описанными в публикации D 'Amour et al., Nature Biotechnology 24, 1392-1401 (2006).
Так, например, клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, могут быть также дифференцированы в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндокринной системы, путем культивирования клеток, экспрессирующих маркеры линии дифференцировки клеток панкреатической эндодермы, в среде, содержащей DAPT и эксендин 4, с последующим удалением среды, содержащей DAPT и эксендин 4, и культивированием клеток в среде, содержащей эксендин 1, IGF-1 и HGF. Пример такого метода описан в публикации Nature Biotechnology 24, 1392-1401 (2006).
Так, например, клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, могут быть также дифференцированы в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндокринной системы, путем культивирования клеток, экспрессирующих маркеры линии дифференцировки клеток панкреатической эндодермы, в среде, содержащей эксендин 4, с последующим удалением среды, содержащей эксендин 4, и культивированием клеток в среде, содержащей эксендин 1, IGF-1 и HGF. Пример такого метода описан в публикации D'Amour et al., Nature Biotechnology, 2006.
Так, например, клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, могут быть также дифференцированы в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндокринной системы, путем культивирования клеток, экспрессирующих маркеры линии дифференцировки клеток панкреатической эндодермы, в среде, содержащей DAPT и эксендин 4. Пример такого метода описан в публикации D'Amour et al, Nature Biotechnology, 2006.
Так, например, клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, могут быть также дифференцированы в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндокринной системы, путем культивирования клеток, экспрессирующих маркеры линии дифференцировки клеток панкреатической эндодермы, в среде, содержащей эксендин 4. Пример такого метода описан в публикации D'Amour et al., Nature Biotechnology, 2006.
В одном из аспектов изобретения клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, могут быть также дифференцированы в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндокринной системы, путем обработки клеток, экспрессирующих маркеры линии дифференцировки панкреатической эндодермы, фактором, ингибирующим путь передачи сигнала Notch. Фактором, ингибирующим путь передачи сигнала Notch, может быть антагонист внеклеточного рецептора Notch. Альтернативно, указанный фактор может ингибировать биологическую активность рецептора Notch. Альтернативно, указанный фактор может ингибировать элемент пути передачи сигнала Notch в клетке или может быть антагонистом указанного элемента.
В одном из вариантов изобретения фактором, ингибирующим путь передачи сигнала Notch, является ингибитор γ-секретазы. В одном из вариантов изобретения ингибитором γ-секретазы является трет-бутиловый эфир 1S-бензил-4R-[1-(1S-карбамоил-2-фенетилкарбамоил)-1S-3-метилбутилкарбамоил]-2R-гидрокси-5-фенилпентил]карбаминовой кислоты, также известный как L-685458.
L-685458 может быть использован в концентрации примерно от 0,1 мкМ до 100 мкМ. В одном из вариантов изобретения L-685458 используют в концентрации примерно 90 мкМ. В одном из вариантов изобретения L-685458 используют в концентрации примерно 80 мкМ. В одном из вариантов изобретения L-685458 используют в концентрации примерно 70 мкМ. В одном из вариантов изобретения L-685458 используют в концентрации примерно 60 мкМ. В одном из вариантов изобретения L-685458 используют в концентрации примерно 50 мкМ. В одном из вариантов изобретения L-685458 используют в концентрации примерно 40 мкМ. В одном из вариантов изобретения L-685458 используют в концентрации примерно 30 мкМ. В одном из вариантов изобретения L-685458 используют в концентрации примерно 20 мкМ. В одном из вариантов изобретения L-685458 используют в концентрации примерно 10 мкМ.
В одном из своих вариантов настоящее изобретение относится к способу дифференцировки клеток, экспрессирующих маркеры линии дифференцировки панкреатической эндодермы, в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндокринной системы, где указанный способ включает стадии:
a. культивирования клеток, экспрессирующих маркеры линии дифференцировки панкреатической эндодермы, и
b. обработки клеток фактором, ингибирующим путь передачи сигнала Notch.
Для дифференцировки в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндокринной системы, осуществляемой с применением указанного способа, могут быть использованы любые клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы.
В одном из вариантов изобретения фактором, ингибирующим путь передачи сигнала Notch, является ингибитор γ-секретазы. В одном из вариантов изобретения ингибитором γ-секретазы является трет-бутиловый эфир 1S-бензил-4R-[1-(1S-карбамоил-2-фенетилкарбамоил)-1S-3-метилбутилкарбамоил]-2R-гидрокси-5-фенилпентил]карбаминовой кислоты, также известный как L-685458.
Клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, обрабатывают фактором, ингибирующим путь передачи сигнала Notch, в течение примерно от одного до пяти дней. Альтернативно, клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, обрабатывают фактором, ингибирующим путь передачи сигнала Notch, в течение примерно от трех до пяти дней. Альтернативно, клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, обрабатывают фактором, ингибирующим путь передачи сигнала Notch, в течение примерно пяти дней.
В одном из вариантов изобретения фактором, ингибирующим путь передачи сигнала Notch, является ингибитор γ-секретазы. В одном из вариантов изобретения ингибитором γ-секретазы является трет-бутиловый эфир 1S-бензил-4R-[1-(1S-карбамоил-2-фенетилкарбамоил)-1S-3-метилбутилкарбамоил]-2R-гидрокси-5-фенилпентил]карбаминовой кислоты, также известный как L-685458.
L-685458 может быть использован в концентрации примерно от 0,1 мкМ до 100 мкМ. В одном из вариантов изобретения L-685458 используют в концентрации примерно 90 мкМ. В одном из вариантов изобретения L-685458 используют в концентрации примерно 80 мкМ. В одном из вариантов изобретения L-685458 используют в концентрации примерно 70 мкМ. В одном из вариантов изобретения L-685458 используют в концентрации примерно 60 мкМ. В одном из вариантов изобретения L-685458 используют в концентрации примерно 50 мкМ. В одном из вариантов изобретения L-685458 используют в концентрации примерно 40 мкМ. В одном из вариантов изобретения L-685458 используют в концентрации примерно 30 мкМ. В одном из вариантов изобретения L-685458 используют в концентрации примерно 20 мкМ. В одном из вариантов изобретения L-685458 используют в концентрации примерно 10 мкМ.
Клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, могут быть обработаны по меньшей мере одним другим дополнительным фактором, который может стимулировать образование клеток, экспрессирующих маркеры линии дифференцировки панкреатической эндокринной системы. Альтернативно, по меньшей мере один другой дополнительный фактор может усиливать пролиферацию клеток, экспрессирующих маркеры линии дифференцировки панкреатической эндокринной системы, генерированной способами согласно изобретению. Кроме того, по меньшей мере один другой дополнительный фактор может повышать способность клеток, экспрессирующих маркеры линии дифференцировки панкреатической эндокринной системы, генерированной способами согласно изобретению, образовывать клетки других типов, или повышать эффективность любых других дополнительных стадий дифференцировки.
По меньшей мере одним дополнительным фактором может быть, например, никотинамид, члены семейства TGF-β, включая TGF-β1, 2 и 3, сывороточный альбумин, члены семейства факторов роста фибробластов, тромбоцитарный фактор роста-AA и -BB, плазма, обогащенная тромбоцитами, инсулиновый фактор роста (IGF-I, II), фактор роста-дифференцировки (GDF-5, -6, -8, -10, -11), глюкагон-подобный пептид-I и II (GLP-I и II), антитело-миметик против GLP-1 и GLP-2, эксендин-4, ретиноевая кислота, паратиреоидный гормон, инсулин, прогестерон, апротинин, гидрокортизон, этаноламин, бета-меркаптоэтанол, эпидермальный фактор роста (EGF), гастрин I и II, реагенты, образующие хелатные комплексы с медью, такие как, например, триэтиленпентамин, форсколин, Na-бутират, активин, бета-целлюлин, ITS, ноггин, фактор роста нейритов, белок nodal, вальпроевая кислота, трихостатин A, бутират натрия, фактор роста гепатоцитов (HGF), сфингозин-1, VEGF, MG 132 (EMD, CA), добавки N2 и B27 (Gibco, CA), стероидный алкалоид, такой как, например, циклопамин (EMD, CA), фактор роста кератиноцитов (KGF), белок семейства Dickkopf, экстракт бычьего гипофиза, белок, ассоциированный с неогенезом островков (INGAP), домен «indian hedgehog», домен «sonic hedgehog», ингибиторы протеосомы, ингибиторы пути Notch, ингибиторы домена «sonic hedgehog» или их комбинации.
По меньшей мере один другой дополнительный фактор может поставляться кондиционированной средой, полученной от панкреатических клеточных линий, таких как, например, PANC-1 (ATCC No: CRL-1469), CAPAN-1 (ATCC No: HTB-79), BxPC-3 (ATCC No: CRL-1687), HPAF-II (ATCC No: CRL-1997), клеточные линии печени, такие как, например, HepG2 (ATCC No: HTB-8065) и клеточные линии тонкой кишки, такие как, например, FHs 74 (ATCC No: CCL-241).
В одном из своих вариантов настоящее изобретение относится к улучшенному способу дифференцировки клеток, экспрессирующих маркеры линии дифференцировки панкреатической эндодермы, в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндокринной системы, где указанный способ включает стадии:
a. культивирования клеток, экспрессирующих маркеры линии дифференцировки панкреатической эндодермы, и
b. обработки указанных клеток фактором, способствующим дифференцировке клеток, экспрессирующих маркеры линии дифференцировки панкреатической эндодермы, в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндокринной системы, в среде, содержащей глюкозу в концентрации примерно от 10 мМ до 20 мМ.
Для дифференцировки в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндокринной системы, осуществляемой с применением указанного способа, могут быть использованы любые клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы.
Для осуществления настоящего изобретения может быть применен любой способ дифференцировки клеток, экспрессирующих маркеры линии дифференцировки панкреатической эндодермы, в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндокринной системы.
В одном из вариантов изобретения клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, обрабатывают в среде, содержащей глюкозу в концентрации примерно 10 мМ. В альтернативном варианте клетки обрабатывают в среде, содержащей глюкозу в концентрации примерно 20 мМ.
Клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, обрабатывают в течение периода времени примерно от 2 до 30 дней. В одном из вариантов изобретения клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, обрабатывают в течение периода времени примерно от 2 до 20 дней. В одном из вариантов изобретения клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, обрабатывают в течение периода времени примерно от 2 до 10 дней. В одном из вариантов изобретения клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, обрабатывают в течение примерно 10 дней. В одном из вариантов изобретения клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, обрабатывают в течение примерно 4 дней. В одном из вариантов изобретения клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, обрабатывают в течение примерно 2 дней.
Детектирование клеток, экспрессирующих маркеры линии дифференцировки панкреатической эндокринной системы
Маркеры линии дифференцировки клеток панкреатической эндокринной системы хорошо известны специалистам, при этом могут быть идентифицированы и другие маркеры линии дифференцировки панкреатической эндокринной системы. Такие маркеры могут быть использованы для подтверждения того факта, что клетки, обработанные в соответствии с настоящим изобретением, будут подвергаться дифференцировке и будут приобретать свойства линии дифференцировки панкреатической эндокринной системы. Маркерами линии дифференцировки панкреатической эндокринной системы являются один или несколько экспрессируемых факторов транскрипции, таких как, например, NGN-3, NeuroD, Islet-1.
Маркеры линии β-клеточной дифференцировки хорошо известны специалистам, при этом могут быть идентифицированы и другие маркеры линии β-клеточной дифференцировки. Такие маркеры могут быть использованы для подтверждения того факта, что клетки, обработанные в соответствии с настоящим изобретением, будут подвергаться дифференцировке и будут приобретать свойства линии β-клеточной дифференцировки. Маркерами линии β-клеточной дифференцировки являются один или несколько экспрессируемых факторов транскрипции, таких как, например, Pdx1 (ген 1 гомеобокса поджелудочной железы и двенадцатиперстной кишки), Nkx2.2, Nkx6.1, Isl1, Pax6, Pax4, NeuroD, Hnflb, Hnf-6, Hnf-3-бета и MafA и т.п. Эти факторы транскрипции хорошо известны специалистам в области идентификации эндокринных клеток. См., например, Edlund (Nature Reviews Genetics 3:524-632 (2002)).
Эффективность дифференцировки может быть оценена посредством контактирования популяции обработанных клеток с агентом (таким как антитело), который специфически распознает белковый маркер, экспрессируемый клетками, экспрессирующими маркеры линии дифференцировки панкреатической эндокринной системы. Альтернативно, эффективность дифференцировки может быть оценена посредством контактирования популяции обработанных клеток с агентом (таким как антитело), который специфически распознает белковый маркер, экспрессируемый клетками, экспрессирующими маркеры линии β-клеточной дифференцировки.
Методы оценки экспрессии белковых и нуклеиновокислотных маркеров в культивированных или в выделенных клетках известны специалистам. Такими методами являются количественная полимеразная цепная реакция с обратной транскриптазой (ОТ-ПЦР), Нозерн-блот-анализ, гибридизация in situ (см., например, руководство «Current Protocols in Molecular Biology» (Ausubel et al., eds. 2001 supplement)), и иммуноанализы, такие как иммуногистохимический анализ срезов, вестерн-блот-анализ, а для маркеров, которые являются доступными в интактных клетках, проточный цитометрический анализ (FACS) (см., например, Harlow and Lane, Using Antibodies: A Laboratory Manual, New York: Cold Spring Harbor Laboratory Press (1998)).
Альтернативные антитела против тех же самых маркеров, распознаваемых антителами, либо являются коммерчески доступными, либо могут быть легко получены. Такие альтернативные антитела могут быть также использованы для оценки экспрессии маркеров в клетках, выделенных в соответствии с настоящим изобретением.
Терапия
В одном из своих аспектов настоящее изобретение относится к способу лечения пациента, страдающего диабетом типа I, или пациента, подверженного риску развития диабета типа I. Этот способ включает культивирование плюрипотентных стволовых клеток, дифференцировку плюрипотентных стволовых клеток in vitro в линию β-клеточной дифференцировки и имплантацию указанных клеток линии β-клеточной дифференцировки пациенту.
В еще одном своем аспекте настоящее изобретение относится к способу лечения пациента, страдающего диабетом типа 2, или пациента, подверженного риску развития диабета типа 2. Этот способ включает культивирование плюрипотентных стволовых клеток, дифференцировку культивированных клеток in vitro в линию β-клеточной дифференцировки и имплантацию указанных клеток линии β-клеточной дифференцировки пациенту.
Если это необходимо, то пациент может быть также подвергнут лечению фармацевтическими средствами или биологически активными веществами, повышающими продолжительность жизни и улучшающими функцию трансплантированных клеток. Такими средствами могут быть, например, инсулин, члены семейства TGF-β, включая TGF-β1, 2 и 3, белки остеогенеза (BMP-2, -3, -4, -5, -6, -7, -11, -12 и -13), факторы роста фибробластов 1 и 2, тромбоцитарный фактор роста-AA и -BB, плазма, обогащенная тромбоцитами, инсулиновый фактор роста (IGF-I, II), фактор роста-дифференцировки (GDF-5, -6, -7, -8, -10, -15), васкулярный эндотелиальный фактор роста (VEGF), плейотропин, эндотелин и т.п. Другими фармацевтическими соединениями могут быть, например, никотинамид, глюкагон-подобный пептид-I (GLP-I) и II, антитело-миметик против GLP-1 и 2, эксендин-4, ретиноевая кислота, паратиреоидный гормон, ингибиторы MAPK, такие как, например, соединения, описанные в опубликованной заявке на патент США 2004/0209901 и в опубликованной заявке на патент США 2004/0132729.
Плюрипотентные стволовые клетки перед их трансплантацией реципиенту могут быть подвергнуты дифференцировке в инсулин-продуцирующие клетки. В конкретном варианте изобретения плюрипотентные стволовые клетки перед их трансплантацией реципиенту подвергают полной дифференцировке в β-клетки. Альтернативно, плюрипотентные стволовые клетки могут быть трансплантированы реципиенту в недифференцированном или в частично дифференцированном состоянии. У реципиента может иметь место и другая дифференцировка.
Клетки дефинитивной эндодермы или, альтернативно, клетки панкреатической эндодермы, или альтернативно, β-клетки могут быть имплантированы в виде диспергированных клеток, либо из этих клеток могут быть образованы кластеры, которые могут быть введены в воротную вену печени путем инфузии. Альтернативно, клетки могут быть включены в биологически совместимые разлагаемые полимерные носители и в пористые неразлагаемые системы, либо эти клетки могут быть инкапсулированы для защиты от иммунного ответа хозяина. Клетки могут быть имплантированы реципиенту в соответствующий участок. Участками имплантации могут быть, например, печень, здоровая поджелудочная железа, почечное субкапсулярное пространство, сальник, брюшина, подсерозное пространство, тонкий кишечник, желудок или подкожный карман.
Для еще большего повышения уровня дифференцировки, выживания или активности имплантированных клеток могут быть введены дополнительные факторы, такие как факторы роста, антиоксиданты или противовоспалительные средства, причем эти факторы могут быть введены до, во время или после введения клеток. В некоторых вариантах изобретения факторы роста используют для дифференцировки введенных клеток in vivo. Эти факторы могут быть секретированы эндогенными клетками и обработаны введенными клетками in situ. Имплантированные клетки могут быть индуцированы для их дифференцировки любыми комбинациями эндогенно и экзогенно вводимых факторов роста, известных специалистам.
Количество клеток, используемых для имплантации, зависит от ряда различных факторов, включая состояние здоровья пациента и его восприимчивость к данной терапии, и такое количество может быть определено самим специалистом в данной области.
В одном из своих аспектов настоящее изобретение относится к способу лечения пациента, страдающего диабетом, или пациента, подверженного риску развития диабета. Такой способ включает культивирование плюрипотентных стволовых клеток, дифференцировку культивированных клеток in vitro в линию β-клеточной дифференцировки и включение клеток в трехмерный носитель. Клетки перед их имплантацией пациенту могут поддерживаться на этом носителе in vitro. Альтернативно, носитель, содержащий указанные клетки, может быть непосредственно имплантирован пациенту без дополнительного культивирования in vitro. Носитель может быть, но необязательно, введен вместе с по меньшей мере одним фармацевтическим средством, которое способствует выживанию и функционированию трансплантированных клеток.
Материалами-носителями, подходящими для использования в целях настоящего изобретения, являются ткани-матрицы, шунты, защитные барьеры и резервуары, используемые для репарации тканей. В частности, для осуществления способов согласно изобретению подходящими являются синтетические и природные материалы в форме пен, губок, гелей, гидрогелей, текстильных материалов и нетканых структур, которые могут быть использованы in vitro и in vivo для реконструирования или регенерации биологической ткани, а также для доставки хемотаксических средств в целях индуцирования роста ткани. См., например, материалы, описанные в патентах США 5770417, 6022743, 5567612, 5759830, 6626950, 6534084, 6306424, 6365149, 6599323, 6656488, в опубликованной заявке на патент США 2004/0062753 A1, в патенте США 4557264 и в патенте США 6333029.
Для создания носителя, вводимого вместе с фармацевтическим средством, указанное фармацевтическое средство перед формированием носителя может быть смешано с полимерным раствором. Альтернативно, фармацевтическое средство может быть нанесено на изготовленный носитель, предпочтительно, в присутствии фармацевтического носителя. Фармацевтическое средство может присутствовать в виде жидкости, тонкоизмельченного твердого вещества или в любой другой соответствующей физической форме. Альтернативно, для изменения скорости высвобождения фармацевтического средства, к носителю могут быть добавлены наполнители. В альтернативном варианте изобретения носитель вводят вместе с по меньшей мере одним фармацевтическим соединением, которое представляет собой противовоспалительное соединение, такое как, например, соединения, описанные в патенте США № 6509369.
Носитель может быть также введен вместе с по меньшей мере одним фармацевтическим соединением, которое представляет собой антиапоптотическое соединение, такое как, например, соединения, описанные в патенте США 6793945.
Носитель может быть также введен вместе с по меньшей мере одним фармацевтическим соединением, которое является ингибитором фиброза, таким как, например, соединения, описанные в патенте США 6331298.
Носитель может быть также введен вместе с по меньшей мере одним фармацевтическим соединением, стимулирующим ангиогенез, таким как, например, соединения, описанные в опубликованной заявке на патент США 2004/0220393 и в опубликованной заявке на патент США 2004/0209901.
Носитель может быть также введен вместе с по меньшей мере одним фармацевтическим соединением, которое представляет собой иммунодепрессант, такое как, например, соединения, описанные в опубликованной заявке на патент США 2004/0171623.
Носитель может быть также введен вместе с по меньшей мере одним фармацевтическим соединением, которое представляет собой фактор роста, такой как, например, члены семейства TGF-β, включая TGF-β1, 2 и 3, белки остеогенеза (BMP-2, -3, -4, -5, -6, -7, -11, -12 и -13), факторы роста фибробластов 1 и 2, тромбоцитарный фактор роста-AA и -BB, плазма, обогащенная тромбоцитами, инсулиновый фактор роста (IGF-I, II), фактор роста-дифференцировки (GDF-5, -6, -8, -10, -15), васкулярный эндотелиальный фактор роста (VEGF), плейотропин, эндотелин и т.п. Другими фармацевтическими соединениями могут быть, например, никотинамид, фактор 1-альфа, индуцирующий гипоксию, глюкагон-подобный пептид-I (GLP-I), антитело-миметик против GLP-1 и GLP-2, эксендин-4, Nodal, ноггин, NGF, ретиноевая кислота, паратиреоидный гормон, тенасцин-С, тропоэластин, пептиды, происходящие от тромбина, кателицидины, дефензины, ламинин, биологические пептиды, содержащие связывающиеся с клеткой и гепарином домены адгезивных белков внеклеточного матрикса, таких как фибронектин и витронектин, ингибиторы MAPK, такие как, например, соединения, описанные в опубликованной заявке на патент США 2004/0209901 и в опубликованной заявке на патент США 2004/0132729.
Включение клеток согласно изобретению в каркасную структуру может быть осуществлено путем простого осаждения клеток на каркасной структуре. Клетки могут быть включены в каркасную структуру путем простой диффузии (J. Pediatr. Surg. 23 (1 Pt 2): 3-9 (1988)). Для повышения эффективности посева клеток были разработаны некоторые другие методы. Так, например, для посева хондроцитов в среду, содержащую полигликолевую кислоту, были использованы центрифужные колбы (Biotechnol. Prog. 14(2):193-202 (1998)). Другим методом посева клеток является центрифугирование, которое оказывает минимальное негативное воздействие на засеянные клетки и повышает эффективность посева. Так, например, Yang и сотрудниками был разработан метод посева клеток (J.Biomed. Mater. Res. 55(3): 379-86 (2001)), называемый центрифужной иммобизизацией клеток (CCI).
Настоящее изобретение также проиллюстрировано на нижеследующих неограничивающих примерах.
Общее описание
Пример 1
Культура человеческих эмбриональных стволовых клеток
Линии человеческих эмбриональных стволовых клеток H1, H7 и H9 были получены от WiCell Research Institute, Inc., (Madison, WI) и были культивированы в соответствии с инструкциями, рекомендованными сотрудниками указанного института. Вкратце, клетки культивировали на фидерном слое мышиных эмбриональных фибробластов (MEF) в клеточной среде ES, содержащей DMEM/F12 (Invitrogen/GIBCO), в которую были добавлены заменитель сыворотки (20% Knockout serum replacement), 100 нМ MEM, содержащей заменимые аминокислоты, 0,5 мМ бета-меркаптоэтанол, 2мМ L-глутамин с 4 нг/мл человеческого основного фактора роста фибробластов (bFGF) (все эти компоненты поставлялись Invitrogen/GIBCO). Клетки MEF, происходящие от мышиных эмбрионов E13-13.5, закупали у Charles River. Клетки MEF размножали в среде DMEM, в которую были добавлены 10% FBS (Hyclone), 2 мМ глутамин и 100 мМ MEM, содержащей заменимые аминокислоты. Субконфлюэнтные клеточные культуры MEF обрабатывали 10 мкг/мл митомицина C (Sigma, St. Louis, MO) в течение 3 часов для прекращения деления клеток, а затем обрабатывали трипсином и высевали при плотности 2×104/см2 на чашки, покрытые 0,1% коровьим желатином. Клетки MEF от пассажа 2-4 использовали в качестве фидерных слоев. Человеческие эмбриональные стволовые клетки, засеянные на фидерных слоях клеток MEF, культивировали при 37°С в атмосфере 5% CO2 в инкубаторе для культивирования ткани с повышенной влажностью. Затем конфлюэнтные человеческие эмбриональные стволовые клетки (полученные приблизительно через 5-7 дней после посева) обрабатывали 1 мг/мл коллагеназы типа IV (Invitrogen/GIBCO) в течение 5-10 минут, после чего эти клетки осторожно соскабливали с поверхности с помощью 5-миллилитровой пипетки. Клетки центрифугировали при 900 об/мин в течение 5 минут, а затем осадок ресуспендировали и снова высевали в свежую культуральную среду в отношении 1:3-1:4.
Пример 2
Образование клеток дефинитивной эндодермы
Было оценено влияние активина А на экспрессию маркеров дефинитивной эндодермы. Активин А (100 нг/мл) добавляли к популяциям человеческих эмбриональных стволовых клеток, культивированных на мышиных эмбриональных фибробластах. Клетки непрерывно культивировали в присутствии активина A и собирали через указанные промежутки времени. Уровень экспрессии маркеров дефинитивной эндодермы оценивали с помощью ПЦР (фигура 1), FACS и иммуногистохимического анализа (фигура 2).
Активин A индуцировал зависимое от времени увеличение экспрессии мРНК CXCR4, GATA4, HNF-3-бета, Mixl1 и Sox-17 в клеточной линии H9 (фигура 1, панель a). При этом также наблюдается значительное индуцирование маркерных генов эндодермы передней доли, Cerberus, Otx-1 и Hex (фигура 1, панель b). После обработки активином А наблюдалось увеличение уровня белка CXCR4, как было обнаружено с помощью FACS-анализа. После обработки активином А экспрессия E-кадгерина и N-кадгерина не изменялась. CXCR4-позитивные клетки также были в высокой степени позитивными по C-kit, EPCAM, CD99 и негативными по CD9. Паттерны экспрессии этих маркеров были одинаковыми для всех трех оцениваемых клеточных линий hES. Иммуноцитохимический анализ клеток, обработанных активином A в течение пяти дней, показал, что 30-40% клеток в обработанной культуре были позитивными по Sox17 и HNF-3-бета. Одновременно с этим почти 100% дифференцированных клеток были также позитивными по Oct4 (фигура 2). Данные по снижению уровня экспрессии поверхностных маркеров плюрипотентности вместе с увеличением уровня экспрессии маркеров дефинитивной эндодермы дают основание предположить, что активин A стимулирует дифференцировку человеческих эмбриональных стволовых клеток в дефинитивную эндодерму.
Пример 3
Образование клеток панкреатической эндодермы
В клеточные культуры добавляли факторы роста, которые, как известно, индуцируют дифференцировку человеческих эмбриональных стволовых клеток в панкреатическую эндодерму. В частности, в клеточные культуры добавляли активин A, bFGF и ретиноевую кислоту, которые, как известно, индуцируют образование панкреатической эндодермы.
В первой серии экспериментов активин A добавляли к популяциям человеческих эмбриональных стволовых клеток, культивированных на мышиных эмбриональных фибробластах, в течение 1-7 дней в среде DMEM/F12, в которую были добавлены 0%-2% сыворотка и активин A (100 нг/мл). Клетки собирали через указанные промежутки времени, как показано на фигуре 3, и анализировали с помощью ПЦР на экспрессию генов (фигуры 3, 4 и 5). Как проиллюстрировано на фигуре 3, ПЦР-анализ показал, что обработанные активином клетки экспрессировали широкий спектр генов, ассоциированных с развитием эндодермы, включая GATA4 (фигура 3, панель a), Sox-17 (фигура 3, панель b), HNF-3-бета (фигура 3, панель c) и Mixl-1 (фигура 3, панель d). Однако экспрессия гена Pdx1 не наблюдалась. Тот же самый паттерн экспрессии маркеров линии дифференцировки эндодермы наблюдался в клетках H7, обработанных активином А (фигура 6, панели a-f). На этой стадии какого-либо значимого снижения уровня экспрессии Oct4 не наблюдалось.
Активин A индуцировал зависимое от времени снижение уровня экспрессии маркеров внеэмбриональной эндодермы Sox7 (фигура 4, панель a) и AFP (фигура 4, панель b). Активин A стимулировал снижение уровня экспрессии Brachyury (фигура 5, панель a), но не оказывал влияния на экспрессию маркера нервных клеток Zic1 (фигура 5, панель b).
В целом, полученные данные дают основание предположить, что повышение уровня экспрессии Sox-17, Mixl1, Gata4 и HNF-3-бета наряду с индуцированием экспрессии маркерных генов эндодермы передней доли Otx1, Cer1 и Hex соответствует образованию дефинитивной эндодермы в ответ на обработку активином А. Иммуноцитохимический анализ маркеров дефинитивной эндодермы показал, что экспрессия белка этих генов также отражает тенденцию, наблюдаемую при экспрессии мРНК. Уровни экспрессии HNF-3-бета, Sox-17 и GATA4 были ниже в необработанных клетках приблизительно на 10-20% от всех клеток. Обработка активином A (100 нг/мл) в течение пяти дней приводила к повышению уровней экспрессии HNF-3-бета, Sox-17 и GATA4 приблизительно на 50%-90% от всех клеток (фигура 7).
Во второй серии экспериментов культуры человеческих эмбриональных стволовых клеток поддерживали в условиях культивирования недифференцированных клеток в течение 2-3 дней методами, описанными в примере 1. После достижения клетками 70-80%-ной конфлюентности среду заменяли на среду DMEM/F12, содержащую 0-2% FBS с добавлением активина A при 100 нг/мл и культивировали в присутствии активина A в течение трех, пяти или семи дней. По истечении этого времени клетки снова обрабатывали в течение 5-6 дней комбинацией ретиноевой кислоты и bFGF, как показано на фигуре 8. Культуры собирали, и брали образцы мРНК для анализа. Были также включены контрольные культуры, состоящие из клеток, которые обрабатывали лишь одним активином А в течение пяти дней.
Анализ на экспрессию генов показал, что обработка лишь одним активином А или лишь одной ретиноевой кислотой не приводила к индуцированию экспрессии Pdx1. Аналогичные результаты были получены для клеточных культур, обработанных ретиноевой кислотой в комбинации с FGF и в присутствии активина A (фигура 8, панель a). Однако обработка клеток ретиноевой кислотой и FGF в отсутствие ативина A приводила к еще большему повышению уровня экспрессии Pdx1 (фигура 8, панель a). В клетках, обработанных в течение трех дней активином А, а затем в течение 5 дней 1 мкМ ретиноевой кислотой и 50 нг/мл bFGF (также известным как FGF-2) в отсутствие активина А, наблюдался уровнь экспрессии Pdx1, который примерно в 3500 раз превышал уровень, наблюдаемый при обработке образцов лишь одним активином А в течение 5 дней (фигура 8, панель a). Иммуноцитохимический анализ показал, что 5-20% от всех клеток экспрессировали Pdx1 (фигура 9).
Обработка 1 мкМ ретиноевой кислотой и bFGF в отсутствие активина A также приводила к повышению уровня экспрессии GLUT-2 и PTF1a (фигура 8, панель c), что не наблюдалось в случае клеток, обработанных в присутствии одного активина А. Наибольшее увеличение экспрессии GLUT-2 и PTF1a наблюдалось в клетках, обработанных 1 мкМ ретиноевой кислотой и 50 нг/мл bFGF. В целом, полученные данные позволяют предположить, что образование панкреатической эндодермы еще больше усиливается при удалении активина А из клеточных культур после формирования дефинитивной эндодермы.
Пример 4
Образование клеток панкреатической эндокринной системы
Культуры человеческих эмбриональных стволовых клеток поддерживали в условиях культивирования недифференцированных клеток в течение 3-4 дней методами, описанными в примере 1. После достижения клетками 50-60%-ной конфлюентности среду заменяли на среду DMEM/F12, не содержащую FBS, но содержащую активин A в концентрации 100 нг/мл, и клетки культивировали в этой среде в течение одного дня. После культивирования в течение одного дня среду удаляли и заменяли средой, содержащей 0,5% FBS со 100 нг/мл активина А, и клетки культивировали в течение одного дня. После культивирования в течение еще одного дня среду удаляли и заменяли средой, содержащей 2% FBS со 100 нг/мл активина А, и клетки культивировали в течение одного дня. По истечении этого времени клетки обрабатывали в течение шести дней комбинациями ретиноевой кислоты и FGF, как описано в примере 2, а затем культуральную среду удаляли и заменяли средой, содержащей DMEM/F12 с 2% FBS, содержащим ингибиторы γ-секретазы L-685458 в концентрации 10 мкМ, в течение трех дней. Культуры собирали, и брали образцы мРНК для анализа. Были также включены контрольные культуры, состоящие из клеток, которые были обработаны лишь одним активином А в течение пяти дней.
Анализ на экспрессию генов показал, что обработка лишь одним активином А или активином в комбинации с ретиноевой кислотой и FGF не индуцировала экспрессию Ngn3 или инсулина (фигура 10, панель a, c). После L-685458-обработки также наблюдалось снижение уровня экспрессии Hes-1. Максимальное ингибирование наблюдалось на третий день после обработки (фигура 10, панель d). Однако L-685458-обработка клеток индуцировала экспрессию Ngn3 до уровня, который приблизительно в 50 раз превышал уровень, наблюдаемый в образцах, обработанных только активином А или ретиноевой кислотой в комбинации с FGF. В образцах, обработанных ингибитором γ-секретазы, наблюдалось 70-кратное увеличение уровня экспрессии инсулина. При L-685458-обработке также повышался уровень экспрессии NeuroD1 (фигура 10, панель a). В целом, полученные данные позволяют предположить, что образование эндокринных клеток также усиливалось в результате удаления ретиноевой кислоты и FGF из клеточной культуры и добавления ингибиторов γ-секретазы после образования панкреатической эндодермы.
Пример 5
Образование клеток панкреатической эндокринной системы, экспрессирующих Nkx2.2
Клетки дефинитивной эндодермы, полученные методами, описанными в примере 2, обрабатывали следующим образом: клетки культивировали в базальной среде, включающей DMEM/F12 с 2% FBS плюс 50 нг/мл активина A, 50 нг/мл основного FGF и 1 мкМ ретиноевой кислоты, в течение 3-5 дней. Затем клетки непрерывно культивировали в течение еще 3-5 дней в базальной среде, содержащей ретиноевую кислоту в концентрации 1 мкМ либо отдельно, либо в комбинации с bFGF. Образцы РНК брали из клеток в различные периоды времени в течение всего эксперимента для оценки направленной дифференцировки клеток. Кроме того, культуральную среду и указанные факторы регулярно удаляли и пополняли в течение всего проведения протокола дифференцировки. Добавление активина А приводило примерно к 35-кратному повышению уровней экспрессии Nkx2.2 по сравнению с уровнем экспрессии в образцах, не содержащих активина А. В образцах, обработанных активином А в течение первых трех дней культивирования, поддерживалась экспрессия Pdx1 на уровне, аналогичном уровню экспрессии в образцах, не содержащих активина А (фигура 11). В целом, полученные данные позволяют предположить, что экспрессия маркера панкреатической эндокринной системы Nkx2.2 еще больше усиливалась после добавления активина А при обработке ретиноевой кислотой и bFGF в течение первых трех дней.
Пример 6
Пересев и размножение клеток панкреатической эндодермы в культуре
В этом примере было продемонстрировано, что клетки панкреатической эндодермы, происходящие от человеческих эмбриональных стволовых клеток, могут поддерживаться в клеточной культуре и могут быть подвергнуты пересеву без последующей дифференцировки. Клетки панкреатической эндодермы были дифференцированы в присутствии 100 нг/мл активина A в DMEM/F12 с низким содержанием сыворотки. DMEM/F12 с низким содержанием сыворотки включала 0% (об./об.) фетальной бычьей сыворотки (FBS) на день 1; 0,5% (об./об.) FBS на день 2; и 2% (об./об.) FBS в каждый последующий день. После дифференцировки в течение четырех дней клетки культивировали в среде DMEM/F12, которая имела низкое содержание сыворотки и включала 2% (об./об.) FBS, 1 мкМ ретиноевую кислоту и 50 нг/мл bFGF в течение всех шести дней. После 6-дневной дифференцировки клетки поддерживали в культуральной среде DMEM/F12, имеющей низкое содержание сыворотки и включающей 2% (об./об.) FBS, в присутствии 50 нг/мл FGF10, в течение всего 6 дней. В течение 6-дневного периода культивирования клетки панкреатической эндодермы два раза пересевали, и время удвоения клеточной популяции в течение 6-дневного культивирования составляло примерно 36-48 часов. На 0-, 3- и 6-й дни культивирования для оценки уровня экспрессии маркерных генов, являющихся индикаторами панкреатической эндодермы, проводили количественную ПЦР (Q-PCR). На фигуре 12 показано, что в клетках, культивированных в присутствии 50 нг/мл FGF10, экспрессия макрера панкреатической эндодермы Pdx1 поддерживалась в течение 6-дневного культивирования после их дифференцировки.
Пример 7
Образование гепатоцитов из человеческих эмбриональных стволовых клеток
Культуры человеческих эмбриональных стволовых клеток поддерживали в условиях культивирования недифференцированных клеток в течение 2-3 дней методами, описанными в примере 1. После достижения клетками 70-80%-ной конфлюентности среду заменяли на среду DMEM/F12, содержащую 2% FBS и активин A в концентрации 100 нг/мл, и клетки культивировали в присутствии активина А в течение семи дней. После 7-дневной обработки активином А клетки обрабатывали в течение пяти дней в условиях, проиллюстрированных на фигуре 13. По истечении этого времени клетки собирали и брали образцы мРНК для анализа.
В клетках, культивированных в отсутствие активина А, наблюдалось увеличение уровней экспрессии α-фетопротеина (AFP) и альбумина (фигура 13, панель a). Еще большее увеличение наблюдалось в присутствии ретиноевой кислоты и FGF-4 (фигура 13, панель b). В целом, полученные данные позволяют предположить, что культуры человеческих эмбриональных стволовых клеток обладают способностью экспрессировать маркеры гепатоцитов после обработки, описанной выше. Кроме того, человеческие эмбриональные стволовые клетки обладают способностью дифференцироваться в клетки, экспрессирующие маркеры гепатоцитов.
Пример 8
Характеризация клеточной линии человеческих эмбриональных стволовых клеток H9
В течение всего периода времени проводили мониторинг качества клеток H9 путем оценки экспрессии нескольких маркеров, экспрессируемых недифференцированными клетками ES (Carpenter et al., 2001; Reubinoff et al., 2000; Thomson et al., 1998a). Клетки H9 обнаруживали реципрокную (обратную) экспрессию стадиеспецифических эмбриональных антигенов. Клетки H9 обладают высокой иммунореактивностью по отношению к антигенам SSEA-3, SSEA-4, Tra-1-60, Tra-1-81, AP и CD9, и все эти антигены являются маркерами недифференцированных человеческих эмбриональных стволовых клеток.
Для оценки экспрессии генов, характерных для эмбриональных стволовых клеток, таких как, например, гены OCT3/4, SOX-2, UTF-1, REX-1, Cx43, Cx45, ABCG-2 и TERT, проводили ПЦР в реальном времени, в результате чего было подтверждено, что клетки, культивированные как описано в этом примере, были аналогичны ранее описанным недифференцированным эмбриональным стволовым клеткам. Экспрессию белка OCT3/4 и активность щелочной фосфатазы (Chemicon) подтверждали путем иммунного окрашивания. Большинство клеток H9 были позитивными по OCT3/4 и AP (фигура 14). В целом, при сравнении с данными, полученными в других лабораториях, полученные данные показали, что клетки H9, используемые в этом примере, значительно не отличались по своей морфологии, иммунному окрашиванию антигеном или по экспрессии маркеров плюрипотентности.
Пример 9
Анализ, проводимый с помощью клеточного сортинга с активацией флуоресценции (FACS)
Прилипшие клетки удаляли из культуральных планшетов путем 5-минутного инкубирования с раствором TrypLETM Express (Invitrogen, CA). Отделенные клетки ресуспендировали в среде для культивирования человеческих эмбриональных стволовых клеток и выделяли путем центрифугирования, а затем промывали, и клетки ресуспендировали в окрашивающем буфере, состоящем из 2% BSA, 0,05% азида натрия в PBS (Sigma, MO). При необходимости клетки блокировали Fc-рецептором в течение 15 минут с использованием 0,1% раствора γ-глобулина (Sigma). Аликвоты (приблизительно 105 клеток) инкубировали с моноклональными антителами, конъюгированными с фикоэритрином (ФЭ) или аллофикоцианином (АФЦ) (5 мкл антитела на 106 клеток), или с неконъюгированным «первым» антителом. Контроль включал антитела соответствующего изотипа, неокрашенные клетки и клетки, окрашенные только «вторым» конъюгированным антителом. Все процедуры инкубирования с антителами проводили в течение 30 минут при 4°С, после чего клетки промывали окрашивающим буфером. Образцы, окрашенные неконъюгированными «первыми» антителами, инкубировали еще 30 минут при 4°С со «вторыми» меченными антителами, конъюгированными с ФЭ или АФЦ. Промытые клетки осаждали и ресуспендировали в окрашивающем буфере, после чего молекулы клеточной поверхности идентифицировали на устройстве FACS Array (BD Biosciences), в результате чего было получено по меньшей мере 10000 данных.
Пример 10
Иммуноцитохимический анализ
Клетки, засеянные в чашки, покрытые 0,1% матригеля (BD), фиксировали 4% параформальдигидом в течение 20 минут при комнатной температуре. Фиксированные клетки блокировали в течение 1 часа при комнатной температуре PBS/0,1% BSA/10% нормальной куриной сывороткой/0,5% тритоном X-100, а затем инкубировали в течение ночи с «первыми» антителами в PBS/0,1% BSA/10% нормальной куриной сыворотке при 4°С. После трех промывок в PBS/0,1% BSA флуоресцентные «вторые» антитела при разведении 1:100 в PBS инкубировали с клетками в течение 1 часа при комнатной температуре для связывания. Контрольные образцы включали реакционные смеси, в которых «первое» антитело отсутствовало, или в которых «первое» антитело было заменено соответствующими иммуноглобулинами одного подкласса, используемыми в качестве негативного контроля, в такой же концентрации, как и «первые» антитела. Окрашенные образцы промывали, а затем к каждому образцу добавляли каплю реагента PROLONG® (Invitrogen, CA), содержащего дигидрохлорид диамидино-2-фенилиндола (DAPI), для контрастного окрашивания ядра и для предотвращения потери окраски. Визуализацию осуществляли с использованием конфокального инвертированного микроскопа Nikon Confocal Eclipse C-1 (Nikon, Japan) с объективом 10-60X.
Пример 11
ПЦР-анализ недифференцированных клеток
Экстракция РНК, очистка и синтез кДНК. Образцы РНК очищали путем связывания с мембраной на силикагеле (мининабор Rneasy Mini Kit, Qiagen, CA) в присутствии этанол-содержащего буфера с высокой концентрацией соли, с последующей промывкой для удаления примесей. После этого РНК очищали с использованием набора, не содержащего ДНК, TURBO (Ambion, INC), а затем РНК с высокой степенью чистоты элюировали в воде. Выход и чистоту оценивали на спектрофотометре путем определения оптической плотности A260 и A280. Копии кДНК получали из очищенной РНК с использованием архивной базы данных большой емкости ABI (ABI, CA) для кДНК.
ПЦР-амплификация в реальном времени и количественный анализ. Если это не оговорено особо, то все реагенты были закуплены у Applied Biosystems. ПЦР в реальном времени осуществляли с использованием системы детектирования последовательностей ABI PRISM® 7900 Sequence Detection System. Смесь TAQMAN® UNIVERSAL PCR MASTER MIX® (ABI, CA) использовали с 20 нг обратно транскрибируемой РНК в общем реакционном объеме 20 мкл. Каждый образец кДНК получали в дубликате для коррекции ошибок при пипетировании. Праймеры и FAM-меченные зонды TAQMAN® использовали в концентрации 200 нМ. Уровень экспрессии каждого гена-мишени нормализовали с использованием человеческой глицеральдегид-3-фосфатдегидрогеназы (GAPDH), используемой в качестве эндогенного контроля и разработанной Applied Biosystem. Наборы праймеров и зондов перечислены ниже: Oct3/4 (Hs00742896), SOX-2 (Hs00602736), UTF-1 (Hs00747497), Rex-1 (Hs00399279), Коннексин 43 (Hs00748445), Коннексин 45 (Hs00271416), ABCG2 (Hs00184979), Tert (Hs00162669), HNF 3β (Hs00232764), GATA-4 (Hs00171403), Mixl1 (Hs00430824), Sox7 (Hs00846731), AFP (Hs00173490), Brachyury (Hs00610080), GSC (Hs00418279_ml), Pdx-1 (Hs00426216), PTF1a (Hs00603586), Ngn3 (Hs00360700), NeuroD1 (Hs00159598), инсулин (Hs00355773) и Glu2 (Hs00165775). Праймеры Sox17 были сконструированы с использованием программы PRIMERS (ABI, CA) и имели следующие последовательности: Sox17: TGGCGCAGCAGATACCA (SEQ ID NO:1), AGCGCCTTCCACGACTTG (SEQ ID NO:2) и CCAGCATCTTGCTCAACTCGGCG (SEQ ID NO:3). После первого инкубирования при 50°С в течение 2 минут, а затем при 95°С в течение 10 минут, образцы подвергали 40 циклам реакций в две стадии - стадия денатурации при 95°С в течение 15 секунд, а затем стадия отжига/удлинения при 60°С в течение 1 минуты. Анализ данных осуществляли с помощью компьютерной программы детектирования последовательностей GENEAMP® 7000 Sequence Detection System. Для каждого набора праймеров/зондов величину Ct определяли как число циклов, при которых интенсивность флуоресценции достигала конкретного значения в середине экспоненциальной области амплификации. Относительные уровни экспрессии генов вычисляли сравнительным методом Ct. Вкратце, для каждого образца кДНК величину Ct для эндогенного контроля вычитали из величины Ct представляющего интерес гена, в результате чего получали величину дельта Ct (ΔCt). Нормализованное количество мишени вычисляли как 2-ΔCt, принимая эффективность амплификации за 100%. Окончательные данные выражали по отношению к калибровочному образцу.
Пример 12
Оценка кариотипа
Кариотип клеток H9 определяли с помощью стандартного анализа кариотипа посредством стандартного G-бэндинга. Было оценено всего 100 метафазных пластинок (Applied Genetics Laboratories, Inc.). В 100 проанализированных клетках не было обнаружено каких-либо хромосомных аббераций. Цитогенетический анализ показал, что данные клетки имели нормальное число аутосом, а число модальных хромосом составло 46. На фигуре 15 показан типичный кариотип, полученный для линии человеческих эмбриональных стволовых клеток Н9.
Пример 13
Культивирование человеческих эмбриональных стволовых клеток на субстрате тканевой культуры, покрытом внеклеточным матриксом
Линии человеческих эмбриональных стволовых клеток H1, H7 и H9 получали от WiCell Research Institute, Inc., (Madison, WI) и культивировали в соответствии с инструкциями, рекомендованными сотрудниками указанного института. Вкратце, клетки культивировали на фидерном слое мышиных эмбриональных фибробластов (MEF) в клеточной среде ES, состоящей из среды DMEM/F12 (Invitrogen/GIBCO), в которую были добавлены заменитель сыворотки (20% Knockout serum replacement), 100 нМ MEM, содержащей заменимые аминокислоты, 0,5 мМ бета-меркаптоэтанол, 2мМ L-глутамин с 4 нг/мл человеческого основного фактора роста фибробластов (bFGF). Клетки MEF, происходящие от мышиных эмбрионов E13-13.5, закупали у Charles River. Клетки MEF размножали в среде DMEM, в которую были добавлены 10% FBS (Hyclone), 2 мМ глутамин и 100 мМ MEM, содержащей заменимые аминокислоты. Субконфлюэнтные клеточные культуры MEF обрабатывали 10 мкг/мл митомицина C (Sigma, St. Louis, MO) в течение 3 часов для прекращения деления клеток, а затем обрабатывали трипсином и высевали при плотности 2×104/см2 на чашки, покрытые 0,1% коровьим желатином. Клетки MEF от пассажей 2-4 использовали в качестве фидерных слоев. Человеческие эмбриональные стволовые клетки, засеянные на фидерных слоях клеток MEF, культивировали при 37°С в атмосфере 5% CO2 в инкубаторе для культивирования ткани с повышенной влажностью. Затем конфлюэнтные человеческие эмбриональные стволовые клетки (полученные приблизительно через 5-7 дней после посева) обрабатывали 1 мг/мл коллагеназы типа IV (Invitrogen/GIBCO) в течение 5-10 минут, после чего эти клетки осторожно соскабливали с поверхности с помощью 5-миллилитровой стеклянной пипетки. Клетки центрифугировали при 900 об/мин в течение 5 минут, осадок ресуспендировали, а затем снова высевали в отношении 1:3-1:4 на планшеты, покрытые MATRIGELTM, с пониженным содержанием фактора роста, при разведении 1:30 (BD Biosciences). Затем клетки культивировали в MEF-кондиционированной среде, в которую были добавлены 8 нг/мл bFGF и коллагеназа, и по меньшей мере пять раз пересевали на планшеты, покрытые матригелем. После этого клетки, культивированные на MATRIGELTM, рутинным методом пересевали в среду с коллагеназой IV (Invitrogen/GIBCO), диспазой (BD Biosciences) или либеразой (Roche, IN).
Пример 14
Дифференцировка человеческих эмбриональных стволовых клеток, культивированных на субстрате тканевой культуры, покрытом внеклеточным матриксом, в дефинитивную эндодерму
Дифференцировку эмбриональных стволовых клеток в дефинитивную эндодерму проводили как было описано ранее в публикации Nature Biotechnology 23, 1534-1541 (Dec 2005). Вкратце, культуры H9 при конфлюентности приблизительно 60-70% подвергали контактированию со средой DMEM/F12, в которую были добавлены 0,5% FBS и 100 нг/мл активина A, в течение двух дней, после чего эти культуры обрабатывали средой DMEM/F12, в которую были добавлены 2% FBS и 100 нг/мл активина A (AA), еще в течение трех дней. Клетки H9 культивировали на планшетах, покрытых матригелем с пониженным содержанием факторов роста, при разведении 1:30-1:10 или на стандартном матригеле при разведении 1:30-1:10. Эти планшеты покрывали матригелем и оставляли на 1 час при комнатной температуре.
На 5-й день культуры анализировали с помощью FACS на экспрессию CXCR4, E-кадгерина, CD9 и N-кадгерина, и с помощью ПЦР в реальном времени на экспрессию SOX-17, SOX-7, фетальный белок альфа (AFP), CXCR4, Brychyury (Bry), gooscecoid (GSC), HNF-3 бета и GATA4. AFP и SOX-7 рассматривались как маркеры висцеральной эндодермы, тогда как GATA4, HNF-3 бета и SOX-17 представляют собой маркеры дефинитивной эндодермы, а GSC, Bry и CXCR4 представляют собой маркеры первичной полоски. На фигуре 17 проиллюстрирована экспрессия CXCR4, оцененная с помощью FACS. Эта оценка указывала на значимое увеличение уровня экспрессии CXCR4 клетками, культивированными на планшетах, покрытых матригелем при разведении 1:10, по сравнению с экспрессией, обнаруживаемой при более низких концентрациях матригеля. Кроме того, матригель с пониженным содержанием фактора роста по сравнению со стандартным матригелем, оказался неэффективным в образовании клеток дефинитивной эндодермы.
На фигуре 18 представлены результаты ПЦР в реальном времени, подтверждающие, что клетки, культивированные на планшетах, покрытых матригелем при разведении 1:10, по сравнению с клетками, культивированными на матригеле при разведении 1:30, обнаруживали значимую активацию маркеров дефинитивной эндодермы.
Пример 15
Анализ на изменение уровня экспрессии генов в человеческих эмбриональных стволовых клетках после образования дефинитивной эндодермы, проводимый на микромассивах
Всю РНК выделяли с использованием мининабора RNeasy (Qiagen) из нижеследующих культур человеческих эмбриональных стволовых клеток: клеток H9P83, культивированных на планшетах, покрытых матригелем, и обработанных средой DMEM/F12, в которую были добавлены 0,5% FBS и 100 нг/мл активина A, в течение двух дней, а затем обработанных средой DMEM/F12, в которую были добавлены 2% FBS и 100 нг/мл активина A (AA), в течение еще трех дней; клеток H9P44, культивированных на MEF и обработанных средой DMEM/F12, в которую были добавлены 0,5% FBS и 100 нг/мл активина A, в течение двух дней, а затем обработанных средой DMEM/F12, в которую были добавлены 2% FBS и 100 нг/мл активина A, в течение еще трех дней. Контроль для каждой группы включал клетки, засеянные на чашках, покрытых матригелем, и культивированные в MEF-кондиционированной среде, или клетки, засеянные на MEF и культивированные в среде ES.
Получение образцов, гибридизацию и анализ, проводимый посредством визуализации, осуществляли на массиве Affymetrix Human Genome U133 Plus 2,0 Array. После нормализации и логарифмического преобразования проводили анализ данных с использованием программы OmniViz® (MA) и GENESIFTER (VizXLabs, WA). Вариабельность в пределах каждой обработки и между различными обработками сравнивали с использованием коэффициента корреляции Пирсона. Дисперсия в профилях экспрессии генов между различными обработками и коэффициент корреляции между линиями представлены на фигуре 19. Значимые различия в экспрессии генов между образцами оценивали с помощью дисперсионного анализа и критерия Фишера, где нормализованное значение Р (поправка Бенджамини и Хохберга) составляет 0,05 или менее. В анализ были включены лишь гены, названия которых указаны в описании настоящей заявки. Для каждого из генов, обнаруживающих значимо отличающуюся экспрессию, указана нормализованная величина интенсивности вместе со стандартной ошибкой среднего (SEM).
Пример 16
Дифференцировка человеческих эмбриональных стволовых клеток, культивированных на субстрате тканевой культуры, покрытом матригелем, в дефинитивную эндодерму
Дифференцировку эмбриональных стволовых клеток в дефинитивную эндодерму проводили как описано ранее в публикации Nature Biotechnology 23, 1534-1541 (Dec 2005). Вкратце, клетки H9, Н7 или Н1, засеянные на культуры с MATRIGELTM, имеющим низкое содержание факторов роста (разведение 1:30), при конфлюентности приблизительно 60-70%, подвергали контактированию со средой DMEM/F12, в которую были добавлены 0,5% FBS и 100 нг/мл активина A (R&D Systems, MN), в течение двух дней, после чего эти культуры обрабатывали средой DMEM/F12, в которую были добавлены 2% FBS и 100 нг/мл активина A (AA), еще в течение трех дней. Во всех последующих примерах, если это не оговорено особо, такая схема обработки называется протоколом дифференцировки в дефинитивную эндодерму (DE).
Параллельно, клетки H9, H7 или H1, культивированные на фидерных слоях MEF, также обрабатывали в соответствии с протоколом DE, определенным выше.
На 5-й день культуры анализировали с помощью FACS на экспрессию CXCR4, E-кадгерина, CD9, CD99 и N-кадгерина (CD56) и с помощью ПЦР в реальном времени на экспрессию SOX-17, SOX-7, фетальный белок альфа (AFP), CXCR4, Brychyury (Bry), gooscecoid (GSC), HNF-3 бета и GATA4. AFP и SOX-7 рассматривались как маркеры висцеральной эндодермы, тогда как GATA4, HNF-3-бета и SOX-17 представляют собой маркеры дефинитивной эндодермы, а GSC, Bry и CXCR4 представляют собой маркеры первичной полоски.
H-линии, культивированные на мышиных фидерных слоях и обработанные в соответствии с протоколом DE, обнаруживали стабильную экспрессию маркеров DE и экспрессию CXCR4, оцененную с помощью FACS (фигура 20). После обработки в соответствии с протоколом DE также наблюдалось значимое снижение уровней экспрессии E-кадгерина. И наконец, популяция CXCR4+ также давала позитивную окраску на CD117. На фигуре 21 проиллюстрирована значимая активация маркеров дефинитивной эндодермы, по сравнению с необработанными клетками H7 (фигура 21, панель a) и H9 (фигура 21, панель b).
В отличие от Н-линий, культивированных на фидерных слоях MEF, Н-линии, культивированные на MATRIGELTM (разведение 1:30) и обработанные в соответствии с протоколом дифференцировки в дефинитивную эндодерму, не обнаруживали стабильной экспрессии маркеров дефинитивной эндодермы. В частности, экспрессия CXCR4, оцениваемая с помощью FACS и ПЦР в реальном времени, была значительно ниже в клетках, культивированных на MATRIGELTM, чем в клетках, культивированных на мышиных эмбриональных фибробластах. Экспрессия маркеров дефинитивной эндодермы соответствует общему профилю ответа, причем в клетках Н1 уровень экспрессии выше, чем в клетках Н9, а в клектах Н9 выше, чем в клетках Н7 (фигуры 22 и 23). На фигуре 22 показано, что в клетках H1 наблюдается значительно больший уровень экспрессии CXCR4, чем в клеточных линиях H7 и H9. Следует отметить, что во всех случаях экспрессия CXCR4 в клетках, культивированных на MATRIGELTM (разведение 1:30), была ниже, чем в клетках, культивированных на мышиных эмбриональных фибробластах. На фигуре 23 (панели a-c) представлены результаты ПЦР в реальном времени, которые указывают на то, что в клеточных линиях Н7 (фигура 23, панель a) и H9 (фигура 23, панель b) наблюдается умеренное усиление активации маркеров дефинитивной эндодермы. Однако в линии H1 (фигура 23, панель c), по сравнению с линиями H7 и H9, наблюдалась более стойкая активация маркеров дефинитивной эндодермы.
Пример 17
Дифференцировка человеческих эмбриональных стволовых клеток, культивированных на субстрате тканевой культуры, покрытом матригелем, в дефинитивную эндодерму - роль лигандов Wnt
Эмбриональные стволовые клетки H7P44 и H9P46 культивировали на чашках, покрытых MATRIGELTM (разведение 1:10), и обрабатывали средой DMEM/F12, в которую были добавлены 0,5% FBS и 100 нг/мл активина A (R&D Systems, MN), в течение двух дней, с последующей обработкой средой DMEM/F12, в которую были добавлены 2% FBS и 100 нг/мл активина A (AA), в течение еще трех дней. В некоторые культуры добавляли 20 нг/мл Wnt-3a (Catalog# 1324-WN-002, R&D Systems, MN), 20 нг/мл Wnt-5a (Catalog# 654-WN-010, R&D Systems, MN), 25 нг/мл Wnt-7a (Catalog# 3008-WN-025, R&D Systems, MN), или 25 нг/мл Wnt-5b (Catalog# 3006-WN-025, R&D Systems, MN) в течение всей 5-дневной обработки. На фигуре 24 проиллюстрированы фазово-контрастные изображения культур дефинитивной эндодермы H9P46 в присутствии высоких концентраций (a) AA или (b) AA + 20 нг/мл Wnt-3a. На фигуре 25 проиллюстрирована экспрессия CXCR4, оцениваемая с помощью FACS, на день 5, для клеточных линий H7P44 и H9P46, культивированных на MATRIGELTM (разведение 1:30) и обработанных в соответствии с протоколом дифференцировки DE в присутствии Wnt-3a (фигура 25, панели b и d) и в отсутствие Wnt-3a (фигура 25, панели a и c). Присутствие Wnt-3a в культурах DE давало стабильный уровень экспрессии CXCR4 (CD184), по сравнению с уровнем экспрессии в культурах DE, обработанных средой с низкой концентрацией сыворотки, но с высокой концентрацией AA. На фигуре 26 представлены данные ПЦР в реальном времени для a) культур H7 и b) культур H9, обработанных низкой концентрацией сыворотки + AA +/- лиганды Wnt. Для обеих линий H добавление WNT-3a приводило к значительному усилению активации маркеров дефинитивной эндодермы. В противоположность этому, Wnt-5a, Wnt-5b и Wnt-7a оказывали минимальное влияние на экспрессию маркеров дефинитивной эндодермы.
Пример 18
Дифференцировка человеческих эмбриональных стволовых клеток, культивированных на субстрате тканевой культуры, покрытом матригелем, в дефинитивную эндодерму - эффективная доза Wnt-3а
Эмбриональные стволовые клетки H9P46 культивировали на чашках, покрытых MATRIGELTM (разведение 1:10), и обрабатывали средой DMEM/F12, в которую были добавлены 0,5% FBS, 100 нг/мл активина A (AA) и 10-50 нг/мл Wnt-3a (R&D Systems, MN), в течение двух дней с последующей обработкой средой DMEM/F12, в которую были добавлены 2% FBS, 100 нг/мл активина A (AA) и 10-50 нг/мл Wnt-3a, в течение еще трех дней. Контрольные культуры не обрабатывали Wnt-3a. На фигуре 27, панель a, проиллюстрирована экспрессия CXCR4, оцениваемая с помощью FACS на 5-й день а) в отсутствие Wnt-3a, b) в присутствии 10 нг/мл Wnt-3a, c) в присутствии 20 нг/мл Wnt-3a и d) в присутствии 50 нг/мл Wnt-3a. В отсутствие Wnt-3a экспрессия CXCR4 была очень низкой. В противоположность этому, добавление 10-50 нг/мл Wnt-3a приводило к значительному увеличению числа CXCR4-позитивных клеток. Кроме того, добавление 10 нг/мл Wnt-3a было таким же эффективным, как и добавление 50 нг/мл Wnt-3a. Результаты, полученные с помощью ПЦР в реальном времени (фигура 28, панель a), также подтверждают полученные данные.
В отдельном исследовании клетки H9p52 высевали на MATRIGELTM с низким содержанием фактора роста при разведении 1:30. В первые 2 дня проведения протокола DE использовали следующие дозы Wnt-3a: 10 нг/мл, 5 нг/мл и 1 нг/мл. На фигуре 28, панель b, проиллюстрирован ПЦР-анализ маркеров DE после 5-дневной обработки. Число клеток в конце эксперимента указано на фигуре 28, панели c. Это число указывает на то, что пролиферация клеток происходит в присутствии более высоких доз Wnt-3a. Продолжение Wnt-3a-обработки до 5 дней (5D) дало незначительный эффект в отношении экспрессии маркеров DE, как было определено с помощью ПЦР, и не приводило к значительному увеличению числа клеток (фигура 28, панель c). Эти данные показали, что обработка дозой 10 нг/мл Wnt-3a в течение 2 дней является достаточной для достижения оптимальной пролиферации клеток и дифференцировки в дефинитивную эндодерму.
Пример 19
Дифференцировка человеческих эмбриональных стволовых клеток, культивированных на субстрате тканевой культуры, покрытом матригелем, в дефинитивную эндодерму - эффект ингибиторов GSK-3B
Для подтверждения эффекта Wnt-3a в пути Wnt активацию мишеней, действующих ниже в Wnt-пути, проводили с использованием ингибитора GSK-3, такого как бета-катенин. Эмбриональные стволовые клетки H9P46-Р48 культивировали на чашках, покрытых MATRIGELTM (разведение 1:10), и обрабатывали средой DMEM/F12, в которую были добавлены 0,5% FBS, 100 нг/мл активина A (AA) и 10-1000 нМ ингибитора IX GSK-3В (Catalog# 361550, Calbiochem, CA), в течение двух дней с последующей обработкой средой DMEM/F12, в которую были добавлены 2% FBS, 100 нг/мл активина A (AA) и 0-1000 нМ ингибитора IX GSK-3В (Catalog# 361550, Calbiochem, CA), в течение еще трех дней. Контрольные культуры обрабатывали средой с низкой концентрацией сыворотки и высокой дозой активина А ± Wnt-3a. На фигуре 29, панели a, проиллюстрирована экспрессия CXCR4, оцененная с помощью FACS, на 5-й день а) в отсутствие Wnt-3a или ингибитора GSK-3B, b) +20 нг/мл Wnt-3a, c) +1000 нМ ингибитора IX GSK-3B, d) +500 нМ ингибитора IX GSK-3B, e) +100 нМ ингибитора IX GSK-3B, f) +10 нМ ингибитора IX GSK-3B, g) +100 нМ ингибитора IX GSK-3B в течение 1-2 дней, и h) +10 нМ ингибитора IX GSK-3B в течение 1-2 дней.
В отсутствие Wnt-3a или в присутствии 10 нМ ингибитора GSK-3B наблюдалась очень низкая экспрессия CXCR4. В противоположность этому, добавление 20 нг/мл Wnt-3a или 100-1000 нМ ингибитора GSK-3B приводило к значительному увеличению числа CXCR4-позитивных клеток. Кроме того, добавление 100 нМ ингибитора GSK-3B в течение 1-2 дней было таким же эффективным, как и добавление 100 нМ ингибитора GSK-3B в течение всего 5-дневого периода. На фигуре 30 проиллюстрирована экспрессия гена маркеров дефинитивной эндодермы для клеток H9P48 (панель a) и клеток H9P46 (панель b).
На фигуре 16 представлена схема протокола дифференцировки согласно изобретению, где эмбриональные стволовые клетки дифференцируются в дефинитивную эндодерму в системе, не содержащей фидерного слоя.
Пример 20
Дифференцировка человеческих эмбриональных стволовых клеток, культивированных на субстрате тканевой культуры, покрытом матригелем, в дефинитивную эндодерму - эффективная доза активина А в присутствии ингибитора GSK-3B или Wnt-3а
Эмбриональные стволовые клетки H9P49 и Н1Р46 культивировали на чашках, покрытых MATRIGELTM (разведение 1:10), и обрабатывали средой DMEM/F12, в которую были добавлены 0,5% FBS, 10-100 нг/мл активина A (AA) и 100 нМ ингибитора IX GSK-3В (Catalog# 361550, Calbiochem, CA) или 20 нг/мл Wnt-3a, в течение двух дней с последующей обработкой средой DMEM/F12, в которую были добавлены 2% FBS, 10-100 нг/мл активина A (AA), в течение еще трех дней. Контрольные культуры обрабатывали средой с низкой концентрацией сыворотки + 100 нг/мл активина A. На фигуре 31 проиллюстрирована экспрессия CXCR4, оцениваемая с помощью FACS, для H9P49 и H1P46 на 5-й день, в присутствии a) 10 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3A в течение первых двух дней, b) 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3A в течение первых двух дней, c) 100 нг/мл активина A в течение всех пяти дней плюс 100 нМ ингибитора IX GSK-3B в течение первых двух дней, d) 10 нг/мл активина A в течение всех пяти дней плюс 100 нМ ингибитора IX GSK-3B в течение первых двух дней, e) 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3A в течение первых двух дней, и f) 10 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3A в течение первых двух дней. На фигуре 31, на панелях a-d, представлены клетки H9P49, а на панелях e-f представлены клетки H1P46. На фигуре 32 проиллюстрирована экспрессия генов маркеров дефинитивной эндодермы для культур H9P49, обработанных 10, 50 или 100 нг/мл активина A плюс 20 нг/мл Wnt-3a: панель a: экспрессия AFP, Bry, CXCR4, GSC, HNF-3B и POU5F (Oct-4) и панель b: SOX-17 и GATA4. Очевидно, что стойкая экспрессия маркеров дефинитивной эндодермы может быть достигнута с использованием 50 нг/мл AA + 20 нг/мл Wnt-3A или 100 нМ ингибитора IX GSK-3B. Низкие дозы активина A способствовали образованию внеэмбриональной эндодермы.
Пример 21
Дифференцировка человеческих эмбриональных стволовых клеток, культивированных на субстрате тканевой культуры, покрытом матригелем, в дефинитивную эндодерму - комбинация Wnt-3a и ингибиторов GSK-3B
Эмбриональные стволовые клетки H9P53 культивировали на чашках, покрытых MATRIGELTM (разведение 1:30), и обрабатывали средой DMEM/F12, в которую были добавлены 0,5% FBS, 100 нг/мл активина A (AA) и 100 нМ ингибитора IX GSK-3В (Catalog# 361550, Calbiochem, CA) ±20 нг/мл Wnt-3a, в течение двух дней с последующей обработкой средой DMEM/F12, в которую были добавлены 2% FBS, 10-100 нг/мл активина A (AA), в течение еще трех дней. Одновременно с этим, культуры H9P53 обрабатывали 25 нг/мл BMP-4 (Catalog# 314-BP-010, R&D Systems, MN) ± 20 нг/мл Wnt-3A ± 100 нг/мл активина A. Контрольные культуры обрабатывали средой с низкой концентрацией сыворотки плюс 100 нг/мл активина A. На фигуре 33 проиллюстрирована экспрессия CXCR4, оцениваемая с помощью FACS, на 5-й день, в присутствии a) 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3A в течение первых двух дней и 25 нг/мл BMP-4 в течение 3-5 дней, b) 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3A в течение первых двух дней, c) 100 нг/мл активина A в течение всех пяти дней плюс 100 нМ ингибитора IX GSK-3B в течение первых двух дней, d) 20 нг/мл Wnt-3a + 25 нг/мл BMP-4 в течение всех пяти дней, e) 100 нг/мл активина A в течение всех пяти дней плюс 20 нг/мл Wnt-3A + 100 нМ ингибитора IX GSK-3B в течение первых двух дней, и f) 100 нг/мл активина A + 25 нг/мл BMP-4 в течение всех пяти дней. На фигуре 34 проиллюстрирована экспрессия генов маркеров дефинитивной эндодермы, определенная с помощью ПЦР в реальном времени для культур клеточной линии человеческих эмбриональных стволовых клеток H1 при пассаже 46, обработанных 10 или 100 нг/мл активина A плюс 20 нг/мл Wnt-3a или 100 нМ ингибитора GSK-3B: панель (a): экспрессия AFP, Bry, CXCR4, GSC и POU5F (Oct-4) и панель (b): SOX-17, HNF-3B и GATA4. Результаты выражены как кратность увеличения по сравнению с необработанными клетками. На фигуре 35 проиллюстрирована экспрессия генов маркеров дефинитивной эндодермы, определенная с помощью ПЦР в реальном времени для культур клеточной линии человеческих эмбриональных стволовых клеток H9 при пассаже 49, обработанных 50 или 100 нг/мл активина A плюс 10 или 100 нМ ингибитора GSK-3B: панель (a): экспрессия AFP, Bry, CXCR4, GSC, HNF-3B и POU5F (Oct-4) и панель (b): SOX-17 и GATA4. Результаты выражены как кратность увеличения по сравнению с необработанными клетками. На фигуре 36 проиллюстрирована экспрессия генов маркеров дефинитивной эндодермы для культуры H9P53, обработанной комбинациями активина A, Wnt-3a, ингибитора GSK-3 и BMP-4: a) экспрессия AFP, Bry, CXCR4, GSC, HNF-3B и SOX7 и b) SOX-17, HNF-3B и GATA4. Добавление BMP-4 в протоколе DE, очевидно, приводит к индуцированию образования маркера мезодермы BRY, а добавление комбинации Wnt-3A и ингибитора GSK-4B не приводит к значительному усилению активации маркеров дефинитивной эндодермы по сравнению с добавлением каждого агента по отдельности в присутствии активина А.
Пример 22
Дифференцировка человеческих эмбриональных стволовых клеток, культивированных на MEF, в дефинитивную эндодерму - комбинация Wnt-3a, активина A, Wnt-5a, BMP-2, BMP-4, BMP-6, BMP-7, IL-4 и SDF-1 в среде с низким содержанием сыворотки
Клетки H9P44 высевали на 6-луночные планшеты, предварительно покрытые мышиными эмбриональными фибробластами, обработанными митомицином (MEF). Клетки культивировали до достижения 70-80% конфлюентности в клеточной среде ES, состоящей из среды DMEM/F12 (Invitrogen/GIBCO), в которую были добавлены заменитель сыворотки (20% Knockout serum replacement), 100 нМ MEM с заменимыми аминокислотами, 0,5 мМ бета-меркаптоэтанола, 2 мМ L-глутамина (все эти реагенты поставлялись Invitrogen/GIBCO) и 8 нг/мл человеческого основного фактора роста фибробластов (bFGF) (R&D Systems).
Для образования дефинитивной эндодермы (DE) клетки обрабатывали в присутствии 100 нг/мл активина A или в его отсутствие, а также с добавлением других факторов роста, подробно описанных ниже. Факторы роста постадийно добавляли в FBS в возрастающей концентрации по следующей схеме:
День 0: 0% FBS в DMEM/F12
День 1: 0,5% FBS в DMEM/F12
День 2: 2% FBS в DMEM/F12.
День 3: Клетки собирали для проведения FACS-анализа и ОТ-ПЦР.
Все факторы роста закупали у R&D Systems, MN. Подробное описание и концентрации факторов роста для каждой группы обработки приводятся ниже.
1. Контроль - Фактор роста не добавляли
2. Активин A (100 нг/мл)
3. Активин A (100 нг/мл) + Wnt-3a (10 нг/мл) + Wnt5a (10 нг/мл)
4. Активин A (100 нг/мл) + Wnt-3a (10 нг/мл) + Wnt5a (10 нг/мл) + BMP2 (100 нг/мл)
5. Активин A (100 нг/мл) + BMP-4 (100 нг/мл)
6. Активин A (100 нг/мл) + BMP-6 (100 нг/мл)
7. Активин A (100 нг/мл) + BMP-7 (100 нг/мл)
8. Активин A (100 нг/мл) + BMP-4 (100 нг/мл) + BMP-6 (100 нг/мл) + BMP-7 (100 нг/мл)
9. IL-4 (10 нг/мл)
10. SDF1a (20 нг/мл)
11. Активин A (100 нг/мл) + IL-4 (10 нг/мл) + SDF1a (20 нг/мл)
12. BMP-2 (100 нг/мл) + BMP-4 (l00 нг/мл) + BMP-6 (100 нг/мл) + BMP-7 (100 нг/мл)
13. Активин A (100 нг/мл) + BMP-2 (100 нг/мл) + BMP-4 (l00 нг/мл) + BMP-6 (100 нг/мл) + BMP-7 (100 нг/мл)
14. Активин A (100 нг/мл) + IL-4 (10 нг/мл)
15. Активин A (100 нг/мл) + (SDF1a (20 нг/мл)
16. Активин A (100 нг/мл) + Wnt-3a (10 нг/мл) + Wnt-5a (10 нг/мл) + Wnt-7a (10 нг/мл)
17. Активин A (100 нг/мл) + IL-4 (10 нг/мл) + SDF1a (20 нг/мл) + BMP-4 (100 нг/мл).
Результаты
Клетки собирали на 3-й день обработки в соответствии с протоколом DE. В целях проведения анализа аликвоту обработанных клеток использовали для получения РНК для ОТ-ПЦР-анализа, а остальные клетки использовали для FACS-анализа. Частота (%) CXCR4 приводится на фигуре 37. Добавление вышеуказанного(ых) фактора(ов) роста не приводило к повышению уровня экспрессии CXCR4 после обработки 100 нг/мл AA с низкой концентрацией сыворотки.
Для проведения ОТ-ПЦР-анализа клетки анализировали на экспрессию выбранной панели маркеров дефинитивной эндодермы. Полученные результаты были прокалиброваны по клеткам, культивированным в базальной среде, но не обработанным активином A или любыми другими факторами роста. В соответствии с данными FACS-анализа определено отсутствие какой-либо значимой активации маркеров дефинитивной эндодермы при добавлении факторов роста, таких как Wnt-3a, к культурам, обработанным высокой дозой активина А при низком содержании сыворотки. Эти результаты отличаются от результатов, описанных в предыдущих примерах, где указывается на значимое увеличение уровенй маркеров DE для клеток ES, культивированных в среде, не содержащей фидерного слоя, но в присутствии активина A, Wnt-3A и небольшого количества сыворотки.
Пример 23
Дифференцировка человеческих эмбриональных стволовых клеток, культивированных на субстрате тканевой культуры, покрытом матригелем или человеческим фибронектином, в дефинитивную эндодерму
Клетки H9P55 культивировали и подвергали дифференцировке на MATRIGELTM, содержащем человеческий фибронектин или стандартный фактор роста (BD Biosciences). В каждую лунку 6-луночного планшета с обработанной тканевой культурой добавляли 1 мл среды DMEM/F12 (Invitrogen/GIBCO), содержащей 1 мкг/мл человеческого фибронектина (R&D systems, MN). Альтернативно, в каждую лунку 6-луночного планшета с обработанной тканевой культурой добавляли MATRIGELTM со стандартным фактором роста при разведении 1:10 в DMEM/F12 и 1 мл разведенного MATRIGELTM. Клетки пассировали вместе с коллагеназой. После достижения клетками 80% конфлюентности их обрабатывали 0,5% FBS, содержащим 10 нг/мл мышиного рекомбинантного Wnt-3a (R&D), и 100 нг/мл активина A (R&D) в течение 2 дней. Затем обрабатывали 2% FBS + 100 нг/мл активина A в течение 3 дней. На фигуре 38, на панелях a-b, проиллюстрирована экспрессия CXCR4 эмбриональными стволовыми клетками, культивированными на фибронектине и матригеле, соответственно. Результаты ПЦР в реальном времени (фигура 39) подтвердили, что образование дефинитивной эндодермы на планшетах, покрытых фибронектином и MATRIGELTM, было эквивалентным.
Пример 24
Дифференцировка человеческих эмбриональных стволовых клеток, культивированных на субстрате тканевой культуры, покрытом различными концентрациями матригеля, в дефинитивную эндодерму
Культуры H9 при конфлюентности приблизительно 60-70% обрабатывали средой DMEM/F12, в которую были добавлены 0,5% FBS, 20 нг/мл Wnt-3a и 100 нг/мл активина A, в течение 2 дней с последующей обработкой средой DMEM/F12, в которую были добавлены 2% FBS, 20 нг/мл Wnt-3a и 100 нг/мл активина A (AA), в течение еще трех дней. Клетки H9 культивировали на планшетах, покрытых стандартным матригелем при разведении 1:60-1:10. Планшеты покрывали матригелем и оставляли на 1 час при комнатной температуре.
Результаты ПЦР в реальном времени представлены на фигуре 40. Обработка человеческих эмбриональных стволовых клеток средой с низким содержанием сыворотки, активином A и Wnt-3a приводила к экспрессии генов CXCR4, GATA4, goosecoid, HNF-3-бета и SOX-17, что позволяет предположить, что данные клетки подвергаются дифференцировке в дефинитивную эндодерму. Однако не очевидно, что присутствие указанной концентрации Wnt-3a в матригелевом покрытии играет важную роль в дифференцировке.
Пример 25
Дифференцировка человеческих эмбриональных стволовых клеток, культивированных на субстрате тканевой культуры, покрытом внеклеточным матриксом, а затем на MEF, в дефинитивную эндодерму - роль Wnt-3а
Клетки линии человеческих эмбриональных стволовых клеток H9, культивированных на MATRIGELTM по меньшей мере в пять пассажей, высевали на фидерные слои MEF в среду ES. Когда клетки достигали 60-70% конфлюентности, их обрабатывали средой DMEM/F12, в которую были добавлены 0,5% FBS и 100 нг/мл активина A, в течение двух дней с последующей обработкой средой DMEM/F12, в которую были добавлены 2% FBS и 100 нг/мл активина A (AA), в течение еще трех дней. Дополнительные группы обработки включали 20 нг/мл Wnt-3a в течение всех пяти дней + 10-100 нг/мл активина A.
На 3-й и 5-й дни культуры анализировали с помощью ПЦР в реальном времени на SOX-17, SOX-7, фетальный белок альфа (AFP), CXCR4, Brychyury (Bry), gooscecoid (GSC), HNF-3-бета, GATA4, hTERT и Oct4. AFP и SOX-7 рассматривались как маркеры висцеральной эндодермы, тогда как GATA4, HNF-3 бета и SOX-17 представляют собой маркеры дефинитивной эндодермы, а GSC, Bry и CXCR4 представляют собой маркеры первичной полоски. hTERT и Oct-4 представляют собой маркеры самообновления и плюрипотентности, соответственно. Результаты ПЦР в реальном времени представлены на фигуре 41, панелях a-d. FACS-анализ также осуществляли на 3-й и 5-й день. Были проанализированы уровни экспрессии CXCR-4 и CD9, и результаты представлены на фигуре 41, панели e.
В отсутствие Wnt-3a уровни экспрессии AFP в клетках, культивированных в 100 нг/мл активина A, были аналогичны уровням, наблюдаемым для необработанного контроля. Однако при добавлении Wnt-3a к клеткам, культивированным в 100 нг/мл активина A, на протяжении всего периода времени наблюдалось увеличение уровня экспрессии AFP. При снижении концентрации активина A уровень экспрессии AFP был очень высоким независмо от присутствия Wnt-3a (фигура 41, панель a). Это позволяет предположить, что для предотвращения дифференцировки клеток во внеэмбриональные ткани необходима высокая концентрация активина A.
Как показали FACS-анализы, CXCR4-позитивные клетки составляли 32-42% от всей популяции клеток в образцах, обработанных высокой концентрацией активина A, но не обработанных Wnt-3a, тогда как в образцах, обработанных высокой концентрацией активина А и Wnt-3a, эти клетки составляли 23-33% от всей популяции на день 3 (фигура 41, панель e). На 5-й день обработки CXCR4-экспрессирующие клетки, обработанные высокой концентрацией активина А, но не обработанные Wnt-3a, составляли 28-32%, а CXCR4-экспрессирующие клетки, обработанные высокой концентрацией активина А и Wnt-3a, составляли 43-51% (фигура 41, панель f). Среди клеток, обработанных низкой концентрацией активина A, присутствовало больше CXCR4-позитивных клеток в группе обработки в отсутствие Wnt-3a (11-20%), чем в группе, обработанной Wnt-3a (3-4%) (фигура 41, панель g). В целом, Wnt-3a, очевидно, не играет какой-либо значимой роли в дифференцировке человеческих эмбриональных стволовых клеток, культивированных на MEF, в дефинитивную эндодерму. Это позволяет предположить, что фидерный слой, вероятно, секретирует Wnt-3a или аналогичный лиганд в количестве, достаточном для усиления образования дефинитивной эндодермы, индуцированного активином A.
Пример 26
Дифференцировка человеческих эмбриональных стволовых клеток, культивированных на субстрате тканевой культуры, покрытом внеклеточным матриксом, в дефинитивную эндодерму, после обработки ингибитором Wnt DKK-1
Для того чтобы определить, приводит ли добавление Wnt-3a к повышению уровня дифференцировки, к культурам добавляли ингибитор передачи сигнала Wnt-3. Культуры H9, при конфлюентности 60-70%, обрабатывали средой DMEM/F12, в которую были добавлены 0,5% FBS, 20 нг/мл Wnt-3a, 100 нг/мл Dikkopf-1 (DKK-1) и 100 нг/мл активина A в течение двух дней с последующей обработкой средой DMEM/F12, в которую были добавлены 2% FBS и 100 нг/мл активина A (AA), в течение еще трех дней. Клетки H9 культивировали на планшетах, покрытых матригелем с низким содержанием фактора роста при разведении 1:30. Эти планшеты покрывали матригелем и оставляли на 1 час при комнатной температуре.
На день 5 культуры анализировали с помощью ПЦР в реальном времени на SOX-17, SOX-7, фетальный белок альфа (AFP), CXCR4, Brychyury (Bry), gooscecoid (GSC), HNF-3-бета, GATA4, hTERT и Oct4. AFP и SOX-7 рассматривались как маркеры висцеральной эндодермы, тогда как GATA4, HNF-3 бета и SOX-17 представляют собой маркеры дефинитивной эндодермы, а GSC, Bry и CXCR4 представляют собой маркеры первичной полоски. hTERT и Oct-4 представляют собой маркеры самообновления и плюрипотентности, соответственно. Результаты представлены на фигуре 42.
В присутствии Wnt-3a клетки экспрессировали CXCR4, GATA4, HNF-3-бета и SOX17, то есть все маркеры дефинитивной эндодермы. Маркеры образования первичной полоски, такие как «goosecoid», также детектировали на уровнях, превышающих уровни, детектируемые в необработанном контроле. При добавлении DKK1 уровень экспрессии вышеупомянутых маркеров дифференцировки резко снижался до уровней, аналогичных уровням, наблюдаемым в необработанных клетках.
Пример 27
Иммунофлуоресцентное окрашивание маркеров DE для эмбриональных стволовых клеток H9, культивированных на субстрате тканевой культуры, покрытом матригелем, и дифференцированных в среде с низким содержанием сыворотки плюс активин А ± Wnt-3a
5-дневные DE-культуры клеток H9 окрашивали как описано в примере 10 на SOX-17, HNF-3B, GATA-4, N-кадгерин и E-кадгерин. Все ядра подвергали контрастному окрашиванию реагентом DAPI. Добавление 20 нг/мл Wnt-3a приводило к значительному увеличению числа ядер, позитивно окрашенных на SOX-17, HNF-3-бета и GATA-4, в отличие от культур, дифференцированных в отсутствие Wnt-3a. Кроме того, добавление Wnt-3a приводило к значительной потере экспрессии e-кадгерина и к повышению уровней экспрессии N-кадгерина (фигура 43, панель a и фигура 43, панель b).
Пример 28
Анализ на изменение уровня экспрессии генов в эмбриональных стволовых клетках после образования дефинитивной эндодермы на MEF или матригеле, проводимый на микромассивах
Всю РНК выделяли с использованием мининабора RNeasy (Qiagen) из нижеследующих культур эмбриональных стволовых клеток: (А) клеток H9P33, культивированных на планшетах, покрытых MATRIGELTM (разведение 1:30), и обработанных средой DMEM/F12, в которую были добавлены 0,5% FBS и 100 нг/мл активина A, в течение двух дней, а затем обработанных средой DMEM/F12, в которую были добавлены 2% FBS и 100 нг/мл активина A (AA), в течение еще трех дней; (В) клеток H9P44, культивированных на MEF и обработанных средой DMEM/F12, в которую были добавлены 0,5% FBS и 100 нг/мл активина A, в течение двух дней, а затем обработанных средой DMEM/F12, в которую были добавлены 2% FBS и 100 нг/мл активина A, в течение еще трех дней, и (С) клеток H9P48, культивированных на планшетах, покрытых MATRIGELTM (разведение 1:30), и обработанных средой DMEM/F12, в которую были добавлены 0,5% FBS и 100 нг/мл активина A + 20 нг/мл Wnt-3a, в течение двух дней, а затем обработанных средой DMEM/F12, в которую были добавлены 2% FBS и 100 нг/мл активина A (AA), в течение еще трех дней. Контроль для каждой группы включал клетки, засеянные на чашках, покрытых матригелем, и культивированные в MEF-кондиционированной среде, или клетки, засеянные на MEF и культивированные в среде ES. Все группы содержали три биологические копии и каждая билогическая копия была дублирована на двух отдельных генных чипах.
Получение образцов, гибридизацию и анализ, проводимый посредством визуализации, осуществляли на массиве Affymetrix Human Genome U133 Plus 2.0 Array. После нормализации и логарифмического преобразования проводили анализ данных с использованием программы OmniViz® (MA) и GENESIFTER (VizXLabs, WA). Значимые различия в экспрессии генов между образцами оценивали с помощью дисперсионного анализа и критерия Фишера, где нормализованное значение Р (поправка Бенджамини и Хохберга) составляет 0,05 или менее. В анализ были включены лишь гены, названия которых указаны в описании настоящей заявки. Обнаружено по меньшей мере 5-кратное различие между группами А, В и С со скорректированной величиной Р для каждого гена.
Пример 29
Дифференцировка клеточной линии SA002 ES, культивированной на субстрате тканевой культуры, покрытом матригелем, в дефинитивную эндодерму
Клетки SA002P38 (Cellartis, Sweden), предварительно культивированные по меньшей мере в три пассажа на планшетах, покрытых матригелем (разведение 1:30), в среде MEF-CM, в которую были добавлены 8 нг/мл bFGF, обрабатывали средой DMEM/F12, в которую были добавлены 0,5% FBS и 100 нг/мл активина A (R&D Systems, MN) ± 20 нг/мл Wnt-3a или 100 нМ ингибитора IX GSK-3B, в течение двух дней, после чего эти культуры обрабатывали средой DMEM/F12, в которую были добавлены 2% FBS и 100 нг/мл активина A (AA), в течение еще трех дней. Результаты ПЦР в реальном времени представлены на фигуре 44, панелях a и b. Для стабильной экспрессии маркеров DE, в линию SA002, аналогично линиям H1, H7 и H9, также необходимо добавление Wnt-3A. Экспрессия CXCR4 проиллюстрирована на фигуре 45: a) AA-обработка, b) обработка AA + Wnt-3a, c) обработка AA + ингибитором GSK-3B.
Пример 30
Дифференцировка человеческих эмбриональных стволовых клеток, культивированных на субстрате тканевой культуры, покрытом человеческой сывороткой, в дефинитивную эндодерму
Культуры клеточной линии человеческих эмбриональных стволовых клеток Н1 при пассаже 55 культивировали и подвергали дифференцировке на планшетах, покрытых человеческой сывороткой (Sigma, #H1388, MO). В каждую лунку 6-луночного планшета с обработанной тканевой культурой добавляли 0,5 мл человеческой сыворотки, инкубировали в течение 1 часа при комнатной температуре и отсасывали, после чего добавляли человеческие эмбриональные стволовые клетки. После достижения клетками 80% конфлюентности их обрабатывали 0,5% FBS, содержащим 10 нг/мл мышиного рекомбинантного Wnt-3a (R&D) или 100 нМ ингибитора IX GSK-3B (Catalog# 361550, Calbiochem, CA) и 100 нг/мл активина A (R&D), в течение 2 дней. Затем клетки обрабатывали 2% FBS + 100 нг/мл активина A в течение 3 дней. После этого культуры анализировали с помощью ПЦР в реальном времени (фигура 46, панели a и b). Стабильная экспрессия маркеров дефинитивной эндодермы наблюдалась для клеток, обработанных активином А + ингибитором GSK-3B или Wnt-3A, по сравнению с клетками, обработанными только активином А. Эти результаты соответствуют результатам, полученным авторами настоящего изобретения для человеческих эмбриональных стволовых клеток, культивированных на планшетах, покрытых MATRIGELTM или человеческим фибронектином.
Пример 31
Дифференцировка человеческих эмбриональных стволовых клеток, культивированных на субстрате тканевой культуры, покрытом матригелем, в дефинитивную эндодерму - оценка различных ингибиторов GSK-3B
Различные коммерчески доступные ингибиторы GSK-3B оценивали на их эффективность в образованиии DE из человеческих эмбриональных стволовых клеток. Была проведена оценка ингибиторов GSK-3B в концентрации 100 нМ: ингибитора VIII GSK-3В (Catalog# 361549, Calbiochem, CA), ингибитора IX GSK-3В (Catalog# 361550, Calbiochem, CA), ингибитора XI GSK-3B (Catalog# 361553, Calbiochem, CA) и ингибитора XII GSK-3B (Catalog# 361554, Calbiochem, CA). Клетки H1P54 ES культивировали на планшетах, покрытых MATRIGELTM (разведение 1:30), а затем обрабатывали средой DMEM/F12, в которую были добавлены 0,5% FBS, 100 нг/мл активина A (AA) ± различные ингибиторы GSK-3B, в течение двух дней, с последующей обработкой средой DMEM/F12, в которую были добавлены 2% FBS, 100 нг/мл активина A (AA), в течение еще трех дней. Контрольные культуры обрабатывали средой с низким содержанием сыворотки и с высокой дозой AA. На фигуре 47, панели a и b, проиллюстрирована экспрессия генов маркеров дефинитивной эндодермы на 5-й день. Оба ингибитора IX и XI GSK-3B, по сравнению с ингибиторами VIII и XII GSK-3B, были эффективными в отношении индуцирования образования DE.
Пример 32
Образование панкреатической эндодермы человеческими эмбриональными стволовыми клетами, культивированными в отсутствие фидерного слоя - оценка аналогов ретиноевой кислоты
Эмбриональные стволовые клетки H9P49 культивировали на планшетах, покрытых MATRIGELTM (разведение 1:30), и обрабатывали средой DMEM/F12, в которую были добавлены 0,5% FBS, 20 нг/мл Wnt-3a (Catalog# 1324-WN-002, R&D Systems, MN), и 100 нг/мл активина A (R&D Systems, MN), в течение двух дней, а затем обрабатывали средой DMEM/F12, в которую были добавлены 2% FBS и 100 нг/мл активина A (AA), в течение еще трех дней. На 5-й день клетки собирали для оценки, проводимой с помощью FACS и ПЦР в реальном времени. Как указывается в предыдущих примерах, такой протокол позволяет осуществлять стабильную активацию маркеров дефинитивной эндодермы, таких как CXCR4 и SOX-17. Клетки дефинитивной эндодермы, полученные на 5-й день, подвергали контактированию с нижеследующими средами в условиях, благоприятствующих образованию панкреатической эндодермы, а именно культивированию в среде DMEM/F12, в которую были добавлены 2% FBS и 1 мкМ полного транс-изомера ретиноевой кислоты (РК) (Catalog#R2625, Sigma, MO), или 0,1-10 мкМ AM-580 (4-[(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталинил)карбоксамидо]бензойной кислоты (Catalog#A8843, Sigma, MO) или 0,1-1 мкМ TTNPB (4-[(E)-2-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталинил)-l-пропенил]бензойной кислоты (аротиноидной кислоты) (Catalog#T3757, Sigma, MO), в течение 3 дней. AM-580 и TTNPB представляют собой аналоги ретиноевой кислоты, обладающие аффинностью по отношению к рецепторам ретиноевой кислоты. После РК-обработки проводили дополнительную 3-дневную обработку в среде DMEM/F12, в которую были добавлены 2% FBS и 20-50 нг/мл bFGF (Catalog#F0291, Sigma, MO). Культуры собирали, и брали образцы мРНК для анализа.
Анализ на экспрессию генов показал, что добавление (фигура 48, панели a-d) 1 мкМ РК с последующей обработкой bFGF приводила к значительной активации маркеров панкреатической эндодермы, таких как PDX-1. Кроме того, такая схема обработки давала стабильную экспрессию маркеров эндодермы передней кишки, таких как CDX-2 и AFP. При концентрации 1 мкМ добавление аналогов РК приводило к эквивалентной экспрессии маркеров панкреатической эндодермы и передней кишки. Однако добавление 1 мкМ аналогов РК, по сравнению с полным трансизомером ретиноевой кислоты, приводило к более стабильной экспрессии AFP. Добавление 10 мкМ AM-580 приводило к ингибированию экспрессии AFP и CDX-2, но при этом сохранялся высокий уровень экспрессии PDX-1.
Пример 34
Влияние Wnt-3a-обработки на экспрессию цитокинов в человеческих эмбриональных стволовых клетках
Влияние Wnt-3a-обработки на экспрессию цитокинов анализировали с использованием массива белков. Клетки линии человеческих эмбриональных стволовых клеток Н9 культивировали методами, описанными в примере 15. При пассаже 54 клетки подвергали дифференцировке в присутствии 100 нг/мл активина A ± 10 нг/мл Wnt-3a в течение 2 дней в DMEM/F12 с 0,5% FBS. Затем клетки культивировали в течение еще трех дней в 100 нг/мл активина A и в DMEM/F12 с 2% FBS. По истечении 5-го дня экспрессию CXCR4 оценивали с помощью FACS для каждой группы обработки. Среди клеток, обработанных только активином A, число клеток, экспрессирующих CXCR4, составляло 1%. Среди клеток, обработанных активином A и Wnt-3a, число клеток, позитивных по экспрессии CXCR4, составляло 73%.
Клеточные лизаты получали из клеток от каждой группы обработки с использованием набора для лизиса клеток млекопитающих (Sigma-Aldrich, MO). Среды, кондиционированные клетками от каждой группы обработки, собирали и концентрировали. Анализ на цитокиновых массивах проводили с использованием панелей цитокинов, поставляемых RayBiotech, GA (http://www.raybiotech.com/).
В кондиционированной клетками среде, обработанной Wnt-3a, наблюдалась заметная активация ангиогенина, IGFBP-1 и EGF. В Wnt-3a-обработанных клеточных лизатах наблюдалась активация различных белков, включая IGFBP-1, TGFbeta-1 и TGFbeta-3. Эти активированные белки были снова добавлены в среду для дифференцировки в целях восстановления или усиления влияния Wnt-3a на образование дефинитивной эндодермы.
Пример 35
Дифференцировка человеческих эмбриональных стволовых клеток, культивированных на субстрате тканевой культуры, покрытом матригелем, в дефинитивную эндодерму - роль Wnt1
Клетки ES H1P55 культивировали на чашках, покрытых MATRIGELTM (разведение 1:30), и обрабатывали средой DMEM/F12, в которую были добавлены 0,5% FBS и 100 нг/мл активина A ± 10-20 нг/мл WNT-1 (PeproTech, NJ, Catalogue # 20-17), в течение двух дней с последующей обработкой средой DMEM/F12, в которую были добавлены 2% FBS, 100 нг/мл активина A (AA) и ± 10 или 20 нг/мл WNT-1, в течение еще трех дней. При этом были протестированы следующие комбинации WNT1 + AA:
a) 20 нг/мл WNT1 + 100 нг/мл AA в 0,5% FBS + DM-F12 в течение 1-2 дней, а затем 2% FBS + DM-F12 + 100 нг/мл AA в течение трех дней, b) 20 нг/мл WNT1 + 100 нг/мл AA в 0,5% FBS + DM-F12 в течение 1-2 дней, а затем 2% FBS + DM-F12 + 100 нг/мл AA в течение 3-5 дней, c) 10 нг/мл WNT1 + 100 нг/мл AA в 0,5% FBS + DM-F12 в течение 1-2 дней, а затем 2% FBS + DMF12 + 100 нг/мл AA в течение трех дней, d) 10 нг/мл WNT1 + 100 нг/мл AA в 0,5% FBS + DM-F12 в течение 1-2 дней, а затем 2% FBS + DM-F12 + 100 нг/мл AA в течение 3-5 дней, e) 20 нг/мл WNT1 + 100 нг/мл AA в 0,5% FBS + DM-F12 в течение 1-2 дней, а затем 2% FBS + DM-F12 + 100 нг/мл AA + 20 нг/мл WNT1 в течение трех дней, f) 20 нг/мл WNT1 + 100 нг/мл AA в 0,5% FBS + DM-F12 в течение 1-2 дней, а затем 2% FBS + DM-F12 + 100 нг/мл AA + 20 нг/мл WNT1 в течение 3-5 дней. На фигуре 49, панелях a и b, представлены данные ПЦР в реальном времени для маркеров дефинитивной эндодермы после обработки клеток Н1 сывороткой в низкой концентрации, AA и Wnt-1. Добавление 20 нг/мл WNT1 в присутствии 100 нг/мл AA приводило к значительной активации маркеров дефинитивной эндодермы (Bry, CXCR4, GSC, SOX17, HNF-3B и GATA-4).
Пример 36
Влияние глюкозы на дифференцировку клеток панкреатической эндокринной системы
Эффективность дифференцировки клеток панкреатической эндодермы в клетки панкреатической эндокринной системы зависит от многих факторов, включая, например, выбор базальной среды или концентрацию глюкозы. Было оценено влияние концентрации глюкозы на дифференцировку клеток панкреатической эндодермы, происходящих от эмбриональных стволовых клеток, в клетки панкреатической эндокринной системы.
Изменение концентрации глюкозы в результате замены базальной среды
Культуры недифференцированных человеческих эмбриональных стволовых клеток (H1 и H9) культивировали методами, описанными в примере 1, а затем подвергали дифференцировке в клетки панкреатической эндодермы. Эмбриональные стволовые клетки подвергали дифференцировке в клетки панкреатической эндодермы путем культивирования эмбриональных стволовых клеток в среде RPMI, содержащей 100 нг/мл активина A в отсутствие сыворотки, в течение одного дня. После этого клетки культивировали в среде RPMI, содержащей 100 нг/мл активина A и 0,2% FBS, в течение еще двух дней. После такой обработки среду заменяли средой RPMI, содержащей 2% FBS, FGF10 (50 нг/мл) и KAAD-циклопамин (250 нМ). Клетки культивировали в этой среде в течение четырех дней. По истечение этого времени среду заменяли средой, в которую была добавлена 1×B27, содержащая полный трансизомер ретиноевой кислоты (2 мкМ), FGF10 (50 нг/мл) и KAAD-циклопамин (0,25 мкМ), в течение четырех дней для индуцирования образования клеток панкреатической эндодермы. Выход клеток панкреатической эндодермы заметно не отличался от выхода в культурах, обработанных средой DMEM с низким содержанием глюкозы или DMEM/F12.
Клетки панкреатической эндодермы подвергали дифференцировке в клетки панкреатической эндокринной системы путем обработки этих клеток эксендином 4 и HGF. Эксендин 4 (50 нг/мл) и HGF (50 нг/мл) добавляли в течение десяти дней в среде DMEM с низким содержанием глюкозы или в течение 10 дней в среде DMEM/F12. Обе среды содержали 1×B27. Культуры собирали, и брали образцы мРНК для анализа. Образцы нормализовали по данным для панкреатической эндодермы, полученным методами, описанными в Nature Biotechnology 24, 1392-1401 (2006).
Экспрессию инсулина оценивали с помощью ПЦР в реальном времени. Как показано на фигуре 50, на панелях a и b, экспрессия генов инсулина и глюкагона была значительно выше в клетках, обработанных средой DMEM/F12, чем в клетках, обработанных средой DMEM с низким содержанием глюкозы. Экспрессию инсулина также оценивали с помощью иммуногистохимического анализа (фигура 51). Обработка в DMEM/F12, по сравнению со средой DMEM с низким содержанием глюкозы, давала более высокий процент инсулин-позитивных клеток (фигура 51, панели a и b). Инсулин-позитивные клетки были также позитивными по PDX-1 (панель c).
Изменение концентрации глюкозы
Культуры недифференцированных человеческих эмбриональных стволовых клеток (H1 и H9) культивировали методами, описанными в примере 1, а затем подвергали дифференцировке в клетки панкреатической эндодермы. Эмбриональные стволовые клетки подвергали дифференцировке в клетки панкреатической эндодермы путем культивирования эмбриональных стволовых клеток в среде RPMI, содержащей 100 нг/мл активина A в отсутствие сыворотки, в течение одного дня. После этого клетки культивировали в среде RPMI, содержащей 100 нг/мл активина A и 0,2% FBS, в течение еще двух дней. После такой обработки среду заменяли средой RPMI, содержащей 2% FBS, FGFl0 (50 нг/мл) и KAAD-циклопамин (250 нМ). Клетки культивировали в этой среде в течение четырех дней. По истечение этого времени среду заменяли средой CMRL, в которую была добавлена 1×B27, содержащая полный трансизомер ретиноевой кислоты (2 мкМ), FGF10 (50 нг/мл) и KAAD-циклопамин (0,25 мкМ), в течение четырех дней для индуцирования образования клеток панкреатической эндодермы. Эта среда содержала 5, 10 или 20 мМ глюкозы. Выход клеток панкреатической эндодермы заметно не отличался от выхода в культурах, происходящих от эмбриональных стволовых клеток Н9, обработанных 5, 10 или 20 мМ глюкозы (фигура 52, панель a).
Клетки панкреатической эндодермы подвергали дифференцировке в клетки панкреатической эндокринной системы путем обработки этих клеток средой CMRL, в которую были добавлены 1×B27, эксендин 4 (50 нг/мл) и HGF (50 нг/мл), в течение двух, четырех или десяти дней с 5, 10 или 20 мМ глюкозой. Культуры собирали и брали образцы мРНК для анализа. Образцы нормализовали по данным для панкреатической эндодермы, полученным методами, описанными в Nature Biotechnology 24, 1392-1401 (2006).
На фигуре 52, панели b-g, проиллюстрировано влияние глюкозы на экспрессию Ngn-3, NeuroD-1, Nkx2.2, Pax-4, инсулина и глюкагона в клетках, происходящих от клеточной линии человеческих эмбриональных стволовых клеток H9. Ngn3 представляет собой первый фактор транскрипции, определяющий «судьбу» клеток панкреатической эндокринной системы, а NeuroD1 представляет собой прямую мишень для Ngn3. Глюкоза стимулирует дозозависимое увеличение уровней мРНК Ngn3 и NeuroD1. Другие два имеющих важное значение панкреатических маркера, Nkx2.2 и Pax4 также обнаруживают аналогичный профиль экспрессии (фигура 52, панели d и e). В клетках, обработанных 10 мМ глюкозы в течение 10 дней, наблюдалась оптимальная экспрессия инсулина и глюкагона (фигура 52, панели f и g).
Аналогичные результаты были получены для Ngn-3, NeuroD-1, Nkx2.2, Pax-4 в культурах, происходящих от клеточной линии человеческих эмбриональных стволовых клеток Н1. Однако в клетках, обработанных 20 мМ глюкозы в течение 10 дней, наблюдалась оптимальная экспрессия инсулина и синаптофизина.
Высвобождение C-пептида из инсулин-экспрессирующих клеток способами согласно изобретению
Был проведен мониторинг опосредуемого глюкозой высвобождения С-пептида в инсулин-позитивных клетках, происходящих от клеток Н1, которые были обработаны 2, 10 или 20 мМ глюкозой. Для стимуляции высовобождения С-пептида клетки сначала инкубировали с раствором Кребса-Рингера, содержащим бикарбонат, и с HEPES (KRBH; 129 мМ NaCl, 4,8 мМ KCl, 2,5 мМ CaCl2, 1,2 мМ KH2PO4, 1,2 мМ MgSO4, 5 мМ NaHCO3, 10 мМ HEPES, 0,1% BSA), в течение 1 часа. Затем эту среду удаляли и заменяли раствором Кребса-Рингера, содержащим 2 мМ D-глюкозы. Клетки стимулировали 20 мМ глюкозой или 0,5 мМ IBMX в течение 1 часа (все реагенты были закуплены у Sigma). Усиление стимуляции вычисляли для каждой культуры путем деления концентрации С-пептида в супернатанте-миметике на концентрацию C-пептида в базальном супернатанте.
BMX-стимулированное высвобождение C-пептида увеличивалось в 1,2-3 раза (фигура 53). Глюкоза в концентрации 20 мМ не стимулировала высвобождение C-пептида. Какого-либо значимого различия в секреции С-пептида между инсулин-позитивными клетками, образующимися в присутствии 2, 10 и 20 мМ глюкозы, не наблюдалось.
В целом, данные, полученные авторами изобретения, позволяют предположить, что глюкоза индуцирует дозозависимую активацию эндокринных маркеров, Ngn3 и NeuroD1, что дает основание считать, что глюкоза индуцирует дозозависимую дифференцировку человеческих эмбриональных клеток в клетки панкреатической эндокринной системы. Экспрессия инсулина также регулируется глюкозой в зависимости от дозы.
Публикации, цитируемые в описании настоящего документа, во всей своей полноте вводятся в настоящее описание посредством ссылки. Хотя в вышеприведенных примерах и в описании предпочтительных вариантов изобртения проиллюстрированы различные аспекты его осуществления, однако следует отметить, что объем настоящего изобретения не ограничивается вышеупомянутым описанием, а определяется нижеследующей формулой изобретения, точно сформулированной в соответствии с нормами патентного законодательства.
Реферат
Изобретение относится к областям клеточной технологии и молекулярной биологии. Предложен способ стимуляции дифференцировки плюрипотентных стволовых клеток без использования фидерного клеточного слоя, в частности, в панкреатическую эндодерму. Изобретение может быть применено для целей медицины, а именно, транспланталогии. 3 н. и 10 з.п. ф-лы, 53 ил., 36 пр.
Формула
a. культивирования плюрипотентных стволовых клеток;
b. дифференцировки плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры линии дифференцировки дефинитивной эндодермы, путем обработки плюрипотентных клеток активином А;
c. дифференцировки клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндодермы, путем обработки клеток, экспрессирующих маркеры линии дифференцировки дефинитивной эндодермы, по меньшей мере одним фактором роста фибробластов или ретиноевой кислотой и по меньшей мере одним фактором роста фибробластов, и
d. дифференцировки клеток, экспрессирующих маркеры линии дифференцировки панкреатической эндодермы, в клетки, экспрессирующие маркеры линии дифференцировки панкреатической эндокринной системы, путем обработки клеток, экспрессирующих маркеры линии дифференцировки панкреатической эндодермы, в среде, содержащей глюкозу в концентрации 10 мМ, фактором, выбранным из ингибитора гамма-секретазы или эксендина-4, и комбинации эксендина-4 и HGF, в течение 10 дней или в течение от 2 дней до 30 дней.
Документы, цитированные в отчёте о поиске
Cd19xcd3-специфические полипептиды и их применение

Комментарии