Дифференцировка плюрипотентных стволовых клеток в клетки кишечной энтодермы средней кишки - RU2741114C2
Код документа: RU2741114C2
Чертежи









































Описание
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
[0001] Настоящее изобретение относится к области клеточной терапии таких состояний, как диабет. В частности, изобретение относится к дифференцировке клеток, включая направление дифференцировки плюрипотентных стволовых клеток с получением популяции клеток кишечной энтодермы средней кишки. Изобретение обеспечивает клетки или клеточную популяцию и способы получения клеток, экспрессирующих маркеры, характерные для кишечной энтодермы средней кишки.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
[0002] Развитие знаний о механизме действия гормона инкретина в сочетании с достижениями в понимании дифференцировки кишечника как на стадии стволовых клеток, так и на стадии эндокринных клеток, вызвало интерес к разработке подходящих для имплантации источников клеток, продуцирующих гормон инкретин. Один подход представляет собой получение функциональных энтероэндокринных L- или K-клеток из плюрипотентных стволовых клеток, таких как человеческие эмбриональные стволовые клетки («hESC») или индуцированные плюрипотентные стволовые клетки («iPS»).
[0003] Продукция/секреция глюкагонподобного пептида 1 (GLP-1) L-клетками кишечника или глюкозозависимого инсулинотропного полипептида (GIP) К-клетками кишечника оказывает благоприятные эффекты при лечении сахарного диабета. Инкретиновые гормоны обладают системными эффектами, благоприятными для лечения сахарного диабета (1 типа и 2 типа) (Unger, J., Curr Diab Rep., 2013; 13(5):663-668). Преимущества могут включать в себя усиление многих функциональных аспектов и количества бета (β) клеток, подавление секреции глюкагона, увеличение чувствительности к инсулину периферических метаболических тканей, снижение глюконеогенеза в печени и снижение аппетита. Идентифицированы два класса терапевтических агентов на основе инкретина, полезных для лечения сахарного диабета: агонисты рецептора GLK-1 и ингибиторы дипептидил пептидазы 4 (DPP-4). Однако в настоящее время не существует варианта клеточной терапии на основе инкретина, который бы включал в себя эндогенный и клеточный индикатор, обеспечивающий эффективное лечение диабета на основе GLP1. Более того, существующие терапевтические средства на основе инкретина не регулируются циркулирующим уровнем глюкозы в крови и, таким образом, обеспечивают нефизиологически регулируемую продукцию GLP.
[0004] При эмбриональном развитии позвоночных плюрипотентная клетка дает начало группе клеток, содержащих три зародышевых листка (эктодерму, мезодерму и энтодерму), в ходе процесса, известного как «гаструляция». Мезенхимальная ткань происходит из мезодермы маркирована, среди прочего, генами, именуемыми «heart and neural crest derivatives expressed 1 (HAND1)» и «forkhead box F1 (FOXF1)». Ткани, такие как ткань щитовидной железы, вилочковой железы, поджелудочной железы, кишечника и печени, будут развиваться из энтодермы посредством промежуточной стадии. Промежуточная стадия данного процесса представляет собой образование дефинитивной энтодермы. К концу гаструляции энтодерма разделяется на передний и задний домены, которые можно распознать по экспрессии ряда факторов, однозначно выделяющих передний отдел передней кишки, задний отдел переднекишечный, среднекишечный и заднекишечный отделы энтодермы.
[0005] Уровень экспрессии специфических факторов транскрипции («TF») можно применять для определения типа ткани, как описано в публикации Grapin-Botten et al., Trends Genet, 2000; 16(3):124-130. FOXA2 является маркером всей энтодермы вдоль передне-задней оси. Во время преобразования дефинитивной энтодермы в примитивную кишечную трубку кишечная трубка становится разделенной на широкие домены, которые можно наблюдать на молекулярном уровне посредством моделей ограниченной экспрессии генов. Передний отдел передней кишки обширно маркирован высокой экспрессией SOX2 и включает в себя домены таких органов, как щитовидная железа, легкие и пищевод. Средняя кишка (включает в себя двенадцатиперстную кишку, подвздошную кишку и тощую кишку) и задняя кишка (включает в себя толстую кишку) маркирован высокой экспрессией гена caudal type homeobox 2 (CDX2). Граница SOX2-CDX2 проходит в заднем отделе передней кишки, в котором дополнительные TF маркируют домены конкретных органов. Например, регионализованный домен поджелудочной железы внутри задней части передней кишки демонстрирует очень высокую экспрессию PDX1 и очень низкую экспрессию CDX2 и SOX2. PTF1A имеет высокий уровень экспрессии в ткани поджелудочной железы; Низкая экспрессия PDX1 в сочетании с экспрессией CDX2 маркирует домен двенадцатиперстной кишки. Кишечная энтодерма структурируется конкретными гомеобоксовыми (HOX) генами. Например, HOXC5 предпочтительно экспрессируется в энтодермальных клетках средней кишки. Кроме этого, экспрессия HOXA13 и HOXD13 ограничена энтодермальными клетками задней кишки. Ген ALB, или белок альбумин 1, маркирует наиболее ранних предшественников печени в энтодерме заднего отдела передней кишки (Zaret et al., Curr Top Dev Biol, 2016; 117:647-669).
[0006] Были предприняты шаги по совершенствованию протоколов получения клеток кишечной энтодермы из человеческих плюрипотентных стволовых клеток. Например, в публикациях (Spence et al., Nature, 2011; 470(7332):105-109; Watson et al., Nature Medicine, 2014; 20(11):1310-1314; и Kauffman et al., Front Pharmacol, 2013; 4(79):1-18) описываются протоколы дифференцировки с использованием фактора роста фибробластов (FGF)-4, белка Wingless-type MMTV integration site family, member 3A (WNT3A), Chiron 99021 или ретиноевой кислоты (RA) и FGF7, начиная со стадии дефинитивной энтодермы, которые приводят к образованию среднекишечных/заднекишечных сфероидов, содержащих не только популяцию энтодермальных клеток CDX2+/FOXA2+, но также существенную популяцию мезенхимальных клеток CDX2+. Процесс дифференцировки энтероэндокринных клеток из этих среднекишечных/заднекишечных сфероидов, производных от hESC, является очень неэффективным, требует длительного времени и направлен на генерацию всех типов кишечных клеток ворсинчатых и межворсинчатых областей, без дискриминирования. Сохраняется потребность в технологии получения клеток кишечной энтодермы средней кишки без существенного количества загрязняющей мезенхимы, так чтобы была возможность производить с высокой эффективностью энтероэндокринные клетки для клеточной терапии.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0007] Согласно осуществлению и полному описанию в настоящем изобретении предложены клетки, популяции клеток и способы получения клеток путем дифференцировки человеческих плюрипотентных стволовых клеток. В частности, в изобретении предлагаются способы направленной дифференцировки человеческих плюрипотентных стволовых клеток с получением клеток кишечной энтодермы средней кишки, более конкретно, энтодермального монослоя клеток кишечной энтодермы средней кишки.
[0008] Один аспект настоящего изобретения представляет способ получения популяции клеток кишечной энтодермы средней кишки, который включает в себя культивирование человеческих плюрипотентных стволовых клеток в культуральных средах. В вариантах осуществления способ включает в себя индукцию дифференцировки человеческих плюрипотентных стволовых клеток в клетки кишечной энтодермы средней кишки. В некоторых вариантах осуществления получают популяцию клеток кишечной энтодермы средней кишки. В некоторых вариантах осуществления получают популяцию по существу клеток кишечной энтодермы средней кишки. В вариантах осуществления настоящего изобретения клетки кишечной энтодермы средней кишки формируются и являются стабильными в культуре в виде монослоя. В вариантах осуществления более 50% дифференцированных клеток экспрессируют маркеры, характерные для кишечной энтодермы средней кишки, предпочтительно, более чем 60% дифференцированных клеток экспрессируют характерные маркеры кишечной энтодермы средней кишки, более предпочтительно, более чем 70%, более чем 80% и более чем 90% экспрессируют характерные маркеры кишечной энтодермы средней кишки. В вариантах осуществления дифференцированные клетки, которые экспрессируют характерные маркеры кишечной энтодермы средней кишки, представляют собой клетки кишечной энтодермы средней кишки. В вариантах осуществления клетки кишечной энтодермы средней кишки экспрессируют CDX2 и FOXA2. Во всех вариантах осуществления клетки кишечной энтодермы средней кишки экспрессируют транскрипционные факторы, выбранные из SOX9, PDX1, KLF5 и HOXC5. В вариантах осуществления клетки кишечной энтодермы средней кишки не экспрессируют транскрипционные факторы, выбранные из SOX2, ALB, PTF1A, HOXA13 и LGR5.
[0009] В вариантах осуществления изобретения человеческие плюрипотентные стволовые клетки дифференцируются в клетки кишечной энтодермы средней кишки в стадиях, включающих: a) культивирование человеческих плюрипотентных стволовых клеток в первой культуральной среде, содержащей GDF-8 и ингибитор GSK3β, например, соединение MCX, для индукции дифференцировки в клетки дефинитивной энтодермы; b) культивирование клеток дефинитивной энтодермы во второй культуральной среде, содержащей аскорбиновую кислоту и FGF7 для индукции дифференцировки в клетки примитивной кишечной трубки; и c) культивирование клеток примитивной кишечной трубки в третьей культуральной среде, содержащей ретиноевую кислоту и BMP2 или BMP4 в кислых условиях для индукции дифференцировки в клетки кишечной энтодермы средней кишки. В конкретных вариантах осуществления кислые условия представляют собой культивирование со средой BLAR. Значение pH кислой культуры может лежать в диапазоне от 6,8 до 7,2. В вариантах осуществления изобретения клетки кишечной энтодермы средней кишки образуют в культуре монослой. В вариантах осуществления монослой клеток кишечной энтодермы средней кишки поддерживается в культуре.
[0010] Другой вариант осуществления изобретения представляет собой способ лечения пациента, страдающего от диабета или подверженного риску его развития, включающий дифференцировку человеческих плюрипотентных стволовых клеток в клетки кишечной энтодермы средней кишки и введение дифференцированных клеток кишечной энтодермы средней кишки пациенту с диабетом. В вариантах осуществления диабет относится к 1 типу или 2 типу. В вариантах осуществления введение клеток может осуществляться посредством имплантации, инъекции или иного введения, прямого или косвенного, в участок лечения. В некоторых вариантах осуществления клетки кишечной энтодермы средней кишки имплантируют в тело, например, в подкожное пространство, сальник, печень, почку и т. п. Дополнительные варианты осуществления включают в себя инкапсуляционную доставку клеток, включая инкапсуляцию макро- или микрокапсульных устройств.
[0011] Дополнительный вариант осуществления изобретения представляет собой способ получения клеток кишечной энтодермы средней кишки, включающий индукцию дифференцировки клеток дефинитивной энтодермы в культуре в клетки примитивной кишечной трубки. В вариантах осуществления клетки дефинитивной энтодермы культивируют в культуральных средах, содержащих аскорбиновую кислоту и FGF7. В дополнительных вариантах осуществления клетки примитивной кишечной трубки культивируют в культуральных средах, содержащих ретиноевую кислоту и BMP2 или BMP4. Клетки примитивной кишечной трубки дифференцируют в клетки кишечной энтодермы средней кишки. В некоторых вариантах осуществления клетки примитивной кишечной трубки дифференцируют в клетки кишечной энтодермы средней кишки в кислых условиях (кислая культуральная среда). В конкретных вариантах осуществления кислые условия представляют собой культивирование со средой BLAR. Значение pH кислой культуры может лежать в диапазоне от 6,8 до 7,2. В вариантах осуществления клетки кишечной энтодермы средней кишки формируют и поддерживают в культуре монослой.
[0012] В каждом из вышеописанных вариантов осуществления человеческие плюрипотентные стволовые клетки представляют собой человеческие эмбриональные стволовые клетки или индуцированные плюрипотентные стволовые клетки. В каждом из вышеуказанных вариантов осуществления клетки кишечной энтодермы средней кишки экспрессируют CDX2 и FOXA2. Во всех вариантах осуществления клетки кишечной энтодермы средней кишки экспрессируют транскрипционные факторы, выбранные из SOX9, PDX1, KLF5 и HOXC5. В вариантах осуществления клетки кишечной энтодермы средней кишки не экспрессируют транскрипционные факторы, выбранные из SOX2, ALB, PTF1A, HOXA13 и LGR5. в вышеуказанных вариантах осуществления клетки кишечной энтодермы средней кишки экспрессируют CDX2, FOXA2, SOX9, PDX1, KLF5 и HOXC5. в вышеуказанных вариантах осуществления клетки кишечной энтодермы средней кишки не экспрессируют SOX2, ALB, PTF1A, HOXA13 и LGR5. В вариантах осуществления более 50% дифференцированных клеток экспрессируют маркеры, характерные для кишечной энтодермы средней кишки, предпочтительно, более чем 60% дифференцированных клеток экспрессируют характерные маркеры кишечной энтодермы средней кишки, более предпочтительно, более чем 70%, более чем 80% и более чем 90% экспрессируют характерные маркеры кишечной энтодермы средней кишки. В вариантах осуществления дифференцированные клетки, которые экспрессируют характерные маркеры кишечной энтодермы средней кишки, представляют собой клетки кишечной энтодермы средней кишки. В вариантах осуществления клетки кишечной энтодермы средней кишки экспрессируют CDX2 и FOXA2. В вариантах осуществления клетки кишечной энтодермы средней кишки экспрессируют транскрипционные факторы, выбранные из SOX9, PDX1, KLF5 и HOXC5. В вариантах осуществления клетки кишечной энтодермы средней кишки не экспрессируют транскрипционные факторы, выбранные из SOX2, ALB, PTF1A, HOXA13 и LGR5. В вариантах осуществления клетки кишечной энтодермы средней кишки не экспрессируют HAND1.
[0013] В вышеописанных вариантах осуществления популяция клеток кишечной энтодермы средней кишки по существу представляет собой клетки кишечной энтодермы средней кишки. В некоторых вариантах осуществления популяция клеток кишечной энтодермы средней кишки содержит более 70% клеток кишечной энтодермы средней кишки, предпочтительно, более чем 80%, более чем 90%, и более чем 95% клеток кишечной энтодермы средней кишки. В некоторых вариантах осуществления популяция клеток кишечной энтодермы средней кишки содержит 20% мезенхимальных клеток, предпочтительно, менее чем 15%, более предпочтительно, менее чем 10%, менее чем 5%, менее чем 2%, менее чем 1%, менее чем 0,5%. В вариантах осуществления в клетках кишечной энтодермы средней кишки отсутствует экспрессия HAND1.
[0014] В некоторых вышеописанных вариантах осуществления изобретения дифференцировку индуцируют in vitro. В других вариантах осуществления клетки кишечной энтодермы средней кишки дополнительно дифференцируются in vivo. Другой вариант осуществления относится к клеткам кишечной энтодермы средней кишки, дополнительно дифференцирующимся в энтероэндокринные клетки in vivo. Энтероэндокринные клетки экспрессируют или секретируют инкретиновые гормоны. В вариантах осуществления инкретиновые гормоны представляют собой GLP1 и GIP.
[0015] В дополнительном варианте осуществления клетки кишечной энтодермы средней кишки служат исходным материалом для идентификации низкомолекулярных соединений, способствующих более высокой эффективности дифференцировки in vitro клеток кишечной энтодермы средней кишки, во-первых, в предшественники энтероэндокринных клеток и, в конечном итоге, в экспрессирующие или секретирующие инкретин энтероэндокринные клетки.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0016] На ФИГ. 1A-1D представлен способ дифференцировки для клеток кишечной энтодермы средней кишки. На ФИГ. 1A представлено краткое описание способа дифференцировки, включая компоненты среды, ростовые факторы и низкомолекулярные соединения, добавляемые на каждой стадии, а также ключевые специфичные для каждой стадии маркеры дифференцировки клеток кишечной энтодермы средней кишки (FOXA2, forkhead box A2; CDX2, caudal type homeobox 2; KLF5, Kruppel-like factor 5; SOX9, SRY (sex determining region Y)-box 9; PDX1, pancreatic and duodenal homeobox 1; LO, low expression and protein presence). В сравнении с нейтральным pH, отмеченным на С2Д2 (7,35 ± 0,04), клетки подвергаются действию слабокислых условий в среде BLAR (термин используется взаимозаменяемо с «кислая среда BLAR») на стадии 3 (pH; С3Д1, 6,98 ± 0,05; С3Д2, 7,02 ± 0,04; С3Д5, 7,18 ± 0,03) (ФИГ. 1B) и в результате более низкого содержания бикарбоната натрия в среде BLAR. На ФИГ. 1C показаны характерные фазово-контрастные изображения монослоя на С3Д5 (слева), и клеточной линии человеческой эпителиальной аденокарциномы толстой кишки («Caco-2») (справа), которую используют в качестве сравнения при характеризации дифференцировки. Устойчиво наблюдается единообразная морфология на С3Д5. Описание количества клеток с использованием прибора Nucleocounter® NC-100 (Chemometec, г. Аллерод, Дания, кат. № 900-004) показывает, что одна клетка hESC дифференцируется в 4,56 ± 2,60 клетки кишечной энтодермы средней кишки на С3Д5 (ФИГ. 1D).
[0017] На ФИГ. 2A-2D показан способ дифференцировки с использованием костного морфогенетического белка-4 (Bone morphogenic protein-4, BMP4), позволяющий получить монослой клеток кишечной энтодермы средней кишки, содержащих как CDX2, так и FOXA2 на уровнях транскриптов и белков. На ФИГ. 2A (внизу) показано, что в 90,0 ± 5,85 процента клеток на С3Д5 одновременно присутствовал как белок CDX2, так и белок FOXA2, что сходно с процентной долей, наблюдаемой в клетках Caco-2 (86,0 ± 6,67). Напротив, клетки дефинитивной энтодермы (DE-С1Д3) лишены одновременного присутствия CDX2 и FOXA2 (2,3 ± 1,2). Анализ экспрессии генов показывает, что CDX2 был индуцирован (ФИГ. 2B), а FOXA2 сохранялся (ФИГ. 2C) в ходе стадии 3. На ФИГ. 2D показано, что индукция уровней белка CDX2 и одновременное присутствие белков CDX2/FOXA2 после установления стадии FOXA2-положительной энтодермы примитивной кишечной трубки на С2Д2 (ФИГ. 2D-i) прогрессивно возрастали к С3Д2 (ФИГ. 2D-ii), а к С3Д5 (ФИГ. 2D-iii) достигали уровней, сходных с наблюдаемыми в клетках Caco-2 (ФИГ. 2D-iv). Белок CDX2 показан в нижнем ряду, а белок FOXA2 показан в верхнем ряду. Все изображения получали с использованием одинаковых параметров, чтобы можно было выполнить количественный анализ. Экспрессию белков оценивали методом цитометрии посредством сортировки клеток с активацией флуоресценции (FACS); экспрессию генов оценивали методом количественной полимеразной цепной реакции (qPCR).
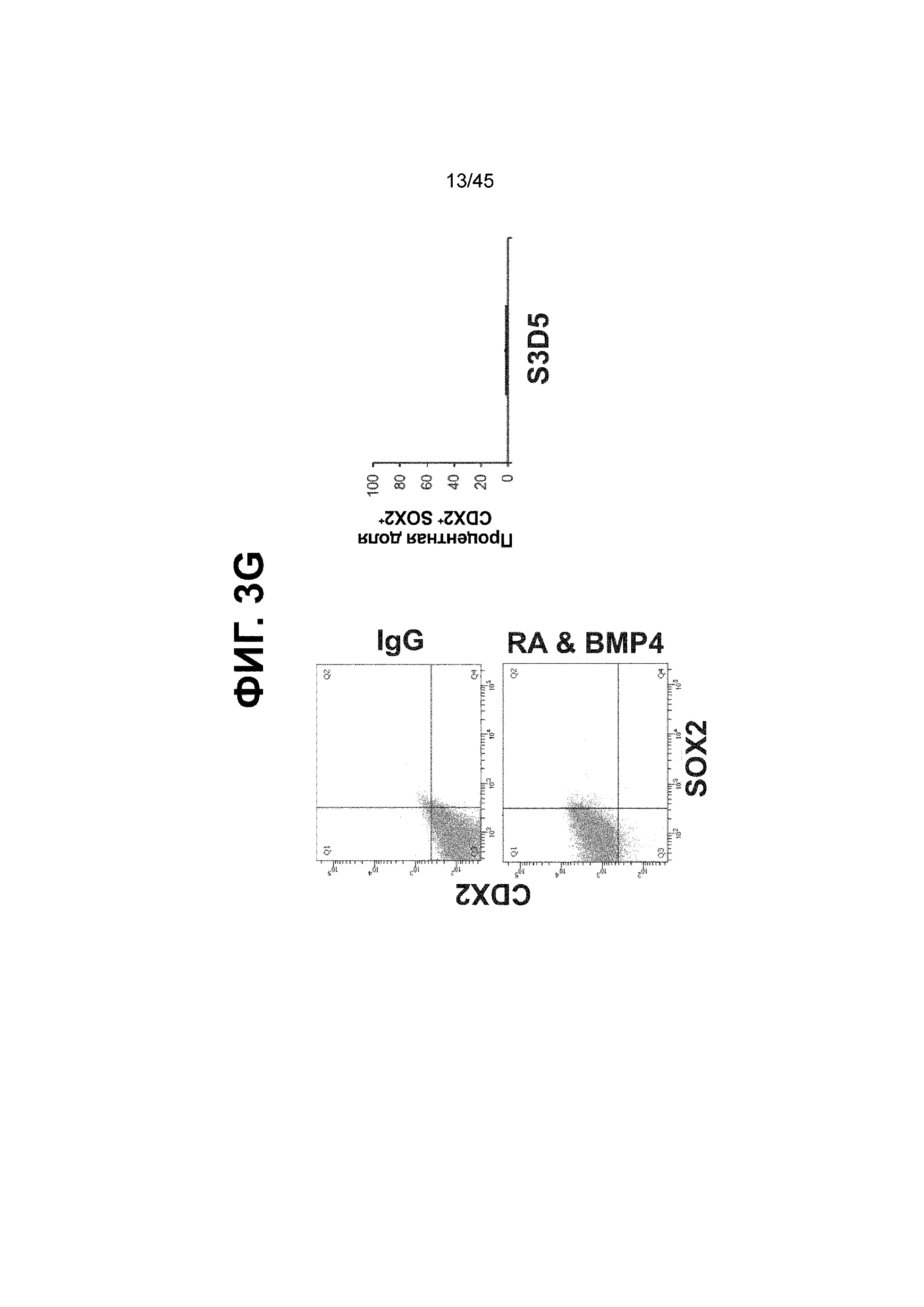
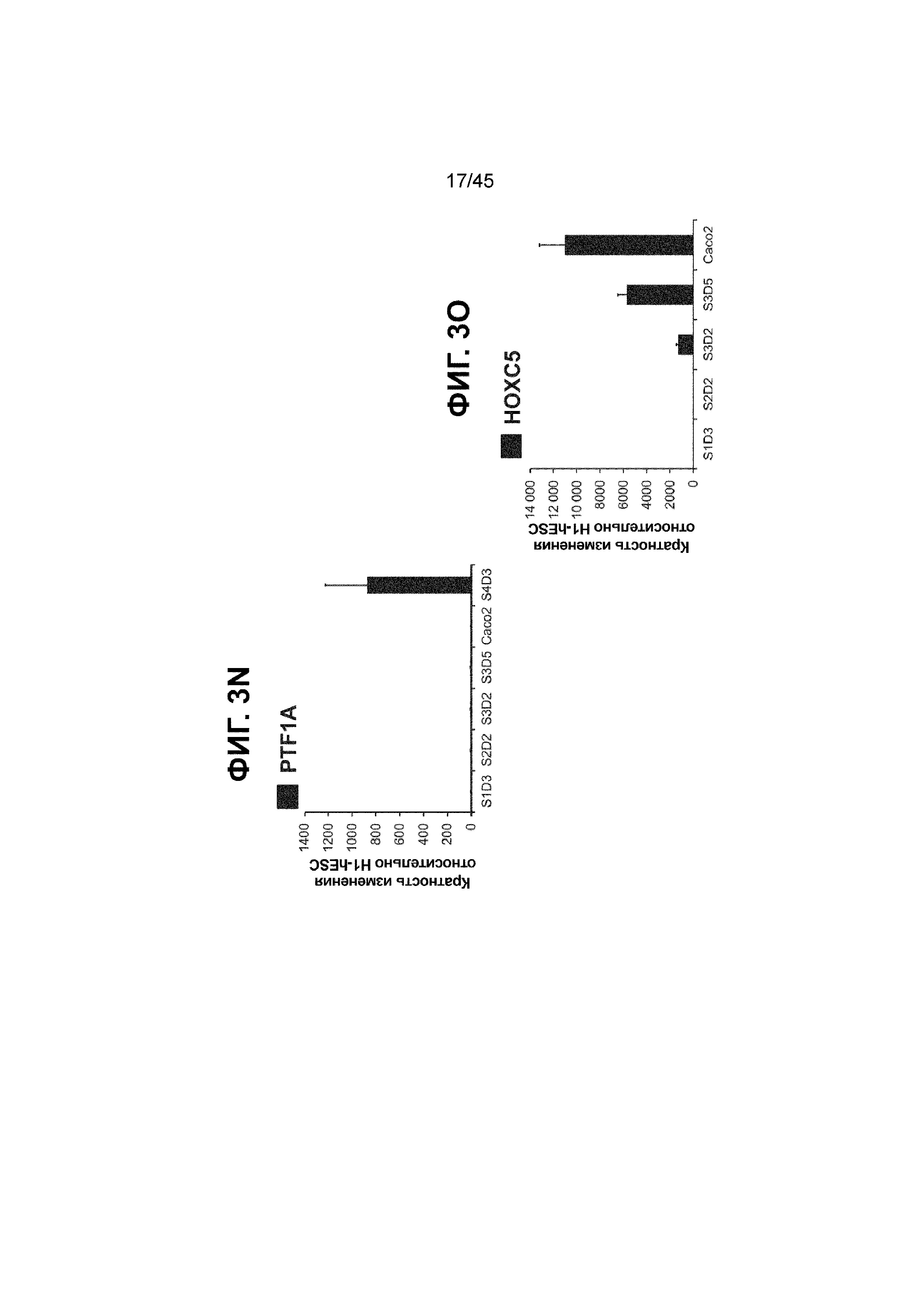
[0018] На ФИГ. 3A-3Q представлена индукция к С3Д5 уровней транскриптов и белков дополнительных транскрипционных факторов (TF), которые вызывают надежную индукцию кишечной энтодермы средней кишки; получена надлежащая кишечная энтодерма средней кишки. Наряду с совместной экспрессией CDX2 и FOXA2, клетки на С3Д5 также демонстрируют совместную экспрессию SOX9, PDX1, KLF5, HOXC5 (гомеобокс C5), но не SOX2 (SRY-box 2), ALB (альбумин), PTF1A (специфичный для поджелудочной железы транскрипционный фактор 1a) и LGR5 (богатый лейциновыми повторами сопряженный с G-белком рецептор 5). Белковая последовательность всех TF показана в отдельных одноканальных изображениях. На ФИГ. 3A (внизу) показано, что в 98,7 ± 0,25 процентах клеток одновременно присутствовали CDX2 и SOX9 на С3Д5. Наблюдали сильную индукцию экспрессии гена SOX9 до уровней, наблюдаемых в клетках Caco-2 (ФИГ. 3B), и присутствие белка, определяемое иммунофлуоресцентным (IF) анализом (ФИГ. 3C). 69,4 ± 14,2 процентов клеток были одновременно положительными по CDX2 и PDX1 (ФИГ. 3D внизу). Экспрессия гена PDX1 индуцировалась с низким уровнем по сравнению с клетками S4D3 со склонностью дифференцироваться в направлении клеток поджелудочной железы (см., например, US2014/0242693) (ФИГ. 3E), а IF анализ показал низкий уровень или отсутствие белка (ФИГ. 3F). Транскрипционный фактор переднего отдела энтодермы SOX2 не наблюдался в клетках на С3Д5, и одновременное присутствие SOX2 и CDX2 наблюдалось в 1,45 ± 0,15 процента клеток на С3Д5 (ФИГ. 3G внизу; ФИГ. 3I), и экспрессия гена была ниже уровней, наблюдаемых в клетках hESC и Caco-2 (ФИГ. 3H). Экспрессия гена KLF5, необходимого для правильно развития кишечной энтодермы средней/задней кишки, была повышена на С3Д5 (ФИГ. 3J). Наблюдали одновременное присутствие белка KLF5 в CDX2-положительных клетках на С3Д5 (ФИГ. 3K). Экспрессии гена ALB (ФИГ. 3L) и присутствия соответствующего белка (ФИГ. 3M) в клетках на С3Д5 не наблюдалось. Экспрессия гена транскрипционного фактора PTF1A, определяющего панкреатическую линию, не индуцировалась в клетках на С3Д5, в отличие клеток S4D3 со склонностью дифференцироваться в направлении клеток поджелудочной железы (ФИГ. 3N). Гомеобоксовый ген HOXC5, присутствующий в энтодерме эмбриональной средней кишки, в клетках на С3Д5 был индуцирован (ФИГ. 3O). На ФИГ. 3P показано, что LGR5, маркер эмбриональной кишечной энтодермы, который появляется у мышей в середине гестационной фазы, в клетках на С3Д5 не был индуцирован. На ФИГ. 3Q показано, что HOXA13, маркер кишечной энтодермы задней кишки, в клетках на С3Д5 не был индуцирован (ФИГ. 3P). Экспрессию генов оценивали методом количественной полимеразной цепной реакции (qPCR).
[0019] На ФИГ. 4A-4B представлен профиль пролиферации дифферецирующихся клеток на С3Д5. На ФИГ. 4A представлены клетки Caco-2, где большая часть клеток, положительных по белку CDX2 находятся в активном клеточном цикле (на что указывает совместная экспрессия с белком KI67) (слева), и индекс пролиферации клеток, производных от H1-hESC, в ходе стадии 3, который снижается со временем (С3Д2 в середине; С3Д5 справа). Уровни белков CDX2 (верхний ряд) и KI67 (нижний ряд) показаны в виде одноканальных изображений. Процентная доля положительных по белку KI67 клеток от общего числа клеток на С3Д5 (всего > 90% клеток CDX2-положительные), по данным FACS, составила 16,8 ± 3,12, в отличие от процентной доли, наблюдаемой на С1Д3 (97,3 ± 1,3) и в клетках Caco-2 (99,2 ± 0,2) (ФИГ. 4B).
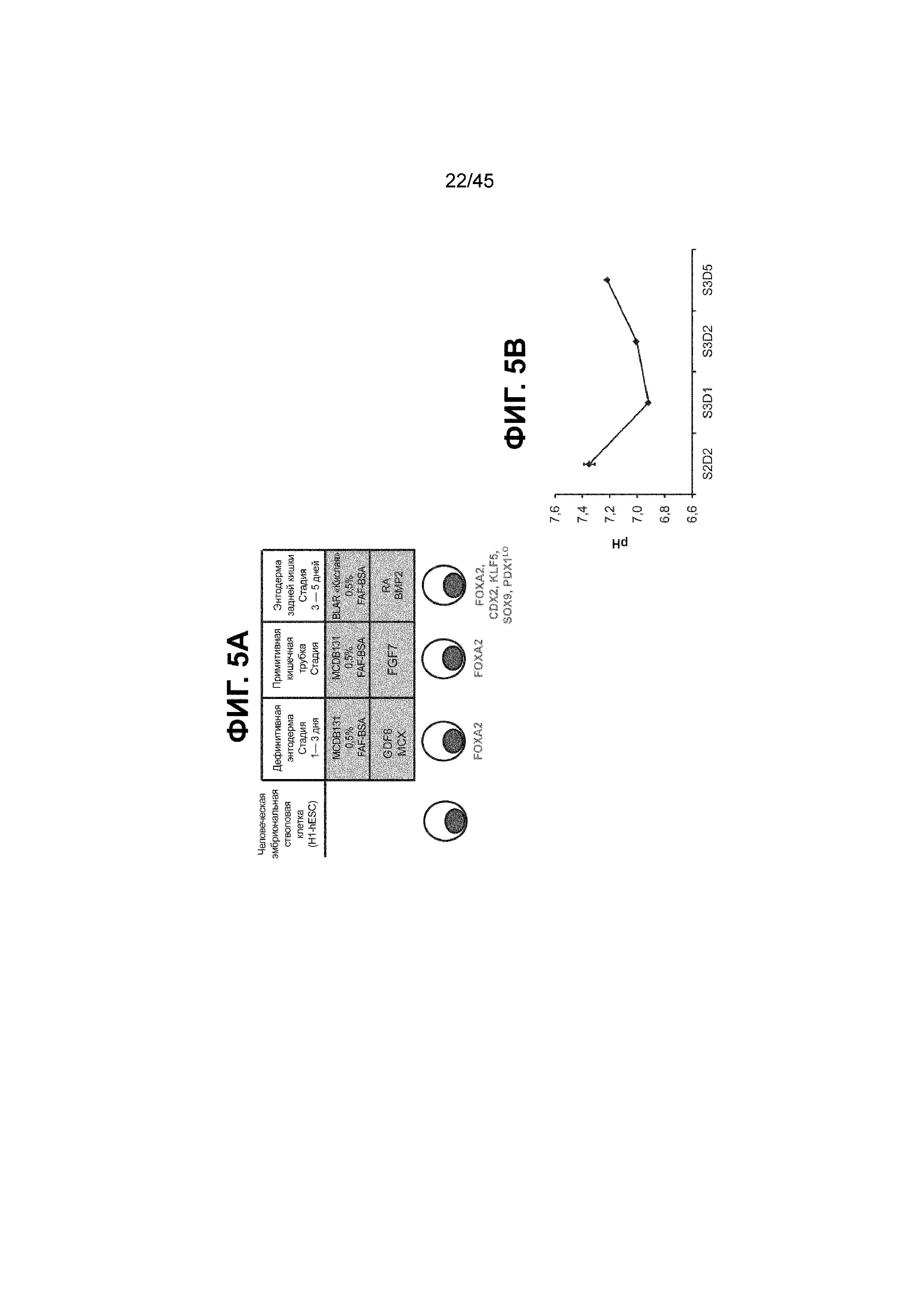
[0020] На ФИГ. 5A-5C показано использование BMP2 в качестве альтернативы BMP4 на стадии 3 для получения монослоя клеток кишечной энтодермы средней кишки с одновременным присутствием белков CDX2 и FOXA2. На ФИГ. 5A представлено краткое описание способа дифференцировки, включая компоненты среды, ростовые факторы и низкомолекулярные соединения, добавляемые на каждой стадии, а также ключевые специфичные для каждой стадии маркеры дифференцировки клеток кишечной энтодермы средней кишки (FOXA2, CDX2, KLF5, SOX9 и PDX1LO). В сравнении с нейтральным pH, отмеченным на С2Д2 (7,35 ± 0,04), клетки подвергаются действию слабокислых условий в среде BLAR в течение всей стадии 3 (pH; С3Д1, 6,92; С3Д2, 7,01; С3Д5, 7,22) (ФИГ. 5B) и в результате более низкого содержания бикарбоната натрия в среде BLAR. На ФИГ. 5C представлены характерные фазово-контрастные изображения монослоя на С3Д5 (слева) и клеток Caco-2 (справа); наблюдается единообразная морфология на С3Д5.
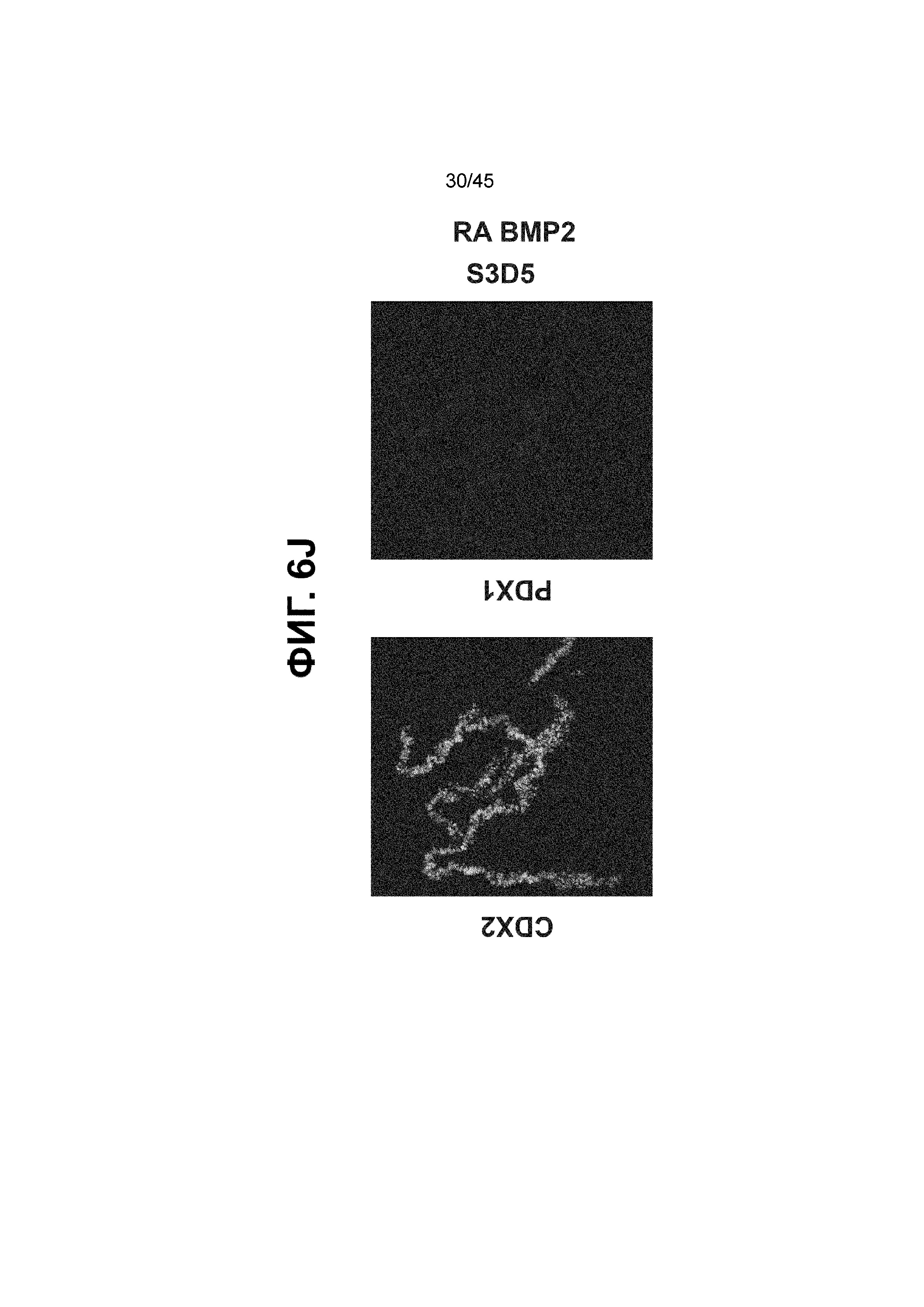
[0021] На ФИГ. 6A-6U представлено получение надлежащих клеток кишечной энтодермы средней кишки в виде монослоя, причем каждая клетка содержит CDX2, FOXA2, KLF5, SOX9, PDX1LO и HOXC5 на уровне транскриптов и белков. На IF-изображениях уровни белков транскрипционных факторов показаны в виде одноканальных изображений. На ФИГ. 6A (внизу) показано, что в 94 процентах клеток на С3Д5 одновременно присутствовал как белок CDX2, так и белок FOXA2, что сходно или превышает процентную долю, наблюдаемую в клетках Caco-2 (86,0 ± 6,67). Анализ экспрессии генов показывает, что CDX2 был индуцирован (ФИГ. 6B), а FOXA2 сохранялся (ФИГ. 6C) в ходе стадии 3. На ФИГ. 6D показаны уровни белка CDX2 и полное одновременное присутствие белков CDX2/FOXA2, индуцированное на С3Д5, достигающее уровней, сходных с наблюдаемыми в клетках Caco-2 (ФИГ. 2D-iv). На ФИГ. 6E (внизу) показано, что в 99,8 процентах клеток одновременно присутствовали CDX2 и SOX9 на С3Д5. Наблюдали сильную индукцию экспрессии гена SOX9 до уровней, наблюдаемых в клетках Caco-2 (ФИГ. 6F), и присутствие белка, определяемое IF анализом (ФИГ. 6G). 45,5 процентов клеток были одновременно положительными по CDX2 и PDX1 (ФИГ. 6H внизу). Экспрессия гена PDX1 индуцировалась при низком уровне в сравнении с клетками S4D3 со склонностью дифференцироваться в направлении клеток поджелудочной железы (ФИГ. 6I); IF анализ показал низкие уровни или отсутствие белка (ФИГ. 6J). Транскрипционный фактор переднего отдела энтодермы SOX2 не наблюдался в клетках на С3Д5, и одновременное присутствие SOX2 и CDX2 наблюдалось в 0,8 процента клеток на С3Д5 (ФИГ. 6K внизу; ФИГ. 6M), и экспрессия гена была ниже уровней, наблюдаемых в клетках hESC и Caco-2 (ФИГ. 6L). Экспрессия гена KLF5, необходимого для правильно развития кишечной энтодермы средней/задней кишки, была повышена на С3Д5 (ФИГ. 6N). Наблюдали одновременное присутствие белка KLF5 в CDX2-положительных клетках на С3Д5 (ФИГ. 6O). Экспрессии гена ALB (ФИГ. 6P) и присутствия соответствующего белка (ФИГ. 6Q) в клетках на С3Д5 не наблюдалось. Экспрессия гена транскрипционного фактора PTF1A, определяющего панкреатическую линию, не индуцировалась в клетках на С3Д5 в отличие от клеток S4D3 со склонностью дифференцироваться в направлении клеток поджелудочной железы (ФИГ. 6R). Гомеобоксовый ген HOXC5, присутствующий в кишечной энтодерме эмбриональной средней кишки, в клетках на С3Д5 был индуцирован (ФИГ. 6S). На ФИГ. 6T показано, что LGR5, маркер эмбриональной кишечной энтодермы, который появляется в середине гестационной фазы, в клетках на С3Д5 не был индуцирован. На ФИГ. 6U показано, что HOXA13, маркер кишечной энтодермы задней кишки, в клетках на С3Д5 не был индуцирован (ФИГ. 6U).
[0022] На ФИГ. 7 представлен профиль пролиферации дифференцирующихся клеток на С3Д5. По сравнению с клетками Caco-2, где большая часть клеток, положительных по белку CDX2, находились в активном клеточном цикле (на что указывает совместная экспрессия с белком KI67) (слева), индекс пролиферации клеток, производных от H1-hESC, в ходе стадии 3 был ниже (С3Д5 в середине). Уровни белков CDX2 (верхний ряд) и KI67 (нижний ряд) показаны в виде одноканальных изображений. Процент положительных по белку KI67 клеток от общего числа клеток на С3Д5 (всего > 90% клеток CDX2-положительные), по данным FACS, составила 14,1, в отличие от процента, наблюдаемого в случае клеток С1Д3 (97,3 ± 1,3) и клеток Caco-2 (99,2 ± 0,2).
[0023] На ФИГ. 8A-8F показана индукция гетерогенной популяции клеток CDX2+. На ФИГ. 8A представлено краткое описание способов дифференцировки, включая компоненты среды, ростовые факторы и низкомолекулярные соединения, добавляемые на каждой стадии, а также ключевые специфичные для каждой стадии маркеры дифференцировки клеток кишечной энтодермы средней/задней кишки (HAND1); На ФИГ. 8B представлены фазово-контрастные изображения клеток H1-hESC (верхний ряд, слева), клеток пост-стадии 1, кондиционированных в течение двух дней с 500 нг/мл FGF4 и 3 мкM Chiron99021 (верхний ряд, середина), клеток пост-стадии 1, кондиционированных в течение двух дней с 500 нг/мл FGF4 и 500 нг/мл WNT3A (верхний ряд, справа), монослоя на С3Д5, кондиционированных RA/BMP4 (нижний ряд, слева), и монослоя на С3Д5, кондиционированных RA/BMP2 (нижний ряд, справа). Показано, что индукция экспрессии генов после двухдневного кондиционирования имеет низкий уровень для CDX2 (FIG. 8C), сохраняется для энтодермального маркера FOXA2 (FIG. 8D) и индуцируется для мезодермального/мезенхимального маркера HAND1 (ФИГ. 8F). Маркер KLF5 не индуцируется (ФИГ. 8E).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0024] Необходимо понимать, что это изобретение не ограничивается конкретными способами, реагентами, соединениями, композициями или биологическими системами, которые, конечно, могут варьироваться. Следует также иметь в виду, что применяемые в настоящем документе термины используются только в целях описания конкретных вариантов осуществления настоящего изобретения и не носят ограничительного характера.
[0025] Настоящее изобретение относится к получению клеток кишечной энтодермы средней кишки. Клетки получают, используя специфическую последовательность культивирования. Соответственно, в настоящем изобретении представлена клеточная культура in vitro для дифференцировки клеток, полученных из плюрипотентных стволовых клеток, в клетки, экспрессирующие маркеры, характерные для линии дифференцирования клеток кишечной энтодермы средней кишки, такие как маркеры CDX2 и FOXA2. Изобретение дополнительно представляет метод получения и поддержания таких клеток в монослое посредством клеточной культуры в условиях in vitro. В определенных вариантах осуществления изобретение основано на открытии, согласно которому включение ретиноевой кислоты и BMP4 или BMP2 или их аналогов приводят к индукции экспрессии белка CDX2 и поддержанию экспрессии белка FOXA2 в дифференцирующихся клетках для облегчения дифференцировки в клетки кишечной энтодермы средней кишки. CDX2 не экспрессируется на уровне белка в дефинитивной энтодерме (стадия 1) или в примитивной кишечной трубке (стадия 2). Соответственно, в настоящем изобретении предлагаются способы дифференцировки плюрипотентных стволовых клеток с получением клеток кишечной энтодермы средней кишки, экспрессирующих CDX2 и FOXA2.
Определения
[0026] Все применяемые в настоящем документе технические и научные термины, если не указано иное, имеют общепринятое значение, понятное обычному специалисту в области, к которой относится изобретение. Хотя любые способы и материалы, подобные или эквивалентные тем, что описаны в этом документе, могут использоваться на практике для испытаний по настоящему изобретению, предпочтительные материалы и способы описаны в настоящем документе. При описании и изложении формулы настоящего изобретения будут применяться следующие термины.
[0027] Стволовые клетки представляют собой недифференцированные клетки, определяемые по способности единичной клетки как к самообновлению, так и к дифференцированию с образованием клеток-потомков, включая самообновляющиеся клетки-предшественники, необновляющиеся клетки-предшественники и окончательно дифференцированные клетки. Стволовые клетки также характеризуются своей способностью к дифференцированию in vitro в функциональные клетки различных клеточных линий дифференцирования из множества зародышевых листков (энтодермы, мезодермы и эктодермы), а также к порождению тканей множества зародышевых листков после трансплантации и к содействию образованию по существу большинства, если не всех, тканей после инъекции в бластоцисты.
[0028] По своему потенциалу развития стволовые клетки разделяются на: (1) тотипотентные; (2) плюрипотентные; (3) мультипотентные; (4) олигопотентные; и (5) унипотентные. Тотипотентные клетки способны давать начало всем типам эмбриональных и внеэмбриональных клеток. Плюрипотентные клетки способны давать начало всем типам эмбриональных клеток. Мультипотентные клетки включают клетки, способные преобразовываться в подмножество клеточных линий дифференцирования, но в рамках конкретной ткани, органа или физиологической системы (например, гематопоэтические стволовые клетки (ГСК) могут вырабатывать потомков, которые включают ГСК (самообновление), олигопотентные ограниченные клетки-предшественники крови и все типы клеток и элементов (например, тромбоциты), которые представляют собой нормальные компоненты крови). Клетки, которые являются олигопотентными, способны преобразовываться в более ограниченное подмножество клеточных линий дифференцирования, чем мультипотентные стволовые клетки; а клетки, которые являются унипотентными, способны преобразовываться в единственную клеточную линию дифференцирования (например, сперматогенные стволовые клетки).
[0029] Стволовые клетки также разделяются на категории по источнику их потенциального получения. Взрослая стволовая клетка по существу представляет собой мультипотентную недифференцированную клетку, которая находится в ткани, содержащей множество дифференцированных типов клеток. Взрослая стволовая клетка способна к самообновлению. В нормальных условиях она также может дифференцироваться с образованием специализированных типов клеток ткани, из которой они происходят, и возможно, тканей других типов. Индуцированные плюрипотентные стволовые клетки (iPS-клетки) представляют собой взрослые клетки, преобразованные в плюрипотентные стволовые клетки. (Takahashi et al., Cell, 2006; 126(4):663-676; Takahashi et al., Cell, 2007; 131:1-12). Эмбриональная стволовая клетка представляет собой плюрипотентную клетку из внутренней клеточной массы эмбриона на стадии бластоцисты. Фетальная стволовая клетка представляет собой клетку, происходящую из тканей или оболочек плода.
[0030] Эмбриональную ткань, как правило, определяют как ткань, происходящую из эмбриона (что для человека обозначает срок развития от оплодотворения до около шести недель). Ткань плода обозначает ткань, происходящую из плода, что для человека обозначает срок развития от приблизительно шести недель до рождения. Внеэмбриональная ткань представляет собой ткань, связанную с эмбрионом или плодом, но не происходящую из них. Внеэмбриональные ткани включают внеэмбриональные мембраны (хорион, амнион, желточный мешок и аллантоис), пуповину и плаценту (которая сама образуется из хориона и базальной отпадающей материнской плаценты).
[0031] «Дифференцировка» представляет собой процесс, при помощи которого неспециализированная («некоммитированная») или менее специализированная клетка приобретает характеристики специализированной клетки, например, такой как клетка кишечника или клетка поджелудочной железы. Дифференцированная клетка представляет собой клетку, занявшую более специализированное («коммитированное») положение в пределах клеточной линии дифференцирования. Термин «коммитированная» применительно к процессу дифференцировки относится к клетке, дошедшей в процессе дифференцировки до стадии, с которой в нормальных условиях она продолжит дифференцироваться до конкретного типа клеток или подмножества типов клеток и не сможет в нормальных условиях дифференцироваться в иной тип клеток или вернуться к менее дифференцированному типу клеток. Дедифференцирование относится к процессу, в ходе которого клетка возвращается к менее специализированному (или коммитированному) положению в линии дифференцирования клетки. Используемый в настоящем документе термин «клеточная линия дифференцирования» определяет наследственность клетки, т. е. определяет, из какой клетки произошла данная клетка и каким клеткам она может дать начало. Клеточная линия дифференцировки помещает клетку в пределы наследственной схемы развития и дифференцировки.
[0032] В широком смысле, «клетка-предшественник» представляет собой клетку, обладающую способностью к созданию клеток-потомков, которые будут более дифференцированы по сравнению с ней, и при этом сохраняющую способность к восполнению пула клеток-предшественников. По данному определению сами стволовые клетки также являются клетками-предшественницами, поскольку являются ближайшими предками окончательно дифференцированных клеток. В более узком смысле клетку-предшественника часто определяют как клетку, которая является промежуточной в процессе дифференцирования, т. е. она происходит из стволовой клетки и является промежуточным звеном в продукции зрелого типа клеток или подмножества типов клеток. Клетки-предшественницы этого типа по существу не способны к самообновлению. Соответственно, при упоминании клетки данного типа в настоящем документе она будет обозначать необновляющуюся клетку-предшественник или промежуточную клетку-предшественник.
[0033] В контексте настоящего документа термин «маркеры» означает молекулы нуклеиновых кислот или полипептидов, которые дифференциально экспрессируются в интересующей клетке. В данном контексте под дифференциальной экспрессией понимают повышенный уровень положительного маркера и пониженный уровень отрицательного маркера по сравнению с недифференцированной клеткой. Обнаруживаемый уровень маркерной нуклеиновой кислоты или полипептида в интересующих клетках оказывается значительно выше или ниже по сравнению с другими клетками, что позволяет идентифицировать интересующую клетку и отличать ее от других клеток с помощью любого из множества способов, известных в данной области.
[0034] В контексте настоящего документа клетка «положительна по» заданному маркеру или «положительна», если заданный маркер явно обнаруживается в клетке. Аналогично клетка «отрицательна по» заданному маркеру или «отрицательна», если заданный маркер не обнаруживают в клетке. В частности, положительность по цитометрии посредством сортировки клеток с активацией флуоресценции (FACS) обычно превышает 2%, в то время как отрицательный предел по FACS обычно составляет менее 1%.
[0035] В настоящем документе положительность по данным ПЦР в реальном времени (ПЦР-РВ) составляла менее чем 28 циклов (Cts), а при использовании анализа Taqman® Low Density Array (TLDA) составляла менее чем 33 Cts; тогда как отрицательность по данным Open Array® соответствует более 28,5 циклам, а отрицательность по TLDA соответствует более 33,5 Cts.
[0036] Для дифференцировки плюрипотентных стволовых клеток в функциональные клетки кишечной энтодермы средней кишки в статичной клеточной культуре in vitro, процесс дифференцировки часто рассматривают как проходящий последовательные стадии. В данном случае процесс дифференцировки в кишечную энтодерму средней кишки проходит три стадии. В этой постадийной прогрессии «стадия 1» относится к первому шагу в процессе дифференцировки, дифференцировке плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для клеток дефинитивной энтодермы (здесь и далее упоминаются как «клетки стадии 1»). «Стадия 2» относится ко второму шагу, дифференцировке клеток, экспрессирующих маркеры, характерные для клеток дефинитивной энтодермы, в клетки, экспрессирующие маркеры, характерные для клеток примитивной кишечной трубки (здесь и далее упоминаются как «клетки стадии 2»). «Стадия 3» относится к третьему шагу, дифференцировке клеток, экспрессирующих маркеры, характерные для клеток кишечной трубки, в клетки, экспрессирующие маркеры, характерные для клеток кишечной энтодермы средней кишки (здесь и далее упоминаются как «клетки стадии 3»).
[0037] Однако, следует отметить, что не все клетки в отдельно взятой популяции прогрессируют через эти стадии с одинаковой скоростью. Вследствие этого, в клеточных культурах в условиях in vitro нередко обнаруживается присутствие клеток, которые прогрессировали менее или более по пути дифференцировки, чем большинство клеток, присутствующих в популяции, в особенности на поздних стадиях дифференцировки. Для иллюстративных нужд настоящего изобретения в настоящем документе описаны характеристики различных типов клеток, связанных с определенными выше стадиями.
[0038] «Клетки дефинитивной энтодермы», как используется в настоящем документе, относится к клеткам, которые несут в себе характеристики клеток, появившиеся из эпибласта во время гаструляции, и которые формируют желудочно-кишечный тракт и его производные. Клетки дефинитивной энтодермы экспрессируют по меньшей мере один из следующих маркеров: FOXA2 (также известный куак гепатоцитный ядерный фактор 3-β (HNF3β)), GATA4, SOX17, CXCR4, брахиурия, Cerberus, OTX2, goosecoid, C-Kit, CD99, и MIXL1. Маркерные характеристики клеток дефинитивной энтодермы включают CXCR4, FOXA2 и SOX17. Таким образом, клетки дефинитивной энтодермы могут быть охарактеризованы их экспрессией CXCR4, FOXA2 и SOX17. Дополнительно, в зависимости от длительности времени, на протяжении которого клеткам позволяется оставаться на стадии 1, можно наблюдать рост в HNF4α.
[0039] В настоящем документе «клетки примитивной кишечной трубки» обозначает клетки, полученные из дефинитивной энтодермы, из которых могут образоваться все энтодермальные органы, такие как легкие, печень, поджелудочная железа, желудок и кишечник. Клетки примитивной кишечной трубки могут характеризоваться своей по существу растущей экспрессией HNF4α, выше, чем экспрессия клеток дефинитивной энтодермы.
[0040] В контексте настоящего документа выражение «клетки энтодермы передней кишки» относится к клеткам энтодермы, которые дают начало пищеводу, легким, желудку, печени, поджелудочной железе, желчному пузырю и самого переднего участка двенадцатиперстной кишки. Клетки энтодермы передней кишки могут характеризоваться экспрессией, среди прочего, SOX2, PDX1, ALB, SOX17 и FOXA2.
[0041] «Клеткой кишечной энтодермы средней кишки» в настоящем документе называются энтодермальные клетки, из которых образуется тонкий кишечник. Таким образом, клетки кишечной энтодермы средней кишки могут характеризоваться экспрессией CDX2, FOXA2 и низкой экспрессией PDX1 (PDX1LO). Экспрессия некоторых генов HOX позволяет различать энтодерму средней и задней кишки. Например, HOXC5 предпочтительно экспрессируется в энтодермальных клетках средней кишки.
[0042] «Клеткой энтодермы задней кишки» в настоящем документе называются энтодермальные клетки, из которых образуется толстый кишечник. Клетки энтодермы задней кишки могут характеризоваться своей экспрессией CDX2, FOXA2, HOXA13 и HOXD13.
[0043] «Мезенхимальной клеткой» в настоящем документе называются мезодермальные клетки, из которых образуются соединительные ткани, такие как кость, хрящ, лимфатическая и кровеносная системы. Мезенхимальные клетки определяются экспрессией HAND1 и FOXF1.
[0044] В настоящем документе термин «пациент» или «субъект», или «хозяин» относится к животным, включая млекопитающих, предпочтительно людей, которые подвергаются лечению с помощью композиций или фармацевтических композиций или в соответствии со способами, описанными в настоящем документе.
[0045] Термином «эффективное количество» или его эквивалентами называется количество агента или соединения, включая без ограничений ростовой фактор, достаточное для стимуляции и дифференцировки человеческих плюрипотентных стволовых клеток в дифференцированную клеточную популяцию, например, в дефинитивную энтодерму, энтодерму передней кишки, кишечную энтодерму средней кишки, энтодерму задней кишки, панкреатическую энтодерму и т. п.
[0046] Термины «ввод» и «введение» используются в настоящем документе взаимозаменяемо и означают, что клетки можно имплантировать, вводить путем инъекции, трансплантации или иным способом, непосредственно или косвенно в место лечения. Если клетки вводятся в полутвердых или твердых устройствах, подходящим средством доставки является имплантация, в частности, хирургическая имплантация в точное место в организме, например, в подкожное пространство, сальник, печень, почку (почечную капсулу). Жидкие или текучие фармацевтические композиции можно вводить в более обширные места.
[0047] При использовании в этом описании и в прилагаемой формуле изобретения формы единственного числа включают и множественное число, если содержание текста ясно не указывает на иное. Так, например, ссылка на «клетку» включает в себя комбинацию двух или более клеток и т. п.
[0048] Используемый в настоящем документе термин «около», когда он относится к измеряемому значению, такому как количество, длительность времени и т. п., означает колебания в пределах от ± 20% до ± 0,1%, предпочтительно ± 20% или ± 10%, более предпочтительно ± 5%, еще более предпочтительно ± 1%, и еще более предпочтительно ± 0,5%, ± 0,1%. Такие вариации как 0,05% или 0,01% от установленного значения являются подходящими для выполнения указанных способов.
[0049] В описании и пунктах формулы изобретения могут использоваться следующие сокращения:
ABCG2 - ATP-Binding Cassette, Sub-Family G, Member 2 (АТФ-связывающая кассета, подсемейство G, член 2);
ALB - альбумин;
BMP - bone morphogenic protein (костный морфогенетический белок);
CDX2 - caudal type homeobox 2 (гомеобокс 2 каудального типа);
CXCR4 - C-X-C chemokine receptor type 4 (C-X-C хемокиновый рецептор типа 4);
FAF-BSA - Не содержащий жирных кислот бычий сывороточный альбумин
FGF - фактор роста фибробластов;
FOXA2 - Forkhead Box A2 (белок А2 типа Forkhead Box);
GATA4 - GATA binding protein 4 (связывающийся с GATA белок 4);
GDF - growth differentiation factor (ростовой дифференцировочный фактор);
GIP - glucose-dependent insulinotropic polypeptide (глюкозозависимый инсулинотропный полипептид);
GLP-1 - glucagon-like peptide 1 (глюкагон-подобный белок 1);
GSK3B - Glycogen synthase kinase 3 beta (гликогенсинтазакиназа 3-бета);
HAND1- heart и neural crest derivatives expressed 1 (экспрессируемый в производных сердца и нервного гребня белок 1);
HOX - homeobox (гомеобокс);
hTERT - human telomerase reverse transcriptase (человеческая теломеразная обратная транскриптаза);
KLF - Kruppel-like factor (Kruppel-подобный фактор);
LGR5 - leucine rich repeat containing G protein coupled receptor 5 (содержащий богатые лейцином повторы сопряженный с G-белком рецептор 5);
MIXL1 - Mix Paired-Like Homeobox-1 (Mix Paired-подобный гомеобокс 1);
OCT4 - octamer-binding transcription factor 4 (связывающийся с октамером транскрипционный фактор 4);
OTX2 - orthodenticle homeobox 2 (ортодентикульный гомеобокс 2);
PDX1 - pancreatic и duodenal homeobox 1 (панкреатический и дуоденальный гомеобокс 1);
PTF1A - pancreas specific transcription factor, 1a (специфический для поджелудочной железы транскрипционный фактор 1а);
SOX - sex determining region Y (SRY)-box (определяющий пол бокс Y);
TRA1-60 - T cell receptor alpha-1-60 (Т-клеточный рецептор альфа 1-60);
UTF1 - Undifferentiated embryonic cell transcription factor 1 (транскрипционный фактор недифференцированных эмбриональных клеток 1);
WNT3A - wingless-type MMTV integration site family, member 3A (семейство сайтов интеграции MMTV типа wingless, член 3A); и
ZFP42 - белок «цинковые пальцы» 42.
Подробное описание
[0050] Плюрипотентные стволовые клетки имеют потенциал дифференцировки в клетки всех трех зародышевых листков: в энтодертмальные, мезодермальные и эктодермальные ткани. Примерные типы плюрипотентных стволовых клеток, которые можно применять, включают в себя устойчивые линии плюрипотентных клеток, в том числе преэмбриональной ткани (такой как, например, бластоцист), эмбриональной ткани или ткани плода, взятой в любой момент во время беременности, как правило, но не обязательно перед сроком приблизительно от 10 до 12 недель беременности. Не имеющими ограничительного характера примерами являются устойчивые линии эмбриональных стволовых клеток человека, такие как, например, эмбриональные стволовые клетки человека линий H1, H7 и H9 (WiCell Research Institute, г. Мэдисон, штат Висконсин, США). Также подходят клетки, взятые из популяции плюрипотентных стволовых клеток, уже культивированных в отсутствие питающих клеток. iPS или перепрограммированные плюрипотентные клетки, полученные из зрелых соматических клеток с помощью принудительной экспрессии ряда факторов транскрипции, относящихся к плюрипотенции, таких как OCT4, NANOG, SOX2, KLF4 и ZFP42 (Annu Rev Genomics Hum Genet 2011, 12:165-185; см. также iPS, Cell, 126(4): 663-676), также могут применяться. Эмбриональные стволовые клетки человека, которые используются в способах настоящего изобретения, также могут быть получены, как описано Thomson et al. (патент США № 5,843,780; Science, 1998, 282:1145-1147; Curr Top Dev Biol 1998, 38:133-165; Proc Natl Acad Sci U.S.A. 1995, 92:7844-7848). Мутантные линии эмбриональных стволовых клеток человека, такие как BG01v (BresaGen, г. Афины, штат Джорджия, США), или клетки, полученные из зрелых соматических клеток человека, такие как клетки, описанные в Takahashi et al., Cell 131: 1-12 (2007), также могут применяться. В определенных вариантах осуществления плюрипотентные стволовые клетки, приемлемые для применения в настоящем изобретении, могут быть получены в соответствии со способами, описанными в: Li et al. (Cell Stem Cell 4: 16-19, 2009); Maherali et al. (Cell Stem Cell 1: 55-70, 2007); Stadtfeld et al. (Cell Stem Cell 2: 230-240); Nakagawa et al. (Nature Biotechnol 26: 101-106, 2008); Takahashi et al. (Cell 131: 861-872, 2007); и заявке на патент США на патент США № 2011/0104805. В определенных вариантах осуществления плюрипотентные стволовые клетки могут иметь неэмбриональное происхождение. Все эти ссылки, патенты и заявки на патенты полностью включены в настоящий документ путем ссылки, в частности, поскольку они относятся к выделению, культивированию, размножению и дифференцировке плюрипотентных клеток.
[0051] Плюрипотентные стволовые клетки дифференцируются через различные стадии, каждая из которых может характеризоваться наличием или отсутствием определенных маркеров. Дифференцировка клеток на этих стадиях достигается путем создания специфических условий культивирования, в том числе присутствие или отсутствие определенных факторов, добавленный в культуральную среду. В целом, эта дифференцировка может задействовать дифференцировку плюрипотентных стволовых клеток в дефинитивные клетки энтодермы (здесь и далее упоминаются как «стадия 1»). Такие клетки дефинитивной энтодермы дополнительно можно дифференцировать в клетки примитивной кишечной трубки, именуемые в настоящем документе клетками стадии 2. Клетки примитивной кишечной трубки, в свою очередь, далее можно дифференцировать в клетки кишечной энтодермы средней кишки, именуемые в настоящем документе клетками стадии 3.
Дифференцировка плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для клеток кишечной эндодермы средней кишки
[0052] Характеристики плюрипотентных стволовых клеток хорошо известны специалистам в данной области, и продолжается выявление дополнительных характеристик плюрипотентных стволовых клеток. Маркеры плюрипотентных стволовых клеток включают в себя, например, экспрессию одного или более из следующих маркеров: ABCG2; Cripto; FOXD3; CONNEXIN43; CONNEXIN45; OCT4; SOX2; NANOG; hTERT; UTF1; ZFP42; SSEA-3; SSEA-4; TRA-1-60; и TRA-1-81.
[0053] Примеры плюрипотентных стволовых клеток включают линию H1 человеческих эмбриональных стволовых клеток (код NIH: WA01), человеческие эмбриональные стволовые клетки линии H9 (код NIH: WA09), человеческие эмбриональные стволовые клетки линии H7 (код NIH: WA07), а также человеческие эмбриональные стволовые клетки линии SA002 (Cellartis, Швеция). Также приемлемыми являются клетки, экспрессирующие по меньшей мере один из следующих маркеров, характерных для плюрипотентных клеток: ABCG2, Cripto, CD9, FOXD3, CONNEXIN43, CONNEXIN45, OCT4, SOX2, NANOG, hTERT, UTF1, ZFP42, SSEA-3, SSEA-4, TRA-1-60 и TRA-1-81.
[0054] Также подходящими для применения в рамках настоящего изобретения являются клетки с экспрессией по меньшей мере одного из маркеров, характерных для линии дифференцирования дефинитивной энтодермы. В одном из вариантов осуществления настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии дифференцирования дефинитивной энтодермы, представляет собой клетку-предшественника первичной полоски. В альтернативном варианте осуществления клетка, экспрессирующая маркеры, характерные для линии дифференцирования дефинитивной энтодермы, представляет собой мезэнтодермальную клетку. В альтернативном варианте осуществления клетка, экспрессирующая маркеры, характерные для линии дифференцирования дефинитивной энтодермы, представляет собой клетку дефинитивной энтодермы.
[0055] Также для применения в настоящем изобретении приемлемой является клетка, экспрессирующая по меньшей мере один из маркеров, характерных для линии кишечной энтодермы средней кишки. В одном из вариантов осуществления данного изобретения клетка, экспрессирующая маркеры, характерные для линии дифференцирования кишечной энтодермы, представляет собой клетку кишечной энтодермы средней кишки, экспрессирующую FOXA2 и CDX2. В некоторых вариантах осуществления клетка не экспрессирует SOX2, ALB, PTF1A, HOXA13 или LGR5. В этих вариантах осуществления клетка, экспрессирующая маркеры, характерные для линии дифференцирования кишечной энтодермы, представляет собой клетку кишечной энтодермы средней кишки, экспрессирующую каждый из следующих маркеров FOXA2, CDX2, SOX9, PDX1, KLF5 и HOXC5. В этих вариантах осуществления клетка, экспрессирующая маркеры, характерные для линии дифференцирования кишечной энтодермы, представляет собой клетку кишечной энтодермы средней кишки, которая не экспрессирует ни один из следующих маркеров SOX2, ALB, PTF1A, HOXA13 и LGR5.
[0056] В изобретении предлагается постадийная направленная дифференцировка плюрипотентных стволовых клеток в клетки кишечной энтодермы средней кишки с использованием условий клеточной культуры и сред. В вариантах осуществления изобретения для получения клетки, экспрессирующей маркеры, характерные для клеток кишечной энтодермы средней кишки, применяется протокол, начинающийся с плюрипотентных стволовых клеток, таких как эмбриональные стволовые клетки и индуцированные плюрипотентные клетки. Данный протокол включает следующие стадии.
Стадия 1: Плюрипотентные стволовые клетки, такие как эмбриональные стволовые клетки, полученные для культуры клеточных линий, обрабатываются соответствующими факторами для стимулирования дифференцировки в клетки, экспрессирующие маркеры, характерные для дефинитивных энтодермальных клеток.
Стадия 2: Клетки, полученные на стадии 1, обрабатываются соответствующими факторами для стимулирования дополнительной дифференцировки в клетки, экспрессирующие маркеры, характерные для клеток примитивной кишечной трубки.
Стадия 3: Клетки, полученные на стадии 2, обрабатываются соответствующими факторами для стимулирования дополнительной дифференцировки в клетки, экспрессирующие маркеры, характерные для клеток кишечной энтодермы средней кишки.
[0057] Способы оценки экспрессии белковых маркеров и маркеров нуклеиновых кислот в культивированных или выделенных клетках являются стандартными для данной области. Эти способы включают в себя ОТ-ПЦР, Нозерн-блоттинг, гибридизацию in situ (см., например, Current Protocols in Molecular Biology (Ausubel et al., eds. 2001 г., дополнение)), а также иммунологические анализы (такие как иммуногистохимический анализ среза материала), Вестерн-блоттинг, а для маркеров, доступных в интактных клетках, - способ проточной цитометрии (FACS) (см., например, Harlow and Lane, Using Antibodies: A Laboratory Manual, New York: Cold Spring Harbor Laboratory Press (1998)). Эффективность дифференцировки может быть определена путем обработки популяции клеток агентом (например, антителом), специфически распознающим белковый маркер, экспрессированный клетками, экспрессирующими маркеры, характерные для интересующего типа клеток.
1. Дифференцировка плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для клеток дефинитивной энтодермы.
[0058] Плюрипотентные стволовые клетки можно дифференцировать в клетки, экспрессирующие маркеры, характерные для клеток дефинитивной энтодермы, с использованием любого способа, известного специалистам в данной области, или любого способа, предложенного в настоящем изобретении. В одном варианте осуществления изобретения плюрипотентные стволовые клетки обрабатывают средой, такой как среда MCDB-131 (Life Technologies, г. Карлсбад, штат Калифорния, США), обогащенной факторами, включающими ингибитор GDF8 и GSK3β (такими как циклические анилин-пиридинотриазиновые соединения, описанные в заявке на патент США № 2010/0015711; полностью включенной в данный документ путем ссылки) для стимулирования дифференцировки в клетки, экспрессирующие маркеры, характерные для клеток дефинитивной энтодермы. Существует широкий спектр ингибиторов GSK3β, таких как стауроспорин, а предпочтительный ингибитор GSK3β, 14-проп-2-ен-1-ил-3,5,7,14,17,23,27-гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~] гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаен-16-он, именуется в настоящем документе «соединение MCX». Обработка может включать контакт плюрипотентных стволовых клеток со средой, обогащенной от около 10 нг/мл до около 1000 нг/мл, предпочтительно от около 50 нг/мл до около 150 нг/мл, альтернативно от около 75 нг/мл до около 125 нг/мл, альтернативно около 100 нг/мл GDF8. Обработка может также включать в себя контакт клеток с от около 0,1 до около 10 мкМ, предпочтительно от около 0,1 до около 5 мкМ, предпочтительно от около 0,5 до около 2,5 мкМ, предпочтительно около 1,5 мкМ или около 1,0 мкМ композиции МСХ. К другим компонентам среды могут относиться: бикарбонат натрия в количестве от около 2,7 г/1000 мл до 3,6 г/1000 мл, предпочтительно 2,7 г/1000 мл; FAF-BSA в количестве от около 0,1% до 2,0%, предпочтительно около 0,5%; GlutaMAX™ (Life Technologies Corporation, г. Карлсбад, штат Калифорния, США) с разведением 1: 100 («концентрация 1X»); и D-глюкоза с концентрацией в диапазоне от около 2 мМ до 20 мМ, предпочтительно 4,5 мМ, для получения концентрации D-глюкозы 10 мМ.
[0059] Плюрипотентные клетки можно культивировать на протяжении приблизительно двух-пяти дней, предпочтительно приблизительно три-четыре дня, для обеспечения удобства их дифференцировки в клетки дефинитивной энтодермы. В одном из вариантов осуществления плюрипотентные клетки культивируют в присутствии эффективного количества сигнальной молекулы TGFβ и/или ингибитора GSK3β, например, эффективного количества GDF8 и композиции МСХ на протяжении одного дня, с последующим культивированием в присутствии GDF8 и более низкой концентрации композиции МСХ на протяжении одного дня, с последующим культивированием в присутствии GDF8 на протяжении одного дня в отсутствии композиции МСХ. В частности, клетки культивируют в присутствии GDF8 и около 1,5 мкМ композиции МСХ на протяжении одного дня, с последующим культивированием в присутствии GDF8 и около 0,1 мкМ композиции МСХ на протяжении одного дня, с последующим культивированием в присутствии GDF8 на протяжении одного дня без добавления композиции МСХ. В другом варианте осуществления клетки можно культивировать в присутствии GDF8 и около 1,5 мкМ композиции МСХ на протяжении одного дня, с последующим культивированием в присутствии GDF8 и около 0,1 мкМ композиции МСХ на протяжении одного дня.
[0060] Образование клеток, экспрессирующих маркеры, характерные для клеток дефинитивной энтодермы, можно определить путем проверки на наличие маркеров до и после выполнения конкретного протокола. Плюрипотентные стволовые клетки, как правило, не экспрессируют таких маркеров. Таким образом, дифференцировка плюрипотентных клеток может быть обнаружена, когда клетки начинают экспрессировать маркеры, характерные для клеток дефинитивной энтодермы, таких как CXCR4, FOXA2 и SOX17. В вариантах осуществления клетки, экспрессирующие маркеры, характерные для клеток дефинитивной энтодермы, представляют собой клетки дефинитивной энтодермы.
2. Дифференцировка клеток экспрессирующих маркеры, характерные для клеток дефинитивной эндодермы, в клетки, экспрессирующие маркеры, характерные для клеток примитивной кишечной трубки.
[0061] Клетки экспрессирующие маркеры, характерные для клеток дефинитивной эндодермы, могут быть дополнительно дифференцированы в клетке, экспрессирующие маркеры, характерные для клеток примитивной кишечной трубки. В одном из вариантов осуществления формирование клеток, экспрессирующих маркеры, характерные для клеток примитивной кишечной трубки, включает культивирование клеток, экспрессирующих маркеры, характерные для клеток дефинитивной энтодермы с такой средой как MCDB-131, содержащей FGF7 для дифференцировки этих клеток. Например, культуральная среда может содержать от около 10 нг/мл до 100 нг/мл, предпочтительно от около 25 нг/мл до около 75 нг/мл, альтернативно от около 30 нг/мл до около 60 нг/мл, альтернативно около 50 нг/мл FGF7. Клетки можно культивировать в этих условиях на протяжении двух-трех дней, предпочтительно около двух дней.
[0062] В другом варианте осуществления дифференцировка в клетки, экспрессирующие маркеры, характерные для клеток примитивной кишечной трубки, включает культивирование клеток, экспрессирующих маркеры, характерные для клеток дефинитивной энтодермы, с FGF7 и аскорбиновой кислотой (витамином С). Культуральная среда, такая как MCDB-131, может содержать от приблизительно 0,1 мМ до приблизительно 1,0 мМ аскорбиновой кислоты, предпочтительно от около 0,1 мМ до около 1,0 мМ, альтернативно от приблизительно 0,2 мМ до приблизительно 0,4 мМ, альтернативно приблизительно 0,25 мМ аскорбиновой кислоты. Культуральная среда может содержать от около 10 нг/мл до 100 нг/мл, предпочтительно от около 10 нг/мл до около 50 нг/мл, альтернативно от около 15 нг/мл до около 30 нг/мл, альтернативно около 50 нг/мл или около 25 нг/мл FGF7. Например, культуральная среда может включать около 0,25 мМ аскорбиновой кислоты и около 50 нг/мл FGF7. К другим компонентам среды могут относиться: бикарбонат натрия в концентрации от около 2,7 г/1000 мл до 3,6 г/1000 мл, предпочтительно 2,7 г/1000 мл; FAF-BSA в количестве от около 0,1% до 2,0%, предпочтительно около 0,5%; GlutaMAX™ с разведением 1: 100 («концентрация 1X»); и D-глюкоза с концентрацией в диапазоне от около 2 мМ до 20 мМ, предпочтительно 4,5 мМ, для получения концентрации D-глюкозы10 мМ. В одном из вариантов осуществления клетки, экспрессирующие маркеры, характерные для клеток дефинитивной энтодермы, обрабатывают FGF7 и аскорбиновой кислотой на протяжении 2 дней. Дифференцировку клеток дефинитивной энтодермы можно обнаружить, когда клетки начинают экспрессировать маркеры, характерные для клеток примитивной кишечной трубки, например, по экспрессии FOXA2 и повышенной экспрессии HNF4α. В вариантах осуществления клетки, экспрессирующие маркеры, характерные для клеток примитивной кишечной трубки, представляют собой клетки примитивной кишечной трубки.
3. Дифференцировка клеток, экспрессирующих маркеры, характерные для клеток кишечной трубки, в клетки, экспрессирующие маркеры, характерные для клеток кишечной энтодермы средней кишки.
[0063] Клетки, экспрессирующие маркеры, характерные для клеток примитивной кишечной трубки, могут дополнительно дифференцироваться в клетки, экспрессирующие маркеры, характерные для клеток кишечной энтодермы средней кишки. В одном варианте осуществления клетки примитивной кишечной трубки дополнительно дифференцируются в клетки кишечной энтодермы средней кишки путем культивирования клеток примитивной кишечной трубки в культуральной среде, такой как среда BLAR (Life Technologies, Corporation, г. Карлсбад, штат Калифорния, США), с добавлением ретиноевой кислоты и BMP4 или BMP2. В предпочтительном варианте осуществления в среду добавляют от около 0,5 мкM до около 5 мкM ретиноевой кислоты, предпочтительно около 1 мкM, и от около 10 нг/мл до около 100 нг/мл BMP4 или BMP2, предпочтительно около 50 нг/мл BMP4 или BMP2. К другим добавкам к среде могут относиться: FAF-BSA в количестве от около 0,1% до 2,0%, предпочтительно около 0,5%; GlutaMAX™; и D-глюкоза с концентрацией в диапазоне от около 2 мМ до 20 мМ, предпочтительно 4,5 мМ, для получения концентрации D-глюкозы10 мМ. В одном варианте осуществления клетки, экспрессирующие маркеры, характерные для клеток примитивной кишечной трубки, обрабатывают в течение 3-5 дней, предпочтительно в течение 5 дней BMP4 или BMP2 и ретиноевой кислотой. pH культуры в ходе 5-дневного периода кондиционирования стадии 3 может лежать в диапазоне от 6,8 до 7,2 (в сравнении с нормальным pH на С2Д2, составляющим 7,3 или более).
[0064] Изобретение относится к способу получения популяции клеток кишечной энтодермы средней кишки путем культивирования человеческих плюрипотентных стволовых клеток в выбранной культуральной среде с целью получения клеток кишечной энтодермы средней кишки. В вариантах осуществления способ индуцирует дифференцировку человеческой плюрипотентной стволовой клетки в клетки кишечной энтодермы средней кишки в ходе многоэтапного процесса. В вариантах осуществления получают популяцию клеток кишечной энтодермы средней кишки. В некоторых вариантах осуществления получают популяцию по существу клеток кишечной энтодермы средней кишки. В вариантах осуществления клетки кишечной энтодермы средней кишки формируют и поддерживают монослой в плоской культуре. В вариантах осуществления клетки кишечной энтодермы средней кишки представляют собой стабильный в культуре монослой. Клетками, стабильными в монослое или сохраняющими стабильность в монослое, называется монослой клеток, который не образует в культуре сфероиды.
[0065] В вариантах осуществления более чем 50% дифференцированных клеток экспрессируют маркеры, характерные для кишечной энтодермы средней кишки. В вариантах осуществления более чем 60%, более чем 70%, более чем 80%, более чем 90% или более чем 95% дифференцированных клеток экспрессируют характерные маркеры кишечной энтодермы средней кишки. В вариантах осуществления дифференцированные клетки, которые экспрессируют характерные маркеры кишечной энтодермы средней кишки, представляют собой клетки кишечной энтодермы средней кишки. В вариантах осуществления клетки кишечной энтодермы средней кишки экспрессируют CDX2 и FOXA2, что определяется по данным анализов FACS и qPCR. В некоторых вариантах осуществления клетки кишечной энтодермы средней кишки экспрессируют транскрипционные факторы, выбранные из SOX9, PDX1, KLF5 и HOXC5, определяемые анализами IF и qPCR. В вариантах осуществления клетки кишечной энтодермы средней кишки не экспрессируют транскрипционные факторы, выбранные из SOX2, ALB, PTF1A по данным анализов IF и qPCR, а также HOXA13 и LGR5 по данным qPCR.
[0066] Дополнительный вариант осуществления изобретения представляет собой способ получения клеток кишечной энтодермы средней кишки, включающий в себя индукцию дифференцировки клеток дефинитивной энтодермы в культуре в клетки примитивной кишечной трубки. В вариантах осуществления клетки дефинитивной энтодермы культивируют в культуральных средах, содержащих аскорбиновую кислоту и FGF7. В дополнительных вариантах осуществления клетки примитивной кишечной трубки культивируют в культуральных средах, содержащих ретиноевую кислоту и BMP2 или BMP4. Клетки примитивной кишечной трубки дифференцируют в клетки кишечной энтодермы средней кишки. В некоторых вариантах осуществления клетки примитивной кишечной трубки дифференцируют в клетки кишечной энтодермы средней кишки в кислых условиях (кислая культуральная среда). В конкретных вариантах осуществления кислые условия представляют собой культивирование в среде BLAR. pH кислой культуры может лежать в диапазоне от 6,8 до 7,2 в ходе 5-дневного периода кондиционирования дифференцировки из клеток примитивной кишечной трубки в клетки кишечной энтодермы средней кишки (в сравнении с нормальным pH на С2Д2, составляющим 7,3 или более). В вариантах осуществления клетки кишечной энтодермы средней кишки формируют и поддерживают в культуре монослой.
[0067] В каждом из вариантов осуществления, рассмотренных в настоящем документе, человеческие плюрипотентные стволовые клетки представляют собой человеческие клетки hESC или iPS. В каждом из вариантов осуществления, указанных выше и в настоящем документе, клетки кишечной энтодермы средней кишки экспрессируют CDX2 и FOXA2 по данным анализов FACS и qPCR. Во всех вариантах осуществления клетки кишечной энтодермы средней кишки экспрессируют транскрипционные факторы, выбранные из SOX9, PDX1, KLF5 и HOXC5, определяемые анализами IF и qPCR. В вышеуказанных вариантах осуществления и в настоящем документе клетки кишечной энтодермы средней кишки не экспрессируют транскрипционные факторы, выбранные из SOX2, ALB, PTF1A по данным анализов IF и qPCR, а также HOXA13 и LGR5 по данным qPCR. В вышеуказанных вариантах осуществления и в настоящем документе клетки кишечной энтодермы средней кишки экспрессируют CDX2, FOXA2, SOX9, PDX1, KLF5 и HOXC5 по данным анализов IF и qPCR. В каждом из этих вариантов осуществления клетки кишечной энтодермы средней кишки не экспрессируют SOX2, ALB и PTF1A по данным анализов IF и qPCR, и HOXA13 и LGR5 по данным qPCR.
[0068] В результате применения описанного выше и в настоящем документе протокола дифференцировки с использованием специфических культуральных компонентов и условий культивирования, в частности, условий культивирования в кислой среде, например, культивирования в среде BLAR, получают культуру клеток, экспрессирующих маркеры, характерные для клеток кишечной энтодермы средней кишки; клетки по данным qPCR не имеют экспрессии HAND1, маркера мезодермальной/мезенхимальной линии. Изменение протокола дифференцировки плюрипотентных стволовых клеток в линию дифференцирования энтодермы средней/задней кишки, например, индуцирование дифференцировки стволовых клеток в клетки дефинитивной энтодермы стадии 1, а не в клетки примитивной кишечной трубки стадии 2, приводит к появлению смешанной популяции энтодермально-мезенхимальных клеток CDX2+ средней/задней кишки, экспрессирующих HAND1 по данным qPCR.
[0069] В определенных вариантах осуществления популяция клеток кишечной энтодермы средней кишки по существу представляет собой клетки кишечной энтодермы средней кишки. В некоторых вариантах осуществления популяция клеток кишечной энтодермы средней кишки содержит более 70% клеток кишечной энтодермы средней кишки, предпочтительно, более чем 80%, более чем 90%, и более чем 95% клеток кишечной энтодермы средней кишки. В некоторых вариантах осуществления популяция клеток кишечной энтодермы средней кишки содержит 20% мезенхимальных клеток, предпочтительно, менее чем 15%, более предпочтительно, менее чем 10%, менее чем 5%, менее чем 2%, менее чем 1%, менее чем 0,5%. В вариантах осуществления в клетках кишечной энтодермы средней кишки отсутствует экспрессия HAND1.
Применение дифференцированных клеток кишечной энтодермы средней кишки
[0070] В другом варианте осуществления изобретения дифференцированные клетки кишечной энтодермы средней кишки можно использовать для лечения пациента с риском развития диабета, применяя их либо отдельно, либо в комбинации с дифференцированными или зрелыми эндокринными клетками, например, энтероэндокринными клетками. В таких вариантах осуществления дифференцированные клетки кишечной энтодермы средней кишки или их смеси можно вводить пациентам с диабетом, например, с диабетом 1 или 2 типа. В вариантах осуществления клетки кишечной энтодермы средней кишки дифференцируются и созревают в энтероэндокринные клетки. В вариантах осуществления клетки кишечной энтодермы средней кишки дифференцируются и созревают в энтероэндокринные клетки, и энтероэндокринные клетки экспрессируют или секретируют гормоны инкретинового типа. В вариантах осуществления к инкретиновым гормонам относятся GLP1 и GIP. Введение клеток может осуществляться посредством имплантации или инъекции в тело, в частности, имплантации в подкожное пространство, сальник, печень, почку и т. п.
[0071] В некоторых вышеописанных вариантах осуществления изобретения, дифференцировку клеток кишечной энтодермы средней кишки индуцируют in vitro. В других вариантах осуществления клетки кишечной энтодермы средней кишки дополнительно дифференцируются и созревают in vivo. Другой вариант осуществления относится к клеткам кишечной энтодермы средней кишки, дополнительно дифференцирующимся в энтероэндокринные клетки in vivo или в смеси с энтероэндокринными клетками in vivo. Такие энтероэндокринные клетки экспрессируют или секретируют инкретиновые гормоны. В вариантах осуществления к инкретиновым гормонам, секретируемым энтероэндокринными клетками, относятся GLP1 и GIP.
[0072] В дополнительном варианте осуществления клетки кишечной энтодермы средней кишки служат исходным материалом для идентификации низкомолекулярных соединений, способствующих более высокой эффективности дифференцировки in vitro клеток типа кишечной энтодермы средней кишки, во-первых, в предшественники энтероэндокринных клеток и, затем, в экспрессирующие или секретирующие инкретин энтероэндокринные клетки.
[0073] Клетки, популяции клеток и смеси, описанные в настоящем документе, могут быть заключены в микро- или макрокапсулы и затем трансплантированы млекопитающему-хозяину. Инкапсулированные или самостоятельные клетки можно трансплантировать (ввести) подкожно или в любое другое место тела, причем клетки могут снабжаться кровью, дифференцироваться и созревать in vivo.
ПРИМЕРЫ
[0074] Изобретение можно лучше понять в свете приведенных ниже примеров, не имеющих ограничительного характера.
Пример 1
Способ получения популяции клеток кишечной энтодермы средней кишки, в которых одновременно присутствуют/совместно экспрессируются CDX2 и FOXA2
[0075] В приведенном ниже примере описывается направленный способ получения клеток кишечной энтодермы средней кишки из человеческих эмбриональных стволовых клеток («hESC»). «Кишечной энтодермой средней кишки» называется соответствующий тип клеток in vivo или in situ, представляющих собой CDX2-положительные и FOXA2-положительные энтодермальные клетки, присутствующие приблизительно на 8,5 день («E8,5») развития эмбриона мыши или приблизительно на 3-4 неделе развития эмбриона человека.
Материалы и методы
[0076] Клеточная культура: Человеческие эмбриональные стволовые клетки линии H1 («H1-hESC») (WA01 cells, WiCell Research Institute, г. Мэдисон, штат Висконсин, США), культивируемые со средой EZ8 (Cat#A1516901 Gibco, Thermo Fisher Scientific) при пассаже 28 сеяли в виде одиночных клеток в концентрации 0,094×106 клеток/см2 на покрытые MATRIGEL™, разведение 1:30, (Corning Incorporated, г. Корнинг, штат Нью-Йорк, США, кат. №356231) чашки Петри в модифицированную по способу Дульбекко среду Игла с питательной смесью F-12 («DMEM-F12») (Life Technologies Corporation, г. Карлсбад, штат Калифорния, США, кат. № 11330-032) со следующими реагентами:
[0077] Приблизительно через сорок восемь часов после посева культуры промыли в неполном PBS (натрий-фосфатный буфер без магния или кальция) (Life Technologies, г. Карлсбад, штат Калифорния, США, кат. № 14190). Rock Inhibitor Y-27632 (соединение Y) использовали только в первые 24 часа культивирования.
[0078] Дифференцировка: Культуры дифференцировали, используя следующий протокол. На протяжении стадий с 1 по 3 протокола культуры поддерживали в виде плоских прикрепленных культур. Однако другие авторы описывают дифференцировку с использованием суспензионных культур, в том числе, в публикации США US2014/0242693, полностью включенной в настоящий документ путем ссылки; протокол, описанный в настоящем документе, можно модифицировать и выполнить в суспензионной культуре, что обеспечивает масштабируемость производства. Используемая далее номенклатура S#D# указывает точное время на стадиях с 1 по 3. Например, С1Д3 - это стадия 1, день 3. Если коротко, каждая стадия определяет дифференцировку в дефинитивную энтодерму (стадия 1), примитивную кишечную трубку (стадия 2) и кишечную энтодерму средней кишки (стадия 3).
а. Стадия 1 (3 дня): Клетки культивировали один день в следующей среде стадии 1:
Затем клетки культивировали в течение еще одного дня в следующей среде:
Затем клетки культивировали в течение еще одного дня в той же среде, что и в день 2, но без соединения MCX.
b. Стадия 2 (2 дня): Клетки в течение двух дней обрабатывали следующей средой:
c. Стадия 3 (5 дней): Клетки обрабатывали в течение пяти дней особой средой BLAR 001:
[0079] В данном способе на стадии 3 для получения монослоя клеток кишечной энтодермы средней кишки, имеющих одновременное присутствие белков CDX2 и FOXA2, можно использовать либо BMP4, либо BMP2, как показано на ФИГ. 1A-4B (на основе BMP4), и ФИГ. 5A-7 (на основе BMP2).
Таблица I. Список компонентов среды BLAR
[0080] Количественная оценка дифференцированных клеток: Для количественной оценки присутствия и со-локализации белков, клетки на С3Д5 собирали и анализировали методом FACS. Окрашивание для FACS проводили как описано в публикации Nature Biotechnology, 2014 (32) 11, 1121-1133, полностью включенной в настоящий документ путем ссылки и с применением антител, указанных в таблице II. Вкратце, дифференцированные клетки инкубировали в TrypLE™ Express (Life Technologies, г. Карлсбад, штат Калифорния, № по каталогу 12604) в течение 5-10 минут при 37°C и высвобождали в суспензию одиночных клеток, после чего их дважды промывали буферным натрий-фосфатным раствором для окрашивания, содержащим 0,2% BSA (BD Biosciences, г. Сан-Хосе, штат Калифорния, № по каталогу 554657). Внутриклеточное окрашивание антителами проводили с использованием фиолетового флуоресцентного реактивного красителя LIVE/DEAD (Life Technologies, г. Карлсбад, штат Калифорния, США, кат. № L34955) при 4°C в течение 30 минут с последующей однократной промывкой холодным PBS. Фиксирование клеток проводили в 300 мкл буфера Cytofix/Cytoperm Buffer (BD Biosciences, г. Сан-Хосе, штат Калифорния, США, кат. № 554723) с последующей двукратной промывкой в буфере Perm/Wash Buffer (BD Biosciences, г. Сан-Хосе, штат Калифорния, США, кат. № 554722). Далее клетки инкубировали с соответствующими антителами при 4°C в течение 30 минут (для неконъюгированных антител) или 1 часа (для конъюгированных антител) и затем дважды отмывали и анализировали на приборе BD FACS Canto II с применением программного обеспечения BD FACS Diva, регистрируя по меньшей мере 30 000 событий. Нежизнеспособные клетки при анализе FACS исключали и проводили дискриминирование, используя изотипические антитела («IgG»). Данные FACS по IgG показаны на верхней панели каждого представленного эксперимента FACS. Антитела проверяли на специфичность, используя положительные контроли, такие как клетки Caco-2, или отрицательные контроли, такие как клетки дефинитивной энтодермы С1Д3 («DE»).
Таблица II. Список антител, применяемых для анализа FACS
[0081] Для количественной оценки солокализации белков на различных стадиях собирали клетки Caco-2, клетки на С2Д2, С3Д2 и С3Д5 в виде монослоя и анализировали иммунофлуоресцентным анализом («IF»). Следует отметить, что морфология, наблюдаемая на IF-изображениях, вызвана скребковым методом отделения монослоя прикрепленных культур. Клетки, производные от H1-hESC, получали и окрашивали как описано в публикации Nature Biotechnology, 2014 (32) 11, 1121-1133, и с использованием антител, перечисленных в таблице III. Для приготовления криосрезов клетки промывали в PBS, а затем фиксировали в течение ночи в 4% PFA (Sigma Aldrich, г. Сэнт-Луис, штат Миссури, США, кат. № 158127) при 4 °C. После фиксации 4% PFA удаляли, клетки двукратно промывали PBS и инкубировали в течение ночи 4°C в 30% растворе сахарозы (Amresco, г. Солон, штат Огайо, США, кат. № 0335). Образцы криоконсервировали в растворе OCT (Sakura Finetek USA Inc., г. Торранс, штат Калифорния, США, кат. № 4583), и срезы толщиной 5 мкм помещали на стекла Superfrost plus (VWR International, LLC, Рэднор, штат Пенсильвания, США, кат. № 48311-703). Для выполнения иммунофлуоресцентного окрашивания первичные антитела добавляли в соответствующих разведениях в течение ночи при 4 °C, а вторичные антитела добавляли в течение 30 минут при комнатной температуре с последующим промыванием PBS и добавлением прикрепляющегося реагента Vectastain с DAPI (Vector Laboratories Inc., г. Берлингейм, штат Калифорния, США, кат. № H-1200). Срезы визуализировали с использованием флуоресцентного микроскопа Nikon Ti (Nikon Instruments, Inc., г. Мелвилл, штат Нью-Йорк, США).
Таблица III. Список антител, применяемых для анализа IF
[0082] Для количественной оценки экспрессии генов на разных стадиях клетки Caco-2, H1-hESC, клетки на С1Д3, С2Д2, С3Д2 и С3Д5 собирали как описано в публикации Nature Biotechnology, 2014 (32) 11, 1121-1133. Вкратце, экспрессию генов оценивали с использованием специально изготовленных матриц Taqman® Arrays (Applied Biosystems, г. Фостер Сити, штат Калифорния, США); Open Array® (OA) использовали для CDX2, FOXA2, SOX2, SOX9, PDX1, ALB, PTF1A, и Taqman® Low Density Array (TLDA) использовали для KLF5, HOXC5 и LGR5, и в обоих тестах применяли конститутивный ген GAPDH. Данные анализировали с использованием программного обеспечения Sequence Detection (Applied Biosystems, г. Фостер Сити, штат Калифорния, США) и нормализовали, используя GAPDH в качестве конститутивного гена недифференцированных клеток H1-hESC, применяя метод ΔΔCt. Информация о праймерах представлена в таблице IV.
Таблица IV. Перечень праймеров для количественной ПЦР в реальном времени (RT-qPCR)
Результаты
[0083] Сводное описание способов дифференцировки, включая важные компоненты среды, ростовые факторы и низкомолекулярные соединения, добавляемые на каждой стадии, а также ключевые специфичные для каждой стадии маркеры дифференцировки клеток кишечной энтодермы средней кишки (FOXA2; CDX2; KLF5; SOX9; PDX1LO) представлено на ФИГ. 1A. В сравнении с нейтральным pH, указанным для С2Д2 (7,35 ± 0,04), клетки подвергаются действию слабокислых условий в среде BLAR в течение всей стадии 3 (pH; С3Д1, 6,98 ± 0,05; С3Д2, 7,02 ± 0,04; С3Д5, 7,18 ± 0,03) (ФИГ. 1B), и в результате более низкого содержания бикарбоната натрия в среде BLAR. Значение pH для культуры в течение пяти дней стадии 3 может лежать в диапазоне от около 6,8 до 7,2. На ФИГ. 1C показаны характерные фазово-контрастные изображения монослоя на С3Д5 (слева), и клеточной линии человеческой эпителиальной аденокарциномы толстой кишки («Caco-2») (справа), которую используют в качестве сравнения при характеризации дифференцировки. Наблюдается единообразная морфология на С3Д5. Описание количества клеток с использованием прибора Nucleocounter® NC-100 (Chemometec, г. Аллерод, Дания, кат. № 900-004) показывает, что одна клетка hESC дифференцируется в 4,56 ± 2,60 клеток энтодермы задней кишки на С3Д5 (ФИГ. 1D).
[0084] Способ дифференцировки с использованием BMP4 эффективно создает и поддерживает монослой клеток кишечной энтодермы средней кишки, каждая из которых содержит как CDX2, так и FOXA2 на уровнях транскриптов и белков. На ФИГ. 2A (внизу) показано, что в 90,0 ± 5,85 процентов клеток на С3Д5 одновременно присутствовал как белок CDX2, так и белок FOXA2, что сходно с процентной долей, наблюдаемой в клетках Caco-2 (86,0 ± 6,67). Напротив, клетки дефинитивной энтодермы (DE-С1Д3) лишены одновременного присутствия CDX2 и FOXA2 (2,3 ± 1,2). Анализ экспрессии генов показывает, что CDX2 был индуцирован (ФИГ. 2B), а FOXA2 сохранялся (ФИГ. 2C) в ходе стадии 3. На ФИГ. 2D индуцированные уровни белка CDX2 и одновременное присутствие белков CDX2/FOXA2 после установления стадии FOXA2-положительной энтодермы примитивной кишечной трубки на С2Д2 (ФИГ. 2D-i) прогрессивно возрастали к С3Д2 (ФИГ. 2D-ii), а к С3Д5 (ФИГ. 2D-iii) достигали уровней, сходных с наблюдаемыми в клетках Caco-2 (ФИГ. 2D-iv). Белок CDX2 показан в нижнем ряду, а белок FOXA2 показан в верхнем ряду.
[0085] На С3Д5 обнаружены уровни транскриптов и белков дополнительных транскрипционных факторов, формирующих полноценную индукцию кишечной энтодермы средней кишки. На ФИГ. 3A-3P показано, что получена полноценная кишечная энтодерма средней кишки. Наряду с одновременным присутствием CDX2 и FOXA2 в клетках на С3Д5 также наблюдается одновременное присутствие SOX9, PDX1, KLF5, HOXC5, но не экспрессия SOX2, ALB, PTF1A и LGR5. Белковая последовательность всех TF показана в отдельных одноканальных изображениях. На ФИГ. 3A (внизу) показано, что в 98,7 ± 0,25 процентах клеток одновременно присутствовали CDX2 и SOX9 на С3Д5. Сильная индукция экспрессии гена SOX9 была сопоставима с наблюдаемой в клетках Caco-2 (ФИГ. 3B), и наблюдалось присутствие белка, определяемое IF анализом (ФИГ. 3C). 69,4 ± 14,2 процентов клеток были одновременно положительными по CDX2 и PDX1 (ФИГ. 3D внизу). Экспрессия гена PDX1 индуцировалась с низким уровнем по сравнению с клетками S4D3 со склонностью дифференцироваться в направлении клеток поджелудочной железы (см., например, US2014/0242693) (ФИГ. 3E), и это отражалось в низком уровне или отсутствии белка по данным IF анализа (ФИГ. 3F).
[0086] Клетки на С3Д5 не экспрессировали транскрипционный фактор передней энтодермы SOX2, и лишь в 1,45 ± 0,15 процента клеток на С3Д5 наблюдалось одновременное присутствие SOX2 и CDX2 (ФИГ. 3G внизу; 3I), и экспрессия гена была ниже уровней, наблюдаемых в клетках hESC и Caco-2 (ФИГ. 3H). Экспрессия гена KLF5, необходимого для правильно развития энтодермы задней кишки, была повышена на С3Д5 (ФИГ. 3J). Наблюдали одновременное присутствие белка KLF5 в CDX2-положительных клетках на С3Д5 (ФИГ. 3K). Экспрессии гена ALB (ФИГ. 3L) и присутствия соответствующего белка (ФИГ. 3M) в клетках на С3Д5 не наблюдалось. Экспрессия гена транскрипционного фактора PTF1A, маркера панкреатической линии, не индуцировалась в клетках на С3Д5, в отличие от клеток S4D3 со склонностью дифференцироваться в направлении клеток поджелудочной железы (ФИГ. 3N). Гомеобоксовый ген HOXC5, присутствующий в кишечной энтодерме эмбриональной средней кишки, в клетках на С3Д5 был индуцирован в высокой степени (ФИГ. 3O). На ФИГ. 3P показано, что LGR5, маркер эмбриональной кишечной энтодермы, который появляется у мышей в середине гестационной фазы, в клетках на С3Д5 не был индуцирован (ФИГ. 3P). На ФИГ. 3Q показано, что HOXA13, маркер кишечной энтодермы задней кишки, в клетках на С3Д5 не был индуцирован (ФИГ. 3P).
[0087] На ФИГ. 4A-4B показан профиль пролиферации дифференцирующихся клеток на С3Д5. На ФИГ. 4A представлены клетки Caco-2, где большая часть клеток, положительных по белку CDX2, находятся в активном клеточном цикле (что показывает совместная экспрессия с белком KI67) (слева), и индекс пролиферации клеток, производных от H1-hESC, в ходе стадии 3, который снижается со временем (С3Д2 в середине; С3Д5 справа). Уровни белков CDX2 (верхний ряд) и KI67 (нижний ряд) показаны в виде одноканальных изображений. Процентная доля положительных по белку KI67 клеток от общего числа клеток на С3Д5 (всего > 90% клеток CDX2-положительные) по данным FACS составила 16,8 ± 3,12, в отличие от процентной доли в клетках С1Д3 (97,3 ± 1,3) и Caco-2 (99,2 ± 0,2) (ФИГ. 4B).
[0088] BMP2 можно применять в качестве альтернативы BMP4 на стадии 3 данного способа для получения монослоя клеток кишечной энтодермы средней кишки с одновременным присутствием белков CDX2 и FOXA2. На ФИГ. 5A представлено сводное описание способа дифференцировки, включая компоненты среды, ростовые факторы и низкомолекулярные соединения, добавляемые на каждой стадии, а также ключевые специфичные для каждой стадии маркеры дифференцировки клеток кишечной энтодермы средней кишки (FOXA2, CDX2, KLF5, SOX9 и PDX1LO). В сравнении с нейтральным pH, отмеченным на С2Д2 (7,35 ± 0,04), клетки подвергаются действию слабокислых условий в среде BLAR в течение всей стадии 3 (pH; С3Д1, 6,92; С3Д2, 7,01; С3Д5, 7,22) (ФИГ. 5B) и в результате более низкого содержания бикарбоната натрия в кислой среде BLAR. На ФИГ. 5C представлены характерные фазово-контрастные изображения монослоя на С3Д5 (слева) и клеток Caco-2 (справа). Наблюдается единообразная морфология на С3Д5.
[0089] Способ дифференцировки позволяет получить и поддерживать надлежащие клетки кишечной энтодермы средней кишки в виде монослоя, где каждая клетка содержит CDX2, FOXA2, KLF5, SOX9, PDX1LO и HOXC5 на уровне транскриптов и белков. Уровни белков транскрипционных факторов показаны в виде одноканальных IF-изображений. На ФИГ. 6A (внизу) показано, что в 94 процентах клеток на С3Д5 одновременно присутствовал как белок CDX2, так и белок FOXA2, что сходно с процентной долей, наблюдаемой в клетках Caco-2 (86,0 ± 6,67). Анализ экспрессии генов показывает, что CDX2 был индуцирован (ФИГ. 6B), а FOXA2 сохранялся (ФИГ. 6C) в ходе стадии 3. На ФИГ. 6D показано, что на С3Д5 индуцировались уровни белка CDX2 и итоговое одновременное присутствие белков CDX2/FOXA2, (ФИГ. 6D), сопоставимые с уровнями, наблюдаемыми в клетках Caco-2 (ФИГ. 2D-iv). На ФИГ. 6E (внизу) показано, что в 99,8 процентах клеток одновременно присутствовали CDX2 и SOX9 на С3Д5. Наблюдаемая сильная индукция экспрессии гена SOX9 была сходна с уровнями в клетках Caco-2 (ФИГ. 3F), и наблюдалось присутствие белка, определяемое IF анализом (ФИГ. 6G). 45,5 процентов клеток были одновременно положительными по CDX2 и PDX1 (ФИГ. 6H внизу). Экспрессия гена PDX1 индуцировалась с низким уровнем по сравнению с клетками S4D3 со склонностью дифференцироваться в направлении клеток поджелудочной железы (ФИГ. 6I), а IF анализ показал низкий уровень или отсутствие белка (ФИГ. 6J). Транскрипционный фактор переднего отдела энтодермы SOX2 не наблюдался в клетках на С3Д5, и одновременное присутствие SOX2 и CDX2 наблюдалось в 0,8 процента клеток на С3Д5 (ФИГ. 6K внизу; 6M), и экспрессия гена была ниже уровней, наблюдаемых в клетках hESC и Caco-2 (ФИГ. 6L). Экспрессия гена KLF5, необходимого маркера правильного развития энтодермы задней кишки, была сильно повышена на С3Д5 (ФИГ. 6N). Наблюдали одновременное присутствие белка KLF5 в CDX2-положительных клетках на С3Д5 (ФИГ. 6O). Экспрессии гена ALB (ФИГ. 6P) и присутствия соответствующего белка (ФИГ. 6Q) в клетках на С3Д5 не наблюдалось. Экспрессия гена транскрипционного фактора PTF1A, определяющего панкреатическую линию, не индуцировалась в клетках на С3Д5, в отличие от клеток S4D3 со склонностью дифференцироваться в направлении клеток поджелудочной железы (ФИГ. 6R). Гомеобоксовый ген HOXC5, присутствующий в кишечной энтодерме эмбриональной средней кишки, в клетках на С3Д5 был индуцирован в высокой степени (ФИГ. 6S). На ФИГ. 6T показано, что LGR5, маркер эмбриональной кишечной энтодермы, который появляется в середине гестационной фазы, в клетках на С3Д5 не был индуцирован. На ФИГ. 6U показано, что HOXA13, маркер кишечной энтодермы задней кишки, в клетках на С3Д5 не был индуцирован (ФИГ. 6U).
[0090] На ФИГ. 7 охарактеризован профиль пролиферации дифференцирующихся клеток на С3Д5, с демонстрацией клеток Caco-2, где большая часть клеток, положительных по белку CDX2, находятся в активном клеточном цикле (на что указывает совместная экспрессия с белком KI67) (слева), в сравнении с индексом пролиферации клеток, производных от H1-hESC, в ходе стадии 3, который был ниже (С3Д5 справа). Уровни белков CDX2 (верхний ряд) и KI67 (нижний ряд) показаны в виде одноканальных изображений. Процентная доля положительных по белку KI67 клеток от общего числа клеток на С3Д5 (всего > 90% клеток CDX2-положительные) по данным FACS составила 14,1, в отличие от процентной доли, наблюдаемой в клетках на С1Д3 (97,3 ± 1,3) в сравнении с клетками Caco-2 (99,2 ± 0,2) (ФИГ. 7; 4B).
ПРИМЕР 2
Культивирование кишечных клеток, начиная со стадии дефинитивной энтодермы и с использованием FGF4 и агонистов WNT, дает энтодермально-мезенхимальную смесь клеток средней/задней кишки CDX2+
[0091] В данном примере демонстрируется смешанный энтодермально-мезенхимальный характер клеток средней/задней кишки CDX2+, полученных путем культивирования кишечных клеток начиная со стадии дефинитивной энтодермы, с использованием FGF4 и агонистов WNT (Spence et al., Nature, 2011; 470:105-109; Watson et al. Nature Med, 2014; 11:1310-1314). Для исследования индукции клеток в энтодермальные клетки средней/задней кишки, описанной в публикации Spence et al., ниже, клетки hESC дифференцировали с использованием описанного ниже протокола. Следует отметить, что условия дифференцировки, описанные в данном примере, отличаются от примера 1 по следующим пунктам: (i) начальной точкой для дифференцировки в кишечные клетки служит стадия дефинитивной энтодермы; (ii) используются факторы роста и низкомолекулярные соединения, отличные от RA и BMP4 или BMP2; И (iii) культивирование в кислой среде не используется.
Материалы и методы
[0092] Клеточная культура: Клетки H1-hESC культивировали и поддерживали как описано в примере 1.
[0093] Дифференцировка: Культуры дифференцировали, используя следующий протокол.
Стадия 1-имитация (3 дня): Клетки культивировали один день в следующей среде стадии 1:
[0094] Затем клетки культивировали в течение еще одного дня в следующей среде:
[0095] Затем клетки культивировали в течение еще одного дня в следующей среде:
[0096] Пост-стадия 1 (2 дня): Например, pS1d1 - это Пост-стадия 1 день 1 и pS1d2 Пост-стадия 1 день 2. Клетки культивировали два дня в следующей среде пост-стадии 1:
[0097] Количественное определение: Получение фазово-контрастных изображений и количественная оценка экспрессии генов проводились в соответствии с процедурами, описанными в примере 1.
Результаты
[0098] Краткое описание способов дифференцировки, включая компоненты среды, ростовые факторы и низкомолекулярные соединения, добавляемые на каждой стадии, а также ключевые специфичные для каждой стадии маркеры дифференцировки клеток кишечной энтодермы средней/задней кишки (HAND1), представлены на ФИГ. 8A. Кондиционирование кишечных клеток (пост-стадия 1) начиналось со стадии дефинитивной энтодермы с применением 500 нг/мл FGF4 и либо 3 мкМ Chiron99021 (Watson et al.), либо 500 нг/мл Wnt3A (Spence et al.). Термин «стадия 1-имитация» относится к протоколу дифференцировки дефинитивной энтодермы данного примера, который отличается от «С1Д3 - оригинала», который относится к кондиционированию стадии 1, описанному в примере 1. На ФИГ. 8B представлены фазово-контрастные изображения клеток H1-hESC (верхний ряд, слева), клеток пост-стадии 1, кондиционированных в течение двух дней с 500 нг/мл FGF4 и 3 мкМ Chiron99021 (верхний ряд, середина), клеток пост-стадии 1, кондиционированных в течение двух дней с 500 нг/мл FGF4 и 500 нг/мл Wnt3A (верхний ряд, справа), а также монослоя на С3Д5, кондиционированных RA/BMP4 (нижний ряд, слева), и монослоя на С3Д5, кондиционированных RA/BMP2 (нижний ряд, справа) (из примера 1).
[0099] Индукция экспрессии гена CDX2 достигалась после двух дней кондиционирования, но она имела намного более низкий уровень, чем для RA/BMP2 или RA/BMP4 на С3Д5 (ФИГ. 8C). Однако экспрессия гена энтодермального маркера FOXA2 сохранялась (ФИГ. 8D), а мезодермальный/мезенхимальный маркер HAND1 был сильно индуцирован (ФИГ. 8F). Кроме этого, ген KLF5 не был индуцирован к двухдневному сроку, в отличие от кондиционирования с использованием RA/BMP4 и RA/BMP2 (ФИГ. 8E). Как убедительно показывает ФИГ. 8F, такой характер экспрессии генов отражает гетерогенную популяцию клеток, наблюдаемую в способах Watson et al. и Spence et al., которая содержит не только энтодермальную популяцию CDX2+ FOXA2+, но также существенную мезенхимальную популяцию CDX2+. Напротив, кондиционирование RA/BMP4 или RA/BMP2 на пост-стадии 2 (клетки примитивной кишечной трубки) не приводит к индукции мезодермального/мезенхимального маркера HAND1; индуцируется только энтодермальная популяция CDX2+ FOXA2+.
[0100] При описании настоящего изобретения и вариантов его осуществления для ясности используется конкретная терминология. Однако изобретение не ограничивается конкретной выбранной терминологией. Специалист в данной области техники признает, что могут быть использованы другие эквивалентные компоненты и другие способы, разработанные без отхода от общих понятий настоящего изобретения. Все ссылки, процитированные в любых местах настоящего описания, включены в настоящий документ путем ссылки, как если бы каждая из них включалась в настоящий документ индивидуально.
Реферат
Изобретение относится к области биотехнологии, а именно к получению популяции клеток кишечной энтодермы средней кишки. Способ включает культивирование человеческих плюрипотентных стволовых клеток, не полученных из эмбриона человека в первой культуральной среде, содержащей GDF-8, и соединение ингибитора GSK3β, в клетки дефинитивной энтодермы. Затем осуществляют культивирование клеток дефинитивной энтодермы во второй культуральной среде, содержащей аскорбиновую кислоту и FGF7, в клетки примитивной кишечной трубки. Затем осуществляют культивирование клеток примитивной кишечной трубки в третьей культуральной среде, содержащей ретиноевую кислоту и BMP2 или BMP4, в клетки кишечной энтодермы средней кишки. Изобретение позволяет расширить арсенал технических средств. 8 з.п. ф-лы, 4 табл., 2 пр., 8 ил.
Формула
Документы, цитированные в отчёте о поиске
Дифференцирование человеческих эмбриональных стволовых клеток в линию панкреатических эндокринных клеток

Комментарии