Дифференцирование человеческих эмбриональных стволовых клеток в линию панкреатических эндокринных клеток - RU2528861C2
Код документа: RU2528861C2
Чертежи



Описание
В рамках настоящего изобретения испрашивается приоритет заявки с серийным номером 61/110278, поданной 31 октября 2008 года.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
В настоящем изобретении предлагаются способы стимуляции дифференцирования плюрипотентных стволовых клеток. В частности, в настоящем изобретении предлагается способ увеличения экспрессии маркеров, ассоциированных с линией панкреатических эндокринных клеток.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Последние достижения в области заместительной клеточной терапии для лечения сахарного диабета 1 типа и нехватка островков Лангерганса для трансплантации заставили обратить внимание на разработку источников инсулинпродуцирующих клеток, или β-клеток, подходящих для трансплантации. Одним из подходов является формирование функциональных β-клеток из плюрипотентных стволовых клеток, таких как, например, эмбриональные стволовые клетки.
При эмбриональном развитии позвоночных плюрипотентные клетки дают начало группе клеток, формирующих три зародышевых листка (эктодерму, мезодерму и эндодерму) в ходе процесса, именуемого гаструляцией. Такие ткани, как, например, щитовидная железа, тимус, поджелудочная железа, кишечник и печень, будут развиваться из эндодермы через промежуточную стадию. Промежуточной стадией данного процесса является образование сформированной эндодермы. Клетки сформированной эндодермы экспрессируют ряд маркеров, таких как HNF-3бета, GATA4, Mixl1, CXCR4 и Sox-17.
Формирование поджелудочной железы происходит при дифференцировании сформированной эндодермы в панкреатическую эндодерму. Клетки панкреатической эндодермы экспрессируют ген панкреатико-дуоденального гомеобокса, Pdx1. При отсутствии Pdx1 развитие поджелудочной железы не идет дальше формирования вентрального и дорзального зачатков. Таким образом, экспрессия Pdx1 характеризует критическую стадию органогенеза поджелудочной железы. Зрелая поджелудочная железа содержит, помимо других типов клеток, экзокринную ткань и эндокринную ткань. Экзокринная и эндокринная ткани образуются при дифференцировании панкреатической эндодермы.
По имеющимся данным клетки, обладающие свойствами островковых клеток, были получены из эмбриональных клеток мыши. Например, в публикации Lumelsky et al. (Science 292:1389, 2001) сообщается о дифференцировании эмбриональных стволовых клеток мыши в инсулин-секретирующие структуры, сходные с островками поджелудочной железы. В публикации Soria et al. (Diabetes 49:157, 2000) сообщается, что инсулин-секретирующие клетки, полученные из эмбриональных стволовых клеток мыши, нормализовали гликемию у мышей с диабетом, вызванным стрептозотоцином.
В одном примере, в публикации Hori et al. (PNAS 99: 16105, 2002), описывается, что обработка мышиных эмбриональных стволовых клеток ингибиторами фосфоинозитид 3-киназы (LY294002) приводила к образованию клеток, сходных с β-клетками.
В другом примере, в публикации Blyszczuk et al. (PNAS 100:998, 2003), сообщается о получении инсулин-продуцирующих клеток из эмбриональных стволовых клеток мыши с конститутивной экспрессией Pax4.
В публикации Micallef et al. сообщается, что ретиноевая кислота может регулировать способность эмбриональных стволовых клеток формировать Pdx1-положительную панкреатическую эндодерму. Ретиноевая кислота с наибольшей эффективностью индуцирует экспрессию Pdx1 при добавлении в культуру на 4 день дифференцирования эмбриональных стволовых клеток в течение периода, соответствующего концу гаструляции эмбриона (Diabetes 54:301, 2005).
В публикации Miyazaki et al. сообщается о линии мышиных эмбриональных стволовых клеток со сверхэкспрессией Pdx1. Эти результаты показывают, что экспрессия экзогенного Pdx1 очевидно повышает экспрессию генов инсулина, соматостатина, глюкокиназы, нейрогенина 3, P48, Pax6 и HNF6 в образующихся дифференцированных клетках (Diabetes 53: 1030, 2004).
В публикации Skoudy et al. сообщается, что активин A (входящий в суперсемейство TGF-β) повышает экспрессию экзокринных панкреатических генов (p48 и амилаза) и эндокринных генов (Pdx1, инсулин и глюкагон) в эмбриональных стволовых клетках мыши. Максимальный эффект наблюдался при использовании активина A в количестве 1 нМ. Также эти авторы наблюдали, что на уровень экспрессии мРНК инсулина и Pdx1 не влияла ретиноевая кислота; однако обработка раствором FGF7 в количестве 3 нM приводила к повышению уровня транскрипта Pdx1 (Biochem. J. 379: 749, 2004).
В работе Shiraki et al. изучались эффекты факторов роста, специфически ускоряющих дифференцирование эмбриональных стволовых клеток в Pdx1-положительные клетки. Эти авторы наблюдали, что TGF-β2 приводил к воспроизводимому увеличению доли Pdx1-положительных клеток (Genes Cells. 2005 Jun; 10(6): 503-16.).
В публикации Gordon et al. продемонстрирована индукция образования эндодермальных клеток brachyury+/HNF-3бета+ из эмбриональных стволовых клеток мыши в отсутствие сыворотки и в присутствии активина в сочетании с ингибитором сигнального пути Wnt (US 2006/0003446A1).
В публикации Gordon et al. (PNAS, Vol 103, page 16806, 2006) говорится: «Для образования передней первичной полоски требовались одновременно сигнальные пути Wnt и TGF-бета/Nodal/активин».
Однако модель развития эмбриональных стволовых клеток на мышах может не имитировать в точности программу развития у высших млекопитающих, например у человека.
В работе Thomson et al. эмбриональные стволовые клетки выделяли из человеческих бластоцист (Science 282:114, 1998). Параллельно Gearhart и соавторы получили клеточные линии эмбриональных зародышевых клеток человека (hEG) из ткани половых желез эмбриона (Shamblott et al., Proc. Natl. Acad. Sci. USA 95:13726, 1998). В отличие от эмбриональных стволовых клеток мыши, воспрепятствовать дифференцированию которых можно путем простого культивирования с фактором торможения лейкемии (LIF), эмбриональные стволовые клетки человека должны культивироваться в очень специфических условиях (патенты США №№ 6200806; WO 99/20741; WO 01/51616).
D'Amour et al. описывают производство обогащенных культур сформированной эндодермы, производной от человеческих эмбриональных стволовых клеток, в присутствии высокой концентрации активина и низкой концентрации сыворотки (Nature Biotechnology 2005). Трансплантация этих клеток под почечную капсулу мышей привела к их дифференцированию в более зрелые клетки, обладающие характерными особенностями некоторых эндодермальных органов. Клетки сформированной эндодермы, производные от эмбриональных стволовых клеток человека, могут подвергаться дальнейшему дифференцированию в Pdx1-положительные клетки после добавления FGF-10 (US 2005/0266554A1).
В публикации D'Amour et al. (Nature Biotechnology - 24, 1392-1401 (2006)) говорится: «Мы разработали процесс дифференцирования, преобразующий человеческие эмбриональные стволовые клетки (чЭС) в эндокринные клетки, способные синтезировать гормоны поджелудочной железы, инсулин, глюкагон, соматостатин, панкреатический полипептид и грелин. Данный процесс имитирует органогенез поджелудочной железы in vivo, проводя клетки через стадии, напоминающие образование сформированной эндодермы, эндодермы кишечной трубки, панкреатической эндодермы и превращение предшественников эндокринных клеток в клетки, экспрессирующие эндокринные гормоны».
В другом примере, в публикации Fisk et al., сообщается о системе для производства островковых клеток поджелудочной железы из эмбриональных стволовых клеток человека (US2006/0040387A1). В данном случае процесс дифференцирования был разделен на три стадии. Сначала человеческие эмбриональные стволовые клетки были дифференцированы до эндодермы с помощью сочетания бутирата натрия и активина А. Далее клетки культивировали с антагонистами TGF-β, такими как Noggin, в сочетании с EGF или бетацеллюлином с получением Pdx1-положительных клеток. Окончательное дифференцирование запускалось никотинамидом.
В одном примере Benvenistry et al. сообщают: «Мы делаем вывод, что сверхэкспрессия Pdx1 увеличивала экспрессию панкреатических обогащенных генов, а для индукции экспрессии инсулина могут требоваться дополнительные сигналы, присутствующие только in vivo» (Benvenistry et al, Stem Cells 2006; 24:1923-1930).
Следовательно, насущной потребностью по-прежнему остается разработка условий для создания стабильных линий плюрипотентных стволовых клеток, способных расти для решения текущих клинических задач и сохраняющих потенциал дифференцирования в панкреатические эндокринные клетки, в клетки, экспрессирующие гормоны поджелудочной железы, или в клетки, секретирующие гормоны поджелудочной железы. Мы использовали альтернативный подход к повышению эффективности дифференцирования человеческих эмбриональных стволовых клеток в панкреатические эндокринные клетки.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном из вариантов осуществления настоящего изобретения предлагается способ дифференцирования плюрипотентных стволовых клеток, включающий следующие этапы:
а. культивирование плюрипотентных стволовых клеток,
b. дифференцирование плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы,
c. дифференцирование клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы, в клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, и
d. дифференцирование клеток, экспрессирующих маркеры, характерные для линии дифференцирования в клетки панкреатической эндодермы, в клетки, экспрессирующие маркеры, характерные для линии дифференцирования в панкреатические эндокринные клетки.
В одном варианте осуществления настоящего изобретения предлагается способ увеличения экспрессии маркеров, ассоциированных с линией панкреатических эндокринных клеток, включающий обработку клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, средой, содержащей достаточное количество агониста рецептора TGF-β, чтобы вызвать увеличение экспрессии маркеров, ассоциированных с линией панкреатических эндокринных клеток.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг.1 показана схема протокола дифференцирования, используемого в настоящем изобретении.
На фиг.2 показана экспрессия маркеров, ассоциированных с различными стадиями протокола дифференцирования, используемого в настоящем изобретении. На панели a) показана измеренная методом FACS экспрессия CXCR4 в клетках линии человеческих эмбриональных стволовых клеток H1, дифференцированных в стадию 1. На панели b) показана измеренная методом ПЦР в реальном времени экспрессия маркеров, ассоциированных со стадией 1, в клетках линии человеческих эмбриональных стволовых клеток H1, дифференцированных в стадию 1.
На фиг.3 показаны окрашенные дитизоном клетки линии человеческих эмбриональных стволовых клеток H1, дифференцированных в стадию 6 протокола дифференцирования, использованного в настоящем изобретении, а затем обработанных активином A (стадия 7). На панели a) показано фазово-контрастное изображение клеток, окрашенных дитизоном, перед пропусканием через клеточный фильтр 40 мкм. На панели b) показано фазово-контрастное изображение клеток, окрашенных дитизоном, которые прошли через клеточный фильтр 40 мкм. На панели c) показано фазово-контрастное изображение клеток, окрашенных дитизоном, которые не смогли пройти через клеточный фильтр 40 мкм.
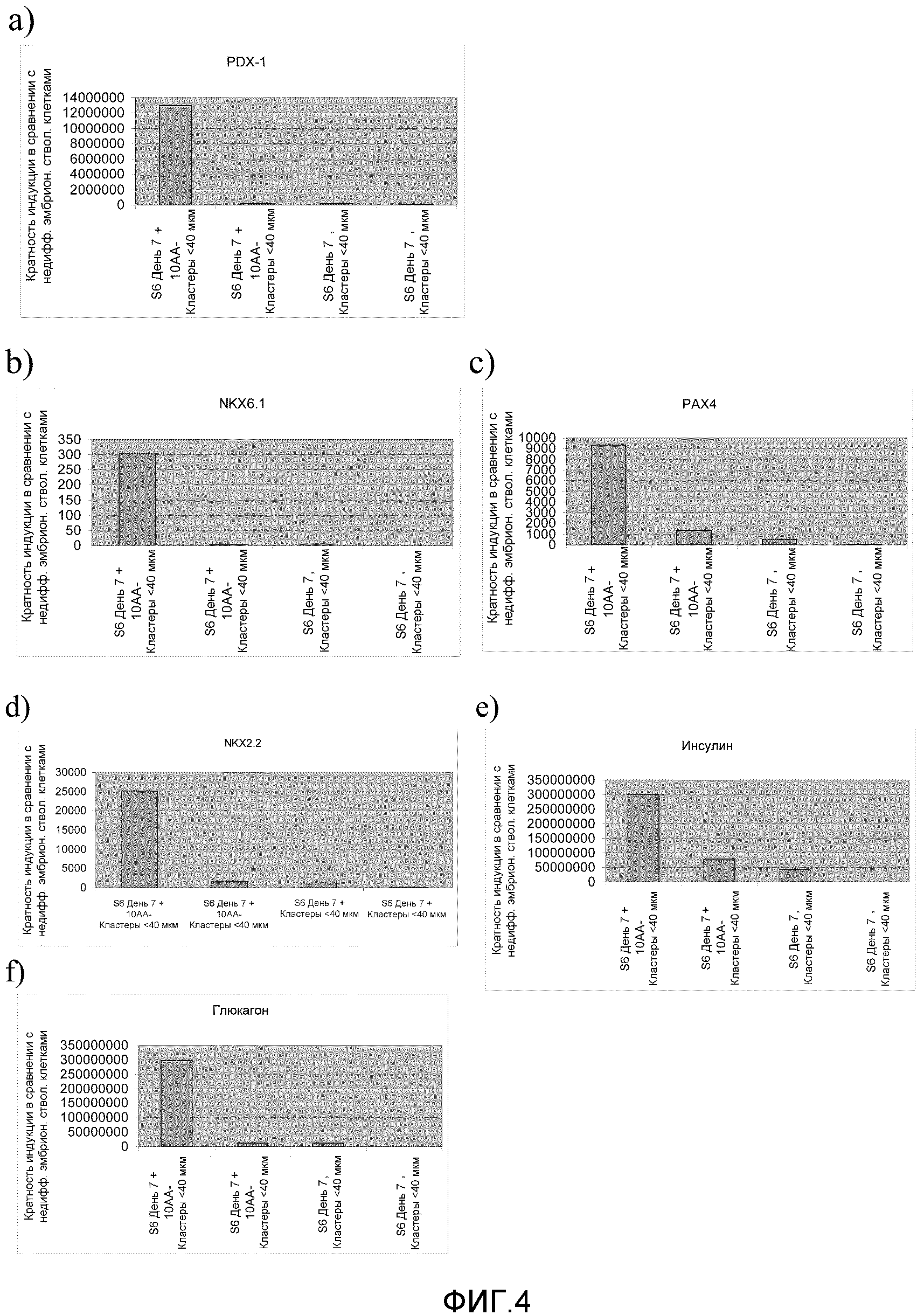
На фиг.4 показана измеренная методом ПЦР в реальном времени экспрессия pdx-1 (панель a), nkx6-1 (панель b), Pax4 (панель c), nkx2.2 (панель d), инсулина (панель e) и глюкагона (панель f) в клетках линии человеческих эмбриональных стволовых клеток H1, дифференцированных в стадию 6 протокола дифференцирования, использованного в настоящем изобретении, и обработанных активином А после дифференцирования в стадию 6, в соответствии со способами, описанными в Примере 2.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для ясности описания, а не для ограничения изобретения, подробное описание изобретения разделено на следующие подразделы, описывающие или иллюстрирующие определенные особенности, варианты осуществления или области применения настоящего изобретения.
Определения
Стволовые клетки представляют собой недифференцированные клетки, определяемые по их способности на уровне единичной клетки как самообновляться, так и дифференцироваться с образованием клеток-потомков, таких как самообновляющиеся клетки-предшественники, необновляющиеся клетки-предшественники и окончательно дифференцированные клетки. Стволовые клетки также характеризуются способностью дифференцироваться in vitro в функциональные клетки различных клеточных линий дифференцирования из нескольких зародышевых листков (эндодермы, мезодермы и эктодермы), а также после трансплантации давать начало тканям, происходящим от нескольких зародышевых листков, и вносить существенный вклад в формирование большинства, если не всех, тканей после инъекции в бластоцисты.
По потенциалу развития стволовые клетки классифицируют следующим образом: (1) тотипотентные, т.е. способные давать начало всем эмбриональным и внеэмбриональным типам клеток; (2) плюрипотентные, т.е. способные давать начало всем эмбриональным типам клеток; (3) мультипотентные, т.е. способные давать начало группе клеточных линий дифференцирования в пределах конкретной ткани, органа или физиологической системы (например, гематопоэтические стволовые клетки (HSC) могут давать таких потомков, как HSC (самообновление), олигопотентные предшественники, ограниченные клетками крови, и все типы клеток и клеточных элементов (таких как тромбоциты), являющиеся нормальными компонентами крови); (4) олигопотентные, т.е. способные давать начало более ограниченному набору клеточных линий дифференцирования, чем мультипотентные стволовые клетки; и (5) унипотентные, т.е. способные давать начало единственной клеточной линии дифференцирования (например, сперматогенные стволовые клетки).
Дифференцирование представляет собой процесс, при помощи которого неспециализированная («некоммитированная») или менее специализированная клетка приобретает свойства специализированной клетки, например нервной или мышечной клетки. Дифференцированная клетка или клетка с индуцированным дифференцированием представляет собой клетку, занявшую более специализированное («коммитированное») положение в линии дифференцирования клетки. Термин «коммитированная» применительно к процессу дифференцирования обозначает клетку, дошедшую в ходе процесса дифференцирования до стадии, от которой в нормальных условиях она продолжит дифференцироваться до определенного типа клеток или набора типов клеток и не сможет в нормальных условиях дифференцироваться в иной тип клеток или вернуться обратно к менее дифференцированному типу. Дедифференцированием называется процесс, в ходе которого клетка возвращается к менее специализированному (или коммитированному) положению в линии дифференцирования. Используемый в настоящей заявке термин «линия дифференцирования клетки» определяет наследственность клетки, то есть определяет, из какой клетки произошла данная клетка и каким клеткам она может дать начало. В линии дифференцирования клетка помещается в наследственную схему развития и дифференцирования. Маркером, специфичным для линии дифференцирования, называется характерная особенность, специфически ассоциированная с фенотипом клеток конкретной линии дифференцирования, которая может использоваться для оценки дифференцирования некоммитированных клеток в клетки данной линии дифференцирования.
Термин «β-клеточная линия дифференцирования» используется в настоящем документе для обозначения клеток, положительных по экспрессии гена транскрипционного фактора PDX-1 и по меньшей мере одного из следующих транскрипционных факторов: NGN-3, Nkx2.2, Nkx6.1, NeuroD, Isl-1, HNF-3бета, MAFA, Pax4 и Pax6. К клеткам, экспрессирующим маркеры, характерные для β-клеточной линии, относятся β-клетки.
Термин «клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы», или «клетки стадии 1», или «стадия 1» в настоящем документе обозначает клетки, экспрессирующие по меньшей мере один из следующих маркеров: SOX-17, GATA-4, HNF-3 бета, GSC, Cer1, Nodal, FGF8, Brachyury, Mix homeobox-подобный белок, FGF4, CD48, эомезодермин (EOMES), DKK4, FGF17, GATA-6, CXCR4, C-Kit, CD99 или OTX2. К клеткам, экспрессирующим маркеры, характерные для линии сформированной эндодермы, относятся клетки-предшественники первичной полоски, клетки первичной полоски, клетки мезэндодермы и клетки сформированной эндодермы.
Термин «клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы» в настоящем документе обозначает клетки, экспрессирующие по меньшей мере один из следующих маркеров: PDX-1, HNF-1бета, PTF-1 альфа, HNF-6 или HB9. К клеткам, экспрессирующим маркеры, характерные для линии панкреатической эндодермы, относятся клетки панкреатической эндодермы, клетки первичной кишечной трубки и клетки поздней передней кишки.
Термин «клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток», или «клетки стадии 5», или «стадия 5» в настоящем документе обозначает клетки, экспрессирующие по меньшей мере один из следующих маркеров: NGN-3, NeuroD, Islet-1, PDX-1, NKX6.1, Pax-4, Ngn-3 или PTF-1 альфа. Клетки с экспрессией маркеров, характерных для линии панкреатических эндокринных клеток, включают в себя панкреатические эндокринные клетки, клетки, экспрессирующие панкреатические гормоны, клетки, секретирующие панкреатические гормоны, а также клетки β-клеточной линии.
Используемый в настоящей заявке термин «сформированная эндодерма» относится к клеткам, обладающим характерными особенностями клеток, происходящих в ходе гаструляции от эпибласта, и формирующим желудочно-кишечный тракт и его производные. Клетки сформированной эндодермы экспрессируют следующие маркеры: HNF-3 бета, GATA-4, SOX-17, Cerberus, OTX2, goosecoid, C-Kit, CD99 и Mixl1.
Термином «внеэмбриональная эндодерма» в настоящем документе называется популяция клеток, экспрессирующих по меньшей мере один из следующих маркеров: SOX-7, AFP и SPARC.
Используемый в настоящей заявке термин «маркеры» обозначает молекулы нуклеиновых кислот или полипептидов с дифференциальной экспрессией в интересующих клетках. В данном контексте термин «дифференциальная экспрессия» обозначает повышение уровня экспрессии для положительного маркера и понижение уровня экспрессии для отрицательного маркера. Поддающийся обнаружению уровень маркерной нуклеиновой кислоты или полипептида в интересующих клетках оказывается значительно выше или ниже по сравнению с другими клетками, что позволяет идентифицировать интересующую клетку и отличить ее от других клеток с помощью любого из множества известных в данной области способов.
Термин «мезэндодермальная клетка» в настоящем документе используется для обозначения клетки, экспрессирующей по меньшей мере один из следующих маркеров: CD48, эомезодермин (EOMES), SOX-17, DKK4, HNF-3 бета, GSC, FGF17 и GATA-6.
Используемый в настоящей заявке термин «панкреатическая эндокринная клетка» или «клетка, экспрессирующая панкреатические гормоны» относится к клеткам, способным к экспрессии по меньшей мере одного из следующих гормонов: инсулина, глюкагона, соматостатина и панкреатического полипептида.
Используемые в настоящей заявке термины «клетка панкреатической эндодермы», или «клетки стадии 4», или «стадия 4» относятся к клеткам, способным к экспрессии по меньшей мере одного из следующих маркеров: NGN-3, NeuroD, Islet-1, PDX-1, PAX-4 и NKX2.2.
Используемый в настоящей заявке термин «клетка, продуцирующая панкреатические гормоны» относится к клеткам, способным производить по меньшей мере один из следующих гормонов: инсулин, глюкагон, соматостатин и панкреатический полипептид.
Используемый в настоящей заявке термин «клетка, секретирующая панкреатический гормон», или «клетки стадии 6», или «стадия 6» относится к клеткам, способным к секреции по меньшей мере одного из следующих гормонов: инсулина, глюкагона, соматостатина и панкреатического полипептида.
Используемые в настоящей заявке термины «клетка задней части передней кишки», или «клетки стадии 3», или «стадия 3» относятся к клеткам, способным к секреции по меньшей мере одного из следующих маркеров: PDX-1, HNF-1, PTF-1A, HNF-6, HB-9 и PROX-1.
Используемый в настоящей заявке термин «клетка-предшественник клетки первичной полоски» относится к клеткам, экспрессирующим по меньшей мере один из следующих маркеров: Nodal и FGF8.
Используемые в настоящей заявке термины «клетка первичной кишечной трубки», или «клетки стадии 2», или «стадия 2» относятся к клеткам, способным к секреции по меньшей мере одного из следующих маркеров: HNF-1 или HNF-4A.
Используемый в настоящей заявке термин «клетка первичной полоски» относится к клеткам, экспрессирующим по меньшей мере один из следующих маркеров: Brachyury, Mix homeobox-подобный белок или FGF4.
Выделение, размножение и культивирование плюрипотентных стволовых клеток
Характеристика плюрипотентных стволовых клеток
Плюрипотентные стволовые клетки могут экспрессировать один или несколько стадийно-специфичных эмбриональных антигенов (SSEA) 3 и 4, а также маркеры, определяемые антителами, обозначенными как Tra-1-60 и Tra-1-81 (Thomson et al., Science 282:1145, 1998). Дифференцирование плюрипотентных стволовых клеток in vitro приводит к утрате экспрессии SSEA-4, Tra-1-60 и Tra-1-81 (если имеются) и к увеличению экспрессии SSEA-1. В недифференцированных плюрипотентных стволовых клетках, как правило, активна щелочная фосфатаза, которая может быть обнаружена путем фиксации клеток с помощью 4% параформальдегида с последующим обнаружением с помощью Vector Red, применяемого в качестве субстрата, в соответствии с инструкциями производителя (Vector Laboratories, Burlingame Calif.) Недифференцированные плюрипотентные стволовые клетки также, как правило, экспрессируют Oct-4 и TERT, обнаруживаемые методом ОТ-ПЦР.
Другим желательным фенотипическим свойством выращенных плюрипотентных клеток является потенциал дифференцирования в клетки всех трех зародышевых листков: в эндодермальные, мезодермальные и эктодермальные ткани. Плюрипотентность плюрипотентных стволовых клеток может быть подтверждена, например, путем инъекции клеток мышам с тяжелым комбинированным иммунодефицитом (SCID), фиксирования образующихся тератом с помощью 4% параформальдегида, и их гистологического исследования для получения доказательств наличия клеточных типов, происходящих от трех зародышевых листков. В качестве альтернативы плюрипотентность можно определить по созданию эмбриоидных телец и анализа их на предмет присутствия маркеров, ассоциирующихся с тремя зародышевыми листками.
Выращенные линии плюрипотентных стволовых клеток могут быть кариотипированы с применением стандартного способа окрашивания с использованием красителя Гимза (G-banding) и сравнения с опубликованными кариотипами соответствующих видов приматов. Желательно получить клетки, имеющие «нормальный кариотип», т.е. эуплоидные клетки, в которых все человеческие хромосомы присутствуют и не имеют видимых изменений.
Источники плюрипотентных стволовых клеток
К типам плюрипотентных стволовых клеток, которые можно использовать, относятся стабильные линии плюрипотентных клеток, получаемых из ткани, формирующейся после наступления беременности, в том числе из преэмбриональной ткани (например, бластоциста), эмбриональной ткани или ткани плода, взятой в любой момент в ходе беременности, как правило, но не обязательно, до срока приблизительно 10-12 недель беременности. Примерами, не ограничивающими настоящее изобретение, являются стабильные линии человеческих эмбриональных стволовых клеток или человеческих эмбриональных зародышевых клеток, например клеточные линии человеческих эмбриональных стволовых клеток H1, H7 и H9 (WiCell). Также возможно использование описываемых в настоящей заявке составов в ходе первоначального установления или стабилизации таких клеток, в этом случае исходными клетками являются первичные плюрипотентные клетки, взятые напрямую из тканей-источников. Также соответствуют целям настоящего изобретения клетки, взятые из популяции плюрипотентных стволовых клеток, уже культивированных в отсутствие питающих клеток. Также соответствуют целям настоящего изобретения клетки мутантных линий эмбриональных стволовых клеток человека, таких как, например, BG01v (BresaGen, Атенс, Джорджия, США).
В одном из вариантов осуществления эмбриональные стволовые клетки человека готовят, как описано в следующих публикациях Thomson et al. (патент США № 5843780; Science 282:1145, 1998; Curr. Top. Dev. Biol. 38:133 ff., 1998; Proc. Natl. Acad. Sci. U.S.A. 92:7844, 1995).
Культивирование плюрипотентных стволовых клеток
В одном из вариантов осуществления плюрипотентные стволовые клетки, как правило, культивируют на слое питающих клеток, которые оказывают разностороннюю поддержку плюрипотентным клеткам. Как вариант, плюрипотентные стволовые клетки культивируют в культуральной системе, по существу не содержащей питающих клеток, но, тем не менее, поддерживающей пролиферацию плюрипотентных стволовых клеток и не допускающей существенного дифференцирования. Рост плюрипотентных стволовых клеток в свободной от питающих клеток культуральной системе без дифференцирования поддерживается путем использования среды, кондиционированной посредством предварительного культивирования клеток иного типа. В качестве альтернативы рост плюрипотентных стволовых клеток в свободной от питающих клеток культуральной системе без дифференцирования поддерживается путем использования среды с химически определенным составом.
Например, в публикациях Reubinoff et al (Nature Biotechnology 18: 399-404 (2000)) и Thompson et al (Science 6 November 1998: Vol. 282. no. 5391, pp. 1145-1147) описано культивирование линий плюрипотентных стволовых клеток из человеческих бластоцист с применением слоя питающих клеток из мышиных эмбриональных фибробластов.
В публикации Richards et al. (Stem Cells 21: 546-556, 2003) анализировали набор из 11 различных слоев питающих клеток, полученных от взрослых, новорожденных и эмбрионов людей, по их способности осуществлять поддержку культуры человеческих плюрипотентных стволовых клеток. Richards et al. сообщают: «линии человеческих эмбриональных стволовых клеток, культивируемые на питающих слоях из фибробластов кожи взрослых людей, сохраняют морфологию, характерную для эмбриональных стволовых клеток, и остаются плюрипотентными».
В заявке на патент US 20020072117 описываются линии клеток, продуцирующие среду, осуществляющую поддержку плюрипотентных стволовых клеток приматов в культуре, не содержащей питающих клеток. Использованные клеточные линии представляют собой мезенхимо- и фибробластоподобные линии, полученные из эмбриональной ткани или дифференцированные из эмбриональных стволовых клеток. В заявке на патент US 20020072117 также описывается использование этих клеточных линий в качестве первичного слоя питающих клеток.
В другом примере, Wang et al. (Stem Cells 23: 1221-1227, 2005) описывают способы длительного выращивания человеческих плюрипотентных стволовых клеток на слоях питающих клеток, полученных из человеческих эмбриональных стволовых клеток.
В другом примере, Stojkovic et al. (Stem Cells 2005 23: 306-314, 2005) описывают систему питающих клеток, получаемую в результате спонтанного дифференцирования человеческих эмбриональных стволовых клеток.
В еще одном примере, Miyamoto et al. (Stem Cells 22: 433-440, 2004) описывают источник питающих клеток, получаемых из человеческой плаценты.
Amit et al (Biol. Reprod 68: 2150-2156, 2003) описывают слой питающих клеток, полученных из человеческой крайней плоти.
В другом примере, Inzunza et al. (Stem Cells 23: 544-549, 2005) описывают слой питающих клеток, полученных из человеческих постнатальных фибробластов крайней плоти.
В патенте US 6642048 описывается среда, поддерживающая рост плюрипотентных стволовых клеток приматов (пПС) в среде, не содержащей питающих клеток, и клеточные линии, которые могут использоваться для производства такой среды. В патенте US 6642048 говорится: «Данное изобретение включает мезенхимо- и фибробластоподобные клеточные линии, полученные из эмбриональной ткани или дифференцированные из эмбриональных стволовых клеток. В документе описываются и иллюстрируются способы получения таких клеточных линий, обработки среды и выращивания стволовых клеток с применением кондиционированной среды».
В другом примере, в заявке на патент WO 2005014799, описывается кондиционированная среда для поддержания, пролиферации и дифференцирования клеток млекопитающих. В заявке на патент WO 2005014799 говорится: «Культуральная среда, произведенная в соответствии с настоящим изобретением, кондиционируется при помощи секреторной активности клеток мыши, в частности активности дифференцированных и иммортализованных трансгенных гепатоцитов, именуемых MMH (Met Murine Hepatocyte)».
В другом примере, Xu et al (Stem Cells 22: 972-980, 2004) описывают кондиционированную среду, полученную из производных человеческих эмбриональных стволовых клеток, генетически модифицированных для увеличения экспрессии обратной транскриптазы человеческой теломеразы.
В другом примере, в заявке на патент US 20070010011, описывается культуральная среда определенного химического состава для поддержания плюрипотентных стволовых клеток.
В альтернативной культуральной системе используется не содержащая сыворотки среда, обогащенная факторами роста, способными стимулировать пролиферацию эмбриональных стволовых клеток. Например, Cheon et al. (BioReprod DOI:10.1095/biolreprod.105.046870, 19 октября 2005 г.) описывают не содержащую питающих клеток и сыворотки культуральную систему, в которой эмбриональные стволовые клетки поддерживаются в некондиционированной, заменяющей сыворотку среде (SR), обогащенной различными факторами роста, способными запустить самообновление эмбриональных стволовых клеток.
В другом примере, Levenstein et al (Stem Cells 24: 568-574, 2006) описывают способы длительного культивирования человеческих эмбриональных стволовых клеток в отсутствие фибробластов или кондиционированной среды, с применением среды, обогащенной основным фактором роста фибробластов (bFGF).
В другом примере, в заявке на патент US 20050148070, описывается способ культивирования человеческих эмбриональных стволовых клеток в среде с определенным составом без сыворотки и без питающих клеток-фибробластов, где указанный способ включает культивирование стволовых клеток в культуральной среде, содержащей альбумин, аминокислоты, витамины, минеральные вещества, по меньшей мере один трансферрин или заменитель трансферрина, по меньшей мере один инсулин или заместитель инсулина, культуральную среду, по существу не включающую эмбриональную сыворотку млекопитающих и содержащую по меньшей мере приблизительно 100 нг/мл фактора роста фибробластов, способного активировать сигнальный рецептор фактора роста фибробластов, причем фактор роста происходит из источника, отличного от просто слоя питающих фибробластов, среду, поддерживающую пролиферацию стволовых клеток в недифференцированном состоянии без слоя питающих клеток или кондиционированной среды.
В другом примере, в заявке на патент US 20050233446, описывается среда с определенным составом, которая может быть использована при культивировании стволовых клеток, включая недифференцированные зародышевые стволовые клетки приматов. В растворе среда является по существу изотонической относительно культивируемых стволовых клеток. В данной культуре указанная среда содержит основную среду и количество bFGF, инсулина и аскорбиновой кислоты, достаточное для поддержания роста зародышевых стволовых клеток без существенного дифференцирования.
В другом примере, в заявке на патент US 6800480, отмечается: «В одном варианте осуществления предлагается культуральная среда для выращивания зародышевых стволовых клеток приматов в по существу недифференцированном состоянии, включающая основную среду с низким содержанием эндотоксина и низким осмотическим давлением, которая эффективно поддерживает рост зародышевых стволовых клеток приматов. Основная среда объединяется с питательной сывороткой, способной поддерживать рост зародышевых стволовых клеток приматов, и субстратом, выбираемым из группы, состоящей из питающих клеток и экстраклеточного матрикса, полученного из питающих клеток. Среда также содержит аминокислоты, не относящиеся к незаменимым, антиоксидант и первый фактор роста, выбираемый из группы, состоящей из нуклеозидов и соль-пирувата».
В другом примере, в заявке на патент US 20050244962, говорится: «В одном аспекте в изобретении предлагается способ культивирования эмбриональных стволовых клеток приматов. Стволовые клетки культивируются в культуре, по существу свободной от эмбриональной сыворотки млекопитающих (предпочтительно также по существу свободной от сыворотки любых животных) и в присутствии фактора роста фибробластов, полученного из источника, отличного от просто слоя питающих фибробластов. В предпочтительной форме слой питающих фибробластов, ранее необходимый для поддержания культуры стволовых клеток, становится необязательным вследствие добавления достаточного количества фактора роста фибробластов».
В другом примере, в заявке на патент WO 2005065354, описывается изотоническая культуральная среда определенного состава, по существу не содержащая питающих клеток и сыворотки, содержащая: a. базальную среду; b. количество bFGF, достаточное для поддержания роста по существу недифференцированных стволовых клеток млекопитающих; c. количество инсулина, достаточное для поддержания роста по существу недифференцированных стволовых клеток млекопитающих; и d. количество аскорбиновой кислоты, достаточное для поддержки роста по существу недифференцированных стволовых клеток млекопитающих.
В другом примере, в заявке на патент WO 2005086845, описывается способ поддержания недифференцированных стволовых клеток, включающий воздействие на стволовые клетки одним членом семейства белков трансформирующего ростового фактора-бета (TGF-β), одним членом семейства белков фактора роста фибробластов (FGF) или никотинамидом (NIC) в количестве, достаточном для поддержания клеток в недифференцированном состоянии в течение периода времени, достаточного для получения желаемого результата.
Плюрипотентные стволовые клетки могут быть высеяны на соответствующий культуральный субстрат. В одном из вариантов осуществления соответствующим культуральным субстратом является компонент внеклеточного матрикса, такой как, например, полученный из базальной мембраны или тот, который может участвовать в лиганд-рецепторном взаимодействии с участием молекулы адгезивного слоя. В одном из вариантов осуществления подходящим культуральным субстратом является MATRIGEL® (Becton Dickenson). MATRIGEL® представляет собой растворимый препарат из клеток опухоли Энгельбрета-Холма-Суорма, который при комнатной температуре превращается в гель и образует восстановленную базальную мембрану.
В качестве альтернативы можно использовать другие компоненты внеклеточного матрикса и смеси компонентов. В зависимости от типа пролиферирующих клеток, это может быть ламинин, фибронектин, протеогликан, энтактин, гепарансульфат и т.п., по отдельности или в различных сочетаниях.
Плюрипотентные стволовые клетки могут высеиваться на субстрат с соответствующим распределением по поверхности и в присутствии среды, поддерживающей выживание, размножение и сохранение требуемых характеристик клеток. Все эти характеристики улучшаются при тщательном подходе к распределению клеток при посеве и могут быть определены специалистом в данной области.
Подходящая культуральная среда может содержать следующие компоненты, например модифицированную по способу Дульбекко среду Игла (DMEM), Gibco № 11965-092; модифицированную по способу Дульбекко среду Игла Knockout (KO DMEM), Gibco № 10829-018; базальную среду Хэма F12/50% DMEM; 200 мM L-глутамина, Gibco № 15039-027; раствор заменимых аминокислот, Gibco № 11140-050; β-меркаптоэтанол, Sigma № M7522; человеческий рекомбинантный основной фактор роста фибробластов (bFGF), Gibco № 13256-029.
Образование панкреатических продуцирующих гормоны клеток из плюрипотентных стволовых клеток
В одном из вариантов осуществления настоящего изобретения предлагается способ получения панкреатических продуцирующих гормоны клеток из плюрипотентных стволовых клеток, включающий:
a. культивирование плюрипотентных стволовых клеток,
b. дифференцирование плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы,
c. дифференцирование клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы, в клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, и
d. дифференцирование клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток.
В одном из аспектов настоящего изобретения панкреатическая эндокринная клетка представляет собой клетку, продуцирующую панкреатические гормоны. В другом аспекте указанная панкреатическая эндокринная клетка представляет собой клетку, экспрессирующую маркеры, характерные для β-клеточной линии. Клетка, экспрессирующая маркеры, характерные для β-клеточной линии, экспрессирует Pdx1 и по меньшей мере один из следующих транскрипционных факторов: NGN-3, Nkx2.2, Nkx6.1, NeuroD, Isl-1, HNF-3 бета, MAFA, Pax4 и Pax6. В одном аспекте настоящего изобретения клетка, экспрессирующая маркеры, характерные для β-клеточной линии, представляет собой β-клетку.
Плюрипотентные стволовые клетки, соответствующие целям настоящего изобретения, включают, например, эмбриональные стволовые клетки человека линии H9 (код NIH: WA09), эмбриональные стволовые клетки человека линии H1 (код NIH: WA01), эмбриональные стволовые клетки человека линии H7 (код NIH: WA07) и эмбриональные стволовые клетки человека линии SA002 (Cellartis, Швеция). Также подходят для использования в рамках настоящего изобретения клетки, экспрессирующие по меньшей мере один из следующих маркеров, характерных для плюрипотентных клеток: ABCG2, крипто, CD9, FoxD3, коннексин43, коннексин45, Oct4, Sox2, Nanog, hTERT, UTF-1, ZFP42, SSEA-3, SSEA-4, Tra1-60, Tra1-81.
Маркеры, характерные для линии сформированной эндодермы, выбирают из группы, состоящей из SOX-17, GATA4, Hnf-3бета, GSC, Cer1, Nodal, FGF8, Brachyury, Mix homeobox-подобного белка, FGF4 CD48, эомезодермина (EOMES), DKK4, FGF17, GATA6, CXCR4, C-Kit, CD99 и OTX2. Подходит для использования в настоящем изобретении клетка, экспрессирующая по меньшей мере один из маркеров, характерных для линии сформированной эндодермы. В одном из аспектов настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии сформированной эндодермы, представляет собой клетку-предшественника первичной полоски. В другом аспекте настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии сформированной эндодермы, представляет собой мезэндодермальную клетку. В другом аспекте настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии сформированной эндодермы, представляет собой клетку сформированной эндодермы.
Маркеры, характерные для линии панкреатической эндодермы, выбирают из группы, состоящей из Pdx1, HNF-1 бета, PTF1a, HNF-6, HB9 и PROX1. Подходит для использования в настоящем изобретении клетка, экспрессирующая по меньшей мере один из маркеров, характерных для линии панкреатической эндодермы. В одном из аспектов настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии панкреатической эндодермы, представляет собой клетку панкреатической эндодермы.
Маркеры, характерные для линии дифференцирования панкреатических эндокринных клеток, выбирают из группы, состоящей из NGN-3, NeuroD, Islet-1, Pdx-1, NKX6.1, Pax-4, Ngn-3 и PTF-1 альфа. В одном из вариантов осуществления панкреатическая эндокринная клетка способна экспрессировать по меньшей мере один из следующих гормонов: инсулин, глюкагон, соматостатин и панкреатический полипептид. Соответствующей целям настоящего изобретения является клетка, экспрессирующая по меньшей мере один из маркеров, характерных для линии панкреатических эндокринных клеток. В одном из аспектов настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии панкреатических эндокринных клеток, представляет собой панкреатическую эндокринную клетку. Панкреатическая эндокринная клетка может представлять собой панкреатическую экспрессирующую гормоны клетку. В качестве альтернативы панкреатическая эндокринная клетка может представлять собой панкреатическую секретирующую гормоны клетку.
В одном аспекте настоящего изобретения панкреатическая эндокринная клетка представляет собой клетку с экспрессией маркеров, характерных для линии дифференцирования β-клеток. Клетка, экспрессирующая маркеры, характерные для β-клеточной линии, экспрессирует Pdx1 и по меньшей мере один из следующих транскрипционных факторов: NGN-3, Nkx2.2, Nkx6.1, NeuroD, Isl-1, HNF-3 бета, MAFA, Pax4 и Pax6. В одном аспекте настоящего изобретения клетка, экспрессирующая маркеры, характерные для β-клеточной линии, представляет собой β-клетку.
Образование клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы
Плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, с использованием любого известного специалистам способа или с использованием любого способа, предложенного в настоящем изобретении.
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, в соответствии со способами, описанными в публикации D'Amour et al, Nature Biotechnology 23, 1534-1541 (2005).
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, в соответствии со способами, описанными в публикации Shinozaki et al, Development 131, 1651-1662 (2004).
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, в соответствии со способами, описанными в публикации McLean et al, Stem Cells 25, 29-38 (2007).
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, в соответствии со способами, описанными в публикации D'Amour et al, Nature Biotechnology 24, 1392-1401 (2006).
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, путем культивирования плюрипотентных стволовых клеток в среде, содержащей активин A в отсутствие сыворотки, затем культивирования клеток с активином A и сывороткой, а затем культивирования клеток с активином A и сывороткой в другой концентрации. Пример данного способа описан в публикации Nature Biotechnology 23, 1534-1541 (2005).
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, путем культивирования плюрипотентных стволовых клеток в среде, содержащей активин А в отсутствие сыворотки, затем культивирования клеток с активином A и сывороткой в другой концентрации. Пример данного способа описан в публикации D' Amour et al, Nature Biotechnology, 2005.
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, путем культивирования плюрипотентных стволовых клеток в среде, содержащей активин А и лиганд Wnt в отсутствие сыворотки, затем удаления лиганда Wnt и культивирования клеток с активином A и сывороткой. Пример использования данного способа приведен в публикации Nature Biotechnology 24, 1392-1401 (2006).
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, путем обработки плюрипотентных стволовых клеток в соответствии со способами, изложенными в заявке на патент США № 11/736908, принадлежащей LifeScan, Inc.
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, путем обработки плюрипотентных стволовых клеток в соответствии со способами, изложенными в заявке на патент США № 11/779311, принадлежащей LifeScan, Inc.
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, путем обработки плюрипотентных стволовых клеток в соответствии со способами, изложенными в заявке на патент США № 60/990529.
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, путем обработки плюрипотентных стволовых клеток в соответствии со способами, изложенными в заявке на патент США № 61/076889.
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, путем обработки плюрипотентных стволовых клеток в соответствии со способами, изложенными в заявке на патент США № 61/076900.
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, путем обработки плюрипотентных стволовых клеток в соответствии со способами, изложенными в заявке на патент США № 61/076908.
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, путем обработки плюрипотентных стволовых клеток в соответствии со способами, изложенными в заявке на патент США № 61/076915.
Дифференцирование клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы
Образование клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы, может быть выявлено путем проверки на наличие маркеров до и после выполнения конкретного протокола. Плюрипотентные стволовые клетки, как правило, не экспрессируют такие маркеры. Таким образом, дифференцирование плюрипотентных клеток определяется по началу экспрессии таких маркеров.
Эффективность дифференцирования может быть определена путем обработки популяции клеток агентом (например, антителом), специфически распознающим белковый маркер, экспрессированный клетками, экспрессирующими маркеры, характерные для линии сформированной эндодермы.
Способы оценки экспрессии маркеров белков и нуклеиновых кислот в культивированных или выделенных клетках являются стандартными для данной области. Сюда относятся количественная полимеразная цепная реакция с обратной транскрипцией (ОТ-ПЦР), Нозерн-блоттинг, гибридизация in situ (см., например, Current Protocols in Molecular Biology (Ausubel et al., eds. 2001 supplement)), и иммунологические способы, такие как иммуногистохимический анализ среза материала, Вестерн-блоттинг, а для маркеров, доступных в интактных клетках, метод проточной цитометрии (FACS) (см., например, Harlow and Lane, Using Antibodies: A Laboratory Manual, New York: Cold Spring Harbor Laboratory Press (1998)).
Характеристики плюрипотентных стволовых клеток хорошо известны специалистам в данной области, и продолжается выявление дополнительных характеристик плюрипотентных стволовых клеток. К маркерам плюрипотентных стволовых клеток относятся, например, экспрессия одного или нескольких следующих факторов: ABCG2, крипто, FoxD3, коннексин43, коннексин45, Oct4, Sox2, Nanog, hTERT, UTF-1, ZFP42, SSEA-3, SSEA-4, Tra1-60, Tra1-81.
После обработки плюрипотентных стволовых клеток с применением способов, составляющих предмет настоящего изобретения, дифференцированные клетки могут быть выделены путем воздействия на популяцию клеток агентом (например, антителом), специфически распознающим белковый маркер, например CXCR4, экспрессируемый клетками, экспрессирующими маркеры, характерные для линии сформированной эндодермы.
Образование клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы
Клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, с использованием любого способа, известного специалистам в данной области, или с использованием способа, предложенного в настоящем изобретении.
Например, клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, в соответствии со способами, описанными в публикации D'Amour et al, Nature Biotechnology 24, 1392-1401 (2006).
Например, клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, далее дифференцируют в клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, путем обработки клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы, фактором роста фибробластов и ингибитором сигнального пути Hedgehog KAAD-циклопамином с последующим удалением содержащей фактор роста фибробластов и KAAD-циклопамин среды и культивированием клеток в среде, содержащей ретиноевую кислоту, фактор роста фибробластов и KAAD-циклопамин. Пример использования данного способа приведен в публикации Nature Biotechnology 24, 1392-1401 (2006).
В одном из аспектов настоящего изобретения клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, далее дифференцируют в клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, путем обработки клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы, ретиноевой кислотой и по меньшей мере одним фактором роста фибробластов в течение периода времени, в соответствии со способами, описанными в заявке США № 11/736908, принадлежащей LifeScan, Inc.
В одном из аспектов настоящего изобретения клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, путем обработки клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы, ретиноевой кислотой и по меньшей мере одним фактором роста фибробластов в течение периода времени, в соответствии со способами, описанными в заявке США № 11/779311, принадлежащей LifeScan, Inc.
В одном из аспектов настоящего изобретения клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, путем обработки клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы, в соответствии со способами, описанными в заявке США № 60/990529.
Обнаружение клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы
Маркеры, характерные для линии панкреатической эндодермы, хорошо известны специалистам в данной области, и дополнительные маркеры, характерные для линии панкреатической эндодермы, продолжают выявляться. Такие маркеры могут использоваться для подтверждения того, что клетки, прошедшие обработку в соответствии с настоящим изобретением, дифференцировались и приобрели характерные особенности линии панкреатической эндодермы. К маркерам, характерным для линии панкреатической эндодермы, относится экспрессия одного или нескольких факторов транскрипции, таких как, например, Hlxb9, PTF-1a, PDX-1, HNF-6, HNF-1 бета.
Эффективность дифференцирования может быть определена путем обработки популяции клеток агентом (например, антителом), специфически распознающим белковый маркер, экспрессированный клетками, экспрессирующими маркеры, характерные для линии панкреатической эндодермы.
Способы оценки экспрессии маркеров белков и нуклеиновых кислот в культивированных или выделенных клетках являются стандартными для данной области. Сюда относятся количественная полимеразная цепная реакция обратной транскрипции (ОТ-ПЦР), Нозерн-блоттинг, гибридизация in situ (см., например, Current Protocols in Molecular Biology (Ausubel et al., eds. 2001 supplement)), и иммунологические способы, такие как иммуногистохимический анализ среза материала, Вестерн-блоттинг, а для маркеров, доступных в интактных клетках, метод проточной цитометрии (FACS) (см., например, Harlow and Lane, Using Antibodies: A Laboratory Manual, New York: Cold Spring Harbor Laboratory Press (1998)).
Создание клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток
Клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, с использованием любого способа, известного специалистам в данной области, или с использованием способа, раскрываемого в настоящем изобретении.
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, в соответствии со способами, описанными в публикации D'Amour et al, Nature Biotechnology 24, 1392-1401 (2006).
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, далее дифференцируют в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем культивирования клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, в среде, содержащей DAPT и экзендин-4, с последующим удалением содержащей DAPT и экзендин-4 среды и культивированием клеток в среде, содержащей экзендин-1, IGF-1 и HGF. Пример использования данного способа приведен в публикации Nature Biotechnology 24, 1392-1401 (2006).
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, далее дифференцируют в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем культивирования клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, в среде, содержащей экзендин-4, с последующим удалением содержащей экзендин-4 среды и культивированием клеток в среде, содержащей экзендин-1, IGF-1 и HGF. Пример использования данного способа приведен в публикации D' Amour et al, Nature Biotechnology, 2006.
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, далее дифференцируют в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем культивирования клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, в среде, содержащей DAPT и экзендин-4. Пример использования данного способа приведен в публикации D' Amour et al, Nature Biotechnology, 2006.
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, далее дифференцируют в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток. путем культивирования клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, в среде, содержащей экзендин-4. Пример использования данного способа приведен в публикации D' Amour et al, Nature Biotechnology, 2006.
В одном из аспектов настоящего изобретения клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, далее дифференцируют в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем обработки клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, фактором, ингибирующим сигнальный путь Notch, в соответствии со способами, описанными в заявке США № 11/736908, принадлежащей LifeScan, Inc.
В одном из аспектов настоящего изобретения клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем обработки клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, фактором, ингибирующим сигнальный путь Notch, в соответствии со способами, описанными в заявке США № 11/779311, принадлежащей LifeScan, Inc.
В одном из аспектов настоящего изобретения клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем обработки клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, фактором, ингибирующим сигнальный путь Notch, в соответствии со способами, описанными в заявке США № 60/953178, принадлежащей LifeScan, Inc.
В одном из аспектов настоящего изобретения клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем обработки клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, в соответствии со способами, описанными в заявке США № 60/990529.
В одном аспекте настоящего изобретения предлагается способ увеличения экспрессии маркеров, ассоциированных с линией панкреатических эндокринных клеток, включающий обработку клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, средой, содержащей достаточное количество агониста рецептора TGF-β, чтобы вызвать увеличение экспрессии маркеров, ассоциированных с линией панкреатических эндокринных клеток.
Агонист рецептора TGF-β может представлять собой любой агент, способный связываться с рецептором TGF-β и активировать его. В одном из вариантов осуществления агонист рецептора TGF-β выбран из группы, состоящей из активина A, активина B и активина C.
В альтернативном варианте осуществления агонист рецептора TGF-β может представлять собой вариант пептида активина A. Примеры подобных пептидов приводятся в заявке на патент США № 61/076889, принадлежащей Centocor R&D, Inc.
В одном варианте осуществления клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, обрабатывают активином А в количестве, достаточном для увеличения экспрессии маркеров, ассоциированных с линией панкреатических эндокринных клеток, в течение периода от приблизительно одного до приблизительно пяти дней. Как вариант, клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, обрабатывают активином А в количестве, достаточном для увеличения экспрессии маркеров, ассоциированных с линией панкреатических эндокринных клеток, в течение периода от приблизительно трех до приблизительно пяти дней. Как вариант, клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, обрабатываются активином А в количестве, достаточном для увеличения экспрессии маркеров, ассоциированных с линией панкреатических эндокринных клеток, в течение периода, составляющего приблизительно пять дней.
В альтернативном варианте осуществления агонист рецептора TGF-β выбран из группы, состоящей из GDF-8, GDF-11 и GDF-15. В одном варианте осуществления клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, обрабатываются агонистом рецептора TGF-β, выбираемым из группы, состоящей из GDF-8, GDF-11 и GDF-15, и по меньшей мере одним другим фактором. В одном варианте осуществления такой по меньшей мере один другой фактор представляет собой циклический анилин-пиридинотриазин. Примеры подобных циклических анилин-пиридинотриазинов приводятся в заявке на патент США № 61/076900, принадлежащей Centocor R&D, Inc. В альтернативном варианте осуществления такой по меньшей мере один другой фактор представляет собой анилин-пиридинотриазиновое соединение. Примеры подобных анилин-пиридинотриазиновых соединений приводятся в заявке на патент США № 61/076908, принадлежащей Centocor R&D, Inc. В альтернативном варианте осуществления такой по меньшей мере один другой фактор представляет собой соединение, описанное в заявке на патент США № 61/076915, принадлежащей Centocor R&D, Inc.
В одном аспекте настоящего изобретения клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, далее проходят процедуру обогащения. Этап обогащения может выполняться до обработки клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, агонистом рецептора TGF-β. Как вариант, этап обогащения может выполняться после обработки клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, агонистом рецептора TGF-β.
В одном варианте осуществления обогащение достигается путем получения суспензии клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, и пропускания суспензии клеток через клеточный фильтр 40 мкм.
Обнаружение клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток
Маркеры, характерные для линии панкреатических эндокринных клеток, хорошо известны специалистам в данной области, и продолжается выявление дополнительных маркеров, характерных для линии панкреатических эндокринных клеток. Такие маркеры могут использоваться для подтверждения того, что клетки, прошедшие обработку в соответствии с настоящим изобретением, дифференцировались и приобрели характерные особенности линии панкреатических эндокринных клеток. К маркерам, специфическим для линии панкреатических эндокринных клеток, относится экспрессия одного или нескольких факторов транскрипции, таких как, например, NGN-3, NeuroD, Islet-1.
Маркеры, характерные для линии β-клеток, хорошо известны специалистам в данной сфере, и дополнительные маркеры, характерные для линии β-клеток, продолжают выявляться. Эти маркеры могут использоваться для подтверждения того, что клетки, прошедшие обработку в соответствии с настоящим изобретением, дифференцировались и приобрели свойства, характерные для линии β-клеток. К специфическим особенностям линии β-клеток относится экспрессия одного или нескольких факторов транскрипции, в том числе таких, как Pdx1 (ген панкреатико-дуоденального гомеобокса-1), Nkx2.2, Nkx6.1, Isl1, Pax6, Pax4, NeuroD, Hnf1b, Hnf-6, Hnf-3бета и MafA. Такие факторы транскрипции широко используются в данной области для идентификации эндокринных клеток. См., например, обзор Edlund (Nature Reviews Genetics 3: 524-632 (2002)).
Эффективность дифференцирования может быть определена путем обработки популяции клеток агентом (например, антителом), специфически распознающим белковый маркер, экспрессированный клетками, экспрессирующими маркеры, характерные для линии панкреатических эндокринных клеток. В качестве альтернативы эффективность дифференцирования может быть определена путем обработки популяции клеток агентом (например, антителом), специфически распознающим белковый маркер, экспрессированный клетками, экспрессирующими маркеры, характерные для линии β-клеток.
Способы оценки экспрессии маркеров белков и нуклеиновых кислот в культивированных или выделенных клетках являются стандартными для данной области. Сюда относятся количественная полимеразная цепная реакция обратной транскрипции (ОТ-ПЦР), Нозерн-блоттинг, гибридизация in situ (см., например, Current Protocols in Molecular Biology (Ausubel et al., eds. 2001 supplement)), и иммунологические способы, такие как иммуногистохимический анализ среза материала, Вестерн-блоттинг, а для маркеров, доступных в интактных клетках, метод проточной цитометрии (FACS) (см., например, Harlow and Lane, Using Antibodies: A Laboratory Manual, New York: Cold Spring Harbor Laboratory Press (1998)).
В одном из аспектов настоящего изобретения эффективность дифференцирования определялась путем измерения процентной доли инсулин-положительных клеток в данной клеточной культуре после обработки. В одном из вариантов осуществления способы, составляющие предмет настоящего изобретения, давали приблизительно 100% инсулин-положительных клеток в данной культуре. В альтернативном варианте осуществления способы, составляющие предмет настоящего изобретения, давали приблизительно 90% инсулин-положительных клеток в данной культуре. В альтернативном варианте осуществления способы, составляющие предмет настоящего изобретения, давали приблизительно 80% инсулин-положительных клеток в данной культуре. В альтернативном варианте осуществления способы, составляющие предмет настоящего изобретения, давали приблизительно 70% инсулин-положительных клеток в данной культуре. В альтернативном варианте осуществления способы, составляющие предмет настоящего изобретения, давали приблизительно 60% инсулин-положительных клеток в данной культуре. В альтернативном варианте осуществления способы, составляющие предмет настоящего изобретения, давали приблизительно 50% инсулин-положительных клеток в данной культуре. В альтернативном варианте осуществления способы, составляющие предмет настоящего изобретения, давали приблизительно 40% инсулин-положительных клеток в данной культуре. В альтернативном варианте осуществления способы, составляющие предмет настоящего изобретения, давали приблизительно 30% инсулин-положительных клеток в данной культуре. В альтернативном варианте осуществления способы, составляющие предмет настоящего изобретения, давали приблизительно 20% инсулин-положительных клеток в данной культуре. В альтернативном варианте осуществления способы, составляющие предмет настоящего изобретения, давали приблизительно 10% инсулин-положительных клеток в данной культуре. В альтернативном варианте осуществления способы, составляющие предмет настоящего изобретения, давали приблизительно 5% инсулин-положительных клеток в данной культуре.
В одном из аспектов настоящего изобретения эффективность дифференцирования определяли путем измерения стимулированной глюкозой секреции инсулина, определявшейся по количеству С-пептида, секретируемого клетками. В одном из вариантов осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 1000 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 900 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 800 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 700 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 600 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 500 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 400 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 500 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 400 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 300 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 200 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 100 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 90 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 80 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 70 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 60 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 50 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 40 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 30 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 20 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 10 нг C-пептида/пг ДНК.
Способы лечения
В одном из аспектов настоящего изобретения предлагается способ лечения пациентов, страдающих от диабета 1 типа или подвергающихся риску развития этого заболевания. Данный способ включает культивирование плюрипотентных стволовых клеток, дифференцирование плюрипотентных стволовых клеток in vitro в линию β-клеток и имплантирование клеток β-линии пациенту.
В еще одном аспекте настоящего изобретения предлагается способ лечения пациентов, страдающих от диабета 2 типа или подвергающихся риску развития этого заболевания. Данный способ включает культивирование плюрипотентных стволовых клеток, дифференцирование плюрипотентных культивированных стволовых клеток in vitro в линию β-клеток и имплантирование клеток β-линии пациенту.
При необходимости, пациент далее может получать лечение фармацевтическими средствами или биологически активными веществами, улучшающими выживаемость и функционирование трансплантированных клеток. К этим веществам могут относиться, например, в том числе, инсулин, члены семейства TGF-β, включая TGF-β1, 2 и 3, костные морфогенетические белки (BMP-2, -3, -4, -5, -6, -7, -11, -12 и -13), факторы роста фибробластов-1 и -2, тромбоцитарный фактор роста -AA и -BB, плазма, богатая тромбоцитами, инсулин-подобный фактор роста (IGF-I, II), фактор роста и дифференцирования (GDF-5, -6, -7, -8, -10, -15), фактор роста из клеток эндотелия сосудов (VEGF), плейотропин, эндотелин. К другим фармацевтическим веществам могут относиться, например, никотинамид, глюкагон-подобный пептид-I (GLP-1) и II, миметические антитела GLP-1 и 2, экзендин-4, ретиноевая кислота, паратиреоидный гормон, ингибиторы MAPK, такие, например, как описаны в опубликованной патентной заявке США 2004/0209901 и опубликованной патентной заявке США 2004/0132729.
Плюрипотентные стволовые клетки могут быть дифференцированы в инсулин-продуцирующие клетки перед трансплантацией реципиенту. В специфическом варианте осуществления плюрипотентные стволовые клетки являются полностью дифференцированными в β-клетки до трансплантации реципиенту. В качестве альтернативы плюрипотентные стволовые клетки могут быть трансплантированы реципиенту в недифференцированном или частично дифференцированном состоянии. Дальнейшее дифференцирование может происходить в организме реципиента.
Клетки сформированной эндодермы или, в качестве альтернативы, клетки панкреатической эндодермы или, в качестве альтернативы, β-клетки, могут быть имплантированы в форме дисперсных клеток или клеток, образовавших кластеры, которые методом инфузии могут вводиться в воротную вену печени. В качестве альтернативы клетки можно вводить в биологически-совместимые разрушающиеся полимерные вспомогательные материалы, в пористые неразрушающиеся приспособления или в инкапсулированном виде для защиты от иммунной реакции организма-хозяина. Клетки могут быть имплантированы в подходящее место организма реципиента. К таким местам для имплантации относятся, например, печень, естественная поджелудочная железа, пространство под почечной капсулой, сальник, брюшная полость, субсерозное пространство, кишечник, желудок или подкожный карман.
Для стимуляции дальнейшего дифференцирования, выживания и активности имплантированных клеток предварительно, одновременно или после имплантации клеток могут вводиться дополнительные факторы, такие как факторы роста, антиоксиданты или противовоспалительные вещества. В некоторых вариантах осуществления факторы роста применяются для дифференцирования введенных клеток in vivo. Эти факторы могут секретироваться эндогенными клетками и воздействовать на введенные клетки in situ. Дифференцирование имплантированных клеток можно индуцировать любым сочетанием эндогенных и введенных экзогенно факторов роста, известных специалистам в данной области.
Число клеток, используемое при имплантации, зависит от ряда различных факторов, в том числе от состояния пациента и его реакции на лечение, и может быть определено специалистом в данной области.
В одном из аспектов настоящего изобретения предлагается способ лечения пациентов, страдающих от диабета или подвергающихся риску развития этого заболевания. Данный способ включает культивирование плюрипотентных стволовых клеток, дифференцирование культивированных стволовых клеток in vitro в линию β-клеток и заключение клеток в опорный материал с трехмерной структурой. Клетки могут поддерживаться in vitro на этом опорном материале до имплантации пациенту. В качестве альтернативы опорный материал, содержащий клетки, может быть напрямую имплантирован в организм пациента без дополнительного культивирования in vitro. Опорный материал может содержать по меньшей мере одно фармацевтическое средство, улучшающее выживание и функционирование трансплантированных клеток.
К опорным материалам, соответствующим целям настоящего изобретения, относятся тканевые шаблоны, каналы, перегородки и резервуары, применяемые для восстановления тканей. В частности, соответствуют целям практического применения способов настоящего изобретения синтетические и природные материалы в форме пены, губок, гелей, гидрогелей, тканых и нетканых структур, применяемых in vitro и in vivo для реконструкции и регенерации биологической ткани, а также для доставки хемотаксических агентов, индуцирующих рост ткани. См., например, материалы, содержащиеся в патентах США №№ 5770417, 6022743, 5567612, 5759830, 6626950, 6534084, 6306424, 6365149, 6599323, 6656488, опубликованной заявке на патент США 2004/0062753 A1 и патентах США №№ 4557264 и 6333029.
Для того чтобы создать опорный материал с включенным фармацевтическим средством, такое средство можно смешать с раствором полимера до изготовления опорной структуры. В качестве альтернативы фармацевтическое средство можно нанести на изготовленную опорную структуру, предпочтительно в присутствии фармацевтического носителя. Фармацевтическое средство может быть в виде жидкости, мелкодисперсного твердого вещества или иметь любую другую подходящую физическую форму. В качестве альтернативы в опорный материал могут быть добавлены инертные наполнители для изменения скорости высвобождения фармацевтического средства. В альтернативном варианте осуществления опорный материал содержит по меньшей мере одно фармацевтическое средство, являющееся противовоспалительным средством, как, например, описанные в патенте США № 6509369.
Опорный материал может содержать по меньшей мере одно фармацевтическое средство, являющееся антиапоптозным средством, как например, средства, описанные в патенте США № 6793945.
Опорный материал дополнительно может содержать по меньшей мере одно фармацевтическое средство, являющееся ингибитором фиброза, как например, средства, описанные в патенте США № 6331298.
Опорный материал дополнительно может содержать по меньшей мере одно фармацевтическое средство, являющееся стимулятором ангиогенеза, как например, средства, описанные в опубликованной заявке на патент США 2004/0220393 и опубликованной заявке на патент США 2004/0209901.
Опорный материал дополнительно может содержать по меньшей мере одно фармацевтическое средство, являющееся иммуносупрессором, как например, средства, описанные в опубликованной заявке на патент США 2004/0171623.
Опорный материал дополнительно может содержать по меньшей мере одно фармацевтическое средство, представляющее собой фактор роста, например члены семейства TGF-β, включая TGF-β1, 2 и 3, костные морфогенетические белки (BMP-2, -3, -4, -5, -6, -7, -11, -12 и -13), факторы роста фибробластов-1 и -2, тромбоцитарный фактор роста -AA и -BB, плазму, богатую тромбоцитами, инсулин-подобный фактор роста (IGF-I, II), фактор роста и дифференцирования (GDF-5, -6, -8, -10, -15), фактор роста из клеток эндотелия сосудов (VEGF), плейотропин, эндотелин. Другие фармацевтические средства могут включать, например, никотинамид, индуцированный гипоксией фактор 1-альфа, глюкагонподобный пептид-I (GLP-1), миметические антитела GLP-1 и GLP-2, и II, экзендин-4, Nodal, Noggin, NGF, ретиноевую кислоту, паратиреоидный гормон, тенасцин-C, тропоэластин, пептиды тромбинового происхождения, кателицидины, дефензины, ламинин, биологические пептиды, содержащие связывающие клетки и гепарин домены протеинов адгезивного внеклеточного матрикса, такие как фибронектин и витронектин, ингибиторы MAPK, такие как средства, описанные в опубликованных заявках на патент США 2004/0209901 и 2004/0132729.
Включение клеток, составляющих предмет настоящего изобретения, в опорный каркас может осуществляться путем простого нанесения клеток на опорный каркас. Клетки могут входить внутрь каркаса путем простой диффузии (J. Pediatr. Surg. 23 (1 Pt 2): 3-9 (1988)). Было разработано несколько других подходов для повышения эффективности посева клеток. Например, для посева хондроцитов на каркасы из полигликолевой кислоты используются центрифужные пробирки (Biotechnol. Prog. 14(2): 193-202 (1998)). Другой подход к посеву клеток представляет собой использование центрифугирования, создающего минимальный стресс для высеиваемых клеток и повышающий эффективность посева. Например, в публикации Yang et al. разработан способ нанесения клеток (J.Biomed. Mater. Res. 55(3): 379-86 (2001)), названный центрифужной иммобилизацией клеток (CCI).
Настоящее изобретение далее иллюстрируют, помимо прочих, следующие примеры.
ПРИМЕРЫ
Пример 1
Дифференцирование человеческих эмбриональных стволовых клеток линии H1 в панкреатические эндокринные клетки в отсутствие эмбриональной бычьей сыворотки
Клетки линии человеческих эмбриональных стволовых клеток H1, пассаж 52, культивировали на чашках с покрытием MATRIGEL™ (разведение 1:30) и подвергали воздействию среды RPMI с добавлением 2% БСА (№ по каталогу 152401, MP Biomedical, Огайо) и 100 нг/мл активина A (R&D Systems, MN), с добавлением 20 нг/мл WNT-3a (№ по каталогу 1324-WN-002, R&D Systems, MN), с добавлением 8 нг/мл bFGF (№ по каталогу 100-18B, PeproTech, NJ) в течение одного дня с последующей обработкой средой RPMI с добавлением 2% БСА и 100 нг/мл активина A, с добавлением 8 нг/мл bFGF в течение еще двух дней. Далее культуры обрабатывали DMEM/F12 + 2% БСА + 50 нг/мл FGF7 + 0,25 мкM KAAD-циклопамина (№ 239804, Calbiochem, Калифорния) в течение двух дней с последующей четырехдневной инкубацией в DMEM/F12 + 1% B27 (Invitrogen, Калифорния) + 50 нг/мл FGF7 + 0,25 мкM KAAD-циклопамина + 2 мкM ретиноевой кислоты (RA) (Sigma, MO) + 100 нг/мл Noggin (R & D Systems, Миннесота).
Клетки дифференцировали в панкреатические эндокринные клетки путем инкубации в DMEM/F12 + 1% B27 (Invitrogen, Калифорния) + 100 нг/мл Noggin + 1 мкM DAPT (ингибитор гамма-секретазы) (№ по каталогу 565784, Calbiochem, Калифорния) + 1 мкM ALK5-ингибитора II (№ по каталогу 616452, Calbiochem, Калифорния) + 100 нг/мл Netrin-4 (R&D Systems, Миннесота) в течение трех дней с дополнительной семидневной инкубацией в DMEM/F12 + 1% B27 (Invitrogen, Калифорния) + 1 мкM ALK5-ингибитора II (Calbiochem, Калифорния). Для дальнейшего созревания эндокринных культур была добавлена последняя стадия семидневной обработки средой DMEM/F12 + 1% B27 (Invitrogen, Калифорния). За исключением последней стадии, все прочие стадии были связаны с ежедневной сменой среды. Общая схема процедуры изображена на фиг.1. На каждой стадии количество клеток подсчитывали с помощью гемоцитометра и для ПЦР-анализа отбирали образцы РНК. Все образцы отбирали трехкратно.
На фиг.2, панели а и b, показана измеренная методом FACS экспрессия в клетках маркера CXCR4, а также данные ПЦР реального времени для трехдневного срока, соответствующего стадии 1. Виден многократный рост экспрессии относительно недифференцированных эмбриональных стволовых клеток H1.
Пример 2
Добавление активина А к культурам стадии 6 значительно увеличивало экспрессию маркеров панкреатических эндокринных клеток
Клетки линии человеческих эмбриональных стволовых клеток H1, пассаж 43, культивировали на чашках, покрытых реактивом MATRIGEL™ (разведение 1:30), и дифференцировали в панкреатические эндокринные клетки в соответствии со способами, описанными в Примере 1. На стадии 6 некоторые культуры обрабатывали 10 нг/мл активина A (R&D Systems, Миннесота) в течение семи дней. В день 7 клетки обрабатывали в течение 5 мин при комнатной температуре 1X раствором Accutase (Sigma, Миссури) с последующим удалением раствора Accutase и добавлением среды DMEM/12 + 1% B27. Прикрепленные клетки снимали клеточным скребком, аккуратно ресуспендировали и пропускали через клеточный фильтр на 40 мкм. Фильтрат и задержанные фильтром клетки извлекали и отбирали образцы для ПЦР и окрашивания дитизоном. Дитизон (DTZ) представляет собой краситель, избирательно связывающийся с цинком, присутствующим, как было показано, в островковых клетках. На фиг.3, панели a-c, показаны окрашенные DTZ культуры до и после разделения с использованием клеточного фильтра 40 мкм. Значительная часть (приблизительно 80%) кластеров с размерами более 40 мкм оказалась положительной по окрашиванию DTZ. Это дает быстрый и простой способ обогащения кластеров, богатых эндокринными клетками. На фиг.4, панели a-f, показан профиль экспрессии генов в клетках, обработанных на стадии 6 +/- 10 нг/мл активина A, а затем обогащенных при помощи фильтра на 40 мкм. Добавление активина А к культурам стадии 6 значительно увеличивало экспрессию маркеров панкреатических эндокринных клеток.
Публикации, цитируемые в настоящем документе, в силу ссылки на них полностью включены в настоящий документ. Хотя различные аспекты изобретения иллюстрируются выше ссылками на примеры и предпочтительные варианты осуществления, подразумевается, что область изобретения ограничивается не упомянутым выше описанием, а следующими пунктами формулы изобретения, составленными в соответствии с принципами патентного законодательства.
Реферат
Изобретение относится к области биотехнологии. В настоящем изобретении предлагаются способы стимуляции дифференцирования плюрипотентных стволовых клеток. В частности, в настоящем изобретении предлагается способ увеличения экспрессии маркеров, ассоциированных с линией панкреатических эндокринных клеток, с применением агониста рецептора TGF-бета, такого как активин A, активин B, активин C, GDF-8, GDF-11 или GDF-15. 2 н. и 5 з.п. ф-лы, 4 ил., 2 пр.
Формула
a. культивирование плюрипотентных стволовых клеток,
b. дифференцирование плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы,
c. дифференцирование клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы, в клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, и
d. дифференцирование клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, в панкреатические эндокринные клетки, и где
экспрессия маркеров, характерных для панкреатических эндокринных клеток, увеличивается путем обработки панкреатических эндокринных клеток средой, содержащей агонист рецептора TGF-β, выбранный из группы, состоящей из активина А, активина В, активина С, пептидных вариантов активина A, GDF-8, GDF-11 и GDF-15, чтобы вызвать увеличение экспрессии одного или более PDX.1, NKX6.1, PAX4 и NKX2.2.
a. примерно от одного до пяти дней;
b. примерно от трех до пяти дней;
c. примерно пяти дней.
