Способ получения тромбоцитов с помощью устройства для возвратно-поступательного перемешивания - RU2741871C2
Код документа: RU2741871C2
Чертежи







Описание
Область Техники
[0001] Настоящее изобретение относится к способу получения тромбоцитов с использованием устройства для перемешивания, содержащего перемешивающую лопасть, которая движется возвратно-поступательно.
Уровень Техники
[0002] Препарат тромбоцитов вводят субъектам, которые потеряли большое количество крови при операциях или травмах, или у которых есть склонность к кровотечению с уменьшением количества тромбоцитов после лечения противораковыми препаратами, для лечения или профилактики симптомов. Производство препарата тромбоцитов в настоящее время зависит от донорства крови здоровыми добровольцами. Однако число доноров крови уменьшается из-за состава населения в Японии, и по оценкам в 2027 году будет иметь место нехватка донорской крови примерно для миллиона человек. Поэтому стабильное снабжение тромбоцитами является одной из целей в области техники настоящего изобретения.
[0003] Кроме того, обычный препарат тромбоцитов подвержен высокому риску микробного загрязнения. Поэтому ввод препарата тромбоцитов может вызывать серьезные инфекционные заболевания. Поэтому в клинических центрах всегда требуются более безопасные препараты тромбоцитов. Для удовлетворения этой потребности в настоящее время разработан способ получения тромбоцитов из мегакариоцитарных клеток, культивируемых in vitro.
[0004] Тромбоциты обычно получают из культивируемых клеток в статической системе культивирования с использованием чашки (WO 2014/100779 A1, Qiang Feng, et al., Stem Cell Reports). Однако производство в статической системе культивирования приводит к множеству проблем и не подходит для массового культивирования.
Список литературы
Патентный документ
[0005] Патентный документ 1: WO 2014/1007791
Непатентный документ
[0006] Непатентный документ 1: Qiang Feng, et al., Stem Cell Reports 3 1-15 (2014)
Сущность изобретения
Техническая проблема
[0007] Авторам настоящего изобретения удалось получить тромбоциты с высокой биоактивностью с использованием способа культивирования в системе культивирования при встряхивании с использованием встряхиваемой колбы, т.е. при встряхивании самого культурального сосуда. Однако было обнаружено, что количество получаемых тромбоцитов (CD41a+CD42b+) и биоактивность (способность связывать PAC1, P-селектин-положительность) тромбоцитов в системе культивирования со встряхиваемой колбой снижается при масштабировании количества среды.
[0008] Кроме того, было обнаружено, что в системе культивирования со встряхиваемой колбой происходит реакция деградации (уменьшение доли CD42b-положительных) тромбоцитов, которая, как полагают, обусловлена реакцией шеддинга. Кроме того, обнаружено, что тромбоциты содержат много аномальных тромбоцитов (аннексин V-положительных тромбоцитов), которые непригодны для введения в биологические тела.
[0009] Таким образом, настоящее изобретение предназначено для обеспечения способа получения большого количества высококачественных тромбоцитов, котоорые можно вводить в биологические тела.
Решение проблемы
[0010] Авторы настоящего изобретения провели тщательные исследования для решения данной проблемы. В результате тщательных исследований авторы настоящего изобретения обнаружили, что эффективность производства и биоактивность тромбоцитов могут быть увеличены, деградация тромбоцитов может быть ингибирована, а количество аномальных тромбоцитов может быть уменьшено посредством культивирования мегакариоцитарных клеток при возвратно-поступательном движении перемешивающей лопасти, расположенной в культуральном сосуде, для перемешивания культурального раствора без встряхивания культурального сосуда. Кроме того, авторы настоящего изобретения провели исследования других условий, таких как плотность клеток во время перемешивания культуры с использованием устройства для возвратно-поступательного перемешивания, и завершили настоящее изобретение.
[0011] То есть настоящее изобретение предлагает способ получения тромбоцитов, который включает в себя: этап культивирования, содержащий культивирование мегакариоцитарных клеток в культуральном растворе в культуральном сосуде, причем на этапе культивирования культуральный раствор перемешивают с использованием устройства для переменного перемешивания, в котором перемешивающая лопасть перемещается не в одном направлении, но движется возвратно-поступательно или переворачивается.
[0012] В способе получения тромбоцитов в соответствии с настоящим изобретением культуральный сосуд, предпочтительно, представляет собой закрытый биореактор.
[0013] В способе получения тромбоцитов в соответствии с настоящим изобретением мегакариоцитарные клетки, предпочтительно, получают, подвергая принудительной экспрессии по меньшей мере один ген, выбранный из группы, состоящей из генов рака, генов Polycomb и генов ингибирования апоптоза, в клетках до дифференцировки в мегакариоцитарные клетки, а затем прекращая принудительную экспрессию.
[0014] Настоящее изобретение дополнительно предлагает способ получения препарата тромбоцитов, который включает в себя: этап получения тромбоцитов в мегакариоцитарных клетках с помощью вышеописанного способа и извлечения тромбоцитов из культуры; и этап удаления компонента гемопоэтических клеток, отличного от тромбоцитов, из тромбоцитов.
[0015] Настоящее изобретение дополнительно предлагает способ получения препарата крови, который включает в себя: этап производства, заключающийся в получении препарата тромбоцитов с помощью вышеописанного способа; и этап получения, заключающийся в смешивании препарата тромбоцитов и другого компонента для получения препарата крови.
[0016] Настоящее изобретение представляет собой тромбоциты, полученные с помощью любого из вышеописанных способов.
[0017] Настоящее изобретение дополнительно предлагает препарат тромбоцитов, полученный с помощью любого из вышеописанных способов, или препарат тромбоцитов, содержащий тромбоциты.
[0018] Настоящее изобретение представляет собой препарат крови, полученный с помощью вышеописанного способа, или препарат крови, содержащий тромбоциты.
Выгодные эффекты изобретения
[0019] Способ настоящего изобретения может дополнительно повышать эффективность производства тромбоцитов по сравнению с обычным культивированием со встряхиванием. Кроме того, тромбоциты, полученные с помощью способа настоящего изобретения, обладают более высокой биоактивностью, чем полученные с помощью обычного культивирования со встряхиванием.
[0020] Способ настоящего изобретения может ингибировать реакцию деградации (уменьшение доли CD42b-положительных) тромбоцитов и может также ингибировать производство аномальных тромбоцитов (аннексин V-положительных тромбоцитов).
Краткое описание чертежей
[0021] Фиг. 1 показывает биореактор в соответствии с вариантом осуществления настоящего изобретения.
Фиг. 2 показывает примеры размещения уплотнения, приводного вала, перемешивающей лопасти в биореакторе в соответствии с вариантом осуществления настоящего изобретения.
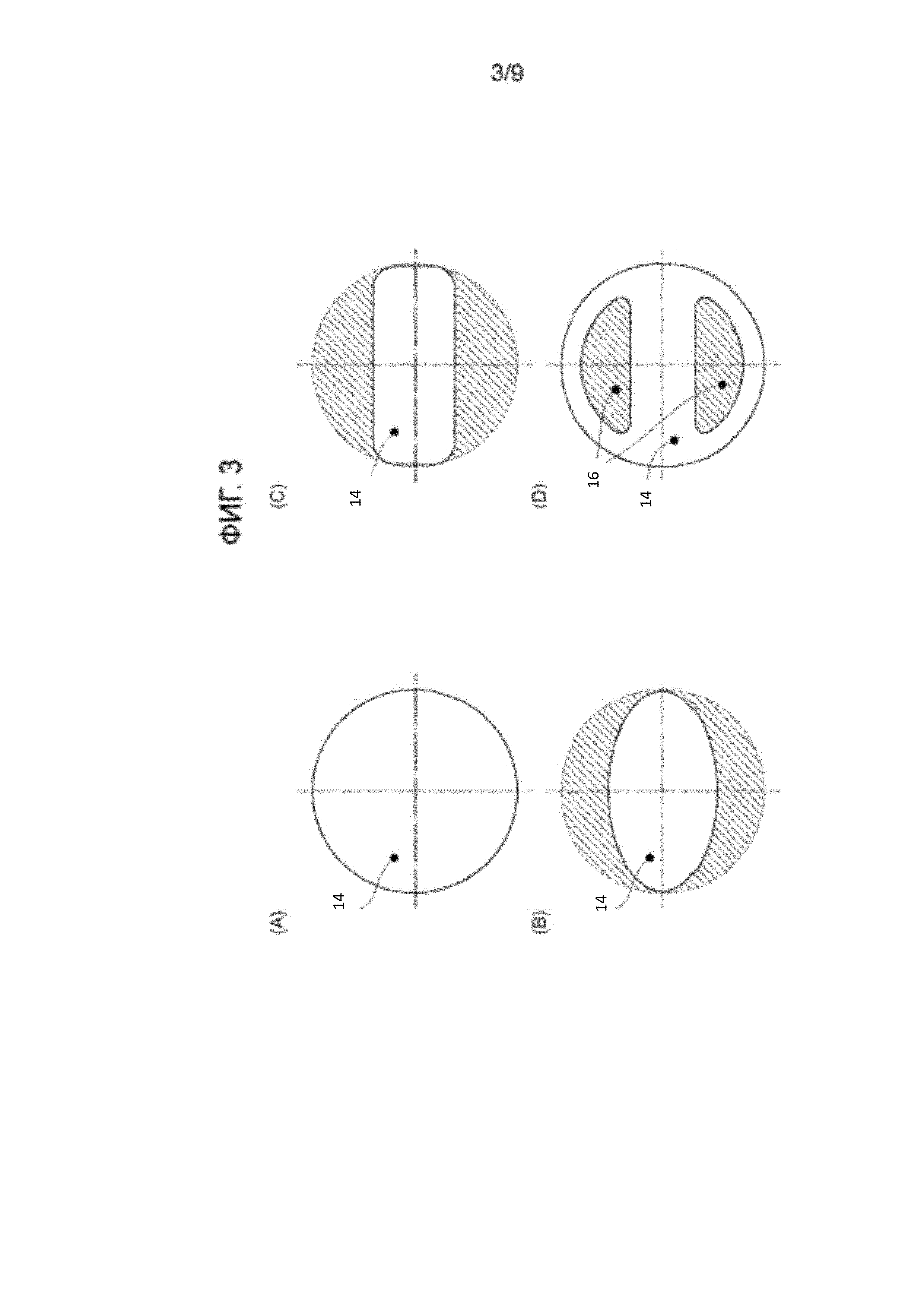
Фиг. 3 показывает структуры перемешивающей лопасти в биореакторе в соответствии с вариантом осуществления настоящего изобретения.
Фиг. 4 показывает структуру устройства для культивирования VMF, используемого в примере настоящего изобретения.
Фиг. 5 показывает результаты, полученные путем подвергания тромбоцитов, полученных путем культивирования с перемешиванием или культивирования со встряхиванием мегакариоцитарных клеток, проточной цитометрии с использованием анти-CD42b антитела и анти-CD41a антитела.
Фиг. 6 показывает результаты, полученные путем подвергания тромбоцитов, полученных путем культивирования с перемешиванием или культивирования со встряхиванием мегакариоцитарных клеток, проточной цитометрии до или после стимуляции PMA или ADP с использованием анти-CD42b антитела и анти-PAC-1 антитела.
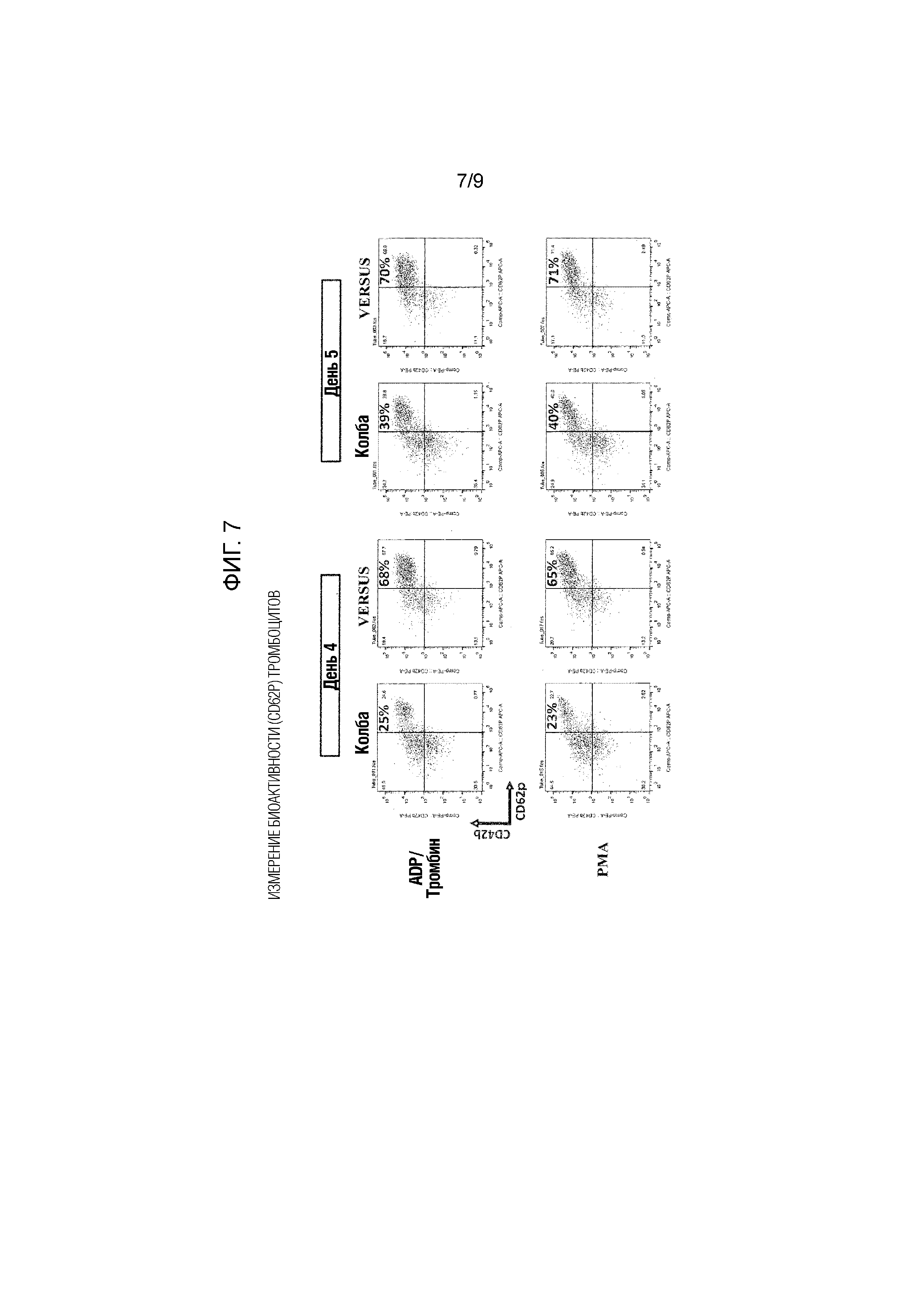
Фиг. 7 показывает результаты, полученные путем подвергания тромбоцитов, полученных путем культивирования с перемешиванием или культивирования со встряхиванием мегакариоцитарных клеток, проточной цитометрии до или после стимуляции PMA или ADP с использованием анти-CD42b антитела и анти-CD62p антитела.
Фиг. 8 показывает результаты, полученные путем измерения скорости связывания аннексина V в тромбоцитах, полученных путем культивирования с перемешиванием или культивирования со встряхиванием мегакариоцитарных клеток, с использованием проточной цитометрии.
Фиг. 9 схематически показывает пример конфигурации биореактора, снабженного перемешивающими лопастями в несколько ярусов.
Описание вариантов осуществления
[0022] Способ получения тромбоцитов в соответствии с настоящим изобретением включает в себя: этап культивирования, содержащий культивирование мегакариоцитарных клеток в культуральном растворе в культуральном сосуде, причем на этапе культивирования культуральный раствор перемешивают с использованием устройства для переменного перемешивания, в котором перемешивающая лопасть перемещается не в одном направлении, но движется возвратно-поступательно или переворачивается. Например, культуральный раствор можно перемешивать с помощью перемешивающей лопасти таким образом, что перемешивающая лопасть может испытывать сопротивление жидкости на основной поверхности. Более предпочтительно, перемешивающая лопасть движется возвратно-поступательно в направлении опорного вала. Более предпочтительно, культуральный сосуд стоит неподвижно, а опорный вал, который поддерживает перемешивающую лопасть, движется возвратно-поступательно в направлении, в котором проходит опорный вал, для перемещения перемешивающей лопасти в вертикальном направлении.
[0023] В настоящем описании изобретения "культуральный сосуд" представляет собой контейнер, пригодный для культивирования мегакариоцитарных клеток при перемешивании культурального раствора с помощью устройства для возвратно-поступательного перемешивания, и не ограничен конкретными сосудами. Примеры культурального сосуда включают культуральную чашку в открытой системе, колбу с завинчивающейся крышкой в закрытой системе и биореактор (включая закрытый биореактор).
[0024] В настоящем описании изобретения необходимо только, чтобы "перемешивающая лопасть" была пригодна для помещения в культуральный раствор и непосредственного перемешивания культурального раствора. Например, в качестве перемешивающей лопасти используют перемешивающую лопасть в форме пластины или перемешивающую лопасть, имеющую согнутую структуру.
[0025] Нижеследующее описывает пример использования биореактора 10, включающего в себя перемешивающую лопасть, в качестве варианта осуществления настоящего изобретения.
Биореактор 10 в соответствии с настоящим вариантом осуществления включает в себя: культуральный резервуар 11, уплотнение 12, приводной вал (перемешивающий вал) 13 и перемешивающую лопасть 14, как показано на фиг. 1. Условия, в которых приводной вал 13 и т.п. помещают в культуральный резервуар 11, могут включать, как показано на фиг. 2, нижнее крепление, когда приводной вал 13 прикреплен к нижней части культурального резервуара 11, и боковое крепление, когда приводной вал 13 прикреплен к боковой части культурального резервуара 11. Культуральный резервуар 11 имеет имеет трехмерный корпус, имеющий форму, полученную растягиванием круглой или прямоугольной плоской формы в продольном направлении. Уплотнение 12 образовано пленочным элементом, изготовленным из гибкого материала, такого как резина, который следует за движением приводного вала 13, или гофрированной структурой, изготовленной из такого материала, как металл или тефлон (зарегистрированный товарный знак), и закрывает верхнее отверстие культурального резервуара 11 для герметизации. Приводной вал 13 связан в своей верхней части с устройством для вертикального перемещения, например с мотором 15 для возвратно-поступательного перемещения, проходит через уплотнение 12 в своей средней части и герметично зафиксирован к уплотнению 12. Перемешивающая лопасть 14 имеет плоскую форму или согнутую структуру, и плоская форма представляет собой, например, как показано на фиг. 3, овальную форму (фиг. 3(B)), прямоугольник (фиг. 3(C)) или структуру со сквозным отверстием (фиг. 3(D)), полученную путем снабжения круглой пластины сквозным отверстием 16, причем каждую из них получают ортогональным уменьшением площади круглой формы (фиг. 3(A)). Перемешивающая лопасть 14 на одном или нескольких ярусах зафиксирована к приводному валу 13. Когда перемешивающая лопасть 14 имеет сквозное отверстие 16, сдвигающее воздействие на жидкость или клетки, проходящие через сквозное отверстие 16, может быть увеличено (смотри фиг. 9). Сквозное отверстие 16 может быть образовано из большого отверстия, выполненного в перемешивающей лопасти 14 (фиг. 3(D)), или из множества маленьких отверстий, выполненных в заранее определенном участке перемешивающей лопасти 14 (фиг. 9).
[0026] Перемешивающая лопасть 14 может представлять собой несколько ярусов перемешивающих лопастей. Например, биореактор 10, показанный на фиг. 9, имеет двухъярусную конфигурацию лопастей, включающую в себя: перемешивающую лопасть 14 на верхнем ярусе, прикрепленную к приводному валу 13; и перемешивающую лопасть 14 на нижнем ярусе, снабженную сквозными отверстиями 16, причем, в частности, сдвигающий эффект на перемешивающую лопасть 14 на нижнем ярусе дополнительно улучшен.
[0027] В биореакторе 10 в настоящем варианте осуществления перемешивающая лопасть, перпендикулярно прикрепленная к приводному валу (перемешивающему валу) 13, может быть вынуждена выполнять вращение в прямом и обратном направлении под управлением сервомотором. Кроме того, управлением вращением в прямом и обратном направлении со стороны этого сервомотора управляет ведущий элемент, так что получается конфигурация мотора 15 для движения в прямом и обратном направлении. Таким образом, вращением в прямом и обратном направлении (ускорением, профилем волны и скоростью) можно управлять с помощью сервомотора.
[0028] Биореактор 10 обеспечивает физико-химическую среду, благоприятную для оптимального роста клеток, клеточного метаболизма, дифференцированной зрелости мегакариоцитарных клеток, мультинуклеации мегакариоцитарных клеток, образования предшественников тромбоцитов, производства тромбоцитов и поддержания биоактивности тромбоцитов. Биореактор 10 может включать в себя аэратор, вытяжной вентилятор, регулятор температуры, регулятор pH, регулятор давления растворенного кислорода (DOT), перегородку, рассеиватель и порт.
[0029] Форма культурального резервуара 11 в биореакторе 10 не ограничена конкретными формами. Культуральный резервуар 11 может иметь, например, вытянутую вертикально трубчатую форму и иметь плоскую поверхность как сверху, так и снизу.
[0030] Объем культурального резервуара составляет по меньшей мере 300 мл, предпочтительно по меньшей мере 1 л, 50 л, более предпочтительно по меньшей мере 200 л, более предпочтительно по меньшей мере 500 л, еще более предпочтительно по меньшей мере 1000 л и еще более предпочтительно по меньшей мере 2000 л.
[0031] В настоящем описании изобретения "мегакариоцитарные клетки" представляют собой крупнейшие клетки, которые in vivo находятся в костном мозге и характеризуются высвобождением тромбоцитов. Мегакариоцитарные клетки характеризуются тем, что они положительны по маркеру CD41a, CD42a и CD42b, а также в некоторых случаях экспрессируют маркер, выбранный из группы, состоящей из CD9, CD61, CD62p, CD42c, CD42d, CD49f, CD51, CD110, CD123, CD131 и CD203c. Многоядерные (полиплоидизированные) "мегакариоцитарные клетки" имеют геномы, которые в 16-32 раза больше, чем в обычных клетках. Однако просто упомянутые в настоящем описании изобретения "мегакариоцитарные клетки" включают многоядерные мегакариоцитарные клетки и мегакариоцитарные клетки до мультинуклеации, при условии, что они имеют вышеописанные характеристики. "Мегакариоцитарные клетки до мультинуклеации" означают то же самое, что и "незрелые мегакариоцитарные клетки" или "мегакариоцитарные клетки в состоянии роста".
[0032] Мегакариоцитарные клетки могут быть получены с помощью различных известных способов. Неограничивающим примером способа получения мегакариоцитарных клеток может быть способ, описанный в WO 2011/034073. В данном способе гены рака и гены Polycomb в "клетках до дифференцировки в мегакариоцитарные клетки" подвергают принудительной экспрессии, так что может быть получен штамм бесконечно растущих иммортализованных мегакариоцитарных клеток. Иммортализованные мегакариоцитарные клетки могут быть получены также путем подвергания гена ингибирования апоптоза в "клетках до дифференцировки в мегакариоцитарные клетки" принудительной экспрессии в соответствии со способом, описанным в WO 2012/157586. Мультинуклеация таких иммортализованных мегакариоцитарных клеток протекает путем отмены принудительной экспрессии этих генов, что высвобождает тромбоциты.
[0033] Для получения мегакариоцитарных клеток способы, описанные в вышеуказанных документах, могут быть объединены. В этом случае принудительная экспрессия генов рака, генов Polycomb и генов ингибирования апоптоза может осуществляться параллельно или последовательно. Например, для получения многоядерных мегакариоцитарных клеток гены рака и гены Polycomb подвергают принудительной экспрессии, ингибируют принудительную экспрессию, затем подвергают принудительной экспрессии гены ингибирования апоптоза, и ингибируют принудительную экспрессию. Многоядерные мегакариоцитарные клетки могут быть получены также путем параллельного подвергания генов рака, генов Polycomb и генов ингибирования апоптоза принудительной экспрессии. Многоядерные мегакариоцитарные клетки могут быть получены также путем подвергания генов рака и генов Polycomb принудительной экспрессии, затем подвергания генов ингибирования апоптоза принудительной экспрессии, и параллельного ингибирования принудительной экспрессии.
[0034] В настоящем описании изобретения "клетки до дифференцировки в мегакариоцитарные клетки" представляют собой клетки, обладающие потенциалом дифференцировки в мегакариоциты и обозначают клетки на различных стадиях дифференцировки от системы гемопоэтических стволовых клеток в мегакариоцитарные клетки. Неограничивающие примеры клеток до дифференцировки в мегакариоциты включают гемопоэтические стволовые клетки, гемопоэтические клетки-предшественники, CD34-положительные клетки и эритро-мегакариоцитарные клетки-предшественники (MEP). Эти клетки могут быть получены посредством выделения из, например, костного мозга, пуповинной крови и периферической крови или посредством индуцирования дифференцировки плюрипотентных стволовых клеток, таких как ES-клетки, iPS-клетки, которые не подвергались дальнейшей дифференцировке.
[0035] В настоящем описании изобретения "гены рака" представляют собой гены, которые индуцируют озлокачествление клеток in vivo, и их примеры включают гены семейства MYC (например, c-MYC, N-MYC, L-MYC), гены семейства SRC, гены семейства RAS, гены семейства RAF и гены семейства протеинкиназ, такие как c-Kit, PDGFR и Abl.
[0036] В настоящем описании изобретения "гены Polycomb" известны как гены, которые функционируют, отрицательно регулируя гены CDKN2a (INK4a/ARF) и предотвращая клеточное старение (Ogura et al., Regenerative Medicine, vol. 6, № 4, pp. 26-32; Jseus et al., Jseus et al., Nature Reviews Molecular Cell Biology vol. 7, pp. 667-677, 2006; Proc. Natl. Acad. Sci. USA vol. 100, pp. 211-216, 2003). Неограничивающие примеры генов Polycomb включают BMI1, Mel18, Ring1a/b, Phc1/2/3, Cbx2/4/6/7/8, Ezh2, Eed, Suz12, HADC и Dnmt1/3a/3b.
[0037] В настоящем описании изобретения "ген ингибирования апоптоза" представляет собой ген, имеющий функцию ингибирования апоптоза клеток, и его примеры включают ген BCL2, ген BCL-xL, ген сурвивина и ген MCL1.
[0038] Принудительная экспрессия генов и прекращение принудительной экспрессии могут быть осуществлены с помощью способов, описанных в документах WO 2011/034073, WO 2012/157586, WO 2014/123242 и Nakamura S et al, Cell Stem Cell. 14, 535-548, 2014, других известных способов или эквивалентных им способов.
[0039] В настоящем описании изобретения "тромбоциты" представляют собой один из клеточных компонентов крови и характеризуются тем, что они являются CD41a-положительными и CD42b-положительными. Тромбоциты играют важную роль в образовании тромбов и гемостазе и участвуют в патофизиологии регенерации тканей и воспаления после травмы. Когда тромбоциты активируются при кровотечении, на мембранах экспрессируются рецепторы цитоадгезии, такие как интегрин αIIBβ3 (гликопротеин IIb/IIIa; комплекс CD41a и CD61). Затем тромбоциты агрегируют, и фибрин подвергается коагуляции различными факторами свертывания крови, высвобождаемыми из тромбоцитов. Таким образом, образуются тромбы, и развивается гемостаз.
[0040] Функция тромбоцитов может быть оценена с помощью измерений известными методами. Например, количество активированных тромбоцитов можно измерять с использованием антител к PAC-1, которые специфически связываются с интегрином αIIBβ3 на активированных мембранах тромбоцитов. Альтернативно, количество активированных тромбоцитов можно измерять путем детектирования CD62P (P-селектина), который является маркером активации тромбоцитов антителом. Например, измерение может быть выполнено путем гейтирования тромбоцитов с помощью антитела по независящему от активации маркеру тромбоцитов CD61 или CD41 и затем детектирования связывания анти-PAC-1 антитела и анти-CD62P антитела с использованием проточной цитометрии. Эти этапы могут быть выполнены в присутствии аденозиндифосфата (ADP).
[0041] Функция тромбоцитов может быть оценена путем проверки, связываются ли тромбоциты с фибриногеном в присутствии ADP. Когда тромбоциты связываются с фибриногеном, активируется интегрин, который нужен в начале образования тромба.
[0042] Функция тромбоцитов может быть оценена также с помощью способа визуализации и наблюдения способности к образованию тромба in vivo, как показано на фиг. 6 в WO 2011/034073.
[0043] Когда тромбоциты имеют низкий уровень экспрессии CD42b или низкий уровень аннексин V-положительных, тромбоциты оценивают как деградированные или аномальные. Эти тромбоциты не обладают достаточной функцией образования тромбов и достаточной функцией гемостаза и, следовательно, не являются клинически полезными.
[0044] В настоящем описании изобретения "деградация тромбоцитов" относится к уменьшению количества CD42b (GPIbα) на мембранах тромбоцитов. Таким образом, деградировавшие тромбоциты содержат тромбоциты со сниженным уровнем экспрессии CD42b и тромбоциты, в которых внеклеточные домены CD42b расщеплены реакцией шеддинга. Когда на мембранах тромбоцитов отсутствует CD42b, тромбоциты не могут объединяться с фактором фон Виллебранда (VWF), и поэтому функция свертывания крови тромбоцитов утрачивается. Деградация тромбоцитов может быть оценена с использованием доли CD42b-отрицательных (или количества CD42b-отрицательных частиц) по отношению к доле CD42b-положительных (или количеству CD42b-положительных частиц) в фракциях тромбоцитов в качестве индикатора. Чем выше доля CD42b-отрицательных по отношению к доле CD42b-положительных, или чем выше количество CD42b-отрицательных частиц по отношению к количеству CD42b-положительных частиц, тем сильнее деградация тромбоцитов. Доля CD42b-положительных означает относительное количество тромбоцитов, которые могут связываться с анти-CD42b антителом, среди тромбоцитов, содержащихся во фракциях тромбоцитов, а доля CD42b-отрицательных означает относительное количество тромбоцитов, с которыми анти-CD42b антитело не связывается, среди тромбоцитов, содержащихся во фракциях тромбоцитов.
[0045] В настоящем описании изобретения "аномальные тромбоциты" представляют собой тромбоциты, в которых фосфатидилсерин, который является отрицательно заряженным фосфолипидом, выходит изнутри липидного бислоя наружу. Известно, что фосфатидилсерин экспонируется на мембранах тромбоцитов in vivo при активации тромбоцитов, и с фосфатидилсерином связываются многие факторы свертывания крови, и, таким образом, усиливается реакция каскада свертывания крови. У аномальных тромбоцитов много фосфатидилсерина всегда экспонировано на мембранах аномальных тромбоцитов, и когда субъекту вводят аномальные тромбоциты, может быть вызвана чрезмерная реакция свертывания крови, которая приводит к серьезным патологическим состояниям, таким как диссеминированная внутрисосудистая коагуляция. Аннексин V связывается с фосфатидилсерином, и поэтому фосфатидилсерин на мембранах тромбоцитов может быть детектирован с помощью проточного цитометра по количеству связанного флуоресцентно-меченого аннексина V в качестве индикатора. Таким образом, количество аномальных тромбоцитов может быть оценено по доле аннексин V-положительных, т.е. относительному количеству тромбоцитов с которыми связывается аннексин, в фракциях тромбоцитов. Чем выше доля аннексин V-положительных, или чем выше количество частиц аннексина V, тем выше количество аномальных тромбоцитов.
[0046] Условия культивирования мегакариоцитарных клеток в настоящем изобретении могут представлять собой нормальные условия. Например, температура может составлять от приблизительно 35°C до приблизительно 42°C, от приблизительно 36°C до приблизительно 40°C или от приблизительно 37°C до приблизительно 39°C при от 5% до 15% CO2 и/или 20% O2.
[0047] Среда, которую следует использовать при культивировании мегакариоцитарных клеток, не ограничена конкретными средами, и можно использовать в соответствующих случаях любые известные среды, которые подходят для получения тромбоцитов из мегакариоцитарных клеток, и эквивалентные им среды. Например, среда, используемая для культивирования клеток животных, может быть приготовлена в виде базальной среды. Примеры базальных сред включают IMDM, среду 199, минимальную эссенциальную среду Игла (EMEM), αMEM, модифицированную Дульбекко среду Игла (DMEM), среду F12 Хама, среду RPMI 1640, среду Фишера и нейробазальную среду (Life Technologies Corporation) и их смеси.
[0048] Среда может содержать сыворотку или плазму или быть свободной от сыворотки. При необходимости среда может содержать по меньшей мере одно вещество, выбранное из, например, альбумина, инсулина, трансферрина, селена, жирной кислоты, следовых элементов, 2-меркаптоэтанола, тиолглицерина, монотиоглицерина (MTG), липида, аминокислот (например, L-глутамина), аскорбиновой кислоты, гепарина, заменимых аминокислот, витаминов, факторов роста, низкомолекулярных соединений, антибиотиков, антиоксидантов, пировиноградной кислоты, буферных веществ, неорганических солей и цитокина. Цитокин представляет собой белок, который ускоряет гемопоэтическую дифференцировку, и его примеры включают фактор роста эндотелия сосудов (VEGF), тромбопоэтин (TPO), различные TPO-подобные активные вещества, фактор стволовых клеток (SCF), добавку ITS (инсулин-трансферрин-селенит) и ингибитор ADAM. Предпочтительной средой в настоящем изобретении является среда IMDM, содержащая сыворотку, инсулин, трансферрин, серин, тиолглицерин, аскорбиновую кислоту и TPO. Среда может дополнительно содержать SCF и может дополнительно содержать гепарин. Концентрация каждого компонента не ограничена конкретными концентрациями, и, например, концентрация TPO может составлять от приблизительно 10 нг/мл до приблизительно 200 нг/мл или от приблизительно 50 нг/мл до приблизительно 100 нг/мл, концентрация SCF может составлять от приблизительно 10 нг/мл до приблизительно 200 нг/мл или приблизительно 50 нг/мл, и концентрация гепарина может составлять от приблизительно 10 ед/мл до приблизительно 100 ед/мл или приблизительно 25 ед/мл. Дополнительно в среду может быть добавлен форболовый эфир (например, форбол-12-миристат-13-ацетат; PMA).
[0049] Когда используют сыворотку, желательна человеческая сыворотка. Например, в качестве замены сыворотки можно использовать человеческую плазму. С помощью способа в соответствии с настоящим изобретением тромбоциты, сравнимые с полученными с использованием сыворотки, могут быть получены даже с использованием этих компонентов.
[0050] Когда для принудительной экспрессии генов или прекращения принудительной экспрессии используют систему чувствительной к препарату индукции экспрессии гена, такую как система Tet-On (зарегистрированная товарный знак) или Tet-Off (зарегистрированная товарный знак), на этапе принудительной экспрессии может быть обеспечено содержание в среде подходящего препарата, такого как тетрациклин или доксициклин, и принудительная экспрессия может быть ингибирована удалением подходящего препарата из среды.
[0051] Этап культивирования мегакариоцитарных клеток в настоящем изобретении проводят путем суспензионного культивирования, и, следовательно, он может быть проведен без питающих клеток.
[0052] Настоящее изобретение охватывает тромбоциты, полученные с помощью способа в соответствии с настоящим изобретением.
[0053] Способ получения препарата тромбоцитов в соответствии с настоящим изобретением включает в себя: этап культивирования мегакариоцитарных клеток с помощью способа в соответствии с настоящим изобретением для получения тромбоцитов и извлечения фракции, в которой преобладают тромбоциты, из культуры; и этап удаления компонента гемопоэтических клеток, отличного от тромбоцитов, из фракции. Этап удаления компонента гемопоэтических клеток может быть проведен путем удаления компонента гемопоэтических клеток, отличного от тромбоцитов, который содержит мегакариоцитарные клетки, с использованием фильтра для удаления лейкоцитов (например, производства корпорации Terumo или Asahi Kasei Medical Co., Ltd.). Другой особый способ получения препарата тромбоцитов описан, например, в WO 2011/034073.
[0054] Способ получения препарата крови в соответствии с настоящим изобретением включает в себя: этап получения препарата тромбоцитов с помощью способа в соответствии с настоящим изобретением; и этап смешивания препарата тромбоцитов и другого компонента. Другой компонент может представлять собой, например, эритроидные клетки.
[0055] К препарату тромбоцитов и препарату крови могут быть дополнительно добавлены другие компоненты, которые способствуют стабилизации клеток.
[0056] Раскрытия патентного документа и непатентного документа, цитируемых в настоящем описании изобретения, включены в настоящее описание изобретения посредством ссылки.
Пример 1
[0057] Ниже подробно описано настоящее изобретение на основе примеров. Настоящее изобретение, никоим образом не ограничено ими. Специалисты в данной области техники могут изменять настоящее изобретение в различных вариантах осуществления без отхода от смысла настоящего изобретения, такие изменения также включены в объем настоящего изобретения.
[0058] 1. Получение иммортализованных мегакариоцитарных клеток
1-1. Получение гемопоэтических клеток-предшественников из iPS-клеток
Культивирование для дифференцировки из человеческих iPS-клеток (TKDN SeV2: iPS-клетки, происходящие от человеческих фетальных фибробластов кожи, сформированы с использованием вируса Сендай) в клетки крови проводили в соответствии со способом, описанным в документе Takayama N., et al., J Exp Med. 2817-2830 (2010). То есть колонии человеческих ES/iPS-клеток совместно культивировали с питающими клетками C3H10T1/2 в присутствии 20 нг/мл VEGF (R&D Systems, Inc.) в течение 14 дней для получения гемопоэтических клеток-предшественников (HPC). Совместное культивирование проводили в условиях культивирования при 20% O2 и 5% CO2 (далее в данном документе так же, если специально не описано иначе).
[0059] 1-2. Система доставки генов
В качестве системы доставки генов использовали лентивирусную векторную систему. Лентивирусный вектор является вектором управляемой тетрациклином системы индукции экспрессии генов Tet-On (зарегистрированная товарный знак). Лентивирусные векторы получали, заменяя кассету mOKS из LV-TRE-mOKS-Ubc-tTA-I2G (Kobayashi, T., et al., Cell 142, 787-799 (2010)) на c-MYC, BMI1 и BCL-xL. Лентивирусные векторы представляли собой LV-TRE-c-Myc-Ubc-tTA-I2G, LV-TRE-BMI1-Ubc-tTA-I2G и LV-TRE-BCL-xL-Ubc-tTA-I2G.
[0060] Вирусные частицы получали путем переноса генов лентивирусных векторов в клетки 293T с помощью любого способа.
[0061] Гены BMI1, MYC и BCL-xL переносят в геномные последовательности клеток-мишеней путем инфицирования различными частицами клеток-мишеней. Эти гены, стабильно перенесенные в геномные последовательности, могут быть подвергнуты принудительной экспрессии посредством добавления в среду доксициклина (#631311, Clontech Laboratories, Inc.).
[0062] 1-3. Инфицирование вирусом с c-MYC и BMI1 гемопоэтических клеток-предшественников
На 6-луночные планшеты, на которых были заранее посеяны питающие клетки C3H10T1/2, высевали по 5×104 на лунку клеток HPC, полученных с помощью вышеописанного способа, и подвергали c-MYC и BMI1 принудительной экспрессии с помощью лентивирусного способа. В этом случае на один тип штаммов клеток использовали 6 лунок. То есть в среду добавляли вирусные частицы до MOI 20. Клетки инфицировали различными частицами с помощью инфицирования центрифугированием (центрифугирование при 32°C и 900 об/мин в течение 60 минут). Эту операцию выполняли в общей сложности два раза каждые 12 часов.
[0063] В качестве среды получали среду путем дополнительного добавления протамина к среде (далее в данном документе называемую средой для дифференцировки), которую получали, добавляя человеческий тромбопоэтин 50 нг/мл (TPO) (R&D Systems, Inc.), человеческий фактор стволовых клеток (SCF) 50 нг/мл (R&D Systems, Inc.) и доксициклин (Dox) 2 мкг/мл к базальной среде (IMDM (модифицированная Исковым среда Дульбекко) (Sigma-Aldrich), содержащей 15% фетальной бычьей сывороткы (GIBCO), 1% пенициллина-стрептомицина-глутамина (GIBCO), 1% инсулина, трансферрин, раствор селена (ITS-G) (GIBCO), 1-тиоглицерин 0,45 мМ (Sigma-Aldrich) и L-аскорбиновую кислоту 50 мкг/мл (Sigma-Aldrich)), для получения конечной концентрации 10 мкг/мл.
[0064] 1-4. Получение и поддержание культуры самостоятельно растущего штамма мегакариоцитов
При условии, что день, в который осуществили инфицирование вирусом с cMYC и BMI1 с помощью вышеописанного способа, являлся днем 0 инфицирования, получали самостоятельно растущие штаммы мегакариоцитов путем культивирования мегакариоцитарных клеток с переносом гена cMYC и мегакариоцитарных клеток с переносом гена BMI1. Принудительную экспрессию гена BMI1 и гена c-MYC осуществляли путем добавления к среде доксициклина 1 мкг/мл (#631311, Clontech Laboratories, Inc.).
[0065] С 2 по 11 день инфицирования
Клетки крови, инфицированные вирусом с помощью вышеописанного способа, собирали путем пипетирования, центрифугировали на 1200 об/мин в течение 5 минут для удаления супернатанта, затем суспендировали в новой среде для дифференцировки и высевали на новые питающие клетки C3H10T1/2 (6-луночные планшеты). На день 9 инфицирования ту же операцию выполняли для субкультуры. Подсчитывали число клеток, и клетки высевали на питающие клетки C3H10T1/2 по 1×105 клеток на 2 мл на лунку (6-луночные планшеты).
[0066] С 12 по 13 день инфицирования
Выполняли ту же операцию, которую выполняли на день 2 инфицирования. Подсчитывали число клеток, и клетки высевали на питающие клетки C3H10T1/2 по 3×105 клеток на 10 мл на чашку 100 мм (чашка 100 мм).
[0067] День 14 инфицирования
Собирали клетки крови, инфицированные вирусом, и проводили реакцию с антителом с использованием 2 мкл антитела против человеческого CD41a-APC (BioLegend, Inc.), 1 мкл антитела против человеческого CD42b-PE (eBioscience, Inc.) и 1 мкл антитела против человеческого CD235ab-pacific blue (BioLegend, Inc.) на 1,0×105 клеток. После реакции с антителом проводили анализ с использованием FACS Verse (BD). Клетки с долей CD41a-положительных 50% или больше на день 14 инфицирования считали самостоятельно растущими штаммами мегакариоцитов.
[0068] 1-5. Инфицирование самостоятельно растущих штаммов мегакариоцитов вирусом с BCL-xL
BCL-xL переносили в самостоятельно растущие штаммы мегакариоцитов на день 14 инфицирования с помощью лентивирусного способа. Вирусные частицы добавляли в среду до MOI 10. Клетки инфицировали вирусом с BCL-xL с помощью инфицирования центрифугированием (центрифугирование при 32°C и 900 об/мин в течение 60 минут). Принудительную экспрессию гена BCL-xL осуществляли с помощью доксициклина 1 мкг/мл (#631311, Clontech Laboratories, Inc.) в среде.
[0069] 1-6. Получение и поддержание культуры иммортализованных мегакариоцитов
С 14 по 18 день инфицирования
Самостоятельно растущие штаммы мегакариоцитов, в которые был перенесен BCL-xL, полученные с помощью вышеописанного способа, собирали и центрифугировали на 1200 об/мин в течение 5 минут. После центрифугирования осажденные клетки суспендировали в новой среде для дифференцировки и затем высевали на питающие клетки C3H10T1/2 по 2×105 клеток на 2 мл на лунку (6-луночные планшеты).
[0070] День 18 инфицирования: Субкультивирование
Подсчитывали число клеток, и клетки высевали по 3×105 клеток на 10 мл на чашку 100 мм.
[0071] День 24 инфицирования: Субкультивирование
Подсчитывали число клеток, и клетки высевали по 1×105 клеток на 10 мл на чашку 100 мм. После этого проводили субкультивирование каждые 4-7 дней для поддержания культуры.
[0072] Самостоятельно растущие штаммы мегакариоцитов, в которые был перенесен BCL-xL, собирали на день 24 инфицирования, и проводили иммунное окрашивание с использованием 2 мкл антитела против человеческого CD41a-APC (BioLegend, Inc.), 1 мкл антитела против человеческого CD42b-PE (eBioscience, Inc.) и 1 мкл антитела против человеческого CD235ab-pacific blue (Anti-CD235ab-PB; BioLegend, Inc.) на 1,0×105 клеток. После иммунного окрашивания проводили анализ с использованием FACS Verse (BD). Клетки с долей CD41a-положительных 50% или больше на день 24 инфицирования считали штаммами иммортализованных мегакариоцитарных клеток. Клетки, которые могли расти после инфицирования в течение 24 дней или больше, определяли как штамм SeV2-MKCL иммортализованных мегакариоцитарных клеток.
[0073] Полученный SeV2-MKCL подвергали статическому культивированию в чашка 10 см (10 мл на чашку). В качестве среды получали среду путем добавления к IMDM в качестве базальной среды следующих компонентов (концентрации являются конечными концентрациями).
FBS (#172012, lot.12E261, Sigma), 15%
L-глутамин (#25030-081, Gibco), 2 мМ
ITS (#41400-045, Gibco), 100-кратный
MTG (монотиоглицерин, #M6145-25ML, Sigma) 450 мкМ
Аскорбиновая кислота (#A4544, Sigma) 50 мкг/мл
Пуромицин (#P8833-100MG, Sigma) 2 мкг/мл
SCF (#193-15513, Wako Pure Chemical Industries Ltd.) 50 нг/мл
TPO-подобное активное вещество, 200 нг/мл
Условия культивирования 37°C и 5% CO2
[0074] 2. Генерация тромбоцитов
Затем принудительную экспрессию прекращали путем культивирования SeV2-MKCL в среде, не содержащей доксициклин. В частности, штамм иммортализованных мегакариоцитарных клеток (SeV2-MKCL), полученный в способе по п. 1 выше, дважды промывали ФСБ (-) и суспендировали в следующей среде при плотности посева 1,0×105 клеток на мл.
[0075] Среду получали путем добавления следующих компонентов к IMDM (концентрации являются конечными концентрациями).
FBS, 15%
L-глутамин (#25030-081, Gibco), 2 мМ
ITS (#41400-045, Gibco), 100-кратный.
[0076] MTG (монотиоглицерин, #M6145-25ML, Sigma), 450 мкМ
Аскорбиновая кислота (#A4544, Sigma), 50 мкг/мл
SCF (#193-15513, Wako Pure Chemical Industries Ltd.), 50 нг/мл
TPO-подобное активное вещество, 200 нг/мл
Ингибитор ADAM, 15 мкМ
SR1, 750 нМ
Ингибитор ROCK, 10 мкМ
[0077] Штамм иммортализованных мегакариоцитарных клеток (SeV2-MKCL), полученный с помощью способа по п. 1 выше, суспендировали в среде для получения суспензии клеток. В биореактор 10 добавляли 2,4 л суспензии клеток, а во встряхиваемую колбу объемом 125 мл добавляли 25 мл суспензии клеток. Биореактор 10 имеет перемешивающую лопасть 14 на одном или нескольких ярусах, и использовали устройство для культивирования VMF (далее в данном документе называемое VMF) объемом 3,0 л, которое может возвратно-поступательно перемещать перемешивающую лопасть 14 в вертикальном направлении. VMF имеет следующие характеристики. Внешние размеры корпуса (мм): 300 W × 485 D × 890 H; размеры культурального резервуара 11 (мм): 140 (внутренний диаметр) × 203 (глубина); количество жидкости в культуральном резервуаре 11: 3,0 л; перемешивающая лопасть 14: структура в форме согнутого овала (нижний ярус)+форма плоского овала (верхний ярус), двухъярусное крепление; прямой привод: линейный привод от вала без уплотнения; диапазон регулировки температуры: комнатная температура от +5°C до 20°C; диапазон вертикальных колебаний: от 10 мм до 30 мм; максимальная скорость лопастей при вертикальном перемещении: от 80 мм/с до 150 мм/с; контрольные измерения: перемешивание, температура, pH, растворенный кислород, уровень, поле. Фиг. 4 показывает VMF.
[0078] В VMF культивировали 2,4 л суспензии штамма иммортализованных мегакариоцитарных клеток. Культивирование проводили при 37°C и 5% CO2. Скорость перемешивания составляла 1,6 Гц, а длина хода перемешивания составляла 3 см.
[0079] Во встряхиваемой колбе объемом 125 мл культивировали 25 мл суспензии штамма иммортализованных мегакариоцитарных клеток. Культивирование со встряхиванием проводили с использованием шейкера-инкубатора (AniCell, N-BIOTEK Inc.) при 37°C, 5% CO2 и 100 об/мин.
[0080] 3. Измерение тромбоцитов
Для проведения измерений тромбоцитов, полученных в способе по п. 2 выше, образец культурального супернатанта собирали после 6 дней культивирования, и окрашивали и анализировали его с использованием проточной цитометрии. Количество CD41a-положительных CD42b-положительных частиц определяли как количество нормальных тромбоцитов, количество CD41a-положительных CD42b-отрицательных частиц определяли как количество деградировавших тромбоцитов. Количество аннексин V-положительных частиц определяли как количество аномальных тромбоцитов. Кроме того, образец стимулировали PMA или ADP/тромбином, и рассчитывали долю PAC-1-положительных и долю CD62p-положительных до и после стимуляции для измерения биоактивности.
[0081] Конкретные способы измерения были следующими.
3-1. Измерение тромбоцитов
Для измерения биоактивности нормальных тромбоцитов, деградированных тромбоцитов и тромбоцитов добавляли по 900 мл разбавителя в каждую микропробирку объемом 1,5 мл, а затем туда дополнительно добавляли по 100 мл культурального супернатанта и перемешивали. В каждую пробирку для FACS отмеряли по 200 мл разбавленного смешанного культурального супернатанта, и дополнительно добавляли следующее меченое антитело или белок для окрашивания. Для проведения измерений аномальных тромбоцитов отмеряли по 100 мл культурального супернатанта в каждую пробирку для FACS, и дополнительно добавляли следующее меченое антитело или белок для окрашивания, и смесь разбавляли в 5 раз буфером для связывания аннексина V (BD) непосредственно перед анализом с помощью проточного цитометра, и затем проводили анализ.
Использовали следующие антитела.
Измерение нормальных тромбоцитов и деградировавших тромбоцитов
0,5 мкл анти-CD41 антитела, меченого APC (303710, BioLegend, Inc.)
0,5 мкл анти-CD42a антитела, меченого PB (48-0428-42, eBioscience, Inc.)
0,5 мкл анти-CD42b антитела, меченого PE (12-0428-42, eBioscience, Inc.)
Измерение биоактивности тромбоцитов
0,5 мкл анти-CD42a антитела, меченого PB (48-0428-42, eBioscience, Inc.)
0,5 мкл анти-CD42b антитела, меченого PE (12-0428-42, eBioscience, Inc.)
0,5 мкл анти-CD62p антитела, меченого APC (304910, BioLegend, Inc.)
10 мкл анти-PAC-1 антитела, меченого FITC (303704, BD)
Измерение количества анломальных тромбоцитов
0,5 мкл анти-CD41 антитела, меченого APC (303710, BioLegend, Inc.)
0,5 мкл анти-CD42a антитела, меченого PB (48-0428-42, eBioscience, Inc.)
5 (л, меченый аннексином V-FITC (556419, BD)
[0082] 3-2. Измерение количества получаемых нормальных тромбоцитов
Фиг. 5 показывает результаты. Количество получаемых нормальных тромбоцитов оказалось выше при культивировании в VMF по сравнению с культивированием с использованием встряхиваемой колбы (фиг. 5(B)). При вычислении количества нормальных тромбоцитов по отношению к количеству мегакариоцитарных клеток в качестве эффективности производства нормальных тромбоцитов, эффективность производства нормальных тромбоцитов оказалась приблизительно в 6,0-7,7 раза выше при культивирование в VMF, чем при культивировании с использованием встряхиваемой колбы (фиг. 5(C)). То есть количество получаемых нормальных тромбоцитов по отношению к количеству мегакариоцитарных клеток может быть с помощью культивирования в VMF повышено по сравнению с обычным культивированием с использованием встряхиваемой колбы.
[0083] 3-3. Измерение деградировавших тромбоцитов
При измерении деградировавших тромбоцитов каждый обработанный образец анализировали с помощью способа по п. 3-1 выше с использованием проточного цитометра, и измеряли количество CD41a-положительных CD42b-положительных частиц и количество CD41a-положительных CD42b-отрицательных частиц. Затем количество CD41a-положительных CD42b-положительных частиц определяли как количество нормальных тромбоцитов, а количество CD41a-положительных CD42b-отрицательных частиц определяли как количество деградировавших тромбоцитов, и вычисляли отношение количества деградировавших тромбоцитов к количеству нормальных тромбоцитов.
Фиг. 5 показывает результаты. Отношение количества деградировавших тромбоцитов к количеству нормальных тромбоцитов при культивировании в VMF оказалась приблизительно в 0,31-0,39 раза меньше, чем при культивировании с использованием встряхиваемой колбы (фиг. 5(A)). То есть количество получаемых деградировавших тромбоцитов может быть при культивировании в VMF уменьшено по сравнению с обычным культивированием с использованием встряхиваемой колбы.
[0084] 3-3. Измерение биоактивности тромбоцитов
Стимуляцию тромбоцитов проводили с использованием 0,2 мМ PMA (форбол-12-миристат-13-ацетат, #P1585-1MG, Sigma) или 100 мкМ ADP (#A2754, Sigma) и 0,5 ед/мл тромбина (Sigma) при комнатной температуре. Измерение проводили с использованием FACS verce производства BD через 30 минут после стимуляции. Долю PAC-1-положительных и долю CD62p-положительных в фракции CD42a-положительных тромбоцитов до и после стимуляции измеряли и подвергали сравнительной оценке.
Фиг. 6 и 7 показывают результаты. Доля PAC-1-положительных во время стимуляции PMA или ADP/тромбином оказалась приблизительно в 1,9-3,1 раза выше при культивировании в VMF по сравнению с культивированием с использованием встряхиваемой колбы (фиг. 6). Доля CD62p-положительных оказалась выше приблизительно в 1,8-2,7 раза или больше при культивировании в VMF по сравнению с культивированием с использованием встряхиваемой колбы (фиг. 7). То есть количество получаемых тромбоцитов, имеющих высокую биоактивность, может быть с помощью культивирования в VMF увеличено по сравнению с обычным культивированием с использованием встряхиваемой колбы.
[0085] 3-4. Измерение аномальных тромбоцитов
Каждый обработанный образец анализировали с помощью способа по п. 3-1 выше с использованием проточного цитометра, и измеряли количество аннексин V-положительных частиц. Количество CD42b-положительных аннексин V-положительных частиц определяли как количество аномальных тромбоцитов.
Фиг. 8 показывает результаты. Количество CD42b-положительных частиц с аннексином V оказалась уменьшено приблизительно в от 0,31 до менее чем 0,34 раза при культивировании в VMF по сравнению с культивированием с использованием встряхиваемой колбы (фиг. 8). То есть количество получаемых аномальных тромбоцитов может быть с помощью культивирования в VMF уменьшено по сравнению с обычным культивированием с использованием встряхиваемой колбы.
Промышленная применимость
[0086] Очевидно, что высококачественные тромбоциты, которые не могут быть получены с помощью культивирования со встряхиванием с использованием встряхиваемых колб, могут быть получены с помощью настоящего изобретения. Поэтому настоящее изобретение может внести вклад в производство большого количества тромбоцитов в промышленном масштабе.
Реферат
Группа изобретений относится к области биотехнологии. Предложен способ получения тромбоцитов, способ получения препарата тромбоцитов для восстановления потери крови у субъекта и способ получения препарата крови для восстановления потери крови у субъекта. Способ получения тромбоцитов включает этап культивирования мегакариоцитарных клеток в культуральном растворе в культуральном сосуде, где перемешивание культурального раствора осуществляют с помощью движущейся возвратно-поступательно перемешивающей лопасти. Способ получения препарата тромбоцитов содержит получение тромбоцитов, извлечение тромбоцитов из культуры и удаление отличного от тромбоцитов компонента гемопоэтических клеток из тромбоцитов. Способ получения препарата крови включает получение препарата тромбоцитов и смешивание препарата тромбоцитов и способствующего стабилизации клеток компонента для получения препарата крови. Изобретения обеспечивают получение большого количества высококачественных тромбоцитов, которые можно вводить в биологические тела. 3 н. и 7 з.п. ф-лы, 9 ил.
Формула
Документы, цитированные в отчёте о поиске
Способ тестирования тромбоцитов и устройство для тестирования тромбоцитов

Комментарии