Способ тестирования тромбоцитов и устройство для тестирования тромбоцитов - RU2543652C2
Код документа: RU2543652C2
Чертежи























Описание
Настоящее изобретение относится к способу и устройству тестирования для измерения функции тромбоцитов в крови, используя небольшое количество крови, более конкретно к способу и устройству для тестирования с помощью микрочипа для тестирования функции тромбоцитов в крови.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
(Проблемы, связанные с тестированием агрегации тромбоцитов в предшествующем уровне техники)
Активация и агрегация тромбоцитов играют центральную роль в формировании тромбов (белый тромб) в артерии и первичном гемостазе.
При повреждении кровеносного сосуда тромбоциты непосредственно и опосредованно связываются с коллагеном, расположенным под сосудистыми эндотелиальными клетками. В среде с медленным кровотоком (низкий гемодинамический удар) связывание тромбоцитов, главным образом, происходит в результате прямого связывания с коллагеновыми рецепторами, такими как GPVI, в то время как в среде с быстрым кровотоком (высокий гемодинамический удар) vWF связывается с коллагеном, а рецептор GPIbα тромбоцитов связывается с vWF, в результате чего происходит опосредованное связывание тромбоцитов с коллагеном. Прямое и опосредованное взаимодействие с коллагеном активирует тромбоциты, и благодаря такой стимуляции из плотных гранул и α-гранул высвобождаются различные активирующие тромбоциты вещества, такие как ADP и серотонин.
Такие высвободившиеся активирующие тромбоциты факторы активируют свои собственные тромбоциты и тромбоциты, находящиеся поблизости. В активированных тромбоцитах рецепторы фибриногена GPIIb и IIIa структурно изменяются в активированные формы, изменяющие тромбоциты в форму, обладающую высоким сродством к фибриногену. Благодаря фибриногену, который является димерным, активированные тромбоциты последовательно склеиваются друг с другом, что приводит к их агрегации.
Однако в большинстве обычных агрегометров используется способ измерения процесса активации и агрегации тромбоцитов, вызванного стимуляцией большим количеством активирующего тромбоциты реагента (Непатентный документ 1).
Поэтому реакция активации тромбоцитов индуцируется в среде, которая очень сильно отличается от физиологических условий активации тромбоцитов, и, хотя существует возможность измерения явного изменения функции, такого как врожденная дисфункция каждого рецептора, трудно измерить большее количество физиологических функций тромбоцитов.
PFA-100 (анализатор функций тромбоцитов: непатентный документ 2) представляет собой систему для измерения окклюзии отверстий посредством общей активации тромбоцитов, вызванной контактом с иммобилизованным коллагеном, гемодинамическим ударом и контактом с тромбоцит-индуцирующим веществом. По сравнению с обычной агрегацией тромбоцитов путем стимуляции одним индуцирующим активацию тромбоцитов веществом этот анализатор представляет собой систему для измерения, использующую среду, более сходную с физиологической средой. Однако отсутствует возможность управлять вариацией данных и концентрациями, вызывающими индукцию веществ, содержавшихся в крови, текущей через отверстия. Поэтому агрегацию тромбоцитов индуцируют в условиях, при которых индуцирующие активацию тромбоцитов вещества имеют очень низкие концентрации или отсутствуют совсем, при этом агрегация тромбоцитов наблюдается у пациентов, у которых тромбоциты уже были активированы развитием тромбоза. По этой причине агрегируемость тромбоцитов, вызываемая стимуляцией очень высокой концентрацией тромбоцит-индуцирующего вещества, в случае измерения функции тромбоцитов у пациентов, страдающих дисфункцией тромбоцитов, не может быть измерена соответствующим образом.
Кроме того, в патентном документе 1 раскрыт способ измерения функции тромбоцитов, при котором кровь может проходить внутри капилляра, а затем через отверстие в разделительный блок, при этом измеряется время, необходимое для окклюзии отверстия разделительного блока в результате формирования тромба. Однако, поскольку в этом способе добавляется большое количество активирующего тромбоциты реагента, трудно проводить измерение функции тромбоцитов, которая бы более детально отражала ситуацию в живом организме в случаях, например, когда тромбоциты активированы, но их количество снижено, и когда уровень тромбоцитов нормальный, но их функция ослаблена.
ДОКУМЕНТЫ ПРЕДШЕСТВУЮЩЕГО УРОВНЯ ТЕХНИКИ
Патентный документ
Патентный документ 1: JP 2007-298511 А
Непатентные документы
Непатентный документ 1: "Platelet Aggregability Test", Thrombosis and Circulation, vol.12, No.4, p.17-20, 2004
Непатентный документ 2: "Measurement of Platelet Aggregability with PFA-100" Thrombosis and Circulation, vol.13, No.3, p.90-94, 2005
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
При таких заболеваниях, как сепсис и рассеянная внутрисосудистая коагуляция (DIC), тромбоциты находятся в активированном состоянии из-за повреждения сосудистого эндотелия и образования тромбов, при этом между тромбоцитами и лейкоцитами и т.п. также формируются комплексы. К тому же, поскольку в процессе непрерывного формирования тромбов происходит чрезмерный расход тромбоцитов, несмотря на in vivo процесс формирования тромбов, может возникнуть кровотечение.
В обычных тестах функции тромбоцитов анализ, который мог бы точно отражать такие симптомы, является трудновыполнимым.
Например, в турбидиметрическом способе, когда активируется реактивность к тромбоцит-индуцирующему веществу, оценивается насколько (сильно) активирована функция тромбоцитов даже в случаях со сниженным уровнем тромбоцитов. Кроме того, поскольку комплексы между тромбоцитами и лейкоцитами, сформированные в результате воспалительной реакции или подобным образом in vivo и в значительной степени влияющие на формирование тромбов, оседают вместе с эритроцитами при центрифугировании для получения обогащенной тромбоцитами плазмы, они не входят в состав такой плазмы.
Более того, когда используется PFA-100, то в измерениях используется одна и та же концентрация индуцирующего вещества как для пациентов с сильной функцией тромбоцитов, так и для пациентов со слабой функцией тромбоцитов. Поэтому невозможно выполнить тест должным образом для подтверждения естественной индукции агрегации в условиях, когда индуцирующее вещество отсутствует или находится в очень низкой концентрации, или для подтверждения фармакологического эффекта антитромбоцитарного агента у пациента, которому он был введен, при очень высокой концентрации индуцирующего вещества. К тому же, даже в случаях замедленного времени окклюзии при измерении с помощью PFA-100 трудно провести сравнение между случаями со слабой функцией тромбоцитов и малым количеством тромбоцитов, но функция которых стимулирована (активирована в живом организме).
Настоящее изобретение выполнено с учетом вышеописанных обстоятельств, и его задачей является предоставление устройства и способа, которые позволяют выполнить эффективную и точную оценку функции тромбоцитов в среде, аналогичной кровотоку, с использованием небольшого количества крови.
Для решения этой задачи настоящее изобретение предоставляет способ тестирования функции тромбоцитов, в котором функцию тромбоцитов тестируют, позволяя антикоагулированной крови проходить через капилляр, имеющий склеивающую тромбоциты поверхность на, по меньшей мере, части ее внутренней поверхности, и отслеживают или измеряют поведение крови в капилляре.
Здесь антикоагуляционную обработку предпочтительно осуществляют с помощью лимонной кислоты, гепарина или гирудина.
Кроме того, склеивающую тромбоциты поверхность предпочтительно изготавливают из коллагенового покрытия или стекла.
При этом антикоагулированная кровь предпочтительно проходит обработку для слабой активации тромбоцитов, а обработка для слабой активации тромбоцитов предпочтительно осуществляется путем смешивания активирующего тромбоциты реагента с антикоагулированной кровью в количестве, при котором не происходит необратимая агрегация тромбоцитов.
Здесь обработка для активации тромбоцитов предпочтительно осуществляется с использованием активирующего тромбоциты реагента, а активирующий тромбоциты реагент предпочтительно представляет собой аденозиндифосфат, который смешивают с антикоагулированной кровью в концентрации 0,001-5 мкМ, или активирующий тромбоциты реагент предпочтительно представляет собой арахидоновую кислоту, которую смешивают с антикоагулированной кровью в концентрации 0,001-1 мМ.
Кроме того, по меньшей мере, часть внутренней части капилляра предпочтительно имеет секцию, содержащую стенки, проходящие по направлению кровотока в капилляре, и делит ширину капилляра на множество каналов.
Ширина каждого канала в этой секции предпочтительно составляет 10-200 мкм.
Склеивающая тромбоциты поверхность предпочтительно предоставлена в этой секции капилляра.
Капилляр предпочтительно сформирован в микрочипе.
В способе по настоящему изобретению для тестирования функции тромбоцитов функцию тромбоцитов предпочтительно тестируют с помощью метода, в котором антикоагулированную кровь, предпочтительно антикоагулированную кровь, прошедшую обработку для слабой активации тромбоцитов, вводят в капилляр с помощью насоса, и с помощью датчика давления измеряют давление, оказываемое на насос притоком крови в капилляр. Здесь антикоагулированную кровь предпочтительно хранят в секции для хранения крови, соединенной с капилляром и насосом, причем кровь с помощью насоса вводится в капилляр путем введения жидкости, удельная масса которой меньше удельной массы крови, в секцию для хранения крови, и измеряется давление притока жидкости, таким образом, выполняя опосредованное измерение давления, оказываемого притоком крови в капилляр.
Кроме того, антикоагулированную кровь предпочтительно хранят в секции для хранения крови, которая соединена с капилляром и насосом, причем антикоагулированная кровь смешивается с активирующим тромбоциты реагентом в секции для хранения крови путем введения в секцию для хранения крови активирующего тромбоциты реагента с помощью насоса, и кровь, смешанную с активирующим тромбоциты реагентом, вводят в капилляр, измеряя при этом давление притока активирующего тромбоциты реагента, таким образом, выполняя опосредованное измерение давления, оказываемого притоком крови в капилляр.
При этом предпочтительно, чтобы в способе по настоящему изобретению для тестирования функции тромбоцитов капилляр был соединен с секцией для хранения крови, а антикоагулированная кровь, смешанная в секции для хранения крови с активирующим тромбоциты реагентом, могла проходить через этот капилляр. Здесь активирующий тромбоциты реагент предпочтительно смешивают с антикоагулированной кровью непосредственно перед измерением. В качестве альтернативы, активирующий тромбоциты реагент смешивают с антикоагулированной кровью таким образом, чтобы концентрация активирующего тромбоциты реагента в смеси антикоагулированной крови с активирующим тромбоциты реагентом увеличивалась в виде линейного градиента концентрации или ступенчатого градиента концентрации. Смесь антикоагулированной крови с активирующим тромбоциты реагентом предпочтительно перемешивают.
Настоящее изобретение также предоставляет устройство для тестирования функции тромбоцитов, содержащее: капилляр, имеющий склеивающую тромбоциты поверхность на, по меньшей мере, части его внутренней поверхности; и секцию, предоставленную в, по меньшей мере, части капилляра, причем указанная секция имеет стенки, которые проходят по направлению кровотока в капилляре и делят ширину капилляра на множество каналов.
Здесь капилляр предпочтительно сформирован в микрочипе, и в микрочипе предпочтительно сформировано не менее 2 капилляров. В последнем случае капилляры предпочтительно имеют ширину не менее 2 видов, каждая находится в пределах от 10 до 150 мкм и от 50 до 200 мкм.
Кроме того, устройство для тестирования функции тромбоцитов предпочтительно имеет насос для закачки жидкости. К тому же оно предпочтительно имеет камеру для получения изображений внутренней части микрочипа.
Кроме того, устройство для тестирования функции тромбоцитов предпочтительно имеет секцию для хранения отработанной жидкости, которая расположена в микрочипе ниже склеивающей тромбоциты поверхности, при этом в секции для хранения отработанной жидкости хранят отработанную кровь, которая прошла через склеивающую тромбоциты поверхность. В этом случае, глубина секции для хранения отработанной жидкости предпочтительно не превышает 100 мкм. Более предпочтительно, в месте расположения секции для хранения отработанной жидкости имеется отверстие, выходящее на внешнюю поверхность микрочипа, и особенно предпочтительным является то, что в месте, соответствующем расположению отверстия на поверхности микрочипа, предоставляется абсорбирующий кровь материал.
С помощью способа тестирования функции тромбоцитов согласно настоящему изобретению можно тестировать функцию тромбоцитов, позволяя антикоагулированной крови проходить через капилляр, имеющий склеивающую тромбоциты поверхность на, по меньшей мере, части его внутренней поверхности, и отслеживая или измеряя поведение крови в капилляре, используя в качестве показателя активации тромбоцитов гемодинамический удар, вызываемый прохождением крови через склеивающую тромбоциты поверхность.
С помощью способа тестирования функции тромбоцитов по настоящему изобретению можно проводить недорогую антикоагуляционную обработку, поскольку для этого используется лимонная кислота, гепарин или гирудин.
В случаях, когда в качестве склеивающей тромбоциты поверхности используется коллагеновое покрытие, а используемый антикоагулянт представляет собой хелатор кальция, такой как лимонная кислота, более предпочтительно проводить измерение функции тромбоцитов путем смешивания активирующим тромбоциты реагентом с кровью и позволяя смеси проходить через коллагеновое покрытие. С другой стороны, в тех случаях, когда антикоагулянт отличается от хелатора кальция, в частности, когда используется гирудин, агрегация тромбоцитов на коллагене происходит быстрее и сильнее, чем в тех случаях, когда антикоагуляционную обработку выполняют с помощью лимонной кислоты, вызывая окклюзию капилляра для возможности стабильного тестирования функции тромбоцитов даже без использования активирующего тромбоциты реагента. Если агрегация тромбоцитов не происходит по причине их дисфункции, использования антитромбоцитарного агента или т.п., можно измерить степень снижения функции тромбоцитов или влияние антитромбоцитарного агента путем смешивания активирующего тромбоциты реагента перед началом измерения. Устанавливая каналы различной ширины в одном и том же чипе и используя кровь, антикоагулированную гирудином и лимонной кислотой, можно провести всестороннее измерение степени агрегируемости тромбоцитов, чувствительность к тромбоцит-индуцирующему веществу, влияние антитромбоцитарного агента и т.п.
Способом тестирования функции тромбоцитов по настоящему изобретению можно измерить более сходную с физиологической функцию тромбоцитов, поскольку склеивающая тромбоциты поверхность изготовлена из коллагенового покрытия.
Способом тестирования функции тромбоцитов по настоящему изобретению функцию тромбоцитов можно измерить с помощью вещества, которое является менее дорогостоящим, поскольку склеивающая тромбоциты поверхность изготовлена из стекла.
Способом тестирования функции тромбоцитов по настоящему изобретению функцию тромбоцитов можно измерить в условиях, более приближенных к физиологическим условиям, и могут быть получены результаты исследований, отражающие различные заболевания, поскольку антикоагулированная кровь прошла обработку для слабой активации тромбоцитов.
Способом тестирования функции тромбоцитов по настоящему изобретению обработка для слабой активации тромбоцитов может быть выполнена простым способом, поскольку обработка для слабой активации тромбоцитов выполняется путем смешивания активирующего тромбоциты реагента с антикоагулированной кровью в количестве, при котором не происходит необратимая агрегация тромбоцитов, и комбинированная активация тромбоцитов с помощью активирующего тромбоциты реагента и гемодинамического удара на склеивающей тромбоциты поверхности позволяет отслеживать более физиологическую активацию тромбоцитов.
Способом тестирования функции тромбоцитов по настоящему изобретению функцию тромбоцитов можно тестировать в условиях, более приближенных к физиологическим условиям, и можно получить результаты, отражающие различные заболевания, поскольку активирующий тромбоциты реагент представляет собой аденозиндифосфат, который смешивают с антикоагулированной кровью в концентрации от 0,001 до 5 мкМ.
Способом тестирования функции тромбоцитов по настоящему изобретению функцию тромбоцитов можно тестировать в условиях, более приближенных к физиологическим условиям, и можно получить результаты, отражающие различные заболевания, поскольку активирующий тромбоциты реагент представляет собой арахидоновую кислоту, которую смешивают с антикоагулированной кровью в концентрации от 0,001 до 1 мМ.
Способом тестирования функции тромбоцитов по настоящему изобретению легко происходит активация тромбоцитов с помощью гемодинамического удара, поскольку, по меньшей мере, часть внутренней поверхности капилляра имеет секцию, содержащую стенки, которые проходят по направлению кровотока в капилляре и делят ширину капилляра на множество каналов.
Способом тестирования функции тромбоцитов по настоящему изобретению небольшие сформированные тромбоцитарные агрегаты могут увеличивать внутреннее давление, при этом не смываясь кровотоком, даже быстрым кровотоком и сильным гемодинамическим ударом, поскольку ширина каждого канала в указанной секции составляет от 10 до 200 мкм, обеспечивая канал каркасом.
Способом тестирования функции тромбоцитов по настоящему изобретению агрегация тромбоцитов легко удерживается в указанной секции, поскольку в этой секции имеется склеивающая тромбоциты поверхность.
Способом тестирования функции тромбоцитов по настоящему изобретению тестирование можно проводить, используя небольшое количество крови, поскольку капилляр сформирован на микрочипе.
Способом тестирования функции тромбоцитов по настоящему изобретению можно выполнить количественное измерение функции тромбоцитов, поскольку в капилляр с помощью насоса закачивают антикоагулированную кровь, и с помощью датчика давления измеряют давление, создаваемое в насосе притоком крови в капилляр, таким образом оценивая функцию тромбоцитов.
Способом тестирования функции тромбоцитов по настоящему изобретению насос не загрязняется кровью, поскольку антикоагулированная кровь хранится в секции для хранения крови, которая соединена с капилляром и насосом, причем кровь поступает в капилляр путем закачки с помощью насоса в секцию для хранения крови жидкости, удельная масса которой меньше удельной массы крови, и измеряется давление притока жидкости, таким образом происходит опосредованное измерение давления, создаваемого притоком крови в капилляр.
Способом тестирования функции тромбоцитов по настоящему изобретению тестирование можно выполнять быстро, поскольку антикоагулированная кровь хранится в секции для хранения крови, которая соединена с капилляром и насосом, причем антикоагулированную кровь смешивают с активирующим тромбоциты реагентом в секции для хранения крови путем закачки с помощью насоса в секцию для хранения крови активирующего тромбоциты реагента, и смешанную с активирующим тромбоциты реагентом кровь вводят в капилляр, при этом измеряют давление притока активирующего тромбоциты реагента, таким образом происходит опосредованное измерение давления, создаваемого притоком крови в капилляр.
Способом тестирования функции тромбоцитов по настоящему изобретению активацию тромбоцитов с помощью активирующего тромбоциты реагента можно измерять в широком диапазоне концентраций, и в одном эксперименте можно измерять гиперактивность и гипоактивность тромбоцитов, что является желательным, поскольку активирующий тромбоциты реагент смешивается с антикоагулированной кровью таким образом, чтобы концентрация активирующего тромбоциты реагента в смеси антикоагулированной крови с активирующим тромбоциты реагентом увеличивалась в виде линейного градиента концентрации или ступенчатого градиента концентрации.
Способом тестирования функции тромбоцитов по настоящему изобретению можно получить более точные результаты тестирования, поскольку смесь антикоагулированной крови с активирующим тромбоциты реагентом перемешивается.
С помощью устройства для тестирования функции тромбоцитов по настоящему изобретению можно эффективно активировать тромбоциты, поскольку устройство для тестирования функции тромбоцитов содержит: капилляр, имеющий склеивающую тромбоциты поверхность на, по меньшей мере, части его внутренней поверхности; и секцию, содержащую стенки, которые проходят по направлению кровотока в капилляре и делят ширину капилляра на множество каналов. Таким образом, устройство является подходящим для вышеописанного способа тестирования тромбоцитов.
С помощью устройства для тестирования функции тромбоцитов по настоящему изобретению можно легко создать капилляр, и можно выполнить тестирование с использованием небольшого количества образца, поскольку капилляр формируют на микрочипе.
С помощью устройства для тестирования функции тромбоцитов по настоящему изобретению можно выполнять одновременно множество тестов, поскольку на микрочипе формируют не менее двух капилляров.
С помощью устройства для тестирования функции тромбоцитов по настоящему изобретению можно выполнять одновременно множество тестов, поскольку имеются капилляры, имеющие ширину не менее двух видов в пределах от 10 до 150 мкм и от 50 до 200 мкм.
С помощью устройства для тестирования функции тромбоцитов по настоящему изобретению можно управлять скоростью притока крови в капилляр, что является предпочтительным, поскольку устройство имеет насос для закачки жидкости.
С помощью устройства для тестирования функции тромбоцитов по настоящему изобретению можно отслеживать активацию тромбоцитов, поскольку устройство имеет камеру для получения изображения внутренней части микрочипа. Размещенная камера предпочтительно может давать статичное или движущееся изображение. Если камера может автоматически делать и сохранять статичные или движущиеся изображения внутренней части через постоянные интервалы времени, после измерения можно визуально оценивать состояние активации тромбоцитов в масштабе времени, что является предпочтительным. Если изображения внутренней части всего канала можно делать в виде панорамного изображения или непрерывных статичных изображений, их можно легко сохранять и сравнивать, что является более желательным. Если получают статичные или движущиеся изображения, установка передающего источника света, т.е. источника света на противоположной стороне от камеры, позволяет делать более четкие изображения.
С помощью устройства для тестирования функции тромбоцитов по настоящему изобретению нет необходимости в адсорбции и удалении использованной крови, и, следовательно, тестирование может быть выполнено просто, поскольку устройство имеет секцию для хранения отработанной жидкости, которая расположена на микрочипе ниже склеивающей тромбоциты поверхности, при этом в секции для хранения отработанной жидкости хранится использованная кровь, которая прошла через склеивающую тромбоциты поверхность.
С помощью устройства для тестирования функции тромбоцитов по настоящему изобретению использованная кровь может храниться в достаточно большом количестве, поскольку глубина секции для хранения отработанной жидкости составляет не менее 100 мкм.
С помощью устройства для тестирования функции тромбоцитов по настоящему изобретению воздух, находящийся в секции для хранения отработанной жидкости, выходит во внешнюю среду, и, следовательно, кровь может храниться в секции для хранения без увеличения внутреннего давления, поскольку отверстие, выходящее на внешнюю поверхность микрочипа, находится в месте расположения секции для хранения отработанной жидкости.
С помощью устройства для тестирования функции тромбоцитов по настоящему изобретению использованная кровь может абсорбироваться абсорбирующим кровь материалом, и, следовательно, использованная кровь не растекается, поскольку абсорбирующий кровь материал расположен в месте, соответствующем отверстию на поверхности микрочипа.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг.1 представляет собой диаграмму, демонстрирующую первый вариант осуществления микрочипа, входящего в состав устройства для наблюдения за тромбоцитами по настоящему изобретению.
Фиг.2 представляет собой диаграмму, демонстрирующую первый вариант осуществления устройства для наблюдения за тромбоцитами по настоящему изобретению.
Фиг.3 представляет собой диаграмму, демонстрирующую второй вариант осуществления микрочипа, входящего в состав устройства для наблюдения за тромбоцитами по настоящему изобретению.
Фиг.4 представляет собой диаграмму, демонстрирующую второй вариант осуществления устройства для наблюдения за тромбоцитами по настоящему изобретению.
Фиг.5 представляет собой диаграмму, демонстрирующую изменение давления в насосе 109 в Примере 1.
Фиг.6 представляет собой диаграмму, демонстрирующую изменение давления в насосе 109 в Примере 2.
Фиг.7 представляет собой диаграмму, демонстрирующую изменение давления в насосе 109 в Примере 3.
Фиг.8 представляет собой диаграмму, демонстрирующую изменение давления в насосе 109 в Примере 4.
Фиг.9 представляет собой диаграмму, демонстрирующую изменение давления в насосе 109 в Примере 5.
Фиг.10 представляет собой диаграмму, демонстрирующую изменение давления в насосе 109 в Примере 6.
Фиг.11 представляет собой диаграмму (фотографии), демонстрирующую состояние активации тромбоцитов в Примере 7. A: без ADP; B: 0,025 мкМ ADP; C: 0,05 мкМ ADP; D: 0,1 мкМ ADP.
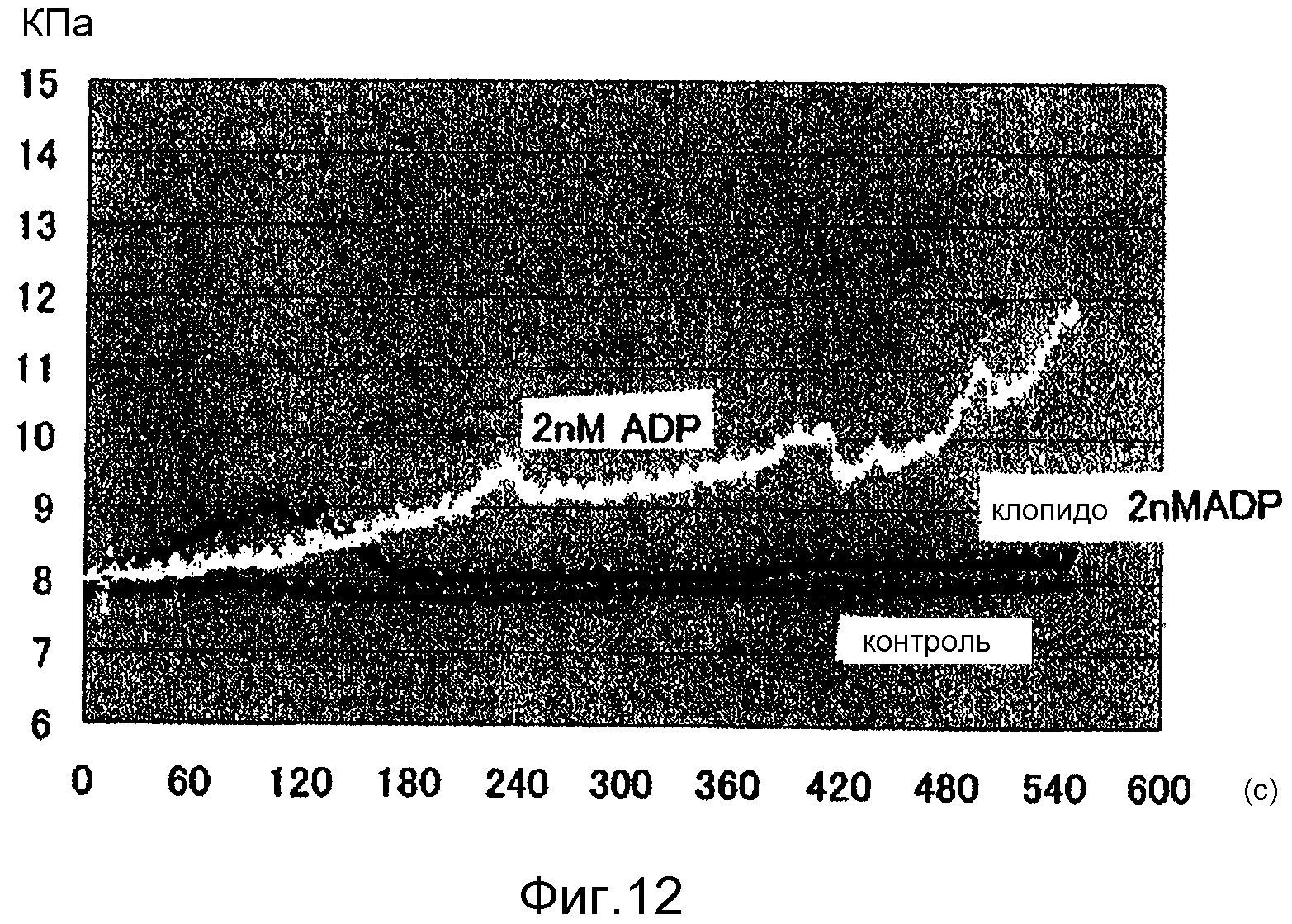
Фиг.12 представляет собой диаграмму, демонстрирующую изменение давления в насосе 109 в Примерах 8-10.
Фиг.13 представляет собой диаграмму, демонстрирующую третий вариант осуществления устройства для наблюдения за тромбоцитами по настоящему изобретению.
Фиг.14 представляет собой диаграмму, демонстрирующую изменение давления в насосе 109 в Примерах 11-13.
Фиг.15 представляет собой диаграмму, демонстрирующую изменение давления в насосе 109 в Примерах 14 и 15.
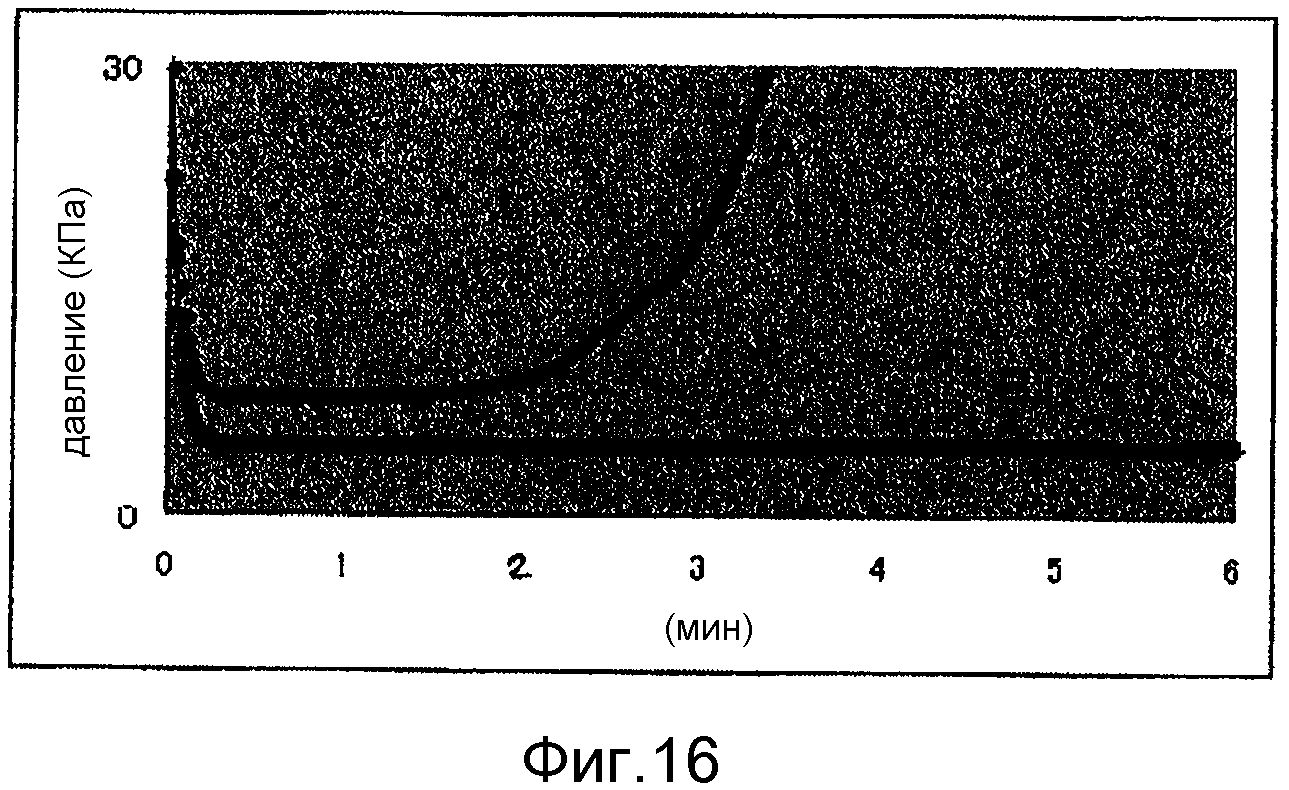
Фиг.16 представляет собой диаграмму, демонстрирующую результаты увеличения давления при скорости потока 20 мкл/мин, полученные в результате использования крови, к которой добавлена арахидоновая кислота. А - показаны результаты увеличения давления при скорости потока 20 мкл/мин, полученные в результате использования крови субъекта G в Примере 16a, в которую добавлена арахидоновая кислота. В - показано увеличение давления в эксперименте, аналогичном 16a, в котором субъекту G предварительно ввели 100 мг аспирина.
Фиг.17 представляет собой диаграмму, демонстрирующую результаты увеличения давления при скорости потока 10 мкл/мин, полученные в результате использования крови, в которую добавлена арахидоновая кислота. С - показаны результаты увеличения давления при скорости потока 10 мкл/мин, полученные в результате использования крови субъекта G в Примере 16b, в которую добавлена арахидоновая кислота. D - показано увеличение давления в эксперименте, аналогичном 16b, в котором субъекту G предварительно ввели 100 мг аспирина.
Фиг.18 представляет собой диаграмму, демонстрирующую результаты увеличения давления при скорости потока 5 мкл/мин, полученные в результате использования крови, в которую добавлена арахидоновая кислота. E - показаны результаты увеличения давления при скорости потока 5 мкл/мин, полученные в результате использования крови субъекта G в Примере 16c, в которую добавлена арахидоновая кислота. F - показано увеличение давления в эксперименте, аналогичном 16c, в котором субъекту G предварительно ввели 100 мг аспирина.
Фиг.19 представляет собой диаграмму, демонстрирующую результаты увеличения давления при скорости потока 20 мкл/мин, полученные в результате использования крови, в которую добавлен коллаген. А - показаны результаты увеличения давления при скорости потока 20 мкл/мин, полученные в результате использования крови субъекта G в Примере 16d, в которую добавлено 6 мкл коллагена. В, С и D - показано увеличение давления в экспериментах, аналогичных Примеру 16d, где использовали кровь, в которую в Примере 18 добавили 18 мкл коллагена; где использовали кровь, в которую в Примере 18 добавили 12 мкл коллагена; и где субъекту G предварительно вводили 100 мг аспирина соответственно.
Фиг.20 представляет собой диаграмму, демонстрирующую результаты увеличения давления при скорости потока 10 мкл/мин, полученные путем использования крови, в которую добавлен коллаген. E - показаны результаты увеличения давления при скорости потока 10 мкл/мин, полученные в результате использования крови субъекта G в Примере 16e, в которую добавлен коллаген. F - показано увеличение давления в эксперименте, аналогичном 16e, в котором субъекту G предварительно ввели 100 мг аспирина.
Фиг.21 представляет собой диаграмму, демонстрирующую результаты увеличения давления при скорости потока 5 мкл/мин, полученные путем использования крови, в которую добавлен коллаген. G - показаны результаты увеличения давления при скорости потока 5 мкл/мин, полученные путем использования крови субъекта G в Примере 16f, в которую добавлен коллаген. Н - показано увеличение давления в эксперименте, аналогичном I6f, в котором субъекту G предварительно ввели 100 мг аспирина.
Фиг.22 представляет собой диаграмму, демонстрирующую результаты увеличения давления при скорости потока 20 мкл/мин, полученные путем использования крови, обработанной 0,4 мкг/мл или 0,8 мкг/мл ReoPro в Примере 21. 'Контроль' указывает на результаты увеличении давления при скорости потока 20 мкл/мин, полученные путем использования крови в Примере 19 (без обработки ReoPro).
Фиг.23 представляет собой диаграмму, демонстрирующую результаты увеличения давления при скорости потока 7 мкл/мин, полученные путем использования крови, обработанной 0,4 мкг/мл или 0,8 мкг/мл ReoPro в Примере 21. 'Контроль' указывает на результаты увеличения давления при скорости потока 7 мкл/мин, полученные путем использования крови в Примере 20 (без обработки ReoPro).
Фиг.24 представляет собой диаграмму, демонстрирующую результаты увеличения давления при скорости потока 20 мкл/мин, полученные путем использования крови, обработанной 0,01 мкг/мл или 0,1 мкг/мл OS-1 в Примере 22. 'Контроль' указывает на результаты увеличения давления при скорости потока 20 мкл/мин, полученные путем использования крови без обработки OS-1.
Фиг.25 представляет собой диаграмму, демонстрирующую результаты увеличения давления при скорости потока 7 мкл/мин, полученные путем использования крови, обработанной 0,01 мкг/мл или 0,1 мкг/мл OS-1 в Примере 22. 'Контроль' показывает результаты увеличения давления при скорости потока 7 мкл/мин, полученные путем использования крови без обработки OS-1.
РЕЖИМЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Устройство для тестирования тромбоцитов по настоящему изобретению описано со ссылкой на чертежи. В настоящем изобретении 'кровь' включает цельную кровь и обогащенную тромбоцитами плазму.
Фиг.1 представляет собой концептуальную диаграмму, демонстрирующую первый вариант осуществления микрочипа, входящего в состав устройства для тестирования тромбоцитов по настоящему изобретению. Объяснение приведено на основе фиг.1.
Фиг.1(A) представляет собой вид сверху, демонстрирующий первую подложку 100, на поверхности которой вырезано углубление, соответствующее капилляру 101 микрочипа 1. Форма профиля этого углубления является произвольной и может быть прямоугольной, U-образной, V-образной или т.п. Поскольку тромбоцитарные агрегаты являются хрупкими, глубина углубления для измерения увеличения давления предпочтительно не превышает 10-200 мкм. Ширина углубления предпочтительно составляет 10-100 мкм.
На участке между первым концом (конец со стороны входного отверстия) и вторым концом (конец со стороны выходного отверстия) углубления, соответствующего капилляру 101, находится множество разделяющих канал стенок 103, расположенных по направлению кровотока, для формирования разделяющей канал секции 102, которая делит ширину капилляра на множество каналов.
Кроме того, интервалы между разделяющими канал стенками 103 предпочтительно не превышают 200 мкм. Сформированный тромбоцитарный агрегат шириной, не превышающей 200 мкм, может привести к увеличению внутреннего давления, и при этом он не будет смыт кровотоком даже при быстрой скорости кровотока и при высоком гемодинамическом ударе. Кроме того, в разделяющей канал секции 102 ширина капилляра 101 предпочтительно разделена на не менее, чем 5 каналов разделяющей канал стенкой 103. Таким образом, в случае, если ширина канала разделена на не менее чем 5 каналов, происходит усреднение величины окклюзии соответствующих разделенных каналов, и, следовательно, можно легко получать данные с меньшей вариацией.
Форма разделяющих канал стенок 103 не ограничена при условии, что они могут делить ширину капилляра 101 на множество каналов.
Фиг.1(B) представляет собой вид сверху, демонстрирующий вторую подложку 110, на которой вырезаны сквозные отверстия, соответствующие входному отверстию 104 и выходному отверстию 105 микрочипа 1. Сквозные отверстия, соответствующие входному отверстию 104 и выходному отверстию 105, расположены в местах, соответствующих, при наложении на первую подложку 100, первому концу капилляра 101 и второму концу капилляра 101 соответственно первой подложки 100. Кроме того, покрытие коллагеном или т.п. задней стороны второй подложки 110, которая покрывает разделяющую канал секцию 102 на первой подложке 100, сформировано из склеивающей тромбоциты поверхности 106. Более конкретно, как показано на фиг.1(C), коллаген или т.п. широко применяется в используемой области в качестве склеивающей тромбоциты поверхности 106 с учетом запаса прочности.
Склеивающая тромбоциты поверхность также может проходить по всей длине капилляра, как показано на фиг.3 (второй вариант осуществления). Во втором варианте осуществления материал второй подложки 210 представляет собой стекло, и вторая сторона подложки по всей длине капилляра 201 в микрочипе 2 работает в качестве склеивающей тромбоциты поверхности 206.
В качестве альтернативы, вместо предоставления сквозного отверстия в положении, соответствующем на второй подложке второму концу капилляра и, таким образом, обеспечивающем выходное отверстие, как показано на фиг.1 и 3, может быть предоставлена секция 307 для хранения отработанной жидкости для хранения использованной крови, которая прошла через склеивающую тромбоциты поверхность 306 в виде углубления, расположенного таким образом, чтобы оно окружало положение, соответствующее второму концу капилляра 301 на второй подложке 310 и было покрыто первой подложкой 300, как показано на фиг.13 (третий вариант осуществления). Путем установки емкости секции 307 для хранения отработанной жидкости, превышающей количество протестированной крови, можно отменить операцию отсасывания насосом или т.п. использованной крови из выходного отверстия и выведения ее, как в первом и во втором вариантах осуществления, поэтому тестирование может быть выполнено проще. Сквозное отверстие может быть предоставлено в секции 307 для хранения использованной жидкости в виде воздушного отверстия 305. Путем размещения абсорбирующего кровь материала 308 в месте, соответствующем сквозному отверстию 305 на поверхности микрочипа 3, можно избежать растекания использованной крови за пределы микрочипа даже в случае использования большого количества образца крови. Примеры прикрепляемого абсорбирующего кровь материала включают губки и ткани.
Фиг.1(C) представляет собой вид сверху, демонстрирующий микрочип 1, в котором первая подложка 100 и вторая подложка 110 наложены друг на друга таким образом, чтобы углубление на первой подложке 100 и склеивающая тромбоциты поверхность второй подложки 110 были обращены внутрь. Волнистой линией показан капилляр 103, расположенный в микрочипе 1.
Примеры склеивающей тромбоциты поверхности включают коллагеновое покрытие и стекло. Среди них, коллаген является особенно предпочтительным, поскольку его можно легко получить и обработать, и он может обеспечить модель, аналогичную реальному кровеносному сосуду. Склеивающая тромбоциты поверхность также может представлять собой поверхность, содержащую коллаген и тканевый тромбопластин. Обладающее высокой адгезией вещество, такое как коллаген, накладывается на склеивающую тромбоциты поверхность 106 для того, чтобы тромбоциты не смывались кровотоком.
Коллагеновое покрытие с высокой силой адгезии может быть просто нанесено, например, путем растворения коллагена в кислом растворе и нанесения полученного раствора на заранее определенное положение на подложке, такой как стекло или полистирол, для придания ей гидрофильности с последующей промывкой и сушкой подложки, как описано в JP 05-260950 A и Blood. 1995 Apr 1;85(7):1826-35.
В случаях нанесения гидрофобной смолы или т.п. покрытие может быть получено путем гидрофилизации поверхности смолы с помощью плазменной обработки или т.п., а затем нанесения коллагенового раствора на нужную область с последующей сушкой на воздухе или сушкой при пониженном давлении.
В случае использования пластика в качестве материала основы, он может быть легко покрыт коллагеном или содержащим коллаген тканевым тромбопластином путем гидрофилизации поверхности с помощью плазменной обработки или т.п., а затем нанесения раствора коллагена на нужную область с помощью диспенсера, такого как пипетка или шприц.
В случаях использования стекла в качестве склеивающей тромбоциты поверхности может использоваться вторая подложка 110, на которой только то место, которое соответствует склеивающей тромбоциты поверхности 106, сформировано из стекла, а другая область сформирована из пластика, силикона или т.п., или, как показано на фиг.3, в случае использования стеклянной подложки в качестве второй подложки 210 склеивающая тромбоциты поверхность 206 может проходить по всей длине капилляра 201, и вторая подложка накладывается на первую подложку 200, сформированную из пластика, силикона или т.п.
Материал микрочипа 1 предпочтительно представляет собой металл, стекло, пластик, силикон или т.п. С точки зрения использования для мониторинга крови (особенно при анализе изображений) предпочтительным является прозрачный материал. Кроме того, с точки зрения формирования контура, пластик является предпочтительным, и особенно предпочтительным является прозрачный пластик. В случаях, когда материал представляет собой силикон, такой как PDMS (полидиметилсилоксан), между подложками достигается превосходная адгезия так, что первую подложку 100 можно наложить на вторую подложку 110 просто путем сжатия без использования адгезива или т.п. для склеивания, но в случае приложения высокого давления к внутренней части микрочипа 1 предпочтительно использовать адгезив. К тому же можно легко и эффективно подавлять коагуляцию крови в неожиданных участках с помощью поли(2-метоксиэтилакрилата) (PMEA). Углубление и отверстие, предоставленные на подложке микрочипа 1, могут быть вырезаны резаком или лазерным лучом, а в тех случаях, когда материал микрочипа 1 представляет собой пластик, они также могут быть сформированы литьевым прессованием. Формирование литьевым прессованием является предпочтительным, поскольку можно более эффективно изготавливать микрочипы 1 неизменного качества.
Пример тестирования функции тромбоцитов с помощью микрочипа 1 настоящего варианта осуществления описан со ссылкой на фиг.1(C). С первым входным отверстием 104 соединена трубка, которая не показана, а через трубку соединены резервуар с кровью (секция для хранения крови) 107 и насос 109 для закачки жидкости, которые не показаны. Путем закачки жидкости в резервуар 107 с помощью подсоединенного насоса 109 кровь из резервуара поступает в микрочип 1. Если жидкость в насосе представляет собой активирующий тромбоциты реагент, то тромбоциты антикоагулированной крови в резервуаре являются активированными, и они дополнительно активируются гемодинамическим ударом при прохождении через склеивающую тромбоциты поверхность. Кроме того, концентрация активирующего тромбоциты реагента в резервуаре может непрерывно увеличиваться. Путем помещения в резервуар с кровью магнитной вертушки и перемешивания в нем крови активирующий тромбоциты реагент постоянно смешивается с кровью, что является предпочтительным.
Жидкость в насосе для закачки жидкости может представлять собой жидкость, удельная масса которой меньше удельной массы крови, такую как минеральное масло или физиологический раствор, и эта жидкость может быть введена в резервуар, предварительно заполненный антикоагулированной кровью, таким образом давая возможность крови течь в капилляр. Путем измерения давления притока жидкости, можно опосредованно измерить давление, создаваемое притоком крови в капилляре. Антикоагулированная кровь, которой предварительно был заполнен резервуар, предпочтительно представляет собой смесь активирующих тромбоциты реагентов. Активирующий тромбоциты реагент также может быть помещен в резервуар заранее в сухом или жидком состоянии с последующим смешиванием его с кровью. Кроме того, путем ступенчатого увеличения скорости жидкости с помощью насоса для закачки жидкости также ступенчато можно увеличивать гемодинамический удар.
Примеры антикоагулянта, используемого для антикоагуляционной обработки с целью подавления коагуляции крови, включают калиевую или натриевую соль лимонной кислоты; оксалат натрия или калия; ACD (кислый цитрат декстрозы); и соли этилендиаминтетрауксусной кислоты (ЭДТ).
Такой антикоагулянт можно использовать в виде порошка, лиофилизированного продукта или раствора, такого как водный раствор. Среди этих антикоагулянтов предпочтительным является обычно используемый 3,2% цитрат натрия, поскольку он является легко доступным. В этом случае, предпочтительно использовать 1 объем такого антикоагулянта на 9 объемов крови.
Примеры других используемых антикоагулянтов включают гепарин, гирудин, аптамеры тромбина и выделенные из зерна ингибиторы трипсина (1977. J. Biol. Chem 252. 8105). Можно использовать более одного антикоагулянта. В случаях, когда используемым антикоагулянтом является гирудин, происходит более сильная агрегация тромбоцитов, по сравнению с антикоагуляционной обработкой с помощью лимонной кислоты, даже без обработки активирующим тромбоциты реагентом, так что гирудин является подходящим для измерения зависящей от гемодинамического удара функции тромбоцитов. В случае крови, антикоагулированной лимонной кислотой можно проводить точные измерения функции тромбоцитов, которая зависит от стимуляции активирующим тромбоциты реагентом, в этом случае лимонная кислота является более подходящей для оценки антитромбоцитарного агента и т.п.
Примеры способа получения антикоагулированной крови включают способ, в котором вышеописанный антикоагулянт предварительно помещают в шприц или вакуумную канюлю для забора крови с последующим забором крови, и способ, в котором сразу после забора крови в нее быстро добавляют антикоагулянт.
Кровь также можно собирать с помощью вакуумной канюли для забора крови или т.п., содержащей гепарин с последующим добавлением гепариназы и антикоагулянта, подходящего для мониторинга, таким образом разрушая гепарин с помощью гепариназы для замены гепарина подходящим для измерения антикоагулянтом.
Примеры активирующего тромбоциты реагента, смешиваемого с антикоагулированной кровью, включают ADP, коллаген, тромбин, арахидоновую кислоту и ристоцетин. Активирующий тромбоциты реагент смешивают с антикоагулированной кровью с концентрацией, при которой происходит слабая активация тромбоцитов. Концентрация, при которой происходит слабая активация тромбоцитов, представляет собой концентрацию, при которой не происходит необратимая агрегация тромбоцитов (вторичная агрегация тромбоцитов) в статичном состоянии. Например, в случае ADP она составляет от 0,001 до 5 мкМ, а в случае арахидоновой кислоты она составляет от 0,001 до 1 мМ. Однако в тех случаях, где время реакции с такими активирующими тромбоциты реагентами явно замедлено из-за нарушенной функции тромбоцитов или введения антитромбоцитарного агента, измерение величины такого замедления предпочтительно выполняют путем добавления активирующего тромбоциты реагента в концентрации, превышающей вышеуказанные. В частности, в тех случаях, когда измеряется степень воздействия клопидогреля или аспирина, измерение предпочтительно выполняют путем увеличения концентрации соответственно ADP или арахидоновой кислоты.
Смесь слабо активирующего тромбоциты реагента и антикоагулированной крови вводят через входное отверстие 104. Эта смесь проходит по капилляру 101 через разделяющую канал секцию 102, вызывая при этом гемодинамический удар и, таким образом, усиливая активацию тромбоцитов, что приводит к их адгезии и накоплению на склеивающей тромбоциты поверхности. Путем подбора скорости потока и микрочипа и путем выполнения сравнительных экспериментов в условиях высокого гемодинамического удара и низкого гемодинамического удара можно получить более подробную оценку функции тромбоцитов, оценку фармакологического эффекта антитромбоцитарного агента и т.п. Отслеживая скорость потока и прохождение самой смеси через разделяющую канал секцию 102, можно контролировать функцию тромбоцитов. Отслеживаемую кровь выводят через выходное отверстие 105, находящееся на конце капилляра 101.
Ниже описано устройство для тестирования тромбоцитов по настоящему изобретению с использованием микрочипа 1.
Фиг.2 представляет собой концептуальную диаграмму устройства А для тестирования тромбоцитов в качестве первого варианта осуществления устройства для тестирования тромбоцитов, в котором микрочип 1 имеет прозрачную подложку и встроен в устройство. Ниже со ссылкой на фиг.2 описан первый вариант осуществления.
К входному отверстию 104 микрочипа 1 присоединен резервуар 107 (секция для хранения крови), в котором находится кровь и магнитная вертушка 108, в перевернутом положении, и к резервуару 107 через трубку подсоединен насос 109 для закачки жидкости для подачи активирующего тромбоциты реагента. К насосу 109 для закачки жидкости подсоединен датчик давления, который не показан.
Из насоса 109 для закачки жидкости активирующий тромбоциты реагент подается в резервуар 107, и активирующий тромбоциты реагент и антикоагулированную кровь смешивают с помощью магнитной вертушки 108 магнитной мешалки 113.
Путем подбора скорости потока в насосе при введении активирующего тромбоциты реагента из насоса 109 для закачки жидкости в резервуар 107 и, таким образом, автоматически увеличивая концентрацию активирующего тромбоциты агента в смеси с кровью от 0 до концентрации, при которой тромбоциты могут быть индуцированы в достаточной степени, в одном эксперименте можно измерить стимуляцию функции тромбоцитов и снижение функции тромбоцитов, что является предпочтительным. Например, концентрация ADP может увеличиваться в виде градиента концентрации от 0 до 0,1 мкМ, или концентрация индуцирующего вещества может увеличиваться ступенчато от 0 до 0,02; 0,04; 0,06; 0,08 и 0,1 мкМ.
Антикоагулированную кровь, смешанную с активирующим тромбоциты реагентом, вводят в капилляр 101 из микрочипа 1. Смесь проходит через капилляр 101 и достигает разделяющей канал секции 102, имеющей склеивающую тромбоциты поверхность, такую как коллаген или стекло.
Отслеживая активацию тромбоцитов (адгезию, агрегацию и т.п.) в разделяющей канал секции 102 и окклюзию капилляра, вызванную путем использования таким образом камеры 111, можно тестировать функцию тромбоцитов. В качестве альтернативы, более точное количественное тестирование функции тромбоцитов можно выполнять путем измерения давления в канале с помощью датчика давления, соединенного с насосом 109 для закачки жидкости. Кроме того, тестирование функции тромбоцитов также можно выполнять путем измерения временного отрезка, необходимого смеси, состоящей из крови и активирующего тромбоциты реагента, для прохождения через капилляр 101, или путем измерения количества смеси, прошедшей через капилляр 101.
Камера 111 соединена с анализатором 114 изображения, что дает возможность получать изображения и т.п. состояния активации тромбоцитов. Комбинация визуальной оценки, получаемой с помощью изображения активации тромбоцитов в капилляре, и количественного тестирования активации тромбоцитов, основанного на увеличении давления, очень важна для получения полного представления о состоянии крови пациента. Например, в случаях, когда тромбоциты уже активированы in vivo, но происходит значительное их потребление и уменьшение количества во время болезни, такой как DIC, происходит задержка увеличения давления и окклюзии. Даже в таких случаях получение изображения внутренней части с помощью камеры позволяет подтвердить увеличенную адгезию и агрегацию и т.п. тромбоцитов на склеивающей тромбоциты поверхности сразу после начала тестирования, так что можно получить полное представление о состоянии крови пациента.
Камера 111 может двигаться вдоль направления кровотока в капилляре 101.
Тромбоциты можно анализировать также путем флуоресцентного мечения тромбоцитов хинокрином или т.п. В этом случае результаты мониторинга могут быть оцифрованы с помощью анализа изображений путем регистрации света, испускаемого в результате флюоресценции, на единичной площади, получая таким образом результаты мониторинга в виде данных.
Микрочип 1 помещают на нагреватель 115 в форме предметного столика, и путем нагревания микрочипа 1 до 37°C с помощью нагревателя 115 можно осуществлять мониторинг в условиях, аналогичных условиям внутри тела.
Смесь, содержащая кровь, которая прошла через разделяющую канал секцию 102, спокойно вытекает из выходного отверстия 105 в выходное отверстие трубки 112.
Магнитную вертушку подвергают антикоагуляционной обработке. Антикоагуляционная обработка может представлять собой покрытие поверхности магнитного материала гепарином, поливиниллактонамидом (PVLA), поли(2-метоксиэтилакрилатом) (PMEA) или т.п., путем пропитки магнитного материала в расплавленной смоле или путем формирования поверхности магнитной вертушки из этого полимера, получая продукт, как при формовании литьем под давлением.
Хотя вариант осуществления, в котором активирующий тромбоциты реагент и антикоагулированную кровь смешивают вместе в резервуаре, находящемся за пределами микрочипа, с последующим введением в капилляр микрочипа, объяснен выше в виде примера, устройство для тестирования функции тромбоцитов по настоящему изобретению не ограничено вышеописанным вариантом осуществления.
Например, также возможна конструкция устройства, в котором секция для смешивания антикоагулированной крови и активирующего тромбоциты реагента находится в микрочипе, и кровь и активирующий тромбоциты реагент смешивают вместе в микрочипе, после чего из секции для смешивания смесь может поступать в капилляр.
ПРИМЕРЫ
Ниже более подробно описано настоящее изобретение с помощью конкретных Примеров, которые не ограничивают настоящее изобретение.
[Подготовка микрочипа и устройства для тестирования функции тромбоцитов]
Были подготовлены две прозрачные подложки, т.е. первая подложка 100, показанная на фиг.1(A), и вторая подложка 110, показанная на фиг.1(B) (продукты, выполненные формованием под давлением, Richell Corporation). Сторону первой подложки 100, на которой открывается углубление, соответствующее капилляру 101, и сторону второй подложки 110, имеющую склеивающую тромбоциты поверхность 106, соединяют вместе таким образом, чтобы они были обращены друг к другу, с помощью силанового адгезива и термокомпрессии при 60°C в течение 16 часов для получения микрочипа 1, показанного на фиг.1(C). На первой подложке 100 длина, глубина и ширина канала (капилляра) 101 составляют 20 мм, 50 мкм и 2 мм соответственно. Что касается разделяющей канал секции 102, то разделяющие стенки 103, каждая из которых имеет длину 2 мм, ширину 25 мкм и высоту 50 мкм, размещены через равные 25 мкм интервалы, и эта часть используется в качестве разделяющей канал секции 102. На второй подложке 110 каждое из отверстий, соответствующее входному отверстию 104 и выходному отверстию 105, является сквозным отверстием с круглым поперечным сечением и внутренним диаметром 2 мм и глубиной 2 мм. На то место второй подложки 110, которое перекрывается разделяющей канал секцией 102 первой подложки 100, наносят коллаген I типа в количестве 3 мг/мл (производство Nitta Gelatin Inc.) и сушат под вакуумом для получения склеивающей тромбоциты поверхности 106.
Как показано на фиг.2, готовый микрочип 1 помещают на нагреватель в форме предметного столика 115, и резервуар 107 соединяют со входным отверстием 104 микрочипа 1. Насос 109 соединяют с резервуаром 107 через трубку, и давление, возникающее в насосе, измеряют с помощью датчика давления, который не показан. В резервуаре 107 находится цилиндрическая магнитная вертушка 108 диаметром 2 мм и длиной 5 мм, которая получена путем покрытия железного цилиндра PMEA, магнитную вертушку 108 устанавливают таким образом, чтобы она могла вращаться со скоростью 60-180 об/мин при приложении магнитной силы мешалки 113, находящейся под нагревателем 115, нагреваемым до 37°C. Выходной патрубок 112 соединяют с выходным отверстием таким образом, чтобы можно было сливать кровь после анализа. Камеру 111, с которой соединен анализатор 114 изображений, располагают выше разделяющей канал секции 102 микрочипа 1, таким образом позволяя проводить наблюдение за состоянием активации тромбоцитов в разделяющей канал секции 102.
Пример 1
С помощью микрочипа 1 и системы тестирования тромбоцитов, показанной на фиг.2, было проведено измерение. У субъекта A брали кровь, которая было подвергнута антикоагуляционной обработке лимонной кислотой.
Цельную кровь, подвергнутую антикоагуляционной обработке лимонной кислотой, наливали в резервуар 107, и из входного отверстия вводили в резервуар 107 физиологический раствор с помощью подсоединенного насоса 109, таким образом вытесняя кровь из резервуара 107 и позволяя ей течь в микрочип 1. В резервуаре 107 находилась магнитная вертушка 108, которая перемешивала кровь.
В течение первых 10 секунд скорость потока насоса 109 составляла 100 мкл/мин, а затем - 3 мкл/мин.
Изменение давления в насосе 109 показано на фиг.5.
Пример 2
Эксперимент выполняли таким же образом, как и в Примере 1, за исключением того, что вместо 3 мкл/мин скорость потока составляла 6 мкл/мин.
(Использовали образец крови того же субъекта А, что и в Примере 1.) Изменение давления в насосе 109 показано на фиг.6.
Обсуждение
При увеличении скорости потока с 3 мкл/мин до 6 мкл/мин при использовании одного и того же образца увеличивался гемодинамический удар, и было подтверждено увеличение давления.
Пример 3
Эксперимент выполняли таким же образом, как в Примере 2, за исключением того, что вместо физиологического раствора с помощью насоса 109 вводили 0,5 мкМ раствор ADP. (Использовали образец крови того же субъекта А, что и в Примере.) Изменение давления в насосе 109 показано на фиг.7.
Примеры 4-6
Эксперименты в Примерах 1-3 выполняли путем измерения образцов, полученных от другого субъекта (субъект B). Изменение давления в насосе 109 показано на фиг.8, 9 и 10 соответственно.
Сравнительный эксперимент
Кровь, полученную от субъектов A и В, центрифугировали при 800 об/мин для получения обогащенной тромбоцитами плазмы, и измеряли агрегируемость тромбоцитов, индуцированную ADP, используя агрегометр (РА-20, Kowa Company, Ltd.). Количество больших агрегатов, индуцированных 1 мкМ ADP в крови пациента A, составляло примерно половину от количества больших агрегатов в крови субъекта В.
Обсуждение
На основе результатов, полученных для субъектов A и B, было подтверждено, что увеличение давления в результате адгезии и агрегации на коллагене в условиях гемодинамического удара было более слабым у субъекта А по сравнению с субъектом B. Однако у субъекта A агрегируемость была сильнее благодаря ADP, и было подтверждено, что увеличение давления в результате адгезии и агрегации на коллагене после введения ADP было эквивалентным давлению у субъекта B.
Пример 7
Эксперимент выполняли с использованием микрочипа 1 и системы А Примера 1 для постановки диагноза с помощью изображений. Насос 109 заполняли минеральным маслом, а резервуар 107 заполняли кровью, антикоагулированной лимонной кислотой. Минеральное масло направляли в резервуар 107 с помощью насоса 109 со скоростью потока 8 мкл/мин, давая возможность крови поступать в микрочип 1. Такие же эксперименты выполняли, используя кровь, обработанную добавлением ADP к крови, обработанной лимонной кислотой, до получения конечной концентрации 0,025 мкМ, 0,05 мкМ и 0,1 мкМ соответственно. На каждой панели на фиг.11 показано полученное камерой 111 изображение внутреннего состояния микрочипа 1 через 1 минуту после начала эксперимента.
Обсуждение
При добавлении ADP наблюдалось зависимое от концентрации ADP увеличение количества тромбоцитов, прикрепленных к части гребенки, и имелась возможность визуально подтвердить прикрепление тромбоцитов даже тогда, когда не происходило увеличение давления.
[Подготовка микрочипа и устройства для тестирования функции тромбоцитов]
Первую подложку 200, показанную на фиг.3А, и вторую подложку 210, показанную на фиг.3B, накладывали друг на друга и соединяли, получая микрочип 2, показанный на фиг.3C. Что касается подложки 200, то использовали подложку, изготовленную из PDMS (Fluidware), с глубиной всех каналов 120 мкм; шириной 1 мм; длиной гребенки 1 мм; шириной гребенки 50 мкм; шириной углубления 50 мкм. Что касается подложки 210, то использовали предметное стекло, и были проделаны сквозные отверстия, соответствующие входному и выходному отверстиям, как на подложке 110, но, в отличие от подложки 110, не наслаивали коллаген, поскольку в качестве склеивающей тромбоциты поверхности работало стекло. Таким образом, вся длина второй стороны подложки в капилляре 201 служила в качестве склеивающей тромбоциты поверхности 206.
Устройство В для тестирования функции тромбоцитов, показанное на фиг.4, было таким же, как и устройство А для тестирования функции тромбоцитов, показанное на фиг.2, за исключением того, что вместо микрочипа 1 использовали микрочип 2, у которого отсутствовала магнитная вертушка и мешалка. Поскольку в приведенных ниже примерах антикоагулированную кровь, предварительно смешанную с ADP, помещали в резервуар, то в магнитной вертушке и мешалке не было необходимости.
Пример 8
Использовали микрочип 2, показанный на фиг.3, и устройство В для тестирования функции тромбоцитов, показанное на фиг. 4. Примерно 600 мкл крови, антикоагулированной лимонной кислотой, наливали в резервуар 207 для крови. Насос 209 заполняли минеральным маслом и соединяли с резервуаром 207, верхний конец которого соединяли со входным отверстием 204 микрочипа 2. Минеральное масло вводили из насоса 209 в микрочип 2 со скоростью потока 20 мкл/мин, и давление притока минерального масла измеряли датчиком давления, который не показан.
Пример 9
Изменение давления измеряли в эксперименте, который был аналогичным эксперименту в Примере 8, за исключением того, что в резервуар 207 дополнительно к крови, антикоагулированной лимонной кислотой, добавляли ADP (производство Wako Pure Chemical Industries, Ltd.) с финальной концентрацией 2 нМ.
Пример 10
Изменение давления измеряли в таком же эксперименте, что и в Примере 9, за исключением того, что использовали кровь, которую отбирали через 3 часа после введения 75 мг дозы клопидогреля (Sanofi-aventis).
Изменение давления в насосе 209 в Примерах 8-10 показано на фиг.12. Добавление очень небольшого количества ADP приводило к увеличению давления, которое подавляли введением клопидогреля.
[Подготовка микрочипа и устройства для тестирования функции тромбоцитов]
Были подготовлены две прозрачные подложки, т.е. первая подложка 100, показанная на фиг.1(A), и вторая подложка 110, показанная на фиг.1(B) (продукты, полученные литьевым формованием, производство Richell Corporation). Сторону первой подложки 100, на которую открывается углубление, соответствующее капилляру 101, и сторону второй подложки 110, имеющую склеивающую тромбоциты поверхность 106, соединяли вместе термокомпрессией таким образом, чтобы они были обращены друг к другу, используя силановый адгезив, получая при этом микрочип 1, показанный на фиг.1(C). В первой подложке 100 длина, глубина и ширина канала (капилляра) 101 составляли 20 мм, 50 мкм и 2 мм соответственно. Что касается разделяющей канал секции 102, разделяющие стенки 103, каждая из которых имела длину 1,5 мм, ширину 50 мкм и высоту 50 мкм, были размещены через равные интервалы 50 мкм, и эта часть использовалась в качестве разделяющей канал секции. Во второй подложке каждое из отверстий, соответствующих входному отверстию и выходному отверстию, представляло собой сквозное отверстие, имеющее круглое поперечное сечение и внутренний диаметр 2 мм и глубину 2 мм. На то место второй подложки 110, которое перекрывается разделяющей канал секцией 102 первой подложки 100, наносили примерно 10 мкл 3 мг/мл коллагена типа I (производство Nitta Gelatin Inc.) и сушили под вакуумом для получения склеивающей тромбоциты поверхности 106. Область, на которую наносили коллаген, находилась на 4 мм выше и на 2 мм ниже положения гребенки, включая саму гребенку.
Как показано на фиг.4, готовый микрочип 1 помещали на нагреватель 215, и к микрочипу 1 подсоединяли насос 209 и резервуар 207, как описано в Примере 8.
Пример 11
(a) У субъекта D брали кровь, используя катетер для забора крови с гирудином (Multiplate Services GmbH), и примерно 600 мкл крови, антикоагулированной гирудином, наливали в резервуар 207, насос 209 заполняли минеральным маслом и соединяли с резервуаром 207, верхний конец которого соединяли со входным отверстием 104 микрочипа 1. Минеральное масло накачивали из насоса 209 в резервуар со скоростью потока 200 мкл/мин в течение первых 5 секунд, а затем со скоростью 20 мкл/мин, таким образом вводя кровь в резервуар микрочипа 1 с такой же скоростью потока, при этом измеряли давление притока минерального масла с помощью датчика давления, который не показан.
(b) Эксперимент выполняли таким же образом, как в пункте (a), за исключением того, что минеральное масло вводили в резервуар со скоростью потока 200 мкл/мин в течение первых 5 секунд, а затем со скоростью 10 мкл/мин, таким образом вводя кровь в резервуар микрочипа 1 с такой же скоростью, при этом измеряли давление притока минерального масла.
(c) Эксперимент выполняли таким же образом, как в пункте (a), за исключением того, что минеральное масло вводили в резервуар со скоростью 200 мкл/мин в течение первых 5 секунд, а затем со скоростью 5 мкл/мин, таким образом вводя кровь в резервуар микрочипа 1 с такой же скоростью, при этом измеряли давление притока минерального масла.
Результаты Примера 11(a), (b) и (c) показаны на фиг.14(A). На оси абсцисс указано время, а на оси ординат указано увеличение давления в чипе в результате окклюзии. У субъекта D давление увеличивалось в порядке указанных примеров (a), (b) и (c), т.е. согласно уменьшению гемодинамического удара.
Пример 12
Такой же эксперимент, как в Примере 11, выполняли для субъекта E, результаты показаны на фиг.14(B).
Пример 13
Такой же эксперимент, как в Примере 11, выполняли для субъекта F, результаты показаны на фиг.14(С).
Референсный пример
Агрегируемость тромбоцитов измеряли у субъектов D, E и F, используя агрегометр на цельной крови Multiplate (Dynabyte). Кровь собирали, используя катетер для забора крови с гирудином, измеряли агрегируемость, индуцированную 6 мкМ ADP. Результаты были следующими: D - 691 МЕ/мин; Е - 525 МЕ/мин; и F - 652 МЕ/мин. ADP-индуцированная агрегируемость была наиболее сильной у субъекта D, затем у субъекта F и E в данном порядке.
Обсуждение
У всех субъектов D, E и F происходило увеличение давления сначала в условиях высокого гемодинамического удара, затем среднего и слабого гемодинамического удара в данном порядке. Кроме того, сначала давление увеличилось у субъекта D, затем у субъектов F и E в данном порядке, и этот результат коррелирует с результатом теста ADP-индуцированной агрегируемости, который был выполнен с помощью Multiplate.
Эксперимент проводили таким же образом, что и в Примере 11(a) за исключением того, что кровь брали, используя катетер для забора крови с лимонной кислотой, и получали антикоагулированную кровь, используя цитрат натрия. В этом случае увеличение давления не наблюдалось даже спустя 10 минут.
Пример 14
Примерно 600 мкл крови субъекта E, антикоагулированной лимонной кислотой, смешивали с 6 мкл 100 мМ ADP (Chrono-log Corporation), и затем ее сразу вводили в резервуар. Насос, заполненный минеральным маслом, соединяли с резервуаром, который затем соединяли с микрочипом, как в Примере 11(a). Микрочип 1 помещали на нагреватель, и давали возможность крови течь со скоростью потока 200 мкл/мин в течение первых 5 секунд, а затем со скоростью 20 мкл/мин.
Пример 15
a) Эксперимент выполняли таким же образом, как в Примере 14, за исключением того, что использовали кровь субъекта D, b) эксперимент выполняли таким же образом, как в Примере 14, за исключением того, что использовали кровь субъекта D через 6 часов после введения 100 мг клопидогреля.
Результаты Примеров 15 и 14 показаны на Фиг.15. На Фиг.5A показаны результаты Примера 15(a); на фиг.5В показаны результаты Примера 15(b); и на фиг.5С показаны результаты Примера 14. Можно отметить, что у субъекта D увеличение давления происходило с задержкой из-за введения клопидогреля и что после введения клопидогреля давление крови увеличивалось даже медленнее, чем у субъекта E.
Пример 16
a) Примерно 600 мкл крови субъекта G, антикоагулированной лимонной кислотой, смешивали с 6 мкл 50 мМ арахидоновой кислоты (Chrono-log Corporation), и сразу после этого наливали кровь в резервуар. Насос, заполненный минеральным маслом, соединяли с резервуаром, который затем соединяли с микрочипом, как в Примере 11(a). Микрочип 1 помещали на нагреватель, и давали возможность крови течь со скоростью потока 200 мкл/мин в течение первых 5 секунд, а затем со скоростью 20 мкл/мин.
b) Примерно 600 мкл крови субъекта G, антикоагулированной лимонной кислотой, смешивали с 6 мкл 50 мМ арахидоновой кислоты (Chrono-log Corporation), и сразу после этого наливали эту кровь в резервуар. Насос, заполненный минеральным маслом, соединяли с резервуаром, который соединяли с микрочипом, как в Примере 11(a). Микрочип 1 помещали на нагреватель, и давали возможность крови течь со скоростью потока 200 мкл/мин в течение первых 5 секунд, а затем со скоростью 10 мкл/мин.
c) Примерно 600 мкл крови субъекта G, антикоагулированной лимонной кислотой, смешивали с 6 мкл 50 мМ арахидоновой кислоты (Chrono-log Corporation), и сразу после этого наливали кровь в резервуар. Насос, заполненный минеральным маслом, соединяли с резервуаром, который затем соединяли с микрочипом, как в Примере 11(a). Микрочип 1 помещали на нагреватель, и давали возможность крови течь со скоростью потока 200 мкл/мин в течение первых 5 секунд, а затем со скоростью 5 мкл/мин.
d) Примерно 600 мкл крови субъекта G, антикоагулированной лимонной кислотой, смешивали с 6 мкл 100 мкг/мл коллагена (Chrono-log Corporation), и сразу после этого наливали кровь в резервуар. Насос, заполненный минеральным маслом, соединяли с резервуаром, который затем соединяли с микрочипом, как в Примере 11(a). Микрочип 1 помещали на нагреватель, и давали возможность крови течь со скоростью потока 200 мкл/мин в течение первых 5 секунд, а затем со скоростью 20 мкл/мин.
е) Примерно 600 мкл крови пациента G, антикоагулированной лимонной кислотой, смешивали с 6 мкл 100 мкг/мл коллагена (Chrono-log Corporation), и сразу после наливали кровь в резервуар. Насос, заполненный минеральным маслом, соединяли с резервуаром, который затем соединяли с микрочипом, как в Примере 11(a). Микрочип 1 помещали на нагреватель, и давали возможность крови течь со скоростью потока 200 мкл/мин в течение первых 5 секунд, а затем со скоростью 10 мкл/мин.
Примерно 600 мкл крови пациента G, антикоагулированной лимонной кислотой, смешивали с 6 мкл 100 мкг/мл коллагена (Chrono-log Corporation), и сразу после этого наливали кровь в резервуар. Насос, заполненный минеральным маслом, соединяли с резервуаром, который затем соединяли с микрочипом, как в Примере 11(a). Микрочип 1 помещали на нагреватель, и давали возможность крови течь со скоростью потока 200 мкл/мин в течение первых 5 секунд, а затем со скоростью 5 мкл/мин.
Пример 17
Эксперименты а-f Примера 16 выполняли для субъекта G через 6 часов после введения 100 мг дозы аспирина.
Пример 18
Используя кровь субъекта G, собранную через 6 часов после введения 100 мг дозы аспирина, эксперименты проводили таким же образом, как в Примерах 16 d-f, за исключением того, что количество добавленного коллагена было увеличено до 12 мкл или 18 мкл.
Результаты примеров 16-18 приведены на фиг.16-21.
Из этих результатов видно, что антитромбоцитарный эффект аспирина может быть проанализирован путем добавления арахидоновой кислоты или коллагена в кровь, обработанную лимонной кислотой, и предоставления возможности полученной смеси течь в микрочип, при этом измеряя увеличение давления. Далее, как показано на фиг.19, давление крови, собранной после введения дозы аспирина, также может быть увеличено путем увеличения количества добавленного коллагена. Следовательно, было выявлено, что способ по настоящему изобретению позволяет оценить не только наличие/отсутствие влияния аспирина, но также и степень подавления функции тромбоцитов.
Таким образом, путем комбинационного диагноза, основанного на визуальном подтверждении агрегатов активированных тромбоцитов благодаря возможности получения изображений и на увеличении давления, можно более детально оценить состояние тромбоцитов у субъекта.
Пример 19
Эксперимент выполняли таким же образом, как в Примере 11(a), за исключением того, что использовали кровь субъекта H.
Пример 20
Эксперимент выполняли таким же образом, как в Примере 19, за исключением того, что минеральное масло вводили из насоса 209 в резервуар со скоростью потока 200 мкл/мин в течение первых 5 секунд, а затем со скоростью 7 мкл/мин, таким образом вводя кровь в резервуар микрочипа 1 с такой же скоростью потока, измеряя при этом давление притока минерального масла.
Пример 21
Измерение выполняли таким же образом, как в Примере 19 и Примере 20, за исключением того, что в кровь, антикоагулированную гирудином, добавляли 0,4 мкг/мл и 0,8 мкг/мл соответственно ReoPro (Eli lilly), который представляет собой антитело к рецептору GPIIb/IIIa на мембране тромбоцита.
Пример 22
Измерение выполняли таким же способом, как в Примере 19 и Примере 20, за исключением того, что в кровь, антикоагулированную гирудином, добавляли 0,01 мкг/мл и 0,1 мкг/мл соответственно OS-1 (Biochemistry, 2008 Apr 22; 47(16):4674-82), который является ингибитором рецептора GPIb на мембране тромбоцитов.
Результаты Примеров 19,20 и 21 показаны на фиг.22 и 23.
На фиг.22 показан эффект ингибирования ReoPro при скорости потока 20 мкл/мин, а на фиг.23 показан эффект ингибирования ReoPro при скорости потока 7 мкл/мин.
Результаты Примера 22 показаны на фиг.24 и 25.
На фиг.24 показан эффект ингибирования OS-1 при скорости потока 20 мкл/мин, а на фиг.25 показан эффект ингибирования OS-1 при скорости потока 7 мкл/мин.
Обсуждение
GPIIb/IIIa связывается главным образом с фибриногеном и участвует в агрегации тромбоцитов, а GPIb представляет собой рецептор, который связывается с vWF и участвует в адгезии тромбоцитов при высоком гемодинамическом ударе.
OS-1, который подавляет адгезию тромбоцитов, показал сильное антитромбоцитарное действие при высоком гемодинамическом ударе, в то время как ReoPro наоборот показал сильное антитромбоцитарное действие при низком гемодинамическом ударе.
ОПИСАНИЕ СИМВОЛОВ
A, B: устройство наблюдения за тромбоцитами; 1, 2, 3: микрочип; 100, 200, 300: первая подложка; 101, 201, 301: капилляр; 102, 202, 302: разделяющая канал секция; 103, 203, 303: разделяющие канал стенки; 104, 204, 304: входное отверстие; 105, 205: выходное отверстие; 106, 206, 306: склеивающая тромбоциты поверхность; 107, 207: резервуар; 108: магнитная вертушка; 109, 209: насос; 110, 210: вторая подложка; 111, 211: камера; 112, 212: выходная трубка; 113: мешалка; 114, 214: анализатор изображения; 115, 215: нагреватель; 305: воздушное отверстие; 307: секция для хранения отработанной жидкости; 308: абсорбирующий кровь материал.
Реферат
Группа изобретений относится к медицине, а именно к лабораторной диагностике, и может быть использована для тестирования функции тромбоцитов. Для этого предоставляют возможность антикоагулированной крови проходить через капилляр, имеющий склеивающую тромбоциты поверхность, и наблюдают или измеряют поведение крови в капилляре для оценки функции тромбоцитов. При этом часть внутренней части указанного капилляра имеет секцию, содержащую стенки, которые проходят по направлению кровотока в капилляре и делят ширину капилляра на пять и более каналов, где ширина каждого канала в указанной секции составляет не более 200 мкм. При этом антикоагулированная кровь проходит обработку для слабой активации тромбоцитов путем смешивания ее с активирующим тромбоциты реагентом в количестве, при котором не происходит необратимая агрегация тромбоцитов. Активирующий тромбоциты реагент представляет собой аденозиндифосфат в конечной концентрации от 0,001 до 5 мкМ или арахидоновую кислоту в конечной концентрации от 0,001 до 1 мМ. Также предложено устройство для тестирования функции тромбоцитов. Группа изобретений обеспечивает точную диагностику тромбоцитов при использовании небольшого количества крови. 2 н. и 15 з.п. ф-лы, 25 ил., 22 пр.

Комментарии