Продуцирование сконструированных клеток для адоптивной клеточной терапии - RU2780156C2
Код документа: RU2780156C2
Чертежи


Описание
Перекрестная ссылка на родственные заявки
[0001] По настоящей заявке испрашивается приоритет временной заявки на патент США No. 62/430349, поданной 5 декабря 2016 и озаглавленной «Продуцирование сконструированных клеток для адоптивной клеточной терапии», содержание которой включено в настоящее описание в полном объеме посредством ссылки.
Включение списка последовательностей посредством ссылки
[0002] Содержание нижеследующего, представленного в текстовом файле ASCII, включено в настоящее описание в полном объеме посредством ссылки, а именно, в виде списка последовательностей в компьютерном формате (CRF) (имя файла 735042005040SeqList.txt, дата создания: 28 ноября 2017, размер: 50233 байтов).
Область изобретения
[0003] Настоящее изобретение относится к способам генетического конструирования клеток, включая клетки для их применения в комбинации с адоптивной клеточной терапией. В некоторых вариантах осуществления изобретения, описанные способы включают трансдукцию клеток путем инкубирования с частицей ретровирусного вектора, например, с лентивирусным вектором, где, до инкубирования, клетки не были инкубированы с активирующим или стимулирующим агентом, например, они не были инкубированы с анти-CD3/анти-CD28 антителами и/или с одним или более рекомбинантными цитокинами. В некоторых вариантах осуществления изобретения, такие способы сообщают признаки, ассоциированные с сокращением или усовершенствованием процедуры генетического конструирования клеток. Настоящее изобретение также относится к полученным клеткам, которые были трансдуцированы рекомбинантным или гетерологичным геном, таким как ген, кодирующий химерный рецептор, такой как химерный антигенный рецептор, или другой рекомбинантный антигенный рецептор, такой как трансгенный T-клеточный рецептор, и к их композициям. В некоторых вариантах осуществления изобретения, описанные клетки и композиции могут быть использованы в способах адоптивной иммунотерапии.
Уровень техники
[0004] Существуют различные стратегии трансдукции Т-клеточных популяций in vitro, включая трансдукцию антигенспецифических T-клеток in vitro для их применения в адоптивной клеточной иммунотерапии или в противораковой терапии. Для трансдукции клеточных популяций in vitro, включая их применения в исследованиях, в диагностике и в терапии, необходимо разработать усовершенствованные стратегии. Настоящее изобретение относится к реагентам, способам, промышленным изделиям и наборам, которые удовлетворяют таким требованиям.
Сущность
[0005] Настоящее изобретение относится к способу трансдукции T-клеток, включающему инкубацию частицы вирусного вектора, содержащей рекомбинантную нуклеиновую кислоту, и исходной композиции, содержащей множество T-клеток, где указанное множество T-клеток было получено из образца, содержащего клетки, взятые у индивидуума, где инкубирование начинают не более, чем через 24 часа после взятия образца у индивидуума; и/или где до инкубации, T-клетки не были доведены до температуры более чем, или более, чем приблизительно 15°C, приблизительно 18°C, приблизительно 22°C или приблизительно 25°C в течение более, чем 1 часа, 2 часов, 4 часов, 6 часов, 8 часов, 12 часов или 24 часов после взятия образца у индивидуума; и/или до инкубации, T-клетки не доводили до температуры, равной, составляющей приблизительно, более, чем или приблизительно более, чем 37°C ± 2,0°C в течение периода времени более, чем 15 минут, 30 минут, 1 часа или 2 часов после взятия образца у индивидуума. В некоторых вариантах осуществления изобретения, инкубацию начинают не более, чем или не более, чем приблизительно через 1 час, 3 часа, 6 часов, 12 часов или 18 часов после взятия образца у индивидуума.
[0006] В некоторых из любых таких вариантов осуществления изобретения, перед указанной инкубацией, способ не включает стимуляцию T-клеток в условиях, стимулирующих активацию клеток. В некоторых из любых таких вариантов осуществления изобретения, перед указанной инкубацией, исходная композиция не была подвергнута стимуляции ex vivo, включая инкубацию при температуре более, чем или приблизительно более, чем 37°С ± 2,0°C и/или инкубацию в присутствии агента или агентов, способных активировать T-клетки, CD4+-T-клетки и/или CD8+-T-клетки, инкубацию в присутствии агента или агентов, способных индуцировать сигнал посредством комплекса TCR и/или инкубацию в присутствии агента или агентов, способных индуцировать пролиферацию T-клеток, CD4+-T-клеток и/или CD8+-T-клеток; CD3-связывающих молекул; CD28-связывающих молекул; рекомбинантного IL-2; рекомбинантного IL-15; и рекомбинантного IL-7.
[0007] В некоторых из любых таких вариантов осуществления изобретения, до указанной инкубации, не более, чем 5%, 10%, 20%, 30% или 40% T-клеток, представляющие собой активированные клетки, экспрессируют поверхностный маркер, выбранный из группы, состоящей из HLA-DR, CD25, CD69, CD71, CD40L и 4-1BB; включают экспрессируемый внутриклеточный цитокин, выбранный из группы, состоящей из IL-2, IFN-гамма, TNF-альфа; присутствуют в фазе G1 или в более поздней фазе клеточного цикла и/или способны пролиферироваться.
[0008] В некоторых из любых таких вариантов осуществления изобретения, способ включает инкубацию частицы вирусного вектора, содержащей рекомбинантную нуклеиновую кислоту, и исходной композиции, содержащей T-клетки, где указанные T-клетки были получены из образца, взятого у индивидуума, где перед указанной инкубацией, T-клетки или исходная композиция не были подвергнуты стимуляции ex vivo, включая инкубацию при температуре более, чем или приблизительно более, чем 37°С ± 2,0°C и/или инкубацию в присутствии агента или агентов, способных активировать T-клетки, CD4+-T-клетки и/или CD8+-T-клетки, инкубацию в присутствии агента или агентов, способных индуцировать сигнал посредством комплекса TCR и/или инкубацию в присутствии агента или агентов, способных индуцировать пролиферацию T-клеток, CD4+-T-клеток и/или CD8+-T-клеток; CD3-связывающих молекул; CD28-связывающих молекул; рекомбинантного IL-2; рекомбинантного IL-15; и рекомбинантного IL-7.
[0009] В некоторых из любых таких вариантов осуществления изобретения, один или более агентов содержат анти-CD3 антитело и/или анти-CD28 антитело.
[0010] Настоящее изобретение также относится к способу трансдукции T-клеток, включающему инкубацию частицы вирусного вектора, содержащей рекомбинантную нуклеиновую кислоту, и исходной композиции, содержащей T-клетки, где указанные T-клетки были получены из образца, взятого у индивидуума, где до указанной инкубации, не более, чем 5%, 10%, 20%, 30% или 40% T-клеток, представляющих собой активированные клетки, экспрессируют поверхностный маркер, выбранный из группы, состоящей из HLA-DR, CD25, CD69, CD71, CD40L и 4-1BB; включают экспрессируемый внутриклеточный цитокин, выбранный из группы, состоящей из IL-2, IFN-гамма, TNF-альфа; и/или присутствуют в фазе G1 или в более поздней фазе клеточного цикла.
[0011] В некоторых из любых таких вариантов осуществления изобретения, непосредственно до инкубации, не более, чем 10% T-клеток в исходной композиции содержат маркер автивации T-клеток, выбранный из группы, состоящей из HLA-DR, CD25, CD69, CD71, CD40L и 4-1BB. В некоторых из любых таких вариантов осуществления изобретения, до указанной инкубации, более, чем 5%, 10%, 20%, 30% или 40% T-клеток экспрессируют рецептор липида низкой плотности (LDL-R).
[0012] В некоторых из любых таких вариантов осуществления изобретения, индивидуумом является человек.
[0013] В некоторых из любых таких вариантов осуществления изобретения, T-клетки не доводили до температуры от 2°C до 8°C и/или не поддерживали при этой температуре за более, чем 48 часов до инкубации.
[0014] В некоторых из любых таких вариантов осуществления изобретения, образцом является проба крови. В некоторых из любых таких вариантов осуществления изобретения, образцом является образец, взятый после лейкафереза.
[0015] В некоторых из любых таких вариантов осуществления изобретения, T-клетки представляют собой нефракционированные T-клетки, обогащенные или выделенные CD3+-T-клетки, обогащенные или выделенные CD4+-T-клетки или обогащенные или выделенные CD8+-T-клетки. В некоторых из любых таких вариантов осуществления изобретения, T-клетки были отобраны или обогащены из образца, взятого у индивидуума, и в некоторых аспектах изобретения, эти клетки продуцируют обогащенную композицию и/или исходную композицию.
[0016] В некоторых из любых таких вариантов осуществления изобретения, способ также включает, до инкубации, взятие образца у индивидуума и, необязательно, отбор или обогащение T-клеток из образца, где эти клетки, в некоторых аспектах изобретения, продуцируют обогащенную композицию и/или исходную композицию. В некоторых случаях, процент T-клеток в исходной композиции составляет более, чем или приблизительно более, чем 75%, 80%, 85%, 90%, 95% T-клеток.
[0017] В некоторых из любых таких вариантов осуществления изобретения, T-клетки содержат CD4+- или CD8+-клетки. В некоторых вариантах осуществления изобретения, T-клетки содержат CD4+- и CD8+-клетки. В некоторых случаях, отношение CD4+-клеток к CD8+-клеткам составляет или приблизительно составляет 1:1, 1:2, 2:1, 1:3 или 3:1.
[0018] В некоторых из любых таких вариантов осуществления изобретения, образец содержит сыворотку или плазму в концентрации по меньшей мере или по меньшей мере приблизительно 10% (об/об), по меньшей мере или по меньшей мере приблизительно 15% (об/об), по меньшей мере или по меньшей мере приблизительно 20% (об/об), по меньшей мере или по меньшей мере приблизительно 25% (об/об), по меньшей мере или по меньшей мере приблизительно 30% (об/об), по меньшей мере или по меньшей мере приблизительно 33% (об/об), по меньшей мере или по меньшей мере приблизительно 35% (об/об) или по меньшей мере или по меньшей мере приблизительно 40% (об/об); и/или, до инкубации, образец подвергают контактированию ex vivo с сывороткой или плазмой в концентрации по меньшей мере или по меньшей мере приблизительно 10% (об/об), по меньшей мере или по меньшей мере приблизительно 15% (об/об), по меньшей мере или по меньшей мере приблизительно 20% (об/об), по меньшей мере или по меньшей мере приблизительно 25% (об/об), по меньшей мере или по меньшей мере приблизительно 30% (об/об), по меньшей мере или по меньшей мере приблизительно 33% (об/об), по меньшей мере или по меньшей мере приблизительно 35% (об/об), или по меньшей мере или по меньшей мере приблизительно 40% (об/об).
[0019] В некоторых из любых таких вариантов осуществления изобретения, образец содержит сыворотку или плазму в концентрации по меньшей мере или по меньшей мере приблизительно 30% (об/об); и/или, до инкубации, образец вводят в контакт ex vivo с сывороткой или плазмой в концентрации по меньшей мере или по меньшей мере приблизительно 30% (об/об). В некоторых вариантах осуществления изобретения, сыворотка или плазма является человеческой. В некоторых случаях, сыворотка или плазма является аутологичной для индивидуума.
[0020] В некоторых из любых таких вариантов осуществления изобретения, образец содержит антикоагулянт и/или антикоагулянт был добавлен к образцу до инкубации. В некоторых случаях, антикоагулянт содержит свободный ион цитрата.
[0021] В некоторых из любых таких вариантов осуществления изобретения, способ включает, до инкубации, криоконсервацию T-клеток, необязательно T-клеток образца или обогащенной композиции в присутствии криозащитного средства с получением криоконсервированной композиции. В некоторых аспектах изобретения, способ включает, до инкубации, промывку криоконсервированной композиции в условиях, способствующих снижению количества или удалению криозащитного средства и/или образованию исходной композиции.
[0022] В некоторых из любых таких вариантов осуществления изобретения, исходная композиция содержит N-ацетилцистеин (NAC); сыворотку, необязательно человеческую сыворотку; рекомбинантный интерлейкин-2 (IL-2), рекомбинантный интерлейкин-15 (IL-15), и/или рекомбинантный интерлейкин-7 (IL-7).
[0023] В некоторых из любых таких вариантов осуществления изобретения, исходная композиция содержит N-ацетилцистеин в концентрации от или приблизительно от 0,4 мг/мл до 4 мг/мл, от 0,8 мг/мл до 3,6 мг/мл или от 1,6 мг/мл до 2,4 мг/мл, включительно; или исходная композиция содержит N-ацетилцистеин в концентрации по меньшей мере или по меньшей мере приблизительно или приблизительно 0,4 мг/мл, 0,8 мг/мл, 1,2 мг/мл, 1,6 мг/мл, 2,0 мг/мл, 2,4 мг/мл, 2,8 мг/мл, 3,2 мг/мл, 3,6 мг/мл или 4,0 мг/мл. В некоторых из любых таких вариантов осуществления изобретения, исходная композиция содержит сыворотку, необязательно человеческую сыворотку, в концентрации от или приблизительно от 0,5% до 25% (об/об), от 1,0% до 10% (об/об) или от 2,5% до 5,0% (об/об), включительно; или исходная композиция содержит сыворотку, необязательно человеческую сыворотку в концентрации по меньшей мере или по меньшей мере приблизительно или приблизительно 0,5%, 1,%, 2,5%, 5% (об/об) или 10%.
[0024] В некоторых из любых таких вариантов осуществления изобретения, исходная композиция содержит рекомбинантный IL-2, необязательно рекомбинантный человеческий IL-2 в концентрации от или приблизительно от 10 ИЕ/мл до 500 ИЕ/мл, от 50 ИЕ/мл до 250 ИЕ/мл или от 100 ИЕ/мл до 200 ИЕ/мл, включительно; или в концентрации по меньшей мере или по меньшей мере приблизительно 10 ИЕ/мл, 50 ИЕ/мл, 100 ИЕ/мл, 200 ИЕ/мл, 300 ИЕ/мл, 400 ИЕ/мл или 500 ИЕ/мл; и/или исходная композиция содержит рекомбинантный IL-15, необязательно рекомбинантный человеческий IL-15, в концентрации от или приблизительно от 1 ИЕ/мл до 100 ИЕ/мл, от 2 ИЕ/мл до 50 ИЕ/мл или от 5 ИЕ/мл до 10 ИЕ/мл, включительно; или в концентрации по меньшей мере или по меньшей мере приблизительно 1 ИЕ/мл, 2 ИЕ/мл, 5 ИЕ/мл, 10 ИЕ/мл, 25 ИЕ/мл или 50 ИЕ/мл; и/или исходная композиция содержит рекомбинантный IL-7, необязательно, рекомбинантный человеческий IL-7, в концентрации от или приблизительно от 50 ИЕ/мл до 1500 ИЕ/мл, от 100 ИЕ/мл до 1000 ИЕ/мл, от 200 ИЕ/мл до 600 ИЕ/мл, включительно; или в концентрации по меньшей мере или по меньшей мере приблизительно 50 ИЕ/мл, 100 ИЕ/мл, 200 ИЕ/мл, 300 ИЕ/мл, 400 ИЕ/мл, 500 ИЕ/мл, 600 ИЕ/мл, 700 ИЕ/мл, 800 ИЕ/мл, 900 ИЕ/мл или 1000 ИЕ/мл.
[0025] В некоторых из любых таких вариантов осуществления изобретения, инкубация включает стадию центрифужной инокуляции частиц вирусного вектора исходной композицией. В некоторых случаях, центрифужная инокуляция включает вращение, во внутреннем отсеке центрифужной камеры, частиц вирусного вектора и исходной композиции, где вращение осуществляют при относительной центробежной силе, подаваемой на внутреннюю поверхность боковой стенки отсека, и составляющей от или приблизительно от 500 g до 2500 g, от 500 g до 2000 g, от 500 g до 1600 g, от 500 g до 1000 g, 600 g и 1600 g, от 600 g до 1000 g, от 1000 g до 2000 g или 1000 g и 1600 g включительно; или по меньшей мере или по меньшей мере приблизительно 600 g, 800 g, 1000 g, 1200 g, 1600 g или 2000 g.
[0026] В некоторых вариантах осуществления изобретения, центрифужную инокуляцию осуществляют в течение периода времени более, чем или приблизительно 5 минут, более, чем или приблизительно 10 минут, более, чем или приблизительно 15 минут, более, чем или приблизительно 20 минут, более, чем или приблизительно 30 минут, более, чем или приблизительно 45 минут, более, чем или приблизительно 60 минут, более, чем или приблизительно 90 минут, более, чем или приблизительно 120 минут; или от или приблизительно от 5 минут до 60 минут, от 10 минут до 60 минут, от 15 минут до 60 минут, от 15 минут до 45 минут, от 30 минут до 60 минут или от 45 минут до 60 минут, включительно.
[0027] В некоторых из любых таких вариантов осуществления изобретения, способ также включает контакт исходной композиции и/или частиц вирусного вектора с адъювантом для трансдукции. В некоторых случаях, контакт осуществляют до, во время или после центрифужной инокуляции частиц вирусного вектора с исходной композицией.
[0028] В некоторых из любых таких вариантов осуществления изобретения, по меньшей мере часть инкубации осуществляют при или приблизительно при 37°C ± 2°C. В некоторых аспектах изобретения, по меньшей мере часть инкубации осуществляют после центрифужной инокуляции. В некоторых случаях, по меньшей мере часть инкубации осуществляют в течение периода времени не более, чем или не более, чем приблизительно 2 часов, 4 часов, 12 часов, 18 часов, 24 часов, 30 часов, 36 часов, 48 часов, 60 часов или 72 часов. В некоторых вариантах осуществления изобретения, по меньшей мере часть инкубации осуществляют в течение или приблизительно в течение 24 часов. В некоторых из любых таких вариантов осуществления изобретения, весь период инкубации составляет не более, чем 12 часов, 24 часов, 36 часов, 48 часов или 72 часов.
[0029] В некоторых из любых таких вариантов осуществления изобретения, частицей вирусного вектора является частица лентивирусного вектора. В некоторых случаях, частица лентивирусного вектора происходит от ВИЧ-1. В некоторых из любых таких вариантов осуществления изобретения, частицу вирусного вектора псевдотипируют гликопротеином вирусной оболочки. В некоторых случаях, гликопротеином вирусной оболочки является VSV-G.
[0030] В некоторых из любых таких вариантов осуществления изобретения, частица вирусного вектора содержит лентивирусный белок, обладающий SAMHD1-ингибирующей активностью, где указанный белок упакован в вирусную частицу. В некоторых случаях, SAMHD1-ингибирующим белком является белок Vpx дикого типа, белок Vpr дикого типа или вариант или часть белка Vpx или Vpr дикого типа, обладающие SAMHD1-ингибирующей активностью. В некоторых случаях, SAMHD1-ингибирующий белок является гетерологичным частице ретровирусного вектора. В некоторых вариантах осуществления изобретения, SAMHD1-ингибирующим белком является белок Vpx дикого типа или вариант или часть белка Vpx дикого типа, обладающие SAMHD1-ингибирующей активностью.
[0031] В некоторых из любых таких вариантов осуществления изобретения, частицу вирусного вектора инкубируют при множественности инфицирования менее, чем или менее, чем приблизительно 20,0 или менее, чем или менее, чем приблизительно 10,0. В некоторых из любых таких вариантов осуществления изобретения, частицу вирусного вектора инкубируют при множественности инфицирования от или приблизительно от 1,0 ИЕ/клетку до 10 ИЕ/клетку или от 2,0 ед/клетку до 5,0 ИЕ/клетку; или частицу вирусного вектора инкубируют при множественности инфицирования по меньшей мере или по меньшей мере приблизительно 1,6 ИЕ/клетку, 1,8 ИЕ/клетку, 2,0 ИЕ/клетку, 2,4 ИЕ/клетку, 2,8 ИЕ/клетку, 3,2 ИЕ/клетку или 3,6 ИЕ/клетку, 4,0 ИЕ/клетку, 5,0 ИЕ/клетку, 6,0 ИЕ/клетку, 7,0 ИЕ/клетку, 8,0 ИЕ/клетку, 9,0 ИЕ/клетку или 10,0 ИЕ/клетку.
[0032] В некоторых из любых таких вариантов осуществления изобретения, исходная композиция содержит по меньшей мере или приблизительно по меньшей мере или приблизительно 50 × 106 клеток, 100 × 106 клеток или 200 × 106 клеток.
[0033] В некоторых из любых таких вариантов осуществления изобретения, рекомбинантная нуклеиновая кислота кодирует антигенный рецептор. В некоторых случаях, антигенным рецептором является трансгенный T-клеточный рецептор (TCR). В некоторых вариантах осуществления изобретения, антигенным рецептором является химерный антигенный рецептор (CAR). В некоторых случаях, химерный антигенный рецептор (CAR) содержит внеклеточный антиген-распознающий домен, который специфически связывается с антигеном-мишенью и с внутриклеточным сигнал-передающим доменом, содержащим ITAM. В некоторых аспектах изобретения, внутриклеточный сигнал-передающий домен содержит внутриклеточный домен цепи CD3-дзета (CD3ζ). В некоторых из любых таких вариантов осуществления изобретения, CAR также содержит трансмембранный домен, связывающий внеклеточный домен и внутриклеточный сигнал-передающий домен. В некоторых случаях, трансмембранный домен содержит трансмембранную часть CD28.
[0034] В некоторых из любых таких вариантов осуществления изобретения, внутриклеточный сигнал-передающий домен также содержит внутриклеточный сигнал-передающий домен T-клеточной костимулирующей молекулы. В некоторых случаях, T-клеточная костимулирующая молекула выбрана из группы, состоящей из CD28 и 41BB.
[0035] В некоторых из любых таких вариантов осуществления изобретения, антигенный рецептор специфически связывается с антигеном, ассоциированным с заболеванием или состоянием, или специфически связывается с универсальной меткой. В некоторых случаях, заболеванием или состоянием является рак, аутоиммунное заболевание или расстройство или инфекционное заболевание.
[0036] В некоторых из любых таких вариантов осуществления изобретения, способ включает получение конечной композиции, содержащей T-клетки, трансдуцированные рекомбинантной нуклеиновой кислотой. В некоторых случаях, по меньшей мере 30%, или по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70% или по меньшей мере 80% T-клеток в конечной композиции, трансдуцируют рекомбинантной нуклеиновой кислотой. В некоторых аспектах изобретения, способ также включает получение или выделение из конечной композиции трансдуцированных T-клеток, полученных указанным способом. В некоторых случаях, способ также включает активацию или размножение клеток конечной композиции или клеток, трансдуцированных этим способом. В некоторых случаях, активацию и/или размножение осуществляют ex vivo.
[0037] В некоторых из любых таких вариантов осуществления изобретения, после инкубации, клетки в конечной композиции также инкубируют в присутствии одного или более стимулирующих агентов, способных активировать T-клетки, индуцировать передачу сигнала посредством комплекса TCR и/или индуцировать пролиферацию T-клеток. В некоторых аспектах изобретения, один или более стимулирующих агентов выбраны из группы, состоящей из CD3-связывающих молекул; CD28-связывающих молекул; рекомбинантного IL-2; рекомбинантного IL-15; и рекомбинантного IL-7. В некоторых вариантах осуществления изобретения, один или более стимулирующих агентов содержат анти-CD3 антитело и/или анти-CD28 антитело.
[0038] В некоторых случаях, активацию и/или размножение осуществляют in vivo. В некоторых вариантах осуществления изобретения, активация и/или размножение происходят в присутствии антигена, специфически связывающегося с антигенным рецептором, и/или активация и/или размножение являются трансген-специфическими.
[0039] В некоторых из любых таких вариантов осуществления изобретения, после инкубации, клетки в конечной композиции дополнительно не инкубируют ex vivo в присутствии одного или более стимулирующих агентов, необязательно состоящих из CD3-связывающих молекул; CD28-связывающих молекул; рекомбинантного IL-2; рекомбинантного IL-15; и рекомбинантного IL-7 и/или клетки в конечной композиции дополнительно не инкубируют при температуре более, чем 30°C в течение более, чем 24 часов.
[0040] Настоящее изобретение также относится к генетически сконструированным T-клеткам, полученным любым описанным здесь способом. Настоящее изобретение также относится к композиции, содержащей генетически сконструированные T-клетки, описанные в настоящей заявке, и фармацевтически приемлемый носитель.
[0041] Настоящее изобретение также относится к способу лечения, включающему введение индивидууму, страдающему заболеванием или расстройством, композиции, описанной выше. В некоторых случаях, композицию вводят или будут вводить индивидууму, и/или эту композицию подготавливают для анализа в течение не более, чем 9 дней, не более, чем 8 дней, не более, чем 7 дней, не более, чем 6 дней или не более, чем 5 дней после взятия образца у индивидуума. В некоторых случаях, композицию вводят или будут вводить индивидууму, и/или эту композицию подготавливают для анализа в течение не более, чем 1 дня, 2 дней, 3 дней или 4 дней после взятия образца у индивидуума. В некоторых случаях, полученная композиция может быть введена индивидууму в течение не более, чем 21 дня, не более, чем 20 дней, не более, чем 19 дней, не более, чем 15 дней, не более, чем 14 дней, не более, чем 13 дней, не более, чем 12 дней, не более, чем 10 дней, не более, чем 9 дней, не более, чем 8 дней, не более, чем 7 дней, не более, чем 6 дней или не более, чем 5 дней после взятия образца у индивидуума.
[0042] Настоящее изобретение также относится к способу адоптивной клеточной терапии, включающему обогащение или выделение T-клеток из образца, взятого у индивидуума, страдающего заболеванием или расстройством; трансдукцию исходной композиции, содержащей обогащенные или выделенные T-клетки, частицей вирусного вектора любыми описанными здесь способами, с получением конечной композиции, содержащей трансдуцированные клетки, где частица вирусного вектора содержит рекомбинантную нуклеиновую кислоту, кодирующую антигенный рецептор, который специфически связывается с антигеном, ассоциированным с заболеванием или расстройством; и введение конечной композиции, содержащей трансдуцированные клетки, индивидууму для лечения заболевания или состояния.
[0043] Настоящее изобретение также относится к способу лечения, который включает введение конечной композиции, содержащей T-клетки, трансдуцированные рекомбинантной нуклеиновой кислотой, индивидууму для лечения заболевания или состояния, где конечную композицию получают любыми описанными здесь способами трансдукции клеток.
[0044] В одном из вариантов любых таких способов, композицию вводят или будут вводить индивидууму, или эту композицию подготавливают для анализа в течение не более, чем 11 дней, не более, чем 9 дней, не более, чем 8 дней, не более, чем 7 дней, не более, чем 6 дней или не более, чем 5 дней после взятия образца у индивидуума. В некоторых вариантах осуществления изобретения, композицию вводят или будут вводить индивидууму в течение не более, чем 1 дня, 2 дней, 3 дней, 4 дней или 5 дней после взятия образца у индивидуума. В некоторых случаях, перед введением композиции, трансдуцированные клетки или клетки конечной композиции приготовливают в фармацевтически приемлемом буфере.
[0045] В некоторых из любых таких вариантов осуществления изобретения, до введения конечной композиции, содержащей трансдуцированные клетки, эти клетки культивируют ex vivo в течение периода времени до 24 часов, 2 дней, 3 дней, 4 дней, 5 дней, 6 дней, 7 дней, 8 дней, 9 дней или 10 дней после трансдукции, где указанное культивирование осуществляют при температуре более, чем 30°C. В некоторых вариантах осуществления изобретения, после трансдукции, конечную композицию или клетки, содержащие трансдуцированные клетки, культивируют в присутствии одного или более стимулирующих агентов, способных активировать T-клетки, индуцировать передачу сигнала посредством комплекса TCR и/или индуцировать пролиферацию T-клеток с получением композиции, содержащей трансдуцированные клетки.
[0046] В некоторых из любых таких вариантов осуществления изобретения, перед введением трансдуцированных клеток, конечную композицию или клетки, содержащие трансдуцированные клетки, дополнительно не инкубируют ex vivo в присутствии одного или более стимулирующих агентов, и/или дополнительно не инкубируют при температуре более, чем 30°C в течение более, чем 24 часов.
[0047] В некоторых из любых таких вариантов осуществления изобретения, один или более стимулирующих агентов выбраны из группы, состоящей из CD3-связывающих молекул; CD28-связывающих молекул; рекомбинантного IL-2; рекомбинантного IL-15; и рекомбинантного IL-7; вакцины, содержащей антиген, специфически распознаваемый антигенным рецептором; и антиидиотипического антитела, которое специфически связывается с антигенным рецептором.
[0048] В некоторых случаях, один или более стимулирующих агентов содержат анти-CD3 антитело и/или анти-CD28 антитело. В некоторых вариантах осуществления изобретения, клетки конечной композиции или трансдуцированные клетки вводят в субоптимальной дозе.
[0049] В некоторых из любых таких вариантов осуществления изобретения, способ также включает введение индивидууму одного или более агентов для индукции или усиления стимуляции и/или размножения трансдуцированных T-клеток in vivo. В некоторых случаях, один или более агентов являются трансген-специфическими и/или стимулируют или активируют клетки посредством экспрессируемого трансгена, который представляет собой или содержит, но необязательно, антигенный рецептор. В некоторых аспектах изобретения, один или более агентов выбраны из вакцины, содержащей антиген, специфически распознаваемый антигенным рецептором; антиидиотипического антитела, которое специфически связывается с антигенным рецептором, или агента, способного химически индуцировать димеризацию антигенного рецептора. В некоторых вариантах осуществления изобретения, один или более агентов представляют собой иммуномодулирующий агент; ингибитор контрольной точки иммунитета; ингибитор внеклеточного аденозина или аденозинового рецептора, необязательно рецептора A2aR; модулятор кинуренинового пути и модуляторы сигнальных путей, например, ингибиторы киназы.
[0050] Настоящее изобретение также относится к композиции, содержащей популяцию первичных человеческих T-клеток, генетически сконструированных для экспрессии химерного антигенного рецептора (CAR) или трансгенного TCR, который специфически связывается с антигеном-мишенью, где такая популяция содержит множество покоящихся T-клеток, и где множество покоящихся T-клеток содержит по меньшей мере 7,5% генетически сконструированных клеток в композиции. В некоторых случаях, генетически сконструированные покоящиеся T-клетки содержат по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, или по меньшей мере 90% генетически сконструированных клеток в композиции.
[0051] В некоторых вариантах осуществления изобретения, покоящиеся T-клетки являются негативными по поверхностному маркеру активации T-клеток, выбранному из группы, состоящей из HLA-DR, CD25, CD69, CD71, CD40L (CD154) и 4-1BB (CD137); не экспрессируют внутриклеточный цитокин, выбранный из группы, состоящей из IL-2, IFN-гамма и TNF-альфа; присутствуют в фазе G0 или G0G1a клеточного цикла; и/или содержат активный SAMHD1. В некоторых случаях, покоящиеся T-клетки являются негативными по поверхностным CD25 и CD69 (CD25-/CD69-). В некоторых аспектах изобретения, покоящиеся T-клетки содержат CD4+- и/или CD8+-T-клетки.
[0052] В некоторых из любых таких вариантов осуществления изобретения, антиген-мишень ассоциируется с заболеванием или расстройством. В некоторых случаях, заболеванием ил расстройством являются инфекционное заболевание или состояние, аутоиммунное заболевание, воспалительное заболевание или рак.
[0053] В некоторых из любых таких вариантов осуществления изобретения, антиген-мишень выбран из группы, состоящей из RORl, Her2, L1-CAM, CD19, CD20, CD22, мезотелина, CEA, поверхностного антигена вируса гепатита B, антифолатного рецептора, CD23, CD24, CD30, CD33, CD38, CD44, EGFR, EGP-2, EGP-4, EPHa2, ErbB2, ErbB3, ErbB4, FBP, фетального ацетилхолинового рецептора, GD2, GD3, HMW-MAA, IL-22R-альфа, IL-13R-альфа2, kdr, легкой цепи каппа, антигена Льюиса Y, молекулы L1-клеточной адгезии, MAGE-A1, мезотелина, лигандов MUC1, MUC16, PSCA, NKG2D, NY-ESO-1, MART-1, gp100, онкофетального антигена, TAG72, VEGF-R2, карциноэмбрионального антигена (CEA), антигена, специфичного к предстательной железе, PSMA, рецептора эстрогена, рецептора прогестерона, эфрина B2, CD123, CS-1, c-Met, GD-2, MAGE A3, CE7, антигена опухоли Вильмса 1 (WT-1) и циклина A1 (CCNA1). В некоторых вариантах описанных здесь композиций, первичные человеческие T-клетки генетически конструируют для экспрессии CAR, содержащего внеклеточный антиген-распознающий домен, который специфически связывается с антигеном-мишенью и с внутриклеточным сигнал-передающим доменом, содержащим ITAM. В некоторых случаях, внутриклеточный сигнал-передающий домен содержит внутриклеточный домен цепи CD3-дзета (CD3ζ). В некоторых случаях, CAR также содержит трансмембранный домен, связывающий внеклеточный домен и внутриклеточный сигнал-передающий домен. В некоторых аспектах изобретения, трансмембранный домен содержит трансмембранную часть CD28.
[0054] В некоторых из любых таких вариантов осуществления изобретения, внутриклеточный сигнал-передающий домен CAR также содержит внутриклеточный сигнал-передающий домен T-клеточной костимулирующей молекулы. В некоторых случаях, T-клеточная костимулирующая молекула выбрана из группы, состоящей из CD28 и 41BB.
[0055] В некоторых из любых таких вариантов осуществления изобретения, композиция содержит фармацевтически приемлемый носитель.
Краткое описание чертежей
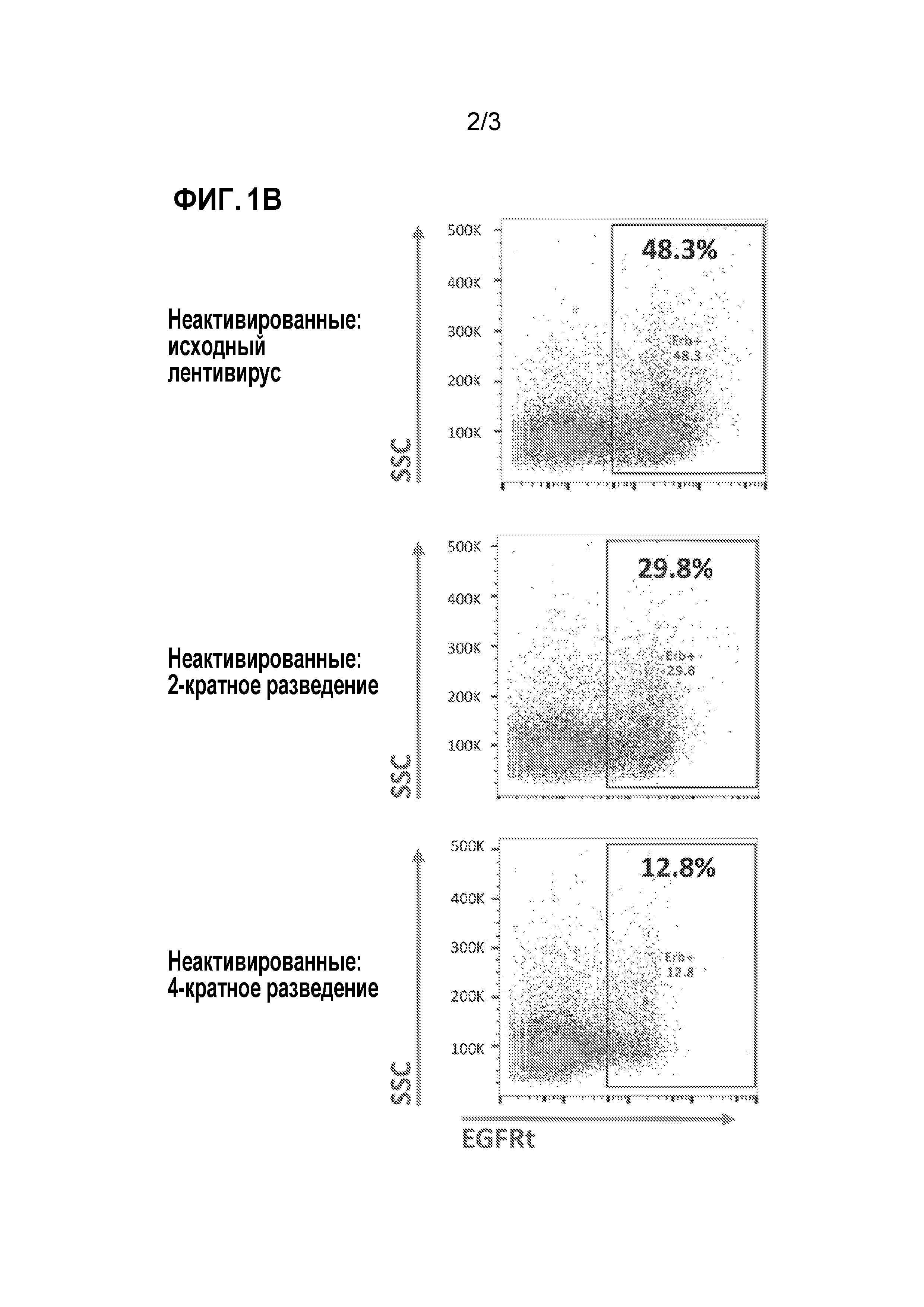
[0056] На фиг. 1А-1В представлены точечные кривые для бокового рассеяния (SSC; ось y) и экспрессии поверхностного маркера EGFRt (ось x), а именно, индикатора экспрессии трансгена T-клеток в присутствии или в отсутствии активации перед трансдукцией частицами лентивирусного вектора, экспрессирующими трансген. На фиг. 1А представлены точечные кривые для экспрессии EGFRt после трансдукции частицами лентивирусного вектора, в CD4+- и CD8+-T-клетках, активированных реагентом 1 в виде сфер с анти-CD3/анти-CD28 антителами или реагентом 2 в виде сфер с анти-CD3/анти-CD28 антителами до трансдукции. На фиг. 1B представлены точечные кривые для экспрессии EGFRt после трансдукции частицами лентивирусного вектора при различных концентрациях вируса (в двухкратных серийных разведениях по сравнению с исходной концентрацией) в CD4+- и CD8+-T-клетках, которые не были активированы до трансдукции. Процент клеток, которые представляют собой EGFRt+-клетки, также показан в рамке.
[0057] На фиг. 2 проиллюстрирована частота экспрессии суррогатных поверхностных маркеров (указывающих на частоту трансдукции) для CD4+- и CD8+-T-клеток через указанные дни после отбора, трансдукции и обработки в различных условиях.
Подробное описание
I. Обзор
[0058] Настоящее изобретение относится к способам переноса вирусных векторов в клетки (например, T-клетки), где эти способы включают трансдукцию клеток, таких как иммунные клетки, например, T-клетки, без предварительной активации клеток и/или в течение периода времени не более, чем через 24 часа после взятия образца у индивидуума, и/или где эти клетки не были доведены до температуры более, чем 15°C-25°C, например, более, чем или более, чем приблизительно 37°C ± 2,0°C, в течение более, чем нескольких часов (и не более, чем 24 часов) после взятия клеток у индивидуума и до трансдукции. В некоторых вариантах осуществления изобретения, описанные способы включают инкубацию и/или контакт частицы ретровирусного вектора, такого как лентивирусный вектор, с популяцией клеток, таких как иммунные клетки, например, T-клетки с частицей ретровирусного вектора, такой как лентивирусные частицы, без начальной активации и/или стимуляции, то есть, до трансдукции, T-клеток стимулирующим реагентом ex vivo (например, анти-CD3/анти-CD28 реагентом) до и/или одновременно с контактом или инкубацией клеток с вирусными частицами.
[0059] В некоторых вариантах осуществления изобретения, описанные способы используются для генетического конструирования таких клеток с гетерологичной молекулой, такой как рекомбинантный рецептор, например, антигенный рецептор, такой как химерный антигенный рецептор (CAR) или трансгенный T-клеточный рецептор (TCR). Полученные генетически сконструированные клетки могут быть использованы в адоптивной иммунотерапии. В некоторых таких вариантах, описанные способы могут быть применены для получения иммунных клеток, таких как T-клетки для адоптивной терапии, где указанные способы не включают стадию активации и/или стимуляции T-клеток. В некоторых аспектах изобретения, благодаря отсутствию необходимости активации или стимуляции клеток, описанные способы позвоялют сократить процедуру конструирования и/или получения клеток для адоптивной клеточной терапии.
[0060] Вообще говоря, ретровирусные веторы могут быть использованы для стабильной интеграции представляющих интерес генов в клетки. Хотя лентивирусные векторы, псевдотипированные G-белком вируса везикулярного стоматита (VSV-g) могут быть перенесены в неделящиеся клетки, однако, покоящиеся клетки не обеспечивают достаточной трансдукции. Поэтому, что касается существующих ретровирусных векторов, не всегда возможно эффективно генетически сконструировать стабильные молчащие и/или покоящиеся клетки, такие как покоящиеся миелоидные клетки или покоящиеся Т-клетки с использованием ретровирусного вектора в количестве, достаточном для их последующего применения, например, в клеточной терапии. В некоторых случаях, для трансдукции в T-клетки может потребоваться активация T-клеток посредством их связывания с T-клеточным рецептором (TCR) или стимуляции цитокином. В некоторых случаях, одно из наблюдений показало низкий уровень экспрессии рецептора LDL, партнера по связыванию с VSV-G, в покоящихся T-клетках. В некоторых случаях, было показано, что активация приводит к повышению уровня экспрессии рецептора LDL и, тем самым, к усилению степени поглощения лентивирусных векторов. Обычно, T-клетки активируют по меньшей мере за один день (а иногда за 3 дня или более) до трансдукции в целях проведения адоптивной Т-клеточной терапии. Так, например, протоколы трансдукции T-клеток лентивирусами обычно предусматривают активацию по меньшей мере за 24 часа до трансдукции (Amirache et al. (2014) Blood, 123:1422-1424).
[0061] В некоторых случаях, современные способы получения генетически сконструированных T-клеток для адоптивной иммунотерапии могут включать последовательное проведение стадий отбора, активации, трансдукции и размножения ex vivo. Однако, ex vivo стимуляция или активация иммунных клеток, таких как T-клетки, не всегда может оказаться желательной для приготовления клеток в целях их применения в некоторых способах адоптивной иммунотерапии. Так, например, проведение стадии(й) активации и/или стимуляции, например, до трансдукции, может увеличивать время, стоимость, число реагентов и/или усложнять обработку полученных клеток для адоптивной клеточной терапии. Такие стадии могут повышать риск вариабельности различных способов и/или клеток, взятых у различных индивидуумов. Таким образом, в некоторых вариантах осуществления изобретения, описанные способы являются предпочтительными, поскольку они не включают стадию активации и/или стимуляции до обработки частицей ретровирусного вектора по сравнению с другими методами.
[0062] Кроме того, в некоторых аспектах, персистентность и/или истощение T-клеток после адоптивной клеточной терапии могут ассоциироваться со стимуляцией и/или активацией T-клеток до введения, например, до или во время генетического конструирования (например, введения нуклеиновой кислоты, кодирующей генетически сконструированную молекулу, такую как рецептор, такой как антигенный рецептор, например, CAR). Так, например, активация T-клеток для облегчения трансдукции может приводить к изменению статуса дифференцировки или активации T-клеток, что, в свою очередь, может приводить и/или способствовать снижению персистентности in vivo при введении индивидууму генетически сконструированных клеток. Изменениями статуса дифференцировки могут быть, в некоторых случаях, потеря природного фенотипа, потеря фенотипа T-клеток памяти и/или образование эффекторных клеток с ослабленным T-клеточным фенотипом. Истощение T-клеток может приводить к прогрессирующей потере T-клеточных функций и/или к истощению клеток (Yi et al. (2010) Immunology, 129:474-481).
[0063] Описанные способы основаны на наблюдении того, что достаточная трансдукция первичных клеток, взятых у индивидуума, может быть достигнута путем инкубации и/или контакта популяции клеток, такой как популяция T-клеток, с частицами ретровирусного вектора, такими как частицы лентивирусного вектора сразу после отбора и/или обогащения клеток, взятых у индивидуума. В некоторых вариантах осуществления изобретения, было обнаружено, что процесс трансдукции в соответствии с описанными здесь способами не ограничивается необходимостью стимуляции клеток посредством связывания с белками CD3 и/или CD28 и/или активации LDL-рецепторов путем предварительной активации клеток. Не ограничиваясь какой-либо конкретной теорией, авторы лишь отмечают, что вышеописанная обработка отобранных и/или обогащенных клеток, включая сбор путем афереза, а также процессы отбора и/или обогащения T-клеток, уже могут способствовать активации экспрессии LDL-рецептора и/или какого-либо другого сообщения T-клеткам способности к проникновению в них вируса. В соответствии с этим, было обнаружено, что можно трансдуцировать T-клетки сразу после отбора без необходимости их активации по меньшей мере в течение 24 часов, что позволяет сократить данный процесс. В некоторых случаях, относящихся к описанным способам, перед трансдукцией может быть проведена криоконсервация обогащенных и/или отобранных клеток при условии, что такие обогащенные и/или отобранные клетки не будут подвергаться стимуляции ex vivo стимулирующим агентом или агентами до инкубации и/или контакта.
[0064] В некоторых вариантах осуществления изобретения, описанные способы включают инкубацию и/или контакт исходной композиции, содержащей трансдуцируемые клетки, где перед инкубацией, клетки исходной композиции не были подвергнуты стимуляции ex vivo, включая инкубацию с агентом, который запускает или инициирует каскад реакций передачи внутриклеточного сигнала TCR/CD3 в T-клетке, такой как CD4+-Т-клетка и/или CD8+-T-клетка. Такими агентами являются связывающие молекулы или антитела, такие как антитела, специфичные к компоненту TCR и/или костимиулирующему рецептору, например, анти-CD3 антитело, анти-CD28 антитело, которые, например, связываются с твердым носителем, таким как сферы, и/или с одним или более цитокинами, например, с рекомбинантными цитокинами, такими как as IL-2 и/или IL-15 и/или IL-7. В некоторых вариантах осуществления изобретения, описанные способы, до введения описанного ретровирусного вектора, не включают активацию и/или стимуляцию популяции клеток, содержащих T-клетки, одним или более компонентами, такими как анти-CD3 антитело, анти-CD28 антитело и/или рекомбинантные цитокины IL-2, IL-15 или IL-7. В некоторых вариантах осуществления изобретения, термин «рекомбинантный» относится к цитокинам, которые не были получены обычным способом из образца, взятого у индивидуума, а вместо этого, они были получены методами рекомбинантных ДНК, такими как методы, включающие экспрессию в клетке из ДНК, в которую была искусственно или экзогенно введена генная последовательность, кодирующая белок. Следовательно, термин «рекомбинантные цитокины» не включает цитокины, которые могут присутствовать в образце индивидуума, например, в образце, взятом путем афереза, и/или присутствовать в сыворотке, полученной от такого индивидуума. В некоторых вариантах осуществления изобретения, исходная композиция содержит популяцию первичных клеток, которые были получены из образца, взятого у индивидуума, и/или обогащены конкретной субпопуляцией клеток, например, T-клеток.
[0065] В некоторых вариантах осуществления изобретения, популяция клеток, например, исходная композиция может представлять собой популяцию клеток, которая была предварительно подвергнута криоконсервации. В некоторых таких вариантах осуществления изобретения, перед криоконсервацией клеток, клеточная популяция не была обработана и/или экспонирована и/или инкубирована в любых условиях, индуцирующих активацию или стимуляцию клеток, такую как активация или стимуляция T-клеток. В некоторых вариантах осуществления изобретения, перед криоконсервацией клеток, клеточная популяция не была обработана и/или экспонирована и/или инкубирована в присутствии одного или более агентов, способных активировать внутриклеточный домен передачи сигнала комплекса TCR, таких как анти-CD3 и/или анти-CD28 антитело и/или один или более цитокинов, таких как IL-2 и/или IL-15 и/или IL-7.
[0066] В некоторых вариантах осуществления изобретения, популяцией клеток, например, исходной композицией, которая была инкубирована с описанным ретровирусным вектором, является композиция, которая, перед инкубацией с частицей ретровирусного вектора, не была экспонирована и/или доведена до температуры, которая превышает 0°C, например, составляет более, чем 4°C, 15°C, 20°C или более, чем 25°C в течение более, чем приблизительно 1 часа, 3 часов, 6 часов, 12 часов, 24 часов, 36 часов, 48 часов или 72 часов.
[0067] В некоторых вариантах осуществления изобретения, инкубацию и/или контакт начинают не более, чем или не более, чем приблизительно через 1 час, 3 часа, 6 часов, 12 часов, 18 часов или 24 часа после получения образца, например, образца, полученного путем афереза у индивидуума, содержащего первичные клетки. В некоторых вариантах осуществления изобретения, до инкубации, T-клетки не были доведены до температуры более, чем или более, чем приблизительно 15°C, 18°C, 22°C или 25°C в течение более, чем 1 часа, 2 часов, 4 часов, 6 часов, 8 часов, 12 часов или 24 часов после взятия образца у индивидуума, например, они не были доведены до температуры более, чем или более, чем приблизительно 37°C ± 2,0°C в течение более, чем 15 минут, 30 минут, 1 часа или 2 часов после взятия образца у индивидуума.
[0068] В некоторых вариантах осуществления изобретения, описанные способы включают получение конечной композиции, содержащей трансдуцированные клетки, где такая активация клеток не проводилась до трансдукции. В некоторых вариантах осуществления изобретения, эти способы могут быть применены для трансдукции популяции T-клеток, в которой по меньшей мере 40%, 50%, 60%, 70%, 80%, 90% или более T-клеток в популяции представляют собой покоящиеся T-клетки, такие как T-клетки, не содержащие маркера активации T-клеток, такого как поверхностный маркер или внутриклеточный цитокин или другой маркер, и/или T-клетки, которые присутствуют в фазе G0 или G0G1a клеточного цикла.
[0069] В некоторых вариантах осуществления изобретения, способы включают получение конечной композиции, в которой по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50% или по меньшей мере 75% всех клеток (или клеток-мишеней конкретного типа, таких как T-клетки) были трансдуцированы указанным вирусным вектором и/или экспрессировали рекомбинантный генный продукт, кодируемый этим вектором.
[0070] В некоторых вариантах осуществления изобретения, описанные способы позволяют осуществлять относительно эффективную трансдукцию иммунных клеток, таких как молчащие и/или покоящиеся клетки, такие как неактивированные или нестимулированные иммунные клетки, например, покоящиеся T-клетки. В некоторых вариантах осуществления изобретения, по меньшей мере 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% молчащих или покоящихся клеток, таких как покоящиеся T-клетки в клеточной популяции, например, в конечной композиции, были трансдуцированы частицами ретровирусного вектора в соответствии с описанными здесь способами.
[0071] В некоторых вариантах осуществления изобретения, не более, чем 5%, 10%, 20%, 30%, или 40% T-клеток в исходной композиции и/или в конечной композиции, которые представляют собой активированные клетки, экспрессируют поверхностный маркер, выбранный из группы, состоящей из HLA-DR, CD25, CD69, CD71, CD40L и 4-1BB; содержат экспрессируемый внутри клеток цитокин, выбранный из группы, состоящей из IL-2, IFN-гамма, TNF-альфа, присутствуют в фазе G1 или в более поздней фазе клеточного цикла и/или способны пролиферироваться. Так, например, в некоторых аспектах изобретения, популяцией клеток исходной композиции и/или конечной композиции является популяция, в которой по меньшей мере 40%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% являются негативными по поверхностным CD25 и/или CD69, например, CD25- и CD69.
[0072] Методы и технологии оценки и/или анализа статуса клеточного цикла, например, покоящихся T-клеток, являются известными (Tumeh et al. (2010) J Immunother., 33:759-768). В некоторых вариантах осуществления изобретения, покоящиеся T-клетки имеют меньший размер, чем пролиферирующиеся T-клетки, такие как активированные T-клетки. Следовательно, в некоторых аспектах изобретения, могут быть использованы клетки, размер которых был определен на автоматическом счетчике клеток в присутствии или в отсутствии красителя-индикатора жизнеспособности, такого как трипановый синий. В некоторых вариантах осуществления изобретения, большинство клеток или, в основном, все T-клетки в популяции представляют собой клетки, имеющие диаметр менее, чем 4 мкм, например, в основном, менее, чем 3 мкм, например, от или приблизительно от 1 мкм до 3 мкм, например, в основном, около или приблизительно 2 мкм. В некоторых вариантах осуществления изобретения, поглощение метаболического субстрата может быть оценено, например, с использованием 2'-дезокси-D-глюкозы, меченной тритием ([3H])([3H]-2'DDG),3H-меченного 3'-дезокси-3'-фтортимидина([3H]-3'FLT) и/или3H-меченного 3'-дезокси-3'-фторарабинофлуранозилцитозина ([3H]-FAC), которые представляют собой маркеры, поглощаемые активированными или стимулированными клетками. В некоторых вариантах осуществления изобретения, большинство клеток или, в основном, все T-клетки в популяции не способны поглощать и/или аккумулировать маркер метаболического субстрата. В некоторых вариантах осуществления изобретения, клеточный цикл может быть оценен или проанализирован непосредственно, например, путем количественной оценки содержания ДНК, например, с использованием иодида пропидия (PI), 7-аминоактиномицина-D (7-AAD), Hoechst 33342, 33258 и S769121, TO-PRO-3, 4'6'-диамидино-2-фенилиндола (DAPI), DRAQ5™ или DRAQ7™.
[0073] Методы и технологии оценки экспрессии и/или уровней маркера активации T-клеток известны специалистам. Антитела и реагенты для детектирования таких маркеров хорошо известны специалистам и являются легко доступными. Анализами и методами детектирования таких маркеров являются, но не ограничиваются ими, проточная цитометрия, включая внутриклеточную проточную цитометрию, ELISA, ELISPOT, методы с использованием цитометрических массивов сфер или другие мультиплексные методы, вестерн-блот-анализ и другие методы на основе иммуноаффинности.
[0074] В некоторых вариантах осуществления изобретения, указанные способы позволяют достичь по меньшей мере определенной эффективности трансдукции в определенных условиях. Так, например, в некоторых вариантах осуществления изобретения, если исходная композиция включает вирус и клетки в отношении, равном от или приблизительно от 1 инфекционной единицы (ИЕ) на одну клетку до 10 ИЕ на одну клетку, например, по меньшей мере или равном или приблизительно равном 1 инфекционной единице (ИЕ) на одну клетку или по меньшей мере или равном или приблизительно равном 2 ИЕ на одну клетку, по меньшей мере или равном или приблизительно равном 5 ИЕ на одну клетку, или по меньшей мере или равном или приблизительно равном 10 ИЕ на одну клетку, то это означает, что указанный способ позволяет получить конечную композицию, в которой по меньшей мере 10%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, или по меньшей мере 75% клеток в композиции, полученной таким способом, содержат рекомбинантный вирусный вектор, например, эти клетки трансдуцированы рекомбинантным вирусным вектором.
[0075] В некоторых вариантах осуществления изобретения, может быть проведен мониторинг и/или оценка эффективности трансдукции клеток частицей ретровирусного вектора путем измерения уровня экспрессии рекомбинантной молекулы или белка, таких как гетерологичная молекула или белок, кодируемые нуклеиновой кислотой, содержащейся в геноме ретровирусного вектора, после трансдукции или другой формы переноса вектора в клетку, такую как покоящаяся клетка-хозяин, например, покоящаяся T-клетка или популяция этих клеток. Может быть применен ряд хорошо известных методов оценки уровней экспрессии рекомбинантных молекул, таких как методы аффинного детектирования, например, иммуноаффинного детектирования, а в случае белков клеточной поверхности, методы проточной цитометрии. В некоторых примерах, уровень экспрессии измеряют путем детектирования маркера трансдукции и/или репортерной конструкции. В некоторых вариантах осуществления изобретения, нуклеиновая кислота, кодирующая усеченный поверхностный белок, входит в состав вектора и используется в качестве маркера экспрессии и/или увеличения ее уровня.
[0076] В некоторых вариантах осуществления изобретения, описанные способы могут включать стадию криоконсервации, проводимую до или после инкубации, например, трансдукции клеток вирусными частицами. В некоторых вариантах осуществления изобретения, такая стадия в этом способе представляет собой промежуточную стадию введения материалов, образцов материалов или «поддерживания» состояния пациента до проведения терапии.
[0077] Хотя в некоторых аспектах изобретения описанный способ не включает стадию предварительной активации и/или стимуляции клеток, однако, этот способ может включать активацию или стимуляцию клеток одновременно с трансдукцией и/или после трансдукции. Активация или стимуляция могут быть осуществлены ex vivo или in vivo. В некоторых вариантах осуществления изобретения, после инкубации, например, трансдукции клеток вирусными частицами, эти клетки могут быть введены пациенту путем инфузии для активации и размножения in vivo.
[0078] В некоторых вариантах осуществления изобретения, во время или после инкубации, описанные здесь способы могут также включать культивирование исходной композиции, конечной композиции и/или трансдуцированных клеток ex vivo, например, в условиях стимуляции клеток, например, для индукции их пролиферации и/или активации. В некоторых вариантах осуществления изобретения, культивирование осуществляют при температуре более, чем 30°C, например, более, чем или более, чем приблизительно 32°C, 35°C или 37°C, в течение более, чем 24 часов, 2 дней, 3 дней, 4 дней, 5 дней, 6 дней, 7 дней, 8 дней, 9 дней или более. В некоторых вариантах осуществления изобретения, стимуляцию осуществляют в присутствии одного или более стимулирующих агентов. В некоторых вариантах осуществления изобретения, один или более стимулирующих агентов представляют собой CD3-связывающую молекулу, CD28-связывающую молекулу или цитокин, такой как рекомбинантный IL-2, рекомбинантный IL-15 или рекомбинантный IL-7. В некоторых вариантах осуществления изобретения, связывающей молекулой является антитело или его антигенсвязывающий фрагмент, такой как анти-CD3 антитело и/или анти-CD28 антитело. В некоторых вариантах осуществления изобретения, дополнительное культивирование осуществляют в условиях, эффективных для размножения клеток, с получением терапевтически эффективной дозы клеток для их введения индивидууму с помощью адоптивной клеточной терапии.
[0079] В некоторых вариантах осуществления изобретения, конечную композицию или трансдуцированные клетки не подвергают дополнительному культивированию ex vivo при температуре более, чем 30°C и/или в присутствии одного или более стимулирующих агентов.
[0080] В некоторых вариантах осуществления изобретения, описанные способы позволяют избежать значительных изменений и/или минимизировать изменения статуса дифференцировки T-клеток ex vivo в процессе введения, переноса в T-клетки нуклеиновой кислоты, кодирующей рекомбинантный рецептор, такой как CAR, и/или трансдукции T-клеток этой нуклеиновой кислотой. В некоторых вариантах осуществления изобретения, клетки с введенной нуклеиновой кислотой, полученные в соответствии с описанными здесь способами, имеют менее истощенный фенотип.
[0081] В некоторых вариантах осуществления изобретения, исходная композиция и/или конечная композиция, например, композиция, содержащая T-клетки, включает меньшее число или меньший процент эффекторных клеток, таких как эффекторные клетки с истощенным T-клеточным фенотипом, чем клетки в композиции, в которой клетки исходной композиции были активированы и/или стимулированы до инкубации, например, активированы и/или стимулированы анти-CD3/анти-CD28 антителом в течение по меньшей мере или по меньшей мере приблизительно 24 часов. В некоторых вариантах осуществления изобретения, T-клетки в исходной композиции и/или в конечной композиции содержат меньшее число или меньший процент эффекторных T-клеток памяти (TEM) или эффекторных T-клеток (TEFF), таких как CD45RO+CD62L-CCR7--клетки, чем клетки в композиции, в которой клетки исходной композиции были активированы и/или стимулированы до инкубации, например, активированы и/или стимулированы анти-CD3/анти-CD28 антителом в течение по меньшей мере или по меньшей мере приблизительно 24 часов. В некоторых вариантах осуществления изобретения, число или процент снижается по меньшей мере или по меньшей мере приблизительно в 1,5, 2, 3, 4 или 5 раз.
[0082] В некоторых вариантах осуществления изобретения, исходная композиция и/или конечная композиция, например, композиция, содержащая T-клетки, включает большее число или больший процент T-клеток с фенотипом T-клеток памяти, чем клетки в композиции, в которой клетки исходной композиции были активированы и/или стимулированы до инкубации, например, активированы и/или стимулированы анти-CD3/анти-CD28 антителом в течение по меньшей мере или по меньшей мере приблизительно 24 часов. Так, например, в некоторых вариантах осуществления изобретения, T-клетки памяти представляют собой клетки, имеющие фенотип центральных T-клеток памяти (TCM), например, CD45RO+CCR7+CD62L+-T-клетки и/или CD45RO+CCR7+CD27+CD28+CD62L+-T-клетки. В некоторых вариантах осуществления изобретения, число или процент снижается по меньшей мере или по меньшей мере приблизительно в 1,5, 2, 3, 4 или 5 раз.
[0083] В некоторых вариантах осуществления изобретения, описанные способы осуществляют так, чтобы одна, несколько или все стадии получения клеток для их клинического применения, например, в адоптивной клеточной терапии, были осуществлены без обработки клеток в нестерильных условиях и без их хранения в стерильной камере или в стерильном помещении. В некоторых вариантах такого способа, клетки выделяют, разделяют или отбирают, трансдуцируют, промывают, необязательно, активируют или стимулируют и приготавливают в закрытой системе. В некоторых вариантах осуществления изобретения, закрытая система представляет собой или включает устройство, имеющее центрифужную камеру. В некоторых вариантах осуществления изобретения, указанные способы осуществляют автоматически. В некоторых вариантах осуществления изобретения, одну или более стадий осуществляют за пределами закрытой системы или закрытого устройства, например, за пределами системы с центрифужной камерой.
[0084] В некоторых вариантах осуществления изобретения, описанные способы представляют собой оптимизированный или усовершенствованный процесс, в котором клетки обрабатывают ex vivo в течение более короткого периода времени, что экономит время и снижает стоимость процедуры. В некоторых аспектах изобретения, описанные способы могут также включать получение трансдуцированных клеток с лучшим или более желательным фенотипом, например, клеток с менее истощенным фенотипом и/или с большим количеством центральных клеток памяти по сравнению с эффекторными клетками памяти, для их введения индивидууму.
[0085] В некоторых вариантах осуществления изобретения, такие клетки, полученные указанным способом, или композицию, содержащую такие клетки, вводят индивидууму для лечения заболевания или расстройства.
[0086] В некоторых вариантах осуществления изобретения, описанные способы включают введение индивидууму субоптимальной дозы клеток. В некоторых вариантах осуществления изобретения, доза клеток меньше или приблизительно в 1,5, 2, 3, 4, 5 или 10 раз меньше, чем терапевтически эффективная доза клеток для лечения заболевания или расстройства. В таком примере, размножение клеток с получением терапевтически эффективного количества клеток может быть осуществлено in vivo после введения клеток индивидууму.
[0087] В некоторых вариантах осуществления изобретения, описанные здесь способы включают размножение клеток in vivo. В некоторых аспектах изобретения, размножение клеток in vivo может быть осуществлено in vivo путем трансген-специфической активации или стимуляции трансдуцированных клеток. В некоторых вариантах осуществления изобретения, антигенный рецептор (например, CAR) стимулируют, например, активируют или амплифицируют после распознавания антигена. В некоторых вариантах осуществления изобретения, один или более агентов вводят индивидууму для усиления, увеличения или повышения уровня стимуляции, активации или размножения клеток in vivo у индивидуума.
[0088] В некоторых вариантах осуществления изобретения, описанные способы включают получение генетически сконструированных T-клеток, которые, при их введении индивидууму повышают персистентность T-клеток и/или снижают степень их истощения. В некоторых вариантах осуществления изобретения, генетически сконструированные клетки с повышенной персистентностью и/или с меньшим истощением обладают большей активностью у индивидуума, которому их вводят. В некоторых вариантах осуществления изобретения, описанные частицы ретровирусного вектора и способы позволяют снизить вариабельность исходов лечения при проведении способов адоптивной иммунотерапии, например, благодаря минимизации и/или снижения числа манипуляций с T-клетками ex vivo до их введения индивидууму. В некоторых вариантах осуществления изобретения, отсутствие необходимости в активации T-клеток ex vivo позволяет усовершенствовать способ продуцирования или получения генетически сконструированных T-клеток для адоптивной иммунотерапии за счет сокращения времени и числа реагентов, необходимых для манипуляций ex vivo.
[0089] В некоторых вариантах осуществления изобретения, отбор трансдуцированных или сконструированных T-клеток осуществляют после их конструирования методами генной инженерии. В некоторых вариантах осуществления изобретения, сконструированныя неделящиеся и/или молчащие или покоящиеся клетки, такие как покоящиеся T-клетки, могут быть обогащены для их применения в адоптивной иммунотерапии.
[0090] Кроме того, в некоторых своих вариантах, настоящее изобретение относится к полученным генетически сконструированным клеткам, таким как клетки, экспрессирующие генетически сконструированный рецептор, такой как рекомбинантный антигенный рецептор, такой как СAR и/или другой рекомбинантный рецептор, а также к способам и применению таких генетически сконструированных клеток для адоптивной иммунотерапии.
II. Способы трансдукции
[0091] Настоящее изобретение относится к способу инкубации или контакта клеток исходной композиции с частицей ретровирусного вектора, например, с частицами лентивирусного вектора. В некоторых аспектах изобретения, исходной композицией является композиция первичных клеток, взятых у индивидуума, где, в некоторых случаях, субпопуляция или субсерия клеток были отобраны и/или обогащены. Настоящее изобретение относится к исходной композиции с отличительными признаками.
[0092] В некоторых вариантах осуществления изобретения, клетки включают одну или более нуклеиновых кислот, введенных методами генной инженерии согласно изобретению, и тем самым экспрессируют рекомбинантные или генетически сконструированные продукты таких нуклеиновых кислот. В некоторых вариантах осуществления изобретения, нуклеиновые кислоты являются гетерологичными, то есть, они обычно не присутствуют в клетке или в образце, полученном из клеток, таких как клетки, полученные от другого организма или клетки, то есть, такие нуклеиновые кислоты обычно не присутствуют в сконструированной клетке и/или в организме, из которого выделяют такую клетку. В некоторых вариантах осуществления изобретения, нуклеиновые кислоты представляют собой неприродные нуклеиновые кислоты, которые не присутствуют в природе, включая нуклеиновые кислоты, содержащие химерные комбинации нуклеиновых кислот, кодирующих различные домены, происходящие от клеток многих различных типов.
[0093] Стадии способов обработки могут включать любые одну или более из различных стадий обработки клеток, проводимых отдельно или в комбинации. В конкретных вариантах осуществления изобретения, стадии обработки включают трансдукцию клеток частицами вирусного вектора, содержащими ретровирусный вектор, такой как вектор, кодирующий рекомбинантный продукт для его экспрессии в клетках. Эти способы могут дополнительно или альтернативно, включать другие стадии обработки, такие как стадии выделения, разделения, отбора, промывки, суспендирования, разведения, концентрирования и/или получения клеток. В некоторых случаях, эти способы также могут включать стадию ex vivo культивирования (например, стимуляции клеток, например, для индукции их пролиферации и/или активации). В других случаях, стадию стимуляции или активации клеток осуществляют in vivo после введения клеток индивидууму посредством распознавания антигена и/или после введения одного или более агентов индивидууму для усиления или повышения степени размножения, активации и/или пролиферации клеток у индивидуума. В некоторых вариантах осуществления изобретения, эти способы включают выделение клеток у индивидуума, а также их получение, обработку, культивирование и/или конструирование с их последующим введением тому же самому индивидууму до или после криоконсервации.
[0094] В некоторых вариантах осуществления изобретения, этот способ включает стадии обработки, проводимые в следующем порядке: клетки, например, первичные клетки, сначала выделяют, например, отбирают или отделяют от биологического образца, а затем отобранные клетки инкубируют с частицами вирусного вектора для трансдукции, и трансдуцированные клетки приготавливают в виде композиции. В некоторых случаях, трансдуцированные клетки активируют, размножают или культивируют ex vivo, например, путем стимуляции в присутствии стимулирующего реагента. В некоторых вариантах осуществления изобретения, этот способ может включать одну или более стадий обработки, а именно, стадий промывки, суспендирования, разведения и/или концентрирования, которые могут быть осуществлены до, во время или после одной или более стадий выделения, таких как отделение или отбор, а также стадий трансдукции, стимуляции и/или приготовления.
[0095] В некоторых вариантах осуществления изобретения, одну или более или все стадии обработки, например, выделение, отбор и/или обогащение, обработку, инкубацию в комбинации с трансдукцией и конструированием, и стадии приготовления осуществляют с использованием системы, устройства или оборудования в интегрированной или самоограничивающей системе и/или автоматизировнным или программируемым способом. В некоторых аспектах изобретения, система или оборудование включают компьютер и/или компьютерную программу, связанную с системой или оборудованием, что позволяет пользователю программировать, регулировать, оценивать результат и/или корректировать различные аспекты стадий обработки, выделения, конструирования и приготовления. В одном из примеров, такой системой является система, описанная в публикации Международной патентной заявки № WO2009/072003 или US 20110003380 A1. В одном из примеров, такой системой является система, описанная в публикации Международной заявки № WO2016/073602.
[0096] В некоторых вариантах осуществления изобретения, одна или более стадий обработки клеток в комбинации с приготовлением, обработкой и/или инкубацией клеток в комбинации с описанным здесь способом трансдукции могут быть осуществлены во внутреннем отсеке центрифужной камеры, такой как, в основном, жесткая камера, имеющая, по существу, цилиндрическую форму и вращающуюся вокруг своей оси, что может давать некоторые преимущества, по сравнению с другими применяемыми методами. В некоторых вариантах осуществления изобретения, все стадии обработки осуществляют в одной и той же центрифужной камере. В некоторых вариантах осуществления изобретения, одну или более стадий обработки осуществляют в различных центрифужных камерах, таких как множество центрифужных камер одного и того же типа. Такие способы включают любые способы, описанные в публикации Международной заявки WO2016/073602.
[0097] Репрезентативными центрифужными камерами являются камеры, изготавливаемые и поставляемые Biosafe SA, включая камеры с системой Sepax® и Sepax® 2, включая центрифужные камеры A-200/F и A-200 и различные комплекты для использования таких систем. Репрезентативные камеры, системы и оборудование для обработки и помещения описаны, например, в патенте США No. 6123655, в патенте США No. 6733433, в опубликованной заявке на патент США No.: US 2008/0171951 и в опубликованной Международной патентной заявке No. WO 00/38762, содержание которых включено в настоящее описание в полном объеме посредством ссылки. В зависимости от конкретного способа (например, разведения, промывки, трансдукции, приготовления), специалист в данной области может самостоятельно выбрать конкретный комплект, подходящий для осуществления такого способа. Репрезентативными комплектами для использования таких систем являются, но не ограничиваются ими, одноразовые комплекты, поставляемые фирмой BioSafe SA под товарными знаками CS-430.1, CS-490.1, CS-600.1 или CS-900.2.
[0098] В некоторых вариантах осуществления изобретения, эту систему вводят в другое оборудование и/или подсоединяют к этому оборудованию, включая оборудование для осуществления, автоматизированного выполнения, регуляциии и/или мониторинга стадий обработки в различных аспектах изобретения, осуществляемых в этой системе. В некоторых вариантах осуществления изобретения, это оборудование находится в помещении. В некоторых вариантах осуществления изобретения, оборудование включает камеру, которая имеет корпус, содержащий схемы регуляции, центрифугу, крышку, моторы, насосы, сенсоры, дисплеи и пользовательский интерфейс. Пример такого устройства описан в патенте США No. 6123655, в патенте США No. 6733433 и в заявке США 2008/0171951.
[0099] В некоторых вариантах осуществления изобретения, система включает серию контейнеров, например, пакеты, трубки, запорные краны, зажимы, соединители и центрифужную камеру. В некоторых вариантах осуществления изобретения, контейнеры, такие как пакеты, включают один или более контейнеров, таких как пакеты, содержащие трансдуцированные клетки и частицы вирусного вектора, находящиеся в одном и том же или в различных контейнерах, например, в одном и том же пакете или в отдельных пакетах. В некоторых вариантах осуществления изобретения, система для проведения данных способов также включает один или более контейнеров, таких как пакеты, содержащие среду, такую как раствор для разведения и/или промывки, которые помещают в камеру, и/или другие компоненты для разведения, ресуспендирования и/или для промывки, и/или композиции. Контейнеры могут быть подсоединены к системе в одном или более положениях, например, в положении, соответствующем линии входа, линии разведения, линии промывки, линии удаления отходов и/или выпускной линии.
[0100] В некоторых вариантах осуществления изобретения, система, такая как закрытая система, является стерильной. В некоторых вариантах осуществления изобретения, все соединительные части компонентов системы, например, находящиеся между линией трубок и контейнером, связанные посредством соединителя, изготавливают в стерильных условиях. В некоторых вариантах осуществления изобретения, соединители изготавливают в ламинарном потоке. В некоторых вариантах осуществления изобретения, соединители изготавливают с использованием стерильного устройства, которое позволяет получить стерильные соединители, например, посредством стерильной сварки, между системой трубок и контейнером. В некоторых вариантах осуществления изобретения, стерильное соединительное устройство позволяет осуществлять контакт при температуре, которая является достаточно высокой для поддержания стерильности, например, при температуре по меньшей мере 200°C, такой как температура по меньшей мере 260°C или 300°C.
[0101] В некоторых вариантах осуществления изобретения, система может быть одноразовой, такой как комплект для одноразового применения. В некоторых вариантах осуществления изобретения, одноразовый комплект может быть использован для проведения множества циклов процесса или процессов, например, по меньшей мере 2, 3, 4, 5 или более раз, например, процессов, которые осуществляют непрерывно или полунепрерывным методом. В некоторых вариантах осуществления изобретения, система, такая как одноразовый комплект, используется для обработки клеток, взятых у одного пациента.
[0102] Центрифужная камера обычно вращается вокруг своей оси, а ее отсек обычно является коаксиальным по отношению к этой камере. В некоторых вариантах осуществления изобретения, центрифужная камера также включает подвижный элемент, такой как поршень, который обычно может двигаться (например, аксиально) по камере и изменять объем отсека. Таким образом, в конкретных вариантах осуществления изобретения, внутренний отсек соединен с боковой стенкой, с концевой стенкой камеры и подвижным элементом и имеет изменяющийся объем, который может быть скорректирован благодаря движению подвижного элемента. Подвижный элемент может быть изготовлен из жестких, по существу или в основном, жестких или гибких материалов или их комбинаций.
[0103] Камера также обычно включает одно или более отверстий, таких как одно или более впускных отверстий, одно или более выпускных отверстий и/или одно или более впускных/выпускных отверстий, которые могут обеспечивать поглощение и поступление жидкости и/или газа в отсек и из отсека. В некоторых случаях, отверстие может представлять собой впускное/выпускное отверстие, которое может обеспечивать поглощение и поступление жидкости и/или газа. В некоторых случаях, одно или более впускных отверстий могут находиться отдельно или на расстоянии от одного или более выпускных отверстий. Отверстие или отверстия могут находиться на одной из концевых стенок. В некоторых вариантах осуществления изобретения, жидкость или газ поступают в отсек и/или выходят из отсека посредством движения подвижного элемента, что обеспечивает повышение и/или снижение объема отсека. В других вариантах осуществления изобретения, жидкость и/или газ могут поступать в отсек и/или выходить из отсека посредством системы трубок или другого канала, который соединен с отверстием, например, посредством подсоединения линии или канала к насосу, шприцу или другому механизму, которые могут регулироваться автоматизированным способом.
[0104] В некоторых вариантах осуществления изобретения, камера является частью закрытой системы, такой как стерильная система, имеющая различные дополнительные компоненты, такие как линии трубок, соединители и крышки, и в этой системе осуществляют стадии обработки. Таким образом, в некоторых вариантах осуществления изобретения, описанные способы или стадии осуществляют в полностью закрытом или наполовину закрытом пространстве, таком как закрытая или наполовину закрытая стерильная система, облегчающая продуцирование клеток для их терапевтического введения индивидууму, при этом отсутствует необходимость использования отдельного стерильного пространства, такого как биологически безопасная камера или помещение. В некоторых вариантах осуществления изобретения, способы осуществляют автоматическим или частично автоматическим методом.
[0105] В некоторых вариантах осуществления изобретения, камера подвоединена к центрифуге, которая осуществляет вращение камеры, например, вокруг своей оси. Вращение может осуществляться до, во время и/или после инкубации в одной или более стадиях обработки. Таким образом, в некоторых вариантах осуществления изобретения, одну или более различных стадий обработки осуществляют с вращением, например, с конкретной силой. Обычно, камера вращается вертикально или, по существу, вертикально, а поэтому, во время центрифугирования, камеру устанавливают в вертикальное положение, боковую стенку и ось устанавливают в вертикальное положение или в почти вертикальное положение, а концевую(ые) стенку(и) устанавливают в горизонтальное или в почти горизонтальное положение.
[0106] В некоторых аспектах этих способов, данные процессы необязательно осуществляют в одной и той же закрытой системе, такой как одна и та же центрифужная камера, и они могут быть осуществлены в другой закрытой системе, такой как другая центрифужная камера, а в некоторых вариантах осуществления изобретения, такие различные центрифужные камеры, при проведении данных способов, размещены в соответствующих положениях по отношению к одной и той же системе, например, они размещены на одной и той же центрифуге. В некоторых вариантах осуществления изобретения, все стадии обработки осуществляют в закрытой системе, где все стадии или часть одной или более отдельных стадий обработки осуществляют в одной и той же или в различных центрифужных камерах.
А. Приготовление образцов и клеток
[0107] Клетками обычно являются эукариотические клетки, такие как клетки млекопитающих, а обычно человеческие клетки. В некоторых вариантах осуществления изобретения, эти клетки происходят от крови, костного мозга, лимфы или лимфоидных органов, и такими клетками являются клетки иммунной системы, такие как клетки врожденной или адаптивной иммунной системы, например, миелоидные или лимфоидные клетки, включая лимфоциты, а обычно, T-клетки и/или NK-клетки. Другими репрезентативными клетками являются стволовые клетки, такие как мультипотентные и плюрипотентные стволовые клетки, включая индуцированные плюрипотентные стволовые клетки (iPSC).
[0108] Клетками обычно являются первичные клетки, например, клетки, непосредственно выделенные у индивидуума и/или выделенные у индивидуума и замороженные. В некоторых вариантах осуществления изобретения, клетками являются одна или более субпопуляций T-клеток или клеток других типов, таких как популяции целых T-клеток, CD4+-клетки, CD8+-клетки и их субпопуляции, такие как субпопуляции с определенными функциями, такими как статус активации, способность к созреванию, к дифференцировке, к размножению, к рециркуляции, к локализации и/или персистентности, специфичность к антигену, тип антигенного рецептора, присутствие в конкретном органе или компартменте, профиль секреции маркеров или цитокинов и/или степень дифференцировки. Что касается индивидуума, подвергаемого лечению, то такие клетки могут быть аллогенными и/или аутологичными. Эти методы включают коммерчески доступные методы. В некоторых аспектах, таких как аспектиы с применением коммерчески доступных технологий, клетки являются плюрипотентными и/или мультипотентными, такие как стволовые клетки, например, индуцированные плюрипотентные стволовые клетки (iPSC). В некоторых вариантах осуществления изобретения, способы включают выделение клеток у индивидуума, а также их приготовление, обработку, культивирование и/или конструирование и их повторное введение тому же индивидууму до или после криоконсервации.
[0109] Подтипами и субпопуляциями T-клеток и/или CD4+- и/или CD8+-T-клеток являются «необученные» T(TN)-клетки, эффекторные T-клетки (TEFF), T-клетки памяти и их подтипы, такие как стволовые T-клетки памяти (TSCM), центральные T-клетки памяти (TCM), эффекторные T-клетки памяти (TEM) или эффекторные T-клетки памяти в конечной стадии дифференцировки, опухоль-инфильтрирующие лимфоциты (TIL), незрелые T-клетки, зрелые T-клетки, хелперные T-клетки, цитотоксические T-клетки, инвариантные T-клетки, ассоциированные со слизистой (MAIT), природные и адаптивные регуляторные T-клетки (Treg), хелперные T-клетки, такие как клетки TH1, клетки TH2, клетки TH3, клетки TH17, клетки TH9, клетки TH22, фолликулярные хелперные T-клетки, T-клетки альфа/бета и T-клетки дельта/гамма.
[0110] В некоторых вариантах осуществления изобретения, клетками являются природные клетки-киллеры (NK). В некоторых вариантах осуществления изобретения, клетками являются моноциты или гранулоциты, например, миелоидные клетки, макрофаги, нейтрофилы, дендритные клетки, тучные клетки, эозинофилы и/или базофилы.
[0111] В некоторых вариантах осуществления изобретения, клетки происходят от клеточных линий, например, T-клетояных линий. В некоторых вариантах осуществления изобретения, клетки получают из ксеногенного источника, например, берут у мышей, крыс, приматов, не явлющихся человеком, и свиней.
[0112] В некоторых вариантах осуществления изобретения, клетки могут быть выделены из образца, такого как биологический образец, например, образец, полученный или взятый у индивидуума. В некоторых вариантах осуществления изобретения, индивидуумом, у которого выделяют клетки, является индивидуум, страдающий заболеванием или расстройством или нуждающийся в клеточной терапии, или индивидуум, которому будет проведена клеточная терапия. В некоторых вариантах осуществления изобретения, индивидуумом является человек, нуждающийся в конкретном терапевтическом лечении, таком как адоптивная клеточная терапия, для которой были выделены, обработаны и/или сконструированы клетки.
[0113] В соответствии с этим, в некоторых вариантах осуществления изобретения, клетками являются первичные клетки, например, первичные человеческие клетки. Образцами являются ткань, жидкость и другие образцы, непосредственно взятые у индивидуума, а также образцы, полученные в одной или более стадиях обработки, таких как разделение, центрифугирование, генная инженерия (например, трансдукция вирусным вектором), промывка и/или инкубация. Биологическим образцом может быть образец, полученный непосредственно из биологического источника, или образец, который был обработан. Биологическими образцами являются, но не ограничиваются ими, физиологические жидкости, такие как кровь, плазма, сыворотка, цереброспинальная жидкость, синовиальная жидкость, моча и пот, образцы тканей и органов, включая обработанные образцы, происходящие от этих образцов.
[0114] В некоторых аспектах изобретения, образцом, от которого происходят или из которого были выделены клетки, являются кровь или образец, полученный из крови, или продукт афереза или лейкафереза или происходящий от него продукт. Репрезентативными образцами являются цельная кровь, мононуклеарные клетки периферической крови (МКПК), лейкоциты, костный мозг, тимус, биоптат ткани, опухоль, лейкозные клетки, лимфома, лимфоузел, лимфоидная ткань кишечника, лимфоидная ткань слизистой, селезенка, другие лимфоидные ткани, печень, легкие, желудок, тонкий кишечник, толстый кишечник, почки, поджелудочная железа, молочная железа, кость, предстательная железа, шейка матки, яички, яичник, миндалины или другие органы и/или клетки, происходящие от этих органов. Для клеточной терапии, образцами являются образцы для адоптивной клеточной терапии, например, образцы, происходящие от аутологичных и аллогенных источников.
[0115] В некоторых примерах, клетки, взятые из кровотока индивидуума, получают, например, путем афереза или лейкафереза. В некоторых аспектах изобретения, образцы содержат лимфоциты, включая T-клетки, моноциты, гранулоциты, В-клетки, другие зародышевые лейкоциты, эритроциты и/или тромбоциты, а в некоторых аспектах, они содержат клетки, не являющиеся эритроцитами и тромбоцитами.
[0116] В некоторых вариантах осуществления изобретения, клетки крови, взятые у индивидуума, промывают, например, для удаления фракций плазмы и для введения клеток в соответствующий буфер или в среду для последующих стадий обработки. В некоторых вариантах осуществления изобретения, клетки промывают забуференным фосфатом физиологическим раствором (PBS). В некоторых вариантах осуществления изобретения, промывочный раствор не содержит калькция и/или магния и/или многих или всех двухвалентных катионов. В некоторых аспектах изобретения, стадию промывки осуществляют на полуавтоматической «проточной» центрифуге (например, на центрифуге для обработки клеток Cobe 2991, Baxter) в соответствии с инструкциями производителей. В некоторых аспектах изобретения, стадию промывки осуществляют путем фильтрации в тангенциальном потоке (TFF) в соответствии с инструкциями производителей. В некоторых вариантах осуществления изобретения, клетки ресуспендируют в различных биосовместимых буферах после промывки, таких как, например, PBS без Ca++/Mg++. В некоторых вариантах осуществления изобретения, компоненты образца клеток крови удаляют, и клетки непосредственно ресуспендируют в культуральной среде.
[0117] В некоторых вариантах осуществления изобретения, до обогащения и/или отбора клеток, образец вводят в контакт с сывороткой или плазмой, и/или этот образец содержит сыворотку или плазму, такую как человеческая сыворотка или плазма. В некоторых вариантах осуществления изобретения, сыворотка или плазма являются аутологичными для индивидуума, у которого берут клетки. В некоторых вариантах осуществления изобретения, сыворотка или плазма присутствует в образце в концентрации по меньшей мере или по меньшей мере приблизительно 10% (об/об), по меньшей мере или по меньшей мере приблизительно 15% (об/об), по меньшей мере или по меньшей мере приблизительно 20% (об/об), по меньшей мере или по меньшей мере приблизительно 25% (об/об), по меньшей мере или по меньшей мере приблизительно 30% (об/об), по меньшей мере или по меньшей мере приблизительно 35% (об/об) или по меньшей мере или по меньшей мере приблизительно 40% (об/об). В некоторых вариантах осуществления изобретения, до отбора и/или трансдукции клеток, образец, содержащий первичные клетки, вводят в контакт с антикоагулянтом, или этот образец содержит антикоагулянт. В некоторых вариантах осуществления изобретения, антикоагулянт представляет собой или содержит свободный ион цитрата, например, раствор антикоагулянта, цитрата и дектрозы, Раствор A (ACD-A).
[0118] В некоторых вариантах осуществления изобретения, перед обогащением и/или отбором клеток, клетки, взятые из образца, переносят в бессывороточную среду или суспендируют в этой среде. В некоторых вариантах осуществления изобретения, бессывороточная среда представляет собой среду для культивирования клеток с определенным и/или с хорошо определенным химическим составом. В некоторых вариантах осуществления изобретения, бессывороточная среда представляет собой регулируемую клеточную среду, которая была обработана, например, отфильтрована для удаления ингибиторов и/или факторов роста. В некоторых вариантах осуществления изобретения, бессывороточная среда содержит белки. В некоторых вариантах осуществления изобретения, бессывороточная среда может содержать сывороточный альбумин, гидролизаты, факторы роста, гормоны, белки-носители и/или факторы связывания. В некоторых вариантах осуществления изобретения, бессывороточная среда содержит белки, например, альбумин, такой как альбумин бычьей сыворотки, альбумин человеческой сыворотки и/или рекомбинантный альбумин. В некоторых вариантах осуществления изобретения, бессывороточная среда содержит базальную среду, например, DMEM или RPMI 1640, содержащую аминокислоты, витамины, неорганические соли, буферы, антиоксиданты и источники энергии. В некоторых вариантах осуществления изобретения, в бессывороточную среду добавляют компоненты, такие как, но не ограничивающиеся ими, альбумин, липиды определенного химического состава, факторы роста, инсулин, цитокины и/или антиоксиданты. В некоторых вариантах осуществления изобретения, бессывороточную среду приготавливают для поддержания роста, пролиферации, здоровья, гомеостаза клеток некоторых типов, таких как иммунные клетки, T-клетки и/или CD4+- и/или CD8+-T-клетки.
[0119] В некоторых вариантах осуществления изобретения, перед отбором и/или обогащением клеток, образец или клетки в образце могут быть оставлены или сохранены до проведения следующих стадий обработки. В некоторых вариантах осуществления изобретения, образец поддерживают или хранят при температуре от или приблизительно от 2°C до 8°C в течение 48 часов, например, в течение 12 часов, 24 часов или 36 часов.
[0120] В некоторых вариантах осуществления изобретения, способы приготовления включают стадии замораживания, например, криоконсервации клеток до или после выделения, отбора и/или обогащения и/или инкубирования для трансдукции и конструирования. В некоторых вариантах осуществления изобретения, замораживание и последующие стадии оттаивания проводят для удаления гранулоцитов, и в определенной степени, моноцитов из клеточной популяции. В некоторых вариантах осуществления изобретения, клетки суспендируют в замораживающем растворе, например, после стадии промывки, для удаления плазмы и тромбоцитов. При этом, в некоторых аспектах изобретения, могут быть использованы любые различные и известные замораживающие растворы и их параметры. Один из примеров включает использование PBS, содержащего 20% ДМСО и 8% альбумин человеческой сыворотки (HSA), или другие подходящие среды для замораживания клеток. Затем, эти растворы разводят 1:1 средой так, чтобы конечная концентрация ДМСО и HSA составляла 10% и 4%, соответственно. Затем, клетки обычно замораживают до -80°C со скоростью 1° в минуту в паровой фазе резервуара для хранения в жидком азоте.
[0121] В некоторых вариантах осуществления изобретения, выделение клеток включает одну или более стадий приготовления и/или разделения клеток не-аффинными методами. В некоторых примерах, клетки промывают, центрифугируют и/или инкубируют в присутствии одного или более реагентов, например, для удаления нежелательных компонентов, обогащения нужными компонентами, лизиса или удаления клеток, чувствительных к конкретным реагентам. В некоторых примерах, клетки разделяют исходя из одного или более свойств, таких как плотность, адгезивные свойства, размер, чувствительность и/или резистентность к конкретным компонентам.
[0122] В некоторых вариантах осуществления изобретения, способы включает способы разделения клеток по их плотности, такие как способы приготовления лейкоцитов из периферической крови путем лизиса эритроцитов и центрифугирования в градиенте Перколла или Фиколла.
[0123] В некоторых вариантах осуществления изобретения, способы выделения включают разделение клеток различных типов на основе экспрессии или присутствия в клетках одной или более специфических молекул, таких как поверхностные маркеры, например, поверхностные белки, внутриклеточные маркеры или нуклеиновая кислота. В некоторых вариантах осуществления изобретения, может быть применен любой известный метод разделения на основе таких маркеров. В некоторых вариантах осуществления изобретения, разделение осуществляют аффинными или иммунноаффинными методами. Так, например, в некоторых аспектах изобретения, выделение включает разделение клеток и клеточных популяций исходя из экспрессии или уровня экспрессии клетками одного или более маркеров, а обычно, маркеров клеточной поверхности, например, путем инкубации с антителом или с его партнером по связыванию, которые специфически связываются с такими маркерами, с последующим проведением стадий промывки и разделения клеток, имеющих связанное антитело или его партнера по связыванию, из клеток, не имеющих связанного антитела или его партнера по связыванию.
[0124] Такие стадии разделения могут быть проведены на основе позитивного отбора, где клетки, имеющие связанные реагенты, сохраняют для их последующего применения, и/или негативного отбора, где сохраняют клетки, не имеющие связанного антитела или его партнера по связыванию. В некоторых примерах, обе фракции сохраняют для последующего применения. В некоторых аспектах изобретения, негативный отбор может оказаться особенно подходящим, если отсутствует антитело, которое могло бы специфически идентифицировать тип клеток в гетерогенной популяции, а поэтому разделение лучше всего осуществлять на основе маркеров, экспрессируемых клетками, отличающимися от клеток нужной популяции.
[0125] Разделение необязательно будет приводить к 100% обогащению или удалению конкретной клеточной популяции или кдеток, экспрессирующих конкретный маркер. Так, например, позитивный отбор или обогащение клетками конкретного типа, такими как клетки, экспрессирующие маркер, означает повышение числа или процента таких клеток, но необязательно полное отсутствие клеток, которые не экспрессируют маркер. Аналогичным образом, негативный отбор, удаление или истощение клеток конкретного типа, таких как клетки, экспрессирующие маркер, означают снижение числа или процента таких клеток, но необязательно, полное удаление всех этих клеток.
[0126] В некоторых примерах осуществляют множество раундов стадий разделения, где позитивно или негативно отобранную фракцию одной стадии подвергают другой стадии разделения, такой как последующий позитивный или негативный отбор. В некоторых примерах, одна стадия разделения может способствовать одновременному истощению клеток, экспрессирующих сразу множество маркеров, например, путем инкубации клеток со множеством антител или их партнеров по связыванию, каждый из которых является специфичным к маркеру для негативного отбора. Аналогичным образом, клетки многих типов могут быть позитивно и одновременно отобраны путем инкубации клеток со множеством антител или их партнеров по связыванию, экспрессируемых на клетках различных типов.
[0127] Так, например, в некоторых аспектах, специфические субпопуляции T-клеток, таких как клетки, позитивные по одному или более поверхностным маркерам или экспрессирующие высокие уровни этих маркеров, например, CD28+-, CD62L+-, CCR7+-, CD27+-, CD127+-, CD4+-, CD8+-, CD45RA+- и/или CD45RO+-T-клетки выделяют методами позитивного или негативного отбора.
[0128] Так, например, CD3+-, CD28+-T-клетки могут быть подвергнуты позитивному отбору с использованием магнитных сфер, конъюгированных с анти-CD3/анти-CD28 антителами (например, на устройстве DYNABEADS® M-450 CD3/CD28 T Cell Expander).
[0129] В некоторых вариантах осуществления изобретения, выделение осуществляют путем обогащения конкретными клеточными популяциями путем позитивного отбора или истощения конкретной клеточной популяции путем негативного отбора. В некоторых вариантах осуществления изобретения, позитивный или негативный отбор осуществляют путем инкубации клеток с одним или более антителами или другим связывающим агентом, которые специфически связываются с одним или более поверхностными маркерами, экспрессируемыми или экспрессируемыми (маркер+) на относительно более высоком уровне (маркервысокий) на позитивно или негативно отобранных клетках, соответственно.
[0130] В некоторых вариантах осуществления изобретения, T-клетки отделяют от образца МКПК путем негативного отбора маркеров, экспрессируемых на не-T-клетках, таких как В-клетки, моноциты или другие лейкоциты, такие как CD14-клетки. В некоторых аспектах, стадию отбора CD4+- или CD8+-клеток проводят для отделения хелперных CD4+- и CD8+-клеток и цитотоксических CD8+-Т-клеток. Такие CD4+- и CD8+-популяции могут быть дополнительно отсортированы в субпопуляции посредством позитивного или негативного отбора на экспрессируемые маркеры или маркеры, экспрессируемые в относительно более высокой степени, на одной или более субпопуляциях «необученных» T-клеток, T-клеток памяти и/или эффекторных T-клеток.
[0131] В некоторых вариантах осуществления изобретения, CD8+-клетки также обогащают или истощают «необученными» клетками, центральными клетками памяти, эффекторными клетками памяти и/или центральными стволовыми клетками памяти, или снижают их количество путем позитивного или негативного отбора на поверхностных антигенах, ассоциированных с соответствующей субпопуляцией. В некоторых вариантах осуществления изобретения, обогащение центральными Т-клетками памяти (TCM) осуществляют для повышения эффективности, например, для увеличения продолжительности жизни, усиления размножения и/или улучшения приживления трансплантата после введения, где в некоторых аспектах, такое обогащение является особенно подходящим для таких субпопуляций. См. Terakura et al. (2012) Blood.1:72-82; Wang et al. (2012) J. Immunother 35(9):689-701. В некоторых вариантах осуществления изобретения, объединение TCM-обогащенных CD4+- и/или CD8+-T-клеток также повышает эффективность.
[0132] В некоторых вариантах осуществления изобретения, T-клетки памяти присутствуют в обеих CD62L+- и CD62L--субпопуляциях CD8+-лимфоцитов периферической крови. МКПК могут быть обогащены или истощены CD62L-CD8+- и/или CD62L+CD8+-фракциями, например, с использованием анти-CD8 и анти-CD62L антител.
[0133] В некоторых вариантах осуществления изобретения, обогащение центральными T-клетками памяти (TCM) осуществляют исходя из позитивный поверхностной экспрессии или высокого уровня экспрессии CD45RO, CD62L, CCR7, CD28, CD3 и/или CD127; а в некоторых аспектах, на основе негативного отбора клеток, экспрессирующих или в высокой степени экспрессирующих CD45RA и/или гранзим B. В некоторых аспектах, выделение CD8+-популяции, обогащенной клетками TCM, осуществляют путем истощения клеток, экспрессирующих CD4, CD14, CD45RA, и позитивного отбора или обогащения клетками, экспрессирующими CD62L. В одном аспекте изобретения, обогащение центральными T-клетками памяти (TCM) осуществляют исходя из негативной фракции клеток, отобранных по экспрессии CD4, где указанные клетки подвергают негативному отбору исходя из экспрессии CD14 и CD45RA, и позитивному отбору исходя из экспрессии CD62L. В некоторых аспектах, такой отбор осуществляют одновременно, а в других аспектах, последовательно, в любом порядке. В некоторых аспектах, ту же самую стадию отбора исходя из экспрессии CD4, проводимую для приготовления популяции или субпопуляции CD8+-клеток, также осуществляют для приготовления популяции или субпопуляции CD4+-клеток так, чтобы позитивные и негативные фракции разделения на основе CD4+, сохранялись и использовались в последующих стадиях этих способов, необязательно после одной или более дополнительных стадий позитивного или негативного отбора.
[0134] В конкретном примере, образец МКПК или образец других лейкоцитов подвергают отбору на CD4+-клетки, где фракции негативного и позитивного отбора были сохранены. Затем негативную фракцию подвергают негативному отбору исходя из экспрессии CD14 и CD45RA или CD19, и позитивному отбору исходя из маркеров, характерных для центральных T-клеток памяти, таких как CD62L или CCR7, где позитивный и негативный отбор осуществляют в любом порядке.
[0135] Хелперные CD4+-Т-клетки отсортировывают на «необученные» клетки, центральные клетки памяти и эффекторные клетки путем идентификации клеточных популяций, имеющих антигены клеточной поверхности. CD4+-лимфоциты могут быть получены стандартными методами. В некоторых вариантах осуществления изобретения, «необученными» CD4+-T-лимфоцитами являются CD45RO-, CD45RA+-, CD62L+-, CD4+-T-клетки. В некоторых вариантах осуществления изобретения, центральными CD4+-клетками памяти являются CD62L+ и CD45RO+. В некоторых вариантах изобретения, эффекторными CD4+-клетками являются CD62L- и CD45RO-.
[0136] В одном примере, для обогащения CD4+-клетками путем негативного отбора, смесь моноклональных антител обычно включает антитела против CD14, CD20, CD11b, CD16, HLA-DR и CD8. В некоторых вариантах осуществления изобретения, антитело или его партнер по связыванию присоединяют к твердому носителю или к матрице, такой как магнитная сфера или парамагнитная сфера в целях разделения клеток путем позитивного и/или негативного отбора. Так, например, в некоторых вариантах осуществления изобретения, клетки и клеточные популяции разделяют или выделяют методами иммуномагнитного (или аффинномагнитного) разделения (описанного в Methods in Molecular Medicine, vol. 58: Metastasis Research Protocols, Vol. 2: Cell Behavior In Vitro and In Vivo, p 17-25 Edited by: S. A. Brooks and U. Schumacher © Humana Press Inc., Totowa, NJ).
[0137] В некоторых аспектах, образец или композицию разделяемых клеток инкубируют с небольшим намагниченным или магнитно-восприимчивым материалом, таким как магнитно-восприимчивые частицы или микрочастицы, такие как парамагнитные сферы (например, такие как сферы Dynalbeads или MACS). Магнитно-восприимчивый материал, например, частицы, в основном, прямо или опосредованно присоединют к партнеру по связыванию, например, к антителу, которое специфически связывается с молекулой, например, с поверхностным маркером, присутствующим на клетке, клетках или популяции клеток, необходимых для разделения, например, клеток, необходимых для негативного или позитивного отбора.
[0138] В некоторых вариантах осуществления изобретения, магнитаня частица или сфера содержит магнитно-восприимчивый материал, связанный со специфическим партнером по связыванию, таким как антитело или другой партнер по связыванию. Существует множество хорошо известных магнитно-восприимчивых материалов, используемых в методах магнитного разделения. Подходящие магнитные частицы описаны Molday в патенте США No. 4452773 и в описании Европейской патентной заявки EP 452342 B, которые вводится в настоящее описание посредством ссылки. Другими примерами могут служить коллоидные частицы определенного размера, такие как частицы, описанные Owen в патенте США No. 4795698 м Liberti et al., в патенте США No. 5200084.
[0139] Инкубацию обычно осуществляют в условиях, при которых антитела или партнеры по связыванию или молекулы, такие как вторые антитела или другие реагенты, которые специфически связываются с такими антителами или партнерами по связыванию, которые, в свою очередь, присоединены к магнитным частицам или сферам, специфически связываются с молекулами клеточной поверхности, если они присутствуют на клетках в образце.
[0140] В некоторых аспектах, образец помещают в магнитное поле, и клетки, имеющие связанные с ними магнитно-восприимчивые или намагниченные частицы, будут притягиваться к магниту и отделяться от немеченных клеток. Для позитивного отбора, клетки, притягивающиеся к магниту, сохраняют, а для негативного отбора, сохраняют клетки, которые не притягиваются к магниту (немеченные клетки). В некоторых аспектах, комбинацию негативного и позитивного отбора осуществляют в одной и той же стадии отбора, где позитивные и негативные фракции сохраняют, а затем обрабатывают или проводят дополнительные стадии разделения.
[0141] В некоторых вариантах осуществления изобретения, магнитно-восприимчивые частицы покрывают «первыми» антителами или другими партнерами по связыванию, «вторыми» антителами, лектинами, ферментами или стрептавидином. В некоторых вариантах осуществления изобретения, магнитные частицы присоединяют к клеткам путем покрытия первыми антителами, специфичными к одному или более маркерам. В некоторых вариантах осуществления изобретения, клетки, вместо сфер, метят первым антителом или его партнером по связыванию, а затем добавляют магнитные частицы, покрытые вторым антителом или другим партнером по связыванию (например, стрептавидином), специфичным к клеткам конкретного типа. В некоторых вариантах осуществления изобретения, магнитные частицы, покрытые стрептавидином, используют в комбинации с биотинилированными первыми или вторыми антителами.
[0142] В некоторых вариантах осуществления изобретения, магнитно-восприимчивые частицы оставляют связанными с клетками, которые затем инкубируют, культивируют и/или конструируют, а в некоторых аспектах, частицы оставляют связанными с клетками для их введения пациенту. В некоторых вариантах осуществления изобретения, намагниченные или магнитно-восприимчивые частицы удаляют с клеток. Методы удаления намагниченных частиц с клеток являются известными и включают, например, использование конкурирующих немеченных антител и намагниченных частиц или антител, конъюгированных с расщепляемыми линкерами. В некоторых вариантах осуществления изобретения, намагниченные частицы являются биоразлагаемыми.
[0143] В некоторых вариантах осуществления изобретения, отбор на основе аффинности осуществляют посредством клеточного сортинга с магнитной активацией (MACS) (Miltenyi Biotech, Auburn, CA). Системы клеточного сортинга с магнитной активацией (MACS) позволяют осуществлять отбор клеток с высокой чистотой, имеющих намагниченные частицы, связанные с этими клетками. В некоторых вариантах осуществления изобретения, MACS осуществляют в режиме, при котором молекулы, не являющиеся мишенями, и молекулы-мишени последовательно элюируют после приложения внешнего магнитного поля. То есть, клетки, связанные с намагниченными частицами, сохраняются, а несвязанные клетки элюируются. Затем, после завершения этой первой стадии элюирования, молекулы, которые были захвачены магнитным полем, и которые не элюировались, высвобождают по определенному механизму так, чтобы они могли элюироваться и могли быть выделены. В некоторых вариантах осуществления изобретения, клетки, не являющиеся мишенями, метят и выделяют из гетерогенной популяции клеток.
[0144] В некоторых вариантах осуществления изобретения, выделение или разделение осуществляют с использованием системы, устройства или оборудования, на которых осуществляют один или более методов выделения, приготовления клеток, разделения, обработки, инкубирования, культивирования и/или стадий приготовления композиций. В некоторых аспектах, эту систему используют для проведения каждой из этих стадий в закрытом или стерильном пространстве, например, для минимизации ошибки, для облегчения работы пользователя и/или снижения степени загрязнения. В одном примере, такой системой являются система, описанная в публикации Международной патентной заявки № WO2009/072003 или US 20110003380 A1. В одном примере, такой системой являются система, описанная в публикации Международной заявки № WO2016/073602.
[0145] В некоторых вариантах осуществления изобретения, способы включают отбор клеток, где всю поцедуру отбора или ее часть осуществляют во внутреннем отсеке центрифужной камеры, например, при центрифужном вращении. В некоторых вариантах осуществления изобретения, инкубацию клеток с реагентами для отбора, такими как реагенты для отбора на основе иммунноаффинности, осуществляют в центрифужной камере.
[0146] Так, например, отбор на основе иммунноаффинности может зависеть от благоприятного энергетического взаимодействия между клетками, подвергаемыми разделению, и молекулой, специфически связывающейся с маркером на клетке, например, с антителом или другим партнером по связыванию на твердой поверхности, например, на частице. В некоторых известных методах аффинного разделения с использованием частиц, таких как сферы, частицы и клетки инкубируют в контейнере, таком как трубка или пакет, со встряхиванием или при перемешивании с постоянным отношением плотности клеток к частице (например, сфере) для облегчения стимуляции энергетически благоприятных взаимодействий. Такие методы могут быть не идеальными для их применения при крупномасштабном продуцировании, что, например, обусловлено тем, что для них может потребоваться использование больших объемов в целях поддержания оптимального или желаемого отношения клетка-частица при сохранении нужного числа клеток. В соответствии с этим, для проведения таких методов может потребоваться серийная обработка или обработка в серийном формате, что может занимать много времени, потребовать проведения большего числа стадий и более тщательной обработки, повысить стоимость и увеличить риск ошибки пользователя.
[0147] В некоторых вариантах осуществления изобретения, при проведении таких стадий отбора или их частей (например, инкубирования с частицами, покрытых антителами, например, магнитными сферами) в отсеке центрфужной камеры, пользователь может регулировать некоторые параметры, такие как объем различных растворов, добавление раствора в процессе обработки, а также их синхронизацию, которые могут обеспечить преимущества по сравнению с другими доступными методами. Так, например, возможность уменьшить объем жидкости в отсеке во время инкубировании позволяет увеличить концентрацию частиц (например, реагентов-сфер), используемых при отборе, и, таким образом, химический потенциал раствора, без влияния на общее число клеток в отсеке. Это, в свою очередь, может усилить попарные взаимодействия между обрабатываемыми клетками и частицами, используемыми для отбора. В некоторых вариантах осуществления изобретения, проведение стадии инкубирования в камере, например, в ассоциации с системами, схемами регуляции и контролем, как описано в настоящей заявке, позволяет пользователю осуществлять перемешивание раствора в нужное время в процессе инкубирования, что может также улучшить взаимодействие.
[0148] В некоторых вариантах осуществления изобретения, по меньшей мере часть стадии отбора осуществляют в центрифужной камере, и эта стадия включает инкубацию клеток с реагентом для отбора. В некоторых аспектах таких способов, объем клеток смешивают с некоторым количеством нужного реагента для аффинного отбора, которое гораздо меньше, чем это обычно используется при осуществлении подобного отбора в трубке или контейнере для отбора одного и того же числа клеток и/или объема клеток в соответствии с инструкциями производителя. В некоторых вариантах осуществления изобретения, количество реагента или реагентов для отбора составляет не более, чем 5%, не более, чем 10%, не более, чем 15%, не более, чем 20%, не более, чем 25%, не более, чем 50%, не более, чем 60%, не более, чем 70% или не более, чем 80% от количества тех же самых реагентов для отбора, используемых для отбора клеток в трубке или в контейнере для инкубирования одного и того же числа клеток и/или объема клеток в соответствии с инструкциями производителя.
[0149] Инкубация с реагентом или с реагентами для отбора, например, как части способов отбора, которые могут быть осуществлены в отсеке камеры, включает использование одного или более реагентов для отбора клеток одного или более различных типов исходя из экспрессии или присутствия в клетке или на клетке одной или более специфических молекул, таких как поверхностные маркеры, например, поверхностные белки, внутриклеточные маркеры, или нуклеиновая кислота. В некоторых вариантах осуществления изобретения может быть применен любой известный метод использования реагента или реагентов для отбора в целях разделения на основе таких маркеров. В некоторых вариантах осуществления изобретения, реагент или реагенты для отбора позволяют осуществлять разделение на основе аффинности или иммуноаффинности. Так, например, в некоторых аспектах изобретения, отбор включает инкубацию с реагентом или реагентами для разделения клеток и клеточных популяций на основе экспрессии или уровня экспрессии клетками одного или более маркеров, а обычно маркеров клеточной поверхности, например, путем инкубировании с антителом или партнером по связыванию, который специфически связывается с такими маркерами, с последующим проведением стадий промывки и отделения клеток, имеющих связанное антитело или партнера по связыванию, от клеток, которые не связаны с антителом или партнером по связыванию.
[0150] В некоторых вариантах осуществления изобретения, для отбора, например, иммуноаффинного отбора клеток, эти клетки инкубируют в отсеке камеры в композиции, которая также содержит буфер для отбора вместе с реагентом для отбора, таким как молекула, специфически связывающаяся с поверхностным маркером на клетке, которую желательно обогатить и/или истощить, но не на других клетках в композиции, например, антитело, которое необязательно присоединено к каркасу, такому как полимер или поверхность, например, сфера, например, магнитная сфера, такая как магнитные сферы, связанные с моноклональными антителами, специфичными к CD4 и CD8. В некоторых вариантах осуществления изобретения, как описано выше, реагент для отбора добавляют к клеткам в отсеке камеры в количестве, которое существенно меньше (например, не более, чем на 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70% или 80%) количества реагента для отбора, который обычно используется, или который необходимо использовать для достижения приблизительно такого же или аналогичного эффекта отбора того же самого числа клеток или того же самого объема клеток, если такой отбор осуществляют в пробирке со встряхиванием или с вихревым перемешиванием. В некоторых вариантах осуществления изобретения, инкубацию осуществляют с добавлением буфера для отбора к клеткам и реагента для отбора для достижения нужного объема при инкубировании реагента, например, от 10 мл до 200 мл, например, по меньшей мере или по меньшей мере приблизительно или приблизительно или 10 мл, 20 мл, 30 мл, 40 мл, 50 мл, 60 мл, 70 мл, 80 мл, 90 мл, 100 мл, 150 мл или 200 мл. В некоторых вариантах осуществления изобретения, буфер для отбора и реагент для отбора предварительно смешивают перед их добавлением к клеткам. В некоторых вариантах осуществления изобретения, буфер для отбора и реагент для отбора отдельно добавляют к клеткам. В некоторых вариантах осуществления изобретения, инкубацию для отбора осуществляют при периодическом легком помешивании, что может облегчать стимуляцию энергетически благоприятных взаимодействий и тем самым позволяет использовать меньшее число общих реагентов для отбора при одновременном достижении высокой эффективности отбора.
[0151] В некоторых вариантах осуществления изобретения, общая продолжительность инкубирования с реагентом для отбора составляет от или приблизительно от 5 минут до 6 часов, например, от 30 минут до 3 часов, например, по меньшей мере или по меньшей мере приблизительно 30 минут, 60 минут, 120 минут или 180 минут.
[0152] В некоторых вариантах осуществления изобретения, инкубацию обычно осуществляют в условиях смешивания, например, при центрифугировании, обычно при относительно низкой силе или скорости, такой как скорость ниже, чем скорость, используемая для осаждения клеток, например, от или приблизительно от 600 об/мин до 1700 об/мин (например, при или приблизительно или по меньшей мере при 600 об/мин, 1000 об/мин, или 1500 об/мин или 1700 об/мин), например, при RCF, действующей на образец или стенку камеры или другого контейнера и составляющей от или приблизительно от 80 g до 100 g (например, при или приблизительно или по меньшей мере при 80 g, 85 g, 90 g, 95 g или 100 g). В некоторых вариантах осуществления изобретения, центрифугирование осуществляют с повторяющимися интервалами при низкой скорости, с последующими перерывами, где центрифугирование и/или перерывы следуют через 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 секунд, например, после центрифугирования в течение приблизительно 1 или 2 секунд делается перерыв приблизительно на 5, 6, 7 или 8 секунд.
[0153] В некоторых вариантах осуществления изобретения, такой способ осуществляют в полностью закрытой системе, в которой камера является ее неотъемлемой частью. В некоторых вариантах осуществления изобретения, этот способ (а в некоторых аспектах, также одна или более дополнительных стадий, таких как предварительная стадия промывки образца, содержащего клетки, такие как образец после афереза) осуществляют в автоматическом режиме, при котором клетки, реагент и другие компоненты забираются в камеру и выталкиваются из камеры в соответствующие моменты времени при центрифугировании так, чтобы стадия промывки и связывания осуществлялась в одной закрытой системе по автоматизированной программе.
[0154] В некоторых вариантах осуществления изобретения, после инкубации и/или смешивания клеток и реагента и/или реагентов для отбора, инкубированные клетки подвергают разделению для отбора клеток, исходя из присутствия или отсутствия конкретного реагента или реагентов. В некоторых вариантах осуществления изобретения, дальнейший отбор осуществляют за пределами центрифужной камеры. В некоторых вариантах осуществления изобретения, разделение осуществляют в той же самой закрытой системе, в которой присутствует центрифужная камера, и в которой осуществляется инкубация клеток с реагентом для отбора. В некоторых вариантах осуществления изобретения, после инкубации с реагентами для отбора, инкубированные клетки, включая клетки, в которых реагент для отбора является связанным, вынимают из центрифужной камеры, то есть, переносят из центрифужной камеры в систему для иммуноаффинного разделения клеток. В некоторых вариантах осуществления изобретения, система иммуноаффинного разделения представляет собой или содержит колонку для магнитного разделения. В некоторых вариантах осуществления изобретения, перед разделением, одна или более других стадий обработки, таких как промывка, могут быть осуществлены в камере.
[0155] В некоторых аспектах, разделение и/или другие стадии осуществляют с использованием системы CliniMACS (Miltenyi Biotic), например, для автоматического разделения клеток на клинически масштабируемом уровне в закрытой и стерильной системе. Компоненты могут включать встроенный микрокомпьютер, устройство для магнитного разделения, перистальтический насос и различные прижимные клапаны. В некоторых аспектах изобретения, встроенный компьютер регулирует все компоненты устройства и направляет систему на выполнение повторяющихся процедур в стандартизированной последовательности. В некоторых аспектах изобретения, устройство для магнитного разделения включает подвижный постоянный магнит и держатель колонки для отбора. Перистальтический насос регулирует скорость потока по всему ряду трубок, вместе с прижимными клапанами, что обеспечивает регулируемый поток буфера через систему и непрерывное суспендирование клеток.
[0156] В некоторых аспектах изобретения, в системе CliniMACS используются намагниченные частицы, связанные с антителом, которые подаются в стерильный апирогенный раствор. В некоторых вариантах осуществления изобретения, после мечения клеток магнитными частицами, клетки промывают для удаления избытка частиц. После этого, пакет для приготовления клеток подсоединяют к системе трубок, которая, в свою очередь, подсоединена к пакету, содержащему буфер, и к пакету для сбора клеток. Система трубок состоит из предварительно собранных стерильных трубок, включая предварительную колонку и разделительную колонку, и предназначена только для одноразового использования. После запуска программы разделения, система автоматически подает образец клеток на разделительную колонку. Меченые клетки сохраняются в колонке, в то время как немеченные клетки удаляются с помощью серии стадий промывок. В некоторых вариантах осуществления изобретения, клеточные популяции, используемые в описанных здесь способах, являются немечеными и не сохраняются в колонке. В некоторых вариантах осуществления изобретения, клеточные популяции, используемые в описанных здесь способах, являются мечеными и сохраняются в колонке. В некоторых вариантах осуществления изобретения, клеточные популяции, используемые в описанных здесь способах, элюируют в колонке после снятия магнитного поля, и собирают в пакет для сбора клеток.
[0157] В некоторых вариантах осуществления изобретения, разделение и/или другие стадии осуществляют с использованием системы CliniMACS Prodigy (Miltenyi Biotec). В некоторых аспектах изобретения, система CliniMACS Prodigy оснащена устройством для обработки клеток, которое обеспечивает автоматическую промывку и фракционирование клеток путем центрифугирования. Система CliniMACS Prodigy также может включать встроенную камеру и компьютерную программу распознавания изображений, которая определяет оптимальную конечную точку фракционирования клеток, что позволяет различать макроскопические слои продукта-источника клеток. Так, например, периферическая кровь автоматически разделяется на эритроциты, лейкоциты и слои плазмы. Система CliniMACS Prodigy может также включать встроенную камеру для культивирования клеток, в которой осуществляют протоколы культивирования клеток, такие как, например, дифференцировка и размножение клеток, загрузка антиген и длительное культивирование клеток. Входные отверстия могут служить для стерильного удаления и пополнения среды, а мониторинг клеток может быть осуществлен на встроенном микроскопе. См., например, Klebanoff et al. (2012) J. Immunother. 35(9): 651-660, Terakura et al. (2012) Blood. 1:72-82, и Wang et al. (2012) J. Immunother. 35(9):689-701.
[0158] В некоторых вариантах осуществления изобретения, описанную здесь клеточную популяцию собирают и обогащают (или истощают) с помощью проточной цитометрии, где клетки, окрашенные на множество маркеров клеточной поверхности, захватываются потоком жидкости. В некоторых вариантах осуществления изобретения, описанную здесь клеточную популяцию собирают и обогащают (или истощают) с помощью препаративного масштабируемого (FACS)-сортинга. В некоторых вариантах осуществления изобретения, описанную здесь клеточную популяцию собирают и обогащают (или истощают) с использованием чипов микроэлектромеханических систем (MEMS) в комбинации с системой FACS-детектирования (см., например, WO 2010/033140, Cho et al. (2010) Lab Chip 10, 1567-1573; и Godin et al. (2008) J Biophoton. 1(5):355-376). В обоих случаях, клетки могут быть помечены множеством маркеров, что позволяет выделять четко определенные субпопуляции Т-клеток с высокой чистотой.
[0159] В некоторых вариантах осуществления изобретения, антитела или партнеры по связыванию метят одним или более детектируемыми маркерами в целях облегчения разделения для позитивного и/или негативного отбора. Так, например, разделение может быть основано на связывании с флуоресцентно меченными антителами. В некоторых примерах, разделение клеток на основе связывания антител или других партнеров по связыванию, специфичных к одному или более маркерам клеточной поверхности, осуществляют в потоке жидкости, например, с помощью клеточного сортинга с активацией флуоресценции (FACS), включая препаративный масштабируемый (FACS)-сортинг, и/или использование чипов микроэлектромеханических систем (MEMS), например, в комбинации с системой проточно-цитометрического детектирования. Такие способы позволяют осуществлять одновременно позитивный и негативный отбор на основе множества маркеров.
[0160] В некоторых вариантах осуществления изобретения, клетками для трансдукции описанными здесь частицами ретровирусного вектора являются, например, моноциты, макрофаги, происходящие от моноцитов, дендритные клетки, происходящие от моноцитов, или покоящиеся T-клетки. В конкретных вариантах осуществления изобретения, описанные ретровирусные частицы могут инфицировать покоящиеся Т-клетки. В некоторых вариантах осуществления изобретения, исходная композиция включает множество клеток, таких как иммунные клетки, например Т-клетки, которые являются неделящимися, и/или молчащими, и/или покоящимися, и/или клетки, в популяции которых присутствует множество клеток, например, более, чем 50%, 60%, 70%, 80%, 80% или более клеток, которые были трансдуцированы, и которые являются неделящимися, и/или молчащими, и/или покоящимися. В некоторых вариантах осуществления изобретения, исходная композиция содержит популяцию Т-клеток, в которой по меньшей мере 40%, 50%, 60%, 70%, 80%, 90% или более из Т-клеток в популяции представляют собой покоящиеся T-клетки, такие как T-клетки, в которых отсутствует маркер активации T-клеток, такой как поверхностный маркер или внутриклеточный цитокин или другой маркер и/или T-клетки, которые находятся на стадии G0 или G0G1a клеточного цикла. В некоторых вариантах осуществления изобретения, клетка содержит активный SAMHD1, такой как нефосфорилированный SAMHD1. В некоторых вариантах осуществления изобретения, клетки находятся на стадии G0, G0/G1a или G1 клеточного цикла.
[0161] В некоторых вариантах осуществления изобретения, способы включают трансдукцию T-клеток, в которых не более, чем 5%, 10%, 20%, 30% или 40% T-клеток экспрессируют маркер активации T-клеток. В некоторых вариантах осуществления изобретения, не более, чем 5%, 10%, 20%, 30% или 40% T-клеток являются позитивными по одному или более поверхностным маркерам активации T-клеток HLA-DR, CD25, CD69, CD71, CD40L (CD154) и/или 4-1BB (CD137). В некоторых вариантах осуществления изобретения, не более, чем 5%, 10%, 20%, 30% или 40% T-клеток экспрессируют внутриклеточный цитокин, который представляет собой IL-2, IFN-гамма и/или TNF-альфа.
В. Частицы вирусного вектора
[0162] В некоторых вариантах осуществления изобретения, частицами вирусного вектора являются частицы ретровирусного вектора, такие как лентивирусные частицы, содержащие нуклеиновую кислоту, кодирующую рекомбинантную и/или гетерологичную молекулу, например, рекомбинантный или гетерологичный белок, такой как рекомбинантный и/или гетерологичный рецептор, например, химерный антигенный рецептор (CAR) или другой антигенный рецептор в геноме вирусного вектора. Геном частицы вирусного вектора, обычно включает последовательности, помимо нуклеиновой кислоты, кодирующей рекомбинантную молекулу. Такие последовательности могут включать последовательности, позволящие геному упаковываться в вирусную частицу и/или последовательности, которые стимулируют экспрессию нуклеиновой кислоты, кодирующей рекомбинантный рецептор, такой как CAR.
1. Вирусный вектор
[0163] В некоторых вариантах осуществления, вирусные векторные частицы содержат геном, происходящий от вектора на основе ретровирусного генома, такого как вектор на основе лентивирусного генома. В некоторых аспектах описанных здесь вирусных векторов, гетерологичная нуклеиновая кислота, кодирующая рекомбинантный рецептор, такой как антигенный рецептор, такой как CAR, содержится и/или расположена между последовательностями 5'-LTR и 3'-LTR векторного генома.
[0164] В некоторых вариантах осуществления изобретения, геном вирусного вектора представляет собой лентивирусный геном, такой как геном ВИЧ-1 или геном SIV. Так, например, лентивирусные векторы были получены путем аттенюации множества генов вирулентности, например, гены env, vif, vpu и nef могут быть делетированы, что делает вектор более безопасным для его использования в терапевтических целях. Лентивирусные векторы являются известными. См., Naldini et al., (1996 и 1998); Zufferey et al., (1997); Dull et al., 1998, патенты США NN. 6013516 и 5994136). В некоторых вариантах осуществления изобретения, эти вирусные векторы получены на основе плазмиды или вируса и имеют такую конфигурацию, при которой они несут основные последовательности для включения чужеродной нуклеиновой кислоты в целях проведения отбора и переноса нуклеиновой кислоты в клетку-хозяина. Известные лентивирусы могут быть легко получены из депозитариев или коллекций, таких как Американская Коллекция типовых культур («ATCC»; 10801 University Blvd., Manassas, Va.20110-2209), или выделены из известных источников с применением общедоступных методов.
[0165] Неограничивающими примерами лентивирусных векторов являются векторы, происходящие от лентивируса, такого как вирус иммунодефицита человека 1 (ВИЧ-1), ВИЧ-2, вирус обезьяньего иммунодефицита (SIV), человеческий T-лимфотропный вирус 1 (HTLV-1), HTLV-2 или вирус инфекционной анемии лошадей (E1AV). Так, например, лентивирусные векторы были получены путем аттенюации множества генов вирулентности ВИЧ, например, гены env, vif, vpu и nef были делетированы, что делает вектор более безопасным для его использования в терапевтических целях. Лентивирусные векторы известны специалистам, см., Naldini et al., (1996 и 1998); Zufferey et al., (1997); Dull et al., 1998, патенты США NN. 6013516 и 5994136). В некоторых вариантах осуществления изобретения, эти вирусные векторы были получены на основе плазмиды или вируса и имеют такую конфигурацию, при которой они несут основные последовательности для включения чужеродной нуклеиновой кислоты в целях проведения отбора и переноса нуклеиновой кислоты в клетку-хозяина. Известные лентивирусы могут быть легко получены из депозитариев или коллекций, таких как Американская Коллекция типовых культур («ATCC»; 10801 University Blvd., Manassas, Va.20110-2209), или выделены из известных источников с применением общедоступных методов.
[0166] В некоторых вариантах осуществления изобретения, вектор вирусного генома может содержать последовательности 5′- и 3′-LTR ретровируса, такого как лентивирус. В некоторых аспектах изобретения, конструкция вирусного генома может содержать последовательности 5′- и 3′-LTR лентивируса, а в частности, она может содержать последовательности R и U5 от 5′-LTR лентивируса и инактивированные или самоинактивирующиеся 3′-LTR лентивируса. Последовательности LTR могут представлять собой последовательности LTR любого лентивируса, происходящего от любого вида. Так, например, они могут представлять собой последовательности LTR от ВИЧ, SIV, FIV или BIV. Обычно, последовательностями LTR являются последовательности LTR ВИЧ.
[0167] В некоторых вариантах осуществления изобретения, нуклеиновая кислота вирусного вектора, такого как вирусный вектор ВИЧ, не содержит дополнительных транскрипционных единиц. Геном вектора может содержать инактивированные или самоинактивирующиеся 3′-LTR (Zufferey et al. J Virol 72: 9873, 1998; Miyoshi et al., J Virol 72:8150, 1998). Так, например, делеция в области U3 3′-LTR нуклеиновой кислоты, используемой для продуцирования РНК вирусного вектора, может быть введена для получения самоинактивирующихся (SIN) векторов. Затем эта делеция может быть перенесена в 5′-LTR провирусной ДНК в процессе обратной транскрипции. Самоинактивирующийся вектор обычно имеет делецию в последовательностях энхансера и промотора от 3′ длинного концевого повтора (LTR), которая будет копироватся в 5′-LTR в процессе интеграции вектора. В некоторых вариантах осуществления изобретения, достаточная часть последовательности может быть удалена, включая TATA-бокс, в целях отмены транскрипционной активности LTR. Это позволяет предотвратить продуцирование полноразмерной векторной РНК в трансдуцированных клетках. В некоторых аспектах, элемент U3 3′-LTR содержит делецию в последовательности энхансера, в TATA-боксе, и в сайтах Sp1 и NF-каппа B. В результате самоинактивации 3′-LTR, провирус, образующийся после проникновения в клетку и обратной транскрипции, содержит инактивированный 5′-LTR. Это может повысить безопасность благодаря снижению риска мобилизации векторного генома и влияния LTR на соседние клеточные промоторы. Самоинактивирующийся 3′-LTR может быть сконструирован любым методом, известным специалистам. В некоторых вариантах осуществления изобретения, это не влияет на титры вектора или на in vitro или in vivo свойства вектора.
[0168] Последовательность U3 5'-LTR лентивируса может быть заменена, но необязательно, последовательностью промотора в вирусной конструкции, такой как гетерологичная промоторная последовательность. Это может повышать титр вируса, выделенного из упаковывающей клеточной линии. Может быть также включена последовательность энхансера. Может быть также использована любая комбинация энхансера/промотора, которая повышает уровень экспрессии генома вирусной РНК в упаковывающей клеточной линии. В одном из примеров используется последовательность энхансера/промотора CMV (патент США No. 5385839 и патент США No. 5168062).
[0169] В некоторых вариантах осуществления, риск инсерционного мутагенеза может быть сведен к минимуму путем конструирования генома ретровирусного вектора, такого как геном лентивирусного вектора, дефектного по интеграции. Для получения неинтегрирующегося векторного генома может быть применен ряд методов. В некоторых вариантах осуществления изобретения, мутация(и) может (могут) быть введена(ы) в компонент гена фермента интегразы Pol, так, чтобы он кодировал белок с неактивной интегразой. В некоторых вариантах осуществления изобретения, сам векторный геном может быть модифицирован для предотвращения интеграции, например, путем мутации или делеции одого или обоих сайтов связывания, получения 3'-LTR-проксимального полипуринового каскада (РРТ), который был сделан нефункциональным в результате делеции или модификации. В некоторых вариантах осуществления изобретения могут быть применены и не-генетические методы; эти методы включают использование фармакологических средств, которые ингибируют одну или более функций интегразы. Эти подходы не являются взаимоисключающими, то есть, одновременно могут быть применены боле, чем один из этих подходов. Так, например, интеграза и сайты связывания могут быть нефункциональными, либо интеграза и сайт РРТ могут быть нефункциональными, либо сайты связывания и сайт РРТ могут быть нефункциональными, или все они могут быть нефункциональными. Такие методы и геномы вирусного вектора являются известными и доступными (см., Philpott and Thrasher, Human Gene Therapy 18:483, 2007; Engelman et al. J Virol 69:2729, 1995; Brown et al J Virol 73:9011 (1999); WO 2009/076524; McWilliams et al., J Virol 77:11150, 2003; Powell and Levin J Virol 70:5288, 1996).
[0170] В некоторых вариантах осуществления изобретения, вектор содержит последовательности для размножения в клетке-хозяине, такой как прокариотическая клетка-хозяин. В некоторых вариантах осуществления изобретения, нуклеиновая кислота вирусного вектора содержит один или более ориджинов репликации для размножения в прокариотической клетке, такой как бактериальная клетка. В некоторых вариантах осуществления изобретения, векторы, включающие прокариотический ориджин репликации, также могут содержать ген, который экспрессирует детектируемый или селективный маркер, например, маркер резистентности к лекарственному средству.
2. SAMHD1-ингибирующий вспомогательный белок
[0171] В одном из своих вариантов, настоящее изобретение относится к частицам ретровирусного вектора, содержащим SAMHD1-ингибирующий вспомогательный белок, инкапсулированный в вирионе. В некоторых аспектах, такие частицы позволяют осуществлять эффективную трансдукцию неделящихся клеток, таких как неделящиеся иммунные клетки, например, покоящиеся Т-клетки. В некоторых аспектах, такие частицы позволяют осуществлять эффективную трансдукцию моноцитов, макрофагов, происходящих от моноцитов, или дендритных клеток, происходящих от моноцитов. В некоторых аспектах изобретения, описанные частицы ретровирусного вектора минимизируют и/или снижают потребность в манипуляциях ex vivo для трансдукции клеток, такой как активация и/или стимуляция клеток.
[0172] SAMHD1 представляет собой белок, присутствующий в некоторых молчащих и/или покоящихся иммунных клетках и обладающий dGTP-зависимой дезоксинуклеотид-трифосфогидролазной активностью, и такой белок может дефосфорилировать клеточные дезоксинуклеотид-трифосфаты (dNTP). Присутствие активного SAMHD1 в клетках, который обладает противовирусной активностью, такой как нефосфорилированный SAMHD1, может снижать нуклеотидный пул. Такое снижение может тем самым ограничить ретровирусную трансдукцию благодаря предотвращению взаимодействия вирусного вектора с достаточным количеством нуклеотидов, что будет в достаточной степени облегчать реакцию обратной транскрипции вирусной РНК, например, вирусного генома. Хотя в некоторых случаях покоящиеся клетки, такие как активированные или пролиферирующиеся Т-клетки, могут экспрессировать SAMHD1, однако, в некоторых аспектах, противовирусная активность SAMHD1 регулируется фосфорилированием SAMHD1 в зависимости от клеточного цикла (Cribier et al. (2013) Cell Reports, 3:1036-1043). Так, например, в делящихся клетках, SAMHD1 обычно взаимодействует с белками, ассоциированными с клеточным циклом, а в некоторых аспектах, фосфорилируется циклин-зависимой киназой 1 (CDK1). Репрезентативная последовательность человеческого SAMHD1 представлена в SEQ ID NO: 19 (см., например, UniProt No. Q9Y3Z3). Так, например, в некоторых вариантах осуществления изобретения, SAMHD1 может фосфорилироваться в положении, соответствующем положению T592 репрезентативной последовательности SAMHD1, представленной в SEQ ID NO: 19. Фосфорилированный SAMHD1 обладает пониженной и/или минимальной активностью, что указывает на отсутствие ограничения трансдукции делящихся T-клеток вирусом.
[0173] В некоторых вариантах описанных здесь частиц вектора и способов, в результате включения SAMHD1-ингибирующего вспомогательного белка в вирион, SAMHD1 ингибируется, например, разлагается в клетках, в которые была введена описаннная частица ретровирусного вектора. Это приводит к увеличению нуклеотидного пула, и тем самым позволяет осуществлять трансдукцию молчащих и/или неделящихся клеток, которые экспрессируют SAMHD1. В некоторых вариантах осуществления изобретения, описанные ретровирусные частицы содержат SAMHD1-ингибирующий белок и могут трансдуцировать клетки, содержащие активный SAMHD1, такой как нефосфорилированный белок SAMHD1. В некоторых вариантах осуществления изобретения, трансдуцирование описанными частицами ретровирусного вектора происходит в клетках, в которых SAMHD1 не фосфорилируется в положении, соответствующем положению T592 в репрезентативной последовательности SAMHD1, представленной в SEQ ID NO: 19. Методы оценки экспрессии и/или фосфорилирования SAMHD1 могут быть проведены с применением любой известной технологии, например, с помощью вестерн-блот-анализа с использованием SAMHD1-специфического антитела после электрофореза в ДСН-ПААГ и/или после электрофореза в ДСН-ПААГ на основе аффинности к фосфату с помощью акриламидной технологии с использованием фосфатных меток или другими аналогичными методами (см. например Cribier et al.).
[0174] В конкретных вариантах осуществления изобретения, описанные частицы ретровирусного вектора, модифицированные так, чтобы они содержали SAMHD1-ингибирующий вспомогательный белок в их вирионе, представляют собой любой вирусный вектор, который основан на нуклеотидах хозяина для трансдукции. Такие частицы вирусного вектора могут включать частицы ретровирусного вектора, например, частицы лентивирусного или гамма-ретровирусного вектора, которые используют клеточные dGTP для синтеза вирусной кДНК из вирусной РНК посредством обратной транскриптазы вируса.
[0175] В некоторых вариантах осуществления изобретения, SAMHD1-ингибирующий белок представляет собой вирусный белок клетки-хозяина, который обладает SAMHD1-ингибирующей активностью. В некоторых вариантах осуществления изобретения, SAMHD1-ингибирующим белком являются лентивирусный белок, такой как лентивирусный белок Vpx или белок Vpr или его вариант или его часть, которые обладают SAMHD1-ингибирующей активностью. Vpx и Vpr, которые экспрессируются в различных лентивирусах, имеют общие последовательности и структурную гомологию и представляют собой ассоциированные с вирионом белки, упаковывающиеся в вирион в процессе сборки. После введении в клетку, Vpx, а в некоторых аспектах Vpr, могут блокировать убихитинизацию SAMHD1 посредством комплекса убихитинлигазы в клетке, образовавшегося из белков клетки-хозяина CUL4A-DDB1-DCAF1, что будет приводить к протеосомной деградации SAMHD1 (Schwefel et al. (2014) Nature 505:234-238). В некоторых вариантах осуществления изобретения, ингибирование, такое как разложение SAMHD1 под действием белка Vpr или Vpx, опосредуется связыванием лентивирусного белка Vpr или Vpx с SAMHD1 и/или с одним или более DDB1 или DCAF1 в комплексе убихитинлигазы.
[0176] В некоторых вариантах осуществления изобретения, SAMHD1-ингибирующий белок представляет собой антитело или его фрагмент, которые специфически связываются с SAMHD1 и/или ингибируют SAMHD1.
[0177] В некоторых вариантах осуществления изобретения, описанные частицы ретровирусного вектора обладают активностью разлагать SAMHD1 в клетках-хозяевах, таких как покоящиеся Т-клетки, в которые была введена частица вирусного вектора. В некоторых аспектах, количество SAMHD1 может быть снижено в 2 раза, 3 раза, 4 раза, 5 раз, в 6 раз, 7 раз, 8 раз, 9 раз, 10 раз, 15 раз, 20 раз, 30 раз, 35 раз, 40 раз, 45 раз, 50 раз, 60 раз, 70 раз, 80 раз, 90 раз, 100 раз, 150 раз, 200 раз или более по сравнению с экспрессией или уровнем SAMHD1 в тех же клетках, в которые не были введены частицы ретровирусного вектора. В некоторых таких вариантах осуществления изобретения, могут быть проведены мониторинг или наблюдение разложения SAMHD1 после трансдукции или другой формы переноса описанной частицы ретровирусного вектора, содержащей SAMHD1-ингибирующий белок, в молчащие клетки-хозяева, такие как покоящиеся T-клетки. Разложение может быть оценено путем определения относительного уровня экспрессии SAMHD1 по сравнению с экспрессией SAMHD1 в тех же клетках, в которые не были введены частицы ретровирусного вектора. Может быть применен ряд хорошо известных методов оценки уровня экспрессии белка. В некоторых вариантах осуществления изобретения, SAMHD1 может быть детектирован с помощью иммуноблоттинга с использованием SAMHD1-специфического антитела, например, в образце лизированных клеток. Степень или уровень экспрессии могут быть также оценены и/или количественно определены с помощью стандартных процедур, таких как денситометрия. В некоторых вариантах осуществления изобретения, может быть проведен мониторинг уровней и/или экспрессии SAMHD1 в течение определенного периода времени и/или может быть проведен мониторинг на изменение исходного вируса.
[0178] В некоторых аспектах, описанные частицы ретровирусного вектора, содержащие SAMHD1-ингибирующие белок, такие как Vpx или белок Vpr, сообщают неделящимся и/или молчащим или покоящимся иммунным клеткам еще большую восприимчивость к трансдукции и введению генетически сконструированной молекулы, кодируемой таким вектором, например, вектором, кодирующим генетически сконструированные рецепторы, такие как рекомбинантные антигенные рецепторы, такие как CAR и/или другие рекомбинантные рецепторы, такие как рецепторы, содержащие внеклеточный лиганд-связывающий или распознающий домен и домен внутриклеточной передачи сигнала или домены, способные передавать стимулирующий сигнал Т-клетке, такие как ITAM-содержащие домены и/или Т-клеточные костимулирующие домены. В некоторых своих вариантах, настоящее изобретение относится к способам применения описанных частиц ретровирусного вектора, содержащих SAMHD1-ингибирующий белок, такой как белок Vpx или белок Vpr для трансдукции и/или введения генетически сконструированного рецептора, такого как рекомбинантные антигенные рецепторы, такие как CAR, и/или другие рекомбинантные рецепторы, в макрофаги, происходящие от моноцитов, в дендритные клетки, происходящие от моноцитов, или покоящиеся T-клетки.
[0179] В некоторых вариантах осуществления изобретения, ингибитор SAMHD1 представляет собой белок Vpx, белок Vpr или функциональный вариант или часть белка Vpx или Vpr, обладающие SAMHD1-ингибирующей активностью. В некоторых вариантах осуществления изобретения, Vpx представляет собой 18 кДа-белок, состоящий из 112 аминокислот (а.к.) и обнаруженный в лентивирусах приматов. Vpx от SIV и ВИЧ-2 являются на 83% идентичными на аминокислотном уровне (Goujon et al., J Virol, 82:12335-12345 (2008) и обладают активностью связывания с SAMHD1 и его разложения (Laguette et al., Nature, 474: 654-657 (2011). Vpx присутствует только в некоторых лентивирусах, и он не был обнаружен в ВИЧ-1. Близкородственный ген Vpr, который имеет высокую степень структурного сходства и гомологии последовательностей с Vpx, кодируется всеми лентивирусами приматов, а, в некоторых случаях, он также обладает SAMHD1-активностью. Оба Vpx и Vpr упаковываются в вирион посредством его взаимодействия с областью р6 предшественника р55gag.
[0180] В рассматриваемых частицах, композициях и способах может быть использован любой подходящий белок Vpx и/или Vpr, обладающий SAMHD1-ингибирующей активностью. Белок обладает SAMHD1-ингибирующей активностью, если он способен ингибировать, например, разлагать SAMHD1 в клетке. В некоторых случаях, может быть проведен мониторинг ингибирования путем оценки разложения SAMHD1 в молчащих клетках, таких как покоящиеся T-клетки, после введения частицы вирусного вектора, содержащей такой белок, по сравнению с вирусным вектором, не содержащим такого белка, с применением методов, описанных в литературе или в настоящей заявке. В некоторых вариантах осуществления, Vpx, Vpr и их варианты тестируют на способность ингибировать активность SAMHDl в соответствии с одним или более различными известными методами. См. Lim et al., Cell Host & Microbe, 11, 194-204 (2012) и Lahouassa et al., Nature Immunol, 13:3, 223-229 (2012). В некоторых случаях, мониторинг ингибирования может быть проведен путем оценки эффективности трансдукции в молчащих клетках, таких как покоящиеся T-клетки, после введения частицы вирусного вектора, содержащей такой белок, по сравнению с вирусным вектором, который явлеются сравнимым с этим вектором или является таким же, но не содержит белка Vpx или Vpr, с применением методов, описанных в литературе или в настоящей заявке.
[0181] В некоторых вариантах осуществления изобретения, Vpx и/или Vpr или их вариант или часть предназначены для упаковки и введения в вирион. В некоторых вариантах осуществления изобретения, ген, кодирующий белок Vpx, белок Vpr или вариант или часть белка Vpx или Vpr включены в лентивирусный геном и экспрессируются в нем, если вирусная частица инфицирует клетку-мишень.
[0182] В некоторых вариантах осуществления изобретения, SAMHD1-ингибирующий белок представляет собой белок Vpx, который кодируется лентивирусом дикого типа, таким как лентивирус примата дикого типа или их вариант или часть, обладающие SAMHD1-ингибирующей активностью (см., например, Fregoso (2013) PLoS Pathogens, 9:e1003496). Лентивирусами приматов, которые кодируют Vpx, являются ВИЧ-2/SIVsmc-родственные и SIVrcm/SIVmnd2-родственные вирусы линии дифференцировки (Lim et al. (2012) Cell Host & Microbe, 11:194-204), такие как ВИЧ-2, SIV черного мангабея (SIVsm), SIV красноголового мангабея (SIVrcm) и SIV макака (SIVmac), SIV мандрила (SIVmnd2), SIV дрила (SIVdrl), SIV свинохвостого макака (SIVmne).
[0183] В некоторых вариантах осуществления изобретения, частицы ретровирусного вектора, такие как частицы лентивирусного вектора, содержат белок Vpx, кодируемый ВИЧ-2, SIVsm, SIVrcm, SIVmac, SIVmnd2, SIVdrl, SIVmne, или их вариант или часть, которые обладают SAMHD1-ингибирующей активностью. В некоторых вариантах осуществления изобретения, белок Vpx имеет аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 1 (SIVmac Vpx) или представляет собой функциональный фрагмент или часть такого белка. В некоторых вариантах осуществления изобретения, белок Vpx имеет аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 2 (SIVsm Vpx) или представляет собой функциональный фрагмент или часть такого белка. В некоторых вариантах осуществления изобретения, белок Vpx имеет аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, или 99% идентична SEQ ID NO: 3 (SIVrcm Vpx) или представляет собой функциональный фрагмент или часть такого белка. В некоторых вариантах осуществления изобретения, белок Vpx имеет аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, или 99% идентична SEQ ID NO: 4 (ВИЧ-2) или представляет собой функциональный фрагмент или часть такого белка. В некоторых вариантах осуществления изобретения, белок Vpx имеет аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, или 99% идентична SEQ ID NO: 16 (SIVmnd2) или представляет собой функциональный фрагмент или часть такого белка. В некоторых вариантах осуществления изобретения, белок Vpx имеет аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, или 99% идентична SEQ ID NO: 17 (SIVdrl) или представляет собой функциональный фрагмент или часть такого белка. В некоторых вариантах осуществления изобретения, белок Vpx имеет аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, или 99% идентична SEQ ID NO: 18 (SIVmne) или представляет собой функциональный фрагмент или часть такого белка.
[0184] В некоторых вариантах осуществления изобретения, SAMHD1-ингибирующим белком является белок Vpr, который обладает SAMHD1-ингибирующей активностью. Vpr обычно кодируется природными лентивирусами. Но не все белки Vpr обладают SAMHD1-ингибирующей активностью. Так, например, сообщалось, что Vpr от SIVdeb, SIVmus, SIVagm, SIVden, SIVtal, SIVgsn, SIVmon и SIVsyk обладают SAMHD1-ингибирующей активностью (Lim et al. (2012) Cell Host & Microbe, 11:194-204).
[0185] В некоторых вариантах осуществления изобретения, SAMHD1-ингибирующим белком являются SIVdeb Vpr, SIVmus Vpr, SIVagm Vpr, SIVden Vpr, SIVtal Vpr, SIVgsn Vpr, SIVmon Vpr или SIVsyk Vpr или их вариант или часть, обладающие SAMHD1-ингибирующей активностью. В некоторых вариантах осуществления изобретения, белок Vpr имеет аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 5 (SIVdeb) или представляет собой его функциональный фрагмент или часть. В некоторых вариантах осуществления изобретения, белок Vpr имеет аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 6 (SIVmus) или представляет собой его функциональный фрагмент или часть. В некоторых вариантах осуществления изобретения, белок Vpr имеет аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 7 (SIVagm Vpr) или представляет собой его функциональный фрагмент или часть. В некоторых вариантах осуществления изобретения, белок Vpr имеет аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 8 (SIVagm Vpr) или представляет собой его функциональный фрагмент или часть. В некоторых вариантах осуществления изобретения, белок Vpr имеет аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 9 (SIVdeb Vpr) или представляет собой его функциональный фрагмент или часть. В некоторых вариантах осуществления изобретения, белок Vpr имеет аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 10 (SIVden Vpr) или представляет собой его функциональный фрагмент или часть. В некоторых вариантах осуществления изобретения, белок Vpr имеет аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 11 (SIVtal Vpr) или представляет собой его функциональный фрагмент или часть. В некоторых вариантах осуществления изобретения, белок Vpr имеет аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 12 (SIVgsn Vpr) или представляет собой его функциональный фрагмент или часть. В некоторых вариантах осуществления изобретения, белок Vpr имеет аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 13 (SIVgsn Vpr) или представляет собой его функциональный фрагмент или часть. В некоторых вариантах осуществления изобретения, белок Vpr имеет аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 14 (SIVmon Vpr) или представляет собой его функциональный фрагмент или часть. В некоторых вариантах осуществления изобретения, белок Vpr имеет аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 15 (SIVsyk Vpr) или представляет собой его функциональный фрагмент или часть.
[0186] В некоторых вариантах осуществления изобретения, SAMHD1-ингибирующий белок, такой как белок Vpx или Vpr, является гетерологичными для вируса. В этом контексте, термин «гетерологичный» означает, что белок происходит от другого вирусного семейства, класса или вида, отличающегося от семейства класса или вида вируса, в который его вводят. Так, например, в некоторых аспектах, белок Vpx от SIVmac может быть введен в частицу вектора ВИЧ-1. В других аспектах, белок Vpx, происходящий от любого лентивируса, такого как SIVmac, может быть введен в гамма-ретровирус, такой как MLV.
[0187] В некоторых вариантах осуществления изобретения, SAMHD1-ингибирующий белок, такой как белок Vpx или Vpr, ингибирует, например, разлагает человеческий SAMHD1, например, представленный в SEQ ID NO:19 (Lim et al. (2012) Cell Host & Microbe, 11:194-204). В некоторых вариантах осуществления изобретения, белок Vpx, который разлагает человеческий SAMHD1, кодируется ВИЧ-2 или SIVmac или представляет собой вариант или функциональный фрагмент или часть белка, разлагающего человеческий SAMHD1. Так, например, в некоторых вариантах осуществления изобретения, белок Vpx имеет аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 1 или SEQ ID NO:4 или представляет собой функциональный фрагмент или часть белка, разлагающего человеческий SAMHD1. В некоторых вариантах осуществления изобретения, белок Vpr, который разлагает человеческой SAMHD1, может кодироваться SIVdeb или SIVmus или представляет собой вариант или функциональный фрагмент или часть белка, разлагающего человеческий SAMHD1. Так, например, в некоторых вариантах осуществления изобретения, белок Vpr имеет аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 5 или SEQ ID NO:6 или представляет собой функциональный фрагмент или часть белка, разлагающего человеческий SAMHD1.
[0188] В некоторых вариантах осуществления изобретения, вариантами являются белки, содержащие одну или более аминокислотных делеций, инсерций и/или замен по сравнению с последовательностью белка дикого типа или эталонного белка Vpx или Vpr. В некоторых случаях, вариантами являются либо неконсервативные, либо консервативные замены. В некоторых случаях, информация о выравнивании последовательностей белков Vpx и/или белков Vpr может быть использована для получения функциональных вариантов и вариантов функциональных фрагментов Vpx или Vpr. Так, например, одна или более консервативных или неконсервативных замен могут быть введены в положения, которые отличаются у вирусов, кодирующих белок Vpx или Vpr.
[0189] Так, например, в некоторых вариантах осуществления изобретения, остатки, которые являются идентичными у белков Vpx, кодируемых SIV и ВИЧ-2, не варьируются или не изменяются в варианте описанного здесь белка Vpx. Так, например, было показано, что нижеследующие мутации снижают или отменяют активность Vpx: делеция богатого пролином С-концевого 11 остатка, Ser13Ala, Lys84Ala/Lys85Ala, Thr17Ala, Thr28Ala, Gly86Ala/Cys87Ala, Ser13Ala/Thr17Ala/Thr28Ala, His39Ala, Tyr66Ala/Tyr69Ala/Tyr71Ala, Trp49Ala/Trp53Ala/Trp56Ala, Lys68Ala/Lys77Ala, Gln76Ala, Pro9Gly, Asn12Ala, Glu15Ala, Glu16Ala, Phe80Ala, где каждый остаток представлен по сравнению с остатками в SEQ ID NO: 1. См. Goujon et al., Gramberg et al. (2010) Journal of Virology, 84:1387-1396., Laguette et al. (2011). Следовательно, в некоторых вариантах осуществления изобретения, вариант белка Vpx не содержит замены в положении остатка, соответствующего любому из вышеуказанных остатков в SEQ ID NO:1, которые, как было показано, необходимы для сообщения активности. В некоторых вариантах осуществления изобретения, вариант белка Vpx содержит консервативную замену, но не неконсервативную замену в остатке, соответствующем любому из вшеуказанных остатков в SEQ ID NO:1.
[0190] В некоторых вариантах осуществления изобретения, варианты белка Vpx или Vpr могут включать мутацию, которая, как известно, не влияет на SAMHD1-ингибирующую активность (см. Goujon et al., J Virol, 82:12335-12345 (2008)). Так, например, в некоторых вариантах осуществления изобретения, мутации, такие как аминокислотные замены, соответствующие одной или более мутациям Asn26Ala, Ser52Ala, и Ser63Ala/Ser65Ala в SEQ ID NO: 1, не влияют на функцию Vpx.
[0191] В некоторых вариантах осуществления изобретения, для ингибирования и/или разложения SAMHD1 необходима локализация в ядре SAMHD1-ингибирующего белка, такого как белок Vpx, белок Vpr или их вариант или часть. Vpx индуцирует убихитинизацию SAMHD1 и разложение в ядре, так, чтобы оба SAMHD1 и Vpx локализовались в ядре. Таким образом, в некоторых вариантах осуществления изобретения, белок Vpx, белок Vpr или их вариант или часть содержат сигнал локализации в ядре. В некоторых вариантах осуществления изобретения, белок Vpx или его вариант или часть содержат сигнал локализации в ядре, соответствующий остаткам 62-80 или 65-72 в SEQ ID NO:4.
[0192] В некоторых вариантах осуществления изобретения, ингибирование и/или разложение SAMHD1 включает связывание и/или взаимодействие с DCAF. Таким образом, в некоторых вариантах осуществления изобретения, белок Vpx, белок Vpr или их вариант или часть связываются с DCAF. В некоторых вариантах осуществления изобретения, белок Vpx, белок Vpr или их вариант или часть содержат мотив Wx4Φx2Φx3AΦxH (представленный в SEQ ID NO: 26; Wei et al. (2012) Cell Microbiol., 14:1745-56). Так, например, в некоторых вариантах осуществления изобретения, белок Vpx, белок Vpr или их вариант или часть содержат мотив Wx4Φx2Φx3AΦxH в остатках, соответствующих остаткам 24-39 в SEQ ID NO:1 или SEQ ID NO:4. В некоторых вариантах осуществления изобретения, белок Vpx, белок Vpr или их вариант или часть содержат мотив Gln (Q) в положении, соответствующем положению 76 SEQ ID NO:1.
[0193] В некоторых вариантах осуществления изобретения, белок Vpx, белок Vpr или их вариант или часть содержат остатки, соответствующие остаткам N-концевой части, спирали 1, спирали 2 и/или спирали 3 белка (Gramberg et al. (2010) Journal of Virology, 84:1387-1396). Так, например, в некоторых вариантах осуществления изобретения, белок Vpx, белок Vpr или их вариант или часть содержат последовательность аминокислот, соответствующих остаткам 1-86 аминокислотной последовательности, представленной в SEQ ID NO:1, или их вариант с аминокислотными заменами, который по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичен остаткам 1-86 SEQ ID NO: 1 и обладает SAMHD1-ингибирующей активностью.
[0194] В некоторых вариантах осуществления изобретения, белок Vpx, белок Vpr или их функциональную часть или вариант упаковывают в вирион, что позволяет белкам ингибировать, например, разлагать SAMHD1 после инфицирования клетки-хозяина перед интеграцией провируса. В некоторых вариантах осуществления изобретения, частица ретровирусного вектора содержит домен p6 белка Gag, который стимулирует упаковывание SAMHD1-ингибирующего лентивирусного белка в ретровирусный вектор. Vpx и Vpr упаковывают посредством взаимодействий с мотивом упаковки аминокислот в области p6 полипептида-предшественника Gag (p6gag). В некоторых вариантах осуществления изобретения, достаточный уровень введения достигается с использованием эндогенного вирусного p6 Gag. В некоторых вариантах осуществления изобретения, введение осуществляется и/или облегчается с использованием химерного p6 Gag, содержащего упаковывающий мотив, который стимулирует упаковывание.
[0195] В некоторых вариантах осуществления изобретения, упаковывающий мотив соответствует мотиву, который присутствует в N-концевой области P6, содержащей аминокислоты, соответствующие аминокислотным остаткам 17-23 SEQ ID NO:21 (Accola et al. (1999) J. Virol., 73:9992-9). Так, например, в некоторых вариантах осуществления изобретения, упаковывающий мотив содержит лейцин-содержащий мотив DXAXXLL (SEQ ID NO:22).
[0196] В некоторых вариантах осуществления изобретения, частицу ретровирусного вектора модифицируют путем введения упаковывающего мотива, который опосредует и/или стимулирует упаковывание Vpx или Vpr в вирион. В некоторых вариантах осуществления изобретения, упаковывающий мотив встраивают в соответствующее положение эндогенной вирусной области p6. В некоторых вариантах осуществления изобретения, упаковывающий мотив содержит аминокислотные последовательности DPAVDLL (SEQ ID NO:23) или DPAVDLLKNY (SEQ ID NO:24), которые соответствуют аминокислотам 17-23 или аминокислотам 17-26, соответственно, SIVmac p6, представленного в SEQ ID NO:21. В некоторых вариантах осуществления изобретения, упаковывающий мотив представляет собой любой упаковывающий мотив, описанный в опубликованной заявке на патент США No. US2013/0183334. В некоторых вариантах осуществления изобретения, перенос мотива в соответствующее положение ВИЧ-1 p6, представленного в SEQ ID NO:20, приводит к упаковыванию Vpx в вирионы ВИЧ-1.
[0197] В некоторых вариантах осуществления изобретения, белок Vpx, белок Vpr или их вариант или часть упаковывают без модификации области p6 белка Gag. В некоторых таких вариантах, ретровирусный вектор происходит от ВИЧ-1, и достаточный уровень его введения достигается с использованием p6 Gag ВИЧ-1. В некоторых таких вариантах, SAMHD1-ингибирующий белок представляет собой SIVmac Vpx или его вариант или часть, которые обладают SAMHD1-ингибирующей активностью.
[0198] В некоторых вариантах осуществления изобретения, ретровирусный вектор происходит от ВИЧ-1 и содержит химерный или гибридный домен p6, содержащий p6 ВИЧ-1, в который был встроен мотив, упаковывающий SIVmac p6. Так, например, в некоторых вариантах осуществления изобретения, ретровирусный вектор содержит химерный или гибридный домен p6, содержащий, в следующем порядке: аминокислотные остатки, соответствующие аминокислотам 1-14 ВИЧ-P6, представленным в SEQ ID NO:20, аминокислоты, соответствующие SIVmac-упаковывающему мотиву, представленному как остатки 17-26 SEQ ID NO:21, и C-концевую часть p6 ВИЧ-1, соответствующую аминокислотным остаткам 21-52 SEQ ID NO:20 (обозначенные SIV 17-23b; см. US2013/0183334; Sunseri et al. (2011) J. Virol., 85:6263-6274). Так, например, в некоторых вариантах осуществления изобретения, гибридный или химерный домен p6 содержит аминокислотную последовательность, представленную в SEQ ID NO:25.
3. Нуклеиновая кислота, кодирующая гетерологичный белок
[0199] В некоторых вариантах осуществления изобретения, вирусный вектор содержит нуклеиновую кислоту, которая кодирует гетерологичный рекомбинантный белок. В некоторых вариантах осуществления изобретения, гетерологичная рекомбинантная молекула представляет собой рекомбинантный рецептор, например, антигенный рецептор, SB-транспозоны, например, для сайленсинга гена, транспозоны, заключенные в капсид, гомологичную двухцепочечную нуклеиновую кислоту, например, для геномной рекомбинации, или репортерные гены (например, флуоресцентные белки, такие как GFP) или люцифераза).
[0200] В некоторых вариантах осуществления изобретения, вирусный вектор содержит нуклеиновую кислоту, которая кодирует рекомбинантный рецептор и/или химерный рецептор, такой как гетерологичный белок-рецептор. Рекомбинантный рецептор, такой как гетерологичный рецептор, может включать антигенные рецепторы, такие как функциональные антигенные не-TCR рецепторы, включая химерные антигенные рецепторы (CAR) и другие антигенсвязывающие рецепторы, такие как трансгенные T-клеточные рецепторы (TCR). Рецепторы могут также включать и другие рецепторы, такие как другие химерные рецепторы, например, рецепторы, которые связываются с конкретными лигандами и имеют трансмембранные и/или внутриклеточные сигнал-передающие домены, аналогичные доменам, присутствующим в CAR.
[0201] В любом из таких примеров, нуклеиновую кислоту встраивают или вводят в область вирусного вектора, такого как вектор, присутствующий, главным образом, в неосновной области вирусного генома. В некоторых вариантах осуществления изобретения, нуклеиновую кислоту встраивают в вирусный геном вместо некоторых вирусных последовательностей для продуцирования вируса, дефектного по репликации.
[0202] В некоторых вариантах осуществления изобретения, кодируемый рекомбинантный антигенный рецептор, например, CAR, представляет собой рецептор, способный специфически связываться с одним или более лигандами на клетке или на участке, пораженном заболеванием, таким как рак, инфекционное заболевание, воспалительное или аутоиммунное заболевание или другое заболевание или расстройство, включая описанные здесь заболевания, подвергаемые лечению с применением описанных здесь способов и композиций.
[0203] В некоторых вариантах осуществления изобретения, репрезентативный антиген представляет собой или включает интегрин ανβ6 (интегрин avb6), антиген, ответственный за созревание В-клеток (BCMA), B7-H3, B7-H6, угольная кислота-ангидразу 9 (CA9, также известную как CAIX или G250), антиген рака яичек, антиген рака яичек 1B (CTAG, также известный как NY-ESO-1 и LAGE-2), карциноэмбриональный антиген (CEA), циклин, циклин A2, мотив C-C лиганда хемокина 1 (CCL-1), CD19, CD20, CD22, CD23, CD24, CD30, CD33, CD38, CD44, CD44v6, CD44v7/8, CD123, CD138, CD171, белок эпидермального фактора роста (EGFR), усеченный белок эпидермального фактора роста (tEGFR), рецептор эпидермального фактора роста типа III с мутацией (EGFR vIII), эпителиальный гликопротеин 2 (EPG-2), эпителиальный гликопротеин 40 (EPG-40), эфрин B2, рецептор эфрина A2 (EPHa2), рецептор эстрогена, рецептор 5, подобный Fc-рецептору (FCRL5; также известный как гомолог Fc-рецептора 5 или FCRH5), фетальный рецептор ацетилхолина (фетальный AchR), белок, связывающийся с фолатом (FBP), рецептор фолата альфа, ганглиозид GD2, O-ацетилированный GD2 (OGD2), ганглиозид GD3, гликопротеин 100 (gp100), рецептор, связанный с G-белком 5D (GPCR5D), Her2/neu (тирозинкиназный рецептор erb-B2), Her3 (erb-B3), Her4 (erb-B4), димеры erbB, человеческий высокомолекулярный антиген, ассоциированный с меланомой (HMW-MAA), антиген поверхности вируса гепатита B, человеческий лейкоцитарный антиген A1 (HLA-A1), человеческий лейкоцитарный антиген A2 (HLA-A2), рецептор IL-22 альфа (IL-22Ra), рецептор IL-13 альфа 2 (IL-13Ra2), рецептор домена киназной вставки (kdr), легкую цепь каппа, клеточно-адгезивную молекулу L1 (L1-CAM), эпитоп CE7 L1-CAM, богатый лейцином повтор, содержащий член семейства А8 (LRRC8A), антиген Льюиса Y, ассоциированный с меланомой антиген (MAGE)-A1, MAGE-A3, MAGE-A6, мезотелин, c-Met, мышиный цитомегаловирус (CMV), муцин 1 (MUC1), MUC16, лиганды антигена члена D группы 2 природных клеток-киллеров (NKG2D), мелан A (MART-1), клеточно-адгезивную молекулу нервных клеток (NCAM), онкофетальный антиген, преимущественно экспрессируемый антиген меланомы (PRAME), рецептор прогестерона, антиген, специфичный к предстательной железе, антиген стволовых клеток предстательной железы (PSCA), мембранный антиген, специфичный к предстательной железе (PSMA), рецептор-«сироту» 1, подобный тирозинкиназному рецептору (ROR1), сурвивин, трофобластный гликопротеин (TPBG, также известный как 5T4), опухолеассоциированный гликопротеин 72 (TAG72), рецептор васкулярного эндотелиального фактора роста (VEGFR), рецептор васкулярного эндотелиального фактора роста 2 (VEGFR2), антиген опухоли Вильмса 1 (WT-1), патоген-специфический антиген или антиген, ассоциированный с универсальной меткой и/или биотинилированные молекулы и/или молекулы, экспрессируемые ВИЧ, HCV, HBV или другими патогенами. В некоторых вариантах осуществления изобретения, антигены, которые являются мишенями для рецепторов, включают антигены, ассоциированные со злокачественностью В-клеток, такие как любые антигены из числа известных В-клеточных маркеров. В некоторых вариантах осуществления изобретения, антиген представляет собой или включает CD20, CD19, CD22, ROR1, CD45, CD21, CD5, CD33, Ig-каппа, Ig-лямбда, CD79a, CD79b или CD30.
[0204] В некоторых вариантах осуществления изобретения, репрезентативными антигенами являются тирозинкиназный рецептор-«сирота» ROR1, tEGFR, Her2, Ll-CAM, CD19, CD20, CD22, мезотелин, CEA, и антиген поверхности вируса гепатита B, антифолатный рецептор, CD23, CD24, CD30, CD33, CD38, CD44, EGFR, EGP-2, EGP-4, 0EPHa2, ErbB2, 3, или 4, FBP, фетальный рецептор ацетилхолина, GD2, GD3, HMW-MAA, IL-22R-альфа, IL-13R-альфа2, kdr, легкая цепь каппа, антиген Льюиса Y, клеточно-адгезивная молекула L1, MAGE-A1, мезотелин, лиганды MUC1, MUC16, PSCA, NKG2D, NY-ESO-1, MART-1, gp100, онкофетальный антиген, ROR1, TAG72, VEGF-R2, карциноэмбриональный антиген (CEA), антиген, специфичный к предстательной железе, PSMA, Her2/neu, рецептор эстрогена, рецептор прогестерона, эфрин B2, CD123, CS-1, c-Met, GD-2, и MAGE A3, CE7, антиген опухоли Вильмса 1 (WT-1), циклин, такой как циклин A1 (CCNA1), и/или биотинилированные молекулы, и/или молекулы, экспрессируемые ВИЧ, HCV, HBV, HPV, и/или другими патогенами и/или их онкогенными вариантами, и/или характерные или специфичные для этих патогенов.
[0205] В некоторых вариантах осуществления изобретения, антиген представляет собой или включает патоген-специфический антиген или антиген, экспрессируемый патогеном. В некоторых вариантах осуществления изобретения, антигеном являются вирусный антиген (такой как вирусный антиген, происходящий от ВИЧ, HCV, HBV и т.п.), бактериальные антигены и/или паразитарные антигены.
[0206] В некоторых вариантах осуществления изобретения, антигенные рецепторы, включая CAR и рекомбинантные TCR, и их продуцирование и введение, описаны, например, в публикациях Международных патентных заявок №№ WO200014257, WO2013126726, WO2012/129514, WO2014031687, WO2013/166321, WO2013/071154, WO2013/123061, в публикациях заявок на патент США US2002131960, US2013287748, US20130149337, в патентах США NN: 6451995, 7446190, 8252592, 8339645, 8398282, 7446179, 6410319, 7070995, 7265209, 7354762, 7446191, 8324353, и 8479118, и в Европейской патентной заявке № EP2537416, и/или в публикациях Sadelain et al., Cancer Discov. 2013 April; 3(4): 388-398; Davila et al. (2013) PLoS ONE 8(4): e61338; Turtle et al., Curr. Opin. Immunol., 2012 October; 24(5): 633-39; Wu et al., Cancer, 2012 March 18(2): 160-75.
а. Химерные антигенные рецепторы
[0207] В некоторых вариантах осуществления изобретения, нуклеиновая кислота, содержащаяся в геноме вирусного вектора, кодирует химерный антигенный рецептор (CAR). CAR представляет собой, по существу, генетически сконструированный рецептор с внеклеточным лиганд-связывающим доменом, таким как внеклеточная часть, содержащая антитело или его фрагмент, связанные с одним или более внутриклеточными сигнал-передающими компонентами. В некоторых вариантах осуществления изобретения, химерный антигенный рецептор включает трансмембранный домен и/или внутриклеточный домен, соединяющий внеклеточный домен и внутриклеточный сигнал-передающий домен. Такие молекулы обычно имитируют или аппроксимируют сигнал, передаваемый посредством природного антигенного рецептора и/или сигнал, передаваемый посредством такого рецептора, в комбинации с костимулирующим рецептором.
[0208] В некоторых вариантах осуществления изобретения, CAR конструируют так, чтобы они были специфичными к конкретному маркеру, такому как маркер, экспрессируемый в клетках конкретного типа, которые являются мишенями для адоптивной терапии, например, маркер рака и/или любой из описанных антигенов. Таким образом, CAR обычно включает один или более антигенсвязывающий фрагментов, доменов или частей антитела, или один или более вариабельных доменов антител, и/или молекул антитела. В некоторых вариантах осуществления изобретения, CAR включает антигенсвязывающую часть или части молекулы антитела, такие как вариабельная область тяжелой цепи (VH) или ее антиген-связывающая часть, или одноцепочечный фрагмент антитела (ScFv), происходящие от вариабельной области тяжелой цепи (VH) и вариабельной области легкой цепи (VL) моноклонального антитела (mAb).
[0209] В некоторых своих вариантах, настоящее изобретение относится к сконструированным клеткам, таким как Т-клетки, которые экспрессируют CAR со специфичностью к конкретному антигену (или маркеру или лиганду), такому как антиген, экспрессируемый на поверхности клеток определенного типа. В некоторых вариантах осуществления изобретения, антигеном является полипептид. В некоторых вариантах осуществления изобретения, антигеном является углевод или другая молекула. В некоторых вариантах осуществления изобретения, антиген селективно экспрессируется или сверхэкспрессируется на клетках, вызывающих заболевание или расстройство, например, опухоль, или на патогенных клетках, по сравнению с нормальными клетками или тканями, или клетками или тканями, не являющимися мишенями. В других вариантах осуществления изобретения, антиген экспрессируется на нормальных клетках и/или экспрессируется на сконструированных клетках.
[0210] В конкретных вариантах осуществления изобретения, рекомбинантный рецептор, такой как химерный рецептор, содержит внутриклеточную сигнал-передающую область, которая включает цитоплазматический сигнал-передающий домен или область (также называемую внутриклеточным сигнал-передающим доменом или областью), такую как цитоплазматическая (внутриклеточная) область, способная индуцировать первичный сигнал активации в Т-клетке, например, цитоплазматический сигнал-передающий домен или область компонента T-клеточного рецептора (TCR) (например, цитоплазматический сигнал-передающий домен или область цепи дзета, цепи CD3-дзета (CD3ζ) или их функциональный вариант или сигнал-передающая часть), и/или включающая мотив активации на основе иммунорецептора тирозина (ITAM).
[0211] В некоторых вариантах осуществления изобретения, химерный рецептор также содержит внеклеточный лиганд-связывающий домен, который специфически связывается с антигеном-лигандом (например, антигеном). В некоторых вариантах осуществления изобретения, химерный рецептор представляет собой CAR, содержащий внеклеточный антиген-распознающий домен, который специфически связывается с антигеном. В некоторых вариантах осуществления изобретения, лиганд, такой как антиген, представляет собой белок, экспрессируемый на поверхности клеток. В некоторых вариантах осуществления изобретения, CAR представляет собой ТCR-подобный CAR, а антиген представляет собой процессированный пептидный антиген, такой как пептид антиген внутриклеточного белка, который, подобно TCR, распознается на клеточной поверхности в окружении молекулы главного комплекса гистосовместимости (MHC).
[0212] Репрезентативные антигенные рецепторы, включая CAR и способы конструирования и введения таких рецепторов в клетки, описаны, например, в публикациях Международных патентных заявок №№ WO200014257, WO2013126726, WO2012/129514, WO2014031687, WO2013/166321, WO2013/071154, WO2013/123061, в публикациях заявок на патент США US2002131960, US2013287748, US20130149337, в патентах США NN: 6451995, 7446190, 8252592, 8339645, 8398282, 7446179, 6410319, 7070995, 7265209, 7354762, 7446191, 8324353, и 8479118, и в Европейской патентной заявке № EP2537416, и/или описаны в публикации Sadelain et al., Cancer Discov. 2013 April; 3(4): 388-398; Davila et al. (2013) PLoS ONE 8(4): e61338; Turtle et al., Curr. Opin. Immunol., 2012 October; 24(5): 633-39; Wu et al., Cancer, 2012 March 18(2): 160-75. В некоторых аспектах изобретения, антигенными рецепторами являются CAR, описанный в патенте США No. 7446190 и публикации Международнной патентной заявки No.: WO/2014055668 A1. Примерами CAR являются CAR, описанные в любой из вышеупомянутых публикаций, таких как WO2014031687, US 8339645, US 7446179, US 2013/0149337, патент США No.: 7446190, патент США No.: 8389282, Kochenderfer et al., 2013, Nature Reviews Clinical Oncology, 10, 267-276 (2013); Wang et al. (2012) J. Immunother. 35(9): 689-701; и Brentjens et al., Sci Transl Med. 2013 5(177). См., также WO2014031687, US 8339645, US 7446179, US 2013/0149337, патент США No: 7446190 и патент США No.: 8389282.
[0213] В некоторых вариантах осуществления изобретения, CAR конструируют так, чтобы он был специфичным к конкретному антигену (маркеру или лиганду), такому как антиген, экспрессируемый в клетках конкретного типа, которые являются мишенями для адоптивной терапии, например, маркер рака и/или антиген, который, как предполагается, индуцирует снижение ответа, такой как антиген, экспрессируемый на нормальных или непораженных клетках. Таким образом, CAR обычно включает одну или более антигенсвязывающих молекул внеклеточной части, таких как один или более антигенсвязывающих фрагментов, доменов или частей, или один или более вариабельных доменов антител и/или молекул антитела. В некоторых вариантах осуществления изобретения, CAR включает антигенсвязывающую часть или части молекулы антитела, такие как одноцепочечный фрагмент антитела (ScFv), происходящий от вариабельной области тяжелой цепи (VH) и вариабельной области легкой цепи (VL) моноклонального антитела (mAb).
[0214] В некоторых вариантах осуществления изобретения, антитело или его антигенсвязывающая часть экспрессируются на клетках как часть рекомбинантного рецептора, такого как антигенный рецептор. Антигенными рецепторами являются, среди прочих, функциональные антигеннные не-TCR рецепторы, такие как химерные антигенные рецепторы (CAR). Обычно, CAR, содержащий антитело или его антигенсвязывающий фрагмент, обладающий TCR-подобной специфичностью, направленной против комплексов пептид-MHC, может также сокращенно обозначаться здесь как TCR-подобный CAR. В некоторых вариантах осуществления изобретения, внеклеточный антигенсвязывающий домен, специфичный к комплексу «МНС-пептид» TCR-подобного CAR, связан с одним или более внутриклеточными сигнал-передающими компонентами, а в некоторых аспектах, посредством линкеров и/или трансмембранного(ых) домена(ов). В некоторых вариантах осуществления изобретения, такие молекулы обычно имитируют или аппроксимируют сигнал, передаваемый природным ангиогенным рецептором, таким как TCR, и необязательно, сигнал, передаваемый таким рецептором в комбинации с костимулирующим рецептором.
[0215] В некоторых вариантах осуществления изобретения, рекомбинантный рецептор, такой как химерный рецептор (например, CAR), включает лиганд-связывающий домен, который связывается, например, специфически связывается, с антигеном (или лигандом). Антигенами-мишенями химерных рецепторов являются антигены, которые экспрессируются при определенных заболеваниях, расстройствах или в клетках определенного типа, которые являются мишенями для адоптивной клеточной терапии. Такими заболеваниями и расстройствами являются пролиферативные, опухолевые и злокачественные заболевания и расстройства, включая рак и опухоли, включая злокачественные новообразования кроветворной системы, злокачественные новообразования иммунной системы, такие как лимфомы, лейкозы и/или миеломы, такие как B-, T- и миелоидные лейкозы, лимфомы и множественные миеломы.
[0216] В некоторых вариантах осуществления изобретения, антигеном (или лигандом) является полипептид. В некоторых вариантах осуществления изобретения, таким антигеном является углевод или другая молекула. В некоторых вариантах осуществления изобретения, антиген (или лиганд) селективно экспрессируется или сверхэкспрессируется на клетках, вызывающих заболевание или расстройство, например, опухоль, или на патогенных клетках, по сравнению с нормальными клетками или тканями, или клетками или тканями, не являющимися мишенями. В других вариантах осуществления изобретения, антиген экспрессируется на нормальных клетках и/или экспрессируется на сконструированных клетках.
[0217] В некоторых вариантах осуществления изобретения, CAR содержит антитело или его антигенсвязывающий фрагмент (например, ScFv), который специфически распознает антиген, такой как интактный антиген, экспрессируемый на поверхности клетки.
[0218] В некоторых вариантах осуществления изобретения, антиген (или лиганд) представляет собой опухолевый антиген или маркер рака. В некоторых вариантах осуществления изобретения, антиген (или лиганд) представляет собой или включает интегрин ανβ6 (интегрин avb6), антиген, ответственный за созревание В-клеток (BCMA), B7-H3, B7-H6, угольная кислота-ангидразу 9 (CA9, также известную как CAIX или G250), антиген рака яичек, антиген рака яичек 1B (CTAG, также известный как NY-ESO-1 и LAGE-2), карциноэмбриональный антиген (CEA), циклин, циклин A2, мотив C-C лиганда хемокина 1 (CCL-1), CD19, CD20, CD22, CD23, CD24, CD30, CD33, CD38, CD44, CD44v6, CD44v7/8, CD123, CD138, CD171, белок эпидермального фактора роста (EGFR), усеченный белок эпидермального фактора роста (tEGFR), рецептор эпидермального фактора роста типа III с мутацией (EGFR vIII), эпителиальный гликопротеин 2 (EPG-2), эпителиальный гликопротеин 40 (EPG-40), эфрин B2, рецептор эфрина A2 (EPHa2), рецептор эстрогена, рецептор 5, подобный Fc-рецептору (FCRL5; также известный как гомолог Fc-рецептора 5 или FCRH5), фетальный рецептор ацетилхолина (фетальный AchR), белок, связывающийся с фолатом (FBP), рецептор фолата альфа, ганглиозид GD2, O-ацетилированный GD2 (OGD2), ганглиозид GD3, гликопротеин 100 (gp100), рецептор, связанный с G-белком 5D (GPCR5D), Her2/neu (тирозинкиназный рецептор erb-B2), Her3 (erb-B3), Her4 (erb-B4), димеры erbB, человеческий высокомолекулярный антиген, ассоциированный с меланомой (HMW-MAA), антиген поверхности вируса гепатита B, человеческий лейкоцитарный антиген A1 (HLA-A1), человеческий лейкоцитарный антиген A2 (HLA-A2), рецептор IL-22 альфа (IL-22Ra), рецептор IL-13 альфа 2 (IL-13Ra2), рецептор домена киназной вставки (kdr), легкую цепь каппа, клеточно-адгезивную молекулу L1 (L1-CAM), эпитоп CE7 L1-CAM, богатый лейцином повтор, содержащий член семейства А8 (LRRC8A), антиген Льюиса Y, ассоциированный с меланомой антиген (MAGE)-A1, MAGE-A3, MAGE-A6, мезотелин, c-Met, мышиный цитомегаловирус (CMV), муцин 1 (MUC1), MUC16, лиганды антигена члена D группы 2 природных клеток-киллеров (NKG2D), мелан A (MART-1), клеточно-адгезивную молекулу нервных клеток (NCAM), онкофетальный антиген, преимущественно экспрессируемый антиген меланомы (PRAME), рецептор прогестерона, антиген, специфичный к предстательной железе, антиген стволовых клеток предстательной железы (PSCA), мембранный антиген, специфичный к предстательной железе (PSMA), рецептор-«сироту» 1, подобный тирозинкиназному рецептору (ROR1), сурвивин, трофобластный гликопротеин (TPBG, также известный как 5T4), опухолеассоциированный гликопротеин 72 (TAG72), рецептор васкулярного эндотелиального фактора роста (VEGFR), рецептор васкулярного эндотелиального фактора роста 2 (VEGFR2), антиген опухоли Вильмса 1 (WT-1), патоген-специфический антиген или антиген, ассоциированный с универсальной меткой и/или биотинилированные молекулы и/или молекулы, экспрессируемые ВИЧ, HCV, HBV или другими патогенами. В некоторых вариантах осуществления изобретения, антигены, которые являются мишенями для рецепторов, включают антигены, ассоциированные со злокачественностью В-клеток, такие как любые антигены из числа известных В-клеточных маркеров. В некоторых вариантах осуществления изобретения, антиген представляет собой или включает CD20, CD19, CD22, ROR1, CD45, CD21, CD5, CD33, Ig-каппа, Ig-лямбда, CD79a, CD79b или CD30.
[0219] В некоторых вариантах осуществления изобретения, антиген представляет собой или включает патоген-специфический антиген или антиген, экспрессируемый патогеном. В некоторых вариантах осуществления изобретения, антигеном являются вирусный антиген (такой как вирусный антиген, происходящий от ВИЧ, HCV, HBV и т.п.), бактериальные антигены и/или паразитарные антигены. В некоторых вариантах осуществления изобретения, CAR содержит TCR-подобное антитело, такое как антитело или его антигенсвязывающий фрагмент (например, scFv), который специфически распознает внутриклеточный антиген, такой как опухолеассоциированный антиген, презентированный на клеточной поверхности как комплекс «MHC-пептид». В некоторых вариантах осуществления изобретения, антитело или его антигенсвязывающая часть, которые распознают комплекс «MHC-пептид», могут экспрессироваться на клетках как часть рекомбинантного рецептора, такого как антигенный рецептор. Антигенными рецепторами являются, среди прочих, функциональные антигенные не-TCR рецепторы, такие как химерные антигенные рецепторы (CAR). Вообще говоря, CAR, содержащий антитело или его антигенсвязывающий фрагмент, которые обладают TCR-подобной специфичностью, направленной против комплексов «пептид-MHC», могут также обозначаться как TCR-подобный CAR.
[0220] Термин «главный комплекс гистосовместимости» (МНС) означает белок, обычно гликопротеин, который содержит полиморфный пептид-связывающий сайт или связывающую бороздку, которые могут, в некоторых случаях, образовывать комплекс с пептидными антигенами полипептидов, в том числе, с пептидными антигенами, процессированными по клеточным механизмам. В некоторых случаях, молекулы МНС могут презентироваться или экспрессироваться на клеточной поверхности, включая комплекс с пептидом, то есть, комплекс «MHC-пептид» для презентации антигена в конформации, распознаваемой антигенным рецептором на Т-клетках, таким как TCR или TCR-подобное антитело. Обычно, молекулы МНС класса I являются гетеродимерами, имеющими трансмембранную альфа-цепь, а в некоторых случаях, с тремя α- доменами, и нековалентно связанный β2-микроглобулин. Обычно, молекулы МНС класса II состоят из двух трансмембранных гликопротеинов, α и β, которые оба обычно охватывают всю мембрану. Молекула МНС может включать действующую часть МНС, которая содержит антигенсвязывающий сайт или сайты для связывания с пептидом и последовательности, необходимые для распознавания соответствующим антигенным рецептором. В некоторых вариантах осуществления изобретения, молекулы МНС класса I доставляют пептиды, находящиеся в цитозоле, к клеточной поверхности, где МНС-пептидный комплекс распознается Т-клетками, такими как CD8+-T-клетки, а в некоторых случаях, CD4+-Т-клетки. В некоторых вариантах осуществления изобретения, молекулы МНС класса II доставляют пептиды, находящиеся в везикулярной системе, к клеточной поверхности, где они, обычно, распознаются CD4+-Т-клетками. Как правило, молекулы МНС кодируются группой сцепленных локусов, которые в совокупности обозначаются Н-2 у мышей и называются человеческим лейкоцитарным антигеном (HLA) у человека. Следовательно, обычно человеческий МНС может также называться человеческим лейкоцитарным антигеном (HLA).
[0221] Термин «комплекс МНС-пептид» или «комплекс пептид-МНС» или их варианты, означает комплекс или ассоциацию пептидного антигена и молекулы МНС, например, как правило, посредством нековалентных взаимодействий пептида в связывающей бороздке или в щели молекулы MHC. В некоторых вариантах осуществления изобретения, комплекс МНС-пептид презентируется или экспрессируется на поверхности клеток. В некоторых вариантах осуществления изобретения, комплекс МНС-пептид может специфически распознаваться антигенным рецептором, таким как TCR, TCR-подобный CAR или их антигенсвязывающие части.
[0222] В некоторых вариантах осуществления изобретения, пептид, такой как пептидный антиген или эпитоп полипептида, может ассоциироваться с молекулой MHC, например, для распознавания антигенным рецептором. Обычно пептид происходит от фрагмента или получен на основе фрагмента более крупной биологической молекулы, такой как полипептид или белок. В некоторых вариантах осуществления изобретения, пептид обычно имеет длину приблизительно от 8 и приблизительно до 24 аминокислот. В некоторых вариантах осуществления изобретения, пептид имеет длину от или приблизительно от 9 до 22 аминокислот и распознается в комплексе МНС класса II. В некоторых вариантах осуществления изобретения, пептид имеет длину от или приблизительно от 8 до 13 аминокислот и распознается в комплексе МНС класса I. В некоторых вариантах осуществления изобретения, после распознавания пептида в окружении молекулы MHC, такой как комплекс МНС-пептид, антигенный рецептор, такой как TCR или TCR-подобный CAR, продуцирует или запускает сигнал активации T-клеткам на индуцирование T-клеточного ответа, такого как пролиферация T-клеток, продуцирование цитокинов, цитотоксический T-клеточный ответ или другой ответ.
[0223] В некоторых вариантах осуществления изобретения, TCR-подобное антитело или его антигенсвязывающая часть являются известными или могут быть получены известными методами (см., например, опубликованные заявки на патент США 2002/0150914; US 2003/0223994; US 2004/0191260; US 2006/0034850; США 2007/00992530; US20090226474; US20090304679; и публикацию Международной заявки РСТ WO 03/068201).
[0224] В некоторых вариантах осуществления изобретения, антитело или его антигенсвязывающий фрагмент, которые специфически связываются с комплексом «MHC-пептид», могут быть получены путем иммунизации хозяина эффективным количеством иммуногена, содержащего специфический комплекс «MHC-пептид». В некоторых случаях, пептид комплекса «MHC-пептид» представляет собой эпитоп антигена, способного связываться с МНС, такого как опухолевый антиген, например, универсальный опухолевый антиген, антиген миеломы или другой антиген, описанный ниже. В некоторых вариантах осуществления изобретения, эффективное количество иммуногена затем вводят хозяинау для вырабатывания у него иммунного ответа, где иммуноген сохраняет свою трехмерную форму в течение периода времени, достаточного для вырабатывания иммунного ответа против трехмерной презентации пептида в связывающей бороздке молекулы MHC. После этого, сыворотку, взятую у хозяина, анализируют для того, чтобы определить, продуцируются ли нужные антитела, которые распознают трехмерную презентацию пептида в связывающей бороздке молекулы МНС. В некоторых вариантах осуществления изобретения, полученные антитела могут быть оценены для того, чтобы подтвердить, может ли антитело отличать комплекс «MHC-пептид» от только одной молекулы МНС, одного представляющего интерес пептида и комплекса МНС и несоответствующего пептида. Затем нужные антитела могут быть выделены.
[0225] В некоторых вариантах осуществления изобретения, антитело или его антигенсвязывающий фрагмент, которые специфически связываются с комплексом «MHC-пептид», могут быть получены с применением методов представления библиотеки антител, таких как фаговые библиотеки антител. В некоторых вариантах осуществления изобретения, библиотеки фагового представления мутантного Fab, ScFv или антител других форм могут быть получены, например, путем введения мутаций в члены библиотеки в положениях одного или более остатков CDR или множества CDR. См., например, опубликованную заявку на патент США, No. US20020150914, US2014/0294841; и Cohen CJ et al. (2003) J. Mol. Recogn. 16: 324-332.
[0226] Термин «антитело» используется здесь в самом широком смысле и включает поликлональные и моноклональные антитела, в том числе интактные антитела и функциональные (антиген-связывающие) фрагменты антител, включая антигенсвязывающие (Fab) фрагменты, F(аb')2-фрагменты, Fab'-фрагменты, Fv-фрагменты, фрагменты рекомбинантных IgG (rIgG), вариабельные области тяжелой цепи (VH), способные специфически связываться с антигеном, одноцепочечные фрагменты антител, включая одноцепочечные вариабельные фрагменты (ScFv) и фрагменты однодоменных антител (например, sdAb, sdFv, наноантитела). Этот термин охватывает генетически сконструированные и/или как-либо иначе модифицированные формы иммуноглобулинов, такие как интрантитела, пептиантитела, химерные антитела, полностью человеческие антитела, гуманизованные антитела и гетероконъюгированные антитела, мультиспецифические антитела, например, биспецифические антитела, диантитела, триантитела и тетраантитела, тандемный ди-ScFv, тандемный три-ScFv. Если это не оговорено особо, то термин «антитело» должен охватывать функциональные фрагменты антитела. Этот термин также охватывает интактные или полноразмерные антитела, включая антитела любого класса или подкласса, в том числе IgG и их подклассы, IgM, IgE, IgA и IgD.
[0227] В некоторых вариантах осуществления изобретения, антигенсвязывающие белки, антитела и их антигенсвязывающие фрагменты специфически распознают антиген для полноразмерного антитела. В некоторых вариантах осуществления настоящего изобретения, тяжелые и легкие цепи антитела могут быть полноразмерными или могут представлять собой антигенсвязывающую часть (Fab, F(аb')2, Fv или одноцепочечный Fv-фрагмент (ScFv)). В других вариантах осуществления изобретения, константная область тяжелой цепи антитела выбрана, например, из IgG1, IgG2, IgG3, IgG4, IgM, IgA1, IgA2, IgD и IgE, а в частности, например, из IgG1, IgG2, IgG3 и IgG4, а более конкретно, IgG1 (например, человеческого IgG1). В другом варианте осуществления изобретения, константная область легкой цепи антитела выбрана, например, из цепей каппа или лямбда, а в частности, каппа.
[0228] Рассматриваемыми антителами являются, среди прочих, фрагменты антител. Термин «фрагмент антитела» означает молекулу, которая не является интактным антителом, но включает часть интактного антитела, которая связывается с антигеном, с которым связывается интактное антитело. Примерами фрагментов антител являются, но не ограничиваются ими, Fv, Fab, Fab', Fab'-SH, F(аb')2; диантитела; линейные антитела; вариабельные области тяжелой цепи (VH), одноцепочечные молекулы антител, такие как scFv, и однодоменные одноцепочечноные VH-антитела; и мультиспецифические антитела, образованные фрагментами антител. В конкретных вариантах осуществления изобретения, антитела представляют собой одноцепочечные фрагменты антител, содержащие вариабельную область тяжелой цепи и/или вариабельную область легкой цепи, такую как scFv.
[0229] Термин «вариабельная область» или «вариабельный домен» означает домен тяжелой и легкой цепей антитела, который участвует в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) нативного антитела обычно имеют сходные структуры, причем, каждый домен содержит четыре консервативных каркасных области (FR) и три CDR. (См., например, Kindt et al. Kuby Immunology, 6th ed., W.H. Freeman & Co., page 91 (2007). Один VH- или VL-домен может быть достаточным для сообщения специфичности связывания с антигеном. Кроме того, антитела, которые связываются с конкретным антигеном, могут быть выделены с использованием VH- или VL-домена антитела, которое связывается с антигеном, для скрининга библиотеки комплементарных VL- или VH-доменов, соответственно. См. например, Portolano et al., J. Immunol. 150:880-887 (1993); Clarkson et al., Nature 352:624-628 (1991).
[0230] Однодоменные антитела представляют собой фрагменты антител, содержащие весь или часть вариабельного домена тяжелой цепи, или весь или часть вариабельного домена легкой цепи антитела. В некоторых вариантах осуществления изобретения, однодоменным антителом является человеческое однодоменное антитело. В некоторых вариантах осуществления изобретения, CAR содержит домен тяжелой цепи антитела, который специфически связывается с антигеном, таким как маркер рака или антиген клеточной поверхности на клетке или пораженном участке-мишени, таком как опухолевые или раковые клетки, например, с любым из антигенов-мишеней, описанных в настоящей заявке или известных специалистам.
[0231] Фрагменты антител могут быть получены различными методами, включая, но не ограничиваясь ими, протеолитическое расщепление интактного антитела, а также продуцирование антитела рекомбинантными клетками-хозяевами. В некоторых вариантах осуществления изобретения, антителами являются рекомбинантно продуцируемые фрагменты, такие как фрагменты, содержащие реаранжировки, которые не встречаются в природе, такие как фрагменты, в которых две или более областей или цепей антитела соединены синтетическими линкерами, например, пептидными линкерами, и/или фрагменты, которые не могут быть получены путем ферментативного расщепления природного интактного антитела. В некоторых вариантах осуществления изобретения, фрагментами антитела являются scFv.
[0232] «Гуманизованное» антитело представляет собой антитело, в котором все или практически все аминокислотные остатки CDR происходят от не-человеческих CDR, и все или почти все аминокислотные остатки FR аминокислот происходят от человеческих FR. Гуманизованное антитело может включать, но необязательно, по меньшей мере, часть антитела константной области антитела, происходящей от человеческого антитела. Термин «гуманизованная форма» не-человеческого антитела означает вариант не-человеческого антитела, который подвергается гуманизации обычно для снижения иммуногенности у человека, но при этом, сохраняет специфичность и аффинность родителельского не-человеческого антитела. В некоторых вариантах осуществления изобретения, некоторые остатки FR в гуманизованном антителе заменены соответствующими остатками не-человеческого антитела (например, антитела, от которого происходят остатки CDR), например, для восстановления или повышения специфичности или аффинности антитела.
[0233] Таким образом, в некоторых вариантах осуществления изобретения, химерный антигенный рецептор, включая TCR-подобные CAR, включают внеклеточную часть, содержащую антитело или фрагмент антитела. В некоторых вариантах осуществления изобретения, антитело или фрагмент включают ScFv. В некоторых аспектах, химерный антигенный рецептор включает внеклеточную часть, содержащую антитело или его фрагмент и внутриклеточную сигнал-передающую область. В некоторых вариантах осуществления изобретения, внутриклеточная сигнал-передающая область содержит внутриклеточный сигнал-передающий домен. В некоторых вариантах осуществления изобретения, внутриклеточный сигнал-передающий домен представляет собой или содержит первичный сигнал-передающий домен, домен передачи сигнала, способный индуцировать первичный сигнал активации в Т-клетках, домен передачи сигнала компоненту Т-клеточного рецептора (TCR), и/или сигнал-передающий домен, содержащий иммунорецепторный мотив активации на основе тирозина (ITAM).
[0234] В некоторых вариантах осуществления изобретения, внеклеточная часть CAR, такая как часть антитела, также включает спейсер, такой как спейсерная область между антиген-распознающим компонентом, например, ScFv, и трансмембранным доменом. Спейсер может представлять собой или включать по меньшей мере часть константной области иммуноглобулина или его вариант или модифицированный вариант, такие как шарнирная область, например, шарнирная область IgG4, и/или CH1/CL и/или Fc-область. В некоторых вариантах осуществления изобретения, рекомбинантный рецептор дополнительно содержит спейсер и/или шарнирную область. В некоторых вариантах осуществления изобретения, константная область или ее часть представляет собой константную область или часть человеческого IgG, такого как IgG4 или IgG1. В некоторых аспектах изобретения, часть константной области служит в качестве спейсерной области между антиген-распознающим компонентом, например, ScFv и трансмембранным доменом. В некоторых вариантах осуществления, спейсер имеет последовательность, представленную в SEQ ID NО: 27 и кодируется последовательностью, представленной в SEQ ID NО: 28. В некоторых вариантах осуществления изобретения, спейсер имеет последовательность, представленную в SEQ ID NО: 29. В некоторых вариантах осуществления изобретения, спейсер имеет последовательность, представленную в SEQ ID NО: 30.
[0235] В некоторых вариантах осуществления изобретения, константная область или ее часть представляет собой константную область или часть IgD. В некоторых вариантах осуществления изобретения, спейсер имеет последовательность, представленную в SEQ ID NO: 31. В некоторых вариантах осуществления изобретения, спейсер имеет аминокислотную последовательность, которая по меньшей мере, или, по меньшей мере, приблизительно на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентична последовательности любой из SEQ ID NO: 27, 29, 30 и 31.
[0236] В некоторых вариантах осуществления изобретения, спейсер может представлять собой или включать по меньшей мере часть константной области иммуноглобулина или его вариант или модифицированный вариант, такие как шарнирная область, например, шарнирная область IgG4, и/или CH1/CL и/или Fc-область. В некоторых вариантах осуществления изобретения, рекомбинантный рецептор дополнительно содержит спейсер и/или шарнирную область. В некоторых вариантах осуществления изобретения, константная область или ее часть представляет собой константную область или часть человеческого IgG, такого как IgG4 или IgG1. В некоторых аспектах изобретения, часть константной области служит в качестве спейсерной области между антиген-распознающим компонентом, например, ScFv и трансмембранным доменом. Спейсер может иметь длину, которая обеспечивает повышенную чувствительность клеток после связывания с антигеном по сравнению с чувствительностью в отсутствии спейсера. В некоторых примерах, спейсер имеет длину, составляющую или приблизительно составляющую 12 аминокислот или не более, чем 12 аминокислот. Репрезентативными спейсерами являются спейсеры, имеющие длину по меньшей мере приблизительно от 10 до 229 аминокислот, приблизительно от 10 до 200 аминокислот, приблизительно от 10 до 175 аминокислот, приблизительно от 10 до 150 аминокислот, приблизительно от 10 до 125 аминокислот, приблизительно от 10 до 100 аминокислот, приблизительно от 10 до 75 аминокислот, приблизительно от 10 до 50 аминокислот, приблизительно от 10 до 40 аминокислот, приблизительно от 10 до 30 аминокислот, приблизительно от 10 до 20 аминокислот, или приблизительно от 10 до 15 аминокислот, включая любое целое число между указанными граничными величинами в любом из перечисленных интервалов. В некоторых вариантах осуществления изобретения, спейсерная область имеет приблизительно 12 аминокислот или менее, приблизительно 119 аминокислот или менее, или приблизительно 229 аминокислот или менее. Репрезентативными спейсерами являются только шарнирная область IgG4, шарнирная область IgG4, связанная с доменами СН2 и СН3, или шарнирная область IgG4, связанная с доменом СН3. Репрезентативными спейсерами являются, но не ограничиваются ими, спейсеры, описанные в Hudeček et al., (2013) Clin., Cancer Res, 19: 3153 или в публикации Международной патентной заявки WO2014/031687. В некоторых вариантах осуществления, спейсер имеет последовательность, представленную в SEQ ID NО: 27 и кодируется последовательностью, представленной в SEQ ID NО: 28. В некоторых вариантах осуществления изобретения, спейсер имеет последовательность, представленную в SEQ ID NО: 29. В некоторых вариантах осуществления изобретения, спейсер имеет последовательность, представленную в SEQ ID NО: 30.
[0237] В некоторых вариантах осуществления изобретения, константная область или ее часть представляет собой константную область или часть IgD. В некоторых вариантах осуществления изобретения, спейсер имеет последовательность, представленную в SEQ ID NO: 31. В некоторых вариантах осуществления изобретения, спейсер имеет аминокислотную последовательность, которая по меньшей мере или по меньшей мере приблизительно на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентична последовательности любой из SEQ ID NO: 27, 29, 30 и 31.
[0238] Домен, связывающийся с внеклеточным лигандом, такой как антиген-распознающий домен, обычно связан с одним или более внутриклеточными сигнал-передающими компонентами, такими как сигнал-передающие компоненты, которые имитируют активацию посредством комплекса «антиген-рецептор», такого как комплекс TCR, в случае CAR, и/или посредством передачи сигнала через другой рецептор клеточной поверхности. В некоторых вариантах осуществления изобретения, трансмембранный домен соединяет домены, связывающиеся с внеклеточным лигандом и внутриклеточные сигнал-передающие домены. В некоторых вариантах осуществления изобретения, антигенсвязывающий компонент (например, антитело) связан с одним или более трансмембранными и внутриклеточными сигнал-передающими областями. В некоторых вариантах осуществления изобретения, CAR включает трансмембранный домен, присоединенный к внеклеточному домену. В одном варианте осуществления изобретения используется трансмембранный домен, который по своей природе ассоциируется с одним из доменов в рецепторе, например, CAR. В некоторых случаях, трансмембранный домен отбирают или модифицируют путем аминокислотной замены во избежание связывания таких доменов с трансмембранными доменами одного и того же белка или различных белков мембранной поверхности в целях минимизации взаимодействий с другими членами рецепторного комплекса.
[0239] В некоторых вариантах осуществления изобретения, трансмембранный домен происходит от природного или от синтетического источника. В некоторых аспектах, если источник является природным, то домен происходит от любого мембраносвязанного или трансмембранного белка. Трансмембранными областями являются области, происходящие от (то есть, содержащие по меньшей мере трансмембранную(ые) область(и)) цепи альфа, бета или дзета Т-клеточного рецептора, CD28, CD3-эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 или CD154. Альтернативно, в некоторых вариантах осуществления изобретения, трансмембранный домен является синтетическим. В некоторых аспектах, синтетический трансмембранный домен содержит преимущественно гидрофобные остатки, такие как лейцин и валин. В некоторых аспектах, триплет фенилаланина, триптофана и валина будет находиться на каждом конце синтетического трансмембранного домена. В некоторых вариантах осуществления изобретения, связывание осуществляется посредством линкеров, спейсеров и/или трансмембранного(ых) домена(ов).
[0240] В некоторых вариантах осуществления изобретения, короткий олиго- или полипептидный линкер, например, линкер длиной от 2 до 10 аминокислот, такой как линкер, содержащий глицины и серины, например, дублет глицина-серина, присутствует и образует связь между трансмембранным доменом и цитоплазматическим сигнал-передающим доменом CAR.
[0241] Рекомбинантный рецептор, например, CAR, обычно включает по меньшей мере один внутриклеточный сигнал-передающий компонент или сигнал-передающие компоненты. В некоторых вариантах осуществления изобретения, рецептор включает внутриклеточный компонент комплекса TCR, такой, как цепь TCR-CD3, которая опосредует активацию Т-клеток и цитотоксичность T-клеток, например, цепь CD3-дзета. Таким образом, в некоторых аспектах, антигенсвязывающая часть связана с одним или более модулями, передающими сигнал клеткам. В некоторых вариантах осуществления изобретения, модули, передающие сигнал клеткам, включают трансмембранный домен CD3, внутриклеточные сигнал-передающие домены CD3 и/или другие трансмембранные домены CD. В некоторых вариантах осуществления изобретения, рецептор, например, CAR, также включает часть одной или более дополнительных молекул, таких как Fc-рецептор γ, CD8, CD4, CD25, или CD16. Так, например, в некоторых аспектах, CAR или другой химерный рецептор включает химерную молекулу между CD3-дзета (CD3-ζ) или Fc-рецептором γ и CD8, CD4, CD25 или CD16.
[0242] В некоторых вариантах осуществления изобретения, после лигирования CAR или другого химерного рецептора, цитоплазматический домен и/или область или внутриклеточный сигнал-передающий домен и/или область рецептора активирует по меньшей мере одну нормальную эффекторную функцию или ответ в иммунных клетках, например, в Т-клетке, сконструированной для экспрессии CAR. Так, например, в некоторых аспектах, CAR индуцирует функцию Т-клетки, такую как цитолитическая активность или Т-хелперная активность, такая как секреция цитокинов или других факторов. В некоторых вариантах осуществления изобретения, усеченная часть внутриклеточного сигнал-передающего домена компонента антигенного рецептора или костимулирующей молекулы используются вместо интактной иммуностимулирующей цепи, например, если она передает сигнал эффекторной функции. В некоторых вариантах осуществления изобретения, внутриклеточные сигнал-передающие области, например, содержащие внутриклеточный домен или домены, включают цитоплазматические последовательности Т-клеточного рецептора (TCR), а в некоторых аспектах, они также являются ко-рецепторами, которые в своем природном окружении действуют вместе с такими рецепторами для инициации передачи сигнала после связывания с антигенным рецептором, и/или они включают любое производное или вариант таких молекул и/или любую синтетическую последовательность, которая имеет такую же функциональную активность.
[0243] В случае природного TCR, для полной активации обычно требуется передача сигнала не только посредством TCR, но также и посредством костимулирующего сигнала. Таким образом, в некоторых вариантах осуществления изобретения, в целях стимуляции полной активации, компонент для передачи вторичного или костимулирующего сигнала также включают в CAR. В других вариантах осуществления изобретения, CAR не включает компонент для генерирования костимулирующего сигнала. В некоторых аспектах, дополнительный CAR экспрессируется в той же самой клетке, и представляет собой компонент, обеспечивающий генерирование вторичного или костимулирующего сигнала.
[0244] В некоторых аспектах, активация Т-клеток описана как активация, опосредованная по меньшей мере двумя классами цитоплазматических сигнал-передающих последовательностей: последовательностей, которые инициируют антиген-зависимую первичную активацию посредством TCR (первичные цитоплазматические сигнал-передающие последовательности), и последовательностей, которые действуют по антиген-независимому механизму и генерируют вторичный или костимулирующий сигнал (вторичные цитоплазматические сигнал-передающие последовательности). В некоторых аспектах, CAR включает один или оба таких сигнал-передающих компонента.
[0245] В некоторых аспектах, CAR включает первичную цитоплазматическую сигнал-передающую последовательность, которая регулирует первичную активацию комплекса TCR. Первичные цитоплазматические сигнал-передающие последовательности, которые действуют по стимулирующему механизму, могут содержать сигнал-передающие мотивы, известные как иммунорецепторные мотивы активации на основе тирозина или ITAM. Примерами ITAM- содержащих первичных цитоплазматических сигнал-передающих последовательностей являются последовательности, происходящие от TCR или CD3 дзета, FcR гамма, FcR бета, CD3 гамма, CD3 дельта, CD3 эпсилон, CD8, CD22, CD79a, CD79b и CD66d. В некоторых вариантах осуществления изобретения, ITAM-содержащими первичными цитоплазматическими сигнал-передающими последовательностями являются последовательности, происходящие от TCR или CD3 дзета, FcR гамма или FcR бета. В некоторых вариантах осуществления изобретения, цитоплазматическая(ие) сигнал-передающая(ие) молекула(ы) в CAR содержит(ат) цитоплазматический сигнал-передающий домен, его часть, или последовательность, происходящую от CD3 дзета.
[0246] В некоторых вариантах осуществления изобретения, CAR включает сигнал-передающий домен и/или трансмембранную часть костимулирующего рецептора, такую как CD28, 4-1ВВ, OX40, CD27, DAP10 и ICOS. В некоторых аспектах, тот же самый CAR включает активирующую или сигнал-передающую область и костимулирующие компоненты.
[0247] В некоторых вариантах осуществления изобретения, активирующий домен включают в один CAR, тогда как костимулирующий компонент доставляется другим антигеном, распознающим другой CAR. В некоторых вариантах осуществления изобретения, CAR включают активирующие или стимулирующие CAR и костимулирующие CAR, которые оба экспрессируются на одной и той же клетке (см. WO2014/055668). В некоторых аспектах, CAR представляет собой стимулирующий или активирующий CAR; а в других аспектах, он представляет собой костимулирующий CAR. В некоторых вариантах осуществления изобретения, клетки также включают ингибирующие CAR (iCAR, см. Fedorov et al., Sci. Transl. Medicine, 5(215) (December, 2013), такие как CAR, распознающий другой антиген, в результате чего активирующий сигнал, доставляемый посредством CAR, распознающего первый антиген, ослабляется или ингибируется посредством связывания ингибирующего CAR со своим лигандом, что будет приводить, например, к снижению нежелательных эффектов.
[0248] В некоторых вариантах осуществления изобретения, внутриклеточный сигнал-передающий домен содержит трансмембранный и сигнал-передающий домен CD28, связанный с внутриклеточным доменом CD3. В некоторых вариантах осуществления изобретения, внутриклеточный сигнал-передающий домен содержит химерные костимулирующие домены CD28 и CD137, связанные с внутриклеточным доменом CD3.
[0249] В некоторых вариантах осуществления изобретения, внутриклеточный сигнал-передающий домен цитотоксических CD8+-Т- клеток является таким же, как внутриклеточный сигнал-передающий домен хелперных CD4+-Т-клеток. В некоторых вариантах осуществления изобретения, внутриклеточный сигнал-передающий домен цитотоксических CD8+-Т-клеток отличается от внутриклеточного сигнал-передающего домена хелперных CD4+-Т-клеток.
[0250] В некоторых вариантах осуществления изобретения, CAR включает один или более, например, два или более, костимулирующих доменов и домен активации, например, первичный домен активации в цитоплазматической части. Репрезентативными CAR являются внутриклеточные компоненты CD3-дзета, CD28 и 4-1ВВ.
[0251] В некоторых вариантах осуществления изобретения, рекомбинантный(е) рецептор(ы), например, CAR, кодируемый нуклеиновой(ыми) кислотой(ами) в предоставленных здесь вирусных векторах, также включает(ют) один или более маркеров, например, для подтверждения трансдукции или конструирования клеток, экспрессирующих рецептор, и/или отбора и/или таргетинга клеток, экспрессирующих молекулу(ы), кодируемую(ые) полинуклеотидом. В некоторых аспектах, такой маркер может кодироваться другой нуклеиновой кислотой или другим полинуклеотидом, которые могут быть также введены методом генной инженерии, а обычно, тем же самым методом, например, путем трансдукции с применением любых описанных здесь способов, например, с использованием того же вектора или вектора того же типа.
[0252] В некоторых аспектах, маркер, например, маркер для трансдукции, представляет собой белок и/или молекулу клеточной поверхности. Репрезентативными маркерами являются усеченные варианты природных, например, эндогенных маркеров, таких как природные молекулы клеточной поверхности. В некоторых аспектах, варианты имеют пониженную иммуногенность, пониженную функцию транспорта и/или пониженную сигнал-передающую функцию по сравнению с природной или эндогенной молекулой клеточной поверхности. В некоторых вариантах осуществления изобретения, маркер представляет собой усеченный вариант рецептора клеточной поверхности, такой как усеченный EGFR (tEGFR). В некоторых аспектах, маркер включает все или часть (например, усеченную форму) CD34, NGFR или рецептор эпидермального фактора роста (например, tEGFR). В некоторых вариантах осуществления изобретения, нуклеиновая кислота, кодирующая маркер, функционально присоединена к полинуклеотиду, кодирующему линкерную последовательность, такую как расщепляемая линкерная последовательность, например, T2A P2A, E2A и/или F2A. См., например, WO2014/031687.
[0253] В некоторых вариантах осуществления изобретения, маркер представляет собой молекулу, например, белок клеточной поверхности, который не встречается в природе на Т-клетках, или, не встречается в природе на поверхности Т-клеток, или его часть.
[0254] В некоторых вариантах осуществления изобретения, молекулой является чужеродная молекула, например, чужеродный белок, то есть, белок, который не распознается как «свой» иммунной системой хозяина, в клетки которого его адоптивно переносят.
[0255] В некоторых вариантах осуществления изобретения, маркер не осуществляет никакой терапевтической функции и/или не дает никакого эффекта, кроме того, что он используется в качестве маркера для генной инженерии, например, для отбора успешно сконструированных клеток. В других вариантах осуществления изобретения, маркером может быть терапевтическая молекула или молекула, которая дает несколько другой желаемый эффект, например, лиганд для взаимодействия с клеткой in vivo, такой как костимулирующая молекула или молекула контрольной точки иммунитета, способствующая усилению и/или ослаблению ответов клеток после адоптивного переноса и взаимодействия с лигандом.
[0256] В некоторых случаях, CAR упоминаются как CAR первой, второй и/или третьей генерации. В некоторых аспектах, CAR первой генерации представляет собой CAR, который дает только сигнал, индуцируемый CD3-цепью после связывания с антигеном; в некоторых аспектах, CAR второй генерации представляет собой CAR, который дает именно такой сигнал и костимулирующий сигнал, например, CAR, включающий внутриклеточный сигнал-передающий домен от костимулирующего рецептора, такого как CD28 или CD137; а в некоторых аспектах, CAR третьей генерации представляет собой CAR, который включает множество костимулирующих доменов различных костимулирующих рецепторов.
[0257] В некоторых вариантах осуществления изобретения, химерный антигенный рецептор включает внеклеточную лиганд-связывающую часть, такую как антигенсвязывающая часть, например, антитело или его фрагмент и внутриклеточный домен. В некоторых вариантах осуществления изобретения, антитело или его фрагмент включают ScFv или VH однодоменного антитела, а внутриклеточный домен содержит ITAM. В некоторых аспектах, внутриклеточный сигнал-передающий домен включает сигнал-передающий домен цепи CD3-дзета (CD3ζ). В некоторых вариантах осуществления изобретения, химерный антигенный рецептор включает трансмембранный домен, соединяющий внеклеточный домен и внутриклеточную сигнал-передающую область или домен, и/или трансмембранный домен, расположенный между ними.
[0258] В некоторых аспектах, трансмембранный домен содержит трансмембранную часть CD28. Внеклеточный домен и трансмембранный домен могут быть связаны прямо или опосредованно. В некоторых вариантах осуществления изобретения, внеклеточный домен и трансмембранный домен связаны посредством спейсера, такого как любой описанный здесь спейсер. В некоторых вариантах осуществления изобретения, химерный антигенный рецептор содержит внутриклеточный домен Т-клеточной костимулирующей молекулы, например, между трансмембранным доменом и внутриклеточным сигнал-передающим доменом. В некоторых аспектах, Т-клеточной костимулирующей молекулой является CD28 или 4-1ВВ.
[0259] В некоторых вариантах осуществления, CAR содержит антитело, например, фрагмент антитела, трансмембранный домен, который представляет собой или содержит трансмембранную часть CD28 или его функциональный вариант, и внутриклеточный сигнал-передающий домен, содержащий сигнал-передающую часть CD28 или его функциональный вариант и сигнал-передающую часть CD3 дзета или ее функциональный вариант. В некоторых вариантах осуществления изобретения, CAR содержит антитело, например, фрагмент антитела, трансмембранный домен, который представляет собой или содержит трансмембранную часть CD28 или его функциональный вариант, и внутриклеточный сигнал-передающий домен, содержащий сигнал-передающую часть CD28 или его функциональный вариант, и сигнал-передающую часть 4-1ВВ или ее функциональный вариант, и сигнал-передающую часть CD3 дзета или ее функциональный вариант. В некоторых таких вариантах осуществления изобретения, рецептор также включает спейсер, содержащий часть молекулы Ig, такой как молекула человеческого Ig, например, шарнирную область Ig, например, шарнирную область IgG4, а именно, шарнирную область, связанную только посредством спейсера.
[0260] В некоторых вариантах осуществления изобретения, трансмембранный домен рецептора, например, CAR представляет собой трансмембранный домен человеческого CD28 или его варианта, например, трансмембранный домен человеческого CD28 из 27 аминокислот (рег. No. P10747.1) или трансмембранный домен, который содержит аминокислотную последовательность, представленную в SEQ ID NO: 34 или аминокислотную последовательность, которая по меньшей мере или по меньшей мере приблизительно на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентична последовательности SEQ ID NO: 34; а в некоторых вариантах осуществления изобретения, трансмембранный домен, содержащий часть рекомбинантного рецептора, содержит аминокислотную последовательность, представленную в SEQ ID NO: 35 или аминокислотную последовательность, которая по меньшей мере или по меньшей мере приблизительно на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентична этой последовательности.
[0261] В некоторых вариантах осуществления изобретения, химерный антигенный рецептор содержит внутриклеточный домен Т-клеточной костимулирующей молекулы. В некоторых аспектах изобретения, Т-клеточной костимулирующей молекулой является CD28 или 4-1ВВ.
[0262] В некоторых вариантах осуществления изобретения, внутриклеточный домен содержит внутриклеточный костимулирующий сигнал-передающий домен человеческого CD28 или его функциональный вариант или часть, например, домен, состоящий из 41 аминокислоты и/или домен с заменой LL на GG в положениях 186- 187 нативного белка CD28. В некоторых вариантах осуществления изобретения, внутриклеточная сигнал-передающая область и/или домен могут содержать аминокислотную последовательность, представленную в SEQ ID NO: 36 или 37 или аминокислотную последовательность, которая по меньшей мере или по меньшей мере приблизительно на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентична последовательности SEQ ID NO: 36 или 37. В некоторых вариантах осуществления изобретения, внутриклеточная область и/или внутриклеточный домен содержат внутриклеточный костимулирующий сигнал-передающий домен 4-1ВВ или его функциональный вариант, например, цитоплазматический домен человеческого 4-1ВВ из 42 аминокислот (рег. No. Q07011.1) или его функциональный вариант или часть, например, аминокислотную последовательность, представленную в SEQ ID NO: 38 или аминокислотную последовательность, которая по меньшей мере или по меньшей мере приблизительно на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентична последовательности SEQ ID NO: 38.
[0263] В некоторых вариантах осуществления изобретения, внутриклеточная сигнал-передающая область и/или сигнал-передающий домен содержат цепь человеческого CD3, необязательно стимулирующий сигнал-передающий домен CD3-дзета или его функциональный вариант, такой как цитоплазматический домен изоформы 3 человеческого CD3ζ из 112 аминокислот (рег. No. P20963.2) и/или сигнал-передающий домен CD3 дзета, как описано в патенте США № 7446190 или в патенте США № 8911993. В некоторых вариантах осуществления изобретения, внутриклеточная сигнал-передающая область содержит аминокислотную последовательность, представленную в SEQ ID NO: 39, 40 или 41 или аминокислотную последовательность, которая по меньшей мере или по меньшей мере приблизительно на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентична последовательности SEQ ID NO: 39, 40 или 41.
[0264] В некоторых аспектах, спейсер содержит только шарнирную область IgG, например, только шарнирную область IgG4 или IgG1, например, спейсер только из шарнирной области, представленный в SEQ ID NO: 27. В других вариантах осуществления изобретения, спейсер представляет собой шарнирную область Ig, например, шарнирную область IgG4, связанную с доменами СН2 и/или СН3. В некоторых вариантах осуществления изобретения, спейсер представляет собой шарнирную область Ig, например, шарнирную область IgG4, связанную с доменами CH2 и CH3, представленными в SEQ ID NO: 29. В некоторых вариантах осуществления изобретения, спейсер представляет собой шарнирную область Ig, например, шарнирную область IgG4, связанную только с доменом CH3, такую как шарнирная область, представленная в SEQ ID NO: 30. В некоторых вариантах осуществления изобретения, спейсер представляет собой или содержит последовательность, богатую глицином-серином или другой гибкий линкер, такой как известные гибкие линкеры.
[0265] Так, например, в некоторых вариантах осуществления изобретения, CAR включает: внеклеточную лиганд-связывающую часть, такую как антигенсвязывающая часть, например, антитело или его фрагмент, включая sdAb и scFv, которые специфически связываются с антигеном, например, с описанным здесь антигеном; спейсер, такой как любой спейсер, содержащий шарнирную область Ig; трансмембранный домен, который представляет собой часть CD28 или его варианты; внутриклеточный сигнал-передающий домен, содержащий сигнал-передающую часть CD28 или его функциональный вариант; и сигнал-передающую часть сигнал-передающего домена CD3 дзета или его функциональный вариант. В некоторых вариантах осуществления изобретения, CAR включает: внеклеточную лиганд-связывающую часть, такую как антигенсвязывающая часть, например, антитело или его фрагмент, включая sdAb и scFv, которые специфически связываются с антигеном, например, с описанным здесь антигеном; спейсер, такой как любой спейсер, содержащий шарнирную область Ig; трансмембранный домен, который представляет собой часть CD28 или его вариант; внутриклеточный сигнал-передающий домен, содержащий сигнал-передающую часть 4-1ВВ или его функциональный вариант; и сигнал-передающую часть сигнал-передающего домена CD3 дзета или его функциональный вариант. В некоторых вариантах осуществления изобретения, такие конструкции CAR также включают элемент вырезания рибосомы Т2А и/или последовательность tEGFR, например, расположенную ниже CAR.
b. Т-клеточные рецепторы (TCR)
[0266] В некоторых вариантах осуществления изобретения, рекомбинантная(ые) молекула(ы), кодируемая(ые) нуклеиновой(ыми) кислотой(ами), представляет(ют) собой или включает(ют) рекомбинантный Т-клеточный рецептор (TCR). В некоторых вариантах осуществления изобретения, рекомбинантный TCR является специфичным к антигену, а в основном, к антигену, присутствующему на клетке-мишени, такому как опухолеспецифический антиген, антиген, экспрессируемый на клетках конкретных типов, ассоциированных с аутоиммунным или воспалительным заболеванием, или антиген, происходящий от вирусного патогена или бактериального патогена. В некоторых своих вариантах, настоящее изобретение относится к сконструированным клеткам, таким как T-клетки, экспрессирующие TCR или его антигенсвязывающую часть, которые распознают пептидный эпитоп или Т-клеточный эпитоп полипептида-мишени, такого как антиген опухолевого, вирусного или аутоиммунного белка.
[0267] В некоторых вариантах осуществления изобретения, «Т-клеточный рецептор» или «TCR» представляет собой молекулу, содержащую вариабельные α- и β-цепи (также известные как TCRα и TCRβ, соответственно) или вариабельные γ- и δ-цепи (также известные как TCRα и TCRβ, соответственно), или их антигенсвязывающие части и способную специфически связываться с пептидом, связанным с молекулой МНС. В некоторых вариантах осуществления изобретения, TCR присутствует в форме αβ. Обычно, TCR, присутствующие в формах αβ и γδ, по существу, являются структурно сходными, но T-клетки, экспрессирующие эти формы, могут иметь различные анатомические положения или функции. TCR может присутствовать на поверхности клетки, либо он может присутствовать в растворимой форме. Вообще говоря, TCR присутствует на поверхности Т-клеток (или Т-лимфоцитов), где он обычно ответственнен за распознавание антигенов, связанных с молекулами главного комплекса гистосовместимости (MHC).
[0268] Если это не оговорено особо, то следует отметить, что термин «TCR» охватывает полноразмерные TCR, а также их антигенсвязывающие части или антигенсвязывающие фрагменты. В некоторых вариантах осуществления изобретения, TCR представляет собой интактный или полноразмерный TCR, включая TCR в форме αβ или γδ. В некоторых вариантах осуществления изобретения, TCR представляет собой антигенсвязывающую часть, длина которой меньше, чем длина полноразмерного TCR, но которая связывается со специфическим пептидом, связанным с молекулой MHC, например, с комплексом «МНС-пептид». В некоторых случаях, антиген-связывающая часть или фрагмент TCR могут содержать только часть структурных доменов полноразмерного или интактного TCR, но тем не менее способны связываться с пептидным эпитопом, таким как комплекс «МНС-пептид», с которым связывается полноразмерный TCR. В некоторых случаях, антигенсвязывающая чать содержит вариабельные домены TCR, такие как вариабельная α-цепь и вариабельная β-цепь TCR, достаточные для образования сайта связывания со специфическим комплексом «МНС-пептид». Вообще говоря, вариабельные цепи TCR содержат гипервариабельные области, участвующие в распознавании пептида, МНС и/или комплекса «МНС-пептид».
[0269] В некоторых вариантах осуществления изобретения, вариабельные домены TCR содержат гипервариабельные петли или гипервариабельные области (CDR), которые обычно вносят основной вклад в распознавание антигена, способность к связыванию и специфичность. В некоторых вариантах осуществления изобретения, CDR TCR или их комбинация образуют весь или почти весь антиген-связывающий сайт данной молекулы TCR. Различные CDR, находящиеся в вариабельной области цепи TCR, обычно разделены каркасными областями (FR), которые как правило, проявляют меньшую вариабельность между молекулами TCR по сравнению с CDR (см, например, Jores et al., Proc. Nat'l Acad. Sci. U.S.A. 87:9138, 1990; Chothia et al., EMBO J. 7:3745, 1988; см. также Lefranc et al., Dev. Comp. Immunol. 27:55, 2003). В некоторых вариантах осуществления изобретения, CDR3 представляет собой основной CDR, ответственный за связывание с антигеном или специфичность к антигену или играет самую важную роль из всех трех CDR на данной вариабельной области TCR в распознавании антигена и/или во взаимодействии с процессированной пептидной частью комплекса «пептид-МНС». В некоторых случаях, CDR1 альфа-цепи может взаимодействовать с N-концевой частью некоторых антигенных пептидов. В некоторых случаях, CDR1 бета-цепи может взаимодействовать с С-концевой частью пептида. В некоторых аспектах, CDR2 вносит основной вклад или участвует в сообщении первичному CDR способности взаимодействовать с частью МНС комплекса «МНС-пептид» или распознавать его. В некоторых вариантах осуществления изобретения, вариабельная область β-цепи может содержать другую гипервариабельную область (CDR4 или HVR4), которая, в основном, участвует в связывании с суперантигеном и не распознает антиген (Kotb (1995) Clinical Microbiology Reviews, 8:411-426).
[0270] В некоторых вариантах осуществления изобретения, TCR может также содержать константный домен, трансмембранный домен и/или короткий цитоплазматический хвост (см, например, Janeway et al., Immunobiology: The Immune System in Health and Disease, 3rd Ed., Current Biology Publications, p. 4:33, 1997). В некоторых аспектах, каждая цепь TCR может иметь один N-концевой вариабельный домен иммуноглобулина, один константный домен иммуноглобулина, трансмембранную область и короткий цитоплазматический хвост у C-конца. В некоторых вариантах осуществления изобретения, TCR ассоциируется с инвариантными белками комплекса CD3, участвующего в опосредовании передачи сигнала.
[0271] В некоторых вариантах осуществления изобретения, цепь TCR содержит один или более константных доменов. Так, например, внеклеточная часть данной цепи TCR (например, α-цепи или β-цепи) может содержать два иммуноглобулин-подобных домена, таких как вариабельный домен (например, Vα или Vβ; обычно аминокислоты 1-116, пронумерованные по Кэбату, Kabat et al., ʺSequences of Proteins of Immunological Interest, US Dept. Health and Human Services, Public Health Service National Institutes of Health, 1991, 5th ed.) и константный домен (например, константный домен α-цепи или Cα, обычно в положениях 117-259 цепи, пронумерованной по Кэбату, или константный домен β-цепи или Cβ, обычно в положениях 117-295 цепи, пронумерованной по Кэбату), смежные с клеточной мембраной. Так, например, в некоторых случаях, внеклеточная часть TCR, образованная двумя цепями, содержит два константных домена, расположенных поблизости от мембраны, и два вариабельных домена, расположенных на расстоянии от мембраны, где каждый вариабельный домен содержит CDR. Константный домен TCR может содержать короткие соединяющие последовательности, в которых цистеиновый остаток образует дисульфидную связь, что будет способствовать связыванию двух цепей TCR. В некоторых вариантах осуществления изобретения, TCR может иметь дополнительный цистеиновый остаток в каждой из α- и β-цепей, в результате чего TCR будет содержать две дисульфидных связи в константных доменах.
[0272] В некоторых вариантах осуществления изобретения, цепи TCR содержат трансмембранный домен. В некоторых вариантах осуществления изобретения, трансмембранный домен являются положительно заряженным. В некоторых случаях, цепь TCR содержит цитоплазматический хвост. В некоторых случаях, такая структура позволяет TCR ассоциироваться с другими молекулами, такими как CD3 и их субъединицы. Так, например, TCR, содержащий константные домены с трансмембранной областью, может заякоривать белок в клеточной мембране и ассоциироваться с инвариантными субъединицами аппарата, передающего сигнал CD3, или комплекса. Внутриклеточные хвосты сигнал-передающих субъединиц CD3 (например, цепей CD3γ, CD3δ, CD3ε и CD3ζ) содержат один или более иммунорецепторных мотивов активации на основе тирозина или ITAM, которые сообщают комплексу TCR способность передавать сигнал.
[0273] В некоторых вариантах осуществления изобретения, TCR может представлять собой гетеродимер из двух цепей α и β (или, необязательно γ и δ), либо он может представлять собой одноцепочечную конструкцию TCR. В некоторых вариантах осуществления изобретения, TCR представляет собой гетеродимер, содержащий две отдельных цепи (цепи α и β или цепи γ и δ), связанные, например, дисульфидной связью или дисульфидными связями.
[0274] В некоторых вариантах осуществления изобретения, TCR может быть получен из известной(ых) последовательности(ей) TCR, таких как последовательности цепей V α,β, для которых, по существу, полноразмерная кодирующая последовательность является легко доступной. Методы получения полноразмерных последовательностей TCR, включая последовательности V-цепи, из клеточных источников, являются хорошо известными. В некоторых вариантах осуществления изобретения, нуклеиновые кислоты, кодирующие TCR, могут быть получены из различных источников, например, с помощью амплификации TCR-кодирующих нуклеиновых кислот посредством полимеразной цепной реакции (ПЦР) в данной клетке или в клетках или за пределами таких клеток, или путем синтеза общедоступных последовательностей ДНК TCR.
[0275] В некоторых вариантах осуществления изобретения, TCR получают из биологического источника, например, из клеток, таких как T-клетки (например, цитотоксические Т-клетки), Т-клеточные гибридомы или другие общедоступные источники. В некоторых вариантах осуществления изобретения, Т-клетки могут быть получены из клеток, выделенных in vivo. В некоторых вариантах осуществления изобретения, TCR представляет собой TCR, выделенный из тимуса. В некоторых вариантах осуществления изобретения, TCR представляет собой TCR, рестриктированный неоэпитопом. В некоторых вариантах осуществления изобретения, Т-клетки могут представлять собой культивированные T-клеточные гибридомы или клоны. В некоторых вариантах осуществления изобретения, TCR или его антигенсвязывающая часть или антигенсвязывающий фрагмент могут быть синтезированы из известной последовательности TCR.
[0276] В некоторых вариантах осуществления изобретения, TCR получают из TCR, идентифицированного или выбранного путем скрининга библиотеки кандидатов TCR против полипептидного антигена-мишени или эпитопа Т-клеток мишеней. Библиотеки TCR могут быть получены путем амплификации репертуара Vα и Vβ из Т-клеток, выделенных у индивидуума, включая клетки, присутствующие в МКПК, в селезенке или в другом лимфоидном органе. В некоторых случаях, Т-клетки могут быть амплифицированы из опухоль- инфильтрующих лимфоцитов (TIL). В некоторых вариантах осуществления изобретения, библиотеки TCR могут быть получены из CD4+- или CD8+-клеток. В некоторых вариантах осуществления изобретения, TCR могут быть амплифицированы из T-клеточного источника здорового индивидуума, то есть, из библиотек нормальных TCR. В некоторых вариантах осуществления изобретения, TCR могут быть амплифицированы из Т-клеточного источника от индивидуума с заболеванием, то есть, из библиотек патологических TCR. В некоторых вариантах осуществления изобретения, вырожденные праймеры используют для амплификации репертуара генов Vα и Vβ, например, с помощью ОТ-ПЦР в образцах, таких как Т-клетки, взятые у человека. В некоторых вариантах осуществления изобретения, библиотеки scTv могут быть сконструированы из нативных библиотек Vα и Vβ, в которых амплифицированные продукты были клонированы или собраны так, чтобы они были разделены линкером. В зависимости от индивидуума и источника клеток, библиотеки могут быть специфичными к аллелю HLA. Альтернативно, в некоторых вариантах осуществления, библиотеки TCR могут быть получены путем мутагенеза или диверсификации родительской или каркасной молекулы TCR. В некоторых аспектах, TCR подвергаются направленной эволюции, например, посредством мутагенеза, например, из α- или β-цепи. В некоторых аспектах, конкретные остатки в CDR TCR являются модифицированными. В некоторых вариантах осуществления изобретения, отобранные TCR могут быть модифицированы посредством созревания аффинности. В некоторых вариантах осуществления изобретения, антиген-специфические Т-клетки могут быть отобраны, например, путем скрининга для оценки активности TCR против пептида. В некоторых аспектах, TCR, присутствующие, например, на антиген-специфических Т-клетках, могут быть отобраны, например, по активности связывания, например, по конкретной аффинности или авидности к антигену.
[0277] В некоторых вариантах осуществления изобретения, генетически сконструированными антигенными рецепторами являются рекомбинантные T-клеточные рецепторы (TCR), и/или TCR, клонированные из природных Т-клеток. В некоторых вариантах осуществления изобретения, TCR представляет собой TCR, клонированный из природных Т-клеток. В некоторых вариантах осуществления изобретения, T-клеточный клон, обладающий высокой аффинностью к антигену-мишени (например, к раковому антигену), идентифицируют и выделяют у пациента, а затем вводят в клетки. В некоторых вариантах осуществления изобретения, клон TCR для антигена-мишени был получен у трансгенных мышей, которым были введены гены человеческий иммунной системы (например, системы человеческих лейкоцитарных антигенов или HLA). См., например, опухолевые антигены (см., например, Parkhurst et al. (2009) Clin Cancer Res. 15:169-180 и Cohen et al. (2005) J Immunol. 175:5799-5808). В некоторых вариантах осуществления изобретения, для выделения TCR против антигена-мишени применяется фаговое представление (см. например, Varela-Rohena et al. (2008) Nat Med. 14:1390-1395 and Li (2005) Nat Biotechnol. 23:349-354). В некоторых вариантах осуществления изобретения, TCR или его антигенсвязывающая часть были модифицированы или сконструированы. В некоторых вариантах осуществления изобретения, методы направленной эволюции были применены для получения TCR с измененными свойствами, такие как повышенная аффинность к специфическому МНС-пептидному комплексу. В некоторых вариантах осуществления изобретения, направленная эволюция достигается методами представления, включая, но не ограничиваясь ими, дрожжеое представление (Holler et al. (2003) Nat Immunol, 4, 55-62; Holler et al. (2000) Proc Natl Acad Sci U S A, 97, 5387-92), фаговое представление (Li et al. (2005) Nat Biotechnol, 23, 349-54), или T-клеточное представление (Chervin et al. (2008) J Immunol Methods, 339, 175-84). В некоторых вариантах осуществления изобретения, методы представления включают конструирование или модификацию известного, родительского или эталонного TCR. Так, например, в некоторых случаях, TCR дикого типа может быть использован в качестве матрицы для продуцирования мутагенных TCR, в которых один или более остатков CDR были мутированы с последующим отбором мутантов, обладающих желаемыми модифицированными свойствами, такие как более высокая аффинность к нужному антигену-мишени.
[0278] В некоторых вариантах осуществления изобретения, пептиды полипептида-мишени для использования в целях продуцирования или получения представляющего интерес TCR являются известными, либо они могут быть легко идентифицированы специалистами в данной области. В некоторых вариантах осуществления изобретения, пептиды, подходящие для их использования в целях продуцирования TCR или антигенсвязывающих частей, могут быть определены исходя из присутствия HLA-рестриктированного мотива в представляющем интерес полипептиде-мишени, таком как полипептид-мишень, описанный ниже. В некоторых вариантах осуществления изобретения, пептиды идентифицируют с использованием доступных моделей компьютерного прогнозирования. В некоторых вариантах осуществления изобретения, для предсказания сайтов связывания с MHC класса I, такими моделями являются, но не ограничиваются ими, ProPred1 (Singh and Raghava (2001), Bioinformatics 17(12):1236-1237 2001), и SYFPEITHI (см, Schuler et al. (2007) Immunoinformatics Methods in Molecular Biology, 409(1): 75-93 2007). В некоторых вариантах осуществления изобретения, МНС-рестриктированным эпитопом является HLA-A0201, который экспрессируется приблизительно у 39-46% всех людей индоевропейской расы и, следовательно, представляет собой подходящий выбор антигена МНС для его использования в целях получения TCR или другой молекулы, связывающейся с МНС-пептидом.
[0279] HLA-A0201-связывающие мотивы и сайты расщепления для протеасом и иммунных протеасом, полученные с использованием компьютерных моделей прогнозирования, являются известными. Для предсказания сайтов связывания с МНС класса I, такими моделями являются, но не ограничиваются ими, ProPred1 (более подробно описанная у Singh and Raghava, ProPred: prediction of HLA-DR binding sites. BIOINFORMATICS 17(12):1236-1237, 2001), и SYFPEITHI (см. Schuler et al. SYFPEITHI, Database for Searching and T-Cell Epitope Prediction. in Immunoinformatics Methods in Molecular Biology, vol 409(1): 75-93 2007).
[0280] В некоторых вариантах осуществления изобретения, TCR или его антигенсвязывающая часть могут представлять собой рекомбинантно продуцированный природный белок или его мутантную форму, в которых одно или более свойств, таких как связывающие свойства, были модифицированы. В некоторых вариантах осуществления изобретения, TCR может происходить от одного из различных видов животных, таких как человек, мыши, крысы или другие млекопитающие. TCR может присутствовать в форме, связанной с клеткой, или в растворимой форме. В некоторых вариантах осуществления изобретения, для осуществления описанных здесь способов, TCR получают в клеточно-связанной форме, экспрессирующейся на поверхности клетки.
[0281] В некоторых вариантах осуществления изобретения, TCR представляет собой полноразмерный TCR. В некоторых вариантах осуществления изобретения, TCR представляет собой антигенсвязывающую часть. В некоторых вариантах осуществления изобретения, TCR представляет собой димерный TCR (dTCR). В некоторых вариантах осуществления изобретения, TCR представляет собой одноцепочечный TCR (sc-TCR). В некоторых вариантах осуществления изобретения, dTCR или scTCR имеют структуры, описанные в WO 03/020763, WO 04/033685, WO2011/044186.
[0282] В некоторых вариантах осуществления изобретения, TCR содержит последовательность, соответствующую трансмембранной последовательности. В некоторых вариантах осуществления изобретения, TCR не содержит последовательность, соответствующую трансмембранной последовательности. В некоторых вариантах осуществления изобретения, TCR способен образовывать комплекс TCR с CD3. В некоторых вариантах осуществления изобретения, любые TCR, включая dTCR или scTCR, могут быть связаны с сигнал-передающими доменами, которые образуют активный TCR на поверхности Т-клетки. В некоторых вариантах осуществления изобретения, TCR экспрессируется на поверхности клеток.
[0283] В некоторых вариантах осуществления изобретения, dTCR содержит первый полипептид, в котором последовательность, соответствующая последовательности вариабельной области α-цепи TCR присоединена к N-концу последовательности, соответствующей последовательности внеклеточной константной области α-цепи TCR, и второй полипептид, в котором последовательность, соответствующая последовательности вариабельной области β-цепи TCR, присоединена к N-концу последовательности, соответствующей последовательности внеклеточной константной области β-цепи TCR, где первый и второй полипептиды связаны дисульфидной связью. В некоторых вариантах осуществления, связь может соответствовать нативной межцепочечной дисульфидной связи, присутствующей в нативных димерных TCR αβ. В некоторых вариантах осуществления изобретения, межцепочечные дисульфидные связи не присутствуют в нативном TCR. Так, например, в некоторых вариантах осуществления, один или более цистеинов могут быть включены во внеклеточные последовательности полипептидной пары dTCR константной области. В некоторых случаях, желательными могут быть как нативная, так и ненативная дисульфидные связи. В некоторых вариантах осуществления изобретения, TCR содержит трансмембранную последовательность, заякоренную на мембране.
[0284] В некоторых вариантах осуществления изобретения, dTCR содержит α-цепь TCR, содержащую вариабельный домен α, константный домен α и первый мотив димеризации, присоединенный к С-концу константного домена α, и β-цепь TCR, содержащую вариабельный домен β, константный домен β и первый мотив димеризации, присоединенный к С-концу константного домена β, где первый и второй мотивы димеризации легко взаимодействуют с образованием ковалентной связи между аминокислотой в первым мотивом димеризации и аминокислотой во втором мотиве димеризации, соединяющими α-цепь TCR и β-цепь TCR.
[0285] В некоторых вариантах осуществления изобретения, TCR представляет собой scTCR. Обычно, scTCR могут быть получены известными методами, см., например, Soo Hoo, W. F. et al. PNAS (USA) 89, 4759 (1992); Wülfing, C. and Plückthun, A., J. Mol. Biol. 242, 655 (1994); Kurucz, I. et al. PNAS (USA) 90 3830 (1993); публикацию Международной заявки PCT Nо. WO 96/13593, WO 96/18105, WO99/60120, WO99/18129, WO 03/020763, WO2011/044186; и Schlueter, C. J. et al. J. Mol. Biol. 256, 859 (1996). В некоторых вариантах осуществления изобретения, scTCR содержит введенную ненативную дисульфидную межцепочечную связь для облегчения ассоциации цепей TCR (см., например, публикацию Международной заявки PCT Nо. WO 03/020763). В некоторых вариантах осуществления изобретения, scTCR представляет собой не связанный дисульфидной связью усеченный TCR, в котором гетерологичные «лейциновые молнии», связанные с С-концом, облегчают ассоциацию цепи (см., например, публикацию Международной заявки PCT Nо. WO99/ 60120). В некоторых вариантах осуществления изобретения, scTCR содержит вариабельный домен TCRα, ковалентно связанный с вариабельным доменом TCRβ посредством пептидного линкера (см., например, публикацию Международной заявки PCT Nо. WO99/ 18129).
[0286] В некоторых вариантах осуществления изобретения, scTCR содержит первый сегмент, образованный аминокислотной последовательностью, соответствующей вариабельной области α-цепи TCR; второй сегмент, образованный аминокислотной последовательностью, соответствующей последовательности вариабельной области β-цепи TCR, присоединенной к N-концу аминокислотной последовательности, соответствующей внеклеточной последовательности константного домена β-цепи TCR, и линкерную последовательность, соединяющую С-конец первого сегмента с N-концом второго сегмента.
[0287] В некоторых вариантах осуществления изобретения, scTCR содержит первый сегмент, образованный последовательностью вариабельной области α-цепи, присоединенной к N-концу последовательности внеклеточного константного домена α-цепи, и второй сегмент, образованный последовательностью вариабельной области β-цепи, присоединенной к N-концу внеклеточной константной и трансмембранной последовательности β-цепи и, необязательно, линкерную последовательность, соединяющую С-конец первого сегмента с N-концом второго сегмента.
[0288] В некоторых вариантах осуществления изобретения, scTCR содержит первый сегмент, образованный последовательностью вариабельной области β-цепи TCR, присоединенной к N-концу последовательности внеклеточного константного домена β-цепи, и второй сегмент, образованный последовательностью вариабельной области α-цепи, присоединенной к N-концу внеклеточной константной и трансмембранной последовательности α-цепи и, необязательно, линкерную последовательность, соединяющую С-конец первого сегмента с N-концом второго сегмента.
[0289] В некоторых вариантах осуществления изобретения, линкером scTCR, который связывает первый и второй сегменты TCR, может быть любой линкер, способный образовывать одну полипептидную цепь, сохраняя при этом специфичность связывания с TCR. В некоторых вариантах осуществления изобретения, линкерная последовательность может иметь, например, формулу -P-AA-P-, где Р означает пролин, а АА означает аминокислотную последовательность, в которой аминокислотами являются глицин и серин. В некоторых вариантах осуществления изобретения, первые и вторые сегменты образуют пары, а поэтому, последовательности вариабельной области ориентированы на такое связывание. Следовательно, в некоторых случаях, линкер имеет длину, достаточную для перекрывания расстояния между C-концом первого сегмента и N-концом второго сегмента, или наоборот, но не слишком длинную, чтобы блокировать или уменьшать степень связывания scTCR с лигандом-мишенью. В некоторых вариантах осуществления изобретения, линкер может содержать от или приблизительно от 10 до 45 аминокислот, например, от 10 до 30 аминокислот, или от 26 до 41 аминокислотных остатков, например, 29, 30, 31 или 32 аминокислоты. В некоторых вариантах осуществления изобретения, такой линкер имеет формулу -PGGG-(SGGGG)5-P-, где Р обозначает пролин, G означает глицин, а S означает серин (SEQ ID NO: 48). В некоторых вариантах осуществления изобретения, линкер имеет последовательность GSADDAKKDAAKKDGKS (SEQ ID NO: 49).
[0290] В некоторых вариантах осуществления изобретения, scTCR содержит ковалентную дисульфидную связь, связывающую остаток константного домена α-цепи области иммуноглобулина с остатком константного домена β-цепи области иммуноглобулина. В некоторых вариантах осуществления изобретения, межцепочечная дисульфидная связь в нативном TCR отсутствует. Так, например, в некоторых вариантах осуществления изобретения, один или более цистеинов могут быть включены во внеклеточные последовательностеи первого и второго сегментов полипептида scTCR константной области. В некоторых случаях могут оказаться желательными как нативная, так и ненативная дисульфидные связи.
[0291] В некоторых вариантах dTCR или scTCR, содержащих введенные межцепочечные дисульфидные связи, нативные дисульфидные связи отсутствуют. В некоторых вариантах осуществления изобретения, один или более нативных цистеинов, образующих нативные межцепочечные дисульфидные связи, заменены другим остатком, таким как серин или аланин. В некоторых вариантах осуществления изобретения, введенная дисульфидная связь может быть образована посредством замены нецистеиновых остатков в первом и втором сегментах на цистеин. Репрезентативные ненативные дисульфидные связи в TCR описаны в публикации Международной заявки PCT Nо. WO2006/000830.
[0292] В некоторых вариантах осуществления изобретения, TCR или его антигенсвязывающий фрагмент обладает аффинностью к константе равновесного связывания с антигеном-мишенью, которая составляет в пределах или приблизительно в пределах от 10 до 5 и от 10 до 12 М и все отдельные значения и интервалы между ними. В некоторых вариантах осуществления изобретения, антиген-мишень представляет собой комплекс «МНС-пептид» или лиганд.
[0293] В некоторых вариантах осуществления изобретения, нуклеиновая кислота или нуклеиновые кислоты, кодирующие TCR, такие как α-цепи и β-цепи, могут быть амплифицированы с помощью ПЦР, клонирования или другими подходящими методами, и клонированы в подходящий экспрессионный вектор или векторы. Экспрессионный вектор может представлять собой любой подходящий рекомбинантный экспрессионный вектор и может быть использован для трансформации или трансфекции любого подходящего хозяина. Подходящими векторами являются векторы, которые были сконструированы для амплификации и размножения или для экспрессии или того и другого, например, плазмиды и вирусы.
[0294] В некоторых вариантах осуществления, таким вектором может быть вектор серии pUC (Fermentas Life Sciences), серии pBluescript (Stratagene, LaJolla, Calif.), серии pET (Novagen, Madison, Wis.), серии pGEX (Pharmacia Biotech, Uppsala, Sweden), или серии pEX (Clontech, Palo Alto, Calif.). В некоторых случаях могут быть также использованы бактериофаговые векторы, такие как λG10, λGT11, λZapII (Stratagene), λEMBL4 и λNM1149. В некоторых вариантах осуществления изобретения могут быть использованы растительные экспрессионные векторы и ими являются pBI01, pBI101.2, pBI101.3, pBI121 и pBIN19 (Clontech). В некоторых вариантах осуществления изобретения, экспрессионными векторами животных являются pEUK-Cl, pMAM и pMAMneo (Clontech). В некоторых вариантах осуществления изобретения используется вирусный вектор, такой как ретровирусный вектор.
[0295] В некоторых вариантах осуществления изобретения, рекомбинантные экспрессионные векторы могут быть получены с применением стандартных методов рекомбинантных ДНК. В некоторых вариантах осуществления изобретения, эти векторы могут содержать регуляторные последовательности, такие как кодоны инициации и терминации транскрипции и трансляции, которые являются специфическими для хозяина конкретного типа (например, бактерий, грибов, растений или животных), которому встраивают данный вектор, если это необходимо, с учетом того, является данный вектор ДНК- или РНК-вектором. В некоторых вариантах осуществления изобретения, вектор может содержать ненативный промотор, функционально присоединенный к нуклеотидной последовательности, кодирующей TCR или антиген-связывающую часть (или другую молекулу, связывающуюся с МНС-пептидом). В некоторых вариантах осуществления изобретения, промотором может быть невирусный промотор или вирусный промотор, такой как промотор цитомегаловируса (CMV), промотор SV40, промотор RSV и промотор, присутствующий в длинном концевом повторе вируса мышиных стволовых клеток. Также рассматриваются и другие известные промоторы.
[0296] В некоторых вариантах осуществления изобретения, после получения Т-клеточного клона, альфа- и бета-цепи TCR выделяют и клонируют в генный экспрессионный вектор. В некоторых вариантах осуществления изобретения, гены TCR альфа и бета присоединяют посредством пептида сайта разрезания рибосомы пикорнавируса 2A так, чтобы обе цепи были коэкспрессированы. В некоторых вариантах осуществления изобретения, нуклеиновая кислота, кодирующая TCR, дополнительно включает маркер, подтверждающий трансдукцию или конструирование клеток, экспрессирующих рецептор. В некоторых вариантах осуществления изобретения, генетический перенос TCR осуществляют посредством ретровирусных или лентивирусных векторов или посредством транспозонов (см., например, Baum et al. (2006) Molecular Therapy: The Journal of the American Society of Gene Therapy. 13:1050-1063; Frecha et al. (2010) Molecular Therapy: The Journal of the American Society of Gene Therapy. 18:1748-1757; and Hackett et al. (2010) Molecular Therapy: The Journal of the American Society of Gene Therapy. 18:674-683).
[0297] В некоторых вариантах осуществления изобретения, для получения вектора, кодирующего TCR, α-цепи и β-цепи подвергают ПЦР-амплификации из общей кДНК, выделенной из Т-клеточного клона, экспрессирующего представляющий интерес TCR, и клонируют в экспрессионный вектор. В некоторых вариантах осуществления настоящего изобретения, α-цепи и β-цепи клонируют в один и тот же вектор. В некоторых вариантах осуществления изобретения, α-цепи и β-цепи клонируют в различные векторы. В некоторых вариантах осуществления изобретения, полученные α-цепи и β-цепи вводят в ретровирусный, например, лентивирусный вектор.
с. Химерный рецептор аутоантитела (CAAR)
[0298] В некоторых вариантах осуществления изобретения, рекомбинантный рецептор представляет собой химерный рецептор аутоантитела (CAAR). В некоторых вариантах осуществления изобретения, CAAR является специфичным для аутоантитела. В некоторых вариантах осуществления изобретения, клетка, экспрессирующая CAAR, такая как Т-клетка, сконструированная для экспрессии CAAR, может быть использована для специфического связывания с клетками, экспрессирующими аутоантитело, но не с клетками, экспрессирующими нормальное антитело, и для их уничтожения. В некоторых вариантах осуществления изобретения, CAAR-экспрессирующие клетки могут быть использованы для лечения аутоиммунного заболевания, ассоциированного с экспрессией аутоантигенов, такого как аутоиммунные заболевания. В некоторых вариантах осуществления изобретения, CAAR-экспрессирующие клетки могут быть нацелены на В-клетки, которые, в конечном счете, будут продуцировать аутоантитела и представлять аутоантитела на клеточных поверхностях, являющихся маркерами этих В-клеток, как мишени, специфичные к заболеванию, в целях терапевтического лечения. В некоторых вариантах осуществления изобретения, CAAR-экспрессирующие клетки могут быть использованы для эффективного таргетинга и уничтожения патогенных В-клеток при аутоиммунных заболеваниях посредством нацеливания на В-клетки, вызывающие заболевания, с использованием антигенспецифического химерного рецептора аутоантитела. В некоторых вариантах осуществления изобретения, рекомбинантный рецептор представляет собой CAAR, такой, как любой CAAR, описанный в публикации заявки на патент США № 2017/0051035.
[0299] В некоторых вариантах осуществления изобретения, CAAR содержит домен, связывающийся с аутоантителом, трансмембранный домен и внутриклеточную сигнал-передающую область. В некоторых вариантах осуществления изобретения, внутриклеточная сигнал-передающая область содержит внутриклеточный сигнал-передающий домен. В некоторых вариантах осуществления изобретения, внутриклеточный сигнал-передающий домен представляет собой или содержит первичный сигнал-передающий домен, сигнал-передающий домен, способный индуцировать первичный сигнал активации в Т-клетке, сигнал-передающий домен компонента Т-клеточного рецептора (TCR), и/или сигнал-передающий домен, содержащий иммунорецепторный мотив активации на основе тирозина (ITAM). В некоторых вариантах осуществления изобретения, внутриклеточная сигнал-передающая область содержит вторичную или костимулирующую сигнал-передающую область (вторичные внутриклеточные сигнал-передающие области).
[0300] В некоторых вариантах осуществления изобретения, домен, связывающийся с аутоантителом, содержит аутоантиген или его фрагмент. Выбор аутоантигена может зависеть от типа аутоантитела-мишени. Так, например, может быть выбран аутоантиген, поскольку он распознает аутоантитело на клетке-мишени, такой как В-клетка, ассоциированная с конкретным патологическим состояниемм, например, аутоиммунным заболеванием, таким как аутоиммунное заболевание, опосредуемое аутоантителом. В некоторых вариантах осуществления изобретения, аутоиммунное заболевание включает вульгарную пузырчатку (ВП). Примерами аутоантигенов являются десмоглеин 1 (Dsg1) и Dsg3.
d. Мультитаргетинг
[0301] с. В некоторых вариантах осуществления изобретения, применение клеток и способов включает стратегии мультитаргетинга, такие как экспрессия двух или более генетически сконструированных рецепторов на клетку, каждый из которых отличает один антиген от другого антигена, и, как правило, каждый из них включает различные внутриклеточные сигнал-передающие компоненты. Такие стратегии мультитаргетинга описаны, например, в публикации Международной патентной заявки No: WO 2014055668 A1 (где описаны комбинации активирующих и костимулирующих CAAR, например, нацеленных на два различных антигена, присутствующих по отдельности на клетках, не являющихся мишенью, например, на нормальных клетках, но присутствующих вместе только на клетках, ответственных за заболевание или состояние, подвергаемое лечению) и в публикации Fedorov et al., Sci. Transl. Medicine, 5(215) (декабрь, 2013) (где описаны клетки, экспрессирующие активирующий и ингибирующий CAR, такой как CAR, где активирующий CAR связывается с одним антигеном, экспрессирующимся на нормальных или непораженных клетках, и на клетках, ответственных за заболевание или состояние, подвергаемое лечению, а ингибирующий CAR связывается с другим антигеном, экспрессирующимся только на нормальных клетках или клетках, которые не должны быть уничтожены).
[0302] Так, например, в некоторых вариантах осуществления изобретения, клетка включает рецептор, экспрессирующий первый генетически сконструированный антигеннный рецептор (например, CAR или TCR), который способен индуцировать активирующий или стимулирующий сигнал в клетке, обычно после специфического связывания с антигеном, распознаваемым первым рецептором, например, с первым антигеном. В некоторых вариантах осуществления изобретения, клетка дополнительно включает второй генетически сконструированный антигеннный рецептор (например, CAR или TCR), например, химерный костимулирующий рецептор, который способен индуцировать костимулирующий сигнал в иммунной клетке, обычно после специфического связывания со вторым антигеном, распознаваемым вторым рецептором. В некоторых вариантах осуществления изобретения, первый антиген и второй антиген являются одинаковыми. В некоторых вариантах осуществления изобретения, первый антиген и второй антиген являются различными.
[0303] В некоторых вариантах осуществления изобретения, первый и/или второй генетически сконструированный антигенный рецептор (например, CAR или TCR) способны индуцировать активирующий или стимулирующий сигнал в клетке. В некоторых вариантах осуществления изобретения, рецептор включает внутриклеточный сигнал-передающий компонент, содержащий мотивы ITAM или мотивы, подобные ITAM. В некоторых вариантах осуществления изобретения, активация, индуцированная первым рецептором, включает передачу сигнала или изменение уровня экспрессии белка в клетке, что будет приводить к инициации иммунного ответа, такого как фосфорилирование ITAM и/или инициация ITAM-опосредованного каскада передачи сигнала, к образованию иммунологического синапса и/или кластеризации молекулы поблизости от связанного рецептора (например, CD4 или CD8 и т.п.), к активации одного или более факторов транскрипции, таких как NF-kB и/или AP-1 и/или к индуцированию генной экспрессии факторов, таких как цитокины, к пролиферации и/или к повышению выживаемости.
[0304] В некоторых вариантах осуществления изобретения, первый и/или второй рецептор включает внутриклеточные сигнал-передающие домены костимуляторных рецепторов, таких как CD28, CD137 (4-1ВВ), OX40 и/или ICOS. В некоторых вариантах осуществления изобретения, первый и второй рецепторы включают внутриклеточный сигнал-передающий домен костимулирующего рецептора, и эти рецепторы отличаются друг от друга. В одном варианте осуществления изобретения, первый рецептор содержит костимулирующую сигнал-передающую область CD28, а второй рецептор содержит костимулирующую сигнал-передающую область 4-1ВВ, или наоборот.
[0305] В некоторых вариантах осуществления изобретения, первый и/или второй рецептор включают внутриклеточный сигнал-передающий домен, содержащий мотивы ITAM или ITAM-подобные мотивы и внутриклеточный сигнал-передающий домен костимулирующего рецептора.
[0306] В некоторых вариантах осуществления изобретения, первый рецептор содержит внутриклеточный сигнал-передающий домен, содержащий мотивы ITAM или ITAM-подобные мотивы, а второй рецептор содержит внутриклеточный сигнал-передающий домен костимулирующего рецептора. Костимулирующий сигнал в комбинации с активирующим или стимулирующим сигналом, индуцируемым в одной и той же клетке, представляет собой сигнал, дающий иммунный ответ, такой как надежный и устойчивый иммунный ответ, например, повышеие уровня экспрессии гена, секрецию цитокинов и других факторов, а также эффекторные функции, опосредуемые Т-клетками, такие как уничтожение клеток.
[0307] В некоторых вариантах осуществления изобретения, ни лигирование только одного первого рецептора, ни лигирование только одного второго рецептора не индуцирует надежного иммунного ответа. В некоторых аспектах, если лигированным является только один рецептор, то клетка становится устойчивой или не восприимчивой к антигену, или ингибируется и/или не индуцирует пролиферацию или секрецию факторов или не выполняет эффекторных функций. Однако, в некоторых таких вариантах, если лигированными является множество рецепторов, например, после взаимодействия с клеткой, экспрессирующей первый и второй антигены, то достигается желаемый ответ, такой как полная иммунная активация или стимуляция, на которую указывает, например, секреция одного или более цитокинов, пролиферация, персистентность и/или выполнение иммунной эффекторной функции, такой как цитотоксическое уничтожение клетки-мишени.
[0308] В некоторых вариантах осуществления изобретения, два рецептора индуцируют, соответственно, активирующий и ингибирующий сигнал в клетке, в результате чего связывание одного рецептора с антигеном активирует клетку или индуцирует ответ, а связывание второго ингибирующего рецептора с антигеном индуцирует сигнал, который подавляет или гасит эту реакцию. Примерами являются комбинация активирующих CAR и ингибирующих CAR или iCAR. Такая стратегия может быть использована, например, в том случае, если активирующий CAR связывается с антигеном, экспрессирующимся в случае заболевании или расстройства, но при этом также экспрессируется на нормальных клетках, а ингибирующий рецептор связывается с отдельным антигеном, который экспрессируется на нормальных клетках, но не на клетках, вызывающих заболевание или расстройство.
[0309] В некоторых вариантах осуществления изобретения, стратегии мультитаргетинга применяются в том случае, когда антиген, ассоциированный с конкретным заболеванием или состоянием, экспрессируется на непораженной клетке и/или экспрессируется на самой сконструированной клетке, либо транзиентно (например, после стимуляции в комбинации с генной инженерией), либо перманентно. В таких случаях, специфичность, селективность и/или эффективность могут быть повышены, и для этого необходимо лигирование двух отдельных и индивидуально специфических антигенных рецепторов.
[0310] В некоторых вариантах осуществления изобретения, множество антигенов, например, первый и второй антигены экспрессируются на клетках, тканях или на участках-мишенях, ассоциированных с заболеванием или состоянием, например, на раковых клетках. В некоторых аспектах, клетки, ткани, заболевания или состояния относятся к множественной миеломе или к клеткам множественной миеломы. В некоторых вариантах осуществления изобретения, один или более из множества антигенов обычно также экспрессируются на клетках, которые являются не желательными в качестве мишени для клеточной терапии, таких как нормальные или непораженные клетки или ткани и/или сами сконструированные клетки. В таких вариантах осуществления изобретения, для достижения желаемого клеточного ответа, специфичности и/или эффективности необходимо лигирование множества рецепторов.
е. Другие регуляторные элементы
[0311] В некоторых вариантах рассматриваемых здесь способов и композиций, последовательность нуклеиновой кислоты, содержащуюся в геноме вирусного вектора, кодирующего рекомбинантный рецептор, такой как антигенный рецептор, например, CAR, функционально присоединяют посредством других генетических элементов, например, последовательностей регуляции транскрипции, включая промоторы или энхансеры, для регуляции экспрессии представляющей интерес последовательности определенным образом. В некоторых случаях, такими последовательностями регуляции транскрипции являются последовательности, активность которых временно и/или пространственно регулируется. Элементы регуляции экспрессии, которые могут быть использованы для регуляции экспрессии компонентов, известны специалистам и включают, но не ограничиваются ими, индуцибельные промоторы, конститутивные промоторы, сигналы секреции, энхансеры и другие регуляторные элементы. В некоторых вариантах осуществления изобретения, последовательность нуклеиновой кислоты, содержащаяся в геноме вирусного вектора, включает множество элементов регуляции экспрессии, которые регулируют различные кодированные компоненты, например, различные компоненты рецепторов и/или сигнал-передающие компоненты, в результате чего экспрессия, функция и/или активность рекомбинантного рецептора и/или сконструированной клетки, например, клетки, экспрессирующей сконструированный рецептор, может регулироваться, например, является индуцибельной, ингибируемой, регулируемой и/или контролируемой пользователем. В некоторых вариантах осуществления изобретения, один или более векторов могут содержать одну или более последовательностей нуклеиновой кислоты, которые содержат один или более элементов регуляции экспрессии и/или один или более кодируемых компонентов, в результате чего последовательности нуклеиновой кислоты, взятые вместе, могут регулировать экспрессию, активность и/или функцию кодируемых компонентов, например, рекомбинантного рецептора или сконструированной клетки.
[0312] В некоторых вариантах осуществления изобретения, последовательность нуклеиновой кислоты, кодирующую рекомбинантный рецептор, такой как антигенный рецептор, например, CAR, функционально присоединяют к внутренним промоторным/энхансерным регуляторным последовательностям. Используемые промоторы могут быть конститутивными, тканеспецифическими, индуцибельными и/или подходящими при соответствующих условиях для обеспечения высокого уровня экспрессии введенного сегмента ДНК. Промотор может быть гетерологичным или эндогенным. В некоторых вариантах осуществления изобретения, промотор и/или энхансер получают путем синтеза. В некоторых вариантах осуществления изобретения, промотор и/или энхансер получают посредством рекомбинантного клонирования и/или технологии амплификации нуклеиновой кислоты.
[0313] В некоторых случаях, последовательность нуклеиновой кислоты, кодирующая рекомбинантный рецептор, содержит сигнальную последовательность, которая кодирует сигнальный пептид. В некоторых аспектах, сигнальная последовательность может кодировать сигнальный пептид, происходящий от нативного полипептида. В других аспектах, сигнальная последовательность может кодировать гетерологичный или ненативный сигнальный пептид, такой как репрезентативный сигнальный пептид альфа-цепи GMCSFR, представленной в SEQ ID NO: 51 и кодируемой нуклеотидной последовательностью, представленной в SEQ ID NO: 50. В некоторых случаях, последовательность нуклеиновой кислоты, кодирующая рекомбинантный рецептор, например, химерный антигенный рецептор (CAR), содержит сигнальную последовательность, которая кодирует сигнальный пептид. Неограничивающиими репрезентативными примерами сигнальных пептидов являются, например, сигнальный пептид альфа-цепи GMCSFR, представленный в SEQ ID NO: 51 и кодируемый нуклеотидной последовательностью, представленной в SEQ ID NO: 50, или сигнальный пептид CD8-альфа, представленный в SEQ ID NO: 52.
[0314] В некоторых вариантах осуществления изобретения, полинуклеотид, кодирующий рекомбинантный рецептор, содержит по меньшей мере один промотор, который функционально присоединяют для регуляции экспрессии рекомбинантного рецептора. В некоторых примерах осуществления изобретения, полинуклеотид содержит два, три или более промоторов, функционально присоединеннных для регуляции экспрессии рекомбинантного рецептора.
[0315] В некоторых случаях, когда молекулы нуклеиновой кислоты кодируют две или более различных полипептидных цепей, например, рекомбинантный рецептор и маркер, каждая полипептидная цепь может кодироваться отдельной молекулой нуклеиновой кислоты. Так, например, рассматриваются две отдельных нуклеиновых кислоты, каждая из которых может быть отдельно перенесена или введена в клетку для экспрессии в клетке. В некоторых вариантах осуществления изобретения, нуклеиновую кислоту, кодирующую рекомбинантный рецептор, и нуклеиновую кислоту, кодирующую маркер, функционально присоединяют к одному и тому же промотору и разделяют, но необязательно, внутренним сайтом связывания с рибосомой (IRES) или нуклеиновой кислотой, кодирующей саморасщепляющийся пептид или пептид, который вызывает разрезание рибосомы, и который представляет собой, но необязательно, T2A, а P2A, а E2A или F2a. В некоторых вариантах осуществления изобретения, нуклеиновые кислоты, кодирующие маркер и нуклеиновую кислоту, кодирующую рекомбинантный рецептор, функционально присоединяют к двум различными промоторам. В некоторых вариантах осуществления изобретения, нуклеиновая кислота, кодирующая маркер, и нуклеиновая кислота, кодирующая рекомбинантный рецептор, присутствуют в различных положениях клеточного генома, или встроены в эти положения. В некоторых вариантах осуществления изобретения, полинуклеотид, кодирующий рекомбинантный рецептор, вводят в композицию, содержащую культивируемые клетки, например, посредством ретровирусной трансдукции, трансфекции или трансформации.
[0316] В некоторых вариантах осуществления изобретения, например, где полинуклеотид содержит первую и вторую последовательность нуклеиновой кислоты, последовательности, кодирующие каждую из различных полипептидных цепей, могут быть функционально присоединены к промотору, и эти цепи могут быть одинаковыми или различными. В некоторых вариантах осуществления изобретения, молекула нуклеиновой кислоты может содержать промотор, который запускает экспрессию двух или более различных полипептидных цепей. В некоторых вариантах осуществления изобретения, такие молекулы нуклеиновой кислоты могут быть мультицистронными (бицистронными или трицистронными, см., например, патент США No. 6060273). В некоторых вариантах осуществления изобретения, транскрипционные единицы могут быть сконструированы в виде бицистронной единицы, содержащей IRES (внутренний сайт связывания с рибосомой), что позволяет обеспечивать коэкспрессию генных продуктов (например, кодирующих маркер и рекомбинантный рецептор) посредством одного промотора-мессенджера. Альтернативо, в некоторых случаях, один промотор может регулировать экспрессию РНК, которая содержит, в одной открытой рамке считывания (ОРС), два или три гена (например, кодирующих маркер и рекомбинантный рецептор), отделенных друг от друга последовательностями, кодирующими саморасщепляющийся пептид (например, последовательности 2А), или сайтом распознавания протеазы (например, фурином). Таким образом, ОРС кодирует один полипептид, который, либо во время (в случае 2А), либо после трансляции, процессируется в отдельные белки. В некоторых случаях, пептид, такой как T2A, может сообщать рибосоме способность блокировать (рибосомное вырезание) синтез пептидной связи у С-конца элемента 2А, что будет приводить к разделению конца последовательности 2А и следующего расположенного ниже пептида (см., например, de Felipe, Genetic Vaccines and Ther. 2:13 (2004) и de Felipe et al. Traffic 5:616-626 (2004)). Различные элементы 2A являются ивестными. Примерами последовательностей 2A, которые могут быть использованы в раскрытых здесь способах и системах, являются, но не ограничиваются ими, последовательности 2A вируса ящура (F2A, например, SEQ ID NO: 47), вируса лошадиного ринита A (E2A, например, SEQ ID NO: 46), вируса Thosea asigna (T2A, например, SEQ ID NO: 32 или 43), и свиного теховируса-1 (P2A, например, SEQ ID NO: 44 или 45) как описано в публикации патента США No. 20070116690.
[0317] Любой из описанных здесь рекомбинантных рецепторов может кодироваться полинуклеотидами, содержащими одну или более последовательностей нуклеиновой кислоты, кодирующих рекомбинантные рецепторы, в любых комбинациях или реаранжировках. Так, например, один, два, три или более полинуклеотидов могут кодировать один, два, три или более различных полипептидов, например, рекомбинантных рецепторов. В некоторых вариантах осуществления изобретения, один вектор или одна конструкция содержат последовательность, кодирующую маркер, а отдельный вектор или отдельная конструкция содержат последовательность нуклеиновой кислоты, кодирующую рекомбинантный рецептор, например, CAR. В некоторых вариантах осуществления изобретения, нуклеиновую кислоту, кодирующую маркер, и нуклеиновую кислоту, кодирующую рекомбинантный рецептор, функционально присоединяют к двум различным промоторам. В некоторых вариантах осуществления изобретения, нуклеиновая кислота, кодирующая рекомбинантный рецептор, расположена ниже нуклеиновой кислоты, кодирующей маркер.
[0318] В некоторых вариантах осуществления изобретения, остов вектора содержит последовательность нуклеиновой кислоты, кодирующую один или более маркеров. В некоторых вариантах осуществления изобретения, один или более маркеров представляют собой маркер трансдукции, суррогатный маркер и/или маркер отбора.
[0319] В некоторых вариантах осуществления изобретения, маркером является маркер трансдукции или суррогатный маркер. Маркер трансдукции или суррогатный маркер могут быть использованы для детектирования клеток, в которые был введен полинуклеотид, например, полинуклеотид, кодирующий рекомбинантный рецептор. В некоторых вариантах осуществления изобретения, маркер трансдукции может идентифицировать или подтверждать модификацию клетки. В некоторых вариантах осуществления изобретения, суррогатный маркер представляет собой белок, который был получен так, чтобы он коэкспрессировался на поверхности клетки вместе с рекомбинантным рецептором, например, CAR. В конкретных вариантах осуществления изобретения, такой суррогатный маркер представляет собой поверхностный белок, который был модифицирован так, чтобы он обладал незначительной активностью, или вообще не обладал такой активностью. В некоторых вариантах осуществления изобретения, суррогатный маркер кодируется тем же самым полинуклеотидом, который кодирует рекомбинантный рецептор. В некоторых вариантах осуществления изобретения, последовательность нуклеиновой кислоты, кодирующая рекомбинантный рецептор, функционально присоединена к последовательности нуклеиновой кислоты, кодирующей маркер, и разделена, но необязательно, внутренним сайтом связывания с рибосомой (IRES) или нуклеиновой кислотой, кодирующей саморасщепляющийся пептид или пептид, который вызывает разрезание рибосомы, и который представляет собой последовательность 2А, такую как T2A, P2A, E2A или F2А. В некоторых случаях, могут быть использованы внешние маркерные гены в комбинации со сконструированной клеткой для детектирования или отбора клеток, а в некоторых случаях, также для стимуляции клеточного «суицида».
[0320] Репрезентативными суррогатными маркерами могут быть усеченные полипептиды клеточной поверхности, такие как усеченный рецептор человеческого эпидермального фактора роста 2 (tHER2), усеченный рецептор эпидермального фактора роста (EGFRt, репрезентативная последовательность EGFRt, представленная в SEQ ID NO: 33 или 42) или мембранный антиген, специфичный к предстательной железе (PSMA) или его модифицированная форма. EGFRt может содержать эпитоп, распознаваемый антителом цетуксимабом (Erbitux®) или другим терапевтическим анти-EGFR антителом или связывающей молекулой, которые могут быть использованы для идентификации или отбора клеток, которые были сконструированы с использованием конструкции EGFRt и рекомбинантного рецептора, такого как химерный антигенный рецептор (CAR), и/или для удаления или отделения клеток, экспрессирующих рецептор. См. патент США No. 8802374 и Liu et al., Nature Biotech. 2016 April; 34(4): 430-434). В некоторых аспектах, маркер, например, суррогатный маркер, включает все или часть (например, усеченную форму) CD34, NGFR или рецептора эпидермального фактора роста (например, tEGFR). В некоторых вариантах осуществления изобретения, нуклеиновую кислоту, кодирующую маркер, функционально присоединяют к полинуклеотиду, кодирующему линкерную последовательность, такую как расщепляемая линкерная последовательность, например, T2A. Так, например, маркер и, необязательно, линкерная последовательность могут представлять собой любую последовательность, описанную в публикации заявки РСТ No. WO2014031687. Так, например, маркером может быть усеченный EGFR (tEGFR), который, но необязательно, присоединяют к линкерной последовательности, такой как расщепляемая линкерная последовательность T2A. Репрезентативный полипептид усеченного EGFR (например, tEGFR) содержит аминокислотную последовательность, представленную в SEQ ID NO: 33 или 42, или аминокислотную последовательность, которая по меньшей мере на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентична последовательности SEQ ID NO: 33 или 42.
[0321] В некоторых вариантах осуществления изобретения, маркер представляет собой или содержит флуоресцентный белок, такой как белок, флуоресцирующий в зеленом диапазоне спектра (GFP), белок, флуоресцирующий в зеленом диапазоне спектра с повышенной интенсивностью флуоресценции (EGFP), такой как суперспирализованный GFP, белок, флуоресцирующий в красном диапазоне спектра (RFP), такой как tdTomato, mCherry, mStrawberry, AsRed2, DsRed или DsRed2, белок, флуоресцирующий в голубом диапазоне спектра (CFP), белок, флуоресцирующий в синем диапазоне спектра (BFP), белок, флуоресцирующий в синем диапазоне спектра с повышенной интенсивностью флуоресценции (EBFP), и белок, флуоресцирующий в желтом диапазоне спектра (YFP), и их варианты, включая видовые варианты, мономерные варианты и оптимизированные по кодонам и/или активированные варианты флуоресцентных белков. В некоторых вариантах осуществления изобретения, маркер представляет собой или включает фермент, такой как люцифераза, ген LacZ E. coli, щелочная фосфатаза, секретированная эмбриональная щелочная фосфатаза (SEAP), хлорамфениколацетилтрансфераза (CAT). Репрезентативными генами-репортерами, излучающими свет, являются гены люциферазы (luc), β-галактозидазы, хлорамфениколацетилтрансферазы (САТ), β-глюкуронидазы (GUS) или их варианты.
[0322] В некоторых вариантах осуществления изобретения, маркер представляет собой маркер отбора. В некоторых вариантах осуществления изобретения, маркер отбора представляет собой или включает полипептид, сообщающий резистентность к экзогенным агентам или лекарственным средствам. В некоторых вариантах осуществления изобретения, маркер отбора представляет собой ген резистентности к антибиотикам. В некоторых вариантах осуществления изобретения, маркер отбора представляет собой ген резистентности к антибиотикам, сообщающий клетке млекопитающего резистентность к антибиотикам. В некоторых вариантах осуществления изобретения, маркер отбора представляет собой или включает ген резистентности к пуромицину, ген резистентности к гигромицину, ген резистентности к бластицидину, ген резистентности к неомицину, ген резистентности к генетицину или ген резистентности к зеоцину или их модифицированную форму.
[0323] Дополнительными нуклеиновыми кислотами, например, генами для введения, являются гены, повышающие эффективность терапии, например, посредством стимуляции жизнеспособности и/или функции перенесенных клеток; гены, кодирующие генетический маркер для отбора и/или оценки клеток, например, для оценки выживаемости или локализации in vivo; гены для повышения безопасности, например, посредством получения клеток, восприимчивых к негативному отбору in vivo, как описано Lupton S. D. et al., Mol. and Cell Biol., 11:6 (1991); и Riddell et al., Human Gene Therapy 3:319-338 (1992); см. также публикации PCT/US91/08442 и PCT/US94/05601, Lupton et al., где описано использование бифункциональных селективных гибридных генов, полученных в результате присоединения доминантно позитивного селективного маркера к негативному селективному маркеру. См., например, Riddell et al., патент США No. 6040177, столбцы 14-17.
[0324] В некоторых вариантах осуществления изобретения, промотор и/или энхансер могут представлять собой промотор и/или энхансер, которые, по своей природе, ассоциируются с последовательностью нуклеиновой кислоты, поскольку они могут быть получены путем выделения 5'-некодирующих последовательностей, расположенных выше кодирующего сегмента и/или экзона. Альтернативно, в некоторых вариантах осуществления изобретения, кодирующий сегмент нуклеиновой кислоты может находиться под контролем рекомбинантного и/или гетерологичного промотора и/или энхансера, которые обычно не ассоциируются с кодирующей последовательностью нуклеиновой кислоты в природе. Так, например, репрезентативными промоторами, используемыми для конструирования рекомбинантных ДНК, являются, но не ограничиваются ими, промоторы β-лактамазы (пенициллиназы), лактозы, триптофана (trp), РНК-полимеразы (Pol) III, включая человеческие и мышиные промоторы U6 Pol III, а также человеческие и мышиные промоторы РНК H1 Pol III; промоторы РНК-полимеразы (рol) II; предранний промотор цитомегаловируса (рCMV), промотор фактора элонгации 1 альфа (EF-1 альфа), и промоторные системы длинных концевых повторов вируса саркомы Рауса (pRSV). В некоторых вариантах осуществления изобретения, промотор может быть получен, например, из геномов вирусов, таких как вирус полиомы, вирус оспы домашней птицы, аденовирус, бычий вирус папилломы, птичий вирус саркомы, цитомегаловирус, ретровирус, вирус гепатита В и обезьяний вирус 40 (SV40). Промотор может также представлять собой, например, гетерологичный промотор млекопитающих, например, промотор актина или промотор иммуноглобулина, промотор белков теплового шока, или промотор, обычно ассоциированный с нативной последовательностью, при условии, что такие промоторы будут совместимы с клеткой-мишенью. В одном варианте осуществления изобретения, промотор представляет собой природный вирусный промотор в вирусной экспрессионной системе.
[0325] В некоторых вариантах осуществления изобретения, промотор может быть конститутивно активным. Неограничивающими примерами конститутивных промоторов, которые могут быть использованы, являются промотор убихитина (патент США No. 5510474; WO 98/32869), CMV (Thomsen et al., PNAS 81:659, 1984; патент США No. 5168062), бета-актина (Gunning et al. 1989 Proc. Natl. Acad. Sci. USA 84:4831-4835) и pgk (см., например, Adra et al. 1987 Gene 60:65-74; Singer-Sam et al. 1984 Gene 32:409-417; и Dobson et al. 1982 Nucleic Acids Res. 10:2635-2637).
[0326] В некоторых вариантах осуществления изобретения, промотор может представлять собой тканеспецифический промотор и/или промотор, специфичный к клетке-мишени. В некоторых вариантах осуществления изобретения, промоторы могут быть выбраны так, чтобы они индуцировали экспрессию представляющей интерес последовательности. Известен ряд систем для индукции экспрессии, включая систему, чувствительную к тетрациклину, систему оператора-репрессора lac, а также промоторы, чувствительные к различным изменениям окружающей среды или физиологическим изменениям, включая промоторы теплового шока, ионов металлов, таких как промоторы металлотионеина, интерферонов, гипоксии, стероидов, такие как промотор рецептора прогестерона или глюкокортикоида, и промотор, чувствительный к облучению, такой как промотор VEGF. В некоторых вариантах осуществления изобретения, система, регулируемая тетрациклином (tet), которая основана на ингибирующем действии репрессора tet (tetr) Escherichia coli на последовательность оператора tet (ТЕСО), может быть модифицирована для ее использования в системах млекопитающих и в качестве элемента регуляции экспрессии в экспрессионных кластерах. Эти системы хорошо известны. (См. Goshen and Badgered, Proc. Natl. Acad. Sci. USA 89: 5547-51 (1992), Shockett et al., Proc. Natl. Acad. Sci. USA 92:6522-26 (1996), Lindemann et al., Mol. Med. 3:466-76 (1997)).
[0327] Комбинация промоторов может также быть использована для достижения желаемой экспрессии представляющего интерес гена. Специалист в данной области может выбрать промотор на основе желаемого паттерна экспрессии гена в организме или в представляющей интерес клетке-мишени.
[0328] В некоторых вариантах осуществления изобретения, энхансер может также присутствовать в вирусной конструкции для повышения уровня экспрессии представляющего интерес гена. Энхансерами обычно являются цис-действующие элементы нуклеиновых кислот, в основном, длиной приблизительно от 10 до 300 п.о., которые действуют на промотор с повышением уровня его транскрипции. Многие энхансеры в вирусных геномах, таких как ВИЧ или CMV, являются известными. Так, например, может быть использован энхансер CMV (Boshart et al. Cell, 41:521, 1985). Другими примерами являются, например, энхансер SV40, находящийся за ориджином репликации (100-270 п.о.), энхансер раннего промотора цитомегаловируса, энхансер полиомы, расположенный за ориджином репликации, и аденовирусные энхансеры. В некоторых случаях, энхансер происходит от гена млекопитающего, например, энхансер глобина, эластазы, альбумина, альфа-фетопротеина или инсулина. Энхансер может быть использован в комбинации с гетерологичным промотором. Энхансер может быть сплайсирован в вектор в положении 5' или 3' в полинуклеотидной последовательности, кодирующей представляющий интерес ген, но, обычно, он расположен на участке 5' от промотора. Специалист в данной области может выбрать соответствующий энхансер исходя из желаемого паттерна экспрессии.
[0329] Геном вирусного вектора может также содержать дополнительные генетические элементы. Типы элементов, которые могут быть включены в конструкции, не имеют каких-либо ограничений и могут быть выбраны специалистом.
[0330] Так, например, может быть включен сигнал, облегчающий проникновение вирусного генома в ядро клетки-мишени. Примером такого сигнала является последовательность захвата ВИЧ-1 (в некоторых случаях, указанная последовательность называется последовательностью для захвата). Кроме того, векторный геном может содержать один или более генетических элементов, предназначенных для усиления экспрессии представляющнго интерес гена. В некоторых вариантах осуществления изобретения, геном содержит пост-транскрипционный регуляторный элемент (PRE) или его модифицированную форму, которые обладают пост-транскрипционной активностью. Так, например, в некоторых вариантах осуществления изобретения, в конструкцию может быть введен посттранскрипционный чувствительный элемент вируса гепатита сурка (WPRE) (Zufferey et al. 1999. J. Virol. 74:3668-3681; Deglon et al. 2000. Hum. Gene Ther. 11:179-190). В некоторых вариантах осуществления изобретения, векторный геном не содержит последовательности для захвата и/или WPRE. В некоторых вариантах осуществления изобретения, векторный геном содержит мутированную или дефектную последовательность для захвата и/или WPRE.
[0331] В некоторых случаях, могут быть включены более, чем одна открытая рамка считывания, кодирующая отдельные гетерологичные белки. Так, например, в некоторых вариантах осуществления изобретения, если в экспрессионную конструкцию включен репортерный и/или детектируемый и/или селективный ген, то может быть включена последовательность внутреннего сайта связывания с рибосомой (IRES). Обычно, дополнительные генетические элементы функционально присоединены к промотору/энхансеру и независимо регулируются ими. Дополнительный генетический элемент может представлять собой ген-репортер, селективный маркер или другой нужный ген.
[0332] В некоторых вариантах осуществления изобретения, другие различные регуляторные элементы могут включать область инициации и/или терминации транскрипции. Экспрессионные векторы могут также содержать последовательности для терминации транскрипции и для стабилизации мРНК. Такие последовательности являются известными и часто встречаются в природе в 5'- а иногда и в 3'-нетранслируемых областях эукариотических или вирусных ДНК или кДНК. Примерами областей терминации транскрипции являются, но не ограничиваются ими, последовательности сигнала полиаденилирования. Примерами последовательности сигнала полиаденилирования являются, но не ограничиваются ими, последовательности poly(А) бычьего гормона роста (BGH), poly(А) позднего SV40, poly(А) кроличьего бета-глобина (RBG), poly(А) тимидинкиназы (ТК) и любые их варианты.
[0333] В некоторых вариантах осуществления изобретения, регуляторные элементы могут включать регуляторные элементы и/или системы, обеспечивающие регулируемую экспрессию и/или активность рекомбинантного рецептора, например, CAR. В некоторых вариантах осуществления изобретения, регулируемая экспрессия и/или активность достигается благодаря конфигурации рекомбинантного рецептора, содержащего конкретные регуляторные элементы и/или системы или находящегося под их контролем. В некоторых вариантах осуществления изобретения, один или более дополнительных рецепторов могут быть использованы в системах регуляции экспрессии. В некоторых вариантах осуществления изобретения, системы регуляции экспрессии могут включать системы, которые требуют воздействия специфического лиганда или связывания со специфическим лигандом, который может регулировать экспрессию и/или активность рекомбинантного рецептора. В некоторых вариантах осуществления изобретения, регулируемая экспрессия рекомбинантного рецептора, например, CAR, достигается посредством регулируемой системы высвобождения фактора транскрипции, например, модифицированной системы передачи Notch-сигнала (см., например, Roybal et al., Cell (2016) 164:770-779; Morsut et al., Cell (2016) 164:780-791). В некоторых вариантах осуществления изобретения, регуляция активности рекомбинантного рецептора достигается путем введения дополнительного агента, который может индуцировать конформационные изменения и/или мультимеризацию полипептидов, например, рекомбинантного рецептора. В некоторых вариантах осуществления изобретения, дополнительный агент представляет собой химический индуктор (см., например, публикацию патента США No. 2016/0046700, Clackson et al. (1998) Proc. Natl. Acad. Sci. USA. 95(18):10437-42; Spencer et al. (1993) Science 262(5136):1019-24; Farrar et al. (1996) Nature 383 (6596):178-81; Miyamoto et al. (2012) Nature Chemical Biology 8(5): 465-70; Erhart et al. (2013) Chemistry and Biology 20(4): 549-57).
4. Получение частиц вирусного вектора
[0334] Геном вирусного вектора обычно конструируют в форме плазмиды, которая можеут быть перенесена в упаковывающую клеточную линию или в клеточную линию-продуцент. Для продуцирования ретровирусных частиц, геном которых содержит РНК-копию генома вирусного вектора, может быть применен ряд различных известных методов. В некоторых вариантах осуществления изобретения, в создании системы доставки генов на основе вируса участвуют по меньшей мере два компонента, одним из которых являются упаковывающие плазмиды, содержащие структурные белки, а также ферменты, необходимые для образования частицы вирусного вектора, а вторым является сам вирусный вектор, то есть, перенесенный генетический материал. При конструировании одного или обоих этих компонентов могут быть введены агенты, обеспечивающие биологическую безопасность.
[0335] В некоторых вариантах осуществления изобретения, упаковывающая плазмида может содержать все ретровирусные белки, такие как ВИЧ-1, не являющиеся оболочечными белками (Naldini et al., 1998). В других вариантах осуществления изобретения, вирусные векторы могут не содержать дополнительных вирусных генов, таких как гены, которые ассоциируются с вирулентностью, например, vpr, vif, vpu and nef и/или Tat, то есть, первичный трансактиватор ВИЧ. В некоторых вариантах осуществления изобретения, лентивирусные векторы, такие как лентивирусные векторы на основе ВИЧ, содержат только три гена родительского вируса: gag, pol и rev, которые уменьшают или исключают возможность реконструирования вируса дикого типа посредством рекомбинации.
[0336] В некоторых вариантах осуществления изобретения, геном вирусного вектора вводят в упаковывающую клеточную линию, содержащую все компоненты, необходимые для упаковки вирусной геномной РНК, транскрибируемой из генома вирусного вектора, в вирусные частицы. Альтернативно, геном вирусного вектора может включать один или более генов, кодирующих вирусные компоненты помимо одной или более последовательностей, например, представляющих интерес рекомбинантных нуклеиновых кислот. Однако, в некоторых аспектах, для предотвращения репликации генома в клетке-мишени, эндогенные вирусные гены, необходимые для репликации, удаляют и вводят отдельно в упаковывающую клеточную линию.
[0337] В некоторых вариантах осуществления изобретения, упаковывающую клеточную линию трансфецируют одним или более плазмидными векторами, содержащими компоненты, необходимые для образования частиц. В некоторых вариантах осуществления изобретения, упаковывающую клеточную линию трансфецируют плазмидой, содержащей геном вирусного вектора, включая LTR, цис-действующую упаковывающую последовательность и представляющую интерес последовательность, то есть, нуклеиновую кислоту, кодирующую антигенный рецептор, такой как CAR, и одной или более хелперными плазмидами, кодирующими ферментные и/или структурные компоненты вируса, такие как gag, pol и/или rev. В некоторых вариантах осуществления изобретения, для разделения различных генетических компонентов, которые генерируют частицы ретровирусного вектора, используют множество векторов. В некоторых таких вариантах изобретения, введение отдельных векторов в упаковывающую клетку снижает вероятность событий рекомбинации, которые могут так или иначе генерировать компетентные по репликации вирусы. В некоторых вариантах осуществления изобретения может быть использован один плазмидный вектор, имеющий все ретровирусные компоненты.
[0338] В некоторых вариантах осуществления изобретения, частицу ретровирусного вектора, такую как частица лентивирусного вектора, псевдотипируют для повышения эффективности трансдукции клеток-хозяев. Так, например, в некоторых вариантах осуществления изобретения, частицу ретровирусного вектора, такую как частица лентивирусного вектора, псевдотипируют гликопротеином VSV-G, который обеспечивает более широкий круг клеток-хозяев, которые могут быть трансдуцированными. В некоторых вариантах осуществления изобретения, упаковывающую клеточную линию трансфецируют плазмидой или полинуклеотидом, кодирующими ненативный оболочечный гликопротеин, так, чтобы она включала ксенотропные, политропные или амфотропные оболочки, такие как оболочка вируса Синдбис, GALV или VSV-G.
[0339] В некоторых вариантах осуществления изобретения, упаковывающая клеточная линия содержит компоненты, включая вирусные регуляторные и структурные белки, которые необходимы in trans для упаковки вирусной геномной РНК в частицы лентивирусного вектора. В некоторых вариантах осуществления изобретения, упаковывающей клеточной линией может быть любая клеточная линия, способная экспрессировать лентивирусные белки и продуцировать функциональные частицы лентивирусного вектора. В некоторых аспектах, подходящими упаковывающими клеточными линиями являются клетки 293 (АТСС CCL Х), 293T, HeLA (АТСС CCL 2), D17 (АТСС CCL 183), MDCK (АТСС CCL 34), ВНК (АТСС CCL-10) и Cf2Th (ATCC CRL 1430).
[0340] В некоторых вариантах осуществления изобретения, упаковывающая клеточная линия стабильно экспрессирует вирусный(е) белок (белки). Так, например, в некоторых аспектах изобретения может быть сконструирована упаковывающая клеточная линия, содержащая gag, pol, rev и/или другие структурные гены, но не LTR и упаковывающие компоненты. В некоторых вариантах осуществления изобретения, упаковывающая клеточная линия может быть транзиентно трансфецирована молекулами нуклеиновой кислоты, кодирующими один или более вирусных белков, вместе с геномом вирусного вектора, содержащим молекулу нуклеиновой кислоты, кодирующую гетерологичный белок, и/или нуклеиновой кислотой, кодирующей оболочечный гликопротеин.
[0341] В некоторых вариантах осуществления изобретения, вирусные векторы и упаковывающие и/или хелперные плазмиды вводят посредством трансфекции или инфицирования упаковывающей клеточной линии. Упаковывающая клеточная линия продуцирует частицы вирусного вектора, содержащие геном вирусного вектора. Методы трансфекции или инфицирования хорошо известны. Неограничивающими примерами являются методы с использованием фосфата кальция, DEAE-декстрана и методы липофекции, электропорации и микроинжекции.
[0342] При введении рекомбинантной плазмиды и ретровирусных LTR и упаковывающих последовательностей в специальную клеточную линию (например, путем осаждения фосфатом кальция), упаковывающие последовательности могут обеспечивать упаковку РНК-транскрипта рекомбинантной плазмиды в вирусные частицы, которые затем могут секретироваться в культуральную среду. Затем, в некоторых вариантах осуществления изобретения, среду, содержащую рекомбинантные ретровирусы, собирают, необязательно концентрируют и используют для переноса генов. Так, например, в некоторых аспектах, после котрансфекции упаковывающих плазмид и переноса вектора в упаковывающую клеточную линию, частицы вирусного вектора выделяют из культуральной среды и титруют стандартными методами, применяемыми специалистами в данной области.
[0343] В некоторых вариантах осуществления изобретения, ретровирусный вектор, такой как лентивирусный вектор, может быть продуцирован в упаковывающей клеточной линии, такой как репрезентативная клеточная линия НЕК 293T, путем введения плазмид для образования лентивирусных частиц. В некоторых вариантах осуществление изобретения, упаковывающую клетку трансфецируют полинуклеотидом, кодирующим gag и pol, и полинуклеотидом, кодирующим рекомбинантный рецептор, такой как антигенный рецептор, например, CAR, и/или эта клетка содержит указанные компоненты. В некоторых вариантах осуществления изобретения, упаковывающую клеточную линию необязательно и/или дополнительно трансфецируют полинуклеотидом, кодирующим белок rev, и/или эта линия содержит такой полинуклеотид. В некоторых вариантах осуществления изобретения, упаковывающую клеточную линию необязательно и/или дополнительно трансфецируют полинуклеотидом, кодирующим ненативный оболочечный гликопротеин, такой как VSV-G, и/или эта линия содержит такой полинуклеотид. В некоторых таких вариантах осуществления изобретения, приблизительно через два дня после трансфекции клеток, например, клеток НЕК293Т, клеточный супернатант содержит рекомбинантные лентивирусные векторы, которые могут быть выделены и оттитрованы.
[0344] Восстановленные и/или полученные частицы ретровирусного вектора могут быть использованы для трансдукции клеток-мишеней описанными методами. После этого, в клетках-мишенях, вирусная РНК подвергается обратной транскрипции, импортируется в ядро и стабильно встраивается в геном хозяина. Через один или два дня после интеграции вирусной РНК может быть детектирована экспрессия рекомбинантного белка, например, антигенного рецептора, такого как CAR.
С. Инкубация
[0345] В некоторых вариантах осуществления изобретения, рассматриваемые способы включают способы трансдукции клеток путем контакта, например, инкубирования клеточной композиции, включающей множество клеток (далее также называеиой «исходной композицией»), с (1) вирусной частицей. В некоторых вариантах осуществления изобретения, исходная композиция представляет собой или включает первичные клетки, взятые у индивидуума, например, обогащенные клетки и/или клетки, отобранные у индивидуума.
[0346] В некоторых вариантах осуществления изобретения, исходная композиция содержит первичные клетки, взятые у индивидуума. В некоторых аспектах, образцом является проба цельной крови, образец лейкоцитарной пленки, образец мононуклеарных клеток периферической крови (МКПК), образец нефракционированных T-клеток, образец лимфоцитов, образец лейкоцитов, продукт афереза или продукт лейкафереза.
[0347] В некоторых вариантах осуществления изобретения, до отбора и/или трансдукции клеток, образец, содержащий первичные клетки, вводят в контакт ex vivo с сывороткой или плазмой, и/или этот образец содержит сыворотку или плазму в концентрации по меньшей мере или по меньшей мере приблизительно 10% (об/об), по меньшей мере или по меньшей мере приблизительно 15% (об/об), по меньшей мере или по меньшей мере приблизительно 20% (об/об), по меньшей мере или по меньшей мере приблизительно 25% (об/об), по меньшей мере или по меньшей мере приблизительно 30% (об/об), по меньшей мере или по меньшей мере приблизительно 35% (об/об), по меньшей мере или по меньшей мере приблизительно 40% (об/об) или по меньшей мере или по меньшей мере приблизительно 50%. В некоторых вариантах осуществления изобретения, образец содержит сыворотку или плазму в концентрации, которая составляет или составляет приблизительно или по меньшей мере приблизительно 25%, 26%, 27%, 28%, 29%, 30%, 31%, 32%, 33%, 34%, или 35% (об/об). В некоторых вариантах осуществления изобретения, сыворотка или плазма являются человеческими. В некоторых вариантах осуществления изобретения, сыворотка или плазма являются аутологичными для индивидуума. В некоторых вариантах осуществления изобретения, до отбора и/или трансдукции клеток, образец, содержащий первичные клетки, вводят в контакт с антикоагулянтом, либо этот образец содержит антикоагулянт. В некоторых вариантах осуществления изобретения, антикоагулянт представляет собой или содержит свободный ион цитарата, например, раствор антикоагулянта, цитрата и дектрозы, раствор A (ACD-A).
[0348] В некоторых вариантах осуществления изобретения, перед отбором и/или трансдукцией клеток, образец поддерживают при температуре от или приблизительно от 2°C до 8°C в течение 48 часов, например, в течение 12 часов, 24 часов или 36 часов.
[0349] В некоторых вариантах осуществления изобретения, исходная композиция содержит T-клетки и/или обогащена T-клетками, включая CD4+- и/или CD8+-T-клетки. В некоторых аспектах, обогащение может быть осуществлено путем аффинного отбора посредством инкубирования первичных клеток с одним или более реагентами для отбора или созревания аффинности, которые специфически связываются с молекулой клеточной поверхности, экспрессируемой на субпопуляции первичных клеток, что будет способствовать обогащению первичных клеток, исходя из их связывания с реагентом для отбора. В некоторых вариантах осуществления изобретения, обогащение может быть осуществлено путем инкубации клеток с частицами, покрытыми антителом, например, магнитными сферами.
[0350] В некоторых вариантах осуществления изобретения, исходная композиция содержит более, чем или более, чем приблизительно 75%, 80%, 85%, 90%, 95% или более Т-клеток, полученных из образца, взятого у индивидуума. В некоторых аспектах, до инкубации, не более чем на 5%, 10%, 20%, 30%, или 40% Т-клеток исходной композиции представляют собой активированные клетки, экспрессируют поверхностный маркер, выбранный из группы, состоящей из HLA-DR, CD25, CD69, CD71, CD40L и 4-1BB; содержат экспрессируемый внутри клеток цитокин, выбранный из группы, состоящей из IL-2, IFN-гамма, TNF-альфа, присутствуют в фазе G1 или в более поздней фазе клеточного цикла и/или способны пролиферироваться.
[0351] В некоторых вариантах осуществления, исходная композиция, содержащая такие клетки, например, клетки, которые не были подвергнуты ex vivo стимуляции посредством стимулирующего агента или агентов до инкубации и/или контакта, представляет собой композицию, в которой более, чем 20%, 30%, 40%, 50%, 60%, 70% или более клеток экспрессируют рецептор липида низкой плотности (LDL-R). В некоторых вариантах осуществления изобретения, исходную композицию обогащают T-клетками и/или отбирают на T-клетки, такие как CD4+- и/или CD8+-T-клетки и до указанной инкубации, более, чем 20%, 30%, 40%, 50%, 60%, 70% или более Т-клеток экспрессируют рецептор липида низкой плотности (LDL-R).
[0352] В некоторых вариантах осуществления изобретения, во время или в течение по меньшей мере части процесса инкубации и/или контакта, исходная композиция может включать один или более цитокинов. В некоторых вариантах осуществления изобретения, цитокин выбран из IL-2, IL-7 или IL-15. В некоторых вариантах осуществления изобретения, цитокин представляет собой рекомбинантный цитокин. В некоторых вариантах осуществления изобретения, концентрация цитокина в исходной композиции независимо составляет от или приблизительно от 1 ИЕ/мл до 1500 ИЕ/мл, например, от или приблизительно от 1 ИЕ/мл до 100 ИЕ/мл, от 2 ИЕ/мл до 50 ИЕ/мл, от 5 ИЕ/мл до 10 ИЕ/мл, от 10 ИЕ/мл до 500 ИЕ/мл, от 50 ИЕ/мл до 250 ИЕ/мл или от 100 ИЕ/мл до 200 ИЕ/мл, от 50 ИЕ/мл до 1500 ИЕ/мл, от 100 ИЕ/мл до 1000 ИЕ/мл или от 200 ИЕ/мл до 600 ИЕ/мл. В некоторых вариантах осуществления изобретения, концентрация цитокина в исходной композиции независимо составляет по меньшей мере или по меньшей мере приблизительно 1 ИЕ/мл, 5 ИЕ/мл, 10 ИЕ/мл, 50 ИЕ/мл, 100 ИЕ/мл, 200 ИЕ/мл, 500 ИЕ/мл, 1000 ИЕ/мл или 1500 ИЕ/мл. В некоторых аспектах, агент, способный активировать внутриклеточный сигнал-передающий домен комплекса TCR, такой как домен анти-CD3 и/или анти-CD28 антитела, может быть также включен во время или в течение по меньшей мере части процесса инкубирования или после инкубации.
[0353] В некоторых вариантах осуществления изобретения, во время или в течение по меньшей мере части процесса инкубации и/или контакта, исходная композиция может содержать сыворотку. В некоторых вариантах осуществления изобретения, сывороткой является фетальная бычья сыворотка. В некоторых вариантах осуществления изобретения, сывороткой является человеческая сыворотка. В некоторых вариантах осуществления изобретения, сыворотка присутствует в исходной композиции в концентрации от или приблизительно от 0,5% до 25% (об/об), от 1,0% до 10% (об/об) или от 2,5% до 5,0% (об/об), включительно. В некоторых вариантах осуществления изобретения, сыворотка присутствует в исходной композиции в концентрации по меньшей мере или по меньшей мере приблизительно 0,5% (об/об), 1,0% (об/об), 2,5% (об/об), 5% (об/об) или 10% (об/об).
[0354] В некоторых вариантах осуществления изобретения, во время или в течение по меньшей мере части процесса инкубирования и/или контакта, исходная композиция не содержит и/или, по существу, не содержит сыворотку. В некоторых вариантах осуществления изобретения, во время или в течение по меньшей мере части процесса инкубирования и/или контакта, исходную композицию инкубируют и/или вводят в контакт в отсутствии сыворотки. В конкретных вариантах осуществления изобретения, во время или в течение по меньшей мере части процесса инкубирования и/или контакта, исходную композицию инкубируют и/или вводят в контакт в бессывороточной среде. В некоторых вариантах осуществления изобретения, бессывороточная среда представляет собой среду для культивирования клеток, имеющую опрежделенный и/или хорошо определенный состав. В некоторых вариантах осуществления изобретения, бессывороточная среда представляет собой регулируемую культуральную среду, которая была обработана, например, отфильтрована для удаления ингибиторов и/или факторов роста. В некоторых вариантах осуществления изобретения, бессывороточная среда содержит белки. В некоторых вариантах осуществления изобретения, бессывороточная среда может содержать сывороточный альбумин, гидролизаты, факторы роста, гормоны, белки-носители и/или факторы связывания. В некоторых вариантах осуществления изобретения, бессывороточная среда содержит белки, например, альбумин, такой как альбумин бычьей сыворотки, альбумин человеческой сыворотки и/или рекомбинантный альбумин. В некоторых вариантах осуществления изобретения, бессывороточная среда содержит базальную среду, например, DMEM или RPMI 1640, содержащую аминокислоты, витамины, неорганические соли, буферы, антиоксиданты и источники энергии. В некоторых вариантах осуществления изобретения, бессывороточную среду дополняют компонентами, такими как, но не ограничивающимися ими, альбумин, липиды определенного химического состава, факторы роста, инсулин, цитокины и/или антиоксиданты. В некоторых вариантах осуществления изобретения, бессывороточную среду приготавливают так, чтобы она поддерживала рост, пролиферацию, здоровье, гомеостаз клеток определенного типа, таких как клетки иммунной системы, Т-клетки, и/или CD4+- и CD8+-T-клетки.
[0355] В некоторых вариантах осуществления изобретения, во время или в течение по меньшей мере части процесса инкубирования и/или контакта, исходная композиция содержит N-ацетилцистеин. В некоторых вариантах осуществления изобретения, концентрация N-ацетилцистеина в исходной композиции составляет от или приблизительно от 0,4 мг/мл до 4 мг/мл, от 0,8 мг/мл до 3,6 мг/мл или от 1,6 мг/мл до 2,4 мг/мл, включительно. В некоторых вариантах осуществления изобретения, концентрация N-ацетилцистеина в исходной композиции составляет по меньшей мере или по меньшей мере приблизительно или приблизительно 0,4 мг/мл, 0,8 мг/мл, 1,2 мг/мл, 1,6 мг/мл, 2,0 мг/мл, 2,4 мг/мл, 2,8 мг/мл, 3,2 мг/мл, 3,6 мг/мл или 4,0 мг/мл.
[0356] В некоторых вариантах осуществления изобретения, концентрация клеток исходной композиции составляет от или приблизительно от 1,0 × 105 клеток/мл до 1,0 × 108 клеток/мл, например, по меньшей мере или по меньшей мере приблизительно или приблизительно 1,0 × 105 клеток/мл, 5 × 105 клеток/мл, 1 × 106 клеток/мл, 5 × 106 клеток/мл, 1 × 107 клеток/мл, 5 × 107клеток/мл или 1 × 108 клеток/мл.
[0357] В некоторых вариантах осуществления изобретения, вирусные частицы получают при определенном отношении копий частиц вирусного вектора или инфекционных единиц (ИЕ) на общее число клеток (ИЕ/клетку) в исходной композиции или на общее число трансдуцированных клеток. Так, например, в некоторых вариантах осуществления изобретения, вирусные частицы присутствуют во время контакта в количестве, составляющем или приблизительно или по меньшей мере приблизительно или приблизительно составляющем, или составляющем по меньшей мере или приблизительно 0,5, 1, 2, 3, 4, 5, 10, 15, 20, 30, 40, 50 или 60 ИЕ частиц вирусного вектора на одну клетку.
[0358] В некоторых вариантах осуществления изобретения, титр вирусных векторных частиц составляет в пределах или приблизительно в пределах от 1 × 106 ИЕ/мл до 1 × 108 ИЕ/мл, например, в пределах или приблизительно в пределах от 5 × 106 ИЕ/мл до 5 × 107 ИЕ/мл, например, по меньшей мере 6 × 106 ИЕ/мл, × 106 ИЕ/мл, 8 × 106 ИЕ/мл, 9 × 106 ИЕ/мл, 1 × 107 ИЕ/мл, 2 × 107 ИЕ/мл, 3 × 107 ИЕ/мл, 4 × 107 ИЕ/мл или 5 × 107 ИЕ/мл.
[0359] В некоторых вариантах осуществления изобретения, трансдукция может быть достигнута при множественности заражения (MOI) менее, чем 100, например, обычно менее, чем 60, 50, 40, 30, 20, 10, 5 или менее.
[0360] В некоторых вариантах осуществления изобретения, способ включает контакт или инкубацию, например, смешивание клеток с вирусными частицами. В некоторых вариантах осуществления изобретения, контакт осуществляют в течение периода времени от 30 минут до 72 часов, например, от 30 минут до 48 часов, от 30 минут до 24 часов или от 1 часа до 24 часов, например, по меньшей мере или по меньшей мере приблизительно в течение 30 минут, 1 часа, 2 часов, 6 часов, 12 часов, 24 часов, 36 часов или более.
[0361] В некоторых вариантах осуществления изобретения, контакт осуществляют в растворе. В некоторых вариантах осуществления изобретения, клетки и вирусные частицы вводят в контакт в объеме от или приблизительно от 0,5 мл до 500 мл, например, от или приблизительно от 0,5 мл до 200 мл, от 0,5 мл до 100 мл, от 0,5 мл до 50 мл, от 0,5 мл до 10 мл, от 0,5 мл до 5 мл, от 5 мл до 500 мл, от 5 мл до 200 мл, от 5 мл до 100 мл, от 5 мл до 50 мл, от 5 мл до 10 мл, от 10 мл до 500 мл, от 10 мл до 200 мл, от 10 мл до 100 мл, от 10 мл до 50 мл, от 50 мл до 500 мл, от 50 мл до 200 мл, от 50 мл до 100 мл, от 100 мл до 500 мл, от 100 мл до 200 мл или от 200 мл до 500 мл.
[0362] В некоторых вариантах осуществления изобретения, контакт может быть осуществлено путем центрифугирования, такого как центрифужная инокуляция (например, инокуляция в центрифуге). В некоторых вариантах осуществления изобретения, композиция, содержащая клетки, вирусные частицы и реагент, может быть подвергнута вращению, обычно, при относительно низкой силе или скорости, такой как скорость ниже, чем скорость осаждения клеток, например, от или приблизительно от 600 оборотов в минуту до 1700 оборотов в минуту (например, при или приблизительно при или по меньшей мере при 600 оборотов в минуту, 1000 оборотов в минуту, или 1500 оборотов в минуту или 1700 оборотов в минуту). В некоторых вариантах осуществления изобретения, вращение осуществляют при силе, например, относительной центробежной силе от или приблизительно от 100 g до 3200 g (например, при или приблизительно при, или по меньшей мере при или приблизительно при 100 g, 200 g, 300 g, 400 g, 500 g, 1000 g, 1500 g, 2000 g, 2500 g, 3000 g или 3200 g), как было измерено, например, на внутренней или на внешней стенке камеры или отсека. Термин «относительная центрифужная сила» или RCF, обычно, означает действующую силу, сообщаемую объекту или веществу (такому как клетка, образец или осадок и/или положение в камере или в другом вращающемся контейнере), по отношению к силе земного притяжения в определенной точке в пространстве по отношению к оси вращения. Это значение может быть определено по хорошо известным формулам, принимая во внимание силу тяжести, скорость вращения и радиус вращения (расстояние от оси вращения и объекта, вещества или частицы, по которым измеряется RCF).
[0363] В некоторых вариантах осуществления изобретения, инкубацию клеток с частицами вирусного вектора позволяет получить или продуцировать конечную композицию, содержащую клетки, трансдуцированные частицами вирусного вектора.
D. Другие стадии обработки
[0364] В некоторых вариантах осуществления изобретения, стадии обработки для трансдукции, например, в комбинации с клеточной инженерией, могут дополнительно включать культивирование, выращивание, стимуляцию, активацию, размножение и/или приготовление клеток. В некоторых вариантах осуществления изобретения, конечные композиции или клетки инкубируют в стимулирующих условиях или в присутствии стимулирующего агента. Такие условия включают условия, необходимые для индукции пролиферации, размножения, активации и/или выживаемости клеток в популяции и/или для имитации воздействия антигеном. Стимуляция может быть проведена ex vivo или in vivo после введения индивидууму.
1. Активация после трансдукции и/или размножение клеток
[0365] В некоторых вариантах осуществления изобретения, клетки, например, конечную композицию дополнительно инкубируют и/или дополнительно культивируют методами генной инженерии. Стадии инкубирования могут включать культивирование, выращивание, стимулирование, активацию и/или размножение. В некоторых таких вариантах, дополнительную инкубацию осуществляют в условиях, способствующих интеграции вирусного вектора в геном одной или более клеток-хозяев. Инкубация и/или конструирование может быть осуществлено в сосуде для культивирования, таком как устройство, камера, лунка, колонка, пробирка, система трубок, клапан, флакон, чашка для культивирования, пакет или другой контейнер для выращивания или культивирования клеток. В некоторых вариантах осуществления изобретения, композиции или клетки инкубируют в условиях стимуляции или в присутствии стимулирующего агента. Такие условиями являются условия, способствующие индуцированию пролиферации, размножению, активации и/или увеличению продолжительности жизни клеток в популяции; имитации воздействия антигена и/или инициации конструирования клеток методами генной инженерии, например, для введения рекомбинантного антигеного рецептора.
[0366] В некоторых вариантах осуществления изобретения, дополнительное инкубацию проводят при температуре выше комнатной, например, более, чем или более, чем приблизительно при 25°С, например, обычно более, чем или более, чем приблизительно при 32°C, 35°C или 37°C. В некоторых вариантах осуществления изобретения, дополнительную инкубацию проводят при температуре, равной или приблизительно равной 37°C ± 2°С, например, при температуре, равной или приблизительно равной 37°C.
[0367] В некоторых вариантах осуществления изобретения, дополнительную инкубацию проводят в условиях, способствующих стимуляции и/или активации клеток, и такие условия могут включать использование одной или более конкретных сред, температуру, содержание кислорода, содержание диоксида углерода, время, использование конкретных агентов, например, питательных веществ, аминокислот, антибиотиков, ионов и/или стимулирующих факторов, таких как цитокины, хемокины, антигены, партнеры по связыванию, гибридные белки, рекомбинантные растворимые рецепторы и любые другие агенты, предназначенные для активации клеток.
[0368] В некоторых вариантах осуществления изобретения, условиями стимуляции или агентами являются один или более агентов (например, стимулирующие и/или вспомогательные агенты), например, лиганд, способный активировать внутриклеточный сигнал-передающий домен комплекса TCR. В некоторых аспектах, агент запускает или инициирует каскад передачи внутриклеточных сигналов TCR/CD3 в Т-клетке, и такие агенты являются подходящими для передачи первичного сигнала, например, для инициации активации ITAM-индуцированного сигнала, такого как сигнал, специфичный к компоненту TCR, и/или подходящими для стимуляции костимулирующего сигнала, такого как сигнал, специфичный к T-клеточному костимулирующему рецептору, например, анти-CD3 антитело, анти-CD28 антитело или анти-41-ВВ антитело, например, необязательно связанное с твердым носителем, таким как сферы, и/или с одним или более цитокинами. Стимулирующими агентами являются, среди прочих, сферы с анти-CD3/анти-CD28 антителами (например, сферы, содержащие анти-CD3/анти-CD28 антитело DYNABEADS® M-450 для размножения T-клеток и/или сферы ExpACT®). Способ размножения может также включать, но необязательно, стадию добавления анти-CD3 и/или анти-CD28 антитела в культуральную среду. В некоторых вариантах осуществления изобретения, стимулирующими агентами являются IL-2 и/или IL-15, например, IL-2 в концентрации по меньшей мере приблизительно 10 единиц/мл.
[0369] В некоторых вариантах осуществления изобретения, условиями стимуляции или агентами являются один или более агентов, например, лиганд, способный активировать внутриклеточный сигнал-передающий домен комплекса TCR. В некоторых аспектах, агент запускает или инициирует каскад передачи внутриклеточных сигналов TCR/CD3 в Т-клетке. Такими агентами могут быть антитела, такие как антитела, специфичные к компоненту TCR и/или костимулирующему рецептору, например, анти-CD3 антитело, анти-CD28 антитело, например, связанные с твердым носителем, таким как сферы, и/или с одним или более цитокинами. Способ размножения может также включать, но необязательно, стадию добавления анти-CD3 и/или анти-CD28 антитела в культуральную среду (например, в концентрации по меньшей мере приблизительно 0,5 нг/мл). В некоторых вариантах осуществления изобретения, стимулирующими агентами являются IL-2 и/или IL-15, например, IL-2 в концентрации по меньшей мере приблизительно 10 единиц/мл, по меньшей мере приблизительно 50 единиц/мл, по меньшей мере приблизительно 100 единиц/мл или по меньшей мере приблизительно 200 единиц/мл.
[0370] Условия могут включать использование одной или более конкретных сред, температуру, содержание кислорода, содержание диоксида углерода, время, использование конкретных агентов, например, питательных веществ, аминокислот, антибиотиков, ионов и/или стимулирующих факторов, таких как цитокины, хемокины, антигены, партнеры по связыванию, гибридные белки, рекомбинантные растворимые рецепторы и любые другие агенты, предназначенные для активации клеток.
[0371] В некоторых аспектах, инкубацию проводят методами, такими как методы, описанные в патенте США No. 6040177, Riddell et al., Klebanoff et al. (2012) J Immunother. 35(9): 651-660, Terakura et al. (2012) Blood.1:72-82, и/или Wang et al. (2012) J Immunother. 35(9):689-701.
[0372] В некоторых вариантах осуществления изобретения, дополнительную инкубацию проводят в том же самом контейнере или в устройстве, в котором проводят контакт. В некоторых вариантах осуществления изобретения, дополнительную инкубацию проводят без вращения или центрифугирования, которое обычно проводят после по меньшей мере части процесса инкубирования во время вращения, например, в комбинации с центрифугированием или центрифужной инокуляцией. В некоторых вариантах осуществления изобретения, дополнительную инкубацию проводят за пределами стационарной фазы, например, за пределами хроматографической матрицы, например, в растворе.
[0373] В некоторых вариантах осуществления изобретения, дополнительную инкубацию проводят в другом контейнере или устройстве, в которых осуществляют контакт, например, путем переноса, например, посредством автоматического переноса клеточной композиции в другой контейнер или устройство после контакта с вирусными частицами и реагентом.
[0374] В некоторых вариантах осуществления изобретения, Т-клетки размножают путем их добавления к композиции фидерных клеток, инициирующих культивирование, таких как неделящиеся мононуклеарные клетки периферической крови (МКПК) (например, так, чтобы конечная популяция клеток содержала по меньшей мере приблизительно 5, 10, 20 или 40 или более фидерных клеток МКПК для каждого Т-лимфоцита в исходной размножаемой популяции); и инкубирования культуры (например, в течение периода времени, достаточного для размножения определенного числа Т-клеток). В некоторых аспектах, неделящиеся фидерные клетки могут содержать гамма-облученные фидерные клетки МКПК. В некоторых вариантах осуществления изобретения, МКПК облучают гамма-лучами в диапазоне приблизительно от 3000 до 3600 рад для предотвращения деления клеток. В некоторых аспектах, фидерные клетки добавляют в культуральную среде до добавления популяций Т-клеток.
[0375] В некоторых вариантах осуществления изобретения, стимулирующие условия включают температуру, подходящую для роста человеческих Т-лимфоцитов, например, по меньшей мере приблизительно 25 градусов Цельсия, обычно по меньшей мере приблизительно 30 градусов Цельсия, а чаще всего 37 градусов Цельсия или приблизительно 37 градусов Цельсия. Инкубация может также включать, но необязательно, добавление неделящихся трансформированных вирусом лимфобластоидных клеток (LCL) в качестве фидерных клеток, где, например, вирус может представлять собой EBV, CMV или вирус гриппа, а трансформированные LCL презентируют вирусный антиген на поверхности клеток, необязательно в присутствии MHC. В некоторых вариантах осуществления изобретения, Т-клетки экспрессируют TCR, распознающий вирусный антиген. В некоторых вариантах осуществления изобретения, вирусным антигеном может быть антиген вируса EBV, CMV или гриппа. LCL может быть облучены гамма-лучами в диапазоне приблизительно от 6000 до 10000 рад. В некоторых аспектах, фидерные клетки LCL получают в любом подходящем количестве так, чтобы отношение фидерных клеток LCL к исходным Т-лимфоцитам составляло по меньшей мере приблизительно 10:1.
[0376] В некоторых вариантах осуществления изобретения, дополнительное культивирование или инкубация, осуществляемые, например, для облегчения размножения ex vivo, проводят в течение более, чем или приблизительно более, чем 24 часов, 2 дней, 3 дней, 4 дней, 5 дней, 6 дней, 7 дней, 8 дней, 9 дней, 10 дней, 11 дней, 12 дней, 13 дней или 14 дней. В некоторых вариантах осуществления изобретения, дополнительное культивирование или инкубацию осуществляют в течение не более, чем 6 дней, не более, чем 5 дней, не более, чем 4 дней, не более, чем 3 дней, не более, чем 2 дней или не более, чем 24 часов.
[0377] В некоторых вариантах осуществления изобретения, общая продолжительность инкубирования, например, со стимулирующим агентом составляет в пределах или приблизительно в пределах от 1 часа до 96 часов, от 1 часа до 72 часов, от 1 часа до 48 часов, от 4 часов до 36 часов, от 8 часов до 30 часов или от 12 часов до 24 часов, например, по меньшей мере или по по меньшей мере приблизительно 6 часов, 12 часов, 18 часов, 24 часа, 36 часов или 72 часов. В некоторых вариантах изобретения, дополнительную инкубацию осуществляют в течение периода времени от или приблизительно от 1 часа до 48 часов, от 4 часов до 36 часов, от 8 часов до 30 часов или от 12 часов до 24 часов, включительно.
[0378] В некоторых вариантах осуществления изобретения, рассматриваемые здесь способы не включают дополнительного культивирования или инкубации, например, не включают стадии размножения ex vivo или включают, в основном, более короткую стадию размножения ex vivo.
[0379] В некоторых вариантах осуществления, весь процесс конструирования клеток, например, отбора и/или обогащения, инкубирования вместе с трансдукцией и/или дополнительного культивирования или размножения проводят в течение периода времени не более, чем 9 дней, не более, чем 8 дней, не более, чем 7 дней, не более, чем 6 дней, не более, чем 5 дней, не более, чем 4 дней, не более, чем 3 дней, не более, чем 2 дней, или не более, чем 1 день после взятия образца у индивидуума. Очевидно, что такой период времени не включает какой-либо период времени, за который клетки подвергают криоконсервации.
[0380] В некоторых вариантах рассматриваемых здесь способов, сконструированные клетки, например, конечную композицию или приготовленную композицию вводят индивидууму сразу или непосредственно после трансдукции, без какого-либо значительного размножения ex vivo. В некоторых вариантах осуществления изобретения, сконструированные клетки могут быть введены сразу после стадии трансдукции. В некоторых вариантах осуществления изобретения, сконструированные клетки могут быть введены сразу после стадии трансдукции, например, без какого-либо значительного размножения ex vivo, или, в основном, за более короткую стадию размножения ex vivo, чем в стандартных методах, где может потребоваться значительная активация, размножение и/или обогащение in vitro. Так, например, в некоторых вариантах описанных здесь способов, сконструированные клетки могут быть введены через три, два или один день после трансдукции. В некоторых вариантах осуществления изобретения, сконструированные клетки могут быть введены через 48, 36, 24, 20, 16, 12, 8, 4, 2, 1 или менее часов после стадии трансдукции. В некоторых вариантах осуществления изобретения, сконструированные клетки подвергают, в основном, более короткой стадии размножения in vitro, чем в стандартных методах, например, за 48, 36, 24, 20, 16, 12, 8, 4, 2, 1 или менее часов.
[0381] В любом из таких вариантов осуществления изобретения, размножение и/или активация клеток могут происходить in vivo после обработки антигеном, например, размножение сконструированных клеток в организме индивидуума может происходить после введения клеток. В некоторых вариантах осуществления изобретения, уровень, степень или величина размножения in vivo могут быть также повышены, усилены или увеличены различными методами, позволяющими модулировать, например, повышать уровень размножения, пролиферации, выживаемости и/или эффективности вводимых клеток, например, клеток, экспрессирующих рекомбинантный рецептор.
[0382] В некоторых вариантах осуществления изобретения, такие способы включают введение сконструированных клеток, которые дополнительно модифицируют агентом, например, нуклеиновой кислотой для изменения (например, увеличения или уменьшения) уровня экспрессии или активности молекулы, где такое изменение уровня экспрессии или активности способствует повышению, усилению или увеличению уровня размножения, пролиферации, выживаемости и/или эффективности вводимых клеток. В некоторых вариантах осуществления изобретения, экспрессия агента, например, нуклеиновой кислоты, индуцируется, подавляется, регулируется и/или контролируется пользователем, например, путем введения индуктора или другой модулирующей молекулы.
[0383] В некоторых вариантах осуществления изобретения, такие способы включают способы комбинированного введения, например, одновременного или последовательного введения вместе с лекарственным средством или агентом, способствующим повышению, усилению или увеличению уровня размножения, пролиферации, выживаемости и/или эффективности вводимых клеток, например, клеток, экспрессирующих рекомбинантный рецептор. Примеры таких лекарственных средств и агентов описаны в Разделе III.
2. Приготовление композиции
[0384] В некоторых вариантах осуществления изобретения, после дополнительного инкубирования, способ получения клеток может также включать промывку или приготовление клеток. Таким образом, стадии обработки могут включать, среди прочих, приготовление таких композиций.
[0385] Настоящее изобретение также относится к фармацевтическим композициям или препаратам для их использования в таких способах, где в некоторых вариантах, такие способы осуществляют в комбинации с рассматриваемыми здесь способами обработки, например, в закрытой системе, в которой осуществляют другие стадии обработки, например, в автоматическом или в полуавтоматическом режиме.
[0386] В некоторых вариантах осуществления изобретения, клетки и композиции вводят индивидууму в форме фармацевтической композиции или препарата, такой как композиция, содержащая клетки или популяции клеток и фармацевтически приемлемый носитель или наполнитель.
[0387] Термин «фармацевтическая композиция» означает препарат, который приготавливают в такой форме, которая сообщает активному ингредиенту, содержащемуся в этой композиции, эффективную биологическую активность, и которая не содержит каких-либо дополнительных компонентов, которые являются неприемлемо токсичными для индивидуума, которому вводят данную композицию.
[0388] В некоторых вариантах осуществления изобретения, фармацевтические композиции дополнительно включают другие фармацевтически активные агенты или лекарственные средства, такие как химиотерапевтические средства, например, аспарагиназа, бусульфан, карбоплатин, цисплатин, даунорубицин, доксорубицин, фторурацил, гемцитабин, гидроксимочевина, метотрексат, паклитаксел, ритуксимаб, винбластин, винкристин и т.п. В некоторых вариантах осуществления изобретения, эти средства вводят в форме соли, например, фармацевтически приемлемой соли. Подходящими фармацевтически приемлемыми кислотно-аддитивными солями являются соли минеральных кислот, таких как соляная, бромистоводородная, фосфорная, метафосфорная, азотная и серная кислоты, и органических кислот, таких как винная, уксусная, лимонная, яблочная, молочная, фумаровая, бензойная, гликолевая, глюконовая, янтарная и арилсульфоновая кислоты, например, п-толуолсульфоновая кислота.
[0389] Термин «фармацевтически приемлемый носитель» означает ингредиент в фармацевтической композиции, который не является активным ингредиентом, и который является нетоксичным для индивидуума. Фармацевтически приемлемый носитель включает, но не ограничиваются ими, буфер, наполнитель, стабилизатор или консервант.
[0390] В некоторых аспектах, выбор носителя частично определяется конкретной клеткой и/или способом введения. Соответственно, существуют различные подходящие композиции. Так, например, фармацевтическая композиция может содержать консерванты. Подходящими консервантами могут быть, например, метилпарабен, пропилпарабен, бензоат натрия и хлорид бензалкония. В некоторых аспектах используют смесь из двух или более консервантов. Консервант или его смеси обычно присутствуют в количестве приблизительно от 0,0001% до приблизительно 2% по массе всей композиции. Носители описаны, например, в руководстве Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980). Фармацевтически приемлемые носители обычно являются нетоксичными для реципиентов в используемых дозах и концентрациях и включают, но не ограничиваются ими: буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; хлорид бензетония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные полипептиды (приблизительно менее чем в 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатобразующие агенты, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как полиэтиленгликоль (ПЭГ).
[0391] В некоторых аспектах, композиции включают забуферивающие агенты. Подходящими забуферивающими агентами являются, например, лимонная кислота, цитрат натрия, фосфорная кислота, фосфат калия и различные другие кислоты и соли. В некоторых аспектах используют смесь из двух или более забуферивающих агентов. Забуферивающий агент или его смеси обычно присутствуют в количестве приблизительно от 0,001% до приблизительно 4% по массе всей композиции. Методы получения вводимых фармацевтических композиций являются известными. Репрезентативные методы более подробно описаны, например, в руководстве Remington: The Science and Practice of Pharmacy, Lippincott Williams & Wilkins; 21st ed. (May 1, 2005).
[0392] Композиции могут включать водные растворы. Препарат или композиция могут также содержать более, чем один активный ингредиент, подходящий для лечения конкретного заболевания, расстройства или состояния, которое подвергают лечению с использованием клеток, а предпочтительно клеток, активность которых соответствует активности клеток, где соответствующие активности не оказывают негативного влияния друг на друга. Такие активные ингредиенты предпочтительно присутствуют в комбинации в количествах, эффективных для достижения нужных целей. Таким образом, в некоторых вариантах осуществления изобретения, фармацевтическая композиция также включает другие фармацевтически активные агенты или лекарственные средства, такие как химиотерапевтические средства, например, аспарагиназа, бусульфан, карбоплатин, цисплатин, даунорубицин, доксорубицин, фторурацил, гемцитабин, гидроксимочевина, метотрексат, паклитаксел, ритуксимаб, винбластин и/или винкристин.
[0393] В некоторых вариантах осуществления изобретения, фармацевтическая композиция содержит клетки в количестве, эффективном для лечения или профилактики заболевания или состояния, например, терапевтически эффективном или профилактически эффективном количестве. В некоторых вариантах осуществления изобретения, индивидуумов, подвергаемых лечению, периодически обследуют для оценки терапевтической или профилактической эффективности. Желаемая доза может быть доставлена путем одноразового введения ударной дозы клеток, многократного введения ударной дозы клеток или путем непрерывной инфузии клеток.
[0394] Композициями являются композиции для перорального, внутривенного, внутрибрюшинного, подкожного, пульмонарного, трансдермального, внутримышечного, интраназального, трансбуккального, подъязычного введения или введения в виде суппозиториев. В некоторых вариантах осуществления изобретения, клеточные популяции вводят парентерально. Используемый здесь термин «парентеральный» включает внутривенное, внутримышечное, подкожное, ректальное, вагинальное и внутрибрюшинное введение. В некоторых вариантах осуществления изобретения, клетки вводят индивидууму посредством периферической системной доставки путем внутривенной, внутрибрюшинной или подкожной инъекции.
[0395] В некоторых вариантах осуществления изобретения, композиции приготавливают в виде стерильных жидких препаратов, например, изотонических водных растворов, суспензий, эмульсий, дисперсий или вязких композиций, которые, в некоторых аспектах, могут быть забуферены до выбранного рН. Жидкие препараты обычно легче приготавливать, чем гели, другие вязкие композиции и твердые композиции. Кроме того, жидкие композиции несколько более удобны для введения, особенно путем инъекции. С другой стороны, вязкие композиции, могут быть приготовлены в пределах соответствующего диапазона вязкости так, чтобы это обеспечивало более длительный период контакта с определенными тканями. Жидкие или вязкие композиции могут содержать носители, которые могут представлять собой растворитель или дисперсионную среду, содержащую, например, воду, физиологический раствор, забуференный фосфатом физиологический раствор, полиол (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль) и их подходящие смеси.
[0396] Стерильные инъекцируемые растворы могут быть приготовлены путем включения клеток в растворитель, например, в смеси с подходящим носителем, разбавителем или наполнителем, таким как стерильная вода, физиологический раствор, глюкоза, декстроза или т.п. Композиции могут содержать вспомогательные вещества, такие как смачивающие, диспергирующие или эмульгирующие агенты (например, метилцеллюлоза), рН- забуферивающие агенты, гелеобразующие агенты или добавки, повышающие вязкость, консерванты, ароматизаторы и/или красители, в зависимости от нужного способа введения и приготовления препарата. В некоторых аспектах изобретения, способы приготовления подходящих препаратов можно найти в стандартных руководствах.
[0397] В композиции могут быть добавдены различные добавки, повышающие стабильность и стерильность композиций, включая антимикробные консерванты, антиоксиданты, хелатообразующие агенты и буферы. Предотвращение действия микроорганизмов может обеспечиваться с использованием различных антибактериальных и противогрибковых агентов, например, парабенов, хлорбутанола, фенола и сорбиновой кислоты. Пролонгированное поглощение инъецируемой фармацевтической формы может быть достигнуто с использованием агентов, замедляющих всасывание, например, моностеарата алюминия и желатина.
[0398] Композиции, используемые для введения in vivo, обычно являются стерильными. Стерильность может быть легко достигнута, например, путем фильтрации через стерильные фильтрующие мембраны.
III. Терапевтические способы и композиции для введения
[0399] В некоторых аспектах, результаты методов используют в способах лечения, например, в терапии, а именно, для введения клеток и композиций индивидууму, подвергаемому адоптивной клеточной терапии. Настоящее изобретение также относится к таким способам и применениям клеток, обработанных и полученных такими способами, и к фармацевтическим композициям и препаратам для их использования в этих целях. Рассматриваемые способы обычно включают введение индивидуумам клеток или композиций, например, конечной композиции и/или приготовленных композиций.
[0400] В некоторых вариантах осуществления изобретения, клетка экспрессируют рекомбинантные рецепторы, такие как CAR, или другие антигенные рецепторы, такие, как трансгенные TCR, например, TCR, используемые в описанных здесь способах трансдукции. Такие клетки обычно вводят пациентам, страдающим заболеванием или состоянием, которые ассоциируются с лигандом, специфически распознаваемым рецептором. В одном из вариантов осуществления изобретения, клетки экспрессируют рекомбинантный рецептор или химерный рецептор, такой как антигенный рецептор, например, CAR или TCR, которые специфически связываются с лигандом, ассоциированным с заболеванием или расстройством или экспрессируемым в клетках или тканях. Так, например, в некоторых вариантах осуществления изобретения, рецептор представляет собой антигенный рецептор, а лиганд представляет собой антиген, специфичный к заболеванию или расстройству и/или ассоциированный с таким заболеванием или расстройством. Введение обычно способствует ослаблению одного или более симптомов заболевания или состояния и/или лечению или профилактике такого заболевания или состояния или его симптома.
[0401] Заболеваниями, состояниями и расстройствами являются, среди прочих, опухоли, включая солидные опухоли, гематологические злокачественные новообразования и меланомы, в том числе, локализованные и метастазирующие опухоли, инфекционные заболевания, такие как инфекции, вызываемые вирусом или другим патогеном, например, ВИЧ, HCV, HBV, CMV, и паразитарные заболевания, а также аутоиммунные и воспалительные заболевания. В некоторых вариантах осуществления изобретения, заболеваниями или состояниями являются опухоли, рак, злокачественные опухоли, новообразования или другие пролиферативные заболевания или расстройства. Такими заболеваниями являются, но не ограничиваются ими, лейкоз, лимфома, например, хронический лимфоцитарный лейкоз (ХЛЛ), ОЛЛ, неходжкинская лимфома, острый миелоидный лейкоз, множественная миелома, трудноизлечимая фолликулярная лимфома, лимфома коры головного мозга, слабовыраженная В-клеточная лимфома, В-клеточные злокачественные опухоли, рак толстой кишки, рак легких, рак печени, рак молочной железы, рак предстательной железы, рак яичников, рак кожи, меланома, рак кости и рак головного мозга, рак яичника, эпителиальный рак, почечно-клеточная карцинома, аденокарцинома поджелудочной железы, лимфома Ходжкина, карцинома шейки матки, рак прямой и ободочной кишки, глиобластома, нейробластома, саркома Юинга, медуллобластома, остеосаркома, синовиальная саркома и/или мезотелиома.
[0402] В некоторых вариантах осуществления изобретения, такими заболеваниями являются, но не ограничиваются ими, лейкоз, лимфома, например, острый миелоидный (или миелогенный) лейкоз (ОМЛ), хронический миелоидный (или миелогенный) лейкоз (ХМЛ), острый лимфоцитарный (или лимфобластный) лейкоз (ОЛЛ), хронический лимфоцитарный лейкоз (ХЛЛ), ретикулоэндотелиоз (РЭ), мелкоклеточная лимфоцитарная лимфома (МЛЛ), лимфома клеток коры головного мозга (ЛККГМ), лимфома маргинальной зоны, лимфома Беркитта, лимфома Ходжкина (ЛХ), неходжкинская лимфома (НХЛ), анапластическая крупноклеточная лимфома (АККЛ), фолликулярная лимфома, трудноизлечимая фолликулярная лимфома, диффузная крупноклеточная В-клеточная лимфома (ДККЛ) и множественная миелома (ММ). В некоторых вариантах осуществления изобретения, заболеваниями или расстройствами являются В-клеточные злокачественные заболевания, выбранные из острого лимфобластного лейкоза (ОЛЛ), ОЛЛ взрослых, хронического лимфобластного лейкоза (ХЛЛ), неходжкинской лимфомы (НХЛ) и диффузной крупноклеточной В-клеточной лимфомы (ДККЛ). В некоторых вариантах осуществления изобретения, заболеваниями или расстройствами являются НХЛ, где НХЛ выбрана из группы, состоящей из агрессивной НХЛ, диффузной крупноклеточной В-клеточной лимфомы (ДККЛ), NOS (лимфомы De Novo и лимфомы, трансформированной из слабовыраженной лимфомы), первичной крупноклеточной В-клеточной лимфомы средостения (ПККЛС), Т-клеточной/богатой гистоцитами крупноклеточной В-клеточной лимфомы (TКБГККЛ), лимфомы Беркитта, лимфомы клеток коры головного мозга (ЛККГМ), и/или фолликулярной лимфомы (ФЛ) и, необязательно, фолликулярной лимфомы класса 3B (ФЛ-3B).
[0403] В некоторых вариантах осуществления изобретения, заболеваниями или состояниями являются инфекционные заболевания или состояния, такие как, но не ограничивающиеся ими, вирусные, ретровирусные, бактериальные и протозойные инфекции, иммунодефицит, цитомегаловирусные (CMV) инфекции, инфекции, вызываемые вирусом Эпштейна-Барра (EBV), аденовирусом, и полиомавирусом BK. В некоторых вариантах осуществления изобретения, заболеваниями или состояниями являются аутоиммунное или воспалительноее заболевание или состояние, такое как артрит, например, ревматоидный артрит (РА), сахарный диабет типа I, системная красная волчанка (СКВ), воспалительное заболевание кишечника, псориаз, склеродермия, аутоиммунное заболевание щитовидной железы, болезнь Грейвса, болезнь Крона, рассеянный склероз, астма и/или заболевание или состояние, ассоциированное с трансплантацией.
[0404] В некоторых вариантах осуществления изобретения, антиген, ассоциированный с заболеванием или расстройством, представляет собой или включает интегрин ανβ6 (интегрин avb6), антиген, ответственный за созревание В-клеток (BCMA), B7-H3, B7-H6, угольная кислота-ангидразу 9 (CA9, также известную как CAIX или G250), антиген рака яичек, антиген рака яичек 1B (CTAG, также известную как NY-ESO-1 и LAGE-2), карциноэмбриональный антиген (CEA), циклин, циклин A2, мотив C-C лиганда хемокина 1 (CCL-1), CD19, CD20, CD22, CD23, CD24, CD30, CD33, CD38, CD44, CD44v6, CD44v7/8, CD123, CD138, CD171, белок эпидермального фактора роста (EGFR), усеченный белок эпидермального фактора роста (tEGFR), рецептор эпидермального фактора роста типа III с мутацией (EGFR vIII), эпителиальный гликопротеин 2 (EPG-2), эпителиальный гликопротеин 40 (EPG-40), эфрин B2, рецептор эфрина A2 (EPHa2), рецептор эстрогена, рецептор 5, подобный Fc-рецептору (FCRL5; также известный как гомолог Fc-рецептора 5 или FCRH5), фетальный рецептор ацетилхолина (фетальный AchR), белок, связывающийся с фолатом (FBP), рецептор фолата альфа, ганглиозид GD2, O-ацетилированный GD2 (OGD2), ганглиозид GD3, гликопротеин 100 (gp100), рецептор, связанный с G-белком 5D (GPCR5D), Her2/neu (тирозинкиназный рецептор erb-B2), Her3 (erb-B3), Her4 (erb-B4), димеры erbB, человеческий высокомолекулярный антиген, ассоциированный с меланомой (HMW-MAA), антиген поверхности вируса гепатита B, человеческий лейкоцитарный антиген A1 (HLA-A1), человеческий лейкоцитарный антиген A2 (HLA-A2), рецептор IL-22 альфа (IL-22Ra), рецептор IL-13 альфа 2 (IL-13Ra2), рецептор домена киназной вставки (kdr), легкую цепь каппа, клеточно-адгезивную молекулу L1 (L1-CAM), эпитоп CE7 L1-CAM, богатый лейцином повтор, содержащий член семейства А8 (LRRC8A), антиген Льюиса Y, ассоциированный с меланомой антиген (MAGE)-A1, MAGE-A3, MAGE-A6, мезотелин, c-Met, мышиный цитомегаловирус (CMV), муцин 1 (MUC1), MUC16, лиганды антигена члена D группы 2 природных клеток-киллеров (NKG2D), мелан A (MART-1), клеточно-адгезивную молекулу нервных клеток (NCAM), онкофетальный антиген, преимущественно экспрессируемый антиген меланомы (PRAME), рецептор прогестерона, антиген, специфичный к предстательной железе, антиген стволовых клеток предстательной железы (PSCA), мембранный антиген, специфичный к предстательной железе (PSMA), рецептор-«сироту» 1, подобный тирозинкиназному рецептору (ROR1), сурвивин, трофобластный гликопротеин (TPBG, также известный как 5T4), опухолеассоциированный гликопротеин 72 (TAG72), рецептор васкулярного эндотелиального фактора роста (VEGFR), рецептор васкулярного эндотелиального фактора роста 2 (VEGFR2), антиген опухоли Вильмса 1 (WT-1), патоген-специфический антиген или антиген, ассоциированный с универсальной меткой и/или биотинилированные молекулы и/или молекулы, экспрессируемые ВИЧ, HCV, HBV или другими патогенами. В некоторых вариантах осуществления изобретения, антигены, которые являются мишенями для рецепторов, включают антигены, ассоциированные со злокачественностью В-клеток, такие как любые антигены из числа известных В-клеточных маркеров. В некоторых вариантах осуществления изобретения, антиген представляет собой или включает CD20, CD19, CD22, ROR1, CD45, CD21, CD5, CD33, Ig-каппа, Ig-лямбда, CD79a, CD79b или CD30.
[0405] В некоторых вариантах осуществления изобретения, антиген, ассоциированный с заболеванием или расстройством, которые подвергают лечению с использованием клеток или композиций, выбран из группы, состоящей из тирозинкиназного рецептора-«сироты» ROR1, tEGFR, Her2, Ll-CAM, CD19, CD20, CD22, мезотелина, CEA, и антигена поверхности вируса гепатита B, антифолатного рецептора, CD23, CD24, CD30, CD33, CD38, CD44, EGFR, EGP-2, EGP-4, 0EPHa2, ErbB2, 3, или 4, FBP, фетального рецептора ацетилхолина, GD2, GD3, HMW-MAA, IL-22R-альфа, IL-13R-альфа2, kdr, легкой цепи каппа, антигена Льюиса Y, клеточно-адгезивной молекулы L1, MAGE-A1, мезотелина, лигандов MUC1, MUC16, PSCA, NKG2D, NY-ESO-1, MART-1, gp100, онкофетального антигена, ROR1, TAG72, VEGF-R2, карциноэмбрионального антигена (CEA), антигена, специфичного к предстательной железе, PSMA, Her2/neu, рецептора эстрогена, рецептора прогестерона, эфрин B2, CD123, CS-1, c-Met, GD-2, и MAGE A3, CE7, антигена опухоли Вильмса 1 (WT-1), циклина, такого как циклин A1 (CCNA1), и/или биотинилированных молекул, и/или молекул, экспрессируемых ВИЧ, HCV, HBV или другими патогенами.
[0406] В некоторых вариантах осуществления изобретения, антиген представляет собой или включает патоген-специфический антиген или антиген, экспрессируемый патогеном. В некоторых вариантах осуществления изобретения, антиген представляет собой вирусный антиген (например, вирусный антиген от ВИЧ, HCV, HBV и т.д.), бактериальные антигены и/или паразитарные антигены.
[0407] Используемый здесь термин «лечение» (и его грамматические варианты, такие как «лечить» или «терапия») относится к полному или частичному ослаблению или уменьшению заболевания, или состояния, или расстройства, или симптома, неблагоприятного эффекта или результата, или фенотипа, ассоциированного с ними. Желательными эффектами лечения являются, но не ограничиваются ими, профилактика возникновения или рецидива заболевания, ослабление симптомов, снижение любого прямого или опосредованного патологического последствия заболевания, профилактика возникновения метастазов, снижение скорости прогрессирования заболевания, улучшение или временное облегчение патологического состояния и ремиссия или улучшение прогноза. Этот термин не включает полное излечение заболевания или полное устранение каких-либо симптомов или эффекта(ов), влияющих на все симптомы или исход лечения.
[0408] Используемый здесь термин «замедление развития заболевания» означает отсрочку, задержку, препятствование, стабилизацию, подавление и/или ингибирование развития заболевания (например, рака). Это замедление может быть различным по времени, в зависимости от истории болезни и/или конкретного индивидуума, подвергаемого лечению. Специалисту в данной области очевидно, что достаточное или значительное замедление может, по существу, охватывать профилактику, то есть, ситуацию, когда у индивидуума не развивается заболевание. Так, например, может наблюдаться задержка наступления поздней стадии рака, такой как развитие метастазов.
[0409] Используемый здесь термин «предотвращение» включает профилактику возникновения или рецидива заболевания у индивидуума, который может быть предрасположен к данному заболеванию, но у которого это заболевание еще не было диагностировано. В некоторых вариантах осуществления изобретения, рассматриваемые клетки и композиции используются для замедления развития заболевания или замедления прогрессирования заболевания.
[0410] Используемый здесь термин «подавление» функции или активности означает снижение функции или активности по сравнению с функцией или активностью в других условиях, за исключением состояния или представляющего интерес параметра, или, альтернативно, по сравнению с другим условием. Так, например, клетки, которые подавляют рост опухоли, уменьшают скорость роста опухоли по сравнению со скоростью роста опухоли в отсутствии этих клеток.
[0411] Способы введения клеток для проведения адоптивной клеточной терапии известны специалистам и могут быть применены в комбинации с рассматриваемыми здесь способами и композициями. Так, например, методы адоптивной Т-клеточной терапии описаны, например, в публикации заявки на патент США No. 2003/0170238, Gruenberg et al; в патенте США No. 4690915, Rosenberg; Rosenberg (2011) Nat Rev Clin Oncol. 8(10):577-85). См., например, Themeli et al. (2013) Nat Biotechnol. 31(10): 928-933; Tsukahara et al. (2013) Biochem Biophys Res Commun 438(1): 84-9; Davila et al. (2013) PLoS ONE 8(4): e61338.
[0412] Заболевание или состояние, подвергаемое лечению, может представлять собой любое заболевание или состояние, при котором экспрессия антигена ассоциируется с этиологией патологического состояния или расстройства и/или участвует в развитии такого патологического состояния или расстройства, например, вызывает, обостряет или каким-либо иным образом участвует в развитии такого заболевания, состояния или расстройства. Репрезентативными заболеваниями и состояниями могут быть заболевания или состояния, ассоциированные со малигнизацией или трансформацией клеток (например, рака), аутоиммунные или воспалительные заболевания или инфекционное заболевание, например, вызываемое бактериальным, вирусным или другим патогеном. Примеры антигенов, которые включают антигены, ассоциированные с различными заболеваниями и состояниями, которые могут быть подвергнуты лечению, описаны выше. В конкретных вариантах осуществления изобретения, химерный антигенный рецептор или трансгенный TCR специфически связывается с антигеном, ассоциированным с заболеванием или состоянием.
[0413] Клетки и композиции могут быть введены стандартными методами введения с использованием препаратов и/или устройств. Вводимые клетки могут быть аутологичными или гетерологичными, например, аллогенными. Так, например, иммуночувствительные клетки или клетки-предшественники могут быть взяты у одного индивидуума и введены тому же самому индивидууму или другому совместимому индивидууму. Иммуночувствительные клетки или их потомство, происходящее от периферической крови (например, полученные in vivo, ex vivo или in vitro), могут быть введены посредством локальной инъекции, включая введение с помощью катетера, системную инъекцию, локализованную инъекцию, внутривенную инъекцию или парентеральное введение. При введении терапевтической композиции (например, фармацевтической композиции, содержащей генетически модифицированные иммуночувствительные клетки), такую композицию обычно приготавливают в виде инъецируемой унифицированной лекарственной формы (раствора, суспензии, эмульсии).
[0414] В некоторых вариантах осуществления изобретения, клеточную терапию, например, адоптивную клеточную терапию, например, адоптивную Т-клеточную терапию осуществляют путем аутологичного переноса, где T-клетки выделяют и/или как-либо иначе берут у индивидуума, которму проводят клеточную терапию или выделяют из образца, взятого у такого индивидуума. Таким образом, в некоторых аспектах изобретения, клетки берут у индивидуума, например, пациента, нуждающегося в проведении терапии и во введении клеток, и после выделения и обработки, клетки вводят тому же индивидууму.
[0415] В некоторых вариантах осуществления изобретения, клеточную терапию, например, адоптивную клеточную терапию, например, адоптивную Т-клеточную терапию осуществляют путем аллогенного переноса, где клетки выделяют и/или как-либо иначе берут у индивидуума, не являющегося индивидуумом, которому проводят кдеточную терапию или которому, в конечном счете, проводят такую клеточную терапию, например, у первого индивидуума. В таких вариантах осуществления изобретения, клетки затем вводят другоиу индивидууму, например, второму индивидууму того же вида. В некоторых вариантах осуществления изобретения, первый и второй индивидуумы являются генетически идентичными. В некоторых вариантах осуществления изобретения, первый и второй индивидуумы являются генетически схожими. В некоторых вариантах осуществления изобретения, у второго индивидуума экспрессируется HLA того же класса или супертипа, как и у первого индивидуума.
[0416] Клетки могут быть введены любым подходящим способом, например, путем инфузии ударной дозы, путем инъекции, например, путем внутривенных или подкожных инъекций, внутриглазной инъекции, периокулярной инъекции, субретинальной инъекции, инъекции в стекловидное тело, транс-септальной инъекции, инъекции в область под склерой, инъекции во внутрихороидальное пространство, инъекции во внутрь камеры, инъекции под конъюнктиву, инъекции в субтенонову капсулу, ретробульбарной инъекции, перибульбарной инъекции или инъекции в заднее пространство рядом со склерой. В некоторых вариантах осуществления изобретения, эти инъекции вводят парентерально, внутрилегочно и интраназально, и, если это необходимо, то местно путем введения в пораженный участок. Парентеральными инфузиями являются внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. В некоторых вариантах осуществления изобретения, данную дозу вводят путем введения одной ударной дозы клеток, путем введения множества ударных доз клеток, например, в течение периода времени не более, чем 3 дня, или путем непрерывного вливания клеток.
A. Дозы и введение
[0417] Клетки или композиции вводят в дозе, содержащей клетки, экспрессирующие терапевтически эффективноое количество рекомбинантного рецептора (например, CAR), in vivo для лечения заболевания или состояния. Для профилактики или лечения заболевания, соответствующая доза может зависеть от типа заболевания, подвергаемого лечению, типа клеток или рекомбинантных рецепторов, введения других лекарственных средств или агентов в комбинации, для повышения, увеличения или усиления степени размножения клеток, тяжести и течения заболевания, независимо от того, вводят ли эти клетки в профилактических или терапевтических целях, от проводимого ранее лечения, истории болезни пациента и от реакции на клетки, а также по усмотрению лечащего врача. В некоторых вариантах осуществления изобретения, композиции и клетки являются подходящими для их введения индивидууму сразу или в виде курса лечения.
[0418] Термин «эффективное количество» агента, например, фармацевтического препарата, клеток или композиции, если он относится к введению, означает количество, эффективное в определенных дозах/уровнях и в течение периода времени, необходимого для достижения желаемого результата, такого как терапевтический или профилактический эффект.
[0419] Термин «терапевтически эффективное количество» агента, например, фармацевтической композиции или клеток, означает количество, эффективное в определенных дозах и в течение периода времени, необходимого для достижения желаемого терапевтического результата, например, для лечения заболевания, состояния или расстройства, и/или фармакокинетического или фармакодинамического эффекта лечения. Терапевтически эффективное количество может варьироваться в зависимости от таких факторов, как патологическое состояние, возраст, пол и масса индивидуума, и от популяции клеток, вводимых индивидууму, а также от других лекарственных средств или агентов, вводимых в комбинации, например, одновременно.
[0420] Термин «профилактически эффективное количество» означает количество, эффективное в указанных дозах и в течение периодов времени, необходимого для достижения желаемого профилактического результата. Поскольку профилактическую дозу вводят индивидуумам до развития заболевания или на ранней сталии его развития, то обычно, но не обязательно, профилактически эффективное количество будет меньше, чем терапевтически эффективное количество.
[0421] В некоторых вариантах осуществления изобретения, клетки или композиции вводят в количестве, которое является эффективным для лечения или профилактики заболевания или состояния, например, терапевтически эффективным или профилактически эффективным количеством. Таким образом, в некоторых вариантах осуществления изобретения, способы введения включают введение клеток и композиций в эффективных количествах. В некоторых вариантах осуществления изобретения, пациентов, подвергаемых лечению, периодически обследуют для оценки терапевтической или профилактической эффективности. В случае повторных введений в течение нескольких дней или более, в зависимости от состояния, лечение повторяют до желаемого подавления симптомов заболевания. Тем не менее, могут быть использованы и выбраны и другие схемы введения доз.
[0422] В некоторых вариантах осуществления изобретения, индивидууму вводят терапевтически эффективное количество клеток. В некоторых вариантах осуществления изобретения, индивидууму вводят субоптимальную дозу клеток, например, в некоторых случаях, когда клетки вводят в условиях, подходящих для размножения клеток in vivo.
[0423] В некоторых вариантах осуществления изобретения, клетки или отдельные популяции подтипов клеток вводят индивидууму в пределах приблизительно от 0,1 миллиона до приблизительно 100 миллиардов клеток и/или в объеме на килограмм массы тела индивидуума, например, от 0,1 миллиона до приблизительно 50 миллиардов клеток (например, менее, чем 0,5 миллиона клеток, менее, чем 1 миллиона клеток, приблизительно 0,1 миллиона клеток, приблизительно 0,2 миллиона клеток, приблизительно 0,3 миллиона клеток, приблизительно 0,4 миллиона клеток, приблизительно 0,5 миллиона клеток, приблизительно 1 миллиона клеток, приблизительно 5 миллионов клеток, приблизительно 25 миллионов клеток, приблизительно 500 миллионов клеток, приблизительно 1 миллиарда клеток, приблизительно 5 миллиардов клеток, приблизительно 20 миллиардов клеток, приблизительно 30 миллиардов клеток, приблизительно 40 миллиардов клеток, или в пределах, определяемых любыми двумя вышеуказанными значениями), от 1 миллиона до приблизительно 50 миллиардов клеток (например, приблизительно 5 миллионов клеток, приблизительно 25 миллионов клеток, приблизительно 500 миллионов клеток, приблизительно 1 миллиардов клеток, приблизительно 5 миллиардов клеток, приблизительно 20 миллиардов клеток, приблизительно 30 миллиардов клеток, приблизительно 40 миллиардов клеток, или в пределах, определяемых любыми двумя вышеуказанными значениями), например, приблизительно от 10 миллионов до приблизительно 100 миллиардов клеток (например, приблизительно 20 миллионов клеток, приблизительно 30 миллионов клеток, приблизительно 40 миллионов клеток, приблизительно 60 миллионов клеток, приблизительно 70 миллионов клеток, приблизительно 80 миллионов клеток, приблизительно 90 миллионов клеток, приблизительно 10 миллиардов клеток, приблизительно 25 миллиардов клеток, приблизительно 50 миллиардов клеток, приблизительно 75 миллиардов клеток, приблизительно 90 миллиардов клеток, или или в пределах, определяемых любыми двумя вышеуказанными значениями), а в некоторых случаях, приблизительно от 100 миллионов клеток до приблизительно 50 миллиардов клеток (например, приблизительно 120 миллионов клеток, приблизительно 250 миллионов клеток, приблизительно 350 миллионов клеток, приблизительно 450 миллионов клеток, приблизительно 650 миллионов клеток, приблизительно 800 миллионов клеток, приблизительно 900 миллионов клеток, приблизительно 3 миллиардов клеток, приблизительно 30 миллиардов клеток, приблизительно 45 миллиардов клеток) или в любом количестве в пределах этих интервалов и/или в количестве на килограммм массы тела индивидуума. Дозы могут варьироваться в зависимости от конкретных признаков заболевания или расстройства и/или пациента и/или других курсов лечения. В некоторых вариантах осуществления изобретения, такие величины означают число клеток, экспрессирующих рекомбинантный рецептор, а в других вариантах осуществления изобретения, эти величины означают число вводимых T-клеток или МКПК или всех клеток.
[0424] В некоторых вариантах осуществления изобретения, клеточная терапия включает введение дозы, содержащей количество клеток, которое составляет по меньшей мере или по меньшей мере приблизительно или точно или приблизительно составляет 0,1 × 106 клеток/кг массы тела индивидуума, 0,2 × 106 клеток/кг, 0,3 × 106 клеток/кг, 0,4 × 106 клеток/кг, 0,5 × 106 клеток/кг, 1 × 106 клеток/кг, 2,0 × 106 клеток/кг, 3 × 106 клеток/кг или 5 × 106 клеток/кг.
[0425] В некоторых вариантах осуществления изобретения, клеточная терапия включает введение дозы, содержащей число клеток в пределах или приблизительно в пределах от 0,1 × 106 клеток/кг массы тела индивидуума до 1,0 × 107 клеток/кг, в пределах или приблизительно в пределах от 0,5 × 106 клеток/кг до 5 × 106 клеток/кг, в пределах или приблизительно в пределах от 0,5 × 106 клеток/кг до 3 × 106 клеток/кг, в пределах или приблизительно в пределах от 0,5 × 106 клеток/кг до 2 × 106 клеток/кг, в пределах или приблизительно в пределах от 0,5 × 106 клеток/кг до 1 × 106 клеток/кг, в пределах или приблизительно в пределах от 1,0 × 106 клеток/кг массы тела до 5 × 106 клеток/кг, в пределах или приблизительно в пределах от 1,0 × 106 клеток/кг до 3 × 106 клеток/кг, в пределах или приблизительно в пределах от 1,0 × 106 клеток/кг до 2 × 106 клеток/кг, в пределах или приблизительно в пределах от 2,0 × 106 клеток/кг массы тела до 5 × 106 клеток/кг, в пределах или приблизительно в пределах от 2,0 × 106 клеток/кг до 3 × 106 клеток/кг, или в пределах или приблизительно в пределах от 3,0 × 106 клеток/кг массы тела до 5 × 106 клеток/кг, включительно.
[0426] В некоторых вариантах осуществления изобретения, доза клеток составляет от или приблизительно от 2 × 105 клеток/кг до или приблизительно до 2 × 106 клеток/кг, например, от или приблизительно от 4 × 105 клеток/кг до или приблизительно до 1 × 106 клеток/кг, или от или приблизительно от 6 × 105 клеток/кг до или приблизительно до 8 × 105 клеток/кг. В некоторых вариантах осуществления изобретения, доза клеток составляет не более, чем 2 × 105 клеток (например, антиген-экспрессирующих, таких как CAR-экспрессирующих клеток) на килограмм массы тела индивидуум (клеток/кг), например, не более, чем или приблизительно 3 × 105 клеток/кг, не более, чем или приблизительно 4 × 105 клеток/кг, не более, чем или приблизительно 5 × 105 клеток/кг, не более, чем или приблизительно 6 × 105 клеток/кг, не более, чем или приблизительно 7 × 105 клеток/кг, не более, чем или приблизительно 8 × 105 клеток/кг, не более, чем или приблизительно 9 × 105 клеток/кг, не более, чем или приблизительно 1 × 106 клеток/кг, или не более, чем или приблизительно 2 × 106клеток/кг.
[0427] В некоторых вариантах осуществления изобретения, доза клеток составляет по меньшей мере или по меньшей мере приблизительно или точно или приблизительно 2 × 105 клеток (например, антиген-экспрессирующих, таких как CAR-экспрессирующих клеток) на килограмм массы тела индивидуума (клеток/кг), например, по меньшей мере или по меньшей мере приблизительно или точно или приблизительно 3 × 105 клеток/кг, составляет по меньшей мере или по меньшей мере приблизительно или точно или приблизительно 4 × 105 клеток/кг, составляет по меньшей мере или по меньшей мере приблизительно или точно или приблизительно 5 × 105 клеток/кг, составляет по меньшей мере или по меньшей мере приблизительно или точно или приблизительно 6 × 105 клеток/кг, составляет по меньшей мере или по меньшей мере приблизительно или точно или приблизительно 7 × 105 клеток/кг, составляет по меньшей мере или по меньшей мере приблизительно или точно или приблизительно 8 × 105 клеток/кг, составляет по меньшей мере или по меньшей мере приблизительно или точно или приблизительно 9 × 105 клеток/кг, составляет по меньшей мере или по меньшей мере приблизительно или точно или приблизительно 1 × 106 клеток/кг, или составляет по меньшей мере или по меньшей мере приблизительно или точно или приблизительно 2 × 106 клеток/кг.
[0428] В некоторых вариантах осуществления изобретения, доза клеток представляет собой плоскую дозу клеток или фиксированную дозу клеток, то есть, дозу клеток, которая не зависит от площади поверхности тела или массы индивидуума или не была вычислена на их основе.
[0429] В некоторых вариантах осуществления изобретения, клетки или отдельные популяции подтипов клеток вводят индивидууму в пределах приблизительно от одного миллиона до приблизительно 100 миллиардов клеток и/или в объеме на килограмм массы тела, например, приблизительно от 1 миллиона до приблизительно 50 миллиардов клеток (например, приблизительно 5 миллионов клеток, приблизительно 25 миллионов клеток, приблизительно 500 миллионов клеток, приблизительно 1 миллиарда клеток, приблизительно 5 миллиардов клеток, приблизительно 20 миллиардов клеток, приблизительно 30 миллиардов клеток, приблизительно 40 миллиардов клеток, или в пределах, определяемых любыми двумя вышеуказанными значениями), например, приблизительно от 10 миллионов до приблизительно 100 миллиардов клеток (например, приблизительно 20 миллионов клеток, приблизительно 30 миллионов клеток, приблизительно 40 миллионов клеток, приблизительно 60 миллионов клеток, приблизительно 70 миллионов клеток, приблизительно 80 миллионов клеток, приблизительно 90 миллионов клеток, приблизительно 10 миллиардов клеток, приблизительно 25 миллиардов клеток, приблизительно 50 миллиардов клеток, приблизительно 75 миллиардов клеток, приблизительно 90 миллиардов клеток, или или в пределах, определяемых любыми двумя вышеуказанными значениями), а в некоторых случаях, приблизительно от 100 миллионов клеток до приблизительно 50 миллиардов клеток (например, приблизительно 120 миллионов клеток, приблизительно 250 миллионов клеток, приблизительно 350 миллионов клеток, приблизительно 450 миллионов клеток, приблизительно 650 миллионов клеток, приблизительно 800 миллионов клеток, приблизительно 900 миллионов клеток, приблизительно 3 миллиарда клеток, приблизительно 30 миллиардов клеток, приблизительно 45 миллиардов клеток) или в любом количестве в пределах этих интервалов и/или в количестве на килограммм массы тела индивидуума. Дозы могут варьироваться в зависимости от конкретных признаков заболевания или расстройства и/или от пациента и/или от других курсов лечения.
[0430] В некоторых вариантах осуществления изобретения, например, если индивидуумом является человек, то доза включает менее, чем приблизительно 5 × 108 всех клеток, экспрессирующих рекомбинантный рецептор (например, CAR), T-клеток или мононуклеарных клеток периферической крови (МКПК), например, в пределах приблизительно от 1 × 106 до 5 × 108 таких клеток, например, всего 2 × 106, 5 × 106, 1 × 107, 5 × 107, 1 × 108 или 5 × 108 таких клеток, или в пределах любых двух указанных выше значений.
[0431] В некоторых вариантах осуществления изобретения, клеточная терапия включает введение дозы, содержащей число клетки от или приблизительно от 1 × 105 до 5 × 108 всех клеток, экспрессирующих рекомбинантный рецептор, всех Т-клеток, или всех мононуклеарных клеток периферической крови (МКПК), от или приблизительно от 5 × 105 до 1 × 107 всех клеток, экспрессирующих рекомбинантный рецептор, всех Т-клеток, или всех мононуклеарных клеток периферической крови (МКПК), или от или приблизительно от 1 × 106 до 1 × 107 всех клеток, экспрессирующих рекомбинантный рецептор, всех Т-клеток, или всех мононуклеарных клеток периферической крови (МКПК), включительно. В некоторых вариантах осуществления изобретения клеточная терапия включает введение дозы клеток, содержащих число клеток по меньшей мере или по меньшей мере приблизительно 1 × 105 всех клеток, экспрессирующих рекомбинантный рецептор, всех Т-клеток, или всех мононуклеарных клеток периферической крови (МКПК), например, по меньшей мере или по меньшей мере приблизительно 1 × 106, по меньшей мере или по меньшей мере приблизительно1 × 107, по меньшей мере или по меньшей мере приблизительно 1 × 108 таких клеток. В некоторых вариантах осуществления изобретения, указанное число означает число всех CD4+- и/или CD8+-клеток, а в некоторых случаях, также клеток, экспрессирующих рекомбинантный рецептор (например, CAR+). В некоторых вариантах осуществления изобретения, клеточная терапия включает введение дозы, содержащей число клеток от или приблизительно от 1 × 105 до 5 × 108 всех CD3+- и/или CD8+-T-клетки или CD3+- и/или CD8+-клеток, экспрессирующих рекомбинантный рецептор, от или приблизительно от 5 × 105 до 1 × 107 всех CD3+- и/или CD8+-T-клетки или CD3+- и/или CD8+-клеток, экспрессирующих рекомбинантный рецептор, или от или приблизительно от 1 × 106 до 1 × 107 всех CD3+- и/или CD8+-T-клетки или CD3+- и/или CD8+-клеток, экспрессирующих рекомбинантный рецептор, включительно. В некоторых вариантах осуществления изобретения, клеточная терапия включает введение дозы, содержащей число клеток от или приблизительно от 1 × 105 до 5 × 108 всех CD3+/CAR+ или CD8+/CAR+-клеток, от или приблизительно от 5 × 105 до 1 × 107 всех CD3+/CAR+ или CD8+/CAR+-клеток, или от или приблизительно от 1 × 106 до 1 × 107 всех CD3+/CAR+ или CD8+/CAR+-клеток, включительно.
[0432] В некоторых вариантах осуществления изобретения, T-клетками дозы являются CD4+-Т-клетки, CD8+-T-клетки или CD4+- и/или CD8+-T-клетки.
[0433] В некоторых вариантах осуществления изобретения, например, если индивидуумом является человек, то CD8+-T-клетки дозы, включая дозу, включающую CD4+- и CD8+-T-клетки, содержат приблизительно от 1 × 106 до 5 × 108 всех CD8+-клеток, экспрессирующих рекомбинантный рецептор (например, CAR), например, в интервале приблизительно от 5 × 106 до 1 × 108 таких клеток, а именно, 1 × 107, 2,5 × 107, 5 × 107, 7,5 × 107, 1 × 108, или 5 × 108 таких всех клеток, или в интервале любых двух вышеуказанных значений. В некоторых вариантах осуществления изобретения, пациенту вводят дробные дозы, и каждая из этих доз или общих доз может составлять в интервале любых двух вышеуказанных значений. В некоторых вариантах осуществления изобретения, введение дозы клеток включает введение от или приблизительно от 1 × 107 до 0,75 × 108 всех CD8+-T-клеток, экспрессирующих рекомбинантный рецептор, от 1 × 107 до 2,5 × 107 всех CD8+-T-клеток, экспрессирующих рекомбинантный рецептор, от или приблизительно от 1 × 107 до 0,75 × 108 всех CD8+-T-клеток, экспрессирующих рекомбинантный рецептор, включительно. В некоторых вариантах осуществления изобретения, введение дозы клеток включает введение дозы клеток, составляющей или приблизительно составляющей 1 × 107, 2,5 × 107, 5 × 107, 7,5 × 107, 1 × 108 или 5 × 108 всех CD8+-T-клеток, экспрессирующих рекомбинантный рецептор.
[0434] В некоторых вариантах осуществления изобретения, дозу клеток, например, T-клеток, экспрессирующих рекомбинантный рецептор, вводят индивидууму в виде разовой дозы, или вводят только один раз за период времени в течение двух недель, одного месяца, трех месяцев, шести месяцев, 1 года или более.
[0435] В случае адоптивной клеточной терапии, введение данной «дозы» клеток включает введение данного количества или числа клеток в виде одной композиции, или одного непрерывного введения, например, в виде одноразовой инъекции или непрерывной инфузии, а также введение данного количества или числа клеток в виде дробной дозы или в виде множества композиций, представленных в виде нескольких отдельных композиций или инфузий, в течение определенного периода времени, например, в течение не более, чем 3 дней. Таким образом, в некоторых случаях, дозу вводят путем одноразового или непрерывного введения определенного количества клеток, взятых или инициированных в определенный момент времени. Однако, в некоторых случаях, дозу вводят путем многократных инъекций или инфузий в течение не более, чем трех дней, например, один раз в день в течение трех дней или в течение двух дней, или путем многократных инфузий в течение одного дня.
[0436] Таким образом, в некоторых аспектах, клетки дозы вводят в виде одной фармацевтической композиции. В некоторых вариантах осуществления изобретения, клетки дозы вводят в виде множества композиций, в совокупности содержащих клетки данной дозы.
[0437] Термин «дробная доза» означает дозу, которую разделяют так, чтобы ее можно было вводить в течение более, чем одного дня. Такой тип введения дозы входит в объем способов согласно изобретению и рассматривается как введение одной дозы. В некоторых вариантах осуществления изобретения, клетки дробной дозы вводят в виде множества композиций, которые в совокупности, содержат клетки дозы, в течение периода не более трех дней.
[0438] Таким образом, доза клеток может быть введена в виде дробной дозы, например, дробной дозы, вводимой в течение определенного периода времени. Так, например, в некоторых вариантах осуществления изобретения, доза может быть введена индивидууму в течение 2 дней или 3 дней. Репрезентативные способы введения дробных доз включают введение 25% дозы в первый день и введение остальных 75% дозы на второй день. В других вариантах осуществления изобретения, 33% дозы могут быть введены в первый день, а остальные 67% вводят на второй день. В некоторых аспектах, 10% дозы вводят в первый день, 30% дозы вводят на второй день, а 60% дозы вводят на третий день. В некоторых вариантах осуществления изобретения, дробную дозу вводят в течение не более, чем 3-х дней.
[0439] В некоторых вариантах осуществления изобретения, клетки дозы могут быть введены путем введения множества композиций или растворов, таких как первые и вторые композиции и растворы, а возможно и более, каждые из которых содержат некоторые клетки дозы. В некоторых аспектах, множество композиций, каждая из которых содержит клетки различных популяций и/или подтипов, вводят отдельно или независимо, необязательно в течение определенного периода времени. Так, например, популяция или подтипы клеток могут включать CD8+- и CD4+-T-клетки, соответственно, и/или популяции, обогащенные CD8+- и/или CD4+-T-клетками, соответственно, например, CD4+- и/или CD8+-T-клетки, каждая из которых отдельно включает клетки, генетически сконструированные так, чтобы они экспрессировали рекомбинантный рецептор. В некоторых вариантах осуществления изобретения, введение дозы включает введение первой композиции, содержащей дозу CD8+-T-клеток или дозу CD4+-Т-клеток, и введение второй композиции, содержащей другую дозу CD4+-T-клеток и CD8+-Т-клеток.
[0440] В некоторых вариантах осуществления изобретения, введение композиции или дозы, например, введение множества клеточных композиций, включает введение клеточных композиций по отдельности. В некоторых аспектах, отдельные введения осуществляют одновременно или последовательно в любом порядке. В некоторых вариантах осуществления изобретения, доза содержит первую композицию и вторую композицию, где первую композицию и вторую композицию вводят с интервалами от 0 до 12 часов, от 0 до 6 часов или от 0 до 2 часов. В некоторых вариантах осуществления изобретения, начало введения первой композиции и начало введения второй композиции осуществляют с интервалами не более, чем 2 часов, не более чем 1 часа или не более, чем 30 минут, не более, чем 15 минут, не более, чем 10 минут или не более, чем 5 минут. В некоторых вариантах осуществления изобретения, начало и/или завершение введения первой композиции и завершение и/или начало введения второй композиции осуществляют с интервалами не более, чем в 2 часа, не более чем в 1 час или не более, чем в 30 минут, не более, чем в 15 минут, не более, чем в 10 минут или не более, чем в 5 минут.
[0441] В некоторых вариантах композиции, первая композиция, например, первая композиция дозы, включает CD4+-Т-клетки. В некоторых вариантах композиции, первая композиция, например, первая композиция дозы, включает CD8+-Т-клетки. В некоторых вариантах осуществления изобретения, первую композицию вводят до введения второй композиции.
[0442] В некоторых вариантах осуществления изобретения, доза или композиция клеток включает определенное или целевое отношение CD4+-клеток, экспрессирующих рекомбинантный рецептор, к CD8+-клеткам, экспрессирующим рекомбинантный рецептор, и/или CD4+-клеток к CD8+-клеткам, где такое отношение составляет, но необязательно, приблизительно 1:1 или в пределах приблизительно от приблизительно от 1:3 до приблизительно 3:1, например, приблизительно 1:1. В некоторых аспектах, введение композиции или дозы с целевым или нужным отношением различных клеточных популяций (таким как отношение CD4+-клеток:CD8+-клеток или отношение CAR+CD4+-клеток:CAR+CD8+-клеток, составляющее, например, 1:1) включает введение клеточной композиции, содержащей одну из популяций, а затем введение отдельной клеточной композиции, содержащей клетки другой популяции, где введение осуществляют в целевом или нужном отношении или приблизительно в таких отношениях. В некоторых аспектах, введение дозы или композиции клеток в определенном отношении способствует повышению степени размножения, персистентности и/или противоопухолевой активности T-клеток, используемых в T-клеточной терапии.
[0443] В некоторых вариантах осуществления изобретения, индивидууму вводят несколько доз, например, две или более дозы или несколько последовательных доз клеток. В некоторых вариантах осуществления изобретения, индивидууму вводят две дозы. В некоторых вариантах осуществления изобретения, индивидууму вводят дозы последовательно, например, вторую дозу вводят приблизительно через 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или 21 день после введения первой дозы. В некоторых вариантах осуществления изобретения, несколько последовательных доз вводят после первой дозы, так, чтобы дополнительная доза или дополнительные дозы были введены после введения последующей дозы. В некоторых аспектах, количество клеток, вводимых индивидууму в дополнительной дозе, является таким же, или аналогичным количеству клеток в первой дозе и/или в последующей дозе. В некоторых вариантах осуществления изобретения, дополнительная доза или дополнительные дозы превышают предыдущие дозы.
[0444] В некоторых аспектах изобретения, размер первой и/или последующий дозы определяют на основе одного или более критериев, таких как реакция индивидуума на ранее проводимое лечение, например, химиотерапию, тяжесть заболевания у индивидуума, например, опухолевая нагрузка, объем, размер или степень, уровень или тип метастазирования, стадия и/или вероятность или возможность развития у индивидуума токсических эффектов, например, CRS, синдрома активации макрофагов, синдрома лизиса опухоли, нейротоксичности и/или иммунного ответа у хозяина на введение клеток и/или рекомбинантных рецепторов.
[0445] В некоторых аспектах, время между введением первой дозы и введением последующей дозы составляет приблизительно от 9 до приблизительно 35 дней, приблизительно от 14 до приблизительно 28 дней, или от 15 до 27 дней. В некоторых вариантах осуществления изобретения, введение последующей дозы осуществляют более, чем приблизительно через 14 дней и менее, чем приблизительно 28 дней после введения первой дозы. В некоторых аспектах, время между введением первой дозы и введением последующей дозы составляет приблизительно 21 день. В некоторых вариантах осуществления изобретения, дополнительная дозу или дозы, например, последующие дозы, вводят после введения последующей дозы. В некоторых аспектах, дополнительную последующую дозу или дозы вводят по меньшей мере, приблизительно через 14 и менее, чем приблизительно через 28 дней после введения предыдущей дозы. В некоторых вариантах осуществления изобретения, дополнительную дозу вводят менее, чем приблизительно через 14 дней после введения предыдущей дозы, например, через 4, 5, 6, 7, 8, 9, 10, 11, 12 или 13 дней после введения предыдущей дозы. В некоторых вариантах осуществления изобретения, менее, чем приблизительно через 14 дней после предыдущей дозы, дозу не вводят, и/или дозу не вводят более, чем приблизительно через 28 дней после введения предыдущей дозы.
[0446] В некоторых вариантах осуществления изобретения, доза клеток, например, клеток, экспрессирующих рекомбинантный рецептор, включает две дозы (например, двойную дозу), содержащую первую дозу Т-клеток и последующую дозу Т-клеток, где введение одной или обеих первой дозы и второй дозы включает введение дробной дозы Т-клеток.
[0447] В некоторых вариантах осуществления изобретения, доза клеток обычно должна быть достаточно большой, чтобы она была эффективной для снижения тяжести заболевания.
[0448] В некоторых вариантах осуществления изобретения, клетки вводят в нужной дозе, которая, в некоторых аспектах, включает желаемую дозу или число клеток или клеток определенного типа(ов) и/или желаемое отношение клеток определенных типов. Таким образом, в некоторых вариантах осуществления изобретения, дозу клеток вычисляют исходя из общего числа клеток (или числа на кг массы тела) и желаемого отношения отдельных популяций или подтипов, таких как отношение CD4+-клеток к CD8+-клеткам. В некоторых вариантах осуществления изобретения, дозу клеток вычисляют исходя из желаемого общего числа (или числа на кг массы тела) клеток в отдельных популяциях клеток или клеток отдельных типов. В некоторых вариантах осуществления изобретения, дозу клеток вычисляют исходя из комбинации таких признаков, как желаемое число всех клеток, нужное отношение, и желаемое общее число клеток в отдельных популяциях.
[0449] В некоторых вариантах осуществления изобретения, клетки определенных популяций или подтипов, такие как CD8+- и CD4+-T-клетки, вводят в пределах или интервалах допустимых различий желаемых доз всех клеток, таких как желаемая доза Т-клеток. В некоторых аспектах, нужная доза представляет собой желаемое число клеток или желаемое число клеток в расчете на единицу массы тела индивидуума, которому вводят эти клетки, например, клеток/кг. В некоторых аспектах, нужная доза составляет или превышает минимальное число клеток или минимальное число клеток в расчете на единицу массы тела. В некоторых аспектах, из всех клеток, вводимых в нужной дозе, клетки отдельных популяций или подтипов присутствуют в отношении или приблизительно в нужном конечном отношении (таком как отношение CD4+-клеток к CD8+-клеткам), например, в пределах определенных допустимых различий или ошибок такого отношения.
[0450] В некоторых вариантах осуществления изобретения, клетки вводят в пределах или интервалах допустимых различий желаемой дозы одной или более отдельных популяций или подтипов клеток, таких как желаемая доза CD4+-клеток и/или желаемая доза CD8+-клеток. В некоторых аспектах, желаемой дозой является нужное число клеток определенного подтипа или популяции, или желаемое количество таких клеток в расчете на единицу массы тела индивидуума, которому вводят эти клетки, например, клеток/кг. В некоторых аспектах, нужная доза составляет или превышает минимальное число клеток определенной популяции и определенного подтипа или минимальное число клеток популяции или подтипа в расчете на единицу массы тела.
[0451] Таким образом, в некоторых вариантах осуществления изобретения, дозу вычисляют исходя из желаемой фиксированной дозы всех клеток и нужного отношения и/или исходя из нужной фиксированной дозы одной или более клеток, например, каждой клетки отдельных подтипов или субпопуляций. Таким образом, в некоторых вариантах осуществления изобретения, дозу вычисляют исходя из нужной фиксированной или минимальной дозы Т-клеток и нужного отношения CD4+-клеток к CD8+-клеткам и/или исходя из нужной фиксированной или минимальной дозы CD4+-клеток и/или CD8+-клеток.
[0452] В некоторых вариантах осуществления изобретения, клетки вводят в пределах или интервалах допустимого диапазона желаемого конечного отношения множества клеточных популяций или подтипов, таких как CD4+- и CD8+-клеток или их подтипов. В некоторых аспектах, желаемое отношение может представлять собой конкретное отношение или интервал таких отношений. Так, например, в некоторых вариантах осуществления изобретения, нужное отношение (например, отношение CD4+-клеток к CD8+-клеткам) составляет в пределах от или приблизительно от 5:1 до или приблизительно до 5:1 (или более, чем приблизительно 1:5 и менее чем приблизительно 5:1), или в пределах от или приблизительно от 1:3 до или приблизительно до 3:1 (или более, чем приблизительно 1:3 и менее чем приблизительно 3:1), например, в пределах от или приблизительно от 2:1 до или приблизительно до 1:5 (или более, чем приблизительно 1:5 и менее, чем приблизительно 2:1, например, равно или приблизительно равно 5:1, 4,5:1, 4:1, 3,5:1, 3:1, 2,5:1, 2:1, 1,9:1, 1,8:1, 1,7:1, 1,6:1, 1,5:1, 1,4:1, 1,3:1, 1,2:1, 1,1:1, 1:1, 1:1,1, 1:1,2, 1:1,3, 1:1,4, 1:1,5, 1:1,6, 1:1,7, 1:1,8, 1:1,9, 1:2, 1:2,5, 1:3, 1:3,5, 1:4, 1:4,5 или 1:5. В некоторых аспектах, допустимое различие составляет в пределах приблизительно 1%, приблизительно 2%, приблизительно 3%, приблизительно 4% приблизительно 5%, приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50% нужного отношения, включая любую величину в этих интервалах.
[0453] В конкретных вариантах осуществления изобретения, количества и/или концентрации клеток означают число клеток, экспрессирующих рекомбинантный рецептор (например, CAR). В других вариантах осуществления изобретения, количества и/или концентрации клеток означают число или концентрацию всех вводимых клеток, Т-клеток или мононуклеарных клеток периферической крови (МКПК).
[0454] В некоторых аспектах, размер дозы определяют на основе одного или более критериев, таких как реакция индивидуума на ранее проводимое лечение, например, химиотерапия, тяжесть заболевания у индивидуума, например, опухолевая нагрузка, объем, размер или степень, уровень или тип метастазирования, стадия и/или вероятность или возможность развития у индивидуума токсических эффектов, например, CRS, синдрома активации макрофагов, синдрома лизиса опухоли, нейротоксичности и/или иммунного ответа хозяина на введение клеток и/или рекомбинантных рецепторов.
[0455] В некоторых вариантах осуществления изобретения, способы также включают введение одной или более дополнительных доз клеток, экспрессирующих химерный антигенный рецептор (CAR), и/или лимфоистощающую терапию, и/или повторение одной или более стадий этих способов. В некоторых вариантах осуществления изобретения, одна или более дополнительных доз являются такими же, как начальная доза. В некоторых вариантах осуществления изобретения, одна или более дополнительных доз отличаются от начальной дозы, и, например, в 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз или 10 раз или более превышают начальную дозу, или являются, например, в 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз или 10 раз или менее ниже, чем начальная доза. В некоторых вариантах осуществления изобретения, введение одной или более дополнительных доз зависит от реакции индивидуума на первое лечение или ранее проводимое лечение, тяжести заболевания у индивидуума, например, опухолевой нагрузки, объема, размера или степени, уровня или типа метастазирования, стадии и/или вероятности или возможности развития у индивидуума токсических эффектов, например, CRS, синдрома активации макрофагов, синдрома лизиса опухоли, нейротоксичности и/или иммунного ответа хозяина на введение клеток и/или рекомбинантных рецепторов.
[0456] В некоторых вариантах осуществления изобретения, может быть введена относительно более низкая доза клеток, такая как субоптимальная доза клеток или доза клеток меньше, чем терапевтически эффективное количество, и эта доза, после стимуляции in vivo (например, эндогенным антигеном или экзогенным агентом) может способствовать повышению уровня, например, увеличению числа или степени размножения сконструированных клеток, присутствующих у индивидуума. В любом из таких вариантов осуществления изобретения, размножение и/или активация клеток могут происходить под воздействием антигена in vivo, например, размножение сконструированных клеток в организме индивидуума после введения клеток. В некоторых вариантах осуществления изобретения, уровень, степень или величина размножения in vivo могут быть дополнительно увеличены, усилены или повышены различными способами, позволяющими модулировать, например, повышать уровень, усиливать размножение, повышать степень пролиферации, выживаемости и/или эффективности вводимых клеток, например, клеток, экспрессирующих рекомбинантный рецептор.
[0457] В некоторых аспектах, после введения клеток индивидууму (например, человеку), биологическую активность клеточных популяций измеряют любыми известными методами. Параметры оценки включают специфическое связывание клеток с антигеном in vivo, например, посредством визуализации или ex vivo, например, с помощью ELISA или проточной цитометрии. В некоторых вариантах осуществления изобретения, способность клеток разрушать клетки-мишени может быть оценена любым подходящим методом, известным специалистам, таким как анализы на цитотоксичность, описанные, например, Kochenderfer et al., J. Immunotherapy, 32(7): 689-702 (2009), и Herman et al. J. Immunological Methods, 285(1): 25-40 (2004). В некоторых вариантах осуществления изобретения, биологическая активность клеток также может быть оценена путем анализа экспрессии и/или секреции определенных цитокинов, таких как CD107a, IFNγ, IL-2 и TNF. В некоторых аспектах изобретения, биологическую активность измеряют путем оценки клинических результатов, таких как уменьшение опухолевой нагрузки или объема опухоли. В некоторых аспектах оценивают токсические эффекты, персистентность и/или размножение клеток, и/или наличие или отсутствие иммунного ответа у хозяина.
В. Композиции и препараты
[0458] В некоторых вариантах осуществления изобретения, дозу клеток, содержащих клетки, сконструированные с использованием рекомбинантного антигенного рецептора, например, CAR или TCR, получают в виде композиции или препарата, такого как фармацевтическая композиция или препарат. Такие композиции могут быть использованы в соответствии с рассматриваемыми здесь способами и/или как описано в статьях, относящихся к приготовлению или к композициям, например, в целях профилактики или лечения заболеваний, состояний и расстройств или в способах детектирования, диагностики и оценки прогноза.
[0459] Термин «фармацевтическая композиция» означает препарат, который приготавливают в такой форме, которая сообщает активному ингредиенту, содержащемуся в этой композиции, эффективную биологическую активность, и которая не содержит каких-либо дополнительных компонентов, которые являются неприемлемо токсичными для индивидуума, которому вводят данную композицию.
[0460] Термин «фармацевтически приемлемый носитель» означает ингредиент в фармацевтической композиции, который не является активным ингредиентом, и который является нетоксичным для индивидуума. Фармацевтически приемлемый носитель включает, но не ограничиваются ими, буфер, наполнитель, стабилизатор или консервант.
[0461] В некоторых аспектах, выбор носителя частично определяется конкретной клеткой или агентом и/или способом введения. Соответственно, существуют различные подходящие композиции. Так, например, фармацевтическая композиция может содержать консерванты. Подходящими консервантами могут быть, например, метилпарабен, пропилпарабен, бензоат натрия и хлорид бензалкония. В некоторых аспектах используют смесь из двух или более консервантов. Консервант или его смеси обычно присутствуют в количестве приблизительно от 0,0001% до приблизительно 2% по массе всей композиции. Носители описаны, например, в руководстве Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980). Фармацевтически приемлемые носители обычно являются нетоксичными для реципиентов в используемых дозах и концентрациях и включают, но не ограничиваются ими: буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; хлорид бензетония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные полипептиды (приблизительно менее чем в 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатобразующие агенты, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как полиэтиленгликоль (ПЭГ).
[0462] В некоторых аспектах, композиции включают забуферивающие агенты. Подходящими забуферивающими агентами являются, например, лимонная кислота, цитрат натрия, фосфорная кислота, фосфат калия и различные другие кислоты и соли. В некоторых аспектах используют смесь из двух или более забуферивающих агентов. Забуферивающий агент или его смеси обычно присутствуют в количестве приблизительно от 0,001% до приблизительно 4% по массе всей композиции. Методы получения вводимых фармацевтических композиций являются известными. Репрезентативные методы более подробно описаны, например, в руководстве Remington: The Science and Practice of Pharmacy, Lippincott Williams & Wilkins; 21st ed. (May 1, 2005).
[0463] Препарат или композиция могут также включать более, чем один активный ингредиент, подходящий для лечения конкретного заболевания, расстройства или состояния, которое подвергают профилактике или лечению с использованием клеток или агентов, где соответствующие активности не оказывают негативного влияния друг на друга. Такие активные ингредиенты предпочтительно присутствуют в комбинации в количествах, эффективных для достижения нужных целей. Таким образом, в некоторых вариантах осуществления изобретения, фармацевтическая композиция также включает другие фармацевтически активные агенты или лекарственные средства, такие как химиотерапевтические средства, например, аспарагиназа, бусульфан, карбоплатин, цисплатин, даунорубицин, доксорубицин, фторурацил, гемцитабин, гидроксимочевина, метотрексат, паклитаксел, ритуксимаб, винбластин, винкристин и т.п. В некоторых вариантах осуществления изобретения, агенты или клетки вводят в форме соли, например, фармацевтически приемлемой соли. Подходящими фармацевтически приемлемыми кислотно-аддитивными солями являются соли минеральных кислот, таких как соляная, бромистоводородная, фосфорная, метафосфорная, азотная и серная кислоты, и органических кислот, таких как винная, уксусная, лимонная, яблочная, молочная, фумаровая, бензойная, гликолевая, глюконовая, янтарная и арилсульфоновая кислоты, например, п-толуолсульфоновая кислота.
[0464] В некоторых вариантах осуществления изобретения, фармацевтическая композиция содержит агенты или клетки в количестве, эффективном для лечения или профилактики заболевания или состояния, например, терапевтически эффективном или в профилактически эффективном количестве. В некоторых вариантах осуществления изобретения, индивидуумов, подвергаемых лечению, периодически обследуют для оценки терапевтической или профилактической эффективности. Для повторного введения в течение нескольких дней или более, в зависимости от состояния, лечение продолжают до достижения желаемого подавления симптомов заболевания. Однако, могут оказаться подходящими и могут быть разработаны и другие схемы введения доз. Нужная доза может быть доставлена путем одноразового введения ударной дозы композиции, многократного введения ударной дозы композиции или путем непрерывной инфузии композиции.
[0465] Агенты или клетки могут быть введены любым подходящим способом, например, путем инфузии ударной дозы, путем инъекции, например, путем внутривенных или подкожных инъекций, внутриглазной инъекции, периокулярной инъекции, субретинальной инъекции, инъекции в стекловидное тело, транс-септальной инъекции, инъекции в область под склерой, инъекции во внутрихороидальное пространство, инъекции во внутрь камеры, инъекции под конъюнктиву, инъекции в субтенонову капсулу, ретробульбарной инъекции, перибульбарной инъекции или инъекции в заднее пространство рядом со склерой. В некоторых вариантах осуществления изобретения, эти инъекции вводят парентерально, внутрилегочно и интраназально, и, если это необходимо, местно путем введения в пораженный участок. Парентеральными инфузиями являются внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. В некоторых вариантах осуществления изобретения, данную дозу вводят путем введения одной ударной дозы клеток или агента. В некоторых вариантах осуществления изобретения, дозу вводят путем введения множества ударных доз клеток или агента, например, в течение периода времени не более, чем 3 дней, или путем непрерывного вливания клеток или агента.
[0466] Для профилактики или лечения заболевания, соответствующая доза может зависеть от типа заболевания, подвергаемого лечению, типа агента или агентов, типа клеток или рекомбинантных рецепторов, тяжести и течения заболевания, независимо от того, вводят ли агент или клетки в профилактических или терапевтических целях, от проводимого ранее лечения, истории болезни пациента и от реакции на агент или клетки, а также по усмотрению лечащего врача. В некоторых вариантах осуществления изобретения, композиции являются подходящими для их введения индивидууму сразу или в виде курса лечения.
[0467] Клетки или агенты могут быть введены стандартными методами введения, с использованием препаратов и/или устройств. Для хранения и введения композиций используются препараты и устройства, такие как шприцы и сосуды. Вводимые клетки могут быть аутологичными или гетерологичными. Так, например, иммуночувствительные клетки или клетки-предшественники могут быть взяты у одного индивидуума и введены тому же самому индивидууму или другому совместимому индивидууму. Иммуночувствительные клетки или их потомство, происходящее от периферической крови (например, полученные in vivo, ex vivo или in vitro), могут быть введены посредством локальной инъекции, включая введение с помощью катетера, системную инъекцию, локализованную инъекцию, внутривенную инъекцию или парентеральное введение. При введении терапевтической композиции (например, фармацевтической композиции, содержащей генетически модифицированные иммуночувствительные клетки или агент, которые способствуют лечению или ослаблению симптомов нейротоксичности), такую композицию обычно приготавливают в виде инъецируемой унифицированной лекарственной формы (раствора, суспензии, эмульсии).
[0468] Композициями являются композиции для перорального, внутривенного, внутрибрюшинного, подкожного, пульмонарного, трансдермального, внутримышечного, интраназального, трансбуккального, подъязычного введения или введения в виде суппозиториев. В некоторых вариантах осуществления изобретения, агент или клеточные популяции вводят парентерально. Используемый здесь термин «парентеральный» включает внутривенное, внутримышечное, подкожное, ректальное, вагинальное и внутрибрюшинное введение. В некоторых вариантах осуществления изобретения, агент или клеточные популяции вводят индивидууму посредством периферической системной доставки путем внутривенной, внутрибрюшинной или подкожной инъекции.
[0469] В некоторых вариантах осуществления изобретения, композиции приготавливают в виде стерильных жидких препаратов, например, изотонических водных растворов, суспензий, эмульсий, дисперсий или вязких композиций, которые, в некоторых аспектах, могут быть забуферены до выбранного рН. Жидкие препараты обычно легче приготавливать, чем гели, другие вязкие композиции и твердые композиции. Кроме того, жидкие композиции несколько более удобны для введения, особенно путем инъекции. С другой стороны, вязкие композиции могут быть приготовлены в пределах соответствующего диапазона вязкости так, чтобы это обеспечивало более длительный период контакта с определенными тканями. Жидкие или вязкие композиции могут содержать носители, которые могут представлять собой растворитель или дисперсионную среду, содержащую, например, воду, физиологический раствор, забуференный фосфатом физиологический раствор, полиол (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль) и их подходящие смеси.
[0470] Стерильные инъекцируемые растворы могут быть приготовлены путем включения агента или клеток в растворитель, например, в смеси с подходящим носителем, разбавителем или наполнителем, таким как стерильная вода, физиологический раствор, глюкоза, декстроза или т.п.
[0471] Композиции, используемые для введения in vivo, обычно являются стерильными. Стерильность может быть легко достигнута, например, путем фильтрации через стерильные фильтрующие мембраны.
С. Комбинированная терапия, например, агенты для модуляции размножения и активности клеток
[0472] В некоторых вариантах осуществления изобретения, клетки вводят как часть комбинированной терапии, например, одновременно или последовательно в любом порядке вместе с другим агентом, например, терапевтическим агентом, таким как лекарственное средство. В некоторых вариантах осуществления изобретения, другим агентом, например, лекарственным средством, может быть терапевтическое средство, такое как антитело или сконструированная клетка или рецептор или агент, такой как цитотоксическое или терапевтическое средство. В некоторых вариантах осуществления изобретения, другим агентом, например, лекарственным средством, может быть агент, который усиливает, повышает или увеличивает степень размножения, пролиферации, выживаемости и/или эффективности клеток. В некоторых случаях, клетки вводят вместе с другой терапией, через достаточно короткий промежуток времени так, чтобы клеточные популяции усиливали эффект одного или более дополнительных терапевтических средств, или наоборот. В некоторых вариантах осуществления изобретения, клетки вводят до введения одного или более дополнительных терапевтических средств. В некоторых вариантах осуществления изобретения, клетки вводят после введения одного или более дополнительных терапевтических средств.
[0473] В некоторых вариантах осуществления изобретения, такими способами являются способы комбинированного введения, например, одновременного или последовательного введения вместе с лекарственным средством или агентом, способным повышать, усиливать или увеличивать степень размножения, пролиферации, выживаемости и/или эффективности вводимых клеток, например, клеток, экспрессирующих рекомбинантный рецептор. В некоторых вариантах осуществления изобретения, такие агенты вводят одновременно или последовательно в любом порядке вместе с другим агентом, таким как лекарственное средство. В некоторых вариантах осуществления изобретения, агент вводят до, во время, в течение курса лечения или после введения клеток, например, клеток, экспрессирующих рекомбинантный рецептор, например CAR. В некоторых вариантах осуществления изобретения, такими агентами являются агенты, которые специфически повышают, усиливают или увеличивают степень размножения, пролиферации, выживаемости и/или эффективности сконструированных клеток благодаря специфической модуляции трансгена, например, трансгена, кодирующего рекомбинантный рецептор. В некоторых вариантах осуществления изобретения, такие агенты включают агенты, которые модулируют размножение клеток и/или активность вводимых клеток, например, иммунных клеток, таких как Т-клетки.
[0474] В некоторых вариантах осуществления изобретения, вводимые клетки, например, клетки, сконструированные для экспрессии рекомбинантного рецептора, модифицируют так, чтобы они повышали, усиливали или увеличивали степень размножения, пролиферации, выживаемости и/или эффективности вводимых клеток. В некоторых вариантах осуществления изобретения, вводимые клетки, например, клетки, сконструированные для экспрессии рекомбинантного рецептора, модифицируют так, чтобы размножение, пролиферация, выживаемость и/или эффективность вводимых клеток могла регулироватьсЯ и/или контролироваться, например, путем введения агента.
[0475] В некоторых вариантах осуществления изобретения, способы включают стадии in vivo для уменьшения, ингибирования и/или минимизации эффектов ингибирующих факторов, которые подавляют пролиферацию, размножение и/или выживаемость сконструированных клеток in vivo. В некоторых вариантах осуществления изобретения, способы включают стадии in vivo для стимуляции, поддержания и/или усиления пролиферации, размножения и/или выживаемости сконструированных клеток in vivo.
[0476] В некоторых вариантах осуществления изобретения, дополнительным агентом являются небольшая молекула, пептид, полипептид, антитело или его антигенсвязывающий фрагмент, антитело-миметик, аптамер или молекула нуклеиновой кислоты (например, киРНК), липид, полисахарид или любые их комбинации. В некоторых вариантах осуществления изобретения, дополнительным агентом является ингибитор или активатор конкретного фактора, молекулы, рецептора, функции и/или фермента. В некоторых вариантах осуществления изобретения, дополнительным агентом является агонист или антагонист конкретного фактора, молекулы, рецептора, функции и/или фермента. В некоторых вариантах осуществления изобретения, дополнительным агентом является аналог или производное одного или более факторов и/или метаболитов. В некоторых вариантах осуществления изобретения, дополнительным агентом является белок или полипептид. В некоторых вариантах осуществления изобретения, дополнительным агентом является клетка, например, сконструированная клетка.
1. Агенты для трансген-специфического размножения
[0477] В некоторых вариантах осуществления изобретения, способы включают введение агентов, например, агенов для комбинированной терапии помимо клеток, таких как, клетки, сконструированные для экспрессии рекомбинантных рецепторов. В некоторых вариантах осуществления изобретения, агенты специфически увеличивают, усиливают или повышают уровень размножения, пролиферации, выживаемости и/или эффективность сконструированных клеток благодаря специфической модуляции трансгена, например, трансгена, кодирующего рекомбинантный рецептор. В некоторых вариантах осуществления изобретения, агент специфически нацелен на трансген, например, рекомбинантный рецептор. В некоторых вариантах осуществления изобретения, агент специфически связывается с рекомбинантным рецептором, активирует и/или повышает активность этого рекомбинантного рецептора и/или других функций всей или части рекомбинантной молекулы, кодируемой трансгеном. В некоторых вариантах осуществления изобретения, введение агента в комбинации с рекомбинантными клетками может увеличивать, усиливать или повышать уровень пролиферации, размножения и/или выживаемости вводимых клеток, например, повышать уровень размножения клеток in vivo.
[0478] В некоторых вариантах осуществления изобретения, репрезентативные способы или агенты для трансген-специфического размножения включают обработку эндогенным антигеном, вакцинацию, обработку антиидиотипическими антителами или их антигенсвязывающими фрагментами и/или регулируемым рекомбинантным рецептором. Так, например, в некоторых вариантах осуществления изобретения, способы трансген-специфического размножения включают способы вакцинации. В некоторых вариантах осуществления изобретения, агент представляет собой пептидную вакцину или вакцину на основе клеток, например, клеток, сконструированных для экспрессии конкретного антигена, распознаваемого рекомбинантным рецептором (см., например, WO 2016/069647, WO 2011/066048, US 2016/0304624, патент США No. 9476028 и Hailemichael & Overwijk, Int J Biochem Cell Biol. (2014) 53:46-50). В некоторых вариантах осуществления изобретения, способы трансген-специфического размножения включают введение антиидиотипических антител. Антиидиотипические антитела, включая их антигенсвязывающие фрагменты, специфически распознают, специфически нацелены на идиотоп антитела и/или его антигенсвязывающий фрагмент и/или специфически связывается с этим идиотопом или с его антигенсвязывающим фрагментом, например, антигенсвязывающим доменом рекомбинантного рецептора, такого как химерный антигенный рецептор (CAR). Идиотоп представляет собой любую одну антигенную детерминанту или эпитоп в вариабельной области антитела. В некоторых вариантах осуществления изобретения, антиидиотипические антитела или их антигенсвязывающие фрагменты представляют собой агонисты и/или обладают специфической активностью, способствующей стимуляции клеток, экспрессирующих конкретное антитело, включая конъюгаты или рекомбинантные рецепторы, содержащие это антитело или его антигенсвязывающий фрагмент (см., например, публикации заявок на патент США NN 2016/0096902; 2016/0068601; 2014/0322183; 2015/0175711; 2015/283178; патент США No. 9102760; Jena et al. PloS one (2013) 8(3):e57838; Long et al., Nature Medicine (2015) 21(6):581-590; Lee et al., The Lancet (2015) 385(9967):517-528; Zhao et al., PloS One (2014) 9(5):e96697; Leung et al., MAbs. (2015) 7(1):66-76).
2. Агенты для модуляции размножения или активности клеток
[0479] В некоторых вариантах осуществления изобретения, способы включают модуляцию размножения, пролиферации, выживаемости и/или активности иммунных клеток или иммунной функции в целом, включая вводимые сконструированные клетки. В некоторых вариантах осуществления изобретения, способы включают стадии, которые, по существу, способствуют иммуностимуляции или, по существу, способствуют стимуляции, усилению, повышению и/или увеличению размножения, пролиферации, выживаемости и/или активности иммунных клеток, включая вводимые клетки in vivo, например, в организме индивидуумов. В некоторых вариантах осуществления изобретения, агент может снижать, ингибировать и/или минимизировать эффекты ингибирующих факторов, которые подавляют пролиферацию, размножение и/или выживаемость иммунных клеток, например, вводимых клеток in vivo.
а. Ингибирование негативных регуляторов
[0480] В некоторых вариантах осуществления изобретения, способы включают модуляцию размножения сконструированных клеток, например, путем ингибирования негативного регулятора пролиферации, размножения и/или активации вводимых клеток, например, сконструированных иммунных клеток. В конкретном случае, в организме индивидуума, введенные клетки, экспрессирующие рекомбинантный рецептор, могут взаимодействовать с окружающей средой, которая подавляет или ингибирует рост, пролиферацию, размножение и/или выживаемость клеток, например, в иммуносупрессорной среде. Так, например, иммуносупрессорные среды могут содержать иммуносупрессорные цитокины, регуляторные модуляторы и коингибирующие рецепторы. В некоторых вариантах осуществления изобретения, дополнительный агент может быть использован для модуляции размножения вводимых клеток, например, для подавления супрессорной окружающей среды.
[0481] В некоторых вариантах осуществления изобретения, дополнительный агент включает иммуномодулирующий агент, ингибитор контрольной точки иммунитета, модуляторы путей метаболизма, аденозинового пути или антагониста или агониста рецептора аденозина и модуляторы сигнальных путей, например, ингибиторы киназы.
[0482] В некоторых вариантах осуществления изобретения, дополнительный агент представляет собой иммуномодулирующий агент, такой как ингибитор контрольной точки иммунитета. В некоторых примерах, дополнительный агент (то есть, ингибитор контрольной точки иммунитета) увеличивает, усиливает или повышает степень размножения и/или пролиферации вводимых клеток, и тем самым увеличивает, усиливает или повышает иммунный ответ посредством блокирования белка контрольной точки иммунитета. В некоторых вариантах осуществления изобретения, дополнительный агент представляет собой агент, который повышает активность сконструированной клетки, например, клетки, экспрессирующей рекомбинантный рецептор, и представляет собой молекулу, которая ингибирует молекулу, подавляющую иммунитет, или молекулу контрольной точки иммунитета. Примерами молекул, ингибирующих иммунитет, являются PD-1, PD-L1, CTLA4, TEVI3, CEACAM (e.g., CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 и TGFR β. В некоторых вариантах осуществления изобретения, ингибитор контрольной точки иммунитета может представлять собой антитело, направленное против белка контрольной точки иммунитета, такое как антитело, направленное против цитотоксического Т-лимфоцитарного антигена 4 (CTLA4 или CD152), белка запрограммированной гибели клеток 1 (PD-1), или лиганда 1 белка запрограммированной гибели клеток 1 (PD-L1) (см., e.g., Pardoll, Nat Rev Cancer. 2012 Mar. 22; 12(4):252-264).
[0483] В некоторых вариантах осуществления изобретения, способы включают контакт клеток, экспрессирующих рекомбинантный рецептор, с агентом, который ингибирует ингибирующие рецепторы клеточной поверхности, например, рецептор трансформирующего фактора роста бета (TGFβR). В некоторых вариантах осуществления изобретения, введенные клетки, например, клетки, экспрессирующие рекомбинантный рецептор, могут быть сконструированы так, чтобы они блокировали эффекты иммуносупрессорных цитокинов, которые могут ингибировать эффекторные функции этих клеток (см., например, Foster et al., J Immunother. (2008) 31:500-505; Bollard et al., Molecular Therapy. (2012) 20:S22; Bendle et al., J. Immunol. (2013) 191(6):3232-3239). В некоторых вариантах осуществления изобретения, дополнительный агент представляет собой анти-TGFβ или анти-TGFβR антитело (см., например, WO 2011/109789).
[0484] В некоторых вариантах осуществления изобретения, дополнительный агент модулирует метаболизм, сигнальный путь и/или транспорт иммуносупрессорных факторов, например, аденозина. В некоторых вариантах осуществления изобретения, дополнительный агент представляет собой ингибитор внеклеточного аденозина или рецептора аденозина, или агент, который вызывает уменьшение или снижение внеклеточных уровней аденозина, такой как агент, который предотвращает образование внеклеточного аденозина, разлагает его, делает неактивным и/или снижает его уровни. В некоторых вариантах осуществления изобретения, дополнительный агент представляет собой антагонист рецептора аденозина, такой как рецептор А2а, A2b и/или A3.
[0485] В некоторых вариантах осуществления изобретения, дополнительный агент представляет собой модулятор уровней аденозина и/или компонента аденозинового пути. Аденозин может функционировать как иммуномодулирующий агент в организме. Так, например, аденозин и некоторые аналоги аденозина, которые неселективно активируют подтипы рецептора аденозина, снижают уровень продуцирования нейтрофилами воспалительных продуктов окисления (Cronstein et al., Ann. N.Y. Acad. Sci. 451:291, 1985; Roberts et al., Biochem. J., 227:669, 1985; Schrier et al., J. Immunol. 137:3284, 1986; Cronstein et al., Clinical Immunol. Immunopath. 42:76, 1987). В некоторых случаях, концентрация внеклеточного аденозина или аденозиновых аналогов может увеличиваться в определенных средах, например, в микроокружении опухоли (TME). В некоторых случаях, аденозин или аналог аденозина передают сигналы в зависимости от гипоксии или факторов, участвующих в развитии гипоксии или ее регуляции, например, фактора, индуцирующего гипоксию (HIF). В некоторых вариантах осуществления изобретения, повышение уровня аденозинового сигнала может повышать уровень внутриклеточного cAMP и cAMP-зависимой протеинкиназы, что будет приводить к ингибированию продуцирования провоспалительных цитокинов, и может приводить к синтезу иммуносупрессорных молекул и развитию Treg (Sitkovsky et al., Cancer Immunol Res (2014) 2(7):598-605). В некоторых вариантах осуществления изобретения, дополнительный агент может снижать или отменять иммуносупрессорные эффекты аденозина, аналогов аденозина и/или аденозинвых сигналов. В некоторых вариантах осуществления изобретения, дополнительный агент может снижать или отменять A2-аденосинергическую иммуносупрессию T-клеток, индуцированную гипоксией. В некоторых вариантах осуществления изобретения, дополнительный агент выбирают из антагонистов аденозинвых рецепторов, агентов, разрушающих внеклеточный аденозин, ингибиторов продуцирования аденозина CD39/CD73-эктоферментами и ингибиторов сигнала HIF-1α, вызывающего гипоксию. В некоторых вариантах осуществления изобретения, дополнительный агент представляет собой антагонист или агонист рецептора аденозина.
[0486] Ингибирование или снижение внеклеточного аденозина или аденозинового рецептора посредством ингибитора внеклеточного аденозина (такого как агент, который предотвращает образование внеклеточного аденозина, разлагает его, делает неактивным и/или снижает его уровни) и/или ингибитора аденозинового рецептора (такого как антагонист аденозинового рецептора) может усиливать иммунный ответ, такой как ответ, опосредуемый макрофагами, нейтрофилами, гранулоцитами, дендритными клетками, Т- и/или В-клетками. Кроме того, ингибиторы cAMP-зависимого внутриклеточного пути, опосредуемого белком Gs, и ингибиторы внутриклеточных путей, опосредуемых белком Gi и запускаемых аденозиновым рецептором, могут также усиливать острое и хроническое воспаление.
[0487] В некоторых вариантах осуществления изобретения, дополнительный агент представляет собой антагонист или агонист аденозинового рецептора, например, антагонист или агонист одного или нескольких аденозинвых рецепторов A2a, A2b, A1 и A3. А1 и А3 ингибируют, а А2а и A2b стимулируют, соответственно, аденилатциклазную активность. Некоторые аденозиновые рецепторы, такие как A2a, A2b и A3, могут подавлять или уменьшать иммунный ответ в процессе воспаления. Таким образом, ингибирование иммуносупрессорных аденозиновых рецепторов может повышать, усиливать или увеличивать иммунный ответ, например, иммунный ответ на вводимые клетки, например, CAR-экспрессирующие Т-клетки. В некоторых вариантах осуществления изобретения, дополнительный агент ингибирует продуцирование внеклеточных аденозинов и передачу сигнала, запускаемого аденозином, посредством аденозиновых рецепторов. Так, например, усиление иммунного ответа, местного воспаления ткани и нацеленной деструкции ткани может быть еще больше увеличено за счет ингибирования или снижения местной гипоксии тканей, продуцирующей аденозин; разрушения аккумулированного внеклеточного аденозина (или блокирования его активности); предотвращения или уменьшения экспрессии аденозиновых рецепторов на клетках иммунной системы; и/или ингибирования/блокирования передачи сигнала аденозиновыми лигандами посредством аденозиновых рецепторов.
[0488] Антагонист представляет собой любое вещество, которое имеет тенденцию сводить к нулю действие другого агента, такого как агент, который связывается с клеточным рецептором, но не дает биологического ответа. В некоторых вариантах осуществления изобретения, антагонист представляет собой химическое соединение, которое представляет собой антагонист аденозинового рецептора, такого как рецептор A2a, A2b или A3. В некоторых вариантах осуществления изобретения, антагонист представляет собой пептид или пептидомиметик, который связывается с аденозиновым рецептором, но не запускает внутриклеточный путь, зависящий от белка G1. Примеры антагонистов аденозиновых рецепторов описаны в патентах США NN 5565566, 5545627, 5981524, 5861405, 6066642, 6326390, 5670501, 6117998, 6232297, 5786360, 5424297, 6313131, 5504090 и 6322771; и Jacobson and Gao, Nat Rev Drug Discov. (2006) 5(3): 247-264.
b. Инициация иммуностимуляции
[0489] В некоторых вариантах осуществления изобретения, способы включают введение дополнительных агентов, которые являются иммуностимулирующими. В некоторых вариантах осуществления изобретения, дополнительный агент может, по существу, стимулировать пролиферацию, размножение, выживаемость и/или эффективность иммунных клеток. В некоторых вариантах осуществления изобретения, дополнительный агент может специфически стимулировать вводимые клетки, например, клетки, экспрессирующие рекомбинантный рецептор. В некоторых вариантах осуществления изобретения, дополнительный агент представляет собой цитокин. В некоторых вариантах осуществления изобретения, дополнительный агент представляет собой лиганд.
[0490] В некоторых вариантах осуществления изобретения, дополнительный агент представляет собой иммуностимулирующий лиганд, например, CD40L. В некоторых вариантах осуществления изобретения, дополнительный агент представляет собой цитокин, например, IL-2, IL-3, IL-6, IL-11, IL-7, IL-12, IL-15, IL-21, гранулоцитарный-макрофагальный колониестимулирующий фактор (GM-CSF), интерферон альфа, бета или гамма (IFN) и эритропоэтин (ЕРО).
3. Лимфоистощающая терапия
[0491] В некоторых аспектах, рассматриваемые здесь способы могут также включать проведение одной или более лимфоистощающих терапий, например, до начала или одновременно с началом введения клеток, например, клеток, экспрессирующих рекомбинантный рецептор. В некоторых вариантах осуществления изобретения, лимфоистощающая терапия включает введение фосфамида, такого как циклофосфамид. В некоторых вариантах осуществления изобретения, лимфоистощающая терапия может включать введение флударабина. В некоторых вариантах осуществления изобретения, при лимфоистощающей терапии, флударабин не вводят. В некоторых вариантах осуществления изобретения, лимфоистощающую терапию не проводят.
[0492] Предварительное проведение индивидууму иммуноистощающей (например, лимфоистощающей) терапии может улучшить эффекты адоптивной клеточной терапии (ACT). Предварительное введение лимфоистощающих агентов, включая комбинации циклоспорина и флударабина, оказалось эффективным для повышения эффективности переноса опухоль-инфильтрирующих лимфоцитов (TIL) в клеточной терапии, включая улучшение ответа и/или персистентности перенесенных клеток. См., например, Dudley et al., Science, 298, 850-54 (2002); Rosenberg et al., Clin Cancer Res, 17(13):4550-4557 (2011).Аналогичным образом,в случае CAR+-Т-клеток было проведено несколько исследований с использованием лимфоистощающих агентов, главным образом, циклофосфамида, флударабина, бендамустина или их комбинации, иногда вместе с облучением низкими дозами. См., Han et al. Journal of Hematology & Oncology, 6:47 (2013); Kochenderfer et al., Blood, 119: 2709-2720 (2012); Kalos et al., Sci Transl Med, 3(95):95ra73 (2011); Clinical Trial Study Record Nos.: NCT02315612; NCT01822652.
[0493] Такая предварительная подготовка может быть осуществлена в целях снижения риска одного или более различных исходов, которые могут снижать эффективность терапии. Ими являются феномен, известный как «цитокиновая раковина», где Т-клетки, В-клетки, NK-клетки конкурируют с TIL за гомеостаз и активацию цитокинов, таких как IL-2, IL-7 и/или IL-15; подавление TIL регуляторными Т-клетками, NK-клетками или другими клетками иммунной системы; и воздействие негативных регуляторов в микроокружении опухоли. Muranski et al., Nat Clin Pract Oncol. December; 3(12): 668-681 (2006).
[0494] Таким образом, в некоторых вариантах осуществления изобретения, рассматриваемый способ также включает проведение индивидууму лимфоистощающей терапии. В некоторых вариантах осуществления изобретения, способ включает проведение индивидууму лимфоистощающей терапии до введения дозы клеток. В некоторых вариантах осуществления изобретения, лимфоистощающая терапия включает введение химиотерапевтического средства, такого как флударабин и/или циклофосфамид. В некоторых вариантах осуществления изобретения, введение клеток и/или проведение лимфоистощающей терапии осуществляют в режиме амбулаторного лечения.
[0495] В некоторых вариантах осуществления изобретения, способы включают введение индивидууму прекондиционирующего агента, такого как лимфоистощающее или химиотерапевтическое средство, такое как циклофосфамид, флударабин или их комбинации, до введения дозы клеток. Так, например, индивидууму может быть введен прекондиционирующий агент по меньшей мере за 2 дня, например, по меньшей мере за 3, 4, 5, 6 или 7 дней до введения первой или последующей дозы. В некоторых вариантах осуществления изобретения, индивидууму вводят прекондиционирующий агент не более, чем за 7 дней, например, не более, чем за 6, 5, 4, 3 или 2 дня до введения дозы клеток.
[0496] В некоторых вариантах осуществления изобретения, индивидууму предварительно вводят циклофосфамид в дозе от или приблизительно от 20 мг/кг до 100 мг/кг, например, от или приблизительно от 40 мг/кг до 80 мг/кг. В некоторых аспектах, индивидууму предварительно вводят 60 мг/кг или приблизительно 60 мг/кг циклофосфамида. В некоторых вариантах осуществления изобретения, циклофосфамид может быть введен в разовой дозе или в виде дробных доз, например, ежедневно, через день или через три дня. В некоторых вариантах осуществления изобретения, циклофосфамид вводят один раз в день в течение одного или двух дней. В некоторых вариантах осуществления изобретения, если лимфоистощающий агент включает циклофосфамид, то индивидууму вводят циклофосфамид в дозе от или приблизительно от 100 мг/м2 до 500 мг/м2, например, в дозе от или приблизительно от 200 мг/м2 до 400 мг/м2, или от 250 мг/м2 до 350 мг/м2, включительно. В некоторых случаях, индивидууму вводят приблизительно 300 мг/м2 циклофосфамида. В некоторых вариантах осуществления изобретения, циклофосфамид может быть введен в разовой дозе или в виде дробных доз, например, ежедневно, через день или через три дня. В некоторых вариантах осуществления изобретения, циклофосфамид вводят ежедневно, например, в течение 1-5 дней, например, в течение 3-5 дней. В некоторых случаях, индивидууму вводят приблизительно 300 мг/м2 циклофосфамида, ежедневно в течение 3 дней до начала клеточной терапии.
[0497] В некоторых вариантах осуществления изобретения, флударабин может быть введен в разовой дозе или в виде дробных доз, например, ежедневно, через день или через три дня. В некоторых вариантах осуществления изобретения, флударабин вводят ежедневно, например, в течение 1-5 дней, например, в течение 3-5 дней. В некоторых случаях, индивидууму вводят приблизительно 30 мг/м2 флударабина, ежедневно в течение 3 дней до начала клеточной терапии. В некоторых вариантах осуществления изобретения, циклофосфамид вводят ежедневно в течение одного или двух дней.
[0498] В некоторых вариантах осуществления изобретения, если лимфоистощающий агент включает флударабин, то индивидууму вводят флударабин в дозе от или приблизительно от 1 мг/м2 до 100 мг/м2, например, от или приблизительно от 10 мг/м2 до 75 мг/м2, от 15 мг/м2 до 50 мг/м2, от 20 мг/м2 до 30 мг/м2 или от 24 мг/м2 до 26 мг/м2. В некоторых случаях, индивидууму вводят 25 мг/м2 флударабина. В некоторых вариантах осуществления изобретения, флударабин может быть введен в разовой дозе или в виде дробных доз, например, ежедневно, через день или через три дня. В некоторых вариантах осуществления изобретения, флударабин вводят ежедневно, например, в течение 1-5 дней, например, в течение 3-5 дней.
[0499] В некоторых вариантах осуществления изобретения, лимфоистощающий агент включает комбинацию агентов, таких как комбинация циклофосфамида и флударабина. Таким образом, комбинация агентов может включать циклофосфамид в любых дозах или в любых схемах введения, таких как дозы и схемы, описанные выше, и флударабин в любых дозах или в любых схемах введения, таких как дозы и схемы, описанные выше. Так, например, в некоторых аспектах, индивидууму вводят 60 мг/кг (~2 г/м2) циклофосфамида и от 3 до 5 доз 25 мг/м2 флударабина до введения дозы клеток.
[0500] В одном репрезентативном режиме введения доз, перед введением первой дозы, индивидууму проводят предварительную лимфоистощающую химиотерапию циклофосфамидом и флударабином (цик./флу.), которую проводят по меньшей мере за два дня до введения первой дозы CAR-экспрессирующих клеток и, в основном, не более, чем за 7 дней до введения клеток. После предварительного лечения, индивидууму вводят дозу CAR-экспрессирующих Т-клеток, как описано выше.
[0501] В некоторых вариантах осуществления изобретения, введение прекондиционирующего агента до инфузии дозы клеток улучшает исход лечения. Так, например, в некоторых аспектах, предварительное лечение повышает эффективность лечения дозой или повышает персистентность клеток, экспрессирующих рекомбинантный рецептор (например, CAR-экспрессирующих клеток, таких как CAR-экспрессирующие Т-клетки) у индивидуума. В некоторых вариантах осуществления изобретения, предварительное лечение повышает продолжительность жизни без заболевания, например, повышает процент выживших индивидуумов, у которых не наблюдалось минимальных остаточных или молекулярно детектируемых признаков заболевания в течение определенного периода времени после введения дозы клеток. В некоторых вариантах осуществления изобретения, медианная продолжительность жизни без заболевания увеличивалась.
[0502] После введения клеток индивидууму (например, человеку), биологическую активность сконструированных клеточных популяций в некоторых аспектах измеряют любыми из ряда известных методов. Параметры оценки включают специфическое связывание сконструированных или природных T-клеток или других иммунных клеток с антигеном in vivo, например, посредством визуализации, или ex vivo, например, с помощью ELISA или проточной цитометрии. В некоторых вариантах осуществления изобретения, способность сконструированных клеток разрушать клетки-мишени может быть оценена любым подходящим методом, известным специалистам, таким как анализы на цитотоксичность, описанные, например, Kochenderfer et al., J. Immunotherapy, 32(7): 689-702 (2009), и Herman et al. J. Immunological Methods, 285(1): 25-40 (2004). В некоторых вариантах осуществления изобретения, биологическая активность клеток может быть также оценена путем анализа экспрессии и/или секреции определенных цитокинов, таких как CD107a, IFNγ, IL-2 и TNF. В некоторых аспектах изобретения, биологическую активность измеряют путем оценки клинических результатов, таких как уменьшение опухолевой нагрузки или объема опухоли. В некоторых аспектах оценивают токсические эффекты, персистентность и/или размножение клеток, и/или наличие или отсутствие иммунного ответа у хозяина.
[0503] В некоторых вариантах осуществления изобретения, введение прекондиционирующего агента до инфузии дозы клеток улучшает исход лечения, например, повышает эффективность лечения дозой или повышает персистентность клеток, экспрессирующих рекомбинантный рецептор (например, CAR-экспрессирующих клеток, таких как CAR-экспрессирующие Т-клетки) у индивидуума.
D. Модификация клеток
[0504] В некоторых вариантах осуществления изобретения, клетки модифицируют любыми способами, так, чтобы это приводило к повышению их терапевтической или профилактической эффективности, и/или к модуляции размножения, пролиферации, выживаемости и/или эффективности. В некоторых вариантах осуществления изобретения, клетки модифицируют для модуляции размножения, пролиферации, выживаемости и/или эффективности, например, для их повышения, усиления и/или увеличения in vivo после введения клеток индивидууму. В некоторых вариантах осуществления изобретения, клетки модифицируют так, чтобы могла осуществляться модуляция и/или регуляция экспрессии трансгенов и/или иммуномодулирующих факторов. В некоторых вариантах осуществления изобретения, клетки модифицируют для модуляции экспрессии и/или активности конкретных компонентов рекомбинантного рецептора. В некоторых вариантах осуществления изобретения, клетки модифицируют для повышения или снижения уровня экспрессии агента, например, нуклеиновой кислоты, такой, как ингибирующие нуклеиновые кислоты. В некоторых вариантах осуществления изобретения, клетки модифицируют для экспрессии и/или секреции агента.
[0505] В некоторых вариантах осуществления изобретения, сконструированный рекомбинантный рецептор, например, CAR, экспрессируемый сконструированными клетками, может быть конъюгирован либо непосредственно, либо опосредованно через линкер с молекулой-мишенью. Практический способ осуществления контакта соединений, например, рекомбинантного рецептора с молекулами-мишенями известен специалистам. См., например, Wadwa et al., J. Drug Targeting 3: 111 (1995) и патент США 5087616.
1. Ингибирующие нуклеиновые кислоты и модификация гена
[0506] В некоторых вариантах осуществления изобретения, способы включают модификацию вводимых клеток путем контакта клеток с агентом, который снижает или обладает способностью эффективно уменьшать уровень экспрессии негативных регуляторов вводимыми клетками, например, сконструированной Т-клеткой, экспрессирующей рекомбинантный рецептор. Негативные регуляторы клеток включают любые описанные здесь регуляторы, такие как ингибитор контрольной точки иммунитета, ингибирующие рецепторы и/или модуляторы аденозина. В некоторых вариантах осуществления изобретения, агент, который снижает или обладает способностью эффективно уменьшать уровень экспрессии негативных регуляторов, включает агенты, которые представляют собой или включают ингибирующую молекулу нуклеиновой кислоты, такую, как молекула, которая комплементарна гену или нуклеиновой кислоте, кодирующей негативный регулятор, и которая нацелена на этот ген или нуклеиновую кислоту, ингибирует его и/или связывается с ними. В некоторых вариантах осуществления изобретения, агент представляет собой или включает комплекс, содержащий рибонуклеопротеиновый комплекс (RNP), который включает Сas9, например, в некоторых случаях, ферментативно неактивный Сas9 и рРНК, нацеленную на ген, кодирующий негативный регулятор.
[0507] В некоторых из любых таких вариантов осуществления изобретения, ингибирующая молекула нуклеиновой кислоты включает РНК-интерферирующий агент. В некоторых из любых таких вариантов осуществления изобретения, ингибирующая нуклеиновая кислота представляет собой или содержит или кодирует короткую интерферирующую РНК (киРНК), кшРНК, адаптированную микроРНК, короткую шпилечную РНК (кшРНК), шпилечную кшРНК, микроРНК-предшественник (пре-миРНК) или микроРНК (миРНК). Методы конструирования ингибирующих нуклеиновые кислот и модификации клеток для экспрессии ингибирующих нуклеиновых кислот известны специалистам в данной области (см., например, WO 2004/0455543 и WO 2004/048566).
[0508] В некоторых вариантах осуществления изобретения, сконструированную клетку подвергают модификации гена или редактированию гена, который нацелен на локус, кодирующий ген, участвующий в иммуномодуляции, в негативной регуляции иммунных клеток и/или в иммуносупрессии. В некоторых вариантах осуществления изобретения, редактирование гена приводит к инсерции или делеции в локусе-мишени или к «нокауту» локуса-мишени и к элиминации экспрессии кодируемого белка. В некоторых вариантах осуществления изобретения, редактирование гена достигается за счет присоединения негомологичных концов (NHEJ) под действием системы CRISPR/Сas9. В некоторых вариантах осуществления изобретения, одна или более молекул руководящих РНК (рРНК) могут быть использованы вместе с одной или более нуклеазами Сas9, никазами Сas9, ферментативно неактивными Сas9 или их вариантами или со сконструированными белками «цинковый палец» или с системами TALE. Методы модификации генов известны специалистам в данной области (см., например, WO 2015/161276; патенты США. NN. 6140081; 6453242; и 6534261; WO 98/53058; WO 98/53059; WO 98/53060; WO 02/016536, WO 03/016496 и публикацию заявки США 2011/0301073).
2. Модификация для экспрессии дополнительных агентов
[0509] В некоторых вариантах осуществления изобретения, клетки, например, клетки, экспрессирующие рекомбинантный рецептор, дополнительно модифицируют для экспрессии и/или секреции дополнительного агента, который стимулирует, усиливает, повышает и/или увеличивает пролиферацию, размножение, выживаемость и/или эффективность вводимых клеток. Так, например, клетки, экспрессирующие рекомбинантный рецептор, например, CAR-экспрессирующие клетки, могут быть дополнительно сконструированы для экспрессии и/или секреции дополнительных агентов, которые блокируют иммуносупрессорные эффекты и/или усиливают размножение и/или улучшают функцию Т-клеток и рекомбинантного рецептора. В некоторых вариантах осуществления изобретения, клетки могут быть сконструированы для экспрессии цитокинов, которые способствуют размножению вводимых клеток. В некоторых вариантах осуществления изобретения, такие дополнительные агенты могут быть функционально присоединены к индуцибельной системе экспрессии, например, к индуцибельному промотору.
[0510] В некоторых вариантах осуществления изобретения, вводимые клетки могут быть модифицированы для экспрессии и/или секреции агента, который ингибирует иммуносупрессорные факторы, такие как любые описанные здесь факторы, и/или стимулирует иммуностимулирующий фактор. В некоторых вариантах осуществления изобретения, дополнительный агент, экспрессируемый введенной клеткой, снижает или предотвращает иммуносупрессию указанной клетки в микроокружении опухоли (см., например, публикацию заявки на патент США No. 2016/0045551). В некоторых вариантах осуществления изобретения, дополнительный агент, который кодируется и/или секретируется вводимыми клетками, может включать любой из описанных здесь дополнительных агентов.
[0511] В некоторых вариантах осуществления изобретения, дополнительный агент, который кодируется введенной клеткой, является растворимым и секретируется. В некоторых вариантах осуществления изобретения, дополнительный агент представляет собой растворимый ScFv. В некоторых вариантах осуществления изобретения, дополнительный агент представляет собой цитокин.
3. Регуляция экспрессии и/или активности рекомбинантного рецептора
[0512] В некоторых вариантах осуществления изобретения, способы включают модификации клеток для регуляции экспрессии и/или активности рекомбинантного рецептора, например, CAR, и тем самым регуляции сигнала посредством рекомбинантного рецептора. В некоторых вариантах осуществления изобретения, регулируемая экспрессия и/или активность достигаются путем конструирования рекомбинантного рецептора так, чтобы он содержал конкретные регуляторные элементы и/или системы или находился под контролем таких элементов и/или систем, таких как любые описанные здесь элменты или системы. В некоторых вариантах осуществления изобретения, введение сконструированной клетки в организм индивидуума и/или ее обработка конкретным лигандом могут регулировать экспрессию и/или активность рекомбинантного рецептора, например, CAR. В некоторых вариантах осуществления, регуляция экспрессии и/или активности рекомбинантного рецептора достигается путем введения дополнительного агента, который может регулировать экспрессию рекомбинантного рецептора, например, CAR. В некоторых вариантах осуществления изобретения, регулируемая экспрессия рекомбинантного рецептора, например, CAR, достигается посредством регулируемой системы высвобождения фактора транскрипции или путем введения дополнительного агента, который может индуцировать конформационные изменения и/или мультимеризацию полипептидов, например, рекомбинантного рецептора. В некоторых вариантах осуществления изобретения, дополнительный агент представляет собой химический индуктор.
IV. ОПРЕДЕЛЕНИЯ
[0513] Если это не оговорено особо то все термины, используемые в литературе, пояснительные термины и другие технические и научные термины или терминология, используемые в настоящей заявке, имеют общепринятые значения, понятные специалисту в области, к которой относится заявленный предмет изобретения. В некоторых случаях, термины, имеющие общепринятые значения, определены в настоящей заявке для ясности и/или в качестве справочного материала, и такие определения, включенные в данное описание, не должны быть обязательно истолкованы как существенно отличающиеся от определений, обычно используемых в данной области.
[0514] Используемые здесь объекты в форме единственного числа с артиклями «a», «an» и «the» включают референты и во множественном числе, если из контекста описания не следует обратное. Так, например, «a» или «an» означает «по меньшей мере один» или «один или более».
[0515] Во всем описании изобретения, различные аспекты заявленного предмета изобретения представлены в систематизированном формате. Следует отметить, что описание в систематизированном формате приводится лишь для удобства и краткости описания и не должно быть истолковано как негибкое ограничение объема заявленного предмета изобретения. В соответствии с этим, описание интервалов следует рассматривать как конкретное раскрытие всех возможные подинтервалов, а также отдельных численных значений в этом интервале. Так, например, если указан интервал величин, то это следует понимать, что каждое промежуточное значение между верхним и нижним пределом этого интревала и любым другим указанным или промежуточным значением в этом указанном интервале охватывается заявленным предметом изобретения. Верхние и нижние пределы этих меньших интервалов могут быть независимо включены в меньшие интервалы и также охватываются заявленным предметом изобретения с учетом любого конкретно исключенного предела в указанном интервале. Если указанный интервал включает один или оба предела, то интервалы, исключающие любой или оба из этих включенных пределов, также включены в заявленный предмет изобретения. Это применяется независимо от широты интервала.
[0516] Термин «приблизительно», используемый в данном описании, относится к обычному интервалу ошибок для соответствующего значения, хорошо известного специалисту в данной области техники. Ссылка на «приблизительное» значение или параметр в данном описании включает (и описывает) варианты, относящиеся к этому значению или параметру per se.
[0517] Используемый здесь термин «индивидуум» включает любой живой организм, такой как человек и другие млекопитающие. Млекопитающими являются, но не ограничиваются ими, человек и животные, не являющиеся человеком, включая сельскохозяйственных животных, животных, участвующих в спортивных состязаниях, грызунов и домашних питомцев.
[0518] Используемый в данном описании термин «истощение», если он относится к одному или более конкретному типу клеток или к популяции клеток, означает уменьшение числа или процента клеток определенного типа или определенной популяции, например, по сравнению с общим числом клеток в композиции или в объеме композиции, или по сравнению с клетками других типов, например, в результате негативного отбора на основе маркеров, экспрессируемых популяцией или клеткой, или позитивного отбора на основе маркеров, не присутствующих в истощенной клеточной популяции или клетке. Этот термин не подразумевает полного удаления клеток, клеток определенного типа или популяции из композиции.
[0519] Используемый в данном описании термин «обогащение», если он относится к одному или более конкретному типу клеток или к популяции клеток, означает увеличение числа или процента клеток определенного типа или определенной популяции, например, по сравнению с общим числом клеток в композиции или в объеме композиции, или по сравнению с клетками других типов, например, в результате позитивного отбора на основе маркеров, экспрессируемых популяцией или клеткой, или негативного отбора на основе маркеров, не присутствующих в истощенной клеточной популяции или клетке. Этот термин не подразумевает полного удаления других клеток, клеток определенного типа или популяций из композиции и не предусмативает обогащения клетками на 100% или даже почти на 100% в обогащеной композиции.
[0520] Утверждение, используемое в данном описании, что клетка или популяция клеток являются «позитивными» или «+» по конкретному маркеру, означает детектируемое присутствие на клетке или в клетке конкретного маркера, обычно маркера клеточной поверхности. Если речь идет о поверхностном маркере, то этот термин означает наличие экспрессии на поверхности, детектируемое, в некоторых вариантах изобретения с помощью проточной цитометрии, например, путем окрашивания антителом, которое специфически связывается с маркером, и детектирования указанного антитела, где такое окрашивание обнаруживается с помощью проточной цитометрии на уровне, значительно превышающем окрашивание, детектируемое с помощью той же самой процедуры, но в присутствии контроля соответствующего изотипа при всех прочих равных условиях, и/или на уровне, по существу, аналогичном уровню для клеток, которые, как известно, являются позитивными по маркеру, и/или на уровне, значительно превышающем уровень для клеток, которые, как известно, являются негативными по маркеру.
[0521] Утверждение, используемое в данном описании, что клетка или популяция клеток являются «негативными» по конкретному маркеру, означает отсутствие какого-либо детектируемого присутствия на клетке или в клетке конкретного маркера, обычно маркера клеточной поверхности. Если речь идет о поверхностном маркере, то этот термин означает отсутствие поверхностной экспрессии, детектируемое, в некоторых вариантах осуществления, с помощью проточной цитометрии, например, путем окрашивания антителом, которое специфически связывается с маркером, и детектирования указанного антитела, где такое окрашивание не обнаруживается с помощью проточной цитометрии на уровне, значительно превышающем окрашивание, детектируемое с помощью той же самой процедуры, но в присутствии контроля соответствующего изотипа при всех прочих равных условиях, и/или на уровне, который, по существу, значительно ниже для клеток, которые, как известно, являются позитивными по маркеру, и/или на уровне, в основном, аналогичном уровню для клеток, которые, как известно, являются негативными по маркеру.
[0522] Используемый здесь термин «процент (%) идентичности аминокислотных последовательностей» и «процент идентичности», если он относится к аминокислотной последовательности (эталонной полипептидной последовательности), определяется как процент аминокислотных остатков в последовательности-кандидате (например, белка Vpx или Vpr), которые являются идентичными аминокислотным остаткам в эталонной полипептидной последовательности после выравнивания последовательностей и введения пробелов, если это необходимо для достижения максимального процента идентичности последовательностей, и без учета каких-либо консервативных замен как части идентичности последовательностей. Выравнивание с целью определения процента идентичности аминокислотных последовательностей может быть достигнуто различными способами, которые известны специалистам в данной области, например, с использованием общедоступных компьютерных программ, таких как программы BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалист в данной области может самостоятельно определить соответствующие параметры для выравнивания последовательностей, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей.
[0523] Аминокислотная замена может включать замену одной аминокислоты в полипептиде другой аминокислотой. Аминокислоты, как правило, могут быть классифицированы в соответствии со следующими общими свойствами боковой цепи:
[0524] (1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
[0525] (2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
[0526] (3) кислотные: Asp, Glu;
[0527] (4) основные: His, Lys, Arg;
[0528] (5) остатки, влияющие на ориентацию цепи: Gly, Pro;
[0529] (6) ароматические: Trp, Tyr, Phe.
[0530] Неконсервативные аминокислотные замены включают замену члена одного из этих классов на член другого класса.
[0531] Используемый здесь термин «в положении, соответствующем» или утверждение, что нуклеотиды или положения аминокислот «соответствуют» нуклеотидам или положениям аминокислот в раскрытой последовательности, такой, как последовательность, указанная в списке последовательностей, относится к положениям нуклеотидов или аминокислот, идентифицированным после выравнивания с раскрытой последовательностью для максимизации идентичности в соответствии со стандартным алгоритмом выравнивания, таким как алгоритм GAP. В некоторых вариантах осуществления изобретения, репрезентативные соответствующие остатки белка Vpx или Vpr могут быть идентифицированы путем выравнивания последовательности с репрезентативной последовательностью Vpx, представленной в SEQ ID NO: 1 или с другой последовательностью Vpx или Vpr, описанной в настоящей заявке. В некоторых вариантах осуществления изобретения, репрезентативные соответствующие остатки SAMHD1 могут быть идентифицированы путем выравнивания последовательности с репрезентативной последовательностью SAMHD1, представленной в SEQ ID NO: 19. После выравнивания последовательностей, специалист в данной области может идентифицировать соответствующие остатки, например, с использованием консервативных и идентичных аминокислотных остатков в качестве эталона. Вообще говоря, чтобы определить соответствующие положения, последовательности аминокислот выравнивают так, чтобы достигалось наибольшее соответствие (см., например: Computational Molecular Biology, Lesk, A.M., ed., Oxford University Press, New York, 1988; Biocomputing: Informatics and Genome Projects, Smith, D.W., ed., Academic Press, New York, 1993; Computer Analysis of Sequence Data, Part I, Griffin, A.M., and Griffin, H.G., eds., Humana Press, New Jersey, 1994; Sequence Analysis in Molecular Biology, von Heinje, G., Academic Press, 1987; and Sequence Analysis Primer, Gribskov, M. and Devereux, J., eds., M Stockton Press, New York, 1991; Carrillo et al. (1988) SIAM J Applied Math 48: 1073).
[0532] Используемый здесь термин «вектор» означает молекулу нуклеиновой кислоты, способную реплицировать другую нуклеиновую кислоту, к которой она присоединена. Этот термин включает вектор как самореплицирующуюся структуру нуклеиновой кислоты, а также вектор, включенный в геном клетки-хозяина, в которую он был введен. Некоторые векторы способны направлять экспрессию нуклеиновых кислот, к которым они функционально присоединены. Такие векторы называются здесь «экспрессионными векторами». Векторы включают вирусные векторы, такие как ретровирусные векторы, например лентивирусные или гамма-ретровирусные векторы, имеющие геном, несущий другую нуклеиновую кислоту и способные встраиваться в геном хозяина с их репликацией.
[0533] Используемый здесь термин «композиция» означает любую смесь из двух или более продуктов, веществ или соединений, включая клетки. Композиция может представлять собой раствор, суспензию, жидкость, порошок, пасту, водную, безводную или любую их комбинацию.
[0534] Используемые здесь термины «лечение», «лечить» и «терапия» относится к полному или частичному ослаблению или снижению тяжести заболевания или состояния или расстройства или симптома, неблагоприятного эффекта или результата или ассоциированного с ними фенотипа. В некоторых вариантах осуществления изобретения, эффект является терапевтическим, то есть, он заключается в частичном или полном излечивании заболевания или состояния, или неблагоприятного симптома, ассоциированного с ними.
[0535] Используемый здесь термин «терапевтически эффективное количество» соединения или композиции или комбинации, означает количество, которое в определенных дозах и в течение определенного периода времени является эффективном для достижения желаемого терапевтического результата, например, для лечения заболевания, состояния или расстройства и/или фармакокинетического или фармакодинамического эффекта лечения. Терапевтически эффективное количество может варьироваться в зависимости от таких факторов, как патологическое состояние, возраст, пол и масса тела индивидуума и популяции вводимых клеток.
[0536] Все публикации, включая патентные документы, научные статьи и базы данных, упоминаемых в данной заявке, включены посредством ссылки в полном объеме во всех целях так, как если бы каждая отдельная публикация была отдельно включена посредством ссылки. Если представленные здесь определения противоречат или каким-либо иным образом не соответствуют определением, представленным в патентах, заявках, опубликованных заявках и в других публикациях, которые включены в данное описание посредством ссылки, то следует отдать предпочтение определениям, представленным в настоящей заявке, но не определениям, включенным в настоящее описание посредством ссылки.
[0537] Заголовки разделов, представленных в данном документе, приводятся лишь в организационных целях и не должны быть истолкованы как ограничение описанного здесь предмета изобретения.
V. Репрезентативные варианты
[0538] Представленными здесь вариантами являются:
1. Способ трансдукции T-клеток, где указанный способ включает инкубацию частицы вирусного вектора, содержащей рекомбинантную нуклеиновую кислоту, и исходной композиции, содержащей множество T-клеток, где указанное множество T-клеток было получено из образца, содержащего клетки, взятые у индивидуума, где:
инкубацию начинают не позднее, чем через 24 часа после взятия образца у индивидуума; и/или
до инкубации, T-клетки не были доведены до температуры более чем, или более, чем приблизительно 15°C, приблизительно 18°C, приблизительно 22°C или приблизительно 25°C в течение более чем 1 часа, 2 часов, 4 часов, 6 часов, 8 часов, 12 часов или 24 часов после взятия образца у индивидуума; и/или
до инкубации, T-клетки не были доведены до температуры, составляющей, приблизительно, более, чем или более, чем приблизительно 37°C ± 2,0°C в течение периода времени более, чем 15 минут, 30 минут, 1 часа или 2 часов после взятия образца у индивидуума.
2. Способ согласно варианту 1, где инкубацию начинают не позднее, чем или не позднее, чем приблизительно через 1 час, 3 часа, 6 часов, 12 часов или 18 часов после взятия образца у индивидуума.
3. Способ согласно варианту 1 или варианту 2, где до указанной инкубации, способ не включает стимуляцию T-клеток в условиях, стимулирующих активацию клеток.
4. Способ согласно любому из вариантов 1-3, где до указанной инкубации, исходная композиция не была подвергнута стимуляции ex vivo, включая инкубацию при температуре более, чем или приблизительно более, чем 37°С ± 2,0°C и/или инкубацию в присутствии агента или агентов, способных активировать T-клетки, CD4+-T-клетки и/или CD8+-T-клетки, инкубацию в присутствии агента или агентов, способных активировать сигнал посредством комплекса TCR и/или инкубацию в присутствии агента или агентов, способных индуцировать пролиферацию T-клеток, CD4+-T-клеток и/или CD8+-T-клеток; CD3-связывающих молекул; CD28-связывающих молекул; рекомбинантного IL-2; рекомбинантного IL-15; и рекомбинантного IL-7.
5. Способ согласно любому из вариантов 1-4, где до указанной инкубации, не более, чем 5%, 10%, 20%, 30% или 40% T-клеток, представляющих собой активированные клетки, экспрессируют поверхностный маркер, выбранный из группы, состоящей из HLA-DR, CD25, CD69, CD71, CD40L и 4-1BB; содержат экспрессируемый внутри клеток цитокин, выбранный из группы, состоящей из IL-2, IFN-гамма, TNF-альфа; присутствуют в фазе G1 или в более поздней фазе клеточного цикла и/или способны пролиферироваться.
6. Способ трансдукции T-клеток, где указанный способ включает инкубацию частицы вирусного вектора, содержащей рекомбинантную нуклеиновую кислоту, и исходной композиции, содержащей T-клетки, где указанные T-клетки были получены из образца, взятого у индивидуума, где до указанной инкубации, T-клетки или исходная композиция не были подвергнуты стимуляции ex vivo, включая инкубацию при температуре более, чем или приблизительно более, чем 37°С ± 2,0°C, и/или инкубацию в присутствии агента или агентов, способных активировать T-клетки, CD4+-T-клетки и/или CD8+-T-клетки; инкубацию в присутствии агента или агентов, способных индуцировать сигнал посредством комплекса TCR; и/или инкубацию в присутствии агента или агентов, способных индуцировать пролиферацию T-клеток, CD4+-T-клеток и/или CD8+-T-клеток; CD3-связывающих молекул; CD28-связывающих молекул; рекомбинантного IL-2; рекомбинантного IL-15; и рекомбинантного IL-7.
7. Способ согласно варианту 4 или варианту 6, где один или более агентов содержат анти-CD3 антитело и/или анти-CD28 антитело.
8. Способ трансдукции T-клеток, где указанный способ включает инкубацию частицы вирусного вектора, содержащей рекомбинантную нуклеиновую кислоту, и исходной композиции, содержащей T-клетки, где указанные T-клетки были получены из образца, взятого у индивидуума, и где до указанной инкубации, не более, чем 5%, 10%, 20%, 30% или 40% T-клеток, представляющих собой активированные клетки, экспрессируют поверхностный маркер, выбранный из группы, состоящей из HLA-DR, CD25, CD69, CD71, CD40L и 4-1BB; содержат экспрессируемый внутри клеток цитокин, выбранный из группы, состоящей из IL-2, IFN-гамма, TNF-альфа; и/или присутствуют в фазе G1 или в более поздней фазе клеточного цикла.
9. Способ согласно варианту 5 или варианту 8, где непосредственно перед инкубацией, не более, чем 10% T-клеток в исходной композиции содержат маркер активации T-клеток, выбранный из группы, состоящей из HLA-DR, CD25, CD69, CD71, CD40L и 4-1BB.
10. Способ согласно любому из вариантов 1-9, где до указанной инкубации, более, чем 5%, 10%, 20%, 30% или 40% T-клеток экспрессируют рецептор липида низкой плотности (LDL-R).
11. Способ согласно любому из вариантов 1-9, где индивидуумом является человек.
12. Способ согласно любому из вариантов 1-8, где T-клетки не были доведены до температуры от 2°C до 8°C и/или не поддерживались при этой температуре в течение более, чем 48 часов до инкубации.
13. Способ согласно любому из вариантов 1-12, где образцом является проба крови.
14. Способ согласно любому из вариантов 1-12, где образцом является образец, взятый после лейкафереза.
15. Способ согласно вариантам 1-14, где T-клетки представляют собой нефракционированные T-клетки, обогащенные или выделенные CD3+-T-клетки, обогащенные или выделенные CD4+-T-клетки или обогащенные или выделенные CD8+-T-клетки.
16. Способ согласно любому из вариантов 1-15, где T-клетки были отобраны или обогащены из образца, взятого у индивидуума.
17. Способ согласно любому из вариантов 1-16, который дополнительно включает, до инкубации, взятие образца у индивидуума и, необязательно, отбор или обогащение T-клеток из образца, где эти клетки представляют собой, но необязательно, обогащенную композицию и/или продуцируют исходную композицию.
18. Способ согласно любому из вариантов 1-17, где процент T-клеток в исходной композиции составляет более, чем или приблизительно более, чем 75%, 80%, 85%, 90%, 95% T-клеток.
19. Способ согласно любому из вариантов 3-18, где T-клетки содержат CD4+- или CD8+-клетки.
20. Способ согласно любому из вариантов 3-18, где T-клетки содержат CD4+- и CD8+-клетки.
21. Способ согласно варианту 20, где отношение CD4+-клеток к CD8+-клеткам составляет или приблизительно составляет 1:1, 1:2, 2:1, 1:3 или 3:1.
22. Способ согласно любому из вариантов 1-21, где:
образец содержит сыворотку или плазму в концентрации по меньшей мере или по меньшей мере приблизительно 10% (об/об), по меньшей мере или по меньшей мере приблизительно 15% (об/об), по меньшей мере или по меньшей мере приблизительно 20% (об/об), по меньшей мере или по меньшей мере приблизительно 25% (об/об), по меньшей мере или по меньшей мере приблизительно 30% (об/об), по меньшей мере или по меньшей мере приблизительно 33% (об/об), по меньшей мере или по меньшей мере приблизительно 35% (об/об), или по меньшей мере или по меньшей мере приблизительно 40% (об/об); и/или,
до инкубации, образец не вводят в контакт ex vivo с сывороткой или плазмой в концентрации по меньшей мере или по меньшей мере приблизительно 10% (об/об), по меньшей мере или по меньшей мере приблизительно 15% (об/об), по меньшей мере или по меньшей мере приблизительно 20% (об/об), по меньшей мере или по меньшей мере приблизительно 25% (об/об), по меньшей мере или по меньшей мере приблизительно 30% (об/об), по меньшей мере или по меньшей мере приблизительно 33% (об/об), по меньшей мере или по меньшей мере приблизительно 35% (об/об), или по меньшей мере или по меньшей мере приблизительно 40% (об/об).
23. Способ согласно любому из вариантов 1-22, где:
образец содержит сыворотку или плазму в концентрации по меньшей мере или по меньшей мере приблизительно 30% (об/об); и/или
до инкубации, образец не вводят в контакт ex vivo с сывороткой или плазмой в концентрации по меньшей мере или по меньшей мере приблизительно 30% (об/об).
24. Способ согласно варианту 22 или варианту 23, где сыворотка или плазма является человеческой.
25. Способ согласно любому из вариантов 22-24, где сыворотка или плазма является аутологичной для индивидуума.
26. Способ согласно любому из вариантов 1-22, где образец содержит антикоагулянт.
27. Способ согласно варианту 26, где антикоагулянт содержит свободный ион цитрата.
28. Способ согласно любому из вариантов 1-27, где до инкубации способ включает криоконсервацию T-клеток, необязательно в образце или в обогащенной композиции в присутствии криозащитного средства, и тем самым продуцирование криоконсервированной композиции.
29. Способ согласно варианту 28, где до инкубации осуществляют промывку криоконсервированной композиции в условиях, способствующих снижению количества или удалению криозащитного средства и/или продуцированию исходной композиции.
30. Способ согласно любому из вариантов 1-29, где исходная композиция содержит N-ацетилцистеин (NAC); сыворотку, необязательно человеческую сыворотку; рекомбинантный интерлейкин-2 (IL-2), рекомбинантный интерлейкин-15 (IL-15) и/или рекомбинантный интерлейкин-7 (IL-7).
31. Способ согласно любому из вариантов 1-30, где:
исходная композиция содержит N-ацетилцистеин в концентрации от или приблизительно от 0,4 мг/мл до 4 мг/мл, от 0,8 мг/мл до 3,6 мг/мл или от 1,6 мг/мл до 2,4 мг/мл, включительно; или
исходная композиция содержит N-ацетилцистеин в концентрации по меньшей мере или по меньшей мере приблизительно или приблизительно 0,4 мг/мл, 0,8 мг/мл, 1,2 мг/мл, 1,6 мг/мл, 2,0 мг/мл, 2,4 мг/мл, 2,8 мг/мл, 3,2 мг/мл, 3,6 мг/мл или 4,0 мг/мл.
32. Способ согласно любому из вариантов 1-31, где:
исходная композиция содержит сыворотку, необязательно человеческую сыворотку в концентрации от или приблизительно от 0,5% до 25% (об/об), от 1,0% до 10% (об/об) или от 2,5% до 5,0% (об/об), включительно; или
исходная композиция содержит сыворотку, необязательно человеческую сыворотку в концентрации по меньшей мере или по меньшей мере приблизительно или приблизительно 0,5%, 1,%, 2,5%, 5% (об/об) или 10%.
33. Способ согласно любому из вариантов 1-32, где:
исходная композиция содержит рекомбинантный IL-2, необязательно рекомбинантный человеческий IL-2 в концентрации от или приблизительно от 10 ИЕ/мл до 500 ИЕ/мл, от 50 ИЕ/мл до 250 ИЕ/мл или от 100 ИЕ/мл до 200 ИЕ/мл, включительно; или в концентрации по меньшей мере или по меньшей мере приблизительно 10 ИЕ/мл, 50 ИЕ/мл, 100 ИЕ/мл, 200 ИЕ/мл, 300 ИЕ/мл, 400 ИЕ/мл или 500 ИЕ/мл; и/или
исходная композиция содержит рекомбинантный IL-15, необязательно рекомбинантный человеческий IL-15, в концентрации от или приблизительно от 1 ИЕ/мл до 100 ИЕ/мл, от 2 ИЕ/мл до 50 ИЕ/мл или от 5 ИЕ/мл до 10 ИЕ/мл, включительно; или в концентрации по меньшей мере или по меньшей мере приблизительно 1 ИЕ/мл, 2 ИЕ/мл, 5 ИЕ/мл, 10 ИЕ/мл, 25 ИЕ/мл или 50 ИЕ/мл; и/или
исходная композиция содержит рекомбинантный IL-7, необязательно, рекомбинантный человеческий IL-7, в концентрации от или приблизительно от 50 ИЕ/мл до 1500 ИЕ/мл, от 100 ИЕ/мл до 1000 ИЕ/мл, от 200 ИЕ/мл до 600 ИЕ/мл, включительно; или в концентрации по меньшей мере или по меньшей мере приблизительно 50 ИЕ/мл, 100 ИЕ/мл, 200 ИЕ/мл, 300 ИЕ/мл, 400 ИЕ/мл, 500 ИЕ/мл, 600 ИЕ/мл, 700 ИЕ/мл, 800 ИЕ/мл, 900 ИЕ/мл или 1000 ИЕ/мл.
34. Способ согласно любому из вариантов 1-33, где: инкубация включает стадию центрифужной инокуляции частиц вирусного вектора исходной композицией.
35. Способ согласно варианту 34, где центрифужная инокуляция включает вращение во внутреннем отсеке центрифужной камеры частиц вирусного вектора и исходной композиции, где вращение осуществляют при относительной центробежной силе, подаваемой на внутреннюю поверхность боковой стенки отсека, и составляющей:
от или приблизительно от 500 g до 2500 g, от 500 g до 2000 g, от 500 g до 1600 g, от 500 g до 1000 g, от 600 g до 1600 g, от 600 g до 1000 g, от 1000 g до 2000 g или от 1000 g до 1600 g включительно; или
по меньшей мере или по меньшей мере приблизительно 600 g, 800 g, 1000 g, 1200 g, 1600 g или 2000 g.
36. Способ согласно варианту 34 или варианту 35, где центрифужную инокуляцию осуществляют в течение периода времени, который составляет:
более, чем или приблизительно 5 минут, более, чем или приблизительно 10 минут, более, чем или приблизительно 15 минут, более, чем или приблизительно 20 минут, более, чем или приблизительно 30 минут, более, чем или приблизительно 45 минут, более, чем или приблизительно 60 минут, более, чем или приблизительно 90 минут, или более, чем или приблизительно 120 минут; или
от или приблизительно от 5 минут до 60 минут, от 10 минут до 60 минут, от 15 минут до 60 минут, от 15 минут до 45 минут, от 30 минут до 60 минут или от 45 минут до 60 минут, включительно.
37. Способ согласно любому из вариантов 1-36, дополнительно включающий контакт исходной композиции и/или частиц вирусного вектора с адъювантом для трансдукции.
38. Способ согласно варианту 37, где контакт осуществляют до, во время или после центрифужной инокуляции частиц вирусного вектора исходной композицией.
39. Способ согласно любому из вариантов 1-38, где по меньшей мере часть инкубации осуществляют при или приблизительно при 37°C ± 2°C.
40. Способ согласно любому из вариантов 34-39, где по меньшей мере часть инкубации осуществляют после центрифужной инокуляции.
41. Способ согласно варианту 39 или варианту 40, где по меньшей мере часть инкубации осуществляют в течение периода времени не более, чем или не более, чем приблизительно 2 часов, 4 часов, 12 часов, 18 часов, 24 часов, 30 часов, 36 часов, 48 часов, 60 часов или 72 часов.
42. Способ согласно любому из вариантов 39-41, где по меньшей мере часть инкубации осуществляют в течение или приблизительно в течение 24 часов.
43. Способ согласно любому из вариантов 1-42, где весь период инкубации составляет не более, чем 12 часов, 24 часов, 36 часов, 48 часов или 72 часов.
44. Способ согласно любому из вариантов 1-43, где частицей вирусного вектора является частица лентивирусного вектора.
45. Способ согласно варианту 44, где частица лентивирусного вектора происходит от ВИЧ-1.
46. Способ согласно любому из вариантов 1-45, где частицу вирусного вектора псевдотипируют гликопротеином вирусной оболочки.
47. Способ согласно варианту 46, где гликопротеином вирусной оболочки является VSV-G.
48. Способ согласно любому из вариантов 1-47, где частица вирусного вектора содержит лентивирусный белок, обладающий SAMHD1-ингибирующей активностью, где указанный белок упакован в вирусную частицу.
49. Способ согласно варианту 48, где SAMHD1-ингибирующим белком является белок Vpx дикого типа, белок Vpr дикого типа или вариант или часть белка Vpx или Vpr дикого типа, обладающие SAMHD1-ингибирующей активностью.
50. Способ согласно варианту 48 или варианту 49, где SAMHD1-ингибирующий белок является гетерологичным частице ретровирусного вектора.
51. Способ согласно любому из вариантов 48-50, где SAMHD1-ингибирующим белком является белок Vpx дикого типа или вариант или часть белка Vpx дикого типа, обладающие SAMHD1-ингибирующей активностью.
52. Способ согласно любому из вариантов 1-51, где частицу вирусного вектора инкубируют при множественности инфицирования менее, чем или менее, чем приблизительно 20,0 или менее, чем или менее, чем приблизительно 10,0.
53. Способ согласно любому из вариантов 1-52, где:
частицу вирусного вектора инкубируют при множественности инфицирования в пределах или приблизительно в пределах от 1,0 ИЕ/клетку до 10 ИЕ/клетку или от 2,0 ед/клетку до 5,0 ИЕ/клетку; или
частицу вирусного вектора инкубируют при множественности инфицирования по меньшей мере или по меньшей мере приблизительно 1,6 ИЕ/клетку, 1,8 ИЕ/клетку, 2,0 ИЕ/клетку, 2,4 ИЕ/клетку, 2,8 ИЕ/клетку, 3,2 ИЕ/клетку или 3,6 ИЕ/клетку, 4,0 ИЕ/клетку, 5,0 ИЕ/клетку, 6,0 ИЕ/клетку, 7,0 ИЕ/клетку, 8,0 ИЕ/клетку, 9,0 ИЕ/клетку или 10,0 ИЕ/клетку.
54. Способ согласно любому из вариантов 1-53, где исходная композиция содержит:
по меньшей мере или приблизительно по меньшей мере или приблизительно 50 × 106 клеток, 100 × 106 клеток или 200 × 106 клеток.
55. Способ согласно любому из вариантов 1-54, где рекомбинантная нуклеиновая кислота кодирует антигенный рецептор.
56. Способ согласно варианту 55, где антигенным рецептором является трансгенный T-клеточный рецептор (TCR).
57. Способ согласно варианту 55 или варианту 56, где антигенным рецептором является химерный антигенный рецептор (CAR).
58. Способ согласно варианту 57, где химерный антигенный рецептор (CAR) содержит внеклеточный антиген-распознающий домен, который специфически связывается с антигеном-мишенью и с внутриклеточным сигнал-передающим доменом, содержащим ITAM.
59. Способ согласно варианту 58, где внутриклеточный сигнал-передающий домен содержит внутриклеточный домен цепи CD3-дзета (CD3ζ).
60. Способ согласно варианту 58 или варианту 59, дополнительно включающий трансмембранный домен, связывающий внеклеточный домен и внутриклеточный сигнал-передающий домен.
61. Способ согласно варианту 60, где трансмембранный домен содержит трансмембранную часть CD28.
62. Способ согласно любому из вариантов 58-61, где внутриклеточный сигнал-передающий домен также содержит внутриклеточный сигнал-передающий домен T-клеточной костимулирующей молекулы.
63. Способ согласно варианту 62, где T-клеточная костимулирующая молекула выбрана из группы, состоящей из CD28 и 41BB.
64. Способ согласно любому из вариантов 55-63, где антигенный рецептор специфически связывается с антигеном, ассоциированным с заболеванием или состоянием, или специфически связывается с универсальной меткой.
65. Способ согласно варианту 64, где заболеванием или состоянием является рак и аутоиммунное заболевание или расстройство или инфекционное заболевание.
66. Способ согласно любому из вариантов 1-65, где способ включает получение конечной композиции, содержащей T-клетки, трансдуцированные рекомбинантной нуклеиновой кислотой.
67. Способ согласно варианту 66, где по меньшей мере 30%, или по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70% или по меньшей мере 80% T-клеток в конечной композиции трансдуцируют рекомбинантной нуклеиновой кислотой.
68. Способ согласно варианту 66 или варианту 67, дополнительно включающий получение или выделение из конечной композиции трансдуцированных T-клеток, полученных указанным способом.
69. Способ согласно варианту 66 или варианту 68, дополнительно включающий активацию или размножение клеток конечной композиции или клеток, трансдуцированных этим способом.
70. Способ согласно варианту 69, где активацию и/или размножение осуществляют ex vivo.
71. Способ согласно варианту 69 или варианту 70, где после инкубации клетки в конечной композиции также инкубируют в присутствии одного или более стимулирующих агентов, способных активировать T-клетки, индуцировать передачу сигнала посредством комплекса TCR и/или индуцировать пролиферацию T-клеток.
72. Способ согласно варианту 71, где один или более стимулирующих агентов выбраны из группы, состоящей из CD3-связывающих молекул; CD28-связывающих молекул; рекомбинантного IL-2; рекомбинантного IL-15; и рекомбинантного IL-7.
73. Способ согласно варианту 71 или варианту 72, где один или более стимулирующих агентов содержат анти-CD3 антитело и/или анти-CD28 антитело.
74. Способ согласно варианту 69, где активацию и/или размножение осуществляют in vivo.
75. Способ согласно варианту 69 или варианту 74, где активацию и/или размножение осуществляют в присутствии антигена, специфически связывающегося с антигенным рецептором, и/или активация и/или размножение являются трансген-специфическими.
76. Способ согласно варианту 72 или варианту 75, где после инкубации клетки в конечной композиции дополнительно не инкубируют ex vivo в присутствии одного или более стимулирующих агентов, необязательно состоящих из CD3-связывающих молекул; CD28-связывающих молекул; рекомбинантного IL-2; рекомбинантного IL-15; и рекомбинантного IL-7, и/или клетки в конечной композиции дополнительно не инкубируют при температуре более, чем 30°C в течение более, чем 24 часов.
77. Генетически сконструированная T-клетка, полученная способом согласно любому из вариантов 1-76.
78. Композиция, содержащая генетически сконструированную T-клетку согласно варианту 77 и фармацевтически приемлемый носитель.
79. Способ лечения, включающий введение индивидууму, страдающему заболеванием или состоянием, композиции согласно варианту 78.
80. Способ согласно варианту 79, где композицию вводят индивидууму не позднее, чем через 5 дней после взятия образца у индивидуума.
81. Способ согласно варианту 80, где композицию вводят индивидууму не позднее, чем через 1 день, 2 дня, 3 дня или 4 дня после взятия образца у индивидуума.
82. Способ адоптивной клеточной терапии, включающий:
(a) обогащение или выделение T-клеток из образца, взятого у индивидуума, страдающего заболеванием или состоянием;
(b) трансдукцию исходной композиции, содержащей T-клетки, частицей вирусного вектора способом согласно любому из вариантов 1-71 с получением конечной композиции, содержащей трансдуцированные клетки, где частица вирусного вектора содержит рекомбинантную нуклеиновую кислоту, кодирующую антигенный рецептор, который специфически связывается с антигеном, ассоциированным с заболеванием или расстройством;
(c) введение конечной композиции, содержащей трансдуцированные клетки, индивидууму для лечения заболевания или состояния, где конечную композицию вводят индивидууму не более, чем через 9 дней после взятия образца у индивидуума.
83. Способ адоптивной клеточной терапии, включающий введение конечной композиции, содержащей T-клетки, трансдуцированные рекомбинантной нуклеиновой кислотой, индивидууму для лечения заболевания или состояния, где конечную композицию получают способом согласно любому из вариантов 1-71.
84. Способ согласно варианту 82 или варианту 83, где конечную композицию вводят индивидууму не позднее, чем через 1 день, 2 дня, 3 дня, 4 дня или 5 дней после взятия образца у индивидуума.
85. Способ согласно любому из вариантов 82-84, где до введения композиции, трансдуцированные клетки или клетки конечной композиции приготавливают в фармацевтически приемлемом буфере.
86. Способ согласно любому из вариантов 82-85, где до введения композиции, содержащей трансдуцированные клетки, эти клетки культивируют ex vivo в течение периода времени до 24 часов, 2 дней, 3 дней, 4 дней, 5 дней, 6 дней, 7 дней, 8 дней или 9 дней после трансдукции, где указанное культивирование осуществляют при температуре более, чем 30°C.
87. Способ согласно любому из вариантов 82-86, где после трансдукции конечную композицию или клетки, содержащие трансдуцированные клетки, культивируют в присутствии одного или более стимулирующих агентов, способных активировать T-клетки, индуцировать передачу сигнала посредством комплекса TCR и/или индуцировать пролиферацию T-клеток с получением композиции, содержащей трансдуцированные клетки.
88. Способ согласно любому из вариантов 82-85, где до введения трансдуцированных клеток конечную композицию или клетки, содержащие трансдуцированные клетки, дополнительно не инкубируют ex vivo в присутствии одного или более стимулирующих агентов, и/или дополнительно не инкубируют при температуре более, чем 30°C в течение более, чем 24 часов.
89. Способ согласно варианту 87 или варианту 88, где один или более стимулирующих агентов выбраны из группы, состоящей из CD3-связывающих молекул; CD28-связывающих молекул; рекомбинантного IL-2; рекомбинантного IL-15; и рекомбинантного IL-7; вакцины, содержащей антиген, специфически распознаваемый антигенным рецептором; и антиидиотипического антитела, которое специфически связывается с антигенным рецептором.
90. Способ согласно варианту 89, где один или более стимулирующих агентов содержат анти-CD3 антитело и/или анти-CD28 антитело.
91. Способ согласно любому из вариантов 82-90, где клетки конечной композиции или трансдуцированные клетки вводят в субоптимальной дозе.
92. Способ согласно любому из вариантов 82-91, дополнительно включающий введение индивидууму одного или более агентов для индукции или усиления стимуляции и/или размножения трансдуцированных T-клеток in vivo.
93. Способ согласно варианту 92, где один или более агентов являются трансген-специфическими и/или стимулируют или активируют клетки посредством экспрессируемого трансгена, который представляет собой или содержит, но необязательно, антигенный рецептор.
94. Способ согласно варианту 92 или варианту 93, где один или более агентов выбраны из вакцины, содержащей антиген, специфически распознаваемый антигенным рецептором; антиидиотипического антитела, которое специфически связывается с антигенным рецептором, или агента, способного химически индуцировать димеризацию антигенного рецептора.
95. Способ согласно варианту 92, где один или более агентов представляют собой иммуномодулирующий агент; ингибитор контрольной точки иммунитета; ингибитор внеклеточного аденозина или аденозинового рецептора, необязательно рецептора A2aR; модулятор кинуренинового пути и модуляторы путей передачи сигнала, например, ингибиторы киназы.
96. Композиция, содержащая популяцию первичных человеческих T-клеток, генетически сконструированных для экспрессии химерного антигенного рецептора (CAR) или трансгенного TCR, который специфически связывается с антигеном-мишенью, где:
такая популяция содержит множество покоящихся T-клеток, и
множество покоящихся T-клеток содержит по меньшей мере 7,5% генетически сконструированных клеток в композиции.
97. Композиция согласно варианту 96, где генетически сконструированные покоящиеся T-клетки содержат по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, или по меньшей мере 90% генетически сконструированных клеток в композиции.
98. Композиция согласно варианту 96 или варианту 97, где покоящиеся T-клетки являются негативными по поверхностному маркеру активации T-клеток, выбранному из группы, состоящей из HLA-DR, CD25, CD69, CD71, CD40L (CD154) и 4-1BB (CD137); не содержат экспрессируемого внутри клеток цитокина, выбранного из группы, состоящей из IL-2, IFN-гамма и TNF-альфа; присутствуют в фазе G0 или G0G1a клеточного цикла; и/или содержат активный SAMHD1.
99. Композиция согласно варианту 98, где покоящиеся T-клетки являются негативными по поверхностным CD25 и CD69 (CD25-/CD69-).
100. Композиция согласно любому из вариантов 96-99, где покоящиеся T-клетки содержат CD4+- и/или CD8+-T-клетки.
101. Композиция согласно любому из вариантов 96-100, где антиген-мишень ассоциируется с заболеванием или расстройством.
102. Композиция согласно варианту 100, где заболеванием или расстройством являются инфекционное заболевание или состояние, аутоиммунное заболевание, воспалительное заболевание или рак.
103. Композиция согласно любому из вариантов 96-102, где антиген-мишень выбран из группы, состоящей из антигена созревания В-клеток (ВСМА), угольная кислота-ангидразы 9 (CAIX), tEGFR, HER2/Neu (тирозинкиназного рецептора erbB2), CD19, CD20, CD22, мезотелина, СЕА и поверхностного антигена вируса гепатита В, антифолатного рецептора, CD23, CD24, CD30, CD33, CD38, CD44, EGFR, эпителиального гликопротеина 2 (EPG-2), эпителиального гликопротеина 40 (EPG-40), EPHa2, erb-B2, erb-B3, erb-B4, димеров ErbB, EGFR vIII, белка, связывающегося с фолатом (FBP), FCRL5, FCRH5, фетального рецептора ацетилхолина, GD2, GD3, HMW-MAA, IL-22R-альфа, IL-13R-альфа2, рецептора домена киназной вставки (kdr), легкой цепи каппа, антигена Льюиса Y, молекулы клеточной адгезии L1 (L1-CAM), антигена, ассоциированного с меланомой (MAGE)-A1, MAGE-A3, MAGE-A6, преимущественно экспрессируемого антигена меланомы (PRAME), сурвивина, TAG72, B7-H6, рецептора IL-13 альфа 2 (IL-13Ra2), CA9, GD3, HMW-MAA, CD171, G250/CAIX, HLA-AI MAGE Al, HLA-A2, PSCA, фолатного рецептора-a, CD44v6, CD44v7/8, интегрина avb6, 8H9, NCAM, рецепторов VEGF, 5T4, фетального AchR, лигандов NKG2D, CD44v6, двойного антигена, антигена рака яичек, мезотелина, мышиного CMV, муцина 1 (MUC1), MUC16, PSCA, NKG2D, NY-ESO-1, MART-1, gp100, онкофетального антигена, рецептора, связанного с G-белком 5D (GPCR5D), ROR1, TAG72, VEGF-R2, карциноэмбрионального антигена (CEA), антигена, специфичного к предстательной железе, PSMA, Her2/neu, рецептора эстрогена, рецептора прогестерона, эфрина B2, CD123, c-Met, GD-2, O-ацетилированного GD2 (OGD2), CE7, опухоли Вильмса 1 (WT-1), циклина, циклина A2, CCL-1, CD138, патоген-специфичного антигена и антигена, ассоциированного с универсальной меткой.
104. Композиция согласно любому из вариантов 96-103, где первичные человеческие T-клетки генетически конструируют для экспрессии CAR, содержащего внеклеточный антиген-распознающий домен, который специфически связывается с антигеном-мишенью и с внутриклеточным сигнал-передающим доменом, содержащим ITAM.
105. Композиция согласно варианту 104, где внутриклеточный сигнал-передающий домен содержит внутриклеточный домен цепи CD3-дзета (CD3ζ).
106. Композиция согласно варианту 104 или варианту 105, где CAR дополнительно содержит трансмембранный домен, связывающий внеклеточный домен и внутриклеточный сигнал-передающий домен.
107. Композиция согласно варианту 106, где трансмембранный домен содержит трансмембранную часть CD28.
108. Композиция согласно любому из вариантов 104-107, где внутриклеточный сигнал-передающий домен CAR дополнительно содержит внутриклеточный сигнал-передающий домен T-клеточной костимулирующей молекулы.
109. Композиция согласно варианту 108, где T-клеточная костимулирующая молекула выбрана из группы, состоящей из CD28 и 41BB.
110. Композиция согласно любому из вариантов 96-108, содержащая фармацевтически приемлемый носитель.
VI. ПРИМЕРЫ
[0539] Нижеследующие примеры включены лишь в иллюстративных целях и не должны рассматриваться как ограничение объема изобретения.
Пример 1: Оценка трансдукции первичных человеческих Т-клеток лентивирусом без предварительной активации клеток
[0540] Трансдукцию первичных CD4+- и CD8+-T-клеток, обогащенных из образца, взятого у человека после лейкафереза, лентивирусом, проводили без предварительной стадии активации клеток T-клетками ex vivo перед трансдукцией.
[0541] Образец, взятый у человека после лейкафереза, и обогащенный мононуклеарными клетками, был получен из образца цельной крови индивидуума с использованием системы сбора образцов после лейкафереза. Кровь была подвергнута лейкаферезу, в результате чего был получен образец, содержащий мононуклеарные клетки, аутологичную плазму и антикоагулянт, ACD-A (антикоагулянт цитрат декстрозы A).
[0542] Клетки образца после лейкафереза промывали и ресуспендировали в буфере для их использования в отборе на основе аффинности, где буфер содержал забуференный фосфатом физиологический раствор (PBS), EDTA и альбумин человеческой сыворотки. Для отбора T-клеток на основе иммуноаффинности, промытые клетки в буфере для отбора инкубировали в течение 30 минут при комнатной температуре с магнитными сферами, связанными с моноклональными антителами для отбора, а затем подвергали отбору на колонке с магнитным разделением. Обогащенные Т-клетки ресуспендировали в среде для криоконсервации, и клетки подвергали криоконсервации и хранили в жидком азоте до их дальнейшего использования. Криоконсервированные CD4+- и CD8+-T-клетки оттаивали, промывали и ресуспендировали в среде для трансдукции.
[0543] Затем Т-клетки подвергали контактированию с частицами лентивирусного вектора без инкубирования клеток с агентом для активации Т-клеток, например, без инкубирования клеток с анти-CD3 и анти-CD28 реагентами. Для трансдукции, Т-клетки добавляли в отдельные лунки 24-луночного планшета в объеме 200 мкл. Частицы лентивирусного вектора, содержащие нуклеиновую кислоту, кодирующую трансген (в данном случае, кодирующую репрезентативный химерный антигенный рецептор (CAR) и усеченный EGFR, EGFRt, последовательность для применения в качестве маркера трансдукции, отделенную от последовательности CAR саморасщепляющейся последовательностью T2A), который был предварительно смешан с поликатионным адъювантом для трансдукции, добавляли в лунки в 2-кратных серийных разведениях. Конечный объем на лунку доводили до 1,1 мл. Композиции подвергали центрифугированию в течение приблизительно 1 часа, а затем инкубировали в течение 24 часов при 37°C.
[0544] В качестве контроля, трансдукцию также осуществляли, как описано выше, с использованием CD4+- и CD8+-T-клеток, оттаянных из криоконсервированной композиции, за исключением того, что до трансдукции, Т-клетки были активированы путем культивирования при 37°C в течение приблизительно 24 часов с одним из двух различных реагентов для активации, каждый из которых содержит магнитные сферы, покрытые фрагментами анти-CD3 и анти-CD28 антител (обозначенными здесь как реагент 1 или реагент 2).
[0545] После трансдукции при каждом из указанных выше условий, клетки каждой композиции культивировали при 37°C в присутствии среды и IL-2 в течение 48 часов.
[0546] В качестве показателя эффективности трансдукции был проведен анализ на основе проточной цитометрии для определения процента клеток, позитивных по поверхностной экспрессии CAR (в данном случае, экспрессии, детектируемой с использованием анти-EGFR антитела, которое распознает суррогатный маркер EGFRt). Как показано на фиг. 1А-1В, в этом исследовании, эффективность трансдукции (оцениваемая по экспрессии поверхностного EGFRt) без активации была сравнима с эффективностью трансдукции в клетках, которые были активированы анти-CD3/анти-CD28 реагентами до трансдукции. Результаты показали, что сравнимая трансдукция Т-клеток может быть достигнута с использованием лентивирусных векторов без предварительного инкубирования с агентом для ex vivo активации Т-клеток.
Пример 2: Крупномасштабный способ трансдукции первичных человеческих Т-клеток лентивирусом без предварительной клеточной активации
[0547] В этом примере описана трансдукция CD4+- и CD8+-T-клеток, взятых после афереза у здорового донора, с помощью крупномасштабной процедуры, где полученные клетки подвергали аффинному отбору, трансдуцировали (с предварительной активацией или без нее) и культивировали или инкубировали в различных условиях. Промывку, отбор на основе аффинности и трансдукцию осуществляли, в основном, в вертикальной центрифужной камере для обработки, например, как описано в публикации Международной заявки WO2016/073602.
1. Сбор образцов и лейкаферез
[0548] Аутологичные мононуклеарные клетки периферической крови (МКПК) были взяты у пациента с использованием системы сбора клеток после лейкафереза. Кровь обрабатывали с получением образца, содержащего мононуклеарные клетки и приблизительно 1/3 объема аутологичной плазмы и антикоагулянт, ACD-A (антикоагулянт цитрат декстрозы A). Образец после лейкафереза герметично хранили при 2-8°C в течение приблизительно 24 часов.
2. Промывка после лейкафереза
[0549] Образец после лейкафереза стерильно переносили в пакет для переноса. Клетки образца после лейкафереза промывали и ресуспендировали в буфере для отбора для проведения отбора выбора на основе аффинности, где указанный буфер содержал PBS, EDTA и альбумин человеческой сыворотки. Промывку проводили с помощью стерильного, одноразового комплекта, закупленного у Biosafe SA, применяемого в регенеративной медицине, где указанный комплект включал центрифужную камеру для обработки (А-200F). Пакет для переноса, содержащий клетки, и пакет, содержащий буфер, стерильно подсоединяли к комплекту, который был помещен в устройство для обработки Sepax® 2. Было проведено два (2) цикла промывок, каждый из которых осуществляли при RCF, подаваемой на внутреннюю стенку отсека приблизительно при 200 g в течение 180 секунд, а затем проводили конечное ресуспендирование клеток в 20 мл. По окончании протокола, клетки выдерживали в отсеке центрифужной камеры для обработки в целях последующего инкубирования с реагентами для отбора на основе аффинности.
3. Отбор на основе аффинности
[0550] CD4- и CD8-Т-клетки обогащали путем отбора на основе иммуноаффинности с использованием магнитных сфер, связанных с моноклональными антителами, которые добавляли к промытому образцу, взятому после лейкафереза, в центрифужной камере. Сферы смешивали в буфере для отбора, описанном выше, а затем подсоединяли к устройству. Программу осуществляли в устройстве Sepax® 2, в результате чего смесь сфер и буфера для отбора поступала в камеру с промытыми клетками, и содержимое камеры перемешивали в течение 30 минут.
[0551] В конце программы, в устройстве Sepax® 2 происходили: осаждение клеток и выталкивание избытка буфера/сфер, промывка осажденных клеток и ресуспендирование в буфере для отбора. Программа запускала сбор промытых клеток в пакет для переноса.
[0552] Затем клетки вынимали из пакета для переноса с помощью закрытой стерильной системы трубок и разделительной колонки в присутствии магнитного поля стандартными методами для разделения клеток, которые были связаны с CD4- и/или CD8-специфическими реагентами. Затем эти магнитно-меченые клетки собирали в пакет для переноса для последующей обработки.
4. Трансдукция
[0553] Трансдукцию лентивирусным вектором проводили в центрифужной камере, встроенной в комплект, помещенный в устройство для обработки Sepax®. Отобранные клетки либо трансдуцировали (трансдуцировали на t=0), либо активировали с использованием анти-CD3/CD28 реагента(ов) (активация на t=0 и трансдукция на t=24 ч).
[0554] Для клеток, которые были впервые активированы, отобранные клетки промывали и ресуспендировали в полной среде с использованием системы Sepax® 2, и эту среду затем объединяли с анти-CD3/28 реагентом(ами) в отсеке камеры при комнатной температуре. После инкубации инкубированный материал переносили посредством устройства Sepax® 2 в пакет для культивирования клеток, а затем инкубировали при 37°C в течение 24 часов.
[0555] Для инициации трансдукции проводили следующие стадии.
[0556] Был получен раствор реагента для трансдукции, содержащий полную среду (Х-VIVO-15, включающую 5% (об/об) человеческую сыворотку, 1,6 мг/мл N-ацетилцистеина (NAC) и 100 ИЕ/мл IL-2) и поликатион в количестве, достаточном для достижения конечной концентрации в процессе инициации трансдукции, составляющей 10 мкг/мл), частицы вирусного вектора (приблизительно 3,2 ИЕ/клетку), и, если это необходимо, воздух. Раствор реагента для трансдукции асептически переносили в центрифужный пакет.
[0557] Пакет с продуктом, содержащий композицию, включающую приблизительно 200×106 отобранных клеток или 200×106 активированных клеток, стерильно подсоединяли к одноразовому комплекту, который был помещен в устройство для обработки Sepax® 2. Автоматизированный цикл был запущен на Sepax® 2, что облегчало поступление композиции, содержащей клетки, в отсек камеры, центрифугирование композиции на Sepax® 2 для осаждения клеток и удаление соответствующего объема жидкости, необходимого для достижения желаемого объема, например, 10 мл. Затем, все содержимое раствора реагента для трансдукции поступало в отсек камеры с клетками. После этого, конечный объем 200 мл (содержащий клетки и вирус) переносили в центрифужный пакет.
[0558] Для инициации трансдукции, центрифужный пакет, содержащий вирус и клетки, удаляли и стерильно подсоединяли к исходному положению комплекта, а затем переносили в отсек камеры. Вирус и клетки центрифугировали в отсеке камеры при RCF, подаваемой на внутреннюю стенку отсека и приблизительно равной 1600 g. Центрифугирование проводили при указанной скорости в течение 1 часа. Трансдуцированный материал был затем перенесен в выходной пакет. Полную среду переносили в камеру, смешивали в течение 60 секунд, а затем переносили из отсека для обработки в выходной пакет до достижения общего объема 200 мл в выходном пакете, содержащем трансдуцированный материал.
[0559] Затем, клетки, трансдуцированные после отбора, без предварительной стадии активации, (1) сразу активировали анти-CD3/анти-CD28 реагентом в культуральной среде с добавлением FBS, 100 ИЕ/мл IL-2 и 10 ИЕ/мл IL-15 и собирали на 9-й день; (2) инкубировали при 37°C, 5% CO2 в течение 24 часов, а затем активировали анти-CD3/анти-CD28 реагентом в культуральной среде, и собирали на 9-й день; (3) поддерживали без активации путем культивирования при 37°C, 5% CO2 в течение 3 дней; (4) инкубировали при 37°C, 5% CO2 в течение 24 часов, подвергали криоконсервации, оттаивали и активировали анти-CD3/анти-CD28 реагентом в культуральной среде и собирали на 14 день. В случае контрольных клеток, которые были активированы до трансдукции, а затем трансдуцированы через 24 часа, эти клетки размножали в присутствии культуральной среды (без активации) и собирали на день 9. Для каждого условия, клетки культивировали при 37°C, 5% CO2.
[0560] В таблице 1 систематизированы исследуемые группы и условия инкубирования после трансдукции.
Таблица 1: Группы трансдукции
[0561] Частоту трансдукции в различные дни после отбора клеток после лейкафереза измеряли, как описано в примере 1. Как показано на фиг. 2, сравнимые частоты трансдукции (как было измерено по экспрессии поверхностных маркеров) наблюдались в том случае, когда Т-клетки были сначала трансдуцированы, а затем сразу же активированы по сравнению с Т-клетками, которые были сначала активированы в течение 24 часов, а затем трансдуцированы (63% по сравнению с 68%, соответственно, в криоконсервированном продукте, собранном через 9 дней после отбора). Этот результат продемонстрировал, что относительно высокая эффективность трансдукции может быть достигнута без активации Т-клеток до трансдукции.
[0562] Принимая во внимание, что для трансдукции (интеграции гена) не требуется предварительной активации Т-клеток, результаты, полученные в этом исследовании, позволяют предположить, что инкубация клеток с активирующим агентом имеет важное значение для стабильной поверхностной экспрессии рекомбинантного белка. В клетках, которые не были активированы, экспрессиия EGFRt на поверхности (поверхностого суррогатного маркера экспрессии CAR) была транзиентной; а максимальная детектируемая частота поверхностной экспрессии EGFRt (указывающая на трансдукцию) достигалась через 24 часа после трансдукции на уровне 29% и снижалась до <1% на 3-й день после трансдукции.
[0563] Кроме того, на фиг. 2 показано, что даже если инкубация с активирующим реагентом проводилась через 24 часа (по сравнению с клетками, активированными до трансдукции), то это давало достаточно высокую частоту экспрессии маркера (показателя частоты трансдукции), составляющую 43%. Немедленная инкубация с активирующим реагентом (с магнитными сферами, содержащими анти-CD3/CD28 антитело) после трансдукции давала более высокую частоту встречаемости клеток с поверхностной экспрессией маркера трансдукции, чем при активации, которая была проведена через 24 часа (63% по сравнению с 43% соответствующей частоты, измеренной в криоконсервированном продукте, собранном через 9 дней после отбора). Криоконсервация трансдуцированных клеток (через 24 часа после трансдукции), проводимая до оттаивания и инкубирования с активирующим реагентом, приводила к снижению частоты экспрессии маркера трансдукции по сравнению с клетками, трансдуцированными и инкубированными с активирующим реагентом без криоконсервации (16% по сравнению с 43% соответствующей частоты трансдукции, измеренной в криоконсервированном продукте).
[0564] Настоящее изобретение не должно рассматриваться как ограничение объема конкретно раскрытых вариантов осуществления изобретения, которые представлены, например, для иллюстрации различных аспектов изобретения. Различные модификации, вводимые в описанные здесь композиции и способы, будут очевидными исходя из представленного здесь описания и изложения сути изобретения. Такие варианты могут быть осуществлены, не выходя за рамки истинного существа и объема изобретения, и входят в объем раскрытия настоящего изобретения.
Последовательности
[0565] Настоящее изобретение не должно рассматриваться как ограничение объема конкретно раскрытых вариантов осуществления изобретения, которые представлены, например, для иллюстрации различных аспектов изобретения. Различные модификации, вводимые в описанные здесь композиции и способы, будут очевидными исходя из представленного здесь описания и изложения сути изобретения. Такие варианты могут быть осуществлены, не выходя за рамки истинного существа и объема изобретения, и входят в объем раскрытия настоящего изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Juno Therapeutics, Inc.
Tareen, Semih U
Beaushesne, Pascal
<120> ПРОДУЦИРОВАНИЕ СКОНСТРУИРОВАННЫХ КЛЕТОК ДЛЯ
АДОПТИВНОЙ КЛЕТОЧНОЙ ТЕРАПИИ
<130> 735042005040
<150> US 62/430,349
<151> 2016-12-05
<160> 52
<170> PatentIn version 3.5
<210> 1
<211> 112
<212> белок
<213> Вирус обезьяньего иммунодефицита
<400> 1
Met Ser Asp Pro Arg Glu Arg Ile Pro Pro Gly Asn Ser Gly Glu Glu
1 5 10 15
Thr Ile Gly Glu Ala Phe Glu Trp Leu Asn Arg Thr Val Glu Glu Ile
20 25 30
Asn Arg Glu Ala Val Asn His Leu Pro Arg Glu Leu Ile Phe Gln Val
35 40 45
Trp Gln Arg Ser Trp Glu Tyr Trp His Asp Glu Gln Gly Met Ser Gln
50 55 60
Ser Tyr Val Lys Tyr Arg Tyr Leu Cys Leu Met Gln Lys Ala Leu Phe
65 70 75 80
Met His Cys Lys Lys Gly Cys Arg Cys Leu Gly Glu Gly His Gly Ala
85 90 95
Gly Gly Trp Arg Pro Gly Pro Pro Pro Pro Pro Pro Pro Gly Leu Ala
100 105 110
<210> 2
<211> 112
<212> белок
<213> Вирус обезьяньего иммунодефицита
<400> 2
Met Thr Asp Pro Arg Glu Arg Ile Pro Pro Gly Asn Ser Gly Glu Glu
1 5 10 15
Thr Ile Gly Glu Ala Phe Glu Trp Leu His Asn Thr Val Glu Ala Leu
20 25 30
Asn Gln Thr Ala Val Gln His Leu Pro Arg Glu Leu Ile Phe Gln Val
35 40 45
Trp Arg Arg Cys Trp Glu Tyr Trp Val Asp Glu Gln Gly Tyr Ser Pro
50 55 60
Ser Tyr Ala Lys Tyr Arg Tyr Val Gln Leu Met Gln Lys Ala Met Phe
65 70 75 80
Gln His Phe Arg Lys Gly Cys Thr Cys Arg Gly Glu Gly His Ser Gln
85 90 95
Gly Gly Trp Arg Thr Gly Pro Pro Pro Pro Pro Pro Pro Gly Leu Ala
100 105 110
<210> 3
<211> 112
<212> белок
<213> Вирус обезьяньего иммунодефицита
<400> 3
Met Ser Asp Pro Arg Glu Arg Ile Pro Pro Gly Asn Ser Gly Glu Glu
1 5 10 15
Thr Ile Gly Glu Ala Phe Asp Trp Leu Asp Arg Thr Val Glu Glu Ile
20 25 30
Asn Arg Ala Ala Val Asn His Leu Pro Arg Glu Leu Ile Phe Gln Val
35 40 45
Trp Arg Arg Ser Trp Glu Tyr Trp His Asp Glu Met Gly Met Ser Val
50 55 60
Ser Tyr Thr Lys Tyr Arg Tyr Leu Cys Leu Ile Gln Lys Ala Met Phe
65 70 75 80
Met His Cys Lys Lys Gly Cys Arg Cys Leu Gly Gly Glu His Gly Ala
85 90 95
Gly Gly Trp Arg Pro Gly Pro Pro Pro Pro Pro Pro Pro Gly Leu Ala
100 105 110
<210> 4
<211> 112
<212> белок
<213> Вирус обезьяньего иммунодефицита
<400> 4
Met Ala Asp Pro Arg Glu Arg Val Pro Pro Gly Asn Ser Gly Glu Glu
1 5 10 15
Thr Ile Gly Glu Ala Phe Glu Trp Leu Asp Arg Thr Ile Glu Ala Leu
20 25 30
Asn Arg Glu Ala Val Asn His Leu Pro Arg Glu Leu Ile Phe Gln Val
35 40 45
Trp Gln Arg Ser Trp Ala Tyr Trp His Asp Glu Gln Gly Met Ser Thr
50 55 60
Ser Tyr Thr Lys Tyr Arg Tyr Leu Cys Ile Met Gln Lys Ala Val Tyr
65 70 75 80
Ile His Phe Lys Lys Gly Cys Thr Cys Leu Gly Arg Gly His Gly Pro
85 90 95
Gly Gly Trp Arg Pro Gly Pro Pro Pro Pro Pro Pro Pro Gly Leu Val
100 105 110
<210> 5
<211> 117
<212> белок
<213> Вирус обезьяньего иммунодефицита
<400> 5
Met Glu Arg Tyr Pro Pro Ser His Pro Pro His Phe Thr Ser Arg Thr
1 5 10 15
Val Pro Met Thr Arg Leu Ala Leu Gln Gln Ala Met Gln Asp Leu Asn
20 25 30
Glu Glu Ala Leu Lys His Phe Thr Arg Glu Glu Leu Trp Gly Val Trp
35 40 45
Asn His Cys Val Asp Leu Pro Ala Gln Pro Asp Trp Thr Gly Glu Gln
50 55 60
Ala Trp Ala Ala Ser Val Ile Asp Tyr Ile Lys Ile Val Gln Arg Met
65 70 75 80
Leu Trp Leu His Leu Arg Glu Ala Cys Phe His Arg Glu Arg Glu Ala
85 90 95
Thr Arg Arg Tyr Pro Asn Ile Arg Pro Leu Thr Gly Arg Asn Arg Glu
100 105 110
Val Arg Asp Gly Glu
115
<210> 6
<211> 135
<212> белок
<213> Вирус обезьяньего иммунодефицита
<400> 6
Met Glu Arg Val Pro Pro Ser His Arg Pro Pro Trp His Ser Arg Val
1 5 10 15
Val Pro Thr Thr Met Gln Gln Ala Gln Gln Ala Met Trp Asp Leu Asn
20 25 30
Glu Glu Ala Glu Lys His Phe Ser Arg Glu Glu Leu Arg Gly Ile Trp
35 40 45
Asn Asp Val Thr Glu Leu Pro Ala Asp Pro Asn Trp Thr Val Asp Gln
50 55 60
Ala Ala Ile Ala Cys Ala Ile Asp Tyr Ile Arg Arg Thr Gln Thr Leu
65 70 75 80
Leu Phe Arg His Tyr Arg Glu Gly Cys Tyr His Arg Tyr Ser Asn Thr
85 90 95
Ile Arg Arg Tyr Pro Asn Ile Arg Pro Leu Arg Gly Thr Gln Ala Pro
100 105 110
Pro Ser Asn Ser Met Pro Asn Ala Asp Pro Thr Pro Pro Leu Arg Pro
115 120 125
Ser Arg Tyr Arg Met Asp Glu
130 135
<210> 7
<211> 119
<212> белок
<213> Вирус обезьяньего иммунодефицита
<400> 7
Met Ala Ser Gly Arg Asp Pro Arg Glu Glu Arg Pro Gly Glu Leu Glu
1 5 10 15
Ile Trp Asp Leu Ser Arg Glu Pro Trp Asp Glu Trp Leu Arg Asp Met
20 25 30
Leu Thr Glu Leu Asn Gln Glu Ala Gln Arg His Phe Gly Arg Glu Leu
35 40 45
Leu Phe Gln Val Trp Asn Tyr Cys Gln Glu Glu Gly Glu Arg Gln Asn
50 55 60
Val Pro Met Gln Glu Arg Ala Tyr Lys Tyr Tyr Lys Leu Val Gln Arg
65 70 75 80
Ala Leu Phe Val His Phe Arg Cys Gly Cys Arg Arg Arg Gln Pro Phe
85 90 95
Glu Pro Tyr Glu Glu Arg Arg Asn Gly Gln Gly Gly Gly Arg Ala Gly
100 105 110
Arg Val Pro Pro Gly Leu Asp
115
<210> 8
<211> 119
<212> белок
<213> Вирус обезьяньего иммунодефицита
<400> 8
Met Ala Ser Gly Arg Asp Pro Arg Glu Glu Arg Pro Gly Glu Val Glu
1 5 10 15
Ile Trp Asp Leu Ser Arg Glu Pro Trp Asp Glu Trp Leu Arg Asp Met
20 25 30
Leu Ala Glu Leu Asn Arg Glu Ala Gln Arg His Phe Gly Arg Glu Leu
35 40 45
Leu Phe Gln Val Trp Asn Tyr Cys Gln Glu Glu Gly Glu Arg Gln Asn
50 55 60
Ile Pro Met Gln Glu Arg Ala Tyr Lys Tyr Tyr Arg Leu Val Gln Lys
65 70 75 80
Ala Leu Phe Val His Ile Arg Cys Gly Cys Arg Arg Arg Gln Pro Phe
85 90 95
Glu Pro Tyr Glu Glu Arg Arg Asn Gly Gln Gly Gly Gly Arg Ala Glu
100 105 110
Arg Val Pro Pro Gly Leu Asp
115
<210> 9
<211> 117
<212> белок
<213> Вирус обезьяньего иммунодефицита
<400> 9
Met Glu Arg Tyr Pro Pro Ser His Pro Pro His Phe Thr Ser Arg Thr
1 5 10 15
Val Pro Met Thr Arg Leu Ala Leu Gln Gln Ala Met Gln Asp Leu Asn
20 25 30
Glu Glu Ala Leu Lys His Phe Thr Arg Glu Glu Leu Trp Gly Val Trp
35 40 45
Asn His Cys Val Asp Leu Pro Ala Gln Pro Asp Trp Thr Gly Glu Gln
50 55 60
Ala Trp Ala Ala Ser Val Ile Asp Tyr Ile Lys Ile Val Gln Arg Met
65 70 75 80
Leu Trp Leu His Leu Arg Glu Ala Cys Phe His Arg Glu Arg Glu Ala
85 90 95
Thr Arg Arg Tyr Pro Asn Ile Arg Pro Leu Thr Gly Arg Asn Arg Glu
100 105 110
Val Arg Asp Gly Glu
115
<210> 10
<211> 113
<212> белок
<213> Вирус обезьяньего иммунодефицита
<400> 10
Met Glu Arg Leu Pro Pro Ser His Pro Pro Ala Leu Val Ser Arg Met
1 5 10 15
Ala Glu Thr Thr Gln Arg Gln Leu Gln Glu Ala Val Trp Asp Ile Thr
20 25 30
Glu Glu Ala Arg Lys His Phe Ser Lys Glu Glu Ile Thr Gly Ile Trp
35 40 45
Asp His Cys Trp Ser Leu Pro Ala Leu Pro His Trp Thr Glu Gly Gln
50 55 60
Val Met Ala Ala Ala Val Ile Asp Phe Ile Arg Ile Met Gln Lys Glu
65 70 75 80
Ile Trp Lys His Tyr Arg Val Gly Cys Phe His Arg Glu Ala Glu Arg
85 90 95
Val Arg His Tyr Pro Asn Ile Arg Pro Leu Arg Pro Arg Arg Glu Glu
100 105 110
Pro
<210> 11
<211> 115
<212> белок
<213> Вирус обезьяньего иммунодефицита
<400> 11
Met Glu Arg Leu Pro Pro Ser His Pro Leu Pro Leu Thr Ser Arg Leu
1 5 10 15
Ile Pro Thr Pro Arg Pro Gln Leu Glu Arg Leu Met Arg Glu Val Arg
20 25 30
Asp Glu Met Leu Ile His Phe Thr Arg Asp Glu Val Ile Gly Val Trp
35 40 45
Asn His Cys Val Glu Leu Pro Ala Asp Pro Asp Trp Thr Gly Glu Gln
50 55 60
Ala Trp Ala Ala Ser Val Ile Asp Phe Ala Arg Lys Gly Asn Gln Met
65 70 75 80
Leu Leu Leu His Phe Gln Gln Gly Cys Tyr His Glu Gln Gln Arg Arg
85 90 95
Thr Pro His Tyr Pro Asn Ile Arg Pro Leu Ser Gly Arg Gly Glu Arg
100 105 110
Thr Met Gln
115
<210> 12
<211> 133
<212> белок
<213> Вирус обезьяньего иммунодефицита
<400> 12
Met Glu Arg Ile Pro Pro Ser His Pro Met Pro Trp Leu Ser Arg Arg
1 5 10 15
Val Pro Thr Thr Met Ala Ile Ala Gln Asn Ala Leu Trp Glu Ile Asn
20 25 30
Glu Glu Ala Glu Lys His Phe Ser Arg Asp Glu Leu Arg Gly Ile Trp
35 40 45
His Asp Val Thr Glu Leu Pro Ala Asp Pro Asp Trp Thr Val Asp Gln
50 55 60
Ala Ala Ile Ala Cys Ala Ile Asp Tyr Ile Arg Val Gln Thr Leu Leu
65 70 75 80
Phe Arg His Phe Lys Asp Gly Cys Phe His Arg Val Asn Leu Ser Gly
85 90 95
Arg Tyr Pro Ala Ile Arg Pro Ser Arg Gly Thr Ala Pro Pro Asp Ser
100 105 110
Asn Ser Val Ser His Ala Asp Pro Glu Gln Pro Arg Arg Pro Ser Arg
115 120 125
Tyr Arg Met Asp Glu
130
<210> 13
<211> 135
<212> белок
<213> Вирус обезьяньего иммунодефицита
<400> 13
Met Glu Arg Thr Pro Pro Ser His Pro Leu Pro Trp Ile Ser Arg Arg
1 5 10 15
Val Pro Thr Thr Met Ala Val Ala Gln Ser Ala Met Trp Glu Ile Asn
20 25 30
Glu Glu Ala Glu Lys His Phe Ser Arg Glu Glu Leu Arg Gly Ile Trp
35 40 45
His Asp Val Thr Glu Leu Pro Ala Asp Pro Asp Trp Thr Val Asp Gln
50 55 60
Ala Ala Ile Ala Cys Ala Ile Asp Tyr Val Arg Arg Val Gln Thr Leu
65 70 75 80
Leu Phe Arg His Phe Arg Asp Gly Cys Phe His Arg Tyr Asn Arg Ile
85 90 95
Val Arg Arg Tyr Pro Val Ile Arg Pro Leu Arg Gly Thr Ala Pro Pro
100 105 110
Asp Ser Asn Ser Val Pro His Ala Asp Pro Glu Gln Pro Arg Arg Pro
115 120 125
Ser Arg Tyr Arg Met Asp Glu
130 135
<210> 14
<211> 135
<212> белок
<213> Вирус обезьяньего иммунодефицита
<400> 14
Met Glu Gln Pro Pro Gln Ser His Pro Leu His Trp Thr Ser Arg Met
1 5 10 15
Val Pro Ile Glu Arg Gln Ala Leu Gln Ala Ala Ile Trp Glu Leu Asn
20 25 30
Glu Glu Ala Leu Lys His Phe Ser Arg Glu Glu Leu Arg Gly Ile Trp
35 40 45
Glu Gln Val Thr Glu Leu Pro Ala Asp Pro Ala Trp Asn Ala Asp Gln
50 55 60
Ala Trp Ala Ala Cys Ala Ile Asp Tyr Thr Arg Trp Val Gln Thr Ile
65 70 75 80
Leu Tyr Arg His Tyr Arg Glu Gly Cys Tyr His Arg Tyr Ala Glu Gln
85 90 95
Ile Arg Arg Tyr Pro Val Leu Arg Pro Met Arg Gly Thr Ala Pro Gly
100 105 110
Pro Thr Ser Ser Val Pro Gln Ala Asp Pro Asp Asn Pro Arg Arg Pro
115 120 125
Ser Arg Tyr Arg Met Asp Glu
130 135
<210> 15
<211> 113
<212> белок
<213> Вирус обезьяньего иммунодефицита
<400> 15
Met Ala Glu Ala Phe Phe Asn Pro Ser Gln His Val Gln Gly Thr Pro
1 5 10 15
Trp Phe Phe Ile Pro Arg Asn Val Glu Leu Thr Pro Asn Val Ile Asn
20 25 30
Val Thr Val Lys Ala Glu Leu Val Val Thr Glu Ala Ser Lys His Phe
35 40 45
Thr Pro Gln Glu Ile Tyr Gly Val Trp Asn Gln Ser Leu Asn Glu Glu
50 55 60
Ala Gly Thr Asp Ser Pro Thr Met Ala Trp Glu Arg Thr Met Leu Asp
65 70 75 80
Met Val Arg Ala Leu Asn Leu Met Leu Phe Glu His Phe Ala Ala Gly
85 90 95
Cys Pro Gln Arg Thr Arg Tyr Ala Arg His Arg Gly Tyr Pro His Pro
100 105 110
Ser
<210> 16
<211> 99
<212> белок
<213> Вирус обезьяньего иммунодефицита
<400> 16
Met Ala Glu Arg Ala Pro Glu Ala Pro Glu Gly Ala Gly Glu Val Gly
1 5 10 15
Leu Glu Gln Trp Leu Glu Thr Ser Leu Glu Arg Ile Asn Arg Glu Ala
20 25 30
Arg Leu His Phe His Pro Glu Phe Leu Phe Arg Leu Trp Asn Thr Cys
35 40 45
Val Glu His Trp His Asp Arg His Gln Arg Ser Leu Asp Tyr Ala Lys
50 55 60
Tyr Arg Tyr Leu Leu Leu Met His Lys Ala Met Tyr Thr His Met Gln
65 70 75 80
Gln Gly Cys Pro Cys Arg Asn Gly Arg Pro Arg Gly Pro Pro Pro Pro
85 90 95
Gly Met Ala
<210> 17
<211> 113
<212> белок
<213> Вирус обезьяньего иммунодефицита
<400> 17
Met Ala Glu Arg Gln Ser Val Glu Arg Ala Pro Ala Glu Pro Met Gly
1 5 10 15
Ala Gly Glu Val Glu Leu Glu Glu Trp Leu Gln Arg Ser Leu Leu Arg
20 25 30
Ile Asn Gln Glu Ala Arg Leu His Phe His Pro Glu Phe Leu Phe Arg
35 40 45
Leu Trp Asn Thr Cys Met Glu His Tyr His Asp Ala Leu Gln Leu Ser
50 55 60
Phe Thr Tyr Ser Lys Tyr Arg Tyr Leu Leu Leu Leu Gln Lys Ala Met
65 70 75 80
Phe Met His Phe Gln Gln Gly Cys Ser Cys Leu Gln Gly Arg His Pro
85 90 95
Pro Pro Leu Arg Pro Ala Gly Asp Arg Leu Pro Pro Pro Pro Pro Pro
100 105 110
Pro
<210> 18
<211> 112
<212> белок
<213> Вирус обезьяньего иммунодефицита
<400> 18
Met Ser Asp Pro Arg Glu Arg Ile Pro Pro Gly Asn Ser Gly Glu Glu
1 5 10 15
Thr Ile Gly Glu Ala Phe Glu Trp Leu Asn Arg Thr Val Glu Glu Ile
20 25 30
Asn Arg Glu Ala Val Asn His Leu Pro Arg Glu Leu Ile Phe Gln Val
35 40 45
Trp Gln Arg Ser Trp Glu Tyr Trp His Asp Glu Gln Gly Met Ser Pro
50 55 60
Ser Tyr Val Lys Tyr Arg Tyr Leu Cys Leu Ile Gln Lys Ala Leu Phe
65 70 75 80
Met His Cys Lys Lys Gly Cys Arg Cys Leu Gly Glu Gly His Gly Ala
85 90 95
Gly Gly Trp Arg Pro Gly Pro Pro Pro Pro Pro Pro Pro Gly Leu Ala
100 105 110
<210> 19
<211> 626
<212> белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> Человеческий SAMHD1
<300>
<308> UniProt:Q9Y3Z3
<309> 1999-11-01
<400> 19
Met Gln Arg Ala Asp Ser Glu Gln Pro Ser Lys Arg Pro Arg Cys Asp
1 5 10 15
Asp Ser Pro Arg Thr Pro Ser Asn Thr Pro Ser Ala Glu Ala Asp Trp
20 25 30
Ser Pro Gly Leu Glu Leu His Pro Asp Tyr Lys Thr Trp Gly Pro Glu
35 40 45
Gln Val Cys Ser Phe Leu Arg Arg Gly Gly Phe Glu Glu Pro Val Leu
50 55 60
Leu Lys Asn Ile Arg Glu Asn Glu Ile Thr Gly Ala Leu Leu Pro Cys
65 70 75 80
Leu Asp Glu Ser Arg Phe Glu Asn Leu Gly Val Ser Ser Leu Gly Glu
85 90 95
Arg Lys Lys Leu Leu Ser Tyr Ile Gln Arg Leu Val Gln Ile His Val
100 105 110
Asp Thr Met Lys Val Ile Asn Asp Pro Ile His Gly His Ile Glu Leu
115 120 125
His Pro Leu Leu Val Arg Ile Ile Asp Thr Pro Gln Phe Gln Arg Leu
130 135 140
Arg Tyr Ile Lys Gln Leu Gly Gly Gly Tyr Tyr Val Phe Pro Gly Ala
145 150 155 160
Ser His Asn Arg Phe Glu His Ser Leu Gly Val Gly Tyr Leu Ala Gly
165 170 175
Cys Leu Val His Ala Leu Gly Glu Lys Gln Pro Glu Leu Gln Ile Ser
180 185 190
Glu Arg Asp Val Leu Cys Val Gln Ile Ala Gly Leu Cys His Asp Leu
195 200 205
Gly His Gly Pro Phe Ser His Met Phe Asp Gly Arg Phe Ile Pro Leu
210 215 220
Ala Arg Pro Glu Val Lys Trp Thr His Glu Gln Gly Ser Val Met Met
225 230 235 240
Phe Glu His Leu Ile Asn Ser Asn Gly Ile Lys Pro Val Met Glu Gln
245 250 255
Tyr Gly Leu Ile Pro Glu Glu Asp Ile Cys Phe Ile Lys Glu Gln Ile
260 265 270
Val Gly Pro Leu Glu Ser Pro Val Glu Asp Ser Leu Trp Pro Tyr Lys
275 280 285
Gly Arg Pro Glu Asn Lys Ser Phe Leu Tyr Glu Ile Val Ser Asn Lys
290 295 300
Arg Asn Gly Ile Asp Val Asp Lys Trp Asp Tyr Phe Ala Arg Asp Cys
305 310 315 320
His His Leu Gly Ile Gln Asn Asn Phe Asp Tyr Lys Arg Phe Ile Lys
325 330 335
Phe Ala Arg Val Cys Glu Val Asp Asn Glu Leu Arg Ile Cys Ala Arg
340 345 350
Asp Lys Glu Val Gly Asn Leu Tyr Asp Met Phe His Thr Arg Asn Ser
355 360 365
Leu His Arg Arg Ala Tyr Gln His Lys Val Gly Asn Ile Ile Asp Thr
370 375 380
Met Ile Thr Asp Ala Phe Leu Lys Ala Asp Asp Tyr Ile Glu Ile Thr
385 390 395 400
Gly Ala Gly Gly Lys Lys Tyr Arg Ile Ser Thr Ala Ile Asp Asp Met
405 410 415
Glu Ala Tyr Thr Lys Leu Thr Asp Asn Ile Phe Leu Glu Ile Leu Tyr
420 425 430
Ser Thr Asp Pro Lys Leu Lys Asp Ala Arg Glu Ile Leu Lys Gln Ile
435 440 445
Glu Tyr Arg Asn Leu Phe Lys Tyr Val Gly Glu Thr Gln Pro Thr Gly
450 455 460
Gln Ile Lys Ile Lys Arg Glu Asp Tyr Glu Ser Leu Pro Lys Glu Val
465 470 475 480
Ala Ser Ala Lys Pro Lys Val Leu Leu Asp Val Lys Leu Lys Ala Glu
485 490 495
Asp Phe Ile Val Asp Val Ile Asn Met Asp Tyr Gly Met Gln Glu Lys
500 505 510
Asn Pro Ile Asp His Val Ser Phe Tyr Cys Lys Thr Ala Pro Asn Arg
515 520 525
Ala Ile Arg Ile Thr Lys Asn Gln Val Ser Gln Leu Leu Pro Glu Lys
530 535 540
Phe Ala Glu Gln Leu Ile Arg Val Tyr Cys Lys Lys Val Asp Arg Lys
545 550 555 560
Ser Leu Tyr Ala Ala Arg Gln Tyr Phe Val Gln Trp Cys Ala Asp Arg
565 570 575
Asn Phe Thr Lys Pro Gln Asp Gly Asp Val Ile Ala Pro Leu Ile Thr
580 585 590
Pro Gln Lys Lys Glu Trp Asn Asp Ser Thr Ser Val Gln Asn Pro Thr
595 600 605
Arg Leu Arg Glu Ala Ser Lys Ser Arg Val Gln Leu Phe Lys Asp Asp
610 615 620
Pro Met
625
<210> 20
<211> 52
<212> белок
<213> Вирус иммунодефицита человека
<220>
<221> MISC_FEATURE
<223> ВИЧ-1 P6
<400> 20
Leu Gln Ser Arg Pro Glu Pro Thr Ala Pro Pro Glu Glu Ser Phe Arg
1 5 10 15
Phe Gly Val Glu Thr Thr Thr Pro Pro Gln Lys Gln Glu Pro Ile Asp
20 25 30
Lys Glu Leu Tyr Pro Leu Thr Ser Leu Arg Ser Leu Phe Gly Asn Asp
35 40 45
Pro Ser Ser Gln
50
<210> 21
<211> 63
<212> белок
<213> Вирус обезьяньего иммунодефицита
<220>
<221> MISC_FEATURE
<223> SIVmac P6
<400> 21
Pro Met Ala Gln Val His Gln Gly Leu Met Pro Thr Ala Pro Pro Glu
1 5 10 15
Asp Pro Ala Val Asp Leu Leu Lys Asn Tyr Met Gln Leu Gly Lys Gln
20 25 30
Gln Arg Glu Lys Gln Arg Glu Ser Arg Glu Lys Pro Tyr Lys Glu Val
35 40 45
Thr Glu Asp Leu Leu His Leu Asn Ser Leu Phe Gly Gly Asp Gln
50 55 60
<210> 22
<211> 7
<212> белок
<213> Искусственная последовательность
<220>
<223> синтетическая конструкция
<220>
<221> MISC_FEATURE
<223> SIVmac P6
<220>
<221> ВАРИАНТ
<222> 2, 4, 5
<223> Xaa может представлять собой любую аминокислоту
<220>
<221> misc_feature
<222> (4)..(5)
<223> Xaa может представлять собой любую природную аминокислоту
<400> 22
Asp Xaa Ala Xaa Xaa Leu Leu
1 5
<210> 23
<211> 7
<212> белок
<213> Искусственная последовательность
<220>
<223> синтетическая конструкция
<220>
<221> MISC_FEATURE
<223> упаковывающий мотив
<400> 23
Asp Pro Ala Val Asp Leu Leu
1 5
<210> 24
<211> 10
<212> белок
<213> Искусственная последовательность
<220>
<223> синтетическая конструкция
<220>
<221> MISC_FEATURE
<223> упаковывающий мотив
<400> 24
Asp Pro Ala Val Asp Leu Leu Lys Asn Tyr
1 5 10
<210> 25
<211> 52
<212> белок
<213> Искусственная последовательность
<220>
<223> синтетическая конструкция
<220>
<221> MISC_FEATURE
<223> Гибридный домен P6
<400> 25
Leu Gln Ser Arg Pro Glu Pro Thr Ala Pro Pro Glu Glu Ser Asp Pro
1 5 10 15
Ala Val Asp Leu Leu Thr Thr Pro Pro Gln Lys Gln Glu Pro Ile Asp
20 25 30
Lys Glu Leu Tyr Pro Leu Thr Ser Leu Arg Ser Leu Phe Gly Asn Asp
35 40 45
Pro Ser Ser Gln
50
<210> 26
<211> 16
<212> белок
<213> Искусственная последовательность
<220>
<223> синтетическая конструкция
<220>
<221> MISC_FEATURE
<223> Связывающий мотив
<220>
<221> ВАРИАНТ
<222> 6, 9, 14
<223> Xaa может представлять собой Val, Ile, Leu, Phe, Trp, Tyr или Met
<220>
<221> ВАРИАНТ
<222> 2, 3, 4, 5, 7, 8, 10, 11, 12, 15
<223> Xaa может представлять собой любую аминокислоту
<400> 26
Trp Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Ala Xaa Xaa His
1 5 10 15
<210> 27
<211> 12
<212> белок
<213> Искусственная последовательность
<220>
<223> спейсер (шарнирная область IgG4) (a.к.)
<400> 27
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro
1 5 10
<210> 28
<211> 36
<212> белок
<213> Искусственная последовательность
<220>
<223> спейсер (шарнирная область IgG4) (нук.)
<400> 28
Gly Ala Ala Thr Cys Thr Ala Ala Gly Thr Ala Cys Gly Gly Ala Cys
1 5 10 15
Cys Gly Cys Cys Cys Thr Gly Cys Cys Cys Cys Cys Cys Thr Thr Gly
20 25 30
Cys Cys Cys Thr
35
<210> 29
<211> 119
<212> белок
<213> Искусственная последовательность
<220>
<223> Спейсер "шарнирная область-CH3"
<400> 29
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Gly Gln Pro Arg
1 5 10 15
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
20 25 30
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
35 40 45
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
50 55 60
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
65 70 75 80
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
85 90 95
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
100 105 110
Leu Ser Leu Ser Leu Gly Lys
115
<210> 30
<211> 229
<212> белок
<213> Искусственная последовательность
<220>
<223> Спейсер "шарнирная область-CH2-CH3"
<400> 30
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 31
<211> 282
<212> белок
<213> Искусственная последовательность
<220>
<223> IgD-шарнирная область-Fc
<400> 31
Arg Trp Pro Glu Ser Pro Lys Ala Gln Ala Ser Ser Val Pro Thr Ala
1 5 10 15
Gln Pro Gln Ala Glu Gly Ser Leu Ala Lys Ala Thr Thr Ala Pro Ala
20 25 30
Thr Thr Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys Glu Lys
35 40 45
Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro
50 55 60
Ser His Thr Gln Pro Leu Gly Val Tyr Leu Leu Thr Pro Ala Val Gln
65 70 75 80
Asp Leu Trp Leu Arg Asp Lys Ala Thr Phe Thr Cys Phe Val Val Gly
85 90 95
Ser Asp Leu Lys Asp Ala His Leu Thr Trp Glu Val Ala Gly Lys Val
100 105 110
Pro Thr Gly Gly Val Glu Glu Gly Leu Leu Glu Arg His Ser Asn Gly
115 120 125
Ser Gln Ser Gln His Ser Arg Leu Thr Leu Pro Arg Ser Leu Trp Asn
130 135 140
Ala Gly Thr Ser Val Thr Cys Thr Leu Asn His Pro Ser Leu Pro Pro
145 150 155 160
Gln Arg Leu Met Ala Leu Arg Glu Pro Ala Ala Gln Ala Pro Val Lys
165 170 175
Leu Ser Leu Asn Leu Leu Ala Ser Ser Asp Pro Pro Glu Ala Ala Ser
180 185 190
Trp Leu Leu Cys Glu Val Ser Gly Phe Ser Pro Pro Asn Ile Leu Leu
195 200 205
Met Trp Leu Glu Asp Gln Arg Glu Val Asn Thr Ser Gly Phe Ala Pro
210 215 220
Ala Arg Pro Pro Pro Gln Pro Gly Ser Thr Thr Phe Trp Ala Trp Ser
225 230 235 240
Val Leu Arg Val Pro Ala Pro Pro Ser Pro Gln Pro Ala Thr Tyr Thr
245 250 255
Cys Val Val Ser His Glu Asp Ser Arg Thr Leu Leu Asn Ala Ser Arg
260 265 270
Ser Leu Glu Val Ser Tyr Val Thr Asp His
275 280
<210> 32
<211> 24
<212> белок
<213> Искусственная последовательность
<220>
<223> T2A
<400> 32
Leu Glu Gly Gly Gly Glu Gly Arg Gly Ser Leu Leu Thr Cys Gly Asp
1 5 10 15
Val Glu Glu Asn Pro Gly Pro Arg
20
<210> 33
<211> 357
<212> белок
<213> Искусственная последовательность
<220>
<223> tEGFR
<400> 33
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Arg Lys Val Cys Asn Gly Ile Gly Ile Gly
20 25 30
Glu Phe Lys Asp Ser Leu Ser Ile Asn Ala Thr Asn Ile Lys His Phe
35 40 45
Lys Asn Cys Thr Ser Ile Ser Gly Asp Leu His Ile Leu Pro Val Ala
50 55 60
Phe Arg Gly Asp Ser Phe Thr His Thr Pro Pro Leu Asp Pro Gln Glu
65 70 75 80
Leu Asp Ile Leu Lys Thr Val Lys Glu Ile Thr Gly Phe Leu Leu Ile
85 90 95
Gln Ala Trp Pro Glu Asn Arg Thr Asp Leu His Ala Phe Glu Asn Leu
100 105 110
Glu Ile Ile Arg Gly Arg Thr Lys Gln His Gly Gln Phe Ser Leu Ala
115 120 125
Val Val Ser Leu Asn Ile Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu
130 135 140
Ile Ser Asp Gly Asp Val Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr
145 150 155 160
Ala Asn Thr Ile Asn Trp Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys
165 170 175
Thr Lys Ile Ile Ser Asn Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly
180 185 190
Gln Val Cys His Ala Leu Cys Ser Pro Glu Gly Cys Trp Gly Pro Glu
195 200 205
Pro Arg Asp Cys Val Ser Cys Arg Asn Val Ser Arg Gly Arg Glu Cys
210 215 220
Val Asp Lys Cys Asn Leu Leu Glu Gly Glu Pro Arg Glu Phe Val Glu
225 230 235 240
Asn Ser Glu Cys Ile Gln Cys His Pro Glu Cys Leu Pro Gln Ala Met
245 250 255
Asn Ile Thr Cys Thr Gly Arg Gly Pro Asp Asn Cys Ile Gln Cys Ala
260 265 270
His Tyr Ile Asp Gly Pro His Cys Val Lys Thr Cys Pro Ala Gly Val
275 280 285
Met Gly Glu Asn Asn Thr Leu Val Trp Lys Tyr Ala Asp Ala Gly His
290 295 300
Val Cys His Leu Cys His Pro Asn Cys Thr Tyr Gly Cys Thr Gly Pro
305 310 315 320
Gly Leu Glu Gly Cys Pro Thr Asn Gly Pro Lys Ile Pro Ser Ile Ala
325 330 335
Thr Gly Met Val Gly Ala Leu Leu Leu Leu Leu Val Val Ala Leu Gly
340 345 350
Ile Gly Leu Phe Met
355
<210> 34
<211> 27
<212> белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> CD28 (аминокислоты 153-179, регистрационный No. P10747)
<400> 34
Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu
1 5 10 15
Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val
20 25
<210> 35
<211> 66
<212> белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> CD28 (аминокислоты 114-179, регистрационный No. P10747)
<400> 35
Ile Glu Val Met Tyr Pro Pro Pro Tyr Leu Asp Asn Glu Lys Ser Asn
1 5 10 15
Gly Thr Ile Ile His Val Lys Gly Lys His Leu Cys Pro Ser Pro Leu
20 25 30
Phe Pro Gly Pro Ser Lys Pro Phe Trp Val Leu Val Val Val Gly Gly
35 40 45
Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile Ile Phe
50 55 60
Trp Val
65
<210> 36
<211> 41
<212> белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> CD28 (аминокислоты 180-220, P10747)
<400> 36
Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp Tyr Met Asn Met Thr
1 5 10 15
Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro
20 25 30
Pro Arg Asp Phe Ala Ala Tyr Arg Ser
35 40
<210> 37
<211> 41
<212> белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> CD28 (LL-GG)
<400> 37
Arg Ser Lys Arg Ser Arg Gly Gly His Ser Asp Tyr Met Asn Met Thr
1 5 10 15
Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro
20 25 30
Pro Arg Asp Phe Ala Ala Tyr Arg Ser
35 40
<210> 38
<211> 42
<212> белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> 4-1BB (аминокислоты 214-255, Q07011.1)
<400> 38
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 10 15
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
20 25 30
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
35 40
<210> 39
<211> 112
<212> белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> CD3 дзета
<400> 39
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 40
<211> 112
<212> белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> CD3 дзета
<400> 40
Arg Val Lys Phe Ser Arg Ser Ala Glu Pro Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 41
<211> 112
<212> белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<223> CD3 дзета
<400> 41
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 42
<211> 335
<212> белок
<213> Искусственная последовательность
<220>
<223> tEGFR
<400> 42
Arg Lys Val Cys Asn Gly Ile Gly Ile Gly Glu Phe Lys Asp Ser Leu
1 5 10 15
Ser Ile Asn Ala Thr Asn Ile Lys His Phe Lys Asn Cys Thr Ser Ile
20 25 30
Ser Gly Asp Leu His Ile Leu Pro Val Ala Phe Arg Gly Asp Ser Phe
35 40 45
Thr His Thr Pro Pro Leu Asp Pro Gln Glu Leu Asp Ile Leu Lys Thr
50 55 60
Val Lys Glu Ile Thr Gly Phe Leu Leu Ile Gln Ala Trp Pro Glu Asn
65 70 75 80
Arg Thr Asp Leu His Ala Phe Glu Asn Leu Glu Ile Ile Arg Gly Arg
85 90 95
Thr Lys Gln His Gly Gln Phe Ser Leu Ala Val Val Ser Leu Asn Ile
100 105 110
Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu Ile Ser Asp Gly Asp Val
115 120 125
Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr Ala Asn Thr Ile Asn Trp
130 135 140
Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys Thr Lys Ile Ile Ser Asn
145 150 155 160
Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly Gln Val Cys His Ala Leu
165 170 175
Cys Ser Pro Glu Gly Cys Trp Gly Pro Glu Pro Arg Asp Cys Val Ser
180 185 190
Cys Arg Asn Val Ser Arg Gly Arg Glu Cys Val Asp Lys Cys Asn Leu
195 200 205
Leu Glu Gly Glu Pro Arg Glu Phe Val Glu Asn Ser Glu Cys Ile Gln
210 215 220
Cys His Pro Glu Cys Leu Pro Gln Ala Met Asn Ile Thr Cys Thr Gly
225 230 235 240
Arg Gly Pro Asp Asn Cys Ile Gln Cys Ala His Tyr Ile Asp Gly Pro
245 250 255
His Cys Val Lys Thr Cys Pro Ala Gly Val Met Gly Glu Asn Asn Thr
260 265 270
Leu Val Trp Lys Tyr Ala Asp Ala Gly His Val Cys His Leu Cys His
275 280 285
Pro Asn Cys Thr Tyr Gly Cys Thr Gly Pro Gly Leu Glu Gly Cys Pro
290 295 300
Thr Asn Gly Pro Lys Ile Pro Ser Ile Ala Thr Gly Met Val Gly Ala
305 310 315 320
Leu Leu Leu Leu Leu Val Val Ala Leu Gly Ile Gly Leu Phe Met
325 330 335
<210> 43
<211> 18
<212> белок
<213> Искусственная последовательность
<220>
<223> T2A
<400> 43
Glu Gly Arg Gly Ser Leu Leu Thr Cys Gly Asp Val Glu Glu Asn Pro
1 5 10 15
Gly Pro
<210> 44
<211> 22
<212> белок
<213> Искусственная последовательность
<220>
<223> P2A
<400> 44
Gly Ser Gly Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala Gly Asp Val
1 5 10 15
Glu Glu Asn Pro Gly Pro
20
<210> 45
<211> 19
<212> белок
<213> Искусственная последовательность
<220>
<223> P2A
<400> 45
Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala Gly Asp Val Glu Glu Asn
1 5 10 15
Pro Gly Pro
<210> 46
<211> 20
<212> белок
<213> Искусственная последовательность
<220>
<223> E2A
<400> 46
Gln Cys Thr Asn Tyr Ala Leu Leu Lys Leu Ala Gly Asp Val Glu Ser
1 5 10 15
Asn Pro Gly Pro
20
<210> 47
<211> 22
<212> белок
<213> Искусственная последовательность
<220>
<223> F2A
<400> 47
Val Lys Gln Thr Leu Asn Phe Asp Leu Leu Lys Leu Ala Gly Asp Val
1 5 10 15
Glu Ser Asn Pro Gly Pro
20
<210> 48
<211> 30
<212> белок
<213> Искусственная последовательность
<220>
<223> Линкер
<400> 48
Pro Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Pro
20 25 30
<210> 49
<211> 17
<212> белок
<213> Искусственная последовательность
<220>
<223> Линкер
<400> 49
Gly Ser Ala Asp Asp Ala Lys Lys Asp Ala Ala Lys Lys Asp Gly Lys
1 5 10 15
Ser
<210> 50
<211> 66
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Сигнальная последовательность альфа-цепи GMCSFR
<400> 50
atgcttctcc tggtgacaag ccttctgctc tgtgagttac cacacccagc attcctcctg 60
atccca 66
<210> 51
<211> 22
<212> белок
<213> Искусственная последовательность
<220>
<223> Сигнальная последовательность альфа-цепи GMCSFR
<400> 51
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro
20
<210> 52
<211> 18
<212> белок
<213> Искусственная последовательность
<220>
<223> Сигнальный пептид CD8-альфа
<400> 52
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala
<---
Реферат
Настоящее изобретение относится к биотехнологии и клеточной биологии, в частности к способам трансдукции Т-клеток и способам адоптивной клеточной терапии. Для осуществления способов трансдукции Т-клеток сначала инкубируют частицу ретровирусного вектора, например лентивирусного вектора, содержащую рекомбинантную нуклеиновую кислоту, кодирующую гетерологичную молекулу, с композицией, содержащей Т-клетки. Затем инкубируют полученную на первой стадии композицию ex vivo в присутствии стимулирующих агентов, способных активировать Т-клетки. После чего индуцируют сигнал посредством комплекса TCR либо индуцируют пролиферацию Т-клеток. При этом первую стадию начинают не позднее чем через 24 часа после взятия образца у индивидуума. При этом исходная композиция не была подвергнута стимуляции ex vivo, включая инкубацию в присутствии агентов, способных активировать Т-клетки. А инкубацию на конечной стадии осуществляют в течение не позднее чем 10 дней после первой стадии инкубации. Настоящее изобретение позволяет усовершенствовать стратегии трансдукции клеточных популяций in vitro для возможности применения их в исследованиях, диагностике и терапии. 4 н. и 86 з.п. ф-лы, 3 ил., 1 табл., 2 пр.
Формула
Документы, цитированные в отчёте о поиске
Молекулы биспецифических антител и т-клетки, трансфецированные антигеном, и их применение в медицине

Комментарии