Химерные рецепторы антигена, нацеленные на her2 - RU2753695C2
Код документа: RU2753695C2
Чертежи
















Описание
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Иммунотерапии на основе опухолеспецифичных Т-клеток, включающие терапии с использованием генетически модифицированных Т-клеток, были исследованы в отношении противоопухолевого лечения. В некоторых случаях Т-клетки, используемые в таких терапиях, не остаются активными in vivo в течение достаточно длительных периодов. В некоторых случаях опухолеспецифичность Т-клеток является относительно низкой, отчасти из-за гетерогенной природы солидных опухолей и потенциальных эффектов на нераковые клетки вне мишени при нацеливании на собственные антигены. Следовательно, в данной области существует потребность в опухолеспецифичных противораковых терапиях с улучшенной противоопухолевой специфичностью и функцией.
Химерные рецепторы антигена (CAR) состоят из внеклеточного домена распознавания/нацеливания на опухоль, внеклеточного линкера/спейсера, трансмембранного домена и внутриклеточных домена активации Т-клеток и костимулирующего домена сигнализации. Конструкция домена распознавания/нацеливания является критически важной для избегания вредных эффектов вне мишени. Большинство доменов CAR нацеливания на опухоль представляют собой одноцепочечные вариабельные фрагменты (scFv), происходящие из последовательностей антител, в которых используется специфичность связывания антитела с конкретными антигенами. Также существуют примеры доменов CAR нацеливания на опухоль, происходящих из нормальных лигандов рецептора, как, например, CAR на основе цитокина IL-13 (интерлейкин-13), который нацеливается на клетки, экспрессирующие рецептор IL-13 - IL13Rα2.
Адоптивная Т-клеточная терапия (ACT) с использованием генетически модифицированных Т-клеток, экспрессирующих CAR, продемонстрировала надежную и долговременную клиническую эффективность у пациентов с CD19+ В-клеточными злокачественными заболеваниями (Priceman et al. 2015 Curr Opin Oncol; Maus et al. 2014 Blood 123: 2625-2635). С достижением ранних успехов при гематологических заболеваниях, более широкое применение данного подхода к солидным опухолям сейчас интенсивно исследуется.
Согласно данным Программы по наблюдению, эпидемиологии и конечным результатам (SEER) Национального института рака в 2014 г. было оценочно 40000 случаев смерти от рака молочной железы, главным образом, от метастатического заболевания. Приблизительно 25-30% пациентов с раком молочной железы несут амплификацию гена HER2 (рецептор человеческого эпидермального фактора роста 2), которая дает особенно плохой прогноз. Даже с появлением более новых агентов, включающих таргетные терапии, имели место только умеренные улучшения общего коэффициента смертности при заболевании IV стадии. Например, в рандомизированном испытании с пациентами с HER2-позитивным раком молочной железы наиболее многообещающая комбинация лечения двумя антителами, нацеленными на HER2 - трастузумабом и пертузумабом - плюс доцетакселом давала медианное общее выживание 56,5 месяцев и продление выживания без прогрессирования лишь на 6,3 месяца по сравнению с одними трастузумабом и доцетакселом.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В данном документе описаны химерные трансмембранные иммунорецепторы (химерные рецепторы антигена или «CAR»), которые содержат внеклеточный домен, трансмембранную область и внутриклеточный домен сигнализации. Внеклеточный домен включает scFv, нацеленный на HER2, и, возможно, спейсер, содержащий, например, часть человеческого домена Fc. Трансмембранная часть включает, например, трансмембранный домен CD4, трансмембранный домен CD8, трансмембранный домен CD28 или трансмембранный домен CD3. Внутриклеточный домен сигнализации включает домен сигнализации из зета-цепи человеческого комплекса CD3 (CD3ζ) и один или более чем один костимулирующий домен, например, костимулирующий домен 4-1ВВ или CD28. Внеклеточный домен дает возможность CAR, при экспрессии на поверхности Т-клетки, направлять активность Т-клетки против тех клеток, которые экспрессируют HER2. Такие клетки включают определенные клетки рака молочной железы и определенные клетки рака мозга. Включение костимулирующего домена, такого как костимулирующий домен 4-1ВВ (CD137), последовательно с CD3ζ во внутриклеточной области дает возможность Т-клеткам получать костимулирующие сигналы. Т-клетки, например, специфичные для пациента аутологические Т-клетки, могут быть генетически модифицированы для экспрессии CAR, описанных в данном документе, и данные генетически модифицированные клетки можно размножать и использовать в ACT. Можно использовать разные поднаборы Т-клеток, включающие и альфа бета Т-клетки, и гамма дельта Т-клетки. Кроме того, CAR могут экспрессироваться в других иммунных клетках, таких как NK-клетки (природные клетки-киллеры). Когда пациента лечат иммунной клеткой, экспрессирующей CAR, описанный в данном документе, данная клетка может представлять собой аутологическую Т-клетку или аллогенную Т-клетку. В некоторых случаях использованные клетки представляют собой популяцию клеток, которая включает центральные Т-клетки памяти (ТСМ) и CD4+, и CD8+, которые являются CD62L+, CCR7+, CD45RO+ и CD45RA-, или использованные клетки представляют собой популяцию клеток, которая включает клетки ТСМ CD4+и CD8+, стволовые центральные Т-клетки памяти и наивные Т-клетки (т.е. популяцию клеток TCM/SCM/N). Популяция клеток TCM/SCM/N представляет собой клетки CD62L+, CCR7+и включает и клетки CD45RA+, и CD45RO+, а также и клетки CD4+, и CD8+. Применение таких клеток может улучшать долговременное сохранение данных клеток после адоптивного переноса по сравнению с применением других типов Т-клеток, специфичных для пациента.
В данном документе описана молекула нуклеиновой кислоты, кодирующая CAR, содержащий: scFv, нацеленный на HER2 (например,

В разных воплощениях костимулирующий домен выбран из группы, состоящей из следующих: костимулирующий домен CD28 или его вариант, имеющий 1-5 (например, 1 или 2) модификаций аминокислот, костимулирующий домен 4-1ВВ или его вариант, имеющий 1-5 (например, 1 или 2) модификаций аминокислот, и костимулирующий домен ОХ40 или его вариант, имеющий 1-5 (например, 1 или 2) модификаций аминокислот.В некоторых воплощениях присутствует костимулирующий домен 4-1ВВ или его вариант, имеющий 1-5 (например, 1 или 2) модификаций аминокислот. В некоторых воплощениях имеются два костимулирующих домена, например, костимулирующий домен CD28 или его вариант, имеющий 1-5 (например, 1 или 2) модификаций аминокислот (например, замен), и костимулирующий домен 4-1ВВ или его вариант, имеющий 1-5 (например, 1 или 2) модификаций аминокислот (например, замен). В разных воплощениях 1-5 (например, 1 или 2) модификаций аминокислот представляют собой замены.
В некоторых случаях имеется короткая последовательность из 1-6 аминокислот (например, GGG) между костимулирующими доменами и доменом сигнализации CD3ζ, и/или между двумя костимулирующими доменами.
Дополнительное воплощение CAR содержит: scFv, нацеленный на HER2; два разных костимулирующих домена, выбранных из группы, состоящей из следующих: костимулирующий домен CD28 или его вариант, имеющий 1-5 (например, 1 или 2) модификаций аминокислот, костимулирующий домен 4-1ВВ или его вариант, имеющий 1-5 (например, 1 или 2) модификаций аминокислот, и костимулирующий домен ОХ40 или его вариант, имеющий 1-5 (например, 1 или 2) модификаций аминокислот; два разных костимулирующих домена, выбранных из группы, состоящей из следующих: костимулирующий домен CD28 или его вариант, имеющий 1-2 модификации аминокислот, костимулирующий домен 4-1ВВ или его вариант, имеющий 1-2 модификации аминокислот, и костимулирующий домен ОХ40 или его вариант, имеющий 1-2 модификации аминокислот; scFv против HER2 или его вариант, имеющий 1-2 модификации аминокислот; трансмембранный домен, выбранный из следующих: трансмембранный домен CD4 или его вариант, имеющий 1-2 модификации аминокислот, трансмембранный домен CD8 или его вариант, имеющий 1-2 модификации аминокислот, трансмембранный домен CD28 или его вариант, имеющий 1-2 модификации аминокислот, и трансмембранный домен CD3ζ или его вариант, имеющий 1-2 модификации аминокислот; костимулирующий домен (например, костимулирующий домен CD28 или его вариант, имеющий 1-5 (например, 1 или 2) модификаций аминокислот (например, замен), или костимулирующий домен 4-1ВВ или его вариант, имеющий 1-5 (например, 1 или 2) модификаций аминокислот (например, замен); или и костимулирующий домен CD28 или его вариант, имеющий 1-5 (например, 1 или 2) модификаций аминокислот (например, замен), и костимулирующий домен 4-1ВВ или его вариант, имеющий 1-5 (например, 1 или 2) модификаций аминокислот (например, замен); и домен сигнализации CD3ζ или его вариант, имеющий 1-2 модификации аминокислот; спейсерную область, расположенную между scFv против HER2 или ее вариантом и трансмембранным доменом (например, спейсерная область содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2-12 и 42 (Таблица 3), или ее вариант, имеющий 1-5 (например, 1 или 2) модификаций аминокислот); спейсер содержит шарнирную область IgG; спейсерная область содержит 1-150 аминокислот; отсутствует спейсер; домен сигнализации 4-1ВВ содержит аминокислотную последовательность SEQ ID NO: 24, домен сигнализации CD3ζ содержит аминокислотную последовательность SEQ ID NO: 21, и линкер из 3-15 аминокислот расположен между костимулирующий доменом и доменом сигнализации CD3ζ или его вариантом. В некоторых воплощениях, где имеется два костимулирующих домена, один представляет собой костимулирующий домен 4-1ВВ, а другой - костимулирующий домен, выбранный из CD28 и CD28gg. В разных воплощениях 1-5 (например, 1 или 2) модификаций аминокислот представляют собой замены, например, консервативные замены.
В некоторых воплощениях молекула нуклеиновой кислоты экспрессирует полипептид, содержащий аминокислотную последовательность, выбранную из SEQ ID NO: 26-41; химерный рецептор антигена содержит аминокислотную последовательность, выбранную из SEQ ID NO: 26-41.
Также раскрыта популяция человеческих Т-клеток, трансдуцированных вектором, содержащим экспрессионную кассету, кодирующую химерный рецептор антигена, где химерный рецептор антигена содержит: scFv, нацеленный на HER2; трансмембранный домен, выбранный из: трансмембранного домена CD4 или его варианта, имеющего 1-5 (например, 1 или 2) модификаций аминокислот (например, замен), трансмембранного домена CD8 или его варианта, имеющего 1-5 (например, 1 или 2) модификаций аминокислот (например, замен), трансмембранного домена CD28 или его варианта, имеющего 1-5 (например, 1 или 2) модификаций аминокислот (например, замен), и трансмембранного домена CD3ζ или его варианта, имеющего 1-5 (например, 1 или 2) модификаций аминокислот (например, замен); костимулирующий домен (например, костимулирующий домен CD28 или его вариант, имеющий 1-5 (например, 1 или 2) модификаций аминокислот (например, замен); или костимулирующий домен 4-1ВВ или его вариант, имеющий 1-5 (например, 1 или 2) модификаций аминокислот (например, замен); или и костимулирующий домен CD28 или его вариант, имеющий 1-5 (например, 1 или 2) модификаций аминокислот (например, замен), и костимулирующий домен 4-1ВВ или его вариант, имеющий 1-5 (например, 1 или 2) модификаций аминокислот (например, замен); и домен сигнализации CD3ζ или его вариант, имеющий 1-5 (например, 1 или 2) модификаций аминокислот (например, замен). В разных воплощениях популяция человеческих Т-клеток содержит вектор, экспрессирующий химерный рецептор антигена, содержащий аминокислотную последовательность, выбранную из любой из SEQ ID NO: 26-41 или ее варианта, имеющего 1-5 (например, 1 или 2) модификаций аминокислот (например, замен); данная популяция человеческих Т-клеток содержит центральные Т-клетки памяти (клетки ТСМ), например, по меньшей мере 20%, 30%, 40%, 50%, 60%, 70%, 80% клеток представляют собой клетки ТСМ, или популяция Т-клеток содержит комбинацию центральных Т-клеток памяти, наивных Т-клеток и стволовых центральных Т-клеток памяти (клетки TCM/SCM/N), например, например, по меньшей мере 20%, 30%, 40%, 50%, 60%, 70%, 80% клеток представляют собой клетки TCM/SCM/N. В любом случае популяция Т-клеток включает и клетки CD4+, и клетки CD8+ (например, по меньшей мере 20% Т-клеток CD3+ представляют собой CD4+, и по меньшей мере 3% Т-клеток CD3+ представляют собой CD8+, и по меньшей мере 70, 80 или 90% представляют собой либо CD4+, либо CD8+; по меньшей мере 15%, 20%, 25%, 30%, 35%, 40%, 50%, 60% клеток CD3+ представляют собой CD4+, и по меньшей мере 4%, 5%, 8%, 10%, 20% клеток CD3+ представляют собой клетки CD8+).
Также описан способ лечения рака у пациента, включающий введение популяции аутологических или аллогенных человеческих Т-клеток (например, аутологических или аллогенных Т-клеток, содержащих центральные Т-клетки памяти (клетки ТСМ) или комбинацию центральных Т-клеток памяти, наивных Т-клеток и стволовых центральных Т-клеток памяти (т.е. Т-клетки представляют собой клетки TCM/SCM/N), по меньшей мере 20%, 30%, 40%, 50%, 60%, 70%, 80% клеток представляют собой клетки TCM/SCM/N. В любом случае популяция Т-клеток включает и клетки CD4+, и клетки CD8+ (например, по меньшей мере 20% Т-клеток CD3+ представляют собой CD4+, и по меньшей мере 3% Т-клеток CD3+ представляют собой CD8+, и по меньшей мере 70, 80 или 90% представляют собой либо CD4+, либо CD8+; по меньшей мере 15%, 20%, 25%, 30%, 35%, 40%, 50%, 60% клеток CD3+ представляют собой CD4+, и по меньшей мере 4%, 5%, 8%, 10%, 20% клеток CD3+ представляют собой клетки CD8+), трансдуцированные вектором, содержащим экспрессионную кассету, кодирующую химерный рецептор антигена, где химерный рецептор антигена содержит аминокислотную последовательность, выбранную из SEQ ID NO: 26-41, или ее вариант, имеющий 1-5 (например, 1 или 2) модификаций аминокислот (например, замен). В разных воплощениях раковое заболевание представляет собой рак мозга, например, рак мозга, экспрессирующий HER2, который представляет собой метастаз от рака молочной железы; и трансдуцированные человеческие Т-клетки были получены способом, включающим получение Т-клеток от пациента, обработку Т-клеток для выделения центральных Т-клеток памяти и трансдуцирование по меньшей мере части центральных клеток памяти вирусным вектором, содержащим экспрессионную кассету, кодирующую химерный рецептор антигена, где химерный рецептор антигена содержит аминокислотную последовательность, выбранную из SEQ ID NO: 26 или 27, или ее вариант, имеющий 1-5 (например, 1 или 2) модификаций аминокислот (например, замен). В некоторых случаях Т-клетки с CAR не вводятся непосредственно в опухоль мозга, но вместо этого вводятся во внутрижелудочковое пространство в мозге пациента.
Также описана молекула нуклеиновой кислоты, кодирующая полипептид, содержащий аминокислотную последовательность, которая является по меньшей мере на 95% идентичной аминокислотной последовательности, выбранной из SEQ ID NO: 26-41; молекула нуклеиновой кислоты, кодирующая полипептид, содержащий аминокислотную последовательность, которая является идентичной аминокислотной последовательности, выбранной из SEQ ID NO: 26-41, за исключением присутствия не более чем 5 аминокислотных замен, делеций или вставок; молекула нуклеиновой кислоты, кодирующая полипептид, содержащий аминокислотную последовательность, которая является идентичной аминокислотной последовательности, выбранной из SEQ ID NO: 26-41, за исключением присутствия не более чем 5 аминокислотных замен; и молекула нуклеиновой кислоты, кодирующая полипептид, содержащий аминокислотную последовательность, которая является идентичной аминокислотной последовательности, выбранной из SEQ ID NO: 26-41, за исключением присутствия не более чем 2 аминокислотных замен.
Данное раскрытие также включает молекулы нуклеиновой кислоты, которые кодируют любой из CAR, описанных в данном документе (например, векторы, которые включают последовательность нуклеиновой кислоты, кодирующую один из CAR), и выделенные Т-лимфоциты, которые экспрессируют любой из CAR, описанных в данном документе.
Описанный в данном документе CAR может включать спейсерную область, расположенную между доменом связывания HER2 (например, scFv против HER2) и трансмембранным доменом. Можно использовать целый ряд разных спейсеров. Некоторые из них включают по меньшей мере часть человеческой области Fc, например, шарнирную часть человеческой области Fc или домен СН3, или их варианты. В Таблице 1 ниже приведены разные спейсеры, которые можно использовать в CAR, описанных в данном документе.


Некоторые спейсерные области включают всю шарнирную область иммуноглобулина (например, IgG1, IgG2, IgG3, IgG4) или ее часть, например, последовательность, которая попадает между доменами СН1 и СН2 иммуноглобулина, например, шарнирную область Fc IgG4 или шарнирную область CD8. Некоторые спейсерные области включают домен СН3 иммуноглобулина или и домен СН3, и домен СН2. Последовательности, происходящие от иммуноглобулина, могут включать одну или более чем одну модификацию аминокислот, например, 1, 2, 3, 4 или 5 замен, например, замены, которые уменьшают связывание вне мишени.
Термин «модификация аминокислот» относится к аминокислотной замене, вставке и/или делеции в последовательности белка или пептида. «Аминокислотная замена» или «замена» относится к замене аминокислоты в конкретном положении в последовательности родительского пептида или белка другой аминокислотой. Замену можно делать для изменения аминокислоты в полученном в результате белке неконсервативным образом (т.е. посредством замены кодона от аминокислоты, принадлежащей к группе аминокислот, имеющих конкретный размер или характеристику, до аминокислоты, принадлежащей к другой группе) или консервативным образом (т.е. посредством замены кодона от аминокислоты, принадлежащей к группе аминокислот, имеющих конкретный размер или характеристику, до аминокислоты, принадлежащей к той же самой группе). Такое консервативное изменение обычно приводит к меньшему изменению в структуре и функции образующегося белка. Следующее представляет собой примеры разных групп аминокислот: 1) аминокислоты с неполярными группами R: аланин, валин, лейцин, изолейцин, пролин, фенилаланин, триптофан, метионин; 2) аминокислоты с незаряженными полярными группами R: глицин, серин, треонин, цистеин, тирозин, аспарагин, глутамин; 3) аминокислоты с заряженными полярными группами R (отрицательно заряженными при рН 6,0): аспарагиновая кислота, глутаминовая кислота; 4) основные аминокислоты (положительно заряженные при рН 6,0): лизин, аргинин, гистидин (при рН 6,0). Другая группа может представлять собой те аминокислоты, которые имеют фенильные группы: фенилаланин, триптофан и тирозин.
В некоторых воплощениях спейсер происходит из IgG1, IgG2, IgG3 или IgG4 и включает один или более чем один аминокислотный остаток, замененный аминокислотным остатком, отличающимся от остатка, присутствующего в немодифицированном спейсере. Один или более чем один замененный аминокислотный остаток выбран из одного или более чем одного аминокислотного остатка в положениях 220, 226, 228, 229, 230, 233, 234, 235, 234, 237, 238, 239, 243, 247, 267, 268, 280, 290, 292, 297, 298, 299, 300, 305, 309, 218, 326, 330, 331, 332, 333, 334, 336, 339 или их комбинации, но не ограничивается ими. В данной схеме нумерации, описанной ниже более подробно, первая аминокислота в спейсере IgG4(L235E, N297Q) в Таблице 1 является 219-ой, и первая аминокислота в спейсере IgG4(HL-CH3) в Таблице 1 является 219-ой, также как и первая аминокислота в последовательности шарнира IgG и в последовательности шарнирного линкера (HL) IgG4 в Таблице 1.
В некоторых воплощениях модифицированный спейсер происходит из IgG1, IgG2, IgG3 или IgG4, который включает одну или более чем одну из следующих замен аминокислотных остатков: C220S, C226S, S228P, C229S, P230S, Е233Р, V234A, L234V, L234F, L234A, L235A, L235E, G236A, G237A, P238S, S239D, F243L, P247I, S267E, H268Q, S280H, K290S, K290E, K290N, R292P, N297A, N297Q, S298A, S298G, S298D, S298V, Т299А, Y300L, V305I, V309L, Е318А, K326A, K326W, K326E, L328F, A330L, A330S, A331S, P331S, I332E, Е333А, E333S, E333S, K334A, A339D, A339Q, P396L или их комбинацию, но не ограничивается ими.
В некоторых воплощениях модифицированный спейсер происходит из области IgG4, которая включает один или более чем один аминокислотный остаток, замененный аминокислотным остатком, отличным от аминокислотного остатка, присутствующего в немодифицированной области. Один или более чем один замененный аминокислотный остаток выбран из одного или более чем одного аминокислотного остатка в положениях 220, 226, 228, 229, 230, 233, 234, 235, 234, 237, 238, 239, 243, 247, 267, 268, 280, 290, 292, 297, 298, 299, 300, 305, 309, 218, 326, 330, 331, 332, 333, 334, 336, 339 или их комбинации, но не ограничивается ими.
В некоторых воплощениях модифицированный спейсер происходит из области IgG4, которая включает одну или более чем одну из следующих замен аминокислотных остатков: 220S, 226S, 228Р, 229S, 230S, 233Р, 234А, 234V, 234F, 234А, 235А, 235Е, 236А, 237А, 238S, 239D, 243L, 247I, 267Е, 268Q, 280Н, 290S, 290Е, 290N, 292Р, 297А, 297Q, 298А, 298G, 298D, 298V, 299А, 300L, 305I, 309L, 318А, 326А, 326W, 326Е, 328F, 330L, 330S, 331S, 331S, 332Е, 333А, 333S, 333S, 334А, 339D, 339Q, 396L или их комбинацию, но не ограничивается ими, где аминокислота в немодифицированном спейсере заменяется определенными выше аминокислотами в указанном положении.
Для положений аминокислот в иммуноглобулине, обсуждаемых в данном документе, нумерация осуществляется согласно индексу EU или схеме нумерации EU (Kabat et al. 1991 Sequences of Proteins of Immunological Interest, 5th Ed., United States Public Health Service, National Institutes of Health, Bethesda, тем самым целиком включена посредством ссылки). Индекс EU или индекс EU по Kabat или схема нумерации EU относится к нумерации антитела EU (Edelman et al. 1969 Proc Natl Acad Sci USA 63:78-85).
В CAR по изобретению можно использовать целый ряд трансмембранных доменов. Таблица 2 включает примеры подходящих трансмембранных доменов. При наличии спейсерного домена трансмембранный домен располагается ближе к карбоксильному концу относительно спейсерного домена.

Многие из CAR, описанных в данном документе, включают один или более чем один (например, два) костимулирующих домена. Костимулирующий(щие) домен(ны) располагается(ются) между трансмембранным доменом и доменом сигнализации CD3ζ. Таблица 3 включает примеры подходящих костимулирующих доменов, наряду с последовательностью домена сигнализации CD3ζ.


ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1 показана аминокислотная последовательность Her2scFv-IgG4(S228P,L235E,N297Q)-CD28tm-CD28gg-Zeta-T2A-CD19t (SEQ ID NO: 26). Разные домены перечисляются в порядке приведенной ниже последовательности и указываются чередованием подчеркивания и неподчеркивания. Последовательность зрелого CAR (SEQ ID NO: 34) не включает сигнальный пептид GMCSFRa (рецептор а гранулоцитарно-макрофагального колониестимулирующего фактора), последовательность перескакивания рибосомы Т2А или усеченный CD19. Также называемый HER2(EQ)28ζ на Фиг. 3А-8Д и в настоящем описании.
На Фиг. 2 показана аминокислотная последовательность Her2scFv-IgG4(S228P,L235E,N297Q)-CD8tm-41BB-Zeta-T2A-CD19t (SEQ ID NO: 27). Разные домены перечисляются в порядке приведенной ниже последовательности и указываются чередованием подчеркивания и неподчеркивания. Последовательность зрелого CAR (SEQ ID NO: 35) не включает сигнальный пептид GMCSFRa, последовательность перескакивания рибосомы Т2А или усеченный CD19. Также называемый HER2(EQ)BB£ на Фиг. 3А-8Д и в настоящем описании.
На Фиг. 3А-Г показаны конструкции HER2-специфичных CAR и данные по размножению Т-клеток с CAR.
На Фиг. 4А-Г показана характеризация in vitro Т-клеток с CAR против HER2 против линий клеток рака молочной железы.
На Фиг. 5А-5Е показан результат исследований по противоопухолевой активности Т-клеток с CAR против HER2 in vitro.
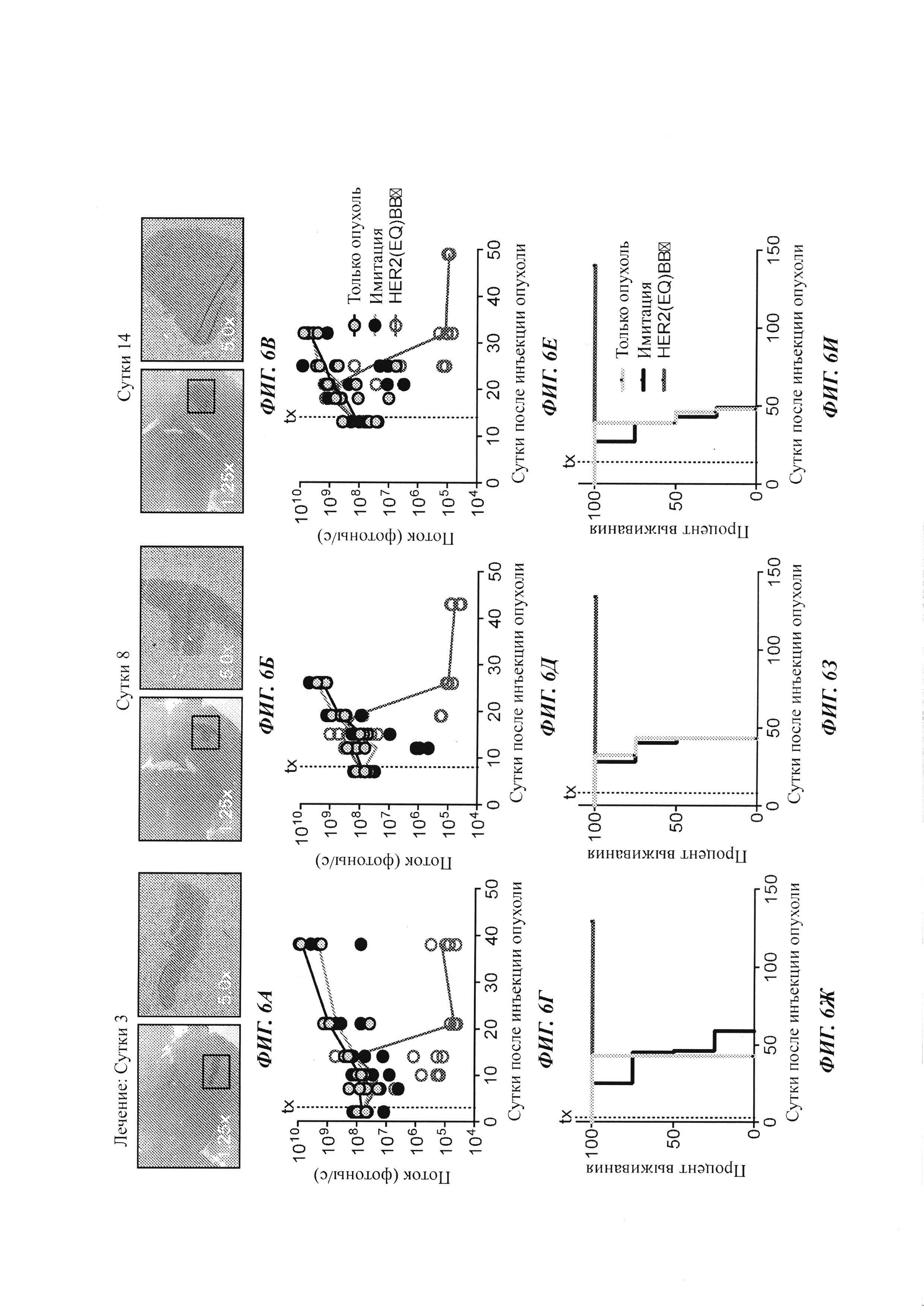
На Фиг. 6А-6И показан результат исследований по противоопухолевой эффективности in vivo доставляемых местно внутриопухолево Т-клеток с CAR против HER2.
На Фиг. 7А-7Г показаны результаты исследований по местной доставке Т-клеток с CAR против HER2 в человеческих ортотопичских моделях ксенотрансплантатов ВВМ.
На Фиг. 8А-8Д показаны результаты исследований по внутрижелудочковой доставке Т-клеток с CAR против HER2.
На Фиг. 9-14 показаны дополнительные CAR, нацеленные на HER2.
На Фиг. 9 представлена аминокислотная последовательность Her2scFv-CD8 шарнир-CD8tm-41BB-Zeta-T2A-CD19t (SEQ ID NO: 28). Разные домены перечисляются в порядке приведенной ниже последовательности и указываются чередованием подчеркивания и неподчеркивания. Последовательность зрелого CAR (SEQ ID NO: 36) не включает сигнальный пептид GMCSFRa, последовательность перескакивания рибосомы Т2А или усеченный CD19.
На Фиг. 10 представлена аминокислотная последовательность Her2scFv-IgG4 шарнир(S228P)-линкер-CD8tm-41BB-Zeta-T2A-CD19t (SEQ ID NO: 29). Разные домены перечисляются в порядке приведенной ниже последовательности и указываются чередованием подчеркивания и неподчеркивания. Последовательность зрелого CAR (SEQ ID NO: 37) не включает сигнальный пептид GMCSFRa, последовательность перескакивания рибосомы Т2А или усеченный CD19.
На Фиг. 11 представлена аминокислотная последовательность Her2scFv-IgG4(S228P)-линкер-IgG4 CH3-CD8tm-41BB-Zeta-T2A-CD19t (SEQ ID NO: 30). Разные домены перечисляются в порядке приведенной ниже последовательности и указываются чередованием подчеркивания и неподчеркивания. Последовательность зрелого CAR (SEQ ID NO: 38) не включает сигнальный пептид GMCSFRa, последовательность перескакивания рибосомы Т2А или усеченный CD19.
На Фиг. 12 представлена аминокислотная последовательность Her2scFv-IgG4(S228P)-линкер-IgG4 CH3-CD28tm-CD28gg-Zeta-T2A-CD19t (SEQ ID NO: 31). Разные домены перечисляются в порядке приведенной ниже последовательности и указываются чередованием подчеркивания и неподчеркивания. Последовательность зрелого CAR (SEQ ID NO: 39) не включает сигнальный пептид GMCSFRa, последовательность перескакивания рибосомы Т2А или усеченный CD19.
На Фиг. 13 представлена аминокислотная последовательность Her2scFv-линкер-CD28tm-CD28gg-Zeta-Т2А-CD19t (SEQ ID NO: 32). Разные домены перечисляются в порядке приведенной ниже последовательности и указываются чередованием подчеркивания и неподчеркивания. Последовательность зрелого CAR (SEQ ID NO: 40) не включает сигнальный пептид GMCSFRa, последовательность перескакивания рибосомы Т2А или усеченный CD19.
На Фиг. 14 представлена аминокислотная последовательность Her2scFv-линкер-CD8tm-41 ВВ-Zeta-Т2А-CD19t (SEQ ID NO: 33). Разные домены перечисляются в порядке приведенной ниже последовательности и указываются чередованием подчеркивания и неподчеркивания. Последовательность зрелого CAR (SEQ ID NO: 41) не включает сигнальный пептид GMCSFRa, последовательность перескакивания рибосомы Т2А или усеченный CD19.
На Фиг. 15А-15В показаны результаты исследований, характеризующих некоторые дополнительные CAR с разными спейсерами. IgG3(EQ) показан на Фиг. 2; ДельтаСh2 показан на Фиг. 11; CD8h показан на Фиг. 9; HL показан на Фиг. 10; и L показан на Фиг. 14.
На Фиг. 16А-16 В показаны результаты исследований, проверяющих CD107a и IFN-гамма (интерферон-гамма), продуцируемые при воздействии на ТСМ, экспрессирующие разные CAR, клеток, не экспрессирующих HER2 (MDA-MB-468), с низким уровнем HER2 (231BR), с низким уровнем HER2 (231BRHER2LO) или с высоким уровнем HER2 (231BRHER2HI).
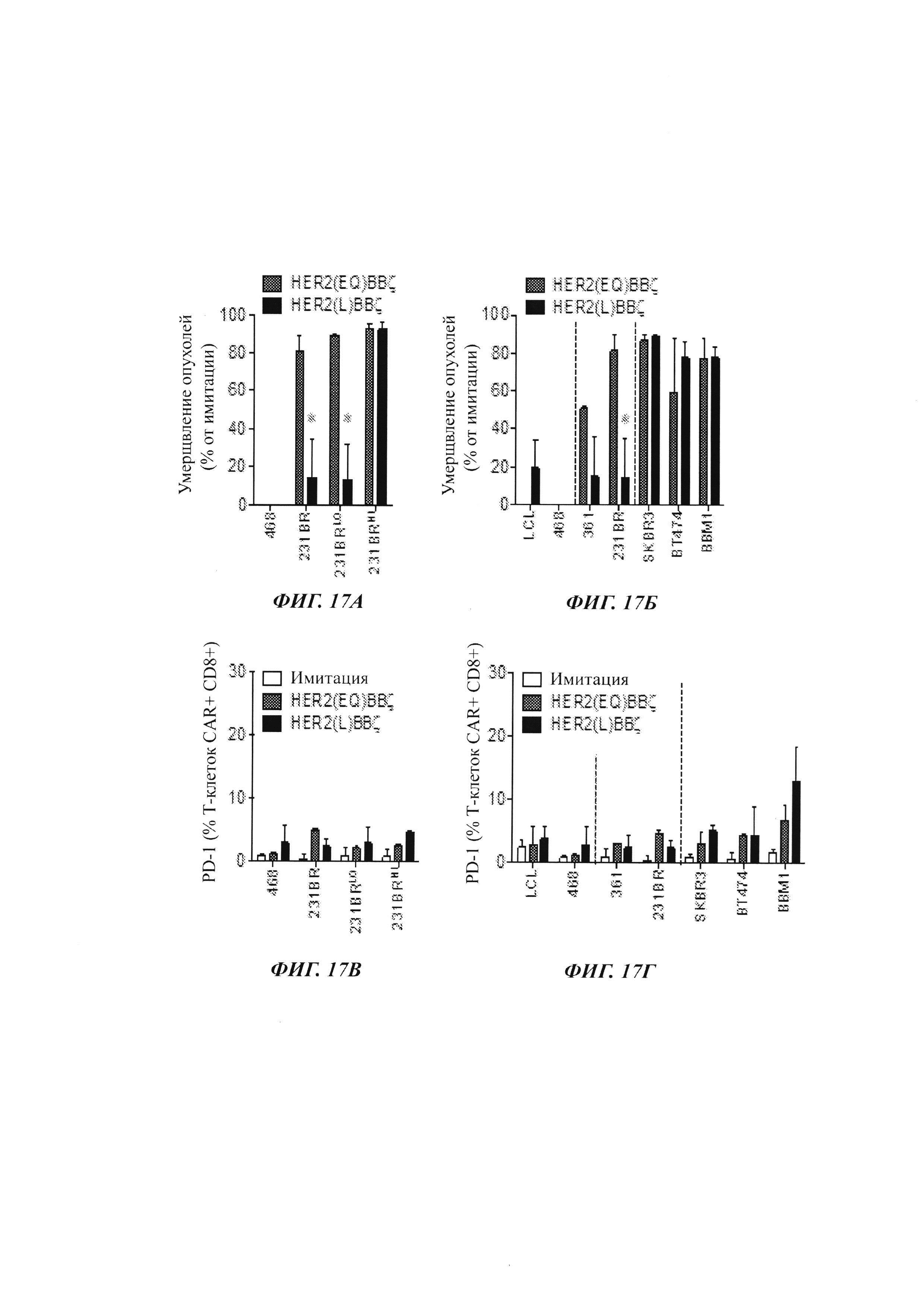
На Фиг. 17А-17Г показаны результаты исследований, проверяющих продукцию PD-1 и умерщвление опухолевых клеток в разных линиях клеток с CAR Фиг. 2 (HER2(EQ)BBζ) или Фиг. 14 (HER2(L)BBζ).
На Фиг. 18А-18Б показаны результаты исследований, проверяющих CD107a и IFN-гамма, продуцируемых при воздействии на TCM, экспрессирующие разные CAR, клеток, не экспрессирующих HER2 (MDA-MB-468), с низким уровнем HER2 (231BR), с низким уровнем HER2 (231BRHER2LO) или высоким уровнем HER2 (231BRHER2HI).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Ниже описаны структура, конструирование и характеризация разных химерных рецепторов антигена, нацеленных на HER2 и полезных в лечении рака молочной железы, экспрессирующего HER2, а также метастазов из молочной железы в мозг. Важно то, что CAR, описанный в данном документе, может использоваться в ACT для лечения опухолей в мозге, экспрессирующих HER2, посредством внутрижелудочковой или внутриопухолевой доставки.
Химерный рецептор антигена (CAR) представляет собой рекомбинантную биомолекулу, которая содержит, как минимум, внеклеточный домен распознавания, трансмембранную область и внутриклеточный домен сигнализации. Термин «антиген», следовательно, не ограничивается молекулами, которые связываются антителами, но относится к любой молекуле, которая может специфично связываться с мишенью. Например, CAR может включать лиганд, который специфично связывается с рецептором поверхности клетки. Внеклеточный домен распознавания (также именуемый внеклеточным доменом или просто элементом распознавания, который он содержит) содержит элемент распознавания, который специфично связывается с молекулой, присутствующей на клеточной поверхности клетки-мишени. Трансмембранная область заякоривает CAR в мембране. Внутриклеточный домен сигнализации содержит домен сигнализации из зета цепи человеческого комплекса CD3 и, возможно, содержит один или более чем один костимулирующий домен сигнализации. CAR могут и связываться с антигеном, и трансдуцировать активацию Т-клеток, независимо от ограничения МНС (главный комплекс гистосовместимости). Таким образом, CAR представляют собой «универсальные» иммунорецепторы, которые могут лечить популяцию пациентов с антигенпозитивными опухолями, независимо от их генотипа HLA (человеческий лейкоцитарный антиген). Адоптивная иммунотерапия с использованием Т-лимфоцитов, которые экспрессируют опухолеспецифичные CAR, может быть мощной терапевтической стратегией для лечения рака.
В некоторых случаях CAR, описанные в данном документе, могут быть продуцированы с использованием вектора, в котором после открытой рамки считывания CAR следует последовательность перескакивания рибосомы Т2А и усеченный CD19 (CD19t), у которого отсутствует цитоплазматический сигнализирующий хвост (усеченная аминокислота 323). При данной организации коэкспрессия CD19t дает инертный неиммуногенный поверхностный маркер, который обеспечивает точное измерение генномодифицированных клеток и делает возможной позитивную селекцию генномодифицированных клеток, а также эффективное отслеживание клеток и/или визуализацию терапевтических Т-клеток in vivo после адоптивного переноса. Коэкспрессия CD19t дает маркер для иммунологического нацеливания на трансдуцированные клетки in vivo с использованием клинически доступных антител и/или реактивов на основе иммунотоксина для избирательного устранения терапевтических клеток и функционирования, посредством этого, в качестве суицидного переключателя.
CAR, описанный в данном документе, может быть получен посредством любых способов, известных в данной области, хотя предпочтительно его получают с использованием методик генной инженерии. Нуклеиновые кислоты, кодирующие несколько областей химерного рецептора, могут быть получены и собраны в полную кодирующую последовательность посредством стандартных методик молекулярного клонирования, известных в данной области (скрининг геномных библиотек, ПЦР, лигирование с помощью праймера, сайтнаправленный мутагенез и т.д.), которые являются удобными. Образующуюся кодирующую область предпочтительно вставляют в экспрессионный вектор и используют для трансформации подходящей экспрессионной линии клеток-хозяев, предпочтительно линии клеток Т-лимфоцитов и, наиболее предпочтительно, аутологической линии клеток Т-лимфоцитов.
Вектором для экспрессии CAR могут быть трансдуцированы разные поднаборы Т-клеток, выделенных из пациента, включая не подвергавшиеся селекции РВМС или Т-клетки, обогащенные CD3, или обогащенные CD3, или поднаборы Т-клеток памяти, или ТСМ, или TCM/SCM/N. Центральные Т-клетки памяти являются одним полезным поднабором Т-клеток. Центральные Т-клетки памяти могут быть выделены из одноядерных клеток периферической крови (РВМС) посредством обогащения в отношении клеток CD45RO+/CD62L+ с использованием, например, прибора CliniMACS® для иммуномагнитной селекции клеток, экспрессирующих желательные рецепторы. Клетки, обогащенные центральными Т-клетками памяти, можно активировать антителами против CD3/CD28, трансдуцировать, например, лентивирусным вектором SIN, который управляет экспрессией CAR, а также усеченным человеческим CD19 (CD19t) - неиммуногенным поверхностным маркером как для выявления in vivo, так и для потенциальной селекции ex vivo. Активированные/генетически модифицированные центральные Т-клетки памяти можно размножать in vitro с использованием IL-2/IL-15 и затем криоконсервировать.
Пример 1: структура двух CAR против HER2
Один CAR, содержащий scFv против HER2, описанный в данном документе, называется Her2scFv-IgG4(L235E, N297Q)-CD28tm-CD28gg-Zeta-T2A-CD19t. Данный CAR включает целый ряд важных элементов, включающих: scFv, нацеленный на HER2; область Fc IgG4, которая мутирована в двух сайтах в пределах области СН2 (L235E; N292Q) способом, который уменьшает связывание с рецепторами Fc (FcR); трансмембранный домен CD28, костимулирующий домен CD28 и домен антивации CD3ζ. На Фиг. 1 представлена аминокислотная последовательность данного CAR, включающая последовательность усеченного CD19, используемого для мониторинга экспресии CAR, и последовательность перескакивания рибосомы Т2А, которая обеспечивает продукцию CAR без слияния с последовательностью усеченного CD19. Как показано на Фиг. 2, незрелый CAR включает: сигнальный пептид GMCSFR, scFv против HER2, IgG4, который работает в качестве спейсера, трансмембранный домен CD8, костимулирующий домен 4-1ВВ, который включает изменение последовательности от LL до GG, последовательность из трех Gly, стимулирующий домен CD3 Зета. Данный транскрипт также кодирует последовательность перескакивания рибосомы Т2А и последовательность усеченного CD19, которые не являются частью последовательности белка CAR. Зрелый CAR является идентичным незрелому CAR, но не имеет сигнального пептида GMCSF.
Пример 2: конструирование и структура epHIV7, используемого для экспрессии HER2-специфичного CAR Т-клеток
Вектор epHIV7 представляет собой вектор, который можно использовать для экспрессии HER2-специфичного CAR. Его получали из вектора pHIV7. Важно то, что в данном векторе для управления экспрессией CAR используется человеческий промотор EF1. И 5'-, и 3'-последовательности данного вектора были получены из pv653RSN, который был ранее получен из провируса НХВс2. Вытесняемые последовательности полиуринового тракта ДНК (сРРТ) были получены из штамма pNL4-3 ВИЧ-I (вирус иммунодефицита человека-I) из репозитория реактивов NIH AIDS (Национальный институт здравоохранения по СПИД). Последовательность посттранскрипционного регуляторного элемента лесного сурка (WPRE) была описана ранее.
Конструирование pHIV7 проводили следующим образом. Вкратце, pv653RSN, содержащую 653 п.о. из gag-pol плюс 5'- и 3'-длинные концевые повторы (LTR) с расположенным между ними геном SL3-неомицинфосфотрансферазы (Neo), субклонировали в pBluescript следующим образом: на стадии 1 из последовательностей от 5' LTR до элемента, отвечающего на rev (RRE), делали р5' HIV-I 5l, и затем 5' LTR модифицировали посредством удаления последовательностей выше TATA бокса и лигировали сначала с энхансером CMV (цитомегаловирус) и затем с репликатором SV40 (p5'HIV-2). На стадии 2 после клонирования 3'LTR в pBluescript с получением p3'HIV-1 делали делецию 400 п.о. в 3'LTR энхансере/промоторе для удаления цис-регуляторных элементов в U3 HIV и образования p3'HIV-2. На стадии 3 фрагменты, выделенные из p5'HIV-3 и p3'HIV-2, лигировали с получением pHIV-3. На стадии 4 p3'HIV-2 дополнительно модифицировали посредством удаления дополнительных расположенных выше последовательностей HIV с получением p3'HIV-3, и фрагмент из 600 п.о. BamHI-SaIl, содержащий WPRE, добавляли к p3'HIV-3 с получением p3'HIV-4. На стадии 5 уменьшали размер RRE pHIV-3 посредством ПЦР и лигировали с 5' фрагментом из pHIV-3 (не показан) и с p3'HIV-4 с получением pHIV-6. На Стадии 6 фрагмент BgIII-BamHI из 190 п.о., содержащий вытесняемую последовательность ДНК сРРТ из pNL4-3 HIV-1 (55), амплифицировали из pNL4-3 и помещали между последовательностями RRE и WPRE в pHIV6 с получением pHIV-7. Данную родительскую плазмиду - pHIV7-GFP (GFP - зеленый флуоресцентный белок) использовали для упаковки родительского вектора с использованием четырехплазмидной системы.
Упаковочный сигнал - пси (ψ) - требуется для эффективной упаковки вирусного генома в вектор. RRE и WPRE усиливают транспорт РНК-транскрипта и экспрессию трансгена. Было продемонстрировано то, что вытесняемая последовательность в комбинации с WPRE усиливает эффективность трансдукции лентивирусного вектора в клетках млекопитающих.
Хелперные функции, требующиеся для продукции вирусного вектора, разделяются на три отдельные плазмиды для уменьшения вероятности образования компетентного к репликации лентивируса посредством рекомбинации: 1) pCgp кодирует белок gag/pol, требующийся для сборки вирусного вектора; 2) pCMV-Rev2 кодирует белок Rev, который действует на последовательность RRE для помощи в транспортировке вирусного генома для эффективной упаковки; и 3) pCMV-G кодирует гликопротеин вируса везикулостоматита (VSV), который требуется для инфективности вирусного вектора.
Имеется минимальная гомология последовательности ДНК между геномом вектора, кодируемого pHIV7, и хелперными плазмидами. Области гомологии включают область упаковочного сигнала из приблизительно 600 нуклеотидов, расположенную в последовательности gag/pol хелперной плазмиды pCgp; последовательность промотора CMV во всех трех хелперных плазмидах и последовательность RRE в хелперной плазмиде pCgp. Весьма маловероятно то, что из-за гомологии в данных областях мог бы быть генерирован компетентный к репликации рекомбинантный вирус, так как это потребовало бы многочисленных событий рекомбинации. Кроме того, у любых образующихся рекомбинантов отсутствовали бы функциональные последовательности LTR и tat, требующиеся для лентивирусной репликации.
Промотор CMV был заменен промотором EF1α-HTLV (EF1p), и новая плазмида была названа epHIV7. EF1р имел 563 п.о. и был введен в epHIV7 с использованием NruI и NheI, затем промотор CMV был вырезан.
Из данной системы был удален лентивирусный геном, исключая gag/pol и rev, которые необходимы для патогенности вируса дикого типа и требуются для продуктивной инфекции клеток-мишеней. Кроме того, конструкция вектора не содержит интактного промотора 3'LTR, таким образом, полученная в результате экспрессируемая и обратно транскрибированная ДНК провирусного генома в клетках-мишенях будет иметь неактивные LTR. В результате данной конструкции последовательности, происходящие из ВИЧ-1, не будут транскрибироваться из провируса, и только терапевтические последовательности будут экспрессироваться от соответствующих им промоторов. Ожидается то, что удаление промоторной активности LTR в векторе SIN значительно уменьшает возможность непреднамеренной активации генов хозяина.
Пример 3: получение векторов для трансдукции Т-клеток пациента
Векторы для трансдукции Т-клеток пациента могут быль получены следующим образом. Для каждой плазмиды, экспрессирующей CAR и, возможно, маркер, такой как усеченный CD19; 2) pCgp; 3) pCMV-G и 4) pCMV-Rev2), получают семенной банк, который используется для инокуляции ферментера с получением достаточных количеств плазмидной ДНК. Данную плазмидную ДНК тестировали на идентичность, стерильность и присутствие эндотоксина перед ее применением в производстве лентивирусного вектора.
Вкратце, клетки размножают от рабочей клетки 293Т (WCB), которая была протестирована для подтверждения стерильности и отсутствия вирусного загрязнения. Сосуд с клетками 293Т от WCB 293Т оттаивают. Клетки выращивают и размножают до наличия достаточного числа клеток для посева в подходящее число 10-слойных клеточных фабрик (CF) для продукции вектора и поддержания линии клеток. Для продукции можно использовать одну линию клеток.
Лентивирусный вектор продуцируется в подпартиях из вплоть до 10 CF. Две подпартии можно продуцировать в ту же самую неделю, приводя к продукции приблизительно 20 л лентивирусного супернатанта/неделю. Материал, продуцированный из всех подпартий, объединяют на протяжении последующей фазы переработки для того, чтобы произвести одну партию продукта. Клетки 293Т высевают в CF в среду 293Т (DMEM (среда Игла, модифицированная по Дульбекко) с 10% FBS (фетальная телячья сыворотка)). Фабрики помещают в инкубатор при 37°С и горизонтально выравнивают для получения равномерного распределения клеток на всех слоях CF. Через двое суток клетки трансфицируют четырьмя лентивирусными плазмидами, описанными выше, с использованием способа с CaPO4, который включает смесь Tris:EDTA (этилендиаминтетрауксусная кислота), 2 М CaCl2, 2× HBS (человеческий сывороточный альбумин) и четырех ДНК плазмид. В сутки 3 после трансфекции супернатант, содержащий секретированные лентивирусные векторы, отбирают, очищают и концентрируют. После удаления супернатанта из CF из каждой CF отбирают клетки конца продуцирования. Клетки из каждой фабрики трипсинизируют и отбирают центрифугированием. Клетки ресуспендируют в среде для замораживания и криоконсервируют. Данные клетки позднее используют для тестирования на лентивирус, компетентный в отношении репликации (RCL).
Для очистки и приготовления векторов в виде препарата неочищенный супернатант осветляют мембранной фильтрацией для удаления клеточных обломков. ДНК клетки-хозяина и остаточную плазмидную ДНК деградируют посредством расщепления эндонуклеазой (Бензоназа®). Вирусный супернатант осветляют от клеточных обломков с использованием 0,45 мкм фильтра. Осветленный супернатант отбирают в предварительно взвешенный контейнер, в который добавляют Бензоназу® (конечная концентрация 50 U/мл). Эндонуклеазное расщепление остаточной плазмидной ДНК и геномной ДНК хозяина проводится при 37°С в течение 6 ч. Для удаления остаточных низкомолекулярных компонентов из неочищенного супернатанта используется исходное концентрирование супернатанта, обработанного эндонуклеазой, посредством ультрафильтрации с тангенциальным потоком (TFF), концентрируя вирус в ~20 раз. Осветленный, обработанный эндонуклеазой вирусный супернатант циркулирует через картридж с полыми волокнами с NMWCO (номинальный порог отсечения молекулярной массы) 500 кДа при скорости тока, подобранной для поддержания скорости сдвига ~4000 с-1 или меньше при максимизации скорости потока. Во время процесса концентрирования запускают диафильтрацию супернатанта, обработанного нуклеазой, для поддержания эффективности картриджа. С использованием 4%-ной лактозы в PBS (фосфатно-солевой буферный раствор) в качестве диафильтрационного буфера устанавливается скорость замены пермеата 80%. Вирусный супернатант доводится до целевого объема, представляющего 20-кратное концентрирование неочищенного супернатанта, и диафильтрацию продолжают в течение 4 дополнительных смен объема со скоростью замены пермеата 100%.
Дальнейшее концентрирование вирусного продукта осуществляется с применением методики высокоскоростного центрифугирования. Каждую подпартию лентивируса осаждают с использованием центрифуги Sorvall RC-26 plus при 6000 об./мин (6088 RCF (относительная сила центрифугирования) при 6°С в течение 16-20 ч. Вирусный осадок из каждой подпартии затем растворяют в 50 мл объеме 4%-ной лактозы в PBS. Растворенный осадок в данном буфере представляет собой конечную композицию вирусного препарата. Весь процесс концентрирования вектора приводит приблизительно к 200-кратному уменьшению объема. После завершения получения всех подпартий материал затем помещают при -80°С, при тестировании образцов из каждой подпартии на стерильность. После подтверждения стерильности образца подпартии быстро оттаивают при 37°С с частым встряхиванием. Материал затем объединяют и вручную аликвотируют в боксе биологической безопасности Класса II Типа А/В3. Используется конфигурация заполнения 1 мл концентрированного лентивируса в стерильных криососудах класса 6 USP (Фармакопея США) с наружной резьбой и О-кольцом.
Для обеспечения чистоты препарата лентивирусного вектора его тестируют на остаточные загрязнения ДНК хозяина и перенос остаточной ДНК хозяина и плазмид. Наряду с другими тестами идентичность вектора оценивается посредством ПЦР-ОТ (полимеразная цепная реакция, сопряженная с обратной транскрипцией) для обеспечения того, что присутствует правильный вектор.
Пример 4: получение Т-клеток, подходящих для применения в ACT
Если ТСМ подлежат применению для экспрессии CAR, подходящие клетки пациента могут быть получены следующим образом. Во-первых, Т-лимфоциты получают от пациента посредством лейкафереза, и подходящий под набор аллогенных или аутологических Т-клеток, например, центральных Т-клеток памяти (ТСМ) генетически изменяется для экспрессии CAR, затем вводится обратно пациенту посредством любых клинически приемлемых способов для достижения противораковой терапии.
Подходящие ТСМ могут быть получены следующим образом. Продукты афереза, полученные от участников исследования, подписавших информированное согласие, разделяют на фиколе, промывают и инкубируют в течение ночи. Клетки затем обедняют в отношении популяций моноцитов, регуляторных Т-клеток и наивных Т-клеток с использованием реактивов против CD14, против CD25 и против CD45RA уровня качества GMP (надлежащая медицинская практика) (Miltenyi Biotec) и прибора для разделения CliniMACS™. После обеднения негативная фракция клеток обогащается в отношении клеток ТСМCD62L+ с использованием DREG56-биотина (клинический уровень качества СОН (City of Норе)) и микрошариков против биотина (Miltenyi Biotec) на приборе для разделения CliniMACS™.
После обогащения клетки ТСМ готовят в полной X-Vivo15 плюс 50 IU (международные единицы)/мл IL-2 и 0,5 нг/мл IL-15 и переносят в тефлоновый мешок для культуры клеток, где они стимулируются шариками Dynal ClinEx™ Vivo CD3/CD28. Вплоть до пяти суток после стимуляции клетки трансдуцируются лентивирусным вектором, экспрессирующим желательный CAR, при множественности заражения (MOI) от 1,0 до 0,3. Культуры поддерживаются в течение вплоть до 42 суток с добавлением полной X-Vivo15 и цитокинов IL-2 и IL-15, как требуется для размножения клеток (поддерживая плотность клеток от 3×105до 2×106 жизнеспособных клеток/мл и осуществляя дополнение цитокинами каждый понедельник, среду и пятницу культивирования). При данных условиях клетки типично размножаются до приблизительно 109 клеток в пределах 21 суток. В конце периода культивирования клетки отбирают, дважды промывают и готовят в виде препарата в криоконсервирующей среде клинического уровня качества (Cryostore CS5, BioLife Solutions).
В сутки инфузии Т-клеток криоконсервированный и выпущенный продукт оттаивают, промывают и готовят в виде препарата для повторной инфузии. Криоконсервированные сосуды, содержащие выпущенный клеточный продукт, удаляют из хранилища с жидким азотом, оттаивают, охлаждают и промывают промывочным буфером на основе PBS/2% человеческого сывороточного альбумина (HSA). После центрифугирования супернатант удаляют, и клетки ресуспендируют в инфузионном разбавителе на основе нормального физиологического раствора, не содержащего консервантов (PFNS)/2% HSA. Образцы удаляют для контроля качества.
Пример 5: экспрессия CAR, нацеленного на HER2
Фиг. 3А представляет собой схематическую диаграмму двух HER2-специфичных конструкций CAR, показанных на Фиг. 1 и Фиг. 2. В HER2(EQ)28ζ scFv связывается с мембраной модифицированным линкером на основе Fc IgG4 (двойной мутант, L235E; N297Q), содержит трансмембранный домен CD28, внутриклеточный костимулирующий домен CD28 и цитолитический домен CD3ζ. Последовательность перескакивания рибосомы Т2А отделяет CAR от усеченного белка CD19 (CD19t), используемого для отслеживания клеток. HER2(EQ)BBζ является аналогичным, за исключением того, что костимулирующим доменом является 4-1 ВВ, а не CD28, и трансмембранный домен представляет собой трансмембранный домен CD8, а не трансмембранный домен CD28. Человеческие центральные Т-клетки памяти (ТСМ) трансфицировали лентивирусным вектором, экспрессирующим либо HER2(EQ)28ζ, либо HER2(EQ)BBζ. На Фиг. 3Б показаны репрезентативные данные FACS (флуоресцентная сортировка клеток) фенотипа поверхности человеческих ТСМ. На Фиг. 3В показаны результаты анализов на экспрессию CD19 и белка L в ТСМ, трансфицированных лентивирусным вектором, экспрессирующим либо HER2(EQ)28ζ, либо HER2(EQ)BBζ. Как можно видеть из данных результатов, эффективность трансфекции, оцениваемая по экспрессии CD19, была аналогичной для обоих CAR. Однако экспрессия белка L была ниже для HER2(EQ)BBζ, чем для HER2(EQ)28ζ, свидетельствуя о том, что CAR HER2(EQ)BBζ является менее стабильным, чем HER2(EQ)BBζ. Анализ размножения клеток (Фиг. 3Г) показывает то, что ни один из CAR не препятствует размножению Т-клеток.
Пример 6: характеризация in vitro Т-клеток с CAR против HER2 относительно разных линий клеток рака молочной железы
Для характеризации HER2(EQ)28ζ и HER2(EQ)BBζ использовали целый ряд линий клеток рака молочной железы, включающих HER2-негативные линии (лимфома LCL, MDA-MB-468, глиома U87), линии с низкой экспрессией HER2 (MDA-MB-361, 231BR) и линии с высокой экспрессией HER2 (SKBR3, ВТ474, ВВМ1). На Фиг. 4А показан уровень экспрессии HER2 каждой из этих линий. Для характеризации дегранулирования CD107a и продукции IFNγ использовали проточную цитометрию (сортирующую Т-клетки CAR+) на Т-клетках имитации (нетрансдуцированные), с CAR HER2(EQ)28ζ или HER2(EQ)BBζ после 5 ч сокультивирования либо с опухолевыми клетками MDA-MB-361 (с низкой экспрессией HER2), либо с опухолевыми клетками ВВМ1 (с высокой экспрессией HER2). Результаты данного анализа представлены на Фиг. 4Б. Аналогичные исследования проводили с другими линиями клеток рака молочной железы, и результаты обобщаются на Фиг. 4В. Продукцию IFNγ Т-клетками с CAR против HER2 после 24 ч культивирования с рекомбинантным белком HER2 или опухолями-мишенями измеряли ELISA (твердофазный иммуноферментный анализ), и результаты данного анализа показаны на Фиг. 4Г.
Пример 7: противоопухолевая активность in vitro
Проточную цитометрию использовали для оценки умерщвления опухолевых клеток после 72 ч сокультивирования Т-клеток имитации (нетрансдуцированные), с CAR HER2(EQ)28ζ или HER2(EQ)BBζ с опухолями-мишенями. Результаты данного анализа представлены на Фиг. 5А. Измеряли индукцию PD-1 и LAG-3 в общем пуле Т-клеток с CAR после 72 ч сокультивирования с HER2-негативными MDA-MB-468 или HER2-позитивными клетками ВВМ1, и результаты данного анализа представлены на Фиг. 5Б. Измеряли индукцию PD-1 в Т-клетках с CAR CD8+ после 72 ч сокультивирования с опухолями-мишенями, которые являются HER2-негативными (лимфома LCL, MDA-MB-468, глиома U87), с низкой экспрессией HER2 (MDA-MB-361, 231 BR) или с высокой экспрессией HER2 (SKBR3, ВТ474, ВВМ1), и результаты данного анализа представлены на Фиг. 5В. Данные исследования свидетельствуют о том, что HER2(EQ)BBζ вызывает меньшую индукцию PD-1, чем HER2(EQ)28ζ. Измеряли умерщвление опухолевых клеток при отношении эффектор : опухоль (Е:Т), варьирующем от 0,25:1 до 2:1 и для Т-клеток с CAR HER2(EQ)28ζ, и с CAR HER2(EQ)BBζ. Результаты данного анализа представлены на Фиг. 5Г, которая показывает то, что и HER2(EQ)28ζ, и HER2(EQ)BBζ являются эффективными в умерщвлении опухолевых клеток in vitro. Оцениваемую посредством CFSE (сукцинимидиловый эфир карбоксифлуоресцеина) пролиферацию Т-клеток с CAR против HER2 измеряли проточной цитометрией после 72 ч сокультивирования с клетками MDA-MB-468 или ВВМ1. Результаты данного анализа представлены на Фиг. 5Д, которая показывает то, что Т-клетки с CAR HER2(EQ)BBζ пролиферируют более активно, чем Т-клетки с CAR HER2(EQ)2ζ.
Пример 8: противоопухолевая активность in vivo
Активность доставленных внутриопухолево Т-клеток с CAR против HER2 оценивали в полученной от пациента модели метастазов из молочной железы в мозг. Фиг. 6А-6В представляют собой окрашивание опухолей Н&Е (гематоксилин и эозин). Мышей обрабатывали инъекцией непосредственно в опухоль Т-клеток имитации (нетрансдуцированных) или с CAR HER2(EQ)BBζ. На Фиг. 6Г-6Е показаны результаты оптической визуализации опухолей, а на Фиг. 6Ж-6И - кривые выживания Каплана-Мейера для мышей, местно обработанных в сутки 3, либо 8, либо 14 после инъекции опухоли. Данные исследования показывают то, что Т-клетки с CAR HER2(EQ)BBζ имеют мощную противоопухолевую эффективность in vivo при инъецировании непосредственно в опухоль.
Для оценки противоопухолевой эффективности в моделях человеческих ксенотрансплантатов метастазов из молочной железы в мозг клетки ВВМ1 (0,2 М) или ВТ474 (0,15 М) вводили внутричерепной инъекцией мышам NSG. В сутки 8 после инъекции опухоли внутриопухолево инъецировали Т-клетки имитации (нетрансдуцированные) (IM), с HER2(EQ)28ζ или с HER2(EQ)BBζ. Опухоли ВВМ1 (Фиг. 7А) и ВТ474 (Фиг. 7Б) отслеживали посредством оптической визуализации на основе люциферазы. Кривые Каплана-Мейера представлены на Фиг. 7В и Фиг. 7Г.
Для оценки Т-клеток с CAR HER2(EQ)28ζ и HER2(EQ)BBζ также использовали происходящую от человеческого пациента ортотопическую модель ксенотрансплантата метастазов из молочной железы в мозг. На Фиг. 8А проиллюстрирована область имплантации опухоли посредством стереотаксической инъекции клеток ВВМ1 (0,2 М) и внутрижелудочковой доставки Т-клеток. Окрашивание опухолей показано на Фиг. 8Б. В сутки 14 после инъекции опухоли внутриопухолево инъецировали Т-клетки (0,5 М) с HER2(EQ)28ζ, HER2(EQ)BBζ или Т-клетки имитации (нетрансдуцированные). Рост опухоли отслеживали посредством оптической визуализации на основе люциферазы. На Фиг. 8В показаны средние значения потока для каждой группы обработки, и на Фиг. 8Г представлена кривая выживания Каплана-Мейера для каждой группы обработки.
Пример 9: дополнительные CAR, нацеленные на HER2
На Фиг. 9-14 показаны аминокислотные последовательности разных CAR, имеющих разные линкеры. В частности, данные CAR отличаются по последовательности и длине части между scFv, нацеленным на HER2, и трансмембранным доменом. Трансмембранный домен представляет собой CD8, CD28 или CD28gg. Костимулирующий домен представляет собой 4-1 ВВ или CD28. Все имеют стимулирующий домен CD3ζ. В каждом случае последовательность перескакивания рибосомы Т2А отделяет CAR от усеченного белка CD19 (CD19t), используемого для отслеживания клетки.
На Фиг. 15А схематически показаны разные CAR против HER2, которые являются идентичными, за исключением последовательности и длины части между scFv против HER2 и трансмембранным доменом CD8. Все включают костимулирующий домен 4-1ВВ, с последующим стимулирующим доменом CD3ζ. На Фиг. 15Б показаны результаты анализов на экспрессию CD19 и белка L в TCM, трансфицированных лентивирусным вектором, экспрессирующим указанный CAR. Как можно видеть из данных результатов, эффективность трансфекции при оценке по экспрессии CD19 была аналогичной для обоих CAR. Однако экспрессия белка L была меньше для HER2(EQ)BBζ, чем для HER2(EQ)28ζ, свидетельствуя о том, что CAR HER2(EQ)BBζ является менее стабильным, чем HER2(EQ)BBζ. Анализ размножения клеток (Фиг. 15В) показывает то, что ни один из CAR не препятствует размножению Т-клеток. На Фиг. 16-18 показаны результаты дополнительных исследований, демонстрирующих то, что CAR с очень коротким спейсером (Фиг. 14) является относительно селективным в отношении клеток, экспрессирующих высокие уровни HER2. Такие CAR могут быть полезными в лечении раковых заболеваний, экспрессирующих HER, где желательно сохранять клетки, экспрессирующий более низкий уровень HER2, чем раковые клетки.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ПРАЙСМЕН, Сол Дж.
ФОРМЭН, Стивен Дж.
БРАУН, Кристин Е.
<120> Химерные рецепторы антигена, нацеленные на HER2
<130> 40056-0021WO1
<140> US 15/773,754
<141> 2018-05-04
<150> PCT/US2016/060724
<151> 2016-11-04
<150> US 62/251,052
<151> 2015-11-04
<160> 42
<170> PatentIn version 3.5
<210> 1
<211> 245
<212> ПРТ
<213> Homo sapiens
<220>
<221> ВАРИАНТ
<222> (1)..(245)
<223> scEv, нацеленный на HER2
<400> 1
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Ser Thr Ser Gly
100 105 110
Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Glu Val Gln
115 120 125
Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg
130 135 140
Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His
145 150 155 160
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile
165 170 175
Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg
180 185 190
Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met
195 200 205
Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp
210 215 220
Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu
225 230 235 240
Val Thr Val Ser Ser
245
<210> 2
<211> 10
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Линкер
<400> 2
Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly
1 5 10
<210> 3
<211> 12
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутировавшая шарнирная область IgG4
<400> 3
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro
1 5 10
<210> 4
<211> 12
<212> ПРТ
<213> Homo sapiens
<220>
<221> ВАРИАНТ
<222> (1)..(12)
<400> 4
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro
1 5 10
<210> 5
<211> 22
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутировавшие шарнирная область и линкер химерного IgG4
<400> 5
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Gly Gly Gly Ser
1 5 10 15
Ser Gly Gly Gly Ser Gly
20
<210> 6
<211> 39
<212> ПРТ
<213> Homo sapiens
<400> 6
Ile Glu Val Met Tyr Pro Pro Pro Tyr Leu Asp Asn Glu Lys Ser Asn
1 5 10 15
Gly Thr Ile Ile His Val Lys Gly Lys His Leu Cys Pro Ser Pro Leu
20 25 30
Phe Pro Gly Pro Ser Lys Pro
35
<210> 7
<211> 48
<212> ПРТ
<213> Homo sapiens
<400> 7
Ala Lys Pro Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro
1 5 10 15
Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro
20 25 30
Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
35 40 45
<210> 8
<211> 45
<212> ПРТ
<213> Homo sapiens
<400> 8
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
35 40 45
<210> 9
<211> 129
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> шарнирная область химерного IgG4 +
<400> 9
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Gly Gly Gly Ser
1 5 10 15
Ser Gly Gly Gly Ser Gly Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
20 25 30
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
35 40 45
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
50 55 60
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
65 70 75 80
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
85 90 95
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
100 105 110
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
115 120 125
Lys
<210> 10
<211> 228
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутировавший IgG4
<400> 10
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe
1 5 10 15
Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Ser Thr
65 70 75 80
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
85 90 95
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser
100 105 110
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
115 120 125
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
130 135 140
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
145 150 155 160
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
165 170 175
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
180 185 190
Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
195 200 205
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
210 215 220
Ser Leu Gly Lys
225
<210> 11
<211> 229
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутировавший IgG4
<400> 11
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Gln Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 12
<211> 107
<212> ПРТ
<213> Homo sapiens
<400> 12
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu
1 5 10 15
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
20 25 30
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
35 40 45
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
50 55 60
Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly
65 70 75 80
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
85 90 95
Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
100 105
<210> 13
<211> 21
<212> ПРТ
<213> Homo sapiens
<400> 13
Leu Cys Tyr Leu Leu Asp Gly Ile Leu Phe Ile Tyr Gly Val Ile Leu
1 5 10 15
Thr Ala Leu Phe Leu
20
<210> 14
<211> 27
<212> ПРТ
<213> Homo sapiens
<400> 14
Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu
1 5 10 15
Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val
20 25
<210> 15
<211> 28
<212> ПРТ
<213> Homo sapiens
<400> 15
Met Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser
1 5 10 15
Leu Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val
20 25
<210> 16
<211> 22
<212> ПРТ
<213> Homo sapiens
<400> 16
Met Ala Leu Ile Val Leu Gly Gly Val Ala Gly Leu Leu Leu Phe Ile
1 5 10 15
Gly Leu Gly Ile Phe Phe
20
<210> 17
<211> 21
<212> ПРТ
<213> Homo sapiens
<400> 17
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
1 5 10 15
Ser Leu Val Ile Thr
20
<210> 18
<211> 23
<212> ПРТ
<213> Homo sapiens
<400> 18
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
1 5 10 15
Ser Leu Val Ile Thr Leu Tyr
20
<210> 19
<211> 24
<212> ПРТ
<213> Homo sapiens
<400> 19
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
1 5 10 15
Ser Leu Val Ile Thr Leu Tyr Cys
20
<210> 20
<211> 28
<212> ПРТ
<213> Homo sapiens
<400> 20
Ile Ile Ser Phe Phe Leu Ala Leu Thr Ser Thr Ala Leu Leu Leu Phe
1 5 10 15
Leu Leu Phe Phe Leu Thr Leu Arg Phe Ser Val Val
20 25
<210> 21
<211> 112
<212> ПРТ
<213> Homo sapiens
<400> 21
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 22
<211> 41
<212> ПРТ
<213> Homo sapiens
<400> 22
Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp Tyr Met Asn Met Thr
1 5 10 15
Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro
20 25 30
Pro Arg Asp Phe Ala Ala Tyr Arg Ser
35 40
<210> 23
<211> 41
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутировавший человеческий
<400> 23
Arg Ser Lys Arg Ser Arg Gly Gly His Ser Asp Tyr Met Asn Met Thr
1 5 10 15
Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro
20 25 30
Pro Arg Asp Phe Ala Ala Tyr Arg Ser
35 40
<210> 24
<211> 42
<212> ПРТ
<213> Homo sapiens
<400> 24
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 10 15
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
20 25 30
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
35 40
<210> 25
<211> 42
<212> ПРТ
<213> Homo sapiens
<400> 25
Ala Leu Tyr Leu Leu Arg Arg Asp Gln Arg Leu Pro Pro Asp Ala His
1 5 10 15
Lys Pro Pro Gly Gly Gly Ser Phe Arg Thr Pro Ile Gln Glu Glu Gln
20 25 30
Ala Asp Ala His Ser Thr Leu Ala Lys Ile
35 40
<210> 26
<211> 1027
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> человеческий химерный Her2scFv-IgG4(L235E,
N297Q)-CD28tm-CD28gg-Zeta-T2A-CD19t
<400> 26
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser
35 40 45
Gln Asp Val Asn Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys
50 55 60
Ala Pro Lys Leu Leu Ile Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln
100 105 110
His Tyr Thr Thr Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
115 120 125
Lys Gly Ser Thr Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
145 150 155 160
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile
165 170 175
Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
180 185 190
Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala
195 200 205
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn
210 215 220
Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
225 230 235 240
Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr
245 250 255
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Glu Ser Lys Tyr Gly
260 265 270
Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser
275 280 285
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
290 295 300
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
305 310 315 320
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
325 330 335
Lys Thr Lys Pro Arg Glu Glu Gln Phe Gln Ser Thr Tyr Arg Val Val
340 345 350
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
355 360 365
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
370 375 380
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
385 390 395 400
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
405 410 415
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
420 425 430
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
435 440 445
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
450 455 460
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
465 470 475 480
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
485 490 495
Met Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser
500 505 510
Leu Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg
515 520 525
Ser Arg Gly Gly His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro
530 535 540
Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe
545 550 555 560
Ala Ala Tyr Arg Ser Gly Gly Gly Arg Val Lys Phe Ser Arg Ser Ala
565 570 575
Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu
580 585 590
Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly
595 600 605
Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu
610 615 620
Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser
625 630 635 640
Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly
645 650 655
Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu
660 665 670
His Met Gln Ala Leu Pro Pro Arg Leu Glu Gly Gly Gly Glu Gly Arg
675 680 685
Gly Ser Leu Leu Thr Cys Gly Asp Val Glu Glu Asn Pro Gly Pro Arg
690 695 700
Met Pro Pro Pro Arg Leu Leu Phe Phe Leu Leu Phe Leu Thr Pro Met
705 710 715 720
Glu Val Arg Pro Glu Glu Pro Leu Val Val Lys Val Glu Glu Gly Asp
725 730 735
Asn Ala Val Leu Gln Cys Leu Lys Gly Thr Ser Asp Gly Pro Thr Gln
740 745 750
Gln Leu Thr Trp Ser Arg Glu Ser Pro Leu Lys Pro Phe Leu Lys Leu
755 760 765
Ser Leu Gly Leu Pro Gly Leu Gly Ile His Met Arg Pro Leu Ala Ile
770 775 780
Trp Leu Phe Ile Phe Asn Val Ser Gln Gln Met Gly Gly Phe Tyr Leu
785 790 795 800
Cys Gln Pro Gly Pro Pro Ser Glu Lys Ala Trp Gln Pro Gly Trp Thr
805 810 815
Val Asn Val Glu Gly Ser Gly Glu Leu Phe Arg Trp Asn Val Ser Asp
820 825 830
Leu Gly Gly Leu Gly Cys Gly Leu Lys Asn Arg Ser Ser Glu Gly Pro
835 840 845
Ser Ser Pro Ser Gly Lys Leu Met Ser Pro Lys Leu Tyr Val Trp Ala
850 855 860
Lys Asp Arg Pro Glu Ile Trp Glu Gly Glu Pro Pro Cys Val Pro Pro
865 870 875 880
Arg Asp Ser Leu Asn Gln Ser Leu Ser Gln Asp Leu Thr Met Ala Pro
885 890 895
Gly Ser Thr Leu Trp Leu Ser Cys Gly Val Pro Pro Asp Ser Val Ser
900 905 910
Arg Gly Pro Leu Ser Trp Thr His Val His Pro Lys Gly Pro Lys Ser
915 920 925
Leu Leu Ser Leu Glu Leu Lys Asp Asp Arg Pro Ala Arg Asp Met Trp
930 935 940
Val Met Glu Thr Gly Leu Leu Leu Pro Arg Ala Thr Ala Gln Asp Ala
945 950 955 960
Gly Lys Tyr Tyr Cys His Arg Gly Asn Leu Thr Met Ser Phe His Leu
965 970 975
Glu Ile Thr Ala Arg Pro Val Leu Trp His Trp Leu Leu Arg Thr Gly
980 985 990
Gly Trp Lys Val Ser Ala Val Thr Leu Ala Tyr Leu Ile Phe Cys Leu
995 1000 1005
Cys Ser Leu Val Gly Ile Leu His Leu Gln Arg Ala Leu Val Leu
1010 1015 1020
Arg Arg Lys Arg
1025
<210> 27
<211> 1021
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> человеческий химерный
Her2scFv-IgG4(L235E,N297Q)-CD8tm-41BB-Zeta-T2A-CD19t
<400> 27
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser
35 40 45
Gln Asp Val Asn Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys
50 55 60
Ala Pro Lys Leu Leu Ile Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln
100 105 110
His Tyr Thr Thr Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
115 120 125
Lys Gly Ser Thr Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
145 150 155 160
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile
165 170 175
Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
180 185 190
Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala
195 200 205
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn
210 215 220
Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
225 230 235 240
Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr
245 250 255
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Glu Ser Lys Tyr Gly
260 265 270
Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser
275 280 285
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
290 295 300
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
305 310 315 320
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
325 330 335
Lys Thr Lys Pro Arg Glu Glu Gln Phe Gln Ser Thr Tyr Arg Val Val
340 345 350
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
355 360 365
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
370 375 380
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
385 390 395 400
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
405 410 415
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
420 425 430
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
435 440 445
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
450 455 460
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
465 470 475 480
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
485 490 495
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
500 505 510
Ser Leu Val Ile Thr Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe
515 520 525
Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly
530 535 540
Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Gly
545 550 555 560
Gly Gly Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln
565 570 575
Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu
580 585 590
Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly
595 600 605
Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu
610 615 620
Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly
625 630 635 640
Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser
645 650 655
Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro
660 665 670
Pro Arg Leu Glu Gly Gly Gly Glu Gly Arg Gly Ser Leu Leu Thr Cys
675 680 685
Gly Asp Val Glu Glu Asn Pro Gly Pro Arg Met Pro Pro Pro Arg Leu
690 695 700
Leu Phe Phe Leu Leu Phe Leu Thr Pro Met Glu Val Arg Pro Glu Glu
705 710 715 720
Pro Leu Val Val Lys Val Glu Glu Gly Asp Asn Ala Val Leu Gln Cys
725 730 735
Leu Lys Gly Thr Ser Asp Gly Pro Thr Gln Gln Leu Thr Trp Ser Arg
740 745 750
Glu Ser Pro Leu Lys Pro Phe Leu Lys Leu Ser Leu Gly Leu Pro Gly
755 760 765
Leu Gly Ile His Met Arg Pro Leu Ala Ile Trp Leu Phe Ile Phe Asn
770 775 780
Val Ser Gln Gln Met Gly Gly Phe Tyr Leu Cys Gln Pro Gly Pro Pro
785 790 795 800
Ser Glu Lys Ala Trp Gln Pro Gly Trp Thr Val Asn Val Glu Gly Ser
805 810 815
Gly Glu Leu Phe Arg Trp Asn Val Ser Asp Leu Gly Gly Leu Gly Cys
820 825 830
Gly Leu Lys Asn Arg Ser Ser Glu Gly Pro Ser Ser Pro Ser Gly Lys
835 840 845
Leu Met Ser Pro Lys Leu Tyr Val Trp Ala Lys Asp Arg Pro Glu Ile
850 855 860
Trp Glu Gly Glu Pro Pro Cys Val Pro Pro Arg Asp Ser Leu Asn Gln
865 870 875 880
Ser Leu Ser Gln Asp Leu Thr Met Ala Pro Gly Ser Thr Leu Trp Leu
885 890 895
Ser Cys Gly Val Pro Pro Asp Ser Val Ser Arg Gly Pro Leu Ser Trp
900 905 910
Thr His Val His Pro Lys Gly Pro Lys Ser Leu Leu Ser Leu Glu Leu
915 920 925
Lys Asp Asp Arg Pro Ala Arg Asp Met Trp Val Met Glu Thr Gly Leu
930 935 940
Leu Leu Pro Arg Ala Thr Ala Gln Asp Ala Gly Lys Tyr Tyr Cys His
945 950 955 960
Arg Gly Asn Leu Thr Met Ser Phe His Leu Glu Ile Thr Ala Arg Pro
965 970 975
Val Leu Trp His Trp Leu Leu Arg Thr Gly Gly Trp Lys Val Ser Ala
980 985 990
Val Thr Leu Ala Tyr Leu Ile Phe Cys Leu Cys Ser Leu Val Gly Ile
995 1000 1005
Leu His Leu Gln Arg Ala Leu Val Leu Arg Arg Lys Arg
1010 1015 1020
<210> 28
<211> 843
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> человеческий химерный
Her2scFv-CD8шарнир-CD8tm-41BB-Zeta-T2A-CD19t
<400> 28
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser
35 40 45
Gln Asp Val Asn Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys
50 55 60
Ala Pro Lys Leu Leu Ile Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln
100 105 110
His Tyr Thr Thr Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
115 120 125
Lys Gly Ser Thr Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
145 150 155 160
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile
165 170 175
Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
180 185 190
Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala
195 200 205
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn
210 215 220
Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
225 230 235 240
Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr
245 250 255
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Lys Pro Thr Thr
260 265 270
Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln
275 280 285
Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala
290 295 300
Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala
305 310 315 320
Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr
325 330 335
Gly Gly Gly Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln
340 345 350
Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser
355 360 365
Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly
370 375 380
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
385 390 395 400
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
405 410 415
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
420 425 430
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
435 440 445
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
450 455 460
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
465 470 475 480
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490 495
Leu Glu Gly Gly Gly Glu Gly Arg Gly Ser Leu Leu Thr Cys Gly Asp
500 505 510
Val Glu Glu Asn Pro Gly Pro Arg Met Pro Pro Pro Arg Leu Leu Phe
515 520 525
Phe Leu Leu Phe Leu Thr Pro Met Glu Val Arg Pro Glu Glu Pro Leu
530 535 540
Val Val Lys Val Glu Glu Gly Asp Asn Ala Val Leu Gln Cys Leu Lys
545 550 555 560
Gly Thr Ser Asp Gly Pro Thr Gln Gln Leu Thr Trp Ser Arg Glu Ser
565 570 575
Pro Leu Lys Pro Phe Leu Lys Leu Ser Leu Gly Leu Pro Gly Leu Gly
580 585 590
Ile His Met Arg Pro Leu Ala Ile Trp Leu Phe Ile Phe Asn Val Ser
595 600 605
Gln Gln Met Gly Gly Phe Tyr Leu Cys Gln Pro Gly Pro Pro Ser Glu
610 615 620
Lys Ala Trp Gln Pro Gly Trp Thr Val Asn Val Glu Gly Ser Gly Glu
625 630 635 640
Leu Phe Arg Trp Asn Val Ser Asp Leu Gly Gly Leu Gly Cys Gly Leu
645 650 655
Lys Asn Arg Ser Ser Glu Gly Pro Ser Ser Pro Ser Gly Lys Leu Met
660 665 670
Ser Pro Lys Leu Tyr Val Trp Ala Lys Asp Arg Pro Glu Ile Trp Glu
675 680 685
Gly Glu Pro Pro Cys Val Pro Pro Arg Asp Ser Leu Asn Gln Ser Leu
690 695 700
Ser Gln Asp Leu Thr Met Ala Pro Gly Ser Thr Leu Trp Leu Ser Cys
705 710 715 720
Gly Val Pro Pro Asp Ser Val Ser Arg Gly Pro Leu Ser Trp Thr His
725 730 735
Val His Pro Lys Gly Pro Lys Ser Leu Leu Ser Leu Glu Leu Lys Asp
740 745 750
Asp Arg Pro Ala Arg Asp Met Trp Val Met Glu Thr Gly Leu Leu Leu
755 760 765
Pro Arg Ala Thr Ala Gln Asp Ala Gly Lys Tyr Tyr Cys His Arg Gly
770 775 780
Asn Leu Thr Met Ser Phe His Leu Glu Ile Thr Ala Arg Pro Val Leu
785 790 795 800
Trp His Trp Leu Leu Arg Thr Gly Gly Trp Lys Val Ser Ala Val Thr
805 810 815
Leu Ala Tyr Leu Ile Phe Cys Leu Cys Ser Leu Val Gly Ile Leu His
820 825 830
Leu Gln Arg Ala Leu Val Leu Arg Arg Lys Arg
835 840
<210> 29
<211> 814
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> человеческий химерный
Her2scFv-Шарнир-Линкер-CD8tm-41BB-Zeta-T2A-CD19t
<400> 29
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser
35 40 45
Gln Asp Val Asn Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys
50 55 60
Ala Pro Lys Leu Leu Ile Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln
100 105 110
His Tyr Thr Thr Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
115 120 125
Lys Gly Ser Thr Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
145 150 155 160
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile
165 170 175
Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
180 185 190
Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala
195 200 205
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn
210 215 220
Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
225 230 235 240
Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr
245 250 255
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Glu Ser Lys Tyr Gly
260 265 270
Pro Pro Cys Pro Pro Cys Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser
275 280 285
Gly Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu
290 295 300
Leu Ser Leu Val Ile Thr Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile
305 310 315 320
Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp
325 330 335
Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
340 345 350
Gly Gly Gly Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
355 360 365
Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
370 375 380
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
385 390 395 400
Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu
405 410 415
Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys
420 425 430
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu
435 440 445
Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu
450 455 460
Pro Pro Arg Glu Gly Gly Gly Glu Gly Arg Gly Ser Leu Leu Thr Cys
465 470 475 480
Gly Asp Val Glu Glu Asn Pro Gly Pro Arg Leu Met Pro Pro Pro Arg
485 490 495
Leu Leu Phe Phe Leu Leu Phe Leu Thr Pro Met Glu Val Arg Pro Glu
500 505 510
Glu Pro Leu Val Val Lys Val Glu Glu Gly Asp Asn Ala Val Leu Gln
515 520 525
Cys Leu Lys Gly Thr Ser Asp Gly Pro Thr Gln Gln Leu Thr Trp Ser
530 535 540
Arg Glu Ser Pro Leu Lys Pro Phe Leu Lys Leu Ser Leu Gly Leu Pro
545 550 555 560
Gly Leu Gly Ile His Met Arg Pro Leu Ala Ile Trp Leu Phe Ile Phe
565 570 575
Asn Val Ser Gln Gln Met Gly Gly Phe Tyr Leu Cys Gln Pro Gly Pro
580 585 590
Pro Ser Glu Lys Ala Trp Gln Pro Gly Trp Thr Val Asn Val Glu Gly
595 600 605
Ser Gly Glu Leu Phe Arg Trp Asn Val Ser Asp Leu Gly Gly Leu Gly
610 615 620
Cys Gly Leu Lys Asn Arg Ser Ser Glu Gly Pro Ser Ser Pro Ser Gly
625 630 635 640
Lys Leu Met Ser Pro Lys Leu Tyr Val Trp Ala Lys Asp Arg Pro Glu
645 650 655
Ile Trp Glu Gly Glu Pro Pro Cys Val Pro Pro Arg Asp Ser Leu Asn
660 665 670
Gln Ser Leu Ser Gln Asp Leu Thr Met Ala Pro Gly Ser Thr Leu Trp
675 680 685
Leu Ser Cys Gly Val Pro Pro Asp Ser Val Ser Arg Gly Pro Leu Ser
690 695 700
Trp Thr His Val His Pro Lys Gly Pro Lys Ser Leu Leu Ser Leu Glu
705 710 715 720
Leu Lys Asp Asp Arg Pro Ala Arg Asp Met Trp Val Met Glu Thr Gly
725 730 735
Leu Leu Leu Pro Arg Ala Thr Ala Gln Asp Ala Gly Lys Tyr Tyr Cys
740 745 750
His Arg Gly Asn Leu Thr Met Ser Phe His Leu Glu Ile Thr Ala Arg
755 760 765
Pro Val Leu Trp His Trp Leu Leu Arg Thr Gly Gly Trp Lys Val Ser
770 775 780
Ala Val Thr Leu Ala Tyr Leu Ile Phe Cys Leu Cys Ser Leu Val Gly
785 790 795 800
Ile Leu His Leu Gln Arg Ala Leu Val Leu Arg Arg Lys Arg
805 810
<210> 30
<211> 921
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> человеческий химерный
Her2scFv-IgG4(HL-CH3)-CD8tm-41BB-Zeta-T2A-CD19t
<400> 30
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser
35 40 45
Gln Asp Val Asn Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys
50 55 60
Ala Pro Lys Leu Leu Ile Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln
100 105 110
His Tyr Thr Thr Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
115 120 125
Lys Gly Ser Thr Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
145 150 155 160
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile
165 170 175
Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
180 185 190
Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala
195 200 205
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn
210 215 220
Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
225 230 235 240
Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr
245 250 255
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Glu Ser Lys Tyr Gly
260 265 270
Pro Pro Cys Pro Pro Cys Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser
275 280 285
Gly Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
290 295 300
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
305 310 315 320
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
325 330 335
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
340 345 350
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
355 360 365
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
370 375 380
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Ile Tyr Ile Trp
385 390 395 400
Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile
405 410 415
Thr Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe
420 425 430
Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg
435 440 445
Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly Arg Val
450 455 460
Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn
465 470 475 480
Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val
485 490 495
Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg
500 505 510
Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys
515 520 525
Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg
530 535 540
Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys
545 550 555 560
Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg Leu Glu
565 570 575
Gly Gly Gly Glu Gly Arg Gly Ser Leu Leu Thr Cys Gly Asp Val Glu
580 585 590
Glu Asn Pro Gly Pro Arg Met Pro Pro Pro Arg Leu Leu Phe Phe Leu
595 600 605
Leu Phe Leu Thr Pro Met Glu Val Arg Pro Glu Glu Pro Leu Val Val
610 615 620
Lys Val Glu Glu Gly Asp Asn Ala Val Leu Gln Cys Leu Lys Gly Thr
625 630 635 640
Ser Asp Gly Pro Thr Gln Gln Leu Thr Trp Ser Arg Glu Ser Pro Leu
645 650 655
Lys Pro Phe Leu Lys Leu Ser Leu Gly Leu Pro Gly Leu Gly Ile His
660 665 670
Met Arg Pro Leu Ala Ile Trp Leu Phe Ile Phe Asn Val Ser Gln Gln
675 680 685
Met Gly Gly Phe Tyr Leu Cys Gln Pro Gly Pro Pro Ser Glu Lys Ala
690 695 700
Trp Gln Pro Gly Trp Thr Val Asn Val Glu Gly Ser Gly Glu Leu Phe
705 710 715 720
Arg Trp Asn Val Ser Asp Leu Gly Gly Leu Gly Cys Gly Leu Lys Asn
725 730 735
Arg Ser Ser Glu Gly Pro Ser Ser Pro Ser Gly Lys Leu Met Ser Pro
740 745 750
Lys Leu Tyr Val Trp Ala Lys Asp Arg Pro Glu Ile Trp Glu Gly Glu
755 760 765
Pro Pro Cys Val Pro Pro Arg Asp Ser Leu Asn Gln Ser Leu Ser Gln
770 775 780
Asp Leu Thr Met Ala Pro Gly Ser Thr Leu Trp Leu Ser Cys Gly Val
785 790 795 800
Pro Pro Asp Ser Val Ser Arg Gly Pro Leu Ser Trp Thr His Val His
805 810 815
Pro Lys Gly Pro Lys Ser Leu Leu Ser Leu Glu Leu Lys Asp Asp Arg
820 825 830
Pro Ala Arg Asp Met Trp Val Met Glu Thr Gly Leu Leu Leu Pro Arg
835 840 845
Ala Thr Ala Gln Asp Ala Gly Lys Tyr Tyr Cys His Arg Gly Asn Leu
850 855 860
Thr Met Ser Phe His Leu Glu Ile Thr Ala Arg Pro Val Leu Trp His
865 870 875 880
Trp Leu Leu Arg Thr Gly Gly Trp Lys Val Ser Ala Val Thr Leu Ala
885 890 895
Tyr Leu Ile Phe Cys Leu Cys Ser Leu Val Gly Ile Leu His Leu Gln
900 905 910
Arg Ala Leu Val Leu Arg Arg Lys Arg
915 920
<210> 31
<211> 927
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> человеческий химерный
Her2scFv-IgG4(HL-CH3)-CD28tm-CD28gg-Zeta-T2A-CD19t
<400> 31
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser
35 40 45
Gln Asp Val Asn Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys
50 55 60
Ala Pro Lys Leu Leu Ile Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln
100 105 110
His Tyr Thr Thr Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
115 120 125
Lys Gly Ser Thr Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
145 150 155 160
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile
165 170 175
Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
180 185 190
Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala
195 200 205
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn
210 215 220
Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
225 230 235 240
Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr
245 250 255
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Glu Ser Lys Tyr Gly
260 265 270
Pro Pro Cys Pro Pro Cys Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser
275 280 285
Gly Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
290 295 300
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
305 310 315 320
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
325 330 335
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
340 345 350
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
355 360 365
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
370 375 380
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Met Phe Trp Val
385 390 395 400
Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr
405 410 415
Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser Arg Gly Gly
420 425 430
His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg
435 440 445
Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg
450 455 460
Ser Gly Gly Gly Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala
465 470 475 480
Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg
485 490 495
Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu
500 505 510
Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
515 520 525
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
530 535 540
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
545 550 555 560
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
565 570 575
Leu Pro Pro Arg Leu Glu Gly Gly Gly Glu Gly Arg Gly Ser Leu Leu
580 585 590
Thr Cys Gly Asp Val Glu Glu Asn Pro Gly Pro Arg Met Pro Pro Pro
595 600 605
Arg Leu Leu Phe Phe Leu Leu Phe Leu Thr Pro Met Glu Val Arg Pro
610 615 620
Glu Glu Pro Leu Val Val Lys Val Glu Glu Gly Asp Asn Ala Val Leu
625 630 635 640
Gln Cys Leu Lys Gly Thr Ser Asp Gly Pro Thr Gln Gln Leu Thr Trp
645 650 655
Ser Arg Glu Ser Pro Leu Lys Pro Phe Leu Lys Leu Ser Leu Gly Leu
660 665 670
Pro Gly Leu Gly Ile His Met Arg Pro Leu Ala Ile Trp Leu Phe Ile
675 680 685
Phe Asn Val Ser Gln Gln Met Gly Gly Phe Tyr Leu Cys Gln Pro Gly
690 695 700
Pro Pro Ser Glu Lys Ala Trp Gln Pro Gly Trp Thr Val Asn Val Glu
705 710 715 720
Gly Ser Gly Glu Leu Phe Arg Trp Asn Val Ser Asp Leu Gly Gly Leu
725 730 735
Gly Cys Gly Leu Lys Asn Arg Ser Ser Glu Gly Pro Ser Ser Pro Ser
740 745 750
Gly Lys Leu Met Ser Pro Lys Leu Tyr Val Trp Ala Lys Asp Arg Pro
755 760 765
Glu Ile Trp Glu Gly Glu Pro Pro Cys Val Pro Pro Arg Asp Ser Leu
770 775 780
Asn Gln Ser Leu Ser Gln Asp Leu Thr Met Ala Pro Gly Ser Thr Leu
785 790 795 800
Trp Leu Ser Cys Gly Val Pro Pro Asp Ser Val Ser Arg Gly Pro Leu
805 810 815
Ser Trp Thr His Val His Pro Lys Gly Pro Lys Ser Leu Leu Ser Leu
820 825 830
Glu Leu Lys Asp Asp Arg Pro Ala Arg Asp Met Trp Val Met Glu Thr
835 840 845
Gly Leu Leu Leu Pro Arg Ala Thr Ala Gln Asp Ala Gly Lys Tyr Tyr
850 855 860
Cys His Arg Gly Asn Leu Thr Met Ser Phe His Leu Glu Ile Thr Ala
865 870 875 880
Arg Pro Val Leu Trp His Trp Leu Leu Arg Thr Gly Gly Trp Lys Val
885 890 895
Ser Ala Val Thr Leu Ala Tyr Leu Ile Phe Cys Leu Cys Ser Leu Val
900 905 910
Gly Ile Leu His Leu Gln Arg Ala Leu Val Leu Arg Arg Lys Arg
915 920 925
<210> 32
<211> 808
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> человеческий химерный
Her2scFv-Линкер-CD28tm-CD28gg-Zeta-T2A-CD19t
<400> 32
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser
35 40 45
Gln Asp Val Asn Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys
50 55 60
Ala Pro Lys Leu Leu Ile Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln
100 105 110
His Tyr Thr Thr Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
115 120 125
Lys Gly Ser Thr Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
145 150 155 160
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile
165 170 175
Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
180 185 190
Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala
195 200 205
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn
210 215 220
Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
225 230 235 240
Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr
245 250 255
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Ser Ser
260 265 270
Gly Gly Gly Ser Gly Met Phe Trp Val Leu Val Val Val Gly Gly Val
275 280 285
Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile Ile Phe Trp
290 295 300
Val Arg Ser Lys Arg Ser Arg Gly Gly His Ser Asp Tyr Met Asn Met
305 310 315 320
Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala
325 330 335
Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser Gly Gly Gly Arg Val Lys
340 345 350
Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln
355 360 365
Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu
370 375 380
Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg
385 390 395 400
Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met
405 410 415
Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly
420 425 430
Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp
435 440 445
Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg Leu Glu Gly
450 455 460
Gly Gly Glu Gly Arg Gly Ser Leu Leu Thr Cys Gly Asp Val Glu Glu
465 470 475 480
Asn Pro Gly Pro Arg Met Pro Pro Pro Arg Leu Leu Phe Phe Leu Leu
485 490 495
Phe Leu Thr Pro Met Glu Val Arg Pro Glu Glu Pro Leu Val Val Lys
500 505 510
Val Glu Glu Gly Asp Asn Ala Val Leu Gln Cys Leu Lys Gly Thr Ser
515 520 525
Asp Gly Pro Thr Gln Gln Leu Thr Trp Ser Arg Glu Ser Pro Leu Lys
530 535 540
Pro Phe Leu Lys Leu Ser Leu Gly Leu Pro Gly Leu Gly Ile His Met
545 550 555 560
Arg Pro Leu Ala Ile Trp Leu Phe Ile Phe Asn Val Ser Gln Gln Met
565 570 575
Gly Gly Phe Tyr Leu Cys Gln Pro Gly Pro Pro Ser Glu Lys Ala Trp
580 585 590
Gln Pro Gly Trp Thr Val Asn Val Glu Gly Ser Gly Glu Leu Phe Arg
595 600 605
Trp Asn Val Ser Asp Leu Gly Gly Leu Gly Cys Gly Leu Lys Asn Arg
610 615 620
Ser Ser Glu Gly Pro Ser Ser Pro Ser Gly Lys Leu Met Ser Pro Lys
625 630 635 640
Leu Tyr Val Trp Ala Lys Asp Arg Pro Glu Ile Trp Glu Gly Glu Pro
645 650 655
Pro Cys Val Pro Pro Arg Asp Ser Leu Asn Gln Ser Leu Ser Gln Asp
660 665 670
Leu Thr Met Ala Pro Gly Ser Thr Leu Trp Leu Ser Cys Gly Val Pro
675 680 685
Pro Asp Ser Val Ser Arg Gly Pro Leu Ser Trp Thr His Val His Pro
690 695 700
Lys Gly Pro Lys Ser Leu Leu Ser Leu Glu Leu Lys Asp Asp Arg Pro
705 710 715 720
Ala Arg Asp Met Trp Val Met Glu Thr Gly Leu Leu Leu Pro Arg Ala
725 730 735
Thr Ala Gln Asp Ala Gly Lys Tyr Tyr Cys His Arg Gly Asn Leu Thr
740 745 750
Met Ser Phe His Leu Glu Ile Thr Ala Arg Pro Val Leu Trp His Trp
755 760 765
Leu Leu Arg Thr Gly Gly Trp Lys Val Ser Ala Val Thr Leu Ala Tyr
770 775 780
Leu Ile Phe Cys Leu Cys Ser Leu Val Gly Ile Leu His Leu Gln Arg
785 790 795 800
Ala Leu Val Leu Arg Arg Lys Arg
805
<210> 33
<211> 802
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> человеческий химерный
Her2scFv-Линкер-CD8tm-41BB-Zeta-T2A-CD19t
<400> 33
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser
35 40 45
Gln Asp Val Asn Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys
50 55 60
Ala Pro Lys Leu Leu Ile Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln
100 105 110
His Tyr Thr Thr Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
115 120 125
Lys Gly Ser Thr Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
145 150 155 160
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile
165 170 175
Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
180 185 190
Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala
195 200 205
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn
210 215 220
Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
225 230 235 240
Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr
245 250 255
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Ser Ser
260 265 270
Gly Gly Gly Ser Gly Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys
275 280 285
Gly Val Leu Leu Leu Ser Leu Val Ile Thr Lys Arg Gly Arg Lys Lys
290 295 300
Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr
305 310 315 320
Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly
325 330 335
Gly Cys Glu Leu Gly Gly Gly Arg Val Lys Phe Ser Arg Ser Ala Asp
340 345 350
Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn
355 360 365
Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg
370 375 380
Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly
385 390 395 400
Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu
405 410 415
Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu
420 425 430
Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His
435 440 445
Met Gln Ala Leu Pro Pro Arg Leu Glu Gly Gly Gly Glu Gly Arg Gly
450 455 460
Ser Leu Leu Thr Cys Gly Asp Val Glu Glu Asn Pro Gly Pro Arg Met
465 470 475 480
Pro Pro Pro Arg Leu Leu Phe Phe Leu Leu Phe Leu Thr Pro Met Glu
485 490 495
Val Arg Pro Glu Glu Pro Leu Val Val Lys Val Glu Glu Gly Asp Asn
500 505 510
Ala Val Leu Gln Cys Leu Lys Gly Thr Ser Asp Gly Pro Thr Gln Gln
515 520 525
Leu Thr Trp Ser Arg Glu Ser Pro Leu Lys Pro Phe Leu Lys Leu Ser
530 535 540
Leu Gly Leu Pro Gly Leu Gly Ile His Met Arg Pro Leu Ala Ile Trp
545 550 555 560
Leu Phe Ile Phe Asn Val Ser Gln Gln Met Gly Gly Phe Tyr Leu Cys
565 570 575
Gln Pro Gly Pro Pro Ser Glu Lys Ala Trp Gln Pro Gly Trp Thr Val
580 585 590
Asn Val Glu Gly Ser Gly Glu Leu Phe Arg Trp Asn Val Ser Asp Leu
595 600 605
Gly Gly Leu Gly Cys Gly Leu Lys Asn Arg Ser Ser Glu Gly Pro Ser
610 615 620
Ser Pro Ser Gly Lys Leu Met Ser Pro Lys Leu Tyr Val Trp Ala Lys
625 630 635 640
Asp Arg Pro Glu Ile Trp Glu Gly Glu Pro Pro Cys Val Pro Pro Arg
645 650 655
Asp Ser Leu Asn Gln Ser Leu Ser Gln Asp Leu Thr Met Ala Pro Gly
660 665 670
Ser Thr Leu Trp Leu Ser Cys Gly Val Pro Pro Asp Ser Val Ser Arg
675 680 685
Gly Pro Leu Ser Trp Thr His Val His Pro Lys Gly Pro Lys Ser Leu
690 695 700
Leu Ser Leu Glu Leu Lys Asp Asp Arg Pro Ala Arg Asp Met Trp Val
705 710 715 720
Met Glu Thr Gly Leu Leu Leu Pro Arg Ala Thr Ala Gln Asp Ala Gly
725 730 735
Lys Tyr Tyr Cys His Arg Gly Asn Leu Thr Met Ser Phe His Leu Glu
740 745 750
Ile Thr Ala Arg Pro Val Leu Trp His Trp Leu Leu Arg Thr Gly Gly
755 760 765
Trp Lys Val Ser Ala Val Thr Leu Ala Tyr Leu Ile Phe Cys Leu Cys
770 775 780
Ser Leu Val Gly Ile Leu His Leu Gln Arg Ala Leu Val Leu Arg Arg
785 790 795 800
Lys Arg
<210> 34
<211> 658
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> человеческий химерный Her2scFv-IgG4(L235E,
N297Q)-CD28tm-CD28gg-Zeta-T2A-CD19t минус лидер, TSA или CD19t
<400> 34
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Ser Thr Ser Gly
100 105 110
Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Glu Val Gln
115 120 125
Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg
130 135 140
Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His
145 150 155 160
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile
165 170 175
Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg
180 185 190
Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met
195 200 205
Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp
210 215 220
Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu
225 230 235 240
Val Thr Val Ser Ser Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys
245 250 255
Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
260 265 270
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
275 280 285
Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp
290 295 300
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
305 310 315 320
Glu Gln Phe Gln Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
325 330 335
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
340 345 350
Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
355 360 365
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu
370 375 380
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
385 390 395 400
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
405 410 415
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
420 425 430
Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn
435 440 445
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
450 455 460
Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Met Phe Trp Val Leu Val
465 470 475 480
Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala
485 490 495
Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser Arg Gly Gly His Ser
500 505 510
Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His
515 520 525
Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser Gly
530 535 540
Gly Gly Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln
545 550 555 560
Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu
565 570 575
Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly
580 585 590
Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu
595 600 605
Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly
610 615 620
Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser
625 630 635 640
Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro
645 650 655
Pro Arg
<210> 35
<211> 652
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> человеческий химерный Her2scFv-IgG4(L235E,N297Q)-CD8tm-41BB-Zeta-T2A-CD19t
минус лидер, TSA или CD19t
<400> 35
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Ser Thr Ser Gly
100 105 110
Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Glu Val Gln
115 120 125
Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg
130 135 140
Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His
145 150 155 160
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile
165 170 175
Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg
180 185 190
Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met
195 200 205
Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp
210 215 220
Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu
225 230 235 240
Val Thr Val Ser Ser Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys
245 250 255
Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
260 265 270
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
275 280 285
Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp
290 295 300
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
305 310 315 320
Glu Gln Phe Gln Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
325 330 335
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
340 345 350
Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
355 360 365
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu
370 375 380
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
385 390 395 400
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
405 410 415
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
420 425 430
Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn
435 440 445
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
450 455 460
Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Ile Tyr Ile Trp Ala Pro
465 470 475 480
Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Lys
485 490 495
Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg
500 505 510
Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro
515 520 525
Glu Glu Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly Arg Val Lys Phe
530 535 540
Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu
545 550 555 560
Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp
565 570 575
Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys
580 585 590
Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala
595 600 605
Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys
610 615 620
Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr
625 630 635 640
Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
645 650
<210> 36
<211> 474
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> человеческий химерный Her2scFv-CD8hinge-CD8tm-41BB-Zeta-T2A-CD19t
минус лидер, TSA или CD19t
<400> 36
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Ser Thr Ser Gly
100 105 110
Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Glu Val Gln
115 120 125
Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg
130 135 140
Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His
145 150 155 160
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile
165 170 175
Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg
180 185 190
Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met
195 200 205
Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp
210 215 220
Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu
225 230 235 240
Val Thr Val Ser Ser Ala Lys Pro Thr Thr Thr Pro Ala Pro Arg Pro
245 250 255
Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro
260 265 270
Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu
275 280 285
Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys
290 295 300
Gly Val Leu Leu Leu Ser Leu Val Ile Thr Gly Gly Gly Lys Arg Gly
305 310 315 320
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
325 330 335
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
340 345 350
Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly Arg Val Lys Phe Ser Arg
355 360 365
Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn
370 375 380
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
385 390 395 400
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
405 410 415
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
420 425 430
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
435 440 445
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
450 455 460
Ala Leu His Met Gln Ala Leu Pro Pro Arg
465 470
<210> 37
<211> 445
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> человеческий химерный Her2scFv-Шарнир-Линкер-CD8tm-41BB-Zeta-T2A-CD19t
минус лидер, TSA или CD19t
<400> 37
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Ser Thr Ser Gly
100 105 110
Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Glu Val Gln
115 120 125
Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg
130 135 140
Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His
145 150 155 160
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile
165 170 175
Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg
180 185 190
Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met
195 200 205
Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp
210 215 220
Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu
225 230 235 240
Val Thr Val Ser Ser Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys
245 250 255
Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Ile Tyr Ile Trp Ala
260 265 270
Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr
275 280 285
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
290 295 300
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
305 310 315 320
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly Arg Val Lys
325 330 335
Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln
340 345 350
Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu
355 360 365
Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg
370 375 380
Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met
385 390 395 400
Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly
405 410 415
Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp
420 425 430
Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
435 440 445
<210> 38
<211> 552
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> человеческий химерный Her2scFv-IgG4(HL-CH3)-CD8tm-41BB-Zeta-T2A-CD19t
минус лидер, TSA или CD19t
<400> 38
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Ser Thr Ser Gly
100 105 110
Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Glu Val Gln
115 120 125
Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg
130 135 140
Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His
145 150 155 160
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile
165 170 175
Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg
180 185 190
Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met
195 200 205
Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp
210 215 220
Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu
225 230 235 240
Val Thr Val Ser Ser Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys
245 250 255
Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Gly Gln Pro Arg Glu
260 265 270
Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn
275 280 285
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
290 295 300
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
305 310 315 320
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg
325 330 335
Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys
340 345 350
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
355 360 365
Ser Leu Ser Leu Gly Lys Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr
370 375 380
Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Lys Arg Gly Arg Lys
385 390 395 400
Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr
405 410 415
Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu
420 425 430
Gly Gly Cys Glu Leu Gly Gly Gly Arg Val Lys Phe Ser Arg Ser Ala
435 440 445
Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu
450 455 460
Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly
465 470 475 480
Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu
485 490 495
Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser
500 505 510
Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly
515 520 525
Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu
530 535 540
His Met Gln Ala Leu Pro Pro Arg
545 550
<210> 39
<211> 558
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> человеческий химерный Her2scFv-IgG4(HL-CH3)-CD28tm-CD28gg-Zeta-T2A-CD19t
минус лидер, TSA или CD19t
<400> 39
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Ser Thr Ser Gly
100 105 110
Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Glu Val Gln
115 120 125
Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg
130 135 140
Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His
145 150 155 160
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile
165 170 175
Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg
180 185 190
Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met
195 200 205
Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp
210 215 220
Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu
225 230 235 240
Val Thr Val Ser Ser Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys
245 250 255
Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Gly Gln Pro Arg Glu
260 265 270
Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn
275 280 285
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
290 295 300
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
305 310 315 320
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg
325 330 335
Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys
340 345 350
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
355 360 365
Ser Leu Ser Leu Gly Lys Met Phe Trp Val Leu Val Val Val Gly Gly
370 375 380
Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile Ile Phe
385 390 395 400
Trp Val Arg Ser Lys Arg Ser Arg Gly Gly His Ser Asp Tyr Met Asn
405 410 415
Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr
420 425 430
Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser Gly Gly Gly Arg Val
435 440 445
Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn
450 455 460
Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val
465 470 475 480
Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg
485 490 495
Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys
500 505 510
Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg
515 520 525
Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys
530 535 540
Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
545 550 555
<210> 40
<211> 439
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> человеческий химерный Her2scFv-Линкер-CD28tm-CD28gg-Zeta-T2A-CD19t
минус лидер, TSA или CD19t
<400> 40
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Ser Thr Ser Gly
100 105 110
Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Glu Val Gln
115 120 125
Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg
130 135 140
Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His
145 150 155 160
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile
165 170 175
Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg
180 185 190
Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met
195 200 205
Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp
210 215 220
Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu
225 230 235 240
Val Thr Val Ser Ser Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Met
245 250 255
Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu
260 265 270
Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser
275 280 285
Arg Gly Gly His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly
290 295 300
Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala
305 310 315 320
Ala Tyr Arg Ser Gly Gly Gly Arg Val Lys Phe Ser Arg Ser Ala Asp
325 330 335
Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn
340 345 350
Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg
355 360 365
Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly
370 375 380
Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu
385 390 395 400
Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu
405 410 415
Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His
420 425 430
Met Gln Ala Leu Pro Pro Arg
435
<210> 41
<211> 433
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> человеческий химерный Her2scFv-Линкер-CD8tm-41BB-Zeta-T2A-CD19t
минус лидер, TSA или CD19t
<400> 41
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Ser Thr Ser Gly
100 105 110
Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Glu Val Gln
115 120 125
Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg
130 135 140
Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr Ile His
145 150 155 160
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile
165 170 175
Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys Gly Arg
180 185 190
Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met
195 200 205
Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Trp
210 215 220
Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu
225 230 235 240
Val Thr Val Ser Ser Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Ile
245 250 255
Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser
260 265 270
Leu Val Ile Thr Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys
275 280 285
Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys
290 295 300
Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Gly Gly
305 310 315 320
Gly Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln
325 330 335
Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu
340 345 350
Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly
355 360 365
Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln
370 375 380
Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu
385 390 395 400
Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr
405 410 415
Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro
420 425 430
Arg
<210> 42
<211> 22
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> домен шарнирная область-линкер
<400> 42
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Gly Gly Gly Ser
1 5 10 15
Ser Gly Gly Gly Ser Gly
20
<---
Реферат
Группа изобретений относится к области фармацевтики и может быть использована для лечения рака мозга. Раскрыта молекула нуклеиновой кислоты, кодирующая химерный рецептор антигена, где данный химерный рецептор антигена содержит аминокислотную последовательность SEQ ID NO: 26 или SEQ ID NO: 27. Также раскрыты популяция человеческих Т-клеток, композиция для применения в лечении рака мозга, экспрессирующего HER2, у пациента и химерный рецептор антигена. Группа изобретений обеспечивает улучшенную противоопухолевую специфичность. 4 н. и 7 з.п. ф-лы, 18 ил., 3 табл., 9 пр.
Формула
Документы, цитированные в отчёте о поиске
Композиция антител к her2

Комментарии