Способ и композиции для клеточной иммунотерапии - RU2752275C2
Код документа: RU2752275C2
Чертежи






























































































Описание
РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящее изобретение испрашивает приоритет по предварительной заявке на патент США №61/977751, поданной 10 апреля 2014 г., предварительной заявке на патент США №61/986479, поданной 30 апреля 2014 г., предварительной заявке на патент США №62/058973, поданной 2 октября 2014 г., предварительной заявке на патент США №62/088363, поданной 5 декабря 2014 г., предварительной заявке на патент США №62/089730, поданной 9 декабря 2014 г. и предварительной заявке на патент США №62/090845, поданной 11 декабря 2014 г. Все содержание вышеупомянутых заявок явным образом и полностью включено в настоящий документ посредством ссылок.
ССЫЛКА НА ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0002] Заявка на настоящее изобретение подана совместно с перечнем последовательностей в электронном формате. Указанный перечень последовательностей представлен файлом, озаглавленным «SCRI-065WO_SEQUENCE_LISTING.TXT», созданным 1 апреля 2014 г. и имеющим размер 114 кБ. Представленная в электронном формате информация из перечня последовательностей включена в настоящий документ посредством ссылки полностью.
ОБЛАСТЬ ТЕХНИКИ
[0003] Настоящее изобретение относится к области биомедицины и, в частности, к способам и композициям для применения в клеточной иммунотерапии, в том числе подходящим для лечения раковых заболеваний. В частности, варианты реализации настоящего изобретения относятся к способам и композициям для проведения клеточной иммунотерапии, включающим T-клетки, модифицированные нацеленными на опухоль рецепторами.
УРОВЕНЬ ТЕХНИКИ
[0004] Способы иммунотерапии раковых заболеваний, в соответствии с которыми T-клетки генетически модифицируют для экспрессии синтетических химерных антигенных рецепторов (CAR), являются предметом значимых клинических испытаний ранней фазы для применения у человека. Хотя у пациентов, получающих лечение CD19-специфическими или содержащими нацеленные на CD19 CAR T-клетками, наблюдается ярковыраженная противоопухолевая активность в отношении В-клеточных злокачественных новообразований, таких как острый лимфобластный лейкоз и неходжкинские лимфомы, при попытках получить аналогичный ответ у пациентов с солидными опухолями возникают значительные трудности. В настоящее время разработка и клиническое тестирование перенаправленной с применением CAR T-клеточной адоптивной терапии у пациентов с раковыми заболеваниями являются в значительной степени эмпирическими и ограничены различными техническими параметрами, влияющими на осуществимость клинических испытаний фазы I, включающих ранее проходивших интенсивное лечение пациентов с объемными рефрактерными опухолями. Два связанных с клеточными продуктами параметра, которые могут быть заданы с высокой точностью, представлены составом субпопуляции T-лимфоцитов и настройкой CAR-сигнализации для получения функциональных результатов, максимизирующих их противоопухолевую активность. Согласно некоторым вариантам реализации исследовали терапевтическую активность экспрессирующих CAR центральных T-клеток памяти и было показано, что группа стабильных обученных антигеном клеток из репертуара T-клеток, имеющая признаки стволовых клеток, обладает способностью к восстановлению популяции в нишах долгоживущих функциональных клеток памяти после адоптивного переноса. Были получены и исследованы в клинике экспрессирующие CAR анти-CD19 клетки после обогащения по T-клеткам памяти (TCM) CD45RO+CD62L+ с применением иммуномагнитного разделения.
[0005] Помимо нацеливания на экспрессирующие CD19 В-клеточные злокачественные новообразования, в данной области техники может возникать проблема идентификации и анализа целевых молекул клеточной поверхности на опухолевых клетках, поддающихся распознаванию несущими CAR T-клетками при приемлемом уровне реактивности в отношении неопухолевых клеток-мишеней (отношение «on target/off tumor»). Тем не менее, применявшиеся после этапа идентификации способы настройки новых CAR для сигнализации, совместимой с активацией CD4 и CD8 T-клеток, не давали достаточно удовлетворительных результатов. Обычно ключевыми для разработки CAR параметрами считают аффинность в отношении целевой молекулы антигенсвязывающего домена CAR, как правило, но не обязательно представленного scFv-антителом, и сигнальных модулей цитоплазматического домена.
[0006] Существует потребность в разработке способов идентификации элементов дизайна химерных рецепторов, важных для терапевтической активности; способах усиления или усовершенствования химерных рецепторов для нацеливания на специфические антигены и клеточных популяций для генетической модификации и адоптивного переноса, отличающихся повышенной выживаемостью и эффективностью in vivo. Предложенные варианты реализации изобретения включают варианты, удовлетворяющие указанные потребности.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0007] Несмотря на терапевтическую эффективность перенаправленной T-клеточной иммунотерапии с применением химерных антигенных рецепторов (CAR) у пациентов с лейкозами и лимфомами, имеется потребность в способах и композициях для обеспечения аналогичных клинических ответов для солидных опухолей. Разработка CAR может, в некоторых случаях, быть смещена в сторону выбора конструкций, которые обеспечивают максимальные функциональные результаты от применения T-клеток, например, на основании показателей in vitro. Для настройки величины активации CD8+ цитотоксических T-клеток (CTL) для лизиса опухолевых клеток и секреции цитокинов могут быть скомбинированы различные варианты внеклеточных спейсеров и цитоплазматических сигнальных доменов CAR. В описанных в настоящем документе исследованиях конструкции CAR, демонстрировавшие максимальную активность в таких анализах in vitro, также демонстрировали минимальную противоопухолевую активность in vivo, тогда как рецепторы CAR, настроенные для обеспечения умеренной сигнализации, опосредовали инактивацию и/или эрадикацию опухоли. Согласно наблюдению, рекурсивная стимуляция CAR могла придавать клеткам CTL, экспрессирующим гиперактивные рецепторы CAR, значительную восприимчивость к индуцированной активацией клеточной смерти (AICD), возможно, в результате повышенной экспрессии FasL. Настройка CAR для ограничения AICD с использованием комбинаций внеклеточных спейсеров и цитоплазматических сигнальных модулей, например, путем независимого изменения характеристик таких частей, может способствовать повышенной или улучшенной клинической активности в отношении солидных опухолей. В настоящем документе описано влияние характеристик внеклеточного спейсера, соединяющего антигенсвязывающие и трансмембранные домены, например, длины спейсера, на вклад в функционирование несущих CAR T-клеток. Согласно некоторым вариантам реализации выбирают спейсеры CAR для коррекции и/или усиления или улучшения биофизического синаптического расстояния между экспрессирующей CAR клеткой, например, T-клеткой, и целевой клеткой, например, опухолевой клеткой, например, для достижения совместимого синаптического расстояния и/или расстояния, оптимального для активации иммунной клетки, например, T-клетки.
[0008] Описанные в настоящем документе варианты реализации относятся к соответствующим вкладам длины внеклеточного спейсера и выбора цитоплазматического сигнального фрагмента на функционирование рецептора CAR, способного к нацеливанию и/или специфического в отношении опухолеселективного эпитопа на CD171 (L1-CAM), распознаваемого моноклональным антителом к СЕ7, и протестированного в качестве CAR первого поколения в пилотном клиническом исследовании. При применении функционального анализа перенаправленной CAR эффекторной активности in vitro, наблюдалась количественная иерархия эффекторной активности в зависимости от размеров спейсера в контексте цитоплазматических сигнальных доменов второго и третьего поколения. Согласно одному варианту реализации было продемонстрировано ярковыраженное отличие функционирования несущих CAR T-клеток in vitro и in vivo из-за индуцированной активацией клеточной смерти (AICD) для большинства функционально активных форматов CAR. В указанных вариантах реализации выявлены клинически значимые параметры для исследования при разработке CAR T-клеточной иммунотерапии солидных опухолей. Учитывая, что каждая новая область scFv и каждая новая целевая молекула задает уникальное расстояние от плазматической мембраны опухолевой клетки, для каждой конструкции проводится уникальная подгонка спейсеров CAR путем эмпирического тестирования библиотек вариантов спейсеров разной длины.
[0009] Согласно одному аспекту раскрытое изобретение относится к способам и композициям для обеспечения и/или усиления иммунного ответа, опосредованного клеточной иммунотерапией, например, путем адоптивного переноса опухолеспецифичных генетически модифицированных популяций иммунных клеток, таких как генетически модифицированные субпопуляции CD8+ или CD4+ Т-клеток, по отдельности или в комбинации. В раскрытом изобретении предложены нуклеиновые кислоты химерных рецепторов, векторы и клетки-хозяева, содержащие такие нуклеиновые кислоты, а также кодируемые ими химерные рецепторы. Последовательность нуклеиновой кислоты, кодирующая такой химерный рецептор, обычно соединяет ряд модульных компонентов, которые могут быть вырезаны и заменены другими компонентами для получения индивидуального химерного рецептора, способного к нацеливанию и/или специфического для эффективной активации клеток и распознавания специфической целевой молекулы или эпитопа на целевой молекуле.
[0010] Адоптивная иммунотерапия с применением экспрессирующих химерный антигенный рецептор (CAR) клеток может подходить для лечения, смягчения и/или ингибирования разрастания ракового новообразования. Согласно некоторым вариантам реализации используют рецептор CAR, направленный на эпитоп антигена CD171 (L1CAM). Такие конструкции CAR подходят для лечения, смягчения или ингибирования любого заболевания или расстройства, или злокачественного новообразования, при котором клетки экспрессируют CD171. Согласно некоторым вариантам реализации указанное заболевание или расстройство представляет собой раковое новообразование или опухоль, экспрессирующее(ую) CD171 (L1CAM). Согласно некоторым вариантам реализации указанное раковое новообразование, экспрессирующее CD171, представляет собой нейробластому (NB). CD171 экспрессируется нейробластомами высокой степени риска в 100% случаев. Другие раковые новообразования, экспрессирующие CD171, включают меланому, карциному шейки матки, рак яичников, карциному матки, рак поджелудочной железы, карциному толстой кишки, карциному почки и глиобластому.
[0011] CD171, также известный как L1CAM, представляет собой трансмембранный гликопротеин размером 200 кДа. Он представляет собой молекулу клеточной адгезии нейронов, вовлеченную в аксональное наведение и миграцию клеток, глубоко задействованную при резистентных к лечению раковых заболеваниях. CD171 принадлежит к иммуноглобулиновому суперсемейству распознающих молекул и участвует в гетерофильных взаимодействиях с другими молекулами адгезии, такими как ламинин, интегрины, протеогликаны и CD24. Согласно некоторым вариантам реализации CD171 содержит, состоит или по существу состоит из эпитопа, обнаруживаемого в основном на опухолевых клетках. Согласно некоторым вариантам реализации указанный эпитоп обнаруживается на внеклеточном домене гликозилированного CD171 и не обнаруживается на негликозилированном CD171. Согласно некоторым вариантам реализации указанный эпитоп называется СЕ7 или эпитопом, распознаваемым предполагаемым антителом к СЕ7.
[0012] Нейробластома представляет собой наиболее распространенную внечерепную солидную опухоль, возникающую в детском возрасте. Это эмбриональное злокачественное новообразование симпатической нервной системы, возникающее из нейробластов (плюрипотентных симпатических клеток). В развивающемся эмбрионе указанные клетки инвагинируют, мигрируют вдоль нервной трубки и заселяют симпатические ганглии, мозговой слой надпочечников и другие сайты. Паттерны распределения указанных клеток коррелируют с сайтами первичного проявления нейробластомы. Возраст, стадия и биологические характеристики, свойственные опухолевым клеткам, являются важными прогностическими факторами и используются для стратификации рисков и назначения лечения. Различия в исходах заболевания у пациентов с нейробластомой ярко выражены. Для пациентов с нейробластомой низкой и промежуточной степени риска характерен благоприятный прогноз и исход. Однако у пациентов с заболеванием высокой степени риска по-прежнему наблюдаются крайне неблагоприятные исходы даже при интенсивной терапии. К сожалению, приблизительно у 70-80% пациентов в возрасте более 18 месяцев наблюдается метастатическая форма заболевания, как правило, с метастазами в лимфатические узлы, печень, кости и костный мозг. Излечение наступает менее чем у половины указанных пациентов даже при применении высокодозной терапии с последующей консервацией аутологичных клеток костного мозга или стволовых клеток. Соответственно, описанные в настоящем документе трансфицированные CAR лимфоциты подходят для лечения, смягчения или ингибирования нейробластомы у субъектов.
[0013] Согласно некоторым вариантам реализации нацеленный на CD171 рецептор CAR содержит компоненты, усиливающие in vivo активность и/или повышающие выживаемость и/или персистенцию CAR или экспрессирующих его клеток. Согласно некоторым вариантам реализации лигандсвязывающий домен содержит антитело или антигенсвязывающий фрагмент, который, в частности, связывает эпитоп и/или нацелен на эпитоп CD171, например, более часто обнаруживаемый на опухолевых клетках, а не на здоровых клетках. Согласно другим вариантам реализации включена спейсерная область, которая представляет собой короткий внеклеточный спейсер. Согласно некоторым вариантам реализации внутриклеточный сигнальный домен содержит один костимулирующий домен и один внутриклеточный сигнальный домен и не содержит других сигнальных доменов.
[0014] Некоторые варианты реализации относятся к нуклеиновой кислоте химерного рецептора, которая содержит полинуклеотид, кодирующий лигандсвязывающий домен, и/или к кодируемым указанной нуклеиновой кислотой химерным рецепторам, при этом указанный лиганд представляет собой молекулу, экспрессируемую на раковых или опухолевых клетках; полинуклеотид, кодирующий полипептидный спейсер; полинуклеотид, кодирующий трансмембранный домен; и полинуклеотид, кодирующий внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный спейсер соединяет лигандсвязывающий домен и трансмембранный домен или находится между ними. Согласно некоторым вариантам реализации указанный полипептидный спейсер содержит шарнирную область, например, шарнирную область молекулы антитела, например, шарнирную область, содержащую последовательность аминокислот X1PPX2P. Такая шарнирная область может быть соединена с другими последовательностями аминокислот, в том числе с одной или более константных областей антитела, в том числе, но не ограничиваясь указанными, с областями СН2 и СН3, например, только с последовательностями СН3 Fc иммуноглобулина. Неожиданно было обнаружено, что длина спейсерной области может быть адаптирована для индивидуальных целевых молекул для лучшего распознавания опухолевых или целевых клеток и/или эффекторной функции и/или персистенции клеток, экспрессирующих указанный рецептор, в частности, in vivo.
[0015] Согласно некоторым вариантам реализации длина спейсера составляет 229, 200, 150, 120, 119, 100, 50, 40, 30, 20, 19, 18, 17, 16, 15, 14, 13, 12 аминокислот или менее (но не менее чем 2 или 1 аминокислоту), или находится в диапазоне, ограниченном любыми двумя вышеупомянутыми вариантами длины. Согласно некоторым вариантам реализации длина спейсера составляет 15 или 12 аминокислот. Согласно некоторым вариантам реализации спейсер имеет малую длину (короткий спейсер), промежуточную длину (также называемую в настоящем документе «средней») или значительную длину (длинный спейсер). Согласно некоторым вариантам реализации короткий, промежуточный или длинный спейсер представляет собой короткий, промежуточный или длинный спейсер, представленный в таблицах 7 и 8.
[0016] Согласно некоторым вариантам реализации длина линкера определена расстоянием или на нее влияет расстояние от эпитопа антигена, с которым связывается химерный рецептор, до поверхности плазматической мембраны клетки, на которую он нацелен, например, опухолевой клетки.
[0017] Согласно некоторым вариантам реализации рецептор CAR, нацеленный на CD171, содержит полинуклеотид, кодирующий короткую спейсерную область длиной 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты), например, 15, 14, 13 или 12 аминокислот, или 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3 или 2 аминокислоты; или длина спейсера находится в диапазоне, ограниченном любыми двумя вышеупомянутыми вариантами длины. Согласно некоторым вариантам реализации короткий спейсер содержит, состоит или по существу состоит из последовательности аминокислот X1PPX2P. Согласно некоторым вариантам реализации рецептор CAR, нацеленный на эпитоп CD171, распознающий СЕ7 или эпитоп, расположенный на CD171 на аналогичном расстоянии от поверхности плазматической мембраны, содержит спейсерную область, длина которой составляет менее чем 100, 50, 40, 20, 15 или 12 аминокислот, например, короткую спейсерную область, длина которой составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты), например, 15, 14, 13 или 12 аминокислот, или 11, 10, 9, 8, 7, 6, 5, 4, 3 или 2 аминокислоты; или находится в диапазоне, ограниченном любыми двумя вышеупомянутыми вариантами длины.
[0018] Согласно другому аспекту в раскрытом изобретении предложена выделенная нуклеиновая кислота химерного рецептора, содержащая: полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лиганд представляет собой опухолеспецифичный антиген или любую другую молекулу, экспрессируемую на клетках популяции целевых клеток, подходящую для опосредования распознавания, инактивации и/или элиминации лимфоцитами; полинуклеотид, кодирующий полипептидный спейсер, причем указанный полипептидный спейсер имеет индивидуальную длину, при этом указанный спейсер оптимизирован; полинуклеотид, кодирующий трансмембранный домен; и полинуклеотид, кодирующий один или более внутриклеточных сигнальных доменов. Раскрытое изобретение включает экспрессионные векторы и клетки-хозяева, содержащие также выделенный химерный рецептор согласно описанию в настоящем документе. Согласно некоторым вариантам реализации указанный спейсер оптимизирован для повышенной пролиферации T-клеток и/или синтеза цитокинов в ответ на лиганд по сравнению с референсным химерным рецептором. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой клетку-предшественника T-клетки. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой гемопоэтическую стволовую клетку.
[0019] Согласно другому аспекту в раскрытом изобретении предложен полипептид химерного рецептора, содержащий лигандсвязывающий домен, при этом указанный лиганд представляет собой опухолеспецифичный антиген или любую другую молекулу, экспрессируемую на клетках популяции целевых клеток, и может быть нацелен для опосредования распознавания и элиминации лимфоцитами; полипептидный спейсер, длина которого составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты), например, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3 или 2 аминокислоты или находится в диапазоне, ограниченном любыми двумя вышеупомянутыми вариантами длины; трансмембранный домен; и один или более внутриклеточных сигнальных доменов. Согласно некоторым вариантам реализации указанный полипептидный спейсер содержит шарнирную область, содержащую последовательность аминокислот X1PPX2P.
[0020] Согласно другому аспекту в настоящем изобретении предложены композиции для обеспечения и/или усиления иммунного ответа, опосредованного клеточной иммунотерапией, например, путем адоптивного переноса опухолеспецифичной субпопуляции генетически модифицированных экспрессирующих CD4+ Т-клеток, при этом указанные экспрессирующие CD4+ Т-клетки придают экспрессирующим CD8+ Т-клеткам способность к поддержанию противоопухолевой реактивности и/или усиливают ее, и увеличивают и/или максимизируют опухолеспецифичную пролиферацию. Согласно некоторым вариантам реализации указанные экспрессирующие CD4+ Т-клетки генетически модифицированы для экспрессии нуклеиновой кислоты химерного рецептора и/или полипептида химерного рецептора согласно описанию в настоящем документе.
[0021] Согласно другому аспекту в настоящем изобретении предложены композиции для обеспечения и/или усиления иммунного ответа, опосредованного клеточной иммунотерапией, например, путем адоптивного переноса опухолеспецифичной субпопуляции генетически модифицированных экспрессирующих CD8+ Т-клеток. Согласно некоторым вариантам реализации указанный экспрессирующие CD8+ Т-клетки экспрессируют нуклеиновую кислоту химерного рецептора и/или полипептид химерного рецептора согласно описанию в настоящем документе.
[0022] Согласно другому варианту реализации в аспектах настоящего изобретения предложена композиция для адоптивной клеточной иммунотерапии, содержащая состав с генетически модифицированными экспрессирующими CD8+ цитотоксическими T-лимфоцитами для обеспечения и/или усиления иммунного ответа, при этом указанный состав с цитотоксическими T-лимфоцитами содержит экспрессирующие CD8+ Т-клетки, экспрессирующие химерный рецептор, содержащий лигандсвязывающий домен для лиганда, связанного с заболеванием или расстройством, индивидуализированную спейсерную область, трансмембранный домен; и внутриклеточный сигнальный домен T-клеточного или других рецепторов, например, костимулирующий домен, и/или состав с генетически модифицированными хелперными T-лимфоцитами, при этом указанный состав с хелперными T-лимфоцитами содержит экспрессирующие CD4+ Т-клетки, экспрессирующие химерный рецептор, содержащий вариабельный домен антитела, способный к нацеливанию и/или специфический для лиганда, связанного с заболеванием или расстройством, индивидуализированную спейсерную область, трансмембранный домен; и один или более внутриклеточных сигнальных доменов.
[0023] Согласно некоторым вариантам реализации в настоящем изобретении предложен способ лечения, смягчения или ингибирования ракового заболевания, такого как нейробластома, у пациента, способ ингибирования или задержки прогрессирования и/или метастазирования ракового заболевания, такого как нейробластома, у пациента, способ ингибирования или уменьшение количества присутствующих опухолевых или раковых клеток, например, нейробластомы, у пациента, и/или способ ингибирования или уменьшения целевой популяции экспрессирующих CD171 клеток у нуждающегося в этом пациента. Такие способы включают введение указанному субъекту или указанному пациенту состава с генетически модифицированными цитотоксическими T-лимфоцитами, обеспечивающего клеточный иммунный ответ, при этом указанный состав с цитотоксическими T-лимфоцитами содержит экспрессирующие CD8+ Т-клетки, которые содержат химерный рецептор, кодируемый полинуклеотидом, кодирующим лигандсвязывающий домен, при этом указанный лиганд представляет собой опухолеспецифичный антиген или любую другую молекулу, экспрессируемую на клетках популяции целевых клеток (например, CD171), подходящую для опосредования распознавания и элиминации лимфоцитом; полинуклеотид, кодирующий полипептидный спейсер, причем указанный полипептидный спейсер имеет индивидуальную длину, при этом указанный спейсер обеспечивает усиленную пролиферацию T-клеток, повышенную клеточную активность in vivo и/или синтез цитокинов (например, in vivo) по сравнению с референсным химерным рецептором; полинуклеотид, кодирующий трансмембранный домен; и полинуклеотид, кодирующий один или более внутриклеточных сигнальных доменов.
[0024] Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой внеклеточный вариабельный домен антитела, способный к нацеливанию и/или специфический для лиганда, связанного с заболеванием или расстройством. Альтернативный вариант реализации включает состав с генетически модифицированными хелперными T-лимфоцитами, при этом указанный состав с хелперными T-лимфоцитами содержит экспрессирующие CD4+ Т-клетки, которые содержат химерный рецептор, содержащие полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лиганд представляет собой опухолеспецифичный антиген или нацеленный на опухоль антиген, или любую другую молекулу, экспрессируемую на клетках популяции целевых клеток, подходящую для опосредования распознавания и элиминации лимфоцитом; полинуклеотид, кодирующий полипептидный спейсер, причем указанный полипептидный спейсер имеет индивидуальную длину, при этом указанный спейсер обеспечивает усиленную пролиферацию T-клеток, усиленную клеточную активность in vivo и/или синтез цитокинов по сравнению с референсным химерным рецептором; полинуклеотид, кодирующий трансмембранный домен; и полинуклеотид, кодирующий один или более внутриклеточных сигнальных доменов. Согласно некоторым вариантам реализации лигандсвязывающий домен содержит антитело или его антигенсвязывающий фрагмент, способный нацеливаться на эпитоп CD171 и/или специфически связывать эпитоп CD171, чаще обнаруживаемый на опухолевых клетках, чем на здоровых клетках. Согласно другим вариантам реализации спейсерная область содержит короткий внеклеточный спейсер. Согласно некоторым вариантам реализации сигнальный домен включает один сигнальный домен и не включает других сигнальных доменов.
[0025] Согласно некоторым вариантам реализации указанные популяции генетически модифицированных CD8+ и генетически модифицированных экспрессирующих CD4+ Т-клеток вводят совместно. Согласно некоторым вариантам реализации указанные T-клетки представляют собой аутологичные или аллогенные T-клетки. Возможны различные модификации описанных в настоящем документе способов. Например, химерные рецепторы, экспрессируемые экспрессирующей CD4+ Т-клеткой и экспрессирующей CD8+ Т-клеткой, могут быть одинаковыми или разными.
[0026] Другой вариант реализации относится к способу получения композиции для адоптивной иммунотерапии путем получения состава с модифицированными экспрессирующими опухолеспецифичный или нацеленный на опухоль химерный рецептор CD8+ цитотоксическими T-лимфоцитами, вызывающими клеточный иммунный ответ и экспрессирующими антиген-реактивный химерный рецептор, при этом указанный состав с модифицированными цитотоксическими T-лимфоцитами содержит экспрессирующие CD8+ Т-клетки, которые содержат химерный рецептор, содержащий лигандсвязывающий домен, при этом указанный лиганд представляет собой опухолеспецифичный антиген или нацеленный на опухоль антиген, или любую другую молекулу, экспрессируемую на клетках популяции целевых клеток, подходящую для опосредования распознавания и элиминации лимфоцитом; полипептидный спейсер, причем указанный полипептидный спейсер имеет индивидуальную длину, при этом указанный спейсер обеспечивает усиленную пролиферацию T-клеток, усиленную in vivo клеточную активность и/или синтез цитокинов по сравнению с референсным химерным рецептором; трансмембранный домен; и один или более внутриклеточных сигнальных доменов; и/или получение модифицированной экспрессирующей CD4+ наивной или хелперной T-клетки памяти, при этом указанный состав с модифицированными хелперными T-лимфоцитами содержит экспрессирующие CD4+ клетки, содержащие химерный рецептор, содержащий лигандсвязывающий домен, при этом указанный лиганд представляет собой опухолеспецифичный антиген или нацеленный на опухоль антиген, или любую другую молекулу, экспрессируемую на клетках популяции целевых клеток, подходящую для опосредования распознавания и элиминации лимфоцитом; полипептидный спейсер, причем указанный полипептидный спейсер имеет индивидуальную длину, при этом указанный спейсер оптимизирован; трансмембранный домен; и один или более внутриклеточных сигнальных доменов. Согласно некоторым вариантам реализации указанный спейсер оптимизирован для повышенной пролиферации T-клеток и/или синтеза цитокинов в ответ на лиганд по сравнению с референсным химерным рецептором. Согласно некоторым вариантам реализации лигандсвязывающий домен содержит антитело или антигенсвязывающий фрагмент, который специфически связывает эпитоп CD171 и/или нацелен на эпитоп CD171, чаще обнаруживаемый на опухолевых клетках, чем на здоровых клетках. Согласно другим вариантам реализации спейсерная область содержит короткий внеклеточный спейсер, длина которого может составлять 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты), например, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3 или 2 аминокислоты, или может находиться в диапазоне, ограниченном любыми двумя вышеупомянутыми вариантами длины. Согласно некоторым вариантам реализации сигнальный домен включает один сигнальный домен и не включает других сигнальных доменов.
[0027] Некоторые варианты реализации также относятся к нуклеиновой кислоте, кодирующей химерный рецептор. Согласно некоторым вариантам реализации указанная нуклеиновая кислота содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лигандсвязывающий домен связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, расположенный между лигандсвязывающим доменом и трансмембранным доменом, с) полинуклеотид, кодирующий трансмембранный домен, и d) полинуклеотид, кодирующий внутриклеточный сигнальный домен, при этом экспрессия химерного рецептора в популяции иммунных клеток приводит к повышенной выживаемости и/или персистенции иммунных клеток на протяжении периода времени после контакта с CD171 и/или повышению терапевтической эффективности при введении субъекту с экспрессирующей CD171 опухолью, связанному с экспрессией указанного референсного химерного рецептора, содержащего более длинный полипептидный спейсер. Согласно некоторым вариантам реализации указанная повышенная выживаемость и/или персистенция на протяжении периода времени включает относительное уменьшение антиген-индуцированной клеточной смерти согласно измерениям в стресс-тесте in vitro, включающем приведение клеток, экспрессирующих указанный химерный рецептор, в контакт с клетками, экспрессирующими CD171, на протяжении нескольких последовательных циклов, и/или указанная повышенная выживаемость и/или персистенция на протяжении периода времени включает повышение персистенции клеток in vivo после введения субъекту с экспрессирующей CD171 опухолью, и/или длина указанного более длинного полипептидного спейсера больше по меньшей мере в 2, 3, 4, 5, 6, 7, 8, 9 или 10 раз. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой фрагмент антитела. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент. Согласно некоторым вариантам реализации длина указанного спейсера составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации длина указанного спейсера составляет менее чем 200, 150, 100, 50 или 20 аминокислот или менее (но не менее чем 1 или 2 аминокислоты) или находится в диапазоне, ограниченном любыми двумя вышеупомянутыми вариантами длины.
[0028] Некоторые варианты реализации относятся к нуклеиновой кислоте химерного рецептора, при этом указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, который специфически связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, длина которого составляет менее 100 аминокислот (но не менее чем 1 или 2 аминокислоты), соединяющий лигандсвязывающий домен и трансмембранный домен химерного рецептора, с) полинуклеотид, кодирующий трансмембранный домен химерного рецептора, и полинуклеотид, кодирующий внутриклеточный сигнальный домен химерного рецептора. Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P, где X1 и X2 независимым образом представлены любой аминокислотой. Согласно некоторым вариантам реализации X1 и/или X2 представляет собой цистеин. Согласно некоторым вариантам реализации длина указанного спейсера составляет менее чем 15 аминокислот (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации длина указанного спейсера составляет 12, 13, 14 или 15 аминокислот или находится в диапазоне, ограниченном любыми двумя вышеупомянутыми вариантами длины. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный спейсер содержит, состоит или по существу состоит из EPKSCDKTHTCPPCP (SEQ ID NO: 17), ERKCCVECPPCP (SEQ ID NO: 18), ELKTPLGDTHTCPRCP (EPKSCDTPPPCPRCP)3 (SEQ ID NO: 19), ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный спейсер состоит или по существу состоит из ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, и NKG2C, В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен дополнительно не содержит внутриклеточной части другой костимулирующей молекулы, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части молекулы, выбранной из группы, состоящей из CD27, CD28, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части CD28. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера.
[0029] Согласно некоторым вариантам реализации предложена нуклеиновая кислота химерного рецептора, при этом указанная нуклеиновая кислота химерного рецептора содержит а) полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лигандсвязывающий домен связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер некоторой длины, при этом указанный спейсер оптимизирован, с) полинуклеотид, кодирующий трансмембранный домен, и d) полинуклеотид, кодирующий внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой фрагмент антитела. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент. Согласно некоторым вариантам реализации длина указанного спейсера составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера.
[0030] Согласно некоторым вариантам реализации предложен полипептид химерного рецептора, при этом указанный полипептид химерного рецептора кодирует нуклеиновая кислота химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит а) полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лигандсвязывающий домен связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер некоторой длины, при этом указанный спейсер оптимизирован, с) полинуклеотид, кодирующий трансмембранный домен, и d) полинуклеотид, кодирующий внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой фрагмент антитела. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент. Согласно некоторым вариантам реализации длина указанного спейсера составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера.
[0031] Согласно некоторым вариантам реализации предложен экспрессионный вектор, содержащий выделенную нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит а) полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лигандсвязывающий домен связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер некоторой длины, при этом указанный спейсер оптимизирован, с) полинуклеотид, кодирующий трансмембранный домен, и d) полинуклеотид, кодирующий внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой фрагмент антитела. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент. Согласно некоторым вариантам реализации длина указанного спейсера составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера.
[0032] Согласно некоторым вариантам реализации предложена клетка-хозяин, содержащая экспрессионный вектор. Согласно некоторым вариантам реализации указанный экспрессионный вектор содержит выделенную нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит а) полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лигандсвязывающий домен связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер некоторой длины, при этом указанный спейсер оптимизирован, с) полинуклеотид, кодирующий трансмембранный домен, и d) полинуклеотид, кодирующий внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой фрагмент антитела. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент. Согласно некоторым вариантам реализации длина указанного спейсера составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит, выбранный из группы, состоящей из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти и смешанных CD8+ Т-клеток. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO+, CD62L+ и CD8+. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA+, CD62L+ и CD4+, и отрицательной по CD45RO. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой клетку-предшественника T-клетки. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой гемопоэтическую стволовую клетку.
[0033] Согласно некоторым вариантам реализации предложена композиция, содержащая клетку-хозяин в фармацевтически приемлемом вспомогательном веществе. Согласно некоторым вариантам реализации указанная клетка-хозяин содержит экспрессионный вектор. Согласно некоторым вариантам реализации указанный экспрессионный вектор содержит выделенную нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит а) полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лигандсвязывающий домен связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер некоторой длины, при этом указанный спейсер оптимизирован, с) полинуклеотид, кодирующий трансмембранный домен, и d) полинуклеотид, кодирующий внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой фрагмент антитела. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент. Согласно некоторым вариантам реализации длина указанного спейсера составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит, выбранный из группы, состоящей из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти и смешанных CD8+ Т-клеток. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO+, CD62L+ и CD8+. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA+, CD62L+ и CD4+, и отрицательной по CD45RO. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой клетку-предшественника T-клетки. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой гемопоэтическую стволовую клетку. Согласно некоторым вариантам реализации указанная композиция содержит CD8+ цитотоксический T-лимфоцит, выбранный из группы, состоящей из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти и смешанных CD8+ Т-клеток, или центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO+, CD62L+ и CD8+, и другую клетку-хозяина, при этом указанная клетка-хозяин представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO+, CD62L+ и CD8+, или CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток, или наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA+, CD62L+ и CD4+, и отрицательной по CD45RO.
[0034] Согласно некоторым вариантам реализации предложен способ получения клетки-хозяина, включающий а) получение библиотеки нуклеиновых кислот, кодирующих химерный рецептор, причем каждая нуклеиновая кислота совокупности нуклеиновых кислот кодирует химерный рецептор отличной длины, b) введение каждой нуклеиновой кислоты из указанной совокупности нуклеиновых кислот в отдельную популяцию выделенных T-лимфоцитов и размножение каждой популяции T-лимфоцитов in vitro, с) введение каждой популяции генетически модифицированных T-лимфоцитов несущим опухоли животным в моделях на животных и определение наличия у популяции генетически модифицированных T-лимфоцитов противоопухолевой эффективности и d) выбор нуклеиновой кислоты, кодирующей химерный рецептор, обеспечивающий противоопухолевую эффективность. Согласно некоторым вариантам реализации указанная клетка-хозяин содержит экспрессионный вектор. Согласно некоторым вариантам реализации указанный экспрессионный вектор содержит выделенную нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит а) полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лигандсвязывающий домен связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер некоторой длины, при этом указанный спейсер оптимизирован, с) полинуклеотид, кодирующий трансмембранный домен, и d) полинуклеотид, кодирующий внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой фрагмент антитела. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент. Согласно некоторым вариантам реализации длина указанного спейсера составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит, выбранный из группы, состоящей из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти и смешанных CD8+ Т-клеток. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO+, CD62L+ и CD8+. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA+, CD62L+ и CD4+, и отрицательной по CD45RO. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой клетку-предшественника T-клетки. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой гемопоэтическую стволовую клетку. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит а) полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лигандсвязывающий домен связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер некоторой длины, при этом указанный спейсер оптимизирован, с) полинуклеотид, кодирующий трансмембранный домен, и d) полинуклеотид, кодирующий внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой фрагмент антитела. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент. Согласно некоторым вариантам реализации длина указанного спейсера составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанный способ дополнительно включает введение выбранной нуклеиновой кислоты, кодирующей химерный рецептор, в клетку-хозяина.
[0035] Согласно некоторым вариантам реализации предложен способ получения клетки-хозяина по любому из пунктов формулы изобретения, при этом указанный способ включает а) введение нуклеиновой кислоты или экспрессионного вектора в популяцию лимфоцитов с фенотипами CD45RA-, CD45RO+ и CD62L+ и b) культивирование указанных клеток в присутствии антител к CD3 и/или к CD28, и по меньшей мере одного гомеостатического цитокина до получения достаточного количества клеток для применения в качестве клеточной инфузии. Согласно некоторым вариантам реализации указанный экспрессионный вектор содержит выделенную нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит а) полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лигандсвязывающий домен связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер некоторой длины, при этом указанный спейсер оптимизирован, с) полинуклеотид, кодирующий трансмембранный домен, и d) полинуклеотид, кодирующий внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой фрагмент антитела. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент. Согласно некоторым вариантам реализации длина указанного спейсера составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит, выбранный из группы, состоящей из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти и смешанных CD8+ Т-клеток. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO+, CD62L+ и CD8+. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA+, CD62L+ и CD4+, и отрицательной по CD45RO. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой клетку-предшественника T-клетки. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой гемопоэтическую стволовую клетку. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанный лимфоцит представляет собой CD8+ или CD4+.
[0036] Согласно некоторым вариантам реализации предложено применение клетки-хозяина или композиции согласно формуле изобретения, при этом указанное применение относится к лечению ракового заболевания или солидной опухоли, экспрессирующего(ей) CD171. Согласно некоторым вариантам реализации указанная клетка-хозяин содержит экспрессионный вектор. Согласно некоторым вариантам реализации указанный экспрессионный вектор содержит выделенную нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит а) полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лигандсвязывающий домен связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер некоторой длины, при этом указанный спейсер оптимизирован, с) полинуклеотид, кодирующий трансмембранный домен, и d) полинуклеотид, кодирующий внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой фрагмент антитела. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент. Согласно некоторым вариантам реализации длина указанного спейсера составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит, выбранный из группы, состоящей из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти и смешанных CD8+ Т-клеток. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO+, CD62L+ и CD8+. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA+, CD62L+ и CD4+, и отрицательной по CD45RO. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой клетку-предшественника T-клетки. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой гемопоэтическую стволовую клетку. Согласно некоторым вариантам реализации предложена композиция, содержащая клетку-хозяина в фармацевтически приемлемом вспомогательном веществе. Согласно некоторым вариантам реализации указанная клетка-хозяин содержит экспрессионный вектор. Согласно некоторым вариантам реализации указанный экспрессионный вектор содержит выделенную нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит а) полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лигандсвязывающий домен связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер некоторой длины, при этом указанный спейсер оптимизирован, с) полинуклеотид, кодирующий трансмембранный домен, и d) полинуклеотид, кодирующий внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой фрагмент антитела. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент. Согласно некоторым вариантам реализации длина указанного спейсера составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит, выбранный из группы, состоящей из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти и смешанных CD8+ Т-клеток. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO+, CD62L+ и CD8+. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA+, CD62L+ и CD4+, и отрицательной по CD45RO. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой клетку-предшественника T-клетки. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой гемопоэтическую стволовую клетку. Согласно некоторым вариантам реализации указанная композиция содержит CD8+ цитотоксический T-лимфоцит, выбранный из группы, состоящей из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти и смешанных CD8+ Т-клеток, или центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO+, CD62L+ и CD8+, и другую клетку-хозяина, при этом указанная клетка-хозяин представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO+, CD62L+ и CD8+, или CD4+ хелперный T-лимфоцит выбран из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток, или наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA+, CD62L+ и CD4+, и отрицательной по CD45RO. Согласно некоторым вариантам реализации указанное раковое заболевание представляет собой нейробластому. Согласно некоторым вариантам реализации указанная солидная опухоль выбрана из группы, состоящей из рака молочной железы, рака головного мозга, рака толстой кишки, рака почки, рака поджелудочной железы и рака яичников.
[0037] Согласно некоторым вариантам реализации предложен способ осуществления клеточной иммунотерапии у субъекта, у которого имеется раковое заболевание или опухоль, при этом указанный способ включает введение композиции или клетки-хозяина указанному субъекту. Согласно некоторым вариантам реализации указанная клетка-хозяин содержит экспрессионный вектор. Согласно некоторым вариантам реализации указанный экспрессионный вектор содержит выделенную нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит а) полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лигандсвязывающий домен связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер некоторой длины, при этом указанный спейсер оптимизирован, с) полинуклеотид, кодирующий трансмембранный домен, и d) полинуклеотид, кодирующий внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой фрагмент антитела. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент. Согласно некоторым вариантам реализации длина указанного спейсера составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит, выбранный из группы, состоящей из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти и смешанных CD8+ Т-клеток. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO+, CD62L+ и CD8+. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA+, CD62L+ и CD4+, и отрицательной по CD45RO. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой клетку-предшественника T-клетки. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой гемопоэтическую стволовую клетку. Согласно некоторым вариантам реализации предложена композиция, содержащая клетку-хозяина, в фармацевтически приемлемом вспомогательном веществе. Согласно некоторым вариантам реализации указанная клетка-хозяин содержит экспрессионный вектор. Согласно некоторым вариантам реализации указанный экспрессионный вектор содержит выделенную нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит а) полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лигандсвязывающий домен связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер некоторой длины, при этом указанный спейсер оптимизирован, с) полинуклеотид, кодирующий трансмембранный домен, и d) полинуклеотид, кодирующий внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой фрагмент антитела. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент. Согласно некоторым вариантам реализации длина указанного спейсера составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит, выбранный из группы, состоящей из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти и смешанных CD8+ Т-клеток. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO+, CD62L+ и CD8+. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA+, CD62L+ и CD4+, и отрицательной по CD45RO. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой клетку-предшественника T-клетки. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой гемопоэтическую стволовую клетку. Согласно некоторым вариантам реализации указанная композиция содержит CD8+ цитотоксический T-лимфоцит, выбранный из группы, состоящей из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти и смешанных CD8+ Т-клеток, или центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO+, CD62L+ и CD8+, и другую клетку-хозяина, при этом указанная клетка-хозяин представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO+, CD62L+ и CD8+; или CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток; или наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA+, CD62L+ и CD4+, и отрицательной по CD45RO. Согласно некоторым вариантам реализации указанное раковое заболевание представляет собой нейробластому. Согласно некоторым вариантам реализации указанная опухоль выбрана из группы, состоящей из рака молочной железы, рака головного мозга, рака толстой кишки, рака почки, рака поджелудочной железы и рака яичников. Согласно некоторым вариантам реализации указанный спейсер оптимизирован для повышенной пролиферации T-клеток и/или синтеза цитокинов в ответ на лиганд по сравнению с референсным химерным рецептором.
[0038] Другой вариант реализации относится к полипептиду химерного рецептора, кодируемому нуклеиновой кислотой химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, который специфически связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, длина которого составляет менее 100 аминокислот (но не менее чем 1 или 2 аминокислоты), соединяющий лигандсвязывающий домен и трансмембранный домен химерного рецептора, с) полинуклеотид, кодирующий трансмембранный домен химерного рецептора, и полинуклеотид, кодирующий внутриклеточный сигнальный домен химерного рецептора. Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P, где X1 и X2 независимым образом представлены любой аминокислотой. Согласно некоторым вариантам реализации X1 и/или X2 представляет собой цистеин. Согласно некоторым вариантам реализации длина указанного спейсера составляет менее чем 15 аминокислот (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации длина указанного спейсера составляет 12, 13, 14 или 15 аминокислот или находится в диапазоне, ограниченном любыми двумя вышеупомянутыми вариантами длины. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный спейсер содержит, состоит или по существу состоит из EPKSCDKTHTCPPCP (SEQ ID NO: 17), ERKCCVECPPCP (SEQ ID NO: 18), ELKTPLGDTHTCPRCP (EPKSCDTPPPCPRCP)3 (SEQ ID NO: 19), ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный спейсер состоит или по существу состоит из ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен дополнительно не содержит внутриклеточной части другой костимулирующей молекулы, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части молекулы, выбранной из группы, состоящей из CD27, CD28, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части CD28. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанный спейсер обеспечивает повышенную пролиферацию T-клеток и/или синтез цитокинов в ответ на лиганд по сравнению с референсным химерным рецептором.
[0039] Другой вариант реализации относится к экспрессионному вектору, содержащему нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, который специфически связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, длина которого составляет менее 100 аминокислот (но не менее чем 1 или 2 аминокислоты), соединяющий лигандсвязывающий домен и трансмембранный домен химерного рецептора, с) полинуклеотид, кодирующий трансмембранный домен химерного рецептора, и полинуклеотид, кодирующий внутриклеточный сигнальный домен химерного рецептора. Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P, где X1 и X2 независимым образом представлены любой аминокислотой. Согласно некоторым вариантам реализации X1 и/или X2 представляет собой цистеин. Согласно некоторым вариантам реализации длина указанного спейсера составляет менее чем 15 аминокислот (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации длина указанного спейсера составляет 12, 13, 14 или 15 аминокислот или находится в диапазоне, ограниченном любыми двумя вышеупомянутыми вариантами длины. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный спейсер содержит, состоит или по существу состоит из EPKSCDKTHTCPPCP (SEQ ID NO: 17), ERKCCVECPPCP (SEQ ID NO: 18), ELKTPLGDTHTCPRCP (EPKSCDTPPPCPRCP)3 (SEQ ID NO: 19), ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный спейсер состоит или по существу состоит из ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен дополнительно не содержит внутриклеточной части другой костимулирующей молекулы, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части молекулы, выбранной из группы, состоящей из CD27, CD28, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части CD28. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанный спейсер обеспечивает повышенную пролиферацию T-клеток и/или синтез цитокинов в ответ на лиганд по сравнению с референсным химерным рецептором.
[0040] Согласно некоторым вариантам реализации предложена клетка-хозяин, содержащая экспрессионный вектор. Согласно некоторым вариантам реализации указанный экспрессионный вектор содержит нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, который специфически связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, длина которого составляет менее 100 аминокислот (но не менее чем 1 или 2 аминокислоты), соединяющий лигандсвязывающий домен и трансмембранный домен химерного рецептора, с) полинуклеотид, кодирующий трансмембранный домен химерного рецептора, и полинуклеотид, кодирующий внутриклеточный сигнальный домен химерного рецептора. Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P, где X1 и Х2 независимым образом представлены любой аминокислотой. Согласно некоторым вариантам реализации X1 и/или X2 представляет собой цистеин. Согласно некоторым вариантам реализации длина указанного спейсера составляет менее чем 15 аминокислот (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации длина указанного спейсера составляет 12, 13, 14 или 15 аминокислот или находится в диапазоне, ограниченном любыми двумя вышеупомянутыми вариантами длины. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный спейсер содержит, состоит или по существу состоит из EPKSCDKTHTCPPCP (SEQ ID NO: 17), ERKCCVECPPCP (SEQ ID NO: 18), ELKTPLGDTHTCPRCP (EPKSCDTPPPCPRCP)3 (SEQ ID NO: 19), ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный спейсер состоит или по существу состоит из ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен дополнительно не содержит внутриклеточной части другой костимулирующей молекулы, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части молекулы, выбранной из группы, состоящей из CD27, CD28, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части CD28. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO, CD62L и CD8. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA, CD62L и/или CD4, и/или отрицательной по CD45RO. Согласно некоторым вариантам реализации указанный спейсер обеспечивает повышенную пролиферацию T-клеток и/или синтез цитокинов в ответ на лиганд по сравнению с референсным химерным рецептором. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой клетку-предшественника T-клетки. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой гемопоэтическую стволовую клетку.
[0041] Согласно некоторым вариантам реализации предложена композиция, содержащая клетки-хозяева. Согласно некоторым вариантам реализации указанная композиция содержит клетки-хозяева, содержащие экспрессионный вектор. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой клетку-предшественника T-клетки. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой гемопоэтическую стволовую клетку. Согласно некоторым вариантам реализации указанный экспрессионный вектор содержит нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, который специфически связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, длина которого составляет менее 100 аминокислот (но не менее чем 1 или 2 аминокислоты), соединяющий лигандсвязывающий домен и трансмембранный домен химерного рецептора, с) полинуклеотид, кодирующий трансмембранный домен химерного рецептора, и полинуклеотид, кодирующий внутриклеточный сигнальный домен химерного рецептора. Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P, где X1 и X2 независимым образом представлены любой аминокислотой. Согласно некоторым вариантам реализации X1 и/или X2 представляет собой цистеин. Согласно некоторым вариантам реализации длина указанного спейсера составляет менее чем 15 аминокислот (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации длина указанного спейсера составляет 12, 13, 14 или 15 аминокислот или находится в диапазоне, ограниченном любыми двумя вышеупомянутыми вариантами длины. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный спейсер содержит, состоит или по существу состоит из EPKSCDKTHTCPPCP (SEQ ID NO: 17), ERKCCVECPPCP (SEQ ID NO: 18), ELKTPLGDTHTCPRCP (EPKSCDTPPPCPRCP)3 (SEQ ID NO: 19), ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный спейсер состоит или по существу состоит из ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен дополнительно не содержит внутриклеточной части другой костимулирующей молекулы, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части молекулы, выбранной из группы, состоящей из CD27, CD28, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части CD28. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит. Согласно некоторым вариантам реализации указанной композиции клетки-хозяева содержат популяцию CD8+ клеток, состоящую по существу из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти или смешанных CD8+ Т-клеток, или обогащенную по указанным клеткам. Согласно некоторым вариантам реализации указанная популяция CD8+ клеток состоит по существу из CD8+ центральных T-клеток памяти или была обогащена по CD8+ центральным T-клеткам памяти, положительным по CD45RO, CD62L и CD8. Согласно некоторым вариантам реализации указанные клетки-хозяева содержат популяцию CD4+ клеток, состоящую по существу из CD4+ хелперных T-лимфоцитов или обогащенную по CD4+ хелперным T-лимфоцитам, выбранным из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанная популяция CD4+ клеток состоит по существу из наивных CD4+ Т-клеток или была обогащена по наивным CD4+ Т-клеткам, положительным по CD45RA, CD62L, и CD4, и отрицательным по CD45RO. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO, CD62L и CD8. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA, CD62L и/или CD4, и/или отрицательной по CD45RO. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой клетку-предшественника T-клетки. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой гемопоэтическую стволовую клетку.
[0042] Согласно другому варианту реализации предложена композиция, содержащая клетку-хозяина, или композиция и фармацевтически приемлемое вспомогательное вещество. Согласно некоторым вариантам реализации указанная клетка-хозяин содержит экспрессионный вектор. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой клетку-предшественника T-клетки. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой гемопоэтическую стволовую клетку. Согласно некоторым вариантам реализации указанный экспрессионный вектор содержит нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, который специфически связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, длина которого составляет менее 100 аминокислот (но не менее чем 1 или 2 аминокислоты), соединяющий лигандсвязывающий домен и трансмембранный домен химерного рецептора, с) полинуклеотид, кодирующий трансмембранный домен химерного рецептора, и полинуклеотид, кодирующий внутриклеточный сигнальный домен химерного рецептора. Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P, где X1 и X2 независимым образом представлены любой аминокислотой. Согласно некоторым вариантам реализации X1 и/или X2 представляет собой цистеин. Согласно некоторым вариантам реализации длина указанного спейсера составляет менее чем 15 аминокислот (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации длина указанного спейсера составляет 12, 13, 14 или 15 аминокислот или находится в диапазоне, ограниченном любыми двумя вышеупомянутыми вариантами длины. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный спейсер содержит, состоит или по существу состоит из EPKSCDKTHTCPPCP (SEQ ID NO: 17), ERKCCVECPPCP (SEQ ID NO: 18), ELKTPLGDTHTCPRCP (EPKSCDTPPPCPRCP)3 (SEQ ID NO: 19), ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный спейсер состоит или по существу состоит из ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен дополнительно не содержит внутриклеточной части другой костимулирующей молекулы, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части молекулы, выбранной из группы, состоящей из CD27, CD28, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части CD28. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO, CD62L и/или CD8. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA, CD62L и/или CD4, и/или отрицательной по CD45RO. Согласно некоторым вариантам реализации указанная композиция содержит клетки-хозяева, содержащие экспрессионный вектор. Согласно некоторым вариантам реализации указанный экспрессионный вектор содержит нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, который специфически связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, длина которого составляет менее 100 аминокислот (но не менее чем 1 или 2 аминокислоты), соединяющий лигандсвязывающий домен и трансмембранный домен химерного рецептора, с) полинуклеотид, кодирующий трансмембранный домен химерного рецептора, и полинуклеотид, кодирующий внутриклеточный сигнальный домен химерного рецептора. Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P, где X1 и X2 независимым образом представлены любой аминокислотой. Согласно некоторым вариантам реализации X1 и/или X2 представляет собой цистеин. Согласно некоторым вариантам реализации длина указанного спейсера составляет менее чем 15 аминокислот (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации длина указанного спейсера составляет 12, 13, 14 или 15 аминокислот или находится в диапазоне, ограниченном любыми двумя вышеупомянутыми вариантами длины. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный спейсер содержит, состоит или по существу состоит из EPKSCDKTHTCPPCP (SEQ ID NO: 17), ERKCCVECPPCP (SEQ ID NO: 18), ELKTPLGDTHTCPRCP (EPKSCDTPPPCPRCP)3 (SEQ ID NO: 19), ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный спейсер состоит или по существу состоит из ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен дополнительно не содержит внутриклеточной части другой костимулирующей молекулы, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части молекулы, выбранной из группы, состоящей из CD27, CD28, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части CD28. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит. Согласно некоторым вариантам реализации указанной композиции клетки-хозяева содержат популяцию CD8+ клеток, состоящую по существу из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти или смешанных CD8+ Т-клеток, или обогащенную по указанным клеткам. Согласно некоторым вариантам реализации указанная популяция CD8+ клеток состоит по существу из CD8+ центральных T-клеток памяти или была обогащена по CD8+ центральным T-клеткам памяти, положительным по CD45RO, CD62L и/или CD8. Согласно некоторым вариантам реализации указанные клетки-хозяева содержат популяцию CD4+ клеток, состоящую по существу из CD4+ хелперных T-лимфоцитов или обогащенную по CD4+ хелперным T-лимфоцитам, выбранным из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанная популяция CD4+ клеток состоит по существу из наивных CD4+ Т-клеток или была обогащена по наивным CD4+ Т-клеткам, положительным по CD45RA, CD62L и/или CD4, и/или отрицательным по CD45RO. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO, CD62L и CD8. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA, CD62L и/или CD4, и/или отрицательной по CD45RO. Согласно некоторым вариантам реализации указанная композиция содержит клетку-хозяина, при этом указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит, или указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO, CD62L и/или CD8, и другую клетку-хозяина, при этом указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток, или указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA, CD62L и/или CD4, и/или отрицательной по CD45RO. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой клетку-предшественника T-клетки. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой гемопоэтическую стволовую клетку.
[0043] Согласно другому варианту реализации предложен in vitro способ получения клетки-хозяина. Согласно некоторым вариантам реализации указанная клетка-хозяин содержит экспрессионный вектор. Согласно некоторым вариантам реализации указанный экспрессионный вектор содержит нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, который специфически связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, длина которого составляет менее 100 аминокислот (но не менее чем 1 или 2 аминокислоты), соединяющий лигандсвязывающий домен и трансмембранный домен химерного рецептора, с) полинуклеотид, кодирующий трансмембранный домен химерного рецептора, и полинуклеотид, кодирующий внутриклеточный сигнальный домен химерного рецептора. Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P, где X1 и X2 независимым образом представлены любой аминокислотой. Согласно некоторым вариантам реализации X1 и/или X2 представляет собой цистеин. Согласно некоторым вариантам реализации длина указанного спейсера составляет менее чем 15 аминокислот (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации длина указанного спейсера составляет 12, 13, 14 или 15 аминокислот или находится в диапазоне, ограниченном любыми двумя вышеупомянутыми вариантами длины. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный спейсер содержит, состоит или по существу состоит из EPKSCDKTHTCPPCP (SEQ ID NO: 17), ERKCCVECPPCP (SEQ ID NO: 18), ELKTPLGDTHTCPRCP (EPKSCDTPPPCPRCP)3 (SEQ ID NO: 19), ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный спейсер состоит или по существу состоит из ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен дополнительно не содержит внутриклеточной части другой костимулирующей молекулы, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части молекулы, выбранной из группы, состоящей из CD27, CD28, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части CD28. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO, CD62L и/или CD8. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA, CD62L и/или CD4, и/или отрицательной по CD45RO. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO, CD62L и/или CD8. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA, CD62L и/или CD4, и/или отрицательной по CD45RO. Согласно некоторым вариантам реализации указанный способ включает а) получение библиотеки, содержащей совокупность нуклеиновых кислот, каждая из которых кодирует химерный рецептор, причем длина каждого рецептора совокупности химерных рецепторов, кодируемой указанной совокупностью нуклеиновых кислот, отличается, b) введение каждой нуклеиновой кислоты из указанной совокупности нуклеиновых кислот в отдельную популяцию лимфоцитов и размножение каждой популяции T-лимфоцитов in vitro, с получением таким образом совокупности генетически модифицированных популяций T-лимфоцитов, с) введение каждой популяции из совокупности популяций генетически модифицированных T-лимфоцитов несущим опухоли животным в моделях на животных и оценку показателей противоопухолевой эффективности и d) выбор нуклеиновой кислоты, кодирующей химерный рецептор, проявляющий противоопухолевую эффективность in vitro и/или в модели на животных. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, который специфически связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, длина которого составляет менее 100 аминокислот (но не менее чем 1 или 2 аминокислоты), соединяющий лигандсвязывающий домен и трансмембранный домен химерного рецептора, с) полинуклеотид, кодирующий трансмембранный домен химерного рецептора, и полинуклеотид, кодирующий внутриклеточный сигнальный домен химерного рецептора. Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P, где X1 и Х2 независимым образом представлены любой аминокислотой. Согласно некоторым вариантам реализации X1 и/или X2 представляет собой цистеин. Согласно некоторым вариантам реализации длина указанного спейсера составляет менее чем 15 аминокислот (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации длина указанного спейсера составляет 12, 13, 14 или 15 аминокислот или находится в диапазоне, ограниченном любыми двумя вышеупомянутыми вариантами длины. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный спейсер содержит, состоит или по существу состоит из EPKSCDKTHTCPPCP (SEQ ID NO: 17), ERKCCVECPPCP (SEQ ID NO: 18), ELKTPLGDTHTCPRCP (EPKSCDTPPPCPRCP)3 (SEQ ID NO: 19), ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный спейсер состоит или по существу состоит из ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен дополнительно не содержит внутриклеточной части другой костимулирующей молекулы, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части молекулы, выбранной из группы, состоящей из CD27, CD28, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части CD28. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанная совокупность нуклеиновых кислот кодирует экспрессионный вектор. Согласно некоторым вариантам реализации указанный экспрессионный вектор содержит нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, который специфически связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, длина которого составляет менее 100 аминокислот (но не менее чем 1 или 2 аминокислоты), соединяющий лигандсвязывающий домен и трансмембранный домен химерного рецептора, с) полинуклеотид, кодирующий трансмембранный домен химерного рецептора, и полинуклеотид, кодирующий внутриклеточный сигнальный домен химерного рецептора. Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P, где X1 и X2 независимым образом представлены любой аминокислотой. Согласно некоторым вариантам реализации X1 и/или X2 представляет собой цистеин. Согласно некоторым вариантам реализации длина указанного спейсера составляет менее чем 15 аминокислот (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации длина указанного спейсера составляет 12, 13, 14 или 15 аминокислот или находится в диапазоне, ограниченном любыми двумя вышеупомянутыми вариантами длины. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный спейсер содержит, состоит или по существу состоит из EPKSCDKTHTCPPCP (SEQ ID NO: 17), ERKCCVECPPCP (SEQ ID NO: 18), ELKTPLGDTHTCPRCP (EPKSCDTPPPCPRCP)3 (SEQ ID NO: 19), ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный спейсер состоит или по существу состоит из ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен дополнительно не содержит внутриклеточной части другой костимулирующей молекулы, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части молекулы, выбранной из группы, состоящей из CD27, CD28, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части CD28. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанный способ дополнительно включает введение выбранной нуклеиновой кислоты, кодирующей химерный рецептор, в клетку-хозяина. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой клетку-предшественника T-клетки. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой гемопоэтическую стволовую клетку.
[0044] Согласно некоторым вариантам реализации предложен способ выбора химерного рецептора для нацеливания на антиген in vitro, при этом указанный способ включает инкубирование каждой популяции из совокупности популяций клеток с донорными клетками, экспрессирующими указанный антиген, в ходе серии последовательных рекурсивных циклов, при этом указанная совокупность популяций клеток содержит нуклеиновые кислоты, кодирующие совокупность химерных рецепторов варьирующей длины, каждый из которых специфически связывается с указанным антигеном и/или нацелен на указанный антиген, и оценку размножения, активации и/или выживаемости каждой популяции из совокупности популяций клеток, и выбор химерного рецептора на основании указанной оценки. Согласно некоторым вариантам реализации указанная серия последовательных циклов включает по меньшей мере три цикла инкубации, при этом указанные популяции клеток собирают между циклами. Согласно некоторым вариантам реализации указанную оценку проводят путем детекции выживаемости, или числа или процента выживших в каждой популяции клеток после последовательных циклов инкубации, при этом выбранный химерный рецептор экспрессируется популяцией, в которой выживаемость, или число или процент клеток повышены относительно другой популяции из совокупности популяций клеток. Согласно некоторым вариантам реализации клетки указанных популяций и клетки, экспрессирующие указанный антиген, инкубируют в соотношении 1:1 в начале каждого цикла. Согласно некоторым вариантам реализации указанные химерные рецепторы варьирующей длины содержат спейсеры различной длины, при этом каждый спейсер соединяет антигенсвязывающий домен и трансмембранный домен химерного рецептора; и/или указанные химерные рецепторы варьирующей длины содержат химерные рецепторы с варьирующим числом внутриклеточных костимулирующих доменов, при этом каждый внутриклеточный домен происходит индивидуальным образом от разных природных костимулирующих молекул. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой клетку-предшественника T-клетки. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой гемопоэтическую стволовую клетку.
[0045] Согласно другим вариантам реализации предложен способ получения клетки-хозяина in vitro, при этом указанный способ включает: введение нуклеиновой кислоты согласно приведенному выше описанию, или экспрессионный вектор согласно приведенному выше описанию в популяцию лимфоцитов с фенотипами CD45RA, CD45RO+ и/или CD62L+, и культивирование указанных клеток в присутствии антител к CD3 и/или к CD28, и по меньшей мере одного гомеостатического цитокина до получения достаточного количества клеток для применения в качестве клеточной инфузии. Согласно некоторым вариантам реализации указанная клетка-хозяин содержит экспрессионный вектор согласно приведенному выше описанию. Согласно некоторым вариантам реализации указанный экспрессионный вектор содержит нуклеиновую кислоту химерного рецептора согласно приведенному выше описанию. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, который специфически связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, длина которого составляет менее 100 аминокислот (но не менее чем 1 или 2 аминокислоты), соединяющий лигандсвязывающий домен и трансмембранный домен химерного рецептора, с) полинуклеотид, кодирующий трансмембранный домен химерного рецептора, и полинуклеотид, кодирующий внутриклеточный сигнальный домен химерного рецептора. Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P, где X1 и X2 независимым образом представлены любой аминокислотой. Согласно некоторым вариантам реализации X1 и/или X2 представляет собой цистеин. Согласно некоторым вариантам реализации длина указанного спейсера составляет менее чем 15 аминокислот (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации длина указанного спейсера составляет 12, 13, 14 или 15 аминокислот или находится в диапазоне, ограниченном любыми двумя вышеупомянутыми вариантами длины. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный спейсер содержит, состоит или по существу состоит из EPKSCDKTHTCPPCP (SEQ ID NO: 17), ERKCCVECPPCP (SEQ ID NO: 18), ELKTPLGDTHTCPRCP (EPKSCDTPPPCPRCP)3 (SEQ ID NO: 19), ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный спейсер состоит или по существу состоит из ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен дополнительно не содержит внутриклеточной части другой костимулирующей молекулы, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части молекулы, выбранной из группы, состоящей из CD27, CD28, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части CD28. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO, CD62L и/или CD8. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA, CD62L и/или CD4, и/или отрицательной по CD45RO. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, который специфически связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, длина которого составляет менее 100 аминокислот (но не менее чем 1 или 2 аминокислоты), соединяющий лигандсвязывающий домен и трансмембранный домен химерного рецептора, с) полинуклеотид, кодирующий трансмембранный домен химерного рецептора, и полинуклеотид, кодирующий внутриклеточный сигнальный домен химерного рецептора. Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P, где X1 и X2 независимым образом представлены любой аминокислотой. Согласно некоторым вариантам реализации X1 и/или X2 представляет собой цистеин. Согласно некоторым вариантам реализации длина указанного спейсера составляет менее чем 15 аминокислот (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации длина указанного спейсера составляет 12, 13, 14 или 15 аминокислот или находится в диапазоне, ограниченном любыми двумя вышеупомянутыми вариантами длины. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный спейсер содержит, состоит или по существу состоит из EPKSCDKTHTCPPCP (SEQ ID NO: 17), ERKCCVECPPCP (SEQ ID NO: 18), ELKTPLGDTHTCPRCP (EPKSCDTPPPCPRCP)3 (SEQ ID NO: 19), ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный спейсер состоит или по существу состоит из ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен дополнительно не содержит внутриклеточной части другой костимулирующей молекулы, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части молекулы, выбранной из группы, состоящей из CD27, CD28, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части CD28. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанный лимфоцит представляет собой лимфоцит CD8+ или CD4+. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой клетку-предшественника T-клетки. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой гемопоэтическую стволовую клетку.
[0046] Согласно некоторым вариантам реализации предложено применение клетки-хозяина или композиции для лечения или ингибирования ракового заболевания или солидной опухоли, экспрессирующего(ей) CD171. Согласно некоторым вариантам реализации указанное раковое заболевание представляет собой нейробластому. Согласно некоторым вариантам реализации указанная солидная опухоль выбрана из группы, состоящей из рака молочной железы, рака головного мозга, рака толстой кишки, рака почки, рака поджелудочной железы и рака яичников. Согласно некоторым вариантам реализации указанная клетка-хозяин содержит экспрессионный вектор согласно описанию в настоящем документе. Согласно некоторым вариантам реализации указанный экспрессионный вектор содержит нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, который специфически связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, длина которого составляет менее 100 аминокислот (но не менее чем 1 или 2 аминокислоты), соединяющий лигандсвязывающий домен и трансмембранный домен химерного рецептора, с) полинуклеотид, кодирующий трансмембранный домен химерного рецептора, и полинуклеотид, кодирующий внутриклеточный сигнальный домен химерного рецептора. Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P, где X1 и X2 независимым образом представлены любой аминокислотой. Согласно некоторым вариантам реализации X1 и/или X2 представляет собой цистеин. Согласно некоторым вариантам реализации длина указанного спейсера составляет менее чем 15 аминокислот (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации длина указанного спейсера составляет 12, 13, 14 или 15 аминокислот или находится в диапазоне, ограниченном любыми двумя вышеупомянутыми вариантами длины. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный спейсер содержит, состоит или по существу состоит из EPKSCDKTHTCPPCP (SEQ ID NO: 17), ERKCCVECPPCP (SEQ ID NO: 18), ELKTPLGDTHTCPRCP (EPKSCDTPPPCPRCP)3 (SEQ ID NO: 19), ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный спейсер состоит или по существу состоит из ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен дополнительно не содержит внутриклеточной части другой костимулирующей молекулы, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части молекулы, выбранной из группы, состоящей из CD27, CD28, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и B7-H3, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части CD28. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO, CD62L и/или CD8. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA, CD62L и/или CD4, и/или отрицательной по CD45RO. Согласно некоторым вариантам реализации композиция содержит клетки-хозяева. Согласно некоторым вариантам реализации указанная композиция содержит клетки-хозяева, содержащие экспрессионный вектор согласно описанию в настоящем документе. Согласно некоторым вариантам реализации указанный экспрессионный вектор содержит нуклеиновую кислоту химерного рецептора согласно описанию в настоящем документе. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, который специфически связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, длина которого составляет менее 100 аминокислот (но не менее чем 1 или 2 аминокислоты), соединяющий лигандсвязывающий домен и трансмембранный домен химерного рецептора, с) полинуклеотид, кодирующий трансмембранный домен химерного рецептора, и полинуклеотид, кодирующий внутриклеточный сигнальный домен химерного рецептора. Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P, где X1 и X2 независимым образом представлены любой аминокислотой. Согласно некоторым вариантам реализации X1 и/или X2 представляет собой цистеин. Согласно некоторым вариантам реализации длина указанного спейсера составляет менее чем 15 аминокислот (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации длина указанного спейсера составляет 12, 13, 14 или 15 аминокислот или находится в диапазоне, ограниченном любыми двумя вышеупомянутыми вариантами длины. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный спейсер содержит, состоит или по существу состоит из EPKSCDKTHTCPPCP (SEQ ID NO: 17), ERKCCVECPPCP (SEQ ID NO: 18), ELKTPLGDTHTCPRCP (EPKSCDTPPPCPRCP)3 (SEQ ID NO: 19), ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный спейсер состоит или по существу состоит из ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен дополнительно не содержит внутриклеточной части другой костимулирующей молекулы, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части молекулы, выбранной из группы, состоящей из CD27, CD28, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части CD28. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит. Согласно некоторым вариантам реализации указанной композиции клетки-хозяева включают популяцию CD8+ клеток, состоящую по существу из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти или смешанных CD8+ Т-клеток, или обогащенную по указанным клеткам. Согласно некоторым вариантам реализации указанная популяция CD8+ клеток состоит по существу из CD8+ центральных T-клеток памяти или была обогащена по CD8+ центральным T-клеткам памяти, положительным по CD45RO, CD62L и CD8. Согласно некоторым вариантам реализации указанные клетки-хозяева содержат популяцию CD4+ клеток, состоящую по существу из CD4+ хелперных T-лимфоцитов или обогащенную по CD4+ хелперным T-лимфоцитам, выбранным из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанная популяция CD4+ клеток состоит по существу из наивных CD4+ Т-клеток или была обогащена по наивным CD4+ Т-клеткам, положительным по CD45RA, CD62L и CD4, и отрицательным по CD45RO. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO, CD62L и CD8. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA, CD62L и/или CD4, и/или отрицательной по CD45RO. Согласно некоторым вариантам реализации указанная композиция дополнительно содержит фармацевтически приемлемое вспомогательное вещество. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой клетку-предшественника T-клетки. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой гемопоэтическую стволовую клетку.
[0047] Согласно некоторым вариантам реализации предложен способ осуществления клеточной иммунотерапии у субъекта, у которого имеется раковое заболевание или опухоль, при этом указанный способ включает: введение композиции или клетки-хозяина согласно формуле изобретения указанному субъекту. Согласно некоторым вариантам реализации указанное раковое заболевание представляет собой нейробластому. Согласно некоторым вариантам реализации указанная опухоль выбрана из группы, состоящей из рака молочной железы, рака головного мозга, рака толстой кишки, рака почки, рака поджелудочной железы и рака яичников. Согласно некоторым вариантам реализации указанная клетка-хозяин содержит экспрессионный вектор согласно описанию в настоящем документе. Согласно некоторым вариантам реализации указанный экспрессионный вектор содержит нуклеиновую кислоту химерного рецептора согласно описанию в настоящем документе. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, который специфически связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, длина которого составляет менее 100 аминокислот (но не менее чем 1 или 2 аминокислоты), соединяющий лигандсвязывающий домен и трансмембранный домен химерного рецептора, с) полинуклеотид, кодирующий трансмембранный домен химерного рецептора, и полинуклеотид, кодирующий внутриклеточный сигнальный домен химерного рецептора. Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P, где X1 и X2 независимым образом представлены любой аминокислотой. Согласно некоторым вариантам реализации X1 и/или X2 представляет собой цистеин. Согласно некоторым вариантам реализации длина указанного спейсера составляет менее чем 15 аминокислот (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации длина указанного спейсера составляет 12, 13, 14 или 15 аминокислот или находится в диапазоне, ограниченном любыми двумя вышеупомянутыми вариантами длины. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный спейсер содержит, состоит или по существу состоит из EPKSCDKTHTCPPCP (SEQ ID NO: 17), ERKCCVECPPCP (SEQ ID NO: 18), ELKTPLGDTHTCPRCP (EPKSCDTPPPCPRCP)3 (SEQ ID NO: 19), ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный спейсер состоит или по существу состоит из ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен дополнительно не содержит внутриклеточной части другой костимулирующей молекулы, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части молекулы, выбранной из группы, состоящей из CD27, CD28, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части CD28. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO, CD62L и/или CD8. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA, CD62L и/или CD4, и/или отрицательной по CD45RO. Согласно некоторым вариантам реализации композиция содержит клетки-хозяева. Согласно некоторым вариантам реализации указанная композиция содержит клетки-хозяева, содержащие экспрессионный вектор. Согласно некоторым вариантам реализации указанный экспрессионный вектор содержит нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, который специфически связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, длина которого составляет менее 100 аминокислот (но не менее чем 1 или 2 аминокислоты), соединяющий лигандсвязывающий домен и трансмембранный домен химерного рецептора, с) полинуклеотид, кодирующий трансмембранный домен химерного рецептора, и полинуклеотид, кодирующий внутриклеточный сигнальный домен химерного рецептора. Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P, где X1 и X2 независимым образом представлены любой аминокислотой. Согласно некоторым вариантам реализации X1 и/или X2 представляет собой цистеин. Согласно некоторым вариантам реализации длина указанного спейсера составляет менее чем 15 аминокислот (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации длина указанного спейсера составляет 12, 13, 14 или 15 аминокислот или находится в диапазоне, ограниченном любыми двумя вышеупомянутыми вариантами длины. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный спейсер содержит, состоит или по существу состоит из EPKSCDKTHTCPPCP (SEQ ID NO: 17), ERKCCVECPPCP (SEQ ID NO: 18), ELKTPLGDTHTCPRCP (EPKSCDTPPPCPRCP)3 (SEQ ID NO: 19), ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный спейсер состоит или по существу состоит из ESKYGPPCPSCP (SEQ ID NO: 20), ESKYGPPCPPCP (SEQ ID NO: 21), YGPPCPPCP (SEQ ID NO: 51), KYGPPCPPCP (SEQ ID NO: 52) или EVVKYGPPCPPCP (SEQ ID NO: 53). Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен дополнительно не содержит внутриклеточной части другой костимулирующей молекулы, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части молекулы, выбранной из группы, состоящей из CD27, CD28, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3, и/или внутриклеточный сигнальный домен не содержит внутриклеточной сигнальной части CD28. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит. Согласно некоторым вариантам реализации указанной композиции клетки-хозяева содержат популяцию CD8+ клеток, состоящую по существу из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти или смешанных CD8+ Т-клеток, или обогащенную по указанным клеткам. Согласно некоторым вариантам реализации указанная популяция CD8+ клеток состоит по существу из CD8+ центральных T-клеток памяти или была обогащена по CD8+ центральным T-клеткам памяти, положительным по CD45RO, CD62L и/или CD8. Согласно некоторым вариантам реализации указанные клетки-хозяева содержат популяцию CD4+ клеток, состоящую по существу из CD4+ хелперных T-лимфоцитов или обогащенную по CD4+ хелперным T-лимфоцитам, выбранным из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанная популяция CD4+ клеток состоит по существу из наивных CD4+ Т-клеток или была обогащена по наивным CD4+ Т-клеткам, положительным по CD45RA, CD62L и/или CD4, и/или отрицательной по CD45RO. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO, CD62L и/или CD8. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA, CD62L и/или CD4, и/или отрицательной по CD45RO. Согласно некоторым вариантам реализации указанная композиция дополнительно содержит фармацевтически приемлемое вспомогательное вещество. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой клетку-предшественника T-клетки. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой гемопоэтическую стволовую клетку.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0048] На фиг. 1 показано выделение центральных T-клеток памяти из мононуклеарных клеток периферической крови. А) показан профиль проточной цитометрии клеток после предварительной сортировки по маркерам CD4 и CD8. В) показан профиль проточной цитометрии клеток после сортировки по наличию CD8. С) показан профиль проточной цитометрии клеток после истощения по популяции клеток CD8+ для отбора клеток, положительных по CD45RA. D) показан профиль проточной цитометрии популяции клеток, обогащенной по CD8, после истощения по CD45RA, обогащенной по CD45RO и обогащенной по CD62L.
[0049] На фиг. 2А показаны профили проточной цитометрии CD8 центральных клеток памяти, трансфицированные конструкциями CAR, содержащими короткий, средний или длинный спейсер. Экспрессию CAR к CD171 детектируют с применением антитела, которое связывается с F(ab). На дополнительных графиках на каждой панели приведен % клеток, экспрессирующих CD 8 и усеченного рЭФР, присутствующих в каждой конструкции в каждой популяции клеток. На панели 1 показаны ложноинфицированные клетки и не наблюдается экспрессии F(ab) или рЭФР-t. На панели 2 показана экспрессия короткой конструкции по оценке на основании экспрессии CD8, рЭФР-t и F(ab). На панели 3 показана экспрессия конструкции промежуточного размера по оценке на основании экспрессии CD8, рЭФР-t и F(ab). На панели 4 показана экспрессия длинной конструкции по оценке на основании экспрессии CD8, рЭФР-t и F(ab). Экспрессия каждой из указанных конструкций в клетках CD8 аналогична независимо от того, используется ли в конструкции короткий (панель 2), средний (панель 3) или длинный спейсер (панель 4).
[0050] На фиг. 2В представлен вестерн-блоттинг с применением антитела к зета-цепи CD3, демонстрирующий эквивалентную экспрессию каждой конструкции, содержащей короткий, средний или длинный спейсер, в трансфицированных CD8 клетках. На дорожке 2 представлена экспрессия короткой конструкции. На дорожке 3 показана экспрессия конструкции промежуточного размера. На дорожке 4 показана экспрессия длинной конструкции.
[0051] На фиг. 2С показана цитолитическая активность ложноинфицированных CD8 клеток







[0052] На фиг. 2D показан синтез цитокинов клетками CD8, трансфицированными конструкцией с коротким спейсером, спейсером промежуточного размера или длинным спейсером при контакте с клетками нейробластомы Ве2 или контрольными TML. На панели 1 показано, что трансфицированные длинным спейсером CD8 клетки (L) продуцировали больше ИФН-γ чем CD8 клетки, трансфицированные спейсером промежуточного размера (I) и коротким спейсером (S), при контакте с клетками нейробластомы Ве2. На панели 2 показано, что трансфицированные длинным спейсером CD8 клетки (L) продуцировали больше IL-2, чем CD8 клетки, трансфицированные спейсером промежуточного размера (I) и коротким спейсером (S), при контакте с клетками нейробластомы Ве2. На панели 3 показано, что трансфицированные длинным спейсером CD8 клетки (L) продуцировали больше ФНО-α, чем CD8 клетки, трансфицированные спейсером промежуточного размера (I) и коротким спейсером (S), при контакте с клетками нейробластомы Ве2.
[0053] На фиг. 2Е показаны выживаемость и пролиферация опухолевых клеток в модели внутричерепного ксенотрансплантата нейробластомы у мышей NSG. На левом графике видно, что меченые клетки нейробластомы у мышей, получающих лечение CD8 клетками, трансфицированными короткой конструкцией, демонстрировали очень незначительную экспрессию метки (нижняя линия) по сравнению с CD8 клетками, трансфицированными длинной конструкцией (вторая сверху линия), или контрольными мышами, получающими лечение ложнотрансфицированными T-клетками (верхняя линия). Правый график отражает выживаемость у мышей с ксенотрансплантированной нейробластомой, получающих лечение CD8 клетками, трансфицированными короткой спейсерной областью, спейсерной областью промежуточного размера или длинной спейсерной областью. У мышей, получающие лечение CD8 клетками, трансфицированными конструкцией с коротким спейсером (верхняя линия), выживаемость была значительно выше по сравнению с мышами, получавшими лечение CD8 клетками, трансфицированными спейсером промежуточного размера (вторая линия) или длинным спейсером (третья сверху линия).
[0054] На фиг. 2F показано, что в опухолях от мышей, получающих лечение CD8 клетками, трансфицированными конструкцией с длинным спейсером, обнаруживались ббльшие количества CD3+ клеток.
[0055] На фиг. 2G показано, что опухоли от мышей, получающих лечение CD8 клетками, трансфицированными конструкцией с длинным спейсером, экспрессировали больше каспазы - 3.
[0056] На фиг. 3А, 3В и 3С показан статус активации и жизнеспособность трансфицированных CAR T-клеток после контакта с опухолевыми клетками в течение 24 часов (цикл 1); затем T-клетки собирают из культуры клеток цикла 1 и переносят в новую культуру еще на 24 часа (цикл 2); затем T-клетки собирают из культуры клеток цикла 2 и переносят в новую культуру еще на 24 часа для цикла 3). Между переносами поддерживалось количество жизнеспособных T-клеток, идентичное количеству T-клеток других линий.
[0057] На фиг. 3А показано, что среди CD8 клеток, трансфицированных конструкцией с длинной спейсерной областью (L), % клеток с активированными маркерами клеточной поверхности CD25/CD69 выше по сравнению с такими клетками, трансфицированными конструкцией с коротким спейсером (S), в каждом цикле переноса.
[0058] На фиг. 3В показано, что среди CD8 клеток, трансфицированных конструкцией с длинной спейсерной областью



[0059] На фиг. 3С показано, что CD8 клетки, трансфицированные конструкцией с длинной спейсерной областью или спейсерной областью промежуточной длины, обеспечивали более высокие уровни экспрессии FasR в опухолевых клетках по сравнению с такими клетками, трансфицированными конструкцией с коротким спейсером.
[0060] На фиг. 4А, 4В, 4С, 4D, 4Е, и 4F показаны центральные CD8 T-клетки памяти, трансфицированные конструкциями CAR с короткой спейсерной областью, при этом содержащими дополнительную внутриклеточную сигнальную область CD28, так что указанная конструкция включает костимулирующие сигнальные области CD28 и 4-1ВВ наряду с сигнальным доменом CD3 зета.
[0061] На фиг. 4А показаны профили проточной цитометрии CD8 центральных клеток памяти, трансфицированные конструкциями CAR, содержащими цитоплазматический домен CD28 / костимулирующий домен 4-1ВВ, и конструкцией, содержащей костимулирующий домен 4-1ВВ. Экспрессию анти- CD171 CAR детектируют с применением антитела, которое связывается с F(ab). На дополнительных графиках на каждой панели приведен % клеток, экспрессирующих CD8 и усеченный рецептор эпидермального фактора роста рЭФР (рЭФР-t), присутствующий в каждой конструкции, в каждой популяции клеток. На панели 1 показаны ложноинфицированные клетки, демонстрирующие отсутствие экспрессии F(ab) или рЭФР-t. На панели 2 показана экспрессия короткой конструкции с костимулирующим доменом 4-1ВВ по оценке на основании экспрессии CD8, рЭФР-t и F(ab). На панели 3 показана экспрессия короткой конструкции с цитоплазматический доменом CD28/костимулирующим доменом 4-1ВВ по оценке на основании экспрессии CD8, рЭФР-t и F(ab). Экспрессия каждой из указанных конструкций в клетках CD8 аналогична.
[0062] На фиг. 4В показана цитолитическая активность клеток CD8, трансфицированных конструкцией, содержащей короткий спейсер, костимулирующий домен 4-1ВВ и сигнальный домен CD3ζ, и конструкцией, содержащей короткий спейсер, костимулирующий цитоплазматический CD28, костимулирующий домен 4-1ВВ и сигнальный домен CD3ζ, в отношении клеток нейробластомы линии SK-N-BE 2 (Ве2). На графике видно, что клетки, трансфицированные конструкцией с костимулирующим цитоплазматический доменом CD28 (верхняя линия ♦), более эффективны для киллинга экспрессирующих CD171 клеток нейробластомы по сравнению с клетками, трансфицированными конструкцией, не содержащей цитоплазматического домена CD28 (2-ая сверху линия

[0063] На фиг. 4С показан синтез цитокинов трансфицированными T-клетками при контакте с клетками нейробластомы Ве2 или контрольными TML. Клетки Ве2 или TML приводят в контакт с CD8 клетками, трансфицированными конструкцией, содержащей короткий спейсер, костимулирующий домен 4-1ВВ и сигнальный домен CD3ζ, и конструкцией, содержащей короткий спейсер, костимулирующий цитоплазматический CD28, костимулирующий домен 4-1ВВ и сигнальный домен CD3ζ. На графике видно, что CD8 клетки, трансфицированные конструкцией с цитоплазматическим костимулирующим доменом CD28 (CD28-цито), при контакте с клетками Ве2 продуцировали больше ИФН-γ, чем CD8 клетки, трансфицированные конструкцией, не содержащей цитоплазматического домена CD28 и костимулирующего домена (4-1ВВ).
[0064] На фиг. 4D показана выживаемость и пролиферация опухолевых клеток в модели внутричерепного ксенотрансплантата нейробластомы у мышей NSG. График отражает выживаемость мышей с ксенотрансплантированной нейробластомой, получающих лечение CD8 клетками, трансфицированными конструкцией, содержащей короткий спейсер, костимулирующий домен 4-1ВВ и сигнальный домен CD3ζ (4-1BB), и конструкцией, содержащей короткий спейсер, костимулирующий цитоплазматический домен CD28, костимулирующий домен 4-1ВВ, и сигнальный домен CD3ζ (CD28-цито). Среди мышей, получающих лечение CD8 клетками, трансфицированными конструкцией без цитоплазматического CD28/костимулирующего домена (4-1ВВ), процент выживания был выше по сравнению с мышами, получающими лечение клетками, трансфицированными конструкцией с цитоплазматическим костимулирующим доменом CD28 (CD28-цито).
[0065] На фиг. 4Е показан статус активации и жизнеспособность трансфицированных CAR T-клеток после контакта с опухолевыми клетками в течение 24 часов (цикл 1). Затем T-клетки собирают из культуры клеток цикла 1 и переносят в новую культуру еще на 24 часа (цикл 2); затем T-клетки собирают из культуры клеток цикла 2 и переносят в новую культуру еще на 24 часа (цикл 3). На графике видно, что среди CD8 клеток, трансфицированных конструкцией с цитоплазматическим костимулирующим доменом CD28 (CD28-цито) наблюдался больший % клеток с активированными маркерами клеточной поверхности CD25/CD69 по сравнению с такими клетками, трансфицированными конструкцией без цитоплазматического костимулирующего домена CD28 (4-1ВВ).
[0066] На фиг. 4F видно, что среди CD8 клеток, трансфицированных конструкцией с цитоплазматическим костимулирующим доменом CD28

[0067] На фиг. 5 приведены последовательности, содержащие Ce7scFv-шарнир IgG4 - СН2 - СН3 - CD28tm (трансмембранный домен CD28)/41BB - зета - Т2А - рЭФР-t - epHIV7 (длинная конструкция) (SEQ ID NO: 54). Тильдами отмечены начало и конец кодирующей последовательности для каждого компонента указанной конструкции.
[0068] На фиг. 6 приведена карта плазмиды, в том числе последовательностей, содержащих Ce7scFv-шарнир IgG4 - СН2 - СН3 - CD28tm/41BB - зета - Т2А - рЭФР-t -epHIV7 (длинная конструкция).
[0069] На фиг. 7 приведены последовательности, содержащие scFv СЕ7 - шарнир IgG4 - CH3 - CD28tm/41BB - зета - Т2А - рЭФР-t - epHIV7 (промежуточная длина) (SEQ ID NO: 55). Тильдами отмечены начало и конец кодирующей последовательности для каждого компонента указанной конструкции.
[0070] На фиг. 8 приведена карта плазмиды, в том числе последовательностей, содержащих scFv СЕ7 - шарнир IgG4 - CH3-CD28tm/41BB - зета - Т2А - рЭФР-t - epHIV7 (промежуточная длина).
[0071] На фиг. 9 приведены последовательности, содержащие scFv СЕ7 - шарнир IgG4 - CD28tm/41ВВ - зета - Т2А - рЭФР-t - epHIV7 (короткая конструкция) (SEQ ID NO: 56). Тильдами отмечены начало и конец кодирующей последовательности для каждого компонента указанной конструкции.
[0072] На фиг. 10 приведена карта плазмиды с последовательностями, содержащими scFv СЕ7 - шарнир IgG4 - CD28tm/41BB - зета - Т2А - рЭФР-t - epHIV7 (короткая конструкция).
[0073] На фиг. 11 приведена последовательность конструкции scFv СЕ7 - шарнир IgG4 - CD28tm/цито-41BB - зета - Т2А - рЭФР-t - epHIV7 (короткая конструкция) с двумя костимулирующими доменами (SEQ ID NO: 57). Тильдами отмечены начало и конец кодирующей последовательности для каждого компонента указанной конструкции.
[0074] На фиг. 12 приведена карта плазмиды, в том числе последовательности конструкции scFv СЕ7 - шарнир IgG4 - CD28tm/цито-41ВВ - зета - Т2А - рЭФР-t - epHIV7 (короткая конструкция) с двумя костимулирующими доменами.
[0075] На фиг. 13А-13Н показано, что внеклеточный спейсер CAR регулирует противоопухолевую эффекторную функцию экспрессирующих CD8+ клеток CTL. На фиг. 13А схематически представлены варианты внеклеточных спейсерных доменов специфических в отношении CD171 и/или нацеленных на CD171 рецепторов CAR второго поколения (2G-CAR). На фиг. 13В показана экспрессия вариантов спейсеров 2G SS, МС или LS на поверхности клеток человека CD8+ TE(CM) и рЭФР-t, детектируемая с применением антител против FAB мыши и цетуксимаба, соответственно. На фиг. 13С приведены уровни экспрессии 2G-CAR, детектируемая с применением CD3-ζ-специфического вестерн-блоттинга. На фиг. 13D показаны уровни индуцированного 2G-CAR фосфо-ERK при совместном культивировании с опухолевыми CD171+ клетками нейробластомы Ве2 при соотношении Е:Т (эффекторных клеток к целевым), составляющем 1:1 (n≥3 для каждого условия). На фиг. 13Е показана индуцированная 2G-CAR активация поверхностной экспрессии CD137 при совместном культивировании с опухолью согласно фиг. 13D. На фиг. 13F показана противоопухолевая литическая активность клеток CTL с содержащими варианты спейсеров 2G-CAR, определенная с применением метода высвобождения радиоактивного хрома в течение 4 часов. Сравнение величины специфического лизиса клетками CTL, содержащими 2G-CAR с LS- и МС-спейсерами и клетками, содержащими 2G-CAR с SS-спейсерами при соотношении Е:Т, составляющем 10:1. На фиг. 13G показана стимуляция секреции цитокинов в смешанных культурах клеток 2G-CAR CTL и опухолевых клеток (Ве2) (n≥5 для каждого условия). Сравнение уровней синтеза цитокинов относится к SS 2G-CAR согласно фиг. 13Н.
[0076] На фиг. 14А-14Н показана обратная корреляция зависимой от спейсера CAR функциональной эффективности CTL in vitro и противоопухолевой активности in vivo. На фиг. 14А представлены схема модели терапии внутричерепного ксенотрансплантата нейробластомы у мышей NSG и биофотонный сигнал от опухолей ffLuc+ Ве2 на +6 день после стереотаксической имплантации. На фиг. 14В показан биофотонный сигнал от опухоли Ве2 при ответе на инфузию внутриопухолевых 2G-CAR СD8+ TE(CM) с вариантами спейсера (n=6 мышей на группу). Животных когорты LS 2G-CAR умерщвляли на 20 день из-за связанного с опухолью тяжелого недомогания. На фиг. 14С приведена оценка выживаемости по методу Каплана-Мейера в экспериментальных когортах, представленных на фиг. 14В. На фиг. 14D представлено количественное определение внутриопухолевых 2G-CAR T-клеток в период симптоматического прогрессирования опухоли. Плотность T-клеток определяли путем подсчета CD3+ клеток человека и выражали как общее число на 40 полей зрения (данные отражают анализ индивидуальных опухолей). На фиг. 14Е показан временной график извлечения опухолей у мышей NSG, несущих в/ч ксенотрансплантаты Ве2 и получающих лечение клетками 2G-CAR CTL для последующего иммуногистохимического/иммунофлюоресцентного (ИГХ/ИФ) исследования. На фиг. 14F1 и 14F2 приведены репрезентативные иммунофлуоресцентные изображения опухолей и противоположного полушария после совместного окрашивания колокализованных SS 2G-CAR CTL на CD3, Ki67 и активированную каспазу-3. На фиг. 14G показано количественное определение с применением ИФ сохранившихся через три дня после внутриопухолевой имплантации клеток CTL с вариантами спейсера 2G-CAR. N = общее число CD3+ клеток человека на 40 полей зрения согласно фиг. 14D. На фиг. 14Н приведен процент CD3+ Т-клеток, которые коэкспрессируют гранзим В (левая панель), Ki67 (средняя панель) и активированную каспазу-3 (правая панель) (n = среднее число клеток/на 40 полей зрения у двух индивидуальных получивших трансплантаты мышей).
[0077] На фиг. 15А-15Н видно, что рекурсивный контакт с антигеном in vitro приводит к различным уровням опосредованной FasL AICD в зависимости от размеров спейсера CAR. На фиг. 15А приведена схема стресс-теста in vitro для анализа функционального статуса и жизнеспособности CAR T-клетки при неоднократной стимуляции опухолевыми клетками. На фиг. 15В представлено количественное определение оставшихся жизнеспособных опухолевых клеток fLuc+Be2 после последовательных циклов переноса 2G-CAR (% жизнеспособности опухоли = среднее для 3 независимых экспериментов). На фиг. 15С показано проточно-цитометрическое количественное определение поверхностной экспрессии CD25 и CD69 после последовательных циклов совместного культивирования с клетками Ве2 в пропорции эффекторыхтимуляторы (E:S), равной 1:1 (значения % CD25+CD69+ = среднее для 2 независимых экспериментов). На фиг. 15D показано определение жизнеспособности 2G-CAR T-клеток с применением анализа Guava Viacount после каждого цикла. % погибших T-клеток определяли согласно фиг. 15С. На фиг. 15Е показана концентрация FasL+2G-CAR CTL до и после 8-часового совместного культивирования с Ве2 (E:S=1:1; каждая экспериментальная точка получена в независимом эксперименте). На фиг. 15F представлено сравнение (кратность) индуцированной транскрипции мРНК FasL по оценке с применением количественной ПЦР в реальном времени при совместном культивировании МС и CTL с вариантом спейсера LS 2G-CAR и CTL с SS 2G-CAR, нормированной по бета-актину (среднее значение для 5 независимых экспериментов). На фиг. 15G приведена концентрация 3+2G-CAR CTL с активированной каспазой после 16-часового совместного культивирования с Ве2 (E:S=1:1; значения = среднее для 4 независимых экспериментов). На фиг. 15Н показан эффект миРНК-нокдауна Fas или FasL на индукцию апоптоза в LS 2G-CAR CTL после 3 циклов. Определение средней жизнеспособности с применением анализа Guava Viacount в 3 независимых экспериментах («1+» соответствует ложной трансфекции T-клеток с применением электропорации, «scr» соответствует скремблированной миРНК).
[0078] На фиг. 16A-16F показано, что повышенная костимуляция через цитоплазматический домен CD28:4-1BB : зета третьего поколения приводит к усилению эффекторной функции in vitro. На фиг. 16А приведена схема состава 2G-CAR и 3G-CAR. На фиг. 16В приведено сравнение поверхностной экспрессии 2G- и 3G-CAR(SS) или рЭФР-t человека клетками CD8+ TE(CM), детектированной с применением антитела против FAB мыши и цетуксимаба, соответственно. На фиг. 16С приведены уровни экспрессии 2G- или 3G-CAR(SS), детектированные с применением CD3-ζ-специфического вестерн-блоттинга. На фиг. 16D показана индуцированная активацией 2G- или 3G-CAR(SS) поверхностная экспрессия CD137 при совместном культивировании с опухолью. На фиг. 16Е показана противоопухолевая литическая активность CTL, содержащих 2G- и 3G-CAR(SS), определенная с применением метода 4-часового высвобождения радиоактивного хрома. Сравнение величины специфического лизиса клетками CTL, содержащими рецепторы третьего поколения с короткими спейсерами (SS-3G) или содержащими рецепторы с короткими спейсерами второго поколения (SS-2G) при соотношении Е:Т, составляющем 10:1 (среднее для 3 независимых экспериментов). На фиг. 16F показана стимуляция секреции цитокинов при совместном культивировании 2G- или 3G-CAR(SS) CTL с опухолевыми клетками (Ве2) (n≥6 для каждого условия). Сравнение уровня (кратности) синтеза цитокинов относится к 2G-CAR(SS) согласно (Е).
[0079] На фиг. 17A-17D показано, что 3G-CAR(SS) CTL не отличаются повышенной противоопухолевой активностью in vivo. На фиг. 17А приведены кривые выживаемости Каплана-Мейера для мышей NSG с трансплантированными клетками Ве2, получавших лечение 2G- или 3G-CAR(SS) CTL (n=5-6 на группу, ложнотрансфицированные контрольные CTL показаны черным цветом). На фиг. 17В приведены кривые выживаемости Каплана-Мейера для мышей с трансплантатами SK-N-DZ, получавших лечение согласно фиг. 17А. На фиг. 17С показана внутриопухолевая персистенция 2G- или 3G-CAR(SS) T-клеток через 3 дня после адоптивного переноса. N = число CD3+ клеток на 40 полей зрения в двух независимым образом полученных образцах опухоли. На фиг. 17D представлена ИФ-детекция гранзима В (левая панель) и активированной каспазы-3 + (правая панель) в CD3+CTL согласно фиг. 17С.
[0080] На фиг. 18А-18Е видно, что рекурсивный контакт с антигеном in vitro приводит к различным уровням опосредованной FasL AICD, основанной на цитоплазматической сигнализации через CAR в контексте короткого внеклеточного спейсерного домена. На фиг. 18А показано проточно-цитометрическое количественное определение поверхностной экспрессии CD25 и CD69 клетками CTL, несущими 2G- или 3G-CAR(SS), после последовательных циклов совместного культивирования с клетками Ве2 в соотношении E:S, составляющем 1:1 (% значения CD25+CD69+ соответствуют среднему значению для двух независимых экспериментов). На фиг. 18В показано определение жизнеспособности несущих 2G- или 3G-CAR(SS) T-клеток с применением анализа Guava Viacount после каждого цикл совместного культивирования с опухолевыми клетками. % погибших T-клеток определяли согласно приведенному выше описанию. На фиг. 18С приведена концентрация FasL+ 2G- и 3G-CAR(SS) CTL до и после 8-часового совместного культивирования с клетками Ве2 в соотношении E:S, составляющем 1:1 (каждая экспериментальная точка из 5 точек на каждый вариант спейсера 2G-CAR получена в независимом эксперименте). На фиг. 18D представлено сравнение (кратность) индукции транскрипции мРНК FasL по оценке с применением количественной ПЦР в реальном времени при совместном культивировании 2G- или 3G-CAR(SS) CTL, с нормированием по бета-актину (результаты представлены в виде среднего значения для 5 независимых экспериментов). На фиг. 18Е приведена концентрация содержащих цитоплазматическую активированную каспазу-3 2G- или 3G-CAR(SS) клеток CTL после 16-часового совместного культивирования с Ве2 при соотношении E:S, составляющем 1:1 (средние значения для 4 независимых экспериментов). + (фиг. 18D) и содержащих активированную каспазу-3 (фиг. 18Е) CD3+ CTL согласно описанию на фиг. 18С.
[0081] На фиг. 19А-19С показано фенотипическое сходство между выделенными CD45RO+CD62L+Tcm человека, размноженными после лентивирусной трансдукции рецепторами 2G-CAR с вариантами спейсера. На фиг. 19А показан временной график выделения, трансдукции и размножения CD8 ТСМ перед использованием в экспериментах. На фиг. 19В описаны метод иммуномагнитного выделения и чистота клеток CD8+ TCM (CD45RO+CD62L+) из МКПК. На фиг. 19С описан фенотип CD8+ TE(CM), трансфицированных 2G-CAR с разными вариантами спейсера в период экспериментального применения.
[0082] На фиг. 20A-20D показана противоопухолевая активность CD8+ TE(CM) CLT, содержащих специфический в отношении CD171 и/или нацеленный на CD171 2G-CAR с вариантами спейсера в отношении низкоэкспрессирующих CD171 (CD171low) SK-N-DZ ксенотрансплантатов нейробластомы человека in vitro и in vivo. На фиг. 20А показана литическая активность 2G-CAR с вариантами спейсера в отношении SK-N-DZ в ходе 4-часового анализа с высвобождением радиоактивного хрома (CRA). На фиг. 20 В показана стимуляция SK-N-DZ секреции ИФН-γ при применении 2G-CAR CTL с вариантами спейсера. На фиг. 20С показан биофотонный ответ опухолей SK-N-DZ на внутриопухолевую инфузию 2G-CAR (SS, МС или LS) CD8+ TE(CM) (n=5 на группу). На фиг. 20D представлена оценка выживаемости в экспериментальных когортах по методу Каплана-Мейера.
[0083] На фиг. 21 показана экспрессия Fas и FasL после миРНК-нокдауна. На панели А приведена сравнительная концентрация Fas+ LS 2G-CAR CTL после миРНК-нокдауна Fas и LS 2G-CAR CTL, обработанных scr миРНК (значения % Fas+соответствуют среднему значению для 4 независимых экспериментов). На панели В приведена концентрация FasL+ LS 2G-CAR CTL после миРНК-нокдауна FasL согласно описанию на панели А.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0084] Если не указано иное, все технические и научные термины в настоящем документе имеют значения, общепринятые среди специалистов в области техники, к которой относится изобретение.
[0085] «Активация» в настоящем документе относится к состоянию T-клетки, стимулированной в достаточной степени для индукции детектируемой клеточной пролиферации, синтеза цитокинов или экспрессии маркеров клеточной поверхности, таких как CD69 и CD25, или детектируемых эффекторных функций.
[0086] «Индуцированная активацией клеточная смерть» в настоящем документе относится к состоянию T-клетки, которая активирована, но не способна к пролиферации на протяжении более чем 2 поколений и демонстрирует маркеры апоптоза.
[0087] «Антиген», или «Ag» в настоящем документе относится к молекуле, вызывающей иммунный ответ. Указанный иммунный ответ может включать либо продукцию антител, либо активацию специфических иммунокомпетентных клеток, или и первое, и второе. Очевидно, что антиген может быть синтезирован, получен рекомбинантным путем или из биологического образца. Такой биологический образец может включать, не ограничиваясь перечисленным, образец ткани, образец опухоли, клетки или биологической жидкости.
[0088] «Противоопухолевый эффект» в настоящем документе относится к биологическому эффекту, который может проявляться уменьшением объема опухоли, уменьшением числа опухолевых клеток, уменьшением числа метастазов, увеличением ожидаемой продолжительности жизни или уменьшением различных физиологических симптомов, связанных с раковым заболеванием. «Противоопухолевый эффект» может также проявляться уменьшением рецидивирования или увеличением продолжительности периода времени до рецидива.
[0089] «Химерный рецептор» в настоящем документе относится к сконструированному синтетическим путем рецептору, содержащему лигандсвязывающий домен антитела или другую белковую последовательность, которая связывается с молекулой, связанной с заболеванием или расстройством, соединенную спейсерным доменом с одним или несколькими внутриклеточными сигнальными доменами T-клеточного или других рецепторов, например, с костимулирующим доменом. Химерный рецептор может также называться искусственным T-клеточным рецептором, химерным T-клеточным рецептором, химерным иммунорецептором или химерным антигенным рецептором (CAR). Указанные CAR представляют собой сконструированные рецепторы, способные придавать произвольно выбранную специфичность несущей иммунный рецептор клетке. Согласно мнению ряда исследователей, химерные антигенные рецепторы, или «CAR», включают антитело или фрагмент антитела, спейсер, сигнальный домен и трансмембранную область. Однако ввиду неожиданно обнаруженных эффектов модификации разных компонентов или доменов CAR, таких как связывающая эпитоп область (например, фрагмент антитела, scFv или его часть), спейсер, трансмембранный домен и/или сигнальный домен) в определенных условиях, в раскрытом изобретении компоненты CAR описаны независимым образом. Варианты различных элементов CAR могут, например, обеспечивать большее сродство к связыванию специфического эпитопа.
[0090] Термин «костимулирующий домен» в настоящем документе относится к сигнальному фрагменту, обеспечивающему получение T-клетками сигнала, который, наряду с первичным сигналом, обеспечиваемым, например, зета-цепью CD3 комплекса TCR/CD3, опосредует T-клеточный ответ, в том числе, не ограничиваясь перечисленными, активацию, пролиферацию, дифференцировку, секрецию цитокинов и т.п. Костимулирующий домен может включать полностью или частично, но не ограничиваясь перечисленными, CD27, CD28, 4-1ВВ, ОХ40, CD30, CD40, ICOS, лимфоцитарный функциональный антиген-1 (LFA-1), CD2, CD7, LIGHT, NKG2C, В7-Н3 и/или лиганд, который специфически связывает CD83 и/или нацелен на CD83. Согласно некоторым вариантам реализации указанный костимулирующий домен представляет собой внутриклеточный сигнальный домен, который взаимодействует с другими внутриклеточными медиаторами для опосредования клеточного ответа, в том числе активации, пролиферации, дифференцировки и секреции цитокинов, и т.п.
[0091] «Кодирующий» в настоящем документе относится к свойству специфических последовательностей нуклеотидов в полинуклеотиде, например, гене, кДНК или мРНК, служить в качестве матриц для синтеза других макромолекул, таких как заданная последовательность аминокислот. Соответственно, ген кодирует белок, если транскрипция и трансляция мРНК, соответствующего указанному гену, приводит к получению указанного белка в клетке или другой биологической системе. «Последовательность нуклеиновой кислоты, кодирующая полипептид» включает все представляющие собой вырожденные и кодирующие одну и ту же последовательность аминокислот варианты последовательности нуклеотидов.
[0092] «Цитотоксический T-лимфоцит» (CTL) в настоящем документе относится к T-лимфоциту, экспрессирующему на поверхности CD8 (например, экспрессирующей CD8+ Т-клетке, также называемой CD8+ Т-клеткой или CD8 T-клеткой; все указанные термины могут применяться взаимозаменяемо). Согласно некоторым вариантам реализации такие клетки предпочтительно представляют собой T-клетки «памяти» (клетки TM), обученные антигеном. Аналогичным образом, экспрессирующие CD4+ Т-клетки могут взаимозаменяемо называться CD4+ Т-клетками или CD4 T-клетками.
[0093] Термин «центральные T-клетки памяти» (или «ТСМ») в настоящем документе относится к стимулированным антигеном CTL, экспрессирующим CD62L или CCR-7, и/или CD45RO на поверхности, и не экспрессирующим или отличающимся пониженной экспрессией CD45RA по сравнению с наивными клетками. Согласно некоторым вариантам реализации центральные клетки памяти являются положительными по экспрессии CD62L, CCR7, CD28, CD127, CD45RO, и/или CD95, и/или отличаются пониженной экспрессией CD54RA по сравнению с наивными клетками.
[0094] Термин «эффекторные T-клетки памяти» (или «ТЕМ») в настоящем документе относится к стимулированным антигеном T-клеткам, которые не экспрессируют или отличаются пониженной экспрессией CD62L на поверхности по сравнению с центральными клетками памяти, и не экспрессируют или отличаются пониженной экспрессией CD45RA по сравнению с наивной клеткой. Согласно некоторым вариантам реализации эффекторные клетки памяти отрицательны по экспрессии CD62L и/или CCR7 в отличие от наивных клеток или центральных клеток памяти, и отличаются вариабельной экспрессией CD28 и/или CD45RA.
[0095] Термин «наивные» T-клетки в настоящем документе относится к не стимулированным антигеном T-лимфоцитам, экспрессирующим CD62L и/или CD45RA, и/или не экспрессируют CD45RO- в отличие от центральных или эффекторных клеток памяти. Согласно некоторым вариантам реализации наивные CD8+ Т-лимфоциты характеризуются экспрессией фенотипических маркеров наивных T-клеток, в том числе CD62L, CCR7, CD28, CD127 и/или CD45RA.
[0096] Термин «эффекторные ТЕ» T-клетки в настоящем документе относится к стимулированным антигеном цитотоксическим T-лимфоцитам, которые не экспрессируют или отличаются пониженной экспрессией CD62L, CCR7, CD28, и/или являются положительными по гранзиму В и/или перфорину в отличие от центральных клеток памяти или наивных T-клеток.
[0097] Термин «клетки-предшественники T-клеток» в настоящем документе относится к лимфоидным клеткам-предшественникам, способным мигрировать в вилочковую железу и становиться предшественниками T-клеток, которые не экспрессируют T-клеточный рецептор. Все T-клетки происходят из гемопоэтических стволовых клеток костного мозга. Гемопоэтические предшественники (лимфоидные клетки-предшественники) из гемопоэтических стволовых клеток заселяют вилочковую железу и размножаются путем клеточного деления с получением большой популяции незрелых тимоцитов. Самые ранние тимоциты не экспрессируют ни CD4, ни CD8, и, соответственно, классифицируются дважды негативные (CD4-CD8-) клетки. В процессе развития они становятся дважды позитивными тимоцитами (CD4+CD8+) и наконец созревают в единожды позитивными (CD4+CD8- или CD4-CD8+) тимоцитами, которые затем высвобождаются из вилочковой железы в периферические ткани.
[0098] Приблизительно 98% тимоцитов погибают в ходе процессов развития в вилочковой железе, не пройдя позитивную или негативную селекцию; оставшиеся 2% выживают, покидают вилочковую железу и становятся зрелыми иммунокомпетентными T-клетками.
[0099] На стадии дважды негативных (DN) клеток-предшественников T-клетки сфокусированы на синтезе функциональной β-цепи, тогда как клетки на дважды позитивной (DP) стадии сфокусированы на синтезе функциональной α-цепи, в конечном итоге обеспечивая получение функционального αβ-Т-клеточного рецептора. По мере прохождения развивающимся тимоцитом четырех DN-стадий (DN1, DN2, DN3 и DN4) T-клетка экспрессирует инвариантную α-цепь, однако происходит реаранжировка локуса β-цепи. В том случае, если реаранжированная β-цепь успешно спаривается с инвариантной α-цепью, генерируются сигналы, подавляющие реаранжировку β-цепи (и обеспечивающие сайленсинг альтернативного аллеля) и приводящие к пролиферации клетки. Хотя для указанных сигналов необходим указанный пре-TCR на поверхности клетки, они зависят от связывания лиганда с пре-TCR. Указанные тимоциты затем экспрессируют как CD4, так и CD8, и развиваются в клетки дважды позитивной (DP) стадии, на которой происходит селекция по α-цепи. В том случае, если реаранжированная β-цепь не обеспечивает генерации какого-либо сигнала (например, в результате неспособности к спариванию с инвариантной α-цепью), клетка может погибнуть в результате «забвения» (отсутствия сигнализации).
[0100] «Гемопоэтические стволовые клетки», или «HSC» в настоящем документе представляют собой клетки-предшественники, из которых могут развиваться миелоидные клетки, такие как, например, макрофаги, моноциты, макрофаги, нейтрофилы, базофилы, эозинофилы, эритроциты, мегакариоциты/тромбоциты, дендритные клетки и клетки лимфоидных линий (такие как, например, T-клетки, В-клетки, NK-клетки). Популяция HSC гетерогенна и включает три класса стволовых клеток, различающихся отношением происходящих из них лимфоидных и миелоидных клеток в крови (L/M).
[0101] «Таргетинг» («нацеливание») и «мишень» согласно описанию в настоящем документе относится к способности специфической для лиганда молекулы связываться с указанным лигандом. «Специфический» или «специфичность» может относиться к характеристике поведения лиганда в отношении партнера для связывания или, как вариант, поведения партнера для связывания в отношении лиганда, и может включать комплементарную форму, заряд и гидрофобность, обеспечивающие специфичность связывания. Специфичность связывания может включать стереоспецифичность, региоселективность и хемоселективность.
[0102] Термины «обогащенный» и «истощенный» в настоящем документе описывают количество клеток разных типов в смеси и относятся к проведению в смеси клеток процесса или этапа, который приводит к увеличению числа клеток того типа, по которому происходит «обогащение», и уменьшению числа клеток типа, по которому происходит «истощение». Соответственно, в зависимости от источника исходной популяции клеток, подвергаемых процессу обогащения, смесь или композиция может содержать 60, 70, 80, 90, 95 или 99% или более (по количеству или содержанию) клеток типа, по которому происходит «обогащение», и 40, 30, 20, 10, 5 или 1% или менее (по количеству или содержанию) клеток типа, по которому происходит «истощение».
[0103] «Эпитоп» в настоящем документе относится к части антигена или молекулы, распознаваемой иммунной системой, в том числе антителами, T-клетками и/или В-клетками. Эпитопы обычно содержат по меньшей мере 7 аминокислот и могут быть линейными или конформационными.
[0104] «Выделенный» при использовании для описания различных описанных в настоящем документе полипептидов означает полипептид или нуклеиновую кислоту, который(ая) был(а) идентифицирован(а) и выделен(а) и/или получен(а) из компонента естественной среды. Предпочтительно, указанный(ая) выделенный(ая) полипептид или нуклеиновая кислота не связан(а) ни с какими компонентами, с которыми связан(а) в естественных условиях. Загрязняющие компоненты естественной среды представлены материалами, которые, как правило, мешают диагностическому или терапевтическому применению указанного(ой) полипептида или нуклеиновой кислоты, и могут включать ферменты, гормоны, и другие белковые или небелковые растворенные вещества.
[0105] «Внутриклеточный сигнальный домен» в настоящем документе относится к полным последовательностям или частям одного или нескольких доменов молекулы (в настоящем документе - молекулы химерного рецептора), обеспечивающим активацию лимфоцита. Внутриклеточные домены таких молекул опосредуют сигнал посредством взаимодействия с клеточными медиаторами, обеспечивая пролиферацию, дифференцировку, активацию и другие эффекторные функции. Согласно некоторым вариантам реализации такие молекулы включают полностью или частично CD28, CD3 или 4-1ВВ, или их комбинации. Внутриклеточные сигнальные домены включают костимулирующие домены.
[0106] «Лиганд» в настоящем документе относится к веществу, которое специфически связывается с другим веществом с образованием комплекса, и/или нацелен на другое вещество. Примеры лигандов включают эпитопы на антигенах, молекулы, которые связываются с рецепторами, субстратами, ингибиторами, гормонами и активаторами. «Лигандсвязывающий домен» в настоящем документе относится к веществу или фрагменту вещества, которое(ый) связывается с лигандом. Примеры лигандсвязывающих доменов включают антигенсвязывающие фрагменты антител, внеклеточные домены рецепторов и активные сайты ферментов.
[0107] «Функционально связанный» в настоящем документе относится к функциональной связи между регуляторной последовательностью и гетерологичной последовательностью нуклеиновой кислоты, приводящей к экспрессии указанной нуклеиновой кислоты. Например, первая последовательность нуклеиновой кислоты функционально связана с второй последовательностью нуклеиновой кислоты в том случае, если указанная первая последовательность нуклеиновой кислоты находится в функциональной связи с второй последовательностью нуклеиновой кислоты. Например, промотор функционально связан с кодирующей последовательностью в том случае, если указанный промотор влияет на транскрипцию или экспрессию кодирующей последовательности. Обычно функционально связанные последовательности ДНК являются непрерывными и, в случае необходимости соединения двух кодирующих областей белка, находятся в одной рамке считывания.
[0108] «Процент (%) идентичности последовательностей аминокислот» в отношении полипептидных последовательностей химерного рецептора, описанных в настоящем документе, определен как процент остатков аминокислот в кандидатной последовательности, идентичных остаткам аминокислот в референсной последовательности для каждого из лигандсвязывающего домена, спейсера, трансмембранного домена и/или активирующего лимфоциты домена после выравнивания указанных последовательностей и, при необходимости, введения пропусков для получения максимального процента идентичности последовательностей, без учета каких-либо консервативных замен, как части идентичности последовательностей. Выравнивание для определения процента идентичности последовательностей аминокислот может осуществляться различными способами, известными в данной области техники, например, с применением общедоступного компьютерного программного обеспечения, такого как BLAST, BLAST-2, ALIGN, ALIGN-2 или Megalign (DNASTAR).
[0109] Специалисты в данной области техники могут определить подходящие параметры для оценки выравнивания, в том числе любые алгоритмы, необходимые для обеспечения максимального выравнивания сравниваемых полноразмерных последовательностей. Например, для получения значений % идентичности последовательностей аминокислот, полученные с применением компьютерной программы WU-BLAST-2 [Altschul et al., Methods in Enzymology, 266: 460-480 (1996)] используется несколько параметров поиска, для большинства из которых используются значения, заданные по умолчанию. Для параметров, не заданных по умолчанию (т.е. переменных параметров) устанавливают следующие значения: длина перекрывания = 1, доля перекрывания = 0,125, пороговая длина слова (Т) = 11 и матрица весов выравнивания = BLOSUM62. Значение % идентичности последовательностей аминокислот определяют путем деления (а) числа совпадающих идентичных остатков аминокислот между каждой аминокислотой или всеми аминокислотами в последовательности аминокислот полипептида референсной последовательности химерного рецептора, приведенной в таблице 2, и сравниваемой представляющей интерес последовательности аминокислот, по оценке с применением WU-BLAST-2 по (b) общему числу остатков аминокислот представляющего интерес полипептида.
[0110] «Вариант полинуклеотида химерного рецептора» или «вариант последовательности нуклеиновой кислоты химерного рецептора» в настоящем документе относится к кодирующей полипептид молекуле нуклеиновой кислоты согласно приведенному ниже определению, отличающейся по меньшей мере 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности нуклеиновой кислоты относительно последовательности полинуклеотида, приведенной на фиг. 5, 7, 9 или 11, или его специально полученного фрагмента, например, полинуклеотида, кодирующего антигенсвязывающий домен, полинуклеотида, кодирующего спейсерный домен, полинуклеотида, кодирующего трансмембранный домен и/или полинуклеотида, кодирующего стимулирующие лимфоциты домен. Обычно вариант полинуклеотида химерного рецептора или его фрагмент отличается по меньшей мере 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности нуклеиновой кислоты, более предпочтительно по меньшей мере 81% идентичностью последовательности нуклеиновой кислоты, более предпочтительно по меньшей мере 82% идентичностью последовательности нуклеиновой кислоты, более предпочтительно по меньшей мере 83% идентичностью последовательности нуклеиновой кислоты, более предпочтительно по меньшей мере 84% идентичностью последовательности нуклеиновой кислоты, более предпочтительно по меньшей мере 85% идентичностью последовательности нуклеиновой кислоты, более предпочтительно по меньшей мере 86% идентичностью последовательности нуклеиновой кислоты, более предпочтительно по меньшей мере 87% идентичностью последовательности нуклеиновой кислоты, более предпочтительно по меньшей мере 8% идентичностью последовательности нуклеиновой кислоты, более предпочтительно по меньшей мере 89% идентичностью последовательности нуклеиновой кислоты, более предпочтительно по меньшей мере 90% идентичностью последовательности нуклеиновой кислоты, более предпочтительно по меньшей мере 91% идентичностью последовательности нуклеиновой кислоты, более предпочтительно по меньшей мере 92% идентичностью последовательности нуклеиновой кислоты, более предпочтительно по меньшей мере 93% идентичностью последовательности нуклеиновой кислоты, более предпочтительно по меньшей мере 94% идентичностью последовательности нуклеиновой кислоты, более предпочтительно по меньшей мере 95% идентичностью последовательности нуклеиновой кислоты, более предпочтительно по меньшей мере 96% идентичностью последовательности нуклеиновой кислоты, более предпочтительно по меньшей мере 97% идентичностью последовательности нуклеиновой кислоты, более предпочтительно по меньшей мере 98% идентичностью последовательности нуклеиновой кислоты и еще более предпочтительно по меньшей мере 99% идентичностью последовательности нуклеиновой кислоты, приведенной на фиг. 5, 7, 9 или 11 или полученного из нее фрагмента. Варианты не включают природную нуклеотидную последовательность. В указанном отношении, специалисту в данной области техники будет сразу понятно, что, ввиду вырожденности генетического кода, существует значительное число вариантов полинуклеотидов химерного рецептора, отличающихся по меньшей мере 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности нуклеиновой кислоты относительно последовательностей нуклеотидов согласно фигурам 5, 7, 9 или 11.
[0111] «По существу очищенный» относится к молекуле, по существу не содержащей других типов молекул, или клетке, по существу не содержащей других типов клеток. По существу очищенная клетка также относится к клетке, которая была отделена от клеток других типов, с которыми она обычно связана в естественном состоянии. В некоторых случаях популяция по существу очищенных клеток относится к гомогенной популяции клеток.
[0112] Термин «по существу не обнаруживается» в отношении присутствия опухолевого антигена или других молекул на нормальных клетках относится к проценту клеток нормального типа, содержащих указанный антиген или молекулу, и/или к плотности указанного антигена на клетках. Согласно некоторым вариантам реализации «по существу не обнаруживается» означает, что указанный(ая) антиген или молекула обнаруживается менее чем на 50% клеток нормального типа и/или обнаруживается с меньшей на 50% плотностью по сравнению с количеством клеток или плотностью антигена на опухолевой клетке или другой пораженной заболеванием клетке.
[0113] «Т-клетки» или «Т-лимфоциты» в настоящем документе могут происходить от любого вида млекопитающих, предпочтительно, примата, в том числе обезьян, собак и человека. Согласно некоторым вариантам реализации T-клетки являются аллогенными (полученными от другого донора того же самого вида) для реципиента; согласно некоторым вариантам реализации указанные T-клетки аутологичны (донор и реципиент являются одним субъектом); согласно некоторым вариантам реализации указанные T-клетки являются сингенными (донор и реципиенты являются разными субъектами, однако представляют собой идентичных близнецов).
[0114] «Специфический» или «специфичность» может относиться к характеристике лиганда в отношении партнера для связывания, или, как вариант, характеристике партнера для связывания в отношении лиганда, и может включать комплементарную форму, заряд и гидрофобность, обеспечивающие специфичность связывания. Специфичность связывания может включать стереоспецифичность, региоселективность и хемоселективность.
[0115] Согласно некоторым вариантам реализации описан спейсер, отличающийся специфичностью в отношении лиганда. Специфический для лиганда спейсер может относиться к специфической длине полипептида, которая может обеспечивать усиленное связывание или нацеливание лигандсвязывающего домена на специфический для него или целевой лиганд, таким образом, что указанный спейсер обеспечивает повышенную пролиферацию T-клеток и/или синтез цитокинов в ответ на лиганд по сравнению с референсным химерным рецептором.
[0116] «Нацеливание» в настоящем документе относится к распознаванию уникального части чужеродной мишени, такой как, например, белковый эпитоп.Нацеливание может также относиться к связыванию или распознаванию специфической области белка, которая может называться антигеном. Аналогичные антигенные сайты могут также распознаваться нацеленным антителом, что может обеспечивать способность указанного антитела вступать в реакцию с аналогичными антигенными сайтами на других белках, соответственно, приводя к образованию перекрестно-реактивного антитела.
[0117] «Клеточная активность» может относиться к гуморальному ответу, клеточному иммунному ответу, клеточному ответу, путям созревания, путям роста и/или отвечаемости конкретных популяций клеток. Согласно некоторым вариантам реализации предложен химерный антигенный рецептор, отличающийся тем, что указанный химерный антигенный рецептор содержит спейсер. Согласно некоторым вариантам реализации указанный спейсер обеспечивает усиленную или улучшенную пролиферацию Т-клеток, усиление и/или уменьшение клеточной активности in vivo и/или синтез цитокинов.
[0118] В настоящем изобретении предложены нуклеиновые кислоты химерных рецепторов, а также векторы и клетки-хозяева, содержащие такие нуклеиновые кислоты. Нуклеиновая кислота химерного рецептора содержит ряд модульных компонентов, которые могут быть вырезаны и заменены на другие компоненты для получения индивидуального химерного рецептора для нацеливания на специфическую целевую молекулу. В раскрытом изобретении предложено использование спейсерного компонента в качестве одного из модульных компонентов. Неожиданно было обнаружено, что длина спейсерной области влияет на эффективность T-клеток, модифицированных для экспрессии химерного рецептора, in vivo и может быть индивидуализирована для индивидуальных целевых молекул для повышения терапевтической активности.
[0119] Согласно одному аспекту предложены способы и конструкции с нуклеиновой кислотой для конструирования химерного рецептора, обеспечивающего усиленное или улучшенное распознавание опухоли, повышенную пролиферацию T-клеток и/или синтез цитокинов в ответ на лиганд по сравнению с референсным химерным рецептором, в частности, in vivo, и/или обеспечивающего повышенную выживаемость клеток, несущих указанный химерный рецептор, после специфического связывания или нацеливания указанного рецептора на антиген, по сравнению с референсным химерным рецептором.
[0120] Согласно некоторым вариантам реализации указанный референсный химерный рецептор представляет собой химерный рецептор, идентичный рассматриваемому химерному рецептору, за исключением одной или более модификаций в спейсере, например, в полипептидном спейсере, соединяющем лигандсвязывающий домен, например, фрагмент антитела, указанного рецептора, и трансмембранные и/или внутриклеточные части рецептора. Например, согласно некоторым вариантам реализации указанный референсный химерный рецептор идентичен рассматриваемому рецептору, за исключением другой длины или последовательности спейсера, например, содержит спейсер большей длины, например, содержащий по меньшей мере в 2, 3, 4, 5, 6, 7, 8, 9 или 10 раз больше аминокислот по сравнению с рассматриваемым химерным рецептором.
[0121] Согласно некоторым вариантам реализации предложена библиотека нуклеиновых кислот, причем каждая нуклеиновая кислота кодирует спейсерную область, отличающуюся от других последовательностью и/или длиной. Каждая из указанных нуклеиновых кислот затем может быть использована для формирования конструкции нуклеиновых кислот химерного рецептора, которая может быть протестирована in vivo (в модели на животных) и/или in vitro; таким образом может быть выбран спейсер, обеспечивающий усиленное или улучшенное распознавание опухоли, повышенную пролиферацию T-клеток и/или синтез цитокинов в ответ на указанный лиганд.
[0122] Согласно некоторым вариантам реализации нуклеиновая кислота химерного рецептора содержит полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лиганд представляет собой опухолевый антиген, полинуклеотид, кодирующий индивидуализированный полипептидный спейсер, при этом указанный спейсер оптимизирован. Согласно некоторым вариантам реализации указанный спейсер оптимизирован для повышенной пролиферации T-клеток и/или синтеза цитокинов в ответ на лиганд по сравнению с референсным химерным рецептором.
[0123] Дизайн химерного рецептора может быть индивидуализирован в зависимости от типа опухоли, целевого антигена или молекулы, присутствующей на опухоли, сродства антитела к целевой молекуле, гибкости, необходимой для антигенсвязывающего домена и/или внутриклеточного сигнального домена. Согласно некоторым вариантам реализации ряд конструкций химерного рецептора тестируют in vitro и в моделях in vivo для определения способности T-клеток, модифицированных указанным рецептором, к киллингу опухолевых клеток у мышей с иммунодефицитом, к пролиферации и сохранению после адоптивного переноса.
[0124] В зависимости от того, присутствует ли целевая молекула на опухолевых клетках субъекта, химерный рецептор включает лигандсвязывающий домен, который специфически связывается с указанной целевой молекулой и/или нацелен на указанную целевую молекулу. Согласно некоторым вариантам реализации опухолевые клетки субъекта характеризуются молекулами на поверхности опухолевых клеток. Целевая молекула может быть выбрана на основании определения присутствия на конкретных опухолевых клетках субъекта. Согласно некоторым вариантам реализации выбирают целевую молекулу или эпитоп целевой молекулы, которая представляет собой молекулу клеточной поверхности, обнаруживаемую преимущественно на опухолевых клетках и не обнаруживаемую в нормальных тканях на сколь-либо значимых уровнях. Согласно некоторым вариантам реализации выбирают антитело для связывания с эпитопом на целевой молекуле клеточной поверхности. Согласно некоторым вариантам реализации указанная целевая молекула представляет собой CD171. Согласно некоторым вариантам реализации указанный химерный рецептор специфически связывается с эпитопом на CD171 и/или нацелен на эпитоп на CD171, распознаваемый антителом, известным как СЕ7, и/или эпитоп CD171 или другого антигена, расположенный на таком же или аналогичном расстоянии от поверхности плазматической мембраны CD171+ клетки. Согласно некоторым вариантам реализации внеклеточная часть указанного антигена имеет размер или длину, аналогичный(ую) внеклеточной части CD171, и, соответственно, подходящей является аналогичная конфигурация химерного рецептора.
[0125] Кроме того, спейсерная область химерного рецептора может быть изменена для усиления или улучшения распознавания T-клетками лиганда на целевой клетке. Согласно некоторым вариантам реализации спейсерный домен выбран из короткого спейсерного домена длиной 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты), такие как 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, или 2 аминокислот, или включает количество аминокислот в пределах диапазона, ограниченного любыми двумя вышеупомянутыми вариантами длины. Согласно некоторым вариантам реализации спейсерный домен выбран из спейсерного домена промежуточной длины, составляющей 119 аминокислот или менее (но не менее чем 1 или 2 аминокислоты), например, 119, 115, 110, 100, 95, 90, 85, 80, 75, 70, 65, 60, 55, 50, 45, 40, 35, 30, 25, 20 или 15 аминокислот, или включает количество аминокислот в пределах диапазона, ограниченного любыми двумя вышеупомянутыми вариантами длины. Согласно некоторым вариантам реализации спейсерный домен выбран из длинного спейсера, длина которого составляет 229 аминокислот или менее (но не менее чем 1 или 2 аминокислоты), например, 229, 225, 220, 215, 210, 205, 200, 195, 190, 185, 180, 175, 170, 165, 160, 155, 150, 145, 140, 135, 130, 125 или 120 аминокислот, или включает количество аминокислот в пределах диапазона, ограниченного любыми двумя вышеупомянутыми вариантами длины. Согласно некоторым вариантам реализации спейсер представляет собой шарнирную область Fc-рецептора или модифицированную шарнирную область. Согласно некоторым вариантам реализации спейсерная область представляет собой шарнирную область в комбинации с областью СН2 или областью СН3, или с обеими областями. Согласно некоторым вариантам реализации спейсер содержит последовательность аминокислот X1PPX2P. Согласно варианту реализации спейсерная область не включает полноразмерный Fc-рецептор, и/или не включает домен СН2 и/или СН3. Согласно некоторым таким вариантам реализации указанный спейсер включает шарнирную область антитела.
[0126] Различные комбинации первичных и костимулирующих внутриклеточных сигнальных доменов могут применяться для повышения эффективности химерного рецептора in vivo. Согласно некоторым вариантам реализации разные конструкции химерного рецептора могут быть протестированы в модели на животных in vivo для определения эффективности киллинга опухолевых клеток. Согласно некоторым вариантам реализации костимулирующий внутриклеточный сигнальный домен выбран из группы, состоящей из CD28 и его модифицированных вариантов, 4-1ВВ и его модифицированных вариантов, и/или их комбинаций. Могут быть включены другие костимулирующие домены, такие как ОХ40. Согласно некоторым вариантам реализации костимулирующая внутриклеточная сигнальная часть рецептора включает только внутриклеточные домены, происходящие из одной костимулирующей молекулы, например, только 4-1ВВ или только CD28, и дополнительно не содержит такого домена из другой такой молекулы.
[0127] Согласно некоторым вариантам реализации модифицированные химерным рецептором, например, модифицированные специфическим в отношении CD171 и/или нацеленным на CD171 химерным рецептором клетки, например, цитотоксические T-клетки, полученные из отсортированных очищенных CD8+ центральных T-клеток памяти, вводят в присутствии или в отсутствие CD4+ модифицированных химерным рецептором клеток, например, модифицированных специфическим в отношении CD171 и/или нацеленным на CD171 химерным рецептором T-клеток. Согласно некоторым вариантам реализации опухолеспецифичные или нацеленные на опухоль экспрессирующие CD4+ Т-клетки придают противоопухолевую реактивность и обеспечивают поддержку опухолеспецифичным экспрессирующим CD8+ Т-клеткам in vitro и in vivo. Согласно конкретному варианту реализации опухолеспецифичные или нацеленные на опухоль экспрессирующие CD4+ Т-клетки или экспрессирующие CD4+ Т-клетки, выбранные из субпопуляций наивных клеток или центральных клеток памяти, используют отдельно или в комбинации с CD8+ ТСМ.
[0128] Адоптивная иммунотерапия с применением экспрессирующих химерный антигенный рецептор (CAR) T-клеток согласно некоторым вариантам реализации подходит для лечения или ингибирования ракового заболевания. Согласно некоторым вариантам реализации получают CAR, направленный на эпитоп антигена CD171 (L1CAM). Такие конструкции CAR подходят для лечения или ингибирования любого ракового заболевания, отличающегося экспрессией CD171 (L1CAM). Согласно некоторым вариантам реализации одно из раковых заболеваний, отличающихся экспрессией CD171, является нейробластома (NB). CD171 экспрессируется в 100% нейробластом с высокой степенью риска. Другие раковые новообразования, предположительно сверхэкспрессирующие CD171, включают меланому, карциному шейки матки, рак яичников, карциному матки, рак поджелудочной железы, карциному толстой кишки, карциному почки и глиобластому.
[0129] В раскрытом изобретении предложена нуклеиновая кислота химерного рецептора, подходящая для трансформации или трансдукции лимфоцитов для применения в адоптивной иммунотерапии. Согласно некоторым вариантам реализации указанная нуклеиновая кислота содержит ряд модульных компонентов, обеспечивающих легкую замену элементов нуклеиновой кислоты. Считается, без ограничения объема настоящего изобретения, что компоненты химерного рецептора для каждого опухолевого антигена предпочтительно должны быть индивидуализированы для обеспечения эффективности in vivo и эффективной экспрессии в клетках млекопитающих. Например, согласно конкретному варианту реализации, для обеспечения эффективности химерного рецептора, содержащего scFV, который связывается с эпитопом CD171 L1CAM, например, идентичным или аналогичным распознаваемому предполагаемым антителом к СЕ7, или эпитопом на CD171 или другом антигене, расположенном на таком же относительном расстоянии от поверхности плазматической мембраны, используется спейсер, длина которого составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации экспрессионный вектор содержит химерную нуклеиновую кислоту согласно описанию в настоящем документе. Полипептиды, кодируемые полными последовательностями или фрагментами нуклеиновых кислот химерных рецепторов, также включены в настоящее изобретение.
[0130] Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит полинуклеотид, кодирующий лигандсвязывающий домен. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен специфически связывается с CD171 и/или нацелен на CD171, или ограниченный опухолью эпитоп CD171. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой антитело или его фрагмент. Последовательность нуклеиновой кислоты, кодирующая антитело или его связывающий фрагмент, может быть легко определена. Согласно конкретному варианту реализации указанный полинуклеотид кодирует одноцепочечную область Fv, которая специфически связывает и/или нацелена на CD171 (L1CAM). Примером антитела является антитело СЕ7. Пример последовательности нуклеиновой кислоты scFv антитела СЕ7 приведен на фиг. 5. Последовательности других антител известны специалистам в данной области техники или могут быть легко ими определены.
[0131] Опухолевые антигены представляют собой белки, продуцируемые опухолевыми клетками, вызывающими иммунный ответ. Выбор лигандсвязывающего домена согласно настоящему изобретению зависит от типа ракового заболевания, лечение или ингибирование которого предусмотрено, и может быть нацелено на опухолевые антигены или другие поверхностные молекулы опухолевых клеток. Образец опухоли от субъекта может характеризоваться присутствием определенных биомаркеров или маркеров клеточной поверхности. Например, клетки нейробластомы от субъекта характеризуются присутствием CD171 (L1CAM). Другие раковые или опухолевые клетки могут также характеризоваться присутствием CD171 (L1CAM) и могут подвергаться лечению или ингибированию композициями, описанными в настоящем документе. Согласно некоторым вариантам реализации целевая молекула представляет собой молекулу клеточной поверхности, которая обнаруживается на опухолевых клетках и по существу не обнаруживается нормальных тканях, или экспрессия которой ограничена нежизнеспособными нормальными тканями.
[0132] После идентификации поверхностной молекулы опухолевой клетки, на которую способен нацеливаться химерный рецептор, выбирают и описывают эпитоп целевой молекулы. L1CAM представляет собой молекулу клеточной мембраны, вовлеченную в клеточную адгезию нейронов. L1CAM содержит несколько доменов, в том числе содержащий аминокислоты 1-19 сигнальный пептид, содержащий аминокислоты 35-125 Ig-подобный С2-домен типа 1, содержащий аминокислоты 139-226 Ig-подобный С2-домен типа 2, содержащий аминокислоты 240-328 Ig-подобный С2-домен типа 3, содержащий аминокислоты 333-420 Ig-подобный С2-домен типа 4, содержащий аминокислот 425-507 Ig-подобный С2-домен типа 5, содержащий аминокислоты 518-607 Ig-подобный С2-домен типа 6, содержащий аминокислоты 615-712 фибронектиновый домен типа III 1, содержащий аминокислоты 717-810 фибронектиновый домен типа III 2, содержащий аминокислоты 814-916 фибронектиновый домен типа III 3, содержащий аминокислоты 920-1015 фибронектиновый домен типа III 4 и содержащий аминокислоты 1016-1115 фибронектиновый домен типа III 5. Эпитопы могут располагаться в любом из указанных доменов. Один из описанных эпитопов известен как эпитоп СЕ7. Эпитоп СЕ7 представляет собой эпитоп, чаще обнаруживаемый на опухолевых клетках по сравнению с нормальными тканями. Согласно некоторым вариантам реализации выбирают эпитоп CD171, который обнаруживается на опухолевых клетках чаще, чем на здоровых клеток.
[0133] Антитела, которые специфически связывают и/или нацелены на поверхностную молекулу опухолевой клетки, могут быть получены с применением способов получения моноклональных антител, способов с применением фагового дисплея, способов получения антител человека или гуманизированных антител или способов применения трансгенного животного или растения, сконструированного для получения антител человека. Доступны библиотеки фагового дисплея частично или полностью синтетических антител для скрининга на антитело или его фрагмент, способных связываться с целевой молекулой. Также доступны библиотеки фагового дисплея антител человека. Согласно некоторым вариантам реализации антитела специфически связывают и/или нацелены на поверхностную молекулу опухолевой клетки и не вступают в перекрестные реакции с неспецифическими компонентами, такими как бычий сывороточный альбумин или другие неродственные антигены. После идентификации может быть выделена и/или определена последовательность аминокислот или последовательность полинуклеотида, кодирующего указанное антитело.
[0134] Антитела или антигенсвязывающие фрагменты включают полностью или частично поликлональные антитела, моноклональные антитело, антитело человека, гуманизированное антитело, синтетическое антитело, химерное антитело, биспецифическое антитело, минитело и линейное антитело. Фрагменты антител содержат часть интактного антитела, предпочтительно, антигенсвязывающую или вариабельную область интактного антитела и могут быть легко получены. Примеры фрагментов антител включают фрагменты Fab, Fab', F(ab')2 и Fv; диатела; линейные антитела; молекулы одноцепочечных антител; и мультиспецифические антитела, образованные фрагментами антител. Известен и коммерчески доступен ряд антител против CD171.
[0135] Согласно некоторым вариантам реализации может быть выделен и описан ряд других антител, которые связываются с конкретной поверхностной молекулой опухолевой клетки. Согласно некоторым вариантам реализации указанный антитела характеризуют на основании специфичности в отношении эпитопов и/или нацеливания на целевую молекулу. Кроме того, в некоторых случаях антитела, которые связываются с одним и тем же эпитопом, могут быть выбраны на основании сродства (аффинности) указанного антитела к указанному эпитопу. Согласно некоторым вариантам реализации антитело обладает аффинностью, равной по меньшей мере 1 мМ и предпочтительно <50 нМ. Согласно некоторым вариантам реализации выбирают антитело, обладающее большим сродством к указанному эпитопу по сравнению с другими антителами. Например, выбирают антитело, которое отличается по меньшей мере 2-кратным, по меньшей мере 5-кратным, по меньшей мере 10-кратным, по меньшей мере 20-кратным, по меньшей мере 30-кратным, по меньшей мере 40-кратным или по меньшей мере 50-кратным сродством по сравнению с референсным антителом, которое связывается с тем же эпитопом.
[0136] Согласно некоторым вариантам реализации полинуклеотид, кодирующий лигандсвязывающий домен, функционально связан с полинуклеотидом, кодирующим спейсерную область. Согласно некоторым вариантам реализации указанный полинуклеотид, кодирующий лигандсвязывающий домен, может также содержать один или более сайтов распознавания рестриктазными ферментами на 5'- и/или 3'-конце кодирующей последовательности для обеспечения легкого вырезания и замены полинуклеотида на другой полинуклеотид, кодирующий лигандсвязывающий домен, кодирующий другой антиген или имеющий другие характеристики связывания. Например, рестрикционный сайт NheI закодирован в 5'-направлении от лидерной последовательности; а 3' RsrII, расположенный в шарнирной области, позволяет осуществлять субклонирование любого требуемого scFv в вектор с химерным рецептором. Согласно некоторым вариантам реализации указанный полинуклеотид кодон-оптимизирован для экспрессии в клетках млекопитающих.
[0137] Согласно некоторым вариантам реализации указанный полинуклеотид, кодирующий лигандсвязывающий домен, функционально связан с сигнальным пептидом. Согласно некоторым вариантам реализации указанный сигнальный пептид представляет собой сигнальный пептид гранулоцитарного колониестимулирующего фактора. Могут использоваться полинуклеотиды, кодирующие другие сигнальные пептиды, такие как CD8-альфа.
[0138] Согласно некоторым вариантам реализации полинуклеотид, кодирующий лигандсвязывающий домен, функционально связан с промотором. Выбирают промотор, обеспечивающий экспрессию химерного антигенного рецептора клетки млекопитающего. Согласно конкретному варианту реализации указанный промотор представляет собой промотор фактора элонгации (EF-1). Другой пример подходящего промотора представлен последовательностью немедленно-раннего цитомегаловирусного (CMV) промотора. Однако также могут использоваться и другие последовательности конститутивных промоторов, включая, но не ограничиваясь перечисленными, ранний промотор вируса обезьян 40 (SV 40), вируса опухоли молочной железы мышей (MMTV), длинный концевой повтор промотора вируса иммунодефицита человека (HIV) (LTR), промотора MuMoLV, промотор вируса лейкоза птиц, немедленно-раннего промотора вируса Эпштейна-Барра, промотор вируса саркомы Рауса, а также промоторы генов человека, такие как, не ограничиваясь перечисленными, актиновый промотор, миозиновый промотор, гемоглобиновый промотор и промотор креатинкиназы. Также предусмотрены индуцируемые промоторы. Примеры индуцируемых промоторов включают, не ограничиваясь перечисленными, промотор металлотионеина, глюкокортикоидный промотор, прогестероновый промотор и тетрациклиновый промотор. Конкретный вариант полинуклеотида, кодирующего лигандсвязывающий домен, приведен на фиг. 5 в виде scFv антитела, которое специфически связывает и/или нацелено на эпитоп Се7 на CD171.
[0139] Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит полинуклеотид, кодирующий спейсерную область. Неожиданно было обнаружено, что длина спейсерной области влияет на эффективность in vivo T-клеток, модифицированных для экспрессии химерного рецептора, и может быть индивидуализирована для индивидуальных целевых молекул для оптимального распознавания опухолевой или целевой клетки. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит полинуклеотид, кодирующий индивидуализируемую спейсерную область, выбранную из библиотеки полинуклеотидов, кодирующих спейсерные области. Согласно некоторым вариантам реализации длину спейсера выбирают на основании расположения эпитопа, сродства указанного антитела к эпитопу и/или способности T-клеток, экспрессирующих химерный рецептор, к пролиферации in vitro и/или in vivo в ответ на распознавание антигена.
[0140] Как правило, спейсерная область находится между лигандсвязывающим доменом и трансмембранным доменом химерного рецептора. Согласно некоторым вариантам реализации спейсерная область обеспечивает гибкость лигандсвязывающего домена, создающую возможность для высоких уровней экспрессии в лимфоцитах. Специфический в отношении CD171 и/или нацеленный на химерный рецептор CD171 со спейсерным доменом длиной 229 аминокислот обладает меньшей противоопухолевой активностью in vivo по сравнению со специфическим в отношении CD171 и/или нацеленным на CD171 химерным рецептором с короткой спейсерной областью, состоящей из 15 аминокислот или менее (но не менее чем из 1 или 2 аминокислот).
[0141] Согласно некоторым вариантам реализации спейсерная область содержит по меньшей мере 10-229 аминокислот, 10-200 аминокислот, 10-175 аминокислот, 10-150 аминокислот, 10-125 аминокислот, 10-115 аминокислот, 10-100 аминокислот, 10-75 аминокислот, 10-50 аминокислот, 10-40 аминокислот, 10-30 аминокислот, 10-20 аминокислот или 10-15 аминокислот, или длина спейсерной области находится в диапазоне, ограниченном любыми двумя вышеупомянутыми вариантами числа аминокислот. Согласно некоторым вариантам реализации спейсерная область содержит 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты), 119 аминокислот или менее (но не менее чем 1 или 2 аминокислоты), или 229 аминокислот или менее (но не менее чем 1 или 2 аминокислоты).
[0142] Согласно некоторым вариантам реализации указанная спейсерная область происходит из шарнирной области иммуноглобулиноподобной молекулы. Согласно некоторым вариантам реализации спейсерная область содержит полностью или частично шарнирную область IgG1 человека, IgG2 человека, IgG3 человека или IgG4 человека, или ее модифицированный вариант, и может содержать одну или более замен аминокислот.Примеры последовательностей шарнирных областей приведены в таблице 6. Согласно некоторым вариантам реализации часть шарнирной области включает аминокислоты верхней шарнирной области, расположенные между вариабельной областью тяжелой цепи и коровой областью, и аминокислоты коровой шарнирной области, в том числе полипролиновую область. Как правило, верхняя шарнирная область содержит 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот. В некоторых случаях спейсерная область содержит последовательность аминокислот X1PPX2P (SEQ ID NO: 1). Согласно некоторым вариантам реализации X1 представляет собой цистеин, глицин или аргинин, и X2 представляет собой цистеин или треонин.
[0143] Согласно некоторым вариантам реализации последовательности шарнирной области могут быть модифицированы по одной или более аминокислот, чтобы избежать нежелательных структурных взаимодействий, таких как димеризация. Согласно конкретному варианту реализации спейсерная область содержит часть модифицированной шарнирной области IgG4 человека, например, согласно таблице 1 или таблице 6. Пример полинуклеотида, кодирующего часть модифицированной шарнирной области IgG4, приведен в таблице 1. Согласно некоторым вариантам реализации шарнирная область может отличаться по меньшей мере 90%, 92%, 95% или 100% идентичностью последовательности аминокислот относительно шарнирной области, приведенной в таблице 1 или таблице 6. Согласно конкретному варианту реализации часть шарнирной области человека из IgG4 содержит замену аминокислот в коровой области аминокислот: CPSP→CPPC.
[0144] Согласно некоторым вариантам реализации шарнирную область полностью или ее фрагмент комбинируют с одним или более доменов константной области иммуноглобулина. Например, часть шарнирной области может быть скомбинирована с полным доменом СН2 или СН3 или его фрагментом, или его вариантом. Согласно некоторым вариантам реализации указанная спейсерная область не включает последовательность шарнирной области длиной 47-48 аминокислот из CD8-альфа, полноразмерный Fc-рецептор и/или спейсерную область, состоящую из внеклеточной части молекулы CD28.
[0145] Согласно некоторым вариантам реализации короткая спейсерная область содержит 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты) и содержит полностью или частично последовательность IgG4 шарнирной области или ее вариант, спейсерная область промежуточной длины содержит 119 аминокислот или менее (но не менее чем 1 или 2 аминокислоты) и содержит полностью или частично последовательность шарнирной области IgG4 и область СН3 или ее вариант, и длинный спейсер содержит 229 аминокислот или менее (но не менее чем 1 или 2 аминокислоты) и содержит полностью или частично последовательность шарнирной области IgG4, область СН2 и область СН3, или их вариант.
[0146] Полинуклеотид, кодирующий спейсерную область, может быть легко получен с применением синтетических или рекомбинантных способов из последовательности аминокислот. Согласно некоторым вариантам реализации полинуклеотид, кодирующий спейсерную область, функционально связан с полинуклеотидом, кодирующим трансмембранную область. Согласно некоторым вариантам реализации указанный полинуклеотид, кодирующий спейсерную область, может также содержать один или более сайтов распознавания рестриктазными ферментами на 5'-и/или 3'-конце кодирующей последовательности для обеспечения легкого вырезания и замены полинуклеотида на другой полинуклеотид, кодирующий другую спейсерную область. Согласно некоторым вариантам реализации указанный полинуклеотид, кодирующий спейсерную область, кодон-оптимизирован для экспрессии в клетках млекопитающих, предпочтительно у человека.
[0147] Согласно некоторым вариантам реализации предложена библиотека полинуклеотидов, каждый из которых кодирует другую спейсерную область. Согласно некоторым вариантам реализации указанная спейсерная область выбрана из группы, состоящей из последовательности шарнирной области IgG1, IgG2, IgG3 или IgG4 или его части, последовательности шарнирной области IgG1, IgG2, IgG3 или IgG4 в комбинации с полной областью СН2 или фрагментом области СН2, или их вариантом, последовательности шарнирной области IgG1, IgG2, IgG3 или IgG4 в комбинации с полной областью СН3 или ее фрагментом, или их вариантом, и последовательности шарнирной области IgG1, IgG2, IgG3 или IgG4 в комбинации с полной областью СН2 или ее фрагментом, или их вариантом, и областью СН3 или ее вариантом. Согласно некоторым вариантам реализации короткая спейсерная область представляет собой модифицированную последовательность шарнира IgG4, содержащую 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты), последовательность промежуточной длины представляет собой последовательность шарнира IgG4 с последовательностью СН3, содержащей 119 аминокислот или менее (но не менее чем 1 или 2 аминокислоты) (SEQ ID NO: 49); или последовательность шарнира IgG4 с областью СН2 и областью СН3, содержащей 229 аминокислот или менее (но не менее чем 1 или 2 аминокислоты).
[0148] Согласно некоторым вариантам реализации в настоящем изобретении предложен способ выбора спейсерной области для химерного рецептора. Неожиданным образом некоторые конструкции химерного рецептора, несмотря на эффективность для активации T-клеток и способность направлять киллинг опухолевых клеток T-клетками in vitro, не были эффективны in vivo. Кроме того, профиль побочных эффектов модифицированных химерным рецептором T-клеток может приводить к увеличению числа клеток, погибающих в результате индуцированной активацией клеточной смерти, или вызывать увеличение количества цитокинов in vivo. Согласно некоторым вариантам реализации способ включает получение совокупности нуклеиновых кислот химерных рецепторов, при этом указанные нуклеиновые кислоты химерных рецепторов отличаются только спейсерной областью; введение каждой из нуклеиновых кислот химерных рецепторов в отдельную популяцию T-лимфоцитов; размножение каждой из отдельных популяций лимфоцитов in vitro, и введение каждой популяции лимфоцитов несущему опухоль животному для определения противоопухолевой эффективности каждого из химерных рецепторов при экспрессии в T-клетках, и выбор химерного рецептора, обеспечивающего противоопухолевую эффективность, путем сравнения с каждой из других отдельных популяций лимфоцитов, модифицированных каждым из других химерных рецепторов.
[0149] Известны модели других опухолей на животных. Противоопухолевая эффективность может быть измерена путем определения уменьшения объема опухоли, определения смерти животного, персистенции генетически модифицированных T-клеток in vivo, активации генетически модифицированных T-клеток (например, путем детекции увеличения экспрессии CD25 и/CD69) и/или пролиферации генетически модифицированных T-клеток in vivo. Согласно некоторым вариантам реализации выбирают химерный рецептор, обеспечивающий наилучшую противоопухолевую эффективность in vivo по оценке с применением одного или нескольких указанных параметров. Отсутствие противоопухолевой эффективности может быть определено по отсутствию сохранных генетически модифицированных лимфоцитов in vivo, смерти животных, усилению апоптоза на основании оценки повышения индукции каспазы-3 и/или снижения пролиферации генетически модифицированных лимфоцитов.
[0150] Согласно некоторым вариантам реализации выбирают химерный рецептор, обеспечивающий пролиферацию по меньшей мере 30% клеток на протяжении двух поколений in vitro и/или in vivo. Согласно другим вариантам реализации химерный рецептор не выбирают, если он обуславливает индуцированную активацией клеточную смерть по меньшей мере 50% клеток в течение 72 часов.
[0151] Согласно некоторым вариантам реализации предложенная совокупность нуклеиновых кислот химерных рецепторов, отличающихся только спейсерной областью, включает получение конструкции химерного рецептора, содержащей полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лиганд представляет собой опухолеспецифичный и/или нацеленный на опухоль антиген, или любую другую молекулу, экспрессируемую на клетках популяции целевых клеток, подходящую для опосредования распознавания и элиминации лимфоцитом; полинуклеотид, кодирующий первый полипептидный спейсер с заданным рестрикционным сайтом на 5'- и 3'-конце кодирующей последовательности первого полипептидного спейсера; полинуклеотид, кодирующий трансмембранный домен; и полинуклеотид, кодирующий один или более внутриклеточных сигнальных доменов.
[0152] Согласно некоторым вариантам реализации способ дополнительно включает получение одного или более полинуклеотидов, каждый из которых кодирует другую спейсерную область. Примеры конструкций представлены на фиг. 5, 7 и 9. Согласно некоторым вариантам реализации способ дополнительно включает замену полинуклеотида, кодирующего спейсерную область, на полинуклеотид, кодирующий другую спейсерную область, для получения нуклеиновой кислоты химерного рецептора с другой спейсерной областью. Указанный способ может использоваться неоднократно для получения любого количества нуклеиновых кислот химерных рецепторов, каждый из которых будет отличаться спейсерной областью. Согласно некоторым вариантам реализации указанные нуклеиновые кислоты химерных рецепторов отличаются только спейсерной областью.
[0153] Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит полинуклеотид, кодирующий трансмембранный домен. Указанный трансмембранный домен обеспечивает заякоривание химерного рецептора в мембране. Согласно некоторым вариантам реализации используют трансмембранный домен, который в естественных условиях связан с одним из доменов химерного рецептора. В некоторых случаях указанный трансмембранный домен может быть выбран или модифицирован путем замены аминокислот, позволяющей избежать связывание таких доменов с трансмембранными доменами тех же или других белков поверхностной мембраны для минимизации взаимодействий с другими элементами рецепторного комплекса.
[0154] Трансмембранный домен может быть получен из источника либо естественного, либо синтетического происхождения. При использовании источника естественного происхождения указанный домен может быть получен из любого мембраносвязанного или трансмембранного белка. Трансмембранные области содержат по меньшей мере трансмембранную(ые) область(и) альфа, бета или зета-цепи T-клеточного рецептора, CD28, CD3, CD45, CD4, CD8, CD9, CD16, CD22; CD33, CD37, CD64, CD80, CD86, CD134, CD137 и/или CD154. Согласно конкретному варианту реализации указанный трансмембранный домен содержит последовательность аминокислот трансмембранного домена CD28 согласно таблице 1. Пример последовательности полинуклеотида, кодирующего CD28tm, показан в таблице 1 (SEQ ID NO: 5).
[0155] Трансмембранный домен может быть синтетическим или представлять собой вариант встречающегося в природе трансмембранного домена. Согласно некоторым вариантам реализации синтетические трансмембранные домены или варианты трансмембранных доменов содержат преимущественно гидрофобные остатки, такие как лейцин и валин. Согласно некоторым вариантам реализации трансмембранный домен может отличаться по меньшей мере 80%, 85%, 90%, 95%, или 100% идентичностью последовательностей аминокислот последовательности трансмембранного домена согласно таблице 1 или таблице 3. Варианты трансмембранных доменов предпочтительно имеют показатель гидрофобности, составляющий по меньшей мере 50 по шкале Кайта-Дулитла.
[0156] Полинуклеотид, кодирующий трансмембранный домен, может быть легко получен с применением синтетических или рекомбинантных способов. Согласно некоторым вариантам реализации полинуклеотид, кодирующий трансмембранный домен, функционально связан с полинуклеотидом, кодирующим внутриклеточную сигнальную область. Согласно некоторым вариантам реализации указанный полинуклеотид, кодирующий трансмембранный домен, может также содержать один или более сайтов распознавания рестриктазными ферментами на 5'- и/или 3'-конце кодирующей последовательности для обеспечения легкого вырезания и замены полинуклеотида, кодирующего трансмембранный домен, на другой полинуклеотид, кодирующий другой трансмембранный домен. Согласно некоторым вариантам реализации указанный полинуклеотид, кодирующий трансмембранный домен, кодон-оптимизирован для экспрессии в клетках млекопитающих.
[0157] Согласно некоторым вариантам реализации нуклеиновая кислота химерного рецептора содержит полинуклеотид, кодирующий внутриклеточный сигнальный домен. Указанный внутриклеточный сигнальный домен обеспечивает активацию одной из функций трансфицированной клетки, экспрессирующей химерный рецептор, при связывании с лигандом, экспрессируемым на опухолевых клетках. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит один или более костимулирующих доменов. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен представляет собой часть и/или вариант внутриклеточного сигнального домена, обеспечивающего активацию по меньшей мере одной функции трансфицированной клетки.
[0158] Примеры внутриклеточных сигнальных доменов для применения в химерном рецепторе согласно раскрытому изобретению включают цитоплазматические последовательности зета-цепи CD3 и/или корецепторы, действующие совместно, инициируя передачу сигнала после стимуляции химерного рецептора, а также любое производное или вариант указанных последовательностей и любую синтетическую последовательность, обладающую теми же функциональными возможностями. Можно сказать, что активация T-клеток опосредована двумя отдельными классами цитоплазматических сигнальных последовательностей: инициирующие антигензависимую первичную активацию и обеспечивающие сигнал, подобный передаваемому T-клеточным рецептором (первичные цитоплазматические сигнальные последовательности), и действующие антигеннезависимым образом, обеспечивая вторичный или костимулирующий сигнал (вторичные цитоплазматические сигнальные последовательности). Первичные цитоплазматические сигнальные последовательности, действующие стимулирующим образом, могут содержать сигнальные мотивы, известные как рецепторные тирозиновые активирующие мотивы, или ITAM. Примеры мотивов ITAM, содержащих первичные цитоплазматические сигнальные последовательности, включают происходящие из CD3-зета, FcR-гамма, CD3-гамма, CD3-дельта, CD3-эпсилон, CD5, CD22, CD79a, CD79b и/или CD66d. Согласно некоторым вариантам реализации указанный первичный сигнальный внутриклеточный домен может отличаться по меньшей мере 80%, 85%, 90% или 95% идентичностью последовательности относительно последовательности CD3-зета, приведенной в таблице 1. Согласно некоторым вариантам реализации варианты CD3-зета сохраняют по меньшей мере одну, две, три или все области ITAM согласно таблице 5.
[0159] Согласно предпочтительному варианту реализации внутриклеточный сигнальный домен химерного рецептора может быть сконструирован таким образом, чтобы содержать сигнальный домен CD3-зета, отдельно или в комбинации с любым(и) другим(и) требуемым(и) цитоплазматическими доменом(ами). Например, внутриклеточный сигнальный домен химерного рецептора может содержать зета-цепь CD3 и костимулирующую сигнальную область.
[0160] Костимулирующая сигнальная область относится к части химерного рецептора, содержащей внутриклеточный домен костимулирующей молекулы. Костимулирующая молекула представляет собой молекулу клеточной поверхности, отличную от антигенного рецептора или его лигандов, необходимых для ответа лимфоцитов на антиген. Примеры таких молекул включают CD27, CD28, 4-1ВВ (CD137), ОХ40, CD30, CD40, лимфоцитарный функциональный антиген-1 (LFA-1), CD2, CD7, LIGHT, NKG2C, В7-Н3 и/или лиганд, который специфически связывает CD83 и/или нацелен на CD83. Согласно некоторым вариантам реализации указанный костимулирующий сигнальный домен может отличаться идентичностью последовательностей аминокислот, составляющей по меньшей мере 80%, 85%, 90% или 95%, последовательности внутриклеточного домена CD28, приведенной в таблице 3, или последовательности 4-1ВВ, приведенной в таблице 4. Согласно некоторым вариантам реализации вариант внутриклеточного домена CD28 содержит замену аминокислот в положениях 186-187, где LL заменен на GG.
[0161] Внутриклеточные сигнальные последовательности химерного рецептора могут быть соединены друг с другом в случайном или в определенном порядке. Необязательно короткий олигонуклеотидный или полипептидный линкер, длина которого предпочтительно составляет от 2 до 10 аминокислот, может формировать указанную связь. Согласно одному варианту реализации указанные внутриклеточные сигнальные домены содержат полностью или частично сигнальный домен CD3-зета или его вариант, а также содержат полностью или частично сигнальный домен CD28 или его вариант. Согласно другому варианту реализации указанный внутриклеточный сигнальный домен содержит полностью или частично сигнальный домен CD3-зета или его вариант, а также содержит полностью или частично сигнальный домен 4-1ВВ или его вариант. Согласно еще одному варианту реализации указанный внутриклеточный сигнальный домен содержит полностью или частично сигнальный домен CD3-зета или его вариант, полностью или частично сигнальный домен CD28 или его вариант, и содержит полностью или частично сигнальный домен 4-1ВВ или его вариант. Согласно конкретному варианту реализации последовательность аминокислот внутриклеточного сигнального домена, содержащая вариант CD3-зета и часть внутриклеточного сигнального домена 4-1ВВ, приведена в таблице 1. Пример последовательности нуклеиновой кислоты предложен в таблице 1.
[0162] Согласно некоторым вариантам реализации полинуклеотид, кодирующий внутриклеточный сигнальный домен, содержит внутриклеточный домен 4-1ВВ, соединенный с частью домена CD3-зета. Согласно другим вариантам реализации указанный внутриклеточный сигнальный домен содержит только один костимулирующий домен и не содержит двойных костимулирующих доменов, таких как цитоплазматический домен CD28 в комбинации с костимулирующими доменами 4-1ВВ.
[0163] Согласно некоторым вариантам реализации полинуклеотид, кодирующий внутриклеточный сигнальный домен, который содержит домен CD28, соединен с внутриклеточным доменом 4-1ВВ, соединенным с частью домена CD3-зета, предложен на фиг. 11. Полинуклеотид, кодирующий внутриклеточный сигнальный домен, может быть легко получен с применением синтетических или рекомбинантных способов из последовательности аминокислот. Согласно некоторым вариантам реализации указанный полинуклеотид, кодирующий внутриклеточный сигнальный домен может также содержать один или более сайтов распознавания рестриктазными ферментами на 5'- и/или 3'-конце кодирующей последовательности для обеспечения легкого вырезания и замены полинуклеотида, кодирующий внутриклеточный сигнальный домен на другой полинуклеотид, кодирующий другой внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный полинуклеотид, кодирующий внутриклеточный сигнальный домен, кодон-оптимизирован для экспрессии в клетках млекопитающих, предпочтительно у человека.
[0164] Согласно некоторым вариантам реализации нуклеиновая кислота химерного рецептора необязательно дополнительно содержит последовательность полинуклеотида, кодирующую маркер. Последовательность маркера предпочтительно кодирует экспрессируемый на клеточной поверхности маркер, позволяющий отбирать трансфицированные клетки и/или идентифицировать трансфицированные клетки. Согласно некоторым вариантам реализации последовательность маркера функционально связана с последовательностью полинуклеотида, кодирующей последовательность линкера. Согласно некоторым вариантам реализации указанная последовательность линкера представляет собой расщепляемую последовательность линкера.
[0165] Может применяться ряд различных последовательностей маркеров. Как правило, последовательность маркера обладает функциональной характеристикой, позволяющей осуществлять выбор трансфицированных клеток и/или детекцию трансфицированных клеток. Согласно некоторым вариантам реализации последовательность маркера совместима с трансдукцией лимфоцитов человека.
[0166] Положительный селективный маркер может представлять собой ген, при введении в клетку-хозяина обуславливающий доминантный фенотип, позволяющий осуществить положительный отбор клеток, несущих указанный ген. Гены такого типа известны в данной области техники, и включают, в том числе, ген гигромицин-В-фосфотрансферазы (hph), придающий устойчивость к гигромицину В, ген аминогликозидфосфотрансферазы (neo или aph) из Tn5, который кодирует устойчивость к антибиотику G418, ген дигидрофолатредуктазы (DHFR), ген аденозиндезаминазы (ADA) и/или ген множественной лекарственной устойчивости (MDR).
[0167] Согласно некоторым вариантам реализации нуклеиновая кислота химерного рецептора дополнительно содержит полинуклеотид, кодирующий маркер. Согласно некоторым вариантам реализации указанная последовательность маркера кодирует усеченный рецептор эпидермального фактора роста, который экспрессируется на поверхности клетки. Пример полинуклеотида, кодирующего указанный усеченный рецептор эпидермального фактора роста, приведен в таблице 1. Согласно некоторым вариантам реализации указанный полинуклеотид кодирующий маркер, функционально связан с полинуклеотидом, кодирующим последовательность линкера. Согласно конкретному варианту реализации последовательность линкера представляет собой расщепляемую последовательность линкера Т2А согласно таблице 1. Пример последовательности полинуклеотида, кодирующей линкер Т2А, предложен в таблице 1.
[0168] Полинуклеотид, кодирующий маркер, может быть легко получен с применением синтетических или рекомбинантных методов из последовательности аминокислот. Согласно некоторым вариантам реализации полинуклеотид, кодирующий маркер, функционально связан с полинуклеотидом, кодирующим внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный полинуклеотид, кодирующий маркер, может также содержать один или более сайтов распознавания рестриктазными ферментами на 5'- и/или 3'-конце кодирующей последовательности для обеспечения легкого вырезания и замены полинуклеотида, кодирующего маркер, на другой полинуклеотид, кодирующий другой маркер. Согласно некоторым вариантам реализации указанный кодирующий маркер полинуклеотид кодон-оптимизирован для экспрессии в клетках млекопитающих.
[0169] Описанные в настоящем документе композиции обеспечивают получение CD4+ и/или CD8+ Т-лимфоцитов. T-лимфоциты могут быть собраны в соответствии с известными техниками, обогащены или истощены с применением известных техник, таких как аффинное связывание с антителами, например, проточная цитометрия и/или иммуномагнитное разделение. После этапов обогащения и/или истощения может осуществляться размножение требуемых T-лимфоцитов in vitro в соответствии с известными техниками (в том числе описанными в патенте США №6040177, Riddell et al., но не ограничиваясь ими), или их вариантами, очевидными для специалистов в данной области техники. Согласно некоторым вариантам реализации указанные T-клетки представляют собой аутологичные T-клетки, полученные от пациента.
[0170] Например, требуемая популяция или субпопуляция T-клеток может быть размножена путем добавления исходной популяции T-лимфоцитов в культуральную среду in vitro и последующего добавления в культуральную среду фидерных клеток, таких как неделящиеся мононуклеарные клетки периферической крови (МКПК), (например, таким образом, чтобы полученная популяция клеток содержала по меньшей мере 5, 10, 20 или 40 или более МКПК фидерных клеток на каждый T-лимфоцит в исходной популяции для размножения); и инкубирование культуры (например, на протяжении периода времени, достаточного для размножения T-клеток). Неделящиеся фидерные клетки могут включать гамма-облученные фидерные клетки МКПК. Согласно некоторым вариантам реализации указанные МКПК облучают гамма-лучами в диапазоне доз 3000-3600 рад для предотвращения деления клеток. Порядок добавления T-клеток и фидерных клеток в культуральную среду может быть при необходимости изменен. Культура, как правило, может быть инкубирована в температурных и прочих условиях, подходящих для роста T-лимфоцитов. Для роста T-лимфоцитов человека, например, температура обычно составляет по меньшей мере 25 градусов Цельсия, предпочтительно по меньшей мере 30 градусов, более предпочтительно 37 градусов.
[0171] Размножаемые T-лимфоциты включают CD8+ цитотоксические T-лимфоциты (CTL) и CD4+ хелперные T-лимфоциты, которые могут быть специфическими в отношении антигена, присутствующего на опухоли человека или на патогене. Необязательно, способ размножения может дополнительно включать этап добавления неделящихся трансформированных вирусом Эпштейна-Барра лимфобластоидных клеток (LCL) в качестве фидерных клеток. LCL могут быть облучены гамма-лучами в диапазоне от 6000 до 10000 рад. Может быть получено любое подходящее количество фидерных клеток LCL, например, соотношение фидерных клеток LCL к исходным T-лимфоцитам может составлять по меньшей мере 10:1. Необязательно, способ размножения может дополнительно включать этап добавления антитела против CD3 и/или против CD28 в культуральную среду (например, в концентрации, составляющей по меньшей мере 0,5 нг/мл). Необязательно, способ размножения может дополнительно включать этап добавления IL-2 и/или IL-15 в культуральную среду (например, концентрация IL-2 составляет по меньшей мере 10 единиц/мл). После выделения T-лимфоцитов как цитотоксические, так и хелперные T-лимфоциты могут быть рассортированы на субпопуляции наивных клеток, клеток памяти и эффекторных T-клеток до или после размножения.
[0172] CD8+ Т-клетки могут быть получены с применением стандартных способов. Согласно некоторым вариантам реализации CD8+ Т-клетки дополнительно сортируют с разделением на наивные клетки, центральные клетки памяти и эффекторные клетки памяти путем идентификации антигенов клеточной поверхности, связанных с каждым из указанных типов CD8+ Т-клеток. Согласно некоторым вариантам реализации T-клетки памяти присутствуют как в CD62L+, так и в CD62L- субпопуляциях CD8+ лимфоцитов периферической крови. МКПК сортируют с разделением на CD62L-CD8+ и/или CD62L+CD8+ фракции после окрашивания антителами против CD8 и против CD62L. Согласно некоторым вариантам реализации экспрессия фенотипических маркеров центральных клеток памяти ТСМ включает CD45RO, CD62L, CCR7, CD28, CD3 и/или CD127 и не включает или включает низкие уровни гранзима В и/или CD45RA. Согласно некоторым вариантам реализации центральные T-клетки памяти представляют собой CD45RO+, CD62L+, или CD8+ Т-клетки. Согласно некоторым вариантам реализации эффекторные ТЕ являются отрицательными по CD62L, CCR7, CD28, и/или CD127, и положительными по гранзиму В и/или перфорину. Согласно некоторым вариантам реализации наивные CD8+ Т-лимфоциты характеризуются экспрессией фенотипических маркеров наивных T-клеток, в том числе CD62L, CCR7, CD28, CD3, CD127 и/или CD45RA.
[0173] Определение того, является ли клетка или популяция клеток положительной по конкретному маркеру клеточной поверхности, может осуществляться с помощью проточной цитометрии с применением окрашивания специфическим антителом к поверхностному маркеру и контрольным антителом совпадающего изотипа. Под популяцией клеток, отрицательных по маркеру, подразумевается популяция клеток, отличающаяся отсутствием значимого окрашивания специфическим антителом относительно окрашивания антителом контрольного изотипа, под положительной по маркеру популяцией подразумевается популяция клеток, отличающаяся однородным окрашиванием указанной популяции клеток, превышающим окрашивание антителом контрольного изотипа. Согласно некоторым вариантам реализации уменьшение экспрессии одного из маркеров относится к уменьшению средней интенсивности флуоресценции на один порядок и/или уменьшению процента клеток, демонстрирующих наличие указанного маркера, по меньшей мере на 20% клеток, 25% клеток, 30% клеток, 35% клеток, 40% клеток, 45% клеток, 50% клеток, 55% клеток, 60% клеток, 65% клеток, 70% клеток, 75% клеток, 80% клеток, 85% клеток, 90% клеток, 95% клеток и 100% клеток, или на любой % от 20% до 100%, относительно референсной популяции клеток. Согласно некоторым вариантам реализации под популяцией клеток, положительной по одному из маркеров, подразумевается, что в указанной популяции процент клеток, демонстрирующих наличие указанного маркера, составляет по меньшей мере 50% клеток, 55% клеток, 60% клеток, 65% клеток, 70% клеток, 75% клеток, 80% клеток, 85% клеток, 90% клеток, 95% клеток и 100% клеток, или любое количество от 50% до 100% относительно референсной популяции клеток.
[0174] Хелперные CD4+ Т-клетки сортируют с разделением на наивные клетки, центральные клетки памяти и эффекторные клетки путем идентификации популяций клеток, содержащих антигены клеточной поверхности. CD4+ лимфоциты могут быть получены с применением стандартных способов. Согласно некоторым вариантам реализации наивные CD4+ Т-лимфоциты представляют собой CD45RO-, CD45RA+, CD62L+ и/или CD4+ Т-клетки. Согласно некоторым вариантам реализации центральные CD4+ клетки памяти представляют собой CD62L+ и/или CD45RO+. Согласно некоторым вариантам реализации эффекторные CD4+ клетки являются CD62L- и/или CD45RO-.
[0175] Согласно некоторым вариантам реализации популяции антигенспецифических клеток CD4+ и CD8+ могут быть получены путем стимуляции наивных или антигенспецифических T-лимфоцитов антигеном. Например, могут быть получены антигенспецифические линии или клоны T-клеток к антигенам цитомегаловируса путем выделения T-клеток от инфицированных субъектов и стимуляции указанных клеток in vitro тем же антигеном. Также могут использоваться наивные T-клетки. В качестве мишеней для обеспечения T-клеточного ответа может использоваться любое число антигенов опухолевых клеток. Согласно некоторым вариантам реализации указанные композиции для адоптивной клеточной иммунотерапии подходят для лечения заболевания или расстройства, в том числе солидной опухоли, гематологического злокачественного новообразования, рака молочной железы или меланомы.
[0176] Согласно некоторым вариантам реализации может требоваться введение функциональных генов в T-клетки для применения в иммунотерапии в соответствии с раскрытым изобретением. Например, введенный(ые) ген или гены могут усиливать или повышать эффективность терапии путем обеспечения жизнеспособности и/или функции перенесенных T-клеток; либо могут обеспечивать генетический маркер, позволяющий осуществлять выбор и/или оценку выживаемости или миграции in vivo; либо могут обеспечивать функции, усиливающие или повышающие безопасность иммунотерапии, например, путем получения клетки, чувствительной к отрицательной селекции in vivo согласно описанию у Lupton S.D. et al., Mol. and Cell Biol, 11:6 (1991); и Riddell et al., Human Gene Therapy 3:319-338 (1992); см. также публикации PCT/US91/08442 и PCT/US94/05601, Lupton et al., где описано применение бифункциональных селектируемых химерных генов, полученных путем слияния доминантного маркера для положительной селекции с маркером для отрицательной селекции. Это может осуществляться в соответствии с известными техниками (см., например, патент США №6040177, Riddell et al., в разделах 14-17) или их вариантами, которые будут очевидны для специалистов в данной области техники на основании настоящего описания.
[0177] Согласно некоторым вариантам реализации T-клетки модифицированы химерными рецепторами согласно описанию в настоящем документе. Согласно некоторым вариантам реализации указанные T-клетки получают от субъекта, лечение которого планируется, согласно другим вариантам реализации указанные лимфоциты получают от аллогенных доноров-людей, предпочтительно здоровых доноров-людей. Предпочтительно, T-клетки, содержащие химерные антигенные рецепторы согласно описанию в настоящем документе, происходят из тимоцитов (возникающих у человека естественным образом), а также из сконструированных предшественников, таких как клетки иСК.
[0178] Согласно некоторым вариантам реализации химерные рецепторы содержат лигандсвязывающий домен, который специфически связывает и/или нацелен на поверхностную молекулу опухолевой клетки, область полипептидного спейсера, трансмембранный домен и внутриклеточный сигнальный домен согласно описанию в настоящем документе. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный фрагмент антитела (scFv), происходящий из вариабельных областей тяжелых цепей (VH) и вариабельных областей легких цепей (VL) моноклонального антитела (mAb). Костимулирующие сигналы могут также передаваться через химерный рецептор за счет слияния костимулирующего домена CD28 и/или 4-1ВВ с цепью CD3ζ. Химерные рецепторы являются специфическими в отношении молекул клеточной поверхности и/или обеспечивают нацеливание на молекулы клеточной поверхности независимо от HLA, с преодолением таким образом ограничений, связанных с распознаванием T-клеточных рецепторов, в том числе ограничение по HLA и низкие уровни экспрессии HLA на опухолевых клетках.
[0179] Согласно некоторым вариантам реализации в каждую популяцию CD4+ и CD8+ Т-лимфоцитов может быть введен один и тот же химерный рецептор или разные химерные рецепторы. Согласно некоторым вариантам реализации указанный химерный рецептор в каждой из указанных популяций содержит лигандсвязывающий домен, который специфически связывается с одним и тем же лигандом и/или нацелен на один и тот же лиганд на опухолевой или инфицированной клетке. Клеточные сигнальные модули могут различаться. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен CD8+ цитотоксических T-клеток идентичен внутриклеточному сигнальному домену CD4+ хелперных T-клеток. Согласно другим вариантам реализации указанный внутриклеточный сигнальный домен CD8+ цитотоксических T-клеток отличается от внутриклеточного сигнального домена CD4+ хелперных T-клеток.
[0180] Согласно некоторым вариантам реализации каждая популяция CD4 или CD8 T-лимфоцитов может быть разделена на наивные клетки, центральные клетки памяти, эффекторные клетки памяти или эффекторные клетки перед трансдукцией согласно описанию в настоящем документе. Согласно альтернативным вариантам реализации каждая популяция CD4 или CD8 T-лимфоцитов может быть разделена на наивные клетки, центральные клетки памяти, эффекторные клетки памяти или эффекторные клетки после трансдукции.
[0181] Были разработаны различные техники трансдукции, задействующие рекомбинантные инфекционные вирусные частицы для доставки генов. В настоящее время они представляют собой предпочтительный способ трансдукции T-лимфоцитов согласно настоящему изобретению. Вирусные векторы, которые использовались указанным способом, включают вирусные векторы, происходящие из вируса обезьян 40, аденовирусов, аденоассоциированного вируса (AAV), лентивирусные векторы и/или ретровирусы. Соответственно, перенос генов и способы экспрессии многочисленны, однако по существу позволяют введение и экспрессию генетического материала в клетках млекопитающих. Некоторые из описанных выше техник использовались для трансдукции гемопоэтических или лимфоидных клеток, в том числе трансфекция с фосфатом кальция, слияние протопластов, электропорация и/или инфекция рекомбинантным аденовирусом, аденоассоциированным вирусом и/или ретровирусными векторами. Первичные T-лимфоциты были успешно трансфицированы посредством электропорации и ретровирусной или лентивирусной инфекции.
[0182] Ретровирусные и лентивирусные векторы обеспечивают высокоэффективный способ переноса генов в эукариотические клетки. Кроме того, ретровирусная или лентивирусная интеграция происходит контролируемым образом и приводит к стабильной интеграции одной или нескольких копий новой генетической информации в каждую клетку.
[0183] Согласно некоторым вариантам реализации может быть полезным включение в T-клетки маркера для положительной селекции, позволяющего осуществлять выбор клеток отрицательного селектируемого фенотипа in vitro. Маркер для положительной селекции может представлять собой ген, при введении в клетку-хозяина экспрессирующий доминантный фенотип, что позволяет осуществлять положительный отбор клеток, несущих указанный ген. Гены указанного типа известны в данной области техники и включают, в том числе, ген гигромицин-В-фосфотрансферазы (hph), который придает устойчивость к гигромицину В, ген аминогликозидфосфотрансферазы (пео или aph) из Tn5, который кодирует устойчивость к антибиотику G418, ген дигидрофолатредуктазы (DHFR), ген аденозиндезаминазы (ADA) и/или ген множественной лекарственной устойчивости (MDR).
[0184] Как хорошо известно в данной области техники, для трансдукции T-лимфоцитов могут применяться различные способы. Согласно некоторым вариантам реализации трансдукцию осуществляют с применением лентивирусных векторов. Согласно некоторым вариантам реализации и CD4+, и CD8+ Т-клетки могут по отдельности быть модифицированы экспрессионным вектором, кодирующим химерный рецептор, с образованием определенных популяций. Согласно некоторым вариантам реализации указанные клетки затем дополнительно сортируют на субпопуляции наивных центральных клеток памяти и эффекторных клеток согласно описанию выше, путем сортировки по антигенам клеточной поверхности, уникальным для каждой из указанных популяций клеток. Кроме того, CD4+ или CD8+ популяции T-клеток могут быть выбраны исходя из профиля цитокинов или пролиферативной активности. Например, могут быть выбраны CD4+ Т-лимфоциты, отличающиеся усиленным синтезом цитокинов, таких как IL-2, IL-4, IL-10, ФНО-α и/или ИФН-γ по сравнению с ложнотрансфицированными клетками или трансфицированными CD8+ клетками при стимуляции антигеном. Согласно другим вариантам реализации выбирают наивные CD4+ Т-клетки или центральные CD4+ Т-клетки памяти, продуцирующие больше IL-2 и/или ФНО-α. Аналогичным образом выбирают CD8+ клетки, продуцирующие больше ИФН-γ по сравнению с ложнотрансфицированными CD8+ клетками.
[0185] Согласно некоторым вариантам реализации выбирают CD4+ и CD8+ Т-клетки, пролиферирующие при воздействии антигенных или опухолевых мишеней. Например, выбирают CD4+ Т-клетки, интенсивно пролиферирующие при стимуляции антигеном или опухолевыми мишенями по сравнению с ложнотрансфицированными клетками или трансфицированными CD8+ клетками. Согласно некоторым вариантам реализации выбирают CD4+ и CD8+ Т-клетки, цитотоксические для несущих антиген клеток. Согласно некоторым вариантам реализации предполагается слабая цитотоксичность CD4+ Т-клеток по сравнению с CD8+ Т-клетками.
[0186] Согласно предпочтительному варианту реализации выбирают трансфицированные лимфоциты, такие как CD8+ центральные клетки памяти, которые обеспечивают киллинг опухолевых клеток in vivo с применением модели на животных, предназначенной для исследования конкретного типа ракового заболевания. Такие модели на животных известны специалистам в данной области техники и исключают исследования на людях. Согласно описанию в настоящем документе, не все конструкции химерного рецептора при трансфекции лимфоцитов придают им способность к киллингу опухолевых клеток in vivo, несмотря на способность к активации и киллингу опухолевых клеток in vitro. В частности, в случае некоторых целевых молекул T-клетки, содержащие конструкции химерного рецептора с длинной спейсерной областью, были менее эффективными в отношении киллинга опухолевых клеток in vivo по сравнению с T-клетками, содержащими химерный рецептор с короткой спейсерной областью.
[0187] Настоящим изобретением предусмотрено применение в указанных композициях комбинаций CD4+ и CD8+ Т-клеток. Согласно одному варианту реализации комбинаций трансфицированные химерным рецептором CD4+ клетки могут быть скомбинированы с трансфицированными химерным рецептором CD8+ клетками, обладающими специфичностью в отношении того же лиганда, или скомбинированы с CD8+ Т-клетками, специфическими в отношении другого опухолевого лиганда и/или нацеленными на другой опухолевый лиганд. Согласно другим вариантам реализации трансфицированные химерным рецептором CD8+ клетки комбинируют с трансфицированными химерным рецептором CD4+ клетками, специфическими в отношении другого лиганда и/или способными нацеливаться на другой лиганд, экспрессируемый на опухоли. Согласно еще одному варианту реализации комбинируют модифицированные химерным рецептором CD4+ и CD8+ клетки. Согласно некоторым вариантам реализации CD8+ и CD4+ клетки могут быть скомбинированы в различных соотношениях, например, в соотношении CD8+ и CD4+, равном 1:1, соотношении CD8+ и CD4+, равном 10:1, или соотношении CD8+ и CD4+, равном 100:1. Согласно некоторым вариантам реализации комбинированную популяцию тестируют на пролиферацию клеток in vitro и/или in vivo, и выбирают соотношение, обеспечивающее пролиферацию клеток.
[0188] Согласно описанию настоящим изобретением предусмотрено возможное дополнительное разделение CD4+ и CD8+ Т-клеток на субпопуляции, такие как популяции наивных клеток, центральных клеток памяти и эффекторных клеток памяти. Согласно описанию в настоящем документе в некоторых вариантах реализации наивные CD4+ клетки представляют собой CD45RO-, CD45RA+, CD62L+, CD4+ положительные T-клетки. Согласно некоторым вариантам реализации центральные клетки памяти CD4+ клетки представляют собой положительные по CD62L и положительные по CD45RO клетки. Согласно некоторым вариантам реализации эффекторные CD4+ клетки представляют собой отрицательные по CD62L и положительные по CD45RO клетки. Каждая указанных популяций может быть независимым образом модифицирована химерным рецептором.
[0189] После трансдукции и/или выбора несущих химерный рецептор клеток популяции указанных клеток предпочтительно размножают in vitro до получения числа клеток, достаточного по меньшей мере для одной инфузии субъекту-человеку, как правило, приблизительно от 104 клеток/кг до 109 клеток/кг. Согласно некоторым вариантам реализации указанные трансфицированные клетки культивируют в присутствии несущих антиген клеток, антител против CD3, антител против CD28; IL-2, IL-7, IL-15 или IL-21, или их комбинаций.
[0190] Каждая из субпопуляций CD4+ и CD8+ клеток может быть скомбинирована с любой другой. Согласно конкретному варианту реализации модифицированные наивные CD4+ Т-клетки или центральные клетки памяти CD4+ клетки комбинируют с модифицированными центральными CD8+ Т-клетками памяти для обеспечения синергетического цитотоксического эффекта на несущие антиген клетки, такие как опухолевые клетки.
[0191] В раскрытом изобретении предложена композиция для адоптивной клеточной иммунотерапии, содержащая состав с генетически модифицированными T-лимфоцитами согласно описанию в настоящем документе.
[0192] Согласно некоторым вариантам реализации получение T-лимфоцитов включает CD4+ Т-клетки, которые содержат химерный рецептор, содержащий внеклеточные вариабельный домен антитела, специфического для лиганда, связанного с заболеванием или расстройством, индивидуализируемую спейсерную область, трансмембранный домен и внутриклеточный сигнальный домен T-клеточного рецептора или других рецепторов согласно описанию в настоящем документе. Согласно другим вариантам реализации композиция для адоптивной клеточной иммунотерапии дополнительно включает состав с модифицированными химерным рецептором опухолеспецифичными CD8+ цитотоксическими T-лимфоцитами, обеспечивающими клеточный иммунный ответ, при этом указанный состав с цитотоксическими T-лимфоцитами содержит CD8+ Т-клетки, которые содержат химерный рецептор, содержащий внеклеточный одноцепочечный фрагмент антитела, специфический для лиганда, связанного с заболеванием или расстройством, индивидуализируемую спейсерную область, трансмембранный домен и внутриклеточный сигнальный домен T-клеточного рецептора согласно описанию в настоящем документе.
[0193] Согласно некоторым вариантам реализации композиция для адоптивной клеточной иммунотерапии содержит состав с модифицированными химерным рецептором опухолеспецифичными CD8+ цитотоксическими T-лимфоцитами, обеспечивающими клеточный иммунный ответ, при этом указанный состав с цитотоксическими T-лимфоцитами содержит CD8+ Т-клетки, которые содержат химерный рецептор, содержащий внеклеточную одноцепочечную область антитела, способную к нацеливанию и/или специфическую для лиганда, связанного с заболеванием или расстройством, индивидуализируемую спейсерную область, трансмембранный домен и внутриклеточный сигнальный домен T-клеточного рецептора в комбинации с модифицированными антигенреактивным химерным рецептором наивными CD4+ хелперными T-клетками, происходящими из CD45RO- CD62L + CD4 + Т-клеток, и фармацевтически приемлемым носителем.
[0194] Согласно другим вариантам реализации композиция для адоптивной клеточной иммунотерапии содержит состав с обеспечивающими клеточный иммунный ответ антигенспецифическими и/или нацеливающими CD8+ цитотоксическими T-лимфоцитами, полученными от пациента, в комбинации с модифицированной антигенреактивным химерным рецептором наивной CD4+ хелперной T-клеткой, которая усиливает CD8+ иммунный ответ, при этом указанный состав с хелперными T-лимфоцитами содержит CD4+ Т-клетки, которые содержат химерный рецептор, содержащий внеклеточный вариабельный домен антитела, способный к нацеливанию и/или специфический для антигена, связанного с заболеванием или расстройством, индивидуализируемую спейсерную область, трансмембранный домен и внутриклеточный сигнальный домен T-клеточного рецептора.
[0195] Согласно дополнительному варианту реализации композиция для адоптивной клеточной иммунотерапии содержит наивные CD4+ хелперные T-клетки, модифицированные антигенреактивным химерным рецептором, который усиливает CD8+ иммунный ответ, при этом указанный состав с хелперными T-лимфоцитами содержит CD4+ Т-клетки, которые содержат химерный рецептор, содержащий внеклеточный вариабельный домен антитела, способный к нацеливанию и/или специфический для лиганда, связанного с заболеванием или расстройством, индивидуализируемую спейсерную область, трансмембранный домен и внутриклеточный сигнальный домен T-клеточного рецептора.
[0196] Согласно некоторым вариантам реализации указанный CD4+ хелперный T-лимфоцит выбран из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти или смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка включает CD45RO-, CD45RA+ и/или CD62L+CD4+ Т-клетку. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит выбран из группы, состоящей из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти или смешанных CD8+ Т-клеток. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти включает CD45RO+, CD62L+ и/или CD8+ Т-клетку. Согласно другим вариантам реализации CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, a CD4+ хелперный T-лимфоцит представляет собой CD4+ наивную CD4+ или центральную CD4+ Т-клетку памяти.
[0197] В раскрытом изобретении предложены способы получения композиций для адоптивной иммунотерапии, и варианты применения или способы применения указанных композиций для проведения клеточной иммунотерапии у субъекта, у которого имеется заболевание или расстройство. Пролиферация и персистенция модифицированных химерным рецептором T-клеток могут быть определены с применением модели заболевания или расстройства на животных, путем введения указанных клеток и определения персистенции и/или пролиферативной способности перенесенных клеток. Согласно другим вариантам реализации пролиферация и активация могут быть протестированы in vitro путем проведения нескольких циклов активации несущих антиген клеток.
[0198] Согласно некоторым вариантам реализации способ получения указанных композиций включает получение модифицированной наивной CD4+ хелперной T-клетки, при этом состав с модифицированными хелперными T-лимфоцитами содержит CD4+ Т-клетки, которые содержат химерный рецептор, содержащий лигандсвязывающий домен, способный к нацеливанию и/или специфический для поверхностной молекулы опухолевой клетки, индивидуализированные спейсерный домен, трансмембранный домен и внутриклеточный сигнальный домен согласно описанию в настоящем документе.
[0199] Согласно другому варианту реализации способ дополнительно включает получение модифицированной CD8+ цитотоксической T-клетки, при этом указанный состав с модифицированными цитотоксическими T-лимфоцитами содержит CD8+ клетки, которые содержат химерный рецептор, содержащий лигандсвязывающий домен, способный к нацеливанию и/или специфический для поверхностной молекулы опухолевой клетки, индивидуализированный спейсерный домен, трансмембранный домен и внутриклеточный сигнальный домен согласно описанию в настоящем документе.
[0200] Согласно другому варианту реализации способ включает получение модифицированной CD8+ цитотоксической T-клетки, при этом указанный состав с модифицированными цитотоксическими T-лимфоцитами содержит CD8+ Т-клетки, которые содержат химерный рецептор, содержащий лигандсвязывающий домен, способный к нацеливанию и/или специфический для поверхностной молекулы опухолевой клетки, индивидуализированный спейсерный домен, трансмембранный домен и внутриклеточный сигнальный домен согласно описанию в настоящем документе, и дополнительно включает комбинирование модифицированных CD8+ цитотоксических T-клеток с составом, содержащим CD4+ хелперные лимфоциты.
[0201] Получение CD4+ и CD8+ клеток, модифицированных химерным рецептором, описано выше в настоящем документе, а также в разделе примеров. Антигенспецифические или нацеленные на антиген T-лимфоциты могут быть получены от пациента, страдающего указанным заболеванием или расстройством, или могут быть получены путем стимуляции T-лимфоцитов in vitro в присутствии антигена. Субпопуляции CD4+ и CD8+ Т-лимфоцитов, не отбираемых на основании антигенспецифичности или способности к нацеливанию, могут также быть выделены согласно описанию в настоящем документе и скомбинированы в способах получения. Согласно некоторым вариантам реализации комбинация популяций клеток может быть оценена на однородность маркеров клеточной поверхности и способность к пролиферации на протяжении по меньшей мере двух поколений для обеспечения однородности статуса дифференцировки клеток. Контроль качества может осуществляться путем совместного культивирования линии клеток, экспрессирующих целевой лиганд, с модифицированными химерным рецептором T-клетками для определения того, распознают ли модифицированные химерным рецептором T-клетки указанную линию клеток с применением анализов цитотоксичности, пролиферации или синтеза цитокинов, известных в данной области техники. Статус дифференцировки клеток и маркеры клеточной поверхности на модифицированных химерных рецепторах T-клетках могут быть определены с помощью проточной цитометрии. Согласно некоторым вариантам реализации указанный маркеры и статус дифференцировки клеток на клетках CD8+ включают CD3, CD8, CD62L, CD28, CD27, CD69, CD25, PD-1, CTLA-4, CD45RO и/или CD45RA. Согласно некоторым вариантам реализации указанные маркеры и статус дифференцировки клеток на CD4+ клетках включают CD3, CD4, CD62L, CD28, CD27, CD69, CD25, PD-1, CTLA-4 CD45RO, и/или CD45RA.
[0202] Согласно некоторым вариантам реализации в настоящем изобретении предложен способ выбора спейсерной области для химерного рецептора. Неожиданным образом, некоторые конструкции с химерным рецептором, несмотря на эффективность для активации T-клеток in vitro, не были эффективными in vivo. Согласно некоторым вариантам реализации способ включает получение совокупности нуклеиновых кислот химерных рецепторов, при этом указанные нуклеиновые кислоты химерных рецепторов различаются только спейсерной областью; введение каждой из нуклеиновых кислот химерных рецепторов в отдельную популяцию T-лимфоцитов; размножение каждой из отдельных популяций лимфоцитов in vitro и введение каждой популяции лимфоцитов несущему опухоль животному для определения противоопухолевой эффективность каждой из модифицированных химерным рецептором T-клеток, и выбор химерного рецептора, обеспечивающего противоопухолевую эффективность, путем сравнения с каждой из других отдельных популяций лимфоцитов, модифицированных каждой из указанных других модифицированных химерным рецептором T-клеток.
[0203] Известны модели различных опухолей на животных. Противоопухолевая эффективность может быть измерена путем определения уменьшения объема опухоли, смерти животного, персистенции генетически модифицированных T-клеток in vivo, активации генетически модифицированных T-клеток (например, путем детекции увеличения экспрессии CD25 и/CD69) и/или пролиферации генетически модифицированных T-клеток in vivo. Согласно некоторым вариантам реализации выбирают химерный рецептор, обеспечивающий наилучшую противоопухолевую эффективность in vivo по оценке с применением одного или нескольких указанных параметров. Отсутствие противоопухолевой эффективности может быть определено по отсутствию сохранных генетически модифицированных лимфоцитов in vivo, смерти животных, усилению апоптоза на основании оценки повышения индукции каспазы -3 и/или снижения пролиферации генетически модифицированных лимфоцитов.
[0204] Согласно некоторым вариантам реализации получение совокупности нуклеиновых кислот химерных рецепторов, отличающейся тем, что указанные нуклеиновые кислоты химерных рецепторов различаются только спейсерной областью, включает получение конструкции химерного рецептора, содержащей полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лиганд представляет собой опухолеспецифичный или нацеленный на опухоль антиген (например, CD171), или любую другую молекулу, экспрессируемую на клетках популяции целевых клеток, подходящую для опосредования распознавания и элиминации лимфоцитом; полинуклеотид, кодирующий первый полипептидный спейсер с заданным рестрикционным сайтом на 5'- и 3'-конце кодирующей последовательности первого полипептидного спейсера; полинуклеотид, кодирующий трансмембранный домен; и полинуклеотид, кодирующий внутриклеточный сигнальный домен.
[0205] Согласно некоторым вариантам реализации в настоящем изобретении предложен способ лечения или ингибирования ракового заболевания, способ ингибирования или задержки прогрессирования и/или метастазирования ракового заболевания, способ ингибирования или уменьшения количества присутствующих опухолевых или раковых клеток и/или способ ингибирования или уменьшения целевой популяции экспрессирующих CD171 клеток у нуждающегося в этом пациента. Такие способы включают введение нуждающегося в этом субъекту или пациенту состава с генетически модифицированными цитотоксическими T-лимфоцитами, обеспечивающего клеточный иммунный ответ, при этом указанный состав с цитотоксическими T-лимфоцитами содержит CD8+ Т-клетки, которые содержат химерный рецептор, содержащий полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лиганд представляет собой опухолеспецифичный или нацеленный на опухоль антиген, или любую другую молекулу, экспрессируемую на клетках популяции целевых клеток (например CD171), подходящую для опосредования распознавания и элиминации лимфоцитом; полинуклеотид, кодирующий полипептидный спейсер, при этом указанный полипептидный спейсер имеет индивидуальную длину и обеспечивает усиленную пролиферацию T-клеток и/или синтез цитокинов по сравнению с референсным химерным рецептором; полинуклеотид, кодирующий трансмембранный домен; и полинуклеотид, кодирующий один или более внутриклеточных сигнальных доменов. Согласно некоторым вариантам реализации указанный субъект идентифицирован или выбран как субъект, нуждающийся в терапии, направленной на ингибирование или лечение ракового заболевания. Такой выбор или идентификация может быть осуществлен(а) путем клинической или диагностической оценки.
[0206] В раскрытом изобретении также предложены способы проведения клеточной иммунотерапии у субъекта, у которого имеется заболевание или расстройство, включающие: введение композиции с лимфоцитами, экспрессирующими химерный рецептор согласно описанию в настоящем документе. Согласно другим вариантам реализации способ включает введение указанному субъекту состава с генетически модифицированными цитотоксическими T-лимфоцитами, обеспечивающего клеточный иммунный ответ, при этом указанный состав с цитотоксическими T-лимфоцитами содержит CD8+ Т-клетки, которые содержат химерный рецептор, содержащий лигандсвязывающий домен, способный к нацеливанию и/или специфический для поверхностной молекулы опухолевой клетки, индивидуализированный спейсерный домен, трансмембранный домен и внутриклеточный сигнальный домен согласно описанию в настоящем документе, и состава с генетически модифицированными хелперными T-лимфоцитами, обеспечивающего прямое распознавание опухоли и усиливает способность состава с генетически модифицированными цитотоксическими T-лимфоцитами опосредовать клеточный иммунный ответ, при этом указанный состав с хелперными T-лимфоцитами содержит CD4+ Т-клетки, которые содержат химерный рецептор, содержащий лигандсвязывающий домен, способный к нацеливанию и/или специфический для поверхностной молекулы опухолевой клетки, индивидуализированный спейсерный домен, трансмембранный домен и внутриклеточный сигнальный домен согласно описанию в настоящем документе. Согласно некоторым вариантам реализации указанный субъект идентифицирован или выбран в качестве субъекта, нуждающегося в терапии, направленной на ингибирование или лечение ракового заболевания. Такой выбор или идентификация может быть осуществлен(а) путем клинической или диагностической оценки.
[0207] Считается, без ограничения объема настоящего изобретения, что выбор модифицированной химерным рецептором популяции T-клеток, способной сохраняться и пролиферировать in vivo, перед введением может обеспечивать возможность применения меньшей дозы T-клеток и более однородную терапевтическую активность. Согласно некоторым вариантам реализации указанная доза T-клеток может быть уменьшена по меньшей мере на 10%, 20% или 30%, или более. Уменьшение дозы T-клеток может быть благоприятным в отношении снижения риска возникновения синдрома лизиса опухоли и цитокиновой бури.
[0208] Согласно другому варианту реализации способ осуществления клеточной иммунотерапии у субъекта, у которого имеется заболевание или расстройство, включает: введение указанному субъекту состава с генетически модифицированными хелперными T-лимфоцитами, при этом указанный состав с модифицированными хелперными T-лимфоцитами содержит CD4+ Т-клетки, которые содержат химерный рецептор, содержащий лигандсвязывающий домен, способный к нацеливанию на поверхностную молекулу опухолевой клетки и/или специфический для поверхностной молекулы опухолевой клетки, индивидуализированный спейсерный домен, трансмембранный домен и внутриклеточный сигнальный домен, согласно описанию в настоящем документе. Согласно некоторым вариантам реализации указанный способ дополнительно включает введение указанному субъекту состава с генетически модифицированными цитотоксическими T-лимфоцитами, при этом указанный состав с модифицированными цитотоксическими T-лимфоцитами содержит CD8+ клетки, которые содержат химерный рецептор, содержащий лигандсвязывающий домен, способный к нацеливанию на поверхностную молекулу опухолевой клетки и/или специфический для поверхностной молекулы опухолевой клетки, индивидуализированный спейсерный домен, трансмембранный домен и внутриклеточный сигнальный домен согласно описанию в настоящем документе. Согласно некоторым вариантам реализации указанный субъект идентифицирован или выбран в качестве субъекта, нуждающегося в терапии, направленной на ингибирование или лечение ракового заболевания. Такой выбор или идентификация может быть осуществлен(а) путем клинической или диагностической оценки.
[0209] Согласно другому варианту реализации предложен способ осуществления клеточной иммунотерапии у субъекта, у которого имеется заболевание или расстройство, включающий: анализ биологического образца, полученного от указанного субъекта, на присутствие целевой молекулы (например, CD171), связанной с заболеванием или расстройством, и введение описанных в настоящем документе композиций для адоптивной иммунотерапии, при этом указанный химерный рецептор специфически связывает и/или нацелен на целевую молекулу. Согласно некоторым вариантам реализации указанный субъект идентифицирован или выбран в качестве субъекта, нуждающегося в терапии, направленной на ингибирование или лечение ракового заболевания. Такой выбор или идентификация может быть осуществлен(а) путем клинической или диагностической оценки.
[0210] Согласно некоторым вариантам реализации указанный CD4+ хелперный T-лимфоцит выбирают до введения химерного рецептора из группы, состоящей из наивных CD4+ Т-клетки, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти или смешанных CD4+ Т-клеток. Согласно конкретному варианту реализации CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка включает CD45RO-, CD45RA+ и/или CD62L+CD4+ Т-клетку. Согласно другим вариантам реализации указанный CD8+ цитотоксический T-лимфоцит выбирают до введения химерного рецептора из группы, состоящей из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти или смешанных CD8+ Т-клеток. Согласно конкретному варианту реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти включает CD45RO+, CD62L+ и/или CD8+ Т-клетку. Согласно конкретному варианту реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, a CD4+ хелперный T-лимфоцит представляет собой наивную CD4+ Т-клетку. Согласно некоторым вариантам реализации указанный субъект идентифицирован или выбран в качестве субъекта, нуждающегося в терапии, направленной на ингибирование или лечение ракового заболевания. Такой выбор или идентификация может быть осуществлен(а) путем клинической или диагностической оценки.
[0211] Согласно некоторым вариантам реализации и CD8+ Т-клетка, и CD4+ Т-клетка генетически модифицированы химерным рецептором, содержащим домен тяжелой цепи антитела, который специфически связывает и/или нацелен на опухолеспецифичную молекулу клеточной поверхности. Согласно другим вариантам реализации указанный внутриклеточный сигнальный домен CD8 цитотоксических T-клеток идентичен внутриклеточному сигнальному домену CD4 хелперных T-клеток. Согласно другим вариантам реализации внутриклеточный сигнальный домен CD8 цитотоксических T-клеток отличается от внутриклеточного сигнального домена CD4 хелперных T-клеток.
[0212] Субъекты, которые могут получать описанные в настоящем документе композиции, представлены, в общем случае, человеком и другими приматами, такими как обезьяны и человекообразные обезьяны, для ветеринарных медицинских целей; однако указанная технология также подходит для применения у домашних животных, таких как лошади, свиньи, овцы, крупный рогатый скот и козы, а также животные-компаньоны, такие как собаки и кошки. Включены субъекты мужского или женского пола любого походящего возраста, в том числе дети, подростки, молодые люди, субъекты взрослого и пожилого возраста.
[0213] Указанные способы подходят для лечения или ингибирования, например, несущих CD171 раковых или опухолевых клеток. Согласно некоторым вариантам реализации несущие CD171 раковые или опухолевые клетки включают клетки нейробластомы, меланомы, карциномы шейки матки, рака яичников, карциномы матки, рака поджелудочной железы, карциномы толстой кишки, карциномы почки и глиобластомы.
[0214] Полученные согласно описанию выше T-клетки с химерным антигенным рецептором могут применяться в способах и композициях для адоптивной иммунотерапии в соответствии с известными техниками или их вариантами, очевидными для специалистов в данной области техники, на основании настоящего описания. Согласно некоторым вариантам реализации указанные T-клетки получают путем сбора из культуральной среды с последующим промыванием и концентрированием указанных клеток в подходящей среде и с применением подходящего способа упаковки для введения («фармацевтически приемлемый» носитель) в эффективном для лечения количестве. Подходящая инфузионная среда может представлять собой любую среду изотонического состава, как правило, физиологический раствор, Нормосол-Р (Abbott) или Plasma-Lyte A (Baxter), но для использования подходит также 5% декстроза в воде или лактат Рингера. В инфузионную среду может быть добавлен альбумин сыворотки человека, фетальная бычья сыворотка или другие компоненты сыворотки человека.
[0215] Эффективное для лечения количество клеток в композиции представлено по меньшей мере двумя субпопуляциями клеток (например, одной субпопуляцией CD8+ центральных T-клеток памяти и одной субпопуляцией CD4+ хелперных T-клеток) или, в более общем случае, составляет более чем 102 клеток и до 106 клеток, до 108 или 109 клеток включительно, и может составлять более чем 1010 клеток. Число клеток, а также тип клеток, содержащихся в композиции, зависит от предусмотренного конечного использования указанной композиции. Например, в том случае, когда требуются клетки, способные к нацеливанию и/или специфические в отношении а конкретного антигена, популяция содержит более 70%, обычно более 80%, 85% и 90-95% таких клеток. Для применения согласно настоящему изобретению клетки обычно помещают в объем, равный 1 л или менее, 500 мл или менее; 250 мл или 100 мл; или менее. Поэтому плотность требуемых клеток, как правило, превышает 104 клеток/мл, обычно превышает 107 клеток/мл, составляя 108 клеток/мл или более. Клинически значимое количество иммунных клеток может быть распределено на несколько инфузий, в совокупности содержащих 106, 107,108, 108,109,1010 или 1011 клеток, или более.
[0216] Согласно некоторым вариантам реализации лимфоциты согласно настоящему изобретению могут применяться для обеспечения иммунитета индивидуумам. Под «иммунитетом» подразумевается ослабление одного или более физических симптомов, связанных с ответом на патогенную инфекцию или на опухоль, на которую направлен ответ указанных лимфоцитов. Количество вводимых клеток обычно находится в диапазоне, наблюдаемом у нормальных индивидуумов, обладающих иммунитетом к указанному патогену. Соответственно, клетки обычно вводят путем инфузий, при этом при каждой инфузий вводится количество клеток в диапазоне от 2 до по меньшей мере 106- 3×1010 клеток, предпочтительно в диапазоне от по меньшей мере 107 до 109 клеток. T-клетки могут вводиться путем однократной инфузий или нескольких инфузий на протяжении периода времени. Тем не менее, поскольку отвечаемость у разных индивидуумов предположительно варьирует, тип и количество инфузируемых клеток, а также количество инфузий и временной диапазон, на протяжении которого проводят ряд инфузий, задает лечащий врач, и они могут быть определены путем рутинного исследования. Получение достаточных уровней T-лимфоцитов (в том числе цитотоксических T-лимфоцитов и/или хелперных T-лимфоцитов) легко достигается с применением способа быстрого размножения согласно настоящему изобретению, согласно приведенным в настоящем документе примерам. См., например, патент США №6040177, Riddell et al. раздел 17, явным образом и полностью включенный в настоящий документ посредством ссылки.
[0217] Согласно некоторым вариантам реализации композицию согласно описанию в настоящем документе вводят внутривенно, внутрибрюшинно, внутрь опухоли, в костный мозг, в лимфатический узел и/или в спинномозговую жидкость. Согласно некоторым вариантам реализации указанный химерный рецептор сконструированные композиции доставляют в сайт локализации опухоли. Как вариант, композиции согласно описанию в настоящем документе могут быть скомбинированы с соединением, направляющим указанные клетки в опухоль или отделы иммунной системы, с избеганием таких областей, как легкие. Согласно некоторым вариантам реализации композиции согласно описанию в настоящем документе вводят с химиотерапевтические агенты и/или иммунодепрессанты. Согласно некоторым вариантам реализации пациент сначала получает лечение химиотерапевтическим агентом, который ингибирует или уничтожает другие иммунные клетки, а затем композициями, описанными в настоящем документе. В некоторых случаях химиотерапия может быть полностью опущена.
[0218] Настоящее изобретение также проиллюстрировано дополнительными вариантами реализации, описанными ниже.
Варианты реализации
[0219] Описанные ниже варианты реализации предназначены для иллюстрации, но не для ограничения настоящего изобретения каким-либо образом, в каком-либо виде или форме, прямо или косвенно. Хотя они представляют типичные для возможного применения варианты, могут также использоваться другие процедуры, методики или техники, известные специалистам в данной области техники.
Индивидуализация длины спейсерного домена для оптимального распознавания CD171 модифицированными химерным рецептором T-клетками
[0220] Были сконструированы химерные рецепторы, способные к нацеливанию и/или специфические для молекулы CD171, которая экспрессируется при значительном числе злокачественных новообразований человека, включая нейробластому. Химерные рецепторы к CD171 конструировали из специфических в отношении CD171 и/или нацеленных на CD171 scFV, которые специфически связывают и/или нацелены на эпитоп СЕ7 на CD171 и содержат внеклеточные спейсерные домены различной длины. Последовательности Ce7scFv-шарнир IgG4 - СН2 - СН3 - CD28tm/41BB - зета - Т2А - рЭФР-t - epHIV7 (длинная конструкция) (SEQ ID NO: 54) показаны на фиг. 5 и фиг. 6. Последовательности scFv СЕ7 - шарнир IgG4 - CH3-CD28tm/41BB - зета - Т2А - рЭФР-t - epHIV7 (промежуточного размера) (SEQ ID NO: 55) показаны на фиг. 7 и 8. Последовательности scFv СЕ7 - шарнир IgG4 - CD28tm/41BB - зета - Т2А - рЭФР-t - epHIV7 (короткая конструкция) (SEQ ID NO: 56) показаны на фиг. 9 и 10. Последовательность конструкции scFv СЕ7 - шарнир IgG4 - CD28tm/цито-41BB - зета - Т2А - рЭФР-t - epHIV7 с двумя костимулирующими доменами (SEQ ID NO: 57) показана на фиг. 11-12. Анализировали способность T-клеток, экспрессирующих каждый специфический в отношении CD171 и/или нацеленный на химерный рецептор CD171 к распознаванию CD171 нейробластомы опухоли in vitro и элиминации опухолевых клеток нейробластомы, трансплантированных мышам с иммунодефицитом.
Субъекты-люди
[0221] Мононуклеарные клетки периферической крови (МКПК) получали от здоровых доноров и пациентов после получения письменного информированного согласия на прохождение исследований согласно протоколу.
Линии клеток
[0222] Клетки нейробластомы линии SK-N-BE 2 (Ве2) получали из Американской коллекции типовых культур. Трансформированные вирусом Эпштейна-Барра TMLCL получали из МКПК согласно приведенному ранее описанию Pelloquin F, Lamelin JP, Lenoir GM. In vitro cell dev biol 1986; 22(12): 689-694.
Иммунофенотипирование
[0223] МКПК и линии клеток окрашивали следующими конъюгированными моноклональными антителами: CD4, CD8, CD28, CD45RA и CD62L и контрольные антитела совпадающего изотипа (BD Biosciences). Центральные T-клетки памяти выделяли из МКПК путем выделения CD8+ клеток и истощения CD8+ популяции по клеткам CD45RA с применением иммуномагнитных гранул. CD8+ клетки, истощенные по CD45RA, обогащали по CD62L с применением иммуномагнитных гранул согласно фиг. 1. Поверхностная экспрессия химерного рецептора CD171 анализировали с применением поликлонального антитела козы IgG против мыши (Fab-специфического) (Jackson ImmunoResearch). Проточно-цитометрический анализ осуществляли на FACSCanto®, отбор-сортировку на FACSAriaII® (Becton Dickinson); данные анализировали с применением программного обеспечения FlowJo® (Treestar).
Конструирование векторов и получение химерного рецептора, кодирующего лентивирус
[0224] Специфические в отношении CD171 и/или нацеленные на CD171 химерные рецепторы конструировали с применением сегментов цепей VL и VH моноклонального антитела к СЕ7 (CD171). (Последовательности вариабельных областей антитела к СЕ7 приведены на фиг. 5, 7, 9 и 11). Каждую область scFV соединяли со спейсерным доменом, происходящим из IgG4-Fc (база данных Uniprot: Р01861; таблица 2), содержащим либо последовательность «шарнир-СН2-СН3» (длинный спейсер: 229 аминокислот), либо последовательность «шарнир-СН3' (спейсер промежуточной длины: 119 аминокислот), либо только последовательность «шарнира» (короткий спейсер: 12 аминокислот) (таблица 6). Все спейсеры содержали замену S→P в «шарнирном» домене в положении 108 нативного белка IgG4-Fc, и были соединены с трансмембранным доменом длиной 27 аминокислот CD28 человека (Uniprot: Р10747, таблица 3) и с сигнальным модулем, содержащим либо (i) цитоплазматический домен длиной 41 аминокислот CD28 человека с заменой LL→GG в положениях 186-187 нативного белка CD28 (таблица 3) соединенный с цитоплазматическим доменом длиной 42 аминокислоты 4-1ВВ человека (Uniprot: Q07011, таблица 4), либо (ii) только цитоплазматический домен 4-1ВВ человека; каждый модуль был соединен с цитоплазматическим доменом длиной 112 аминокислот изоформы 3 CD3ζ человека (Uniprot: Р20963, таблица 5). Указанная конструкция кодировала элемент рибосомного «перепрыгивания» Т2А (таблица 1) и последовательность t-рЭФР (таблица 1) в 3'-направлении от химерного рецептора. Синтезировали (Life Technologies) и клонировали в лентивирусный вектор epHIV7 кодон-оптимизированные последовательности нуклеотидов человека, кодирующие каждый трансген.
[0225] Кодирующие химерный рецептор CD171 или t-рЭФР лентивирусы продуцировали в клетках 293Т с применением упаковывающих векторов pCHGP-2, pCMV-Rev2 и pCMV-G и реагента для трансфекции Calphos® (Clontech).
Получение линий T-клеток, экспрессирующих химерные рецепторы CD171
[0226] Проводили сортировку с отбором CD8+ CD45RA- CD62L+ центральных T-клеток памяти (TCM) из МКПК здоровых доноров (см. фиг. 1), активированных анти-CD3/CD28 гранулами (Life Technologies), и трансфицировали на 3 день после активации путем центрифугирования при 800 g в течение 45 минут при 32°C лентивирусным супернатантом (MOI=3) с добавлением 1 мкг/мл полибрена (Millipore). T-клетки размножали в RPMI с 10% сыворотки человека, 2 мМ L-глутамином (среда для CTL) с добавлением рекомбинантного IL-2 человека до конечной концентрации 50 ед/мл. Каждую линию T-клеток обогащали по субпопуляции t-pЭФР+ путем иммуномагнитного разделения с биотин-конъюгированными моноклональными антителами против рЭФР (ImClone Systems) и стрептавидиновыми гранулами (Miltenyi).
Цитотоксичность и секреция цитокинов
[0227] Целевые клетки, клетки Ве2 или TML CL, метили51Cr (PerkinElmer), промывали и инкубировали в трех повторностях в концентрации 1-2×103 клеток/лунку эффекторными модифицированными химерным рецептором T-клетками при различном соотношении эффекторных и целевых клеток (Е:Т). Супернатанты собирали для гамма-радиометрии через 4 часа инкубирования и определяли специфический лизис с применением стандартной формулы. Для анализа секреции цитокинов 5×104 T-клеток высевали в трех повторностях с целевыми клетками при соотношении Е:Т, составляющем 30:1, 10:1, 3:1 или 1:1, и определяли ИФН-γ, ФНО-α и IL-2 с применением ИФА ELISA или мультиплексного иммуноанализа на цитокины (Luminex) в супернатанте, собранном после инкубации в течение 24 часов.
Эксперименты на мышах NOD/SCID/γc-/- (NSG)
[0228] Самок мышей NOD.Cg-Prkdcscid Il2rgtmlWjl/SzJ (NSG) возрастом 6-8 недель получали от Jackson Laboratory или из собственного источника. Мышам вводили внутричерепные инъекции 0,2×106 опухолевых клеток нейробластомы, и через 7 дней вводили внутричерепную инъекцию, содержащую 2×106 модифицированных химерным рецептором или контрольных T-клеток. Для биолюминесцентной визуализации роста опухоли мышам инъецировали субстрат люциферина (Caliper Life Sciences), ресуспендированного в ФСБ (15 мкг/г массы тела). Мышей анестезировали изофлураном и визуализировали с применением системы визуализации Xenogen IVIS (Caliper) через 15 минут после инъекции люциферина в режиме низкого или среднего разрешения со временем регистрации от 1 с до 1 мин для получения ненасыщенных изображений. Активность люциферазы анализировали с применением программного обеспечения Living Image (Caliper); анализировали поток фотонов в представляющих интерес областях, охватывающих весь организм.
Статистический анализ
[0229] Статистический анализ осуществляли с применением программного обеспечения Prism (GraphPad®). Применяли двусторонний парный t-критерий Стьюдента с доверительным интервалом 95%; значимыми считали результаты с р-значением р<0,05. Статистический анализ выживаемости осуществляли с применением логарифмического рангового критерия; значимыми считали результаты с р-значением р<0,05.
Более длинный спейсерный домен химерного рецептора CD171 обеспечивает более выраженные цитотоксичность и секрецию цитокинов in vivo
[0230] Имеются данные о конструировании специфического в отношении CD171 и/или нацеленного на CD171 химерного рецептора с применением scFV к СЕ7 (Park J et al. Molecular Therapy 2007, April 15(4): 825-33). Указанный химерный рецептор придавал способность к специфическому распознаванию и/или нацеливанию на экспрессирующие CD171 опухоли in vitro, однако было высказано предположение, что модификация спейсерного домена может улучшать распознавание опухоли и T-клеточную сигнализацию. Соответственно, конструировали химерные рецепторы, содержащие спейсерный домен, выбранный из вариантов «шарнир-СН2-СН3» (229 аминокислот, длинный спейсер), «шарнир-СН3» (119 аминокислот, спейсер промежуточной длины) и «только шарнир» (12 аминокислот, короткий спейсер). Каждый из новых рецепторов содержал идентичную область scFV к СЕ7, и сигнальные модули 4-1ВВ и CD3ζ. Трансгенная кассета включала усеченный рЭФР (t-рЭФР) в качестве маркера трансдукции, селекции и для отслеживания in vivo модифицированных химерным рецептором T-клеток.
[0231] Очищенные CD8+ ТСМ трансфицировали химерными рецепторами CD171, содержащими спейсеры другой длины, и контрольным вектором t-рЭФР. Поверхностную экспрессию каждого из химерных рецепторов подтверждали окрашиванием F(ab)-специфическими антителами (фиг. 2А). Вестерн-блоттинг трансфицированных клеток с антителом, специфическим в отношении CD3ζ, демонстрирует экспрессию короткой, средней и длинной конструкций (фиг. 2В). Для каждого из указанных короткого, среднего или длинного спейсерного домена наблюдалась аналогичная экспрессия F(ab) и рЭФР-t.
[0232] Анализ in vitro функции CD8+ Т-клеток, модифицированных для экспрессии каждого из химерных рецепторов CD171, показал, что каждый рецептор придавал способность к специфическому лизису клеток Ве2, которые в естественных условиях экспрессируют CD171, однако не придавал способность к распознаванию контрольных TML CL (фиг. 2С). T-клетки, экспрессирующие длинный химерный рецептор CD171, обладали максимальной цитолитической активностью, и наблюдалась очевидная иерархия (длинный спейсер» промежуточный спейсер» короткий спейсер) выраженности лизиса опухолей в отношении несущих CD171 опухолевых мишеней (фиг. 2С).
[0233] Количественный анализ синтеза цитокинов в ответ на стимуляцию клетками Ве2 продемонстрировал продукцию ИФН-γ, ФНО-α и IL-2 T-клетками, экспрессирующими каждый из химерных рецепторов CD171. Согласно наблюдениям в ходе анализов на цитотоксичность, T-клетки, содержащие конструкцию с длинным спейсером, превосходили остальные в отношении опосредования секреции цитокинов после распознавания опухоли (фиг. 2D).
Для активности in vivo специфического в отношении CD171 и/или нацеленного на CD171 CAR требуется короткий внеклеточный спейсерный домен
[0234] Оставалось неясным, распространяется ли превосходящая активность модифицированных химерным рецептором CD171 с более длинным спейсером T-клеток in vitro на усиленную или улучшенную противоопухолевую активность in vivo. Для разрешения указанных вопросов животным в когортах иммунодефицитных мышей NSG инокулировали клетки нейробластомы путем внутричерепной инъекции; через 7 дней мыши получали лечение путем внутричерепного введения одной дозы CD8+ Т-клеток. содержащих CD171-специфический химерный рецептор с коротким, промежуточным или длинным спейсером. Контрольные мыши получали лечение T-клетками с t-рЭФР или не получали лечения. У не получавших лечение мышей NSG/NB развивалась нейробластома, приводящая к необходимости умерщвления приблизительно через 4 недели после инокуляции опухолей (фиг. 2Е, правая панель).
[0235] Регрессия опухоли и повышенная или улучшенная выживаемость наблюдались у всех мышей, получавших лечение содержащими химерный рецептор CD171 T-клетками с коротким спейсером. У мышей, получавших лечение содержащими химерный рецептор CD171 T-клетками с коротким спейсером, наблюдались превосходящие противоопухолевый ответ и выживаемость по сравнению с мышами, получавших лечение T-клетками, содержащими химерный рецептор CD171 с длинным спейсером (фиг. 2Е, правая панель). Измерение общего потока от опухолевых клеток, нагруженных субстратом люциферина, показывает, что у мышей, получавших лечение CD8-клетками, трансфицированными конструкцией с коротким спейсером или спейсером промежуточного размера, наблюдался значительно меньший поток по сравнению с не получавшими лечения мышами или мышами, получавшими лечение CD8-клетками, трансфицированными конструкцией с длинным спейсером (фиг. 2Е, левая панель).
[0236] В опухолях от мышей, получавших лечение CD8 Tcm, экспрессирующими CAR к CD171 с длинным спейсером, наблюдался более высокий процент клеток CD3+ по оценке с применением иммуногистохимии по сравнению с мышами, получавшими ложное лечение или лечение CD8 Tcm, экспрессирующими CD171 CAR с коротким или средним спейсером (фиг. 2F). В разных CD8 Tcm не было детектировано различий Ki67 по оценке с применением иммуногистохимии, однако в CD8 Tcm, экспрессирующих CAR CD171 с длинным спейсером, обнаруживались более высокие уровни каспазы 3 и гранзима В по сравнению с CD8 Tcm, экспрессирующими рецептор с коротким спейсером или спейсером среднего размера через 3 дня после инъекции T-клеток (фиг. 2G).
Специфический в отношении CD171 и/или нацеленный на CD171 CAR, содержащий длинный внеклеточный спейсерный домен, обуславливал более высокие наблюдаемые уровни индуцированной активацией клеточной смерти
[0237] Для определения потенциальных механизмов, обуславливающих более низкую противоопухолевую активность in vivo T-клеток, экспрессирующих химерные рецепторы CD171 с длинными спейсерными доменами, была рассмотрена возможность того, что опухолевые клетки не активировали T-клетки in vivo в достаточной степени, или же что происходила индуцированная активацией смерть T-клеток in vivo.
[0238] Центральные CD8-клетки памяти, трансфицированные конструкциями CD171 CAR с коротким, промежуточным или длинным спейсером, приводили в контакт с клетками нейробластомы in vitro в течение 24 часов (цикл 1). Центральные CD8-клетки памяти извлекали из культуры и фенотипически характеризовали, после чего инкубировали с опухолевыми клетками в течение еще 24 часов (цикл 2). CD8-клетки извлекали из культуры, фенотипически характеризовали, после чего проводили культивирование с опухолевыми клетками в течение еще 24 часов (цикл 3). Затем CD8-клетки извлекали и фенотипически характеризовали.
[0239] Клетки каждого цикла характеризовали по экспрессии маркеров активации CD25 и CD69 с применением проточной цитометрии. Процент погибших клеток в каждом цикле определяли с применением Guava Viacount. Клетки NB характеризовали по экспрессии FasR после цикла I.
[0240] Результаты показывают, что содержащие CAR с коротким спейсером клетки демонстрировали меньшую активацию и
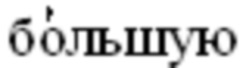
[0241] В совокупности эти данные свидетельствуют о том, что направленные на CD171 химерные рецепторы с длинным внеклеточным спейсерным доменом, несмотря на опосредовать эквивалентные или превосходящие уровни эффекторной функции in vitro, индуцируют высокий уровень индуцированной активацией клеточной смерти in vivo и не способны обеспечивать эрадикацию развившейся нейробластомы.
[0242] CD171 привлекал интерес в качестве потенциальной мишени иммунотерапии раковых заболеваний благодаря экспрессии на поверхности многих карцином. Дизайн и функцию химерных рецепторов CD171 повышали или улучшали путем модификации внеклеточного спейсерного домена. Результаты показывают, что центральные T-клетки памяти, трансфицированные направленным на CD171 CAR с коротким спейсерным доменом, содержащим только шарнир, проявляли значительно большую эффективность в модели эрадикации опухолей нейробластомы in vivo по сравнению с T-клетками, трансфицированными направленным на CD171 CAR со спейсерным доменом, содержащим шарнир-СН3 (спейсер промежуточного размера) или шарнир-СН2-СН3 (длинный спейсер).
Модификация костимулирующих доменов
[0243] Конструировали химерные рецепторы, способные к нацеливанию или специфические в отношении молекулы CD171, которая экспрессируется на значительном числе злокачественных новообразований человека, в том числе нейробластоме. Химерные рецепторы CD171 конструировали из специфических в отношении CD171 и/или нацеленных на CD171 scFV, которые специфически связывают и/или нацелены на эпитоп СЕ7 на CD171 и содержат короткий внеклеточный спейсерный домен. Одна из конструкций содержит костимулирующий домен 4-1ВВ, соединенный с доменом CD3-зета (4-1ВВ); другая конструкция включает двойной костимулирующий домен, включающий цитоплазматический домен CD28 и 4-1ВВ, соединенный с CD3-зета (цитоплазматический домен CD28). Последовательность конструкции scFv СЕ7 - шарнир IgG4 - CD28tm/цито-41BB - зета - Т2А - рЭФР-t - epHIV7 с двумя костимулирующими доменами приведена на фиг. 11-12. Последовательность scFv СЕ7 - шарнир IgG4 - CD28tm/41BB - зета - Т2А - рЭФР-t - epHIV7 (короткая конструкция) приведена на фиг. 9-10. Анализировали способность T-клеток, экспрессирующих каждый из CD171-специфических химерных рецепторов, к распознаванию CD171 на опухолях нейробластомы in vitro и к элиминации опухолевых клеток нейробластомы, трансплантированных мышам с иммунодефицитом.
Субъекты-люди
[0244] Мононуклеарные клетки периферической крови (МКПК) получали от здоровых доноров и пациентов после получения письменного информированного согласия на прохождение исследований согласно протоколу.
Линии клеток
[0245] Клетки нейробластомы линии SK-N-BE 2 (Ве2) получали из Американской коллекции типовых культур. Трансформированные вирусом Эпштейна-Барра TMLCL получали из МКПК согласно приведенному ранее описанию Pelloquin F, Lamelin JP, Lenoir GM. In vitro cell dev biol 1986; 22(12): 689-694.
Иммунофенотипирование
[0246] МКПК и линии клеток окрашивали следующими конъюгированными моноклональными антителами: CD4, CD8, CD28, CD45RA и CD62L, и контрольными антителами совпадающего изотипа (BD Biosciences). Центральные T-клетки памяти выделяли из МКПК путем выделения CD8+ клеток и истощения популяции клеток CD8+ по клеткам CD45RA с применением иммуномагнитных гранул. Клетки CD8+, истощенные по CD45RA, обогащали по CD62L с применением иммуномагнитных гранул согласно фиг. 1. Поверхностную экспрессию химерного рецептора CD171 анализировали с применением поликлонального антитела козы против IgG мыши (Fab-специфического) (Jackson ImmunoResearch). Проточно-цитометрический анализ осуществляли на FACSCanto®, отбор-сортировку на FACSAriaII® (Becton Dickinson) и данные анализировали с применением программного обеспечения FlowJo® (Treestar).
Конструирование векторов и получение кодирующего химерный рецептор лентивируса
[0247] Специфические в отношении CD171 и/или нацеленные на CD171 химерные рецепторы конструировали с применением сегментов цепей VL и VH моноклонального антитела к СЕ7 (CD171). (Последовательности вариабельных областей СЕ7 приведены на фиг. 5, 7, 9 и 11). Каждая scFV соединена со спейсерным доменом, происходящим из последовательностей IgG4-Fc (база данных Uniprot: Р01861; таблица 2), содержащим либо «шарнир-СН2-СН3» (длинный спейсер: 229 аминокислот), либо «шарнир-СН3» (спейсер промежуточной длины: 119 аминокислот), либо только «шарнир» (короткий спейсер: 12 аминокислот) (таблица 6). Все спейсеры содержали замену S→P в «шарнирном» домене в положении 108 нативного белка IgG4-Fc, и были соединены с трансмембранным доменом CD28 человека длиной 27 аминокислот (Uniprot: P10747, таблица 3) и с сигнальным модулем, содержащим либо (i) цитоплазматический домен длиной 41 аминокислот CD28 человека с заменой LL→GG в положениях 186-187 нативного белка CD28 (таблица 3), соединенный с цитоплазматическим доменом длиной 42 аминокислот 4-1ВВ человека (Uniprot: Q07011, таблица 4) или (ii) только цитоплазматический домен 4-1ВВ человека; каждый модуль был соединен с цитоплазматическим доменом длиной 112 аминокислот изоформы 3 CD3ζ человека (Uniprot: Р20963, таблица 5). Одна конструкция содержала костимулирующий сигнальный модуль, содержащий цитоплазматический домен длиной 42 аминокислоты 4-1ВВ человека (Uniprot: Q07011, SEQ ID NO: 15), который был соединен с цитоплазматическим доменом длиной 112 аминокислот изоформы 3 CD3ζ человека (Uniprot: Р20963, SEQ ID NO: 16). Указанная конструкция кодировала элемент рибосомного «перепрыгивания» Т2А (SEQ ID NO: 8) и последовательность t-рЭФР (SEQ ID NO: 9) в 3'-направлении от химерного рецептора. Синтезировали кодон-оптимизированные последовательности нуклеотидов человека, кодирующие каждый трансген (Life Technologies) и клонировали в лентивирусный вектор epHIV7. Кодирующие химерный рецептор CD171 или t-рЭФР лентивирусы продуцировали в клетках 293Т с применением упаковывающих векторов pCHGP-2, pCMV-Rev2 и pCMV-G и реагента для трансфекции Calphos® (Clontech). Получение линий T-клеток, экспрессирующих химерные рецепторы CD171
[0248] Проводили сортировку с отбором CD8+ CD45RA-CD62L+ центральные T-клетки памяти (TCM) из МКПК здоровых доноров (см. фиг. 1), активированных анти-CD3/CD28 гранулами (Life Technologies), и трансфицировали на 3 день после активации путем центрифугирования при 800 g в течение 45 минут при 32°C лентивирусным супернатантом (MOI=3) с добавлением 1 мкг/мл полибрена (Millipore). T-клетки размножали в RPMI с 10% сыворотки человека, 2 мМ L-глутамина (среда для CTL) с добавлением рекомбинантного IL-2 человека до конечной концентрации 50 ед/мл и IL-15 до конечной концентрации 10 нг/мкл. Каждую линию T-клеток обогащали по субпопуляции t-рЭФР+ путем иммуномагнитного разделения с биотин-конъюгированным моноклональным антителом к рЭФР (ImClone Systems) и стрептавидиновыми гранулами (Miltenyi).
Цитотоксичность и секреция цитокинов
[0249] Целевые клетки, клетки Ве2 или TML CL, метили51Cr (PerkinElmer), промывали и инкубировали в трех повторностях в концентрации 1-2×103 клеток/лунку с эффекторными модифицированными химерным рецептором T-клетками при различном соотношении эффекторных и целевых клеток (Е:Т). Собирали супернатанты для гамма-радиометрии через 4 часа инкубирования и определяли специфический лизис с применением стандартной формулы. Для анализа секреции цитокинов 5×104 T-клеток высевали с целевыми клетками в трех повторностях при соотношении Е:Т, составляющем 30:1, 10:1, 3:1 или 1:1, и оценивали уровни ИФН-γ, ФНО-α и IL-2 с применением ИФА ELISA или мультиплексного иммуноанализа на цитокины (Luminex) в супернатанте, собранном после инкубации в течение 24 часов.
Эксперименты на мышах NOD/SCID/γc-/- (NSG)
[0250] Самок мышей NOD.Cg-Prkdcscid Il2rgtmlWjl/SzJ (NSG) возрастом 6-8 недель получали от Jackson Laboratory или из собственного источника. Мышам вводили внутричерепную инъекцию с 0,2×106 опухолевых клеток нейробластомы и внутричерепную инъекцию с 2×106 модифицированных химерным рецептором или контрольных T-клеток. Для биолюминесцентной визуализации роста опухоли мышам инъецировали субстрат люциферина (Caliper Life Sciences), ресуспендированного в ФСБ (15 мкг/г массы тела). Мышей анестезировали изофлураном и визуализировали с применением системы визуализации Xenogen IVIS (Caliper) через 15 минут после инъекции люциферина в режиме низкого или среднего разрешения со временем регистрации от 1 секунды до 1 минуты для получения ненасыщенных изображений. Активность люциферазы анализировали с применением программного обеспечения Living Image (Caliper) и анализировали поток фотонов в представляющих интерес областях, охватывающих весь организм.
Статистический анализ
[0251] Статистический анализ осуществляли с применением программного обеспечения Prism (GraphPad®). Применяли двусторонний парный t-критерий Стьюдента с доверительным интервалом 95%; значимыми считали результаты с р-значением р<0,05. Статистический анализ выживаемости выполняли с применением логарифмического рангового критерия; значимыми считали результаты с р-значением р<0,05.
Химерный рецептор CD171 с короткой спейсерной областью и двумя костимулирующими доменами обеспечивает более выраженные цитотоксичность и секрецию цитокинов in vivo
[0252] Авторы изобретения трансфицировали очищенные CD8+ ТСМ с химерными рецепторами к CD171, содержащими разные костимулирующие домены, и контрольным вектором t-рЭФР. Поверхностную экспрессию каждого из химерных рецепторов подтверждали окрашиванием F(ab)-специфическими антителами (фиг. 4А). Аналогичная экспрессия F(ab) и рЭФР-t наблюдалась для каждой из конструкций с одним костимулирующим доменом 4-1ВВ (панель 2) и конструкции с цитоплазматическим CD28/костимулирующим доменом 4-1ВВ (панель 3). Анализ функции CD8+ Т-клеток, модифицированных для экспрессии каждого из химерных рецепторов CD171 in vitro показал, что каждый рецептор обеспечивал способность к специфическому лизису клеток Ве2, в естественных условиях экспрессирующих CD171, однако не обеспечивал способность к распознаванию контрольных TML CL (фиг. 4В). Экспрессирующие химерный рецептор CD171 с цитоплазматическим доменом CD28/костимулирующим доменом 4-1ВВ T-клетки обладали более высокой цитолитической активностью. Количественный анализ синтеза цитокинов в ответ на стимуляцию клетками Ве2 показал синтез ИФН-γ T-клетками, экспрессирующими каждый из химерных рецепторов CD171. Согласно наблюдениям в ходе анализов на цитотоксичность конструкция, содержащая цитоплазматический домен CD28/костимулирующий домен 4-1ВВ, превосходила остальные в отношении опосредования секреции цитокинов после распознавания опухоли (фиг. 4С).
Специфический в отношении CD171 и/или нацеленный на CD171 CAR, содержащий цитоплазматический домен CD28/костимулирующий домен 4-1ВВ, был менее эффективен in vivo
[0253] Оставалось неясным, распространяется ли превосходящая активность in vitro T-клеток, модифицированных химерным рецептором CD171 с цитоплазматическим доменом CD28/костимулирующим доменом 4-1ВВ на усиленную или улучшенную противоопухолевую активность in vivo. Для разрешения указанных вопросов авторы настоящего изобретения инокулировали животным в когортах мышей NSG с иммунодефицитом клетки нейробластомы путем внутричерепной инъекции, и через 7 дней вводили мышам одну внутричерепную дозу CD8+ Т-клеток, содержащих специфический в отношении CD171 и/или нацеленный на CD171 химерный рецептор с коротким, промежуточным или длинным спейсером. Контрольные мыши получали лечение t-рЭФР T-клетками или не получали лечения. У не получавших лечение мышей NSG/NB развивалась нейробластома, приводящая к необходимости умерщвления приблизительно через 4 недели после инокуляции опухолей (фиг. 4D).
[0254] Авторы наблюдали регрессию опухоли и повышение выживаемости у всех мышей, получавших лечение T-клетками с химерным рецептором CD171, содержащим конструкцию с одним костимулирующим доменом 4-1ВВ. У мышей, получавших лечение T-клетками с химерным рецептором CD171, содержащим конструкцию с одним костимулирующим доменом 4-1ВВ, наблюдались превосходящие противоопухолевый ответ и выживаемость по сравнению с мышами, получавших лечение T-клетками, содержащими химерный рецептор CD171 с цитоплазматическим доменом СЭ28/костимулирующим доменом 4-1ВВ (фиг. 4D).
При применении специфических в отношении CD171 и/или нацеленных на CD171 CAR с длинным внеклеточным спейсерным доменом наблюдались более высокие уровни индуцированной активацией клеточной смерти
[0255] Авторы настоящего изобретения попытались определить потенциальные механизмы, определяющие более низкую противоопухолевую активность in vivo T-клеток, экспрессирующих химерные рецепторы CD171 с цитоплазматическим доменом CD28/костимулирующим доменом 4-1ВВ. Авторы предположили, что опухолевые клетки не активировали указанные T-клетки in vivo в достаточной степени, или же что происходила индуцированная активацией смерть T-клеток in vivo.
[0256] Центральные CD8-клетки памяти, трансфицированные конструкциями CD171CAR с цитоплазматическим CD28/костимулирующим доменом 4-1ВВ или костимулирующим доменом 4-1ВВ приводили в контакт с клетками нейробластомы in vitro в течение 24 часов (цикл 1). Центральные CD8-клетки памяти извлекали из культуры и характеризовали фенотипически, после чего инкубировали с опухолевыми клетками в течение еще 24 часов (цикл 2). CD8-клетки извлекали из культуры и характеризовали фенотипически, после чего проводили культивирование с опухолевыми клетками в течение еще 24 часов (цикл 3). Затем CD8-клетки извлекали и фенотипически характеризовали. Клетки каждого цикла характеризовали по экспрессии маркеров активации CD25 и CD69 с применением проточной цитометрии. Процент погибших клеток в каждом цикле определяли с применением Guava Viacount.
[0257] Эти результаты показывают, что несущие CAR клетки, содержащие только костимулирующий домен 4-1ВВ, демонстрировали меньшую степень активации и большую жизнеспособность по сравнению с клетками, экспрессирующими рецепторы CAR с цитоплазматическим доменом CD28/костимулирующим доменом 4-1ВВ после серийной стимуляции путем совместного культивирования с опухолевыми клетками (цикл III: CD25 + CD69 + 40% (4-1ВВ): 60% (цитоплазматический домен CD28/4-1BB) (фиг. 4Е), % мертвых клеток 20% (4-1ВВ): 45% (цитоплазматический домен CD28/4-1BB) (фиг. 4F). В совокупности эти данные свидетельствуют о том, что направленные на CD171 химерные рецепторы с двойным цитоплазматическим доменом CD28/ костимулирующим доменом 4-1ВВ, несмотря на опосредование эквивалентной или превосходящей эффекторной функции in vitro, индуцируют высокие уровни индуцированной активацией клеточной смерти in vivo и отличаются пониженной способностью к эрадикации развившейся нейробластомы.
[0258] Дизайн и функцию химерных рецепторов CD171 усовершенствовали или улучшали путем модификации костимулирующего домена. Эти результаты показывают, что центральные T-клетки памяти, трансфицированные направленным на CD171 CAR с одним костимулирующим доменом 4-1ВВ, проявляли значительно
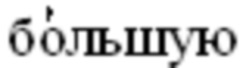
Вклад длины внеклеточного спейсера и цитоплазматического сигнального домена в эффективность функционирования нацеленного на CD171 CAR in vitro и in vivo.
[0259] Оценивали in vitro и in vivo вклад длины внеклеточного спейсера и цитоплазматического сигнального домена в эффективность функционирования нацеленного на CD171 CAR. In vitro основное внимание уделяли анализу цитотоксичности, секреции цитокинов, статуса активации и клеточной смерти с применением стандартных анализов и нового стресс-теста с несущими CAR T-клетками, включающего несколько последовательных циклов контакта с опухолевыми клетками. Каждое исследование повторяли несколько раз с применением разных донорных T-клеток; последний анализ включал либо объединенные данные, либо данные репрезентативных экспериментов на двух или более образцах. В ходе экспериментов in vivo анализировали противоопухолевую активность с применением визуализации живых клеток, выживаемость и иммуногистохимические параметры. Все эксперименты на мышах включали по меньшей мере по 2 мыши на группу. Все выбросы были включены в анализ данных.
Конструирование CAR и получение лентивирусов
[0260] Специфические в отношении CD171 и/или нацеленные на CD171 рецепторы CAR конструировали с применением (G4S)3 пептидосвязанных сегментов VL и VH моноклонального антитела IgG2 к СЕ7 (против CD171). Область scFv была кодон-оптимизирована и затем соединена со спейсерными доменами вариабельной длины на основе 12 аминокислот (короткий спейсер (SS) / «только шарнир»), 119 аминокислот (средний спейсер (МС) / «шарнир-СН3») или 229 аминокислот (длинный спейсер (LS) / «шарнир-СН2-СН3»), происходящих из Fc IgG4 человека. Все спейсеры содержали замену S→Р в «шарнирном» домене в положении 108 белка Fc IgG4 и были соединены с трансмембранным доменом CD28 человека и с сигнальными модулями, содержащими либо (i) только цитоплазматический домен 4-1ВВ (2G CAR), либо (ii) цитоплазматический домен CD28 (мутантный) и 4-1ВВ (3G CAR), при этом каждый сигнальный модуль соединен карбоксильным концом с эндодоменом CD3-ζ человека. Часть цитоплазматического домена CD28, используемого в указанных конструкциях, содержала замены LL→GG в положениях 186-187 нативного белка CD28. Клоны кДНК, кодирующие варианты CAR, соединяли с расположенным в направлении 3' элементом рибосомного «перепрыгивания» Т2А и усеченным рецептором ЭФР (рЭФР-t), клонировали в лентивирусный вектор epHIV7 и синтезировали несущие CD171-CAR лентивирусы в клетках 293Т.
ПЦР в реальном времени
[0261] Тотальную РНК экстрагировали из T-клеток с применением набора RNeasy Minikit в соответствии с инструкциями производителя (Qiagen). кДНК синтезировали путем реакции обратной транскрипции с применением набора First Strand Kit (Life Technologies). Количественное определение РНК специфических генов выполняли с применением праймеров для рт-ПЦР для FasL (IDT) и системы детекции в реальном времени CFX96 (Biorad). Актин использовали в качестве гена домашнего хозяйства. Данные анализировали с применением программного обеспечения CFX Manager версии 3.0.
Экспрессия белков
[0262] После вестерн-блоттинга (WB) T-клетки собирали, дважды промывали в ФСБ и лизировали ингибитором протеаз (Millipore). Белки анализировали с применением ДСН-ПААГ-электрофореза, а затем вестерн-блоттинга с антителами к CD247 (CD3-ζ, BD Biosciences) в соответствии с инструкциями производителя. Сигналы детектировали с применением инфракрасного визуализатора Odyssey и количественно определяли интенсивность полос с применением программного обеспечения Odyssey v2.0 (LI-COR).
Проточная цитометрии
[0263] Иммунофенотипирование выполняли с применением конъюгированных с флуорофорами моноклональных антител: CD4, CD8, CD27, CD28, CD45RA, CD45RO, CD62L, CCR7 (Biolegend). Поверхностную экспрессию L1CAM анализировали с применением конъюгированного с флуорофорами моноклонального антитела (клон 014, Sino Biological). Экспрессию рЭФР-t анализировали с применением биотинилированного цетуксимаба (Bristol-Myers-Squibb) и конъюгированного с флуорофором стрептавидином вторичного реагента. Для оценки активации и AICD использовали конъюгированные с флуорофорами моноклональные антитела к CD25, CD69, CD137, С178 (Лиганд Fas) и CD95 (Fas, все от Biolegend). Активность каспазы-3 измеряли с применением CaspGlow (eBioscience) согласно протоколу производителя. Проточно-цитометрический анализ осуществляли на системе LSRFortessa (BD Biosciences) и данные анализировали с применением программного обеспечения FlowJo (Treestar).
Получение линий T-клеток, экспрессирующих рецепторы CAR к CD171
[0264] Образцы гепаринизированной цельной крови получали от здоровых доноров после получения письменного информированного согласия на прохождение исследования по протоколу, одобренному Экспертным советом научно-исследовательского института детской больницы Сиэтла (SCRI IRB #13795). Мононуклеарные клетки периферической крови (МКПК) выделяли, используя стандартный протокол с применением фиколла (GE Healthcare Life Sciences); центральные CD8+CD45RO+CD62L+ Т-клетки памяти (TCM) выделяли с применением иммуномагнитных микрогранул в соответствии с инструкциями производителя (Miltenyi Biotec). Сначала получали CD8+CD45RO+ клетки путем негативного отбора с применением набора для выделения CD8 T-клеток и гранул CD45RA, затем клетки обогащали по CD62L, активировали анти-CD3/CD28 гранулами при соотношении гранул и клеток, составляющем 3:1 (Life Technologies, Thermo Fisher Scientific) и трансфицировали на 3 день путем центрифугирования при 800 g и температуре 32°C в течение 30 минут лентивирусным супернатантом (множественность заражения [MOI]=5) с добавлением 1 мг/мл сульфата протамина (АРР Pharmaceuticals). T-клетки размножали в RPMI (Cellgro), содержащей 10% термоинактивированной фетальной бычьей сыворотки (Atlas, Fort Collins, СО), 2 ммоль/л L-глутамина (Cellgro) с добавлением рекомбинантного интерлейкина человека (IL)-2 (Chiron Corporation) до конечной концентрации 50 ед/мл и 10 нг/мкл IL-15 (Miltenyi Biotec). Каждую линию T-клеток обогащали по субпопуляции pЭФР-t+ путем иммуномагнитного разделения с применением конъюгированных с биотином антитела Erbitux (Bristol-Myers-Squibb) и стрептавидиновыми микрогранулами (Miltenyi Biotec). Содержащие CD171 CAR и ложнотрансфицированные контрольные T-клетки размножали, используя протокол быстрого размножения (Т-клетки для анализов in vivo замораживали на стадии S1R2D14 и размораживали в день проведения инъекций.
Линии клеток
[0265] Линии клеток нейробластомы Ве2 и SK-N-DZ получали из Американской коллекции типовых культур (АТСС). Ве2 GFP-ffLuc_epHIV7 и SK-N-DZ GFP-ffLuc_epHIV7 получали путем лентивирусной трансдукции геном люциферазы светлячков (ffLuc) и очищали путем сортировки на GFP. Обе линии клеток дополнительно трансфицировали CD19t-2A-IL2_pHIV7 для получения секретирующих IL-2 линий клеток нейробластомы, очищенных сортировкой на CD19t. Все линии клеток NB культивировали в DMEM (Cellgro) с добавлением 10% термоинактивированной фетальной бычьей сыворотки и 2 ммоль/L L-глутамина. Трансформированные вирусом Эпштейна-Барра клетки лимфобластоидных линий (TMLCL) и TMLCL, экспрессирующие мембраносвязанный CD3-эпсилон специфический scFvFc, происходящий из моноклонального антитела ОКТ3 (TMLCL-OKT3), культивировали в RPMI 1640 с добавлением 10% термоинактивированной фетальной бычьей сыворотки и 2 ммоль/л L-глутамина.
Сигнализация через T-клеточный рецептор CAR
[0266] После совместного культивирования 1×106 эффекторных или целевых клеток на протяжении 4-8 минут клетки обрабатывали для измерения Erk/MAP-киназной

Анализ T-клеток in vitro
[0267] Цитотоксичность по оценке с применением метода высвобождения радиоактивного хрома. Целевые клетки метили51Cr (Perkin Elmer), промывали и инкубировали в трех повторностях в концентрации 5×103 клеток на лунку с T-клетками (S1R2D12-14) при различных соотношениях эффекторных и целевых клеток (Е:Т). Супернатанты собирали через 4 часа инкубирования для гамма-радиометрии с применением Top Count NTX (Perkin Elmer) и определяли специфический лизис согласно приведенному ранее описанию.
Цитотоксичность по оценке с применением биофотонного люциферазного анализа
[0268] Линии клеток NB, содержащие GFP-ffLuc_epHIV7, культивировали совместно с эффекторными клетками в соотношении 5:1 Е:Т. Эффекторные клетки находились на этапе первого, второго или третьего цикла стимуляции опухолевыми клетками согласно описанию выше. Для оценки количества жизнеспособных опухолевых клеток, сохранившихся после контакта с T-клетками, добавляли D-люциферин и через 5 минут измеряли биофотонный сигнал от клеток NB с применением системы визуализации IVIS Spectrum (Perkin Elmer).
Высвобождение цитокинов
[0269] T-клетки в общем количестве (S1R2D12-14) 5×105 клеток высевали со стимулирующими клетками при соотношении Е:Т, составляющем 2:1, и культивировали в течение 24 часов. ИФН-γ, TNF-a и IL-2 в супернатанте измеряли с применением анализа на цитокины Bio-plex и системы Bioplex-200 (Bio-rad Laboratories).
Стресс-тест
[0270] Для имитации рекурсивного воздействия антигена начинали совместное культивирование адгезивных целевых клеток и свежеразмороженных неадгезивных эффекторных клеток в соотношении Е:Т, равном 1:1. Через 24 (цикл I) и 48 (цикл II) часов, оценивали жизнеспособность T-клеток с применением анализа Guava ViaCount (Millipore) и неадгезивные эффекторные клетки перемещали к новой партии адгезивных целевых клеток в соотношении Е:Т, равном 1:1. После циклов I, II и III (72 часа) T-клетки собирали и обрабатывали с применением набора для удаления мертвых клеток (Miltenyi) перед дальнейшим анализом.
Иммуногистохимия
[0271] После умерщвления головной мозг мышей извлекали, фиксировали в течение 24 часов в 10% буферном растворе нейтрального формалина (Thermo), обрабатывали, заливали в парафин и изготавливали срезы толщиной 5 мкм. Демаскировку антигенов выполняли с применением буфера Diva Decloaker RTU (Biocare Medical). Первичные антитела инкубировали со срезами в течение ночи при температуре 4°C и разводили в блокирующем буфере следующим образом: моноклональное антитело крысы против CD3 человека (клон CD3-12, AbD Serotec/Bio-rad) в пропорции 1:100, моноклональное антитело мыши против Ki67 человека (клон MIB-1, Dako) в пропорции 1:200, поликлональное антитело кролика против расщепленной каспазы-3 человека (Biocare Medical) в пропорции 1:100, поликлональное антитело кролика против гранзима В человека (Covance) в пропорции 1:200. Вторичные антитела (Life technologies) инкубировали со срезами в течение 2 часов при комнатной температуре и разбавляли ФСБ с 0,2% БСА в пропорции 1:500.
[0272] Препараты визуализировали при 40× увеличении на вертикальном эпифлуоресцентном микроскопе Eclipse Ci (Nikon), оснащенном системой многоспектральной визуализации Nuance (Perkin Elmer). Данные визуализации анализировали с применением аналитического программного обеспечения InForm (Perkin Elmer).
Эксперименты на мышах NOD/SOD/γc-/-
[0273] Модели опухолей на мышах NSG исследовали согласно протоколам, одобренным Институциональным комитетом по содержанию и использованию животных при SCRI.
Модель внутричерепного ксенотрансплантата нейробластомы человека на мышах NSG
[0274] Взрослых самцов мышей

Статистический анализ
[0275] Статистический анализ проводили с применением программного обеспечения Prism (GraphPad). Данные представлены в виде значений среднего ±SD или SEM согласно указанному на условных обозначениях к фигурам. Применяли двусторонний парный t-критерий Стьюдента с доверительным интервалом 95%; результаты с Р-значением, составляющим менее чем 0,05, считали значимыми. Статистический анализ выживаемости проводили с применением логарифмического рангового критерия; результаты с Р-значением, составляющим менее чем 0,05, считали значимыми. Величину обеспечиваемого CAR цитолитического и цитокинового функционального ответа может повышающе модулировать размер внеклеточного спейсера CAR
[0276] На биофизический синапс между экспрессирующей CAR T-клеткой и опухолевой клеткой влияет расстояние от эпитопа на целевой поверхностной молекуле опухолевой клетки до плазматической мембраны опухолевой клетки. Было высказано предположение, что коррекция размера внеклеточного спейсера CAR в соответствии с требуемым для функционального сигнального синапса представляет собой ключевой элемент для конструирования биологически активных рецепторов CAR. Для оценки влияния размера внеклеточного спейсера специфического в отношении CD171 и/или нацеленного на CD171 CAR с применением модульных доменов IgG4 человека собирали серию спейсеров следующим образом: «длинный спейсер» (LS) шарнир IgG4-CH2-CH3, «средний спейсер» (МС), содержащий соединенные шарнир IgG4 и СН3, и «короткий спейсер» (SS), содержащий шарнир IgG4. Каждый вариант спейсера соединяли с трансмембранным доменом CD28, а затем с эндодоменом 4-1ВВ : зета второго поколения (2G), который, в свою очередь, был соединен с меткой клеточной поверхности рЭФР-t с применением пептида рибосомного «перепрыгивания» Т2А (фиг. 13А). Серии происходящих из CD8+ центральных клеток памяти человека линий эффекторных T-клеток (TE(CM)) 2G-CAR+/рЭФР-t+ с вариантами спейсера получали из очищенных предшественников CD8+CD45RO+CD62L+ центральных клеток памяти с помощью иммуномагнитного разделения (фиг. 19А и 19В). После размножения линии трансфицированных лентивирусом ТЕ(СМ) дополнительно обогащали для обеспечения гомогенных уровней экспрессии рЭФР-t путем положительного отбора с применением иммуномагнитного разделения с цетуксимабом (18). Подтверждали аналогичные уровни поверхностной экспрессии каждого из вариантов спейсера CAR с применением проточно-цитометрического окрашивания специфическими антителами против мыши F(ab) и рЭФР и количественного определения экспрессии белка с применением вестерн-блоттинга CD3ζ в каждой линии T-клеток (фиг. 13В и С).
[0277] После получения указанных результатов требовалось определить, влияет ли на величину запускаемой 2G-CAR in vitro активации CD8+ TE(CM) размер спейсерного домена. После активации опухолевыми клетками CD171+ нейробластомы (NB) человека специфические в отношении CD171 и/или нацеленные на CD171 2G-CAR(LS) CD8+ ТЕ(СМ) демонстрировали в 3,1 раз более высокие уровни фосфо-ERK (р=0,003), и 5,7 раз более высокий процент клеток экспрессировали маркер активации CD137 (р=0,015) по сравнению с их эквивалентами CD171-CAR(SS) (фиг. 13D и 13Е). 2G-CAR(MC) демонстрировали промежуточные уровни фосфо-ERK и индукции CD137 по сравнению с LS и SS рецепторами CAR второго поколения. Затем определяли, модулирует ли размер спейсера также величину противоопухолевой цитолитической активности согласно паттерну LS>MC>SS. С применением способа 4-часового высвобождения радиоактивного хрома наблюдали лизис целевых клеток CD171+NB, соответствующий тому же градиенту эффективности LS>MC>SS, как для высокоэкспрессирующих CD171 Ве2, так и для низкоэкспрессирующих CD171 SK-N-DZ линий клеток NB (фиг. 13F и фиг. 20А). Кроме того, активация секреции цитокинов соответствовала той же иерархической схеме нарастания эффекта, так что 2G-CAR(LS) обеспечивал синтез в 8,4 раз большего количества ИФН-γ (р=0,003), в 6,3 раз большего количества IL-2 (р<0,0001) и в 6,1 раз большего количества ФНО-α (р=0,005; фиг. 13G) по сравнению с 2G-CAR(SS); для 2G-CAR(MC) наблюдались промежуточные результаты между указанными двумя крайностями. Эти данные показывают, что размер спейсера может обеспечивать настройку биофизического синапса, образуемого рецепторами CAR, с достижением нарастающих уровней активации и функциональных результатов. На основании стандартных критериев разработки CAR, обычно используемых в данной области техники, вариант спейсера 2G-CAR(LS) возглавляет список кандидатных вариантов при дальнейших разработках для клинического применения.
Обратная корреляция модулируемой спейсером функциональной эффективности перенаправленных CAR CTL in vitro и противоопухолевой активности in vivo
[0278] Для определения взаимосвязи наблюдаемой эффективности CAR-сигнализации на основании in vitro анализов и терапевтической активности in vivo, осуществляли эксперименты по адоптивному переносу у мышей NSG с прижившимися ксенотрансплантатами нейробластомы человека, стереотаксически имплантируют в полушарие головного мозга (фиг. 14А). Неожиданным образом, у мышей с трансплантатами опухолей Ве2, получавших лечение в виде внутриопухолевой инъекции 2G-CAR(LS), наблюдалось отсутствие терапевтической активности, что обуславливало необходимость умерщвления животных приблизительно через 3 недели после инокуляции опухолей (фиг. 14В и 14С). Напротив, у мышей, получавших лечение 2G-CAR(SS) CAR CD8+ TE(CM) и, в умеренной степени, у мышей, получающих лечение вариантом 2G-CAR(MC) (р=0,001, биофотонный сигнал от опухоли был менее интенсивным и выживаемость повышалась; медианная выживаемость других групп: LS=20 дней, ложное лечение = 21 день, МС=59,5 дней, SS=76 дней). У мышей с трансплантированными опухолями SK-N-DZ наблюдалась иерархия отклика опухолей SS>MC>>LS, при однородной элиминации опухоли и 100% выживаемости у животных, получавших лечение 2G-CAR(SS) CD8+ ТЕ(СМ) (фиг. 20С и D). Неспособность перенаправленных 2G-CAR(LS) CTL, которые инъецировали непосредственно в трансплантированные опухоли, не может быть объяснена их неспособностью выживать в ходе адоптивного переноса и активироваться in situ, поскольку при ИГХ-анализе вскоре после адоптивного переноса (на 3 день) наблюдалась эквивалентная внутриопухолевая плотность перенесенных T-клеток, которые экспрессировали гранзим В и Ki67 (фиг. 14D-G). Концентрация клеток 2G-CAR(LS) CD8+ ТЕ(СМ), в которых была детектирована активированная каспаза-3, была выше в 12,1 раз по сравнению с эквивалентами, содержащими 2G-CAR(SS), хотя указанные результаты и не были статистически значимыми (р=0,34). Эти данные указывают на неожиданное расхождение между противоопухолевой активностью перенаправленных CAR T-клеток in vitro, определяемой размером внеклеточного спейсера, и их противоопухолевой терапевтической активностью in vivo.
Гиперактивная сигнализация, обеспечиваемая содержащими длинный спейсер рецепторами CAR второго поколения, сопровождается повышением уровней индуцированной активацией клеточной смерти при рекурсивных контактах с антигеном
[0279] Было высказано предположение, что, хотя активация цитолиза in vitro в ходе 4-часового анализа с радиоактивным хромом (CRA) является следствием ограниченной продолжительности опосредованной CAR сигнализации, для достижения эрадикации опухолей в модели in vivo необходимы рекурсивные циклы активации. Соответственно, показатели эффективности сигнализации при применении конкретного формата CAR, обеспечивающего высокие показатели in vitro, могут не отражать результатов сигнализации in vivo. Для воспроизведения рекурсивной многократной стимуляции in vitro был разработан «стресс-тест», включающий совместное культивирование несущих CAR T-клеток и опухолевых клеток, в соответствии с которым каждые 24 часа несущие CAR T-клетки собирают и повторно переносят в культуральные чашки с высеянными опухолевыми клетками, поддерживая постоянное соотношение жизнеспособных T-клеток и опухолевых клеток на уровне 1:1 (фиг. 15А). Клетки Ве2, модифицированные для экспрессии гена люциферазы светлячков, использовали для одновременного отслеживания киллинга опухолевых клеток в каждом из трех циклов многократного переноса. Рекурсивная активация линий клеток, несущих 2G-CAR с вариантами спейсера, приводила к эквивалентному уменьшению противоопухолевой активности к III циклу (фиг. 15В). Кроме того, анализ экспрессирующих каждый вариант спейсера эффекторных клеток после каждого цикла с применением проточной цитометрии показал, что среди 2G-CAR(LS) CD8+ TE(CM) присутствовало большее число клеток, экспрессирующих маркеры активации CD25 и CD69, по сравнению с их эквивалентами, несущими 2G-CAR(SS) (цикл I: 79,4% и 46,8%, р=0,007; цикл II: 74,0% и 47,6%; цикл III: 65,7% и 42,1%, р=0,037) (фиг. 15С).
[0280] В отличие от повышающей регуляции маркеров активации в соответствии с паттерном LS>MC>SS в цикле I, имитирующей ранее наблюдавшуюся в ходе анализа in vitro, наблюдалось уменьшение жизнеспособности T-клеток в соответствии с паттерном LS/MC>SS, наиболее выраженное в цикле III (процент погибших клеток в цикле III: LS 58,7%, МС 62,6%, SS 21,1%, значимость различия LS и SS: р=0,024; значимость различия МС и SS: р=0,007) (фиг. 15D). Для подтверждения того, что асимметричное уменьшение жизнеспособности T-клеток при использовании 2G-CAR(LS) CTL в ходе рекурсивной активации представляло собой результат повышения уровней AICD, проводили анализ механизма клеточной смерти, сосредоточенный на опосредованном FasL-Fas взаимном уничтожении T-клеток. Для повышающей регуляции FasL, зависимой от индуцированной опухолью активации CAR, наблюдалась иерархия LS>MC>SS, поскольку 2G-CAR(LS) CD8+ TE(CM) демонстрировали в 4,8 и 2,5 раз более высокие уровни поверхностной экспрессии FasL, и в 5,5- и 3,3 раз более высокое относительное содержание мРНК FasL, чем T-клетки, содержащие CAR с коротким или средним спейсером, соответственно (длинный спейсер/короткий спейсер: р<0,0001 и р=0,002; длинный спейсер/средний спейсер: р<0,0001 и р=0,016) (фиг. 15Е и 15F). Для определения взаимосвязи экспрессии FasL с повышением уровня опосредованного Fas апоптоза анализировали активность каспазы-3; в 2G-CAR(LS) CD8+ TE(CM) наблюдались в 13,2 раз более высокие уровни расщепленной каспазы-3 по сравнению с их содержащими SS эквивалентами (р<0,0001) (фиг. 15G). Наконец, в 2G-CAR(LS) CD8+ ТЕ(СМ) осуществляли нокдаун миРНК Fas или FasL, а затем приводили их в контакт с опухолью и наблюдали 1,4-кратное (Fas) (р=0,005) и 1,6-кратное (FasL) (р=0,0001) увеличение жизнеспособности T-клеток после цикла III, соответственно (фиг. 15Н). Для подтверждения того, что нокдаун миРНК приводил к снижению уровней Fas/FasL, оценивали их поверхностную экспрессию на 2G-CAR(LS) CD8+ TE(CM) и наблюдали снижение числа Fas+ клеток CTL на 91,3% (р<0,0001) и снижение числа FasL + клеток CTL на 80,1% (р<0,0001) по сравнению с 2G-CAR(LS) CD8+ TE(CM), обработанных скремблированной миРНК (фиг. 21А и 21В). В совокупности эти данные показывают, что настройка размера спейсера CAR может обеспечивать модуляцию последующей сигнализации, что приводит не только к различным уровням противоопухолевых функциональных результатов, но и к соответствующему повышению чувствительности к AICD. Баланс между указанными двумя процессами для оптимальной противоопухолевой активности in vivo не всегда может быть достигнут за счет настройки спейсера для обеспечения максимальных уровней сигнализации CAR, что проиллюстрировано приведенным сравнением структурных вариантов 2G-CAR(LS) и 2G-CAR(SS).
Введение цитоплазматического эндодомена в состав рецептора CAR превращает CD171-CAR с коротким спейсером в подверженный AICD вариант при рекурсивном контакте с опухолью
[0281] Рецепторы CAR третьего поколения содержат два модуля костимулирующих эндодоменов, присоединенные к активирующему модулю CD3-ζ; было отмечено, что они повышают уровни цитолиза и синтеза цитокинов по сравнению с эквивалентами второго поколения. Специфический в отношении CD171 и/или нацеленный на CD171 3G-CAR собирали путем добавления эндодомена CD28 к эндодомену 2G 4-1ВВ : зета (фиг. 16А). CD8+ TE(CM), экспрессирующие сопоставимые уровни 2G-CAR(SS) и 3G-CAR(SS), получали из очищенных предшественников ТСМ путем иммуномагнитного разделения (фиг. 16В и С). 3G-CAR(SS) CD8+ TE(CM) демонстрировали 8,4-кратное увеличение индуцированной экспрессии CD137 при контакте с опухолью по сравнению с эквивалентами второго поколения (р<0,0001) (фиг. 16D), 1,3-кратное увеличение цитолитической активности в отношении мишеней Ве2 (соотношение эффекторных и целевых клеток: 1:10, р=0,0001) (фиг. 16Е), 5,1-кратное увеличение секреции IL-2 и 2,5-кратное увеличение секреции ФНО-α (р<0,0001 и р=0,003) (фиг. 16F).
[0282] Затем оценивали, способна ли повышенная активация T-клеток за счет дополненного CAR, опосредованная эндодоменом третьего поколения (3G) в контексте короткого внеклеточного спейсера избирательно повышать противоопухолевую активность in vivo без интенсификации AICD. Неожиданным образом было обнаружено, что уровни Ве2 (фиг. 17А) и SK-N-DZ (фиг. 17В) были ниже, хотя не до статистически значимой степени, по сравнению с обеспечиваемыми эквивалентами 2G-CAR(SS). Указанные результаты не могут быть объяснены различиями краткосрочной персистенции несущих CAR T-клеток в опухолях, определенной на основании аналогичных концентраций CD3+ Т-клеток человека, детектированных через 3 дня после адоптивного переноса (фиг. 17С). Несмотря на обнаруженные более высокие концентрации положительных по гранзиму В 3G-CAR(SS) T-клеток по сравнению с внутриопухолевыми 2G-CAR(SS) T-клетками, наблюдалось также и повышенное количество T-клеток третьего поколения с активированной каспазой-3, что свидетельствует о том, что повышенная костимуляция за счет комбинированного эффекта CD28 и 4-1ВВ в CAR третьего поколения могла обеспечивать гиперстимуляцию, приводящую к повышению уровней AICD, несмотря на короткий внеклеточный спейсерный домен (фиг. 17D). Эти данные подтверждали путем сравнения эффективности с применением стресс-теста in vitro. После каждого цикла опухолевой стимуляции наблюдалось увеличение концентрации CD25+CD69+ Т-клеток в популяции 3G-CAR(SS) T-клеток (фиг. 18А), сопровождаемое повышением концентраций погибших T-клеток в ходе последовательных циклов активации (фиг. 18В). Повышенные уровни AICD, в свою очередь, были связаны с повышенными уровнями экспрессии FasL по оценке на основании поверхностного окрашивания и содержания мРНК, которые также совпадали с повышенными уровнями активированной каспазы 3 (фиг. 18С-Е). Эти данные показывают, что настройка путем модификации состава внутриклеточного сигнального домена CAR, приводящая к сверхстимуляции сигнализации, в результате комбинаторного эффекта отрицательно сказывалась на эффективности отрегулированного короткого спейсера за счет увеличения уровней опосредованной FasL AICD T-клеток.
[0283] Рецепторы CAR способны опосредовать мультиплексную сигнализацию, запускающую эффекторную функцию перенаправленных противоопухолевых T-клеток. Несмотря на бесспорную терапевтическую эффективность перенаправленных на CD19 CAR T-клеток у пациентов с острым лимфобластным лейкозом, биофизические структурно-функциональные характеристики указанного класса синтетических рецепторов до сих пор не вполне понятны. Хотя очевидно, что настройка рецепторов CAR для эффективной T-клеточной противоопухолевой активности должна быть более точной при применении для солидных опухолей, эмпирический дизайн рецепторов CAR на основании ограниченного понимания влияния их состава на противоопухолевую функцию in vivo только тормозит прогресс в направлении клинического применения у человека. В настоящем изобретении было проведено системное исследование структурно-функциональных свойств CAR в полученных из центральных клеток памяти человека CD8+ эффекторных CTL, сфокусированное на комбинаторном(ых) эффекте(ах) размеров внеклеточного спейсера в контексте состава цитоплазматических сигнальных модулей. Исследование уровней CAR-сигнализации с применением анализов in vitro позволило описать иерархическую схему эффективности структурных вариантов CAR. В ходе указанных анализов был определен диапазон уровней CAR-сигнализации, обеспечивающих уровень противоопухолевой активности in vivo, при превышении которых in vivo эффективность уменьшается в результате повышения уровней AICD.
[0284] Эволюция дизайна рецепторов CAR до настоящего времени представляла собой в значительной степени эмпирический процесс, и фокусировалась преимущественно на усилении сигнализации за счет применения комбинируемых модулей костимулирующих рецепторных цитоплазматических доменов, последовательно присоединяемых к ITAM, содержащие активация домены, такие как зета-цепь комплекса CD3. Сравнение функции CTL, экспрессирующих рецепторы CAR первого, второго или третьего поколения, как правило, проводят в контексте «базового» внеклеточного спейсерного домена, предпочитаемого в конкретной лаборатории, размер которого варьирует от полноразмерных IgG до относительно коротких шарниров CD8α или расположенных у мембраны фрагментов CD28. Многие исследователи изучали влияние размеров спейсера на сигнальную и функциональную активность CAR. В отличие от контакта TcR с нагруженными пептидами HLA класса I или II, который определяет заданное биофизическое расстояние между плазматической мембраной T-клетки и плазматической мембраной целевой клетки, позволяющее сборку супрамолекулярного активационного комплекса (SMAC), рецепторы CAR не соответствуют указанным размерным отношениям вследствие конструктивных размеров целевой молекулы, расположения эпитопа scFv на целевой молекуле и размера спейсера CAR. Молекулярная сборка комплекса SMAC, задействующая рецепторы CAR, относительно малоизучена, однако полученные к настоящему времени результаты анализов предполагают, что она не повторяет упорядоченную архитектуру SMAC TcR. Хотя первые два размера уникальны для каждого выбранного антигена и выбранного связывающего домена антитела, размер спейсера CAR является настраиваемым параметром и до некоторой степени способен скомпенсировать остальные, нормализуя ортогональное синаптическое расстояние между несущей CAR T-клеткой и целевой клеткой. Указанная конфигурация иммунологического синапса между T-клеткой и целевой клеткой также определяет расстояния, которые не могут быть функционально соединены рецептором CAR, так как отдаленный от мембраны эпитоп на целевой молекуле клеточной поверхности, даже при коротком спейсере CAR, не может обеспечить синаптическое расстояние, приблизительно соответствующее необходимому для сигнализации. Аналогичным образом, были описаны расположенные у мембраны эпитопы целевых антигенов CAR, обеспечивающие сигнализацию исключительно в контексте длинного спейсера CAR.
[0285] Сначала проводили оценку влияния размера внеклеточного спейсера на сигнализацию 4-1ВВ : зета второго поколения CAR с применением специфического в отношении CD171 и/или нацеленного на CD171 связывающего домена scFv, происходящего из моноклонального антитела к СЕ7. Наблюдалось нарастание эффективности сигнальной функции на основании in vitro анализов по мере увеличения размеров спейсера от короткого спейсера, содержащего шарнир IgG4, к спейсеру промежуточного размера, содержащему шарнир : СН3 и полноразмерному спейсеру, содержащему шарнир IgG4:Fc. Неожиданным образом, при тестировании in vivo на развившихся стереотаксически имплантированных ксенотрансплантатах интрапаренхиматозной нейробластомы головного мозга у мышей NSG, противоопухолевая активность инъецируемых внутрь опухолей CAR CD8+ CTL отрицательно коррелировала с размерами спейсера (т.е. SS>MC>>LS) и функциональной эффективностью in vitro. T-клетки вводили непосредственно внутрь опухолей для устранения потенциальных эффектов спейсера на миграцию T-клеток или взаимодействий с клетками Fc+ мыши, способных влиять на выживаемость. С учетом указанных открытий было высказано предположение, что обычно применяемые in vitro анализы для оценки функции несущих CAR T-клеток (т.е. анализ цитолиза опухолевых клеток, стимуляции секреции цитокинов и пролиферации) при однократной ограниченной по времени стимуляции опухолевыми клетками не позволяют детектировать последующие события, происходящие с несущими CAR T-клетками при рекурсивном контакте с опухолью, предположительно происходящем в солидных опухолях in vivo. Для более точной оценки указанной возможности был разработан анализ in vitro, в ходе которого несущие CAR T-клетки подвергают рекурсивному воздействию равного количества экспрессирующих биофотонный репортерный ген опухолевые клетки. Киллинг опухолевых клеток может, таким образом, быть количественно определен с применением биофотонного сканирования, а статус активации, жизнеспособность, и каспазная активность извлеченных несущих CAR T-клеток может быть исследован после каждого цикла совместного культивирования с опухолевыми клетками. После трех рекурсивных контактов с опухолью in vitro наблюдалось возрастание расхождения концентрации подвергавшихся апоптозу 2G-CAR(LS) T-клеток и 2G-CAR(SS) Т-клеток. Повышенные уровни AICD коррелировали с повышенной индуцированной LS CAR экспрессией FasL и активированной каспазы-3 по сравнению с SS CAR. Уровни AICD в несущих LS CAR T-клетках были понижены за счет миРНК-нокдауна FAS или FasL до контакта с опухолевыми клетками. Указанные полученные in vitro данные коррелировали с ограниченной внутриопухолевой персистенцией LS CAR T-клеток в опухолевых ксенотрансплантатах по сравнению с SS CAR T-клетками. В совокупности эти данные демонстрируют, что не участвующий в сигнализации внеклеточный спейсер представляет собой основной настраиваемый элемент дизайна CAR, оказывающий влияние не только на сигнальную активность, но и на персистенцию несущих CAR T-клеток в солидных опухолях.
[0286] С учетом взаимосвязи между размерами спейсера и выживаемости in vivo в контексте рецепторов CAR 4-1ВВ-зета второго поколения (2G) была предпринята попытка определить, является ли короткий спейсер в общем случае оптимальным в контексте повышения эффективности сигнализации, обеспечиваемой рецепторами CAR третьего поколения (3G), содержащими эндодомен CD28:4-1ВВ : зета. В соответствии с наблюдениями, полученными рядом других групп, специфические в отношении CD171 и/или нацеленные на CD171 3G-CAR(SS) стимулировали повышенные уровни цитолитической активности и синтеза цитокинов по сравнению с 2G-CAR(SS) при опухолевой стимуляции in vitro. Однако повышенная эффективность сигнализации 3G-CAR в контексте короткого спейсера также обеспечивала повышение экспрессии FasL и интенсификацию апоптоза, определяемую по повышению уровней активированной каспазы-3, и приводила к большей частоте клеточной смерти. Соответственно, наблюдалась ослабленная противоопухолевая эффективность 3G-CAR(SS) T-клеток in vivo по сравнению с 2G-CAR(SS) в результате пониженной выживаемости внутри опухоли in vivo. Хотя CD28 костимулирует T-клетки при начальной антигенной активации и повышает жизнеспособность T-клеток, останавливая AICD за счет регулируемого NFAT повышения уровней cFLIPshort, опубликованные исследования также свидетельствуют о том, что рекурсивная костимуляция CD28 ранее активированных T-клеток может уменьшать их последующую выживаемость за счет повышенной экспрессии FasL и, вследствие этого, повышенных уровней AICD. Соответственно, было бы интересно выяснить, отвечает ли рекурсивная CD28-сигнализация, опосредованная несущими анти-CD19-CD28 : зета CAR T-клетками, за относительно непродолжительную персистенцию у получавших лечение пациентов с ОЛЛ, в отличие от часто пролонгированной персистенции у получавших лечение анти-CD19 4-1ВВ : зета пациентами в описанных клинических испытаниях (2, 35).
В совокупности эти данные показывают, что эффективность перенаправленных CAR T-клеток in vivo зависит, отчасти, от идентификации подходящих комбинаций оптимизированных по размеру внеклеточных спейсерных доменов в контексте конкретного состава цитоплазматического сигнального домена. Кроме того, был описан in vitro анализ для оценки предрасположенности конструкции CAR к индукции AICD в первичных CD8+ CTL человека при рекурсивной активации. Указанные исследования обнаруживают риск «избыточной модификации» рецепторов CAR в результате комбинаторного эффекта размеров спейсера и выбора цитоплазматического сигнального модуля.
[0287] На настоящий момент не существует априорной прогностической структурной модели для надежного направленного конструирования рецепторов CAR на основании расположения эпитопа целевой молекулы относительно плазматической мембраны опухолевой клетки. Кроме того, обычно используемые биологические анализы для имитации in vitro могут направлять на ложный путь, не позволяя осуществлять точный выбор состава CAR, обеспечивающего максимально высокие уровни функциональной противоопухолевой эффективности несущих CAR T-клеток при максимально низких уровнях AICD. Описанные в настоящем документе исследования показали, что техника скрининга библиотеки структур рецепторов CAR с применением стресс-теста in vitro может обеспечивать дополнительный ценный параметр для использования при конструировании CAR. Можно предположить, что восприимчивость гиперактивных конструкций CAR к AICD может быть ограничена за счет применения генетических стратегий, таких как принудительная сверхэкспрессия cFLIP или Toso, или направляемый векторами синтез миРНК, обеспечивающих нокдаун FasL или Fas. Для манипуляций с восприимчивостью T-клеток к апоптозу требуется применение соразмерно строгих мер безопасности, например, включение индуцируемых суицидных конструкций, или реостатов для контроля трансгенной экспрессии под контролем клинического специалиста, например, регулируемых малыми молекулами систем контроля транскрипции или трансляции. Дополнительные вторичные последствия избыточной модификации CAR также требуют вмешательства, например, предрасположенность гиперактивных рецепторов CAR к запуску повышенной экспрессии ингибирующих рецепторов, таких как PD-1, способных стимулировать функциональный статус с истощением по T-клеткам, в PD-L1. Полученные данные показывают, что: 1.) Тестирование зависимости структуры и функции CAR in vitro с применением стандартных функциональных анализов может приводить к неверному выбору кандидатных конструкций, поскольку обычно внимание сосредоточено на конструкциях, проявляющих максимальную функциональную активность, и; 2.) настройка эффективности перенаправленных CAR эффекторных CTL ограничена верхним пределом, после прохождения которого прирост величины эффекторной активности сводится на нет в результате увеличения AICD при рекурсивной стимуляции через CAR. Указанные результаты направляли выбор специфического в отношении CD171 и/или нацеленного на CD171 CAR с коротким спейсером для исследования I фазы у детей с рецидивирующей/рефрактерной нейробластомой.
Дополнительные варианты реализации
[0288] Согласно некоторым вариантам реализации предложена нуклеиновая кислота химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лигандсвязывающий домен связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, имеющий некоторую длину, позволяющую нацеливание и/или обеспечивающую специфичность в отношении лиганда, при этом указанный спейсер оптимизирован, с) полинуклеотид, кодирующий трансмембранный домен, и d) полинуклеотид, кодирующий внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой фрагмент антитела. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент. Согласно некоторым вариантам реализации длина указанного спейсера составляет 15 аминокислот или менее. Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3, или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанный спейсер оптимизирован для повышенной пролиферации T-клеток и/или синтеза цитокинов в ответ на лиганд по сравнению с референсным химерным рецептором.
[0289] Согласно некоторым вариантам реализации предложен полипептид химерного рецептора. Согласно некоторым вариантам реализации указанный полипептид химерного рецептора кодирует нуклеиновая кислота химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лигандсвязывающий домен связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, имеющий специфическую для указанного лиганда длину, при этом указанный спейсер оптимизирован, с) полинуклеотид, кодирующий трансмембранный домен, и d) полинуклеотид, кодирующий внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой фрагмент антитела. Согласно некоторым вариантам реализации указанный спейсер оптимизирован для повышенной пролиферации T-клеток и/или синтеза цитокинов в ответ на лиганд по сравнению с референсным химерным рецептором. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент. Согласно некоторым вариантам реализации длина указанного спейсера составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера.
[0290] Согласно некоторым вариантам реализации предложен экспрессионный вектор, содержащий выделенную нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лигандсвязывающий домен связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, имеющий специфическую для указанного лиганда длину, при этом указанный спейсер оптимизирован, с) полинуклеотид, кодирующий трансмембранный домен, и d) полинуклеотид, кодирующий внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный спейсер оптимизирован для повышенной пролиферации T-клеток и/или синтеза цитокинов в ответ на лиганд по сравнению с референсным химерным рецептором. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой фрагмент антитела. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент. Согласно некоторым вариантам реализации длина указанного спейсера составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера.
[0291] Согласно некоторым вариантам реализации предложена клетка-хозяин. Согласно некоторым вариантам реализации указанная клетка-хозяин содержит экспрессионный вектор. Согласно некоторым вариантам реализации предложен экспрессионный вектор, содержащий выделенную нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лигандсвязывающий домен связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, имеющий специфическую для указанного лиганда длину, при этом указанный спейсер оптимизирован, с) полинуклеотид, кодирующий трансмембранный домен, и d) полинуклеотид, кодирующий внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный спейсер оптимизирован для повышенной пролиферации T-клеток и/или синтеза цитокинов в ответ на лиганд по сравнению с референсным химерным рецептором. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой фрагмент антитела. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент. Согласно некоторым вариантам реализации длина указанного спейсера составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит, выбранный из группы, состоящей из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти и смешанных CD8+ Т-клеток. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO+, CD62L+ и/или CD8+. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA+, CD62L+ и/или CD4+, и/или отрицательной по CD45RO.
[0292] Согласно некоторым вариантам реализации предложена композиция. Согласно некоторым вариантам реализации указанная композиция содержит клетку-хозяина в фармацевтически приемлемом вспомогательном веществе. Согласно некоторым вариантам реализации указанная клетка-хозяин содержит экспрессионный вектор. Согласно некоторым вариантам реализации предложен экспрессионный вектор, содержащий выделенную нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лигандсвязывающий домен связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, имеющий специфическую для указанного лиганда длину, при этом указанный спейсер оптимизирован, с) полинуклеотид, кодирующий трансмембранный домен, и d) полинуклеотид, кодирующий внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой фрагмент антитела. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент. Согласно некоторым вариантам реализации длина указанного спейсера составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит, выбранный из группы, состоящей из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти и смешанных CD8+ Т-клеток. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO+, CD62L+ и/или CD8+. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA+, CD62L+ и/или CD4+, и/или отрицательной по CD45RO. Согласно некоторым вариантам реализации указанная композиция содержит клетку-хозяина, при этом указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит, выбранный из группы, состоящей из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти и смешанных CD8+ Т-клеток, или указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO+, CD62L+ и/или CD8+, и другую клетку-хозяина, при этом указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток, или указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA+, CD62L+ и/или CD4+, и/или отрицательной по CD45RO. Согласно некоторым вариантам реализации указанный спейсер оптимизирован для повышенной пролиферации T-клеток и/или синтеза цитокинов в ответ на лиганд по сравнению с референсным химерным рецептором.
[0293] Согласно некоторым вариантам реализации предложен способ получения клетки-хозяина in vitro. Согласно некоторым вариантам реализации указанный in vitro способ получения клетки-хозяина включает: а) получение библиотеки нуклеиновых кислот, кодирующих химерный рецептор причем каждая нуклеиновая кислота совокупности нуклеиновых кислот кодирует химерный рецептор отличной длины, b) введение каждой нуклеиновой кислоты из указанной совокупности нуклеиновых кислот в отдельную популяцию выделенных T-лимфоцитов и размножение каждой популяции T-лимфоцитов in vitro, с) введение каждой популяции генетически модифицированных T-лимфоцитов несущим опухоли животным в моделях на животных и определение наличия у популяции генетически модифицированных T-лимфоцитов противоопухолевой эффективности и d) выбор нуклеиновой кислоты, кодирующей химерный рецептор, обеспечивающий противоопухолевую эффективность in vitro и/или в модели на животных. Согласно некоторым вариантам реализации указанная клетка-хозяин содержит экспрессионный вектор. Согласно некоторым вариантам реализации предложен указанный экспрессионный вектор, содержащий выделенную нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лигандсвязывающий домен связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, имеющий специфическую для указанного лиганда длину, при этом указанные спейсер оптимизирован, с) полинуклеотид, кодирующий трансмембранный домен, и d) полинуклеотид, кодирующий внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный спейсер оптимизирован для повышенной пролиферации T-клеток и/или синтеза цитокинов в ответ на лиганд по сравнению с референсным химерным рецептором. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой фрагмент антитела. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент. Согласно некоторым вариантам реализации длина указанного спейсера составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит, выбранный из группы, состоящей из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти и смешанных CD8+ Т-клеток. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO+, CD62L+ и/или CD8+. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA+, CD62L+ и/или CD4+, и отрицательной по CD45RO. Согласно некоторым вариантам реализации указанные нуклеиновые кислоты, кодирующие химерный рецептор, содержит экспрессионный вектор. Согласно некоторым вариантам реализации указанный экспрессионный вектор содержит выделенную нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лигандсвязывающий домен связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, имеющий специфическую для указанного лиганда длину, при этом указанный спейсер оптимизирован, с) полинуклеотид, кодирующий трансмембранный домен, и d) полинуклеотид, кодирующий внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный спейсер оптимизирован для повышенной пролиферации T-клеток и/или синтеза цитокинов в ответ на лиганд по сравнению с референсным химерным рецептором. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой фрагмент антитела. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент. Согласно некоторым вариантам реализации длина указанного спейсера составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанный способ дополнительно включает введение выбранной нуклеиновой кислоты, кодирующей химерный рецептор, в клетку-хозяина.
[0294] Согласно некоторым вариантам реализации предложен способ получения клетки-хозяина in vitro. Согласно некоторым вариантам реализации указанный способ включает а) введение нуклеиновой кислоты химерного рецептора или экспрессионного вектора в популяцию лимфоцитов, имеющих фенотип CD45RA-, CD45RO+ и/или CD62L+ и b) культивирование указанных клеток в присутствии антител к CD3 и/или к CD28, и по меньшей мере одного гомеостатического цитокина до получения достаточного количества клеток для применения в качестве клеточной инфузий. Согласно некоторым вариантам реализации указанная клетка-хозяин содержит экспрессионный вектор. Согласно некоторым вариантам реализации предложен экспрессионный вектор, содержащий выделенную нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лигандсвязывающий домен связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, имеющий специфическую для указанного лиганда длину, при этом указанный спейсер оптимизирован, с) полинуклеотид, кодирующий трансмембранный домен, и d) полинуклеотид, кодирующий внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой фрагмент антитела. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент. Согласно некоторым вариантам реализации указанный спейсер оптимизирован для повышенной пролиферации T-клеток и/или синтеза цитокинов в ответ на лиганд по сравнению с референсным химерным рецептором. Согласно некоторым вариантам реализации длина указанного спейсера составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит, выбранный из группы, состоящей из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти и смешанных CD8+ Т-клеток. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO+, CD62L+ и/или CD8+. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA+, CD62L+ и/или CD4+, и/или отрицательной по CD45RO. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лигандсвязывающий домен связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, имеющий специфическую для указанного лиганда длину, при этом указанный спейсер оптимизирован, с) полинуклеотид, кодирующий трансмембранный домен, и d) полинуклеотид, кодирующий внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой фрагмент антитела. Согласно некоторым вариантам реализации указанный спейсер оптимизирован для повышенной пролиферации T-клеток и/или синтеза цитокинов в ответ на лиганд по сравнению с референсным химерным рецептором. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент. Согласно некоторым вариантам реализации длина указанного спейсера составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанный экспрессионный вектор содержит выделенную нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лигандсвязывающий домен связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, имеющий специфическую для указанного лиганда длину, при этом указанный спейсер оптимизирован, с) полинуклеотид, кодирующий трансмембранный домен, и d) полинуклеотид, кодирующий внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный спейсер оптимизирован для повышенной пролиферации T-клеток и/или синтеза цитокинов в ответ на лиганд по сравнению с референсным химерным рецептором. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой фрагмент антитела. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент. Согласно некоторым вариантам реализации длина указанного спейсера составляет 15 аминокислот или менее. Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанный лимфоцит представляет собой CD8+ или CD4+.
[0295] Согласно некоторым вариантам реализации предложено применение клетки-хозяина или композиции в лечении ракового заболевания или солидной опухоли, экспрессирующего(ей) CD171. Согласно некоторым вариантам реализации указанная композиция содержит клетку-хозяина в фармацевтически приемлемом вспомогательном веществе. Согласно некоторым вариантам реализации указанная клетка-хозяин содержит экспрессионный вектор. Согласно некоторым вариантам реализации предложен экспрессионный вектор, содержащий выделенную нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лигандсвязывающий домен связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, имеющий специфическую для указанного лиганда длину, при этом указанный спейсер оптимизирован, с) полинуклеотид, кодирующий трансмембранный домен, и d) полинуклеотид, кодирующий внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный спейсер оптимизирован для повышенной пролиферации T-клеток и/или синтеза цитокинов в ответ на лиганд по сравнению с референсным химерным рецептором. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой фрагмент антитела. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент. Согласно некоторым вариантам реализации длина указанного спейсера составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит, выбранный из группы, состоящей из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти и смешанных CD8+ Т-клеток. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO+, CD62L+ и/или CD8+. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA+, CD62L+ и/или CD4+, и/или отрицательной по CD45RO. Согласно некоторым вариантам реализации указанная композиция содержит клетку-хозяина, при этом указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит, выбранный из группы, состоящей из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти и смешанных CD8+ Т-клеток, или указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO+, CD62L+ и/или CD8+, и другую клетку-хозяина, при этом указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток, или указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA+, CD62L+ и/или CD4+, и/или отрицательной по CD45RO. Согласно некоторым вариантам реализации указанная клетка-хозяин содержит экспрессионный вектор. Согласно некоторым вариантам реализации предложен экспрессионный вектор, содержащий выделенную нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лигандсвязывающий домен связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, имеющий специфическую для указанного лиганда длину, при этом указанный спейсер оптимизирован, с) полинуклеотид, кодирующий трансмембранный домен, и d) полинуклеотид, кодирующий внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный спейсер оптимизирован для повышенной пролиферации T-клеток и/или синтеза цитокинов в ответ на лиганд по сравнению с референсным химерным рецептором. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой фрагмент антитела. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент. Согласно некоторым вариантам реализации длина указанного спейсера составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит, выбранный из группы, состоящей из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти и смешанных CD8+ Т-клеток. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO+, CD62L+ и/или CD8+. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA+, CD62L+ и/или CD4+, и/или отрицательной по CD45RO. Согласно некоторым вариантам реализации указанное раковое заболевание представляет собой нейробластому. Согласно некоторым вариантам реализации указанная солидная опухоль выбрана из группы, состоящей из рака толстой кишки, рака почки, рака поджелудочной железы и рака яичников.
[0296] Согласно некоторым вариантам реализации предложен способ осуществления клеточной иммунотерапии у субъекта с раковым заболеванием или опухолью. Согласно некоторым вариантам реализации указанный способ включает введение композиции или клетки-хозяина указанному субъекту. Согласно некоторым вариантам реализации указанная клетка-хозяин содержит экспрессионный вектор. Согласно некоторым вариантам реализации предложен экспрессионный вектор, содержащий выделенную нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лигандсвязывающий домен связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, имеющий специфическую для указанного лиганда длину, при этом указанный спейсер оптимизирован, с) полинуклеотид, кодирующий трансмембранный домен, и а) полинуклеотид, кодирующий внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой фрагмент антитела. Согласно некоторым вариантам реализации указанный спейсер оптимизирован для повышенной пролиферации T-клеток и/или синтеза цитокинов в ответ на лиганд по сравнению с референсным химерным рецептором. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент. Согласно некоторым вариантам реализации длина указанного спейсера составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит, выбранный из группы, состоящей из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти и смешанных CD8+ Т-клеток. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO+, CD62L+ и/или CD8+. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA+, CD62L+ и/или CD4+, и/или отрицательной по CD45RO. Согласно некоторым вариантам реализации указанная композиция содержит клетку-хозяина в фармацевтически приемлемом вспомогательном веществе. Согласно некоторым вариантам реализации указанная клетка-хозяин содержит экспрессионный вектор. Согласно некоторым вариантам реализации предложен экспрессионный вектор, содержащий выделенную нуклеиновую кислоту химерного рецептора. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора содержит: а) полинуклеотид, кодирующий лигандсвязывающий домен, при этом указанный лигандсвязывающий домен связывается с CD171 и/или нацелен на CD171, b) полинуклеотид, кодирующий полипептидный спейсер, имеющий специфическую для указанного лиганда длину, при этом указанный спейсер оптимизирован, с) полинуклеотид, кодирующий трансмембранный домен, и d) полинуклеотид, кодирующий внутриклеточный сигнальный домен. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой фрагмент антитела. Согласно некоторым вариантам реализации указанный лигандсвязывающий домен представляет собой одноцепочечный вариабельный фрагмент. Согласно некоторым вариантам реализации длина указанного спейсера составляет 15 аминокислот или менее (но не менее чем 1 или 2 аминокислоты). Согласно некоторым вариантам реализации указанный спейсер содержит последовательность аминокислот X1PPX2P. Согласно некоторым вариантам реализации указанная спейсерная область содержит часть шарнирной области антитела человека. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит полностью или частично CD3-зета в комбинации с костимулирующим доменом, выбранным из группы, состоящей из CD27, CD28, 4-1ВВ, ОХ-40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, NKG2C и В7-Н3 или их комбинаций. Согласно некоторым вариантам реализации указанный внутриклеточный сигнальный домен содержит часть CD3-зета и часть 4-1ВВ. Согласно некоторым вариантам реализации указанная нуклеиновая кислота химерного рецептора дополнительно содержит нуклеиновую кислоту, кодирующую последовательность маркера. Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит, выбранный из группы, состоящей из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти и смешанных CD8+ Т-клеток. Согласно некоторым вариантам реализации указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO+, CD62L+ и/или CD8+ . Согласно некоторым вариантам реализации указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. Согласно некоторым вариантам реализации указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA+, CD62L+ и/или CD4+, и/или отрицательной по CD45RO. Согласно некоторым вариантам реализации указанная композиция содержит клетку-хозяина, при этом указанная клетка-хозяин представляет собой CD8+ цитотоксический T-лимфоцит, выбранный из группы, состоящей из наивных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти и смешанных CD8+ Т-клеток, или указанный CD8+ цитотоксический T-лимфоцит представляет собой центральную T-клетку памяти, при этом указанная центральная T-клетка памяти является положительной по CD45RO+, CD62L+ и/или CD8+ и другую клетку-хозяина, при этом указанная клетка-хозяин представляет собой CD4+ хелперный T-лимфоцит, выбранный из группы, состоящей из наивных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток, или указанный CD4+ хелперный лимфоцит представляет собой наивную CD4+ Т-клетку, при этом указанная наивная CD4+ Т-клетка является положительной по CD45RA+, CD62L+ и/или CD4+, и/или отрицательной по CD45RO. Согласно некоторым вариантам реализации указанное раковое заболевание представляет собой нейробластому. Согласно некоторым вариантам реализации указанная опухоль выбрана из группы, состоящей из рака толстой кишки, рака почки, рака поджелудочной железы и рака яичников.












--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Seattle Children's Hospital
d/b/a Seattle Children's Research Institute
Jensen, Michael C.
<120> СПОСОБ И КОМПОЗИЦИИ ДЛЯ КЛЕТОЧНОЙ ИММУНОТЕРАПИИ
<130> SCRI.065NP
<140> 15/302,403
<141> 2016-10-06
<150> PCT/US2015/024882
<151> 2015-04-08
<150> 62/090,845
<151> 2014-12-11
<150> 62/089,730
<151> 2014-12-09
<150> 62/088,363
<151> 2014-10-02
<150> 61/986,479
<151> 2014-04-30
<150> 61/977,751
<151> 2014-04-10
<160> 60
<170> FastSEQ for Windows Version 4.0
<210> 1
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Спейсерный участок
<220>
<221> ВАРИАНТ
<222> 1
<223> Xaa = цистеин, глицин или аргинин
<220>
<221> ВАРИАНТ
<222> 4
<223> Xaa = цистеин или треонин
<400> 1
Xaa Pro Pro Xaa Pro
1 5
<210> 2
<400> 2
000
<210> 3
<400> 3
000
<210> 4
<400> 4
000
<210> 5
<211> 34
<212> PRT
<213> Искусственная последовательность
<220>
<223> полинуклеотид трансмембранного домена CD28
<400> 5
Pro Pro Cys Pro Pro Cys Pro Met Phe Trp Val Leu Val Val Val Gly
1 5 10 15
Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile Ile
20 25 30
Phe Trp
<210> 6
<400> 6
000
<210> 7
<400> 7
000
<210> 8
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> элемент "рибосомного перепрыгивания" T2A
<400> 8
Tyr Gly Pro Pro Cys Pro Pro Cys Pro
1 5
<210> 9
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> tEGFR
<400> 9
Tyr Gly Pro Pro Cys Pro Pro Cys Pro
1 5
<210> 10
<211> 1152
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T2A домен
<400> 10
ccaaggctcg agggcggcgg agagggcaga ggaagtcttc taacatgcgg tgacgtggag 60
gagaatcccg gccctaggat gcttctcctg gtgacaagcc ttctgctctg tgagttacca 120
cacccagcat tcctcctgat cccacgcaaa gtgtgtaacg gaataggtat tggtgaattt 180
aaagactcac tctccataaa tgctacgaat attaaacact tcaaaaactg cacctccatc 240
agtggcgatc tccacatcct gccggtggca tttaggggtg actccttcac acatactcct 300
cctctggatc cacaggaact ggatattctg aaaaccgtaa aggaaatcac agggtttttg 360
ctgattcagg cttggcctga aaacaggacg gacctccatg cctttgagaa cctagaaatc 420
atacgcggca ggaccaagca acatggtcag ttttctcttg cagtcgtcag cctgaacata 480
acatccttgg gattacgctc cctcaaggag ataagtgatg gagatgtgat aatttcagga 540
aacaaaaatt tgtgctatgc aaatacaata aactggaaaa aactgtttgg gacctccggt 600
cagaaaacca aaattataag caacagaggt gaaaacagct gcaaggccac aggccaggtc 660
tgccatgcct tgtgctcccc cgagggctgc tggggcccgg agcccaggga ctgcgtctct 720
tgccggaatg tcagccgagg cagggaatgc gtggacaagt gcaaccttct ggagggtgag 780
ccaagggagt ttgtggagaa ctctgagtgc atacagtgcc acccagagtg cctgcctcag 840
gccatgaaca tcacctgcac aggacgggga ccagacaact gtatccagtg tgcccactac 900
attgacggcc cccactgcgt caagacctgc ccggcaggag tcatgggaga aaacaacacc 960
ctggtctgga agtacgcaga cgccggccat gtgtgccacc tgtgccatcc aaactgcacc 1020
tacggatgca ctgggccagg tcttgaaggc tgtccaacga atgggcctaa gatcccgtcc 1080
atcgccactg ggatggtggg ggccctcctc ttgctgctgg tggtggccct ggggatcggc 1140
ctcttcatgt ga 1152
<210> 11
<211> 383
<212> PRT
<213> Искусственная последовательность
<220>
<223> T2A домен
<400> 11
Pro Arg Leu Glu Gly Gly Gly Glu Gly Arg Gly Ser Leu Leu Thr Cys
1 5 10 15
Gly Asp Val Glu Glu Asn Pro Gly Pro Arg Met Leu Leu Leu Val Thr
20 25 30
Ser Leu Leu Leu Cys Glu Leu Pro His Pro Ala Phe Leu Leu Ile Pro
35 40 45
Arg Lys Val Cys Asn Gly Ile Gly Ile Gly Glu Phe Lys Asp Ser Leu
50 55 60
Ser Ile Asn Ala Thr Asn Ile Lys His Phe Lys Asn Cys Thr Ser Ile
65 70 75 80
Ser Gly Asp Leu His Ile Leu Pro Val Ala Phe Arg Gly Asp Ser Phe
85 90 95
Thr His Thr Pro Pro Leu Asp Pro Gln Glu Leu Asp Ile Leu Lys Thr
100 105 110
Val Lys Glu Ile Thr Gly Phe Leu Leu Ile Gln Ala Trp Pro Glu Asn
115 120 125
Arg Thr Asp Leu His Ala Phe Glu Asn Leu Glu Ile Ile Arg Gly Arg
130 135 140
Thr Lys Gln His Gly Gln Phe Ser Leu Ala Val Val Ser Leu Asn Ile
145 150 155 160
Thr Ser Leu Gly Leu Arg Ser Leu Lys Glu Ile Ser Asp Gly Asp Val
165 170 175
Ile Ile Ser Gly Asn Lys Asn Leu Cys Tyr Ala Asn Thr Ile Asn Trp
180 185 190
Lys Lys Leu Phe Gly Thr Ser Gly Gln Lys Thr Lys Ile Ile Ser Asn
195 200 205
Arg Gly Glu Asn Ser Cys Lys Ala Thr Gly Gln Val Cys His Ala Leu
210 215 220
Cys Ser Pro Glu Gly Cys Trp Gly Pro Glu Pro Arg Asp Cys Val Ser
225 230 235 240
Cys Arg Asn Val Ser Arg Gly Arg Glu Cys Val Asp Lys Cys Asn Leu
245 250 255
Leu Glu Gly Glu Pro Arg Glu Phe Val Glu Asn Ser Glu Cys Ile Gln
260 265 270
Cys His Pro Glu Cys Leu Pro Gln Ala Met Asn Ile Thr Cys Thr Gly
275 280 285
Arg Gly Pro Asp Asn Cys Ile Gln Cys Ala His Tyr Ile Asp Gly Pro
290 295 300
His Cys Val Lys Thr Cys Pro Ala Gly Val Met Gly Glu Asn Asn Thr
305 310 315 320
Leu Val Trp Lys Tyr Ala Asp Ala Gly His Val Cys His Leu Cys His
325 330 335
Pro Asn Cys Thr Tyr Gly Cys Thr Gly Pro Gly Leu Glu Gly Cys Pro
340 345 350
Thr Asn Gly Pro Lys Ile Pro Ser Ile Ala Thr Gly Met Val Gly Ala
355 360 365
Leu Leu Leu Leu Leu Val Val Ala Leu Gly Ile Gly Leu Phe Met
370 375 380
<210> 12
<400> 12
000
<210> 13
<211> 326
<212> PRT
<213> Искусственная последовательность
<220>
<223> Exemplary IgG4-Fc
<400> 13
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu
100 105 110
Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
115 120 125
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
130 135 140
Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
145 150 155 160
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
165 170 175
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
180 185 190
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
195 200 205
Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
210 215 220
Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn
225 230 235 240
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
245 250 255
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
260 265 270
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg
275 280 285
Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys
290 295 300
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
305 310 315 320
Ser Leu Ser Leu Gly Lys
325
<210> 14
<211> 219
<212> PRT
<213> Искусственная последовательность
<220>
<223> модифицированная шарнирная область IgG4
<400> 14
Leu Arg Leu Leu Leu Ala Leu Asn Leu Phe Pro Ser Ile Gln Val Thr
1 5 10 15
Gly Asn Lys Ile Leu Val Lys Gln Ser Pro Met Leu Val Ala Tyr Asp
20 25 30
Asn Ala Val Asn Leu Ser Cys Lys Tyr Ser Tyr Asn Leu Phe Ser Arg
35 40 45
Glu Phe Arg Ala Ser Leu His Lys Gly Leu Asp Ser Ala Val Glu Val
50 55 60
Cys Val Val Tyr Gly Asn Tyr Ser Gln Gln Leu Gln Val Tyr Ser Lys
65 70 75 80
Thr Gly Phe Asn Cys Asp Gly Lys Leu Gly Asn Glu Ser Val Thr Phe
85 90 95
Tyr Leu Gln Asn Leu Tyr Val Asn Gln Thr Asp Ile Tyr Phe Cys Lys
100 105 110
Ile Glu Val Met Tyr Pro Pro Pro Tyr Leu Asp Asn Glu Lys Ser Asn
115 120 125
Gly Thr Ile Ile His Val Lys Gly Lys His Leu Cys Pro Ser Pro Leu
130 135 140
Phe Pro Gly Pro Ser Lys Pro Phe Trp Val Leu Val Val Val Gly Gly
145 150 155 160
Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile Ile Phe
165 170 175
Trp Val Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp Tyr Met Asn
180 185 190
Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr
195 200 205
Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser
210 215
<210> 15
<211> 255
<212> PRT
<213> Искусственная последовательность
<220>
<223> цитоплазматический домен 4-1BB человека
<400> 15
Met Gly Asn Ser Cys Tyr Asn Ile Val Ala Thr Leu Leu Leu Val Leu
1 5 10 15
Asn Phe Glu Arg Thr Arg Ser Leu Gln Asp Pro Cys Ser Asn Cys Pro
20 25 30
Ala Gly Thr Phe Cys Asp Asn Asn Arg Asn Gln Ile Cys Ser Pro Cys
35 40 45
Pro Pro Asn Ser Phe Ser Ser Ala Gly Gly Gln Arg Thr Cys Asp Ile
50 55 60
Cys Arg Gln Cys Lys Gly Val Phe Arg Thr Arg Lys Glu Cys Ser Ser
65 70 75 80
Thr Ser Asn Ala Glu Cys Asp Cys Thr Pro Gly Phe His Cys Leu Gly
85 90 95
Ala Gly Cys Ser Met Cys Glu Gln Asp Cys Lys Gln Gly Gln Glu Leu
100 105 110
Thr Lys Lys Gly Cys Lys Asp Cys Cys Phe Gly Thr Phe Asn Asp Gln
115 120 125
Lys Arg Gly Ile Cys Arg Pro Trp Thr Asn Cys Ser Leu Asp Gly Lys
130 135 140
Ser Val Leu Val Asn Gly Thr Lys Glu Arg Asp Val Val Cys Gly Pro
145 150 155 160
Ser Pro Ala Asp Leu Ser Pro Gly Ala Ser Ser Val Thr Pro Pro Ala
165 170 175
Pro Ala Arg Glu Pro Gly His Ser Pro Gln Ile Ile Ser Phe Phe Leu
180 185 190
Ala Leu Thr Ser Thr Ala Leu Leu Phe Leu Leu Phe Phe Leu Thr Leu
195 200 205
Arg Phe Ser Val Val Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe
210 215 220
Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly
225 230 235 240
Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
245 250 255
<210> 16
<211> 164
<212> PRT
<213> Искусственная последовательность
<220>
<223> Цитоплазматический домен изоформы 3 zeta CD3 человека
<400> 16
Met Lys Trp Lys Ala Leu Phe Thr Ala Ala Ile Leu Gln Ala Gln Leu
1 5 10 15
Pro Ile Thr Glu Ala Gln Ser Phe Gly Leu Leu Asp Pro Lys Leu Cys
20 25 30
Tyr Leu Leu Asp Gly Ile Leu Phe Ile Tyr Gly Val Ile Leu Thr Ala
35 40 45
Leu Phe Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
50 55 60
Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
65 70 75 80
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
85 90 95
Gly Gly Lys Pro Gln Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
100 105 110
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
115 120 125
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
130 135 140
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
145 150 155 160
Leu Pro Pro Arg
<210> 17
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> шарнирная область IgG1 человека
<400> 17
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
1 5 10 15
<210> 18
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Шарнирная область IgG2 человека
<400> 18
Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro
1 5 10
<210> 19
<211> 61
<212> PRT
<213> Искусственная последовательность
<220>
<223> шарнирная область IgG3 человека
<400> 19
Glu Leu Lys Thr Pro Leu Gly Asp Thr His Thr Cys Pro Arg Cys Pro
1 5 10 15
Glu Pro Lys Ser Cys Asp Thr Pro Pro Pro Cys Pro Arg Cys Pro Glu
20 25 30
Pro Lys Ser Cys Asp Thr Pro Pro Pro Cys Pro Arg Cys Pro Glu Pro
35 40 45
Lys Ser Cys Asp Thr Pro Pro Pro Cys Pro Arg Cys Pro
50 55 60
<210> 20
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> шарнирная область IgG4 человека
<400> 20
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro
1 5 10
<210> 21
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> модифицированная шарнирная область IgG4 человека
<400> 21
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro
1 5 10
<210> 22
<400> 22
000
<210> 23
<400> 23
000
<210> 24
<400> 24
000
<210> 25
<400> 25
000
<210> 26
<400> 26
000
<210> 27
<400> 27
000
<210> 28
<400> 28
000
<210> 29
<400> 29
000
<210> 30
<400> 30
000
<210> 31
<400> 31
000
<210> 32
<400> 32
000
<210> 33
<400> 33
000
<210> 34
<400> 34
000
<210> 35
<400> 35
000
<210> 36
<211> 348
<212> ДНК
<213> Искусственная последовательность
<220>
<223> спейсер промежуточной длины шарнир-CH3 IgG4
<400> 36
tacggaccgc cctgcccccc ttgccctggc cagcctcgcg agccccaggt gtacaccctg 60
cctccctccc aggaagagat gaccaagaac caggtgtccc tgacctgcct ggtgaagggc 120
ttctacccca gcgacatcgc cgtggagtgg gagagcaacg gccagcctga gaacaactac 180
aagaccaccc ctcccgtgct ggacagcgac ggcagcttct tcctgtacag ccggctgacc 240
gtggacaaga gccggtggca ggaaggcaac gtctttagct gcagcgtgat gcacgaggcc 300
ctgcacaacc actacaccca gaagagcctg agcctgtccc tgggcaag 348
<210> 37
<400> 37
000
<210> 38
<400> 38
000
<210> 39
<400> 39
000
<210> 40
<400> 40
000
<210> 41
<400> 41
000
<210> 42
<400> 42
000
<210> 43
<400> 43
000
<210> 44
<400> 44
000
<210> 45
<400> 45
000
<210> 46
<400> 46
000
<210> 47
<400> 47
000
<210> 48
<400> 48
000
<210> 49
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> шарнир IgG4
<400> 49
Glu Ser Lys Tyr Gly
1 5
<210> 50
<400> 50
000
<210> 51
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Modified Human IgG4 hinge region
<400> 51
Tyr Gly Pro Pro Cys Pro Pro Cys Pro
1 5
<210> 52
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> модифицированная шарнирная область IgG4 человека
<400> 52
Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro
1 5 10
<210> 53
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> модифицированная шарнирная область IgG4 человека
<400> 53
Glu Val Val Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro
1 5 10
<210> 54
<211> 10024
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Ce7scFv-IgG4-шарнир-CH2-CH3-CD28tm/4-1BB-zeta-T2A-EG
FRt-epHIV7
<400> 54
gttagaccag atctgagcct gggagctctc tggctaacta gggaacccac tgcttaagcc 60
tcaataaagc ttgccttgag tgcttcaagt agtgtgtgcc cgtctgttgt gtgactctgg 120
taactagaga tccctcagac ccttttagtc agtgtggaaa atctctagca gtggcgcccg 180
aacagggact tgaaagcgaa agggaaacca gaggagctct ctcgacgcag gactcggctt 240
gctgaagcgc gcacggcaag aggcgagggg cggcgactgg tgagtacgcc aaaaattttg 300
actagcggag gctagaagga gagagatggg tgcgagagcg tcagtattaa gcgggggaga 360
attagatcga tgggaaaaaa ttcggttaag gccaggggga aagaaaaaat ataaattaaa 420
acatatagta tgggcaagca gggagctaga acgattcgca gttaatcctg gcctgttaga 480
aacatcagaa ggctgtagac aaatactggg acagctacaa ccatcccttc agacaggatc 540
agaagaactt agatcattat ataatacagt agcaaccctc tattgtgtgc atcaaaggat 600
agagataaaa gacaccaagg aagctttaga caagatagag gaagagcaaa acaaaagtaa 660
gaaaaaagca cagcaagcag cagctgacac aggacacagc aatcaggtca gccaaaatta 720
ccctatagtg cagaacatcc aggggcaaat ggtacatcag gccatatcac ctagaacttt 780
aaatgcatgg gtaaaagtag tagaagagaa ggctttcagc ccagaagtga tacccatgtt 840
ttcagcatta tcagaaggag ccaccccaca agatttaaac accatgctaa acacagtggg 900
gggacatcaa gcagccatgc aaatgttaaa agagaccatc aatgaggaag ctgcaggcaa 960
agagaagagt ggtgcagaga gaaaaaagag cagtgggaat aggagctttg ttccttgggt 1020
tcttgggagc agcaggaagc actatgggcg cagcgtcaat gacgctgacg gtacaggcca 1080
gacaattatt gtctggtata gtgcagcagc agaacaattt gctgagggct attgaggcgc 1140
aacagcatct gttgcaactc acagtctggg gcatcaagca gctccaggca agaatcctgg 1200
ctgtggaaag atacctaaag gatcaacagc tcctggggat ttggggttgc tctggaaaac 1260
tcatttgcac cactgctgtg ccttggatct acaaatggca gtattcatcc acaattttaa 1320
aagaaaaggg gggattgggg ggtacagtgc aggggaaaga atagtagaca taatagcaac 1380
agacatacaa actaaagaat tacaaaaaca aattacaaaa attcaaaatt ttcgggttta 1440
ttacagggac agcagagatc cagtttgggg atcaattgca tgaagaatct gcttagggtt 1500
aggcgttttg cgctgcttcg cgaggatctg cgatcgctcc ggtgcccgtc agtgggcaga 1560
gcgcacatcg cccacagtcc ccgagaagtt ggggggaggg gtcggcaatt gaaccggtgc 1620
ctagagaagg tggcgcgggg taaactggga aagtgatgtc gtgtactggc tccgcctttt 1680
tcccgagggt gggggagaac cgtatataag tgcagtagtc gccgtgaacg ttctttttcg 1740
caacgggttt gccgccagaa cacagctgaa gcttcgaggg gctcgcatct ctccttcacg 1800
cgcccgccgc cctacctgag gccgccatcc acgccggttg agtcgcgttc tgccgcctcc 1860
cgcctgtggt gcctcctgaa ctgcgtccgc cgtctaggta agtttaaagc tcaggtcgag 1920
accgggcctt tgtccggcgc tcccttggag cctacctaga ctcagccggc tctccacgct 1980
ttgcctgacc ctgcttgctc aactctacgt ctttgtttcg ttttctgttc tgcgccgtta 2040
cagatccaag ctgtgaccgg cgcctacggc tagcgccgcc accatgctgc tgctggtgac 2100
cagcctgctg ctgtgcgagc tgccccaccc cgcctttctg ctgatccccc aggtgcagct 2160
gcagcagcct ggcgccgagc tggtgaagcc aggcgccagc gtgaagctgt cctgcaaggc 2220
cagcggctac accttcaccg gctactggat gcactgggtg aagcagagac ccggccacgg 2280
cctggaatgg atcggcgaga tcaaccccag caacggccgg accaactaca acgagcggtt 2340
caagagcaag gccaccctga ccgtggacaa gagcagcacc accgccttca tgcagctgtc 2400
cggcctgacc agcgaggaca gcgccgtgta cttctgcgcc agggactact acggcaccag 2460
ctacaacttc gactactggg gccagggcac cacactgacc gtgagcagcg gcggaggggg 2520
ctctggcggc ggaggatctg ggggaggggg cagcgacatc cagatgaccc agagcagcag 2580
cagcttcagc gtgagcctgg gcgaccgggt gaccatcacc tgtaaggcca acgaggacat 2640
caacaaccgg ctggcctggt atcagcagac ccccggcaac agccccaggc tgctgatcag 2700
cggcgccacc aacctggtga ccggcgtgcc cagccggttt agcggcagcg gctccggcaa 2760
ggactacacc ctgaccatca caagcctgca ggccgaggac ttcgccacct actactgcca 2820
gcagtactgg tccaccccct tcaccttcgg cagcggcacc gagctggaaa tcaaagagag 2880
caagtacgga ccgccctgcc ccccttgccc tgcccccgag ttcctgggcg gacccagcgt 2940
gttcctgttc ccccccaagc ccaaggacac cctgatgatc agccggaccc ccgaggtgac 3000
ctgcgtggtg gtggacgtga gccaggaaga tcccgaggtc cagttcaatt ggtacgtgga 3060
cggcgtggaa gtgcacaacg ccaagaccaa gcccagagag gaacagttca acagcaccta 3120
ccgggtggtg tctgtgctga ccgtgctgca ccaggactgg ctgaacggca aagaatacaa 3180
gtgcaaggtg tccaacaagg gcctgcccag cagcatcgaa aagaccatca gcaaggccaa 3240
gggccagcct cgcgagcccc aggtgtacac cctgcctccc tcccaggaag agatgaccaa 3300
gaaccaggtg tccctgacct gcctggtgaa gggcttctac cccagcgaca tcgccgtgga 3360
gtgggagagc aacggccagc ctgagaacaa ctacaagacc acccctcccg tgctggacag 3420
cgacggcagc ttcttcctgt acagccggct gaccgtggac aagagccggt ggcaggaagg 3480
caacgtcttt agctgcagcg tgatgcacga ggccctgcac aaccactaca cccagaagag 3540
cctgagcctg tccctgggca agatgttctg ggtgctggtg gtggtgggcg gggtgctggc 3600
ctgctacagc ctgctggtga cagtggcctt catcatcttt tgggtgaaac ggggcagaaa 3660
gaaactcctg tatatattca aacaaccatt tatgagacca gtacaaacta ctcaagagga 3720
agatggctgt agctgccgat ttccagaaga agaagaagga ggatgtgaac tgcgggtgaa 3780
gttcagcaga agcgccgacg cccctgccta ccagcagggc cagaatcagc tgtacaacga 3840
gctgaacctg ggcagaaggg aagagtacga cgtcctggat aagcggagag gccgggaccc 3900
tgagatgggc ggcaagcctc ggcggaagaa cccccaggaa ggcctgtata acgaactgca 3960
gaaagacaag atggccgagg cctacagcga gatcggcatg aagggcgagc ggaggcgggg 4020
caagggccac gacggcctgt atcagggcct gtccaccgcc accaaggata cctacgacgc 4080
cctgcacatg caggccctgc ccccaaggct cgagggcggc ggagagggca gaggaagtct 4140
tctaacatgc ggtgacgtgg aggagaatcc cggccctagg atgcttctcc tggtgacaag 4200
ccttctgctc tgtgagttac cacacccagc attcctcctg atcccacgca aagtgtgtaa 4260
cggaataggt attggtgaat ttaaagactc actctccata aatgctacga atattaaaca 4320
cttcaaaaac tgcacctcca tcagtggcga tctccacatc ctgccggtgg catttagggg 4380
tgactccttc acacatactc ctcctctgga tccacaggaa ctggatattc tgaaaaccgt 4440
aaaggaaatc acagggtttt tgctgattca ggcttggcct gaaaacagga cggacctcca 4500
tgcctttgag aacctagaaa tcatacgcgg caggaccaag caacatggtc agttttctct 4560
tgcagtcgtc agcctgaaca taacatcctt gggattacgc tccctcaagg agataagtga 4620
tggagatgtg ataatttcag gaaacaaaaa tttgtgctat gcaaatacaa taaactggaa 4680
aaaactgttt gggacctccg gtcagaaaac caaaattata agcaacagag gtgaaaacag 4740
ctgcaaggcc acaggccagg tctgccatgc cttgtgctcc cccgagggct gctggggccc 4800
ggagcccagg gactgcgtct cttgccggaa tgtcagccga ggcagggaat gcgtggacaa 4860
gtgcaacctt ctggagggtg agccaaggga gtttgtggag aactctgagt gcatacagtg 4920
ccacccagag tgcctgcctc aggccatgaa catcacctgc acaggacggg gaccagacaa 4980
ctgtatccag tgtgcccact acattgacgg cccccactgc gtcaagacct gcccggcagg 5040
agtcatggga gaaaacaaca ccctggtctg gaagtacgca gacgccggcc atgtgtgcca 5100
cctgtgccat ccaaactgca cctacggatg cactgggcca ggtcttgaag gctgtccaac 5160
gaatgggcct aagatcccgt ccatcgccac tgggatggtg ggggccctcc tcttgctgct 5220
ggtggtggcc ctggggatcg gcctcttcat gtgagcggcc gctctagacc cgggctgcag 5280
gaattcgata tcaagcttat cgataatcaa cctctggatt acaaaatttg tgaaagattg 5340
actggtattc ttaactatgt tgctcctttt acgctatgtg gatacgctgc tttaatgcct 5400
ttgtatcatg ctattgcttc ccgtatggct ttcattttct cctccttgta taaatcctgg 5460
ttgctgtctc tttatgagga gttgtggccc gttgtcaggc aacgtggcgt ggtgtgcact 5520
gtgtttgctg acgcaacccc cactggttgg ggcattgcca ccacctgtca gctcctttcc 5580
gggactttcg ctttccccct ccctattgcc acggcggaac tcatcgccgc ctgccttgcc 5640
cgctgctgga caggggctcg gctgttgggc actgacaatt ccgtggtgtt gtcggggaaa 5700
tcatcgtcct ttccttggct gctcgcctgt gttgccacct ggattctgcg cgggacgtcc 5760
ttctgctacg tcccttcggc cctcaatcca gcggaccttc cttcccgcgg cctgctgccg 5820
gctctgcggc ctcttccgcg tcttcgcctt cgccctcaga cgagtcggat ctccctttgg 5880
gccgcctccc cgcatcgata ccgtcgacta gccgtacctt taagaccaat gacttacaag 5940
gcagctgtag atcttagcca ctttttaaaa gaaaaggggg gactggaagg gctaattcac 6000
tcccaaagaa gacaagatct gctttttgcc tgtactgggt ctctctggtt agaccagatc 6060
tgagcctggg agctctctgg ctaactaggg aacccactgc ttaagcctca ataaagcttg 6120
ccttgagtgc ttcaagtagt gtgtgcccgt ctgttgtgtg actctggtaa ctagagatcc 6180
ctcagaccct tttagtcagt gtggaaaatc tctagcagaa ttcgatatca agcttatcga 6240
taccgtcgac ctcgaggggg ggcccggtac ccaattcgcc ctatagtgag tcgtattaca 6300
attcactggc cgtcgtttta caacgtcgtg actgggaaaa ccctggcgtt acccaactta 6360
atcgccttgc agcacatccc cctttcgcca gctggcgtaa tagcgaagag gcccgcaccg 6420
atcgcccttc ccaacagttg cgcagcctga atggcgaatg gaaattgtaa gcgttaatat 6480
tttgttaaaa ttcgcgttaa atttttgtta aatcagctca ttttttaacc aataggccga 6540
aatcggcaaa atcccttata aatcaaaaga atagaccgag atagggttga gtgttgttcc 6600
agtttggaac aagagtccac tattaaagaa cgtggactcc aacgtcaaag ggcgaaaaac 6660
cgtctatcag ggcgatggcc cactacgtga accatcaccc taatcaagtt ttttggggtc 6720
gaggtgccgt aaagcactaa atcggaaccc taaagggagc ccccgattta gagcttgacg 6780
gggaaagccg gcgaacgtgg cgagaaagga agggaagaaa gcgaaaggag cgggcgctag 6840
ggcgctggca agtgtagcgg tcacgctgcg cgtaaccacc acacccgccg cgcttaatgc 6900
gccgctacag ggcgcgtcag gtggcacttt tcggggaaat gtgcgcggaa cccctatttg 6960
tttatttttc taaatacatt caaatatgta tccgctcatg agacaataac cctgataaat 7020
gcttcaataa tattgaaaaa ggaagagtat gagtattcaa catttccgtg tcgcccttat 7080
tccctttttt gcggcatttt gccttcctgt ttttgctcac ccagaaacgc tggtgaaagt 7140
aaaagatgct gaagatcagt tgggtgcacg agtgggttac atcgaactgg atctcaacag 7200
cggtaagatc cttgagagtt ttcgccccga agaacgtttt ccaatgatga gcacttttaa 7260
agttctgcta tgtggcgcgg tattatcccg tattgacgcc gggcaagagc aactcggtcg 7320
ccgcatacac tattctcaga atgacttggt tgagtactca ccagtcacag aaaagcatct 7380
tacggatggc atgacagtaa gagaattatg cagtgctgcc ataaccatga gtgataacac 7440
tgcggccaac ttacttctga caacgatcgg aggaccgaag gagctaaccg cttttttgca 7500
caacatgggg gatcatgtaa ctcgccttga tcgttgggaa ccggagctga atgaagccat 7560
accaaacgac gagcgtgaca ccacgatgcc tgtagcaatg gcaacaacgt tgcgcaaact 7620
attaactggc gaactactta ctctagcttc ccggcaacaa ttaatagact ggatggaggc 7680
ggataaagtt gcaggaccac ttctgcgctc ggcccttccg gctggctggt ttattgctga 7740
taaatctgga gccggtgagc gtgggtctcg cggtatcatt gcagcactgg ggccagatgg 7800
taagccctcc cgtatcgtag ttatctacac gacggggagt caggcaacta tggatgaacg 7860
aaatagacag atcgctgaga taggtgcctc actgattaag cattggtaac tgtcagacca 7920
agtttactca tatatacttt agattgattt aaaacttcat ttttaattta aaaggatcta 7980
ggtgaagatc ctttttgata atctcatgac caaaatccct taacgtgagt tttcgttcca 8040
ctgagcgtca gaccccgtag aaaagatcaa aggatcttct tgagatcctt tttttctgcg 8100
cgtaatctgc tgcttgcaaa caaaaaaacc accgctacca gcggtggttt gtttgccgga 8160
tcaagagcta ccaactcttt ttccgaaggt aactggcttc agcagagcgc agataccaaa 8220
tactgttctt ctagtgtagc cgtagttagg ccaccacttc aagaactctg tagcaccgcc 8280
tacatacctc gctctgctaa tcctgttacc agtggctgct gccagtggcg ataagtcgtg 8340
tcttaccggg ttggactcaa gacgatagtt accggataag gcgcagcggt cgggctgaac 8400
ggggggttcg tgcacacagc ccagcttgga gcgaacgacc tacaccgaac tgagatacct 8460
acagcgtgag ctatgagaaa gcgccacgct tcccgaaggg agaaaggcgg acaggtatcc 8520
ggtaagcggc agggtcggaa caggagagcg cacgagggag cttccagggg gaaacgcctg 8580
gtatctttat agtcctgtcg ggtttcgcca cctctgactt gagcgtcgat ttttgtgatg 8640
ctcgtcaggg gggcggagcc tatggaaaaa cgccagcaac gcggcctttt tacggttcct 8700
ggccttttgc tggccttttg ctcacatgtt ctttcctgcg ttatcccctg attctgtgga 8760
taaccgtatt accgcctttg agtgagctga taccgctcgc cgcagccgaa cgaccgagcg 8820
cagcgagtca gtgagcgagg aagcggaaga gcgcccaata cgcaaaccgc ctctccccgc 8880
gcgttggccg attcattaat gcagctggca cgacaggttt cccgactgga aagcgggcag 8940
tgagcgcaac gcaattaatg tgagttagct cactcattag gcaccccagg ctttacactt 9000
tatgcttccg gctcgtatgt tgtgtggaat tgtgagcgga taacaatttc acacaggaaa 9060
cagctatgac catgattacg ccaagctcga aattaaccct cactaaaggg aacaaaagct 9120
ggagctccac cgcggtggcg gcctcgaggt cgagatccgg tcgaccagca accatagtcc 9180
cgcccctaac tccgcccatc ccgcccctaa ctccgcccag ttccgcccat tctccgcccc 9240
atggctgact aatttttttt atttatgcag aggccgaggc cgcctcggcc tctgagctat 9300
tccagaagta gtgaggaggc ttttttggag gcctaggctt ttgcaaaaag cttcgacggt 9360
atcgattggc tcatgtccaa cattaccgcc atgttgacat tgattattga ctagttatta 9420
atagtaatca attacggggt cattagttca tagcccatat atggagttcc gcgttacata 9480
acttacggta aatggcccgc ctggctgacc gcccaacgac ccccgcccat tgacgtcaat 9540
aatgacgtat gttcccatag taacgccaat agggactttc cattgacgtc aatgggtgga 9600
gtatttacgg taaactgccc acttggcagt acatcaagtg tatcatatgc caagtacgcc 9660
ccctattgac gtcaatgacg gtaaatggcc cgcctggcat tatgcccagt acatgacctt 9720
atgggacttt cctacttggc agtacatcta cgtattagtc atcgctatta ccatggtgat 9780
gcggttttgg cagtacatca atgggcgtgg atagcggttt gactcacggg gatttccaag 9840
tctccacccc attgacgtca atgggagttt gttttggcac caaaatcaac gggactttcc 9900
aaaatgtcgt aacaactccg ccccattgac gcaaatgggc ggtaggcgtg tacggaattc 9960
ggagtggcga gccctcagat cctgcatata agcagctgct ttttgcctgt actgggtctc 10020
tctg 10024
<210> 55
<211> 9694
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Ce7scFv-IgG4hinge-CH3-CD28tm/4-1BB-zeta-T2A-EGFRt-
epHIV7 (промежуточный)
<400> 55
gttagaccag atctgagcct gggagctctc tggctaacta gggaacccac tgcttaagcc 60
tcaataaagc ttgccttgag tgcttcaagt agtgtgtgcc cgtctgttgt gtgactctgg 120
taactagaga tccctcagac ccttttagtc agtgtggaaa atctctagca gtggcgcccg 180
aacagggact tgaaagcgaa agggaaacca gaggagctct ctcgacgcag gactcggctt 240
gctgaagcgc gcacggcaag aggcgagggg cggcgactgg tgagtacgcc aaaaattttg 300
actagcggag gctagaagga gagagatggg tgcgagagcg tcagtattaa gcgggggaga 360
attagatcga tgggaaaaaa ttcggttaag gccaggggga aagaaaaaat ataaattaaa 420
acatatagta tgggcaagca gggagctaga acgattcgca gttaatcctg gcctgttaga 480
aacatcagaa ggctgtagac aaatactggg acagctacaa ccatcccttc agacaggatc 540
agaagaactt agatcattat ataatacagt agcaaccctc tattgtgtgc atcaaaggat 600
agagataaaa gacaccaagg aagctttaga caagatagag gaagagcaaa acaaaagtaa 660
gaaaaaagca cagcaagcag cagctgacac aggacacagc aatcaggtca gccaaaatta 720
ccctatagtg cagaacatcc aggggcaaat ggtacatcag gccatatcac ctagaacttt 780
aaatgcatgg gtaaaagtag tagaagagaa ggctttcagc ccagaagtga tacccatgtt 840
ttcagcatta tcagaaggag ccaccccaca agatttaaac accatgctaa acacagtggg 900
gggacatcaa gcagccatgc aaatgttaaa agagaccatc aatgaggaag ctgcaggcaa 960
agagaagagt ggtgcagaga gaaaaaagag cagtgggaat aggagctttg ttccttgggt 1020
tcttgggagc agcaggaagc actatgggcg cagcgtcaat gacgctgacg gtacaggcca 1080
gacaattatt gtctggtata gtgcagcagc agaacaattt gctgagggct attgaggcgc 1140
aacagcatct gttgcaactc acagtctggg gcatcaagca gctccaggca agaatcctgg 1200
ctgtggaaag atacctaaag gatcaacagc tcctggggat ttggggttgc tctggaaaac 1260
tcatttgcac cactgctgtg ccttggatct acaaatggca gtattcatcc acaattttaa 1320
aagaaaaggg gggattgggg ggtacagtgc aggggaaaga atagtagaca taatagcaac 1380
agacatacaa actaaagaat tacaaaaaca aattacaaaa attcaaaatt ttcgggttta 1440
ttacagggac agcagagatc cagtttgggg atcaattgca tgaagaatct gcttagggtt 1500
aggcgttttg cgctgcttcg cgaggatctg cgatcgctcc ggtgcccgtc agtgggcaga 1560
gcgcacatcg cccacagtcc ccgagaagtt ggggggaggg gtcggcaatt gaaccggtgc 1620
ctagagaagg tggcgcgggg taaactggga aagtgatgtc gtgtactggc tccgcctttt 1680
tcccgagggt gggggagaac cgtatataag tgcagtagtc gccgtgaacg ttctttttcg 1740
caacgggttt gccgccagaa cacagctgaa gcttcgaggg gctcgcatct ctccttcacg 1800
cgcccgccgc cctacctgag gccgccatcc acgccggttg agtcgcgttc tgccgcctcc 1860
cgcctgtggt gcctcctgaa ctgcgtccgc cgtctaggta agtttaaagc tcaggtcgag 1920
accgggcctt tgtccggcgc tcccttggag cctacctaga ctcagccggc tctccacgct 1980
ttgcctgacc ctgcttgctc aactctacgt ctttgtttcg ttttctgttc tgcgccgtta 2040
cagatccaag ctgtgaccgg cgcctacggc tagcgccgcc accatgctgc tgctggtgac 2100
cagcctgctg ctgtgcgagc tgccccaccc cgcctttctg ctgatccccc aggtgcagct 2160
gcagcagcct ggcgccgagc tggtgaagcc aggcgccagc gtgaagctgt cctgcaaggc 2220
cagcggctac accttcaccg gctactggat gcactgggtg aagcagagac ccggccacgg 2280
cctggaatgg atcggcgaga tcaaccccag caacggccgg accaactaca acgagcggtt 2340
caagagcaag gccaccctga ccgtggacaa gagcagcacc accgccttca tgcagctgtc 2400
cggcctgacc agcgaggaca gcgccgtgta cttctgcgcc agggactact acggcaccag 2460
ctacaacttc gactactggg gccagggcac cacactgacc gtgagcagcg gcggaggggg 2520
ctctggcggc ggaggatctg ggggaggggg cagcgacatc cagatgaccc agagcagcag 2580
cagcttcagc gtgagcctgg gcgaccgggt gaccatcacc tgtaaggcca acgaggacat 2640
caacaaccgg ctggcctggt atcagcagac ccccggcaac agccccaggc tgctgatcag 2700
cggcgccacc aacctggtga ccggcgtgcc cagccggttt agcggcagcg gctccggcaa 2760
ggactacacc ctgaccatca caagcctgca ggccgaggac ttcgccacct actactgcca 2820
gcagtactgg tccaccccct tcaccttcgg cagcggcacc gagctggaaa tcaaagaatc 2880
taagtacgga ccgccctgcc ccccttgccc tggccagcct agagaacccc aggtgtacac 2940
cctgcctccc agccaggaag agatgaccaa gaaccaggtg tccctgacct gcctggtcaa 3000
aggcttctac cccagcgata tcgccgtgga atgggagagc aacggccagc ccgagaacaa 3060
ctacaagacc accccccctg tgctggacag cgacggcagc ttcttcctgt actcccggct 3120
gaccgtggac aagagccggt ggcaggaagg caacgtcttc agctgcagcg tgatgcacga 3180
ggccctgcac aaccactaca cccagaagtc cctgagcctg agcctgggca agatgttctg 3240
ggtgctggtg gtggtcggag gcgtgctggc ctgctacagc ctgctggtca ccgtggcctt 3300
catcatcttt tgggtgaaac ggggcagaaa gaaactcctg tatatattca aacaaccatt 3360
tatgagacca gtacaaacta ctcaagagga agatggctgt agctgccgat ttccagaaga 3420
agaagaagga ggatgtgaac tgcgggtgaa gttcagcaga agcgccgacg cccctgccta 3480
ccagcagggc cagaatcagc tgtacaacga gctgaacctg ggcagaaggg aagagtacga 3540
cgtcctggat aagcggagag gccgggaccc tgagatgggc ggcaagcctc ggcggaagaa 3600
cccccaggaa ggcctgtata acgaactgca gaaagacaag atggccgagg cctacagcga 3660
gatcggcatg aagggcgagc ggaggcgggg caagggccac gacggcctgt atcagggcct 3720
gtccaccgcc accaaggata cctacgacgc cctgcacatg caggccctgc ccccaaggct 3780
cgagggcggc ggagagggca gaggaagtct tctaacatgc ggtgacgtgg aggagaatcc 3840
cggccctagg atgcttctcc tggtgacaag ccttctgctc tgtgagttac cacacccagc 3900
attcctcctg atcccacgca aagtgtgtaa cggaataggt attggtgaat ttaaagactc 3960
actctccata aatgctacga atattaaaca cttcaaaaac tgcacctcca tcagtggcga 4020
tctccacatc ctgccggtgg catttagggg tgactccttc acacatactc ctcctctgga 4080
tccacaggaa ctggatattc tgaaaaccgt aaaggaaatc acagggtttt tgctgattca 4140
ggcttggcct gaaaacagga cggacctcca tgcctttgag aacctagaaa tcatacgcgg 4200
caggaccaag caacatggtc agttttctct tgcagtcgtc agcctgaaca taacatcctt 4260
gggattacgc tccctcaagg agataagtga tggagatgtg ataatttcag gaaacaaaaa 4320
tttgtgctat gcaaatacaa taaactggaa aaaactgttt gggacctccg gtcagaaaac 4380
caaaattata agcaacagag gtgaaaacag ctgcaaggcc acaggccagg tctgccatgc 4440
cttgtgctcc cccgagggct gctggggccc ggagcccagg gactgcgtct cttgccggaa 4500
tgtcagccga ggcagggaat gcgtggacaa gtgcaacctt ctggagggtg agccaaggga 4560
gtttgtggag aactctgagt gcatacagtg ccacccagag tgcctgcctc aggccatgaa 4620
catcacctgc acaggacggg gaccagacaa ctgtatccag tgtgcccact acattgacgg 4680
cccccactgc gtcaagacct gcccggcagg agtcatggga gaaaacaaca ccctggtctg 4740
gaagtacgca gacgccggcc atgtgtgcca cctgtgccat ccaaactgca cctacggatg 4800
cactgggcca ggtcttgaag gctgtccaac gaatgggcct aagatcccgt ccatcgccac 4860
tgggatggtg ggggccctcc tcttgctgct ggtggtggcc ctggggatcg gcctcttcat 4920
gtgagcggcc gctctagacc cgggctgcag gaattcgata tcaagcttat cgataatcaa 4980
cctctggatt acaaaatttg tgaaagattg actggtattc ttaactatgt tgctcctttt 5040
acgctatgtg gatacgctgc tttaatgcct ttgtatcatg ctattgcttc ccgtatggct 5100
ttcattttct cctccttgta taaatcctgg ttgctgtctc tttatgagga gttgtggccc 5160
gttgtcaggc aacgtggcgt ggtgtgcact gtgtttgctg acgcaacccc cactggttgg 5220
ggcattgcca ccacctgtca gctcctttcc gggactttcg ctttccccct ccctattgcc 5280
acggcggaac tcatcgccgc ctgccttgcc cgctgctgga caggggctcg gctgttgggc 5340
actgacaatt ccgtggtgtt gtcggggaaa tcatcgtcct ttccttggct gctcgcctgt 5400
gttgccacct ggattctgcg cgggacgtcc ttctgctacg tcccttcggc cctcaatcca 5460
gcggaccttc cttcccgcgg cctgctgccg gctctgcggc ctcttccgcg tcttcgcctt 5520
cgccctcaga cgagtcggat ctccctttgg gccgcctccc cgcatcgata ccgtcgacta 5580
gccgtacctt taagaccaat gacttacaag gcagctgtag atcttagcca ctttttaaaa 5640
gaaaaggggg gactggaagg gctaattcac tcccaaagaa gacaagatct gctttttgcc 5700
tgtactgggt ctctctggtt agaccagatc tgagcctggg agctctctgg ctaactaggg 5760
aacccactgc ttaagcctca ataaagcttg ccttgagtgc ttcaagtagt gtgtgcccgt 5820
ctgttgtgtg actctggtaa ctagagatcc ctcagaccct tttagtcagt gtggaaaatc 5880
tctagcagaa ttcgatatca agcttatcga taccgtcgac ctcgaggggg ggcccggtac 5940
ccaattcgcc ctatagtgag tcgtattaca attcactggc cgtcgtttta caacgtcgtg 6000
actgggaaaa ccctggcgtt acccaactta atcgccttgc agcacatccc cctttcgcca 6060
gctggcgtaa tagcgaagag gcccgcaccg atcgcccttc ccaacagttg cgcagcctga 6120
atggcgaatg gaaattgtaa gcgttaatat tttgttaaaa ttcgcgttaa atttttgtta 6180
aatcagctca ttttttaacc aataggccga aatcggcaaa atcccttata aatcaaaaga 6240
atagaccgag atagggttga gtgttgttcc agtttggaac aagagtccac tattaaagaa 6300
cgtggactcc aacgtcaaag ggcgaaaaac cgtctatcag ggcgatggcc cactacgtga 6360
accatcaccc taatcaagtt ttttggggtc gaggtgccgt aaagcactaa atcggaaccc 6420
taaagggagc ccccgattta gagcttgacg gggaaagccg gcgaacgtgg cgagaaagga 6480
agggaagaaa gcgaaaggag cgggcgctag ggcgctggca agtgtagcgg tcacgctgcg 6540
cgtaaccacc acacccgccg cgcttaatgc gccgctacag ggcgcgtcag gtggcacttt 6600
tcggggaaat gtgcgcggaa cccctatttg tttatttttc taaatacatt caaatatgta 6660
tccgctcatg agacaataac cctgataaat gcttcaataa tattgaaaaa ggaagagtat 6720
gagtattcaa catttccgtg tcgcccttat tccctttttt gcggcatttt gccttcctgt 6780
ttttgctcac ccagaaacgc tggtgaaagt aaaagatgct gaagatcagt tgggtgcacg 6840
agtgggttac atcgaactgg atctcaacag cggtaagatc cttgagagtt ttcgccccga 6900
agaacgtttt ccaatgatga gcacttttaa agttctgcta tgtggcgcgg tattatcccg 6960
tattgacgcc gggcaagagc aactcggtcg ccgcatacac tattctcaga atgacttggt 7020
tgagtactca ccagtcacag aaaagcatct tacggatggc atgacagtaa gagaattatg 7080
cagtgctgcc ataaccatga gtgataacac tgcggccaac ttacttctga caacgatcgg 7140
aggaccgaag gagctaaccg cttttttgca caacatgggg gatcatgtaa ctcgccttga 7200
tcgttgggaa ccggagctga atgaagccat accaaacgac gagcgtgaca ccacgatgcc 7260
tgtagcaatg gcaacaacgt tgcgcaaact attaactggc gaactactta ctctagcttc 7320
ccggcaacaa ttaatagact ggatggaggc ggataaagtt gcaggaccac ttctgcgctc 7380
ggcccttccg gctggctggt ttattgctga taaatctgga gccggtgagc gtgggtctcg 7440
cggtatcatt gcagcactgg ggccagatgg taagccctcc cgtatcgtag ttatctacac 7500
gacggggagt caggcaacta tggatgaacg aaatagacag atcgctgaga taggtgcctc 7560
actgattaag cattggtaac tgtcagacca agtttactca tatatacttt agattgattt 7620
aaaacttcat ttttaattta aaaggatcta ggtgaagatc ctttttgata atctcatgac 7680
caaaatccct taacgtgagt tttcgttcca ctgagcgtca gaccccgtag aaaagatcaa 7740
aggatcttct tgagatcctt tttttctgcg cgtaatctgc tgcttgcaaa caaaaaaacc 7800
accgctacca gcggtggttt gtttgccgga tcaagagcta ccaactcttt ttccgaaggt 7860
aactggcttc agcagagcgc agataccaaa tactgttctt ctagtgtagc cgtagttagg 7920
ccaccacttc aagaactctg tagcaccgcc tacatacctc gctctgctaa tcctgttacc 7980
agtggctgct gccagtggcg ataagtcgtg tcttaccggg ttggactcaa gacgatagtt 8040
accggataag gcgcagcggt cgggctgaac ggggggttcg tgcacacagc ccagcttgga 8100
gcgaacgacc tacaccgaac tgagatacct acagcgtgag ctatgagaaa gcgccacgct 8160
tcccgaaggg agaaaggcgg acaggtatcc ggtaagcggc agggtcggaa caggagagcg 8220
cacgagggag cttccagggg gaaacgcctg gtatctttat agtcctgtcg ggtttcgcca 8280
cctctgactt gagcgtcgat ttttgtgatg ctcgtcaggg gggcggagcc tatggaaaaa 8340
cgccagcaac gcggcctttt tacggttcct ggccttttgc tggccttttg ctcacatgtt 8400
ctttcctgcg ttatcccctg attctgtgga taaccgtatt accgcctttg agtgagctga 8460
taccgctcgc cgcagccgaa cgaccgagcg cagcgagtca gtgagcgagg aagcggaaga 8520
gcgcccaata cgcaaaccgc ctctccccgc gcgttggccg attcattaat gcagctggca 8580
cgacaggttt cccgactgga aagcgggcag tgagcgcaac gcaattaatg tgagttagct 8640
cactcattag gcaccccagg ctttacactt tatgcttccg gctcgtatgt tgtgtggaat 8700
tgtgagcgga taacaatttc acacaggaaa cagctatgac catgattacg ccaagctcga 8760
aattaaccct cactaaaggg aacaaaagct ggagctccac cgcggtggcg gcctcgaggt 8820
cgagatccgg tcgaccagca accatagtcc cgcccctaac tccgcccatc ccgcccctaa 8880
ctccgcccag ttccgcccat tctccgcccc atggctgact aatttttttt atttatgcag 8940
aggccgaggc cgcctcggcc tctgagctat tccagaagta gtgaggaggc ttttttggag 9000
gcctaggctt ttgcaaaaag cttcgacggt atcgattggc tcatgtccaa cattaccgcc 9060
atgttgacat tgattattga ctagttatta atagtaatca attacggggt cattagttca 9120
tagcccatat atggagttcc gcgttacata acttacggta aatggcccgc ctggctgacc 9180
gcccaacgac ccccgcccat tgacgtcaat aatgacgtat gttcccatag taacgccaat 9240
agggactttc cattgacgtc aatgggtgga gtatttacgg taaactgccc acttggcagt 9300
acatcaagtg tatcatatgc caagtacgcc ccctattgac gtcaatgacg gtaaatggcc 9360
cgcctggcat tatgcccagt acatgacctt atgggacttt cctacttggc agtacatcta 9420
cgtattagtc atcgctatta ccatggtgat gcggttttgg cagtacatca atgggcgtgg 9480
atagcggttt gactcacggg gatttccaag tctccacccc attgacgtca atgggagttt 9540
gttttggcac caaaatcaac gggactttcc aaaatgtcgt aacaactccg ccccattgac 9600
gcaaatgggc ggtaggcgtg tacggaattc ggagtggcga gccctcagat cctgcatata 9660
agcagctgct ttttgcctgt actgggtctc tctg 9694
<210> 56
<211> 9373
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Ce7scFv-IgG4-шарнир-CD28tm/4-1BB-zeta-T2A-EGFRt-epHI
V7
<400> 56
gttagaccag atctgagcct gggagctctc tggctaacta gggaacccac tgcttaagcc 60
tcaataaagc ttgccttgag tgcttcaagt agtgtgtgcc cgtctgttgt gtgactctgg 120
taactagaga tccctcagac ccttttagtc agtgtggaaa atctctagca gtggcgcccg 180
aacagggact tgaaagcgaa agggaaacca gaggagctct ctcgacgcag gactcggctt 240
gctgaagcgc gcacggcaag aggcgagggg cggcgactgg tgagtacgcc aaaaattttg 300
actagcggag gctagaagga gagagatggg tgcgagagcg tcagtattaa gcgggggaga 360
attagatcga tgggaaaaaa ttcggttaag gccaggggga aagaaaaaat ataaattaaa 420
acatatagta tgggcaagca gggagctaga acgattcgca gttaatcctg gcctgttaga 480
aacatcagaa ggctgtagac aaatactggg acagctacaa ccatcccttc agacaggatc 540
agaagaactt agatcattat ataatacagt agcaaccctc tattgtgtgc atcaaaggat 600
agagataaaa gacaccaagg aagctttaga caagatagag gaagagcaaa acaaaagtaa 660
gaaaaaagca cagcaagcag cagctgacac aggacacagc aatcaggtca gccaaaatta 720
ccctatagtg cagaacatcc aggggcaaat ggtacatcag gccatatcac ctagaacttt 780
aaatgcatgg gtaaaagtag tagaagagaa ggctttcagc ccagaagtga tacccatgtt 840
ttcagcatta tcagaaggag ccaccccaca agatttaaac accatgctaa acacagtggg 900
gggacatcaa gcagccatgc aaatgttaaa agagaccatc aatgaggaag ctgcaggcaa 960
agagaagagt ggtgcagaga gaaaaaagag cagtgggaat aggagctttg ttccttgggt 1020
tcttgggagc agcaggaagc actatgggcg cagcgtcaat gacgctgacg gtacaggcca 1080
gacaattatt gtctggtata gtgcagcagc agaacaattt gctgagggct attgaggcgc 1140
aacagcatct gttgcaactc acagtctggg gcatcaagca gctccaggca agaatcctgg 1200
ctgtggaaag atacctaaag gatcaacagc tcctggggat ttggggttgc tctggaaaac 1260
tcatttgcac cactgctgtg ccttggatct acaaatggca gtattcatcc acaattttaa 1320
aagaaaaggg gggattgggg ggtacagtgc aggggaaaga atagtagaca taatagcaac 1380
agacatacaa actaaagaat tacaaaaaca aattacaaaa attcaaaatt ttcgggttta 1440
ttacagggac agcagagatc cagtttgggg atcaattgca tgaagaatct gcttagggtt 1500
aggcgttttg cgctgcttcg cgaggatctg cgatcgctcc ggtgcccgtc agtgggcaga 1560
gcgcacatcg cccacagtcc ccgagaagtt ggggggaggg gtcggcaatt gaaccggtgc 1620
ctagagaagg tggcgcgggg taaactggga aagtgatgtc gtgtactggc tccgcctttt 1680
tcccgagggt gggggagaac cgtatataag tgcagtagtc gccgtgaacg ttctttttcg 1740
caacgggttt gccgccagaa cacagctgaa gcttcgaggg gctcgcatct ctccttcacg 1800
cgcccgccgc cctacctgag gccgccatcc acgccggttg agtcgcgttc tgccgcctcc 1860
cgcctgtggt gcctcctgaa ctgcgtccgc cgtctaggta agtttaaagc tcaggtcgag 1920
accgggcctt tgtccggcgc tcccttggag cctacctaga ctcagccggc tctccacgct 1980
ttgcctgacc ctgcttgctc aactctacgt ctttgtttcg ttttctgttc tgcgccgtta 2040
cagatccaag ctgtgaccgg cgcctacggc tagcgccgcc accatgctgc tgctggtgac 2100
cagcctgctg ctgtgcgagc tgccccaccc cgcctttctg ctgatccccc aggtgcagct 2160
gcagcagcct ggcgccgagc tggtgaagcc aggcgccagc gtgaagctgt cctgcaaggc 2220
cagcggctac accttcaccg gctactggat gcactgggtg aagcagagac ccggccacgg 2280
cctggaatgg atcggcgaga tcaaccccag caacggccgg accaactaca acgagcggtt 2340
caagagcaag gccaccctga ccgtggacaa gagcagcacc accgccttca tgcagctgtc 2400
cggcctgacc agcgaggaca gcgccgtgta cttctgcgcc agggactact acggcaccag 2460
ctacaacttc gactactggg gccagggcac cacactgacc gtgagcagcg gcggaggggg 2520
ctctggcggc ggaggatctg ggggaggggg cagcgacatc cagatgaccc agagcagcag 2580
cagcttcagc gtgagcctgg gcgaccgggt gaccatcacc tgtaaggcca acgaggacat 2640
caacaaccgg ctggcctggt atcagcagac ccccggcaac agccccaggc tgctgatcag 2700
cggcgccacc aacctggtga ccggcgtgcc cagccggttt agcggcagcg gctccggcaa 2760
ggactacacc ctgaccatca caagcctgca ggccgaggac ttcgccacct actactgcca 2820
gcagtactgg tccaccccct tcaccttcgg cagcggcacc gagctggaaa tcaaagaatc 2880
taagtacgga ccgccctgcc ccccttgccc tatgttctgg gtgctggtgg tggtcggagg 2940
cgtgctggcc tgctacagcc tgctggtcac cgtggccttc atcatctttt gggtgaaacg 3000
gggcagaaag aaactcctgt atatattcaa acaaccattt atgagaccag tacaaactac 3060
tcaagaggaa gatggctgta gctgccgatt tccagaagaa gaagaaggag gatgtgaact 3120
gcgggtgaag ttcagcagaa gcgccgacgc ccctgcctac cagcagggcc agaatcagct 3180
gtacaacgag ctgaacctgg gcagaaggga agagtacgac gtcctggata agcggagagg 3240
ccgggaccct gagatgggcg gcaagcctcg gcggaagaac ccccaggaag gcctgtataa 3300
cgaactgcag aaagacaaga tggccgaggc ctacagcgag atcggcatga agggcgagcg 3360
gaggcggggc aagggccacg acggcctgta tcagggcctg tccaccgcca ccaaggatac 3420
ctacgacgcc ctgcacatgc aggccctgcc cccaaggctc gagggcggcg gagagggcag 3480
aggaagtctt ctaacatgcg gtgacgtgga ggagaatccc ggccctagga tgcttctcct 3540
ggtgacaagc cttctgctct gtgagttacc acacccagca ttcctcctga tcccacgcaa 3600
agtgtgtaac ggaataggta ttggtgaatt taaagactca ctctccataa atgctacgaa 3660
tattaaacac ttcaaaaact gcacctccat cagtggcgat ctccacatcc tgccggtggc 3720
atttaggggt gactccttca cacatactcc tcctctggat ccacaggaac tggatattct 3780
gaaaaccgta aaggaaatca cagggttttt gctgattcag gcttggcctg aaaacaggac 3840
ggacctccat gcctttgaga acctagaaat catacgcggc aggaccaagc aacatggtca 3900
gttttctctt gcagtcgtca gcctgaacat aacatccttg ggattacgct ccctcaagga 3960
gataagtgat ggagatgtga taatttcagg aaacaaaaat ttgtgctatg caaatacaat 4020
aaactggaaa aaactgtttg ggacctccgg tcagaaaacc aaaattataa gcaacagagg 4080
tgaaaacagc tgcaaggcca caggccaggt ctgccatgcc ttgtgctccc ccgagggctg 4140
ctggggcccg gagcccaggg actgcgtctc ttgccggaat gtcagccgag gcagggaatg 4200
cgtggacaag tgcaaccttc tggagggtga gccaagggag tttgtggaga actctgagtg 4260
catacagtgc cacccagagt gcctgcctca ggccatgaac atcacctgca caggacgggg 4320
accagacaac tgtatccagt gtgcccacta cattgacggc ccccactgcg tcaagacctg 4380
cccggcagga gtcatgggag aaaacaacac cctggtctgg aagtacgcag acgccggcca 4440
tgtgtgccac ctgtgccatc caaactgcac ctacggatgc actgggccag gtcttgaagg 4500
ctgtccaacg aatgggccta agatcccgtc catcgccact gggatggtgg gggccctcct 4560
cttgctgctg gtggtggccc tggggatcgg cctcttcatg tgagcggccg ctctagaccc 4620
gggctgcagg aattcgatat caagcttatc gataatcaac ctctggatta caaaatttgt 4680
gaaagattga ctggtattct taactatgtt gctcctttta cgctatgtgg atacgctgct 4740
ttaatgcctt tgtatcatgc tattgcttcc cgtatggctt tcattttctc ctccttgtat 4800
aaatcctggt tgctgtctct ttatgaggag ttgtggcccg ttgtcaggca acgtggcgtg 4860
gtgtgcactg tgtttgctga cgcaaccccc actggttggg gcattgccac cacctgtcag 4920
ctcctttccg ggactttcgc tttccccctc cctattgcca cggcggaact catcgccgcc 4980
tgccttgccc gctgctggac aggggctcgg ctgttgggca ctgacaattc cgtggtgttg 5040
tcggggaaat catcgtcctt tccttggctg ctcgcctgtg ttgccacctg gattctgcgc 5100
gggacgtcct tctgctacgt cccttcggcc ctcaatccag cggaccttcc ttcccgcggc 5160
ctgctgccgg ctctgcggcc tcttccgcgt cttcgccttc gccctcagac gagtcggatc 5220
tccctttggg ccgcctcccc gcatcgatac cgtcgactag ccgtaccttt aagaccaatg 5280
acttacaagg cagctgtaga tcttagccac tttttaaaag aaaagggggg actggaaggg 5340
ctaattcact cccaaagaag acaagatctg ctttttgcct gtactgggtc tctctggtta 5400
gaccagatct gagcctggga gctctctggc taactaggga acccactgct taagcctcaa 5460
taaagcttgc cttgagtgct tcaagtagtg tgtgcccgtc tgttgtgtga ctctggtaac 5520
tagagatccc tcagaccctt ttagtcagtg tggaaaatct ctagcagaat tcgatatcaa 5580
gcttatcgat accgtcgacc tcgagggggg gcccggtacc caattcgccc tatagtgagt 5640
cgtattacaa ttcactggcc gtcgttttac aacgtcgtga ctgggaaaac cctggcgtta 5700
cccaacttaa tcgccttgca gcacatcccc ctttcgccag ctggcgtaat agcgaagagg 5760
cccgcaccga tcgcccttcc caacagttgc gcagcctgaa tggcgaatgg aaattgtaag 5820
cgttaatatt ttgttaaaat tcgcgttaaa tttttgttaa atcagctcat tttttaacca 5880
ataggccgaa atcggcaaaa tcccttataa atcaaaagaa tagaccgaga tagggttgag 5940
tgttgttcca gtttggaaca agagtccact attaaagaac gtggactcca acgtcaaagg 6000
gcgaaaaacc gtctatcagg gcgatggccc actacgtgaa ccatcaccct aatcaagttt 6060
tttggggtcg aggtgccgta aagcactaaa tcggaaccct aaagggagcc cccgatttag 6120
agcttgacgg ggaaagccgg cgaacgtggc gagaaaggaa gggaagaaag cgaaaggagc 6180
gggcgctagg gcgctggcaa gtgtagcggt cacgctgcgc gtaaccacca cacccgccgc 6240
gcttaatgcg ccgctacagg gcgcgtcagg tggcactttt cggggaaatg tgcgcggaac 6300
ccctatttgt ttatttttct aaatacattc aaatatgtat ccgctcatga gacaataacc 6360
ctgataaatg cttcaataat attgaaaaag gaagagtatg agtattcaac atttccgtgt 6420
cgcccttatt cccttttttg cggcattttg ccttcctgtt tttgctcacc cagaaacgct 6480
ggtgaaagta aaagatgctg aagatcagtt gggtgcacga gtgggttaca tcgaactgga 6540
tctcaacagc ggtaagatcc ttgagagttt tcgccccgaa gaacgttttc caatgatgag 6600
cacttttaaa gttctgctat gtggcgcggt attatcccgt attgacgccg ggcaagagca 6660
actcggtcgc cgcatacact attctcagaa tgacttggtt gagtactcac cagtcacaga 6720
aaagcatctt acggatggca tgacagtaag agaattatgc agtgctgcca taaccatgag 6780
tgataacact gcggccaact tacttctgac aacgatcgga ggaccgaagg agctaaccgc 6840
ttttttgcac aacatggggg atcatgtaac tcgccttgat cgttgggaac cggagctgaa 6900
tgaagccata ccaaacgacg agcgtgacac cacgatgcct gtagcaatgg caacaacgtt 6960
gcgcaaacta ttaactggcg aactacttac tctagcttcc cggcaacaat taatagactg 7020
gatggaggcg gataaagttg caggaccact tctgcgctcg gcccttccgg ctggctggtt 7080
tattgctgat aaatctggag ccggtgagcg tgggtctcgc ggtatcattg cagcactggg 7140
gccagatggt aagccctccc gtatcgtagt tatctacacg acggggagtc aggcaactat 7200
ggatgaacga aatagacaga tcgctgagat aggtgcctca ctgattaagc attggtaact 7260
gtcagaccaa gtttactcat atatacttta gattgattta aaacttcatt tttaatttaa 7320
aaggatctag gtgaagatcc tttttgataa tctcatgacc aaaatccctt aacgtgagtt 7380
ttcgttccac tgagcgtcag accccgtaga aaagatcaaa ggatcttctt gagatccttt 7440
ttttctgcgc gtaatctgct gcttgcaaac aaaaaaacca ccgctaccag cggtggtttg 7500
tttgccggat caagagctac caactctttt tccgaaggta actggcttca gcagagcgca 7560
gataccaaat actgttcttc tagtgtagcc gtagttaggc caccacttca agaactctgt 7620
agcaccgcct acatacctcg ctctgctaat cctgttacca gtggctgctg ccagtggcga 7680
taagtcgtgt cttaccgggt tggactcaag acgatagtta ccggataagg cgcagcggtc 7740
gggctgaacg gggggttcgt gcacacagcc cagcttggag cgaacgacct acaccgaact 7800
gagataccta cagcgtgagc tatgagaaag cgccacgctt cccgaaggga gaaaggcgga 7860
caggtatccg gtaagcggca gggtcggaac aggagagcgc acgagggagc ttccaggggg 7920
aaacgcctgg tatctttata gtcctgtcgg gtttcgccac ctctgacttg agcgtcgatt 7980
tttgtgatgc tcgtcagggg ggcggagcct atggaaaaac gccagcaacg cggccttttt 8040
acggttcctg gccttttgct ggccttttgc tcacatgttc tttcctgcgt tatcccctga 8100
ttctgtggat aaccgtatta ccgcctttga gtgagctgat accgctcgcc gcagccgaac 8160
gaccgagcgc agcgagtcag tgagcgagga agcggaagag cgcccaatac gcaaaccgcc 8220
tctccccgcg cgttggccga ttcattaatg cagctggcac gacaggtttc ccgactggaa 8280
agcgggcagt gagcgcaacg caattaatgt gagttagctc actcattagg caccccaggc 8340
tttacacttt atgcttccgg ctcgtatgtt gtgtggaatt gtgagcggat aacaatttca 8400
cacaggaaac agctatgacc atgattacgc caagctcgaa attaaccctc actaaaggga 8460
acaaaagctg gagctccacc gcggtggcgg cctcgaggtc gagatccggt cgaccagcaa 8520
ccatagtccc gcccctaact ccgcccatcc cgcccctaac tccgcccagt tccgcccatt 8580
ctccgcccca tggctgacta atttttttta tttatgcaga ggccgaggcc gcctcggcct 8640
ctgagctatt ccagaagtag tgaggaggct tttttggagg cctaggcttt tgcaaaaagc 8700
ttcgacggta tcgattggct catgtccaac attaccgcca tgttgacatt gattattgac 8760
tagttattaa tagtaatcaa ttacggggtc attagttcat agcccatata tggagttccg 8820
cgttacataa cttacggtaa atggcccgcc tggctgaccg cccaacgacc cccgcccatt 8880
gacgtcaata atgacgtatg ttcccatagt aacgccaata gggactttcc attgacgtca 8940
atgggtggag tatttacggt aaactgccca cttggcagta catcaagtgt atcatatgcc 9000
aagtacgccc cctattgacg tcaatgacgg taaatggccc gcctggcatt atgcccagta 9060
catgacctta tgggactttc ctacttggca gtacatctac gtattagtca tcgctattac 9120
catggtgatg cggttttggc agtacatcaa tgggcgtgga tagcggtttg actcacgggg 9180
atttccaagt ctccacccca ttgacgtcaa tgggagtttg ttttggcacc aaaatcaacg 9240
ggactttcca aaatgtcgta acaactccgc cccattgacg caaatgggcg gtaggcgtgt 9300
acggaattcg gagtggcgag ccctcagatc ctgcatataa gcagctgctt tttgcctgta 9360
ctgggtctct ctg 9373
<210> 57
<211> 9496
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Ce7scFv-IgG4-шарнир-CD28tm/cyto-4-1BB-zeta-T2A-EGFRt
-epHIV7 (короткие два костимулирующие домена)
<400> 57
gttagaccag atctgagcct gggagctctc tggctaacta gggaacccac tgcttaagcc 60
tcaataaagc ttgccttgag tgcttcaagt agtgtgtgcc cgtctgttgt gtgactctgg 120
taactagaga tccctcagac ccttttagtc agtgtggaaa atctctagca gtggcgcccg 180
aacagggact tgaaagcgaa agggaaacca gaggagctct ctcgacgcag gactcggctt 240
gctgaagcgc gcacggcaag aggcgagggg cggcgactgg tgagtacgcc aaaaattttg 300
actagcggag gctagaagga gagagatggg tgcgagagcg tcagtattaa gcgggggaga 360
attagatcga tgggaaaaaa ttcggttaag gccaggggga aagaaaaaat ataaattaaa 420
acatatagta tgggcaagca gggagctaga acgattcgca gttaatcctg gcctgttaga 480
aacatcagaa ggctgtagac aaatactggg acagctacaa ccatcccttc agacaggatc 540
agaagaactt agatcattat ataatacagt agcaaccctc tattgtgtgc atcaaaggat 600
agagataaaa gacaccaagg aagctttaga caagatagag gaagagcaaa acaaaagtaa 660
gaaaaaagca cagcaagcag cagctgacac aggacacagc aatcaggtca gccaaaatta 720
ccctatagtg cagaacatcc aggggcaaat ggtacatcag gccatatcac ctagaacttt 780
aaatgcatgg gtaaaagtag tagaagagaa ggctttcagc ccagaagtga tacccatgtt 840
ttcagcatta tcagaaggag ccaccccaca agatttaaac accatgctaa acacagtggg 900
gggacatcaa gcagccatgc aaatgttaaa agagaccatc aatgaggaag ctgcaggcaa 960
agagaagagt ggtgcagaga gaaaaaagag cagtgggaat aggagctttg ttccttgggt 1020
tcttgggagc agcaggaagc actatgggcg cagcgtcaat gacgctgacg gtacaggcca 1080
gacaattatt gtctggtata gtgcagcagc agaacaattt gctgagggct attgaggcgc 1140
aacagcatct gttgcaactc acagtctggg gcatcaagca gctccaggca agaatcctgg 1200
ctgtggaaag atacctaaag gatcaacagc tcctggggat ttggggttgc tctggaaaac 1260
tcatttgcac cactgctgtg ccttggatct acaaatggca gtattcatcc acaattttaa 1320
aagaaaaggg gggattgggg ggtacagtgc aggggaaaga atagtagaca taatagcaac 1380
agacatacaa actaaagaat tacaaaaaca aattacaaaa attcaaaatt ttcgggttta 1440
ttacagggac agcagagatc cagtttgggg atcaattgca tgaagaatct gcttagggtt 1500
aggcgttttg cgctgcttcg cgaggatctg cgatcgctcc ggtgcccgtc agtgggcaga 1560
gcgcacatcg cccacagtcc ccgagaagtt ggggggaggg gtcggcaatt gaaccggtgc 1620
ctagagaagg tggcgcgggg taaactggga aagtgatgtc gtgtactggc tccgcctttt 1680
tcccgagggt gggggagaac cgtatataag tgcagtagtc gccgtgaacg ttctttttcg 1740
caacgggttt gccgccagaa cacagctgaa gcttcgaggg gctcgcatct ctccttcacg 1800
cgcccgccgc cctacctgag gccgccatcc acgccggttg agtcgcgttc tgccgcctcc 1860
cgcctgtggt gcctcctgaa ctgcgtccgc cgtctaggta agtttaaagc tcaggtcgag 1920
accgggcctt tgtccggcgc tcccttggag cctacctaga ctcagccggc tctccacgct 1980
ttgcctgacc ctgcttgctc aactctacgt ctttgtttcg ttttctgttc tgcgccgtta 2040
cagatccaag ctgtgaccgg cgcctacggc tagcgccgcc accatgctgc tgctggtgac 2100
cagcctgctg ctgtgcgagc tgccccaccc cgcctttctg ctgatccccc aggtgcagct 2160
gcagcagcct ggcgccgagc tggtgaagcc aggcgccagc gtgaagctgt cctgcaaggc 2220
cagcggctac accttcaccg gctactggat gcactgggtg aagcagagac ccggccacgg 2280
cctggaatgg atcggcgaga tcaaccccag caacggccgg accaactaca acgagcggtt 2340
caagagcaag gccaccctga ccgtggacaa gagcagcacc accgccttca tgcagctgtc 2400
cggcctgacc agcgaggaca gcgccgtgta cttctgcgcc agggactact acggcaccag 2460
ctacaacttc gactactggg gccagggcac cacactgacc gtgagcagcg gcggaggggg 2520
ctctggcggc ggaggatctg ggggaggggg cagcgacatc cagatgaccc agagcagcag 2580
cagcttcagc gtgagcctgg gcgaccgggt gaccatcacc tgtaaggcca acgaggacat 2640
caacaaccgg ctggcctggt atcagcagac ccccggcaac agccccaggc tgctgatcag 2700
cggcgccacc aacctggtga ccggcgtgcc cagccggttt agcggcagcg gctccggcaa 2760
ggactacacc ctgaccatca caagcctgca ggccgaggac ttcgccacct actactgcca 2820
gcagtactgg tccaccccct tcaccttcgg cagcggcacc gagctggaaa tcaaagaatc 2880
taagtacgga ccgccctgcc ccccttgccc tatgttctgg gtgctggtgg tggtcggagg 2940
cgtgctggcc tgctacagcc tgctggtcac cgtggccttc atcatctttt gggtccgcag 3000
caagcggagc agaggcggcc acagcgacta catgaacatg acccctagac ggcctggccc 3060
caccagaaag cactaccagc cctacgcccc tccccgggac tttgccgcct acagaagcaa 3120
acggggcaga aagaaactcc tgtatatatt caaacaacca tttatgagac cagtacaaac 3180
tactcaagag gaagatggct gtagctgccg atttccagaa gaagaagaag gaggatgtga 3240
actgcgggtg aagttcagca gaagcgccga cgcccctgcc taccagcagg gccagaatca 3300
gctgtacaac gagctgaacc tgggcagaag ggaagagtac gacgtcctgg ataagcggag 3360
aggccgggac cctgagatgg gcggcaagcc tcggcggaag aacccccagg aaggcctgta 3420
taacgaactg cagaaagaca agatggccga ggcctacagc gagatcggca tgaagggcga 3480
gcggaggcgg ggcaagggcc acgacggcct gtatcagggc ctgtccaccg ccaccaagga 3540
tacctacgac gccctgcaca tgcaggccct gcccccaagg ctcgagggcg gcggagaggg 3600
cagaggaagt cttctaacat gcggtgacgt ggaggagaat cccggcccta ggatgcttct 3660
cctggtgaca agccttctgc tctgtgagtt accacaccca gcattcctcc tgatcccacg 3720
caaagtgtgt aacggaatag gtattggtga atttaaagac tcactctcca taaatgctac 3780
gaatattaaa cacttcaaaa actgcacctc catcagtggc gatctccaca tcctgccggt 3840
ggcatttagg ggtgactcct tcacacatac tcctcctctg gatccacagg aactggatat 3900
tctgaaaacc gtaaaggaaa tcacagggtt tttgctgatt caggcttggc ctgaaaacag 3960
gacggacctc catgcctttg agaacctaga aatcatacgc ggcaggacca agcaacatgg 4020
tcagttttct cttgcagtcg tcagcctgaa cataacatcc ttgggattac gctccctcaa 4080
ggagataagt gatggagatg tgataatttc aggaaacaaa aatttgtgct atgcaaatac 4140
aataaactgg aaaaaactgt ttgggacctc cggtcagaaa accaaaatta taagcaacag 4200
aggtgaaaac agctgcaagg ccacaggcca ggtctgccat gccttgtgct cccccgaggg 4260
ctgctggggc ccggagccca gggactgcgt ctcttgccgg aatgtcagcc gaggcaggga 4320
atgcgtggac aagtgcaacc ttctggaggg tgagccaagg gagtttgtgg agaactctga 4380
gtgcatacag tgccacccag agtgcctgcc tcaggccatg aacatcacct gcacaggacg 4440
gggaccagac aactgtatcc agtgtgccca ctacattgac ggcccccact gcgtcaagac 4500
ctgcccggca ggagtcatgg gagaaaacaa caccctggtc tggaagtacg cagacgccgg 4560
ccatgtgtgc cacctgtgcc atccaaactg cacctacgga tgcactgggc caggtcttga 4620
aggctgtcca acgaatgggc ctaagatccc gtccatcgcc actgggatgg tgggggccct 4680
cctcttgctg ctggtggtgg ccctggggat cggcctcttc atgtgagcgg ccgctctaga 4740
cccgggctgc aggaattcga tatcaagctt atcgataatc aacctctgga ttacaaaatt 4800
tgtgaaagat tgactggtat tcttaactat gttgctcctt ttacgctatg tggatacgct 4860
gctttaatgc ctttgtatca tgctattgct tcccgtatgg ctttcatttt ctcctccttg 4920
tataaatcct ggttgctgtc tctttatgag gagttgtggc ccgttgtcag gcaacgtggc 4980
gtggtgtgca ctgtgtttgc tgacgcaacc cccactggtt ggggcattgc caccacctgt 5040
cagctccttt ccgggacttt cgctttcccc ctccctattg ccacggcgga actcatcgcc 5100
gcctgccttg cccgctgctg gacaggggct cggctgttgg gcactgacaa ttccgtggtg 5160
ttgtcgggga aatcatcgtc ctttccttgg ctgctcgcct gtgttgccac ctggattctg 5220
cgcgggacgt ccttctgcta cgtcccttcg gccctcaatc cagcggacct tccttcccgc 5280
ggcctgctgc cggctctgcg gcctcttccg cgtcttcgcc ttcgccctca gacgagtcgg 5340
atctcccttt gggccgcctc cccgcatcga taccgtcgac tagccgtacc tttaagacca 5400
atgacttaca aggcagctgt agatcttagc cactttttaa aagaaaaggg gggactggaa 5460
gggctaattc actcccaaag aagacaagat ctgctttttg cctgtactgg gtctctctgg 5520
ttagaccaga tctgagcctg ggagctctct ggctaactag ggaacccact gcttaagcct 5580
caataaagct tgccttgagt gcttcaagta gtgtgtgccc gtctgttgtg tgactctggt 5640
aactagagat ccctcagacc cttttagtca gtgtggaaaa tctctagcag aattcgatat 5700
caagcttatc gataccgtcg acctcgaggg ggggcccggt acccaattcg ccctatagtg 5760
agtcgtatta caattcactg gccgtcgttt tacaacgtcg tgactgggaa aaccctggcg 5820
ttacccaact taatcgcctt gcagcacatc cccctttcgc cagctggcgt aatagcgaag 5880
aggcccgcac cgatcgccct tcccaacagt tgcgcagcct gaatggcgaa tggaaattgt 5940
aagcgttaat attttgttaa aattcgcgtt aaatttttgt taaatcagct cattttttaa 6000
ccaataggcc gaaatcggca aaatccctta taaatcaaaa gaatagaccg agatagggtt 6060
gagtgttgtt ccagtttgga acaagagtcc actattaaag aacgtggact ccaacgtcaa 6120
agggcgaaaa accgtctatc agggcgatgg cccactacgt gaaccatcac cctaatcaag 6180
ttttttgggg tcgaggtgcc gtaaagcact aaatcggaac cctaaaggga gcccccgatt 6240
tagagcttga cggggaaagc cggcgaacgt ggcgagaaag gaagggaaga aagcgaaagg 6300
agcgggcgct agggcgctgg caagtgtagc ggtcacgctg cgcgtaacca ccacacccgc 6360
cgcgcttaat gcgccgctac agggcgcgtc aggtggcact tttcggggaa atgtgcgcgg 6420
aacccctatt tgtttatttt tctaaataca ttcaaatatg tatccgctca tgagacaata 6480
accctgataa atgcttcaat aatattgaaa aaggaagagt atgagtattc aacatttccg 6540
tgtcgccctt attccctttt ttgcggcatt ttgccttcct gtttttgctc acccagaaac 6600
gctggtgaaa gtaaaagatg ctgaagatca gttgggtgca cgagtgggtt acatcgaact 6660
ggatctcaac agcggtaaga tccttgagag ttttcgcccc gaagaacgtt ttccaatgat 6720
gagcactttt aaagttctgc tatgtggcgc ggtattatcc cgtattgacg ccgggcaaga 6780
gcaactcggt cgccgcatac actattctca gaatgacttg gttgagtact caccagtcac 6840
agaaaagcat cttacggatg gcatgacagt aagagaatta tgcagtgctg ccataaccat 6900
gagtgataac actgcggcca acttacttct gacaacgatc ggaggaccga aggagctaac 6960
cgcttttttg cacaacatgg gggatcatgt aactcgcctt gatcgttggg aaccggagct 7020
gaatgaagcc ataccaaacg acgagcgtga caccacgatg cctgtagcaa tggcaacaac 7080
gttgcgcaaa ctattaactg gcgaactact tactctagct tcccggcaac aattaataga 7140
ctggatggag gcggataaag ttgcaggacc acttctgcgc tcggcccttc cggctggctg 7200
gtttattgct gataaatctg gagccggtga gcgtgggtct cgcggtatca ttgcagcact 7260
ggggccagat ggtaagccct cccgtatcgt agttatctac acgacgggga gtcaggcaac 7320
tatggatgaa cgaaatagac agatcgctga gataggtgcc tcactgatta agcattggta 7380
actgtcagac caagtttact catatatact ttagattgat ttaaaacttc atttttaatt 7440
taaaaggatc taggtgaaga tcctttttga taatctcatg accaaaatcc cttaacgtga 7500
gttttcgttc cactgagcgt cagaccccgt agaaaagatc aaaggatctt cttgagatcc 7560
tttttttctg cgcgtaatct gctgcttgca aacaaaaaaa ccaccgctac cagcggtggt 7620
ttgtttgccg gatcaagagc taccaactct ttttccgaag gtaactggct tcagcagagc 7680
gcagatacca aatactgttc ttctagtgta gccgtagtta ggccaccact tcaagaactc 7740
tgtagcaccg cctacatacc tcgctctgct aatcctgtta ccagtggctg ctgccagtgg 7800
cgataagtcg tgtcttaccg ggttggactc aagacgatag ttaccggata aggcgcagcg 7860
gtcgggctga acggggggtt cgtgcacaca gcccagcttg gagcgaacga cctacaccga 7920
actgagatac ctacagcgtg agctatgaga aagcgccacg cttcccgaag ggagaaaggc 7980
ggacaggtat ccggtaagcg gcagggtcgg aacaggagag cgcacgaggg agcttccagg 8040
gggaaacgcc tggtatcttt atagtcctgt cgggtttcgc cacctctgac ttgagcgtcg 8100
atttttgtga tgctcgtcag gggggcggag cctatggaaa aacgccagca acgcggcctt 8160
tttacggttc ctggcctttt gctggccttt tgctcacatg ttctttcctg cgttatcccc 8220
tgattctgtg gataaccgta ttaccgcctt tgagtgagct gataccgctc gccgcagccg 8280
aacgaccgag cgcagcgagt cagtgagcga ggaagcggaa gagcgcccaa tacgcaaacc 8340
gcctctcccc gcgcgttggc cgattcatta atgcagctgg cacgacaggt ttcccgactg 8400
gaaagcgggc agtgagcgca acgcaattaa tgtgagttag ctcactcatt aggcacccca 8460
ggctttacac tttatgcttc cggctcgtat gttgtgtgga attgtgagcg gataacaatt 8520
tcacacagga aacagctatg accatgatta cgccaagctc gaaattaacc ctcactaaag 8580
ggaacaaaag ctggagctcc accgcggtgg cggcctcgag gtcgagatcc ggtcgaccag 8640
caaccatagt cccgccccta actccgccca tcccgcccct aactccgccc agttccgccc 8700
attctccgcc ccatggctga ctaatttttt ttatttatgc agaggccgag gccgcctcgg 8760
cctctgagct attccagaag tagtgaggag gcttttttgg aggcctaggc ttttgcaaaa 8820
agcttcgacg gtatcgattg gctcatgtcc aacattaccg ccatgttgac attgattatt 8880
gactagttat taatagtaat caattacggg gtcattagtt catagcccat atatggagtt 8940
ccgcgttaca taacttacgg taaatggccc gcctggctga ccgcccaacg acccccgccc 9000
attgacgtca ataatgacgt atgttcccat agtaacgcca atagggactt tccattgacg 9060
tcaatgggtg gagtatttac ggtaaactgc ccacttggca gtacatcaag tgtatcatat 9120
gccaagtacg ccccctattg acgtcaatga cggtaaatgg cccgcctggc attatgccca 9180
gtacatgacc ttatgggact ttcctacttg gcagtacatc tacgtattag tcatcgctat 9240
taccatggtg atgcggtttt ggcagtacat caatgggcgt ggatagcggt ttgactcacg 9300
gggatttcca agtctccacc ccattgacgt caatgggagt ttgttttggc accaaaatca 9360
acgggacttt ccaaaatgtc gtaacaactc cgccccattg acgcaaatgg gcggtaggcg 9420
tgtacggaat tcggagtggc gagccctcag atcctgcata taagcagctg ctttttgcct 9480
gtactgggtc tctctg 9496
<210> 58
<211> 679
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Длинный спейсер IgG4 шарнир-CH2-CH3
<400> 58
tacggaccgt ccctgccccc cttgccctgc ccccgagttc ctgggcggac ccagcgtgtt 60
cctgttcccc cccaagccca aggacaccct gatgatcagc cggacccccg aggtgacctg 120
cgtggtggtg gacgtgagcc aggaagatcc cgaggtccag ttcaattggt acgtggacgg 180
cgtggaagtg cacaacgcca agaccaagcc cagagaggaa cagttcaaca gcacctaccg 240
ggtggtgtct gtgctgaccg tgctgcacca ggactggctg aacggcaaag aatacaagtg 300
caaggtgtcc aacaagggcc tgcccagcag catcgaaaag accatcagca aggccaaggg 360
ccagcctcgc gagccccagg tgtacaccct gcctccctcc caggaagaga tgaccaagaa 420
ccaggtgtcc ctgacctgcc tggtgaaggg cttctacccc agcgacatcg ccgtggagtg 480
ggagagcaac ggccagcctg agaacaacta caagaccacc cctcccgtgc tggacagcga 540
cggcagcttc ttcctgtaca gccggctgac cgtggacaag agccggtggc aggaaggcaa 600
cgtctttagc tgcagcgtga tgcacgaggc cctgcacaac cactacaccc agaagagcct 660
gagcctgtcc ctgggcaag 679
<210> 59
<211> 119
<212> PRT
<213> Искусственная последовательность
<220>
<223> Спейсер промежуточной длины
<400> 59
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Gly Gln Pro Arg
1 5 10 15
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
20 25 30
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
35 40 45
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
50 55 60
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
65 70 75 80
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
85 90 95
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
100 105 110
Leu Ser Leu Ser Leu Gly Lys
115
<210> 60
<211> 229
<212> PRT
<213> Искусственная последовательность
<220>
<223> Длинный спейсер
<400> 60
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<---
Реферат
Изобретение относится к области биотехнологии, конкретно к получению Т-клеток, экспрессирующих химерный антигенный рецептор (CAR), специфически связывающийся с CD171, и может быть использовано в медицине. Полученные клетки могут быть использованы в эффективной терапии ракового заболевания, экспрессирующего CD171. 8 н. и 22 з.п. ф-лы, 21 ил., 8 табл., 1 пр.
Формула
Документы, цитированные в отчёте о поиске
Способ экспрессии белков, содержащих в качестве компонента гибридный изотип антитела

Комментарии