Сконструированные мезенхимальные стволовые клетки и способ их применения для лечения опухолей - RU2539099C2
Код документа: RU2539099C2
Чертежи










Описание
По всему тексту настоящей заявки цитируются разнообразные публикации. Описания этих публикаций включены в настоящую заявку в качестве ссылки для более полного описания состояния уровня техники области, к которой имеет отношение настоящее изобретение.
Уровень техники изобретения
Возникшая система представлений предполагает, что злокачественные клетки существуют в сложном клеточном и внеклеточном микроокружении, которое оказывает значительное влияние на инициацию и поддержание злокачественного фенотипа.1,2 Солидные опухоли можно рассматривать как состоящие из злокачественных клеток, а также поддерживающих клеток, которые составляют строму, в том числе из фибробластов, эндотелия, перицитов, лимфатических сосудов и, как правило, моноядерного инфильтрата.2-6 Также стромальные клетки являются настолько жизненно важными для выживания опухоли, что они стали важной мишенью для химиотерапевтического вмешательства.
Мезенхимальные стволовые клетки (MSC) представляют собой плюрипотентные клетки-предшественники, которые вносят вклад в поддержание и регенерацию разнообразных тканей.7,8 MSC могут быть обнаружены во многих тканях, где они служат в качестве местных источников стволовых клеток, таких как костный мозг, кровь или различные источники мезенхимальной ткани. MSC вносят вклад в реконструкцию ткани после повреждения или в процессе хронического воспаления. Полагают, что поврежденная ткань высвобождает специфические эндокринные факторы, которые затем приводят к мобилизации мультипотентных MSC и их последующему рекрутингу к участку повреждения. MSC также сильно привлекаются к строме опухоли. MSC, введенные посредством инфузии в кровь, у экспериментальных животных локализуются в злокачественных образованиях. Как только MSC попадают туда, они могут вносить вклад в разнообразные типы клеток, которые составляют строму опухоли, включая сосудистую систему опухоли и стромальные фибробласты.
При раке молочной железы, Karnoub et al., как было недавно показано, MSC на участке опухоли высвобождают небольшой белок, хемокин CCL5. CCL5 может действовать как хемоатрактант для разнообразных стромальных клеток9,10,и его экспрессия связана с повышенной неоваскуляризацией опухоли. Кроме того, CCL5 могут способствовать росту опухоли и метастазированию посредством рекрутинга ряда типов стромальных клеток к участкам первичного роста опухоли.9,11,12
Недавно было показано, что субпопуляция CD34- предшественников MSC рекрутирует к растущей опухоли и способствует неоангиогенезу опухоли посредством их дифференциации в новые сосудистые эндотелиальные клетки (EC) или перициты.13,15 Важно, что эти и относящиеся к ним непосредственные эффекты могут наблюдаться после прямой инъекции MSC в периферическое кровообращение.16
Существует неудовлетворенная потребность в терапии, основанной на стволовых клетках, в которой используют экспрессию цитотоксического белка, основанную на близости к стромальной ткани опухоли per se для экспрессии цитотоксического белка, в большей степени, чем экспрессии цитотоксического белка, основанной на близости к опухолевой ткани, проходящей ангиогенез. Эта необходимость является особенно острой для лечения метастатических опухолей, которые еще не претерпели ангиогенез.
Сущность изобретения
В одном из вариантов осуществления настоящее изобретение относится к способу лечения индивида, пораженного опухолью, предусматривающему введение в кровоток индивида терапевтически эффективного количества генетически модифицированных мезенхимальных стволовых клеток, где каждая генетически модифицированная мезенхимальная стволовая клетка содержит экзогенную нуклеиновую кислоту, содержащую (i) область, кодирующую цитотоксический белок, функционально связанную с (ii) промотором или комбинацией промотор/энхансер, посредством чего цитотоксический белок селективно экспрессируется, когда генетически модифицированные мезенхимальные стволовые клетки приближаются к стромальной ткани опухоли.
В еще одном варианте осуществления изобретение также относится к генетически модифицированным мезенхимальным стволовым клеткам для применения в любом из способов лечения индивида, пораженного опухолью, раскрытых в настоящей патентной заявке.
Настоящее изобретение также относится к способу лечения человека, пораженного опухолью поджелудочной железы, предусматривающему введение в кровоток индивида от приблизительно 1×105 до приблизительно 1×109 клеток/кг массы тела генетически модифицированных стволовых клеток CD34-, где (a) каждая генетически модифицированная стволовая клетка CD34- содержит экзогенную нуклеиновую кислоту, содержащую (i) область, кодирующую вирусную тимидинкиназу простого герпеса, функционально связанную с (ii) промотором RANTES, (b) индивид получает лечение ганцикловиром способом, позволяющим вирусной тимидинкиназе простого герпеса придавать ганцикловиру цитотоксические свойства, и (c) введение генетически модифицированных мезенхимальных стволовых клеток не следует за миелоабляцией, не сопровождается или не осуществляется перед миелоабляцией.
Настоящее изобретение также относится к генетически модифицированной мезенхимальной стволовой клетке, содержащей экзогенную нуклеиновую кислоту, содержащую (i) область, кодирующую цитотоксический белок, функционально связанную с (ii) промотором или комбинацией промотор/энхансер, посредством чего цитотоксический белок селективно экспрессируется, когда генетически модифицированная мезенхимальная стволовая клетка подходит близко к стромальной ткани опухоли.
В еще одном дополнительном варианте осуществления изобретение относится к ретровирусной пакующей клетке, содержащей:
- ретровирусный вектор, содержащий (i) область, кодирующую цитотоксический белок, функционально связанную с (ii) промотором или комбинацией промотор/энхансер, индуцируемыми воспалительными медиаторами, и
- ген, кодирующий белок поверхности вируса, обеспечивающий тропизм для мезенхимальных или стволовых клеток CD34-.
Дополнительно, ретровирусная пакующая клетка также содержит гены, кодирующие структурные белки и ферменты для выработки псевдотипированных вирионов из пакующей клетки.
Наконец, настоящее изобретение относится к генетически модифицированной стволовой клетке человека CD34-, содержащей экзогенную нуклеиновую кислоту, содержащую (i) область, кодирующую вирусную тимидинкиназу простого герпеса, функционально связанную с (ii) промотором RANTES.
Краткое описание фигур
Фиг.1
(A) При рассечении 1 см с левой стороны паха экспонировали поджелудочную железу. Шприц объемом 1 мл применяли для инъекции 150000 клеток рака поджелудочной железы Panc02 в поджелудочную железу. (B) Через две недели после процедуры у всех мышей вырастали пальпируемые опухоли, и их статистически распределяли в соответствующие экспериментальные группы.
Фиг.2
Исследования с модифицированной камерой Бойдена применяли для оценки миграционного отклика C57Bl6 MSC на кондиционированную среду, полученную от клеток Panc02. Результаты показывают дозозависимую индуцированную миграцию MSC к среде для роста, полученной от Panc02.
Фиг.3
Исследовали способность MSC (сконструированных для конститутивной экспрессии eGFP под контролем промотора CMV) к инфильтрации к имплантированной опухоли Panc02. Три раза в неделю 500000 клеток вводили посредством внутривенной инъекции мышам с растущими опухолями поджелудочной железы. Через пять недель мышей умерщвляли, и опухоли удаляли и анализировали на предмет экспрессии GFP. (A) Результаты показывают сильную экспрессию GFP, ассоциированную с опухолью. (B) Было обнаружено, что адоптивный перенос MSC увеличивает рост имплантированной опухоли во время эксперимента.
Фиг.4
Промотор CCL5 предоставляет увеличенную селективность экспрессии репортерного гена для направленного действия MSC на опухоль Panc02. MSC были сконструированы для экспрессии либо RFP или eGFP под контролем промотора CCL5. После инъекции 500000 клеток в неделю в течение трех недель животных умерщвляли и опухоль исследовали на предмет экспрессии репортерного гена посредством флуоресцентной микроскопии. Как eGFP- (A), так и RFP- (B) репортерные гены, управляемые промотором CCL5, показали экспрессию в окружении опухоли. Более точную морфологию опухоли наблюдали посредством иммуногистохимии на фиксированных срезах ткани с использованием RFP-специфичных поликлональных антител (C и D). (C) Результаты показывают очаговую экспрессию RFP в стромальных областях опухоли (100×). (D+E) Аналогичные образцы опухоли при более высоком увеличении (200×, 500×, соответственно) показывают обширную инфильтрацию MSC, показывающую экспрессию репортерного гена RFP в окружении опухоли.
Фиг.5
Применение MSC, сконструированных для экспрессии HSV-TK под контролем промотора CCL5, в сочетании с GVC в качестве терапевтической модальности для карциномы поджелудочной железы. (A) Общее представление о конструкции, применяемой для конструирования MSC для экспрессии HSV-TK суицидного гена. (B) Для терапевтического режима, 500000 MSC, сконструированных с CCL5-TK, вводили посредством внутривенной инъекции. Клетки давали три дня для прохождения рекрутинга к растущей опухоли и активации экспрессии гена TK. Мыши получали однократную ежедневную внутривенную инъекцию 7,5 мг GVC в течение четырех дней с последующим одним днем отдыха. Мышам затем снова проводили инъекцию сконструированных стволовых клеток и цикл повторяли в течение всей продолжительности эксперимента. После 3 циклов (36 дней после индукции опухоли или 21 день после первой инъекции MSC) животных умерщвляли и рост опухоли оценивали. (C) Примеры опухолей, удаленных из животных, обработанных контролями сред, контролями сконструированных MSC (RFP, eGFP) и после обработки HSV-TK/GCV. (D) обработка HSV-TK/GCV приводила к значительному снижению роста опухоли в течение всего прохождения эксперимента.
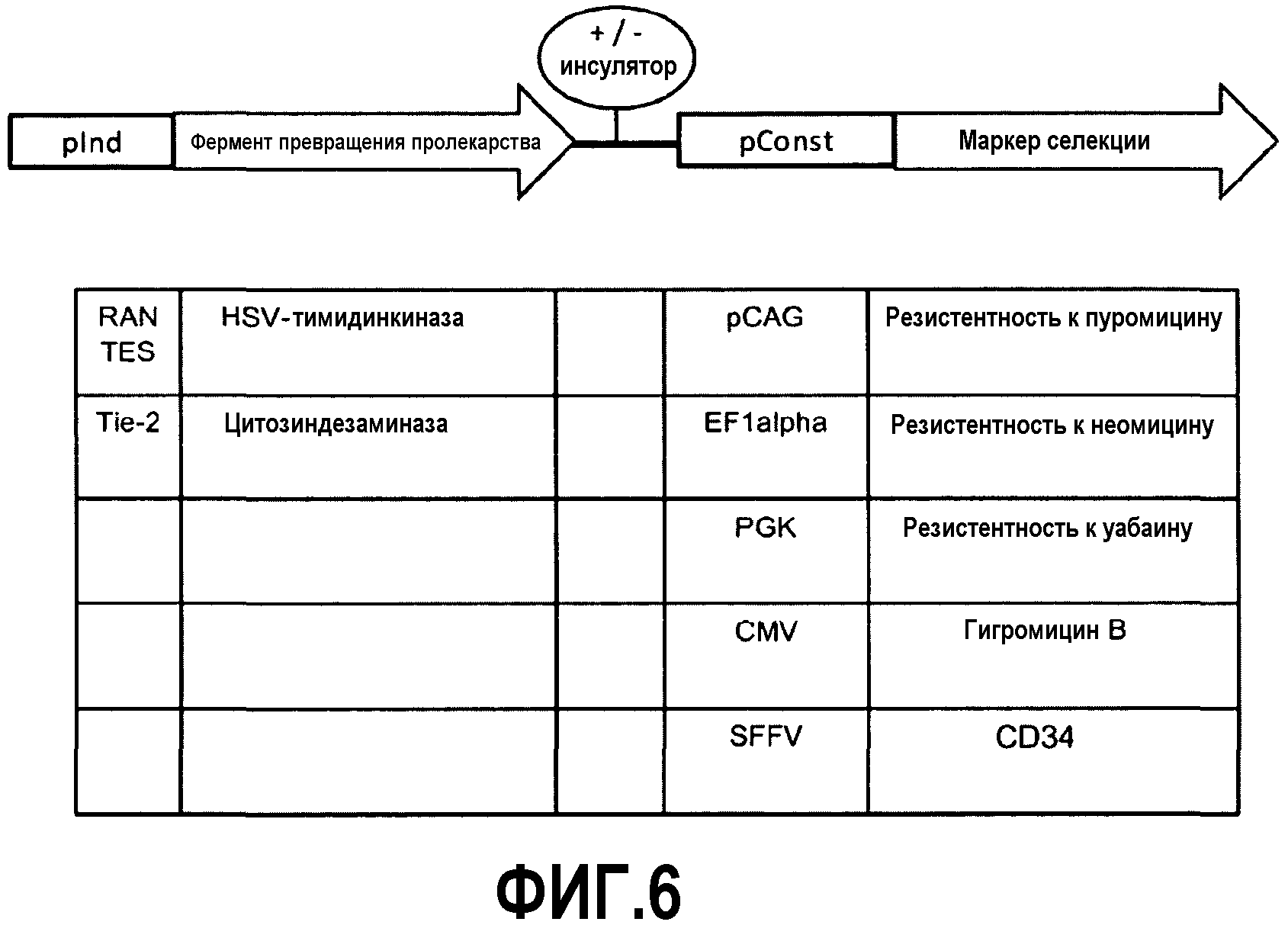
Фиг.6
Схематический общий вид трансгенной кассеты с некоторыми примерами генетических элементов. Индуцируемый промотор (pInd) связан с областью, кодирующей цитотоксический белок. Второй конститутивный клеточный или вирусный промотор (pConst) связан с геном маркера селекции. Две единицы могут быть разделены последовательностью инсулятора (+/- инсулятор).
Фиг.7
Общий вид ретровирусных векторов, несущих трансгенную кассету для генетической модификации MSC, изображенную на Фиг.6. Выработка вектора будет направляться активностью промотора U3-области в 5' длинном терминальном повторе (LTR). 5' U3-область может быть заменена на другие вирусные промоторы. Пакующий сигнал Ψ облегчает инкапсидацию (включение в капсид) векторного генома в векторные частицы. Для выработки лентивирусных частиц необходимы дополнительные элементы, такие как элемент отклика rev (RRE) и центральный полипуриновый тракт (cPPT). Необязательное добавление пост-транскрипционного регуляторного элемента гепатита лесного сурка (wPRE) будет способствовать увеличению титра вектора и трансгенной экспрессии. Индуцируемый промотор (pInd) связан с областью, кодирующей цитотоксический белок. Второй конститутивный клеточный или вирусный промотор (pConst) связан с геном маркера селекции. Две единицы могут быть разделены последовательностью инсулятора (+/- инсулятор).
Фиг.8
Карта плазмиды лентивирусного вектора для экспрессии HSV tk под контролем промотора RANTES.
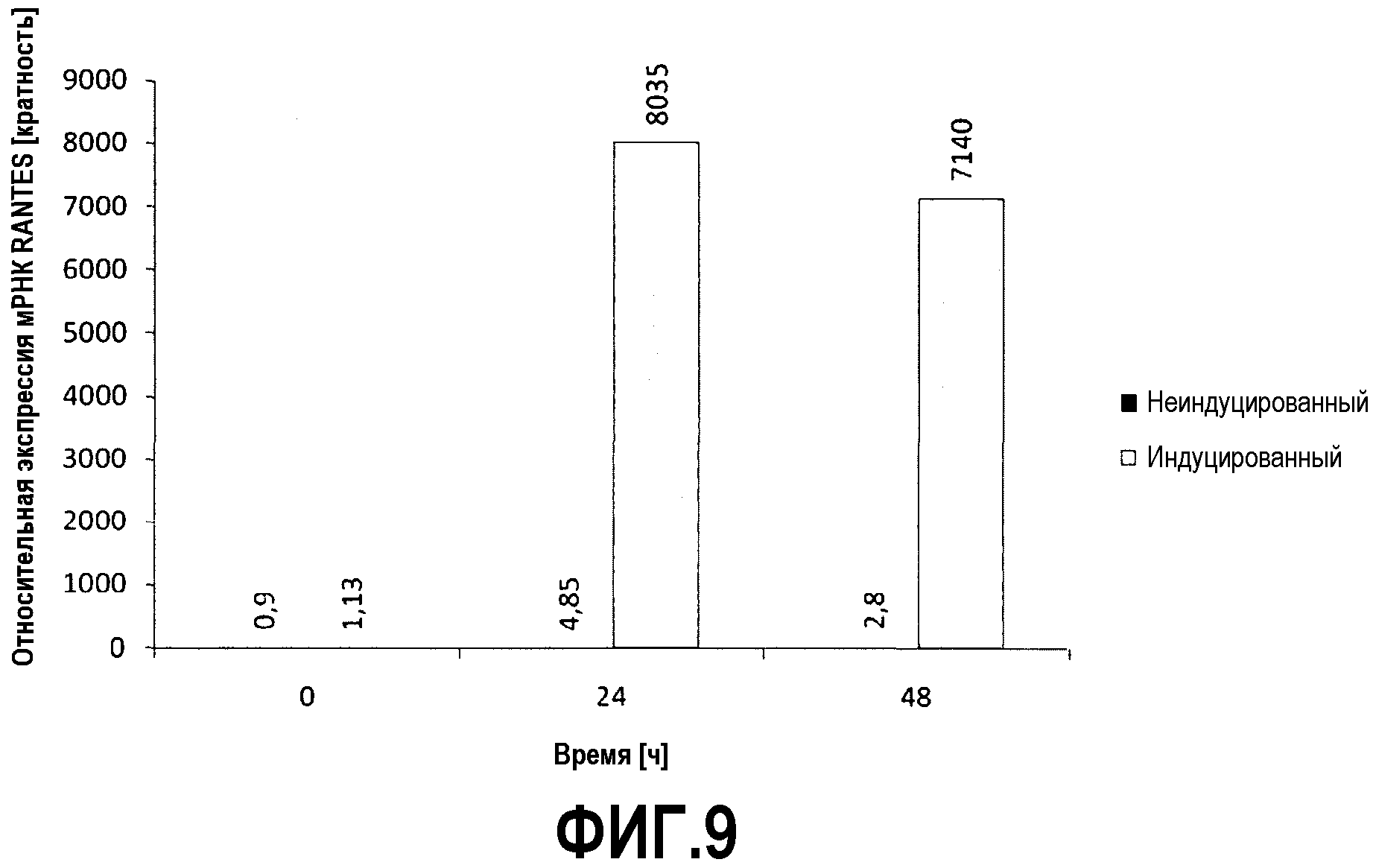
Фиг.9
Экспрессия мРНК RANTES после индукции MSC TNFα (10 нг/мл) и IFNγ (10 нг/мл). Относительные количества мРНК RANTES были рассчитаны с использованием метода ΔΔCT с 0h, неиндуцированным образцом в качестве значения нормализации. Показаны средние значения от двух биологических образцов.
Фиг.10
Обработка hMSC ганцикловиром приводит к специфической смерти клеток после индукции промотора RANTES с помощью TNFα и IFNγ. Представительная микроскопическая картина hMSC, которые не были обработаны (A), индуцированы с помощью TNFα и IFNγ (B), обработаны только ганцикловиром (C) или сначала индуцированы с помощью TNFα и IFNγ и затем обработаны ганцикловиром (D). 100× увеличение.
Подробное описание изобретения
Термины
В настоящей заявке используются некоторые термины, которые будут иметь значения, определенные следующим образом.
Как использовано в настоящем документе, клетка является "аллогенной" по отношению к индивиду, если она или любые из ее клеток-предшественников получены от еще одного индивида того же вида.
Как использовано в настоящем документе, клетка является "аутологической" по отношению к индивиду, если она или клетки-предшественники получены от того же индивида.
Как использовано в настоящем документе, "стволовая клетка CD34-" означает стволовую клетку с недостатком CD34 на ее поверхности. Стволовые клетки CD34- и способы их выделения описаны, например, в Lange C. et al., Accelerated and safe expansion of human mesenchymal stromal cells in animal serum-free medium for transplantation and regenerative medicine. J. Cell. Physiol. 2007, Apr. 25 [электронная публикация перед печатью].
Как использовано в настоящем документе, "цитотоксический белок" означает белок, который, если присутствует в, на и/или в близости от клетки, вызывает смерть этой клетки непосредственно и/или опосредованно. Цитотоксические белки включают, например, суицидные белки (например, HSV-tk) и индукторы апоптоза. Цитотоксические гены включают нулевые гены, siPHK или miPHK для выключения генов (например, CCR5-/-). Ряд систем суицидных генов был идентифицирован, включая ген тимидинкиназы вируса простого герпеса, ген цитозиндезаминазы, ген тимидинкиназы вируса varicella-zoster, ген нитроредуктазы, ген gpt Escherichia coli и ген Deo E. coli. Цитозиндезаминаза; Цитохром P450; Фосфорилаза пуриновых нуклеозидов; Карбоксипептидаза G2; Нитроредуктаза. Как подробно описано в: Yazawa K, Fisher WE, Brunicardi FC: Current progress in suicide gen therapy for cancer. World J Surg. 2002 Jul; 26(7):783-9. Цитотоксические факторы включают следующие: (i) факторы хоуминга, такие как хемокины и муцинхемокиновые гибриды GPI (средства, полученные из хемокинов, могут применяться для облегчения направленного рекрутинга сконструированных стволовых клеток, см., например, PCT Международная Заявка № PCT/EP2006/011508, касающаяся муциновых гибридов, закрепленных с GPI); (ii) вирусные антигены (корь, ветряная оспа) в качестве цитотоксических белков; и (iii) антигены Her2/neu, которые могут быть представлены на поверхностях сконструированных стволовых клеток, с последующим введением антител her-2/neu и CamPath® (Алемтузумаб), направленных против эпитопа CD52.
Как использовано в настоящем документе, нуклеиновая кислота является "экзогенной" по отношению к клетке, если она была искусственно внедрена в эту клетку или любые клетки-предшественники этой клетки.
Как использовано в настоящем документе, стволовая клетка является "генетически модифицированной", если либо она или любая из ее клеток-предшественников имеет нуклеиновую кислоту, искусственно в нее внедренную. Способы получения генетически модифицированных стволовых клеток включают применение вирусного или невирусного гена переноса (например, переноса плазмиды, интегразы фага, транспозонов, AdV, AAV и Лентивируса).
Как использовано в настоящем документе, "введение" стволовых клеток в кровоток индивида будет включать, без ограничения, введение таких клеток в одну из вен или артерий индивида посредством инъекции. Такое введение может также осуществляться, например, однократно, множество раз и/или в течение одного или более продленных периодов. Единственная инъекция является предпочтительной, но повторные инъекции в течение времени (например, ежедневно, каждые три дня, еженедельно, два раза в неделю, ежемесячно, ежеквартально, один раз в полгода или ежегодные) могут быть необходимыми в некоторых случаях. Такое введение также предпочтительно осуществляют с использованием смеси стволовых клеток и фармацевтически приемлемого носителя. Фармацевтически приемлемые носители являются хорошо известными специалистам в данной области и включают, но не ограничены ими, 0,01-0,1 M и предпочтительно 0,05 M фосфатный буфер или 0,8% физиологический раствор. Дополнительно, такие фармацевтически приемлемые носители могут представлять собой водные или неводные растворы, суспензии и эмульсии. Примеры неводных растворителей представляют собой пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло и инъицируемые органические сложные эфиры, такие как этилолеат. Водные носители включают воду, спиртовые/водные растворы, эмульсии и суспензии, включая физиологический раствор и забуференную среду. Парентеральные среды включают раствор хлорида натрия, декстрозу Рингера, декстрозу и хлорид натрия, раствор Рингера с лактатом и нелетучие масла. Внутривенные среды включают текучую среду и питательные компенсирующие добавки, электролитные компенсирующие добавки, такие как декстроза Рингера, которые основаны на декстрозе Рингера и т.п. Текучие среды, обычно используемые для внутривенного введения, можно найти, например, в Remington (34). Также могут присутствовать консерванты и другие добавки, такие как, например, антимикробные средства, антиоксиданты, хелатирующие средства, инертные газы и т.п.
"Мезенхимальные стволовые клетки" (также именуемые "MSC") могут служить источником соединительной ткани, костной ткани, хрящевой ткани и клеток в циркуляторной и лимфатической системах. Мезенхимальные стволовые клетки обнаружены в мезенхиме, части эмбриональной мезодермы, которая состоит из свободно упакованных, фузиформных или звездчатых неспециализированных клеток. Как использовано в настоящем документе, мезенхимальные стволовые клетки включают, без ограничения, стволовые клетки CD34-.
В одном из вариантов осуществления изобретения MSC представляют собой фибробластные, подобные прилипающим к пластику клеткам, определяемые как мультипотентные мезенхимальные стромальные клетки в Horwitz et al.49, а также включают клетки CD34-. Чтобы избежать сомнений, термин "мультипотентные мезенхимальные стромальные клетки" также включает субпопуляцию мезенхимальных стволовых клеток и их предшественников, причем эта субпопуляция составлена из плюрипотентных самообновляющихся клеток, способных к дифференциации в конкретные, множественные типы клеток in vivo.
Как использовано в настоящем документе, "миелоабляция" будет означать значительную или полную элиминацию клеток костного мозга, вызванную, например, введением высоких доз химиотерапии или лучевой терапии. Миелоабляция является стандартной процедурой и описана, например, у Deeg (33).
Как использовано в настоящем документе, "нуклеиновая кислота" будет означать любую молекулу нуклеиновой кислоты, включая, без ограничения, ДНК, РНК и их гибриды. Основания нуклеиновой кислоты, которые образуют молекулы нуклеиновой кислоты, могут представлять собой основания A, C, G, T и U, а также их производные. Производные этих оснований являются хорошо известными в данной области и приведены в качестве примеров в PCR Systems, Reagents and Consumables (Perkin Elmer Catalogue 1996-1997, Roche Molecular Systems, Inc., Branchburg, N.J., USA).
Как использовано в настоящем документе, область нуклеиновой кислоты, кодирующая цитотоксический белок, "функционально связана" с промотором или комбинацией промотор/энхансер, если такой промотор или комбинация промотор/энхансер вызывает экспрессию цитотоксического белка при соответствующих обстоятельствах.
Как использовано в настоящем документе, "полипептид" означает полимер из аминокислотных остатков. "Пептид" обычно означает более короткий полипептид (например, 10 аминокислотных остатков), и "белок", как правило, относится к более длинному полипептиду (например, 200 аминокислотных остатков). Аминокислотные остатки могут быть природными или их химическими аналогами. Полипептиды также могут включать модификации, такие как гликозилирование, присоединение липида, сульфатирование, гидроксилирование и АДФ-рибозилирование.
Как использовано в настоящем документе, в "близости от ткани" включает, например, в пределах 1 мм от ткани, в пределах 0,5 мм от ткани и в пределах 0,25 мм от ткани.
Термин промотор "RANTES" применяют в настоящем документе как синоним термина промотор "CCL5".
Как использовано в настоящем документе, цитотоксический белок "селективно экспрессируется", когда генетически модифицированная мезенхимальная стволовая клетка, кодирующая этот белок, подходит близко к стромальной ткани опухоли, если цитотоксический белок экспрессируется в этой среде, в большей степени, чем он экспрессируется в любой другой среде в индивиде. Предпочтительно, цитотоксический белок экспрессируется в этой среде, по меньшей мере, в 10 раз больше, чем он экспрессируется в любой другой среде в индивиде.
Как использовано в настоящем документе, "индивид" будет означать любое животное, такое как человек, нечеловеческий примат, мышь, крысу, морскую свинку или кролика.
Как использовано в настоящем документе, "лечение" индивида с нарушением будет означать замедление, прекращение или обращение развития нарушения. В предпочтительном варианте осуществления, лечение индивида с нарушением означает обращение развития нарушения, в идеальном варианте до состояния устранения самого нарушения. Как использовано в настоящем документе, облегчение состояния нарушения и лечение нарушения являются эквивалентными.
Как использовано в настоящем документе, "опухоль" включает, без ограничения, опухоль простаты, опухоль поджелудочной железы, плоскоклеточную карциному, опухоль молочной железы, меланому, базальноклеточную карциному, гепатоцеллюлярную карциному, рак яичка, нейробластому, глиому или злокачественную астроцитарную опухоль, такую как мультиформная глиобластома, колоректальную опухоль, карциному эндометрия, карциному легких, опухоль яичника, опухоль шейки матки, остеосаркому, рабдо/лейомиосаркому, синовиальную саркому, ангиосаркому, саркому Юинга/PNET и злокачественную лимфому. Эти опухоли включают первичные опухоли, а также метастатические опухоли (как васкуляризированные и неваскуляризированные).
Как использовано в настоящем документе, клетка является "ксеногенной" по отношению к индивиду, если она или любая из ее клеток-предшественников происходят от еще одного индивида из отличного вида.
Как использовано в настоящем документе, термин "стромальная ткань опухоли" включает соединительную, структурную ткань вокруг и в близости от опухоли, которая содержит разнообразные клетки, такие как фибробласты/миофибробласты, глиальные, эпителиальные, жировые, сосудистые, мягкой мускулатуры и иммунные клетки. Строма опухоли также предоставляет внеклеточный матрикс и внеклеточные молекулы53.
Как использован в настоящем документе, термин "воспалительные медиаторы" включает иммунные модуляторные молекулы, которые действуют на участке повреждения ткани и роста опухоли, и опосредует про- и антивоспалительный ответ на повреждение ткани и рост опухоли. Неограничивающими примерами воспалительных медиаторов являются цитокины и эйкозаноиды. Известно, что опухолевые клетки и окружающие стромальные клетки вырабатывают многочисленные провоспалительные медиаторы, такие как провоспалительные цитокины и протеазы, которые координируют воспалительные реакции. Примерами таких медиаторов являются TNF-альфа и IL-6. Дополнительно, опухолевые клетки и стромальные клетки способны подавлять иммунные ответы посредством секреции противовоспалительных молекул, таких как TGF-бета, IL-I0 и M-CSF, которые, например, ингибируют созревание дендритных клеток54.
Варианты осуществления изобретения
Настоящее изобретение относится к способу лечения индивида, пораженного опухолью, предусматривающему введение в кровоток индивида терапевтически эффективного числа генетически модифицированных мезенхимальных стволовых клеток, где каждая генетически модифицированная мезенхимальная стволовая клетка содержит экзогенную нуклеиновую кислоту, содержащую (i) область, кодирующую цитотоксический белок, функционально связанную с (ii) промотором или комбинацией промотор/энхансер, посредством чего цитотоксический белок селективно экспрессируется, когда генетически модифицированные мезенхимальные стволовые клетки приближаются к стромальной ткани опухоли.
Индивид, подвергаемый лечению, может являться любым животным и, предпочтительно, является человеком. Опухоль, подвергаемая лечению, может быть первичной или метастатической и может быть васкуляризированной или неваскуляризированной. Предпочтительно, опухоль является метастатической и неваскуляризированной. Опухоль может представлять собой, например, опухоль простаты, опухоль молочной железы, опухоль поджелудочной железы, плоскоклеточную карциному, опухоль молочной железы, меланому, базальноклеточную карциному, гепатоцеллюлярную карциному, рак яичка, нейробластому, глиому или злокачественную астроцитарную опухоль, такую как мультиформная глиобластома, колоректальную опухоль, карциному эндометрия, карциному легких, опухоль яичника, опухоль шейки матки, остеосаркому, рабдо/лейомиосаркому, синовиальную саркому, ангиосаркому, саркому Юинга/PNET и злокачественную лимфому. Предпочтительно, опухоль является опухолью поджелудочной железы. В еще одном предпочтительном варианте осуществления, стромальная ткань опухоли, подлежащей лечению, содержит фибробластоподобные клетки.
Мезенхимальные стволовые клетки могут быть выделены из разнообразных источников, например костного мозга, крови пуповины, (мобилизованной) периферической крови и жировой ткани49. В дополнительном предпочтительном варианте осуществления генетически модифицированные мезенхимальные стволовые клетки представляют собой стволовые клетки CD34-. Дополнительно, генетически модифицированные мезенхимальные стволовые клетки могут быть аллогенными, аутологическими или ксеногенными по отношению к индивиду. В способах настоящего изобретения с использованием генетически модифицированных стволовых клеток экзогенные гены экспрессируются, т.е. "включаются", если стволовые клетки (i) приближаются к соответствующим клеткам в мишеневые ткани, (ii) дифференцируют, и/или (iii) сливаются с соответствующими клетками в мишеневой ткани.
В настоящем изобретении введение генетически модифицированных мезенхимальных стволовых клеток предпочтительно не следует за, сопровождается или осуществляется перед миелоабляцией.
Еще один вариант осуществления изобретения предоставляет мезенхимальные или CD34- стволовые клетки для применения в любом из способов лечения индивида, пораженного опухолью. В частности, мезенхимальные или CD34- стволовые клетки могут включать промотор или комбинацию промотор/энхансер, которые являются индуцируемыми воспалительными медиаторами и которые контролируют транскрипцию области, кодирующей цитотоксический белок. Эти воспалительные медиаторы могут высвобождаться стромальной тканью опухоли таким образом, что экспрессия цитотоксического белка в мезенхимальных стволовых клетках индуцируется, когда стволовые клетки приближаются к стромальной ткани опухоли. Воспалительные медиаторы могут, например, представлять собой цитокины, такие как TNFα или IFNγ. В частности, промотор может представлять собой промотор RANTES, который среди прочих может индуцироваться TNFα или IFNγ35. Промотор RANTES также может индуцироваться дифференцирующими сигналами в контексте дифференциации MSC. Дополнительные примеры промоторов, которые являются индуцируемыми провоспалительными медиаторами, представляют собой NF-kB-чувствительный элемент36 и, в целом, промоторы, которые могут индуцироваться IL1β или TNFα37.
Дополнительно, промоторы, активируемые противовоспалительными медиаторами (например, TGF-бета), могут использоваться для достижения мишеневой экспрессии цитотоксического белка в мезенхимальных стволовых клетках. Примерами являются промоторы, которые содержат Smad-связывающие элементы55.
Применение промоторов, которые являются индуцируемыми воспалительными медиаторами, позволяет осуществить селективное лечение опухолей, которые еще не претерпели ангиогенез.
Стволовые клетки, используемые в любом из терапевтических способов изобретения, могут дополнительно содержать (iii) ген маркера селекции функционально связанный с (iv) конститутивным промотором или комбинацией промотор/энхансер. Ген маркера селекции может содержать ген резистентности к антибиотикам, такой как ген, придающий резистентность к Пуромицину, Неомицину или Уабаину38. Гены резистентности к антибиотикам могут применяться для осуществления выбора генетически модифицированных мезенхимальных стволовых клеток в присутствии антибиотика и для подавления немодифицированных мезенхимальных стволовых клеток, которые не должны использоваться при лечении опухолей вследствие их активирующего опухоль потенциала. Дополнительно или в качестве альтернативы для гена резистентности к антибиотикам, может применяться ген, кодирующий белок маркера клеточной поверхности, который экспрессируется на поверхности только генетически модифицированных мезенхимальных стволовых клеток. Неограничивающие примеры белков маркера клеточной поверхности представляют собой сплайс-варианты CD34 и CD2439-40. Магнитные шарики, зацепляющие специфичные антитела, распознающие белки маркеров клеточной поверхности, могут применяться для селекции генетически модифицированных мезенхимальных стволовых клеток41.
Конститутивный промотор, контролирующий транскрипцию гена маркера селекции, может представлять собой разнообразие различных промоторов, таких как pCAG42, EF1α43, PGK42, CMV и SFFV42.
В дополнение, стволовые клетки в соответствии с разнообразными вариантами осуществления изобретения могут содержать (v) последовательность инсулятора, расположенную между областью, кодирующей цитотоксический белок, и геном маркера селекции. Последовательность инсулятора может гарантировать, что конститутивный промотор гена маркера селекции не оказывает влияния и "включает" транскрипцию области, кодирующей цитотоксический белок, в отсутствие любых воспалительных медиаторов44.
Предпочтительно, область, кодирующую цитотоксический белок, функционально связанную с промотором или комбинацией промотор/энхансер, а также ген маркера селекции, функционально связанный с конститутивным промотором или комбинацией промотор/энхансер, встраивают в геном стволовой клетки. Это позволяет обеспечить выработку генетически модифицированных мезенхимальных стволовых клеток, которые являются более устойчивыми, чем генетически модифицированные стволовые клетки, зацепляющие экстрахромосомный вектор.
В дополнительном варианте осуществления изобретения генетически модифицированные стволовые клетки дополнительно содержат провирусную последовательность, встроенную в геном стволовой клетки, где область, кодирующую цитотоксический белок, функционально связанную с промотором или комбинацией промотор/энхансер, и ген маркера селекции, функционально связанный с конститутивным промотором или комбинацией промотор/энхансер, являются частью провирусной последовательности. В частности, вирусы из семейства Retroviridae могут применяться для устойчивой генетической модификации мезенхимальных стволовых клеток. Примерами ретровирусов являются лентивирусы, альфа-ретровирусы или гамма-ретровирусы.
Ниже будут описаны ретровирусные векторы, включающие трансгенную кассету, имеющую две функциональные единицы (Фиг. 6). Две функциональные единицы представляют собой:
1. Селекция in vitro: конститутивный промотор (например, CAG-промотор) клеточного или вирусного происхождения, связанный с геном маркера селекции, таким как ген резистентности к антибиотикам (например, ген резистентности к пуромицину), или геном маркера клеточной поверхности, пригодным для разделения с помощью магнитных шариков (например, CD34).
2. Уничтожение окружающих: Индуцируемый опухоль-специфичный промотор клеточного или вирусного происхождения (например, промотор RANTES), связанный с областью, кодирующей цитотоксический белок (например, кодирующей Тимидинкиназу вируса простого герпеса).
Необязательно, функциональные единицы могут быть разделены последовательностью инсулятора для предотвращения промоторного взаимодействия между двумя промоторами.
Описанная выше трансгенная кассета будет встраиваться в разнообразные вирусные и невирусные векторные системы для доставки и устойчивой экспрессии в MSC, такие как вирусные векторные системы, полученные из ретровирусов.
Ретровирусные векторы для генетической модификации MSC будут получены из альфа-, гамма-ретровирусов или (человеческих и нечеловеческих) лентивирусов. Ретровирусные векторные системы включают остов вектора переноса, который несет трансген, представляющий интерес, т.e. область, кодирующую цитотоксический белок, и все элементы последовательности, необходимые для обратной транскрипции и встраивания векторной ДНК, но он лишен большей части или всех вирусных генов, таких как gag- pol- и env-гены. Новейшее поколение ретровирусных векторов будет нести особые модификации для безопасности: в этих так называемых самоинактивирующихся (SIN) векторах 3' U3-область частично или полностью удалена, для выключения активности вирусного промотора и для предотвращения трансактивации соседствующих генов в геноме клетки-хозяина. Для выработки векторных частиц необходимо переменное число хелперных плазмид, которые обеспечивают структурные белки, ферментные и оболочечные белки in trans50. Вирусные частицы могут быть получены как несущие чужеродные оболочечные гликопротеины. Этот процесс называется псевдотипирование. Он позволяет осуществить изменение тропизма векторных частиц и в некоторых случаях усиливает векторный титр.
Описанная выше трансгенная кассета будет внедрена в остов SIN-ретровирусного вектора с использованием стандартных методов молекулярной биологии и вырабатывать вирусные частицы в соответствии со стандартными способами50.
Фиг.7 дает примерное общее представление об альфа- и гамма-ретровирусных и лентивирусных векторных конструкциях, которые будут нести упомянутый трансген, изображенный на Фиг.6.
Планируется псевдотипировать векторные частицы гликопротеином вируса лимфоцитарного хориоменингита (LCMV GP), вируса везикулярного стоматита (VSV-g), RD114-TR или вируса лейкоза гиббонов (GALV env).
Еще одним альтернативным способом генетической модификации мезенхимальных стволовых клеток является химическая (например, Липофектамин) или физическая (например, электропорация) трансфекция. Затем трансфицированные клетки могут быть подвергнуты селекции, как описано выше, для выбора устойчиво трансфицированных MSC, где трансгенная кассета встраивается случайным образом в геном мезенхимальной стволовой клетки.
Еще одна альтернатива для генетической модификации MSC состоит в использовании невирусной векторной системы, полученной из транспозонов. После фланкирования описанной выше кассеты экспрессии терминальными инвертированными повторами конструкция может быть перенесена в MSC посредством трансфекции. Если Транспозаза, такая как Sleeping Beauty51 или Piggybac52, экспрессируется in trans во время трансфекции, кассета экспрессии будет устойчиво встроена в геном MSC.
Генетически модифицированные мезенхимальные стволовые клетки в соответствии с некоторыми вариантами осуществления изобретения могут быть получены посредством трансдукции нативных мезенхимальных стволовых клеток псевдотипированными вирионами, экспрессирующими чужеродные гликопротеины на их поверхности, которые изменяют тропизм и часто титр вириона.
Псевдотипированные вирионы могут генерироваться с помощью ретровирусных пакующих клеток, содержащих:
- ретровирусный вектор, включающий (i) область, кодирующую цитотоксический белок, функционально связанную с (ii) промотором или комбинацией промотор/энхансер, индуцируемыми воспалительными медиаторами, и
- ген, кодирующий белок поверхности вируса, обеспечивающий тропизм для мезенхимальных или CD34- стволовых клеток.
Дополнительно, ретровирусная пакующая клетка также содержит гены, кодирующие структурные белки и ферменты, для выработки псевдотипированных вирионов из пакующей клетки, таких как gag-, pol- и env-гены, которые позволяют осуществить сборку псевдотипированных вирионов.
Предпочтительно, эти гены, кодирующие структурные белки и ферменты, расположены на векторе, отличном от гена, кодирующего белок поверхности вируса, обеспечивающий тропизм для мезенхимальных или CD34- стволовых клеток, чтобы вырабатывать вирионы, которые являются инфекционными, но не способными к репликации. Эти псевдотипированные вирионы закрепляют область, кодирующую цитотоксический белок, функционально связанную с (ii) промотором или комбинацией промотор/энхансер, и экспрессируют белок поверхности вируса. Обычно супернатант ретровирусных пакующих клеток, содержащих псевдотипированные вирионы, будет применяться для трансдукции мезенхимальных стволовых клеток.
Ген, кодирующий белок поверхности вируса, обеспечивающий тропизм для мезенхимальных или CD34- стволовых клеток (псевдотипирование), может иметь большое разнообразие гликопротеинов, придающих тропизм к широкому ряду хозяев, таких как вирус лимфоцитарного хориоменингита (LCMV GP)45, вирус везикулярного стоматита (VSV-g)45, RD114-TR46 или вирус лейкоза гиббонов (GALV env)47.
Как уже упоминалось выше, промотор или комбинация промотор/энхансер могут быть индуцируемыми цитокинами или другими воспалительными медиаторами. В предпочтительном варианте осуществления промотор представляет собой промотор RANTES. Ретровирусная пакующая клетка может также включать дополнительные гены и промоторы.
В еще одном конкретном варианте осуществления изобретения цитотоксический белок в идеальном варианте представляет собой вирусную тимидинкиназу простого герпеса, и индивида в идеальном варианте лечат ганцикловиром способом, позволяющим вирусной тимидинкиназе простого герпеса придавать ганцикловиру цитотоксические свойства. Ганцикловир и способы его применения хорошо известны в данной области. Еще одной возможностью является применение цитозиндезаминазы в качестве цитотоксического белка, который преобразует 5-фторцитозин в токсическое соединение 5-фторурацил48.
В настоящем изобретении терапевтически эффективное число генетически модифицированных мезенхимальных стволовых клеток включает, без ограничения, следующие количества и интервалы количеств: (i) от приблизительно 1×105 до приблизительно 1×109 клеток/кг массы тела; (ii) от приблизительно 1×106 до приблизительно 1×108 клеток/кг массы тела; (iii) от приблизительно 5×106 до приблизительно 2×107 клеток/кг массы тела; (iv) от приблизительно 5×106 до приблизительно 1×107 клеток/кг массы тела; (v) от приблизительно 1×107 до приблизительно 2×107 клеток/кг массы тела; (vi) от приблизительно 7×106 до приблизительно 9×106 клеток/кг массы тела; (vii) приблизительно 1×105 клеток/кг массы тела; (viii) приблизительно 1×106 клеток/кг массы тела; (ix) приблизительно 5×106 клеток/кг массы тела; (x) приблизительно 1×107 клеток/кг массы тела; (xi) приблизительно 6×106 клеток/кг массы тела; (xii) приблизительно 7×106 клеток/кг массы тела; (xiii) приблизительно 8×106 клеток/кг массы тела; и (ix) приблизительно 9×106 клеток/кг массы тела. Предусмотренные значения массы тела человека включают, без ограничения, приблизительно 50 кг, приблизительно 60 кг; приблизительно 70 кг; приблизительно 80 кг, приблизительно 90 кг; и приблизительно 100 кг. Эти числа основаны на доклинических экспериментах на животных и стандартных протоколах пересадки MSC.
Настоящее изобретение также относится к способу лечения человека, пораженного опухолью поджелудочной железы, предусматривающему введение в кровоток индивида от приблизительно 5×106 до приблизительно 2×107 клеток/кг массы тела генетически модифицированных стволовых клеток CD34-, где (a) каждая генетически модифицированная стволовая клетка CD34- содержит экзогенную нуклеиновую кислоту, содержащую (i) область, кодирующую вирусную тимидинкиназу простого герпеса, функционально связанную с (ii) промотором RANTES, (b) индивида лечат ганцикловиром по способу, позволяющему вирусной тимидинкиназе простого герпеса придавать ганцикловиру цитотоксические свойства, и (c) введение генетически модифицированных мезенхимальных стволовых клеток не следует за, сопровождается или осуществляется перед миелоабляцией. В данном способе опухоль предпочтительно является метастатической и может быть васкуляризированной или нет. Дополнительно, генетически модифицированные мезенхимальные стволовые клетки может являться аллогенными, аутологическими или ксеногенными по отношению к индивиду.
Настоящее изобретение дополнительно относится к генетически модифицированной мезенхимальной стволовой клетке, содержащей экзогенную нуклеиновую кислоту, содержащую (i) область, кодирующую цитотоксический белок, функционально связанную с (ii) промотором или комбинацией промотор/энхансер, посредством чего цитотоксический белок селективно экспрессируется, когда генетически модифицированная мезенхимальная стволовая клетка подходит близко к стромальной ткани опухоли. Предпочтительно, мезенхимальная стволовая клетка является человеческой стволовой клеткой CD34-. Также предпочтительной является экзогенная нуклеиновая кислота, содержащая промотор RANTES, где цитотоксический белок представляет собой вирусную тимидинкиназу простого герпеса.
Наконец, настоящее изобретение относится к генетически модифицированной человеческой стволовой клетке CD34-, содержащей экзогенную нуклеиновую кислоту, содержащую (i) область, кодирующую вирусную тимидинкиназу простого герпеса, функционально связанную с (ii) промотором RANTES.
Разнообразные белки и регуляторные последовательности, используемые в настоящем изобретении, могут быть легко получены специалистом в данной области. Например, промотор RANTES раскрыт в (22) и может быть получен с применением обычной квалификации. Ген герпеса HSV TK - V00467 может применяться для тимидинкиназы (АТФ: тимидин 5' фосфотрансфераза, e.c. 2.7.1.21) (тип 1 штамм CL101).
Настоящее изобретение будет более понятным при обращении к Экспериментальным подробностям, которые приведены ниже, но квалифицированные специалисты в области смогут легко осознать, что конкретные детализированные эксперименты являются только иллюстративными для изобретения, как описано более полно в формуле изобретения, следующей за этим разделом.
Экспериментальные подробности
Аннотация
Цель: Проанализировать эффективность действия терапии, основанной на сконструированных мезенхимальных стволовых клетках, направленной против стромы опухоли поджелудочной железы.
Краткое изложение данных предшествующего уровня: Мезенхимальные стволовые клетки (MSC) активно мобилизуются в строму опухоли, где они усиливают рост опухоли и метастазы. Показано, что повышенная регуляция хемотаксического цитокина CCL5 посредством MSC в строме опухоли играет главную роль в этом процессе. Мышиные MSC были сконструированы для экспрессии репортерных генов или терапевтических генов под контролем промотора CCL5 и адоптивно перенесены в мышей с растущими опухолями поджелудочной железы. Затем оценивали воздействие на рост опухоли и метастазы.
Методы: MSC, выделенные из костного мозга C57/Bl6 p53(-/-) мышей, устойчиво трансфицировали Красным флуоресцентным белком (RFP), усиленным Зеленым флуоресцениным белком (eGFP) или геном тимидинкиназы (tk) вируса простого герпеса (HSV), управляемым промотором RANTES. MSC вводили внутривенно один раз в неделю в течение 3 недель мышам, несущим ортотопическую, изогенную опухоль поджелудочной железы Panc02.
Результаты: Сигналы eGFP и RFP, управляемые промотором CCL5, обнаруживали по флуоресценции в образцах опухолей поджелудочной железы, подвернутых лечению. Лечение группы HSV-tk, подвергнутой лечению внутрибрюшинно пролекарством ганцикловир (GCV), через 5-7 дней после применения стволовых клеток, приводило к 50% снижению роста первичной опухоли поджелудочной железы (p<0,0003, t-тест Стьюдента) и уменьшенным метастазам в печени (30% по сравнению с 100%).
Выводы: Активный хоуминг MSC в строму первичной опухоли поджелудочной железы и активация промотора RANTES подтверждались с использованием eGFP- и RFP-репортерных генов. В присутствии ганцикловира HSV-tk-трансфицированные MSC приводили к значительному снижению роста первичной опухоли поджелудочной железы и распространению метастазов.
Материалы и Методы
Мезенхимальные стволовые клетки
Мезенхимальные стволовые клетки выделяли из костного мозга мышей C57BL/6, гомозиготных для направленной делеции p53, как описано.15 Клетки выросли с прилипанием и непрерывно в культуре клеток. После субклонирования единичные клоны клеток подвергали селекции и характеризовали.15 Клетки трансфицировали красным флуоресцентным белком (RFP), зеленым флуоресцентным белком (eGFP) или тимидинкиназой HSV, связанной с промотором CCL5. Последовательность промотора использовала -972 восходящей области и полную 5' нетранслированную область.18 В дополнение, все векторы содержали CMV-контролируемый ген резистентности к Бластицидину Bsr2. Бластицидин применяли для селекции трансфицированных клеток при концентрации, равной 5 мкг/мл. Перед инъекцией мышам клетки отделяли от колб для культивирования, промывали дважды PBS и ресуспендировали в PBS.
Модифицированный анализ с камерой Бойдена
Направленную миграцию MSC in vitro осуществляли с использованием модифицированного анализа с камерой Бойдена.15 Стволовые клетки мигрировали против снижающихся концентраций супернатанта сингенных клеток карциномы поджелудочной железы Panc02.
Модель ортотопической карциномы поджелудочной железы
Мышей C57BL6 получали от Jackson Labs. Все эксперименты на животных проводили при соответствующем разрешении от комиссии по правам животных земли Бавария. Мышей C57BL/6 в возрасте от двух месяцев до трех месяцев со средней массой, равной приблизительно 20 г, применяли для имплантации Panc02 (сингенных с мышами C57BL/6) опухоли поджелудочной железы.19 Мышей подвергали анестезии, используя Кетамин (l00 мг на кг массы тела), Ксилазин (5 мг на кг массы тела) и Атропин. Участок операции на левой стороне паховой области мышей выбривали и подготавливали стерильным образом. При разрезе в 1 см на левой стороне паховой области поджелудочную железу экспонировали. Калиброванное кнопочное устройство (Hamilton Syringe Company, USA) и шприц 1 мл с иглой 30 G (оба от BD Biosciences, Spain) применяли для инъекции 150000 клеток рака поджелудочной железы Panc02 в 40 мкл раствора PBS в поджелудочную железу. Были предприняты меры для гарантии того, что никакие клетки рака поджелудочной железы не были диссеминированы в брюшной полости. С этой целью Q-наконечник слегка надавливали на участок инъекции в течение одной минуты после того, как иглу вынимали из поджелудочной железы. После инъекции опухолевых клеток брюшную полость и кожу закрывали перемежающимися швами 4-0 пролена (Braun AG, Germany). Через две недели после процедуры у всех мышей вырастали пальпируемые опухоли, и их статистически распределяли в соответствующие экспериментальные группы. Группа А не получала стволовых клеток или инъекций Ганцикловира, группа B получала немодифицированные стволовые клетки, группа C получала C57BL/6 p53-/- CCL5/HSV-tk+ мезенхимальные стволовые клетки и инъекции GCV, группа D получала C57BL/6 p53-/- CCL5/RFP+ мезенхимальные стволовые клетки, и группа E получала C57BL/6 p53-/- CCL5/eGFP мезенхимальные стволовые клетки. Все инъекции стволовых клеток дозировали при 0,5×106 клеток в неделю и вводили через хвостовую вену. Инъекции GCV (Cymeven®, Roche, Germany) группы C осуществляли при дозе, равной 1,5 мг, и проводили внутрибрюшинно в дни 5-7 после инъекций стволовых клеток. Всех мышей умерщвляли через три цикла лечения, и опухоли выделяли и взвешивали. Тестирования для статистической значимости достигали с помощью непарного двухстороннего t-теста для независимых образцов.
Флуоресцентная микроскопия
Образцы тканей опухолей поджелудочной железы погружали в Tissue-Tek O. C. T. (Miles Inc. USA) и быстро замораживали в жидком азоте. Получали криосрезы толщиной 5 мкм. Раствор для окрашивания ядер DAPI (Vectashield "Hard set mounting medium with Dapi", USA) добавляли к срезам и их немедленно оценивали на предмет сигналов флуоресценции от GFP или RFP. Фотоснимки получали с использованием камеры микроскопа AxioCam MR и картины от различных флуоресцентных каналов накладывали, используя программное обеспечение Photoshop® (Adobe, USA).
Инъекция MSC и лечение Ганцикловиром
Перед инъекцией клетки считали и разбавляли до конечной концентрации, равной 1×106 клеток/мл PBS. Ганцикловир (GCV) (Cymeven; Roche) растворяли в H2O (вода для инъекций) до концентрации, равной 10 мг/мл. Суспензии клеток вводили иглой 26 G через хвостовую вену, лекарственные средства посредством внутрибрюшинных инъекций. Лечение было начато в день 1, инъекцией 0,5 мл клеток (500000 клеток). В дни 5-7 применяли Ганцикловир при суточной дозе, равной 60 мкг/г МТ, например 150 мкл для мыши с МТ, равной 25 г. После дня 7 циклы лечения повторяли до препарирования. Во время лечения развитие опухоли и поведение регистрировали.
Препарат ткани и опухоли
После диссекции все опухоли препарировали раздельно. Одну треть каждой опухоли фиксировали в формальдегиде и погружали в парафиновый воск, в то время как дополнительную треть быстро замораживали. Последнюю треть сохраняли в растворе RNAlater (Ambion) в соответствии с инструкциями производителя для более позднего выделения РНК и планового анализа qRT-ПЦР.
Иммуногистохимия
Иммуногистохимию осуществляли на срезах 5 мкм, как описано ранее.20 В качестве первичных антител поликлональные кроличьи антитела против-RFP (MbI Medical and Biological Laboratories, Japan) разбавляли 1:50 в блокирующем растворе (молоко+суперблок). В качестве вторичных антител поликлональные биотинилированные козьи против-кроличьих (Linaris, Wertheim-Bettingen, Germany) антитела разбавляли 1: 300 в молоке.
Результаты
Рекрутинг MSC в опухолях поджелудочной железы
Изогенные, ортотопические мышиные опухоли поджелудочной железы прежде устанавливали в основе мыши C57Bl/6.31,32 Опухолевые клетки, имплантированные под капсулу поджелудочной железы, выросли и показали глубокую опухолевую сосудистую сеть (Фиг.1). CD34- MSC, выделенные из костного мозга P53(-/-), применяли для оценки эффективности сконструированных MSC для направленного действия на строму опухоли.15,16,21
Чтобы сначала оценить общий тропизм MSC для опухоли Panc02, применяли модифицированные анализы с камерой Бойдена для исследования индуцированной миграции C57Bl6 MSC в сторону опухолевых факторов. Результаты показывают дозозависимую миграцию MSC в ответ на возрастающие уровни кондиционированной среды для роста опухоли (Фиг.2).
Клетки затем сконструировали с плазмидой, содержащей зеленый флуоресцентный белок (GFP), под контролем промотора CMV. Один раз в неделю 500000 клеток внутривенно вводили посредством инъекции мышам с растущими опухолями поджелудочной железы. Через пять недель мышей умерщвляли, и опухоли удаляли и анализировали на экспрессию GFP. Результаты показывают сильную экспрессию GFP, ассоциированную с опухолью (Фиг.3A). Было также обнаружено, что клетки мигрируют во вторичные селезенку, лимфатические узлы, тимус, кожу и желудок (данные не показаны и (15)). Это демонстрирует хоуминг системно вводимых инъекционно стволовых клеток к растущей опухоли. Внутривенная инъекция MSC в мышей C57Bl6 с растущими опухолями поджелудочной железы также приводила в результате к значительному увеличению роста опухоли (Фиг.3B).
Эффект применяемых внутривенно MSC на метастазы в печени, селезенке и брюшной полости также оценивали. Было обнаружено, что MSC значительно увеличивают метастазы в брюшной полости (Таблица 1).
Промотор CCL5 управляет экспрессией репортерного гена в строме опухоли
Авторы изобретения далее исследовали возможность управления более контролируемой экспрессией репортерных генов в контексте рекрутинга MSC к строме опухоли с использованием промотора CCL5. С этой целью линия клеток P53(-/-) MSC C57/Bl6 была сконструирована с репортерными генами RFP и eGFP под контролем промотора CCL518,22. Промотор CCL5 является активным в разнообразных типах тканей в целом в контексте тканевого стресса или повреждения.23-27 Немедленные -972 восходящие нуклеотиды и полная 5' нетранслированная область для начала трансляции были клонированы с увеличением eGFP или RFP в векторе.
Полученные в результате устойчиво сконструированные MSC с CCL5-eGFP или RFP показали низкие, но обнаруживаемые уровни экспрессии репортера через FACS (данные не показаны). Клетки (500000) затем вводили посредством инъекции в периферическое кровообращение мышей с растущими опухолями поджелудочной железы каждые восемь дней в течение 21 дня.
Через три недели мышей умерщвляли и опухоль и окружающую ткань анализировали на предмет экспрессии гена репортера RFP и eGFP посредством флуоресцентной микроскопии и иммуногистохимии. Результаты показали экспрессию RFP и GFP по их флуоресценции в растущей опухоли (Фиг.4A и B). Для исследования экспрессии RFP в образцах ткани с лучшей морфологией образцы, фиксированные в формальдегиде, тестировали на предмет экспрессии белка RFP посредством иммуногистохимии. MSC, экспрессирующие RFP, были обнаружены во всей строме опухоли (Фиг.4C, D и E).
Применение HSV-tk в качестве терапевтической модальности в сконструированных MSC
На следующей фазе эксперимента исследовали доставку терапевтических генов с использованием промотора CCL5. С этой целью ген тимидинкиназы простого герпеса (HSV-Tk)28 клонировали сзади промотора CCL5 (Фиг.5A).
После инъекции 0,5×106 CCL5-tk сконструированных MSC клеткам давали три дня для прохождения рекрутинга к растущей строме опухоли, прохождения дифференциации и последующей экспрессии гена tk. Мыши затем получали курс лечения, состоящий из однократных ежедневных внутрибрюшинных инъекций 1,5 мг GVC в течение трех дней. Мышам повторно вводили инъекцию сконструированных стволовых клеток и цикл повторяли в течение продолжительности эксперимента (Фиг.5B). Через 36 дней животных умерщвляли и оценивали рост опухоли (Фиг.5C и D) . Результаты показали значительное снижение объема опухоли в группе мышей, которая получала терапевтические CCL5/HSV-Tk конструкции стволовых клеток с GCV в сравнении с контрольными животными с опухолями, которые не получали лечения или получали контрольные MSC (CCL5-RFP MSC и CCL5-eGFP MSC). Фиг.5C показывает представительные опухоли, удаленные по окончании эксперимента. Массы опухолей показывают статистически значимое снижение массы опухоли по сравнению с не прошедшими лечение или прошедшими лечение контрольными животными.
В качестве дополнительного параметра, печень, селезенку и брюшную полость анализировали на предмет метастазов в контексте лечения. В то время как введение MSC увеличивало число метастазов в брюшной полости, лечение GCV приводило к значительному снижению метастазов в селезенке и печени (двусторонний точный тест Фишера) (Таблица 2). Метастазы оценивали посредством инспекции селезенки, печени и брюшной полости на месте и пальпации соответствующих органов.
Обсуждение
Мезенхимальные стволовые клетки активно рекрутировались к строме опухоли, где они вносят вклад в разнообразные аспекты роста опухоли. MSC могут функционировать в качестве клеток-предшественников для сосудов опухоли, а также, по-видимому, вносят вклад в генерацию стромальных-фибробластоподобных клеток. Конкретное влияние опухоль-ассоциированных стромальных клеток на рост опухоли и на потенциал к метастазированию является предметом настоящего исследования. В доклинических исследованиях модели карциномы молочной железы было показано, что мезенхимальные стволовые клетки (MSC) в строме опухоли вырабатывают повышенные уровни цитокина CCL5. Секреция CCL5 приводит к более высокому распространению метастазов в легких.
Секреция CCL5 также дифференцированно регулируется в периацинарных миофибробластах поджелудочной железы, что предполагает участие этих клеток в опосредовании инфильтрации и аккумуляции воспалительных клеток в поджелудочной железе.29 Среди пациентов с раком поджелудочной железы панкреатит в значительной степени ассоциирован с полиморфизмом промотора CCL5.30 Работа, описанная в настоящем документе, оценивает применение сконструированных MSC в качестве терапевтической среды для селективной доставки суицидного гена в контексте влияния стромы опухоли на рост первичной опухоли, а также метастазы.
MSC были сконструированы для экспрессии тимидинкиназы (TK) вируса простого герпеса (HSV) под контролем промотора CCL5 для тканеспецифичной экспрессии. MSC трансфицировали, используя тимидинкиназу (tk) вируса простого герпеса и под контролем промотора CCL5 для более тканеспецифичной экспрессии гена. Tk фосфорилирует ганцикловир (GCV), генерируя токсин, который убивает трансфицированные клетки и близлежащие опухолевые клетки посредством эффекта свидетеля. HSV-TK генная терапия ганцикловиром образует базис для широко применяемой стратегии для суицидной генной терапии.17
Поскольку солидные опухоли проявляют сильное воздействие на хоуминг циркулирующих предшественников, окружение опухоли эффективно достигается с использованием этого подхода. Это направленное действие среды стволовых клеток в дополнение к тканеспецифичной генной экспрессии, управляемой промотором CCL5 суицидного гена, приводит как к высокой эффективности действия, так и низкому профилю побочных эффектов. Кроме того, MSC, полученные из костного мозга, могут быть получены от самих раковых пациентов. Это может обеспечить специфичную доставку суицидных генов посредством простого внутривенного введения без необходимости в проведении миелоабляции и пересадки костного мозга.
Стратегии лечения рака поджелудочной железы, основанные на доклинических исследованиях, не преуспели в значительном расширении выживаемости пациентов. Во время постановки диагноза только 20% пациентов, страдающих от рака поджелудочной железы, представленного локализованным заболеванием, подлежат хирургическому лечению. Сорок процентов пациентов представлены с местно прогрессирующим (и, следовательно, нерезектабельным) заболеванием, и еще 40% уже страдают от удаленных метастазов. Модель опухоли поджелудочной железы продемонстрировала, что MSC играют важную роль при карциноме поджелудочной железы. Клетки активно ищут опухоль, как иллюстрируется посредством исследований миграции, а также системными инъекциями CCL5/RFP MSC. Системно вводимые инъекционно стволовые клетки были обнаружены исключительно в опухоли. Последующее снижение размера опухоли и сниженный перитонеальный карциноматоз являются многообещающими для клинического применения подобранной для пациента комбинированной терапии с использованием стволовых клеток/суицидного гена.
Сконструированные стволовые клетки, которые рекрутируются для других тканевых ниш, не претерпевают такую же программу дифференциации и, следовательно, не экспрессируют терапевтический ген. Этот подход обеспечивает значительную степень контроля селективной экспрессии терапевтического гена в пределах определенного микроокружения.
Увязывание терапии стволовыми клетками с селективной генной терапией усиливает терапевтические варианты для регенерации или замены заболевших или пропущенных клеток, а также для деструкции опухоли. Здесь показано, что генетически модифицированные стволовые клетки могут служить в качестве среды для транспорта тканеспецифичной генной терапии к опухолям и что MSC, сконструированная с CCL5-промотором, может управлять экспрессией tk.
Эффект от лечения MSC на развитие метастазов. Сравнение контрольной среды и животных, прошедших лечение нативными MSC (MSC давали в течение периода, равного трем неделям, при дозе 500000 клеток ежедневно). Исследование было проведено посредством инспекции и пальпации через 36 дней роста опухоли. Числа обозначают животных с метастазами. Значимость тестировали посредством двустороннего точного теста Фишера.
Таблица 2. Распределение опухолевых метастазов. Животных с контрольной средой и контрольными MSC трансфицированными репортерными генами GFP и RFP, сравнивали с животными, подвергнутыми суицидной генной терапии. Исследование посредством инспекции и пальпации через 36 дней роста опухоли. Числа обозначают животных с метастазами. Значимость тестировали посредством двустороннего точного теста Фишера. Все MSC давали в течение периода, равного трем неделям, при дозе 500000 клеток ежедневно.
Эксперименты in vitro по устойчивой трансдукции человеческих MSC и исследование in vitro индукции экспрессии HSV tk
Генерация генетически модифицированных человеческих MSC
Человеческие MSC инкубировали в течение ночи с лентивирусами с недостаточной репликацией, несущими вектор pLenti6 TK RANTES, закрепляющий ген HSV tk под контролем промотора RANTES, и ген резистентности к бластицидину, ген под контролем промотора SV40 (множественная инфекция (MOI): 10) (см. Фиг.8).
После инкубации в течение ночи среду, содержащую вирус, удаляли и заменяли свежей средой. На следующий день к клеткам добавляли бластицидин (6 мкг/мл) для селекции генетически модифицированных MSC. Культуральную среду, включающую бластицидин, заменяли каждые 3-4 дня в течение минимально 6 дней.
Индукция промотора RANTES in vitro
Было продемонстрировано, что комбинация цитокинов TNFα (10 нг/мл) и IFNγ (10 нг/мл) приводит к индукции промотора RANTES в человеческих сосудистых эндотелиальных клетках пуповины (HUVECS)35.
В проведенных экспериментах авторы хотели продемонстрировать, что такая же комбинация цитокинов также приводит к индукции эндогенного промотора RANTES в MSC. Авторы хотели применить это исследование, чтобы иметь возможность индуцировать экспрессию экзогенной HSV tk in vitro. Генетически модифицированные MSC культивировали в течение до 48 ч с TNFα и IFNγ или без цитокинов и выделяли цельную РНК через 0, 24 и 48 ч. РНК (600 нг) подвергали обратной транскрипции в кДНК, которую, в свою очередь, использовали в реакциях в qRT-ПЦР для количественного определения экспрессии эндогенного RANTES с помощью системы LighCycler (Roche, Праймер: прямой: CCT CAT TGC TAC TGC CCT CT; обратный: GGT GTG GTG TCC GAG GAA TA; Универсальный зонд 16). Для подтверждения того, что использовались такие же количества РНК от различных образцов, ген “домашнего хозяйства” (актин) применяли в качестве гена сравнения (Universal ProbeLibrary Human ACTB gene Assay, Roche) и относительные количества рассчитывали, используя метод ΔΔCT.
Как показано на Фиг.9, авторы смогли обнаружить выраженное увеличение мРНК эндогенного RANTES через 24 и 48 ч после индукции MSC TNFα (10 нг/мл) и IFNγ (10 нг/мл). Эти результаты демонстрируют, что экспрессия RANTES индуцируется посредством TNFα и IFNγ не только в HUVEC, но также в человеческих MSC.
Специфическая смерть клеток, индуцированная генетически модифицированными MSC после обработки ганцикловиром
После того как авторы смогли продемонстрировать индуцируемость эндогенного промотора RANTES, они продолжили исследование того, возможно ли индуцировать экспрессию HSV tk, которая находилась под контролем экзогенного промотора RANTES, и впоследствии инициировать смерть клеток после обработки индуцированных клеток ганцикловиром. Генетически модифицированные клетки (50000 клеток в 6 лунках), которые генерировались, как описано выше, обрабатывали в течение 9 дней TNFα (10 нг/мл) и IFNγ (10 нг/мл) с добавлением свежих цитокинов каждые 3 дня. Далее клетки инкубировали в течение 3 дней с 100 мкМ ганцикловира.
Результаты ясно продемонстрировали, что генетически модифицированные MSC, которые индуцировали с помощью TNFα и IFNγ, и в последующем обрабатывали ганцикловиром, не выживали (Фиг.10D). Противоположный результат наблюдали для клеток, которые индуцировали только с помощью TNFα и IFNγ (Фиг.10B) или обрабатывали ганцикловиром (Фиг.10C).
Ссылки













Реферат
Изобретениеотносится к области молекулярной биологии и генетической инженерии. Заявлена генетически модифицированная мезенхимальная стволовая клетка для селективной экспрессии цитотоксического белка, содержащая экзогенную нуклеиновую кислоту, содержащую область, кодирующую цитотоксический белок, функционально связанную с промотором или комбинацией промотор/энхансер, где промотор или комбинация промотор/энхансер вызывают селективную экспрессию цитотоксического белка, когда генетически модифицированная мезенхимальная стволовая клетка подходит близко к стромальной ткани опухоли. 3 н. и 27 з. п. ф-лы, 10 ил., 2 табл.
Формула
где промотор или комбинация промотор/энхансер вызывают селективную экспрессию цитотоксического белка, когда генетически модифицированная мезенхимальная стволовая клетка подходит близко к стромальной ткани опухоли.
где промотор или комбинация промотор/энхансер вызывают селективную экспрессию цитотоксического белка, когда генетически модифицированная мезенхимальная стволовая клетка приближается к стромальной ткани опухоли, когда терапевтически эффективное число стволовых клеток вводят в кровоток индивида.

Комментарии