Выделенная молекула нуклеиновой кислоты, кодирующая химерный tie-2-лиганд (варианты), химерный или модифицированный tie-2-лиганд и способ его получения, вектор, способ получения системы вектор-хозяин, конъюгат, фармацевтическая композиция - RU2233880C2
Код документа: RU2233880C2
Чертежи





















































































Описание
Данная заявка заявляет о приоритете U.S. Serial No. 08/740223 filed October 25, 1996 и U.S. Provisional application 60/022999 filed August 2, 1996. Во всей заявке даются ссылки на различные публикации. Описание этих публикаций во всей их полноте включены в качестве ссылок в эту заявку.
Введение
Данное изобретение относится в общем к области генной инженерии и, более конкретно, к генам для рецепторных тирозинкиназ и их родственных лигандов, их встраиванию в рекомбинантные ДНК-векторы и к получению кодируемых белков в реципиентных штаммах микроорганизмов и реципиентных эукариотических клетках. Более конкретно, данное изобретение относится к новому модифицированному TIE-2-лиганду, который связывает TIE-2-рецептор, а также к способам получения и применения этого модифицированного лиганда. Далее данное изобретение обеспечивает последовательность нуклеиновой кислоты, кодирующую модифицированный лиганд, и способы генерирования нуклеиновой кислоты, кодирующей модифицированный лиганд, и продукт гена. Модифицированный TIE-2-лиганд, а также кодирующая его нуклеиновая кислота могут быть применимы в диагностике и лечении некоторых заболеваний, в которых участвуют эндотелиальные клетки и ассоциированные с ними TIE-рецепторы, таких как неопластические заболевания, вовлекающие в себя ангиогенез опухоли, заживление ран, тромбоэмболические заболевания, атеросклероз и воспалительные заболевания. Кроме того, модифицированный лиганд может быть использован для усиления пролиферации и/или дифференцировки гемопоэтических стволовых клеток. Более обобщенно, активирующие рецептор модифицированные TIE-2-лиганды, описанные здесь, могут быть использованы для ускорения роста, выживания, миграции и/или дифференцировки и/или стабилизации или дестабилизации клеток, экспрессирующих TIE-рецептор. Биологически активный модифицированный TIE-2-лиганд может быть использован для поддержания in vitro экспрессирующих TIE-рецептор клеток в культуре. Клетки и ткани, экспрессирующие TIE-рецептор, включают в себя, например, сердечные и сосудистые эндотелиальные клетки, эпителий хрусталика и клетки эпикарда сердца и ранние гемопоэтические клетки. Альтернативно такой лиганд человека может быть использован для поддержания клеток, которые сконструированы генной инженерией для экспрессии TIE-рецептора. Кроме того, модифицированный TIE-2-лиганд и родственный ему рецептор могут быть использованы в тест-системах для идентификации дополнительных агонистов или антагонистов этого рецептора.
Предпосылки изобретения
Клеточное поведение, ответственное за развитие, поддержание и репарацию дифференцированных клеток и тканей, регулируется, в значительной части, межклеточными сигналами, передаваемыми через факторы роста и подобные лиганды и их рецепторы. Рецепторы локализованы на клеточной поверхности клеток-респондентов и они связывают пептиды и полипептиды, известные как факторы роста, а также другие гормоноподобные лиганды. Результатом этого взаимодействия являются быстрые биохимические изменения в клетках-респондентах, а также быстрая и долгосрочная корректировка экспрессии клеточных генов. Некоторые рецепторы, связанные с различными клеточными поверхностями, могут связывать специфические факторы роста.
Фосфорилирование остатков тирозина в белках тирозинкиназами является одним из ключевых способов, при помощи которых сигналы трансдуцируются (переносятся) через цитоплазматическую мембрану. Некоторые известные в настоящее время гены протеинтирозинкиназ кодируют трансмембранные рецепторы для полипептидных факторов роста и гормонов, таких как эпидермальный фактор роста (EGF), инсулин, инсулиноподобный фактор роста 1 (IGF-1), тромбоцитарные факторы роста (PDGF-A и -В) и фибробластные факторы роста (FGF) (Heldin et al., Cell Regulation, 1:555-566 (1990); Ullrich, et al., Cell, 61:243-254 (1990)). В этом случае эти факторы роста проявляют их активность путем связывания с внеклеточной частью из родственных рецепторов, что приводит к активации внутренней тирозинкиназы, присутствующей на цитоплазматической части этого рецептора. Рецепторы факторов роста эндотелиальных клеток представляют особый интерес вследствие возможного участия факторов роста в некоторых важных физиологических и патологических процессах, таких как образование и развитие сосудов, ангиогенез, атеросклероз и воспалительные заболевания (Folkman, et al., Science, 235:442-447 (1987)). Рецепторы некоторых гемопоэтических факторов роста также являются тирозинкиназами; они включают в себя c-fms, который представляет собой рецептор колониестимулирующего фактора роста, Sherr, et al., Cell, 41:665-676 (1985), и c-kit, рецептор недифференцированного гемопоэтического фактора роста, сообщенный в Huang, et al., Cell, 63:225-233 (1990).
Рецепторные тирозинкиназы были подразделены на эволюционные подсемейства на основе характерной структуры их эктодоменов (Ullrich, et al., Cell, 61:243-254 (1990)). Такие подсемейства включают в себя EGF-рецептор-подобную киназу (подкласс I) и инсулиновый рецептор-подобную киназу (подкласс II), каждая из которых содержит повторяющиеся гомологичные обогащенные цистеином последовательности в их внеклеточных доменах. Одна обогащенная цистеином область была также обнаружена во внеклеточных доменах eph-подобных киназ. Hirai, et al., Science, 238:1717-1720 (1987); Lindberg, et al., Mol. Cell. Biol., 10:6316-6324 (1990); Lhotak, et al., Mol. Cell. Biol., 11:2496-2502 (1991). PDGF-рецепторы так же, как и c-fms- и c-kit-рецепторные тирозинкиназы, могут быть сгруппированы в подкласс III; тогда как FGF-рецепторы образуют подкласс IV. Типичными для членов обоих этих подклассов являются внеклеточные единицы укладки, стабилизированные внутрицепочечными дисульфидными связями. Эти так называемые иммуноглобулин-(Ig)-подобные укладки обнаружены в белках суперсемейства иммуноглобулинов, которое содержит большое разнообразие других рецепторов клеточной поверхности, имеющих клеточносвязанные или растворимые лиганды. Williams, et al., Ann. Rev. Immunol., 6:381-405 (1988).
Рецепторные тирозинкиназы различаются по их специфичности и аффинности. Как правило, рецепторные тирозинкиназы являются гликопротеинами, которые состоят из (1) внеклеточного домена, способного связывать специфический фактор (факторы) роста; (2) трансмембранного домена, который обычно находится в альфа-спиральной части этого белка; (3) юкстамембранного (околомембранного) домена, где рецептор может регулироваться, например, фосфорилированием белка; (4) тирозинкиназного домена, который является ферментативным компонентом рецептора; и (5) карбоксиконцевого хвоста, который во многих рецепторах участвует в распознавании и связывании субстратов для тирозинкиназы.
Сообщалось, что такие процессы, как альтернативный сплайсинг экзонов и альтернативный выбор промотора гена или сайтов полиаденилирования, способны производить несколько отличающихся полипептидов из одного и того же гена. Эти полипептиды могут содержать или не содержать различные домены, перечисленные выше. Вследствие этого некоторые внеклеточные домены могут экспрессироваться в виде отдельных, секретируемых белков и некоторые формы рецепторов могут не иметь тирозинкиназного домена и содержат только внеклеточный домен, встроенный в цитоплазматическую мембрану через трансмембранный домен плюс короткий карбоксиконцевой хвост.
Ген, кодирующий трансмембранную тирозинкиназу эндотелиальных клеток, первоначально идентифицированный при помощи RT-PCR как гомологичный неизвестной тирозинкиназе кДНК-фрагмент из лейкозных клеток человека, был описан Partanen, et al., Proc. Natl. Acad. Sci. USA, 87:8913-8917 (1990). Этот ген и кодируемый им белок были названы "TIE", что является аббревиатурой для "тирозинкиназы с доменами гомологии Ig и EGF". Partanen, et al., Mol. Cell. Biol., 12:1698-1707 (1992).
Сообщалось, что мРНК



Сообщалось, что два структурно родственных крысиных TIE-рецепторных белка кодируются отличающимися генами с близкими профилями экспрессии. Один ген, названный





Было обнаружено, что оба гена в большом масштабе экспрессируются в эндотелиальных клетках эмбриональных и постнатальных тканей. Значительные уровни

Преобладающая экспрессия TIE-рецептора в васкулярном эндотелии предполагает, что TIE играет роль в развитии и поддержании сосудистой системы. Это могло бы играть роль в определении эндотелиальных клеток, пролиферации, дифференцировке и миграции клеток и превращении в васкулярные элементы. Анализы мышиных эмбрионов, недостаточных по TIE-2, иллюстрируют его важное значение в ангиогенезе, в частности для образования сети кровеносных сосудов в эндотелиальных клетках. Sato T.N., et al., Nature 376:70-74 (1995). В зрелой сосудистой системе TIE могли бы функционировать в выживании эндотелиальных клеток, поддержании и ответных реакциях на патогенные воздействия.
TIE-рецепторы экспрессируются также в незрелых гемопоэтических стволовых клетках, В-клетках и подсерии мегакариоцитов, что предполагает, таким образом, роль лигандов, которые связывают эти рецепторы, в раннем гематопоэзе, в дифференцировке и/или пролиферации В-клеток и в пути дифференцировки мегакариоцитов. Iwama, et al., Biochem. Biophys. Research Communications 195:301-309 (1993); Hashiyama, et al., Blood 87:93-101 (1996); Batard, et al., Blood 87:2212-2220 (1996).
Сущность изобретения
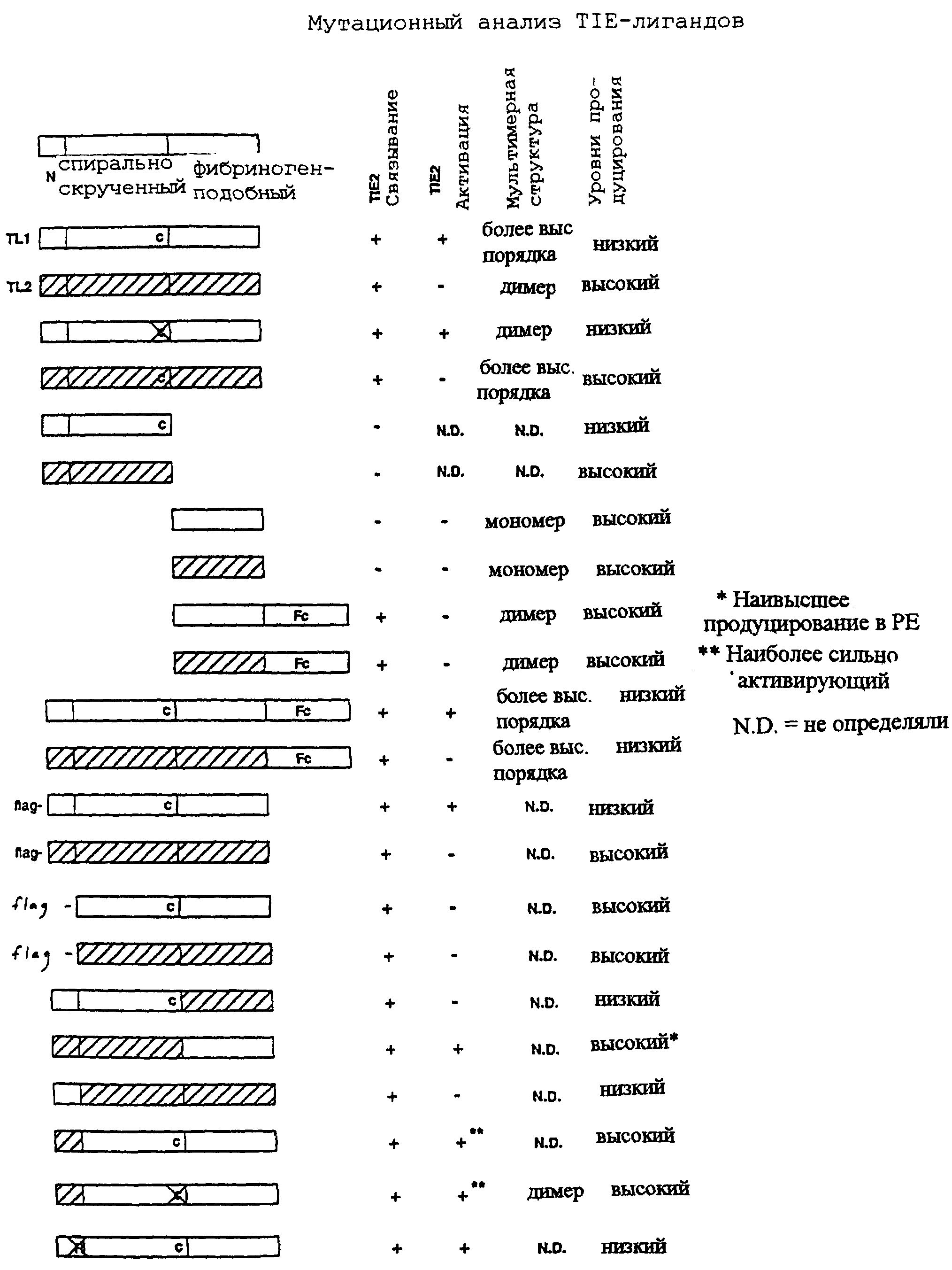
Данное изобретение обеспечивает композицию, содержащую модифицированный TIE-2-лиганд, по существу не содержащий других белков. В применении здесь модифицированным лигандом TIE-2 называют лиганд TIE-семейства лигандов, характерные представители которого включают в себя лиганды TL1, TL2, TL3 и TL4, описанные здесь, которые были изменены добавлением, делецией или заменой одной или нескольких аминокислот или посредством мечения, например, Fc-частью человеческого IgG-1, но которые сохраняют их способность связывать TIE-2-рецептор. Модифицированный TIE-2-лиганд включает в себя также химерный TIE-2-лиганд, содержащий, по меньшей мере, часть первого TIE-2-лиганда и часть второго TlE-2-лиганда, который отличается от первого. В качестве неограничительного примера первый TIE-2-лиганд является TL1, а второй TIE-2-лиганд является TL2. Данное изобретение рассматривает другие комбинации с использованием дополнительных членов семейства лигандов TIE-2. Например, возможны другие комбинации для создания химерного TIE-2-лиганда, в том числе, но не только, комбинации, в которых первый лиганд выбран из группы, состоящей из TL1, TL2, TL3 и TL4, и второй лиганд, отличающийся от первого лиганда, выбран из группы, состоящей из TL1, TL2, TL3 и TL4.
Данное изобретение обеспечивает также выделенную молекулу нуклеиновой кислоты, кодирующую модифицированный TIE-2-лиганд. В одном варианте выделенная молекула нуклеиновой кислоты кодирует TIE-2-лиганд TIE-семейства лигандов, характерные представители которого включают в себя лиганды TL1, TL2, TL3 и TL4, описанные здесь, которые были изменены добавлением, делецией или заменой одной или нескольких аминокислот или посредством мечения, например, Fc-частью человеческого IgG-1, но которые сохраняют их способность связывать TIE-2-рецептор. В другом варианте выделенная молекула нуклеиновой кислоты кодирует модифицированный TIE-2-лиганд, который представляет собой химерный TIE-2-лиганд, содержащий, по меньшей мере, часть первого TIE-2-лиганда и часть второго TIE-2-лиганда, который отличается от первого. В качестве неограничительного примера первый TIE-2-лиганд является TL1, а второй TIE-2-лиганд является TL2. Данное изобретение рассматривает другие комбинации с использованием дополнительных членов семейства лигандов TIE-2. Например, возможны другие комбинации, в том числе, но не только, комбинации, в которых выделенная молекула нуклеиновой кислоты кодирует модифицированный TIE-2-лиганд, который представляет собой химерный TIE-2-лиганд, содержащий часть первого лиганда, выбранного из группы, состоящей из TL1, TL2, TL3 и TL4, и часть второго лиганда, отличающегося от первого лиганда, выбранного из группы, состоящей из TL1, TL2, TL3 и TL4.
Выделенная молекула нуклеиновой кислоты может представлять собой ДНК, кДНК или РНК. Данное изобретение обеспечивает также вектор, содержащий выделенную молекулу нуклеиновой кислоты, кодирующую модифицированный TIE-2-лиганд. Данное изобретение обеспечивает также систему вектор - хозяин для продуцирования в подходящей клетке-хозяине полипептида, имеющего биологическую активность модифицированного TIE-2-лиганда. Походящей клеткой-хозяином могут быть клетки бактерий, насекомых или млекопитающего. Данное изобретение обеспечивает также способ получения полипептида, обладающего биологической активностью модифицированного TIE-2-лиганда, который предусматривает выращивание клеток системы хозяин - вектор в условиях, позволяющих продуцирование этого полипептида и извлечение полученного таким образом полипептида.
Описанное здесь изобретение, касающееся выделенной молекулы нуклеиновой кислоты, кодирующей модифицированный TIE-2-лиганд, обеспечивает далее разработку этого лиганда в качестве терапевтического средства для лечения пациентов, страдающих от нарушений, в которых участвуют клетки, ткани или органы, экспрессирующие TIE-2-рецептор. Данное изобретение обеспечивает также антитело, которое специфически связывает такую терапевтическую молекулу. Это антитело может быть моноклональным или поликлональным. Данное изобретение обеспечивает также способ применения такого моноклонального или поликлонального антитела для измерения количества терапевтической молекулы в пробе, взятой из пациента, для целей мониторинга хода терапии.
Данное изобретение обеспечивает также антитело, которое связывает модифицированный TIE-2-лиганд, описанный выше. Это антитело может быть моноклональным или поликлональным. Таким образом, данное изобретение обеспечивает, кроме того, терапевтические композиции, содержащие антитело, которое специфически связывает модифицированный TIE-2-лиганд, в фармацевтически приемлемом носителе. Данное изобретение обеспечивает также способ ингибирования роста кровеносных сосудов в млекопитающих введением эффективного количества терапевтической композиции, содержащей антитело, которое специфически связывает модифицированный TIE-2-лиганд, описанный здесь, в фармацевтически приемлемом носителе.
Данное изобретение обеспечивает далее терапевтические композиции, содержащие модифицированный TIE-2-лиганд, описанный здесь, в фармацевтически приемлемом носителе. Данное изобретение обеспечивает также способ усиления образования новых сосудов в пациенте введением эффективного количества терапевтической композиции, содержащей активирующий рецептор модифицированный TIE-2-лиганд, описанный здесь, в фармацевтически приемлемом носителе. В одном варианте этот способ может быть применен для лечения ишемии. Еще в одном в варианте активирующий рецептор модифицированный TIE-2-лиганд, описанный здесь, используют отдельно или в сочетании с другими гемопоэтическими факторами для стимуляции пролиферации или дифференцировки гемопоэтических стволовых клеток, В-клеток или мегакариоцитов.
Альтернативно данное изобретение обеспечивает конъюгирование модифицированного TIE-2-лиганда с цитотоксическим агентом и терапевтическую композицию, приготовленную на основе этого конъюгата. Далее, изобретение обеспечивает слитый белок рецептортело (receptorbody), который специфически связывает модифицированный TIE-2-лиганд, в фармацевтически приемлемом носителе. Данное изобретение обеспечивает также способ ингибирования роста кровеносных сосудов в млекопитающем введением эффективного количества рецептортела, которое специфически связывает модифицированный TIE-2-лиганд, в фармацевтически приемлемом носителе.
Данное изобретение обеспечивает также антагонист TIE-2-рецептора, а также способ ингибирования биологической активности TIE-2 в млекопитающем, предусматривающий введение этому млекопитающему эффективного количества антагониста TIE-2. Согласно данному изобретению антагонистом может быть модифицированный TIE-2-лиганд, описанный здесь, который связывается с TIE-2-рецептором, но не активирует его.
Краткое описание чертежей
Фиг.1А и 1В - TIE-2-рецептортело (TIE-2-RB) ингибирует развитие кровеносных сосудов в эмбриональной куриной хориоаллантоисной мембране (САМ). Один кусочек ресорбируемого желатина (Gelfoam), пропитанного 6 мкг RB вставляли непосредственно под САМ 1-дневных куриных эмбрионов. После 3 дополнительных дней инкубирования 4-дневные эмбрионы и окружающие их САМ удаляли и исследовали. Фиг.1А: эмбрионы, обработанные EHK-1-RB (rEHK-1 ecto/hIgG1 Fc), были жизнеспособными и обладали нормально развитыми кровеносными сосудами в окружающей их САМ. Фиг.1В: все эмбрионы, обработанные TIE-2-RB (r TIE-2-RB ecto/hIgG1 Fc), были мертвыми, уменьшенными в размере и почти полностью лишены окружающих кровеносных сосудов.
Фиг.2 - вектор pJFE14.
Фиг.3 - рестрикционная карта λgt10.
Фиг.4 - последовательность нуклеиновой кислоты и расшифрованная аминокислотная последовательность (однобуквенный код) человеческого TIE-2-лиганда 1 из клона γgt10, кодирующего htie-2-лиганд 1.
Фиг.5 - последовательность нуклеиновой кислоты и расшифрованная аминокислотная последовательность (однобуквенный код) человеческого TIE-2-лиганда 1 из клона T98G.
Фиг.6 - последовательность нуклеиновой кислоты и расшифрованная аминокислотная последовательность (однобуквенный код) человеческого TIE-2-лиганда 2 из клона pBluescript KS, кодирующего человеческий TIE-2-лиганд 2.
Фиг.7 - вестерн-блот, показывающий активацию TIE-2-рецептора TIE-2-лигандом 1 (Дорожка L1), но не TIE-2-лигандом 2 (Дорожка L2) или контроль.
Фиг.8 - вестерн-блот, показывающий, что предварительная обработка клеток НАЕС избытком TIE-2-лиганда 2 (Дорожка 2) препятствует последующей способности разведенного TIE-2-лиганда 1 активировать TIE-2-рецептор (TIE2-R) по сравнению с предварительной обработкой клеток НАЕС средой MOCK (Дорожка 1).
Фиг.9 - вестерн-блот, демонстрирующий способность TL2 конкурентно ингибировать активацию TL1 TIE-2-рецептора, с использованием линии гибридных клеток человека, EA.hy926.
Фиг.10 (a, b, c, d) - представление в виде гистограммы связывания поверхности с иммобилизованным TIE-2-IgG TIE-2-лигандом в кондиционированной С2С12 ras, Rat2 ras, SHEP и T98G концентрированной (10х) среде. Специфическое связывание крысиного TIE-2 (rTIE) продемонстрировано значимым уменьшением активности связывания в присутствии 25 мкг/мл крысиного TIE-2-RB в сравнении с небольшим уменьшением в присутствии растворимого trkB-RB.
Фиг.11 a, b - связывание рекомбинантного человеческого TIE-2-лиганда 1 (hTL1) и человеческого TIE-2-лиганда 2 (hTL2) в супернатантах клеток COS, с поверхностью с иммобилизованным человеческим TIE-2-"рецептортелом" (RB). Специфическое для человеческого TIE-2 связывание определяли инкубированием проб с 25 мкг/мл либо растворимого hTIE-2-RB, либо trk-RB; значимое уменьшение активности связывания наблюдали только для проб, инкубированных с hTIE-2-RB.
Фиг.12 - вестерн-блот, показывающий, что TIE-2-рецептортело (обозначаемое TIE-2-RB или, как здесь, TIE-2-Fc) ингибирует активацию TIE-2-рецепторов TIE-2-лигандом 1 (TL1) в клетках HUVEC, тогда как постороннее рецептортело (TRKB-Fc) не ингибирует эту активацию.
Фиг.13 - агарозные гели, показывающие серийные разведения [неразведенные (1) – 10-4] продуктов RT-PCR TL1 и TL2, полученных из мышиной эмбриональной печени Е14,5 (Дорожки 1 - общие, Дорожки 3 - стромально обогащенные и Дорожки 4 - гемопоэтические клетки-предшественники c-kit+TER119) и мышиного фетального тимуса (Дорожки 2 - общие).
Фиг.14 - агарозные гели, показывающие серийные разведения [неразведенные (1) – 10-3] продуктов RT=PCR TL1 и TL2, полученных из мышиных фетальных стромальных корковых клеток тимуса (Дорожки 1 - CDR1+/A2B5-) и медуллярных стромальных клеток (Дорожка CDR1-/A2B5+).
Фиг.15 - схематическое представление гипотетической роли ТIЕ-2/ТIЕ-лигандов в ангиогенезе. TL1 представлен (•), TL2 представлен (*), TIE-2 представлен (Т), VEGF представлен ([]) и flk-1 (VEGF-рецептор) представлен (V).
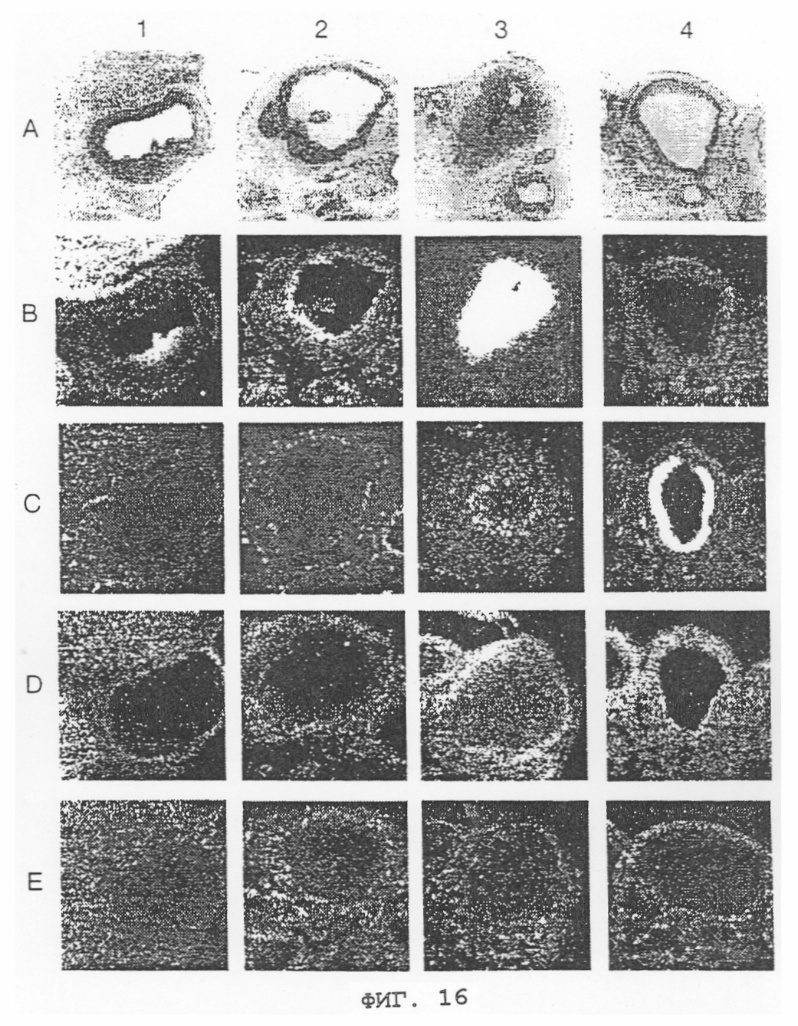
Фиг.16 - слайды гибридизации in situ, показывающие характер временной экспрессии TIE-2, TL1, TL2 и VEGF во время ангиогенеза, связанного с фолликулярным развитием и образованием corpus luteum (желтого тела) в яичнике крысы, которая получала сыворотку жеребой кобылы. Колонка 1: ранний преовуляторный фолликул; Колонка 2: преовуляторный фолликул; Колонка 3: ранний corpus luteum; и Колонка 4: атретичный фолликул; Ряд А: блестящая зона; Ряд В: VEGF; Ряд С: TL2; Ряд D: TL1 и Ряд Е: TIE-2-рецептор.
Фиг.17 - сравнение аминокислотных последовательностей зрелого белка TL1 и зрелого белка TL2. Последовательность TL1 является такой же, какая представлена на Фиг.4, за исключением того, что предполагаемая лидерная последовательность была удалена. Подобным образом, последовательность TL2 является такой же, какая представлена на Фиг.6, за исключением того, что предполагаемая лидерная последовательность была удалена. Стрелки указывают остатки Arg49, Cys245 и Аrg264 TL1, которые соответствуют остаткам в положениях аминокислот 69, 265 и 284, соответственно TL1, представленного на Фиг.4.
Фиг.18 - вестерн-блот ковалентной мультимерной структуры TL1 и TL2 (Панель А) и взаимопревращения TL1 в TL2 мутацией одного цистеина (Панель В).
Фиг.19 - типичная кривая связывания TIE-2-IgG с иммобилизованным TL1 в количественном бесклеточном тесте связывания.
Фиг.20 - типичная кривая, показывающая связывание "лигандтела" TIE-2-лиганда 1, содержащего фибриноген-подобный домен лиганда, связанный с Fc-доменом IgG (TL1-fFc), с иммобилизованным эктодоменом TIE-2, в количественном бесклеточном тесте связывания.
Фиг.21 - нуклеотидная и расшифрованная (однобуквенный код) аминокислотная последовательности TIE-лиганда-3. Кодирующая последовательность начинается в положении 47. Фибриноген-подобный домен начинается в положении 929.
Фиг.22 - сравнение аминокислотных последовательностей членов семейства TIE-лигандов. mTL3 = мышиный TIE-лиганд-3; hTL1 = человеческий TIE-2-лиганд 1; chTL1 = куриный TIE-2-лиганд 1; mTL1 = мышиный TIE-2-лиганд 1; mTL2 = мышиный TIE-2-лиганд 2; hTL2 = человеческий TIE-2-лиганд 2. Заключенные в блоки районы указывают консервативные районы гомологии среди членов этого семейства.
Фиг.23 - нуклеотидная и расшифрованная аминокислотная последовательности (однобуквенный код) ТIЕ-лиганда-4. Стрелка показывает положение нуклеотида 569.
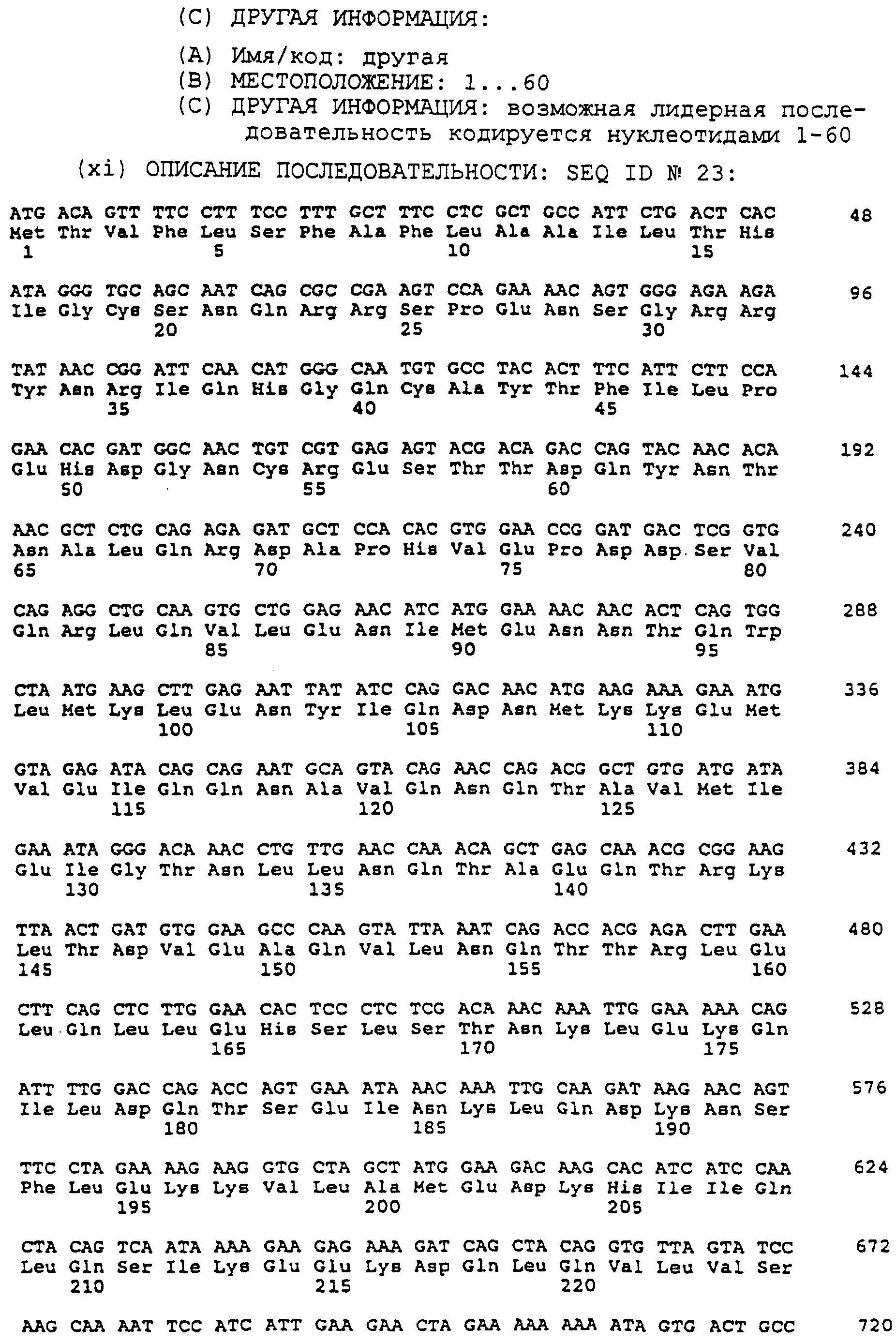
Фиг.24 - нуклеотидная и расшифрованная аминокислотная (однобуквенный код) последовательности химерного TIE-лиганда, обозначенного 1N1C2F (химера 1). Предполагаемая лидерная последовательность кодируется нуклеотидами 1-60.
Фиг.25 - нуклеотидная и расшифрованная аминокислотная (однобуквенный код) последовательности химерного TIE-лиганда, обозначенного 2N2C1F (химера 2). Предполагаемая лидерная последовательность кодируется нуклеотидами 1-48.
Фиг.26 - нуклеотидная и расшифрованная аминокислотная (однобуквенный код) последовательности химерного TIE-лиганда, обозначенного 1N2C2F (химера 3). Предполагаемая лидерная последовательность кодируется нуклеотидами 1-60.
Фиг.27 - нуклеотидная и расшифрованная аминокислотная (однобуквенный код) последовательности химерного TIE-лиганда, обозначенного 2N1C1F (химера 4). Предполагаемая лидерная последовательность кодируется нуклеотидами 1-48.
Подробное описание изобретения
Как описано более детально ниже, заявители создали новые модифицированные TIE-2-лиганды, которые связывают TIE-2-рецептор. Данное изобретение обеспечивает композицию, содержащую модифицированный TIE-2-лиганд, по существу не содержащий других белков. В применении здесь TIE-2-лигандом называют лиганд TIE-семейства лигандов, характерные представители которого включают в себя лиганды ТL1, TL2, TL3 и TL4, описанные здесь, которые были изменены добавлением, делецией или заменой одной или нескольких аминокислот или мечением, например, Fc-частью человеческого IgG-1, но которые сохраняют их способность связывать TIE-2-рецептор. Модифицированный TIE-2-лиганд включает в себя также химерный TIE-2-лиганд, содержащий, по меньшей мере, часть первого TIE-2-лиганда и часть второго TIE-2-лиганда, который отличается от первого. В качестве неограничительного примера первым TIE-2-лигандом является ТL1 и вторым лигандом является TL2. Изобретение рассматривает также другие комбинации с использованием дополнительных членов семейства TIE-2-лигандов. Например, возможны другие комбинации для создания химерного TIE-2-лиганда, в том числе, но не только, комбинации, в которых первый лиганд выбран из группы, состоящей из ТL1, TL2, TL3 и TL4, и второй лиганд, отличающийся от первого лиганда, выбран из группы, состоящей из TL1, TL2, TL3 и TL4.
Данное изобретение обеспечивает также выделенную молекулу нуклеиновой кислоты, кодирующую модифицированный TIE-2-лиганд. В одном варианте выделенная молекула нуклеиновой кислоты кодирует TIE-2-лиганд TIE-семейства лигандов, характерные представители которого включают в себя лиганды TL1, TL2, TL3 и TL4, описанные здесь, которые были изменены добавлением, делецией или заменой одной или нескольких аминокислот или посредством мечения, например, Fc-частью человеческого IgG-1, но которые сохраняют их способность связывать TIE-2-рецептор. В другом варианте выделенная молекула нуклеиновой кислоты кодирует модифицированный TIE-2-лиганд, который представляет собой химерный TIE-2-лиганд, содержащий, по меньшей мере, часть первого TIE-2-лиганда и часть второго TIE-2-лиганда, которая отличается от первой. В качестве неограничительного примера, первый TIE-2-лиганд является TL1, а второй TIE-2-лиганд является TL2. Данное изобретение рассматривает другие комбинации с использованием дополнительных членов семейства лигандов TIE-2. Например, возможны другие комбинации, в том числе, но не только, комбинации, в которых выделенная молекула нуклеиновой кислоты кодирует модифицированный TIE-2-лиганд, который представляет собой химерный TIE-2-лиганд, содержащий часть первого лиганда, выбранного из группы, состоящей из TL1, TL2, TL3 и TL4, и часть второго лиганда, отличающегося от первого лиганда, выбранного из группы, состоящей из TL1, TL2, TL3 и TL4.
Данное изобретение включает в себя модифицированные TIE-2-лиганды и их аминокислотные последовательности, а также их функционально эквивалентные варианты, а также белки или пептиды, включающие в себя мутанты с заменами, делеционные или инсерционные мутанты описанных последовательностей, которые связывают TIE-2-рецептор и действуют как его агонисты или антагонисты. Такие варианты включают в себя варианты, в которых аминокислотные остатки заменены на остатки в последовательности, приводящей к молчащему изменению. Например, один или несколько аминокислотных остатков в этой последовательности могут быть заменены другой аминокислотой (аминокислотами) одинаковой полярности, которая действует как функциональный эквивалент, что приводит к молчащему изменению. Замены для аминокислот в этой последовательности могут быть выбраны из других членов того класса, к которому принадлежит эта аминокислота. Например, класс неполярных (гидрофобных) аминокислот включает в себя аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин. Полярные нейтральные аминокислоты включают в себя глицин, серии, треонин, цистеин, тирозин, аспарагин и глутамин. Положительно заряженные (основные) аминокислоты включают в себя аргинин, лизин и гистидин. Отрицательно заряженные (кислые) аминокислоты включают в себя аспарагиновую кислоту и глутаминовую кислоту.
В объем данного изобретения включены также белки или их фрагменты или производные, которые проявляют ту же самую или сходную активность, что и модифицированные TIE-2-лиганды, описанные здесь, и производные, которые дифференциально модифицированы во время или после трансляции, например гликозилированием, протеолитическим расщеплением, связью с молекулой антитела или другим клеточным лигандом и т.д. Функционально эквивалентные молекулы включают в себя также молекулы, которые содержат модификации, в том числе N-концевые модификации, которые возникают вследствие экспрессии в определенном рекомбинантном хозяине, такие как, например, N-концевое метилирование, которое имеет место в некоторых бактериальных системах экспрессии (например, Е.соli).
Данное изобретение включает в себя также нуклеотидные последовательности, которые кодируют белки, описанные здесь в качестве модифицированных TIE-2-лигандов, а также клетки-хозяева, в том числе дрожжи, бактерии, вирусы и клетки млекопитающих, которые сконструированы генетически для получения этих белков, например, трансфекцией, трансдукцией, инфекцией, электропорацией или микроинъекцией нуклеиновой кислоты, кодирующей модифицированные TIE-2-лиганды, описанные здесь, в подходящем экспрессирующем векторе. Данное изобретение включает в себя также введение нуклеиновой кислоты, кодирующей модифицированные TIE-2-лиганды, с применением способов генной терапии, как описано, например, в Finkel and Epstein FASEB J. 9:843-851 (1995); Guzman, et al., PNAS (USA) 91:10732-10736 (1994).
Специалисту в данной области будет также понятно, что данное изобретение включает в себя последовательности ДНК и РНК, которые гибридизуются с нуклеотидной последовательностью, кодирующей TIE-2-лиганд, в условиях умеренной строгости, определенных, например, в Sambrook, et al., Molecular Cloning: A Laboratory Manual, 2 Ed., Vol.1, pp. 101-104, Cold Spring Harbor Laboratory Press (1989). Так, молекула нуклеиновой кислоты, рассматриваемая данным изобретением, включает в себя молекулу, имеющую нуклеотидную последовательность, расшифрованную из аминокислотной последовательности модифицированного TIE-2-лиганда, полученного, как описано выше, а также молекулу, имеющую последовательность нуклеотидов, которая гибридизуется с такой нуклеотидной последовательностью, и также нуклеотидную последовательность, которая является вырожденной последовательностью вышеуказанных последовательностей как результат вырожденности генетического кода, но которая кодирует лиганд, связывающий TIE-2-рецептор и имеющий аминокислотную последовательность и другие первичные, вторичные и третичные характеристики, которые достаточно дублируют модифицированный TIE-2-лиганд, описанный здесь, так что эта молекула имеет ту же самую биологическую активность, что и активность модифицированного TIE-2-лиганда, описанного здесь.
Данное изобретение обеспечивает выделенную молекулу нуклеиновой кислоты, кодирующую модифицированный TIE-2-лиганд, который связывает и активирует TIE-2-рецептор, содержащую нуклеотидную последовательность, кодирующую TIE-2-лиганд 1, в которой часть нуклеотидной последовательности, которая кодирует N-концевой домен TIE-2-лиганда 1, заменена нуклеотидной последовательностью, которая кодирует N-концевой домен TIE-2-лиганда 2. Данное изобретение обеспечивает также такую молекулу нуклеиновой кислоты с дополнительной модификацией, так что часть нуклеотидной последовательности, кодирующей скрученный спирально домен TIE-2-лиганда 1, заменена нуклеотидной последовательностью, кодирующей скрученный спирально домен TIE-2-лиганда 2.
Данное изобретение обеспечивает также выделенную молекулу нуклеиновой кислоты, кодирующую модифицированный TIE-2-лиганд, который связывает и активирует TIE-2-рецептор, включающую в себя нуклеотидную последовательность, кодирующую TIE-2-лиганд 1, в которой часть нуклеотидной последовательности, кодирующая N-концевой домен TIE-2-лиганд 1, заменена нуклеотидной последовательностью, кодирующей N-концевой домен TIE-2-лиганд 2, и которая дополнительно модифицирована таким образом, что она кодирует отличающуюся аминокислоту вместо остатка цистеина, кодируемого нуклеотидами 784-787, как показано на Фиг.27. Остаток цистеина предпочтительно заменен остатком серина. В другом варианте молекула нуклеиновой кислоты дополнительно модифицирована для кодирования другой аминокислоты вместо остатка аргинина, кодируемого нуклеотидами 199-201, как показано на Фиг.27. Остаток аргинина предпочтительно заменен остатком серина.
Данное изобретение обеспечивает также выделенную молекулу нуклеиновой кислоты, кодирующую модифицированный TIE-2-лиганд, который связывает и активирует TIE-2-рецептор, содержащую нуклеотидную последовательность, кодирующую TIE-2-лиганд 1, которая модифицирована таким образом, чтобы кодировать другую аминокислоту вместо остатка цистеина в положении аминокислоты 245. Остаток цистеина предпочтительно заменен остатком серина.
Данное изобретение обеспечивает далее выделенную молекулу нуклеиновой кислоты, кодирующую модифицированный TIE-2-лиганд, который связывает, но не активирует TIE-2-рецептор, содержащую нуклеотидную последовательность, кодирующую TIE-2-лиганд 1, в которой часть нуклеотидной последовательности, кодирующей N-концевой домен TIE-2-лиганда 1, делетирована. Данное изобретение обеспечивает также такую молекулу нуклеиновой кислоты, дополнительно модифицированную таким образом, что часть нуклеотидной последовательности, кодирующая скрученный спирально домен TIE-2-лиганда 1, делетирована и часть, кодирующая фибриноген-подобный домен, слита в рамке считывания с нуклеотидной последовательностью, кодирующей константную область человеческого иммуноглобулина гамма-1 (Fc IgG1).
Данное изобретение обеспечивает далее выделенную молекулу нуклеиновой кислоты, кодирующую модифицированный TIE-2-лиганд, который связывает, но не активирует, TIE-2-рецептор, содержащую нуклеотидную последовательность, кодирующую TIE-2-лиганд 2, в которой часть нуклеотидной последовательности, кодирующей N-концевой домен TIE-2-лиганда 2, делетирована. Данное изобретение обеспечивает также такую молекулу нуклеиновой кислоты, дополнительно модифицированную таким образом, что часть нуклеотидной последовательности, кодирующей скрученный спирально домен TIE-2-лиганда 2, делетирована и часть, кодирующая фибриноген-подобный домен, слита в рамке считывания с нуклеотидной последовательностью, кодирующей константную область человеческого иммуноглобулина гамма-1 (Fc IgG1).
Данное изобретение обеспечивает далее выделенную молекулу нуклеиновой кислоты, кодирующую модифицированный TIE-2-лиганд, который связывает, но не активирует, TIE-2-рецептор, содержащую нуклеотидную последовательность, кодирующую TIE-2-лиганд 1, в которой часть нуклеотидной последовательности, кодирующая фибриноген-подобный домен TIE-2-лиганда 1, заменена нуклеотидной последовательностью, кодирующей фибриноген-подобный домен TIE-2-лиганда 2. Данное изобретение обеспечивает также такую молекулу нуклеиновой кислоты, дополнительно модифицированную таким образом, что часть нуклеотидной последовательности, кодирующая скрученный спирально домен TIE-2-лиганда 1, заменена нуклеотидной последовательностью, кодирующей скрученный спирально домен TIE-2-лиганда 2.
Данное изобретение дополнительно обеспечивает модифицированный TIE-2-лиганд, кодируемый любой молекулой нуклеиновой кислоты данного изобретения.
Данное изобретение обеспечивает также химерный TIE-2-лиганд, включающий в себя, по меньшей мере, часть первого TIE-2-лиганда и часть второго TIE-2-лиганда, отличающегося от первого, причем первый и второй TIE-2-лиганды выбраны из группы, состоящей из TIE-2-лиганда-1, ТIЕ-2-лиганда-2, TIE-лиганда-3 и TIE-лиганда-4. Предпочтительно химерный TIE-лиганд содержит, по меньшей мере, часть TIE-2-лиганда-1 и часть ТIЕ-2-лиганда-2.
Данное изобретение обеспечивает также молекулу нуклеиновой кислоты, кодирующей химерный TIE-лиганд, представленную на Фиг.24, 25, 26 или 27. Данное изобретение обеспечивает также химерный TIE-лиганд, представленный на Фиг.24, 25, 26 или 27. Дополнительно изобретение обеспечивает химерный TIE-лиганд, представленный на Фиг.27, модифицированный таким образом, что он имеет другую аминокислоту вместо остатка цистеина, кодируемого нуклеотидами 784-787.
Любой из способов, известных специалисту в данной области, введения фрагментов ДНК в вектор может быть применен для конструирования экспрессирующих векторов, кодирующих модифицированный TIE-2-лиганд, с использованием подходящих сигналов регуляции транскрипции/трансляции и кодирующих этот белок последовательностей. Эти способы могут включать в себя способы синтеза рекомбинантной ДНК in vitro и рекомбинации in vivo (генетическую рекомбинацию). Экспрессия последовательности нуклеиновой кислоты, кодирующей модифицированный TIE-2-лиганд или его пептидные фрагменты, может регулироваться второй последовательностью нуклеиновой кислоты, которая оперативно связана с последовательностью, кодирующей модифицированный TIE-2-лиганд, так что модифицированный белок или пептид TIE-2-лиганда экспрессируется в хозяине, трансформированном рекомбинантной молекулой ДНК. Например, экспрессия модифицированного TIE-2-лиганда, описанная здесь, может регулироваться любым промоторным/энхансерным элементом, известным в данной области. Промоторы, которые могут быть использованы для регуляции экспрессии лиганда, включают в себя (но не ограничиваются ими) длинный концевой повтор, описанный в Squinto et al. (Cell 65:1-20 (1991)); ранний промоторный район SV40 (Bernoist and Chambon, Nature 290:304-310), промотор, CMV, 5'-концевой повтор M-MuLV, промотор, содержащийся в 3'-длинном концевом повторе вируса саркомы Рауса (Yamamoto, et al., Cell 22:787-797 (1980)), промотор тимидинкиназы герпеса (Wagner et al., Proc. Natl. Acad. Sci. USA 18: 144-145 (1981)), промотор аденовируса, регуляторные последовательности гена металлотионеина (Brinster et al., Nature 296:39-42 (1982)); прокариотические экспрессирующие векторы, такие как промотор β-лактамазы (Villa-Kamaroff, et al., Proc. Natl. Acad. Sci. USA 75:3727-3731 (1978)) или промотор

Таким образом, согласно данному изобретению экспрессирующие векторы, способные реплицироваться в бактериальном или эукариотическом хозяине, содержащие нуклеиновую кислоту, кодирующую модифицированный TIE-2-лиганд, описанный выше, используют для трансфекции хозяина и тем самым для направления экспрессии такой нуклеиновой кислоты для продуцирования модифицированного TIE-2-лиганда, который может быть выделен в биологически активной форме. В применении здесь биологически активная форма включает в себя форму, способную связывать TIE-рецептор и вызывать биологический ответ, такой как функция дифференцировки, или влиять на фенотип клетки, экспрессирующей этот рецептор. Такие биологически активные формы могут, например, индуцировать фосфорилирование домена тирозинкиназы TIE-рецептора. Альтернативно эта биологическая активность может быть фактически антагонистической в отношении TIE-рецептора. В альтернативных вариантах активная форма модифицированного TIE-2-лиганда является формой, которая может узнавать TIE-рецептор и тем самым действовать в качестве нацеливающего агента для рецептора для применения как в диагностических, так и в терапевтических средствах. В соответствии с такими вариантами эта активная форма не должна вызывать какого-либо изменения в фенотипе любой экспрессирующей TIE клетки.
Экспрессирующие векторы, содержащие генные инсерции, могут быть идентифицированы при помощи четырех основных подходов, таких как: (а) ДНК-ДНК-гибридизация, (b) присутствие или отсутствие функций "маркерных" генов, (с) экспрессия встроенных последовательностей и (d) PCR-детектирование. В первом подходе присутствие чужеродного гена, встроенного в экспрессирующий вектор, может быть обнаружено ДНК-ДНК-гибридизацией с применением зондов, содержащих последовательности, которые гомологичны встроенному, кодирующему модифицированный TIE-2-лиганд, гену. Во втором подходе рекомбинантная система вектор/хозяин может быть обнаружена и отобрана на основе присутствия или отсутствия определенных функций "маркерного" гена (например, активности тимидинкиназы, устойчивости к антибиотикам, трансформированного фенотипа, образования тел включения в бакуловирусе и т.д.), вызываемых встраиванием чужеродных генов в вектор. Например, если нуклеиновая кислота, кодирующая модифицированный TIE-2-лиганд, встроена в последовательность маркерного гена вектора, рекомбинанты, содержащие эту вставку, могут быть идентифицированы по отсутствию функции маркерного гена. В третьем подходе рекомбинантные экспрессирующие векторы могут быть идентифицированы анализом продукта чужеродного гена, экспрессируемого рекомбинантом. Такие анализы могут быть основаны, например, на физических или функциональных свойствах продукта гена модифицированного TIE-2-лиганда, например, по связыванию лиганда с TIE-рецептором или его частью, который может быть помечен, например, детектируемым антителом или его частью, или по связыванию антител, продуцируемых против белка модифицированного TIE-2-лиганда или его части. Клетки данного изобретения могут временно или предпочтительно конститутивно и перманентно экспрессировать модифицированный TIE-2-лиганд, как описано здесь. В четвертом подходе могут быть приготовлены нуклеотидные праймеры ДНК, соответствующие специфической последовательности ДНК


Рекомбинантный лиганд может быть очищен любым способом, который делает возможным последующее образование стабильного, биологически активного белка. Предпочтительно этот лиганд секретируется в культуральную среду, из которой его извлекают. Альтернативно лиганд может быть выделен из клеток либо в виде растворимых белков, либо в виде тел включения, из которых он может быть экстрагирован количественно 8М хлоридом гуанидиния и диализом в соответствии с хорошо известными способами. Для дальнейшей очистки лиганда могут быть использованы аффинная хроматография, общепринятая ионообменная хроматография, гидрофобная хроматография, хроматография с обращенной фазой или гель-фильтрация.
В дополнительных вариантах данного изобретения, как описано подробно в Примерах, ген, кодирующий модифицированный TIE-2-лиганд, может быть использован для инактивации "нокаута" эндогенного гена гомологичной рекомбинацией и, тем самым, создания TIE-лиганднедостаточных клетки, ткани или животного. Например, но не для ограничения, может быть сконструирован ген, кодирующий рекомбинантный ТIЕ-лиганд-4, содержащий инсерционную мутацию, например, ген

Данное изобретение обеспечивает также антитела к модифицированному TIE-2-лиганду, описанному здесь, которые применимы для обнаружения этого лиганда, например в диагностике. Для получения моноклональных антител, направленных против модифицированного TIE-2-лиганда, может быть применен любой способ, который обеспечивает образование молекул антител непрерывными клеточными линиями в культуре. Например, в сфере действия данного изобретения находятся гибридомный способ, первоначально разработанный Kohler and Milstein (1975, Nature 256:495-497), в также триомный способ, способ с применением В-клеточной гибридомы человека (Kozbor et al., 1983, Immunology Today 4:72) и EBV-гибридомный способ для получения моноклональных антител человека (Cole et al., 1985, in "Monoclonal Antibodies and Cancer Therapy", Alan R. Liss, Inc. pp.77-96) и т.п.
Моноклональные антитела могут быть моноклональными антителами человека или химерными человек-мышь (или другие виды) моноклональными антителами. Моноклональные антитела человека могут быть получены любым из многочисленных способов, известных в данной области (например, Teng et al., 1983, Proc. Natl. Acad. Sci. U.S.A. 80:7308-7312; Kozbor et al., 1983, Immunology Today 4:72-79; Olsson et al., 1982, Meth. Enzymol. 92:3-16). Могут быть получены молекулы химерных антител, содержащие мышиный антигенсвязывающий домен с константными областями человека (Morrison et al., 1984, Proc. Natl. Acad. Sci. USA 81:6851; Takeda et al., 1985, Nature 314: 452).
Различные процедуры, известные в данной области, могут быть использованы для получения поликлональных антител к эпитопам описанного здесь модифицированного TIE-2-лиганда. Для получения антител различные животные-хозяева, в том числе, но не только, кролики, мыши и крысы, могут быть иммунизированы инъекцией модифицированным TIE-2-лигандом или его фрагментом или производным. Для увеличения иммунного ответа могут быть использованы разнообразные адъюванты в зависимости от вида хозяина, включающие в себя, но не ограничивающиеся ими, адъюванты Фрейнда (полный и неполный), минеральные гели, такие как гидроксид алюминия, поверхностно-активные вещества, такие как лизолецитин, полиолы блоксополимера полиоксиэтилена и полиоксипропилена (pluronic), полианионы, пептиды, масляные эмульсии, гемоцианины фиссуреллы, динитрофенол и потенциально применимые адъюванты для человека, такие как BCG (Bacille Calmette-Guerin) и Corinebacterium parvum.
Молекулярный клон антитела к выбранному модифицированному эпитопу TIE-2-лиганда может быть получен известными способами. Методология рекомбинантных ДНК (см., например, Maniatis et al., 1982, Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York) может быть использована для конструирования последовательностей нуклеиновых кислот, которые кодируют молекулу антитела или ее антигенсвязывающий район.
Данное изобретение обеспечивает молекулы антител, а также фрагменты таких молекул антител. Фрагменты антител, которые содержат идиотип этой молекулы, могут быть получены известными способами. Например, такие фрагменты включают в себя, но не ограничиваются ими: F(ab')2-фрагмент, который может быть получен расщеплением пепсином молекулы антитела; Fab'-фрагменты, которые могут быть получены восстановлением дисульфидных мостиков F(ab')2-фрагмента, и Fab-фрагменты, которые могут быть получены обработкой молекулы антитела папаином и восстанавливающим агентом. Молекулы антител могут быть очищены известными способами, например иммуноадсорбционной или иммуноаффинной хроматографией, такими хроматографическими способами, как HPLC (жидкостная хроматография высокого разрешения) или их сочетанием.
Данное изобретение включает в себя также иммуноанализ для измерения количества модифицированного TIE-2-лиганда в биологической пробе
a) контактированием биологической пробы, по меньшей мере, с одним антителом, которое специфически связывает модифицированный TIE-2-лиганд таким образом, что антитело образует комплекс с любым модифицированным TIE-2-лигандом, присутствующим в пробе; и
b) измерением количества этого комплекса и, тем самым, измерением количества модифицированного TIE-2-лиганда в биологической пробе.
Далее изобретение включает в себя анализ для измерения количества TIE-рецептора в биологической пробе
а) контактированием биологической пробы, по меньшей мере, с одним лигандом данного изобретения таким образом, что этот лиганд образует комплекс с TIE-рецептором; и
b) измерением количества этого комплекса и, тем самым, измерением количества TIE-рецептора в биологической пробе.
Данное изобретение обеспечивает также использование модифицированного TIE-2-лиганда, который активирует TIE-2-рецептор, как описано здесь, для поддержания выживания, и/или роста, и/или миграции, и/или дифференцировки экспрессирующих TIE-2-рецептор клеток. Так, этот лиганд может быть использован в качестве добавки для поддержания, например, эндотелиальных клеток в культуре.
Кроме того, создание заявителями модифицированного TIE-2-лиганда для TIE-2-рецептора делает возможным использование тест-систем, применимых для идентификации агонистов или антагонистов TIE-2-рецептора. Такие тест-системы были бы полезны в идентификации молекул, способных стимулировать или ингибировать ангиогенез. Например, в одном варианте, антагонисты TIE-2-рецептора могут быть идентифицированы как молекулы, которые способны противодействовать взаимодействию TIE-2-рецептора с модифицированным TIE-2-лигандом, который связывает TIE-2-рецептор. Такие антагонисты идентифицируются их способностью 1) ингибировать связывание биологически активного модифицированного TIE-2-лиганда с рецептором, измеряемое, например, при помощи BIAcore биосенсорной технологии (BIAcore; Pharmacia Biosensor, Piscataway, NJ); или 2) ингибировать способность биологически активного модифицированного TIE-2-лиганда вызывать биологическую ответную реакцию. Такие биологические ответные реакции включают в себя, но не ограничиваются ими, фосфорилирование TIE-рецептора или расположенных по ходу трансдукции компонентов пути трансдукции TIE-сигнала или выживание, рост или дифференцировку несущих TIE-рецептор клеток.
В одном варианте клетки, сконструированные для экспрессии TIE-рецептора, могут быть зависимыми в отношении роста от добавления модифицированного TIE-2-лиганда. Такие клетки являются ценными тест-системами для идентификации дополнительных агонистов TIE-рецептора или антагонистов, способных противодействовать активности модифицированного TIE-2-лиганда на таких клетках. Альтернативно аутокринные клетки, сконструированные для обеспечения способности этих клеток коэкспрессировать как модифицированный TIE-2-лиганд, так и рецептор, могут быть ценными системами для анализа на потенциальные агонисты и антагонисты.
Таким образом, данное изобретение обеспечивает введение TIE-2-рецептора в клетки, которые обычно не экспрессируют этот рецептор, что позволяет этим клеткам проявлять глубокие и легко различимые ответные реакции на лиганд, который связывает этот рецептор. Тип вызываемого ответа зависит от используемой клетки и не зависит от специфического рецептора, введенного в эту клетку. Могут быть выбраны подходящие клеточные линии, дающие ответ, наиболее применимый для анализа, а также для обнаружения молекул, которые могут действовать на тирозинкиназные рецепторы. Эти молекулы могут быть молекулой любого типа, в том числе, но не только, пептидными и непептидными молекулами, которые будут действовать в описанных системах рецепторспецифическим образом.
Одна из более применимых систем для такого использования включает в себя введение TIE-рецептора (или химерного рецептора, содержащего внеклеточный домен другой рецепторной тирозинкиназы, такой, например, как trkC и внутриклеточный домен TIE-рецептора) в линию фибробластных клеток (например, клеток NIH3T3), таким образом, что рецептор, который обычно не медиирует пролиферативные или другие ответы, может, тем не менее, после введения в фибробласты анализироваться различными хорошо установленными способами для количественного определения эффектов факторов роста фибробластов (например, по включению тимидина или другими типами тестов пролиферации; см. van Zoelen, 1990, "The Use of Biological Assays For Detection Of Polypeptide Growth Factors" in Progress Factor Research, Vol.2, pp.131-152; Zhan and M. Goldfarb, 1986, Mol. Cell. Biol., Vol.6, pp.3541-3544). Эти тесты имеют дополнительное преимущество, заключающееся в том, что любой препарат может быть тестирован как на клеточной линии, имеющей введенный рецептор, так и на исходной клеточной линии, не имеющей рецептора; только специфические эффекты на клеточной линии с рецептором могли бы рассматриваться как медиируемые введенным рецептором. Такие клетки могут быть, кроме того, сконструированы для экспрессии модифицированного TIE-2-лиганда, что создает аутокринную систему, применимую для тестирования на молекулы, которые действуют как антагонисты/агонисты этого взаимодействия. Таким образом, данное изобретение обеспечивает клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую модифицированный TIE-2-лиганд, и нуклеиновую кислоту, кодирующую TIE-рецептор.
Взаимодействие TIE-рецептор/модифицированный TIE-2-лиганд обеспечивает также ценную систему для идентификации агонистов или антагонистов с молекулами небольшого размера TIE-рецептора. Например, могут быть идентифицированы фрагменты, мутанты или производные модифицированного TIE-2-лиганда, которые связывают TIE-рецептор, но не вводят какую-либо другую биологическую активность. Альтернативно характеристика модифицированного TIE-2-лиганда делает возможной дополнительную характеристику активных частей этой молекулы. Кроме того, идентификация лиганда позволяет определить рентгеновскую структуру комплекса рецептор/лиганд, что позволяет идентифицировать сайт связывания на рецепторе. Знание сайта связывания обеспечит важное понимание рационального конструирования новых агонистов и антагонистов.
Специфическое связывание тест-молекулы с TIE-рецептором может быть измерено различными путями. Например, истинное связывание тест-молекулы с клетками, экспрессирующими TIE, может быть обнаружено или измерено путем детектирования или измерения (i) тест-молекулы, связанной с поверхностью интактных клеток; (ii) тест-молекулы, сшитой с белком TIE, в клеточных лизатах; или (iii) тест-молекулы, связанной с TIE, in vitro. Специфическое взаимодействие между тест-молекулой и TIE может оцениваться с применением реагентов, которые демонстрируют уникальные свойства этого взаимодействия.
В качестве характерного нелимитирующего примера способы данного изобретения могут быть использованы следующим образом. Рассмотрим случай, в котором должен быть измерен модифицированный TIE-2-лиганд в пробе. Различные разведения пробы (тест-молекулы) параллельно с негативным контролем (NC), не содержащим активности модифицированного TIE-2-лиганда, и позитивным контролем (PC), содержащим известное количество модифицированного TIE-2-лиганда, могут экспонироваться с клетками, экспрессирующими TIE, в присутствии детектируемо меченного модифицированного TIE-2-лиганда (в данном примере, радиоиодинированного лиганда). Количество модифицированного TIE-2-лиганда в тест-пробе может быть оценено определением количества125I-меченого модифицированного TIE-2-лиганда, который связывается с контролями и в каждом из разведений, с последующим сравнением величин пробы со стандартной кривой. Чем больше модифицированного TIE-2-лиганда в пробе, тем меньше125I-лиганда будет связываться с TIE.
Количество связанного125I-лиганда может быть определено измерением количества радиоактивности на клетку или сшиванием модифицированного TIE-2-лиганда с белками клеточной поверхности с использованием ДСН, как описано в Meakin and Shooter, 1991, Neuron 6:153-163, и детектированием количества меченого белка в клеточных экстрактах при помощи, например, электрофореза в ДСН-полиакриламидном геле, который может выявить меченый белок, имеющий размер, соответствующий комплексу TIE-рецептор/модифицированный TIE-2-лиганд. Специфическое взаимодействие тест-молекулы и TIE может быть дополнительно тестировано добавлением к тестам различных разведений немеченого контрольного лиганда, который не связывает TIE-рецептор и, следовательно, не имеет значимого действия на конкуренцию между модифицированным TIE-2-лигандом и тест-молекулой за TIE-связывание. Альтернативно можно ожидать, что молекула, которая, как известно, разрушает связывание TIE-рецептор/модифицированный TIE-2-лиганд, такая как, но не только, антитело против TIE или антитело против TIE-рецептора, описанные здесь, будет противодействовать конкуренции между125I-модифицированным TIE-2-лигандом 2 и тест-молекулой за связывание TIE-рецептора.
Детектируемо меченный модифицированный TIE-2-лиганд включает в себя, но не ограничивается ими, модифицированный TIE-2-лиганд, связанный ковалентно или нековалентно с радиоактивным веществом, флуоресцентным веществом, веществом, имеющим ферментативную активность, веществом, которое может служить в качестве субстрата для фермента (предпочтительны ферменты и субстраты, связанные с колориметрически детектируемыми реакциями), или с веществом, которое может узнаваться молекулой антитела, которая предпочтительно является детектируемо меченной молекулой антитела.
Альтернативно специфическое связывание тест-молекулы с TIE может быть измерено оценкой вторичных биологических эффектов связывания модифицированный ТIЕ-2-лиганд/ТIЕ-рецептор, в том числе, но не только, клеточного роста и/или дифференцировки или экспрессии немедленно ранних генов или фосфорилирования TIE. Например, способность тест-молекулы индуцировать дифференцировку может быть тестирована в клетках, не имеющих






Подобным образом, данное изобретение обеспечивает способ идентификации молекулы, которая имеет биологическую активность модифицированного TIE-2-лиганда, включающий в себя (i) экспонирование клетки, экспрессирующей




В дополнительных вариантах данное изобретение обеспечивает способы обнаружения или измерения TIE-лиганд-подобной активности или идентификации молекулы, имеющей такую активность, включающие в себя (i) экспонирование тест-молекулы TIE-рецепторному белку in vitro в условиях, в которых может происходить связывание, и (ii) детектирование связывания тест-молекулы с TIE-рецепторным белком, в которых связывание тест-молекулы с TIE-рецептором коррелирует с TIE-2-лиганд-подобной активностью. Согласно таким способам TIE-рецептор может быть или может не быть по существу очищенным, может быть прикреплен к твердому носителю (например в виде аффинной колонки или в виде теста ELISA) или может быть включен в искусственную мембрану. Связывание тест-молекулы с TIE-рецептором может быть оценено любым способом, известным в данной области. В предпочтительных вариантах, связывание тест-молекулы может детектироваться или измеряться оценкой ее способности конкурировать с детектируемо меченными известными TIE-лигандами за связывание TIE-рецептора.
Данное изобретение обеспечивает также способ обнаружения способности тест-молекулы функционировать в качестве антагониста TIE-лиганд-подобной активности, включающий в себя детектирование способности этой молекулы ингибировать эффект связывания TIE-лиганда с TIE-рецептором на клетке, экспрессирующей этот рецептор. Такой антагонист может противодействовать или не противодействовать связыванию TIE-рецептор/модифицированный TIE-2-лиганд. Эффекты связывания TIE-2-лиганда с TIE-рецептором предпочтительно являются биологическими или биохимическими эффектами, в том числе, но не только, выживанием или пролиферацией клеток, трансформацией клеток, индукцией немедленно ранних генов или фосфорилированием TIE.
Данное изобретение обеспечивает далее как способ идентификации антител или других молекул, способных нейтрализовать лиганд или блокировать связывание с рецептором, так и молекулы, идентифицированные этим способом. В качестве неограничительного примера способ может выполняться посредством анализа, который концептуально сходен с анализом ELISA. Например, антитело против TIE-рецептора может быть связано с твердым носителем, таким как пластиковый многолуночный планшет. Затем в качестве контроля известное количество модифицированного TIE-2-лиганда, который был Мус-маркирован (помечен Мус), может быть введено в лунку и затем любой меченый модифицированный TIE-2-лиганд, который связывается с антителом против рецептора, может быть идентифицирован при помощи репортерного антитела, направленного против Мус-метки. Эта тест-система может быть затем использована для скрининга тест-проб на молекулы, которые способны i) связываться с маркированным лигандом или ii) связываться с антителом против рецептора и тем самым блокировать связывание с антителом против рецептора маркированным лигандом. Например, в лунку может быть введена тест-проба, содержащая возможную представляющую интерес молекулу с известным количеством маркированного лиганда, и может быть измерено количество маркированного лиганда, которое связывается с антителом против рецептора. Путем сравнения количества связанного маркированного лиганда в тест-пробе с количеством в контроле могут быть идентифицированы молекулы, которые способны блокировать связывание лиганда с рецептором.
Представляющие интерес молекулы, идентифицированные таким образом, могут быть выделены при помощи способов, хорошо известных специалистам в данной области.
При обнаружении блокатора (ингибитора) связывания лиганда специалист в данной области сможет выполнить вторичные тесты для определения, связывается ли блокатор с рецептором или лигандом, а также тесты для определения, может ли молекула блокатора нейтрализовать биологическую активность лиганда. Например, путем применения теста связывания с использованием биосенсорной технологии BIAcore (или эквивалента этого теста), в котором ТIЕ-"рецептортело" либо модифицированный TIE-2-лиганд или "лигандтело" ковалентно связывают с твердым носителем (например, с карбоксиметилдекстраном на золотой поверхности), специалист в данной области сможет определить, связывается ли молекула блокатора (ингибитора) специфически с лигандом, "лигандтелом" или "рецептортелом". Для определения, может ли молекула блокатора нейтрализовать биологическую активность лиганда, специалист в данной области мог бы выполнить тест фосфорилирования (см. Пример 5) или, альтернативно, функциональный биотест, такой как тест выживания, с применением первичных культур, например эндотелиальных клеток. Альтернативно молекула блокатора, которая связывается с антителом к рецептору, могла бы быть агонистом, и специалист в данной области смог бы определить это путем проведения подходящего теста для идентификации дополнительных агонистов TIE-рецептора.
Кроме того, данное изобретение рассматривает далее композиции, в которых TIE-лиганд представляет собой рецептор-связывающий домен описанного здесь TIE-2-лиганда. Например, TIE-2-лиганд 1 содержит "спирально скрученный" домен (начинающийся при 5'-конце и простирающийся до нуклеотида в положении ~1160, Фиг.4, и положения ~1157, Фиг.5) и фибриноген-подобный домен (кодируемый нуклеотидной последовательностью, Фиг.4, начинающейся при положении ~1161, и при положении -1158, Фиг.5). Считают, что фибриноген-подобный домен TIE-2-лиганда 2 начинается на или около той же самой аминокислотной последовательности, что и в лиганде 1 (FRDCA), которая кодируется нуклеотидами, начинающимися около 1197, Фиг.6. Считают, что фибриноген-подобный домен TIE-2-лиганда-3 начинается на или около аминокислотной последовательности, которая кодируется нуклеотидами, представленными на Фиг.21. Мультимеризация спирально скрученных доменов во время образования лиганда затрудняет очистку. Однако, как описано в Примере 19, заявители обнаружили, что фибриноген-подобный домен содержит домен связывания TIE-2-рецептора. Однако мономерные формы фибриноген-подобного домена, по-видимому, не связывают рецептор. Исследования с использованием myc-маркированного фибриноген-подобного домена, который был собран в "кластеры" при помощи антител против myc, показали, что они действительно связывают TIE-2-рецептор. [Способы получения "собранных в кластеры" лигандов и "лигандтел" описаны в Davis et al., Science 266:816-819 (1994)]. На основании этого открытия заявители получили "лигандтела", которые содержат фибриноген-подобный домен TIE-2-лигандов, связанный с Fc-доменом IgG ("fFc"). Эти лигандтела, которые образуют димеры, эффективно связывают TIE-2-рецептор. В соответствии с этим данное изобретение рассматривает получение модифицированных TIЕ-лигандтел, которые могут быть использованы в качестве нацеливающих агентов для опухолей и/или связанной с ними сосудистой сети, где необходим антагонист TIE.
Далее, данное изобретение обеспечивает разработку лиганда, его фрагмента или производного, или другой молекулы, которая является агонистом или антагонистом рецептора, в качестве терапевтического средства для лечения пациентов, страдающих от нарушений, в которых участвуют клетки, ткани или органы, экспрессирующие TIE-рецептор. Такие молекулы могут быть использованы в способе лечения организма человека или животного или в способе диагностики.
Поскольку TIE-рецептор был идентифицирован в связи с эндотелиальными клетками и, как показано здесь, блокирование TIE-2-лиганда 1, по-видимому, предотвращает образование новых сосудов, заявители ожидают, что модифицированный TIE-2-лиганд, описанный здесь, может быть применим для индукции образования новых сосудов в случае заболеваний или нарушений, когда показана такая индукция. Такие заболевания или нарушения могли бы включать в себя заживление ран, ишемию и диабет. Эти лиганды могут тестироваться в животных моделях и использоваться терапевтически, как описано для других агентов, таких как фактор роста васкулярного эндотелия (VEGF), другой специфический для эндотелиальных клеток фактор, который является ангиогенным. Ferrara, et al., U.S. Patent No. 5332671, issued July 26, 1994. Ссылка Ferrara, а также другие работы описывают исследования in vitro и in vivo, которые могут быть использованы для демонстрации действия антиогенного фактора в ускорении кровотока к ишемическому миокарду, ускорении заживления ран и в других терапевтических условиях, в которых желательно образование новых сосудов (ангиогенез de novo) [см. Sudo, et al., European Patent Application 0550296 A2, published July 7, 1993; Banai, et al., Circulation 89:2183-2189 (1994); Unger, et al., Am.J. Physiol. 266:H1588-H1595 (1994); Lazarous, et al., Circulation 91:145-153 (1995)]. В соответствии с данным изобретением модифицированный TIE-2-лиганд может быть использован один или в комбинации с одним или несколькими дополнительными фармацевтически активными соединениями, такими как, например, VEGF или основной фактор роста фибробластов (bFGF), а также цитокинами, нейротрофинами и т.д.
Наоборот, антагонисты TIE-рецептора, такие как модифицированные TIE-2-лиганды, которые связываются с рецептором, но не активируют его, как описано здесь, "рецептортела", описанные здесь в Примерах 2 и 3, и TIE-2-лиганд 2, описанный в Примере 9, могли бы применяться для предотвращения или ослабления образования новых сосудов и, следовательно, предотвращения или ослабления, например, роста опухолей. Эти агенты могут применяться отдельно или в комбинации в другими композициями, такими как антитела против VEGF, которые, как было показано, применимы в лечении состояний, в котором целью терапии является блокирование (ингибирование) ангиогенеза. Заявители ожидают, что модифицированный TIE-2-лиганд, описанный здесь, может быть также использован в комбинации с такими агентами, как антагонисты цитокинов, такие как антагонисты IL-6, которые, как известно, ингибируют воспаление.
Например, заявители определили, что TIE-лиганды экспресрессируются в клетках в опухолях или в клетках, тесно связанных с опухолями. Например, TIE-2-лиганд 2, по-видимому, прочно связан с опухолевыми эндотелиальными клетками. Поэтому, он и другие TIE-антагонисты могут быть также применимы в предотвращении или ослаблении, например, опухолевого роста. Кроме того, TIE-лиганды или "лигандтела" (ligandbodies) могут применяться для доставки токсинов к несущей рецептор клетке. Альтернативно другие молекулы, такие как факторы роста, цитокины или питательные вещества, могут доставляться в несущую TIE-рецептор клетку через TIE-лиганды или лигандтела. TIE-лиганды или лигандтела, такие как модифицированный TIE-2-лиганд, описанный здесь, могут также применяться в качестве диагностических реагентов для TIE-рецептора для детектирования этого рецептора in vivo или in vitro. В случае, когда TIE-рецептор ассоциирован с патологическим состоянием, TIE-рецепторы или лигандтела, такие как модифицированный TIE-2-лиганд, могут быть применимы в качестве диагностических реагентов для обнаружения заболевания, например окрашиванием тканей или томографией всего тела. Такие реагенты включают радиоизотопы, флуорохром, красители, энзимы и биотин. Такие диагностические или терапевтические агенты могут быть приготовлены, как описано в Alitalo, et al., WO 95/26364, published October 5, 1995 и Burrows, F. and P. Thorpe, PNAS (USA) 90:8996-9000 (1993), включенных здесь в виде полной ссылки.
В других вариантах TIE-лиганды, активирующий рецептор модифицированный TIE-2-лиганд, описанный здесь, используют в качестве гемопоэтических факторов. Разнообразные гемопоэтические факторы и их рецепторы участвуют в пролиферации, и/или дифференцировке, и/или миграции клеток разных типов, содержащихся в крови. Поскольку TIE-рецепторы экспрессируются в ранних гемопоэтических клетках, ожидается, что TIE-лиганды играют сравнимую роль в пролиферации, или дифференцировке, или миграции этих клеток. Так, например, содержащие TIE композиции могут быть получены, проанализированы и испытаны в биологических системах in vitro и in vivo и использованы терапевтически, как описано в любой из следующих ссылок: Sousa, U.S. Patent No. 4810643; Lee, et al., Proc. Nail. Acad. Sci. USA 82:4360-4364 (1985); Wong, et al., Science, 228:810-814 (1984); Yokota, et al., Proc. Natl. Acad. Sci. USA 81:1070 (1984); Bosselman, et al., WO 9105795, published May 2, 1991, entitled "Stem Cell Factor" и Kirkness, et al., WO 95/19985, published July 27, 1995 entitled "Haemopoietic Maturation Factor". Таким образом, активирующий рецептор модифицированный TIE-2-лиганд может быть использован для диагностики или лечения состояний, в которых нормальный гематопоэз подавлен, в том числе, но не только, при анемии, тромбоцитопении, лейкопении и гранулоцитопении. В предпочтительном варианте активирующий рецептор модифицированный TIE-2-лиганд может быть использован для стимуляции дифференцировки клеток-предшественников крови в ситуациях, когда пациент имеет заболевание, такое как синдром приобретенного иммунодефицита (СПИД), которое вызвало уменьшение нормальных уровней клеток крови, или в клинических условиях, в которых желательно увеличение гемопоэтических популяций, таких как состояния, возникающие при пересадке костного мозга или при лечении аплазии или миелосупрессии под действием облучения, химической обработки или химиотерапии.
Активирующие рецептор модифицированные TIE-2-лиганды данного изобретения могут использоваться отдельно или в комбинации с другим фармацевтически активным агентом, таким как, например, цитокины, нейротрофины, интерлейкины и т.д. В предпочтительном варианте эти лиганды могут быть использованы вместе с любым из числа вышеупомянутых факторов, которые, как известно, индуцируют пролиферацию стволовых клеток или других гемопоэтических предшественников, или факторов, действующих на эти клетки в пути гематопоэза, в том числе, но не только, вместе с фактором гемопоэтического созревания, тромбопоэтином, фактором стволовых клеток, эритропоэтином, G-CSF, GM-CSF и т.д.
В альтернативном варианте антагонисты TIE-рецептора используют для диагностики или лечения пациентов, у которых желательным результатом является ингибирование гемопоэтического пути, такого как лечение миелопролиферативных или других пролиферативных нарушений образующих кровь органов, таких как тромбоцитемии, полицитемии и лейкозы. В таких вариантах лечение может включать в себя использование терапевтически эффективного количества модифицированного TIE-2-лиганда, TIE-антитела, TIE-рецептортела, конъюгата модифицированного TIE-2-лиганда или лигандтела или fFc, описанных выше.
Данное изобретение обеспечивает также фармацевтические композиции, содержащие модифицированный TIE-2-лиганд или лигандтела, описанные здесь, их пептидные фрагменты или производные в фармакологически приемлемом носителе. Модифицированные TIE-2-лигандные белки, пептидные фрагменты или производные могут вводиться системно или местно. Может быть использован любой подходящий способ введения, известный в данной области, в том числе, но не только, внутривенный, внутриспинномозговой, внутриартериальный, через нос, пероральный, подкожный, внутрибрюшинный или местная инъекция или хирургический трансплантат. Обеспечены также композиции с пролонгированным действием.
Данное изобретение обеспечивает также антитело, которое специфически связывает такую терапевтическую молекулу. Это антитело может быть моноклональным или поликлональным. Изобретение обеспечивает также способ применения такого моноклонального или поликлонального антитела для измерения количества терапевтической молекулы в пробе, взятой из пациента, с целью мониторинга хода терапии.
Далее, данное изобретение обеспечивает терапевтическую композицию, содержащую модифицированный TIE-2-лиганд или слитый белок лигандтело и конъюгированный с ними цитотоксический агент. В одном варианте цитотоксическим агентом может быть радиоизотоп или токсин.
Данное изобретение обеспечивает также антитело, которое специфически связывает модифицированный TIE-2-лиганд. Это антитело может быть моноклональным или поликлональным.
Далее, данное изобретение обеспечивает способ очистки модифицированного TIE-2-лиганда, включающий в себя:
a) связывание, по меньшей мере, одного TIE-связывающего субстрата с твердым матриксом;
b) инкубирование этого субстрата а) с клеточным лизатом таким образом, что этот субстрат образует комплекс с любым модифицированным TIE-2-лигандом в клеточном лизате;
c) промывание твердого матрикса; и
d) элюирование модифицированного TIE-2-лиганда из связанного субстрата.
Субстрат может быть любым веществом, которое специфически связывает модифицированный TIE-2-лиганд. В одном варианте субстрат выбран из группы, состоящей из антитела против модифицированного TIE-2-лиганда, TIE-рецептора и слитого белка TIE-рецептортело. Кроме того, изобретение обеспечивает слитый белок рецептортело, который специфически связывает модифицированный TIE-2-лиганд, а также терапевтическую композицию, содержащую слитый белок рецептортело в фармацевтически приемлемом носителе, и способ блокирования роста кровеносных сосудов в человеке, предусматривающий введение эффективного количества терапевтической композиции.
Данное изобретение обеспечивает также терапевтическую композицию, содержащую активирующий рецептор модифицированный TIE-2-лиганд или слитый белок лигандтело в фармацевтически приемлемом носителе, а также способ усиления образования новых сосудов в пациенте, предусматривающий введение пациенту эффективного количества этой терапевтической композиции.
Кроме того, данное изобретение обеспечивает способ идентификации клетки, экспрессирующей TIE-рецептор, который предусматривает контактирование клетки с детектируемо меченным модифицированным TIE-2-лигандом или лигандтелом в условиях, делающих возможным связывание детектируемо меченного лиганда с TIE-рецептором, и определение, связывается ли детектируемо меченный лиганд с TIE-рецептором, и идентификацию, тем самым, этой клетки как клетки, экспрессирующей TIE-рецептор. Данное изобретение обеспечивает также терапевтическую композицию, содержащую модифицированный TIE-2-лиганд или слитый белок лигандтело и цитотоксический агент, конъюгированный с ними. Цитотоксическим агентом может быть радиоизотоп или токсин.
Данное изобретение обеспечивает также способ обнаружения экспрессии модифицированного TIE-2-лиганда клеткой, который предусматривает получение мРНК из этой клетки, контактирование мРНК, полученной таким образом, с меченой молекулой нуклеиновой кислоты, кодирующей модифицированный TIE-2-лиганд, в условиях гибридизации, определение присутствия мРНК, гибридизованной с меченой молекулой, и, тем самым, обнаружение экспрессии модифицированного TIE-2-лиганда в этой клетке.
Изобретение обеспечивает далее способ обнаружения экспрессии модифицированного TIE-2-лиганда в срезах ткани, который предусматривает контактирование срезов ткани с меченой молекулой нуклеиновой кислоты, кодирующей модифицированный TIE-2-лиганд, в условиях гибридизации, определение присутствия мРНК, гибридизованной с меченой молекулой, и, тем самым, обнаружение экспрессии модифицированного TIE-2-лиганда в срезах ткани.
ПРИМЕР 1. Идентификация клеточной линии АВAЕ в качестве репортерных клеток для TIE-2-рецептора
Взрослые клетки ВАЕ зарегистрированы в European Cell Culture Repository под ЕСАСС#92010601 (см. PNAS 75:2621 (1978)). Нозерн-анализы (РНК) выявили умеренные уровни


Культивирование АВАЕ клеток и сбор клеточных лизатов проводили следующим образом. Клетки АВАЕ с низким числом пассажей высевали в виде монослоя при плотности 2×106 клеток/150-миллиметровую пластиковую чашку Петри (Falcon) и культивировали в модифицированной по способу Дульбекко среде Игла (DMEM), содержащей 10% фетальную телячью сыворотку (10% BCS), 2 мМ L-глутамин (Q) и 1% каждого из пенициллина и стрептомицина (P-S), в атмосфере 5% СО2. Перед сбором клеточных лизатов клетки выдерживали на бессывороточной среде (голодание) в течение 24 часов в DMEM/Q/P-S, с последующим отсасыванием среды и промыванием чашек охлажденным на льду забуференным фосфатом солевым раствором (PBS) с добавленным к нему орто-ванадатом натрия, фторидом натрия и бензамидином натрия. Клетки лизировали в небольшом объеме этого промывного буфера, к которому был добавлен 1% детергент NP40 и ингибиторы протеаз PMSF и апротинин. Нерастворимые остатки клеток удаляли из клеточных лизатов центрифугированием при 14000 × g в течение 10 минут при 4°С и супренатанты подвергали иммунопреципитации антисыворотками, специфическими для TIE-2-рецептора, в присутствии или в отсутствие блокирующих пептидов, добавленных до ~20 мкг/мл лизата. Иммунопреципитированные белки разделяли электрофорезом в полиакриламидном геле (7,5% гель Laemmli) и затем переносили электроблоттингом на PVDF-мембрану и инкубировали либо с различными TIE-2-специфическими, либо фосфотирозин-специфическими антисыворотками. Белок TIE-2 визуализировали инкубированием этой мембраны со вторичными связанными с пероксидазой хрена антисыворотками с последующей обработкой реагентом ECL (Amersham).
ПРИМЕР 2. Клонирование и экспрессия TIE-2-рецептортела для исследования аффинных взаимодействий TIE-2-лиганда
Была создана экспрессионная конструкция, которая могла бы давать секретируемый белок, состоящий из внеклеточной части крысиного TIE-2-рецептора, слитого с константной областью человеческого иммуноглобулина гамма-1 (IgG1 Fc). Этот слитый белок был назван TIE-2-"рецептортело" (receptorbody) (RB), и можно было ожидать, что он в норме существует в виде димера в растворе в результате образования дисульфидных связей между отдельными хвостами Fc IgGl. Fc-часть TIE-2-RB получали следующим образом. Фрагмент ДНК, кодирующий Fc-часть человеческого IgGl, которая простирается от шарнирной области до карбоксиконца этого белка, амплифицировали из плацентарной кДНК человека при помощи ПЦР с олигонуклеотидами, соответствующими опубликованной последовательности человеческого IgGl; полученный фрагмент ДНК клонировали в плазмидный вектор. Подходящие фрагменты рестрикции ДНК из плазмиды, кодирующей полноразмерный TIE-2-рецептор, и из содержащей Fc человеческого IgGl плазмиды лигировали на каждой стороне короткого полученного при помощи ПЦР фрагмента, который был сконструирован таким образом, чтобы он мог сливать, в рамке считывания, последовательности, кодирующие TIE-2 и белок Fc человеческого IgGl. Таким образом, полученный слитый белок TIE-2-эктодомен-FС точно заменял белком Fc IgGl район, охватывающий трансмембранный и цитоплазматический домены TIE-2. Альтернативный способ получения RB описан в Goodwin, et al., Cell 73:447-456 (1993).
Количества порядка миллиграммов TIE-2-RB получали клонированием фрагмента ДНК TIE-2-RB в бакуловирусный вектор pVL1393 и последующим инфицированием линии клеток насекомого Spodoptera frugiperda SF-21AE. Альтернативно можно использовать клеточную линию SF-9 (ATCC Accession No. CRL-1711) или клеточную линию BTI-TN-5bl-4. ДНК, кодирующую TIE-2-RB, клонировали в виде Eco RI-NotI-фрагмента в бакуловирусную транспортную плазмиду pVL1393. Плазмидную ДНК, очищенную центрифугированием в градиенте плотности хлорида цезия, рекомбинировали в вирусную ДНК смешиванием 3 мкг плазмидной ДНК с 0,5 мкг Baculo-Gold ДНК (Pharminigen) с последующим введением в липосомы с использованием 30 мкг Липофектина (GIBCO BRL). Смеси ДНК-липосомы добавляли к клеткам SF-21AE (2×106 клеток на 60-миллиметровую чашку) в среде TMN-FH (Модифицированная Среда Grace для клеток насекомых (GIBCO BRL)) в течение 5 часов при 27°С с последующим инкубированием при 27°С в течение 5 дней с среде TMN-FH, дополненной 5% фетальной телячьей сывороткой. Среду для культуры ткани собирали для очистки бляшек рекомбинантных вирусов, которую проводили с применением способов, описанных ранее (O'Reilly, D.R., L.K. Miller and V.A. Luckow, Baculovirus Expression Vectors - A Laboratory Manual, 1992, New York: W.H. Freeman) за исключением того, что покрывающий слой агарозы содержал 125 мкг/мл Х-gа1 (5-бром-4-хлор-3-индолил-β -D-галактопиранозид; GIBCO-BRL). После 5 дней инкубирования при 27°С нерекомбинантные бляшки оценивали в баллах при помощи позитивной хромогенной реакции с X-gal-субстратом и их положения маркировали. Затем рекомбинантные бляшки визуализировали добавлением второго покрывающего слоя, содержащего 100 мкг/мл МТТ (бромид 3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия; Sigma). Предполагаемые бляшки рекомбинантного вируса вынимали отсасыванием пробок и очищали многочисленными циклами выделения бляшек для гарантии гомогенности. Исходные линии вируса получали серийным пассажем с низкой множественностью заражения очищенного из бляшек вируса. Получали линии с низким числом пассажей одного вирусного клона (vTIE-2-рецептортело).
Клетки SF-21AE культивировали в бессывороточной среде (SF-900 II, Gibco DRL), содержащей 1 × раствор антибиотика/фунгицида (Gibco BRL) и 25 мг/мл Гентамицина (Gibco BRL). Pluronic A-68 (блоксополимер полиоксиэтилена и полиоксипропилена) добавляли в качестве поверхностно-активного вещества до конечной концентрации 1 г/л. Культуры (4 л) выращивали в биореакторе (Artisan Cell Station System) в течение, по меньшей мере, трех дней перед инцициированием. Клетки выращивали при 27°С с пропусканием газа до 50% растворенного кислорода при скорости тока газа 80 мл/мин (аэрация при барботирующем кольце). Перемешивание проводили marine мешалкой при скорости 100 об/мин. Клетки собирали в середине фазы логарифмического роста (~2×106 клеток/мл), концентрировали центрифугированием и инфицировали 5 бляшкообразующими единицами слитого белка vTIE-2-рецептортела на клетку. Клетки и инокулят доводили до 400 мл свежей средой и вирус адсорбировали в течение 2 часов при 27°С во вращаемой колбе. Затем эту культуру ресуспендировали в конечном объеме 8 л со свежей бессывороточной средой и клетки инкубировали в биореакторе с применеием описанных выше условий.
Культуральную среду от инфицированных слитым белком vTIE-2-рецептортело клеток SF21AE собирали центрифугированием (500 × g, 10 минут) при 72 часах после инфицирования. Клеточные супернатанты доводили до рН 8 NaOH. Добавляли ЭДТА до конечной концентрации 10 мМ и рН супернатанта повторно доводили до 8. Супернатанты фильтровали (0,45 мкм, Millipore) и наносили на протеин А-колонку (protein A sepharose 4 fast flow или HiTrap protein А, оба от Pharmacia). Колонку промывали PBS, содержащим 0,5 M NaCl, пока поглощение при 280 нм не уменьшалось до фона. Колонку промывали PBS и элюировали 0,5 М уксусной кислотой. Фракции, элюированные с колонки, собирали в пробирки, содержащие для нейтрализации 1 М Трис рН 9. Фракции пиков, содержащие слитый белок TIE-2-рецептортело, объединяли и диализовали против PBS.
ПРИМЕР 3. Демонстрация того, что TIE-2 играет решающую роль в развитии сосудистой сети
Выяснение функции TIE-2- было достигнуто путем введения "избытка" растворимого TIE-2-рецептортела (TIE-2-RB) в развивающуюся систему. Потенциальная способность TIE-2-RB связывать и тем самым нейтрализовать доступный TIE-2-лиганд приводит к наблюдаемому разрушению нормального развития сосудистой сети и нормальных свойств этого лиганда. Для выяснения, можно ли использовать TIE-2-RB для нарушения развития сосудов в ранних куриных эмбрионах, небольшие кусочки биологически ресорбируемой пены пропитывали TIE-2-RB и вводили сразу же под хориоаллантоисную мембрану в положениях непосредственно сбоку от недифференцированного эмбриона.
Ранние куриные эмбрионы развиваются на верхней части желтка из небольшого диска клеток, который покрыт хориоаллантоисной мембраной (САМ). Эндотелиальные клетки, которые будут выстилать сосуды в эмбрионе, возникают из источников как внеэмбриональных, так и внутриэмбриональных клеток. Внеэмбриональные эндотелиальные клетки, которые обеспечивают основной источник эндотелиальных клеток в эмбрионе, происходят из срастаний мезенхимы, которая расположена латерально вокруг собственно эмбриона, непосредственно под САМ. Когда эти мезенхимные клетки созревают, они дают начало общему предшественнику как эндотелиальной, так и гемопоэтической линий дифференцировки, называемому гемангиобластом. В свою очередь, гемангиобласт дает начало смешанной популяции ангиобластов (предшественников эндотелиальных клеток) и гематобластов (полипотентных гемопоэтических предшественников). Образование зачатков кровеносной системы начинается, когда предшественники эндотелиальных клеток расщепляются с образованием пузырька толщиной в одну клетку, который окружает недифференцированные клетки крови. Пролиферация и миграция этих клеточных компонентов со временем продуцирует сеть заполненных кровью микрососудов под САМ, которые будут в конце концов проникать в эмбрион для соединения с ограниченными образующимися внутриэмбрионально сосудистыми элементами.
Свежеоплодотворенные куриные яйца, полученные из Spatas Inc. (Boston, MA), инкубировали при 99,5°F и 55% относительной влажности. При приблизительно 24 часах развития скорлупу яйца протирали 70% этанолом и стоматологическим сверлом проделывали отверстие 1,5 см в тупой верхней части каждого яйца. Мембрану скорлупы удаляли для открывания воздушного пространства непосредственно над эмбрионом. Небольшие прямоугольные кусочки стерильной Gelfoam (Upjohn) вырезали скальпелем и пропитывали в одинаковых концентрациях TIE-2- или ЕНК-1-рецептортела. ЕНК-1-рецептортело было приготовлено, как описано в Примере 2, с использованием внеклеточного домена ЕНК-1 вместо внеклеточного домена TIE-2 (Maisonpierre et al., Oncogene 8:3277-3288 (1993)). Каждый кусочек Gelfoam поглощал приблизительно 6 мкг белка в 30 мкл. Стерильные пинцеты для наблюдения использовали для проделывания небольшого разреза в САМ в положении на расстоянии нескольких миллиметров сбоку от недифференцированного зародыша. Больший кусок пропитанной RB Gelfoam вводили под САМ, и яичную скорлупу закрывали герметично сверху куском липкой ленты. Другие подобным образом обработанные яйца обрабатывали RB посторонней, экспрессируемой нейронами рецепторной тирозинкиназы, ЕНК-1 (Maisonpierre et al., Oncogene 8:3277-3288 (1993)). Развитию давали проходить в течение 4 дней и затем эмбрионы подвергали визуальному обследованию. Эмбрионы удаляли осторожным разбиванием скорлупы в чашках с подогретым PBS и осторожным вырезанием эмбриона с окружающей САМ. Из 12 яиц, обработанных каждым из RB, 6 обработанных TIE-2-RB и 5 обработанных EHK-1-RB эмбрионов развились далее стадии, наблюдаемой в начале эксперимента. Драматичное различие наблюдали между этими развившимися эмбрионами, как показано на Фиг.1А и 1В. Эмбрионы, обработанные EHK-1-RB, по-видимому, развивались относительно нормально. Четыре из эмбрионов ЕНК-1 были жизнеспособными, что оценивали по пульсации сердца. Кроме того, внеэмбриональная сосудистая сеть, визуально обнаруживаемая вследствие присутствия эритроцитов, была обильной и простиралась на несколько сантиметров латерально под САМ. В противоположность этому, эмбрионы, обработанные TIE-2-RB, были сильно задержаны в росте, имея 2-5 мм в диаметре, в сравнении с диаметром >10 мм для обработанных EHK-1-RB эмбрионов. Все обработанные TIE-2-RB эмбрионы были мертвыми и их САМ не содержала кровеносных сосудов. Способность TIE-2-RB блокировать развитие сосудов в куриных эмбрионах показала, что TIE-2-лиганд является необходимым для развития сосудистой сети.
ПРИМЕР 4. Идентификация TIE-2-специфической связывающей активности в кондиционированной среде от линии мышиных миобластных клеток С2С12, трансформированных rac-онкогеном
Скрининг 10-кратно концентрированных клеточно-кондиционированных сред (10 × ССМ) от различных клеточных линий в присутствии растворимой TIE-2-специфической связывающей активности (BIAcore; Pharmacia Biosensor, Pitcataway, NJ) выявил связывающую активность в бессывороточной среде от клеток С2С12, трансформированных онкогенным ras (C2C12-

10 × ССМ C2C12-


Связывающую активность 10 × ССМ измеряли при помощи биосенсорной технологии (BIAcore; Pharmacia Biosensor, Piscataway, NJ), которая подвергает мониторингу биомолекулярные взаимодействия в реальном масштабе времени через поверхностный плазмоновый резонанс. Очищенный TIE-2-RB связывали ковалентно через первичные амины со слоем карбоксиметилдекстрана сенсорного кристалла СМ5 research grade (Pharmacia Biosensor, Piscataway, NJ). Поверхность сенсорного кристалла активировали при помощи смеси N-гидроксисукцинимида (NHS) и N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) с последующей иммобилизацией TIE-2-RB (25 мкг/мл, рН 4,5) и деактивацией непрореагировавших сайтов 1,0 М этаноламином (рН 8,5). Негативную контрольную поверхность ЕНК-1-рецептор-антитела получали сходным образом.
Используемым в этой системе буфером подвижной фазы был HBS (10 мМ Hepes, 3,4 мМ ЭДТА, 150 мМ NaCl, 0,005% поверхностно-активное вещество Р20, рН 7,4). Пробы 10 х ССМ центрифугировали в течение 15 минут при 4°С и затем осветляли при помощи стерильного, связывающего низкомолекулярный белок фильтра 0,45 мкм (Millipore; Bedford, МА). К каждой пробе СММ добавляли декстран (2 мг/мл) и поверхностно-активное вещество Р20 (0,005%). Аликвоты 40 мкл инъецировали через поверхность с иммобилизованными белками (TIE-2 или ЕНК-1) при скорости тока 5 мкл/мин и связывание рецептора наблюдали в течение 8 минут. Активность связывания (резонансные единицы, РЕ) измеряли как разность между фоновой величиной, определенной за 30 с до инъекции пробы, и измерением, выполненным через 30 секунд после инъекции. Регенерацию поверхности выполняли одним 12 мкл-импульсом 3 М MgCl2.
Уровень шума прибора равен 20 РЕ; таким образом, любая активность связывания с сигналом выше 20 РЕ может интерпретироваться как реальное взаимодействие с рецептором. Для С2С12-


ПРИМЕР 5. C2C12-ras CMM содержит активность, которая индуцирует фосфорилирование тирозина TIE-2-рецептора
C2C12-



Клетки АВАЕ, инкубированные в течение 10 минут с определенной средой, не обнаружили индукции фосфорилирования тирозина TIE-2, тогда как инкубирование с C2C12-


ПРИМЕР 6. Экспрессионное клонирование TIE-2-лиганда
Клетки COS-7 культивировали в модифицированной по способу Дульбекко среде Игла (DMEM), содержащей 10% фетальную телячью сыворотку (ФТС), 1% каждого из пенициллина и стрептомицина (P/S) и 2 мМ глутамин, в атмосфере 5% CO2. Мышиную клеточную линию миобластов С2С12
Клетки COS-7 временно трансфицировали либо библиотекой pJFE14, либо контрольным вектором по протоколу ДЭАЭ-декстран-трансфекции. Вкратце, клетки COS-7 высевали при плотности 1,0×106 клеток/100-миллиметровую чашку за 24 часа перед трансфекцией. Для трансфекции эти клетки культивировали в бессывороточной DMEM, содержащей 400 мкг/мл ДЭАЭ-декстрана, 1 мкМ хлорохина и 2 мМ глутамина, и 1 мкг подходящей ДНК, в течение 3-4 часов при 37°С в атмосфере 5% СО2 . Среду для трансфекции отсасывали и заменяли PBS с 10% ДМСО на 2-3 минуты. После этого ДМСО-"шока" клетки COS-7 помещали в DMEM с 10% ФТС, 1% каждого из пенициллина и стрептомицина и 2 мМ глутамином и культивировали в течение 48 часов.
Поскольку TIE-2-лиганд секретируется, было необходимо сделать клетки проницаемыми для детектирования связывания зонда-рецептортело с лигандом. Через 2 дня после трансфекции клетки промывали PBS и затем инкубировали с PBS, содержащим 1,8% формальдегид, в течение 15-30 минут при комнатной температуре. Затем клетки промывали PBS и инкубировали в течение 15 минут с PBS, содержащим 0,1% Тритона Х-100 и 10% телячью сыворотку, для того, чтобы сделать клетки проницаемыми и блокировать сайты неспецифического связывания.
Скрининг проводили прямой локализацией окрашивания с использованием TIE-2-рецептортела (RB), которое состоит из внеклеточного домена TIE-2, слитого с константной областью IgG1. Это рецептортело получали, как описано в Примере 2. Чашку, диаметром 100 мм, с трансфицированными, фиксированными и проницаемыми клетками COS- зондировали путем инкубирования их в течение 30 минут с TIE-2-RB. Затем клетки промывали дважды PBS и инкубировали еще 30 минут с PBS/10% ФТС/конъюгат IgG человека со щелочной фосфатазой. После трех промывок PBS клетки инкубировали в субстрате для щелочной фосфатазы в течение 30-60 минут. Затем чашку просматривали под микроскопом для обнаружения присутствия окрашенных клеток. Для каждой окрашенной клетки небольшую зону клеток, включающую в себя окрашенные клетки, выскребали из чашки кончиком пластиковой пипетки и затем выделяли плазмидную ДНК, и использовали ее для электропорации бактериальных клеток. Отдельные бактериальные колонии, полученные при электропорации, выскребали, и плазмидную ДНК, полученную из этих колоний, использовали для трансфекции клеток COS-7, которые зондировали на экспрессию TIE-2-лиганда, обнаруживаемую по связыванию с TIE-2-рецептортелами. Это позволило идентифицировать отдельные клоны, кодирующие TIE-2-лиганд. Подтверждение экспрессий TIE-2-лиганда получали путем фосфорилирования TIE-2-рецептора с применением способа, описанного в Примере 5. Плазмидный клон, кодирующий TIE-2-лиганд, был депонирован в АТСС 7 октября 1994 года и обозначен как "pJFE14, кодирующий TIE-2-лиганд", под номером доступа АТСС Accession No. 75910.
ПРИМЕР 7. Выделение и секвенирование полноразмерного кДНК-клона, кодирующего TIE-2-ЛИГАНД человека
Библиотеку кДНК легкого эмбриона человека в лямбда gt-10 (см. Фиг.3) получили из Clontech Laboratories, Inc. (Palo Alto, CA). Бляшки высевали при плотности 1,25 × 106/чашку 20×20 см и фильтры-реплики получали согласно стандартным процедурам (Sambrook, et al. (1989) Molecular Cloning: A Laboratory Manual, 2nd Ed., page 8.46, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York).
Выделение клонов человеческого



Субклонирование ДНК человеческого

Кодирующий район htie-2-лиганд 1 из клона λgt10 секвенировали при помощи секвенатора ДНК ABI 373А и набора для секвенирования Taq Dideoxy Terminator Cycle (Applied Biosystems, Inc., Foster City, CA). Нуклеотидная и соответствующая ей аминокислотная последовательность человеческого TIE-2-лиганда из клона λgt10, кодирующего htie-2-лиганд 1, показаны на Фиг.4.
Кроме того, полноразмерные кДНК-клоны htie-2-лиганда 1 были получены скринингом библиотеки кДНК глиобластомы T98G человека в векторе pJFE14. Клоны, кодирующие TIE-2-лиганд человека, идентифицировали ДНК-гибридизацией с применением фрагмента XhoI 2,2 т.п.н. из депонированного клона tie-лиганда 2 (АТСС No 75910) в качестве зонда (см. Пример 6 выше). Кодирующий район секвенировали при помощи секвенатора ДНК ABI 373А и набора для секвенирования Taq Dideoxy Terminator Cycle (Applied Biosystems, Inc., Foster City, CA). Эта последовательность была почти идентична последовательности клона λgt10, кодирующего htie-2-лиганд 1. Как показано на Фиг.4, клон λgt10, кодирующий htie-2-лиганд 1, содержит дополнительный остаток глицина, который кодируется нуклеотидами 1114-1116. Кодирующая последовательность клона T98G не содержит этого остатка глицина, но в остальном идентична кодирующей последовательности клона λgt10, кодирующего htie-2-лиганд 1. Фиг.5 показывает нуклеотидную и соответствующую ей аминокислотную последовательность человеческого TIE-2-лиганда из клона T98G.
ПРИМЕР 8. Выделение и секвенирование второго полноразмерного кДНК-клона, кодирующего TIE-2-лиганд человека
Библиотеку кДНК легкого эмбриона человека в лямбда gt-10 (см. Фиг.3) получили из Clontech Laboratories, Inc., (Palo Alto, CA). Бляшки высевали при плотности 1,25×106/чашку 20×20 см и фильтры-реплики получали согласно стандартным процедурам (Sambrook et al.; (1989) Molecular Cloning: A Laboratory Manual, 2nd Ed., page 8.46, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York). Фильтры в двух поверхностях подвергали скринингу в относительно нестрогих условиях (2 × SSC, 55°С) с помощью зондов, приготовленных для последовательности TIE-2-лиганда человека. Одни из фильтров-дубликатов анализировали с помощью 5'-зонда, кодирующего аминокислоты 2-265 TIE-2-лиганда человека, как показано на Фиг.4. Второй фильтр-дубликат анализировали с помощью 3'-зонда, кодирующего аминокислоты 282-498 последовательности TIE-2-лиганда человека (см. Фиг.4). Оба зонда гибридизовали при 55°С в растворе для гибридизации, содержащем 0,5 мг/мл ДНК спермы лосося. Фильтры промывали в 2 × SSC при 55°С и экспонировали в течение ночи на рентгеновской пленке. Кроме того, фильтры-дубликаты гибридизовали также при нормальной строгости (2 × SSC, 65°С) с полноразмерным кодирующим зондом мышиного TIE-2-лиганда 1 (F3-15, XhoI-вставка). Выскребали три позитивных клона, которые удовлетворяли следующим критериям: i) гибридизации не наблюдали с полноразмерным (мышиным) зондом при нормальной строгости, и ii) гибридизацию наблюдали при низкой строгости с зондами 5' и 3'. Расщепление EcoRI ДНК фага, полученной из этих клонов, показало два независимых клона с размерами вставки приблизительно 2,2 т.п.н. и приблизительно 1,8 т.п.н. Вставку EcoRI 2,2 т.п.н. субклонировали в сайты EcoRI как pBluescript KS (Stratagene), так и экспрессирующего вектора млекопитающего, пригодного для использования в клетках COS. Для экспрессирующего вектора млекопитающего были обнаружены две ориентации. Вставка 2,2 т.п.н. в pBluescript KS была депонирована в АТСС 9 декабря 1994 года и названа pBluescript KS, кодирующая TIE-2-лиганд 2 человека. Стартовый сайт кодирующей последовательности TIE-2-лиганда 2 находится приблизительно на расстоянии 355 п.н. по ходу транскрипции от сайта EcoRI pBluescript.
Клетки COS-7 трансфицировали либо экспрессирующим вектором, либо контрольным вектором согласно протоколу ДЭАЭ-декстран-трансфекции. Вкратце, клетки COS-7 высевали при плотности 1,0×106 клеток/100-миллиметровую чашку за 24 часа перед трансфекцией. Для трансфекции эти клетки культивировали в бессывороточной DMЭM, содержащей 400 мкг/мл ДЭАЭ-декстрана, 1 мкМ хлорохин и 2 мМ глутамин и 1 мкг подходящей ДНК, в течение 3-4 часов при 37°С в атмосфере 5% CO2. Среду для трансфекции отсасывали и заменяли PBS с 10% ДМСО на 2-3 минуты. После этого ДМСО-"шока" клетки COS-7 помещали в DMEM с 10% ФТС, 1% каждого из пенициллина и стрептомицина и 2 мМ глутамином и культивировали в течение 48 часов.
Поскольку TIE-2-лиганд секретируется, было необходимо сделать клетки проницаемыми для детектирования связывания зонда-рецептортело с лигандом. Трансфицированные клетки COS-7 высевали при плотности 1,0×106 клеток/чашку 100 мм. Клетки промывали PBS и затем инкубировали с PBS, содержащим 1,8% формальдегид, в течение 15-30 минут при комнатной температуре. Затем клетки промывали PBS и инкубировали в течение 15 минут с PBS, содержащим 0,1% Тритон Х-100 и 10% телячью сыворотку, для того, чтобы сделать клетки проницаемыми и блокировать сайты неспецифического связывания.
Скрининг проводили прямой локализацией окрашивания с использованием TIE-2-рецептортела, которое состояло из внеклеточного домена TIE-2, слитого с константной областью IgGl. Это рецептортело получали, как описано в Примере 2. Трансфицированные клетки COS-7 зондировали путем инкубирования их в течение 30 минут с TIE-2-рецептортелом. Затем клетки промывали дважды PBS, фиксировали метанолом и затем инкубировали еще 30 минут с PBS/10% ФТС/конъюгат IgG человека со щелочной фосфатазой. После трех промывок PBS клетки инкубировали в субстрате для щелочной фосфатазы в течение 30-60 минут. Затем чашку просматривали под микроскопом для обнаружения присутствия окрашенных клеток. Наблюдали, что клетки, экспрессирующие одну ориентацию клона, но не другую ориентацию клона, связывают TIE-2-рецептортело.
Специалисту в данной области будет понятно, что описанные способы могут быть использованы для дальнейшей идентификации других родственных членов семейства TIE-лигандов.
Кодирующий район из клона pBluescript KS, кодирующего TIE-2-лиганд 2 человека, секвенировали при помощи секвенатора ДНК АВ1 373А и набора для секвенирования Tag Dideoxy Terminator Cycle Sequencing Kit (Applied Biosystems, Inc. Foster City, CA).
Нуклеотидная и соответствующая ей аминокислотная последовательность человеческого TIE-2-лиганда из клона pBluescript KS, кодирующего TIE-2-лиганд 2 человека, показаны на Фиг.6.
ПРИМЕР 9. TIE-2-лиганд 2 является антагонистом рецептора
Кондиционированные среды от клеток COS, экспрессирующих либо TIE-2-лиганд 2 (TL2), либо TIE-2-лиганд 1 (TL1), сравнивали по их способности активировать TIE-2-рецепторы, природно присутствующие в эндотелиальных клеточных линиях человека.
Липофектаминовый реагент (GIBCO BRL, Inc.) и рекомендуемые протоколы использовали для трансфекции клеток COS-7 либо одним экспрессирующим вектором pJFE14, вектором pJFE14, содержащим кДНК TIE-2-лиганда 1 человека, либо экспрессирующим вектором рМТ21 (Kaufman, R.J., 1985, Proc. Natl. Acad. Sci. USA 82:689-693), содержащим кДНК TIE-2-лиганда 2 человека. COS-среды, содержащие секретированные лиганды, собирали после трех дней и концентрировали в 20 раз диафильграцией (ультрафильтрационные мембраны DIAFLO, Amicon, Inc.). Количество активных TIE-2-лиганда 1 и TIE-2-лиганда 2, присутствующих в этих средах, определяли и выражали в виде количества (в резонансных единицах, РЕ) активности TIE-2-рецептор-специфического связывания, измеренной в тесте связывания BIAcore.
Нозерн (РНК)-анализы выявили значимые уровни TIE-2-транскриптов в эндотелиальных клетках НАЕС (Human Aortic Endothelial Cell) (Clontech, Inc). Таким образом, эти клетки использовали для исследования, является ли TIE-2-рецептор фосфорилированным по тирозину при экспонировании со средами COS, содержащими TIE-2-лиганды. Клетки НАЕС поддерживали в полной среде для выращивания эндотелиальных клеток (Clontech, Inc.), которая содержала 5% фетальную телячью сыворотку, растворимый экстракт бычьего мозга, 10 нг/мл человеческого EGF, 1 мг/мл гидрокортизона, 50 мг/мл гентамицина и 50 нг/мл амфотерицина-В. Оценку, может ли TL1 и TL2 активировать TIE-2-рецептор в клетках НАЕС, выполняли следующим образом. Полуконфлюентные клетки НАЕС выдерживали на бессывороточной среде (голодание) в течение 2 часов, в среде Дульбекко MEM с высоким содержанием глюкозы с добавленными L-глутамином и пенициллином-стрептомицином, при 37°С с последующей заменой среды для голодания лигандсодержащей кондиционированной COS-средой в течение 7 минут при 37°С в термостате с 5% СО2. Затем эти клетки лизировали и TIE-2-рецепторный белок извлекали иммунопреципитацией лизатов антисывороткой против TIE-2-пептида, точно так, как описано в Примере 1. Результаты представлены на Фиг.7. Уровни фосфотирозина на TIE-2-рецепторе (TIE-2-R) индуцировались обработкой клеток COS-средами, кондиционированными TIE-2-лигандом 1 (Дорожка L1), но не TIE-2-лигандом 2 (Дорожка L2). MOCK представляет собой кондиционированную среду от клеток COS-7, трансфицированных пустым вектором pJFE14.
Доказательство того, что как TL1, так и TL2 специфически связываются с TIE-2-рецептором, было продемонстрировано с использованием BIAcore для определения активностей TIE-2-рецептор-специфического связывания в трансфицированных COS-средах и иммуноокрашиванием экспрессирующих TL1 и TL2 клеток COS TIE-2-рецептортелами.
Поскольку TL2 не активировал TIE-2-рецептор, заявители решили определить, может ли TL2 быть способным служить антагонистом активности TL1. Выполняли тесты фосфорилирования клеток НАЕС, в которых клетки сначала инкубировали с "избытком" TL2, а потом добавляли разведенный TL1. Это обосновано тем, что первичное занятие TIE-2-рецептора вследствие высоких уровней TL2 может предотвращать последующую стимуляцию рецептора после экспонирования в TL1, присутствующего в лимитирующей концентрации.
Полуконфлюентные клетки НАЕС находились на бессывороточной среде (голодание), как описано выше, и затем их инкубировали в течение 3 минут при 37°С с 1-2 мл кондиционированной 20 × COS/pJFE14-TL2-среды. Контрольные чашки обрабатывали 20 × COS/pJFE14 - только средой (MOCK). Чашки вынимали из термостата и затем добавляли различные разведения среды COS/pJFE14-TLl с последующим дальнейшим инкубированием чашек в течение 5-7 минут при 37°С. Затем клетки промывали, лизировали и TIE-2-специфическое фосфорилирование тирозина в лизатах определяли иммунопреципитацией рецептора и Вестерн-блоттингом, как описано выше. Разведения TL1 выполняли с использованием среды COS/pJFE14-TLl, разведенной до 2х, 0,5х, 0,1х или 0,02х добавлением среды 20 × COS/pJFE14 - только. Анализ исходных 20х TL1 и 20х TL2 СОS-сред при помощи биосенсорной технологии BIAcore показал, что они содержали одинаковые количества активностей TIE-2-специфического связывания, т.е. 445 РЕ и 511 РЕ для TL1 и TL2 соответственно. Результаты антител против фосфотирозина в Вестерн-блоттинге, показанные на Фиг.8, показывают, что при сравнении с предварительной обработкой клеток НАЕС средой MOCK (дорожка 1) предварительная обработка клеток НАЕС избытком TIE-2-лиганда 2 (дорожка 2) противодействует (оказывает антагонистическое действие) последующей способности разбавленного TIE-2-лиганда 1 активировать TIE-2-рецептор (TIE-2-R).
Способность TL2 конкурентно ингибировать активацию TL1 TIE-2-R была продемонстрирована далее с использованием гибридной линии клеток человека, ЕА.Hy926 (см. Пример 21 в отношении подробного описания этой клеточной линии и ее поддержания). Проводили эксперименты, в которых неконцентрированную среду для клеток COS, содержащую ТL1, смешивали при различных разведениях либо со средой MOCK, либо со средой, кондиционированной TL2, и помещали на монослои голодавших (в бессывороточной среде) клеток EA.hy926 на 5 минут при 37°С. Затем эти среды удаляли, клетки собирали посредством лизиса и TIE-2-специфическое фосфорилирование тирозина исследовали при помощи Вестернблотов, как описано выше. Фиг.9 показывает эксперимент, который содержит три группы обработок, при рассмотрении слева направо. Как показано в четырех дорожках слева, обработка клеток EA.hy926 одной средой lx COS-TL1 сильно активировала эндогенный TIE-2-R в этих клетках, тогда как lx TL2 СОS-среда была неактивной. Однако смесь TL1 либо с MOCK, либо с TL2 показала, что TL2 может блокировать активность TL1 зависимым от дозы образом. В центральных трех парах дорожек отношение TL2 (или MOCK) уменьшалось, тогда как количество TL1 в смеси соответственно увеличивалось с 0,1х до 0,3х. При любом из этих отношений смесей дорожки TL1:TL2 показали уменьшенный уровень фосфорилирования TIE-2-R по сравнению с уровнем фосфорилирования соответствующих дорожек TL1:MOCK. Однако, когда количество TL1 поддерживалось постоянным, а количество TL2 (или MOCK) уменьшалось (показано в трех парах дорожек справа), достигалась точка, при которой TL2 в пробе был слишком разведенным для эффективного ингибирования активности TL1. Относительное количество каждого лиганда, присутствующего в этих кондиционированных COS-средах, можно было бы оценить из их единиц связывания, измеренных анализом BIAcore, или из Вестерн-блотов COS-сред с лиганд-специфическими антителами. Таким образом, мы можем сделать вывод, что для эффективного блокирования активности ТL1 in vitro требуется лишь небольшой молярный избыток (в несколько раз) TL2. Это важно, так как мы наблюдали отдельные примеры in vivo (см. Пример 17 и Фиг.16), в которых мРНК TL2 достигают значительных количеств относительно количеств TL1. Таким образом, TL2 может играть важную физиологическую роль в эффективном блокировании передачи сигнала TIE-2-R в этих сайтах.
Взятые вместе, эти данные подтверждают, что в отличие от TL1, TL2 неспособен стимулировать эндогенно экспрессируемый TIE-2-R на эндотелиальных клетках. Кроме того, при небольшом (в небольшое число раз) молярном избытке TL2 может блокировать стимуляцию TL1 TIE-2-рецептора, что свидетельствует о том, что TL2 является природно встречающимся антагонистом TIE-2-рецептора.
ПРИМЕР 10. Идентификация TIE-2-специфической связывающей активности в кондиционированной среде и супернатантах клеток COS
Связывающую активность 10 × ССМ от клеточных линий C2C12-


Используемым в этой системе буфером подвижной фазы был HBS (10 мМ Hepes, 150 мМ NaCl, 0,005% поверхностно-активное вещество Р20, рН 7,4). Пробы центрифугировали в течение 15 минут при 4°С и затем осветляли при помощи стерильного, связывающего низкомолекулярный белок, фильтра 0,45 мкм (Millipore; Bedford, MA). К каждой пробе СММ добавляли декстран (2 мг/мл) и поверхностно-активное вещество Р20 (0,005%). Аликвоты 40 мкл инъецировали через поверхность с иммобилизованными белками (либо крысиным, либо человеческим TIE-2) при скорости тока 5 мкл/мин и связывание рецептора наблюдали в течение 8 минут. Активность связывания (резонансные единицы, РЕ) измеряли как разность между фоновой величиной, определенной за 30 с до инъекции пробы, и измерением, выполненным через 30 секунд после инъекции. Регенерацию поверхности выполняли одним 15 мкл-импульсом 3 М MgCl2.
ССМ-пробы (C2C12-

ПРИМЕР 11. TIE-2-RB специфически блокирует активацию TIE-2-рецептора TIE-2-лигандом 1
Заявители пытались определить, может ли TIE-2-RB служить в качестве конкурентного ингибитора для блокирования TIE-2-рецептора TIE-2-лигандом 1 (TL1). Для этого TLl-содержащие COS-среды предынкубировали либо с TIE-2-RB, либо с TrkB-RB и затем сравнивали их способность активировать TIE-2-рецепторы, природно присутствующие в линии эндотелиальных клеток человека.
Кондиционированные COS-среды получали от клеток COS-7, трансфицированных либо одним экспрессирующим вектором pJFE14 (MOCK), либо вектором pJFE14, содержащим кДНК TIE-2-лиганда 1 (TL1) человека, и собирали, как описано в Примере 9 выше, за исключением того, что эти среды стерильно фильтровали, но не концентрировали. Количество TL1 определяли и выражали в виде (в резонансных единицах, РЕ) TIE-2-рецептор-специфической связывающей активности, измеренной тестом связывания BIAcore.
Нозерн (РНК)-анализы выявили значимые уровни
ПРИМЕР 12. Конструирование TIE-2-лигандтел
Была создана экспрессионная конструкция, которая может давать секретируемый белок, состоящий из полной кодирующей последовательности TIE-2-лиганда 1 (TL1) человека или TIE-2-лиганда 2 (TL2) человека, слитой с константной областью иммуноглобулина гамма-1 человека (IgG Fc). Эти слитые белки названы TIE-2-"лигандтелами" (TLl-Fc или TL2-Fc). Fc-часть TLl-Fc и TL2-Fc получали следующим образом. Фрагмент ДНК, кодирующий Fc-часть человеческого IgG1, который простирается от шарнирной области до карбоксиконца этого белка, амплифицировали из плацентарной кДНК человека при помощи ПЦР с олигонуклеотидами, соответствующими опубликованной последовательности человеческого IgG1; полученный фрагмент ДНК клонировали в плазмидный вектор. Подходящие фрагменты рестрикции ДНК из плазмиды, кодирующей полноразмерный TL1 или TL2, и из содержащей Fc человеческого IgG1 плазмиды лигировали на каждой стороне короткого, полученного при помощи ПЦР, фрагмента, который был сконструирован таким образом, чтобы он мог сливать в рамке считывания последовательности, кодирующие TL1 или TL2, с белком Fc человеческого IgG1.
Количества порядка миллиграммов TL2-2-FC получали клонированием фрагмента ДНК TL2-Fc в бакуловирусный вектор pVL1393 и последующим инфицированием линии клеток насекомого Spodoptera frugiperda SF-21AE. Альтернативно можно использовать клеточную линию SF-9 (ATCC Accession No. CRL-1711) или клеточную линию BTI-TN-5bl-4. ДНК, кодирующую TL2-2-Fc, клонировали в виде Есо RI-NotI-фрагмента в бакуловирусную транспортную плазмиду pVL1393. Плазмидную ДНК рекомбинировали в вирусную ДНК смешиванием 3 мкг плазмидной ДНК с 0,5 мкг Baculo-Gold ДНК (Pharminigen) с последующим введением в липосомы с использованием 30 мкг Липофектина (GIBCO BRL). Смеси ДНК-липосомы добавляли к клеткам SF-21AE (2×106 клеток на 60-миллиметровую чашку) в среде TMN-FH (Модифицированная Среда Grace для клеток насекомых (GIBCO BRL)) в течение 5 часов при 27°С с последующим инкубированием при 27°С в течение 5 дней с среде TMN-FH, дополненной 5% фетальной телячьей сывороткой. Среду для культуры ткани собирали для очистки бляшек рекомбинантных вирусов, которую проводили с применением способов, описанных ранее (O'Reilly, D.R., L.К. Miller and V.A. Luckow, Baculovirus Expression Vectors-A Laboratory Manual, 1992, New York: W.H. Freeman) за исключением того, что покрывающий слой агарозы содержал 125 мкг/мл X-gal (5-бром-4-хлор-3-индолил-β -D-галактопиранозид; GIBCO-BRL). После 5 дней инкубирования при 27°С нерекомбинантные бляшки оценивали в баллах при помощи позитивной хромогенной реакции с X-gal-субстратом и их положения маркировали. Затем рекомбинантные бляшки визуализировали добавлением второго покрывающего слоя, содержащего 100 мкг/мл МТТ (бромид 3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия; Sigma). Предполагаемые бляшки рекомбинантного вируса вынимали отсасыванием пробок и очищали многочисленными циклами выделения бляшек для гарантии гомогенности. Исходные линии вируса получали серийным пассажем с низкой множественностью заражения очищенного из бляшек вируса. Получали исходные линии с низким числом пассажей одного вирусного клона (vTL2-Fc Clone # 7).
Клетки SF-21AE культивировали в бессывороточной среде (SF-900 II, Gibco BRL), содержащей 1 × раствор антибиотика/фунгицида (Gibco BRL) и 25 мг/мл Гентамицина (Gibco BRL). Pluronic A-68 (блоксополимер полиоксиэтилена и полиоксипропилена) добавляли в качестве поверхностно-активного вещества до конечной концентрации 1 г/л. Культуры (4 л) выращивали в биореакторе (Artisan Cell Station System) в течение, по меньшей мере, трех дней перед инфицированием. Клетки выращивали при 27°С с пропусканием газа до 50% растворенного кислорода при скорости тока газа 80 мл/мин (аэрация при барботирующем кольце). Перемешивание проводили marine мешалкой при скорости 100 об/мин. Клетки собирали в фазе середины логарифмического роста (~2×106 клеток/мл), концентрировали центрифугированием и инфицировали 5 бляшкообразующими единицами слитого белка vTL2-Fc на клетку. Клетки и инокулят доводили до 400 мл свежей средой и вирус адсорбировали в течение 2 часов при 27°С во вращаемой колбе. Затем эту культуру ресуспендировали в конечном объеме 8 л со свежей бессывороточной средой и клетки инкубировали в биореакторе с применением описанных выше условий.
Культуральную среду от инфицированных слитым белком vTL2-Fc клеток SF21AE собирали центрифугированием (500 × g, 10 минут) при 72 часах после инфицирования. Клеточные супернатанты доводили до рН 8 NaOH. Добавляли ЭДТА до конечной концентрации 10 мМ и рН супернатанта повторно доводили до 8. Супернатанты фильтровали (0,45 мкм, Millipore) и наносили на протеин А-колонку (protein A sepharose 4 fast flow или HiTrap protein А, обе из Pharmacia). Колонку промывали PBS, содержащим 0,5 М NaCl, пока поглощение при 280 нм не уменьшалось до фона. Колонку промывали PBS и элюировали 0,5 М уксусной кислотой. Фракции после элюирования с колонки собирали в пробирки, содержащие 1 М Трис рН 9 для нейтрализации. Фракции ции пиков, содержащие слитый белок TL2-FC, объединяли и диализовали против PBS.
ПРИМЕР 13. Экспрессия TIE-1, TIE-2, ТL1 И TL2 при раке почки
Эксперименты по гибридизации in situ проводили на опухолевой ткани рака почки человека с применением кДНК-зондов TIE-1, TIE-2, TL1 И TL2. Экспрессия TIE-1, TIE-2, TL1 И TL2 отрицательно регулировалась в сосудистой сети опухоли. Экспрессия лигандов, по-видимому, была локализована либо в эндотелиальных клетках сосудов (TL2), либо очень близко от эндотелиальных клеток сосудов в мезенхиме (TL1). Было показано, что VEGF драматично отрицательно регулируется в этой опухолевой ткани. Brown, et al., Am. J. Pathol. 143:1255-1262 (1993).
ПРИМЕР 14. Экспрессия TIE-1, TIE-2, ТЫ И TL2 при заживлении ран
Эксперименты по гибридизации in situ проводили на поперечных срезах ткани, полученной из крысиной модели кожной раны, с использованием кДНК-зондов TIE-1, TIE-2, TL1 и TL2. Модель заживления раны включает в себя надавливание небольшого пробочного сверла на кожу крысы и извлечение небольшой цилиндрической пробки кожи. Так как заживление начинается при основании раны, делается вертикальный срез ткани и используется для гибридизации in situ. В тестируемой пробе ткани TL1 и TL2, по-видимому, испытывают небольшую отрицательную регуляцию при 4 днях после поврежедения. В противоположность этой небольшой отрицательной регуляции экспрессии TL1 и TL2 в этой ткани, экспрессия VEGF, которая может предшествовать экспрессии TL1 и TL2, драматично отрицательно регулируется.
ПРИМЕР 15. Экспрессия TIE-лигандов в печени и тимусе эмбриона
ПЦР с использованием обратной транскриптазы (РТ-РCR) проводили на печени эмбриона мыши Е14.5 и тимусе эмбриона мыши Е17.5. Электрофорез в агарозном геле продуктов pT-PCR обнаружил, что в печени эмбриона мыши район стромы обогащен РНК TIE-2-лиганда 1 (TL1), но TL1 отсутствует в гемопоэтических клетках-предшественниках c-kit+TER119. В той же самой ткани стромальные клетки обогащены РНК TIE-2-лиганда 2 (TL2), но TL2 отсутствует в гемопоэтических клетках-предшественниках (Фиг.13). В тимусе эмбриона мыши стромальные клетки обогащены TL2 (Фиг.14).
ПРИМЕР 16. Система TIE-рецептор/лиганд в ангиогенезе
Хотя система ТIЕ-2/ТIЕ-лиганд, по-видимому, играет важную роль в биологии эндотелиальных клеток, не было показано, что она играет существенную активную роль в ранних-промежуточных стадиях образования новых сосудов (например, пролиферации и миграции ангиобластов или эндотелиальных клеток, образовании трубочек и других событиях ранней стадии образования сосудов). В противоположность рецепторам и факторам, о которых известно, что они медиируют эти аспекты развития сосудов, более поздняя по времени экспрессия TIE-2 и ТL1 в ходе образования новых сосудов предполагает, что эта система играет особую роль в более поздних стадиях развития кровеносных сосудов, в том числе в структурной и функциональной дифференцировке и стабилизации новых кровеносных сосудов. Характер экспрессии TIE-2/TL1 также согласуется с продолжающейся ролью в поддержании структурной целостности и/или физиологических характеристик развитой сосудистой сети.
TIE-лиганд 2 (TL2), по-видимому, является конкурентным ингибитором TL1. Пространственно-временные характеристики экспрессии TL2 предполагают, что эта единственная ингибиторная молекула может играть множественные роли, существенные для соответствующего развития или повторного моделирования (коррекции) сосудов (например, дестабилизации/дедифференцировки зрелых эндотелиальных клеток, делающей возможным образование новых сосудов из существующей сосудистой сети, ингибирования ненужного образования сосудов и регрессии (обратного развития)/инволюции зрелых кровеносных сосудов).
Фиг.15 является схематическим изображением гипотетической роли ТIЕ-2/ТIЕ-лигандов в ангиогенезе. На этом чертеже TL1 представлен как (•), TL2 представлен как (*), TIE-2 представлен как (Т), VEGF представлен как ([])и flk-1 (VEGF-рецептор) представлен как (Y).
ПРИМЕР 17. Экспрессия TIE-лигандов в женской репродуктивной системе: экспрессия в яичнике
Предварительные наблюдения, сделанные в экспериментах, исследующих экспрессию TIE-рецепторов и TIE-лигандов в женской репродуктивной системе, согласуются с гипотезой, что TL1 играет роль в образовании новых сосудов, которое во времени следует за VEGF. Характер экспрессии TL2 также согласуется с антагонизмом действия TL1 и специфической ролью в обратном развитии сосудов. Для подтверждения этого может быть исследована экспрессия релевантных мРНК после экспериментальной индукции развития фолликула и желтого тела так, чтобы можно было более четко определить их временное отношение с различными аспектами образования новых сосудов/обратного развития сосудов (например, вместе с окрашиванием эндотелиальных клеток, васкулярных запасов). Ангиогенез, связанный с развитием фолликула и образованием corpus luteum (желтого тела) в яичниках определенной стадии взрослых самок крыс или после индуцированной овуляции в препубертатных животных, прослеживали с применением гибридизации in situ. Фиг.16 содержит фотографии слайдов гибридизации in situ, показывающие временной характер экспрессии TIE-2, TL1, TL2 и VEGF во время овариального цикла [Колонка 1: ранний преовуляторный фолликул; Колонка 2: преовуляторный фолликул; Колонка 3: раннее желтое тело; и Колонка 4: атретический фолликул; Ряд А: блестящая зона; Ряд В: VEGF; Ряд С: TL2; Ряд D: TL1; и Ряд Е: TIE-2-рецептор]. Эти исследования обнаружили, что VEGF, TL1 и TL2 экспрессируются во временных и пространственных координатах в соответствии с развитием и обратным развитием сосудистой сети, конкретно относительно установления сосудистой системы, которая генерируется в ходе превращения овариального фолликула в corpus luteum (CL).
Вкратце, экспрессия VEGF увеличивается в грануляционном слое фолликула перед его васкуляризацией во время процесса лютеинизации (образования желтого тела). Во время процесса образования CL наивысшие уровни экспрессии VEGF видны в центре развивающегося желтого тела, вблизи лютеинизирующих клеток, которые еще не васкуляризованы. Уровни VEGF остаются умеренно высокими и диффузно распределены в развивающемся желтом теле. В противоположность этому, заметно повышенная экспрессия TIE-2-лиганда 1 имеет место только поздно в процессе образования желтого тела, после образования первичного сосудистого сплетения. Позднее, экспрессия TL1 заметна по всему желтому телу и в это время устанавливается четкая капиллярная сеть желтого тела.
TL2 проявляет более сложный характер экспрессии, чем VEGF или TL1. В развивающемся желтом теле TL2 экспрессируется при наивысших уровнях впереди развивающегося капиллярного сплетения - между центральным, не имеющим сосудов, районом CL, где экспрессия VEGF является наивысшей, и наиболее периферической частью CL, где доминирующей является экспрессия TL1 и где процесс лютеинизации завершен и сосудистая система является наиболее зрелой. TL2 также экспрессируется, по-видимому, при высоких уровнях в фолликулярном слое больших фолликулов, которые подвергаются атрезии. В то время как TL1 также заметен в атретических фолликулах, VEGF в них не экспрессируется.
Распределение экспрессии, описанное выше, является наиболее согласующимся с ролью VEGF в инициации ангиогенеза, с TL1, действующим поздно в этом процессе - например, в моделировании и/или стабилизации окончательной сосудистой сети.
В противоположность этому, TL2 присутствует как в зонах активного распространения новой образующейся сосудистой сети (во время образования желтого тела), так и в участках, которые не способны развить новую сосудистую сеть и в перспективе имеют обратное развитие сосудов (атретические фолликулы). Это предполагает более динамичную и сложную роль TL2, возможно включающую в себя дестабилизацию существующей сосудистой сети (необходимую для обратного развития) или развивающейся сосудистой сети (необходимую для динамичного моделирования образующихся новых сосудов).
ПРИМЕР 18. Тест связывания рецептортела и тест связывания и конкуренции лигандов
Был разработан количественный бесклеточный тест связывания с двумя разными формами для детектирования связывания TIE-2-рецептортела или связывания и конкуренции лигандов. В варианте связывания рецептортела этого теста TIE-2-лиганды (очищенные или частично очищенные; TL1 или TL2) наносят на планшет ELISA. Затем добавляют рецептортело в различных концентрациях, которое связывается с иммобилизованным лигандом зависимым от дозы образом. В конце 2 часов избыток рецептортела вымывают, затем количество, связанное с планшетом, регистрируется при помощи специфического антитела против человеческого Fc, которое маркировано щелочной фосфатазой. Избыток репортерного антитела вымывают, затем проводят реакцию щелочной фосфатазы с применением окрашенного субстрата. Тест проводят количественно при помощи спектрофотометра. Фиг.19 показывает типичную кривую связывания TIE-2-IgG. Этот тест использовали для оценки целостности TIE-2-IgG после инъекции в крыс и мышей. Тест может быть также использован в форме конкурентного анализа лигандов, в котором очищенные или частично очищенные TIE-лиганды конкурируют с иммобилизованным лигандом за рецептортело. TIE-2-эктодомен наносят на планшет ELISA. Затем Fc-маркированные фрагменты фибриноген-подобного домена TIE-лигандов (TLl-fFc и TL2-fFc) связываются с этим эктодоменом и могут быть детектированы с применением того же самого антитела против человеческого Fc, как описано выше. Фиг.20 показывает пример связывания TLl-fFc с TIE-2-эктодоменом. Этот вариант теста может быть также использован для количественного определения уровней TLl-fFc в сыворотке или в других пробах. Если одновременно с TLl-fFc добавляют немеченый лиганд (опять, либо очищенный, либо неочищенный), то имеет место конкуренция между меченым фрагментом лиганда и полноразмерным лигандом. Полноразмерный лиганд может вытеснять Fc-меченый фрагмент и получают кривую конкуренции.
ПРИМЕР 19. Клеточная линия EA.hy926 может быть использована в качестве репортерной клеточной линии для активности лиганда
EA.hy926 представляет собой клеточную гибридную линию, которая была создана слиянием HUVEC с полученной из рака легкого человека линией, А549 [Edgell, et al., Proc. Natl. Acad. Sci. USA 80, 3734-3737 (1983)]. Было обнаружено, что клетки EA.hy926 экспрессируют значительные уровни TIE-2-рецепторного белка с низкими базальными уровнями фосфотирозина. Плотность, при которой клетки EA.hy926 пассируют перед их использованием для рецепторных тестов, а также степень их конфлюентности в момент анализа могут влиять на обилие TIE-2-рецептора и относительную индуцируемость в ответ на обработку лигандом. Путем выбора следующего режима для выращивания этих клеток клеточная линия EA.hy926 может быть использована в качестве надежной системы для анализа активностей TIE-2-лигандов.
Клетки EA.hy926 высевают при 1,5×106 клеток в колбы Т-75 (Falconware) и каждый второй день подают среду Дульбекко MEM с высоким содержанием глюкозы, 10% фетальной телячьей сывороткой, L-глутамином, пенициллином-стрептомицином и 1х гипоксантином/аминоптерином/тимидином (HAT, Gibco/BRL). После 3-4 дней роста клетки пассируют один раз опять при 1, 5×106 клеток на колбу Т-75 и культивируют дополнительно в течение 3-4 дней. Для тестов фосфорилирования клетки, полученные как описано выше, подвергались сывороточному голоданию путем замены культуральной среды DMEM с высоким содержанием глюкозы и инкубирования в течение 2-3 часов при 37°С. Эту среду отсасывали из колбы и пробы кондиционированных сред или очищенного лиганда добавляли в эту колбу в общем объеме 1,5 мл с последующим инкубированием при 37°С в течение 5 минут. Колбы вынимали из термостата и помещали на слой льда. Среду удаляли и заменяли 1,25 мл буфера для лизиса, содержащего 1% нонидет Р-40, 0,5% дезоксихолат натрия, 0,1% ДСН 6 20 мМ Трисе, рН 7,6, 150 мМ NaCl, 50 мМ NaF, 1 мМ орто-ванадат натрия, 5 мМ бензамидин и 1 мМ ЭДТА, содержащего ингибиторы протеаз PMSF, апротинин и лейпептин. После 10 минут на льду для солюбилизации мембран чашки выскребали и клеточные лизаты осветляли микроцентрифугированием при наивысшей скорости в течение 10 минут при 4°С. TIE-2-рецептор иммунопреципитировали из осветленного супернатанта инкубированием на холоду с поликлональной антисывороткой против TIE-2 и гранулами Протеин G-конъюгированной Сефарозы. Гранулы промывали три раза холодным буфером для лизиса клеток и кипятили в течение 5 минут в буфере для проб Laemmli и затем нагружали на 7,5% ДСН-полиакриламидные гели. Разделенные белки переносили электроблоттингом на PVDF-мембрану (Lamblia-P) и затем подвергали Вестерн-блот-анализу с использованием антитела против фосфотирозина и реагента ECL. Последующее сравнение общих уровней TIE-2-белка на одних и тех же блотах выполняли путем отсоединения антител против фосфотирозина ("раздевания") и повторного инкубирования с поликлональной антисывороткой, специфической для эктодомена TIE-2.
ПРИМЕР 20. Выделение и секвенирование полноразмерного кДНК-клона, кодирующего TIE-2-лиганд-3 млекопитающего
TIE-2-лиганд-3 (TL3) клонировали из геномной библиотеки мышей ВАС (Research Genetics) путем гибридизации дубликатов библиотеки с мышиным TLl-зондом или мышиным ТL2-зондом, соответствующими полной кодирующей последовательности этих генов. Каждую копию этой библиотеки гибридизовали с применением фосфатного буфера при 55°С в течение ночи. После гибридизации фильтры промывали при помощи 2 × SSC, 0,1% ДСН при 60°С с последующим экспонированием фильтров на рентгеновской пленке. Были обнаружены сильные сигналы гибридизации, соответствующие мышиному TL1 и мышиному TL2. Кроме того, были идентифицированы сигналы, которые слабо гибридизовались как с мышиным TL1, так и с мышиным TL2. ДНК, соответствующую этим клонам, очищали, затем расщепляли рестриктазами и два фрагмента, которые гибридизовались с исходными зондами, субклонировали в бактериальную плазмиду и секвенировали. Последовательность этих фрагментов содержала два экзона с гомологией относительно мышиного TL1 и мышиного TL2. Для идентификации тканей, содержащих транскрипты, соответствующие TL3, использовали праймеры, специфические для этих последовательностей, в качестве ПЦР-праймеров. ПЦР-полоса, соответствующая TL3, была идентифицирована в библиотеке кДНК мышиной матки в лямбда gt-11. (Clontech Laboratories, Inc., Palo Alto, CA).
Бляшки высевали при плотности 1,25×106/чашку 20×20 см и фильтры-реплики получали согласно стандартным процедурам (Sambrook, et al. (1989) Molecular Cloning: A Laboratory Manual, 2nd Ed., page 8.46, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York). Фильтры в двух повторностях подвергали скринингу при "нормальной" строгости (2 × SSC, 65°С) с 200 п.н. радиоактивным ПЦР-зондом, приготовленным для последовательности TL3 мыши. Гибридизацию проводили при 65°С в растворе, содержащем 0,5 мг/мл ДНК спермы лосося. Фильтры промывали в 2 × SSC при 65°С и экспонировали в течение 6 часов на рентгеновской пленке. Два позитивных клона, которые гибридизовались в двух повторностях, выскребались. Расщепление EcoRI ДНК фага, полученной из этих клонов, показало два независимых клона с размерами вставок приблизительно 1,2 т.п.н. и приблизительно 2,2 т.п.н. Вставку EcoRI 2,2 т.п.н. субклонировали в сайты EcoRI pBluescript KS (Stratagene). Анализ последовательности показал, что этот более длинный клон не имел инициирующего кодона метионина и сигнального пептида, но в остальном он кодировал зонд, гомологичный как мышиному TL1, так и мышиному TL2.
Затем синтезировали следующие ТL3-специфические ПЦР-праймеры:
US2: cctctgggctcgccagtttgttagg
US1: ccagctggcagatatcagg
Следующие ПЦР-реакции проводили с использованием экспрессионных библиотек, полученных из мышиных клеточных линий C2C12ras и MG87. В первичной ПЦР-реакции специфический праймер US2 использовали вместе с вектор-специфическими олигонуклеотидами для создания возможности амплификации в любой ориентации. ПЦР проводили в общем объеме 100 мл с применением 35 циклов 94°С, 1 мин; 42°С или 48°С в течение 1 мин; 72°С, 1 мин. Вторая ПЦР-реакция включала в себя второй специфический праймер, US1, который содержался в продукте первичной ПЦР, вместе с теми же самыми олигонуклеотидами. Вторичные реакции имели 30 циклов, использующих те же самые температуры и временные периоды, указанные ранее. На основании последовательностей, полученных в целом из четырех независимых ПЦР-реакции с использованием двух различных библиотек кДНК, был расшифрован 5'-конец последовательности TL3. Нозерн-анализ выявил умеренно низкие уровни транскрипта мышиного TL3 в мышиной плаценте. Экспрессия мышиного TL3 давала транскрипт ~3 т.п.н. Полноразмерная кодирующая последовательность TL3 представлена на Фиг.21.
Затем мышиная последовательность TL3 может быть использована для получения человеческого клона, содержащего кодирующую последовательность человеческого TL3, путем гибридизации либо геномной, либо кДНК-библиотеки человека с зондом, соответствующим мышиному TL3, как было описано ранее, например в Примере 8 supra.
ПРИМЕР 21. Выделение полноразмерного геноиного клона, кодирующего ТIЕ-2-лиганд-4 человека
ТIЕ-2-лиганд-4 (TL4) клонировали из геномной библиотеки мышей ВАС (ВАС HUMAN (II), Genome Systems Inc.) путем гибридизации дубликатов библиотеки либо с радиоактивным зондом TL1 человека, соответствующим полной кодирующей фибриноген последовательности TL1 (нуклеотиды 1153-1806 Фиг.4), либо с радиоактивным зондом TL3 мыши, соответствующим сегменту из 186 нуклеотидов из района фибриногена мышиного TL3 (нуклеотиды 1307-1492 Фиг.21). Каждый зонд метили при помощи ПЦР с использованием точных олигонуклеотидов и стандартных условий ПЦР, за исключением того, что dCTP был заменен32P-dCTP. Затем ПЦР-смесь пропускали через гель-фильтрационную колонку для отделения зонда от свободного32P-dCTP. Каждую копию этой библиотеки гибридизовали с применением фосфатного буфера и радиоактивного зонда при 55°С в течение ночи с использованием стандартных условий гибридизации. После гибридизации фильтры промывали при помощи 2 × SSC, 0,1% ДСН при 55°С с последующим экспонированием фильтров на рентгеновской пленке. Были обнаружены сильные сигналы гибридизации, соответствующие человеческому TL1. Кроме того, были идентифицированы сигналы, которые слабо гибридизовались как с человеческим TL1, так и с мышиным TL3. ДНК, соответствующую этим клонам, очищали, затем расщепляли рестриктазами и один фрагмент, который гибридизовался с исходными зондами, субклонировали в бактериальную плазмиду и секвенировали. Последовательность этих фрагментов содержала два экзона с гомологией относительно человеческого TL1 и относительно мышиного TL3 и других членов семейства TIE-лигандов. Для идентификации тканей, содержащих транскрипты, соответствующие TL4, могут быть использованы праймеры, специфические для этих последовательностей, в качестве ПЦР-праймеров.
Полная последовательность человеческого TL4 может быть получена секвенированием полного клона ВАС, содержащегося в депонированных бактериальных клетках. Экзоны могут быть идентифицированы по гомологии с известными членами семейства TIE-лигандов, такими: как TL1, TL2 и TL3. Затем может быть определена полная кодирующая последовательность TL4 сплайсингом вместе экзонов из геномного клона TL4, которая, в свою очередь, может быть использована для получения белка TL4. Альтернативно эти экзоны могут быть использованы в качестве зондов для получения полноразмерного кДНК-клона, который затем может быть использован для получения белка TL4. Экзоны могут быть также идентифицированы из клона ВАС по гомологии с белковыми доменами, такими как домены фибриногена, скрученные спирально домены или белковые сигналы, такие как сигнальные пептидные последовательности. Отсутствующие экзоны из клона ВАС могут быть получены идентификацией близких клонов ВАС, например путем использования концов депонированного клона ВАС в качестве зондов для скрининга геномной библиотеки человека, такой как использованная здесь, путем использования последовательности экзона, содержащегося в этом клоне ВАС, для скрининга кДНК-библиотеки или путем проведения 5'- или 3'-RACE-процедуры с применением олигонуклеотидных праймеров на основе последовательностей экзонов TL4.
Идентификация дополнительных членов семейства TIE-лигандов
Новая последовательность ТТЕ-лиганда-4 может быть использована в рациональном поиске дополнительных членов семейства TIE-лигандов при помощи подхода, которые используют преимущество существования консервативных сегментов сильной гомологии между известными членами этого семейства. Например, сравнение (выстраиванием) аминокислотных последовательностей TIE-лигандов показывает несколько районов консервативной последовательности (см. заключенные в блоки районы Фиг.22). Вырожденные олигонуклеотиды, по существу основанные на этих блоках, в комбинации с сегментами гомологии ранее известных или новых TIE-лигандов, могут использоваться для идентификации новых TIE-лигандов.
Высококонсервативные районы среди TL1, TL2 и TL3 могут быть использованы в конструировании вырожденных олигонуклеотидных праймеров, которыми можно праймировать ПЦР-реакции с использованием кДНК. кДНК-матрицы могут быть образованы обратной транскрипцией тканевых РНК с применением олиго d(T) или других подходящих праймеров. Затем аликвоты ПЦР-реакций могут быть подвергнуты электрофорезу на агарозном геле. Полученные амплифицированные фрагменты ДНК могут быть клонированы встраиванием в плазмиды, секвенированы и полученные последовательности ДНК могут быть сравнены с последовательностями всех известных TIE-лигандов.
Отобранные по размеру амплифицированные фрагменты ДНК из этих ПЦР-реакций можно клонировать в плазмиды, ввести в Е.соli электропорацией и полученные трансформанты можно посеять на селективный агар. Бактериальные колонии из ПЦР-трансформантов могут быть проанализированы секвенированием плазмидных ДНК, которые очищают стандартными, применяемыми для плазмид процедурами.
Клонированные фрагменты, содержащие сегмент нового TIE-лиганда, могут быть использованы в качестве гибридизационных зондов для получения полноразмерных кДНК-клонов из библиотеки кДНК. Например, геномная последовательность TL4 человека может быть использована для получения кДНК-клона, содержащего полную кодирующую последовательность TL4 человека, гибридизацией библиотеки кДНК человека с зондом, соответствующим TL4 человека, как было описано ранее.
ПРИМЕР 22. Клонирование полной кодирующей последовательности hTL4
Как 5'-, так и 3'-кодирующую последовательность из геномного клона TL4 человека, кодирующего ТIЕ-лиганд-4 человека (hTL-4 ATCC Accession No.98095), получали расщеплением рестриктазами, блоттингом по Саузерну и гибридизацией hTL-4-клона с кодирующими последовательностями из мышиного TL3 с последующим субклонированием и секвенированием гибридизующихся фрагментов. Кодирующие последовательности, соответствующие N-концевым и С-концевым аминокислотам hTL-4, использовали для конструирования ПЦР-праймеров (показанных ниже), которые, в свою очередь, использовали для ПЦР-амплификации TL4 из кДНК яичника человека. Полосу ПЦР идентифицировали как соответствующую TL4 человека секвенированием ДНК при помощи секвенатора. ДНК АВ1 373А и набора для секвенирования Taq Dideoxy Terminator Cycle (Applied Biosystems, Inc. Foster City, CA). ПЦР-полосу затем субклонировали в вектор pCR-script и несколько плазмидных клонов анализировали секвенированием. Затем составляли полную кодирующую последовательность TL4 человека, которая показана на Фиг.23. В другом варианте данного изобретения нуклеотид в положении 569 заменен А на G, что приводит к замене аминокислоты с Q на В.
Использованные здесь ПЦР-праймеры, описанные выше, были сконструированы в следующем виде:
hTL4atg 5'-gcatgctatctcgagccaccATGCTCTCCCAGCTAGCCATGCTGCAG-3'
hTL4not 5'-gtgtcgacgcggccgctctagatcagacTTAGATGTCCAAAGGCCGTACCCGTATCATCAT-3'.
Маленькие буквы указывают последовательности "хвостов", добавленные к ПЦР-праймерам для облегчения клонирования амплифицированных фрагментов ПЦР.
ПРИМЕР 23. Конструирование и характеристика модифицированных TIE-лигандов
Для лучшего понимания ряда наблюдаемых свойств был предпринят генетический анализ TIE-2-лиганда-1 и TIE-2-лиганда-2 (TL1 и TL2). Хотя TL1 и TL2 имеют одинаковую структурную гомологию, они проявляют различные физические и биологические свойства. Наиболее выдающимся признаком, который отличает эти два лиганда, является то, что, хотя они оба связываются с TIE-2-рецептором, TL1 является агонистом, тогда как TL2 является антагонистом. При невосстанавливающих условиях электрофореза оба белка обнаруживают ковалентные мультимерные структуры. TL1 продуцируется в виде смеси сшитых дисульфидными связями мультимеров, прежде всего тримеров, и молекулярных частиц более высокого порядка, без каких-либо димерных молекулярных частиц. Но TL2 продуцируется почти исключительно в виде димерных молекулярных частиц. Также, в то время как TL2 продуцируется хорошо в большинстве экспрессионных систем, TL1 экспрессируется слабо и его трудно получить в больших количествах. Наконец, условия получения и очистки также, по-видимому, предрасполагают TL1 к инактивации протеолитическим расщеплением в сайте, находящемся около аминоконца.
Для исследования этих различий несколько модифицированных лигандов были сконструированы следующим образом.
23.1. Замена цистеина
Исследования того, какие факторы могут способствовать различным физическим и биологическим свойствам этих двух молекул, выявили присутствие в TL1 остатка цистеина (CYS 265 на Фиг.4; CYS 245 на Фиг.17), предшествующего фибриноген-подобному домену в TL1, но отсутствующего в TL2 - т.е. в TL2 не было соответствующего остатка цистеина. Остаток CYS265 в TL1 кодируется TGC и расположен при нуклеотидах ~1102-1104 (см. Фиг.4) при приблизительном месте соединения между скрученным спирально и фибриноген-подобным доменами. Поскольку остатки цистеина обычно участвуют в образовании дисульфидных связей, присутствие которых вносит вклад как в третичную структуру, так и биологические свойства молекулы, полагали, что, возможно, присутствие остатка CYS265 в TL1 может быть, по крайней мере, частично ответственным за различные свойства этих двух молекул.
Для испытания этой гипотезы была сконструирована экспрессионная плазмида, которая содержала мутацию в TL1, в которой CYS (остаток 265 на Фиг.4; остаток 245 на Фиг.17) был заменен аминокислотой (серином), которая не образует дисульфидных связей. Кроме этого мутанта ТL1/CYS-, была сконструирована вторая экспрессионная плазмида, которая мутировала приблизительно соответствующее положение в TL2 (Met247 на Фиг.17), так что этот остаток был теперь цистеином. Как немутированные, так и мутированные экспрессионные плазмиды TL1 и TL2 были трансфицированы в клетки COS-7, клеточные супернатанты, содержащие рекомбинантные белки, собирали и пробы подвергали как восстанавливающему, так и невосстанавливающему электрофорезу в ДСН-НААГ и последующему Вестерн-блоттингу.
Фиг.18 показывает Вестерн-блоты при невосстанавливающих условиях как немутированных, так и мутированных белков, TL1 и TL2, показывающие, что мутант TL1/CYS- перемещается в виде димера, что более подобно TL2, и что мутант TL2/CYS+ способен образовать тример, а также мультимеры более высокого порядка, что более подобно TL1. При тестировании этих двух мутантных белков на их способность индуцировать фосфорилирование в экспрессирующих TIE-2 клетках мутант TL1/CYS- был способен активировать TIE-2-рецептор, тогда как мутант TL2/CYS+ не был способен активировать TIE-2-рецептор.
Таким образом, при генетическом изменении остатка цистеина (остатка 265 на Фиг.4; остатка 245 на Фиг.17) TL1 в серии было обнаружено, что ковалентная структура TL1 становится похожей на структуру TL2, т.е. прежде всего является димерной. Модифицированная молекула TL1 все еще ведет себя как агонист, следовательно, тримерная и/или мультимерная структура более высокого порядка не является определяющим фактором, придающим TL1 способность к активации рецептора. Хотя удаление цистеина производило молекулу с более желательными свойствами, оно не улучшало уровня продуцирования TL1.
23.2. Делеции доменов
Нуклеотидные последовательности, кодирующие TL1 и TL2, имеют общую генетическую структуру, которая может быть подразделена на три домена на основе аминокислотных последовательностей зрелых белков. Приблизительно 215 последних аминокислотных остатков каждого зрелого белка содержат шесть цистеинов и имеют сильное сходство с доменом фибриногена. Поэтому этот район был назван "фибриноген-подобным" доменом или "F-доменом". Центральный район зрелого белка, содержащий приблизительно 205 остатков, имел высокую вероятность предположения "спирально скрученной" структуры и был назван "спирально скрученным" доменом или "С-доменом". Приблизительно 55 аминоконцевых остатков зрелого белка содержали два цистеина и имели низкую вероятность спирально скрученной структуры. Этот район был назван "N-концевым" доменом или "N-доменом". Модифицированные лиганды, описанные здесь, обозначаются с использованием терминологии, в которой N = N-концевой домен, С = спирально скрученный домен, F = фибриноген-подобный домен и цифры 1 и 2 относятся к TL1 и TL2 соответственно. Таким образом, 1N указывает N-концевой домен из TL1, 2F указывает фибриноген-подобный домен TL2 и т.д.
Для тестирования, содержал ли фибриноген-подобный домен (F-домен) TIE-2-лигандов TIE-2-активирующую активность, были сконструированы экспрессионные плазмиды, которые имели делеции спирально скрученного и N-концевого доменов и имели только часть последовательности ДНК, кодирующую F-домен (для TL1, начинающийся на Фиг.4 при ~нуклеотиде 1159, аминокислотном остатке ARG284; для TL2, соответствующий ~ нуклеотиду 1200 на Фиг.6, аминокислотному остатку 282). Затем эту мутантную конструкцию трансфицировали в клетки COS. Супернатант, содержащий рекомбинантный белок, собирали. Мутант TLl/F-домен тестировали на его способность связывать TIE-2-рецептор. Результаты показали, что в виде мономера мутант TL1/F-домен не был способен связывать TIE-2 при детектируемом уровне.
Но когда мономер TLl/F-домена был myc-маркирован и затем подвергнут образованию кластеров антителом против myс-метки, он обнаружил детектируемое связывание с TIE-2. Однако превращенный в кластер антителом мутант TLl/F-домена не был способен индуцировать фосфорилирование в экспрессирующей TIE-2 клеточной линии.
Таким образом, было определено, что F-домен TIE-2-лигандов участвует в связывании рецептора, но укороченный белок, состоящий только из одного F-домена, не является достаточным для связывания рецептора. Это выдвинуло возможность, что спирально скрученный домен был ответственным за удерживание вместе нескольких фибриноген-подобных доменов, что может быть существенным для связывания рецептора. В попытке подтверждения этой гипотезы, F-домен сливали с Fc-частью человеческого антитела IgG1. Поскольку Fc-участки димеризуются при экспрессии клетками млекопитающих, эти рекомбинантные белки, имитирующие теоретическую конфигурацию F-доменов, были нативными лигандами для димеризации. Эта конструкция F-домен-Fc связывала, но не активировала рецептор. Очевидно, мультимеризация, обусловленная другими районами этих лигандов, является необходимой, чтобы позволить этим лигандам связывать TIE-2-рецептор. Кроме того, некий другой фактор вне F-домена должен способствовать фосфорилированию рецептора.
Затем конструировали мутанты, которые не имели фибриноген-подобного домена и, следовательно, содержали только N-концевой и спирально скрученный домены. Они не были способны связываться с рецептором. Для оценки роли N-концевого домена в связывании и активации рецептора эти лиганды укорачивали до их С- и F-доменов и маркировали FLAG-меткой при N-конце с получением конструкций, названных FLAG-1C1F и FLAG-2C2F. Хотя эти молекулы сильно окрашивались в клетках COS-7, трансфицированных для экспрессии TIE-2-рецептора, они не давали позитивного ответа в тесте фосфорилирования. Таким образом, N-домен не содержит существенного фактора для активации рецептора, хотя, как описано infra, способность химерной молекулы 2N2C1F активировать рецептор показывает, что даже N-домен неактивного лиганда может выполнять эту роль.
Различия в поведении между myс-маркированным укороченным F-доменом и Fc-маркированным укороченным F-доменом, описанные ранее, предполагают, что TIE-лиганды могут связываться только в димерной форме или в мультимерных, с более высоким порядком мультимеризации, формах. Действительно, невосстанавливающий электрофорез в ДСН-ПААГ показал, что TIE-лиганды существуют в природе в димерной, тримерной и мультимерных формах. То, что укороченные белки FLAG-1C1F и FLAG-2C2F могут связываться с TIE-2-рецептором без димеризации синтетической меткой (такой как Fc), тогда как укороченные F не могут, предполагает, что С-район является, по меньшей мере, частично ответственным за агрегацию F-доменов.
23.3. Обменивающиеся конструкции (химеры)
Заявители отмечали, что уровень продуцирования TL1 в клетках COS-7 был приблизительно в 10 раз ниже, чем продуцирование TL2. Поэтому были сконструированы химеры TL1 и TL2 в попытке объяснить это различие и также дополнительно охарактеризовать агонистическую активность TL1 в сравнении с антагонистической активностью TL2.
Были сконструированы четыре химеры, в которых N-концевой домен или фибриноген-подобный домен был подвергнут обмену между TL1 и TL2 и которые были названы с использованием терминологии, описанной ранее, так что, например, 1N1C2F относится к химере, имеющей N-концевой и спирально скрученный домены TL1, вместе с фибриноген-подобным доменом из TL2. Были сконструированы следующие 4 химеры:
химера 1 - 1N1C2F
химера 2 - 2N2C1F
химера 3 - 1N2C2F
химера 4 - 2N1C1F
Нуклеотидная и аминокислотная последовательности химер 1-4 показаны на Фиг.24-27 соответственно.
Каждую химеру встраивали в отдельный экспрессирующий вектор pJFE14.
Затем химеры трансфицировали в клетки COS-7 вместе с пустым вектором pJFE14, нативным TL1 и нативным TL2 в качестве контролей и собирали культуральные супернатанты.
Для определения, как обмен влиял на уровень экспрессии этих лигандов, разведение 1:5 и разведение 1:50 COS-7-супернатантов дот-блоттировали на нитроцеллюлозу. Три лиганда, которые содержали N-домен TL1 (т.е. нативный TL1, 1N2C2F и 1N1C2F), зондировали затем кроличьим антителом, специфическим для N-конца TL1. Три лиганда, содержащие N-домен TL2 (т.е. нативный TL2, 2N1C1F и 2N2C1F), зондировали кроличьим антителом, специфическим для N-конца TL2. Результаты показали, что клетки COS-7 экспрессировали любую молекулу, содержащую N-домен TL2 при уровне, в 10 раз более высоком, чем уровень любой молекулы, содержащей N-домен TL1, независимо от конструкции остальной части белка. Был сделан вывод, что N-домен должен, главным образом, регулировать уровень экспрессии лиганда.
Следующий вопрос относился к способности или неспособности этих химер активировать TIE-2-рецептор. Клетки EA.hy926 обрабатывались четырьмя химерами, а также TL1 в качестве позитивного контроля на фосфорилирование и TL2 или супернатантом pJFE14-тpaнcфициpoвaнныx клеток COS-7 в качестве негативных контролей на фосфорилирование. Эти клетки лизировали и TL2 иммунопреципитировали из лизата клеток и подвергали электрофорезу в ДСН-ПААГ. Пробы подвергали Вестерн-блоттингу и зондировали антителом против фосфотирозина для детектирования каких-либо фосфорилированных рецепторов. Неожиданно, только конструкции, содержащие фибриноген-подобный домен TL1 (2N1C1F и 2N2C1F), могли фосфорилировать TIE-2-рецептор. Таким образом, хотя N-концевой район TL1 является существенным для активации, он может быть заменен N-концевым районом TL2, т.е. информация, которая определяет, является лиганд агонистом или антагонистом, в действительности содержится в фибриноген-подобном домене.
Таким образом, было определено, что F-домен, кроме связывания TIE-2-рецептора, ответственен за активность фосфорилирования TL1. Далее, когда TL2, в другом случае неактивную молекулу, изменяли заменой ее F-домена F-доменом TL1, измененный TL2 действовал как агонист.
Однако конструкция 2N1C1F была несколько более сильнодействующей. Сигнал, вызываемый химерой 2N1C1F, по-видимому, является несколько более сильным, чем сигнал химеры 2N2C1F, что приводит к предположению, что С-домен TL1, хотя и не решающий для фосфорилирования, может увеличивать силу TL1. Однако, поскольку пробы, использованные для теста фосфорилирования, не были нормализованы в отношении концентрации лиганда, не исключена возможность, что более сильный сигнал фосфорилирования свидетельствует лишь о большем содержании лиганда. Поэтому тест фосфорилирования повторяли с вариирующимися количествами лиганда для определения, проявляют ли активные химеры действия различной силы. Концентрацию лиганда в СOS-7 супернатантах лигандных трансфекций определяли посредством биосенсорной технологии BIAcore согласно описанным ранее способам (Stitt, T.N., et al., (1995) Cell 80:661-670). Способ BIAcore измерял активность связывания супернатанта с TIE-2-рецептором в относительных единицах, названных резонансными единицами (РЕ). Наблюдали, как правило, вполне хорошую корреляцию между РЕ и концентрацией лиганда, причем 400 РЕ активности соответствовали ~1 мкг белка на мл супернатанта. Пробы разводили до концентраций 100 РЕ, 20 РЕ и 5 РЕ, каждую, и повторяли тест фосфорилирования. Результаты показали, что химера 2N2C1F была явно более активной, чем нативный TL1 или химера 1N1C2F, при одной и той же концентрации.
Другим интересным аспектом этих обменных конструкций являются их уровни экспрессии. Каждую из четырех химер тестировали на уровень продуцирования в клетках COS, способность связываться с TL2 и способность фосфорилировать TIE-2. Результаты этих экспериментов показали, что химеры 1 и 3 продуцировались при уровнях, сравнимых с TL1, тогда как химеры 2 и 4 продуцировались при уровнях, сравнимых с TL2. Таким образом, высокий уровень образования белка коррелировал с N-концевым доменом TL2. Кроме того, при тестировании эндотелиальных клеток EA.hy926 химеры 2 и 4 были активными, тогда как химеры 1 и 3 были неактивными. Таким образом, эта активность (фосфорилирование рецептора) коррелирует с фибриноген-подобным доменом TL1. Следовательно, химеры 2 и 4, каждая, имели желательные свойства высоких уровней продуцирования, а также агонистическую активность.
23.4. Протеолитически резистентные конструкции
На основании наблюдения, что большая фракция препаратов TL1 часто Протеолитически расщепляется вблизи N-конца, было сделано предположение, что остаток аргинина, расположенный в положении 49 зрелого белка (см. Фиг.17), был кандидатом сайта расщепления, который может участвовать в регуляции активности этого белка in vivo, и что замена этого аргинина серином (R49 → S) может увеличивать стабильность этого белка без обязательного влияния на его активность. Был сконструирован такой мутант TL1 и было обнаружено, что он так же активен, как и нативный TL1, но он не обнаруживал резистентности к протеолитическому расщеплению.
23.5 Комбинационные мутанты
Наиболее активная из химерных конструкций, 2N1C1F, была дополнительно изменена таким образом, что цистеин, кодируемый нуклеотидами 784-787, как показано на Фиг.27, превращали в серин. Эта молекула (названная 2N1C1F (C246S)) экспрессировалась хорошо, сильно активировала рецептор, была устойчивой к протеолитическому расщеплению и была, в основном, димерной, а не более мультимерной. Таким образом, 2N-домен, по-видимому, придает устойчивость к протеазам этой молекуле. Наконец, эту молекулу дополнительно изменяли для элиминации потенциально чувствительного к протеазе сайта, кодируемого нуклеотидами 199-201, как показано на Фиг.27, с получением молекулы (названной 2N1C1F (R51 → S, C246 → S)), которая, как ожидалось, является активирующей, хорошо экспрессируемой, димерной и устойчивой к протеазам.
Таблица суммирует модифицированные конструкции TIE-2-лиганда, которые были приготовлены, и характеризует каждую из них в отношении способности связывать TIE-2-рецептор, способности активировать TIE-2-рецептор, типа образованной структуры (мономер, димер и т.д.) и их относительных уровней продуцирования. Немодифицированный TL1 (простые, без штрихов) и TL2 (заштрихованные) показаны с тремя доменами в виде блоков. Так, заштрихованные блоки показывают домены из TL1. Цистеин, расположенный в положении 245 зрелого белка TL1, указан как "С". "Х"-"С" показывают, что этот остаток цистеина был заменен другой аминокислотой, как например в мутанте TL1 CYS-. Подобным образом, "X"-"R" в последней конструкции указывают замену Аrg в положении 49 зрелого белка TL1. "С" присутствует в одной модифицированной конструкции TL2, обозначая мутант TL2 CYS+. Конструкции, имеющие хвосты Fc или FLAG-маркирование, также показаны.
На основании высказанных здесь утверждений специалист в данной области легко увидит, что могут быть сделаны дополнительные конструкции для создания дополнительных модифицированных и химерных TIE-2-лигандов, которые имеют измененные свойства. Например, можно создать конструкцию, состоящую из N-концевого домена TL2 и F-домена TL1, слитую с Fc-частью человеческого антитела IgG. Можно было бы ожидать, что эта конструкция будет связывать и активировать TIE-2-рецептор. Подобным образом могут быть созданы другие конструкции с использованием пояснений, представленных здесь, и, следовательно, все они находятся в сфере действия данного изобретения.
23.6. Материалы и способы
Конструирование химер
Обменивающиеся конструкции встраивали в вектор pJFE14, в котором сайт ХbаI был заменен на сайт AscI. Затем этот вектор расщепляли AscI и NotI с получением AscI-NotI-структуры. Фрагменты ДНК для этих химер получали при помощи ПЦР с использованием подходящих олигонуклеотидов.
Вставки FLAG-1C1F И FLAG-2C2F субклонировали в структуру вектора рМТ21, которая была расщеплена EcoRI и NotI. Укороченные "CF" получали при помощи ПЦР, и метку FLAG и предшествующую сигнальную последовательность трипсина конструировали отжигом синтетических олигонуклеотидов.
Трансфекции
Все конструкции трансфицировали в клетки COS-7 с применением ДЭАЭ-Декстрана или ЛипофектАМИНА в соответствии со стандартными протоколами. Клеточные культуру собирали через 3 дня после трансфекции и центрифугировали при 1000 об/мин в течение 1 минуты, и супернатанты переносили в свежие пробирки и хранили при -20°С.
Окрашивание FLAG-lClF-трансфицированных и FLАG-2С2F-трансфицированных клеток
6-луночные планшеты клеток COS-7 трансфицировали TIE-2-рецептором. COS-7-супернатант из различных лигандных трансфекций инкубировали на этих клетках в течение 30 минут с последующими двумя промывками забуференным фосфатом солевым раствором (PBS) без магния или кальция. Клетки фиксировали в -20°С метаноле в течение 3 минут, промывали один раз PBS и инкубировали с антителом против FLAG M2 (IBI; разведение 1:3000) в PBS/10% телячья сыворотка (ТС) в течение 30 минут. Клетки промывали один раз PBS, и инкубировали с конъюгированным антителом козьи антитела против мышиного IgG/щелочная фосфатаза (АР) (Promega; 1:1000) в ЗФР/10% ТС. Клетки промывали дважды PBS, и инкубировали с фосфатным субстратом, BCIP/NBT, с 1 мМ левамизолом.
Тесты фосфорилирования
Разведения COS-супернатантов для исследования зависимости ответа от дозы выполняли в супернатантах клеток COS-7, трансфицированных пустым вектором pJFE14. Клетки ЕА, которые в природе экспрессируют TIE-2-рецептор, голодали на бессывороточной среде в течение >2 часов с последующим введением подходящего СОS-супернатанта на 10 минут при 37°С в атмосфере 5% СО2. Затем клетки промывали охлажденным на льду PBS и лизировали 1% NP40-бyфepoм для лизиса, содержащим ингибиторы протеаз (10 мкг/мл лейпептина, 10 мкг/мл апротинина, 1 мМ PMSF) с последующей иммунопреципитацией антителом, специфическим для TIE-2-рецептора. Затем пробы подвергали иммуноблоттингу с использованием антител против фосфотирозина (pTyr).
Дот-блоты
Пробы наносили на нитроцеллюлозную мембрану, которую блокировали и зондировали подходящими антителами.
23.7. Получение химерного TIE-2-лиганда из клеток СНО и инфицированных бакуловирусом клеток насекомых
Получение вируса
Ген для химерного лиганда (названного 2N1C1F (C246S)) встраивали в бакуловирусную экспрессирующую плазмиду и рекомбинировали с вирусной ДНК для получения рекомбинантного бакуловируса, амплифицировали и собирали при помощи способов, описанных ранее (O'Reilly, D.R., L.К. Miller and V.A. Luckow, Baculovirus Expression Vectors-A Laboratory Manual. 1992, New York: W.H. Freeman). Клетки насекомого SF21 (Spodoptera frugiperda), полученные из Invitrogen, адаптировали и размножали при 27°С в бессывороточной среде Gibco SF900 II. Неинфицированные клетки выращивали при плотности 1×106клеток/мл. Плотность клеток определяли счетом жизнеспособных клеток при помощи гемоцитометра. Исходный вирусный материал для лиганда добавляли в биореактор при низкой множественности заражения 0,01-0,1 бляшкообразующих единиц (PFU) на клетку для начала инфицирования. Процесс инфицирования продолжали в течение 3-4 дней для максимальной репликации вируса без навлечения существенного лизиса клеток. Из суспензии клеток брали стерильно аликвоты в стерильные центрифужные флаконы и клетки удаляли центрифугированием (1600 об/мин, 30 минут). Бесклеточный супернатант собирали в стерильные флаконы и хранили при 4°С в отсутствие света до дальнейшего использования.
Титр вируса определяли анализом бляшкообразования, как описано O'Reilly, D.R., L.К. Miller и V.A. Luckow. Способ проводили в чашках 60 мм для культуры ткани, которые засевали 1,5×106 клеток. Серийные разведения исходного вирусного материала добавляли к прикрепленным клеткам и смесь инкубировали с качанием, чтобы дать вирусу адсорбироваться к индивидуальным клеткам. Добавляли покрывающий слой агара и чашки инкубировали в течение 5 дней при 27°С. Жизнеспособные клетки окрашивали нейтральным красным, выявляя кольцевые бляшки, которые считали с получением титра вируса, выраженного в бляшкообразующих единицах на миллилитр (PFU/мл, БОЕ/мл).
Инфицирование клеток для получения белка
Неинфицированные клетки SF21 выращивали в чашках для культуры ткани и вирус, содержащий ген химерного лиганда, добавляли при множественности заражения 1-10 БОЕ/клетку. Вирусу давали адсорбироваться в течение 90 минут при 27°С с медленным качанием, после чего клеткам предоставляли свежие количества бессывороточной среды Sf-900 II. После 3 дней роста при 27°С культуральные жидкости собирали и лиганд детектировали иммуноблоттингом.
Экспрессия клетками СНО химер TIE-2-лигандов
Химеры TIE-2-лигандов клонировали в любой из нескольких экспрессирующих векторов клеток млекопитающих, в том числе, но не только, pJFE, pcDNA3, pMT21, pED или другие.
Плазмиды трансфицировали в клетки СНО DG44 (Urlaub, G. and Chasin, L.A. 1980. Isolation of Chinese hamster cell mutants deficient in dihydrofolate reductase activity. Proc. Natl. Acad. Sci. USA 77:4216-4220; Urlaub, G., Kas, E., Carothers, A.M. and Chasin, L.A. 1983. Deletion of the diploid dihydrofolate locus from cultured mammalian cells. Cell 33:405-412) осаждением фосфатом кальция или катионными липосомами. В случае векторов, не имеющих dhfr селектируемого маркера, плазмиду pSV2.dhfr котрансфицировали при 20% молярном отношении к плазмиде, содержащей химеру TIE-лиганда. DHFR+-клетки отбирали по росту в селективной среде (среде, не содержащей нуклеозидов и нуклеотидов, содержащей 10% фетальную телячью сыворотку), и клоны подвергали скринингу на продуцирование химерных TIE-лигандов при помощи иммуноблоттинга с TIE-2-рецептортелом. Клоны, экспрессирующие желательный белок, подвергали нескольким циклам генной амплификации с применением ступенчатых концентраций метотрексата в селективной среде. Клоны с высокой экспрессией идентифицировали после амплификации генов подобными способами иммуноблоттинга.
Клеточные линии, экспрессирующие химерные TIE-лиганды, культивировали в монослоях, суспензионных колбах, роллер-флаконах и биореакторах в селективной среде или в среде без отбора, и они могут выращиваться в композициях бессывороточных сред.
Депозиты
Нижеследующее было депонировано в American Type Culture Collection, 12301 Parklawn Drive, Rockville, Maryland 20852 в соответствии с Будапештским Договором. Плазмидный клон, кодирующий TIE-2-лиганд, был депонирован в АТСС 7 октября 1994 года и назван "pJFE14, кодирующий TIE-2-лиганд" под номером доступа 75910. Рекомбинантный бакуловирус Autographa californica, кодирующий TIE-2-рецептортело, был депонирован в АТСС 7 октября 1994 года и назван "vTIE-2-рецептортело" под номером доступа VR24484. Лямбда фаг-вектор, содержащий ДНК tie-2-лиганда был депонирован в АТСС 26 октября 1994 года и назван "lgtIO, кодирующий htie-2-лиганд 1" под номером доступа 75928. Плазмидный клон, кодирующий второй TIE-2-лиганд, был депонирован в АТСС 9 декабря 1994 года и назван "pBluescript KS, кодирующий TIE-2-лиганд 2 человека" под номером доступа 75963. Штамм E.coli DHIOB, содержащий плазмиду pBeLoBacll со вставкой гена TL-4 человека, кодирующей ТIЕ-лиганд-4 человека, был депонирован в АТСС 2 июля 1996 года и назван "hTL-4" под номером доступа 98095.
Данное изобретение не ограничивается в его объеме описанными здесь характерными вариантами. Действительно, различные модификации данного изобретения, кроме описанных здесь, будут очевидными для специалистов в данной области из предшествующего описания и сопутствующих рисунков. Предполагается, что такие модификации находятся в сфере действия прилагаемой формулы изобретения.
Реферат
Изобретение относится к биотехнологии, в частности к генной инженерии, и может быть использовано для получения химерного или модифицированного TIE-2-лиганда. Химерный TIE-2-лиганд, связывающий и активирующий TIE-2-рецептор, содержит N-концевой домен, спирально скрученный домен и фибриноген-подобный домен, которые выбраны из TIE-2-лиганда 1, TIE-2-лиганда 2, TIE-лиганда 3, TIE-лиганда 4. Модифицированный лиганд может иметь замены нуклеотидов 1102-1104 последовательности на фиг.4, кодирующих цистеин, или нуклеотидов 555-557 последовательности на фиг.6, кодирующих аргинин. Химерный TIE-2-лиганд получают путем культивирования клеток, трансформированных вектором, содержащим нуклеиновую кислоту, кодирующую химерный TIE-2-лиганд. Фармацевтическая композиция для индуцирования гематопоэза или неоваскуляризации содержит химерный или модифицированный лиганд. Изобретение позволяет разрабатывать средства, усиливающие гематопоэз. 8 н. и 15 з.п. ф-лы, 44 ил., 1 табл.


Комментарии